アンモニア電解合成装置
【課題】水と窒素からアンモニアを電解合成する装置であって、アンモニア合成効率が改善されたアンモニア電解合成装置を提供する。
【解決手段】水と窒素とからアンモニアを電解合成する装置であって、前記装置は、
(1)電解浴である溶融塩に微細化された水蒸気とN3−とを供給することによって前記アンモニアを合成する装置であり、
(2)前記溶融塩にガス成分を供給し、前記ガス成分を含む前記溶融塩の上昇流によって前記溶融塩を撹拌する手段と、
(3)前記水蒸気の反応によって生じるO2−を酸化して酸素ガスを発生させる陽極と、
(4)窒素ガスを還元してN3−を発生させる陰極とを
有することを特徴とするアンモニア電解合成装置。
【解決手段】水と窒素とからアンモニアを電解合成する装置であって、前記装置は、
(1)電解浴である溶融塩に微細化された水蒸気とN3−とを供給することによって前記アンモニアを合成する装置であり、
(2)前記溶融塩にガス成分を供給し、前記ガス成分を含む前記溶融塩の上昇流によって前記溶融塩を撹拌する手段と、
(3)前記水蒸気の反応によって生じるO2−を酸化して酸素ガスを発生させる陽極と、
(4)窒素ガスを還元してN3−を発生させる陰極とを
有することを特徴とするアンモニア電解合成装置。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、アンモニア電解合成装置に関する。
【背景技術】
【0002】
従来、アンモニアはハーバーボッシュ法により工業レベルで広く製造されている。当該ハーバーボッシュ法は、水素ガスと窒素ガスからアンモニアを合成する方法であり、Fe、FeO、Fe3O4等にAl2O3及びK2Oを含む鉄系の三元系触媒の存在下、水素ガスと窒素ガスとを反応させることによってアンモニアを製造する。
【0003】
しかしながら、当該ハーバーボッシュ法は高温・高圧での合成であるため、エネルギー消費や設備規模が巨大である。しかも炭化水素の水蒸気改質によって水素ガスを得る際に多量のCO2を排出するという問題がある。
【0004】
上記問題を改善する方法として、水素ガスを用いない方法の開発が挙げられる。例えば、非特許文献1には、常圧下で水と窒素とからアンモニアを電解合成する方法が記載されている。この方法は、陰極から窒化物イオン(N3−)を発生させ、水(水蒸気)と反応させることによりアンモニアを電解合成する。具体的には、電解浴として溶融塩を用いる。陰極では、窒素ガスを還元してN3−を電解浴に供給する。電解浴には水蒸気が供給されており、N3−と反応してアンモニアを生成させる。陽極では、電解合成により副生する酸化物イオン(O2−)や水蒸気の平衡反応により生じる水酸化物イオン(OH−)が酸化されて酸素ガスが発生する。なお、各反応は次のように例示される。
【0005】
陽極反応:3O2− → 3/2O2+6e−
溶融塩中:3H2O+2N3−→2NH3+3O2−
陰極反応:N2+6e− → 2N3−
全反応 :N2+3H2O → 2NH3+3/2O2
【非特許文献1】伊藤靖彦、溶融塩および高温化学、Vol.46、No.2、(2003年8月)「常圧アンモニア電解合成−アンモニアエコノミーの基盤技術−」
【発明の開示】
【発明が解決しようとする課題】
【0006】
非特許文献1に記載されたアンモニア電解合成法は、ハーバーボッシュ法と比べて温和且つ消費エネルギーが低減された条件で水と窒素からアンモニアを電解合成できる。また、水素ガスを用いないため、多量のCO2を排出する問題がない。
【0007】
しかしながら、非特許文献1に具体的に開示されている電解合成装置はアンモニア合成効率が不十分であり、更なる改善の余地がある。よって、本発明は、水と窒素からアンモニアを電解合成する装置であって、アンモニア合成効率が改善されたアンモニア電解合成装置を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明者は、上記目的を達成すべく鋭意研究を重ねた結果、電解浴に供給する水蒸気の種類と電解浴を撹拌する手段とを工夫することにより上記目的を達成できることを見出し、本発明を完成するに至った。
【0009】
即ち、本発明は下記のアンモニア電解合成装置に関する。
1.水と窒素とからアンモニアを電解合成する装置であって、前記装置は、
(1)電解浴である溶融塩に微細化された水蒸気とN3−とを供給することによって前記アンモニアを合成する装置であり、
(2)前記溶融塩にガス成分を供給し、前記ガス成分を含む前記溶融塩の上昇流によって前記溶融塩を撹拌する手段と、
(3)前記水蒸気の反応によって生じるO2−を酸化して酸素ガスを発生させる陽極と、
(4)窒素ガスを還元してN3−を発生させる陰極とを
有することを特徴とするアンモニア電解合成装置。
2.前記溶融塩は、アルカリ金属ハロゲン化物及びアルカリ土類金属ハロゲン化物からなる群から選択される少なくとも1種である、上記項1に記載のアンモニア電解合成装置。
3.前記微細化された水蒸気は、気泡径が100nm〜10mmである、上記項1又は2に記載のアンモニア電解合成装置。
4.前記微細化された水蒸気は、前記溶融塩1cm3当たりに前記気泡が10個〜1000万個含まれるように供給される、上記項1又は2に記載のアンモニア電解合成装置。
5.前記ガス成分は、不活性ガスを含む、上記項1〜4のいずれかに記載のアンモニア電解合成装置。
6.前記ガス成分は、電解浴の底部又は底部近傍に設けられた供給口から供給される、上記項1〜5のいずれかに記載のアンモニア電解合成装置。
7.前記電解合成により得られるアンモニア含有ガスから不純物を除去するトラップ手段を更に有する、上記項1〜6のいずれかに記載のアンモニア電解合成装置。
【発明の効果】
【0010】
本発明のアンモニア電解合成装置は、微細化された水蒸気を溶融塩に供給する。また、溶融塩にガス成分を供給し、ガス成分を含む溶融塩の上昇流によって溶融塩を撹拌する。これにより、N3−と水蒸気とを効率的に接触させるとともに、O2−を効率的に酸化除去することができるため、アンモニア合成効率が向上する。
【0011】
本発明のアンモニア電解合成装置は、電解合成によって得られるアンモニア含有ガスに含まれる不純物を除去するトラップ手段(例えば、溶融塩蒸気、未反応水蒸気、不活性ガス等の不純物を除去するトラップ手段)を設けることにより、より高純度なアンモニアを得ることができる。
【発明を実施するための最良の形態】
【0012】
本発明のアンモニア電解合成装置(本発明装置)は、水と窒素とからアンモニアを電解合成する装置であって、前記装置は、
(1)電解浴である溶融塩に微細化された水蒸気とN3−とを供給することによって前記アンモニアを合成する装置であり、
(2)前記溶融塩にガス成分を供給し、前記ガス成分を含む前記溶融塩の上昇流によって前記溶融塩を撹拌する手段と、
(3)前記水蒸気の反応によって生じるO2−を酸化して酸素ガスを発生させる陽極と、
(4)窒素ガスを還元してN3−を発生させる陰極とを、
有することを特徴とする。
【0013】
本発明の電解合成装置を用いたアンモニア電解合成の概要を以下に示す。即ち、陰極で窒素ガスを還元して電解浴(溶融塩)にN3−を供給する。溶融塩に水蒸気を供給し、水蒸気とN3−を反応させてアンモニアとO2−を生成させる。陽極では、O2−を酸化して酸素ガスを発生させる。つまり、原理的には水と窒素からアンモニアと酸素を合成する。
【0014】
本発明装置は、特に水蒸気として微細化された水蒸気を用いる。そのため、アンモニア合成反応に関与する水蒸気の表面積を多く確保することができる。また、本発明装置は、溶融塩にガス成分を供給し、上昇流によって溶融塩を撹拌するため、溶融塩へのN3−の供給及び溶融塩からのO2−の除去が促進されてアンモニア合成効率が向上する。
【0015】
以下、本発明装置の各構成について説明する。
【0016】
(電解浴)
電解浴としては、溶融塩を用いる。
【0017】
溶融塩としては、N3−が安定に存在できるものであれば良く、例えば、アルカリ金属ハロゲン化物及びアルカリ土類金属ハロゲン化物の少なくとも1種が挙げられる。
【0018】
アルカリ金属ハロゲン化物としては、例えば、LiF、NaF、KF、RbF、CsF、LiCl、NaCl、KCl、RbCl、CsCl、LiBr、NaBr、KBr、RbBr、CsBr、LiI、NaI、KI、RbI、CsI等が挙げられる。
【0019】
アルカリ土類金属ハロゲン化物としては、例えば、MgF2、CaF2、SrF2、BaF2、MgCl2、CaCl2、SrCl2、BaCl2、MgBr2、CaBr2、SrBr2、BaBr2、MgI2、CaI2、SrI2、BaI2等が挙げられる。
【0020】
これらの化合物は単独又は二種以上を組み合わせて使用できる。化合物の組み合わせや混合比は限定的ではなく、溶融塩の所望の作動温度等に応じて適宜設定する。
【0021】
溶融塩の温度は限定的ではないが、高温領域ではアンモニアが窒素ガスと水素ガスとに分解し易いため、アンモニアの分解を抑制する点で200〜450℃が好ましく、250〜400℃がより好ましい。
【0022】
本発明では、溶融塩として下記(1)〜(4)の少なくとも1種が好ましい。
(1)LiCl−KCl
〔組成比:LiCl:KCl=35〜100mol%:65〜0mol%が好ましく、55〜65mol%:45〜35mol%がより好ましい。〕
(2)LiCl−KCl−CsCl
〔組成比:LiCl:KCl:CsCl=57.5:13.3:29.2mol%の共融組成が好ましい。但し、組成比はそれぞれ20%程度変化したものでもよい。〕
(3)LiBr−KBr
〔組成比:LiBr:KBr=35〜100mol%:65〜0mol%が好ましく、60〜70mol%:40〜30mol%がより好ましい。〕
(4)LiBr−KBr−CsBr
〔組成比:LiBr:KBr:CsBr=56.1:18.9:25.0mol%の共融組成が好ましい。但し、組成比はそれぞれ20%程度変化したものでもよい。〕
その他、溶融塩として下記(5)〜(19)の少なくとも1種も使用できる。
(5)LiCl−CsCl
〔組成比:35〜65mol%:65〜35mol%が好ましい。共融点:306℃〕
(6)LiCl−NaCl−KCl
〔組成比:45〜60mol%:5〜15mol%:30〜40mol%が好ましい。共融点:346℃〕
(7)LiCl−NaCl−KCl−RbCl
〔組成比:45〜55mol%:5〜15mol%:15〜25mol%:20〜30mol%が好ましい。共融点:297℃〕
(8)LiCl−NaCl−KCl−LiF
〔組成比:45〜55mol%:5〜15mol%:30〜40mol%:1〜10mol%が好ましい。共融点:332℃〕
(9)LiCl−KBr
〔組成比:55〜65mol%:45〜35mol%が好ましい。共融点:360℃〕
(10)LiCl−NaCl−KBr
〔組成比:50〜65mol%:5〜15mol%:30〜40mol%が好ましい。共融点:340℃〕
(11)LiCl−KCl−LiBr−KBr
〔組成比:5〜20mol%:5〜40mol%:30〜50mol%:20〜35mol%が好ましい。共融点:310℃〕
(12)LiBr−KCl
〔組成比:55〜65mol%:45〜35mol%が好ましい。共融点:327℃〕
(13)LiBr−NaBr−KCl
〔組成比:50〜60mol%:5〜15mol%:30〜40mol%が好ましい。共融点:320℃〕
(14)LiBr−CsBr
〔組成比:45〜70mol%:55〜30mol%が好ましい。共融点:230℃〕
(15)LiBr−RbBr
〔組成比:50〜65mol%:50〜35mol%が好ましい。共融点259℃〕
(16)LiBr−NaBr−KBr
〔組成比:50〜65mol%:5〜15mol%:30〜40mol%が好ましい。共融点324℃〕
(17)LiBr−KBr−RbBr
〔組成比:50〜60mol%:5〜15mol%:30〜40mol%が好ましい。共融点268℃〕
(18)LiI−KI
〔組成比:60〜70mol%:40〜30mol%が好ましい。共融点260℃〕
(19)CsCl−CsF−CsI
〔組成比:30〜40mol%:30〜40mol%:30〜40mol%が好ましい。共融点:365℃〕
(陰極)
陰極としては、窒素ガスを還元してN3−を溶融塩に供給する陰極を用いる。陰極反応は次の通りである。
【0023】
1/2N2+3e− → N3−
陰極の材質としては窒素ガスを還元できる金属や合金であれば良い。例えば、ニッケルや鉄を含むものが好ましく、特にニッケルを含むものが好ましい。陰極の形状としては、ラネー触媒やMCFCの電極に用いられるような多孔質、金網状、メッシュ状が好ましく、陰極の表面にPt、Ir、Ru等の触媒を担持しても良い。
【0024】
多孔質ニッケルは溶融塩に対する濡れ性が良いため、単に溶融塩に接触させただけでは多孔質内部が完全に浸って窒素ガスの還元反応が進行し易い固気液三相界面が十分に形成されず、電極表面を効果的に利用できない場合がある。そのため、多孔質ニッケル表面を処理することにより濡れ性を制御する(濡れやすい箇所と濡れにくい箇所を共存させる)工夫や多孔質ニッケルの内部に窒素ガスを吹き込むなどして常に新鮮な固気液三相界面を生成する工夫をすることが好ましい。例えば、多孔性のガス拡散型電極を用いて陰極内に窒素ガスを吹き込んで常に新鮮な固気液三相界面を生成することが好ましい。
【0025】
また、生成したN3−が多孔質電極内部に留まることは、窒素ガスの還元反応を持続させるための障害となるため、多孔質電極を用いる場合には、N3−を速やかに多孔質電極外部に取り除くのが好ましい。例えば、溶融塩を常に多孔質電極中を流動(通過)させる工夫や多孔質電極内に窒素ガスを吹き込んで多孔質内部の溶融塩を常に流動させる(撹拌させる)工夫をすることが好ましい。
【0026】
(陽極)
陽極としては、水蒸気の反応により生じるO2−を酸化して酸素ガスを発生させる陽極を用いる。陽極反応は次の通りである。
【0027】
O2− → 1/2O2+2e−
なお、上記陽極反応は主反応であり、その他、溶融塩中でH2Oの平衡反応により生じるOH−を酸化して酸素ガスを発生させる反応(※1)や、ごく僅かであるが溶融塩中に残留するH2Oから酸素ガスを発生させる反応(※2)も生じるものと考えられる。
【0028】
H2O+O2− ←→ 2OH−、2OH− → 1/2O2+H2O+2e(※1)
H2O → 1/2O2+2H++2e(※2)
陽極としては、不溶性陽極や酸素発生陽極として市販されている電極材料が使用できる。この中でも、ニッケルフェライトなどの導電性セラミックスや導電性ダイヤモンド電極が好ましい。特にNi酸化物とFe酸化物の固溶体からなるニッケルフェライトについては、NiXFe3−XO4(X=0.1〜2.0)であるものが好ましく、X=0.3〜1.5であるものがより好ましい。
【0029】
陽極反応でO2−やOH−が十分に除去できない場合には、溶融塩にこれらのアニオンが蓄積してアンモニア生成反応や陰極での窒素ガス還元反応に支障をきたす可能性がある。従って、(1)アンモニア生成反応により生じたO2−を速やかに陽極近傍へと導く工夫、(2)O2−を含む電解浴と陽極が効果的に接触する工夫、及び、(3)発生する酸素ガスが速やかに電解浴外へと排出される工夫をすることが好ましい。
【0030】
上記(1)については、電解浴の対流を利用してアンモニア生成部(N3−と水蒸気の反応場)からO2−を陽極近傍へと導くのが好ましい。上記(2)については、対流により移動する溶融塩の流速に対する陽極の接触面積を大きくとるために、陽極表面に溶融塩流路や凹凸を付与することや、多孔質状、メッシュ状にした陽極内部を溶融塩が流動する構造とするのが好ましい、上記(3)については、アルゴンやヘリウム等の不活性ガスを吹き込むことで、溶融塩中から酸素ガスを排出することが好ましい。
【0031】
(微細化された水蒸気)
本発明装置は、溶融塩に供給する水蒸気として微細化された水蒸気を用いる。
【0032】
水蒸気とN3−とのアンモニア生成反応は主に気液反応として進行するため、水蒸気の気泡サイズ(気泡径)が小さい方が、反応は効率的に進行する。
【0033】
水蒸気の気泡径は、溶融塩の温度、N3−濃度、水蒸気の気泡数等に依存する。従って、水蒸気の気泡径は、アンモニア生成部の規模や陰極でのN3−生成速度に応じて決定する。水蒸気の気泡径は厳密ではないが、100nm〜10mm程度が好ましく、1μm〜1mm程度がより好ましい。なお、この気泡径は水蒸気を溶融塩に供給時(又は供給直後)の気泡径であり、N3−との反応が進行するにつれて気泡径が減少する。
【0034】
また、単位体積当たりに含まれる水蒸気の気泡数も、溶融塩の温度、N3−濃度、水蒸気の気泡径等によって決定すれば良いが、水蒸気供給時(又は供給直後)において、溶融塩1cm3当たりに10個〜1000万個含まれるのが好ましく、100個〜500万個含まれるのがより好ましい。
【0035】
気泡径やその分布の測定には、一般的な液体中の気泡径や気泡数の測定法が利用できる。例えば、数μm〜数十μm以上の比較的大きい気泡であれば、気泡供給部近傍にパイレックス(登録商標)ガラス製や石英ガラス製の透明の窓を設け、溶融塩中の気泡又は窓に付着する気泡を顕微鏡などで直接観察しても良いし、アンモニア電解合成反応の障害とならない範囲でコールタカウンタ法(気泡を含む溶融塩の電気抵抗の変化を測定して気泡径分布を求める方法)により気泡径分布を測定しても良い。また、ナノメートルサイズの非常に微細な気泡の場合には、光散乱法(半導体レーザーなどを溶融塩中に照射し、その散乱光から単位時間当たりに通過した気泡の分布を求める方法)を利用して、気泡径分布を測定できる。
【0036】
微細化された水蒸気を発生させる方法は特に限定されない。例えば、ミクロンオーダーの気泡の場合には、パイレックス(登録商標)製や高純度アルミナ製の多孔質部材を通過させる方法が挙げられる。サブミクロンオーダー以下の微細な気泡を得るには、超音波印加等で水蒸気気泡を更に微細化させれば良い。
【0037】
微細化された水蒸気の温度は限定されないが、溶融塩の温度を低下させないために溶融塩の温度近くまで予備的に加熱しておくのが好ましいが、水蒸気とN3−との反応熱により比較的低温の水蒸気を吹き込んだ場合でも浴温の低下を抑制することはできる。水蒸気は別途ヒーターなどにより加熱しても良く、水蒸気の流路を溶融塩浴中に設置することで溶融塩浴により加熱しても良い。
【0038】
(溶融塩を撹拌する手段)
本発明装置は、溶融塩にガス成分を供給し、ガス成分を含む溶融塩の上昇流によって溶融塩を撹拌する手段を有する。この手段は、ガス成分を溶融塩に供給し、ガス供給部の溶融塩が周囲の溶融塩よりも見かけの密度が小さくなることにより浮力を生じさせ、ガス供給部の溶融塩に上昇流が生じること(ガスリフト)によって溶融塩を撹拌する。溶融塩を流動させる方法としては、プロペラなどの駆動部を設ける方法もあり、本発明装置は、当該駆動部を併用することもできる。
【0039】
ガス成分の供給口は電解浴の底部又は底部近傍に設けることが好ましい。このように、ガス成分が溶融塩中を上昇する距離を多く確保することにより効率的に撹拌できる。このような電解浴の撹拌は、陰極で生じるN3−をアンモニア生成部に効率的に移動させる点、N3−を水蒸気と接触させる効率を高める点、及び電解合成によって副生されるO2−を陽極に移動させて酸素ガスとして排出する効率を高める点で好ましい。
【0040】
ガスリフトに用いるガス成分としては、例えば、前記水蒸気を利用できる。即ち、アンモニア合成に用いる水蒸気をガスリフトに利用して溶融塩を撹拌しても良い。但し、微細な気泡は、一般に液体中での浮上速度が極めて遅いため、未反応の微細な水蒸気の気泡が溶融塩に残存した場合、浴外に容易に脱離されず、対流する浴内を循環し、陰極反応の障害になる可能性が高くなる。また、水蒸気はアンモニア生成反応により消費されて気泡径は徐々に小さくなる場合が多いことや、水蒸気の過剰の供給はアンモニア生成反応の障害になる可能性がある。そこで、溶融塩の流速を大きくするためには、アルゴンガス、ヘリウムガス、窒素ガス等の不活性ガスによりガスリフトさせることが好ましい。このような不活性ガスは、水蒸気と混合して又は水蒸気と別途に供給することができる。
【0041】
電解合成により生じたアンモニアは、溶融塩中に溶け込みやすいことから、この点でも、不活性ガスの吹込みにより、アンモニアを積極的に溶融塩中から追い出すことが好ましい。このような不活性ガスの気泡は、前記の水蒸気気泡のように微細な気泡である必要はない。不活性ガスの気泡の気泡径は限定されないが、1μm〜300mmが好ましく、30μm〜100mmがより好ましい。
【0042】
不活性ガスを併用する場合の水蒸気と不活性ガスの比は限定的ではない。ガスリフトによる溶融塩の流動速度と、陰極からのN3−供給速度に応じて適宜設定すればよい。ガスリフトによる溶融塩の流動速度は、陽極においてO2−の大部分が酸素ガスとして系外に排出されるのに適した速度が好ましい。また、陰極からアンモニア生成部へのN3−供給速度は、陰極でのN3−生成速度と溶融塩の流動速度に左右されるが、陰極電流値から求められる陰極でのN3−生成速度から、単位時間当たりに必要となるH2O供給量が算出できるので、これに基づいて水蒸気流量と不活性ガス流量を設定するのが好ましい。
【0043】
以下に実施態様1、実施態様2を例示して本発明装置を具体的に説明する。
【0044】
(実施態様1)
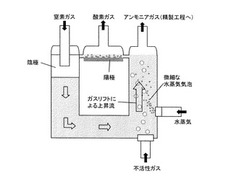
本発明装置の一例(図1)を実施態様1として説明する。
【0045】
実施態様1では、溶融塩はループ内を循環し、その駆動力は不活性ガス供給によるガスリフトである。多孔質陰極で生成したN3−は、ガスリフトで生じた溶融塩の流動により多孔質陰極内部を通過する溶融塩の流れに乗って、ガスリフトによる溶融塩駆動部と同一箇所であるアンモニア生成部に運ばれる。このアンモニア生成部では、微細な水蒸気の気泡が供給されており、浴上部に到達するまでにほぼ全ての水蒸気はN3−と反応してアンモニアを生成する。生成したアンモニアは、未反応の微細な水蒸気の気泡とともに、ガスリフトの駆動力となった不活性ガスにより気相中へと排出され、後述するアンモニア精製工程へと運ばれる。一方、アンモニア生成反応により副成するO2−は、溶融塩の流れに乗って陽極へと運ばれる。この陽極部では、陽極上の凹凸により溶融塩流量に対する陰極面積の割合を増大させており、また溶融塩厚みを数mm程度の薄い液膜とすることで、陽極上で発生する酸素ガスが気相中へと速やかに排出される。陽極部を通過した溶融塩は、引き続き多孔質陰極内部へと送られる。
【0046】
上記装置を用いて電解を行うことにより、電解浴中では、下記の反応が進行する。
【0047】
N3−+3/2H2O → NH3+3/2O2−
つまり、アンモニア電解合成の全反応は、次の通りである。
【0048】
1/2N2+3/2H2O → NH3+3/4O2
上反応式から計算される理論分解電圧は600Kで1.17Vである。例えば、LiCl−KCl系で例示するならば、陽極は2.8V(Li+/Li電位に対する表記、以下同様)程度よりも貴な電位領域に、陰極は0.6V程度よりも卑な電位領域に設定すればよい。この場合、極間電圧2.2V以上で合成反応は進行することになり、理論分解電圧よりも1.0V程度大きい値となる。この原因は、H2OとN3−からのアンモニア生成反応が溶融塩中で自発的に進行していることが理由であり、このアンモニア生成反応を電気化学的に生じさせることで、電解電圧を理論分解電圧に大幅に近づけることができる。
【0049】
(実施態様2)
本発明装置の一例(図2)を実施態様2として説明する。
【0050】
実施態様2は、電解槽Aと電解槽Bの2つの電解槽を用いて、槽間を水素透過性金属膜により隔てている。
【0051】
図2の装置を用いて電解を行うことにより、電解槽A側では、次の反応が進行する。
【0052】
陽極反応:3O2− → 3/2O2+6e−
陰極反応:3H2O+6e− → 3O2− +6H (a)
全反応A :3H2O → 3/2O2 +6H
即ち、水素透過性金属膜の電解槽A側では、水の電気分解により原子状の水素が金属膜へと吸蔵されて、金属膜内を電解槽B側へと拡散する。一方、電解槽B側では、次の反応が進行する。
【0053】
陽極反応:6H+2N3−→2NH3+6e−
陰極反応:N2+6e− → 2N3− (b)
全反応B :N2+6H → 2NH3
即ち、金属膜内を電解槽B側へと拡散してきた水素原子は、電解槽Bの浴中のN3−と電気化学的に反応し、NH3を生成する。この場合の、両電解槽で必要となる電解電圧は、約1.2V程度である。このことは、溶融塩中で自発的に進む、
H2O+N3−→NH3+O2−
なる反応を、上記の陰極反応(a)と陽極反応(b)により電気化学的に進行させることで、約1.0V程度の電圧が回収できたことに等しい。この場合の電解槽Aの溶融塩には、前述した溶融塩の他に、溶融水酸化物もしくは溶融水酸化物−H2O系のものが利用できる。このような金属水酸化物としてはアルカリ金属の水酸化物が好ましく、特にNaOH、KOHがより好ましい。また、電解槽Aでは、プロトン導電性の固体電解質も利用できる。
【0054】
(アンモニア精製手段)
電解合成によりアンモニアが得られるが、回収ガスには通常アンモニア以外の不純物も含まれているため、精製により高純度のアンモニアを得ることが好ましい。
【0055】
回収ガスに含まれる可能性のある不純物は、(イ)溶融塩蒸気、(ロ)未反応水蒸気、(ハ)不活性ガス(陰極で使用する窒素ガスを含む)である。なお、精製により上記(イ)〜(ハ)を除去する際は、(イ)→(ロ)→(ハ)の順で除去するのが好ましい。
(イ)溶融塩蒸気の除去
溶融塩蒸気は、溶融塩の融点以下に達した時点で凝結・固化が始まり、ガス回収ラインに到達した時点では全てが微粒子状に固化した状態にある。従って、常温〜150℃程度に保持した粉塵フィルター等で容易に除去可能である。なお、ガス回収ライン中で結露が生じた場合、生成アンモニアが結露に吸収されてアンモニア収率の低下や配管の劣化を招くおそれがあるため、電解セル〜電解質回収部間は、少なくとも80℃程度以上に保持し、結露を防ぐのが好ましい。
(ロ)未反応水蒸気の除去
未反応水蒸気は、0℃以下(好ましくは−5℃以下)に保持した冷却機を使用して速やかに固化させることが好ましい。これは、溶融塩が凝結した水滴に溶解し、凝固点降下によって固化速度が低下するのを防ぐ為であり、また凝結した水滴に生成アンモニアが吸収されて収率の低下や冷却機の劣化を防ぐ為である。冷却の方法は、気化熱を利用したり、ペルチェ効果を利用するなど、一般的なガス流体の冷却方法が利用できる。例えば、水蒸気を含むアンモニアガスを冷却した構造体に吹き付けて構造体上に氷の膜として回収しても良いし、冷却された不活性ガスを吹き付けることで氷の粒子として回収しても良い。
(ハ)不活性ガス(陰極で使用する窒素ガスを含む)の除去
不活性ガスは、精製手段の最後で除去することが好ましい。アンモニアは、常圧下でも−33℃で液化するため、この特徴を利用し、例えば、−40℃程度以下に晒すことで液体のアンモニアと不活性ガスとを分離できる。精製アンモニアをボンベ等の容器に一時保管することを考慮し、数気圧程度まで加圧すれば、より高温でアンモニアは液化する(8〜9気圧程度であれば常温でも液化する)ため、回収は容易となる。
【図面の簡単な説明】
【0056】
【図1】本発明のアンモニア電解合成装置の一例を示す模式図である。
【図2】本発明のアンモニア電解合成装置の一例を示す模試図である。
【技術分野】
【0001】
本発明は、アンモニア電解合成装置に関する。
【背景技術】
【0002】
従来、アンモニアはハーバーボッシュ法により工業レベルで広く製造されている。当該ハーバーボッシュ法は、水素ガスと窒素ガスからアンモニアを合成する方法であり、Fe、FeO、Fe3O4等にAl2O3及びK2Oを含む鉄系の三元系触媒の存在下、水素ガスと窒素ガスとを反応させることによってアンモニアを製造する。
【0003】
しかしながら、当該ハーバーボッシュ法は高温・高圧での合成であるため、エネルギー消費や設備規模が巨大である。しかも炭化水素の水蒸気改質によって水素ガスを得る際に多量のCO2を排出するという問題がある。
【0004】
上記問題を改善する方法として、水素ガスを用いない方法の開発が挙げられる。例えば、非特許文献1には、常圧下で水と窒素とからアンモニアを電解合成する方法が記載されている。この方法は、陰極から窒化物イオン(N3−)を発生させ、水(水蒸気)と反応させることによりアンモニアを電解合成する。具体的には、電解浴として溶融塩を用いる。陰極では、窒素ガスを還元してN3−を電解浴に供給する。電解浴には水蒸気が供給されており、N3−と反応してアンモニアを生成させる。陽極では、電解合成により副生する酸化物イオン(O2−)や水蒸気の平衡反応により生じる水酸化物イオン(OH−)が酸化されて酸素ガスが発生する。なお、各反応は次のように例示される。
【0005】
陽極反応:3O2− → 3/2O2+6e−
溶融塩中:3H2O+2N3−→2NH3+3O2−
陰極反応:N2+6e− → 2N3−
全反応 :N2+3H2O → 2NH3+3/2O2
【非特許文献1】伊藤靖彦、溶融塩および高温化学、Vol.46、No.2、(2003年8月)「常圧アンモニア電解合成−アンモニアエコノミーの基盤技術−」
【発明の開示】
【発明が解決しようとする課題】
【0006】
非特許文献1に記載されたアンモニア電解合成法は、ハーバーボッシュ法と比べて温和且つ消費エネルギーが低減された条件で水と窒素からアンモニアを電解合成できる。また、水素ガスを用いないため、多量のCO2を排出する問題がない。
【0007】
しかしながら、非特許文献1に具体的に開示されている電解合成装置はアンモニア合成効率が不十分であり、更なる改善の余地がある。よって、本発明は、水と窒素からアンモニアを電解合成する装置であって、アンモニア合成効率が改善されたアンモニア電解合成装置を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明者は、上記目的を達成すべく鋭意研究を重ねた結果、電解浴に供給する水蒸気の種類と電解浴を撹拌する手段とを工夫することにより上記目的を達成できることを見出し、本発明を完成するに至った。
【0009】
即ち、本発明は下記のアンモニア電解合成装置に関する。
1.水と窒素とからアンモニアを電解合成する装置であって、前記装置は、
(1)電解浴である溶融塩に微細化された水蒸気とN3−とを供給することによって前記アンモニアを合成する装置であり、
(2)前記溶融塩にガス成分を供給し、前記ガス成分を含む前記溶融塩の上昇流によって前記溶融塩を撹拌する手段と、
(3)前記水蒸気の反応によって生じるO2−を酸化して酸素ガスを発生させる陽極と、
(4)窒素ガスを還元してN3−を発生させる陰極とを
有することを特徴とするアンモニア電解合成装置。
2.前記溶融塩は、アルカリ金属ハロゲン化物及びアルカリ土類金属ハロゲン化物からなる群から選択される少なくとも1種である、上記項1に記載のアンモニア電解合成装置。
3.前記微細化された水蒸気は、気泡径が100nm〜10mmである、上記項1又は2に記載のアンモニア電解合成装置。
4.前記微細化された水蒸気は、前記溶融塩1cm3当たりに前記気泡が10個〜1000万個含まれるように供給される、上記項1又は2に記載のアンモニア電解合成装置。
5.前記ガス成分は、不活性ガスを含む、上記項1〜4のいずれかに記載のアンモニア電解合成装置。
6.前記ガス成分は、電解浴の底部又は底部近傍に設けられた供給口から供給される、上記項1〜5のいずれかに記載のアンモニア電解合成装置。
7.前記電解合成により得られるアンモニア含有ガスから不純物を除去するトラップ手段を更に有する、上記項1〜6のいずれかに記載のアンモニア電解合成装置。
【発明の効果】
【0010】
本発明のアンモニア電解合成装置は、微細化された水蒸気を溶融塩に供給する。また、溶融塩にガス成分を供給し、ガス成分を含む溶融塩の上昇流によって溶融塩を撹拌する。これにより、N3−と水蒸気とを効率的に接触させるとともに、O2−を効率的に酸化除去することができるため、アンモニア合成効率が向上する。
【0011】
本発明のアンモニア電解合成装置は、電解合成によって得られるアンモニア含有ガスに含まれる不純物を除去するトラップ手段(例えば、溶融塩蒸気、未反応水蒸気、不活性ガス等の不純物を除去するトラップ手段)を設けることにより、より高純度なアンモニアを得ることができる。
【発明を実施するための最良の形態】
【0012】
本発明のアンモニア電解合成装置(本発明装置)は、水と窒素とからアンモニアを電解合成する装置であって、前記装置は、
(1)電解浴である溶融塩に微細化された水蒸気とN3−とを供給することによって前記アンモニアを合成する装置であり、
(2)前記溶融塩にガス成分を供給し、前記ガス成分を含む前記溶融塩の上昇流によって前記溶融塩を撹拌する手段と、
(3)前記水蒸気の反応によって生じるO2−を酸化して酸素ガスを発生させる陽極と、
(4)窒素ガスを還元してN3−を発生させる陰極とを、
有することを特徴とする。
【0013】
本発明の電解合成装置を用いたアンモニア電解合成の概要を以下に示す。即ち、陰極で窒素ガスを還元して電解浴(溶融塩)にN3−を供給する。溶融塩に水蒸気を供給し、水蒸気とN3−を反応させてアンモニアとO2−を生成させる。陽極では、O2−を酸化して酸素ガスを発生させる。つまり、原理的には水と窒素からアンモニアと酸素を合成する。
【0014】
本発明装置は、特に水蒸気として微細化された水蒸気を用いる。そのため、アンモニア合成反応に関与する水蒸気の表面積を多く確保することができる。また、本発明装置は、溶融塩にガス成分を供給し、上昇流によって溶融塩を撹拌するため、溶融塩へのN3−の供給及び溶融塩からのO2−の除去が促進されてアンモニア合成効率が向上する。
【0015】
以下、本発明装置の各構成について説明する。
【0016】
(電解浴)
電解浴としては、溶融塩を用いる。
【0017】
溶融塩としては、N3−が安定に存在できるものであれば良く、例えば、アルカリ金属ハロゲン化物及びアルカリ土類金属ハロゲン化物の少なくとも1種が挙げられる。
【0018】
アルカリ金属ハロゲン化物としては、例えば、LiF、NaF、KF、RbF、CsF、LiCl、NaCl、KCl、RbCl、CsCl、LiBr、NaBr、KBr、RbBr、CsBr、LiI、NaI、KI、RbI、CsI等が挙げられる。
【0019】
アルカリ土類金属ハロゲン化物としては、例えば、MgF2、CaF2、SrF2、BaF2、MgCl2、CaCl2、SrCl2、BaCl2、MgBr2、CaBr2、SrBr2、BaBr2、MgI2、CaI2、SrI2、BaI2等が挙げられる。
【0020】
これらの化合物は単独又は二種以上を組み合わせて使用できる。化合物の組み合わせや混合比は限定的ではなく、溶融塩の所望の作動温度等に応じて適宜設定する。
【0021】
溶融塩の温度は限定的ではないが、高温領域ではアンモニアが窒素ガスと水素ガスとに分解し易いため、アンモニアの分解を抑制する点で200〜450℃が好ましく、250〜400℃がより好ましい。
【0022】
本発明では、溶融塩として下記(1)〜(4)の少なくとも1種が好ましい。
(1)LiCl−KCl
〔組成比:LiCl:KCl=35〜100mol%:65〜0mol%が好ましく、55〜65mol%:45〜35mol%がより好ましい。〕
(2)LiCl−KCl−CsCl
〔組成比:LiCl:KCl:CsCl=57.5:13.3:29.2mol%の共融組成が好ましい。但し、組成比はそれぞれ20%程度変化したものでもよい。〕
(3)LiBr−KBr
〔組成比:LiBr:KBr=35〜100mol%:65〜0mol%が好ましく、60〜70mol%:40〜30mol%がより好ましい。〕
(4)LiBr−KBr−CsBr
〔組成比:LiBr:KBr:CsBr=56.1:18.9:25.0mol%の共融組成が好ましい。但し、組成比はそれぞれ20%程度変化したものでもよい。〕
その他、溶融塩として下記(5)〜(19)の少なくとも1種も使用できる。
(5)LiCl−CsCl
〔組成比:35〜65mol%:65〜35mol%が好ましい。共融点:306℃〕
(6)LiCl−NaCl−KCl
〔組成比:45〜60mol%:5〜15mol%:30〜40mol%が好ましい。共融点:346℃〕
(7)LiCl−NaCl−KCl−RbCl
〔組成比:45〜55mol%:5〜15mol%:15〜25mol%:20〜30mol%が好ましい。共融点:297℃〕
(8)LiCl−NaCl−KCl−LiF
〔組成比:45〜55mol%:5〜15mol%:30〜40mol%:1〜10mol%が好ましい。共融点:332℃〕
(9)LiCl−KBr
〔組成比:55〜65mol%:45〜35mol%が好ましい。共融点:360℃〕
(10)LiCl−NaCl−KBr
〔組成比:50〜65mol%:5〜15mol%:30〜40mol%が好ましい。共融点:340℃〕
(11)LiCl−KCl−LiBr−KBr
〔組成比:5〜20mol%:5〜40mol%:30〜50mol%:20〜35mol%が好ましい。共融点:310℃〕
(12)LiBr−KCl
〔組成比:55〜65mol%:45〜35mol%が好ましい。共融点:327℃〕
(13)LiBr−NaBr−KCl
〔組成比:50〜60mol%:5〜15mol%:30〜40mol%が好ましい。共融点:320℃〕
(14)LiBr−CsBr
〔組成比:45〜70mol%:55〜30mol%が好ましい。共融点:230℃〕
(15)LiBr−RbBr
〔組成比:50〜65mol%:50〜35mol%が好ましい。共融点259℃〕
(16)LiBr−NaBr−KBr
〔組成比:50〜65mol%:5〜15mol%:30〜40mol%が好ましい。共融点324℃〕
(17)LiBr−KBr−RbBr
〔組成比:50〜60mol%:5〜15mol%:30〜40mol%が好ましい。共融点268℃〕
(18)LiI−KI
〔組成比:60〜70mol%:40〜30mol%が好ましい。共融点260℃〕
(19)CsCl−CsF−CsI
〔組成比:30〜40mol%:30〜40mol%:30〜40mol%が好ましい。共融点:365℃〕
(陰極)
陰極としては、窒素ガスを還元してN3−を溶融塩に供給する陰極を用いる。陰極反応は次の通りである。
【0023】
1/2N2+3e− → N3−
陰極の材質としては窒素ガスを還元できる金属や合金であれば良い。例えば、ニッケルや鉄を含むものが好ましく、特にニッケルを含むものが好ましい。陰極の形状としては、ラネー触媒やMCFCの電極に用いられるような多孔質、金網状、メッシュ状が好ましく、陰極の表面にPt、Ir、Ru等の触媒を担持しても良い。
【0024】
多孔質ニッケルは溶融塩に対する濡れ性が良いため、単に溶融塩に接触させただけでは多孔質内部が完全に浸って窒素ガスの還元反応が進行し易い固気液三相界面が十分に形成されず、電極表面を効果的に利用できない場合がある。そのため、多孔質ニッケル表面を処理することにより濡れ性を制御する(濡れやすい箇所と濡れにくい箇所を共存させる)工夫や多孔質ニッケルの内部に窒素ガスを吹き込むなどして常に新鮮な固気液三相界面を生成する工夫をすることが好ましい。例えば、多孔性のガス拡散型電極を用いて陰極内に窒素ガスを吹き込んで常に新鮮な固気液三相界面を生成することが好ましい。
【0025】
また、生成したN3−が多孔質電極内部に留まることは、窒素ガスの還元反応を持続させるための障害となるため、多孔質電極を用いる場合には、N3−を速やかに多孔質電極外部に取り除くのが好ましい。例えば、溶融塩を常に多孔質電極中を流動(通過)させる工夫や多孔質電極内に窒素ガスを吹き込んで多孔質内部の溶融塩を常に流動させる(撹拌させる)工夫をすることが好ましい。
【0026】
(陽極)
陽極としては、水蒸気の反応により生じるO2−を酸化して酸素ガスを発生させる陽極を用いる。陽極反応は次の通りである。
【0027】
O2− → 1/2O2+2e−
なお、上記陽極反応は主反応であり、その他、溶融塩中でH2Oの平衡反応により生じるOH−を酸化して酸素ガスを発生させる反応(※1)や、ごく僅かであるが溶融塩中に残留するH2Oから酸素ガスを発生させる反応(※2)も生じるものと考えられる。
【0028】
H2O+O2− ←→ 2OH−、2OH− → 1/2O2+H2O+2e(※1)
H2O → 1/2O2+2H++2e(※2)
陽極としては、不溶性陽極や酸素発生陽極として市販されている電極材料が使用できる。この中でも、ニッケルフェライトなどの導電性セラミックスや導電性ダイヤモンド電極が好ましい。特にNi酸化物とFe酸化物の固溶体からなるニッケルフェライトについては、NiXFe3−XO4(X=0.1〜2.0)であるものが好ましく、X=0.3〜1.5であるものがより好ましい。
【0029】
陽極反応でO2−やOH−が十分に除去できない場合には、溶融塩にこれらのアニオンが蓄積してアンモニア生成反応や陰極での窒素ガス還元反応に支障をきたす可能性がある。従って、(1)アンモニア生成反応により生じたO2−を速やかに陽極近傍へと導く工夫、(2)O2−を含む電解浴と陽極が効果的に接触する工夫、及び、(3)発生する酸素ガスが速やかに電解浴外へと排出される工夫をすることが好ましい。
【0030】
上記(1)については、電解浴の対流を利用してアンモニア生成部(N3−と水蒸気の反応場)からO2−を陽極近傍へと導くのが好ましい。上記(2)については、対流により移動する溶融塩の流速に対する陽極の接触面積を大きくとるために、陽極表面に溶融塩流路や凹凸を付与することや、多孔質状、メッシュ状にした陽極内部を溶融塩が流動する構造とするのが好ましい、上記(3)については、アルゴンやヘリウム等の不活性ガスを吹き込むことで、溶融塩中から酸素ガスを排出することが好ましい。
【0031】
(微細化された水蒸気)
本発明装置は、溶融塩に供給する水蒸気として微細化された水蒸気を用いる。
【0032】
水蒸気とN3−とのアンモニア生成反応は主に気液反応として進行するため、水蒸気の気泡サイズ(気泡径)が小さい方が、反応は効率的に進行する。
【0033】
水蒸気の気泡径は、溶融塩の温度、N3−濃度、水蒸気の気泡数等に依存する。従って、水蒸気の気泡径は、アンモニア生成部の規模や陰極でのN3−生成速度に応じて決定する。水蒸気の気泡径は厳密ではないが、100nm〜10mm程度が好ましく、1μm〜1mm程度がより好ましい。なお、この気泡径は水蒸気を溶融塩に供給時(又は供給直後)の気泡径であり、N3−との反応が進行するにつれて気泡径が減少する。
【0034】
また、単位体積当たりに含まれる水蒸気の気泡数も、溶融塩の温度、N3−濃度、水蒸気の気泡径等によって決定すれば良いが、水蒸気供給時(又は供給直後)において、溶融塩1cm3当たりに10個〜1000万個含まれるのが好ましく、100個〜500万個含まれるのがより好ましい。
【0035】
気泡径やその分布の測定には、一般的な液体中の気泡径や気泡数の測定法が利用できる。例えば、数μm〜数十μm以上の比較的大きい気泡であれば、気泡供給部近傍にパイレックス(登録商標)ガラス製や石英ガラス製の透明の窓を設け、溶融塩中の気泡又は窓に付着する気泡を顕微鏡などで直接観察しても良いし、アンモニア電解合成反応の障害とならない範囲でコールタカウンタ法(気泡を含む溶融塩の電気抵抗の変化を測定して気泡径分布を求める方法)により気泡径分布を測定しても良い。また、ナノメートルサイズの非常に微細な気泡の場合には、光散乱法(半導体レーザーなどを溶融塩中に照射し、その散乱光から単位時間当たりに通過した気泡の分布を求める方法)を利用して、気泡径分布を測定できる。
【0036】
微細化された水蒸気を発生させる方法は特に限定されない。例えば、ミクロンオーダーの気泡の場合には、パイレックス(登録商標)製や高純度アルミナ製の多孔質部材を通過させる方法が挙げられる。サブミクロンオーダー以下の微細な気泡を得るには、超音波印加等で水蒸気気泡を更に微細化させれば良い。
【0037】
微細化された水蒸気の温度は限定されないが、溶融塩の温度を低下させないために溶融塩の温度近くまで予備的に加熱しておくのが好ましいが、水蒸気とN3−との反応熱により比較的低温の水蒸気を吹き込んだ場合でも浴温の低下を抑制することはできる。水蒸気は別途ヒーターなどにより加熱しても良く、水蒸気の流路を溶融塩浴中に設置することで溶融塩浴により加熱しても良い。
【0038】
(溶融塩を撹拌する手段)
本発明装置は、溶融塩にガス成分を供給し、ガス成分を含む溶融塩の上昇流によって溶融塩を撹拌する手段を有する。この手段は、ガス成分を溶融塩に供給し、ガス供給部の溶融塩が周囲の溶融塩よりも見かけの密度が小さくなることにより浮力を生じさせ、ガス供給部の溶融塩に上昇流が生じること(ガスリフト)によって溶融塩を撹拌する。溶融塩を流動させる方法としては、プロペラなどの駆動部を設ける方法もあり、本発明装置は、当該駆動部を併用することもできる。
【0039】
ガス成分の供給口は電解浴の底部又は底部近傍に設けることが好ましい。このように、ガス成分が溶融塩中を上昇する距離を多く確保することにより効率的に撹拌できる。このような電解浴の撹拌は、陰極で生じるN3−をアンモニア生成部に効率的に移動させる点、N3−を水蒸気と接触させる効率を高める点、及び電解合成によって副生されるO2−を陽極に移動させて酸素ガスとして排出する効率を高める点で好ましい。
【0040】
ガスリフトに用いるガス成分としては、例えば、前記水蒸気を利用できる。即ち、アンモニア合成に用いる水蒸気をガスリフトに利用して溶融塩を撹拌しても良い。但し、微細な気泡は、一般に液体中での浮上速度が極めて遅いため、未反応の微細な水蒸気の気泡が溶融塩に残存した場合、浴外に容易に脱離されず、対流する浴内を循環し、陰極反応の障害になる可能性が高くなる。また、水蒸気はアンモニア生成反応により消費されて気泡径は徐々に小さくなる場合が多いことや、水蒸気の過剰の供給はアンモニア生成反応の障害になる可能性がある。そこで、溶融塩の流速を大きくするためには、アルゴンガス、ヘリウムガス、窒素ガス等の不活性ガスによりガスリフトさせることが好ましい。このような不活性ガスは、水蒸気と混合して又は水蒸気と別途に供給することができる。
【0041】
電解合成により生じたアンモニアは、溶融塩中に溶け込みやすいことから、この点でも、不活性ガスの吹込みにより、アンモニアを積極的に溶融塩中から追い出すことが好ましい。このような不活性ガスの気泡は、前記の水蒸気気泡のように微細な気泡である必要はない。不活性ガスの気泡の気泡径は限定されないが、1μm〜300mmが好ましく、30μm〜100mmがより好ましい。
【0042】
不活性ガスを併用する場合の水蒸気と不活性ガスの比は限定的ではない。ガスリフトによる溶融塩の流動速度と、陰極からのN3−供給速度に応じて適宜設定すればよい。ガスリフトによる溶融塩の流動速度は、陽極においてO2−の大部分が酸素ガスとして系外に排出されるのに適した速度が好ましい。また、陰極からアンモニア生成部へのN3−供給速度は、陰極でのN3−生成速度と溶融塩の流動速度に左右されるが、陰極電流値から求められる陰極でのN3−生成速度から、単位時間当たりに必要となるH2O供給量が算出できるので、これに基づいて水蒸気流量と不活性ガス流量を設定するのが好ましい。
【0043】
以下に実施態様1、実施態様2を例示して本発明装置を具体的に説明する。
【0044】
(実施態様1)
本発明装置の一例(図1)を実施態様1として説明する。
【0045】
実施態様1では、溶融塩はループ内を循環し、その駆動力は不活性ガス供給によるガスリフトである。多孔質陰極で生成したN3−は、ガスリフトで生じた溶融塩の流動により多孔質陰極内部を通過する溶融塩の流れに乗って、ガスリフトによる溶融塩駆動部と同一箇所であるアンモニア生成部に運ばれる。このアンモニア生成部では、微細な水蒸気の気泡が供給されており、浴上部に到達するまでにほぼ全ての水蒸気はN3−と反応してアンモニアを生成する。生成したアンモニアは、未反応の微細な水蒸気の気泡とともに、ガスリフトの駆動力となった不活性ガスにより気相中へと排出され、後述するアンモニア精製工程へと運ばれる。一方、アンモニア生成反応により副成するO2−は、溶融塩の流れに乗って陽極へと運ばれる。この陽極部では、陽極上の凹凸により溶融塩流量に対する陰極面積の割合を増大させており、また溶融塩厚みを数mm程度の薄い液膜とすることで、陽極上で発生する酸素ガスが気相中へと速やかに排出される。陽極部を通過した溶融塩は、引き続き多孔質陰極内部へと送られる。
【0046】
上記装置を用いて電解を行うことにより、電解浴中では、下記の反応が進行する。
【0047】
N3−+3/2H2O → NH3+3/2O2−
つまり、アンモニア電解合成の全反応は、次の通りである。
【0048】
1/2N2+3/2H2O → NH3+3/4O2
上反応式から計算される理論分解電圧は600Kで1.17Vである。例えば、LiCl−KCl系で例示するならば、陽極は2.8V(Li+/Li電位に対する表記、以下同様)程度よりも貴な電位領域に、陰極は0.6V程度よりも卑な電位領域に設定すればよい。この場合、極間電圧2.2V以上で合成反応は進行することになり、理論分解電圧よりも1.0V程度大きい値となる。この原因は、H2OとN3−からのアンモニア生成反応が溶融塩中で自発的に進行していることが理由であり、このアンモニア生成反応を電気化学的に生じさせることで、電解電圧を理論分解電圧に大幅に近づけることができる。
【0049】
(実施態様2)
本発明装置の一例(図2)を実施態様2として説明する。
【0050】
実施態様2は、電解槽Aと電解槽Bの2つの電解槽を用いて、槽間を水素透過性金属膜により隔てている。
【0051】
図2の装置を用いて電解を行うことにより、電解槽A側では、次の反応が進行する。
【0052】
陽極反応:3O2− → 3/2O2+6e−
陰極反応:3H2O+6e− → 3O2− +6H (a)
全反応A :3H2O → 3/2O2 +6H
即ち、水素透過性金属膜の電解槽A側では、水の電気分解により原子状の水素が金属膜へと吸蔵されて、金属膜内を電解槽B側へと拡散する。一方、電解槽B側では、次の反応が進行する。
【0053】
陽極反応:6H+2N3−→2NH3+6e−
陰極反応:N2+6e− → 2N3− (b)
全反応B :N2+6H → 2NH3
即ち、金属膜内を電解槽B側へと拡散してきた水素原子は、電解槽Bの浴中のN3−と電気化学的に反応し、NH3を生成する。この場合の、両電解槽で必要となる電解電圧は、約1.2V程度である。このことは、溶融塩中で自発的に進む、
H2O+N3−→NH3+O2−
なる反応を、上記の陰極反応(a)と陽極反応(b)により電気化学的に進行させることで、約1.0V程度の電圧が回収できたことに等しい。この場合の電解槽Aの溶融塩には、前述した溶融塩の他に、溶融水酸化物もしくは溶融水酸化物−H2O系のものが利用できる。このような金属水酸化物としてはアルカリ金属の水酸化物が好ましく、特にNaOH、KOHがより好ましい。また、電解槽Aでは、プロトン導電性の固体電解質も利用できる。
【0054】
(アンモニア精製手段)
電解合成によりアンモニアが得られるが、回収ガスには通常アンモニア以外の不純物も含まれているため、精製により高純度のアンモニアを得ることが好ましい。
【0055】
回収ガスに含まれる可能性のある不純物は、(イ)溶融塩蒸気、(ロ)未反応水蒸気、(ハ)不活性ガス(陰極で使用する窒素ガスを含む)である。なお、精製により上記(イ)〜(ハ)を除去する際は、(イ)→(ロ)→(ハ)の順で除去するのが好ましい。
(イ)溶融塩蒸気の除去
溶融塩蒸気は、溶融塩の融点以下に達した時点で凝結・固化が始まり、ガス回収ラインに到達した時点では全てが微粒子状に固化した状態にある。従って、常温〜150℃程度に保持した粉塵フィルター等で容易に除去可能である。なお、ガス回収ライン中で結露が生じた場合、生成アンモニアが結露に吸収されてアンモニア収率の低下や配管の劣化を招くおそれがあるため、電解セル〜電解質回収部間は、少なくとも80℃程度以上に保持し、結露を防ぐのが好ましい。
(ロ)未反応水蒸気の除去
未反応水蒸気は、0℃以下(好ましくは−5℃以下)に保持した冷却機を使用して速やかに固化させることが好ましい。これは、溶融塩が凝結した水滴に溶解し、凝固点降下によって固化速度が低下するのを防ぐ為であり、また凝結した水滴に生成アンモニアが吸収されて収率の低下や冷却機の劣化を防ぐ為である。冷却の方法は、気化熱を利用したり、ペルチェ効果を利用するなど、一般的なガス流体の冷却方法が利用できる。例えば、水蒸気を含むアンモニアガスを冷却した構造体に吹き付けて構造体上に氷の膜として回収しても良いし、冷却された不活性ガスを吹き付けることで氷の粒子として回収しても良い。
(ハ)不活性ガス(陰極で使用する窒素ガスを含む)の除去
不活性ガスは、精製手段の最後で除去することが好ましい。アンモニアは、常圧下でも−33℃で液化するため、この特徴を利用し、例えば、−40℃程度以下に晒すことで液体のアンモニアと不活性ガスとを分離できる。精製アンモニアをボンベ等の容器に一時保管することを考慮し、数気圧程度まで加圧すれば、より高温でアンモニアは液化する(8〜9気圧程度であれば常温でも液化する)ため、回収は容易となる。
【図面の簡単な説明】
【0056】
【図1】本発明のアンモニア電解合成装置の一例を示す模式図である。
【図2】本発明のアンモニア電解合成装置の一例を示す模試図である。
【特許請求の範囲】
【請求項1】
水と窒素とからアンモニアを電解合成する装置であって、前記装置は、
(1)電解浴である溶融塩に微細化された水蒸気とN3−とを供給することによって前記アンモニアを合成する装置であり、
(2)前記溶融塩にガス成分を供給し、前記ガス成分を含む前記溶融塩の上昇流によって前記溶融塩を撹拌する手段と、
(3)前記水蒸気の反応によって生じるO2−を酸化して酸素ガスを発生させる陽極と、
(4)窒素ガスを還元してN3−を発生させる陰極とを
有することを特徴とするアンモニア電解合成装置。
【請求項2】
前記溶融塩は、アルカリ金属ハロゲン化物及びアルカリ土類金属ハロゲン化物からなる群から選択される少なくとも1種である、請求項1に記載のアンモニア電解合成装置。
【請求項3】
前記微細化された水蒸気は、気泡径が100nm〜10mmである、請求項1又は2に記載のアンモニア電解合成装置。
【請求項4】
前記微細化された水蒸気は、前記溶融塩1cm3当たりに前記気泡が10個〜1000万個含まれるように供給される、請求項1又は2に記載のアンモニア電解合成装置。
【請求項5】
前記ガス成分は、不活性ガスを含む、請求項1〜4のいずれかに記載のアンモニア電解合成装置。
【請求項6】
前記ガス成分は、電解浴の底部又は底部近傍に設けられた供給口から供給される、請求項1〜5のいずれかに記載のアンモニア電解合成装置。
【請求項7】
前記電解合成により得られるアンモニア含有ガスから不純物を除去するトラップ手段を更に有する、請求項1〜6のいずれかに記載のアンモニア電解合成装置。
【請求項1】
水と窒素とからアンモニアを電解合成する装置であって、前記装置は、
(1)電解浴である溶融塩に微細化された水蒸気とN3−とを供給することによって前記アンモニアを合成する装置であり、
(2)前記溶融塩にガス成分を供給し、前記ガス成分を含む前記溶融塩の上昇流によって前記溶融塩を撹拌する手段と、
(3)前記水蒸気の反応によって生じるO2−を酸化して酸素ガスを発生させる陽極と、
(4)窒素ガスを還元してN3−を発生させる陰極とを
有することを特徴とするアンモニア電解合成装置。
【請求項2】
前記溶融塩は、アルカリ金属ハロゲン化物及びアルカリ土類金属ハロゲン化物からなる群から選択される少なくとも1種である、請求項1に記載のアンモニア電解合成装置。
【請求項3】
前記微細化された水蒸気は、気泡径が100nm〜10mmである、請求項1又は2に記載のアンモニア電解合成装置。
【請求項4】
前記微細化された水蒸気は、前記溶融塩1cm3当たりに前記気泡が10個〜1000万個含まれるように供給される、請求項1又は2に記載のアンモニア電解合成装置。
【請求項5】
前記ガス成分は、不活性ガスを含む、請求項1〜4のいずれかに記載のアンモニア電解合成装置。
【請求項6】
前記ガス成分は、電解浴の底部又は底部近傍に設けられた供給口から供給される、請求項1〜5のいずれかに記載のアンモニア電解合成装置。
【請求項7】
前記電解合成により得られるアンモニア含有ガスから不純物を除去するトラップ手段を更に有する、請求項1〜6のいずれかに記載のアンモニア電解合成装置。
【図1】


【図2】




【図2】


【公開番号】特開2009−84615(P2009−84615A)
【公開日】平成21年4月23日(2009.4.23)
【国際特許分類】
【出願番号】特願2007−253970(P2007−253970)
【出願日】平成19年9月28日(2007.9.28)
【出願人】(503027931)学校法人同志社 (346)
【出願人】(506360310)アイ’エムセップ株式会社 (17)
【Fターム(参考)】
【公開日】平成21年4月23日(2009.4.23)
【国際特許分類】
【出願日】平成19年9月28日(2007.9.28)
【出願人】(503027931)学校法人同志社 (346)
【出願人】(506360310)アイ’エムセップ株式会社 (17)
【Fターム(参考)】
[ Back to top ]

