イオン交換クロマトグラフィによるタンパク質精製
【課題】ポリペプチド及び少なくとも1つの汚染物質を含有する組成物からイオン交換クロマトグラフィー法を用いて精製する方法を提供する。
【解決手段】連続的に実施される以下の工程:(a)当該ポリペプチドを、第1の伝導率及びpHの負荷バッファーを用いてイオン交換材料に結合させ;(b)当該イオン交換材料を第2の伝導率及び/又はpHの中間バッファーで洗浄して汚染物質をイオン交換材料から溶離し;(c)当該イオン交換材料を第3の伝導率及び/又はpHの洗浄バッファーで洗浄し、ここで、中間バッファーから洗浄バッファーへの伝導率及び/又はpHの変化が、負荷バッファーから中間バッファーへの伝導率及び/又はpHの変化と反対方向であり;(d)当該イオン交換材料を第4の伝導率及び/又はpHの溶離バッファーで洗浄してポリペプチドをイオン交換材料から溶離する。
【解決手段】連続的に実施される以下の工程:(a)当該ポリペプチドを、第1の伝導率及びpHの負荷バッファーを用いてイオン交換材料に結合させ;(b)当該イオン交換材料を第2の伝導率及び/又はpHの中間バッファーで洗浄して汚染物質をイオン交換材料から溶離し;(c)当該イオン交換材料を第3の伝導率及び/又はpHの洗浄バッファーで洗浄し、ここで、中間バッファーから洗浄バッファーへの伝導率及び/又はpHの変化が、負荷バッファーから中間バッファーへの伝導率及び/又はpHの変化と反対方向であり;(d)当該イオン交換材料を第4の伝導率及び/又はpHの溶離バッファーで洗浄してポリペプチドをイオン交換材料から溶離する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は一般的にタンパク質精製に関する。特に本発明は、ポリペプチド(例えば抗体)を、当該ポリペプチド及び少なくとも1つの汚染物質を含有する組成物からイオン交換クロマトグラフィー法を用いて精製する方法に関する。
【背景技術】
【0002】
タンパク質の大規模で経済的な精製は、バイオテクノロジー工業にとって重要な問題となってきている。一般的に、タンパク質は、そのタンパク質に対する遺伝子を含む組換えプラスミドの挿入により対象とするタンパク質を生産するように加工された哺乳動物又は最近細胞系を用いて、細胞培養により製造される。用いられる細胞系は生きている生物であるので、それらには、通常は動物血清の調製物から供給される糖、アミノ酸、及び成長因子を含む複合成長媒体を与えなければならない。細胞に与えられる化合物類から及び細胞自体の副生成物から所望のタンパク質を精製してヒト治療用として使用するのに十分な純度とすることは手強い難問を提出する。
細胞細片からのタンパク質の精製方法は、まず最初にタンパク質の発現部位に依存する。幾つかのタンパク質は細胞から周囲の培地中に直接分泌され;他は細胞内で作られる。後者のタンパク質については、精製プロセスの第1の工程は細胞の溶解を含み、それは、機械的せん断、浸透圧ショック、又は酵素的処理を含む種々の方法で実施できる。このような破壊は細胞内容物全てをホモジネート中に放出させ、さらに細胞下断片を生成し、それらはサイズが小さいために除去が困難である。これらは一般に、差動的遠心分離又は濾過により除去される。同じ問題は、スケールは小さいものの、タンパク質製造の実行中での細胞の自然死及び細胞内宿主細胞タンパク質の放出により直接分泌タンパク質でも生じる。
【0003】
対象とするタンパク質を含有する透明化溶液が得られたら、細胞によって生産された他のタンパク質からのその分離は、通常は異なるクロマトグラフィー技術の組み合わせによってなされる。これらの技術は、タンパク質の混合物を、それらの電荷、疎水性度、又はサイズに基づいて分離する。これらの技術の各々には幾つかの異なるクロマトグラフィー樹脂が利用可能であり、含まれる特定のタンパク質に対する精製スキームの精密な設計が可能になる。これらの各分離法の本質は、タンパク質が、長いカラムの下方へ異なる速度で移動し、カラムの更に下方へ通過するときに増加する物理的分離を達成すること、あるいは分子媒体に選択的に接着し、次いで異なる溶媒により別々に溶離されることである。幾つかの場合では、不純物はカラムに接着するが対象とするタンパク質はしないとき、即ち、対象とするタンパク質が「流通」中に存在するときに対象とするタンパク質が不純物から分離される。
イオン効果クロマトグラフィーはタンパク質精製に通常使用されるクロマトグラフィー技術である。イオン交換クロマトグラフィーでは、溶質の表面上の荷電パッチがクロマトグラフィーマトリクスに反対電荷によって結合するが、周囲のバッファーのイオン強度は低い。溶離は、バッファーのイオン強度(即ち、伝導率)を上昇させ、イオン交換マトリクスの荷電部位に対して溶質と競合させることにより達成される。pHを変化させ、それにより溶質の電荷を変化させることは、溶質の溶離を達成する他の方法である。伝導率又はpHの変化は、徐々に(勾配溶離)又は段階的に(段階溶離)してよい。以前は、これらの変化は進行性;即ち、pH又は伝導率が一方向に増加又は減少するものであった。
【発明の概要】
【0004】
本発明は、最初の伝導率及びpHにおいて対象とするポリペプチドがイオン交換材料に結合し、次いでイオン交換材料を伝導率又はpH、又は両方が異なる中間バッファーで洗浄するイオン交換クロマトグラフィー法を提供する。この中間洗浄に続く特定の時点で、そしてイオン交換クロマトグラフィーの標準的な実務に反して、イオン交換材料を洗浄バッファーで洗浄するが、中間バッファーから洗浄バッファーへの伝導率又はpH、又は両方の変化が、上記工程でなされた伝導率又はpH、又は両方の変化と逆方向である。洗浄バッファーでの洗浄後のみに、上記工程で使用されたバッファーの伝導率又はpH、又は両方と異なる伝導率又はpH、又は両方を有する溶離バッファーの適用で溶離される対象ポリペプチド分子のためのイオン交換材料が調製される。
【0005】
イオン交換クロマトグラフィーのこの新規な方法は、生成分子を極めて密接に関連した分子から、ポリペプチド生成物の純度及び高い回収が望まれる完全製造スケールで分離しなければならない状況で特に有用である。
【0006】
従って、本発明は、連続的に実施される以下の工程を含んでなる、ポリペプチドを、当該ポリペプチド及び汚染物質を含有する組成物から単離する方法を提供する:
(a)当該ポリペプチドを、第1の伝導率及びpHの負荷バッファーを用いてイオン交換材料に結合させ;
(b)当該イオン交換材料を第2の伝導率及び/又はpHの中間バッファーで洗浄して汚染物質をイオン交換材料から溶離し;
(c)当該イオン交換材料を第3の伝導率及び/又はpHの洗浄バッファーで洗浄し、ここで、中間バッファーから洗浄バッファーへの伝導率及び/又はpHの変化が、負荷バッファーから中間バッファーへの伝導率及び/又はpHの変化と反対方向であり;そして
(d)当該イオン交換材料を第4の伝導率及び/又はpHの溶離バッファーで洗浄してポリペプチドをイオン交換材料から溶離する。第1の伝導率及び/又はpHは第3の伝導率及び/又はpHと同じであってもよい。
【0007】
イオン交換材料がカチオン交換樹脂である場合、中間バッファーの伝導率及び/又はpHは好ましくは負荷バッファーの伝導率及び/又はpHよりも大きく;洗浄バッファーの伝導率及び/又はpHは好ましくは中間バッファーの伝導率及び/又はpHよりも小さく、溶離バッファーの伝導率及び/又はpHは好ましくは中間バッファーの伝導率及び/又はpHより大きい。好ましくは、洗浄バッファーの伝導率及び/又はpHは負荷バッファーの伝導率及び/又はpHとほぼ同じである。
好ましくは、汚染物質及びポリペプチドの溶離は、各々中間バッファー及び溶離バッファーの伝導率の変更によって達成されるが、これらのバッファーのpHはほぼ同じに維持される。
【0008】
また本発明は、連続的に実施される以下の工程を含んでなる、ポリペプチドを、当該ポリペプチド及び汚染物質を含有する組成物から単離する方法を提供する:
(a)当該ポリペプチドを、第1の伝導率及びpHの負荷バッファーを用いてカチオン交換材料に結合させ;
(b)当該カチオン交換材料を、負荷バッファーのものより大きな第2の伝導率及び/又はpHの中間バッファーで洗浄して汚染物質をイオン交換材料から溶離し;
(c)当該カチオン交換材料を、中間バッファーのものより小さな第3の伝導率及び/又はpHの洗浄バッファーで洗浄し;そして
(d)当該イオン交換材料を、中間バッファーのものより大きな第4の伝導率及び/又はpHの溶離バッファーで洗浄してポリペプチドをイオン交換材料から溶離する。
【0009】
さらに本発明は、抗体を、当該抗体及び汚染物質を含有する組成物から精製する方法において、当該組成物をカチオン交換樹脂上に負荷すること、場合によっては抗体をカチオン交換樹脂から溶離することをさらに含んでなり、カチオン交換樹脂上に負荷される抗体の量が、カチオン交換樹脂1mL当たりに約20mgから約35mgの抗体である方法を提供する。この方法は、好ましくはイオン交換樹脂から一又は複数の汚染物質を溶離する中間洗浄工程をさらに含む。この中間洗浄工程は、通常は抗体の溶離工程より先行する。
さらに本発明は、抗-HER2抗体及び一又は複数のその酸性変異体を含む組成物を提供し、当該組成物中の酸性変異体の量は約25%未満、好ましくは約20%未満、例えば約1%から約18%の範囲である。場合によっては、この組成物は製薬的に許容される担体をさらに含んでいる。
【図面の簡単な説明】
【0010】
【図1】伝導率の(例えば下記実施例1のNaCl濃度への)変化又はpHの(例えば流れ図に示したpH値への)変化によりカチオン交換クロマトグラフィーを実施する方法を示す流れ図である。
【図2】伝導率の(例えば図に示したNaCl濃度への)変化又はpHの(例えば示したpH値への)変化によりアニオン交換クロマトグラフィーを実施する方法を示す流れ図である。
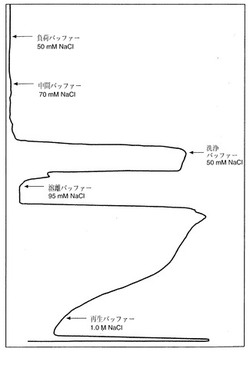
【図3】実施例1で実行した完全製造スケールでのカチオン交換クロマトグラフィーからの吸収履歴を示す図である。ここに記載する異なるバッファーでカラムを洗浄した点を矢印で示した。
【図4】各クロマトグラフィー分画において回収された組換えヒト化抗-HER2モノクローナル抗体(rhuMAb HER2)を示す図である(関連するクロマトグラフィーの全ての画分合計の割合として計算した)。流通、洗浄工程、及びプレプールは、負荷開始からプールの最初までに回収した全ての流出物である。プール画分は、先行ショルダーの変曲点で開始する溶離の5カラム容量の流出試料である。再生画分は、プール終了から再生終了までに捕捉した流出物を含む。
【図5】カルボキシスルホン交換高圧液体クロマトグラフィー(CSx HPIEX)によって評価した場合の、各カチオン交換クロマトグラフィープール試料中のrhuMAb HER2の量を示す図である。ピークa、b、及び1は、rhuMAb HER2の脱アミド化形態である。ピーク3は非脱アミド化rhuMAb HER2である。ピーク4は、rhuMAb HER2のC-末端リジン含有及びイソ-アスパラギン酸変異体の組み合わせである。
【図6】各クロマトグラフィーについての0.025M MES / 0.070M NaCl, pH 5.6洗浄の吸収(280nm)プロフィールを示す図である。カチオン交換樹脂に負荷したrhuMAb HER2の質量が、頂点におけるピークの吸収レベル並びに頂点に達するのに要するバッファーの量に影響する。この洗浄において生ずる小さなピーク(30mg/mL負荷で最も良く見える)により、頂点は少なくとも0.5吸収単位(AU)の吸収レベルと定義される。
【図7A】humMAb4D5-8軽鎖(配列番号:1)のアミノ酸配列を示す図である。
【図7B】humMAb4D5-8重鎖(配列番号:2)のアミノ酸配列を示す図である。
【発明を実施するための形態】
【0011】
(好ましい実施態様の詳細な説明)
定義:
ここで精製されるべき「組成物」は、対象とするポリペプチド及び一または複数の汚染物質を含む。この組成物は「部分的に精製」(即ち、下記の実施例1におけるようにプロテインAクロマトグラフィー等の一または複数の精製工程を施され)ていてもよく、あるいは、ポリペプチドを産生する宿主細胞または生物から直接に得てもよい(例えば、組成物は回収した細胞培養液を含んでいてもよい)。
ここで用いられる「ポリペプチド」は、一般的には約10より多いアミノ酸を有するペプチド及びタンパク質を意味する。好ましくは、ポリペプチドは哺乳動物タンパク質であり、その例は、例えば、レニン;ヒト成長ホルモン及びウシ成長ホルモンを含む成長ホルモン;成長ホルモン放出因子;副甲状腺ホルモン;甲状腺刺激ホルモン;リポタンパク;アルファ−1−アンチトリプシン;インシュリンA−鎖;インシュリンB−鎖;プロインシュリン;卵胞刺激ホルモン;カルシトニン;黄体形成ホルモン;グルカゴン;因子VIIIC、因子IX、組織因子、及びvonWillebrands因子等の凝固因子;プロテインC等の抗凝固因子;心房性ナトリウム利尿因子;肺界面活性剤;ウロキナーゼ又はヒト尿又は組織型プラスミノーゲン活性化剤(t−PA)等のプラスミノーゲン活性化剤;ボンベシン;トロンビン;造血性成長因子;腫瘍壊死因子−アルファ及びベータ;エンケファリナーゼ;RANTES(正常なT細胞発現及び分泌での調節);ヒトマクロファージ感染タンパク質(MIP-1-アルファ);ヒト血清アルブミン等の血清アルブミン;ミューラー阻害物質;リラキシンA−鎖;リラキシンB−鎖;プロリラキシン;マウスゴナドトロピン関連ペプチド;ベータ−ラクタマーゼ等の微生物タンパク質;DNA分解酵素;IgE;CTLA−4等の細胞毒性Tリンパ球関連抗原(CTLA);インヒビン;アクチビン;血管内皮成長因子(VEGF);ホルモン又は成長因子のレセプター;プロテインA又はD;リウマチ因子;骨誘導神経向性因子(BDNF)、ニューロトロフィン−3、−4、−5又は−6(NT−3、NT−4、NT−5、又はNT−6)、又はNGF−β等の神経成長因子などの神経向性因子;血小板誘導成長因子(PDGF);aFGF及びbFGF等の繊維芽成長因子;表皮成長因子(EGF);TGF−β1、TGF−β2、TGF−β3、TGF−β4、又はTGF−β5を含むTGF−アルファ及びTGF−ベータ等のトランスホーミング増殖因子(TGF);インシュリン様成長因子−I及び−II(IGF−I及びIGF−II);des(1−3)−IGF−I(脳IGF−I)、インシュリン様成長因子結合タンパク質(IGFBPs);CD3、CD4、CD8、CD19及びCD20等のCDタンパク質;エリスロポエチン;骨誘導因子;免疫毒素;骨形成タンパク質(BMP);インターフェロン−アルファ、−ベータ、及び−ガンマ等のインターフェロン;コロニー刺激因子(CSFs)、例えば、M−CSF、GM−CSF、及びG−CSF;インターロイキン(ILs)、例えば、IL−1〜IL−10;スーパーオキシドジスムターゼ;T細胞レセプター;表面膜タンパク質;崩壊促進因子;ウイルス性抗原、例えば、AIDSエンベロープの一部など;輸送タンパク質;ホーミングレセプター;アドレシン(addressins);調節タンパク質;CD11a、CD11b、CD11c、CD18,ICAM、VLA−4及びVCAM等のインテグリン;HER2、HER3またはHER4レセプター等の腫瘍関連抗原;及び上に列挙した任意のポリペプチドの断片及び/又は変異体を含む。最も好ましいのは、ヒトHER2に結合する全長抗体である。
【0012】
「汚染物質」とは、所望のポリペプチド生成物とは異なる物質である。汚染物質は、所望のポリペプチドの変異体(例えば、所望のポリペプチドの脱アミド変異体またはアミノ−アスパラギン酸変異体)または他のポリペプチド、核酸、エンドトキシン等でありうる。
出発ポリペプチドの「変異体」または「アミノ酸変異体」は、出発ポリペプチドのアミノ酸配列と異なるアミノ酸配列を含むポリペプチドである。一般的に、変異体は天然ポリペプチドと少なくとも80%の配列同一性、好ましくは少なくとも90%の配列同一性、より好ましくは少なくとも95%の配列同一性、最も好ましくは少なくとも98%の配列同一性を有する。パーセント配列同一性は、例えば、Fitch等, Proc. Natl. Acad. Sci. USA 80: 1382-1386 (1983)、Needleman等, J. Mol. Biol. 48: 443-453 (1970)に記載されたバージョンのアルゴリズムにより、最大の相同性を与えるように配列を整列させた後に決定される。ポリペプチドのアミノ酸配列変異体は、ポリペプチドをコードするDNAに適当な核酸変化を導入することにより、あるいはペプチド合成により調製される。このような変異体は、例えば、対象とするポリペプチドのアミノ酸配列内残基からの欠失、及び/又はそれへの挿入及び/又はその置換を含む。最終的な作成物に到達する欠失、挿入、及び置換の任意の組み合わせが、最終作成物が所望の特徴を持つ限りなされる。また、アミノ酸変化は、グリコシル化部位の数又は位置の変更といったポリペプチドの翻訳後プロセスを変えてもよい。ポリペプチドのアミノ酸配列変異体の生成方法は、例えば米国特許第5,534,615号に記載され、ここに出典明示して参考として取り入れる。
【0013】
「酸性変異体」は、対象とするポリペプチドの変異体であって、対象とするポリペプチドより酸性(例えば、カチオン交換クロマトグラフィーで決定)であるものである。酸性変異体の例は脱アミド化変異体である。
ポリペプチド分子の「脱アミド化変異体」は、最初のポリペプチドの一又は複数のアスパラギン残基がアスパラギン酸に変換された、即ち、中性アミド側鎖が全体として酸性特性を持つ残基に変換されたポリペプチドである。下記の実施例からの脱アミド化humMAb4D5抗体は、そのVL領域の一方又は両方のCDR1におけるAsn30がアスパラギン酸に変換されている。ここで用いられる「脱アミド化ヒトDNase」は、天然成熟ヒトDNaseのアミノ酸配列の位置74で生ずるアスパラギン残基で脱アミドされたヒトDNaseを意味する(米国特許第5,279,823号;出典明示してここに参考として取り入れる)。
抗-HER2抗体を含む組成物を参照してここで用いられる「混合物」とは、所望の抗-HER2抗体及びその一又は複数の酸性変異体の存在を意味する。酸性変異体は、主に脱アミド化抗-HER2抗体を含み、少量の他の酸性変異体を含んでもよい。例えば、組換え発現から得た抗-HER2抗体の調製では、抗-HER2抗体の約25%までが脱アミド化されていることが見いだされた。
【0014】
本発明の好ましい実施態様では、ポリペプチドは組換えポリペプチドである。「組換えポリペプチド」は、ポリペプチドをコードする核酸で形質転換又は形質移入された又は相同組換えの結果としてポリペプチドを産生する宿主細胞において産生されたものである。「形質転換」及び「形質移入」は、細胞に核酸を導入するプロセスを指すのに交換可能に用いられる。形質転換又は形質移入に続いて、核酸は宿主細胞ゲノムに組み込まれるか、染色体外成分として存在する。「宿主細胞」は、インビトロ細胞培養における細胞並びに宿主細胞内の細胞を含む。ポリペプチドの組換え生産の方法は、例えば米国特許第5,534,615号に記載され、出典明示してここに参考として取り入れる。
「抗体」という用語は最も広い意味において使用され、特にモノクローナル抗体(全長モノクローナル抗体を含む)、ポリクローナル抗体、多重特異性抗体(例えば、二重特異性抗体)、及び抗体断片を、それらが所望の生物学的特性を有する限り包含する。
【0015】
ここでいう抗体は対象とする「抗原」に対するものである。好ましくは、抗原は生物学的に重要なポリペプチドであり、病気又は疾患に罹っている哺乳動物への抗体の投与によりその哺乳動物に治療的恩恵が生じうる。しかし、非ポリペプチド抗原に対する抗体(例えば腫瘍関連糖脂質抗原;米国特許第5,091,178号参照)もまた考えられる。抗原がポリペプチドである場合、それは膜貫通分子(例えば、レセプター)あるいはリガンド、例えば成長因子でありうる。抗原の例には、上で議論したポリペプチドが含まれる。本発明により包含される抗体に対する好適な分子標的には、CDポリペプチド、例えばCD3、CD4、CD8、CD19、CD20及びCD34;HERレセプターファミリーのメンバー、例えばEGFレセプター、HER2、HER3又はHER4レセプター;細胞接着分子、例えばLFA-1、Mac1、p150.95、VLA-4、ICAM-1、VCAM及びそのα又はβサブユニットの何れかを含むav/β3インテグリン(例えば、抗CD11a、抗CD18又は抗CD11b抗体);成長因子、例えばVEGF;IgE;血液型抗原;flk2/flt3レセプター;肥満(OB)レセプター;mplレセプター;CTLA-4;ポリペプチドC等々が含まれる。場合によっては他の分子に抱合していてもよい、可溶型抗原又はその断片を、抗体を産生するための免疫原として使用することができる。レセプターのような膜貫通分子に対しては、これらの断片(例えば、レセプターの細胞外ドメイン)を免疫原として使用することができる。あるいは、膜貫通分子を発現する細胞を免疫原として使用することもできる。そのような細胞は天然源(例えば、癌株化細胞)から取り出すことができ、又は膜貫通分子を発現するために組み換え技術により形質転換された細胞でありうる。
【0016】
ここで使用される「モノクローナル抗体」という用語は、実質的に均一な抗体の集団から得られる抗体を称する、すなわち、集団を構成する個々の抗体が、少量存在しうる自然に生じる可能な突然変異を除いて同一である。モノクローナル抗体は高度に特異的であり、一つの抗原部位に対応する。更に、異なる決定基(エピトープ)に対応する異なる抗体を典型的に含む従来の(ポリクローナル)抗体調製物とは異なり、各モノクローナル抗体は抗原の単一の決定基に対応する。「モノクローナル」との形容は、実質的に均一な抗体集団から得られたという抗体の性質を示し、抗体を何か特定の方法で生産しなければならないことを意味するものではない。例えば、本発明に従って使用されるモノクローナル抗体は、最初にKohler等によって、Nature, 256: 495 (1975)に記載されたハイブリドーマ法によって作ることができ、あるいは組換えDNA法(例えば米国特許第4,816,567号参照)によって作ることができる。さらなる実施態様では、「モノクローナル抗体」は、例えば、McCafferty等, Nature, 348:552-554(1990)に記載された技術を用いて作成された抗体ファージライブラリから単離することができる。Clackson等, Nature, 352:624-628 (1991)及びMarks等, J. Mol. biol. 222: 581-597 (1991)は、各々ファージライブラリを用いたマウス及びヒト抗体を単離を記載している。続く文献は、鎖混合による高親和性(nM範囲)ヒト抗体の生成(Marks等, Bio/Technology, 10: 779-783 (1992))、並びに非常に大きなファージライブラリの作成方法としての組み合わせ感染及びインビボ組換えを記載している(Waterhouse等, Nuc. Acid. Res., 21: 2265-2266 (1993))。即ち、これらの技術は、モノクローナル抗体の単離のための伝統的なモノクローナル抗体ハイブリドーマ技術の別法として利用可能である。あるいは、免疫時に、内因性免疫グロブリンの産生なしにヒト抗体の全レパートリーを産生することのできるトランスジェニック動物(例えば、マウス)を作ることが今は可能である。例えば、キメラ及び生殖系列突然変異体マウスにおける抗体重鎖結合領域(JH)遺伝子の同型接合除去が内因性抗体産生の完全な阻害をもたらすということが記載されている。このような生殖系列突然変異体マウスでのヒト生殖系列免疫グロブリン遺伝子列の転移は、抗原投与時にヒト抗体の産生をもたらすであろう。例えば、Jakobovits等, Proc.Natl.Acad.Sci.USA, 90:2551 (1993);Jakobovits等, Nature 362:255-258 (1993); Bruggerman等, Year in Immuno., 7:33 (1993);及びDuchosal等, Nature 355:258 (1992)を参照されたい。
【0017】
ここに記載のモノクローナル抗体は、特に、重鎖及び/又は軽鎖の一部が、特定の種から由来するか、特定の抗体クラス又はサブクラスに属する抗体の対応する配列と同一か相同である一方、鎖の残りが、他の種から由来するか、他の抗体クラス又はサブクラスに属する抗体の対応する配列と同一か相同である「キメラ」抗体(免疫グロブリン)、並びにそれらが所望の生物学的活性を示す限りはその抗体の断片を含む(米国特許第,4816,567号;及びMorrison等, Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984))。
ここで使用される場合の「高頻度可変領域」なる用語は、抗原結合性を生じる抗体のアミノ酸残基を意味する。高頻度可変領域は「相補性決定領域」又は「CDR」からのアミノ酸残基(即ち、軽鎖可変ドメインの残基24−34(L1)、50−56(L2)及び89−97(L3)及び重鎖可変ドメインの31−35(H1)、50−65(H2)及び95−102(H3);Kabat等, Sequences of Proteins of Immunological Interest,5版, Public Health Service, National Institutes of Health, Bethesda, MD.(1991))及び/又は「高頻度可変ループ」からの残基(すなわち、軽鎖可変ドメインの残基26−32(L1)、50−52(L2)及び91−96(L3)及び重鎖可変ドメインの残基26−32(H1)、53−55(H2)及び96−101(H3);Chothia及びLesk J.Mol.Biol. 196:901-917 (1987))を含んでなる。「フレームワーク」又は「FR」残基はここに定義した高頻度可変領域残基以外の可変ドメイン残基である。下記実施例のrhuMAb HER2抗体のCDR及びFR残基(humAb4D5-8)は、Carter等, Proc. Natl. Acad. Sci. USA, 89: 4285 (1992)で同定されている。
【0018】
非ヒト(例えばマウス)抗体の「ヒト化」型は、非ヒト免疫グロブリンに由来する最小配列を含むキメラ抗体である。大部分においてヒト化抗体はレシピエントの高頻度可変領域からの残基が、マウス、ラット、ウサギ又は所望の特異性、親和性及び能力を有する霊長類などの非ヒト(ドナー抗体)の高頻度可変領域からの残基によって置換されたヒト免疫グロブリン(レシピエント抗体)である。ある場合には、ヒト免疫グロブリンのFvフレームワーク領域(FR)残基は、対応する非ヒト残基によって置換されている。さらに、ヒト化抗体は、レシピエント抗体にも、もしくはドナー抗体にも見出されない残基を含んでもよい。これらの修飾は抗体の特性を更に洗練するために行われる。一般に、ヒト化抗体は、全てあるいはほとんど全ての高頻度可変ループが非ヒト免疫グロブリンのものに対応し、全てあるいはほとんど全てのFR領域がヒト免疫グロブリン配列のものである、少なくとも1つ、典型的には2つの可変ドメインの実質的に全てを含む。ヒト化抗体は、場合によっては免疫グロブリン定常領域(Fc)、典型的にはヒト免疫グロブリンのものの少なくとも一部を含んでなる。
抗原性を軽減するには、ヒト化抗体を生成するために使用するヒトの軽及び重可変ドメインの両方の選択が非常に重要である。いわゆる「ベストフィット法」では、齧歯動物抗体の可変ドメインの配列を既知のヒト可変ドメイン配列ライブラリ全体に対してスクリーニングする。齧歯動物のものと最も近いヒトの配列を次にヒト化抗体のヒトフレームワーク(FR)として受け入れる(Sims等, J. Immunol., 151: 2296 (1993);Chothia等, J. Mol. Biol., 196: 901 (1987))。
【0019】
他の方法では、軽鎖又は重鎖の特定のサブグループのヒト抗体全てのコンセンサス配列から誘導される特定のフレームワークを使用する。同じフレームワークを幾つかの異なるヒト化抗体に使用できる(Carter等, Proc. Natl. Acad. Sci. USA, 89: 4285 (1992);Presta等, J. Immunol., 151: 2623 (1993))。
さらに、抗体は、抗原に対する高親和性及び他の望ましい生物学的性質を保持したままヒト化することが重要である。この目的を達成するため、好ましい方法によれば、親配列及び様々な概念的ヒト化生成物を、親およびヒト化配列の三次元モデルを用いて分析する工程によってヒト化抗体を調製する。三次元免疫グロブリンモデルは一般に利用でき、当業者には良く知られている。選ばれた候補免疫グロブリン配列の可能な三次元コンホメーション構造を例示し表示するコンピュータープログラムが利用できる。これらの表示を調べることにより、候補免疫グロブリン配列の機能における残基の可能な役割の分析、すなわち、候補免疫グロブリンがその抗原を結合させる能力に影響を及ぼす残基の分析が可能となる。このようにしてレシピエント及び移入配列からのFR残基を選択し、結びつけることができ、所望の抗体の特性、例えば標的抗原に対する親和性の増加が達成される。一般に、CDR残基は、直接的かつ最も実質的に抗原結合への影響に関与する。
【0020】
「抗体断片」は、全長抗体の一部、一般的にはその抗原結合又は可変領域を含む。抗体断片の例は、Fab、Fab’、F(ab’)2及びFv断片;ダイアボディ;直鎖状抗体;一本鎖抗体分子;及び抗体断片から形成された多重特異性抗体を含む。
抗体断片を生産するために様々な技術が開発されている。伝統的には、これらの断片は、無傷の抗体のタンパク分解性消化を介して誘導された(例えば、Morimoto等, Journal of Biochemical and Biophysical Methods 24:107-117 (1992)及びBrennan等, Science, 229:81[1985]を参照)。しかし、これらの断片は現在は組換え宿主細胞により直接生産することができる。例えば、抗体断片は上記で検討した抗体ファージライブラリから分離することができる。あるいは、Fab’-SH断片は大腸菌から直接回収することができ、化学的に結合してF(ab’)2断片を形成することができる(Carter等, Bio/Technology 10:163-167[1992])。他の実施態様では、F(ab’)2はロイシンジッパーGCN4を用いて形成されてF(ab’)2分子の組立が促進される。他の方法に従うと、F(ab’)2断片を組換え宿主細胞培養から直接分離することができる。抗体断片の生産のための他の技術は当業者には明らかであろう。
【0021】
他の実施態様では、選択抗体は一本鎖Fv断片(scFv)である。WO 93/16185を参照のこと。「一本鎖Fv」又は「sFv」抗体断片は、抗体のVH及びVLドメインを含む抗体断片を含み、これらのドメインは単一のポリペプチド鎖に存在する。好ましくは、FvポリペプチドはVH及びVLドメイン間にポリペプチドリンカーを更に含み、それはsFVが抗原結合に望まれる構造を形成するのを可能にする。sFvの概説については、The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg及びMoore編, Springer-Verlag, New York, pp. 269-315 (1994)のPluckthunを参照のこと。
【0022】
「ダイアボディ」なる用語は、二つの抗原結合部位を持つ小さい抗体断片を指し、その断片は同一のポリペプチド鎖(VH−VL)内で軽鎖可変ドメイン(VL)に重鎖可変ドメイン(VH)が結合している。非常に短いために同一鎖上で二つのドメインの対形成を可能にするリンカーを使用して、ドメインを他の鎖の相補ドメインと強制的に対形成させ、二つの抗原結合部位を創製する。ダイアボディーは、例えば、EP404,097;WO 93/11161;及びHollinger等, Proc.Natl.Acad.Sci. USA 90:6444-6448 (1993)に更に詳細に記載されている。
「直鎖状抗体」という表現は、この出願を通してZapata等, Polypeptide Eng. 8(10):1057-1062 (1995)に記載された抗体を意味する。簡単に言えば、これらの抗体は抗原結合領域の対を形成する直列のFdセグメント(VH-CH1-VH-CH1)を含む。直鎖状抗体は二重特異性でも単特異性でもよい。
【0023】
「多重特異性抗体」は、少なくとも二つの異なるエピトープに対する結合特異性を有し、これらのエピトープは通常異なる抗原からのものである。このような分子は通常は二つの抗原を結合させるのみであるが(即ち、二重特異性抗体、BsAbs)、三重特異性抗体のような更なる特異性を持つ抗体もここで使用される場合この表現に包含される。BsAbsの例には、一方の腕が腫瘍細胞抗原に向けられ他方の腕が細胞毒性トリガー分子に向けられたもの、例えば抗-FcγRI/抗-CD15、抗-p185HER2/FcγRIII(CD16)、抗-CD3/抗-悪性B細胞(1D10)、抗-CD3/抗-p185HER2、抗-CD3/抗-p97、抗-CD3/抗-腎臓細胞癌腫、抗-CD3/抗-OVCAR-3、抗-CD3/L-D1(抗-大腸ガン腫)、抗-CD3/抗-メラニン細胞刺激ホルモン類似体、抗-EGFレセプター/抗-CD3、抗-CD3/抗-CAMA1、抗-CD3/抗-CD19、抗-CD3/MoV18、抗-神経細胞接着分子(NCAM)/抗-CD3、抗-葉酸塩結合タンパク質(FBP)/抗-CD3、抗-全癌腫随伴抗原(AMOC-31)/抗-CD3;腫瘍抗原に特異的に結合する一つの腕と毒素に結合する一つの腕を持つBsAbs、例えば、抗-サポリン/抗-Id-1、抗-CD22/抗-サポリン、抗-CD7/抗-サポリン、抗-CD38/抗-サポリン、抗-CEA/抗-リシンA鎖、抗-インターフェロンα(IFN-α)/抗-ハイブリドーマイディオタイプ、抗-CEA/抗-ビンカアルカロイド;(マイトマイシンホスフェートのマイトマイシンアルコールへの転換を触媒する)抗-CD30/抗-アルカリホスファターゼのような酵素活性化プロドラッグを転換するためのBsAbs;抗-フィブリン/抗-組織プラスミノーゲンアクチベーター(tPA)、抗-フィブリン/抗-ウロキナーゼ型プラスミノーゲンアクチベーター(uPA)のような線維素溶解剤として使用することができるBsAbs;抗-低密度リポタンパク質(LDL)/抗-Fcレセプター(例えばFcγRI、FcγRII又はFcγRIII)のような細胞表面レセプターへ免疫複合体をターゲティングするためのBsAbs;抗-CD3/抗-単純ヘルペスウィルス(HSV)、抗-T細胞レセプター:CD3複合体/抗-インフルエンザ、抗-FcγR/抗-HIVのような感染性疾患の治療に使用されるBsAbs;抗-CEA/抗-EOTUBE、抗-CEA/抗-DPTA、抗-p185HER2/抗-ハプテンのようなインビトロ又はインビボでの腫瘍検出のためのBsAbs;ワクチンアジュバントとしてのBsAbs;及び抗-ウサギIgG/抗-フェリチン、抗-セイヨウワサビペルオキシダーゼ(HRP)/抗-ホルモン、抗-ソマトスタチン/抗-サブスタンスP、抗-HRP/抗-FITC、抗-CEA/抗-βガラクトシダーゼのような診断ツールとしてのBsAbsが含まれる。三重特異性抗体の例には、抗-CD3/抗-CD4/抗-CD37、抗-CD3/抗-CD5/抗-CD37及び抗-CD3/抗-CD8/抗-CD37が含まれる。二重特異性抗体は全長抗体又は抗体断片(例えばF(ab’)2二重特異性抗体)として調製することができる。
【0024】
二重特異性抗体を作成する方法は当分野において既知である。全長二重特異性抗体の伝統的な組換え産生は二つの免疫グロブリン重鎖-軽鎖対の同時発現に基づき、ここで二つの該鎖は異なる特異性を持っている(Millstein等, Nature, 305:537-539 (1983))。免疫グロブリン重鎖及び軽鎖が無作為に取り揃えられているため、これらのハイブリドーマ(クアドローマ)は10個の異なる抗体分子の可能性ある混合物を産生し、そのうちただ一つが正しい二重特異性構造を有する。通常、アフィニティークロマトグラフィー工程により行われる正しい分子の精製は、かなり煩わしく生成物収率は低い。同様の方法がWO 93/08829号及びTraunecker等, EMBO J., 10:3655-3659 (1991)に開示されている。
【0025】
異なったアプローチ法によると、所望の結合特異性を有する抗体可変ドメイン(抗原−抗体結合部位)を、免疫グロブリン不変ドメイン配列と融合させる。該融合は好ましくは、少なくともヒンジの一部、CH2及びCH3領域を含む免疫グロブリン重鎖定常部との融合である。軽鎖の結合に必要な部位を含む第一の重鎖定常領域(CH1)を、融合の少なくとも一つに存在させることが望ましい。免疫グロブリン重鎖の融合、そして、望まれるならば免疫グロブリン軽鎖をコードしているDNAを、別個の発現ベクター中に挿入し、適当な宿主生物に同時形質移入する。これにより、作成に使用される三つのポリペプチド鎖の等しくない比率が最適な収率を提供する態様において、三つのポリペプチド断片の相互の割合の調節に大きな融通性が与えられる。しかし、少なくとも二つのポリペプチド鎖の等しい比率での発現が高収率をもたらすとき、又は、その比率が特に重要性を持たないときは、2または3個全てのポリペプチド鎖のためのコード化配列を一つの発現ベクターに挿入することが可能である。
【0026】
このアプローチ法の好適な実施態様において、二重特異性抗体は、第一の結合特異性を有する一方の腕のハイブリッド免疫グロブリン重鎖、及び他方の腕のハイブリッド免疫グロブリン重鎖-軽鎖対(第二の結合特異性を提供する)で構成される。二重特異性分子の半分しか免疫グロブリン軽鎖がないことで容易な分離法が提供されるため、この非対称的構造は、所望の二重特異性化合物を不要な免疫グロブリン鎖の組み合わせから分離することを容易にすることが分かった。このアプローチ法は、WO 94/04690に開示されている。二重特異性抗体を作製する更なる詳細については、例えばSuresh等, Methods in Enzymology, 121:210 (1986)を参照されたい。
国際公開WO 96/27011号に記載された他のアプローチ法によれば、一対の抗体分子間の界面を操作して組換え細胞培養から回収されるヘテロ二量体のパーセントを最大にすることができる。好適な界面は抗体定常ドメインのCH3ドメインの少なくとも一部を含む。この方法では、第1抗体分子の界面からの一又は複数の小さいアミノ酸側鎖がより大きな側鎖(例えばチロシン又はトリプトファン)と置換される。大きな側鎖と同じ又はより小さいサイズの相補的「キャビティ」を、大きなアミノ酸側鎖を小さいもの(アラニン又はスレオニン)と置き換えることにより第2の抗体分子の界面に作り出す。これにより、ホモ二量体のような不要の他の最終産物に対してヘテロダイマーの収量を増大させるメカニズムが提供される。
【0027】
二重特異性抗体は、架橋した又は「ヘテロ抱合体抗体」もまた含む。例えば、ヘテロ抱合体の抗体の一方はアビジンに結合され、他方はビオチンに結合され得る。そのような抗体は、例えば、不要の細胞に対する免疫系細胞を標的とするため(米国特許第4,676,980号)、及びHIV感染の治療のために提案された(WO 91/00360, WO 92/00373, 及びEP 03089)。ヘテロ抱合体抗体は、任意の簡便な架橋法を用いて作製することができる。好適な架橋剤は当該分野において良く知られており、多くの架橋技術と共に米国特許第4,676,980号に開示されている。
抗体断片から二重特異性抗体を産生する技術もまた文献に記載されている。例えば、化学結合を使用して二重特異性抗体を調製することができる。Brennan等, Science, 229:81 (1985) は無傷の抗体をタンパク分解性に切断してF(ab’)2断片を産生する手順を記述している。これらの断片は、ジチオール錯体形成剤亜砒酸ナトリウムの存在下で還元して近接ジチオールを安定化させ、分子間ジスルフィド形成を防止する。産生されたFab’断片はついでチオニトロベンゾアート(TNB)誘導体に転換される。Fab'-TNB誘導体の一つをついでメルカプトエチルアミンでの還元によりFab’-チオールに再転換し、他のFab’-TNB誘導体の等モル量と混合して二重特異性抗体を形成する。作られた二重特異性抗体は酵素の選択的固定化用の薬剤として使用することができる。
【0028】
最近の進歩により、大腸菌からのFab’-SH断片の直接の回収が容易になり、これは化学的に結合して二重特異性抗体を形成することができる。Shalaby等, J.Exp.Med., 175:217-225 (1992)は完全にヒト化された二重特異性抗体F(ab’)2分子の製造を記述している。各Fab’断片は大腸菌から別個に分泌され、インビトロで定方向化学共役を受けて二重特異性抗体を形成する。
組換え細胞培養から直接的に二重特異性抗体断片を作成し分離する様々な方法もまた記述されている。例えば、二重特異性抗体はロイシンジッパーを使用して生産されている。Kostelny等, J. Immunol. 148(5):1547-1553 (1992)。Fos及びJunタンパク質からのロイシンジッパーペプチドを遺伝子融合により二つの異なった抗体のFab'部分に結合させる。抗体ホモダイマーをヒンジ領域で還元してモノマーを形成し、ついで再酸化して抗体ヘテロダイマーを形成する。この方法はまた抗体ホモダイマーの生産に対して使用することができる。Hollinger等, Proc.Natl.Acad.Sci. USA, 90:6444-6448 (1993)により記述された「ダイアボディ」技術は二重特異性抗体断片を作成する別のメカニズムを提供した。断片は、同一鎖上の2つのドメイン間の対形成を可能にするには十分に短いリンカーにより軽鎖可変ドメイン(VL)に重鎖可変ドメイン(VH)を結合してなる。従って、一つの断片のVH及びVLドメインは他の断片の相補的VL及びVHドメインと強制的に対形成させられ、2つの抗原結合部位を形成する。単鎖Fv(sFv)ダイマーの使用により二重特異性抗体断片を製造する他の方策もまた報告されている。Gruber等, J. Immunol. 152:5368 (1994)を参照されたい。
二価より多い抗体も考えられる。例えば、三重特異性抗体を調製することができる。Tutt等 J. Immunol. 147:60(1991)。
【0029】
「イオン交換材料」という語句は、負に荷電(即ちカチオン交換樹脂)又は正に荷電(即ちアニオン交換樹脂)した固相を意味する。電荷は固相に一又は複数の荷電リガンドを、例えば共有結合で結合させることにより与えられる。あるいは、又はそれに加えて、電荷は固相に固有の特性であってもよい(例えば、全体として負電荷を有するシリカの場合のように)。
「固相」とは、本発明の抗体が接着できる非水性マトリクスを意味する。固相は、精製カラム、別々の粒子の不連続相、膜又はフィルター等であってよい。固相を形成する材料の例は、ポリサッカリド(例えばアガロース及びセルロース);及び他の機械的に安定な材料、例えばシリカ(例えば孔制御されたガラス)、ポリ(スチレンジビニル)ベンゼン、ポリアクリルアミド、セラミック粒子及び上記の誘導体を含む。
「カチオン交換樹脂」は負に荷電した固相を意味し、よってそれは、固相の上又は中を通過する水溶液中のカチオンと交換される遊離のカチオンを有する。固相に結合してカチオン交換樹脂を形成する負に荷電したリガンドは、例えば、カルボキシレート又はスルホネートであってよい。市販のカチオン交換樹脂は、カルボキシ-メチル-セルロース、BAKERBOND ABX(商品名)、アガロース上に固定化されたスルホプロピル(SP)(例えば、SP-SEPHAROSE FAST FLOW(商品名)又はSP-SEPHAROSE HIGH PERFORMANCE(商品名)、Pharmaciaより)及びアガロース上に固定化されたスルホニル(例えば、S-SEPHAROSE FAST FLOW(商品名)、Pharmaciaより)を含む。
ここで用いられる「アニオン交換樹脂」は、正に荷電した固相を意味し、例えばそれに結合した第4級アミノ基等の一又は複数の正荷電リガンドを有する。市販のアニオン交換樹脂は、DEAEセルロース、QAE SEPHADEX(商品名)及びFAST Q SEPHAROSE(商品名(Pharmacia)を含む。
【0030】
「バッファー」は、その酸−塩基結合成分の作用によりpH変化に抗する緩衝溶液を意味する。例えば所望のバッファーpH等に応じて使用できる種々のバッファーが、Buffers. A Guide for the Preparation and Use of Buffers in Biological Systems, Gueffroy, D., 編, Calbiochem Corporation (1975)に記載されている。一実施態様では、バッファーは(下記実施例1におけるように)約5から約7のpHを有する。この範囲内にpHを調節するバッファーの例は、MES、MOPS、MOPSO、リン酸塩、酢酸塩、クエン酸塩、コハク酸塩、及びアンモニウムバッファー、並びにこれらの組み合わせを含む。
「負荷バッファー」は、対象とするポリペプチド及び一又は複数の汚染物質を含む組成物をイオン交換樹脂に負荷するのに使用するものである。負荷バッファーは、対象とするポリペプチド分子(及び一般に一又は複数の汚染物質)がイオン交換樹脂に結合するような伝導率及び/又はpHを有する。
「中間バッファー」は、対象とするポリペプチド分子の溶離に先立って、一又は複数の汚染物質をイオン交換樹脂から溶離するのに使用される。中間バッファーの伝導率及び/又はpHは、汚染物質はイオン交換樹脂から溶離されるが、対象とするポリペプチドの有意な量は溶離されないものである。
「洗浄バッファー」は、ここで用いられる場合、対象とするポリペプチド分子の溶離に先立って、イオン交換樹脂を洗浄又は再平衡化するのに使用されるバッファーを意味する。便利には、洗浄バッファー及び負荷バッファーは同じであってもよいが、そうである必要はない。
「溶離バッファー」は、対象とするポリペプチドを固相から溶離するのに使用される。溶離バッファーの伝導率及び/又はpHは、対象とするポリペプチドがイオン交換樹脂から溶離されるものである。「再生バッファー」は、イオン交換樹脂を再生して再利用できるようにするのに使用される。再生バッファーは、実質的に全ての汚染物質と対象とするポリペプチドをイオン交換樹脂から除去するのに必要な伝導率及び/又はpHを有する。
【0031】
「伝導率」なる用語は、水溶液が2電極間に電流を伝える能力を意味する。溶液では、電流はイオン輸送によって流れる。従って、水溶液中に存在するイオンの量が増加すると溶液の伝導率は高くなる。伝導率の測定単位はmmhos(mS/cm)であり、例えばOrionの伝導率計を用いて測定できる。溶液の伝導率は、その中のイオン濃度の変化によって変わる。例えば、溶液中の緩衝剤の濃度及び/又は塩(例えばNaCl又はKCl)の濃度を所望の伝導率を達成するために変更してもよい。好ましくは、種々のバッファーの塩濃度は、下記の実施例のように所望の伝導率を達成するために改変される。
ポリペプチド及び一又は複数の汚染物質を含む組成物からポリペプチドを「精製する」とは、組成物から少なくとも1つの汚染物質を(完全又は部分的に)除去することにより組成物中のポリペプチドの純度を向上させることを意味する。「精製工程」は、ここで組成物全重量に対して少なくとも70重量%、好ましくは少なくとも80重量%の対象ポリペプチドを含む組成物を意味する「均一な」組成物をもたらす全精製プロセスの一部であってよい。
【0032】
特に示さなければ、ここで用いられる「HER2」はヒトHER2タンパク質、「HER2」はヒトHER2遺伝子を意味する。ヒトHER2遺伝子及びHER2タンパク質は、例えば、Semba等, PNAS (USA) 82: 6497-6501 (1985)及びYamamoto等, Nature 319: 230-234 (1986)(Genebank登録番号X03363)に記載されている。
ここで用いられる「humMAb4D5-8」はヒト化抗-HER2抗体を意味し、それは配列番号:1の軽鎖アミノ酸配列及び配列番号:2の重鎖アミノ酸配列、又はそのアミノ酸配列変異体を含み、HER2に結合してHER2を過剰発現する腫瘍細胞の成長を阻害する能力を保持しているものである(米国特許第5,677,171号を参照して、ここに参考として取り入れる)。
ポリペプチドの「pI」又は「等電点」は、ポリペプチドの正電荷がその負電荷と均衡するpHを意味する。pIはポリペプチドのアミノ酸残基の電荷から計算でき、等電点電気泳動により決定できる(例えば、下記実施例のようにCSxクロマトグラフィーを用いて)。
【0033】
分子がイオン交換材料に「結合する」とは、分子を適当な条件(pH/伝導率)下でイオン交換材料に暴露し、分子とイオン交換材料の荷電基との間のイオン性相互作用によって、分子がイオン交換材料内又は上に可逆的に固定化されることを意味する。
イオン交換材料を「洗浄する」とは、適当なバッファーをイオン交換材料中又は上に通すことを意味する。
イオン交換材料から分子(例えばポリペプチド又は汚染物質)を「溶離する」とは、イオン交換材料周囲のバッファーのイオン強度を変えることによりそこから分子を除去し、イオン交換材料上の荷電部位に対してバッファーを分子と競合させることを意味する。
【0034】
「治療」は治療的処置及び予防的あるいは防護的措置の双方を意味する。治療を要するものには、障害を既に持つもの並びに障害を防止すべきものが含まれる。「疾患」とは、ここに記載するように精製されたポリペプチドでの治療から恩恵を受けるであろう任意の症状である。これには、哺乳動物が問題とする疾患になる素因になる病理的症状を含む慢性及び急性の疾患又は障害が含まれる。
ここで使用される「標識」なる語句は、ポリペプチドに直接的に又は間接的に抱合する検出可能な化合物又は組成物を意味する。標識はそれ自体が検出可能(例えば、放射性標識又は蛍光標識)であり得、あるいは酵素標識の場合には、検出可能な基質化合物又は組成物の化学変化を触媒しうる。
【0035】
ここで用いられる「細胞毒性薬」なる用語は、細胞の機能を阻害又は抑制する又は細胞破壊を生ずる物質を意味する。この用語は、放射性同位体(例えば、I131、I125、Y90及びRe186)、化学治療薬、及び細菌、真菌、植物又は動物由来の酵素的活性毒素といった毒素、またはその断片を含むとされる。
「化学治療薬」は、癌の治療に有用な化合物である。化学治療薬の例は、アドリアマイシン、ドキソルビシン、エピルビシン、5-フルオロウラシル、シトシンアラビノシド(「Ara−C」)、シクロホスファミド、チオテパ、ブスルファン、サイトキシン、タキソイド、例えばパクリタキセル(TAXOL(商品名), Bristol-Myers Squibb Oncology, Princeton, NJ)及びドキセタキセル、トキソテール、メトトレキセート、シスプラチン、メルファラン、ビンブラスチン、ブレオマイシン、エトポシド、イフォスファミド、マイトマイシンC、マイトキサントロン、ビンクリスチン、ビノレルビン、カルボプラチン、テニポシド、ダウノマイシン、カルミノマイシン、アミノプテリン、ダクチノマイシン、マイトマイシン、エスペラマイシン(米国特許第4,675,187号参照)、メルファラン、及び他の関連するナイトロジェンマスタードを含む。また、この定義に含まれるのは、タモキシフェン及びオナプリストンなどの腫瘍へのホルモン作用を調節又は阻害するように作用するホルモン様薬剤である。
【0036】
(発明の実施の形態)
本発明はここに、ポリペプチドを、当該ポリペプチド及び一又は複数の汚染物質を含有する組成物(例えば、水溶液)から精製する方法を提供する。組成物は一般に、ポリペプチドの組換え生産から得られたものであるが、ペプチド合成(又は他の合成手段)によるポリペプチドの製造から得られたものでもよく、あるいはポリペプチドはポリペプチドの天然源から精製されてもよい。好ましくは、ポリペプチドは抗体、例えばHER2抗原に結合するものである。
ポリペプチドの組換え生産のために、それをコードする核酸が単離され、さらなるクローニング(DNAの増幅)又は発現のために複製可能なベクター内に挿入される。ポリペプチドをコードするDNAは直ぐに単離され、従来の手法を用いて(例えば、ポリペプチドが抗体である場合、抗体の重鎖及び軽鎖をコードする遺伝子に特異的に結合可能なオリゴヌクレオチドプローブを用いることにより)配列決定される。多くのベクターが利用可能である。ベクター成分としては、一般に、これらに制限されるものではないが、次のものの一又は複数が含まれる:シグナル配列、複製開始点、一又は複数のマーカー遺伝子、エンハンサーエレメント、プロモーター、及び転写終結配列である(例えば、米国特許第5,534,615号に記載されており、ここで特に参考として取り入れる)。
【0037】
ここでベクターにおいてDNAを発現させるのに好ましい宿主細胞は、原核生物、酵母、又は上記のより高等な真核生物である。この目的に適した原核生物は、グラム陰性又はグラム陽性生物体などの真正細菌、例えば、大腸菌(Escherichia)、例えば大腸菌(E. coli)、エンテロバクター、エルウィニア(Erwinia)、クレブシエラ、プロテウス、サルモネラ、例えばネズミチフス菌、セラチア、例えば霊菌、及び赤痢菌等の腸内細菌科、枯草菌及びビーリシェニフォルミス(B. licheniformis)等の桿菌(例えば、1989年4月12日に発行されたDD266,710に開示されたビーリシェニフォルミス41P)、緑膿菌等のシュードモナス、及びストレプトマイセスである。適した大腸菌(E. coli)クローニング宿主はE. coli 294(ATCC 31,446)であるが、E. coli B、及びE. coli X1776(ATCC 31,537)及びE. coli W3110(ATCC 27,325)等の他の株も好ましい。これらの例は例示的であり限定するものではない。
原核生物に加えて、糸状菌又は酵母菌のような真核微生物は、ポリペプチドコード化ベクターのための適切なクローニング又は発現宿主である。サッカロミセス・セレヴィシア又は普通のベーカーの酵母菌は、最も普通に用いられる下等真核生物宿主微生物である。しかし、シゾサッカロミセスプロンブ(Schizosaccharomyces prombe);クルベロミセスホスツ(Kluveromyces hosts)、例えばケーラクチス(K. lactis)、ケーフラギリス(K. fragilis)(ATCC 12,424)、ケーブルガリクス(K. bulgaricus)(ATCC 16,045)、ケーウィケラミイ(K. wickeramii)(ATCC 24,178)、ケーワルチイ(K. waltii)(ATCC 56,500)、ケードロソフィラルム(K. drosophilarum)(ATCC 36,906)、ケーテモトレランス(K. themotolerans)及びケーマルキシアナス(K. marxianus);ヤロウィア(yarrowia)(EP 402,226);ピッチャパストリス(Pichia pastoris)(EP 183,070);カンジダ;トリコデルマレーシア(reesia)(EP 244,234);アカパンカビ;シュワニオマイセス(schwanniomyces)、例えばシュワニオマイセスオクシデンタリス(occidentalis);及び糸状真菌、例えば、ニューロスポラ、ペニシリウム、トリポクラジウム(Tolypocladium);及びコウジ菌、例えば偽巣性コウジ菌及びクロカビなどの他の多くの属、種及び株が通常利用可能であり、ここで有用である。
【0038】
グリコシル化ポリペプチドの発現に適した宿主細胞は多細胞生物から誘導される。無脊椎動物細胞の例としては植物及び昆虫細胞が含まれる。宿主からの多数のバキュロウィルス株及び変異体及び対応する許容可能な昆虫宿主細胞、例えばスポドプテラ・フルギペルダ(毛虫)、アエデス・アエジプティ(蚊)、アエデス・アルボピクトゥス(蚊)、ドゥロソフィラ・メラノガスター(ショウジョウバエ)、及びボンビクス・モリが同定されている。形質移入のための種々のウィルス株、例えば、オートグラファ・カリフォルニカNPVのL-1変異体とボンビクス・モリ NPVのBm-5株が公に利用でき、そのようなウィルスは本発明においてここでウィルスとして使用でき、特にスポドプテラ・フルギペルダ細胞の形質移入に使用できる。綿花、コーン、ジャガイモ、ダイズ、ペチュニア、トマト、及びタバコのような植物細胞培養を宿主として利用することができる。
しかしながら、脊椎動物細胞におけるものが最も興味深く、培養(組織培養)中での脊椎動物細胞の増殖は常套的な手順となっている。有用な哺乳動物宿主株化細胞の例は、SV40によって形質転換されたサル腎臓CV1株 (COS-7, ATCC CRL 1651);ヒト胚腎臓株(293又は懸濁培養での増殖のためにサブクローン化された293細胞、Graham等, J. Gen Virol., 36:59 (1977));ハムスター乳児腎細胞(BHK, ATCC CCL 10);チャイニーズハムスター卵巣細胞/-DHFR(CHO, Urlaub等, Proc. Natl. Acad. Sci. USA, 77:4216 (1980));マウスのセルトリ細胞(TM4, Mather, Biol. Reprod., 23:243-251 (1980));サルの腎細胞 (CVI ATCC CCL 70);;アフリカミドリザルの腎細胞(VERO-76, ATCC CRL-1587);ヒト子宮頸癌細胞 (HELA, ATCC CCL 2);イヌ腎細胞 (MDCK, ATCC CCL 34);バッファローラット肝細胞 (BRL 3A, ATCC CRL 1442);ヒト肺細胞 (W138, ATCC CCL 75);ヒト肝細胞 (Hep G2, HB 8065);マウス乳房腫瘍細胞 (MMT 060562, ATTC CCL51);TRI細胞(Mother等, Annals N.Y. Acad. Sci., 383:44-68 (1982));MRC5細胞;FS4細胞;及びヒト肝癌株(HepG2)である。
【0039】
宿主細胞は、ポリペプチド生成のための上記発現又はクローニングベクターで形質転換し、プロモーターを誘導し、形質転換体を選択し、又は所望の配列をコードしている遺伝子を増幅するために適当に修飾された常套的栄養培地で培養する。
本発明のポリペプチドを生成するために用いられる宿主細胞は種々の培地において培養することができる。例えばハム(Ham)のF10(Sigma)、最小必須培地((MEM) Sigma)、RPMI−1640(Sigma)及びダルベッコの改変イーグル培地((DMEM), Sigma)のような市販培地が当該宿主細胞の培養に適している。さらに、Ham等, Meth. Enz., 58:44 (1979), Barnes等, Anal. Biochem., 102:255 (1980), 米国特許 4,767,704; 4,657,866; 4,927,762; 4,560,655; 又は5,122,469; WO 90/03430; WO 87/00195; 米国再発行特許 30,985に記載された任意の培地を宿主細胞の培養培地として用いることができる。これらの培地はいずれも、ホルモン及び/又は他の成長因子(例えばインスリン、トランスフェリン、又は表皮成長因子)、塩類(例えば、塩化ナトリウム、カルシウム、マグネシウム及びリン酸塩)、バッファー類(例えばHEPES)、ヌクレオシド(例えばアデノシン及びチミジン)、抗生物質(例えば、GENTAMYCIN(商品名)薬)、微量元素(最終濃度がマイクロモル範囲で通常存在する無機化合物と定義される)及びグルコース又は同等のエネルギー源を必要に応じて補充することができる。任意の他の必要な補充物質も又当業者に知られている適当な濃度で含むことができる。培養条件、例えば温度、pH等々は、発現のために選ばれた宿主細胞について従来用いられているものであり、当業者には明らかであろう。
【0040】
組換え技術を用いる場合、ポリペプチドは細胞内、細胞膜周辺腔に生成され、又は培地に直接分泌される。ポリペプチドが細胞内に生成された場合、第1の工程として、粒子状の細片、(均一化によって得られた)宿主細胞又は溶解された細胞のいずれかが、例えば遠心分離又は限外濾過によって除去される。ポリペプチドが培地に分泌された場合、そのような発現系からの上清は、一般的には第1に市販のタンパク質濃縮フィルター、例えばAmicon又はPelliconの限外濾過ユニットを用いて濃縮される。
次いでポリペプチドに、ここで特許請求するイオン交換クロマトグラフィー法を含む一又は複数の精製工程を施す。イオン交換クロマトグラフィー法に先立って、その最中に、又はその後のさらなる精製方法の例は、疎水性相互作用クロマトグラフィー(例えばフェニルセファロース)での分画、エタノール沈殿、等電点電気泳動、逆相HPLC、シリカ上でのクロマトグラフィー、HEPARIN SEPHAROSE(商品名)でのクロマトグラフィー、さらなるアニオン交換クロマトグラフィー及び/又はさらなるカチオン交換クロマトグラフィー、クロマトフォーカシング、SDS-PAGE、硫酸アンモニウム沈殿、ヒドロキシアパタイトクロマトグラフィー、ゲル電気泳動、透析、及びアフィニティクロマトグラフィー(例えば、プロテインA、プロテインG、抗体、特異的基質、リガンド、又は抗原、例えば捕捉剤を用いる)を含む。
【0041】
イオン交換クロマトグラフィーはここに特許請求したように実施される。第1に、アニオン又はカチオン交換樹脂のいずれを用いるべきかを決定する。一般に、カチオン交換樹脂は約7より大きなpIを有するポリペプチドに対して使用され、アニオン交換樹脂は約7より小さなpIを有するポリペプチドに対して使用される。
アニオン又はカチオン交換樹脂は、公知の方法によって調製される。通常は、ポリペプチド及び一又は複数の汚染物質を含有する組成物を樹脂に負荷する前に、平衡化バッファーをイオン交換樹脂に通す。便利には、平衡化バッファーは負荷バッファーと同じであるが、そうである必要はない。
クロマトグラフィーに使用される種々のバッファーは、例えば、カチオン又はアニオン交換樹脂のいずれが用いられるかによる。このことは、Fig1及び2の流れ図においてより明確に示される。
【0042】
特にカチオン交換樹脂が用いられる工程の実施を例示するFig1を参照すると、各バッファーのpH及び/又は伝導率は前のバッファーに比較して増大しているが、伝導率及び/又はpHが先行する中間バッファーの伝導率及び/又はpHより小さい洗浄バッファーは除く。対象とするポリペプチドと汚染物質とを含有する水溶液が負荷バッファーを用いてカチオン交換樹脂に負荷されるが、それは、ポリペプチド及び汚染物質がカチオン交換樹脂に結合するpH及び/又は伝導率においてである。下記の実施例のように、負荷バッファーは第1の低い伝導率(例えば、約5.2から約6.6mmhos)であってよい。負荷バッファーの例示的pHは約5.0である(Fig1参照)。例えば、約20mg/mLから約35mg/mLのポリペプチド(例えば全長抗体)をイオン交換樹脂に負荷してもよい。
カチオン交換樹脂は、次いで、実質的に汚染物質を溶離するが実質的に対象とするポリペプチドは溶離しないような第2の伝導率及び/又はpHにある中間バッファーで洗浄される。これは、中間バッファーの伝導率又はpH、あるいは両方を増大させることにより達成される。負荷バッファーから中間バッファーへの変化は、必要に応じて段階的でも徐々にでもよい。ここでの実施例では、中間バッファーは負荷バッファーより大きな伝導率を有していた(即ち、中間バッファーの伝導率は約7.3から約8.8mmhosの範囲であった)。あるいは、Fig1に示すように、カチオン交換樹脂が用いられる本発明のこの実施態様では、中間バッファーのpHが負荷バッファーのpHを越えるようにしてもよい。例えば、中間バッファーは約5.4のpHを持ち得る。
【0043】
中間バッファーでの洗浄に続いて、カチオン交換樹脂は、中間バッファーより小さな伝導率又はpH、あるいは両方を有する洗浄バッファーで洗浄又は再平衡化される(即ち、文献におけるイオン交換クロマトグラフィー工程とは異なり、伝導率又はpH、あるいは両方が先行工程とは反対、即ち逆方向に変化する)。下記の実施例では、洗浄バッファーは負荷バッファーとほぼ同じ伝導率を有し(即ち、約5.2から約6.6mmhosの範囲)、従ってその伝導率は中間バッファーのものより小さい。他の実施態様では、洗浄バッファーの伝導率を負荷バッファーのものより小さく又は大きくしてもよいが、洗浄バッファーの伝導率は中間バッファーのものよりは小さい。他の実施態様では、洗浄バッファーのpHが中間バッファーのpHより小さい(例えば、洗浄バッファーのpHは約5.0であってよい)。中間バッファーに比較した洗浄バッファーの伝導率及び/又はpHの変化は、これらのパラメータの段階的又は徐々の変化により達成される。
【0044】
前段落の洗浄工程の後に、カチオン交換樹脂は、そこから所望のポリペプチド分子を溶離するために調製される。これは、所望のポリペプチドがもはやカチオン交換樹脂に結合せず、従ってそこから溶離されるようなpH及び/又は伝導率を有する溶離バッファーを用いて達成される。溶離バッファーのpH及び/又は伝導率は、一般に先行する工程で使用した負荷バッファー、中間バッファー及び洗浄バッファーのpH及び/又は伝導率を越える。下記の実施例では、溶離バッファーの伝導率は約10.0から11.0mmhosの範囲である。あるいは、又はそれに加えて、溶離バッファーのpHを洗浄バッファー及び中間バッファーに比較して増大させてもよい(例えば、溶離バッファーのpHを約6.0としてよい)。伝導率及び/又はpHの変化は、必要に応じて段階的でも徐々にでもよい。しかして、所望のポリペプチドは、本方法のこの段階においてカチオン交換樹脂から回収される。
【0045】
これに代わる実施態様では、イオン交換材料がアニオン交換樹脂を含んでなる。本発明のこの実施態様は、ここでFig2に示されている。この図に例示されているように、伝導率の変化は一般にカチオン交換樹脂について上述したようなものである。しかしながら、pHの変化の方向は、アニオン交換樹脂については異なっている。例えば、汚染物質及びポリペプチドの溶離がpH変化によってなされる場合、負荷バッファーは第1のpHを有し、pHは中間バッファーにおいて低下して汚染物質が溶離される。第3工程で、カラムは洗浄バッファーで洗浄/再平衡化されるが、伝導率又はpH、あるいは両方の変化は先行する工程とは反対方向である。即ち、pHは洗浄バッファーにおいて中間バッファーよりも増大してよい。この工程に続いて、対象とするポリペプチドは、第4の伝導率及び/又はpHにおける溶離バッファーを用いてアニオン交換樹脂から溶離される。pHが変化する場合、通常は負荷バッファー、中間バッファー及び洗浄バッファーより小さい。進行バッファーにおけるpH及び/又は伝導率の変化は、上述したように段階的でも徐々にでもよい。
【0046】
本発明の好ましい実施態様では、ポリペプチド及び汚染物質の両方の溶離を達成するのに1つのパラメータ(即ち、伝導率又はpHのいずれか)を変化させ、他のパラメータ(即ち、各々pH又は伝導率)はほぼ一定に維持される。例えば、種々のバッファー(負荷バッファー、中間バッファー、洗浄バッファー及び/又は溶離バッファー)の伝導率を相違させ、それらのpHを実質的に同じにしてもよい。
本発明の任意の実施態様では、イオン交換樹脂はポリペプチドの溶離の後に再生バッファーで再生され、カラムを再利用できるようにする。一般に、再生バッファーの伝導率及び/又はpHは、実質的に全ての汚染物質及び対象とするポリペプチドがイオン交換樹脂から溶離されるものである。一般に、再生バッファーは、汚染物質及びポリペプチドをイオン交換樹脂から溶離させるために非常に高い伝導率を有する。
【0047】
ここでの方法は、対象とするポリペプチドを少なくとも1つの汚染物質から分離するに当たり、汚染物質と対象とするポリペプチド分子とがイオン性電荷で僅かしか相違していない場合に特に有用である。例えば、ポリペプチドと汚染物質のpIが「僅かにしか相違していなく」てもよく、例えば、それらは約0.05から約0.2pI単位しか相違していなくてもよい。下記の実施例では、この方法は、8.87のpIを持つ抗-HER2抗体を、8.79のpIを持つ単一の脱アミド化変異体から分離するのに使用できた。あるいは、この方法は脱アミド化DNaseを、例えば非脱アミド化DNaseから分離するのに使用してもよい。他の実施態様では、この方法は、ポリペプチドのそのグリコシル化変異体からの分離、例えば、非変異ポリペプチドに比較して異なるシアル酸分布を有するポリペプチドの変異体の分離に使用してもよい。
ここでのイオン交換クロマトグラフィー法に従って得られたポリペプチド調製物は、必要ならばさらなる精製工程を施してもよい。さらなる精製工程の例は上述した。
場合によっては、ポリペプチドは必要に応じて一又は複数の異種分子に抱合させる。異種分子は、例えば、ポリペプチドの血清半減期を向上させるもの(例えばポリエチレングリコール、PEG)であってよく、標識(例えば酵素、蛍光標識及び/又は放射性核種)又は細胞毒性分子(例えば毒素、化学治療薬、または放射性同位元素など)であってもよい。
【0048】
場合によっては異種分子に縫合されたポリペプチドを含む治療用製剤は、所定の純度を持つポリペプチドと、任意の製薬的に許容される担体、賦形剤又は安定化剤を混合することにより(Remington's Pharmaceutical sciences 16th edition, Osol, A. 編, (1980))、凍結乾燥製剤又は水溶液の形態で調製される。「製薬的に許容される」担体、賦形剤又は安定化剤は、用いられる用量及び濃度で受容者に非毒性であり、リン酸塩、クエン酸塩、及び他の有機酸等のバッファー;アスコルビン酸及びメチオニンを含む酸化防止剤;防腐剤(オクタデシルジメチルベンジルアンモニウムクロリド、ヘキサメトニウムクロリド、ベンズアルコニウムクロリド、ベンズエトニウムクロリド、フェノール、ブチル又はベンジルアルコール、メチル又はプロピルパラベン等のアルキルパラベン、カテコール、レゾルシノール、シクロヘキサノール、3-ペンタノール、及びm-クレゾール等);低分子量(約10残基未満)のポリペプチド;血清アルブミン、ゼラチン、または免疫グロブリン等のタンパク質;ポリビニルピロリドン等の親水性ポリマー;グリシン、グルタミン、アスパラギン、ヒスチジン、アルギニン又はリジン等のアミノ酸;グルコース、マンノース、又はデキストリンを含む単糖類、二糖類、及び他の炭水化物;EDTA等のキレート化剤;スクロース、マンニトール、トレハロース又はソルビトール等の糖;ナトリウム等の塩形成対イオン;金属錯体(例えば、Zn−-タンパク質錯体);及び/又はTWEEN(商品名)、PLURONICS(商品名)又はポリエチレングリコール(PEG)等の非イオン性界面活性剤を含む。ここで特に興味深いhumMAb4D5-8抗体は、WO 97/04801に記載されているように凍結乾燥製剤として製剤してもよく、ここに参考として出展明示して取り込むものとする。
【0049】
ここでの製剤は、治療される特定の徴候のために必要ならば1以上の活性化合物も含んでよく、好ましくは互いに悪影響を与えない相補的活性を持つものである。そのような分子は、意図する目的のために有効な量で組み合わされて好適に存在する。例えば、抗-HER2抗体については、タキソイド又はタモキシフェン等の化学治療薬を製剤に添加してもよい。
また活性成分は、各々例えばコアセルベーション技術又は界面重合により調製されたマイクロカプセル、例えばヒドロキシメチルセルロース又はゼラチンマイクロカプセル及びポリペプチド-(メタクリル酸メチル)マイクロカプセル、コロイド状ドラッグデリバリー系(例えば、リポソーム、アルブミン微小球、マイクロエマルション、ナノ-粒子及びナノカプセル)又はマクロエマルションに捕捉させてもよい。このような技術は、Remington's Pharmaceutical sciences 16th edition, Osol, A. 編, (1980)に開示されている。
インビボ投与に使用される製剤は無菌でなければならない。このことは、滅菌濾過膜を通して濾過することにより容易に達成される。
【0050】
徐放性調製物を調製してもよい。徐放性調製物の好ましい例は、ポリペプチド変異体を含む疎水性固体ポリマーの半透性マトリクスを含み、そのマトリクスは成形物、例えばフィルム又はマイクロカプセルの形態である。徐放性マトリクスの例は、ポリエステル、ヒドロゲル(例えば、ポリペプチド(2-ヒドロキシエチルメタクリレート)又はポリ(ビニルアルコール)、ポリラクチド(米国特許第3,773,919号))、L-グルタミン酸及びγ-エチル-L-グルタメートのコポリマー、非分解性エチレン-酢酸ビニル、分解性乳酸-グリコール酸コポリマー、例えばLUPRON DEPOT(商品名)(分解性乳酸注グリコール酸コポリマー及び酢酸ロイプロリドからなる注射可能な微小球)、及びポリ-D-(−)-3-ヒドロキシブチル酸を含む。
ここに開示したように精製されたポリペプチド又は当該ポリペプチド及び製薬的に許容される担体を含有する組成物は、次いで、そのようなポリペプチド及び組成物について知られた種々の診断、治療又は他の用途に使用される。例えば、ポリペプチドは、ポリペプチドの治療的有効量を哺乳動物に投与することにより、哺乳動物における疾患の治療に使用できる。
以下の実施例は例示を目的とし、何ら限定するものではない。明細書における全ての引用の開示は、ここに出典明示して参考として取り入れるものとする。
【0051】
実施例1
全長ヒトIgG rhuMAb HER2(Carter等, Proc. Natl. Acad. Sci. 89: 4285-4289 (1992)の配列番号:1の軽鎖アミノ酸配列及び配列番号:2の重鎖アミノ酸配列を含むhumAb4D5-8)をCHO細胞で組換え的に製造した。タンパク質生成及び細胞培養培地への分泌に続いて、CHO細胞を細胞培養培地から接線方向流動濾過(PROSTACK(商品名))により分離した。次いで、平衡化PROSEPA(商品名)カラム(Bioprocessing, Ltd.)にCHO細胞からの回収細胞培養流体(HCCF)を直接適用することにより、プロテインAクロマトグラフィーを実施した。
プロテインAクロマトグラフィーに続いて、スルホプロピル(SP)-SEPHAROSE FAST FLOW(商品名)(SPSFF)カラム(Pharmacia)を用いてカチオン交換クロマトグラフィーを実施して所望の抗-HER2抗体分子をさらに分離した。クロマトグラフィー操作は、結合及び溶離モードで実施した。
【0052】
再生バッファー(0.025M MES / 1.0M NaCl, pH5.6)次いで平衡化バッファー(0.025M MES / 50mM NaCl, pH5.6)で洗浄することにより、負荷のためのSPSFFカラムを調製した。次いでカラムに、5.60+-0.05のpH及び5.8+-0.2mmhosの伝導率に調節したプロテインAプールを負荷した。溶離に先立って、カラムを3段階:(1)負荷バッファー(0.025M MES / 50mM NaCl, pH5.6)で最低1カラム容量;(2)中間バッファー(0.025M MES / 70mM NaCl, pH5.6)で280nmピークの頂点に達するまで;そして(3)洗浄バッファー(0.025M MES / 50mM NaCl, pH5.6)で最低1.2カラム容量で洗浄した。次にrhuMAb HER2を溶離バッファー(0.025M MES / 95mM NaCl, pH5.6)でカラムから溶離した。溶離280nmプロフィールは、先行端にショルダーを有していた(Fig3)。このショルダーの変曲点においてプールを開始し、さらに5カラム容量まで続けた。次いでカラムを再生バッファー(0.025M MES / 1.0M NaCl, pH5.6)で再生した。
【0053】
材料及び方法
カラム及び負荷調製:縮小スケールのSPSFFカラムを充填した。寸法は、27.0mL容量、1.0cm直径及び34.5cmベッド高さであった。プロテインAプールのアリコートのpHは、1.5Mトリス塩基で5.6に滴定した。プールの伝導率は、等量の注射用滅菌水(SWFI)の添加で低下させた。
クロマトグラフィー:この実験のために実行したクロマトグラフィーは、PharmaciaのUNICORN(商品名)FPLCシステムで実施した。平衡化、負荷、及び最初の洗浄工程は、200cm/hの線形流速で実施した。全てのクロマトグラフィー工程は、100cm/hの線形流速で実施した。クロマトグラフィー工程の順序は表1に定義した。実行した6つのクロマトグラフィーは、SPSFF樹脂1mL当たり、15, 20, 25, 30, 35, 及び40mgのrhuMAb HER2という負荷密度で実施した。
【0054】

1.樹脂の平衡化は手動モードで実施した;残りの工程はファーマシア・ユニコーン・プログラムから実行した。
2.CV=カラム容量
【0055】
全タンパク質:各クロマトグラフィー画分(流通、洗浄工程、溶離プレプール、溶離プール、及び再生)のタンパク質濃度は、各試料の分光学的走査によって決定した。結果は生成物回収収率の計算に用いた。rhuMAb HER2の級光係数は1.45である。結果を導くのに使用した計算は次の通りである:

【0056】
rhuMAb HER2抗体変異体の決定(CSx HPIEX):rhuMAb HER2 SPSFFクロマトグラフィーカラムは抗体変異体を分離した。各クロマトグラフィー実験からの画分をCSx HPIEXクロマトグラフィーによって変異抗体の相対量について試験した。BAKERBOND WIDEPORE(商品名)CSx HPIEXカラム(4.6 x 250mm)を55℃において1mL/分で実行した。移動相は三元勾配から形成した(表2)。

カラムは55℃において1mL/分で実行した。
【0057】
Aバッファーは0.025M MES, pH 5.9;Bバッファーは1M 酢酸アンモニウム, pH 7.0;及びC溶液は注射用滅菌水であった。カラムは勾配の初期条件(49%A; 1%B; および50%C)で平衡化し、SWFIで希釈して<300μgタンパク質を含む試料200μlを注入した。得られた各クロマトグラフを積分し、各画分について各ピーク面積の割合を決定した(表3およびFig5)。

クロマトグラムの比較:各クロマトグラフィーファイルからの吸収データ(AU280nm)をASCIIフォーマットのUnicornから移した。0.025M MES / 0.07M NaCl, pH5.6洗浄からのデータをExcelフォーマットに翻訳し、KALEIDAGRAPH(商品名)にコピーした。KALEIDAGRAPH(商品名)を用いて、洗浄プロフィールを上書きし(Fig6)、互いに比較した。
【0058】
結果と議論
抗体を組み換えDNA技術で作成した場合、rhuMAb HER2の脱アミド化及び他の酸性変異体が生成された(例えば、Fig5のCSxピークa、bおよび1参照)。脱アミド化及び他の酸性変異体は、最初のプロテインAクロマトグラフィー工程で得られた組成物の(積分曲線下の面積又はCSxクロマトグラフィーで得られたプロフィールとして計算すると)約25%を構成していた。ここに記載したイオン交換クロマトグラフィー法は、抗-HER2組成物中の脱アミド化及び他の酸性変異体の量を有意に、即ち約13%又はそれ以下に減少させるのに使用できた(即ち、ここに記載したカチオン交換クロマトグラフィーを施した調製物中の酸性変異体の量は、約50%又はそれ以上減少した)。
【0059】
上記のように実施したカチオン交換カラムからの吸収痕跡をFig3に示す、この方法は、非脱アミド化抗-HER2抗体と僅かにしか相違していない抗-HER2の脱アミド化変異体を分離した。初期条件から中間洗浄への伝導率の変化が脱アミド化抗-HER2抗体の溶離を開始させた。しかしながら、この伝導率での洗浄を続けると非脱アミド化抗-HER2抗体の溶離が見られ、生成物の損失をもたらす。中間バッファーから溶離バッファーに直接進めると、プールを早く始めた場合の生成物からの脱アミド化抗-HER2抗体の許容できない低除去率、あるいはプールを脱アミド化抗-HER2抗体が減少するまで遅く始めた場合の許容できない抗-HER2抗体生成物の低収率のいずれかの結果をまねく。最初に使用したような低伝導率に戻すことにより、抗-HER2抗体生成物の有意な溶離が無く、脱アミド化抗-HER2抗体の溶離が続くことが見いだされた。
【0060】
rhuMAb HER2負荷の(a)バッファー必要量、(b)プールにおける生成物回収、及び(c)プール中の生成物の質に対する影響を評価した。
15mg/mLから35mg/mLまでの負荷密度において、溶離プールにおける生成物収率は約75%であった。40mg/mLの負荷密度については、プールの生成物収率は65%に低下した(Fig4)。プールにおけるこの回収の低下は、(各々70mM NaCl及び50mM NaClでの)二つの洗浄工程における抗体の増加に大きく依存する。
全ての溶離プールにおけるrhuMAb HER2の量は、CSx HPIEX分析によって測定した場合に等価であった(Fig5)。負荷材料に比較して;非脱アミド化抗体の富化があり(ピーク3)、Iso-Asp102又はLys450抗体量の変化が無く(ピーク4)、Asp30脱アミド化抗体量の減少があった(ピークa、b、1、その他)。
【0061】
これらのカチオンプール中のrhuMAb HER2の質は、中間洗浄工程を通して向上した。樹脂に結合したrhuMAb HER2の質量が増加すると、280nmピークに到達するのに要する中間バッファーの消費が減少する。40mg/mL負荷密度に必要とされるバッファー容量は、約2.5カラム容量である。15mg/mL負荷密度に必要とされるバッファー容量は、約15カラム容量である。バッファー必要量の正確な増加は、これら2つの極限点間の5mg/mL刻みの変化に比例してはいない。最も大きな増加は、20mg/mLと15mg/mLの負荷密度間に見られた。ここで、必要量は、7.5カラム容量から既に述べたように15カラム容量のバッファーへと2倍になった。しかし、70mM NaCl洗浄の頂点に達した場合、生成物の質は試験した全ての負荷密度について等価である。
この実験は、どれくらいのrhuMAb HER2がSPSFFに負荷できるかを決定した。樹脂1mL当たりに15から40mgの範囲の抗体では、溶離プールに回収されたrhuMAb HER2の質に相違は無かった。しかし、回収されたrhuMAb HER2の量は、樹脂に35mg/mLより大きな負荷をした場合に約10%減少した。一貫した収率のために、rhuMAb HER2製造については35mg/mLを負荷上限とすることが推奨される。さらに、20から15mg/mLの間では、必要とされる70mM NaCl洗浄容量が有意に増加するので、rhuMAb HER2の製造には20mg/mLを負荷下限とすることが推奨される。
【0062】
実施態様
1. ポリペプチドを、当該ポリペプチド及び汚染物質を含有する組成物から単離する方法において、連続的に実施される以下の工程:
(a)当該ポリペプチドを、第1の伝導率及びpHの負荷バッファーを用いてイオン交換材料に結合させ;
(b)当該イオン交換材料を第2の伝導率及び/又はpHの中間バッファーで洗浄して汚染物質をイオン交換材料から溶離し;
(c)当該イオン交換材料を第3の伝導率及び/又はpHの洗浄バッファーで洗浄し、ここで、中間バッファーから洗浄バッファーへの伝導率及び/又はpHの変化が、負荷バッファーから中間バッファーへの伝導率及び/又はpHの変化と反対方向であり;そして
(d)当該イオン交換材料を第4の伝導率及び/又はpHの溶離バッファーで洗浄してポリペプチドをイオン交換材料から溶離することを含んでなる方法。
2. 前記イオン交換材料がカチオン交換樹脂である、実施態様1に記載の方法。
3. 前記イオン交換材料がアニオン交換樹脂である、実施態様1に記載の方法。
4. 中間バッファーの伝導率及び/又はpHが負荷バッファーの伝導率及び/又はpHよりも大きく、洗浄バッファーの伝導率及び/又はpHが中間バッファーの伝導率及び/又はpHよりも小さい、実施態様2に記載の方法。
5. 洗浄バッファーの伝導率及び/又はpHが負荷バッファーの伝導率及び/又はpHとほぼ同じである、実施態様1に記載の方法。
6. 溶離バッファーの伝導率及び/又はpHが中間バッファーの伝導率及び/又はpHより大きい、実施態様2に記載の方法。
7. 汚染物質及びポリペプチドの溶離が、各々中間バッファー及び溶離バッファーの伝導率の変更によって達成される、実施態様1に記載の方法。
8. 各工程(a)−(d)でほぼ一定のpHが維持される、実施態様1に記載の方法。
9. ポリペプチド及び汚染物質が僅かに異なるpIを有する、実施態様1に記載の方法。
10. 汚染物質がポリペプチドの脱アミド化変異体である、実施態様1に記載の方法。
11. 中間及び溶離バッファーの伝導率が、それらの塩濃度の変化によって改変される、実施態様7に記載の方法。
12. 中間及び溶離バッファーの伝導率が、それらのNaCl濃度の変化によって改変される、実施態様11に記載の方法。
13. 工程(d)の後に、イオン交換体を再生バッファーで洗浄することをさらに含む、実施態様1に記載の方法。
14. カチオン交換樹脂がアガロース上に固定化されたスルホプロピルを含む、実施態様2に記載の方法。
15. ポリペプチドが抗体である、実施態様1に記載の方法。
16. 抗体がHER2に結合する、実施態様15に記載の方法。
17. 汚染物質がポリペプチドの脱アミド変異体である、実施態様1に記載の方法。
18. イオン交換クロマトグラフィーの前、最中又は後に、ポリペプチドを含む組成物に一又は複数の精製工程を施し、ポリペプチドの均一な調製物を得ることをさらに含む、実施態様1に記載の方法。
19. 精製したポリペプチドを異種分子と複合させることをさらに含む、実施態様18に記載の方法。
20. 異種分子が、ポリエチレングリコール、標識、又は細胞毒性薬である、実施態様19に記載の方法。
21. ポリペプチドの調製物と製薬的に許容される担体とを混合することにより製薬組成物を調製することをさらに含む、実施態様18に記載の方法。
22. 実施態様1に記載の方法に従って精製されたポリペプチド。
23. ポリペプチドを、当該ポリペプチド及び汚染物質を含有する組成物から単離する方法において、連続的に実施される以下の工程:
(a)当該ポリペプチドを、第1の伝導率及びpHの負荷バッファーを用いてカチオン交換材料に結合させ;
(b)当該カチオン交換材料を、負荷バッファーのものより大きな第2の伝導率及び/又はpHの中間バッファーで洗浄して汚染物質をイオン交換材料から溶離し;
(c)当該カチオン交換材料を、中間バッファーのものより小さな第3の伝導率及び/又はpHの洗浄バッファーで洗浄し;そして
(d)当該イオン交換材料を、中間バッファーのものより大きな第4の伝導率及び/又はpHの溶離バッファーで洗浄してポリペプチドをイオン交換材料から溶離することを含んでなる方法。
24. 抗体を、当該抗体及び汚染物質を含有する組成物から精製する方法において、当該組成物をカチオン交換樹脂上に負荷することを含んでなり、カチオン交換樹脂上に負荷される抗体の量が、カチオン交換樹脂1mL当たりに約20mgから約35mgの抗体である方法。
25. カチオン交換樹脂がアガロース上に固定化されたスルホプロピルを含む、実施態様24に記載の方法。
26. 抗体をカチオン交換樹脂から溶離することをさらに含む、実施態様24に記載の方法。
27. 抗体をカチオン交換樹脂から溶離する前の中間洗浄工程において汚染物質をカチオン交換樹脂から溶離することをさらに含む、実施態様26に記載の方法
28. 抗-HER2抗体及び一又は複数のその酸性変異体を含み、当該酸性変異体の量が約25%未満である組成物。
29. 製薬的に許容される担体をさらに含む、実施態様28に記載の組成物。
30. 抗-HER2抗体がhumMAb4D5-8である、実施態様28に記載の組成物。
31. 抗HER2抗体とその一又は複数の酸性変異体との混合物を含んでなる組成物であって、
当該酸性変異体の量がおよそ25%より少なく、
当該酸性変異体が主に、抗HER2抗体の一又は複数のアスパラギン残基が脱アミドされている脱アミド化変異体であり、
当該抗HER2抗体がhumMAb4D5−8であり、
当該脱アミド化変異体が、アスパラギン酸に転換されたhumMAb4D5−8のVL領域の何れか又は両方のCDR1にAsn30を有するものである、組成物。
32. 酸性変異体の量がおよそ20%より少ない、実施態様31に記載の組成物。
33. 酸性変異体の量がおよそ13%より少ない、実施態様32に記載の組成物。
34. 酸性変異体の量がおよそ1から18%の範囲である、実施態様32に記載の組成物。
35. 抗HER2抗体が配列番号1の軽鎖アミノ酸配列と配列番号2の重鎖アミノ酸配列とを含む、実施態様31に記載の組成物。
36. さらに、薬学的に許容される担体を含有してなる、実施態様31から35の何れか一に記載の組成物。
【技術分野】
【0001】
本発明は一般的にタンパク質精製に関する。特に本発明は、ポリペプチド(例えば抗体)を、当該ポリペプチド及び少なくとも1つの汚染物質を含有する組成物からイオン交換クロマトグラフィー法を用いて精製する方法に関する。
【背景技術】
【0002】
タンパク質の大規模で経済的な精製は、バイオテクノロジー工業にとって重要な問題となってきている。一般的に、タンパク質は、そのタンパク質に対する遺伝子を含む組換えプラスミドの挿入により対象とするタンパク質を生産するように加工された哺乳動物又は最近細胞系を用いて、細胞培養により製造される。用いられる細胞系は生きている生物であるので、それらには、通常は動物血清の調製物から供給される糖、アミノ酸、及び成長因子を含む複合成長媒体を与えなければならない。細胞に与えられる化合物類から及び細胞自体の副生成物から所望のタンパク質を精製してヒト治療用として使用するのに十分な純度とすることは手強い難問を提出する。
細胞細片からのタンパク質の精製方法は、まず最初にタンパク質の発現部位に依存する。幾つかのタンパク質は細胞から周囲の培地中に直接分泌され;他は細胞内で作られる。後者のタンパク質については、精製プロセスの第1の工程は細胞の溶解を含み、それは、機械的せん断、浸透圧ショック、又は酵素的処理を含む種々の方法で実施できる。このような破壊は細胞内容物全てをホモジネート中に放出させ、さらに細胞下断片を生成し、それらはサイズが小さいために除去が困難である。これらは一般に、差動的遠心分離又は濾過により除去される。同じ問題は、スケールは小さいものの、タンパク質製造の実行中での細胞の自然死及び細胞内宿主細胞タンパク質の放出により直接分泌タンパク質でも生じる。
【0003】
対象とするタンパク質を含有する透明化溶液が得られたら、細胞によって生産された他のタンパク質からのその分離は、通常は異なるクロマトグラフィー技術の組み合わせによってなされる。これらの技術は、タンパク質の混合物を、それらの電荷、疎水性度、又はサイズに基づいて分離する。これらの技術の各々には幾つかの異なるクロマトグラフィー樹脂が利用可能であり、含まれる特定のタンパク質に対する精製スキームの精密な設計が可能になる。これらの各分離法の本質は、タンパク質が、長いカラムの下方へ異なる速度で移動し、カラムの更に下方へ通過するときに増加する物理的分離を達成すること、あるいは分子媒体に選択的に接着し、次いで異なる溶媒により別々に溶離されることである。幾つかの場合では、不純物はカラムに接着するが対象とするタンパク質はしないとき、即ち、対象とするタンパク質が「流通」中に存在するときに対象とするタンパク質が不純物から分離される。
イオン効果クロマトグラフィーはタンパク質精製に通常使用されるクロマトグラフィー技術である。イオン交換クロマトグラフィーでは、溶質の表面上の荷電パッチがクロマトグラフィーマトリクスに反対電荷によって結合するが、周囲のバッファーのイオン強度は低い。溶離は、バッファーのイオン強度(即ち、伝導率)を上昇させ、イオン交換マトリクスの荷電部位に対して溶質と競合させることにより達成される。pHを変化させ、それにより溶質の電荷を変化させることは、溶質の溶離を達成する他の方法である。伝導率又はpHの変化は、徐々に(勾配溶離)又は段階的に(段階溶離)してよい。以前は、これらの変化は進行性;即ち、pH又は伝導率が一方向に増加又は減少するものであった。
【発明の概要】
【0004】
本発明は、最初の伝導率及びpHにおいて対象とするポリペプチドがイオン交換材料に結合し、次いでイオン交換材料を伝導率又はpH、又は両方が異なる中間バッファーで洗浄するイオン交換クロマトグラフィー法を提供する。この中間洗浄に続く特定の時点で、そしてイオン交換クロマトグラフィーの標準的な実務に反して、イオン交換材料を洗浄バッファーで洗浄するが、中間バッファーから洗浄バッファーへの伝導率又はpH、又は両方の変化が、上記工程でなされた伝導率又はpH、又は両方の変化と逆方向である。洗浄バッファーでの洗浄後のみに、上記工程で使用されたバッファーの伝導率又はpH、又は両方と異なる伝導率又はpH、又は両方を有する溶離バッファーの適用で溶離される対象ポリペプチド分子のためのイオン交換材料が調製される。
【0005】
イオン交換クロマトグラフィーのこの新規な方法は、生成分子を極めて密接に関連した分子から、ポリペプチド生成物の純度及び高い回収が望まれる完全製造スケールで分離しなければならない状況で特に有用である。
【0006】
従って、本発明は、連続的に実施される以下の工程を含んでなる、ポリペプチドを、当該ポリペプチド及び汚染物質を含有する組成物から単離する方法を提供する:
(a)当該ポリペプチドを、第1の伝導率及びpHの負荷バッファーを用いてイオン交換材料に結合させ;
(b)当該イオン交換材料を第2の伝導率及び/又はpHの中間バッファーで洗浄して汚染物質をイオン交換材料から溶離し;
(c)当該イオン交換材料を第3の伝導率及び/又はpHの洗浄バッファーで洗浄し、ここで、中間バッファーから洗浄バッファーへの伝導率及び/又はpHの変化が、負荷バッファーから中間バッファーへの伝導率及び/又はpHの変化と反対方向であり;そして
(d)当該イオン交換材料を第4の伝導率及び/又はpHの溶離バッファーで洗浄してポリペプチドをイオン交換材料から溶離する。第1の伝導率及び/又はpHは第3の伝導率及び/又はpHと同じであってもよい。
【0007】
イオン交換材料がカチオン交換樹脂である場合、中間バッファーの伝導率及び/又はpHは好ましくは負荷バッファーの伝導率及び/又はpHよりも大きく;洗浄バッファーの伝導率及び/又はpHは好ましくは中間バッファーの伝導率及び/又はpHよりも小さく、溶離バッファーの伝導率及び/又はpHは好ましくは中間バッファーの伝導率及び/又はpHより大きい。好ましくは、洗浄バッファーの伝導率及び/又はpHは負荷バッファーの伝導率及び/又はpHとほぼ同じである。
好ましくは、汚染物質及びポリペプチドの溶離は、各々中間バッファー及び溶離バッファーの伝導率の変更によって達成されるが、これらのバッファーのpHはほぼ同じに維持される。
【0008】
また本発明は、連続的に実施される以下の工程を含んでなる、ポリペプチドを、当該ポリペプチド及び汚染物質を含有する組成物から単離する方法を提供する:
(a)当該ポリペプチドを、第1の伝導率及びpHの負荷バッファーを用いてカチオン交換材料に結合させ;
(b)当該カチオン交換材料を、負荷バッファーのものより大きな第2の伝導率及び/又はpHの中間バッファーで洗浄して汚染物質をイオン交換材料から溶離し;
(c)当該カチオン交換材料を、中間バッファーのものより小さな第3の伝導率及び/又はpHの洗浄バッファーで洗浄し;そして
(d)当該イオン交換材料を、中間バッファーのものより大きな第4の伝導率及び/又はpHの溶離バッファーで洗浄してポリペプチドをイオン交換材料から溶離する。
【0009】
さらに本発明は、抗体を、当該抗体及び汚染物質を含有する組成物から精製する方法において、当該組成物をカチオン交換樹脂上に負荷すること、場合によっては抗体をカチオン交換樹脂から溶離することをさらに含んでなり、カチオン交換樹脂上に負荷される抗体の量が、カチオン交換樹脂1mL当たりに約20mgから約35mgの抗体である方法を提供する。この方法は、好ましくはイオン交換樹脂から一又は複数の汚染物質を溶離する中間洗浄工程をさらに含む。この中間洗浄工程は、通常は抗体の溶離工程より先行する。
さらに本発明は、抗-HER2抗体及び一又は複数のその酸性変異体を含む組成物を提供し、当該組成物中の酸性変異体の量は約25%未満、好ましくは約20%未満、例えば約1%から約18%の範囲である。場合によっては、この組成物は製薬的に許容される担体をさらに含んでいる。
【図面の簡単な説明】
【0010】
【図1】伝導率の(例えば下記実施例1のNaCl濃度への)変化又はpHの(例えば流れ図に示したpH値への)変化によりカチオン交換クロマトグラフィーを実施する方法を示す流れ図である。
【図2】伝導率の(例えば図に示したNaCl濃度への)変化又はpHの(例えば示したpH値への)変化によりアニオン交換クロマトグラフィーを実施する方法を示す流れ図である。
【図3】実施例1で実行した完全製造スケールでのカチオン交換クロマトグラフィーからの吸収履歴を示す図である。ここに記載する異なるバッファーでカラムを洗浄した点を矢印で示した。
【図4】各クロマトグラフィー分画において回収された組換えヒト化抗-HER2モノクローナル抗体(rhuMAb HER2)を示す図である(関連するクロマトグラフィーの全ての画分合計の割合として計算した)。流通、洗浄工程、及びプレプールは、負荷開始からプールの最初までに回収した全ての流出物である。プール画分は、先行ショルダーの変曲点で開始する溶離の5カラム容量の流出試料である。再生画分は、プール終了から再生終了までに捕捉した流出物を含む。
【図5】カルボキシスルホン交換高圧液体クロマトグラフィー(CSx HPIEX)によって評価した場合の、各カチオン交換クロマトグラフィープール試料中のrhuMAb HER2の量を示す図である。ピークa、b、及び1は、rhuMAb HER2の脱アミド化形態である。ピーク3は非脱アミド化rhuMAb HER2である。ピーク4は、rhuMAb HER2のC-末端リジン含有及びイソ-アスパラギン酸変異体の組み合わせである。
【図6】各クロマトグラフィーについての0.025M MES / 0.070M NaCl, pH 5.6洗浄の吸収(280nm)プロフィールを示す図である。カチオン交換樹脂に負荷したrhuMAb HER2の質量が、頂点におけるピークの吸収レベル並びに頂点に達するのに要するバッファーの量に影響する。この洗浄において生ずる小さなピーク(30mg/mL負荷で最も良く見える)により、頂点は少なくとも0.5吸収単位(AU)の吸収レベルと定義される。
【図7A】humMAb4D5-8軽鎖(配列番号:1)のアミノ酸配列を示す図である。
【図7B】humMAb4D5-8重鎖(配列番号:2)のアミノ酸配列を示す図である。
【発明を実施するための形態】
【0011】
(好ましい実施態様の詳細な説明)
定義:
ここで精製されるべき「組成物」は、対象とするポリペプチド及び一または複数の汚染物質を含む。この組成物は「部分的に精製」(即ち、下記の実施例1におけるようにプロテインAクロマトグラフィー等の一または複数の精製工程を施され)ていてもよく、あるいは、ポリペプチドを産生する宿主細胞または生物から直接に得てもよい(例えば、組成物は回収した細胞培養液を含んでいてもよい)。
ここで用いられる「ポリペプチド」は、一般的には約10より多いアミノ酸を有するペプチド及びタンパク質を意味する。好ましくは、ポリペプチドは哺乳動物タンパク質であり、その例は、例えば、レニン;ヒト成長ホルモン及びウシ成長ホルモンを含む成長ホルモン;成長ホルモン放出因子;副甲状腺ホルモン;甲状腺刺激ホルモン;リポタンパク;アルファ−1−アンチトリプシン;インシュリンA−鎖;インシュリンB−鎖;プロインシュリン;卵胞刺激ホルモン;カルシトニン;黄体形成ホルモン;グルカゴン;因子VIIIC、因子IX、組織因子、及びvonWillebrands因子等の凝固因子;プロテインC等の抗凝固因子;心房性ナトリウム利尿因子;肺界面活性剤;ウロキナーゼ又はヒト尿又は組織型プラスミノーゲン活性化剤(t−PA)等のプラスミノーゲン活性化剤;ボンベシン;トロンビン;造血性成長因子;腫瘍壊死因子−アルファ及びベータ;エンケファリナーゼ;RANTES(正常なT細胞発現及び分泌での調節);ヒトマクロファージ感染タンパク質(MIP-1-アルファ);ヒト血清アルブミン等の血清アルブミン;ミューラー阻害物質;リラキシンA−鎖;リラキシンB−鎖;プロリラキシン;マウスゴナドトロピン関連ペプチド;ベータ−ラクタマーゼ等の微生物タンパク質;DNA分解酵素;IgE;CTLA−4等の細胞毒性Tリンパ球関連抗原(CTLA);インヒビン;アクチビン;血管内皮成長因子(VEGF);ホルモン又は成長因子のレセプター;プロテインA又はD;リウマチ因子;骨誘導神経向性因子(BDNF)、ニューロトロフィン−3、−4、−5又は−6(NT−3、NT−4、NT−5、又はNT−6)、又はNGF−β等の神経成長因子などの神経向性因子;血小板誘導成長因子(PDGF);aFGF及びbFGF等の繊維芽成長因子;表皮成長因子(EGF);TGF−β1、TGF−β2、TGF−β3、TGF−β4、又はTGF−β5を含むTGF−アルファ及びTGF−ベータ等のトランスホーミング増殖因子(TGF);インシュリン様成長因子−I及び−II(IGF−I及びIGF−II);des(1−3)−IGF−I(脳IGF−I)、インシュリン様成長因子結合タンパク質(IGFBPs);CD3、CD4、CD8、CD19及びCD20等のCDタンパク質;エリスロポエチン;骨誘導因子;免疫毒素;骨形成タンパク質(BMP);インターフェロン−アルファ、−ベータ、及び−ガンマ等のインターフェロン;コロニー刺激因子(CSFs)、例えば、M−CSF、GM−CSF、及びG−CSF;インターロイキン(ILs)、例えば、IL−1〜IL−10;スーパーオキシドジスムターゼ;T細胞レセプター;表面膜タンパク質;崩壊促進因子;ウイルス性抗原、例えば、AIDSエンベロープの一部など;輸送タンパク質;ホーミングレセプター;アドレシン(addressins);調節タンパク質;CD11a、CD11b、CD11c、CD18,ICAM、VLA−4及びVCAM等のインテグリン;HER2、HER3またはHER4レセプター等の腫瘍関連抗原;及び上に列挙した任意のポリペプチドの断片及び/又は変異体を含む。最も好ましいのは、ヒトHER2に結合する全長抗体である。
【0012】
「汚染物質」とは、所望のポリペプチド生成物とは異なる物質である。汚染物質は、所望のポリペプチドの変異体(例えば、所望のポリペプチドの脱アミド変異体またはアミノ−アスパラギン酸変異体)または他のポリペプチド、核酸、エンドトキシン等でありうる。
出発ポリペプチドの「変異体」または「アミノ酸変異体」は、出発ポリペプチドのアミノ酸配列と異なるアミノ酸配列を含むポリペプチドである。一般的に、変異体は天然ポリペプチドと少なくとも80%の配列同一性、好ましくは少なくとも90%の配列同一性、より好ましくは少なくとも95%の配列同一性、最も好ましくは少なくとも98%の配列同一性を有する。パーセント配列同一性は、例えば、Fitch等, Proc. Natl. Acad. Sci. USA 80: 1382-1386 (1983)、Needleman等, J. Mol. Biol. 48: 443-453 (1970)に記載されたバージョンのアルゴリズムにより、最大の相同性を与えるように配列を整列させた後に決定される。ポリペプチドのアミノ酸配列変異体は、ポリペプチドをコードするDNAに適当な核酸変化を導入することにより、あるいはペプチド合成により調製される。このような変異体は、例えば、対象とするポリペプチドのアミノ酸配列内残基からの欠失、及び/又はそれへの挿入及び/又はその置換を含む。最終的な作成物に到達する欠失、挿入、及び置換の任意の組み合わせが、最終作成物が所望の特徴を持つ限りなされる。また、アミノ酸変化は、グリコシル化部位の数又は位置の変更といったポリペプチドの翻訳後プロセスを変えてもよい。ポリペプチドのアミノ酸配列変異体の生成方法は、例えば米国特許第5,534,615号に記載され、ここに出典明示して参考として取り入れる。
【0013】
「酸性変異体」は、対象とするポリペプチドの変異体であって、対象とするポリペプチドより酸性(例えば、カチオン交換クロマトグラフィーで決定)であるものである。酸性変異体の例は脱アミド化変異体である。
ポリペプチド分子の「脱アミド化変異体」は、最初のポリペプチドの一又は複数のアスパラギン残基がアスパラギン酸に変換された、即ち、中性アミド側鎖が全体として酸性特性を持つ残基に変換されたポリペプチドである。下記の実施例からの脱アミド化humMAb4D5抗体は、そのVL領域の一方又は両方のCDR1におけるAsn30がアスパラギン酸に変換されている。ここで用いられる「脱アミド化ヒトDNase」は、天然成熟ヒトDNaseのアミノ酸配列の位置74で生ずるアスパラギン残基で脱アミドされたヒトDNaseを意味する(米国特許第5,279,823号;出典明示してここに参考として取り入れる)。
抗-HER2抗体を含む組成物を参照してここで用いられる「混合物」とは、所望の抗-HER2抗体及びその一又は複数の酸性変異体の存在を意味する。酸性変異体は、主に脱アミド化抗-HER2抗体を含み、少量の他の酸性変異体を含んでもよい。例えば、組換え発現から得た抗-HER2抗体の調製では、抗-HER2抗体の約25%までが脱アミド化されていることが見いだされた。
【0014】
本発明の好ましい実施態様では、ポリペプチドは組換えポリペプチドである。「組換えポリペプチド」は、ポリペプチドをコードする核酸で形質転換又は形質移入された又は相同組換えの結果としてポリペプチドを産生する宿主細胞において産生されたものである。「形質転換」及び「形質移入」は、細胞に核酸を導入するプロセスを指すのに交換可能に用いられる。形質転換又は形質移入に続いて、核酸は宿主細胞ゲノムに組み込まれるか、染色体外成分として存在する。「宿主細胞」は、インビトロ細胞培養における細胞並びに宿主細胞内の細胞を含む。ポリペプチドの組換え生産の方法は、例えば米国特許第5,534,615号に記載され、出典明示してここに参考として取り入れる。
「抗体」という用語は最も広い意味において使用され、特にモノクローナル抗体(全長モノクローナル抗体を含む)、ポリクローナル抗体、多重特異性抗体(例えば、二重特異性抗体)、及び抗体断片を、それらが所望の生物学的特性を有する限り包含する。
【0015】
ここでいう抗体は対象とする「抗原」に対するものである。好ましくは、抗原は生物学的に重要なポリペプチドであり、病気又は疾患に罹っている哺乳動物への抗体の投与によりその哺乳動物に治療的恩恵が生じうる。しかし、非ポリペプチド抗原に対する抗体(例えば腫瘍関連糖脂質抗原;米国特許第5,091,178号参照)もまた考えられる。抗原がポリペプチドである場合、それは膜貫通分子(例えば、レセプター)あるいはリガンド、例えば成長因子でありうる。抗原の例には、上で議論したポリペプチドが含まれる。本発明により包含される抗体に対する好適な分子標的には、CDポリペプチド、例えばCD3、CD4、CD8、CD19、CD20及びCD34;HERレセプターファミリーのメンバー、例えばEGFレセプター、HER2、HER3又はHER4レセプター;細胞接着分子、例えばLFA-1、Mac1、p150.95、VLA-4、ICAM-1、VCAM及びそのα又はβサブユニットの何れかを含むav/β3インテグリン(例えば、抗CD11a、抗CD18又は抗CD11b抗体);成長因子、例えばVEGF;IgE;血液型抗原;flk2/flt3レセプター;肥満(OB)レセプター;mplレセプター;CTLA-4;ポリペプチドC等々が含まれる。場合によっては他の分子に抱合していてもよい、可溶型抗原又はその断片を、抗体を産生するための免疫原として使用することができる。レセプターのような膜貫通分子に対しては、これらの断片(例えば、レセプターの細胞外ドメイン)を免疫原として使用することができる。あるいは、膜貫通分子を発現する細胞を免疫原として使用することもできる。そのような細胞は天然源(例えば、癌株化細胞)から取り出すことができ、又は膜貫通分子を発現するために組み換え技術により形質転換された細胞でありうる。
【0016】
ここで使用される「モノクローナル抗体」という用語は、実質的に均一な抗体の集団から得られる抗体を称する、すなわち、集団を構成する個々の抗体が、少量存在しうる自然に生じる可能な突然変異を除いて同一である。モノクローナル抗体は高度に特異的であり、一つの抗原部位に対応する。更に、異なる決定基(エピトープ)に対応する異なる抗体を典型的に含む従来の(ポリクローナル)抗体調製物とは異なり、各モノクローナル抗体は抗原の単一の決定基に対応する。「モノクローナル」との形容は、実質的に均一な抗体集団から得られたという抗体の性質を示し、抗体を何か特定の方法で生産しなければならないことを意味するものではない。例えば、本発明に従って使用されるモノクローナル抗体は、最初にKohler等によって、Nature, 256: 495 (1975)に記載されたハイブリドーマ法によって作ることができ、あるいは組換えDNA法(例えば米国特許第4,816,567号参照)によって作ることができる。さらなる実施態様では、「モノクローナル抗体」は、例えば、McCafferty等, Nature, 348:552-554(1990)に記載された技術を用いて作成された抗体ファージライブラリから単離することができる。Clackson等, Nature, 352:624-628 (1991)及びMarks等, J. Mol. biol. 222: 581-597 (1991)は、各々ファージライブラリを用いたマウス及びヒト抗体を単離を記載している。続く文献は、鎖混合による高親和性(nM範囲)ヒト抗体の生成(Marks等, Bio/Technology, 10: 779-783 (1992))、並びに非常に大きなファージライブラリの作成方法としての組み合わせ感染及びインビボ組換えを記載している(Waterhouse等, Nuc. Acid. Res., 21: 2265-2266 (1993))。即ち、これらの技術は、モノクローナル抗体の単離のための伝統的なモノクローナル抗体ハイブリドーマ技術の別法として利用可能である。あるいは、免疫時に、内因性免疫グロブリンの産生なしにヒト抗体の全レパートリーを産生することのできるトランスジェニック動物(例えば、マウス)を作ることが今は可能である。例えば、キメラ及び生殖系列突然変異体マウスにおける抗体重鎖結合領域(JH)遺伝子の同型接合除去が内因性抗体産生の完全な阻害をもたらすということが記載されている。このような生殖系列突然変異体マウスでのヒト生殖系列免疫グロブリン遺伝子列の転移は、抗原投与時にヒト抗体の産生をもたらすであろう。例えば、Jakobovits等, Proc.Natl.Acad.Sci.USA, 90:2551 (1993);Jakobovits等, Nature 362:255-258 (1993); Bruggerman等, Year in Immuno., 7:33 (1993);及びDuchosal等, Nature 355:258 (1992)を参照されたい。
【0017】
ここに記載のモノクローナル抗体は、特に、重鎖及び/又は軽鎖の一部が、特定の種から由来するか、特定の抗体クラス又はサブクラスに属する抗体の対応する配列と同一か相同である一方、鎖の残りが、他の種から由来するか、他の抗体クラス又はサブクラスに属する抗体の対応する配列と同一か相同である「キメラ」抗体(免疫グロブリン)、並びにそれらが所望の生物学的活性を示す限りはその抗体の断片を含む(米国特許第,4816,567号;及びMorrison等, Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984))。
ここで使用される場合の「高頻度可変領域」なる用語は、抗原結合性を生じる抗体のアミノ酸残基を意味する。高頻度可変領域は「相補性決定領域」又は「CDR」からのアミノ酸残基(即ち、軽鎖可変ドメインの残基24−34(L1)、50−56(L2)及び89−97(L3)及び重鎖可変ドメインの31−35(H1)、50−65(H2)及び95−102(H3);Kabat等, Sequences of Proteins of Immunological Interest,5版, Public Health Service, National Institutes of Health, Bethesda, MD.(1991))及び/又は「高頻度可変ループ」からの残基(すなわち、軽鎖可変ドメインの残基26−32(L1)、50−52(L2)及び91−96(L3)及び重鎖可変ドメインの残基26−32(H1)、53−55(H2)及び96−101(H3);Chothia及びLesk J.Mol.Biol. 196:901-917 (1987))を含んでなる。「フレームワーク」又は「FR」残基はここに定義した高頻度可変領域残基以外の可変ドメイン残基である。下記実施例のrhuMAb HER2抗体のCDR及びFR残基(humAb4D5-8)は、Carter等, Proc. Natl. Acad. Sci. USA, 89: 4285 (1992)で同定されている。
【0018】
非ヒト(例えばマウス)抗体の「ヒト化」型は、非ヒト免疫グロブリンに由来する最小配列を含むキメラ抗体である。大部分においてヒト化抗体はレシピエントの高頻度可変領域からの残基が、マウス、ラット、ウサギ又は所望の特異性、親和性及び能力を有する霊長類などの非ヒト(ドナー抗体)の高頻度可変領域からの残基によって置換されたヒト免疫グロブリン(レシピエント抗体)である。ある場合には、ヒト免疫グロブリンのFvフレームワーク領域(FR)残基は、対応する非ヒト残基によって置換されている。さらに、ヒト化抗体は、レシピエント抗体にも、もしくはドナー抗体にも見出されない残基を含んでもよい。これらの修飾は抗体の特性を更に洗練するために行われる。一般に、ヒト化抗体は、全てあるいはほとんど全ての高頻度可変ループが非ヒト免疫グロブリンのものに対応し、全てあるいはほとんど全てのFR領域がヒト免疫グロブリン配列のものである、少なくとも1つ、典型的には2つの可変ドメインの実質的に全てを含む。ヒト化抗体は、場合によっては免疫グロブリン定常領域(Fc)、典型的にはヒト免疫グロブリンのものの少なくとも一部を含んでなる。
抗原性を軽減するには、ヒト化抗体を生成するために使用するヒトの軽及び重可変ドメインの両方の選択が非常に重要である。いわゆる「ベストフィット法」では、齧歯動物抗体の可変ドメインの配列を既知のヒト可変ドメイン配列ライブラリ全体に対してスクリーニングする。齧歯動物のものと最も近いヒトの配列を次にヒト化抗体のヒトフレームワーク(FR)として受け入れる(Sims等, J. Immunol., 151: 2296 (1993);Chothia等, J. Mol. Biol., 196: 901 (1987))。
【0019】
他の方法では、軽鎖又は重鎖の特定のサブグループのヒト抗体全てのコンセンサス配列から誘導される特定のフレームワークを使用する。同じフレームワークを幾つかの異なるヒト化抗体に使用できる(Carter等, Proc. Natl. Acad. Sci. USA, 89: 4285 (1992);Presta等, J. Immunol., 151: 2623 (1993))。
さらに、抗体は、抗原に対する高親和性及び他の望ましい生物学的性質を保持したままヒト化することが重要である。この目的を達成するため、好ましい方法によれば、親配列及び様々な概念的ヒト化生成物を、親およびヒト化配列の三次元モデルを用いて分析する工程によってヒト化抗体を調製する。三次元免疫グロブリンモデルは一般に利用でき、当業者には良く知られている。選ばれた候補免疫グロブリン配列の可能な三次元コンホメーション構造を例示し表示するコンピュータープログラムが利用できる。これらの表示を調べることにより、候補免疫グロブリン配列の機能における残基の可能な役割の分析、すなわち、候補免疫グロブリンがその抗原を結合させる能力に影響を及ぼす残基の分析が可能となる。このようにしてレシピエント及び移入配列からのFR残基を選択し、結びつけることができ、所望の抗体の特性、例えば標的抗原に対する親和性の増加が達成される。一般に、CDR残基は、直接的かつ最も実質的に抗原結合への影響に関与する。
【0020】
「抗体断片」は、全長抗体の一部、一般的にはその抗原結合又は可変領域を含む。抗体断片の例は、Fab、Fab’、F(ab’)2及びFv断片;ダイアボディ;直鎖状抗体;一本鎖抗体分子;及び抗体断片から形成された多重特異性抗体を含む。
抗体断片を生産するために様々な技術が開発されている。伝統的には、これらの断片は、無傷の抗体のタンパク分解性消化を介して誘導された(例えば、Morimoto等, Journal of Biochemical and Biophysical Methods 24:107-117 (1992)及びBrennan等, Science, 229:81[1985]を参照)。しかし、これらの断片は現在は組換え宿主細胞により直接生産することができる。例えば、抗体断片は上記で検討した抗体ファージライブラリから分離することができる。あるいは、Fab’-SH断片は大腸菌から直接回収することができ、化学的に結合してF(ab’)2断片を形成することができる(Carter等, Bio/Technology 10:163-167[1992])。他の実施態様では、F(ab’)2はロイシンジッパーGCN4を用いて形成されてF(ab’)2分子の組立が促進される。他の方法に従うと、F(ab’)2断片を組換え宿主細胞培養から直接分離することができる。抗体断片の生産のための他の技術は当業者には明らかであろう。
【0021】
他の実施態様では、選択抗体は一本鎖Fv断片(scFv)である。WO 93/16185を参照のこと。「一本鎖Fv」又は「sFv」抗体断片は、抗体のVH及びVLドメインを含む抗体断片を含み、これらのドメインは単一のポリペプチド鎖に存在する。好ましくは、FvポリペプチドはVH及びVLドメイン間にポリペプチドリンカーを更に含み、それはsFVが抗原結合に望まれる構造を形成するのを可能にする。sFvの概説については、The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg及びMoore編, Springer-Verlag, New York, pp. 269-315 (1994)のPluckthunを参照のこと。
【0022】
「ダイアボディ」なる用語は、二つの抗原結合部位を持つ小さい抗体断片を指し、その断片は同一のポリペプチド鎖(VH−VL)内で軽鎖可変ドメイン(VL)に重鎖可変ドメイン(VH)が結合している。非常に短いために同一鎖上で二つのドメインの対形成を可能にするリンカーを使用して、ドメインを他の鎖の相補ドメインと強制的に対形成させ、二つの抗原結合部位を創製する。ダイアボディーは、例えば、EP404,097;WO 93/11161;及びHollinger等, Proc.Natl.Acad.Sci. USA 90:6444-6448 (1993)に更に詳細に記載されている。
「直鎖状抗体」という表現は、この出願を通してZapata等, Polypeptide Eng. 8(10):1057-1062 (1995)に記載された抗体を意味する。簡単に言えば、これらの抗体は抗原結合領域の対を形成する直列のFdセグメント(VH-CH1-VH-CH1)を含む。直鎖状抗体は二重特異性でも単特異性でもよい。
【0023】
「多重特異性抗体」は、少なくとも二つの異なるエピトープに対する結合特異性を有し、これらのエピトープは通常異なる抗原からのものである。このような分子は通常は二つの抗原を結合させるのみであるが(即ち、二重特異性抗体、BsAbs)、三重特異性抗体のような更なる特異性を持つ抗体もここで使用される場合この表現に包含される。BsAbsの例には、一方の腕が腫瘍細胞抗原に向けられ他方の腕が細胞毒性トリガー分子に向けられたもの、例えば抗-FcγRI/抗-CD15、抗-p185HER2/FcγRIII(CD16)、抗-CD3/抗-悪性B細胞(1D10)、抗-CD3/抗-p185HER2、抗-CD3/抗-p97、抗-CD3/抗-腎臓細胞癌腫、抗-CD3/抗-OVCAR-3、抗-CD3/L-D1(抗-大腸ガン腫)、抗-CD3/抗-メラニン細胞刺激ホルモン類似体、抗-EGFレセプター/抗-CD3、抗-CD3/抗-CAMA1、抗-CD3/抗-CD19、抗-CD3/MoV18、抗-神経細胞接着分子(NCAM)/抗-CD3、抗-葉酸塩結合タンパク質(FBP)/抗-CD3、抗-全癌腫随伴抗原(AMOC-31)/抗-CD3;腫瘍抗原に特異的に結合する一つの腕と毒素に結合する一つの腕を持つBsAbs、例えば、抗-サポリン/抗-Id-1、抗-CD22/抗-サポリン、抗-CD7/抗-サポリン、抗-CD38/抗-サポリン、抗-CEA/抗-リシンA鎖、抗-インターフェロンα(IFN-α)/抗-ハイブリドーマイディオタイプ、抗-CEA/抗-ビンカアルカロイド;(マイトマイシンホスフェートのマイトマイシンアルコールへの転換を触媒する)抗-CD30/抗-アルカリホスファターゼのような酵素活性化プロドラッグを転換するためのBsAbs;抗-フィブリン/抗-組織プラスミノーゲンアクチベーター(tPA)、抗-フィブリン/抗-ウロキナーゼ型プラスミノーゲンアクチベーター(uPA)のような線維素溶解剤として使用することができるBsAbs;抗-低密度リポタンパク質(LDL)/抗-Fcレセプター(例えばFcγRI、FcγRII又はFcγRIII)のような細胞表面レセプターへ免疫複合体をターゲティングするためのBsAbs;抗-CD3/抗-単純ヘルペスウィルス(HSV)、抗-T細胞レセプター:CD3複合体/抗-インフルエンザ、抗-FcγR/抗-HIVのような感染性疾患の治療に使用されるBsAbs;抗-CEA/抗-EOTUBE、抗-CEA/抗-DPTA、抗-p185HER2/抗-ハプテンのようなインビトロ又はインビボでの腫瘍検出のためのBsAbs;ワクチンアジュバントとしてのBsAbs;及び抗-ウサギIgG/抗-フェリチン、抗-セイヨウワサビペルオキシダーゼ(HRP)/抗-ホルモン、抗-ソマトスタチン/抗-サブスタンスP、抗-HRP/抗-FITC、抗-CEA/抗-βガラクトシダーゼのような診断ツールとしてのBsAbsが含まれる。三重特異性抗体の例には、抗-CD3/抗-CD4/抗-CD37、抗-CD3/抗-CD5/抗-CD37及び抗-CD3/抗-CD8/抗-CD37が含まれる。二重特異性抗体は全長抗体又は抗体断片(例えばF(ab’)2二重特異性抗体)として調製することができる。
【0024】
二重特異性抗体を作成する方法は当分野において既知である。全長二重特異性抗体の伝統的な組換え産生は二つの免疫グロブリン重鎖-軽鎖対の同時発現に基づき、ここで二つの該鎖は異なる特異性を持っている(Millstein等, Nature, 305:537-539 (1983))。免疫グロブリン重鎖及び軽鎖が無作為に取り揃えられているため、これらのハイブリドーマ(クアドローマ)は10個の異なる抗体分子の可能性ある混合物を産生し、そのうちただ一つが正しい二重特異性構造を有する。通常、アフィニティークロマトグラフィー工程により行われる正しい分子の精製は、かなり煩わしく生成物収率は低い。同様の方法がWO 93/08829号及びTraunecker等, EMBO J., 10:3655-3659 (1991)に開示されている。
【0025】
異なったアプローチ法によると、所望の結合特異性を有する抗体可変ドメイン(抗原−抗体結合部位)を、免疫グロブリン不変ドメイン配列と融合させる。該融合は好ましくは、少なくともヒンジの一部、CH2及びCH3領域を含む免疫グロブリン重鎖定常部との融合である。軽鎖の結合に必要な部位を含む第一の重鎖定常領域(CH1)を、融合の少なくとも一つに存在させることが望ましい。免疫グロブリン重鎖の融合、そして、望まれるならば免疫グロブリン軽鎖をコードしているDNAを、別個の発現ベクター中に挿入し、適当な宿主生物に同時形質移入する。これにより、作成に使用される三つのポリペプチド鎖の等しくない比率が最適な収率を提供する態様において、三つのポリペプチド断片の相互の割合の調節に大きな融通性が与えられる。しかし、少なくとも二つのポリペプチド鎖の等しい比率での発現が高収率をもたらすとき、又は、その比率が特に重要性を持たないときは、2または3個全てのポリペプチド鎖のためのコード化配列を一つの発現ベクターに挿入することが可能である。
【0026】
このアプローチ法の好適な実施態様において、二重特異性抗体は、第一の結合特異性を有する一方の腕のハイブリッド免疫グロブリン重鎖、及び他方の腕のハイブリッド免疫グロブリン重鎖-軽鎖対(第二の結合特異性を提供する)で構成される。二重特異性分子の半分しか免疫グロブリン軽鎖がないことで容易な分離法が提供されるため、この非対称的構造は、所望の二重特異性化合物を不要な免疫グロブリン鎖の組み合わせから分離することを容易にすることが分かった。このアプローチ法は、WO 94/04690に開示されている。二重特異性抗体を作製する更なる詳細については、例えばSuresh等, Methods in Enzymology, 121:210 (1986)を参照されたい。
国際公開WO 96/27011号に記載された他のアプローチ法によれば、一対の抗体分子間の界面を操作して組換え細胞培養から回収されるヘテロ二量体のパーセントを最大にすることができる。好適な界面は抗体定常ドメインのCH3ドメインの少なくとも一部を含む。この方法では、第1抗体分子の界面からの一又は複数の小さいアミノ酸側鎖がより大きな側鎖(例えばチロシン又はトリプトファン)と置換される。大きな側鎖と同じ又はより小さいサイズの相補的「キャビティ」を、大きなアミノ酸側鎖を小さいもの(アラニン又はスレオニン)と置き換えることにより第2の抗体分子の界面に作り出す。これにより、ホモ二量体のような不要の他の最終産物に対してヘテロダイマーの収量を増大させるメカニズムが提供される。
【0027】
二重特異性抗体は、架橋した又は「ヘテロ抱合体抗体」もまた含む。例えば、ヘテロ抱合体の抗体の一方はアビジンに結合され、他方はビオチンに結合され得る。そのような抗体は、例えば、不要の細胞に対する免疫系細胞を標的とするため(米国特許第4,676,980号)、及びHIV感染の治療のために提案された(WO 91/00360, WO 92/00373, 及びEP 03089)。ヘテロ抱合体抗体は、任意の簡便な架橋法を用いて作製することができる。好適な架橋剤は当該分野において良く知られており、多くの架橋技術と共に米国特許第4,676,980号に開示されている。
抗体断片から二重特異性抗体を産生する技術もまた文献に記載されている。例えば、化学結合を使用して二重特異性抗体を調製することができる。Brennan等, Science, 229:81 (1985) は無傷の抗体をタンパク分解性に切断してF(ab’)2断片を産生する手順を記述している。これらの断片は、ジチオール錯体形成剤亜砒酸ナトリウムの存在下で還元して近接ジチオールを安定化させ、分子間ジスルフィド形成を防止する。産生されたFab’断片はついでチオニトロベンゾアート(TNB)誘導体に転換される。Fab'-TNB誘導体の一つをついでメルカプトエチルアミンでの還元によりFab’-チオールに再転換し、他のFab’-TNB誘導体の等モル量と混合して二重特異性抗体を形成する。作られた二重特異性抗体は酵素の選択的固定化用の薬剤として使用することができる。
【0028】
最近の進歩により、大腸菌からのFab’-SH断片の直接の回収が容易になり、これは化学的に結合して二重特異性抗体を形成することができる。Shalaby等, J.Exp.Med., 175:217-225 (1992)は完全にヒト化された二重特異性抗体F(ab’)2分子の製造を記述している。各Fab’断片は大腸菌から別個に分泌され、インビトロで定方向化学共役を受けて二重特異性抗体を形成する。
組換え細胞培養から直接的に二重特異性抗体断片を作成し分離する様々な方法もまた記述されている。例えば、二重特異性抗体はロイシンジッパーを使用して生産されている。Kostelny等, J. Immunol. 148(5):1547-1553 (1992)。Fos及びJunタンパク質からのロイシンジッパーペプチドを遺伝子融合により二つの異なった抗体のFab'部分に結合させる。抗体ホモダイマーをヒンジ領域で還元してモノマーを形成し、ついで再酸化して抗体ヘテロダイマーを形成する。この方法はまた抗体ホモダイマーの生産に対して使用することができる。Hollinger等, Proc.Natl.Acad.Sci. USA, 90:6444-6448 (1993)により記述された「ダイアボディ」技術は二重特異性抗体断片を作成する別のメカニズムを提供した。断片は、同一鎖上の2つのドメイン間の対形成を可能にするには十分に短いリンカーにより軽鎖可変ドメイン(VL)に重鎖可変ドメイン(VH)を結合してなる。従って、一つの断片のVH及びVLドメインは他の断片の相補的VL及びVHドメインと強制的に対形成させられ、2つの抗原結合部位を形成する。単鎖Fv(sFv)ダイマーの使用により二重特異性抗体断片を製造する他の方策もまた報告されている。Gruber等, J. Immunol. 152:5368 (1994)を参照されたい。
二価より多い抗体も考えられる。例えば、三重特異性抗体を調製することができる。Tutt等 J. Immunol. 147:60(1991)。
【0029】
「イオン交換材料」という語句は、負に荷電(即ちカチオン交換樹脂)又は正に荷電(即ちアニオン交換樹脂)した固相を意味する。電荷は固相に一又は複数の荷電リガンドを、例えば共有結合で結合させることにより与えられる。あるいは、又はそれに加えて、電荷は固相に固有の特性であってもよい(例えば、全体として負電荷を有するシリカの場合のように)。
「固相」とは、本発明の抗体が接着できる非水性マトリクスを意味する。固相は、精製カラム、別々の粒子の不連続相、膜又はフィルター等であってよい。固相を形成する材料の例は、ポリサッカリド(例えばアガロース及びセルロース);及び他の機械的に安定な材料、例えばシリカ(例えば孔制御されたガラス)、ポリ(スチレンジビニル)ベンゼン、ポリアクリルアミド、セラミック粒子及び上記の誘導体を含む。
「カチオン交換樹脂」は負に荷電した固相を意味し、よってそれは、固相の上又は中を通過する水溶液中のカチオンと交換される遊離のカチオンを有する。固相に結合してカチオン交換樹脂を形成する負に荷電したリガンドは、例えば、カルボキシレート又はスルホネートであってよい。市販のカチオン交換樹脂は、カルボキシ-メチル-セルロース、BAKERBOND ABX(商品名)、アガロース上に固定化されたスルホプロピル(SP)(例えば、SP-SEPHAROSE FAST FLOW(商品名)又はSP-SEPHAROSE HIGH PERFORMANCE(商品名)、Pharmaciaより)及びアガロース上に固定化されたスルホニル(例えば、S-SEPHAROSE FAST FLOW(商品名)、Pharmaciaより)を含む。
ここで用いられる「アニオン交換樹脂」は、正に荷電した固相を意味し、例えばそれに結合した第4級アミノ基等の一又は複数の正荷電リガンドを有する。市販のアニオン交換樹脂は、DEAEセルロース、QAE SEPHADEX(商品名)及びFAST Q SEPHAROSE(商品名(Pharmacia)を含む。
【0030】
「バッファー」は、その酸−塩基結合成分の作用によりpH変化に抗する緩衝溶液を意味する。例えば所望のバッファーpH等に応じて使用できる種々のバッファーが、Buffers. A Guide for the Preparation and Use of Buffers in Biological Systems, Gueffroy, D., 編, Calbiochem Corporation (1975)に記載されている。一実施態様では、バッファーは(下記実施例1におけるように)約5から約7のpHを有する。この範囲内にpHを調節するバッファーの例は、MES、MOPS、MOPSO、リン酸塩、酢酸塩、クエン酸塩、コハク酸塩、及びアンモニウムバッファー、並びにこれらの組み合わせを含む。
「負荷バッファー」は、対象とするポリペプチド及び一又は複数の汚染物質を含む組成物をイオン交換樹脂に負荷するのに使用するものである。負荷バッファーは、対象とするポリペプチド分子(及び一般に一又は複数の汚染物質)がイオン交換樹脂に結合するような伝導率及び/又はpHを有する。
「中間バッファー」は、対象とするポリペプチド分子の溶離に先立って、一又は複数の汚染物質をイオン交換樹脂から溶離するのに使用される。中間バッファーの伝導率及び/又はpHは、汚染物質はイオン交換樹脂から溶離されるが、対象とするポリペプチドの有意な量は溶離されないものである。
「洗浄バッファー」は、ここで用いられる場合、対象とするポリペプチド分子の溶離に先立って、イオン交換樹脂を洗浄又は再平衡化するのに使用されるバッファーを意味する。便利には、洗浄バッファー及び負荷バッファーは同じであってもよいが、そうである必要はない。
「溶離バッファー」は、対象とするポリペプチドを固相から溶離するのに使用される。溶離バッファーの伝導率及び/又はpHは、対象とするポリペプチドがイオン交換樹脂から溶離されるものである。「再生バッファー」は、イオン交換樹脂を再生して再利用できるようにするのに使用される。再生バッファーは、実質的に全ての汚染物質と対象とするポリペプチドをイオン交換樹脂から除去するのに必要な伝導率及び/又はpHを有する。
【0031】
「伝導率」なる用語は、水溶液が2電極間に電流を伝える能力を意味する。溶液では、電流はイオン輸送によって流れる。従って、水溶液中に存在するイオンの量が増加すると溶液の伝導率は高くなる。伝導率の測定単位はmmhos(mS/cm)であり、例えばOrionの伝導率計を用いて測定できる。溶液の伝導率は、その中のイオン濃度の変化によって変わる。例えば、溶液中の緩衝剤の濃度及び/又は塩(例えばNaCl又はKCl)の濃度を所望の伝導率を達成するために変更してもよい。好ましくは、種々のバッファーの塩濃度は、下記の実施例のように所望の伝導率を達成するために改変される。
ポリペプチド及び一又は複数の汚染物質を含む組成物からポリペプチドを「精製する」とは、組成物から少なくとも1つの汚染物質を(完全又は部分的に)除去することにより組成物中のポリペプチドの純度を向上させることを意味する。「精製工程」は、ここで組成物全重量に対して少なくとも70重量%、好ましくは少なくとも80重量%の対象ポリペプチドを含む組成物を意味する「均一な」組成物をもたらす全精製プロセスの一部であってよい。
【0032】
特に示さなければ、ここで用いられる「HER2」はヒトHER2タンパク質、「HER2」はヒトHER2遺伝子を意味する。ヒトHER2遺伝子及びHER2タンパク質は、例えば、Semba等, PNAS (USA) 82: 6497-6501 (1985)及びYamamoto等, Nature 319: 230-234 (1986)(Genebank登録番号X03363)に記載されている。
ここで用いられる「humMAb4D5-8」はヒト化抗-HER2抗体を意味し、それは配列番号:1の軽鎖アミノ酸配列及び配列番号:2の重鎖アミノ酸配列、又はそのアミノ酸配列変異体を含み、HER2に結合してHER2を過剰発現する腫瘍細胞の成長を阻害する能力を保持しているものである(米国特許第5,677,171号を参照して、ここに参考として取り入れる)。
ポリペプチドの「pI」又は「等電点」は、ポリペプチドの正電荷がその負電荷と均衡するpHを意味する。pIはポリペプチドのアミノ酸残基の電荷から計算でき、等電点電気泳動により決定できる(例えば、下記実施例のようにCSxクロマトグラフィーを用いて)。
【0033】
分子がイオン交換材料に「結合する」とは、分子を適当な条件(pH/伝導率)下でイオン交換材料に暴露し、分子とイオン交換材料の荷電基との間のイオン性相互作用によって、分子がイオン交換材料内又は上に可逆的に固定化されることを意味する。
イオン交換材料を「洗浄する」とは、適当なバッファーをイオン交換材料中又は上に通すことを意味する。
イオン交換材料から分子(例えばポリペプチド又は汚染物質)を「溶離する」とは、イオン交換材料周囲のバッファーのイオン強度を変えることによりそこから分子を除去し、イオン交換材料上の荷電部位に対してバッファーを分子と競合させることを意味する。
【0034】
「治療」は治療的処置及び予防的あるいは防護的措置の双方を意味する。治療を要するものには、障害を既に持つもの並びに障害を防止すべきものが含まれる。「疾患」とは、ここに記載するように精製されたポリペプチドでの治療から恩恵を受けるであろう任意の症状である。これには、哺乳動物が問題とする疾患になる素因になる病理的症状を含む慢性及び急性の疾患又は障害が含まれる。
ここで使用される「標識」なる語句は、ポリペプチドに直接的に又は間接的に抱合する検出可能な化合物又は組成物を意味する。標識はそれ自体が検出可能(例えば、放射性標識又は蛍光標識)であり得、あるいは酵素標識の場合には、検出可能な基質化合物又は組成物の化学変化を触媒しうる。
【0035】
ここで用いられる「細胞毒性薬」なる用語は、細胞の機能を阻害又は抑制する又は細胞破壊を生ずる物質を意味する。この用語は、放射性同位体(例えば、I131、I125、Y90及びRe186)、化学治療薬、及び細菌、真菌、植物又は動物由来の酵素的活性毒素といった毒素、またはその断片を含むとされる。
「化学治療薬」は、癌の治療に有用な化合物である。化学治療薬の例は、アドリアマイシン、ドキソルビシン、エピルビシン、5-フルオロウラシル、シトシンアラビノシド(「Ara−C」)、シクロホスファミド、チオテパ、ブスルファン、サイトキシン、タキソイド、例えばパクリタキセル(TAXOL(商品名), Bristol-Myers Squibb Oncology, Princeton, NJ)及びドキセタキセル、トキソテール、メトトレキセート、シスプラチン、メルファラン、ビンブラスチン、ブレオマイシン、エトポシド、イフォスファミド、マイトマイシンC、マイトキサントロン、ビンクリスチン、ビノレルビン、カルボプラチン、テニポシド、ダウノマイシン、カルミノマイシン、アミノプテリン、ダクチノマイシン、マイトマイシン、エスペラマイシン(米国特許第4,675,187号参照)、メルファラン、及び他の関連するナイトロジェンマスタードを含む。また、この定義に含まれるのは、タモキシフェン及びオナプリストンなどの腫瘍へのホルモン作用を調節又は阻害するように作用するホルモン様薬剤である。
【0036】
(発明の実施の形態)
本発明はここに、ポリペプチドを、当該ポリペプチド及び一又は複数の汚染物質を含有する組成物(例えば、水溶液)から精製する方法を提供する。組成物は一般に、ポリペプチドの組換え生産から得られたものであるが、ペプチド合成(又は他の合成手段)によるポリペプチドの製造から得られたものでもよく、あるいはポリペプチドはポリペプチドの天然源から精製されてもよい。好ましくは、ポリペプチドは抗体、例えばHER2抗原に結合するものである。
ポリペプチドの組換え生産のために、それをコードする核酸が単離され、さらなるクローニング(DNAの増幅)又は発現のために複製可能なベクター内に挿入される。ポリペプチドをコードするDNAは直ぐに単離され、従来の手法を用いて(例えば、ポリペプチドが抗体である場合、抗体の重鎖及び軽鎖をコードする遺伝子に特異的に結合可能なオリゴヌクレオチドプローブを用いることにより)配列決定される。多くのベクターが利用可能である。ベクター成分としては、一般に、これらに制限されるものではないが、次のものの一又は複数が含まれる:シグナル配列、複製開始点、一又は複数のマーカー遺伝子、エンハンサーエレメント、プロモーター、及び転写終結配列である(例えば、米国特許第5,534,615号に記載されており、ここで特に参考として取り入れる)。
【0037】
ここでベクターにおいてDNAを発現させるのに好ましい宿主細胞は、原核生物、酵母、又は上記のより高等な真核生物である。この目的に適した原核生物は、グラム陰性又はグラム陽性生物体などの真正細菌、例えば、大腸菌(Escherichia)、例えば大腸菌(E. coli)、エンテロバクター、エルウィニア(Erwinia)、クレブシエラ、プロテウス、サルモネラ、例えばネズミチフス菌、セラチア、例えば霊菌、及び赤痢菌等の腸内細菌科、枯草菌及びビーリシェニフォルミス(B. licheniformis)等の桿菌(例えば、1989年4月12日に発行されたDD266,710に開示されたビーリシェニフォルミス41P)、緑膿菌等のシュードモナス、及びストレプトマイセスである。適した大腸菌(E. coli)クローニング宿主はE. coli 294(ATCC 31,446)であるが、E. coli B、及びE. coli X1776(ATCC 31,537)及びE. coli W3110(ATCC 27,325)等の他の株も好ましい。これらの例は例示的であり限定するものではない。
原核生物に加えて、糸状菌又は酵母菌のような真核微生物は、ポリペプチドコード化ベクターのための適切なクローニング又は発現宿主である。サッカロミセス・セレヴィシア又は普通のベーカーの酵母菌は、最も普通に用いられる下等真核生物宿主微生物である。しかし、シゾサッカロミセスプロンブ(Schizosaccharomyces prombe);クルベロミセスホスツ(Kluveromyces hosts)、例えばケーラクチス(K. lactis)、ケーフラギリス(K. fragilis)(ATCC 12,424)、ケーブルガリクス(K. bulgaricus)(ATCC 16,045)、ケーウィケラミイ(K. wickeramii)(ATCC 24,178)、ケーワルチイ(K. waltii)(ATCC 56,500)、ケードロソフィラルム(K. drosophilarum)(ATCC 36,906)、ケーテモトレランス(K. themotolerans)及びケーマルキシアナス(K. marxianus);ヤロウィア(yarrowia)(EP 402,226);ピッチャパストリス(Pichia pastoris)(EP 183,070);カンジダ;トリコデルマレーシア(reesia)(EP 244,234);アカパンカビ;シュワニオマイセス(schwanniomyces)、例えばシュワニオマイセスオクシデンタリス(occidentalis);及び糸状真菌、例えば、ニューロスポラ、ペニシリウム、トリポクラジウム(Tolypocladium);及びコウジ菌、例えば偽巣性コウジ菌及びクロカビなどの他の多くの属、種及び株が通常利用可能であり、ここで有用である。
【0038】
グリコシル化ポリペプチドの発現に適した宿主細胞は多細胞生物から誘導される。無脊椎動物細胞の例としては植物及び昆虫細胞が含まれる。宿主からの多数のバキュロウィルス株及び変異体及び対応する許容可能な昆虫宿主細胞、例えばスポドプテラ・フルギペルダ(毛虫)、アエデス・アエジプティ(蚊)、アエデス・アルボピクトゥス(蚊)、ドゥロソフィラ・メラノガスター(ショウジョウバエ)、及びボンビクス・モリが同定されている。形質移入のための種々のウィルス株、例えば、オートグラファ・カリフォルニカNPVのL-1変異体とボンビクス・モリ NPVのBm-5株が公に利用でき、そのようなウィルスは本発明においてここでウィルスとして使用でき、特にスポドプテラ・フルギペルダ細胞の形質移入に使用できる。綿花、コーン、ジャガイモ、ダイズ、ペチュニア、トマト、及びタバコのような植物細胞培養を宿主として利用することができる。
しかしながら、脊椎動物細胞におけるものが最も興味深く、培養(組織培養)中での脊椎動物細胞の増殖は常套的な手順となっている。有用な哺乳動物宿主株化細胞の例は、SV40によって形質転換されたサル腎臓CV1株 (COS-7, ATCC CRL 1651);ヒト胚腎臓株(293又は懸濁培養での増殖のためにサブクローン化された293細胞、Graham等, J. Gen Virol., 36:59 (1977));ハムスター乳児腎細胞(BHK, ATCC CCL 10);チャイニーズハムスター卵巣細胞/-DHFR(CHO, Urlaub等, Proc. Natl. Acad. Sci. USA, 77:4216 (1980));マウスのセルトリ細胞(TM4, Mather, Biol. Reprod., 23:243-251 (1980));サルの腎細胞 (CVI ATCC CCL 70);;アフリカミドリザルの腎細胞(VERO-76, ATCC CRL-1587);ヒト子宮頸癌細胞 (HELA, ATCC CCL 2);イヌ腎細胞 (MDCK, ATCC CCL 34);バッファローラット肝細胞 (BRL 3A, ATCC CRL 1442);ヒト肺細胞 (W138, ATCC CCL 75);ヒト肝細胞 (Hep G2, HB 8065);マウス乳房腫瘍細胞 (MMT 060562, ATTC CCL51);TRI細胞(Mother等, Annals N.Y. Acad. Sci., 383:44-68 (1982));MRC5細胞;FS4細胞;及びヒト肝癌株(HepG2)である。
【0039】
宿主細胞は、ポリペプチド生成のための上記発現又はクローニングベクターで形質転換し、プロモーターを誘導し、形質転換体を選択し、又は所望の配列をコードしている遺伝子を増幅するために適当に修飾された常套的栄養培地で培養する。
本発明のポリペプチドを生成するために用いられる宿主細胞は種々の培地において培養することができる。例えばハム(Ham)のF10(Sigma)、最小必須培地((MEM) Sigma)、RPMI−1640(Sigma)及びダルベッコの改変イーグル培地((DMEM), Sigma)のような市販培地が当該宿主細胞の培養に適している。さらに、Ham等, Meth. Enz., 58:44 (1979), Barnes等, Anal. Biochem., 102:255 (1980), 米国特許 4,767,704; 4,657,866; 4,927,762; 4,560,655; 又は5,122,469; WO 90/03430; WO 87/00195; 米国再発行特許 30,985に記載された任意の培地を宿主細胞の培養培地として用いることができる。これらの培地はいずれも、ホルモン及び/又は他の成長因子(例えばインスリン、トランスフェリン、又は表皮成長因子)、塩類(例えば、塩化ナトリウム、カルシウム、マグネシウム及びリン酸塩)、バッファー類(例えばHEPES)、ヌクレオシド(例えばアデノシン及びチミジン)、抗生物質(例えば、GENTAMYCIN(商品名)薬)、微量元素(最終濃度がマイクロモル範囲で通常存在する無機化合物と定義される)及びグルコース又は同等のエネルギー源を必要に応じて補充することができる。任意の他の必要な補充物質も又当業者に知られている適当な濃度で含むことができる。培養条件、例えば温度、pH等々は、発現のために選ばれた宿主細胞について従来用いられているものであり、当業者には明らかであろう。
【0040】
組換え技術を用いる場合、ポリペプチドは細胞内、細胞膜周辺腔に生成され、又は培地に直接分泌される。ポリペプチドが細胞内に生成された場合、第1の工程として、粒子状の細片、(均一化によって得られた)宿主細胞又は溶解された細胞のいずれかが、例えば遠心分離又は限外濾過によって除去される。ポリペプチドが培地に分泌された場合、そのような発現系からの上清は、一般的には第1に市販のタンパク質濃縮フィルター、例えばAmicon又はPelliconの限外濾過ユニットを用いて濃縮される。
次いでポリペプチドに、ここで特許請求するイオン交換クロマトグラフィー法を含む一又は複数の精製工程を施す。イオン交換クロマトグラフィー法に先立って、その最中に、又はその後のさらなる精製方法の例は、疎水性相互作用クロマトグラフィー(例えばフェニルセファロース)での分画、エタノール沈殿、等電点電気泳動、逆相HPLC、シリカ上でのクロマトグラフィー、HEPARIN SEPHAROSE(商品名)でのクロマトグラフィー、さらなるアニオン交換クロマトグラフィー及び/又はさらなるカチオン交換クロマトグラフィー、クロマトフォーカシング、SDS-PAGE、硫酸アンモニウム沈殿、ヒドロキシアパタイトクロマトグラフィー、ゲル電気泳動、透析、及びアフィニティクロマトグラフィー(例えば、プロテインA、プロテインG、抗体、特異的基質、リガンド、又は抗原、例えば捕捉剤を用いる)を含む。
【0041】
イオン交換クロマトグラフィーはここに特許請求したように実施される。第1に、アニオン又はカチオン交換樹脂のいずれを用いるべきかを決定する。一般に、カチオン交換樹脂は約7より大きなpIを有するポリペプチドに対して使用され、アニオン交換樹脂は約7より小さなpIを有するポリペプチドに対して使用される。
アニオン又はカチオン交換樹脂は、公知の方法によって調製される。通常は、ポリペプチド及び一又は複数の汚染物質を含有する組成物を樹脂に負荷する前に、平衡化バッファーをイオン交換樹脂に通す。便利には、平衡化バッファーは負荷バッファーと同じであるが、そうである必要はない。
クロマトグラフィーに使用される種々のバッファーは、例えば、カチオン又はアニオン交換樹脂のいずれが用いられるかによる。このことは、Fig1及び2の流れ図においてより明確に示される。
【0042】
特にカチオン交換樹脂が用いられる工程の実施を例示するFig1を参照すると、各バッファーのpH及び/又は伝導率は前のバッファーに比較して増大しているが、伝導率及び/又はpHが先行する中間バッファーの伝導率及び/又はpHより小さい洗浄バッファーは除く。対象とするポリペプチドと汚染物質とを含有する水溶液が負荷バッファーを用いてカチオン交換樹脂に負荷されるが、それは、ポリペプチド及び汚染物質がカチオン交換樹脂に結合するpH及び/又は伝導率においてである。下記の実施例のように、負荷バッファーは第1の低い伝導率(例えば、約5.2から約6.6mmhos)であってよい。負荷バッファーの例示的pHは約5.0である(Fig1参照)。例えば、約20mg/mLから約35mg/mLのポリペプチド(例えば全長抗体)をイオン交換樹脂に負荷してもよい。
カチオン交換樹脂は、次いで、実質的に汚染物質を溶離するが実質的に対象とするポリペプチドは溶離しないような第2の伝導率及び/又はpHにある中間バッファーで洗浄される。これは、中間バッファーの伝導率又はpH、あるいは両方を増大させることにより達成される。負荷バッファーから中間バッファーへの変化は、必要に応じて段階的でも徐々にでもよい。ここでの実施例では、中間バッファーは負荷バッファーより大きな伝導率を有していた(即ち、中間バッファーの伝導率は約7.3から約8.8mmhosの範囲であった)。あるいは、Fig1に示すように、カチオン交換樹脂が用いられる本発明のこの実施態様では、中間バッファーのpHが負荷バッファーのpHを越えるようにしてもよい。例えば、中間バッファーは約5.4のpHを持ち得る。
【0043】
中間バッファーでの洗浄に続いて、カチオン交換樹脂は、中間バッファーより小さな伝導率又はpH、あるいは両方を有する洗浄バッファーで洗浄又は再平衡化される(即ち、文献におけるイオン交換クロマトグラフィー工程とは異なり、伝導率又はpH、あるいは両方が先行工程とは反対、即ち逆方向に変化する)。下記の実施例では、洗浄バッファーは負荷バッファーとほぼ同じ伝導率を有し(即ち、約5.2から約6.6mmhosの範囲)、従ってその伝導率は中間バッファーのものより小さい。他の実施態様では、洗浄バッファーの伝導率を負荷バッファーのものより小さく又は大きくしてもよいが、洗浄バッファーの伝導率は中間バッファーのものよりは小さい。他の実施態様では、洗浄バッファーのpHが中間バッファーのpHより小さい(例えば、洗浄バッファーのpHは約5.0であってよい)。中間バッファーに比較した洗浄バッファーの伝導率及び/又はpHの変化は、これらのパラメータの段階的又は徐々の変化により達成される。
【0044】
前段落の洗浄工程の後に、カチオン交換樹脂は、そこから所望のポリペプチド分子を溶離するために調製される。これは、所望のポリペプチドがもはやカチオン交換樹脂に結合せず、従ってそこから溶離されるようなpH及び/又は伝導率を有する溶離バッファーを用いて達成される。溶離バッファーのpH及び/又は伝導率は、一般に先行する工程で使用した負荷バッファー、中間バッファー及び洗浄バッファーのpH及び/又は伝導率を越える。下記の実施例では、溶離バッファーの伝導率は約10.0から11.0mmhosの範囲である。あるいは、又はそれに加えて、溶離バッファーのpHを洗浄バッファー及び中間バッファーに比較して増大させてもよい(例えば、溶離バッファーのpHを約6.0としてよい)。伝導率及び/又はpHの変化は、必要に応じて段階的でも徐々にでもよい。しかして、所望のポリペプチドは、本方法のこの段階においてカチオン交換樹脂から回収される。
【0045】
これに代わる実施態様では、イオン交換材料がアニオン交換樹脂を含んでなる。本発明のこの実施態様は、ここでFig2に示されている。この図に例示されているように、伝導率の変化は一般にカチオン交換樹脂について上述したようなものである。しかしながら、pHの変化の方向は、アニオン交換樹脂については異なっている。例えば、汚染物質及びポリペプチドの溶離がpH変化によってなされる場合、負荷バッファーは第1のpHを有し、pHは中間バッファーにおいて低下して汚染物質が溶離される。第3工程で、カラムは洗浄バッファーで洗浄/再平衡化されるが、伝導率又はpH、あるいは両方の変化は先行する工程とは反対方向である。即ち、pHは洗浄バッファーにおいて中間バッファーよりも増大してよい。この工程に続いて、対象とするポリペプチドは、第4の伝導率及び/又はpHにおける溶離バッファーを用いてアニオン交換樹脂から溶離される。pHが変化する場合、通常は負荷バッファー、中間バッファー及び洗浄バッファーより小さい。進行バッファーにおけるpH及び/又は伝導率の変化は、上述したように段階的でも徐々にでもよい。
【0046】
本発明の好ましい実施態様では、ポリペプチド及び汚染物質の両方の溶離を達成するのに1つのパラメータ(即ち、伝導率又はpHのいずれか)を変化させ、他のパラメータ(即ち、各々pH又は伝導率)はほぼ一定に維持される。例えば、種々のバッファー(負荷バッファー、中間バッファー、洗浄バッファー及び/又は溶離バッファー)の伝導率を相違させ、それらのpHを実質的に同じにしてもよい。
本発明の任意の実施態様では、イオン交換樹脂はポリペプチドの溶離の後に再生バッファーで再生され、カラムを再利用できるようにする。一般に、再生バッファーの伝導率及び/又はpHは、実質的に全ての汚染物質及び対象とするポリペプチドがイオン交換樹脂から溶離されるものである。一般に、再生バッファーは、汚染物質及びポリペプチドをイオン交換樹脂から溶離させるために非常に高い伝導率を有する。
【0047】
ここでの方法は、対象とするポリペプチドを少なくとも1つの汚染物質から分離するに当たり、汚染物質と対象とするポリペプチド分子とがイオン性電荷で僅かしか相違していない場合に特に有用である。例えば、ポリペプチドと汚染物質のpIが「僅かにしか相違していなく」てもよく、例えば、それらは約0.05から約0.2pI単位しか相違していなくてもよい。下記の実施例では、この方法は、8.87のpIを持つ抗-HER2抗体を、8.79のpIを持つ単一の脱アミド化変異体から分離するのに使用できた。あるいは、この方法は脱アミド化DNaseを、例えば非脱アミド化DNaseから分離するのに使用してもよい。他の実施態様では、この方法は、ポリペプチドのそのグリコシル化変異体からの分離、例えば、非変異ポリペプチドに比較して異なるシアル酸分布を有するポリペプチドの変異体の分離に使用してもよい。
ここでのイオン交換クロマトグラフィー法に従って得られたポリペプチド調製物は、必要ならばさらなる精製工程を施してもよい。さらなる精製工程の例は上述した。
場合によっては、ポリペプチドは必要に応じて一又は複数の異種分子に抱合させる。異種分子は、例えば、ポリペプチドの血清半減期を向上させるもの(例えばポリエチレングリコール、PEG)であってよく、標識(例えば酵素、蛍光標識及び/又は放射性核種)又は細胞毒性分子(例えば毒素、化学治療薬、または放射性同位元素など)であってもよい。
【0048】
場合によっては異種分子に縫合されたポリペプチドを含む治療用製剤は、所定の純度を持つポリペプチドと、任意の製薬的に許容される担体、賦形剤又は安定化剤を混合することにより(Remington's Pharmaceutical sciences 16th edition, Osol, A. 編, (1980))、凍結乾燥製剤又は水溶液の形態で調製される。「製薬的に許容される」担体、賦形剤又は安定化剤は、用いられる用量及び濃度で受容者に非毒性であり、リン酸塩、クエン酸塩、及び他の有機酸等のバッファー;アスコルビン酸及びメチオニンを含む酸化防止剤;防腐剤(オクタデシルジメチルベンジルアンモニウムクロリド、ヘキサメトニウムクロリド、ベンズアルコニウムクロリド、ベンズエトニウムクロリド、フェノール、ブチル又はベンジルアルコール、メチル又はプロピルパラベン等のアルキルパラベン、カテコール、レゾルシノール、シクロヘキサノール、3-ペンタノール、及びm-クレゾール等);低分子量(約10残基未満)のポリペプチド;血清アルブミン、ゼラチン、または免疫グロブリン等のタンパク質;ポリビニルピロリドン等の親水性ポリマー;グリシン、グルタミン、アスパラギン、ヒスチジン、アルギニン又はリジン等のアミノ酸;グルコース、マンノース、又はデキストリンを含む単糖類、二糖類、及び他の炭水化物;EDTA等のキレート化剤;スクロース、マンニトール、トレハロース又はソルビトール等の糖;ナトリウム等の塩形成対イオン;金属錯体(例えば、Zn−-タンパク質錯体);及び/又はTWEEN(商品名)、PLURONICS(商品名)又はポリエチレングリコール(PEG)等の非イオン性界面活性剤を含む。ここで特に興味深いhumMAb4D5-8抗体は、WO 97/04801に記載されているように凍結乾燥製剤として製剤してもよく、ここに参考として出展明示して取り込むものとする。
【0049】
ここでの製剤は、治療される特定の徴候のために必要ならば1以上の活性化合物も含んでよく、好ましくは互いに悪影響を与えない相補的活性を持つものである。そのような分子は、意図する目的のために有効な量で組み合わされて好適に存在する。例えば、抗-HER2抗体については、タキソイド又はタモキシフェン等の化学治療薬を製剤に添加してもよい。
また活性成分は、各々例えばコアセルベーション技術又は界面重合により調製されたマイクロカプセル、例えばヒドロキシメチルセルロース又はゼラチンマイクロカプセル及びポリペプチド-(メタクリル酸メチル)マイクロカプセル、コロイド状ドラッグデリバリー系(例えば、リポソーム、アルブミン微小球、マイクロエマルション、ナノ-粒子及びナノカプセル)又はマクロエマルションに捕捉させてもよい。このような技術は、Remington's Pharmaceutical sciences 16th edition, Osol, A. 編, (1980)に開示されている。
インビボ投与に使用される製剤は無菌でなければならない。このことは、滅菌濾過膜を通して濾過することにより容易に達成される。
【0050】
徐放性調製物を調製してもよい。徐放性調製物の好ましい例は、ポリペプチド変異体を含む疎水性固体ポリマーの半透性マトリクスを含み、そのマトリクスは成形物、例えばフィルム又はマイクロカプセルの形態である。徐放性マトリクスの例は、ポリエステル、ヒドロゲル(例えば、ポリペプチド(2-ヒドロキシエチルメタクリレート)又はポリ(ビニルアルコール)、ポリラクチド(米国特許第3,773,919号))、L-グルタミン酸及びγ-エチル-L-グルタメートのコポリマー、非分解性エチレン-酢酸ビニル、分解性乳酸-グリコール酸コポリマー、例えばLUPRON DEPOT(商品名)(分解性乳酸注グリコール酸コポリマー及び酢酸ロイプロリドからなる注射可能な微小球)、及びポリ-D-(−)-3-ヒドロキシブチル酸を含む。
ここに開示したように精製されたポリペプチド又は当該ポリペプチド及び製薬的に許容される担体を含有する組成物は、次いで、そのようなポリペプチド及び組成物について知られた種々の診断、治療又は他の用途に使用される。例えば、ポリペプチドは、ポリペプチドの治療的有効量を哺乳動物に投与することにより、哺乳動物における疾患の治療に使用できる。
以下の実施例は例示を目的とし、何ら限定するものではない。明細書における全ての引用の開示は、ここに出典明示して参考として取り入れるものとする。
【0051】
実施例1
全長ヒトIgG rhuMAb HER2(Carter等, Proc. Natl. Acad. Sci. 89: 4285-4289 (1992)の配列番号:1の軽鎖アミノ酸配列及び配列番号:2の重鎖アミノ酸配列を含むhumAb4D5-8)をCHO細胞で組換え的に製造した。タンパク質生成及び細胞培養培地への分泌に続いて、CHO細胞を細胞培養培地から接線方向流動濾過(PROSTACK(商品名))により分離した。次いで、平衡化PROSEPA(商品名)カラム(Bioprocessing, Ltd.)にCHO細胞からの回収細胞培養流体(HCCF)を直接適用することにより、プロテインAクロマトグラフィーを実施した。
プロテインAクロマトグラフィーに続いて、スルホプロピル(SP)-SEPHAROSE FAST FLOW(商品名)(SPSFF)カラム(Pharmacia)を用いてカチオン交換クロマトグラフィーを実施して所望の抗-HER2抗体分子をさらに分離した。クロマトグラフィー操作は、結合及び溶離モードで実施した。
【0052】
再生バッファー(0.025M MES / 1.0M NaCl, pH5.6)次いで平衡化バッファー(0.025M MES / 50mM NaCl, pH5.6)で洗浄することにより、負荷のためのSPSFFカラムを調製した。次いでカラムに、5.60+-0.05のpH及び5.8+-0.2mmhosの伝導率に調節したプロテインAプールを負荷した。溶離に先立って、カラムを3段階:(1)負荷バッファー(0.025M MES / 50mM NaCl, pH5.6)で最低1カラム容量;(2)中間バッファー(0.025M MES / 70mM NaCl, pH5.6)で280nmピークの頂点に達するまで;そして(3)洗浄バッファー(0.025M MES / 50mM NaCl, pH5.6)で最低1.2カラム容量で洗浄した。次にrhuMAb HER2を溶離バッファー(0.025M MES / 95mM NaCl, pH5.6)でカラムから溶離した。溶離280nmプロフィールは、先行端にショルダーを有していた(Fig3)。このショルダーの変曲点においてプールを開始し、さらに5カラム容量まで続けた。次いでカラムを再生バッファー(0.025M MES / 1.0M NaCl, pH5.6)で再生した。
【0053】
材料及び方法
カラム及び負荷調製:縮小スケールのSPSFFカラムを充填した。寸法は、27.0mL容量、1.0cm直径及び34.5cmベッド高さであった。プロテインAプールのアリコートのpHは、1.5Mトリス塩基で5.6に滴定した。プールの伝導率は、等量の注射用滅菌水(SWFI)の添加で低下させた。
クロマトグラフィー:この実験のために実行したクロマトグラフィーは、PharmaciaのUNICORN(商品名)FPLCシステムで実施した。平衡化、負荷、及び最初の洗浄工程は、200cm/hの線形流速で実施した。全てのクロマトグラフィー工程は、100cm/hの線形流速で実施した。クロマトグラフィー工程の順序は表1に定義した。実行した6つのクロマトグラフィーは、SPSFF樹脂1mL当たり、15, 20, 25, 30, 35, 及び40mgのrhuMAb HER2という負荷密度で実施した。
【0054】

1.樹脂の平衡化は手動モードで実施した;残りの工程はファーマシア・ユニコーン・プログラムから実行した。
2.CV=カラム容量
【0055】
全タンパク質:各クロマトグラフィー画分(流通、洗浄工程、溶離プレプール、溶離プール、及び再生)のタンパク質濃度は、各試料の分光学的走査によって決定した。結果は生成物回収収率の計算に用いた。rhuMAb HER2の級光係数は1.45である。結果を導くのに使用した計算は次の通りである:

【0056】
rhuMAb HER2抗体変異体の決定(CSx HPIEX):rhuMAb HER2 SPSFFクロマトグラフィーカラムは抗体変異体を分離した。各クロマトグラフィー実験からの画分をCSx HPIEXクロマトグラフィーによって変異抗体の相対量について試験した。BAKERBOND WIDEPORE(商品名)CSx HPIEXカラム(4.6 x 250mm)を55℃において1mL/分で実行した。移動相は三元勾配から形成した(表2)。

カラムは55℃において1mL/分で実行した。
【0057】
Aバッファーは0.025M MES, pH 5.9;Bバッファーは1M 酢酸アンモニウム, pH 7.0;及びC溶液は注射用滅菌水であった。カラムは勾配の初期条件(49%A; 1%B; および50%C)で平衡化し、SWFIで希釈して<300μgタンパク質を含む試料200μlを注入した。得られた各クロマトグラフを積分し、各画分について各ピーク面積の割合を決定した(表3およびFig5)。

クロマトグラムの比較:各クロマトグラフィーファイルからの吸収データ(AU280nm)をASCIIフォーマットのUnicornから移した。0.025M MES / 0.07M NaCl, pH5.6洗浄からのデータをExcelフォーマットに翻訳し、KALEIDAGRAPH(商品名)にコピーした。KALEIDAGRAPH(商品名)を用いて、洗浄プロフィールを上書きし(Fig6)、互いに比較した。
【0058】
結果と議論
抗体を組み換えDNA技術で作成した場合、rhuMAb HER2の脱アミド化及び他の酸性変異体が生成された(例えば、Fig5のCSxピークa、bおよび1参照)。脱アミド化及び他の酸性変異体は、最初のプロテインAクロマトグラフィー工程で得られた組成物の(積分曲線下の面積又はCSxクロマトグラフィーで得られたプロフィールとして計算すると)約25%を構成していた。ここに記載したイオン交換クロマトグラフィー法は、抗-HER2組成物中の脱アミド化及び他の酸性変異体の量を有意に、即ち約13%又はそれ以下に減少させるのに使用できた(即ち、ここに記載したカチオン交換クロマトグラフィーを施した調製物中の酸性変異体の量は、約50%又はそれ以上減少した)。
【0059】
上記のように実施したカチオン交換カラムからの吸収痕跡をFig3に示す、この方法は、非脱アミド化抗-HER2抗体と僅かにしか相違していない抗-HER2の脱アミド化変異体を分離した。初期条件から中間洗浄への伝導率の変化が脱アミド化抗-HER2抗体の溶離を開始させた。しかしながら、この伝導率での洗浄を続けると非脱アミド化抗-HER2抗体の溶離が見られ、生成物の損失をもたらす。中間バッファーから溶離バッファーに直接進めると、プールを早く始めた場合の生成物からの脱アミド化抗-HER2抗体の許容できない低除去率、あるいはプールを脱アミド化抗-HER2抗体が減少するまで遅く始めた場合の許容できない抗-HER2抗体生成物の低収率のいずれかの結果をまねく。最初に使用したような低伝導率に戻すことにより、抗-HER2抗体生成物の有意な溶離が無く、脱アミド化抗-HER2抗体の溶離が続くことが見いだされた。
【0060】
rhuMAb HER2負荷の(a)バッファー必要量、(b)プールにおける生成物回収、及び(c)プール中の生成物の質に対する影響を評価した。
15mg/mLから35mg/mLまでの負荷密度において、溶離プールにおける生成物収率は約75%であった。40mg/mLの負荷密度については、プールの生成物収率は65%に低下した(Fig4)。プールにおけるこの回収の低下は、(各々70mM NaCl及び50mM NaClでの)二つの洗浄工程における抗体の増加に大きく依存する。
全ての溶離プールにおけるrhuMAb HER2の量は、CSx HPIEX分析によって測定した場合に等価であった(Fig5)。負荷材料に比較して;非脱アミド化抗体の富化があり(ピーク3)、Iso-Asp102又はLys450抗体量の変化が無く(ピーク4)、Asp30脱アミド化抗体量の減少があった(ピークa、b、1、その他)。
【0061】
これらのカチオンプール中のrhuMAb HER2の質は、中間洗浄工程を通して向上した。樹脂に結合したrhuMAb HER2の質量が増加すると、280nmピークに到達するのに要する中間バッファーの消費が減少する。40mg/mL負荷密度に必要とされるバッファー容量は、約2.5カラム容量である。15mg/mL負荷密度に必要とされるバッファー容量は、約15カラム容量である。バッファー必要量の正確な増加は、これら2つの極限点間の5mg/mL刻みの変化に比例してはいない。最も大きな増加は、20mg/mLと15mg/mLの負荷密度間に見られた。ここで、必要量は、7.5カラム容量から既に述べたように15カラム容量のバッファーへと2倍になった。しかし、70mM NaCl洗浄の頂点に達した場合、生成物の質は試験した全ての負荷密度について等価である。
この実験は、どれくらいのrhuMAb HER2がSPSFFに負荷できるかを決定した。樹脂1mL当たりに15から40mgの範囲の抗体では、溶離プールに回収されたrhuMAb HER2の質に相違は無かった。しかし、回収されたrhuMAb HER2の量は、樹脂に35mg/mLより大きな負荷をした場合に約10%減少した。一貫した収率のために、rhuMAb HER2製造については35mg/mLを負荷上限とすることが推奨される。さらに、20から15mg/mLの間では、必要とされる70mM NaCl洗浄容量が有意に増加するので、rhuMAb HER2の製造には20mg/mLを負荷下限とすることが推奨される。
【0062】
実施態様
1. ポリペプチドを、当該ポリペプチド及び汚染物質を含有する組成物から単離する方法において、連続的に実施される以下の工程:
(a)当該ポリペプチドを、第1の伝導率及びpHの負荷バッファーを用いてイオン交換材料に結合させ;
(b)当該イオン交換材料を第2の伝導率及び/又はpHの中間バッファーで洗浄して汚染物質をイオン交換材料から溶離し;
(c)当該イオン交換材料を第3の伝導率及び/又はpHの洗浄バッファーで洗浄し、ここで、中間バッファーから洗浄バッファーへの伝導率及び/又はpHの変化が、負荷バッファーから中間バッファーへの伝導率及び/又はpHの変化と反対方向であり;そして
(d)当該イオン交換材料を第4の伝導率及び/又はpHの溶離バッファーで洗浄してポリペプチドをイオン交換材料から溶離することを含んでなる方法。
2. 前記イオン交換材料がカチオン交換樹脂である、実施態様1に記載の方法。
3. 前記イオン交換材料がアニオン交換樹脂である、実施態様1に記載の方法。
4. 中間バッファーの伝導率及び/又はpHが負荷バッファーの伝導率及び/又はpHよりも大きく、洗浄バッファーの伝導率及び/又はpHが中間バッファーの伝導率及び/又はpHよりも小さい、実施態様2に記載の方法。
5. 洗浄バッファーの伝導率及び/又はpHが負荷バッファーの伝導率及び/又はpHとほぼ同じである、実施態様1に記載の方法。
6. 溶離バッファーの伝導率及び/又はpHが中間バッファーの伝導率及び/又はpHより大きい、実施態様2に記載の方法。
7. 汚染物質及びポリペプチドの溶離が、各々中間バッファー及び溶離バッファーの伝導率の変更によって達成される、実施態様1に記載の方法。
8. 各工程(a)−(d)でほぼ一定のpHが維持される、実施態様1に記載の方法。
9. ポリペプチド及び汚染物質が僅かに異なるpIを有する、実施態様1に記載の方法。
10. 汚染物質がポリペプチドの脱アミド化変異体である、実施態様1に記載の方法。
11. 中間及び溶離バッファーの伝導率が、それらの塩濃度の変化によって改変される、実施態様7に記載の方法。
12. 中間及び溶離バッファーの伝導率が、それらのNaCl濃度の変化によって改変される、実施態様11に記載の方法。
13. 工程(d)の後に、イオン交換体を再生バッファーで洗浄することをさらに含む、実施態様1に記載の方法。
14. カチオン交換樹脂がアガロース上に固定化されたスルホプロピルを含む、実施態様2に記載の方法。
15. ポリペプチドが抗体である、実施態様1に記載の方法。
16. 抗体がHER2に結合する、実施態様15に記載の方法。
17. 汚染物質がポリペプチドの脱アミド変異体である、実施態様1に記載の方法。
18. イオン交換クロマトグラフィーの前、最中又は後に、ポリペプチドを含む組成物に一又は複数の精製工程を施し、ポリペプチドの均一な調製物を得ることをさらに含む、実施態様1に記載の方法。
19. 精製したポリペプチドを異種分子と複合させることをさらに含む、実施態様18に記載の方法。
20. 異種分子が、ポリエチレングリコール、標識、又は細胞毒性薬である、実施態様19に記載の方法。
21. ポリペプチドの調製物と製薬的に許容される担体とを混合することにより製薬組成物を調製することをさらに含む、実施態様18に記載の方法。
22. 実施態様1に記載の方法に従って精製されたポリペプチド。
23. ポリペプチドを、当該ポリペプチド及び汚染物質を含有する組成物から単離する方法において、連続的に実施される以下の工程:
(a)当該ポリペプチドを、第1の伝導率及びpHの負荷バッファーを用いてカチオン交換材料に結合させ;
(b)当該カチオン交換材料を、負荷バッファーのものより大きな第2の伝導率及び/又はpHの中間バッファーで洗浄して汚染物質をイオン交換材料から溶離し;
(c)当該カチオン交換材料を、中間バッファーのものより小さな第3の伝導率及び/又はpHの洗浄バッファーで洗浄し;そして
(d)当該イオン交換材料を、中間バッファーのものより大きな第4の伝導率及び/又はpHの溶離バッファーで洗浄してポリペプチドをイオン交換材料から溶離することを含んでなる方法。
24. 抗体を、当該抗体及び汚染物質を含有する組成物から精製する方法において、当該組成物をカチオン交換樹脂上に負荷することを含んでなり、カチオン交換樹脂上に負荷される抗体の量が、カチオン交換樹脂1mL当たりに約20mgから約35mgの抗体である方法。
25. カチオン交換樹脂がアガロース上に固定化されたスルホプロピルを含む、実施態様24に記載の方法。
26. 抗体をカチオン交換樹脂から溶離することをさらに含む、実施態様24に記載の方法。
27. 抗体をカチオン交換樹脂から溶離する前の中間洗浄工程において汚染物質をカチオン交換樹脂から溶離することをさらに含む、実施態様26に記載の方法
28. 抗-HER2抗体及び一又は複数のその酸性変異体を含み、当該酸性変異体の量が約25%未満である組成物。
29. 製薬的に許容される担体をさらに含む、実施態様28に記載の組成物。
30. 抗-HER2抗体がhumMAb4D5-8である、実施態様28に記載の組成物。
31. 抗HER2抗体とその一又は複数の酸性変異体との混合物を含んでなる組成物であって、
当該酸性変異体の量がおよそ25%より少なく、
当該酸性変異体が主に、抗HER2抗体の一又は複数のアスパラギン残基が脱アミドされている脱アミド化変異体であり、
当該抗HER2抗体がhumMAb4D5−8であり、
当該脱アミド化変異体が、アスパラギン酸に転換されたhumMAb4D5−8のVL領域の何れか又は両方のCDR1にAsn30を有するものである、組成物。
32. 酸性変異体の量がおよそ20%より少ない、実施態様31に記載の組成物。
33. 酸性変異体の量がおよそ13%より少ない、実施態様32に記載の組成物。
34. 酸性変異体の量がおよそ1から18%の範囲である、実施態様32に記載の組成物。
35. 抗HER2抗体が配列番号1の軽鎖アミノ酸配列と配列番号2の重鎖アミノ酸配列とを含む、実施態様31に記載の組成物。
36. さらに、薬学的に許容される担体を含有してなる、実施態様31から35の何れか一に記載の組成物。
【特許請求の範囲】
【請求項1】
明細書に記載の組成物。
【請求項1】
明細書に記載の組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7A】


【図7B】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7A】


【図7B】


【公開番号】特開2013−32365(P2013−32365A)
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−207108(P2012−207108)
【出願日】平成24年9月20日(2012.9.20)
【分割の表示】特願2009−249903(P2009−249903)の分割
【原出願日】平成11年5月3日(1999.5.3)
【出願人】(509012625)ジェネンテック, インコーポレイテッド (357)
【Fターム(参考)】
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願番号】特願2012−207108(P2012−207108)
【出願日】平成24年9月20日(2012.9.20)
【分割の表示】特願2009−249903(P2009−249903)の分割
【原出願日】平成11年5月3日(1999.5.3)
【出願人】(509012625)ジェネンテック, インコーポレイテッド (357)
【Fターム(参考)】
[ Back to top ]

