イオン性高分岐ポリマー及び炭素ナノ材料分散剤
【課題】炭素ナノ材料の分散剤としての応用が期待できる新規なイオン性高分岐ポリマー、並びに、炭素ナノ材料分散剤、及び炭素ナノ材料組成物を提供すること。
【解決手段】分子内に2個以上のラジカル重合性二重結合を有するモノマーAと、分子内にカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーBとを、該モノマーA及び該モノマーBの合計モル数に対して、5モル%以上200モル%以下の重合開始剤Cの存在下で重合させる段階と、前記重合段階の前、前記重合段階の間、又は前記重合段階に続いて、前記カルボキシル基に窒素原子含有塩基性化合物を反応させる段階とにより得られる、イオン性高分岐ポリマー、該ポリマーよりなる炭素ナノ材料分散剤、及び該分散剤を含む炭素ナノ材料組成物。
【解決手段】分子内に2個以上のラジカル重合性二重結合を有するモノマーAと、分子内にカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーBとを、該モノマーA及び該モノマーBの合計モル数に対して、5モル%以上200モル%以下の重合開始剤Cの存在下で重合させる段階と、前記重合段階の前、前記重合段階の間、又は前記重合段階に続いて、前記カルボキシル基に窒素原子含有塩基性化合物を反応させる段階とにより得られる、イオン性高分岐ポリマー、該ポリマーよりなる炭素ナノ材料分散剤、及び該分散剤を含む炭素ナノ材料組成物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規なイオン性高分岐ポリマー、詳細にはカルボキシル基を有する高分岐ポリマーの窒素原子含有塩基性化合物塩であるイオン性高分岐ポリマー、該イオン性高分岐ポリマーからなる炭素ナノ材料分散剤、並びに該炭素ナノ材料分散剤を含む組成物に関する。
【背景技術】
【0002】
ハイパーブランチポリマーは、デンドリマーと共にデンドリティック(樹枝状)ポリマーとして分類されている。従来の高分子が一般的に紐状の形状であるのに対し、これらのデンドリティックポリマーは、積極的に枝分かれを導入しているため、特異な構造を有する点、ナノメートルオーダーのサイズである点、多くの官能基を保持する表面を形成することができる点、線状ポリマーに比べて低粘度化できる点、分子間の絡み合いが少なく微粒子的挙動を示す点、非晶性になり溶媒溶解性を制御できる点等において様々な特性を有しており、これらの特性を利用した応用が期待されている。
【0003】
ハイパーブランチポリマーのデンドリマーに対する利点としては、その合成の簡便さが挙げられ、特に工業的生産においては有利である。一般に、デンドリマーが保護−脱保護を繰り返し合成されるのに対し、ハイパーブランチポリマーは1分子中に2種類の置換基を合計3個又はそれ以上持つ、いわゆるABx型モノマーの一段階重合により合成される。
【0004】
これらハイパーブランチポリマーの合成法の一つとして、例えば、ラジカル重合性二重結合を2個以上有するモノマーと1個のラジカル重合性二重結合を有するモノマーとを、ラジカル重合開始剤の存在下で反応させることによる高分岐ポリマーの合成方法が知られている(特許文献1)。
但し現在までのところ、これら高分岐ポリマーの窒素原子含有塩基性化合物塩については報告がない。
【0005】
一方、カーボンナノチューブをはじめとする炭素ナノ材料は、金属的な性質から半導体までの多様で優れた電気的特性を有し、また、大きな表面積や機械強度特性などから、電気電子材料から高性能樹脂補強材などに至る各種の分野において、次世代先端材料として注目が集まり、世界的な規模で実用化研究が進行中である。また、イオン液体をカーボンナノ材料、特にSWCNT(単層カーボンナノチューブ:single walled carbon nano tube)の分散剤として使用する技術が知られている(特許文献2)。また、特許文献3には、ラジカル反応性部位を有するイオン液体を重合して得られる直鎖状ポリマーとSWCNTとの複合体が開示されているが、薄膜形成やその導電性については何ら開示されていない。
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、前記特許文献2、3に記載の方法では、SWCNTはゲル状組成物の形態となっており、またイオン液体が低分子化合物であるため自己支持性がなく、スプレー塗布などの工程による薄膜の形成が困難であることが課題であった。
本発明は、上記事情に鑑みなされたものであって、炭素ナノ材料の分散剤としての応用が期待できる新規なイオン性高分岐ポリマーを提供することを目的とするものである。
また、本発明の別な目的は、炭素ナノ材料を分散させるのに好適な炭素ナノ材料分散剤、及び炭素ナノ材料組成物を提供することである。
【課題を解決するための手段】
【0007】
本発明者らは、上記目的を達成するために鋭意検討を重ねた結果、従来検討されていなかった高分岐ポリマーを所謂イオン液体由来の塩とすることにより、炭素ナノ材料の分散剤としても有用な高分岐ポリマーが得られることを見出し、本発明を完成させた。
【0008】
すなわち、本発明は、第1観点として、分子内に2個以上のラジカル重合性二重結合を有するモノマーAと、分子内にカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーBとを、該モノマーA及び該モノマーBの合計モル数に対して、5モル%以上200モル%以下の重合開始剤Cの存在下で重合させる段階と、前記重合段階の前、前記重合段階の間、又は前記重合段階に続いて、前記カルボキシル基に窒素原子含有塩基性化合物を反応させる段階とにより得られる、イオン性高分岐ポリマーに関する。
第2観点として、分子内に2個以上のラジカル重合性二重結合を有するモノマーAと、分子内に保護基で保護されたカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーDとを、該モノマーA及び該モノマーDの合計モル数に対して、5モル%以上200モル%以下の重合開始剤Cの存在下で重合させる段階と、前記重合段階に続いて、前記保護基を除去してカルボキシル基とする段階と、更に該カルボキシル基に窒素原子含有塩基性化合物を反応させる段階とにより得られる、イオン性高分岐ポリマーに関する。
第3観点として、分子内にカルボキシル基を有する高分岐ポリマーのカルボン酸アニオンに、窒素原子含有塩基性化合物が持つ窒素原子含有カチオンが結合してなる、イオン性高分岐ポリマーに関する。
第4観点として、前記窒素原子含有塩基性化合物が、式[1]乃至式[4]で表されるカチオンのうち何れか一種を有する化合物である、第1観点乃至第3観点のうち何れか一項に記載のイオン性高分岐ポリマーに関する。
【化1】

(式中、R1、R2、R3、R4、R5、R6、R7及びR8はそれぞれ独立して、水素原子、炭素原子数1乃至6のアルキル基、炭素原子数1乃至6のヒドロキシアルキル基又はビニル基を表し、Xは単結合、メチレン基又は酸素原子を表し、nは0乃至4の整数を表し、nが2以上の場合、R8は同一であっても異なっていてもよい。)
第5観点として、前記重合開始剤Cがアゾ系重合開始剤である、第1観点又は第2観点に記載のイオン性高分岐ポリマーに関する。
第6観点として、前記モノマーAがジビニルベンゼンである、第1観点又は第2観点に記載のイオン性高分岐ポリマーに関する。
第7観点として、窒素原子含有塩基性化合物を反応させる前の高分岐ポリマーがゲル浸透クロマトグラフィーによるポリスチレン換算での測定において1,000乃至200,000の重量平均分子量を有する、第1観点又は第2観点に記載のイオン性高分岐ポリマーに関する。
第8観点として、第1観点乃至第7観点のうち何れか一項に記載のイオン性高分岐ポリマーからなる、炭素ナノ材料分散剤に関する。
第9観点として、第8観点に記載の炭素ナノ材料分散剤と、炭素ナノ材料とを含む炭素ナノ材料組成物に関する。
第10観点として、さらに有機溶媒を含む、第9観点に記載の炭素ナノ材料組成物に関
する。
第11観点として、前記炭素ナノ材料分散剤が、前記炭素ナノ材料の表面に付着又は配位して複合体を形成している、第9観点又は第10観点に記載の炭素ナノ材料組成物に関する。
第12観点として、前記炭素ナノ材料が、フラーレン及び単層カーボンナノチューブからなる群から選ばれる少なくとも一種である、第9観点乃至第11観点のうち何れか一項に記載の炭素ナノ材料組成物に関する。
第13観点として、前記炭素ナノ材料が前記有機溶媒に分散されてなる、第10観点に記載の炭素ナノ材料組成物に関する。
第14観点として、前記複合体が前記有機溶媒に分散されてなる、第11観点に記載の炭素ナノ材料組成物に関する。
第15観点として、第9観点乃至第14観点のうち何れか一項に記載の炭素ナノ材料組成物から得られる薄膜に関する。
第16観点として、第8観点に記載の炭素ナノ材料分散剤、炭素ナノ材料及び有機溶媒を混合して混合物を調製する工程と、この混合物を機械的処理する工程とを含むことを特徴とする、炭素ナノ材料組成物の製造方法に関する。
第17観点として、前記機械的処理が超音波処理である、第16観点に記載の製造方法に関する。
第18観点として、前記炭素ナノ材料分散剤を前記有機溶媒に溶解させてなる溶液中に、前記炭素ナノ材料を添加して混合物を調製する工程と、この混合物を超音波処理する工程とを含むことを特徴とする、第17観点に記載の製造方法に関する。
【発明の効果】
【0009】
本発明によれば、炭素ナノ材料の分散剤としての応用が期待できる新規なイオン性高分岐ポリマーを提供することができる。
また本発明によれば、前記イオン性高分岐ポリマーを炭素ナノ材料の分散剤として好適に用いることができる。特に炭素ナノ材料としてカーボンナノチューブを用いた場合には、その少なくとも一部をその単独サイズ(直径0.8乃至100nm)までに分離して、所謂「孤立溶解」の状態で安定に(凝集することなく)有機溶媒に分散させることができる。なお本発明において「孤立溶解」とは、カーボンナノチューブが相互の凝集力によって塊状や束状、縄状となることなく、カーボンナノチューブの1本1本がバラバラになって媒体に分散して存在している状態を指す。
しかも分散剤、炭素ナノ材料及び有機溶媒を含有する溶液を超音波処理などの機械的処理をするだけで、炭素ナノ材料を分散させることができ、分散にあたり更なる加熱などの工程を省略し且つ処理時間を短縮することができ、炭素ナノ材料組成物を容易に得ることができる。
従って、本発明の炭素ナノ分散剤を用いることで炭素ナノ材料を分散させた、また炭素ナノ材料がカーボンナノチューブの場合にはその少なくとも一部を孤立溶解の状態で分散させた、炭素ナノ材料組成物を容易に得ることができる。
【0010】
そして本発明により得られる炭素ナノ材料組成物は、基板に塗布するだけで容易に薄膜形成が可能であり、しかも高導電性薄膜を得ることができる。
そして上記組成物において、炭素ナノ材料の量をその用途に応じて調整することが容易であるため、各種半導体素材、電導体素材等として幅広い用途に好適に用いることができる。
【図面の簡単な説明】
【0011】
【図1】図1は、合成例1で調製したtert−ブトキシカルボニル基含有高分岐ポリマー1Aの1H NMRスペクトルを示す図である。
【図2】図2は、合成例1で調製したカルボキシル基含有高分岐ポリマー2Aの1H NMRスペクトルを示す図である。
【図3】図3は、実施例1で調製した高分岐ポリマーイミダゾリウム塩3Aの1H NMRスペクトルを示す図である。
【図4】図4は、合成例2で調製したtert−ブトキシカルボニル基含有高分岐ポリマー1Bの1H NMRスペクトルを示す図である。
【図5】図5は、合成例2で調製したカルボキシル基含有高分岐ポリマー2Bの1H NMRスペクトルを示す図である。
【図6】図6は、実施例2で調製した高分岐ポリマーイミダゾリウム塩3Bの1H NMRスペクトルを示す図である。
【図7】図7は、高分岐ポリマーイミダゾリウム塩3Bを分散剤として用いたSWCNT含有分散液(実施例3)の紫外可視近赤外吸収スペクトルを示す図である。
【図8】図8は、高分岐ポリマーイミダゾリウム塩3Bを分散剤として用いたC60分散液(実施例4)及びC60単独分散液(比較例2)の紫外可視近赤外吸収スペクトルを示す図である。
【図9】図9は、カーボンナノチューブのカイラルベクトルを示す図である。
【発明を実施するための形態】
【0012】
[イオン性高分岐ポリマー]
本発明において、イオン性高分岐ポリマーは、分子内に2個以上のラジカル重合性二重結合を有するモノマーAと、分子内にカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーBとを、該モノマーA及び該モノマーBの合計モル数に対して、5モル%以上200モル%以下の重合開始剤Cの存在下で重合させる段階と、前記重合段階の前、前記重合段階の間、又は前記重合段階に続いて、前記カルボキシル基に窒素原子含有塩基性化合物を反応させる段階とにより得られるものである。
あるいは、本発明のイオン性高分岐ポリマーは、分子内に2個以上のラジカル重合性二重結合を有するモノマーAと、分子内に保護基で保護されたカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーDとを、該モノマーA及び該モノマーDの合計モル数に対して、5モル%以上200モル%以下の重合開始剤Cの存在下で重合させる段階と、前記重合段階に続いて、前記保護基を除去してカルボキシル基とする段階と、更に該カルボキシル基に窒素原子含有塩基性化合物を反応させる段階により得られるものである。
すなわち、本発明のイオン性高分岐ポリマーは、分子内にカルボキシル基を有する高分岐ポリマーのカルボン酸アニオンに、窒素原子含有塩基性化合物が持つ窒素原子含有カチオンが結合してなるものである。
以下、まずイオン性高分岐ポリマーを構成する、高分岐ポリマー及び窒素原子含有塩基性化合物について夫々説明する。
【0013】
<高分岐ポリマー>
本発明において、分子内に2個以上のラジカル重合性二重結合を有するモノマーAは、ビニル基又は(メタ)アクリル基の何れか一方又は双方を有することが好ましく、特にジビニル化合物又はジ(メタ)アクリレート化合物であることが好ましい。なお、本発明では(メタ)アクリレート化合物とは、アクリレート化合物とメタクリレート化合物の両方をいう。例えば(メタ)アクリル酸は、アクリル酸とメタクリル酸をいう。
【0014】
このようなモノマーAとしては、例えば、以下の(A1)乃至(A7)に示した有機化合物が例示される。
(A1)ビニル系炭化水素:
(A1−1)脂肪族ビニル系炭化水素類;イソプレン、ブタジエン、3−メチル−1,2−ブタジエン、2,3−ジメチル−1,3−ブタジエン、1,2−ポリブタジエン、ペンタジエン、ヘキサジエン、オクタジエン等
(A1−2)脂環式ビニル系炭化水素;シクロペンタジエン、シクロヘキサジエン、シクロオクタジエン、ノルボルナジエン等
(A1−3)芳香族ビニル系炭化水素;ジビニルベンゼン、ジビニルトルエン、ジビニルキシレン、トリビニルベンゼン、ジビニルビフェニル、ジビニルナフタレン、ジビニルフルオレン、ジビニルカルバゾール、ジビニルピリジン等
(A2)ビニルエステル、アリルエステル、ビニルエーテル、アリルエーテル、ビニルケトン:
(A2−1)ビニルエステル;アジピン酸ジビニル、マレイン酸ジビニル、フタル酸ジビニル、イソフタル酸ジビニル、イタコン酸ジビニル、ビニル(メタ)アクリレート等
(A2−2)アリルエステル;マレイン酸ジアリル、フタル酸ジアリル、イソフタル酸ジアリル、アジピン酸ジアリル、アリル(メタ)アクリレート等
(A2−3)ビニルエーテル;ジビニルエーテル、ジエチレングリコールジビニルエーテル、トリエチレングリコールジビニルエーテル等
(A2−4)アリルエーテル;ジアリルエーテル、ジアリルオキシエタン、トリアリルオキシエタン、テトラアリルオキシエタン、テトラアリルオキシプロパン、テトラアリルオキシブタン、テトラメタリルオキシエタン等
(A2−5)ビニルケトン;ジビニルケトン、ジアリルケトン等
(A3)(メタ)アクリル酸エステル:
エチレングリコールジ(メタ)アクリレート、トリエチレングリコールジ(メタ)アクリレート、プロピレングリコールジ(メタ)アクリレート、ネオペンチルグリコールジ(メタ)アクリレート、トリメチロールプロパントリ(メタ)アクリレート、ジトリメチロールプロパンテトラ(メタ)アクリレート、グリセロールトリ(メタ)アクリレート、ペンタエリスリトールテトラ(メタ)アクリレート、アルコキシチタントリ(メタ)アクリレート、1,6−ヘキサンジオールジ(メタ)アクリレート、2−メチル−1,8−オクタンジオールジ(メタ)アクリレート、1,9−ノナンジオールジ(メタ)アクリレート、1,10−デカンジオールジ(メタ)アクリレート、トリシクロデカンジメタノールジ(メタ)アクリレート、ジオキサングリコールジ(メタ)アクリレート、2−ヒドロキシ−1−アクリロイルオキシ−3−メタクリロイルオキシプロパン、2−ヒドロキシ−1,3−ジ(メタ)アクリロイルオキシプロパン、9,9−ビス[4−(2−(メタ)アクリロイルオキシエトキシ)フェニル]フルオレン、ウンデシレノキシエチレングリコールジ(メタ)アクリレート、ビス[4−(メタ)アクリロイルチオフェニル]スルフィド、ビス[2−(メタ)アクリロイルチオエチル]スルフィド、1,3−アダマンタンジオールジ(メタ)アクリレート、1,3−アダマンタンジメタノールジ(メタ)アクリレート、ビスフェノールAジエトキシジ(メタ)アクリレート等
(A4)ポリアルキレングリコール鎖を有するビニル系化合物:
ポリエチレングリコール(分子量300)ジ(メタ)アクリレート、ポリプロピレングリコール(分子量500)ジ(メタ)アクリレート等
(A5)含窒素ビニル系化合物:
ジアリルアミン、ジアリルイソシアヌレート、ジアリルシアヌレート、メチレンビス(メタ)アクリルアミド、ビスマレイミド等
(A6)含ケイ素ビニル系化合物:
ジメチルジビニルシラン、ジビニルメチルフェニルシラン、ジフェニルジビニルシラン、1,3−ジビニル−1,1,3,3−テトラメチルジシラザン、1,3−ジビニル−1,1,3,3−テトラフェニルジシラザン、ジエトキジビニルシラン等
(A7)含フッ素ビニル系化合物:
1,4−ジビニルパーフルオロブタン、1,4−ジビニルオクタフルオロブタン、1,6−ジビニルパーフルオロヘキサン、1,6−ジビニルドデカフルオロヘキサン、1,8−ジビニルパーフルオロオクタン、1,8−ジビニルヘキサデカフルオロオクタン等
【0015】
これらのうち好ましいものは、上記(A1−3)群の芳香族ビニル系炭化水素化合物、
(A2)群のビニルエステル、アリルエステル、ビニルエーテル、アリルエーテル及びビニルケトン、(A3)群の(メタ)アクリル酸エステル、(A4)群のポリアルキレングリコール鎖を有するビニル系化合物、並びに(A5)群の含窒素ビニル系化合物である。特に好ましいのは、(A1−3)群に属するジビニルベンゼン、(A2)群に属するフタル酸ジアリル、(A3)群に属するエチレングリコールジ(メタ)アクリレート、1,3−アダマンタンジメタノールジ(メタ)アクリレート、トリシクロデカンジメタノールジ(メタ)アクリレート、ビスフェノールAジエトキシジ(メタ)アクリレート、9,9−ビス[4−(2−(メタ)アクリロイルオキシエトキシ)フェニル]フルオレン並びに(A5)群に属するメチレンビス(メタ)アクリルアミドである。これらの中でもジビニルベンゼン、エチレングリコールジ(メタ)アクリレート及びビスフェノールAジエトキシジ(メタ)アクリレートが好ましく、より好ましくはジビニルベンゼンである。
【0016】
本発明において、分子内にカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーBは、好ましくはカルボキシル基に加えてビニル基又は(メタ)アクリル基の何れか一方を少なくとも1つ有することが好ましい。
このようなモノマーとしては、(メタ)アクリル酸、イタコン酸、2−トリフルオロメチルアクリル酸、2−エチルアクリル酸、2−プロピルアクリル酸、2−ブロモメチルアクリル酸、2−アセトアミドアクリル酸などの(メタ)アクリル酸類;3−ビニル安息香酸、4−ビニル安息香酸などのビニル安息香酸類等が挙げられる。
【0017】
なお、本発明において、分子内にカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーBに替えて、該カルボキシル基を保護基にて保護した基、すなわち、分子内に保護基で保護されたカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーDを用いることができる。
その場合、モノマーAと重合させた後に、保護基にて保護したカルボキシル基における保護基を除去してカルボキシル基とする。
なお、上記カルボキシル基の保護基としては特に限定されないが、例えばクミルエステル基、エノールエステル基、アセタールエステル基、第3級のアルキルエステル基等のエステル基であり、好ましくは、第3級アルキルエステル基である。
例えば、前記モノマーDとしては前述のモノマーBのカルボキシル基をこれら保護基で保護したモノマーであり、具体的には、メチル(メタ)アクリレート、エチル(メタ)アクリレート、ブチル(メタ)アクリレート、イソブチル(メタ)アクリレート、tert−ブチル(メタ)アクリレート、ヘキシル(メタ)アクリレート、2−エチルヘキシル(メタ)アクリレート、4−tert−ブチルシクロヘキシル(メタ)アクリレート、イソオクチル(メタ)アクリレート、イソデシル(メタ)アクリレート、ラウリル(メタ)アクリレート、オクタデシル(メタ)アクリレート、イソボルニル(メタ)アクリレート、アダマンチル(メタ)アクリレート、2−(2−メチル)アダマンチル(メタ)アクリレート等が挙げられる。このうち、tert−ブチル(メタ)アクリレート、アダマンチル(メタ)アクリレート、2−(2−メチル)アダマンチル(メタ)アクリレートが好ましい。
【0018】
本発明における重合開始剤Cとしては、好ましくはアゾ系重合開始剤が用いられる。アゾ系重合開始剤としては、例えば以下の(1)〜(5)に示す化合物を挙げることができる。
(1)アゾニトリル化合物:
2,2’−アゾビスイソブチロニトリル、2,2’−アゾビス(2−メチルブチロニトリル)、2,2’−アゾビス(2,4−ジメチルバレロニトリル)、1,1’−アゾビス(1−シクロヘキサンカルボニトリル)、2,2’−アゾビス(4−メトキシ−2,4−ジメチルバレロニトリル)、2−(カルバモイルアゾ)イソブチロニトリル等;
(2)アゾアミド化合物:
2,2’−アゾビス{2−メチル−N−[1,1−ビス(ヒドロキシメチル)−2−ヒドロキシエチル]プロピオンアミド}、2,2’−アゾビス{2−メチル−N−[2−(1−ヒドロキシブチル)]プロピオンアミド}、2,2’−アゾビス[2−メチル−N−(2−ヒドロキシエチル)プロピオンアミド]、2,2’−アゾビス[N−(2−プロペニル)−2−メチルプロピオンアミド]、2,2’−アゾビス(N−ブチル−2−メチルプロピオンアミド)、2,2’−アゾビス(N−シクロヘキシル−2−メチルプロピオンアミド)等;
(3)環状アゾアミジン化合物:
2,2’−アゾビス[2−(2−イミダゾリン−2−イル)プロパン]ジヒドロクロリド、2,2’−アゾビス[2−(2−イミダゾリン−2−イル)プロパン]ジスルフェートジヒドレート、2,2’−アゾビス[2−[1−(2−ヒドロキシエチル)−2−イミダ
ゾリン−2−イル]プロパン]ジヒドロクロリド、2,2'−アゾビス[2−(2−イミダゾリン−2−イル)プロパン]、2,2'−アゾビス(1−イミノ−1−ピロリジノ−2
−メチルプロパン)ジヒドロクロリド等;
(4)アゾアミジン化合物:
2,2’−アゾビス(2−メチルプロピオンアミジン)ジヒドロクロリド、2,2’−アゾビス[N−(2−カルボキシエチル)−2−メチルプロピオンアミジン]テトラヒドレート等;
(5)その他:
2,2’−アゾビスイソ酪酸ジメチル、4,4’−アゾビス(4−シアノバレリン酸)、2,2’−アゾビス(2,4,4−トリメチルペンタン)、1,1’−アゾビス(1−アセトキシ−1−フェニルエタン)、ジメチル1,1’−アゾビス(1−シクロヘキサンカルボキシレート)、4,4’−アゾビス(4−シアノペンタン酸)等。
【0019】
上記アゾ系重合開始剤の中でも好ましいものは、(1)アゾニトリル系、(5)その他であり、特に2,2’−アゾビスイソブチロニトリル、2,2’−アゾビスイソ酪酸ジメチルが好ましく、最も好ましいものは2,2’−アゾビスイソ酪酸ジメチルである。
【0020】
前記重合開始剤Cは、前記ラジカル重合性二重結合を有するモノマーA及び前記分子内にカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーB(又は分子内に保護されたカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーD)の合計モル数に対して、5モル%乃至200モル%の量で使用され、好ましくは15モル%乃至200モル%、より好ましくは15モル%乃至170モル%、より好ましくは50モル%乃至100モル%の量で使用される。
【0021】
本発明において、前記重合段階とは、重合開始剤Cの存在下で、前記ラジカル重合性二重結合を有するモノマーA(以降、単にラジカル重合性モノマーAとも称する)と、前記分子内にカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーB(以降、単にラジカル重合性モノマーBとも称する)又は前記分子内に保護されたカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーD(以降、単にラジカル重合性モノマーDとも称する)を重合する段階である。前記Cを前記A及び前記B(又はD)に添加する方法は、以下の方法が好ましく例示される。
(1)ラジカル重合性モノマーA及びB(又はD)に予め重合開始剤Cを混合した後重合する方法
(2)ラジカル重合性モノマーA及びB(又はD)に予め重合開始剤Cの一部を混合し重合を開始した後、さらに残りの重合開始剤Cを重合中に添加する方法
(3)ラジカル重合性モノマーA及びB(又はD)を重合条件にした後、重合開始剤Cを重合反応物中に添加して重合を行う方法
【0022】
ラジカル重合性モノマーA及びB(又はD)の重合方法としては、公知の方法、例えば
溶液重合、分散重合、沈殿重合及び塊状重合等が挙げられる。これらのうち好ましいものは溶液重合及び塊状重合である。分子量調節の点から有機溶媒中で重合を行うのが好ましい。
【0023】
このとき用いられる有機溶媒としては、ベンゼン、トルエン、キシレン、エチルベンゼン、テトラリン等の芳香族炭化水素系溶媒;n−ヘキサン、n−ヘプタン、ミネラルスピリット、シクロヘキサン等の脂肪族又は脂環式炭化水素系溶媒;塩化メチル、臭化メチル、ヨウ化メチル、メチレンジクロライド、クロロホルム、四塩化炭素、トリクロロエチレン、パークロロエチレン、オルトジクロロベンゼン等のハロゲン系溶媒;酢酸エチル、酢酸ブチル、メトキシブチルアセテート、メチルセロソルブアセテート、エチルセロソルブアセテート、プロピレングリコールモノメチルエーテルアセテート等のエステル系又はエステルエーテル系溶媒;ジエチルエーテル、テトラヒドロフラン、1,4−ジオキサン等のエーテル系溶媒;アセトン、メチルエチルケトン、メチルイソブチルケトン、ジn−ブチルケトン、シクロヘキサノン等のケトン系溶媒;メタノール、エタノール、n−プロパノール、イソプロパノール、n−ブタノール、イソブタノール、tert−ブタノール、2−エチルヘキシルアルコール、ベンジルアルコール、エチレングリコール、プロピレングリコール、メチルセロソルブ、エチルセロソルブ、ブチルセロソルブ、プロピレングリコールモノメチルエーテル、乳酸エチル等のアルコール系溶媒;N,N’−ジメチルホルムアミド、N,N’−ジメチルアセトアミド等のアミド系溶媒;ジメチルスルホキシド等のスルホキシド系溶媒;N−メチル−2−ピロリドン等の複素環式化合物系溶媒、並びにこれらの2種以上の混合溶媒が挙げられる。
【0024】
これらのうち好ましいものは、芳香族炭化水素系溶媒、ハロゲン系溶媒、エステル系溶媒、エーテル系溶媒、ケトン系溶媒、アルコール系溶媒、アミド系溶媒、スルホキシド系溶媒等であり、特に好ましいものはベンゼン、トルエン、キシレン、オルトジクロロベンゼン、クロロホルム、酢酸エチル、酢酸ブチル、プロピレングリコールモノメチルエーテルアセテート、テトラヒドロフラン、ジオキサン、アセトン、メチルエチルケトン、メチルイソブチルケトン、メタノール、エタノール、n−プロパノール、イソプロパノール、n−ブタノール、イソブタノール、tert−ブタノール、エチレングリコール、プロピレングリコールモノメチルエーテル、N,N’−ジメチルホルムアミド、N,N’−ジメチルアセトアミド、N−メチル−2−ピロリドン、ジメチルスルホキシド等である。
なお、本重合反応において、前記有機溶媒として非極性有機溶媒を使用する場合、得られる重合体の重量平均分子量(Mw)は低下する。
本発明の重合反応を有機溶媒の存在下で行う場合、前記ラジカル重合性モノマーAに対する前記有機溶媒の質量は、好ましくは5乃至50質量部、さらに好ましくは10乃至30質量部である。また本重合反応は、前記ラジカル重合性モノマーAに対する前記有機溶媒の質量が高いほど、得られる重合体の重量平均分子量(Mw)は低下する。
また、有機溶媒の存在下で重合を行う場合、以下の方法が好ましく例示される。
(1)ラジカル重合性モノマーA、B(又はD)及び重合開始剤Cを有機溶媒に溶解させた後、加熱して重合する方法
(2)ラジカル重合性モノマーA、B(又はD)及び重合開始剤Cを有機溶媒に溶解させた溶液を、加熱中の有機溶媒へ滴下して重合する方法
【0025】
重合反応は常圧、加圧密閉下、又は減圧下で行われ、装置及び操作の簡便さから常圧下で行うのが好ましい。また、N2等の不活性ガス雰囲気下で行うのが好ましい。
重合温度は、反応混合物の沸点以下であれば任意であるが、重合効率と分子量調節の点から、好ましくは50℃以上200℃以下、さらに好ましくは80℃以上150℃以下である。また、前記ラジカル重合性モノマーA、B(又はD)及び重合開始剤Cを有機溶媒に溶解させた溶液の重合温度が高いほど、重合反応によって得られる重合体の重量平均分子量(Mw)は低下する。
反応時間は、反応温度や、ラジカル重合性モノマーA、B(又はD)及び重合開始剤Cの種類及び割合、有機溶媒種等によって変動するものであるため一概には規定できないが、好ましくは20分以上480分以下、さらに好ましくは40分以上360分以下である。
【0026】
前記重合段階において、前記ラジカル重合性モノマーBに替えて、前記ラジカル重合性モノマーDを使用した場合、ラジカル重合性モノマーBを使用した場合と同じ手法や条件にて、重合反応を実施できる。
その場合、ラジカル重合性モノマーAと重合させた後、酸による分解反応、例えば脱エステル化反応により、ラジカル重合性モノマーDが持つ保護基で保護されたカルボキシル基の保護基を除去してカルボキシル基とする。
上記酸の具体例としては、塩酸、硫酸、リン酸、臭化水素酸等の無機酸の他、p−トルエンスルホン酸、酢酸、トリフルオロ酢酸、トリフルオロメタンスルホン酸、ギ酸等の有機酸が挙げられる。好ましくは塩酸、硫酸、p−トルエンスルホン酸、トリフルオロ酢酸、さらに好ましくはトリフルオロ酢酸が好適である。
【0027】
上記酸分解反応における上記酸の使用量は、保護基で保護されたカルボキシル基1モルに対して好ましくは1乃至10モル当量、さらに好ましくは1乃至5モル当量である。
【0028】
上記酸分解反応は、有機溶媒の存在下で行うことが好ましい。
有機溶媒としては、ベンゼン、トルエン、キシレン、エチルベンゼン、テトラリン等の芳香族炭化水素系溶媒;n−ヘキサン、n−ヘプタン、ミネラルスピリット、シクロヘキサン等の脂肪族又は脂環式炭化水素系溶媒;塩化メチル、臭化メチル、ヨウ化メチル、ジクロロメタン、1,2−ジクロロエタン、クロロホルム、四塩化炭素、トリクロロエチレン、パークロロエチレン、オルトジクロロベンゼン等のハロゲン系溶媒;酢酸エチル、酢酸ブチル、メトキシブチルアセテート、メチルセロソルブアセテート、エチルセロソルブアセテート、プロピレングリコールモノメチルエーテルアセテート等のエステル系又はエステルエーテル系溶媒;ジエチルエーテル、テトラヒドロフラン、1,4−ジオキサン等のエーテル系溶媒;アセトン、メチルエチルケトン、メチルイソブチルケトン、ジn−ブチルケトン、シクロヘキサノン等のケトン系溶媒;メタノール、エタノール、n−プロパノール、イソプロパノール、n−ブタノール、イソブタノール、tert−ブタノール、2−エチルヘキシルアルコール、ベンジルアルコール、エチルセロソルブ、ブチルセロソルブ、プロピレングリコールモノメチルエーテル、乳酸エチル等のアルコール系溶媒;N,N’−ジメチルホルムアミド、N,N’−ジメチルアセトアミド等のアミド系溶媒;ジメチルスルホキシド等のスルホキシド系溶媒;N−メチル−2−ピロリドンなどの複素環式化合物系溶媒、並びにこれらの2種以上の混合溶媒が挙げられる。
これらのうち好ましいものは、芳香族炭化水素系溶媒、ハロゲン系溶媒、エーテル系溶媒、アルコール系溶媒、アミド系溶媒等であり、特に好ましいものはベンゼン、トルエン、キシレン、オルトジクロロベンゼン、ジクロロメタン、1,2−ジクロロエタン、クロロホルム、テトラヒドロフラン、1,4−ジオキサン、メタノール、エタノール、イソプロパノール、プロピレングリコールモノメチルエーテル、ジメチルホルムアミド、ジメチルアセトアミド等である。さらに最も好ましいものはジクロロメタンである。
前記ラジカル重合性モノマーAに対する前記有機溶媒の質量は、好ましくは3乃至20質量部、さらに好ましくは5乃至10質量部である。
【0029】
反応温度は、0℃以上80℃以下で行うことが好ましい。さらに好ましくは10℃以上60℃以下である。
反応時間は、0.5時間以上24時間以下で行うことが好ましい。さらに好ましくは1時間以上12時間以下である。
【0030】
<窒素原子含有塩基性化合物>
本発明において、前記ラジカル重合性モノマーBのカルボキシル基に対して、又は前記ラジカル重合性モノマーDが持つ保護基で保護されたカルボキシル基の保護基を除去したカルボキシル基に対して反応させる窒素原子含有塩基性化合物は、下記式[1]乃至式[4]で表されるカチオンのうち何れか一種を有する化合物であって、これらカチオンは所謂イオン液体におけるカチオン種となるものである。
【0031】
【化2】

式中、R1、R2、R3、R4、R5、R6、R7及びR8はそれぞれ独立して、水素原子、炭素原子数1乃至6のアルキル基、炭素原子数1乃至6のヒドロキシアルキル基又はビニル基を表し、Xは単結合、メチレン基又は酸素原子を表し、nは0乃至4の整数を表し、nが2以上の場合、R8は同一であっても異なっていてもよい。
【0032】
上記式[1]で表されるカチオンとしては例えば1,3−ジアルキルイミダゾリウムカチオン、1,2,3−トリアルキルイミダゾリウムカチオン等が挙げられ、その一例として、1−メチルイミダゾリウムカチオン、1,3−ジメチルイミダゾリウムカチオン、1−メチル−3−エチルイミダゾリウムカチオン、1−メチル−3−n−プロピルイミダゾリウムカチオン、1−メチル−3−n−ブチルイミダゾリウムカチオン、1−メチル−3−n−ペンチルイミダゾリウムカチオン、1−メチル−3−n−ヘキシルイミダゾリウムカチオン、1−エチル−3−n−プロピルイミダゾリウムカチオン、1−エチル−3−n−ブチルイミダゾリウムカチオン、1,2−ジメチル−3−n−プロピルイミダゾリウムカチオン、1−エチル−2,3−ジメチルイミダゾリウムカチオン、1−n−ブチル−2,3−ジメチルイミダゾリウムカチオン、1,2,3−トリメチルイミダゾリウムカチオン、1−メチル−3−ビニルイミダゾリウムカチオン、1,3−ジビニルイミダゾリウムカチオン等を挙げることができる。
【0033】
上記式[2]で表されるカチオンとしては例えばN−アルキルピリジニウムカチオンが挙げられ、その一例として、1−エチルピリジニウムカチオン、1−エチル−3−メチルピリジニウムカチオン、1−エチル−3−ヒドロキシメチルピリジニウムカチオン、1−n−ブチルピリジニウムカチオン、1−n−ブチル−3−メチルピリジニウムカチオン、1−n−ブチル−4−メチルピリジニウムカチオン、1−n−ヘキシルピリジニウムカチオン等を挙げることができる。
【0034】
上記式[3]で表されるカチオンとしては、Xが単結合の場合には例えばN,N−ジアルキルピロリジニウムカチオン、Xがメチレン基の場合には例えばN,N−ジアルキルピペリジニウムカチオン、Xが酸素原子の場合には例えばN,N−ジアルキルモルホリニウムカチオンが挙げられる。
その各々の具体例は以下の通りである:
・Xが単結合の場合:N,N−ジメチルピロリジニウムカチオン、N−n−ブチル−N−メチルピロリジニウムカチオン、N−n−ブチル−N−エチルピロリジニウムカチオン、N−n−ブチル−N−プロピルピロリジニウムカチオン、N−メチル−N−プロピルピロリジニウムカチオン等
・Xがメチレン基の場合:N,N−ジメチルピペリジニウムカチオン、N,N−ジエチル
ピペリジニウムカチオン、N−エチル−N−メチルピペリジニウムカチオン、N−メチル−N−プロピルピペリジニウムカチオン、N−n−ブチル−N−メチルピペリジニウムカチオン、N−ヘキシル−N−メチル−ピペリジニウムカチオン等
・Xが酸素原子の場合:N,N−ジメチルモルホリニウムカチオン、N,N−ジn−ブチルモルホリニウムカチオン等
【0035】
上記式[4]で表されるカチオンとしては、例えばテトラアルキルアンモニウムカチオンが挙げられ、その一例として、トリメチルn−ペンチルアンモニウムカチオン、シクロヘキシルトリメチルアンモニウムカチオン、テトラエチルアンモニウムカチオン、テトラn−ブチルアンモニウムカチオン、テトラn−ペンチルアンモニウムカチオン、テトラn−ヘキシルアンモニウムカチオン、トリn−ブチルメチルアンモニウムカチオン等が挙げられる。
【0036】
また、上記式[1]乃至式[4]で表されるカチオンと対をなすアニオン種としては、テトラフルオロボレート(BF4-)アニオン、ヘキサフルオロホスフェート(PF6-)アニオン、トリフルオロメタンスルホネート(CF3SO3-)アニオン、ヘキサフルオロア
ンチモネート(SbF6-)アニオン、ビス(トリフルオロメチルスルホニル)イミド((CF3SO2)2N-)アニオン、ビス(フルオロスルホニル)イミド((FSO2)2N-)
アニオン、トリス(トリフルオロメチルスルホニル)メチド((CF3SO2)3C-)アニオン、ニトレート(NO3-)アニオン、トリフルオロメチルカルボキシレート(CF3C
O2-)アニオン、カルボキシレート(CH3CO2-)アニオン、クロロアルミネート(A
l2Cl7-)アニオン、ハイドロゲンカーボネート(HCO3-)、メチルカーボネート(
CH3OCO2-)などが挙げられる。
これらのうち好ましいものは、ハイドロゲンカーボネート(HCO3-)、メチルカーボネート(CH3OCO2-)等である。
【0037】
このような窒素原子含有塩基性化合物の具体例としては、1,3−ジメチルイミダゾリウム=ハイドロゲンカーボネート、1−エチル−3−メチルイミダゾリウム=ハイドロゲンカーボネート、1−ブチル−3−メチルイミダゾリウム=ハイドロゲンカーボネート、1−ビニル−3−メチルイミダゾリウム=ハイドロゲンカーボネート、1−エチル−2,3−ジメチルイミダゾリウム=メチルカーボネート、1−ブチル−1−メチルピロリジニウム=メチルカーボネート、1−エチル−1−メチルピペリジニウム=メチルカーボネート、4−エチル−4−メチルモルホリニウム=メチルカーボネート、トリエチルメチルアンモニウム=メチルカーボネート、トリブチルメチルアンモニウム=メチルカーボネート等が挙げられる。これらの化合物は、アルドリッチ社よりCBILS(商標)シリーズとして販売されているものを使用することもできる。
【0038】
本発明のイオン性高分岐ポリマーは、前記ラジカル重合性モノマーBのカルボキシル基に対して、又は前記ラジカル重合性モノマーDが持つ保護基で保護されたカルボキシル基の保護基を除去したカルボキシル基に対して、前記窒素原子含有塩基性化合物を有機溶媒中で反応させる(混合する)ことにより得られる。
【0039】
このとき用いられる有機溶媒としては、ベンゼン、トルエン、キシレン、エチルベンゼン、テトラリン等の芳香族炭化水素系溶媒;n−ヘキサン、n−ヘプタン、ミネラルスピリット、シクロヘキサン等の脂肪族又は脂環式炭化水素系溶媒;塩化メチル、臭化メチル、ヨウ化メチル、メチレンジクロライド、クロロホルム、四塩化炭素、トリクロロエチレン、パークロロエチレン、オルトジクロロベンゼン等のハロゲン系溶媒;酢酸エチル、酢酸ブチル、メトキシブチルアセテート、メチルセロソルブアセテート、エチルセロソルブアセテート、プロピレングリコールモノメチルエーテルアセテート等のエステル系又はエステルエーテル系溶媒;ジエチルエーテル、テトラヒドロフラン、1,4−ジオキサン等
のエーテル系溶媒;アセトン、メチルエチルケトン、メチルイソブチルケトン、ジn−ブチルケトン、シクロヘキサノン等のケトン系溶媒;メタノール、エタノール、n−プロパノール、イソプロパノール、n−ブタノール、イソブタノール、tert−ブタノール、2−エチルヘキシルアルコール、ベンジルアルコール、エチレングリコール、プロピレングリコール、メチルセロソルブ、エチルセロソルブ、ブチルセロソルブ、プロピレングリコールモノメチルエーテル、乳酸エチル等のアルコール系溶媒;N,N’−ジメチルホルムアミド、N,N’−ジメチルアセトアミド等のアミド系溶媒;ジメチルスルホキシド等のスルホキシド系溶媒;N−メチル−2−ピロリドン等の複素環式化合物系溶媒、並びにこれらの2種以上の混合溶媒が挙げられる。また窒素原子含有塩基性化合物を溶解させるために、これら有機溶媒に水を添加することが好ましい。
【0040】
これらのうち好ましいものは、エーテル系溶媒、ケトン系溶媒、アルコール系溶媒、アミド系溶媒、スルホキシド系溶媒等であり、特に好ましいものはベンゼン、テトラヒドロフラン、ジオキサン、アセトン、メタノール、エタノール、n−プロパノール、イソプロパノール、n−ブタノール、イソブタノール、tert−ブタノール、エチレングリコール、プロピレングリコールモノメチルエーテル、N,N’−ジメチルホルムアミド、N,N’−ジメチルアセトアミド、N−メチル−2−ピロリドン、ジメチルスルホキシド等である。
【0041】
反応温度は、0℃以上80℃以下で行うことが好ましい。さらに好ましくは10℃以上60℃以下である。
反応時間は、通常0.1時間以上24時間以下で行うことが好ましい。さらに好ましくは0.5時間以上12時間以下である。
【0042】
本発明のイオン性高分岐ポリマーは、前記ラジカル重合性モノマーAとラジカル重合性モノマーBとの重合段階と、その重合段階の前、重合段階の間、又は重合段階に続いて、ラジカル重合性モノマーBのカルボキシル基に、前記窒素原子含有塩基性化合物を反応させる段階とにより、得られるものである。
したがって、例えば、ラジカル重合性モノマーAとラジカル重合性モノマーBとを重合させて高分岐ポリマーを得た後、窒素原子含有塩基性化合物を反応させてもよいし、或いは、ラジカル重合性モノマーBに前記窒素原子含有塩基性化合物を反応させた後、ラジカル重合性モノマーAと重合させてもよい。
なお、ラジカル重合性モノマーBに替えてラジカル重合性モノマーDを用いる場合には、
ラジカル重合性モノマーAとラジカル重合性モノマーDとを重合させて高分岐ポリマーを得た後、ラジカル重合性モノマーDが持つ保護基で保護されたカルボキシル基の保護基を除去し、その後、前記窒素原子含有塩基性化合物を反応させることとなる。
【0043】
なお、本発明において、イオン性高分岐ポリマーの窒素原子含有塩基性化合物部分を除去した、すなわち窒素原子含有塩基性化合物を反応させる前のカルボン酸形態の高分岐ポリマーのゲル浸透クロマトグラフィーによるポリスチレン換算で測定される重量平均分子量(以下Mwと略記)は、好ましくは1,000乃至2,000,000、さらに好ましくは2,000乃至1,000,000である。
また該高分岐ポリマーの1次粒子の平均粒子径は、好ましくは1nm以上100nm以下、さらに好ましくは5nm以上50nm以下である。
【0044】
そして、重合反応終了後、或いは、窒素原子含有塩基性化合物との反応終了後、適宜得られた高分岐ポリマー又はその窒素原子含有塩基性化合物塩(イオン性高分岐ポリマー)を任意の方法で回収し、必要に応じて洗浄等の後処理を行う。反応溶液から高分岐ポリマー又はその窒素原子含有塩基性化合物塩(イオン性高分岐ポリマー)を回収する方法とし
ては、再沈殿、濾過、遠心分離等の方法が挙げられる。
【0045】
[炭素ナノ材料分散剤、炭素ナノ材料組成物]
本発明は、前述のイオン性高分岐ポリマーからなる炭素ナノ材料分散剤にも関する。
そして、本発明は、前記炭素ナノ材料分散剤と、炭素ナノ材料とを含んでなる炭素ナノ材料組成物にも関する。
【0046】
本発明の炭素ナノ材料組成物において、炭素ナノ材料としてはフラーレン、カーボンナノチューブ(CNT)が挙げられる。
CNTは通常、アーク放電法、化学気相成長法(以下、CVD法という。)、レーザー・アブレーション法等によって作製され、このとき、同時にフラーレンやグラファイト、非晶性炭素も生成される。本発明において使用されるCNT及びフラーレンは、何れの方法によって得られたものであってもよい。
なお、CNT及びフラーレンの生成時には、ニッケル、鉄、コバルト、イットリウムなどの触媒金属も残存するので、これらの不純物の除去、精製を必要とする場合がある。不純物の除去には、硝酸、硫酸などによる酸処理とともに、超音波処理が有効である。しかし、硝酸、硫酸などによる酸処理では炭素ナノ材料を構成するπ共役系が破壊され、炭素ナノ材料本来の特性が損なわれてしまう可能性があるため、適切な条件下で精製して使用することが望ましい。
【0047】
なおCNTには1枚の炭素膜(グラフェン・シート)が円筒状に巻かれた単層CNT(以下、SWCNTと記載。)と、2枚のグラフェン・シートが同心円状に巻かれた二層CNT(以下、DWCNTと記載。)と、複数のグラフェン・シートが同心円状に巻かれた多層CNT(以下、MWCNTと記載。)とがあり、本発明の炭素ナノ材料組成物においては、SWCNT、DWCNT、MWCNTをそれぞれ単体で、又は複数を組み合わせて使用できる。特に好ましくは単層カーボンナノチューブ(SWCNT)である。
【0048】
CNTはグラフェン・シートの巻き方(螺旋度、カイラリティー)により電気特性が金属的なものから半導体的なものまで変化する。
CNTのカイラリティーは図9に示されるカイラルベクトル(R=na1+ma2、ただしm、nは整数)により規定され、n=m及びn−m=3p(ただしpは整数)の場合には金属的性質、それ以外の場合(n≠m、n−m≠3p)には半導体性質をそれぞれ示すことが知られている。このため、特にSWCNTを使用する場合は、ある種のカイラリティーを選択的に分散した組成物とすることが重要である。
本発明のイオン性高分岐ポリマーを、CNTの分散剤として使用することで、ある特定のカイラリティーを有するCNTを、選択的に分散させた組成物が得られる可能性がある。
【0049】
またフラーレンには、炭素原子60個からなる切頂二十面体(サッカーボール状)構造のC60フラーレン、炭素原子70個からなるC70フラーレン等があり、本発明の炭素ナノ材料組成物においては、C60フラーレン、C70フラーレンをそれぞれ単体で、又は複数を組み合わせて使用できる。特に好ましくはC60フラーレンである。
また、これらフラーレンの局所的変形構造体、中空部にイオン種を導入したもの、炭素原子の一部を他の原子により置換したもの、官能基を結合させたもの等の誘導体も包含される。
【0050】
本発明の炭素ナノ材料組成物は、さらに上記炭素ナノ材料分散剤(イオン性高分岐ポリマー)の溶解能を有する有機溶媒を含んでいてもよい。
このような有機溶媒としては、例えば、テトラヒドロフラン(THF)、ジエチルエーテル、ジメトキシエタン(DME)などのエーテル系化合物;塩化メチレン、クロロホル
ムなどのハロゲン化炭化水素;N,N’−ジメチルホルムアミド(DMF)、N,N’−ジメチルアセトアミド(DMAc)、N−メチル−2−ピロリドン(NMP)などのアミド系化合物;アセトン、メチルエチルケトン、メチルイソブチルケトン、シクロヘキサノンなどのケトン系化合物;メタノール、エタノール、イソプロパノール、プロパノールなどのアルコール類;n−ヘプタン、n−ヘキサン、シクロヘキサンなどの脂肪族炭化水素類;ベンゼン、トルエン、キシレン、エチルベンゼンなどの芳香族炭化水素類等が挙げられ、これら有機溶媒は、一種単独で又は二種以上混合して用いることができる。
特に、炭素ナノ材料の分散を向上させ得るという点、とりわけ、炭素ナノ材料としてCNTを用いた場合に、CNTの孤立溶解の状態での分散の割合を向上させ得るという点から、NMP、メタノール、イソプロパノールが好ましく、さらに後述する炭素ナノ材料組成物の成膜性をも向上し得るための添加剤として、エチルセロソルブ、ブチルセロソルブなどのセロソルブ類の溶媒を、少量含むことが望ましい。
【0051】
本発明の炭素ナノ材料組成物の調製法は任意であり、炭素ナノ材料分散剤が液状の場合には、当該炭素ナノ材料分散剤と炭素ナノ材料とを適宜混合し、分散剤が固体の場合には、これを溶融させた後、炭素ナノ材料と混合して調製することができる。
また、有機溶媒を用いる場合には、炭素ナノ材料分散剤、炭素ナノ材料、有機溶媒を任意の順序で混合して組成物を調製すればよく、例えばこれらを一緒に混合してもよいし、或いは、炭素ナノ材料分散剤を有機溶媒に溶解した溶液中に、炭素ナノ材料を添加して混合してもよい。
この際、炭素ナノ材料分散剤、炭素ナノ材料及び有機溶媒からなる混合物を分散処理することが好ましく、この処理により、炭素ナノ材料の分散性、とりわけ炭素ナノ材料としてCNTを用いた場合に、CNTの孤立溶解の状態での分散の割合をより向上させることができる。分散処理としては、機械的処理としてのボールミル、ビーズミル、ジェットミルなどを用いた湿式処理や、バス型やプローブ型のソニケータを用いる超音波処理が挙げられるが、処理効率を考慮すると、超音波処理が好適である。
分散処理の時間は任意であるが、5分間から10時間程度が好ましく、10分間から5時間程度がより好ましい。
【0052】
本発明の炭素ナノ材料組成物における、炭素ナノ材料分散剤と炭素ナノ材料との混合比率は、質量比で1,000:1乃至1:100程度とすることができる。
また、有機溶媒を使用した炭素ナノ材料組成物中における炭素ナノ材料分散剤の濃度は、炭素ナノ材料を有機溶媒に分散させ得る濃度であれば特に限定されるものではないが、本発明においては、炭素ナノ材料組成物中に0.001乃至30質量%程度とすることが好ましく、0.005乃至20質量%程度とすることがより好ましい。
また、この炭素ナノ材料組成物中における炭素ナノ材料の濃度は任意であり、とりわけ、炭素ナノ材料としてCNTを用いた場合には少なくともCNTの一部が孤立溶解の状態で分散する限りにおいて任意であるが、本発明においては、炭素ナノ材料組成物中に0.0001乃至20質量%程度とすることが好ましく、0.001乃至10質量%程度とすることがより好ましい。
以上のようにして調製された炭素ナノ材料組成物中では、炭素ナノ材料分散剤が炭素ナノ材料の表面に付着又は配位して複合体を形成しているものと推測される。
【0053】
本発明の炭素ナノ材料組成物(溶液)は、PET、ガラス、ITOなどの適当な基板上にキャスト法、スピンコート法、バーコート法、ロールコート法、ディップコート法などの適宜な方法により、塗布して成膜することが可能である。
得られた薄膜は、炭素ナノ材料の金属的性質を活かした帯電防止膜、透明電極等の導電性材料、あるいは半導体的性質を活かした光電変換素子及び電界発光素子等に好適に用いることができる。
【実施例】
【0054】
以下、実施例を挙げて本発明をより具体的に説明するが、本発明は下記の実施例に限定されるものではない。
なお、実施例において、試料の調製及び物性の分析に用いた装置及び条件は、以下の通りである。
【0055】
(1)ゲル浸透クロマトグラフィー(GPC)
装置:東ソー(株)製 高速GPC装置 HLC−8220GPC
カラム:東ソー(株)製 TSKgel SuperHM−M & TSKgel SuperHM−H
カラム温度:40℃
溶媒:10mmol/L LiBr添加DMF
検出器:RI
(2−1)1H NMRスペクトル(高分岐ポリマー1A,1B)
装置:日本電子(株)製 EX−400(400MHz)
溶媒:CDCl3
基準物質:テトラメチルシラン(0.03体積%)
(2−2)1H NMRスペクトル(高分岐ポリマー2A,2B,3A,3B)
装置:日本電子(株)製 EX−400(400MHz)
溶媒:ジメチルスルホキシド
基準物質:テトラメチルシラン(0.05体積%)
(3)超音波処理
装置:東京硝子器械(株)製 Fine超音波洗浄器 FU−6H
(4)遠心分離
装置:(株)トミー精工製 小型高速冷却遠心機 SRX−201
(5)紫外可視近赤外吸収スペクトル(UV−Vis−NIR)
装置:(株)島津製作所製 紫外可視近赤外分光光度計 UV−3600
測定波長:400〜1,650nm
(6)表面抵抗
装置:(株)三菱化学アナリテック製 高抵抗率計 ハイレスタ−UP
【0056】
また、略記号は以下の意味を表す。
DVB:ジビニルベンゼン[新日鐵化学(株)製、製品名:DVB−960の減圧蒸留品]
tBA:tert−ブチルアクリレート[和光純薬工業(株)製の減圧蒸留品]
MAIB:2,2’−アゾビスイソ酪酸ジメチル[大塚化学(株)製、商品名:MAIBのメタノール再結晶品]
TFA:トリフルオロ酢酸[東京化成工業(株)製]
SWCNT:単層カーボンナノチューブ[Unidym社製、HiPco CNT(精製)]
C60:フラーレンC60[フロンティアカーボン(株)製、nanom purple ST−A]
THF:テトラヒドフラン
NMP:N−メチル−2−ピロリドン
【0057】
[合成例1]
<カルボキシル基含有高分岐ポリマー2Aの合成>
250mLのナスフラスコへ、DVB0.65g(5mmol)、tBA0.64g(5mmol)、及びMAIB4.65g(25mmol)を仕込み、トルエン50mLを加えた。この溶液を−50℃に冷却した後、脱気及び窒素パージを5回繰り返して、反応
容器内及び溶液中の溶存酸素を極力除去した。次に、この反応容器を80℃に保った油浴中に入れ、窒素気流下で2時間重合させた。その後、反応混合物をメタノール−水混合液(体積比4:1)1Lに注ぎ込んだ。生成した白色沈殿物を遠心分離(740G、20分間)で単離し、真空乾燥することで、tert−ブトキシカルボニル基含有高分岐ポリマー1A 1.18g(収率22%)を得た。得られた高分岐ポリマーのGPCによるポリスチレン換算で測定される数平均分子量Mnは12,000、多分散度(重量平均分子量Mw/数平均分子量Mn)は2.4であった。また、得られた高分岐ポリマーの組成を1
H NMRスペクトルにより求めたところ、DVB:tBA:MAIB断片=32:26:42(モル%)であった。得られた高分岐ポリマーの1H NMRスペクトルを図1に
示す。
次いで、50mLナスフラスコへ前記tert−ブトキシカルボニル基含有高分岐ポリマー1A 1.00gを仕込み、ジクロロメタン20mLを加えた。そこにTFA1.36g(tert−ブチル基に対して5mol当量)を加え、室温(およそ25℃)で24時間撹拌した。反応後、エバポレーターを用いてジクロロメタンを留去し、その残渣をn−ヘキサン1Lに注ぎ込んだ。生成した白色沈殿物を遠心分離(740G、20分間)で単離し、真空乾燥することで、カルボキシル基含有高分岐ポリマー2A 0.72g(収率82%)を得た。得られた高分岐ポリマーの1H NMRスペクトルを図2に示す。
【0058】
[実施例1]
<高分岐ポリマーイミダゾリウム塩3Aの合成>
100mLのナスフラスコへ合成例1で得られたカルボキシル基含有高分岐ポリマー2A 0.50gを仕込み、メタノール33mLを加えた。この溶液へ50%炭酸水素1−エチル−3−メチルイミダゾリウム水−メタノール溶液(水:メタノール=3:2)[アルドリッチ社製]0.41gを加え、室温(およそ25℃)で24時間撹拌した。反応後、エバポレーターを用いてメタノールを留去し、その残渣をTHF500mLに注ぎ込んだ。生成した白色沈殿物を遠心分離(740G、20分間)で単離し、真空乾燥することで、目的とする高分岐ポリマーイミダゾリウム塩3A 0.50g(収率80%)を得た。得られた高分岐ポリマーイミダゾリウム塩の1H NMRスペクトルを図3に示す。
【0059】
[合成例2]
<カルボキシル基含有高分岐ポリマー2Bの合成>
tBAの使用量を3.20g(25mmol)に変更した以外は合成例1と同様に操作し、tert−ブトキシカルボニル基含有高分岐ポリマー1B 3.01g(収率38%)を得た。得られた高分岐ポリマーのGPCによるポリスチレン換算で測定される数平均分子量Mnは25,000、多分散度(重量平均分子量Mw/数平均分子量Mn)は2.2であった。また、得られた高分岐ポリマーの組成を1H NMRスペクトルにより求め
たところ、DVB:tBA:MAIB断片=14:66:20(モル%)であった。得られた高分岐ポリマーの1H NMRスペクトルを図4に示す。
次いで、TFAの使用量を3.16g(tert−ブチル基に対して5mol当量)に変更した以外は合成例1と同様に操作し、カルボキシル基含有高分岐ポリマー2B 0.59g(収率85%)を得た。得られた高分岐ポリマーの1H NMRスペクトルを図5
に示す。
【0060】
[実施例2]
<高分岐ポリマーイミダゾリウム塩3Bの合成>
カルボキシル基含有高分岐ポリマー2Aを合成例2で得られたカルボキシル基含有高分岐ポリマー2Bに、50%炭酸水素1−エチル−3−メチルイミダゾリウム水−メタノール溶液の使用量を0.95gに、それぞれ変更した以外は実施例1と同様に操作し、目的とする高分岐ポリマーイミダゾリウム塩3B 0.65g(収率81%)を得た。得られた高分岐ポリマーイミダゾリウム塩の1H NMRスペクトルを図6に示す。
【0061】
[実施例3]
<高分岐ポリマーイミダゾリウム塩3Bを用いたSWCNTの分散>
分散剤として実施例2において合成した高分岐ポリマーイミダゾリウム塩3B 1.0mgをNMP5mLに溶解させ、この溶液へSWCNT2.5mgを添加した。この混合物に、室温(およそ25℃)で超音波処理(出力150W)を1時間行い、その後、室温(およそ25℃)で10,000G、1時間の遠心分離により、上澄み液として黒色透明なSWCNT含有分散液を回収した。
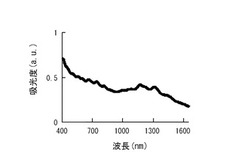
得られた黒色透明なSWCNT含有分散液の紫外可視近赤外吸収スペクトルを測定したところ、半導体性S11バンド(1,400〜1,000nm)、S22バンド(1,000〜600nm)、及び金属性バンド(600〜450nm)の吸収が明確に観察され、SWCNTが分散されていることが確認された。得られた紫外可視近赤外吸収スペクトルを図7に示す。
【0062】
[比較例1]
<SWCNT単独での分散>
分散剤として高分岐ポリマーイミダゾリウム塩3Bを添加しなかった以外は実施例3と同様に操作したが、SWCNTを分散させることはできなかった。
【0063】
[実施例4]
<高分岐ポリマーイミダゾリウム塩3Bを用いたC60の分散>
分散剤として実施例2において合成した高分岐ポリマーイミダゾリウム塩3B 1.0mgをNMP5mLに溶解させ、この溶液へC60 10mgを添加した。この混合物に、室温(およそ25℃)で超音波処理(出力150W)を1時間行い、フィルター[ワットマン社製、孔径0.2μm、メンブレン:PTFE]濾過により、黄褐色透明なC60分散液を回収した。
得られた黄褐色透明なC60分散液の紫外可視近赤外吸収スペクトルを図8に示す。
【0064】
[比較例2]
<C60単独での分散>
分散剤として高分岐ポリマーイミダゾリウム塩3Bを添加しなかった以外は実施例4と同様に操作し、C60分散液を回収した。
得られたC60分散液の紫外可視近赤外吸収スペクトルを図8に合わせて示す。
【0065】
図8に示したように、高分岐ポリマーイミダゾリウム塩を添加したC60分散液(実施例4)は、高分岐ポリマーイミダゾリウム塩を加えていないもの(比較例2)に比べ吸光度が大きく、より多くのC60が分散されていることが確認された。
【0066】
[実施例5]
<高分岐ポリマーイミダゾリウム塩3A薄膜の作製>
実施例1において合成した高分岐ポリマーイミダゾリウム塩3A 20mgを、エタノール20mLに溶解しワニスを調製した。
得られたワニスをガラス基板上にキャストし、高分岐ポリマーイミダゾリウム塩3Aの薄膜を得た。得られた薄膜の表面抵抗を測定したところ、1.22×1013Ω/cm2で
あった。
【0067】
[実施例6]
<高分岐ポリマーイミダゾリウム塩3A−C60分散薄膜の作製>
サンプル瓶へ、フラーレン2mg及びトルエン2mLを仕込み、室温(およそ25℃)で超音波処理(出力150W)を5分間行った。そこへ、実施例1において合成した高分
岐ポリマーイミダゾリウム塩3A 18mg、及びクロロホルム6mLを加え、さらに超音波処理を20分間行った。その後、エバポレーターを用いて溶媒を留去した。その残渣へエタノール20mLを加え、室温(およそ25℃)で超音波処理(出力150W)を20分間行った。フィルター[ワットマン社製、孔径0.2μm、メンブレン:PTFE]濾過により、黄褐色透明なC60分散液を得た。
得られた分散液をガラス基板上にキャストし、高分岐ポリマーイミダゾリウム塩3AにC60が分散した薄膜を得た。得られた薄膜の表面抵抗を測定したところ、3.47×108Ω/cm2であった。
【先行技術文献】
【特許文献】
【0068】
【特許文献1】特開2010−024330号公報
【特許文献2】特開2004−142972号公報
【特許文献3】特開2004−255481号公報
【技術分野】
【0001】
本発明は、新規なイオン性高分岐ポリマー、詳細にはカルボキシル基を有する高分岐ポリマーの窒素原子含有塩基性化合物塩であるイオン性高分岐ポリマー、該イオン性高分岐ポリマーからなる炭素ナノ材料分散剤、並びに該炭素ナノ材料分散剤を含む組成物に関する。
【背景技術】
【0002】
ハイパーブランチポリマーは、デンドリマーと共にデンドリティック(樹枝状)ポリマーとして分類されている。従来の高分子が一般的に紐状の形状であるのに対し、これらのデンドリティックポリマーは、積極的に枝分かれを導入しているため、特異な構造を有する点、ナノメートルオーダーのサイズである点、多くの官能基を保持する表面を形成することができる点、線状ポリマーに比べて低粘度化できる点、分子間の絡み合いが少なく微粒子的挙動を示す点、非晶性になり溶媒溶解性を制御できる点等において様々な特性を有しており、これらの特性を利用した応用が期待されている。
【0003】
ハイパーブランチポリマーのデンドリマーに対する利点としては、その合成の簡便さが挙げられ、特に工業的生産においては有利である。一般に、デンドリマーが保護−脱保護を繰り返し合成されるのに対し、ハイパーブランチポリマーは1分子中に2種類の置換基を合計3個又はそれ以上持つ、いわゆるABx型モノマーの一段階重合により合成される。
【0004】
これらハイパーブランチポリマーの合成法の一つとして、例えば、ラジカル重合性二重結合を2個以上有するモノマーと1個のラジカル重合性二重結合を有するモノマーとを、ラジカル重合開始剤の存在下で反応させることによる高分岐ポリマーの合成方法が知られている(特許文献1)。
但し現在までのところ、これら高分岐ポリマーの窒素原子含有塩基性化合物塩については報告がない。
【0005】
一方、カーボンナノチューブをはじめとする炭素ナノ材料は、金属的な性質から半導体までの多様で優れた電気的特性を有し、また、大きな表面積や機械強度特性などから、電気電子材料から高性能樹脂補強材などに至る各種の分野において、次世代先端材料として注目が集まり、世界的な規模で実用化研究が進行中である。また、イオン液体をカーボンナノ材料、特にSWCNT(単層カーボンナノチューブ:single walled carbon nano tube)の分散剤として使用する技術が知られている(特許文献2)。また、特許文献3には、ラジカル反応性部位を有するイオン液体を重合して得られる直鎖状ポリマーとSWCNTとの複合体が開示されているが、薄膜形成やその導電性については何ら開示されていない。
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、前記特許文献2、3に記載の方法では、SWCNTはゲル状組成物の形態となっており、またイオン液体が低分子化合物であるため自己支持性がなく、スプレー塗布などの工程による薄膜の形成が困難であることが課題であった。
本発明は、上記事情に鑑みなされたものであって、炭素ナノ材料の分散剤としての応用が期待できる新規なイオン性高分岐ポリマーを提供することを目的とするものである。
また、本発明の別な目的は、炭素ナノ材料を分散させるのに好適な炭素ナノ材料分散剤、及び炭素ナノ材料組成物を提供することである。
【課題を解決するための手段】
【0007】
本発明者らは、上記目的を達成するために鋭意検討を重ねた結果、従来検討されていなかった高分岐ポリマーを所謂イオン液体由来の塩とすることにより、炭素ナノ材料の分散剤としても有用な高分岐ポリマーが得られることを見出し、本発明を完成させた。
【0008】
すなわち、本発明は、第1観点として、分子内に2個以上のラジカル重合性二重結合を有するモノマーAと、分子内にカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーBとを、該モノマーA及び該モノマーBの合計モル数に対して、5モル%以上200モル%以下の重合開始剤Cの存在下で重合させる段階と、前記重合段階の前、前記重合段階の間、又は前記重合段階に続いて、前記カルボキシル基に窒素原子含有塩基性化合物を反応させる段階とにより得られる、イオン性高分岐ポリマーに関する。
第2観点として、分子内に2個以上のラジカル重合性二重結合を有するモノマーAと、分子内に保護基で保護されたカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーDとを、該モノマーA及び該モノマーDの合計モル数に対して、5モル%以上200モル%以下の重合開始剤Cの存在下で重合させる段階と、前記重合段階に続いて、前記保護基を除去してカルボキシル基とする段階と、更に該カルボキシル基に窒素原子含有塩基性化合物を反応させる段階とにより得られる、イオン性高分岐ポリマーに関する。
第3観点として、分子内にカルボキシル基を有する高分岐ポリマーのカルボン酸アニオンに、窒素原子含有塩基性化合物が持つ窒素原子含有カチオンが結合してなる、イオン性高分岐ポリマーに関する。
第4観点として、前記窒素原子含有塩基性化合物が、式[1]乃至式[4]で表されるカチオンのうち何れか一種を有する化合物である、第1観点乃至第3観点のうち何れか一項に記載のイオン性高分岐ポリマーに関する。
【化1】

(式中、R1、R2、R3、R4、R5、R6、R7及びR8はそれぞれ独立して、水素原子、炭素原子数1乃至6のアルキル基、炭素原子数1乃至6のヒドロキシアルキル基又はビニル基を表し、Xは単結合、メチレン基又は酸素原子を表し、nは0乃至4の整数を表し、nが2以上の場合、R8は同一であっても異なっていてもよい。)
第5観点として、前記重合開始剤Cがアゾ系重合開始剤である、第1観点又は第2観点に記載のイオン性高分岐ポリマーに関する。
第6観点として、前記モノマーAがジビニルベンゼンである、第1観点又は第2観点に記載のイオン性高分岐ポリマーに関する。
第7観点として、窒素原子含有塩基性化合物を反応させる前の高分岐ポリマーがゲル浸透クロマトグラフィーによるポリスチレン換算での測定において1,000乃至200,000の重量平均分子量を有する、第1観点又は第2観点に記載のイオン性高分岐ポリマーに関する。
第8観点として、第1観点乃至第7観点のうち何れか一項に記載のイオン性高分岐ポリマーからなる、炭素ナノ材料分散剤に関する。
第9観点として、第8観点に記載の炭素ナノ材料分散剤と、炭素ナノ材料とを含む炭素ナノ材料組成物に関する。
第10観点として、さらに有機溶媒を含む、第9観点に記載の炭素ナノ材料組成物に関
する。
第11観点として、前記炭素ナノ材料分散剤が、前記炭素ナノ材料の表面に付着又は配位して複合体を形成している、第9観点又は第10観点に記載の炭素ナノ材料組成物に関する。
第12観点として、前記炭素ナノ材料が、フラーレン及び単層カーボンナノチューブからなる群から選ばれる少なくとも一種である、第9観点乃至第11観点のうち何れか一項に記載の炭素ナノ材料組成物に関する。
第13観点として、前記炭素ナノ材料が前記有機溶媒に分散されてなる、第10観点に記載の炭素ナノ材料組成物に関する。
第14観点として、前記複合体が前記有機溶媒に分散されてなる、第11観点に記載の炭素ナノ材料組成物に関する。
第15観点として、第9観点乃至第14観点のうち何れか一項に記載の炭素ナノ材料組成物から得られる薄膜に関する。
第16観点として、第8観点に記載の炭素ナノ材料分散剤、炭素ナノ材料及び有機溶媒を混合して混合物を調製する工程と、この混合物を機械的処理する工程とを含むことを特徴とする、炭素ナノ材料組成物の製造方法に関する。
第17観点として、前記機械的処理が超音波処理である、第16観点に記載の製造方法に関する。
第18観点として、前記炭素ナノ材料分散剤を前記有機溶媒に溶解させてなる溶液中に、前記炭素ナノ材料を添加して混合物を調製する工程と、この混合物を超音波処理する工程とを含むことを特徴とする、第17観点に記載の製造方法に関する。
【発明の効果】
【0009】
本発明によれば、炭素ナノ材料の分散剤としての応用が期待できる新規なイオン性高分岐ポリマーを提供することができる。
また本発明によれば、前記イオン性高分岐ポリマーを炭素ナノ材料の分散剤として好適に用いることができる。特に炭素ナノ材料としてカーボンナノチューブを用いた場合には、その少なくとも一部をその単独サイズ(直径0.8乃至100nm)までに分離して、所謂「孤立溶解」の状態で安定に(凝集することなく)有機溶媒に分散させることができる。なお本発明において「孤立溶解」とは、カーボンナノチューブが相互の凝集力によって塊状や束状、縄状となることなく、カーボンナノチューブの1本1本がバラバラになって媒体に分散して存在している状態を指す。
しかも分散剤、炭素ナノ材料及び有機溶媒を含有する溶液を超音波処理などの機械的処理をするだけで、炭素ナノ材料を分散させることができ、分散にあたり更なる加熱などの工程を省略し且つ処理時間を短縮することができ、炭素ナノ材料組成物を容易に得ることができる。
従って、本発明の炭素ナノ分散剤を用いることで炭素ナノ材料を分散させた、また炭素ナノ材料がカーボンナノチューブの場合にはその少なくとも一部を孤立溶解の状態で分散させた、炭素ナノ材料組成物を容易に得ることができる。
【0010】
そして本発明により得られる炭素ナノ材料組成物は、基板に塗布するだけで容易に薄膜形成が可能であり、しかも高導電性薄膜を得ることができる。
そして上記組成物において、炭素ナノ材料の量をその用途に応じて調整することが容易であるため、各種半導体素材、電導体素材等として幅広い用途に好適に用いることができる。
【図面の簡単な説明】
【0011】
【図1】図1は、合成例1で調製したtert−ブトキシカルボニル基含有高分岐ポリマー1Aの1H NMRスペクトルを示す図である。
【図2】図2は、合成例1で調製したカルボキシル基含有高分岐ポリマー2Aの1H NMRスペクトルを示す図である。
【図3】図3は、実施例1で調製した高分岐ポリマーイミダゾリウム塩3Aの1H NMRスペクトルを示す図である。
【図4】図4は、合成例2で調製したtert−ブトキシカルボニル基含有高分岐ポリマー1Bの1H NMRスペクトルを示す図である。
【図5】図5は、合成例2で調製したカルボキシル基含有高分岐ポリマー2Bの1H NMRスペクトルを示す図である。
【図6】図6は、実施例2で調製した高分岐ポリマーイミダゾリウム塩3Bの1H NMRスペクトルを示す図である。
【図7】図7は、高分岐ポリマーイミダゾリウム塩3Bを分散剤として用いたSWCNT含有分散液(実施例3)の紫外可視近赤外吸収スペクトルを示す図である。
【図8】図8は、高分岐ポリマーイミダゾリウム塩3Bを分散剤として用いたC60分散液(実施例4)及びC60単独分散液(比較例2)の紫外可視近赤外吸収スペクトルを示す図である。
【図9】図9は、カーボンナノチューブのカイラルベクトルを示す図である。
【発明を実施するための形態】
【0012】
[イオン性高分岐ポリマー]
本発明において、イオン性高分岐ポリマーは、分子内に2個以上のラジカル重合性二重結合を有するモノマーAと、分子内にカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーBとを、該モノマーA及び該モノマーBの合計モル数に対して、5モル%以上200モル%以下の重合開始剤Cの存在下で重合させる段階と、前記重合段階の前、前記重合段階の間、又は前記重合段階に続いて、前記カルボキシル基に窒素原子含有塩基性化合物を反応させる段階とにより得られるものである。
あるいは、本発明のイオン性高分岐ポリマーは、分子内に2個以上のラジカル重合性二重結合を有するモノマーAと、分子内に保護基で保護されたカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーDとを、該モノマーA及び該モノマーDの合計モル数に対して、5モル%以上200モル%以下の重合開始剤Cの存在下で重合させる段階と、前記重合段階に続いて、前記保護基を除去してカルボキシル基とする段階と、更に該カルボキシル基に窒素原子含有塩基性化合物を反応させる段階により得られるものである。
すなわち、本発明のイオン性高分岐ポリマーは、分子内にカルボキシル基を有する高分岐ポリマーのカルボン酸アニオンに、窒素原子含有塩基性化合物が持つ窒素原子含有カチオンが結合してなるものである。
以下、まずイオン性高分岐ポリマーを構成する、高分岐ポリマー及び窒素原子含有塩基性化合物について夫々説明する。
【0013】
<高分岐ポリマー>
本発明において、分子内に2個以上のラジカル重合性二重結合を有するモノマーAは、ビニル基又は(メタ)アクリル基の何れか一方又は双方を有することが好ましく、特にジビニル化合物又はジ(メタ)アクリレート化合物であることが好ましい。なお、本発明では(メタ)アクリレート化合物とは、アクリレート化合物とメタクリレート化合物の両方をいう。例えば(メタ)アクリル酸は、アクリル酸とメタクリル酸をいう。
【0014】
このようなモノマーAとしては、例えば、以下の(A1)乃至(A7)に示した有機化合物が例示される。
(A1)ビニル系炭化水素:
(A1−1)脂肪族ビニル系炭化水素類;イソプレン、ブタジエン、3−メチル−1,2−ブタジエン、2,3−ジメチル−1,3−ブタジエン、1,2−ポリブタジエン、ペンタジエン、ヘキサジエン、オクタジエン等
(A1−2)脂環式ビニル系炭化水素;シクロペンタジエン、シクロヘキサジエン、シクロオクタジエン、ノルボルナジエン等
(A1−3)芳香族ビニル系炭化水素;ジビニルベンゼン、ジビニルトルエン、ジビニルキシレン、トリビニルベンゼン、ジビニルビフェニル、ジビニルナフタレン、ジビニルフルオレン、ジビニルカルバゾール、ジビニルピリジン等
(A2)ビニルエステル、アリルエステル、ビニルエーテル、アリルエーテル、ビニルケトン:
(A2−1)ビニルエステル;アジピン酸ジビニル、マレイン酸ジビニル、フタル酸ジビニル、イソフタル酸ジビニル、イタコン酸ジビニル、ビニル(メタ)アクリレート等
(A2−2)アリルエステル;マレイン酸ジアリル、フタル酸ジアリル、イソフタル酸ジアリル、アジピン酸ジアリル、アリル(メタ)アクリレート等
(A2−3)ビニルエーテル;ジビニルエーテル、ジエチレングリコールジビニルエーテル、トリエチレングリコールジビニルエーテル等
(A2−4)アリルエーテル;ジアリルエーテル、ジアリルオキシエタン、トリアリルオキシエタン、テトラアリルオキシエタン、テトラアリルオキシプロパン、テトラアリルオキシブタン、テトラメタリルオキシエタン等
(A2−5)ビニルケトン;ジビニルケトン、ジアリルケトン等
(A3)(メタ)アクリル酸エステル:
エチレングリコールジ(メタ)アクリレート、トリエチレングリコールジ(メタ)アクリレート、プロピレングリコールジ(メタ)アクリレート、ネオペンチルグリコールジ(メタ)アクリレート、トリメチロールプロパントリ(メタ)アクリレート、ジトリメチロールプロパンテトラ(メタ)アクリレート、グリセロールトリ(メタ)アクリレート、ペンタエリスリトールテトラ(メタ)アクリレート、アルコキシチタントリ(メタ)アクリレート、1,6−ヘキサンジオールジ(メタ)アクリレート、2−メチル−1,8−オクタンジオールジ(メタ)アクリレート、1,9−ノナンジオールジ(メタ)アクリレート、1,10−デカンジオールジ(メタ)アクリレート、トリシクロデカンジメタノールジ(メタ)アクリレート、ジオキサングリコールジ(メタ)アクリレート、2−ヒドロキシ−1−アクリロイルオキシ−3−メタクリロイルオキシプロパン、2−ヒドロキシ−1,3−ジ(メタ)アクリロイルオキシプロパン、9,9−ビス[4−(2−(メタ)アクリロイルオキシエトキシ)フェニル]フルオレン、ウンデシレノキシエチレングリコールジ(メタ)アクリレート、ビス[4−(メタ)アクリロイルチオフェニル]スルフィド、ビス[2−(メタ)アクリロイルチオエチル]スルフィド、1,3−アダマンタンジオールジ(メタ)アクリレート、1,3−アダマンタンジメタノールジ(メタ)アクリレート、ビスフェノールAジエトキシジ(メタ)アクリレート等
(A4)ポリアルキレングリコール鎖を有するビニル系化合物:
ポリエチレングリコール(分子量300)ジ(メタ)アクリレート、ポリプロピレングリコール(分子量500)ジ(メタ)アクリレート等
(A5)含窒素ビニル系化合物:
ジアリルアミン、ジアリルイソシアヌレート、ジアリルシアヌレート、メチレンビス(メタ)アクリルアミド、ビスマレイミド等
(A6)含ケイ素ビニル系化合物:
ジメチルジビニルシラン、ジビニルメチルフェニルシラン、ジフェニルジビニルシラン、1,3−ジビニル−1,1,3,3−テトラメチルジシラザン、1,3−ジビニル−1,1,3,3−テトラフェニルジシラザン、ジエトキジビニルシラン等
(A7)含フッ素ビニル系化合物:
1,4−ジビニルパーフルオロブタン、1,4−ジビニルオクタフルオロブタン、1,6−ジビニルパーフルオロヘキサン、1,6−ジビニルドデカフルオロヘキサン、1,8−ジビニルパーフルオロオクタン、1,8−ジビニルヘキサデカフルオロオクタン等
【0015】
これらのうち好ましいものは、上記(A1−3)群の芳香族ビニル系炭化水素化合物、
(A2)群のビニルエステル、アリルエステル、ビニルエーテル、アリルエーテル及びビニルケトン、(A3)群の(メタ)アクリル酸エステル、(A4)群のポリアルキレングリコール鎖を有するビニル系化合物、並びに(A5)群の含窒素ビニル系化合物である。特に好ましいのは、(A1−3)群に属するジビニルベンゼン、(A2)群に属するフタル酸ジアリル、(A3)群に属するエチレングリコールジ(メタ)アクリレート、1,3−アダマンタンジメタノールジ(メタ)アクリレート、トリシクロデカンジメタノールジ(メタ)アクリレート、ビスフェノールAジエトキシジ(メタ)アクリレート、9,9−ビス[4−(2−(メタ)アクリロイルオキシエトキシ)フェニル]フルオレン並びに(A5)群に属するメチレンビス(メタ)アクリルアミドである。これらの中でもジビニルベンゼン、エチレングリコールジ(メタ)アクリレート及びビスフェノールAジエトキシジ(メタ)アクリレートが好ましく、より好ましくはジビニルベンゼンである。
【0016】
本発明において、分子内にカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーBは、好ましくはカルボキシル基に加えてビニル基又は(メタ)アクリル基の何れか一方を少なくとも1つ有することが好ましい。
このようなモノマーとしては、(メタ)アクリル酸、イタコン酸、2−トリフルオロメチルアクリル酸、2−エチルアクリル酸、2−プロピルアクリル酸、2−ブロモメチルアクリル酸、2−アセトアミドアクリル酸などの(メタ)アクリル酸類;3−ビニル安息香酸、4−ビニル安息香酸などのビニル安息香酸類等が挙げられる。
【0017】
なお、本発明において、分子内にカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーBに替えて、該カルボキシル基を保護基にて保護した基、すなわち、分子内に保護基で保護されたカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーDを用いることができる。
その場合、モノマーAと重合させた後に、保護基にて保護したカルボキシル基における保護基を除去してカルボキシル基とする。
なお、上記カルボキシル基の保護基としては特に限定されないが、例えばクミルエステル基、エノールエステル基、アセタールエステル基、第3級のアルキルエステル基等のエステル基であり、好ましくは、第3級アルキルエステル基である。
例えば、前記モノマーDとしては前述のモノマーBのカルボキシル基をこれら保護基で保護したモノマーであり、具体的には、メチル(メタ)アクリレート、エチル(メタ)アクリレート、ブチル(メタ)アクリレート、イソブチル(メタ)アクリレート、tert−ブチル(メタ)アクリレート、ヘキシル(メタ)アクリレート、2−エチルヘキシル(メタ)アクリレート、4−tert−ブチルシクロヘキシル(メタ)アクリレート、イソオクチル(メタ)アクリレート、イソデシル(メタ)アクリレート、ラウリル(メタ)アクリレート、オクタデシル(メタ)アクリレート、イソボルニル(メタ)アクリレート、アダマンチル(メタ)アクリレート、2−(2−メチル)アダマンチル(メタ)アクリレート等が挙げられる。このうち、tert−ブチル(メタ)アクリレート、アダマンチル(メタ)アクリレート、2−(2−メチル)アダマンチル(メタ)アクリレートが好ましい。
【0018】
本発明における重合開始剤Cとしては、好ましくはアゾ系重合開始剤が用いられる。アゾ系重合開始剤としては、例えば以下の(1)〜(5)に示す化合物を挙げることができる。
(1)アゾニトリル化合物:
2,2’−アゾビスイソブチロニトリル、2,2’−アゾビス(2−メチルブチロニトリル)、2,2’−アゾビス(2,4−ジメチルバレロニトリル)、1,1’−アゾビス(1−シクロヘキサンカルボニトリル)、2,2’−アゾビス(4−メトキシ−2,4−ジメチルバレロニトリル)、2−(カルバモイルアゾ)イソブチロニトリル等;
(2)アゾアミド化合物:
2,2’−アゾビス{2−メチル−N−[1,1−ビス(ヒドロキシメチル)−2−ヒドロキシエチル]プロピオンアミド}、2,2’−アゾビス{2−メチル−N−[2−(1−ヒドロキシブチル)]プロピオンアミド}、2,2’−アゾビス[2−メチル−N−(2−ヒドロキシエチル)プロピオンアミド]、2,2’−アゾビス[N−(2−プロペニル)−2−メチルプロピオンアミド]、2,2’−アゾビス(N−ブチル−2−メチルプロピオンアミド)、2,2’−アゾビス(N−シクロヘキシル−2−メチルプロピオンアミド)等;
(3)環状アゾアミジン化合物:
2,2’−アゾビス[2−(2−イミダゾリン−2−イル)プロパン]ジヒドロクロリド、2,2’−アゾビス[2−(2−イミダゾリン−2−イル)プロパン]ジスルフェートジヒドレート、2,2’−アゾビス[2−[1−(2−ヒドロキシエチル)−2−イミダ
ゾリン−2−イル]プロパン]ジヒドロクロリド、2,2'−アゾビス[2−(2−イミダゾリン−2−イル)プロパン]、2,2'−アゾビス(1−イミノ−1−ピロリジノ−2
−メチルプロパン)ジヒドロクロリド等;
(4)アゾアミジン化合物:
2,2’−アゾビス(2−メチルプロピオンアミジン)ジヒドロクロリド、2,2’−アゾビス[N−(2−カルボキシエチル)−2−メチルプロピオンアミジン]テトラヒドレート等;
(5)その他:
2,2’−アゾビスイソ酪酸ジメチル、4,4’−アゾビス(4−シアノバレリン酸)、2,2’−アゾビス(2,4,4−トリメチルペンタン)、1,1’−アゾビス(1−アセトキシ−1−フェニルエタン)、ジメチル1,1’−アゾビス(1−シクロヘキサンカルボキシレート)、4,4’−アゾビス(4−シアノペンタン酸)等。
【0019】
上記アゾ系重合開始剤の中でも好ましいものは、(1)アゾニトリル系、(5)その他であり、特に2,2’−アゾビスイソブチロニトリル、2,2’−アゾビスイソ酪酸ジメチルが好ましく、最も好ましいものは2,2’−アゾビスイソ酪酸ジメチルである。
【0020】
前記重合開始剤Cは、前記ラジカル重合性二重結合を有するモノマーA及び前記分子内にカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーB(又は分子内に保護されたカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーD)の合計モル数に対して、5モル%乃至200モル%の量で使用され、好ましくは15モル%乃至200モル%、より好ましくは15モル%乃至170モル%、より好ましくは50モル%乃至100モル%の量で使用される。
【0021】
本発明において、前記重合段階とは、重合開始剤Cの存在下で、前記ラジカル重合性二重結合を有するモノマーA(以降、単にラジカル重合性モノマーAとも称する)と、前記分子内にカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーB(以降、単にラジカル重合性モノマーBとも称する)又は前記分子内に保護されたカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーD(以降、単にラジカル重合性モノマーDとも称する)を重合する段階である。前記Cを前記A及び前記B(又はD)に添加する方法は、以下の方法が好ましく例示される。
(1)ラジカル重合性モノマーA及びB(又はD)に予め重合開始剤Cを混合した後重合する方法
(2)ラジカル重合性モノマーA及びB(又はD)に予め重合開始剤Cの一部を混合し重合を開始した後、さらに残りの重合開始剤Cを重合中に添加する方法
(3)ラジカル重合性モノマーA及びB(又はD)を重合条件にした後、重合開始剤Cを重合反応物中に添加して重合を行う方法
【0022】
ラジカル重合性モノマーA及びB(又はD)の重合方法としては、公知の方法、例えば
溶液重合、分散重合、沈殿重合及び塊状重合等が挙げられる。これらのうち好ましいものは溶液重合及び塊状重合である。分子量調節の点から有機溶媒中で重合を行うのが好ましい。
【0023】
このとき用いられる有機溶媒としては、ベンゼン、トルエン、キシレン、エチルベンゼン、テトラリン等の芳香族炭化水素系溶媒;n−ヘキサン、n−ヘプタン、ミネラルスピリット、シクロヘキサン等の脂肪族又は脂環式炭化水素系溶媒;塩化メチル、臭化メチル、ヨウ化メチル、メチレンジクロライド、クロロホルム、四塩化炭素、トリクロロエチレン、パークロロエチレン、オルトジクロロベンゼン等のハロゲン系溶媒;酢酸エチル、酢酸ブチル、メトキシブチルアセテート、メチルセロソルブアセテート、エチルセロソルブアセテート、プロピレングリコールモノメチルエーテルアセテート等のエステル系又はエステルエーテル系溶媒;ジエチルエーテル、テトラヒドロフラン、1,4−ジオキサン等のエーテル系溶媒;アセトン、メチルエチルケトン、メチルイソブチルケトン、ジn−ブチルケトン、シクロヘキサノン等のケトン系溶媒;メタノール、エタノール、n−プロパノール、イソプロパノール、n−ブタノール、イソブタノール、tert−ブタノール、2−エチルヘキシルアルコール、ベンジルアルコール、エチレングリコール、プロピレングリコール、メチルセロソルブ、エチルセロソルブ、ブチルセロソルブ、プロピレングリコールモノメチルエーテル、乳酸エチル等のアルコール系溶媒;N,N’−ジメチルホルムアミド、N,N’−ジメチルアセトアミド等のアミド系溶媒;ジメチルスルホキシド等のスルホキシド系溶媒;N−メチル−2−ピロリドン等の複素環式化合物系溶媒、並びにこれらの2種以上の混合溶媒が挙げられる。
【0024】
これらのうち好ましいものは、芳香族炭化水素系溶媒、ハロゲン系溶媒、エステル系溶媒、エーテル系溶媒、ケトン系溶媒、アルコール系溶媒、アミド系溶媒、スルホキシド系溶媒等であり、特に好ましいものはベンゼン、トルエン、キシレン、オルトジクロロベンゼン、クロロホルム、酢酸エチル、酢酸ブチル、プロピレングリコールモノメチルエーテルアセテート、テトラヒドロフラン、ジオキサン、アセトン、メチルエチルケトン、メチルイソブチルケトン、メタノール、エタノール、n−プロパノール、イソプロパノール、n−ブタノール、イソブタノール、tert−ブタノール、エチレングリコール、プロピレングリコールモノメチルエーテル、N,N’−ジメチルホルムアミド、N,N’−ジメチルアセトアミド、N−メチル−2−ピロリドン、ジメチルスルホキシド等である。
なお、本重合反応において、前記有機溶媒として非極性有機溶媒を使用する場合、得られる重合体の重量平均分子量(Mw)は低下する。
本発明の重合反応を有機溶媒の存在下で行う場合、前記ラジカル重合性モノマーAに対する前記有機溶媒の質量は、好ましくは5乃至50質量部、さらに好ましくは10乃至30質量部である。また本重合反応は、前記ラジカル重合性モノマーAに対する前記有機溶媒の質量が高いほど、得られる重合体の重量平均分子量(Mw)は低下する。
また、有機溶媒の存在下で重合を行う場合、以下の方法が好ましく例示される。
(1)ラジカル重合性モノマーA、B(又はD)及び重合開始剤Cを有機溶媒に溶解させた後、加熱して重合する方法
(2)ラジカル重合性モノマーA、B(又はD)及び重合開始剤Cを有機溶媒に溶解させた溶液を、加熱中の有機溶媒へ滴下して重合する方法
【0025】
重合反応は常圧、加圧密閉下、又は減圧下で行われ、装置及び操作の簡便さから常圧下で行うのが好ましい。また、N2等の不活性ガス雰囲気下で行うのが好ましい。
重合温度は、反応混合物の沸点以下であれば任意であるが、重合効率と分子量調節の点から、好ましくは50℃以上200℃以下、さらに好ましくは80℃以上150℃以下である。また、前記ラジカル重合性モノマーA、B(又はD)及び重合開始剤Cを有機溶媒に溶解させた溶液の重合温度が高いほど、重合反応によって得られる重合体の重量平均分子量(Mw)は低下する。
反応時間は、反応温度や、ラジカル重合性モノマーA、B(又はD)及び重合開始剤Cの種類及び割合、有機溶媒種等によって変動するものであるため一概には規定できないが、好ましくは20分以上480分以下、さらに好ましくは40分以上360分以下である。
【0026】
前記重合段階において、前記ラジカル重合性モノマーBに替えて、前記ラジカル重合性モノマーDを使用した場合、ラジカル重合性モノマーBを使用した場合と同じ手法や条件にて、重合反応を実施できる。
その場合、ラジカル重合性モノマーAと重合させた後、酸による分解反応、例えば脱エステル化反応により、ラジカル重合性モノマーDが持つ保護基で保護されたカルボキシル基の保護基を除去してカルボキシル基とする。
上記酸の具体例としては、塩酸、硫酸、リン酸、臭化水素酸等の無機酸の他、p−トルエンスルホン酸、酢酸、トリフルオロ酢酸、トリフルオロメタンスルホン酸、ギ酸等の有機酸が挙げられる。好ましくは塩酸、硫酸、p−トルエンスルホン酸、トリフルオロ酢酸、さらに好ましくはトリフルオロ酢酸が好適である。
【0027】
上記酸分解反応における上記酸の使用量は、保護基で保護されたカルボキシル基1モルに対して好ましくは1乃至10モル当量、さらに好ましくは1乃至5モル当量である。
【0028】
上記酸分解反応は、有機溶媒の存在下で行うことが好ましい。
有機溶媒としては、ベンゼン、トルエン、キシレン、エチルベンゼン、テトラリン等の芳香族炭化水素系溶媒;n−ヘキサン、n−ヘプタン、ミネラルスピリット、シクロヘキサン等の脂肪族又は脂環式炭化水素系溶媒;塩化メチル、臭化メチル、ヨウ化メチル、ジクロロメタン、1,2−ジクロロエタン、クロロホルム、四塩化炭素、トリクロロエチレン、パークロロエチレン、オルトジクロロベンゼン等のハロゲン系溶媒;酢酸エチル、酢酸ブチル、メトキシブチルアセテート、メチルセロソルブアセテート、エチルセロソルブアセテート、プロピレングリコールモノメチルエーテルアセテート等のエステル系又はエステルエーテル系溶媒;ジエチルエーテル、テトラヒドロフラン、1,4−ジオキサン等のエーテル系溶媒;アセトン、メチルエチルケトン、メチルイソブチルケトン、ジn−ブチルケトン、シクロヘキサノン等のケトン系溶媒;メタノール、エタノール、n−プロパノール、イソプロパノール、n−ブタノール、イソブタノール、tert−ブタノール、2−エチルヘキシルアルコール、ベンジルアルコール、エチルセロソルブ、ブチルセロソルブ、プロピレングリコールモノメチルエーテル、乳酸エチル等のアルコール系溶媒;N,N’−ジメチルホルムアミド、N,N’−ジメチルアセトアミド等のアミド系溶媒;ジメチルスルホキシド等のスルホキシド系溶媒;N−メチル−2−ピロリドンなどの複素環式化合物系溶媒、並びにこれらの2種以上の混合溶媒が挙げられる。
これらのうち好ましいものは、芳香族炭化水素系溶媒、ハロゲン系溶媒、エーテル系溶媒、アルコール系溶媒、アミド系溶媒等であり、特に好ましいものはベンゼン、トルエン、キシレン、オルトジクロロベンゼン、ジクロロメタン、1,2−ジクロロエタン、クロロホルム、テトラヒドロフラン、1,4−ジオキサン、メタノール、エタノール、イソプロパノール、プロピレングリコールモノメチルエーテル、ジメチルホルムアミド、ジメチルアセトアミド等である。さらに最も好ましいものはジクロロメタンである。
前記ラジカル重合性モノマーAに対する前記有機溶媒の質量は、好ましくは3乃至20質量部、さらに好ましくは5乃至10質量部である。
【0029】
反応温度は、0℃以上80℃以下で行うことが好ましい。さらに好ましくは10℃以上60℃以下である。
反応時間は、0.5時間以上24時間以下で行うことが好ましい。さらに好ましくは1時間以上12時間以下である。
【0030】
<窒素原子含有塩基性化合物>
本発明において、前記ラジカル重合性モノマーBのカルボキシル基に対して、又は前記ラジカル重合性モノマーDが持つ保護基で保護されたカルボキシル基の保護基を除去したカルボキシル基に対して反応させる窒素原子含有塩基性化合物は、下記式[1]乃至式[4]で表されるカチオンのうち何れか一種を有する化合物であって、これらカチオンは所謂イオン液体におけるカチオン種となるものである。
【0031】
【化2】

式中、R1、R2、R3、R4、R5、R6、R7及びR8はそれぞれ独立して、水素原子、炭素原子数1乃至6のアルキル基、炭素原子数1乃至6のヒドロキシアルキル基又はビニル基を表し、Xは単結合、メチレン基又は酸素原子を表し、nは0乃至4の整数を表し、nが2以上の場合、R8は同一であっても異なっていてもよい。
【0032】
上記式[1]で表されるカチオンとしては例えば1,3−ジアルキルイミダゾリウムカチオン、1,2,3−トリアルキルイミダゾリウムカチオン等が挙げられ、その一例として、1−メチルイミダゾリウムカチオン、1,3−ジメチルイミダゾリウムカチオン、1−メチル−3−エチルイミダゾリウムカチオン、1−メチル−3−n−プロピルイミダゾリウムカチオン、1−メチル−3−n−ブチルイミダゾリウムカチオン、1−メチル−3−n−ペンチルイミダゾリウムカチオン、1−メチル−3−n−ヘキシルイミダゾリウムカチオン、1−エチル−3−n−プロピルイミダゾリウムカチオン、1−エチル−3−n−ブチルイミダゾリウムカチオン、1,2−ジメチル−3−n−プロピルイミダゾリウムカチオン、1−エチル−2,3−ジメチルイミダゾリウムカチオン、1−n−ブチル−2,3−ジメチルイミダゾリウムカチオン、1,2,3−トリメチルイミダゾリウムカチオン、1−メチル−3−ビニルイミダゾリウムカチオン、1,3−ジビニルイミダゾリウムカチオン等を挙げることができる。
【0033】
上記式[2]で表されるカチオンとしては例えばN−アルキルピリジニウムカチオンが挙げられ、その一例として、1−エチルピリジニウムカチオン、1−エチル−3−メチルピリジニウムカチオン、1−エチル−3−ヒドロキシメチルピリジニウムカチオン、1−n−ブチルピリジニウムカチオン、1−n−ブチル−3−メチルピリジニウムカチオン、1−n−ブチル−4−メチルピリジニウムカチオン、1−n−ヘキシルピリジニウムカチオン等を挙げることができる。
【0034】
上記式[3]で表されるカチオンとしては、Xが単結合の場合には例えばN,N−ジアルキルピロリジニウムカチオン、Xがメチレン基の場合には例えばN,N−ジアルキルピペリジニウムカチオン、Xが酸素原子の場合には例えばN,N−ジアルキルモルホリニウムカチオンが挙げられる。
その各々の具体例は以下の通りである:
・Xが単結合の場合:N,N−ジメチルピロリジニウムカチオン、N−n−ブチル−N−メチルピロリジニウムカチオン、N−n−ブチル−N−エチルピロリジニウムカチオン、N−n−ブチル−N−プロピルピロリジニウムカチオン、N−メチル−N−プロピルピロリジニウムカチオン等
・Xがメチレン基の場合:N,N−ジメチルピペリジニウムカチオン、N,N−ジエチル
ピペリジニウムカチオン、N−エチル−N−メチルピペリジニウムカチオン、N−メチル−N−プロピルピペリジニウムカチオン、N−n−ブチル−N−メチルピペリジニウムカチオン、N−ヘキシル−N−メチル−ピペリジニウムカチオン等
・Xが酸素原子の場合:N,N−ジメチルモルホリニウムカチオン、N,N−ジn−ブチルモルホリニウムカチオン等
【0035】
上記式[4]で表されるカチオンとしては、例えばテトラアルキルアンモニウムカチオンが挙げられ、その一例として、トリメチルn−ペンチルアンモニウムカチオン、シクロヘキシルトリメチルアンモニウムカチオン、テトラエチルアンモニウムカチオン、テトラn−ブチルアンモニウムカチオン、テトラn−ペンチルアンモニウムカチオン、テトラn−ヘキシルアンモニウムカチオン、トリn−ブチルメチルアンモニウムカチオン等が挙げられる。
【0036】
また、上記式[1]乃至式[4]で表されるカチオンと対をなすアニオン種としては、テトラフルオロボレート(BF4-)アニオン、ヘキサフルオロホスフェート(PF6-)アニオン、トリフルオロメタンスルホネート(CF3SO3-)アニオン、ヘキサフルオロア
ンチモネート(SbF6-)アニオン、ビス(トリフルオロメチルスルホニル)イミド((CF3SO2)2N-)アニオン、ビス(フルオロスルホニル)イミド((FSO2)2N-)
アニオン、トリス(トリフルオロメチルスルホニル)メチド((CF3SO2)3C-)アニオン、ニトレート(NO3-)アニオン、トリフルオロメチルカルボキシレート(CF3C
O2-)アニオン、カルボキシレート(CH3CO2-)アニオン、クロロアルミネート(A
l2Cl7-)アニオン、ハイドロゲンカーボネート(HCO3-)、メチルカーボネート(
CH3OCO2-)などが挙げられる。
これらのうち好ましいものは、ハイドロゲンカーボネート(HCO3-)、メチルカーボネート(CH3OCO2-)等である。
【0037】
このような窒素原子含有塩基性化合物の具体例としては、1,3−ジメチルイミダゾリウム=ハイドロゲンカーボネート、1−エチル−3−メチルイミダゾリウム=ハイドロゲンカーボネート、1−ブチル−3−メチルイミダゾリウム=ハイドロゲンカーボネート、1−ビニル−3−メチルイミダゾリウム=ハイドロゲンカーボネート、1−エチル−2,3−ジメチルイミダゾリウム=メチルカーボネート、1−ブチル−1−メチルピロリジニウム=メチルカーボネート、1−エチル−1−メチルピペリジニウム=メチルカーボネート、4−エチル−4−メチルモルホリニウム=メチルカーボネート、トリエチルメチルアンモニウム=メチルカーボネート、トリブチルメチルアンモニウム=メチルカーボネート等が挙げられる。これらの化合物は、アルドリッチ社よりCBILS(商標)シリーズとして販売されているものを使用することもできる。
【0038】
本発明のイオン性高分岐ポリマーは、前記ラジカル重合性モノマーBのカルボキシル基に対して、又は前記ラジカル重合性モノマーDが持つ保護基で保護されたカルボキシル基の保護基を除去したカルボキシル基に対して、前記窒素原子含有塩基性化合物を有機溶媒中で反応させる(混合する)ことにより得られる。
【0039】
このとき用いられる有機溶媒としては、ベンゼン、トルエン、キシレン、エチルベンゼン、テトラリン等の芳香族炭化水素系溶媒;n−ヘキサン、n−ヘプタン、ミネラルスピリット、シクロヘキサン等の脂肪族又は脂環式炭化水素系溶媒;塩化メチル、臭化メチル、ヨウ化メチル、メチレンジクロライド、クロロホルム、四塩化炭素、トリクロロエチレン、パークロロエチレン、オルトジクロロベンゼン等のハロゲン系溶媒;酢酸エチル、酢酸ブチル、メトキシブチルアセテート、メチルセロソルブアセテート、エチルセロソルブアセテート、プロピレングリコールモノメチルエーテルアセテート等のエステル系又はエステルエーテル系溶媒;ジエチルエーテル、テトラヒドロフラン、1,4−ジオキサン等
のエーテル系溶媒;アセトン、メチルエチルケトン、メチルイソブチルケトン、ジn−ブチルケトン、シクロヘキサノン等のケトン系溶媒;メタノール、エタノール、n−プロパノール、イソプロパノール、n−ブタノール、イソブタノール、tert−ブタノール、2−エチルヘキシルアルコール、ベンジルアルコール、エチレングリコール、プロピレングリコール、メチルセロソルブ、エチルセロソルブ、ブチルセロソルブ、プロピレングリコールモノメチルエーテル、乳酸エチル等のアルコール系溶媒;N,N’−ジメチルホルムアミド、N,N’−ジメチルアセトアミド等のアミド系溶媒;ジメチルスルホキシド等のスルホキシド系溶媒;N−メチル−2−ピロリドン等の複素環式化合物系溶媒、並びにこれらの2種以上の混合溶媒が挙げられる。また窒素原子含有塩基性化合物を溶解させるために、これら有機溶媒に水を添加することが好ましい。
【0040】
これらのうち好ましいものは、エーテル系溶媒、ケトン系溶媒、アルコール系溶媒、アミド系溶媒、スルホキシド系溶媒等であり、特に好ましいものはベンゼン、テトラヒドロフラン、ジオキサン、アセトン、メタノール、エタノール、n−プロパノール、イソプロパノール、n−ブタノール、イソブタノール、tert−ブタノール、エチレングリコール、プロピレングリコールモノメチルエーテル、N,N’−ジメチルホルムアミド、N,N’−ジメチルアセトアミド、N−メチル−2−ピロリドン、ジメチルスルホキシド等である。
【0041】
反応温度は、0℃以上80℃以下で行うことが好ましい。さらに好ましくは10℃以上60℃以下である。
反応時間は、通常0.1時間以上24時間以下で行うことが好ましい。さらに好ましくは0.5時間以上12時間以下である。
【0042】
本発明のイオン性高分岐ポリマーは、前記ラジカル重合性モノマーAとラジカル重合性モノマーBとの重合段階と、その重合段階の前、重合段階の間、又は重合段階に続いて、ラジカル重合性モノマーBのカルボキシル基に、前記窒素原子含有塩基性化合物を反応させる段階とにより、得られるものである。
したがって、例えば、ラジカル重合性モノマーAとラジカル重合性モノマーBとを重合させて高分岐ポリマーを得た後、窒素原子含有塩基性化合物を反応させてもよいし、或いは、ラジカル重合性モノマーBに前記窒素原子含有塩基性化合物を反応させた後、ラジカル重合性モノマーAと重合させてもよい。
なお、ラジカル重合性モノマーBに替えてラジカル重合性モノマーDを用いる場合には、
ラジカル重合性モノマーAとラジカル重合性モノマーDとを重合させて高分岐ポリマーを得た後、ラジカル重合性モノマーDが持つ保護基で保護されたカルボキシル基の保護基を除去し、その後、前記窒素原子含有塩基性化合物を反応させることとなる。
【0043】
なお、本発明において、イオン性高分岐ポリマーの窒素原子含有塩基性化合物部分を除去した、すなわち窒素原子含有塩基性化合物を反応させる前のカルボン酸形態の高分岐ポリマーのゲル浸透クロマトグラフィーによるポリスチレン換算で測定される重量平均分子量(以下Mwと略記)は、好ましくは1,000乃至2,000,000、さらに好ましくは2,000乃至1,000,000である。
また該高分岐ポリマーの1次粒子の平均粒子径は、好ましくは1nm以上100nm以下、さらに好ましくは5nm以上50nm以下である。
【0044】
そして、重合反応終了後、或いは、窒素原子含有塩基性化合物との反応終了後、適宜得られた高分岐ポリマー又はその窒素原子含有塩基性化合物塩(イオン性高分岐ポリマー)を任意の方法で回収し、必要に応じて洗浄等の後処理を行う。反応溶液から高分岐ポリマー又はその窒素原子含有塩基性化合物塩(イオン性高分岐ポリマー)を回収する方法とし
ては、再沈殿、濾過、遠心分離等の方法が挙げられる。
【0045】
[炭素ナノ材料分散剤、炭素ナノ材料組成物]
本発明は、前述のイオン性高分岐ポリマーからなる炭素ナノ材料分散剤にも関する。
そして、本発明は、前記炭素ナノ材料分散剤と、炭素ナノ材料とを含んでなる炭素ナノ材料組成物にも関する。
【0046】
本発明の炭素ナノ材料組成物において、炭素ナノ材料としてはフラーレン、カーボンナノチューブ(CNT)が挙げられる。
CNTは通常、アーク放電法、化学気相成長法(以下、CVD法という。)、レーザー・アブレーション法等によって作製され、このとき、同時にフラーレンやグラファイト、非晶性炭素も生成される。本発明において使用されるCNT及びフラーレンは、何れの方法によって得られたものであってもよい。
なお、CNT及びフラーレンの生成時には、ニッケル、鉄、コバルト、イットリウムなどの触媒金属も残存するので、これらの不純物の除去、精製を必要とする場合がある。不純物の除去には、硝酸、硫酸などによる酸処理とともに、超音波処理が有効である。しかし、硝酸、硫酸などによる酸処理では炭素ナノ材料を構成するπ共役系が破壊され、炭素ナノ材料本来の特性が損なわれてしまう可能性があるため、適切な条件下で精製して使用することが望ましい。
【0047】
なおCNTには1枚の炭素膜(グラフェン・シート)が円筒状に巻かれた単層CNT(以下、SWCNTと記載。)と、2枚のグラフェン・シートが同心円状に巻かれた二層CNT(以下、DWCNTと記載。)と、複数のグラフェン・シートが同心円状に巻かれた多層CNT(以下、MWCNTと記載。)とがあり、本発明の炭素ナノ材料組成物においては、SWCNT、DWCNT、MWCNTをそれぞれ単体で、又は複数を組み合わせて使用できる。特に好ましくは単層カーボンナノチューブ(SWCNT)である。
【0048】
CNTはグラフェン・シートの巻き方(螺旋度、カイラリティー)により電気特性が金属的なものから半導体的なものまで変化する。
CNTのカイラリティーは図9に示されるカイラルベクトル(R=na1+ma2、ただしm、nは整数)により規定され、n=m及びn−m=3p(ただしpは整数)の場合には金属的性質、それ以外の場合(n≠m、n−m≠3p)には半導体性質をそれぞれ示すことが知られている。このため、特にSWCNTを使用する場合は、ある種のカイラリティーを選択的に分散した組成物とすることが重要である。
本発明のイオン性高分岐ポリマーを、CNTの分散剤として使用することで、ある特定のカイラリティーを有するCNTを、選択的に分散させた組成物が得られる可能性がある。
【0049】
またフラーレンには、炭素原子60個からなる切頂二十面体(サッカーボール状)構造のC60フラーレン、炭素原子70個からなるC70フラーレン等があり、本発明の炭素ナノ材料組成物においては、C60フラーレン、C70フラーレンをそれぞれ単体で、又は複数を組み合わせて使用できる。特に好ましくはC60フラーレンである。
また、これらフラーレンの局所的変形構造体、中空部にイオン種を導入したもの、炭素原子の一部を他の原子により置換したもの、官能基を結合させたもの等の誘導体も包含される。
【0050】
本発明の炭素ナノ材料組成物は、さらに上記炭素ナノ材料分散剤(イオン性高分岐ポリマー)の溶解能を有する有機溶媒を含んでいてもよい。
このような有機溶媒としては、例えば、テトラヒドロフラン(THF)、ジエチルエーテル、ジメトキシエタン(DME)などのエーテル系化合物;塩化メチレン、クロロホル
ムなどのハロゲン化炭化水素;N,N’−ジメチルホルムアミド(DMF)、N,N’−ジメチルアセトアミド(DMAc)、N−メチル−2−ピロリドン(NMP)などのアミド系化合物;アセトン、メチルエチルケトン、メチルイソブチルケトン、シクロヘキサノンなどのケトン系化合物;メタノール、エタノール、イソプロパノール、プロパノールなどのアルコール類;n−ヘプタン、n−ヘキサン、シクロヘキサンなどの脂肪族炭化水素類;ベンゼン、トルエン、キシレン、エチルベンゼンなどの芳香族炭化水素類等が挙げられ、これら有機溶媒は、一種単独で又は二種以上混合して用いることができる。
特に、炭素ナノ材料の分散を向上させ得るという点、とりわけ、炭素ナノ材料としてCNTを用いた場合に、CNTの孤立溶解の状態での分散の割合を向上させ得るという点から、NMP、メタノール、イソプロパノールが好ましく、さらに後述する炭素ナノ材料組成物の成膜性をも向上し得るための添加剤として、エチルセロソルブ、ブチルセロソルブなどのセロソルブ類の溶媒を、少量含むことが望ましい。
【0051】
本発明の炭素ナノ材料組成物の調製法は任意であり、炭素ナノ材料分散剤が液状の場合には、当該炭素ナノ材料分散剤と炭素ナノ材料とを適宜混合し、分散剤が固体の場合には、これを溶融させた後、炭素ナノ材料と混合して調製することができる。
また、有機溶媒を用いる場合には、炭素ナノ材料分散剤、炭素ナノ材料、有機溶媒を任意の順序で混合して組成物を調製すればよく、例えばこれらを一緒に混合してもよいし、或いは、炭素ナノ材料分散剤を有機溶媒に溶解した溶液中に、炭素ナノ材料を添加して混合してもよい。
この際、炭素ナノ材料分散剤、炭素ナノ材料及び有機溶媒からなる混合物を分散処理することが好ましく、この処理により、炭素ナノ材料の分散性、とりわけ炭素ナノ材料としてCNTを用いた場合に、CNTの孤立溶解の状態での分散の割合をより向上させることができる。分散処理としては、機械的処理としてのボールミル、ビーズミル、ジェットミルなどを用いた湿式処理や、バス型やプローブ型のソニケータを用いる超音波処理が挙げられるが、処理効率を考慮すると、超音波処理が好適である。
分散処理の時間は任意であるが、5分間から10時間程度が好ましく、10分間から5時間程度がより好ましい。
【0052】
本発明の炭素ナノ材料組成物における、炭素ナノ材料分散剤と炭素ナノ材料との混合比率は、質量比で1,000:1乃至1:100程度とすることができる。
また、有機溶媒を使用した炭素ナノ材料組成物中における炭素ナノ材料分散剤の濃度は、炭素ナノ材料を有機溶媒に分散させ得る濃度であれば特に限定されるものではないが、本発明においては、炭素ナノ材料組成物中に0.001乃至30質量%程度とすることが好ましく、0.005乃至20質量%程度とすることがより好ましい。
また、この炭素ナノ材料組成物中における炭素ナノ材料の濃度は任意であり、とりわけ、炭素ナノ材料としてCNTを用いた場合には少なくともCNTの一部が孤立溶解の状態で分散する限りにおいて任意であるが、本発明においては、炭素ナノ材料組成物中に0.0001乃至20質量%程度とすることが好ましく、0.001乃至10質量%程度とすることがより好ましい。
以上のようにして調製された炭素ナノ材料組成物中では、炭素ナノ材料分散剤が炭素ナノ材料の表面に付着又は配位して複合体を形成しているものと推測される。
【0053】
本発明の炭素ナノ材料組成物(溶液)は、PET、ガラス、ITOなどの適当な基板上にキャスト法、スピンコート法、バーコート法、ロールコート法、ディップコート法などの適宜な方法により、塗布して成膜することが可能である。
得られた薄膜は、炭素ナノ材料の金属的性質を活かした帯電防止膜、透明電極等の導電性材料、あるいは半導体的性質を活かした光電変換素子及び電界発光素子等に好適に用いることができる。
【実施例】
【0054】
以下、実施例を挙げて本発明をより具体的に説明するが、本発明は下記の実施例に限定されるものではない。
なお、実施例において、試料の調製及び物性の分析に用いた装置及び条件は、以下の通りである。
【0055】
(1)ゲル浸透クロマトグラフィー(GPC)
装置:東ソー(株)製 高速GPC装置 HLC−8220GPC
カラム:東ソー(株)製 TSKgel SuperHM−M & TSKgel SuperHM−H
カラム温度:40℃
溶媒:10mmol/L LiBr添加DMF
検出器:RI
(2−1)1H NMRスペクトル(高分岐ポリマー1A,1B)
装置:日本電子(株)製 EX−400(400MHz)
溶媒:CDCl3
基準物質:テトラメチルシラン(0.03体積%)
(2−2)1H NMRスペクトル(高分岐ポリマー2A,2B,3A,3B)
装置:日本電子(株)製 EX−400(400MHz)
溶媒:ジメチルスルホキシド
基準物質:テトラメチルシラン(0.05体積%)
(3)超音波処理
装置:東京硝子器械(株)製 Fine超音波洗浄器 FU−6H
(4)遠心分離
装置:(株)トミー精工製 小型高速冷却遠心機 SRX−201
(5)紫外可視近赤外吸収スペクトル(UV−Vis−NIR)
装置:(株)島津製作所製 紫外可視近赤外分光光度計 UV−3600
測定波長:400〜1,650nm
(6)表面抵抗
装置:(株)三菱化学アナリテック製 高抵抗率計 ハイレスタ−UP
【0056】
また、略記号は以下の意味を表す。
DVB:ジビニルベンゼン[新日鐵化学(株)製、製品名:DVB−960の減圧蒸留品]
tBA:tert−ブチルアクリレート[和光純薬工業(株)製の減圧蒸留品]
MAIB:2,2’−アゾビスイソ酪酸ジメチル[大塚化学(株)製、商品名:MAIBのメタノール再結晶品]
TFA:トリフルオロ酢酸[東京化成工業(株)製]
SWCNT:単層カーボンナノチューブ[Unidym社製、HiPco CNT(精製)]
C60:フラーレンC60[フロンティアカーボン(株)製、nanom purple ST−A]
THF:テトラヒドフラン
NMP:N−メチル−2−ピロリドン
【0057】
[合成例1]
<カルボキシル基含有高分岐ポリマー2Aの合成>
250mLのナスフラスコへ、DVB0.65g(5mmol)、tBA0.64g(5mmol)、及びMAIB4.65g(25mmol)を仕込み、トルエン50mLを加えた。この溶液を−50℃に冷却した後、脱気及び窒素パージを5回繰り返して、反応
容器内及び溶液中の溶存酸素を極力除去した。次に、この反応容器を80℃に保った油浴中に入れ、窒素気流下で2時間重合させた。その後、反応混合物をメタノール−水混合液(体積比4:1)1Lに注ぎ込んだ。生成した白色沈殿物を遠心分離(740G、20分間)で単離し、真空乾燥することで、tert−ブトキシカルボニル基含有高分岐ポリマー1A 1.18g(収率22%)を得た。得られた高分岐ポリマーのGPCによるポリスチレン換算で測定される数平均分子量Mnは12,000、多分散度(重量平均分子量Mw/数平均分子量Mn)は2.4であった。また、得られた高分岐ポリマーの組成を1
H NMRスペクトルにより求めたところ、DVB:tBA:MAIB断片=32:26:42(モル%)であった。得られた高分岐ポリマーの1H NMRスペクトルを図1に
示す。
次いで、50mLナスフラスコへ前記tert−ブトキシカルボニル基含有高分岐ポリマー1A 1.00gを仕込み、ジクロロメタン20mLを加えた。そこにTFA1.36g(tert−ブチル基に対して5mol当量)を加え、室温(およそ25℃)で24時間撹拌した。反応後、エバポレーターを用いてジクロロメタンを留去し、その残渣をn−ヘキサン1Lに注ぎ込んだ。生成した白色沈殿物を遠心分離(740G、20分間)で単離し、真空乾燥することで、カルボキシル基含有高分岐ポリマー2A 0.72g(収率82%)を得た。得られた高分岐ポリマーの1H NMRスペクトルを図2に示す。
【0058】
[実施例1]
<高分岐ポリマーイミダゾリウム塩3Aの合成>
100mLのナスフラスコへ合成例1で得られたカルボキシル基含有高分岐ポリマー2A 0.50gを仕込み、メタノール33mLを加えた。この溶液へ50%炭酸水素1−エチル−3−メチルイミダゾリウム水−メタノール溶液(水:メタノール=3:2)[アルドリッチ社製]0.41gを加え、室温(およそ25℃)で24時間撹拌した。反応後、エバポレーターを用いてメタノールを留去し、その残渣をTHF500mLに注ぎ込んだ。生成した白色沈殿物を遠心分離(740G、20分間)で単離し、真空乾燥することで、目的とする高分岐ポリマーイミダゾリウム塩3A 0.50g(収率80%)を得た。得られた高分岐ポリマーイミダゾリウム塩の1H NMRスペクトルを図3に示す。
【0059】
[合成例2]
<カルボキシル基含有高分岐ポリマー2Bの合成>
tBAの使用量を3.20g(25mmol)に変更した以外は合成例1と同様に操作し、tert−ブトキシカルボニル基含有高分岐ポリマー1B 3.01g(収率38%)を得た。得られた高分岐ポリマーのGPCによるポリスチレン換算で測定される数平均分子量Mnは25,000、多分散度(重量平均分子量Mw/数平均分子量Mn)は2.2であった。また、得られた高分岐ポリマーの組成を1H NMRスペクトルにより求め
たところ、DVB:tBA:MAIB断片=14:66:20(モル%)であった。得られた高分岐ポリマーの1H NMRスペクトルを図4に示す。
次いで、TFAの使用量を3.16g(tert−ブチル基に対して5mol当量)に変更した以外は合成例1と同様に操作し、カルボキシル基含有高分岐ポリマー2B 0.59g(収率85%)を得た。得られた高分岐ポリマーの1H NMRスペクトルを図5
に示す。
【0060】
[実施例2]
<高分岐ポリマーイミダゾリウム塩3Bの合成>
カルボキシル基含有高分岐ポリマー2Aを合成例2で得られたカルボキシル基含有高分岐ポリマー2Bに、50%炭酸水素1−エチル−3−メチルイミダゾリウム水−メタノール溶液の使用量を0.95gに、それぞれ変更した以外は実施例1と同様に操作し、目的とする高分岐ポリマーイミダゾリウム塩3B 0.65g(収率81%)を得た。得られた高分岐ポリマーイミダゾリウム塩の1H NMRスペクトルを図6に示す。
【0061】
[実施例3]
<高分岐ポリマーイミダゾリウム塩3Bを用いたSWCNTの分散>
分散剤として実施例2において合成した高分岐ポリマーイミダゾリウム塩3B 1.0mgをNMP5mLに溶解させ、この溶液へSWCNT2.5mgを添加した。この混合物に、室温(およそ25℃)で超音波処理(出力150W)を1時間行い、その後、室温(およそ25℃)で10,000G、1時間の遠心分離により、上澄み液として黒色透明なSWCNT含有分散液を回収した。
得られた黒色透明なSWCNT含有分散液の紫外可視近赤外吸収スペクトルを測定したところ、半導体性S11バンド(1,400〜1,000nm)、S22バンド(1,000〜600nm)、及び金属性バンド(600〜450nm)の吸収が明確に観察され、SWCNTが分散されていることが確認された。得られた紫外可視近赤外吸収スペクトルを図7に示す。
【0062】
[比較例1]
<SWCNT単独での分散>
分散剤として高分岐ポリマーイミダゾリウム塩3Bを添加しなかった以外は実施例3と同様に操作したが、SWCNTを分散させることはできなかった。
【0063】
[実施例4]
<高分岐ポリマーイミダゾリウム塩3Bを用いたC60の分散>
分散剤として実施例2において合成した高分岐ポリマーイミダゾリウム塩3B 1.0mgをNMP5mLに溶解させ、この溶液へC60 10mgを添加した。この混合物に、室温(およそ25℃)で超音波処理(出力150W)を1時間行い、フィルター[ワットマン社製、孔径0.2μm、メンブレン:PTFE]濾過により、黄褐色透明なC60分散液を回収した。
得られた黄褐色透明なC60分散液の紫外可視近赤外吸収スペクトルを図8に示す。
【0064】
[比較例2]
<C60単独での分散>
分散剤として高分岐ポリマーイミダゾリウム塩3Bを添加しなかった以外は実施例4と同様に操作し、C60分散液を回収した。
得られたC60分散液の紫外可視近赤外吸収スペクトルを図8に合わせて示す。
【0065】
図8に示したように、高分岐ポリマーイミダゾリウム塩を添加したC60分散液(実施例4)は、高分岐ポリマーイミダゾリウム塩を加えていないもの(比較例2)に比べ吸光度が大きく、より多くのC60が分散されていることが確認された。
【0066】
[実施例5]
<高分岐ポリマーイミダゾリウム塩3A薄膜の作製>
実施例1において合成した高分岐ポリマーイミダゾリウム塩3A 20mgを、エタノール20mLに溶解しワニスを調製した。
得られたワニスをガラス基板上にキャストし、高分岐ポリマーイミダゾリウム塩3Aの薄膜を得た。得られた薄膜の表面抵抗を測定したところ、1.22×1013Ω/cm2で
あった。
【0067】
[実施例6]
<高分岐ポリマーイミダゾリウム塩3A−C60分散薄膜の作製>
サンプル瓶へ、フラーレン2mg及びトルエン2mLを仕込み、室温(およそ25℃)で超音波処理(出力150W)を5分間行った。そこへ、実施例1において合成した高分
岐ポリマーイミダゾリウム塩3A 18mg、及びクロロホルム6mLを加え、さらに超音波処理を20分間行った。その後、エバポレーターを用いて溶媒を留去した。その残渣へエタノール20mLを加え、室温(およそ25℃)で超音波処理(出力150W)を20分間行った。フィルター[ワットマン社製、孔径0.2μm、メンブレン:PTFE]濾過により、黄褐色透明なC60分散液を得た。
得られた分散液をガラス基板上にキャストし、高分岐ポリマーイミダゾリウム塩3AにC60が分散した薄膜を得た。得られた薄膜の表面抵抗を測定したところ、3.47×108Ω/cm2であった。
【先行技術文献】
【特許文献】
【0068】
【特許文献1】特開2010−024330号公報
【特許文献2】特開2004−142972号公報
【特許文献3】特開2004−255481号公報
【特許請求の範囲】
【請求項1】
分子内に2個以上のラジカル重合性二重結合を有するモノマーAと、分子内にカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーBとを、該モノマーA及び該モノマーBの合計モル数に対して、5モル%以上200モル%以下の重合開始剤Cの存在下で重合させる段階と、
前記重合段階の前、前記重合段階の間、又は前記重合段階に続いて、
前記カルボキシル基に窒素原子含有塩基性化合物を反応させる段階とにより得られる、
イオン性高分岐ポリマー。
【請求項2】
分子内に2個以上のラジカル重合性二重結合を有するモノマーAと、分子内に保護基で保護されたカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーDとを、該モノマーA及び該モノマーDの合計モル数に対して、5モル%以上200モル%以下の重合開始剤Cの存在下で重合させる段階と、
前記重合段階に続いて、前記保護基を除去してカルボキシル基とする段階と、更に
該カルボキシル基に窒素原子含有塩基性化合物を反応させる段階とにより得られる、
イオン性高分岐ポリマー。
【請求項3】
分子内にカルボキシル基を有する高分岐ポリマーのカルボン酸アニオンに、窒素原子含有塩基性化合物が持つ窒素原子含有カチオンが結合してなる、イオン性高分岐ポリマー。
【請求項4】
前記窒素原子含有塩基性化合物が、式[1]乃至式[4]で表されるカチオンのうち何れか一種を有する化合物である、請求項1乃至請求項3のうち何れか一項に記載のイオン性高分岐ポリマー。
【化1】

(式中、R1、R2、R3、R4、R5、R6、R7及びR8はそれぞれ独立して、水素原子、炭素原子数1乃至6のアルキル基、炭素原子数1乃至6のヒドロキシアルキル基又はビニル基を表し、Xは単結合、メチレン基又は酸素原子を表し、nは0乃至4の整数を表し、nが2以上の場合、R8は同一であっても異なっていてもよい。)
【請求項5】
前記重合開始剤Cがアゾ系重合開始剤である、請求項1又は請求項2に記載のイオン性高分岐ポリマー。
【請求項6】
前記モノマーAがジビニルベンゼンである、請求項1又は請求項2に記載のイオン性高分岐ポリマー。
【請求項7】
窒素原子含有塩基性化合物を反応させる前の高分岐ポリマーがゲル浸透クロマトグラフィーによるポリスチレン換算での測定において1,000乃至200,000の重量平均分子量を有する、請求項1又は請求項2に記載のイオン性高分岐ポリマー。
【請求項8】
請求項1乃至請求項7のうち何れか一項に記載のイオン性高分岐ポリマーからなる、炭素ナノ材料分散剤。
【請求項9】
請求項8に記載の炭素ナノ材料分散剤と、炭素ナノ材料とを含む炭素ナノ材料組成物。
【請求項10】
さらに有機溶媒を含む、請求項9に記載の炭素ナノ材料組成物。
【請求項11】
前記炭素ナノ材料分散剤が、前記炭素ナノ材料の表面に付着又は配位して複合体を形成している、請求項9又は請求項10に記載の炭素ナノ材料組成物。
【請求項12】
前記炭素ナノ材料が、フラーレン及び単層カーボンナノチューブからなる群から選ばれる少なくとも一種である、請求項9乃至請求項11のうち何れか一項に記載の炭素ナノ材料組成物。
【請求項13】
前記炭素ナノ材料が前記有機溶媒に分散されてなる、請求項10に記載の炭素ナノ材料組成物。
【請求項14】
前記複合体が前記有機溶媒に分散されてなる、請求項11に記載の炭素ナノ材料組成物。
【請求項15】
請求項9乃至請求項14のうち何れか一項に記載の炭素ナノ材料組成物から得られる薄膜。
【請求項16】
請求項8に記載の炭素ナノ材料分散剤、炭素ナノ材料及び有機溶媒を混合して混合物を調製する工程と、この混合物を機械的処理する工程とを含むことを特徴とする、炭素ナノ材料組成物の製造方法。
【請求項17】
前記機械的処理が超音波処理である、請求項16に記載の製造方法。
【請求項18】
前記炭素ナノ材料分散剤を前記有機溶媒に溶解させてなる溶液中に、前記炭素ナノ材料を添加して混合物を調製する工程と、この混合物を超音波処理する工程とを含むことを特徴とする、請求項17に記載の製造方法。
【請求項1】
分子内に2個以上のラジカル重合性二重結合を有するモノマーAと、分子内にカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーBとを、該モノマーA及び該モノマーBの合計モル数に対して、5モル%以上200モル%以下の重合開始剤Cの存在下で重合させる段階と、
前記重合段階の前、前記重合段階の間、又は前記重合段階に続いて、
前記カルボキシル基に窒素原子含有塩基性化合物を反応させる段階とにより得られる、
イオン性高分岐ポリマー。
【請求項2】
分子内に2個以上のラジカル重合性二重結合を有するモノマーAと、分子内に保護基で保護されたカルボキシル基及び少なくとも1個のラジカル重合性二重結合を有するモノマーDとを、該モノマーA及び該モノマーDの合計モル数に対して、5モル%以上200モル%以下の重合開始剤Cの存在下で重合させる段階と、
前記重合段階に続いて、前記保護基を除去してカルボキシル基とする段階と、更に
該カルボキシル基に窒素原子含有塩基性化合物を反応させる段階とにより得られる、
イオン性高分岐ポリマー。
【請求項3】
分子内にカルボキシル基を有する高分岐ポリマーのカルボン酸アニオンに、窒素原子含有塩基性化合物が持つ窒素原子含有カチオンが結合してなる、イオン性高分岐ポリマー。
【請求項4】
前記窒素原子含有塩基性化合物が、式[1]乃至式[4]で表されるカチオンのうち何れか一種を有する化合物である、請求項1乃至請求項3のうち何れか一項に記載のイオン性高分岐ポリマー。
【化1】

(式中、R1、R2、R3、R4、R5、R6、R7及びR8はそれぞれ独立して、水素原子、炭素原子数1乃至6のアルキル基、炭素原子数1乃至6のヒドロキシアルキル基又はビニル基を表し、Xは単結合、メチレン基又は酸素原子を表し、nは0乃至4の整数を表し、nが2以上の場合、R8は同一であっても異なっていてもよい。)
【請求項5】
前記重合開始剤Cがアゾ系重合開始剤である、請求項1又は請求項2に記載のイオン性高分岐ポリマー。
【請求項6】
前記モノマーAがジビニルベンゼンである、請求項1又は請求項2に記載のイオン性高分岐ポリマー。
【請求項7】
窒素原子含有塩基性化合物を反応させる前の高分岐ポリマーがゲル浸透クロマトグラフィーによるポリスチレン換算での測定において1,000乃至200,000の重量平均分子量を有する、請求項1又は請求項2に記載のイオン性高分岐ポリマー。
【請求項8】
請求項1乃至請求項7のうち何れか一項に記載のイオン性高分岐ポリマーからなる、炭素ナノ材料分散剤。
【請求項9】
請求項8に記載の炭素ナノ材料分散剤と、炭素ナノ材料とを含む炭素ナノ材料組成物。
【請求項10】
さらに有機溶媒を含む、請求項9に記載の炭素ナノ材料組成物。
【請求項11】
前記炭素ナノ材料分散剤が、前記炭素ナノ材料の表面に付着又は配位して複合体を形成している、請求項9又は請求項10に記載の炭素ナノ材料組成物。
【請求項12】
前記炭素ナノ材料が、フラーレン及び単層カーボンナノチューブからなる群から選ばれる少なくとも一種である、請求項9乃至請求項11のうち何れか一項に記載の炭素ナノ材料組成物。
【請求項13】
前記炭素ナノ材料が前記有機溶媒に分散されてなる、請求項10に記載の炭素ナノ材料組成物。
【請求項14】
前記複合体が前記有機溶媒に分散されてなる、請求項11に記載の炭素ナノ材料組成物。
【請求項15】
請求項9乃至請求項14のうち何れか一項に記載の炭素ナノ材料組成物から得られる薄膜。
【請求項16】
請求項8に記載の炭素ナノ材料分散剤、炭素ナノ材料及び有機溶媒を混合して混合物を調製する工程と、この混合物を機械的処理する工程とを含むことを特徴とする、炭素ナノ材料組成物の製造方法。
【請求項17】
前記機械的処理が超音波処理である、請求項16に記載の製造方法。
【請求項18】
前記炭素ナノ材料分散剤を前記有機溶媒に溶解させてなる溶液中に、前記炭素ナノ材料を添加して混合物を調製する工程と、この混合物を超音波処理する工程とを含むことを特徴とする、請求項17に記載の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−21100(P2012−21100A)
【公開日】平成24年2月2日(2012.2.2)
【国際特許分類】
【出願番号】特願2010−161021(P2010−161021)
【出願日】平成22年7月15日(2010.7.15)
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に係る特許出願(平成21年度、独立行政法人科学技術振興機構、地域イノベーション創出総合支援事業、重点地域研究開発推進プログラム「シーズ発掘試験」、産業技術力強化法第19条の適用を受けるもの)
【出願人】(304020292)国立大学法人徳島大学 (307)
【出願人】(000003986)日産化学工業株式会社 (510)
【Fターム(参考)】
【公開日】平成24年2月2日(2012.2.2)
【国際特許分類】
【出願日】平成22年7月15日(2010.7.15)
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に係る特許出願(平成21年度、独立行政法人科学技術振興機構、地域イノベーション創出総合支援事業、重点地域研究開発推進プログラム「シーズ発掘試験」、産業技術力強化法第19条の適用を受けるもの)
【出願人】(304020292)国立大学法人徳島大学 (307)
【出願人】(000003986)日産化学工業株式会社 (510)
【Fターム(参考)】
[ Back to top ]

