イオン濃度の測定方法
【課題】硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水について、各イオンの濃度を、簡便、迅速、正確かつ連続的に測定することができるイオン濃度の測定方法を提供する。
【解決手段】硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水中の各イオン濃度の測定方法であって、試料水のpHを所定の3水準に調整し、pHを調整した3点の試料水にバリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液とし、該3点の懸濁液の濃度指標となる物理量を測定し、あらかじめイオン濃度既知の水について作成した検量線の勾配を係数とし、試料水中の硫酸イオン、リン酸イオン及び炭酸イオンの濃度を未知数とする三元一次連立方程式を解くことにより、各イオン濃度を求めることを特徴とするイオン濃度の測定方法。
【解決手段】硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水中の各イオン濃度の測定方法であって、試料水のpHを所定の3水準に調整し、pHを調整した3点の試料水にバリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液とし、該3点の懸濁液の濃度指標となる物理量を測定し、あらかじめイオン濃度既知の水について作成した検量線の勾配を係数とし、試料水中の硫酸イオン、リン酸イオン及び炭酸イオンの濃度を未知数とする三元一次連立方程式を解くことにより、各イオン濃度を求めることを特徴とするイオン濃度の測定方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、イオン濃度の測定方法に関する。さらに詳しくは、本発明は、硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水について、各イオンの濃度を、簡便、迅速、正確かつ連続的に測定することができるイオン濃度の測定方法に関する。
【背景技術】
【0002】
各種の工場の製造工程において、硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種を含有する排水が発生する。このような排水は、それぞれのイオンの存在量を把握した上で、適切に処理する必要がある。
【0003】
硫酸イオンの定量方法として、JIS K 0102 41.に、クロム酸バリウム吸光光度法、重量法、イオンクロマトグラフ法が規定されている。リン酸イオンの定量法として、JIS K 0102 46.1に、モリブデン青吸光光度法が規定されている。炭酸イオンの定量法としては、例えば、試料水を水素イオン形強酸性陽イオン交換樹脂に接触させたのち、接触水を高純度水で希釈し、その希釈液の導電率の値から炭酸イオン濃度を算出する方法が提案されている(特許文献1)。
【0004】
しかし、これらの定量方法は、高価な測定装置と高度な分析技術を必要とし、分析に長時間を要する。また、イオンクロマトグラフ法を除いて、1回の分析操作で定量し得るイオンは1種のみである。硫酸イオンとリン酸イオンは、排水中に共存する場合が多く、水処理、特に凝集沈殿処理において、監視対象であるが、従来技術でこれらのイオンを同時に測定するためには、複雑、かつ複数の工程が必要である。現場で発生する排水のイオン濃度は時々刻々変動するので、排水中のイオン濃度を簡便かつ迅速に測定して、適切に排水処理を行うことができるイオン濃度の測定方法が求められている。
【特許文献1】特開平11−258191号公報(第2頁)
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水について、各イオンの濃度を、簡便、迅速、正確かつ連続的に測定することができるイオン濃度の測定方法を提供することを目的としてなされたものである。
【課題を解決するための手段】
【0006】
本発明者らは、上記の課題を解決すべく鋭意研究を重ねた結果、硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水のpHを、所定の3水準に調整し、バリウムイオンを含有する水溶液を添加してバリウム塩が析出した懸濁液とし、該懸濁液の濃度指標となる物理量を測定し、硫酸イオン、リン酸イオン及び炭酸イオンの濃度を未知数とする三元一次連立方程式を解くことにより各イオン濃度を求め得ることを見いだし、この知見に基づいて本発明を完成するに至った。
【0007】
すなわち、本発明は、
(1)硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水中の各イオン濃度の測定方法であって、試料水のpHを所定の3水準に調整し、pHを調整した3点の試料水にバリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液とし、該3点の懸濁液の濃度指標となる物理量を測定し、あらかじめ硫酸イオン、リン酸イオン及び炭酸イオンの内の1種のイオンを含むイオン濃度既知の水について、所定の3水準のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液の濃度指標となる物理量を測定して作成したイオン濃度−物理量の関係を示す検量線の勾配を係数とし、試料水中の硫酸イオン、リン酸イオン及び炭酸イオンの濃度を未知数とする三元一次連立方程式を解くことにより、各イオン濃度を求めることを特徴とするイオン濃度の測定方法、
(2)所定の3水準のpHが、pH5未満、pH5以上10未満及びpH10以上の範囲内でそれぞれ選択される(1)記載のイオン濃度の測定方法、
(3)懸濁液の濃度指標となる物理量が、透過光又は散乱光の強度である(1)記載のイオン濃度の測定方法、
(4)試料水中に存在するイオンが、硫酸イオン、リン酸イオン及び炭酸イオンの内の既知の2種であり、試料水のpHを所定の2水準に調整し、pHを調整した2点の試料水にバリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液とし、該2点の懸濁液の濃度指標となる物理量を測定し、あらかじめ試料水中に存在する硫酸イオン、リン酸イオン又は炭酸イオンを含むイオン濃度既知の水について、所定の2水準のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液の濃度指標となる物理量を測定して作成したイオン濃度−物理量の関係を示す検量線の勾配を係数とし、試料水中の2種のイオンの濃度を未知数とする二元一次連立方程式を解くことにより、各イオン濃度を求めることを特徴とするイオン濃度の測定方法、
(5)懸濁液の濃度指標となる物理量が、透過光又は散乱光の強度である(4)記載のイオン濃度の測定方法、及び、
(6)リン酸イオンを含有する試料水のpHを10以上の範囲内に選ばれる所定の値に調整し、pHを調整した試料水にバリウムイオンを含有する水溶液を添加してリン酸バリウムが生成した懸濁液とし、懸濁液の濃度指標となる物理量を測定し、あらかじめ試料水中に存在するリン酸イオン濃度既知の水について、所定の値のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液の濃度指標となる物理量を測定して作成したイオン濃度−物理量の関係を示す検量線より、試料水中のリン酸イオン濃度を求めることを特徴とするイオン濃度の測定方法、
を提供するものである。
【発明の効果】
【0008】
本発明のイオン濃度の測定方法により、硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水中の各イオン濃度を、複雑な工程を経ることなく、簡便、迅速、正確かつ連続的に測定することができる。本発明方法を水処理、特に凝集沈殿処理を伴う水処理に適用することにより、水質監視や薬品添加量の制御を伴う高度な水質管理を行うことが可能となる。
【発明を実施するための最良の形態】
【0009】
本発明のイオン濃度の測定方法の第一の態様は、硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水中の各イオン濃度の測定方法であって、試料水のpHを所定の3水準に調整し、pHを調整した3点の試料水にバリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液とし、該3点の懸濁液の濃度指標となる物理量を測定し、あらかじめ硫酸イオン、リン酸イオン及び炭酸イオンの内の1種のイオンを含むイオン濃度既知の水について、所定の3水準のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液の濃度指標となる物理量を測定して作成したイオン濃度−物理量の関係を示す検量線の勾配を係数とし、試料水中の硫酸イオン、リン酸イオン及び炭酸イオンの濃度を未知数とする三元一次連立方程式を解くことにより、各イオン濃度を求める。
【0010】
本発明方法の第一の態様は、試料水が、硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含むが、含まれるイオン濃度は未知であり、硫酸イオン、リン酸イオン及び炭酸イオン以外には、水不溶性のバリウム塩を形成するイオンが実質的に存在しない試料水に適用することができる。
【0011】
硫酸イオンとバリウムイオンが反応すると、酸性域、中性域、アルカリ性域のいずれにおいても、溶解度の低い硫酸バリウムが生成する。したがって、硫酸イオンが存在する試料水に過剰のバリウムイオンを添加して硫酸バリウムの沈殿が析出した懸濁液を形成させ、硫酸イオン濃度を横軸とし、懸濁液の濃度指標となる物理量を縦軸とする検量線を作成すると、試料水のpHに関係なく、ほぼ同じ検量線が得られる。
【0012】
リン酸イオンは、酸性域と中性域では、バリウムイオンとほとんど反応しないが、アルカリ性域では、リン酸バリウムとなって沈殿を生ずる。したがって、リン酸イオン濃度を横軸とし、形成された懸濁液の濃度指標となる物理量を縦軸とする検量線を作成すると、酸性域では検量線の勾配が小さく、アルカリ性域では検量線の勾配が大きくなる。
【0013】
炭酸イオンもリン酸イオンと同様、酸性域や中性域では、バリウムイオンとほとんど反応せず、アルカリ性域で炭酸バリウムとなって沈殿を生ずる。リン酸イオンとの相違点は、中性域における反応率であり、リン酸イオンが10〜40%程度反応するのに対し、炭酸イオンはほぼ0%である。したがって、炭酸イオン濃度を横軸とし、形成された懸濁液の濃度指標となる物理量を縦軸とする検量線を作成すると、酸性域、中性域では、勾配はほぼ0となり、アルカリ性域で傾きがある検量線が得られる。
【0014】
本発明方法において、懸濁液の濃度指標となる物理量としては、例えば、懸濁液の透過光又は散乱光の強度、懸濁液をろ過する際の透過流束、懸濁液をろ過して得られる沈殿物の湿重量又は乾燥重量などを挙げることができる。これらの中で、懸濁液の透過光又は散乱光の強度は、容易、迅速かつ正確に測定することができるので、好適に用いることができる。図1は、透過光の強度の測定方法の一例の説明図である。光源1から放射された光が、分光器2で単色光に分光されてセル3に入射する。セル内の懸濁液を通過した透過光は、測光部4において受光され、指示記録部5で指示記録される。透過光の強度を測定するための光の波長は、500〜660nmであることが好ましく、600〜660nmであることがより好ましい。透過光の強度の指標として、吸光度を用いることが好ましい。強度I0の光が懸濁液層を透過して強度Iとなったとき、吸光度は A=log10(I0/I) で表される値であり、単色光の波長とセルの光路長が一定であれば、液の濃度に比例するので、数値の解析に好都合である。図2は、散乱光の強度の測定方法の一例の説明図である。懸濁液が液槽6の下部から送り込まれ、上部より溢流する。光源7から放射された光がレンズ8により集光され、液面に入射して散乱する。散乱光が測光部9において受光され、指示記録部10で指示記録される。
【0015】
本発明方法においては、試料水のpHを5未満、5以上10未満及び10以上の範囲内に選ばれる所定の3水準に調整し、pHを調整した3点の試料水にバリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液とすることが好ましい。試料水のpHは、例えば、pH3、pH6、pH13の3水準を選ぶことができる。硫酸イオン濃度xを横軸とし、pH3における懸濁液の吸光度A3Sを縦軸とする検量線をA3S=axとし、同様にpH6及びpH13における懸濁液の吸光度A6S及びA13Sを縦軸とする検量線をA6S=a'x、A13S=a''xとすると、a、a'及びa''の値はほぼ同じである。また、リン酸イオン濃度yを横軸とし、pH3、pH6、pH13における懸濁液の吸光度A3P、A6P、A13Pを縦軸とする検量線をA3P=by、A6P=b'y、A13P=b''yとすると、b、b'及びb''の値はこの順に大きくなり、b、b'に比べてb''は非常に大きくなる。炭酸イオン濃度zを横軸とし、pH3、pH6、pH13における懸濁液の吸光度A3C、A6C、A13Cを縦軸とする検量線をA3C=cy、A6C=c'y、A13C=c''yとすると、c、c'及びc''の値は、c、c'がほぼ0であり、c''が大きくなり、リン酸イオンの場合と異なる。
【0016】
したがって、硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水のpHを3、6、13に調整し、バリウムイオンを含有する水溶液を添加して懸濁液を形成させ、各pHにおける吸光度A3、A6及びA13を測定すると、A3、A6、A13は次の3式で表される。
A3 = ax + by + cz
A6 = a'x + b'y + c'z
A13 = a''x + b''y + c''z
【0017】
この3式からなる三元一次方程式を解くことにより、硫酸イオン濃度x、リン酸イオン濃度y及び炭酸イオン濃度zを求めることができる。a、a'、a''、b、b'、b''、c、c'及びc''の値は、あらかじめ硫酸イオン、リン酸イオン及び炭酸イオンの内の1種のイオンを含むイオン濃度既知の水について、所定の3水準のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液について吸光度を測定して作成した検量線の勾配として求めることができる。
【0018】
本発明方法に用いるバリウムイオンを含有する水溶液に特に制限はなく、例えば、塩化バリウムの水溶液などを挙げることができる。本発明方法において、バリウムイオンの添加量は、予測される硫酸イオン、リン酸イオン及び炭酸イオンの存在量に対して4〜15当量倍であることが好ましく、6〜12当量倍であることがより好ましい。バリウムイオンの添加量が予測される硫酸イオン、リン酸イオン及び炭酸イオンの存在量に対して4当量倍未満であると、試料水中のイオン濃度が大きく変動したときに、沈殿を生成するためのバリウムイオンが不足するおそれがある。バリウムイオンの添加量は、予測される硫酸イオン、リン酸イオン及び炭酸イオンの存在量に対して15当量倍以下で、不溶性のバリウム塩が十分に形成され、通常は、予測される硫酸イオン、リン酸イオン及び炭酸イオンの存在量に対して15当量倍を超えるバリウムイオンを添加する必要はない。濃度指標となる物理量の測定後の懸濁液には、過剰なバリウムイオンが含まれるので、硫酸イオンなどを含む水を添加し、すべて硫酸バリウムなどとして沈殿させたのち処分することが好ましい。
【0019】
本発明のイオン濃度の測定方法の第二の態様においては、試料水中に存在するイオンが、硫酸イオン、リン酸イオン及び炭酸イオンの内の既知の2種であり、試料水のpHを所定の2水準に調整し、pHを調整した2点の試料水にバリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液とし、該2点の懸濁液の濃度指標となる物理量を測定し、あらかじめ試料水中に存在する硫酸イオン、リン酸イオン又は炭酸イオンを含むイオン濃度既知の水について、所定の2水準のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液の濃度指標となる物理量を測定して作成したイオン濃度−物理量の関係を示す検量線の勾配を係数とし、試料水中の2種のイオンの濃度を未知数とする二元一次連立方程式を解くことにより、各イオン濃度を求める。懸濁液の濃度指標となる物理量としては、例えば、懸濁液の透過光又は散乱光の強度、懸濁液をろ過する際の透過流束、懸濁液をろ過して得られる沈殿物の湿重量又は乾燥重量などを挙げることができる。これらの中で、懸濁液の透過光の強度の指標となる吸光度は、容易、迅速かつ正確に測定することができ、懸濁液の濃度に比例するので、特に好適に用いることができる。
【0020】
各種の工程における排水には、不溶性のバリウム塩を生成するイオンが、例えば、硫酸イオン及びリン酸イオンのように既知の2種である場合が多い。このような場合には、本発明方法の第二の態様を好適に適用することができる。硫酸イオンとリン酸イオンが存在する場合には、試料水のpHを5未満と10以上の範囲内に選ばれる所定の2水準、例えば、pH3とpH13に調整した2点の試料水に、バリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液とすることが好ましい。硫酸イオン濃度xを横軸とし、pH3における懸濁液の吸光度A3Sを縦軸とする検量線をA3S=ax、pH13における懸濁液の吸光度A6Sを縦軸とする検量線をA13S=a''xとすると、a及びa''の値はほぼ同じである。また、リン酸イオン濃度yを横軸とし、pH3、pH13における懸濁液の吸光度A3P、A13Pを縦軸とする検量線をA3P=by、A13P=b''yとすると、b''の値はbの値より大きい。
【0021】
したがって、硫酸イオン及びリン酸イオンを含む試料水のpHを3と13に調整し、バリウムイオンを含有する水溶液を添加して懸濁液を形成させ、各pHにおける吸光度A3及びA13を測定すると、A3及びA13は次の2式で表される。
A3 = ax + by
A13 = a''x + b''y
この2式からなる二元一次方程式を解くことにより、硫酸イオン濃度x及びリン酸イオン濃度yを求めることができる。a、a''、b及びb''の値は、あらかじめ硫酸イオン又はリン酸イオンを含むイオン濃度既知の水について、pH3及びpH13においてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液について吸光度を測定して作成した検量線の勾配として求めることができる。
【0022】
硫酸イオンと炭酸イオンが存在する場合には、試料水のpHを5未満と10以上の範囲内に選ばれる所定の2水準、例えば、pH3とpH13に調整した2点の試料水に、バリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液を形成させ、硫酸イオン濃度及び炭酸イオン濃度を測定することができる。炭酸イオンとリン酸イオンが存在する場合には、試料水のpHを5以上10未満と10以上の範囲内に選ばれる所定の2水準、例えば、pH6とpH13に調整した2点の試料水に、バリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液を形成させ、炭酸イオン濃度及びリン酸イオン濃度を測定することができる。
【0023】
本発明のイオン濃度の測定方法の第三の態様においては、リン酸イオンを含有する試料水のpHを10以上の範囲内に選ばれる所定の値に調整し、pHを調整した試料水にバリウムイオンを含有する水溶液を添加してリン酸バリウムが生成した懸濁液とし、懸濁液の濃度指標となる物理量を測定し、あらかじめ試料水中に存在するリン酸イオン濃度既知の水について、所定の値のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液の濃度指標となる物理量を測定して作成したイオン濃度−物理量の関係を示す検量線より、試料水中のリン酸イオン濃度を求める。懸濁液の濃度指標となる物理量に特に制限はないが、容易、迅速かつ正確に測定することができ、懸濁液の濃度に比例する吸光度を好適に用いることができる。
【0024】
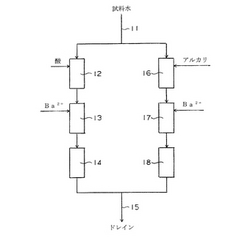
本発明方法において、試料水中の各種のイオンとバリウムイオンの反応による不溶性バリウム塩の生成は瞬時に起こるので、フローセルを用いて本発明方法を実施することができる。図3は、フローセルを用いる測定方法の一態様の説明図である。試料水配管11を経由して送られた硫酸イオンとリン酸イオンを含む試料水が、2系統に分岐される。分岐された一方の系統の試料水には、pH調整部12において、酸が添加されpH3に調整される。pH3に調整された試料水は、次いで沈殿析出部13においてバリウムイオンを含有する水溶液が添加され、不溶性のバリウム塩が析出して懸濁液となる。懸濁液はフローセル14に送られて吸光度が測定されたのち、ドレイン配管15からドレインとして排出される。分岐された他方の系統の試料水にはpH調整部16において、アルカリが添加されpH13に調整される。pH13に調整された試料水は、次いで沈殿析出部17においてバリウムイオンを含有する水溶液が添加され、不溶性のバリウム塩が析出して懸濁液となる。懸濁液はフローセル18に送られて吸光度が測定されたのち、ドレイン配管15からドレインとして排出される。フローセル14の測定データとフローセル18の測定データはデータ処理装置に送られ、二元一次連立方程式としてデータ処理がなされ、試料水中の硫酸イオン濃度とリン酸イオン濃度がリアルタイムでアウトプットされる。
【0025】
なお、SS成分やTOC成分は、沈殿の生成に影響を及ぼしたり、測定される物理量自体に影響を及ぼすので、フィルターや活性炭などを用いてあらかじめ除去することが好ましい。
本発明方法によれば、試料水中に存在する硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオン濃度を、簡便、迅速、正確、かつ連続的に測定し、監視することが可能となる。これらのイオンが、水処理、特に凝集沈殿処理に影響を及ぼす場合においては、測定される硫酸イオン、リン酸イオン、炭酸イオンの濃度に基づいて、添加薬品量を制御することができる。なお、測定対象が、リン酸イオンのみであっても、本発明方法は有効であり、アルカリ性域における沈殿物の生成量からリン酸イオン濃度を求めることができる。
【実施例】
【0026】
以下に、実施例を挙げて本発明をさらに詳細に説明するが、本発明はこれらの実施例によりなんら限定されるものではない。
実施例1
(硫酸イオン、リン酸イオン、炭酸イオンとバリウムイオンの反応のpH依存性)
硫酸ナトリウム148mgを水1Lに溶解して、硫酸イオン100mg/Lを含む水溶液を調製した。この水溶液を9個のビーカーに100mLずつ取り分け、塩酸又は水酸化ナトリウム水溶液を添加して、pH3、4、5、6、7、8、10、12、13に調整した。
塩化バリウム20.8gを水に溶解し、水溶液の全量を100mLにして、バリウムイオン137g/Lを含む水溶液を調製した。
pH3に調整した硫酸ナトリウム水溶液100mLに、上記の塩化バリウム水溶液1mLを添加して撹拌し、硫酸バリウムの沈殿を析出させた。沈殿をろ別して105℃で3時間乾燥すると、硫酸バリウム24.3mgが得られた。硫酸イオンの反応率は、100%であった。
pH4、5、6、7、8、10、12、13に調整した硫酸ナトリウム水溶液にも、同様にして、塩化バリウム水溶液を添加して硫酸バリウムの沈殿を析出させ、ろ別、乾燥、秤量して、硫酸イオンの反応率を求めた。結果を、図4に示す。pH3〜13の全領域において、硫酸イオンのほぼ全量がバリウムイオンと反応していることが分かる。
リン酸二水素ナトリウム126mgを水1Lに溶解して、リン酸イオン100mg/Lを含む水溶液を調製した。この水溶液を9個のビーカーに100mLずつ取り分け、塩酸又は水酸化ナトリウム水溶液を添加して、pH3、4、5、6、7、8、10、12、13に調整した。
pH3に調整したリン酸二水素ナトリウム水溶液100mLに、上記のバリウムイオン137g/Lを含む塩化バリウム水溶液1mLを添加して撹拌し、リン酸バリウムの沈殿を析出させた。沈殿をろ別して105℃で3時間乾燥すると、リン酸水素バリウム1.2mgが得られた。リン酸イオンの反応率は、5%であった。
pH4、5、6、7、8、10、12、13に調整したリン酸二水素ナトリウム水溶液にも、同様にして、塩化バリウム水溶液を添加してリン酸バリウムの沈殿を析出させ、ろ別、乾燥、秤量して、リン酸イオンの反応率を求めた。結果を、図5に示す。リン酸イオンの反応率は、pH3では5%であり、pHの上昇とともに反応率が上昇し、pH13ではほぼ全量がバリウムイオンと反応することが分かる。
炭酸水素ナトリウム140mgを水1Lに溶解して、炭酸イオン100mg/Lを含む水溶液を調製した。この水溶液を9個のビーカーに100mLずつ取り分け、塩酸又は水酸化ナトリウム水溶液を添加して、pH3、4、5、6、7、8、10、12、13に調整した。
pH3に調整した炭酸水素ナトリウム水溶液100mLに、上記のバリウムイオン137g/Lを含む塩化バリウム水溶液1mLを添加して撹拌し、炭酸バリウムの沈殿を析出させた。沈殿をろ別して105℃で3時間乾燥すると、炭酸バリウム0.1mg以下が得られた。炭酸イオンの反応率は、0.3%以下であった。
pH4、5、6、7、8、10、12、13に調整した炭酸水素ナトリウム水溶液にも、同様にして、塩化バリウム水溶液を添加して炭酸バリウムの沈殿を析出させ、ろ別、乾燥、秤量して、炭酸イオンの反応率を求めた。結果を、図6に示す。炭酸イオンは、pH7以下ではバリウムイオンとほとんど反応せず、pHが7を超えると反応がはじまり、pHの上昇とともに反応率が上昇し、pH13ではほぼ全量がバリウムイオンと反応することが分かる。
【0027】
実施例2(検量線の作成)
実施例1と同様にして、硫酸イオン25mg/L、50mg/L又は100mg/Lを含む硫酸ナトリウム水溶液を調製し、それぞれ3個のビーカーに100mLずつ取り分けた。硫酸イオン25mg/Lを含む水溶液、硫酸イオン50mg/Lを含む水溶液、硫酸イオン100mg/Lを含む水溶液を、塩酸又は水酸化ナトリウム水溶液を用いて、それぞれpH3、pH6又はpH13に調整した。
pH3に調整した硫酸イオン25mg/Lを含む水溶液に、実施例1と同様にして、バリウムイオン137g/Lを含む塩化バリウム水溶液1mLを添加して撹拌し、硫酸バリウムの沈殿が析出した懸濁液とした。この懸濁液を光路長5mmのセルに入れ、分光光度計[(株)島津製作所、UV−3600]を用いて、波長660nmで吸光度を測定した。吸光度は、0.016であった。pH3に調整した硫酸イオン50mg/Lを含む水溶液と硫酸イオン100mg/Lを含む水溶液について、同様に処理したところ、吸光度はそれぞれ0.039と0.178であった。
pH6に調整した硫酸イオンを含む水溶液と、pH13に調整した硫酸イオンを含む水溶液についても、同様にして塩化バリウム水溶液を添加して懸濁液とし、吸光度を測定した。pH6、硫酸イオン25mg/Lを含む水溶液から得られた懸濁液の吸光度は0.019、pH6、硫酸イオン50mg/Lを含む水溶液から得られた懸濁液の吸光度は0.041、pH6、硫酸イオン100mg/Lを含む水溶液から得られた懸濁液の吸光度は0.181であった。pH13、硫酸イオン25mg/Lを含む水溶液から得られた懸濁液の吸光度は0.021、pH13、硫酸イオン50mg/Lを含む水溶液から得られた懸濁液の吸光度は0.043、pH13、硫酸イオン100mg/Lを含む水溶液から得られた懸濁液の吸光度は0.183であった。
リン酸イオン及び炭酸イオンについても、同様にして、イオン濃度25mg/L、50mg/L、100mg/Lの水溶液を、pH3、pH6、pH13に調整し、塩化バリウム水溶液を添加して懸濁液とし、吸光度を測定した。得られた吸光度の値及び検量線の勾配を第1表に示し、検量線を図7に示す。
【0028】
【表1】

【0029】
実施例3(硫酸イオンとリン酸イオンの分析)
硫酸ナトリウム148mgとリン酸二水素ナトリウム63mgを水1Lに溶解して、硫酸イオン100mg/Lとリン酸イオン50mg/Lを含む水溶液を調製した。2個のビーカーにこの水溶液100mLずつを取り、一方を塩酸を用いてpH3に、他方を水酸化ナトリウム水溶液を用いてpH13に調整した。それぞれのビーカーに、実施例1と同じバリウムイオン137g/Lを含む塩化バリウム水溶液1mLを添加して撹拌し、沈殿が析出した懸濁液とした。この懸濁液を光路長5mmのセルに入れ、分光光度計[(株)島津製作所、UV−3600]を用いて、波長660nmで吸光度を測定した。pH3に調整した水溶液から得られた懸濁液の吸光度は0.153であり、pH13に調整した水溶液から得られた懸濁液の吸光度は0.234であった。
水溶液中の硫酸イオンの濃度をx(mg/L)、リン酸イオンの濃度をy(mg/L)とし、第1表に示す検量線の勾配を係数として連立方程式をたてると、次の式が得られる。
0.00150x + 0.00012y = 0.153
0.00160x + 0.00160y = 0.234
この連立方程式を解くと、x = 98.2、y = 48.1となる。
硫酸ナトリウム148mgとリン酸二水素ナトリウム126mgを水1Lに溶解し、硫酸イオン100mg/Lとリン酸イオン100mg/Lを含む水溶液を調製し、同様にしてpH3とpH13に調整し、バリウム塩が析出した懸濁液として吸光度を測定した。pH3に調整した水溶液から得られた懸濁液の吸光度は0.159であり、pH13に調整した水溶液から得られた懸濁液の吸光度は0.312であった。
水溶液中の硫酸イオンの濃度をx(mg/L)、リン酸イオンの濃度をy(mg/L)として連立方程式をたてると、次の式が得られる。
0.00150x + 0.00012y = 0.159
0.00160x + 0.00160y = 0.312
この連立方程式を解くと、x = 98.3、y = 96.7となる。
硫酸ナトリウム74mgとリン酸二水素ナトリウム126mgを水1Lに溶解して、硫酸イオン50mg/Lとリン酸イオン100mg/Lを含む水溶液を調製し、同様にしてpH3とpH13に調整し、バリウム塩が析出した懸濁液として吸光度を測定した。pH3に調整した水溶液から得られた懸濁液の吸光度は0.089であり、pH13に調整した水溶液から得られた懸濁液の吸光度は0.242であった。
水溶液中の硫酸イオンの濃度をx(mg/L)、リン酸イオンの濃度をy(mg/L)として連立方程式をたてると、次の式が得られる。
0.00150x + 0.00012y = 0.089
0.00160x + 0.00160y = 0.242
この連立方程式を解くと、x = 98.1、y = 97.1となる。
硫酸ナトリウム148mgを水1Lに溶解して、硫酸イオン100mg/Lを含む水溶液を調製し、同様にしてpH3とpH13に調整し、バリウム塩が析出した懸濁液として吸光度を測定した。pH3に調整した水溶液から得られた懸濁液の吸光度は0.150であり、pH13に調整した水溶液から得られた懸濁液の吸光度も0.160であった。
水溶液中の硫酸イオンの濃度をx(mg/L)、リン酸イオンの濃度をy(mg/L)として連立方程式をたてると、次の式が得られる。
0.00150x + 0.00012y = 0.150
0.00160x + 0.00160y = 0.160
この連立方程式を解くと、x = 100.0、y = 0.0となる。
リン酸二水素ナトリウム63mgを水1Lに溶解して、リン酸イオン50mg/Lを含む水溶液を調製し、同様にしてpH3とpH13に調整し、バリウム塩が析出した懸濁液として吸光度を測定した。pH3に調整した水溶液から得られた懸濁液の吸光度は0.007であり、pH13に調整した水溶液から得られた懸濁液の吸光度は0.080であった。
水溶液中の硫酸イオンの濃度をx(mg/L)、リン酸イオンの濃度をy(mg/L)として連立方程式をたてると、次の式が得られる。
0.00150x + 0.00012y = 0.007
0.00160x + 0.00160y = 0.080
この連立方程式を解くと、x = 0.5、y = 49.3となる。
リン酸二水素ナトリウム126mgを水1Lに溶解して、リン酸イオン100mg/Lを含む水溶液を調製し、同様にしてpH3とpH13に調整し、バリウム塩が析出した懸濁液として吸光度を測定した。pH3に調整した水溶液から得られた懸濁液の吸光度は0.012であり、pH13に調整した水溶液から得られた懸濁液の吸光度は0.160であった。
水溶液中の硫酸イオンの濃度をx(mg/L)、リン酸イオンの濃度をy(mg/L)として連立方程式をたてると、次の式が得られる。
0.00150x + 0.00012y = 0.012
0.00160x + 0.00160y = 0.160
この連立方程式を解くと、x = 0.0、y = 100.0となる。
実施例3の結果を、第2表に示す。
【0030】
【表2】

【0031】
第2表に見られるように、本発明方法により測定されたイオン濃度と、試料水中のイオン濃度の差はきわめて小さく、本発明方法により、硫酸イオンとリン酸イオンが共存する試料水又はいずれか一方のイオンが存在する試料水について、イオン濃度を迅速かつ正確に測定し得ることが分かる。
実施例4(硫酸イオン、リン酸イオン及び炭酸イオンの分析)
硫酸ナトリウム74mg、リン酸二水素ナトリウム50.5mg及び炭酸水素ナトリウム56mgを水1Lに溶解して、硫酸イオン50mg/L、リン酸イオン40mg/L及び炭酸イオン40mg/Lを含む水溶液を調製した。3個のビーカーにこの水溶液100mLずつを取り、pH3、pH6及びpH13に調整した。それぞれのビーカーに、実施例1と同じバリウムイオン137g/Lを含む塩化バリウム水溶液1mLを添加して撹拌し、沈殿が析出した懸濁液とした。この懸濁液を光路長5mmのセルに入れ、分光光度計[(株)島津製作所、UV−3600]を用いて、波長660nmで吸光度を測定した。pH3に調整した水溶液から得られた懸濁液の吸光度は0.079であり、pH6に調整した水溶液から得られた懸濁液の吸光度は0.086であり、pH13に調整した水溶液から得られた懸濁液の吸光度は0.310であった。
水溶液中の硫酸イオンの濃度をx(mg/L)、リン酸イオンの濃度をy(mg/L)、炭酸イオンの濃度をz(mg/L)とし、第1表に示す検量線の勾配を係数として連立方程式をたてると、次の式が得られる。
0.00150x + 0.00012y + 0.00000z = 0.079
0.00160x + 0.00018y + 0.00000z = 0.086
0.00160x + 0.00160y + 0.00408z = 0.310
この連立方程式を解くと、x = 49.2、y = 39.7、z = 41.0となる。
同様にして、硫酸ナトリウム、リン酸二水素ナトリウム及び炭酸水素ナトリウムを水に溶解し、硫酸イオン20mg/L、リン酸イオン40mg/L及び炭酸イオン40mg/Lを含む水溶液、硫酸イオン50mg/L、リン酸イオン15mg/L及び炭酸イオン40mg/Lを含む水溶液、及び、硫酸イオン50mg/L、リン酸イオン40mg/L及び炭酸イオン15mg/Lを含む水溶液を調製した。
それぞれの水溶液を、pH3、pH6又はpH13に調整し、塩化バリウム水溶液を添加して、沈殿が析出した懸濁液とし、吸光度を測定し、三元一次連立方程式を解くことにより、各イオンの濃度を求めた。
実施例4の結果を、第3表に示す。
【0032】
【表3】

【0033】
第3表に見られるように、本発明方法により測定されたイオン濃度と、試料水中のイオン濃度の差はきわめて小さく、本発明方法により、硫酸イオン、リン酸イオン及び炭酸イオンが共存する試料水について、イオン濃度を迅速かつ正確に測定し得ることが分かる。
【産業上の利用可能性】
【0034】
本発明のイオン濃度の測定方法により、硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種を含む試料水中の各イオン濃度を、複雑な工程を経ることなく、簡便、迅速、正確かつ連続的に測定することができる。本発明方法を水処理、特に凝集沈殿処理を伴う水処理に適用することにより、水質監視や薬品添加量の制御を伴う高度な水質管理を行うことが可能となる。
【図面の簡単な説明】
【0035】
【図1】透過光の強度の測定方法の一例の説明図である。
【図2】散乱光の強度の測定方法の一例の説明図である。
【図3】フローセルを用いる測定方法の一態様の説明図である。
【図4】硫酸イオンのバリウムイオンとの反応率とpHの関係を示すグラフである。
【図5】リン酸イオンのバリウムイオンとの反応率とpHの関係を示すグラフである。
【図6】炭酸イオンのバリウムイオンとの反応率とpHの関係を示すグラフである。
【図7】硫酸イオン、リン酸イオン及び炭酸イオンの検量線である。
【符号の説明】
【0036】
1 光源
2 分光器
3 セル
4 測光部
5 指示記録部
6 液槽
7 光源
8 レンズ
9 測光部
10 指示記録部
11 試料水配管
12 pH調整部
13 沈殿析出部
14 フローセル
15 ドレイン配管
16 pH調整部
17 沈殿析出部
18 フローセル
【技術分野】
【0001】
本発明は、イオン濃度の測定方法に関する。さらに詳しくは、本発明は、硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水について、各イオンの濃度を、簡便、迅速、正確かつ連続的に測定することができるイオン濃度の測定方法に関する。
【背景技術】
【0002】
各種の工場の製造工程において、硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種を含有する排水が発生する。このような排水は、それぞれのイオンの存在量を把握した上で、適切に処理する必要がある。
【0003】
硫酸イオンの定量方法として、JIS K 0102 41.に、クロム酸バリウム吸光光度法、重量法、イオンクロマトグラフ法が規定されている。リン酸イオンの定量法として、JIS K 0102 46.1に、モリブデン青吸光光度法が規定されている。炭酸イオンの定量法としては、例えば、試料水を水素イオン形強酸性陽イオン交換樹脂に接触させたのち、接触水を高純度水で希釈し、その希釈液の導電率の値から炭酸イオン濃度を算出する方法が提案されている(特許文献1)。
【0004】
しかし、これらの定量方法は、高価な測定装置と高度な分析技術を必要とし、分析に長時間を要する。また、イオンクロマトグラフ法を除いて、1回の分析操作で定量し得るイオンは1種のみである。硫酸イオンとリン酸イオンは、排水中に共存する場合が多く、水処理、特に凝集沈殿処理において、監視対象であるが、従来技術でこれらのイオンを同時に測定するためには、複雑、かつ複数の工程が必要である。現場で発生する排水のイオン濃度は時々刻々変動するので、排水中のイオン濃度を簡便かつ迅速に測定して、適切に排水処理を行うことができるイオン濃度の測定方法が求められている。
【特許文献1】特開平11−258191号公報(第2頁)
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水について、各イオンの濃度を、簡便、迅速、正確かつ連続的に測定することができるイオン濃度の測定方法を提供することを目的としてなされたものである。
【課題を解決するための手段】
【0006】
本発明者らは、上記の課題を解決すべく鋭意研究を重ねた結果、硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水のpHを、所定の3水準に調整し、バリウムイオンを含有する水溶液を添加してバリウム塩が析出した懸濁液とし、該懸濁液の濃度指標となる物理量を測定し、硫酸イオン、リン酸イオン及び炭酸イオンの濃度を未知数とする三元一次連立方程式を解くことにより各イオン濃度を求め得ることを見いだし、この知見に基づいて本発明を完成するに至った。
【0007】
すなわち、本発明は、
(1)硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水中の各イオン濃度の測定方法であって、試料水のpHを所定の3水準に調整し、pHを調整した3点の試料水にバリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液とし、該3点の懸濁液の濃度指標となる物理量を測定し、あらかじめ硫酸イオン、リン酸イオン及び炭酸イオンの内の1種のイオンを含むイオン濃度既知の水について、所定の3水準のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液の濃度指標となる物理量を測定して作成したイオン濃度−物理量の関係を示す検量線の勾配を係数とし、試料水中の硫酸イオン、リン酸イオン及び炭酸イオンの濃度を未知数とする三元一次連立方程式を解くことにより、各イオン濃度を求めることを特徴とするイオン濃度の測定方法、
(2)所定の3水準のpHが、pH5未満、pH5以上10未満及びpH10以上の範囲内でそれぞれ選択される(1)記載のイオン濃度の測定方法、
(3)懸濁液の濃度指標となる物理量が、透過光又は散乱光の強度である(1)記載のイオン濃度の測定方法、
(4)試料水中に存在するイオンが、硫酸イオン、リン酸イオン及び炭酸イオンの内の既知の2種であり、試料水のpHを所定の2水準に調整し、pHを調整した2点の試料水にバリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液とし、該2点の懸濁液の濃度指標となる物理量を測定し、あらかじめ試料水中に存在する硫酸イオン、リン酸イオン又は炭酸イオンを含むイオン濃度既知の水について、所定の2水準のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液の濃度指標となる物理量を測定して作成したイオン濃度−物理量の関係を示す検量線の勾配を係数とし、試料水中の2種のイオンの濃度を未知数とする二元一次連立方程式を解くことにより、各イオン濃度を求めることを特徴とするイオン濃度の測定方法、
(5)懸濁液の濃度指標となる物理量が、透過光又は散乱光の強度である(4)記載のイオン濃度の測定方法、及び、
(6)リン酸イオンを含有する試料水のpHを10以上の範囲内に選ばれる所定の値に調整し、pHを調整した試料水にバリウムイオンを含有する水溶液を添加してリン酸バリウムが生成した懸濁液とし、懸濁液の濃度指標となる物理量を測定し、あらかじめ試料水中に存在するリン酸イオン濃度既知の水について、所定の値のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液の濃度指標となる物理量を測定して作成したイオン濃度−物理量の関係を示す検量線より、試料水中のリン酸イオン濃度を求めることを特徴とするイオン濃度の測定方法、
を提供するものである。
【発明の効果】
【0008】
本発明のイオン濃度の測定方法により、硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水中の各イオン濃度を、複雑な工程を経ることなく、簡便、迅速、正確かつ連続的に測定することができる。本発明方法を水処理、特に凝集沈殿処理を伴う水処理に適用することにより、水質監視や薬品添加量の制御を伴う高度な水質管理を行うことが可能となる。
【発明を実施するための最良の形態】
【0009】
本発明のイオン濃度の測定方法の第一の態様は、硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水中の各イオン濃度の測定方法であって、試料水のpHを所定の3水準に調整し、pHを調整した3点の試料水にバリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液とし、該3点の懸濁液の濃度指標となる物理量を測定し、あらかじめ硫酸イオン、リン酸イオン及び炭酸イオンの内の1種のイオンを含むイオン濃度既知の水について、所定の3水準のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液の濃度指標となる物理量を測定して作成したイオン濃度−物理量の関係を示す検量線の勾配を係数とし、試料水中の硫酸イオン、リン酸イオン及び炭酸イオンの濃度を未知数とする三元一次連立方程式を解くことにより、各イオン濃度を求める。
【0010】
本発明方法の第一の態様は、試料水が、硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含むが、含まれるイオン濃度は未知であり、硫酸イオン、リン酸イオン及び炭酸イオン以外には、水不溶性のバリウム塩を形成するイオンが実質的に存在しない試料水に適用することができる。
【0011】
硫酸イオンとバリウムイオンが反応すると、酸性域、中性域、アルカリ性域のいずれにおいても、溶解度の低い硫酸バリウムが生成する。したがって、硫酸イオンが存在する試料水に過剰のバリウムイオンを添加して硫酸バリウムの沈殿が析出した懸濁液を形成させ、硫酸イオン濃度を横軸とし、懸濁液の濃度指標となる物理量を縦軸とする検量線を作成すると、試料水のpHに関係なく、ほぼ同じ検量線が得られる。
【0012】
リン酸イオンは、酸性域と中性域では、バリウムイオンとほとんど反応しないが、アルカリ性域では、リン酸バリウムとなって沈殿を生ずる。したがって、リン酸イオン濃度を横軸とし、形成された懸濁液の濃度指標となる物理量を縦軸とする検量線を作成すると、酸性域では検量線の勾配が小さく、アルカリ性域では検量線の勾配が大きくなる。
【0013】
炭酸イオンもリン酸イオンと同様、酸性域や中性域では、バリウムイオンとほとんど反応せず、アルカリ性域で炭酸バリウムとなって沈殿を生ずる。リン酸イオンとの相違点は、中性域における反応率であり、リン酸イオンが10〜40%程度反応するのに対し、炭酸イオンはほぼ0%である。したがって、炭酸イオン濃度を横軸とし、形成された懸濁液の濃度指標となる物理量を縦軸とする検量線を作成すると、酸性域、中性域では、勾配はほぼ0となり、アルカリ性域で傾きがある検量線が得られる。
【0014】
本発明方法において、懸濁液の濃度指標となる物理量としては、例えば、懸濁液の透過光又は散乱光の強度、懸濁液をろ過する際の透過流束、懸濁液をろ過して得られる沈殿物の湿重量又は乾燥重量などを挙げることができる。これらの中で、懸濁液の透過光又は散乱光の強度は、容易、迅速かつ正確に測定することができるので、好適に用いることができる。図1は、透過光の強度の測定方法の一例の説明図である。光源1から放射された光が、分光器2で単色光に分光されてセル3に入射する。セル内の懸濁液を通過した透過光は、測光部4において受光され、指示記録部5で指示記録される。透過光の強度を測定するための光の波長は、500〜660nmであることが好ましく、600〜660nmであることがより好ましい。透過光の強度の指標として、吸光度を用いることが好ましい。強度I0の光が懸濁液層を透過して強度Iとなったとき、吸光度は A=log10(I0/I) で表される値であり、単色光の波長とセルの光路長が一定であれば、液の濃度に比例するので、数値の解析に好都合である。図2は、散乱光の強度の測定方法の一例の説明図である。懸濁液が液槽6の下部から送り込まれ、上部より溢流する。光源7から放射された光がレンズ8により集光され、液面に入射して散乱する。散乱光が測光部9において受光され、指示記録部10で指示記録される。
【0015】
本発明方法においては、試料水のpHを5未満、5以上10未満及び10以上の範囲内に選ばれる所定の3水準に調整し、pHを調整した3点の試料水にバリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液とすることが好ましい。試料水のpHは、例えば、pH3、pH6、pH13の3水準を選ぶことができる。硫酸イオン濃度xを横軸とし、pH3における懸濁液の吸光度A3Sを縦軸とする検量線をA3S=axとし、同様にpH6及びpH13における懸濁液の吸光度A6S及びA13Sを縦軸とする検量線をA6S=a'x、A13S=a''xとすると、a、a'及びa''の値はほぼ同じである。また、リン酸イオン濃度yを横軸とし、pH3、pH6、pH13における懸濁液の吸光度A3P、A6P、A13Pを縦軸とする検量線をA3P=by、A6P=b'y、A13P=b''yとすると、b、b'及びb''の値はこの順に大きくなり、b、b'に比べてb''は非常に大きくなる。炭酸イオン濃度zを横軸とし、pH3、pH6、pH13における懸濁液の吸光度A3C、A6C、A13Cを縦軸とする検量線をA3C=cy、A6C=c'y、A13C=c''yとすると、c、c'及びc''の値は、c、c'がほぼ0であり、c''が大きくなり、リン酸イオンの場合と異なる。
【0016】
したがって、硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水のpHを3、6、13に調整し、バリウムイオンを含有する水溶液を添加して懸濁液を形成させ、各pHにおける吸光度A3、A6及びA13を測定すると、A3、A6、A13は次の3式で表される。
A3 = ax + by + cz
A6 = a'x + b'y + c'z
A13 = a''x + b''y + c''z
【0017】
この3式からなる三元一次方程式を解くことにより、硫酸イオン濃度x、リン酸イオン濃度y及び炭酸イオン濃度zを求めることができる。a、a'、a''、b、b'、b''、c、c'及びc''の値は、あらかじめ硫酸イオン、リン酸イオン及び炭酸イオンの内の1種のイオンを含むイオン濃度既知の水について、所定の3水準のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液について吸光度を測定して作成した検量線の勾配として求めることができる。
【0018】
本発明方法に用いるバリウムイオンを含有する水溶液に特に制限はなく、例えば、塩化バリウムの水溶液などを挙げることができる。本発明方法において、バリウムイオンの添加量は、予測される硫酸イオン、リン酸イオン及び炭酸イオンの存在量に対して4〜15当量倍であることが好ましく、6〜12当量倍であることがより好ましい。バリウムイオンの添加量が予測される硫酸イオン、リン酸イオン及び炭酸イオンの存在量に対して4当量倍未満であると、試料水中のイオン濃度が大きく変動したときに、沈殿を生成するためのバリウムイオンが不足するおそれがある。バリウムイオンの添加量は、予測される硫酸イオン、リン酸イオン及び炭酸イオンの存在量に対して15当量倍以下で、不溶性のバリウム塩が十分に形成され、通常は、予測される硫酸イオン、リン酸イオン及び炭酸イオンの存在量に対して15当量倍を超えるバリウムイオンを添加する必要はない。濃度指標となる物理量の測定後の懸濁液には、過剰なバリウムイオンが含まれるので、硫酸イオンなどを含む水を添加し、すべて硫酸バリウムなどとして沈殿させたのち処分することが好ましい。
【0019】
本発明のイオン濃度の測定方法の第二の態様においては、試料水中に存在するイオンが、硫酸イオン、リン酸イオン及び炭酸イオンの内の既知の2種であり、試料水のpHを所定の2水準に調整し、pHを調整した2点の試料水にバリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液とし、該2点の懸濁液の濃度指標となる物理量を測定し、あらかじめ試料水中に存在する硫酸イオン、リン酸イオン又は炭酸イオンを含むイオン濃度既知の水について、所定の2水準のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液の濃度指標となる物理量を測定して作成したイオン濃度−物理量の関係を示す検量線の勾配を係数とし、試料水中の2種のイオンの濃度を未知数とする二元一次連立方程式を解くことにより、各イオン濃度を求める。懸濁液の濃度指標となる物理量としては、例えば、懸濁液の透過光又は散乱光の強度、懸濁液をろ過する際の透過流束、懸濁液をろ過して得られる沈殿物の湿重量又は乾燥重量などを挙げることができる。これらの中で、懸濁液の透過光の強度の指標となる吸光度は、容易、迅速かつ正確に測定することができ、懸濁液の濃度に比例するので、特に好適に用いることができる。
【0020】
各種の工程における排水には、不溶性のバリウム塩を生成するイオンが、例えば、硫酸イオン及びリン酸イオンのように既知の2種である場合が多い。このような場合には、本発明方法の第二の態様を好適に適用することができる。硫酸イオンとリン酸イオンが存在する場合には、試料水のpHを5未満と10以上の範囲内に選ばれる所定の2水準、例えば、pH3とpH13に調整した2点の試料水に、バリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液とすることが好ましい。硫酸イオン濃度xを横軸とし、pH3における懸濁液の吸光度A3Sを縦軸とする検量線をA3S=ax、pH13における懸濁液の吸光度A6Sを縦軸とする検量線をA13S=a''xとすると、a及びa''の値はほぼ同じである。また、リン酸イオン濃度yを横軸とし、pH3、pH13における懸濁液の吸光度A3P、A13Pを縦軸とする検量線をA3P=by、A13P=b''yとすると、b''の値はbの値より大きい。
【0021】
したがって、硫酸イオン及びリン酸イオンを含む試料水のpHを3と13に調整し、バリウムイオンを含有する水溶液を添加して懸濁液を形成させ、各pHにおける吸光度A3及びA13を測定すると、A3及びA13は次の2式で表される。
A3 = ax + by
A13 = a''x + b''y
この2式からなる二元一次方程式を解くことにより、硫酸イオン濃度x及びリン酸イオン濃度yを求めることができる。a、a''、b及びb''の値は、あらかじめ硫酸イオン又はリン酸イオンを含むイオン濃度既知の水について、pH3及びpH13においてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液について吸光度を測定して作成した検量線の勾配として求めることができる。
【0022】
硫酸イオンと炭酸イオンが存在する場合には、試料水のpHを5未満と10以上の範囲内に選ばれる所定の2水準、例えば、pH3とpH13に調整した2点の試料水に、バリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液を形成させ、硫酸イオン濃度及び炭酸イオン濃度を測定することができる。炭酸イオンとリン酸イオンが存在する場合には、試料水のpHを5以上10未満と10以上の範囲内に選ばれる所定の2水準、例えば、pH6とpH13に調整した2点の試料水に、バリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液を形成させ、炭酸イオン濃度及びリン酸イオン濃度を測定することができる。
【0023】
本発明のイオン濃度の測定方法の第三の態様においては、リン酸イオンを含有する試料水のpHを10以上の範囲内に選ばれる所定の値に調整し、pHを調整した試料水にバリウムイオンを含有する水溶液を添加してリン酸バリウムが生成した懸濁液とし、懸濁液の濃度指標となる物理量を測定し、あらかじめ試料水中に存在するリン酸イオン濃度既知の水について、所定の値のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液の濃度指標となる物理量を測定して作成したイオン濃度−物理量の関係を示す検量線より、試料水中のリン酸イオン濃度を求める。懸濁液の濃度指標となる物理量に特に制限はないが、容易、迅速かつ正確に測定することができ、懸濁液の濃度に比例する吸光度を好適に用いることができる。
【0024】
本発明方法において、試料水中の各種のイオンとバリウムイオンの反応による不溶性バリウム塩の生成は瞬時に起こるので、フローセルを用いて本発明方法を実施することができる。図3は、フローセルを用いる測定方法の一態様の説明図である。試料水配管11を経由して送られた硫酸イオンとリン酸イオンを含む試料水が、2系統に分岐される。分岐された一方の系統の試料水には、pH調整部12において、酸が添加されpH3に調整される。pH3に調整された試料水は、次いで沈殿析出部13においてバリウムイオンを含有する水溶液が添加され、不溶性のバリウム塩が析出して懸濁液となる。懸濁液はフローセル14に送られて吸光度が測定されたのち、ドレイン配管15からドレインとして排出される。分岐された他方の系統の試料水にはpH調整部16において、アルカリが添加されpH13に調整される。pH13に調整された試料水は、次いで沈殿析出部17においてバリウムイオンを含有する水溶液が添加され、不溶性のバリウム塩が析出して懸濁液となる。懸濁液はフローセル18に送られて吸光度が測定されたのち、ドレイン配管15からドレインとして排出される。フローセル14の測定データとフローセル18の測定データはデータ処理装置に送られ、二元一次連立方程式としてデータ処理がなされ、試料水中の硫酸イオン濃度とリン酸イオン濃度がリアルタイムでアウトプットされる。
【0025】
なお、SS成分やTOC成分は、沈殿の生成に影響を及ぼしたり、測定される物理量自体に影響を及ぼすので、フィルターや活性炭などを用いてあらかじめ除去することが好ましい。
本発明方法によれば、試料水中に存在する硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオン濃度を、簡便、迅速、正確、かつ連続的に測定し、監視することが可能となる。これらのイオンが、水処理、特に凝集沈殿処理に影響を及ぼす場合においては、測定される硫酸イオン、リン酸イオン、炭酸イオンの濃度に基づいて、添加薬品量を制御することができる。なお、測定対象が、リン酸イオンのみであっても、本発明方法は有効であり、アルカリ性域における沈殿物の生成量からリン酸イオン濃度を求めることができる。
【実施例】
【0026】
以下に、実施例を挙げて本発明をさらに詳細に説明するが、本発明はこれらの実施例によりなんら限定されるものではない。
実施例1
(硫酸イオン、リン酸イオン、炭酸イオンとバリウムイオンの反応のpH依存性)
硫酸ナトリウム148mgを水1Lに溶解して、硫酸イオン100mg/Lを含む水溶液を調製した。この水溶液を9個のビーカーに100mLずつ取り分け、塩酸又は水酸化ナトリウム水溶液を添加して、pH3、4、5、6、7、8、10、12、13に調整した。
塩化バリウム20.8gを水に溶解し、水溶液の全量を100mLにして、バリウムイオン137g/Lを含む水溶液を調製した。
pH3に調整した硫酸ナトリウム水溶液100mLに、上記の塩化バリウム水溶液1mLを添加して撹拌し、硫酸バリウムの沈殿を析出させた。沈殿をろ別して105℃で3時間乾燥すると、硫酸バリウム24.3mgが得られた。硫酸イオンの反応率は、100%であった。
pH4、5、6、7、8、10、12、13に調整した硫酸ナトリウム水溶液にも、同様にして、塩化バリウム水溶液を添加して硫酸バリウムの沈殿を析出させ、ろ別、乾燥、秤量して、硫酸イオンの反応率を求めた。結果を、図4に示す。pH3〜13の全領域において、硫酸イオンのほぼ全量がバリウムイオンと反応していることが分かる。
リン酸二水素ナトリウム126mgを水1Lに溶解して、リン酸イオン100mg/Lを含む水溶液を調製した。この水溶液を9個のビーカーに100mLずつ取り分け、塩酸又は水酸化ナトリウム水溶液を添加して、pH3、4、5、6、7、8、10、12、13に調整した。
pH3に調整したリン酸二水素ナトリウム水溶液100mLに、上記のバリウムイオン137g/Lを含む塩化バリウム水溶液1mLを添加して撹拌し、リン酸バリウムの沈殿を析出させた。沈殿をろ別して105℃で3時間乾燥すると、リン酸水素バリウム1.2mgが得られた。リン酸イオンの反応率は、5%であった。
pH4、5、6、7、8、10、12、13に調整したリン酸二水素ナトリウム水溶液にも、同様にして、塩化バリウム水溶液を添加してリン酸バリウムの沈殿を析出させ、ろ別、乾燥、秤量して、リン酸イオンの反応率を求めた。結果を、図5に示す。リン酸イオンの反応率は、pH3では5%であり、pHの上昇とともに反応率が上昇し、pH13ではほぼ全量がバリウムイオンと反応することが分かる。
炭酸水素ナトリウム140mgを水1Lに溶解して、炭酸イオン100mg/Lを含む水溶液を調製した。この水溶液を9個のビーカーに100mLずつ取り分け、塩酸又は水酸化ナトリウム水溶液を添加して、pH3、4、5、6、7、8、10、12、13に調整した。
pH3に調整した炭酸水素ナトリウム水溶液100mLに、上記のバリウムイオン137g/Lを含む塩化バリウム水溶液1mLを添加して撹拌し、炭酸バリウムの沈殿を析出させた。沈殿をろ別して105℃で3時間乾燥すると、炭酸バリウム0.1mg以下が得られた。炭酸イオンの反応率は、0.3%以下であった。
pH4、5、6、7、8、10、12、13に調整した炭酸水素ナトリウム水溶液にも、同様にして、塩化バリウム水溶液を添加して炭酸バリウムの沈殿を析出させ、ろ別、乾燥、秤量して、炭酸イオンの反応率を求めた。結果を、図6に示す。炭酸イオンは、pH7以下ではバリウムイオンとほとんど反応せず、pHが7を超えると反応がはじまり、pHの上昇とともに反応率が上昇し、pH13ではほぼ全量がバリウムイオンと反応することが分かる。
【0027】
実施例2(検量線の作成)
実施例1と同様にして、硫酸イオン25mg/L、50mg/L又は100mg/Lを含む硫酸ナトリウム水溶液を調製し、それぞれ3個のビーカーに100mLずつ取り分けた。硫酸イオン25mg/Lを含む水溶液、硫酸イオン50mg/Lを含む水溶液、硫酸イオン100mg/Lを含む水溶液を、塩酸又は水酸化ナトリウム水溶液を用いて、それぞれpH3、pH6又はpH13に調整した。
pH3に調整した硫酸イオン25mg/Lを含む水溶液に、実施例1と同様にして、バリウムイオン137g/Lを含む塩化バリウム水溶液1mLを添加して撹拌し、硫酸バリウムの沈殿が析出した懸濁液とした。この懸濁液を光路長5mmのセルに入れ、分光光度計[(株)島津製作所、UV−3600]を用いて、波長660nmで吸光度を測定した。吸光度は、0.016であった。pH3に調整した硫酸イオン50mg/Lを含む水溶液と硫酸イオン100mg/Lを含む水溶液について、同様に処理したところ、吸光度はそれぞれ0.039と0.178であった。
pH6に調整した硫酸イオンを含む水溶液と、pH13に調整した硫酸イオンを含む水溶液についても、同様にして塩化バリウム水溶液を添加して懸濁液とし、吸光度を測定した。pH6、硫酸イオン25mg/Lを含む水溶液から得られた懸濁液の吸光度は0.019、pH6、硫酸イオン50mg/Lを含む水溶液から得られた懸濁液の吸光度は0.041、pH6、硫酸イオン100mg/Lを含む水溶液から得られた懸濁液の吸光度は0.181であった。pH13、硫酸イオン25mg/Lを含む水溶液から得られた懸濁液の吸光度は0.021、pH13、硫酸イオン50mg/Lを含む水溶液から得られた懸濁液の吸光度は0.043、pH13、硫酸イオン100mg/Lを含む水溶液から得られた懸濁液の吸光度は0.183であった。
リン酸イオン及び炭酸イオンについても、同様にして、イオン濃度25mg/L、50mg/L、100mg/Lの水溶液を、pH3、pH6、pH13に調整し、塩化バリウム水溶液を添加して懸濁液とし、吸光度を測定した。得られた吸光度の値及び検量線の勾配を第1表に示し、検量線を図7に示す。
【0028】
【表1】

【0029】
実施例3(硫酸イオンとリン酸イオンの分析)
硫酸ナトリウム148mgとリン酸二水素ナトリウム63mgを水1Lに溶解して、硫酸イオン100mg/Lとリン酸イオン50mg/Lを含む水溶液を調製した。2個のビーカーにこの水溶液100mLずつを取り、一方を塩酸を用いてpH3に、他方を水酸化ナトリウム水溶液を用いてpH13に調整した。それぞれのビーカーに、実施例1と同じバリウムイオン137g/Lを含む塩化バリウム水溶液1mLを添加して撹拌し、沈殿が析出した懸濁液とした。この懸濁液を光路長5mmのセルに入れ、分光光度計[(株)島津製作所、UV−3600]を用いて、波長660nmで吸光度を測定した。pH3に調整した水溶液から得られた懸濁液の吸光度は0.153であり、pH13に調整した水溶液から得られた懸濁液の吸光度は0.234であった。
水溶液中の硫酸イオンの濃度をx(mg/L)、リン酸イオンの濃度をy(mg/L)とし、第1表に示す検量線の勾配を係数として連立方程式をたてると、次の式が得られる。
0.00150x + 0.00012y = 0.153
0.00160x + 0.00160y = 0.234
この連立方程式を解くと、x = 98.2、y = 48.1となる。
硫酸ナトリウム148mgとリン酸二水素ナトリウム126mgを水1Lに溶解し、硫酸イオン100mg/Lとリン酸イオン100mg/Lを含む水溶液を調製し、同様にしてpH3とpH13に調整し、バリウム塩が析出した懸濁液として吸光度を測定した。pH3に調整した水溶液から得られた懸濁液の吸光度は0.159であり、pH13に調整した水溶液から得られた懸濁液の吸光度は0.312であった。
水溶液中の硫酸イオンの濃度をx(mg/L)、リン酸イオンの濃度をy(mg/L)として連立方程式をたてると、次の式が得られる。
0.00150x + 0.00012y = 0.159
0.00160x + 0.00160y = 0.312
この連立方程式を解くと、x = 98.3、y = 96.7となる。
硫酸ナトリウム74mgとリン酸二水素ナトリウム126mgを水1Lに溶解して、硫酸イオン50mg/Lとリン酸イオン100mg/Lを含む水溶液を調製し、同様にしてpH3とpH13に調整し、バリウム塩が析出した懸濁液として吸光度を測定した。pH3に調整した水溶液から得られた懸濁液の吸光度は0.089であり、pH13に調整した水溶液から得られた懸濁液の吸光度は0.242であった。
水溶液中の硫酸イオンの濃度をx(mg/L)、リン酸イオンの濃度をy(mg/L)として連立方程式をたてると、次の式が得られる。
0.00150x + 0.00012y = 0.089
0.00160x + 0.00160y = 0.242
この連立方程式を解くと、x = 98.1、y = 97.1となる。
硫酸ナトリウム148mgを水1Lに溶解して、硫酸イオン100mg/Lを含む水溶液を調製し、同様にしてpH3とpH13に調整し、バリウム塩が析出した懸濁液として吸光度を測定した。pH3に調整した水溶液から得られた懸濁液の吸光度は0.150であり、pH13に調整した水溶液から得られた懸濁液の吸光度も0.160であった。
水溶液中の硫酸イオンの濃度をx(mg/L)、リン酸イオンの濃度をy(mg/L)として連立方程式をたてると、次の式が得られる。
0.00150x + 0.00012y = 0.150
0.00160x + 0.00160y = 0.160
この連立方程式を解くと、x = 100.0、y = 0.0となる。
リン酸二水素ナトリウム63mgを水1Lに溶解して、リン酸イオン50mg/Lを含む水溶液を調製し、同様にしてpH3とpH13に調整し、バリウム塩が析出した懸濁液として吸光度を測定した。pH3に調整した水溶液から得られた懸濁液の吸光度は0.007であり、pH13に調整した水溶液から得られた懸濁液の吸光度は0.080であった。
水溶液中の硫酸イオンの濃度をx(mg/L)、リン酸イオンの濃度をy(mg/L)として連立方程式をたてると、次の式が得られる。
0.00150x + 0.00012y = 0.007
0.00160x + 0.00160y = 0.080
この連立方程式を解くと、x = 0.5、y = 49.3となる。
リン酸二水素ナトリウム126mgを水1Lに溶解して、リン酸イオン100mg/Lを含む水溶液を調製し、同様にしてpH3とpH13に調整し、バリウム塩が析出した懸濁液として吸光度を測定した。pH3に調整した水溶液から得られた懸濁液の吸光度は0.012であり、pH13に調整した水溶液から得られた懸濁液の吸光度は0.160であった。
水溶液中の硫酸イオンの濃度をx(mg/L)、リン酸イオンの濃度をy(mg/L)として連立方程式をたてると、次の式が得られる。
0.00150x + 0.00012y = 0.012
0.00160x + 0.00160y = 0.160
この連立方程式を解くと、x = 0.0、y = 100.0となる。
実施例3の結果を、第2表に示す。
【0030】
【表2】

【0031】
第2表に見られるように、本発明方法により測定されたイオン濃度と、試料水中のイオン濃度の差はきわめて小さく、本発明方法により、硫酸イオンとリン酸イオンが共存する試料水又はいずれか一方のイオンが存在する試料水について、イオン濃度を迅速かつ正確に測定し得ることが分かる。
実施例4(硫酸イオン、リン酸イオン及び炭酸イオンの分析)
硫酸ナトリウム74mg、リン酸二水素ナトリウム50.5mg及び炭酸水素ナトリウム56mgを水1Lに溶解して、硫酸イオン50mg/L、リン酸イオン40mg/L及び炭酸イオン40mg/Lを含む水溶液を調製した。3個のビーカーにこの水溶液100mLずつを取り、pH3、pH6及びpH13に調整した。それぞれのビーカーに、実施例1と同じバリウムイオン137g/Lを含む塩化バリウム水溶液1mLを添加して撹拌し、沈殿が析出した懸濁液とした。この懸濁液を光路長5mmのセルに入れ、分光光度計[(株)島津製作所、UV−3600]を用いて、波長660nmで吸光度を測定した。pH3に調整した水溶液から得られた懸濁液の吸光度は0.079であり、pH6に調整した水溶液から得られた懸濁液の吸光度は0.086であり、pH13に調整した水溶液から得られた懸濁液の吸光度は0.310であった。
水溶液中の硫酸イオンの濃度をx(mg/L)、リン酸イオンの濃度をy(mg/L)、炭酸イオンの濃度をz(mg/L)とし、第1表に示す検量線の勾配を係数として連立方程式をたてると、次の式が得られる。
0.00150x + 0.00012y + 0.00000z = 0.079
0.00160x + 0.00018y + 0.00000z = 0.086
0.00160x + 0.00160y + 0.00408z = 0.310
この連立方程式を解くと、x = 49.2、y = 39.7、z = 41.0となる。
同様にして、硫酸ナトリウム、リン酸二水素ナトリウム及び炭酸水素ナトリウムを水に溶解し、硫酸イオン20mg/L、リン酸イオン40mg/L及び炭酸イオン40mg/Lを含む水溶液、硫酸イオン50mg/L、リン酸イオン15mg/L及び炭酸イオン40mg/Lを含む水溶液、及び、硫酸イオン50mg/L、リン酸イオン40mg/L及び炭酸イオン15mg/Lを含む水溶液を調製した。
それぞれの水溶液を、pH3、pH6又はpH13に調整し、塩化バリウム水溶液を添加して、沈殿が析出した懸濁液とし、吸光度を測定し、三元一次連立方程式を解くことにより、各イオンの濃度を求めた。
実施例4の結果を、第3表に示す。
【0032】
【表3】

【0033】
第3表に見られるように、本発明方法により測定されたイオン濃度と、試料水中のイオン濃度の差はきわめて小さく、本発明方法により、硫酸イオン、リン酸イオン及び炭酸イオンが共存する試料水について、イオン濃度を迅速かつ正確に測定し得ることが分かる。
【産業上の利用可能性】
【0034】
本発明のイオン濃度の測定方法により、硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種を含む試料水中の各イオン濃度を、複雑な工程を経ることなく、簡便、迅速、正確かつ連続的に測定することができる。本発明方法を水処理、特に凝集沈殿処理を伴う水処理に適用することにより、水質監視や薬品添加量の制御を伴う高度な水質管理を行うことが可能となる。
【図面の簡単な説明】
【0035】
【図1】透過光の強度の測定方法の一例の説明図である。
【図2】散乱光の強度の測定方法の一例の説明図である。
【図3】フローセルを用いる測定方法の一態様の説明図である。
【図4】硫酸イオンのバリウムイオンとの反応率とpHの関係を示すグラフである。
【図5】リン酸イオンのバリウムイオンとの反応率とpHの関係を示すグラフである。
【図6】炭酸イオンのバリウムイオンとの反応率とpHの関係を示すグラフである。
【図7】硫酸イオン、リン酸イオン及び炭酸イオンの検量線である。
【符号の説明】
【0036】
1 光源
2 分光器
3 セル
4 測光部
5 指示記録部
6 液槽
7 光源
8 レンズ
9 測光部
10 指示記録部
11 試料水配管
12 pH調整部
13 沈殿析出部
14 フローセル
15 ドレイン配管
16 pH調整部
17 沈殿析出部
18 フローセル
【特許請求の範囲】
【請求項1】
硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水中の各イオン濃度の測定方法であって、試料水のpHを所定の3水準に調整し、pHを調整した3点の試料水にバリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液とし、該3点の懸濁液の濃度指標となる物理量を測定し、あらかじめ硫酸イオン、リン酸イオン及び炭酸イオンの内の1種のイオンを含むイオン濃度既知の水について、所定の3水準のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液の濃度指標となる物理量を測定して作成したイオン濃度−物理量の関係を示す検量線の勾配を係数とし、試料水中の硫酸イオン、リン酸イオン及び炭酸イオンの濃度を未知数とする三元一次連立方程式を解くことにより、各イオン濃度を求めることを特徴とするイオン濃度の測定方法。
【請求項2】
所定の3水準のpHが、pH5未満、pH5以上10未満及びpH10以上の範囲内でそれぞれ選択される請求項1記載のイオン濃度の測定方法。
【請求項3】
懸濁液の濃度指標となる物理量が、透過光又は散乱光の強度である請求項1記載のイオン濃度の測定方法。
【請求項4】
試料水中に存在するイオンが、硫酸イオン、リン酸イオン及び炭酸イオンの内の既知の2種であり、試料水のpHを所定の2水準に調整し、pHを調整した2点の試料水にバリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液とし、該2点の懸濁液の濃度指標となる物理量を測定し、あらかじめ試料水中に存在する硫酸イオン、リン酸イオン又は炭酸イオンを含むイオン濃度既知の水について、所定の2水準のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液の濃度指標となる物理量を測定して作成したイオン濃度−物理量の関係を示す検量線の勾配を係数とし、試料水中の2種のイオンの濃度を未知数とする二元一次連立方程式を解くことにより、各イオン濃度を求めることを特徴とするイオン濃度の測定方法。
【請求項5】
懸濁液の濃度指標となる物理量が、透過光又は散乱光の強度である請求項4記載のイオン濃度の測定方法。
【請求項6】
リン酸イオンを含有する試料水のpHを10以上の範囲内に選ばれる所定の値に調整し、pHを調整した試料水にバリウムイオンを含有する水溶液を添加してリン酸バリウムが生成した懸濁液とし、懸濁液の濃度指標となる物理量を測定し、あらかじめ試料水中に存在するリン酸イオン濃度既知の水について、所定の値のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液の濃度指標となる物理量を測定して作成したイオン濃度−物理量の関係を示す検量線より、試料水中のリン酸イオン濃度を求めることを特徴とするイオン濃度の測定方法。
【請求項1】
硫酸イオン、リン酸イオン及び炭酸イオンの内の1〜3種のイオンを含む試料水中の各イオン濃度の測定方法であって、試料水のpHを所定の3水準に調整し、pHを調整した3点の試料水にバリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液とし、該3点の懸濁液の濃度指標となる物理量を測定し、あらかじめ硫酸イオン、リン酸イオン及び炭酸イオンの内の1種のイオンを含むイオン濃度既知の水について、所定の3水準のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液の濃度指標となる物理量を測定して作成したイオン濃度−物理量の関係を示す検量線の勾配を係数とし、試料水中の硫酸イオン、リン酸イオン及び炭酸イオンの濃度を未知数とする三元一次連立方程式を解くことにより、各イオン濃度を求めることを特徴とするイオン濃度の測定方法。
【請求項2】
所定の3水準のpHが、pH5未満、pH5以上10未満及びpH10以上の範囲内でそれぞれ選択される請求項1記載のイオン濃度の測定方法。
【請求項3】
懸濁液の濃度指標となる物理量が、透過光又は散乱光の強度である請求項1記載のイオン濃度の測定方法。
【請求項4】
試料水中に存在するイオンが、硫酸イオン、リン酸イオン及び炭酸イオンの内の既知の2種であり、試料水のpHを所定の2水準に調整し、pHを調整した2点の試料水にバリウムイオンを含有する水溶液を添加して不溶性バリウム塩が生成した懸濁液とし、該2点の懸濁液の濃度指標となる物理量を測定し、あらかじめ試料水中に存在する硫酸イオン、リン酸イオン又は炭酸イオンを含むイオン濃度既知の水について、所定の2水準のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液の濃度指標となる物理量を測定して作成したイオン濃度−物理量の関係を示す検量線の勾配を係数とし、試料水中の2種のイオンの濃度を未知数とする二元一次連立方程式を解くことにより、各イオン濃度を求めることを特徴とするイオン濃度の測定方法。
【請求項5】
懸濁液の濃度指標となる物理量が、透過光又は散乱光の強度である請求項4記載のイオン濃度の測定方法。
【請求項6】
リン酸イオンを含有する試料水のpHを10以上の範囲内に選ばれる所定の値に調整し、pHを調整した試料水にバリウムイオンを含有する水溶液を添加してリン酸バリウムが生成した懸濁液とし、懸濁液の濃度指標となる物理量を測定し、あらかじめ試料水中に存在するリン酸イオン濃度既知の水について、所定の値のpHにおいてバリウムイオンを含有する水溶液を添加して懸濁液とし、該懸濁液の濃度指標となる物理量を測定して作成したイオン濃度−物理量の関係を示す検量線より、試料水中のリン酸イオン濃度を求めることを特徴とするイオン濃度の測定方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2006−266698(P2006−266698A)
【公開日】平成18年10月5日(2006.10.5)
【国際特許分類】
【出願番号】特願2005−81141(P2005−81141)
【出願日】平成17年3月22日(2005.3.22)
【出願人】(000001063)栗田工業株式会社 (1,536)
【Fターム(参考)】
【公開日】平成18年10月5日(2006.10.5)
【国際特許分類】
【出願日】平成17年3月22日(2005.3.22)
【出願人】(000001063)栗田工業株式会社 (1,536)
【Fターム(参考)】
[ Back to top ]

