イヌ感染性呼吸器疾患(CIRD)に対してイヌにワクチン接種するためのワクチン組成物
(a)イヌにおいてStreptococcus equi亜種zooepidemicusに対する免疫応答を生じることが可能である作用物質;(b)イヌにおいてMycoplasma cynosに対する免疫応答を生じることが可能である作用物質;及び(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質のいずれか1以上を含むイヌにワクチン接種をするためのワクチン組成物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はワクチン組成物に関するものであり、特に、イヌ感染性呼吸器疾患に対して使用するためにワクチン組成物に関する。
【背景技術】
【0002】
イヌ感染性呼吸器疾患(CIRD)は、リホーミング施設及び搭乗用犬舎又は訓練用犬舎のような混み合った条件で飼われているイヌに共通する伝染性の高い疾患である。多数のイヌは軽い咳のみを病み、短期間で回復するが、重篤な気管支肺炎を発生しうる場合もある(Appel & Binn, 1987)。CIRDは稀にしか死に至ることはないが、救護施設のイヌのリホーミングを遅らせ、訓練用犬舎のスケジュールを中断させると共に、相当な治療コストを生じる。
【0003】
CIRDの病態発生は、幾つかのウイルス及び細菌が関与する多因子性であるとみなされている。原因となる主な病原体であるとみなされている作用物質は、イヌパラインフルエンザウイルス(CPIV)(Binn et al., 1967)、イヌアデノウイルス2型(CAV−2)(Ditchifield et al., 1962)、及びイヌヘルペスウイルス(CHV)(Karpas et al., 1968a & 1986b)、イヌ呼吸器コロナウイルス(CRCV)(WO 2004/011651 (The Royal Veterinary College); Erles et al., 2003)、及び細菌、Bordetella bronchiseptica(B.bronchiseptica(Bemis et al., 1977a; Keil et al., 1998)である。
【0004】
これらのウイルス及び細菌は発生している間に単離されるとこが多く、実験的感染において呼吸器症状又は肺病変を生じることが示されている(Appel & Percy, 1970; Swango et al., 1970; Karpas et al., 1986b)。
【0005】
また、CIRDの症状を持つイヌからヒトのレオウイルス及びマイコプラズマの種が単離されている(Lou & Wenner 1963; Randolph et al., 1993)。ストレスのような追加的因子も重要であってもよい。
【0006】
B.bronchisepticaは、呼吸器疾患「犬舎咳」における主な病因菌であるとして報告された(Bemis et al., 1977b; Thompson et al., 1976)。それによって、イヌはそのほかの呼吸器病因の影響を受けやすくなり、それはそれらと同時に存在することが多い。伝染力の強いB.bronchisepticaで感作することにより犬舎咳を再生することができる。さらに、寒い、隙間風及び高い湿度のような環境因子は、犬舎での典型的な条件であることが多いが、疾患への感受性を高める(Ellis et al., 2001)。抗体は、一次疾患を治療するための弱い作用物質として一般に認識される(Ellis et al., 2001)。それに対して、B.bronchisepticaに対する免疫予防法は、疾患の制御に役立つ相対的に有効な手段を提供する。
【0007】
B.bronchiseptica感染の際立った徴候は、活動又は興奮によって悪化する荒い、乾いた咳である。激しい咳の発作が生じ、咽喉からの少量の粘液を除こうとする吐き気又は嘔吐がそれに続く。二次的な細菌の侵襲が起きるにつれて体温が上昇してもよい。犬舎咳は伝染性が高いので、疾患は、感受性のイヌに容易に伝染することができ、重度の咳を生じることができる。最も重度の徴候は、感染後2〜5日目に見られ始めるが、延長した期間継続しうる。ストレス、特に有害な環境条件は、疾患の後期段階の間に再発を引き起こす可能性がある。
【0008】
犬舎咳は通常、上部気道の症状であり、鼻汁及び咳き込みを特徴とする。犬舎咳は主として上部気道の変化が関与するが、CIRDの病理学は、それが肺の損傷、場合によっては気管支肺炎に関与することを示している。犬舎咳は、CIRDより軽い症候群であり、CIRDで見られる幅広い範囲の病態を有さない。重症度及び死亡率の上昇によってもCIRDは識別される。
【0009】
CIRDは、軽い疾患から致死的な疾患までの範囲で呼吸器の徴候を示すイヌにおける症候群である。それは、炎症性から滲出性、浮腫性、時に、肺組織内で広く広がりうる出血性の病態の進行を伴った上部及び下部の気道の感染の関与を特徴とする。CIRDはまた、B.bronchisepticaの非存在下でも生じることができ、実際、検出可能なB.bronchisepticaを有さないのにCIRDに罹るイヌがあり、それは、犬舎咳とCIRDが識別可能な感染であることを示している。
【0010】
我々はまた、呼吸器疾患にはそのほかの作用物質が関与すると結論付ける一方で、B.bronchisepticaと呼吸器疾患の関係も確認している(Chalker et al., 2006)。
【発明の開示】
【発明が解決しようとする課題】
【0011】
我々は今やまた、Streptococcus equi亜種zooepidermicus(実施例1を参照のこと)、Mycoplasma cynos(実施例2を参照のこと)、及びChlamydophila(実施例3を参照のこと)がCIRDに関係することを示している。我々の試験集団のイヌはすべて、CPIV及びCAV−2に対するワクチン接種をしたので、我々は、これらのウイルスのCIRDへの関与を支持する新しいデータを有していない。しかしながら、我々はまた、さらに重度の呼吸器症状を伴ったイヌにおけるイヌヘルペスウイルスの罹患率の上昇も見い出した(実施例4を参照のこと)。
【0012】
Streptococcus equi亜種zooepidermicus(S.zooepidemicus)は、ウマからのみではなく、種々の動物宿主から頻繁に単離される日和見病原体である。それは哺乳類の上部気道粘膜の共生生物として見い出されることが多く(Timoney et al., 1988; Quinn et al., 1999)、下部気道疾患、ウマにおける巣状肺炎及び子宮頸管炎(Chanter et al., 1997; Biberstein & Hirshm 1999)、ラマにおける肺炎(Biberstein & Hirshm 1999)、ブタにおける敗血症及び関節炎(Timoney, 1987)、ウシ及びヤギにおける乳腺炎(Timoney et al., 1988)、ニワトリにおける敗血症、ラマにおける心膜炎及び肺炎(Timoney, 1987)、モルモットにおけるリンパ節炎(Quinn et al., 1999)、ヒトにおける糸球体腎炎(Blalter et al., 2000)及びヒトにおける髄膜炎(Ural et al., 2003)を含む幾つかの疾患症候群に関係している。イヌでは、S.zooepidemicusは、創傷感染及び敗血症(Quinn et al., 1999)及び急性壊死性出血性肺炎(Gamett et al., 1982)に関係している。
【0013】
出血性連鎖球菌肺炎(HSP)の後期におけるイヌは、CIRDのイヌと組織学的特徴の幾つかを共有しているが、早期ではこのようなことはなく(Chalker et al., 2003を参照のこと)、HSPでは敗血性の血栓が存在する(Gamett et al., 1982)。HSPは、ほとんどの場合、臨床的徴候なしで致死的な急激な発症を有するが、CIRDでは、我々は、鼻汁、咳き込み、くしゃみ、吐き気、食欲不振、肺炎及び気管支肺炎のような幅広い範囲の臨床的な徴候と共に緩慢な発症を見ている。
【0014】
Mycoplasma cynos(M.cynos)は、イヌの尿路感染症に関係している(Jang et al., 1984)。それはまた、ジステンパーのイヌの肺でも同定されており(Rosendal, 1978)、M.cynosの気管支内接種はイヌで肺炎を誘発することが判っている(Rosendal & Vinther, 1977)。
【0015】
Rosendal(1978)によって記載されたイヌジステンパーは、ジステンパーウイルス、種々のマイコプラズマ及び細菌Pseudomonasによる感染に続く複合疾患である。これは微生物による感作の強力な組み合わせであり、当然、結果として肺炎を生じる。Mycoplasma sppによる病態の比率ははっきりしなかった。M.cynosによるそれに続く感作は、接種した5匹のうち4匹で小さな局所の炎症病変が見られたが、病気の徴候がないことを特徴とした。この症候群におけるM.cynosの意味は、Rosendalが述べたように「評価するのが難しい」だった。
【0016】
CIRDに関係するChlamydophila種は、23SrRNA遺伝子における218のヌクレオチド配列の比較によってChlamydophila aborus(C.aborus)に極めて密接に関係している。このChlamydophila種におけるこの領域のヌクレオチド配列(配列番号1)は、C.aborusと99%以上同一であり、Chlamydophila psiticasiと98.6%同一であり、Chlamydophila felisと96.3%同一である。
【0017】
Chlamydophila種は、CIRDのイヌの気管及び肺で同定された。それに対して、C.aborusによる感染は通常、繁殖性障害に関係しており、特にヒツジでは望まない流産を招くことが多い。C.aborusは、イヌでは呼吸器感染に役割を有するとしては以前記載されていない。
【0018】
イヌに感染するChlamydiae種に関する出版物はほとんどないので、イヌのChlamydiae種の生物多様性はほとんど知られていない。最近、Chlamydiae pneumoniae(C.pneumoniae)がイヌのアテローム性硬化症に関係していた(Sako et al., 2002)。同定されていなかったChlamydiae sppも敗血性多発性関節炎のイヌで同定された(Lambrechts et al., 1999)。
【0019】
C.psiticasiは、以前、飼いイヌの糞便、脳、肝臓、脾臓、腎臓及び肺の組織から単離された(Arizmendi et al., 1992; Fraser et al., 1985; Gresham et al., 1996)。研究によれば、ドイツのペット犬集団の20%及び日本では10%がChlamydiaeaeに暴露され、それに対する抗体を生じている(Werth et al., 1987; Fukushi et al., 1985)。英国におけるC.psiticasiの血清陽性のイヌの罹患率は知られていない(Gresham et al., 1996)。C.psiticasiに感染したイヌは、やや臨床的な、慢性の感染、アテローム性硬化症、関節炎、結膜炎又は呼吸器疾患さえも発生する可能性がある(Gresham et al., 1996; Storz, 1988)。Gresham et al., (1996)は、症状はCIRDほど重度ではなかったが、呼吸器疾患の症状を持つイヌからC.psiticasiを単離した。イヌは潜在的な保菌者であってもよく、従ってヒトのChlamydiae感染の疫学において重要であることが示唆されている(Gresham et al., 1996; Werth, 1989)。自然感染したイヌからのC.psiticasiの細胞培養における単離を記録したたった一例(Arizmendi et al., 1992)及び実験的に感染させたイヌからの単離の一例がある(Young et al., 1972)。
【0020】
CPIV及びCAV−2と同様に、CIRDに関係する感染性作用物質の一部、すなわち、B.bronchisepticaに対してワクチンが利用可能である。しかしながら、これらのワクチンの使用にもかかわらず、CIRDは世界中の犬舎で依然として流行しており、それは、おそらく、CIRDに関与するすべての感染性作用物質に対して防御を提供しないワクチンのせいである。
【課題を解決するための手段】
【0021】
従って、本発明の第1の側面は、以下の1以上を含むイヌにワクチン接種するためのワクチン組成物を提供する。
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
【0022】
該組成物は、これら作用物質の任意の2つ、たとえば、(a)と(b)、(a)と(c)又は(b)と(c)を含有してもよいことが十分理解される。組成物は、これら作用物質3つすべて(a)、(b)及び(c)を含有してもよい。
【0023】
イヌにおいて特定の生物に対して免疫応答を生じることが可能である作用物質によって、我々は、免疫不全でない又は免疫抑制されていないイヌに投与した場合、作用物質がイヌの免疫系を誘導して該生物に特異的に結合する抗体を生じるという意味を包含する。従って、作用物質は、特定の生物に対して防御的免疫応答を誘導することが可能である。
【0024】
好ましくは、従って、産生される抗体は、個体におけるいかなるほかの分子よりも大きな親和性で特定の生物を特異的に結合する。好ましくは、抗体は、個体におけるいかなるほかの分子よりも少なくとも2倍、又は少なくとも5倍、又は少なくとも10倍又は少なくとも50倍大きな親和性で特定の生物を結合する。さらに好ましくは、抗体は、個体におけるいかなるほかの分子よりも、少なくとも100倍、又は少なくとも1,000倍又は少なくとも10,000倍大きな親和性で特定の生物を結合する。
【0025】
イヌにおいて特定の生物に対して免疫応答を生じることが可能である作用物質によって、我々は、免疫不全でない又は免疫抑制されていないイヌに投与した場合、作用物質がイヌの免疫系を誘導して、該生物から分泌されるタンパク質のような高分子に特異的に結合する抗体を産生するという意味も包含する。抗体は、毒素又は溶血素のような分泌された高分子を特異的に結合し、それを不活化するので、宿主における病態変化及び疾患の重症度を軽減し、従って宿主が感染を克服することができる。従って、イヌにおいて特定の生物に対して免疫応答を生じることが可能である作用物質によって、我々は、分泌された高分子のような該生物の一部に対して免疫応答を生じることが可能である作用物質を包含する。
【0026】
通常、イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質は、不活化した又は弱毒化したS.zooepidemicus、又はS.zooepidemicusの免疫原性の断片、若しくはその派生物、又は前記断片若しくは前記派生物をコードする核酸(その場合、前記断片又は前記派生物はポリペプチドを含む)を含む。
【0027】
Streptococcus equi亜種zooepidermicusは、NCTC(寄託番号4646.S34)、ATCC(寄託番号43079)及びナショナル・コレクション・オブ・デイリー・オーガニズムズ(NCDO)(寄託番号1358)に寄託されており、Farrow et al. (1984)によって記載されている。
【0028】
ワクチンの「不活化された」成分によって、我々は、細菌、マイコプラズマ又はウイルスのような特定のワクチン成分が、疾患を誘発する能力を取り除くが、依然として防御的免疫を呼び起こす能力を保持するような方法で処理されているという意味を包含する。「不活化された」ワクチン成分によって、我々は殺した生物を包含する。
【0029】
ワクチンに使用するために細菌、マイコプラズマ又はウイルスのような生物を不活化し、殺す方法は当該技術で周知であり、以下に記載されるように、たとえば、イヌのワクチン用の成分の一部の調製に使用されている。
【0030】
ワクチンを調製するために微生物を不活化する方法は幾つかある。最も簡単な方法は、熱で殺すこと(たとえば、ウイルスを58℃で30分間加熱すること;細菌を5分間煮沸すること又は65℃で1時間加熱すること)又はホルマリンと混合して殺すことである。様々な化学薬品によって、又はUV光による処理によっても微生物を殺すことができる。
【0031】
ワクチンの弱毒化した成分によって、我々は、細菌、マイコプラズマ又はウイルスのような特定のワクチン成分が、疾患を誘発する能力を大きく減じているが、依然として防御的免疫を呼び起こす能力を保持するような方法で選択される、さもなければ処理されるという意味を包含する。
【0032】
ワクチンに使用するために細菌、マイコプラズマ又はウイルスのような生物を弱毒化する方法は当該技術で周知であり、以下に記載されるように、たとえば、イヌのワクチン用の成分の一部の調製に使用されている。
【0033】
異なった設定での、すなわち、ウイルス又はChlamydophilaについては細胞培養、及び細菌については固体培地上又は異なった宿主で、病原性の低下が見られるまでの引き延ばした継代によって微生物を弱毒化することができる。或いは、細菌の病原性に関与する特定の遺伝子に点突然変異を起こす、又はそれを欠失させ、従って生物の病原能力を限定させることができ、又は生物が、動物宿主には存在しない化学物質について特異的な要求を有し、従って、宿主中では複製できず、仮にも生き残れないように生物に変異を起こさせることができる。化学物質処理及びUV光処理によってゲノムに点突然変異を生じることによっても細菌において弱毒化を行うことができる。
【0034】
S.zooepidemicusの免疫原性の断片は、イヌにおいて防御的免疫応答を生じることが可能である、S.zooepidemicusのいかなる断片でもあってもよい。従って、S.zooepidemicusの免疫原性の断片を、免疫不全ではない又は免疫抑制されていないイヌに投与した場合、それは、イヌの免疫系を誘導してS.zooepidemicusに特異的に結合する抗体を産生する。
【0035】
通常、特定の生物の免疫原性の断片は、その生物のタンパク質成分である。生物の「タンパク質成分」によって、我々は、タンパク質全体又はタンパク質の一部の意味を包含する。タンパク質断片がグリコシル化されていてもよく、又はされていなくてもよいことが十分理解される。従って、「タンパク質」によって、我々は糖タンパク質も包含する。糖タンパク質のアミノ酸配列は、それに結合する糖の種類、数、配列及び位置にかかわりなく、ポリペプチド主鎖のアミノ酸配列を言う。
【0036】
S.zooepidemicusのタンパク質には、細胞表面タンパク質前駆体(ジェンバンク、受入番号AAA86832及びBAD00711)、Cpn60(ジェンバンク、受入番号AAM88472)、M様タンパク質(ジェンバンク、受入番号AAP33082、AAP33081、AAP33080、AAP33079、AAP22285、AAB92635、AAB92634、AAB92633、AAB92631、AAB92630、AAB92629、AAB92628、AAB92627、AAB92626、AAB92625、AAB92624、AAB92623、AAB92622、2111310A及びBAD00712)、M様タンパク質前駆体(ジェンバンク、受入番号AAD37432)、M様タンパク質Szp2前駆体(ジェンバンク、受入番号AAF75674)、M様タンパク質Szp3前駆体(ジェンバンク、受入番号AAF75675)、M様タンパク質Szp4前駆体(ジェンバンク、受入番号AAF75676)、Streptococcus pneumoniaeORF5に類似のタンパク質(ジェンバンク、受入番号BAB16041)、推定上の金属結合/付着因子タンパク質(ジェンバンク、受入番号CAB56710)、ゾシンA免疫因子(ジェンバンク、受入番号AAC46073)及びWalker et al., (1998, 2003;ジェンバンク、受入番号AAQ08488−AAQ08510を含む)により記載されたSzpタンパク質が挙げられる。
【0037】
好ましくは、S.zooepidemicusの免疫原性断片は、S.zooepidemicusの構造タンパク質又はその免疫原性の部分である。さらに好ましくは、S.zooepidemicusの免疫原性の断片は、分泌された毒素、又は溶血素、又は付着因子/表面タンパク質、又はこれらの免疫原性部分である。
【0038】
当業者に既知の常法によって、たとえば、S.zooepidemicusのような細菌から追加の表面タンパク質を単離することができる。参照によって本明細書に組み入れられるSambrook et al., (2001)「分子クローニング、実験室マニュアル、第3版(米国、ニューヨーク州、コールドスプリングハーバー、コールドスプリングハーバーラボラトリープレス、サムブルックら編)は、この目的に使用される一般的な細菌のクローニング技術を記載している。
【0039】
イヌにおいて免疫応答を生じることが可能である作用物質がタンパク質のような生物の成分であれば、該生物の培養からそれを単離してもよい。さらに好ましくは、組換えDNA技術を用いて、タンパク質をコードする好適なDNA構築物の発現によってタンパク質を作製する。核酸のクローニング、操作、修飾及び発現並びにタンパク質の精製のための好適な技法は、当該技術で周知であり、たとえば、参照によって本明細書に組み入れられるSambrook et al., (2001)に記載されている。
【0040】
或いは、タンパク質化学技法を用いて、たとえば、単離したタンパク質の部分的なタンパク質分解(外分解的に又は内分解的にのいずれかで)、又はde novo合成によってタンパク質を作製してもよい。Lu et al., (1981) J. Org. Chem., 46:3433に記載され、その中で参照されているような固相ペプチド合成のFmoc−ポリアミド方式でペプチドを合成してもよい。
【0041】
生物の免疫原性断片の「派生物」によって、我々は、その生物に天然で存在する形態から改変されているが、イヌにおいて免疫応答を生じる能力、たとえば、その生物に特異的に結合する抗体の産生を誘導する能力を保持するタンパク質又はタンパク質の一部の意味を包含する。
【0042】
たとえば、派生物には、その生物に特異的に結合する抗体の産生を誘導するのに使用することができるタンパク質又はその一部の配列変異体が挙げられてもよい。通常、アミノ酸置換を行ってワクチンの抗原性を改善する。好ましくは、配列変異体は、少なくとも90%、又は少なくとも91%、又は少なくとも92%、又は少なくとも93%、又は少なくとも94%、又は少なくとも95%、そのタンパク質又はその一部の天然の配列に一致する。さらに好ましくは、配列変異体は、少なくとも96%、又は少なくとも97%、又は少なくとも98%、又は少なくとも99%、又は少なくとも99.5%、そのタンパク質又はその一部の天然の配列に一致する。
【0043】
2つのポリペプチド間の配列同一性パーセントは、好適なコンピュータプログラム、たとえば、ウィスコンシン大学、遺伝計算グループのGAPプログラムを用いて決定してもよい。2つのヌクレオチド配列又は2つのアミノ酸配列の間の同一性の比率は、GCGバージョン10(遺伝計算グループ(1991年)、GCGパッケージのためのプログラムマニュアル、バージョン7、1991年4月;米国53711、ウィスコンシン州、マジソン、サイエンス通り575番地)を用いて決定することができる。使用するGCGパラメータは:DNA用にはギャップ創造ペナルティ50、ギャップ拡張ペナルティ3及びタンパク質用には、ギャップ創造ペナルティ8、ギャップ拡張ペナルティ2であることができる。FASTAバージョン34(Pearson WR, (1990)「FASTP及びFASTAによる迅速で感度の高い比較」、Methods Enzymol., 183:63-98)を用いて、2つのヌクレオチド配列又は2つのアミノ酸配列の間の同一性の比率を決定することもできる。FASTAの設定は、ギャップ開放ペナルティ−16及びギャップ拡張ペナルティ−4であってもよい・
【0044】
同一性パーセントは、その配列が最適に揃えられているポリペプチドに関して計算されることが十分理解されるであろう。
【0045】
整列は或いは、ClustalWプログラム(Thompson et al., (1994), Nucleic Acids Res., 22:4673-80)を用いて行ってもよい。使用されるパラメータは以下のとおりであってもよい。
【0046】
迅速な2つ1組の整列パラメータ:K−タプル(ワード)サイズ;1、ウインドウサイズ;5、ギャップペナルティ;3、上の対角線の数;5、スコアリング法;xパーセント。
【0047】
多数の整列パラメータ:ギャップ開放ペナルティ;10、ギャップ拡張ペナルティ;0.05、スコアリングマトリクス;BLOSUM。
【0048】
通常、配列変異体は、100未満の、又は50未満の、又は40未満の、又は30未満の、又は20未満の、そのタンパク質又はその一部の天然の配列と異なるアミノ酸残基を有する。さらに好ましくは、配列変異体は、15又は14又は13又は12又は11又は10又は9又は8又は7又は6又は5又は4又は3又は2又はたった1個の、そのタンパク質又はその一部の天然の配列と異なるアミノ酸残基を有する。
【0049】
派生物の配列が改変されて作用物質の免疫原性を高めてもよいし、配列が免疫原性に影響を有さなくてもよい。たとえば、派生物は、免疫原性に必要としない1以上の除かれたアミノ酸配列を有してもよい。
【0050】
「派生物」によって、我々はまた、ペプチドの機能、すなわち、生体内での特異的な抗体の産生が実質的に不変のままであるという条件で、ペプチドが合成される前又は後で、1以上のアミノ酸残基が化学的に修飾されているペプチドも包含する。そのような修飾には、酸又は塩基、特に生理学的に許容可能な有機又は無機の酸又は塩基との塩の形成、末端カルボキシル基のエステル又はアミドの形成、及びたとえば、N−t−ブトキシカルボニルのようなアミノ酸保護基の結合が挙げられる。そのような修飾が、生体内での代謝からペプチドを保護してもよい。ペプチドは、単一コピーとして、又は複数コピー、たとえば直列反復として存在してもよい。そのような直列又は複数の反復はそれ自体十分に抗原性であり、キャリアの使用をあらかじめ回避してもよい。N末端とC末端を一緒に結合してループを形成すること、又は1以上のCys残基を末端に付加して抗原性を高めること、及び/又はジスルフィド結合を形成させることがペプチドにとって有利であってもよい。ペプチドがキャリア、好ましくは、ポリペプチドに共有結合しているのならば、そのときは、配置は好ましくは本発明のペプチドがループを形成するようにする。
【0051】
現在の免疫学理論によれば、免疫系を刺激するために、又は免疫系への刺激を高めるために、免疫原性の処方にはキャリア機能が存在すべきである。最良のキャリアは、T細胞エピトープを具体化する(又は抗原と一緒にT細胞エピトープを創造する)と考えられる。たとえば、架橋によって、別のキャリア、たとえば、血清アルブミン、ミオグロビン、細菌毒素及びスカシ貝ヘモシアニンにペプチドを会合させてもよい。免疫応答においてT細胞のヘルプを誘導するさらに最近開発されたキャリアには、B型肝炎コア抗原(ヌクレオカプシドタンパク質とも呼ばれる)、推定T細胞エピトープ、β−ガラクトシダーゼ及びインターロイキン−1の163〜171ペプチドが挙げられる。後者の化合物は、キャリア又はアジュバント又はその両方として様々にみなされてもよい。或いは、本発明の数コピーの同一又は異なったペプチドを互いに架橋し、この状況で、それ自体別のキャリアはないが、そのような架橋によってキャリア機能が提供されてもよい。好適な架橋剤には、シグマ及びピアースのカタログにそのまま列記されるものが挙げられ、たとえば、グルタールアルデヒド、カルボジイミド及びスクシンイミジル4−(N−マレイミドメチル)シクロヘキサン−1−カルボキシレートが挙げられ、後者の作用物質は、C末端のシステイン残基(存在すれば)上のSH基を利用する。
【0052】
好適な宿主内での好適なヌクレオチド配列の発現によって、ペプチドが調製されるのであれば、そのときは、キャリアとして作用するペプチド配列との融合生成物としてペプチドを発現させることが有利であってもよい。カビゲンの「エコセック」システムは、そのような処理の一例である。
【0053】
通常、S.zooepidemicusの免疫原性画分をコードするポリヌクレオチドは、構造タンパク質をコードし、さらに好ましくは、S.zooepidemicusの表面タンパク質、又はその免疫原性部分、又はその派生物をコードする。上記のジェンバンク受入番号を参照することによって、種々のS.zooepidemicusのタンパク質をコードするポリヌクレオチドの配列を容易に確認することができる。しかしながら、標準の分子生物学的技法によって、任意の免疫原性のS.zooepidemicusタンパク質をコードするポリヌクレオチドの配列を容易に決定することができる。
【0054】
通常、イヌにおいてM.cynosに対して免疫応答を生じることが可能である作用物質は、不活化した又は弱毒化したM.cynos、又はM.cynosの免疫原性の断片、若しくはその派生物、又は前記画分若しくは前記派生物をコードする核酸を含む。
【0055】
M.cynosは、NCTC(寄託番号10142H831)及びATCC(寄託番号27544)に寄託されており、Rosendal(1972)によって記載されている。
【0056】
好ましくは、M.cynosの免疫原性の断片は、M.cynosの構造タンパク質又はその免疫原性部分であり、さらに好ましくは、M.cynosの表面タンパク質又はその免疫原性部分、又はその派生物である。当業者に既知の常法によってM.cynosのようなマイコプラズマから表面タンパク質を単離することができる。
【0057】
マイコプラズマタンパク質を同定し、単離する方法は、遺伝子の一部が、マイコプラズマの独特のコドンの利用を認識する特定のベクターを必要としてもよいことを除いて、一般に細菌の方法と同じである(Micoplasmology Vol. 1 Ed. S. Razin & J. Tully, Academic Press Inc, 1995における分子的及び診断的な手段の中のゲノムの性状分析及び遺伝学のB項のすべての章を参照のこと)。
【0058】
最も有効なマイコプラズマワクチンは、熱又はホルマリンで不活化した細胞全体或いは弱毒化した生ワクチンを含有する傾向があるので、そのタンパク質すべて又は少なくとも大半を含有する。ワクチンとして使用するために可能性があるマイコプラズマ成分には、約45kDAであると考えられている一次付着構造膜タンパク質(M.pneumoniae由来のP1シタドヘシン、及び3つの遺伝子オペロンのすべての部分であるM.genitalium由来のMgPaのような相同体と同等)、表面に暴露されたタンパク質及びそのほかの付着タンパク質、膜糖脂質、膜多糖類画分、リポグリカン及び動物のマイコプラズマワクチンの概説(Barile, 1985; Barile et al., 1985)で言及されているすべてのものが挙げられる。
【発明を実施するための最良の形態】
【0059】
実施態様では、Chlamydophilaに対する免疫応答を生じることが可能である作用物質は、不活性化した又は弱毒化したC.abortus又はC.abortusの免疫原性の断片若しくはその派生物、又は前記画分若しくは前記派生物をコードする核酸を含む。
【0060】
Chlamydophila abortus(ATCC寄託番号VR−656)は、ヒツジのクラミジア流産のB−577株としてEvertt et al.によって寄託された。
【0061】
別の実施態様では、Chlamydophilaに対する免疫応答を生じることが可能である作用物質は、不活性化した又は弱毒化したC.psittaci、又はC.psittaciの免疫原性の断片若しくはその派生物、又は前記画分若しくは前記派生物をコードする核酸を含む。
【0062】
Clamydia psittaciとしても知られるChlamydophila psittaciは、ATCC寄託番号VR−125を有する(Lillie (1930) page 1968, Int. Syst. Bacteriol., 30:274 (AL))。
【0063】
さらなる実施態様では、Chlamydophilaに対する免疫応答を生じることが可能である作用物質は、不活性化した又は弱毒化したC.felis又はC.felisのの免疫原性の断片若しくはその派生物、又は前記画分若しくは前記派生物をコードする核酸を含む。
【0064】
Chlamydophila felis(ATCC寄託番号VR−120)は、ネコ肺炎のNo.1株としてEvertt et al.によって寄託された。
【0065】
別の実施態様では、Chlamydophilaに対する免疫応答を生じることが可能である作用物質は、不活性化した又は弱毒化したChlamydia muridarum(ATCC、VR123、MoPn;Everett at al., Int. J. Syst. Bacteriol., 49:431, 1991);Clamydia pecorum(ATCC、VR628、Bo/E58;Fukushi & Hirai, Int. J. Syst. Bacteriol., 42:307);Chlamydia pneumoniae(株型:TW−183;Grayston et al., Int. J. Syst. Bacteriol., 39:88, 1989);Chlamydia suis(ATCC、VR1474、S45;Everett at al., Int. J. Syst. Bacteriol., 49:431, 1999);Chlamydia trachomatis(種型)(ATCC、VR571;Busacca, 1935; Rake, 1957; Everett at al., Int. J. Syst. Bacteriol., 30:274, 1999 (AL));又はそれらの免疫原性の断片、若しくはそれらの派生物、又は前記画分若しくは前記派生物をコードする核酸を含む。
【0066】
C.abotus、C.psittaci、又はC.felis、又はC.muridarum、C.pecorum、C.pneumoniae、C.suis又はC.trachomatisの免疫原性の断片は、イヌにおいて免疫応答を生じることが可能であるそのいかなる断片であることもできる。通常、免疫原性の断片は、タンパク質又はその一部である。好ましくは、免疫原性の断片は、構造タンパク質又はその免疫原性の一部である。さらに好ましくは、免疫原性の断片は、表面タンパク質又はその免疫原性の一部若しくはその派生物である。上述のように、当業者に既知の常法によってChlamydophilaのような細菌から表面タンパク質を単離することができる。
【0067】
C.abotusのタンパク質には、60kDAの熱ショックタンパク質GroEL(ジェンバンク受入番号AAD26144)、60kDaのシステイン−リッチの膜複合体タンパク質(ジェンバンク受入番号AAG60550)、90kDaのタンパク質(ジェンバンク受入番号AAC44400、AAC44401)、システイン−リッチの外膜タンパク質Omp−2(ジェンバンク受入番号AAD09597)、Dnak(ジェンバンク受入番号AAN77259)、伸長因子P(ジェンバンク受入番号AAK72389)、GrpE(ジェンバンク受入番号AAN77258)、HrcA(ジェンバンク受入番号AAN77257)、主要外膜タンパク質(ジェンバンク受入番号AAK00237、CAA36152、CAD29327)、主要外部タンパク質前駆体(ジェンバンク受入番号AAD29103、AAD29102、AAG53881、P16567)、MutS(ジェンバンク受入番号AAD25864)、Omp1(ジェンバンク受入番号CAA06182、CAA06620、CAA06621、CAA06622、CAA06624、CAA06625、CAA06183、CAA06184)、外膜タンパク質(ジェンバンク受入番号AAB02850)、外膜タンパク質2(ジェンバンク受入番号AAD20336)、POMP90A前駆体(ジェンバンク受入番号AAC15922)、POMP90B前駆体(ジェンバンク受入番号AAC15924)、POMP91A(ジェンバンク受入番号AAC15921)、POMP91B前駆体(ジェンバンク受入番号AAC15923)、推定上の98kDaの外膜タンパク質(ジェンバンク受入番号AAB18188)、推定上の外膜タンパク質(ジェンバンク受入番号AAB18187)、小型のシステイン−リッチの外膜リポタンパク質(ジェンバンク受入番号AAG60549)、イオウ−リッチのタンパク質(ジェンバンク受入番号AAG60551)及びOmpA(ジェンバンク受入番号AAT36355及びAAT36356)が挙げられる。
【0068】
C.psittaciのタンパク質には、60Kのシステイン−リッチの外膜タンパク質前駆体(ジェンバンク受入番号P23701、B39439、JC5204及びP27606)、60Kのシステイン−リッチのタンパク質(ジェンバンク受入番号CAA37592及びCAA37591)、シャペロニン同族体(ジェンバンク受入番号AAB22560)、早期上流オープンリーディングフレーム(EUO)(ジェンバンク受入番号AAA23124、Q06566及びC36909)、EUOタンパク質同族体(ジェンバンク受入番号JC5207)、ヒツジ流産タンパク質(ジェンバンク受入番号1601347A)、属特異的タンパク質(ジェンバンク受入番号AAB22559)、高分子量のシステイン−リッチのエンベロープタンパク質(ジェンバンク受入番号AAB61619)、ヒストンH1様タンパク質(AAA23132、JH0658、Q46204)、hypAタンパク質(ジェンバンク受入番号JL0116)、hypBタンパク質(ジェンバンク受入番号JL0117)、仮説のタンパク質(ジェンバンク受入番号JC5206、NP_052329、NP_052332、NP_052331、NP_052330、NP_052328、NP_052327、NP_052326、NP_052325、NP_052323、CAA44340、CAA44339、CAA44341、CAA44338、CAA44337、CAA44336、CAA44335、CAA44332、A39999、NP_052324、CAA44333、S61492、S18143、C39999、D39999、E39999、F39999、S18148、G39999、H39999及びI39999)、封入膜タンパク質(ジェンバンク受入番号2108371A、S61491)、低分子量システイン−リッチのエンベロープタンパク質(ジェンバンク受入番号AAB61618)、リジン−リッチの仮説タンパク質LRO(ジェンバンク受入番号B36909)、主要外膜タンパク質及び前駆体(ジェンバンク受入番号CAA31177、2006276A、1616229A、AAA23148、AAA23147、AAA17396、I40864、I40740、AAA23146、CAA40300、AAK00262、AAK00250、AAK00249、AAK00248、AAK00247、AAK00246、AAK00245、AAK00244、AAK00243、AAK00242、AAK00241、AAK00240、CAC84081、A60341、A40371、B60109、A60109、MMCWPM、MMCWP3、Q00087、P10332及びAAQ91209)、主要シグマ因子(ジェンバンク受入番号AAA50747)、MutS(ジェンバンク受入番号AAD25866及びAAD25863)、未知の機能のタンパク質のN末端部分(ジェンバンク受入番号CAA90624)、ORF2(ジェンバンク受入番号2108371B)、外膜タンパク質1(ジェンバンク受入番号CAA76286及びCAB96859)、外膜タンパク質3前駆体(ジェンバンク受入番号JC5203)、未知の機能のタンパク質(ジェンバンク受入番号CAA90623)、推定上の多型膜タンパク質(ジェンバンク受入番号AAL36963、AAL36962、AAL36961、AAL36960、AAL36959、AAL36958、AAL36957、AAL36956及びAAL36955)、小型システイン−リッチのエンベロープタンパク質envA前駆体(ジェンバンク受入番号A39439)、イオウ−リッチのタンパク質(ジェンバンク受入番号P28164、AAB61620及びJC5205)、未知のタンパク質(ジェンバンク受入番号AAB22561及びAAB22558)、病原性プラスミドparAファミリータンパク質pGP5−D(ジェンバンク受入番号Q46263)、病原性プラスミドタンパク質pGP2−D(ジェンバンク受入番号Q46260)、病原性プラスミドタンパク質pGP3−D(ジェンバンク受入番号Q46261)、病原性プラスミドタンパク質pGP4−D(ジェンバンク受入番号Q46262)、病原性プラスミドタンパク質pGP6−D(ジェンバンク受入番号Q46264)、OmpA(ジェンバンク受入番号AAT36351及びAAT36354)、及び60kDaのシャペロニンタンパク質(ジェンバンク受入番号AAT38208)が挙げられる。
【0069】
C.felisのタンパク質には、熱ショックタンパク質GroEL(ジェンバンク受入番号AAL38954及びAAO24106)、主要外膜タンパク質(ジェンバンク受入番号AAK00238、AAK00239、AAO24108及びCAA43409)、MutS(ジェンバンク受入番号AAD25865)、及び外膜タンパク質2(ジェンバンク受入番号AAK38113、AAK38114、AAK38115、AAL89722、AAO24107、AAQ19779)が挙げられる。
【0070】
好ましい実施態様では、使用されるChlamydophilaタンパク質は、主要外膜タンパク質(MOMP)のような外膜タンパク質である。そのほかの好適なChlamydophilaタンパク質には、LPS又はOmcBタンパク質が挙げられる。
【0071】
通常、C.abortus、C.psittaci又はC.felisの免疫原性の画分をコードするポリヌクレオチドは、構造タンパク質をコードし、さらに好ましくは、表面タンパク質、又はその免疫原性の部分、若しくはその派生物をコードする。種々のタンパク質をコードする核酸配列は、上記のジェンバンク受入番号を参照することによって容易に確認することができ、標準的な分子生物学の技法によって容易に決定することができる。
【0072】
実施態様では、Chlamydophilaに対する免疫応答を生じることが可能である作用物質は、配列番号1の配列を有する23SrRNA遺伝子の218のヌクレオチドの部分配列を有する、不活化された又は弱毒化されたChlamydophila、又はその断片若しくはその派生物、又は前記画分若しくは派生物をコードする核酸を含む。CIRDに罹ったイヌ、特にリホーミング施設及び搭乗用犬舎又は訓練用犬舎のCIRDに罹ったイヌの気管及び肺で、配列番号1の配列を有する23SrRNA遺伝子の218のヌクレオチドの部分配列を有するChlamydophilaが見つかってもよいし、それらから単離されてもよい。
【0073】
シクロヘキシミドの存在下又は非存在下にて組織抽出物をマッコイ細胞株に接種し、5%CO2と共に37℃にて10日間まで細胞を培養し、次いで細胞を凍結融解することによりChlamydophilaを抽出することによってChlamydophilaをイヌから単離することができる。トリ、ネコ、ヒト及びそのほかの宿主からChlamydophilaを単離するのに、この方法を日常的に使用することができる。実施例3に記載されるPCR条件を用いて23SrRNA遺伝子の断片をChlamydophilaから増幅することができ、図5又は図8における配列と比較することによって、得られた配列を検証することができる。
【0074】
ワクチン用途については、種々の複製ベクター(たとえば、組換えアデノウイルスワクチン)又は非複製ベクター(DNAワクチン)にてポリヌクレオチド剤を送達することができる。
【0075】
組換えタンパク質から構成されるワクチンの典型的な用量は、約5〜10μgである。細菌ワクチンの典型的な用量は、mL当たり108コロニー形成単位である。
【0076】
通常、ワクチン組成物は、薬学上許容可能なキャリア、希釈剤又はアジュバントをさらに含む。
【0077】
特定のキャリア及びアジュバントは上で記載されている。そのほかの好適なアジュバントには、フロインド完全又は不完全アジュバント、ムラミールジペプチド、EP109942、EP180564及びEP231039の「イスコム」、水酸化アルミニウム、サポニン、DEAE−デキストラン、中性油(たとえば、ミグリオール)、植物油(たとえば、ラッカセイ油)、リポソーム、プルロニック(登録商標)ポリオール、又はリビアジュバント系(たとえば、GB−A−2189141を参照のこと)が挙げられる。
【0078】
キャリアは、本発明の作用物質と相溶性であるという意味で「許容可能」でなければならず、その受入者に有害であってはならない。通常、キャリアは無菌であり、発熱物質を含まない水又は生理食塩水である。
【0079】
通常、ワクチンは、経口、筋肉内、皮下、静脈内、腹腔内又は鼻内の経路を介して投与される。
【0080】
ワクチン組成物は、非経口投与のために製剤化されてもよく、抗酸化剤、緩衝液、静菌剤、製剤を意図する受入者の血液と等張にする溶質を含有してもよい水性又は非水性の無菌の注射液、及び/又は懸濁剤及び濃厚剤を含んでもよい水性又は非水性の無菌の懸濁液を包含してもよい。
【0081】
ワクチン組成物は、単位用量又は複数用量の容器、たとえば、密封したアンプル及びバイアルで提示されてもよく、使用直前に液体キャリア、たとえば、注射用の水の添加のみを必要とする凍結乾燥(凍結乾燥)の状態で保存されてもよい。無菌の粉末、顆粒、及び錠剤から即席の注射液及び懸濁液を調製してもよい。
【0082】
ワクチン組成物は、鼻内投与用に製剤化されてもよく、好適な高圧ガス、たとえば、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、たとえば、1,1,2,2−テトラフルオロエタン(HFA134A(商標))又は1,1,1,2,3,3,3−ヘプタフルオロプロパン(HFA227EA(商標))のようなハイドロフルオロアルカン、二酸化炭素又はそのほかの好適な気体の使用により、加圧した容器、ポンプ、スプレー又はネブライザーから、エアゾール噴霧提示の形態で都合よく送達されてもよい。加圧エアゾールの場合、弁を提供して測定された量を送達することによって投与量単位を決定してもよい。加圧した容器、ポンプ、スプレー又はネブライザーは、たとえば、エタノール及び高圧ガスを溶媒として用いて、作用物質の溶液又は懸濁液を含有してもよく、さらに、たとえば、トリオレイン酸ソルビタンのような潤滑剤を含有してもよい。
【0083】
家畜病治療での使用については、通常の獣医学診療に従って許容可能な製剤としてワクチンを調製し、獣医師が、特定の動物にとって最も適当である投薬計画及び投与経路を決定する。
【0084】
イヌへの投与に好適なワクチンの処方は周知であり、以下に記載するようなイヌワクチンで使用される処方が挙げられる。
【0085】
上で議論したように、イヌ呼吸器コロナウイルス(CRCV)、イヌパラインフルエンザウイルス(CPIV)、イヌアデノウイルス2型(CAV−2)、イヌヘルペスウイルス(CHV)及びBordetella bronchiseptica(B.bronchiseptica)を含む幾つかのウイルス剤及び細菌剤は、イヌにおける呼吸器疾患に関係することが知られている。
【0086】
従って、実施態様では、ワクチン組成物はさらに以下のいずれか1以上を含む:
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質;
【0087】
従って、ワクチン組成物は、適宜、これら追加の作用物質の任意の2つ、任意の3つ、任意の4つ、又は5つすべても含むこともできる。
【0088】
通常、イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質は、不活化された又は弱毒化されたCRCV、又はCRCVの免疫原性の断片、又は前記免疫原性の画分をコードする核酸を含む。
【0089】
CRCVの好適な免疫原性の断片は、WO2004/011651(王立獣医学大学)及びErles et al., 2003に記載されている。CRCVの好適な免疫原性の断片には、スパイク(S)、血液凝集素−エステラーゼ(HE)表面タンパク質、膜糖タンパク質(M)、及びヌクレオカプシドタンパク質(N)、又はそれらの免疫原性の部分が挙げられる。WO2004/11651に記載されているCRCV様のスパイク及びHEのタンパク質は、CRCVに対して免疫応答を生じる作用物質としても好適であってもよい。ウシコロナウイルス及びヒトコロナウイルスのような密接に関係するコロナウイルス及びそれらの免疫原性の断片もCRCVに対して免疫応答を生じる作用物質としても好適であってもよい。CRCVに対するワクチン成分として使用することができる作用物質に関係するWO2004/011651の開示全体が、参照によって本明細書に組み入れられる。
【0090】
通常、イヌにおいてCRIVに対する免疫応答を生じることが可能である作用物質は、不活化された又は弱毒化されたCPIV、又はCPIVの免疫原性の断片、又は前記免疫原性の画分をコードする核酸を含む。
【0091】
通常、イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質は、不活化された又は弱毒化されたCAV−2、又はその免疫原性の断片、又は前記免疫原性の画分をコードする核酸を含む。
【0092】
イヌアデノウイルス1型は、感染性肝炎の原因となり、イヌアデノウイルス2型は呼吸器疾患の原因となる。CAV−1は、CAV−2に対して交差防御を提供し、逆もまた同様であることが示されている。従って、イヌにおいてCAV−2に対して免疫応答を生じる作用物質は、CAV−1又はCAV−2のいずれか、又はその免疫原性の断片を含有してもよい。下に列記するワクチンは、使用されたウイルス型が特定されていないEURICAN(登録商標)DHPPiを除いて、CAV−2を含有する。
【0093】
イヌにおいてCPIV及びCAV−2に対する免疫応答を生じる好適な作用物質は当業者に既知である。たとえば、英国では、以下のイヌワクチンが認可されている。
【0094】
フォート・ドッジ・アニマル・ヘルスによるKAVAK(登録商標)DA2PiP69は、組織培養で増殖させたイヌジステンパーウイルス、イヌアデノウイルス2型、イヌパラインフルエンザ2型及びイヌパルボウイルスの弱毒化した株を含有する凍結乾燥の生ワクチンである。
【0095】
フォート・ドッジ・アニマル・ヘルスによるKAVAK(登録商標)パラインフルエンザは、確立した相同の細胞株で培養したイヌパラインフルエンザウイルス2型の弱毒化した株に由来する凍結乾燥の生ワクチンを含有する。
【0096】
インターベットUK社によるNOBIVAC(登録商標)DHPPiは、細胞株の組織培養で増殖させたイヌジステンパーウイルス、イヌアデノウイルス2型、イヌパルボウイルス及びイヌパラインフルエンザウイルスを含有する凍結乾燥の生ウイルスワクチンである。
【0097】
インターベットUK社によるNOBIVAC(登録商標)KCは、Bordetella bronchisepticaのB−C2株及びイヌパラインフルエンザウイルスCornell株を含有する改変した凍結乾燥の生ワクチンである(これは鼻内ワクチンである)。管理許可番号:Vm06376/4026。
【0098】
メリアル・アニマル・ヘルス社によるEURICAN(登録商標)DHPPiは、イヌジステンパー、イヌ感染性肝炎、イヌパルボウイルス及びイヌパラインフルエンザウイルス2型に対して併用する凍結乾燥の生ワクチンである。
【0099】
ファイザー社によるVANGUARD(登録商標)7は、確立された細胞株で増殖させた、弱毒化した生のイヌジステンパーウイルス(Snyder Hill株)、アデノウイルス(CAV−2、マンハッタン株)、パラインフルエンザウイルス(NL−CPI株)、イヌパルボウイルス(NL−35−D)、並びにLeptospira canicola及びLeptospira icterohaemorrihagiaeの不活化培養物を含有する。
【0100】
シェーリングプラウ・アニマル・ヘルスによるQUANTUM(登録商標)DOG7は、イヌジステンパー、アデノウイルス2型、パルボウイルス、パラインフルエンザウイルス2型のワクチン(生)、及び不活化したLeptospira canicola及びLeptospira icterohaemorrihagiaeのワクチンを含有する。
【0101】
ビルバック社によるCANIGEN DHPPiは、細胞株組織培養で増殖させたイヌジステンパーウイルス、イヌアデノウイルス(CAV−2)、イヌパルボウイルス及びイヌパラインフルエンザウイルスを含有する弱毒化した凍結乾燥の生ウイルスワクチンである。
【0102】
ビルバック社によるCANIGEN Ppiは、細胞株組織培養で増殖させたイヌパルボウイルス及びイヌパラインフルエンザウイルスを含有する弱毒化させた凍結乾燥の生ウイルスワクチンである。
【0103】
通常、イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質は、不活化された又は弱毒化されたCHV、又はCHVの免疫原性の断片、又は前記免疫原性の画分をコードする核酸を含む。
【0104】
イヌにおいてCHVに対する免疫応答を生じる好適な作用物質は当業者に既知である。たとえば、メリアルによるEURICAN Herpes205は、CHVに対する精製されたサブユニットワクチンであり、妊娠した雌イヌの能動免疫に適応され、出生日に獲得するCHV感染の結果生じる子犬の死亡、臨床徴候及び病変を防ぐ。それは、呼吸器疾患を防ぐための成犬のワクチン接種には認可されていない。
【0105】
通常、イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質は、不活化された又は弱毒化されたB.bronchiseptica、又はその免疫原性の断片、又は前記免疫原性の画分をコードする核酸を含む。
【0106】
イヌにおいてB.bronchisepticaに対する免疫応答を生じる好適な作用物質は当業者に既知である。たとえば、以下のイヌワクチンが使用するために認可されている。
【0107】
ファイザー・アニマル・ヘルス(U.S. Vet. Lic. No. 189)によるCOUGHGUARD−B(登録商標)は、B.bronchisepticaの不活化した培養物を含有する。それは、B.bronchisepticaが原因の疾患、特に犬舎咳に対して健康なイヌを免疫するためのものである。COUGHGUARD−B(登録商標)は、不活化され、イヌに投与した際、非毒性であるように加工されたB.bronchisepticaの抗原性の高い株から調製される。製造方法は、B.bronchisepticaの免疫特性をそのまま残すように報告されている。
【0108】
ファイザー・アニマル・ヘルス(U.S. Vet. Lic. No. 189)によるVANGUARD(登録商標)5/Bは、確立されたイヌ細胞株で増殖させたイヌジステンパーウイルス(CDV)、CAV−2、CPIV及びイヌパルボウイルス(CPV)の弱毒化した株を含有する。CPV抗原は、イヌ細胞株における短い継代で弱毒化され、そのレベルの継代で、母性抗体を無効にすることが可能である免疫原性特性を有する。ワクチンは、真空に代えた不活性気体と共に凍結乾燥された形態で包装される。希釈剤として供給される、B.bronchisepticaの不活性化された全培養物を含有する細菌ワクチン成分。VANGUARD(登録商標)5/BにおけるB.bronchisepticaは、不活化され、イヌに投与した際、非毒性であるように加工された抗原性の高い株から調製される。
【0109】
ファイザー・アニマル・ヘルス(U.S. Vet. Lic. No. 112)によるNASAGUARD−B(商標)は、B.bronchiseptica細菌の無毒の生の培養物から構成される。
【0110】
インターベットによるPROGUARD(登録商標)−KCは、弱毒化したイヌパラインフルエンザウイルス及びBordetella bronchisepticaの無毒の生の培養物を含有する改変された鼻内用生ワクチンである。PROGUARD(登録商標)−KCは、粉末の形態で再構築のために提供される無菌の希釈剤と共に提示される。PROGUARD(登録商標)−KCは、イヌパラインフルエンザウイルス及びB.bronchisepticaによるイヌの感染性気管気管支炎(「犬舎咳」)を防ぐために健康で、感受性の高い子犬及びイヌにワクチン接種するためのものである。
【0111】
インターベットによるPROGUARD(登録商標)−KC PLUSは、鼻内投与のための、B.bronchisepticaの無毒株の生の培養物、弱毒化したイヌアデノウイルス2型及びパラインフルエンザウイルスを含有する。PROGUARD(登録商標)−KC PLUSによるワクチン接種は、気道における迅速な局所免疫を刺激し、それによって臨床徴候を防ぐと同様に入り口での感染を抑制する。局所免疫に加えて、それは、鼻内投与の3週間以内の全身性免疫も刺激する。少量(0.4mL)のPROGUARD(登録商標)−KC PLUSの一方の鼻孔への適用は、特に小型犬種及び年少の子犬におけるワクチン接種に容易さを提供する。PROGUARD(登録商標)−KC PLUSは、粉末の形態で再構築のために提供される無菌の希釈剤と共に提示される。PROGUARD(登録商標)−KC PLUSは、イヌアデノウイルス2型、パラインフルエンザウイルス及びB.bronchisepticaによるイヌの感染性気管気管支炎(「犬舎咳」)を防ぐために、健康なイヌ及び3週令以上の子犬にワクチン接種するためのものである。
【0112】
インターベットによるインタックは、鼻内投与用の、B.bronchisepticaのS55株を含有する改変された凍結乾燥の生ワクチンである。製品の認可番号:PL0201/4011。
【0113】
上で記載されたノビバック(登録商標)−KCもB.bronchisepticaを含有する。
【0114】
実施態様では、ワクチン組成物は以下を含む:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;及び/又は
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び適宜、以下のいずれか1以上
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0115】
好ましい実施態様では、ワクチン組成物は以下を含む:
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質。
【0116】
別の好ましい実施態様では、ワクチン組成物は以下を含む:
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
及び以下のいずれか1以上:
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0117】
従って、作用物質(b)及び(d)と同様に、組成物は、作用物質(c)、(e)、(f)、(g)及び(h)のいずれか2つ、又は全部で5つの作用物質(c)、(e)、(f)、(g)及び(h)のいずれか3つ又はいずれか4つを含有してもよいことが十分理解される。
【0118】
別の好ましい実施態様では、ワクチン組成物は以下を含む:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;及び
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
及び以下のいずれか1以上:
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0119】
従って、作用物質(a)、(b)及び(d)と同様に、組成物は、作用物質(c)、(e)、(f)、(g)及び(h)のいずれか2つ、又は全部で5つの作用物質(c)、(e)、(f)、(g)及び(h)のいずれか3つ又はいずれか4つを含有してもよいことが十分理解される。
【0120】
本発明の第2の側面は、本発明の第1の側面に従ってワクチン組成物をイヌに投与することを含む、CIRDに対してイヌにワクチン接種する方法を提供する。
【0121】
本発明の第3の側面は、本発明の第1の側面に従ってワクチン組成物をイヌに投与することを含む、イヌにおけるCIRDを治療する方法を提供する。
【0122】
従って、本発明の第1の側面のワクチン組成物は、予防的に又は治療上のいずれかで、CIRDと戦うのに使用されてもよいことを理解することができる。
【0123】
本発明の第4の側面は、イヌにおけるCIRDの予防又は治療のための薬物の調製において以下のいずれか1以上の使用を提供する:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質。
【0124】
実施態様では、薬物はさらに、以下のいずれか1以上を含む:
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0125】
本発明のこの側面及び次のすべての側面において、(a)、(b)、(c)、(d)、(e)、(f)、(g)及び(h)に対する優先性は、本発明の第1の側面に関して記載されたとおりである。
【0126】
本発明の第5の側面は、イヌにおいてS.zooepidemicus、M.cynos及びChlamydophilaのいずれか1以上に対する免疫応答を刺激する方法を提供し、該方法は、イヌに以下のいずれか1以上をそれぞれ投与することを含む:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質。
【0127】
実施態様では、該方法は、以下のいずれか1以上を投与することをさらに含む:
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0128】
本発明の第6の側面は、イヌにてS.zooepidemicus、M.cynos及びChlamydophilaの前記いずれか1以上それぞれに対する免疫応答を刺激するするための薬物の調製において以下のいずれか1以上の使用を提供する:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質。
【0129】
実施態様において、薬物はさらに、以下のいずれか1以上を含む:
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0130】
本発明の第7の側面は、医学での使用のために、以下のいずれか1以上を含む組成物を提供する:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質。
このようにして、該組成物が包装され、医学における使用のために提示される。
【0131】
該組成物は、これら作用物質のいずれか2つ、たとえば、(a)と(b)、(a)と(c)又は(b)と(c)を含有してもよい。該組成物は、これら作用物質(a)、(b)及び(c)の3つすべてを含有してもよい。
【0132】
実施態様では、組成物は家畜病医学における使用のためのものである。こうして該組成物が包装され、家畜病医学における使用のために提示される。
【0133】
通常、組成物は、イヌの家畜病の医学における使用のためのものである。こうして該組成物が包装され、イヌの家畜病の医学における使用のために提示され、すなわち、イヌにおける使用のために包装され、提示される。
【0134】
実施態様では、組成物はさらに以下のいずれか1以上を含む:
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0135】
本側面の実施態様では、組成物は以下を含む:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;及び/又は
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;
及び適宜、以下のいずれか1以上
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0136】
本側面の好ましい実施態様では、組成物は、
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質を含む。
【0137】
本側面の別の好ましい実施態様では、組成物は、
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
及び以下のいずれか1以上を含む:
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0138】
従って、作用物質(b)及び(d)と同様に、組成物は、作用物質(c)、(e)、(f)、(g)及び(h)のいずれか2つ、又は全部で5つの作用物質(c)、(e)、(f)、(g)及び(h)のいずれか3つ又はいずれか4つを含有してもよいことが十分理解される。
【0139】
本側面の別の好ましい実施態様では、組成物は、
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;及び
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
及び以下のいずれか1以上を含む:
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0140】
従って、作用物質(a)、(b)及び(d)と同様に、組成物は、作用物質(c)、(e)、(f)、(g)及び(h)のいずれか2つ、又は全部で5つの作用物質(c)、(e)、(f)、(g)及び(h)のいずれか3つ又はいずれか4つを含有してもよいことが十分理解される。
【0141】
本発明の第8の側面は、本発明の第1の側面のワクチン組成物のための部品のキットを提供し、それは、以下のいずれか1以上:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
並びに適宜、薬学上許容可能なキャリア、希釈剤又はアジュバントを含む。
【0142】
部品のキットは、これら作用物質の任意の2つ、たとえば、(a)と(b)、(a)と(c)又は(b)と(c)を含有してもよいことが十分理解される。キットは、これら作用物質3つすべて(a)、(b)及び(c)を含有してもよい。
【0143】
実施態様では、キットはさらに、以下のいずれか1以上を含む:
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0144】
本側面の実施態様では、キットは以下を含む:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;及び/又は
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;
及び適宜、以下のいずれか1以上
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0145】
本側面の好ましい実施態様では、キットは、
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質を含む。
【0146】
本側面の別の好ましい実施態様では、キットは以下を含む:
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
及び以下のいずれか1以上を含む:
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0147】
従って、作用物質(b)及び(d)と同様に、組成物は、作用物質(c)、(e)、(f)、(g)及び(h)のいずれか2つ、又は全部で5つの作用物質(c)、(e)、(f)、(g)及び(h)のいずれか3つ又はいずれか4つを含有してもよいことが十分理解される。
【0148】
本側面の別の好ましい実施態様では、キットは以下を含む:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;及び
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
及び以下のいずれか1以上を含む:
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0149】
従って、作用物質(a)、(b)及び(d)と同様に、組成物は、作用物質(c)、(e)、(f)、(g)及び(h)のいずれか2つ、又は全部で5つの作用物質(c)、(e)、(f)、(g)及び(h)のいずれか3つ又はいずれか4つを含有してもよいことが十分理解される。
【0150】
第9の側面では、本発明は、S.zooepidemicus、M.cynos又はChlamydophilaのいずれか1以上に対する抗体を作製する方法を提供し、それは、動物においてS.zooepidemicus、M.cynos又はChlamydophilaの前記いずれか1以上又はその免疫原性の断片に対する免疫応答を生じること、及び該動物又はそれに由来する不死の細胞から抗体を調製することを含む。
【0151】
モノクローナル抗体を作製するための方法及び技法は、当業者に周知であり、たとえば、参照により本明細書に組み入れられる、「モノクローナル抗体:技法のマニュアル」(H. Zola, CRC Press, 1988)及び「モノクローナルハイブリドーマ抗体:技法及び応用」(J. G. R. Hurrell, CRC Press, 1982)に開示されている。
【0152】
本発明の第10の側面は、S.zooepidemicus、M.cynos又はChlamydophilaのいずれか1以上に対する抗体を入手する方法を提供し、それは、S.zooepidemicus、M.cynos又はChlamydophilaの前記いずれか1以上又はその免疫原性の断片を用いて抗体表示ライブラリから抗体を選択することを含む。
【0153】
第9及び第10の側面の実施態様では、Chlamydophilaは、C.abortus、C.psittaci又はC.felisである。別の実施態様では、Chlamydophilaは、C.muridarum、C.pecorum、C.pneumoniae、C.suis又はC.trachomatisである。
【0154】
本発明の第11の側面は、S.zooepidemicus、M.cynos又はChlamydophilaに特異的に結合する抗体を提供する。本発明の第9及び第10の側面の方法によってこれを行うことができる。
【0155】
実施態様では、Chlamydophilaに特異的に結合する抗体はC.abortus、C.psittaci又はC.felisに結合する。別の実施態様では、Chlamydophilaに特異的に結合する抗体はC.muridarum、C.pecorum、C.pneumoniae、C.suis又はC.trachomatisに結合する。
【0156】
本発明のこの背景及びあとに続く側面において、「抗体」によって、我々は、免疫グロブリン分子全体だけでなく、たとえば、Fab、F(ab’)2のような断片及び抗原結合部位を保持するそのほかのその断片も包含する。同様に、これらの背景において、用語「抗体」は、単鎖Fv分子(scFv)及びドメイン抗体(dAbs)のような抗体の遺伝子操作された派生物を包含する。用語はまた、ファージディスプレイ法又はそのほかの無作為選抜法を用いて、特定の生物又は特定の生物の領域に結合する分子について作製されてもよい抗体様分子も包含する。従って、これらの背景で、用語、抗体は、自然抗体の認識部位(すなわち、エピトープ又は抗原と結合する又は組み合う抗体の部分)の一部である構造、好ましくはペプチド構造を含有する分子すべてを包含する。
【0157】
抗体の可変部重鎖(VH)及び可変部軽鎖(VL)のドメインは、抗原認識に関与するが、初期のプロテアーゼ消化実験で初めて認識された事実である。さらにげっ歯類の抗体を「ヒト化」することによって確認された。得られる抗体がげっ歯類親型抗体の抗原特異性を保持するように、げっ歯類起源の可変部ドメインをヒト起源の定常部ドメインと融合してもよい(Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855, 1984)。
【0158】
抗原特異性が可変部ドメインにより付与され、定常部ドメインに依存しないということは、すべて1以上の可変部ドメインを含有する抗体断片の細菌での発現を含む実験から知られている。これらの分子には、Fab様分子(Better et al., Science, 240:1041, 1988)、Fv分子(Skerra et al., Science, 240, 1038, 1988)、柔軟なオリゴペプチドを介してVHとVLの対ドメインが連結する単鎖Fv(ScFv)分子(Bird et al., Science, 242:423, 1988; Huston et al., Proc. Natl. Acad. Sci. USA, 85:5879, 1988)及び単離されたVドメインを含む単一ドメイン抗体(dAbs)(Ward et al., Nature, 341:544, 1989)が挙げられる。特異的な結合部位を保持する抗体断片の合成に関与する技法の一般的な概説は、Winter & Milstein, Nature, 349:293-299, 1991に見い出されるべきである。
【0159】
「ScFv分子」によって、我々は、柔軟なオリゴペプチドを介してVHとVLの対ドメインが連結する分子を意味する。ScFv抗体のような操作された抗体は、参照によって本明細書に組み入れられる、J. Huston et al., 「抗体結合部位のタンパク質工学:大腸菌で産生された抗ジゴキシン単鎖Fv類縁体における特異的活性の回復」Proc. Natl. Acad. Sci. USA, 85:5879-5883, 1988及びA. Pluckthun, 「抗体工学:大腸菌発現系の使用からの進歩」Bio/technology vol. 9, 1991 (June)に記載された技法及びアプローチを用いて作製することができる。
【0160】
抗体全体ではなく抗体断片を使用することの利点は、数倍である。断片のサイズが小さいほど、たとえば、標的部位へのより良好な浸透のような薬理学的特性の改善を招いてもよい。たとえば、補体結合のような抗体全体のエフェクター機能が除かれる。Fab、Fv、ScFv及びdAbの抗体断片はすべて大腸菌で発現され、分泌されることができるので、断片を大量に容易に製造することができる。
【0161】
抗体全体及びF(ab’)2断片は「二価」である。「二価」によって、我々は、抗体及びF(ab’)2断片が2つの抗原結合部位を有することを意味する。それに対して、Fab、Fv、ScFv及びdAbの断片は一価であり、たった1つの抗原結合部位を有する。
【0162】
抗体はポリクローナル抗体であってもよいが、モノクローナル抗体であることが好ましい。状況によっては、特に、イヌに繰り返し抗体を投与するつもりならば、モノクローナル抗体がイヌのモノクローナル抗体又はイヌ化抗体であれば好ましい。
【0163】
多重特異性又は単一特異性である、ポリクローナル抗体を製造してもよい。それらは単一特異性であることが好ましい。Neuberger et al によってキメラ抗体が議論されている(1998年、第8回国際バイオテクノロジーシンポジウム、第2部、792〜799)。
【0164】
抗体が「イヌ化」された抗体であれば好ましい。既知の方法によって、たとえば、マウス抗体のCDR領域をイヌ抗体のフレームワークに挿入することによって、好適に調製された非イヌ抗体を「イヌ化」することができる。参照により本明細書に組み入れられる、M. Verhoeyen, C. Milstein and G. Winter, 「ヒト抗体の作り直し:抗リゾチーム活性の移植」Science, 239:1534-1536, 1988及びC. Kettleborough et al., 「CDR移植によるマウスモノクローナル抗体のヒト化:ループ構造におけるフレームワーク残基の重要性」Protein Engineering, 14(7):773-783, 1991において抗体のヒト化について記載されるものに相当する技法及びアプローチを用いて、イヌ化抗体を作製することができる。
【0165】
疾患に関与する作用物質と反応する抗体を投与されることによってイヌはCIRDに対する免疫を受動的に獲得することが十分理解される。
【0166】
従って、本発明の第12の側面は、S.zooepidemicus、M.cynos又はChlamydophilaのいずれか1以上のそれぞれに特異的に結合する1以上の抗体をイヌに投与することを含む、CIRDに対してイヌを受動的に免疫する方法を提供する。
【0167】
上述のような標準的な技法を用いてS.zooepidemicus、M.cynos又はChlamydophilaに特異的に結合する抗体を作製してもよく、又は入手してもよい。
【0168】
疾患に関与する作用物質と反応する抗体を投与することによってイヌにおけるCIRDを治療してもよいことが十分理解される。
【0169】
第13の側面では、本発明は、S.zooepidemicus、M.cynos又はChlamydophilaのいずれか1以上のそれぞれに特異的に結合する1以上の抗体をイヌに投与することを含む、イヌにおけるCIRDを治療する方法を提供する。
【0170】
第12又は第13の側面の実施態様では、Chlamydophilaに特異的に結合する抗体はC.abortus、C.psittaci又はC.felisに結合する。別の実施態様では、Chlamydophilaに特異的に結合する抗体はC.muridarum、C.pecorum、C.pneumoniae、C.suis又はC.trachomatisに結合する。
【0171】
第12又は第13の側面の実施態様では、方法はさらに、CRCV、CPIV、CAV−2、CHV及びB.bronchisepticaのいずれか1以上に特異的に結合する抗体を投与することを含む。
【0172】
上述のような標準的な技法を用いて、CRCV、CPIV、CAV−2、CHV及びB.bronchisepticaに特異的に結合する抗体を作製することができる。
【0173】
本発明の第14の側面は、CIRDに対してイヌを受動的に免疫するための薬物の調製におけるS.zooepidemicus、M.cynos又はChlamydophilaのいずれか1以上のそれぞれに特異的に結合する1以上の抗体の使用を提供する。
【0174】
本発明の第15の側面は、イヌでCRIDを治療するための薬物の調製における、S.zooepidemicus、M.cynos又はChlamydophilaのいずれか1以上のそれぞれに特異的に結合する1以上の抗体の使用を提供する。
【0175】
第14又は第15の側面の実施態様では、Chlamydophilaに特異的に結合する抗体はC.abortus、C.psittaci又はC.felisに結合する。別の実施態様では、Chlamydophilaに特異的に結合する抗体はC.muridarum、C.pecorum、C.pneumoniae、C.suis又はC.trachomatisに結合する。
【0176】
第14又は第15の側面の実施態様では、薬物はさらに、CRCV、CPIV、CAV−2、CHV及びB.bronchisepticaのいずれか1以上に特異的に結合する抗体を含む。
【0177】
本発明の第16の側面は、S.zooepidemicusに特異的に結合する抗体、M.cynosに特異的に結合する抗体、及びChlamydophilaに特異的に結合する抗体のいずれか2以上を含む組成物を提供する。
【0178】
実施態様では、Chlamydophilaに特異的に結合する抗体はC.abortus、C.psittaci又はC.felisに結合する。別の実施態様では、Chlamydophilaに特異的に結合する抗体はC.muridarum、C.pecorum、C.pneumoniae、C.suis又はC.trachomatisに結合する。
【0179】
実施態様では、組成物はさらに、CRCV、CPIV、CAV−2、CHV及びB.bronchisepticaのいずれか1以上に特異的に結合する抗体を含む。
【0180】
本発明は診断法及びアッセイを含むことが十分理解されるであろう。従って、本発明は、CRIDに関係するChlamydophila種にイヌが暴露されたことがあるかどうかを決定する方法を提供するが、該方法は、
(a)イヌから好適な試料を得ること;及び
(b)試料中でCRIDに関係するChlamydophila種又はそれに対する抗体を同定することを含む。
【0181】
通常、Chlamydophila種は、配列番号1〜8(23S RNAの部分配列を示す図5及び8、並びに実施例3を参照のこと)のいずれかの配列(RNAとして示される場合)を含む23S RNAを有するものである。
【0182】
本発明は、イヌがCIRDを有するか、又はCIRDに感受性であるかどうかを決定する方法も提供するが、該方法は、
(a)イヌから好適な試料を得ること;及び
(b)試料中で、S.zooepidemicus、M.cynos又はChlamydophilaのいずれか1以上又はこれらのいずれかに対する抗体を同定することを含む。
【0183】
実施態様の1つでは、方法は、たとえば、試料中で生物自体又はその成分(たとえば、タンパク質又は核酸)を検出することによって生物への現在の暴露を検出できることが十分に理解されるであろう。方法はまた、生物又はその成分に向けられた抗体を検出することによって生物への過去の暴露を検出することもできる。
【0184】
通常、試料は、血清、唾液、気管洗浄液及び気管支洗浄液のような抗体含有試料を含む任意の好適な試料である。
【0185】
従って、生物又はその成分の存在について試料を分析することによって試料が由来するイヌにおける生物の存在を決定してもよい。たとえば、23S RNAを含む核酸成分については、核酸を抽出し、必要に応じてDNAにコピーしてもよく、たとえば、厳密性の高いハイブリッド形成、特異的増幅、ヌクレオチド配列決定及び当業者に周知のそのほかの方法(Sambrook et al., 2001, 上記)を含む技法を用いて検出してもよい。「高い厳密性でのハイブリッド形成」によって、それがハイブリッド形成するポリヌクレオチド及び核酸が、厳密性の高い条件下でハイブリッド形成することができる十分なヌクレオチド配列の類似性を有することを意味する。当該技術で周知のように、核酸のハイブリッド形成の厳密性は、ハイブリッド形成が生じる核酸の長さ、ハイブリッド形成する配列の同一性の程度、並びにたとえば、温度、イオン強度及び配列のCG又はATの含量のような因子に依存する。
【0186】
高い厳密性で生物の核酸分子とハイブリッド形成することができる核酸は、生物の核酸の少なくとも一部で、>90%の配列同一性を有する核酸を含み、好ましくは、>95%、又は>96%又は>97%又は98%、さらに好ましくは>99%の配列同一性を持つものを含む。
【0187】
選択的ハイブリッド形成をもたらす典型的な高い厳密性のハイブリッド形成条件は、当該技術で既知であり、たとえば、参照によって本明細書に組み入れられるSambrook et al., 2001(上記)に記載されたものである。
【0188】
核酸がナイロン膜に固相化され、プローブの核酸が500塩基以上である場合の典型的なハイブリッド形成用溶液の例は、
6xSSC(生理食塩水クエン酸ナトリウム)
0.5%ドデシル硫酸ナトリウム(SDS)
100μg/mLの変性させ、断片化させたサケの精子DNA
である。
【0189】
ハイブリッド形成は68℃で行う。核酸を固相化したナイロン膜は0.1xSSC中で68℃にて洗浄してもよい。
【0190】
20xSSCは以下の方法で調製してもよい。800mLのH2Oに175.3gのNaCl及び88.2gのクエン酸ナトリウムを溶解する。NaOHの10N溶液の2、3滴にてpHを7.0に調整する。H2Oで体積を1リットルに調整する。等量に分配する。オートクレーブで滅菌する。
【0191】
核酸がナイロン膜に固相化され、プローブが15〜50塩基のオリゴヌクレオチドである場合の典型的なハイブリッド形成用溶液の例は、
3.0Mの塩化トリメチルアンモニウム(TMACl)
0.01Mのリン酸ナトリウム(pH6.8)
1mmのEDTA(pH7.6)
0.5%SDS
100μg/mLの変性させ、断片化させたサケの精子DNA
0.1%脱脂粉乳
である。
【0192】
ハイブリッド形成の最適な温度は普通、所定の鎖長のTiより5℃低く選択される。Tiは、プローブとその標的配列との間に形成されるハイブリッドの不可逆的融解温度である。Jacob et al., Nucl. Acids Res., 16:4637, 1988は、Tiの決定を議論している。3MのTMACl中の17量体についての推奨されるハイブリッド形成温度は、48〜50℃であり、19量体では55〜57℃であり、20量体では58〜66℃である。
【0193】
当該技術で既知の任意の方法を用いて、イヌの試料における生物のタンパク質成分を分析することができる。通常、そのような方法は、抗体結合であり、抗体が生物又はその成分に結合する。
【0194】
たとえば、古典的な免疫組織学的方法によって生物のタンパク質の発現を検討することができる。これらでは、一次抗体(ポリクローナル又はモノクローナル)によって特異的な認識が提供されるが、二次検出系は、蛍光、酵素又はそのほかを結合した二次抗体を利用することができる。その結果、病理検査のための組織切片の免疫組織学的染色が得られる。たとえば、ウエスタンブロット又はドット/スロットアッセイのためにタンパク質を遊離するため、尿素や中性の界面活性剤によって組織を抽出することもできる(Jalkanen, M. et al., J. Cell Biol., 101:976-985, 1985; Jalkanen M. et al., J. Cell Biol., 105:3087-3096, 1987)。陽イオン固相の使用に基づいたこの技法では、単離したタンパク質を標準として用いてタンパク質の定量を達成することができる。
【0195】
タンパク質の発現を検出するために有用なそのほかの抗体に基づく方法には、酵素結合免疫吸収測定法(ELISA)及び放射性免疫測定法(RIA)のような免疫測定法が挙げられる。たとえば、反応性のモノクローナル抗体を免疫吸収剤及び酵素標識プローブの両方として用いてタンパク質を検出し、定量することができる。直線回帰コンピュータアルゴリズムを用いて標準調製物に存在する量を参照して試料中に存在するタンパク質の量を計算することができる。腫瘍抗原を検出するためのそのようなELISAは、lacobelli et al., 「乳癌の研究及び治療」11:19〜30(1988年)に記載されている。別のELISAでは、2つの異なった特異的モノクローナル抗体を使用して、体液中のタンパク質を検出することができる。この測定法では、抗体の一方を免疫吸収剤として使用し、他方を酵素標識プローブとして使用する。
【0196】
上記の技法は本質的に「一工程」測定法又は「二工程」測定法として実施してもよい。「一工程」測定法には、固相化した抗体とタンパク質を接触させ、洗浄せずに、標識抗体と混合物を接触させることが含まれる。「二工程」測定法には、標識抗体と混合物を接触させる前に洗浄することが含まれる。そのほかの従来の方法を好適に採用してもよい。測定系の一方の成分を支持体に固相化し、それによって系のほかの成分がその成分と接触でき、試料から容易に離されることが普通望ましい。
【0197】
好適な酵素標識には、たとえば、基質と反応することによって過酸化水素の生成を触媒するオキシダーゼ群からのものが挙げられる。グルコースオキシダーゼは、良好な安定性を有し、その基質(グルコース)が容易に入手できるので、特に好ましい。酵素を標識した抗体/基質の反応によって形成される過酸化水素の濃度を測定することによってオキシダーゼ標識の活性を測定してもよい。酵素のほかに、そのほかの好適な標識には、たとえば、ヨウ素(125I、121I)、炭素(14C)、イオウ(35S)、トリチウム(3H)、インジウム(112In)及びテクネチウム(99mTc)のような放射性同位元素、フルオレセイン及びローダミンのような蛍光標識、並びにビオチンが挙げられる。
【0198】
たとえば、酵素結合免疫吸収測定法(ELISA)のような免疫吸収測定法の周知の技法を用いて、生物又はその成分に対する抗体を検出してもよい。
【0199】
従って、本発明のさらなる側面は、CIRDに関係する抗体を検出するための免疫吸収測定法を提供し、該測定法は、(a)イヌにおいてS.zooepidemicusに対して免疫応答を生じることが可能である作用物質、(b)イヌにおいてM.cynosに対して免疫応答を生じることが可能である作用物質、及び(c)イヌにおいてChlamydophilaに対して免疫応答を生じることが可能である作用物質のいずれか1以上で被覆された固相、並びに固相に結合した抗体に結合する検出可能な標識抱合体を含む。
【0200】
好ましくは、固相はマイクロタイターウエルである。さらに好ましくは、抱合体は、抗イヌ抗体の抗体を含む。好ましくは、抱合体は、酵素、たとえば、西洋ワサビのペルオキシダーゼを含む。さらに好ましくは、免疫吸収測定法は、酵素のための基質も含む。本発明は、免疫吸収測定法の成分を含む部品のキットを包含する。従って、部品のキットは、マイクロタイタープレートのような固相、固相を被覆するための生物由来のタンパク質又は生物、固相に結合する抗生物(又はその成分)抗体に結合する抗イヌ抗体のような検出可能な標識抱合体を包含する。検出可能な標識抱合体が酵素であれば、部品のキットは、酵素のための基質も包含してもよい。キットはまた、固体基材上の抗原と反応することが知られている抗体を含有する陽性対照試料及び陰性対照試料も包含してもよい。
【0201】
本発明はまた、上記及び本発明の第1の側面で定義した(a)、(b)及び(c)のいずれか1つ又は2つ又は3つすべてによって被覆される固相基材を包含する。通常、免疫応答を生じることが可能である作用物質は、抗体も結合するものである。通常、作用物質は、抗原性タンパク質である。通常、タンパク質は、抗原の安定性に依存して、4℃〜37℃にて一晩、マイクロタイタープレートに被覆される。たとえば、リン酸緩衝生理食塩水又はトリス緩衝生理食塩水のような洗浄用緩衝液によって、結合しなかったタンパク質を洗い流す。血清又はそのほかの試料をプレート上で、通常、37℃にて1〜数時間の間インキュベートする。結合しなかった物質を洗い流し、酵素標識した(たとえば、西洋ワサビのペルオキシダーゼ)抗体、たとえば、血清試料のためには抗イヌIgG若しくはIgM、又は肺洗浄液のためには抗イヌIgAと共に37℃にて1〜数時間、プレートをインキュベートする。結合しなかった抗体を洗い流し、OPDのような基質と共にプレートを約10分間インキュベートし、光度計にて光学密度を測定する。
【0202】
好ましくは、固体基材は、マイクロタイターウエルである。
【0203】
本明細書で参照された文書はすべてその全体が参照によって本明細書に組み入れられる。本明細書における以前公開された文書の列記又は議論は、必ずしも、文書が最先端技術の一部である又は共通の一般的知識であるという認知として受け取られるべきではない。
【0204】
以下の図面及び実施例の助けによって、本発明を今やさらに詳細に説明する。
【実施例1】
【0205】
Streptococcus equi亜種zooepidermicusのイヌ感染性呼吸器疾患との関係
〈要約〉
イヌの感染性呼吸器疾患(CIRD)は、ワクチン接種の幅広い利用にもかかわらず、多数の犬舎に飼われたイヌを冒す多因子性の感染症である。現在のワクチンは、ウイルス作用物質及び単一の細菌作用物質、Bordetella bronchisepticaに対して防御することを目的としている。我々は、CIRDにおける連鎖球菌種の役割を調べた。臨床的に健康なイヌ及びCIRDのイヌの下部気道において連鎖球菌を単離、同定して特定の連鎖球菌種の存在と呼吸器疾患を相関付けた。我々は、S.equi亜種zooepidermicus(S.zooepidermicus)の存在が、流行性CIRDに罹った犬舎のイヌ集団における疾患の重症度の上昇に関係することを示す。
【0206】
〈序論〉
CIRDは、あらゆる年齢のイヌを冒す感染症であり、多数のイヌを隙間なく一緒に閉じ込めて飼う場合、共通して生じる。該疾患は、早期の咽頭炎に特徴的な乾いた空咳、鼻汁及び/又は眼漏、及び様々な食欲不振及び意気消沈を伴った高い罹患率を有し、気管気管支炎肺炎及びさらに重度の症例では死亡にさえ進行しうる。該疾患は歴史的に、ウイルス(CPIV及びCAV−2)及び細菌の作用物質による組み合わせ感作又は連続した感作が、臨床スコアの相乗的上昇を生じる複合的感染症とみなされてきた(Appel and Binn, 1987)。該疾患の間、最も共通して検出される細菌作用物質は、B.bronchiseptica(McCandlish et al., 1978)であるが、Pasteurella sp、Mycoplasma sp及びβ−出血性連鎖球菌(βhS)のようなそのほかの細菌種も該疾患に関わってきた(McCandlish et al., 1978; Rosendal, 1978; Thrusfield et al., 1991)。
【0207】
疾患に罹ったイヌ及び健康なイヌ双方の上部気道(口腔及び鼻腔)及び下部気道(気管及び肺)から単離された細菌に関与する多数の研究が、βhSの存在に言及している(Smith, 1967; McCandlish et al., 1978; McKieman et al., 1982; Azetaka & Konishi, 1988)。しかしながら、イヌの上部気道で見い出されるβhSの種々の種にもかかわらず、たった2、3の研究しか下部気道疾患に関与するβhSの種に着目していなかった(Garnett et al., 1982; Angus et al., 1997)。イヌの気道におけるβhSの種は、Biberstein et al. (1980)によって注目されたが、この研究は、上部気道と下部気道における運搬を区別するのを怠った。さらに、単離は、獣医病院の患者から行われたとしても、照会理由及び従って特定の臨床症状へのいかなる連鎖も省略された。イヌにおける最も一般的なβhSである、S.canis、ランスフィールド群G Streptococcusは、皮膚と同様に生殖器及び呼吸器の粘膜の正常な共生生物である(Timoney, 1987; Quinn et al., 1999)。Streptococcus canis (S.canis)は、健康なイヌの60〜73%の扁桃腺から以前、単離されている(Smith, 1967; Sadatsune & Moreno, 1975; Biberstein & Hirsh, 1999)。S.canisは、イヌにおいて、肺炎、敗血症、膿瘍、耳炎、乳腺炎、子宮膿腫、直腸炎、毒性ショック症候群及び壊疽性筋膜炎を含む多様な散発的な及び日和見性の感染症の原因となる(Biberstein & Hirsh, 1999; Quinn et al., 1999)。
【0208】
S.canisに加えて、たとえば、A、C及びEのようなほかのランスフィールド群のβhSもイヌから単離されている(Biberstein et al., 1980)。S.zooepidermicus、ランスフィールド群Cは、哺乳類の上部気道粘膜の共生生物として見い出されている(Timoney et al., 1988; Quinn et al., 1999)。それは、ウマにおける下部気道疾患、巣状肺炎及び子宮頸管炎(Chanter et al., 1997; Biberstein & Hirsh, 1999)、ラマにおける肺炎(Biberstein & Hirsh, 1999)、ブタにおける敗血症及び関節炎(Timoney, 1987)、ウシ及びヤギにおける乳腺炎(Timoney et al., 1988)、ニワトリにおける敗血症、ラマにおける心膜炎及び肺炎(Timoney, 1987)、モルモットにおけるリンパ節炎(Quinn et al., 1999)、及びヒトにおける糸球体腎炎(Balter et al., 2000)を含む幾つかの疾患症候群に関係している。イヌでは、S.zooepidemicusは、創傷感染及び敗血症(Quinn et al., 1999)及び急性壊死性出血性肺炎(Gamett et al., 1982)に関係している。本研究で我々は、健康なイヌ及びCIRDに罹ったイヌの双方の気道にβhSのどの種が存在するのかを確立しようとした。
【0209】
〈材料及び方法〉
〈試験集団及び試料採取〉
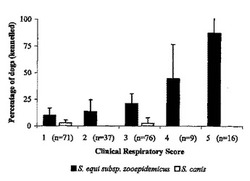
主な試験集団(n=209、気管支肺胞洗浄、BAL)は、風土性のCIRDの履歴を持つ定評のあるリホーミング犬舎(〜600匹のイヌ)からの動物を含んだ。犬舎に入れる際、すべてのイヌに、ジステンパーウイルス、CAV−2、CPIV及びイヌパルボウイルスのための弱毒化生ワクチン並びにレプトスピラ症に対するKAVAK Lである、KAVAK DA2PiP69(フォートドッジ)によるワクチン接種を行った。イヌコロナウイルス(CRCV)及びB.bronchiseptica双方の存在は、この施設におけるCIRDに罹ったイヌで実証されている(Chalker et al., 2003; Erles et al., 2003)。各週、この犬舎は福祉の理由で若干のイヌを犠牲にしなければならず、これらのイヌから、試料採取のために2、3匹を任意に選択した。1999年〜2001年の間、2年間にわたって合計209匹のイヌから以下の方法によってBAL試料を採取した。安楽死の2時間以内に、気管を分岐の真上でクランプで止めて、試料採取中、肺への気管の混入を防いだ。滅菌したカテーテルチュービングを用いて、次いで50mLのハンクス平衡塩溶液を左先端の肺葉に入れた。次いで、この肺葉を30秒間マッサージし、BALを回収した。安楽死の際に、臨床的な呼吸のスコアの重症度について以下のカテゴリ:(1)呼吸器徴候なし、n=71、(2)軽い咳、n=37、(3)咳及び鼻汁、n=76、(4)意気消沈及び/又は食欲不振を伴った咳及び鼻汁、n=9、(5)化膿性気管支肺炎、n=16に、イヌを等級分けした。
【0210】
BAL試料採取の後、組織学的分析のために、右遠位肺葉からの肺組織の切片を必要とした。ホルマリン固定(10%ホルマリン生理食塩水)した組織の塊をパラフィンに包埋し、標準のヘマトキシリン及びエオシン染色した切片を光学顕微鏡(x40、x100、x400)のもとで観察した。肺胞内好中球の存在又は非存在を書き留めた。
【0211】
各イヌが犬舎で過ごした合計日数を記録し、次いで、犬舎での時間を週で算出した。犬舎に入れる際の各イヌの年齢及び臨床症状を書きとめ、栄養状態、被毛、振る舞い、食欲、及び一般の臨床検査(体温、脈拍、呼吸数)に基づいた臨床症状複合スコアを以下の(1)良好、(2)不良、(3)極めて不良のように等級分けした。
【0212】
追加のイヌ集団が、2年間にわたる(1998〜2000年)(n=71、BAL)、RVCでの診断的細菌学を参照した臨床的呼吸器症状を持つ家庭で飼われたペット犬から構成される対照群として含められた。対照群からの試料は、Cocoran (1998)によって記載された内視鏡で誘導する技法を用いて採取した。研究における試料はすべて、細菌学試験まで4℃で保持し、凍結BALで行うmL当たりのCFUの計算を除いて、試験は試料採取の24時間以内に行った。
【0213】
〈細菌の単離及び同定〉
BALの50μL容量を5%無菌のヒツジの血液と共にコロンビア血液寒天(英国、ハンプシャー、オキソイド社)プレートに2つ1組で入れ、好気的又は嫌気的の双方で、37℃にて24時間インキュベートした。β−溶血性コロニーを同定し、次いで単一コロニーに精製した。コロニー及び細胞の形態によって、グラム陽性、カタラーゼ陰性の細菌を連鎖球菌と同定し、ラテックスビーズのスライド凝集(英国、ハンプシャー、オキソイド社)によってランスフィールド群に血清学的に分けた。次いで、APL20STREP手動同定キット(英国、ベージングストーク、バイオメリエクス英国社)を用いて、生化学を利用し、酵素の作用によって単離物を種のレベルに同定した。
【0214】
混合感染を検出するために、研究における最初の12匹のイヌからの3つのコロニーをラテックスビーズスライド凝集とAPI20STREPの両方によって調べた。リン酸緩衝生理食塩水(英国、ドーセット、シグマ−アルドリッチ社)によるBALの連続希釈を3連1組でプレートに播き、上述のようにインキュベートし、BALのmL当たりのCFUを算出した、次いで、βhSの増殖を以下:なし(0)、<100CFU/mL(1)、100〜1000CFU/mL(2)及び>1000CFU/mLのように等級化した。
【0215】
〈統計学的解析〉
解析についてはすべて、0.05の1型誤差(α)の有意レベル又は確率を前提とした。プリズム(米国、サンディエゴ、グラフパッドソフトウエア社、バージョン3.0)統計学解析ソフトウエアX2検定を用いて、年齢、犬舎に入れる際の臨床症状、犬舎での週数、肺胞内好中球の存在及び臨床的呼吸スコアとS.zooepidemicusの存在を解析した。各呼吸スコアに関するS.zooepidemicusの増殖についての合わせた平均スコアの使用によって細菌の増殖と呼吸スコアの相関を決定し、プリズム1方向ANOVA(非パラメータ)検定によって解析した。週の時間経過による犬舎で飼われたイヌの試料中のS.canis、S.zooepidemicus及び呼吸器疾患の存在も計算した。
【0216】
〈結果〉
β−溶血性連鎖球菌は、両方の試験集団から単離されたが、家庭で飼われたペット犬のBALからの単離は、犬舎で飼われたイヌからの単離と大きく異なった(家庭犬1.4%、犬舎23.9%、X2検定***p=0.000)。hSの単離物はすべてS.canis又はS.zooepidemicusであった。異なったランスフィールド群又は種のよる混合感染は見い出されず、さらに個々のプレートはすべて均一な形態のコロニーを生じた。犬舎のイヌからはS.canis及びS.zooepidemicusの双方が単離されたが、家庭のペット犬からはS.zooepidemicusのみが単離され、S.canisは単離されなかった。犬舎のイヌでは、S.zooepidemicusが優勢なhS種であった(92.0%)。臨床的呼吸スコアの各等級の範囲内で犬舎のイヌにおけるS.canis及びS.zooepidemicusの双方の保菌犬を調べた(図1)。S.canisは、臨床スコアの有無にかかわらずイヌに存在し、単離は、疾患の重症度に伴って上昇しなかった。それに対して、健康なイヌは、疾患に罹った動物よりも下部気道にS.zooepidemicusを有する可能性は低く(X2検定**p=0.004)、S.zooepidemicusの単離は、臨床的呼吸スコアの上昇と共に、無症状のイヌでの9.7%から化膿性気管支肺炎のイヌでの87.5%へと劇的に増えた(X2検定***p=0.000)。呼吸スコアの高いイヌほど、臨床的に健康なイヌよりもさらに高い平均のS.zooepidemicusの細菌増殖スコアを有する可能性がさらに高かった(1方向ANOVA解析***p=0.000、R自乗=0.194、F=22.265)。動物の年齢及び犬舎に入れた際の臨床症状は、S.zooepidemicusの単離に影響を与えなかった(X2解析、年齢p=0.341、犬舎に入れた際の臨床症状p=0.295)。
【0217】
犬舎においてCIRDに罹ったイヌの比率は、1週目の21.1%から2週目の70.1%へと劇的に上昇したが、4週目の終わりまで集団においてDIRDは増えなかった(図2)。有意差は検出されなかったが、肺にS.zooepidemicusを持つイヌの数は、犬舎で経時的に1週目の16.7%から3週目の34.4%へと20.6%増えたが(図2)、S.canisではそのような傾向は見られなかった。
【0218】
組織学的解析は、S.zooepidemicusを持つイヌは、S.zooepidemicusのないイヌよりも肺胞内好中球を有する可能性が高いことを示した(X2解析、**p=0.006)。高い細菌スコアを持つイヌでは、S.zooepidemicusが誘発した出血性連鎖球菌肺炎(HSP)のイヌでのGarnett et al. (1982)の知見に類似する、中程度から顕著なマクロファージの凝集を伴う急性の化膿性又は壊死性の肺炎が見られることが多かった。HE染色の切片では、細菌細胞は見られなかった。
【0219】
〈考察〉
本研究では、我々は、疾患の有無にかかわらず、家庭で飼われたイヌ及び犬舎で飼われたイヌの下部気道に存在するβhSの種に着目した。S.canisがイヌの気道では優勢なβhSであり(Biberstein et al., 1980)、本研究における犬舎のイヌの一部の下部気道から単離されたが、それは、犬舎で飼われたイヌのCIRDとは関係しなかった。それに対して、S.zooepidemicusの単離の増加は、CIRDの重症度の上昇と関係していた。何らかの呼吸器症状を持つイヌは犬舎における健康なイヌよりも下部気道にS.zooepidemicusを有する可能性が高く、S.zooepidemicusは、犬舎で飼われたイヌよりも家庭のペットではさらに低い比率で見い出された。
【0220】
Streptococcus equi亜種zooepidermicusはこれまでは、イヌにおけるHSPに関係するとされていた(Garnett et al., 1982)。HSP症候群は、ビーグルの閉鎖コロニーにおける重度の感染であり、事前の臨床スコアなしで突然死を生じた。剖検所見は、気管及び気管支内における多量の出血性滲出物が含まれ、広汎性の暗赤色の肺を伴っていた。さらに、他の組織の範囲で斑状性出血があった。その疾患は、1匹のイヌにおけるS.zooepidemicusの気管内接種により再現された。本研究において興味深いことに、S.zooepidemicusの高い増殖スコアを持つイヌほど肺胞内好中球を有する可能性が高く、低い増殖スコアを持つイヌよりもHSPにおいてGarnett et al., (1982)により記載された肺の組織学的特徴を共有している。
【0221】
CIRDは歴史的に、細菌性及びウイルス性の作用物質が関与する複雑な疾患であるとみなされている。実際、この犬舎で飼育された集団では、CRCV(Erles et al., 2003)及びB.bronchiseptica(Chalker et al., 2003)を含むそのほかの幾つかの作用物質が記載されている。CRCVの病原性の潜在能力は未だ明らかにされていないが、Erles et al., (2003)によるデータは、CRCVが軽い呼吸器疾患(スコア2)のイヌで優勢であることを示し、同様に、Chalker et al., (2003)はB.bronchisepticaを持つイヌは、中程度の疾患(スコア3)のイヌで優勢であることを見い出した。
【0222】
我々が、Streptococcus zooepidemicusはCIRDのさらに重度の症例(スコア4〜5)にのみさらに共通して関係していることを見い出したということは、それが二次的なインベーダとして作用している可能性があることを示している。実際、βhSの種はこれまでCIRDの「複合体」における二次的インベーダであるとされている(McCandlish et al., 1978)。しかしながら、S.zooepidemicusは、これらの動物における呼吸器疾患で主要な役割を担うのか、又はほかの病原体による損傷に続いて単に気道に侵入するだけなのかどうかは未だにわからない。疫学的な証拠は、ウマのS.zooepidemicusは呼吸器疾患の主要な病原体であってもよいが(Wood et al., 1993; Chanter et al., 1997)、それは一般に日和見的な病原体であるとみなされる(Walker & Timoney, 1998; Anzai et al., 2000)ことを示唆している。S.zooepidemicusがこれらのイヌにおけるCIRDの主要な原因でないとしても、化膿性気管支肺炎のイヌからの高率の単離(87.5%)は、S.zooepidemicusが犬舎で見られるさらに重度の臨床徴候に関与するという仮説を支持する。呼吸器疾患に罹った家庭でのペットからの低い単離(1.4%)は、この作用物質が共通の呼吸器感染でなくてもよく、この犬舎に特有の問題であればよいことを示している。以前の犬舎飼育を考慮に入れなかったが、本研究における家庭で飼われているペット犬の一部がかつて犬舎で飼育されたことがあるということはありそうなことである。犬舎で飼育されたイヌにおけるCIRDのほかの症例でのS.zooepidemicusのが担う役割は確認されていない。
【0223】
これらのイヌからのS.zooepidemicusの単離が犬舎において経時的に増加するということは、これらイヌの肺がこの細菌で感染されるようになることを示している。そのような感染は上部気道の無症状性の感染又は単一の病原性株から生じればよい。可変性M−様SzPタンパク質の遺伝子に関するPCRのタイピングシステムによって、S.zooepidemicusの15の既知の血清型を5つの識別可能な群、HV1〜5に分離することができる(Walker & Timoney, 1998)。Anzai et al. (2000)によるこのタイピングシステムの解析によって、S.zooepidemicusの単一クローンの変異体が肺炎のウマの肺で見い出されたが、幾つかの型が健康なウマの扁桃腺で見い出された。CIRDのこの発生に関与するS.zooepidemicusの単離物の亜型をタイプ分けし、疾患に罹った集団に単一クローンの変異体が存在するかどうかを決定し、また、あるとすれば、イヌのS.zooepidemicus単離物が有するウマ及びそのほかの動物における呼吸器疾患を起こすものとの関係を調べることは興味深い。S.zooepidemicusが関係する肺炎はあらゆる年齢のウマで発生し、輸送によるストレスを与えられた老齢のウマでは急性の出血性肺炎を生じる(Anzai et al., 2000)。CIRDのこの発生では、若齢のイヌ及び犬舎に入れる際、哀れな臨床症状のイヌは、年取ったイヌ及び入れる際、健康なイヌと同様に、S.zooepidemicusによる感染に感受性が高かった。
【0224】
この犬舎では、感染の範囲について抗生物質療法を与え、重度の気管支肺炎の症例を除いてCIRDに罹ったイヌへの日常的な治療は行わない。治療が本研究で注目した細菌のスペクトルに影響を与ええた可能性がある。しかしながら、呼吸器疾患の自然発生の調査は、他の手段では得ることができない貴重な情報を提供することができる。
【0225】
CIRDは、CAV−2、CPIV、B.bronchiseptica、及びMycoplasma sppを含む幾つかの作用物質が関与する多因子疾患であることが知られている。種々の場所から多数のイヌが集められ、飼育されているこの犬舎では、幾つかの病原体が存在し、疾患の重症度はこれを反映している可能性がある。
【実施例2】
【0226】
〈Mycoplasma cynosのイヌ感染性呼吸器疾患との関係〉
生物の培養及びPCR解析による同定によってM.cynosの存在を調べた。犬舎で飼育された184匹のイヌの調査で、我々は、気管又は肺にM.cynosを持つイヌの比率が呼吸器疾患の徴候と共に、健康なイヌの10%から疾患に罹ったイヌの31%へと増加することを見い出した(図3)。
【0227】
我々はまた、呼吸器疾患は犬舎で経時的に増加し、第1週目は犬舎のイヌは気管に検出可能なM.cynosを有さなかったのに対して第2週目までに184匹のイヌのうち24%が気管におけるM.cynos陽性であることに気づき、これは、集団の24%がこの細菌に感染していることを示している。さらに小さな、しかし類似の増加も肺のコロニー形成で見られた(15%から23%へ)(図4を参照のこと)。
【実施例3】
【0228】
〈Chlamydophilaのイヌ感染性呼吸器疾患との関係〉
Chlamydophilaの存在について我々は、PCR解析によって210匹のイヌを調査した。以下のPCRによってChlamydophilaから23SrRNA遺伝子の218bpの断片を増幅した。反応条件:95℃にて5分間(x1サイクル)、95℃にて30秒間、50℃にて30秒間、72℃にて1分間(x40サイクル)及び72℃にて5分間。合計50μLのPCR反応混合物には、5.0μLの10xのマグネシウムを含まない緩衝液(プロメガ)、1.5mMのMaCl2(プロメガ)、0.5μL(0.5単位)のTaqDNAポリメラーゼ(プロメガ)、0.2mMのPCRヌクレオチド混合物(プロメガ)、0.025μgの正方向プライマーC1(5’−GATGCCTTGGCATTGATAGGCGATGAAGGA−3’配列番号9)及び逆方向プライマーC2(5’−TGGCTCATCATGCAAAAGGCA−3’配列番号10)、40μLの水及び2μLの試料組織のDNAが含まれた。
【0229】
配列の解析及びFasta解析によるジェンバンクで利用可能な配列とのPCR産物の比較によって8匹のイヌから得られたPCR産物をChlamydophilaとして確認した。そのような配列(DHBC10)の1つの23SrRNA遺伝子の部分配列を図5に示す(配列番号1)。この218bpの配列は、Chlamydophila abortusの同一領域と99.08%同一であり、Chlamydophila psittaciと98.6%同一であり、Chlamydophila felisと96.3%同一であるが、予備的な系統発生解析(Megalignによるクラスター法)では、ほとんどの配列は、別個のクレードでクラスターを作る(図7)。7つのそのほかのChlamydophila単離物の23SrRNAの部分配列を図8に示す(配列番号2〜8)。
【0230】
この調査では、我々は、Chlamydophilaの検出は、気管及び肺の双方における呼吸器疾患の重症度の上昇と共に増加することを見い出した。10%の検出の軽い増加は、気管試料(25%から34%へ)で見い出された。さらに劇的な差異は、肺におけるChlamydophilaの検出で、健康なイヌの0%からCIRDのイヌでの37.5%への増加によって見い出された(図6)。さらに、ChlamydophilaのPCRにより陽性とされたイヌの総数は、健康なイヌの25%から重度疾患のイヌでの50%への増加が見られた(図6)。
【実施例4】
【0231】
〈イヌヘルペスウイルスのイヌ感染性呼吸器疾患との関係〉
我々は、さらに重度の呼吸器症候群に罹ったイヌにおけるイヌヘルペスウイルスの罹患率の上昇を見い出した(図9)。1年にわたってCHVに対する抗体反応をモニターした場合、呼吸器疾患を頻繁に発生する犬舎のイヌは、発生のない匹敵する犬舎のイヌ(8.3%)よりも頻繁に(58.3%)CHVに対する血清変換を示した。
【0232】
《参照文献》
Angus, J. C. , Jang, S. S. , Hirsh. D. C. , (1997). Microbiological study of transtracheal aspirates from dogs with suspected lower respiratory tract disease: 264 cases (1989-1995).J Am. Vet. Med. Assoc. 210,55-58.
Anzai, T. , Walker, J. A. , Blair, M. B. , Chambers, T. M. , Timoney, J. F., (2000). Comparison of the phenotypes of Streptococcus zooepidemicus isolated from tonsils of healthy horses and specimens obtained from foals and donkeys with pneumonia. Am. JVet. Res. 61,162-166.
Appel MJ, Percy DH. SV-5-like parainfluenza virus in dogs. (1970) JAmVetMed Assoc. 1970 Jun 15; 156 (12): 1778-81
Appel, M. , Binn, L. N. , 1987. Canine Infectious Tracheobronchitis Short review: Kennel Cough. In: Appel M. (Ed. ), Virus Infections of Carnivores. Elsevier. Oxford. pp.201-211.
Arizmendi F, Grimes JE, Relford RL. (1992). Isolation of Chlamydia psittaci from pleural effusion in a dog. J VetDiagn Invest. 4 (4): 460-3.
Azetaka, M., Konishi, S. , (1988). Kennel cough complex: confirmation and analysis of the outbreak in Japan. Jap. J Vet. Sci. 50,851-858.
Balter, S. , Benin, A. , Pinto, S. W. L. , Teixeira, L. M. , Alvim, G. G. , Luna, E., Jackson, D. , LaClaire, L. , Elliot, J. , Facklam, R. , Schuchat, A. , (2000). Epidemic nephritis in Nova Serrana, Brazil. Lancet. 355,1776-1780.
Barile, M. F. (1985) Immunization against mycoplasma infections p 451- 492. In S. Razin and M. F. Barile (Ed. ) The Mycoplasamas, vol 4. Mycoplasma pathogenicity. Academic Press, Inc, Orlando, Florida.
Barile M. F. etal.,(1985). Current status on the controls of mycoplasma diseases of man, animals, plants and insects. Bull. Inst. Pasteur. 83: 339- 373.
Bemis, D. A. , Carmichael, L. E. , and Appel, M. J. (1977a). Naturally occurring respiratory disease in a kennel caused by Bordetella bronchiseptica.Cornell Vet. 67,282-93.
Bemis DA, Greisen HA, and Appel MJ. (1977b). Pathogenesis of canine bordetellosis. J Infect Dis 135: 753-762.
Biberstein, E. L. , Brown, C. , Smith, T. , (1980). Serogroups and Biostypes among beta-hemolytic streptococci of canine origin.J. Clin. Microbiol. 11, 558-561.
Biberstein, E. L. , Hirsh, D. C. , (1999). Streptococci. In: Hirsh, D. C. , Zee, Y. C. , (Eds. ) Veterinary Microbiology. Blackwell Science. Oxford. pp 120- 126.
Binn, L. N. , Eddy, G. A. , Lazar, E. C. , Helms, J. , and Murnane, T. (1967). Viruses recovered from laboratory dogs with respiratory disease.Proc SocExp Biol Med 126, 140-5
Chalker VJ, Toomey C, Opperman S, Brooks HW, Ibuoye MA, Brownlie J, Rycroft AN. Respiratory Disease in Kennelled Dogs: Serological Responses to Bordetella bronchisepticaLipopolysaccharide Do Not Correlate with Bacterial Isolation or Clinical Respiratory Symptoms.Clin Diagn Lab Immunol. 10 (3): 352-6.2003
Chanter, N. , (1997) Streptococci and enterococci as animal pathogens. J. Appl. Microbiol. Symp. Suppl. 83, 100S-109S.
Cocoran, B.(1998). Cytological collection techniques. In: Luis Fuentes, V. Swift, S. , (Eds. ), Manual of small animal cardiorespiratory medicine and surgery. BritishSfnall Anim. Vet. Assoc. Cheltenham. pp. 75-79.
Ditchfield, J. , Macpherson, L. W. , and Zbitnew, A. (1962). Association of a canine adenovirus (Toronto A 26/61) with an outbreak of laryngotracheitis ("kennel cough"). Can. Vet. Jour. 3,238-247
Ellis JA, Haines DM, West KH, Burr JH, Dayton A, Townsend HG, Kanara EW, Konoby C, Crichlow A, Martin K, Headrick G.(2001) Effect of vaccination on experimental infection with Bordetella bronchiseptica in dogs.JAm VetMedAssoc. 218 (3):367-75. 2001
Erles,K., Toomey, C. , Brooks, H. W. , Brownlie, J. (2003). Detection of a group 2 coronavirus in dogs with canine infectious respiratory disease. Virology. In press.
Farrow JA, et al. (1984). "Taxonomic studies on Streptococci of serological groups C, G and L and possibly related taxa".Syst. Appl. Microbiol. 5: 483- 493.
Fraser G, Norval J, Withers AR, Gregor WW. (1985) A case history of psittacosis in the dog.VetRec. 196985 (3): 54-8.
Fukushi H, Ogawa H, Minamoto N, Hashimoto A, Yagami K, Tamura H, Shimakura S, Hirai K. (1985) Seroepidemiological surveillance of Chlamydia psittaci in cats and dogs in Japan. Vet Rec. 117 (19): 503-4.
Garnett, N. L. , Eydelloth, R. S., Swindle, M. M. , Vonderfecht, S. L., Strandberg, J. D. , Luzarraga, M. B. , (1982). Hemorrhagic streptococcal pneumonia in newly procured research dogs. J Am. Vet. Med. Assoc. 181, 1371-1374.
Gresham AC, Dixon CE, Bevan BJ. (1996) Domiciliary outbreak of psittacosis in dogs: potential for zoonotic infection.VetRec. 138 (25): 622-3.
Jang SS, Ling GV, Yamamoto R, Wolf AM. (1984) Mycoplasma as a cause of canine urinary tract infection.J Am Vet Med Assoc 185(1) : 45-7
Karpas, A. , King, N. W. , Garcia, F. G. , Calvo, F., and Cross, R. E. (1968a). Canine tracheobronchitis: Isolation and characterization of the agent with experimental reproduction of the disease.Proc Soc Exp Biol Med. 127,45- 52.
Karpas A, Garcia FG, Calvo F, Cross RE. (1968b) Experimental production of canine tracheobronchitis (kennel cough) with canine herpesvirus isolated from naturally infected dogs.Am J VetRes. 29 (6): 1251-7.
Keil, D. J. , and Fenwick, B. (1998). Role of Bordetella bronchiseptica in infectious tracheobronchitis in dogs.JAm Vet Med Assoc. 15,200-7.
Lambrechts N, Picard J, Tustin RC. (1999) Chlamydia-induced septic polyarthritis in a dog.J ; SAfr VetAssoc. 70(1) : 40-2).
Lou, T. Y. , and Wenner, H. A. (1963). Natural and experimental infection of dogs with reovirus, typel: pathogenicity of the strain for other animals. Am.J.Hyg. 77,293-304.
McCandlish, I. A. P. , Thompson, H., Cornwell, H. J. C. , Wright, N. G. , 1978. A study of dogs with kennel cough. Vet. Rec. 102,298-301.
McKiernan, B. C. , Smith, A. R., Kissil, M. , 1982. Bacterial Isolates from the lower trachea of clinically healthy dogs.J. Am. Anim. Hospl. Assoc. 20, 139-142.
Quinn, P. J. , Carter, M. E. , Markey, B. K. , Carter, G.R., (Eds. ), 1999. Clinical Veterinary Microbiology. Mosby. pp. 129-130.
Randolph JF, Moise NS, Scarlett JM, Shin SJ, Blue JT, Bookbinder PR. (1993). Prevalence of mycoplasmal and ureaplasmal recovery from tracheobronchial lavages and prevalence of mycoplasmal recovery from pharyngeal swab specimens in dogs with or without pulmonary disease. AmJ Vet Res. Mar ; 54 (3):387-91.
Rosendal, S.(1972). Acta Vet. Scand. 13: 137.
Rosendal & Vinther (1977). Experimental mycoplasmal pneumonia in dogs: electron microscopy of infected tissue. ActaPathol Microbiol Scand [BJ 85B (6): 462-5.
Rosendal, S. (1978). Canine Mycoplasmas: Pathogenicity of Mycoplasmas associated with distemper pneumonia. J. Infect. Dis. 138 (2),203-210.
Sadatsune, T. , Moreno, G. , 1975. Contribution to the study of b-haemolytic streptococci isolated from dogs.Arq. Inst. Biol. Sao. Paulo. 42,257-264.
Sako T, Takahashi T, Takehana K,Uchida E, Nakade T, Umemura T, Taniyama H. (2002) Chlamydial infection in canine atherosclerotic lesions. Atherosclerosis. 162 (2): 253-9.
Smith J. E. , 1967. The aerobic bacteria of the nose and tonsils of healthy dogs.J Comp. Path. 71,428-433.
Storz, J. (1988) Microbiologyof Chlamydia. p. 168 Ed A. L. Barron, Boca Raton, CRC Press.
Swango LJ, Wooding WL Jr, Binn LN. 1970. A comparison of the pathogenesis and antigenicity of infectious canine hepatitis virus and the A26-61 virus strain (Toronto). J Am Vet MedAssoc. 1970 Jun 15; 156 (12):1687-96.
Thompson H, McCandlish IAP, Wright NG : (1976) Experimental respiratory disease in dogs due to Bordetella bronchiseptica. Res Vet Sci 20: 16-23.
Thrusfield, M. V. , Aitken, C. G. G. , Murihead, R. H. , (1991). A field investigation of kennel cough: incubation period and clinical signs.J. Small Anim. Pract. 32,215-220.
Timoney, J. F. (1987). The Streptococci. In: Gyles, C. L. , Thoen C. O. , (Eds.) Pathogenesis of bacterial infections in animals. Iowa State University Press. pp. 12-13.
Timoney, J. F. , Gillespie, J. H. , Scott, F. W. , Barlough, J. E. , (Eds), 1988. The Genus Streptococcus. In: Hagan and Bruner's Microbiology and Infectious Diseases of Domestic Animals. Comstock Publishing Associates, London. pp. 181-187.
Ural O, Tuncer I, Dikici N, & Aridogan B. (2003). Streptococcus zooepidemicus meningitis and bacteraemia.Scand Jlhfect Dis. 35 (3): 206- 207.
Walker, J. A. , Timoney, J. F. , (1998). Molecular basis of variation in protective SzP proteins ofStreptococcus zooepidemicus. Am. J Vet. Res. 59,1129-1133.
Walker RL & Runyan CA (2003). Identification of variations in SzP proteins of Streptococcus equi subspecies zooepidemicus and the relationship between protein variants and clinical signs of infection in horses.AmJVetRes. 64 (8):976-81.
Werth D, Schmeer N, MullerHP, Karo M, Krauss H. (1987). Demonstration of antibodies against Chlamydia psittaci and Coxiella burnetii in dogs and cats: comparison of the enzyme immunoassay, immunoperoxidase technic, complement fixation test and agar gel precipitation testZen ralbl Veterinarmed B. 34 (3): 165-76.
Wood, J. L. N. , Burrell, M. H. , Roberts, C. A. , Chanter, N. , Shaw, Y. , (1993). Streptococci andPasteurella spp. associated with disease of the equine lower respiratory tract. Equine Vet. J. 25,314-318.
Young S, Storz J, Maierhofer CA. (1972) Pathologic features of experimentally induced chlamydial infection in dogs. Am J Vet Res. 33(2) : 377-83.
【図面の簡単な説明】
【0233】
【図1】臨床的呼吸器スコア(n=各群におけるイヌの総数)を持つ209匹の犬舎で飼育されたイヌからのS.canis及びS.zooepidemicusの単離。エラーバーは、信頼区間(95%)を表す。
【図2】犬舎のCIRDのイヌにおける経時的なS.canis及びS.zooepidemicusの比率(n=合計209匹のイヌの各群におけるイヌの総数)。エラーバーは、信頼区間(95%)を表す。
【図3】CIRDの重症度レベルが高まる場合の気管及び肺にM.cynosの感染を持つイヌの比率。
【図4】犬舎での時間の長さが増した後の気管及び肺にM.cynosの感染を持つイヌの比率。
【図5】CIRDに罹ったイヌ(CHB10)から単離したChlamydophilaの23SrRNA遺伝子の218の部分ヌクレオチド配列(配列番号1)。
【図6】CIRDの重症度レベルが高まる場合の気管及び肺にChlamydophilaの感染を持つイヌの比率。
【図7】Chlamydia及びChlamydophilaの既知の種すべての23SrRNAによって直列させたイヌ23SrRNAの部分配列(DHB)(Cabor-C.abortus、Cpsit-C.psttaci、Cfel-C.felis、Ccavi-C.caviae、Cpne-C.pneumoniae、Cpec-C.pecorum、Csuis-C.suis、Ctrac-C.trachomatis、Wad-Waddlia、Sim-Simkania)。
【図8】CIRDに罹ったイヌ(CHB2、4、5、6、7、8及び9)から単離したChlamydophila種の23SrRNA遺伝子の218の部分ヌクレオチド配列(配列番号2〜8)。
【図9】CIRDの重症度レベルが高まる場合の気管及び肺にイヌヘルペスウイルスの感染を持つイヌの比率。
【技術分野】
【0001】
本発明はワクチン組成物に関するものであり、特に、イヌ感染性呼吸器疾患に対して使用するためにワクチン組成物に関する。
【背景技術】
【0002】
イヌ感染性呼吸器疾患(CIRD)は、リホーミング施設及び搭乗用犬舎又は訓練用犬舎のような混み合った条件で飼われているイヌに共通する伝染性の高い疾患である。多数のイヌは軽い咳のみを病み、短期間で回復するが、重篤な気管支肺炎を発生しうる場合もある(Appel & Binn, 1987)。CIRDは稀にしか死に至ることはないが、救護施設のイヌのリホーミングを遅らせ、訓練用犬舎のスケジュールを中断させると共に、相当な治療コストを生じる。
【0003】
CIRDの病態発生は、幾つかのウイルス及び細菌が関与する多因子性であるとみなされている。原因となる主な病原体であるとみなされている作用物質は、イヌパラインフルエンザウイルス(CPIV)(Binn et al., 1967)、イヌアデノウイルス2型(CAV−2)(Ditchifield et al., 1962)、及びイヌヘルペスウイルス(CHV)(Karpas et al., 1968a & 1986b)、イヌ呼吸器コロナウイルス(CRCV)(WO 2004/011651 (The Royal Veterinary College); Erles et al., 2003)、及び細菌、Bordetella bronchiseptica(B.bronchiseptica(Bemis et al., 1977a; Keil et al., 1998)である。
【0004】
これらのウイルス及び細菌は発生している間に単離されるとこが多く、実験的感染において呼吸器症状又は肺病変を生じることが示されている(Appel & Percy, 1970; Swango et al., 1970; Karpas et al., 1986b)。
【0005】
また、CIRDの症状を持つイヌからヒトのレオウイルス及びマイコプラズマの種が単離されている(Lou & Wenner 1963; Randolph et al., 1993)。ストレスのような追加的因子も重要であってもよい。
【0006】
B.bronchisepticaは、呼吸器疾患「犬舎咳」における主な病因菌であるとして報告された(Bemis et al., 1977b; Thompson et al., 1976)。それによって、イヌはそのほかの呼吸器病因の影響を受けやすくなり、それはそれらと同時に存在することが多い。伝染力の強いB.bronchisepticaで感作することにより犬舎咳を再生することができる。さらに、寒い、隙間風及び高い湿度のような環境因子は、犬舎での典型的な条件であることが多いが、疾患への感受性を高める(Ellis et al., 2001)。抗体は、一次疾患を治療するための弱い作用物質として一般に認識される(Ellis et al., 2001)。それに対して、B.bronchisepticaに対する免疫予防法は、疾患の制御に役立つ相対的に有効な手段を提供する。
【0007】
B.bronchiseptica感染の際立った徴候は、活動又は興奮によって悪化する荒い、乾いた咳である。激しい咳の発作が生じ、咽喉からの少量の粘液を除こうとする吐き気又は嘔吐がそれに続く。二次的な細菌の侵襲が起きるにつれて体温が上昇してもよい。犬舎咳は伝染性が高いので、疾患は、感受性のイヌに容易に伝染することができ、重度の咳を生じることができる。最も重度の徴候は、感染後2〜5日目に見られ始めるが、延長した期間継続しうる。ストレス、特に有害な環境条件は、疾患の後期段階の間に再発を引き起こす可能性がある。
【0008】
犬舎咳は通常、上部気道の症状であり、鼻汁及び咳き込みを特徴とする。犬舎咳は主として上部気道の変化が関与するが、CIRDの病理学は、それが肺の損傷、場合によっては気管支肺炎に関与することを示している。犬舎咳は、CIRDより軽い症候群であり、CIRDで見られる幅広い範囲の病態を有さない。重症度及び死亡率の上昇によってもCIRDは識別される。
【0009】
CIRDは、軽い疾患から致死的な疾患までの範囲で呼吸器の徴候を示すイヌにおける症候群である。それは、炎症性から滲出性、浮腫性、時に、肺組織内で広く広がりうる出血性の病態の進行を伴った上部及び下部の気道の感染の関与を特徴とする。CIRDはまた、B.bronchisepticaの非存在下でも生じることができ、実際、検出可能なB.bronchisepticaを有さないのにCIRDに罹るイヌがあり、それは、犬舎咳とCIRDが識別可能な感染であることを示している。
【0010】
我々はまた、呼吸器疾患にはそのほかの作用物質が関与すると結論付ける一方で、B.bronchisepticaと呼吸器疾患の関係も確認している(Chalker et al., 2006)。
【発明の開示】
【発明が解決しようとする課題】
【0011】
我々は今やまた、Streptococcus equi亜種zooepidermicus(実施例1を参照のこと)、Mycoplasma cynos(実施例2を参照のこと)、及びChlamydophila(実施例3を参照のこと)がCIRDに関係することを示している。我々の試験集団のイヌはすべて、CPIV及びCAV−2に対するワクチン接種をしたので、我々は、これらのウイルスのCIRDへの関与を支持する新しいデータを有していない。しかしながら、我々はまた、さらに重度の呼吸器症状を伴ったイヌにおけるイヌヘルペスウイルスの罹患率の上昇も見い出した(実施例4を参照のこと)。
【0012】
Streptococcus equi亜種zooepidermicus(S.zooepidemicus)は、ウマからのみではなく、種々の動物宿主から頻繁に単離される日和見病原体である。それは哺乳類の上部気道粘膜の共生生物として見い出されることが多く(Timoney et al., 1988; Quinn et al., 1999)、下部気道疾患、ウマにおける巣状肺炎及び子宮頸管炎(Chanter et al., 1997; Biberstein & Hirshm 1999)、ラマにおける肺炎(Biberstein & Hirshm 1999)、ブタにおける敗血症及び関節炎(Timoney, 1987)、ウシ及びヤギにおける乳腺炎(Timoney et al., 1988)、ニワトリにおける敗血症、ラマにおける心膜炎及び肺炎(Timoney, 1987)、モルモットにおけるリンパ節炎(Quinn et al., 1999)、ヒトにおける糸球体腎炎(Blalter et al., 2000)及びヒトにおける髄膜炎(Ural et al., 2003)を含む幾つかの疾患症候群に関係している。イヌでは、S.zooepidemicusは、創傷感染及び敗血症(Quinn et al., 1999)及び急性壊死性出血性肺炎(Gamett et al., 1982)に関係している。
【0013】
出血性連鎖球菌肺炎(HSP)の後期におけるイヌは、CIRDのイヌと組織学的特徴の幾つかを共有しているが、早期ではこのようなことはなく(Chalker et al., 2003を参照のこと)、HSPでは敗血性の血栓が存在する(Gamett et al., 1982)。HSPは、ほとんどの場合、臨床的徴候なしで致死的な急激な発症を有するが、CIRDでは、我々は、鼻汁、咳き込み、くしゃみ、吐き気、食欲不振、肺炎及び気管支肺炎のような幅広い範囲の臨床的な徴候と共に緩慢な発症を見ている。
【0014】
Mycoplasma cynos(M.cynos)は、イヌの尿路感染症に関係している(Jang et al., 1984)。それはまた、ジステンパーのイヌの肺でも同定されており(Rosendal, 1978)、M.cynosの気管支内接種はイヌで肺炎を誘発することが判っている(Rosendal & Vinther, 1977)。
【0015】
Rosendal(1978)によって記載されたイヌジステンパーは、ジステンパーウイルス、種々のマイコプラズマ及び細菌Pseudomonasによる感染に続く複合疾患である。これは微生物による感作の強力な組み合わせであり、当然、結果として肺炎を生じる。Mycoplasma sppによる病態の比率ははっきりしなかった。M.cynosによるそれに続く感作は、接種した5匹のうち4匹で小さな局所の炎症病変が見られたが、病気の徴候がないことを特徴とした。この症候群におけるM.cynosの意味は、Rosendalが述べたように「評価するのが難しい」だった。
【0016】
CIRDに関係するChlamydophila種は、23SrRNA遺伝子における218のヌクレオチド配列の比較によってChlamydophila aborus(C.aborus)に極めて密接に関係している。このChlamydophila種におけるこの領域のヌクレオチド配列(配列番号1)は、C.aborusと99%以上同一であり、Chlamydophila psiticasiと98.6%同一であり、Chlamydophila felisと96.3%同一である。
【0017】
Chlamydophila種は、CIRDのイヌの気管及び肺で同定された。それに対して、C.aborusによる感染は通常、繁殖性障害に関係しており、特にヒツジでは望まない流産を招くことが多い。C.aborusは、イヌでは呼吸器感染に役割を有するとしては以前記載されていない。
【0018】
イヌに感染するChlamydiae種に関する出版物はほとんどないので、イヌのChlamydiae種の生物多様性はほとんど知られていない。最近、Chlamydiae pneumoniae(C.pneumoniae)がイヌのアテローム性硬化症に関係していた(Sako et al., 2002)。同定されていなかったChlamydiae sppも敗血性多発性関節炎のイヌで同定された(Lambrechts et al., 1999)。
【0019】
C.psiticasiは、以前、飼いイヌの糞便、脳、肝臓、脾臓、腎臓及び肺の組織から単離された(Arizmendi et al., 1992; Fraser et al., 1985; Gresham et al., 1996)。研究によれば、ドイツのペット犬集団の20%及び日本では10%がChlamydiaeaeに暴露され、それに対する抗体を生じている(Werth et al., 1987; Fukushi et al., 1985)。英国におけるC.psiticasiの血清陽性のイヌの罹患率は知られていない(Gresham et al., 1996)。C.psiticasiに感染したイヌは、やや臨床的な、慢性の感染、アテローム性硬化症、関節炎、結膜炎又は呼吸器疾患さえも発生する可能性がある(Gresham et al., 1996; Storz, 1988)。Gresham et al., (1996)は、症状はCIRDほど重度ではなかったが、呼吸器疾患の症状を持つイヌからC.psiticasiを単離した。イヌは潜在的な保菌者であってもよく、従ってヒトのChlamydiae感染の疫学において重要であることが示唆されている(Gresham et al., 1996; Werth, 1989)。自然感染したイヌからのC.psiticasiの細胞培養における単離を記録したたった一例(Arizmendi et al., 1992)及び実験的に感染させたイヌからの単離の一例がある(Young et al., 1972)。
【0020】
CPIV及びCAV−2と同様に、CIRDに関係する感染性作用物質の一部、すなわち、B.bronchisepticaに対してワクチンが利用可能である。しかしながら、これらのワクチンの使用にもかかわらず、CIRDは世界中の犬舎で依然として流行しており、それは、おそらく、CIRDに関与するすべての感染性作用物質に対して防御を提供しないワクチンのせいである。
【課題を解決するための手段】
【0021】
従って、本発明の第1の側面は、以下の1以上を含むイヌにワクチン接種するためのワクチン組成物を提供する。
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
【0022】
該組成物は、これら作用物質の任意の2つ、たとえば、(a)と(b)、(a)と(c)又は(b)と(c)を含有してもよいことが十分理解される。組成物は、これら作用物質3つすべて(a)、(b)及び(c)を含有してもよい。
【0023】
イヌにおいて特定の生物に対して免疫応答を生じることが可能である作用物質によって、我々は、免疫不全でない又は免疫抑制されていないイヌに投与した場合、作用物質がイヌの免疫系を誘導して該生物に特異的に結合する抗体を生じるという意味を包含する。従って、作用物質は、特定の生物に対して防御的免疫応答を誘導することが可能である。
【0024】
好ましくは、従って、産生される抗体は、個体におけるいかなるほかの分子よりも大きな親和性で特定の生物を特異的に結合する。好ましくは、抗体は、個体におけるいかなるほかの分子よりも少なくとも2倍、又は少なくとも5倍、又は少なくとも10倍又は少なくとも50倍大きな親和性で特定の生物を結合する。さらに好ましくは、抗体は、個体におけるいかなるほかの分子よりも、少なくとも100倍、又は少なくとも1,000倍又は少なくとも10,000倍大きな親和性で特定の生物を結合する。
【0025】
イヌにおいて特定の生物に対して免疫応答を生じることが可能である作用物質によって、我々は、免疫不全でない又は免疫抑制されていないイヌに投与した場合、作用物質がイヌの免疫系を誘導して、該生物から分泌されるタンパク質のような高分子に特異的に結合する抗体を産生するという意味も包含する。抗体は、毒素又は溶血素のような分泌された高分子を特異的に結合し、それを不活化するので、宿主における病態変化及び疾患の重症度を軽減し、従って宿主が感染を克服することができる。従って、イヌにおいて特定の生物に対して免疫応答を生じることが可能である作用物質によって、我々は、分泌された高分子のような該生物の一部に対して免疫応答を生じることが可能である作用物質を包含する。
【0026】
通常、イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質は、不活化した又は弱毒化したS.zooepidemicus、又はS.zooepidemicusの免疫原性の断片、若しくはその派生物、又は前記断片若しくは前記派生物をコードする核酸(その場合、前記断片又は前記派生物はポリペプチドを含む)を含む。
【0027】
Streptococcus equi亜種zooepidermicusは、NCTC(寄託番号4646.S34)、ATCC(寄託番号43079)及びナショナル・コレクション・オブ・デイリー・オーガニズムズ(NCDO)(寄託番号1358)に寄託されており、Farrow et al. (1984)によって記載されている。
【0028】
ワクチンの「不活化された」成分によって、我々は、細菌、マイコプラズマ又はウイルスのような特定のワクチン成分が、疾患を誘発する能力を取り除くが、依然として防御的免疫を呼び起こす能力を保持するような方法で処理されているという意味を包含する。「不活化された」ワクチン成分によって、我々は殺した生物を包含する。
【0029】
ワクチンに使用するために細菌、マイコプラズマ又はウイルスのような生物を不活化し、殺す方法は当該技術で周知であり、以下に記載されるように、たとえば、イヌのワクチン用の成分の一部の調製に使用されている。
【0030】
ワクチンを調製するために微生物を不活化する方法は幾つかある。最も簡単な方法は、熱で殺すこと(たとえば、ウイルスを58℃で30分間加熱すること;細菌を5分間煮沸すること又は65℃で1時間加熱すること)又はホルマリンと混合して殺すことである。様々な化学薬品によって、又はUV光による処理によっても微生物を殺すことができる。
【0031】
ワクチンの弱毒化した成分によって、我々は、細菌、マイコプラズマ又はウイルスのような特定のワクチン成分が、疾患を誘発する能力を大きく減じているが、依然として防御的免疫を呼び起こす能力を保持するような方法で選択される、さもなければ処理されるという意味を包含する。
【0032】
ワクチンに使用するために細菌、マイコプラズマ又はウイルスのような生物を弱毒化する方法は当該技術で周知であり、以下に記載されるように、たとえば、イヌのワクチン用の成分の一部の調製に使用されている。
【0033】
異なった設定での、すなわち、ウイルス又はChlamydophilaについては細胞培養、及び細菌については固体培地上又は異なった宿主で、病原性の低下が見られるまでの引き延ばした継代によって微生物を弱毒化することができる。或いは、細菌の病原性に関与する特定の遺伝子に点突然変異を起こす、又はそれを欠失させ、従って生物の病原能力を限定させることができ、又は生物が、動物宿主には存在しない化学物質について特異的な要求を有し、従って、宿主中では複製できず、仮にも生き残れないように生物に変異を起こさせることができる。化学物質処理及びUV光処理によってゲノムに点突然変異を生じることによっても細菌において弱毒化を行うことができる。
【0034】
S.zooepidemicusの免疫原性の断片は、イヌにおいて防御的免疫応答を生じることが可能である、S.zooepidemicusのいかなる断片でもあってもよい。従って、S.zooepidemicusの免疫原性の断片を、免疫不全ではない又は免疫抑制されていないイヌに投与した場合、それは、イヌの免疫系を誘導してS.zooepidemicusに特異的に結合する抗体を産生する。
【0035】
通常、特定の生物の免疫原性の断片は、その生物のタンパク質成分である。生物の「タンパク質成分」によって、我々は、タンパク質全体又はタンパク質の一部の意味を包含する。タンパク質断片がグリコシル化されていてもよく、又はされていなくてもよいことが十分理解される。従って、「タンパク質」によって、我々は糖タンパク質も包含する。糖タンパク質のアミノ酸配列は、それに結合する糖の種類、数、配列及び位置にかかわりなく、ポリペプチド主鎖のアミノ酸配列を言う。
【0036】
S.zooepidemicusのタンパク質には、細胞表面タンパク質前駆体(ジェンバンク、受入番号AAA86832及びBAD00711)、Cpn60(ジェンバンク、受入番号AAM88472)、M様タンパク質(ジェンバンク、受入番号AAP33082、AAP33081、AAP33080、AAP33079、AAP22285、AAB92635、AAB92634、AAB92633、AAB92631、AAB92630、AAB92629、AAB92628、AAB92627、AAB92626、AAB92625、AAB92624、AAB92623、AAB92622、2111310A及びBAD00712)、M様タンパク質前駆体(ジェンバンク、受入番号AAD37432)、M様タンパク質Szp2前駆体(ジェンバンク、受入番号AAF75674)、M様タンパク質Szp3前駆体(ジェンバンク、受入番号AAF75675)、M様タンパク質Szp4前駆体(ジェンバンク、受入番号AAF75676)、Streptococcus pneumoniaeORF5に類似のタンパク質(ジェンバンク、受入番号BAB16041)、推定上の金属結合/付着因子タンパク質(ジェンバンク、受入番号CAB56710)、ゾシンA免疫因子(ジェンバンク、受入番号AAC46073)及びWalker et al., (1998, 2003;ジェンバンク、受入番号AAQ08488−AAQ08510を含む)により記載されたSzpタンパク質が挙げられる。
【0037】
好ましくは、S.zooepidemicusの免疫原性断片は、S.zooepidemicusの構造タンパク質又はその免疫原性の部分である。さらに好ましくは、S.zooepidemicusの免疫原性の断片は、分泌された毒素、又は溶血素、又は付着因子/表面タンパク質、又はこれらの免疫原性部分である。
【0038】
当業者に既知の常法によって、たとえば、S.zooepidemicusのような細菌から追加の表面タンパク質を単離することができる。参照によって本明細書に組み入れられるSambrook et al., (2001)「分子クローニング、実験室マニュアル、第3版(米国、ニューヨーク州、コールドスプリングハーバー、コールドスプリングハーバーラボラトリープレス、サムブルックら編)は、この目的に使用される一般的な細菌のクローニング技術を記載している。
【0039】
イヌにおいて免疫応答を生じることが可能である作用物質がタンパク質のような生物の成分であれば、該生物の培養からそれを単離してもよい。さらに好ましくは、組換えDNA技術を用いて、タンパク質をコードする好適なDNA構築物の発現によってタンパク質を作製する。核酸のクローニング、操作、修飾及び発現並びにタンパク質の精製のための好適な技法は、当該技術で周知であり、たとえば、参照によって本明細書に組み入れられるSambrook et al., (2001)に記載されている。
【0040】
或いは、タンパク質化学技法を用いて、たとえば、単離したタンパク質の部分的なタンパク質分解(外分解的に又は内分解的にのいずれかで)、又はde novo合成によってタンパク質を作製してもよい。Lu et al., (1981) J. Org. Chem., 46:3433に記載され、その中で参照されているような固相ペプチド合成のFmoc−ポリアミド方式でペプチドを合成してもよい。
【0041】
生物の免疫原性断片の「派生物」によって、我々は、その生物に天然で存在する形態から改変されているが、イヌにおいて免疫応答を生じる能力、たとえば、その生物に特異的に結合する抗体の産生を誘導する能力を保持するタンパク質又はタンパク質の一部の意味を包含する。
【0042】
たとえば、派生物には、その生物に特異的に結合する抗体の産生を誘導するのに使用することができるタンパク質又はその一部の配列変異体が挙げられてもよい。通常、アミノ酸置換を行ってワクチンの抗原性を改善する。好ましくは、配列変異体は、少なくとも90%、又は少なくとも91%、又は少なくとも92%、又は少なくとも93%、又は少なくとも94%、又は少なくとも95%、そのタンパク質又はその一部の天然の配列に一致する。さらに好ましくは、配列変異体は、少なくとも96%、又は少なくとも97%、又は少なくとも98%、又は少なくとも99%、又は少なくとも99.5%、そのタンパク質又はその一部の天然の配列に一致する。
【0043】
2つのポリペプチド間の配列同一性パーセントは、好適なコンピュータプログラム、たとえば、ウィスコンシン大学、遺伝計算グループのGAPプログラムを用いて決定してもよい。2つのヌクレオチド配列又は2つのアミノ酸配列の間の同一性の比率は、GCGバージョン10(遺伝計算グループ(1991年)、GCGパッケージのためのプログラムマニュアル、バージョン7、1991年4月;米国53711、ウィスコンシン州、マジソン、サイエンス通り575番地)を用いて決定することができる。使用するGCGパラメータは:DNA用にはギャップ創造ペナルティ50、ギャップ拡張ペナルティ3及びタンパク質用には、ギャップ創造ペナルティ8、ギャップ拡張ペナルティ2であることができる。FASTAバージョン34(Pearson WR, (1990)「FASTP及びFASTAによる迅速で感度の高い比較」、Methods Enzymol., 183:63-98)を用いて、2つのヌクレオチド配列又は2つのアミノ酸配列の間の同一性の比率を決定することもできる。FASTAの設定は、ギャップ開放ペナルティ−16及びギャップ拡張ペナルティ−4であってもよい・
【0044】
同一性パーセントは、その配列が最適に揃えられているポリペプチドに関して計算されることが十分理解されるであろう。
【0045】
整列は或いは、ClustalWプログラム(Thompson et al., (1994), Nucleic Acids Res., 22:4673-80)を用いて行ってもよい。使用されるパラメータは以下のとおりであってもよい。
【0046】
迅速な2つ1組の整列パラメータ:K−タプル(ワード)サイズ;1、ウインドウサイズ;5、ギャップペナルティ;3、上の対角線の数;5、スコアリング法;xパーセント。
【0047】
多数の整列パラメータ:ギャップ開放ペナルティ;10、ギャップ拡張ペナルティ;0.05、スコアリングマトリクス;BLOSUM。
【0048】
通常、配列変異体は、100未満の、又は50未満の、又は40未満の、又は30未満の、又は20未満の、そのタンパク質又はその一部の天然の配列と異なるアミノ酸残基を有する。さらに好ましくは、配列変異体は、15又は14又は13又は12又は11又は10又は9又は8又は7又は6又は5又は4又は3又は2又はたった1個の、そのタンパク質又はその一部の天然の配列と異なるアミノ酸残基を有する。
【0049】
派生物の配列が改変されて作用物質の免疫原性を高めてもよいし、配列が免疫原性に影響を有さなくてもよい。たとえば、派生物は、免疫原性に必要としない1以上の除かれたアミノ酸配列を有してもよい。
【0050】
「派生物」によって、我々はまた、ペプチドの機能、すなわち、生体内での特異的な抗体の産生が実質的に不変のままであるという条件で、ペプチドが合成される前又は後で、1以上のアミノ酸残基が化学的に修飾されているペプチドも包含する。そのような修飾には、酸又は塩基、特に生理学的に許容可能な有機又は無機の酸又は塩基との塩の形成、末端カルボキシル基のエステル又はアミドの形成、及びたとえば、N−t−ブトキシカルボニルのようなアミノ酸保護基の結合が挙げられる。そのような修飾が、生体内での代謝からペプチドを保護してもよい。ペプチドは、単一コピーとして、又は複数コピー、たとえば直列反復として存在してもよい。そのような直列又は複数の反復はそれ自体十分に抗原性であり、キャリアの使用をあらかじめ回避してもよい。N末端とC末端を一緒に結合してループを形成すること、又は1以上のCys残基を末端に付加して抗原性を高めること、及び/又はジスルフィド結合を形成させることがペプチドにとって有利であってもよい。ペプチドがキャリア、好ましくは、ポリペプチドに共有結合しているのならば、そのときは、配置は好ましくは本発明のペプチドがループを形成するようにする。
【0051】
現在の免疫学理論によれば、免疫系を刺激するために、又は免疫系への刺激を高めるために、免疫原性の処方にはキャリア機能が存在すべきである。最良のキャリアは、T細胞エピトープを具体化する(又は抗原と一緒にT細胞エピトープを創造する)と考えられる。たとえば、架橋によって、別のキャリア、たとえば、血清アルブミン、ミオグロビン、細菌毒素及びスカシ貝ヘモシアニンにペプチドを会合させてもよい。免疫応答においてT細胞のヘルプを誘導するさらに最近開発されたキャリアには、B型肝炎コア抗原(ヌクレオカプシドタンパク質とも呼ばれる)、推定T細胞エピトープ、β−ガラクトシダーゼ及びインターロイキン−1の163〜171ペプチドが挙げられる。後者の化合物は、キャリア又はアジュバント又はその両方として様々にみなされてもよい。或いは、本発明の数コピーの同一又は異なったペプチドを互いに架橋し、この状況で、それ自体別のキャリアはないが、そのような架橋によってキャリア機能が提供されてもよい。好適な架橋剤には、シグマ及びピアースのカタログにそのまま列記されるものが挙げられ、たとえば、グルタールアルデヒド、カルボジイミド及びスクシンイミジル4−(N−マレイミドメチル)シクロヘキサン−1−カルボキシレートが挙げられ、後者の作用物質は、C末端のシステイン残基(存在すれば)上のSH基を利用する。
【0052】
好適な宿主内での好適なヌクレオチド配列の発現によって、ペプチドが調製されるのであれば、そのときは、キャリアとして作用するペプチド配列との融合生成物としてペプチドを発現させることが有利であってもよい。カビゲンの「エコセック」システムは、そのような処理の一例である。
【0053】
通常、S.zooepidemicusの免疫原性画分をコードするポリヌクレオチドは、構造タンパク質をコードし、さらに好ましくは、S.zooepidemicusの表面タンパク質、又はその免疫原性部分、又はその派生物をコードする。上記のジェンバンク受入番号を参照することによって、種々のS.zooepidemicusのタンパク質をコードするポリヌクレオチドの配列を容易に確認することができる。しかしながら、標準の分子生物学的技法によって、任意の免疫原性のS.zooepidemicusタンパク質をコードするポリヌクレオチドの配列を容易に決定することができる。
【0054】
通常、イヌにおいてM.cynosに対して免疫応答を生じることが可能である作用物質は、不活化した又は弱毒化したM.cynos、又はM.cynosの免疫原性の断片、若しくはその派生物、又は前記画分若しくは前記派生物をコードする核酸を含む。
【0055】
M.cynosは、NCTC(寄託番号10142H831)及びATCC(寄託番号27544)に寄託されており、Rosendal(1972)によって記載されている。
【0056】
好ましくは、M.cynosの免疫原性の断片は、M.cynosの構造タンパク質又はその免疫原性部分であり、さらに好ましくは、M.cynosの表面タンパク質又はその免疫原性部分、又はその派生物である。当業者に既知の常法によってM.cynosのようなマイコプラズマから表面タンパク質を単離することができる。
【0057】
マイコプラズマタンパク質を同定し、単離する方法は、遺伝子の一部が、マイコプラズマの独特のコドンの利用を認識する特定のベクターを必要としてもよいことを除いて、一般に細菌の方法と同じである(Micoplasmology Vol. 1 Ed. S. Razin & J. Tully, Academic Press Inc, 1995における分子的及び診断的な手段の中のゲノムの性状分析及び遺伝学のB項のすべての章を参照のこと)。
【0058】
最も有効なマイコプラズマワクチンは、熱又はホルマリンで不活化した細胞全体或いは弱毒化した生ワクチンを含有する傾向があるので、そのタンパク質すべて又は少なくとも大半を含有する。ワクチンとして使用するために可能性があるマイコプラズマ成分には、約45kDAであると考えられている一次付着構造膜タンパク質(M.pneumoniae由来のP1シタドヘシン、及び3つの遺伝子オペロンのすべての部分であるM.genitalium由来のMgPaのような相同体と同等)、表面に暴露されたタンパク質及びそのほかの付着タンパク質、膜糖脂質、膜多糖類画分、リポグリカン及び動物のマイコプラズマワクチンの概説(Barile, 1985; Barile et al., 1985)で言及されているすべてのものが挙げられる。
【発明を実施するための最良の形態】
【0059】
実施態様では、Chlamydophilaに対する免疫応答を生じることが可能である作用物質は、不活性化した又は弱毒化したC.abortus又はC.abortusの免疫原性の断片若しくはその派生物、又は前記画分若しくは前記派生物をコードする核酸を含む。
【0060】
Chlamydophila abortus(ATCC寄託番号VR−656)は、ヒツジのクラミジア流産のB−577株としてEvertt et al.によって寄託された。
【0061】
別の実施態様では、Chlamydophilaに対する免疫応答を生じることが可能である作用物質は、不活性化した又は弱毒化したC.psittaci、又はC.psittaciの免疫原性の断片若しくはその派生物、又は前記画分若しくは前記派生物をコードする核酸を含む。
【0062】
Clamydia psittaciとしても知られるChlamydophila psittaciは、ATCC寄託番号VR−125を有する(Lillie (1930) page 1968, Int. Syst. Bacteriol., 30:274 (AL))。
【0063】
さらなる実施態様では、Chlamydophilaに対する免疫応答を生じることが可能である作用物質は、不活性化した又は弱毒化したC.felis又はC.felisのの免疫原性の断片若しくはその派生物、又は前記画分若しくは前記派生物をコードする核酸を含む。
【0064】
Chlamydophila felis(ATCC寄託番号VR−120)は、ネコ肺炎のNo.1株としてEvertt et al.によって寄託された。
【0065】
別の実施態様では、Chlamydophilaに対する免疫応答を生じることが可能である作用物質は、不活性化した又は弱毒化したChlamydia muridarum(ATCC、VR123、MoPn;Everett at al., Int. J. Syst. Bacteriol., 49:431, 1991);Clamydia pecorum(ATCC、VR628、Bo/E58;Fukushi & Hirai, Int. J. Syst. Bacteriol., 42:307);Chlamydia pneumoniae(株型:TW−183;Grayston et al., Int. J. Syst. Bacteriol., 39:88, 1989);Chlamydia suis(ATCC、VR1474、S45;Everett at al., Int. J. Syst. Bacteriol., 49:431, 1999);Chlamydia trachomatis(種型)(ATCC、VR571;Busacca, 1935; Rake, 1957; Everett at al., Int. J. Syst. Bacteriol., 30:274, 1999 (AL));又はそれらの免疫原性の断片、若しくはそれらの派生物、又は前記画分若しくは前記派生物をコードする核酸を含む。
【0066】
C.abotus、C.psittaci、又はC.felis、又はC.muridarum、C.pecorum、C.pneumoniae、C.suis又はC.trachomatisの免疫原性の断片は、イヌにおいて免疫応答を生じることが可能であるそのいかなる断片であることもできる。通常、免疫原性の断片は、タンパク質又はその一部である。好ましくは、免疫原性の断片は、構造タンパク質又はその免疫原性の一部である。さらに好ましくは、免疫原性の断片は、表面タンパク質又はその免疫原性の一部若しくはその派生物である。上述のように、当業者に既知の常法によってChlamydophilaのような細菌から表面タンパク質を単離することができる。
【0067】
C.abotusのタンパク質には、60kDAの熱ショックタンパク質GroEL(ジェンバンク受入番号AAD26144)、60kDaのシステイン−リッチの膜複合体タンパク質(ジェンバンク受入番号AAG60550)、90kDaのタンパク質(ジェンバンク受入番号AAC44400、AAC44401)、システイン−リッチの外膜タンパク質Omp−2(ジェンバンク受入番号AAD09597)、Dnak(ジェンバンク受入番号AAN77259)、伸長因子P(ジェンバンク受入番号AAK72389)、GrpE(ジェンバンク受入番号AAN77258)、HrcA(ジェンバンク受入番号AAN77257)、主要外膜タンパク質(ジェンバンク受入番号AAK00237、CAA36152、CAD29327)、主要外部タンパク質前駆体(ジェンバンク受入番号AAD29103、AAD29102、AAG53881、P16567)、MutS(ジェンバンク受入番号AAD25864)、Omp1(ジェンバンク受入番号CAA06182、CAA06620、CAA06621、CAA06622、CAA06624、CAA06625、CAA06183、CAA06184)、外膜タンパク質(ジェンバンク受入番号AAB02850)、外膜タンパク質2(ジェンバンク受入番号AAD20336)、POMP90A前駆体(ジェンバンク受入番号AAC15922)、POMP90B前駆体(ジェンバンク受入番号AAC15924)、POMP91A(ジェンバンク受入番号AAC15921)、POMP91B前駆体(ジェンバンク受入番号AAC15923)、推定上の98kDaの外膜タンパク質(ジェンバンク受入番号AAB18188)、推定上の外膜タンパク質(ジェンバンク受入番号AAB18187)、小型のシステイン−リッチの外膜リポタンパク質(ジェンバンク受入番号AAG60549)、イオウ−リッチのタンパク質(ジェンバンク受入番号AAG60551)及びOmpA(ジェンバンク受入番号AAT36355及びAAT36356)が挙げられる。
【0068】
C.psittaciのタンパク質には、60Kのシステイン−リッチの外膜タンパク質前駆体(ジェンバンク受入番号P23701、B39439、JC5204及びP27606)、60Kのシステイン−リッチのタンパク質(ジェンバンク受入番号CAA37592及びCAA37591)、シャペロニン同族体(ジェンバンク受入番号AAB22560)、早期上流オープンリーディングフレーム(EUO)(ジェンバンク受入番号AAA23124、Q06566及びC36909)、EUOタンパク質同族体(ジェンバンク受入番号JC5207)、ヒツジ流産タンパク質(ジェンバンク受入番号1601347A)、属特異的タンパク質(ジェンバンク受入番号AAB22559)、高分子量のシステイン−リッチのエンベロープタンパク質(ジェンバンク受入番号AAB61619)、ヒストンH1様タンパク質(AAA23132、JH0658、Q46204)、hypAタンパク質(ジェンバンク受入番号JL0116)、hypBタンパク質(ジェンバンク受入番号JL0117)、仮説のタンパク質(ジェンバンク受入番号JC5206、NP_052329、NP_052332、NP_052331、NP_052330、NP_052328、NP_052327、NP_052326、NP_052325、NP_052323、CAA44340、CAA44339、CAA44341、CAA44338、CAA44337、CAA44336、CAA44335、CAA44332、A39999、NP_052324、CAA44333、S61492、S18143、C39999、D39999、E39999、F39999、S18148、G39999、H39999及びI39999)、封入膜タンパク質(ジェンバンク受入番号2108371A、S61491)、低分子量システイン−リッチのエンベロープタンパク質(ジェンバンク受入番号AAB61618)、リジン−リッチの仮説タンパク質LRO(ジェンバンク受入番号B36909)、主要外膜タンパク質及び前駆体(ジェンバンク受入番号CAA31177、2006276A、1616229A、AAA23148、AAA23147、AAA17396、I40864、I40740、AAA23146、CAA40300、AAK00262、AAK00250、AAK00249、AAK00248、AAK00247、AAK00246、AAK00245、AAK00244、AAK00243、AAK00242、AAK00241、AAK00240、CAC84081、A60341、A40371、B60109、A60109、MMCWPM、MMCWP3、Q00087、P10332及びAAQ91209)、主要シグマ因子(ジェンバンク受入番号AAA50747)、MutS(ジェンバンク受入番号AAD25866及びAAD25863)、未知の機能のタンパク質のN末端部分(ジェンバンク受入番号CAA90624)、ORF2(ジェンバンク受入番号2108371B)、外膜タンパク質1(ジェンバンク受入番号CAA76286及びCAB96859)、外膜タンパク質3前駆体(ジェンバンク受入番号JC5203)、未知の機能のタンパク質(ジェンバンク受入番号CAA90623)、推定上の多型膜タンパク質(ジェンバンク受入番号AAL36963、AAL36962、AAL36961、AAL36960、AAL36959、AAL36958、AAL36957、AAL36956及びAAL36955)、小型システイン−リッチのエンベロープタンパク質envA前駆体(ジェンバンク受入番号A39439)、イオウ−リッチのタンパク質(ジェンバンク受入番号P28164、AAB61620及びJC5205)、未知のタンパク質(ジェンバンク受入番号AAB22561及びAAB22558)、病原性プラスミドparAファミリータンパク質pGP5−D(ジェンバンク受入番号Q46263)、病原性プラスミドタンパク質pGP2−D(ジェンバンク受入番号Q46260)、病原性プラスミドタンパク質pGP3−D(ジェンバンク受入番号Q46261)、病原性プラスミドタンパク質pGP4−D(ジェンバンク受入番号Q46262)、病原性プラスミドタンパク質pGP6−D(ジェンバンク受入番号Q46264)、OmpA(ジェンバンク受入番号AAT36351及びAAT36354)、及び60kDaのシャペロニンタンパク質(ジェンバンク受入番号AAT38208)が挙げられる。
【0069】
C.felisのタンパク質には、熱ショックタンパク質GroEL(ジェンバンク受入番号AAL38954及びAAO24106)、主要外膜タンパク質(ジェンバンク受入番号AAK00238、AAK00239、AAO24108及びCAA43409)、MutS(ジェンバンク受入番号AAD25865)、及び外膜タンパク質2(ジェンバンク受入番号AAK38113、AAK38114、AAK38115、AAL89722、AAO24107、AAQ19779)が挙げられる。
【0070】
好ましい実施態様では、使用されるChlamydophilaタンパク質は、主要外膜タンパク質(MOMP)のような外膜タンパク質である。そのほかの好適なChlamydophilaタンパク質には、LPS又はOmcBタンパク質が挙げられる。
【0071】
通常、C.abortus、C.psittaci又はC.felisの免疫原性の画分をコードするポリヌクレオチドは、構造タンパク質をコードし、さらに好ましくは、表面タンパク質、又はその免疫原性の部分、若しくはその派生物をコードする。種々のタンパク質をコードする核酸配列は、上記のジェンバンク受入番号を参照することによって容易に確認することができ、標準的な分子生物学の技法によって容易に決定することができる。
【0072】
実施態様では、Chlamydophilaに対する免疫応答を生じることが可能である作用物質は、配列番号1の配列を有する23SrRNA遺伝子の218のヌクレオチドの部分配列を有する、不活化された又は弱毒化されたChlamydophila、又はその断片若しくはその派生物、又は前記画分若しくは派生物をコードする核酸を含む。CIRDに罹ったイヌ、特にリホーミング施設及び搭乗用犬舎又は訓練用犬舎のCIRDに罹ったイヌの気管及び肺で、配列番号1の配列を有する23SrRNA遺伝子の218のヌクレオチドの部分配列を有するChlamydophilaが見つかってもよいし、それらから単離されてもよい。
【0073】
シクロヘキシミドの存在下又は非存在下にて組織抽出物をマッコイ細胞株に接種し、5%CO2と共に37℃にて10日間まで細胞を培養し、次いで細胞を凍結融解することによりChlamydophilaを抽出することによってChlamydophilaをイヌから単離することができる。トリ、ネコ、ヒト及びそのほかの宿主からChlamydophilaを単離するのに、この方法を日常的に使用することができる。実施例3に記載されるPCR条件を用いて23SrRNA遺伝子の断片をChlamydophilaから増幅することができ、図5又は図8における配列と比較することによって、得られた配列を検証することができる。
【0074】
ワクチン用途については、種々の複製ベクター(たとえば、組換えアデノウイルスワクチン)又は非複製ベクター(DNAワクチン)にてポリヌクレオチド剤を送達することができる。
【0075】
組換えタンパク質から構成されるワクチンの典型的な用量は、約5〜10μgである。細菌ワクチンの典型的な用量は、mL当たり108コロニー形成単位である。
【0076】
通常、ワクチン組成物は、薬学上許容可能なキャリア、希釈剤又はアジュバントをさらに含む。
【0077】
特定のキャリア及びアジュバントは上で記載されている。そのほかの好適なアジュバントには、フロインド完全又は不完全アジュバント、ムラミールジペプチド、EP109942、EP180564及びEP231039の「イスコム」、水酸化アルミニウム、サポニン、DEAE−デキストラン、中性油(たとえば、ミグリオール)、植物油(たとえば、ラッカセイ油)、リポソーム、プルロニック(登録商標)ポリオール、又はリビアジュバント系(たとえば、GB−A−2189141を参照のこと)が挙げられる。
【0078】
キャリアは、本発明の作用物質と相溶性であるという意味で「許容可能」でなければならず、その受入者に有害であってはならない。通常、キャリアは無菌であり、発熱物質を含まない水又は生理食塩水である。
【0079】
通常、ワクチンは、経口、筋肉内、皮下、静脈内、腹腔内又は鼻内の経路を介して投与される。
【0080】
ワクチン組成物は、非経口投与のために製剤化されてもよく、抗酸化剤、緩衝液、静菌剤、製剤を意図する受入者の血液と等張にする溶質を含有してもよい水性又は非水性の無菌の注射液、及び/又は懸濁剤及び濃厚剤を含んでもよい水性又は非水性の無菌の懸濁液を包含してもよい。
【0081】
ワクチン組成物は、単位用量又は複数用量の容器、たとえば、密封したアンプル及びバイアルで提示されてもよく、使用直前に液体キャリア、たとえば、注射用の水の添加のみを必要とする凍結乾燥(凍結乾燥)の状態で保存されてもよい。無菌の粉末、顆粒、及び錠剤から即席の注射液及び懸濁液を調製してもよい。
【0082】
ワクチン組成物は、鼻内投与用に製剤化されてもよく、好適な高圧ガス、たとえば、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、たとえば、1,1,2,2−テトラフルオロエタン(HFA134A(商標))又は1,1,1,2,3,3,3−ヘプタフルオロプロパン(HFA227EA(商標))のようなハイドロフルオロアルカン、二酸化炭素又はそのほかの好適な気体の使用により、加圧した容器、ポンプ、スプレー又はネブライザーから、エアゾール噴霧提示の形態で都合よく送達されてもよい。加圧エアゾールの場合、弁を提供して測定された量を送達することによって投与量単位を決定してもよい。加圧した容器、ポンプ、スプレー又はネブライザーは、たとえば、エタノール及び高圧ガスを溶媒として用いて、作用物質の溶液又は懸濁液を含有してもよく、さらに、たとえば、トリオレイン酸ソルビタンのような潤滑剤を含有してもよい。
【0083】
家畜病治療での使用については、通常の獣医学診療に従って許容可能な製剤としてワクチンを調製し、獣医師が、特定の動物にとって最も適当である投薬計画及び投与経路を決定する。
【0084】
イヌへの投与に好適なワクチンの処方は周知であり、以下に記載するようなイヌワクチンで使用される処方が挙げられる。
【0085】
上で議論したように、イヌ呼吸器コロナウイルス(CRCV)、イヌパラインフルエンザウイルス(CPIV)、イヌアデノウイルス2型(CAV−2)、イヌヘルペスウイルス(CHV)及びBordetella bronchiseptica(B.bronchiseptica)を含む幾つかのウイルス剤及び細菌剤は、イヌにおける呼吸器疾患に関係することが知られている。
【0086】
従って、実施態様では、ワクチン組成物はさらに以下のいずれか1以上を含む:
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質;
【0087】
従って、ワクチン組成物は、適宜、これら追加の作用物質の任意の2つ、任意の3つ、任意の4つ、又は5つすべても含むこともできる。
【0088】
通常、イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質は、不活化された又は弱毒化されたCRCV、又はCRCVの免疫原性の断片、又は前記免疫原性の画分をコードする核酸を含む。
【0089】
CRCVの好適な免疫原性の断片は、WO2004/011651(王立獣医学大学)及びErles et al., 2003に記載されている。CRCVの好適な免疫原性の断片には、スパイク(S)、血液凝集素−エステラーゼ(HE)表面タンパク質、膜糖タンパク質(M)、及びヌクレオカプシドタンパク質(N)、又はそれらの免疫原性の部分が挙げられる。WO2004/11651に記載されているCRCV様のスパイク及びHEのタンパク質は、CRCVに対して免疫応答を生じる作用物質としても好適であってもよい。ウシコロナウイルス及びヒトコロナウイルスのような密接に関係するコロナウイルス及びそれらの免疫原性の断片もCRCVに対して免疫応答を生じる作用物質としても好適であってもよい。CRCVに対するワクチン成分として使用することができる作用物質に関係するWO2004/011651の開示全体が、参照によって本明細書に組み入れられる。
【0090】
通常、イヌにおいてCRIVに対する免疫応答を生じることが可能である作用物質は、不活化された又は弱毒化されたCPIV、又はCPIVの免疫原性の断片、又は前記免疫原性の画分をコードする核酸を含む。
【0091】
通常、イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質は、不活化された又は弱毒化されたCAV−2、又はその免疫原性の断片、又は前記免疫原性の画分をコードする核酸を含む。
【0092】
イヌアデノウイルス1型は、感染性肝炎の原因となり、イヌアデノウイルス2型は呼吸器疾患の原因となる。CAV−1は、CAV−2に対して交差防御を提供し、逆もまた同様であることが示されている。従って、イヌにおいてCAV−2に対して免疫応答を生じる作用物質は、CAV−1又はCAV−2のいずれか、又はその免疫原性の断片を含有してもよい。下に列記するワクチンは、使用されたウイルス型が特定されていないEURICAN(登録商標)DHPPiを除いて、CAV−2を含有する。
【0093】
イヌにおいてCPIV及びCAV−2に対する免疫応答を生じる好適な作用物質は当業者に既知である。たとえば、英国では、以下のイヌワクチンが認可されている。
【0094】
フォート・ドッジ・アニマル・ヘルスによるKAVAK(登録商標)DA2PiP69は、組織培養で増殖させたイヌジステンパーウイルス、イヌアデノウイルス2型、イヌパラインフルエンザ2型及びイヌパルボウイルスの弱毒化した株を含有する凍結乾燥の生ワクチンである。
【0095】
フォート・ドッジ・アニマル・ヘルスによるKAVAK(登録商標)パラインフルエンザは、確立した相同の細胞株で培養したイヌパラインフルエンザウイルス2型の弱毒化した株に由来する凍結乾燥の生ワクチンを含有する。
【0096】
インターベットUK社によるNOBIVAC(登録商標)DHPPiは、細胞株の組織培養で増殖させたイヌジステンパーウイルス、イヌアデノウイルス2型、イヌパルボウイルス及びイヌパラインフルエンザウイルスを含有する凍結乾燥の生ウイルスワクチンである。
【0097】
インターベットUK社によるNOBIVAC(登録商標)KCは、Bordetella bronchisepticaのB−C2株及びイヌパラインフルエンザウイルスCornell株を含有する改変した凍結乾燥の生ワクチンである(これは鼻内ワクチンである)。管理許可番号:Vm06376/4026。
【0098】
メリアル・アニマル・ヘルス社によるEURICAN(登録商標)DHPPiは、イヌジステンパー、イヌ感染性肝炎、イヌパルボウイルス及びイヌパラインフルエンザウイルス2型に対して併用する凍結乾燥の生ワクチンである。
【0099】
ファイザー社によるVANGUARD(登録商標)7は、確立された細胞株で増殖させた、弱毒化した生のイヌジステンパーウイルス(Snyder Hill株)、アデノウイルス(CAV−2、マンハッタン株)、パラインフルエンザウイルス(NL−CPI株)、イヌパルボウイルス(NL−35−D)、並びにLeptospira canicola及びLeptospira icterohaemorrihagiaeの不活化培養物を含有する。
【0100】
シェーリングプラウ・アニマル・ヘルスによるQUANTUM(登録商標)DOG7は、イヌジステンパー、アデノウイルス2型、パルボウイルス、パラインフルエンザウイルス2型のワクチン(生)、及び不活化したLeptospira canicola及びLeptospira icterohaemorrihagiaeのワクチンを含有する。
【0101】
ビルバック社によるCANIGEN DHPPiは、細胞株組織培養で増殖させたイヌジステンパーウイルス、イヌアデノウイルス(CAV−2)、イヌパルボウイルス及びイヌパラインフルエンザウイルスを含有する弱毒化した凍結乾燥の生ウイルスワクチンである。
【0102】
ビルバック社によるCANIGEN Ppiは、細胞株組織培養で増殖させたイヌパルボウイルス及びイヌパラインフルエンザウイルスを含有する弱毒化させた凍結乾燥の生ウイルスワクチンである。
【0103】
通常、イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質は、不活化された又は弱毒化されたCHV、又はCHVの免疫原性の断片、又は前記免疫原性の画分をコードする核酸を含む。
【0104】
イヌにおいてCHVに対する免疫応答を生じる好適な作用物質は当業者に既知である。たとえば、メリアルによるEURICAN Herpes205は、CHVに対する精製されたサブユニットワクチンであり、妊娠した雌イヌの能動免疫に適応され、出生日に獲得するCHV感染の結果生じる子犬の死亡、臨床徴候及び病変を防ぐ。それは、呼吸器疾患を防ぐための成犬のワクチン接種には認可されていない。
【0105】
通常、イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質は、不活化された又は弱毒化されたB.bronchiseptica、又はその免疫原性の断片、又は前記免疫原性の画分をコードする核酸を含む。
【0106】
イヌにおいてB.bronchisepticaに対する免疫応答を生じる好適な作用物質は当業者に既知である。たとえば、以下のイヌワクチンが使用するために認可されている。
【0107】
ファイザー・アニマル・ヘルス(U.S. Vet. Lic. No. 189)によるCOUGHGUARD−B(登録商標)は、B.bronchisepticaの不活化した培養物を含有する。それは、B.bronchisepticaが原因の疾患、特に犬舎咳に対して健康なイヌを免疫するためのものである。COUGHGUARD−B(登録商標)は、不活化され、イヌに投与した際、非毒性であるように加工されたB.bronchisepticaの抗原性の高い株から調製される。製造方法は、B.bronchisepticaの免疫特性をそのまま残すように報告されている。
【0108】
ファイザー・アニマル・ヘルス(U.S. Vet. Lic. No. 189)によるVANGUARD(登録商標)5/Bは、確立されたイヌ細胞株で増殖させたイヌジステンパーウイルス(CDV)、CAV−2、CPIV及びイヌパルボウイルス(CPV)の弱毒化した株を含有する。CPV抗原は、イヌ細胞株における短い継代で弱毒化され、そのレベルの継代で、母性抗体を無効にすることが可能である免疫原性特性を有する。ワクチンは、真空に代えた不活性気体と共に凍結乾燥された形態で包装される。希釈剤として供給される、B.bronchisepticaの不活性化された全培養物を含有する細菌ワクチン成分。VANGUARD(登録商標)5/BにおけるB.bronchisepticaは、不活化され、イヌに投与した際、非毒性であるように加工された抗原性の高い株から調製される。
【0109】
ファイザー・アニマル・ヘルス(U.S. Vet. Lic. No. 112)によるNASAGUARD−B(商標)は、B.bronchiseptica細菌の無毒の生の培養物から構成される。
【0110】
インターベットによるPROGUARD(登録商標)−KCは、弱毒化したイヌパラインフルエンザウイルス及びBordetella bronchisepticaの無毒の生の培養物を含有する改変された鼻内用生ワクチンである。PROGUARD(登録商標)−KCは、粉末の形態で再構築のために提供される無菌の希釈剤と共に提示される。PROGUARD(登録商標)−KCは、イヌパラインフルエンザウイルス及びB.bronchisepticaによるイヌの感染性気管気管支炎(「犬舎咳」)を防ぐために健康で、感受性の高い子犬及びイヌにワクチン接種するためのものである。
【0111】
インターベットによるPROGUARD(登録商標)−KC PLUSは、鼻内投与のための、B.bronchisepticaの無毒株の生の培養物、弱毒化したイヌアデノウイルス2型及びパラインフルエンザウイルスを含有する。PROGUARD(登録商標)−KC PLUSによるワクチン接種は、気道における迅速な局所免疫を刺激し、それによって臨床徴候を防ぐと同様に入り口での感染を抑制する。局所免疫に加えて、それは、鼻内投与の3週間以内の全身性免疫も刺激する。少量(0.4mL)のPROGUARD(登録商標)−KC PLUSの一方の鼻孔への適用は、特に小型犬種及び年少の子犬におけるワクチン接種に容易さを提供する。PROGUARD(登録商標)−KC PLUSは、粉末の形態で再構築のために提供される無菌の希釈剤と共に提示される。PROGUARD(登録商標)−KC PLUSは、イヌアデノウイルス2型、パラインフルエンザウイルス及びB.bronchisepticaによるイヌの感染性気管気管支炎(「犬舎咳」)を防ぐために、健康なイヌ及び3週令以上の子犬にワクチン接種するためのものである。
【0112】
インターベットによるインタックは、鼻内投与用の、B.bronchisepticaのS55株を含有する改変された凍結乾燥の生ワクチンである。製品の認可番号:PL0201/4011。
【0113】
上で記載されたノビバック(登録商標)−KCもB.bronchisepticaを含有する。
【0114】
実施態様では、ワクチン組成物は以下を含む:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;及び/又は
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び適宜、以下のいずれか1以上
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0115】
好ましい実施態様では、ワクチン組成物は以下を含む:
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質。
【0116】
別の好ましい実施態様では、ワクチン組成物は以下を含む:
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
及び以下のいずれか1以上:
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0117】
従って、作用物質(b)及び(d)と同様に、組成物は、作用物質(c)、(e)、(f)、(g)及び(h)のいずれか2つ、又は全部で5つの作用物質(c)、(e)、(f)、(g)及び(h)のいずれか3つ又はいずれか4つを含有してもよいことが十分理解される。
【0118】
別の好ましい実施態様では、ワクチン組成物は以下を含む:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;及び
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
及び以下のいずれか1以上:
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0119】
従って、作用物質(a)、(b)及び(d)と同様に、組成物は、作用物質(c)、(e)、(f)、(g)及び(h)のいずれか2つ、又は全部で5つの作用物質(c)、(e)、(f)、(g)及び(h)のいずれか3つ又はいずれか4つを含有してもよいことが十分理解される。
【0120】
本発明の第2の側面は、本発明の第1の側面に従ってワクチン組成物をイヌに投与することを含む、CIRDに対してイヌにワクチン接種する方法を提供する。
【0121】
本発明の第3の側面は、本発明の第1の側面に従ってワクチン組成物をイヌに投与することを含む、イヌにおけるCIRDを治療する方法を提供する。
【0122】
従って、本発明の第1の側面のワクチン組成物は、予防的に又は治療上のいずれかで、CIRDと戦うのに使用されてもよいことを理解することができる。
【0123】
本発明の第4の側面は、イヌにおけるCIRDの予防又は治療のための薬物の調製において以下のいずれか1以上の使用を提供する:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質。
【0124】
実施態様では、薬物はさらに、以下のいずれか1以上を含む:
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0125】
本発明のこの側面及び次のすべての側面において、(a)、(b)、(c)、(d)、(e)、(f)、(g)及び(h)に対する優先性は、本発明の第1の側面に関して記載されたとおりである。
【0126】
本発明の第5の側面は、イヌにおいてS.zooepidemicus、M.cynos及びChlamydophilaのいずれか1以上に対する免疫応答を刺激する方法を提供し、該方法は、イヌに以下のいずれか1以上をそれぞれ投与することを含む:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質。
【0127】
実施態様では、該方法は、以下のいずれか1以上を投与することをさらに含む:
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0128】
本発明の第6の側面は、イヌにてS.zooepidemicus、M.cynos及びChlamydophilaの前記いずれか1以上それぞれに対する免疫応答を刺激するするための薬物の調製において以下のいずれか1以上の使用を提供する:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質。
【0129】
実施態様において、薬物はさらに、以下のいずれか1以上を含む:
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0130】
本発明の第7の側面は、医学での使用のために、以下のいずれか1以上を含む組成物を提供する:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質。
このようにして、該組成物が包装され、医学における使用のために提示される。
【0131】
該組成物は、これら作用物質のいずれか2つ、たとえば、(a)と(b)、(a)と(c)又は(b)と(c)を含有してもよい。該組成物は、これら作用物質(a)、(b)及び(c)の3つすべてを含有してもよい。
【0132】
実施態様では、組成物は家畜病医学における使用のためのものである。こうして該組成物が包装され、家畜病医学における使用のために提示される。
【0133】
通常、組成物は、イヌの家畜病の医学における使用のためのものである。こうして該組成物が包装され、イヌの家畜病の医学における使用のために提示され、すなわち、イヌにおける使用のために包装され、提示される。
【0134】
実施態様では、組成物はさらに以下のいずれか1以上を含む:
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0135】
本側面の実施態様では、組成物は以下を含む:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;及び/又は
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;
及び適宜、以下のいずれか1以上
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0136】
本側面の好ましい実施態様では、組成物は、
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質を含む。
【0137】
本側面の別の好ましい実施態様では、組成物は、
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
及び以下のいずれか1以上を含む:
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0138】
従って、作用物質(b)及び(d)と同様に、組成物は、作用物質(c)、(e)、(f)、(g)及び(h)のいずれか2つ、又は全部で5つの作用物質(c)、(e)、(f)、(g)及び(h)のいずれか3つ又はいずれか4つを含有してもよいことが十分理解される。
【0139】
本側面の別の好ましい実施態様では、組成物は、
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;及び
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
及び以下のいずれか1以上を含む:
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0140】
従って、作用物質(a)、(b)及び(d)と同様に、組成物は、作用物質(c)、(e)、(f)、(g)及び(h)のいずれか2つ、又は全部で5つの作用物質(c)、(e)、(f)、(g)及び(h)のいずれか3つ又はいずれか4つを含有してもよいことが十分理解される。
【0141】
本発明の第8の側面は、本発明の第1の側面のワクチン組成物のための部品のキットを提供し、それは、以下のいずれか1以上:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
並びに適宜、薬学上許容可能なキャリア、希釈剤又はアジュバントを含む。
【0142】
部品のキットは、これら作用物質の任意の2つ、たとえば、(a)と(b)、(a)と(c)又は(b)と(c)を含有してもよいことが十分理解される。キットは、これら作用物質3つすべて(a)、(b)及び(c)を含有してもよい。
【0143】
実施態様では、キットはさらに、以下のいずれか1以上を含む:
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0144】
本側面の実施態様では、キットは以下を含む:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;及び/又は
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;
及び適宜、以下のいずれか1以上
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0145】
本側面の好ましい実施態様では、キットは、
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質を含む。
【0146】
本側面の別の好ましい実施態様では、キットは以下を含む:
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
及び以下のいずれか1以上を含む:
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0147】
従って、作用物質(b)及び(d)と同様に、組成物は、作用物質(c)、(e)、(f)、(g)及び(h)のいずれか2つ、又は全部で5つの作用物質(c)、(e)、(f)、(g)及び(h)のいずれか3つ又はいずれか4つを含有してもよいことが十分理解される。
【0148】
本側面の別の好ましい実施態様では、キットは以下を含む:
(a)イヌにおいてS.zooepidemicusに対する免疫応答を生じることが可能である作用物質;及び
(b)イヌにおいてM.cynosに対する免疫応答を生じることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じることが可能である作用物質;
及び以下のいずれか1以上を含む:
(c)イヌにおいてChlamydophilaに対する免疫応答を生じることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じることが可能である作用物質;及び
(h)イヌにおいてB.bronchisepticaに対する免疫応答を生じることが可能である作用物質。
【0149】
従って、作用物質(a)、(b)及び(d)と同様に、組成物は、作用物質(c)、(e)、(f)、(g)及び(h)のいずれか2つ、又は全部で5つの作用物質(c)、(e)、(f)、(g)及び(h)のいずれか3つ又はいずれか4つを含有してもよいことが十分理解される。
【0150】
第9の側面では、本発明は、S.zooepidemicus、M.cynos又はChlamydophilaのいずれか1以上に対する抗体を作製する方法を提供し、それは、動物においてS.zooepidemicus、M.cynos又はChlamydophilaの前記いずれか1以上又はその免疫原性の断片に対する免疫応答を生じること、及び該動物又はそれに由来する不死の細胞から抗体を調製することを含む。
【0151】
モノクローナル抗体を作製するための方法及び技法は、当業者に周知であり、たとえば、参照により本明細書に組み入れられる、「モノクローナル抗体:技法のマニュアル」(H. Zola, CRC Press, 1988)及び「モノクローナルハイブリドーマ抗体:技法及び応用」(J. G. R. Hurrell, CRC Press, 1982)に開示されている。
【0152】
本発明の第10の側面は、S.zooepidemicus、M.cynos又はChlamydophilaのいずれか1以上に対する抗体を入手する方法を提供し、それは、S.zooepidemicus、M.cynos又はChlamydophilaの前記いずれか1以上又はその免疫原性の断片を用いて抗体表示ライブラリから抗体を選択することを含む。
【0153】
第9及び第10の側面の実施態様では、Chlamydophilaは、C.abortus、C.psittaci又はC.felisである。別の実施態様では、Chlamydophilaは、C.muridarum、C.pecorum、C.pneumoniae、C.suis又はC.trachomatisである。
【0154】
本発明の第11の側面は、S.zooepidemicus、M.cynos又はChlamydophilaに特異的に結合する抗体を提供する。本発明の第9及び第10の側面の方法によってこれを行うことができる。
【0155】
実施態様では、Chlamydophilaに特異的に結合する抗体はC.abortus、C.psittaci又はC.felisに結合する。別の実施態様では、Chlamydophilaに特異的に結合する抗体はC.muridarum、C.pecorum、C.pneumoniae、C.suis又はC.trachomatisに結合する。
【0156】
本発明のこの背景及びあとに続く側面において、「抗体」によって、我々は、免疫グロブリン分子全体だけでなく、たとえば、Fab、F(ab’)2のような断片及び抗原結合部位を保持するそのほかのその断片も包含する。同様に、これらの背景において、用語「抗体」は、単鎖Fv分子(scFv)及びドメイン抗体(dAbs)のような抗体の遺伝子操作された派生物を包含する。用語はまた、ファージディスプレイ法又はそのほかの無作為選抜法を用いて、特定の生物又は特定の生物の領域に結合する分子について作製されてもよい抗体様分子も包含する。従って、これらの背景で、用語、抗体は、自然抗体の認識部位(すなわち、エピトープ又は抗原と結合する又は組み合う抗体の部分)の一部である構造、好ましくはペプチド構造を含有する分子すべてを包含する。
【0157】
抗体の可変部重鎖(VH)及び可変部軽鎖(VL)のドメインは、抗原認識に関与するが、初期のプロテアーゼ消化実験で初めて認識された事実である。さらにげっ歯類の抗体を「ヒト化」することによって確認された。得られる抗体がげっ歯類親型抗体の抗原特異性を保持するように、げっ歯類起源の可変部ドメインをヒト起源の定常部ドメインと融合してもよい(Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855, 1984)。
【0158】
抗原特異性が可変部ドメインにより付与され、定常部ドメインに依存しないということは、すべて1以上の可変部ドメインを含有する抗体断片の細菌での発現を含む実験から知られている。これらの分子には、Fab様分子(Better et al., Science, 240:1041, 1988)、Fv分子(Skerra et al., Science, 240, 1038, 1988)、柔軟なオリゴペプチドを介してVHとVLの対ドメインが連結する単鎖Fv(ScFv)分子(Bird et al., Science, 242:423, 1988; Huston et al., Proc. Natl. Acad. Sci. USA, 85:5879, 1988)及び単離されたVドメインを含む単一ドメイン抗体(dAbs)(Ward et al., Nature, 341:544, 1989)が挙げられる。特異的な結合部位を保持する抗体断片の合成に関与する技法の一般的な概説は、Winter & Milstein, Nature, 349:293-299, 1991に見い出されるべきである。
【0159】
「ScFv分子」によって、我々は、柔軟なオリゴペプチドを介してVHとVLの対ドメインが連結する分子を意味する。ScFv抗体のような操作された抗体は、参照によって本明細書に組み入れられる、J. Huston et al., 「抗体結合部位のタンパク質工学:大腸菌で産生された抗ジゴキシン単鎖Fv類縁体における特異的活性の回復」Proc. Natl. Acad. Sci. USA, 85:5879-5883, 1988及びA. Pluckthun, 「抗体工学:大腸菌発現系の使用からの進歩」Bio/technology vol. 9, 1991 (June)に記載された技法及びアプローチを用いて作製することができる。
【0160】
抗体全体ではなく抗体断片を使用することの利点は、数倍である。断片のサイズが小さいほど、たとえば、標的部位へのより良好な浸透のような薬理学的特性の改善を招いてもよい。たとえば、補体結合のような抗体全体のエフェクター機能が除かれる。Fab、Fv、ScFv及びdAbの抗体断片はすべて大腸菌で発現され、分泌されることができるので、断片を大量に容易に製造することができる。
【0161】
抗体全体及びF(ab’)2断片は「二価」である。「二価」によって、我々は、抗体及びF(ab’)2断片が2つの抗原結合部位を有することを意味する。それに対して、Fab、Fv、ScFv及びdAbの断片は一価であり、たった1つの抗原結合部位を有する。
【0162】
抗体はポリクローナル抗体であってもよいが、モノクローナル抗体であることが好ましい。状況によっては、特に、イヌに繰り返し抗体を投与するつもりならば、モノクローナル抗体がイヌのモノクローナル抗体又はイヌ化抗体であれば好ましい。
【0163】
多重特異性又は単一特異性である、ポリクローナル抗体を製造してもよい。それらは単一特異性であることが好ましい。Neuberger et al によってキメラ抗体が議論されている(1998年、第8回国際バイオテクノロジーシンポジウム、第2部、792〜799)。
【0164】
抗体が「イヌ化」された抗体であれば好ましい。既知の方法によって、たとえば、マウス抗体のCDR領域をイヌ抗体のフレームワークに挿入することによって、好適に調製された非イヌ抗体を「イヌ化」することができる。参照により本明細書に組み入れられる、M. Verhoeyen, C. Milstein and G. Winter, 「ヒト抗体の作り直し:抗リゾチーム活性の移植」Science, 239:1534-1536, 1988及びC. Kettleborough et al., 「CDR移植によるマウスモノクローナル抗体のヒト化:ループ構造におけるフレームワーク残基の重要性」Protein Engineering, 14(7):773-783, 1991において抗体のヒト化について記載されるものに相当する技法及びアプローチを用いて、イヌ化抗体を作製することができる。
【0165】
疾患に関与する作用物質と反応する抗体を投与されることによってイヌはCIRDに対する免疫を受動的に獲得することが十分理解される。
【0166】
従って、本発明の第12の側面は、S.zooepidemicus、M.cynos又はChlamydophilaのいずれか1以上のそれぞれに特異的に結合する1以上の抗体をイヌに投与することを含む、CIRDに対してイヌを受動的に免疫する方法を提供する。
【0167】
上述のような標準的な技法を用いてS.zooepidemicus、M.cynos又はChlamydophilaに特異的に結合する抗体を作製してもよく、又は入手してもよい。
【0168】
疾患に関与する作用物質と反応する抗体を投与することによってイヌにおけるCIRDを治療してもよいことが十分理解される。
【0169】
第13の側面では、本発明は、S.zooepidemicus、M.cynos又はChlamydophilaのいずれか1以上のそれぞれに特異的に結合する1以上の抗体をイヌに投与することを含む、イヌにおけるCIRDを治療する方法を提供する。
【0170】
第12又は第13の側面の実施態様では、Chlamydophilaに特異的に結合する抗体はC.abortus、C.psittaci又はC.felisに結合する。別の実施態様では、Chlamydophilaに特異的に結合する抗体はC.muridarum、C.pecorum、C.pneumoniae、C.suis又はC.trachomatisに結合する。
【0171】
第12又は第13の側面の実施態様では、方法はさらに、CRCV、CPIV、CAV−2、CHV及びB.bronchisepticaのいずれか1以上に特異的に結合する抗体を投与することを含む。
【0172】
上述のような標準的な技法を用いて、CRCV、CPIV、CAV−2、CHV及びB.bronchisepticaに特異的に結合する抗体を作製することができる。
【0173】
本発明の第14の側面は、CIRDに対してイヌを受動的に免疫するための薬物の調製におけるS.zooepidemicus、M.cynos又はChlamydophilaのいずれか1以上のそれぞれに特異的に結合する1以上の抗体の使用を提供する。
【0174】
本発明の第15の側面は、イヌでCRIDを治療するための薬物の調製における、S.zooepidemicus、M.cynos又はChlamydophilaのいずれか1以上のそれぞれに特異的に結合する1以上の抗体の使用を提供する。
【0175】
第14又は第15の側面の実施態様では、Chlamydophilaに特異的に結合する抗体はC.abortus、C.psittaci又はC.felisに結合する。別の実施態様では、Chlamydophilaに特異的に結合する抗体はC.muridarum、C.pecorum、C.pneumoniae、C.suis又はC.trachomatisに結合する。
【0176】
第14又は第15の側面の実施態様では、薬物はさらに、CRCV、CPIV、CAV−2、CHV及びB.bronchisepticaのいずれか1以上に特異的に結合する抗体を含む。
【0177】
本発明の第16の側面は、S.zooepidemicusに特異的に結合する抗体、M.cynosに特異的に結合する抗体、及びChlamydophilaに特異的に結合する抗体のいずれか2以上を含む組成物を提供する。
【0178】
実施態様では、Chlamydophilaに特異的に結合する抗体はC.abortus、C.psittaci又はC.felisに結合する。別の実施態様では、Chlamydophilaに特異的に結合する抗体はC.muridarum、C.pecorum、C.pneumoniae、C.suis又はC.trachomatisに結合する。
【0179】
実施態様では、組成物はさらに、CRCV、CPIV、CAV−2、CHV及びB.bronchisepticaのいずれか1以上に特異的に結合する抗体を含む。
【0180】
本発明は診断法及びアッセイを含むことが十分理解されるであろう。従って、本発明は、CRIDに関係するChlamydophila種にイヌが暴露されたことがあるかどうかを決定する方法を提供するが、該方法は、
(a)イヌから好適な試料を得ること;及び
(b)試料中でCRIDに関係するChlamydophila種又はそれに対する抗体を同定することを含む。
【0181】
通常、Chlamydophila種は、配列番号1〜8(23S RNAの部分配列を示す図5及び8、並びに実施例3を参照のこと)のいずれかの配列(RNAとして示される場合)を含む23S RNAを有するものである。
【0182】
本発明は、イヌがCIRDを有するか、又はCIRDに感受性であるかどうかを決定する方法も提供するが、該方法は、
(a)イヌから好適な試料を得ること;及び
(b)試料中で、S.zooepidemicus、M.cynos又はChlamydophilaのいずれか1以上又はこれらのいずれかに対する抗体を同定することを含む。
【0183】
実施態様の1つでは、方法は、たとえば、試料中で生物自体又はその成分(たとえば、タンパク質又は核酸)を検出することによって生物への現在の暴露を検出できることが十分に理解されるであろう。方法はまた、生物又はその成分に向けられた抗体を検出することによって生物への過去の暴露を検出することもできる。
【0184】
通常、試料は、血清、唾液、気管洗浄液及び気管支洗浄液のような抗体含有試料を含む任意の好適な試料である。
【0185】
従って、生物又はその成分の存在について試料を分析することによって試料が由来するイヌにおける生物の存在を決定してもよい。たとえば、23S RNAを含む核酸成分については、核酸を抽出し、必要に応じてDNAにコピーしてもよく、たとえば、厳密性の高いハイブリッド形成、特異的増幅、ヌクレオチド配列決定及び当業者に周知のそのほかの方法(Sambrook et al., 2001, 上記)を含む技法を用いて検出してもよい。「高い厳密性でのハイブリッド形成」によって、それがハイブリッド形成するポリヌクレオチド及び核酸が、厳密性の高い条件下でハイブリッド形成することができる十分なヌクレオチド配列の類似性を有することを意味する。当該技術で周知のように、核酸のハイブリッド形成の厳密性は、ハイブリッド形成が生じる核酸の長さ、ハイブリッド形成する配列の同一性の程度、並びにたとえば、温度、イオン強度及び配列のCG又はATの含量のような因子に依存する。
【0186】
高い厳密性で生物の核酸分子とハイブリッド形成することができる核酸は、生物の核酸の少なくとも一部で、>90%の配列同一性を有する核酸を含み、好ましくは、>95%、又は>96%又は>97%又は98%、さらに好ましくは>99%の配列同一性を持つものを含む。
【0187】
選択的ハイブリッド形成をもたらす典型的な高い厳密性のハイブリッド形成条件は、当該技術で既知であり、たとえば、参照によって本明細書に組み入れられるSambrook et al., 2001(上記)に記載されたものである。
【0188】
核酸がナイロン膜に固相化され、プローブの核酸が500塩基以上である場合の典型的なハイブリッド形成用溶液の例は、
6xSSC(生理食塩水クエン酸ナトリウム)
0.5%ドデシル硫酸ナトリウム(SDS)
100μg/mLの変性させ、断片化させたサケの精子DNA
である。
【0189】
ハイブリッド形成は68℃で行う。核酸を固相化したナイロン膜は0.1xSSC中で68℃にて洗浄してもよい。
【0190】
20xSSCは以下の方法で調製してもよい。800mLのH2Oに175.3gのNaCl及び88.2gのクエン酸ナトリウムを溶解する。NaOHの10N溶液の2、3滴にてpHを7.0に調整する。H2Oで体積を1リットルに調整する。等量に分配する。オートクレーブで滅菌する。
【0191】
核酸がナイロン膜に固相化され、プローブが15〜50塩基のオリゴヌクレオチドである場合の典型的なハイブリッド形成用溶液の例は、
3.0Mの塩化トリメチルアンモニウム(TMACl)
0.01Mのリン酸ナトリウム(pH6.8)
1mmのEDTA(pH7.6)
0.5%SDS
100μg/mLの変性させ、断片化させたサケの精子DNA
0.1%脱脂粉乳
である。
【0192】
ハイブリッド形成の最適な温度は普通、所定の鎖長のTiより5℃低く選択される。Tiは、プローブとその標的配列との間に形成されるハイブリッドの不可逆的融解温度である。Jacob et al., Nucl. Acids Res., 16:4637, 1988は、Tiの決定を議論している。3MのTMACl中の17量体についての推奨されるハイブリッド形成温度は、48〜50℃であり、19量体では55〜57℃であり、20量体では58〜66℃である。
【0193】
当該技術で既知の任意の方法を用いて、イヌの試料における生物のタンパク質成分を分析することができる。通常、そのような方法は、抗体結合であり、抗体が生物又はその成分に結合する。
【0194】
たとえば、古典的な免疫組織学的方法によって生物のタンパク質の発現を検討することができる。これらでは、一次抗体(ポリクローナル又はモノクローナル)によって特異的な認識が提供されるが、二次検出系は、蛍光、酵素又はそのほかを結合した二次抗体を利用することができる。その結果、病理検査のための組織切片の免疫組織学的染色が得られる。たとえば、ウエスタンブロット又はドット/スロットアッセイのためにタンパク質を遊離するため、尿素や中性の界面活性剤によって組織を抽出することもできる(Jalkanen, M. et al., J. Cell Biol., 101:976-985, 1985; Jalkanen M. et al., J. Cell Biol., 105:3087-3096, 1987)。陽イオン固相の使用に基づいたこの技法では、単離したタンパク質を標準として用いてタンパク質の定量を達成することができる。
【0195】
タンパク質の発現を検出するために有用なそのほかの抗体に基づく方法には、酵素結合免疫吸収測定法(ELISA)及び放射性免疫測定法(RIA)のような免疫測定法が挙げられる。たとえば、反応性のモノクローナル抗体を免疫吸収剤及び酵素標識プローブの両方として用いてタンパク質を検出し、定量することができる。直線回帰コンピュータアルゴリズムを用いて標準調製物に存在する量を参照して試料中に存在するタンパク質の量を計算することができる。腫瘍抗原を検出するためのそのようなELISAは、lacobelli et al., 「乳癌の研究及び治療」11:19〜30(1988年)に記載されている。別のELISAでは、2つの異なった特異的モノクローナル抗体を使用して、体液中のタンパク質を検出することができる。この測定法では、抗体の一方を免疫吸収剤として使用し、他方を酵素標識プローブとして使用する。
【0196】
上記の技法は本質的に「一工程」測定法又は「二工程」測定法として実施してもよい。「一工程」測定法には、固相化した抗体とタンパク質を接触させ、洗浄せずに、標識抗体と混合物を接触させることが含まれる。「二工程」測定法には、標識抗体と混合物を接触させる前に洗浄することが含まれる。そのほかの従来の方法を好適に採用してもよい。測定系の一方の成分を支持体に固相化し、それによって系のほかの成分がその成分と接触でき、試料から容易に離されることが普通望ましい。
【0197】
好適な酵素標識には、たとえば、基質と反応することによって過酸化水素の生成を触媒するオキシダーゼ群からのものが挙げられる。グルコースオキシダーゼは、良好な安定性を有し、その基質(グルコース)が容易に入手できるので、特に好ましい。酵素を標識した抗体/基質の反応によって形成される過酸化水素の濃度を測定することによってオキシダーゼ標識の活性を測定してもよい。酵素のほかに、そのほかの好適な標識には、たとえば、ヨウ素(125I、121I)、炭素(14C)、イオウ(35S)、トリチウム(3H)、インジウム(112In)及びテクネチウム(99mTc)のような放射性同位元素、フルオレセイン及びローダミンのような蛍光標識、並びにビオチンが挙げられる。
【0198】
たとえば、酵素結合免疫吸収測定法(ELISA)のような免疫吸収測定法の周知の技法を用いて、生物又はその成分に対する抗体を検出してもよい。
【0199】
従って、本発明のさらなる側面は、CIRDに関係する抗体を検出するための免疫吸収測定法を提供し、該測定法は、(a)イヌにおいてS.zooepidemicusに対して免疫応答を生じることが可能である作用物質、(b)イヌにおいてM.cynosに対して免疫応答を生じることが可能である作用物質、及び(c)イヌにおいてChlamydophilaに対して免疫応答を生じることが可能である作用物質のいずれか1以上で被覆された固相、並びに固相に結合した抗体に結合する検出可能な標識抱合体を含む。
【0200】
好ましくは、固相はマイクロタイターウエルである。さらに好ましくは、抱合体は、抗イヌ抗体の抗体を含む。好ましくは、抱合体は、酵素、たとえば、西洋ワサビのペルオキシダーゼを含む。さらに好ましくは、免疫吸収測定法は、酵素のための基質も含む。本発明は、免疫吸収測定法の成分を含む部品のキットを包含する。従って、部品のキットは、マイクロタイタープレートのような固相、固相を被覆するための生物由来のタンパク質又は生物、固相に結合する抗生物(又はその成分)抗体に結合する抗イヌ抗体のような検出可能な標識抱合体を包含する。検出可能な標識抱合体が酵素であれば、部品のキットは、酵素のための基質も包含してもよい。キットはまた、固体基材上の抗原と反応することが知られている抗体を含有する陽性対照試料及び陰性対照試料も包含してもよい。
【0201】
本発明はまた、上記及び本発明の第1の側面で定義した(a)、(b)及び(c)のいずれか1つ又は2つ又は3つすべてによって被覆される固相基材を包含する。通常、免疫応答を生じることが可能である作用物質は、抗体も結合するものである。通常、作用物質は、抗原性タンパク質である。通常、タンパク質は、抗原の安定性に依存して、4℃〜37℃にて一晩、マイクロタイタープレートに被覆される。たとえば、リン酸緩衝生理食塩水又はトリス緩衝生理食塩水のような洗浄用緩衝液によって、結合しなかったタンパク質を洗い流す。血清又はそのほかの試料をプレート上で、通常、37℃にて1〜数時間の間インキュベートする。結合しなかった物質を洗い流し、酵素標識した(たとえば、西洋ワサビのペルオキシダーゼ)抗体、たとえば、血清試料のためには抗イヌIgG若しくはIgM、又は肺洗浄液のためには抗イヌIgAと共に37℃にて1〜数時間、プレートをインキュベートする。結合しなかった抗体を洗い流し、OPDのような基質と共にプレートを約10分間インキュベートし、光度計にて光学密度を測定する。
【0202】
好ましくは、固体基材は、マイクロタイターウエルである。
【0203】
本明細書で参照された文書はすべてその全体が参照によって本明細書に組み入れられる。本明細書における以前公開された文書の列記又は議論は、必ずしも、文書が最先端技術の一部である又は共通の一般的知識であるという認知として受け取られるべきではない。
【0204】
以下の図面及び実施例の助けによって、本発明を今やさらに詳細に説明する。
【実施例1】
【0205】
Streptococcus equi亜種zooepidermicusのイヌ感染性呼吸器疾患との関係
〈要約〉
イヌの感染性呼吸器疾患(CIRD)は、ワクチン接種の幅広い利用にもかかわらず、多数の犬舎に飼われたイヌを冒す多因子性の感染症である。現在のワクチンは、ウイルス作用物質及び単一の細菌作用物質、Bordetella bronchisepticaに対して防御することを目的としている。我々は、CIRDにおける連鎖球菌種の役割を調べた。臨床的に健康なイヌ及びCIRDのイヌの下部気道において連鎖球菌を単離、同定して特定の連鎖球菌種の存在と呼吸器疾患を相関付けた。我々は、S.equi亜種zooepidermicus(S.zooepidermicus)の存在が、流行性CIRDに罹った犬舎のイヌ集団における疾患の重症度の上昇に関係することを示す。
【0206】
〈序論〉
CIRDは、あらゆる年齢のイヌを冒す感染症であり、多数のイヌを隙間なく一緒に閉じ込めて飼う場合、共通して生じる。該疾患は、早期の咽頭炎に特徴的な乾いた空咳、鼻汁及び/又は眼漏、及び様々な食欲不振及び意気消沈を伴った高い罹患率を有し、気管気管支炎肺炎及びさらに重度の症例では死亡にさえ進行しうる。該疾患は歴史的に、ウイルス(CPIV及びCAV−2)及び細菌の作用物質による組み合わせ感作又は連続した感作が、臨床スコアの相乗的上昇を生じる複合的感染症とみなされてきた(Appel and Binn, 1987)。該疾患の間、最も共通して検出される細菌作用物質は、B.bronchiseptica(McCandlish et al., 1978)であるが、Pasteurella sp、Mycoplasma sp及びβ−出血性連鎖球菌(βhS)のようなそのほかの細菌種も該疾患に関わってきた(McCandlish et al., 1978; Rosendal, 1978; Thrusfield et al., 1991)。
【0207】
疾患に罹ったイヌ及び健康なイヌ双方の上部気道(口腔及び鼻腔)及び下部気道(気管及び肺)から単離された細菌に関与する多数の研究が、βhSの存在に言及している(Smith, 1967; McCandlish et al., 1978; McKieman et al., 1982; Azetaka & Konishi, 1988)。しかしながら、イヌの上部気道で見い出されるβhSの種々の種にもかかわらず、たった2、3の研究しか下部気道疾患に関与するβhSの種に着目していなかった(Garnett et al., 1982; Angus et al., 1997)。イヌの気道におけるβhSの種は、Biberstein et al. (1980)によって注目されたが、この研究は、上部気道と下部気道における運搬を区別するのを怠った。さらに、単離は、獣医病院の患者から行われたとしても、照会理由及び従って特定の臨床症状へのいかなる連鎖も省略された。イヌにおける最も一般的なβhSである、S.canis、ランスフィールド群G Streptococcusは、皮膚と同様に生殖器及び呼吸器の粘膜の正常な共生生物である(Timoney, 1987; Quinn et al., 1999)。Streptococcus canis (S.canis)は、健康なイヌの60〜73%の扁桃腺から以前、単離されている(Smith, 1967; Sadatsune & Moreno, 1975; Biberstein & Hirsh, 1999)。S.canisは、イヌにおいて、肺炎、敗血症、膿瘍、耳炎、乳腺炎、子宮膿腫、直腸炎、毒性ショック症候群及び壊疽性筋膜炎を含む多様な散発的な及び日和見性の感染症の原因となる(Biberstein & Hirsh, 1999; Quinn et al., 1999)。
【0208】
S.canisに加えて、たとえば、A、C及びEのようなほかのランスフィールド群のβhSもイヌから単離されている(Biberstein et al., 1980)。S.zooepidermicus、ランスフィールド群Cは、哺乳類の上部気道粘膜の共生生物として見い出されている(Timoney et al., 1988; Quinn et al., 1999)。それは、ウマにおける下部気道疾患、巣状肺炎及び子宮頸管炎(Chanter et al., 1997; Biberstein & Hirsh, 1999)、ラマにおける肺炎(Biberstein & Hirsh, 1999)、ブタにおける敗血症及び関節炎(Timoney, 1987)、ウシ及びヤギにおける乳腺炎(Timoney et al., 1988)、ニワトリにおける敗血症、ラマにおける心膜炎及び肺炎(Timoney, 1987)、モルモットにおけるリンパ節炎(Quinn et al., 1999)、及びヒトにおける糸球体腎炎(Balter et al., 2000)を含む幾つかの疾患症候群に関係している。イヌでは、S.zooepidemicusは、創傷感染及び敗血症(Quinn et al., 1999)及び急性壊死性出血性肺炎(Gamett et al., 1982)に関係している。本研究で我々は、健康なイヌ及びCIRDに罹ったイヌの双方の気道にβhSのどの種が存在するのかを確立しようとした。
【0209】
〈材料及び方法〉
〈試験集団及び試料採取〉
主な試験集団(n=209、気管支肺胞洗浄、BAL)は、風土性のCIRDの履歴を持つ定評のあるリホーミング犬舎(〜600匹のイヌ)からの動物を含んだ。犬舎に入れる際、すべてのイヌに、ジステンパーウイルス、CAV−2、CPIV及びイヌパルボウイルスのための弱毒化生ワクチン並びにレプトスピラ症に対するKAVAK Lである、KAVAK DA2PiP69(フォートドッジ)によるワクチン接種を行った。イヌコロナウイルス(CRCV)及びB.bronchiseptica双方の存在は、この施設におけるCIRDに罹ったイヌで実証されている(Chalker et al., 2003; Erles et al., 2003)。各週、この犬舎は福祉の理由で若干のイヌを犠牲にしなければならず、これらのイヌから、試料採取のために2、3匹を任意に選択した。1999年〜2001年の間、2年間にわたって合計209匹のイヌから以下の方法によってBAL試料を採取した。安楽死の2時間以内に、気管を分岐の真上でクランプで止めて、試料採取中、肺への気管の混入を防いだ。滅菌したカテーテルチュービングを用いて、次いで50mLのハンクス平衡塩溶液を左先端の肺葉に入れた。次いで、この肺葉を30秒間マッサージし、BALを回収した。安楽死の際に、臨床的な呼吸のスコアの重症度について以下のカテゴリ:(1)呼吸器徴候なし、n=71、(2)軽い咳、n=37、(3)咳及び鼻汁、n=76、(4)意気消沈及び/又は食欲不振を伴った咳及び鼻汁、n=9、(5)化膿性気管支肺炎、n=16に、イヌを等級分けした。
【0210】
BAL試料採取の後、組織学的分析のために、右遠位肺葉からの肺組織の切片を必要とした。ホルマリン固定(10%ホルマリン生理食塩水)した組織の塊をパラフィンに包埋し、標準のヘマトキシリン及びエオシン染色した切片を光学顕微鏡(x40、x100、x400)のもとで観察した。肺胞内好中球の存在又は非存在を書き留めた。
【0211】
各イヌが犬舎で過ごした合計日数を記録し、次いで、犬舎での時間を週で算出した。犬舎に入れる際の各イヌの年齢及び臨床症状を書きとめ、栄養状態、被毛、振る舞い、食欲、及び一般の臨床検査(体温、脈拍、呼吸数)に基づいた臨床症状複合スコアを以下の(1)良好、(2)不良、(3)極めて不良のように等級分けした。
【0212】
追加のイヌ集団が、2年間にわたる(1998〜2000年)(n=71、BAL)、RVCでの診断的細菌学を参照した臨床的呼吸器症状を持つ家庭で飼われたペット犬から構成される対照群として含められた。対照群からの試料は、Cocoran (1998)によって記載された内視鏡で誘導する技法を用いて採取した。研究における試料はすべて、細菌学試験まで4℃で保持し、凍結BALで行うmL当たりのCFUの計算を除いて、試験は試料採取の24時間以内に行った。
【0213】
〈細菌の単離及び同定〉
BALの50μL容量を5%無菌のヒツジの血液と共にコロンビア血液寒天(英国、ハンプシャー、オキソイド社)プレートに2つ1組で入れ、好気的又は嫌気的の双方で、37℃にて24時間インキュベートした。β−溶血性コロニーを同定し、次いで単一コロニーに精製した。コロニー及び細胞の形態によって、グラム陽性、カタラーゼ陰性の細菌を連鎖球菌と同定し、ラテックスビーズのスライド凝集(英国、ハンプシャー、オキソイド社)によってランスフィールド群に血清学的に分けた。次いで、APL20STREP手動同定キット(英国、ベージングストーク、バイオメリエクス英国社)を用いて、生化学を利用し、酵素の作用によって単離物を種のレベルに同定した。
【0214】
混合感染を検出するために、研究における最初の12匹のイヌからの3つのコロニーをラテックスビーズスライド凝集とAPI20STREPの両方によって調べた。リン酸緩衝生理食塩水(英国、ドーセット、シグマ−アルドリッチ社)によるBALの連続希釈を3連1組でプレートに播き、上述のようにインキュベートし、BALのmL当たりのCFUを算出した、次いで、βhSの増殖を以下:なし(0)、<100CFU/mL(1)、100〜1000CFU/mL(2)及び>1000CFU/mLのように等級化した。
【0215】
〈統計学的解析〉
解析についてはすべて、0.05の1型誤差(α)の有意レベル又は確率を前提とした。プリズム(米国、サンディエゴ、グラフパッドソフトウエア社、バージョン3.0)統計学解析ソフトウエアX2検定を用いて、年齢、犬舎に入れる際の臨床症状、犬舎での週数、肺胞内好中球の存在及び臨床的呼吸スコアとS.zooepidemicusの存在を解析した。各呼吸スコアに関するS.zooepidemicusの増殖についての合わせた平均スコアの使用によって細菌の増殖と呼吸スコアの相関を決定し、プリズム1方向ANOVA(非パラメータ)検定によって解析した。週の時間経過による犬舎で飼われたイヌの試料中のS.canis、S.zooepidemicus及び呼吸器疾患の存在も計算した。
【0216】
〈結果〉
β−溶血性連鎖球菌は、両方の試験集団から単離されたが、家庭で飼われたペット犬のBALからの単離は、犬舎で飼われたイヌからの単離と大きく異なった(家庭犬1.4%、犬舎23.9%、X2検定***p=0.000)。hSの単離物はすべてS.canis又はS.zooepidemicusであった。異なったランスフィールド群又は種のよる混合感染は見い出されず、さらに個々のプレートはすべて均一な形態のコロニーを生じた。犬舎のイヌからはS.canis及びS.zooepidemicusの双方が単離されたが、家庭のペット犬からはS.zooepidemicusのみが単離され、S.canisは単離されなかった。犬舎のイヌでは、S.zooepidemicusが優勢なhS種であった(92.0%)。臨床的呼吸スコアの各等級の範囲内で犬舎のイヌにおけるS.canis及びS.zooepidemicusの双方の保菌犬を調べた(図1)。S.canisは、臨床スコアの有無にかかわらずイヌに存在し、単離は、疾患の重症度に伴って上昇しなかった。それに対して、健康なイヌは、疾患に罹った動物よりも下部気道にS.zooepidemicusを有する可能性は低く(X2検定**p=0.004)、S.zooepidemicusの単離は、臨床的呼吸スコアの上昇と共に、無症状のイヌでの9.7%から化膿性気管支肺炎のイヌでの87.5%へと劇的に増えた(X2検定***p=0.000)。呼吸スコアの高いイヌほど、臨床的に健康なイヌよりもさらに高い平均のS.zooepidemicusの細菌増殖スコアを有する可能性がさらに高かった(1方向ANOVA解析***p=0.000、R自乗=0.194、F=22.265)。動物の年齢及び犬舎に入れた際の臨床症状は、S.zooepidemicusの単離に影響を与えなかった(X2解析、年齢p=0.341、犬舎に入れた際の臨床症状p=0.295)。
【0217】
犬舎においてCIRDに罹ったイヌの比率は、1週目の21.1%から2週目の70.1%へと劇的に上昇したが、4週目の終わりまで集団においてDIRDは増えなかった(図2)。有意差は検出されなかったが、肺にS.zooepidemicusを持つイヌの数は、犬舎で経時的に1週目の16.7%から3週目の34.4%へと20.6%増えたが(図2)、S.canisではそのような傾向は見られなかった。
【0218】
組織学的解析は、S.zooepidemicusを持つイヌは、S.zooepidemicusのないイヌよりも肺胞内好中球を有する可能性が高いことを示した(X2解析、**p=0.006)。高い細菌スコアを持つイヌでは、S.zooepidemicusが誘発した出血性連鎖球菌肺炎(HSP)のイヌでのGarnett et al. (1982)の知見に類似する、中程度から顕著なマクロファージの凝集を伴う急性の化膿性又は壊死性の肺炎が見られることが多かった。HE染色の切片では、細菌細胞は見られなかった。
【0219】
〈考察〉
本研究では、我々は、疾患の有無にかかわらず、家庭で飼われたイヌ及び犬舎で飼われたイヌの下部気道に存在するβhSの種に着目した。S.canisがイヌの気道では優勢なβhSであり(Biberstein et al., 1980)、本研究における犬舎のイヌの一部の下部気道から単離されたが、それは、犬舎で飼われたイヌのCIRDとは関係しなかった。それに対して、S.zooepidemicusの単離の増加は、CIRDの重症度の上昇と関係していた。何らかの呼吸器症状を持つイヌは犬舎における健康なイヌよりも下部気道にS.zooepidemicusを有する可能性が高く、S.zooepidemicusは、犬舎で飼われたイヌよりも家庭のペットではさらに低い比率で見い出された。
【0220】
Streptococcus equi亜種zooepidermicusはこれまでは、イヌにおけるHSPに関係するとされていた(Garnett et al., 1982)。HSP症候群は、ビーグルの閉鎖コロニーにおける重度の感染であり、事前の臨床スコアなしで突然死を生じた。剖検所見は、気管及び気管支内における多量の出血性滲出物が含まれ、広汎性の暗赤色の肺を伴っていた。さらに、他の組織の範囲で斑状性出血があった。その疾患は、1匹のイヌにおけるS.zooepidemicusの気管内接種により再現された。本研究において興味深いことに、S.zooepidemicusの高い増殖スコアを持つイヌほど肺胞内好中球を有する可能性が高く、低い増殖スコアを持つイヌよりもHSPにおいてGarnett et al., (1982)により記載された肺の組織学的特徴を共有している。
【0221】
CIRDは歴史的に、細菌性及びウイルス性の作用物質が関与する複雑な疾患であるとみなされている。実際、この犬舎で飼育された集団では、CRCV(Erles et al., 2003)及びB.bronchiseptica(Chalker et al., 2003)を含むそのほかの幾つかの作用物質が記載されている。CRCVの病原性の潜在能力は未だ明らかにされていないが、Erles et al., (2003)によるデータは、CRCVが軽い呼吸器疾患(スコア2)のイヌで優勢であることを示し、同様に、Chalker et al., (2003)はB.bronchisepticaを持つイヌは、中程度の疾患(スコア3)のイヌで優勢であることを見い出した。
【0222】
我々が、Streptococcus zooepidemicusはCIRDのさらに重度の症例(スコア4〜5)にのみさらに共通して関係していることを見い出したということは、それが二次的なインベーダとして作用している可能性があることを示している。実際、βhSの種はこれまでCIRDの「複合体」における二次的インベーダであるとされている(McCandlish et al., 1978)。しかしながら、S.zooepidemicusは、これらの動物における呼吸器疾患で主要な役割を担うのか、又はほかの病原体による損傷に続いて単に気道に侵入するだけなのかどうかは未だにわからない。疫学的な証拠は、ウマのS.zooepidemicusは呼吸器疾患の主要な病原体であってもよいが(Wood et al., 1993; Chanter et al., 1997)、それは一般に日和見的な病原体であるとみなされる(Walker & Timoney, 1998; Anzai et al., 2000)ことを示唆している。S.zooepidemicusがこれらのイヌにおけるCIRDの主要な原因でないとしても、化膿性気管支肺炎のイヌからの高率の単離(87.5%)は、S.zooepidemicusが犬舎で見られるさらに重度の臨床徴候に関与するという仮説を支持する。呼吸器疾患に罹った家庭でのペットからの低い単離(1.4%)は、この作用物質が共通の呼吸器感染でなくてもよく、この犬舎に特有の問題であればよいことを示している。以前の犬舎飼育を考慮に入れなかったが、本研究における家庭で飼われているペット犬の一部がかつて犬舎で飼育されたことがあるということはありそうなことである。犬舎で飼育されたイヌにおけるCIRDのほかの症例でのS.zooepidemicusのが担う役割は確認されていない。
【0223】
これらのイヌからのS.zooepidemicusの単離が犬舎において経時的に増加するということは、これらイヌの肺がこの細菌で感染されるようになることを示している。そのような感染は上部気道の無症状性の感染又は単一の病原性株から生じればよい。可変性M−様SzPタンパク質の遺伝子に関するPCRのタイピングシステムによって、S.zooepidemicusの15の既知の血清型を5つの識別可能な群、HV1〜5に分離することができる(Walker & Timoney, 1998)。Anzai et al. (2000)によるこのタイピングシステムの解析によって、S.zooepidemicusの単一クローンの変異体が肺炎のウマの肺で見い出されたが、幾つかの型が健康なウマの扁桃腺で見い出された。CIRDのこの発生に関与するS.zooepidemicusの単離物の亜型をタイプ分けし、疾患に罹った集団に単一クローンの変異体が存在するかどうかを決定し、また、あるとすれば、イヌのS.zooepidemicus単離物が有するウマ及びそのほかの動物における呼吸器疾患を起こすものとの関係を調べることは興味深い。S.zooepidemicusが関係する肺炎はあらゆる年齢のウマで発生し、輸送によるストレスを与えられた老齢のウマでは急性の出血性肺炎を生じる(Anzai et al., 2000)。CIRDのこの発生では、若齢のイヌ及び犬舎に入れる際、哀れな臨床症状のイヌは、年取ったイヌ及び入れる際、健康なイヌと同様に、S.zooepidemicusによる感染に感受性が高かった。
【0224】
この犬舎では、感染の範囲について抗生物質療法を与え、重度の気管支肺炎の症例を除いてCIRDに罹ったイヌへの日常的な治療は行わない。治療が本研究で注目した細菌のスペクトルに影響を与ええた可能性がある。しかしながら、呼吸器疾患の自然発生の調査は、他の手段では得ることができない貴重な情報を提供することができる。
【0225】
CIRDは、CAV−2、CPIV、B.bronchiseptica、及びMycoplasma sppを含む幾つかの作用物質が関与する多因子疾患であることが知られている。種々の場所から多数のイヌが集められ、飼育されているこの犬舎では、幾つかの病原体が存在し、疾患の重症度はこれを反映している可能性がある。
【実施例2】
【0226】
〈Mycoplasma cynosのイヌ感染性呼吸器疾患との関係〉
生物の培養及びPCR解析による同定によってM.cynosの存在を調べた。犬舎で飼育された184匹のイヌの調査で、我々は、気管又は肺にM.cynosを持つイヌの比率が呼吸器疾患の徴候と共に、健康なイヌの10%から疾患に罹ったイヌの31%へと増加することを見い出した(図3)。
【0227】
我々はまた、呼吸器疾患は犬舎で経時的に増加し、第1週目は犬舎のイヌは気管に検出可能なM.cynosを有さなかったのに対して第2週目までに184匹のイヌのうち24%が気管におけるM.cynos陽性であることに気づき、これは、集団の24%がこの細菌に感染していることを示している。さらに小さな、しかし類似の増加も肺のコロニー形成で見られた(15%から23%へ)(図4を参照のこと)。
【実施例3】
【0228】
〈Chlamydophilaのイヌ感染性呼吸器疾患との関係〉
Chlamydophilaの存在について我々は、PCR解析によって210匹のイヌを調査した。以下のPCRによってChlamydophilaから23SrRNA遺伝子の218bpの断片を増幅した。反応条件:95℃にて5分間(x1サイクル)、95℃にて30秒間、50℃にて30秒間、72℃にて1分間(x40サイクル)及び72℃にて5分間。合計50μLのPCR反応混合物には、5.0μLの10xのマグネシウムを含まない緩衝液(プロメガ)、1.5mMのMaCl2(プロメガ)、0.5μL(0.5単位)のTaqDNAポリメラーゼ(プロメガ)、0.2mMのPCRヌクレオチド混合物(プロメガ)、0.025μgの正方向プライマーC1(5’−GATGCCTTGGCATTGATAGGCGATGAAGGA−3’配列番号9)及び逆方向プライマーC2(5’−TGGCTCATCATGCAAAAGGCA−3’配列番号10)、40μLの水及び2μLの試料組織のDNAが含まれた。
【0229】
配列の解析及びFasta解析によるジェンバンクで利用可能な配列とのPCR産物の比較によって8匹のイヌから得られたPCR産物をChlamydophilaとして確認した。そのような配列(DHBC10)の1つの23SrRNA遺伝子の部分配列を図5に示す(配列番号1)。この218bpの配列は、Chlamydophila abortusの同一領域と99.08%同一であり、Chlamydophila psittaciと98.6%同一であり、Chlamydophila felisと96.3%同一であるが、予備的な系統発生解析(Megalignによるクラスター法)では、ほとんどの配列は、別個のクレードでクラスターを作る(図7)。7つのそのほかのChlamydophila単離物の23SrRNAの部分配列を図8に示す(配列番号2〜8)。
【0230】
この調査では、我々は、Chlamydophilaの検出は、気管及び肺の双方における呼吸器疾患の重症度の上昇と共に増加することを見い出した。10%の検出の軽い増加は、気管試料(25%から34%へ)で見い出された。さらに劇的な差異は、肺におけるChlamydophilaの検出で、健康なイヌの0%からCIRDのイヌでの37.5%への増加によって見い出された(図6)。さらに、ChlamydophilaのPCRにより陽性とされたイヌの総数は、健康なイヌの25%から重度疾患のイヌでの50%への増加が見られた(図6)。
【実施例4】
【0231】
〈イヌヘルペスウイルスのイヌ感染性呼吸器疾患との関係〉
我々は、さらに重度の呼吸器症候群に罹ったイヌにおけるイヌヘルペスウイルスの罹患率の上昇を見い出した(図9)。1年にわたってCHVに対する抗体反応をモニターした場合、呼吸器疾患を頻繁に発生する犬舎のイヌは、発生のない匹敵する犬舎のイヌ(8.3%)よりも頻繁に(58.3%)CHVに対する血清変換を示した。
【0232】
《参照文献》
Angus, J. C. , Jang, S. S. , Hirsh. D. C. , (1997). Microbiological study of transtracheal aspirates from dogs with suspected lower respiratory tract disease: 264 cases (1989-1995).J Am. Vet. Med. Assoc. 210,55-58.
Anzai, T. , Walker, J. A. , Blair, M. B. , Chambers, T. M. , Timoney, J. F., (2000). Comparison of the phenotypes of Streptococcus zooepidemicus isolated from tonsils of healthy horses and specimens obtained from foals and donkeys with pneumonia. Am. JVet. Res. 61,162-166.
Appel MJ, Percy DH. SV-5-like parainfluenza virus in dogs. (1970) JAmVetMed Assoc. 1970 Jun 15; 156 (12): 1778-81
Appel, M. , Binn, L. N. , 1987. Canine Infectious Tracheobronchitis Short review: Kennel Cough. In: Appel M. (Ed. ), Virus Infections of Carnivores. Elsevier. Oxford. pp.201-211.
Arizmendi F, Grimes JE, Relford RL. (1992). Isolation of Chlamydia psittaci from pleural effusion in a dog. J VetDiagn Invest. 4 (4): 460-3.
Azetaka, M., Konishi, S. , (1988). Kennel cough complex: confirmation and analysis of the outbreak in Japan. Jap. J Vet. Sci. 50,851-858.
Balter, S. , Benin, A. , Pinto, S. W. L. , Teixeira, L. M. , Alvim, G. G. , Luna, E., Jackson, D. , LaClaire, L. , Elliot, J. , Facklam, R. , Schuchat, A. , (2000). Epidemic nephritis in Nova Serrana, Brazil. Lancet. 355,1776-1780.
Barile, M. F. (1985) Immunization against mycoplasma infections p 451- 492. In S. Razin and M. F. Barile (Ed. ) The Mycoplasamas, vol 4. Mycoplasma pathogenicity. Academic Press, Inc, Orlando, Florida.
Barile M. F. etal.,(1985). Current status on the controls of mycoplasma diseases of man, animals, plants and insects. Bull. Inst. Pasteur. 83: 339- 373.
Bemis, D. A. , Carmichael, L. E. , and Appel, M. J. (1977a). Naturally occurring respiratory disease in a kennel caused by Bordetella bronchiseptica.Cornell Vet. 67,282-93.
Bemis DA, Greisen HA, and Appel MJ. (1977b). Pathogenesis of canine bordetellosis. J Infect Dis 135: 753-762.
Biberstein, E. L. , Brown, C. , Smith, T. , (1980). Serogroups and Biostypes among beta-hemolytic streptococci of canine origin.J. Clin. Microbiol. 11, 558-561.
Biberstein, E. L. , Hirsh, D. C. , (1999). Streptococci. In: Hirsh, D. C. , Zee, Y. C. , (Eds. ) Veterinary Microbiology. Blackwell Science. Oxford. pp 120- 126.
Binn, L. N. , Eddy, G. A. , Lazar, E. C. , Helms, J. , and Murnane, T. (1967). Viruses recovered from laboratory dogs with respiratory disease.Proc SocExp Biol Med 126, 140-5
Chalker VJ, Toomey C, Opperman S, Brooks HW, Ibuoye MA, Brownlie J, Rycroft AN. Respiratory Disease in Kennelled Dogs: Serological Responses to Bordetella bronchisepticaLipopolysaccharide Do Not Correlate with Bacterial Isolation or Clinical Respiratory Symptoms.Clin Diagn Lab Immunol. 10 (3): 352-6.2003
Chanter, N. , (1997) Streptococci and enterococci as animal pathogens. J. Appl. Microbiol. Symp. Suppl. 83, 100S-109S.
Cocoran, B.(1998). Cytological collection techniques. In: Luis Fuentes, V. Swift, S. , (Eds. ), Manual of small animal cardiorespiratory medicine and surgery. BritishSfnall Anim. Vet. Assoc. Cheltenham. pp. 75-79.
Ditchfield, J. , Macpherson, L. W. , and Zbitnew, A. (1962). Association of a canine adenovirus (Toronto A 26/61) with an outbreak of laryngotracheitis ("kennel cough"). Can. Vet. Jour. 3,238-247
Ellis JA, Haines DM, West KH, Burr JH, Dayton A, Townsend HG, Kanara EW, Konoby C, Crichlow A, Martin K, Headrick G.(2001) Effect of vaccination on experimental infection with Bordetella bronchiseptica in dogs.JAm VetMedAssoc. 218 (3):367-75. 2001
Erles,K., Toomey, C. , Brooks, H. W. , Brownlie, J. (2003). Detection of a group 2 coronavirus in dogs with canine infectious respiratory disease. Virology. In press.
Farrow JA, et al. (1984). "Taxonomic studies on Streptococci of serological groups C, G and L and possibly related taxa".Syst. Appl. Microbiol. 5: 483- 493.
Fraser G, Norval J, Withers AR, Gregor WW. (1985) A case history of psittacosis in the dog.VetRec. 196985 (3): 54-8.
Fukushi H, Ogawa H, Minamoto N, Hashimoto A, Yagami K, Tamura H, Shimakura S, Hirai K. (1985) Seroepidemiological surveillance of Chlamydia psittaci in cats and dogs in Japan. Vet Rec. 117 (19): 503-4.
Garnett, N. L. , Eydelloth, R. S., Swindle, M. M. , Vonderfecht, S. L., Strandberg, J. D. , Luzarraga, M. B. , (1982). Hemorrhagic streptococcal pneumonia in newly procured research dogs. J Am. Vet. Med. Assoc. 181, 1371-1374.
Gresham AC, Dixon CE, Bevan BJ. (1996) Domiciliary outbreak of psittacosis in dogs: potential for zoonotic infection.VetRec. 138 (25): 622-3.
Jang SS, Ling GV, Yamamoto R, Wolf AM. (1984) Mycoplasma as a cause of canine urinary tract infection.J Am Vet Med Assoc 185(1) : 45-7
Karpas, A. , King, N. W. , Garcia, F. G. , Calvo, F., and Cross, R. E. (1968a). Canine tracheobronchitis: Isolation and characterization of the agent with experimental reproduction of the disease.Proc Soc Exp Biol Med. 127,45- 52.
Karpas A, Garcia FG, Calvo F, Cross RE. (1968b) Experimental production of canine tracheobronchitis (kennel cough) with canine herpesvirus isolated from naturally infected dogs.Am J VetRes. 29 (6): 1251-7.
Keil, D. J. , and Fenwick, B. (1998). Role of Bordetella bronchiseptica in infectious tracheobronchitis in dogs.JAm Vet Med Assoc. 15,200-7.
Lambrechts N, Picard J, Tustin RC. (1999) Chlamydia-induced septic polyarthritis in a dog.J ; SAfr VetAssoc. 70(1) : 40-2).
Lou, T. Y. , and Wenner, H. A. (1963). Natural and experimental infection of dogs with reovirus, typel: pathogenicity of the strain for other animals. Am.J.Hyg. 77,293-304.
McCandlish, I. A. P. , Thompson, H., Cornwell, H. J. C. , Wright, N. G. , 1978. A study of dogs with kennel cough. Vet. Rec. 102,298-301.
McKiernan, B. C. , Smith, A. R., Kissil, M. , 1982. Bacterial Isolates from the lower trachea of clinically healthy dogs.J. Am. Anim. Hospl. Assoc. 20, 139-142.
Quinn, P. J. , Carter, M. E. , Markey, B. K. , Carter, G.R., (Eds. ), 1999. Clinical Veterinary Microbiology. Mosby. pp. 129-130.
Randolph JF, Moise NS, Scarlett JM, Shin SJ, Blue JT, Bookbinder PR. (1993). Prevalence of mycoplasmal and ureaplasmal recovery from tracheobronchial lavages and prevalence of mycoplasmal recovery from pharyngeal swab specimens in dogs with or without pulmonary disease. AmJ Vet Res. Mar ; 54 (3):387-91.
Rosendal, S.(1972). Acta Vet. Scand. 13: 137.
Rosendal & Vinther (1977). Experimental mycoplasmal pneumonia in dogs: electron microscopy of infected tissue. ActaPathol Microbiol Scand [BJ 85B (6): 462-5.
Rosendal, S. (1978). Canine Mycoplasmas: Pathogenicity of Mycoplasmas associated with distemper pneumonia. J. Infect. Dis. 138 (2),203-210.
Sadatsune, T. , Moreno, G. , 1975. Contribution to the study of b-haemolytic streptococci isolated from dogs.Arq. Inst. Biol. Sao. Paulo. 42,257-264.
Sako T, Takahashi T, Takehana K,Uchida E, Nakade T, Umemura T, Taniyama H. (2002) Chlamydial infection in canine atherosclerotic lesions. Atherosclerosis. 162 (2): 253-9.
Smith J. E. , 1967. The aerobic bacteria of the nose and tonsils of healthy dogs.J Comp. Path. 71,428-433.
Storz, J. (1988) Microbiologyof Chlamydia. p. 168 Ed A. L. Barron, Boca Raton, CRC Press.
Swango LJ, Wooding WL Jr, Binn LN. 1970. A comparison of the pathogenesis and antigenicity of infectious canine hepatitis virus and the A26-61 virus strain (Toronto). J Am Vet MedAssoc. 1970 Jun 15; 156 (12):1687-96.
Thompson H, McCandlish IAP, Wright NG : (1976) Experimental respiratory disease in dogs due to Bordetella bronchiseptica. Res Vet Sci 20: 16-23.
Thrusfield, M. V. , Aitken, C. G. G. , Murihead, R. H. , (1991). A field investigation of kennel cough: incubation period and clinical signs.J. Small Anim. Pract. 32,215-220.
Timoney, J. F. (1987). The Streptococci. In: Gyles, C. L. , Thoen C. O. , (Eds.) Pathogenesis of bacterial infections in animals. Iowa State University Press. pp. 12-13.
Timoney, J. F. , Gillespie, J. H. , Scott, F. W. , Barlough, J. E. , (Eds), 1988. The Genus Streptococcus. In: Hagan and Bruner's Microbiology and Infectious Diseases of Domestic Animals. Comstock Publishing Associates, London. pp. 181-187.
Ural O, Tuncer I, Dikici N, & Aridogan B. (2003). Streptococcus zooepidemicus meningitis and bacteraemia.Scand Jlhfect Dis. 35 (3): 206- 207.
Walker, J. A. , Timoney, J. F. , (1998). Molecular basis of variation in protective SzP proteins ofStreptococcus zooepidemicus. Am. J Vet. Res. 59,1129-1133.
Walker RL & Runyan CA (2003). Identification of variations in SzP proteins of Streptococcus equi subspecies zooepidemicus and the relationship between protein variants and clinical signs of infection in horses.AmJVetRes. 64 (8):976-81.
Werth D, Schmeer N, MullerHP, Karo M, Krauss H. (1987). Demonstration of antibodies against Chlamydia psittaci and Coxiella burnetii in dogs and cats: comparison of the enzyme immunoassay, immunoperoxidase technic, complement fixation test and agar gel precipitation testZen ralbl Veterinarmed B. 34 (3): 165-76.
Wood, J. L. N. , Burrell, M. H. , Roberts, C. A. , Chanter, N. , Shaw, Y. , (1993). Streptococci andPasteurella spp. associated with disease of the equine lower respiratory tract. Equine Vet. J. 25,314-318.
Young S, Storz J, Maierhofer CA. (1972) Pathologic features of experimentally induced chlamydial infection in dogs. Am J Vet Res. 33(2) : 377-83.
【図面の簡単な説明】
【0233】
【図1】臨床的呼吸器スコア(n=各群におけるイヌの総数)を持つ209匹の犬舎で飼育されたイヌからのS.canis及びS.zooepidemicusの単離。エラーバーは、信頼区間(95%)を表す。
【図2】犬舎のCIRDのイヌにおける経時的なS.canis及びS.zooepidemicusの比率(n=合計209匹のイヌの各群におけるイヌの総数)。エラーバーは、信頼区間(95%)を表す。
【図3】CIRDの重症度レベルが高まる場合の気管及び肺にM.cynosの感染を持つイヌの比率。
【図4】犬舎での時間の長さが増した後の気管及び肺にM.cynosの感染を持つイヌの比率。
【図5】CIRDに罹ったイヌ(CHB10)から単離したChlamydophilaの23SrRNA遺伝子の218の部分ヌクレオチド配列(配列番号1)。
【図6】CIRDの重症度レベルが高まる場合の気管及び肺にChlamydophilaの感染を持つイヌの比率。
【図7】Chlamydia及びChlamydophilaの既知の種すべての23SrRNAによって直列させたイヌ23SrRNAの部分配列(DHB)(Cabor-C.abortus、Cpsit-C.psttaci、Cfel-C.felis、Ccavi-C.caviae、Cpne-C.pneumoniae、Cpec-C.pecorum、Csuis-C.suis、Ctrac-C.trachomatis、Wad-Waddlia、Sim-Simkania)。
【図8】CIRDに罹ったイヌ(CHB2、4、5、6、7、8及び9)から単離したChlamydophila種の23SrRNA遺伝子の218の部分ヌクレオチド配列(配列番号2〜8)。
【図9】CIRDの重症度レベルが高まる場合の気管及び肺にイヌヘルペスウイルスの感染を持つイヌの比率。
【特許請求の範囲】
【請求項1】
イヌに予防接種するためのワクチン組成物であって、
(a)イヌにおいてストレプトコックス亜種ゾーエピデミクス(Streptococcus equi亜種zooepidemicus, S.zooepidemicus)に対する免疫応答を生じさせることが可能である作用物質;
(b)イヌにおいてマイコプラズマサイノス(Mycoplasma cynos, M.cynos)に対する免疫応答を生じさせることが可能である作用物質;及び
(c)イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である作用物質のいずれか1以上を含む、ワクチン組成物。
【請求項2】
イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)に対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したS.ゾーエピデミクス、又はS.ゾーエピデミクスの免疫原性の断片若しくはその派生物、又は前記断片若しくは前記派生物をコードする核酸を含む、請求項1に記載のワクチン組成物。
【請求項3】
イヌにおいてM.サイノス(M.cynos)に対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したM.サイノス(M.cynos)、又はM.サイノス(M.cynos)の免疫原性の断片若しくはその派生物、又は前記断片若しくは前記派生物をコードする核酸を含む、請求項1または2に記載のワクチン組成物。
【請求項4】
イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したクラミドフィラアボルタス(Chlamydophila abortus)、又はクラミドフィラアボルタス(Chlamydophila abortus)の免疫原性の断片若しくはその派生物、又は前記断片若しくは前記派生物をコードする核酸を含む、請求項1〜3の何れか1項に記載のワクチン組成物。
【請求項5】
イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したクラミドフィラプシッタキ(Chlamydophila psittaci)、又はクラミドフィラプシッタキ(Chlamydophila psittaci)の免疫原性の断片若しくはその派生物、又は前記断片若しくは前記派生物をコードする核酸を含む、請求項1〜3の何れか1項に記載のワクチン組成物。
【請求項6】
イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したクラミドフィラフェリス(Chlamydophila felis)、又はクラミドフィラフェリス(Chlamydophila felis)の免疫原性の断片若しくはその派生物、又は前記断片若しくは前記派生物をコードする核酸を含む、請求項1〜3の何れか1項に記載のワクチン組成物。
【請求項7】
イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したクラミドフィラムリダルム(Chlamydia muridarum)、クラミドフィラペコルム(Chlamydia pecorum)、クラミドフィラプネウモニアエ(Chlamydia pneumoniae)、クラミディアスイス(Chlamydia suis)又はクラミディアトラコマティス(Chlamydia trachomatis)、又はそれらのの免疫原性の断片若しくはその派生物、又は前記断片若しくは前記派生物をコードする核酸を含む、請求項1〜3のいずれか1項に記載のワクチン組成物。
【請求項8】
請求項1〜7の何れか1項に記載のワクチン組成物と、薬学上許容可能なキャリア、希釈剤又はアジュバント。
【請求項9】
請求項1〜8の何れか1項に記載のワクチン組成物であって、さらに
(d)イヌにおいてイヌ呼吸器コロナウイルス(CRCV)に対する免疫応答を生じさせることが可能である作用物質;
(e)イヌにおいてイヌパラインフルエンザウイルス(CPIV)に対する免疫応答を生じさせることが可能である作用物質;
(f)イヌにおいてイヌアデノウイルス2型(CAV−2)に対する免疫応答を生じさせることが可能である作用物質;
(g)イヌにおいてイヌヘルペスウイルス(CHV)に対する免疫応答を生じさせることが可能である作用物質;及び
(h)イヌにおいてボルデテルラブロンチセプティカ(Bordetella bronchiseptica, B.bronchiseptica)に対する免疫応答を生じさせることが可能である作用物質のいずれか1以上を含む、ワクチン組成物。
【請求項10】
イヌにおいてCRCVに対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したCRCV、又はその免疫原性の断片、又は前記免疫原性の断片をコードする核酸を含む、請求項9に記載のワクチン組成物。
【請求項11】
CRCVの前記免疫原性の断片がスパイクタンパク質又は血液凝集素−エステラーゼ(HE)タンパク質、又は前記スパイクタンパク質若しくは前記HEタンパク質の免疫原性の部分を含む、請求項10に記載のワクチン組成物。
【請求項12】
イヌにおいてCPIVに対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したCPIV、又はその免疫原性の断片、又は前記免疫原性の断片をコードする核酸を含む、請求項9〜11の何れか1項に記載のワクチン組成物。
【請求項13】
イヌにおいてCAV−2に対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したCAV−2、又はその免疫原性の断片、又は前記免疫原性の断片をコードする核酸を含む、請求項9〜12の何れか1項に記載のワクチン組成物。
【請求項14】
イヌにおいてCHVに対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したCHV、又はその免疫原性の断片、又は前記免疫原性の断片をコードする核酸を含む、請求項9〜13の何れか1項に記載のワクチン組成物。
【請求項15】
イヌにおいてB.ブロンチセプティカ(B.bronchiseptica)に対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したB.ブロンチセプティカ、又はその免疫原性の断片、又は前記免疫原性の断片をコードする核酸を含む、請求項9〜14の何れか1項に記載のワクチン組成物。
【請求項16】
請求項1〜15の何れか1項に記載のワクチン組成物をイヌに投与することを含む、イヌの感染性呼吸器疾患(CIRD)に対してイヌに予防接種する方法。
【請求項17】
請求項1〜15の何れか1項に記載のワクチン組成物をイヌに投与することを含む、イヌにおいてCIRDを治療する方法。
【請求項18】
イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)及びクラミドフィラ(Chlamydophila)のいずれか1以上に対する免疫応答を刺激する方法であって、
(a)イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)に対する免疫応答を生じさせることが可能である作用物質;
(b)イヌにおいてM.サイノス(M.cynos)に対する免疫応答を生じさせることが可能である作用物質;及び
(c)イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である作用物質
のそれぞれ1以上をイヌに投与することを含む前記方法。
【請求項19】
請求項18に記載の方法であって、さらに
(d)イヌにおいてCRCVに対する免疫応答を生じさせることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じさせることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じさせることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じさせることが可能である作用物質;及び
(h)イヌにおいてB.ブロンチセプティカ(B.bronchiseptica)に対する免疫応答を生じさせることが可能である作用物質
のいずれか1以上をイヌに投与することを含む方法。
【請求項20】
イヌでのCIRDの予防又は治療のための薬物の調製における使用であって、
(a)イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)に対する免疫応答を生じさせることが可能である作用物質;
(b)イヌにおいてM.サイノス(M.cynos)に対する免疫応答を生じさせることが可能である作用物質;及び
(c)イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である作用物質
のいずれか1以上の使用。
【請求項21】
イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)及びクラミドフィラ(Chlamydophila)の前記それぞれ1以上に対する免疫応答を刺激するための薬物の調製における使用であって、
(a)イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)に対する免疫応答を生じさせることが可能である作用物質;
(b)イヌにおいてM.サイノス(M.cynos)に対する免疫応答を生じさせることが可能である作用物質;及び
(c)イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である作用物質
のいずれか1以上の使用。
【請求項22】
請求項20又は21に記載の使用であって、前記薬物がさらに
(d)イヌにおいてCRCVに対する免疫応答を生じさせることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じさせることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じさせることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じさせることが可能である作用物質;及び
(h)イヌにおいてB.ブロンチセプティカ(B.bronchiseptica)に対する免疫応答を生じさせることが可能である作用物質
のいずれか1以上を含む使用。
【請求項23】
医薬品での使用のための組成物であって、
(a)イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)に対する免疫応答を生じさせることが可能である作用物質;
(b)イヌにおいてM.サイノス(M.cynos)に対する免疫応答を生じさせることが可能である作用物質;及び
(c)イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である作用物質
のいずれか1以上を含む組成物。
【請求項24】
獣医用医薬品での使用のための、請求項23に記載の組成物。
【請求項25】
イヌの獣医用医薬品での使用のための、請求項24に記載の組成物。
【請求項26】
請求項23〜25の何れか1項に記載の組成物であって、さらに
(d)イヌにおいてCRCVに対する免疫応答を生じさせることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じさせることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じさせることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じさせることが可能である作用物質;及び
(h)イヌにおいてB.ブロンチセプティカ(B.bronchiseptica)に対する免疫応答を生じさせることが可能である作用物質
のいずれか1以上を含む組成物。
【請求項27】
ワクチン組成物のキットであって、
(a)イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)に対する免疫応答を生じさせることが可能である作用物質;
(b)イヌにおいてM.サイノス(M.cynos)に対する免疫応答を生じさせることが可能である作用物質;及び
(c)イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である作用物質
のいずれか1以上と、薬学上許容可能なキャリア、希釈剤又はアジュバントを含む、キット。
【請求項28】
請求項27に記載のキットであって、さらに
(d)イヌにおいてCRCVに対する免疫応答を生じさせることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じさせることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じさせることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じさせることが可能である作用物質;及び
(h)イヌにおいてB.ブロンチセプティカ(B.bronchiseptica)に対する免疫応答を生じさせることが可能である作用物質
のいずれか1以上を含むキット。
【請求項29】
S.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)のいずれか1以上に特異的に結合する抗体を作製する方法であって、動物においてS.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)及びクラミドフィラ(Chlamydophila)の1以上又はその免疫原性の断片に対する免疫応答を生じさせることと、前記動物から又はそれに由来する不死化した細胞から抗体を調製すること、を含む方法。
【請求項30】
S.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)のいずれか1以上に特異的に結合する抗体を入手する方法であって、S.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)及びクラミドフィラ(Chlamydophila)のそれぞれ1以上又はその免疫原性の断片を用いた抗体ディスプレイライブラリから抗体を選択することを含む方法。
【請求項31】
S.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)に特異的に結合する抗体。
【請求項32】
CIRDに対してイヌを受動免疫する方法であって、S.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)のそれぞれ1以上に特異的に結合する1以上の抗体をイヌに投与することを含む方法。
【請求項33】
イヌにおいてCIRDを治療する方法であって、S.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)のそれぞれ1以上に特異的に結合する1以上の抗体をイヌに投与することを含む方法。
【請求項34】
CRCV、CPIV、CAV−2、CHV及びB.ブロンチセプティカ(B.bronchiseptica)のいずれか1以上に特異的に結合する抗体をイヌに投与することをさらに含む、請求項32又は33に記載の方法。
【請求項35】
CIRDに対してイヌを受動免疫するための薬物の調製における、S.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)のいずれか1以上に特異的に結合する抗体の使用。
【請求項36】
イヌでCIRDを治療するための薬物の調製におけるS.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)のいずれか1以上に特異的に結合する1以上の抗体の使用。
【請求項37】
薬物がさらに、CRCV、CPIV、CAV−2、CHV及びB.ブロンチセプティカ(B.bronchiseptica)のいずれか1以上に特異的に結合する抗体を含む、請求項35又は36に記載の方法。
【請求項38】
S.ゾーエピデミクス(S.zooepidemicus)に特異的に結合する抗体、M.サイノス(M.cynos)に特異的に結合する抗体及びクラミドフィラ(Chlamydophila)に特異的に結合する抗体のいずれか2以上を含む組成物。
【請求項39】
CRCV、CPIV、CAV−2、CHV及びB.ブロンチセプティカ(B.bronchiseptica)のいずれか1以上に特異的に結合する抗体をさらに含む、請求項38に記載の組成物。
【請求項40】
ワクチン組成物であって、
(b)イヌにおいてM.サイノス(M.cynos)に対する免疫応答を生じさせることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じさせることが可能である作用物質
を含む、ワクチン組成物。
【請求項41】
請求項40に記載のワクチン組成物であって、さらに
(c)イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じさせることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じさせることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じさせることが可能である作用物質;及び
(h)イヌにおいてB.ブロンチセプティカ(B.bronchiseptica)に対する免疫応答を生じさせることが可能である作用物質
のいずれか1以上を含む、ワクチン組成物。
【請求項42】
さらに
(a)イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)に対する免疫応答を生じさせることが可能である作用物質をさらに含む、請求項40又は41に記載のワクチン組成物。
【請求項43】
イヌがCIRDに関係するクラミドフィラ(Chlamydophila)種に暴露されたことがあるかどうかを決定する方法であって
(a)イヌから好適な試料を入手すること;及び
(b)前記試料においてCIRDに関係するクラミドフィラ(Chlamydophila)種又はそれに対する抗体を同定することを含む方法。
【請求項44】
前記CIRDに関係するクラミドフィラ(Chlamydophila)種が、配列をRNAとして示す場合、配列番号1〜8のいずれかを含む23SrRNAを有する、請求項43に記載の方法。
【請求項45】
イヌがCIRDに感受性を有するか又は感受性であるかどうかを決定する方法であって、
(a)イヌから好適な試料を入手すること;及び
(b)試料中にてS.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)のいずれか1以上、又はそれらのいずれかに対する抗体を同定することを含む方法。
【請求項46】
抗体を使用することによりS.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)が同定される、請求項45に記載の方法。
【請求項47】
核酸を使用することによりS.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)が同定される、請求項45に記載の方法。
【請求項48】
S.ゾーエピデミクス(S.zooepidemicus)又はその抗原性の部分を使用して抗S.ゾーエピデミクス(S.zooepidemicus)抗体を検出する、請求項45に記載の方法。
【請求項49】
M.サイノス(M.cynos)又は又はその抗原性の部分を使用して抗M.サイノス(M.cynos)抗体を検出する、請求項45に記載の方法。
【請求項50】
クラミドフィラ(Chlamydophila)又は又はその抗原性の部分を使用して抗クラミドフィラ(Chlamydophila)抗体を検出する、請求項45に記載の方法。
【請求項51】
前記試料が、血清、唾液、気管洗浄液、気管支洗浄液又はその他の抗体を含有する試料である、請求項43〜49のいずれか1項に記載の方法。
【請求項52】
CIRDに関係する抗体を検出するための免疫吸収測定法であって、
(a)イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)に対する免疫応答を生じさせることが可能である作用物質;(b)イヌにおいてM.サイノス(M.cynos)に対する免疫応答を生じさせることが可能である作用物質;及び(c)イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である作用物質のいずれか1以上で被覆された固相と、
固相に結合させた抗体に結合する検出可能な標識抱合体、を含む測定法。
【請求項53】
固相が前記(a)、(b)及び(c)のいずれか2つ又は3つすべてを含有する、請求項52に記載の免疫吸収測定法。
【請求項54】
請求項52に記載の(a)、(b)及び(c)のいずれか2つ又は3つすべてによって被覆される固相基材。
【請求項1】
イヌに予防接種するためのワクチン組成物であって、
(a)イヌにおいてストレプトコックス亜種ゾーエピデミクス(Streptococcus equi亜種zooepidemicus, S.zooepidemicus)に対する免疫応答を生じさせることが可能である作用物質;
(b)イヌにおいてマイコプラズマサイノス(Mycoplasma cynos, M.cynos)に対する免疫応答を生じさせることが可能である作用物質;及び
(c)イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である作用物質のいずれか1以上を含む、ワクチン組成物。
【請求項2】
イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)に対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したS.ゾーエピデミクス、又はS.ゾーエピデミクスの免疫原性の断片若しくはその派生物、又は前記断片若しくは前記派生物をコードする核酸を含む、請求項1に記載のワクチン組成物。
【請求項3】
イヌにおいてM.サイノス(M.cynos)に対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したM.サイノス(M.cynos)、又はM.サイノス(M.cynos)の免疫原性の断片若しくはその派生物、又は前記断片若しくは前記派生物をコードする核酸を含む、請求項1または2に記載のワクチン組成物。
【請求項4】
イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したクラミドフィラアボルタス(Chlamydophila abortus)、又はクラミドフィラアボルタス(Chlamydophila abortus)の免疫原性の断片若しくはその派生物、又は前記断片若しくは前記派生物をコードする核酸を含む、請求項1〜3の何れか1項に記載のワクチン組成物。
【請求項5】
イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したクラミドフィラプシッタキ(Chlamydophila psittaci)、又はクラミドフィラプシッタキ(Chlamydophila psittaci)の免疫原性の断片若しくはその派生物、又は前記断片若しくは前記派生物をコードする核酸を含む、請求項1〜3の何れか1項に記載のワクチン組成物。
【請求項6】
イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したクラミドフィラフェリス(Chlamydophila felis)、又はクラミドフィラフェリス(Chlamydophila felis)の免疫原性の断片若しくはその派生物、又は前記断片若しくは前記派生物をコードする核酸を含む、請求項1〜3の何れか1項に記載のワクチン組成物。
【請求項7】
イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したクラミドフィラムリダルム(Chlamydia muridarum)、クラミドフィラペコルム(Chlamydia pecorum)、クラミドフィラプネウモニアエ(Chlamydia pneumoniae)、クラミディアスイス(Chlamydia suis)又はクラミディアトラコマティス(Chlamydia trachomatis)、又はそれらのの免疫原性の断片若しくはその派生物、又は前記断片若しくは前記派生物をコードする核酸を含む、請求項1〜3のいずれか1項に記載のワクチン組成物。
【請求項8】
請求項1〜7の何れか1項に記載のワクチン組成物と、薬学上許容可能なキャリア、希釈剤又はアジュバント。
【請求項9】
請求項1〜8の何れか1項に記載のワクチン組成物であって、さらに
(d)イヌにおいてイヌ呼吸器コロナウイルス(CRCV)に対する免疫応答を生じさせることが可能である作用物質;
(e)イヌにおいてイヌパラインフルエンザウイルス(CPIV)に対する免疫応答を生じさせることが可能である作用物質;
(f)イヌにおいてイヌアデノウイルス2型(CAV−2)に対する免疫応答を生じさせることが可能である作用物質;
(g)イヌにおいてイヌヘルペスウイルス(CHV)に対する免疫応答を生じさせることが可能である作用物質;及び
(h)イヌにおいてボルデテルラブロンチセプティカ(Bordetella bronchiseptica, B.bronchiseptica)に対する免疫応答を生じさせることが可能である作用物質のいずれか1以上を含む、ワクチン組成物。
【請求項10】
イヌにおいてCRCVに対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したCRCV、又はその免疫原性の断片、又は前記免疫原性の断片をコードする核酸を含む、請求項9に記載のワクチン組成物。
【請求項11】
CRCVの前記免疫原性の断片がスパイクタンパク質又は血液凝集素−エステラーゼ(HE)タンパク質、又は前記スパイクタンパク質若しくは前記HEタンパク質の免疫原性の部分を含む、請求項10に記載のワクチン組成物。
【請求項12】
イヌにおいてCPIVに対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したCPIV、又はその免疫原性の断片、又は前記免疫原性の断片をコードする核酸を含む、請求項9〜11の何れか1項に記載のワクチン組成物。
【請求項13】
イヌにおいてCAV−2に対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したCAV−2、又はその免疫原性の断片、又は前記免疫原性の断片をコードする核酸を含む、請求項9〜12の何れか1項に記載のワクチン組成物。
【請求項14】
イヌにおいてCHVに対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したCHV、又はその免疫原性の断片、又は前記免疫原性の断片をコードする核酸を含む、請求項9〜13の何れか1項に記載のワクチン組成物。
【請求項15】
イヌにおいてB.ブロンチセプティカ(B.bronchiseptica)に対する免疫応答を生じさせることが可能である前記作用物質が、不活化した又は弱毒化したB.ブロンチセプティカ、又はその免疫原性の断片、又は前記免疫原性の断片をコードする核酸を含む、請求項9〜14の何れか1項に記載のワクチン組成物。
【請求項16】
請求項1〜15の何れか1項に記載のワクチン組成物をイヌに投与することを含む、イヌの感染性呼吸器疾患(CIRD)に対してイヌに予防接種する方法。
【請求項17】
請求項1〜15の何れか1項に記載のワクチン組成物をイヌに投与することを含む、イヌにおいてCIRDを治療する方法。
【請求項18】
イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)及びクラミドフィラ(Chlamydophila)のいずれか1以上に対する免疫応答を刺激する方法であって、
(a)イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)に対する免疫応答を生じさせることが可能である作用物質;
(b)イヌにおいてM.サイノス(M.cynos)に対する免疫応答を生じさせることが可能である作用物質;及び
(c)イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である作用物質
のそれぞれ1以上をイヌに投与することを含む前記方法。
【請求項19】
請求項18に記載の方法であって、さらに
(d)イヌにおいてCRCVに対する免疫応答を生じさせることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じさせることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じさせることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じさせることが可能である作用物質;及び
(h)イヌにおいてB.ブロンチセプティカ(B.bronchiseptica)に対する免疫応答を生じさせることが可能である作用物質
のいずれか1以上をイヌに投与することを含む方法。
【請求項20】
イヌでのCIRDの予防又は治療のための薬物の調製における使用であって、
(a)イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)に対する免疫応答を生じさせることが可能である作用物質;
(b)イヌにおいてM.サイノス(M.cynos)に対する免疫応答を生じさせることが可能である作用物質;及び
(c)イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である作用物質
のいずれか1以上の使用。
【請求項21】
イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)及びクラミドフィラ(Chlamydophila)の前記それぞれ1以上に対する免疫応答を刺激するための薬物の調製における使用であって、
(a)イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)に対する免疫応答を生じさせることが可能である作用物質;
(b)イヌにおいてM.サイノス(M.cynos)に対する免疫応答を生じさせることが可能である作用物質;及び
(c)イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である作用物質
のいずれか1以上の使用。
【請求項22】
請求項20又は21に記載の使用であって、前記薬物がさらに
(d)イヌにおいてCRCVに対する免疫応答を生じさせることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じさせることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じさせることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じさせることが可能である作用物質;及び
(h)イヌにおいてB.ブロンチセプティカ(B.bronchiseptica)に対する免疫応答を生じさせることが可能である作用物質
のいずれか1以上を含む使用。
【請求項23】
医薬品での使用のための組成物であって、
(a)イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)に対する免疫応答を生じさせることが可能である作用物質;
(b)イヌにおいてM.サイノス(M.cynos)に対する免疫応答を生じさせることが可能である作用物質;及び
(c)イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である作用物質
のいずれか1以上を含む組成物。
【請求項24】
獣医用医薬品での使用のための、請求項23に記載の組成物。
【請求項25】
イヌの獣医用医薬品での使用のための、請求項24に記載の組成物。
【請求項26】
請求項23〜25の何れか1項に記載の組成物であって、さらに
(d)イヌにおいてCRCVに対する免疫応答を生じさせることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じさせることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じさせることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じさせることが可能である作用物質;及び
(h)イヌにおいてB.ブロンチセプティカ(B.bronchiseptica)に対する免疫応答を生じさせることが可能である作用物質
のいずれか1以上を含む組成物。
【請求項27】
ワクチン組成物のキットであって、
(a)イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)に対する免疫応答を生じさせることが可能である作用物質;
(b)イヌにおいてM.サイノス(M.cynos)に対する免疫応答を生じさせることが可能である作用物質;及び
(c)イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である作用物質
のいずれか1以上と、薬学上許容可能なキャリア、希釈剤又はアジュバントを含む、キット。
【請求項28】
請求項27に記載のキットであって、さらに
(d)イヌにおいてCRCVに対する免疫応答を生じさせることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じさせることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じさせることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じさせることが可能である作用物質;及び
(h)イヌにおいてB.ブロンチセプティカ(B.bronchiseptica)に対する免疫応答を生じさせることが可能である作用物質
のいずれか1以上を含むキット。
【請求項29】
S.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)のいずれか1以上に特異的に結合する抗体を作製する方法であって、動物においてS.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)及びクラミドフィラ(Chlamydophila)の1以上又はその免疫原性の断片に対する免疫応答を生じさせることと、前記動物から又はそれに由来する不死化した細胞から抗体を調製すること、を含む方法。
【請求項30】
S.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)のいずれか1以上に特異的に結合する抗体を入手する方法であって、S.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)及びクラミドフィラ(Chlamydophila)のそれぞれ1以上又はその免疫原性の断片を用いた抗体ディスプレイライブラリから抗体を選択することを含む方法。
【請求項31】
S.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)に特異的に結合する抗体。
【請求項32】
CIRDに対してイヌを受動免疫する方法であって、S.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)のそれぞれ1以上に特異的に結合する1以上の抗体をイヌに投与することを含む方法。
【請求項33】
イヌにおいてCIRDを治療する方法であって、S.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)のそれぞれ1以上に特異的に結合する1以上の抗体をイヌに投与することを含む方法。
【請求項34】
CRCV、CPIV、CAV−2、CHV及びB.ブロンチセプティカ(B.bronchiseptica)のいずれか1以上に特異的に結合する抗体をイヌに投与することをさらに含む、請求項32又は33に記載の方法。
【請求項35】
CIRDに対してイヌを受動免疫するための薬物の調製における、S.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)のいずれか1以上に特異的に結合する抗体の使用。
【請求項36】
イヌでCIRDを治療するための薬物の調製におけるS.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)のいずれか1以上に特異的に結合する1以上の抗体の使用。
【請求項37】
薬物がさらに、CRCV、CPIV、CAV−2、CHV及びB.ブロンチセプティカ(B.bronchiseptica)のいずれか1以上に特異的に結合する抗体を含む、請求項35又は36に記載の方法。
【請求項38】
S.ゾーエピデミクス(S.zooepidemicus)に特異的に結合する抗体、M.サイノス(M.cynos)に特異的に結合する抗体及びクラミドフィラ(Chlamydophila)に特異的に結合する抗体のいずれか2以上を含む組成物。
【請求項39】
CRCV、CPIV、CAV−2、CHV及びB.ブロンチセプティカ(B.bronchiseptica)のいずれか1以上に特異的に結合する抗体をさらに含む、請求項38に記載の組成物。
【請求項40】
ワクチン組成物であって、
(b)イヌにおいてM.サイノス(M.cynos)に対する免疫応答を生じさせることが可能である作用物質;及び
(d)イヌにおいてCRCVに対する免疫応答を生じさせることが可能である作用物質
を含む、ワクチン組成物。
【請求項41】
請求項40に記載のワクチン組成物であって、さらに
(c)イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である作用物質;
(e)イヌにおいてCPIVに対する免疫応答を生じさせることが可能である作用物質;
(f)イヌにおいてCAV−2に対する免疫応答を生じさせることが可能である作用物質;
(g)イヌにおいてCHVに対する免疫応答を生じさせることが可能である作用物質;及び
(h)イヌにおいてB.ブロンチセプティカ(B.bronchiseptica)に対する免疫応答を生じさせることが可能である作用物質
のいずれか1以上を含む、ワクチン組成物。
【請求項42】
さらに
(a)イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)に対する免疫応答を生じさせることが可能である作用物質をさらに含む、請求項40又は41に記載のワクチン組成物。
【請求項43】
イヌがCIRDに関係するクラミドフィラ(Chlamydophila)種に暴露されたことがあるかどうかを決定する方法であって
(a)イヌから好適な試料を入手すること;及び
(b)前記試料においてCIRDに関係するクラミドフィラ(Chlamydophila)種又はそれに対する抗体を同定することを含む方法。
【請求項44】
前記CIRDに関係するクラミドフィラ(Chlamydophila)種が、配列をRNAとして示す場合、配列番号1〜8のいずれかを含む23SrRNAを有する、請求項43に記載の方法。
【請求項45】
イヌがCIRDに感受性を有するか又は感受性であるかどうかを決定する方法であって、
(a)イヌから好適な試料を入手すること;及び
(b)試料中にてS.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)のいずれか1以上、又はそれらのいずれかに対する抗体を同定することを含む方法。
【請求項46】
抗体を使用することによりS.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)が同定される、請求項45に記載の方法。
【請求項47】
核酸を使用することによりS.ゾーエピデミクス(S.zooepidemicus)、M.サイノス(M.cynos)又はクラミドフィラ(Chlamydophila)が同定される、請求項45に記載の方法。
【請求項48】
S.ゾーエピデミクス(S.zooepidemicus)又はその抗原性の部分を使用して抗S.ゾーエピデミクス(S.zooepidemicus)抗体を検出する、請求項45に記載の方法。
【請求項49】
M.サイノス(M.cynos)又は又はその抗原性の部分を使用して抗M.サイノス(M.cynos)抗体を検出する、請求項45に記載の方法。
【請求項50】
クラミドフィラ(Chlamydophila)又は又はその抗原性の部分を使用して抗クラミドフィラ(Chlamydophila)抗体を検出する、請求項45に記載の方法。
【請求項51】
前記試料が、血清、唾液、気管洗浄液、気管支洗浄液又はその他の抗体を含有する試料である、請求項43〜49のいずれか1項に記載の方法。
【請求項52】
CIRDに関係する抗体を検出するための免疫吸収測定法であって、
(a)イヌにおいてS.ゾーエピデミクス(S.zooepidemicus)に対する免疫応答を生じさせることが可能である作用物質;(b)イヌにおいてM.サイノス(M.cynos)に対する免疫応答を生じさせることが可能である作用物質;及び(c)イヌにおいてクラミドフィラ(Chlamydophila)に対する免疫応答を生じさせることが可能である作用物質のいずれか1以上で被覆された固相と、
固相に結合させた抗体に結合する検出可能な標識抱合体、を含む測定法。
【請求項53】
固相が前記(a)、(b)及び(c)のいずれか2つ又は3つすべてを含有する、請求項52に記載の免疫吸収測定法。
【請求項54】
請求項52に記載の(a)、(b)及び(c)のいずれか2つ又は3つすべてによって被覆される固相基材。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公表番号】特表2007−526884(P2007−526884A)
【公表日】平成19年9月20日(2007.9.20)
【国際特許分類】
【出願番号】特願2006−518335(P2006−518335)
【出願日】平成16年7月1日(2004.7.1)
【国際出願番号】PCT/GB2004/002865
【国際公開番号】WO2005/002618
【国際公開日】平成17年1月13日(2005.1.13)
【出願人】(505033743)ザ ロイヤル ヴェテリネリ カレッジ (2)
【Fターム(参考)】
【公表日】平成19年9月20日(2007.9.20)
【国際特許分類】
【出願日】平成16年7月1日(2004.7.1)
【国際出願番号】PCT/GB2004/002865
【国際公開番号】WO2005/002618
【国際公開日】平成17年1月13日(2005.1.13)
【出願人】(505033743)ザ ロイヤル ヴェテリネリ カレッジ (2)
【Fターム(参考)】
[ Back to top ]

