イミダゾ[2,1−B][1,3]ベンゾチアゾール誘導体の調製方法
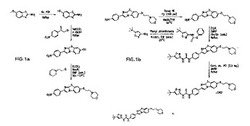
本明細書では、N−(5−tert−ブチル−イソオキサゾール−3−イル)−N’−{4−[7−(2−モルホリン−4−イル−エトキシ)イミダゾ[2,1−b][1,3]ベンゾチアゾール−2−イル]フェニル}尿素、又はその医薬上許容される塩、溶媒和物、水和物若しくは多形の調製方法を提供する。N−(5−tert−ブチル−イソオキサゾール−3−イル)−N’−{4−[7−(2−モルホリン−4−イル−エトキシ)イミダゾ[2,1−b][1,3]ベンゾチアゾール−2−イル]フェニル}尿素は、疾患又は状態(増殖性疾患、FLT−3媒介性疾患及び癌を含むが、これらに限定されない)を治療、予防及び/又は管理するのに有用である。N−(5−tert−ブチル−イソオキサゾール−3−イル)−N’−{4−[7−(2−モルホリン−4−イル−エトキシ)イミダゾ[2,1−b][1,3]ベンゾチアゾール−2−イル]フェニル}尿素は、以下の構造により表される:


Notice: Undefined index: DEJ in /mnt/www/gzt_disp.php on line 298
【特許請求の範囲】
【請求項1】
7−(2−モルホリン−4−イル−エトキシ)−2−(4−アミノフェニル)イミダゾ[2,1−b]ベンゾチアゾールを5−tert−ブチルイソオキサゾール−3−イルカルバメート誘導体(X):
【化1】

(式中、R2は、置換されていてもよい、アリール、ヘテロアリール、アルキル又はシクロアルキルである)と反応させて、N−(5−tert−ブチル−イソオキサゾール−3−イル)−N’−{4−[7−(2−モルホリン−4−イル−エトキシ)イミダゾ[2,1−b][1,3]ベンゾチアゾール−2−イル]フェニル}尿素を得る工程を含む、N−(5−tert−ブチル−イソオキサゾール−3−イル)−N’−{4−[7−(2−モルホリン−4−イル−エトキシ)イミダゾ[2,1−b][1,3]ベンゾチアゾール−2−イル]フェニル}尿素、又はその医薬上許容される塩、溶媒和物、水和物若しくは多形の調製方法。
【請求項2】
(E)3−アミノ−5−tert−ブチルイソオキサゾールを5−tert−ブチルイソオキサゾール−3−イルカルバメート誘導体(X)に変換する工程;及び
(F)7−(2−モルホリン−4−イル−エトキシ)−2−(4−アミノフェニル)イミダゾ[2,1−b]ベンゾチアゾールを5−tert−ブチルイソオキサゾール−3−イルカルバメート誘導体(X)と反応させて、N−(5−tert−ブチル−イソオキサゾール−3−イル)−N’−{4−[7−(2−モルホリン−4−イル−エトキシ)イミダゾ[2,1−b][1,3]ベンゾ−チアゾール−2−イル]フェニル}尿素を得る工程
を含む、請求項1記載の方法。
【請求項3】
アルコール溶媒中、少なくとも1つの炭酸塩又は炭酸水素塩の存在下で、2−アミノ−6−ヒドロキシベンゾチアゾールを2−置換4’−ニトロアセトフェノン誘導体(IV):
【化2】

(式中、X1は脱離基である)と反応させて、2−(4−ニトロフェニル)イミダゾ[2,1−b]ベンゾチアゾール−7−オールを得る工程を含む、2−(4−ニトロフェニル)イミダゾ[2,1−b]ベンゾチアゾール−7−オールの調製方法。
【請求項4】
(A)6−置換2−アミノ−ベンゾチアゾール誘導体(II):
【化3】

(式中、R1はフェノール性ヒドロキシル保護基である)を脱保護して、2−アミノ−6−ヒドロキシベンゾチアゾールを得る工程;
(B)2−アミノ−6−ヒドロキシベンゾチアゾールを2−置換4’−ニトロアセトフェノン誘導体(IV):
【化4】

(式中、X1は脱離基である)と反応させて、2−(4−ニトロフェニル)イミダゾ[2,1−b]ベンゾチアゾール−7−オールを得る工程;
(C)2−(4−ニトロフェニル)イミダゾ[2,1−b]ベンゾチアゾール−7−オールを4−(2−置換−エチル)モルホリン誘導体(VI):
【化5】

(式中、X2は脱離基である)と反応させて、7−(2−モルホリン−4−イル−エトキシ)−2−(4−ニトロフェニル)イミダゾ[2,1−b]ベンゾチアゾールを得る工程;
(D)7−(2−モルホリン−4−イル−エトキシ)−2−(4−ニトロフェニル)イミダゾ[2,1−b]ベンゾチアゾールを還元して、7−(2−モルホリン−4−イル−エトキシ)−2−(4−アミノフェニル)イミダゾ[2,1−b]ベンゾチアゾールを得る工程;
(E)3−アミノ−5−tert−ブチルイソオキサゾールを5−tert−ブチルイソオキサゾール−3−イルカルバメート誘導体(X)に変換する工程;及び
(F)7−(2−モルホリン−4−イル−エトキシ)−2−(4−アミノフェニル)イミダゾ[2,1−b]ベンゾチアゾールを5−tert−ブチルイソオキサゾール−3−イルカルバメート誘導体(X)と反応させて、N−(5−tert−ブチル−イソオキサゾール−3−イル)−N’−{4−[7−(2−モルホリン−4−イル−エトキシ)イミダゾ[2,1−b][1,3]ベンゾ−チアゾール−2−イル]フェニル}尿素を得る工程
を含む、請求項1記載の方法。
【請求項5】
(G)遊離塩基のN−(5−tert−ブチル−イソオキサゾール−3−イル)−N’−{4−[7−(2−モルホリン−4−イル−エトキシ)イミダゾ[2,1−b][1,3]ベンゾ−チアゾール−2−イル]フェニル}尿素を、N−(5−tert−ブチル−イソオキサゾール−3−イル)−N’−{4−[7−(2−モルホリン−4−イル−エトキシ)イミダゾ[2,1−b][1,3]ベンゾ−チアゾール−2−イル]フェニル}尿素の酸付加塩に変換する工程
をさらに含む、請求項4記載の方法。
【請求項6】
R1が置換されていてもよいC1−C6アルキルである、請求項4記載の方法。
【請求項7】
R1がメチルである、請求項6記載の方法。
【請求項8】
X1がブロモである、請求項4記載の方法。
【請求項9】
X2がクロロである、請求項4記載の方法。
【請求項10】
R2がアリール又はヘテロアリールであり、それぞれが、1つ以上のハロ、ニトロ、シアノ、アルキル又はアルコキシルで置換されていてもよい、請求項4記載の方法。
【請求項11】
R2がフェニルである、請求項10記載の方法。
【請求項12】
工程Aの反応が水性臭化水素酸の存在下で実施される、請求項4記載の方法。
【請求項13】
工程Aの反応が約105℃と約110℃の間の温度で実施される、請求項4記載の方法。
【請求項14】
工程Bの反応が炭酸塩又は炭酸水素塩の存在下で実施される、請求項4記載の方法。
【請求項15】
炭酸塩又は炭酸水素塩が炭酸水素ナトリウムである、請求項14記載の方法。
【請求項16】
工程Bの反応がアルコール溶媒中で実施される、請求項4記載の方法。
【請求項17】
工程Bの反応がn−ブタノール中で実施される、請求項16記載の方法。
【請求項18】
工程Bの反応が約110℃と約115℃の間の温度で実施される、請求項4記載の方法。
【請求項19】
工程Cの反応が炭酸塩又は炭酸水素塩の存在下で実施される、請求項4記載の方法。
【請求項20】
炭酸塩又は炭酸水素塩が炭酸カリウムである、請求項19記載の方法。
【請求項21】
工程Cの反応が相間移動試薬の存在下で実施される、請求項4記載の方法。
【請求項22】
相間移動試薬がテトラブチルアンモニウムヨージドである、請求項21記載の方法。
【請求項23】
工程Cの反応が炭酸カリウム及びテトラブチルアンモニウムヨージドの存在下で実施される、請求項4記載の方法。
【請求項24】
工程Cの反応がN,N−ジメチルホルムアミド中で実施される、請求項4記載の方法。
【請求項25】
工程Cの反応が約90℃と約110℃の間の温度で実施される、請求項4記載の方法。
【請求項26】
工程Dの反応が還元剤又は触媒の存在下で実施される、請求項4記載の方法。
【請求項27】
還元剤又は触媒がラネーニッケルである、請求項26記載の方法。
【請求項28】
工程Dの反応が水素雰囲気下で実施される、請求項4記載の方法。
【請求項29】
水素が約200psiと約300psiの間の圧力である、請求項28記載の方法。
【請求項30】
水素圧が約150psiである、請求項29記載の方法。
【請求項31】
工程Dの反応が極性溶媒中で実施される、請求項4記載の方法。
【請求項32】
極性溶媒がメタノールとテトラヒドロフランとの混合物である、請求項31記載の方法。
【請求項33】
工程Dの反応が約50℃の温度で実施される、請求項4記載の方法。
【請求項34】
工程Eの反応がハロホルメート試薬の存在下で実施される、請求項4記載の方法。
【請求項35】
ハロホルメート試薬がフェニルクロロホルメートである、請求項34記載の方法。
【請求項36】
工程Eの反応が塩基の存在下で実施される、請求項4記載の方法。
【請求項37】
塩基が炭酸塩又は炭酸水素塩である、請求項36記載の方法。
【請求項38】
塩基が炭酸カリウムである、請求項37記載の方法。
【請求項39】
工程Eの反応が極性溶媒中で実施される、請求項4記載の方法。
【請求項40】
極性溶媒がテトラヒドロフランである、請求項39記載の方法。
【請求項41】
工程Eの反応が約20℃の温度で実施される、請求項4記載の方法。
【請求項42】
工程Fの反応が塩基の存在下で実施される、請求項4記載の方法。
【請求項43】
塩基がトリエチルアミンである、請求項42記載の方法。
【請求項44】
工程Fの反応が触媒の存在下で実施される、請求項4記載の方法。
【請求項45】
触媒が4−ジメチルアミノピリジンである、請求項44記載の方法。
【請求項46】
工程Fの反応が非極性溶媒中で実施される、請求項4記載の方法。
【請求項47】
非極性溶媒がジクロロメタンである、請求項46記載の方法。
【請求項48】
工程Fの反応が約40℃の温度で実施される、請求項4記載の方法。
【請求項49】
工程Fの反応で使用される、7−(2−モルホリン−4−イル−エトキシ)−2−(4−アミノフェニル)イミダゾ[2,1−b]ベンゾチアゾールに対する5−tert−ブチルイソオキサゾール−3−イルカルバメート誘導体のモル比率が、約1.0と約1.5の間である、請求項4記載の方法。
【請求項50】
工程Gの反応が塩酸の存在下で実施され、工程Gの酸付加塩が塩酸塩である、請求項4記載の方法。
【請求項51】
工程Gの酸付加塩が二塩酸塩である、請求項50記載の方法。
【請求項52】
工程A、B、C、D、E、F及びGの各反応の生成物が濾過又は遠心分離により単離される、請求項4記載の方法。
【請求項53】
工程A、B、C、D、E、F及びGの各反応の単離生成物の収率が約80%超である、請求項52記載の方法。
【請求項54】
工程A、B、C、D、E、F及びGの各反応の単離生成物の純度が約97%超である、請求項52記載の方法。
【請求項55】
2−(4−ニトロフェニル)イミダゾ[2,1−b]ベンゾチアゾール−7−オールを4−(2−置換−エチル)モルホリン誘導体(VI):
【化6】

(式中、X2は脱離基である)と反応させて、7−(2−モルホリン−4−イル−エトキシ)−2−(4−ニトロフェニル)イミダゾ[2,1−b]ベンゾチアゾールを得る工程をさらに含む、請求項3記載の方法。
【請求項56】
7−(2−モルホリン−4−イル−エトキシ)−2−(4−ニトロフェニル)イミダゾ[2,1−b]ベンゾチアゾールを還元して、7−(2−モルホリン−4−イル−エトキシ)−2−(4−アミノフェニル)イミダゾ[2,1−b]ベンゾチアゾールを得る工程をさらに含む、請求項55記載の方法。
【請求項1】
7−(2−モルホリン−4−イル−エトキシ)−2−(4−アミノフェニル)イミダゾ[2,1−b]ベンゾチアゾールを5−tert−ブチルイソオキサゾール−3−イルカルバメート誘導体(X):
【化1】

(式中、R2は、置換されていてもよい、アリール、ヘテロアリール、アルキル又はシクロアルキルである)と反応させて、N−(5−tert−ブチル−イソオキサゾール−3−イル)−N’−{4−[7−(2−モルホリン−4−イル−エトキシ)イミダゾ[2,1−b][1,3]ベンゾチアゾール−2−イル]フェニル}尿素を得る工程を含む、N−(5−tert−ブチル−イソオキサゾール−3−イル)−N’−{4−[7−(2−モルホリン−4−イル−エトキシ)イミダゾ[2,1−b][1,3]ベンゾチアゾール−2−イル]フェニル}尿素、又はその医薬上許容される塩、溶媒和物、水和物若しくは多形の調製方法。
【請求項2】
(E)3−アミノ−5−tert−ブチルイソオキサゾールを5−tert−ブチルイソオキサゾール−3−イルカルバメート誘導体(X)に変換する工程;及び
(F)7−(2−モルホリン−4−イル−エトキシ)−2−(4−アミノフェニル)イミダゾ[2,1−b]ベンゾチアゾールを5−tert−ブチルイソオキサゾール−3−イルカルバメート誘導体(X)と反応させて、N−(5−tert−ブチル−イソオキサゾール−3−イル)−N’−{4−[7−(2−モルホリン−4−イル−エトキシ)イミダゾ[2,1−b][1,3]ベンゾ−チアゾール−2−イル]フェニル}尿素を得る工程
を含む、請求項1記載の方法。
【請求項3】
アルコール溶媒中、少なくとも1つの炭酸塩又は炭酸水素塩の存在下で、2−アミノ−6−ヒドロキシベンゾチアゾールを2−置換4’−ニトロアセトフェノン誘導体(IV):
【化2】

(式中、X1は脱離基である)と反応させて、2−(4−ニトロフェニル)イミダゾ[2,1−b]ベンゾチアゾール−7−オールを得る工程を含む、2−(4−ニトロフェニル)イミダゾ[2,1−b]ベンゾチアゾール−7−オールの調製方法。
【請求項4】
(A)6−置換2−アミノ−ベンゾチアゾール誘導体(II):
【化3】

(式中、R1はフェノール性ヒドロキシル保護基である)を脱保護して、2−アミノ−6−ヒドロキシベンゾチアゾールを得る工程;
(B)2−アミノ−6−ヒドロキシベンゾチアゾールを2−置換4’−ニトロアセトフェノン誘導体(IV):
【化4】

(式中、X1は脱離基である)と反応させて、2−(4−ニトロフェニル)イミダゾ[2,1−b]ベンゾチアゾール−7−オールを得る工程;
(C)2−(4−ニトロフェニル)イミダゾ[2,1−b]ベンゾチアゾール−7−オールを4−(2−置換−エチル)モルホリン誘導体(VI):
【化5】

(式中、X2は脱離基である)と反応させて、7−(2−モルホリン−4−イル−エトキシ)−2−(4−ニトロフェニル)イミダゾ[2,1−b]ベンゾチアゾールを得る工程;
(D)7−(2−モルホリン−4−イル−エトキシ)−2−(4−ニトロフェニル)イミダゾ[2,1−b]ベンゾチアゾールを還元して、7−(2−モルホリン−4−イル−エトキシ)−2−(4−アミノフェニル)イミダゾ[2,1−b]ベンゾチアゾールを得る工程;
(E)3−アミノ−5−tert−ブチルイソオキサゾールを5−tert−ブチルイソオキサゾール−3−イルカルバメート誘導体(X)に変換する工程;及び
(F)7−(2−モルホリン−4−イル−エトキシ)−2−(4−アミノフェニル)イミダゾ[2,1−b]ベンゾチアゾールを5−tert−ブチルイソオキサゾール−3−イルカルバメート誘導体(X)と反応させて、N−(5−tert−ブチル−イソオキサゾール−3−イル)−N’−{4−[7−(2−モルホリン−4−イル−エトキシ)イミダゾ[2,1−b][1,3]ベンゾ−チアゾール−2−イル]フェニル}尿素を得る工程
を含む、請求項1記載の方法。
【請求項5】
(G)遊離塩基のN−(5−tert−ブチル−イソオキサゾール−3−イル)−N’−{4−[7−(2−モルホリン−4−イル−エトキシ)イミダゾ[2,1−b][1,3]ベンゾ−チアゾール−2−イル]フェニル}尿素を、N−(5−tert−ブチル−イソオキサゾール−3−イル)−N’−{4−[7−(2−モルホリン−4−イル−エトキシ)イミダゾ[2,1−b][1,3]ベンゾ−チアゾール−2−イル]フェニル}尿素の酸付加塩に変換する工程
をさらに含む、請求項4記載の方法。
【請求項6】
R1が置換されていてもよいC1−C6アルキルである、請求項4記載の方法。
【請求項7】
R1がメチルである、請求項6記載の方法。
【請求項8】
X1がブロモである、請求項4記載の方法。
【請求項9】
X2がクロロである、請求項4記載の方法。
【請求項10】
R2がアリール又はヘテロアリールであり、それぞれが、1つ以上のハロ、ニトロ、シアノ、アルキル又はアルコキシルで置換されていてもよい、請求項4記載の方法。
【請求項11】
R2がフェニルである、請求項10記載の方法。
【請求項12】
工程Aの反応が水性臭化水素酸の存在下で実施される、請求項4記載の方法。
【請求項13】
工程Aの反応が約105℃と約110℃の間の温度で実施される、請求項4記載の方法。
【請求項14】
工程Bの反応が炭酸塩又は炭酸水素塩の存在下で実施される、請求項4記載の方法。
【請求項15】
炭酸塩又は炭酸水素塩が炭酸水素ナトリウムである、請求項14記載の方法。
【請求項16】
工程Bの反応がアルコール溶媒中で実施される、請求項4記載の方法。
【請求項17】
工程Bの反応がn−ブタノール中で実施される、請求項16記載の方法。
【請求項18】
工程Bの反応が約110℃と約115℃の間の温度で実施される、請求項4記載の方法。
【請求項19】
工程Cの反応が炭酸塩又は炭酸水素塩の存在下で実施される、請求項4記載の方法。
【請求項20】
炭酸塩又は炭酸水素塩が炭酸カリウムである、請求項19記載の方法。
【請求項21】
工程Cの反応が相間移動試薬の存在下で実施される、請求項4記載の方法。
【請求項22】
相間移動試薬がテトラブチルアンモニウムヨージドである、請求項21記載の方法。
【請求項23】
工程Cの反応が炭酸カリウム及びテトラブチルアンモニウムヨージドの存在下で実施される、請求項4記載の方法。
【請求項24】
工程Cの反応がN,N−ジメチルホルムアミド中で実施される、請求項4記載の方法。
【請求項25】
工程Cの反応が約90℃と約110℃の間の温度で実施される、請求項4記載の方法。
【請求項26】
工程Dの反応が還元剤又は触媒の存在下で実施される、請求項4記載の方法。
【請求項27】
還元剤又は触媒がラネーニッケルである、請求項26記載の方法。
【請求項28】
工程Dの反応が水素雰囲気下で実施される、請求項4記載の方法。
【請求項29】
水素が約200psiと約300psiの間の圧力である、請求項28記載の方法。
【請求項30】
水素圧が約150psiである、請求項29記載の方法。
【請求項31】
工程Dの反応が極性溶媒中で実施される、請求項4記載の方法。
【請求項32】
極性溶媒がメタノールとテトラヒドロフランとの混合物である、請求項31記載の方法。
【請求項33】
工程Dの反応が約50℃の温度で実施される、請求項4記載の方法。
【請求項34】
工程Eの反応がハロホルメート試薬の存在下で実施される、請求項4記載の方法。
【請求項35】
ハロホルメート試薬がフェニルクロロホルメートである、請求項34記載の方法。
【請求項36】
工程Eの反応が塩基の存在下で実施される、請求項4記載の方法。
【請求項37】
塩基が炭酸塩又は炭酸水素塩である、請求項36記載の方法。
【請求項38】
塩基が炭酸カリウムである、請求項37記載の方法。
【請求項39】
工程Eの反応が極性溶媒中で実施される、請求項4記載の方法。
【請求項40】
極性溶媒がテトラヒドロフランである、請求項39記載の方法。
【請求項41】
工程Eの反応が約20℃の温度で実施される、請求項4記載の方法。
【請求項42】
工程Fの反応が塩基の存在下で実施される、請求項4記載の方法。
【請求項43】
塩基がトリエチルアミンである、請求項42記載の方法。
【請求項44】
工程Fの反応が触媒の存在下で実施される、請求項4記載の方法。
【請求項45】
触媒が4−ジメチルアミノピリジンである、請求項44記載の方法。
【請求項46】
工程Fの反応が非極性溶媒中で実施される、請求項4記載の方法。
【請求項47】
非極性溶媒がジクロロメタンである、請求項46記載の方法。
【請求項48】
工程Fの反応が約40℃の温度で実施される、請求項4記載の方法。
【請求項49】
工程Fの反応で使用される、7−(2−モルホリン−4−イル−エトキシ)−2−(4−アミノフェニル)イミダゾ[2,1−b]ベンゾチアゾールに対する5−tert−ブチルイソオキサゾール−3−イルカルバメート誘導体のモル比率が、約1.0と約1.5の間である、請求項4記載の方法。
【請求項50】
工程Gの反応が塩酸の存在下で実施され、工程Gの酸付加塩が塩酸塩である、請求項4記載の方法。
【請求項51】
工程Gの酸付加塩が二塩酸塩である、請求項50記載の方法。
【請求項52】
工程A、B、C、D、E、F及びGの各反応の生成物が濾過又は遠心分離により単離される、請求項4記載の方法。
【請求項53】
工程A、B、C、D、E、F及びGの各反応の単離生成物の収率が約80%超である、請求項52記載の方法。
【請求項54】
工程A、B、C、D、E、F及びGの各反応の単離生成物の純度が約97%超である、請求項52記載の方法。
【請求項55】
2−(4−ニトロフェニル)イミダゾ[2,1−b]ベンゾチアゾール−7−オールを4−(2−置換−エチル)モルホリン誘導体(VI):
【化6】

(式中、X2は脱離基である)と反応させて、7−(2−モルホリン−4−イル−エトキシ)−2−(4−ニトロフェニル)イミダゾ[2,1−b]ベンゾチアゾールを得る工程をさらに含む、請求項3記載の方法。
【請求項56】
7−(2−モルホリン−4−イル−エトキシ)−2−(4−ニトロフェニル)イミダゾ[2,1−b]ベンゾチアゾールを還元して、7−(2−モルホリン−4−イル−エトキシ)−2−(4−アミノフェニル)イミダゾ[2,1−b]ベンゾチアゾールを得る工程をさらに含む、請求項55記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【公表番号】特表2013−510162(P2013−510162A)
【公表日】平成25年3月21日(2013.3.21)
【国際特許分類】
【出願番号】特願2012−537984(P2012−537984)
【出願日】平成22年11月4日(2010.11.4)
【国際出願番号】PCT/US2010/055399
【国際公開番号】WO2011/056939
【国際公開日】平成23年5月12日(2011.5.12)
【出願人】(508278239)
【Fターム(参考)】
【公表日】平成25年3月21日(2013.3.21)
【国際特許分類】
【出願日】平成22年11月4日(2010.11.4)
【国際出願番号】PCT/US2010/055399
【国際公開番号】WO2011/056939
【国際公開日】平成23年5月12日(2011.5.12)
【出願人】(508278239)

【Fターム(参考)】
[ Back to top ]

