イムノクロマトグラフィー用試験キット、これを用いた検出方法及びこれに用いられる標識試薬
【課題】蛍光イムノクロマト試験に特有の課題の解決を目的とし、コントロールラインの蛍光発光によるテストラインの蛍光の視認性の低下を抑制・防止しうるイムノクロマトグラフィー用試験キットを提供する。
【解決手段】イムノクロマトグラフィー用の平面試験片と、蛍光微粒子と、吸光微粒子とを組み合わせて具備する試験キットであって、前記平面試験片は試験領域と参照領域を有し、前記蛍光微粒子には標的物質に対する結合性が付与され、該標的物質は前記試験領域の試験用捕捉性物質との結合性を有し、一方、前記吸光微粒子は前記参照領域の参照用捕捉性物質に対する結合性が付与されたイムノクロマトグラフィー用試験キット。
【解決手段】イムノクロマトグラフィー用の平面試験片と、蛍光微粒子と、吸光微粒子とを組み合わせて具備する試験キットであって、前記平面試験片は試験領域と参照領域を有し、前記蛍光微粒子には標的物質に対する結合性が付与され、該標的物質は前記試験領域の試験用捕捉性物質との結合性を有し、一方、前記吸光微粒子は前記参照領域の参照用捕捉性物質に対する結合性が付与されたイムノクロマトグラフィー用試験キット。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、イムノクロマトグラフィー用試験キット、これを用いた検出方法及びこれに用いられる標識試薬に関する。
【背景技術】
【0002】
生体中の抗原などの微量物質を検出する手法としてラテラルフロー型のイムノクロマトグラフィーによる検査法がある。この方法では、検体液に含まれる被検物質を標識粒子に捕捉させ、多孔質支持体を毛細管現象により移動させる。そして、多孔質支持体に例えばライン状に固定された捕捉物質と接触させることによって、前記被検物質を濃縮し、捕捉物質が固定されたラインを発色させる。この発色によって被検物質の有無を判定することができる。かかるイムノクロマトグラフィー法の特徴として下記の3点が挙げられる。
(1)判定までに要する時間が短く迅速な検査が可能である。
(2)検体を滴下するだけで測定でき操作が簡便である。
(3)特別な検出装置を必要とせず判定が容易である。
これらの特徴を利用して、イムノクロマト法は妊娠検査薬やインフルエンザ検査薬に用いられており、新たなPOCT(Point Of Care Testing)の手法として利用されている。また、食品検査においても、例えば食物アレルゲンの検査試薬等として広く利用され益々注目を集めている。
【0003】
ここで、POCTとは、患者にできる限り近い場所で診断するための検査をいう。従来は採取した血液、尿、患部組織などの検体は、病院の中央検査室や専門の検査センターに送られデータを出すので、診断の確定までに時間がかかっていた。POCTによれば、瞬時に提供される検査情報をもとに迅速かつ的確な治療が可能となる。このことから、病院での緊急検査や手術中の検査が可能になり、とりわけ医療現場でのニーズが高い。
【0004】
本出願人は、上記のような要求に鑑み、メンブレンに適用する試薬について研究開発を行い、蛍光シリカ微粒子を用いる技術を開発した(特許文献1等参照)。これにより、従来の生体物質や生体細胞、あるいは金コロイド粒子を試薬に用いたものと比べ、安価かつ格段に安定した測定及び検出を可能とした。また、検出感度の向上や定量化といった要望にもより的確に応えることができ、イムノクロマトグラフィーの利用領域の拡大に大いに貢献するものである。
【0005】
また、本出願人は蛍光シリカ微粒子と吸光シリカ微粒子とを組み合わせたコンジュゲートパッドを提案した(特許文献2参照)。これにより、蛍光照射しない状態でも一応の検出ができ、さらに必要に応じて蛍光検出をすることで検出精度の向上や定量測定を併せて行うことを可能とした。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】国際公開第2008/018566号パンフレット
【特許文献2】特開2010−014631号公報
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明者らは、さらに上記蛍光微粒子を用いたイムノクロマトグラフィー(以下、蛍光イムノクロマト試験ということがある)について研究を継続したところ、テストラインよりもコントロールラインにより多くの粒子が吸着するため、前者よりも後者の発光強度が強くなってしまう傾向があることが分かってきた。そうすると、高い感度で陽性・陰性判定を行う場合、発光強度の強いコントロールラインの発光によって、発光強度がより微弱なテストラインの視認性が落ちてしまう。
すなわち、本発明は、蛍光イムノクロマト試験に特有の課題の解決を目的とし、コントロールラインの蛍光発光によるテストラインの蛍光の視認性の低下を抑制・防止しうるイムノクロマトグラフィー用試験キット、これを用いた検出方法及びこれに用いられる標識試薬の提供を目的とする。
【課題を解決するための手段】
【0008】
上記の課題は、下記の手段により解決された。
(1)イムノクロマトグラフィー用の平面試験片と、蛍光微粒子と、吸光微粒子とを組み合わせて具備する試験キットであって、
前記平面試験片は試験領域と参照領域を有し、
前記蛍光微粒子には標的物質に対する結合性が付与され、該標的物質は前記試験領域の試験用捕捉性物質との結合性を有し、一方、前記吸光微粒子は前記参照領域の参照用捕捉性物質に対する結合性が付与されたイムノクロマトグラフィー用試験キット。
(2)前記蛍光微粒子に、標的物質に対して結合性を有する試験用結合性物質が導入されている(1)に記載のキット。
(3)前記吸光微粒子に、前記参照用捕捉性物質に対して結合性を有する参照用結合性物質が導入されている(1)又は(2)に記載のキット。
(4)前記蛍光微粒子及び吸光微粒子の一方又は両方がシリカ微粒子からなる(1)〜(3)のいずれかに記載のキット。
(5)前記蛍光微粒子及び吸光微粒子の一方又は両方が平均粒径20〜1000nmである(1)〜(4)のいずれかに記載のキット。
(6)イムノクロマトグラフィー用の平面試験片と、標的物質に対する結合性が付与された蛍光微粒子と、前記試験片の参照領域にある参照用捕捉性物質に対する結合性が付与された吸光微粒子とを準備し、
前記蛍光微粒子と、前記吸光微粒子とをあらかじめ前記試験片に付与しておき、前記試験片に標的物質を付与して前記蛍光微粒子と結合させ、該蛍光微粒子を平面試験片内で移行させ、その試験領域にある試験用捕捉性物質と前記蛍光微粒子とを前記標的物質を介して結合させ、他方、前記吸光微粒子を前記試験片の参照領域にある参照用捕捉性物質と結合させ、
前記試験領域の蛍光微粒子からの蛍光発光と、前記参照領域の吸光微粒子の吸光状態とから前記標的物質の検出を行うイムノクロマトグラフィーによる検出方法。
(7)前記蛍光微粒子及び吸光微粒子の一方又は両方がシリカ微粒子からなる(6)に記載の検出方法。
(8)前記蛍光微粒子及び吸光微粒子の一方又は両方が平均粒径20〜1000nmである(6)又は(7)に記載の検出方法。
(9)蛍光微粒子と吸光微粒子とを含む、イムノクロマトグラフィーに用いられる標識試薬であって、
前記蛍光微粒子には標的物質に対する結合性が付与され、該標的物質は試験片の試験領域の試験用捕捉性物質との結合性を有し、一方、前記吸光微粒子には試験片の参照領域の参照用捕捉性物質に対する結合性が付与された標識試薬。
(10)前記蛍光微粒子に、標的物質に対して結合性を有する試験用結合性物質が導入されている(9)に記載の標識試薬。
(11)前記吸光微粒子に、前記参照用捕捉性物質に対して結合性を有する参照用結合性物質が導入されている(9)又は(10)に記載の標識試薬。
(12)前記蛍光微粒子及び吸光微粒子の一方又は両方がシリカ微粒子からなる(9)〜(11)のいずれか1項に記載の標識試薬。
(13)前記蛍光微粒子及び吸光微粒子の一方又は両方が平均粒径20〜1000nmである(9)〜(12)のいずれか1項に記載の標識試薬。
【発明の効果】
【0009】
本発明のイムノクロマトグラフィー用試験キット、これを用いた検出方法及びこれに用いられる標識試薬によれば、コントロールラインの蛍光発光によるテストラインの蛍光の視認性の低下を抑制・防止しうる。また、蛍光微粒子と吸光微粒子とを組み合わせて適用したため、使用済みであることを目視で確認することができる。
【図面の簡単な説明】
【0010】
【図1】本発明の好ましい実施形態としての長尺試験体を模式的に示す分解斜視図である。
【図2】本発明の好ましい実施形態としての標識粒子の試験領域ないし参照領域での固定状態を模式的に示す説明図である。
【発明を実施するための最良の形態】
【0011】
本発明のイムノクロマトグラフィー用試験キットは、参照領域及び試験領域を有するイムノクロマトグラフィー用の平面試験片と、特定の性質が付与された蛍光微粒子と、特定の性質が付与された吸光微粒子とを組み合わせて具備する。以下、本発明の構成についてその好ましい実施形態を中心に詳述する。
[標識試薬]
(蛍光微粒子)
本発明において好ましい実施形態の蛍光微粒子は標識試薬に含有され、標的物質(検体)を認識する結合性物質で表面修飾されている。
【0012】
・平均粒径
前記標識粒子の平均粒径は、特に限定されないが、20〜1000nmであることが好ましく、20〜600nmであることがより好ましく、60〜300nmであることがさらに好ましい。粒径が小さすぎると、検出感度が低下し、粒径が大きすぎると、イムノクロマト法に用いられる多孔質支持体(メンブレン)の目詰まりの原因となる。
【0013】
本発明において、前記平均粒径は、透過型電子顕微鏡(TEM)、走査型電子顕微鏡(SEM)等の画像から無作為に選択した50個の標識粒子の合計の投影面積から標識粒子の占有面積を画像処理装置によって求め、この合計の占有面積を、選択した標識粒子の個数(50個)で割った値に相当する円の直径の平均値(平均円相当直径)を求めたものである。粒度分布の変動係数いわゆるCV値は特に制限はないが、15%以下が好ましく、10%以下がより好ましく、8%以下が特に好ましい。
【0014】
・微粒子の構成材料
蛍光微粒子の材質に特に制限はないが、例えば、シリカ粒子、ラテックス粒子等を用いることができる。本実施形態の蛍光微粒子は、上述のように検体の標的物質を認識する物質で表面修飾されていることが好ましい。表面修飾の方法は通常この種の材料に適用されるものを適宜利用すればよい。
【0015】
・シリカ粒子
本発明において、蛍光微粒子はシリカ粒子からなることが好ましい。シリカ粒子としては特に制限はなく、任意のいかなる調製方法によって得られたシリカ粒子であってよい。例えば、国際公開2007/074722A1公報に記載された蛍光色素化合物含有コロイドシリカ粒子の調製方法に準じて得られた、標識物質を含有するシリカ粒子を用いることが特に好ましい。具体的には、前記標識物質を含有するシリカ粒子は、前記標識物質とシラン化合物とを反応させ、共有結合、イオン結合その他の化学的に結合もしくは吸着させて得られた生成物に1又は2種以上のシラン化合物を重合させることにより調製することができる。前記標識物質を含有するシリカ粒子の好ましい調製方法の態様としては、N−ヒドロキシスクシンイミド(NHS)エステル基、マレイミド基、イソシアナート基、イソチオシアナート基、アルデヒド基、パラニトロフェニル基、ジエトキシメチル基、エポキシ基、シアノ基等の活性基を有する前記標識物質と、それら活性基と対応して反応する置換基(例えば、アミノ基、水酸基、チオール基)を有するシランカップリング剤とを反応させ、共有結合させて得られた生成物に1又は2種以上のシラン化合物を重合させることにより調製することができる。
【0016】
前記活性基を有する標識物質(蛍光物質)の具体例として、5−(及び−6)−カルボキシテトラメチルローダミン・スクシンイミジルエステル(商品名、emp Biotech GmbH社製)等のNHSエステル基を有するものを挙げることができる。
【0017】
前記置換基を有するシランカップリング剤の具体例として、γ-アミノプロピルトリエトキシシラン(APS)、3−[2−(2−アミノエチルアミノ)エチルアミノ]プロピル-トリエトキシシラン、N−2(アミノエチル)3−アミノプロピルメチルジメトキシシラン、3−アミノプロピルトリメトキシシラン等のアミノ基を有するシランカップリング剤を挙げることができる。中でも、APSが好ましい。
【0018】
前記重合させる前記シラン化合物としては、特に制限はされないが、テトラエトキシシラン(TEOS)、γ-メルカプトプロピルトリメトキシシラン(MPS)、γ-メルカプトプロピルトリエトキシシラン、γ-アミノプロピルトリエトキシシラン(APS)、3−チオシアナトプロピルトリエトキシシラン、3−グリシジルオキシプロピルトリエトキシシラン、3−イソシアナトプロピルトリエトキシシラン、及び3−[2−(2−アミノエチルアミノ)エチルアミノ]プロピル−トリエトキシシランを挙げることができる。中でも、TEOS、MPS又はAPSが好ましい。本実施形態において、前記標識物質は、前記シリカ粒子中において固定化された状態にある。
【0019】
上述のように調製すると、球状、もしくは、球状に近いシリカ粒子が製造できる。球状に近いシリカ粒子とは、具体的には長軸と短軸の比が2以下の形状である。
所望の平均粒径のシリカ粒子を得るためには、YM−10、YM−100(いずれも商品名、ミリポア社製)等の限外ろ過膜を用いて限外ろ過を行い、粒径が大きすぎたり小さすぎる粒子を除去するか、または適切な重力加速度で遠心分離を行い、上清または沈殿のみを回収することで可能である。
【0020】
・ラテックス粒子
本発明において、前記ラテックス粒子としては、ポリスチレン、スチレン−スルホン酸(塩)共重合体、スチレン−メタクリル酸共重合体、アクリルニトリル−ブタジエン−スルホン酸共重合体、塩化ビニル−アクリル酸エステル共重合体、酢酸ビニル−アクリル酸エステル共重合体等からなる合成高分子粒子を挙げることができる。また、ラテックス粒子の着色方法としては、特開2000−178309、特開平10−48215号、特開平8−269207号、特開平6−306108号などに記載の方法で行うことができる。なお、この種の粒子に対する蛍光物質(標識物質)の固定化は、適宜定法により行うことができる。例えば、特表2005-534907、特開2010-156642、特開2010-156640などを参照することができる。商品化されている蛍光ラテックス粒子としては、Luminex社 製品名xMAP(登録商標)Multi-Analyte COOH Microspheres,(http://hitachisoft.jp/products/lifescience/lineup/luminex/about/bead.htmlhttp://hitachisoft.jp/products/lifescience/pdf/the_luminex_labmap_system.pdf)が知られている。
【0021】
・表面修飾
前記標識粒子に前記検体を認識する物質を表面修飾する方法としては特に制限は無く、静電的引力、ファンデルワールス力、疎水性相互作用等によって前記検体を認識する物質を前記標識粒子に吸着させても良いし、架橋剤や縮合剤によって化学結合で結合させてもよい。また、前記標識粒子表面にチオール基を有する場合には、前記検体を認識する物質のチオール基とS−S結合によって結合させてもよい。
また、前記標識粒子表面の生体分子(例えば、抗体、抗原、DNA、RNA)などの前記検体を認識する物質を結合したときに粒子が凝集する場合は、予め、前記標識粒子表面に交互吸着法によって表面処理を施しておいてもよい。交互吸着法とは、電荷を有する基板や粒子の表面に電荷を持った高分子を静電的引力で吸着させることで、基板や粒子の表面に高分子の薄膜を形成する手法である。前記標識粒子の表面に交互吸着処理を行うことにより粒子表面に電荷を付与できるため、粒子間に静電的反発力が生じ、分散性が向上する。また、粒子に結合した高分子は排除体積を持つことから、立体反発力の効果によっても分散性が向上する。
【0022】
(吸光微粒子)
本発明に用いられる吸光微粒子は参照用捕捉性物質に対して結合性を有する生体分子等で表面修飾されていることが好ましい。その種類や形状は特に限定されない。吸光微粒子の平均粒径、構成材料等の好ましいものは前記蛍光微粒子と同様である。標識物質としては、微粒子の構成材料が吸光性のものであれば特に用いなくてもよい。標識物質(吸光物質)を適用する場合には、多環顔料やアゾ顔料などの有機顔料、カーボンブラックやウルトラマリン青などの無機顔料を用いることができる。例えば、前記シリカ粒子やラテックス粒子に前記吸光物質を内包させてもよい。また、吸光微粒子には下記の半導体微粒子等を用いることも好ましい。
【0023】
・半導体粒子等
前記半導体粒子の材質は特に制限されないが、ZnO、ZnS、ZnSe、ZnTe、CdO、CdS、CdSe、CdTe、HgS、HgSe、HgTe、InP、InAs、GaN、GaP、GaAs、TiO2、WO3、PbS、又はPbSeが好ましく例示される。例えば、特許第3897285号公報等に記載の半導体ナノ粒子を用いることができる。前記半導体ナノ粒子は、チオール化合物の−SH基が半導体ナノ粒子の表面のS、O、Se、Te、P、As、N等の原子と置換することにより表面修飾することができる。前記金粒子、前記金属ナノ粒子としては、特開2003−26638明細書等に記載の金コロイド粒子及び金属コロイド粒子を用いることができる。前記金属コロイド粒子の具体例としては、白金、銅、酸化鉄等の金属コロイド粒子が挙げられる。前記無機結晶としては、酸化鉄(III)(Fe2O3)、酸化銀(I)(Ag2O)、酸化スズ(IV)(SnO2)、酸化チタン(IV)(TiO2)、インジウムスズ酸化物(ITO)等が挙げられる。例えば、特開2005−76064公報に記載の無機結晶を用いることができる。
【0024】
・吸光係数
吸光微粒子は、可視光を吸収し着色して視認できるものであることが好ましい。そのモル吸光係数εが5×106M−1cm−1以上である粒子であることが好ましく、モル吸光係数εが5×107M−1cm−1〜1×1010M−1cm−1であることがより好ましい。
【0025】
ここで、モル吸光係数εは下記ランベルト−ベールの式から算出することができる。
A=Log10(I0/I)=εbp=asbp’
[A:吸光度、I:透過光の強度、I0:入射光の強度、ε:モル吸光係数(M−1cm−1)、b:光路長(cm)、p:標識粒子(着色粒子及び蛍光微粒子の混合分散液を含む。)の濃度(M(mol/l))、as:比吸光度、p’:標識粒子(着色粒子及び蛍光微粒子の混合分散液を含む。)の濃度(g/l)]
【0026】
上記濃度p’(g/l)は、一定量(例えば1ml)の標識粒子分散液から標識粒子のみを回収し、乾燥させて得られた質量を決定して得られた値である。一方、上記濃度p(mol/l)は、標識粒子の大きさをTEM写真から求め、一粒子の体積を決定し、粒子の密度(例えばシリカ粒子の場合は2.3g/cm3)から一粒子の質量を決定し、一定量(例えば1ml)の標識粒子分散液から標識粒子のみを回収し、乾燥させて得られた標識粒子の質量からモル数を決定して得られた値である。本発明において、「標識粒子のモル吸光係数ε」とは、標識粒子分散液について吸光度を測定し、前記ランベルト−ベールの式に適用することにより得られた、前記分散液中における標識粒子のモル吸光係数εをいう。標識粒子の吸光度、吸光スペクトル及びεは、任意の吸光光度計ないしはプレートリーダーを用いて、水分散液、エタノール分散液、N,N−ジメチルフォルムアミド分散液等の分散液として測定できる。
【0027】
吸光微粒子の表面修飾の実施形態は前記蛍光微粒子と同様である。ただし、吸光微粒子には参照用捕捉性物質への結合性が付与され、参照用捕捉性物質に結合性を持つ生体分子等で修飾されることが好ましい。
【0028】
(長尺試験体)
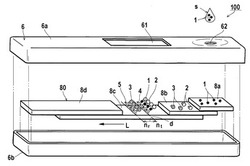
図1は、本発明の好ましい実施形態としての長尺試験体を模式的に示す分解斜視図である。本実施形態の平面試験片(テストストリップ)80は、図1右から、まず、被検物質(標的物質)1を含有する試料(検体)sを添加する部材であるサンプルパッド8aを具備する。次いで、その隣にはコンジュゲートパッド8bが配設されている。ここには、標的物質と特異的に結合する結合性物質が導入された蛍光微粒子をもつ蛍光標識体2と、参照用捕捉性物質5と特異的に結合する結合性物質が導入された吸光微粒子をもつ吸光標識体3が付与されている。
さらに、多孔質支持体からなるメンブレン8cが配されている。ここには、蛍光微粒子を、結合性物質及び標的物質を介して捕捉するための試験用捕捉性物質4が局所的に固定された試験領域ntが設けられている。メンブレン8cには、試験領域ntのさらにフロー方向Lの前方に参照領域nrがある。ここに固定された参照用捕捉性物質5により吸光微粒子をもつ吸光標識体を捕捉するコントロールラインが形成される。その後に、検体液をラテラルフロー方向(L)に流すために、メンブレンから検体液を吸い上げる吸収パッド8dが配され、上記の順に連結されて構成されている。
再度まとめていうと、平面試験片80は、サンプルパッド8aとコンジュゲートパッド8b、コンジュゲートパッド8bとメンブレン8c、メンブレン8cと吸収パッド8dがそれぞれ部分的に重ね合うように連結された構造となっている。サンプルパッド8aに検体液を滴下すると、順にコンジュゲートパッド8b、メンブレン8c、吸収パッド8dへと検体液が毛細管現象(毛管力)により移動していく。
【0029】
本実施形態においては、上述した平面試験片80が筐体上部6aと筐体下部6bとで挟持内包され、長尺試験体100をなしている。筐体上部6aには、検出開口部61と検体導入開口部62とが設けられている。この検出開口部61を介して、照射光を内部の試験片80に送り、そこで発せられる蛍光を集光し検出・観測することができる。一方、検体導入開口部62を介して検体液sを試験片80に供給し測定試験を行うことができる。
【0030】
・用語の定義
ここで用語の定義を確認すると、標的物質1(図中の符号を併せて示すが、これにより限定して解釈されるものではない。)はラテラルフロー法による検出対象となる物質であり、検体中の被検物質と同義である。結合性物質2b,3b(図2)はそれぞれ前記標的物質及び捕捉性物質に対する結合能を有する物質であり、好ましくは生体分子である。標識物質(図示せず)が導入された標識粒子2a,3a(図2)を標識体2,3と呼ぶ。ただし、広義には、標識粒子という用語を標識体を含む意味で用いることがある。また、標識粒子とは蛍光微粒子と吸光微粒子との総称である。一方、試験領域でメンブレンに固定され、標的物質1を介して標識体2を捕捉するものが試験用捕捉性物質4である。他方、参照領域でメンブレンに固定されたものが参照用捕捉性物質5であり、これに標識体3が標的物質1を介さずに捕捉される。
なお、本明細書において物質とは、化合物ないし化学合成された分子などを意味するほか、生体分子(タンパク質、ペプチド、核酸等)を包含し、人工起源のものであっても、天然起源のものであってもよい。広義には生体細胞や微生物(細菌等)、ウィルスをも包含する意味である。また、結合とは、複数のものが分離した状態から連続して一体となることを全般的に指し、共有結合やイオン結合、水素結合といった化学的な結合のほか、化学吸着や物理吸着、そのほか嵌合、螺合、咬合した物理的な連結状態等も含む意味である。ここで、結合とは、直接複数のものが結合しても、別のものを介して間接的に結合してもよい意味である。
【0031】
・検体
本実施形態に適用される検体sとしては、特に制限はないが、ヒトや動物の血液、血漿、血清、リンパ液、尿、唾液、膵液、胃液、喀痰、鼻や咽等の粘膜から採取したぬぐい液等の体液や便等に代表される臨床検体、液体飲料、半固形食品、固形食品等に代表される食品検体、土壌、河川、海水等の自然界からのサンプリング検体、工場内の生産ラインやクリーンルームのふき取り検体、エアーサンプラーによるサンプリング検体等に代表される環境サンプリング検体等が挙げられる。検体は液体であればそのまま用いることもできるし、半固形又は固形物等の場合には、希釈や抽出等の処理を施した後に用いることもできる。
【0032】
・結合性物質
本実施形態において試験用の結合性物質2b(図2)は上記標識粒子2aと一体化して用いる(標識体2)。結合性物質2bの具体的な例は特に限定されないが、上記標的粒子と結合能を有する生体分子が挙げられ、具体的には抗体が挙げられる。結合性物質は標識粒子に直接結合して一体化されていてもよいし、他の物質を介して間接的に結合していてもよい。標識粒子と結合性物質との結合は、疎水的相互作用等により物理的に吸着させる方法、スクシンイミド基とアミノ基との結合やマレイミド基とチオール基との結合のように、官能基を介して化学的に結合させる方法等の常法により行うことができる。標識粒子がナノ粒子である場合には、一つの標識体の表面に複数の結合性物質が結合しうる。なお、標識粒子として蛍光シリカ微粒子を用い結合性物質と一体化した標識体の実施形態については、例えば、国際公開第2008/018566号パンフレットを参照することができる。
【0033】
本実施形態においては、上記試験用の結合性物質2aとは別に、参照用の結合性物質3bを用いる。この参照用結合性物質3bは、後述する参照用の捕捉性物質5と結合性を有する。そして、標識粒子(吸光微粒子)3aと参照用結合性物質3bとは一体化され参照用の標識体3をなしている。したがって、この標識体3がメンブレンを移行していく過程で、捕捉性物質5に捕捉される。標識粒子3aと結合性物質3bとの結合一体化の態様あるいは結合性物質3bの好ましい物質の種類は、前記試験用の結合性物質2bと同様である。ただし、この参照用結合性物質3bは試験用の捕捉性物質4や標的物質とは結合性をもたないことが好ましい。一方、上記試験用の結合性物質2bは参照用の捕捉性物質5と結合性を有していてもよいが、その結合性を有さないことがより好ましい。
【0034】
・試験用捕捉性物質
本実施形態に用いられるメンブレンは、上記のメンブレンの材料に試験用捕捉性物質4が固定化されている。この捕捉性物質4は、前記標識粒子2aと結合性物質2bと前記標的物質1とを含む複合体を捕捉するよう、標的物質1への結合能を有する(図2参照)。捕捉性物質4が上記のような結合能を有することで、標識体2と標的物質1とからなる複合体を捕捉することが可能になる。その結果、標識体2による蛍光を発生するラインが試験領域ntに形成される。「結合性物質」−「標的物質」−「捕捉性物質」の組合わせの例として、抗体(B)−抗体(B)の抗原(C)−抗原(C)の抗体(D)、抗原(E)−抗原(E)の抗体(F)−抗体(F)の抗体(G)、核酸(H)−核酸(H)に相補的な配列を有する核酸(I)−核酸(I)に相補的な配列であって核酸(H)の配列とは異なる配列を有する核酸(J)、受容体(K)−受容体(K)のリガンド(L)−リガンド(L)に対する抗体(M)、アプタマー(N)−アプタマー(N)が特異的に結合するタンパク質(O)−タンパク質(O)とアプタマー(N)とは異なる部位で特異的に結合するアプタマー(P)、アプタマー(Q)−アプタマー(Q)と特異的に結合するタンパク質(R)−タンパク質(R)に対する抗体(S)等が挙げられるが、本発明はこれらに限定されるものではない。
【0035】
・参照用捕捉性物質
本実施形態においては、メンブレンの参照領域nrに参照用捕捉性物質5が固定されている。これは、標的物質1を介さずに、直接、参照用の結合性物質3bと結合するものである。したがって、移行してくる検体液sに混合されて標的物質1と結合していない標識体3が移行してくると、これを直接捕捉する(図2参照)。その結果、標識体3による吸光を呈するラインが参照領域nrに形成される。参照用捕捉性物質5は特に限定されないが、結合性物質と結合能を有する生体分子が挙げられ、具体的には抗体等が挙げられる。
【0036】
この参照領域の参照用捕捉性物質5と試験用結合性物質2bが結合性を有していてもよい。その場合、試験用の蛍光微粒子2aが参照領域nrに捕捉されることとなる。つまり、参照領域に吸光微粒子3aと蛍光微粒子2aとがともに捕捉された状態となるが、その場合にも、参照領域の吸光微粒子の着色状態を視認することができる。一方で、試験領域には標的物質を伴った蛍光性の標識体2が捕捉されているため、通常の使用において支障はない。参照領域に捕捉される蛍光微粒子の割合は特に限定されないが、少ない方が好ましく、蛍光微粒子全体の30〜0数%であることが好ましく、15〜0数%であることがより好ましい。
【0037】
・素材
本実施形態の平面試験片80に採用しうる各構成部材の材料としては特に制限は無く、イムノクロマト法用テストストリップに用いられる通常の部材が使用できる。サンプルパッドおよびコンジュゲートパッドとしては、例えば、Glass Fiber Conjugate Pad(商品名、MILLIPORE社製)等のガラスファイバーのパッドが好ましい。メンブレンとしてはHi−Flow Plus120メンブレン(商品名、MILLIPORE社製)等のニトロセルロースメンブレンが好ましい。吸収パッドとしてはCellulose Fiber Sample Pad(商品名、MILLIPORE社製)等のセルロースメンブレンが好ましい。前記粘着剤付きバッキングシートを用いる場合には、AR9020(商品名、Adhesives Research社製)等が挙げられる。
【0038】
・標識粒子のコンジュゲートパッドへの導入
蛍光イムノクロマト試験においては、前記コンジュゲートパッドに、前記標識体として、結合性物質を結合させた着色粒子と同様の蛍光微粒子とを導入しておくことが好ましい。コンジュゲートパッドにおける単位面積(cm2)当たりの前記標識粒子の含有量は特に制限ないが20μg/cm2〜2mg/cm2が好ましく、20〜200μg/cm2であることがより好ましい。含有量が多すぎると、1粒子当りの検体結合数が低下し、検出感度が低下する。含有させる方法としては、前記標識粒子の分散液を塗布、滴下ないしは噴霧後、乾燥する方法等が挙げられる。このとき着色粒子または蛍光微粒子を含有させ、一旦乾燥させた後、蛍光微粒子または着色粒子を含有させてもよく、予め着色粒子と蛍光微粒子を混合し、この混合コロイドを含有させてもよい。
【0039】
[検出方法]
本発明の好ましい実施形態に係るイムノクロマト法用標識試薬を用いてなる検査方法について説明する。イムノクロマト法用テストストリップを用いてなる検査方法は、まず、検体を含む試料液体(サンプル)をサンプルパッドに滴下して行うことができる。このときコントロールラインの発色は目視で確認が可能であり、陽性あるいは陰性の判定ができる。
【0040】
一方、本実施形態ではテストラインの発色は目視では確認されないが、前記ストリップを、イムノクロマト法用蛍光検出装置を用いて観察することで陽性あるいは陰性の判定を高感度に行うことが可能である。一方、本実施形態のイムノクロマト法用テストストリップを用いてなる検査方法では、コントロールラインは吸光微粒子により着色するため、使用済であることを目視によって確認が可能である。そして、コントロールラインの蛍光に阻害されずにテストラインの蛍光を高感度に判定することが可能である。イムノクロマト法用テストストリップを用いてなる検査方法は、目視による判定を行った後、蛍光検出装置による高感度判定および/または定量測定を行うことが好ましい。
なお、本明細書において「検出」とは、定性検出のみならず定量検出や、その他の各種の測定や同定、分析、評価等を含む概念である。
【0041】
本発明の効果が顕著に発現する観点から、下記のような設定が好ましいものとして挙げられる。
(1)テストラインとコントロールラインとの距離(図1のd)は、1mm以上であることが好ましく、2mm以上であることがより好ましい。上限は特にないが、例えば20mm以下ないし10mm以下が実際的である。
(2)蛍光微粒子のテストラインにおける蛍光発光の波長は下記のように400〜800nmが一般的であり、500〜700nmが好ましい。一方、吸光微粒子の吸収波長は、400〜800であることが好ましく、450〜650であることがより好ましい。
【0042】
[検出装置]
本発明の好ましい実施形態に係るイムノクロマト法用検出装置は、励起光源およびフィルタからなる。前記励起光源としては水銀ランプ、ハロゲンランプ、キセノンランプ、レーザダイオード、発光ダイオードなどが挙げられる。前記フィルタは、励起光源から特定の波長の光のみを透過するためのフィルタと、さらに、蛍光のみを検出する観点から、前記励起光を除去し蛍光のみを透過するフィルタであり、前記蛍光微粒子の蛍光波長、蛍光波長から適宜選択する。前記蛍光検出装置は、前記蛍光を受光する光電子倍増管又はCCD検出器を備えていてもよい。これにより目視では確認できない強度ないしは波長の蛍光も検出でき、さらにはその蛍光強度を測定できることから検体の定量もでき、高感度検出及び定量が可能となる。
【0043】
照射する励起光の波長は特に限定されないが、300〜900nmであることが好ましく、400〜800nmであることがより好ましい。蛍光微粒子から発せられる蛍光の波長は、照射される励起光の波長や蛍光色素の種類にもよるが、400〜800nm程度であるものが一般的である。
【0044】
吸光微粒子の検出は定法によればよく、特に装置を使用せずに、目視により検出を行ってもよい。
【0045】
さらに別の実施形態として、受光器を用い集光された蛍光を信号化する例が挙げられる。そして、その先に接続した液晶表示装置により画像表示するようにしてもよい。これにより、信号を記憶装置に取り込み検査記録を保存するようにしてもよい。あるいは、所定の画像処理をほどこし、蛍光発光の状態をより視認しやすくしたり、自動判定を行う機構としたりしてもよい。さらには、得られた検出信号の強度を算定し、被検物質の定量測定を自動計測する構成としてもよい。
【0046】
前記蛍光測定器における前記受光器としては、フォトダイオード(PD)、アバランシェフォトダイオード(APD)、光電子倍増管(PMT)又はCCDが挙げられ、製造コストの観点からPDであることが好ましく、煩雑な製造工程を要しないCAN実装型PDであることがより好ましい。前記CAN実装型PDの受光面のレンズとしては、前記集光レンズからの光がPDに集光される限り特に制限はない。例えば、口径1.5mm、前記集光レンズ側開口数(NA)が0.2、PD側NAが0.4の回転対称型両凸レンズのCAN実装型PDが市販されている。なお、検出器を備えた装置構成ないしこれを用いた定量方法については特開2010−197248号公報を参照することができる。
【0047】
[変形例]
イムノクロマト試験は、必ずしも2本のライン(テストライン1本、コントロールライン1本)からなるものではない。多項目診断イムノクロマトでは、複数本のテストラインが存在する。デンカ生研で製造されているインフルエンザ検出キット(クイックナビTM−Flu[商品名])は、1度のフロー試験でA型インフルエンザとB型インフルエンザの判定が可能となる。このようなケースにおいて陽性である場合、どちらかのライン+コントロールラインが発色(発光)することとなる。とりわけ、今後、インフルエンザのみならず様々な項目を同時に検出するキットが作製されてくると予測される。例えば、アデノウィルスやインフルエンザ、RSウィルス等を同時に検出する複数のラインが1本のテストストリップに存在する場合、複数の感染症にかかっていれば複数本のテストライン+コントロールラインが発色・発光する可能性がある。
このような場合にも、本発明によれば、蛍光微粒子と吸光微粒子とを適宜組み合わせることで、蛍光微粒子のみを用いるときの検出感度の問題を解消することができ、効果を発揮する。
【実施例】
【0048】
以下、本発明を実施例に基づいてさらに詳細に説明する。本発明はこれらの実施例に何
ら限定されるものではない
【0049】
[製造例1] 標識用粒子の調製
コア粒子としての蛍光色素含有シリカは、特開2009−221059に記載された手法により、粒径約300nmのローダミン6G含有シリカ粒子を作製した。具体的には、以下の方法で作製した。5−(及び−6)−カルボキシローダミン6G・スクシンイミジルエステル(商品名、HiLyte Biosciences社製)ジメチルホルムアミド(DMF)に溶解し、APSを加え、室温(23℃)で1時間反応を行い、カルボキシローダミン6G−APSのDMF溶液を得た。アンモニア水とエタノール混合溶媒にTEOSと前記カルボキシローダミン6G−APSのDMF溶液を加え、40℃にて2時間撹拌した。反応終了後、遠心分離を行い、粒子を沈降させた後、直ちに上清液を除去した。得られた沈殿物をエタノールに再分散させ、再度遠心分離を行い、粒子を沈降させ、未反応のTEOS等を除去した。さらにエタノールの代わりに蒸留水を用いた以外は同様な洗浄操作を4回行い、遊離色素等を除去することで粒径約300nmのローダミン6G含有シリカ粒子を作製した。粒子中の蛍光色素であるローダミン6Gの最大吸収波長は535nmである。
【0050】
[製造例2] 蛍光微粒子の抗体修飾
製造例1で調製した粒子のコロイドに、MES(2-Morpholinoethanesulfonic acid)緩衝液(pH6.0)、NHS、EDC(1-ethyl-3-(3-(dimethylamino)propyl)carbodiimide)、蒸留水を加え、30分間混合した。
反応液を遠心分離し、上清を除去後、蒸留水を加え粒子を分散させた。同様にして遠心分離と蒸留水への分散を繰り返して粒子を洗浄し、最後に50mMのKH2PO4緩衝液(pH8.0)1mLに分散させた。ここにKH2PO4緩衝液(pH8.0)に溶解した抗hCG抗体(Anti−hCG マウスIgG1、Medix Biochemica社製)を加え、2時間混合した。続いてBSA溶液を加え、さらに1時間混合した。
反応液を遠心分離し、上清を除去後、KH2PO4緩衝液(pH8.0)を加え粒子を分散させた。更に、遠心分離とKH2PO4緩衝液(pH8.0)への分散を繰り返して粒子を洗浄し、最後にKH2PO4緩衝液(pH8.0)1mLに分散させ、蛍光微粒子で標識された抗hCG抗体のコロイドを得た。
【0051】
[製造例3] 着色粒子への抗hcG抗体の修飾
粒径約40nmのAuコロイド粒子(BBI社製)に、MES(2-Morpholinoethanesulfonic acid)緩衝液(pH6.0)、NHS、EDC(1-ethyl-3-(3-(dimethylamino)propyl)carbodiimide)、蒸留水を加え、30分間混合した。
反応液を遠心分離し、上清を除去後、蒸留水を加え粒子を分散させた。更に遠心分離と蒸留水への分散を繰り返して粒子を洗浄し、最後にKH2PO4緩衝液(pH8.0)1mLに分散させた。ここにKH2PO4緩衝液(pH8.0)に溶解したヤギIgG抗体(ヤギIgG2b、タカラバイオ社製)を加え、2時間混合した。続いてBSA溶液を100μL加え、さらに1時間混合した。
反応液を遠心分離し、上清を除去後、KH2PO4緩衝液(pH8.0)を加え粒子を分散させた。更に、遠心分離とKH2PO4緩衝液(pH8.0)への分散を繰り返して粒子を洗浄し、最後にKH2PO4緩衝液(pH8.0)1mLに分散させ、蛍光微粒子で標識されたヤギIgG抗体のコロイドを得た。
【0052】
実施例1(着色ラテックス粒子と蛍光シリカ粒子の両方を含有したコンジュゲートパ
ッドの作製)
製造例2で作製した抗hcG抗体で修飾された蛍光シリカ粒子コロイド(10mg/ml)0.25mlと、製造例3で作製したヤギIgG抗体で修飾されたAuコロイド粒子(10mg/ml)0.05mlと、50mg/mlのスクロース3mlと、蒸留水1.7mlを混合した。
続いて前記混合粒子コロイドをGlass Fiber Conjugate Pad(商品名、MILLIPORE社製、8×150mm)1枚に対し0.8ml含有させた(Pad101)。
着色Auコロイド粒子と蛍光ラテックス粒子の混合粒子を含有させたGlass Fiber Conjugate Pad 101は薄い赤色であり、パッドに粒子が含有されていることが目視で確認できた。
【0053】
比較例1(蛍光シリカ粒子を含有したコンジュゲートパッドの作製)
製造例2で作製した、抗hCG抗体で修飾された蛍光シリカ粒子(10mg/ml)0.3mlと、50mg/mlスクロース3mlと、蒸留水1.7mlを混合した。得られた蛍光シリカ粒子コロイドをGlass Fiber Conjugate Pad(商品名、MILLIPORE社製、8×150mm)1枚に対し0.8ml含有させた。粒子を含有させたGlass Fiber Conjugate Pad c01は薄い赤色であり、パッドに粒子が含有されていることが目視で確認できた。
【0054】
実施例2(着色Auコロイド粒子と蛍光シリカ粒子の混合粒子を含有させたコンジュゲートパッド101を用いて作製したイムノクロマト法用テストストリップを用いたリコンビナントhCGの検出)
(1)抗体固定化メンブレンの作製
メンブレン(丈25mm、商品名Hi−Flow Plus120 メンブレン、MILLIPORE社製)の中央付近(端から約12mm)に幅約1mmのテストラインとして抗hCG抗体(alpha subunit of FSH(LH), clone code/6601、Medix Biochemica社製)が1mg/mL含まれる溶液((50mMKH2PO4,pH7.0)+5%スクロース)を0.75μL/cmの塗布量で塗布した。
続いて、幅約1mmのコントロールラインとしてヤギIgG抗体(ヤギIgG2b、タカラバイオ社製)が1mg/mL含まれる溶液((50mMKH2PO4,pH7.0)シュガー・フリー)を0.75μL/cmの塗布量で塗布し、50℃で30分乾燥させた。
次に、ブロッキング処理として前記メンブレン全体をブロッキングバッファー中に室温で30分浸した。
メンブレン洗浄/安定バッファーに移し室温で30分静置した。メンブレンを引上げ、ペーパータオル上に置いて室温で一夜乾燥させて、抗体固定化メンブレンを作製した。
前記得られたメンブレン、実施例1で得られた着色Auコロイド粒子と蛍光シリカ粒子の混合粒子を含有したコンジュゲートパッド、サンプルパッド(Glass Fiber Conjugate Pad(GFCP)、MILLIPORE社製)、吸収パッド(Cellulose Fiber Sample Pad(CFSP)(MILLIPORE社製)をバッキングシート(商品名AR9020,Adhesives Research社製)上で組み立て、5mm幅、長さ60mmのストリップ状に切断し、図1に示した構成のテストストリップ101を得た。図1については前述の通りである。ただし、バッキングシートは図示を省略している。
なお、各構成部材は、図1に示しているように各々その両端を隣接する部材と2mm程度重ね合わせて貼付した(以下、同様である。)。テストラインとコントロールラインとの距離dは3mmであった。
【0055】
(2)リコンビナントhCGの検出
100,50,20,10,5,2,0.2, 0.1IU/LのリコンビナントhCG(ロート製薬社製)100μLを前記ストリップのサンプルパッド部分に100μL滴下し、五分間放置し、目視で抗hCG抗体(alpha subunit of FSH(LH), clone code/6601、Medix Biochemica社製)を塗布したライン(テストライン)および、ヤギIgG抗体を塗布したライン(コントロールライン)の発色を確認したところ、コントロールラインの発色が確認できた。一方、目視ではテストラインの発色は確認されなかった。
続いて、励起光源側のフィルタとしてFF01−482(商品名、Semrock社製)、検出器側のフィルタとしてFF01−536(商品名、Semrock社製)を用い、前記リコンビナントhCGが100,50,20,10,5,0.2,0.1IU/Lのサンプルを滴下したテストストリップを水銀ランプ(103W)で照射し、検出器としてCCD検出器(C2741−35A(商品名、浜松ホトニクス社製))を用いて蛍光の画像化を行った。その結果リコンビナントhCGが100,50,20,10,5,0.2,0.1IU/Lの何れのサンプルについても、テストラインおよびコントロールラインの蛍光発色を確認した。
以上の結果から、前記着色Auコロイド粒子と蛍光シリカ粒子の混合粒子を用いた前記テストストリップはリコンビナントhCGが100〜0.1IU/Lのときであっても蛍光検出装置で判定が可能であることが分かる。
【0056】
比較例2(蛍光シリカ粒子を含有させたコンジュゲートパッドを用いて作製したイムノクロマト法用テストストリップを用いたリコンビナントhCGの検出)
コンジュゲートパッドとして、蛍光シリカ粒子を含有させたコンジュゲートパッドc01を用いた以外は実施例2(1)と同じ方法で作製したテストストリップc01を用いて、実施例2(2)と同じ方法でリコンビナントhCGの検出を行った。その結果、五分間放置したテストストリップのラインの発色を確認したところ、いずれのラインも発色が確認されなかった。
蛍光検出器を用いた評価においては、リコンビナントhCGが100,50,20,10,5,2,0.2IU/Lのサンプルについてのみ、テストラインおよびコントロールラインの蛍光発色を確認した。リコンビナントhCGが0.1IU/Lのときはテストラインの発色は確認されなかった。
以上の結果から、前記蛍光シリカ粒子を用いた前記テストストリップはリコンビナントhCGが0.2IU/L以上の場合に蛍光検出装置で判定が可能であることが分かる。
【符号の説明】
【0057】
1 標的物質(被検物質)
2 蛍光標識体
2a 蛍光微粒子
2b 試験用結合性物質
3 吸光標識体
3a 吸光微粒子
3b 参照用結合性物質
4 試験用捕捉性物質
5 参照用捕捉性物質
6 筐体
61 検出開口部
62 検体導入開口部
6a 筐体上部
6b 筐体下部
80 平面試験片(テストストリップ)
8a サンプルパッド
8b コンジュゲートパッド
8c メンブレン
8d 吸収パッド
100 長尺試験体
nr 参照領域(コントロールライン)
nt 試験領域(テストライン)
L ラテラルフロー方向
S 険体
【技術分野】
【0001】
本発明は、イムノクロマトグラフィー用試験キット、これを用いた検出方法及びこれに用いられる標識試薬に関する。
【背景技術】
【0002】
生体中の抗原などの微量物質を検出する手法としてラテラルフロー型のイムノクロマトグラフィーによる検査法がある。この方法では、検体液に含まれる被検物質を標識粒子に捕捉させ、多孔質支持体を毛細管現象により移動させる。そして、多孔質支持体に例えばライン状に固定された捕捉物質と接触させることによって、前記被検物質を濃縮し、捕捉物質が固定されたラインを発色させる。この発色によって被検物質の有無を判定することができる。かかるイムノクロマトグラフィー法の特徴として下記の3点が挙げられる。
(1)判定までに要する時間が短く迅速な検査が可能である。
(2)検体を滴下するだけで測定でき操作が簡便である。
(3)特別な検出装置を必要とせず判定が容易である。
これらの特徴を利用して、イムノクロマト法は妊娠検査薬やインフルエンザ検査薬に用いられており、新たなPOCT(Point Of Care Testing)の手法として利用されている。また、食品検査においても、例えば食物アレルゲンの検査試薬等として広く利用され益々注目を集めている。
【0003】
ここで、POCTとは、患者にできる限り近い場所で診断するための検査をいう。従来は採取した血液、尿、患部組織などの検体は、病院の中央検査室や専門の検査センターに送られデータを出すので、診断の確定までに時間がかかっていた。POCTによれば、瞬時に提供される検査情報をもとに迅速かつ的確な治療が可能となる。このことから、病院での緊急検査や手術中の検査が可能になり、とりわけ医療現場でのニーズが高い。
【0004】
本出願人は、上記のような要求に鑑み、メンブレンに適用する試薬について研究開発を行い、蛍光シリカ微粒子を用いる技術を開発した(特許文献1等参照)。これにより、従来の生体物質や生体細胞、あるいは金コロイド粒子を試薬に用いたものと比べ、安価かつ格段に安定した測定及び検出を可能とした。また、検出感度の向上や定量化といった要望にもより的確に応えることができ、イムノクロマトグラフィーの利用領域の拡大に大いに貢献するものである。
【0005】
また、本出願人は蛍光シリカ微粒子と吸光シリカ微粒子とを組み合わせたコンジュゲートパッドを提案した(特許文献2参照)。これにより、蛍光照射しない状態でも一応の検出ができ、さらに必要に応じて蛍光検出をすることで検出精度の向上や定量測定を併せて行うことを可能とした。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】国際公開第2008/018566号パンフレット
【特許文献2】特開2010−014631号公報
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明者らは、さらに上記蛍光微粒子を用いたイムノクロマトグラフィー(以下、蛍光イムノクロマト試験ということがある)について研究を継続したところ、テストラインよりもコントロールラインにより多くの粒子が吸着するため、前者よりも後者の発光強度が強くなってしまう傾向があることが分かってきた。そうすると、高い感度で陽性・陰性判定を行う場合、発光強度の強いコントロールラインの発光によって、発光強度がより微弱なテストラインの視認性が落ちてしまう。
すなわち、本発明は、蛍光イムノクロマト試験に特有の課題の解決を目的とし、コントロールラインの蛍光発光によるテストラインの蛍光の視認性の低下を抑制・防止しうるイムノクロマトグラフィー用試験キット、これを用いた検出方法及びこれに用いられる標識試薬の提供を目的とする。
【課題を解決するための手段】
【0008】
上記の課題は、下記の手段により解決された。
(1)イムノクロマトグラフィー用の平面試験片と、蛍光微粒子と、吸光微粒子とを組み合わせて具備する試験キットであって、
前記平面試験片は試験領域と参照領域を有し、
前記蛍光微粒子には標的物質に対する結合性が付与され、該標的物質は前記試験領域の試験用捕捉性物質との結合性を有し、一方、前記吸光微粒子は前記参照領域の参照用捕捉性物質に対する結合性が付与されたイムノクロマトグラフィー用試験キット。
(2)前記蛍光微粒子に、標的物質に対して結合性を有する試験用結合性物質が導入されている(1)に記載のキット。
(3)前記吸光微粒子に、前記参照用捕捉性物質に対して結合性を有する参照用結合性物質が導入されている(1)又は(2)に記載のキット。
(4)前記蛍光微粒子及び吸光微粒子の一方又は両方がシリカ微粒子からなる(1)〜(3)のいずれかに記載のキット。
(5)前記蛍光微粒子及び吸光微粒子の一方又は両方が平均粒径20〜1000nmである(1)〜(4)のいずれかに記載のキット。
(6)イムノクロマトグラフィー用の平面試験片と、標的物質に対する結合性が付与された蛍光微粒子と、前記試験片の参照領域にある参照用捕捉性物質に対する結合性が付与された吸光微粒子とを準備し、
前記蛍光微粒子と、前記吸光微粒子とをあらかじめ前記試験片に付与しておき、前記試験片に標的物質を付与して前記蛍光微粒子と結合させ、該蛍光微粒子を平面試験片内で移行させ、その試験領域にある試験用捕捉性物質と前記蛍光微粒子とを前記標的物質を介して結合させ、他方、前記吸光微粒子を前記試験片の参照領域にある参照用捕捉性物質と結合させ、
前記試験領域の蛍光微粒子からの蛍光発光と、前記参照領域の吸光微粒子の吸光状態とから前記標的物質の検出を行うイムノクロマトグラフィーによる検出方法。
(7)前記蛍光微粒子及び吸光微粒子の一方又は両方がシリカ微粒子からなる(6)に記載の検出方法。
(8)前記蛍光微粒子及び吸光微粒子の一方又は両方が平均粒径20〜1000nmである(6)又は(7)に記載の検出方法。
(9)蛍光微粒子と吸光微粒子とを含む、イムノクロマトグラフィーに用いられる標識試薬であって、
前記蛍光微粒子には標的物質に対する結合性が付与され、該標的物質は試験片の試験領域の試験用捕捉性物質との結合性を有し、一方、前記吸光微粒子には試験片の参照領域の参照用捕捉性物質に対する結合性が付与された標識試薬。
(10)前記蛍光微粒子に、標的物質に対して結合性を有する試験用結合性物質が導入されている(9)に記載の標識試薬。
(11)前記吸光微粒子に、前記参照用捕捉性物質に対して結合性を有する参照用結合性物質が導入されている(9)又は(10)に記載の標識試薬。
(12)前記蛍光微粒子及び吸光微粒子の一方又は両方がシリカ微粒子からなる(9)〜(11)のいずれか1項に記載の標識試薬。
(13)前記蛍光微粒子及び吸光微粒子の一方又は両方が平均粒径20〜1000nmである(9)〜(12)のいずれか1項に記載の標識試薬。
【発明の効果】
【0009】
本発明のイムノクロマトグラフィー用試験キット、これを用いた検出方法及びこれに用いられる標識試薬によれば、コントロールラインの蛍光発光によるテストラインの蛍光の視認性の低下を抑制・防止しうる。また、蛍光微粒子と吸光微粒子とを組み合わせて適用したため、使用済みであることを目視で確認することができる。
【図面の簡単な説明】
【0010】
【図1】本発明の好ましい実施形態としての長尺試験体を模式的に示す分解斜視図である。
【図2】本発明の好ましい実施形態としての標識粒子の試験領域ないし参照領域での固定状態を模式的に示す説明図である。
【発明を実施するための最良の形態】
【0011】
本発明のイムノクロマトグラフィー用試験キットは、参照領域及び試験領域を有するイムノクロマトグラフィー用の平面試験片と、特定の性質が付与された蛍光微粒子と、特定の性質が付与された吸光微粒子とを組み合わせて具備する。以下、本発明の構成についてその好ましい実施形態を中心に詳述する。
[標識試薬]
(蛍光微粒子)
本発明において好ましい実施形態の蛍光微粒子は標識試薬に含有され、標的物質(検体)を認識する結合性物質で表面修飾されている。
【0012】
・平均粒径
前記標識粒子の平均粒径は、特に限定されないが、20〜1000nmであることが好ましく、20〜600nmであることがより好ましく、60〜300nmであることがさらに好ましい。粒径が小さすぎると、検出感度が低下し、粒径が大きすぎると、イムノクロマト法に用いられる多孔質支持体(メンブレン)の目詰まりの原因となる。
【0013】
本発明において、前記平均粒径は、透過型電子顕微鏡(TEM)、走査型電子顕微鏡(SEM)等の画像から無作為に選択した50個の標識粒子の合計の投影面積から標識粒子の占有面積を画像処理装置によって求め、この合計の占有面積を、選択した標識粒子の個数(50個)で割った値に相当する円の直径の平均値(平均円相当直径)を求めたものである。粒度分布の変動係数いわゆるCV値は特に制限はないが、15%以下が好ましく、10%以下がより好ましく、8%以下が特に好ましい。
【0014】
・微粒子の構成材料
蛍光微粒子の材質に特に制限はないが、例えば、シリカ粒子、ラテックス粒子等を用いることができる。本実施形態の蛍光微粒子は、上述のように検体の標的物質を認識する物質で表面修飾されていることが好ましい。表面修飾の方法は通常この種の材料に適用されるものを適宜利用すればよい。
【0015】
・シリカ粒子
本発明において、蛍光微粒子はシリカ粒子からなることが好ましい。シリカ粒子としては特に制限はなく、任意のいかなる調製方法によって得られたシリカ粒子であってよい。例えば、国際公開2007/074722A1公報に記載された蛍光色素化合物含有コロイドシリカ粒子の調製方法に準じて得られた、標識物質を含有するシリカ粒子を用いることが特に好ましい。具体的には、前記標識物質を含有するシリカ粒子は、前記標識物質とシラン化合物とを反応させ、共有結合、イオン結合その他の化学的に結合もしくは吸着させて得られた生成物に1又は2種以上のシラン化合物を重合させることにより調製することができる。前記標識物質を含有するシリカ粒子の好ましい調製方法の態様としては、N−ヒドロキシスクシンイミド(NHS)エステル基、マレイミド基、イソシアナート基、イソチオシアナート基、アルデヒド基、パラニトロフェニル基、ジエトキシメチル基、エポキシ基、シアノ基等の活性基を有する前記標識物質と、それら活性基と対応して反応する置換基(例えば、アミノ基、水酸基、チオール基)を有するシランカップリング剤とを反応させ、共有結合させて得られた生成物に1又は2種以上のシラン化合物を重合させることにより調製することができる。
【0016】
前記活性基を有する標識物質(蛍光物質)の具体例として、5−(及び−6)−カルボキシテトラメチルローダミン・スクシンイミジルエステル(商品名、emp Biotech GmbH社製)等のNHSエステル基を有するものを挙げることができる。
【0017】
前記置換基を有するシランカップリング剤の具体例として、γ-アミノプロピルトリエトキシシラン(APS)、3−[2−(2−アミノエチルアミノ)エチルアミノ]プロピル-トリエトキシシラン、N−2(アミノエチル)3−アミノプロピルメチルジメトキシシラン、3−アミノプロピルトリメトキシシラン等のアミノ基を有するシランカップリング剤を挙げることができる。中でも、APSが好ましい。
【0018】
前記重合させる前記シラン化合物としては、特に制限はされないが、テトラエトキシシラン(TEOS)、γ-メルカプトプロピルトリメトキシシラン(MPS)、γ-メルカプトプロピルトリエトキシシラン、γ-アミノプロピルトリエトキシシラン(APS)、3−チオシアナトプロピルトリエトキシシラン、3−グリシジルオキシプロピルトリエトキシシラン、3−イソシアナトプロピルトリエトキシシラン、及び3−[2−(2−アミノエチルアミノ)エチルアミノ]プロピル−トリエトキシシランを挙げることができる。中でも、TEOS、MPS又はAPSが好ましい。本実施形態において、前記標識物質は、前記シリカ粒子中において固定化された状態にある。
【0019】
上述のように調製すると、球状、もしくは、球状に近いシリカ粒子が製造できる。球状に近いシリカ粒子とは、具体的には長軸と短軸の比が2以下の形状である。
所望の平均粒径のシリカ粒子を得るためには、YM−10、YM−100(いずれも商品名、ミリポア社製)等の限外ろ過膜を用いて限外ろ過を行い、粒径が大きすぎたり小さすぎる粒子を除去するか、または適切な重力加速度で遠心分離を行い、上清または沈殿のみを回収することで可能である。
【0020】
・ラテックス粒子
本発明において、前記ラテックス粒子としては、ポリスチレン、スチレン−スルホン酸(塩)共重合体、スチレン−メタクリル酸共重合体、アクリルニトリル−ブタジエン−スルホン酸共重合体、塩化ビニル−アクリル酸エステル共重合体、酢酸ビニル−アクリル酸エステル共重合体等からなる合成高分子粒子を挙げることができる。また、ラテックス粒子の着色方法としては、特開2000−178309、特開平10−48215号、特開平8−269207号、特開平6−306108号などに記載の方法で行うことができる。なお、この種の粒子に対する蛍光物質(標識物質)の固定化は、適宜定法により行うことができる。例えば、特表2005-534907、特開2010-156642、特開2010-156640などを参照することができる。商品化されている蛍光ラテックス粒子としては、Luminex社 製品名xMAP(登録商標)Multi-Analyte COOH Microspheres,(http://hitachisoft.jp/products/lifescience/lineup/luminex/about/bead.htmlhttp://hitachisoft.jp/products/lifescience/pdf/the_luminex_labmap_system.pdf)が知られている。
【0021】
・表面修飾
前記標識粒子に前記検体を認識する物質を表面修飾する方法としては特に制限は無く、静電的引力、ファンデルワールス力、疎水性相互作用等によって前記検体を認識する物質を前記標識粒子に吸着させても良いし、架橋剤や縮合剤によって化学結合で結合させてもよい。また、前記標識粒子表面にチオール基を有する場合には、前記検体を認識する物質のチオール基とS−S結合によって結合させてもよい。
また、前記標識粒子表面の生体分子(例えば、抗体、抗原、DNA、RNA)などの前記検体を認識する物質を結合したときに粒子が凝集する場合は、予め、前記標識粒子表面に交互吸着法によって表面処理を施しておいてもよい。交互吸着法とは、電荷を有する基板や粒子の表面に電荷を持った高分子を静電的引力で吸着させることで、基板や粒子の表面に高分子の薄膜を形成する手法である。前記標識粒子の表面に交互吸着処理を行うことにより粒子表面に電荷を付与できるため、粒子間に静電的反発力が生じ、分散性が向上する。また、粒子に結合した高分子は排除体積を持つことから、立体反発力の効果によっても分散性が向上する。
【0022】
(吸光微粒子)
本発明に用いられる吸光微粒子は参照用捕捉性物質に対して結合性を有する生体分子等で表面修飾されていることが好ましい。その種類や形状は特に限定されない。吸光微粒子の平均粒径、構成材料等の好ましいものは前記蛍光微粒子と同様である。標識物質としては、微粒子の構成材料が吸光性のものであれば特に用いなくてもよい。標識物質(吸光物質)を適用する場合には、多環顔料やアゾ顔料などの有機顔料、カーボンブラックやウルトラマリン青などの無機顔料を用いることができる。例えば、前記シリカ粒子やラテックス粒子に前記吸光物質を内包させてもよい。また、吸光微粒子には下記の半導体微粒子等を用いることも好ましい。
【0023】
・半導体粒子等
前記半導体粒子の材質は特に制限されないが、ZnO、ZnS、ZnSe、ZnTe、CdO、CdS、CdSe、CdTe、HgS、HgSe、HgTe、InP、InAs、GaN、GaP、GaAs、TiO2、WO3、PbS、又はPbSeが好ましく例示される。例えば、特許第3897285号公報等に記載の半導体ナノ粒子を用いることができる。前記半導体ナノ粒子は、チオール化合物の−SH基が半導体ナノ粒子の表面のS、O、Se、Te、P、As、N等の原子と置換することにより表面修飾することができる。前記金粒子、前記金属ナノ粒子としては、特開2003−26638明細書等に記載の金コロイド粒子及び金属コロイド粒子を用いることができる。前記金属コロイド粒子の具体例としては、白金、銅、酸化鉄等の金属コロイド粒子が挙げられる。前記無機結晶としては、酸化鉄(III)(Fe2O3)、酸化銀(I)(Ag2O)、酸化スズ(IV)(SnO2)、酸化チタン(IV)(TiO2)、インジウムスズ酸化物(ITO)等が挙げられる。例えば、特開2005−76064公報に記載の無機結晶を用いることができる。
【0024】
・吸光係数
吸光微粒子は、可視光を吸収し着色して視認できるものであることが好ましい。そのモル吸光係数εが5×106M−1cm−1以上である粒子であることが好ましく、モル吸光係数εが5×107M−1cm−1〜1×1010M−1cm−1であることがより好ましい。
【0025】
ここで、モル吸光係数εは下記ランベルト−ベールの式から算出することができる。
A=Log10(I0/I)=εbp=asbp’
[A:吸光度、I:透過光の強度、I0:入射光の強度、ε:モル吸光係数(M−1cm−1)、b:光路長(cm)、p:標識粒子(着色粒子及び蛍光微粒子の混合分散液を含む。)の濃度(M(mol/l))、as:比吸光度、p’:標識粒子(着色粒子及び蛍光微粒子の混合分散液を含む。)の濃度(g/l)]
【0026】
上記濃度p’(g/l)は、一定量(例えば1ml)の標識粒子分散液から標識粒子のみを回収し、乾燥させて得られた質量を決定して得られた値である。一方、上記濃度p(mol/l)は、標識粒子の大きさをTEM写真から求め、一粒子の体積を決定し、粒子の密度(例えばシリカ粒子の場合は2.3g/cm3)から一粒子の質量を決定し、一定量(例えば1ml)の標識粒子分散液から標識粒子のみを回収し、乾燥させて得られた標識粒子の質量からモル数を決定して得られた値である。本発明において、「標識粒子のモル吸光係数ε」とは、標識粒子分散液について吸光度を測定し、前記ランベルト−ベールの式に適用することにより得られた、前記分散液中における標識粒子のモル吸光係数εをいう。標識粒子の吸光度、吸光スペクトル及びεは、任意の吸光光度計ないしはプレートリーダーを用いて、水分散液、エタノール分散液、N,N−ジメチルフォルムアミド分散液等の分散液として測定できる。
【0027】
吸光微粒子の表面修飾の実施形態は前記蛍光微粒子と同様である。ただし、吸光微粒子には参照用捕捉性物質への結合性が付与され、参照用捕捉性物質に結合性を持つ生体分子等で修飾されることが好ましい。
【0028】
(長尺試験体)
図1は、本発明の好ましい実施形態としての長尺試験体を模式的に示す分解斜視図である。本実施形態の平面試験片(テストストリップ)80は、図1右から、まず、被検物質(標的物質)1を含有する試料(検体)sを添加する部材であるサンプルパッド8aを具備する。次いで、その隣にはコンジュゲートパッド8bが配設されている。ここには、標的物質と特異的に結合する結合性物質が導入された蛍光微粒子をもつ蛍光標識体2と、参照用捕捉性物質5と特異的に結合する結合性物質が導入された吸光微粒子をもつ吸光標識体3が付与されている。
さらに、多孔質支持体からなるメンブレン8cが配されている。ここには、蛍光微粒子を、結合性物質及び標的物質を介して捕捉するための試験用捕捉性物質4が局所的に固定された試験領域ntが設けられている。メンブレン8cには、試験領域ntのさらにフロー方向Lの前方に参照領域nrがある。ここに固定された参照用捕捉性物質5により吸光微粒子をもつ吸光標識体を捕捉するコントロールラインが形成される。その後に、検体液をラテラルフロー方向(L)に流すために、メンブレンから検体液を吸い上げる吸収パッド8dが配され、上記の順に連結されて構成されている。
再度まとめていうと、平面試験片80は、サンプルパッド8aとコンジュゲートパッド8b、コンジュゲートパッド8bとメンブレン8c、メンブレン8cと吸収パッド8dがそれぞれ部分的に重ね合うように連結された構造となっている。サンプルパッド8aに検体液を滴下すると、順にコンジュゲートパッド8b、メンブレン8c、吸収パッド8dへと検体液が毛細管現象(毛管力)により移動していく。
【0029】
本実施形態においては、上述した平面試験片80が筐体上部6aと筐体下部6bとで挟持内包され、長尺試験体100をなしている。筐体上部6aには、検出開口部61と検体導入開口部62とが設けられている。この検出開口部61を介して、照射光を内部の試験片80に送り、そこで発せられる蛍光を集光し検出・観測することができる。一方、検体導入開口部62を介して検体液sを試験片80に供給し測定試験を行うことができる。
【0030】
・用語の定義
ここで用語の定義を確認すると、標的物質1(図中の符号を併せて示すが、これにより限定して解釈されるものではない。)はラテラルフロー法による検出対象となる物質であり、検体中の被検物質と同義である。結合性物質2b,3b(図2)はそれぞれ前記標的物質及び捕捉性物質に対する結合能を有する物質であり、好ましくは生体分子である。標識物質(図示せず)が導入された標識粒子2a,3a(図2)を標識体2,3と呼ぶ。ただし、広義には、標識粒子という用語を標識体を含む意味で用いることがある。また、標識粒子とは蛍光微粒子と吸光微粒子との総称である。一方、試験領域でメンブレンに固定され、標的物質1を介して標識体2を捕捉するものが試験用捕捉性物質4である。他方、参照領域でメンブレンに固定されたものが参照用捕捉性物質5であり、これに標識体3が標的物質1を介さずに捕捉される。
なお、本明細書において物質とは、化合物ないし化学合成された分子などを意味するほか、生体分子(タンパク質、ペプチド、核酸等)を包含し、人工起源のものであっても、天然起源のものであってもよい。広義には生体細胞や微生物(細菌等)、ウィルスをも包含する意味である。また、結合とは、複数のものが分離した状態から連続して一体となることを全般的に指し、共有結合やイオン結合、水素結合といった化学的な結合のほか、化学吸着や物理吸着、そのほか嵌合、螺合、咬合した物理的な連結状態等も含む意味である。ここで、結合とは、直接複数のものが結合しても、別のものを介して間接的に結合してもよい意味である。
【0031】
・検体
本実施形態に適用される検体sとしては、特に制限はないが、ヒトや動物の血液、血漿、血清、リンパ液、尿、唾液、膵液、胃液、喀痰、鼻や咽等の粘膜から採取したぬぐい液等の体液や便等に代表される臨床検体、液体飲料、半固形食品、固形食品等に代表される食品検体、土壌、河川、海水等の自然界からのサンプリング検体、工場内の生産ラインやクリーンルームのふき取り検体、エアーサンプラーによるサンプリング検体等に代表される環境サンプリング検体等が挙げられる。検体は液体であればそのまま用いることもできるし、半固形又は固形物等の場合には、希釈や抽出等の処理を施した後に用いることもできる。
【0032】
・結合性物質
本実施形態において試験用の結合性物質2b(図2)は上記標識粒子2aと一体化して用いる(標識体2)。結合性物質2bの具体的な例は特に限定されないが、上記標的粒子と結合能を有する生体分子が挙げられ、具体的には抗体が挙げられる。結合性物質は標識粒子に直接結合して一体化されていてもよいし、他の物質を介して間接的に結合していてもよい。標識粒子と結合性物質との結合は、疎水的相互作用等により物理的に吸着させる方法、スクシンイミド基とアミノ基との結合やマレイミド基とチオール基との結合のように、官能基を介して化学的に結合させる方法等の常法により行うことができる。標識粒子がナノ粒子である場合には、一つの標識体の表面に複数の結合性物質が結合しうる。なお、標識粒子として蛍光シリカ微粒子を用い結合性物質と一体化した標識体の実施形態については、例えば、国際公開第2008/018566号パンフレットを参照することができる。
【0033】
本実施形態においては、上記試験用の結合性物質2aとは別に、参照用の結合性物質3bを用いる。この参照用結合性物質3bは、後述する参照用の捕捉性物質5と結合性を有する。そして、標識粒子(吸光微粒子)3aと参照用結合性物質3bとは一体化され参照用の標識体3をなしている。したがって、この標識体3がメンブレンを移行していく過程で、捕捉性物質5に捕捉される。標識粒子3aと結合性物質3bとの結合一体化の態様あるいは結合性物質3bの好ましい物質の種類は、前記試験用の結合性物質2bと同様である。ただし、この参照用結合性物質3bは試験用の捕捉性物質4や標的物質とは結合性をもたないことが好ましい。一方、上記試験用の結合性物質2bは参照用の捕捉性物質5と結合性を有していてもよいが、その結合性を有さないことがより好ましい。
【0034】
・試験用捕捉性物質
本実施形態に用いられるメンブレンは、上記のメンブレンの材料に試験用捕捉性物質4が固定化されている。この捕捉性物質4は、前記標識粒子2aと結合性物質2bと前記標的物質1とを含む複合体を捕捉するよう、標的物質1への結合能を有する(図2参照)。捕捉性物質4が上記のような結合能を有することで、標識体2と標的物質1とからなる複合体を捕捉することが可能になる。その結果、標識体2による蛍光を発生するラインが試験領域ntに形成される。「結合性物質」−「標的物質」−「捕捉性物質」の組合わせの例として、抗体(B)−抗体(B)の抗原(C)−抗原(C)の抗体(D)、抗原(E)−抗原(E)の抗体(F)−抗体(F)の抗体(G)、核酸(H)−核酸(H)に相補的な配列を有する核酸(I)−核酸(I)に相補的な配列であって核酸(H)の配列とは異なる配列を有する核酸(J)、受容体(K)−受容体(K)のリガンド(L)−リガンド(L)に対する抗体(M)、アプタマー(N)−アプタマー(N)が特異的に結合するタンパク質(O)−タンパク質(O)とアプタマー(N)とは異なる部位で特異的に結合するアプタマー(P)、アプタマー(Q)−アプタマー(Q)と特異的に結合するタンパク質(R)−タンパク質(R)に対する抗体(S)等が挙げられるが、本発明はこれらに限定されるものではない。
【0035】
・参照用捕捉性物質
本実施形態においては、メンブレンの参照領域nrに参照用捕捉性物質5が固定されている。これは、標的物質1を介さずに、直接、参照用の結合性物質3bと結合するものである。したがって、移行してくる検体液sに混合されて標的物質1と結合していない標識体3が移行してくると、これを直接捕捉する(図2参照)。その結果、標識体3による吸光を呈するラインが参照領域nrに形成される。参照用捕捉性物質5は特に限定されないが、結合性物質と結合能を有する生体分子が挙げられ、具体的には抗体等が挙げられる。
【0036】
この参照領域の参照用捕捉性物質5と試験用結合性物質2bが結合性を有していてもよい。その場合、試験用の蛍光微粒子2aが参照領域nrに捕捉されることとなる。つまり、参照領域に吸光微粒子3aと蛍光微粒子2aとがともに捕捉された状態となるが、その場合にも、参照領域の吸光微粒子の着色状態を視認することができる。一方で、試験領域には標的物質を伴った蛍光性の標識体2が捕捉されているため、通常の使用において支障はない。参照領域に捕捉される蛍光微粒子の割合は特に限定されないが、少ない方が好ましく、蛍光微粒子全体の30〜0数%であることが好ましく、15〜0数%であることがより好ましい。
【0037】
・素材
本実施形態の平面試験片80に採用しうる各構成部材の材料としては特に制限は無く、イムノクロマト法用テストストリップに用いられる通常の部材が使用できる。サンプルパッドおよびコンジュゲートパッドとしては、例えば、Glass Fiber Conjugate Pad(商品名、MILLIPORE社製)等のガラスファイバーのパッドが好ましい。メンブレンとしてはHi−Flow Plus120メンブレン(商品名、MILLIPORE社製)等のニトロセルロースメンブレンが好ましい。吸収パッドとしてはCellulose Fiber Sample Pad(商品名、MILLIPORE社製)等のセルロースメンブレンが好ましい。前記粘着剤付きバッキングシートを用いる場合には、AR9020(商品名、Adhesives Research社製)等が挙げられる。
【0038】
・標識粒子のコンジュゲートパッドへの導入
蛍光イムノクロマト試験においては、前記コンジュゲートパッドに、前記標識体として、結合性物質を結合させた着色粒子と同様の蛍光微粒子とを導入しておくことが好ましい。コンジュゲートパッドにおける単位面積(cm2)当たりの前記標識粒子の含有量は特に制限ないが20μg/cm2〜2mg/cm2が好ましく、20〜200μg/cm2であることがより好ましい。含有量が多すぎると、1粒子当りの検体結合数が低下し、検出感度が低下する。含有させる方法としては、前記標識粒子の分散液を塗布、滴下ないしは噴霧後、乾燥する方法等が挙げられる。このとき着色粒子または蛍光微粒子を含有させ、一旦乾燥させた後、蛍光微粒子または着色粒子を含有させてもよく、予め着色粒子と蛍光微粒子を混合し、この混合コロイドを含有させてもよい。
【0039】
[検出方法]
本発明の好ましい実施形態に係るイムノクロマト法用標識試薬を用いてなる検査方法について説明する。イムノクロマト法用テストストリップを用いてなる検査方法は、まず、検体を含む試料液体(サンプル)をサンプルパッドに滴下して行うことができる。このときコントロールラインの発色は目視で確認が可能であり、陽性あるいは陰性の判定ができる。
【0040】
一方、本実施形態ではテストラインの発色は目視では確認されないが、前記ストリップを、イムノクロマト法用蛍光検出装置を用いて観察することで陽性あるいは陰性の判定を高感度に行うことが可能である。一方、本実施形態のイムノクロマト法用テストストリップを用いてなる検査方法では、コントロールラインは吸光微粒子により着色するため、使用済であることを目視によって確認が可能である。そして、コントロールラインの蛍光に阻害されずにテストラインの蛍光を高感度に判定することが可能である。イムノクロマト法用テストストリップを用いてなる検査方法は、目視による判定を行った後、蛍光検出装置による高感度判定および/または定量測定を行うことが好ましい。
なお、本明細書において「検出」とは、定性検出のみならず定量検出や、その他の各種の測定や同定、分析、評価等を含む概念である。
【0041】
本発明の効果が顕著に発現する観点から、下記のような設定が好ましいものとして挙げられる。
(1)テストラインとコントロールラインとの距離(図1のd)は、1mm以上であることが好ましく、2mm以上であることがより好ましい。上限は特にないが、例えば20mm以下ないし10mm以下が実際的である。
(2)蛍光微粒子のテストラインにおける蛍光発光の波長は下記のように400〜800nmが一般的であり、500〜700nmが好ましい。一方、吸光微粒子の吸収波長は、400〜800であることが好ましく、450〜650であることがより好ましい。
【0042】
[検出装置]
本発明の好ましい実施形態に係るイムノクロマト法用検出装置は、励起光源およびフィルタからなる。前記励起光源としては水銀ランプ、ハロゲンランプ、キセノンランプ、レーザダイオード、発光ダイオードなどが挙げられる。前記フィルタは、励起光源から特定の波長の光のみを透過するためのフィルタと、さらに、蛍光のみを検出する観点から、前記励起光を除去し蛍光のみを透過するフィルタであり、前記蛍光微粒子の蛍光波長、蛍光波長から適宜選択する。前記蛍光検出装置は、前記蛍光を受光する光電子倍増管又はCCD検出器を備えていてもよい。これにより目視では確認できない強度ないしは波長の蛍光も検出でき、さらにはその蛍光強度を測定できることから検体の定量もでき、高感度検出及び定量が可能となる。
【0043】
照射する励起光の波長は特に限定されないが、300〜900nmであることが好ましく、400〜800nmであることがより好ましい。蛍光微粒子から発せられる蛍光の波長は、照射される励起光の波長や蛍光色素の種類にもよるが、400〜800nm程度であるものが一般的である。
【0044】
吸光微粒子の検出は定法によればよく、特に装置を使用せずに、目視により検出を行ってもよい。
【0045】
さらに別の実施形態として、受光器を用い集光された蛍光を信号化する例が挙げられる。そして、その先に接続した液晶表示装置により画像表示するようにしてもよい。これにより、信号を記憶装置に取り込み検査記録を保存するようにしてもよい。あるいは、所定の画像処理をほどこし、蛍光発光の状態をより視認しやすくしたり、自動判定を行う機構としたりしてもよい。さらには、得られた検出信号の強度を算定し、被検物質の定量測定を自動計測する構成としてもよい。
【0046】
前記蛍光測定器における前記受光器としては、フォトダイオード(PD)、アバランシェフォトダイオード(APD)、光電子倍増管(PMT)又はCCDが挙げられ、製造コストの観点からPDであることが好ましく、煩雑な製造工程を要しないCAN実装型PDであることがより好ましい。前記CAN実装型PDの受光面のレンズとしては、前記集光レンズからの光がPDに集光される限り特に制限はない。例えば、口径1.5mm、前記集光レンズ側開口数(NA)が0.2、PD側NAが0.4の回転対称型両凸レンズのCAN実装型PDが市販されている。なお、検出器を備えた装置構成ないしこれを用いた定量方法については特開2010−197248号公報を参照することができる。
【0047】
[変形例]
イムノクロマト試験は、必ずしも2本のライン(テストライン1本、コントロールライン1本)からなるものではない。多項目診断イムノクロマトでは、複数本のテストラインが存在する。デンカ生研で製造されているインフルエンザ検出キット(クイックナビTM−Flu[商品名])は、1度のフロー試験でA型インフルエンザとB型インフルエンザの判定が可能となる。このようなケースにおいて陽性である場合、どちらかのライン+コントロールラインが発色(発光)することとなる。とりわけ、今後、インフルエンザのみならず様々な項目を同時に検出するキットが作製されてくると予測される。例えば、アデノウィルスやインフルエンザ、RSウィルス等を同時に検出する複数のラインが1本のテストストリップに存在する場合、複数の感染症にかかっていれば複数本のテストライン+コントロールラインが発色・発光する可能性がある。
このような場合にも、本発明によれば、蛍光微粒子と吸光微粒子とを適宜組み合わせることで、蛍光微粒子のみを用いるときの検出感度の問題を解消することができ、効果を発揮する。
【実施例】
【0048】
以下、本発明を実施例に基づいてさらに詳細に説明する。本発明はこれらの実施例に何
ら限定されるものではない
【0049】
[製造例1] 標識用粒子の調製
コア粒子としての蛍光色素含有シリカは、特開2009−221059に記載された手法により、粒径約300nmのローダミン6G含有シリカ粒子を作製した。具体的には、以下の方法で作製した。5−(及び−6)−カルボキシローダミン6G・スクシンイミジルエステル(商品名、HiLyte Biosciences社製)ジメチルホルムアミド(DMF)に溶解し、APSを加え、室温(23℃)で1時間反応を行い、カルボキシローダミン6G−APSのDMF溶液を得た。アンモニア水とエタノール混合溶媒にTEOSと前記カルボキシローダミン6G−APSのDMF溶液を加え、40℃にて2時間撹拌した。反応終了後、遠心分離を行い、粒子を沈降させた後、直ちに上清液を除去した。得られた沈殿物をエタノールに再分散させ、再度遠心分離を行い、粒子を沈降させ、未反応のTEOS等を除去した。さらにエタノールの代わりに蒸留水を用いた以外は同様な洗浄操作を4回行い、遊離色素等を除去することで粒径約300nmのローダミン6G含有シリカ粒子を作製した。粒子中の蛍光色素であるローダミン6Gの最大吸収波長は535nmである。
【0050】
[製造例2] 蛍光微粒子の抗体修飾
製造例1で調製した粒子のコロイドに、MES(2-Morpholinoethanesulfonic acid)緩衝液(pH6.0)、NHS、EDC(1-ethyl-3-(3-(dimethylamino)propyl)carbodiimide)、蒸留水を加え、30分間混合した。
反応液を遠心分離し、上清を除去後、蒸留水を加え粒子を分散させた。同様にして遠心分離と蒸留水への分散を繰り返して粒子を洗浄し、最後に50mMのKH2PO4緩衝液(pH8.0)1mLに分散させた。ここにKH2PO4緩衝液(pH8.0)に溶解した抗hCG抗体(Anti−hCG マウスIgG1、Medix Biochemica社製)を加え、2時間混合した。続いてBSA溶液を加え、さらに1時間混合した。
反応液を遠心分離し、上清を除去後、KH2PO4緩衝液(pH8.0)を加え粒子を分散させた。更に、遠心分離とKH2PO4緩衝液(pH8.0)への分散を繰り返して粒子を洗浄し、最後にKH2PO4緩衝液(pH8.0)1mLに分散させ、蛍光微粒子で標識された抗hCG抗体のコロイドを得た。
【0051】
[製造例3] 着色粒子への抗hcG抗体の修飾
粒径約40nmのAuコロイド粒子(BBI社製)に、MES(2-Morpholinoethanesulfonic acid)緩衝液(pH6.0)、NHS、EDC(1-ethyl-3-(3-(dimethylamino)propyl)carbodiimide)、蒸留水を加え、30分間混合した。
反応液を遠心分離し、上清を除去後、蒸留水を加え粒子を分散させた。更に遠心分離と蒸留水への分散を繰り返して粒子を洗浄し、最後にKH2PO4緩衝液(pH8.0)1mLに分散させた。ここにKH2PO4緩衝液(pH8.0)に溶解したヤギIgG抗体(ヤギIgG2b、タカラバイオ社製)を加え、2時間混合した。続いてBSA溶液を100μL加え、さらに1時間混合した。
反応液を遠心分離し、上清を除去後、KH2PO4緩衝液(pH8.0)を加え粒子を分散させた。更に、遠心分離とKH2PO4緩衝液(pH8.0)への分散を繰り返して粒子を洗浄し、最後にKH2PO4緩衝液(pH8.0)1mLに分散させ、蛍光微粒子で標識されたヤギIgG抗体のコロイドを得た。
【0052】
実施例1(着色ラテックス粒子と蛍光シリカ粒子の両方を含有したコンジュゲートパ
ッドの作製)
製造例2で作製した抗hcG抗体で修飾された蛍光シリカ粒子コロイド(10mg/ml)0.25mlと、製造例3で作製したヤギIgG抗体で修飾されたAuコロイド粒子(10mg/ml)0.05mlと、50mg/mlのスクロース3mlと、蒸留水1.7mlを混合した。
続いて前記混合粒子コロイドをGlass Fiber Conjugate Pad(商品名、MILLIPORE社製、8×150mm)1枚に対し0.8ml含有させた(Pad101)。
着色Auコロイド粒子と蛍光ラテックス粒子の混合粒子を含有させたGlass Fiber Conjugate Pad 101は薄い赤色であり、パッドに粒子が含有されていることが目視で確認できた。
【0053】
比較例1(蛍光シリカ粒子を含有したコンジュゲートパッドの作製)
製造例2で作製した、抗hCG抗体で修飾された蛍光シリカ粒子(10mg/ml)0.3mlと、50mg/mlスクロース3mlと、蒸留水1.7mlを混合した。得られた蛍光シリカ粒子コロイドをGlass Fiber Conjugate Pad(商品名、MILLIPORE社製、8×150mm)1枚に対し0.8ml含有させた。粒子を含有させたGlass Fiber Conjugate Pad c01は薄い赤色であり、パッドに粒子が含有されていることが目視で確認できた。
【0054】
実施例2(着色Auコロイド粒子と蛍光シリカ粒子の混合粒子を含有させたコンジュゲートパッド101を用いて作製したイムノクロマト法用テストストリップを用いたリコンビナントhCGの検出)
(1)抗体固定化メンブレンの作製
メンブレン(丈25mm、商品名Hi−Flow Plus120 メンブレン、MILLIPORE社製)の中央付近(端から約12mm)に幅約1mmのテストラインとして抗hCG抗体(alpha subunit of FSH(LH), clone code/6601、Medix Biochemica社製)が1mg/mL含まれる溶液((50mMKH2PO4,pH7.0)+5%スクロース)を0.75μL/cmの塗布量で塗布した。
続いて、幅約1mmのコントロールラインとしてヤギIgG抗体(ヤギIgG2b、タカラバイオ社製)が1mg/mL含まれる溶液((50mMKH2PO4,pH7.0)シュガー・フリー)を0.75μL/cmの塗布量で塗布し、50℃で30分乾燥させた。
次に、ブロッキング処理として前記メンブレン全体をブロッキングバッファー中に室温で30分浸した。
メンブレン洗浄/安定バッファーに移し室温で30分静置した。メンブレンを引上げ、ペーパータオル上に置いて室温で一夜乾燥させて、抗体固定化メンブレンを作製した。
前記得られたメンブレン、実施例1で得られた着色Auコロイド粒子と蛍光シリカ粒子の混合粒子を含有したコンジュゲートパッド、サンプルパッド(Glass Fiber Conjugate Pad(GFCP)、MILLIPORE社製)、吸収パッド(Cellulose Fiber Sample Pad(CFSP)(MILLIPORE社製)をバッキングシート(商品名AR9020,Adhesives Research社製)上で組み立て、5mm幅、長さ60mmのストリップ状に切断し、図1に示した構成のテストストリップ101を得た。図1については前述の通りである。ただし、バッキングシートは図示を省略している。
なお、各構成部材は、図1に示しているように各々その両端を隣接する部材と2mm程度重ね合わせて貼付した(以下、同様である。)。テストラインとコントロールラインとの距離dは3mmであった。
【0055】
(2)リコンビナントhCGの検出
100,50,20,10,5,2,0.2, 0.1IU/LのリコンビナントhCG(ロート製薬社製)100μLを前記ストリップのサンプルパッド部分に100μL滴下し、五分間放置し、目視で抗hCG抗体(alpha subunit of FSH(LH), clone code/6601、Medix Biochemica社製)を塗布したライン(テストライン)および、ヤギIgG抗体を塗布したライン(コントロールライン)の発色を確認したところ、コントロールラインの発色が確認できた。一方、目視ではテストラインの発色は確認されなかった。
続いて、励起光源側のフィルタとしてFF01−482(商品名、Semrock社製)、検出器側のフィルタとしてFF01−536(商品名、Semrock社製)を用い、前記リコンビナントhCGが100,50,20,10,5,0.2,0.1IU/Lのサンプルを滴下したテストストリップを水銀ランプ(103W)で照射し、検出器としてCCD検出器(C2741−35A(商品名、浜松ホトニクス社製))を用いて蛍光の画像化を行った。その結果リコンビナントhCGが100,50,20,10,5,0.2,0.1IU/Lの何れのサンプルについても、テストラインおよびコントロールラインの蛍光発色を確認した。
以上の結果から、前記着色Auコロイド粒子と蛍光シリカ粒子の混合粒子を用いた前記テストストリップはリコンビナントhCGが100〜0.1IU/Lのときであっても蛍光検出装置で判定が可能であることが分かる。
【0056】
比較例2(蛍光シリカ粒子を含有させたコンジュゲートパッドを用いて作製したイムノクロマト法用テストストリップを用いたリコンビナントhCGの検出)
コンジュゲートパッドとして、蛍光シリカ粒子を含有させたコンジュゲートパッドc01を用いた以外は実施例2(1)と同じ方法で作製したテストストリップc01を用いて、実施例2(2)と同じ方法でリコンビナントhCGの検出を行った。その結果、五分間放置したテストストリップのラインの発色を確認したところ、いずれのラインも発色が確認されなかった。
蛍光検出器を用いた評価においては、リコンビナントhCGが100,50,20,10,5,2,0.2IU/Lのサンプルについてのみ、テストラインおよびコントロールラインの蛍光発色を確認した。リコンビナントhCGが0.1IU/Lのときはテストラインの発色は確認されなかった。
以上の結果から、前記蛍光シリカ粒子を用いた前記テストストリップはリコンビナントhCGが0.2IU/L以上の場合に蛍光検出装置で判定が可能であることが分かる。
【符号の説明】
【0057】
1 標的物質(被検物質)
2 蛍光標識体
2a 蛍光微粒子
2b 試験用結合性物質
3 吸光標識体
3a 吸光微粒子
3b 参照用結合性物質
4 試験用捕捉性物質
5 参照用捕捉性物質
6 筐体
61 検出開口部
62 検体導入開口部
6a 筐体上部
6b 筐体下部
80 平面試験片(テストストリップ)
8a サンプルパッド
8b コンジュゲートパッド
8c メンブレン
8d 吸収パッド
100 長尺試験体
nr 参照領域(コントロールライン)
nt 試験領域(テストライン)
L ラテラルフロー方向
S 険体
【特許請求の範囲】
【請求項1】
イムノクロマトグラフィー用の平面試験片と、蛍光微粒子と、吸光微粒子とを組み合わせて具備する試験キットであって、
前記平面試験片は試験領域と参照領域を有し、
前記蛍光微粒子には標的物質に対する結合性が付与され、該標的物質は前記試験領域の試験用捕捉性物質との結合性を有し、一方、前記吸光微粒子は前記参照領域の参照用捕捉性物質に対する結合性が付与されたイムノクロマトグラフィー用試験キット。
【請求項2】
前記蛍光微粒子に、標的物質に対して結合性を有する試験用結合性物質が導入されている請求項1に記載のキット。
【請求項3】
前記吸光微粒子に、前記参照用捕捉性物質に対して結合性を有する参照用結合性物質が導入されている請求項1又は2に記載のキット。
【請求項4】
前記蛍光微粒子及び吸光微粒子の一方又は両方がシリカ微粒子からなる請求項1〜3のいずれかに記載のキット。
【請求項5】
前記蛍光微粒子及び吸光微粒子の一方又は両方が平均粒径20〜1000nmである請求項1〜4のいずれかに記載のキット。
【請求項6】
イムノクロマトグラフィー用の平面試験片と、標的物質に対する結合性が付与された蛍光微粒子と、前記試験片の参照領域にある参照用捕捉性物質に対する結合性が付与された吸光微粒子とを準備し、
前記蛍光微粒子と、前記吸光微粒子とをあらかじめ前記試験片に付与しておき、前記試験片に標的物質を付与して前記蛍光微粒子と結合させ、該蛍光微粒子を平面試験片内で移行させ、その試験領域にある試験用捕捉性物質と前記蛍光微粒子とを前記標的物質を介して結合させ、他方、前記吸光微粒子を前記試験片の参照領域にある参照用捕捉性物質と結合させ、
前記試験領域の蛍光微粒子からの蛍光発光と、前記参照領域の吸光微粒子の吸光状態とから前記標的物質の検出を行うイムノクロマトグラフィーによる検出方法。
【請求項7】
前記蛍光微粒子及び吸光微粒子の一方又は両方がシリカ微粒子からなる請求項6に記載の検出方法。
【請求項8】
前記蛍光微粒子及び吸光微粒子の一方又は両方が平均粒径20〜1000nmである請求項6又は7に記載の検出方法。
【請求項9】
蛍光微粒子と吸光微粒子とを含む、イムノクロマトグラフィーに用いられる標識試薬であって、
前記蛍光微粒子には標的物質に対する結合性が付与され、該標的物質は試験片の試験領域の試験用捕捉性物質との結合性を有し、一方、前記吸光微粒子には試験片の参照領域の参照用捕捉性物質に対する結合性が付与された標識試薬。
【請求項10】
前記蛍光微粒子に、標的物質に対して結合性を有する試験用結合性物質が導入されている請求項9に記載の標識試薬。
【請求項11】
前記吸光微粒子に、前記参照用捕捉性物質に対して結合性を有する参照用結合性物質が導入されている請求項9又は10に記載の標識試薬。
【請求項12】
前記蛍光微粒子及び吸光微粒子の一方又は両方がシリカ微粒子からなる請求項9〜11のいずれか1項に記載の標識試薬。
【請求項13】
前記蛍光微粒子及び吸光微粒子の一方又は両方が平均粒径20〜1000nmである請求項9〜12のいずれか1項に記載の標識試薬。
【請求項1】
イムノクロマトグラフィー用の平面試験片と、蛍光微粒子と、吸光微粒子とを組み合わせて具備する試験キットであって、
前記平面試験片は試験領域と参照領域を有し、
前記蛍光微粒子には標的物質に対する結合性が付与され、該標的物質は前記試験領域の試験用捕捉性物質との結合性を有し、一方、前記吸光微粒子は前記参照領域の参照用捕捉性物質に対する結合性が付与されたイムノクロマトグラフィー用試験キット。
【請求項2】
前記蛍光微粒子に、標的物質に対して結合性を有する試験用結合性物質が導入されている請求項1に記載のキット。
【請求項3】
前記吸光微粒子に、前記参照用捕捉性物質に対して結合性を有する参照用結合性物質が導入されている請求項1又は2に記載のキット。
【請求項4】
前記蛍光微粒子及び吸光微粒子の一方又は両方がシリカ微粒子からなる請求項1〜3のいずれかに記載のキット。
【請求項5】
前記蛍光微粒子及び吸光微粒子の一方又は両方が平均粒径20〜1000nmである請求項1〜4のいずれかに記載のキット。
【請求項6】
イムノクロマトグラフィー用の平面試験片と、標的物質に対する結合性が付与された蛍光微粒子と、前記試験片の参照領域にある参照用捕捉性物質に対する結合性が付与された吸光微粒子とを準備し、
前記蛍光微粒子と、前記吸光微粒子とをあらかじめ前記試験片に付与しておき、前記試験片に標的物質を付与して前記蛍光微粒子と結合させ、該蛍光微粒子を平面試験片内で移行させ、その試験領域にある試験用捕捉性物質と前記蛍光微粒子とを前記標的物質を介して結合させ、他方、前記吸光微粒子を前記試験片の参照領域にある参照用捕捉性物質と結合させ、
前記試験領域の蛍光微粒子からの蛍光発光と、前記参照領域の吸光微粒子の吸光状態とから前記標的物質の検出を行うイムノクロマトグラフィーによる検出方法。
【請求項7】
前記蛍光微粒子及び吸光微粒子の一方又は両方がシリカ微粒子からなる請求項6に記載の検出方法。
【請求項8】
前記蛍光微粒子及び吸光微粒子の一方又は両方が平均粒径20〜1000nmである請求項6又は7に記載の検出方法。
【請求項9】
蛍光微粒子と吸光微粒子とを含む、イムノクロマトグラフィーに用いられる標識試薬であって、
前記蛍光微粒子には標的物質に対する結合性が付与され、該標的物質は試験片の試験領域の試験用捕捉性物質との結合性を有し、一方、前記吸光微粒子には試験片の参照領域の参照用捕捉性物質に対する結合性が付与された標識試薬。
【請求項10】
前記蛍光微粒子に、標的物質に対して結合性を有する試験用結合性物質が導入されている請求項9に記載の標識試薬。
【請求項11】
前記吸光微粒子に、前記参照用捕捉性物質に対して結合性を有する参照用結合性物質が導入されている請求項9又は10に記載の標識試薬。
【請求項12】
前記蛍光微粒子及び吸光微粒子の一方又は両方がシリカ微粒子からなる請求項9〜11のいずれか1項に記載の標識試薬。
【請求項13】
前記蛍光微粒子及び吸光微粒子の一方又は両方が平均粒径20〜1000nmである請求項9〜12のいずれか1項に記載の標識試薬。
【図1】


【図2】




【図2】


【公開番号】特開2013−53869(P2013−53869A)
【公開日】平成25年3月21日(2013.3.21)
【国際特許分類】
【出願番号】特願2011−190759(P2011−190759)
【出願日】平成23年9月1日(2011.9.1)
【出願人】(000005290)古河電気工業株式会社 (4,457)
【Fターム(参考)】
【公開日】平成25年3月21日(2013.3.21)
【国際特許分類】
【出願日】平成23年9月1日(2011.9.1)
【出願人】(000005290)古河電気工業株式会社 (4,457)
【Fターム(参考)】
[ Back to top ]

