イムノクロマトグラフ検査方法および装置
【課題】試薬による呈色状態を精度良く測定することができるイムノクロマトグラフ検査方法を得る。
【解決手段】担体に保持された試薬と検体とを反応させ、その試薬の部分をカメラ42により撮像して画像信号を得、その画像信号に基づいて試薬の呈色状態を測定して、検体に関する検査を行うイムノクロマトグラフ検査方法において、前記画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけるとともに、前記画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけ、前記オープニング処理の各々にかけられた後の画像信号の間で減算を行って得た差分信号に基づいて呈色状態を測定する。
【解決手段】担体に保持された試薬と検体とを反応させ、その試薬の部分をカメラ42により撮像して画像信号を得、その画像信号に基づいて試薬の呈色状態を測定して、検体に関する検査を行うイムノクロマトグラフ検査方法において、前記画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけるとともに、前記画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけ、前記オープニング処理の各々にかけられた後の画像信号の間で減算を行って得た差分信号に基づいて呈色状態を測定する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、イムノクロマトグラフ法を利用した検査方法および装置に関するものである。
【背景技術】
【0002】
近年、被験物質を含有する可能性のある検体(試料)を担体に保持させ、免疫学的測定等のアッセイ法を用いてこの被験物質について簡便かつ迅速に検査するアッセイ用デバイスが数多く開発されており、体外診断薬や毒物等の検査のための各種デバイスも市販されている。このようなデバイスの一例として、特許文献1に示すようなイムノクロマトグラフ法を利用したものが挙げられる。イムノクロマトグラフ法を利用したデバイスを用いる場合は、検体溶液を担体に保持させた後、早いものであれば約5〜10分間静置するだけで検査結果が得られる。そのため、免疫学的検査等のアッセイ法を用いた検査手法は、簡便かつ迅速な検査手法として、例えば病院における臨床検査や研究室における検定試験等で広く採用されている。
【0003】
特に、医院や診療所あるいは在宅医療等の診療現場においては、臨床検査の専門家によらず簡便に検査を行うPOCT(Point of Care Testing)診療向けの検査装置として、イムノクロマトグラフ検査装置(イムノクロマトリーダー)が多く用いられている。このイムノクロマトグラフ検査装置は、装填されたデバイスの試薬の呈色状態を高感度に測定して、目視判定困難な低呈色状態においても高感度かつ信頼性の高い検査を行うことを可能とする。特許文献2には、この種の検査装置の一例が示されている。
【0004】
上述したような検査方法においては、極く微量の被験物質を高感度で検出可能とすることが求められている。そのような要求に応える検査方法として、例えば特許文献3に示される増幅(増感)処理を行うものが公知となっている。この方法は、担体上に被験物質を展開した後に、洗浄液を送液することによって、担体上の反応部位に特異的な結合により捕捉した標識物質以外を洗浄し、その後増感液を担体上に送液して増感することにより、微量の被験物質を高感度で検出可能としたものである。
【0005】
なお上記増感処理は、必要に応じて行うことができる。すなわち、通常の処理で試薬の呈色状態が測定できた場合はそこで測定を終了し、通常の処理では呈色状態が測定不可能であった場合は、さらに増感処理を行ってから呈色状態を測定するようにしてもよい。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2008−139297号公報
【特許文献2】特開2009−133813号公報
【特許文献3】特開2009−287952号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
以上述べたようなイムノクロマトグラフ検査装置においては、検体と反応した後の試薬の部分を撮像して画像信号を得、その画像信号に基づいて、検体との反応による試薬の呈色状態を測定することが多い。しかしそのようにする場合は、試薬部分の粒状性等に起因して画像信号にノイズが多く含まれ、そのため、呈色状態を精度良く測定することが困難になることがある。
【0008】
そこで本発明は、そのようなノイズの影響を排除して、呈色状態を精度良く測定することができるイムノクロマトグラフ検査方法および装置を提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明による一つのイムノクロマトグラフ検査方法は、前述したように、
担体に保持された試薬と検体とを反応させ、
その試薬の部分を撮像して画像信号を得、
その画像信号に基づいて前記反応による試薬の呈色状態を測定して、検体に関する検査を行うイムノクロマトグラフ検査方法において、
前記画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけるとともに、
前記画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけ、
前記オープニング処理の各々にかけられた後の画像信号の間で減算を行って差分信号を求め、
この差分信号に基づいて前記呈色状態を測定することを特徴とするものである。
【0010】
また、本発明による別のイムノクロマトグラフ検査方法は、
担体に保持された試薬と検体とを反応させ、
その試薬の部分を撮像して画像信号を得、
その画像信号に基づいて前記反応による試薬の呈色状態を測定して、検体に関する検査を行うイムノクロマトグラフ検査方法において、
前記画像信号をレベル反転処理にかけ、
そのレベル反転処理後の画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のクロージング処理にかけるとともに、
前記レベル反転処理後の画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のクロージング処理にかけ、
前記クロージング処理の各々にかけられた後の画像信号の間で減算を行って差分信号を求め、
この差分信号に基づいて前記呈色状態を測定することを特徴とするものである。
【0011】
なお上記の「信号変化幅」とは、画像信号の時間軸上での変化幅ではなく、呈色した試薬部分を撮像して得られた画像信号を変化させている試薬部分の二端間の距離を意味するものである。
【0012】
また本発明によるイムノクロマトグラフ検査方法においては、前記試薬として、所定幅をもって担体に帯状に保持された試薬を用いることが望ましい。
【0013】
また本発明によるイムノクロマトグラフ検査方法においては、前記信号変化幅以下のサイズとされた構造要素として、前記画像信号の強度が高いほどより矩形的な形状で、画像信号の強度が低いほどより円弧的な形状とされたものを用いることが望ましい。
【0014】
また、上記信号変化幅以下のサイズとされた構造要素は、左右対称性が崩れた形状とされてもよい。
【0015】
また、前記信号変化幅以下のサイズとされた構造要素としては、サイズが小さくなり過ぎるとノイズの影響を受けやすくなることから、できるだけ信号変化幅に近いサイズのものが好ましく、現実上は該信号変化幅の60%以上、さらに好ましくは80%以上のサイズのものを用いることが望ましい。
【0016】
それに対して、前記信号変化幅を上回るサイズとされた構造要素としては、該信号変化幅の1.2倍以上、さらに好ましくは1.5倍以上のサイズのものを用いることが現実上望ましい。
【0017】
ただし、上記信号変化幅以下のサイズとされた構造要素も、また信号変化幅を上回るサイズとされた構造要素も、好ましいサイズは試薬部分の幅に応じて適宜変わり得るものである。例えば試薬部分の幅が1mmである場合、前者の構造要素のサイズは0.1〜1mm程度、後者の構造要素のサイズは1mmを超えて1.5mm程度までが好ましい。
【0018】
一方、本発明による一つのイムノクロマトグラフ検査装置は、
試薬を保持した担体を装填する手段と、
検体と反応した後の前記試薬の部分を撮像して画像信号を得る撮像手段と、
前記画像信号に基づいて前記反応による試薬の呈色状態を測定する手段とを備えてなるイムノクロマトグラフ検査装置において、
前記画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけるとともに、前記画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけるモルフォロジー演算部と、
前記オープニング処理の各々にかけられた後の画像信号の間で減算を行って差分信号を求める減算処理部と、
この差分信号に基づいて前記呈色状態を測定する手段とが設けられたことを特徴とするものである。
【0019】
また、本発明による別のイムノクロマトグラフ検査装置は、
試薬を保持した担体を装填する手段と、
検体と反応した後の前記試薬の部分を撮像して画像信号を得る撮像手段と、
前記画像信号に基づいて前記反応による試薬の呈色状態を測定する手段とを備えてなるイムノクロマトグラフ検査装置において、
前記画像信号にレベル反転処理を施す手段と、
前記レベル反転処理後の画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のクロージング処理にかけるとともに、前記レベル反転処理後の画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のクロージング処理にかけるモルフォロジー演算部と、
前記クロージング処理の各々にかけられた後の画像信号の間で減算を行って差分信号を求める減算処理部と、
この差分信号に基づいて前記呈色状態を測定する手段とが設けられたことを特徴とするものである。
【発明の効果】
【0020】
まず、本発明において適用されるモルフォロジー演算処理について説明する。モルフォロジー(Morphology)演算処理とは、モフォロジーまたはモーフォロジー演算処理とも称され、一般的にはN次元空間における集合論として展開されるが、2次元空間である画像へ適用される場合が多い(特開平8-272961号、同9-248291号、同9-91421号公報等参照)。以下、このモルフォロジー演算処理を、本発明のように濃淡画像を処理対象とする場合について簡単に説明する。
【0021】
濃淡画像を、座標(x,y)の点が濃度値f(x,y)に相当する高さをもつ空間とみなし、図8に示すように、この断面に相当する1次元の関数f(x)を考える。モルフォロジー演算処理に用いる構造要素gは次式(1)に示すように、原点について対称な対称関数であり、
【数1】

【0022】
定義域内で値が0で、その定義域Gが下記式(2)であるとする。
【数2】

【0023】
このとき、モルフォロジー演算の基本形は下式(3)〜(6)に示すように、非常に簡単な演算となる。
【数3】

【0024】
すなわち、ダイレーション(dilation)処理は、注目画素を中心とした、±m(構造要素Bに応じて決定される値であって、図8中のマスクサイズに相当)の幅の範囲内の最大値を探索する処理であり(同図(A)参照)、一方、エロージョン(erosion )処理は、注目画素を中心とした、±mの幅の範囲内の最小値を探索する処理である(同図(B)参照)。
【0025】
またオープニング(opening )処理は、エロージョン処理後にダイレーション処理を行う処理、すなわち最小値の探索の後に最大値を探索する処理であり、クロージング(closing )処理は、ダイレーション処理後にエロージョン処理を行う処理、すなわち最大値の探索の後に最小値を探索する処理に相当する。つまりオープニング処理は、低濃度側から濃度曲線f(x)を滑らかにし、マスクサイズ2mより空間的に狭い範囲で変動する凸状の濃度変動部分(周囲部分よりも濃度が高い部分)を抑制することに相当する(同図(C)参照)。一方、クロージング処理は、高濃度側から濃度曲線f(x)を滑らかにし、マスクサイズ2mより空間的に狭い範囲で変動する凹状の濃度変動部分(周囲部分よりも濃度が低い部分)を抑制することに相当する(同図(D)参照)。
【0026】
ここで、濃度の高いもの程大きな値となる高濃度高信号レベルの信号の場合においては、濃度値f(x)を示す画像信号値が高輝度高信号レベルの場合に対して大小関係が逆転するため、高濃度高信号レベルの信号に対するダイレーション処理と高輝度高信号レベルに対するエロージョン処理(同図(B))とは一致し、高濃度高信号レベルの信号に対するエロージョン処理と高輝度高信号レベルに対するダイレーション処理(同図(A))とは一致し、高濃度高信号レベルの信号に対するオープニング処理と高輝度高信号レベルに対するクロージング処理(同図(D))とは一致し、高濃度高信号レベルの信号に対するクロージング処理と高輝度高信号レベルに対するオープニング処理(同図(C))とは一致する。
【0027】
そして、このように原画像を表す画像信号に対して、モルフォロジー演算処理によるオープニング処理もしくはクロージング処理を施すことにより、画像から粒状(画像信号としてのノイズを意味する)を抑制または除去することができる(小畑「モルフォロジー」(コロナ社刊)等参照)。
【0028】
本発明のイムノクロマトグラフ検査方法においては、検体と反応した試薬の部分を示す画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけるとともに、上記画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけている。そこで、元の画像信号が例えば図10(A)に示すものであるとすると、前者のオープニング処理後の画像信号は平滑化された上で同図(B)のようなものとなり、一方、後者のオープニング処理後の画像信号は平滑化された上で同図(C)のようなものとなる(なお、それらの図におけるaは試薬部分を示す信号成分、bは後述するコントロールライン等の検体検査には直接関与しない部分を示す信号成分である)。つまり、前者のオープニング処理では、試薬部分による信号変化幅D以下のサイズとされた構造要素を用いているので、オープニング処理後も信号成分aはそのまま残り、それに対して後者のオープニング処理では、上記信号変化幅Dよりも大きいサイズとされた構造要素を用いているので、オープニング処理後に信号成分aは消去されることになる。
【0029】
したがって、上記2つのオープニング処理の各々にかけられた後の画像信号間で減算処理を行うと、それによって得られる差分信号は同図(D)に示すようなもの、つまり、試薬部分を示す信号成分aが明瞭に残ったものとなる。そこでこの差分信号を用いれば、試薬部分の呈色により変化している信号成分aが微弱であっても、元の画像信号に含まれるノイズの影響を除いて、試薬部分の呈色状態を精度良く測定可能となる。
【0030】
なお、試薬部分を示す信号成分aは、元の画像信号の強度が高いほどより矩形的で、この強度が低いほどより円弧的な形状となる。したがって、本発明のイムノクロマトグラフ検査方法において特に、信号変化幅以下のサイズとされた構造要素として、画像信号の強度が高いほどより矩形的な形状で、画像信号の強度が低いほどより円弧的な形状とされたものを用いる場合、その構造要素を用いたオープニング処理後の画像信号は、呈色による画像信号の変化をより明確に残すものとなる。そこでこの場合は、前記差分信号も呈色による変化をより明確に残すものとなるので、呈色状態の測定精度がさらに高いものとなる。
【0031】
また、試薬部分を示す信号成分aは、特に元の画像信号の強度が低いときに、左右対称性が崩れた形状となる傾向が有る。そこで、元の画像信号の左右対称性が崩れている場合はそれに合わせて、信号変化幅以下のサイズとされた構造要素として左右対称性が崩れた形状のものを適用すれば、ノイズの影響をより確実に排除することが可能になる。元の画像信号の左右対称性は、検査装置ごとに固有の傾向を示すことが多いので、その傾向を予め調べておけば、構造要素の崩れた左右対称性を画像信号の崩れた左右対称性と合わせることができる。
【0032】
また画像信号の強度は、試薬の塗布量が少ない場合に低くなりがちであるが、そのように低塗布量の場合は、一般に試薬を一様に塗布することが難しい。そこで低塗布量の場合は一様な塗布を求めずに、逆に試薬の塗布量に所定の分布を持たせて、画像信号の左右対称性が所定の傾向を持って崩れるようにするのが望ましい。そのようにすれば、その傾向を予め把握しておくことにより、構造要素の崩れた左右対称性を、画像信号の崩れた左右対称性に良く合致するように設定することができる。
【0033】
以上のようにして試薬部分の呈色状態を精度良く測定できれば、それに基づく検体の検査も、高精度で信頼性が高いものとなる。
【0034】
一方、本発明によるイムノクロマトグラフ検査装置は、前述した通りの試薬を保持した担体を装填する手段と、撮像手段と、画像信号に基づいて試薬の呈色状態を測定する手段と、モルフォロジー演算部と、差分信号を求める減算処理部と、この差分信号に基づいて呈色状態を測定する手段とを有するものであるので、この装置によれば、本発明のイムノクロマトグラフ検査方法を実施することができる。
【図面の簡単な説明】
【0035】
【図1】本発明の一実施形態によるイムノクロマトグラフ検査装置を示す斜視図
【図2】上記検査装置の一部破断側面図
【図3】上記検査装置の電気的構成を示すブロック図
【図4】上記検査装置の一部を示す正面図
【図5】上記検査装置に用いられたカートリッジの一状態を示す一部破断平面図
【図6】上記カートリッジの別の状態を示す一部破断平面図
【図7】上記カートリッジのさらに別の状態を示す一部破断平面図
【図8】モルフォロジー演算処理を説明する説明図
【図9】上記検査装置における検査処理の流れを示すフローチャート
【図10】本発明による効果を説明する説明図
【発明を実施するための形態】
【0036】
以下、図面を参照して本発明の実施形態を詳細に説明する。図1は、本発明の一実施形態によるイムノクロマトグラフ検査装置1の斜視形状を、図2はその一部破断側面形状を、そして図3はその電気的構成を示すものである。まず図1および図2を参照して、本装置の基本構成について説明する。
【0037】
それらの図に示されるようにイムノクロマトグラフ検査装置1は、前面に開口10aを有する筐体10と、筐体10の上面に配置された表示部11と、この表示部11に表示されたメニューの操作を行うための操作部12と、電源スイッチ13と、イムノクロマトグラフ用カートリッジ20を装置内部に装填するためのカートリッジ装填部14とを有している。また筐体10の内部には、カートリッジ装填部14を図2中で左右方向に移動自在に案内するレール15と、後述する洗浄液ポット27および増感液ポット28をそれぞれ押し潰すための押圧部30、34と、カートリッジ20から情報を取得する第1の測定部40および第2の測定部50とを有している。
【0038】
上記カートリッジ装填部14は、レール15に沿って自動あるいは手動により移動自在とされている。そして、その大部分が開口10aを通過して筐体10の外に出されたとき、その上に、後述するようにして検査溶液が供給されたカートリッジ20が載置される。その後このカートリッジ装填部14は、図2に示すように筐体10の内部に押し込まれ、それによりカートリッジ20がイムノクロマトグラフ検査装置1の内部に取り込まれる。
【0039】
図4は、上記押圧部30、34の部分を、図2中の左方側から見た状態を示す正面図である。なおここでは、カートリッジ20を破断して示してある。以下、この図4を参照して、押圧部30、34について説明する。押圧部30は、軸31aの周りをシーソー状に回動自在とされたアーム31と、このアーム31の先端下部に固定された押圧片32と、アーム31の後端下側に配置されたカム33とを有している。カム33は、モータ38によって回転される駆動軸39に、例えば図示外の電磁クラッチ等を介して接断自在に連結されている。このカム33が回転するとアーム31の後端が押し上げられて先端の押圧片32が下降動する。もう一つの押圧部34もアーム35、押圧片36およびカム37を有して、押圧部30と同様に構成されている。
【0040】
ここで押圧部30の押圧片32と、押圧部34の押圧片36はそれぞれ、カートリッジ20が筐体10の中の所定位置に配置されたとき、キット内部に配置されている洗浄液ポット27、増感液ポット28の直上位置に来るように配設されている。
【0041】
図5は、上記カートリッジ20の上面部を破断して示す平面図であり、以下、この図5も参照してカートリッジ20について説明する。カートリッジ20は、試薬を帯状に担持したテストラインA、試薬を帯状に担持したテストラインBおよび帯状のコントロールラインCを有する不溶性担体21と、不溶性担体21を収容するキットケース22と、不溶性担体21に検体溶液を注入するためにケース上面に形成された溶液注入口23と、不溶性担体21の検査部位(テストラインA、BおよびコントロールラインCの部分)を観察するための観察窓24とを備えている。キットケース22の上面には情報表示部25が設けられている。なおカートリッジ装填部14にも、上記観察窓24とほぼ整合する観察窓14aが設けられている。
【0042】
上記不溶性担体21は、固定化された標識物質を有するものである。またテストラインAおよびBはそれぞれ、検体(被験物質)に対する特異的結合物質が試薬として固定されたものであり、コントロールラインCは測定の終了時を判断するためのものである。
【0043】
またこのカートリッジ20の内部には、不溶性担体21を間に挟む状態にして、送液用不溶性担体72および吸収用不溶性担体73が配設されている。そして送液用不溶性担体72の上方位置には前述した洗浄液ポット27が固定され、不溶性担体21のコントロールラインC側の端部の上方位置には増感液ポット28が固定されている。なおカートリッジ20のケース22の上面部分は、前述の押圧片32、36によって上から押されたとき、容易に変形してそれぞれ洗浄液ポット27、増感液ポット28が潰されるのを許容するようになっている。
【0044】
第1の測定部40は、カートリッジ20の観察窓24を通して検査部位(テストラインA、BおよびコントロールラインCの部分)の呈色状態を測定するものである。第1の測定部40は、図2に示すようにカメラ42および光源44を備え、カートリッジ20が検査装置1に装填された際に、これらがカートリッジ20の下方から観察窓24に対向するように構成されている。そして、第1の測定部40によって取得された検査部位における光学的情報に基づいて、該検査部位の呈色状態として光学濃度および色度が算出される(この点については後述する)。
【0045】
なお上記光学濃度は、カートリッジ20の検査部位に入射した入射光の強度をI、検査部位からの反射光の強度をIrとしたとき、下記式で定義する。
【0046】
光学濃度=−log10(Ir/I)
また色度は、色相と彩度を数量的に表示したものであり、カメラで読み取ったRGB輝度信号から算出する。色度の表色系としては、一般的なCIE表色系を用いることができる。
【0047】
カメラ42は、例えば複数のフォトダイオードがライン状に配列された構成、あるいはエリアセンサからなるイメージセンサを有するもので、受光光量に応じた出力を生じる。カメラ42の受光範囲は、カートリッジ20の長手方向に延びた帯状範囲とされている。光源44は、例えばLEDが内蔵されたモジュールであり、白色光を発するように構成されている。なお光源44は、後述する増感処理の前後の色度の区別が付けば、例えば単色光を発するものであってもよい。また光源44は、複数のモジュールから構成される場合は、異なる波長の単色光を発する複数のモジュールを用いて構成することもできる。光源44から発せられる光は、カートリッジ20の長手方向の所定範囲を照明可能とされている。
【0048】
一方、第2の測定部50は、カートリッジ20の情報表示部25に照明光を照射し、情報表示部25に表示された情報を取得するものである。情報表示部25は、手書きまたはシール添付等により検査に関する情報が表示される。検査に関する情報とは例えば、被験物質を採取した患者に関する情報(氏名、年齢および性別等)および、検査に使用される試料・試薬に関する情報(検査対象となる検体、洗浄液および増感液等の名称等)等が挙げられる。情報を取得する方法は特に制限されず、情報表示部25をそのまま画像化したり、バーコード化された情報から読み取ったりすることができる。
【0049】
この第2の測定部50は、図2に示すようにカメラ52および光源54を備え、カートリッジ20が検査装置1に装填された際に、これらがカートリッジ20の上方から情報表示部25に対向するように構成されている。そして、第2の測定部50によって取得された検査に関する情報と検査結果とが紐付けされて管理される。カメラ52および光源54の具体的な構成は、前述したカメラ42および光源44とそれぞれ同様である。
【0050】
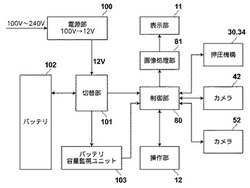
次に、本装置の電気的な構成について図3を参照して説明する。先に説明した表示部11、操作部12、モータ38等を含む押圧機構30、34、カメラ42、52(各々光源44、54を含む)は、同図に示す制御部80によって動作が制御される。また、本検査装置1は、例えば100〜240Vの商用電源を利用して作動可能であり、その商用電源を受け入れて12Vの直流電流に変換する電源部100と、この12Vの直流電流が入力される切替部101とを有している。また本検査装置1は、それとともに二次電池であるバッテリ102でも駆動可能とされており、このバッテリ102も上記切替部101に接続されている。切替部101は、商用電源が接続されているときは電源部100から供給される12Vの直流電流を、そして商用電源が接続されていないときはバッテリ102から供給される12Vの直流電流を各電装部品において使用するように切替を行う。
【0051】
また切替部101には、バッテリ102の残留電力量を検出する電池残量検出手段としてのバッテリ容量監視ユニット103が接続されている。一般に電池はその化学特性から、容量が低下してくると内部抵抗が大きくなって端子電圧が低下する特性があるので、その端子電圧を測定することで残留電力量を検出することができる。バッテリ容量監視ユニット103はこうしてバッテリ102の残留電力量を検出し続け、その残留電力量を示す信号を制御部80に入力する。
【0052】
次に、本実施形態の検査装置1による測定について説明する。本装置においては原則として、第1段階の測定と、それに続く第2段階の測定が行われる。第1段階の測定とは、後述する増感処理を行わないで前記検査部位の呈色状態を測定するものであり、また第2段階の測定とは、後述する増感処理を行ってから検査部位の呈色状態を測定するものである。
【0053】
次に具体的な測定の操作手順について説明する。
【0054】
《第1段階の測定》
この第1段階の測定においては、まず図5に示すように、例えば検査装置1の外においてカートリッジ20の溶液注入口23から検体溶液90が注入される。その後このカートリッジ20は前述の通りにして検査装置1内に配置され、カートリッジ20の検査部位(テストラインA、BおよびコントロールラインCの部分)の光学濃度および色度を算出するために、その部位の像がカメラ42によって撮像される。図3に示す制御部80は、このカメラ42が出力する2次元画像信号を画像処理部81に入力させる。
【0055】
以下、画像処理部81における画像処理と、それに続く検査結果の表示処理について、その処理の流れを示す図9も参照して説明する。まず画像処理部81には、2次元画像を示す上記画像信号が入力される(図9のステップS1、以下同様)。画像処理部81は次に、図9に示す2つのオープニング処理(ステップS2およびS3)を行うが、そのためにまず上記2次元画像信号から1次元画像信号を生成する。
【0056】
この1次元画像信号とは、図5〜7に示すラインA、BおよびCを横切る1本の直線に沿った、不溶性担体21上の1次元濃度分布を示す信号である。その生成は、例えば上記2次元画像信号から、ラインA、BおよびCの中央位置付近を横切る1本の直線に沿った多数点についての画像信号を抽出したり、あるいはそのような直線およびそれと平行な何本かの直線に沿った多数点についての画像信号を抽出し、それらをラインA、BおよびCの並び方向位置(図5〜7の左右方向位置)が同じ点に関する画像信号どうしで足し合わせたり、さらにはその足し合わされた信号の平均値を求めたりすることによってなされる。
【0057】
その後画像処理部81は上記1次元画像信号に対して、モルフォロジー演算による信号検出用オープニング処理(ステップS2)並びに、モルフォロジー演算による信号検出の基準作成用オープニング処理(ステップS3)を行う。前者のオープニング処理は、先に図10を参照して説明した、呈色した試薬部分による信号変化幅D以下のサイズとされた構造要素を用いてなされるものである。また後者のオープニング処理は、同じく図10を参照して説明した、呈色した試薬部分による信号変化幅Dを上回るサイズとされた構造要素を用いてなされるものである。
【0058】
画像処理部81は、上記2つのオープニング処理にかけられた後の各1次元画像信号を内部メモリに一次記憶させた後、次にそれらの画像信号を、疾患の有無等を検出する画像信号を生成する処理にかける(ステップS4)。この検出用画像信号生成処理は、先に図10を参照して説明した減算処理であり、それにより、図10(D)に示すような差分信号が得られる。この差分信号によれば、前述したように元の2次元画像信号に含まれるノイズの影響を除いて、試薬部分の呈色状態を精度良く測定可能となる。その詳しい理由は、先に図10を参照して説明した通りである。
【0059】
画像処理部81は上記差分信号に基づいて、試薬部分の呈色状態つまりその部分の光学濃度および色度を算出し、それらの値を、あるいはそれらの値から判定される疾患の有無等を、検出結果として表示部11に表示させる(ステップS5)。上述のように試薬部分の呈色状態を精度良く測定可能であれば、この検出結果は信頼性が高いものとなる。
【0060】
なお、以上の説明から明らかなように本実施形態では、モルフォロジー演算部、差分信号を求める減算処理部、および呈色状態を測定する手段が画像処理部81から構成されている。
【0061】
また、上記信号検出用オープニング処理(ステップS2)に用いられる構造要素は、試薬部分の形状に応じた形状とすることが好ましい。それに対して、信号検出の基準作成用オープニング処理(ステップS3)に用いられる構造要素は、基準作成用の処理において、前記差分信号つまり信号強度の差分値のベースとなるので、常に一定の形状であることが好ましい。
【0062】
《第2段階の測定》
この第2段階の測定においては、まず図2、4に示した押圧部30が駆動されて、そのアーム31の先端が下降動され、押圧片32がカートリッジ20内の洗浄液ポット27を外部から押し潰す。それにより図6に示すように、洗浄液ポット27に貯えられていた洗浄液91が不溶性担体21の検査部位を洗浄する。このとき洗浄液91は、送液用不溶性担体72で十分に拡がってから、不溶性担体21、吸収用不溶性担体73の順に送液される。
【0063】
次に、図2、4に示した押圧部34が駆動されて、そのアーム35の先端が下降動され、押圧片36がカートリッジ20内の増感液ポット28を外部から押し潰す。それにより図7に示すように、増感液ポット28に貯えられていた増感液92が不溶性担体21の検査部位に送液されて、増感処理がなされる。なおこの増感液92および上記洗浄液91については、前述した特許文献3に詳しい開示がなされており、本発明においてもそれらを適用することができる。
【0064】
この増感処理がなされた後、カートリッジ20の検査部位の像が、上述と同様にカメラ42によって撮像される。図3に示す制御部80は、このカメラ42が出力する2次元画像信号を画像処理部81に入力させる。画像処理部81は、この2次元画像信号に対して、前記第1段階の測定において行ったのと同じ処理を施す。それによりこの場合も、最終的に得られる差分信号に基づいて、試薬部分の呈色状態を精度良く測定可能となる。
【0065】
画像処理部81は上記差分信号に基づいて、試薬部分の呈色状態つまりその部分の光学濃度および色度を算出し、それらの値を、あるいはそれらの値から判定される疾患の有無等を、検出結果として表示部11に表示させる。この場合も、上述のように試薬部分の呈色状態を精度良く測定可能であるから、信頼性の高い検出結果を得ることができる。
【0066】
なお、以上説明した実施形態においては、2次元画像信号から1次元画素信号を生成し、その1次元画素信号に対して1次元モルフォロジー演算処理を行っているが、2次元画像信号に対して2次元モルフォロジー演算処理を行い、その処理後の2次元画像信号から1次元画像信号を生成するようにしてもよい。
【0067】
また、以上説明した実施形態においては、試薬の部分を撮像して得た画像信号に対してモルフォロジー演算のオープニング処理をかけているが、高濃度高信号レベルの信号に対するオープニング処理と高輝度高信号レベルに対するクロージング処理とは一致するので、試薬の部分を撮像して得た画像信号をレベル反転処理にかけ、その反転処理後の画像信号に対してモルフォロジー演算のクロージング処理をかけるようにしても、上記実施形態におけるのと同じ作用、効果が得られる。そのようにするためには、図3に示す画像処理部81に、画像信号をレベル反転処理する機能と、クロージング処理を行う機能を与えればよい。
【0068】
ここで、上記測定に関わる事項について以下簡単に説明する。
【0069】
(検体溶液)
本発明の検査装置を用いて分析することのできる検体溶液としては、被験物質(天然物、毒素、ホルモンまたは農薬等の生理活性物質あるいは環境汚染物質等)を含む可能性のあるものである限り、特に限定されるものではなく、例えば、生物学的試料、特には動物(特にヒト)の体液(例えば、血液、血清、血漿、髄液、涙液、汗、尿、膿、鼻水、または喀痰)若しくは排泄物(例えば、糞便)、臓器、組織、粘膜や皮膚、それらを含むと考えられる搾過検体(スワブ)、うがい液、または動植物それ自体若しくはそれらの乾燥体を後述の希釈液で希釈したもの等を挙げることができる。
【0070】
検体溶液はそのままで、あるいは、検体溶液を適当な抽出用溶媒を用いて抽出して得られる抽出液の形で、さらには、この抽出液を適当な希釈剤で希釈して得られる希釈液の形、若しくは抽出液を適当な方法で濃縮した形で用いることができる。
【0071】
(標識物質)
本発明で使用することができる標識物質としては、一般的なイムノクロマトグラフ法で用いられるような金属微粒子(または金属コロイド)、着色ラテックス粒子、酵素など、有色で視認できる、または、反応により検査できるようになる標識物であれば特に限定されることなく用いることができるが、標識物質を触媒とした金属イオンの還元反応によって、標識物質への金属の沈着でシグナルを増感する場合には、その触媒活性の観点から金属微粒子が好ましい。
【0072】
その金属微粒子の材料としては、金属単体、金属硫化物、その他金属合金、または金属を含むポリマ−粒子標識を用いることができる。粒子(またはコロイド)の平均粒径は、1nm〜10μmの範囲にあることが好ましい。ここで、平均粒径とは、透過型電子顕微鏡(TEM)により実測された複数の粒子の径(粒子の最長径)の平均値である。より詳細には、金コロイド、銀コロイド、白金コロイド、鉄コロイド、水酸化アルミニウムコロイド、およびこれらの複合コロイドなどが挙げられ、好ましくは、金コロイド、銀コロイド、白金コロイド、およびこれらの複合コロイドであることが望ましい。特に、金コロイドと銀コロイドが適当な粒径において、金コロイドは赤色、銀コロイドは黄色を示し視認度が高いという観点からより好ましい。金コロイドを用いることにより、銀イオン含有化合物を用いた増感工程を行うことにより増感の前後で標識の色度が変化する(金コロイドは赤く呈色し、増感後は還元された銀イオンが金コロイドに沈着し黒くなる)ため、後述するようにこの変化を検査のエラー判定に用いることができるようになる。金属コロイドの平均粒径としては、約1〜500nmが好ましく、さらには1〜100nmがより好ましい。
【0073】
(特異的結合物質)
特異的結合物質としては、被検物質に対して親和性を持つものならば特に限定されることはなく例えば、被験物質が抗原である場合には当該抗原に対する抗体、被験物質がたんぱく質、金属イオンまたは低分子量有機化合物である場合にはこれらに対するアプタマー、被験物質がDNAやRNAなど核酸である場合にはこれらに対して相補的な配列を持つDNAやRNA等の核酸分子、被験物質がアビジンである場合にはビオチン、被験物質が特定のペプチドの場合にはこれに特異的に結合する錯体、等を挙げることができる。また、上記した例では特異的結合物質と被験物質との関係を入れ替えることもでき、例えば被験物質が抗体である場合には当該抗体に対する抗原を、特異的結合物質として用いることもできる。さらに、上記のような被検物質に対して親和性を持つ物質を一部に含有する化合物等を特異的結合物質として用いることもできる。
【0074】
上記抗体としては具体的に、その被験物質によって免疫された動物の血清から調製する抗血清、抗血清から精製された免疫グロブリン画分、その被験物質によって免疫された動物の脾臓細胞を用いる細胞融合によって得られるモノクローナル抗体、あるいは、それらの断片[例えば、F(ab’)2、Fab、Fab’、またはFv]を用いることができる。これらの抗体の調製は、常法により行うことができる。
【0075】
(不溶性担体)
不溶性担体21の材料は、多孔性であることが好ましく、例えば、ニトロセルロース膜、セルロース膜、アセチルセルロース膜、ポリスルホン膜、ポリエーテルスルホン膜、ナイロン膜、ガラス繊維、不織布、布、または糸等が好ましく挙げられる。
【0076】
クロマトグラフ担体には、被験物質に対する特異的結合物質を固定化させて検査ラインや所望によりコントロール部位が作製される。特異的結合物質は、特異的結合物質をクロマトグラフ担体の一部に物理的または化学的結合により直接固定化させてもよいし、特異的結合物質をラテックス粒子などの微粒子に物理的または化学的に結合させ、この微粒子をクロマトグラフ担体の一部にトラップさせて固定化させてもよい。
【0077】
(増感液)
増感液は、含まれる薬剤が標識物質や被験物質の触媒作用によって反応することにより、呈色あるいは発光する化合物などを生じ、シグナルの増感を起こすことができる溶液である。例えば、金属標識上で、物理現像により金属銀の析出を起こす銀イオン溶液である。詳細には、写真化学の分野での一般書物(例えば、「改訂写真工学の基礎-銀塩写真編-」(日本写真学会編、コロナ社)、「写真の化学」(笹井明、写真工業出版社)、「最新処方ハンドブック」(菊池真一他、アミコ出版社))に記載されているような、いわゆる現像液を用いることができる。例えば、増感液として銀イオン含有化合物を含む物理現像液を用いれば、銀イオンの還元剤により液中の銀イオンを、現像の核となるような金属コロイド等を中心に還元させることができる。
【0078】
また別の例としては、酵素反応を用いた例がある。例えば、ペルオキシダーゼ標識と過酸化水素の作用により色素となる、フェニレンジアミン化合物とナフトール化合物の溶液などが挙げられる。さらに、非特許文献「臨床検査 Vol.41 no.9 p.1020 H2O2−POD系を利用した染色」に記載されているような、西洋わさびペルオキシダーゼ検出の発色基質などでもよい。また、特開2009−156612号公報に記載の発色基質は特に好ましく用いることができる。なお、酵素の代わりに白金微粒子などの金属触媒を用いる系でもよい。
【0079】
別の酵素を用いた例としては、アルカリホスファターゼを標識とし、5−ブロモ−4クロロ−3−インドリル−リン酸二ナトリウム塩(BCIP)を基質として発色させるような系もある。以上、呈色する反応を代表に挙げたが、一般的にエンザイムイムノアッセイで用いられるような、酵素と基質の組み合わせであればなんでも良く、化学発光する基質であっても、蛍光を発する基質であってもよい。
【0080】
(銀イオン含有化合物)
銀イオン含有化合物としては、有機銀塩、無機銀塩、もしくは銀錯体を用いることができる。好ましくは、水などの溶媒に対して溶解度の高い銀イオン含有化合物であり、硝酸銀、酢酸銀、乳酸銀、酪酸銀、チオ硫酸銀などが挙げられる。特に好ましくは硝酸銀である。銀錯体としては、水酸基やスルホン基など水溶性基を有する配位子に配位された銀錯体が好ましく、ヒドロキシチオエーテル銀等が挙げられる。無機銀塩、もしくは銀錯体は、銀として一般に0.001モル/m2〜0.2モル/m2、好ましくは0.01モル/m2〜0.05モル/m2含有されることが好ましい。
【0081】
(銀イオンの還元剤)
銀イオンの還元剤は、銀イオンを銀に還元することができれば、無機・有機のいかなる材料、またはその混合物でも用いることができる。
【0082】
無機還元剤としては、Fe2+、V2+、Ti3+、などの金属イオンで原子価の変化し得る還元性金属塩、還元性金属錯塩を好ましく挙げることができる。無機還元剤を用いる際には、酸化されたイオンを錯形成するか還元して、除去するか無害化する必要がある。例えば、Fe2+を還元剤として用いる系では、クエン酸やEDTAを用いて酸化物であるFe3+の錯体を形成し、無害化することができる。本系ではこのような無機還元剤を用いることが好ましく、より好ましくはFe2+の金属塩が好ましい。
【0083】
なお、上記実施形態においては、呈色状態の増感方法として銀イオン含有化合物を還元剤で還元することにより標識物質を増感させる方法を用いたが、本発明における増感方法はこれに限定されない。増感液は、含まれる薬剤が標識物質や被験物質の触媒作用によって反応することにより、呈色あるいは発光する化合物などを生じ、シグナルの増感を起こすことができる溶液であればよく、例えば上記したような酵素を用いた用液などが挙げられる。
【0084】
また上記実施形態においては、アッセイ法としてイムノクロマトグラフ法について説明したが、本発明で適用するアッセイ法はこれに限定されない。いわゆる免疫反応を用いない系でもよく、例えば、抗体を用いずにDNAやRNAなどの核酸で被験物質を捕捉する系でもよいし、さらには被験物質に対する親和性を持つ別の小分子やペプチド、たんぱく質、錯体形成物質等、によって被験物質を捕捉する系であってもよい。
【符号の説明】
【0085】
1 イムノクロマトグラフ検査装置
10 筐体
11 表示部
12 操作部
13 電源スイッチ
14 カートリッジ装填部
20 イムノクロマトグラフ用カートリッジ
21 不溶性担体
22 カートリッジケース
23 溶液注入口
26 シート材
27 洗浄液ポット
28 増感液ポット
30、34 押圧部
32、36 押圧片
33、37 カム
38 モータ
40、50 測定部
87、88 刃
80 制御部
81 画像処理部
90 検体溶液
91 洗浄液
92 増感液
A、B テストライン
C コントロールライン
【技術分野】
【0001】
本発明は、イムノクロマトグラフ法を利用した検査方法および装置に関するものである。
【背景技術】
【0002】
近年、被験物質を含有する可能性のある検体(試料)を担体に保持させ、免疫学的測定等のアッセイ法を用いてこの被験物質について簡便かつ迅速に検査するアッセイ用デバイスが数多く開発されており、体外診断薬や毒物等の検査のための各種デバイスも市販されている。このようなデバイスの一例として、特許文献1に示すようなイムノクロマトグラフ法を利用したものが挙げられる。イムノクロマトグラフ法を利用したデバイスを用いる場合は、検体溶液を担体に保持させた後、早いものであれば約5〜10分間静置するだけで検査結果が得られる。そのため、免疫学的検査等のアッセイ法を用いた検査手法は、簡便かつ迅速な検査手法として、例えば病院における臨床検査や研究室における検定試験等で広く採用されている。
【0003】
特に、医院や診療所あるいは在宅医療等の診療現場においては、臨床検査の専門家によらず簡便に検査を行うPOCT(Point of Care Testing)診療向けの検査装置として、イムノクロマトグラフ検査装置(イムノクロマトリーダー)が多く用いられている。このイムノクロマトグラフ検査装置は、装填されたデバイスの試薬の呈色状態を高感度に測定して、目視判定困難な低呈色状態においても高感度かつ信頼性の高い検査を行うことを可能とする。特許文献2には、この種の検査装置の一例が示されている。
【0004】
上述したような検査方法においては、極く微量の被験物質を高感度で検出可能とすることが求められている。そのような要求に応える検査方法として、例えば特許文献3に示される増幅(増感)処理を行うものが公知となっている。この方法は、担体上に被験物質を展開した後に、洗浄液を送液することによって、担体上の反応部位に特異的な結合により捕捉した標識物質以外を洗浄し、その後増感液を担体上に送液して増感することにより、微量の被験物質を高感度で検出可能としたものである。
【0005】
なお上記増感処理は、必要に応じて行うことができる。すなわち、通常の処理で試薬の呈色状態が測定できた場合はそこで測定を終了し、通常の処理では呈色状態が測定不可能であった場合は、さらに増感処理を行ってから呈色状態を測定するようにしてもよい。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2008−139297号公報
【特許文献2】特開2009−133813号公報
【特許文献3】特開2009−287952号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
以上述べたようなイムノクロマトグラフ検査装置においては、検体と反応した後の試薬の部分を撮像して画像信号を得、その画像信号に基づいて、検体との反応による試薬の呈色状態を測定することが多い。しかしそのようにする場合は、試薬部分の粒状性等に起因して画像信号にノイズが多く含まれ、そのため、呈色状態を精度良く測定することが困難になることがある。
【0008】
そこで本発明は、そのようなノイズの影響を排除して、呈色状態を精度良く測定することができるイムノクロマトグラフ検査方法および装置を提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明による一つのイムノクロマトグラフ検査方法は、前述したように、
担体に保持された試薬と検体とを反応させ、
その試薬の部分を撮像して画像信号を得、
その画像信号に基づいて前記反応による試薬の呈色状態を測定して、検体に関する検査を行うイムノクロマトグラフ検査方法において、
前記画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけるとともに、
前記画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけ、
前記オープニング処理の各々にかけられた後の画像信号の間で減算を行って差分信号を求め、
この差分信号に基づいて前記呈色状態を測定することを特徴とするものである。
【0010】
また、本発明による別のイムノクロマトグラフ検査方法は、
担体に保持された試薬と検体とを反応させ、
その試薬の部分を撮像して画像信号を得、
その画像信号に基づいて前記反応による試薬の呈色状態を測定して、検体に関する検査を行うイムノクロマトグラフ検査方法において、
前記画像信号をレベル反転処理にかけ、
そのレベル反転処理後の画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のクロージング処理にかけるとともに、
前記レベル反転処理後の画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のクロージング処理にかけ、
前記クロージング処理の各々にかけられた後の画像信号の間で減算を行って差分信号を求め、
この差分信号に基づいて前記呈色状態を測定することを特徴とするものである。
【0011】
なお上記の「信号変化幅」とは、画像信号の時間軸上での変化幅ではなく、呈色した試薬部分を撮像して得られた画像信号を変化させている試薬部分の二端間の距離を意味するものである。
【0012】
また本発明によるイムノクロマトグラフ検査方法においては、前記試薬として、所定幅をもって担体に帯状に保持された試薬を用いることが望ましい。
【0013】
また本発明によるイムノクロマトグラフ検査方法においては、前記信号変化幅以下のサイズとされた構造要素として、前記画像信号の強度が高いほどより矩形的な形状で、画像信号の強度が低いほどより円弧的な形状とされたものを用いることが望ましい。
【0014】
また、上記信号変化幅以下のサイズとされた構造要素は、左右対称性が崩れた形状とされてもよい。
【0015】
また、前記信号変化幅以下のサイズとされた構造要素としては、サイズが小さくなり過ぎるとノイズの影響を受けやすくなることから、できるだけ信号変化幅に近いサイズのものが好ましく、現実上は該信号変化幅の60%以上、さらに好ましくは80%以上のサイズのものを用いることが望ましい。
【0016】
それに対して、前記信号変化幅を上回るサイズとされた構造要素としては、該信号変化幅の1.2倍以上、さらに好ましくは1.5倍以上のサイズのものを用いることが現実上望ましい。
【0017】
ただし、上記信号変化幅以下のサイズとされた構造要素も、また信号変化幅を上回るサイズとされた構造要素も、好ましいサイズは試薬部分の幅に応じて適宜変わり得るものである。例えば試薬部分の幅が1mmである場合、前者の構造要素のサイズは0.1〜1mm程度、後者の構造要素のサイズは1mmを超えて1.5mm程度までが好ましい。
【0018】
一方、本発明による一つのイムノクロマトグラフ検査装置は、
試薬を保持した担体を装填する手段と、
検体と反応した後の前記試薬の部分を撮像して画像信号を得る撮像手段と、
前記画像信号に基づいて前記反応による試薬の呈色状態を測定する手段とを備えてなるイムノクロマトグラフ検査装置において、
前記画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけるとともに、前記画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけるモルフォロジー演算部と、
前記オープニング処理の各々にかけられた後の画像信号の間で減算を行って差分信号を求める減算処理部と、
この差分信号に基づいて前記呈色状態を測定する手段とが設けられたことを特徴とするものである。
【0019】
また、本発明による別のイムノクロマトグラフ検査装置は、
試薬を保持した担体を装填する手段と、
検体と反応した後の前記試薬の部分を撮像して画像信号を得る撮像手段と、
前記画像信号に基づいて前記反応による試薬の呈色状態を測定する手段とを備えてなるイムノクロマトグラフ検査装置において、
前記画像信号にレベル反転処理を施す手段と、
前記レベル反転処理後の画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のクロージング処理にかけるとともに、前記レベル反転処理後の画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のクロージング処理にかけるモルフォロジー演算部と、
前記クロージング処理の各々にかけられた後の画像信号の間で減算を行って差分信号を求める減算処理部と、
この差分信号に基づいて前記呈色状態を測定する手段とが設けられたことを特徴とするものである。
【発明の効果】
【0020】
まず、本発明において適用されるモルフォロジー演算処理について説明する。モルフォロジー(Morphology)演算処理とは、モフォロジーまたはモーフォロジー演算処理とも称され、一般的にはN次元空間における集合論として展開されるが、2次元空間である画像へ適用される場合が多い(特開平8-272961号、同9-248291号、同9-91421号公報等参照)。以下、このモルフォロジー演算処理を、本発明のように濃淡画像を処理対象とする場合について簡単に説明する。
【0021】
濃淡画像を、座標(x,y)の点が濃度値f(x,y)に相当する高さをもつ空間とみなし、図8に示すように、この断面に相当する1次元の関数f(x)を考える。モルフォロジー演算処理に用いる構造要素gは次式(1)に示すように、原点について対称な対称関数であり、
【数1】

【0022】
定義域内で値が0で、その定義域Gが下記式(2)であるとする。
【数2】

【0023】
このとき、モルフォロジー演算の基本形は下式(3)〜(6)に示すように、非常に簡単な演算となる。
【数3】

【0024】
すなわち、ダイレーション(dilation)処理は、注目画素を中心とした、±m(構造要素Bに応じて決定される値であって、図8中のマスクサイズに相当)の幅の範囲内の最大値を探索する処理であり(同図(A)参照)、一方、エロージョン(erosion )処理は、注目画素を中心とした、±mの幅の範囲内の最小値を探索する処理である(同図(B)参照)。
【0025】
またオープニング(opening )処理は、エロージョン処理後にダイレーション処理を行う処理、すなわち最小値の探索の後に最大値を探索する処理であり、クロージング(closing )処理は、ダイレーション処理後にエロージョン処理を行う処理、すなわち最大値の探索の後に最小値を探索する処理に相当する。つまりオープニング処理は、低濃度側から濃度曲線f(x)を滑らかにし、マスクサイズ2mより空間的に狭い範囲で変動する凸状の濃度変動部分(周囲部分よりも濃度が高い部分)を抑制することに相当する(同図(C)参照)。一方、クロージング処理は、高濃度側から濃度曲線f(x)を滑らかにし、マスクサイズ2mより空間的に狭い範囲で変動する凹状の濃度変動部分(周囲部分よりも濃度が低い部分)を抑制することに相当する(同図(D)参照)。
【0026】
ここで、濃度の高いもの程大きな値となる高濃度高信号レベルの信号の場合においては、濃度値f(x)を示す画像信号値が高輝度高信号レベルの場合に対して大小関係が逆転するため、高濃度高信号レベルの信号に対するダイレーション処理と高輝度高信号レベルに対するエロージョン処理(同図(B))とは一致し、高濃度高信号レベルの信号に対するエロージョン処理と高輝度高信号レベルに対するダイレーション処理(同図(A))とは一致し、高濃度高信号レベルの信号に対するオープニング処理と高輝度高信号レベルに対するクロージング処理(同図(D))とは一致し、高濃度高信号レベルの信号に対するクロージング処理と高輝度高信号レベルに対するオープニング処理(同図(C))とは一致する。
【0027】
そして、このように原画像を表す画像信号に対して、モルフォロジー演算処理によるオープニング処理もしくはクロージング処理を施すことにより、画像から粒状(画像信号としてのノイズを意味する)を抑制または除去することができる(小畑「モルフォロジー」(コロナ社刊)等参照)。
【0028】
本発明のイムノクロマトグラフ検査方法においては、検体と反応した試薬の部分を示す画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけるとともに、上記画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけている。そこで、元の画像信号が例えば図10(A)に示すものであるとすると、前者のオープニング処理後の画像信号は平滑化された上で同図(B)のようなものとなり、一方、後者のオープニング処理後の画像信号は平滑化された上で同図(C)のようなものとなる(なお、それらの図におけるaは試薬部分を示す信号成分、bは後述するコントロールライン等の検体検査には直接関与しない部分を示す信号成分である)。つまり、前者のオープニング処理では、試薬部分による信号変化幅D以下のサイズとされた構造要素を用いているので、オープニング処理後も信号成分aはそのまま残り、それに対して後者のオープニング処理では、上記信号変化幅Dよりも大きいサイズとされた構造要素を用いているので、オープニング処理後に信号成分aは消去されることになる。
【0029】
したがって、上記2つのオープニング処理の各々にかけられた後の画像信号間で減算処理を行うと、それによって得られる差分信号は同図(D)に示すようなもの、つまり、試薬部分を示す信号成分aが明瞭に残ったものとなる。そこでこの差分信号を用いれば、試薬部分の呈色により変化している信号成分aが微弱であっても、元の画像信号に含まれるノイズの影響を除いて、試薬部分の呈色状態を精度良く測定可能となる。
【0030】
なお、試薬部分を示す信号成分aは、元の画像信号の強度が高いほどより矩形的で、この強度が低いほどより円弧的な形状となる。したがって、本発明のイムノクロマトグラフ検査方法において特に、信号変化幅以下のサイズとされた構造要素として、画像信号の強度が高いほどより矩形的な形状で、画像信号の強度が低いほどより円弧的な形状とされたものを用いる場合、その構造要素を用いたオープニング処理後の画像信号は、呈色による画像信号の変化をより明確に残すものとなる。そこでこの場合は、前記差分信号も呈色による変化をより明確に残すものとなるので、呈色状態の測定精度がさらに高いものとなる。
【0031】
また、試薬部分を示す信号成分aは、特に元の画像信号の強度が低いときに、左右対称性が崩れた形状となる傾向が有る。そこで、元の画像信号の左右対称性が崩れている場合はそれに合わせて、信号変化幅以下のサイズとされた構造要素として左右対称性が崩れた形状のものを適用すれば、ノイズの影響をより確実に排除することが可能になる。元の画像信号の左右対称性は、検査装置ごとに固有の傾向を示すことが多いので、その傾向を予め調べておけば、構造要素の崩れた左右対称性を画像信号の崩れた左右対称性と合わせることができる。
【0032】
また画像信号の強度は、試薬の塗布量が少ない場合に低くなりがちであるが、そのように低塗布量の場合は、一般に試薬を一様に塗布することが難しい。そこで低塗布量の場合は一様な塗布を求めずに、逆に試薬の塗布量に所定の分布を持たせて、画像信号の左右対称性が所定の傾向を持って崩れるようにするのが望ましい。そのようにすれば、その傾向を予め把握しておくことにより、構造要素の崩れた左右対称性を、画像信号の崩れた左右対称性に良く合致するように設定することができる。
【0033】
以上のようにして試薬部分の呈色状態を精度良く測定できれば、それに基づく検体の検査も、高精度で信頼性が高いものとなる。
【0034】
一方、本発明によるイムノクロマトグラフ検査装置は、前述した通りの試薬を保持した担体を装填する手段と、撮像手段と、画像信号に基づいて試薬の呈色状態を測定する手段と、モルフォロジー演算部と、差分信号を求める減算処理部と、この差分信号に基づいて呈色状態を測定する手段とを有するものであるので、この装置によれば、本発明のイムノクロマトグラフ検査方法を実施することができる。
【図面の簡単な説明】
【0035】
【図1】本発明の一実施形態によるイムノクロマトグラフ検査装置を示す斜視図
【図2】上記検査装置の一部破断側面図
【図3】上記検査装置の電気的構成を示すブロック図
【図4】上記検査装置の一部を示す正面図
【図5】上記検査装置に用いられたカートリッジの一状態を示す一部破断平面図
【図6】上記カートリッジの別の状態を示す一部破断平面図
【図7】上記カートリッジのさらに別の状態を示す一部破断平面図
【図8】モルフォロジー演算処理を説明する説明図
【図9】上記検査装置における検査処理の流れを示すフローチャート
【図10】本発明による効果を説明する説明図
【発明を実施するための形態】
【0036】
以下、図面を参照して本発明の実施形態を詳細に説明する。図1は、本発明の一実施形態によるイムノクロマトグラフ検査装置1の斜視形状を、図2はその一部破断側面形状を、そして図3はその電気的構成を示すものである。まず図1および図2を参照して、本装置の基本構成について説明する。
【0037】
それらの図に示されるようにイムノクロマトグラフ検査装置1は、前面に開口10aを有する筐体10と、筐体10の上面に配置された表示部11と、この表示部11に表示されたメニューの操作を行うための操作部12と、電源スイッチ13と、イムノクロマトグラフ用カートリッジ20を装置内部に装填するためのカートリッジ装填部14とを有している。また筐体10の内部には、カートリッジ装填部14を図2中で左右方向に移動自在に案内するレール15と、後述する洗浄液ポット27および増感液ポット28をそれぞれ押し潰すための押圧部30、34と、カートリッジ20から情報を取得する第1の測定部40および第2の測定部50とを有している。
【0038】
上記カートリッジ装填部14は、レール15に沿って自動あるいは手動により移動自在とされている。そして、その大部分が開口10aを通過して筐体10の外に出されたとき、その上に、後述するようにして検査溶液が供給されたカートリッジ20が載置される。その後このカートリッジ装填部14は、図2に示すように筐体10の内部に押し込まれ、それによりカートリッジ20がイムノクロマトグラフ検査装置1の内部に取り込まれる。
【0039】
図4は、上記押圧部30、34の部分を、図2中の左方側から見た状態を示す正面図である。なおここでは、カートリッジ20を破断して示してある。以下、この図4を参照して、押圧部30、34について説明する。押圧部30は、軸31aの周りをシーソー状に回動自在とされたアーム31と、このアーム31の先端下部に固定された押圧片32と、アーム31の後端下側に配置されたカム33とを有している。カム33は、モータ38によって回転される駆動軸39に、例えば図示外の電磁クラッチ等を介して接断自在に連結されている。このカム33が回転するとアーム31の後端が押し上げられて先端の押圧片32が下降動する。もう一つの押圧部34もアーム35、押圧片36およびカム37を有して、押圧部30と同様に構成されている。
【0040】
ここで押圧部30の押圧片32と、押圧部34の押圧片36はそれぞれ、カートリッジ20が筐体10の中の所定位置に配置されたとき、キット内部に配置されている洗浄液ポット27、増感液ポット28の直上位置に来るように配設されている。
【0041】
図5は、上記カートリッジ20の上面部を破断して示す平面図であり、以下、この図5も参照してカートリッジ20について説明する。カートリッジ20は、試薬を帯状に担持したテストラインA、試薬を帯状に担持したテストラインBおよび帯状のコントロールラインCを有する不溶性担体21と、不溶性担体21を収容するキットケース22と、不溶性担体21に検体溶液を注入するためにケース上面に形成された溶液注入口23と、不溶性担体21の検査部位(テストラインA、BおよびコントロールラインCの部分)を観察するための観察窓24とを備えている。キットケース22の上面には情報表示部25が設けられている。なおカートリッジ装填部14にも、上記観察窓24とほぼ整合する観察窓14aが設けられている。
【0042】
上記不溶性担体21は、固定化された標識物質を有するものである。またテストラインAおよびBはそれぞれ、検体(被験物質)に対する特異的結合物質が試薬として固定されたものであり、コントロールラインCは測定の終了時を判断するためのものである。
【0043】
またこのカートリッジ20の内部には、不溶性担体21を間に挟む状態にして、送液用不溶性担体72および吸収用不溶性担体73が配設されている。そして送液用不溶性担体72の上方位置には前述した洗浄液ポット27が固定され、不溶性担体21のコントロールラインC側の端部の上方位置には増感液ポット28が固定されている。なおカートリッジ20のケース22の上面部分は、前述の押圧片32、36によって上から押されたとき、容易に変形してそれぞれ洗浄液ポット27、増感液ポット28が潰されるのを許容するようになっている。
【0044】
第1の測定部40は、カートリッジ20の観察窓24を通して検査部位(テストラインA、BおよびコントロールラインCの部分)の呈色状態を測定するものである。第1の測定部40は、図2に示すようにカメラ42および光源44を備え、カートリッジ20が検査装置1に装填された際に、これらがカートリッジ20の下方から観察窓24に対向するように構成されている。そして、第1の測定部40によって取得された検査部位における光学的情報に基づいて、該検査部位の呈色状態として光学濃度および色度が算出される(この点については後述する)。
【0045】
なお上記光学濃度は、カートリッジ20の検査部位に入射した入射光の強度をI、検査部位からの反射光の強度をIrとしたとき、下記式で定義する。
【0046】
光学濃度=−log10(Ir/I)
また色度は、色相と彩度を数量的に表示したものであり、カメラで読み取ったRGB輝度信号から算出する。色度の表色系としては、一般的なCIE表色系を用いることができる。
【0047】
カメラ42は、例えば複数のフォトダイオードがライン状に配列された構成、あるいはエリアセンサからなるイメージセンサを有するもので、受光光量に応じた出力を生じる。カメラ42の受光範囲は、カートリッジ20の長手方向に延びた帯状範囲とされている。光源44は、例えばLEDが内蔵されたモジュールであり、白色光を発するように構成されている。なお光源44は、後述する増感処理の前後の色度の区別が付けば、例えば単色光を発するものであってもよい。また光源44は、複数のモジュールから構成される場合は、異なる波長の単色光を発する複数のモジュールを用いて構成することもできる。光源44から発せられる光は、カートリッジ20の長手方向の所定範囲を照明可能とされている。
【0048】
一方、第2の測定部50は、カートリッジ20の情報表示部25に照明光を照射し、情報表示部25に表示された情報を取得するものである。情報表示部25は、手書きまたはシール添付等により検査に関する情報が表示される。検査に関する情報とは例えば、被験物質を採取した患者に関する情報(氏名、年齢および性別等)および、検査に使用される試料・試薬に関する情報(検査対象となる検体、洗浄液および増感液等の名称等)等が挙げられる。情報を取得する方法は特に制限されず、情報表示部25をそのまま画像化したり、バーコード化された情報から読み取ったりすることができる。
【0049】
この第2の測定部50は、図2に示すようにカメラ52および光源54を備え、カートリッジ20が検査装置1に装填された際に、これらがカートリッジ20の上方から情報表示部25に対向するように構成されている。そして、第2の測定部50によって取得された検査に関する情報と検査結果とが紐付けされて管理される。カメラ52および光源54の具体的な構成は、前述したカメラ42および光源44とそれぞれ同様である。
【0050】
次に、本装置の電気的な構成について図3を参照して説明する。先に説明した表示部11、操作部12、モータ38等を含む押圧機構30、34、カメラ42、52(各々光源44、54を含む)は、同図に示す制御部80によって動作が制御される。また、本検査装置1は、例えば100〜240Vの商用電源を利用して作動可能であり、その商用電源を受け入れて12Vの直流電流に変換する電源部100と、この12Vの直流電流が入力される切替部101とを有している。また本検査装置1は、それとともに二次電池であるバッテリ102でも駆動可能とされており、このバッテリ102も上記切替部101に接続されている。切替部101は、商用電源が接続されているときは電源部100から供給される12Vの直流電流を、そして商用電源が接続されていないときはバッテリ102から供給される12Vの直流電流を各電装部品において使用するように切替を行う。
【0051】
また切替部101には、バッテリ102の残留電力量を検出する電池残量検出手段としてのバッテリ容量監視ユニット103が接続されている。一般に電池はその化学特性から、容量が低下してくると内部抵抗が大きくなって端子電圧が低下する特性があるので、その端子電圧を測定することで残留電力量を検出することができる。バッテリ容量監視ユニット103はこうしてバッテリ102の残留電力量を検出し続け、その残留電力量を示す信号を制御部80に入力する。
【0052】
次に、本実施形態の検査装置1による測定について説明する。本装置においては原則として、第1段階の測定と、それに続く第2段階の測定が行われる。第1段階の測定とは、後述する増感処理を行わないで前記検査部位の呈色状態を測定するものであり、また第2段階の測定とは、後述する増感処理を行ってから検査部位の呈色状態を測定するものである。
【0053】
次に具体的な測定の操作手順について説明する。
【0054】
《第1段階の測定》
この第1段階の測定においては、まず図5に示すように、例えば検査装置1の外においてカートリッジ20の溶液注入口23から検体溶液90が注入される。その後このカートリッジ20は前述の通りにして検査装置1内に配置され、カートリッジ20の検査部位(テストラインA、BおよびコントロールラインCの部分)の光学濃度および色度を算出するために、その部位の像がカメラ42によって撮像される。図3に示す制御部80は、このカメラ42が出力する2次元画像信号を画像処理部81に入力させる。
【0055】
以下、画像処理部81における画像処理と、それに続く検査結果の表示処理について、その処理の流れを示す図9も参照して説明する。まず画像処理部81には、2次元画像を示す上記画像信号が入力される(図9のステップS1、以下同様)。画像処理部81は次に、図9に示す2つのオープニング処理(ステップS2およびS3)を行うが、そのためにまず上記2次元画像信号から1次元画像信号を生成する。
【0056】
この1次元画像信号とは、図5〜7に示すラインA、BおよびCを横切る1本の直線に沿った、不溶性担体21上の1次元濃度分布を示す信号である。その生成は、例えば上記2次元画像信号から、ラインA、BおよびCの中央位置付近を横切る1本の直線に沿った多数点についての画像信号を抽出したり、あるいはそのような直線およびそれと平行な何本かの直線に沿った多数点についての画像信号を抽出し、それらをラインA、BおよびCの並び方向位置(図5〜7の左右方向位置)が同じ点に関する画像信号どうしで足し合わせたり、さらにはその足し合わされた信号の平均値を求めたりすることによってなされる。
【0057】
その後画像処理部81は上記1次元画像信号に対して、モルフォロジー演算による信号検出用オープニング処理(ステップS2)並びに、モルフォロジー演算による信号検出の基準作成用オープニング処理(ステップS3)を行う。前者のオープニング処理は、先に図10を参照して説明した、呈色した試薬部分による信号変化幅D以下のサイズとされた構造要素を用いてなされるものである。また後者のオープニング処理は、同じく図10を参照して説明した、呈色した試薬部分による信号変化幅Dを上回るサイズとされた構造要素を用いてなされるものである。
【0058】
画像処理部81は、上記2つのオープニング処理にかけられた後の各1次元画像信号を内部メモリに一次記憶させた後、次にそれらの画像信号を、疾患の有無等を検出する画像信号を生成する処理にかける(ステップS4)。この検出用画像信号生成処理は、先に図10を参照して説明した減算処理であり、それにより、図10(D)に示すような差分信号が得られる。この差分信号によれば、前述したように元の2次元画像信号に含まれるノイズの影響を除いて、試薬部分の呈色状態を精度良く測定可能となる。その詳しい理由は、先に図10を参照して説明した通りである。
【0059】
画像処理部81は上記差分信号に基づいて、試薬部分の呈色状態つまりその部分の光学濃度および色度を算出し、それらの値を、あるいはそれらの値から判定される疾患の有無等を、検出結果として表示部11に表示させる(ステップS5)。上述のように試薬部分の呈色状態を精度良く測定可能であれば、この検出結果は信頼性が高いものとなる。
【0060】
なお、以上の説明から明らかなように本実施形態では、モルフォロジー演算部、差分信号を求める減算処理部、および呈色状態を測定する手段が画像処理部81から構成されている。
【0061】
また、上記信号検出用オープニング処理(ステップS2)に用いられる構造要素は、試薬部分の形状に応じた形状とすることが好ましい。それに対して、信号検出の基準作成用オープニング処理(ステップS3)に用いられる構造要素は、基準作成用の処理において、前記差分信号つまり信号強度の差分値のベースとなるので、常に一定の形状であることが好ましい。
【0062】
《第2段階の測定》
この第2段階の測定においては、まず図2、4に示した押圧部30が駆動されて、そのアーム31の先端が下降動され、押圧片32がカートリッジ20内の洗浄液ポット27を外部から押し潰す。それにより図6に示すように、洗浄液ポット27に貯えられていた洗浄液91が不溶性担体21の検査部位を洗浄する。このとき洗浄液91は、送液用不溶性担体72で十分に拡がってから、不溶性担体21、吸収用不溶性担体73の順に送液される。
【0063】
次に、図2、4に示した押圧部34が駆動されて、そのアーム35の先端が下降動され、押圧片36がカートリッジ20内の増感液ポット28を外部から押し潰す。それにより図7に示すように、増感液ポット28に貯えられていた増感液92が不溶性担体21の検査部位に送液されて、増感処理がなされる。なおこの増感液92および上記洗浄液91については、前述した特許文献3に詳しい開示がなされており、本発明においてもそれらを適用することができる。
【0064】
この増感処理がなされた後、カートリッジ20の検査部位の像が、上述と同様にカメラ42によって撮像される。図3に示す制御部80は、このカメラ42が出力する2次元画像信号を画像処理部81に入力させる。画像処理部81は、この2次元画像信号に対して、前記第1段階の測定において行ったのと同じ処理を施す。それによりこの場合も、最終的に得られる差分信号に基づいて、試薬部分の呈色状態を精度良く測定可能となる。
【0065】
画像処理部81は上記差分信号に基づいて、試薬部分の呈色状態つまりその部分の光学濃度および色度を算出し、それらの値を、あるいはそれらの値から判定される疾患の有無等を、検出結果として表示部11に表示させる。この場合も、上述のように試薬部分の呈色状態を精度良く測定可能であるから、信頼性の高い検出結果を得ることができる。
【0066】
なお、以上説明した実施形態においては、2次元画像信号から1次元画素信号を生成し、その1次元画素信号に対して1次元モルフォロジー演算処理を行っているが、2次元画像信号に対して2次元モルフォロジー演算処理を行い、その処理後の2次元画像信号から1次元画像信号を生成するようにしてもよい。
【0067】
また、以上説明した実施形態においては、試薬の部分を撮像して得た画像信号に対してモルフォロジー演算のオープニング処理をかけているが、高濃度高信号レベルの信号に対するオープニング処理と高輝度高信号レベルに対するクロージング処理とは一致するので、試薬の部分を撮像して得た画像信号をレベル反転処理にかけ、その反転処理後の画像信号に対してモルフォロジー演算のクロージング処理をかけるようにしても、上記実施形態におけるのと同じ作用、効果が得られる。そのようにするためには、図3に示す画像処理部81に、画像信号をレベル反転処理する機能と、クロージング処理を行う機能を与えればよい。
【0068】
ここで、上記測定に関わる事項について以下簡単に説明する。
【0069】
(検体溶液)
本発明の検査装置を用いて分析することのできる検体溶液としては、被験物質(天然物、毒素、ホルモンまたは農薬等の生理活性物質あるいは環境汚染物質等)を含む可能性のあるものである限り、特に限定されるものではなく、例えば、生物学的試料、特には動物(特にヒト)の体液(例えば、血液、血清、血漿、髄液、涙液、汗、尿、膿、鼻水、または喀痰)若しくは排泄物(例えば、糞便)、臓器、組織、粘膜や皮膚、それらを含むと考えられる搾過検体(スワブ)、うがい液、または動植物それ自体若しくはそれらの乾燥体を後述の希釈液で希釈したもの等を挙げることができる。
【0070】
検体溶液はそのままで、あるいは、検体溶液を適当な抽出用溶媒を用いて抽出して得られる抽出液の形で、さらには、この抽出液を適当な希釈剤で希釈して得られる希釈液の形、若しくは抽出液を適当な方法で濃縮した形で用いることができる。
【0071】
(標識物質)
本発明で使用することができる標識物質としては、一般的なイムノクロマトグラフ法で用いられるような金属微粒子(または金属コロイド)、着色ラテックス粒子、酵素など、有色で視認できる、または、反応により検査できるようになる標識物であれば特に限定されることなく用いることができるが、標識物質を触媒とした金属イオンの還元反応によって、標識物質への金属の沈着でシグナルを増感する場合には、その触媒活性の観点から金属微粒子が好ましい。
【0072】
その金属微粒子の材料としては、金属単体、金属硫化物、その他金属合金、または金属を含むポリマ−粒子標識を用いることができる。粒子(またはコロイド)の平均粒径は、1nm〜10μmの範囲にあることが好ましい。ここで、平均粒径とは、透過型電子顕微鏡(TEM)により実測された複数の粒子の径(粒子の最長径)の平均値である。より詳細には、金コロイド、銀コロイド、白金コロイド、鉄コロイド、水酸化アルミニウムコロイド、およびこれらの複合コロイドなどが挙げられ、好ましくは、金コロイド、銀コロイド、白金コロイド、およびこれらの複合コロイドであることが望ましい。特に、金コロイドと銀コロイドが適当な粒径において、金コロイドは赤色、銀コロイドは黄色を示し視認度が高いという観点からより好ましい。金コロイドを用いることにより、銀イオン含有化合物を用いた増感工程を行うことにより増感の前後で標識の色度が変化する(金コロイドは赤く呈色し、増感後は還元された銀イオンが金コロイドに沈着し黒くなる)ため、後述するようにこの変化を検査のエラー判定に用いることができるようになる。金属コロイドの平均粒径としては、約1〜500nmが好ましく、さらには1〜100nmがより好ましい。
【0073】
(特異的結合物質)
特異的結合物質としては、被検物質に対して親和性を持つものならば特に限定されることはなく例えば、被験物質が抗原である場合には当該抗原に対する抗体、被験物質がたんぱく質、金属イオンまたは低分子量有機化合物である場合にはこれらに対するアプタマー、被験物質がDNAやRNAなど核酸である場合にはこれらに対して相補的な配列を持つDNAやRNA等の核酸分子、被験物質がアビジンである場合にはビオチン、被験物質が特定のペプチドの場合にはこれに特異的に結合する錯体、等を挙げることができる。また、上記した例では特異的結合物質と被験物質との関係を入れ替えることもでき、例えば被験物質が抗体である場合には当該抗体に対する抗原を、特異的結合物質として用いることもできる。さらに、上記のような被検物質に対して親和性を持つ物質を一部に含有する化合物等を特異的結合物質として用いることもできる。
【0074】
上記抗体としては具体的に、その被験物質によって免疫された動物の血清から調製する抗血清、抗血清から精製された免疫グロブリン画分、その被験物質によって免疫された動物の脾臓細胞を用いる細胞融合によって得られるモノクローナル抗体、あるいは、それらの断片[例えば、F(ab’)2、Fab、Fab’、またはFv]を用いることができる。これらの抗体の調製は、常法により行うことができる。
【0075】
(不溶性担体)
不溶性担体21の材料は、多孔性であることが好ましく、例えば、ニトロセルロース膜、セルロース膜、アセチルセルロース膜、ポリスルホン膜、ポリエーテルスルホン膜、ナイロン膜、ガラス繊維、不織布、布、または糸等が好ましく挙げられる。
【0076】
クロマトグラフ担体には、被験物質に対する特異的結合物質を固定化させて検査ラインや所望によりコントロール部位が作製される。特異的結合物質は、特異的結合物質をクロマトグラフ担体の一部に物理的または化学的結合により直接固定化させてもよいし、特異的結合物質をラテックス粒子などの微粒子に物理的または化学的に結合させ、この微粒子をクロマトグラフ担体の一部にトラップさせて固定化させてもよい。
【0077】
(増感液)
増感液は、含まれる薬剤が標識物質や被験物質の触媒作用によって反応することにより、呈色あるいは発光する化合物などを生じ、シグナルの増感を起こすことができる溶液である。例えば、金属標識上で、物理現像により金属銀の析出を起こす銀イオン溶液である。詳細には、写真化学の分野での一般書物(例えば、「改訂写真工学の基礎-銀塩写真編-」(日本写真学会編、コロナ社)、「写真の化学」(笹井明、写真工業出版社)、「最新処方ハンドブック」(菊池真一他、アミコ出版社))に記載されているような、いわゆる現像液を用いることができる。例えば、増感液として銀イオン含有化合物を含む物理現像液を用いれば、銀イオンの還元剤により液中の銀イオンを、現像の核となるような金属コロイド等を中心に還元させることができる。
【0078】
また別の例としては、酵素反応を用いた例がある。例えば、ペルオキシダーゼ標識と過酸化水素の作用により色素となる、フェニレンジアミン化合物とナフトール化合物の溶液などが挙げられる。さらに、非特許文献「臨床検査 Vol.41 no.9 p.1020 H2O2−POD系を利用した染色」に記載されているような、西洋わさびペルオキシダーゼ検出の発色基質などでもよい。また、特開2009−156612号公報に記載の発色基質は特に好ましく用いることができる。なお、酵素の代わりに白金微粒子などの金属触媒を用いる系でもよい。
【0079】
別の酵素を用いた例としては、アルカリホスファターゼを標識とし、5−ブロモ−4クロロ−3−インドリル−リン酸二ナトリウム塩(BCIP)を基質として発色させるような系もある。以上、呈色する反応を代表に挙げたが、一般的にエンザイムイムノアッセイで用いられるような、酵素と基質の組み合わせであればなんでも良く、化学発光する基質であっても、蛍光を発する基質であってもよい。
【0080】
(銀イオン含有化合物)
銀イオン含有化合物としては、有機銀塩、無機銀塩、もしくは銀錯体を用いることができる。好ましくは、水などの溶媒に対して溶解度の高い銀イオン含有化合物であり、硝酸銀、酢酸銀、乳酸銀、酪酸銀、チオ硫酸銀などが挙げられる。特に好ましくは硝酸銀である。銀錯体としては、水酸基やスルホン基など水溶性基を有する配位子に配位された銀錯体が好ましく、ヒドロキシチオエーテル銀等が挙げられる。無機銀塩、もしくは銀錯体は、銀として一般に0.001モル/m2〜0.2モル/m2、好ましくは0.01モル/m2〜0.05モル/m2含有されることが好ましい。
【0081】
(銀イオンの還元剤)
銀イオンの還元剤は、銀イオンを銀に還元することができれば、無機・有機のいかなる材料、またはその混合物でも用いることができる。
【0082】
無機還元剤としては、Fe2+、V2+、Ti3+、などの金属イオンで原子価の変化し得る還元性金属塩、還元性金属錯塩を好ましく挙げることができる。無機還元剤を用いる際には、酸化されたイオンを錯形成するか還元して、除去するか無害化する必要がある。例えば、Fe2+を還元剤として用いる系では、クエン酸やEDTAを用いて酸化物であるFe3+の錯体を形成し、無害化することができる。本系ではこのような無機還元剤を用いることが好ましく、より好ましくはFe2+の金属塩が好ましい。
【0083】
なお、上記実施形態においては、呈色状態の増感方法として銀イオン含有化合物を還元剤で還元することにより標識物質を増感させる方法を用いたが、本発明における増感方法はこれに限定されない。増感液は、含まれる薬剤が標識物質や被験物質の触媒作用によって反応することにより、呈色あるいは発光する化合物などを生じ、シグナルの増感を起こすことができる溶液であればよく、例えば上記したような酵素を用いた用液などが挙げられる。
【0084】
また上記実施形態においては、アッセイ法としてイムノクロマトグラフ法について説明したが、本発明で適用するアッセイ法はこれに限定されない。いわゆる免疫反応を用いない系でもよく、例えば、抗体を用いずにDNAやRNAなどの核酸で被験物質を捕捉する系でもよいし、さらには被験物質に対する親和性を持つ別の小分子やペプチド、たんぱく質、錯体形成物質等、によって被験物質を捕捉する系であってもよい。
【符号の説明】
【0085】
1 イムノクロマトグラフ検査装置
10 筐体
11 表示部
12 操作部
13 電源スイッチ
14 カートリッジ装填部
20 イムノクロマトグラフ用カートリッジ
21 不溶性担体
22 カートリッジケース
23 溶液注入口
26 シート材
27 洗浄液ポット
28 増感液ポット
30、34 押圧部
32、36 押圧片
33、37 カム
38 モータ
40、50 測定部
87、88 刃
80 制御部
81 画像処理部
90 検体溶液
91 洗浄液
92 増感液
A、B テストライン
C コントロールライン
【特許請求の範囲】
【請求項1】
担体に保持された試薬と検体とを反応させ、
その試薬の部分を撮像して画像信号を得、
その画像信号に基づいて前記反応による試薬の呈色状態を測定して、検体に関する検査を行うイムノクロマトグラフ検査方法において、
前記画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけるとともに、
前記画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけ、
前記オープニング処理の各々にかけられた後の画像信号の間で減算を行って差分信号を求め、
この差分信号に基づいて前記呈色状態を測定することを特徴とするイムノクロマトグラフ検査方法。
【請求項2】
担体に保持された試薬と検体とを反応させ、
その試薬の部分を撮像して画像信号を得、
その画像信号に基づいて前記反応による試薬の呈色状態を測定して、検体に関する検査を行うイムノクロマトグラフ検査方法において、
前記画像信号をレベル反転処理にかけ、
そのレベル反転処理後の画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のクロージング処理にかけるとともに、
前記レベル反転処理後の画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のクロージング処理にかけ、
前記クロージング処理の各々にかけられた後の画像信号の間で減算を行って差分信号を求め、
この差分信号に基づいて前記呈色状態を測定することを特徴とするイムノクロマトグラフ検査方法。
【請求項3】
前記試薬として、所定幅をもって担体に帯状に保持された試薬を用いることを特徴とする請求項1または2記載のイムノクロマトグラフ検査方法。
【請求項4】
前記信号変化幅以下のサイズとされた構造要素として、前記画像信号の強度が高いほどより矩形的な形状で、画像信号の強度が低いほどより円弧的な形状とされたものを用いることを特徴とする請求項1から3いずれか1項記載のイムノクロマトグラフ検査方法。
【請求項5】
前記信号変化幅以下のサイズとされた構造要素として、左右対称性が崩れた形状とされたものを用いることを特徴とする請求項1から4いずれか1項記載のイムノクロマトグラフ検査方法。
【請求項6】
前記信号変化幅以下のサイズとされた構造要素が、該信号変化幅の60%以上のサイズであることを特徴とする請求項1から5いずれか1項記載のイムノクロマトグラフ検査方法。
【請求項7】
前記信号変化幅以下のサイズとされた構造要素が、該信号変化幅の80%以上のサイズであることを特徴とする請求項6記載のイムノクロマトグラフ検査方法。
【請求項8】
前記信号変化幅を上回るサイズとされた構造要素が、該信号変化幅の1.2倍以上のサイズであることを特徴とする請求項1から7いずれか1項記載のイムノクロマトグラフ検査方法。
【請求項9】
前記信号変化幅を上回るサイズとされた構造要素が、該信号変化幅の1.5倍以上のサイズであることを特徴とする請求項8記載のイムノクロマトグラフ検査方法。
【請求項10】
試薬を保持した担体を装填する手段と、
検体と反応した後の前記試薬の部分を撮像して画像信号を得る撮像手段と、
前記画像信号に基づいて前記反応による試薬の呈色状態を測定する手段とを備えてなるイムノクロマトグラフ検査装置において、
前記画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけるとともに、前記画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけるモルフォロジー演算部と、
前記オープニング処理の各々にかけられた後の画像信号の間で減算を行って差分信号を求める減算処理部と、
この差分信号に基づいて前記呈色状態を測定する手段とが設けられたことを特徴とするイムノクロマトグラフ検査装置。
【請求項11】
試薬を保持した担体を装填する手段と、
検体と反応した後の前記試薬の部分を撮像して画像信号を得る撮像手段と、
前記画像信号に基づいて前記反応による試薬の呈色状態を測定する手段とを備えてなるイムノクロマトグラフ検査装置において、
前記画像信号にレベル反転処理を施す手段と、
前記レベル反転処理後の画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のクロージング処理にかけるとともに、前記レベル反転処理後の画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のクロージング処理にかけるモルフォロジー演算部と、
前記クロージング処理の各々にかけられた後の画像信号の間で減算を行って差分信号を求める減算処理部と、
この差分信号に基づいて前記呈色状態を測定する手段とが設けられたことを特徴とするイムノクロマトグラフ検査装置。
【請求項1】
担体に保持された試薬と検体とを反応させ、
その試薬の部分を撮像して画像信号を得、
その画像信号に基づいて前記反応による試薬の呈色状態を測定して、検体に関する検査を行うイムノクロマトグラフ検査方法において、
前記画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけるとともに、
前記画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけ、
前記オープニング処理の各々にかけられた後の画像信号の間で減算を行って差分信号を求め、
この差分信号に基づいて前記呈色状態を測定することを特徴とするイムノクロマトグラフ検査方法。
【請求項2】
担体に保持された試薬と検体とを反応させ、
その試薬の部分を撮像して画像信号を得、
その画像信号に基づいて前記反応による試薬の呈色状態を測定して、検体に関する検査を行うイムノクロマトグラフ検査方法において、
前記画像信号をレベル反転処理にかけ、
そのレベル反転処理後の画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のクロージング処理にかけるとともに、
前記レベル反転処理後の画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のクロージング処理にかけ、
前記クロージング処理の各々にかけられた後の画像信号の間で減算を行って差分信号を求め、
この差分信号に基づいて前記呈色状態を測定することを特徴とするイムノクロマトグラフ検査方法。
【請求項3】
前記試薬として、所定幅をもって担体に帯状に保持された試薬を用いることを特徴とする請求項1または2記載のイムノクロマトグラフ検査方法。
【請求項4】
前記信号変化幅以下のサイズとされた構造要素として、前記画像信号の強度が高いほどより矩形的な形状で、画像信号の強度が低いほどより円弧的な形状とされたものを用いることを特徴とする請求項1から3いずれか1項記載のイムノクロマトグラフ検査方法。
【請求項5】
前記信号変化幅以下のサイズとされた構造要素として、左右対称性が崩れた形状とされたものを用いることを特徴とする請求項1から4いずれか1項記載のイムノクロマトグラフ検査方法。
【請求項6】
前記信号変化幅以下のサイズとされた構造要素が、該信号変化幅の60%以上のサイズであることを特徴とする請求項1から5いずれか1項記載のイムノクロマトグラフ検査方法。
【請求項7】
前記信号変化幅以下のサイズとされた構造要素が、該信号変化幅の80%以上のサイズであることを特徴とする請求項6記載のイムノクロマトグラフ検査方法。
【請求項8】
前記信号変化幅を上回るサイズとされた構造要素が、該信号変化幅の1.2倍以上のサイズであることを特徴とする請求項1から7いずれか1項記載のイムノクロマトグラフ検査方法。
【請求項9】
前記信号変化幅を上回るサイズとされた構造要素が、該信号変化幅の1.5倍以上のサイズであることを特徴とする請求項8記載のイムノクロマトグラフ検査方法。
【請求項10】
試薬を保持した担体を装填する手段と、
検体と反応した後の前記試薬の部分を撮像して画像信号を得る撮像手段と、
前記画像信号に基づいて前記反応による試薬の呈色状態を測定する手段とを備えてなるイムノクロマトグラフ検査装置において、
前記画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけるとともに、前記画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のオープニング処理にかけるモルフォロジー演算部と、
前記オープニング処理の各々にかけられた後の画像信号の間で減算を行って差分信号を求める減算処理部と、
この差分信号に基づいて前記呈色状態を測定する手段とが設けられたことを特徴とするイムノクロマトグラフ検査装置。
【請求項11】
試薬を保持した担体を装填する手段と、
検体と反応した後の前記試薬の部分を撮像して画像信号を得る撮像手段と、
前記画像信号に基づいて前記反応による試薬の呈色状態を測定する手段とを備えてなるイムノクロマトグラフ検査装置において、
前記画像信号にレベル反転処理を施す手段と、
前記レベル反転処理後の画像信号を、呈色した試薬部分による信号変化幅以下のサイズとされた構造要素を用いてモルフォロジー演算のクロージング処理にかけるとともに、前記レベル反転処理後の画像信号を、呈色した試薬部分による信号変化幅を上回るサイズとされた構造要素を用いてモルフォロジー演算のクロージング処理にかけるモルフォロジー演算部と、
前記クロージング処理の各々にかけられた後の画像信号の間で減算を行って差分信号を求める減算処理部と、
この差分信号に基づいて前記呈色状態を測定する手段とが設けられたことを特徴とするイムノクロマトグラフ検査装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2012−73125(P2012−73125A)
【公開日】平成24年4月12日(2012.4.12)
【国際特許分類】
【出願番号】特願2010−218428(P2010−218428)
【出願日】平成22年9月29日(2010.9.29)
【出願人】(306037311)富士フイルム株式会社 (25,513)
【Fターム(参考)】
【公開日】平成24年4月12日(2012.4.12)
【国際特許分類】
【出願日】平成22年9月29日(2010.9.29)
【出願人】(306037311)富士フイルム株式会社 (25,513)
【Fターム(参考)】
[ Back to top ]

