イリジウム錯体及びそれを用いた有機エレクトロルミネッセンス素子
【課題】有機エレクトロルミネッセンス素子のドーパントとして有用なイリジウム錯体であり、又、その有機EL素子の青色、黄色又は橙色ドーパントとして好適に使用することができる、高性能のイリジウム錯体を提供する。
【解決手段】

で示されるイリジウム錯体を用いる。
【解決手段】

で示されるイリジウム錯体を用いる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、例えば、有機エレクトロルミネッセンス素子(以下有機EL素子と称することもある。)のドーパントとして有用なイリジウム錯体及びそれを用いた有機エレクトロルミネッセンス素子に関するものである。
【背景技術】
【0002】
従来、有機EL素子のドーパントとして、高効率化・色純度の向上・長寿命化を目的に種々のイリジウム錯体が提案されているが、その中でも3−(ピリジン−2−イル)−2,6−ジフルオロベンゼン又はピリジン誘導体を配位子とするイリジウム錯体が数多く記載されている(例えば、特許文献1〜4及び非特許文献1参照)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2002−117978号公報
【特許文献2】特開2006−182921号公報
【特許文献3】特開2005−220136号公報
【特許文献4】特開2007−161673号公報
【非特許文献】
【0004】
【非特許文献1】Inorganic Chemistry,48,1030(2009)
【発明の概要】
【発明が解決しようとする課題】
【0005】
これらの先行技術文献には数多くのイリジウム錯体が記載されているものの、それらの多くは実際には製造されておらず、それ自体の性能が確認されておらず、未だに高効率青色発光材料であるFIrpic((2−ピリジンカルボキシラト−κN1,κO2)ビス[2−(2−ピリジニル−κN)−3,5−ジフルオロフェニル−κC)]イリジウム)と同程度又はそれ以上の性能を有するイリジウム錯体の開発には到っていなかった。又、FIrpicと類似の構造で黄色発色を示すイリジウム錯体は知られていなかった。
【0006】
本発明の課題は、即ち、有機エレクトロルミネッセンス素子のドーパントとして有用なイリジウム錯体をより具体的に提供することにあり、又、その有機EL素子の青色、黄色又は橙色ドーパントとして好適に使用することができる、高性能のイリジウム錯体を見出すことにもある。
【課題を解決するための手段】
【0007】
本発明の課題は、一般式(1)
【0008】
【化1】

【0009】
(式中、Gはメチン基又は窒素原子、Lは1価のアニオン性二座配位子を表し示し、mは2又は3である。R1、R2、R3及びR4は炭素原子数1〜5のアルキル基であり、且つ隣接するもの同士は互いに結合して無置換のシクロヘキサン環を形成している。)
で示されるイリジウム錯体によって解決される。
【発明の効果】
【0010】
本発明により、有機EL素子の青色、黄色又は橙色ドーパントとして好適に使用することができるイリジウム錯体を提供することができる。
【図面の簡単な説明】
【0011】
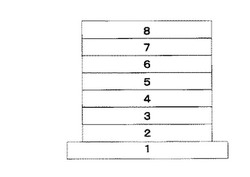
【図1】実施例8〜9で製造した有機EL素子の層構成を示す図である。
【発明を実施するための形態】
【0012】
本発明のイリジウム錯体は一般式(1)で示される。その一般式(1)において、Gはメチレン基又は窒素原子を示す。又、Lは1価のアニオン性二座配位子であるが、例えば、例えば、アセチルアセトナト、ヘキサフルオロアセチルアセトナト、8−ヒドロキシキノリナート、イミンアセチルアセトナト、テトラメチルヘプタンジオネート、1−(2−ヒドロキシフェニル)ピラゾレート、フェニルピラゾレート、3−(2−ピリジル)−5−t−ブチルピラゾレート、3−(2−ピリジル)−5−トリフルオロメチルピラゾレート、2−(2−ピリジル)−4−トリフルオロメチル−1、3,5−トリアゾレート等が挙げられるが、好ましくはアセチルアセトナトである。
【0013】
又、R1、R2、R3及びR4は炭素原子数1〜5のアルキル基であり、且つ隣接するもの同士は互いに結合してシクロヘキサン環を形成している。
【0014】
本発明のイリジウム錯体の配位子としての3−(5,6,7,8−テトラヒドロイソキノリン−2−イル又は5,6,7,8−テトラヒドロイソキノリン−1−イル)−2,6−ジフルオロベンゼン又はピリジン誘導体は、以下のいずれかの方法によって製造できる。
【0015】
【化2】

【0016】
(式中、Gは前記と同義であり、Xはハロゲン原子、Pは脱離基を示す。)
【0017】
前記Xとしては、好ましくは塩素原子である。又、前記脱離基Pとしては、好ましくはジヒドロキシボリル基又はジアルコキシボリル基(2つのアルキル基は互いに結合して環を形成していても良い)である。
【0018】
又、本発明のイリジウム錯体の合成は、式(3)及び(4)で示すように塩化イリジウムを出発原料として合成することができる。
【0019】
【化3】

【0020】
(式中、G、L、R1、R2、R3及びR4は前記と同義である。)
【0021】
【化4】

【0022】
(式中、G、L、R1、R2、R3及びR4は前記と同義である。)
【0023】
(有機エレクトロルミネッセンス素子)
次に本発明の有機エレクトロルミネッセンス素子について説明する。本発明の有機EL素子は、本発明のイリジウム錯体が発光層に含まれるが、それ以外の公知の材料をも併せて使用することができる。
【0024】
有機EL素子は、好ましくは一対の電極間に単層または多層の有機化合物層を有する有機EL素子であり、本発明化合物を、有機化合物薄層のうちの少なくとも1層に含むものである。なお、有機化合物層とは、バッファ層、ホール注入層、ホール輸送層、発光層、電子輸送層、電子注入層などである。
【0025】
単層型の有機EL素子は、陽極と陰極との間に発光層を有する。発光層は、発光材料を含有し、更に、陽極から注入したホール、又は、陰極から注入した電子を発光材料まで輸送させるための有機化合物層に用いられる材料、例えば、ホール輸送材料や電子輸送材料を含有してもよい。
【0026】
多層型の有機EL素子としては、例えば、(陽極/バッファ層/ホール輸送層/発光層/ホール阻止層/電子輸送層/陰極)や(陽極/バッファ層/ホール輸送層/発光層/電子輸送層/陰極)などの多層構成が挙げられるが、他に(陽極/ホール注入層/ホール輸送層/発光層/ホール阻止層/電子輸送層/金属酸化物層/陰極)、(陽極/ホール注入層/発光層/陰極)、(陽極/発光層/電子輸送層/陰極)、(陽極/ホール注入層/発光層/電子輸送層/陰極)等の多層構成も挙げられ、その構成はこれらに限定されるものではない。
【0027】
又、バッファ層、ホール輸送層、電子輸送層、および発光層のそれぞれの層は、一層構造であっても、多層構造であってもよい。更に、ホール輸送層、電子輸送層はそれぞれの層で注入機能を有する層(ホール注入層及び電子注入層)と輸送機能を有する層(ホール輸送層及び電子輸送層)を別々に設けることもできる。
【0028】
以下、本発明の有機EL素子に構成要素に関して、(陽極/バッファ層/ホール輸送層/発光層/ホール阻止層/電子輸送層/陰極)の素子構成を例に詳細に説明する。
【0029】
本発明の有機EL素子において有機層の発光層にホストとして使用される材料は、公知のホスト材料の中から任意のものを選択して用いることができる。例えば、4,4’−ジ(N−カルバゾリル)−1,1’−ビフェニル(CBP)、1,3−ジ(N−カルバゾリル)ベンゼン(mCP)、2,2’―ジ〔4’’−(N−カルバゾリル)フェニル〕−1,1’−ビフェニル(4CzPBP)、ジフェニルジ(o−トリル)シラン、p−ビス(トリフェニルシリル)ベンゼン、4、4’、4’’−トリス(N−カルバゾリル)−トリフェニルアミン(TCTA)、49,10−ビス−[1,1,3’,1’’]ターフェニル−5’−イル−アントラセンなどが挙げられるが、これらに限定されるものではない。
【0030】
発光材料をホスト材料と組み合わせて使用する場合、発光材料はホスト材料に対して、好ましくは0.005〜80質量%である。
【0031】
ホール阻止層として使用される材料(以下、ホール阻止材料という)は、公知の材料としては、例えば、2,9−ジメチル−4,7−ジフェニル−1,10−フェナントロリン、ビス(2−メチル−8−キノリノラート)(p−フェニルフェノラート)アルミニウム、ビス(2−メチル−8−キノリノラート)(トリフェニルシラノラート)アルミニウム、ビス(m−ターフェニル−5’−イル)スルホン(BTPS)等が挙げられるが、これらに限定されるものではない。
【0032】
電子輸送層として使用される材料(以下、電子輸送材料という)は、公知の材料として、例えば、フルオレン、フェナントロリン、バソフェナントロリン、バソクプロイン、アントラキノジメタン、ジフェノキノン、オキサゾール、オキサジアゾール、トリアゾール、イミダゾール、アントラキノジメタン、4,4’−N,N’−ジカルバゾールビフェニル(CBP)等やそれらの化合物、金属錯体化合物もしくは含窒素五員環誘導体を挙げることができる。金属錯体化合物としては、具体的には、8−ヒドロキシキノリナートリチウム、トリス(8−ヒドロキシキノリナート)アルミニウム、トリ(2−メチル−8−ヒドロキシキノリナート)アルミニウム、トリス(8−ヒドロキシキノリナート)ガリウム、ビス(10−ヒドロキシベンゾ[h]キノリナート)ベリリウム、ビス(10−ヒドロキシベンゾ[h]キノリナート)亜鉛、ビス(2−メチル−8−キノリナート)(o−クレゾラート)ガリウム、ビス(2−メチル−8−キノリナート)(1−ナフトラート)アルミニウム、ビス(2−メチル−8−キノリナート)−4−フェニルフェノラート等があるが、これらに限定されるものではない。又、上記の含窒素五員環誘導体としては、オキサゾール、チアゾール、オキサジアゾール、チアジアゾールもしくはトリアゾール誘導体が好ましい。具体的には、2,5−ビス(1−フェニル)−1,3,4−オキサゾール、2,5−ビス(1−フェニル)−1,3,4−チアゾール、2,5−ビス(1−フェニル)−1,3,4−オキサジアゾール、2−(4’−tert−ブチルフェニル)−5−(4’’−ビフェニル)1,3,4−オキサジアゾール、2,5−ビス(1−ナフチル)−1,3,4−オキサジアゾール、1,4−ビス[2−(5−フェニルチアジアゾリル)]ベンゼン、2,5−ビス(1−ナフチル)−1,3,4ートリアゾール、3−(4−ビフェニルイル)−4−フェニル−5−(4−t−ブチルフェニル)−1,2,4−トリアゾール等があるが、これらに限定されるものではない。更に、ポリマ−有機発光素子に使用されるポリマ−材料も使用することができる。例えば、ポリパラフェニレンおよびその誘導体、フルオレン及びその誘導体等であるが、これらに限定されるものではない。
【0033】
一方、ホール輸送層として使用される材料(以下ホール輸送材料)は公知の材料から選択して用いることができる。例えばN,N’−ビス(3−メチルフェニル)−(1,1’−ビフェニル)−4,4’ジアミン(TPD)や4,4’−ビス[N−(ナフチル)−N−フェニル−アミノ]ビフェニル(α−NPD)等の芳香族ジアミン化合物、スチルベン誘導体、ピラゾリン誘導体、ポリアリールアルカン、4,4’,4’’−トリス(N−(3−メチルフェニル)N−フェニルアミノ)トリフェニルアミン(m−MTDATA)、2,2’,7,7’−テトラキス−(N,N−ジフェニルアミノ)−9,9’−スピロビフルオレン、及びポリビニルカルバゾール等の高分子材料が挙げられるが、これに限定されるものではない。
【0034】
又、有機EL素子には、ホールの注入性向上のためにバッファ層を設けることができるが、バッファ層に用いる材料としては公知の材料から選択して用いることができる。より好適には、上記ホール輸送材料に酸化モリブデンを1〜30質量%ドープしたものが使用されるが、これらに限定されるものではない。
【0035】
陽極に使用される導電性材料としては、仕事関数が4eV前後より大きいもの、例えば、炭素原子、アルミニウム、バナジウム、鉄、コバルト、ニッケル、タングステン、銀、金、白金、パラジウム及びそれらの合金、ITO(酸化インジウムに酸化スズを5〜10質量%添加した物質)基板、NESA基板に使用される酸化スズ、酸化インジウム等の酸化金属、更にポリチオフェンやポリピロール等の有機導電性樹脂を用いることが出来る。但し、陽極に使用される導電性材料の仕事関数が当該素子の陰極に使用される導電性材料の仕事関数より0.1eV以上大きなものを用いることが望ましい。
【0036】
陰極に使用される導電性物質としては、仕事関数が4eV前後より小さいもの例えば、マグネシウム、カルシウム、錫、鉛、チタニウム、イットリウム、リチウム、ルテニウム、マンガン、アルミニウム等又はそれらの合金が用いられる。ここで合金としては、マグネシウム/銀、マグネシウム/インジウム、リチウム/アルミニウム等が挙げられる。合金の比率は、蒸着源の温度、雰囲気、真空度等により制御され、特に限定されない。但し、陰極に使用されるこれらの導電性材料の仕事関数は当該素子の陽極に使用される導電性材料の仕事関数より0.1eV以上小さいものを用いることが望ましい。
【0037】
本発明の有機EL素子は、電子注入性向上のために発光層と電極との間に金属酸化物層を設けることも出来る。又、電子輸送材料に金属酸化物をドープして使用してもよい。
【0038】
使用される金属酸化物としては、LiF等のアルカリ金属フッ化物;BaF2、SrF2等のアルカリ土類金属フッ化物;Li2O等のアルカリ金属酸化物;RaO、SrO等のアルカリ土類金属酸化物が使用される。
【0039】
陽極及び陰極は、必要があれば二層以上の層構成により形成されていてもよい。
【0040】
本発明の有機EL素子は、少なくとも一方の面は素子の発光波長領域において透明であることが望ましい。又、基板も透明であることが望ましい。
【0041】
透明電極は、前記の導電性材料を使用して、蒸着又はスパッタリング等の方法で所定の透光性が確保するように設定して得られる。
【0042】
発光面の電極は、光透過率を10%以上にすることが望ましい。
【0043】
基板は、機械的、熱的強度を有し、透明性を有するものであれば特に限定されるものではないが、ガラス基板又は透明性樹脂フィルムが使用される。
【0044】
透明性樹脂フィルムとしては、例えば、ポリエチレン、エチレン−酢酸ビニル共重合体、エチレン−ビニルアルコール共重合体、ポリプロピレン、ポリスチレン、ポリメチルメタアクリレート、ポリ塩化ビニル、ポリビニルアルコール、ポリビニルブチラール、ナイロン、ポリエーテルエーテルケトン、ポリサルホン、ポリエーテルサルフォン、テトラフルオロエチレン−パーフルオロアルキルビニルエーテル共重合体、ポリビニルフルオライド、テトラフルオロエチレン−エチレン共重合体、テトラフルオロエチレン−ヘキサフルオロプロピレン共重合体、ポリクロロトリフルオロエチレン、ポリビニリデンフルオライド、ポリエステル、ポリカーボネート、ポリウレタン、ポリイミド、ポリエーテルイミド、ポリイミド、ポリプロピレン等が挙げられる。
【0045】
本発明の有機EL素子は、温度、湿度、雰囲気等に対する安定性の向上のために、素子の表面に保護層を設けるか、又はシリコンオイル、樹脂等により素子全体を保護してもよい。
【0046】
又、有機EL素子の各層の形成は、真空蒸着、スパッタリング、プラズマ、イオンプレーティング等の乾式成膜法、又はスピンコーティング、ディッピング、フローコーティング等の湿式成膜法のいずれかを適用することができる。膜厚は特に制限されないが、好ましくは0.1nm〜10μm、更に好ましくは0.5nm〜0.2μmである。
【0047】
湿式成膜法の場合、各層上に当該材料を、エタノール、クロロホルム、テトラヒドロフラン、ジオキサン等の溶媒に溶解または分散させて薄膜を調製することが出来る。又、この際前記の材料を共存させることも可能である。
【実施例】
【0048】
以下に実施例を挙げて、さらに本発明を具体的に説明する。
【0049】
参考例1((1−[2−(2’,4’−ジフルオロフェニル)−2−オキソエチル]ピリジニウムクロライド)の合成)
【0050】
【化5】

【0051】
攪拌装置、還流冷却器及び温度計を備えた500mlのガラス製四つ口フラスコに、2−クロロ−1−(2’,4’−ジフルオロフェニル)エタノン25g(0.13mol)及びピリジン250mlを加え、攪拌しながら室温で24時間反応させた。反応終了後、析出した固体を濾過し、得られた濾物をジエチルエーテルで洗浄した後に乾燥させ、淡褐色固体として、1−[2−(2’,4’−ジフルオロフェニル)−2−オキソエチル]ピリジニウムクロライド35gを得た(単離収率;99%)。
【0052】
参考例2((3−(2’,4'−ジフルオロフェニル)−5,6,7,8−テトラヒドロイソキノリンの合成)
【0053】
【化6】

【0054】
攪拌装置、還流冷却器及び温度計を備えた1Lのガラス製四つ口フラスコに、参考例1と同様な方法で合成した1−[2−(2’,4’−ジフルオロフェニル)−2−オキソエチル]ピリジニウムクロライド35g(0.13mol)、1−シクロヘキセンカルボキシアルデヒド15g(0.14mol)、酢酸アンモニウム50g(0.65mol)及びメタノール500mlを加え、攪拌しながら60〜65℃で24時間反応させた。反応終了後、反応液を室温まで冷却し、反応液を減圧下で濃縮した。得られた濃縮物に水を加え、酢酸エチルで抽出した。得られた抽出液を飽和塩化ナトリウム水溶液で洗浄後、無水硫酸ナトリウムで乾燥させた。濾過後、濾液を減圧下で濃縮した後、濃縮物をシリカゲルクロマトグラフィー(展開溶媒:ヘキサン/酢酸エチル=400/20→380/20(容量比))で精製し、黄色液体として、3−(2’,4'−ジフルオロフェニル)−5,6,7,8−テトラヒドロイソキノリン15gを得た(単離収率;47%)。
なお、3−(2’,4'−ジフルオロフェニル)−5,6,7,8−テトラヒドロイソキノリンの物性値は以下の通りであった。
【0055】
1H−NMR(CDCl3、δ(ppm));8.41(1H,s)、7.85(1H,m)、7.38(1H,s)、6.96(1H,m)、6.88(1H,m)、2.90〜2.70(4H,m)、1.90〜1.70(4H,m)
【0056】
参考例3(ジ−μ−クロロテトラキス−[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−ジイリジウムの合成)
【0057】
【化7】

【0058】
攪拌装置、還流冷却器及び温度計を備えた200mlのガラス製四つ口フラスコに、実施例2のように合成した3−(2’,4'−ジフルオロフェニル)−5,6,7,8−テトラヒドロイソキノリン5.0g(20mmol)及び2−エトキシエタノール100mlを加え、混合溶液に窒素を1時間通気した。次いで、三塩化イリジウム三水和物2.4g(8.2mmol)を加え、攪拌しながら130〜140℃で17時間反応させた。反応終了後、反応液を室温まで冷却し、飽和重曹水を添加し、弱塩基性に調整した。次いで、水を添加し、析出した固体をろ過した。得られた固体を水洗した後、50℃で真空乾燥し、黄色固体であるジ−μ−クロロテトラキス−[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−ジイリジウム4.3g(単離収率;59%)を得た。
【0059】
実施例1(G=メチン基、L=ピリジンカルボキシレート、m=2、R2とR3が結合してシクロヘキサン環を形成;(2−ピリジンカルボキシレート−κN1,κO2)ビス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−イリジウムの合成)
【0060】
【化8】

【0061】
攪拌装置、還流冷却器及び温度計を備えた100mlのガラス製三つ口フラスコに、参考例3と同様にして合成したジ−μ−クロロテトラキス−[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−ジイリジウム2.0g(1.4mmol)、ピコリン酸0.45g(3.6mmol)、炭酸ナトリウム1.5g(14mmol)及び2−エトキシエタノール15mlを加え、攪拌しながら140〜150℃で24時間反応させた。反応終了後、反応液を室温まで冷却し、水及び塩化メチレンを加え分液した。得られた有機層を飽和炭酸水素ナトリウム水溶液及び水で洗浄後、無水硫酸マグネシウムで乾燥させた。濾過後、濾液を減圧下で濃縮した後、濃縮物をシリカゲルクロマトグラフィー(展開溶媒:ヘキサン/塩化メチレン(=300/100)→塩化メチレン/酢酸エチル(=300/100)(容量比))で精製し、黄色固体として、2−ピリジンカルボキシレート−κN1,κO2)ビス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−イリジウム1.0gを得た(単離収率;43%)。
なお、2−ピリジンカルボキシレート−κN1,κO2)ビス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−イリジウムは、以下の物性値で示される新規な化合物である。
【0062】
1H−NMR(CDCl3、δ(ppm));8.41(1H,s)、8.32(1H,m)、8.00〜8.85(3H,m)、8.75(1H,m)、7.37(1H,m)、6.94(1H,m)、6.50〜6.25(2H,m)、5.85(1H,m)、5.60(1H,m)1.90〜1.70(4H,m)、3.00〜2.30(8H,m)2.00〜1.60(8H,m)
【0063】
実施例2(G=メチン基、L=アセチルアセトナト、m=2、R2とR3が結合してシクロヘキサン環を形成;ビス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC](2,4−ペンタンジオナート−κO2,κO4)−イリジウムの合成)
【0064】
【化9】

【0065】
攪拌装置、還流冷却器及び温度計を備えた100mlのガラス製三つ口フラスコに、参考例3と同様な方法で合成したジ−μ−クロロテトラキス−[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−ジイリジウム3.0g(2.1mmol)、アセチルアセトン0.4g(4.0mmol)、炭酸ナトリウム1.8g(17mmol)及び2−エトキシエタノール200mlを加え、攪拌しながら100〜110℃で24時間反応させた。反応終了後、反応液を室温まで冷却し、減圧下で濃縮した。濃縮物に水及び塩化メチレンを加え分液した。得られた有機層を飽和炭酸水素ナトリウム及び水で洗浄後、無水硫酸マグネシウムで乾燥させた。濾過後、濾液を減圧下で濃縮した後、濃縮物をシリカゲルクロマトグラフィー(展開溶媒:ヘキサン/酢酸エチル(=300/100)(容量比))で精製し、黄色固体として、ビス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC](2,4−ペンタンジオナート−κO2,κO4)−イリジウム2.3gを得た(単離収率;70%)。
なお、ビス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC](2,4−ペンタンジオナート−κO2,κO4)−イリジウムは新規な化合物である。
【0066】
実施例3(G=メチン基、m=3、R2とR3が結合してシクロヘキサン環を形成;トリス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−イリジウムの合成
【0067】
【化10】

【0068】
攪拌装置、還流冷却器及び温度計を備えた100mlのガラス製三つ口フラスコに、実施例5のように合成したビス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC](2,4−ペンタンジオナート−κO2,κO4)−イリジウム1.0g(1.3mmol)、3−(2’,4'−ジフルオロフェニル)−5,6,7,8−テトラヒドロイソキノリン0.5g(2.0mmol)及びグリセリン10mlを加え、50〜60℃で混合溶液に窒素を1時間通気した。次いで、攪拌しながら180〜200℃で24時間反応させた。反応終了後、反応液を室温まで冷却し、5%塩酸20ml及び塩化メチレンを加えて分液した。得られた有機層を飽和炭酸水素ナトリウム水溶液及び水で洗浄後、無水硫酸マグネシウムで乾燥させた。濾過後、濾液を減圧下で濃縮した後、濃縮物をシリカゲルクロマトグラフィー(展開溶媒:ヘキサン/塩化メチレン(=300/100)(容量比))で精製し、黄色固体として、トリス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−イリジウム0.2gを得た(単離収率;8.2%)。
なお、トリス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−イリジウムは、以下の物性値で示される新規な化合物である。
【0069】
1H−NMR(CD2Cl2、δ(ppm));7.96(3H,s)、7.19(3H,s)、6.35(3H,m)、6.14(3H,m)、3.00〜2.70(6H,m)、2.65〜2.35(6H,m)、1.90〜1.60(12H,m)
【0070】
実施例4(G=メチン基、m=3、R3とR4が結合してシクロヘキサン環を形成;トリス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)フェニル−κC]−イリジウムの合成)
【0071】
【化11】

【0072】
攪拌装置、還流冷却器及び温度計を備えた100mlのガラス製三つ口フラスコに、ジ−μ−クロロテトラキス−[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)フェニル−κC]−ジイリジウム2.6g(1.8mmol)、1−(2’,4’−ジフルオロフェニル)−5,6,7,8−テトラヒドロインキノリン2.2g(9.1mmol)及びジグライム156mlを加え、混合溶液に窒素を1時間通気した。次いで、トリフルオロメタンスルホン酸銀2.3g(9.1mmol)を加え、攪拌しながら150〜155℃で30時間反応させた。反応終了後、反応液を室温まで冷却し、水及びクロロホルムを加え分液した。得られた有機層を水で洗浄後、無水硫酸マグネシウムで乾燥させた。濾過後、減圧下で濃縮した。濃縮物をシリカゲルクロマトグラフィー(展開溶媒;酢酸エチル/n−ヘキサン(=1:4)(容量比))で精製した。黄色粉体として、トリス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)フェニル−κC]−イリジウム1.6gを得た(単離収率;48%)。
なお、[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)フェニル−κC]−イリジウムは、以下の物性値で示される新規な化合物である。
【0073】
1H−NMR(CDCl3,δ(ppm));
7.12〜7.02(3H,m)、6.70〜6.58(3H,m)、6.38〜6.24(3H,m)、6.23〜6.13(3H,m)、2.90〜2.70(12H,m)、1.90〜1.70(6H,m)、1.70〜1.50(6H,m)
【0074】
実施例5(G=窒素原子、m=3、R3とR4が結合してシクロヘキサン環を形成;トリス[2,6−ジフルオロ−3−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)―4−ピリジニル−κC]−イリジウムの合成)
【0075】
【化12】

【0076】
攪拌装置、還流冷却器及び温度計を備えた100mlのガラス製三つ口フラスコに、ジ−μ−クロロテトラキス−[2,6−ジフルオロ−3−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)−4−ピリジニル−κC]−ジイリジウム0.5g(0.3mmol)、1−(2’,6’−ジフルオロ−3’−ピリジル)−5,6,7,8−テトラヒドロインキノリン0.4g(1.7mmol)及びジグライム30mlを加え、混合溶液に窒素を1時間通気した。次いで、トリフルオロメタンスルホン酸銀0.5g(1.9mmol)を加え、攪拌しながら150〜155℃で21時間反応させた。反応終了後、反応液を室温まで冷却し、水及びクロロホルムを加え分液した。得られた有機層を水で洗浄後、無水硫酸マグネシウムで乾燥させた。濾過後、減圧下で濃縮した。濃縮物をシリカゲルクロマトグラフィー(展開溶媒: クロロホルム)で精製した。次いで、エタノールにて分散洗浄し、黄色粉体としてトリス[2,6−ジフルオロ−3−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)―4−ピリジニル−κC]−イリジウム0.18gを得た(単離収率;28%)。
なお、トリス[2,6−ジフルオロ−3−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)―4−ピリジニル−κC]−イリジウムは、以下の物性値で示される新規な化合物である。
【0077】
1H−NMR(CD2Cl2,δ(ppm));7.30〜7.20(3H,m)、6.85〜6.75(3H,m)、2.95〜2.70(12H,m)、2.00〜1.50(12H,m)
【0078】
実施例7(室温での発光スペクトルの測定)
実施例2〜4のイリジウム錯体をテトラヒドロフランに溶解し、堀場製作所社製分光蛍光高度計(Fluoro−Max4)を用いて、室温での発光スペクトルを測定したところ、実施例2のイリジウム錯体の極大吸収波長は460nm及び490nm、実施例3の極大吸収波長は490nm、実施例4の極大吸収波長は460nmであり、実施例2のイリジウム錯体は特に非常に強い青色発光を示した。
【0079】
次に、本発明の化合物を使用した有機EL素子の製造例を説明する。
なお、製造例中、次の略語を使用する。
Ir(3−fiqph)3:トリス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−イリジウム;実施例3で合成したものを使用した。
Ir(1−fiqph)3:トリス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)フェニル−κC]−イリジウム;実施例4で合成したものを使用した。
【0080】
実施例8(本発明のイリジウム錯体を含む有機EL素子の製造)
図1に示すように、基板側から、透明基板1、陽極2、バッファ層3、ホール輸送層4、発光層5、ホール阻止層6、電子輸送層7及び陰極8の各層を備える有機EL素子を以下の方法により作製した。
【0081】
パターニング済みの透明導電膜(ITO)(陽極2)が膜厚110nmで成膜されたガラス基板(透明基板1)を、純水と界面活性剤による超音波洗浄、純水による流水洗浄、純水とイソプロピルアルコールの容量比1:1混合溶液による超音波洗浄、イソプロピルアルコールによる煮沸洗浄の順で洗浄処理した。この基板を沸騰中のイソプロピルアルコールからゆっくり引き上げ、イソプロピルアルコール蒸気中で乾燥させ、最後に紫外線オゾン洗浄を行った。この基板を陽極とし、真空チャンバ内に配置し、7.5×10−3Paまで真空排気し、該チャンバ内には、蒸着材料をそれぞれ充填した各モリブデン製ボードと、所定のパターンで成膜するための蒸着用マスクを設置しておき、ボードを通電加熱し、蒸着材料を蒸発させることにより、順次、次のようにバッファ層3、ホール輸送層4、発光層5、ホール阻止層6、電子輸送層7を成膜した。
【0082】
前記基板上に、ホール輸送材料であるNS21(新日鐵化学株式会社製)と、三酸化モリブデン(MoO3)を共蒸着し、NS21:MoO3=80:20を膜厚9nmで成膜した後、NS21:MoO3=90:10を膜厚7nmで成膜し、バッファ層3を形成した。続いて、3DTAPBP(ケミプロ化成株式会社製)を膜厚22nmで成膜し、ホール輸送層4を形成した。そして、TCTA:Ir(fpth3iq)3:=80:20を膜厚10nmで成膜して形成した。発光層5の上に、KLET03(ケミプロ化成株式会社製)を膜厚70.5nmで成膜し、電子輸送層6を形成した。
【0083】
更に、電子輸送層6の上に、8−ヒドロキシキノリナートリチウムを膜厚0.5nmで成膜し、電子注入層7を形成した。その上にアルミニウム(Al)を膜厚100nmで成膜し、陰極8を形成した
【0084】
このように形成した積層構造を、もう一枚のガラス基板と合わせ、UV硬化樹脂により封止して素子を完成した。
【0085】
本素子の層構成を簡略化して示すと、
陽極2: ITO(110nm)、
バッファ層3: NS21:MoO3(9nm、80:20)/NS21:MoO3=(7nm、90:10)、
ホール輸送層4: 3DTAPBP(22nm)、
発光層5: TCTA:Ir(3−fiqph)3:=(10nm、80:20)
電子輸送層6: KLET03(70.5nm)、
電子輸送層7: Liq(0.5nm)、
陰極8: Al(100nm)
である。
【0086】
実施例9
前記基板上に、ホール輸送材料であるNS21(新日鐵化学株式会社製)と、三酸化モリブデン(MoO3)を共蒸着し、NS21:MoO3=80:20を膜厚13.6nmで成膜した後、KLHT03(ケミプロ化成社製):MoO3=80:20を膜厚5nmで成膜し、バッファ層3を形成した。続いて、KLHT03を膜厚15nmで成膜し、ホール輸送層4を形成した。そして、発光層5は、TCTA:Ir(fpth1iq)3:トリス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)フェニル−κC]−イリジウム=80:20を膜厚10nmで成膜した。発光層5の上に、ビス(m−ターフェニル−5’−イル)スルホン(BTPS)を膜厚8nmで成膜し、ホール阻止層6を形成した。
【0087】
更に、ホール阻止層6の上に、KLET03(ケミプロ化成社製)を膜厚58nmで成膜し、8−ヒドロキシキノリナートリチウム(Liq)を膜厚1nmで成膜し、電子輸送層7を形成した。その上にアルミニウム(Al)を膜厚100nmで成膜し、陰極8を形成した。
【0088】
ここで、ビス(m−ターフェニル−5’−イル)スルホン(BTPS)は下記構造式で示される有機硫黄化合物である。
【0089】
【化13】

【0090】
このように形成した積層構造を、もう一枚のガラス基板と合わせ、UV硬化樹脂により封止して素子を完成した。
【0091】
本素子の層構成を簡略化して示すと、
陽極2: ITO(110nm)、
バッファ層3: NS21:MoO3(13.6nm、80:20)/KLHT03:MoO3=(5nm、80:20)、
ホール輸送層4: KLHT03(15nm)、
発光層5: TCTA:Ir(1−fiqph)3(10nm、80/20)、
ホール阻止層6: BTPS(8nm)、
電子輸送層7: KLET03(58nm)/Liq(1nm)、
陰極8: Al(100nm)
である。
【0092】
上記のように、実施例8で作製した有機EL素子はCIE色度座標(x、y)において(0.188、0.428)の黄色発光を示した。又、実施例9で作製した有機EL素子は、CIE色度座標(x、y)において(0.6、0.4)付近の橙色発光を示した。
【産業上の利用可能性】
【0093】
本発明により、有機エレクトロルミネッセンス素子のドーパントとして有用なイリジウム錯体及びそれを用いた有機エレクトロルミネッセンス素子を提供することができる。
【符号の説明】
【0094】
1 透明基板
2 陽極
3 バッファ層
4 ホール輸送層
5 発光層
6 電子輸送層1またはホール阻止層
7 電子輸送層2
8 陰極
【技術分野】
【0001】
本発明は、例えば、有機エレクトロルミネッセンス素子(以下有機EL素子と称することもある。)のドーパントとして有用なイリジウム錯体及びそれを用いた有機エレクトロルミネッセンス素子に関するものである。
【背景技術】
【0002】
従来、有機EL素子のドーパントとして、高効率化・色純度の向上・長寿命化を目的に種々のイリジウム錯体が提案されているが、その中でも3−(ピリジン−2−イル)−2,6−ジフルオロベンゼン又はピリジン誘導体を配位子とするイリジウム錯体が数多く記載されている(例えば、特許文献1〜4及び非特許文献1参照)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2002−117978号公報
【特許文献2】特開2006−182921号公報
【特許文献3】特開2005−220136号公報
【特許文献4】特開2007−161673号公報
【非特許文献】
【0004】
【非特許文献1】Inorganic Chemistry,48,1030(2009)
【発明の概要】
【発明が解決しようとする課題】
【0005】
これらの先行技術文献には数多くのイリジウム錯体が記載されているものの、それらの多くは実際には製造されておらず、それ自体の性能が確認されておらず、未だに高効率青色発光材料であるFIrpic((2−ピリジンカルボキシラト−κN1,κO2)ビス[2−(2−ピリジニル−κN)−3,5−ジフルオロフェニル−κC)]イリジウム)と同程度又はそれ以上の性能を有するイリジウム錯体の開発には到っていなかった。又、FIrpicと類似の構造で黄色発色を示すイリジウム錯体は知られていなかった。
【0006】
本発明の課題は、即ち、有機エレクトロルミネッセンス素子のドーパントとして有用なイリジウム錯体をより具体的に提供することにあり、又、その有機EL素子の青色、黄色又は橙色ドーパントとして好適に使用することができる、高性能のイリジウム錯体を見出すことにもある。
【課題を解決するための手段】
【0007】
本発明の課題は、一般式(1)
【0008】
【化1】

【0009】
(式中、Gはメチン基又は窒素原子、Lは1価のアニオン性二座配位子を表し示し、mは2又は3である。R1、R2、R3及びR4は炭素原子数1〜5のアルキル基であり、且つ隣接するもの同士は互いに結合して無置換のシクロヘキサン環を形成している。)
で示されるイリジウム錯体によって解決される。
【発明の効果】
【0010】
本発明により、有機EL素子の青色、黄色又は橙色ドーパントとして好適に使用することができるイリジウム錯体を提供することができる。
【図面の簡単な説明】
【0011】
【図1】実施例8〜9で製造した有機EL素子の層構成を示す図である。
【発明を実施するための形態】
【0012】
本発明のイリジウム錯体は一般式(1)で示される。その一般式(1)において、Gはメチレン基又は窒素原子を示す。又、Lは1価のアニオン性二座配位子であるが、例えば、例えば、アセチルアセトナト、ヘキサフルオロアセチルアセトナト、8−ヒドロキシキノリナート、イミンアセチルアセトナト、テトラメチルヘプタンジオネート、1−(2−ヒドロキシフェニル)ピラゾレート、フェニルピラゾレート、3−(2−ピリジル)−5−t−ブチルピラゾレート、3−(2−ピリジル)−5−トリフルオロメチルピラゾレート、2−(2−ピリジル)−4−トリフルオロメチル−1、3,5−トリアゾレート等が挙げられるが、好ましくはアセチルアセトナトである。
【0013】
又、R1、R2、R3及びR4は炭素原子数1〜5のアルキル基であり、且つ隣接するもの同士は互いに結合してシクロヘキサン環を形成している。
【0014】
本発明のイリジウム錯体の配位子としての3−(5,6,7,8−テトラヒドロイソキノリン−2−イル又は5,6,7,8−テトラヒドロイソキノリン−1−イル)−2,6−ジフルオロベンゼン又はピリジン誘導体は、以下のいずれかの方法によって製造できる。
【0015】
【化2】

【0016】
(式中、Gは前記と同義であり、Xはハロゲン原子、Pは脱離基を示す。)
【0017】
前記Xとしては、好ましくは塩素原子である。又、前記脱離基Pとしては、好ましくはジヒドロキシボリル基又はジアルコキシボリル基(2つのアルキル基は互いに結合して環を形成していても良い)である。
【0018】
又、本発明のイリジウム錯体の合成は、式(3)及び(4)で示すように塩化イリジウムを出発原料として合成することができる。
【0019】
【化3】

【0020】
(式中、G、L、R1、R2、R3及びR4は前記と同義である。)
【0021】
【化4】

【0022】
(式中、G、L、R1、R2、R3及びR4は前記と同義である。)
【0023】
(有機エレクトロルミネッセンス素子)
次に本発明の有機エレクトロルミネッセンス素子について説明する。本発明の有機EL素子は、本発明のイリジウム錯体が発光層に含まれるが、それ以外の公知の材料をも併せて使用することができる。
【0024】
有機EL素子は、好ましくは一対の電極間に単層または多層の有機化合物層を有する有機EL素子であり、本発明化合物を、有機化合物薄層のうちの少なくとも1層に含むものである。なお、有機化合物層とは、バッファ層、ホール注入層、ホール輸送層、発光層、電子輸送層、電子注入層などである。
【0025】
単層型の有機EL素子は、陽極と陰極との間に発光層を有する。発光層は、発光材料を含有し、更に、陽極から注入したホール、又は、陰極から注入した電子を発光材料まで輸送させるための有機化合物層に用いられる材料、例えば、ホール輸送材料や電子輸送材料を含有してもよい。
【0026】
多層型の有機EL素子としては、例えば、(陽極/バッファ層/ホール輸送層/発光層/ホール阻止層/電子輸送層/陰極)や(陽極/バッファ層/ホール輸送層/発光層/電子輸送層/陰極)などの多層構成が挙げられるが、他に(陽極/ホール注入層/ホール輸送層/発光層/ホール阻止層/電子輸送層/金属酸化物層/陰極)、(陽極/ホール注入層/発光層/陰極)、(陽極/発光層/電子輸送層/陰極)、(陽極/ホール注入層/発光層/電子輸送層/陰極)等の多層構成も挙げられ、その構成はこれらに限定されるものではない。
【0027】
又、バッファ層、ホール輸送層、電子輸送層、および発光層のそれぞれの層は、一層構造であっても、多層構造であってもよい。更に、ホール輸送層、電子輸送層はそれぞれの層で注入機能を有する層(ホール注入層及び電子注入層)と輸送機能を有する層(ホール輸送層及び電子輸送層)を別々に設けることもできる。
【0028】
以下、本発明の有機EL素子に構成要素に関して、(陽極/バッファ層/ホール輸送層/発光層/ホール阻止層/電子輸送層/陰極)の素子構成を例に詳細に説明する。
【0029】
本発明の有機EL素子において有機層の発光層にホストとして使用される材料は、公知のホスト材料の中から任意のものを選択して用いることができる。例えば、4,4’−ジ(N−カルバゾリル)−1,1’−ビフェニル(CBP)、1,3−ジ(N−カルバゾリル)ベンゼン(mCP)、2,2’―ジ〔4’’−(N−カルバゾリル)フェニル〕−1,1’−ビフェニル(4CzPBP)、ジフェニルジ(o−トリル)シラン、p−ビス(トリフェニルシリル)ベンゼン、4、4’、4’’−トリス(N−カルバゾリル)−トリフェニルアミン(TCTA)、49,10−ビス−[1,1,3’,1’’]ターフェニル−5’−イル−アントラセンなどが挙げられるが、これらに限定されるものではない。
【0030】
発光材料をホスト材料と組み合わせて使用する場合、発光材料はホスト材料に対して、好ましくは0.005〜80質量%である。
【0031】
ホール阻止層として使用される材料(以下、ホール阻止材料という)は、公知の材料としては、例えば、2,9−ジメチル−4,7−ジフェニル−1,10−フェナントロリン、ビス(2−メチル−8−キノリノラート)(p−フェニルフェノラート)アルミニウム、ビス(2−メチル−8−キノリノラート)(トリフェニルシラノラート)アルミニウム、ビス(m−ターフェニル−5’−イル)スルホン(BTPS)等が挙げられるが、これらに限定されるものではない。
【0032】
電子輸送層として使用される材料(以下、電子輸送材料という)は、公知の材料として、例えば、フルオレン、フェナントロリン、バソフェナントロリン、バソクプロイン、アントラキノジメタン、ジフェノキノン、オキサゾール、オキサジアゾール、トリアゾール、イミダゾール、アントラキノジメタン、4,4’−N,N’−ジカルバゾールビフェニル(CBP)等やそれらの化合物、金属錯体化合物もしくは含窒素五員環誘導体を挙げることができる。金属錯体化合物としては、具体的には、8−ヒドロキシキノリナートリチウム、トリス(8−ヒドロキシキノリナート)アルミニウム、トリ(2−メチル−8−ヒドロキシキノリナート)アルミニウム、トリス(8−ヒドロキシキノリナート)ガリウム、ビス(10−ヒドロキシベンゾ[h]キノリナート)ベリリウム、ビス(10−ヒドロキシベンゾ[h]キノリナート)亜鉛、ビス(2−メチル−8−キノリナート)(o−クレゾラート)ガリウム、ビス(2−メチル−8−キノリナート)(1−ナフトラート)アルミニウム、ビス(2−メチル−8−キノリナート)−4−フェニルフェノラート等があるが、これらに限定されるものではない。又、上記の含窒素五員環誘導体としては、オキサゾール、チアゾール、オキサジアゾール、チアジアゾールもしくはトリアゾール誘導体が好ましい。具体的には、2,5−ビス(1−フェニル)−1,3,4−オキサゾール、2,5−ビス(1−フェニル)−1,3,4−チアゾール、2,5−ビス(1−フェニル)−1,3,4−オキサジアゾール、2−(4’−tert−ブチルフェニル)−5−(4’’−ビフェニル)1,3,4−オキサジアゾール、2,5−ビス(1−ナフチル)−1,3,4−オキサジアゾール、1,4−ビス[2−(5−フェニルチアジアゾリル)]ベンゼン、2,5−ビス(1−ナフチル)−1,3,4ートリアゾール、3−(4−ビフェニルイル)−4−フェニル−5−(4−t−ブチルフェニル)−1,2,4−トリアゾール等があるが、これらに限定されるものではない。更に、ポリマ−有機発光素子に使用されるポリマ−材料も使用することができる。例えば、ポリパラフェニレンおよびその誘導体、フルオレン及びその誘導体等であるが、これらに限定されるものではない。
【0033】
一方、ホール輸送層として使用される材料(以下ホール輸送材料)は公知の材料から選択して用いることができる。例えばN,N’−ビス(3−メチルフェニル)−(1,1’−ビフェニル)−4,4’ジアミン(TPD)や4,4’−ビス[N−(ナフチル)−N−フェニル−アミノ]ビフェニル(α−NPD)等の芳香族ジアミン化合物、スチルベン誘導体、ピラゾリン誘導体、ポリアリールアルカン、4,4’,4’’−トリス(N−(3−メチルフェニル)N−フェニルアミノ)トリフェニルアミン(m−MTDATA)、2,2’,7,7’−テトラキス−(N,N−ジフェニルアミノ)−9,9’−スピロビフルオレン、及びポリビニルカルバゾール等の高分子材料が挙げられるが、これに限定されるものではない。
【0034】
又、有機EL素子には、ホールの注入性向上のためにバッファ層を設けることができるが、バッファ層に用いる材料としては公知の材料から選択して用いることができる。より好適には、上記ホール輸送材料に酸化モリブデンを1〜30質量%ドープしたものが使用されるが、これらに限定されるものではない。
【0035】
陽極に使用される導電性材料としては、仕事関数が4eV前後より大きいもの、例えば、炭素原子、アルミニウム、バナジウム、鉄、コバルト、ニッケル、タングステン、銀、金、白金、パラジウム及びそれらの合金、ITO(酸化インジウムに酸化スズを5〜10質量%添加した物質)基板、NESA基板に使用される酸化スズ、酸化インジウム等の酸化金属、更にポリチオフェンやポリピロール等の有機導電性樹脂を用いることが出来る。但し、陽極に使用される導電性材料の仕事関数が当該素子の陰極に使用される導電性材料の仕事関数より0.1eV以上大きなものを用いることが望ましい。
【0036】
陰極に使用される導電性物質としては、仕事関数が4eV前後より小さいもの例えば、マグネシウム、カルシウム、錫、鉛、チタニウム、イットリウム、リチウム、ルテニウム、マンガン、アルミニウム等又はそれらの合金が用いられる。ここで合金としては、マグネシウム/銀、マグネシウム/インジウム、リチウム/アルミニウム等が挙げられる。合金の比率は、蒸着源の温度、雰囲気、真空度等により制御され、特に限定されない。但し、陰極に使用されるこれらの導電性材料の仕事関数は当該素子の陽極に使用される導電性材料の仕事関数より0.1eV以上小さいものを用いることが望ましい。
【0037】
本発明の有機EL素子は、電子注入性向上のために発光層と電極との間に金属酸化物層を設けることも出来る。又、電子輸送材料に金属酸化物をドープして使用してもよい。
【0038】
使用される金属酸化物としては、LiF等のアルカリ金属フッ化物;BaF2、SrF2等のアルカリ土類金属フッ化物;Li2O等のアルカリ金属酸化物;RaO、SrO等のアルカリ土類金属酸化物が使用される。
【0039】
陽極及び陰極は、必要があれば二層以上の層構成により形成されていてもよい。
【0040】
本発明の有機EL素子は、少なくとも一方の面は素子の発光波長領域において透明であることが望ましい。又、基板も透明であることが望ましい。
【0041】
透明電極は、前記の導電性材料を使用して、蒸着又はスパッタリング等の方法で所定の透光性が確保するように設定して得られる。
【0042】
発光面の電極は、光透過率を10%以上にすることが望ましい。
【0043】
基板は、機械的、熱的強度を有し、透明性を有するものであれば特に限定されるものではないが、ガラス基板又は透明性樹脂フィルムが使用される。
【0044】
透明性樹脂フィルムとしては、例えば、ポリエチレン、エチレン−酢酸ビニル共重合体、エチレン−ビニルアルコール共重合体、ポリプロピレン、ポリスチレン、ポリメチルメタアクリレート、ポリ塩化ビニル、ポリビニルアルコール、ポリビニルブチラール、ナイロン、ポリエーテルエーテルケトン、ポリサルホン、ポリエーテルサルフォン、テトラフルオロエチレン−パーフルオロアルキルビニルエーテル共重合体、ポリビニルフルオライド、テトラフルオロエチレン−エチレン共重合体、テトラフルオロエチレン−ヘキサフルオロプロピレン共重合体、ポリクロロトリフルオロエチレン、ポリビニリデンフルオライド、ポリエステル、ポリカーボネート、ポリウレタン、ポリイミド、ポリエーテルイミド、ポリイミド、ポリプロピレン等が挙げられる。
【0045】
本発明の有機EL素子は、温度、湿度、雰囲気等に対する安定性の向上のために、素子の表面に保護層を設けるか、又はシリコンオイル、樹脂等により素子全体を保護してもよい。
【0046】
又、有機EL素子の各層の形成は、真空蒸着、スパッタリング、プラズマ、イオンプレーティング等の乾式成膜法、又はスピンコーティング、ディッピング、フローコーティング等の湿式成膜法のいずれかを適用することができる。膜厚は特に制限されないが、好ましくは0.1nm〜10μm、更に好ましくは0.5nm〜0.2μmである。
【0047】
湿式成膜法の場合、各層上に当該材料を、エタノール、クロロホルム、テトラヒドロフラン、ジオキサン等の溶媒に溶解または分散させて薄膜を調製することが出来る。又、この際前記の材料を共存させることも可能である。
【実施例】
【0048】
以下に実施例を挙げて、さらに本発明を具体的に説明する。
【0049】
参考例1((1−[2−(2’,4’−ジフルオロフェニル)−2−オキソエチル]ピリジニウムクロライド)の合成)
【0050】
【化5】

【0051】
攪拌装置、還流冷却器及び温度計を備えた500mlのガラス製四つ口フラスコに、2−クロロ−1−(2’,4’−ジフルオロフェニル)エタノン25g(0.13mol)及びピリジン250mlを加え、攪拌しながら室温で24時間反応させた。反応終了後、析出した固体を濾過し、得られた濾物をジエチルエーテルで洗浄した後に乾燥させ、淡褐色固体として、1−[2−(2’,4’−ジフルオロフェニル)−2−オキソエチル]ピリジニウムクロライド35gを得た(単離収率;99%)。
【0052】
参考例2((3−(2’,4'−ジフルオロフェニル)−5,6,7,8−テトラヒドロイソキノリンの合成)
【0053】
【化6】

【0054】
攪拌装置、還流冷却器及び温度計を備えた1Lのガラス製四つ口フラスコに、参考例1と同様な方法で合成した1−[2−(2’,4’−ジフルオロフェニル)−2−オキソエチル]ピリジニウムクロライド35g(0.13mol)、1−シクロヘキセンカルボキシアルデヒド15g(0.14mol)、酢酸アンモニウム50g(0.65mol)及びメタノール500mlを加え、攪拌しながら60〜65℃で24時間反応させた。反応終了後、反応液を室温まで冷却し、反応液を減圧下で濃縮した。得られた濃縮物に水を加え、酢酸エチルで抽出した。得られた抽出液を飽和塩化ナトリウム水溶液で洗浄後、無水硫酸ナトリウムで乾燥させた。濾過後、濾液を減圧下で濃縮した後、濃縮物をシリカゲルクロマトグラフィー(展開溶媒:ヘキサン/酢酸エチル=400/20→380/20(容量比))で精製し、黄色液体として、3−(2’,4'−ジフルオロフェニル)−5,6,7,8−テトラヒドロイソキノリン15gを得た(単離収率;47%)。
なお、3−(2’,4'−ジフルオロフェニル)−5,6,7,8−テトラヒドロイソキノリンの物性値は以下の通りであった。
【0055】
1H−NMR(CDCl3、δ(ppm));8.41(1H,s)、7.85(1H,m)、7.38(1H,s)、6.96(1H,m)、6.88(1H,m)、2.90〜2.70(4H,m)、1.90〜1.70(4H,m)
【0056】
参考例3(ジ−μ−クロロテトラキス−[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−ジイリジウムの合成)
【0057】
【化7】

【0058】
攪拌装置、還流冷却器及び温度計を備えた200mlのガラス製四つ口フラスコに、実施例2のように合成した3−(2’,4'−ジフルオロフェニル)−5,6,7,8−テトラヒドロイソキノリン5.0g(20mmol)及び2−エトキシエタノール100mlを加え、混合溶液に窒素を1時間通気した。次いで、三塩化イリジウム三水和物2.4g(8.2mmol)を加え、攪拌しながら130〜140℃で17時間反応させた。反応終了後、反応液を室温まで冷却し、飽和重曹水を添加し、弱塩基性に調整した。次いで、水を添加し、析出した固体をろ過した。得られた固体を水洗した後、50℃で真空乾燥し、黄色固体であるジ−μ−クロロテトラキス−[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−ジイリジウム4.3g(単離収率;59%)を得た。
【0059】
実施例1(G=メチン基、L=ピリジンカルボキシレート、m=2、R2とR3が結合してシクロヘキサン環を形成;(2−ピリジンカルボキシレート−κN1,κO2)ビス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−イリジウムの合成)
【0060】
【化8】

【0061】
攪拌装置、還流冷却器及び温度計を備えた100mlのガラス製三つ口フラスコに、参考例3と同様にして合成したジ−μ−クロロテトラキス−[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−ジイリジウム2.0g(1.4mmol)、ピコリン酸0.45g(3.6mmol)、炭酸ナトリウム1.5g(14mmol)及び2−エトキシエタノール15mlを加え、攪拌しながら140〜150℃で24時間反応させた。反応終了後、反応液を室温まで冷却し、水及び塩化メチレンを加え分液した。得られた有機層を飽和炭酸水素ナトリウム水溶液及び水で洗浄後、無水硫酸マグネシウムで乾燥させた。濾過後、濾液を減圧下で濃縮した後、濃縮物をシリカゲルクロマトグラフィー(展開溶媒:ヘキサン/塩化メチレン(=300/100)→塩化メチレン/酢酸エチル(=300/100)(容量比))で精製し、黄色固体として、2−ピリジンカルボキシレート−κN1,κO2)ビス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−イリジウム1.0gを得た(単離収率;43%)。
なお、2−ピリジンカルボキシレート−κN1,κO2)ビス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−イリジウムは、以下の物性値で示される新規な化合物である。
【0062】
1H−NMR(CDCl3、δ(ppm));8.41(1H,s)、8.32(1H,m)、8.00〜8.85(3H,m)、8.75(1H,m)、7.37(1H,m)、6.94(1H,m)、6.50〜6.25(2H,m)、5.85(1H,m)、5.60(1H,m)1.90〜1.70(4H,m)、3.00〜2.30(8H,m)2.00〜1.60(8H,m)
【0063】
実施例2(G=メチン基、L=アセチルアセトナト、m=2、R2とR3が結合してシクロヘキサン環を形成;ビス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC](2,4−ペンタンジオナート−κO2,κO4)−イリジウムの合成)
【0064】
【化9】

【0065】
攪拌装置、還流冷却器及び温度計を備えた100mlのガラス製三つ口フラスコに、参考例3と同様な方法で合成したジ−μ−クロロテトラキス−[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−ジイリジウム3.0g(2.1mmol)、アセチルアセトン0.4g(4.0mmol)、炭酸ナトリウム1.8g(17mmol)及び2−エトキシエタノール200mlを加え、攪拌しながら100〜110℃で24時間反応させた。反応終了後、反応液を室温まで冷却し、減圧下で濃縮した。濃縮物に水及び塩化メチレンを加え分液した。得られた有機層を飽和炭酸水素ナトリウム及び水で洗浄後、無水硫酸マグネシウムで乾燥させた。濾過後、濾液を減圧下で濃縮した後、濃縮物をシリカゲルクロマトグラフィー(展開溶媒:ヘキサン/酢酸エチル(=300/100)(容量比))で精製し、黄色固体として、ビス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC](2,4−ペンタンジオナート−κO2,κO4)−イリジウム2.3gを得た(単離収率;70%)。
なお、ビス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC](2,4−ペンタンジオナート−κO2,κO4)−イリジウムは新規な化合物である。
【0066】
実施例3(G=メチン基、m=3、R2とR3が結合してシクロヘキサン環を形成;トリス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−イリジウムの合成
【0067】
【化10】

【0068】
攪拌装置、還流冷却器及び温度計を備えた100mlのガラス製三つ口フラスコに、実施例5のように合成したビス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC](2,4−ペンタンジオナート−κO2,κO4)−イリジウム1.0g(1.3mmol)、3−(2’,4'−ジフルオロフェニル)−5,6,7,8−テトラヒドロイソキノリン0.5g(2.0mmol)及びグリセリン10mlを加え、50〜60℃で混合溶液に窒素を1時間通気した。次いで、攪拌しながら180〜200℃で24時間反応させた。反応終了後、反応液を室温まで冷却し、5%塩酸20ml及び塩化メチレンを加えて分液した。得られた有機層を飽和炭酸水素ナトリウム水溶液及び水で洗浄後、無水硫酸マグネシウムで乾燥させた。濾過後、濾液を減圧下で濃縮した後、濃縮物をシリカゲルクロマトグラフィー(展開溶媒:ヘキサン/塩化メチレン(=300/100)(容量比))で精製し、黄色固体として、トリス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−イリジウム0.2gを得た(単離収率;8.2%)。
なお、トリス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−イリジウムは、以下の物性値で示される新規な化合物である。
【0069】
1H−NMR(CD2Cl2、δ(ppm));7.96(3H,s)、7.19(3H,s)、6.35(3H,m)、6.14(3H,m)、3.00〜2.70(6H,m)、2.65〜2.35(6H,m)、1.90〜1.60(12H,m)
【0070】
実施例4(G=メチン基、m=3、R3とR4が結合してシクロヘキサン環を形成;トリス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)フェニル−κC]−イリジウムの合成)
【0071】
【化11】

【0072】
攪拌装置、還流冷却器及び温度計を備えた100mlのガラス製三つ口フラスコに、ジ−μ−クロロテトラキス−[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)フェニル−κC]−ジイリジウム2.6g(1.8mmol)、1−(2’,4’−ジフルオロフェニル)−5,6,7,8−テトラヒドロインキノリン2.2g(9.1mmol)及びジグライム156mlを加え、混合溶液に窒素を1時間通気した。次いで、トリフルオロメタンスルホン酸銀2.3g(9.1mmol)を加え、攪拌しながら150〜155℃で30時間反応させた。反応終了後、反応液を室温まで冷却し、水及びクロロホルムを加え分液した。得られた有機層を水で洗浄後、無水硫酸マグネシウムで乾燥させた。濾過後、減圧下で濃縮した。濃縮物をシリカゲルクロマトグラフィー(展開溶媒;酢酸エチル/n−ヘキサン(=1:4)(容量比))で精製した。黄色粉体として、トリス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)フェニル−κC]−イリジウム1.6gを得た(単離収率;48%)。
なお、[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)フェニル−κC]−イリジウムは、以下の物性値で示される新規な化合物である。
【0073】
1H−NMR(CDCl3,δ(ppm));
7.12〜7.02(3H,m)、6.70〜6.58(3H,m)、6.38〜6.24(3H,m)、6.23〜6.13(3H,m)、2.90〜2.70(12H,m)、1.90〜1.70(6H,m)、1.70〜1.50(6H,m)
【0074】
実施例5(G=窒素原子、m=3、R3とR4が結合してシクロヘキサン環を形成;トリス[2,6−ジフルオロ−3−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)―4−ピリジニル−κC]−イリジウムの合成)
【0075】
【化12】

【0076】
攪拌装置、還流冷却器及び温度計を備えた100mlのガラス製三つ口フラスコに、ジ−μ−クロロテトラキス−[2,6−ジフルオロ−3−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)−4−ピリジニル−κC]−ジイリジウム0.5g(0.3mmol)、1−(2’,6’−ジフルオロ−3’−ピリジル)−5,6,7,8−テトラヒドロインキノリン0.4g(1.7mmol)及びジグライム30mlを加え、混合溶液に窒素を1時間通気した。次いで、トリフルオロメタンスルホン酸銀0.5g(1.9mmol)を加え、攪拌しながら150〜155℃で21時間反応させた。反応終了後、反応液を室温まで冷却し、水及びクロロホルムを加え分液した。得られた有機層を水で洗浄後、無水硫酸マグネシウムで乾燥させた。濾過後、減圧下で濃縮した。濃縮物をシリカゲルクロマトグラフィー(展開溶媒: クロロホルム)で精製した。次いで、エタノールにて分散洗浄し、黄色粉体としてトリス[2,6−ジフルオロ−3−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)―4−ピリジニル−κC]−イリジウム0.18gを得た(単離収率;28%)。
なお、トリス[2,6−ジフルオロ−3−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)―4−ピリジニル−κC]−イリジウムは、以下の物性値で示される新規な化合物である。
【0077】
1H−NMR(CD2Cl2,δ(ppm));7.30〜7.20(3H,m)、6.85〜6.75(3H,m)、2.95〜2.70(12H,m)、2.00〜1.50(12H,m)
【0078】
実施例7(室温での発光スペクトルの測定)
実施例2〜4のイリジウム錯体をテトラヒドロフランに溶解し、堀場製作所社製分光蛍光高度計(Fluoro−Max4)を用いて、室温での発光スペクトルを測定したところ、実施例2のイリジウム錯体の極大吸収波長は460nm及び490nm、実施例3の極大吸収波長は490nm、実施例4の極大吸収波長は460nmであり、実施例2のイリジウム錯体は特に非常に強い青色発光を示した。
【0079】
次に、本発明の化合物を使用した有機EL素子の製造例を説明する。
なお、製造例中、次の略語を使用する。
Ir(3−fiqph)3:トリス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−3’−イソキノリニル−κN)フェニル−κC]−イリジウム;実施例3で合成したものを使用した。
Ir(1−fiqph)3:トリス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)フェニル−κC]−イリジウム;実施例4で合成したものを使用した。
【0080】
実施例8(本発明のイリジウム錯体を含む有機EL素子の製造)
図1に示すように、基板側から、透明基板1、陽極2、バッファ層3、ホール輸送層4、発光層5、ホール阻止層6、電子輸送層7及び陰極8の各層を備える有機EL素子を以下の方法により作製した。
【0081】
パターニング済みの透明導電膜(ITO)(陽極2)が膜厚110nmで成膜されたガラス基板(透明基板1)を、純水と界面活性剤による超音波洗浄、純水による流水洗浄、純水とイソプロピルアルコールの容量比1:1混合溶液による超音波洗浄、イソプロピルアルコールによる煮沸洗浄の順で洗浄処理した。この基板を沸騰中のイソプロピルアルコールからゆっくり引き上げ、イソプロピルアルコール蒸気中で乾燥させ、最後に紫外線オゾン洗浄を行った。この基板を陽極とし、真空チャンバ内に配置し、7.5×10−3Paまで真空排気し、該チャンバ内には、蒸着材料をそれぞれ充填した各モリブデン製ボードと、所定のパターンで成膜するための蒸着用マスクを設置しておき、ボードを通電加熱し、蒸着材料を蒸発させることにより、順次、次のようにバッファ層3、ホール輸送層4、発光層5、ホール阻止層6、電子輸送層7を成膜した。
【0082】
前記基板上に、ホール輸送材料であるNS21(新日鐵化学株式会社製)と、三酸化モリブデン(MoO3)を共蒸着し、NS21:MoO3=80:20を膜厚9nmで成膜した後、NS21:MoO3=90:10を膜厚7nmで成膜し、バッファ層3を形成した。続いて、3DTAPBP(ケミプロ化成株式会社製)を膜厚22nmで成膜し、ホール輸送層4を形成した。そして、TCTA:Ir(fpth3iq)3:=80:20を膜厚10nmで成膜して形成した。発光層5の上に、KLET03(ケミプロ化成株式会社製)を膜厚70.5nmで成膜し、電子輸送層6を形成した。
【0083】
更に、電子輸送層6の上に、8−ヒドロキシキノリナートリチウムを膜厚0.5nmで成膜し、電子注入層7を形成した。その上にアルミニウム(Al)を膜厚100nmで成膜し、陰極8を形成した
【0084】
このように形成した積層構造を、もう一枚のガラス基板と合わせ、UV硬化樹脂により封止して素子を完成した。
【0085】
本素子の層構成を簡略化して示すと、
陽極2: ITO(110nm)、
バッファ層3: NS21:MoO3(9nm、80:20)/NS21:MoO3=(7nm、90:10)、
ホール輸送層4: 3DTAPBP(22nm)、
発光層5: TCTA:Ir(3−fiqph)3:=(10nm、80:20)
電子輸送層6: KLET03(70.5nm)、
電子輸送層7: Liq(0.5nm)、
陰極8: Al(100nm)
である。
【0086】
実施例9
前記基板上に、ホール輸送材料であるNS21(新日鐵化学株式会社製)と、三酸化モリブデン(MoO3)を共蒸着し、NS21:MoO3=80:20を膜厚13.6nmで成膜した後、KLHT03(ケミプロ化成社製):MoO3=80:20を膜厚5nmで成膜し、バッファ層3を形成した。続いて、KLHT03を膜厚15nmで成膜し、ホール輸送層4を形成した。そして、発光層5は、TCTA:Ir(fpth1iq)3:トリス[3,5−ジフルオロ−2−(5’,6’,7’,8’−テトラヒドロ−1’−イソキノリニル−κN)フェニル−κC]−イリジウム=80:20を膜厚10nmで成膜した。発光層5の上に、ビス(m−ターフェニル−5’−イル)スルホン(BTPS)を膜厚8nmで成膜し、ホール阻止層6を形成した。
【0087】
更に、ホール阻止層6の上に、KLET03(ケミプロ化成社製)を膜厚58nmで成膜し、8−ヒドロキシキノリナートリチウム(Liq)を膜厚1nmで成膜し、電子輸送層7を形成した。その上にアルミニウム(Al)を膜厚100nmで成膜し、陰極8を形成した。
【0088】
ここで、ビス(m−ターフェニル−5’−イル)スルホン(BTPS)は下記構造式で示される有機硫黄化合物である。
【0089】
【化13】

【0090】
このように形成した積層構造を、もう一枚のガラス基板と合わせ、UV硬化樹脂により封止して素子を完成した。
【0091】
本素子の層構成を簡略化して示すと、
陽極2: ITO(110nm)、
バッファ層3: NS21:MoO3(13.6nm、80:20)/KLHT03:MoO3=(5nm、80:20)、
ホール輸送層4: KLHT03(15nm)、
発光層5: TCTA:Ir(1−fiqph)3(10nm、80/20)、
ホール阻止層6: BTPS(8nm)、
電子輸送層7: KLET03(58nm)/Liq(1nm)、
陰極8: Al(100nm)
である。
【0092】
上記のように、実施例8で作製した有機EL素子はCIE色度座標(x、y)において(0.188、0.428)の黄色発光を示した。又、実施例9で作製した有機EL素子は、CIE色度座標(x、y)において(0.6、0.4)付近の橙色発光を示した。
【産業上の利用可能性】
【0093】
本発明により、有機エレクトロルミネッセンス素子のドーパントとして有用なイリジウム錯体及びそれを用いた有機エレクトロルミネッセンス素子を提供することができる。
【符号の説明】
【0094】
1 透明基板
2 陽極
3 バッファ層
4 ホール輸送層
5 発光層
6 電子輸送層1またはホール阻止層
7 電子輸送層2
8 陰極
【特許請求の範囲】
【請求項1】
一般式(1)
【化1】

(式中、Gはメチン基又は窒素原子、Lは1価のアニオン性二座配位子を表し示し、mは2又は3である。R1、R2、R3及びR4は炭素原子数1〜5のアルキル基であり、且つ隣接するもの同士は互いに結合して無置換のシクロヘキサン環を形成している。)
で示されるイリジウム化合物。
【請求項2】
請求項1記載のイリジウム錯体を含有することを特徴とする有機エレクトロルミネッセンス素子。
【請求項1】
一般式(1)
【化1】

(式中、Gはメチン基又は窒素原子、Lは1価のアニオン性二座配位子を表し示し、mは2又は3である。R1、R2、R3及びR4は炭素原子数1〜5のアルキル基であり、且つ隣接するもの同士は互いに結合して無置換のシクロヘキサン環を形成している。)
で示されるイリジウム化合物。
【請求項2】
請求項1記載のイリジウム錯体を含有することを特徴とする有機エレクトロルミネッセンス素子。
【図1】




【公開番号】特開2012−1517(P2012−1517A)
【公開日】平成24年1月5日(2012.1.5)
【国際特許分類】
【出願番号】特願2010−140332(P2010−140332)
【出願日】平成22年6月21日(2010.6.21)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成20年度、独立行政法人新エネルギー・産業技術総合開発機構、「エネルギー使用合理化技術戦略的開発/エネルギー使用合理化技術実用化開発/高効率有機EL照明の実用化研究開発」委託研究、産業技術力強化法第19条の適用を受ける特許出願」
【出願人】(000000206)宇部興産株式会社 (2,022)
【Fターム(参考)】
【公開日】平成24年1月5日(2012.1.5)
【国際特許分類】
【出願日】平成22年6月21日(2010.6.21)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成20年度、独立行政法人新エネルギー・産業技術総合開発機構、「エネルギー使用合理化技術戦略的開発/エネルギー使用合理化技術実用化開発/高効率有機EL照明の実用化研究開発」委託研究、産業技術力強化法第19条の適用を受ける特許出願」
【出願人】(000000206)宇部興産株式会社 (2,022)
【Fターム(参考)】
[ Back to top ]

