インテグラーゼN−末端領域を標的としたウイルス感染阻害剤
【課題】従来のインテグラーゼ阻害剤とは薬剤の作用点を全く異にする、HIV感染を逆転写過程以前で阻止することができる新規なインテグラーゼ阻害剤のスクリーニング方法を提供することや、またかかるスクリーニング方法を用いて得られる新規なインテグラーゼ阻害剤を提供することや、新規なエイズ治療薬として期待が大きいこれらインテグラーゼ阻害剤やそれをコードするDNAを含む薬剤組成物を提供するものである。
【解決手段】レトロウイルスのインテグラーゼのN−末端領域のペプチドに対して特異的に結合するペプチドをファージディスプレイ法によりスクリーニングし、スクリーニングの結果、逆転写反応以前にHIV−1等のレトロウイルスの感染・増殖を阻害するペプチドを得る。
【解決手段】レトロウイルスのインテグラーゼのN−末端領域のペプチドに対して特異的に結合するペプチドをファージディスプレイ法によりスクリーニングし、スクリーニングの結果、逆転写反応以前にHIV−1等のレトロウイルスの感染・増殖を阻害するペプチドを得る。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、エイズウイルス等のレトロウイルスのインテグラーゼのN−末端領域を標的とすることにより得られる、エイズウイルス等のレトロウイルスの感染阻害剤や、かかるウイルス阻害剤のスクリーニング方法や、かかるウイルス阻害剤を含む治療用組成物やエイズワクチンに関する。
【背景技術】
【0002】
レトロウイルスの1種であるレンチウイルスに属するヒト免疫不全ウイルス(HIV)には、ヒト免疫不全ウイルス1型(以下「HIV−1」という)とヒト免疫不全ウイルス2型(HIV−2)とがあり、それらは遺伝子レベルで40%の相同性を示すことが知られている。レンチウイルスは宿主細胞を殺す病原性ウイルスであり、HIVは、多くのレンチウイルスと同様に、持続感染し、感染経路の大半を通じて、低い活性を示し、この経過の間、感染者はほとんど無症状であって感染していることに気づかず、この潜伏期間は10年以上続いて、最終的にこのHIV感染者の殆ど全てが後天性免疫不全症候群(AIDS)を発症し、死に至る。
【0003】
HIV−1をはじめとするレトロウイルスは、感染標的細胞に吸着し、脱殻して侵入した後、逆転写酵素によりウイルス粒子内にパッケージされている一本鎖RNA遺伝子を二本鎖DNAに変換し、核内に移行した後、宿主染色体に組み込む(インテグレーション反応)ことで感染を樹立させることが知られている。こうしたHIV−1の増殖に必須なウイルス感染の初期過程における逆転写反応及びインテグレーション反応はウイルス特異的反応過程であり、これらの反応はウイルスのポリメラーゼ(pol)遺伝子産物である逆転写酵素(RT)及びインテグラーゼ(IN)により触媒されることも知られている。
【0004】
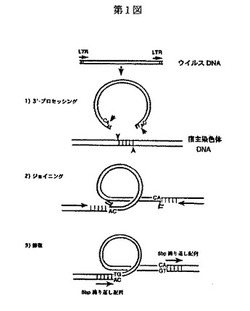
レトロウイルスのインテグレーション反応過程は、図1に示すように、(1)逆転写酵素によりDNAに変換されたウイルスDNAの両末端に存在するLTR領域の各末端に作用し、両3′末端の2のヌクレオチド(HIV−1の場合はGT)を切除除去する3′−プロセッシング反応、(2)3′−プロセッシング反応を終えたウイルスDNAが核内に移行し宿主染色体DNAと会合し、ウイルスDNA両3′末端−OH基の求核反応により切れ目が入れられると同時に切断された宿主染色体DNAの各5′末端リン酸基とウイルスDNA3′末端−OH基が各々エステル結合するジョイニング反応、(3)ウイルスDNAの各5′末端と宿主染色体DNAの各3′末端が結合する修復の3つの過程からなり(非特許文献1)、インテグラーゼが直接触媒する反応は、3′−プロセッシング反応とジョイニング反応であり、修復は宿主細胞のDNA修復酵素系により行われるものと考えられている。
【0005】
HIV−1のインテグラーゼ蛋白は全長288個のアミノ酸からなり、図2に示すように、N−末端ドメイン(N−末端側から数えて1〜50位までのアミノ酸を含むペプチド)、中央酵素活性ドメイン(51〜212位までのアミノ酸を含むペプチド)及びC−末端ドメイン(213〜288位までのアミノ酸を含むペプチド)の機能的相補可能な3つのドメインから構成されている(図2にはすべてのレトロウイルスインテグラーゼに保存されているアミノ酸とその位置が示されており、また、図2中、Hはヒスチジンを、Cはシステインを、Dはアスパラギン酸を、Eはグルタミン酸をそれぞれ表している。)。
【0006】
そして、インテグレーション反応には、インテグラーゼの中央に位置する酵素活性ドメインが重要であるとされ、特に、酵素活性ドメインに存在する64位及び116位のアスパラギン酸、及び152位のグルタミン酸の3つのアミノ酸残基は、Mg2+又はMn2+との結合に関与するインテグレーション反応に必須なアミノ酸残基であり、これらアミノ酸がインテグラーゼの酵素活性中心であることが報告されている(非特許文献2、3、4)。また、この酵素活性ドメインに存在し、レトロウイルス間で強く保存されている136位、156及び159位のリジン残基が、ウイルスDNA末端部位との特異的結合に重要であることも報告されている。
【0007】
インテグラーゼのC−末端ドメインは、DNA結合能をもち、この領域のアミノ酸配列は多様性に富み、現在までにインテグラーゼ多量体形成及び核移行等の機能が知られているが、詳細はまだよくわかっていない。近年、NMRによる構造解析から、このC末端ドメインにSH3(Src−homology3)様構造が存在し、このSH3の2量体形成あるいは非特異的DNA結合能に関与していると考えられており(非特許文献5,6)非特異的DNA結合能に関しては、264位のリジン残基を含むいくつかの塩基性アミノ酸残基の重要性が示唆されている(非特許文献7、8)。
【0008】
また、インテグラーゼのN−末端ドメインには、全てのレトロウイルスのインテグラーゼに保存されている2つのヒスチジン残基(H)と2つのシステイン残基(C)から構成されるHHCCモチーフが存在し、このアミノ酸モチーフはいくつかの転写調節因子のDNA結合ドメインに認められるZnフィンガーモチーフに似ていることから、その機能として、インテグラーゼの特異的DNA結合領域と考えられていたが、現在ではインテグラーゼの二量体あるいは多量体形成に関与しているものと考えられている(非特許文献9)。
【0009】
そして、上記インテグラーゼのN−末端ドメインのNMRによる構造解析から、このN−末端ドメインは、図3のα1〜α4に示される4つのαヘリックス構造からなるヘリックス・ターン・ヘリックス(HTH)構造を有し、HHCCモチーフの各2つのヒスチジン残基とシステイン残基は亜鉛イオンを取り囲むように配位することによりこの構造の安定化、すなわち骨格形成に重要な役割を果たし、また、このN−末端ドメインは液体中で二量体を形成することも報告されている(非特許文献10)。このN−末端ドメインはインテグラーゼ分子の二量体形成の安定化に重要で、間接的にインテグレーション反応に関与していることが知られているが、その真の機能に関しては不明である。
【0010】
また、N−末端領域のHTH構造は、トリプトファンリプレッサー蛋白質のDNA結合部位に代表されるHTH構造に酷似している。インテグラーゼのN−末端ドメインのHTH構造とトリプトファンリプレッサー蛋白質のDNA結合部位に代表されるHTH構造との違いとして、トリプトファンリプレッサー蛋白質のDNA結合部位として考えられている第2番目のヘリックスに相当する領域が、HIV−1インテグラーゼでは二量体形成におけるインテグラーゼ分子間のインターフェイス領域となっている。
【0011】
また、本発明者らによって、インテグラーゼのN−末端ドメインに存在するHHCCモチーフの骨格となるヒスチジン残基又はシステイン残基のアミノ酸置換変異を導入したHIV−1変異株を解析し、ウイルスの感染性がほぼ完全に失われることを見い出し、また、この点変異による感染価欠失機序として、ウイルス吸着・侵入以降、逆転写反応以前のステップ(脱殻過程)が阻害されることを世界で初めて報告した(非特許文献11)。また、これらの研究により、インテグラーゼ蛋白のHHCCモチーフを骨格とするN−末端ドメインの構造がウイルスの感染性維持に非常に重要な役割を担っているものと考えられるようになった。
【0012】
その他、ヒト免疫不全ウイルス(HIV)に対する治療方法等に関する報告も既に多くなされており、例えば、特許文献1には、ヒト免疫不全ウイルス(HIV)に感染した患者に対し、HIVのコア蛋白質(Gagポリ蛋白質)であるHIV基質(MA)ポリペプチドの変異を受けたポリペプチドを投与する治療方法が、特許文献2には、ヒト免疫不全ウイルス(HIV)のNef蛋白質の生物学的に活性なペプチドフラグメント、これらのペプチド又はその生物学的に活性な類似体を含む薬学組成物、ペプチドのアンタゴニスト及びアンタゴニストを含む薬学的組成物、並びに上記化合物及び組成物を利用する治療及びスクリーニング方法が、特許文献3には、少なくとも一つの細胞をレトロウイルス感染に抵抗性にするために、レトロウイルスの複製を阻害することができるトランスドミナント・ネガティブ・インテグラーゼ遺伝子を使用する治療方法がそれぞれ記載されている。
【0013】
本発明者らは、インテグラーゼのN−末端ドメインについての研究をさらに進めるため、インテグラーゼのN−末端領域のアミノ酸配列をHIV−1間、あるいは近縁のHIV−2、SIV、異種のレトロウイルス間でその相同性を調べたところ、図4に示すように、インテグラーゼの二量体形成におけるインターフェース領域に相当する領域に疎水性アミノ酸により構成され、種間で強く保存されている疎水性アミノ酸モチーフα−helix−3が存在することを見い出した(図4中、「NL43」はHIV−1の遺伝子に含まれているインテグラーゼ遺伝子領域の、「HIV−2ROD」はHIV−2のROD株のインテグラーゼ遺伝子領域の、「SIVAGM」はアフリカグリーンモンキー由来のSIVのインテグラーゼ遺伝子領域の、「FIV」はネコ免疫不全ウイルスのインテグラーゼ遺伝子領域の、「MoMuLV」はマウス白血症ウイルスのインテグラーゼ領域の、それぞれN−末端を示している)。これら疎水性アミノ酸モチーフにアミノ酸置換を導入したいくつかの変異HIV−1を作製し解析したところ、HHCC各アミノ酸残基に置換変異を導入した前記HIV−1変異株と同様に、逆転写反応以前のステップでウイルスの感染性がほぼ完全に失われることが新たに判明した。
【0014】
また、インテグラーゼのN−末端領域のHHCCの4つのアミノ酸を亜鉛イオンと結合しうる配列である、HHCH,HHHC,HHHH,CCHH,CCCCのそれぞれに置換したHIV−1変異株や、リン酸化反応が予想される15位のタイロシン残基の置換変異を導入したHIV−1変異株も、逆転写反応以前のステップでウイルスの感染性が完全に失活することが確かめられた。
【0015】
これら一連のアミノ酸置換変異HIV−1の解析から、HIV−1インテグラーゼのN−末端ドメインの構造は、一つのアミノ酸の置換によっても影響され、機能的に不安定になりやすく、その結果、ウイルスの感染性に致命的な影響を与えることを確認した。本発明者らは、また、HIV−1インテグラーゼのN−末端ドメインに限らず、他の酵素活性ドメインやC−末端ドメインについても種間で保存されているアミノ酸の置換変異体を作製し解析を行ったが、逆転写反応以前のステップでウイルスの感染性がほぼ完全に失われる変異体はインテグラーゼのN−末端領域内の置換に限定されていることも確認した。
【0016】
これら本発明者らにより新たに見出された知見は、新規なインテグラーゼ阻害剤を開発する上で、すなわちヒト免疫不全ウイルスの感染を逆転写過程以前で阻止するという新規なエイズ治療薬や治療方法を開発する上できわめて有力な示唆を与えるものである。従来行なわれているインテグラーゼ阻害剤のスクリーニング方法が酵素活性阻害に専ら焦点を当て、インテグラーゼ蛋白のコアともいえる中央酵素活性ドメインを標的としていたのに対し、インテグラーゼ蛋白のN−末端領域を標的とすることにより、薬剤作用点が全く異なる新規なHIV−1阻害剤を得ることが可能となる。
【0017】
【特許文献1】特表平8−503488号公報
【特許文献2】特表平9−501143号公報
【特許文献3】特表平10−503654号公報
【非特許文献1】Annu.Rev.Biochem.63,133−173,1994
【非特許文献2】J.Virol.66,6361−6369,1992
【非特許文献3】Mol.Cell.Biol.12,2331−2338,1992
【非特許文献4】J.Virol.65,5624−5630,1991
【非特許文献5】Nature Structural Biology 2,807−810,1995
【非特許文献6】Biochemistry 34,9826−9833,1995
【非特許文献7】Nucleic Acids Research 22,4125−4131,1994
【非特許文献8】Biochemistry 34,9826−9833,1995
【非特許文献9】Proc.Natl.Acad.Sci.USA.93,13659−13664,1996
【非特許文献10】Nature Structural Biology 4,567−577,1997
【非特許文献11】J.Virol.69,6687−6696,1995
【発明の開示】
【発明が解決しようとする課題】
【0018】
本発明の課題は、従来のインテグラーゼ阻害剤とは薬剤の作用点を全く異にする、HIV感染を逆転写過程以前で阻止することができる新規なインテグラーゼ阻害剤のスクリーニング方法を提供することや、またかかるスクリーニング方法を用いて得られる新規なインテグラーゼ阻害剤を提供することや、新規なエイズ治療薬として期待が大きいこれらインテグラーゼ阻害剤やそれをコードするDNAを含む薬剤組成物を提供することにある。
【0019】
本発明者らは、インテグラーゼ蛋白の本来の酵素活性の場であるウイルス遺伝子の組み込み過程ではなく、ウイルス感染性維持に非常に重要な役割を担っているN末端領域に着目し、独自にデザインし、ウイルスの感染性を完全に失わせることを確認したインテグラーゼ変異クローンを用いて、インテグラーゼ変異蛋白の構造解析により、あるいは変異の認められた領域のアミノ酸配列をもつ合成ペプチドがこれまで報告されているインテグラーゼ阻害剤とは異なった作用で、HIV−1の複製阻害を行うことを見い出し、本発明を完成するに至った。
【課題を解決するための手段】
【0020】
すなわち本発明は、(1)配列番号3〜11のいずれか記載のペプチド又は該ペプチドを含むペプチド若しくは蛋白質からなり、レトロウイルス感染阻害活性を有することを特徴とするレトロウイルス感染阻害剤や、(2)配列番号2に示されるアミノ酸配列のうち26番目から39番目のアミノ酸配列を有するペプチド又は該ペプチドを含むペプチド若しくは蛋白質からなることを特徴とするレトロウイルス感染阻害剤や、(3)配列番号2に示されるアミノ酸配列のうち1番目から55番目のアミノ酸配列を有するペプチドを抗原として用いることにより得られるモノクローナル抗体からなり、レトロウイルス感染阻害活性を有することを特徴とするレトロウイルス感染阻害剤や、(4)前記(1)〜(3)のいずれか記載のペプチド又は蛋白質に他のペプチド若しくは蛋白質又は非蛋白質が結合した複合体からなり、レトロウイルス感染阻害活性を有することを特徴とするレトロウイルス感染阻害剤や、(5)他のペプチド若しくは蛋白質又は非蛋白質が、T細胞抗原であるCD4糖蛋白質であることを特徴とする前記(4)記載のレトロウイルス感染阻害剤や、(6)他のペプチド若しくは蛋白質又は非蛋白質が、レトロウイルスのコート蛋白質であることを特徴とする前記(4)記載のレトロウイルス感染阻害剤や、(7)複合体が、プロテアーゼ耐性を有する複合体又は細胞内導入用の化学修飾がなされた複合体であることを特徴とする前記(4)〜(6)のいずれか記載のレトロウイルス感染阻害剤や、(8)前記(1)〜(7)のいずれか記載のレトロウイルス感染阻害剤を構成するペプチド若しくは蛋白質又は蛋白質部分をコードするDNAが発現可能なDNA構築物からなることを特徴とするレトロウイルス感染阻害剤や、(9)発現可能なDNA構築物が、ウイルスベクターを含むDNA構築物であることを特徴とする前記(8)記載のレトロウイルス感染阻害剤に関する。
【0021】
更に本発明は、(10)レトロウイルスのインテグラーゼのN−末端領域の全部若しくは一部からなるペプチド又は該N−末端領域を含むペプチドにおいて1若しくは数個のアミノ酸が欠失、置換若しくは付加された変異インテグラーゼをコードするDNA又はこのDNAとストリンジェントな条件下でハイブリダイズするDNAであって、これらDNAを有するレトロウイルス変異株が逆転写反応以前にレトロウイルスの複製を阻害する当該DNAからなることを特徴とするレトロウイルス感染阻害剤や、(11)変異インテグラーゼが、配列番号2に示されるアミノ酸配列のうち、43番目のシステインがヒスチジンに置換されたC43H;40番目のシステインがヒスチジンに置換されたC40H;40番目及び43番目のシステインがヒスチジンに置換されたC40H,C43H;12番目及び16番目のヒスチジンがシステインに置換されたH12C,H16C;12番目及び16番目のヒスチジンがシステインに置換され、かつ、40番目及び43番目のシステインがヒスチジンに置換されたH12C,H16C,C40H,C43H;29番目のプロリンがフェニルアラニンに置換されたP29F;32番目のバリンがグルタミン酸に置換されたV32E;36番目のイソロイシンがグルタミン酸に置換されたI36E;15番目のタイロシンがアラニンに置換されたY15A;15番目のタイロシンがスレオニンに置換されたY15T;から選ばれる変異インテグラーゼであり、レトロウイルス感染阻害活性を有することを特徴とする前記(10)記載のレトロウイルス感染阻害剤や、(12)レトロウイルスが、HIV−1であることを特徴とする前記(1)〜(11)のいずれか記載のレトロウイルス感染阻害剤に関する。
【発明の効果】
【0022】
本発明によると、従来のインテグラーゼ阻害剤とは薬剤の作用点を全く異にする、HIV感染を逆転写過程以前で阻止することができる新規なインテグラーゼ阻害剤をスクリーニングすることができる。また、かかるスクリーニングによりレトロウイルスの感染・増殖を完全に阻止することができる新規なインテグラーゼ阻害剤を得ることができる。これら新規なインテグラーゼ阻害剤を含む薬剤組成物は、エイズ治療薬として期待できる。
【発明を実施するための最良の形態】
【0023】
本発明において、レトロウイルスとは、RNAを遺伝子としてもち、逆転写酵素によりゲノムRNAをDNAに変換するものであればどのようなものでもよく、例えば、ヒト免疫不全ウイルス1型(特にHIV−1)、ヒト免疫不全ウイルス2型(HIV−2)、サル免疫不全ウイルス、ネコ免疫不全ウイルス、マウス白血病ウイルス、ウマ伝染性貧血ウイルス、ヤギ関節炎ウイルス、ヒツジのビスナウイルス、ウシ免疫不全ウイルス、メーソン・ファイザーサルウイルス、マウス乳癌ウイルス、ラウス肉腫ウイルス、ウシ白血病ウイルス、ヒトT細胞白血病ウイルス、細網内皮症ウイルス、ネコ白血病ウイルス、ヒト泡沫レトロウイルスを具体的に挙げることができる。また、本発明においてインテグラーゼとは、前記レトロウイルスが感染した細胞内で生産する蛋白質であり、宿主内で逆転写酵素により複製されたウイルスゲノムが、宿主の染色体に組み込まれる反応を触媒するものであればどのようなものでもよい。
【0024】
本発明において、レトロウイルスのインテグラーゼN−末端領域とは、レトロウイルスのインテグラーゼ蛋白のアミノ酸配列において、亜鉛イオンと結合する領域及びその隣接するC−末端側の一部を意味し、例えば、配列番号2に記載するHIV−1のインテグラーゼのアミノ酸配列においては、通常Znフィンガー様ドメインと呼ばれているN−末端ドメイン(1から50個のアミノ酸配列の領域)に加えて、その隣接するC−末端側10残基程度が含まれる。また、本発明において、レトロウイルス感染阻害剤とは、逆転写反応以前にウイルス感染を阻害する物質をいい、本発明のレトロウイルス感染阻害剤によるとレトロウイルスの複製・増殖を阻害することができる。
【0025】
本発明におけるレトロウイルス感染阻害剤のスクリーニング方法としては、レトロウイルスのインテグラーゼのN−末端領域の全部若しくは一部からなる領域又は該N−末端領域を含む領域を標的とする方法であればどのようなものでもよく、例えば、リコンビナントDNA技術により得られる、レトロウイルスのインテグラーゼのN−末端領域の全部若しくは一部からなるペプチド又は該N−末端領域を含むペプチドに対して結合するペプチド又は蛋白質等の被検物質をファージディスプレイ法、免疫沈降法、ツー・ハイブリッド法(two−hybrid assay)、ファー・ウエスタン(Far Western)法等の蛋白質の分子間相互作用を利用して検出する方法を例示することができる。また、ペプチド又は蛋白質の候補被検物質としては、HIV−1インテグラーゼのN−末端領域(1番目から55番目)のアミノ酸配列の一部又は該アミノ酸配列若しくはその一部を有するペプチドにおいて1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含むペプチド又は蛋白質を挙げることができる。
【0026】
ファージ・ディスプレイ法におけるランダムオリゴペプチドとしては、pSKANシステム(Mo Bi Tec社製)を、cDNAライブラリー作成用としてはSurfZAPCloning kit(Stratagene社製)を、ランダムペプチドをファージに挿入したファージライブラリー(NEB社製)を利用することができる。ツー・ハイブリッド分析には、市販のMATCHMAKER(Clontech社製)や、HybridZAP(Stratagene社製)等のシステムを利用することができる。また、ファー・ウエスタン法は、結合蛋白質をメンブレン上のバンドとして直接検出でき、λgt11等の発現ライブラリーを用いればそれらを直接クローニングすることも可能な方法である。これらの方法によると、従来の酵素活性阻害をみるスクリーニング方法に比べて簡単に、かつ、薬剤作用点も異なる新規な阻害剤を見出すことが可能となる。
【0027】
本発明における被検物質としては、上記の他にレトロウイルスのインテグラーゼのN−末端領域の全部若しくは一部からなるペプチド又は該N−末端領域を含むペプチドをコードするRNAに対して結合する物質も例示することができる。ウイルスRNAに結合する物質としては、DNA若しくはRNA又はペプチド若しくは蛋白質を挙げることができ、そして、ウイルスRNAの塩基配列上のどの部位に蛋白質が特異的に結合しているかは、例えば、リボヌクレアーゼを用いるフットプリンティング法によって確認することができる。
【0028】
本発明におけるスクリーニング方法としては、被検物質の存在下及び被検物質がペプチドの場合は該ペプチドをコードするDNAが発現可能な状態下で、野生型レトロウイルスを宿主細胞にインフェクションし、インフェクション後の宿主細胞中のウイルス遺伝子発現量を非感染コントロール(Mock)と比較する方法や、被検物質の存在下及び被検物質がペプチドの場合は該ペプチドをコードするDNAが発現可能な状態下で、野生型レトロウイルスのインテグラーゼ遺伝子を用いるツー・ハイブリッド法を行い、インテグラーゼの2量体形成の阻害を検出する方法を挙げることができる。
【0029】
本発明のレトロウイルス感染阻害剤には、上記のレトロウイルス感染阻害剤のスクリーニング方法により得られる、例えば、DNA若しくはRNA又はペプチド若しくは蛋白質等の物質や、インテグラーゼN−末端領域のリコンビナント精製蛋白質を標的として、ファージ・ディスプレイ法によってそこに結合することが見出された配列番号3〜11に示された9種のペプチド又は該ペプチドを含むペプチド若しくは蛋白質や、HIV−1インテグラーゼのN−末端領域におけるα3近傍のペプチドである配列番号2記載に示されるアミノ酸配列のうち26番目から39番目のアミノ酸配列を有するペプチド又は該ペプチドを含むペプチド若しくは蛋白質等を挙げることができる。また、レトロウイルスのインテグラーゼのN−末端領域を特異的に認識するモノクローナル抗体をレトロウイルス感染阻害剤として例示することができる。
【0030】
そしてまた、本発明のレトロウイルス感染阻害剤には、上記のレトロウイルス感染阻害作用を有するペプチド又は蛋白質に、他のペプチド若しくは蛋白質又は糖蛋白質を含む非蛋白質が結合した複合体を挙げることができ、これら複合体としては、T細胞抗原であるCD4糖蛋白質やレトロウイルスのコート蛋白質が結合した複合体を具体的に例示することができ、これら複合体としては、化学修飾等により、プロテアーゼに抵抗性を有する性質が付加されたものや細胞内への透過性が改善されたものが好ましい。
【0031】
さらに、上記のレトロウイルス感染阻害剤を構成するタンパク質等は、細胞内で発現させることにより細胞内に存在させることもできる。すなわち、ペプチド若しくは蛋白質又は蛋白質部分をコードするDNAをその発現が可能なDNA構築物、例えば、ウイルスベクター等に該DNAを発現可能に組み込んだDNA構築物としたものを用いることもできる。
【0032】
本発明におけるレトロウイルス感染阻害剤としては、上記の阻害物質の他、レトロウイルスの複製を阻害しうる、その活性を失ったトランスドミナント・ネガティブ・インテグラーゼ遺伝子、例えば、レトロウイルスのインテグラーゼのN−末端領域の全部若しくは一部からなるペプチド又は該N−末端領域を含むペプチドにおいて1若しくは数個のアミノ酸が欠失、置換若しくは付加された変異インテグラーゼをコードするDNA又はこのDNAとストリンジェントな条件下でハイブリダイズするDNAであって、これらDNAを有するレトロウイルス変異株が逆転写反応以前にレトロウイルスの複製を阻害する当該DNAからなる遺伝子を挙げることができる。
【0033】
上記不活化された変異インテグラーゼ遺伝子としては、配列番号2に示される野生型HIV−1インテグラーゼのアミノ酸配列のうち、43番目のシステインがヒスチジンに置換された(C43H)や、40番目のシステインがヒスチジンに置換された(C40H)や、40番目及び43番目のシステインがヒスチジンに置換された(C40H,C43H)や、12番目及び16番目のヒスチジンがシステインに置換された(H12C,H16C)や、12番目及び16番目のヒスチジンがシステインに置換され、かつ、40番目及び43番目のシステインがヒスチジンに置換された(H12C,H16C,C40H,C43H)や、29番目のプロリンがフェニルアラニンに置換された(P29F)や、32番目のバリンがグルタミン酸に置換された(V32E)や、36番目のイソロイシンがグルタミン酸に置換された(I36E)や、15番目のタイロシンがアラニンに置換された(Y15A)や、15番目のタイロシンがスレオニンに置換された(Y15T)等から選ばれた変異インテグラーゼ遺伝子を具体的に挙げることができる。
【0034】
本発明の治療用組成物としては、上記のレトロウイルス感染阻害剤を含む組成物を挙げることができ、また、これら組成物には、tat阻害剤、HIVプロテアーゼ阻害剤、及びアジドチミジン、ジデオキシイノシン、ジデオキシシトシン及びd4T等からなるヌクレオシド又は非ヌクレオシド逆転写酵素阻害剤等の抗ウイルス薬を含めることができる。本発明の治療用組成物はエイズ治療用薬剤として有用である。
【0035】
また本発明のエイズワクチン等のレトロウイルス用ワクチンとしては、レトロウイルスのインテグラーゼのN−末端領域の全部若しくは一部からなるペプチド又は該N−末端領域を含むペプチドにおいて1若しくは数個のアミノ酸が欠失、置換若しくは付加された変異インテグラーゼをコードするDNA又はこのDNAとストリンジェントな条件下でハイブリダイズするDNAを有するレトロウイルス変異株であって、該変異株が逆転写反応以前にレトロウイルスの複製を阻害する当該変異株からなるものを挙げることができ、具体的には、前記C43Hや、C40Hや、C40H,C43Hや、H12C,H16Cや、H12C,H16C,C40H,C43Hや、P29Fや、V32Eや、I36Eや、Y15Aや、Y15T等から選ばれた変異インテグラーゼ遺伝子を有する変異株からなるワクチンを挙げることができる。
【0036】
本発明の治療方法においては、前記レトロウイルス感染阻害剤や、治療用組成物や、レトロウイルス用ワクチンを用いることができる。
【実施例】
【0037】
以下本発明を実施例により詳細に説明するが、本発明の技術的範囲はかかる実施例により何ら限定されるものではない。
【0038】
実施例1(HIV−1インテグラーゼの変異クローンの作製)
文献(J.Virol,59,284−291,1986)記載の方法により、HIV−1インテグラーゼの突然変異誘発性DNAフラグメントを感染性クローンであるpNL4−3から得た。このpNL4−3のSPeIサイトからSalIサイトにわたる4.3kbフラグメントをHIV−1インテグラーゼの突然変異誘発性DNAフラグメントとして、pBluescript SK(ストラタジーン社製)にサブクローンした。このベクターDNAを一本鎖DNAに調製し、T7−GEN in vitro mutagenesis kit(米国のBiochemical社製)のプロトコルの指示に基づき、この一本鎖DNAにヘルパーファージM13K07を用いて位置特異的突然変異誘発を行い、前記C43Hや、C40Hや、C40H,C43Hや、H12C,H16Cや、H12C,H16C,C40H,C43Hや、P29Fや、V32Eや、I36Eや、Y15Aや、Y15T等のHIV−1インテグラーゼの変異クローンを得た(図4参照)。
【0039】
実施例2(各HHCCモチーフ変異クローンとマウス白血病ウイルスのアンホトロピックエンベロープとからのシュードタイプウイルスの作製)
実施例1記載の方法によって得られた、1μgのHIV−1インテグラーゼの変異クローン(pNLluc△BgIII)と、1μgのマウス白血病ウイルスのアンホトロピックエンベロープ発現ベクター(pDJ−1)とを、10μlのリポフェクトアミン(BRL社製)に混合し、30度で30分間反応させた。この反応物をCOS細胞に加えてトランスフェクションした。トランスフェクションから6時間後、10%の子牛血清を含むDMEM(Dulbecco’s modified Eagle’s medium)を4ml加え培養した。また、24時間後にこの培養液を同様の新しい培養液4mlと交換させ、さらに培養してCOS細胞から培養液に放出されたシュードタイプウイルスを作製し、このウイルスをp24固相酵素免疫検定法によりウイルス粒子放出量を定量した(図5)。得られた培養液をウイルス溶液として、また、コントロールとして、プラスミドをトランスフェクションしていないCOS細胞培養液を非ウイルス溶液(Mock)を以下の実験に使用した。
【0040】
また、上記シュードタイプウイルス作製に、各ウイルスの変異クローンが影響するかどうかをプロウイルス遺伝子発現量を調べた。前記トランスフェクションから6時間後、全てのCOS細胞をPBS(リン酸緩衝溶液)で3回洗浄し、このCOS細胞に200μlの1×ルシフェラーゼ溶解液(プロメガ社製)を加えて溶解し、この溶解液10μlをluminometer Monolight 2010(カリフォルニア州のサンディエゴのアナリティカル・ルミネッセンス・ラボレトリー社製)を用いてルシフェラーゼアッセイ法によりプロウイルス遺伝子発現量を測定した(図6)。これらのことから、各ウイルスの変異クローンはプロウイルス遺伝子発現及びウイルス粒子放出に影響しないことがわかった。
【0041】
実施例3(各変異ウイルスにおける感染性)
10mMの塩化マグネシウム存在下で、実施例2のp24固相酵素免疫検定法により定量された約50ngの各ウイルス溶液に、デオキシリボヌクレアーゼIを加えて30分間処理し、得られた各変異ウイルスのDNAをRD細胞(ヒトラブドミオザルコーマ細胞)に接種することでウイルス感染させた。ウイルス感染2日後及び6日後、感染細胞中に発現したウイルス遺伝子を前記記載のルシフェラーゼアッセイ法により測定した(図7)。この結果から、1例(P30Nの変異ウイルス)を除いて全ての変異ウイルスがMock以下であり、ウイルス感染性がウイルスの変異により強く阻害することがわかった。
【0042】
実施例4(各変異ウイルスにより逆転写反応以前で感染性が強く阻害されていることの確認)
これらの各変異ウイルスにおいて、逆転写反応以前でウイルスの感染性が完全に失われているかどうかを以下に記載する方法で確認した。実施例3に記載するウイルス感染2日後のRD細胞から、尿素溶解法により全DNAを抽出した。このDNAを含む抽出液をフェノール及びクロロホルムにより処理し、エタノール沈殿させることでDNAを精製し、100μlの超純水に加え再溶解した。HIV−1に特異的なプライマー(R/U5,R/gag)を用いて、このDNA溶液に含まれるウイルス遺伝子をPCR法により増幅させた(94℃で1分間熱変性させ、55℃で2分間アニーリングし、72℃で2分間合成反応させるサイクルを30サイクル行い増幅させた)。このPCR産物を2%のアガロースゲル電気泳動法により分画し、サイバーグリーンにより染色し視覚化した(図8)。この結果から、1例(P30Nの変異ウイルス)を除く全ての変異ウイルスにおいて、R/U5及びR/gagのプライマーを用いてもウイルスDNAを検出されなかったことから、ウイルスの感染性が逆転写反応以前で強く阻害されていることがわかった。
【0043】
実施例5(Yeast two−hybrid分析)
図9に、Gal−4 yeast two−hybrid system法を用いて、HIV−1インテグラーゼの野生型及びその変異体にかかる2量体形成能及び他のウイルス構造蛋白質との会合における蛋白間相互作用を調べた結果を示す。図9のDBに示されているWTIN、D64EIN及びC43LINとは、pPC97(GAL4DBベクター)のMCS(multiple cloning sites)に野生型インテグラーゼの遺伝子、インテグラーゼのD64E変異体の遺伝子、又はインテグラーゼのC43L変異体の遺伝子をそれぞれGAL4DBベクターのフレームに合わせて挿入し、構築されたGAL4DBベクターとの複合体を意味する。また、図9のADに示されているWTIN(野生型インテグラーゼの遺伝子)、D64EIN(インテグラーゼのD64E変異体の遺伝子)、C43LIN(インテグラーゼのC43L変異体の遺伝子)、MA(gag領域に含まれるp17遺伝子)、CA(gag領域に含まれるp24遺伝子)、NC(gag領域に含まれるp7又はp9遺伝子)、RT(逆転写酵素遺伝子)、Vif(ウイルス感染性遺伝子)及びVpr(ウイルス蛋白質R遺伝子)とは、pPC86(GAL4ADベクター)のMCSにそれぞれの相補的なDNAを挿入し、構築されたpPC86−cDNAを意味する。これらの結果から、C43L変異体によりインテグラーゼ分子間の二量体形成能が阻害されることがわかった。
【0044】
実施例6(HIV−1インテグラーゼのN末端ドメインの部分ペプチドの阻害活性)
化学合成より作製した、図3に示されるNZ−1、NZ−2、N−ITFcc及びNZ−4のペプチドを最終濃度で20μMになるように生理的食塩水で希釈し、RD細胞に加え2時間処理した。その後、p24固相酵素免疫検定法により定量された50ngのHIV−1を、この処理されたRD細胞に接種しウイルス感染させた。ウイルス感染3日後、感染細胞中に発現したウイルス遺伝子を上記記載のルシフェラーゼアッセイ法により測定したところ、NZ−1、NZ−2及びNZ−4のペプチドにて処理されたRD細胞は、10〜30%しか抑制されなかったが、N−ITFccのペプチドにて処理されたRD細胞では、80%近く抑制されており、抗ウイルス剤として応用可能なことがわかった。
【0045】
実施例7(ファージディスプレイ法によるHIV−1インテグラーゼのN末端ドメインに結合するペプチドを用いた抗ウイルス剤のスクリーニング)
HIV−1のクローン(pNL4−3)を鋳型としてPCR法により増幅した(94℃で1分間熱変性させ、60℃で1分間アニーリングし、72℃で2分間合成反応させるサイクルを30サイクル行い増幅させた)。このPCR産物から、HIV−1インテグラーゼのN末端ドメイン(N末端側から55個のアミノ酸配列をコードする領域)のDNA断片を取り出し、発現ベクターpGEX−2T(ファルマシア社製)のBamHIやEcoRI等の部位にこのDNA断片を挿入し、HIV−1インテグラーゼ発現ベクター(pGEX2T−zinc)を構築した。構築されたベクターを大腸菌BL21(DE3)に導入した。このトランスフォームされた大腸菌を培養液に加え、最終濃度で100mMになるようにIPTG(イソプロピル−1−チオ−β−D−ガラクトシド)を添加し、37℃で5時間発現誘導を行い、5時間後、この大腸菌を3000rpmで10分間遠心分離させ集菌し、次に1L当たりの培地から集菌された大腸菌を100mlの1MのNaClと3mMのDTTとを含む生理食塩水(A液)に再溶解し、超音波処理(500Wで10分間)によりこの大腸菌を粉砕した。得られた大腸菌粉砕液を12000rpmで30分間遠心分離することにより、蛋白粗分画を回収し、この蛋白粗分画に含まれるGST(グルタチオン−S−トランスフェラーゼ)が融合したインテグラーゼN−末端蛋白をグルタチオンセファロースビーズ(ファルマシア社製)により精製した。
【0046】
次に、種々の長さのランダムペプチドをファージに挿入したファージライブラリー(NEB社製)の中から、パニング操作(各ファージライブラリーの中でGST蛋白質に結合しないファージ粒子を回収する操作、選択されたファージの中から上記記載の作製されたGST融合インテグラーゼN−末端蛋白に結合するファージ粒子を回収する操作)を3〜7回繰り返し、HIV−1インテグラーゼN末端ドメインと特異的に結合するペプチドを含むファージをスクリーニングした。この得られたファージをクローニングし、遺伝子配列を決定した。これらのファージディスプレー法によって得られたペプチドが、HIV−1インテグラーゼN末端ドメインを標的とし、インビトロで結合するかどうかを固相酵素免疫検定法により確認した(図10)。より詳しくは、96穴プレートを100μg/mlのGST融合インテグラーゼN−末端蛋白、GST蛋白質又は無蛋白質でコーティングし、ブロッキング後、1011pFUの各ペプチドをもつクローン化ファージを加えて反応させ、次に、抗M13−HRP抗体(西洋ワサビペルオキシダーゼ標識抗M13)により2次反応させた。反応の終了した96穴プレートに2,2′−アジノビス(3−エチルベンズチアゾリンスルホニックアシッド)(ABTS;シグマ社製)を基質として発色させ、吸光度405nmで定量した。これらの結果から、GST融合インテグラーゼN−末端蛋白に各ペプチドが特異的に結合することが確認できた。
【図面の簡単な説明】
【0047】
【図1】第1図は、レトロウイルスのインテグレーション反応過程を示す図である。
【図2】第2図は、レトロウイルスインテグラーゼ間に保存されているアミノ酸とその位置を示す図である。
【図3】第3図は、HIV−1インテグラーゼのN−末端ドメインのα1〜α4のαヘリックスの領域を示す図である。
【図4】第4図は、標的とされたレトロウイルスのインテグラーゼN−末端領域において保存されるアミノ酸残基を示す図である。
【図5】第5図は、HIV−1インテグラーゼ変異クローンにおける細胞感染後のウイルス粒子の放出を示す図である。
【図6】第6図は、HIV−1インテグラーゼ変異クローンにおけるCOS細胞感染後のウイルス遺伝子の発現量を示す図である。
【図7】第7図は、HIV−1インテグラーゼ変異クローンにおけるRD細胞感染後のウイルス遺伝子の発現量を示す図である。
【図8】第8図は、HIV−1インテグラーゼ変異クローンが逆転写反応以前に感染が阻害されたことを示す図である。
【図9】第9図は、HIV−1変異クローンのツー・ハイブリッド法による蛋白相互間作用を示す図である。
【図10】第10図は、ファージディスプレー法によるウイルス感染阻害剤の特異的結合を示す図である。
【技術分野】
【0001】
本発明は、エイズウイルス等のレトロウイルスのインテグラーゼのN−末端領域を標的とすることにより得られる、エイズウイルス等のレトロウイルスの感染阻害剤や、かかるウイルス阻害剤のスクリーニング方法や、かかるウイルス阻害剤を含む治療用組成物やエイズワクチンに関する。
【背景技術】
【0002】
レトロウイルスの1種であるレンチウイルスに属するヒト免疫不全ウイルス(HIV)には、ヒト免疫不全ウイルス1型(以下「HIV−1」という)とヒト免疫不全ウイルス2型(HIV−2)とがあり、それらは遺伝子レベルで40%の相同性を示すことが知られている。レンチウイルスは宿主細胞を殺す病原性ウイルスであり、HIVは、多くのレンチウイルスと同様に、持続感染し、感染経路の大半を通じて、低い活性を示し、この経過の間、感染者はほとんど無症状であって感染していることに気づかず、この潜伏期間は10年以上続いて、最終的にこのHIV感染者の殆ど全てが後天性免疫不全症候群(AIDS)を発症し、死に至る。
【0003】
HIV−1をはじめとするレトロウイルスは、感染標的細胞に吸着し、脱殻して侵入した後、逆転写酵素によりウイルス粒子内にパッケージされている一本鎖RNA遺伝子を二本鎖DNAに変換し、核内に移行した後、宿主染色体に組み込む(インテグレーション反応)ことで感染を樹立させることが知られている。こうしたHIV−1の増殖に必須なウイルス感染の初期過程における逆転写反応及びインテグレーション反応はウイルス特異的反応過程であり、これらの反応はウイルスのポリメラーゼ(pol)遺伝子産物である逆転写酵素(RT)及びインテグラーゼ(IN)により触媒されることも知られている。
【0004】
レトロウイルスのインテグレーション反応過程は、図1に示すように、(1)逆転写酵素によりDNAに変換されたウイルスDNAの両末端に存在するLTR領域の各末端に作用し、両3′末端の2のヌクレオチド(HIV−1の場合はGT)を切除除去する3′−プロセッシング反応、(2)3′−プロセッシング反応を終えたウイルスDNAが核内に移行し宿主染色体DNAと会合し、ウイルスDNA両3′末端−OH基の求核反応により切れ目が入れられると同時に切断された宿主染色体DNAの各5′末端リン酸基とウイルスDNA3′末端−OH基が各々エステル結合するジョイニング反応、(3)ウイルスDNAの各5′末端と宿主染色体DNAの各3′末端が結合する修復の3つの過程からなり(非特許文献1)、インテグラーゼが直接触媒する反応は、3′−プロセッシング反応とジョイニング反応であり、修復は宿主細胞のDNA修復酵素系により行われるものと考えられている。
【0005】
HIV−1のインテグラーゼ蛋白は全長288個のアミノ酸からなり、図2に示すように、N−末端ドメイン(N−末端側から数えて1〜50位までのアミノ酸を含むペプチド)、中央酵素活性ドメイン(51〜212位までのアミノ酸を含むペプチド)及びC−末端ドメイン(213〜288位までのアミノ酸を含むペプチド)の機能的相補可能な3つのドメインから構成されている(図2にはすべてのレトロウイルスインテグラーゼに保存されているアミノ酸とその位置が示されており、また、図2中、Hはヒスチジンを、Cはシステインを、Dはアスパラギン酸を、Eはグルタミン酸をそれぞれ表している。)。
【0006】
そして、インテグレーション反応には、インテグラーゼの中央に位置する酵素活性ドメインが重要であるとされ、特に、酵素活性ドメインに存在する64位及び116位のアスパラギン酸、及び152位のグルタミン酸の3つのアミノ酸残基は、Mg2+又はMn2+との結合に関与するインテグレーション反応に必須なアミノ酸残基であり、これらアミノ酸がインテグラーゼの酵素活性中心であることが報告されている(非特許文献2、3、4)。また、この酵素活性ドメインに存在し、レトロウイルス間で強く保存されている136位、156及び159位のリジン残基が、ウイルスDNA末端部位との特異的結合に重要であることも報告されている。
【0007】
インテグラーゼのC−末端ドメインは、DNA結合能をもち、この領域のアミノ酸配列は多様性に富み、現在までにインテグラーゼ多量体形成及び核移行等の機能が知られているが、詳細はまだよくわかっていない。近年、NMRによる構造解析から、このC末端ドメインにSH3(Src−homology3)様構造が存在し、このSH3の2量体形成あるいは非特異的DNA結合能に関与していると考えられており(非特許文献5,6)非特異的DNA結合能に関しては、264位のリジン残基を含むいくつかの塩基性アミノ酸残基の重要性が示唆されている(非特許文献7、8)。
【0008】
また、インテグラーゼのN−末端ドメインには、全てのレトロウイルスのインテグラーゼに保存されている2つのヒスチジン残基(H)と2つのシステイン残基(C)から構成されるHHCCモチーフが存在し、このアミノ酸モチーフはいくつかの転写調節因子のDNA結合ドメインに認められるZnフィンガーモチーフに似ていることから、その機能として、インテグラーゼの特異的DNA結合領域と考えられていたが、現在ではインテグラーゼの二量体あるいは多量体形成に関与しているものと考えられている(非特許文献9)。
【0009】
そして、上記インテグラーゼのN−末端ドメインのNMRによる構造解析から、このN−末端ドメインは、図3のα1〜α4に示される4つのαヘリックス構造からなるヘリックス・ターン・ヘリックス(HTH)構造を有し、HHCCモチーフの各2つのヒスチジン残基とシステイン残基は亜鉛イオンを取り囲むように配位することによりこの構造の安定化、すなわち骨格形成に重要な役割を果たし、また、このN−末端ドメインは液体中で二量体を形成することも報告されている(非特許文献10)。このN−末端ドメインはインテグラーゼ分子の二量体形成の安定化に重要で、間接的にインテグレーション反応に関与していることが知られているが、その真の機能に関しては不明である。
【0010】
また、N−末端領域のHTH構造は、トリプトファンリプレッサー蛋白質のDNA結合部位に代表されるHTH構造に酷似している。インテグラーゼのN−末端ドメインのHTH構造とトリプトファンリプレッサー蛋白質のDNA結合部位に代表されるHTH構造との違いとして、トリプトファンリプレッサー蛋白質のDNA結合部位として考えられている第2番目のヘリックスに相当する領域が、HIV−1インテグラーゼでは二量体形成におけるインテグラーゼ分子間のインターフェイス領域となっている。
【0011】
また、本発明者らによって、インテグラーゼのN−末端ドメインに存在するHHCCモチーフの骨格となるヒスチジン残基又はシステイン残基のアミノ酸置換変異を導入したHIV−1変異株を解析し、ウイルスの感染性がほぼ完全に失われることを見い出し、また、この点変異による感染価欠失機序として、ウイルス吸着・侵入以降、逆転写反応以前のステップ(脱殻過程)が阻害されることを世界で初めて報告した(非特許文献11)。また、これらの研究により、インテグラーゼ蛋白のHHCCモチーフを骨格とするN−末端ドメインの構造がウイルスの感染性維持に非常に重要な役割を担っているものと考えられるようになった。
【0012】
その他、ヒト免疫不全ウイルス(HIV)に対する治療方法等に関する報告も既に多くなされており、例えば、特許文献1には、ヒト免疫不全ウイルス(HIV)に感染した患者に対し、HIVのコア蛋白質(Gagポリ蛋白質)であるHIV基質(MA)ポリペプチドの変異を受けたポリペプチドを投与する治療方法が、特許文献2には、ヒト免疫不全ウイルス(HIV)のNef蛋白質の生物学的に活性なペプチドフラグメント、これらのペプチド又はその生物学的に活性な類似体を含む薬学組成物、ペプチドのアンタゴニスト及びアンタゴニストを含む薬学的組成物、並びに上記化合物及び組成物を利用する治療及びスクリーニング方法が、特許文献3には、少なくとも一つの細胞をレトロウイルス感染に抵抗性にするために、レトロウイルスの複製を阻害することができるトランスドミナント・ネガティブ・インテグラーゼ遺伝子を使用する治療方法がそれぞれ記載されている。
【0013】
本発明者らは、インテグラーゼのN−末端ドメインについての研究をさらに進めるため、インテグラーゼのN−末端領域のアミノ酸配列をHIV−1間、あるいは近縁のHIV−2、SIV、異種のレトロウイルス間でその相同性を調べたところ、図4に示すように、インテグラーゼの二量体形成におけるインターフェース領域に相当する領域に疎水性アミノ酸により構成され、種間で強く保存されている疎水性アミノ酸モチーフα−helix−3が存在することを見い出した(図4中、「NL43」はHIV−1の遺伝子に含まれているインテグラーゼ遺伝子領域の、「HIV−2ROD」はHIV−2のROD株のインテグラーゼ遺伝子領域の、「SIVAGM」はアフリカグリーンモンキー由来のSIVのインテグラーゼ遺伝子領域の、「FIV」はネコ免疫不全ウイルスのインテグラーゼ遺伝子領域の、「MoMuLV」はマウス白血症ウイルスのインテグラーゼ領域の、それぞれN−末端を示している)。これら疎水性アミノ酸モチーフにアミノ酸置換を導入したいくつかの変異HIV−1を作製し解析したところ、HHCC各アミノ酸残基に置換変異を導入した前記HIV−1変異株と同様に、逆転写反応以前のステップでウイルスの感染性がほぼ完全に失われることが新たに判明した。
【0014】
また、インテグラーゼのN−末端領域のHHCCの4つのアミノ酸を亜鉛イオンと結合しうる配列である、HHCH,HHHC,HHHH,CCHH,CCCCのそれぞれに置換したHIV−1変異株や、リン酸化反応が予想される15位のタイロシン残基の置換変異を導入したHIV−1変異株も、逆転写反応以前のステップでウイルスの感染性が完全に失活することが確かめられた。
【0015】
これら一連のアミノ酸置換変異HIV−1の解析から、HIV−1インテグラーゼのN−末端ドメインの構造は、一つのアミノ酸の置換によっても影響され、機能的に不安定になりやすく、その結果、ウイルスの感染性に致命的な影響を与えることを確認した。本発明者らは、また、HIV−1インテグラーゼのN−末端ドメインに限らず、他の酵素活性ドメインやC−末端ドメインについても種間で保存されているアミノ酸の置換変異体を作製し解析を行ったが、逆転写反応以前のステップでウイルスの感染性がほぼ完全に失われる変異体はインテグラーゼのN−末端領域内の置換に限定されていることも確認した。
【0016】
これら本発明者らにより新たに見出された知見は、新規なインテグラーゼ阻害剤を開発する上で、すなわちヒト免疫不全ウイルスの感染を逆転写過程以前で阻止するという新規なエイズ治療薬や治療方法を開発する上できわめて有力な示唆を与えるものである。従来行なわれているインテグラーゼ阻害剤のスクリーニング方法が酵素活性阻害に専ら焦点を当て、インテグラーゼ蛋白のコアともいえる中央酵素活性ドメインを標的としていたのに対し、インテグラーゼ蛋白のN−末端領域を標的とすることにより、薬剤作用点が全く異なる新規なHIV−1阻害剤を得ることが可能となる。
【0017】
【特許文献1】特表平8−503488号公報
【特許文献2】特表平9−501143号公報
【特許文献3】特表平10−503654号公報
【非特許文献1】Annu.Rev.Biochem.63,133−173,1994
【非特許文献2】J.Virol.66,6361−6369,1992
【非特許文献3】Mol.Cell.Biol.12,2331−2338,1992
【非特許文献4】J.Virol.65,5624−5630,1991
【非特許文献5】Nature Structural Biology 2,807−810,1995
【非特許文献6】Biochemistry 34,9826−9833,1995
【非特許文献7】Nucleic Acids Research 22,4125−4131,1994
【非特許文献8】Biochemistry 34,9826−9833,1995
【非特許文献9】Proc.Natl.Acad.Sci.USA.93,13659−13664,1996
【非特許文献10】Nature Structural Biology 4,567−577,1997
【非特許文献11】J.Virol.69,6687−6696,1995
【発明の開示】
【発明が解決しようとする課題】
【0018】
本発明の課題は、従来のインテグラーゼ阻害剤とは薬剤の作用点を全く異にする、HIV感染を逆転写過程以前で阻止することができる新規なインテグラーゼ阻害剤のスクリーニング方法を提供することや、またかかるスクリーニング方法を用いて得られる新規なインテグラーゼ阻害剤を提供することや、新規なエイズ治療薬として期待が大きいこれらインテグラーゼ阻害剤やそれをコードするDNAを含む薬剤組成物を提供することにある。
【0019】
本発明者らは、インテグラーゼ蛋白の本来の酵素活性の場であるウイルス遺伝子の組み込み過程ではなく、ウイルス感染性維持に非常に重要な役割を担っているN末端領域に着目し、独自にデザインし、ウイルスの感染性を完全に失わせることを確認したインテグラーゼ変異クローンを用いて、インテグラーゼ変異蛋白の構造解析により、あるいは変異の認められた領域のアミノ酸配列をもつ合成ペプチドがこれまで報告されているインテグラーゼ阻害剤とは異なった作用で、HIV−1の複製阻害を行うことを見い出し、本発明を完成するに至った。
【課題を解決するための手段】
【0020】
すなわち本発明は、(1)配列番号3〜11のいずれか記載のペプチド又は該ペプチドを含むペプチド若しくは蛋白質からなり、レトロウイルス感染阻害活性を有することを特徴とするレトロウイルス感染阻害剤や、(2)配列番号2に示されるアミノ酸配列のうち26番目から39番目のアミノ酸配列を有するペプチド又は該ペプチドを含むペプチド若しくは蛋白質からなることを特徴とするレトロウイルス感染阻害剤や、(3)配列番号2に示されるアミノ酸配列のうち1番目から55番目のアミノ酸配列を有するペプチドを抗原として用いることにより得られるモノクローナル抗体からなり、レトロウイルス感染阻害活性を有することを特徴とするレトロウイルス感染阻害剤や、(4)前記(1)〜(3)のいずれか記載のペプチド又は蛋白質に他のペプチド若しくは蛋白質又は非蛋白質が結合した複合体からなり、レトロウイルス感染阻害活性を有することを特徴とするレトロウイルス感染阻害剤や、(5)他のペプチド若しくは蛋白質又は非蛋白質が、T細胞抗原であるCD4糖蛋白質であることを特徴とする前記(4)記載のレトロウイルス感染阻害剤や、(6)他のペプチド若しくは蛋白質又は非蛋白質が、レトロウイルスのコート蛋白質であることを特徴とする前記(4)記載のレトロウイルス感染阻害剤や、(7)複合体が、プロテアーゼ耐性を有する複合体又は細胞内導入用の化学修飾がなされた複合体であることを特徴とする前記(4)〜(6)のいずれか記載のレトロウイルス感染阻害剤や、(8)前記(1)〜(7)のいずれか記載のレトロウイルス感染阻害剤を構成するペプチド若しくは蛋白質又は蛋白質部分をコードするDNAが発現可能なDNA構築物からなることを特徴とするレトロウイルス感染阻害剤や、(9)発現可能なDNA構築物が、ウイルスベクターを含むDNA構築物であることを特徴とする前記(8)記載のレトロウイルス感染阻害剤に関する。
【0021】
更に本発明は、(10)レトロウイルスのインテグラーゼのN−末端領域の全部若しくは一部からなるペプチド又は該N−末端領域を含むペプチドにおいて1若しくは数個のアミノ酸が欠失、置換若しくは付加された変異インテグラーゼをコードするDNA又はこのDNAとストリンジェントな条件下でハイブリダイズするDNAであって、これらDNAを有するレトロウイルス変異株が逆転写反応以前にレトロウイルスの複製を阻害する当該DNAからなることを特徴とするレトロウイルス感染阻害剤や、(11)変異インテグラーゼが、配列番号2に示されるアミノ酸配列のうち、43番目のシステインがヒスチジンに置換されたC43H;40番目のシステインがヒスチジンに置換されたC40H;40番目及び43番目のシステインがヒスチジンに置換されたC40H,C43H;12番目及び16番目のヒスチジンがシステインに置換されたH12C,H16C;12番目及び16番目のヒスチジンがシステインに置換され、かつ、40番目及び43番目のシステインがヒスチジンに置換されたH12C,H16C,C40H,C43H;29番目のプロリンがフェニルアラニンに置換されたP29F;32番目のバリンがグルタミン酸に置換されたV32E;36番目のイソロイシンがグルタミン酸に置換されたI36E;15番目のタイロシンがアラニンに置換されたY15A;15番目のタイロシンがスレオニンに置換されたY15T;から選ばれる変異インテグラーゼであり、レトロウイルス感染阻害活性を有することを特徴とする前記(10)記載のレトロウイルス感染阻害剤や、(12)レトロウイルスが、HIV−1であることを特徴とする前記(1)〜(11)のいずれか記載のレトロウイルス感染阻害剤に関する。
【発明の効果】
【0022】
本発明によると、従来のインテグラーゼ阻害剤とは薬剤の作用点を全く異にする、HIV感染を逆転写過程以前で阻止することができる新規なインテグラーゼ阻害剤をスクリーニングすることができる。また、かかるスクリーニングによりレトロウイルスの感染・増殖を完全に阻止することができる新規なインテグラーゼ阻害剤を得ることができる。これら新規なインテグラーゼ阻害剤を含む薬剤組成物は、エイズ治療薬として期待できる。
【発明を実施するための最良の形態】
【0023】
本発明において、レトロウイルスとは、RNAを遺伝子としてもち、逆転写酵素によりゲノムRNAをDNAに変換するものであればどのようなものでもよく、例えば、ヒト免疫不全ウイルス1型(特にHIV−1)、ヒト免疫不全ウイルス2型(HIV−2)、サル免疫不全ウイルス、ネコ免疫不全ウイルス、マウス白血病ウイルス、ウマ伝染性貧血ウイルス、ヤギ関節炎ウイルス、ヒツジのビスナウイルス、ウシ免疫不全ウイルス、メーソン・ファイザーサルウイルス、マウス乳癌ウイルス、ラウス肉腫ウイルス、ウシ白血病ウイルス、ヒトT細胞白血病ウイルス、細網内皮症ウイルス、ネコ白血病ウイルス、ヒト泡沫レトロウイルスを具体的に挙げることができる。また、本発明においてインテグラーゼとは、前記レトロウイルスが感染した細胞内で生産する蛋白質であり、宿主内で逆転写酵素により複製されたウイルスゲノムが、宿主の染色体に組み込まれる反応を触媒するものであればどのようなものでもよい。
【0024】
本発明において、レトロウイルスのインテグラーゼN−末端領域とは、レトロウイルスのインテグラーゼ蛋白のアミノ酸配列において、亜鉛イオンと結合する領域及びその隣接するC−末端側の一部を意味し、例えば、配列番号2に記載するHIV−1のインテグラーゼのアミノ酸配列においては、通常Znフィンガー様ドメインと呼ばれているN−末端ドメイン(1から50個のアミノ酸配列の領域)に加えて、その隣接するC−末端側10残基程度が含まれる。また、本発明において、レトロウイルス感染阻害剤とは、逆転写反応以前にウイルス感染を阻害する物質をいい、本発明のレトロウイルス感染阻害剤によるとレトロウイルスの複製・増殖を阻害することができる。
【0025】
本発明におけるレトロウイルス感染阻害剤のスクリーニング方法としては、レトロウイルスのインテグラーゼのN−末端領域の全部若しくは一部からなる領域又は該N−末端領域を含む領域を標的とする方法であればどのようなものでもよく、例えば、リコンビナントDNA技術により得られる、レトロウイルスのインテグラーゼのN−末端領域の全部若しくは一部からなるペプチド又は該N−末端領域を含むペプチドに対して結合するペプチド又は蛋白質等の被検物質をファージディスプレイ法、免疫沈降法、ツー・ハイブリッド法(two−hybrid assay)、ファー・ウエスタン(Far Western)法等の蛋白質の分子間相互作用を利用して検出する方法を例示することができる。また、ペプチド又は蛋白質の候補被検物質としては、HIV−1インテグラーゼのN−末端領域(1番目から55番目)のアミノ酸配列の一部又は該アミノ酸配列若しくはその一部を有するペプチドにおいて1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を含むペプチド又は蛋白質を挙げることができる。
【0026】
ファージ・ディスプレイ法におけるランダムオリゴペプチドとしては、pSKANシステム(Mo Bi Tec社製)を、cDNAライブラリー作成用としてはSurfZAPCloning kit(Stratagene社製)を、ランダムペプチドをファージに挿入したファージライブラリー(NEB社製)を利用することができる。ツー・ハイブリッド分析には、市販のMATCHMAKER(Clontech社製)や、HybridZAP(Stratagene社製)等のシステムを利用することができる。また、ファー・ウエスタン法は、結合蛋白質をメンブレン上のバンドとして直接検出でき、λgt11等の発現ライブラリーを用いればそれらを直接クローニングすることも可能な方法である。これらの方法によると、従来の酵素活性阻害をみるスクリーニング方法に比べて簡単に、かつ、薬剤作用点も異なる新規な阻害剤を見出すことが可能となる。
【0027】
本発明における被検物質としては、上記の他にレトロウイルスのインテグラーゼのN−末端領域の全部若しくは一部からなるペプチド又は該N−末端領域を含むペプチドをコードするRNAに対して結合する物質も例示することができる。ウイルスRNAに結合する物質としては、DNA若しくはRNA又はペプチド若しくは蛋白質を挙げることができ、そして、ウイルスRNAの塩基配列上のどの部位に蛋白質が特異的に結合しているかは、例えば、リボヌクレアーゼを用いるフットプリンティング法によって確認することができる。
【0028】
本発明におけるスクリーニング方法としては、被検物質の存在下及び被検物質がペプチドの場合は該ペプチドをコードするDNAが発現可能な状態下で、野生型レトロウイルスを宿主細胞にインフェクションし、インフェクション後の宿主細胞中のウイルス遺伝子発現量を非感染コントロール(Mock)と比較する方法や、被検物質の存在下及び被検物質がペプチドの場合は該ペプチドをコードするDNAが発現可能な状態下で、野生型レトロウイルスのインテグラーゼ遺伝子を用いるツー・ハイブリッド法を行い、インテグラーゼの2量体形成の阻害を検出する方法を挙げることができる。
【0029】
本発明のレトロウイルス感染阻害剤には、上記のレトロウイルス感染阻害剤のスクリーニング方法により得られる、例えば、DNA若しくはRNA又はペプチド若しくは蛋白質等の物質や、インテグラーゼN−末端領域のリコンビナント精製蛋白質を標的として、ファージ・ディスプレイ法によってそこに結合することが見出された配列番号3〜11に示された9種のペプチド又は該ペプチドを含むペプチド若しくは蛋白質や、HIV−1インテグラーゼのN−末端領域におけるα3近傍のペプチドである配列番号2記載に示されるアミノ酸配列のうち26番目から39番目のアミノ酸配列を有するペプチド又は該ペプチドを含むペプチド若しくは蛋白質等を挙げることができる。また、レトロウイルスのインテグラーゼのN−末端領域を特異的に認識するモノクローナル抗体をレトロウイルス感染阻害剤として例示することができる。
【0030】
そしてまた、本発明のレトロウイルス感染阻害剤には、上記のレトロウイルス感染阻害作用を有するペプチド又は蛋白質に、他のペプチド若しくは蛋白質又は糖蛋白質を含む非蛋白質が結合した複合体を挙げることができ、これら複合体としては、T細胞抗原であるCD4糖蛋白質やレトロウイルスのコート蛋白質が結合した複合体を具体的に例示することができ、これら複合体としては、化学修飾等により、プロテアーゼに抵抗性を有する性質が付加されたものや細胞内への透過性が改善されたものが好ましい。
【0031】
さらに、上記のレトロウイルス感染阻害剤を構成するタンパク質等は、細胞内で発現させることにより細胞内に存在させることもできる。すなわち、ペプチド若しくは蛋白質又は蛋白質部分をコードするDNAをその発現が可能なDNA構築物、例えば、ウイルスベクター等に該DNAを発現可能に組み込んだDNA構築物としたものを用いることもできる。
【0032】
本発明におけるレトロウイルス感染阻害剤としては、上記の阻害物質の他、レトロウイルスの複製を阻害しうる、その活性を失ったトランスドミナント・ネガティブ・インテグラーゼ遺伝子、例えば、レトロウイルスのインテグラーゼのN−末端領域の全部若しくは一部からなるペプチド又は該N−末端領域を含むペプチドにおいて1若しくは数個のアミノ酸が欠失、置換若しくは付加された変異インテグラーゼをコードするDNA又はこのDNAとストリンジェントな条件下でハイブリダイズするDNAであって、これらDNAを有するレトロウイルス変異株が逆転写反応以前にレトロウイルスの複製を阻害する当該DNAからなる遺伝子を挙げることができる。
【0033】
上記不活化された変異インテグラーゼ遺伝子としては、配列番号2に示される野生型HIV−1インテグラーゼのアミノ酸配列のうち、43番目のシステインがヒスチジンに置換された(C43H)や、40番目のシステインがヒスチジンに置換された(C40H)や、40番目及び43番目のシステインがヒスチジンに置換された(C40H,C43H)や、12番目及び16番目のヒスチジンがシステインに置換された(H12C,H16C)や、12番目及び16番目のヒスチジンがシステインに置換され、かつ、40番目及び43番目のシステインがヒスチジンに置換された(H12C,H16C,C40H,C43H)や、29番目のプロリンがフェニルアラニンに置換された(P29F)や、32番目のバリンがグルタミン酸に置換された(V32E)や、36番目のイソロイシンがグルタミン酸に置換された(I36E)や、15番目のタイロシンがアラニンに置換された(Y15A)や、15番目のタイロシンがスレオニンに置換された(Y15T)等から選ばれた変異インテグラーゼ遺伝子を具体的に挙げることができる。
【0034】
本発明の治療用組成物としては、上記のレトロウイルス感染阻害剤を含む組成物を挙げることができ、また、これら組成物には、tat阻害剤、HIVプロテアーゼ阻害剤、及びアジドチミジン、ジデオキシイノシン、ジデオキシシトシン及びd4T等からなるヌクレオシド又は非ヌクレオシド逆転写酵素阻害剤等の抗ウイルス薬を含めることができる。本発明の治療用組成物はエイズ治療用薬剤として有用である。
【0035】
また本発明のエイズワクチン等のレトロウイルス用ワクチンとしては、レトロウイルスのインテグラーゼのN−末端領域の全部若しくは一部からなるペプチド又は該N−末端領域を含むペプチドにおいて1若しくは数個のアミノ酸が欠失、置換若しくは付加された変異インテグラーゼをコードするDNA又はこのDNAとストリンジェントな条件下でハイブリダイズするDNAを有するレトロウイルス変異株であって、該変異株が逆転写反応以前にレトロウイルスの複製を阻害する当該変異株からなるものを挙げることができ、具体的には、前記C43Hや、C40Hや、C40H,C43Hや、H12C,H16Cや、H12C,H16C,C40H,C43Hや、P29Fや、V32Eや、I36Eや、Y15Aや、Y15T等から選ばれた変異インテグラーゼ遺伝子を有する変異株からなるワクチンを挙げることができる。
【0036】
本発明の治療方法においては、前記レトロウイルス感染阻害剤や、治療用組成物や、レトロウイルス用ワクチンを用いることができる。
【実施例】
【0037】
以下本発明を実施例により詳細に説明するが、本発明の技術的範囲はかかる実施例により何ら限定されるものではない。
【0038】
実施例1(HIV−1インテグラーゼの変異クローンの作製)
文献(J.Virol,59,284−291,1986)記載の方法により、HIV−1インテグラーゼの突然変異誘発性DNAフラグメントを感染性クローンであるpNL4−3から得た。このpNL4−3のSPeIサイトからSalIサイトにわたる4.3kbフラグメントをHIV−1インテグラーゼの突然変異誘発性DNAフラグメントとして、pBluescript SK(ストラタジーン社製)にサブクローンした。このベクターDNAを一本鎖DNAに調製し、T7−GEN in vitro mutagenesis kit(米国のBiochemical社製)のプロトコルの指示に基づき、この一本鎖DNAにヘルパーファージM13K07を用いて位置特異的突然変異誘発を行い、前記C43Hや、C40Hや、C40H,C43Hや、H12C,H16Cや、H12C,H16C,C40H,C43Hや、P29Fや、V32Eや、I36Eや、Y15Aや、Y15T等のHIV−1インテグラーゼの変異クローンを得た(図4参照)。
【0039】
実施例2(各HHCCモチーフ変異クローンとマウス白血病ウイルスのアンホトロピックエンベロープとからのシュードタイプウイルスの作製)
実施例1記載の方法によって得られた、1μgのHIV−1インテグラーゼの変異クローン(pNLluc△BgIII)と、1μgのマウス白血病ウイルスのアンホトロピックエンベロープ発現ベクター(pDJ−1)とを、10μlのリポフェクトアミン(BRL社製)に混合し、30度で30分間反応させた。この反応物をCOS細胞に加えてトランスフェクションした。トランスフェクションから6時間後、10%の子牛血清を含むDMEM(Dulbecco’s modified Eagle’s medium)を4ml加え培養した。また、24時間後にこの培養液を同様の新しい培養液4mlと交換させ、さらに培養してCOS細胞から培養液に放出されたシュードタイプウイルスを作製し、このウイルスをp24固相酵素免疫検定法によりウイルス粒子放出量を定量した(図5)。得られた培養液をウイルス溶液として、また、コントロールとして、プラスミドをトランスフェクションしていないCOS細胞培養液を非ウイルス溶液(Mock)を以下の実験に使用した。
【0040】
また、上記シュードタイプウイルス作製に、各ウイルスの変異クローンが影響するかどうかをプロウイルス遺伝子発現量を調べた。前記トランスフェクションから6時間後、全てのCOS細胞をPBS(リン酸緩衝溶液)で3回洗浄し、このCOS細胞に200μlの1×ルシフェラーゼ溶解液(プロメガ社製)を加えて溶解し、この溶解液10μlをluminometer Monolight 2010(カリフォルニア州のサンディエゴのアナリティカル・ルミネッセンス・ラボレトリー社製)を用いてルシフェラーゼアッセイ法によりプロウイルス遺伝子発現量を測定した(図6)。これらのことから、各ウイルスの変異クローンはプロウイルス遺伝子発現及びウイルス粒子放出に影響しないことがわかった。
【0041】
実施例3(各変異ウイルスにおける感染性)
10mMの塩化マグネシウム存在下で、実施例2のp24固相酵素免疫検定法により定量された約50ngの各ウイルス溶液に、デオキシリボヌクレアーゼIを加えて30分間処理し、得られた各変異ウイルスのDNAをRD細胞(ヒトラブドミオザルコーマ細胞)に接種することでウイルス感染させた。ウイルス感染2日後及び6日後、感染細胞中に発現したウイルス遺伝子を前記記載のルシフェラーゼアッセイ法により測定した(図7)。この結果から、1例(P30Nの変異ウイルス)を除いて全ての変異ウイルスがMock以下であり、ウイルス感染性がウイルスの変異により強く阻害することがわかった。
【0042】
実施例4(各変異ウイルスにより逆転写反応以前で感染性が強く阻害されていることの確認)
これらの各変異ウイルスにおいて、逆転写反応以前でウイルスの感染性が完全に失われているかどうかを以下に記載する方法で確認した。実施例3に記載するウイルス感染2日後のRD細胞から、尿素溶解法により全DNAを抽出した。このDNAを含む抽出液をフェノール及びクロロホルムにより処理し、エタノール沈殿させることでDNAを精製し、100μlの超純水に加え再溶解した。HIV−1に特異的なプライマー(R/U5,R/gag)を用いて、このDNA溶液に含まれるウイルス遺伝子をPCR法により増幅させた(94℃で1分間熱変性させ、55℃で2分間アニーリングし、72℃で2分間合成反応させるサイクルを30サイクル行い増幅させた)。このPCR産物を2%のアガロースゲル電気泳動法により分画し、サイバーグリーンにより染色し視覚化した(図8)。この結果から、1例(P30Nの変異ウイルス)を除く全ての変異ウイルスにおいて、R/U5及びR/gagのプライマーを用いてもウイルスDNAを検出されなかったことから、ウイルスの感染性が逆転写反応以前で強く阻害されていることがわかった。
【0043】
実施例5(Yeast two−hybrid分析)
図9に、Gal−4 yeast two−hybrid system法を用いて、HIV−1インテグラーゼの野生型及びその変異体にかかる2量体形成能及び他のウイルス構造蛋白質との会合における蛋白間相互作用を調べた結果を示す。図9のDBに示されているWTIN、D64EIN及びC43LINとは、pPC97(GAL4DBベクター)のMCS(multiple cloning sites)に野生型インテグラーゼの遺伝子、インテグラーゼのD64E変異体の遺伝子、又はインテグラーゼのC43L変異体の遺伝子をそれぞれGAL4DBベクターのフレームに合わせて挿入し、構築されたGAL4DBベクターとの複合体を意味する。また、図9のADに示されているWTIN(野生型インテグラーゼの遺伝子)、D64EIN(インテグラーゼのD64E変異体の遺伝子)、C43LIN(インテグラーゼのC43L変異体の遺伝子)、MA(gag領域に含まれるp17遺伝子)、CA(gag領域に含まれるp24遺伝子)、NC(gag領域に含まれるp7又はp9遺伝子)、RT(逆転写酵素遺伝子)、Vif(ウイルス感染性遺伝子)及びVpr(ウイルス蛋白質R遺伝子)とは、pPC86(GAL4ADベクター)のMCSにそれぞれの相補的なDNAを挿入し、構築されたpPC86−cDNAを意味する。これらの結果から、C43L変異体によりインテグラーゼ分子間の二量体形成能が阻害されることがわかった。
【0044】
実施例6(HIV−1インテグラーゼのN末端ドメインの部分ペプチドの阻害活性)
化学合成より作製した、図3に示されるNZ−1、NZ−2、N−ITFcc及びNZ−4のペプチドを最終濃度で20μMになるように生理的食塩水で希釈し、RD細胞に加え2時間処理した。その後、p24固相酵素免疫検定法により定量された50ngのHIV−1を、この処理されたRD細胞に接種しウイルス感染させた。ウイルス感染3日後、感染細胞中に発現したウイルス遺伝子を上記記載のルシフェラーゼアッセイ法により測定したところ、NZ−1、NZ−2及びNZ−4のペプチドにて処理されたRD細胞は、10〜30%しか抑制されなかったが、N−ITFccのペプチドにて処理されたRD細胞では、80%近く抑制されており、抗ウイルス剤として応用可能なことがわかった。
【0045】
実施例7(ファージディスプレイ法によるHIV−1インテグラーゼのN末端ドメインに結合するペプチドを用いた抗ウイルス剤のスクリーニング)
HIV−1のクローン(pNL4−3)を鋳型としてPCR法により増幅した(94℃で1分間熱変性させ、60℃で1分間アニーリングし、72℃で2分間合成反応させるサイクルを30サイクル行い増幅させた)。このPCR産物から、HIV−1インテグラーゼのN末端ドメイン(N末端側から55個のアミノ酸配列をコードする領域)のDNA断片を取り出し、発現ベクターpGEX−2T(ファルマシア社製)のBamHIやEcoRI等の部位にこのDNA断片を挿入し、HIV−1インテグラーゼ発現ベクター(pGEX2T−zinc)を構築した。構築されたベクターを大腸菌BL21(DE3)に導入した。このトランスフォームされた大腸菌を培養液に加え、最終濃度で100mMになるようにIPTG(イソプロピル−1−チオ−β−D−ガラクトシド)を添加し、37℃で5時間発現誘導を行い、5時間後、この大腸菌を3000rpmで10分間遠心分離させ集菌し、次に1L当たりの培地から集菌された大腸菌を100mlの1MのNaClと3mMのDTTとを含む生理食塩水(A液)に再溶解し、超音波処理(500Wで10分間)によりこの大腸菌を粉砕した。得られた大腸菌粉砕液を12000rpmで30分間遠心分離することにより、蛋白粗分画を回収し、この蛋白粗分画に含まれるGST(グルタチオン−S−トランスフェラーゼ)が融合したインテグラーゼN−末端蛋白をグルタチオンセファロースビーズ(ファルマシア社製)により精製した。
【0046】
次に、種々の長さのランダムペプチドをファージに挿入したファージライブラリー(NEB社製)の中から、パニング操作(各ファージライブラリーの中でGST蛋白質に結合しないファージ粒子を回収する操作、選択されたファージの中から上記記載の作製されたGST融合インテグラーゼN−末端蛋白に結合するファージ粒子を回収する操作)を3〜7回繰り返し、HIV−1インテグラーゼN末端ドメインと特異的に結合するペプチドを含むファージをスクリーニングした。この得られたファージをクローニングし、遺伝子配列を決定した。これらのファージディスプレー法によって得られたペプチドが、HIV−1インテグラーゼN末端ドメインを標的とし、インビトロで結合するかどうかを固相酵素免疫検定法により確認した(図10)。より詳しくは、96穴プレートを100μg/mlのGST融合インテグラーゼN−末端蛋白、GST蛋白質又は無蛋白質でコーティングし、ブロッキング後、1011pFUの各ペプチドをもつクローン化ファージを加えて反応させ、次に、抗M13−HRP抗体(西洋ワサビペルオキシダーゼ標識抗M13)により2次反応させた。反応の終了した96穴プレートに2,2′−アジノビス(3−エチルベンズチアゾリンスルホニックアシッド)(ABTS;シグマ社製)を基質として発色させ、吸光度405nmで定量した。これらの結果から、GST融合インテグラーゼN−末端蛋白に各ペプチドが特異的に結合することが確認できた。
【図面の簡単な説明】
【0047】
【図1】第1図は、レトロウイルスのインテグレーション反応過程を示す図である。
【図2】第2図は、レトロウイルスインテグラーゼ間に保存されているアミノ酸とその位置を示す図である。
【図3】第3図は、HIV−1インテグラーゼのN−末端ドメインのα1〜α4のαヘリックスの領域を示す図である。
【図4】第4図は、標的とされたレトロウイルスのインテグラーゼN−末端領域において保存されるアミノ酸残基を示す図である。
【図5】第5図は、HIV−1インテグラーゼ変異クローンにおける細胞感染後のウイルス粒子の放出を示す図である。
【図6】第6図は、HIV−1インテグラーゼ変異クローンにおけるCOS細胞感染後のウイルス遺伝子の発現量を示す図である。
【図7】第7図は、HIV−1インテグラーゼ変異クローンにおけるRD細胞感染後のウイルス遺伝子の発現量を示す図である。
【図8】第8図は、HIV−1インテグラーゼ変異クローンが逆転写反応以前に感染が阻害されたことを示す図である。
【図9】第9図は、HIV−1変異クローンのツー・ハイブリッド法による蛋白相互間作用を示す図である。
【図10】第10図は、ファージディスプレー法によるウイルス感染阻害剤の特異的結合を示す図である。
【特許請求の範囲】
【請求項1】
配列番号3〜11のいずれか記載のペプチド又は該ペプチドを含むペプチド若しくは蛋白質からなり、レトロウイルス感染阻害活性を有することを特徴とするレトロウイルス感染阻害剤。
【請求項2】
配列番号2に示されるアミノ酸配列のうち26番目から39番目のアミノ酸配列を有するペプチド又は該ペプチドを含むペプチド若しくは蛋白質からなることを特徴とするレトロウイルス感染阻害剤。
【請求項3】
配列番号2に示されるアミノ酸配列のうち1番目から55番目のアミノ酸配列を有するペプチドを抗原として用いることにより得られるモノクローナル抗体からなり、レトロウイルス感染阻害活性を有することを特徴とするレトロウイルス感染阻害剤。
【請求項4】
請求項1〜3のいずれか記載のペプチド又は蛋白質に他のペプチド若しくは蛋白質又は非蛋白質が結合した複合体からなり、レトロウイルス感染阻害活性を有することを特徴とするレトロウイルス感染阻害剤。
【請求項5】
他のペプチド若しくは蛋白質又は非蛋白質が、T細胞抗原であるCD4糖蛋白質であることを特徴とする請求項4記載のレトロウイルス感染阻害剤。
【請求項6】
他のペプチド若しくは蛋白質又は非蛋白質が、レトロウイルスのコート蛋白質であることを特徴とする請求項4記載のレトロウイルス感染阻害剤。
【請求項7】
複合体が、プロテアーゼ耐性を有する複合体又は細胞内導入用の化学修飾がなされた複合体であることを特徴とする請求項4〜6のいずれか記載のレトロウイルス感染阻害剤。
【請求項8】
請求項1〜7のいずれか記載のレトロウイルス感染阻害剤を構成するペプチド若しくは蛋白質又は蛋白質部分をコードするDNAが発現可能なDNA構築物からなることを特徴とするレトロウイルス感染阻害剤。
【請求項9】
発現可能なDNA構築物が、ウイルスベクターを含むDNA構築物であることを特徴とする請求項8記載のレトロウイルス感染阻害剤。
【請求項10】
レトロウイルスのインテグラーゼのN−末端領域の全部若しくは一部からなるペプチド又は該N−末端領域を含むペプチドにおいて1若しくは数個のアミノ酸が欠失、置換若しくは付加された変異インテグラーゼをコードするDNA又はこのDNAとストリンジェントな条件下でハイブリダイズするDNAであって、これらDNAを有するレトロウイルス変異株が逆転写反応以前にレトロウイルスの複製を阻害する当該DNAからなることを特徴とするレトロウイルス感染阻害剤。
【請求項11】
変異インテグラーゼが、配列番号2に示されるアミノ酸配列のうち、
43番目のシステインがヒスチジンに置換されたC43H
40番目のシステインがヒスチジンに置換されたC40H
40番目及び43番目のシステインがヒスチジンに置換されたC40H,C43H
12番目及び16番目のヒスチジンがシステインに置換されたH12C,H16C
12番目及び16番目のヒスチジンがシステインに置換され、かつ、40番目及び43番目のシステインがヒスチジンに置換されたH12C,H16C,C40H,C43H
29番目のプロリンがフェニルアラニンに置換されたP29F
32番目のバリンがグルタミン酸に置換されたV32E
36番目のイソロイシンがグルタミン酸に置換されたI36E
15番目のタイロシンがアラニンに置換されたY15A
15番目のタイロシンがスレオニンに置換されたY15T
から選ばれる変異インテグラーゼであり、レトロウイルス感染阻害活性を有することを特徴とする請求項10記載のレトロウイルス感染阻害剤。
【請求項12】
レトロウイルスが、HIV−1であることを特徴とする請求項1〜11のいずれか記載のレトロウイルス感染阻害剤。
【請求項1】
配列番号3〜11のいずれか記載のペプチド又は該ペプチドを含むペプチド若しくは蛋白質からなり、レトロウイルス感染阻害活性を有することを特徴とするレトロウイルス感染阻害剤。
【請求項2】
配列番号2に示されるアミノ酸配列のうち26番目から39番目のアミノ酸配列を有するペプチド又は該ペプチドを含むペプチド若しくは蛋白質からなることを特徴とするレトロウイルス感染阻害剤。
【請求項3】
配列番号2に示されるアミノ酸配列のうち1番目から55番目のアミノ酸配列を有するペプチドを抗原として用いることにより得られるモノクローナル抗体からなり、レトロウイルス感染阻害活性を有することを特徴とするレトロウイルス感染阻害剤。
【請求項4】
請求項1〜3のいずれか記載のペプチド又は蛋白質に他のペプチド若しくは蛋白質又は非蛋白質が結合した複合体からなり、レトロウイルス感染阻害活性を有することを特徴とするレトロウイルス感染阻害剤。
【請求項5】
他のペプチド若しくは蛋白質又は非蛋白質が、T細胞抗原であるCD4糖蛋白質であることを特徴とする請求項4記載のレトロウイルス感染阻害剤。
【請求項6】
他のペプチド若しくは蛋白質又は非蛋白質が、レトロウイルスのコート蛋白質であることを特徴とする請求項4記載のレトロウイルス感染阻害剤。
【請求項7】
複合体が、プロテアーゼ耐性を有する複合体又は細胞内導入用の化学修飾がなされた複合体であることを特徴とする請求項4〜6のいずれか記載のレトロウイルス感染阻害剤。
【請求項8】
請求項1〜7のいずれか記載のレトロウイルス感染阻害剤を構成するペプチド若しくは蛋白質又は蛋白質部分をコードするDNAが発現可能なDNA構築物からなることを特徴とするレトロウイルス感染阻害剤。
【請求項9】
発現可能なDNA構築物が、ウイルスベクターを含むDNA構築物であることを特徴とする請求項8記載のレトロウイルス感染阻害剤。
【請求項10】
レトロウイルスのインテグラーゼのN−末端領域の全部若しくは一部からなるペプチド又は該N−末端領域を含むペプチドにおいて1若しくは数個のアミノ酸が欠失、置換若しくは付加された変異インテグラーゼをコードするDNA又はこのDNAとストリンジェントな条件下でハイブリダイズするDNAであって、これらDNAを有するレトロウイルス変異株が逆転写反応以前にレトロウイルスの複製を阻害する当該DNAからなることを特徴とするレトロウイルス感染阻害剤。
【請求項11】
変異インテグラーゼが、配列番号2に示されるアミノ酸配列のうち、
43番目のシステインがヒスチジンに置換されたC43H
40番目のシステインがヒスチジンに置換されたC40H
40番目及び43番目のシステインがヒスチジンに置換されたC40H,C43H
12番目及び16番目のヒスチジンがシステインに置換されたH12C,H16C
12番目及び16番目のヒスチジンがシステインに置換され、かつ、40番目及び43番目のシステインがヒスチジンに置換されたH12C,H16C,C40H,C43H
29番目のプロリンがフェニルアラニンに置換されたP29F
32番目のバリンがグルタミン酸に置換されたV32E
36番目のイソロイシンがグルタミン酸に置換されたI36E
15番目のタイロシンがアラニンに置換されたY15A
15番目のタイロシンがスレオニンに置換されたY15T
から選ばれる変異インテグラーゼであり、レトロウイルス感染阻害活性を有することを特徴とする請求項10記載のレトロウイルス感染阻害剤。
【請求項12】
レトロウイルスが、HIV−1であることを特徴とする請求項1〜11のいずれか記載のレトロウイルス感染阻害剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2007−16044(P2007−16044A)
【公開日】平成19年1月25日(2007.1.25)
【国際特許分類】
【出願番号】特願2006−239627(P2006−239627)
【出願日】平成18年9月4日(2006.9.4)
【分割の表示】特願2000−618441(P2000−618441)の分割
【原出願日】平成12年4月25日(2000.4.25)
【出願人】(503360115)独立行政法人科学技術振興機構 (1,734)
【Fターム(参考)】
【公開日】平成19年1月25日(2007.1.25)
【国際特許分類】
【出願日】平成18年9月4日(2006.9.4)
【分割の表示】特願2000−618441(P2000−618441)の分割
【原出願日】平成12年4月25日(2000.4.25)
【出願人】(503360115)独立行政法人科学技術振興機構 (1,734)
【Fターム(参考)】
[ Back to top ]

