インビボイメージング用の放射性標識ピリジニル誘導体
本発明は、インビボイメージングに適した新規な放射性標識アリールオキシアニリン誘導体を提供する。既知のアリールオキシアニリン誘導体系インビボ造影剤に比べて、本発明のインビボ造影剤はインビボイメージングのための良好な性質を有する。本発明のインビボ造影剤は、被験体への投与後における良好な脳内取込み及びインビボ動力学と共に、末梢ベンゾジアゼピンレセプター(PBR)に対する良好な結合性を示す。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、インビボイメージング、特に末梢ベンゾジアゼピンレセプター(PBR)のインビボイメージングに関する。ナノモル親和性をもってPBRに結合し、投与後には脳内への良好な取込みを示し、PBRへの良好な選択的結合を示すアリールオキシアニリド系インビボ造影剤が提供される。本発明はまた、本発明のインビボ造影剤の合成に有用な前駆体化合物、並びに前記前駆体化合物の使用を含む前記インビボ造影剤の合成方法及び前記方法を実施するためのキットも提供する。インビボ造影剤の自動化合成のためのカセットも提供される。加えて本発明は、本発明のインビボ造影剤を含む放射性医薬組成物並びに前記インビボ造影剤の使用方法も提供する。
【背景技術】
【0002】
末梢ベンゾジアゼピンレセプター(PBR)は、主として末梢組織及びグリア細胞に局在することが知られているが、その生理学的機能はまだ明確に解明されていない。細胞レベル以下では、PBRはミトコンドリア外膜上に局在することが知られていて、これはミトコンドリア機能の調節及び免疫系で役割を果たす可能性を表している。さらに、PBRが細胞増殖、ステロイド生成、カルシウム流れ及び細胞呼吸に関係することも仮定されてきた。PBRは、急性及び慢性ストレス、不安、うつ病、パーキンソン病、アルツハイマー病、脳損傷、癌(Gavish et al,Pharm.Rev.1999;51:629)、ハンチントン病(Messmer and Reynolds,Neurosci.Lett.1998;241:53−6)、喘息(Pelaia et al,Gen.Pharmacol.1997;28(4):495−8)、慢性関節リウマチ(Bribes et al,Eur.J.Pharmacol.2002;452(1):111−22)、アテローム性動脈硬化症(Davies et al,J.Nucl.Med.2004;45:1898−1907)及び多発性硬化症(Banati et al,2000 Brain;123:2321)を始めとする各種の状態と関連していた。PBRはニューロパシー性疼痛にも関連する可能性があり、Tsuda et alはニューロパシー性疼痛をもった被験者で小グリア細胞の活性化を観察している(2005 TINS 28(2)pp101−7)。
【0003】
PBR選択性リガンド(R)−[11C]−PK11195を用いる陽電子放出断層撮影(PET)イメージングは、中枢神経系(CNS)炎症の包括的指標を提供する。(R)−[11C]−PK11195の使用の成功にもかかわらず、それには制約がある。それは、高いタンパク質結合性及び低特異的乃至非特異的結合性を有することが知られている。その放射性標識代謝産物の役割は知られておらず、結合の定量化には複雑なモデル化が要求される。PBRに対して高い親和性及び選択性を有することでCNSにおけるPBR測定の向上を可能にする化合物を得るための努力が行われてきた。
【0004】
PBRに対する高い親和性並びに中枢ベンゾジアゼピンレセプター(CBR)に比べてPBRに対する高い選択性を有するアリールオキシアニリン誘導体が提唱された(Chaki et al,1999 Eur.J.Pharmacol.;371:197−204)。[11C]−DAA1106及び[18F]−FE−DAA1106は、これらのアリールオキシアニリン化合物に基づくPET放射性リガンドである。これらのPET放射性リガンドは米国特許第6870069号に教示され、ヒトで研究されてきた(Ikomo et al,J.Cereb.Blood Flow Metab.2007;27:173−84及びFujimura et al,J.Nuc.Med.2006;47:43−50)。別の放射性フッ素化DAA1106誘導体は国際公開第2007/074383号に教示されている。別の11C標識DAA1106誘導体は国際公開第2007/036785号に教示されている。放射性ヨウ素化DAA1106は、欧州特許出願公開第1854781号に記載され、またZhang et al(2007 J.Med.Chem.;50:848−55)によって記載されている。[11C]−DAA1106、[18F]−FE−DAA1106及び[123I]−DAA1106の化学構造は以下の通りである。
【0005】
【化1】

【0006】
しかし、これらの化合物の動力学的性質はインビボイメージングには理想的でないため、定量的研究に対するその適用は制限されることがある。
【0007】
DAA1106系列の放射性リガンドにさらなる改良を加えようという努力の中で、Briard et al(J.Med.Chem.2008;51:17−30)は別のアリールオキシアニリン誘導体PBR28を報告した。PBR28及びPBR28から導かれるPET放射性リガンドの構造は以下の通りである。
【0008】
【化2】

【0009】
([18F]−FE−PBR28としても知られる)[18F]−FEPPAは、感度及び特異性は測定されなかったものの、インビトロでPBRに対するナノモル未満の親和性を有することが判明し、また静脈内注射後に天然ラットの脳内への良好な取込みを示した(Wilson et al,Nuc.Med.Biol.2008;35:305−14)。[11C]−PBR28をサルで試験し、PETを用いてその脳内動力学を評価した。Briard et al(上記)により、[11C]−PBR28は、(R)−[11C]−PK11195に比べて高い脳内取込み、PBR発現組織に対する良好な特異的結合、及びインビボイメージングに一段と適した動力学的性質を有することが報告された。本発明者らは、PBR28が(R)−[11C]−PK11195よりインビボPBR造影剤として良好な性質を示すものの、PBR発現組織に対するその特異性は理想的でないことを見出した。さらに本発明者らは、PBR28のインビボクリアランス特性も理想的でないことを見出した。したがって、さらに改良されたPBR特異的インビボ造影剤を得る余地が存在している。
【0010】
本願の優先日後に公開された国際公開第2010/015340号及び同第2010/015387号は、PBR28と同じ環上であるが、その環中の異なる位置に窒素ヘテロ原子を有するさらに別の部類のアリールオキシアニリン誘導体を開示している。一般的には、国際公開第2010/015340号及び同第2010/015387号は次の式Iの化合物を開示している。
【0011】
【化3】

【0012】
式中、
R1及びR2は各々独立かつ個別に、(G3)アリール、置換(G3)アリール、(G3−(C1〜C8)アルキル)アリール、(G3−(C1〜C8)アルコキシ)アリール、(G3−(C2〜C8)アルキニル)アリール、(G3−(C2〜C8)アルケニル)アリール、置換(G3−(C1〜C8)アルキル)アリール、置換(G3−(C1〜C8)アルコキシ)アリール、置換(G3−(C2〜C8)アルキニル)アリール及び置換(G3−(C2〜C8)アルケニル)アリールからなる群から選択され、
G1、G2及びG3は各々独立かつ個別に、式Iの化合物が正確に1つのLを含むことを条件として、水素及びLからなる群から選択され、
LはR3、[18F]−フルオロ及び[19F]−フルオロからなる群から選択され、
R3は脱離基であり、
nは0〜6の整数である。
【0013】
国際公開第2010/015340号及び同第2010/015387号には、(「2d」及び「5d」と命名された)2種の特定化合物が以前のアリールオキシアニリン誘導体に比べて脳内PBRのインビボイメージングのための改善された性質を有することを示すデータが記載されている。これら2種の化合物の化学式を以下に示す。
【0014】
【化4】

【先行技術文献】
【特許文献】
【0015】
特開2000−001476号公報
【発明の概要】
【0016】
本発明は、インビボイメージングに適した新規な放射性標識アリールオキシアニリン誘導体を提供する。本発明のインビボ造影剤は、中枢神経系(CNS)における末梢ベンゾジアゼピンレセプター(PBR)のインビボイメージングのための良好な性質を有する。本発明のインビボ造影剤は、被験体への投与後における良好な脳内取込み及びインビボ動力学と共に、PBRに対する良好な結合性を示す。
【図面の簡単な説明】
【0017】
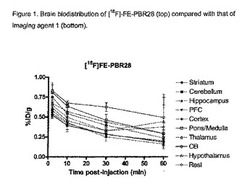
【図1】図1は、[18F]−FE−PBR28の脳内分布(上部)を造影剤1の脳内分布(下部)と比較して示している。
【発明を実施するための形態】
【0018】
造影剤
一態様では、本発明は次の式Iのインビボ造影剤或いはその塩又は溶媒和物を提供する。
【0019】
【化5】

【0020】
式中、
R1はメチル及びC1-3フルオロアルキルから選択され、
R2は水素、ハロゲン、C1-3アルコキシ及びC1-3フルオロアルコキシから選択され、
R3は水素、ハロゲン及びC1-3アルコキシから選択され、
A1はCH又はNであり、
A2及びA4-7の1つ又は2つがNであり、A2及びA4-7の残りがCHであり、
A3はCH又はCH−O−R4(式中、R4はH、C1-3アルキル又はC1-3ハロアルキルである。)であるか、或いは別法としてA2及びA4-7の1つがNでありかつA2及びA4-7の残りがCHである場合にA3はNであってよく、
式Iはインビボイメージングに適した放射性同位体である原子を含む。
【0021】
本発明に関連する「インビボ造影剤」とは、インビボイメージングに適した放射性標識化合物をいう。本明細書で使用する「インビボイメージング」という用語は、被験体の内部構造の全部又は一部の画像を非侵襲的に生成する技術をいう。かかるインビボイメージング方法の例は、単光子放出コンピューター断層撮影法(SPECT)及び陽電子放出断層撮影法(PET)である。
【0022】
本発明に係る好適な塩には、(i)鉱酸(例えば、塩酸、臭化水素酸、リン酸、メタリン酸、硝酸及び硫酸)から導かれるもの並びに有機酸(例えば、酒石酸、トリフルオロ酢酸、クエン酸、リンゴ酸、乳酸、フマル酸、安息香酸、グリコール酸、グルコン酸、コハク酸、メタンスルホン酸及びp−トルエンスルホン酸)から導かれるもののような生理学的に許容される酸付加塩、並びに(ii)アンモニウム塩、アルカリ金属塩(例えば、ナトリウム塩及びカリウム塩)、アルカリ土類金属塩(例えば、カルシウム塩及びマグネシウム塩)、有機塩基(例えば、トリエタノールアミン、N−メチル−D−グルカミン、ピペリジン、ピリジン、ピペラジン及びモルホリン)との塩、及びアミノ酸(例えば、アルギニン及びリシン)との塩のような生理学的に許容される塩基塩がある。
【0023】
本発明に係る好適な溶媒和物には、エタノール、水、食塩水、生理的緩衝液及びグリコールと共に生成されるものがある。
【0024】
特記しない限り、単独で又は組み合わせて使用される「アルキル」という用語は、好ましくは1〜3の炭素原子を含む直鎖又は枝分れアルキル基を意味する。かかる基の例には、メチル、エチル及びプロピルがある。
【0025】
特記しない限り、単独で又は組み合わせて使用される「アルコキシ」という用語は式−O−アルキルのアルキルエーテル基を意味し、ここでアルキルという用語は上記に定義した通りである。好適なアルキルエーテル基の例には、メトキシ、エトキシ及びプロポキシがある。
【0026】
「ハロゲン」又は「ハロ」という用語は、フッ素、塩素、臭素及びヨウ素から選択される置換基を意味する。「ハロアルキル」及び「ハロアルコキシ」とは、それぞれ、上記に定義したアルキル基及びアルコキシ基が1以上のハロゲンで置換されたもの、好ましくは末端で置換されたもの(即ち、−アルキル−ハロゲン及び−アルコキシ−ハロゲン)である。
【0027】
「インビボイメージングに適した放射性同位体である原子を含む」という用語は、上記に定義した式Iにおいて、1つの原子の同位体形態がインビボイメージングに適した放射性同位体であることを意味する。インビボイメージングに適するには、放射性同位体は前記被験体への投与後に外部で検出可能である。本発明の好ましい放射性同位体は、γ線放出型放射性ハロゲン及び陽電子放出型放射性非金属である。本発明で使用するのに適したγ線放出型放射性ハロゲンの例は、123I、131I及び77Brである。好ましいγ線放出型放射性ハロゲンは123Iである。本発明で使用するのに適した陽電子放出型放射性非金属の例は、11C、13N、18F及び124Iである。好ましい陽電子放出型放射性非金属は11C及び18F、特に18Fである。
【0028】
好ましくは、R1がC1-3フルオロアルキルであり、R2が水素であるか、或いはR1がメチルであり、R2がC1-3フルオロアルコキシである。
【0029】
R3は、好ましくは水素である。
【0030】
式Iのインビボ造影剤の好ましい一実施形態では、A1、A2及びA4-7の2つがNであり、A1、A2及びA4-7の残りがCHである。
【0031】
式Iのインビボ造影剤の別の好ましい実施形態では、A2及びA4〜A6の1つがNであり、A1がCHであり、A7がCHである。
【0032】
式Iのインビボ造影剤のさらに別の好ましい実施形態では、A7がNであり、A1-6がCHであり、R3が水素である。
【0033】
本発明におけるインビボイメージングに適した好ましい放射性同位体は18Fである。最も好ましくは、R1が[18F]−フルオロアルキルであるか、或いはR2が[18F]−フルオロアルコキシである。かかるインビボ造影剤の例は、以下の造影剤1〜19である。
【0034】
【化6】

【0035】
本発明の好ましい18Fインビボ造影剤はインビボ造影剤1、18及び19であり、最も好ましくはインビボ造影剤1である。
【0036】
(上記に示した)非放射性インビボ造影剤1の効力(実施例6)を測定し、その異性体であるN−[3−(2−フルオロエトキシ)ベンジル]−N−(4−フェノキシ−ピリジン−3−イル)アセトアミド(即ち、先行技術化合物[18F]−FE−PBR28の非放射性バージョン)と比較した。動物体内分布モデル(実施例7)では、インビボ造影剤1を試験し、その体内分布を(Wilson et al,Nuc.Med.Biol.2008;35:305−14に従って製造した)先行技術化合物[18F]−FE−PBR28の体内分布と比較した。
【0037】
[18F]−FE−PBR28の異性体であるにもかかわらず、造影剤1のPBRに関して測定された効力は2桁低いことが判明した。さらに、造影剤1に関しては、[18F]−FE−PBR28に比べて脳内のPBR発現組織に対する向上した選択性が認められた。本発明者らは、[18F]−FE−PBR28の(30分後に対する2分後の)全脳クリアランス比が造影剤1の3.46に比べて1.97である子とを認めたが、これはPBRレセプターに結合しない造影剤1が脳から一層急速に排出されることを示している。これにより、造影剤1に関して認められる信号/バックグラウンド比が[18F]−FE−PBR28に比べて高いのはそのためであるという仮説が立てられる。
【0038】
図1は、注射後60分までにおける各化合物の脳内分布を示している。これらのグラフは、注射後30分では、インビボ造影剤1が[18F]−FE−PBR28に比べて脳の残部より嗅球(OB)中に多く保持されることを示しており、これはインビボ造影剤1が先に例示したインビボ造影剤[18F]−FE−PBR28よりPBRに対して向上した選択性を有することを実証している。さらに、これらのグラフは、造影剤1のクリアランスプロファイルが[18F]−FE−PBR28に比べてインビボイメージングに一層有利であることを示している。
【0039】
製造方法
さらに別の態様では、本発明は、上述した本発明のインビボ造影剤の製造方法であって、前記放射性同位体の適当な供給源を次の式IIの前駆体化合物と反応させる段階を含んでなる方法を提供する。
【0040】
【化7】

【0041】
式中、
R11-13の1つは前駆体基を含み、R11-13の残りはそれぞれ式IのR1-3に関して定義した通りであって、任意には保護基を含み、
A11-17はそれぞれ式IのA1-7に関して定義した通りであって、任意には保護基を含み、
ただしA17がNであり、かつA11、A12及びA14-16がすべてCHである場合には、A13がCHであり、R13が水素であることを条件とする。
【0042】
「前駆体化合物」は、インビボイメージングに適した前記放射性同位体の好都合な化学形態との化学反応が部位特異的に起こり、最小数の段階(理想的にはただ1つの段階)で反応を実施でき、かつ格別の精製の必要なしに(理想的にはいかなる追加の精製も必要なしに)所望のインビボ造影剤が得られるように設計された、放射性標識化合物の非放射性誘導体からなる。かかる前駆体化合物は合成品であり、良好な化学純度で簡便に得ることができる。前駆体化合物は、任意には前駆体化合物のある種の官能基に関して保護基を含むことができる。前駆体化合物は、キット中又は自動化合成装置と共に使用するのに適したカセット中に溶液状態で供給するか、或いは固体担体に結合した状態で供給することができる。キット及びカセットは本発明の追加の態様をなし、以下に一層詳しく論議される。
【0043】
「保護基」という用語は、望ましくない化学反応を阻止又は抑制するが、分子の残部を変質させない十分に温和な条件下で問題の官能基から脱離させ得るのに十分な反応性を有するように設計された基を意味する。脱保護後には所望のインビボ造影剤が得られる。保護基は当業者にとって公知であり、‘Protective Groups in Organic Synthesis’,Theorodora W.Greene and Peter G.M.Wuts(Third Edition,John Wiley & Sons,1999)に記載されている。
【0044】
「前記放射性同位体の適当な供給源」という用語は、放射性同位体が前駆体化合物に共有結合するようにして前駆体化合物の置換基と反応し得る化学形態の放射性同位体を意味する。
【0045】
概して言えば、前駆体化合物を前記放射性同位体の適当な供給源と「反応させる」段階は、できるだけ高い放射化学収率(RCY)で所望のインビボ造影剤を生成するのに適した反応条件下で2種の反応体を合わせることを含んでいる。若干の一層詳細な経路を以下の実験セクションに示す。
【0046】
次に、本発明の各種インビボ造影剤を得るための一般的方法を記載する。当業者であれば、本発明の技術的範囲全体にわたるインビボ造影剤を得るため、格別の実験を行わなくても以下に記載される教示内容を適用することができよう。
【0047】
Okubu et al(2004 Bioorg.Med.Chem.;12:423−38)は、非放射性アリールオキシアニリド化合物を得るための方法を記載している。本発明のインビボ造影剤に類似したインビボ造影剤を得るための合成スキームは、Briard et al(J.Med.Chem.2008;51;17−31)、Wilson et al(Nuc.Med.Biol.2008;35;305−14)、及びZhang et al(J.Med.Chem.2007;50:848−55)によって記載されている。これらの先行技術方法は、本発明のインビボ造影剤を得るのに適した前駆体化合物を得るために容易に適合させることができる。
【0048】
以下のスキーム1は、本発明のインビボ造影剤を製造するのに適した前駆体化合物を得るための一般反応スキームである。
【0049】
【化8】

【0050】
R22はヒドロキシル、アルコキシ又はハロアルコキシであり、LGはクロリド又はブロミドのような脱離基であり、Zは(CH2)x−Y(式中、xは1〜3であり、Yは水素又はインビボイメージングに適した放射性同位体の適当な供給源によって置換され得る基である。)であり、A21-27はそれぞれA1-7に関して本明細書で定義した通りである。
【0051】
求核芳香族置換が起こる塩基性条件下でo−クロロニトロ芳香族化合物(a)をヒドロキシル芳香族化合物(b)と反応させる。水素化によってニトロ基を還元すれば、対応するアニリン(d)が得られる。芳香族アルデヒド(e)による還元性アルキル化でベンジルアミン(f)が得られる。アセチル化によってアセトキシアミド(g)が得られる。標識に使用すべき放射性同位体に応じ、(g)自体が前駆体化合物であるか、或いは以下に一層詳しく論議されるようにして前駆体化合物に転化させることができる。
【0052】
インビボ造影剤の放射性同位体が18Fである場合、放射性フッ素原子はフルオロアルキル基又はフルオロアルコキシ基の一部をなすことができる。これは、アルキルフルオリドがインビボでの代謝に耐えるからである。別法として、放射性フッ素原子は直接共有結合によって芳香環に結合することができる。
【0053】
放射性フッ素化は、18F−フッ化物と良好な脱離基を有する前駆体化合物(例えば、アルキルブロミド、アルキルメシレート又はアルキルトシレート)中の適当な化学基との反応を用いる直接標識によって実施できる。18Fはまた、[18F]−フルオロアルキルブロミド、[18F]−フルオロアルキルメシレート又は[18F]−フルオロアルキルトシレートでヒドロキシル基をO−アルキル化することによっても導入できる。
【0054】
アリール系に関しては、アリールジアゾニウム塩、アリールニトロ化合物又はアリール第四級アンモニウム塩からの18F−フッ化物求核置換が、アリール−18F誘導体への好適な経路である。
【0055】
別法として、18Fによる標識は、前駆体化合物からの脱離基の求核置換によって達成できる。好適な脱離基には、クロリド、ブロミド、ヨージド、トシレート、メシレート及びトリフレートがある。かかる誘導体は、本発明のインビボ造影化合物を製造するための前駆体化合物である。
【0056】
別の方策は、上記に定義したような好適な脱離基を、前駆体化合物上に存在するアルキルアミド基上に設けることである。このようにすれば、通常は核反応18O(p,n)18Fから水溶液として得られ、次いで陽性対イオンの添加及びそれに続く水の除去によって反応性にされる[18F]−フッ化物イオン(18F-)の適当な供給源との反応によって前駆体化合物を一段階で標識できる。この方法には、前駆体化合物は、放射性フッ素化が化合物上の特定の部位で起こるように選択的に化学保護されるのが普通である。好適な保護基は既に前述したものである。
【0057】
放射性同位体が18Fである場合、前駆体化合物は以下のいずれかであることが好ましい。
(i)求核置換のためのアルキルハライド又はアルキルスルホネート(例えば、アルキルブロミド、アルキルメシレート又はアルキルトシレート)、或いは
(ii)(例えば、18F(CH2)3OMs又は18F(CH2)3OBrでヒドロキシル基をO−アルキル化することによる18Fの導入のための)ヒドロキシル。
【0058】
(上記スキーム1の続きである)以下のスキーム2では、Zは−(CH2)−ブロミド又は−(CH2)−クロリドである。これを塩基性条件下で[18F]−フッ化物イオンで処理すれば、標識18F−フルオロアセチル化合物(h)(即ち、R1が18Fからなる式Iのインビボ造影剤)が得られる。
【0059】
【化9】

【0060】
(上記スキーム1の(f)からの続きである)以下のスキーム3では、(f)のR22はヒドロキシルであり、アセチル−LGによる(f)のアセチル化でアセトキシアミド(i)が得られる。アセテートの加水分解でアルコール(j)が得られ、これを18F−フルオロエチルトシレート及び水素化ナトリウムでアルキル化することで18F−フルオロエトキシ化合物(k)(即ち、R2が18Fからなる式Iのインビボ造影剤)が得られる。
【0061】
【化10】

【0062】
造影剤1もこの経路で得ることができる。
【0063】
【化11】

【0064】
スキーム3についてさらに説明すると、同じインビボ造影剤(k)は、脱離基を含む前駆体化合物を[18F]−フッ化物で直接標識することでも得ることができる。脱離基がトシレートであるこのような直接標識前駆体は、(j)を特定のアルキルグリコールジトシレートと反応させて(j1)とすることで得られる。次に、(j1)を[18F]−フッ化物で直接標識することで18F−フルオロエトキシ化合物(k)が得られる。造影剤1もこの経路で得ることができる。
【0065】
【化12】

【0066】
放射性同位体が放射性ヨウ素である本発明のインビボ造影剤を得るためには、好ましい前駆体化合物は、求電子又は求核ヨウ素化を受ける誘導体或いは標識アルデヒド又はケトンとの縮合を受ける誘導体を含むものである。第1のカテゴリーの例は以下の(a)及び(b)である。
(a)トリアルキルスタンナン(例えば、トリメチルスタンニル又はトリブチルスタンニル)、トリアルキルシラン(例えば、トリメチルシリル)或いは有機ホウ素化合物(例えば、ボロネートエステル又はオルガノトリフルオロボレート)のような有機金属誘導体。
(b)求電子ヨウ素化に向けて活性化された芳香環(例えば、フェノール類)及び求核ヨウ素化に向けて活性化された芳香環(例えば、アリールヨードニウム塩、アリールジアゾニウム塩、アリールトリアルキルアンモニウム塩又はニトロアリール誘導体)。
【0067】
放射性ヨウ素化には、前駆体化合物は好ましくは、(放射性ヨウ素交換を可能にするための)アリールヨージド又はブロミド、活性化前駆体化合物アリール環(例えば、フェノール基)、有機金属前駆体化合物(例えば、トリアルキルスズ、トリアルキルシリル又は有機ホウ素化合物)、或いはトリアゼンのような有機前駆体化合物又は求核置換のための良好な脱離基(例えば、ヨードニウム塩)からなる。放射性ヨウ素を有機分子中に導入するための前駆体化合物及び方法は、Bolton(J.Lab.Comp.Radiopharm.2002;45:485−528)によって記載されている。好適なボロネートエステル有機ホウ素化合物及びその製法は、Kabalka et al(Nucl.Med.Biol.2002;29:841−843及び2003;30:369−373)によって記載されている。好適なオルガノトリフルオロボレート及びその製法は、Kabalka et al(Nucl.Med.Biol.2004;31:935−938)によって記載されている。放射性ヨウ素化用の好ましい前駆体化合物は有機金属前駆体化合物からなり、最も好ましくはトリアルキルスズからなる。
【0068】
放射性ヨウ素を結合できるアリール基の例を以下に示す。
【0069】
【化13】

【0070】
これらの基はいずれも、芳香環上への容易な放射性ヨウ素置換を可能にする置換基を含んでいる。放射性ヨウ素を含む別の置換基は、例えば次式のように、放射性ハロゲン交換による直接ヨウ素化で合成することができる。
【0071】
【化14】

【0072】
例えば、本発明の放射性ヨウ素化インビボ造影剤を得るのに適した前駆体化合物では、式IIIのR21又はR23は、それが結合した芳香族基と共に、
(i)有機金属誘導体又は有機ホウ素化合物で置換された芳香環を形成するか、
(ii)求電子放射性ヨウ素化に向けて活性化された芳香環(例えば、フェノール類)を形成するか、或いは
(iii)求核放射性ヨウ素化に向けて活性化された芳香環(例えば、アリールヨードニウム塩、アリールジアゾニウム塩、アリールトリアルキルアンモニウム塩又はニトロアリール誘導体)を形成する。
【0073】
これらの前駆体化合物は、放射性ヨウ素置換により、本発明の放射性ヨウ素化インビボ造影剤に容易に転化される。
【0074】
本発明のインビボ造影剤に類似した構造を有する放射性ヨウ素化化合物は、Zhang et al(2007 J.Med.Chem.;50:848−55)によって記載されている。これらの化合物は、トリブチルスタンナン前駆体化合物の放射性ヨウ素化によってベンゼン環上に放射性ヨウ素を導入することで得られた。本発明の放射性ヨウ素化インビボ造影剤を得るためには、(上記スキーム1の続きである)以下のスキーム4(式中、(g)のR22はブロミドである。)に例示されるように類似の方法が使用できる。
【0075】
【化15】

【0076】
R2又はR3が放射性臭素である式Iの化合物は、式Iの放射性ヨウ素化化合物に関して上記に記載した前駆体化合物の放射性臭素化によって得ることができる。Kabalka and Varmaは、放射性臭素化化合物を含む放射性ハロゲン化化合物を合成するための様々な方法を総説している(Tetrahedron 1989;45(21):6601−21)。
【0077】
本発明の11C標識インビボ造影剤は、インビボ造影剤のデスメチル化バージョンである前駆体化合物を11C−メチルヨージドと反応させることで直截的に合成できる。11C標識アリールオキシアニリド化合物を得るためのかかる方法は、Briard et al(2008 J.Med.Chem.;51;17−30)によって記載されている。Briardによって記載された方法は、異なる出発原料を使用しながら、本発明の11C標識インビボ造影剤を得るために容易に適合させることができる。(上記スキーム1の続きである)以下のスキーム5(式中、(g)のR22はヒドロキシルである。)は、放射性同位体が11Cである本発明のインビボ造影剤を得るため、Briard et alの教示内容をいかにして適合させ得るかを例示している。
【0078】
【化16】

【0079】
また、所望のインビボ造影剤の特定の炭化水素のグリニャール試薬を[11C]−CO2と反応させて、前駆体化合物中のアミン基と反応して所望の11C標識インビボ造影剤を与える11C試薬を得ることによって11Cを組み込むことも可能である。グリニャール試薬は、所望の放射性標識部位にハロゲン化マグネシウム前駆体基を含んでいる。
【0080】
11Cの半減期は20.4分にすぎないので、11C標識中間体は高い比放射能を有すること、したがってできるだけ速い反応プロセスを用いてそれを製造することが重要である。かかる11C標識技術に関する徹底的な総説を、Antoni et al,“Aspects on the Synthesis of 11C−Labelled Compounds”in Handbook of Radiopharmaceuticals,Ed.M.J.Welch and C.S.Redvanly(2003,John Wiley and Sons)に見出すことができる。
【0081】
本発明の前駆体化合物は、理想的には無菌で非発熱性の形態で供給される。したがって前駆体化合物は、インビボ造影剤を哺乳動物への投与に適した生体適合性キャリヤーと共に含んでなる医薬組成物の製造に使用できる。前駆体化合物はまた、かかる医薬組成物を製造するためのキット中に一成分として含めるためにも適している。
【0082】
好ましい実施形態では、前駆体化合物はキット又は自動化合成装置で使用するように設計されたカセットの一部として溶液状態で供給される。これらの態様は、本発明の追加の態様に関連して以下に一層詳しく論議される。
【0083】
別の好ましい実施形態では、前駆体化合物は固相に結合されている。前駆体化合物は、好ましくは固体担体マトリックスに共有結合した状態で供給される。このようにすれば、所望の生成物は溶液状態で生成される一方、出発原料及び不純物は固相に結合したままに保たれる。かかる系の例としては、18F−フッ化物による固相求電子フッ素化用の前駆体化合物が国際公開第03/002489号に記載されており、18F−フッ化物による固相求核フッ素化用の前駆体化合物が国際公開第03/002157号に記載されている。
【0084】
本発明の製造方法で使用するための好ましい前駆体化合物の多くは、アルキルブロミド、アルキルメシレート、アルキルトシレート、トリアルキルスタンナン、トリアルキルシラン及び有機ホウ素化合物から選択される前駆体基を含んでいる。これら多くの好ましい前駆体化合物自体は、本発明の独立した態様をなしている。
【0085】
放射性医薬組成物
さらに別の態様では、本発明は「放射性医薬組成物」を提供し、これは本発明のインビボ造影剤を哺乳動物への投与に適した形態の生体適合性キャリヤーと共に含んでいる。
【0086】
「生体適合性キャリヤー」は、放射性医薬組成物が生理学的に認容され得るようにして(即ち、毒性又は過度の不快感なしに哺乳動物体に投与できるようにして)インビボ造影剤を懸濁又は溶解するための流体(特に液体)である。生体適合性キャリヤーは、好適には、無菌のパイロジェンフリー注射用水、(有利には注射用の最終生成物が等張性又は非低張性になるように平衡させ得る)食塩水のような水溶液、或いは1種以上の張度調整物質(例えば、血漿陽イオンと生体適合性対イオンとの塩)、糖(例えば、グルコース又はスクロース)、糖アルコール(例えば、ソルビトール又はマンニトール)、グリコール(例えば、グリセロール)又は他の非イオン性ポリオール物質(例えば、ポリエチレングリコール、プロピレングリコールなど)の水溶液のような注射可能なキャリヤー液体である。生体適合性キャリヤーはまた、エタノールのような生体適合性有機溶媒を含んでいてもよい。かかる有機溶媒は、親油性の高い化合物又は配合物を可溶化するために有用である。好ましくは、生体適合性キャリヤーはパイロジェンフリー注射用水、等張食塩水又はエタノール水溶液である。静脈内注射用生体適合性キャリヤーのpHは好適には4.0〜10.5の範囲内にある。
【0087】
本発明の放射性医薬組成物中に含まれる場合におけるインビボ造影剤の好適な実施形態及び好ましい実施形態は、本明細書で既に記載した通りである。
【0088】
かかる放射性医薬組成物は非経口的に(即ち、注射によって)投与でき、最も好ましくは水溶液である。かかる組成物は、緩衝剤、薬学的に許容される可溶化剤(例えば、シクロデキストリン或いはPluronic、Tween又はリン脂質のような界面活性剤)、薬学的に許容される安定剤又は酸化防止剤(例えば、アスコルビン酸、ゲンチジン酸又はp−アミノ安息香酸)のような追加成分を任意に含み得る。本発明のインビボ造影剤が放射性医薬組成物として提供される場合、前記インビボ造影剤の製造方法はさらに、放射性医薬組成物を得るために必要な段階(例えば、有機溶媒の除去、生体適合性緩衝剤及び任意の追加成分の添加)を含むことができる。非経口的投与には、放射性医薬組成物が無菌性かつ無発熱原性であることを保証するための手段を講じることも必要である。
【0089】
キット及びカセット
好ましい実施形態では、本発明のインビボ造影剤の製造方法は、キット又は自動化合成装置に挿入し得るカセットを用いて実施できる。これらのキット及びカセットはまた、本発明の追加の態様をなしており、本明細書で定義される本発明の放射性医薬組成物の製造のため特に好都合である。
【0090】
本発明のキットは、本発明の前駆体化合物を密封容器内に含んでいる。「密封容器」は、好ましくは、注射器による溶液の追加及び抜取りを許しながら、無菌保全性及び/又は放射能安全性の維持、さらに任意には不活性ヘッドスペースガス(例えば、窒素又はアルゴン)の維持を可能にする。好ましい密封容器は、気密クロージャーを(通例はアルミニウムからなる)オーバーシールと共にクリンプ加工した隔壁密封バイアルである。かかる密封容器は、例えばヘッドスペースガスの変更又は溶液のガス抜きに所望される場合、クロージャーが真空に耐え得るという追加の利点を有している。
【0091】
本発明のキット中に使用する場合、前駆体化合物の好適な実施形態及び好ましい実施形態は、本明細書で既に記載した通りである。
【0092】
キット中に使用するための前駆体化合物を無菌製造条件下で使用すれば、所望の無菌で非発熱性の材料を得ることができる。別法として、前駆体化合物を非無菌条件下で使用し、次いで例えばγ線照射、オートクレーブ処理、乾熱又は(例えば、エチレンオキシドによる)化学処理を用いる終末滅菌を施すこともできる。好ましくは、前駆体化合物は無菌で非発熱性の形態で供給される。最も好ましくは、無菌で非発熱性の前駆体化合物は上述したような密封容器に入れて供給される。
【0093】
好ましくは、試験間での汚染の可能性を最小限に抑えると共に無菌性及び品質保証を確実にするため、キットのすべての構成要素が使い捨てである。
【0094】
別の態様では、本発明は、本発明のインビボ造影剤を合成するため適宜に改造された自動化合成装置に挿入し得るカセットを提供する。現在、特に[18F]−ラジオトレーサーはしばしば自動化放射合成装置で簡便に製造されている。かかる装置には、Tracerlab(商標)及びFASTlab(商標)(いずれもGE Healthcare社製)を始めとするいくつかの市販例が存在している。放射化学は、カセットを装置に取り付けることにより、自動化合成装置上で実施される。普通、カセットは流体通路、反応器、及び試薬バイアル並びに放射合成後の清掃段階で使用される任意の固相抽出カートリッジを受け入れるためのポートを含んでいる。
【0095】
本発明のインビボ造影剤の自動化合成のためのカセットは、
(i)本明細書で定義した前駆体化合物を含む容器、及び
(ii)本明細書で定義したような、インビボイメージングに適した放射性同位体の適当な供給源を用いて容器を溶出するための手段
を含んでいる。
【0096】
かかるカセットはさらに、
(iii)過剰の前記放射性同位体を除去するためのイオン交換カートリッジ、及び任意には
(iv)得られた放射性標識生成物を脱保護して本明細書で定義したインビボ造影剤を生成するためのカートリッジ
を含むことができる。
【0097】
自動化合成に必要な試薬、溶媒及び他の消耗品もまた、濃度、体積、送出時間などに関する最終ユーザーの要求条件を満たすように自動化合成装置を運転させるソフトウェアを保持したコンパクトディスクのようなデータ媒体と共に含めることができる。
【0098】
使用方法
さらに別の態様では、本発明は、
被験体におけるPBR発現の分布及び/又は程度を決定する際に使用するためのインビボイメージング方法であって、
(i)本明細書で定義したインビボ造影剤を前記被験体に投与する段階、
(ii)前記造影剤を前記被験体内のPBRに結合させる段階、
(iii)前記造影剤の放射性同位体から放出される信号をインビボイメージング技術によって検出する段階、
(iv)前記信号の位置及び/又は量を表す画像を生成する段階、並びに
(v)前記被験体におけるPBR発現の分布及び程度を決定する段階であって、前記発現は前記インビボ造影剤から放出される前記信号と直接に相関している段階
を含んでなるインビボイメージング方法を提供する。
【0099】
本発明のインビボイメージング方法に関しては、インビボ造影剤の好適な態様及び好ましい態様は本明細書で前記に定義した通りである。
【0100】
インビボ造影剤を「投与する」段階は、好ましくは非経口的に実施され、最も好ましくは静脈内に実施される。静脈内経路は、インビボ造影剤を被験体の身体全域に送達するため、したがって血液脳関門(BBB)を横切って前記被験体で発現されたPBRに接触させるための最も効率的な方法である。本発明のインビボ造影剤は、好ましくは本明細書で定義された本発明の医薬組成物として投与される。本発明のインビボイメージング方法はまた、本発明のインビボ造影剤を予め投与した被験体に関して実施される上記の段階(ii)〜(v)を含むものとしても理解できる。
【0101】
投与段階後かつ検出段階前に、インビボ造影剤をPBRに結合させる。例えば、被験体がインタクトな哺乳動物である場合、インビボ造影剤は哺乳動物の身体を通って動的に移動し、体内の様々な組織に接触する。ひとたびインビボ造影剤がPBRに接触すれば、特異的な相互作用が起こる結果、PBRをもった組織からのインビボ造影剤のクリアランスは、PBRをもたない組織又はPBRの少ない組織よりも長い時間がかかる。一定の時点に達すれば、PBRをもった組織に結合したインビボ造影剤とPBRをもたない組織又はPBRの少ない組織に結合したインビボ造影剤との比の結果として、PBRに特異的に結合したインビボ造影剤の検出が可能となる。理想的には、この比は2:1以上である。
【0102】
本発明の方法の「検出」段階は、放射性同位体から放出される信号を、前記信号に対して感受性を有する検出器によって検出することを含んでいる。この検出段階はまた、信号データの取得として理解することもできる。単光子放出断層撮影法(SPECT)及び陽電子放出断層撮影法(PET)が、本発明の方法で使用するための最も好適なインビボイメージング技術である。PETが、本発明の方法で使用するための好ましいインビボイメージング技術である。
【0103】
本発明の方法の「生成」段階は、取得された信号データに再構築アルゴリズムを適用してデータセットを得るコンピューターによって実施される。次いで、このデータセットを操作することで、前記放射性同位体から放出される信号の位置及び/又は量を示す画像が生成される。放出される信号はPBRの発現と直接に相関する結果、生成された画像を評価することで「決定」段階を行うことができる。
【0104】
本発明の「被験体」は、任意のヒト又は動物被験体であり得る。好ましくは、本発明の被験体は哺乳動物である。最も好ましくは、前記被験体はインタクトな哺乳動物生体である。特に好ましい実施形態では、本発明の被験体はヒトである。本インビボイメージング方法は、健常被験体或いはPBRの異常発現に関連する病的状態(「PBR状態」)を有することが知られ又は疑われる被験体でのPBRの検査に使用できる。好ましくは、前記方法はPBR状態を有することが知られ又は疑われる被験体のインビボイメージングに関し、したがって前記状態の診断方法の一部として有用である。インビボイメージングが役に立つかかるPBR状態の例には、神経炎症が存在するパーキンソン病、多発性硬化症、アルツハイマー病及びハンチントン病のような神経疾患がある。本発明の化合物によるイメージングが有用であり得る他のPBR状態には、ニューロパシー性疼痛、関節炎、喘息、アテローム性動脈硬化症、並びに結腸直腸癌及び乳癌のような悪性疾患がある。本発明のインビボ造影剤は、中枢神経系(CNS)におけるPBR発現のインビボイメージングに特に適している。
【0105】
別の実施形態では、本発明のインビボイメージング方法は前記被験体に関する治療計画の進行中に繰り返して実施することができ、前記計画はPBR状態と戦うための薬物の投与を含んでいる。例えば、本発明のインビボイメージング方法は、PBR状態と戦うための薬物による治療前、治療中及び治療後に実施できる。このようにすれば、前記治療の効果を経時的にモニターすることができる。この実施形態では、好ましくは、インビボイメージング技術はPETである。PETは優れた感度及び分解能を有する結果、病変部における比較的小さい変化でも経時的に観察でき、これは治療モニタリングに有利である。PETスキャナーは、日常的にピコモル範囲内の放射能濃度を測定している。現在、マイクロPETスキャナーは約1mmの空間分解能に接近しているが、臨床スキャナーは約4〜5mmである。
【0106】
さらに別の態様では、本発明はPBR状態の診断方法を提供する。本発明の診断方法は、上記に定義したインビボイメージング方法を、PBR発現の分布及び程度を特定の臨床像に帰因させる追加段階(vi)(即ち、演繹的な医学的決断段階)と共に含んでいる。
【0107】
別の態様では、本発明は、本明細書で定義した診断方法で使用するための、本明細書で定義したインビボ造影剤を提供する。
【0108】
さらに別の態様では、本発明は、本明細書で定義した診断方法で使用するための本明細書で定義した放射性医薬組成物の製造で使用するための、本明細書で定義したインビボ造影剤を提供する。
【実施例】
【0109】
以下、一連の非限定的な実施例によって本発明を例示する。
【0110】
実施例の簡単な説明
実施例1は、非放射性造影剤1の合成法を記載している。
【0111】
実施例2は、非放射性造影剤18の合成法を記載している。
【0112】
実施例3は、非放射性造影剤19の合成法を記載している。
【0113】
実施例4は、造影剤1用の直接標識前駆体化合物の合成法を記載している。
【0114】
実施例5は、造影剤1の合成法を記載している。
【0115】
実施例6は、PBRに対する造影剤の結合親和性を測定するために使用したインビトロ効力アッセイを記載している。
【0116】
実施例7は、静脈内投与後における造影剤の体内分布を測定するために使用した動物モデルを記載している。
【0117】
実施例中で使用される略語のリスト
℃ 摂氏度
aq 水性
DMF ジメチルホルムアミド
DMSO ジメチルスルホキシド
g グラム
h 時間
Ki 半最大阻害に必要な化合物の濃度
MBq メガベクレル
mg ミリグラム
min 分
ml ミリリットル
mM ミリモル濃度
mmol ミリモル
n 実験回数
NMR 核磁気共鳴
PBR 末梢ベンゾジアゼピンレセプター
RT 室温
TLC 薄層クロマトグラフィー
Tris トリス(ヒドロキシメチル)アミノメタン
UV 紫外。
【0118】
実施例1:N−[2−(2−フルオロエトキシ)ベンジル]−N−(2−フェノキシピリジン−3−イル)アセトアミド(非放射性造影剤1)の合成
1(i) 2−フェノキシ−3−ニトロピリジン
【0119】
【化17】

【0120】
DMF(50ml)中の2−クロロ−3−ニトロピリジン(10g、63mmol)をフェノール(8g、85mmol)及び炭酸カリウム(15.4g、1.76mmol)により70℃で2時間処理し、次いで室温で一晩撹拌した。次いで、反応物を高真空中で濃縮してガム質とし、酢酸エチル(50ml)及び水(150ml)の混合物で希釈し、撹拌した。酢酸エチル溶液を分離し、硫酸マグネシウム上で乾燥し、真空中で濃縮してガム質とした。水溶液をさらに50mlの酢酸エチルで再抽出し、酢酸エチル層を分離し、硫酸マグネシウム上で乾燥し、以前の酢酸エチル抽出液に添加し、真空中で濃縮して黄色の結晶質固体を得た。この固体をジエチルエーテル(20ml)で洗浄し、濾過により集めて2−フェノキシ−3−ニトロピリジンの無色結晶(10.49g、46.5mmol、73.8%)を得た。母液は廃棄した。
【0121】
1H NMR(CDCl3)7.18(3H,m,ArH)、7.3(1H,m,ArH)、7.45(2H,t,ArH)、8.34(2H,m,ArH)。
【0122】
13C NMR(CDCl3)118.3、121.6、125.7、129.6、134.5、135.4、151.7、152.5、155.8。
【0123】
1(ii) 2−フェノキシ−3−アミノピリジン
【0124】
【化18】

【0125】
メタノール(250ml)中の2−フェノキシ−3−ニトロピリジン(8.0g、37mmol)を木炭上のパラジウム(800mg)により水素雰囲気下で30℃で2時間処理した。急速な水素の吸収があり、検出可能な発熱の結果として温度が48℃に上昇した後、降下して元に戻った。次いで、反応物をセライトで濾過して無色溶液を得、これを高真空中で濃縮することで油状の2−フェノキシ−3−アミノピリジン(6.8g、36mmol、98%)を得たが、これは静置後に結晶化した。
【0126】
1H NMR(CDCl3)3.96(2H,brs,NH2)、6.86,(1H,m,ArH)、7.00(1H,m,ArH);7.16(3H,m,ArH)、7.36(2H,m,ArH)、7.39(1H,m,ArH)。
【0127】
13C NMR(CDCl3)119.4、120.6、122.0、124.2、129.5、131.9、135.6、151.6、154.2。
【0128】
1(iii) 2−[(2−フェノキシ−ピリド−3−イルアミノ)メチル]フェノール
【0129】
【化19】

【0130】
2−フェノキシ−3−アミノピリジン(6g、32.25mmol)をo−サリチルアルデヒド(2−ヒドロキシベンズアルデヒド)(6g、50mmol)及びトルエン(10ml)で処理し、激しく撹拌しながら窒素雰囲気下で90℃で1時間加熱した。溶液はは黄色で均質になった。次いで、反応物を0℃に冷却したところ凝固し、それをメタノール(100ml)で希釈したところ固体がすべて溶解した。これに水素化ホウ素ナトリウム(3.7g、97.5mmol)を少量ずつ20分かけて添加して処理した。この間に白色の沈殿が生じた。次いで、反応物を室温に放温し、さらに30分間撹拌した。ギ酸(3ml)を添加し、反応物をさらに18時間撹拌した。反応物から固体が晶出し、これを濾過によって集め(7.568g)、真空中で乾燥した。母液を真空中で約30mlに濃縮し、追加量の結晶を集めた(2.2568g)。固体をクロロホルムから再結晶して2−[(2−フェノキシ−ピリド−3−イルアミノ)メチル]フェノール(8.5g、29.1mmol、90%)を得た。
【0131】
1H NMR(CDCl3)1.69(1H,brs,NH);4.45(2H,s,CH2N);4.75,(1H,brs,OH)、6.8−7.7,(12H,m,ArH)。
【0132】
13C NMR(CDCl3)46.9、116.5、119.3、120.2、120.4、121.0、121.5、124.7、128.8、129.3、129.6、131.5、133.0、151.5、152.0、156.0。
【0133】
1(iv) 2−[(フェノキシ−ピリド−3−イルアセチルアミノ)メチル]フェノールアセテート
【0134】
【化20】

【0135】
ジクロロメタン(10ml)中の2−[(フェノキシ−ピリド−3−イルアミノ)メチル]フェノール(1g、3.42mmol)を無水酢酸(1.39g、13.6mmol)及びピリジン(1.074g、13.6mmol)で処理し、窒素雰囲気下で20℃で18時間加熱した。次いで、反応物をジクロロメタン(50ml)で希釈し、5N塩酸(20ml)で洗浄してピリジンを除去し、有機層を分離し、硫酸マグネシウム上で乾燥し、高真空中で濃縮してガム質にしたが、これは静置後に結晶化した。ジエチルエーテル及び石油エーテルから再結晶することで、白色固体の2−[(フェノキシ−ピリド−3−イルアセチルアミノ)メチル]フェノールアセテート(1.05g、2.79mmol、81%)を得た。
【0136】
1H NMR(CDCl3)1.93(3H,s,CH3)、2.25(3H,s,CH3)、4.37(2H,d,CH)、and5.54(2H,d,CH)、together CH2N,6.5−7.5(10H,m,ArH)、8.0(1H,d,ArH)。
【0137】
13C NMR(CDCl3)20.9、22.1、45.4、118.8、121.2、122.7、125.1、125.7、125.9、128.8、129.0、129.6、131.9、140.0、147.0、1249.5、153.1、159.4、169.7、170.1。
【0138】
1(v) N−(2−ヒドロキシベンジル)−N−(フェノキシ−ピリド−3−イル)アセトアミド
【0139】
【化21】

【0140】
メタノール(20ml)中のN−(2−アセトキシベンジル)−N−(フェノキシ−ピリド−3−イル)アセトアミド(0.5g、1.71mmol)を水酸化ナトリウム(212mg、5.3mmol)で処理し、室温で30分間撹拌した。シリカでジクロロメタン中20%酢酸エチルで展開したTLCは、アセテートから(意外にも)一層速く走行するフェノールへの完全な転化を示した。次いで、反応物を酢酸(約318mg、5.3mmol)で(リトマス紙でモニターして)中性に調整し、真空中で濃縮して白色固体を得た。この固体をジクロロメタン(50ml)と水(50ml)との間に分配した。ジクロロメタン層を分離し、硫酸マグネシウム上で乾燥し、真空中で濃縮して固体のN−(2−ヒドロキシベンジル)−N−(フェノキシ−ピリド−3−イル)アセトアミド(411mg、1.22mmol、91%)を得た。
【0141】
1H NMR(CDCl3)2.01(3H,s,CH3)、4.63(1H,s)、5.02(1H,s)together CH2N,6.6−7.4(11H,m,ArH)、8.17(1H,d,ArH)、9.34(1H,s,OH)。
【0142】
13C NMR(CDCl3)21.7、49.7、117.7、118.9、119.25、121.3、121.6、125.3、125.5、129.6、130.3、131.3、138.8.147.7、152.7、156.1、159.1、173.4。
【0143】
1(vi) N−[2−(2−フルオロエトキシ)ベンジル]−N−(2−フェノキシピリジン−3−イル)アセトアミド
【0144】
【化22】

【0145】
DMF(10ml)中のN−[2−(2−ヒドロキシ)ベンジル]−N−(2−フェノキシピリジン−3−イル)アセトアミド(300mg、0.898mmol)を水素化ナトリウム(96mg、2.4mmol)及び2−フルオロエチルトシレート(527g、2.4mmol)で処理し、窒素雰囲気下で30℃で1時間撹拌した。ジクロロメタン中20%酢酸エチルで展開されかつUV光下で可視化されるTLCによって反応物をモニターした。これはゆっくりと走行するスポットの形成を示し、それは1時間後に完了した。次いで、反応物を酢酸(1ml)の添加によって奪活し、高真空中で濃縮して油状物を得た。この油状物を酢酸エチル(100ml)と重炭酸ナトリウム溶液(50ml)との間に分配した。酢酸エチル溶液を分離し、硫酸マグネシウム上で乾燥し、真空中で濃縮してガム質にした。このガム質をシリカゲル上でジクロロメタン中5〜20%酢酸エチルの勾配でクロマトグラフィー処理して2つの画分を得た。画分1は本質的にボイド容積中に溶出する回収フルオロエチルトシレートであり、約6カラム容積後に溶出する画分2はN−[2−(2−フルオロエトキシ)ベンジル]−N−(2−フェノキシピリジン−3−イル)アセトアミド(332mg、0.87mmol、97%)であった。
【0146】
1H NMR(CDCl3)1.98(3H,s,CH3)、3.67(3H,s,OCH3)、3.9(2H,brm,CH2O)、4.44,and4.60(2H,each m,CH2F)、4.86(1H,d)、and 5.23(1H,d)together CH2N,6.67−7.37(10H,m,ArH)、8.0(1h,s,ArH)。
【0147】
13C NMR(CDCl3)22.3、45.6、55.6、67.9、68.1、80.7、83.0、112.8、113.7、116.7、118.6、121.3、125.0、126.7、129.5、139.1、146.6、150.5、153、2、153.9、159.6、170.5。
【0148】
実施例2:N−[2−(2−フルオロエトキシ)ピリジン−3−イルメチル]−N−(2−フェノキシ−フェニル)アセトアミド(非放射性造影剤19)の合成
2(i) 2−アミノジフェニルエーテル
【0149】
【化23】

【0150】
メタノール(250ml)中の2−ニトロジフェニルエーテル(16g、74mmol)を木炭上のパラジウム(1.6g)と共に水素雰囲気下で20〜50℃で30分間振盪した。急速な水素の吸収があり、20〜50℃の検出可能な発熱の結果として温度が急速に上昇し、最終的には降下して元に戻った。温度が50℃を超えて上昇するのを抑えるため、振盪を短時間停止した。次いで、反応物をセライトで濾過し、高真空中で濃縮することで、2−アミノジフェニルエーテル(13.5g、72.9mmol、98%)を油状物として得たが、これは静置後に結晶化した。
【0151】
1H NMR(300MHz,CDCl3):δH 3.8(2H,brs,NH)、6.7−6.75(1H,m,ArH)、6.8−6.94(2H,m,ArH)、6.94−7.1((4H,m,ArH)、7.25−7.4(2H,m,ArH)。
【0152】
13C NMR(75MHz,CDCl3):δC 116.4,117.1,118.7,120.2,12206,124.9,129.7,138.7,143.0,157.5。
【0153】
2(ii) (2−メトキシ−ピリジン−3−イルメチル)−(2−フェノキシ−フェニル)アミン
【0154】
【化24】

【0155】
段階2(i)からの2−アミノジフェニルエーテル(1.80g、9.8mmol)と2−メトキシ−3−ピリジンカルボキシアルデヒド(2.0g、14.6mmol)との混合物を水素下で90℃で1時間加熱した。反応混合物を0℃に冷却し、MeOH(20mL)を添加し、次いで水素化ホウ素ナトリウム(1.11g、29.4mmol)を少量ずつ20分かけて添加した。混合物をRTで24時間撹拌した。ギ酸(2.4g、53.0mmol)を添加し、混合物を15分間撹拌した。溶媒を真空中で除去し、残留物を10%重炭酸ナトリウム水溶液(100mL)で奪活し、DCM(2×30mL)で抽出し、硫酸マグネシウム上で乾燥し、濾過し、溶媒を真空中で除去した。粗物質をDCM(A):酢酸エチル(B)で溶出するシリカゲルクロマトグラフィー(2%(B)、80g、2.0CV、60mL/分)で精製して不純生成物を得た。試料をメタノールから結晶化することで、2.2g(73%)の(2−メトキシ−ピリジン−3−イルメチル)−(2−フェノキシ−フェニル)アミンを白色固体として得た。
【0156】
1H NMR(300MHz,CDCl3):δH 3.90(3H,s,OCH3)、4.33(2H,d,J=6Hz,NCH2)、4.73(1H,m,NH)、6.61−6.68(2H,m,Ph)、6.77−7.09(6H,m,Ph)、7.27−7.34(2H,m,Ph)、7.48(1H,m,Ph)、and 8.03(1H,dd,J=2 and 5Hz,Ph)。
【0157】
LC−MS:C19H18N2O2に関するm/z計算値,306.1、実測値,307.1(M+H)+。
【0158】
2(iii) N−(2−メトキシ−ピリジン−3−イルメチル)−N−(2−フェノキシ−フェニル)アセトアミド
【0159】
【化25】

【0160】
段階2(ii)からの(2−メトキシ−ピリジン−3−イルメチル)−(2−フェノキシ−フェニル)アミン(1.0g、3.26mmol)を無水DCM(15mL)に溶解した溶液に4−(ジメチルアミノ)ピリジン(0.01g、0.08mmol)を添加した。反応物を0℃に冷却し、塩化アセチル(1.54g、19.6mmol、1.40mL)を添加した。混合物をRTで3時間撹拌した。溶媒を真空中で除去し、残留物を1N水酸化ナトリウム水溶液(5mL)で奪活し、DCM(2×20mL)で抽出し、硫酸マグネシウム上で乾燥し、濾過し、溶媒を真空中で除去した。粗物質をDCM(A):メタノール(B)で溶出するシリカゲルクロマトグラフィー(5%(B)、80g、2.0CV、60mL/分)で精製することで、1.1g(97%)のN−(2−メトキシ−ピリジン−3−イルメチル)−N−(2−フェノキシ−フェニル)アセトアミドを無色油状物として得た。
【0161】
1H NMR(300MHz,CDCl3):δH 1.97(3H,s,COCH3)、3.74(3H,s,OCH3)、4.73(1H,d,J=15Hz,NCH)、4.99(1H,d,J=15Hz,NCH)、6.72−6.91(4H,m,Ph)、6.98−7.37(6H,m,Ph)、7.65(1H,dd,J=2 and 7Hz,Ph)、and 8.00(1H,dd,J=2 and 5Hz,Ph)。
【0162】
2(iv) 3−[(2−フェノキシ−フェニルアミノ)メチル]ピリジン−2−オール
【0163】
【化26】

【0164】
段階2(iii)からのN−(2−メトキシ−ピリジン−3−イルメチル)−N−(2−フェノキシ−フェニル)アセトアミド(0.60g、1.72mmol)を48%臭化水素酸水溶液(44.7g、552.0mmol、30mL)に溶解した溶液を水素下で100℃で24時間加熱した。溶媒を真空中で除去し、残留物を10%炭酸カリウム水溶液(50mL)で奪活し、DCM(2×30mL)で抽出し、硫酸マグネシウム上で乾燥し、濾過し、溶媒を真空中で除去することで、0.51g(100%)の3−[(2−フェノキシ−フェニルアミノ)メチル]ピリジン−2−オールをガム質として得た。
【0165】
1H NMR(300MHz,CDCl3):δH 4.32(2H,s,NCH2)、4.90(1H,s,br,NH)、6.22(1H,t,J=7Hz,Ph)、and 6.60−7.44(12H,m,Ph)。
【0166】
LC−MS:C18H16N2O2に関するm/z計算値,292.1、実測値,293.1(M+H)+。
【0167】
2(v) N−(2−ヒドロキシ−ピリジン−3−イルメチル)−N−(2−フェノキシ−フェニル)アセトアミド
【0168】
【化27】

【0169】
段階2(iv)からの3−[(2−フェノキシ−フェニルアミノ)メチル]ピリジン−2−オール(0.51g、1.74mmol)を無水DCM(20mL)に溶解した溶液に4−(ジメチルアミノ)ピリジン(0.01g、0.08mmol)を添加した。反応物を0℃に冷却し、塩化アセチル(1.6g、20.8mmol、1.5mL)を添加した。混合物をRTで24時間撹拌した。溶媒を真空中で除去し、水酸化リチウムの飽和メタノール溶液(10mL)を残留物に添加した。10分間撹拌した後、水(20mL)を添加し、メタノールを真空中で除去した。水溶液をDCM(2×20mL)で抽出し、合わせた有機相をブライン(20mL)で洗浄し、硫酸マグネシウム上で乾燥し、濾過し、溶媒を真空中で除去した。粗物質をDCM(A):メタノール(B)で溶出するシリカゲルクロマトグラフィー(10%(B)、12g、1.0CV、30mL/分)で精製して不純生成物を得た。試料をDCM(A):メタノール(B)で溶出するシリカゲルクロマトグラフィー(2〜10%(B)、40g、8.0CV、40mL/分)で精製することで、0.35g(59%)のN−(2−ヒドロキシ−ピリジン−3−イルメチル)−N−(2−フェノキシ−フェニル)アセトアミドを白色泡状物として得た。
【0170】
1H NMR(300MHz,CDCl3):δH 2.01(3H,s,COCH3)、4.75(1H,d,J=16Hz,NCH)、4.88(1H,d,J=16Hz,NCH)、6.12(1H,t,J=7Hz,Ph)、6.80−7.38(10H,m,Ph)、7.62(1H,d,J=7Hz,Ph)、and 12.66(1H,s,br,OH)。
【0171】
LC−MS:C20H18N2O3に関するm/z計算値,334.1、実測値,357.0(M+Na)+。
【0172】
2(vi) 非放射性インビボ造影剤19
【0173】
【化28】

【0174】
段階2(v)からのN−(2−ヒドロキシ−ピリジン−3−イルメチル)−N−(2−フェノキシ−フェニル)アセトアミド(0.15g、0.45mmol)を窒素下でRTの無水DMF(2mL)に溶解した。炭酸カリウム(0.19g、1.35mmol)及び2−フルオロエチルトシレート(0.20g、0.89mmol)を添加し、混合物を70℃で24時間加熱した。DMFを真空中で除去し、残留物を水(40mL)で奪活し、DCM(2×20mL)で抽出し、硫酸マグネシウム上で乾燥し、濾過し、溶媒を真空中で除去した。粗物質をDCM(A):メタノール(B)で溶出するシリカゲルクロマトグラフィー(2〜5%(B)、40g、3.0CV及び7.0CV、40mL/分)で精製して不純O−アルキル及びN−アルキル生成物を得た。O−アルキル試料をDCM(A):メタノール(B)で溶出するシリカゲルクロマトグラフィー(1%(B)、40g、4.0CV、40mL/分)で再精製して不純生成物を得た。試料をDCM(A):酢酸エチル(B)で溶出するシリカゲルクロマトグラフィー(10〜90%(B)、40g、18.0CV、40mL/分)で再精製することで、35mg(20%)の非放射性インビボ造影剤19を無色油状物として得た。
【0175】
1H NMR(300MHz,CDCl3):δH 1.96(3H,s,COCH3)、4.24−4.65(4H,m,OCH2CH2F)、4.74(1H,d,J=15Hz,NCH)、5.05(1H,d,J=15Hz,NCH)、6.75−7.36(10H,m,Ph)、7.70(1H,dd,J=2 and 7Hz,Ph)、and 7.97(1H,dd,J=2 and 5Hz,Ph)。
【0176】
LC−MS:C22H21FN2O3に関するm/z計算値,380.2、実測値,381.1(M+H)+。
【0177】
実施例3:2−フルオロ−N−(2−メトキシ−ピリジン−3−イルメチル)−N−(2−フェノキシ−フェニル)アセトアミド(非放射性インビボ造影剤18)の合成
【0178】
【化29】

【0179】
段階2(iii)で得られたN−(2−メトキシ−ピリジン−3−イルメチル)−N−(2−フェノキシ−フェニル)アセトアミド(0.31g、1.0mmol)を無水DCM(5mL)に溶解した溶液に、4−(ジメチルアミノ)ピリジン(0.01g、0.08mmol)を添加した。反応物を0℃に冷却し、塩化フルオロアセチル(0.58g、6.0mmol、0.40mL)を添加した。混合物をRTで3時間撹拌した。溶媒を真空中で除去し、残留物を1N水酸化ナトリウム水溶液(5mL)で奪活し、DCM(2×20mL)で抽出し、硫酸マグネシウム上で乾燥し、濾過し、溶媒を真空中で除去した。粗物質をDCM(A):メタノール(B)で溶出するシリカゲルクロマトグラフィー(1〜5%(B)、80g、6.0CV、60mL/分)で精製することで、0.26g(71%)の非放射性造影剤18を白色固体として得た。
【0180】
1H NMR(300MHz,CDCl3):δH 3.72(3H,s,OCH3),4.69(1H,s,FCH),4.79(1H,d,J=15Hz,NCH),4.84(1H,s,FCH),5.02(1H,d,J=15Hz,NCH),6.72−6.88(4H,m,Ph),6.98−7.38(6H,m,Ph),7.64(1H,dd,J=2 and 7Hz,Ph),and 8.02(1H,dd,J=2and5Hz,Ph)、19F NMR(283MHz,CDCl3):δF −226.9。
【0181】
LC−MS:C21H19FN2O3に関するm/z計算値,366.1、実測値,367.1(M+H)+。
【0182】
実施例4:2−[(フェノキシ−ピリド−3−イルアセチルアミノ)メチル]フェノール−2−エチルトルエン−4−スルホネート(造影剤1の直接標識前駆体化合物)の合成
【0183】
【化30】

【0184】
DMF(30ml)中の2−[(フェノキシ−ピリド−3−イルアセチルアミノ)メチル]フェノール(1g、3.0mmol)を水素化ナトリウム(60%)(478mg、2.4mmol)及びエチルグリコールジトシレート(2.77g、7.5mmol)で処理し、窒素雰囲気下で20℃で1時間撹拌した。ガソリン中50%酢酸エチルで展開されかつUV光下で可視化されるTLCによって反応物をモニターした。これは出発原料の消失及びゆっくりと走行する物質の出現を示した。過剰のエチレングリコールジトシレートは、出発原料よりわずかに速く走行するスポットを形成した。1時間後、TLCによれば反応は完了した。次いで、反応物を酢酸(450mg)の滴下によって奪活し、その際には水素ガスが激しく発生した。次いで、反応物を高真空中で濃縮して油状物を得た。この油状物を酢酸エチル(100ml)と重炭酸ナトリウム溶液(50ml)との間に分配した。酢酸エチル溶液を分離し、硫酸マグネシウム上で乾燥し、真空中で濃縮してガム質にした。若干の過剰エチルグリコールジトシレートが晶出したが、エーテルでのトリチュレーション及び濾過によって分離した。このガム質をシリカでガソリン中5〜20%酢酸エチルの勾配でクロマトグラフィー処理して3つの画分を得た。画分1は回収エチレングリコールジトシレートであり、画分2は少量の回収出発原料であり、画分3は所要の化合物(1.246g、2.34mmol、78%)であった。
【0185】
1H NMR(CDCl3)δ,2.0(3H,s,CH3),2.45,(3H,s,CH3),3.9−4.2,(4H,m,2CH2),4.87and5.04(1H,d,together CH2N),6.62(1H,d,ArH),6.8−6.95,(4H,m,ArH),7.1−7.54(8H,m,ArH),7.77((2H,d,ArH),8.0(1H,d,ArH)。
【0186】
13C NMR CDCl3 δ,21.49,22.18,45.7,65.3,67.9,110.9,118.6,121.2,124.9,125.1,126.4,127.7,128.7129.4,129.8,131.1,132.6,139,145.0,146.4,153.0,155.8,159.4,170.4。
【0187】
実施例5:造影剤1の間接標識合成
【0188】
【化31】

【0189】
反応器内の[18F]F-/H2O(約400MBq、100〜300μl)に、クリプトフィックス(Kryptofix)2.2.2(4mg、10.6μmol)、炭酸カリウム(0.1mol・dm-3、50μl、0.7mg、5μmol)及びアセトニトリル(0.5mL)の混合物を添加した。窒素流下で100℃で15〜20分間加熱することで溶媒を除去した。エチレングリコールジトシレート(3〜5mg、8〜13.5μmol)のアセトニトリル(1mL)溶液を添加し、混合物を100℃で10分間加熱した。冷却後、反応物を取り出し、反応器を水(1000μl)ですすいで主たる粗反応物に加えた。[18F]−フルオロエチルトシレートをHPLC(ACE C18(2)カラム,5μ,100×10mm,5mlループ,ポンプ速度3ml/分,波長254nm,移動相(水:MeOH) :0−1分 50%MeOH;1−25分 50−95%MeOH;25−30分 95%MeOH;30−31分 95−50%MeOH;31−33分 50%MeOH)によって精製した。[18F]−フルオロエチルトシレートのtRは7.5分であった。[18F]−フルオロエチルトシレートの放射化学収率は約40%(非崩壊補正収率)であった。
【0190】
[18F]−フルオロエチルトシレートのカットピークをH2Oで約20mlの体積に希釈し、コンディショニング済みのライトt−C18 sep pak上に装填し、H2O(1×2ml)でフラッシュした。装填したsep pakを、高流量のN2ライン上で15〜20分間乾燥した。
【0191】
撹拌機を含むホイートン(Wheaton)バイアル(1ml)内で、CH3CN(100μl)中のN−(2−ヒドロキシベンジル)−N−(フェノキシ−ピリド−3−イル)アセトアミド(2〜4mg、6〜12μmol、実施例1(v)に従って製造)及びCs2CO3(8〜10mg、24〜30μmol)を室温で1〜2時間撹拌した。乾燥したライトt−C18 sep pak上の放射能をCH3CN(0.5ml)でホイートンバイアル中に溶出した。ホイートンバイアルを密封し、反応物を120〜130℃の油浴中で15分間加熱撹拌した。その後、反応物を冷却し、水(500μl)で奪活した。造影剤1を
HPLC(ACE C18(2)カラム,5μ,100x10mm,5mlループ,ポンプ速度3ml/分,波長254nm,移動相(水:MeOH):0−1分 50%MeOH;1−20分 50−95%MeOH;20−25分 95%MeOH;25−26分 95−50%MeOH;26−28分 50%MeOH)によって精製した。
【0192】
実施例6:インビトロ効力アッセイ
Le Fur et al(Life Sci.1983;USA 33:449−57)の方法を改変した方法を用いて、PBRに対する親和性のスクリーニングを行った。試験した化合物は、非放射性造影剤1及び先行技術化合物FE−PBR28の非放射性バージョンであった。
【0193】
(1%DMSOを含む50mMトリス−HCl、pH7.4、10mM MgCl2に溶解した)各試験化合物を、ウィスター系ラットの心臓PBRとの結合に関して0.3nM[3H]−PK−11195と競合させた。反応は50mMトリス−HCl、pH7.4、10mM MgCl2中で25℃で15分間実施した。
【0194】
各試験化合物のスクリーニングは、推定Kiの周辺の300倍の濃度範囲にわたる6種の濃度で行った。非放射性造影剤1に関するKiは4.24nMであることが判明し、FE−PBR28に関するKiは0.056nMであることが判明した。
【0195】
【表1】

【0196】
実施例7:インビボ体内分布方法
インビボ造影剤1及び(Wilson et al,Nuc.Med.Biol.2008;35:305−14に従って製造した)先行技術化合物[18F]−FE−PBR28をインビボ体内分布モデルで試験し、それぞれの体内分布を比較した。
【0197】
雄ウィスター系ラット成体(200〜300g)に、側尾静脈を通して1〜3MBqの各インビボ造影剤を注射した。注射から2分後、10分後、30分後又は60分後(n=3)に、ラットを安楽死させ、γ線カウンター上での放射能測定に組織又は体液の試料を採取した。図1は得られたデータを示している。さらに詳しく説明すると、造影剤の注射後、注射から2分後における嗅球(OB)中への取込み量、並びに注射から30分後におけるOB取込み量と線条体取込み量との比を調べた。これらの特定測定値を採用した理由は、OBがラット脳の他の領域に比べて高いレベルのPBRを発現することが知られているからである(“Handbook of Substance Abuse”by Tarter,Ammerman and Ott;Springer 1998:398−99を参照されたい)。
【0198】
以下表1では、造影剤1が[18F]−FE−PBR28と比較されている。
【0199】
【表2】

【技術分野】
【0001】
本発明は、インビボイメージング、特に末梢ベンゾジアゼピンレセプター(PBR)のインビボイメージングに関する。ナノモル親和性をもってPBRに結合し、投与後には脳内への良好な取込みを示し、PBRへの良好な選択的結合を示すアリールオキシアニリド系インビボ造影剤が提供される。本発明はまた、本発明のインビボ造影剤の合成に有用な前駆体化合物、並びに前記前駆体化合物の使用を含む前記インビボ造影剤の合成方法及び前記方法を実施するためのキットも提供する。インビボ造影剤の自動化合成のためのカセットも提供される。加えて本発明は、本発明のインビボ造影剤を含む放射性医薬組成物並びに前記インビボ造影剤の使用方法も提供する。
【背景技術】
【0002】
末梢ベンゾジアゼピンレセプター(PBR)は、主として末梢組織及びグリア細胞に局在することが知られているが、その生理学的機能はまだ明確に解明されていない。細胞レベル以下では、PBRはミトコンドリア外膜上に局在することが知られていて、これはミトコンドリア機能の調節及び免疫系で役割を果たす可能性を表している。さらに、PBRが細胞増殖、ステロイド生成、カルシウム流れ及び細胞呼吸に関係することも仮定されてきた。PBRは、急性及び慢性ストレス、不安、うつ病、パーキンソン病、アルツハイマー病、脳損傷、癌(Gavish et al,Pharm.Rev.1999;51:629)、ハンチントン病(Messmer and Reynolds,Neurosci.Lett.1998;241:53−6)、喘息(Pelaia et al,Gen.Pharmacol.1997;28(4):495−8)、慢性関節リウマチ(Bribes et al,Eur.J.Pharmacol.2002;452(1):111−22)、アテローム性動脈硬化症(Davies et al,J.Nucl.Med.2004;45:1898−1907)及び多発性硬化症(Banati et al,2000 Brain;123:2321)を始めとする各種の状態と関連していた。PBRはニューロパシー性疼痛にも関連する可能性があり、Tsuda et alはニューロパシー性疼痛をもった被験者で小グリア細胞の活性化を観察している(2005 TINS 28(2)pp101−7)。
【0003】
PBR選択性リガンド(R)−[11C]−PK11195を用いる陽電子放出断層撮影(PET)イメージングは、中枢神経系(CNS)炎症の包括的指標を提供する。(R)−[11C]−PK11195の使用の成功にもかかわらず、それには制約がある。それは、高いタンパク質結合性及び低特異的乃至非特異的結合性を有することが知られている。その放射性標識代謝産物の役割は知られておらず、結合の定量化には複雑なモデル化が要求される。PBRに対して高い親和性及び選択性を有することでCNSにおけるPBR測定の向上を可能にする化合物を得るための努力が行われてきた。
【0004】
PBRに対する高い親和性並びに中枢ベンゾジアゼピンレセプター(CBR)に比べてPBRに対する高い選択性を有するアリールオキシアニリン誘導体が提唱された(Chaki et al,1999 Eur.J.Pharmacol.;371:197−204)。[11C]−DAA1106及び[18F]−FE−DAA1106は、これらのアリールオキシアニリン化合物に基づくPET放射性リガンドである。これらのPET放射性リガンドは米国特許第6870069号に教示され、ヒトで研究されてきた(Ikomo et al,J.Cereb.Blood Flow Metab.2007;27:173−84及びFujimura et al,J.Nuc.Med.2006;47:43−50)。別の放射性フッ素化DAA1106誘導体は国際公開第2007/074383号に教示されている。別の11C標識DAA1106誘導体は国際公開第2007/036785号に教示されている。放射性ヨウ素化DAA1106は、欧州特許出願公開第1854781号に記載され、またZhang et al(2007 J.Med.Chem.;50:848−55)によって記載されている。[11C]−DAA1106、[18F]−FE−DAA1106及び[123I]−DAA1106の化学構造は以下の通りである。
【0005】
【化1】

【0006】
しかし、これらの化合物の動力学的性質はインビボイメージングには理想的でないため、定量的研究に対するその適用は制限されることがある。
【0007】
DAA1106系列の放射性リガンドにさらなる改良を加えようという努力の中で、Briard et al(J.Med.Chem.2008;51:17−30)は別のアリールオキシアニリン誘導体PBR28を報告した。PBR28及びPBR28から導かれるPET放射性リガンドの構造は以下の通りである。
【0008】
【化2】

【0009】
([18F]−FE−PBR28としても知られる)[18F]−FEPPAは、感度及び特異性は測定されなかったものの、インビトロでPBRに対するナノモル未満の親和性を有することが判明し、また静脈内注射後に天然ラットの脳内への良好な取込みを示した(Wilson et al,Nuc.Med.Biol.2008;35:305−14)。[11C]−PBR28をサルで試験し、PETを用いてその脳内動力学を評価した。Briard et al(上記)により、[11C]−PBR28は、(R)−[11C]−PK11195に比べて高い脳内取込み、PBR発現組織に対する良好な特異的結合、及びインビボイメージングに一段と適した動力学的性質を有することが報告された。本発明者らは、PBR28が(R)−[11C]−PK11195よりインビボPBR造影剤として良好な性質を示すものの、PBR発現組織に対するその特異性は理想的でないことを見出した。さらに本発明者らは、PBR28のインビボクリアランス特性も理想的でないことを見出した。したがって、さらに改良されたPBR特異的インビボ造影剤を得る余地が存在している。
【0010】
本願の優先日後に公開された国際公開第2010/015340号及び同第2010/015387号は、PBR28と同じ環上であるが、その環中の異なる位置に窒素ヘテロ原子を有するさらに別の部類のアリールオキシアニリン誘導体を開示している。一般的には、国際公開第2010/015340号及び同第2010/015387号は次の式Iの化合物を開示している。
【0011】
【化3】

【0012】
式中、
R1及びR2は各々独立かつ個別に、(G3)アリール、置換(G3)アリール、(G3−(C1〜C8)アルキル)アリール、(G3−(C1〜C8)アルコキシ)アリール、(G3−(C2〜C8)アルキニル)アリール、(G3−(C2〜C8)アルケニル)アリール、置換(G3−(C1〜C8)アルキル)アリール、置換(G3−(C1〜C8)アルコキシ)アリール、置換(G3−(C2〜C8)アルキニル)アリール及び置換(G3−(C2〜C8)アルケニル)アリールからなる群から選択され、
G1、G2及びG3は各々独立かつ個別に、式Iの化合物が正確に1つのLを含むことを条件として、水素及びLからなる群から選択され、
LはR3、[18F]−フルオロ及び[19F]−フルオロからなる群から選択され、
R3は脱離基であり、
nは0〜6の整数である。
【0013】
国際公開第2010/015340号及び同第2010/015387号には、(「2d」及び「5d」と命名された)2種の特定化合物が以前のアリールオキシアニリン誘導体に比べて脳内PBRのインビボイメージングのための改善された性質を有することを示すデータが記載されている。これら2種の化合物の化学式を以下に示す。
【0014】
【化4】

【先行技術文献】
【特許文献】
【0015】
特開2000−001476号公報
【発明の概要】
【0016】
本発明は、インビボイメージングに適した新規な放射性標識アリールオキシアニリン誘導体を提供する。本発明のインビボ造影剤は、中枢神経系(CNS)における末梢ベンゾジアゼピンレセプター(PBR)のインビボイメージングのための良好な性質を有する。本発明のインビボ造影剤は、被験体への投与後における良好な脳内取込み及びインビボ動力学と共に、PBRに対する良好な結合性を示す。
【図面の簡単な説明】
【0017】
【図1】図1は、[18F]−FE−PBR28の脳内分布(上部)を造影剤1の脳内分布(下部)と比較して示している。
【発明を実施するための形態】
【0018】
造影剤
一態様では、本発明は次の式Iのインビボ造影剤或いはその塩又は溶媒和物を提供する。
【0019】
【化5】

【0020】
式中、
R1はメチル及びC1-3フルオロアルキルから選択され、
R2は水素、ハロゲン、C1-3アルコキシ及びC1-3フルオロアルコキシから選択され、
R3は水素、ハロゲン及びC1-3アルコキシから選択され、
A1はCH又はNであり、
A2及びA4-7の1つ又は2つがNであり、A2及びA4-7の残りがCHであり、
A3はCH又はCH−O−R4(式中、R4はH、C1-3アルキル又はC1-3ハロアルキルである。)であるか、或いは別法としてA2及びA4-7の1つがNでありかつA2及びA4-7の残りがCHである場合にA3はNであってよく、
式Iはインビボイメージングに適した放射性同位体である原子を含む。
【0021】
本発明に関連する「インビボ造影剤」とは、インビボイメージングに適した放射性標識化合物をいう。本明細書で使用する「インビボイメージング」という用語は、被験体の内部構造の全部又は一部の画像を非侵襲的に生成する技術をいう。かかるインビボイメージング方法の例は、単光子放出コンピューター断層撮影法(SPECT)及び陽電子放出断層撮影法(PET)である。
【0022】
本発明に係る好適な塩には、(i)鉱酸(例えば、塩酸、臭化水素酸、リン酸、メタリン酸、硝酸及び硫酸)から導かれるもの並びに有機酸(例えば、酒石酸、トリフルオロ酢酸、クエン酸、リンゴ酸、乳酸、フマル酸、安息香酸、グリコール酸、グルコン酸、コハク酸、メタンスルホン酸及びp−トルエンスルホン酸)から導かれるもののような生理学的に許容される酸付加塩、並びに(ii)アンモニウム塩、アルカリ金属塩(例えば、ナトリウム塩及びカリウム塩)、アルカリ土類金属塩(例えば、カルシウム塩及びマグネシウム塩)、有機塩基(例えば、トリエタノールアミン、N−メチル−D−グルカミン、ピペリジン、ピリジン、ピペラジン及びモルホリン)との塩、及びアミノ酸(例えば、アルギニン及びリシン)との塩のような生理学的に許容される塩基塩がある。
【0023】
本発明に係る好適な溶媒和物には、エタノール、水、食塩水、生理的緩衝液及びグリコールと共に生成されるものがある。
【0024】
特記しない限り、単独で又は組み合わせて使用される「アルキル」という用語は、好ましくは1〜3の炭素原子を含む直鎖又は枝分れアルキル基を意味する。かかる基の例には、メチル、エチル及びプロピルがある。
【0025】
特記しない限り、単独で又は組み合わせて使用される「アルコキシ」という用語は式−O−アルキルのアルキルエーテル基を意味し、ここでアルキルという用語は上記に定義した通りである。好適なアルキルエーテル基の例には、メトキシ、エトキシ及びプロポキシがある。
【0026】
「ハロゲン」又は「ハロ」という用語は、フッ素、塩素、臭素及びヨウ素から選択される置換基を意味する。「ハロアルキル」及び「ハロアルコキシ」とは、それぞれ、上記に定義したアルキル基及びアルコキシ基が1以上のハロゲンで置換されたもの、好ましくは末端で置換されたもの(即ち、−アルキル−ハロゲン及び−アルコキシ−ハロゲン)である。
【0027】
「インビボイメージングに適した放射性同位体である原子を含む」という用語は、上記に定義した式Iにおいて、1つの原子の同位体形態がインビボイメージングに適した放射性同位体であることを意味する。インビボイメージングに適するには、放射性同位体は前記被験体への投与後に外部で検出可能である。本発明の好ましい放射性同位体は、γ線放出型放射性ハロゲン及び陽電子放出型放射性非金属である。本発明で使用するのに適したγ線放出型放射性ハロゲンの例は、123I、131I及び77Brである。好ましいγ線放出型放射性ハロゲンは123Iである。本発明で使用するのに適した陽電子放出型放射性非金属の例は、11C、13N、18F及び124Iである。好ましい陽電子放出型放射性非金属は11C及び18F、特に18Fである。
【0028】
好ましくは、R1がC1-3フルオロアルキルであり、R2が水素であるか、或いはR1がメチルであり、R2がC1-3フルオロアルコキシである。
【0029】
R3は、好ましくは水素である。
【0030】
式Iのインビボ造影剤の好ましい一実施形態では、A1、A2及びA4-7の2つがNであり、A1、A2及びA4-7の残りがCHである。
【0031】
式Iのインビボ造影剤の別の好ましい実施形態では、A2及びA4〜A6の1つがNであり、A1がCHであり、A7がCHである。
【0032】
式Iのインビボ造影剤のさらに別の好ましい実施形態では、A7がNであり、A1-6がCHであり、R3が水素である。
【0033】
本発明におけるインビボイメージングに適した好ましい放射性同位体は18Fである。最も好ましくは、R1が[18F]−フルオロアルキルであるか、或いはR2が[18F]−フルオロアルコキシである。かかるインビボ造影剤の例は、以下の造影剤1〜19である。
【0034】
【化6】

【0035】
本発明の好ましい18Fインビボ造影剤はインビボ造影剤1、18及び19であり、最も好ましくはインビボ造影剤1である。
【0036】
(上記に示した)非放射性インビボ造影剤1の効力(実施例6)を測定し、その異性体であるN−[3−(2−フルオロエトキシ)ベンジル]−N−(4−フェノキシ−ピリジン−3−イル)アセトアミド(即ち、先行技術化合物[18F]−FE−PBR28の非放射性バージョン)と比較した。動物体内分布モデル(実施例7)では、インビボ造影剤1を試験し、その体内分布を(Wilson et al,Nuc.Med.Biol.2008;35:305−14に従って製造した)先行技術化合物[18F]−FE−PBR28の体内分布と比較した。
【0037】
[18F]−FE−PBR28の異性体であるにもかかわらず、造影剤1のPBRに関して測定された効力は2桁低いことが判明した。さらに、造影剤1に関しては、[18F]−FE−PBR28に比べて脳内のPBR発現組織に対する向上した選択性が認められた。本発明者らは、[18F]−FE−PBR28の(30分後に対する2分後の)全脳クリアランス比が造影剤1の3.46に比べて1.97である子とを認めたが、これはPBRレセプターに結合しない造影剤1が脳から一層急速に排出されることを示している。これにより、造影剤1に関して認められる信号/バックグラウンド比が[18F]−FE−PBR28に比べて高いのはそのためであるという仮説が立てられる。
【0038】
図1は、注射後60分までにおける各化合物の脳内分布を示している。これらのグラフは、注射後30分では、インビボ造影剤1が[18F]−FE−PBR28に比べて脳の残部より嗅球(OB)中に多く保持されることを示しており、これはインビボ造影剤1が先に例示したインビボ造影剤[18F]−FE−PBR28よりPBRに対して向上した選択性を有することを実証している。さらに、これらのグラフは、造影剤1のクリアランスプロファイルが[18F]−FE−PBR28に比べてインビボイメージングに一層有利であることを示している。
【0039】
製造方法
さらに別の態様では、本発明は、上述した本発明のインビボ造影剤の製造方法であって、前記放射性同位体の適当な供給源を次の式IIの前駆体化合物と反応させる段階を含んでなる方法を提供する。
【0040】
【化7】

【0041】
式中、
R11-13の1つは前駆体基を含み、R11-13の残りはそれぞれ式IのR1-3に関して定義した通りであって、任意には保護基を含み、
A11-17はそれぞれ式IのA1-7に関して定義した通りであって、任意には保護基を含み、
ただしA17がNであり、かつA11、A12及びA14-16がすべてCHである場合には、A13がCHであり、R13が水素であることを条件とする。
【0042】
「前駆体化合物」は、インビボイメージングに適した前記放射性同位体の好都合な化学形態との化学反応が部位特異的に起こり、最小数の段階(理想的にはただ1つの段階)で反応を実施でき、かつ格別の精製の必要なしに(理想的にはいかなる追加の精製も必要なしに)所望のインビボ造影剤が得られるように設計された、放射性標識化合物の非放射性誘導体からなる。かかる前駆体化合物は合成品であり、良好な化学純度で簡便に得ることができる。前駆体化合物は、任意には前駆体化合物のある種の官能基に関して保護基を含むことができる。前駆体化合物は、キット中又は自動化合成装置と共に使用するのに適したカセット中に溶液状態で供給するか、或いは固体担体に結合した状態で供給することができる。キット及びカセットは本発明の追加の態様をなし、以下に一層詳しく論議される。
【0043】
「保護基」という用語は、望ましくない化学反応を阻止又は抑制するが、分子の残部を変質させない十分に温和な条件下で問題の官能基から脱離させ得るのに十分な反応性を有するように設計された基を意味する。脱保護後には所望のインビボ造影剤が得られる。保護基は当業者にとって公知であり、‘Protective Groups in Organic Synthesis’,Theorodora W.Greene and Peter G.M.Wuts(Third Edition,John Wiley & Sons,1999)に記載されている。
【0044】
「前記放射性同位体の適当な供給源」という用語は、放射性同位体が前駆体化合物に共有結合するようにして前駆体化合物の置換基と反応し得る化学形態の放射性同位体を意味する。
【0045】
概して言えば、前駆体化合物を前記放射性同位体の適当な供給源と「反応させる」段階は、できるだけ高い放射化学収率(RCY)で所望のインビボ造影剤を生成するのに適した反応条件下で2種の反応体を合わせることを含んでいる。若干の一層詳細な経路を以下の実験セクションに示す。
【0046】
次に、本発明の各種インビボ造影剤を得るための一般的方法を記載する。当業者であれば、本発明の技術的範囲全体にわたるインビボ造影剤を得るため、格別の実験を行わなくても以下に記載される教示内容を適用することができよう。
【0047】
Okubu et al(2004 Bioorg.Med.Chem.;12:423−38)は、非放射性アリールオキシアニリド化合物を得るための方法を記載している。本発明のインビボ造影剤に類似したインビボ造影剤を得るための合成スキームは、Briard et al(J.Med.Chem.2008;51;17−31)、Wilson et al(Nuc.Med.Biol.2008;35;305−14)、及びZhang et al(J.Med.Chem.2007;50:848−55)によって記載されている。これらの先行技術方法は、本発明のインビボ造影剤を得るのに適した前駆体化合物を得るために容易に適合させることができる。
【0048】
以下のスキーム1は、本発明のインビボ造影剤を製造するのに適した前駆体化合物を得るための一般反応スキームである。
【0049】
【化8】

【0050】
R22はヒドロキシル、アルコキシ又はハロアルコキシであり、LGはクロリド又はブロミドのような脱離基であり、Zは(CH2)x−Y(式中、xは1〜3であり、Yは水素又はインビボイメージングに適した放射性同位体の適当な供給源によって置換され得る基である。)であり、A21-27はそれぞれA1-7に関して本明細書で定義した通りである。
【0051】
求核芳香族置換が起こる塩基性条件下でo−クロロニトロ芳香族化合物(a)をヒドロキシル芳香族化合物(b)と反応させる。水素化によってニトロ基を還元すれば、対応するアニリン(d)が得られる。芳香族アルデヒド(e)による還元性アルキル化でベンジルアミン(f)が得られる。アセチル化によってアセトキシアミド(g)が得られる。標識に使用すべき放射性同位体に応じ、(g)自体が前駆体化合物であるか、或いは以下に一層詳しく論議されるようにして前駆体化合物に転化させることができる。
【0052】
インビボ造影剤の放射性同位体が18Fである場合、放射性フッ素原子はフルオロアルキル基又はフルオロアルコキシ基の一部をなすことができる。これは、アルキルフルオリドがインビボでの代謝に耐えるからである。別法として、放射性フッ素原子は直接共有結合によって芳香環に結合することができる。
【0053】
放射性フッ素化は、18F−フッ化物と良好な脱離基を有する前駆体化合物(例えば、アルキルブロミド、アルキルメシレート又はアルキルトシレート)中の適当な化学基との反応を用いる直接標識によって実施できる。18Fはまた、[18F]−フルオロアルキルブロミド、[18F]−フルオロアルキルメシレート又は[18F]−フルオロアルキルトシレートでヒドロキシル基をO−アルキル化することによっても導入できる。
【0054】
アリール系に関しては、アリールジアゾニウム塩、アリールニトロ化合物又はアリール第四級アンモニウム塩からの18F−フッ化物求核置換が、アリール−18F誘導体への好適な経路である。
【0055】
別法として、18Fによる標識は、前駆体化合物からの脱離基の求核置換によって達成できる。好適な脱離基には、クロリド、ブロミド、ヨージド、トシレート、メシレート及びトリフレートがある。かかる誘導体は、本発明のインビボ造影化合物を製造するための前駆体化合物である。
【0056】
別の方策は、上記に定義したような好適な脱離基を、前駆体化合物上に存在するアルキルアミド基上に設けることである。このようにすれば、通常は核反応18O(p,n)18Fから水溶液として得られ、次いで陽性対イオンの添加及びそれに続く水の除去によって反応性にされる[18F]−フッ化物イオン(18F-)の適当な供給源との反応によって前駆体化合物を一段階で標識できる。この方法には、前駆体化合物は、放射性フッ素化が化合物上の特定の部位で起こるように選択的に化学保護されるのが普通である。好適な保護基は既に前述したものである。
【0057】
放射性同位体が18Fである場合、前駆体化合物は以下のいずれかであることが好ましい。
(i)求核置換のためのアルキルハライド又はアルキルスルホネート(例えば、アルキルブロミド、アルキルメシレート又はアルキルトシレート)、或いは
(ii)(例えば、18F(CH2)3OMs又は18F(CH2)3OBrでヒドロキシル基をO−アルキル化することによる18Fの導入のための)ヒドロキシル。
【0058】
(上記スキーム1の続きである)以下のスキーム2では、Zは−(CH2)−ブロミド又は−(CH2)−クロリドである。これを塩基性条件下で[18F]−フッ化物イオンで処理すれば、標識18F−フルオロアセチル化合物(h)(即ち、R1が18Fからなる式Iのインビボ造影剤)が得られる。
【0059】
【化9】

【0060】
(上記スキーム1の(f)からの続きである)以下のスキーム3では、(f)のR22はヒドロキシルであり、アセチル−LGによる(f)のアセチル化でアセトキシアミド(i)が得られる。アセテートの加水分解でアルコール(j)が得られ、これを18F−フルオロエチルトシレート及び水素化ナトリウムでアルキル化することで18F−フルオロエトキシ化合物(k)(即ち、R2が18Fからなる式Iのインビボ造影剤)が得られる。
【0061】
【化10】

【0062】
造影剤1もこの経路で得ることができる。
【0063】
【化11】

【0064】
スキーム3についてさらに説明すると、同じインビボ造影剤(k)は、脱離基を含む前駆体化合物を[18F]−フッ化物で直接標識することでも得ることができる。脱離基がトシレートであるこのような直接標識前駆体は、(j)を特定のアルキルグリコールジトシレートと反応させて(j1)とすることで得られる。次に、(j1)を[18F]−フッ化物で直接標識することで18F−フルオロエトキシ化合物(k)が得られる。造影剤1もこの経路で得ることができる。
【0065】
【化12】

【0066】
放射性同位体が放射性ヨウ素である本発明のインビボ造影剤を得るためには、好ましい前駆体化合物は、求電子又は求核ヨウ素化を受ける誘導体或いは標識アルデヒド又はケトンとの縮合を受ける誘導体を含むものである。第1のカテゴリーの例は以下の(a)及び(b)である。
(a)トリアルキルスタンナン(例えば、トリメチルスタンニル又はトリブチルスタンニル)、トリアルキルシラン(例えば、トリメチルシリル)或いは有機ホウ素化合物(例えば、ボロネートエステル又はオルガノトリフルオロボレート)のような有機金属誘導体。
(b)求電子ヨウ素化に向けて活性化された芳香環(例えば、フェノール類)及び求核ヨウ素化に向けて活性化された芳香環(例えば、アリールヨードニウム塩、アリールジアゾニウム塩、アリールトリアルキルアンモニウム塩又はニトロアリール誘導体)。
【0067】
放射性ヨウ素化には、前駆体化合物は好ましくは、(放射性ヨウ素交換を可能にするための)アリールヨージド又はブロミド、活性化前駆体化合物アリール環(例えば、フェノール基)、有機金属前駆体化合物(例えば、トリアルキルスズ、トリアルキルシリル又は有機ホウ素化合物)、或いはトリアゼンのような有機前駆体化合物又は求核置換のための良好な脱離基(例えば、ヨードニウム塩)からなる。放射性ヨウ素を有機分子中に導入するための前駆体化合物及び方法は、Bolton(J.Lab.Comp.Radiopharm.2002;45:485−528)によって記載されている。好適なボロネートエステル有機ホウ素化合物及びその製法は、Kabalka et al(Nucl.Med.Biol.2002;29:841−843及び2003;30:369−373)によって記載されている。好適なオルガノトリフルオロボレート及びその製法は、Kabalka et al(Nucl.Med.Biol.2004;31:935−938)によって記載されている。放射性ヨウ素化用の好ましい前駆体化合物は有機金属前駆体化合物からなり、最も好ましくはトリアルキルスズからなる。
【0068】
放射性ヨウ素を結合できるアリール基の例を以下に示す。
【0069】
【化13】

【0070】
これらの基はいずれも、芳香環上への容易な放射性ヨウ素置換を可能にする置換基を含んでいる。放射性ヨウ素を含む別の置換基は、例えば次式のように、放射性ハロゲン交換による直接ヨウ素化で合成することができる。
【0071】
【化14】

【0072】
例えば、本発明の放射性ヨウ素化インビボ造影剤を得るのに適した前駆体化合物では、式IIIのR21又はR23は、それが結合した芳香族基と共に、
(i)有機金属誘導体又は有機ホウ素化合物で置換された芳香環を形成するか、
(ii)求電子放射性ヨウ素化に向けて活性化された芳香環(例えば、フェノール類)を形成するか、或いは
(iii)求核放射性ヨウ素化に向けて活性化された芳香環(例えば、アリールヨードニウム塩、アリールジアゾニウム塩、アリールトリアルキルアンモニウム塩又はニトロアリール誘導体)を形成する。
【0073】
これらの前駆体化合物は、放射性ヨウ素置換により、本発明の放射性ヨウ素化インビボ造影剤に容易に転化される。
【0074】
本発明のインビボ造影剤に類似した構造を有する放射性ヨウ素化化合物は、Zhang et al(2007 J.Med.Chem.;50:848−55)によって記載されている。これらの化合物は、トリブチルスタンナン前駆体化合物の放射性ヨウ素化によってベンゼン環上に放射性ヨウ素を導入することで得られた。本発明の放射性ヨウ素化インビボ造影剤を得るためには、(上記スキーム1の続きである)以下のスキーム4(式中、(g)のR22はブロミドである。)に例示されるように類似の方法が使用できる。
【0075】
【化15】

【0076】
R2又はR3が放射性臭素である式Iの化合物は、式Iの放射性ヨウ素化化合物に関して上記に記載した前駆体化合物の放射性臭素化によって得ることができる。Kabalka and Varmaは、放射性臭素化化合物を含む放射性ハロゲン化化合物を合成するための様々な方法を総説している(Tetrahedron 1989;45(21):6601−21)。
【0077】
本発明の11C標識インビボ造影剤は、インビボ造影剤のデスメチル化バージョンである前駆体化合物を11C−メチルヨージドと反応させることで直截的に合成できる。11C標識アリールオキシアニリド化合物を得るためのかかる方法は、Briard et al(2008 J.Med.Chem.;51;17−30)によって記載されている。Briardによって記載された方法は、異なる出発原料を使用しながら、本発明の11C標識インビボ造影剤を得るために容易に適合させることができる。(上記スキーム1の続きである)以下のスキーム5(式中、(g)のR22はヒドロキシルである。)は、放射性同位体が11Cである本発明のインビボ造影剤を得るため、Briard et alの教示内容をいかにして適合させ得るかを例示している。
【0078】
【化16】

【0079】
また、所望のインビボ造影剤の特定の炭化水素のグリニャール試薬を[11C]−CO2と反応させて、前駆体化合物中のアミン基と反応して所望の11C標識インビボ造影剤を与える11C試薬を得ることによって11Cを組み込むことも可能である。グリニャール試薬は、所望の放射性標識部位にハロゲン化マグネシウム前駆体基を含んでいる。
【0080】
11Cの半減期は20.4分にすぎないので、11C標識中間体は高い比放射能を有すること、したがってできるだけ速い反応プロセスを用いてそれを製造することが重要である。かかる11C標識技術に関する徹底的な総説を、Antoni et al,“Aspects on the Synthesis of 11C−Labelled Compounds”in Handbook of Radiopharmaceuticals,Ed.M.J.Welch and C.S.Redvanly(2003,John Wiley and Sons)に見出すことができる。
【0081】
本発明の前駆体化合物は、理想的には無菌で非発熱性の形態で供給される。したがって前駆体化合物は、インビボ造影剤を哺乳動物への投与に適した生体適合性キャリヤーと共に含んでなる医薬組成物の製造に使用できる。前駆体化合物はまた、かかる医薬組成物を製造するためのキット中に一成分として含めるためにも適している。
【0082】
好ましい実施形態では、前駆体化合物はキット又は自動化合成装置で使用するように設計されたカセットの一部として溶液状態で供給される。これらの態様は、本発明の追加の態様に関連して以下に一層詳しく論議される。
【0083】
別の好ましい実施形態では、前駆体化合物は固相に結合されている。前駆体化合物は、好ましくは固体担体マトリックスに共有結合した状態で供給される。このようにすれば、所望の生成物は溶液状態で生成される一方、出発原料及び不純物は固相に結合したままに保たれる。かかる系の例としては、18F−フッ化物による固相求電子フッ素化用の前駆体化合物が国際公開第03/002489号に記載されており、18F−フッ化物による固相求核フッ素化用の前駆体化合物が国際公開第03/002157号に記載されている。
【0084】
本発明の製造方法で使用するための好ましい前駆体化合物の多くは、アルキルブロミド、アルキルメシレート、アルキルトシレート、トリアルキルスタンナン、トリアルキルシラン及び有機ホウ素化合物から選択される前駆体基を含んでいる。これら多くの好ましい前駆体化合物自体は、本発明の独立した態様をなしている。
【0085】
放射性医薬組成物
さらに別の態様では、本発明は「放射性医薬組成物」を提供し、これは本発明のインビボ造影剤を哺乳動物への投与に適した形態の生体適合性キャリヤーと共に含んでいる。
【0086】
「生体適合性キャリヤー」は、放射性医薬組成物が生理学的に認容され得るようにして(即ち、毒性又は過度の不快感なしに哺乳動物体に投与できるようにして)インビボ造影剤を懸濁又は溶解するための流体(特に液体)である。生体適合性キャリヤーは、好適には、無菌のパイロジェンフリー注射用水、(有利には注射用の最終生成物が等張性又は非低張性になるように平衡させ得る)食塩水のような水溶液、或いは1種以上の張度調整物質(例えば、血漿陽イオンと生体適合性対イオンとの塩)、糖(例えば、グルコース又はスクロース)、糖アルコール(例えば、ソルビトール又はマンニトール)、グリコール(例えば、グリセロール)又は他の非イオン性ポリオール物質(例えば、ポリエチレングリコール、プロピレングリコールなど)の水溶液のような注射可能なキャリヤー液体である。生体適合性キャリヤーはまた、エタノールのような生体適合性有機溶媒を含んでいてもよい。かかる有機溶媒は、親油性の高い化合物又は配合物を可溶化するために有用である。好ましくは、生体適合性キャリヤーはパイロジェンフリー注射用水、等張食塩水又はエタノール水溶液である。静脈内注射用生体適合性キャリヤーのpHは好適には4.0〜10.5の範囲内にある。
【0087】
本発明の放射性医薬組成物中に含まれる場合におけるインビボ造影剤の好適な実施形態及び好ましい実施形態は、本明細書で既に記載した通りである。
【0088】
かかる放射性医薬組成物は非経口的に(即ち、注射によって)投与でき、最も好ましくは水溶液である。かかる組成物は、緩衝剤、薬学的に許容される可溶化剤(例えば、シクロデキストリン或いはPluronic、Tween又はリン脂質のような界面活性剤)、薬学的に許容される安定剤又は酸化防止剤(例えば、アスコルビン酸、ゲンチジン酸又はp−アミノ安息香酸)のような追加成分を任意に含み得る。本発明のインビボ造影剤が放射性医薬組成物として提供される場合、前記インビボ造影剤の製造方法はさらに、放射性医薬組成物を得るために必要な段階(例えば、有機溶媒の除去、生体適合性緩衝剤及び任意の追加成分の添加)を含むことができる。非経口的投与には、放射性医薬組成物が無菌性かつ無発熱原性であることを保証するための手段を講じることも必要である。
【0089】
キット及びカセット
好ましい実施形態では、本発明のインビボ造影剤の製造方法は、キット又は自動化合成装置に挿入し得るカセットを用いて実施できる。これらのキット及びカセットはまた、本発明の追加の態様をなしており、本明細書で定義される本発明の放射性医薬組成物の製造のため特に好都合である。
【0090】
本発明のキットは、本発明の前駆体化合物を密封容器内に含んでいる。「密封容器」は、好ましくは、注射器による溶液の追加及び抜取りを許しながら、無菌保全性及び/又は放射能安全性の維持、さらに任意には不活性ヘッドスペースガス(例えば、窒素又はアルゴン)の維持を可能にする。好ましい密封容器は、気密クロージャーを(通例はアルミニウムからなる)オーバーシールと共にクリンプ加工した隔壁密封バイアルである。かかる密封容器は、例えばヘッドスペースガスの変更又は溶液のガス抜きに所望される場合、クロージャーが真空に耐え得るという追加の利点を有している。
【0091】
本発明のキット中に使用する場合、前駆体化合物の好適な実施形態及び好ましい実施形態は、本明細書で既に記載した通りである。
【0092】
キット中に使用するための前駆体化合物を無菌製造条件下で使用すれば、所望の無菌で非発熱性の材料を得ることができる。別法として、前駆体化合物を非無菌条件下で使用し、次いで例えばγ線照射、オートクレーブ処理、乾熱又は(例えば、エチレンオキシドによる)化学処理を用いる終末滅菌を施すこともできる。好ましくは、前駆体化合物は無菌で非発熱性の形態で供給される。最も好ましくは、無菌で非発熱性の前駆体化合物は上述したような密封容器に入れて供給される。
【0093】
好ましくは、試験間での汚染の可能性を最小限に抑えると共に無菌性及び品質保証を確実にするため、キットのすべての構成要素が使い捨てである。
【0094】
別の態様では、本発明は、本発明のインビボ造影剤を合成するため適宜に改造された自動化合成装置に挿入し得るカセットを提供する。現在、特に[18F]−ラジオトレーサーはしばしば自動化放射合成装置で簡便に製造されている。かかる装置には、Tracerlab(商標)及びFASTlab(商標)(いずれもGE Healthcare社製)を始めとするいくつかの市販例が存在している。放射化学は、カセットを装置に取り付けることにより、自動化合成装置上で実施される。普通、カセットは流体通路、反応器、及び試薬バイアル並びに放射合成後の清掃段階で使用される任意の固相抽出カートリッジを受け入れるためのポートを含んでいる。
【0095】
本発明のインビボ造影剤の自動化合成のためのカセットは、
(i)本明細書で定義した前駆体化合物を含む容器、及び
(ii)本明細書で定義したような、インビボイメージングに適した放射性同位体の適当な供給源を用いて容器を溶出するための手段
を含んでいる。
【0096】
かかるカセットはさらに、
(iii)過剰の前記放射性同位体を除去するためのイオン交換カートリッジ、及び任意には
(iv)得られた放射性標識生成物を脱保護して本明細書で定義したインビボ造影剤を生成するためのカートリッジ
を含むことができる。
【0097】
自動化合成に必要な試薬、溶媒及び他の消耗品もまた、濃度、体積、送出時間などに関する最終ユーザーの要求条件を満たすように自動化合成装置を運転させるソフトウェアを保持したコンパクトディスクのようなデータ媒体と共に含めることができる。
【0098】
使用方法
さらに別の態様では、本発明は、
被験体におけるPBR発現の分布及び/又は程度を決定する際に使用するためのインビボイメージング方法であって、
(i)本明細書で定義したインビボ造影剤を前記被験体に投与する段階、
(ii)前記造影剤を前記被験体内のPBRに結合させる段階、
(iii)前記造影剤の放射性同位体から放出される信号をインビボイメージング技術によって検出する段階、
(iv)前記信号の位置及び/又は量を表す画像を生成する段階、並びに
(v)前記被験体におけるPBR発現の分布及び程度を決定する段階であって、前記発現は前記インビボ造影剤から放出される前記信号と直接に相関している段階
を含んでなるインビボイメージング方法を提供する。
【0099】
本発明のインビボイメージング方法に関しては、インビボ造影剤の好適な態様及び好ましい態様は本明細書で前記に定義した通りである。
【0100】
インビボ造影剤を「投与する」段階は、好ましくは非経口的に実施され、最も好ましくは静脈内に実施される。静脈内経路は、インビボ造影剤を被験体の身体全域に送達するため、したがって血液脳関門(BBB)を横切って前記被験体で発現されたPBRに接触させるための最も効率的な方法である。本発明のインビボ造影剤は、好ましくは本明細書で定義された本発明の医薬組成物として投与される。本発明のインビボイメージング方法はまた、本発明のインビボ造影剤を予め投与した被験体に関して実施される上記の段階(ii)〜(v)を含むものとしても理解できる。
【0101】
投与段階後かつ検出段階前に、インビボ造影剤をPBRに結合させる。例えば、被験体がインタクトな哺乳動物である場合、インビボ造影剤は哺乳動物の身体を通って動的に移動し、体内の様々な組織に接触する。ひとたびインビボ造影剤がPBRに接触すれば、特異的な相互作用が起こる結果、PBRをもった組織からのインビボ造影剤のクリアランスは、PBRをもたない組織又はPBRの少ない組織よりも長い時間がかかる。一定の時点に達すれば、PBRをもった組織に結合したインビボ造影剤とPBRをもたない組織又はPBRの少ない組織に結合したインビボ造影剤との比の結果として、PBRに特異的に結合したインビボ造影剤の検出が可能となる。理想的には、この比は2:1以上である。
【0102】
本発明の方法の「検出」段階は、放射性同位体から放出される信号を、前記信号に対して感受性を有する検出器によって検出することを含んでいる。この検出段階はまた、信号データの取得として理解することもできる。単光子放出断層撮影法(SPECT)及び陽電子放出断層撮影法(PET)が、本発明の方法で使用するための最も好適なインビボイメージング技術である。PETが、本発明の方法で使用するための好ましいインビボイメージング技術である。
【0103】
本発明の方法の「生成」段階は、取得された信号データに再構築アルゴリズムを適用してデータセットを得るコンピューターによって実施される。次いで、このデータセットを操作することで、前記放射性同位体から放出される信号の位置及び/又は量を示す画像が生成される。放出される信号はPBRの発現と直接に相関する結果、生成された画像を評価することで「決定」段階を行うことができる。
【0104】
本発明の「被験体」は、任意のヒト又は動物被験体であり得る。好ましくは、本発明の被験体は哺乳動物である。最も好ましくは、前記被験体はインタクトな哺乳動物生体である。特に好ましい実施形態では、本発明の被験体はヒトである。本インビボイメージング方法は、健常被験体或いはPBRの異常発現に関連する病的状態(「PBR状態」)を有することが知られ又は疑われる被験体でのPBRの検査に使用できる。好ましくは、前記方法はPBR状態を有することが知られ又は疑われる被験体のインビボイメージングに関し、したがって前記状態の診断方法の一部として有用である。インビボイメージングが役に立つかかるPBR状態の例には、神経炎症が存在するパーキンソン病、多発性硬化症、アルツハイマー病及びハンチントン病のような神経疾患がある。本発明の化合物によるイメージングが有用であり得る他のPBR状態には、ニューロパシー性疼痛、関節炎、喘息、アテローム性動脈硬化症、並びに結腸直腸癌及び乳癌のような悪性疾患がある。本発明のインビボ造影剤は、中枢神経系(CNS)におけるPBR発現のインビボイメージングに特に適している。
【0105】
別の実施形態では、本発明のインビボイメージング方法は前記被験体に関する治療計画の進行中に繰り返して実施することができ、前記計画はPBR状態と戦うための薬物の投与を含んでいる。例えば、本発明のインビボイメージング方法は、PBR状態と戦うための薬物による治療前、治療中及び治療後に実施できる。このようにすれば、前記治療の効果を経時的にモニターすることができる。この実施形態では、好ましくは、インビボイメージング技術はPETである。PETは優れた感度及び分解能を有する結果、病変部における比較的小さい変化でも経時的に観察でき、これは治療モニタリングに有利である。PETスキャナーは、日常的にピコモル範囲内の放射能濃度を測定している。現在、マイクロPETスキャナーは約1mmの空間分解能に接近しているが、臨床スキャナーは約4〜5mmである。
【0106】
さらに別の態様では、本発明はPBR状態の診断方法を提供する。本発明の診断方法は、上記に定義したインビボイメージング方法を、PBR発現の分布及び程度を特定の臨床像に帰因させる追加段階(vi)(即ち、演繹的な医学的決断段階)と共に含んでいる。
【0107】
別の態様では、本発明は、本明細書で定義した診断方法で使用するための、本明細書で定義したインビボ造影剤を提供する。
【0108】
さらに別の態様では、本発明は、本明細書で定義した診断方法で使用するための本明細書で定義した放射性医薬組成物の製造で使用するための、本明細書で定義したインビボ造影剤を提供する。
【実施例】
【0109】
以下、一連の非限定的な実施例によって本発明を例示する。
【0110】
実施例の簡単な説明
実施例1は、非放射性造影剤1の合成法を記載している。
【0111】
実施例2は、非放射性造影剤18の合成法を記載している。
【0112】
実施例3は、非放射性造影剤19の合成法を記載している。
【0113】
実施例4は、造影剤1用の直接標識前駆体化合物の合成法を記載している。
【0114】
実施例5は、造影剤1の合成法を記載している。
【0115】
実施例6は、PBRに対する造影剤の結合親和性を測定するために使用したインビトロ効力アッセイを記載している。
【0116】
実施例7は、静脈内投与後における造影剤の体内分布を測定するために使用した動物モデルを記載している。
【0117】
実施例中で使用される略語のリスト
℃ 摂氏度
aq 水性
DMF ジメチルホルムアミド
DMSO ジメチルスルホキシド
g グラム
h 時間
Ki 半最大阻害に必要な化合物の濃度
MBq メガベクレル
mg ミリグラム
min 分
ml ミリリットル
mM ミリモル濃度
mmol ミリモル
n 実験回数
NMR 核磁気共鳴
PBR 末梢ベンゾジアゼピンレセプター
RT 室温
TLC 薄層クロマトグラフィー
Tris トリス(ヒドロキシメチル)アミノメタン
UV 紫外。
【0118】
実施例1:N−[2−(2−フルオロエトキシ)ベンジル]−N−(2−フェノキシピリジン−3−イル)アセトアミド(非放射性造影剤1)の合成
1(i) 2−フェノキシ−3−ニトロピリジン
【0119】
【化17】

【0120】
DMF(50ml)中の2−クロロ−3−ニトロピリジン(10g、63mmol)をフェノール(8g、85mmol)及び炭酸カリウム(15.4g、1.76mmol)により70℃で2時間処理し、次いで室温で一晩撹拌した。次いで、反応物を高真空中で濃縮してガム質とし、酢酸エチル(50ml)及び水(150ml)の混合物で希釈し、撹拌した。酢酸エチル溶液を分離し、硫酸マグネシウム上で乾燥し、真空中で濃縮してガム質とした。水溶液をさらに50mlの酢酸エチルで再抽出し、酢酸エチル層を分離し、硫酸マグネシウム上で乾燥し、以前の酢酸エチル抽出液に添加し、真空中で濃縮して黄色の結晶質固体を得た。この固体をジエチルエーテル(20ml)で洗浄し、濾過により集めて2−フェノキシ−3−ニトロピリジンの無色結晶(10.49g、46.5mmol、73.8%)を得た。母液は廃棄した。
【0121】
1H NMR(CDCl3)7.18(3H,m,ArH)、7.3(1H,m,ArH)、7.45(2H,t,ArH)、8.34(2H,m,ArH)。
【0122】
13C NMR(CDCl3)118.3、121.6、125.7、129.6、134.5、135.4、151.7、152.5、155.8。
【0123】
1(ii) 2−フェノキシ−3−アミノピリジン
【0124】
【化18】

【0125】
メタノール(250ml)中の2−フェノキシ−3−ニトロピリジン(8.0g、37mmol)を木炭上のパラジウム(800mg)により水素雰囲気下で30℃で2時間処理した。急速な水素の吸収があり、検出可能な発熱の結果として温度が48℃に上昇した後、降下して元に戻った。次いで、反応物をセライトで濾過して無色溶液を得、これを高真空中で濃縮することで油状の2−フェノキシ−3−アミノピリジン(6.8g、36mmol、98%)を得たが、これは静置後に結晶化した。
【0126】
1H NMR(CDCl3)3.96(2H,brs,NH2)、6.86,(1H,m,ArH)、7.00(1H,m,ArH);7.16(3H,m,ArH)、7.36(2H,m,ArH)、7.39(1H,m,ArH)。
【0127】
13C NMR(CDCl3)119.4、120.6、122.0、124.2、129.5、131.9、135.6、151.6、154.2。
【0128】
1(iii) 2−[(2−フェノキシ−ピリド−3−イルアミノ)メチル]フェノール
【0129】
【化19】

【0130】
2−フェノキシ−3−アミノピリジン(6g、32.25mmol)をo−サリチルアルデヒド(2−ヒドロキシベンズアルデヒド)(6g、50mmol)及びトルエン(10ml)で処理し、激しく撹拌しながら窒素雰囲気下で90℃で1時間加熱した。溶液はは黄色で均質になった。次いで、反応物を0℃に冷却したところ凝固し、それをメタノール(100ml)で希釈したところ固体がすべて溶解した。これに水素化ホウ素ナトリウム(3.7g、97.5mmol)を少量ずつ20分かけて添加して処理した。この間に白色の沈殿が生じた。次いで、反応物を室温に放温し、さらに30分間撹拌した。ギ酸(3ml)を添加し、反応物をさらに18時間撹拌した。反応物から固体が晶出し、これを濾過によって集め(7.568g)、真空中で乾燥した。母液を真空中で約30mlに濃縮し、追加量の結晶を集めた(2.2568g)。固体をクロロホルムから再結晶して2−[(2−フェノキシ−ピリド−3−イルアミノ)メチル]フェノール(8.5g、29.1mmol、90%)を得た。
【0131】
1H NMR(CDCl3)1.69(1H,brs,NH);4.45(2H,s,CH2N);4.75,(1H,brs,OH)、6.8−7.7,(12H,m,ArH)。
【0132】
13C NMR(CDCl3)46.9、116.5、119.3、120.2、120.4、121.0、121.5、124.7、128.8、129.3、129.6、131.5、133.0、151.5、152.0、156.0。
【0133】
1(iv) 2−[(フェノキシ−ピリド−3−イルアセチルアミノ)メチル]フェノールアセテート
【0134】
【化20】

【0135】
ジクロロメタン(10ml)中の2−[(フェノキシ−ピリド−3−イルアミノ)メチル]フェノール(1g、3.42mmol)を無水酢酸(1.39g、13.6mmol)及びピリジン(1.074g、13.6mmol)で処理し、窒素雰囲気下で20℃で18時間加熱した。次いで、反応物をジクロロメタン(50ml)で希釈し、5N塩酸(20ml)で洗浄してピリジンを除去し、有機層を分離し、硫酸マグネシウム上で乾燥し、高真空中で濃縮してガム質にしたが、これは静置後に結晶化した。ジエチルエーテル及び石油エーテルから再結晶することで、白色固体の2−[(フェノキシ−ピリド−3−イルアセチルアミノ)メチル]フェノールアセテート(1.05g、2.79mmol、81%)を得た。
【0136】
1H NMR(CDCl3)1.93(3H,s,CH3)、2.25(3H,s,CH3)、4.37(2H,d,CH)、and5.54(2H,d,CH)、together CH2N,6.5−7.5(10H,m,ArH)、8.0(1H,d,ArH)。
【0137】
13C NMR(CDCl3)20.9、22.1、45.4、118.8、121.2、122.7、125.1、125.7、125.9、128.8、129.0、129.6、131.9、140.0、147.0、1249.5、153.1、159.4、169.7、170.1。
【0138】
1(v) N−(2−ヒドロキシベンジル)−N−(フェノキシ−ピリド−3−イル)アセトアミド
【0139】
【化21】

【0140】
メタノール(20ml)中のN−(2−アセトキシベンジル)−N−(フェノキシ−ピリド−3−イル)アセトアミド(0.5g、1.71mmol)を水酸化ナトリウム(212mg、5.3mmol)で処理し、室温で30分間撹拌した。シリカでジクロロメタン中20%酢酸エチルで展開したTLCは、アセテートから(意外にも)一層速く走行するフェノールへの完全な転化を示した。次いで、反応物を酢酸(約318mg、5.3mmol)で(リトマス紙でモニターして)中性に調整し、真空中で濃縮して白色固体を得た。この固体をジクロロメタン(50ml)と水(50ml)との間に分配した。ジクロロメタン層を分離し、硫酸マグネシウム上で乾燥し、真空中で濃縮して固体のN−(2−ヒドロキシベンジル)−N−(フェノキシ−ピリド−3−イル)アセトアミド(411mg、1.22mmol、91%)を得た。
【0141】
1H NMR(CDCl3)2.01(3H,s,CH3)、4.63(1H,s)、5.02(1H,s)together CH2N,6.6−7.4(11H,m,ArH)、8.17(1H,d,ArH)、9.34(1H,s,OH)。
【0142】
13C NMR(CDCl3)21.7、49.7、117.7、118.9、119.25、121.3、121.6、125.3、125.5、129.6、130.3、131.3、138.8.147.7、152.7、156.1、159.1、173.4。
【0143】
1(vi) N−[2−(2−フルオロエトキシ)ベンジル]−N−(2−フェノキシピリジン−3−イル)アセトアミド
【0144】
【化22】

【0145】
DMF(10ml)中のN−[2−(2−ヒドロキシ)ベンジル]−N−(2−フェノキシピリジン−3−イル)アセトアミド(300mg、0.898mmol)を水素化ナトリウム(96mg、2.4mmol)及び2−フルオロエチルトシレート(527g、2.4mmol)で処理し、窒素雰囲気下で30℃で1時間撹拌した。ジクロロメタン中20%酢酸エチルで展開されかつUV光下で可視化されるTLCによって反応物をモニターした。これはゆっくりと走行するスポットの形成を示し、それは1時間後に完了した。次いで、反応物を酢酸(1ml)の添加によって奪活し、高真空中で濃縮して油状物を得た。この油状物を酢酸エチル(100ml)と重炭酸ナトリウム溶液(50ml)との間に分配した。酢酸エチル溶液を分離し、硫酸マグネシウム上で乾燥し、真空中で濃縮してガム質にした。このガム質をシリカゲル上でジクロロメタン中5〜20%酢酸エチルの勾配でクロマトグラフィー処理して2つの画分を得た。画分1は本質的にボイド容積中に溶出する回収フルオロエチルトシレートであり、約6カラム容積後に溶出する画分2はN−[2−(2−フルオロエトキシ)ベンジル]−N−(2−フェノキシピリジン−3−イル)アセトアミド(332mg、0.87mmol、97%)であった。
【0146】
1H NMR(CDCl3)1.98(3H,s,CH3)、3.67(3H,s,OCH3)、3.9(2H,brm,CH2O)、4.44,and4.60(2H,each m,CH2F)、4.86(1H,d)、and 5.23(1H,d)together CH2N,6.67−7.37(10H,m,ArH)、8.0(1h,s,ArH)。
【0147】
13C NMR(CDCl3)22.3、45.6、55.6、67.9、68.1、80.7、83.0、112.8、113.7、116.7、118.6、121.3、125.0、126.7、129.5、139.1、146.6、150.5、153、2、153.9、159.6、170.5。
【0148】
実施例2:N−[2−(2−フルオロエトキシ)ピリジン−3−イルメチル]−N−(2−フェノキシ−フェニル)アセトアミド(非放射性造影剤19)の合成
2(i) 2−アミノジフェニルエーテル
【0149】
【化23】

【0150】
メタノール(250ml)中の2−ニトロジフェニルエーテル(16g、74mmol)を木炭上のパラジウム(1.6g)と共に水素雰囲気下で20〜50℃で30分間振盪した。急速な水素の吸収があり、20〜50℃の検出可能な発熱の結果として温度が急速に上昇し、最終的には降下して元に戻った。温度が50℃を超えて上昇するのを抑えるため、振盪を短時間停止した。次いで、反応物をセライトで濾過し、高真空中で濃縮することで、2−アミノジフェニルエーテル(13.5g、72.9mmol、98%)を油状物として得たが、これは静置後に結晶化した。
【0151】
1H NMR(300MHz,CDCl3):δH 3.8(2H,brs,NH)、6.7−6.75(1H,m,ArH)、6.8−6.94(2H,m,ArH)、6.94−7.1((4H,m,ArH)、7.25−7.4(2H,m,ArH)。
【0152】
13C NMR(75MHz,CDCl3):δC 116.4,117.1,118.7,120.2,12206,124.9,129.7,138.7,143.0,157.5。
【0153】
2(ii) (2−メトキシ−ピリジン−3−イルメチル)−(2−フェノキシ−フェニル)アミン
【0154】
【化24】

【0155】
段階2(i)からの2−アミノジフェニルエーテル(1.80g、9.8mmol)と2−メトキシ−3−ピリジンカルボキシアルデヒド(2.0g、14.6mmol)との混合物を水素下で90℃で1時間加熱した。反応混合物を0℃に冷却し、MeOH(20mL)を添加し、次いで水素化ホウ素ナトリウム(1.11g、29.4mmol)を少量ずつ20分かけて添加した。混合物をRTで24時間撹拌した。ギ酸(2.4g、53.0mmol)を添加し、混合物を15分間撹拌した。溶媒を真空中で除去し、残留物を10%重炭酸ナトリウム水溶液(100mL)で奪活し、DCM(2×30mL)で抽出し、硫酸マグネシウム上で乾燥し、濾過し、溶媒を真空中で除去した。粗物質をDCM(A):酢酸エチル(B)で溶出するシリカゲルクロマトグラフィー(2%(B)、80g、2.0CV、60mL/分)で精製して不純生成物を得た。試料をメタノールから結晶化することで、2.2g(73%)の(2−メトキシ−ピリジン−3−イルメチル)−(2−フェノキシ−フェニル)アミンを白色固体として得た。
【0156】
1H NMR(300MHz,CDCl3):δH 3.90(3H,s,OCH3)、4.33(2H,d,J=6Hz,NCH2)、4.73(1H,m,NH)、6.61−6.68(2H,m,Ph)、6.77−7.09(6H,m,Ph)、7.27−7.34(2H,m,Ph)、7.48(1H,m,Ph)、and 8.03(1H,dd,J=2 and 5Hz,Ph)。
【0157】
LC−MS:C19H18N2O2に関するm/z計算値,306.1、実測値,307.1(M+H)+。
【0158】
2(iii) N−(2−メトキシ−ピリジン−3−イルメチル)−N−(2−フェノキシ−フェニル)アセトアミド
【0159】
【化25】

【0160】
段階2(ii)からの(2−メトキシ−ピリジン−3−イルメチル)−(2−フェノキシ−フェニル)アミン(1.0g、3.26mmol)を無水DCM(15mL)に溶解した溶液に4−(ジメチルアミノ)ピリジン(0.01g、0.08mmol)を添加した。反応物を0℃に冷却し、塩化アセチル(1.54g、19.6mmol、1.40mL)を添加した。混合物をRTで3時間撹拌した。溶媒を真空中で除去し、残留物を1N水酸化ナトリウム水溶液(5mL)で奪活し、DCM(2×20mL)で抽出し、硫酸マグネシウム上で乾燥し、濾過し、溶媒を真空中で除去した。粗物質をDCM(A):メタノール(B)で溶出するシリカゲルクロマトグラフィー(5%(B)、80g、2.0CV、60mL/分)で精製することで、1.1g(97%)のN−(2−メトキシ−ピリジン−3−イルメチル)−N−(2−フェノキシ−フェニル)アセトアミドを無色油状物として得た。
【0161】
1H NMR(300MHz,CDCl3):δH 1.97(3H,s,COCH3)、3.74(3H,s,OCH3)、4.73(1H,d,J=15Hz,NCH)、4.99(1H,d,J=15Hz,NCH)、6.72−6.91(4H,m,Ph)、6.98−7.37(6H,m,Ph)、7.65(1H,dd,J=2 and 7Hz,Ph)、and 8.00(1H,dd,J=2 and 5Hz,Ph)。
【0162】
2(iv) 3−[(2−フェノキシ−フェニルアミノ)メチル]ピリジン−2−オール
【0163】
【化26】

【0164】
段階2(iii)からのN−(2−メトキシ−ピリジン−3−イルメチル)−N−(2−フェノキシ−フェニル)アセトアミド(0.60g、1.72mmol)を48%臭化水素酸水溶液(44.7g、552.0mmol、30mL)に溶解した溶液を水素下で100℃で24時間加熱した。溶媒を真空中で除去し、残留物を10%炭酸カリウム水溶液(50mL)で奪活し、DCM(2×30mL)で抽出し、硫酸マグネシウム上で乾燥し、濾過し、溶媒を真空中で除去することで、0.51g(100%)の3−[(2−フェノキシ−フェニルアミノ)メチル]ピリジン−2−オールをガム質として得た。
【0165】
1H NMR(300MHz,CDCl3):δH 4.32(2H,s,NCH2)、4.90(1H,s,br,NH)、6.22(1H,t,J=7Hz,Ph)、and 6.60−7.44(12H,m,Ph)。
【0166】
LC−MS:C18H16N2O2に関するm/z計算値,292.1、実測値,293.1(M+H)+。
【0167】
2(v) N−(2−ヒドロキシ−ピリジン−3−イルメチル)−N−(2−フェノキシ−フェニル)アセトアミド
【0168】
【化27】

【0169】
段階2(iv)からの3−[(2−フェノキシ−フェニルアミノ)メチル]ピリジン−2−オール(0.51g、1.74mmol)を無水DCM(20mL)に溶解した溶液に4−(ジメチルアミノ)ピリジン(0.01g、0.08mmol)を添加した。反応物を0℃に冷却し、塩化アセチル(1.6g、20.8mmol、1.5mL)を添加した。混合物をRTで24時間撹拌した。溶媒を真空中で除去し、水酸化リチウムの飽和メタノール溶液(10mL)を残留物に添加した。10分間撹拌した後、水(20mL)を添加し、メタノールを真空中で除去した。水溶液をDCM(2×20mL)で抽出し、合わせた有機相をブライン(20mL)で洗浄し、硫酸マグネシウム上で乾燥し、濾過し、溶媒を真空中で除去した。粗物質をDCM(A):メタノール(B)で溶出するシリカゲルクロマトグラフィー(10%(B)、12g、1.0CV、30mL/分)で精製して不純生成物を得た。試料をDCM(A):メタノール(B)で溶出するシリカゲルクロマトグラフィー(2〜10%(B)、40g、8.0CV、40mL/分)で精製することで、0.35g(59%)のN−(2−ヒドロキシ−ピリジン−3−イルメチル)−N−(2−フェノキシ−フェニル)アセトアミドを白色泡状物として得た。
【0170】
1H NMR(300MHz,CDCl3):δH 2.01(3H,s,COCH3)、4.75(1H,d,J=16Hz,NCH)、4.88(1H,d,J=16Hz,NCH)、6.12(1H,t,J=7Hz,Ph)、6.80−7.38(10H,m,Ph)、7.62(1H,d,J=7Hz,Ph)、and 12.66(1H,s,br,OH)。
【0171】
LC−MS:C20H18N2O3に関するm/z計算値,334.1、実測値,357.0(M+Na)+。
【0172】
2(vi) 非放射性インビボ造影剤19
【0173】
【化28】

【0174】
段階2(v)からのN−(2−ヒドロキシ−ピリジン−3−イルメチル)−N−(2−フェノキシ−フェニル)アセトアミド(0.15g、0.45mmol)を窒素下でRTの無水DMF(2mL)に溶解した。炭酸カリウム(0.19g、1.35mmol)及び2−フルオロエチルトシレート(0.20g、0.89mmol)を添加し、混合物を70℃で24時間加熱した。DMFを真空中で除去し、残留物を水(40mL)で奪活し、DCM(2×20mL)で抽出し、硫酸マグネシウム上で乾燥し、濾過し、溶媒を真空中で除去した。粗物質をDCM(A):メタノール(B)で溶出するシリカゲルクロマトグラフィー(2〜5%(B)、40g、3.0CV及び7.0CV、40mL/分)で精製して不純O−アルキル及びN−アルキル生成物を得た。O−アルキル試料をDCM(A):メタノール(B)で溶出するシリカゲルクロマトグラフィー(1%(B)、40g、4.0CV、40mL/分)で再精製して不純生成物を得た。試料をDCM(A):酢酸エチル(B)で溶出するシリカゲルクロマトグラフィー(10〜90%(B)、40g、18.0CV、40mL/分)で再精製することで、35mg(20%)の非放射性インビボ造影剤19を無色油状物として得た。
【0175】
1H NMR(300MHz,CDCl3):δH 1.96(3H,s,COCH3)、4.24−4.65(4H,m,OCH2CH2F)、4.74(1H,d,J=15Hz,NCH)、5.05(1H,d,J=15Hz,NCH)、6.75−7.36(10H,m,Ph)、7.70(1H,dd,J=2 and 7Hz,Ph)、and 7.97(1H,dd,J=2 and 5Hz,Ph)。
【0176】
LC−MS:C22H21FN2O3に関するm/z計算値,380.2、実測値,381.1(M+H)+。
【0177】
実施例3:2−フルオロ−N−(2−メトキシ−ピリジン−3−イルメチル)−N−(2−フェノキシ−フェニル)アセトアミド(非放射性インビボ造影剤18)の合成
【0178】
【化29】

【0179】
段階2(iii)で得られたN−(2−メトキシ−ピリジン−3−イルメチル)−N−(2−フェノキシ−フェニル)アセトアミド(0.31g、1.0mmol)を無水DCM(5mL)に溶解した溶液に、4−(ジメチルアミノ)ピリジン(0.01g、0.08mmol)を添加した。反応物を0℃に冷却し、塩化フルオロアセチル(0.58g、6.0mmol、0.40mL)を添加した。混合物をRTで3時間撹拌した。溶媒を真空中で除去し、残留物を1N水酸化ナトリウム水溶液(5mL)で奪活し、DCM(2×20mL)で抽出し、硫酸マグネシウム上で乾燥し、濾過し、溶媒を真空中で除去した。粗物質をDCM(A):メタノール(B)で溶出するシリカゲルクロマトグラフィー(1〜5%(B)、80g、6.0CV、60mL/分)で精製することで、0.26g(71%)の非放射性造影剤18を白色固体として得た。
【0180】
1H NMR(300MHz,CDCl3):δH 3.72(3H,s,OCH3),4.69(1H,s,FCH),4.79(1H,d,J=15Hz,NCH),4.84(1H,s,FCH),5.02(1H,d,J=15Hz,NCH),6.72−6.88(4H,m,Ph),6.98−7.38(6H,m,Ph),7.64(1H,dd,J=2 and 7Hz,Ph),and 8.02(1H,dd,J=2and5Hz,Ph)、19F NMR(283MHz,CDCl3):δF −226.9。
【0181】
LC−MS:C21H19FN2O3に関するm/z計算値,366.1、実測値,367.1(M+H)+。
【0182】
実施例4:2−[(フェノキシ−ピリド−3−イルアセチルアミノ)メチル]フェノール−2−エチルトルエン−4−スルホネート(造影剤1の直接標識前駆体化合物)の合成
【0183】
【化30】

【0184】
DMF(30ml)中の2−[(フェノキシ−ピリド−3−イルアセチルアミノ)メチル]フェノール(1g、3.0mmol)を水素化ナトリウム(60%)(478mg、2.4mmol)及びエチルグリコールジトシレート(2.77g、7.5mmol)で処理し、窒素雰囲気下で20℃で1時間撹拌した。ガソリン中50%酢酸エチルで展開されかつUV光下で可視化されるTLCによって反応物をモニターした。これは出発原料の消失及びゆっくりと走行する物質の出現を示した。過剰のエチレングリコールジトシレートは、出発原料よりわずかに速く走行するスポットを形成した。1時間後、TLCによれば反応は完了した。次いで、反応物を酢酸(450mg)の滴下によって奪活し、その際には水素ガスが激しく発生した。次いで、反応物を高真空中で濃縮して油状物を得た。この油状物を酢酸エチル(100ml)と重炭酸ナトリウム溶液(50ml)との間に分配した。酢酸エチル溶液を分離し、硫酸マグネシウム上で乾燥し、真空中で濃縮してガム質にした。若干の過剰エチルグリコールジトシレートが晶出したが、エーテルでのトリチュレーション及び濾過によって分離した。このガム質をシリカでガソリン中5〜20%酢酸エチルの勾配でクロマトグラフィー処理して3つの画分を得た。画分1は回収エチレングリコールジトシレートであり、画分2は少量の回収出発原料であり、画分3は所要の化合物(1.246g、2.34mmol、78%)であった。
【0185】
1H NMR(CDCl3)δ,2.0(3H,s,CH3),2.45,(3H,s,CH3),3.9−4.2,(4H,m,2CH2),4.87and5.04(1H,d,together CH2N),6.62(1H,d,ArH),6.8−6.95,(4H,m,ArH),7.1−7.54(8H,m,ArH),7.77((2H,d,ArH),8.0(1H,d,ArH)。
【0186】
13C NMR CDCl3 δ,21.49,22.18,45.7,65.3,67.9,110.9,118.6,121.2,124.9,125.1,126.4,127.7,128.7129.4,129.8,131.1,132.6,139,145.0,146.4,153.0,155.8,159.4,170.4。
【0187】
実施例5:造影剤1の間接標識合成
【0188】
【化31】

【0189】
反応器内の[18F]F-/H2O(約400MBq、100〜300μl)に、クリプトフィックス(Kryptofix)2.2.2(4mg、10.6μmol)、炭酸カリウム(0.1mol・dm-3、50μl、0.7mg、5μmol)及びアセトニトリル(0.5mL)の混合物を添加した。窒素流下で100℃で15〜20分間加熱することで溶媒を除去した。エチレングリコールジトシレート(3〜5mg、8〜13.5μmol)のアセトニトリル(1mL)溶液を添加し、混合物を100℃で10分間加熱した。冷却後、反応物を取り出し、反応器を水(1000μl)ですすいで主たる粗反応物に加えた。[18F]−フルオロエチルトシレートをHPLC(ACE C18(2)カラム,5μ,100×10mm,5mlループ,ポンプ速度3ml/分,波長254nm,移動相(水:MeOH) :0−1分 50%MeOH;1−25分 50−95%MeOH;25−30分 95%MeOH;30−31分 95−50%MeOH;31−33分 50%MeOH)によって精製した。[18F]−フルオロエチルトシレートのtRは7.5分であった。[18F]−フルオロエチルトシレートの放射化学収率は約40%(非崩壊補正収率)であった。
【0190】
[18F]−フルオロエチルトシレートのカットピークをH2Oで約20mlの体積に希釈し、コンディショニング済みのライトt−C18 sep pak上に装填し、H2O(1×2ml)でフラッシュした。装填したsep pakを、高流量のN2ライン上で15〜20分間乾燥した。
【0191】
撹拌機を含むホイートン(Wheaton)バイアル(1ml)内で、CH3CN(100μl)中のN−(2−ヒドロキシベンジル)−N−(フェノキシ−ピリド−3−イル)アセトアミド(2〜4mg、6〜12μmol、実施例1(v)に従って製造)及びCs2CO3(8〜10mg、24〜30μmol)を室温で1〜2時間撹拌した。乾燥したライトt−C18 sep pak上の放射能をCH3CN(0.5ml)でホイートンバイアル中に溶出した。ホイートンバイアルを密封し、反応物を120〜130℃の油浴中で15分間加熱撹拌した。その後、反応物を冷却し、水(500μl)で奪活した。造影剤1を
HPLC(ACE C18(2)カラム,5μ,100x10mm,5mlループ,ポンプ速度3ml/分,波長254nm,移動相(水:MeOH):0−1分 50%MeOH;1−20分 50−95%MeOH;20−25分 95%MeOH;25−26分 95−50%MeOH;26−28分 50%MeOH)によって精製した。
【0192】
実施例6:インビトロ効力アッセイ
Le Fur et al(Life Sci.1983;USA 33:449−57)の方法を改変した方法を用いて、PBRに対する親和性のスクリーニングを行った。試験した化合物は、非放射性造影剤1及び先行技術化合物FE−PBR28の非放射性バージョンであった。
【0193】
(1%DMSOを含む50mMトリス−HCl、pH7.4、10mM MgCl2に溶解した)各試験化合物を、ウィスター系ラットの心臓PBRとの結合に関して0.3nM[3H]−PK−11195と競合させた。反応は50mMトリス−HCl、pH7.4、10mM MgCl2中で25℃で15分間実施した。
【0194】
各試験化合物のスクリーニングは、推定Kiの周辺の300倍の濃度範囲にわたる6種の濃度で行った。非放射性造影剤1に関するKiは4.24nMであることが判明し、FE−PBR28に関するKiは0.056nMであることが判明した。
【0195】
【表1】

【0196】
実施例7:インビボ体内分布方法
インビボ造影剤1及び(Wilson et al,Nuc.Med.Biol.2008;35:305−14に従って製造した)先行技術化合物[18F]−FE−PBR28をインビボ体内分布モデルで試験し、それぞれの体内分布を比較した。
【0197】
雄ウィスター系ラット成体(200〜300g)に、側尾静脈を通して1〜3MBqの各インビボ造影剤を注射した。注射から2分後、10分後、30分後又は60分後(n=3)に、ラットを安楽死させ、γ線カウンター上での放射能測定に組織又は体液の試料を採取した。図1は得られたデータを示している。さらに詳しく説明すると、造影剤の注射後、注射から2分後における嗅球(OB)中への取込み量、並びに注射から30分後におけるOB取込み量と線条体取込み量との比を調べた。これらの特定測定値を採用した理由は、OBがラット脳の他の領域に比べて高いレベルのPBRを発現することが知られているからである(“Handbook of Substance Abuse”by Tarter,Ammerman and Ott;Springer 1998:398−99を参照されたい)。
【0198】
以下表1では、造影剤1が[18F]−FE−PBR28と比較されている。
【0199】
【表2】

【特許請求の範囲】
【請求項1】
次の式Iのインビボ造影剤或いはその塩又は溶媒和物。
【化1】

(式中、
R1はメチル及びC1-3フルオロアルキルから選択され、
R2は水素、ハロゲン、C1-3アルコキシ及びC1-3フルオロアルコキシから選択され、
R3は水素、ハロゲン及びC1-3アルコキシから選択され、
A1はN又はCHであり、
A2及びA4-7の1つ又は2つがNであり、A2及びA4-7の残りがCHであり、
A3はCH又はCH−O−R4(式中、R4はH、C1-3アルキル又はC1-3ハロアルキルである。)であるか、或いは別法としてA2及びA4-7の1つがNでありかつA2及びA4-7の残りがCHである場合にA3はNであってよく、
式Iはインビボイメージングに適した放射性同位体である原子を含む。)
【請求項2】
R1がC1-3フルオロアルキルであり、R2が水素である、請求項1記載のインビボ造影剤。
【請求項3】
R1がメチルであり、R2がC1-3フルオロアルコキシである、請求項1記載のインビボ造影剤。
【請求項4】
R3が水素である、請求項1乃至請求項3のいずれか1項記載のインビボ造影剤。
【請求項5】
A1、A2及びA4-7の2つがNであり、A1、A2及びA4-7の残りがCHである、請求項1乃至請求項4のいずれか1項記載のインビボ造影剤。
【請求項6】
A2及びA4〜A6の1つがNであり、A1がCHであり、A7がCHである、請求項1乃至請求項4のいずれか1項記載のインビボ造影剤。
【請求項7】
A7がNであり、A1-6がCHであり、R3が水素である、請求項1乃至請求項4のいずれか1項記載のインビボ造影剤。
【請求項8】
前記放射性同位体が18F、11C又は123Iである、請求項1乃至請求項7のいずれか1項記載のインビボ造影剤。
【請求項9】
前記放射性同位体が18Fである、請求項8記載のインビボ造影剤。
【請求項10】
次の化学構造を有する、請求項9記載のインビボ造影剤。
【化2】

【請求項11】
請求項1乃至請求項10のいずれか1項記載のインビボ造影剤の製造方法であって、前記放射性同位体の適当な供給源を次の式IIの前駆体化合物と反応させる段階を含んでなる方法。
【化3】

(式中、
R11-13の1つは前駆体基を含み、そうでなければR11-12は請求項1乃至請求項3でそれぞれR1-2に関して定義した通りであり、R13は請求項1又は請求項4でR3に関して定義した通りであり、前駆体基を含まない場合にはR11-13の各々は任意に保護基を含み、
A11-17は請求項1及び請求項5乃至請求項7でそれぞれA1-7に関して定義した通りであり、任意には保護基を含む。)
【請求項12】
前記放射性同位体の前記適当な供給源が18Fの適当な供給源であり、前記前駆体基がヒドロキシル、Cl、Br、I、トシレート、メシレート又はトリフレートからなる、請求項11記載の方法。
【請求項13】
18Fの前記適当な供給源が[18F]−フルオロエチルトシレートであり、前記前駆体化合物が次の化学構造を有する、請求項12記載の方法。
【化4】

【請求項14】
18Fの前記適当な供給源が[18F]−フッ化物であり、前記前駆体化合物が次の化学構造を有する、請求項12記載の方法。
【化5】

(式中、OTsはトシレートを表す。)
【請求項15】
前記放射性同位体の前記適当な供給源が11Cの適当な供給源であり、前記前駆体基がヒドロキシル、カルボキシル、トリアルキルスタンナン又は有機ホウ素化合物である、請求項11記載の方法。
【請求項16】
前記放射性同位体の前記適当な供給源が123Iの適当な供給源であり、前記前駆体基がトリアルキルスタンナン、トリアルキルシラン又は有機ホウ素化合物であるか、或いは前記前駆体基が式IIのアリール基にしている場合にはそれが前記アリール基と共にフェノール、アリールヨードニウム塩、アリールジアゾニウム塩、アリールトリアルキルアンモニウム塩又はニトロアリール誘導体を形成する、請求項11記載の方法。
【請求項17】
自動化される、請求項11乃至請求項16のいずれか1項記載の方法。
【請求項18】
請求項11乃至請求項16のいずれか1項記載の方法で定義される前駆体化合物。
【請求項19】
請求項1乃至請求項10のいずれか1項記載のインビボ造影剤を、哺乳動物への投与に適した形態の生体適合性キャリヤーと共に含んでなる放射性医薬組成物。
【請求項20】
請求項11乃至請求項16のいずれか1項記載の方法を実施するためのキットであって、密封容器内に請求項18記載の前駆体化合物を含んでなるキット。
【請求項21】
請求項17記載の方法を実施するためのカセットであって、
(i)請求項18記載の前駆体化合物を含む容器、並びに
(ii)請求項11乃至請求項16のいずれか1項記載の放射性同位体の適当な供給源を用いて容器を溶出するための手段
を含んでなるカセット。
【請求項22】
さらに、
(iii)過剰の前記放射性同位体を除去するためのイオン交換カートリッジ、及び任意には
(iv)得られた放射性標識生成物を脱保護して請求項1乃至請求項10のいずれか1項記載のインビボ造影剤を生成するためのカートリッジ
を含む、請求項21記載のカセット。
【請求項23】
被験体におけるPBR発現の分布及び/又は程度を決定する際に使用するためのインビボイメージング方法であって、
(i)請求項1乃至請求項10のいずれか1項記載のインビボ造影剤を前記被験体に投与する段階、
(ii)前記インビボ造影剤を前記被験体内のPBRに結合させる段階、
(iii)前記インビボ造影剤の放射性同位体から放出される信号をインビボイメージング技術によって検出する段階、
(iv)前記信号の位置及び/又は量を表す画像を生成する段階、並びに
(v)前記被験体におけるPBR発現の分布及び程度を決定する段階であって、前記発現は前記インビボ造影剤から放出される前記信号と直接に相関している段階
を含んでなるインビボイメージング方法。
【請求項24】
前記被験体に関する治療計画の進行中に繰り返して実施される請求項23記載のインビボイメージング方法であって、前記計画がPBR状態と戦うための薬物の投与を含むインビボイメージング方法。
【請求項25】
PBRがアップレギュレートされた状態の診断方法であって、請求項23又は請求項24のいずれか記載のインビボイメージング方法を、PBR発現の分布及び程度を特定の臨床像に帰因させる追加段階(vi)と共に含んでなる診断方法。
【請求項26】
請求項25記載の診断方法で使用するための、請求項1乃至請求項10のいずれか1項記載のインビボ造影剤。
【請求項27】
請求項25記載の診断方法で使用するための請求項19記載の放射性医薬組成物の製造に使用するための、請求項1乃至請求項10のいずれか1項記載のインビボ造影剤。
【請求項1】
次の式Iのインビボ造影剤或いはその塩又は溶媒和物。
【化1】

(式中、
R1はメチル及びC1-3フルオロアルキルから選択され、
R2は水素、ハロゲン、C1-3アルコキシ及びC1-3フルオロアルコキシから選択され、
R3は水素、ハロゲン及びC1-3アルコキシから選択され、
A1はN又はCHであり、
A2及びA4-7の1つ又は2つがNであり、A2及びA4-7の残りがCHであり、
A3はCH又はCH−O−R4(式中、R4はH、C1-3アルキル又はC1-3ハロアルキルである。)であるか、或いは別法としてA2及びA4-7の1つがNでありかつA2及びA4-7の残りがCHである場合にA3はNであってよく、
式Iはインビボイメージングに適した放射性同位体である原子を含む。)
【請求項2】
R1がC1-3フルオロアルキルであり、R2が水素である、請求項1記載のインビボ造影剤。
【請求項3】
R1がメチルであり、R2がC1-3フルオロアルコキシである、請求項1記載のインビボ造影剤。
【請求項4】
R3が水素である、請求項1乃至請求項3のいずれか1項記載のインビボ造影剤。
【請求項5】
A1、A2及びA4-7の2つがNであり、A1、A2及びA4-7の残りがCHである、請求項1乃至請求項4のいずれか1項記載のインビボ造影剤。
【請求項6】
A2及びA4〜A6の1つがNであり、A1がCHであり、A7がCHである、請求項1乃至請求項4のいずれか1項記載のインビボ造影剤。
【請求項7】
A7がNであり、A1-6がCHであり、R3が水素である、請求項1乃至請求項4のいずれか1項記載のインビボ造影剤。
【請求項8】
前記放射性同位体が18F、11C又は123Iである、請求項1乃至請求項7のいずれか1項記載のインビボ造影剤。
【請求項9】
前記放射性同位体が18Fである、請求項8記載のインビボ造影剤。
【請求項10】
次の化学構造を有する、請求項9記載のインビボ造影剤。
【化2】

【請求項11】
請求項1乃至請求項10のいずれか1項記載のインビボ造影剤の製造方法であって、前記放射性同位体の適当な供給源を次の式IIの前駆体化合物と反応させる段階を含んでなる方法。
【化3】

(式中、
R11-13の1つは前駆体基を含み、そうでなければR11-12は請求項1乃至請求項3でそれぞれR1-2に関して定義した通りであり、R13は請求項1又は請求項4でR3に関して定義した通りであり、前駆体基を含まない場合にはR11-13の各々は任意に保護基を含み、
A11-17は請求項1及び請求項5乃至請求項7でそれぞれA1-7に関して定義した通りであり、任意には保護基を含む。)
【請求項12】
前記放射性同位体の前記適当な供給源が18Fの適当な供給源であり、前記前駆体基がヒドロキシル、Cl、Br、I、トシレート、メシレート又はトリフレートからなる、請求項11記載の方法。
【請求項13】
18Fの前記適当な供給源が[18F]−フルオロエチルトシレートであり、前記前駆体化合物が次の化学構造を有する、請求項12記載の方法。
【化4】

【請求項14】
18Fの前記適当な供給源が[18F]−フッ化物であり、前記前駆体化合物が次の化学構造を有する、請求項12記載の方法。
【化5】

(式中、OTsはトシレートを表す。)
【請求項15】
前記放射性同位体の前記適当な供給源が11Cの適当な供給源であり、前記前駆体基がヒドロキシル、カルボキシル、トリアルキルスタンナン又は有機ホウ素化合物である、請求項11記載の方法。
【請求項16】
前記放射性同位体の前記適当な供給源が123Iの適当な供給源であり、前記前駆体基がトリアルキルスタンナン、トリアルキルシラン又は有機ホウ素化合物であるか、或いは前記前駆体基が式IIのアリール基にしている場合にはそれが前記アリール基と共にフェノール、アリールヨードニウム塩、アリールジアゾニウム塩、アリールトリアルキルアンモニウム塩又はニトロアリール誘導体を形成する、請求項11記載の方法。
【請求項17】
自動化される、請求項11乃至請求項16のいずれか1項記載の方法。
【請求項18】
請求項11乃至請求項16のいずれか1項記載の方法で定義される前駆体化合物。
【請求項19】
請求項1乃至請求項10のいずれか1項記載のインビボ造影剤を、哺乳動物への投与に適した形態の生体適合性キャリヤーと共に含んでなる放射性医薬組成物。
【請求項20】
請求項11乃至請求項16のいずれか1項記載の方法を実施するためのキットであって、密封容器内に請求項18記載の前駆体化合物を含んでなるキット。
【請求項21】
請求項17記載の方法を実施するためのカセットであって、
(i)請求項18記載の前駆体化合物を含む容器、並びに
(ii)請求項11乃至請求項16のいずれか1項記載の放射性同位体の適当な供給源を用いて容器を溶出するための手段
を含んでなるカセット。
【請求項22】
さらに、
(iii)過剰の前記放射性同位体を除去するためのイオン交換カートリッジ、及び任意には
(iv)得られた放射性標識生成物を脱保護して請求項1乃至請求項10のいずれか1項記載のインビボ造影剤を生成するためのカートリッジ
を含む、請求項21記載のカセット。
【請求項23】
被験体におけるPBR発現の分布及び/又は程度を決定する際に使用するためのインビボイメージング方法であって、
(i)請求項1乃至請求項10のいずれか1項記載のインビボ造影剤を前記被験体に投与する段階、
(ii)前記インビボ造影剤を前記被験体内のPBRに結合させる段階、
(iii)前記インビボ造影剤の放射性同位体から放出される信号をインビボイメージング技術によって検出する段階、
(iv)前記信号の位置及び/又は量を表す画像を生成する段階、並びに
(v)前記被験体におけるPBR発現の分布及び程度を決定する段階であって、前記発現は前記インビボ造影剤から放出される前記信号と直接に相関している段階
を含んでなるインビボイメージング方法。
【請求項24】
前記被験体に関する治療計画の進行中に繰り返して実施される請求項23記載のインビボイメージング方法であって、前記計画がPBR状態と戦うための薬物の投与を含むインビボイメージング方法。
【請求項25】
PBRがアップレギュレートされた状態の診断方法であって、請求項23又は請求項24のいずれか記載のインビボイメージング方法を、PBR発現の分布及び程度を特定の臨床像に帰因させる追加段階(vi)と共に含んでなる診断方法。
【請求項26】
請求項25記載の診断方法で使用するための、請求項1乃至請求項10のいずれか1項記載のインビボ造影剤。
【請求項27】
請求項25記載の診断方法で使用するための請求項19記載の放射性医薬組成物の製造に使用するための、請求項1乃至請求項10のいずれか1項記載のインビボ造影剤。
【図1】




【公表番号】特表2012−520855(P2012−520855A)
【公表日】平成24年9月10日(2012.9.10)
【国際特許分類】
【出願番号】特願2012−500269(P2012−500269)
【出願日】平成22年3月19日(2010.3.19)
【国際出願番号】PCT/EP2010/053614
【国際公開番号】WO2010/106166
【国際公開日】平成22年9月23日(2010.9.23)
【出願人】(305040710)ジーイー・ヘルスケア・リミテッド (99)
【Fターム(参考)】
【公表日】平成24年9月10日(2012.9.10)
【国際特許分類】
【出願日】平成22年3月19日(2010.3.19)
【国際出願番号】PCT/EP2010/053614
【国際公開番号】WO2010/106166
【国際公開日】平成22年9月23日(2010.9.23)
【出願人】(305040710)ジーイー・ヘルスケア・リミテッド (99)
【Fターム(参考)】
[ Back to top ]

