インフルエンザウイルス感染症の治療および/または発症抑制剤
【課題】 亜型や変異体の出現などのインフルエンザウイルス側の変化に影響されることなく、インフルエンザウイルス感染症の治療や発症抑制をすることができる、インフルエンザウイルス感染症の治療および/または発症抑制剤を提供する。
【解決手段】 Fasリガンド/Fasレセプター系を介するアポトーシスを抑制するインフルエンザウイルス感染症の治療および/または発症抑制剤であって、Fasリガンドと相互作用する物質を有効成分とする。本発明者らは、鋭意研究の結果、宿主細胞側の因子であるFasリガンドの機能を具体的に抑制することにより、インフルエンザウイルスに感染したマウスのアポトーシスが抑制されて生存率が上昇することを見出し、本発明を完成した。
【解決手段】 Fasリガンド/Fasレセプター系を介するアポトーシスを抑制するインフルエンザウイルス感染症の治療および/または発症抑制剤であって、Fasリガンドと相互作用する物質を有効成分とする。本発明者らは、鋭意研究の結果、宿主細胞側の因子であるFasリガンドの機能を具体的に抑制することにより、インフルエンザウイルスに感染したマウスのアポトーシスが抑制されて生存率が上昇することを見出し、本発明を完成した。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、Fasリガンド/Fasレセプター系を介するアポトーシスを抑制するインフルエンザウイルス感染症の治療および/または発症抑制剤に関し、より詳細には、Fasリガンドと相互作用する物質を有効成分とするインフルエンザウイルス感染症の治療および/または発症抑制剤に関する。
【背景技術】
【0002】
アポトーシスは細胞死の一種であり、細胞の縮小、クロマチンの凝集、核の断片化、細胞の断片化、周辺細胞やマクロファージによる断片化した細胞(アポトーシス小体)の貪食といった一連の形態変化に特徴付けられる。アポトーシスは、特定のシグナル伝達タンパク質やカスパーゼ類、エンドヌクレアーゼ類の秩序立った機能発現によって起こる、能動的な細胞死である。
【0003】
アポトーシスは、個体の発生過程においてはさまざまな臓器や気管の形態形成や細胞数の調整に寄与し、成体においては癌細胞やウイルス感染細胞の除去など組織の恒常性の維持に寄与する重要なシステムであり、その過剰や低下は、ウイルス感染症や癌、自己免疫疾患などの様々な疾患に関与する。
【0004】
アポトーシスが関与する疾患の一つとして、インフルエンザウイルス感染症を挙げることができる。インフルエンザウイルスを感染させた培養細胞では、アポトーシスが起こること(非特許文献1)やアポトーシス誘導因子であるFasリガンドのmRNA発現量が増大すること(非特許文献2、3)、インフルエンザウイルスを感染させた動物体内でアポトーシスが観察されること(非特許文献4)などから、インフルエンザウイルス感染症ではアポトーシスが促進されることが確認されている。インフルエンザウイルス感染症におけるアポトーシスが生体防御反応によるものか、ウイルス複製によるものかは未だ議論されているところであるが、いずれにしても過剰なアポトーシスは身体にダメージを与えることから、インフルエンザウイルス感染症の発症や症状悪化の原因となると考えられている。
【0005】
従来、インフルエンザウイルス感染症に対する予防剤や治療剤として、弱毒化または不活化したインフルエンザウイルスを宿主に取り込ませて獲得させた免疫を利用するインフルエンザワクチンや、インフルエンザウイルス表面に存在する酵素ノイラミニダーゼの働きを阻害するオセルタミビル(商品名タミフル;ロシュ社)、ザナミビル(商品名リレンザ;グラクソ・スミスクライン社)の他、インフルエンザウイルスのM2タンパク質を阻害するアマンタジン(商品名シンメトレル;ノバルティスファーマ社)が開発され、市販されている。また、国際公開WO2007/105565号パンフレットには、インフルエンザウイルスのヘマグルチニンに親和性の高いペプチドからなるインフルエンザウイルス感染阻害ペプチド(特許文献1)が、特開2007−533595号には、アポトーシス誘導機構であるTrailリガンド/Trailレセプター系を阻害するインフルエンザウイルス感染症の予防・治療剤(特許文献2)が開示されている。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Takizawa Y.ら、J.Gen.Virol.、第74巻、第2347−2355頁、1993年
【非特許文献2】Wada N.ら、J.B.C.、第270巻、18007−18012頁、1995年
【非特許文献3】Fujimoto I.ら、Cell Death Differ.ら、第5巻、第426−431頁、1998年
【非特許文献4】Mori I.ら、J.Gen.Virol.、第76巻、第2869−2873頁、1995年
【特許文献】
【0007】
【特許文献1】国際公開WO2007/105565号パンフレット
【特許文献2】特開2007−533595号
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、インフルエンザワクチン、オセルタミビル、ザナミビル、アマンタジン、特許文献1に開示されているインフルエンザウイルス感染阻害ペプチドは、いずれもインフルエンザウイルス本体に由来するタンパク質を標的としているため、亜型への効果が期待できず、また、変異体の出現により耐性獲得が生じやすいという問題点を抱えている。例えば、現在日本で使用されている季節性インフルエンザに対するワクチンは、先行するオーストラリアでの流行株の情報に基づき、日本で流行すると予想された株に対して作製されるため、毎年不安定であるうえ、この予測が外れた場合や変異体が生じた場合には、対応が困難となっている。また、特許文献2に開示されているインフルエンザウイルス感染症の予防・治療剤は、培養細胞でインフルエンザウイルスの増殖を抑制することが示されているに過ぎず、動物個体でインフルエンザウイルスの増殖を抑制することも、インフルエンザウイルスの増殖を抑制することが、個体の体重減少率や致死率の改善などのインフルエンザウイルス感染症における諸症状の予防や治療につながることも、具体的に示されていない。
【0009】
さらに、非特許文献1〜非特許文献4には、Fasリガンド/Fasレセプター系を介するアポトーシスを抑制してインフルエンザウイルス感染症の治療や発症抑制をすることができる、すなわちアンタゴニストとして用いることができるFasリガンドと相互作用する物質についての記載や示唆はない。
【0010】
本発明は、上述の問題点を解決するためになされたものであって、亜型や変異体の出現などのインフルエンザウイルス側の変化に影響されることなく、インフルエンザウイルス感染症の治療や発症抑制をすることができる、インフルエンザウイルス感染症の治療および/または発症抑制剤を提供することを目的としている。
【課題を解決するための手段】
【0011】
本発明者らは、鋭意研究の結果、宿主細胞側の因子であるFasリガンドの機能を具体的に抑制することにより、インフルエンザウイルスに感染したマウスのアポトーシスが抑制されて生存率が上昇することを見出し、下記の各発明を完成した。
【0012】
(1)Fasリガンド/Fasレセプター系を介するアポトーシスを抑制するインフルエンザウイルス感染症の治療および/または発症抑制剤であって、Fasリガンドと相互作用する物質を有効成分とする前記剤。
【0013】
(2)Fasリガンドと相互作用する物質が、Fasレセプターの細胞外領域とIgGのFc領域とを結合させた融合タンパク質Fas−Fcである、(1)に記載の剤。
【0014】
(3)Fasレセプターの細胞外領域が、配列番号8のアミノ酸配列からなるポリペプチドまたは配列番号8において1個もしくは数個のアミノ酸が欠失、置換、挿入および/または付加されたアミノ酸配列であってFasリガンドと相互作用するポリペプチドである、(2)に記載の剤。
【発明の効果】
【0015】
本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤によれば、亜型や変異体の出現などのインフルエンザウイルス側の変化に影響されることなく、さまざまなインフルエンザウイルス株によるインフルエンザウイルス感染症に対する治療や発症抑制をすることができる。
【図面の簡単な説明】
【0016】
【図1】ヒトFasリガンドおよびヒトFasレセプターのアミノ酸配列における各領域および各ドメインを示す模式図である。
【図2】1×103pfuのインフルエンザウイルスを接種したマウス(A群)、1×105pfuのインフルエンザウイルスを接種したマウス(B群)および1×107pfuのインフルエンザウイルスを接種したマウス(C群)の、接種後の経過日数と生存率との関係を示すグラフである。
【図3】1×102pfuのインフルエンザウイルスを接種したマウス(A群)および1×105pfuのインフルエンザウイルスを接種したマウス(B群)の、接種後の経過日数と体重減少率との関係を示すグラフ(a)、1×102pfuのインフルエンザウイルスを接種したマウス(A群)および1×105pfuのインフルエンザウイルスを接種したマウス(B群)のFasL(mFasL)のmRNA発現量と接種後の経過日数と体重減少率との関係を示すグラフ(b)、1×102pfuのインフルエンザウイルスを接種したマウス(A群)および1×105pfuのインフルエンザウイルスを接種したマウス(B群)のFas(mFas)のmRNA発現量と接種後の経過日数と体重減少率との関係を示すグラフ(c)である。
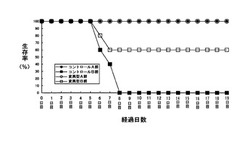
【図4】1×102pfuのインフルエンザウイルスを接種したC57BL/6マウス(コントロールA群)、1×105pfuのインフルエンザウイルスを接種したC57BL/6マウス(コントロールB群)、1×102pfuのインフルエンザウイルスを接種したgldマウス(変異型A群)および1×105pfuのインフルエンザウイルスを接種したgldマウス(変異型B群)の接種後の経過日数と生存率との関係を示すグラフである。
【図5】1×105pfuのインフルエンザウイルスを接種したC57BL/6マウス(コントロール群)および1×105pfuのインフルエンザウイルスを接種したgldマウス(変異型群)の肺をTUNEL法により染色し、細気管支周辺を撮影した写真図である。図中、茶色で示される細胞は、アポトーシス陽性細胞を示す。
【図6】1×105pfuのインフルエンザウイルスを接種したC57BL/6マウス(コントロール群)および1×105pfuのインフルエンザウイルスを接種したgldマウス(変異型群)の肺をTUNEL法により染色し、肺血管周辺を拡大して撮影した写真図である。図中、「V」で示される箇所は肺血管内腔を示し、茶色で示される細胞は、アポトーシス陽性細胞を示す。
【図7】インフルエンザウイルスを接種したC57BL/6マウス(コントロール群)およびインフルエンザウイルスを接種したgldマウス(変異型群)の肺におけるウイルス量について、プラークアッセイにより求めたウイルス量の割合と接種経過日数との関係を示すグラフである。
【図8】インフルエンザウイルスを接種した後、融合タンパク質であるmFas−Fcを100μg/個体投与したマウス(100μg投与群)、mFas−Fcを50μg/個体投与したマウス(50μg投与群)およびPBSを投与したマウス(コントロール群)の生存率を示すグラフである。図中、横軸における●はmFas−Fcを100μg/個体投与した日を示し、△はmFas−Fcを50μg/個体投与した日を示す。
【発明を実施するための形態】
【0017】
以下、本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤について詳細に説明する。本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤は、Fasリガンド/Fasレセプター系を介するアポトーシスを抑制する。
【0018】
一般にアポトーシスが起こる機構としては、個体発生のプログラムに組み込まれたものや物理化学的ストレスにより誘導される機構のほか、特定のレセプターにリガンドが結合し、一連の細胞内シグナル伝達経路が活性化されて起こる機構(系)が知られている。アポトーシスを誘導するレセプターおよびそのリガンドはそれぞれ、デスレセプター(DR)およびデスリガンド(DL)と呼ばれ、例えば、下記の6つの系を挙げることができる。
【0019】
DL/DR
TNF−α/TNFレセプター1(DR1)
Fasリガンド/Fasレセプター(DR2)
APO−3リガンド/APO−3(DR3)
Trail(APO−2リガンド)/Trailレセプター1(DR4)
Trail(APO−2リガンド)/Trailレセプター2(DR5)
unknown(不明)/DR6
【0020】
すなわち、本発明において、Fasリガンド/Fasレセプター系を介するアポトーシスとは、FasレセプターにFasリガンドが相互作用することにより誘導されるアポトーシスをいう。
【0021】
本発明において、アポトーシスを抑制するとは、本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤をインフルエンザウイルスに感染した個体へ投与した場合に、投与していない場合と比較して、その個体においてアポトーシスを起こす細胞の数が少数となること、またはその個体においてアポトーシスを起こす細胞が確認できなくなることをいう。なお、本発明において「アポトーシスを抑制する」は、「アポトーシスを阻害する」ないし「アポトーシスを阻止する」と交換可能に用いられる。
【0022】
アポトーシスの検出は常法に従い行うことができ、その方法としては、例えば、位相差顕微鏡や電子顕微鏡によりアポトーシス小体の形成などの形態変化を観察する方法、電気泳動により断片化したDNAを検出する方法、TUNEL法(TdT−mediated dUTP−biotin nick end labeling;Tornusciolo D.R.ら、Biotechniques、第19巻、第5号、第800−805頁、1995年、「Simultaneous detection of TDT−mediated dUTP−biotin nick end−labeling (TUNEL)−positive cells and multiple immunohistochemical markers in single tissue sections」)、ISNT(in situ nick translation)法、アネキシンVにより細胞外に露出したフォスファチジルセリンを検出する方法、フローサイトメトリーにより細胞サイズの縮小を検出する方法、single−stranded DNA、cleaved caspase3、cleaved PARP、cleaved Cytokeratin18、cleaved actinなどのアポトーシスで特徴的に生じる分子を認識する抗体による免疫染色方法などを挙げることができる。
【0023】
本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤は、Fasリガンドと相互作用してFasリガンド/Fasレセプター系を介するアポトーシスを抑制する物質を有効成分とする。この物質は、Fasリガンドと相互作用することにより、Fasリガンド/Fasレセプター系を介するアポトーシスの誘導を抑制する。すなわち、本発明において、「相互作用」とは、リガンドとそのリガンドに対するレセプター間において共有結合などにより結合を形成することや、分子間引力により結合を形成することなどをいい、このような相互作用としては、例えば、共有結合性相互作用、静電的結合性相互作用、イオン結合性相互作用、水素結合性相互作用、ファンデルワールス結合性相互作用、疎水性相互作用、親水性相互作用などを挙げることができる。
【0024】
また、本発明において、「ウイルス感染症の治療」とは、「ウイルス感染症を治癒させる(完治させる)」ことの他、例えば、「ウイルス感染症の重症化を抑制する」ことや、「ウイルス感染症の重篤化を抑制する」ことを含む趣旨である。
【0025】
本発明におけるFasリガンドおよびFasレセプターは、ヒト、マウス、ラット、サル(ヒトを除く霊長目)、ヤギ、イヌ、ブタ、モルモット、ウサギ、ヒツジ、ニワトリなどの哺乳類や鳥類のFasリガンドおよびFasレセプターを挙げることができ、本発明に係る治療および/または発症抑制剤を投与する対象に応じて適宜選択することができる。
【0026】
ヒト、マウス、ラットの種間で、FasリガンドおよびFasレセプターのドメインの基本構成およびドメイン内のアミノ酸配列はよく保存されている。例えば、ヒトFasリガンドは、腫瘍壊死因子(tumor necrosis factor;TNF)ファミリーに属する分子量約40kDaの2型膜貫通型タンパク質であり、79アミノ酸の細胞内領域、23アミノ酸の細胞膜貫通領域、179アミノ酸の細胞外領域からなる。細胞外領域にはTNFと顕著な相同性を示す約150アミノ酸のTNF相同ドメインが存在する。TNF相同ドメインは生体内においてタンパク質分解酵素により切り出され、可溶型Fasリガンドとして分泌されることがある。
【0027】
ヒトFasレセプターは、TNF受容体ファミリーに属する分子量約45kDaの1型膜貫通型タンパク質であり、約144アミノ酸の細胞内領域、約22アミノ酸の細胞膜貫通領域、約145アミノ酸の細胞外領域および23アミノ酸のシグナルペプチド配列からなる。細胞内領域にはTNFレセプター1と有意な相同性を示す約70アミノ酸のデスドメインが存在する。デスドメインはアポトーシス誘導において重要であることが報告されている。細胞外領域にはTNF受容体ファミリーに特徴的なシステイン残基に富む配列が3回繰り返されるシステインリッチドメインが存在する。システインリッチドメインにFasリガンドが相互作用すると考えられている。また、スプライシングバリアントとして細胞外領域からなる可溶型Fasレセプターが存在することが知られている。ヒトFasリガンドおよびヒトFasレセプターのアミノ酸配列における各領域および各ドメインを示す模式図を図1に示す。
【0028】
Fasリガンドと相互作用する物質は、Fasリガンド/Fasレセプター系を介するアポトーシスの誘導を抑制する物質である限り、特に限定されない。そのような物質としては、例えば、抗Fasリガンド抗体、可溶型Fasレセプター、Fasレセプター誘導体、Decoy Receptor 3、Decoy Receptor 3誘導体などを挙げることができるが、Fasレセプター誘導体が好ましい。Fasレセプター誘導体としては、例えば、Fasレセプターから細胞膜貫通領域を除いたアミノ酸配列からなるポリペプチド、Fasレセプターからデスドメインを除いたアミノ酸配列からなるポリペプチド、Fasレセプターの細胞外領域からなるポリペプチド、Fasレセプターのシステインリッチドメインからなるポリペプチド、それらのポリペプチドとIgGのFc領域とを結合させた融合タンパク質などを挙げることができるが、Fasレセプターの細胞外領域とIgGのFc領域とを結合させた融合タンパク質(Fas−Fc)が好ましい。
【0029】
本発明において、Fasレセプターの細胞外領域は、Fasリガンドと相互作用するのであれば、その全アミノ酸配列からなるポリペプチドでも、その一部のアミノ酸配列からなるポリペプチドでもよい。
【0030】
ここで、本発明におけるポリペプチドとは、2以上のアミノ酸がペプチド結合により結合してなる化合物のことをいい、構成するアミノ酸数は特に限定されず、例えば、2アミノ酸からなるジペプチド、3アミノ酸からなるトリペプチド、4アミノ酸からなるテトラペプチド、5〜19のアミノ酸からなるペプチド(オリゴペプチド)、20以上のアミノ酸からなるペプチドやタンパク質が包含される。
【0031】
また、本発明において、「1個もしくは数個のアミノ酸が欠失、置換、挿入および/または付加されたアミノ酸配列」というときの、欠失、置換、挿入および/または付加されるアミノ酸の個数は、Fasリガンドと相互作用する限り特に限定されないが、例えば1〜85個、好ましくは1〜51個、より好ましくは1〜34個、さらに好ましくは1〜17個、よりさらに好ましくは1〜9個の任意の個数を挙げることができる。なお、同一あるいは性質の似たアミノ酸配列に相当するのであれば、さらに多くのアミノ酸が置換、挿入、および/または付加されてもよい。
【0032】
すなわち、配列番号8において1個もしくは数個のアミノ酸が欠失、置換、挿入および/または付加されたアミノ酸配列については、FasレセプターのN末端側1〜169番目のアミノ酸からなるポリペプチドと高い同一性を有するアミノ酸配列からなり、かつFasリガンドと相互作用するポリペプチドが含まれる。また、ここにいう「高い同一性」とは、少なくとも50%以上、好ましくは70%以上、より好ましくは80%以上、さらに好ましくは90%以上、最も好ましくは95%以上の配列の同一性を指す。
【0033】
本発明に係る配列番号8において1個もしくは数個のアミノ酸が欠失、置換、挿入および/または付加されたアミノ酸配列からなるポリペプチドには、Fasリガンドと相互作用する機能を有する限り、これらアミノ酸配列の1または複数の保存的アミノ酸置換を有するアミノ酸配列からなるペプチドが包含される。
【0034】
本発明において、保存的アミノ酸置換とは、生じる分子の生理学的活性を変化させることなく一般的になされ得る範囲、すなわち保存的置換の範囲で認められるもの(Watsonら,Molecular Biology of Geneなど)であり、例えば、アスパラギン酸およびグルタミン酸の酸性アミノ酸;リシン、アルギニンおよびヒスチジンの塩基性アミノ酸;アラニン、バリン、ロイシン、イソロイシン、プロリン、フェニルアラニン、メチオニンおよびトリプトファンの非極性アミノ酸;グリシン、アスパラギン、システイン、グルタミン、セリン、トレオニンおよびチロシンの極性無電荷側鎖アミノ酸;フェニルアラニン、トリプトファンおよびチロシンの芳香族アミノ酸といった側鎖に類似性のあるアミノ酸同士(アミノ酸のファミリー内部)で起こる置換を挙げることができる。同様に、アスパラギン酸およびグルタミン酸の酸性アミノ酸;リシン、アルギニンおよびヒスチジンの塩基性アミノ酸、グリシン、アラニン、バリン、ロイシン、イソロイシン、セリンおよびトレオニンの脂肪族アミノ酸(セリンおよびトレオニンの脂肪族−ヒドロキシアミノ酸と分類することもできる);フェニルアラニン、チロシンおよびトリプトファンの芳香族アミノ酸;アスパラギンおよびグルタミンのアミド);システインおよびメチオニンの含硫アミノ酸といった分類をすることができる。
【0035】
本発明におけるIgGは、FasリガンドおよびFasレセプターを用いることができる動物と同様の動物のIgGを挙げることができ、本発明に係る治療および/または発症抑制剤を投与する対象に応じて適宜選択することができる。なお、本実施例においては、好適なIgGとしてヒトのIgGを用いている。また、本発明においてIgGのFc領域には、IgGをパパインにより消化して得られるC末端側のフラグメントに相当するポリペプチドまたはその一部のみならず、IgGをペプシンにより消化して得られるC末端側のフラグメント(Fc’領域)またはその一部も包含される。
【0036】
本発明に係るFas−Fcには、Fasリガンドと相互作用することにより、Fasリガンド/Fasレセプター系を介するアポトーシスの誘導を抑制する機能を損なわない限り、他のアミノ酸配列、糖鎖、標識物質などが修飾されていてもよい。
【0037】
本発明において、Fas−Fcの作製は常法に従い行うことができ、例えば、Fasレセプターの細胞外領域に相当するcDNAとIgGのFc領域に相当するcDNAとを翻訳フレームが合うように適当な発現ベクターに挿入し、この発現ベクターを導入した細胞を培養してFas−Fcを分泌させ、培養上清からFas−Fcを精製することにより行うことができる。発現ベクターやこれを導入する細胞は、Fas−Fcの必要量や精製方法などに応じて適宜選択して用いることができる。また、Fas−Fcの精製は、protein Aに対するFcタンパク質の親和性を利用したアフィニティークロマトグラフィーにより簡便に行うことができるが、その他、例えば、硫安塩析法、HPLC、イオン交換クロマトグラフィー、ゲル濾過クロマトグラフィーなどの公知の方法を適宜選択し、またはこれらを組み合わせることにより行うことができる。
【0038】
本発明において、インフルエンザウイルス感染症の治療および/または発症抑制剤の治療効果や発症抑制効果は、常法に従い確認することができ、例えば、対象がインフルエンザウイルスに感染した培養細胞群であれば、本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤を投与した場合に、投与していない場合と比較して、その培養細胞群においてアポトーシスを起こす細胞の数が減少すること、またはその培養細胞群においてアポトーシスを起こす細胞が確認できなくなることを、対象がインフルエンザウイルスに感染した個体であれば、本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤を投与した場合に、投与していない場合と比較して、その個体の体重減少率や生存率が改善することを、特に、インフルエンザウイルスに感染したヒトであれば、本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤を投与した場合に、投与していない場合と比較して、そのヒトにおいて発熱や倦怠感、悪寒、体の痛み、鼻炎、咽頭炎などの諸症状が緩和することやそのヒトの生存率が改善することを、それぞれ確認することなどにより行うことができる。
【0039】
なお、本発明において、「発症を抑制する」は、「発症を予防する」、「発症を防止する」、「発症を阻止する」、「発症を阻害する」と交換可能に用いられる場合があり、「相互作用する」は、「結合する」、「反応する」、「接続する」、「接着する」、「接触する」、「連結する」と交換可能に用いられる場合がある。
【0040】
本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤の製剤化には、当業者に公知の方法を用いることができる。投与形態もまた、当業者によって適宜選択することができる投与形態でよく、そのような投与形態としては、例えば、経口投与製剤として調製する場合の、錠剤、顆粒剤、散剤、カプセル剤、コーティング剤、液剤、懸濁剤などの形態を挙げることができ、非経口投与製剤にする場合の、吸入剤、注射剤、点滴剤、座薬、塗布剤、噴霧剤、貼付剤などの形態を挙げることができる。また、その投与量は、医薬組成物の製剤形態、投与方法、使用目的およびこれに適用される投与対象の年齢、体重、症状によって適宜設定することができる。
【0041】
以下、本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤について、実施例に基づいて説明する。なお、本発明の技術的範囲は、これらの実施例によって示される特徴に限定されない。
【実施例】
【0042】
<実施例1>インフルエンザウイルスを接種したマウスの生存率の確認
(1)ウイルス液の調製
北海道大学の高田礼人氏から供与されたインフルエンザウイルスA/Puerto Rico/8/34(H1N1;PR8)を、リン酸緩衝生理食塩水(PBS)を用いて希釈することにより、それぞれ1×103pfu/50μL、1×105pfu/50μLおよび1×107pfu/50μLのウイルス液を調製した。
【0043】
(2)マウスへのインフルエンザウイルスの接種
6週齢の雄のC57BL/6マウス(C57BL/6−WT/WT;ホクドー社)9個体を、北海道大学人獣共通感染症リサーチセンター内P2動物感染実験室で1週間飼育することにより馴化させた。続いて、イソフルラン(大日本住友製薬社)を吸入させて麻酔をかけた後、3個体ずつ3群に分け、A群、B群およびC群とした。A群、B群およびC群に、それぞれ本実施例(1)の1×103pfu/50μLのウイルス液、1×105pfu/50μLのウイルス液および1×107pfu/50μLのウイルス液を、50μL/1個体、経鼻的に投与することにより、PR8ウイルスを接種した。
【0044】
(3)インフルエンザウイルスを接種したマウスの生存率の確認
本実施例(2)の各群について、PR8ウイルスを接種した日を0日目として12日目まで飼育して毎日生存個体数を確認し、各群における0日目の生存個体数に対する各日の生存個体数の割合を百分率で求め、生存率とした。その結果を図2に示す。
【0045】
図2に示すように、A群の生存率は、0日目から8日目までは100%、9日目から12日目までは66.7%であり、B群の生存率は、0日目から5日目までは100%、6日目は66.7%、7日目は33.3%、8日目以降は0%であり、C群の生存率は、0日目から5日目までは100%、6日目から8日目までは66.7%、9日目から12日目までは33.3%であった。
【0046】
これらの結果から、マウスに1×105pfuのインフルエンザウイルスを接種することにより致死することが確認され、1×105pfuのインフルエンザウイルスを接種したマウスを致死性のウイルス感染モデル(致死性感染モデルマウス)とした。
【0047】
<実施例2>インフルエンザウイルス感染症の重症度とマウスFas(mFas)およびマウスFasリガンド(mFasL)のmRNA発現量との相関の確認
(1)ウイルス液の調製
実施例1(1)に記載の方法により、1×102pfu/50μLのPR8ウイルスのウイルス液を調製した。
【0048】
(2)マウスの体重量の測定および肺の採取
6週齢の雄のC57BL/−WT/WT(ホクドー社)30個体について、各個体の体重量を測定した。またその30個体のうち3個体から肺を採取した。
【0049】
(3)マウスへのインフルエンザウイルスの接種
本実施例(2)の27個体について、実施例1(2)に記載の方法に従い、麻酔後に12個体と15個体との2群に分け、12個体をA群、15個体をB群とし、A群には本実施例(1)で調製した1×102pfu/50μLのウイルス液を、B群には本実施例1(1)で調製した1×105pfu/50μLのウイルス液をそれぞれ投与することにより、PR8ウイルスを接種し、非致死性感染モデルマウス(A群)および致死性感染モデルマウス(B群)とした。
【0050】
(4)インフルエンザウイルスを接種したマウスの体重量の測定および肺の採取
本実施例(3)の各群について、PR8ウイルスを接種した日を0日目として6日目まで飼育して、1日目から6日目まで毎日各個体の体重量を測定した。また、1日目から6日目まで毎日、A群においては2個体、B群においては3個体からそれぞれ肺を採取した。
【0051】
(5)インフルエンザウイルスを接種したマウスの体重減少率の確認
本実施例(2)および(4)で測定した体重量および次式に基づいて体重減少率を求め、各群についてその平均値を算出した。なお、本実施例(2)で測定した体重量を0日目の体重量とした。その結果を図3のaに示す。
体重減少率={(0日目の体重量)−(各日の体重量)/(0日目の体重量)}×100
【0052】
図3のaに示すように、A群の体重減少率は、0日目から5日目までは約0%であり、6日目は約10%であった。一方、B群の体重減少率は、0日目および1日目は約0%であり、2日目は約10%、3日目は約15%、4日目は約20%、5日目は約25%であった。なお、6日目において、B群のすべての個体が致死した。
【0053】
これらの結果から、致死性感染モデルマウスでは、インフルエンザウイルス接種後から致死するまで、経過日数に比例して体重減少率が増大することが確認された。すなわち、体重減少率がインフルエンザウイルス感染症の重症度の指標となることが示された。
【0054】
(6)インフルエンザウイルスを接種したマウスのFas(mFas)およびFasL(mFasL)のmRNA発現量の検討
本実施例(4)で採取した各個体の肺を、速やかにRNA抽出溶解液(TRIzol Reagent;Invitrogen社)中で破砕した後、付属の使用書に従ってtotal RNAを抽出した。
【0055】
抽出したtotal RNAを鋳型として、付属の使用書に従い、RevaTra Ace(東洋紡社)を用いて逆転写反応を行うことにより各個体の肺のcDNAを得た。
【0056】
このcDNAを鋳型として、リアルタイムPCR装置Mx3000P QPCR System(Stratagene社)および試薬SYBR Premix Ex TaqII(Perfect Real Time;タカラバイオ社)を用いて、付属の使用書に従ってリアルタイムPCR法を行うことにより、各個体の肺におけるマウスFasリガンド(mFasL)、マウスFas(mFas)およびマウスグリセルアルデヒド3リン酸脱水素酵素(mGAPDH)のmRNA発現量を測定した。リアルタイムPCRに用いたプライマーは下記のとおりである。
【0057】
mFasLの増幅に用いたプライマー:
センスプライマー;5’−AAGAAGGACCACAACACAAATCTG−3’(配列番号1)
アンチセンスプライマー;5’−CCCTGTTAAATGGGCCACACT−3’(配列番号2)
mFasの増幅に用いたプライマー:
センスプライマー;5’−GAAGATGCACACTCTGCGATGAA−3’(配列番号3)
アンチセンスプライマー;5’−TCGCAGTAGAAGTCTGGTTTGCAC−3’(配列番号4)
mGAPDHの増幅に用いたプライマー:
センスプライマー;5’−AAGGGCTCATGACCACAGTC−3’(配列番号5)
アンチセンスプライマー;5’−GGATGCAGGGATGATGTTCT−3’(配列番号6)
【0058】
測定したmFasLおよびmFasのmRNA発現量の値を、mGAPDHのmRNA発現量の値でそれぞれ除することにより補正した後、各日におけるmFasLおよびmFasのmRNA発現量を、0日目のmFasLおよびmFasのmRNA発現量を1として各日におけるmFasLおよびmFasのmRNA発現量の相対値を算出し、この相対値の各群における平均値(N=2〜3)を算出した。mFasLについての結果を図3のbに、mFasについての結果を図3のcにそれぞれ示す。
【0059】
図3のbに示すように、A群におけるmFasLのmRNA発現量は、0日目から3日目までは約1であり、4日目は約2.5、5日目は約4.4、6日目は約5.5であった。これに対し、B群におけるmFasLのmRNA発現量は、0日目および1日目は約1であり、2日目および3日目は約6、4日目は約5.5、5日目は約8であった。これらの結果から、致死性感染モデルマウスでは、インフルエンザウイルス接種後から致死するまで、経過日数に比例して肺中FasLのmRNA発現量が増大することが確認された。すなわち、ウイルス感染症の重症度が高いほど肺中FasLのmRNA発現量が大きいという相関関係が成立することが示された。
【0060】
また、図3のcに示すように、A群およびB群におけるmFasのmRNA発現量は、0日目から6日目までのいずれも2未満であった。これらの結果から、非致死性感染モデルマウスと致死性感染モデルマウスのいずれにおいても、ウイルス接種後の経過日数に関わらず、mFasのmRNA発現量が同程度であることが確認された。すなわち、ウイルス感染症の重症度と肺中FasのmRNA発現量とは相関しないことが示された。
【0061】
<実施例3>インフルエンザウイルスを接種したFasL機能喪失型変異マウスの生存率の確認
6週齢の雄のC57BL/6−WT/WT(ホクドー社)10個体およびCs7BL/6−WT/WTのFasL機能喪失型変異マウスであるC57BL/6−gld/gld(gldマウス;日本チャールス・リバー社)10個体について、実施例1(2)に記載の方法に従い、麻酔後にコントロールA群、コントロールB群、変異型A群および変異型B群の4群に分け、コントロールA群および変異型A群には実施例2(1)で調製した1×102pfu/50μLのウイルス液を、コントロールB群および変異型B群には実施例1(1)で調製した1×105pfu/50μLのウイルス液をそれぞれ投与することにより、PR8ウイルスを接種した。コントロールA群、コントロールB群、変異型A群および変異型B群の構成は下記のとおりである。
コントロール型A群;C57BL/6WT/WT 5個体、1×102pfu/個体
コントロール型B群;C57BL/6WT/WT 5個体、1×105pfu/個体
変異型A群 ;gldマウス 5個体、1×102pfu/個体
変異型B群 ;gldマウス 5個体、1×105pfu/個体
【0062】
その後、実施例1(3)に記載の方法により、0日目から19日目まで飼育して各群の生存率を求めた。その結果を図4に示す。
【0063】
図4に示すように、コントロールB群の生存率は、6日目は60%、7日目は40%、8日目以降は0%であったのに対し、変異型B群の生存率は、6日目は80%、7日目以降19日目までは60%であった。また、コントロールA群および変異型A群の生存率は0日目から19日目まで100%であった。
【0064】
これらの結果から、FasLの機能を抑制することにより、致死性感染モデルマウスの生存率が上昇することが確認された。
【0065】
<実施例4>インフルエンザウイルスを接種したgldマウスのアポトーシス誘導細胞の観察
6週齢の雄のC57BL/6−WT/WT(ホクドー社)6個体および6週齢の雄のgldマウス(日本チャールス・リバー社)6個体について、実施例1(2)に記載の方法に従い、実施例1(1)で調製した1×105pfu/50μLのウイルス液をそれぞれ投与することにより、PR8ウイルスを接種し、それぞれコントロール群および変異型群とした。
【0066】
次に、PR8ウイルスを接種した日を0日目として4日目まで飼育し、2日目、3日目および4日目に、各群につき2個体から肺を採取した。採取した肺は、速やかに10%中性緩衝ホルマリン溶液に浸漬し、4℃で2週間静置することにより固定を行った。その後、常法に従って肺のパラフィン切片を作製し、札幌総合病理研究所社に委託してTUNEL法(TdT−mediated dUTP−biotin nick end labeling)により染色した。染色したパラフィン切片について、ECLIPSE80i(Nikon社)を用いて観察を行った。細気管支周辺および肺血管周辺を撮影して作成した写真図を図5に、拡大撮影して作成した写真図を図6に、それぞれ示す。
【0067】
図5に示すように、コントロール群では、2日目には陽性シグナルが検出されず、3日目に気管支へ浸潤する好中球および肺上皮細胞において陽性シグナルが検出され、4日目に、肺胞間質の顕著な肥厚部分において陽性シグナルが検出された。これに対し、変異型群では、2日目には陽性シグナルが検出されず、3日目に気管支へ浸潤する好中球において陽性シグナルが検出されたが、肺上皮細胞では陽性シグナルが検出されなかった。また、4日目には、肺胞間質の肥厚部分においてTUNEL染色陽性シグナルが検出されたが、その肥厚の程度は軽微であった。
【0068】
また、図6に示すように、コントロール群では、3日目には陽性シグナルが検出されず、4日目に肺血管に浸潤する細胞に強い陽性シグナルが検出された。これに対し、変異型群では、3日目には陽性シグナルが検出されず、4日目には肺血管に浸潤する細胞が認められるものの、これらの細胞における陽性シグナルは検出されなかった。
【0069】
これらの結果から、FasLの機能を抑制することにより、インフルエンザウイルスの感染に伴う肺組織におけるアポトーシスを抑制できることが示された。
【0070】
<実施例5>インフルエンザウイルスを接種したFasL機能喪失型変異マウスの肺におけるウイルス量の確認
6週齢の雄のC57BL/6−WT/WT(ホクドー社)6個体および6週齢の雄のgldマウス(日本チャールス・リバー社)6個体について、実施例1(2)に記載の方法に従い、実施例1(1)で調製した1×105pfu/50μLのウイルス液をそれぞれ投与することにより、PR8ウイルスを接種し、それぞれコントロール群および変異型群とした。
【0071】
次に、PR8ウイルスを接種した日を0日目として5日目まで飼育し、3日目、4日目および5日目に、各群につき2個体から肺を採取した。採取した肺は、重量を測定した後、ビーズ式細胞破砕装置MS−100R(トミー精工社)を用いて下記の条件により破砕して破砕液を得た。
【0072】
1mmジルコニアビーズ
5mmステンレスビーズ
2mLサンプルチューブ
3500rpm、30秒間を1セットとして2セット
【0073】
得られた破砕液を、12穴プレートで単層培養したMadin−Darby canine kidney(MDCK)細胞群(JCRB細胞バンク:JCRB9029)に添加して、37℃で1時間培養した。続いて、培養上清を除去し、Bact−agar1%(w/v)およびトリプシン5μg/mLを含むMEM培地(インビトロジェン社)を添加して、35℃、CO25%(v/v)を含む加湿環境下にて2日間培養し、出現したプラークを数え、肺組織重量に対するウイルス量の割合(pfu/g)を求めた。その結果を図7に示す。
【0074】
図7に示すように、3日目、4日目および5日目のいずれにおいても、コントロール群と変異型群とではウイルス量の割合がほぼ同じであった。これらの結果から、FasLの機能を抑制した場合とFasLの機能を抑制しない場合とでは、肺の中のインフルエンザウイルスのウイルス増幅量はほとんど変わらないことが確認された。
【0075】
<実施例6>インフルエンザウイルスを接種した後にFasの細胞外領域とIgGのFc領域との融合タンパク質を投与したマウスの生存率の確認
(1)Fasの細胞外領域とIgGのFc領域との融合タンパク質の調製
[1−1]ベクターの調製
mFasの細胞外領域であるアミノ酸配列1番目〜169番目(配列番号8)に相当する塩基配列(アクセッション番号NM007987;配列番号7)とヒトIgGのFc領域(配列番号10)に相当する塩基配列(アクセッション番号Z17370;配列番号9)とを、翻訳フレームが合うように繋げて得られる融合タンパク質(mFas−Fc;配列番号12)に相当する塩基配列(配列番号11)を有するDNA断片を調製した。具体的には、mFasの細胞外領域であるアミノ酸1番目〜169番目に相当する塩基配列(配列番号7)とヒトIgGのFc領域に相当する塩基配列とを、BamHIサイトを付加したプライマーを用いて、それぞれマウス末梢リンパ細胞およびヒト末梢リンパ細胞cDNAライブラリーよりPCR法にて増幅し、翻訳フレームが合うように連結させることにより調製した。得られたDNA断片を制限酵素KpnIおよびXbaIで消化した後、pcDNA3(Invitrogen社)のKpnI/XbaIサイトに挿入し、pcDNA3−mFas−Fcを得た。
【0076】
[1−2]HEK293T細胞へのベクターの導入
本実施例(1)[1−1]のpcDNA3.1−mFas−Fcおよびピューロマイシン耐性遺伝子が挿入されたベクターpGL4.1(Promega社)を1:1の重量比の割合で含むベクター液を調製した。このベクター液に含まれるベクターを、遺伝子病制御研究所の上出利光氏より供与されたヒト胎児腎線維芽細胞由来株HEK293T細胞に、Lipofectamine 2000 Reagentを用いて導入した。
【0077】
その後、胎児牛血清(FBS;Cansera社)を10%(v/v)含むDulbecco’s modified Eagle’s medium(DMEM培地;シグマ社)で、37℃、CO25%(v/v)を含む加湿環境下にて2日間培養した。次に、培地にピューロマイシン(CAYLA社)を3μg/mLとなるよう添加してさらに約2週間培養し、耐性細胞を得た。続いて、得られた耐性細胞について、mFas−Fc/HEK293T細胞とした。
【0078】
[1−3]mFas−Fcの精製
本実施例(1)[1−2]のmFas−Fc/HEK293T細胞を、poly−L−lysinでコートした培養面積150cm2の細胞培養フラスコ(北海道和光純薬社)にて、本実施例(1)[1−2]に記載の条件下でサブコンフルエントの状態まで約24時間培養した。
【0079】
続いて、培養液を除去してPBSで洗浄を4回行った後、GlutaMAX−I Supplement(Invitrogen社)を2%(v/v)含むCD293Medium(Invitrogen社)50mLを添加して37℃、CO25%(v/v)を含む加湿環境下にて2週間培養した。
【0080】
その後、培養上清を回収し、3500×g、4℃の条件下で15分間遠心分離を行って上清を得た。得られた上清を、0.45umのフィルター(Millex−HV;ミリポア社)を用いて濾過し、濾過液を得た。
【0081】
次に、4℃の環境下でprotein A結合アガロースゲル1mLを充填したアフィニティーカラム(HiTrap rProtein A FF;GEヘルスケア社)に濾過液を通した後、5mLのPBSを用いて洗浄した。続いて、0.1mol/Lのglycine−HCl(pH3)5mLを添加して、0.5mLずつ、計10フラクションの溶出液を回収した。各溶出液には速やかに1mol/LのTris−HCl(pH9)15μLを加えて中和した。
【0082】
続いて、各溶出液について波長280nmの吸光度を測定することによりタンパク質濃度を求め、タンパク質濃度が200ug/mL以上である溶出液を選択し、計約1mgのmFas−Fcを得た。これら選択した溶出液は、−80℃で保存した。
【0083】
[1−4]mFas−Fcの大量調製
本実施例(1)[1−3]の操作を繰り返して、15mgのmFas−Fcを含む溶出液を得た。PBSを透析液として、Slide−A−Lyzer Dialysis Cassettes 10k MWCO(Thermo Scientific Pierce社)を用いて、4℃で二晩透析し、mFas−Fc溶液30mLを得た。透析中、透析液の交換を3回行った。得られたmFas−Fc溶液は−80℃で保存した。
【0084】
(2)インフルエンザウイルスを接種した後、mFas−Fcを投与したマウスの生存率の確認
[2−1]マウスへのインフルエンザウイルスの接種
6週齢の雄のC57BL/6−WT/WT(ホクドー社)15個体について、実施例1(2)に記載の方法に従い、麻酔後に5個体ずつ3群に分け、100μg投与群、50μg投与群およびコントロール群として、実施例1(1)で調製した1×105pfu/50μLのウイルス液をそれぞれ投与することにより、PR8ウイルスを接種した。
【0085】
[2−2]mFas−Fcの投与
本実施例(1)[1−4]のmFas−Fc溶液を、PBSを用いて希釈することにより、500μg/mLのmFas−Fc溶液および250μg/mLのmFas−Fc溶液を調製した。本実施例(2)[2−1]の各群について、PR8ウイルスを接種した日を0日目として19日目まで飼育した。この際、0日目から4日目まで、100μg投与群には500μg/mLのmFas−Fc溶液0.2mL(100μg相当)/1個体を腹腔内に1回/日(計5回)投与し、50μg投与群には250μg/mLのmFas−Fc溶液0.2mL(50μg相当)/1個体を腹腔内に1回/隔日(計3回)投与し、コントロール群にはPBS0.2mL/1個体を腹腔内に1回/日(計5回)投与した。
【0086】
[2−3]インフルエンザウイルスを接種した後、mFas−Fcを投与したマウスの生存率の確認
本実施例(2)[2−2]の各群について、実施例1(3)に記載の方法により生存率を求めた。その結果を図8に示す。
【0087】
図8に示すように、100μg投与群の生存率は、mFas−Fcの投与以降、5日目および6日目は60%、7日目から19日目までは40%であった。50μg投与群の生存率は、mFas−Fcの投与以降、5日目は80%、6日目から19日目までは20%であった。これに対し、コントロール群の生存率は、PBSの投与以降、5日目は40%、6日目は20%、7日目以降は0%であった。
【0088】
これらの結果から、mFas−Fcを投与することにより、致死性感染モデルマウスの生存率の上昇が確認された。
【技術分野】
【0001】
本発明は、Fasリガンド/Fasレセプター系を介するアポトーシスを抑制するインフルエンザウイルス感染症の治療および/または発症抑制剤に関し、より詳細には、Fasリガンドと相互作用する物質を有効成分とするインフルエンザウイルス感染症の治療および/または発症抑制剤に関する。
【背景技術】
【0002】
アポトーシスは細胞死の一種であり、細胞の縮小、クロマチンの凝集、核の断片化、細胞の断片化、周辺細胞やマクロファージによる断片化した細胞(アポトーシス小体)の貪食といった一連の形態変化に特徴付けられる。アポトーシスは、特定のシグナル伝達タンパク質やカスパーゼ類、エンドヌクレアーゼ類の秩序立った機能発現によって起こる、能動的な細胞死である。
【0003】
アポトーシスは、個体の発生過程においてはさまざまな臓器や気管の形態形成や細胞数の調整に寄与し、成体においては癌細胞やウイルス感染細胞の除去など組織の恒常性の維持に寄与する重要なシステムであり、その過剰や低下は、ウイルス感染症や癌、自己免疫疾患などの様々な疾患に関与する。
【0004】
アポトーシスが関与する疾患の一つとして、インフルエンザウイルス感染症を挙げることができる。インフルエンザウイルスを感染させた培養細胞では、アポトーシスが起こること(非特許文献1)やアポトーシス誘導因子であるFasリガンドのmRNA発現量が増大すること(非特許文献2、3)、インフルエンザウイルスを感染させた動物体内でアポトーシスが観察されること(非特許文献4)などから、インフルエンザウイルス感染症ではアポトーシスが促進されることが確認されている。インフルエンザウイルス感染症におけるアポトーシスが生体防御反応によるものか、ウイルス複製によるものかは未だ議論されているところであるが、いずれにしても過剰なアポトーシスは身体にダメージを与えることから、インフルエンザウイルス感染症の発症や症状悪化の原因となると考えられている。
【0005】
従来、インフルエンザウイルス感染症に対する予防剤や治療剤として、弱毒化または不活化したインフルエンザウイルスを宿主に取り込ませて獲得させた免疫を利用するインフルエンザワクチンや、インフルエンザウイルス表面に存在する酵素ノイラミニダーゼの働きを阻害するオセルタミビル(商品名タミフル;ロシュ社)、ザナミビル(商品名リレンザ;グラクソ・スミスクライン社)の他、インフルエンザウイルスのM2タンパク質を阻害するアマンタジン(商品名シンメトレル;ノバルティスファーマ社)が開発され、市販されている。また、国際公開WO2007/105565号パンフレットには、インフルエンザウイルスのヘマグルチニンに親和性の高いペプチドからなるインフルエンザウイルス感染阻害ペプチド(特許文献1)が、特開2007−533595号には、アポトーシス誘導機構であるTrailリガンド/Trailレセプター系を阻害するインフルエンザウイルス感染症の予防・治療剤(特許文献2)が開示されている。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Takizawa Y.ら、J.Gen.Virol.、第74巻、第2347−2355頁、1993年
【非特許文献2】Wada N.ら、J.B.C.、第270巻、18007−18012頁、1995年
【非特許文献3】Fujimoto I.ら、Cell Death Differ.ら、第5巻、第426−431頁、1998年
【非特許文献4】Mori I.ら、J.Gen.Virol.、第76巻、第2869−2873頁、1995年
【特許文献】
【0007】
【特許文献1】国際公開WO2007/105565号パンフレット
【特許文献2】特開2007−533595号
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、インフルエンザワクチン、オセルタミビル、ザナミビル、アマンタジン、特許文献1に開示されているインフルエンザウイルス感染阻害ペプチドは、いずれもインフルエンザウイルス本体に由来するタンパク質を標的としているため、亜型への効果が期待できず、また、変異体の出現により耐性獲得が生じやすいという問題点を抱えている。例えば、現在日本で使用されている季節性インフルエンザに対するワクチンは、先行するオーストラリアでの流行株の情報に基づき、日本で流行すると予想された株に対して作製されるため、毎年不安定であるうえ、この予測が外れた場合や変異体が生じた場合には、対応が困難となっている。また、特許文献2に開示されているインフルエンザウイルス感染症の予防・治療剤は、培養細胞でインフルエンザウイルスの増殖を抑制することが示されているに過ぎず、動物個体でインフルエンザウイルスの増殖を抑制することも、インフルエンザウイルスの増殖を抑制することが、個体の体重減少率や致死率の改善などのインフルエンザウイルス感染症における諸症状の予防や治療につながることも、具体的に示されていない。
【0009】
さらに、非特許文献1〜非特許文献4には、Fasリガンド/Fasレセプター系を介するアポトーシスを抑制してインフルエンザウイルス感染症の治療や発症抑制をすることができる、すなわちアンタゴニストとして用いることができるFasリガンドと相互作用する物質についての記載や示唆はない。
【0010】
本発明は、上述の問題点を解決するためになされたものであって、亜型や変異体の出現などのインフルエンザウイルス側の変化に影響されることなく、インフルエンザウイルス感染症の治療や発症抑制をすることができる、インフルエンザウイルス感染症の治療および/または発症抑制剤を提供することを目的としている。
【課題を解決するための手段】
【0011】
本発明者らは、鋭意研究の結果、宿主細胞側の因子であるFasリガンドの機能を具体的に抑制することにより、インフルエンザウイルスに感染したマウスのアポトーシスが抑制されて生存率が上昇することを見出し、下記の各発明を完成した。
【0012】
(1)Fasリガンド/Fasレセプター系を介するアポトーシスを抑制するインフルエンザウイルス感染症の治療および/または発症抑制剤であって、Fasリガンドと相互作用する物質を有効成分とする前記剤。
【0013】
(2)Fasリガンドと相互作用する物質が、Fasレセプターの細胞外領域とIgGのFc領域とを結合させた融合タンパク質Fas−Fcである、(1)に記載の剤。
【0014】
(3)Fasレセプターの細胞外領域が、配列番号8のアミノ酸配列からなるポリペプチドまたは配列番号8において1個もしくは数個のアミノ酸が欠失、置換、挿入および/または付加されたアミノ酸配列であってFasリガンドと相互作用するポリペプチドである、(2)に記載の剤。
【発明の効果】
【0015】
本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤によれば、亜型や変異体の出現などのインフルエンザウイルス側の変化に影響されることなく、さまざまなインフルエンザウイルス株によるインフルエンザウイルス感染症に対する治療や発症抑制をすることができる。
【図面の簡単な説明】
【0016】
【図1】ヒトFasリガンドおよびヒトFasレセプターのアミノ酸配列における各領域および各ドメインを示す模式図である。
【図2】1×103pfuのインフルエンザウイルスを接種したマウス(A群)、1×105pfuのインフルエンザウイルスを接種したマウス(B群)および1×107pfuのインフルエンザウイルスを接種したマウス(C群)の、接種後の経過日数と生存率との関係を示すグラフである。
【図3】1×102pfuのインフルエンザウイルスを接種したマウス(A群)および1×105pfuのインフルエンザウイルスを接種したマウス(B群)の、接種後の経過日数と体重減少率との関係を示すグラフ(a)、1×102pfuのインフルエンザウイルスを接種したマウス(A群)および1×105pfuのインフルエンザウイルスを接種したマウス(B群)のFasL(mFasL)のmRNA発現量と接種後の経過日数と体重減少率との関係を示すグラフ(b)、1×102pfuのインフルエンザウイルスを接種したマウス(A群)および1×105pfuのインフルエンザウイルスを接種したマウス(B群)のFas(mFas)のmRNA発現量と接種後の経過日数と体重減少率との関係を示すグラフ(c)である。
【図4】1×102pfuのインフルエンザウイルスを接種したC57BL/6マウス(コントロールA群)、1×105pfuのインフルエンザウイルスを接種したC57BL/6マウス(コントロールB群)、1×102pfuのインフルエンザウイルスを接種したgldマウス(変異型A群)および1×105pfuのインフルエンザウイルスを接種したgldマウス(変異型B群)の接種後の経過日数と生存率との関係を示すグラフである。
【図5】1×105pfuのインフルエンザウイルスを接種したC57BL/6マウス(コントロール群)および1×105pfuのインフルエンザウイルスを接種したgldマウス(変異型群)の肺をTUNEL法により染色し、細気管支周辺を撮影した写真図である。図中、茶色で示される細胞は、アポトーシス陽性細胞を示す。
【図6】1×105pfuのインフルエンザウイルスを接種したC57BL/6マウス(コントロール群)および1×105pfuのインフルエンザウイルスを接種したgldマウス(変異型群)の肺をTUNEL法により染色し、肺血管周辺を拡大して撮影した写真図である。図中、「V」で示される箇所は肺血管内腔を示し、茶色で示される細胞は、アポトーシス陽性細胞を示す。
【図7】インフルエンザウイルスを接種したC57BL/6マウス(コントロール群)およびインフルエンザウイルスを接種したgldマウス(変異型群)の肺におけるウイルス量について、プラークアッセイにより求めたウイルス量の割合と接種経過日数との関係を示すグラフである。
【図8】インフルエンザウイルスを接種した後、融合タンパク質であるmFas−Fcを100μg/個体投与したマウス(100μg投与群)、mFas−Fcを50μg/個体投与したマウス(50μg投与群)およびPBSを投与したマウス(コントロール群)の生存率を示すグラフである。図中、横軸における●はmFas−Fcを100μg/個体投与した日を示し、△はmFas−Fcを50μg/個体投与した日を示す。
【発明を実施するための形態】
【0017】
以下、本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤について詳細に説明する。本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤は、Fasリガンド/Fasレセプター系を介するアポトーシスを抑制する。
【0018】
一般にアポトーシスが起こる機構としては、個体発生のプログラムに組み込まれたものや物理化学的ストレスにより誘導される機構のほか、特定のレセプターにリガンドが結合し、一連の細胞内シグナル伝達経路が活性化されて起こる機構(系)が知られている。アポトーシスを誘導するレセプターおよびそのリガンドはそれぞれ、デスレセプター(DR)およびデスリガンド(DL)と呼ばれ、例えば、下記の6つの系を挙げることができる。
【0019】
DL/DR
TNF−α/TNFレセプター1(DR1)
Fasリガンド/Fasレセプター(DR2)
APO−3リガンド/APO−3(DR3)
Trail(APO−2リガンド)/Trailレセプター1(DR4)
Trail(APO−2リガンド)/Trailレセプター2(DR5)
unknown(不明)/DR6
【0020】
すなわち、本発明において、Fasリガンド/Fasレセプター系を介するアポトーシスとは、FasレセプターにFasリガンドが相互作用することにより誘導されるアポトーシスをいう。
【0021】
本発明において、アポトーシスを抑制するとは、本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤をインフルエンザウイルスに感染した個体へ投与した場合に、投与していない場合と比較して、その個体においてアポトーシスを起こす細胞の数が少数となること、またはその個体においてアポトーシスを起こす細胞が確認できなくなることをいう。なお、本発明において「アポトーシスを抑制する」は、「アポトーシスを阻害する」ないし「アポトーシスを阻止する」と交換可能に用いられる。
【0022】
アポトーシスの検出は常法に従い行うことができ、その方法としては、例えば、位相差顕微鏡や電子顕微鏡によりアポトーシス小体の形成などの形態変化を観察する方法、電気泳動により断片化したDNAを検出する方法、TUNEL法(TdT−mediated dUTP−biotin nick end labeling;Tornusciolo D.R.ら、Biotechniques、第19巻、第5号、第800−805頁、1995年、「Simultaneous detection of TDT−mediated dUTP−biotin nick end−labeling (TUNEL)−positive cells and multiple immunohistochemical markers in single tissue sections」)、ISNT(in situ nick translation)法、アネキシンVにより細胞外に露出したフォスファチジルセリンを検出する方法、フローサイトメトリーにより細胞サイズの縮小を検出する方法、single−stranded DNA、cleaved caspase3、cleaved PARP、cleaved Cytokeratin18、cleaved actinなどのアポトーシスで特徴的に生じる分子を認識する抗体による免疫染色方法などを挙げることができる。
【0023】
本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤は、Fasリガンドと相互作用してFasリガンド/Fasレセプター系を介するアポトーシスを抑制する物質を有効成分とする。この物質は、Fasリガンドと相互作用することにより、Fasリガンド/Fasレセプター系を介するアポトーシスの誘導を抑制する。すなわち、本発明において、「相互作用」とは、リガンドとそのリガンドに対するレセプター間において共有結合などにより結合を形成することや、分子間引力により結合を形成することなどをいい、このような相互作用としては、例えば、共有結合性相互作用、静電的結合性相互作用、イオン結合性相互作用、水素結合性相互作用、ファンデルワールス結合性相互作用、疎水性相互作用、親水性相互作用などを挙げることができる。
【0024】
また、本発明において、「ウイルス感染症の治療」とは、「ウイルス感染症を治癒させる(完治させる)」ことの他、例えば、「ウイルス感染症の重症化を抑制する」ことや、「ウイルス感染症の重篤化を抑制する」ことを含む趣旨である。
【0025】
本発明におけるFasリガンドおよびFasレセプターは、ヒト、マウス、ラット、サル(ヒトを除く霊長目)、ヤギ、イヌ、ブタ、モルモット、ウサギ、ヒツジ、ニワトリなどの哺乳類や鳥類のFasリガンドおよびFasレセプターを挙げることができ、本発明に係る治療および/または発症抑制剤を投与する対象に応じて適宜選択することができる。
【0026】
ヒト、マウス、ラットの種間で、FasリガンドおよびFasレセプターのドメインの基本構成およびドメイン内のアミノ酸配列はよく保存されている。例えば、ヒトFasリガンドは、腫瘍壊死因子(tumor necrosis factor;TNF)ファミリーに属する分子量約40kDaの2型膜貫通型タンパク質であり、79アミノ酸の細胞内領域、23アミノ酸の細胞膜貫通領域、179アミノ酸の細胞外領域からなる。細胞外領域にはTNFと顕著な相同性を示す約150アミノ酸のTNF相同ドメインが存在する。TNF相同ドメインは生体内においてタンパク質分解酵素により切り出され、可溶型Fasリガンドとして分泌されることがある。
【0027】
ヒトFasレセプターは、TNF受容体ファミリーに属する分子量約45kDaの1型膜貫通型タンパク質であり、約144アミノ酸の細胞内領域、約22アミノ酸の細胞膜貫通領域、約145アミノ酸の細胞外領域および23アミノ酸のシグナルペプチド配列からなる。細胞内領域にはTNFレセプター1と有意な相同性を示す約70アミノ酸のデスドメインが存在する。デスドメインはアポトーシス誘導において重要であることが報告されている。細胞外領域にはTNF受容体ファミリーに特徴的なシステイン残基に富む配列が3回繰り返されるシステインリッチドメインが存在する。システインリッチドメインにFasリガンドが相互作用すると考えられている。また、スプライシングバリアントとして細胞外領域からなる可溶型Fasレセプターが存在することが知られている。ヒトFasリガンドおよびヒトFasレセプターのアミノ酸配列における各領域および各ドメインを示す模式図を図1に示す。
【0028】
Fasリガンドと相互作用する物質は、Fasリガンド/Fasレセプター系を介するアポトーシスの誘導を抑制する物質である限り、特に限定されない。そのような物質としては、例えば、抗Fasリガンド抗体、可溶型Fasレセプター、Fasレセプター誘導体、Decoy Receptor 3、Decoy Receptor 3誘導体などを挙げることができるが、Fasレセプター誘導体が好ましい。Fasレセプター誘導体としては、例えば、Fasレセプターから細胞膜貫通領域を除いたアミノ酸配列からなるポリペプチド、Fasレセプターからデスドメインを除いたアミノ酸配列からなるポリペプチド、Fasレセプターの細胞外領域からなるポリペプチド、Fasレセプターのシステインリッチドメインからなるポリペプチド、それらのポリペプチドとIgGのFc領域とを結合させた融合タンパク質などを挙げることができるが、Fasレセプターの細胞外領域とIgGのFc領域とを結合させた融合タンパク質(Fas−Fc)が好ましい。
【0029】
本発明において、Fasレセプターの細胞外領域は、Fasリガンドと相互作用するのであれば、その全アミノ酸配列からなるポリペプチドでも、その一部のアミノ酸配列からなるポリペプチドでもよい。
【0030】
ここで、本発明におけるポリペプチドとは、2以上のアミノ酸がペプチド結合により結合してなる化合物のことをいい、構成するアミノ酸数は特に限定されず、例えば、2アミノ酸からなるジペプチド、3アミノ酸からなるトリペプチド、4アミノ酸からなるテトラペプチド、5〜19のアミノ酸からなるペプチド(オリゴペプチド)、20以上のアミノ酸からなるペプチドやタンパク質が包含される。
【0031】
また、本発明において、「1個もしくは数個のアミノ酸が欠失、置換、挿入および/または付加されたアミノ酸配列」というときの、欠失、置換、挿入および/または付加されるアミノ酸の個数は、Fasリガンドと相互作用する限り特に限定されないが、例えば1〜85個、好ましくは1〜51個、より好ましくは1〜34個、さらに好ましくは1〜17個、よりさらに好ましくは1〜9個の任意の個数を挙げることができる。なお、同一あるいは性質の似たアミノ酸配列に相当するのであれば、さらに多くのアミノ酸が置換、挿入、および/または付加されてもよい。
【0032】
すなわち、配列番号8において1個もしくは数個のアミノ酸が欠失、置換、挿入および/または付加されたアミノ酸配列については、FasレセプターのN末端側1〜169番目のアミノ酸からなるポリペプチドと高い同一性を有するアミノ酸配列からなり、かつFasリガンドと相互作用するポリペプチドが含まれる。また、ここにいう「高い同一性」とは、少なくとも50%以上、好ましくは70%以上、より好ましくは80%以上、さらに好ましくは90%以上、最も好ましくは95%以上の配列の同一性を指す。
【0033】
本発明に係る配列番号8において1個もしくは数個のアミノ酸が欠失、置換、挿入および/または付加されたアミノ酸配列からなるポリペプチドには、Fasリガンドと相互作用する機能を有する限り、これらアミノ酸配列の1または複数の保存的アミノ酸置換を有するアミノ酸配列からなるペプチドが包含される。
【0034】
本発明において、保存的アミノ酸置換とは、生じる分子の生理学的活性を変化させることなく一般的になされ得る範囲、すなわち保存的置換の範囲で認められるもの(Watsonら,Molecular Biology of Geneなど)であり、例えば、アスパラギン酸およびグルタミン酸の酸性アミノ酸;リシン、アルギニンおよびヒスチジンの塩基性アミノ酸;アラニン、バリン、ロイシン、イソロイシン、プロリン、フェニルアラニン、メチオニンおよびトリプトファンの非極性アミノ酸;グリシン、アスパラギン、システイン、グルタミン、セリン、トレオニンおよびチロシンの極性無電荷側鎖アミノ酸;フェニルアラニン、トリプトファンおよびチロシンの芳香族アミノ酸といった側鎖に類似性のあるアミノ酸同士(アミノ酸のファミリー内部)で起こる置換を挙げることができる。同様に、アスパラギン酸およびグルタミン酸の酸性アミノ酸;リシン、アルギニンおよびヒスチジンの塩基性アミノ酸、グリシン、アラニン、バリン、ロイシン、イソロイシン、セリンおよびトレオニンの脂肪族アミノ酸(セリンおよびトレオニンの脂肪族−ヒドロキシアミノ酸と分類することもできる);フェニルアラニン、チロシンおよびトリプトファンの芳香族アミノ酸;アスパラギンおよびグルタミンのアミド);システインおよびメチオニンの含硫アミノ酸といった分類をすることができる。
【0035】
本発明におけるIgGは、FasリガンドおよびFasレセプターを用いることができる動物と同様の動物のIgGを挙げることができ、本発明に係る治療および/または発症抑制剤を投与する対象に応じて適宜選択することができる。なお、本実施例においては、好適なIgGとしてヒトのIgGを用いている。また、本発明においてIgGのFc領域には、IgGをパパインにより消化して得られるC末端側のフラグメントに相当するポリペプチドまたはその一部のみならず、IgGをペプシンにより消化して得られるC末端側のフラグメント(Fc’領域)またはその一部も包含される。
【0036】
本発明に係るFas−Fcには、Fasリガンドと相互作用することにより、Fasリガンド/Fasレセプター系を介するアポトーシスの誘導を抑制する機能を損なわない限り、他のアミノ酸配列、糖鎖、標識物質などが修飾されていてもよい。
【0037】
本発明において、Fas−Fcの作製は常法に従い行うことができ、例えば、Fasレセプターの細胞外領域に相当するcDNAとIgGのFc領域に相当するcDNAとを翻訳フレームが合うように適当な発現ベクターに挿入し、この発現ベクターを導入した細胞を培養してFas−Fcを分泌させ、培養上清からFas−Fcを精製することにより行うことができる。発現ベクターやこれを導入する細胞は、Fas−Fcの必要量や精製方法などに応じて適宜選択して用いることができる。また、Fas−Fcの精製は、protein Aに対するFcタンパク質の親和性を利用したアフィニティークロマトグラフィーにより簡便に行うことができるが、その他、例えば、硫安塩析法、HPLC、イオン交換クロマトグラフィー、ゲル濾過クロマトグラフィーなどの公知の方法を適宜選択し、またはこれらを組み合わせることにより行うことができる。
【0038】
本発明において、インフルエンザウイルス感染症の治療および/または発症抑制剤の治療効果や発症抑制効果は、常法に従い確認することができ、例えば、対象がインフルエンザウイルスに感染した培養細胞群であれば、本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤を投与した場合に、投与していない場合と比較して、その培養細胞群においてアポトーシスを起こす細胞の数が減少すること、またはその培養細胞群においてアポトーシスを起こす細胞が確認できなくなることを、対象がインフルエンザウイルスに感染した個体であれば、本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤を投与した場合に、投与していない場合と比較して、その個体の体重減少率や生存率が改善することを、特に、インフルエンザウイルスに感染したヒトであれば、本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤を投与した場合に、投与していない場合と比較して、そのヒトにおいて発熱や倦怠感、悪寒、体の痛み、鼻炎、咽頭炎などの諸症状が緩和することやそのヒトの生存率が改善することを、それぞれ確認することなどにより行うことができる。
【0039】
なお、本発明において、「発症を抑制する」は、「発症を予防する」、「発症を防止する」、「発症を阻止する」、「発症を阻害する」と交換可能に用いられる場合があり、「相互作用する」は、「結合する」、「反応する」、「接続する」、「接着する」、「接触する」、「連結する」と交換可能に用いられる場合がある。
【0040】
本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤の製剤化には、当業者に公知の方法を用いることができる。投与形態もまた、当業者によって適宜選択することができる投与形態でよく、そのような投与形態としては、例えば、経口投与製剤として調製する場合の、錠剤、顆粒剤、散剤、カプセル剤、コーティング剤、液剤、懸濁剤などの形態を挙げることができ、非経口投与製剤にする場合の、吸入剤、注射剤、点滴剤、座薬、塗布剤、噴霧剤、貼付剤などの形態を挙げることができる。また、その投与量は、医薬組成物の製剤形態、投与方法、使用目的およびこれに適用される投与対象の年齢、体重、症状によって適宜設定することができる。
【0041】
以下、本発明に係るインフルエンザウイルス感染症の治療および/または発症抑制剤について、実施例に基づいて説明する。なお、本発明の技術的範囲は、これらの実施例によって示される特徴に限定されない。
【実施例】
【0042】
<実施例1>インフルエンザウイルスを接種したマウスの生存率の確認
(1)ウイルス液の調製
北海道大学の高田礼人氏から供与されたインフルエンザウイルスA/Puerto Rico/8/34(H1N1;PR8)を、リン酸緩衝生理食塩水(PBS)を用いて希釈することにより、それぞれ1×103pfu/50μL、1×105pfu/50μLおよび1×107pfu/50μLのウイルス液を調製した。
【0043】
(2)マウスへのインフルエンザウイルスの接種
6週齢の雄のC57BL/6マウス(C57BL/6−WT/WT;ホクドー社)9個体を、北海道大学人獣共通感染症リサーチセンター内P2動物感染実験室で1週間飼育することにより馴化させた。続いて、イソフルラン(大日本住友製薬社)を吸入させて麻酔をかけた後、3個体ずつ3群に分け、A群、B群およびC群とした。A群、B群およびC群に、それぞれ本実施例(1)の1×103pfu/50μLのウイルス液、1×105pfu/50μLのウイルス液および1×107pfu/50μLのウイルス液を、50μL/1個体、経鼻的に投与することにより、PR8ウイルスを接種した。
【0044】
(3)インフルエンザウイルスを接種したマウスの生存率の確認
本実施例(2)の各群について、PR8ウイルスを接種した日を0日目として12日目まで飼育して毎日生存個体数を確認し、各群における0日目の生存個体数に対する各日の生存個体数の割合を百分率で求め、生存率とした。その結果を図2に示す。
【0045】
図2に示すように、A群の生存率は、0日目から8日目までは100%、9日目から12日目までは66.7%であり、B群の生存率は、0日目から5日目までは100%、6日目は66.7%、7日目は33.3%、8日目以降は0%であり、C群の生存率は、0日目から5日目までは100%、6日目から8日目までは66.7%、9日目から12日目までは33.3%であった。
【0046】
これらの結果から、マウスに1×105pfuのインフルエンザウイルスを接種することにより致死することが確認され、1×105pfuのインフルエンザウイルスを接種したマウスを致死性のウイルス感染モデル(致死性感染モデルマウス)とした。
【0047】
<実施例2>インフルエンザウイルス感染症の重症度とマウスFas(mFas)およびマウスFasリガンド(mFasL)のmRNA発現量との相関の確認
(1)ウイルス液の調製
実施例1(1)に記載の方法により、1×102pfu/50μLのPR8ウイルスのウイルス液を調製した。
【0048】
(2)マウスの体重量の測定および肺の採取
6週齢の雄のC57BL/−WT/WT(ホクドー社)30個体について、各個体の体重量を測定した。またその30個体のうち3個体から肺を採取した。
【0049】
(3)マウスへのインフルエンザウイルスの接種
本実施例(2)の27個体について、実施例1(2)に記載の方法に従い、麻酔後に12個体と15個体との2群に分け、12個体をA群、15個体をB群とし、A群には本実施例(1)で調製した1×102pfu/50μLのウイルス液を、B群には本実施例1(1)で調製した1×105pfu/50μLのウイルス液をそれぞれ投与することにより、PR8ウイルスを接種し、非致死性感染モデルマウス(A群)および致死性感染モデルマウス(B群)とした。
【0050】
(4)インフルエンザウイルスを接種したマウスの体重量の測定および肺の採取
本実施例(3)の各群について、PR8ウイルスを接種した日を0日目として6日目まで飼育して、1日目から6日目まで毎日各個体の体重量を測定した。また、1日目から6日目まで毎日、A群においては2個体、B群においては3個体からそれぞれ肺を採取した。
【0051】
(5)インフルエンザウイルスを接種したマウスの体重減少率の確認
本実施例(2)および(4)で測定した体重量および次式に基づいて体重減少率を求め、各群についてその平均値を算出した。なお、本実施例(2)で測定した体重量を0日目の体重量とした。その結果を図3のaに示す。
体重減少率={(0日目の体重量)−(各日の体重量)/(0日目の体重量)}×100
【0052】
図3のaに示すように、A群の体重減少率は、0日目から5日目までは約0%であり、6日目は約10%であった。一方、B群の体重減少率は、0日目および1日目は約0%であり、2日目は約10%、3日目は約15%、4日目は約20%、5日目は約25%であった。なお、6日目において、B群のすべての個体が致死した。
【0053】
これらの結果から、致死性感染モデルマウスでは、インフルエンザウイルス接種後から致死するまで、経過日数に比例して体重減少率が増大することが確認された。すなわち、体重減少率がインフルエンザウイルス感染症の重症度の指標となることが示された。
【0054】
(6)インフルエンザウイルスを接種したマウスのFas(mFas)およびFasL(mFasL)のmRNA発現量の検討
本実施例(4)で採取した各個体の肺を、速やかにRNA抽出溶解液(TRIzol Reagent;Invitrogen社)中で破砕した後、付属の使用書に従ってtotal RNAを抽出した。
【0055】
抽出したtotal RNAを鋳型として、付属の使用書に従い、RevaTra Ace(東洋紡社)を用いて逆転写反応を行うことにより各個体の肺のcDNAを得た。
【0056】
このcDNAを鋳型として、リアルタイムPCR装置Mx3000P QPCR System(Stratagene社)および試薬SYBR Premix Ex TaqII(Perfect Real Time;タカラバイオ社)を用いて、付属の使用書に従ってリアルタイムPCR法を行うことにより、各個体の肺におけるマウスFasリガンド(mFasL)、マウスFas(mFas)およびマウスグリセルアルデヒド3リン酸脱水素酵素(mGAPDH)のmRNA発現量を測定した。リアルタイムPCRに用いたプライマーは下記のとおりである。
【0057】
mFasLの増幅に用いたプライマー:
センスプライマー;5’−AAGAAGGACCACAACACAAATCTG−3’(配列番号1)
アンチセンスプライマー;5’−CCCTGTTAAATGGGCCACACT−3’(配列番号2)
mFasの増幅に用いたプライマー:
センスプライマー;5’−GAAGATGCACACTCTGCGATGAA−3’(配列番号3)
アンチセンスプライマー;5’−TCGCAGTAGAAGTCTGGTTTGCAC−3’(配列番号4)
mGAPDHの増幅に用いたプライマー:
センスプライマー;5’−AAGGGCTCATGACCACAGTC−3’(配列番号5)
アンチセンスプライマー;5’−GGATGCAGGGATGATGTTCT−3’(配列番号6)
【0058】
測定したmFasLおよびmFasのmRNA発現量の値を、mGAPDHのmRNA発現量の値でそれぞれ除することにより補正した後、各日におけるmFasLおよびmFasのmRNA発現量を、0日目のmFasLおよびmFasのmRNA発現量を1として各日におけるmFasLおよびmFasのmRNA発現量の相対値を算出し、この相対値の各群における平均値(N=2〜3)を算出した。mFasLについての結果を図3のbに、mFasについての結果を図3のcにそれぞれ示す。
【0059】
図3のbに示すように、A群におけるmFasLのmRNA発現量は、0日目から3日目までは約1であり、4日目は約2.5、5日目は約4.4、6日目は約5.5であった。これに対し、B群におけるmFasLのmRNA発現量は、0日目および1日目は約1であり、2日目および3日目は約6、4日目は約5.5、5日目は約8であった。これらの結果から、致死性感染モデルマウスでは、インフルエンザウイルス接種後から致死するまで、経過日数に比例して肺中FasLのmRNA発現量が増大することが確認された。すなわち、ウイルス感染症の重症度が高いほど肺中FasLのmRNA発現量が大きいという相関関係が成立することが示された。
【0060】
また、図3のcに示すように、A群およびB群におけるmFasのmRNA発現量は、0日目から6日目までのいずれも2未満であった。これらの結果から、非致死性感染モデルマウスと致死性感染モデルマウスのいずれにおいても、ウイルス接種後の経過日数に関わらず、mFasのmRNA発現量が同程度であることが確認された。すなわち、ウイルス感染症の重症度と肺中FasのmRNA発現量とは相関しないことが示された。
【0061】
<実施例3>インフルエンザウイルスを接種したFasL機能喪失型変異マウスの生存率の確認
6週齢の雄のC57BL/6−WT/WT(ホクドー社)10個体およびCs7BL/6−WT/WTのFasL機能喪失型変異マウスであるC57BL/6−gld/gld(gldマウス;日本チャールス・リバー社)10個体について、実施例1(2)に記載の方法に従い、麻酔後にコントロールA群、コントロールB群、変異型A群および変異型B群の4群に分け、コントロールA群および変異型A群には実施例2(1)で調製した1×102pfu/50μLのウイルス液を、コントロールB群および変異型B群には実施例1(1)で調製した1×105pfu/50μLのウイルス液をそれぞれ投与することにより、PR8ウイルスを接種した。コントロールA群、コントロールB群、変異型A群および変異型B群の構成は下記のとおりである。
コントロール型A群;C57BL/6WT/WT 5個体、1×102pfu/個体
コントロール型B群;C57BL/6WT/WT 5個体、1×105pfu/個体
変異型A群 ;gldマウス 5個体、1×102pfu/個体
変異型B群 ;gldマウス 5個体、1×105pfu/個体
【0062】
その後、実施例1(3)に記載の方法により、0日目から19日目まで飼育して各群の生存率を求めた。その結果を図4に示す。
【0063】
図4に示すように、コントロールB群の生存率は、6日目は60%、7日目は40%、8日目以降は0%であったのに対し、変異型B群の生存率は、6日目は80%、7日目以降19日目までは60%であった。また、コントロールA群および変異型A群の生存率は0日目から19日目まで100%であった。
【0064】
これらの結果から、FasLの機能を抑制することにより、致死性感染モデルマウスの生存率が上昇することが確認された。
【0065】
<実施例4>インフルエンザウイルスを接種したgldマウスのアポトーシス誘導細胞の観察
6週齢の雄のC57BL/6−WT/WT(ホクドー社)6個体および6週齢の雄のgldマウス(日本チャールス・リバー社)6個体について、実施例1(2)に記載の方法に従い、実施例1(1)で調製した1×105pfu/50μLのウイルス液をそれぞれ投与することにより、PR8ウイルスを接種し、それぞれコントロール群および変異型群とした。
【0066】
次に、PR8ウイルスを接種した日を0日目として4日目まで飼育し、2日目、3日目および4日目に、各群につき2個体から肺を採取した。採取した肺は、速やかに10%中性緩衝ホルマリン溶液に浸漬し、4℃で2週間静置することにより固定を行った。その後、常法に従って肺のパラフィン切片を作製し、札幌総合病理研究所社に委託してTUNEL法(TdT−mediated dUTP−biotin nick end labeling)により染色した。染色したパラフィン切片について、ECLIPSE80i(Nikon社)を用いて観察を行った。細気管支周辺および肺血管周辺を撮影して作成した写真図を図5に、拡大撮影して作成した写真図を図6に、それぞれ示す。
【0067】
図5に示すように、コントロール群では、2日目には陽性シグナルが検出されず、3日目に気管支へ浸潤する好中球および肺上皮細胞において陽性シグナルが検出され、4日目に、肺胞間質の顕著な肥厚部分において陽性シグナルが検出された。これに対し、変異型群では、2日目には陽性シグナルが検出されず、3日目に気管支へ浸潤する好中球において陽性シグナルが検出されたが、肺上皮細胞では陽性シグナルが検出されなかった。また、4日目には、肺胞間質の肥厚部分においてTUNEL染色陽性シグナルが検出されたが、その肥厚の程度は軽微であった。
【0068】
また、図6に示すように、コントロール群では、3日目には陽性シグナルが検出されず、4日目に肺血管に浸潤する細胞に強い陽性シグナルが検出された。これに対し、変異型群では、3日目には陽性シグナルが検出されず、4日目には肺血管に浸潤する細胞が認められるものの、これらの細胞における陽性シグナルは検出されなかった。
【0069】
これらの結果から、FasLの機能を抑制することにより、インフルエンザウイルスの感染に伴う肺組織におけるアポトーシスを抑制できることが示された。
【0070】
<実施例5>インフルエンザウイルスを接種したFasL機能喪失型変異マウスの肺におけるウイルス量の確認
6週齢の雄のC57BL/6−WT/WT(ホクドー社)6個体および6週齢の雄のgldマウス(日本チャールス・リバー社)6個体について、実施例1(2)に記載の方法に従い、実施例1(1)で調製した1×105pfu/50μLのウイルス液をそれぞれ投与することにより、PR8ウイルスを接種し、それぞれコントロール群および変異型群とした。
【0071】
次に、PR8ウイルスを接種した日を0日目として5日目まで飼育し、3日目、4日目および5日目に、各群につき2個体から肺を採取した。採取した肺は、重量を測定した後、ビーズ式細胞破砕装置MS−100R(トミー精工社)を用いて下記の条件により破砕して破砕液を得た。
【0072】
1mmジルコニアビーズ
5mmステンレスビーズ
2mLサンプルチューブ
3500rpm、30秒間を1セットとして2セット
【0073】
得られた破砕液を、12穴プレートで単層培養したMadin−Darby canine kidney(MDCK)細胞群(JCRB細胞バンク:JCRB9029)に添加して、37℃で1時間培養した。続いて、培養上清を除去し、Bact−agar1%(w/v)およびトリプシン5μg/mLを含むMEM培地(インビトロジェン社)を添加して、35℃、CO25%(v/v)を含む加湿環境下にて2日間培養し、出現したプラークを数え、肺組織重量に対するウイルス量の割合(pfu/g)を求めた。その結果を図7に示す。
【0074】
図7に示すように、3日目、4日目および5日目のいずれにおいても、コントロール群と変異型群とではウイルス量の割合がほぼ同じであった。これらの結果から、FasLの機能を抑制した場合とFasLの機能を抑制しない場合とでは、肺の中のインフルエンザウイルスのウイルス増幅量はほとんど変わらないことが確認された。
【0075】
<実施例6>インフルエンザウイルスを接種した後にFasの細胞外領域とIgGのFc領域との融合タンパク質を投与したマウスの生存率の確認
(1)Fasの細胞外領域とIgGのFc領域との融合タンパク質の調製
[1−1]ベクターの調製
mFasの細胞外領域であるアミノ酸配列1番目〜169番目(配列番号8)に相当する塩基配列(アクセッション番号NM007987;配列番号7)とヒトIgGのFc領域(配列番号10)に相当する塩基配列(アクセッション番号Z17370;配列番号9)とを、翻訳フレームが合うように繋げて得られる融合タンパク質(mFas−Fc;配列番号12)に相当する塩基配列(配列番号11)を有するDNA断片を調製した。具体的には、mFasの細胞外領域であるアミノ酸1番目〜169番目に相当する塩基配列(配列番号7)とヒトIgGのFc領域に相当する塩基配列とを、BamHIサイトを付加したプライマーを用いて、それぞれマウス末梢リンパ細胞およびヒト末梢リンパ細胞cDNAライブラリーよりPCR法にて増幅し、翻訳フレームが合うように連結させることにより調製した。得られたDNA断片を制限酵素KpnIおよびXbaIで消化した後、pcDNA3(Invitrogen社)のKpnI/XbaIサイトに挿入し、pcDNA3−mFas−Fcを得た。
【0076】
[1−2]HEK293T細胞へのベクターの導入
本実施例(1)[1−1]のpcDNA3.1−mFas−Fcおよびピューロマイシン耐性遺伝子が挿入されたベクターpGL4.1(Promega社)を1:1の重量比の割合で含むベクター液を調製した。このベクター液に含まれるベクターを、遺伝子病制御研究所の上出利光氏より供与されたヒト胎児腎線維芽細胞由来株HEK293T細胞に、Lipofectamine 2000 Reagentを用いて導入した。
【0077】
その後、胎児牛血清(FBS;Cansera社)を10%(v/v)含むDulbecco’s modified Eagle’s medium(DMEM培地;シグマ社)で、37℃、CO25%(v/v)を含む加湿環境下にて2日間培養した。次に、培地にピューロマイシン(CAYLA社)を3μg/mLとなるよう添加してさらに約2週間培養し、耐性細胞を得た。続いて、得られた耐性細胞について、mFas−Fc/HEK293T細胞とした。
【0078】
[1−3]mFas−Fcの精製
本実施例(1)[1−2]のmFas−Fc/HEK293T細胞を、poly−L−lysinでコートした培養面積150cm2の細胞培養フラスコ(北海道和光純薬社)にて、本実施例(1)[1−2]に記載の条件下でサブコンフルエントの状態まで約24時間培養した。
【0079】
続いて、培養液を除去してPBSで洗浄を4回行った後、GlutaMAX−I Supplement(Invitrogen社)を2%(v/v)含むCD293Medium(Invitrogen社)50mLを添加して37℃、CO25%(v/v)を含む加湿環境下にて2週間培養した。
【0080】
その後、培養上清を回収し、3500×g、4℃の条件下で15分間遠心分離を行って上清を得た。得られた上清を、0.45umのフィルター(Millex−HV;ミリポア社)を用いて濾過し、濾過液を得た。
【0081】
次に、4℃の環境下でprotein A結合アガロースゲル1mLを充填したアフィニティーカラム(HiTrap rProtein A FF;GEヘルスケア社)に濾過液を通した後、5mLのPBSを用いて洗浄した。続いて、0.1mol/Lのglycine−HCl(pH3)5mLを添加して、0.5mLずつ、計10フラクションの溶出液を回収した。各溶出液には速やかに1mol/LのTris−HCl(pH9)15μLを加えて中和した。
【0082】
続いて、各溶出液について波長280nmの吸光度を測定することによりタンパク質濃度を求め、タンパク質濃度が200ug/mL以上である溶出液を選択し、計約1mgのmFas−Fcを得た。これら選択した溶出液は、−80℃で保存した。
【0083】
[1−4]mFas−Fcの大量調製
本実施例(1)[1−3]の操作を繰り返して、15mgのmFas−Fcを含む溶出液を得た。PBSを透析液として、Slide−A−Lyzer Dialysis Cassettes 10k MWCO(Thermo Scientific Pierce社)を用いて、4℃で二晩透析し、mFas−Fc溶液30mLを得た。透析中、透析液の交換を3回行った。得られたmFas−Fc溶液は−80℃で保存した。
【0084】
(2)インフルエンザウイルスを接種した後、mFas−Fcを投与したマウスの生存率の確認
[2−1]マウスへのインフルエンザウイルスの接種
6週齢の雄のC57BL/6−WT/WT(ホクドー社)15個体について、実施例1(2)に記載の方法に従い、麻酔後に5個体ずつ3群に分け、100μg投与群、50μg投与群およびコントロール群として、実施例1(1)で調製した1×105pfu/50μLのウイルス液をそれぞれ投与することにより、PR8ウイルスを接種した。
【0085】
[2−2]mFas−Fcの投与
本実施例(1)[1−4]のmFas−Fc溶液を、PBSを用いて希釈することにより、500μg/mLのmFas−Fc溶液および250μg/mLのmFas−Fc溶液を調製した。本実施例(2)[2−1]の各群について、PR8ウイルスを接種した日を0日目として19日目まで飼育した。この際、0日目から4日目まで、100μg投与群には500μg/mLのmFas−Fc溶液0.2mL(100μg相当)/1個体を腹腔内に1回/日(計5回)投与し、50μg投与群には250μg/mLのmFas−Fc溶液0.2mL(50μg相当)/1個体を腹腔内に1回/隔日(計3回)投与し、コントロール群にはPBS0.2mL/1個体を腹腔内に1回/日(計5回)投与した。
【0086】
[2−3]インフルエンザウイルスを接種した後、mFas−Fcを投与したマウスの生存率の確認
本実施例(2)[2−2]の各群について、実施例1(3)に記載の方法により生存率を求めた。その結果を図8に示す。
【0087】
図8に示すように、100μg投与群の生存率は、mFas−Fcの投与以降、5日目および6日目は60%、7日目から19日目までは40%であった。50μg投与群の生存率は、mFas−Fcの投与以降、5日目は80%、6日目から19日目までは20%であった。これに対し、コントロール群の生存率は、PBSの投与以降、5日目は40%、6日目は20%、7日目以降は0%であった。
【0088】
これらの結果から、mFas−Fcを投与することにより、致死性感染モデルマウスの生存率の上昇が確認された。
【特許請求の範囲】
【請求項1】
Fasリガンド/Fasレセプター系を介するアポトーシスを抑制するインフルエンザウイルス感染症の治療および/または発症抑制剤であって、Fasリガンドと相互作用する物質を有効成分とする前記剤。
【請求項2】
Fasリガンドと相互作用する物質が、Fasレセプターの細胞外領域とIgGのFc領域とを結合させた融合タンパク質Fas−Fcである、請求項1に記載の剤。
【請求項3】
Fasレセプターの細胞外領域が、配列番号8のアミノ酸配列からなるポリペプチドまたは配列番号8において1個もしくは数個のアミノ酸が欠失、置換、挿入および/または付加されたアミノ酸配列であってFasリガンドと相互作用するポリペプチドである、請求項2に記載の剤。
【請求項1】
Fasリガンド/Fasレセプター系を介するアポトーシスを抑制するインフルエンザウイルス感染症の治療および/または発症抑制剤であって、Fasリガンドと相互作用する物質を有効成分とする前記剤。
【請求項2】
Fasリガンドと相互作用する物質が、Fasレセプターの細胞外領域とIgGのFc領域とを結合させた融合タンパク質Fas−Fcである、請求項1に記載の剤。
【請求項3】
Fasレセプターの細胞外領域が、配列番号8のアミノ酸配列からなるポリペプチドまたは配列番号8において1個もしくは数個のアミノ酸が欠失、置換、挿入および/または付加されたアミノ酸配列であってFasリガンドと相互作用するポリペプチドである、請求項2に記載の剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2012−6852(P2012−6852A)
【公開日】平成24年1月12日(2012.1.12)
【国際特許分類】
【出願番号】特願2010−142595(P2010−142595)
【出願日】平成22年6月23日(2010.6.23)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成17年度、文部科学省、地域イノベーション創出総合支援事業、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504173471)国立大学法人北海道大学 (971)
【出願人】(503360115)独立行政法人科学技術振興機構 (1,734)
【Fターム(参考)】
【公開日】平成24年1月12日(2012.1.12)
【国際特許分類】
【出願日】平成22年6月23日(2010.6.23)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成17年度、文部科学省、地域イノベーション創出総合支援事業、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504173471)国立大学法人北海道大学 (971)
【出願人】(503360115)独立行政法人科学技術振興機構 (1,734)
【Fターム(参考)】
[ Back to top ]

