インフルエンザ・ウイルスPAの発現精製及びPAのN末端及びPAのC末端とPB1のN末端ポリペプチド複合体の結晶構造
本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAの発現方法に関し、具体的にはPAをN末端前256位アミノ酸及びC末端第257−716位アミノ酸ポリペプチド断片のようにN末端とC末端両部分に分け、そして別々にN末端前256位アミノ酸及びC末端第257−716位アミノ酸ポリペプチド断片を発現する方法;及びPAのC末端第257−716位アミノ酸断片とインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1のN末端オリゴペプチドの発現、共精製と共結晶化の方法;及びPAのC末端第257−716位アミノ酸断片とインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1のN末端オリゴペプチドの共発現、精製と共結晶の方法;及びPA第257−716位残基断片とPB1のN末端オリゴペプチドの複合体の結晶体構造及び結晶体構造の薬物選別並びに薬物設計における応用に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はインフルエンザ・ウイルスPAとPB1のN末端ポリペプチドの細菌における発現、その精製と結晶方法及びPAのC末端とPB1のN末端ポリペプチドの三次元結晶構造とそれらの薬物設計における応用に関する。
【背景技術】
【0002】
インフルエンザ・ウイルスは曾て人類に重大な災難をもたらした(非特許文献1)。対策に乏しく、ウイルス自体変異し続けている為、この種のウイルスは人類にとって脅威の存在である。近年、世界範囲で頻繁に発生している鳥インフルエンザの伝染及び鳥インフルエンザのヒトの間での感染例の頻出は人類の健康及び経済活動に対しても重大な脅威を示した。このようなウイルスについての研究は人類の健康にとって重大な意義がある。鳥インフルエンザはA型インフルエンザ・ウイルスであり、彼らは共にOrthomyxoviridae科の一員である。そのウイルス・ゲノムは負の電荷を持つ8本の一本鎖RNAによって形成されている。鳥インフルエンザ由来遺伝子をほかのA型インフルエンザ・ウイルスと比較分析すると、一次構造上に散在する突然変異が存在する。これらの突然変異は異なるインフルエンザ・ウイルスの異なった病原性をもたらす。目下、インフルエンザ・ウイルスは11種のタンパク質がコードできると思われている。その中インフルエンザ・ウイルス・ゲノムRNAの複製とmRNAへの転写は全てウイルス自身が携帯したRNAポリメラーゼにより行われ、このポリメラーゼが潜在した重要な薬物ターゲットと成りつつある。最近の研究により一部インフルエンザ・ウイルスの高病原性がポリメラーゼの突然変異と直接関連していることが明らかとなり(非特許文献2;非特許文献3)、この複合体に対した薬物設計の必要性が更に示唆された。この複合体に対する研究は、ウイルス複製の分子機構の解明やこの複合体を標的にした薬物設計などに対し、共に重大な意義を持つ。このRNAポリメラーゼは三つのサブユニットPB1、PB2及びPAから構成された複合体である。そのうちPB1は触媒活性サブユニットであり、PB2が宿主細胞のmRNAキャップ(CAP構造)をcap−snatching機構で切り取り、それをウイルスmRNA転写のプライマーとするが、但しこの過程においてPB1はエンドヌクレアーゼである。一種の温度感受性変異体ts53により、PAがウイルス・ゲノム複製過程に関与している事が示唆されたが、その具体的な機能はまだ明らかではない(非特許文献4;非特許文献5)。ポリメラーゼはウイルスに必要な3種のRNA即ちmRNA、cRNA(複製中間体)及びvRNAを合成する活性を持つ。mRNAの合成はキャップ付きオリゴヌクレオチド・プライマーから始まり、vRNA末端から15−17番目のヌクレオチドで終了し、且つポリアデニン(poly A)末端がつく。ポリメラーゼはウイルス全長のcRNA中間体を新たに合成し、よって更に全長のvRNAを合成することができる。昆虫細胞発現システムによりポリメラーゼ各サブユニットを発現させ、三種の異なった複合体を形成させる事ができるが、複合体の一種はポリメラーゼの三つのサブユニットPB1/PB2/PAよりなる三元複合体で、他の二種はそれぞれPB1/PB2とPB1/PAの二元複合体であり、PB2/PAの二元複合体は形成できない(非特許文献6)。その中、PB1のN末端25個のアミノ酸はPAのC末端と相互に作用するのに充分であり、PB1のC末端はPB2のN末端との相互に作用を担う。一つの合成されたPB1のN端競合性オリゴペプチドはウイルス・ポリメラーゼ活性を顕著に抑制できる。非特許文献6のジヌクレオチドApGをプライマーとしたRNA合成実験により、PB1/PA複合体によりウイルスのゲノムRNA複製が有効に開始でき、PB1/PB2によりウイルスmRNAの合成がin vitroで行なえることが明らかにされた。(非特許文献6)。但し、Dengら(2006)が293細胞を使って発現精製した組み替えポリメラーゼの結果は、三つのサブユニットが複製と転写に共に必要であることを示唆した(非特許文献7)。PAが主にウイルスRNA複製過程に関与するのは、一種の温度感受性変異体(L226P)により非許容温度でウイルスにゲノム複製障害をもたらすが転写活性には影響を及ぼさないことの発見がその由来のもとであり(非特許文献5);PB2はウイルスmRNAの転写に関与する。更なる研究によりPAは幅広く転写と複製及びウイルスの安定性等の過程に関与すると考えられている(非特許文献8)。PB1/PA複合体はウイルス5’末端プロモーターと結合でき、PB1単独ではこのプロモーターと結合できない。架橋実験結果によりPAがvRNA及びcRNAプロモーターと結合できることを明らかにしたが(非特許文献9;非特許文献10;非特許文献8)(Fodor 1994;Gonzalez 1999;Jung 2006;Hara 2006)、その具体的な結合サイトはまだ不明である。PAにキモトリプシンに似たプロティナーゼ活性のあることが認められ、Sanz−Ezquerroら(1996)によりそのN末端の約250のアミノ酸が当該プロティナーゼ活性域であることが見出された(非特許文献11)。しかしその後、Haraら(2001)は自らの研究により、C末端の第624位セリンがPAプロティナーゼ活性サイトであり、そのサイトの変異がプロティナーゼ活性の消失をもたらす故、Ser624もこのプロティナーゼ活性領域を構成し得ると考察した(非特許文献12)。PAのプロティナーゼ活性のポリメラーゼ機能に対する影響についてはまだ議論が続いている。2006年、Hara等はトリプシン加水分解作用を通じて精製したPA組み替えタンパク質はPAをそれぞれ分子量約25kDa及び約55kDaの両断片に分解できると報告した(非特許文献8)。タンパク質の三次元構造が薬物設計に対し重要な手助けになるのはよく知られており、PAの三次元構造解明はそれに対した薬物設計及び機能研究にとって重要な価値がある。また、過去の研究でインフルエンザ・ウイルス・タンパク質PAの細菌での発現精製に関する報告はまだ見られず、細菌で発現精製したタンパク質を得ることができればPAの機能研究及び薬物スクリーニング作業に対し重大な助けとなり、時間の多量節約や作業コストと労働強度の大幅低下が可能であろう。
【先行技術文献】
【非特許文献】
【0003】
【非特許文献1】J.K.Taubenberger及びD.M.Morens、“The Pathology of Influenza Virus Infections.”、2007年、Annu Rev Pathol
【非特許文献2】Hulse−Post,D.J.、J.Franksら、“Molecular changes in the polymerase genes (PA and PB1) associated with high pathogenicity of H5N1 influenza virus in mallard ducks”、J Virol 2007年、第81巻、第16号、p.8515−24
【非特許文献3】V.J.Munster、E.de Witら、“The molecular basis of the pathogenicity of the Dutch highly pathogenic human influenza A H7N7 viruses”、J Infect Dis 2007年、第196巻、第2号、p.258−65
【非特許文献4】A.Sugiura、M.Uedaら、“Further isolation and characterization of temperature−sensitive mutants of influenza virus”、Virology、1975年、第65巻、第2号、p.363−73
【非特許文献5】A.Kawaguchi、T.Naitoら、“Involvement of influenza virus PA subunit in assembly of functional RNA polymerase complexes.”、J Virol 2005年、第79巻、第2号、p.732−44
【非特許文献6】A.Honda、K.Mizumotoら、“Minimum molecular architectures for transcription and replication of the influenza virus”、Proc Natl Acad Sci USA 2002年、第99巻、第20号、p.13166−71
【非特許文献7】T.Deng、J.L.Sharpsら、“Role of the influenza virus heterotrimeric RNA polymerase complex in the initiation of replication”、J Gen Virol 2006年、第87巻(Pt 11)、p.3373−7
【非特許文献8】K.Hara、F.I.Schmidtら、“Amino acid residues in the N−terminal region of the PA subunit of influenza A virus RNA polymerase play a critical role in protein stability, endonuclease activity, cap binding, and virion RNA promoter binding”、J Virol 2006年、第80巻、第16号、p.7789−98
【非特許文献9】E.Fodor,D.C.Pritloveら、“The influenza virus panhandle is involved in the initiation of transcription”、J Virol 1994年、第68巻、第6号、p.4092−6
【非特許文献10】T.Deng、J.Sharpsら、“In vitro assembly of PB2 with a PB1−PA dimer supports a new model of assembly of influenza A virus polymerase subunits into a functional trimeric complex”、J Virol 2005年、第79巻、第13号、p.8669−74
【非特許文献11】J.J.Sanz−Ezquerro、T.Zurcherら、“The amino−terminal one−third of the influenza virus PA protein is responsible for the induction of proteolysis” J Virol 1996年、第70巻、第3号、p.1905−11
【非特許文献12】K.Hara、M.Shiotaら、“Influenza virus RNA polymerase PA subunit is a novel serine protease with Ser624 at the active site” Genes Cells 2001年、第6巻、第2号、p.87−97
【発明の概要】
【課題を解決するための手段】
【0004】
本発明はインフルエンザ・ウイルス・ポリメラーゼ複合体サブユニットPAの野生型又は変異型タンパク質のN末端とC末端をそれぞれクローン化、発現する方法、並びにPAのN末端を個別に発現、精製及び結晶させる方法、並びにインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1の野生型又は変異型タンパク質のN末端オリゴペプチドを発現する方法、並びにPAのC末端とPB1のN末端オリゴペプチド共精製の方法を提供する。本発明で使用したPAはN末端の前256のアミノ酸及びC末端の257−716アミノ酸残基の断片であり、これとPB1のN末端25個アミノ酸ペプチド複合体の大腸菌中での発現、共精製の方法、及びPAのC末端とPB1のN末端ペプチド・タンパク質複合体の結晶方法及びそれらが形成する複合体の結晶の三次元構造が提供される。
【0005】
本発明はインフルエンザ・ウイルスのポリメラーゼ・サブユニットPAの野生型又は変異型タンパク質をN末端とC末端の二つの部分に分けて発現、精製する方法を提供する一方、PAのN末端を単独で発現精製及び結晶させる方法を提供し、インフルエンザ・ウイルス・ポリメラーゼのもう一つのサブユニットPB1の野生型又は変異型タンパク質のN末端ポリペプチドの発現を通じて、PAのC末端とPB1のN末端オリゴペプチド複合体を共精製し、タンパク質の結晶に使う。本発明は大腸菌の原核細胞発現系を好ましく使用して(但し、他の発現系を除外するわけでなく、例えば他の細菌中又はその他真核生物細胞での発現も可)上記のポリペプチドをGST(グルタチオン−S−トランスフェラーゼ)融合タンパク質の形で発現し、そしてPAのC末端及びPB1のN末端オリゴペプチドの2種の発現細菌を混合し、さらに細菌から上記PAのC末端及びPB1のN末端オリゴペプチドのタンパク質複合体を共精製し出し、タンパク質を結晶する方法に使用した。本発明は、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAタンパク質N末端の前256位アミノ酸とC末端第257から第716位アミノ酸ポリペプチドを大腸菌を利用して発現して得る発現方法、並びに大腸菌からインフルエンザ・ウイルス・タンパク質PB1のN末端25個又は48個のアミノ酸以内のポリペプチドを発現する細菌叢を得る方法に及ぶが、記述する方法で、対応する遺伝子をpGEX−6pベクターへクローン化し、GST(グルタチオン−S−トランスフェラーゼ)を融合した融合タンパク質を発現させる。
【0006】
もう一方では、本発明はPAのC末端(PAC)とPB1N末端ペプチド複合体を精製する方法を提供するが、その方法は下記を含む:インフルエンザ・ウイルスPAのC末端第257から第716のアミノ酸を発現する細菌叢とインフルエンザ・ウイルスPB1のN末端25個又は48個アミノ酸以内のオリゴペプチドを発現する細菌叢をそれぞれ緩衝液に懸濁させ、そして一定の比率でこの2種類の発現菌を混合し、GST−PACとGST−PB1Nのタンパク質の総含量が一定のモル比に達するようにし、よってこの2種類のタンパク質の混合タンパク質を発現し、アフィニティ・カラムの方法を使い上記混合タンパク質を精製し、そしてPreScissionプロティナーゼで酵素分解によりGST融合タンパク質を切断し;更にゲル濾過とイオン交換クロマトグラフィー等の方法でPAとPB1のN端ペプチド複合体を分離精製し;ゲル電気泳動法でタンパク質の純度を測定すること。
【0007】
もう一方では、本発明は上記で得られたPACとPB1N末端ペプチド複合体を結晶する方法を提供したが、その方法は下記を含む:上記PACとPB1N末端ペプチド複合体を5〜30mg/mlまで濃縮し;摂氏4〜30度中、hanging−drop蒸気拡散法で結晶成長条件をスクリーニングし;当該タンパク質複合体の結晶を得ること。
【0008】
もう一方では、本発明はPACとPB1N末端ペプチド複合体結晶を提供する。
【0009】
もう一方では、本発明はPACとPB1N末端ペプチド複合体結晶の三次元構造を提供し、この構造はPACとPB1N相互作用様式とその相互作用サイト、そしてその複合体のPACとPB1Nポリペプチド・タンパク質の二次構造の仕組み、ペプチド鎖の方向及び三次元分子構造を描き出した。その中で、PACとPB1N末端ペプチド複合体結晶にX線回折を行ない、PACとPB1N末端ペプチド複合体のタンパク質結晶の回折データをとり、上記これらのタンパク質結晶の回折データを元に更なる構造解析過程を通じて、PACとPB1N末端ペプチド複合体の三次構造モデルを構築する。
【0010】
一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、その中でインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACはインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAの約201〜約301位アミノ酸から約650〜末端のアミノ酸までであり、PB1のN末端PB1Nはインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1のN末端PB1Nの48個アミノ酸以内のオリゴペプチドであり、結晶三次元構造中の原子は表1中に挙げた少なくとも一部の原子座標を有し、又はこの座標中の少なくとも40%アミノ酸残基主鎖炭素骨格原子との三次元座標の平均二乗偏差(average root mean square deviation(RMSD))が1.7Å以下である。
【0011】
好ましくは、ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶がP4(1)2(1)2の空間群を持ち、格子定数はおよそα=b=122Å、c=133Å、α=β=γ=90°である。
【0012】
一つの具体的な実施態様を通して、インフルエンザ・ウイルス株はA型、B型又はC型インフルエンザ・ウイルスより選出される。好ましくは、A型インフルエンザ・ウイルス株:A/goose/Guangdong/1/96、A/Brevig Mission/1/1918;B型インフルエンザ・ウイルス株:B/Ann Arbor/1/1966;又はC型インフルエンザ・ウイルス株:C/JJ/1950である。
【0013】
一つの具体的な実施態様を通して、A型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACはインフルエンザ・ウイルス・ポリメラーゼPAのC末端PAC中のαへリックス4、即ち406−414位を含むアミノ酸領域、αへリックス5、即ち440−450位を含むアミノ酸領域、αへリックス8、即ち583−603位を含むアミノ酸領域、αへリックス9、即ち608−613位を含むアミノ酸領域、αへリックス10、即ち633−649位を含むアミノ酸領域、αへリックス11、即ち653−673位を含むアミノ酸領域、αへリックス12、即ち683−691位を含むアミノ酸領域、とαへリックス13、即ち698−714位を含むアミノ酸領域、及び二つのβシート:βシート8とβシート9、それぞれ619−623位を含むアミノ酸領域と628−631位を含むアミノ酸領域が、PAのC末端PACの第一部分を構成する(即ち図4に示す如く結晶構造の口先の部分を構成)、その中でA型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACは主要なβシート折り畳み断片より成り、これらのβシートにはβシート1、即ち290−292位を含むアミノ酸領域、βシート2、即ち317−324位を含むアミノ酸領域、βシート3、即ち480−491位を含むアミノ酸領域、βシート4、即ち496−506位を含むアミノ酸領域、βシート5、即ち517−526位を含むアミノ酸領域、βシート6、即ち541−550位を含むアミノ酸領域、βシート7、即ち557−571位を含むアミノ酸領域などが含まれ、これらのβシートが共同でPAのC末端PAC第二部分(即ち図4に示す結晶構造の頭部)の折り畳みシート層の主な部分を構成する。その中でA型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACはαへリックス1、即ち303−311位を含むアミノ酸領域、αへリックス2、即ち331−349位を含むアミノ酸領域、αへリックス3、即ち364−369位を含むアミノ酸領域、αへリックス6、即ち454−475位を含むアミノ酸領域及びαへリックス7、即ち572−578位を含むアミノ酸領域が、PAのC末端PAC第二部分の上記折り畳みβシート層の周囲を囲い、その中、B型又はC型インフルエンザウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0014】
一つの具体的な実施態様を通して、A型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACは主にαへリックス8、αへリックス10、αへリックス11とαへリックス13の関与を通じてPB1のN末端PB1Nと相互に作用するが、好ましくは、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス11のLeu666、αへリックス13のPhe710、αへリックス10のVal636、Leu640、αへリックス13のTrp706、αへリックス11のGln670から構成される群より選択される少なくとも一つのアミノ酸を、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1との相互作用に関与させる。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0015】
一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のαへリックス9とαへリックス10の間の環状ペプチド断片中のIle621、Gly622、Glu623、Thr618とPro620から構成される群より選択される少なくとも一つのアミノ酸を、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1との相互作用に関与させた。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0016】
一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のAsn647、Gln408、Cys584、Gln587、Gln591、Lys643、Asn647、Ser659、Lys663、Trp699、Asn703から構成される群より選択される少なくとも一つのアミノ酸を、記述のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPACのインフルエンザウイルスポリメラーゼサブユニットPB1Nと結合する「袋状」のアミノ・サイトを構成させた。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0017】
一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のTrp406、Glu410、Lys461、Glu524、Phe525、Ser526、Lys536、Lys539、Tyr540、Leu563、Tyr564、Arg566及びLys574から構成される群より選択される少なくとも一つのアミノ酸を、PAC中ヌクレオチド、RNA若しくはその他の小分子又はタンパク質と結合する主溝及びチャンネルの形成に関与させた。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0018】
一つの具体的な実施態様を通して、PAのC末端PACの370から405位のアミノ酸残基は大きい環を構成するが、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0019】
一つの具体的な実施態様を通して、そこで記述したαへリックス12、αへリックス13はその他のタンパク質との相互作用に関与するが、好ましくは、αへリックス12及αへリックス13中のIle690、Glu691、Glu692、Cys693、Asn696から構成される群より選択される少なくとも一つのアミノ酸を、その他のタンパク質との相互作用に関与させる。
【0020】
一つの具体的な実施態様を通して、Lys506、Gly507、Arg508、Ser509、His510、Leu511、Arg512、Asn513及びAsp514から構成される群より選択される少なくとも一つのアミノ酸を、その他のタンパク質との相互作用に関与させた。その中、His510はポリメラーゼ複合体RNaseの一部分を構成し、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0021】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のαへリックス8、αへリックス10、αへリックス11とαへリックス13から構成される群より選択される少なくとも一つのメンバーと結合したポリペプチド、タンパク質、無機若しくは有機化合物、好ましくは、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス11のLeu666、αへリックス13のPhe710、αへリックス10のVal636、Leu640、αへリックス13のTrp706、αへリックス11のGln670から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供する。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0022】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中αへリックス9及びαへリックス10の間の環状ペプチド断片中のIle621、Gly622、Glu623、Thr618とPro620から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供する。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0023】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACの中でそのインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のAsn647、Gln408、Cys584、Gln587、Gln591、Lys643、Asn647、Ser659、Lys663、Trp699、Asn703から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供する。その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0024】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACの中でそのインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のTrp406、Glu410、Lys461、Glu524、Phe525、Ser526、Lys536、Lys539、Tyr540、Leu563、Tyr564、Arg566及びLys574から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供する。その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0025】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中で第370から405位のアミノ酸から選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供する。その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0026】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中αへリックス12、αへリックス13と結合する、好ましくはαへリックス12及αへリックス13中Ile690、Glu691、Glu692、Cys693、Asn696から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供するが、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりであり、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0027】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中シートβ4とシートβ5の間の環状領域内のLys506、Gly507、Arg508、Ser509、His510、Leu511、Arg512、Asn513及びAsp514から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供するが、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0028】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼPB1と競合的にPACと結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供するが、その中でB型又はC型インフルエンザウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0029】
一つの具体的な実施態様を通して、本発明は主にPAC中αへリックス8、αへリックス11、αへリックス13、αへリックス10により形成した疎水性コアとの相互作用を、好ましくはαへリックス8中のMet595、αへリックス11中のLeu666、αへリックス13中のTrp706とPhe710、及びαへリックス10中のVal636とVal640との相互作用を提供するが、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0030】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼPB1と競合的にPACと結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供するが、その中で記述したポリペプチド、タンパク質、抗体又は免疫結合物のアミノ酸配列における、野生型インフルエンザ・ウイルス・ポリメラーゼPB1のN末端PB1N残基5から10位Pro5、Thr6、Leu7、Leu8、Phe9とLeu10が形成する短へリックス領域を含む短PTLLFLモチーフの中少なくとも三つは、該モチーフとのポリペプチド配列比較において対応する位置のアミノ酸が同じである。
【0031】
一つの具体的な実施態様を通して、本発明は上記のポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物含む組成物を提供する。
【0032】
一つの具体的な実施態様を通して、本発明は上記組成物のインフルエンザ・ウイルスによる疾病の治療薬物の製造における応用を提供する。
【0033】
一つの具体的な実施態様を通して、本発明は(a)標識タンパク質遺伝子を融合した又は融合してないインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC第約201〜約301位のアミノ酸から約650〜末端位置アミノ酸をコードする遺伝子配列のベクターを構築し、そのベクターで原核又は真核細胞を形質転換し、よって標識タンパク質を持つPACを発現することと;(b)PACの発現と似た方法で標識が付く又は付かないPB1Nを発現することと;(c)上記(a)で得たインフルエンザ・ウイルスPACの発現細胞と(b)で得たインフルエンザ・ウイルスPB1のN末端48個のアミノ酸以内のアミノ酸PB1Nの発現細胞を一定比率で混合し、特異的に特異標識を識別する方法で記述の混合タンパク質を分離し、酵素分解により標識つきポリペプチド中の標識タンパク質を取り除き、PACとPB1Nとの複合体を分離し、タンパク質濃度を測定することとを含むインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体を発現精製する方法を提供する。
【0034】
その中、上記ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造中の原子は表1の中で挙げた40%の原子座標を持ち、又はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造中の少なくとも40%のアミノ酸の主鎖炭素骨格の原子構造座標は表1中の座標と平均二乗偏差が1.7Å以下である。
【0035】
一つの具体的な実施態様を通して、本発明は、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体を発現精製する方法を提供するが、そこで記述した標識タンパク質はGST、Flag−tag、Myc−tag、MBP−tag、特異性抗体より選び;記述したベクターは選択性標識遺伝子を含み、ステップ(c)で記述した一定比率とは標識タンパク質−PACと標識タンパク質−PB1Nのタンパク質総量のモル比が0.1:1〜1:0.1に成る様にする比率であり、好ましくは標識タンパク質−PACと標識タンパク質−PB1Nのタンパク質総量のモル比を0.5:1〜1:0.5に、更に好ましくは標識タンパク質−PACと標識タンパク質−PB1のタンパク質総量のモル比を1:1に近づかせる。好ましい標識タンパク質はGSTであり、記述した特異的に特異標識を識別する方法はアフィニティ・カラム・クロマトグラフィーであり、記述した標識を取り除く方法はプロティナーゼによる酵素分解法、記述したPACとPB1Nとの複合体の分離方法はゲル濾過又はイオン交換クロマトグラフィーで行い、記述したタンパク質の濃度確定はゲル電気泳動法で行う。
【0036】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の発現と精製方法を提供するが、そこに記述したベクターはpGEX−6pプラスミド・ベクターで、そこに記述した選択性標識遺伝子はペニシリン耐性遺伝子で、そのステップ(c)で使用したプロティナーゼはProScissionプロティナーゼである;ベクターで使用したプライマーの酵素切断サイトはSalIとNotIから構成される群より選択される酵素切断サイトであり;遺伝子断片の挿入時に使用した酵素切断サイトはSalIとNotIから構成される群より選択される酵素切断サイトであり;記述したインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACの遺伝子断片はPCR方法を利用して、A型インフルエンザ・ウイルス株A/goose/Guangdong/1/96ゲノムを元に増幅して得られ;上記ベクター及び上記挿入遺伝子断片はそれぞれ対応するDNAエンドヌクレアーゼを使用し、たとえばBamHIとXhoIから構成される群より選択されるエンドヌクレアーゼで処理をした後、T4 DNA Ligaseを利用して上記挿入遺伝子を上記ベクターに連結し、よって例えば大腸菌のような原核細胞を形質転換してプラスミド・クローンを取得し;クローン化済みの例えば上記のプラスミド・クローンで大腸菌BL21を形質転換し、得られる形質転換細菌を培養し、IPTGで誘導をかけるが、IPTGの好ましい濃度は0.1mMから1mMであり;培養して得られる上記細菌を遠心して、上記融合タンパク質を発現する細菌叢が得られる。
【0037】
一つの具体的な実施態様を通して、本発明は、上記精製したPACとPB1N複合体のタンパク質濃度を5−30mg/mlまで濃縮することと;hanging−drop蒸気拡散法またはsitting−drop蒸気拡散法を利用した結晶成長条件のスクリーニングすることと;インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶を得ることとを含むインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の共結晶化方法を提供する。
【0038】
一つの具体的な実施態様を通して、本発明は、PAのN末端1位〜約50位のアミノ酸から約200位〜約300位のアミノ酸までであるPANの野生型又は変異型タンパク質を発現させる方法を提供し、標識タンパクの質遺伝子を融合したインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのN末端PANの1位〜約50位のアミノ酸から約200位〜約300位のアミノ酸をコードする遺伝子配列の発現ベクターを構築し、このベクターで細胞を形質転換して、よって標識タンパク質を持つPANを発現させるが、そのPAのN末端PANにおけるアミノ酸配列は、図1Cに示すアミノ酸配列と比べ少なくとも40%の同アミノ酸配列を有する。
【0039】
一つの具体的な実施態様を通して、本発明はPAのN末端PANの野生型又は変異型タンパク質を発現させる方法を提供するが、その方法では、PANのN末端にGSTを融合した融合タンパク質GST−PANを発現させるため、PCR方法及び分子クローン技術を利用して、記述したポリメラーゼ・サブユニットPAのN末端PANの遺伝子配列をそれぞれ例えばpGEX−6p、pGEX−4 T等pGEX系ベクター(Amersham Pharmacia)、pET系ベクター(Novagen)、pMAL−c2 (Invitrogen)系ベクター等のプラスミド・ベクターにクローン化し;上記プラスミド・ベクターはペニシリン耐性遺伝子を含有し、上記PAのN末端PANポリペプチドの遺伝子クローン化時にベクターの使用した酵素切断サイトはpGEX−6pマルチ・クローン・サイトのBamHI、XhoIから構成される群より選択される酵素切断サイトであり;使用したPAN遺伝子クローン断片の酵素切断サイトはそれぞれBamHIとXhoIであり;PANタンパクの遺伝子断片はPCR方法を利用してウイルス株A/goose/Guangdong/1/96ゲノムを元に増幅して得られ;ベクターと挿入遺伝子断片はそれぞれ対応するDNAエンドヌクレアーゼ例えばBamHI、XhoIから構成される群より選択されるエンドヌクレアーゼで処理した後、T4 DNA Ligaseで挿入遺伝子とベクターを結合させ、大腸菌を形質転換してプラスミドクローンを取得し;クローン化済みの例えば上記のプラスミド・クローンで大腸菌BL21を形質転換して、その形質転換細菌を培養し、0.1mMから1mMのIPTGで誘導をかけ、培養した細菌を遠心して上記融合タンパク質を発現する細菌叢が得られる。
【0040】
一つの具体的な実施態様を通して、本発明は、(a)PACを固定ベクターの表面に結合させることと;(b)過剰量の標識付きPB1Nを上記固定されたPACに接触させることと;(c)溶出液で充分に溶出して、未結合PB1Nを取り除くことと;(d)テスト候補化合物の溶液を(b)の項で記述した固定され且つPB1Nと結合したPACに接触させることと;(e)記述した溶出液で充分に溶出して、テスト溶液を得ることと;(f)上記テスト溶液中の標識つき遊離PB1Nの濃度を測定することと;(g)テスト溶液中の標識つき遊離PB1Nの濃度を基に、候補化合物のPACとの結合能力を求めることとを含むことを特徴とするPB1Nと競合的にPACと結合する候補化合物のスクリーニング方法を提供する。
【0041】
一つの具体的な実施態様を通して、本発明は、記述したステップ(a)中PACの固定表面上への結合は、共有結合性架橋又はPACをアフィニティ・マトリックスと結合させることにより実現し、上記アフィニティ・マトリックスは固定表面上にはそのアフィニティ・マトリックスが結合できる結合基を有することを特徴とするPB1Nと競合的にPACと結合する候補化合物のスクリーニング方法を提供する。
【0042】
一つの具体的な実施態様を通して、本発明は、記述したアフィニティ・マトリックスにはGST、Flag−tag、Myc−tag、MBP−tag、His−tag、特異性抗体等その他ポリペプチドが挙げられ、固定表面上はそれぞれのマトリックスに対応する結合基を有することを特徴とするPB1Nと競合的にPACと結合する候補化合物のスクリーニング方法を提供する。
【0043】
一つの具体的な実施態様を通して、本発明は、記述した標識付きPB1Nポリペプチドは同位体又はその他の化学分子で標識したタンパク質より選び出し、好ましくは、その他の化学分子標識は緑色蛍光タンパク質、各種その他融合ポリペプチド、例えば結合したペルオキシダーゼ、ホスファターゼ、プロテインキナーゼ、各種トランスフェラーゼ等より選び出したことを特徴とするPB1Nと競合的にPACと結合する候補化合物のスクリーニング方法を提供する。
【0044】
一つの具体的な実施態様を通して、本発明は、上記固定表面はアフィニティクロマトカラムでもよいことを特徴とするPB1Nと競合的にPACと結合する候補化合物のスクリーニング方法を提供する。
【0045】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造の、インフルエンザ・ウイルス感染による疾病の治療に使用できる各種ポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物の設計とスクリーニングにおける応用を提供する。
【0046】
上記PACタンパク質の発現精製方法;上記PAC及びPB1N端ポリペプチド複合体の発現精製方法;上記タンパク質結晶の獲得方法に基づいて薬物のスクリーニングを行ない、PACとPB1Nの三次元構造に基づいて薬物設計を行う。
【0047】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造の、インフルエンザ・ウイルス感染による疾病の治療に使用できる各種ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物の設計とスクリーニングにおける応用であって、
タンパク質三次元構造座標に基づき、コンピューター・シミュレーションにて特定位置に結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物分子を設計することと;
タンパク質三次元構造座標に基づき、コンピューター・シミュレーションにて特定位置に結合可能なポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物分子を捜すことと;
タンパク質三次元構造座標に基づき、設計或は捜したポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物分子を上記PAC及びPB1N配列と少なくとも50%同配列を持つ任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・タンパク質に結合させ、更に結合状況を分析することと;及び
タンパク質三次元構造座標に基づき、設計或は捜したポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物分子を上記PAC及びPB1N配列と少なくとも50%同配列を持つ任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・タンパク質に結合させ結晶し、タンパク質X線結晶構造解析方法にてポリペプチド及び化合物分子のタンパク質との結合状況を分析することと;
を含み、
上記PAC及びPB1N配列と少なくとも50%の同配列を持つ任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・タンパク質と結合する上記ポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物分子が候補化合物である応用を提供する。
【0048】
PAのポリメラーゼ中での機能及びその三次元微細構造を明らかにする為、本発明者らはPAのC末端257−716残基断片(PAC)とPB1のN末端25個のペプチド(PB1N)の複合体の2.9Å分解能の結晶構造を解析した。この構造により、PAのC末端とPB1のN末端の相互作用方式及び結合に関与したアミノ酸残基の組成と空間的相対位置がはっきりと示され、PAとRNAの結合サイト、PAのC末端及びPB1のN末端複合体の三次元構造モデル、タンパク質の二次構造構成、PAタンパク質分子中の核酸結合サイト、PAタンパク質分子における小分子チャンネル等及びPAタンパク質表面の電荷分布が明らかとなり、更なるPAのウイルスRNAポリメラーゼ複合体における機能研究のための構造学的基盤が提供された。また、上記本発明のタンパク質発現精製方法、結晶方法を使用して薬物スクリーニングを行い、PAとPB1相互作用及びPAとRNAその他タンパク質相互作用を標的にした薬物を設計し、よってインフルエンザ・ウイルス・ポリメラーゼ活性を抑制する目的を達成する為のタンパク質結晶プラットフォーム並びに三次元構造プラットフォームを提供した。
【0049】
注意すべきは、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスのαへリックスとβシートに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりであり、詳細はここでは略す。
【図面の簡単な説明】
【0050】
【図1A】三種の異なったタイプのインフルエンザ・ウイルス由来に基づいたPAタンパク質C末端の配列の比較であり、その中、A_OURSは鳥インフルエンザA型ウイルス株A/goose/Guangdong/1/96のPAタンパク質C末端の配列;A_1918は1918年ヨーロッパで爆発した広範囲インフルエンザで重大な人類死亡事件を引き起こしたA型インフルエンザ・ウイルス株A/Brevig Mission/1/1918 A型インフルエンザ・ウイルスPAタンパク質配列;B_1966は1966 Ann aborのインフルエンザB型ウイルスB/Ann Arbor/1/1966のPAタンパク質配列;C_1950は1950の一種のインフルエンザC型ウイルスC/JJ/1950のPAタンパク質配列であり;これらの結果は、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAタンパク質に高度に保存的なアミノ酸残基が含有されていることを示す。図中、….は該当領域のアミノ酸欠失を表すが、明細書及び特許請求の範囲では具体的なアミノ酸位置を全てA_OURSを例に説明した。
【図1B】四種の異なったタイプのインフルエンザ・ウイルス由来に基づいたPB1Nタンパク質配列の比較であり、その中、A_OURS、A_1918、B_1966、C_1950は図1Aと同様であり、図中、….は該当領域のアミノ酸欠失を表すが、明細書及び特許請求の範囲では具体的なアミノ酸位置を全てA_OURSを例に説明した。
【図1C】三種の異なったタイプのインフルエンザ・ウイルス由来に基づいたPAタンパク質N末端の配列であり、図中、….は該当領域のアミノ酸欠失を表すが、明細書及び特許請求の範囲では具体的なアミノ酸位置を全てA_OURSを例に説明した。
【図2】鳥インフルエンザA型ウイルス野生型ウイルス株A/goose/Guangdong/1/96のPAのN末端前256アミノ酸ポリペプチド断片の精製。その中、A図は精製したタンパク質のゲル濾過クロマトグラフィーSuperdex−200(Amersham Pharmacia Inc.)における溶出ピーク位置を示し、B図はその溶出ピークのPAのN末端タンパク質電気泳動結果を示し、C図は最終精製したPAのN末端タンパク質を示す。
【図3】精製したPAのN末端(1−256残基)タンパク質より得られたタンパク質結晶及びX線回析状況。その中、A及びBは異なる結晶条件下で得た結晶であり、C及びDは二種のPAのN末端タンパク質結晶のX線回析像である。
【図4】大腸菌で発現精製したPAC及びGST−PB1Nタンパク質、及びPACとPB1のN末端ペプチド相互結合実験並びにPACとPB1Nポリペプチド複合体の構造のリボン図。(A)精製したPACタンパク質及び精製したPACとPB1Nポリペプチド・タンパク質のin vitro相互作用試験。(B)PACとPB1Nポリペプチド複合体三次元構造の線状(Wireflame)図で、咀嚼する狼頭状全体構造を呈する。
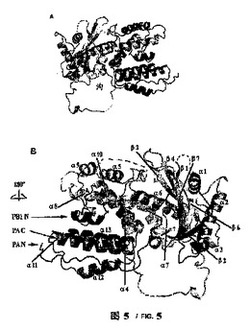
【図5】PAのC末端とPB1のN末端ペプチド複合体の全体構造:(A)PACとPB1N末端ペプチド複合体の全体構造の横視図、タンパク質鎖の成り行きを明瞭に示す。(B)図5(A)中の図をY軸に沿って180度回転し、二次構造には標識を行ない、その中のPB1のN末端ペプチドとPACの二つの末端を矢印で示した。
【図6】PACとPB1Nポリペプチド間の相互作用:(A)PAタンパク質分子の表面図;PB1のN末端ポリペプチドをリボン図で表示し、PA分子は表面電荷分布で表示する。(B)PAとPB1間の相互作用は主に疎水相互作用であることを観察し易いように部分拡大する。
【図7】PAタンパク質分子の表面電荷図。その中でA及びBはそれぞれ図5中A及びB図の方向と一致している。
【図8】PAC/PB1N末端ペプチド複合体分子構造中に存在する大溝領域とチャンネルの図解。A図は大溝領域、その中に分布されている一部アルカリ性アミノ酸残基を表示する。B及びC図はそれぞれ分子の両面から(X軸に沿って180度転回)PA分子中のチャンネル領域構造を観察する図である。チャンネル内外の一部の保存的アミノ酸を表示した。
【図9】PA−CとPB1−Nポリペプチド間の相互作用の図解:(A)PA−CとPB1−Nポリペプチド・タンパク質複合体分子三次元構造のリボン図;PA分子はN末端からC末端まで青から赤に変化するリボン図で表示する。(B)PAタンパク質分子の一つの表面図;PB1N端ポリペプチドはリボン図で表示し、PA分子は表面電荷分布で表示する。(C)PA分子上PB1ポリペプチド相互作用に関与する主なへリックス8、10、11、13の観察用に複合体構造部分を拡大する。(D)PA及びPB1間の相互作用観察用に部分拡大する。PB1N末端ポリペプチドはリボン図で表示し、PA分子は表面電荷分布で表示する。この二つのポリペプチドは主に疎水相互作用で結合する。
【図10】図1Aと図1Bと同様に、三種の異なったタイプのインフルエンザ・ウイルス由来に基づいたPAタンパク質C末端の配列及びPB1Nのタンパク質配列。(A)三種の異なったタイプのインフルエンザ・ウイルス由来に基づいたPAタンパク質の配列比較であり、図中、A_OURSは鳥インフルエンザA型ウイルス ウイルス株A/goose/Guangdong/1/96のPAタンパク質C末端の配列;A_1918は1918年ヨーロッパで爆発した大範囲インフルエンザで重大な人類死亡事件を引き起こしたA型インフルエンザ・ウイルス株A/Brevig Mission/1/1918 A型インフルエンザ・ウイルスPAタンパク質配列;B_1966は1966 Ann aborのインフルエンザB型ウイルスB/Ann Arbor/1/1966のPAタンパク質配列;C_1950は1950の一種のインフルエンザC型ウイルスC/JJ/1950のPAタンパク質配列である。これらの結果はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAタンパク質に高度に保存的なアミノ酸残基が含まれていることを示す。(B)四種の異なったタイプのインフルエンザ・ウイルス由来に基づいたPB1Nのタンパク質配列比較であり、図中、A_OURS、A_1918、B_1966、C_1950は(A)と同様であり、図中、….は該当領域のアミノ酸欠失を表し、明細書及び特許請求の範囲では具体的なアミノ酸位置を全てA_OURSを例に説明した。ボックスの中にRound loopと標記されているのは構造中の大環状領域、もう一方のボックス(未標記)は核酸結合可能領域である。矢印はPAのC末端がPB1オリゴペプチドとの結合に関与するアミノ酸残基を示す。明細書及び特許請求の範囲では具体的なアミノ酸位置を全てA_OURSを例に説明した。
【発明を実施するための形態】
【0051】
本発明は、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAの野生型又は変異型タンパク質を幾つかに分けて発現し、即ちN末端とC末端両部分をそれぞれ大腸菌にて発現し、精製する方法を提供した。それには、PAのN末端を単独に結晶実験に使う方法、PAより得た257−716残基を含むC末端断片とインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1の野生型又は変異型タンパク質のPB1のN末端ペプチドをそれぞれ大腸菌にて発現方する方法、精製方法、またPAのC末端とPB1のN末端ペプチド複合体で結晶する方法、及びこれによって得られたPAC/PB1Nオリゴペプチド複合体の結晶構造、とこれら結晶方法に基づいた薬物スクリーニング及びこれら結晶構造に基づいた薬物設計の実施を提供した。
【0052】
一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、その中でインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACはインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAの約201〜約301位アミノ酸から約650〜末端のアミノ酸までであり、PB1のN末端PB1Nはインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1のN末端PB1Nの48個アミノ酸以内のオリゴペプチドであり、そこに記述した結晶三次元構造中の原子は表1の中で挙げた40%の原子座標を持ち、又はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造中の少なくとも40%のアミノ酸の主鎖炭素骨格の原子構造座標は表1中の座標と平均二乗偏差が1.7Å以下である。
【0053】
一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、そこに記述したインフルエンザ・ウイルスはA、B、C型インフルエンザ・ウイルスより選び、そのうち、そこに記述したインフルエンザ・ウイルスは好ましくはA型インフルエンザ・ウイルス株A/goose/Guangdong/1/96とA/Brevig Mission/1/1918、B型インフルエンザ・ウイルス株B/Ann Arbor/1/1966又はC型インフルエンザ・ウイルス株C/JJ/1950より選んだ。
【0054】
一つの好ましい実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、その中で上記複合体の結晶はP4(1)2(1)2の空間群を持ち、格子定数はおよそα=b=122Å、c=133Å、α=β=γ=90°である。
【0055】
一つの好ましい実施態様を通して、本発明インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、そこに記述したA型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACはインフルエンザ・ウイルス・ポリメラーゼPAのC末端PAC中のαへリックス4、即ち406−414位を含むアミノ酸領域、αへリックス5、即ち440−450位を含むアミノ酸領域、αへリックス8、即ち583−603位を含むアミノ酸領域、αへリックス9、即ち608−613位を含むアミノ酸領域、αへリックス10、即ち633−649位を含むアミノ酸領域、αへリックス11、即ち653−673位を含むアミノ酸領域、αへリックス12、即ち683−691位を含むアミノ酸領域、とαへリックス13、即ち698−714位を含むアミノ酸領域、及び二つのβシート:βシート8とβシート9、それぞれ619−623位を含むアミノ酸領域と628−631位を含むアミノ酸領域が、PAのC末端PACの第一部分を構成し、その中でA型インフルエンザウイルスのポリメラーゼサブユニットPAのC末端PACは主要なβシート折り畳み断片より成り、これらのβシートにはβシート1、即ち290−292位を含むアミノ酸領域、βシート2、即ち317−324位を含むアミノ酸領域、βシート3、即ち480−491位を含むアミノ酸領域、βシート4、即ち496−506位を含むアミノ酸領域、βシート5、即ち517−526位を含むアミノ酸領域、βシート6、即ち541−550位を含むアミノ酸領域、βシート7、即ち557−571位を含むアミノ酸領域などが含まれ、これらのβシートが共同でPAのC末端PAC第二部分の折り畳みシート層の主な部分を構成し、その中でA型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACはαへリックス1、即ち303−311位を含むアミノ酸領域、αへリックス2、即ち331−349位を含むアミノ酸領域、αへリックス3、即ち364−369位を含むアミノ酸領域、αへリックス6、即ち454−475位を含むアミノ酸領域及びαへリックス7、即ち572−578位を含むアミノ酸領域が、PAのC末端PAC第二部分の上記折り畳みβシート層の周囲を囲い、その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0056】
一つの好ましい実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、そこに記述したA型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACは主にαへリックス8、αへリックス10、αへリックス11とαへリックス13の関与を通じてPB1のN末端PB1Nと相互に作用するが、好ましくは、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス11のLeu666、αへリックス13のPhe710、αへリックス10のVal636、Leu640、αへリックス13のTrp706、αへリックス11のGln670から構成される群より選択される少なくとも一つのアミノ酸を、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1との相互作用に関与させる。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0057】
一つの好ましい実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、そこに記述したA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のαへリックス9とαへリックス10の間の環状ペプチド断片のIle621、Gly622、Glu623、Thr618とPro620から構成される群より選択される少なくとも一つのアミノ酸を、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1との相互作用に関与させた。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0058】
一つの好ましい実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、その中、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のAsn647、Gln408、Cys584、Gln587、Gln591、Lys643、Asn647、Ser659、Lys663、Trp699、Asn703から構成される群より選択される少なくとも一つのアミノ酸を、記述のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPACのインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1Nと結合する「袋状」のアミノ・サイトを構成させた。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0059】
一つの好ましい実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、その中、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のTrp406、Glu410、Lys461、Glu524、Phe525、Ser526、Lys536、Lys539、Tyr540、Leu563、Tyr564、Arg566及びLys574から構成される群より選択される少なくとも一つのアミノ酸が、上記A型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACでヌクレオチド、RNA若しくはその他の小分子又はタンパク質と結合する主溝及びチャンネルの形成に関する。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0060】
一つの好ましい実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、そこに記述したA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACの370から405位に位置するアミノ酸残基は一つの大環状を構成し、そこに記述したB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0061】
一つの好ましい実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、そこに記述したA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス12、αへリックス13は他のタンパク質との相互作用に関与するが、好ましくは、αへリックス12及びαへリックス13中のIle690、Glu691、Glu692、Cys693、Asn696から構成される群より選択される少なくとも一つのアミノ酸を他のタンパク質との相互作用に関与させる。そこに記述したB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0062】
一つの好ましい実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、上記A型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのLys506、Gly507、Arg508、Ser509、His510、Leu511、Arg512、Asn513及びAsp514から構成される群より選択される少なくとも一つのアミノ酸をその他タンパク質との相互作用に関与させ、その中でHis510はポリメラーゼ複合体RNaseの一部分を構成し、その中で上記B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0063】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のαへリックス8、αへリックス10、αへリックス11とαへリックス13から構成される群より選択される少なくとも一つのメンバーと結合するポリペプチド、タンパク質、無機若しくは有機化合物を提供し、その中で上記インフルエンザ・ウイルスはA、B、C型インフルエンザ・ウイルスより選び、好ましくは、上記インフルエンザ・ウイルスはA型インフルエンザ・ウイルス株:A/goose/Guangdong/1/96、A/Brevig Mission/1/1918;B型インフルエンザ・ウイルス株:B/Ann Arbor/1/1966又はC型インフルエンザ・ウイルス株:C/JJ/1950より選び、その中で、好ましくは、上記ポリペプチド、タンパク質、無機若しくは有機化合物は上記A型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス11のLeu666、αへリックス13のPhe710、αへリックス10のVal636、Leu640、αへリックス13のTrp706、αへリックス11のGln670から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物であり、その中で上記B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0064】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のαへリックス9とαへリックス10の間の環状ペプチド断片中のA型インフルエンザ・ウイルスIle621、Gly622、Glu623、Thr618とPro620から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供し、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0065】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACでA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のAsn647、Gln408、Cys584、Gln587、Gln591、Lys643、Asn647、Ser659、Lys663、Trp699、Asn703から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供し、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0066】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACでA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のTrp406、Glu410、Lys461、Glu524、Phe525、Ser526、Lys536、Lys539、Tyr540、Leu563、Tyr564、Arg566及びLys574から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供し、その中でB型又はC型インフルエンザウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0067】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACでA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACの370から405位より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供し、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0068】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス12、αへリックス13と結合し、好ましくはA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス12及αへリックス13中のIle690、Glu691、Glu692、Cys693、Asn696から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供し、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0069】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のシートβ4とシートβ5の間の環状領域内でA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのLys506、Gly507、Arg508、Ser509、His510、Leu511、Arg512、Asn513及びAsp514から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供し、その中でB型又はC型インフルエンザウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0070】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼPB1と競合的にPACと結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供する。
【0071】
一つの好ましい実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼPB1と競合的にPACと結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物は主にPAC中αへリックス8、αへリックス11、αへリックス13、αへリックス10からなる疎水性コアを介して相互作用を起こし、好ましくはA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のαへリックス8中のMet595、αへリックス11中のLeu666、αへリックス13中のTrp706とPhe710、及びαへリックス10中のVal636とVal640を介して相互作用を起こし、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0072】
一つの好ましい実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼPB1と競合的にPACと結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供し、上記ポリペプチド又はタンパク質のアミノ酸配列における、野生型インフルエンザ・ウイルス・ポリメラーゼPB1のN末端PB1N残基5から10位Pro5、Thr6、Leu7、Leu8、Phe9とLeu10が形成する短へリックス領域を含む短PTLLFLモチーフの中の少なくとも三つは、該モチーフとのポリペプチド配列対比において対応する位置のアミノ酸が同じである。
【0073】
もう一つの具体的な実施態様を通して、上記ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物の組成物を提供し、キャリア又は賦形剤を選択的に含む。
【0074】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルスによる病気の治療薬物の製造における上記組成物の応用を提供する。
【0075】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の発現精製方法であって、
(a)標識タンパク質遺伝子コードを融合した又は融合しないインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC第約201〜約301位アミノ酸から約650〜末端位アミノ酸をコードする遺伝子配列のベクターを構築し、このベクターを使い原核又は真核細胞を形質転換し、よって標識タンパク質が付いているPACを発現することと;
(b)PACの発現と似た方法で標識が付く又は付かない上記PB1Nを発現することと;
(c)(a)で取得されたインフルエンザ・ウイルスPACの発現細胞と(b)で取得されたインフルエンザ・ウイルスPB1のN末端48個のアミノ酸以内のアミノ酸PB1Nの発現細胞を一定比率で混合し、特異的に特異標識を識別する方法でこの混合タンパク質を分離し、酵素性分解で標識がつくポリペプチド中の標識タンパク質を取り去り、PACとPB1Nとの複合体を分離し、タンパク質の濃度を確定することと;
を含み、
その中で上記ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造中の原子は表1の中で挙げた少なくとも40%の原子座標を持ち、又はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造中の少なくとも40%のアミノ酸の主鎖炭素骨格の原子構造座標は表1中の座標との平均二乗偏差が1.7Å以下である、方法が提供される。
【0076】
一つの好ましい実施態様を通して、その中で上記標識タンパク質はGST、Flag−tag、Myc−tag、MBP−tag、特異性抗体より選ばれ;上記ベクターは選択性標識遺伝子を含み、ステップ(c)中での一定比率とは標識タンパク質−PACと標識タンパク質−PB1Nのタンパク質総量のモル比が0.1:1〜1:0.1となるものであり、好ましくは標識タンパク質−PACと標識タンパク質−PB1Nのタンパク質総量のモル比を0.5:1〜1:0.5にさせ、更に好ましくは標識タンパク質−PACと標識タンパク質−PB1のタンパク質総量のモル比を1:1に近づかせ、好ましい標識タンパク質はGSTであり、上記特異標識識別方法はアフィニティ・カラムを使用し、上記標識を取り除く方法はプロティナーゼ酵素性分解を使用し、上記PACとPB1Nとの複合体の分離方法はゲル濾過法又はイオン交換クロマトグラフィーで行い、上記タンパク質の濃度確定はゲル電気泳動法で行う。
【0077】
更に好ましい実施態様では、その中の上記原核細胞は大腸菌である。
【0078】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の共結晶化方法であって、
上記精製したPACとPB1N複合体のタンパク質濃度を5〜30mg/mlまで濃縮することと;
hanging−drop蒸気拡散法またはsitting−drop蒸気拡散法で結晶成長条件をスクリーニングすることと;
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶を得ることと、
を含む方法を提供する。
【0079】
もう一つの具体的な実施態様を通して、本発明はPAのN末端1〜約50位アミノ酸から約200〜約300位のアミノ酸までであるPANの野生型又は突然変異型タンパク質の発現方法であって、標識タンパク質遺伝子を融合した又は融合していないインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのN末端PANの1〜約50位アミノ酸から約200〜約300位アミノ酸までをコードする遺伝子配列の発現ベクターを構築し、このベクターで細胞を形質転換し、よって標識タンパク質を持つPANを発現し、その中で上記PAのN末端PAN中のアミノ酸配列は図1C中の少なくとも40%のアミノ酸と同じである方法を提供する。
【0080】
一つの好ましい実施態様で、そこに記述した原核細胞は大腸菌である。
【0081】
他のもう一つの具体的な実施態様で、PB1Nと競合的にPACと結合する候補化合物のスクリーニング方法であって、
(a)PACを固定ベクターの表面に結合させることと;
(b)過剰量の標識付きPB1Nを上記の固定されたPACに接触させることと;
(c)溶出液で充分に溶出して、未結合の遊離PB1Nを取り除くことと;
(d)テスト化合物の溶液を(b)の項で記述した操作でPB1Nと結合したPACに接触させることと;
(e)記述した溶出液で充分に溶出して、テスト溶液を得ることと;
(f)上記テスト溶液中の標識つき遊離PB1Nの濃度を測定することと;
(g)テスト溶液中の標識つき遊離PB1Nの濃度を基に、候補化合物のPACとの結合能力を求めることと、
を含む方法を提供する。
【0082】
好ましい実施態様では、上記ステップ(a)中PACの固定表面上への結合を、共有結合性架橋又はPACをアフィニティ・マトリックスと結合させることにより実現した。上記アフィニティ・マトリックスは固定表面上にはそのアフィニティ・マトリックスが結合できる結合基を有する。
【0083】
好ましくは、上記アフィニティ・マトリックスはGST、Flag−tag、Myc−tag、MBP−tag、His−tag、特異性抗体から選択され、固定表面上は対応マトリックスの結合基を有する。
【0084】
好ましくは、上記標識付きPB1Nポリペプチドは同位体又はその他の化学分子で標識したタンパク質より選択され、好ましくは、その他の化学分子での標識は緑色蛍光タンパク質、各種融合ポリペプチドより選び使用した。
【0085】
好ましくは、上記固定表面はアフィニティ・クロマトカラムである。
【0086】
一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造の、インフルエンザ・ウイルス感染による疾病の治療に使用できる各種ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物の設計とスクリーニングにおける応用であって、
タンパク質三次元構造座標に基づき、コンピューター・シミュレーションにて特定位置に結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物分子を設計することと;
タンパク質三次元構造座標に基づき、コンピューター・シミュレーションにて特定位置に結合可能なポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物分子をスクリーニングすることと;
タンパク質三次元構造座標に基づき、設計或はスクリーニングしたポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物分子を上記PAC及びPB1N配列と少なくとも50%同配列を持つ任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・タンパク質に結合させ、更に結合状況を分析することと;
タンパク質三次元構造座標に基づき、設計或はスクリーニングしたポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物分子を上記PAC及びPB1N配列と少なくとも50%同配列を持つ任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・タンパク質に結合させ結晶にし、よってタンパク質X線結晶構造解析方法にてポリペプチド及び化合物分子のタンパク質との結合状況を分析することと、
を含み、
その中、上記PAC及びPB1N配列と少なくとも50%の同配列を持つ任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・タンパク質と結合する上記ポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物分子が即ち候補化合物である。
【0087】
一つの具体的な実施態様を通して、任意亜型のインフルエンザ・ウイルス・ポリメラーゼの三つのサブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の構造を提供したが、その中に含まれる一つのタンパク質又はそのある一領域は、上記PACタンパク質と少なくとも40%の同じ配列を持つ応用を提供する。
【0088】
一つの具体的な実施態様を通して、任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の三次元構造を提供したが、その中に含まれる一つのタンパク質又はそのある一領域の主鎖の三次元構造座標は、上記PACタンパク質配列の少なくとも40%の主鎖炭素骨格の原子三次元座標と平均二乗偏差が1.7Å以下である。
【0089】
一つの具体的な実施態様を通して、任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の構造を提供したが、そこに含まれる一箇所のタンパク質領域は上記のPB1Nポリペプチドのアミノ酸1−11領域と20%の配列相同性を持ち、好ましくは40%の配列相同性を持つ。
【0090】
一つの具体的な実施態様を通して、一種のポリペプチド又は小分子を提供したが、それらの特徴は上記インフルエンザ・ウイルスPAサブユニット上の任意のアミノ酸と相互作用を有することにある。
【0091】
一つの具体的な実施態様を通して、上記の三次元結晶構造の薬物スクリーニング及び薬物設計における応用を提供した。
【0092】
一つの具体的な実施態様を通して、PACとPB1Nタンパク質三次元構造に基づいて、タンパク質と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物をスクリーニングする方法であって、タンパク質結晶方法でPACを含む結晶を取得し、又はPAC及びPB1Nを含むタンパク質複合体結晶の三次元構造座標を取得し;そこに記述した三次元構造はこの座標における少なくとも40%のアミノ酸残基を含有する主鎖炭素骨格原子の三次元座標と比べ平均二乗偏差が1.7Å以下である全ての構造を含む方法を提供する。
【0093】
一つの具体的な実施態様を通して、下記のようなインフルエンザ・ウイルス亜型PAサブユニット・タンパク質の発現精製方法を提供し:PAを断片に分けて細菌又は真核発現システムにて発現するが、記述した方法で、含有するあらゆるタンパク質からある一箇所の断片が記述配列相応領域と同じアミノ酸配列を40%持つタンパク質を発現し精製する。
【0094】
一つの具体的な実施態様を通して、本発明のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体構造中のαへリックス8、10、11、13中任意一つの領域と少なくとも40%の同じアミノ酸を有するタンパク質上のアミノ酸残基と相互に作用するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供した。
【0095】
注意すべきは、その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりであり、ここでは一々詳述することを略す。採用しうるタンパク質又はポリペプチド配列の比較方法としてはCLUSTALW(http://www.ebi.ac.uk/Tools/clustalw2/index.html)を例に挙げる。
【0096】
インフルエンザ・ウイルスPAとPB1タンパク質の発現精製方法:
鳥インフルエンザ由来ウイルス遺伝子A/goose/Guangdong/1/96、そのコードタンパク質配列はそれぞれ:
(1)PAタンパク質配列:
【表1】

即ち:
【表2】

【0097】
(2)PB1タンパク質配列:
【表3】

即ち:
【表4】

である。
【0098】
分子クローン技術にて、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA遺伝子をタンパク質のN末端とC末端の二部分に分けてクローン化する。N末端には256位までのアミノ酸を含み、C末端には257番目から716番目のアミノ酸を含む。これら両遺伝子は、N末端にGSTを融合した融合タンパク質(GST−PA−N及びGST−PAC)を発現させるため、それぞれpGEX−6pベクター(Amersham Pharmacia Inc.より)へクローン化し、クローン化したプラスミドにて大腸菌BL21を形質転換し、形質の転換されたBL21にて最終濃度0.1−1mMのIPTG(イソペニル−β−D−チオガラクトシド)で大腸菌による二種のタンパク質の発現を誘導して当該二種類タンパク質の各自発現菌を獲得した。詳細は実施例1を参照。
【0099】
PB1 N末端の48個以内のアミノ酸の遺伝子(前から25ペプチドを含む)を同様にpGEX−6pベクターへクローン化し、GST−PB1N末端ペプチドを融合した融合タンパク質を発現した。
【0100】
同じく、GSTを融合したPB1N末端25個アミノ酸のオリゴペプチド又は48個以内のアミノ酸のオリゴペプチドをそれぞれ発現した。同様に当該プラスミドにて大腸菌BL21を形質転換し、形質の転換されたBL21にて最終濃度0.1−1mMのIPTGで大腸菌によるタンパク質の発現を誘導してそのタンパク質の発現菌を獲得する。
【0101】
GST−PA−Nを発現した細菌をバッファーに懸濁して溶解し、遠心分離して上清を得たあと、アフィニティ・クロマトカラムを使って、その中からGST−PA−N融合タンパク質を精製し出す。
【0102】
GST−PACを発現した発現菌とGST−PB1オリゴペプチドを発現した発現菌をそれぞれ約20mM Tris−HCl(pH 8.0)及び250mM NaClを含むバッファーに懸濁し、そして二種の発現菌を比率にあわせ混合して、GST−PACとGST−PB1のタンパク質総含有量のモル比が0.1:1〜1:0.1になるようにするが、好ましくはGST−PACとGST−PB1のタンパク質総含有量のモル比を0.5:1〜1:0.5に、更に好ましくはGST−PACとGST−PB1のタンパク質総含有量のモル比を1:1に近づかせる。
【0103】
そして、その混合GST融合タンパク質をグルタチオン−Sepharoseアフィニティ・カラム(Amersham Pharmacia Inc.)を使用して精製する。PreScissionプロティナーゼ(Amersham Pharmacia Inc.より)にて酵素分解後、ゲル濾過Superdex−200及びイオン交換クロマトグラフィー(Q sepharose)等の方法でPAC/PB1オリゴペプチド複合体(クロマトカラムは全てAmersham Pharmacia Inc.より)を分離精製し出し、SDS−PAGEにてタンパク質の純度を測定後、更なる結晶実験に使用する。
【0104】
タンパク質の結晶化とその最適化:
上記方法で発現精製したPAC及びPB1Nポリペプチドの複合物を約5−30mg/ml濃度まで濃縮し、hanging−drop蒸気拡散法にて、結晶化試薬(Hampton Research)を使用して結晶成長条件をスクリーニングし、多種結晶化試薬の使用条件下でイニシャル結晶を得た。
【0105】
更なる最適化を通じて、その中、異なるpHバッファーの条件下(pH 4〜9)約1Mの酢酸ナトリウム溶液より外見の良好な結晶を得た。濃度1〜1.3Mの酢酸ナトリウム(Sigmaより)のバッファー(pH4〜9)より比較的大きい三角錐体結晶を取得し、分解能約4Åくらいであった。
【0106】
X線回折データ収集を行う際、回折に必要な結晶を懸濁液から1.4Mの酢酸ナトリウム約10μlと10%のグリセリン(Sigmaより)を含有する結晶バッファーへ移し、ドロップをオープン放置して空気脱水を1時間以上行った後、分解能が3Åに到る母体及びセレノ結晶と相応のX線回折データを得た。
【0107】
結晶のデータ収集と構造解析:
FR−E X線回折機(Rigakuより)を使用し、1.5418Åの波長下でまずPA−PB1のN端25ペプチド複合体結晶の分解能2.9Åの母体データを一セット収集した。そして、アメリカ、シカゴのAPS(Advanced Photon Source)シンクロトロン放射光施設(synchrotron radiation facility)(ビームライン番号:SBC 19ID;ビームモニター:ADSC Q315)を利用して、波長0.9783Åと0.9785Åの下で、このタンパク質結晶の分解能が約3.3Åに到るpeakとedgeとした2セットのセレン化物結晶データを収集した。HKL2000(Otwinowski 1997)を利用して、得られた3セットのデータを処理し、それらの空間群が全てP4(1)2(1)2であることを発見した。多波長異常分散法(Hendrickson 1991)で位相を計算し、処理しで得たscaファイルよりSHELXD(Sheldrick 1998)でセレン原子を探した。タンパク質自身14個のメチオニンを含むが、本発明者らは合わせて14個のセレン原子を見つけ出し、セレン原子座標及び処理して得たPeakとEdge二セットのデータをautoSHARPプログラム(Vonrhein、Blancら、2007)にインプットして、位相計算と電子密度図の修飾を行なった。計算して得られた電子密度図より、幾つかの二次構造(一部のαへリックスとβシートを含む)がはっきりと見出せる。そして、プログラムCADを利用して位相拡張を行い、受け取った母体データを利用して位相を2.9Åまでを広げて構造モデルの構築を行なった。モデル構築に使ったプログラムはARP/wARP(Perrakis、Morrisら、1999)とPhenix(Adams、Grosse−Kunstleveら、2002)である。この二種のプログラムの自動モデル構築で全体構造の約60%が完成でき、残りの部分はプログラムCOOT(Emsley and Cowtan 2004)を利用して手動で構築した。
【0108】
最後に、得られたモデルをプログラムCNS(Brunger、Adamsら、1998)とREFMAC5(Murshudov、Vaginら、1997)で修正した結果、当該タンパク質構造の解析完成に至り、修正した構造の最終R因子と自由R因子はそれぞれ0.22と0.26である。
【0109】
PAC/PB1Nオリゴペプチドタンパク質複合体結晶構造原子座標は表1を参照。
【実施例】
【0110】
実施例1
インフルエンザ・ウイルスPAとPB1ポリペプチドの発現方法:
本発明の一種の実施態様はPAを二段に分けて発現し、よってPAのN末端前256アミノ酸残基セグメント及び257−716個アミノ酸残基セグメントを別々に発現し、この二つのタンパク質ポリペプチドをコードする二つの遺伝子セグメントを別々に大腸菌発現ベクター上へクローン化し、細菌中でタンパク質の発現を行う。単独にPAのN末端(1−256アミノ酸)を発現する細菌中からPAのN端ポリペプチドを精製し、PAのN端ペプチドをタンパク質結晶に使用する。PAのN末端発現菌を遠心収集後、PB1のN端ポリペプチドとの共同精製に備える。
【0111】
PB1のN末端前25座又は48座アミノ酸以内を含むポリペプチド(第一位メチオニンは含まず)をGST融合タンパク質の形式で細菌中で発現する。インフルエンザ・ウイルス・ポリメラーゼ・タンパク質・サブユニットPAを段分けで細菌中又はその他真核生物細胞中で少なくとも50%の領域が257−716アミノ酸領域の一部分のPAタンパク質・セグメントで発現する。
【0112】
インフルエンザ・ウイルスPAのN末端を大腸菌中で発現精製
分子クローン技術を使用し、インフルエンザ・ウイルスPAのN末端(第1から256位アミノ酸)をpGEX−6pベクター(Amersham Pharmacia Inc.より)へクローン化し、そのクローン・サイトはBamHI及びXhoIであり得る。クローン化で得たPAのN末端遺伝子を含む発現プラスミドで大腸菌BL21を形質転換してタンパク質を発現し、よって細菌にPAタンパク質N端(N末端)にGST融合タンパク質が接続され発現すると同時にProScissionプロティナーゼ (Amersham Biosciences)によって切断可能な酵素切断サイトを含むためGSTタンパク質標識と標的タンパク質PAポリペプチドが分離できる。培養した大腸菌BL21細胞中で最終濃度が0.1−1mMあたりのIPTGを使用して大腸菌を触発し、当該タンパク質の発現菌を獲得する。使用されたベクターはアンピシリン耐性遺伝子を含む。クローン化で構築した融合タンパク質発現プラスミドにて大腸菌、例えばBL21(Novagen)を形質転換した後、37度でLB等細菌培養器を使用し一晩細菌培養し、約12時間後1:100あたりで大量の培養器へ移し、37度温度下でODが1.0あたりまで培養し、そして0.1〜1mMのIPTGを加え発現誘導を行い、およそ3−6時間後遠心して細菌を収集し、収集した沈澱細菌は−20度から−80度の冷蔵庫で保存し、PAのN末端タンパク質の精製に備える。
【0113】
インフルエンザウイルスPAのC末端とPB1ポリペプチド複合体の発現精製:
分子クローン技術を通して、インフルエンザ・ウイルスPAのC末端(第257から第716アミノ酸)をpGEX−6pベクター(Amersham Pharmacia Inc.より)上へクローン化し、そのクローン遺伝子座はBamHI及びNotIである。クローン化したPAのC末端遺伝子を含む発現プラスミドを大腸菌BL21中で形質転換しタンパク質の発現を行い、よって細菌にタンパク質N端(N末端)にGST融合タンパク質が繋ぐのを発現させ、同時にProScissionプロティナーゼ(Amersham Biosciences)によって切断可能な酵素切断遺伝子座が含まれることによって、GSTタンパク質標識と標的タンパク質PAポリペプチドを分離する。培養した大腸菌BL21細胞に最終濃度が0.1−1mMあたりのIPTGを使用してタンパク質発現を誘導し、当該タンパク質の発現菌を獲得する。使用されたベクターはアンピシリン耐性遺伝子を含む。クローン化で構築した融合タンパク質発現プラスミドにて大腸菌例えばBL21(Novagen)を形質転換した後、37度でLB等細菌培養器を使用し一晩細菌培養し、約12時間後1:100あたりで大量の培養器へ移し、37度温度下でODが1.0あたりまで培養し、それから培養温度を16度まで下げ、そして0.1−1mMのIPTGを加え触発発現を行い、およそ12−24時間後遠心して細菌を収集し、収集した沈澱細菌は−20度から−80度の冷蔵庫で保存するか、直接精製に使う。
【0114】
PB1 N端48個以内のアミノ酸の遺伝子(発明者らはPB1のN末端前48個アミノ酸ポリペプチド及び前25個アミノ酸ポリペプチドを発現)を同様にpGEX−6pベクターの多クローン遺伝子座上へクローン化し、使われた酵素切断サイトはBamHI及びXhoIで、細菌にGST融合タンパク質を含む発現ができ、並びに当該融合タンパク質はProScissionプロティナーゼ(Amersham Biosciences)によって切断可能なプロティナーゼ遺伝子座を含み、GST標識及び標的タンパク質PB1ポリペプチドを分離できるようにする。上記通り、PA融合タンパク質発現方法は大腸菌BL21中で融合のGST−PB1N端ペプチドの融合タンパク質を発現することであり、選択性遺伝子はアンピシリン耐性遺伝子であり、タンパク質の発現は37度下であり、使用される誘導物質はIPTGである。最後に遠心分離で発現細菌を収集し、当該細菌はそのままタンパク質の精製に使用し、若しくは−20度から−80度の冷蔵庫で保管する。
【0115】
遠心分離で収集したGST−PAN末端ポリペプチドの発現菌を約20mM Tris−HCl(pH8.0)及び250mM NaClのバッファー又は1×PBS(pH7.4)燐酸バッファーに懸濁し、超音波にて細胞を破砕し、不溶沈殿を遠心して除去し、上清を収集して、グルタチオンアフィニティ・クロマトグラフィーにてGST−PA−N端ポリペプチドを精製し、よってProScissionプロティナーゼ酵素性で融合タンパク質を分解し、融合プロティナーゼをGST(グルタチオンS−トランスフェラーゼ)とPA−Nの二段に分解し、更にイオン交換クロマトグラフィー及びゲルサイズ排除クロマトグラフィーにてPA−Nタンパク質ポリペプチドを精製する。このタンパク質を5〜30mg/mLまで濃縮し、結晶成長に使用する。
【0116】
GST−PACC末端ポリペプチドの発現菌とGST−PB1Nオリゴペプチドの発現菌をそれぞれ約20mM Tris−HCl(pH8.0)及び250mM NaClのバッファー又は1×PBS(pH7.4)燐酸バッファーに懸濁し、そして二種類の発現菌を一定比率で混合し、GST−PAとGST−PB1のタンパク質総含有量のモル比を0.1:1〜1:0.1にさせ、好ましくはGST−PAとGST−PB1のタンパク質総含有量のモル比が0.5:1〜1:0.5で、更に好ましくはGST−PAとGST−PB1のタンパク質総含有量のモル比を1:1に近づかせる。
【0117】
混合された細菌懸濁液は超音波又はその他細胞溶解法で細胞を破砕した後、遠心して細胞溶解物の不溶部と可溶部に分離され、高速遠心(約20,000g)した後得た上清をグルタチオン−Sepharoseアフィニティ・カラム(Amersham Pharmacia Inc.より)を通して、初歩的にこの混合タンパク質を分離精製し、GST標識を含むタンパク質はグルタチオン−Sepharoseアフィニティ・カラムに結合でき、その他タンパク質は当該アフィニティ・カラム上には結合できない。タンパク質がアフィニティ・カラムと結合したら、上記の細菌懸濁バッファーで不純物タンパク質を洗い流す。適量のProScissionプロティナーゼ(Amersham Pharmacia Inc.より)を使用し、アフィニティ・カラム上の混合GST融合タンパク質を酵素性分解し、この過程が約24時間かかる。そして酵素性分解で切断したPACとPB1N融合タンパク質をゲル濾過法Superdex−200(Amersham Pharmacia Inc.より)及びQ sepharoseイオン交換クロマトグラフィー(Amersham Pharmacia Inc.より)等の方法で、PAC/PB1Nオリゴペプチド複合体(クロマトグラフィー・カラムは全てAmersham Pharmacia Inc.より)を分離精製し、SDS−PAGEゲル電気泳動法でタンパク質純度を確定後、純度は通常90%以上に達する。上記ステップを通して精製されたタンパク質を濃縮管(Millipore社より)で約5−30mg/mLあたりまで濃縮し、更なる結晶実験で使用する。
【0118】
当業者が知るとおり、インフルエンザ・ウイルスのPAのN末端及びPAのC末端PACとPB1のN末端PB1Nは本願明細書上記の原核細胞、例えば大腸菌細胞の中だけで発現できるのではなく、真核細胞、例えば昆虫細胞の中でも発現でき;同時に任意のそのエンドヌクレアーゼ、酵素切断サイト、リガーゼが使用でき;精製待ちの目標ポリペプチドをGST如くその他標識と融合させ、そして相応の分離精製方法を選び精製し、最後に目標ポリペプチド中に融合した標識を除去できる。上記本発明に対する各種変更と修飾は全て本発明の保護範囲内にある。
【0119】
注意すべきは、その中でB型又はC型インフルエンザウイルスにおけるA型インフルエンザウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりであり、ここでは略述する。
【0120】
実施例2
PAC/PB1Nオリゴペプチド複合体の結晶
上記方法で発現精製したPAのN末端ポリペプチドの複合物を濃度約5−30mg/mLまで濃縮し、hanging−drop蒸気拡散法で結晶化試薬(Hampton Research社等よりのScreen Kit I/II、Index等の試薬キット)を使用して結晶成長条件をスクリーニングする。プライマリスクリーニングで、本発明者らは各種異なる結晶化試薬の使用条件下でイニシャル結晶を獲得する。
【0121】
更なる最適化を通じて、その中、異なるpHバッファーの条件下(pH 4〜9)約1Mの酢酸ナトリウム溶液より外見の良好な結晶を得た。濃度1〜1.3Mの酢酸ナトリウム(Sigmaより)のバッファー(pH4〜9)より比較的大きい三角錐体結晶を取得し、分解能は約4Åくらいであった。
【0122】
X線回折データ収集を行う際、回折に必要な結晶を懸濁液から1.4Mの酢酸ナトリウム約10μlと10%のグリセリン(Sigmaより)を含有する結晶バッファーへ移し、ドロップをオープン放置して空気脱水を1時間以上行った後、高解析度のタンパク質結晶が得られたが、母体及びセレノタンパク質結晶解析度は2.9Å以上にも達する。
【0123】
注意すべきは、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりであり、ここでは略述する。
【0124】
実施例3
PAC/PB1Nオリゴペプチド複合体の結晶構造
FR−E X線回折機(Rigakuより)を使用し、1.5418Åの波長下でまずPA−PB1のN端25ペプチド複合体結晶の分解能2.9Åの母体データを一セット収集した。そして、アメリカ、シカゴのAPS(Advanced Photon Source)シンクロトロン放射光施設(synchrotron radiation facility)(ビームライン番号:SBC 19ID;ビーム・モニター:ADSC Q315)を利用して、波長0.9783Åと0.9785Åの下で、このタンパク質結晶の分解能が約3.3Åに到るpeakとedgeとした2セットのセレン化物結晶データを収集した。HKL2000(Otwinowski 1997)を利用して、得られた3セットのデータを処理し、これらの空間群が全てP4(1)2(1)2であることを発見した。多波長異常分散法(Hendrickson 1991)で位相を計算し、処理しで得たscaファイルよりSHELXD(Sheldrick 1998)でセレン原子を探した。タンパク質自身14個のメチオニンを含むが、本発明者らは合わせて14個のセレン原子を見つけ出し、セレン原子座標及び処理して得たPeakとEdge二セットのデータをautoSHARPプログラム(Vonrhein、Blancら、2007)にインプットして、位相計算と電子密度図の修飾を行なった。計算して得られた電子密度図より、幾つかの二次構造(一部のαへリックスとβシートを含む)がはっきりと見出せる。そして、プログラムCADを利用して位相拡張を行い、受け取った母体データを利用して位相を2.9Åまでを広げて構造モデルの構築を行なった。モデル構築に使ったプログラムはARP/wARP(Perrakis、Morrisら、1999)とPhenix(Adams、Grosse−Kunstleveら、2002)である。この二種のプログラムの自動モデル構築で全体構造の約60%が完成でき、残りの部分はプログラムCOOT(Emsley及びCowtan 2004)を利用して手動で構築した。
【0125】
最後に、得られたモデルをプログラムCNS(Brunger、Adamsら、1998)とREFMAC5(Murshudov、Vaginら、1997)で修正した結果、当該タンパク質構造の解析完成に至り、修正した構造の最終R因子と自由R因子はそれぞれ0.22と0.26である。
【0126】
実施例4
PAのN末端タンパク質結晶
上記方法で発現精製したPAのN末端ポリペプチドの複合物を濃度約5−30mg/mLまで濃縮し、hanging−drop蒸気拡散法で結晶化試薬(Hampton Research社等よりのScreen Kit I/II、Index等の試薬キット)使用して結晶成長条件をスクリーニングする。プライマリ・スクリーニングで、本発明者らは各種異なる結晶化試薬の使用条件下でイニシャル結晶を獲得する。
【0127】
更に最適化を通じて、その中で、pH6.5のMESバッファー条件下で約20%PEG8000又は20%3350、0.1Mの塩化マグネシウム又は0.1Mの酢酸マグネシウム溶液(使用した試薬は全てSigma Inc.より)からは全てX線回折良好な結晶が得られ(図3のA及びB結晶図及びC及びD回折図)、結晶のX線回折解析度は約2−4Åあたりである。
【0128】
実施例5
PB1Nと競合的にPACと結合する小分子のスクリーニング方法
PAC/PB1Nオリゴペプチド複合体を脱重合させる一種の小分子薬物のスクリーニング過程において、その中でPB1Nオリゴペプチドの遺伝子とGFP(緑色蛍光タンパク質)を発現する遺伝子を融合させ、GFP融合のPB1Nオリゴペプチド・タンパク質を発現し、小分子化合物脱重合タンパク質複合体の指示分子とする。分子クローン化方法でPB1オリゴペプチド遺伝子セグメントをGFP遺伝子断片上に繋ぎ、一つのN末端又はC末端に繋ぐGFPのPB1ペプチド融合タンパク質を発現する。
【0129】
方法1:上記PAのC末端及びPB1オリゴペプチドの発現精製方法、N末端にGSTのあるPAのC末端融合タンパク質即ちGST−PAC融合タンパク質とGFP−PB1Nオリゴペプチド融合タンパク質の複合体を発現精製する。GST−PAC融合タンパク質とGFP−PB1Nオリゴペプチド融合タンパク質の複合体をグルタチオンアフィニティ・カラム上に流し、結合させる。当該複合体にはGFPタンパク質が含まれているため、GST−PACはこのアフィニティ・カラムと結合後、GST−PACと結合したGFP−PB1N融合タンパク質はこのアフィニティ・カラムを緑色に染める。GST−PAC及びGFP−PB1N複合体タンパク質と結合後のアフィニティ・カラムをバッファーで充分に洗浄し、未結合のタンパク質を徹底的に除去する。そして、スクリーニング用の小分子化合物の混合物をこのアフィニティ・カラムに流し(当該混合物中にはグルタチオン又はその他GSTをアフィニティ・カラムから分離され、洗い落とされる成分は含まれるべきではない)、もしも混合物中にPB1Nポリペプチドに代わってPACと結合する小分子が含まれていれば、一部PAC上に結合しているGFP−PB1Nポリペプチド融合タンパク質が代わりに洗い落とされ、洗い出した溶液の中にはこのGFP融合タンパク質が含まれているため、一定波長の蛍光顕微鏡で緑色を示す。更に混合物中より小分子を分離精製し、上記緑色蛍光タンパク質追跡方法で、PB1Nポリペプチドを替えられる成分を追跡し、PAとPB1ペプチドの結合を阻害する小分子化合物を最終確定する。上記の方法の様にGSTをアフィニティ・マトリックスとして使用する以外にも、例えばFlag−tag、Myc−tag、MBP(Maltose binding protein、マルクトース結合タンパク質)−tag、特異性抗体等その他ポリペプチドをアフィニティ・マトリックス結合基として使用でき、相応に、アフィニティ・クロマトカラムにも相応なアフィニティ・マトリックスを使うべきで、例えばFlag−tag使用時、対Flag−tagの抗体(例えばSigma Inc.社のanti−flag単クローン抗体)を使用し、それをアフィニティ・クロマトカラムに固定し、Flagと結合するゲル・マトリックスとして使う。PAに結合且つPB1ペプチド(具体構造)の代わりとなる化合物分子は例えばMS等の方法でその化学構造を確定できる。
【0130】
方法2:PACを単独で精製し(融合タンパク質又は非融合タンパク質)、それを化学的架橋方法を利用して、共有結合性架橋でゲル・マトリックスに繋ぎ、但しタンパク質は不変性を保たせる。GFP−PB1Nを共有結合したゲル・カラムを通して、GFP−PB1N融合タンパク質とPACタンパク質を結合させ、よってゲル・カラムはGFP緑色蛍光を表す。小分子混合物溶液がこのゲル・カラムに流れ、もしもGFP−PB1Nに代わってPACと結合する化合物があれば、GFP−PB1N融合タンパク質が洗い落とされ、溶出液は特定波長光の下で緑色を示し、GFP−PB1Nの代わりの化合物分子は即ちゲルカラム上のPAC分子上に結合した。バッファーでゲル・カラムを洗い流していらないものを取り除き、更に尿素等でPACを変質させ、その上に結合した小分子を洗い落とし、質量分析等の方法で、PA上に結合した小分子を分析し、この小分子の構造情報を得る。この化合物はPAC/PB1Nオリゴペプチド複合体を分解させる小分子薬物に成りうる。
【0131】
実施例6:
PAC/PB1Nの複合体の結晶三次元構造を利用した、インフルエンザ・ウイルス感染による病気の治療に用いる各種ポリペプチド、タンパク質又は無機若しくは有機化合物の設計とスクリーニング方法
インフルエンザ・ウイルスポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を利用した、インフルエンザ・ウイルス感染による病気の治療に用いる各種ポリペプチド、タンパク質又は無機若しくは有機化合物の設計とスクリーニングの具体的ステップは下記通りである:タンパク質三次元構造の座標に基づき、コンピューター・シミュレーションを通して特定位置に結合するポリペプチド及び化合物分子を設計し;タンパク質三次元構造の座標に基づき、コンピューター・シミュレーションを通して特定位置に結合する可能性のあるポリペプチド及び化合物分子を探索し;タンパク質三次元構造の座標に基づき、設計又は探索し出したポリペプチド及び化合物分子を、上記PAC及びPB1N配列と少なくとも50%同じ配列を持つ任意亜型インフルエンザ・ウイルス・ポリメラーゼ・タンパク質の中へ結合させ、更に結合状況の方法を分析し;タンパク質三次元構造の座標に基づき、設計又は探索し出したポリペプチド及び化合物分子を、上記PAC及びPB1N配列と少なくとも50%同じ配列を持つ任意亜型インフルエンザ・ウイルス・ポリメラーゼ・タンパク質の中へ結合させ、並びに結晶させ、よって結晶回折三次元構造分析方法でポリペプチド及び化合物分子とタンパク質の結合状況を分析する。
【0132】
実施例7:
PAC/PB1Nの複合体の結晶三次元構造を利用した、インフルエンザ・ウイルス感染による病気の治療に用いるペプチドの設計とスクリーニング
実験による実証では、一種のM1、D2、V3、N4、P5、T6、L7、L8、F9、L10及びK11を含むオリゴペプチドはPAのC末端と結合する。発明者らはPB1Nから、第一座M1から第11座K11までを含むポリペプチド遺伝子をpFEX−6pベクター上へクローン化し、このGST−PB1N融合タンパク質を精製し、体外結合実験を通して、アフィニティ・ゲル・カラムに固定されたこの融合タンパク質で溶液中のPA−Cと結合させ、発明者らはこの融合タンパク質がPB1Nが持つPA−Cと結合する能力を所有していることを発見した。
【0133】
同じ実験方法を通して、発明者らは一種のM1、D2、V3、N4、P5、T6、L7、L8、F9、L10、K11、V12及びp13を含む融合タンパク質もPB1Nが持つPA−Cと結合する能力を所有していることを発見した。これで、この二種類のオリゴペプチドが持つPA−Cと結合する能力により、これらオリゴペプチドは潜在的なインフルエンザ・ウイルス・ポリメラーゼ活性を阻害するポリペプチド薬物又は更に薬物設計をする模型と成りうる。
【0134】
同様に、スクリーニングされたポリペプチドが、上記ポリペプチドと少なくとも3座同じアミノ酸配列がある場合、このポリペプチドは潜在的にインフルエンザ・ウイルス・ポリメラーゼ活性を阻害するポリペプチド薬物に成りうる。
【0135】
任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の構造で、その中に含まれる一つのタンパク質又はそのある一領域は、上記PACタンパク質と少なくとも40%同じ配列を持つ。
【0136】
任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の構造で、その中に含まれる一つのタンパク質又はそのある一領域の主鎖三次元構造座標は、上記のPACタンパク質配列の少なくとも40%の主鎖炭素骨格三次元座標と平均二乗偏差が1.7Å以下である。
【0137】
任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の構造で、その中に含まれる一つのタンパク質領域は上記のPB1Nポリペプチドのアミノ酸2−12領域と40%の配列同様性がある。
【0138】
任意ポリペプチド又は小分子と、上記インフルエンザ・ウイルスPAサブユニット上のキーアミノ酸との間では相互作用がある。
【0139】
上記構造の薬物スクリーニング及び薬物設計においての応用:
PAC及びPB1Nタンパク質三次元構造に基づいた、タンパク質結合の化合物又はポリペプチドのスクリーニング方法は下記を含む:タンパク質結晶方法でPAC及びPB1Nタンパク質複合体結晶を取得し、当該タンパク質複合体結晶はP4(1)2(1)2の空間群を持ち、単位胞は約α=b=122Å、c=133Å、α=β=γ=90°である;X線回折結晶学技術で、PAC及びPB1Nタンパク質複合体の三次元構造座標を取得し;該三次元構造は、当該座標中の少なくとも40%アミノ酸残基の主鎖炭素骨格三次元座標と平均二乗偏差が1.7Å以下である構造を全て含む。
【0140】
インフルエンザ・ウイルス亜型PAサブユニット・タンパク質の発現精製方法:PAを段分けで細菌又は真核発現系で発現し、上記でこの方法により、任意タンパク質中のある一領域と上記の配列相応領域が40%の同じアミノ酸配列であるタンパク質を発現精製する。
【0141】
一つの好ましい実施例の中で、PAC/PB1N複合体がインフルエンザ・ウイルス感染による病気の治療に用いられるポリペプチド、タンパク質、化合物又は薬物設計と探索中での応用が提供される。
【0142】
一つの好ましい実施例の中で、インフルエンザ・ウイルス感染による病気の治療に用いるポリペプチド、上記で挙げた複合体も含み、少なくとも一種の上記αへリックス又はβシート、少なくとも一個のアミノ・サイトと相互に作用するポリペプチドが含まれる。
【0143】
一つの好ましい実施例の中で、インフルエンザ・ウイルス感染による病気の治療に用いるタンパク質、上記で挙げた複合体も含み、少なくとも一種の上記のαへリックス又はβシート、少なくとも一個のアミノ・サイトと相互に作用するタンパク質が含まれる。
【0144】
一つの好ましい実施例の中で、インフルエンザ・ウイルス感染による病気の治療に用いる化合物、上記で挙げた複合体も含み、少なくとも一種の上記αへリックス又はβシート、少なくとも一個のアミノ・サイトと相互に作用する化合物が含まれる。
【0145】
一つの好ましい実施例の中で、薬物混合物、上記で挙げたポリペプチド、タンパク質又は化合物を含む。
【0146】
本発明の薬物混合物は通常一種の媒体又は賦形剤、一種の薬学的に許容できる媒体に溶解できる抗体及び/又は免疫結合物含み、好ましくは水性媒体である。各種水性媒体が応用できる、例えば、緩衝塩水等。これら溶液は無菌且つ通常不純物質が混ざっていない。これら成分は通常の、一般に知られている滅菌技術で滅菌ができる。これら成分は薬学上許容できる、生理条件の必要に近い補助物質、例えばpH調整用の緩衝剤、毒性調整剤等、たとえば酢酸ナトリウム、塩化ナトリウム、塩化カリウム、塩化カルシウム、乳酸ナトリウム等である。これら成分中の融合タンパク質の濃度変化は非常に大きい、主に特定の投薬方式と患者のニーズに相応しい液体料、粘度、体重等をもとに選択する。
【0147】
従って、本発明中の一つの典型的な脳部投薬の薬学免疫毒素成分は毎日約1.2−1200μg投与するべきである。一つの典型的な静脈投薬で乳腺、卵巣及び肺腫瘍の治療の成分では、各患者に毎日約0.1−10mgを投与する。一人一日0.1−100mgの投薬量が使用可能で、特に薬物を隠蔽した位置に投与し且つ血液循環又はリンパ機構に入らない場合、例えば一つの体腔又は一つの器官の腔隙に投与する場合はそうである。薬成分の製造の実際操作方法は専門家が理解又は把握しており、一部出版物でも詳細が書かれている。例えばRemington’s Pharmaceutical Science, 19th ed., Mack Publishing Company, Easton, Pennsylvania(1995)を参照。
【0148】
本発明中の成分は治療処理に使用できる。治療での応用は、成分を一人の特定の病気(例えば膠芽腫、乳腺癌、卵巣癌及び肺癌)にかかった患者に施され、その投与量は少なくとも緩和又は部分的にその患者の病気及び合併症を制御できる量である必要がある。これらの任務が果たせる最低投与量が「治療有効投与量」と呼ばれる。有効投与量は病気の程度と患者の一般的健康状況に依存する。この成分の有効投与量はある症状に対する主観的緩和、又は臨床医師若しくはその他資格の観察者の記録による客観的改善が提供できる。
【0149】
患者のニーズと認容できる投与量及び頻度で一回又は数回投薬を決める。有効的に患者を治療する為にも、なんにせよ、十分な量のこの免疫毒素を提供するべきである。好ましくは、薬物投与量は、一回きり投与、若しくは周期性投与を、ある種治療効果が達成されるまで又は不良反応で治療の継続が阻止されるまで続ける。通常、これら投与量は治療に足りるか又は病症を改善し且つ患者の認容できない毒性を引き出さない量である。
【0150】
本発明の免疫結合物は胃腸外の徐放剤(例えば挿入物、油注射液、又は微粒子系)に製造できる。タンパク質・デリバリー・システムに対する全面的理解にはBanga,A. J., Therapeutic Peptides and Proteins:Formulation, Processing, and Delivery Systems, Technomic Publishing Company, Inc., Lancaster, PA(1995)が参照できる。微粒子系には微球体、微粒、マイクロカップセル、ナノマイクロカップセル、ナノ微球体、及びナノ微粒子が含まれる。マイクロカップセルは薬効のあるタンパク質をそのコア核にしている。小微球体では、治療性物質が粒子の中に分散されている。約1μmより小さい粒子、微球体、及びマイクロカップセルは通常それぞれナノ微粒、ナノ球体と、ナノマイクロカプセルと呼ばれている。毛細血管の直径はおよそ5μmであるのでナノ微粒子のみが静脈を通して投与できる。微粒子の直径は約100μmであり、皮下又は筋肉注射で投与する。例は下記を参照:Kreuter,J., Colloidal Drug Delivery Systems, J. Kreuter, ed., Marcel Dekker, Inc., New York, NY, pp.219−342(1994);及びTice & Tabibi, Treatise on Controlled Drug Delivery, A. Kydonieus, ed., Marcel Dekker, Inc. New York, NY, pp.315−339(1992)(両方とも本願明細書に援用される)。
【0151】
ポリマーは本発明中の免疫結合物成分のイオン・コントロール・リリースに使われることができる。多種の薬物コントロール・リリースに使用可能な分解可または不可のポリマーは専門領域でよく知られている(Langer,R.、Accounts Chem. Res. 26:537−542(1993))。例えば、遅延剤であるポリマーpolaxamer 407は低温では粘性があり流動的であるが、体温下では半固体ゲルになるが、組み替えIL−2とウレアーゼの形成と持続輸送の一つの有効な媒体であることがすでに証明された(Johnston等、Pharm. Res. 9:425−434(1992);及びPec等, J. Parent. Sci. Tech. 44(2):58−65(1990))。同じく、ハイドロキシアパタイトもすでにタンパク質コントロール・リリースの一個のミクロマトリクスとして使われている(Ijntema等, Int. J. Pharm. 112:215−224(1994))。他方では、リポソームは脂質に被膜された薬物のコントロールリリースと標的デリバリー過程に使われている(Betageri等, Liposome Drug Delivery Systems, Technomic Publishing Co., Inc., Lancaster, PA(1993))。その他多くの治療タンパク質のコントロールリリースシステムが既に知られている。例として、米国特許第5,055,303号、同第5,188,837号、同第4,235,871号、同第4,501,728号、同第4,837,028号、同第4,957,735号、同第5,019,369号、同第5,055,303号、同第5,514,670号、同第5,413,797号、同第5,268,164号、同第5,004,697号、同第4,902,505号、同第5,506,206号、同第5,271,961号、同第5,254,342号、及び同第5,534,496号(これらは、全て本願明細書に援用される)。
【0152】
実験結果
PAC及びPB1N複合体構造の原子座標は表1の通りである。
【0153】
【表5】

【0154】
【表6】

【0155】
【表7】

【0156】
【表8】

【0157】
【表9】

【0158】
【表10】

【0159】
【表11】

【0160】
【表12】

【0161】
【表13】

【0162】
【表14】

【0163】
【表15】

【0164】
【表16】

【0165】
【表17】

【0166】
【表18】

【0167】
【表19】

【0168】
【表20】

【0169】
【表21】

【0170】
【表22】

【0171】
【表23】

【0172】
【表24】

【0173】
【表25】

【0174】
【表26】

【0175】
【表27】

【0176】
【表28】

【0177】
【表29】

【0178】
【表30】

【0179】
【表31】

【0180】
【表32】

【0181】
【表33】

【0182】
【表34】

【0183】
【表35】

【0184】
【表36】

【0185】
【表37】

【0186】
【表38】

【0187】
【表39】

【0188】
【表40】

【0189】
【表41】

【0190】
【表42】

【0191】
【表43】

【0192】
【表44】

【0193】
【表45】

【0194】
【表46】

【0195】
【表47】

【0196】
【表48】

【0197】
【表49】

【0198】
【表50】

【0199】
【表51】

【0200】
【表52】

【0201】
【表53】

【0202】
【表54】

【0203】
【表55】

【0204】
【表56】

【0205】
【表57】

【0206】
【表58】

【0207】
【表59】

【0208】
【表60】

【0209】
【表61】

【0210】
【表62】

【0211】
【表63】

【0212】
【表64】

【0213】
H5N1型鳥インフルエンザ・ウイルス株(A/goose/Guangdong/1/96)由来のポリメラーゼ・サブユニットPAタンパク質と1918年ヨーロッパで爆発した広範囲インフルエンザのA型インフルエンザ・ウイルス株A/Brevig Mission/1/1918、及び二種類のそれぞれB型インフルエンザ・ウイルス株B/Ann Arbor/1/1966とC型インフルエンザ・ウイルス株C/JJ/1950に属するPAタンパク質の配列について比較を行った結果は図1の通りである。
【0214】
本発明者らはPAを二つの部分に分け、違う長さのPA遺伝子の二つの断片を別々に多数クローン化し、大腸菌の中で発現した。その中でPAより分けられたN端1−256残基(図1及び図2参照)と257−716残基(図4A参照)は、GST(グルタチオン−S−トランスフェラーゼ、Glutathione S−Transferase)との融合で良好な発現と精製ができた。その中で精製したPAのN末端(PA_N)からは良好回折のある母体結晶体が得られた(図3参照)。
【0215】
大変な努力を費やしたが、PAのC末端自身は結晶は得られないということが結晶実験によって初歩的に明らかとなった。従って、本発明者らはGST融合方法も使用し、別々にPB1 N端25と48ペプチドを発現した(図4A参照、PAのC末端とPB1のN末端のGST融合前後の電気泳動図、その中でリボン1 PA_C CTはPAのC末端の対照サンプル、リボン2 GST−PB1+PACはPAのC末端とPB1 N末端の複合体とGST融合後のサンプル、リボン3 GST−PB1はPB1N末端とGST融合後のサンプル、リボン4 GST+PA_CはPA C末端とGST融合後のサンプル、リボン5 GST CTはGST対照サンプルであり;その中で、PA_CはPA_Cの電気泳動リボンを表し、GST−PB1はPB1N末端とGST融合後の電気泳動リボンを表し、GSTはGST対照の電気泳動リボンを表す)、GST−PB1は精製されたPA_Cタンパク質と結合ができるということが結果として明らかとなった。
【0216】
ある一定比率でPA及びPB1のポリペプチド発現菌を混合し、グルタチオンアフィニティ・カラム及びゲルサイズ排除クロマトグラフィー等を通してこの二つのタンパク質を共精製すると、両者は共精製が出来ることが体外結合実験から判明し、これによって、精製されたPAのC末端460アミノ酸とGST−PB1ポリペプチドは安定した複合体が形成できることが明らかとなった。
【0217】
更に、プロティナーゼでGST融合ペプチドを切断後、PAC/PB1Nポリペプチド複合体を分離精製し、そして結晶実験に使用し、その結果、多条件下で結晶が得られ、その中の一つの条件下で回折良好な結晶体が得られた。但し、単独精製されたPAのC末端タンパク質は結晶が得られなかったが、それはPB1ポリペプチドの加入がPAタンパク質の安定に補助作用があることを示唆した。
【0218】
PAC/PB1Nポリペプチド複合体三次元構造:
MAD方法を使用し、PAのC末端460アミノ酸及びPB1N末端25ペプチドの複合体結晶体構造を解析し、解析度は2.9Å、最終修正したR因子は23%,自由R因子は26%である。全体的に、構造を線状で表した場合、側面から見ると、PA部分はまるで狼の頭に喩えられ、伸び出す口先、その後ろの頭部と環状の首を有する(図4B)。PB1はまるでPAの口の中に骨を一本くわえているかのようである。PA部分は主に13個のαへリックス、一切れの小さい310へリックス、7つのβシート及びこれらを繋ぐ環(loop)より形成されている(図1、図4B及び図5)。構造から見ると、PAタンパク質部分は二つの構造領域と見なせ、一つはPB1ポリペプチドと結合する領域(構造域I、即ちPAのC末端構造の第一部分)、全部へリックス及び環で形成されており、へリックスは4、5、8、9、10、11、12及び13で狼の口と頬の部分を構成している。この構造域は狼頭部の天辺から見るとやや細く;もう一つの構造域(構造域II即ちPAのC末端構造の第二部分)は残りのへリックス及びβシートからなる狼頭部の後半部分で、天辺から見るとやや太く、下に大きい環が繋がっており、狼の頭部の首の部分に見える。PB1ポリペプチドのN端は狼の頭部の片面に位置しており、C末端はもう片方に位置し、狼の頭部の両方の頬の部分に位置することに値する。本発明者らの結晶体中のPAはPAのN端256残基を取り除いたポリペプチドで、ある報告ではN端はPAプロティナーゼの主な活性領域であり、もう一つの離れている活性遺伝子座Ser624は他の片方の頬に位置し、それによるとSer624はPAプロティナーゼ活性中心アミノ酸で、それはPAの取り除いた部分と共にプロティナーゼ活性領域を構成し、従ってPAのN端の取り除いた部分はもう片方の頬に位置する。狼の頭部の後半部分第二構造域は残りの多数のへリックス及びβシートによって形成されている。長さ、方向が異なる7つのβシートが波のある平面を構成し、構造域の中心部に位置しており、αへリックスはへリックス周辺に分布しており、共にRossmannフォールド構造を構成している。二つの構造域の交差する部分には大きな溝があり、下部の首環と直径約25Åの大きい環を形成する(図5)。
【0219】
PAとPB1ポリペプチド間の相互作用
構造域IのPB1ポリペプチドに結合するへリックスはそれぞれへリックス4(406−415)、8(582−604aa)、10(633−650aa)、11(653−674aa)と13(698−714aa)であり、その中の三つのへリックス(8、11、13)は互いにほぼ平行に伸びだし、へリックス軸の方向から見るとほぼ三角形の形状になっており、四つ目のへリックス(10)は斜めに伸び出し、これらはPB1ポリペプチドを真ん中に挟む(図5及び図6)、へリックス4は側面でPB1N端ペプチド残基と相互に作用をする。四つのへリックスはPB1ポリペプチドと結合する領域で疎水性コアを形成し、これらの側鎖とPB1上の疎水アミノ酸残基は疎水相互作用及び水素相互作用で結合されている。電子雲密度上ではPB1ポリペプチドの第二位アスパラギン酸から15位グルタミンまでが見られ、この結果とは、Perez等の報告によるPB1N末端前12位アミノ酸はPB1とPA結合のキーアミノ酸であるという結果とほぼ一致している(Perez及びDonis 2001)。更に本発明者らはこれらアミノ酸残基とPA間の相互作用を分析した。Perez等(Perez及びDonis 2001)の文献での報告のPB1保存的LLFLペプチド断片は一つの短いへリックス上に存在し、PAが形成する疎水内核中間に浮いている。疎水性コアの形成に関与するPAアミノ酸残基はへリックス11上のLeu666、へリックス13のPhe710及びへリックス10上のIle633、Val636とLeu640等がある。PB1ポリペプチドとの結合に関与するPA中アミノ酸はへリックス13のTrp706、へリックス11のGln670等があり、その中でTrp706とPB1オリゴペプチド上のVal3、N4等アミノ酸は疎水又はファンデルワールス力等を通して相互に作用し、Gln670はPB1のF9、V12、P13及びA14とそれぞれ水素、疎水及びファンデルワールス力等を通して相互に作用する。へリックス10のT639はVal3との作用(ファンデルワールス力)に関与する。へリックス4上のQ408及びN412はPB1のVal3、D2との相互作用に関与する。それらとは別に、9と10の間に挟まれている緩い環もPB1との相互作用に関与し、その中でI621、G622とE623はD2、N5とそれぞれ相互に作用し、T618及びP620はそれぞれL8及びK11と相互に作用する。へリックス8とPB1ポリペプチドの距離が離れているため、主にファンデルワールス力が作用している。この結果は、文献報告でのPB1ポリペプチド上の残基結合に関与する作用とほぼ一致している。これらPAとの結合に関与するアミノ酸はA、B及びC型インフルエンザウイルスの中では全て保存的で;同様に、PB1ポリペプチドとの結合に関与するPA残基も大半は保存的である(図1)。PAとPB1結合方式の精細な三次元構造解析は、薬物設計でインフルエンザ・ウイルス・ポリメラーゼの機能を阻害する為の有力な三次元構造情報のプラットフォームを提供した。
【0220】
PA構造の分析結果では更に、二つの構造域の接続箇所では、構造域Iの下に一つの大溝がある(構造域III)(図8A)。大溝表面にはアルカリ性アミノ酸が豊富にあり、その中で一部アミノ酸、例えばK536、K328、R566等は3型インフルエンザ中で全て保存的で、別途で399座のLys及び401座のArgも保存的である(図1)。K536等遺伝子座突然変異体はこれら遺伝子座の重要性を実証し、この大溝部はヌクレオチド又はRNA結合と関することを提示した。これ以外では、この溝の下部には一つの大きな環状鎖部分があり、この断片のポリペプチドは結晶体積み重ね中、当該環状ポリペプチド領域ともう一つの分子表面に近き、相互作用によって引き離され形成し、一部分のアミノ酸ははっきりとした電子雲密度が見られなかった。大溝と首部分の環は共同で直径約25Åの大きい環を形成し、この空間は二つのRNAへリックスが収納できる程十分広い。上記のように、環状内部溝のところには表面に保存的アルカリ性アミノ酸が分布されていて、鎖領域上のアミノ酸は保守性は高くないが、ただし三つの類型のインフルエンザウイルス中は全て主に酸性アミノ酸より形成されている。PA分子中この溝及びこの環状構造の保守性及び構造の特異性は彼らがポリメラーゼ中での重要な機能を示唆し、よってそれらを共にPAとPB1結合領域以外の二つ目の薬物作用ターゲットとする。
【0221】
RNAプロモーター結合能力。本発明者らが解析した構造から見ると、本発明者らはこの大溝はヌクレオチド又はRNA結合遺伝子座であることを見出した。その中で、K539、E538、K328遺伝子座は三つの類型のインフルエンザウイルス中では非常に保存的であり、これらアミノ酸はRNAヌクレオチドとの結合に関与し、特にRNAとの結合に関与していると本発明者らは考える。PAサブユニットは、プロモーター及びRNAとの結合能力及びRNA合成過程において重要な機能を果たすことが明らかとなった。
【0222】
構造域I及び構造域IIの間で、構造域Iのへリックス及び構造域IIのβシートで直径約8Å−15Åのチャンネルが形成される(図8B及び図8C)。本発明者らが解析したこの構造中では、PAのN端の一切れの緩い断片はまるで紐のようにこのチャンネル中に垂れている。このN端断片はチャンネル両端から距離が離れているため、ポリメラーゼ複合体又はその他宿主タンパク質が作用しポリメラーゼの機能を発揮する時にこのN端断片がこのチャンネルから離れると本発明者らは考える。これで、PA大溝からチャンネルを通って狼の頭部の他の片方の頬まで、構造域の中間に一つのチャンネルが存在する。このチャンネルの表面には三種類のインフルエンザ・ウイルス全ての中で保存的なアミノ酸が存在し、それは例えば大溝表面のR566、K539及びK574に位置するもの、及びチャンネル中間保存的なE410、K460、E524とK536等に位置するものである。その中で一部残基はポリメラーゼの活性に影響を持つことが発見された。Fodor等の研究によると、E524Aの突然変異はウイルスにRNA合成能力を喪失させ、よってウイルスの発生を抑制した;E410の突然変異はポリメラーゼ活性の低下を招き(Fodor、Crowら、2002)、K539Aの突然変異はmRNA合成に影響はしないが、遺伝子からcRNA及びvRNAのコピーに重大な影響が現れることが発見された。この領域がウイルス遺伝子コピーに対して非常に重要なことが判明した。既に知られているヌクレオチドの大きさはこのチャンネルと非常に近く、(例えばATP、長さ約14Å、幅約8Å、その他三種類ヌクレオチドUCGもこれと類似)、従ってこのチャンネルは、とある状況下ではヌクレオチド若しくはその他小分子を通過させ、又はその他タンパク質と相互に作用させ、よって、その表面残基の突然変異はポリメラーゼ活性の顕著な変革をもたらすと本発明者らは考える。このチャンネル独特の構造及び機能の重要性は、チャンネルを三つ目の薬物設計結合ターゲットとさせた。
【0223】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼPB1と競合してPACと結合するポリペプチド、タンパク質、無機若しくは有機化合物、その中で上記ポリペプチド又はタンパク質のアミノ酸配列は野生型インフルエンザ・ウイルス・ポリメラーゼPB1のN末端PB1N残基5から11で形成された短いへリックス領域の短いLLFL配列を含む。
【0224】
その中で、Met595とVal12、Leu666とPhe9、Leu640とLeu8;Leu636とLeu8;Met628とLeu7;Phe710とThr6;Trp706とThr6;Trp706とPro5;Phe411とPro5;Trp706とAsn4の間の一部分の原子は4Å相互作用の範囲内に位置するので、それらの間では疎水相互作用で結合されていることが解る。従って、PAのC末端の当該アミノ酸と疎水相互作用が形成できるポリペプチド又は化合物が、即ちインフルエンザ・ウイルス抑制の薬物となれる。
【0225】
標的タンパク質の構造を基にした薬物設計は既に数多くの成功事例がある(Schneider,G.及びFechner,U.、 Nature Reviews Drug Discovery 2005,4,649)、北京大学来魯華教授のワークグループが開発したLigBuilderプログラムは国際登録者が700件を超えている(Wang,R.X.;Gao,Y.;Lai,L.H.,LigBuilder:A multi−purpose program for structure−based drug design. J. Mol. Mod. 2000,6,498)、既に数多くのLigBuilderプログラムを応用した高活性抑制剤設計の例が報告されている。例えば、Boehringer Ingelheim製薬会社はLigBuilder 1.2を利用し、繋ぎ操作補助設計で高活性のP38 キナーゼ抑制剤を最適化する(Goldberg DR,Hao,M−H.ら、J. Med. Chem. 2007,50,4016)。
【0226】
H5N1ウイルスRNAポリメラーゼのPAC−PB1N複合物結晶体構造に基づき、LigBuilder2.0プログラムを利用し全新な薬物設計計算を行った。まずはPACタンパク質に対し結合遺伝子座分析を行い、点数が一番高い二つの結合遺伝子座は当該構造の“口”区と“チャンネル”区に位置する。LigBuilder2.0プログラムを利用して、別々にこの二つの遺伝子座に対して全新薬物設計計算を行い、一部高予測活性且つ合成し易い化合物が得られた。
【0227】
PA分子中の“チャンネル”区と結合する分子の具体例は下記通りである:
【化1】

R1=−CH3,−CH2CH3
R2=−CH3,−CH2NH2,−CH(OH)CH3,−CH(CH3)2
予測Kd:8.64〜9.60。
【化2】

R1=−NH2
R2=−COCH3,−CH2COCH3,−CO,−OCH2CH3
R3=−CH2NH2,−CH2(NH2)CH2CH3,−CH2(NH2)CH2CH2CH3
予測Kd:8.51〜9.65。
【0228】
PA分子“口”区と結合する分子の具体例は下記通りである:
【化3】

R1=−OH
R2=−OH,−CO,−CONH2,−CONHCH3,COOH
R3=−COOH,−NH2,−C(NH2)2+
R4=−CH(OH)CH3,CONH2,CH(NH2)CH2OH
予測Kd:8.52〜8.96。
【化4】

R1=−OH,−NHCO
R2=−CH2(OH)CH3,−NHCH3,−CH2OH,−CH2NH2,−NH2,−C(NH2)2+
R3=−NH2,−C(NH2)2+,−CH2OH,−CO,−CH2CO,−NHCO
R4=−OH,−OCH3。
【0229】
参考文献
Adams, P. D., R. W. Grosse−Kunstleveら、(2002). “PHENIX: building new software for automated crystallographic structure determination.” Acta Crystallogr D Biol Crystallogr 58(Pt 11): 1948−54。
Brunger, A. T., P. D. Adamsら、(1998). “Crystallography & NMR system: A new software suite for macromolecular structure determination.” Acta Crystallogr D Biol Crystallogr 54(Pt 5): 905−21。
Deng, T., J. Sharpsら、(2005). “In vitro assembly of PB2 with a PB1−PA dimer supports a new model of assembly of influenza A virus polymerase subunits into a functional trimeric complex.” J Virol 79(13): 8669−74。
Deng, T., J. L. Sharpsら、(2006). “Role of the influenza virus heterotrimeric RNA polymerase complex in the initiation of replication.” J Gen Virol 87(Pt 11): 3373−7。
Emsley, P. and K. Cowtan (2004). “Coot: model−building tools for molecular graphics.” Acta Crystallogr D Biol Crystallogr 60(Pt 12 Pt 1): 2126−32。
Fodor, E., M. Crowら、(2002). “A single amino acid mutation in the PA subunit of the influenza virus RNA polymerase inhibits endonucleolytic cleavage of capped RNAs.” J Virol 76(18): 8989−9001。
Fodor, E., D. C. Pritloveら、(1994). “The influenza virus panhandle is involved in the initiation of transcription.” J Virol 68(6): 4092−6。
Hara, K., F. I. Schmidtら、(2006). “Amino acid residues in the N−terminal region of the PA subunit of influenza A virus RNA polymerase play a critical role in protein stability, endonuclease activity, cap binding, and virion RNA promoter binding.” J Virol 80(16): 7789−98。
Hara, K., M. Shiotaら、(2001). “Influenza virus RNA polymerase PA subunit is a novel serine protease with Ser624 at the active site.” Genes Cells 6(2): 87−97。
Hendrickson, W. A. (1991). “Determination of macromolecular structures from anomalous diffraction of synchrotron radiation.” Science 254(5028): 51−8。
Honda, A., K. Mizumotoら、(2002). “Minimum molecular architectures for transcription and replication of the influenza virus.” Proc Natl Acad Sci U S A 99(20): 13166−71。
Hulse−Post, D. J., J. Franksら、(2007). “Molecular changes in the polymerase genes (PA and PB1) associated with high pathogenicity of H5N1 influenza virus in mallard ducks.” J Virol 81(16): 8515−24。
Kawaguchi, A., T. Naitoら、(2005). “Involvement of influenza virus PA subunit in assembly of functional RNA polymerase complexes.” J Virol 79(2): 732−44。
Munster, V. J., E. de Witら、(2007). “The molecular basis of the pathogenicity of the Dutch highly pathogenic human influenza A H7N7 viruses.” J Infect Dis 196(2): 258−65。
Murshudov, G. N., A. A. Vaginら、(1997). “Refinement of macromolecular structures by the maximum−likelihood method.” Acta Crystallogr D Biol Crystallogr 53(Pt 3): 240−55。
Otwinowski, Z. M., Wladek (1997). “Processing of x−ray diffraction data collected in oscillation mode “ Methods in Enzymology 276(Macromolecular Crystallography, Part A): 307−326。
Perez, D. R. and R. O. Donis (2001). “Functional analysis of PA binding by influenza a virus PB1: effects on polymerase activity and viral infectivity.” J Virol 75(17): 8127−36。
Perrakis, A., R. Morrisら、(1999). “Automated protein model building combined with iterative structure refinement.” Nat Struct Biol 6(5): 458−63。
Sanz−Ezquerro, J. J., T. Zurcherら、(1996). “The amino−terminal one−third of the influenza virus PA protein is responsible for the induction of proteolysis.” J Virol 70(3): 1905−11。
Sheldrick, G. M., Ed. (1998). Direct Methods for Solving Macromolecular Structures. Dordrecht, The Netherlands, Kluwer Academic Publishers。
Sugiura, A., M. Uedaら、(1975). “Further isolation and characterization of temperature−sensitive mutants of influenza virus.” Virology 65(2): 363−73。
Taubenberger, J. K. and D. M. Morens (2007). “The Pathology of Influenza Virus Infections.” Annu Rev Pathol。
Vonrhein, C., E. Blancら、(2007). “Automated structure solution with autoSHARP.” Methods Mol Biol 364:215−30。
【図1A−a】

【図1A−b】

【図1A−c】

【図1A−d】

【技術分野】
【0001】
本発明はインフルエンザ・ウイルスPAとPB1のN末端ポリペプチドの細菌における発現、その精製と結晶方法及びPAのC末端とPB1のN末端ポリペプチドの三次元結晶構造とそれらの薬物設計における応用に関する。
【背景技術】
【0002】
インフルエンザ・ウイルスは曾て人類に重大な災難をもたらした(非特許文献1)。対策に乏しく、ウイルス自体変異し続けている為、この種のウイルスは人類にとって脅威の存在である。近年、世界範囲で頻繁に発生している鳥インフルエンザの伝染及び鳥インフルエンザのヒトの間での感染例の頻出は人類の健康及び経済活動に対しても重大な脅威を示した。このようなウイルスについての研究は人類の健康にとって重大な意義がある。鳥インフルエンザはA型インフルエンザ・ウイルスであり、彼らは共にOrthomyxoviridae科の一員である。そのウイルス・ゲノムは負の電荷を持つ8本の一本鎖RNAによって形成されている。鳥インフルエンザ由来遺伝子をほかのA型インフルエンザ・ウイルスと比較分析すると、一次構造上に散在する突然変異が存在する。これらの突然変異は異なるインフルエンザ・ウイルスの異なった病原性をもたらす。目下、インフルエンザ・ウイルスは11種のタンパク質がコードできると思われている。その中インフルエンザ・ウイルス・ゲノムRNAの複製とmRNAへの転写は全てウイルス自身が携帯したRNAポリメラーゼにより行われ、このポリメラーゼが潜在した重要な薬物ターゲットと成りつつある。最近の研究により一部インフルエンザ・ウイルスの高病原性がポリメラーゼの突然変異と直接関連していることが明らかとなり(非特許文献2;非特許文献3)、この複合体に対した薬物設計の必要性が更に示唆された。この複合体に対する研究は、ウイルス複製の分子機構の解明やこの複合体を標的にした薬物設計などに対し、共に重大な意義を持つ。このRNAポリメラーゼは三つのサブユニットPB1、PB2及びPAから構成された複合体である。そのうちPB1は触媒活性サブユニットであり、PB2が宿主細胞のmRNAキャップ(CAP構造)をcap−snatching機構で切り取り、それをウイルスmRNA転写のプライマーとするが、但しこの過程においてPB1はエンドヌクレアーゼである。一種の温度感受性変異体ts53により、PAがウイルス・ゲノム複製過程に関与している事が示唆されたが、その具体的な機能はまだ明らかではない(非特許文献4;非特許文献5)。ポリメラーゼはウイルスに必要な3種のRNA即ちmRNA、cRNA(複製中間体)及びvRNAを合成する活性を持つ。mRNAの合成はキャップ付きオリゴヌクレオチド・プライマーから始まり、vRNA末端から15−17番目のヌクレオチドで終了し、且つポリアデニン(poly A)末端がつく。ポリメラーゼはウイルス全長のcRNA中間体を新たに合成し、よって更に全長のvRNAを合成することができる。昆虫細胞発現システムによりポリメラーゼ各サブユニットを発現させ、三種の異なった複合体を形成させる事ができるが、複合体の一種はポリメラーゼの三つのサブユニットPB1/PB2/PAよりなる三元複合体で、他の二種はそれぞれPB1/PB2とPB1/PAの二元複合体であり、PB2/PAの二元複合体は形成できない(非特許文献6)。その中、PB1のN末端25個のアミノ酸はPAのC末端と相互に作用するのに充分であり、PB1のC末端はPB2のN末端との相互に作用を担う。一つの合成されたPB1のN端競合性オリゴペプチドはウイルス・ポリメラーゼ活性を顕著に抑制できる。非特許文献6のジヌクレオチドApGをプライマーとしたRNA合成実験により、PB1/PA複合体によりウイルスのゲノムRNA複製が有効に開始でき、PB1/PB2によりウイルスmRNAの合成がin vitroで行なえることが明らかにされた。(非特許文献6)。但し、Dengら(2006)が293細胞を使って発現精製した組み替えポリメラーゼの結果は、三つのサブユニットが複製と転写に共に必要であることを示唆した(非特許文献7)。PAが主にウイルスRNA複製過程に関与するのは、一種の温度感受性変異体(L226P)により非許容温度でウイルスにゲノム複製障害をもたらすが転写活性には影響を及ぼさないことの発見がその由来のもとであり(非特許文献5);PB2はウイルスmRNAの転写に関与する。更なる研究によりPAは幅広く転写と複製及びウイルスの安定性等の過程に関与すると考えられている(非特許文献8)。PB1/PA複合体はウイルス5’末端プロモーターと結合でき、PB1単独ではこのプロモーターと結合できない。架橋実験結果によりPAがvRNA及びcRNAプロモーターと結合できることを明らかにしたが(非特許文献9;非特許文献10;非特許文献8)(Fodor 1994;Gonzalez 1999;Jung 2006;Hara 2006)、その具体的な結合サイトはまだ不明である。PAにキモトリプシンに似たプロティナーゼ活性のあることが認められ、Sanz−Ezquerroら(1996)によりそのN末端の約250のアミノ酸が当該プロティナーゼ活性域であることが見出された(非特許文献11)。しかしその後、Haraら(2001)は自らの研究により、C末端の第624位セリンがPAプロティナーゼ活性サイトであり、そのサイトの変異がプロティナーゼ活性の消失をもたらす故、Ser624もこのプロティナーゼ活性領域を構成し得ると考察した(非特許文献12)。PAのプロティナーゼ活性のポリメラーゼ機能に対する影響についてはまだ議論が続いている。2006年、Hara等はトリプシン加水分解作用を通じて精製したPA組み替えタンパク質はPAをそれぞれ分子量約25kDa及び約55kDaの両断片に分解できると報告した(非特許文献8)。タンパク質の三次元構造が薬物設計に対し重要な手助けになるのはよく知られており、PAの三次元構造解明はそれに対した薬物設計及び機能研究にとって重要な価値がある。また、過去の研究でインフルエンザ・ウイルス・タンパク質PAの細菌での発現精製に関する報告はまだ見られず、細菌で発現精製したタンパク質を得ることができればPAの機能研究及び薬物スクリーニング作業に対し重大な助けとなり、時間の多量節約や作業コストと労働強度の大幅低下が可能であろう。
【先行技術文献】
【非特許文献】
【0003】
【非特許文献1】J.K.Taubenberger及びD.M.Morens、“The Pathology of Influenza Virus Infections.”、2007年、Annu Rev Pathol
【非特許文献2】Hulse−Post,D.J.、J.Franksら、“Molecular changes in the polymerase genes (PA and PB1) associated with high pathogenicity of H5N1 influenza virus in mallard ducks”、J Virol 2007年、第81巻、第16号、p.8515−24
【非特許文献3】V.J.Munster、E.de Witら、“The molecular basis of the pathogenicity of the Dutch highly pathogenic human influenza A H7N7 viruses”、J Infect Dis 2007年、第196巻、第2号、p.258−65
【非特許文献4】A.Sugiura、M.Uedaら、“Further isolation and characterization of temperature−sensitive mutants of influenza virus”、Virology、1975年、第65巻、第2号、p.363−73
【非特許文献5】A.Kawaguchi、T.Naitoら、“Involvement of influenza virus PA subunit in assembly of functional RNA polymerase complexes.”、J Virol 2005年、第79巻、第2号、p.732−44
【非特許文献6】A.Honda、K.Mizumotoら、“Minimum molecular architectures for transcription and replication of the influenza virus”、Proc Natl Acad Sci USA 2002年、第99巻、第20号、p.13166−71
【非特許文献7】T.Deng、J.L.Sharpsら、“Role of the influenza virus heterotrimeric RNA polymerase complex in the initiation of replication”、J Gen Virol 2006年、第87巻(Pt 11)、p.3373−7
【非特許文献8】K.Hara、F.I.Schmidtら、“Amino acid residues in the N−terminal region of the PA subunit of influenza A virus RNA polymerase play a critical role in protein stability, endonuclease activity, cap binding, and virion RNA promoter binding”、J Virol 2006年、第80巻、第16号、p.7789−98
【非特許文献9】E.Fodor,D.C.Pritloveら、“The influenza virus panhandle is involved in the initiation of transcription”、J Virol 1994年、第68巻、第6号、p.4092−6
【非特許文献10】T.Deng、J.Sharpsら、“In vitro assembly of PB2 with a PB1−PA dimer supports a new model of assembly of influenza A virus polymerase subunits into a functional trimeric complex”、J Virol 2005年、第79巻、第13号、p.8669−74
【非特許文献11】J.J.Sanz−Ezquerro、T.Zurcherら、“The amino−terminal one−third of the influenza virus PA protein is responsible for the induction of proteolysis” J Virol 1996年、第70巻、第3号、p.1905−11
【非特許文献12】K.Hara、M.Shiotaら、“Influenza virus RNA polymerase PA subunit is a novel serine protease with Ser624 at the active site” Genes Cells 2001年、第6巻、第2号、p.87−97
【発明の概要】
【課題を解決するための手段】
【0004】
本発明はインフルエンザ・ウイルス・ポリメラーゼ複合体サブユニットPAの野生型又は変異型タンパク質のN末端とC末端をそれぞれクローン化、発現する方法、並びにPAのN末端を個別に発現、精製及び結晶させる方法、並びにインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1の野生型又は変異型タンパク質のN末端オリゴペプチドを発現する方法、並びにPAのC末端とPB1のN末端オリゴペプチド共精製の方法を提供する。本発明で使用したPAはN末端の前256のアミノ酸及びC末端の257−716アミノ酸残基の断片であり、これとPB1のN末端25個アミノ酸ペプチド複合体の大腸菌中での発現、共精製の方法、及びPAのC末端とPB1のN末端ペプチド・タンパク質複合体の結晶方法及びそれらが形成する複合体の結晶の三次元構造が提供される。
【0005】
本発明はインフルエンザ・ウイルスのポリメラーゼ・サブユニットPAの野生型又は変異型タンパク質をN末端とC末端の二つの部分に分けて発現、精製する方法を提供する一方、PAのN末端を単独で発現精製及び結晶させる方法を提供し、インフルエンザ・ウイルス・ポリメラーゼのもう一つのサブユニットPB1の野生型又は変異型タンパク質のN末端ポリペプチドの発現を通じて、PAのC末端とPB1のN末端オリゴペプチド複合体を共精製し、タンパク質の結晶に使う。本発明は大腸菌の原核細胞発現系を好ましく使用して(但し、他の発現系を除外するわけでなく、例えば他の細菌中又はその他真核生物細胞での発現も可)上記のポリペプチドをGST(グルタチオン−S−トランスフェラーゼ)融合タンパク質の形で発現し、そしてPAのC末端及びPB1のN末端オリゴペプチドの2種の発現細菌を混合し、さらに細菌から上記PAのC末端及びPB1のN末端オリゴペプチドのタンパク質複合体を共精製し出し、タンパク質を結晶する方法に使用した。本発明は、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAタンパク質N末端の前256位アミノ酸とC末端第257から第716位アミノ酸ポリペプチドを大腸菌を利用して発現して得る発現方法、並びに大腸菌からインフルエンザ・ウイルス・タンパク質PB1のN末端25個又は48個のアミノ酸以内のポリペプチドを発現する細菌叢を得る方法に及ぶが、記述する方法で、対応する遺伝子をpGEX−6pベクターへクローン化し、GST(グルタチオン−S−トランスフェラーゼ)を融合した融合タンパク質を発現させる。
【0006】
もう一方では、本発明はPAのC末端(PAC)とPB1N末端ペプチド複合体を精製する方法を提供するが、その方法は下記を含む:インフルエンザ・ウイルスPAのC末端第257から第716のアミノ酸を発現する細菌叢とインフルエンザ・ウイルスPB1のN末端25個又は48個アミノ酸以内のオリゴペプチドを発現する細菌叢をそれぞれ緩衝液に懸濁させ、そして一定の比率でこの2種類の発現菌を混合し、GST−PACとGST−PB1Nのタンパク質の総含量が一定のモル比に達するようにし、よってこの2種類のタンパク質の混合タンパク質を発現し、アフィニティ・カラムの方法を使い上記混合タンパク質を精製し、そしてPreScissionプロティナーゼで酵素分解によりGST融合タンパク質を切断し;更にゲル濾過とイオン交換クロマトグラフィー等の方法でPAとPB1のN端ペプチド複合体を分離精製し;ゲル電気泳動法でタンパク質の純度を測定すること。
【0007】
もう一方では、本発明は上記で得られたPACとPB1N末端ペプチド複合体を結晶する方法を提供したが、その方法は下記を含む:上記PACとPB1N末端ペプチド複合体を5〜30mg/mlまで濃縮し;摂氏4〜30度中、hanging−drop蒸気拡散法で結晶成長条件をスクリーニングし;当該タンパク質複合体の結晶を得ること。
【0008】
もう一方では、本発明はPACとPB1N末端ペプチド複合体結晶を提供する。
【0009】
もう一方では、本発明はPACとPB1N末端ペプチド複合体結晶の三次元構造を提供し、この構造はPACとPB1N相互作用様式とその相互作用サイト、そしてその複合体のPACとPB1Nポリペプチド・タンパク質の二次構造の仕組み、ペプチド鎖の方向及び三次元分子構造を描き出した。その中で、PACとPB1N末端ペプチド複合体結晶にX線回折を行ない、PACとPB1N末端ペプチド複合体のタンパク質結晶の回折データをとり、上記これらのタンパク質結晶の回折データを元に更なる構造解析過程を通じて、PACとPB1N末端ペプチド複合体の三次構造モデルを構築する。
【0010】
一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、その中でインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACはインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAの約201〜約301位アミノ酸から約650〜末端のアミノ酸までであり、PB1のN末端PB1Nはインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1のN末端PB1Nの48個アミノ酸以内のオリゴペプチドであり、結晶三次元構造中の原子は表1中に挙げた少なくとも一部の原子座標を有し、又はこの座標中の少なくとも40%アミノ酸残基主鎖炭素骨格原子との三次元座標の平均二乗偏差(average root mean square deviation(RMSD))が1.7Å以下である。
【0011】
好ましくは、ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶がP4(1)2(1)2の空間群を持ち、格子定数はおよそα=b=122Å、c=133Å、α=β=γ=90°である。
【0012】
一つの具体的な実施態様を通して、インフルエンザ・ウイルス株はA型、B型又はC型インフルエンザ・ウイルスより選出される。好ましくは、A型インフルエンザ・ウイルス株:A/goose/Guangdong/1/96、A/Brevig Mission/1/1918;B型インフルエンザ・ウイルス株:B/Ann Arbor/1/1966;又はC型インフルエンザ・ウイルス株:C/JJ/1950である。
【0013】
一つの具体的な実施態様を通して、A型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACはインフルエンザ・ウイルス・ポリメラーゼPAのC末端PAC中のαへリックス4、即ち406−414位を含むアミノ酸領域、αへリックス5、即ち440−450位を含むアミノ酸領域、αへリックス8、即ち583−603位を含むアミノ酸領域、αへリックス9、即ち608−613位を含むアミノ酸領域、αへリックス10、即ち633−649位を含むアミノ酸領域、αへリックス11、即ち653−673位を含むアミノ酸領域、αへリックス12、即ち683−691位を含むアミノ酸領域、とαへリックス13、即ち698−714位を含むアミノ酸領域、及び二つのβシート:βシート8とβシート9、それぞれ619−623位を含むアミノ酸領域と628−631位を含むアミノ酸領域が、PAのC末端PACの第一部分を構成する(即ち図4に示す如く結晶構造の口先の部分を構成)、その中でA型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACは主要なβシート折り畳み断片より成り、これらのβシートにはβシート1、即ち290−292位を含むアミノ酸領域、βシート2、即ち317−324位を含むアミノ酸領域、βシート3、即ち480−491位を含むアミノ酸領域、βシート4、即ち496−506位を含むアミノ酸領域、βシート5、即ち517−526位を含むアミノ酸領域、βシート6、即ち541−550位を含むアミノ酸領域、βシート7、即ち557−571位を含むアミノ酸領域などが含まれ、これらのβシートが共同でPAのC末端PAC第二部分(即ち図4に示す結晶構造の頭部)の折り畳みシート層の主な部分を構成する。その中でA型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACはαへリックス1、即ち303−311位を含むアミノ酸領域、αへリックス2、即ち331−349位を含むアミノ酸領域、αへリックス3、即ち364−369位を含むアミノ酸領域、αへリックス6、即ち454−475位を含むアミノ酸領域及びαへリックス7、即ち572−578位を含むアミノ酸領域が、PAのC末端PAC第二部分の上記折り畳みβシート層の周囲を囲い、その中、B型又はC型インフルエンザウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0014】
一つの具体的な実施態様を通して、A型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACは主にαへリックス8、αへリックス10、αへリックス11とαへリックス13の関与を通じてPB1のN末端PB1Nと相互に作用するが、好ましくは、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス11のLeu666、αへリックス13のPhe710、αへリックス10のVal636、Leu640、αへリックス13のTrp706、αへリックス11のGln670から構成される群より選択される少なくとも一つのアミノ酸を、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1との相互作用に関与させる。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0015】
一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のαへリックス9とαへリックス10の間の環状ペプチド断片中のIle621、Gly622、Glu623、Thr618とPro620から構成される群より選択される少なくとも一つのアミノ酸を、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1との相互作用に関与させた。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0016】
一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のAsn647、Gln408、Cys584、Gln587、Gln591、Lys643、Asn647、Ser659、Lys663、Trp699、Asn703から構成される群より選択される少なくとも一つのアミノ酸を、記述のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPACのインフルエンザウイルスポリメラーゼサブユニットPB1Nと結合する「袋状」のアミノ・サイトを構成させた。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0017】
一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のTrp406、Glu410、Lys461、Glu524、Phe525、Ser526、Lys536、Lys539、Tyr540、Leu563、Tyr564、Arg566及びLys574から構成される群より選択される少なくとも一つのアミノ酸を、PAC中ヌクレオチド、RNA若しくはその他の小分子又はタンパク質と結合する主溝及びチャンネルの形成に関与させた。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0018】
一つの具体的な実施態様を通して、PAのC末端PACの370から405位のアミノ酸残基は大きい環を構成するが、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0019】
一つの具体的な実施態様を通して、そこで記述したαへリックス12、αへリックス13はその他のタンパク質との相互作用に関与するが、好ましくは、αへリックス12及αへリックス13中のIle690、Glu691、Glu692、Cys693、Asn696から構成される群より選択される少なくとも一つのアミノ酸を、その他のタンパク質との相互作用に関与させる。
【0020】
一つの具体的な実施態様を通して、Lys506、Gly507、Arg508、Ser509、His510、Leu511、Arg512、Asn513及びAsp514から構成される群より選択される少なくとも一つのアミノ酸を、その他のタンパク質との相互作用に関与させた。その中、His510はポリメラーゼ複合体RNaseの一部分を構成し、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0021】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のαへリックス8、αへリックス10、αへリックス11とαへリックス13から構成される群より選択される少なくとも一つのメンバーと結合したポリペプチド、タンパク質、無機若しくは有機化合物、好ましくは、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス11のLeu666、αへリックス13のPhe710、αへリックス10のVal636、Leu640、αへリックス13のTrp706、αへリックス11のGln670から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供する。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0022】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中αへリックス9及びαへリックス10の間の環状ペプチド断片中のIle621、Gly622、Glu623、Thr618とPro620から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供する。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0023】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACの中でそのインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のAsn647、Gln408、Cys584、Gln587、Gln591、Lys643、Asn647、Ser659、Lys663、Trp699、Asn703から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供する。その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0024】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACの中でそのインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のTrp406、Glu410、Lys461、Glu524、Phe525、Ser526、Lys536、Lys539、Tyr540、Leu563、Tyr564、Arg566及びLys574から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供する。その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0025】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中で第370から405位のアミノ酸から選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供する。その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0026】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中αへリックス12、αへリックス13と結合する、好ましくはαへリックス12及αへリックス13中Ile690、Glu691、Glu692、Cys693、Asn696から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供するが、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりであり、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0027】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中シートβ4とシートβ5の間の環状領域内のLys506、Gly507、Arg508、Ser509、His510、Leu511、Arg512、Asn513及びAsp514から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供するが、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0028】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼPB1と競合的にPACと結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供するが、その中でB型又はC型インフルエンザウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0029】
一つの具体的な実施態様を通して、本発明は主にPAC中αへリックス8、αへリックス11、αへリックス13、αへリックス10により形成した疎水性コアとの相互作用を、好ましくはαへリックス8中のMet595、αへリックス11中のLeu666、αへリックス13中のTrp706とPhe710、及びαへリックス10中のVal636とVal640との相互作用を提供するが、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0030】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼPB1と競合的にPACと結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供するが、その中で記述したポリペプチド、タンパク質、抗体又は免疫結合物のアミノ酸配列における、野生型インフルエンザ・ウイルス・ポリメラーゼPB1のN末端PB1N残基5から10位Pro5、Thr6、Leu7、Leu8、Phe9とLeu10が形成する短へリックス領域を含む短PTLLFLモチーフの中少なくとも三つは、該モチーフとのポリペプチド配列比較において対応する位置のアミノ酸が同じである。
【0031】
一つの具体的な実施態様を通して、本発明は上記のポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物含む組成物を提供する。
【0032】
一つの具体的な実施態様を通して、本発明は上記組成物のインフルエンザ・ウイルスによる疾病の治療薬物の製造における応用を提供する。
【0033】
一つの具体的な実施態様を通して、本発明は(a)標識タンパク質遺伝子を融合した又は融合してないインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC第約201〜約301位のアミノ酸から約650〜末端位置アミノ酸をコードする遺伝子配列のベクターを構築し、そのベクターで原核又は真核細胞を形質転換し、よって標識タンパク質を持つPACを発現することと;(b)PACの発現と似た方法で標識が付く又は付かないPB1Nを発現することと;(c)上記(a)で得たインフルエンザ・ウイルスPACの発現細胞と(b)で得たインフルエンザ・ウイルスPB1のN末端48個のアミノ酸以内のアミノ酸PB1Nの発現細胞を一定比率で混合し、特異的に特異標識を識別する方法で記述の混合タンパク質を分離し、酵素分解により標識つきポリペプチド中の標識タンパク質を取り除き、PACとPB1Nとの複合体を分離し、タンパク質濃度を測定することとを含むインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体を発現精製する方法を提供する。
【0034】
その中、上記ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造中の原子は表1の中で挙げた40%の原子座標を持ち、又はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造中の少なくとも40%のアミノ酸の主鎖炭素骨格の原子構造座標は表1中の座標と平均二乗偏差が1.7Å以下である。
【0035】
一つの具体的な実施態様を通して、本発明は、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体を発現精製する方法を提供するが、そこで記述した標識タンパク質はGST、Flag−tag、Myc−tag、MBP−tag、特異性抗体より選び;記述したベクターは選択性標識遺伝子を含み、ステップ(c)で記述した一定比率とは標識タンパク質−PACと標識タンパク質−PB1Nのタンパク質総量のモル比が0.1:1〜1:0.1に成る様にする比率であり、好ましくは標識タンパク質−PACと標識タンパク質−PB1Nのタンパク質総量のモル比を0.5:1〜1:0.5に、更に好ましくは標識タンパク質−PACと標識タンパク質−PB1のタンパク質総量のモル比を1:1に近づかせる。好ましい標識タンパク質はGSTであり、記述した特異的に特異標識を識別する方法はアフィニティ・カラム・クロマトグラフィーであり、記述した標識を取り除く方法はプロティナーゼによる酵素分解法、記述したPACとPB1Nとの複合体の分離方法はゲル濾過又はイオン交換クロマトグラフィーで行い、記述したタンパク質の濃度確定はゲル電気泳動法で行う。
【0036】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の発現と精製方法を提供するが、そこに記述したベクターはpGEX−6pプラスミド・ベクターで、そこに記述した選択性標識遺伝子はペニシリン耐性遺伝子で、そのステップ(c)で使用したプロティナーゼはProScissionプロティナーゼである;ベクターで使用したプライマーの酵素切断サイトはSalIとNotIから構成される群より選択される酵素切断サイトであり;遺伝子断片の挿入時に使用した酵素切断サイトはSalIとNotIから構成される群より選択される酵素切断サイトであり;記述したインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACの遺伝子断片はPCR方法を利用して、A型インフルエンザ・ウイルス株A/goose/Guangdong/1/96ゲノムを元に増幅して得られ;上記ベクター及び上記挿入遺伝子断片はそれぞれ対応するDNAエンドヌクレアーゼを使用し、たとえばBamHIとXhoIから構成される群より選択されるエンドヌクレアーゼで処理をした後、T4 DNA Ligaseを利用して上記挿入遺伝子を上記ベクターに連結し、よって例えば大腸菌のような原核細胞を形質転換してプラスミド・クローンを取得し;クローン化済みの例えば上記のプラスミド・クローンで大腸菌BL21を形質転換し、得られる形質転換細菌を培養し、IPTGで誘導をかけるが、IPTGの好ましい濃度は0.1mMから1mMであり;培養して得られる上記細菌を遠心して、上記融合タンパク質を発現する細菌叢が得られる。
【0037】
一つの具体的な実施態様を通して、本発明は、上記精製したPACとPB1N複合体のタンパク質濃度を5−30mg/mlまで濃縮することと;hanging−drop蒸気拡散法またはsitting−drop蒸気拡散法を利用した結晶成長条件のスクリーニングすることと;インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶を得ることとを含むインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の共結晶化方法を提供する。
【0038】
一つの具体的な実施態様を通して、本発明は、PAのN末端1位〜約50位のアミノ酸から約200位〜約300位のアミノ酸までであるPANの野生型又は変異型タンパク質を発現させる方法を提供し、標識タンパクの質遺伝子を融合したインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのN末端PANの1位〜約50位のアミノ酸から約200位〜約300位のアミノ酸をコードする遺伝子配列の発現ベクターを構築し、このベクターで細胞を形質転換して、よって標識タンパク質を持つPANを発現させるが、そのPAのN末端PANにおけるアミノ酸配列は、図1Cに示すアミノ酸配列と比べ少なくとも40%の同アミノ酸配列を有する。
【0039】
一つの具体的な実施態様を通して、本発明はPAのN末端PANの野生型又は変異型タンパク質を発現させる方法を提供するが、その方法では、PANのN末端にGSTを融合した融合タンパク質GST−PANを発現させるため、PCR方法及び分子クローン技術を利用して、記述したポリメラーゼ・サブユニットPAのN末端PANの遺伝子配列をそれぞれ例えばpGEX−6p、pGEX−4 T等pGEX系ベクター(Amersham Pharmacia)、pET系ベクター(Novagen)、pMAL−c2 (Invitrogen)系ベクター等のプラスミド・ベクターにクローン化し;上記プラスミド・ベクターはペニシリン耐性遺伝子を含有し、上記PAのN末端PANポリペプチドの遺伝子クローン化時にベクターの使用した酵素切断サイトはpGEX−6pマルチ・クローン・サイトのBamHI、XhoIから構成される群より選択される酵素切断サイトであり;使用したPAN遺伝子クローン断片の酵素切断サイトはそれぞれBamHIとXhoIであり;PANタンパクの遺伝子断片はPCR方法を利用してウイルス株A/goose/Guangdong/1/96ゲノムを元に増幅して得られ;ベクターと挿入遺伝子断片はそれぞれ対応するDNAエンドヌクレアーゼ例えばBamHI、XhoIから構成される群より選択されるエンドヌクレアーゼで処理した後、T4 DNA Ligaseで挿入遺伝子とベクターを結合させ、大腸菌を形質転換してプラスミドクローンを取得し;クローン化済みの例えば上記のプラスミド・クローンで大腸菌BL21を形質転換して、その形質転換細菌を培養し、0.1mMから1mMのIPTGで誘導をかけ、培養した細菌を遠心して上記融合タンパク質を発現する細菌叢が得られる。
【0040】
一つの具体的な実施態様を通して、本発明は、(a)PACを固定ベクターの表面に結合させることと;(b)過剰量の標識付きPB1Nを上記固定されたPACに接触させることと;(c)溶出液で充分に溶出して、未結合PB1Nを取り除くことと;(d)テスト候補化合物の溶液を(b)の項で記述した固定され且つPB1Nと結合したPACに接触させることと;(e)記述した溶出液で充分に溶出して、テスト溶液を得ることと;(f)上記テスト溶液中の標識つき遊離PB1Nの濃度を測定することと;(g)テスト溶液中の標識つき遊離PB1Nの濃度を基に、候補化合物のPACとの結合能力を求めることとを含むことを特徴とするPB1Nと競合的にPACと結合する候補化合物のスクリーニング方法を提供する。
【0041】
一つの具体的な実施態様を通して、本発明は、記述したステップ(a)中PACの固定表面上への結合は、共有結合性架橋又はPACをアフィニティ・マトリックスと結合させることにより実現し、上記アフィニティ・マトリックスは固定表面上にはそのアフィニティ・マトリックスが結合できる結合基を有することを特徴とするPB1Nと競合的にPACと結合する候補化合物のスクリーニング方法を提供する。
【0042】
一つの具体的な実施態様を通して、本発明は、記述したアフィニティ・マトリックスにはGST、Flag−tag、Myc−tag、MBP−tag、His−tag、特異性抗体等その他ポリペプチドが挙げられ、固定表面上はそれぞれのマトリックスに対応する結合基を有することを特徴とするPB1Nと競合的にPACと結合する候補化合物のスクリーニング方法を提供する。
【0043】
一つの具体的な実施態様を通して、本発明は、記述した標識付きPB1Nポリペプチドは同位体又はその他の化学分子で標識したタンパク質より選び出し、好ましくは、その他の化学分子標識は緑色蛍光タンパク質、各種その他融合ポリペプチド、例えば結合したペルオキシダーゼ、ホスファターゼ、プロテインキナーゼ、各種トランスフェラーゼ等より選び出したことを特徴とするPB1Nと競合的にPACと結合する候補化合物のスクリーニング方法を提供する。
【0044】
一つの具体的な実施態様を通して、本発明は、上記固定表面はアフィニティクロマトカラムでもよいことを特徴とするPB1Nと競合的にPACと結合する候補化合物のスクリーニング方法を提供する。
【0045】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造の、インフルエンザ・ウイルス感染による疾病の治療に使用できる各種ポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物の設計とスクリーニングにおける応用を提供する。
【0046】
上記PACタンパク質の発現精製方法;上記PAC及びPB1N端ポリペプチド複合体の発現精製方法;上記タンパク質結晶の獲得方法に基づいて薬物のスクリーニングを行ない、PACとPB1Nの三次元構造に基づいて薬物設計を行う。
【0047】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造の、インフルエンザ・ウイルス感染による疾病の治療に使用できる各種ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物の設計とスクリーニングにおける応用であって、
タンパク質三次元構造座標に基づき、コンピューター・シミュレーションにて特定位置に結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物分子を設計することと;
タンパク質三次元構造座標に基づき、コンピューター・シミュレーションにて特定位置に結合可能なポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物分子を捜すことと;
タンパク質三次元構造座標に基づき、設計或は捜したポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物分子を上記PAC及びPB1N配列と少なくとも50%同配列を持つ任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・タンパク質に結合させ、更に結合状況を分析することと;及び
タンパク質三次元構造座標に基づき、設計或は捜したポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物分子を上記PAC及びPB1N配列と少なくとも50%同配列を持つ任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・タンパク質に結合させ結晶し、タンパク質X線結晶構造解析方法にてポリペプチド及び化合物分子のタンパク質との結合状況を分析することと;
を含み、
上記PAC及びPB1N配列と少なくとも50%の同配列を持つ任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・タンパク質と結合する上記ポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物分子が候補化合物である応用を提供する。
【0048】
PAのポリメラーゼ中での機能及びその三次元微細構造を明らかにする為、本発明者らはPAのC末端257−716残基断片(PAC)とPB1のN末端25個のペプチド(PB1N)の複合体の2.9Å分解能の結晶構造を解析した。この構造により、PAのC末端とPB1のN末端の相互作用方式及び結合に関与したアミノ酸残基の組成と空間的相対位置がはっきりと示され、PAとRNAの結合サイト、PAのC末端及びPB1のN末端複合体の三次元構造モデル、タンパク質の二次構造構成、PAタンパク質分子中の核酸結合サイト、PAタンパク質分子における小分子チャンネル等及びPAタンパク質表面の電荷分布が明らかとなり、更なるPAのウイルスRNAポリメラーゼ複合体における機能研究のための構造学的基盤が提供された。また、上記本発明のタンパク質発現精製方法、結晶方法を使用して薬物スクリーニングを行い、PAとPB1相互作用及びPAとRNAその他タンパク質相互作用を標的にした薬物を設計し、よってインフルエンザ・ウイルス・ポリメラーゼ活性を抑制する目的を達成する為のタンパク質結晶プラットフォーム並びに三次元構造プラットフォームを提供した。
【0049】
注意すべきは、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスのαへリックスとβシートに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりであり、詳細はここでは略す。
【図面の簡単な説明】
【0050】
【図1A】三種の異なったタイプのインフルエンザ・ウイルス由来に基づいたPAタンパク質C末端の配列の比較であり、その中、A_OURSは鳥インフルエンザA型ウイルス株A/goose/Guangdong/1/96のPAタンパク質C末端の配列;A_1918は1918年ヨーロッパで爆発した広範囲インフルエンザで重大な人類死亡事件を引き起こしたA型インフルエンザ・ウイルス株A/Brevig Mission/1/1918 A型インフルエンザ・ウイルスPAタンパク質配列;B_1966は1966 Ann aborのインフルエンザB型ウイルスB/Ann Arbor/1/1966のPAタンパク質配列;C_1950は1950の一種のインフルエンザC型ウイルスC/JJ/1950のPAタンパク質配列であり;これらの結果は、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAタンパク質に高度に保存的なアミノ酸残基が含有されていることを示す。図中、….は該当領域のアミノ酸欠失を表すが、明細書及び特許請求の範囲では具体的なアミノ酸位置を全てA_OURSを例に説明した。
【図1B】四種の異なったタイプのインフルエンザ・ウイルス由来に基づいたPB1Nタンパク質配列の比較であり、その中、A_OURS、A_1918、B_1966、C_1950は図1Aと同様であり、図中、….は該当領域のアミノ酸欠失を表すが、明細書及び特許請求の範囲では具体的なアミノ酸位置を全てA_OURSを例に説明した。
【図1C】三種の異なったタイプのインフルエンザ・ウイルス由来に基づいたPAタンパク質N末端の配列であり、図中、….は該当領域のアミノ酸欠失を表すが、明細書及び特許請求の範囲では具体的なアミノ酸位置を全てA_OURSを例に説明した。
【図2】鳥インフルエンザA型ウイルス野生型ウイルス株A/goose/Guangdong/1/96のPAのN末端前256アミノ酸ポリペプチド断片の精製。その中、A図は精製したタンパク質のゲル濾過クロマトグラフィーSuperdex−200(Amersham Pharmacia Inc.)における溶出ピーク位置を示し、B図はその溶出ピークのPAのN末端タンパク質電気泳動結果を示し、C図は最終精製したPAのN末端タンパク質を示す。
【図3】精製したPAのN末端(1−256残基)タンパク質より得られたタンパク質結晶及びX線回析状況。その中、A及びBは異なる結晶条件下で得た結晶であり、C及びDは二種のPAのN末端タンパク質結晶のX線回析像である。
【図4】大腸菌で発現精製したPAC及びGST−PB1Nタンパク質、及びPACとPB1のN末端ペプチド相互結合実験並びにPACとPB1Nポリペプチド複合体の構造のリボン図。(A)精製したPACタンパク質及び精製したPACとPB1Nポリペプチド・タンパク質のin vitro相互作用試験。(B)PACとPB1Nポリペプチド複合体三次元構造の線状(Wireflame)図で、咀嚼する狼頭状全体構造を呈する。
【図5】PAのC末端とPB1のN末端ペプチド複合体の全体構造:(A)PACとPB1N末端ペプチド複合体の全体構造の横視図、タンパク質鎖の成り行きを明瞭に示す。(B)図5(A)中の図をY軸に沿って180度回転し、二次構造には標識を行ない、その中のPB1のN末端ペプチドとPACの二つの末端を矢印で示した。
【図6】PACとPB1Nポリペプチド間の相互作用:(A)PAタンパク質分子の表面図;PB1のN末端ポリペプチドをリボン図で表示し、PA分子は表面電荷分布で表示する。(B)PAとPB1間の相互作用は主に疎水相互作用であることを観察し易いように部分拡大する。
【図7】PAタンパク質分子の表面電荷図。その中でA及びBはそれぞれ図5中A及びB図の方向と一致している。
【図8】PAC/PB1N末端ペプチド複合体分子構造中に存在する大溝領域とチャンネルの図解。A図は大溝領域、その中に分布されている一部アルカリ性アミノ酸残基を表示する。B及びC図はそれぞれ分子の両面から(X軸に沿って180度転回)PA分子中のチャンネル領域構造を観察する図である。チャンネル内外の一部の保存的アミノ酸を表示した。
【図9】PA−CとPB1−Nポリペプチド間の相互作用の図解:(A)PA−CとPB1−Nポリペプチド・タンパク質複合体分子三次元構造のリボン図;PA分子はN末端からC末端まで青から赤に変化するリボン図で表示する。(B)PAタンパク質分子の一つの表面図;PB1N端ポリペプチドはリボン図で表示し、PA分子は表面電荷分布で表示する。(C)PA分子上PB1ポリペプチド相互作用に関与する主なへリックス8、10、11、13の観察用に複合体構造部分を拡大する。(D)PA及びPB1間の相互作用観察用に部分拡大する。PB1N末端ポリペプチドはリボン図で表示し、PA分子は表面電荷分布で表示する。この二つのポリペプチドは主に疎水相互作用で結合する。
【図10】図1Aと図1Bと同様に、三種の異なったタイプのインフルエンザ・ウイルス由来に基づいたPAタンパク質C末端の配列及びPB1Nのタンパク質配列。(A)三種の異なったタイプのインフルエンザ・ウイルス由来に基づいたPAタンパク質の配列比較であり、図中、A_OURSは鳥インフルエンザA型ウイルス ウイルス株A/goose/Guangdong/1/96のPAタンパク質C末端の配列;A_1918は1918年ヨーロッパで爆発した大範囲インフルエンザで重大な人類死亡事件を引き起こしたA型インフルエンザ・ウイルス株A/Brevig Mission/1/1918 A型インフルエンザ・ウイルスPAタンパク質配列;B_1966は1966 Ann aborのインフルエンザB型ウイルスB/Ann Arbor/1/1966のPAタンパク質配列;C_1950は1950の一種のインフルエンザC型ウイルスC/JJ/1950のPAタンパク質配列である。これらの結果はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAタンパク質に高度に保存的なアミノ酸残基が含まれていることを示す。(B)四種の異なったタイプのインフルエンザ・ウイルス由来に基づいたPB1Nのタンパク質配列比較であり、図中、A_OURS、A_1918、B_1966、C_1950は(A)と同様であり、図中、….は該当領域のアミノ酸欠失を表し、明細書及び特許請求の範囲では具体的なアミノ酸位置を全てA_OURSを例に説明した。ボックスの中にRound loopと標記されているのは構造中の大環状領域、もう一方のボックス(未標記)は核酸結合可能領域である。矢印はPAのC末端がPB1オリゴペプチドとの結合に関与するアミノ酸残基を示す。明細書及び特許請求の範囲では具体的なアミノ酸位置を全てA_OURSを例に説明した。
【発明を実施するための形態】
【0051】
本発明は、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAの野生型又は変異型タンパク質を幾つかに分けて発現し、即ちN末端とC末端両部分をそれぞれ大腸菌にて発現し、精製する方法を提供した。それには、PAのN末端を単独に結晶実験に使う方法、PAより得た257−716残基を含むC末端断片とインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1の野生型又は変異型タンパク質のPB1のN末端ペプチドをそれぞれ大腸菌にて発現方する方法、精製方法、またPAのC末端とPB1のN末端ペプチド複合体で結晶する方法、及びこれによって得られたPAC/PB1Nオリゴペプチド複合体の結晶構造、とこれら結晶方法に基づいた薬物スクリーニング及びこれら結晶構造に基づいた薬物設計の実施を提供した。
【0052】
一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、その中でインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACはインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAの約201〜約301位アミノ酸から約650〜末端のアミノ酸までであり、PB1のN末端PB1Nはインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1のN末端PB1Nの48個アミノ酸以内のオリゴペプチドであり、そこに記述した結晶三次元構造中の原子は表1の中で挙げた40%の原子座標を持ち、又はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造中の少なくとも40%のアミノ酸の主鎖炭素骨格の原子構造座標は表1中の座標と平均二乗偏差が1.7Å以下である。
【0053】
一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、そこに記述したインフルエンザ・ウイルスはA、B、C型インフルエンザ・ウイルスより選び、そのうち、そこに記述したインフルエンザ・ウイルスは好ましくはA型インフルエンザ・ウイルス株A/goose/Guangdong/1/96とA/Brevig Mission/1/1918、B型インフルエンザ・ウイルス株B/Ann Arbor/1/1966又はC型インフルエンザ・ウイルス株C/JJ/1950より選んだ。
【0054】
一つの好ましい実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、その中で上記複合体の結晶はP4(1)2(1)2の空間群を持ち、格子定数はおよそα=b=122Å、c=133Å、α=β=γ=90°である。
【0055】
一つの好ましい実施態様を通して、本発明インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、そこに記述したA型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACはインフルエンザ・ウイルス・ポリメラーゼPAのC末端PAC中のαへリックス4、即ち406−414位を含むアミノ酸領域、αへリックス5、即ち440−450位を含むアミノ酸領域、αへリックス8、即ち583−603位を含むアミノ酸領域、αへリックス9、即ち608−613位を含むアミノ酸領域、αへリックス10、即ち633−649位を含むアミノ酸領域、αへリックス11、即ち653−673位を含むアミノ酸領域、αへリックス12、即ち683−691位を含むアミノ酸領域、とαへリックス13、即ち698−714位を含むアミノ酸領域、及び二つのβシート:βシート8とβシート9、それぞれ619−623位を含むアミノ酸領域と628−631位を含むアミノ酸領域が、PAのC末端PACの第一部分を構成し、その中でA型インフルエンザウイルスのポリメラーゼサブユニットPAのC末端PACは主要なβシート折り畳み断片より成り、これらのβシートにはβシート1、即ち290−292位を含むアミノ酸領域、βシート2、即ち317−324位を含むアミノ酸領域、βシート3、即ち480−491位を含むアミノ酸領域、βシート4、即ち496−506位を含むアミノ酸領域、βシート5、即ち517−526位を含むアミノ酸領域、βシート6、即ち541−550位を含むアミノ酸領域、βシート7、即ち557−571位を含むアミノ酸領域などが含まれ、これらのβシートが共同でPAのC末端PAC第二部分の折り畳みシート層の主な部分を構成し、その中でA型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACはαへリックス1、即ち303−311位を含むアミノ酸領域、αへリックス2、即ち331−349位を含むアミノ酸領域、αへリックス3、即ち364−369位を含むアミノ酸領域、αへリックス6、即ち454−475位を含むアミノ酸領域及びαへリックス7、即ち572−578位を含むアミノ酸領域が、PAのC末端PAC第二部分の上記折り畳みβシート層の周囲を囲い、その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0056】
一つの好ましい実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、そこに記述したA型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACは主にαへリックス8、αへリックス10、αへリックス11とαへリックス13の関与を通じてPB1のN末端PB1Nと相互に作用するが、好ましくは、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス11のLeu666、αへリックス13のPhe710、αへリックス10のVal636、Leu640、αへリックス13のTrp706、αへリックス11のGln670から構成される群より選択される少なくとも一つのアミノ酸を、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1との相互作用に関与させる。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0057】
一つの好ましい実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、そこに記述したA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のαへリックス9とαへリックス10の間の環状ペプチド断片のIle621、Gly622、Glu623、Thr618とPro620から構成される群より選択される少なくとも一つのアミノ酸を、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1との相互作用に関与させた。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0058】
一つの好ましい実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、その中、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のAsn647、Gln408、Cys584、Gln587、Gln591、Lys643、Asn647、Ser659、Lys663、Trp699、Asn703から構成される群より選択される少なくとも一つのアミノ酸を、記述のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPACのインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1Nと結合する「袋状」のアミノ・サイトを構成させた。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0059】
一つの好ましい実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、その中、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のTrp406、Glu410、Lys461、Glu524、Phe525、Ser526、Lys536、Lys539、Tyr540、Leu563、Tyr564、Arg566及びLys574から構成される群より選択される少なくとも一つのアミノ酸が、上記A型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACでヌクレオチド、RNA若しくはその他の小分子又はタンパク質と結合する主溝及びチャンネルの形成に関する。その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0060】
一つの好ましい実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、そこに記述したA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACの370から405位に位置するアミノ酸残基は一つの大環状を構成し、そこに記述したB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0061】
一つの好ましい実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、そこに記述したA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス12、αへリックス13は他のタンパク質との相互作用に関与するが、好ましくは、αへリックス12及びαへリックス13中のIle690、Glu691、Glu692、Cys693、Asn696から構成される群より選択される少なくとも一つのアミノ酸を他のタンパク質との相互作用に関与させる。そこに記述したB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0062】
一つの好ましい実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を提供し、上記A型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのLys506、Gly507、Arg508、Ser509、His510、Leu511、Arg512、Asn513及びAsp514から構成される群より選択される少なくとも一つのアミノ酸をその他タンパク質との相互作用に関与させ、その中でHis510はポリメラーゼ複合体RNaseの一部分を構成し、その中で上記B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0063】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のαへリックス8、αへリックス10、αへリックス11とαへリックス13から構成される群より選択される少なくとも一つのメンバーと結合するポリペプチド、タンパク質、無機若しくは有機化合物を提供し、その中で上記インフルエンザ・ウイルスはA、B、C型インフルエンザ・ウイルスより選び、好ましくは、上記インフルエンザ・ウイルスはA型インフルエンザ・ウイルス株:A/goose/Guangdong/1/96、A/Brevig Mission/1/1918;B型インフルエンザ・ウイルス株:B/Ann Arbor/1/1966又はC型インフルエンザ・ウイルス株:C/JJ/1950より選び、その中で、好ましくは、上記ポリペプチド、タンパク質、無機若しくは有機化合物は上記A型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス11のLeu666、αへリックス13のPhe710、αへリックス10のVal636、Leu640、αへリックス13のTrp706、αへリックス11のGln670から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物であり、その中で上記B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0064】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のαへリックス9とαへリックス10の間の環状ペプチド断片中のA型インフルエンザ・ウイルスIle621、Gly622、Glu623、Thr618とPro620から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供し、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0065】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACでA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のAsn647、Gln408、Cys584、Gln587、Gln591、Lys643、Asn647、Ser659、Lys663、Trp699、Asn703から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供し、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0066】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACでA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のTrp406、Glu410、Lys461、Glu524、Phe525、Ser526、Lys536、Lys539、Tyr540、Leu563、Tyr564、Arg566及びLys574から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供し、その中でB型又はC型インフルエンザウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0067】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACでA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACの370から405位より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供し、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0068】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス12、αへリックス13と結合し、好ましくはA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス12及αへリックス13中のIle690、Glu691、Glu692、Cys693、Asn696から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供し、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0069】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のシートβ4とシートβ5の間の環状領域内でA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのLys506、Gly507、Arg508、Ser509、His510、Leu511、Arg512、Asn513及びAsp514から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供し、その中でB型又はC型インフルエンザウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0070】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼPB1と競合的にPACと結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供する。
【0071】
一つの好ましい実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼPB1と競合的にPACと結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物は主にPAC中αへリックス8、αへリックス11、αへリックス13、αへリックス10からなる疎水性コアを介して相互作用を起こし、好ましくはA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のαへリックス8中のMet595、αへリックス11中のLeu666、αへリックス13中のTrp706とPhe710、及びαへリックス10中のVal636とVal640を介して相互作用を起こし、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである。
【0072】
一つの好ましい実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼPB1と競合的にPACと結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供し、上記ポリペプチド又はタンパク質のアミノ酸配列における、野生型インフルエンザ・ウイルス・ポリメラーゼPB1のN末端PB1N残基5から10位Pro5、Thr6、Leu7、Leu8、Phe9とLeu10が形成する短へリックス領域を含む短PTLLFLモチーフの中の少なくとも三つは、該モチーフとのポリペプチド配列対比において対応する位置のアミノ酸が同じである。
【0073】
もう一つの具体的な実施態様を通して、上記ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物の組成物を提供し、キャリア又は賦形剤を選択的に含む。
【0074】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルスによる病気の治療薬物の製造における上記組成物の応用を提供する。
【0075】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の発現精製方法であって、
(a)標識タンパク質遺伝子コードを融合した又は融合しないインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC第約201〜約301位アミノ酸から約650〜末端位アミノ酸をコードする遺伝子配列のベクターを構築し、このベクターを使い原核又は真核細胞を形質転換し、よって標識タンパク質が付いているPACを発現することと;
(b)PACの発現と似た方法で標識が付く又は付かない上記PB1Nを発現することと;
(c)(a)で取得されたインフルエンザ・ウイルスPACの発現細胞と(b)で取得されたインフルエンザ・ウイルスPB1のN末端48個のアミノ酸以内のアミノ酸PB1Nの発現細胞を一定比率で混合し、特異的に特異標識を識別する方法でこの混合タンパク質を分離し、酵素性分解で標識がつくポリペプチド中の標識タンパク質を取り去り、PACとPB1Nとの複合体を分離し、タンパク質の濃度を確定することと;
を含み、
その中で上記ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造中の原子は表1の中で挙げた少なくとも40%の原子座標を持ち、又はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造中の少なくとも40%のアミノ酸の主鎖炭素骨格の原子構造座標は表1中の座標との平均二乗偏差が1.7Å以下である、方法が提供される。
【0076】
一つの好ましい実施態様を通して、その中で上記標識タンパク質はGST、Flag−tag、Myc−tag、MBP−tag、特異性抗体より選ばれ;上記ベクターは選択性標識遺伝子を含み、ステップ(c)中での一定比率とは標識タンパク質−PACと標識タンパク質−PB1Nのタンパク質総量のモル比が0.1:1〜1:0.1となるものであり、好ましくは標識タンパク質−PACと標識タンパク質−PB1Nのタンパク質総量のモル比を0.5:1〜1:0.5にさせ、更に好ましくは標識タンパク質−PACと標識タンパク質−PB1のタンパク質総量のモル比を1:1に近づかせ、好ましい標識タンパク質はGSTであり、上記特異標識識別方法はアフィニティ・カラムを使用し、上記標識を取り除く方法はプロティナーゼ酵素性分解を使用し、上記PACとPB1Nとの複合体の分離方法はゲル濾過法又はイオン交換クロマトグラフィーで行い、上記タンパク質の濃度確定はゲル電気泳動法で行う。
【0077】
更に好ましい実施態様では、その中の上記原核細胞は大腸菌である。
【0078】
もう一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の共結晶化方法であって、
上記精製したPACとPB1N複合体のタンパク質濃度を5〜30mg/mlまで濃縮することと;
hanging−drop蒸気拡散法またはsitting−drop蒸気拡散法で結晶成長条件をスクリーニングすることと;
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶を得ることと、
を含む方法を提供する。
【0079】
もう一つの具体的な実施態様を通して、本発明はPAのN末端1〜約50位アミノ酸から約200〜約300位のアミノ酸までであるPANの野生型又は突然変異型タンパク質の発現方法であって、標識タンパク質遺伝子を融合した又は融合していないインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのN末端PANの1〜約50位アミノ酸から約200〜約300位アミノ酸までをコードする遺伝子配列の発現ベクターを構築し、このベクターで細胞を形質転換し、よって標識タンパク質を持つPANを発現し、その中で上記PAのN末端PAN中のアミノ酸配列は図1C中の少なくとも40%のアミノ酸と同じである方法を提供する。
【0080】
一つの好ましい実施態様で、そこに記述した原核細胞は大腸菌である。
【0081】
他のもう一つの具体的な実施態様で、PB1Nと競合的にPACと結合する候補化合物のスクリーニング方法であって、
(a)PACを固定ベクターの表面に結合させることと;
(b)過剰量の標識付きPB1Nを上記の固定されたPACに接触させることと;
(c)溶出液で充分に溶出して、未結合の遊離PB1Nを取り除くことと;
(d)テスト化合物の溶液を(b)の項で記述した操作でPB1Nと結合したPACに接触させることと;
(e)記述した溶出液で充分に溶出して、テスト溶液を得ることと;
(f)上記テスト溶液中の標識つき遊離PB1Nの濃度を測定することと;
(g)テスト溶液中の標識つき遊離PB1Nの濃度を基に、候補化合物のPACとの結合能力を求めることと、
を含む方法を提供する。
【0082】
好ましい実施態様では、上記ステップ(a)中PACの固定表面上への結合を、共有結合性架橋又はPACをアフィニティ・マトリックスと結合させることにより実現した。上記アフィニティ・マトリックスは固定表面上にはそのアフィニティ・マトリックスが結合できる結合基を有する。
【0083】
好ましくは、上記アフィニティ・マトリックスはGST、Flag−tag、Myc−tag、MBP−tag、His−tag、特異性抗体から選択され、固定表面上は対応マトリックスの結合基を有する。
【0084】
好ましくは、上記標識付きPB1Nポリペプチドは同位体又はその他の化学分子で標識したタンパク質より選択され、好ましくは、その他の化学分子での標識は緑色蛍光タンパク質、各種融合ポリペプチドより選び使用した。
【0085】
好ましくは、上記固定表面はアフィニティ・クロマトカラムである。
【0086】
一つの具体的な実施態様を通して、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造の、インフルエンザ・ウイルス感染による疾病の治療に使用できる各種ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物の設計とスクリーニングにおける応用であって、
タンパク質三次元構造座標に基づき、コンピューター・シミュレーションにて特定位置に結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物分子を設計することと;
タンパク質三次元構造座標に基づき、コンピューター・シミュレーションにて特定位置に結合可能なポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物分子をスクリーニングすることと;
タンパク質三次元構造座標に基づき、設計或はスクリーニングしたポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物分子を上記PAC及びPB1N配列と少なくとも50%同配列を持つ任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・タンパク質に結合させ、更に結合状況を分析することと;
タンパク質三次元構造座標に基づき、設計或はスクリーニングしたポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物分子を上記PAC及びPB1N配列と少なくとも50%同配列を持つ任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・タンパク質に結合させ結晶にし、よってタンパク質X線結晶構造解析方法にてポリペプチド及び化合物分子のタンパク質との結合状況を分析することと、
を含み、
その中、上記PAC及びPB1N配列と少なくとも50%の同配列を持つ任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・タンパク質と結合する上記ポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物分子が即ち候補化合物である。
【0087】
一つの具体的な実施態様を通して、任意亜型のインフルエンザ・ウイルス・ポリメラーゼの三つのサブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の構造を提供したが、その中に含まれる一つのタンパク質又はそのある一領域は、上記PACタンパク質と少なくとも40%の同じ配列を持つ応用を提供する。
【0088】
一つの具体的な実施態様を通して、任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の三次元構造を提供したが、その中に含まれる一つのタンパク質又はそのある一領域の主鎖の三次元構造座標は、上記PACタンパク質配列の少なくとも40%の主鎖炭素骨格の原子三次元座標と平均二乗偏差が1.7Å以下である。
【0089】
一つの具体的な実施態様を通して、任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の構造を提供したが、そこに含まれる一箇所のタンパク質領域は上記のPB1Nポリペプチドのアミノ酸1−11領域と20%の配列相同性を持ち、好ましくは40%の配列相同性を持つ。
【0090】
一つの具体的な実施態様を通して、一種のポリペプチド又は小分子を提供したが、それらの特徴は上記インフルエンザ・ウイルスPAサブユニット上の任意のアミノ酸と相互作用を有することにある。
【0091】
一つの具体的な実施態様を通して、上記の三次元結晶構造の薬物スクリーニング及び薬物設計における応用を提供した。
【0092】
一つの具体的な実施態様を通して、PACとPB1Nタンパク質三次元構造に基づいて、タンパク質と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物をスクリーニングする方法であって、タンパク質結晶方法でPACを含む結晶を取得し、又はPAC及びPB1Nを含むタンパク質複合体結晶の三次元構造座標を取得し;そこに記述した三次元構造はこの座標における少なくとも40%のアミノ酸残基を含有する主鎖炭素骨格原子の三次元座標と比べ平均二乗偏差が1.7Å以下である全ての構造を含む方法を提供する。
【0093】
一つの具体的な実施態様を通して、下記のようなインフルエンザ・ウイルス亜型PAサブユニット・タンパク質の発現精製方法を提供し:PAを断片に分けて細菌又は真核発現システムにて発現するが、記述した方法で、含有するあらゆるタンパク質からある一箇所の断片が記述配列相応領域と同じアミノ酸配列を40%持つタンパク質を発現し精製する。
【0094】
一つの具体的な実施態様を通して、本発明のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体構造中のαへリックス8、10、11、13中任意一つの領域と少なくとも40%の同じアミノ酸を有するタンパク質上のアミノ酸残基と相互に作用するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を提供した。
【0095】
注意すべきは、その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりであり、ここでは一々詳述することを略す。採用しうるタンパク質又はポリペプチド配列の比較方法としてはCLUSTALW(http://www.ebi.ac.uk/Tools/clustalw2/index.html)を例に挙げる。
【0096】
インフルエンザ・ウイルスPAとPB1タンパク質の発現精製方法:
鳥インフルエンザ由来ウイルス遺伝子A/goose/Guangdong/1/96、そのコードタンパク質配列はそれぞれ:
(1)PAタンパク質配列:
【表1】

即ち:
【表2】

【0097】
(2)PB1タンパク質配列:
【表3】

即ち:
【表4】

である。
【0098】
分子クローン技術にて、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA遺伝子をタンパク質のN末端とC末端の二部分に分けてクローン化する。N末端には256位までのアミノ酸を含み、C末端には257番目から716番目のアミノ酸を含む。これら両遺伝子は、N末端にGSTを融合した融合タンパク質(GST−PA−N及びGST−PAC)を発現させるため、それぞれpGEX−6pベクター(Amersham Pharmacia Inc.より)へクローン化し、クローン化したプラスミドにて大腸菌BL21を形質転換し、形質の転換されたBL21にて最終濃度0.1−1mMのIPTG(イソペニル−β−D−チオガラクトシド)で大腸菌による二種のタンパク質の発現を誘導して当該二種類タンパク質の各自発現菌を獲得した。詳細は実施例1を参照。
【0099】
PB1 N末端の48個以内のアミノ酸の遺伝子(前から25ペプチドを含む)を同様にpGEX−6pベクターへクローン化し、GST−PB1N末端ペプチドを融合した融合タンパク質を発現した。
【0100】
同じく、GSTを融合したPB1N末端25個アミノ酸のオリゴペプチド又は48個以内のアミノ酸のオリゴペプチドをそれぞれ発現した。同様に当該プラスミドにて大腸菌BL21を形質転換し、形質の転換されたBL21にて最終濃度0.1−1mMのIPTGで大腸菌によるタンパク質の発現を誘導してそのタンパク質の発現菌を獲得する。
【0101】
GST−PA−Nを発現した細菌をバッファーに懸濁して溶解し、遠心分離して上清を得たあと、アフィニティ・クロマトカラムを使って、その中からGST−PA−N融合タンパク質を精製し出す。
【0102】
GST−PACを発現した発現菌とGST−PB1オリゴペプチドを発現した発現菌をそれぞれ約20mM Tris−HCl(pH 8.0)及び250mM NaClを含むバッファーに懸濁し、そして二種の発現菌を比率にあわせ混合して、GST−PACとGST−PB1のタンパク質総含有量のモル比が0.1:1〜1:0.1になるようにするが、好ましくはGST−PACとGST−PB1のタンパク質総含有量のモル比を0.5:1〜1:0.5に、更に好ましくはGST−PACとGST−PB1のタンパク質総含有量のモル比を1:1に近づかせる。
【0103】
そして、その混合GST融合タンパク質をグルタチオン−Sepharoseアフィニティ・カラム(Amersham Pharmacia Inc.)を使用して精製する。PreScissionプロティナーゼ(Amersham Pharmacia Inc.より)にて酵素分解後、ゲル濾過Superdex−200及びイオン交換クロマトグラフィー(Q sepharose)等の方法でPAC/PB1オリゴペプチド複合体(クロマトカラムは全てAmersham Pharmacia Inc.より)を分離精製し出し、SDS−PAGEにてタンパク質の純度を測定後、更なる結晶実験に使用する。
【0104】
タンパク質の結晶化とその最適化:
上記方法で発現精製したPAC及びPB1Nポリペプチドの複合物を約5−30mg/ml濃度まで濃縮し、hanging−drop蒸気拡散法にて、結晶化試薬(Hampton Research)を使用して結晶成長条件をスクリーニングし、多種結晶化試薬の使用条件下でイニシャル結晶を得た。
【0105】
更なる最適化を通じて、その中、異なるpHバッファーの条件下(pH 4〜9)約1Mの酢酸ナトリウム溶液より外見の良好な結晶を得た。濃度1〜1.3Mの酢酸ナトリウム(Sigmaより)のバッファー(pH4〜9)より比較的大きい三角錐体結晶を取得し、分解能約4Åくらいであった。
【0106】
X線回折データ収集を行う際、回折に必要な結晶を懸濁液から1.4Mの酢酸ナトリウム約10μlと10%のグリセリン(Sigmaより)を含有する結晶バッファーへ移し、ドロップをオープン放置して空気脱水を1時間以上行った後、分解能が3Åに到る母体及びセレノ結晶と相応のX線回折データを得た。
【0107】
結晶のデータ収集と構造解析:
FR−E X線回折機(Rigakuより)を使用し、1.5418Åの波長下でまずPA−PB1のN端25ペプチド複合体結晶の分解能2.9Åの母体データを一セット収集した。そして、アメリカ、シカゴのAPS(Advanced Photon Source)シンクロトロン放射光施設(synchrotron radiation facility)(ビームライン番号:SBC 19ID;ビームモニター:ADSC Q315)を利用して、波長0.9783Åと0.9785Åの下で、このタンパク質結晶の分解能が約3.3Åに到るpeakとedgeとした2セットのセレン化物結晶データを収集した。HKL2000(Otwinowski 1997)を利用して、得られた3セットのデータを処理し、それらの空間群が全てP4(1)2(1)2であることを発見した。多波長異常分散法(Hendrickson 1991)で位相を計算し、処理しで得たscaファイルよりSHELXD(Sheldrick 1998)でセレン原子を探した。タンパク質自身14個のメチオニンを含むが、本発明者らは合わせて14個のセレン原子を見つけ出し、セレン原子座標及び処理して得たPeakとEdge二セットのデータをautoSHARPプログラム(Vonrhein、Blancら、2007)にインプットして、位相計算と電子密度図の修飾を行なった。計算して得られた電子密度図より、幾つかの二次構造(一部のαへリックスとβシートを含む)がはっきりと見出せる。そして、プログラムCADを利用して位相拡張を行い、受け取った母体データを利用して位相を2.9Åまでを広げて構造モデルの構築を行なった。モデル構築に使ったプログラムはARP/wARP(Perrakis、Morrisら、1999)とPhenix(Adams、Grosse−Kunstleveら、2002)である。この二種のプログラムの自動モデル構築で全体構造の約60%が完成でき、残りの部分はプログラムCOOT(Emsley and Cowtan 2004)を利用して手動で構築した。
【0108】
最後に、得られたモデルをプログラムCNS(Brunger、Adamsら、1998)とREFMAC5(Murshudov、Vaginら、1997)で修正した結果、当該タンパク質構造の解析完成に至り、修正した構造の最終R因子と自由R因子はそれぞれ0.22と0.26である。
【0109】
PAC/PB1Nオリゴペプチドタンパク質複合体結晶構造原子座標は表1を参照。
【実施例】
【0110】
実施例1
インフルエンザ・ウイルスPAとPB1ポリペプチドの発現方法:
本発明の一種の実施態様はPAを二段に分けて発現し、よってPAのN末端前256アミノ酸残基セグメント及び257−716個アミノ酸残基セグメントを別々に発現し、この二つのタンパク質ポリペプチドをコードする二つの遺伝子セグメントを別々に大腸菌発現ベクター上へクローン化し、細菌中でタンパク質の発現を行う。単独にPAのN末端(1−256アミノ酸)を発現する細菌中からPAのN端ポリペプチドを精製し、PAのN端ペプチドをタンパク質結晶に使用する。PAのN末端発現菌を遠心収集後、PB1のN端ポリペプチドとの共同精製に備える。
【0111】
PB1のN末端前25座又は48座アミノ酸以内を含むポリペプチド(第一位メチオニンは含まず)をGST融合タンパク質の形式で細菌中で発現する。インフルエンザ・ウイルス・ポリメラーゼ・タンパク質・サブユニットPAを段分けで細菌中又はその他真核生物細胞中で少なくとも50%の領域が257−716アミノ酸領域の一部分のPAタンパク質・セグメントで発現する。
【0112】
インフルエンザ・ウイルスPAのN末端を大腸菌中で発現精製
分子クローン技術を使用し、インフルエンザ・ウイルスPAのN末端(第1から256位アミノ酸)をpGEX−6pベクター(Amersham Pharmacia Inc.より)へクローン化し、そのクローン・サイトはBamHI及びXhoIであり得る。クローン化で得たPAのN末端遺伝子を含む発現プラスミドで大腸菌BL21を形質転換してタンパク質を発現し、よって細菌にPAタンパク質N端(N末端)にGST融合タンパク質が接続され発現すると同時にProScissionプロティナーゼ (Amersham Biosciences)によって切断可能な酵素切断サイトを含むためGSTタンパク質標識と標的タンパク質PAポリペプチドが分離できる。培養した大腸菌BL21細胞中で最終濃度が0.1−1mMあたりのIPTGを使用して大腸菌を触発し、当該タンパク質の発現菌を獲得する。使用されたベクターはアンピシリン耐性遺伝子を含む。クローン化で構築した融合タンパク質発現プラスミドにて大腸菌、例えばBL21(Novagen)を形質転換した後、37度でLB等細菌培養器を使用し一晩細菌培養し、約12時間後1:100あたりで大量の培養器へ移し、37度温度下でODが1.0あたりまで培養し、そして0.1〜1mMのIPTGを加え発現誘導を行い、およそ3−6時間後遠心して細菌を収集し、収集した沈澱細菌は−20度から−80度の冷蔵庫で保存し、PAのN末端タンパク質の精製に備える。
【0113】
インフルエンザウイルスPAのC末端とPB1ポリペプチド複合体の発現精製:
分子クローン技術を通して、インフルエンザ・ウイルスPAのC末端(第257から第716アミノ酸)をpGEX−6pベクター(Amersham Pharmacia Inc.より)上へクローン化し、そのクローン遺伝子座はBamHI及びNotIである。クローン化したPAのC末端遺伝子を含む発現プラスミドを大腸菌BL21中で形質転換しタンパク質の発現を行い、よって細菌にタンパク質N端(N末端)にGST融合タンパク質が繋ぐのを発現させ、同時にProScissionプロティナーゼ(Amersham Biosciences)によって切断可能な酵素切断遺伝子座が含まれることによって、GSTタンパク質標識と標的タンパク質PAポリペプチドを分離する。培養した大腸菌BL21細胞に最終濃度が0.1−1mMあたりのIPTGを使用してタンパク質発現を誘導し、当該タンパク質の発現菌を獲得する。使用されたベクターはアンピシリン耐性遺伝子を含む。クローン化で構築した融合タンパク質発現プラスミドにて大腸菌例えばBL21(Novagen)を形質転換した後、37度でLB等細菌培養器を使用し一晩細菌培養し、約12時間後1:100あたりで大量の培養器へ移し、37度温度下でODが1.0あたりまで培養し、それから培養温度を16度まで下げ、そして0.1−1mMのIPTGを加え触発発現を行い、およそ12−24時間後遠心して細菌を収集し、収集した沈澱細菌は−20度から−80度の冷蔵庫で保存するか、直接精製に使う。
【0114】
PB1 N端48個以内のアミノ酸の遺伝子(発明者らはPB1のN末端前48個アミノ酸ポリペプチド及び前25個アミノ酸ポリペプチドを発現)を同様にpGEX−6pベクターの多クローン遺伝子座上へクローン化し、使われた酵素切断サイトはBamHI及びXhoIで、細菌にGST融合タンパク質を含む発現ができ、並びに当該融合タンパク質はProScissionプロティナーゼ(Amersham Biosciences)によって切断可能なプロティナーゼ遺伝子座を含み、GST標識及び標的タンパク質PB1ポリペプチドを分離できるようにする。上記通り、PA融合タンパク質発現方法は大腸菌BL21中で融合のGST−PB1N端ペプチドの融合タンパク質を発現することであり、選択性遺伝子はアンピシリン耐性遺伝子であり、タンパク質の発現は37度下であり、使用される誘導物質はIPTGである。最後に遠心分離で発現細菌を収集し、当該細菌はそのままタンパク質の精製に使用し、若しくは−20度から−80度の冷蔵庫で保管する。
【0115】
遠心分離で収集したGST−PAN末端ポリペプチドの発現菌を約20mM Tris−HCl(pH8.0)及び250mM NaClのバッファー又は1×PBS(pH7.4)燐酸バッファーに懸濁し、超音波にて細胞を破砕し、不溶沈殿を遠心して除去し、上清を収集して、グルタチオンアフィニティ・クロマトグラフィーにてGST−PA−N端ポリペプチドを精製し、よってProScissionプロティナーゼ酵素性で融合タンパク質を分解し、融合プロティナーゼをGST(グルタチオンS−トランスフェラーゼ)とPA−Nの二段に分解し、更にイオン交換クロマトグラフィー及びゲルサイズ排除クロマトグラフィーにてPA−Nタンパク質ポリペプチドを精製する。このタンパク質を5〜30mg/mLまで濃縮し、結晶成長に使用する。
【0116】
GST−PACC末端ポリペプチドの発現菌とGST−PB1Nオリゴペプチドの発現菌をそれぞれ約20mM Tris−HCl(pH8.0)及び250mM NaClのバッファー又は1×PBS(pH7.4)燐酸バッファーに懸濁し、そして二種類の発現菌を一定比率で混合し、GST−PAとGST−PB1のタンパク質総含有量のモル比を0.1:1〜1:0.1にさせ、好ましくはGST−PAとGST−PB1のタンパク質総含有量のモル比が0.5:1〜1:0.5で、更に好ましくはGST−PAとGST−PB1のタンパク質総含有量のモル比を1:1に近づかせる。
【0117】
混合された細菌懸濁液は超音波又はその他細胞溶解法で細胞を破砕した後、遠心して細胞溶解物の不溶部と可溶部に分離され、高速遠心(約20,000g)した後得た上清をグルタチオン−Sepharoseアフィニティ・カラム(Amersham Pharmacia Inc.より)を通して、初歩的にこの混合タンパク質を分離精製し、GST標識を含むタンパク質はグルタチオン−Sepharoseアフィニティ・カラムに結合でき、その他タンパク質は当該アフィニティ・カラム上には結合できない。タンパク質がアフィニティ・カラムと結合したら、上記の細菌懸濁バッファーで不純物タンパク質を洗い流す。適量のProScissionプロティナーゼ(Amersham Pharmacia Inc.より)を使用し、アフィニティ・カラム上の混合GST融合タンパク質を酵素性分解し、この過程が約24時間かかる。そして酵素性分解で切断したPACとPB1N融合タンパク質をゲル濾過法Superdex−200(Amersham Pharmacia Inc.より)及びQ sepharoseイオン交換クロマトグラフィー(Amersham Pharmacia Inc.より)等の方法で、PAC/PB1Nオリゴペプチド複合体(クロマトグラフィー・カラムは全てAmersham Pharmacia Inc.より)を分離精製し、SDS−PAGEゲル電気泳動法でタンパク質純度を確定後、純度は通常90%以上に達する。上記ステップを通して精製されたタンパク質を濃縮管(Millipore社より)で約5−30mg/mLあたりまで濃縮し、更なる結晶実験で使用する。
【0118】
当業者が知るとおり、インフルエンザ・ウイルスのPAのN末端及びPAのC末端PACとPB1のN末端PB1Nは本願明細書上記の原核細胞、例えば大腸菌細胞の中だけで発現できるのではなく、真核細胞、例えば昆虫細胞の中でも発現でき;同時に任意のそのエンドヌクレアーゼ、酵素切断サイト、リガーゼが使用でき;精製待ちの目標ポリペプチドをGST如くその他標識と融合させ、そして相応の分離精製方法を選び精製し、最後に目標ポリペプチド中に融合した標識を除去できる。上記本発明に対する各種変更と修飾は全て本発明の保護範囲内にある。
【0119】
注意すべきは、その中でB型又はC型インフルエンザウイルスにおけるA型インフルエンザウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりであり、ここでは略述する。
【0120】
実施例2
PAC/PB1Nオリゴペプチド複合体の結晶
上記方法で発現精製したPAのN末端ポリペプチドの複合物を濃度約5−30mg/mLまで濃縮し、hanging−drop蒸気拡散法で結晶化試薬(Hampton Research社等よりのScreen Kit I/II、Index等の試薬キット)を使用して結晶成長条件をスクリーニングする。プライマリスクリーニングで、本発明者らは各種異なる結晶化試薬の使用条件下でイニシャル結晶を獲得する。
【0121】
更なる最適化を通じて、その中、異なるpHバッファーの条件下(pH 4〜9)約1Mの酢酸ナトリウム溶液より外見の良好な結晶を得た。濃度1〜1.3Mの酢酸ナトリウム(Sigmaより)のバッファー(pH4〜9)より比較的大きい三角錐体結晶を取得し、分解能は約4Åくらいであった。
【0122】
X線回折データ収集を行う際、回折に必要な結晶を懸濁液から1.4Mの酢酸ナトリウム約10μlと10%のグリセリン(Sigmaより)を含有する結晶バッファーへ移し、ドロップをオープン放置して空気脱水を1時間以上行った後、高解析度のタンパク質結晶が得られたが、母体及びセレノタンパク質結晶解析度は2.9Å以上にも達する。
【0123】
注意すべきは、その中でB型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりであり、ここでは略述する。
【0124】
実施例3
PAC/PB1Nオリゴペプチド複合体の結晶構造
FR−E X線回折機(Rigakuより)を使用し、1.5418Åの波長下でまずPA−PB1のN端25ペプチド複合体結晶の分解能2.9Åの母体データを一セット収集した。そして、アメリカ、シカゴのAPS(Advanced Photon Source)シンクロトロン放射光施設(synchrotron radiation facility)(ビームライン番号:SBC 19ID;ビーム・モニター:ADSC Q315)を利用して、波長0.9783Åと0.9785Åの下で、このタンパク質結晶の分解能が約3.3Åに到るpeakとedgeとした2セットのセレン化物結晶データを収集した。HKL2000(Otwinowski 1997)を利用して、得られた3セットのデータを処理し、これらの空間群が全てP4(1)2(1)2であることを発見した。多波長異常分散法(Hendrickson 1991)で位相を計算し、処理しで得たscaファイルよりSHELXD(Sheldrick 1998)でセレン原子を探した。タンパク質自身14個のメチオニンを含むが、本発明者らは合わせて14個のセレン原子を見つけ出し、セレン原子座標及び処理して得たPeakとEdge二セットのデータをautoSHARPプログラム(Vonrhein、Blancら、2007)にインプットして、位相計算と電子密度図の修飾を行なった。計算して得られた電子密度図より、幾つかの二次構造(一部のαへリックスとβシートを含む)がはっきりと見出せる。そして、プログラムCADを利用して位相拡張を行い、受け取った母体データを利用して位相を2.9Åまでを広げて構造モデルの構築を行なった。モデル構築に使ったプログラムはARP/wARP(Perrakis、Morrisら、1999)とPhenix(Adams、Grosse−Kunstleveら、2002)である。この二種のプログラムの自動モデル構築で全体構造の約60%が完成でき、残りの部分はプログラムCOOT(Emsley及びCowtan 2004)を利用して手動で構築した。
【0125】
最後に、得られたモデルをプログラムCNS(Brunger、Adamsら、1998)とREFMAC5(Murshudov、Vaginら、1997)で修正した結果、当該タンパク質構造の解析完成に至り、修正した構造の最終R因子と自由R因子はそれぞれ0.22と0.26である。
【0126】
実施例4
PAのN末端タンパク質結晶
上記方法で発現精製したPAのN末端ポリペプチドの複合物を濃度約5−30mg/mLまで濃縮し、hanging−drop蒸気拡散法で結晶化試薬(Hampton Research社等よりのScreen Kit I/II、Index等の試薬キット)使用して結晶成長条件をスクリーニングする。プライマリ・スクリーニングで、本発明者らは各種異なる結晶化試薬の使用条件下でイニシャル結晶を獲得する。
【0127】
更に最適化を通じて、その中で、pH6.5のMESバッファー条件下で約20%PEG8000又は20%3350、0.1Mの塩化マグネシウム又は0.1Mの酢酸マグネシウム溶液(使用した試薬は全てSigma Inc.より)からは全てX線回折良好な結晶が得られ(図3のA及びB結晶図及びC及びD回折図)、結晶のX線回折解析度は約2−4Åあたりである。
【0128】
実施例5
PB1Nと競合的にPACと結合する小分子のスクリーニング方法
PAC/PB1Nオリゴペプチド複合体を脱重合させる一種の小分子薬物のスクリーニング過程において、その中でPB1Nオリゴペプチドの遺伝子とGFP(緑色蛍光タンパク質)を発現する遺伝子を融合させ、GFP融合のPB1Nオリゴペプチド・タンパク質を発現し、小分子化合物脱重合タンパク質複合体の指示分子とする。分子クローン化方法でPB1オリゴペプチド遺伝子セグメントをGFP遺伝子断片上に繋ぎ、一つのN末端又はC末端に繋ぐGFPのPB1ペプチド融合タンパク質を発現する。
【0129】
方法1:上記PAのC末端及びPB1オリゴペプチドの発現精製方法、N末端にGSTのあるPAのC末端融合タンパク質即ちGST−PAC融合タンパク質とGFP−PB1Nオリゴペプチド融合タンパク質の複合体を発現精製する。GST−PAC融合タンパク質とGFP−PB1Nオリゴペプチド融合タンパク質の複合体をグルタチオンアフィニティ・カラム上に流し、結合させる。当該複合体にはGFPタンパク質が含まれているため、GST−PACはこのアフィニティ・カラムと結合後、GST−PACと結合したGFP−PB1N融合タンパク質はこのアフィニティ・カラムを緑色に染める。GST−PAC及びGFP−PB1N複合体タンパク質と結合後のアフィニティ・カラムをバッファーで充分に洗浄し、未結合のタンパク質を徹底的に除去する。そして、スクリーニング用の小分子化合物の混合物をこのアフィニティ・カラムに流し(当該混合物中にはグルタチオン又はその他GSTをアフィニティ・カラムから分離され、洗い落とされる成分は含まれるべきではない)、もしも混合物中にPB1Nポリペプチドに代わってPACと結合する小分子が含まれていれば、一部PAC上に結合しているGFP−PB1Nポリペプチド融合タンパク質が代わりに洗い落とされ、洗い出した溶液の中にはこのGFP融合タンパク質が含まれているため、一定波長の蛍光顕微鏡で緑色を示す。更に混合物中より小分子を分離精製し、上記緑色蛍光タンパク質追跡方法で、PB1Nポリペプチドを替えられる成分を追跡し、PAとPB1ペプチドの結合を阻害する小分子化合物を最終確定する。上記の方法の様にGSTをアフィニティ・マトリックスとして使用する以外にも、例えばFlag−tag、Myc−tag、MBP(Maltose binding protein、マルクトース結合タンパク質)−tag、特異性抗体等その他ポリペプチドをアフィニティ・マトリックス結合基として使用でき、相応に、アフィニティ・クロマトカラムにも相応なアフィニティ・マトリックスを使うべきで、例えばFlag−tag使用時、対Flag−tagの抗体(例えばSigma Inc.社のanti−flag単クローン抗体)を使用し、それをアフィニティ・クロマトカラムに固定し、Flagと結合するゲル・マトリックスとして使う。PAに結合且つPB1ペプチド(具体構造)の代わりとなる化合物分子は例えばMS等の方法でその化学構造を確定できる。
【0130】
方法2:PACを単独で精製し(融合タンパク質又は非融合タンパク質)、それを化学的架橋方法を利用して、共有結合性架橋でゲル・マトリックスに繋ぎ、但しタンパク質は不変性を保たせる。GFP−PB1Nを共有結合したゲル・カラムを通して、GFP−PB1N融合タンパク質とPACタンパク質を結合させ、よってゲル・カラムはGFP緑色蛍光を表す。小分子混合物溶液がこのゲル・カラムに流れ、もしもGFP−PB1Nに代わってPACと結合する化合物があれば、GFP−PB1N融合タンパク質が洗い落とされ、溶出液は特定波長光の下で緑色を示し、GFP−PB1Nの代わりの化合物分子は即ちゲルカラム上のPAC分子上に結合した。バッファーでゲル・カラムを洗い流していらないものを取り除き、更に尿素等でPACを変質させ、その上に結合した小分子を洗い落とし、質量分析等の方法で、PA上に結合した小分子を分析し、この小分子の構造情報を得る。この化合物はPAC/PB1Nオリゴペプチド複合体を分解させる小分子薬物に成りうる。
【0131】
実施例6:
PAC/PB1Nの複合体の結晶三次元構造を利用した、インフルエンザ・ウイルス感染による病気の治療に用いる各種ポリペプチド、タンパク質又は無機若しくは有機化合物の設計とスクリーニング方法
インフルエンザ・ウイルスポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶三次元構造を利用した、インフルエンザ・ウイルス感染による病気の治療に用いる各種ポリペプチド、タンパク質又は無機若しくは有機化合物の設計とスクリーニングの具体的ステップは下記通りである:タンパク質三次元構造の座標に基づき、コンピューター・シミュレーションを通して特定位置に結合するポリペプチド及び化合物分子を設計し;タンパク質三次元構造の座標に基づき、コンピューター・シミュレーションを通して特定位置に結合する可能性のあるポリペプチド及び化合物分子を探索し;タンパク質三次元構造の座標に基づき、設計又は探索し出したポリペプチド及び化合物分子を、上記PAC及びPB1N配列と少なくとも50%同じ配列を持つ任意亜型インフルエンザ・ウイルス・ポリメラーゼ・タンパク質の中へ結合させ、更に結合状況の方法を分析し;タンパク質三次元構造の座標に基づき、設計又は探索し出したポリペプチド及び化合物分子を、上記PAC及びPB1N配列と少なくとも50%同じ配列を持つ任意亜型インフルエンザ・ウイルス・ポリメラーゼ・タンパク質の中へ結合させ、並びに結晶させ、よって結晶回折三次元構造分析方法でポリペプチド及び化合物分子とタンパク質の結合状況を分析する。
【0132】
実施例7:
PAC/PB1Nの複合体の結晶三次元構造を利用した、インフルエンザ・ウイルス感染による病気の治療に用いるペプチドの設計とスクリーニング
実験による実証では、一種のM1、D2、V3、N4、P5、T6、L7、L8、F9、L10及びK11を含むオリゴペプチドはPAのC末端と結合する。発明者らはPB1Nから、第一座M1から第11座K11までを含むポリペプチド遺伝子をpFEX−6pベクター上へクローン化し、このGST−PB1N融合タンパク質を精製し、体外結合実験を通して、アフィニティ・ゲル・カラムに固定されたこの融合タンパク質で溶液中のPA−Cと結合させ、発明者らはこの融合タンパク質がPB1Nが持つPA−Cと結合する能力を所有していることを発見した。
【0133】
同じ実験方法を通して、発明者らは一種のM1、D2、V3、N4、P5、T6、L7、L8、F9、L10、K11、V12及びp13を含む融合タンパク質もPB1Nが持つPA−Cと結合する能力を所有していることを発見した。これで、この二種類のオリゴペプチドが持つPA−Cと結合する能力により、これらオリゴペプチドは潜在的なインフルエンザ・ウイルス・ポリメラーゼ活性を阻害するポリペプチド薬物又は更に薬物設計をする模型と成りうる。
【0134】
同様に、スクリーニングされたポリペプチドが、上記ポリペプチドと少なくとも3座同じアミノ酸配列がある場合、このポリペプチドは潜在的にインフルエンザ・ウイルス・ポリメラーゼ活性を阻害するポリペプチド薬物に成りうる。
【0135】
任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の構造で、その中に含まれる一つのタンパク質又はそのある一領域は、上記PACタンパク質と少なくとも40%同じ配列を持つ。
【0136】
任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の構造で、その中に含まれる一つのタンパク質又はそのある一領域の主鎖三次元構造座標は、上記のPACタンパク質配列の少なくとも40%の主鎖炭素骨格三次元座標と平均二乗偏差が1.7Å以下である。
【0137】
任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の構造で、その中に含まれる一つのタンパク質領域は上記のPB1Nポリペプチドのアミノ酸2−12領域と40%の配列同様性がある。
【0138】
任意ポリペプチド又は小分子と、上記インフルエンザ・ウイルスPAサブユニット上のキーアミノ酸との間では相互作用がある。
【0139】
上記構造の薬物スクリーニング及び薬物設計においての応用:
PAC及びPB1Nタンパク質三次元構造に基づいた、タンパク質結合の化合物又はポリペプチドのスクリーニング方法は下記を含む:タンパク質結晶方法でPAC及びPB1Nタンパク質複合体結晶を取得し、当該タンパク質複合体結晶はP4(1)2(1)2の空間群を持ち、単位胞は約α=b=122Å、c=133Å、α=β=γ=90°である;X線回折結晶学技術で、PAC及びPB1Nタンパク質複合体の三次元構造座標を取得し;該三次元構造は、当該座標中の少なくとも40%アミノ酸残基の主鎖炭素骨格三次元座標と平均二乗偏差が1.7Å以下である構造を全て含む。
【0140】
インフルエンザ・ウイルス亜型PAサブユニット・タンパク質の発現精製方法:PAを段分けで細菌又は真核発現系で発現し、上記でこの方法により、任意タンパク質中のある一領域と上記の配列相応領域が40%の同じアミノ酸配列であるタンパク質を発現精製する。
【0141】
一つの好ましい実施例の中で、PAC/PB1N複合体がインフルエンザ・ウイルス感染による病気の治療に用いられるポリペプチド、タンパク質、化合物又は薬物設計と探索中での応用が提供される。
【0142】
一つの好ましい実施例の中で、インフルエンザ・ウイルス感染による病気の治療に用いるポリペプチド、上記で挙げた複合体も含み、少なくとも一種の上記αへリックス又はβシート、少なくとも一個のアミノ・サイトと相互に作用するポリペプチドが含まれる。
【0143】
一つの好ましい実施例の中で、インフルエンザ・ウイルス感染による病気の治療に用いるタンパク質、上記で挙げた複合体も含み、少なくとも一種の上記のαへリックス又はβシート、少なくとも一個のアミノ・サイトと相互に作用するタンパク質が含まれる。
【0144】
一つの好ましい実施例の中で、インフルエンザ・ウイルス感染による病気の治療に用いる化合物、上記で挙げた複合体も含み、少なくとも一種の上記αへリックス又はβシート、少なくとも一個のアミノ・サイトと相互に作用する化合物が含まれる。
【0145】
一つの好ましい実施例の中で、薬物混合物、上記で挙げたポリペプチド、タンパク質又は化合物を含む。
【0146】
本発明の薬物混合物は通常一種の媒体又は賦形剤、一種の薬学的に許容できる媒体に溶解できる抗体及び/又は免疫結合物含み、好ましくは水性媒体である。各種水性媒体が応用できる、例えば、緩衝塩水等。これら溶液は無菌且つ通常不純物質が混ざっていない。これら成分は通常の、一般に知られている滅菌技術で滅菌ができる。これら成分は薬学上許容できる、生理条件の必要に近い補助物質、例えばpH調整用の緩衝剤、毒性調整剤等、たとえば酢酸ナトリウム、塩化ナトリウム、塩化カリウム、塩化カルシウム、乳酸ナトリウム等である。これら成分中の融合タンパク質の濃度変化は非常に大きい、主に特定の投薬方式と患者のニーズに相応しい液体料、粘度、体重等をもとに選択する。
【0147】
従って、本発明中の一つの典型的な脳部投薬の薬学免疫毒素成分は毎日約1.2−1200μg投与するべきである。一つの典型的な静脈投薬で乳腺、卵巣及び肺腫瘍の治療の成分では、各患者に毎日約0.1−10mgを投与する。一人一日0.1−100mgの投薬量が使用可能で、特に薬物を隠蔽した位置に投与し且つ血液循環又はリンパ機構に入らない場合、例えば一つの体腔又は一つの器官の腔隙に投与する場合はそうである。薬成分の製造の実際操作方法は専門家が理解又は把握しており、一部出版物でも詳細が書かれている。例えばRemington’s Pharmaceutical Science, 19th ed., Mack Publishing Company, Easton, Pennsylvania(1995)を参照。
【0148】
本発明中の成分は治療処理に使用できる。治療での応用は、成分を一人の特定の病気(例えば膠芽腫、乳腺癌、卵巣癌及び肺癌)にかかった患者に施され、その投与量は少なくとも緩和又は部分的にその患者の病気及び合併症を制御できる量である必要がある。これらの任務が果たせる最低投与量が「治療有効投与量」と呼ばれる。有効投与量は病気の程度と患者の一般的健康状況に依存する。この成分の有効投与量はある症状に対する主観的緩和、又は臨床医師若しくはその他資格の観察者の記録による客観的改善が提供できる。
【0149】
患者のニーズと認容できる投与量及び頻度で一回又は数回投薬を決める。有効的に患者を治療する為にも、なんにせよ、十分な量のこの免疫毒素を提供するべきである。好ましくは、薬物投与量は、一回きり投与、若しくは周期性投与を、ある種治療効果が達成されるまで又は不良反応で治療の継続が阻止されるまで続ける。通常、これら投与量は治療に足りるか又は病症を改善し且つ患者の認容できない毒性を引き出さない量である。
【0150】
本発明の免疫結合物は胃腸外の徐放剤(例えば挿入物、油注射液、又は微粒子系)に製造できる。タンパク質・デリバリー・システムに対する全面的理解にはBanga,A. J., Therapeutic Peptides and Proteins:Formulation, Processing, and Delivery Systems, Technomic Publishing Company, Inc., Lancaster, PA(1995)が参照できる。微粒子系には微球体、微粒、マイクロカップセル、ナノマイクロカップセル、ナノ微球体、及びナノ微粒子が含まれる。マイクロカップセルは薬効のあるタンパク質をそのコア核にしている。小微球体では、治療性物質が粒子の中に分散されている。約1μmより小さい粒子、微球体、及びマイクロカップセルは通常それぞれナノ微粒、ナノ球体と、ナノマイクロカプセルと呼ばれている。毛細血管の直径はおよそ5μmであるのでナノ微粒子のみが静脈を通して投与できる。微粒子の直径は約100μmであり、皮下又は筋肉注射で投与する。例は下記を参照:Kreuter,J., Colloidal Drug Delivery Systems, J. Kreuter, ed., Marcel Dekker, Inc., New York, NY, pp.219−342(1994);及びTice & Tabibi, Treatise on Controlled Drug Delivery, A. Kydonieus, ed., Marcel Dekker, Inc. New York, NY, pp.315−339(1992)(両方とも本願明細書に援用される)。
【0151】
ポリマーは本発明中の免疫結合物成分のイオン・コントロール・リリースに使われることができる。多種の薬物コントロール・リリースに使用可能な分解可または不可のポリマーは専門領域でよく知られている(Langer,R.、Accounts Chem. Res. 26:537−542(1993))。例えば、遅延剤であるポリマーpolaxamer 407は低温では粘性があり流動的であるが、体温下では半固体ゲルになるが、組み替えIL−2とウレアーゼの形成と持続輸送の一つの有効な媒体であることがすでに証明された(Johnston等、Pharm. Res. 9:425−434(1992);及びPec等, J. Parent. Sci. Tech. 44(2):58−65(1990))。同じく、ハイドロキシアパタイトもすでにタンパク質コントロール・リリースの一個のミクロマトリクスとして使われている(Ijntema等, Int. J. Pharm. 112:215−224(1994))。他方では、リポソームは脂質に被膜された薬物のコントロールリリースと標的デリバリー過程に使われている(Betageri等, Liposome Drug Delivery Systems, Technomic Publishing Co., Inc., Lancaster, PA(1993))。その他多くの治療タンパク質のコントロールリリースシステムが既に知られている。例として、米国特許第5,055,303号、同第5,188,837号、同第4,235,871号、同第4,501,728号、同第4,837,028号、同第4,957,735号、同第5,019,369号、同第5,055,303号、同第5,514,670号、同第5,413,797号、同第5,268,164号、同第5,004,697号、同第4,902,505号、同第5,506,206号、同第5,271,961号、同第5,254,342号、及び同第5,534,496号(これらは、全て本願明細書に援用される)。
【0152】
実験結果
PAC及びPB1N複合体構造の原子座標は表1の通りである。
【0153】
【表5】

【0154】
【表6】

【0155】
【表7】

【0156】
【表8】

【0157】
【表9】

【0158】
【表10】

【0159】
【表11】

【0160】
【表12】

【0161】
【表13】

【0162】
【表14】

【0163】
【表15】

【0164】
【表16】

【0165】
【表17】

【0166】
【表18】

【0167】
【表19】

【0168】
【表20】

【0169】
【表21】

【0170】
【表22】

【0171】
【表23】

【0172】
【表24】

【0173】
【表25】

【0174】
【表26】

【0175】
【表27】

【0176】
【表28】

【0177】
【表29】

【0178】
【表30】

【0179】
【表31】

【0180】
【表32】

【0181】
【表33】

【0182】
【表34】

【0183】
【表35】

【0184】
【表36】

【0185】
【表37】

【0186】
【表38】

【0187】
【表39】

【0188】
【表40】

【0189】
【表41】

【0190】
【表42】

【0191】
【表43】

【0192】
【表44】

【0193】
【表45】

【0194】
【表46】

【0195】
【表47】

【0196】
【表48】

【0197】
【表49】

【0198】
【表50】

【0199】
【表51】

【0200】
【表52】

【0201】
【表53】

【0202】
【表54】

【0203】
【表55】

【0204】
【表56】

【0205】
【表57】

【0206】
【表58】

【0207】
【表59】

【0208】
【表60】

【0209】
【表61】

【0210】
【表62】

【0211】
【表63】

【0212】
【表64】

【0213】
H5N1型鳥インフルエンザ・ウイルス株(A/goose/Guangdong/1/96)由来のポリメラーゼ・サブユニットPAタンパク質と1918年ヨーロッパで爆発した広範囲インフルエンザのA型インフルエンザ・ウイルス株A/Brevig Mission/1/1918、及び二種類のそれぞれB型インフルエンザ・ウイルス株B/Ann Arbor/1/1966とC型インフルエンザ・ウイルス株C/JJ/1950に属するPAタンパク質の配列について比較を行った結果は図1の通りである。
【0214】
本発明者らはPAを二つの部分に分け、違う長さのPA遺伝子の二つの断片を別々に多数クローン化し、大腸菌の中で発現した。その中でPAより分けられたN端1−256残基(図1及び図2参照)と257−716残基(図4A参照)は、GST(グルタチオン−S−トランスフェラーゼ、Glutathione S−Transferase)との融合で良好な発現と精製ができた。その中で精製したPAのN末端(PA_N)からは良好回折のある母体結晶体が得られた(図3参照)。
【0215】
大変な努力を費やしたが、PAのC末端自身は結晶は得られないということが結晶実験によって初歩的に明らかとなった。従って、本発明者らはGST融合方法も使用し、別々にPB1 N端25と48ペプチドを発現した(図4A参照、PAのC末端とPB1のN末端のGST融合前後の電気泳動図、その中でリボン1 PA_C CTはPAのC末端の対照サンプル、リボン2 GST−PB1+PACはPAのC末端とPB1 N末端の複合体とGST融合後のサンプル、リボン3 GST−PB1はPB1N末端とGST融合後のサンプル、リボン4 GST+PA_CはPA C末端とGST融合後のサンプル、リボン5 GST CTはGST対照サンプルであり;その中で、PA_CはPA_Cの電気泳動リボンを表し、GST−PB1はPB1N末端とGST融合後の電気泳動リボンを表し、GSTはGST対照の電気泳動リボンを表す)、GST−PB1は精製されたPA_Cタンパク質と結合ができるということが結果として明らかとなった。
【0216】
ある一定比率でPA及びPB1のポリペプチド発現菌を混合し、グルタチオンアフィニティ・カラム及びゲルサイズ排除クロマトグラフィー等を通してこの二つのタンパク質を共精製すると、両者は共精製が出来ることが体外結合実験から判明し、これによって、精製されたPAのC末端460アミノ酸とGST−PB1ポリペプチドは安定した複合体が形成できることが明らかとなった。
【0217】
更に、プロティナーゼでGST融合ペプチドを切断後、PAC/PB1Nポリペプチド複合体を分離精製し、そして結晶実験に使用し、その結果、多条件下で結晶が得られ、その中の一つの条件下で回折良好な結晶体が得られた。但し、単独精製されたPAのC末端タンパク質は結晶が得られなかったが、それはPB1ポリペプチドの加入がPAタンパク質の安定に補助作用があることを示唆した。
【0218】
PAC/PB1Nポリペプチド複合体三次元構造:
MAD方法を使用し、PAのC末端460アミノ酸及びPB1N末端25ペプチドの複合体結晶体構造を解析し、解析度は2.9Å、最終修正したR因子は23%,自由R因子は26%である。全体的に、構造を線状で表した場合、側面から見ると、PA部分はまるで狼の頭に喩えられ、伸び出す口先、その後ろの頭部と環状の首を有する(図4B)。PB1はまるでPAの口の中に骨を一本くわえているかのようである。PA部分は主に13個のαへリックス、一切れの小さい310へリックス、7つのβシート及びこれらを繋ぐ環(loop)より形成されている(図1、図4B及び図5)。構造から見ると、PAタンパク質部分は二つの構造領域と見なせ、一つはPB1ポリペプチドと結合する領域(構造域I、即ちPAのC末端構造の第一部分)、全部へリックス及び環で形成されており、へリックスは4、5、8、9、10、11、12及び13で狼の口と頬の部分を構成している。この構造域は狼頭部の天辺から見るとやや細く;もう一つの構造域(構造域II即ちPAのC末端構造の第二部分)は残りのへリックス及びβシートからなる狼頭部の後半部分で、天辺から見るとやや太く、下に大きい環が繋がっており、狼の頭部の首の部分に見える。PB1ポリペプチドのN端は狼の頭部の片面に位置しており、C末端はもう片方に位置し、狼の頭部の両方の頬の部分に位置することに値する。本発明者らの結晶体中のPAはPAのN端256残基を取り除いたポリペプチドで、ある報告ではN端はPAプロティナーゼの主な活性領域であり、もう一つの離れている活性遺伝子座Ser624は他の片方の頬に位置し、それによるとSer624はPAプロティナーゼ活性中心アミノ酸で、それはPAの取り除いた部分と共にプロティナーゼ活性領域を構成し、従ってPAのN端の取り除いた部分はもう片方の頬に位置する。狼の頭部の後半部分第二構造域は残りの多数のへリックス及びβシートによって形成されている。長さ、方向が異なる7つのβシートが波のある平面を構成し、構造域の中心部に位置しており、αへリックスはへリックス周辺に分布しており、共にRossmannフォールド構造を構成している。二つの構造域の交差する部分には大きな溝があり、下部の首環と直径約25Åの大きい環を形成する(図5)。
【0219】
PAとPB1ポリペプチド間の相互作用
構造域IのPB1ポリペプチドに結合するへリックスはそれぞれへリックス4(406−415)、8(582−604aa)、10(633−650aa)、11(653−674aa)と13(698−714aa)であり、その中の三つのへリックス(8、11、13)は互いにほぼ平行に伸びだし、へリックス軸の方向から見るとほぼ三角形の形状になっており、四つ目のへリックス(10)は斜めに伸び出し、これらはPB1ポリペプチドを真ん中に挟む(図5及び図6)、へリックス4は側面でPB1N端ペプチド残基と相互に作用をする。四つのへリックスはPB1ポリペプチドと結合する領域で疎水性コアを形成し、これらの側鎖とPB1上の疎水アミノ酸残基は疎水相互作用及び水素相互作用で結合されている。電子雲密度上ではPB1ポリペプチドの第二位アスパラギン酸から15位グルタミンまでが見られ、この結果とは、Perez等の報告によるPB1N末端前12位アミノ酸はPB1とPA結合のキーアミノ酸であるという結果とほぼ一致している(Perez及びDonis 2001)。更に本発明者らはこれらアミノ酸残基とPA間の相互作用を分析した。Perez等(Perez及びDonis 2001)の文献での報告のPB1保存的LLFLペプチド断片は一つの短いへリックス上に存在し、PAが形成する疎水内核中間に浮いている。疎水性コアの形成に関与するPAアミノ酸残基はへリックス11上のLeu666、へリックス13のPhe710及びへリックス10上のIle633、Val636とLeu640等がある。PB1ポリペプチドとの結合に関与するPA中アミノ酸はへリックス13のTrp706、へリックス11のGln670等があり、その中でTrp706とPB1オリゴペプチド上のVal3、N4等アミノ酸は疎水又はファンデルワールス力等を通して相互に作用し、Gln670はPB1のF9、V12、P13及びA14とそれぞれ水素、疎水及びファンデルワールス力等を通して相互に作用する。へリックス10のT639はVal3との作用(ファンデルワールス力)に関与する。へリックス4上のQ408及びN412はPB1のVal3、D2との相互作用に関与する。それらとは別に、9と10の間に挟まれている緩い環もPB1との相互作用に関与し、その中でI621、G622とE623はD2、N5とそれぞれ相互に作用し、T618及びP620はそれぞれL8及びK11と相互に作用する。へリックス8とPB1ポリペプチドの距離が離れているため、主にファンデルワールス力が作用している。この結果は、文献報告でのPB1ポリペプチド上の残基結合に関与する作用とほぼ一致している。これらPAとの結合に関与するアミノ酸はA、B及びC型インフルエンザウイルスの中では全て保存的で;同様に、PB1ポリペプチドとの結合に関与するPA残基も大半は保存的である(図1)。PAとPB1結合方式の精細な三次元構造解析は、薬物設計でインフルエンザ・ウイルス・ポリメラーゼの機能を阻害する為の有力な三次元構造情報のプラットフォームを提供した。
【0220】
PA構造の分析結果では更に、二つの構造域の接続箇所では、構造域Iの下に一つの大溝がある(構造域III)(図8A)。大溝表面にはアルカリ性アミノ酸が豊富にあり、その中で一部アミノ酸、例えばK536、K328、R566等は3型インフルエンザ中で全て保存的で、別途で399座のLys及び401座のArgも保存的である(図1)。K536等遺伝子座突然変異体はこれら遺伝子座の重要性を実証し、この大溝部はヌクレオチド又はRNA結合と関することを提示した。これ以外では、この溝の下部には一つの大きな環状鎖部分があり、この断片のポリペプチドは結晶体積み重ね中、当該環状ポリペプチド領域ともう一つの分子表面に近き、相互作用によって引き離され形成し、一部分のアミノ酸ははっきりとした電子雲密度が見られなかった。大溝と首部分の環は共同で直径約25Åの大きい環を形成し、この空間は二つのRNAへリックスが収納できる程十分広い。上記のように、環状内部溝のところには表面に保存的アルカリ性アミノ酸が分布されていて、鎖領域上のアミノ酸は保守性は高くないが、ただし三つの類型のインフルエンザウイルス中は全て主に酸性アミノ酸より形成されている。PA分子中この溝及びこの環状構造の保守性及び構造の特異性は彼らがポリメラーゼ中での重要な機能を示唆し、よってそれらを共にPAとPB1結合領域以外の二つ目の薬物作用ターゲットとする。
【0221】
RNAプロモーター結合能力。本発明者らが解析した構造から見ると、本発明者らはこの大溝はヌクレオチド又はRNA結合遺伝子座であることを見出した。その中で、K539、E538、K328遺伝子座は三つの類型のインフルエンザウイルス中では非常に保存的であり、これらアミノ酸はRNAヌクレオチドとの結合に関与し、特にRNAとの結合に関与していると本発明者らは考える。PAサブユニットは、プロモーター及びRNAとの結合能力及びRNA合成過程において重要な機能を果たすことが明らかとなった。
【0222】
構造域I及び構造域IIの間で、構造域Iのへリックス及び構造域IIのβシートで直径約8Å−15Åのチャンネルが形成される(図8B及び図8C)。本発明者らが解析したこの構造中では、PAのN端の一切れの緩い断片はまるで紐のようにこのチャンネル中に垂れている。このN端断片はチャンネル両端から距離が離れているため、ポリメラーゼ複合体又はその他宿主タンパク質が作用しポリメラーゼの機能を発揮する時にこのN端断片がこのチャンネルから離れると本発明者らは考える。これで、PA大溝からチャンネルを通って狼の頭部の他の片方の頬まで、構造域の中間に一つのチャンネルが存在する。このチャンネルの表面には三種類のインフルエンザ・ウイルス全ての中で保存的なアミノ酸が存在し、それは例えば大溝表面のR566、K539及びK574に位置するもの、及びチャンネル中間保存的なE410、K460、E524とK536等に位置するものである。その中で一部残基はポリメラーゼの活性に影響を持つことが発見された。Fodor等の研究によると、E524Aの突然変異はウイルスにRNA合成能力を喪失させ、よってウイルスの発生を抑制した;E410の突然変異はポリメラーゼ活性の低下を招き(Fodor、Crowら、2002)、K539Aの突然変異はmRNA合成に影響はしないが、遺伝子からcRNA及びvRNAのコピーに重大な影響が現れることが発見された。この領域がウイルス遺伝子コピーに対して非常に重要なことが判明した。既に知られているヌクレオチドの大きさはこのチャンネルと非常に近く、(例えばATP、長さ約14Å、幅約8Å、その他三種類ヌクレオチドUCGもこれと類似)、従ってこのチャンネルは、とある状況下ではヌクレオチド若しくはその他小分子を通過させ、又はその他タンパク質と相互に作用させ、よって、その表面残基の突然変異はポリメラーゼ活性の顕著な変革をもたらすと本発明者らは考える。このチャンネル独特の構造及び機能の重要性は、チャンネルを三つ目の薬物設計結合ターゲットとさせた。
【0223】
一つの具体的な実施態様を通して、本発明はインフルエンザ・ウイルス・ポリメラーゼPB1と競合してPACと結合するポリペプチド、タンパク質、無機若しくは有機化合物、その中で上記ポリペプチド又はタンパク質のアミノ酸配列は野生型インフルエンザ・ウイルス・ポリメラーゼPB1のN末端PB1N残基5から11で形成された短いへリックス領域の短いLLFL配列を含む。
【0224】
その中で、Met595とVal12、Leu666とPhe9、Leu640とLeu8;Leu636とLeu8;Met628とLeu7;Phe710とThr6;Trp706とThr6;Trp706とPro5;Phe411とPro5;Trp706とAsn4の間の一部分の原子は4Å相互作用の範囲内に位置するので、それらの間では疎水相互作用で結合されていることが解る。従って、PAのC末端の当該アミノ酸と疎水相互作用が形成できるポリペプチド又は化合物が、即ちインフルエンザ・ウイルス抑制の薬物となれる。
【0225】
標的タンパク質の構造を基にした薬物設計は既に数多くの成功事例がある(Schneider,G.及びFechner,U.、 Nature Reviews Drug Discovery 2005,4,649)、北京大学来魯華教授のワークグループが開発したLigBuilderプログラムは国際登録者が700件を超えている(Wang,R.X.;Gao,Y.;Lai,L.H.,LigBuilder:A multi−purpose program for structure−based drug design. J. Mol. Mod. 2000,6,498)、既に数多くのLigBuilderプログラムを応用した高活性抑制剤設計の例が報告されている。例えば、Boehringer Ingelheim製薬会社はLigBuilder 1.2を利用し、繋ぎ操作補助設計で高活性のP38 キナーゼ抑制剤を最適化する(Goldberg DR,Hao,M−H.ら、J. Med. Chem. 2007,50,4016)。
【0226】
H5N1ウイルスRNAポリメラーゼのPAC−PB1N複合物結晶体構造に基づき、LigBuilder2.0プログラムを利用し全新な薬物設計計算を行った。まずはPACタンパク質に対し結合遺伝子座分析を行い、点数が一番高い二つの結合遺伝子座は当該構造の“口”区と“チャンネル”区に位置する。LigBuilder2.0プログラムを利用して、別々にこの二つの遺伝子座に対して全新薬物設計計算を行い、一部高予測活性且つ合成し易い化合物が得られた。
【0227】
PA分子中の“チャンネル”区と結合する分子の具体例は下記通りである:
【化1】

R1=−CH3,−CH2CH3
R2=−CH3,−CH2NH2,−CH(OH)CH3,−CH(CH3)2
予測Kd:8.64〜9.60。
【化2】

R1=−NH2
R2=−COCH3,−CH2COCH3,−CO,−OCH2CH3
R3=−CH2NH2,−CH2(NH2)CH2CH3,−CH2(NH2)CH2CH2CH3
予測Kd:8.51〜9.65。
【0228】
PA分子“口”区と結合する分子の具体例は下記通りである:
【化3】

R1=−OH
R2=−OH,−CO,−CONH2,−CONHCH3,COOH
R3=−COOH,−NH2,−C(NH2)2+
R4=−CH(OH)CH3,CONH2,CH(NH2)CH2OH
予測Kd:8.52〜8.96。
【化4】

R1=−OH,−NHCO
R2=−CH2(OH)CH3,−NHCH3,−CH2OH,−CH2NH2,−NH2,−C(NH2)2+
R3=−NH2,−C(NH2)2+,−CH2OH,−CO,−CH2CO,−NHCO
R4=−OH,−OCH3。
【0229】
参考文献
Adams, P. D., R. W. Grosse−Kunstleveら、(2002). “PHENIX: building new software for automated crystallographic structure determination.” Acta Crystallogr D Biol Crystallogr 58(Pt 11): 1948−54。
Brunger, A. T., P. D. Adamsら、(1998). “Crystallography & NMR system: A new software suite for macromolecular structure determination.” Acta Crystallogr D Biol Crystallogr 54(Pt 5): 905−21。
Deng, T., J. Sharpsら、(2005). “In vitro assembly of PB2 with a PB1−PA dimer supports a new model of assembly of influenza A virus polymerase subunits into a functional trimeric complex.” J Virol 79(13): 8669−74。
Deng, T., J. L. Sharpsら、(2006). “Role of the influenza virus heterotrimeric RNA polymerase complex in the initiation of replication.” J Gen Virol 87(Pt 11): 3373−7。
Emsley, P. and K. Cowtan (2004). “Coot: model−building tools for molecular graphics.” Acta Crystallogr D Biol Crystallogr 60(Pt 12 Pt 1): 2126−32。
Fodor, E., M. Crowら、(2002). “A single amino acid mutation in the PA subunit of the influenza virus RNA polymerase inhibits endonucleolytic cleavage of capped RNAs.” J Virol 76(18): 8989−9001。
Fodor, E., D. C. Pritloveら、(1994). “The influenza virus panhandle is involved in the initiation of transcription.” J Virol 68(6): 4092−6。
Hara, K., F. I. Schmidtら、(2006). “Amino acid residues in the N−terminal region of the PA subunit of influenza A virus RNA polymerase play a critical role in protein stability, endonuclease activity, cap binding, and virion RNA promoter binding.” J Virol 80(16): 7789−98。
Hara, K., M. Shiotaら、(2001). “Influenza virus RNA polymerase PA subunit is a novel serine protease with Ser624 at the active site.” Genes Cells 6(2): 87−97。
Hendrickson, W. A. (1991). “Determination of macromolecular structures from anomalous diffraction of synchrotron radiation.” Science 254(5028): 51−8。
Honda, A., K. Mizumotoら、(2002). “Minimum molecular architectures for transcription and replication of the influenza virus.” Proc Natl Acad Sci U S A 99(20): 13166−71。
Hulse−Post, D. J., J. Franksら、(2007). “Molecular changes in the polymerase genes (PA and PB1) associated with high pathogenicity of H5N1 influenza virus in mallard ducks.” J Virol 81(16): 8515−24。
Kawaguchi, A., T. Naitoら、(2005). “Involvement of influenza virus PA subunit in assembly of functional RNA polymerase complexes.” J Virol 79(2): 732−44。
Munster, V. J., E. de Witら、(2007). “The molecular basis of the pathogenicity of the Dutch highly pathogenic human influenza A H7N7 viruses.” J Infect Dis 196(2): 258−65。
Murshudov, G. N., A. A. Vaginら、(1997). “Refinement of macromolecular structures by the maximum−likelihood method.” Acta Crystallogr D Biol Crystallogr 53(Pt 3): 240−55。
Otwinowski, Z. M., Wladek (1997). “Processing of x−ray diffraction data collected in oscillation mode “ Methods in Enzymology 276(Macromolecular Crystallography, Part A): 307−326。
Perez, D. R. and R. O. Donis (2001). “Functional analysis of PA binding by influenza a virus PB1: effects on polymerase activity and viral infectivity.” J Virol 75(17): 8127−36。
Perrakis, A., R. Morrisら、(1999). “Automated protein model building combined with iterative structure refinement.” Nat Struct Biol 6(5): 458−63。
Sanz−Ezquerro, J. J., T. Zurcherら、(1996). “The amino−terminal one−third of the influenza virus PA protein is responsible for the induction of proteolysis.” J Virol 70(3): 1905−11。
Sheldrick, G. M., Ed. (1998). Direct Methods for Solving Macromolecular Structures. Dordrecht, The Netherlands, Kluwer Academic Publishers。
Sugiura, A., M. Uedaら、(1975). “Further isolation and characterization of temperature−sensitive mutants of influenza virus.” Virology 65(2): 363−73。
Taubenberger, J. K. and D. M. Morens (2007). “The Pathology of Influenza Virus Infections.” Annu Rev Pathol。
Vonrhein, C., E. Blancら、(2007). “Automated structure solution with autoSHARP.” Methods Mol Biol 364:215−30。
【図1A−a】

【図1A−b】

【図1A−c】

【図1A−d】

【特許請求の範囲】
【請求項1】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造であって、前記インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACは前記インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAの約201〜約301位アミノ酸から約650〜末端のアミノ酸までであり、前記PB1のN末端PB1Nは前記インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1のN末端PB1Nの48個以内のアミノ酸のオリゴペプチドであり、前記結晶体三次元構造中の原子は表1中で挙げた少なくとも40%の原子座標を持ち、又はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造中少なくとも40%のアミノ酸の主鎖炭素骨格の原子構造座標と表1中の座標の平均二乗偏差が1.7Å以下である、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項2】
前記インフルエンザ・ウイルスはA、B、C型インフルエンザ・ウイルスより選択され、好ましくは、前記インフルエンザ・ウイルスはA型インフルエンザ・ウイルス株:A/goose/Guangdong/1/96、A/Brevig Mission/1/1918;B型インフルエンザ・ウイルス株:B/Ann Arbor/1/1966又はC型インフルエンザ・ウイルス株:C/JJ/1950より選択される、請求項1に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項3】
前記複合体の結晶体はP4(1)2(1)2の空間群を持ち、格子定数は約α=b=122Å、c=133Å、α=β=γ=90°である、請求項1又は2に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項4】
前記A型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACはインフルエンザ・ウイルス・ポリメラーゼPAのC末端PAC中のαへリックス4、即ち406−414位を含むアミノ酸領域、αへリックス5、即ち440−450位を含むアミノ酸領域、αへリックス8、即ち583−603位を含むアミノ酸領域、αへリックス9、即ち608−613位を含むアミノ酸領域、αへリックス10、即ち633−649位を含むアミノ酸領域、αへリックス11、即ち653−673位を含むアミノ酸領域、αへリックス12、即ち683−691位を含むアミノ酸領域、とαへリックス13、即ち698−714位を含むアミノ酸領域、及び二つのβシート:βシート8とβシート9、それぞれ619−623位を含むアミノ酸領域と628−631位を含むアミノ酸領域、がPAのC末端PACの第一部分を構成し、A型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACは主要なβシート折り畳み断片より成り、これらのβシートにはβシート1、即ち290−292位を含むアミノ酸領域、βシート2、即ち317−324位を含むアミノ酸領域、βシート3、即ち480−491位を含むアミノ酸領域、βシート4、即ち496−506位を含むアミノ酸領域、βシート5、即ち517−526位を含むアミノ酸領域、βシート6、即ち541−550位を含むアミノ酸領域、βシート7、即ち557−571位を含むアミノ酸領域などが含まれ、これらのβシートが共同でPAのC末端PAC第二部分の折り畳みシート層の主な部分を構成し、前記A型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACはαへリックス1、即ち303−311位を含むアミノ酸領域、αへリックス2、即ち331−349位を含むアミノ酸領域、αへリックス3、即ち364−369位を含むアミノ酸領域、αへリックス6、即ち454−475位を含むアミノ酸領域及びαへリックス7、即ち572−578位を含むアミノ酸領域、がPAのC末端PAC第二部分の前記折り畳みβシート層の周囲を囲い、その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、請求項2に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項5】
A型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACは主にαへリックス8、αへリックス10、αへリックス11とαへリックス13を通してPB1のN末端PB1N相互作用に関与し、好ましくは、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス11のLeu666、αへリックス13のPhe710、αへリックス10のVal636、Leu640、αへリックス13のTrp706、αへリックス11のGln670から構成される群より選択される少なくとも一つのアミノ酸をインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1との相互作用に関与させ、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、請求項2に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項6】
前記A型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のαへリックス9とαへリックス10の間の環状ペプチド・セグメントのIle621、Gly622、Glu623、Thr618とPro620から構成される群より選択される少なくとも一つのアミノ酸を、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1との相互作用に関与させ、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、請求項2に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項7】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のAsn647、Gln408、Cys584、Gln587、Gln591、Lys643、Asn647、Ser659、Lys663、Trp699、Asn703から構成される群より選択される少なくとも一つのアミノ酸が、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1Nと結合する「袋状」のアミノ・サイトを構成し、前記B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、請求項2に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項8】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のTrp406、Glu410、Lys461、Glu524、Phe525、Ser526、Lys536、Lys539、Tyr540、Leu563、Tyr564、Arg566及びLys574から構成される群より選択される少なくとも一つのアミノ酸はヌクレオチド、RNA若しくはその他小分子又はタンパク質と結合するPAC中の主溝及びチャンネルの形成に関与し、前記B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、請求項2に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項9】
前記A型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACの370から405位アミノ酸残基が一つの大環状を構成し、前記B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、請求項2に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項10】
前記A型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス12、αへリックス13をその他タンパク質の相互作用に関与させ、好ましくは、αへリックス12及αへリックス13中のIle690、Glu691、Glu692、Cys693、Asn696から構成される群より選択される少なくとも一つのアミノ酸を、その他タンパク質との相互作用に関与させ、前記B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、請求項4に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項11】
前記A型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのLys506、Gly507、Arg508、Ser509、His510、Leu511、Arg512、Asn513及びAsp514から構成される群より選択される少なくとも一つのアミノ酸を、その他タンパク質との相互作用に関与させ、His510はポリメラーゼ複合体RNaseの一部分を構成し、前記B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、請求項4に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項12】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のαへリックス8、αへリックス10、αへリックス11とαへリックス13から構成される群より選択される少なくとも一つのメンバーと結合するポリペプチド、タンパク質、無機若しくは有機化合物であって、前記インフルエンザ・ウイルスはA、B、C型インフルエンザ・ウイルスより選択され、好ましくは、前記インフルエンザ・ウイルスはA型インフルエンザ・ウイルス株:A/goose/Guangdong/1/96、A/Brevig Mission/1/1918;B型インフルエンザ・ウイルス株:B/Ann Arbor/1/1966又はC型インフルエンザ・ウイルス株:C/JJ/1950より選択され、好ましくは、前記ポリペプチド、タンパク質、無機若しくは有機化合物は前記A型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス11のLeu666、αへリックス13のPhe710、αへリックス10のVal636、Leu640、αへリックス13のTrp706、αへリックス11のGln670から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物であり、前記B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、ポリペプチド、タンパク質、無機若しくは有機化合物。
【請求項13】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のαへリックス9とαへリックス10との間の環状ペプチド・セグメントのA型インフルエンザ・ウイルスIle621、Gly622、Glu623、Thr618とPro620から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物であって、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項14】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACでA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のAsn647、Gln408、Cys584、Gln587、Gln591、Lys643、Asn647、Ser659、Lys663、Trp699、Asn703から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物であって、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項15】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACでA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のTrp406、Glu410、Lys461、Glu524、Phe525、Ser526、Lys536、Lys539、Tyr540、Leu563、Tyr564、Arg566及びLys574から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物であって、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項16】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACでA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACの370から405位より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物であって、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項17】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中αへリックス12、αへリックス13と結合し、好ましくはA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス12及αへリックス13中Ile690、Glu691、Glu692、Cys693、Asn696から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物であって、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項18】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中シートβ4とシートβ5との間の環状領域内でA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのLys506、Gly507、Arg508、Ser509、His510、Leu511、Arg512、Asn513及びAsp514から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物であって、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項19】
インフルエンザ・ウイルス・ポリメラーゼPB1と競合的にPACと結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項20】
主にPAC中αへリックス8、αへリックス11、αへリックス13、αへリックス10が形成する疎水性コアと相互に作用し、好ましくはA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中αへリックス8中のMet595、αへリックス11中のLeu666、αへリックス13中のTrp706とPhe710、及びαへリックス10中のVal636とVal640と相互に作用し、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、請求項19に記載のインフルエンザ・ウイルス・ポリメラーゼPB1と競合的にPACと結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項21】
前記ポリペプチド又はタンパク質のアミノ酸配列における、野生型インフルエンザ・ウイルス・ポリメラーゼPB1のN末端PB1N残基5から10位Pro5、Thr6、Leu7、Leu8、Phe9とLeu10が形成する短へリックス領域を含む短PTLLFLモチーフの中の少なくとも三つは、該モチーフとのポリペプチド配列対比において対応する位置のアミノ酸が同じである、請求項19に記載のインフルエンザ・ウイルス・ポリメラーゼPB1と競合的にPACと結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項22】
請求項12〜21のいずれか一項に記載のポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を含む組成物であって、キャリア又は賦形剤を選択的に含む、組成物。
【請求項23】
インフルエンザ・ウイルスによる病気の治療薬物の製薬における、請求項22に記載の組成物の応用。
【請求項24】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の発現と精製方法であって、
(a)標識タンパク質遺伝子を融合した又は融合していないインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC約201〜約301位アミノ酸から約650〜末端位アミノ酸をコードする遺伝子配列のベクターを構築し、該ベクターを使って原核又は真核細胞を形質転換し、よって標識タンパク質がついているPACを発現することと;
(b)PACの発現と似た方法で標識が付く又は付かないPB1Nを発現することと;
(c)(a)で取得されるインフルエンザ・ウイルスPACを発現する細胞と(b)で取得されるインフルエンザ・ウイルスPB1のN末端48個のアミノ酸以内のアミノ酸PB1Nを発現する細胞を一定比率で混合し、特異標識を特異的に識別する方法でこの混合タンパク質を分離し、酵素性分解で標識がつくポリペプチド中の標識タンパク質を取り去り、PACとPB1Nとの複合体を分離し、タンパク質の濃度を確定することと、
を含み、
前記ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造中の原子は表1中で挙げた少なくとも40%の原子座標を持ち、又はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造中の少なくとも40%のアミノ酸の主鎖炭素骨格の原子構造座標は表1中の座標と平均二乗偏差が1.7Å以下である、方法。
【請求項25】
前記標識タンパク質はGST、Flag−tag、Myc−tag、MBP−tag、特異性抗体より選ばれ;前記ベクターは選択性標識遺伝子を含み、ステップ(c)中での一定比率とは標識タンパク質−PACと標識タンパク質−PB1Nのタンパク質総量のモル比が0.1:1〜1:0.1となるものであり、好ましくは標識タンパク質−PACと標識タンパク質−PB1Nのタンパク質総量のモル比を0.5:1〜1:0.5にさせ、更に好ましくは標識タンパク質−PACと標識タンパク質−PB1のタンパク質総量のモル比を1:1に近づかせ、更に好ましくは標識タンパク質はGSTであり、特異標識を識別する前記方法はアフィニティ・カラムを使用し、標識を取り除く前記方法はプロティナーゼ酵素性分解を使用し、前記PACとPB1Nとの複合体の分離方法はゲル濾過法又はイオン交換クロマトグラフィーで行い、前記タンパク質の濃度確定はゲル電気泳動法で行う、請求項24に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の発現と精製方法。
【請求項26】
前記原核細胞は大腸菌である、請求項25に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の発現と精製方法。
【請求項27】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の共結晶方法であって、
精製したPACとPB1N複合体のタンパク質濃度を5〜30mg/mlまで濃縮することと;
hanging−drop蒸気拡散法またはsitting−drop蒸気拡散法で結晶体成長条件を選別することと;
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体を得ることと
を含む、方法。
【請求項28】
PAのN末端1〜約50位アミノ酸から約200〜約300位アミノ酸までであるPANの野生型又は変異型タンパク質の発現方法であって、標識タンパク質遺伝子を融合した又は融合していないインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのN末端PANの1〜約50位アミノ酸から約200〜約300位アミノ酸までをコードする遺伝子配列の発現ベクターを構築し、該ベクターで真核又は原核細胞を形質転換し、よって標識タンパク質を持つ又は持たないPANを発現し、前記PAのN末端PAN中のアミノ酸配列は図1C中の少なくとも40%のアミノ酸と同じである、方法。
【請求項29】
前記原核細胞は大腸菌である、請求項28に記載のPAのN末端PANの野生型又は変異型タンパク質の発現方法。
【請求項30】
PB1Nと競合的にPACと結合する候補化合物の選別方法であって、
(a)PACを固定ベクターの表面に結合させることと;
(b)過剰量の標識付きPB1Nを前記固定したPACに接触させることと;
(c)溶出液で充分に溶出して、未結合のPB1Nを取り除くことと;
(d)テスト化合物の溶液を(b)の項で記述した固定され且つPB1Nと結合したPACに接触させることと;
(e)前記溶出液で充分に溶出して、テスト溶液を取得することと;
(f)前記テスト溶液中の標識つき遊離PB1Nの濃度を測定することと;
(g)テスト溶液中の標識つき遊離PB1Nの濃度を基に、候補化合物のPACとの結合能力を求めることと
を含む、方法。
【請求項31】
前記ステップ(a)のPACを固定表面上に結合させることは、共有結合性架橋又はPACをアフィニティ・マトリックスと結合させることにより実現され、前記アフィニティ・マトリックスは、固定表面上にそのアフィニティ・マトリックスが結合できる結合基を有する、請求項30に記載の方法。
【請求項32】
前記アフィニティ・マトリックスはGST、Flag−tag、Myc−tag、MBP−tag、特異性抗体から選択され、固定表面上は対応アフィニティ・マトリックスの結合基を有する、請求項31に記載の方法。
【請求項33】
前記標識付きPB1Nポリペプチドは同位体又はその他の化学分子で標識したタンパク質より選択され、好ましくは、その他の化学分子での標識は緑色蛍光タンパク質、各種融合ポリペプチドより選び使用される、請求項30〜32のいずれか一項に記載の方法。
【請求項34】
前記固定表面はアフィニティ・クロマトカラムである、請求項30〜33のいずれか一項に記載の方法。
【請求項35】
請求項1〜11のいずれか一項に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造の、インフルエンザ・ウイルス感染による病気の治療に用いる各種ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物の設計と選別における応用であって、
タンパク質三次元構造座標に基づき、コンピューター・シミュレーションにて特定位置に結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物分子を設計することと;
タンパク質三次元構造座標に基づき、コンピューター・シミュレーションにて特定位置に結合可能なポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物分子をスクリーニングすることと;
タンパク質三次元構造座標に基づき、設計或はスクリーニングしたポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物分子を前記PAC及びPB1N配列と少なくとも50%同配列を持つ任意亜型のインフルエンザ・ウイルス・ポリメラーゼタンパク質に結合させ、更に結合状況を分析することと;
タンパク質三次元構造座標に基づき、設計或はスクリーニングしたポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物分子を前記PAC及びPB1N配列と少なくとも50%同じ配列を持つ任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・タンパク質に結合させ結晶にし、よってタンパク質X線結晶構造解析方法にてポリペプチド及び化合物分子のタンパク質との結合状況を分析することと
を含み、
前記PAC及びPB1N配列と少なくとも50%の同配列を持つ任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・タンパク質と結合する前記ポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物分子が即ち候補化合物である、応用。
【請求項36】
任意亜型のインフルエンザ・ウイルス・ポリメラーゼの三つのサブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の構造であって、その中に含まれる一つのタンパク質又はそのある一領域は、前記PACタンパク質と少なくとも40%同配列を持つ、任意亜型のインフルエンザ・ウイルス・ポリメラーゼの三つのサブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の構造。
【請求項37】
任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の三次元構造であって、含まれる一つのタンパク質又はそのある一領域の主鎖三次元構造座標は、前記PACタンパク質と、前記PACタンパク質配列の少なくとも40%の主鎖炭素骨格の原子と三次元座標の平均二乗偏差が1.7Å以下である、任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の三次元構造。
【請求項38】
任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の構造であって、含まれる一箇所のタンパク質領域は前記PB1Nポリペプチドのアミノ酸1−11領域と20%の配列の相同性を持ち、好ましくは40%の配列の相同性を有する、任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の構造。
【請求項39】
前記インフルエンザ・ウイルスPAサブユニット上の任意アミノ酸と相互作用を持つことを特徴とするポリペプチド又は小分子。
【請求項40】
請求項36〜38のいずれか一項に記載の構造の、薬物選別及び薬物設計方面における応用。
【請求項41】
PAC及びPB1Nタンパク質三次元構造に基づくタンパク質と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物の選別方法であって、タンパク質結晶方法でPACを含む結晶体を取得し、又はPAC及びPB1Nタンパク質複合体結晶体の三次元構造座標を取得することを含み;前記三次元構造は、この座標における少なくとも40%のアミノ酸残基を含有する主鎖炭素骨格原子の三次元座標との平均二乗偏差が1.7Å以下である構造を全て含む、方法。
【請求項42】
インフルエンザ・ウイルス亜型PAサブユニット・タンパク質の発現精製方法であって、PAを分けて細菌又は真核発現システムで発現し、該方法で、含有するあらゆるタンパク質からある一箇所の断片が前記配列相応領域と同じアミノ酸配列を40%持つタンパク質を発現し精製する、方法。
【請求項43】
請求項5に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体構造中のαへリックス8、10、11、13中任意領域と少なくとも40%同じアミノ酸を有するタンパク質のアミノ酸残基と相互に作用するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項1】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造であって、前記インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACは前記インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAの約201〜約301位アミノ酸から約650〜末端のアミノ酸までであり、前記PB1のN末端PB1Nは前記インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1のN末端PB1Nの48個以内のアミノ酸のオリゴペプチドであり、前記結晶体三次元構造中の原子は表1中で挙げた少なくとも40%の原子座標を持ち、又はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造中少なくとも40%のアミノ酸の主鎖炭素骨格の原子構造座標と表1中の座標の平均二乗偏差が1.7Å以下である、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項2】
前記インフルエンザ・ウイルスはA、B、C型インフルエンザ・ウイルスより選択され、好ましくは、前記インフルエンザ・ウイルスはA型インフルエンザ・ウイルス株:A/goose/Guangdong/1/96、A/Brevig Mission/1/1918;B型インフルエンザ・ウイルス株:B/Ann Arbor/1/1966又はC型インフルエンザ・ウイルス株:C/JJ/1950より選択される、請求項1に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項3】
前記複合体の結晶体はP4(1)2(1)2の空間群を持ち、格子定数は約α=b=122Å、c=133Å、α=β=γ=90°である、請求項1又は2に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項4】
前記A型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACはインフルエンザ・ウイルス・ポリメラーゼPAのC末端PAC中のαへリックス4、即ち406−414位を含むアミノ酸領域、αへリックス5、即ち440−450位を含むアミノ酸領域、αへリックス8、即ち583−603位を含むアミノ酸領域、αへリックス9、即ち608−613位を含むアミノ酸領域、αへリックス10、即ち633−649位を含むアミノ酸領域、αへリックス11、即ち653−673位を含むアミノ酸領域、αへリックス12、即ち683−691位を含むアミノ酸領域、とαへリックス13、即ち698−714位を含むアミノ酸領域、及び二つのβシート:βシート8とβシート9、それぞれ619−623位を含むアミノ酸領域と628−631位を含むアミノ酸領域、がPAのC末端PACの第一部分を構成し、A型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACは主要なβシート折り畳み断片より成り、これらのβシートにはβシート1、即ち290−292位を含むアミノ酸領域、βシート2、即ち317−324位を含むアミノ酸領域、βシート3、即ち480−491位を含むアミノ酸領域、βシート4、即ち496−506位を含むアミノ酸領域、βシート5、即ち517−526位を含むアミノ酸領域、βシート6、即ち541−550位を含むアミノ酸領域、βシート7、即ち557−571位を含むアミノ酸領域などが含まれ、これらのβシートが共同でPAのC末端PAC第二部分の折り畳みシート層の主な部分を構成し、前記A型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACはαへリックス1、即ち303−311位を含むアミノ酸領域、αへリックス2、即ち331−349位を含むアミノ酸領域、αへリックス3、即ち364−369位を含むアミノ酸領域、αへリックス6、即ち454−475位を含むアミノ酸領域及びαへリックス7、即ち572−578位を含むアミノ酸領域、がPAのC末端PAC第二部分の前記折り畳みβシート層の周囲を囲い、その中、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、請求項2に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項5】
A型インフルエンザ・ウイルスのポリメラーゼ・サブユニットPAのC末端PACは主にαへリックス8、αへリックス10、αへリックス11とαへリックス13を通してPB1のN末端PB1N相互作用に関与し、好ましくは、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス11のLeu666、αへリックス13のPhe710、αへリックス10のVal636、Leu640、αへリックス13のTrp706、αへリックス11のGln670から構成される群より選択される少なくとも一つのアミノ酸をインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1との相互作用に関与させ、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、請求項2に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項6】
前記A型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のαへリックス9とαへリックス10の間の環状ペプチド・セグメントのIle621、Gly622、Glu623、Thr618とPro620から構成される群より選択される少なくとも一つのアミノ酸を、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1との相互作用に関与させ、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、請求項2に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項7】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のAsn647、Gln408、Cys584、Gln587、Gln591、Lys643、Asn647、Ser659、Lys663、Trp699、Asn703から構成される群より選択される少なくとも一つのアミノ酸が、インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPB1Nと結合する「袋状」のアミノ・サイトを構成し、前記B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、請求項2に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項8】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のTrp406、Glu410、Lys461、Glu524、Phe525、Ser526、Lys536、Lys539、Tyr540、Leu563、Tyr564、Arg566及びLys574から構成される群より選択される少なくとも一つのアミノ酸はヌクレオチド、RNA若しくはその他小分子又はタンパク質と結合するPAC中の主溝及びチャンネルの形成に関与し、前記B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、請求項2に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項9】
前記A型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACの370から405位アミノ酸残基が一つの大環状を構成し、前記B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、請求項2に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項10】
前記A型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス12、αへリックス13をその他タンパク質の相互作用に関与させ、好ましくは、αへリックス12及αへリックス13中のIle690、Glu691、Glu692、Cys693、Asn696から構成される群より選択される少なくとも一つのアミノ酸を、その他タンパク質との相互作用に関与させ、前記B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、請求項4に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項11】
前記A型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのLys506、Gly507、Arg508、Ser509、His510、Leu511、Arg512、Asn513及びAsp514から構成される群より選択される少なくとも一つのアミノ酸を、その他タンパク質との相互作用に関与させ、His510はポリメラーゼ複合体RNaseの一部分を構成し、前記B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、請求項4に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造。
【請求項12】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のαへリックス8、αへリックス10、αへリックス11とαへリックス13から構成される群より選択される少なくとも一つのメンバーと結合するポリペプチド、タンパク質、無機若しくは有機化合物であって、前記インフルエンザ・ウイルスはA、B、C型インフルエンザ・ウイルスより選択され、好ましくは、前記インフルエンザ・ウイルスはA型インフルエンザ・ウイルス株:A/goose/Guangdong/1/96、A/Brevig Mission/1/1918;B型インフルエンザ・ウイルス株:B/Ann Arbor/1/1966又はC型インフルエンザ・ウイルス株:C/JJ/1950より選択され、好ましくは、前記ポリペプチド、タンパク質、無機若しくは有機化合物は前記A型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス11のLeu666、αへリックス13のPhe710、αへリックス10のVal636、Leu640、αへリックス13のTrp706、αへリックス11のGln670から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物であり、前記B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、ポリペプチド、タンパク質、無機若しくは有機化合物。
【請求項13】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のαへリックス9とαへリックス10との間の環状ペプチド・セグメントのA型インフルエンザ・ウイルスIle621、Gly622、Glu623、Thr618とPro620から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物であって、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項14】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACでA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のAsn647、Gln408、Cys584、Gln587、Gln591、Lys643、Asn647、Ser659、Lys663、Trp699、Asn703から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物であって、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項15】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACでA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中のTrp406、Glu410、Lys461、Glu524、Phe525、Ser526、Lys536、Lys539、Tyr540、Leu563、Tyr564、Arg566及びLys574から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物であって、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項16】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACでA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACの370から405位より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物であって、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項17】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中αへリックス12、αへリックス13と結合し、好ましくはA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのαへリックス12及αへリックス13中Ile690、Glu691、Glu692、Cys693、Asn696から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物であって、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項18】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中シートβ4とシートβ5との間の環状領域内でA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACのLys506、Gly507、Arg508、Ser509、His510、Leu511、Arg512、Asn513及びAsp514から構成される群より選択される少なくとも一つのアミノ酸と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物であって、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項19】
インフルエンザ・ウイルス・ポリメラーゼPB1と競合的にPACと結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項20】
主にPAC中αへリックス8、αへリックス11、αへリックス13、αへリックス10が形成する疎水性コアと相互に作用し、好ましくはA型インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC中αへリックス8中のMet595、αへリックス11中のLeu666、αへリックス13中のTrp706とPhe710、及びαへリックス10中のVal636とVal640と相互に作用し、B型又はC型インフルエンザ・ウイルスにおけるA型インフルエンザ・ウイルスに対応する領域のアミノ酸はそれぞれ図1Aと図1B及び図1C及び図10Aと図10Bに示すとおりである、請求項19に記載のインフルエンザ・ウイルス・ポリメラーゼPB1と競合的にPACと結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項21】
前記ポリペプチド又はタンパク質のアミノ酸配列における、野生型インフルエンザ・ウイルス・ポリメラーゼPB1のN末端PB1N残基5から10位Pro5、Thr6、Leu7、Leu8、Phe9とLeu10が形成する短へリックス領域を含む短PTLLFLモチーフの中の少なくとも三つは、該モチーフとのポリペプチド配列対比において対応する位置のアミノ酸が同じである、請求項19に記載のインフルエンザ・ウイルス・ポリメラーゼPB1と競合的にPACと結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【請求項22】
請求項12〜21のいずれか一項に記載のポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物を含む組成物であって、キャリア又は賦形剤を選択的に含む、組成物。
【請求項23】
インフルエンザ・ウイルスによる病気の治療薬物の製薬における、請求項22に記載の組成物の応用。
【請求項24】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の発現と精製方法であって、
(a)標識タンパク質遺伝子を融合した又は融合していないインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PAC約201〜約301位アミノ酸から約650〜末端位アミノ酸をコードする遺伝子配列のベクターを構築し、該ベクターを使って原核又は真核細胞を形質転換し、よって標識タンパク質がついているPACを発現することと;
(b)PACの発現と似た方法で標識が付く又は付かないPB1Nを発現することと;
(c)(a)で取得されるインフルエンザ・ウイルスPACを発現する細胞と(b)で取得されるインフルエンザ・ウイルスPB1のN末端48個のアミノ酸以内のアミノ酸PB1Nを発現する細胞を一定比率で混合し、特異標識を特異的に識別する方法でこの混合タンパク質を分離し、酵素性分解で標識がつくポリペプチド中の標識タンパク質を取り去り、PACとPB1Nとの複合体を分離し、タンパク質の濃度を確定することと、
を含み、
前記ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造中の原子は表1中で挙げた少なくとも40%の原子座標を持ち、又はインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造中の少なくとも40%のアミノ酸の主鎖炭素骨格の原子構造座標は表1中の座標と平均二乗偏差が1.7Å以下である、方法。
【請求項25】
前記標識タンパク質はGST、Flag−tag、Myc−tag、MBP−tag、特異性抗体より選ばれ;前記ベクターは選択性標識遺伝子を含み、ステップ(c)中での一定比率とは標識タンパク質−PACと標識タンパク質−PB1Nのタンパク質総量のモル比が0.1:1〜1:0.1となるものであり、好ましくは標識タンパク質−PACと標識タンパク質−PB1Nのタンパク質総量のモル比を0.5:1〜1:0.5にさせ、更に好ましくは標識タンパク質−PACと標識タンパク質−PB1のタンパク質総量のモル比を1:1に近づかせ、更に好ましくは標識タンパク質はGSTであり、特異標識を識別する前記方法はアフィニティ・カラムを使用し、標識を取り除く前記方法はプロティナーゼ酵素性分解を使用し、前記PACとPB1Nとの複合体の分離方法はゲル濾過法又はイオン交換クロマトグラフィーで行い、前記タンパク質の濃度確定はゲル電気泳動法で行う、請求項24に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の発現と精製方法。
【請求項26】
前記原核細胞は大腸菌である、請求項25に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の発現と精製方法。
【請求項27】
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の共結晶方法であって、
精製したPACとPB1N複合体のタンパク質濃度を5〜30mg/mlまで濃縮することと;
hanging−drop蒸気拡散法またはsitting−drop蒸気拡散法で結晶体成長条件を選別することと;
インフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体を得ることと
を含む、方法。
【請求項28】
PAのN末端1〜約50位アミノ酸から約200〜約300位アミノ酸までであるPANの野生型又は変異型タンパク質の発現方法であって、標識タンパク質遺伝子を融合した又は融合していないインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのN末端PANの1〜約50位アミノ酸から約200〜約300位アミノ酸までをコードする遺伝子配列の発現ベクターを構築し、該ベクターで真核又は原核細胞を形質転換し、よって標識タンパク質を持つ又は持たないPANを発現し、前記PAのN末端PAN中のアミノ酸配列は図1C中の少なくとも40%のアミノ酸と同じである、方法。
【請求項29】
前記原核細胞は大腸菌である、請求項28に記載のPAのN末端PANの野生型又は変異型タンパク質の発現方法。
【請求項30】
PB1Nと競合的にPACと結合する候補化合物の選別方法であって、
(a)PACを固定ベクターの表面に結合させることと;
(b)過剰量の標識付きPB1Nを前記固定したPACに接触させることと;
(c)溶出液で充分に溶出して、未結合のPB1Nを取り除くことと;
(d)テスト化合物の溶液を(b)の項で記述した固定され且つPB1Nと結合したPACに接触させることと;
(e)前記溶出液で充分に溶出して、テスト溶液を取得することと;
(f)前記テスト溶液中の標識つき遊離PB1Nの濃度を測定することと;
(g)テスト溶液中の標識つき遊離PB1Nの濃度を基に、候補化合物のPACとの結合能力を求めることと
を含む、方法。
【請求項31】
前記ステップ(a)のPACを固定表面上に結合させることは、共有結合性架橋又はPACをアフィニティ・マトリックスと結合させることにより実現され、前記アフィニティ・マトリックスは、固定表面上にそのアフィニティ・マトリックスが結合できる結合基を有する、請求項30に記載の方法。
【請求項32】
前記アフィニティ・マトリックスはGST、Flag−tag、Myc−tag、MBP−tag、特異性抗体から選択され、固定表面上は対応アフィニティ・マトリックスの結合基を有する、請求項31に記載の方法。
【請求項33】
前記標識付きPB1Nポリペプチドは同位体又はその他の化学分子で標識したタンパク質より選択され、好ましくは、その他の化学分子での標識は緑色蛍光タンパク質、各種融合ポリペプチドより選び使用される、請求項30〜32のいずれか一項に記載の方法。
【請求項34】
前記固定表面はアフィニティ・クロマトカラムである、請求項30〜33のいずれか一項に記載の方法。
【請求項35】
請求項1〜11のいずれか一項に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体の結晶体三次元構造の、インフルエンザ・ウイルス感染による病気の治療に用いる各種ポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物の設計と選別における応用であって、
タンパク質三次元構造座標に基づき、コンピューター・シミュレーションにて特定位置に結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物分子を設計することと;
タンパク質三次元構造座標に基づき、コンピューター・シミュレーションにて特定位置に結合可能なポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物分子をスクリーニングすることと;
タンパク質三次元構造座標に基づき、設計或はスクリーニングしたポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物分子を前記PAC及びPB1N配列と少なくとも50%同配列を持つ任意亜型のインフルエンザ・ウイルス・ポリメラーゼタンパク質に結合させ、更に結合状況を分析することと;
タンパク質三次元構造座標に基づき、設計或はスクリーニングしたポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物分子を前記PAC及びPB1N配列と少なくとも50%同じ配列を持つ任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・タンパク質に結合させ結晶にし、よってタンパク質X線結晶構造解析方法にてポリペプチド及び化合物分子のタンパク質との結合状況を分析することと
を含み、
前記PAC及びPB1N配列と少なくとも50%の同配列を持つ任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・タンパク質と結合する前記ポリペプチド、タンパク質又は無機若しくは有機化合物、抗体又は免疫結合物分子が即ち候補化合物である、応用。
【請求項36】
任意亜型のインフルエンザ・ウイルス・ポリメラーゼの三つのサブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の構造であって、その中に含まれる一つのタンパク質又はそのある一領域は、前記PACタンパク質と少なくとも40%同配列を持つ、任意亜型のインフルエンザ・ウイルス・ポリメラーゼの三つのサブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の構造。
【請求項37】
任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の三次元構造であって、含まれる一つのタンパク質又はそのある一領域の主鎖三次元構造座標は、前記PACタンパク質と、前記PACタンパク質配列の少なくとも40%の主鎖炭素骨格の原子と三次元座標の平均二乗偏差が1.7Å以下である、任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の三次元構造。
【請求項38】
任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の構造であって、含まれる一箇所のタンパク質領域は前記PB1Nポリペプチドのアミノ酸1−11領域と20%の配列の相同性を持ち、好ましくは40%の配列の相同性を有する、任意亜型のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPA、PB1、PB2又はPA、PB1とPB2複合体の構造。
【請求項39】
前記インフルエンザ・ウイルスPAサブユニット上の任意アミノ酸と相互作用を持つことを特徴とするポリペプチド又は小分子。
【請求項40】
請求項36〜38のいずれか一項に記載の構造の、薬物選別及び薬物設計方面における応用。
【請求項41】
PAC及びPB1Nタンパク質三次元構造に基づくタンパク質と結合するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物の選別方法であって、タンパク質結晶方法でPACを含む結晶体を取得し、又はPAC及びPB1Nタンパク質複合体結晶体の三次元構造座標を取得することを含み;前記三次元構造は、この座標における少なくとも40%のアミノ酸残基を含有する主鎖炭素骨格原子の三次元座標との平均二乗偏差が1.7Å以下である構造を全て含む、方法。
【請求項42】
インフルエンザ・ウイルス亜型PAサブユニット・タンパク質の発現精製方法であって、PAを分けて細菌又は真核発現システムで発現し、該方法で、含有するあらゆるタンパク質からある一箇所の断片が前記配列相応領域と同じアミノ酸配列を40%持つタンパク質を発現し精製する、方法。
【請求項43】
請求項5に記載のインフルエンザ・ウイルス・ポリメラーゼ・サブユニットPAのC末端PACとPB1のN末端PB1Nとの複合体構造中のαへリックス8、10、11、13中任意領域と少なくとも40%同じアミノ酸を有するタンパク質のアミノ酸残基と相互に作用するポリペプチド、タンパク質、無機若しくは有機化合物、抗体又は免疫結合物。
【図1B】


【図1C−a】


【図1C−b】


【図1C−c】


【図3A】


【図3B】


【図3C】


【図3D】


【図10−a】


【図10−b】


【図10−c】


【図10−d】


【図10−e】


【図2】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図1C−a】


【図1C−b】


【図1C−c】


【図3A】


【図3B】


【図3C】


【図3D】


【図10−a】


【図10−b】


【図10−c】


【図10−d】


【図10−e】


【図2】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公表番号】特表2011−515074(P2011−515074A)
【公表日】平成23年5月19日(2011.5.19)
【国際特許分類】
【出願番号】特願2010−547032(P2010−547032)
【出願日】平成21年2月22日(2009.2.22)
【国際出願番号】PCT/CN2009/070498
【国際公開番号】WO2009/103243
【国際公開日】平成21年8月27日(2009.8.27)
【出願人】(302037630)中国科学院生物物理研究所 (3)
【Fターム(参考)】
【公表日】平成23年5月19日(2011.5.19)
【国際特許分類】
【出願日】平成21年2月22日(2009.2.22)
【国際出願番号】PCT/CN2009/070498
【国際公開番号】WO2009/103243
【国際公開日】平成21年8月27日(2009.8.27)
【出願人】(302037630)中国科学院生物物理研究所 (3)
【Fターム(参考)】
[ Back to top ]

