インフルエンザM2タンパク質に対するヒトモノクローナル抗体及びその生産方法及びその使用
本発明は、インフルエンザM2タンパク質に結合するヒト、ヒト化及びキメラモノクロナール抗体に関する。また、本発明は様々なアミノ酸配列を有するインフルエンザM2タンパク質に結合するヒトモノクローナル抗体に関する。該抗体は他に、M2又はインフルエンザウイルスの治療、診断、精製及び単離、及びサンプル若しくは被験体においてM2又はインフルエンザウイルスの所在を同定するのに、役立つ。
Notice: Undefined index: DEJ in /mnt/www/gzt_disp.php on line 298
【特許請求の範囲】
【請求項1】
インフルエンザA型ウイルスタンパク質M2の細胞外ドメインに存在するエピトープに特異的に結合する単離抗体であって、ATCC PTA-5967として寄託されたCHO細胞又はATCC PTA-5968として寄託されたハイブリドーマにより産生された抗体が特異的に結合するエピトープに結合する前記単離抗体。
【請求項2】
アミノ酸配列LLTEVETPIR (配列番号:1)内のエピトープに結合する、請求項1に記載の抗体。
【請求項3】
ATCC PTA-5967として寄託されたCHO細胞又はATCC PTA-5968として寄託されたハイブリドーマにより産生された抗体が特異的に結合するのと同一の結合特異性を有する、請求項1に記載の抗体。
【請求項4】
ATCC PTA-5967として寄託されたCHO細胞又はATCC PTA-5968として寄託されたハイブリドーマにより産生された抗体が特異的に結合するのと同一の最小結合配列を有する、請求項1に記載の抗体。
【請求項5】
LLTEVETPIR(配列番号:1)で表される最小結合配列に結合する、請求項1に記載の抗体。
【請求項6】
抗体結合に必要な最小結合配列がLLTEVETPIR (配列番号:1)である、請求項1に記載の抗体。
【請求項7】
ATCC PTA-5968として寄託されたハイブリドーマにより産生された抗体の重鎖及び軽鎖可変領域の配列を含む、請求項1に記載の抗体。
【請求項8】
ATCC PTA-5967として寄託されたCHO細胞により産生された抗体の重鎖及び軽鎖可変領域の配列を含む、請求項1に記載の抗体。
【請求項9】
実施例1に記載の重鎖可変領域の成熟部分及び実施例1に記載の軽鎖可変領域の成熟部分を含む、請求項8に記載の抗体。
【請求項10】
ATCC PTA-5967として寄託されたCHO細胞により産生された抗体の重鎖及び軽鎖の可変領域及び定常領域の配列を含む、請求項1に記載の抗体。
【請求項11】
ATCC PTA-5968として寄託されたハイブリドーマにより産生された抗体の重鎖及び軽鎖の可変領域及び定常領域の配列を含む、請求項1に記載の抗体。
【請求項12】
実施例1に記載の重鎖可変及び定常領域の配列を有する成熟部分及び実施例1に示される軽鎖可変及び定常領域の配列を有する成熟部分を含む、請求項1に記載の抗体。
【請求項13】
抗体のサブクラスがヒトIgG1、ヒトIgG2、ヒトIgG3及びヒトIgG4から選択される、請求項1に記載の抗体。
【請求項14】
抗体のサブクラスがヒトIgG1である、請求項13に記載の抗体。
【請求項15】
ATCC PTA-5968として寄託されたハイブリドーマにより産生された抗体が結合するM2ペプチドの最小結合配列に結合する、或いはATCC PTA-5968として寄託されたハイブリドーマにより産生された抗体が結合するM2ペプチドの最小結合配列と実質的に同一の配列に結合する、請求項1に記載の抗体。
【請求項16】
ATCC PTA-5967として寄託されたCHO細胞により産生された抗体が結合するM2ペプチドの最小結合配列に結合する、或いはATCC PTA-5967として寄託されたCHO細胞により産生された抗体が結合するM2ペプチドの最小結合配列と実質的に同一の配列に結合する、請求項1に記載の抗体。
【請求項17】
細胞外ドメインが以下:
SLLTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRSEWGCRCNDSGD; SLLTEVETPIRNEWECRCNGSSD; SLPTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRNEWGCRCNGSSD; SLLTEVDTLTRNGWGCRCSDSSD; SLLTEVETPIRKEWGCNCSDSSD; SLLTEVETLIRNGWGCRCSDSSD; SLLTEVETLTKNGWGCRCSDSSD; SLLTEVETPIRSEWGCRYNDSSD; SLLTEVETPTRNGWECKCSDSSD; SLLTEVETHTRNGWECKCSDSSD; SLLTEVKTPTRNGWECKCSDSSD; SLLTEVETLTRNGWGCRCSDSSD; SLLTEVETPTRDGWECKCSDSSD; SLLTEVETPTRNGWGCRCSDSSD; SLLTEVETPTRNGWECKCNDSSD; SLLTEVETLTRNGWECKCSDSSD; SLLTEVETPIRNEWGCKCNDSSD; SFLTEVETPIRNEWGCRCNGSSD; SLLTEVETPTRNGWECRCNDSSD; SLLTEVETPIRKGWECNCSDSSD; SLLTEVETPTRNEWECRCSDSSD; SLLTGVETHTRNGWGCKCSDSSD及びSLLPEVETHTRNGWGCRCSDSSD (それぞれ配列番号:2〜26に相当する)
から選択される配列を有する、請求項1に記載の抗体。
【請求項18】
以下のM2細胞外ドメイン配列:
SLLTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRSEWGCRCNDSGD; SLLTEVETPIRNEWECRCNGSSD; SLPTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRNEWGCRCNGSSD; SLLTEVDTLTRNGWGCRCSDSSD; SLLTEVETPIRKEWGCNCSDSSD; SLLTEVETLIRNGWGCRCSDSSD; SLLTEVETLTKNGWGCRCSDSSD; SLLTEVETPIRSEWGCRYNDSSD; SLLTEVETPTRNGWECKCSDSSD; SLLTEVETHTRNGWECKCSDSSD; SLLTEVKTPTRNGWECKCSDSSD; SLLTEVETLTRNGWGCRCSDSSD; SLLTEVETPTRDGWECKCSDSSD; SLLTEVETPTRNGWGCRCSDSSD; SLLTEVETPTRNGWECKCNDSSD; SLLTEVETLTRNGWECKCSDSSD; SLLTEVETPIRNEWGCKCNDSSD; SFLTEVETPIRNEWGCRCNGSSD; SLLTEVETPTRNGWECRCNDSSD; SLLTEVETPIRKGWECNCSDSSD; SLLTEVETPTRNEWECRCSDSSD; SLLTGVETHTRNGWGCKCSDSSD及びSLLPEVETHTRNGWGCRCSDSSD (それぞれ配列番号:2〜26に相当する)
から選択される18以上の配列に結合する、請求項1に記載の抗体。
【請求項19】
異なるアミノ酸配列を有する2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20個のM2細胞外ドメインに結合する、請求項1に記載の抗体。
【請求項20】
番号Z3G1 (ATCC寄託番号PTA-5967; American Type Culture Collection, Manassas, VA, USAに2004年3月13日に寄託された)又は番号Z3G3 (Z3.16.25.1) (ATCC寄託番号PTA-5968;American Type Culture Collection, Manassas, VA, USAに2004年3月13日に寄託された)で表示される細胞株(例えば、ハイブリドーマ又はCHO細胞株)により産生された抗体が結合するM2変異体配列であって、少なくとも2〜5、5〜10、10〜15、15〜20、20〜25又はそれより多い該配列に結合するか弱く結合する、請求項1に記載の抗体。
【請求項21】
番号Z3G1 (ATCC寄託番号PTA-5967; American Type Culture Collection, Manassas, VA, USAに2004年3月13日に寄託された)又は番号Z3G3 (Z3.16.25.1) (ATCC寄託番号PTA-5968;American Type Culture Collection, Manassas, VA, USAに2004年3月13日に寄託された)で表示される細胞株(例えば、ハイブリドーマ又はCHO細胞株)により産生された抗体が結合するM2変異体配列であって、少なくとも2〜5、5〜10、10〜15、15〜20、20〜25又はそれより多い該配列に結合するか弱く結合するが、抗M2抗体L66、N547、C40G1又は14C2抗体が結合するM2配列には結合しないか極弱くしか結合しない、請求項1に記載の抗体。
【請求項22】
M2細胞外ドメイン配列が以下:
SLLTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRSEWGCRCNDSGD; SLLTEVETPIRNEWECRCNGSSD; SLPTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRNEWGCRCNGSSD; SLLTEVDTLTRNGWGCRCSDSSD; SLLTEVETPIRKEWGCNCSDSSD; SLLTEVETLIRNGWGCRCSDSSD; SLLTEVETLTKNGWGCRCSDSSD; SLLTEVETPIRSEWGCRYNDSSD; SLLTEVETPTRNGWECKCSDSSD; SLLTEVETHTRNGWECKCSDSSD; SLLTEVKTPTRNGWECKCSDSSD; SLLTEVETLTRNGWGCRCSDSSD; SLLTEVETPTRDGWECKCSDSSD; SLLTEVETPTRNGWGCRCSDSSD; SLLTEVETPTRNGWECKCNDSSD; SLLTEVETLTRNGWECKCSDSSD; SLLTEVETPIRNEWGCKCNDSSD; SFLTEVETPIRNEWGCRCNGSSD; SLLTEVETPTRNGWECRCNDSSD; SLLTEVETPIRKGWECNCSDSSD; SLLTEVETPTRNEWECRCSDSSD; SLLTGVETHTRNGWGCKCSDSSD及びSLLPEVETHTRNGWGCRCSDSSD (それぞれ配列番号:2〜26に相当する)
から選択される、請求項21に記載の抗体。
【請求項23】
2以上のM2細胞外ドメイン配列に結合する抗体であって、M2ペプチドSLLTEVETPIRNEWGCRCNDSSD (配列番号:2)に対し量として少なくとも20〜50%以上結合する、請求項21に記載の抗体。
【請求項24】
検出可能な程度の補体依存性細胞障害活性を有する、請求項1に記載の抗体。
【請求項25】
検出可能な程度の抗体依存性細胞媒介性細胞傷害活性を有する、請求項1に記載の抗体。
【請求項26】
抗体がIgG、IgA、IgM、IgE及びIgDアイソタイプから選択される、請求項1に記載の抗体。
【請求項27】
IgGアイソタイプがIgG1、IgG2、IgG3及びIgG4から選択される、請求項26に記載の抗体。
【請求項28】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株又はハイブリドーマにより産生された、請求項1に記載の抗体。
【請求項29】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株又はハイブリドーマにより産生された抗体と同一又は実質的に同一の結合親和性を有する、請求項1に記載の抗体。
【請求項30】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株又はハイブリドーマにより産生された抗体の約5〜5000倍以内の結合親和性を有する、請求項1に記載の抗体。
【請求項31】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株又はハイブリドーマにより産生された抗体が結合するのと実質的に同一のM2ペプチドの最小結合配列に結合する、請求項1に記載の抗体。
【請求項32】
M2ペプチドがSLLTEVETPIRNEWGCRCNDSSD (配列番号:2)のアミノ酸配列からなる、請求項31に記載の抗体。
【請求項33】
細胞へのインフルエンザウイルス感染、インフルエンザウイルス増殖又はインフルエンザウイルス複製をin vitro又はin vivoで阻害する、請求項1に記載の抗体。
【請求項34】
細胞へのインフルエンザウイルスの結合をin vitro又はin vivoで阻害する、請求項1に記載の抗体。
【請求項35】
被験体において、インフルエンザウイルス力価の増大を阻害し、インフルエンザウイルス力価を低下させ、インフルエンザウイルスの複製又は増殖を減少させ、或いはインフルエンザウイルス感染に付随する1以上の症状又は合併症を減少させる、請求項1に記載の抗体。
【請求項36】
インフルエンザウイルスに暴露したか又は感染した後の被験体において、インフルエンザウイルス力価の増大を阻害し、インフルエンザウイルス力価を低下させ、インフルエンザウイルスの複製又は増殖を減少させ、或いはインフルエンザウイルス感染に付随する1以上の症状又は合併症を減少させる、請求項1に記載の抗体。
【請求項37】
該症状又は合併症が、悪寒、発熱、咳、咽頭痛、鼻閉、副鼻腔閉、鼻の感染症、副鼻腔感染症、体痛、頭痛、倦怠感、肺炎、気管支炎、耳感染、耳痛、又は死亡から選択される、請求項35又は36に記載の抗体。
【請求項38】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株若しくはハイブリドーマにより産生された抗体の結合特異性又は同一若しくは実質的に同一の結合親和性有する、請求項35又は36に記載の抗体。
【請求項39】
被験体へのインフルエンザウイルス感染を阻害し、ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株若しくはハイブリドーマにより産生された抗体と同一若しくは実質的に同一の結合特異性又は同一の結合親和性を有する、請求項1に記載の抗体。
【請求項40】
インフルエンザウイルス感染に対する被験体の感受性を減少させる、請求項1に記載の抗体。
【請求項41】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株若しくはハイブリドーマにより産生された抗体の結合特異性又は同一若しくは実質的に同一の結合親和性を有する、請求項40に記載の抗体。
【請求項42】
インフルエンザA型ウイルスタンパク質M2がヒト又は鳥インフルエンザA型ウイルスである、請求項1に記載の抗体。
【請求項43】
インフルエンザA型ウイルスが、A/PR/8/34 (H1N1)、A/HK/1/68 (H3N2)、A/HK/1/68(H3N2)、A/HK/156/97、A/トルコ/VA/158512/02、及びA/ベトナム/1196/04から選択されるか、又はH1N1、H2N2、H3N2、H5N1、H9N2、H2N1、H4N6、H6N2、H7N2、H7N3、H4N8、H5N2、H2N3、H11N9、H3N8、H1N2、H11N2、H11N9、H7N7、H2N3、H6N1、H13N6、H7N1、H11N1、H7N2及びH5N3サブタイプから選択される株又は分離株である、請求項42に記載の抗体。
【請求項44】
MDCK細胞に対するインフルエンザA型ウイルス感染の阻害に関して、細胞ベースのELISAアッセイで測定したEC50が2.0〜3.0、1.0〜2.0、0.5〜1.0、0.1〜0.5より低いか、又は0.1μg/mlより低い、請求項1に記載の抗体。
【請求項45】
MDCK細胞に対するインフルエンザA型ウイルス感染の阻害に関して、細胞ベースのELISAアッセイで測定したEC50が0.05〜0.1μg/mlより低い、請求項1に記載の抗体。
【請求項46】
インフルエンザA型ウイルスが、A/PR/8/34 (H1N1)、A/HK/1/68 (H3N2)、A/HK/1/68(H3N2)、A/HK/156/97、A/トルコ/VA/158512/02、及びA/ベトナム/1196/04から選択されるか、又はH1N1、H2N2、H3N2、H5N1、H9N2、H2N1、H4N6、H6N2、H7N2、H7N3、H4N8、H5N2、H2N3、H11N9、H3N8、H1N2、H11N2、H11N9、H7N7、H2N3、H6N1、H13N6、H7N1、H11N1、H7N2及びH5N3サブタイプから選択される株若しくは分離株である、請求項44又は45に記載の抗体。
【請求項47】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株若しくはハイブリドーマにより産生された抗体の結合特異性又は同一若しくは実質的に同一の結合親和性を有する、請求項44又は45に記載の抗体。
【請求項48】
MDCK細胞に対するM2の結合阻害に関して、細胞ベースのELISAアッセイで測定したEC50が2.0〜3.0、1.0〜2.0、0.5〜1.0、0.1〜0.5より低いか、又は0.1μg/mlより低い、請求項1に記載の抗体。
【請求項49】
MDCK細胞に対するM2の結合阻害に関して、細胞ベースのELISAアッセイで測定したEC50が0.05〜0.1μg/mlより低い、請求項1に記載の抗体。
【請求項50】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株若しくはハイブリドーマにより産生された抗体の結合特異性又は同一若しくは実質的に同一の結合親和性を有する、請求項48又は49に記載の抗体。
【請求項51】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株若しくはハイブリドーマにより産生された抗体と同一のエピトープを認識する、請求項1に記載の抗体。
【請求項52】
2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20又はそれよい多い異なるインフルエンザウイルス株又は分離株又はサブタイプに特異的に結合する、請求項1に記載の抗体。
【請求項53】
インフルエンザウイルス株又は分離株又はサブタイプが異なるM2細胞外ドメイン配列を有する、請求項52に記載の抗体。
【請求項54】
インフルエンザウイルス株又は分離株又はサブタイプが以下:
SLLTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRSEWGCRCNDSGD; SLLTEVETPIRNEWECRCNGSSD; SLPTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRNEWGCRCNGSSD; SLLTEVDTLTRNGWGCRCSDSSD; SLLTEVETPIRKEWGCNCSDSSD; SLLTEVETLIRNGWGCRCSDSSD; SLLTEVETLTKNGWGCRCSDSSD; SLLTEVETPIRSEWGCRYNDSSD; SLLTEVETPTRNGWECKCSDSSD; SLLTEVETHTRNGWECKCSDSSD; SLLTEVKTPTRNGWECKCSDSSD; SLLTEVETLTRNGWGCRCSDSSD; SLLTEVETPTRDGWECKCSDSSD; SLLTEVETPTRNGWGCRCSDSSD; SLLTEVETPTRNGWECKCNDSSD; SLLTEVETLTRNGWECKCSDSSD; SLLTEVETPIRNEWGCKCNDSSD; SFLTEVETPIRNEWGCRCNGSSD; SLLTEVETPTRNGWECRCNDSSD; SLLTEVETPIRKGWECNCSDSSD; SLLTEVETPTRNEWECRCSDSSD; SLLTGVETHTRNGWGCKCSDSSD及びSLLPEVETHTRNGWGCRCSDSSD (それぞれ配列番号:2〜26に相当する)
から選択されるM2細胞外ドメイン配列を有する、請求項52に記載の抗体。
【請求項55】
複数のインフルエンザウイルス株又は分離株に結合し、それぞれの株又は分離株が以下:
SLLTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRSEWGCRCNDSGD; SLLTEVETPIRNEWECRCNGSSD; SLPTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRNEWGCRCNGSSD; SLLTEVDTLTRNGWGCRCSDSSD; SLLTEVETPIRKEWGCNCSDSSD; SLLTEVETLIRNGWGCRCSDSSD; SLLTEVETLTKNGWGCRCSDSSD; SLLTEVETPIRSEWGCRYNDSSD; SLLTEVETPTRNGWECKCSDSSD; SLLTEVETHTRNGWECKCSDSSD; SLLTEVKTPTRNGWECKCSDSSD; SLLTEVETLTRNGWGCRCSDSSD; SLLTEVETPTRDGWECKCSDSSD; SLLTEVETPTRNGWGCRCSDSSD; SLLTEVETPTRNGWECKCNDSSD; SLLTEVETLTRNGWECKCSDSSD; SLLTEVETPIRNEWGCKCNDSSD; SFLTEVETPIRNEWGCRCNGSSD; SLLTEVETPTRNGWECRCNDSSD; SLLTEVETPIRKGWECNCSDSSD; SLLTEVETPTRNEWECRCSDSSD; SLLTGVETHTRNGWGCKCSDSSD及びSLLPEVETHTRNGWGCRCSDSSD (それぞれ配列番号:2〜26に相当する)
から選択されるM2細胞外ドメイン配列を有する、請求項52に記載の抗体。
【請求項56】
請求項1に記載の抗体のアミノ酸配列。
【請求項57】
サブ配列が請求項1に記載の抗体の結合特異性又は同一若しくは実質的に同一の結合親和性を有する、請求項56に記載のアミノ酸配列。
【請求項58】
サブ配列が、重鎖及び軽鎖可変領域(VH及びVL)、Fab、Fab’、F(ab’)2、Fv、Fd、scFv、及びsdFvから選択される、請求項56に記載のアミノ酸配列。
【請求項59】
多量体抗体を含む、請求項1に記載の抗体。
【請求項60】
1以上の異種ドメインをさらに含む、請求項1に記載の抗体又は請求項56に記載のアミノ酸サブ配列。
【請求項61】
異種ドメインがアミノ酸配列を含む、請求項60に記載の抗体又はサブ配列。
【請求項62】
異種ドメインが結合タンパク質、酵素活性、薬剤、抗ウイルス剤、毒素、免疫調節剤、検出可能な成分又はタグを含む、請求項60に記載の抗体又はサブ配列。
【請求項63】
二重特異性抗体又は二機能性抗体である、請求項1に記載の抗体。
【請求項64】
ヒト免疫グロブリンλ軽鎖をコードする遺伝子座を有する非ヒト動物により産生された、請求項1に記載の抗体。
【請求項65】
非ヒト動物が哺乳動物を含む、請求項64に記載の抗体。
【請求項66】
哺乳動物が内因性免疫グロブリンを発現しない、請求項65に記載の抗体。
【請求項67】
非ヒト動物がマウスを含む、請求項64に記載の抗体。
【請求項68】
マウスが内因性免疫グロブリンを発現しない、請求項67に記載の抗体。
【請求項69】
M2タンパク質配列のN末端側の1〜24位のアミノ酸残基内に含まれるエピトープに結合する、請求項64に記載の抗体。
【請求項70】
M2タンパク質配列のN末端側の2〜12位のアミノ酸残基内に含まれるエピトープに結合する、請求項64に記載の抗体。
【請求項71】
ATCC PTA-5968として寄託されたハイブリドーマ若しくはATCC PTA-5967として寄託されたCHO細胞株により産生された抗体が結合するM2ペプチドの最小結合配列に結合する、請求項64に記載の抗体。
【請求項72】
請求項1〜71のいずれか1項に記載の抗体又はサブ配列を発現する宿主細胞。
【請求項73】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株若しくはハイブリドーマにより産生された抗体の結合特異性又は同一若しくは実質的に同一の結合親和性を有する、請求項72に記載の宿主細胞。
【請求項74】
細胞が細菌、酵母、植物、又は動物のものである、請求項72に記載の宿主細胞。
【請求項75】
請求項1〜71のいずれか1項に記載の抗体又はサブ配列を発現する非ヒトトランスジェニック動物又は植物。
【請求項76】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株若しくはハイブリドーマにより産生された抗体をコードする核酸。
【請求項77】
ベクターをさらに含む、請求項76に記載の核酸。
【請求項78】
請求項1〜71のいずれか1項に記載の抗体又はサブ配列、及び抗ウイルス剤を含む組成物。
【請求項79】
請求項1〜71のいずれか1項に記載の抗体又はサブ配列、及びインフルエンザウイルス感染に付随する1以上の症状又は合併症を阻害する薬剤を含む組成物。
【請求項80】
症状又は合併症が、悪寒、発熱、咳、咽頭痛、鼻閉、副鼻腔閉、鼻の感染症、副鼻腔感染症、体痛、頭痛、倦怠感、肺炎、気管支炎、耳感染、耳痛、又は死亡から選択される、請求項79に記載の組成物。
【請求項81】
請求項1〜71のいずれか1項に記載の抗体又はサブ配列、及び製薬上許容される担体又は賦形剤を含んでなる医薬組成物。
【請求項82】
請求項1〜71のいずれか1項に記載の抗体又はサブ配列、及び1以上のインフルエンザウイルス株若しくは分離株による被験体への感染を治療する、阻害する、予防する、若しくは感染感受性を減少させるための使用説明書を含むキット。
【請求項83】
抗体を粘膜組織へ送達させる製品をさらに含む、請求項82に記載のキット。
【請求項84】
製品が被験体への吸入投与又は鼻腔内投与に適した吸入器、エアロゾル、スプレー又は小型容器を含む、請求項82に記載のキット。
【請求項85】
粘膜組織に鼻腔、副鼻腔、口、咽喉、喉頭又は肺が含まれる、請求項82に記載のキット。
【請求項86】
抗ウイルス剤をさらに含む、請求項82に記載のキット。
【請求項87】
インフルエンザウイルス感染に付随する1以上の症状又は合併症を阻害する薬剤をさらに含む、請求項82に記載のキット。
【請求項88】
被験体へのインフルエンザ感染を治療する方法であって、被験体へのインフルエンザ感染を治療するのに有効量の請求項1〜71のいずれか1項に記載の抗体又はサブ配列を被験体に投与することを含む、前記方法。
【請求項89】
被験体がインフルエンザウイルスに感染する前、感染と実質的に同時、又は感染後に抗体を投与する、請求項88に記載の方法。
【請求項90】
被験体が免疫不全である、請求項88に記載の方法。
【請求項91】
投与により治療効果がもたらされる、請求項88に記載の方法。
【請求項92】
該治療効果が、インフルエンザウイルス力価の増大を阻害し、インフルエンザウイルス力価を低下させ、インフルエンザウイルス複製の増加を阻害し、インフルエンザウイルス複製を阻害し、インフルエンザウイルス増殖の増加を阻害し、インフルエンザウイルス増殖を減少し、又は被験体におけるインフルエンザウイルス感染に付随する1以上の症状又は合併症の増悪、重症度、頻度、罹患期間若しくは罹患可能性を減少させることを含む、請求項91に記載の方法。
【請求項93】
症状又は合併症が、悪寒、発熱、咳、咽頭痛、鼻閉、副鼻腔閉、鼻の感染症、副鼻腔感染症、体痛、頭痛、倦怠感、肺炎、気管支炎、耳感染、耳痛、又は死亡から選択される、請求項92に記載の方法。
【請求項94】
治療効果として被験体がインフルエンザウイルス感染から回復するのを早めることを含む、請求項91に記載の方法。
【請求項95】
インフルエンザウイルスがヒト又は鳥インフルエンザである、請求項88に記載の方法。
【請求項96】
インフルエンザウイルスが、A/PR/8/34 (H1N1)、A/HK/1/68 (H3N2)、A/HK/1/68(H3N2)、A/HK/156/97、A/トルコ/VA/158512/02、A/ベトナム/1196/04、若しくはH1N1、H2N2、H3N2、H5N1、H9N2、H2N1、H4N6、H6N2、H7N2、H7N3、H4N8、H5N2、H2N3、H11N9、H3N8、H1N2、H11N2、H11N9、H7N7、H2N3、H6N1、H13N6、H7N1、H11N1、H7N2及びH5N3サブタイプから選択される株又は分離株である、請求項88に記載の方法。
【請求項97】
LLTEVETPIR (配列番号:1)で表される最小結合配列に結合する、請求項88に記載の方法。
【請求項98】
1以上のインフルエンザウイルス株又は分離株による被験体への感染を阻害する方法であって、1以上のインフルエンザウイルス株又は分離株による被験体の感染を阻害するのに有効量の請求項1〜71のいずれか1項に記載の抗体又はサブ配列を被験体に投与することを含む、前記方法。
【請求項99】
被験体がインフルエンザウイルスにまだ感染していない、請求項98に記載の方法。
【請求項100】
被験体がインフルエンザウイルス感染に付随する1以上の症状又は合併症を呈していない、請求項98に記載の方法。
【請求項101】
被験体がインフルエンザに暴露又は接触したが、インフルエンザウイルス感染に付随する1以上の症状又は合併症を呈さない、請求項98に記載の方法。
【請求項102】
被験体がインフルエンザウイルスに感染する前、感染と実質的に同時、又は感染した後に抗体を投与する、請求項98に記載の方法。
【請求項103】
被験体が免疫不全である、請求項98に記載の方法。
【請求項104】
投与により治療又は予防効果がもたらされる、請求項98に記載の方法。
【請求項105】
該効果が被験体をインフルエンザウイルス感染から保護すること、又はインフルエンザウイルス感染に対する被験体の感受性を減少させることを含む、請求項104に記載の方法。
【請求項106】
インフルエンザウイルス株又は分離株がヒト又は鳥インフルエンザのものである、請求項98に記載の方法。
【請求項107】
インフルエンザウイルス株又は分離株が、A/PR/8/34 (H1N1)、A/HK/1/68 (H3N2)、A/HK/1/68(H3N2)、A/HK/156/97、A/トルコ/VA/158512/02、A/ベトナム/1196/04、又はH1N1、H2N2、H3N2、H5N1、H9N2、H2N1、H4N6、H6N2、H7N2、H7N3、H4N8、H5N2、H2N3、H11N9、H3N8、H1N2、H11N2、H11N9、H7N7、H2N3、H6N1、H13N6、H7N1、H11N1、H7N2及びH5N3サブタイプから選択される、請求項98に記載の方法。
【請求項108】
配列番号:32、33及び36で規定の核酸配列でコードされる重鎖可変配列若しくは軽鎖可変配列、又は配列番号:32、33及び36で規定の核酸が縮重した核酸配列を有する請求項98に記載の方法。
【請求項109】
抗体が配列番号:34、35及び37で規定の重鎖可変配列若しくは軽鎖可変配列を有する、請求項98に記載の方法。
【請求項110】
配列番号:34、35及び37で規定の重鎖可変配列若しくは軽鎖可変配列をコードする核酸。
【請求項111】
配列番号:32、33及び36で規定の重鎖可変及び定常領域配列、若しくは軽鎖可変及び定常領域配列をコードする核酸。
【請求項112】
請求項1〜55、59〜71のいずれか1項に記載のヒトM2抗体を生産する方法であって、以下:
a) それぞれが異なるアミノ酸配列を有する少なくとも2つのM2ペプチド、又はそれぞれが異なるアミノ酸配列を有する2つのM2ペプチドの免疫原性断片を、ヒト免疫グロブリンを発現することができる動物に投与すること;
b) 該動物をヒトM2抗体の発現についてスクリーニングすること;
c) ヒトM2抗体を産生する動物を選別すること;
d) ヒトM2抗体を産生する動物から抗体を単離すること;及び
e) ヒトM2抗体がM2タンパク質に結合するかどうかを決定すること;を含む前記方法。
【請求項113】
請求項1〜55、59〜71のいずれか1項に記載のヒトM2抗体を生産する方法であって、以下:
a) それぞれが異なるアミノ酸配列を有する少なくとも2つのM2ペプチド、又はそれぞれが異なるアミノ酸配列を有する2つのM2ペプチドの免疫原性断片を、ヒト免疫グロブリンを発現することができる動物に投与すること;
b) 該動物をヒトM2抗体の発現についてスクリーニングすること;
c) ヒトM2抗体を産生する動物を選別すること;
d) ヒトM2抗体を産生する動物から脾臓細胞を単離すること;
e) 該脾臓細胞を骨髄腫細胞と融合させ、ハイブリドーマを産生すること;及び
f) ハイブリドーマをヒトM2抗体の発現についてスクリーニングすること;を含む前記方法。
【請求項114】
請求項1〜55、59〜71のいずれか1項に記載のヒトM2抗体を生産する方法であって、以下:
a) M2タンパク質内に含まれるペプチド配列を、ヒト免疫グロブリンλ軽鎖をコードする遺伝子座を有する非ヒト動物に投与すること;
b) 該動物をヒトM2抗体の発現についてスクリーニングすること;
c) ヒトM2抗体を産生する動物を選別すること;
d) ヒトM2抗体を産生する動物から脾臓細胞を単離すること;
e) 該脾臓細胞を骨髄腫細胞と融合させ、ハイブリドーマを産生すること;及び
f) ハイブリドーマをヒトM2抗体の発現についてスクリーニングすること;を含む前記方法。
【請求項115】
M2ペプチドがM2細胞外ドメインを含む、請求項112〜114のいずれか1項に記載の方法。
【請求項116】
ヒトM2抗体の最小結合配列がLLTEVETPIR (配列番号:1)と同一又は実質的に同一である、請求項112〜114のいずれか1項に記載の方法。
【請求項117】
ヒトM2抗体がLLTEVETPIR (配列番号:1)で表される最小結合配列に結合する、請求項112〜114のいずれか1項に記載の方法。
【請求項118】
動物が非ヒト動物である、請求項112又は113のいずれか1項に記載の方法。
【請求項119】
請求項1〜55、59〜71のいずれか1項に記載のヒトM2抗体を生産する方法であって:
a) ATCC 寄託番号PTA-5967又はATCC 寄託番号PTA-5968として寄託されたCHO細胞株又はハイブリドーマを準備し、ヒトM2抗体を産生させること;及び
b) CHO細胞株又はハイブリドーマから抗体を単離すること、を含む前記方法。
【請求項120】
請求項1〜55、59〜71のいずれか1項に記載のヒトM2抗体を生産する方法であって:
a) ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株又はハイブリドーマにより産生された抗体の結合特異性を有するヒトM2抗体を産生する動物を準備すること;
b) ヒトM2抗体を産生する動物から脾臓細胞を単離すること;
c) 該脾臓細胞を骨髄腫細胞と融合させ、ハイブリドーマを産生すること;及び
d) ハイブリドーマを、ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株又はハイブリドーマにより産生された抗体の結合特異性を有するヒトM2抗体の発現についてスクリーニングすること;
を含む前記方法。
【請求項121】
動物又は細胞が非ヒトである、請求項119又は120に記載の方法。
【請求項122】
動物又は細胞がATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株及びハイブリドーマにより産生された抗体と同一又は実質的に同一の結合親和性を有する抗体を発現する、請求項119又は120に記載の方法。
【請求項123】
ヒトM2抗体の最小結合配列が、LLTEVETPIR (配列番号:1)と同一又は実質的に同一である、請求項119又は120に記載の方法。
【請求項124】
ヒトM2抗体がLLTEVETPIR (配列番号:1)で表される最小結合配列に結合する、請求項119又は120に記載の方法。
【請求項1】
インフルエンザA型ウイルスタンパク質M2の細胞外ドメインに存在するエピトープに特異的に結合する単離抗体であって、ATCC PTA-5967として寄託されたCHO細胞又はATCC PTA-5968として寄託されたハイブリドーマにより産生された抗体が特異的に結合するエピトープに結合する前記単離抗体。
【請求項2】
アミノ酸配列LLTEVETPIR (配列番号:1)内のエピトープに結合する、請求項1に記載の抗体。
【請求項3】
ATCC PTA-5967として寄託されたCHO細胞又はATCC PTA-5968として寄託されたハイブリドーマにより産生された抗体が特異的に結合するのと同一の結合特異性を有する、請求項1に記載の抗体。
【請求項4】
ATCC PTA-5967として寄託されたCHO細胞又はATCC PTA-5968として寄託されたハイブリドーマにより産生された抗体が特異的に結合するのと同一の最小結合配列を有する、請求項1に記載の抗体。
【請求項5】
LLTEVETPIR(配列番号:1)で表される最小結合配列に結合する、請求項1に記載の抗体。
【請求項6】
抗体結合に必要な最小結合配列がLLTEVETPIR (配列番号:1)である、請求項1に記載の抗体。
【請求項7】
ATCC PTA-5968として寄託されたハイブリドーマにより産生された抗体の重鎖及び軽鎖可変領域の配列を含む、請求項1に記載の抗体。
【請求項8】
ATCC PTA-5967として寄託されたCHO細胞により産生された抗体の重鎖及び軽鎖可変領域の配列を含む、請求項1に記載の抗体。
【請求項9】
実施例1に記載の重鎖可変領域の成熟部分及び実施例1に記載の軽鎖可変領域の成熟部分を含む、請求項8に記載の抗体。
【請求項10】
ATCC PTA-5967として寄託されたCHO細胞により産生された抗体の重鎖及び軽鎖の可変領域及び定常領域の配列を含む、請求項1に記載の抗体。
【請求項11】
ATCC PTA-5968として寄託されたハイブリドーマにより産生された抗体の重鎖及び軽鎖の可変領域及び定常領域の配列を含む、請求項1に記載の抗体。
【請求項12】
実施例1に記載の重鎖可変及び定常領域の配列を有する成熟部分及び実施例1に示される軽鎖可変及び定常領域の配列を有する成熟部分を含む、請求項1に記載の抗体。
【請求項13】
抗体のサブクラスがヒトIgG1、ヒトIgG2、ヒトIgG3及びヒトIgG4から選択される、請求項1に記載の抗体。
【請求項14】
抗体のサブクラスがヒトIgG1である、請求項13に記載の抗体。
【請求項15】
ATCC PTA-5968として寄託されたハイブリドーマにより産生された抗体が結合するM2ペプチドの最小結合配列に結合する、或いはATCC PTA-5968として寄託されたハイブリドーマにより産生された抗体が結合するM2ペプチドの最小結合配列と実質的に同一の配列に結合する、請求項1に記載の抗体。
【請求項16】
ATCC PTA-5967として寄託されたCHO細胞により産生された抗体が結合するM2ペプチドの最小結合配列に結合する、或いはATCC PTA-5967として寄託されたCHO細胞により産生された抗体が結合するM2ペプチドの最小結合配列と実質的に同一の配列に結合する、請求項1に記載の抗体。
【請求項17】
細胞外ドメインが以下:
SLLTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRSEWGCRCNDSGD; SLLTEVETPIRNEWECRCNGSSD; SLPTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRNEWGCRCNGSSD; SLLTEVDTLTRNGWGCRCSDSSD; SLLTEVETPIRKEWGCNCSDSSD; SLLTEVETLIRNGWGCRCSDSSD; SLLTEVETLTKNGWGCRCSDSSD; SLLTEVETPIRSEWGCRYNDSSD; SLLTEVETPTRNGWECKCSDSSD; SLLTEVETHTRNGWECKCSDSSD; SLLTEVKTPTRNGWECKCSDSSD; SLLTEVETLTRNGWGCRCSDSSD; SLLTEVETPTRDGWECKCSDSSD; SLLTEVETPTRNGWGCRCSDSSD; SLLTEVETPTRNGWECKCNDSSD; SLLTEVETLTRNGWECKCSDSSD; SLLTEVETPIRNEWGCKCNDSSD; SFLTEVETPIRNEWGCRCNGSSD; SLLTEVETPTRNGWECRCNDSSD; SLLTEVETPIRKGWECNCSDSSD; SLLTEVETPTRNEWECRCSDSSD; SLLTGVETHTRNGWGCKCSDSSD及びSLLPEVETHTRNGWGCRCSDSSD (それぞれ配列番号:2〜26に相当する)
から選択される配列を有する、請求項1に記載の抗体。
【請求項18】
以下のM2細胞外ドメイン配列:
SLLTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRSEWGCRCNDSGD; SLLTEVETPIRNEWECRCNGSSD; SLPTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRNEWGCRCNGSSD; SLLTEVDTLTRNGWGCRCSDSSD; SLLTEVETPIRKEWGCNCSDSSD; SLLTEVETLIRNGWGCRCSDSSD; SLLTEVETLTKNGWGCRCSDSSD; SLLTEVETPIRSEWGCRYNDSSD; SLLTEVETPTRNGWECKCSDSSD; SLLTEVETHTRNGWECKCSDSSD; SLLTEVKTPTRNGWECKCSDSSD; SLLTEVETLTRNGWGCRCSDSSD; SLLTEVETPTRDGWECKCSDSSD; SLLTEVETPTRNGWGCRCSDSSD; SLLTEVETPTRNGWECKCNDSSD; SLLTEVETLTRNGWECKCSDSSD; SLLTEVETPIRNEWGCKCNDSSD; SFLTEVETPIRNEWGCRCNGSSD; SLLTEVETPTRNGWECRCNDSSD; SLLTEVETPIRKGWECNCSDSSD; SLLTEVETPTRNEWECRCSDSSD; SLLTGVETHTRNGWGCKCSDSSD及びSLLPEVETHTRNGWGCRCSDSSD (それぞれ配列番号:2〜26に相当する)
から選択される18以上の配列に結合する、請求項1に記載の抗体。
【請求項19】
異なるアミノ酸配列を有する2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20個のM2細胞外ドメインに結合する、請求項1に記載の抗体。
【請求項20】
番号Z3G1 (ATCC寄託番号PTA-5967; American Type Culture Collection, Manassas, VA, USAに2004年3月13日に寄託された)又は番号Z3G3 (Z3.16.25.1) (ATCC寄託番号PTA-5968;American Type Culture Collection, Manassas, VA, USAに2004年3月13日に寄託された)で表示される細胞株(例えば、ハイブリドーマ又はCHO細胞株)により産生された抗体が結合するM2変異体配列であって、少なくとも2〜5、5〜10、10〜15、15〜20、20〜25又はそれより多い該配列に結合するか弱く結合する、請求項1に記載の抗体。
【請求項21】
番号Z3G1 (ATCC寄託番号PTA-5967; American Type Culture Collection, Manassas, VA, USAに2004年3月13日に寄託された)又は番号Z3G3 (Z3.16.25.1) (ATCC寄託番号PTA-5968;American Type Culture Collection, Manassas, VA, USAに2004年3月13日に寄託された)で表示される細胞株(例えば、ハイブリドーマ又はCHO細胞株)により産生された抗体が結合するM2変異体配列であって、少なくとも2〜5、5〜10、10〜15、15〜20、20〜25又はそれより多い該配列に結合するか弱く結合するが、抗M2抗体L66、N547、C40G1又は14C2抗体が結合するM2配列には結合しないか極弱くしか結合しない、請求項1に記載の抗体。
【請求項22】
M2細胞外ドメイン配列が以下:
SLLTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRSEWGCRCNDSGD; SLLTEVETPIRNEWECRCNGSSD; SLPTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRNEWGCRCNGSSD; SLLTEVDTLTRNGWGCRCSDSSD; SLLTEVETPIRKEWGCNCSDSSD; SLLTEVETLIRNGWGCRCSDSSD; SLLTEVETLTKNGWGCRCSDSSD; SLLTEVETPIRSEWGCRYNDSSD; SLLTEVETPTRNGWECKCSDSSD; SLLTEVETHTRNGWECKCSDSSD; SLLTEVKTPTRNGWECKCSDSSD; SLLTEVETLTRNGWGCRCSDSSD; SLLTEVETPTRDGWECKCSDSSD; SLLTEVETPTRNGWGCRCSDSSD; SLLTEVETPTRNGWECKCNDSSD; SLLTEVETLTRNGWECKCSDSSD; SLLTEVETPIRNEWGCKCNDSSD; SFLTEVETPIRNEWGCRCNGSSD; SLLTEVETPTRNGWECRCNDSSD; SLLTEVETPIRKGWECNCSDSSD; SLLTEVETPTRNEWECRCSDSSD; SLLTGVETHTRNGWGCKCSDSSD及びSLLPEVETHTRNGWGCRCSDSSD (それぞれ配列番号:2〜26に相当する)
から選択される、請求項21に記載の抗体。
【請求項23】
2以上のM2細胞外ドメイン配列に結合する抗体であって、M2ペプチドSLLTEVETPIRNEWGCRCNDSSD (配列番号:2)に対し量として少なくとも20〜50%以上結合する、請求項21に記載の抗体。
【請求項24】
検出可能な程度の補体依存性細胞障害活性を有する、請求項1に記載の抗体。
【請求項25】
検出可能な程度の抗体依存性細胞媒介性細胞傷害活性を有する、請求項1に記載の抗体。
【請求項26】
抗体がIgG、IgA、IgM、IgE及びIgDアイソタイプから選択される、請求項1に記載の抗体。
【請求項27】
IgGアイソタイプがIgG1、IgG2、IgG3及びIgG4から選択される、請求項26に記載の抗体。
【請求項28】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株又はハイブリドーマにより産生された、請求項1に記載の抗体。
【請求項29】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株又はハイブリドーマにより産生された抗体と同一又は実質的に同一の結合親和性を有する、請求項1に記載の抗体。
【請求項30】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株又はハイブリドーマにより産生された抗体の約5〜5000倍以内の結合親和性を有する、請求項1に記載の抗体。
【請求項31】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株又はハイブリドーマにより産生された抗体が結合するのと実質的に同一のM2ペプチドの最小結合配列に結合する、請求項1に記載の抗体。
【請求項32】
M2ペプチドがSLLTEVETPIRNEWGCRCNDSSD (配列番号:2)のアミノ酸配列からなる、請求項31に記載の抗体。
【請求項33】
細胞へのインフルエンザウイルス感染、インフルエンザウイルス増殖又はインフルエンザウイルス複製をin vitro又はin vivoで阻害する、請求項1に記載の抗体。
【請求項34】
細胞へのインフルエンザウイルスの結合をin vitro又はin vivoで阻害する、請求項1に記載の抗体。
【請求項35】
被験体において、インフルエンザウイルス力価の増大を阻害し、インフルエンザウイルス力価を低下させ、インフルエンザウイルスの複製又は増殖を減少させ、或いはインフルエンザウイルス感染に付随する1以上の症状又は合併症を減少させる、請求項1に記載の抗体。
【請求項36】
インフルエンザウイルスに暴露したか又は感染した後の被験体において、インフルエンザウイルス力価の増大を阻害し、インフルエンザウイルス力価を低下させ、インフルエンザウイルスの複製又は増殖を減少させ、或いはインフルエンザウイルス感染に付随する1以上の症状又は合併症を減少させる、請求項1に記載の抗体。
【請求項37】
該症状又は合併症が、悪寒、発熱、咳、咽頭痛、鼻閉、副鼻腔閉、鼻の感染症、副鼻腔感染症、体痛、頭痛、倦怠感、肺炎、気管支炎、耳感染、耳痛、又は死亡から選択される、請求項35又は36に記載の抗体。
【請求項38】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株若しくはハイブリドーマにより産生された抗体の結合特異性又は同一若しくは実質的に同一の結合親和性有する、請求項35又は36に記載の抗体。
【請求項39】
被験体へのインフルエンザウイルス感染を阻害し、ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株若しくはハイブリドーマにより産生された抗体と同一若しくは実質的に同一の結合特異性又は同一の結合親和性を有する、請求項1に記載の抗体。
【請求項40】
インフルエンザウイルス感染に対する被験体の感受性を減少させる、請求項1に記載の抗体。
【請求項41】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株若しくはハイブリドーマにより産生された抗体の結合特異性又は同一若しくは実質的に同一の結合親和性を有する、請求項40に記載の抗体。
【請求項42】
インフルエンザA型ウイルスタンパク質M2がヒト又は鳥インフルエンザA型ウイルスである、請求項1に記載の抗体。
【請求項43】
インフルエンザA型ウイルスが、A/PR/8/34 (H1N1)、A/HK/1/68 (H3N2)、A/HK/1/68(H3N2)、A/HK/156/97、A/トルコ/VA/158512/02、及びA/ベトナム/1196/04から選択されるか、又はH1N1、H2N2、H3N2、H5N1、H9N2、H2N1、H4N6、H6N2、H7N2、H7N3、H4N8、H5N2、H2N3、H11N9、H3N8、H1N2、H11N2、H11N9、H7N7、H2N3、H6N1、H13N6、H7N1、H11N1、H7N2及びH5N3サブタイプから選択される株又は分離株である、請求項42に記載の抗体。
【請求項44】
MDCK細胞に対するインフルエンザA型ウイルス感染の阻害に関して、細胞ベースのELISAアッセイで測定したEC50が2.0〜3.0、1.0〜2.0、0.5〜1.0、0.1〜0.5より低いか、又は0.1μg/mlより低い、請求項1に記載の抗体。
【請求項45】
MDCK細胞に対するインフルエンザA型ウイルス感染の阻害に関して、細胞ベースのELISAアッセイで測定したEC50が0.05〜0.1μg/mlより低い、請求項1に記載の抗体。
【請求項46】
インフルエンザA型ウイルスが、A/PR/8/34 (H1N1)、A/HK/1/68 (H3N2)、A/HK/1/68(H3N2)、A/HK/156/97、A/トルコ/VA/158512/02、及びA/ベトナム/1196/04から選択されるか、又はH1N1、H2N2、H3N2、H5N1、H9N2、H2N1、H4N6、H6N2、H7N2、H7N3、H4N8、H5N2、H2N3、H11N9、H3N8、H1N2、H11N2、H11N9、H7N7、H2N3、H6N1、H13N6、H7N1、H11N1、H7N2及びH5N3サブタイプから選択される株若しくは分離株である、請求項44又は45に記載の抗体。
【請求項47】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株若しくはハイブリドーマにより産生された抗体の結合特異性又は同一若しくは実質的に同一の結合親和性を有する、請求項44又は45に記載の抗体。
【請求項48】
MDCK細胞に対するM2の結合阻害に関して、細胞ベースのELISAアッセイで測定したEC50が2.0〜3.0、1.0〜2.0、0.5〜1.0、0.1〜0.5より低いか、又は0.1μg/mlより低い、請求項1に記載の抗体。
【請求項49】
MDCK細胞に対するM2の結合阻害に関して、細胞ベースのELISAアッセイで測定したEC50が0.05〜0.1μg/mlより低い、請求項1に記載の抗体。
【請求項50】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株若しくはハイブリドーマにより産生された抗体の結合特異性又は同一若しくは実質的に同一の結合親和性を有する、請求項48又は49に記載の抗体。
【請求項51】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株若しくはハイブリドーマにより産生された抗体と同一のエピトープを認識する、請求項1に記載の抗体。
【請求項52】
2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20又はそれよい多い異なるインフルエンザウイルス株又は分離株又はサブタイプに特異的に結合する、請求項1に記載の抗体。
【請求項53】
インフルエンザウイルス株又は分離株又はサブタイプが異なるM2細胞外ドメイン配列を有する、請求項52に記載の抗体。
【請求項54】
インフルエンザウイルス株又は分離株又はサブタイプが以下:
SLLTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRSEWGCRCNDSGD; SLLTEVETPIRNEWECRCNGSSD; SLPTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRNEWGCRCNGSSD; SLLTEVDTLTRNGWGCRCSDSSD; SLLTEVETPIRKEWGCNCSDSSD; SLLTEVETLIRNGWGCRCSDSSD; SLLTEVETLTKNGWGCRCSDSSD; SLLTEVETPIRSEWGCRYNDSSD; SLLTEVETPTRNGWECKCSDSSD; SLLTEVETHTRNGWECKCSDSSD; SLLTEVKTPTRNGWECKCSDSSD; SLLTEVETLTRNGWGCRCSDSSD; SLLTEVETPTRDGWECKCSDSSD; SLLTEVETPTRNGWGCRCSDSSD; SLLTEVETPTRNGWECKCNDSSD; SLLTEVETLTRNGWECKCSDSSD; SLLTEVETPIRNEWGCKCNDSSD; SFLTEVETPIRNEWGCRCNGSSD; SLLTEVETPTRNGWECRCNDSSD; SLLTEVETPIRKGWECNCSDSSD; SLLTEVETPTRNEWECRCSDSSD; SLLTGVETHTRNGWGCKCSDSSD及びSLLPEVETHTRNGWGCRCSDSSD (それぞれ配列番号:2〜26に相当する)
から選択されるM2細胞外ドメイン配列を有する、請求項52に記載の抗体。
【請求項55】
複数のインフルエンザウイルス株又は分離株に結合し、それぞれの株又は分離株が以下:
SLLTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRSEWGCRCNDSGD; SLLTEVETPIRNEWECRCNGSSD; SLPTEVETPIRNEWGCRCNDSSD; SLLTEVETPIRNEWGCRCNGSSD; SLLTEVDTLTRNGWGCRCSDSSD; SLLTEVETPIRKEWGCNCSDSSD; SLLTEVETLIRNGWGCRCSDSSD; SLLTEVETLTKNGWGCRCSDSSD; SLLTEVETPIRSEWGCRYNDSSD; SLLTEVETPTRNGWECKCSDSSD; SLLTEVETHTRNGWECKCSDSSD; SLLTEVKTPTRNGWECKCSDSSD; SLLTEVETLTRNGWGCRCSDSSD; SLLTEVETPTRDGWECKCSDSSD; SLLTEVETPTRNGWGCRCSDSSD; SLLTEVETPTRNGWECKCNDSSD; SLLTEVETLTRNGWECKCSDSSD; SLLTEVETPIRNEWGCKCNDSSD; SFLTEVETPIRNEWGCRCNGSSD; SLLTEVETPTRNGWECRCNDSSD; SLLTEVETPIRKGWECNCSDSSD; SLLTEVETPTRNEWECRCSDSSD; SLLTGVETHTRNGWGCKCSDSSD及びSLLPEVETHTRNGWGCRCSDSSD (それぞれ配列番号:2〜26に相当する)
から選択されるM2細胞外ドメイン配列を有する、請求項52に記載の抗体。
【請求項56】
請求項1に記載の抗体のアミノ酸配列。
【請求項57】
サブ配列が請求項1に記載の抗体の結合特異性又は同一若しくは実質的に同一の結合親和性を有する、請求項56に記載のアミノ酸配列。
【請求項58】
サブ配列が、重鎖及び軽鎖可変領域(VH及びVL)、Fab、Fab’、F(ab’)2、Fv、Fd、scFv、及びsdFvから選択される、請求項56に記載のアミノ酸配列。
【請求項59】
多量体抗体を含む、請求項1に記載の抗体。
【請求項60】
1以上の異種ドメインをさらに含む、請求項1に記載の抗体又は請求項56に記載のアミノ酸サブ配列。
【請求項61】
異種ドメインがアミノ酸配列を含む、請求項60に記載の抗体又はサブ配列。
【請求項62】
異種ドメインが結合タンパク質、酵素活性、薬剤、抗ウイルス剤、毒素、免疫調節剤、検出可能な成分又はタグを含む、請求項60に記載の抗体又はサブ配列。
【請求項63】
二重特異性抗体又は二機能性抗体である、請求項1に記載の抗体。
【請求項64】
ヒト免疫グロブリンλ軽鎖をコードする遺伝子座を有する非ヒト動物により産生された、請求項1に記載の抗体。
【請求項65】
非ヒト動物が哺乳動物を含む、請求項64に記載の抗体。
【請求項66】
哺乳動物が内因性免疫グロブリンを発現しない、請求項65に記載の抗体。
【請求項67】
非ヒト動物がマウスを含む、請求項64に記載の抗体。
【請求項68】
マウスが内因性免疫グロブリンを発現しない、請求項67に記載の抗体。
【請求項69】
M2タンパク質配列のN末端側の1〜24位のアミノ酸残基内に含まれるエピトープに結合する、請求項64に記載の抗体。
【請求項70】
M2タンパク質配列のN末端側の2〜12位のアミノ酸残基内に含まれるエピトープに結合する、請求項64に記載の抗体。
【請求項71】
ATCC PTA-5968として寄託されたハイブリドーマ若しくはATCC PTA-5967として寄託されたCHO細胞株により産生された抗体が結合するM2ペプチドの最小結合配列に結合する、請求項64に記載の抗体。
【請求項72】
請求項1〜71のいずれか1項に記載の抗体又はサブ配列を発現する宿主細胞。
【請求項73】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株若しくはハイブリドーマにより産生された抗体の結合特異性又は同一若しくは実質的に同一の結合親和性を有する、請求項72に記載の宿主細胞。
【請求項74】
細胞が細菌、酵母、植物、又は動物のものである、請求項72に記載の宿主細胞。
【請求項75】
請求項1〜71のいずれか1項に記載の抗体又はサブ配列を発現する非ヒトトランスジェニック動物又は植物。
【請求項76】
ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株若しくはハイブリドーマにより産生された抗体をコードする核酸。
【請求項77】
ベクターをさらに含む、請求項76に記載の核酸。
【請求項78】
請求項1〜71のいずれか1項に記載の抗体又はサブ配列、及び抗ウイルス剤を含む組成物。
【請求項79】
請求項1〜71のいずれか1項に記載の抗体又はサブ配列、及びインフルエンザウイルス感染に付随する1以上の症状又は合併症を阻害する薬剤を含む組成物。
【請求項80】
症状又は合併症が、悪寒、発熱、咳、咽頭痛、鼻閉、副鼻腔閉、鼻の感染症、副鼻腔感染症、体痛、頭痛、倦怠感、肺炎、気管支炎、耳感染、耳痛、又は死亡から選択される、請求項79に記載の組成物。
【請求項81】
請求項1〜71のいずれか1項に記載の抗体又はサブ配列、及び製薬上許容される担体又は賦形剤を含んでなる医薬組成物。
【請求項82】
請求項1〜71のいずれか1項に記載の抗体又はサブ配列、及び1以上のインフルエンザウイルス株若しくは分離株による被験体への感染を治療する、阻害する、予防する、若しくは感染感受性を減少させるための使用説明書を含むキット。
【請求項83】
抗体を粘膜組織へ送達させる製品をさらに含む、請求項82に記載のキット。
【請求項84】
製品が被験体への吸入投与又は鼻腔内投与に適した吸入器、エアロゾル、スプレー又は小型容器を含む、請求項82に記載のキット。
【請求項85】
粘膜組織に鼻腔、副鼻腔、口、咽喉、喉頭又は肺が含まれる、請求項82に記載のキット。
【請求項86】
抗ウイルス剤をさらに含む、請求項82に記載のキット。
【請求項87】
インフルエンザウイルス感染に付随する1以上の症状又は合併症を阻害する薬剤をさらに含む、請求項82に記載のキット。
【請求項88】
被験体へのインフルエンザ感染を治療する方法であって、被験体へのインフルエンザ感染を治療するのに有効量の請求項1〜71のいずれか1項に記載の抗体又はサブ配列を被験体に投与することを含む、前記方法。
【請求項89】
被験体がインフルエンザウイルスに感染する前、感染と実質的に同時、又は感染後に抗体を投与する、請求項88に記載の方法。
【請求項90】
被験体が免疫不全である、請求項88に記載の方法。
【請求項91】
投与により治療効果がもたらされる、請求項88に記載の方法。
【請求項92】
該治療効果が、インフルエンザウイルス力価の増大を阻害し、インフルエンザウイルス力価を低下させ、インフルエンザウイルス複製の増加を阻害し、インフルエンザウイルス複製を阻害し、インフルエンザウイルス増殖の増加を阻害し、インフルエンザウイルス増殖を減少し、又は被験体におけるインフルエンザウイルス感染に付随する1以上の症状又は合併症の増悪、重症度、頻度、罹患期間若しくは罹患可能性を減少させることを含む、請求項91に記載の方法。
【請求項93】
症状又は合併症が、悪寒、発熱、咳、咽頭痛、鼻閉、副鼻腔閉、鼻の感染症、副鼻腔感染症、体痛、頭痛、倦怠感、肺炎、気管支炎、耳感染、耳痛、又は死亡から選択される、請求項92に記載の方法。
【請求項94】
治療効果として被験体がインフルエンザウイルス感染から回復するのを早めることを含む、請求項91に記載の方法。
【請求項95】
インフルエンザウイルスがヒト又は鳥インフルエンザである、請求項88に記載の方法。
【請求項96】
インフルエンザウイルスが、A/PR/8/34 (H1N1)、A/HK/1/68 (H3N2)、A/HK/1/68(H3N2)、A/HK/156/97、A/トルコ/VA/158512/02、A/ベトナム/1196/04、若しくはH1N1、H2N2、H3N2、H5N1、H9N2、H2N1、H4N6、H6N2、H7N2、H7N3、H4N8、H5N2、H2N3、H11N9、H3N8、H1N2、H11N2、H11N9、H7N7、H2N3、H6N1、H13N6、H7N1、H11N1、H7N2及びH5N3サブタイプから選択される株又は分離株である、請求項88に記載の方法。
【請求項97】
LLTEVETPIR (配列番号:1)で表される最小結合配列に結合する、請求項88に記載の方法。
【請求項98】
1以上のインフルエンザウイルス株又は分離株による被験体への感染を阻害する方法であって、1以上のインフルエンザウイルス株又は分離株による被験体の感染を阻害するのに有効量の請求項1〜71のいずれか1項に記載の抗体又はサブ配列を被験体に投与することを含む、前記方法。
【請求項99】
被験体がインフルエンザウイルスにまだ感染していない、請求項98に記載の方法。
【請求項100】
被験体がインフルエンザウイルス感染に付随する1以上の症状又は合併症を呈していない、請求項98に記載の方法。
【請求項101】
被験体がインフルエンザに暴露又は接触したが、インフルエンザウイルス感染に付随する1以上の症状又は合併症を呈さない、請求項98に記載の方法。
【請求項102】
被験体がインフルエンザウイルスに感染する前、感染と実質的に同時、又は感染した後に抗体を投与する、請求項98に記載の方法。
【請求項103】
被験体が免疫不全である、請求項98に記載の方法。
【請求項104】
投与により治療又は予防効果がもたらされる、請求項98に記載の方法。
【請求項105】
該効果が被験体をインフルエンザウイルス感染から保護すること、又はインフルエンザウイルス感染に対する被験体の感受性を減少させることを含む、請求項104に記載の方法。
【請求項106】
インフルエンザウイルス株又は分離株がヒト又は鳥インフルエンザのものである、請求項98に記載の方法。
【請求項107】
インフルエンザウイルス株又は分離株が、A/PR/8/34 (H1N1)、A/HK/1/68 (H3N2)、A/HK/1/68(H3N2)、A/HK/156/97、A/トルコ/VA/158512/02、A/ベトナム/1196/04、又はH1N1、H2N2、H3N2、H5N1、H9N2、H2N1、H4N6、H6N2、H7N2、H7N3、H4N8、H5N2、H2N3、H11N9、H3N8、H1N2、H11N2、H11N9、H7N7、H2N3、H6N1、H13N6、H7N1、H11N1、H7N2及びH5N3サブタイプから選択される、請求項98に記載の方法。
【請求項108】
配列番号:32、33及び36で規定の核酸配列でコードされる重鎖可変配列若しくは軽鎖可変配列、又は配列番号:32、33及び36で規定の核酸が縮重した核酸配列を有する請求項98に記載の方法。
【請求項109】
抗体が配列番号:34、35及び37で規定の重鎖可変配列若しくは軽鎖可変配列を有する、請求項98に記載の方法。
【請求項110】
配列番号:34、35及び37で規定の重鎖可変配列若しくは軽鎖可変配列をコードする核酸。
【請求項111】
配列番号:32、33及び36で規定の重鎖可変及び定常領域配列、若しくは軽鎖可変及び定常領域配列をコードする核酸。
【請求項112】
請求項1〜55、59〜71のいずれか1項に記載のヒトM2抗体を生産する方法であって、以下:
a) それぞれが異なるアミノ酸配列を有する少なくとも2つのM2ペプチド、又はそれぞれが異なるアミノ酸配列を有する2つのM2ペプチドの免疫原性断片を、ヒト免疫グロブリンを発現することができる動物に投与すること;
b) 該動物をヒトM2抗体の発現についてスクリーニングすること;
c) ヒトM2抗体を産生する動物を選別すること;
d) ヒトM2抗体を産生する動物から抗体を単離すること;及び
e) ヒトM2抗体がM2タンパク質に結合するかどうかを決定すること;を含む前記方法。
【請求項113】
請求項1〜55、59〜71のいずれか1項に記載のヒトM2抗体を生産する方法であって、以下:
a) それぞれが異なるアミノ酸配列を有する少なくとも2つのM2ペプチド、又はそれぞれが異なるアミノ酸配列を有する2つのM2ペプチドの免疫原性断片を、ヒト免疫グロブリンを発現することができる動物に投与すること;
b) 該動物をヒトM2抗体の発現についてスクリーニングすること;
c) ヒトM2抗体を産生する動物を選別すること;
d) ヒトM2抗体を産生する動物から脾臓細胞を単離すること;
e) 該脾臓細胞を骨髄腫細胞と融合させ、ハイブリドーマを産生すること;及び
f) ハイブリドーマをヒトM2抗体の発現についてスクリーニングすること;を含む前記方法。
【請求項114】
請求項1〜55、59〜71のいずれか1項に記載のヒトM2抗体を生産する方法であって、以下:
a) M2タンパク質内に含まれるペプチド配列を、ヒト免疫グロブリンλ軽鎖をコードする遺伝子座を有する非ヒト動物に投与すること;
b) 該動物をヒトM2抗体の発現についてスクリーニングすること;
c) ヒトM2抗体を産生する動物を選別すること;
d) ヒトM2抗体を産生する動物から脾臓細胞を単離すること;
e) 該脾臓細胞を骨髄腫細胞と融合させ、ハイブリドーマを産生すること;及び
f) ハイブリドーマをヒトM2抗体の発現についてスクリーニングすること;を含む前記方法。
【請求項115】
M2ペプチドがM2細胞外ドメインを含む、請求項112〜114のいずれか1項に記載の方法。
【請求項116】
ヒトM2抗体の最小結合配列がLLTEVETPIR (配列番号:1)と同一又は実質的に同一である、請求項112〜114のいずれか1項に記載の方法。
【請求項117】
ヒトM2抗体がLLTEVETPIR (配列番号:1)で表される最小結合配列に結合する、請求項112〜114のいずれか1項に記載の方法。
【請求項118】
動物が非ヒト動物である、請求項112又は113のいずれか1項に記載の方法。
【請求項119】
請求項1〜55、59〜71のいずれか1項に記載のヒトM2抗体を生産する方法であって:
a) ATCC 寄託番号PTA-5967又はATCC 寄託番号PTA-5968として寄託されたCHO細胞株又はハイブリドーマを準備し、ヒトM2抗体を産生させること;及び
b) CHO細胞株又はハイブリドーマから抗体を単離すること、を含む前記方法。
【請求項120】
請求項1〜55、59〜71のいずれか1項に記載のヒトM2抗体を生産する方法であって:
a) ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株又はハイブリドーマにより産生された抗体の結合特異性を有するヒトM2抗体を産生する動物を準備すること;
b) ヒトM2抗体を産生する動物から脾臓細胞を単離すること;
c) 該脾臓細胞を骨髄腫細胞と融合させ、ハイブリドーマを産生すること;及び
d) ハイブリドーマを、ATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株又はハイブリドーマにより産生された抗体の結合特異性を有するヒトM2抗体の発現についてスクリーニングすること;
を含む前記方法。
【請求項121】
動物又は細胞が非ヒトである、請求項119又は120に記載の方法。
【請求項122】
動物又は細胞がATCC寄託番号PTA-5967又はATCC寄託番号PTA-5968として寄託されたCHO細胞株及びハイブリドーマにより産生された抗体と同一又は実質的に同一の結合親和性を有する抗体を発現する、請求項119又は120に記載の方法。
【請求項123】
ヒトM2抗体の最小結合配列が、LLTEVETPIR (配列番号:1)と同一又は実質的に同一である、請求項119又は120に記載の方法。
【請求項124】
ヒトM2抗体がLLTEVETPIR (配列番号:1)で表される最小結合配列に結合する、請求項119又は120に記載の方法。
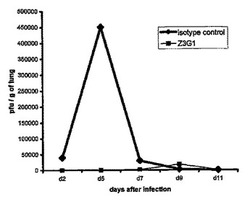
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公表番号】特表2008−522610(P2008−522610A)
【公表日】平成20年7月3日(2008.7.3)
【国際特許分類】
【出願番号】特願2007−545022(P2007−545022)
【出願日】平成17年12月5日(2005.12.5)
【国際出願番号】PCT/IB2005/004146
【国際公開番号】WO2006/061723
【国際公開日】平成18年6月15日(2006.6.15)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.フロッピー
【出願人】(307023122)キリンファーマ株式会社 (11)
【Fターム(参考)】
【公表日】平成20年7月3日(2008.7.3)
【国際特許分類】
【出願日】平成17年12月5日(2005.12.5)
【国際出願番号】PCT/IB2005/004146
【国際公開番号】WO2006/061723
【国際公開日】平成18年6月15日(2006.6.15)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.フロッピー
【出願人】(307023122)キリンファーマ株式会社 (11)
【Fターム(参考)】
[ Back to top ]

