ウイルスと糖鎖との相互作用の測定方法およびリガンド複合体
【課題】ウイルスと糖鎖との相互作用を同時に非標識で、網羅的にリアルタイムで測定する方法を提供する。
【解決手段】糖鎖固定化金属ナノ粒子を含む溶液と、ウイルスを含む溶液とを混和することによって、糖鎖−生体関連物質相互作用体を生成させる工程を含み、上記糖鎖固定化金属ナノ粒子は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、金属ナノ粒子に固定されてなる方法。
【解決手段】糖鎖固定化金属ナノ粒子を含む溶液と、ウイルスを含む溶液とを混和することによって、糖鎖−生体関連物質相互作用体を生成させる工程を含み、上記糖鎖固定化金属ナノ粒子は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、金属ナノ粒子に固定されてなる方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体関連物質と糖鎖との相互作用の測定方法であって、特に、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質であって、上記生体関連物質と、多種多様な糖鎖との相互作用を非標識で、網羅的に迅速かつ直接にリアルタイムで数値化して測定する方法、および当該測定方法を用いた、上記生体関連物質の糖鎖選択性の評価方法、上記生体関連物質のスクリーニング方法、並びに上記生体関連物質のパターニングの方法、そしてこれらの方法を実施するためのキットに関するものである。
【背景技術】
【0002】
糖鎖は、糖がグリコシド結合で複数結合した化合物であり、糖鎖を構成している糖の種類や当該糖の配列を考えると、糖の組み合わせとしては無数の組み合わせがある。そのため糖鎖の種類は多種多様である。また、糖鎖はウイルス、細胞、細菌またはタンパク質といった様々な生体関連物質と相互作用することが知られている。ゆえに、糖鎖と上述の生体関連物質との相互作用が、生体の生理状態に及ぼす影響は大きい。
【0003】
例えば、生体関連物質であるインフルエンザウイルスやエイズウイルス、B型肝炎ウイルスはヒトに感染すると重篤な疾病を引き起こすが、その感染は、ヒトの細胞の細胞膜上の糖鎖と相互作用することがきっかけで始まることが知られている。そして、ウイルスによって相互作用する糖鎖は異なるため、ウイルスの人体への感染経路や人体に及ぼす症状に違いが生じる。
【0004】
例えば、非特許文献1に開示されているように、インフルエンザウイルスの各分離株においても、当該各分離株が相互作用する糖鎖は、糖鎖を構成している糖や、当該糖の配列によって異なることが明らかとなっている。一般的に、ヒトに感染することができるインフルエンザウイルスは、N−アセチルノイラミン酸α2,3−ガラクトース(NeuAcα2,3Gal)よりもN−アセチルノイラミン酸α2,6−ガラクトース(NeuAcα2,6Gal)と強く相互作用することが知られている。
【0005】
そのため、ウイルスと糖鎖との相互作用を網羅的に測定することが、ウイルス感染の予防や治療の戦略を立てる上で重要である。
【0006】
一方、糖鎖とタンパク質に代表される生体関連物質との相互作用は、従来から、酵素標識免疫測定法やウェスタンブロット法等を用いることにより検出されている。上記検出方法は、糖鎖に結合した生体関連物質を主に蛍光物質や、酵素や、抗体を用いることで検出する方法である。
【0007】
また、他の検出方法として、非特許文献2には、糖鎖マイクロアレイによる糖鎖とタンパク質との相互作用の検出方法が開示されている。その内容とは、即ち、化学的に糖鎖を修飾したアルブミンなどに代表される糖鎖修飾タンパク質を作製し、当該糖鎖修飾タンパク質をマイクロアレイ用の媒体上に固定することにより、糖鎖を間接的に上記媒体上に固定する。そして、上記媒体とタンパク質とを反応させた後、蛍光物質を用いて上記糖鎖と上記タンパク質との相互作用を検出するというものである。
【0008】
また、非特許文献3には、金ナノ粒子上に固定された糖鎖とタンパク質との相互作用の検出方法が開示されている。その内容とは、即ち、金ナノ粒子上にアルデヒド基を有するポリエチレングリコールを固定し、当該アルデヒド基と糖鎖とを反応させることにより当該糖鎖を間接的に上記金ナノ粒子上に固定する。そして、当該金ナノ粒子とタンパク質とを反応させた後、当該金ナノ粒子の表面プラズモンバンドの強度を測定することや、透過型電子顕微鏡図を撮影することにより、上記糖鎖と上記タンパク質との相互作用を検出するというものである。
【0009】
また、非特許文献4には、金ナノ粒子上に固定された糖鎖と別の金ナノ粒子上に間接的に固定された糖鎖との相互作用の検出方法が開示されている。その内容とは、即ち、チオール基を有する糖鎖−脂肪酸を作製し、当該糖鎖−脂肪酸を金ナノ粒子上に固定する。そして、当該金ナノ粒子同士を反応させた後、透過型電子顕微鏡図を撮影することにより、当該金ナノ粒子上に固定された上記糖鎖同士の相互作用を検出するというものである。
【0010】
また、非特許文献5には、糖鎖マイクロアレイによる糖鎖と、タンパク質やヒト血清や植物の細胞壁抽出物等の生体関連物質との相互作用の網羅的な検出方法が開示されている。その内容とは、糖鎖が固定されたマイクロアレイ用の媒体と生体関連物質とを反応させた後に、蛍光物質や抗体等を用いることにより、上記糖鎖と上記生体関連物質との相互作用を検出するというものである。
【0011】
また、特許文献1には、表面プラズモン共鳴による、タンパク質と糖鎖との相互作用の測定方法が開示されている。その内容とは、糖鎖が固定された媒体とタンパク質とを反応させ、反応で生じる表面プラズモン共鳴を測定することで、上記糖鎖とタンパク質との相互作用を測定するものである。
【0012】
また、非特許文献6には、インフルエンザウイルスと糖鎖との相互作用の検出方法が開示されている。その内容は、TLCに展開した糖鎖と相互作用したインフルエンザウイルスを、抗体を用いて検出するというものである。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】WO2005/077965号公報(2005年8月25日公開)
【非特許文献】
【0014】
【非特許文献1】VIROLOGY, 1997, 227, 493−499
【非特許文献2】Angew. Chem. Int. Ed. 2006, 45, 3607−3610
【非特許文献3】J. Am. Chem. Soc. 2001, 123, 8226−8230
【非特許文献4】Angew. Chem. Int. Ed. 2001, 40, No.12, 2258−2260
【非特許文献5】Curr. Opinon Struct. Biolog., 2003, 13, 637‐645
【非特許文献6】VIROLOGY, 1992, 189, 121−131
【発明の概要】
【発明が解決しようとする課題】
【0015】
上述のように、糖鎖と上述した生体関連物質との相互作用検出に関して、様々な方法が開発されている。
【0016】
しかしながら、上述の酵素標識免疫測定法、ウェスタンブロット法、非特許文献2、非特許文献5および非特許文献6に記載の方法を用いて生体関連物質を検出するためには、生体関連物質を蛍光物質、酵素、またはビオチン等で標識する必要や、生体関連物質に特異的な抗体を用いる必要がある。
【0017】
この場合、標識することによって以下の問題が生じる。第1は、標識によって、生体関連物質内にある糖鎖との相互作用に重要な部位がマスクされる可能性があることである。そのため、正確な相互作用の測定ができないことが起こりうる。第2は、生体関連物質を標識する場合には、十分な量の生体関連物質を獲得する必要があることである。そして、十分な量の生体関連物質を獲得するためには、莫大なコストが掛かかるため、経済的に好ましくない。
【0018】
また、抗体を用いる場合には、抗体と生体関連物質との特異性を検討しなければならないという煩雑な工程が増える。第3は、標識に用いる分子が生体関連物質と非特異的な結合をしないかどうかの詳細な検討が必要となる。
【0019】
そして、生体関連物質と糖鎖との相互作用の測定は、標識された抗体と、生体関連物質のタンパク質とを反応させた後に、さらに、当該抗体の標識を検出し測定するという複数のステップを必要とする。つまり、生体関連物質と糖鎖との結合を、標識された抗体および標識を介して間接的に測定するため、実際の生体関連物質と糖鎖との結合の強度をリアルタイムで詳細に調べることはできない。
【0020】
また、生体関連物質では、タンパク質に変異が起こることが知られている。タンパク質の変異はランダムに起こるため、タンパク質の抗原部位に変異の起こった生体関連物質と糖鎖との相互作用を、抗体を用いて測定することはできない。
【0021】
特にインフルエンザウイルスに関しては、タンパク質の変異によって誕生した変異体ウイルスに対する免疫がないために、感染率や感染後の死亡率が飛躍的に高くなるということが知られている。
【0022】
上述したようにインフルエンザウイルスの感染と糖鎖との相互作用は、密接な関連があるため、インフルエンザウイルスの感染を予防するために、インフルエンザウイルスと糖鎖との相互作用を測定することは重要である。しかし、非特許文献6に記載されているように、従来法では抗体を用いてインフルエンザウイルスと糖鎖との相互作用を測定しているため、タンパク質の抗原部位に変異の起こったインフルエンザウイルスと糖鎖との相互作用を測定することはできない。
【0023】
また、上述の酵素標識免疫測定法、ウェスタンブロット法、非特許文献2、非特許文献5および非特許文献6に記載の方法では、生体関連物質と反応済みの糖鎖を再生することが困難であるため、1回の検出について、一種類の生体関連物質を用いることしかできない。そのため、複数の生体関連物質を用いて、当該生体関連物質と糖鎖との相互作用を測定する場合には、異なるロットの糖鎖を用いなければならない。従って、上記測定の結果を比較する際には、ロット間性能の差が反映される恐れがあるため、正確性の高い比較をすることができない。その結果、糖鎖に対する特異性の観点から生体関連物質のスクリーニングやパターニングをすることができない。
【0024】
また、上記非特許文献3、非特許文献4、および非特許文献6に記載の方法では、支持体に糖鎖を固定するためには、特別なリンカー化合物が付加された糖鎖(糖鎖―リンカー化合物の複合体)を合成する必要がある。そして、その合成には複雑な反応を必要とするため、作製することのできる糖鎖―リンカー化合物の複合体の種類は限定されている。それゆえ、固定できる糖鎖の種類が少ない。ゆえに、一度の測定で多種多様な糖鎖と生体関連物質との相互作用を測定することはできない。
【0025】
そのため、糖鎖と多種多様な生体関連物質との相互作用を調べる際には、ある糖鎖と生体関連物質との相互作用を測定した後、別の糖鎖と当該生体関連物質との相互作用の測定を行うという工程を何度も繰り返して行うことが必要である。それゆえ、糖鎖と多種多様な生体関連物質との相互作用を測定するには、多くの時間を要するだけでなく、多量の生体関連物質を用意することも必要である。
【0026】
さらに、上記非特許文献2に記載の方法には、上記糖鎖修飾タンパク質自体が生体関連物質と相互作用する可能性があるため、予め糖鎖修飾タンパク質が上記生体関連物質と相互作用するかどうか詳細に検討する煩雑な工程が必要になるという問題がある。
【0027】
また、上記非特許文献3や非特許文献4に記載の方法には、糖鎖を上記金ナノ粒子に固定するためには、複数の複雑な工程を必要とするという問題がある。また、上記非特許文献5に記載の方法には、上記生体関連物質を標識せずに抗体などを用いて段階的に結合させる方法があるが、標識分子がない段階では結合性を測定することは不可能であるという問題がある。
【0028】
本発明は上記の問題に鑑みてなされたものであり、その目的は、微量の生体関連物質を用いて、生体関連物質と、糖鎖との相互作用を同時に非標識で、網羅的にリアルタイムで測定し、糖鎖に対する特異性の観点から生体関連物質をスクリーニングする方法やパターニングする方法を提供することにある。なお、本明細書においては、用語「スクリーニング」は用語「同定」と交換可能に用いられ、用語「パターニング」は用語「差別化」と交換可能に用いられる。また、本明細書において、用語「密度」とは、支持体の単位面積あたりに固定されているリガンド複合体の種類を意味する。
【課題を解決するための手段】
【0029】
本発明者らは、上記課題に鑑み鋭意検討した結果、ジスルフィド結合(S−S結合)またはチオール基(SH基)を有するリンカー化合物に、糖鎖が結合している構造を含むリガンド複合体を表面に金属を備える支持体の表面に固定させたリガンド担持体に、ウイルス、細胞、細菌、リポソーム、またはミセルといった生体関連物質を含む溶液を接触させることによって、上記生体関連物質と糖鎖との相互作用を測定できることを見出し、本発明を完成させるに至った。
【0030】
即ち、本発明に係る生体関連物質と糖鎖との相互作用の測定方法は、リガンド担持体に、生体関連物質を含む溶液を接触させる工程を含み、上記リガンド担持体は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されていると共に、上記表面は金属を備えており、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質であることを特徴としている。
【0031】
上記構成によれば、上記リガンド複合体を金属−硫黄結合により、容易に上記支持体に固定することができる。なお、上記リガンド複合体には糖鎖が含まれているから、糖鎖を、糖鎖の種類に関係なく、上記支持体表面に間接的に固定することができる。
【0032】
また、上記リガンド複合体が1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されているため、1回の測定で多種多様な糖鎖と上記生体関連物質との相互作用を同時に網羅的に測定することができる。そのため、測定に用いる生体関連物質の量を減らすことができる。ゆえに、生体関連物質を多量に用意する必要がなく、微量な生体関連物質を測定に用いることができる。また、1回の測定を低コストで効率的に行うことができる。
【0033】
また、上記支持体の表面は金属を備えるため、上記接触により生じる表面プラズモン共鳴、プラズモン吸収、または水晶振動子の信号量を簡便に測定することができる。そして、上記信号量は、上記リガンド複合体の糖鎖と上記生体関連物質との相互作用の強さによって変化するため、その信号量を測定することにより、上記相互作用を1ステップで、測定し数値化することができる。ゆえに上記生体関連物質の糖鎖選択性を正確に評価することができる。
【0034】
また、上記信号量は、レーザー光等を用いて物理現象を利用してリアルタイムで測定される。従って、上記生体関連物質を標識することなくリアルタイムで直接測定することができる。また、当該相互作用を高感度で測定することができるため、用いる上記生体関連物質の量を少なくすることができる。
【0035】
その上、リガンド担持体を交換することなく、同じリガンド担持体を用いて、上記生体関連物質と糖鎖との相互作用の測定を連続して複数回行うことができる。そのため、網羅的な生体関連物質と糖鎖との相互作用の測定を再現性よく実施することができる。
【0036】
また、本発明に係る生体関連物質の糖鎖選択性の評価方法は、リガンド担持体に、生体関連物質を含む溶液を接触させて、当該生体関連物質と糖鎖との相互作用の測定を行う工程と、上記測定の結果得られる上記生体関連物質の糖鎖に対する特異性を特定する工程とを含み、上記リガンド担持体は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されていると共に、上記表面は金属を備えており、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質であることを特徴としている。
【0037】
上記構成によれば、生体関連物質と糖鎖との相互作用を測定することにより、上記生体関連物質の糖鎖に対する相互作用の強さを調べ、当該強さを特定することができる。ここで、リガンド複合体は、上記の密度で支持体に固定されている。ゆえに、上記生体関連物質の多種多様な糖鎖に対する特異性を特定することができる。その結果、生体関連物質の糖鎖選択性の網羅的な評価をすることができる。
【0038】
また、本発明に係る生体関連物質のスクリーニング方法は、リガンド担持体に、目的の生体関連物質を含む溶液または、対照の生体関連物質を含む溶液を別々に接触させて、それぞれの生体関連物質と糖鎖との相互作用の測定を行う工程と、上記測定を上記目的の生体関連物質を含む溶液を用いて行った場合の結果と、上記測定を上記対照の生体関連物質を含む溶液を用いて行った場合の結果とを比較し、上記結果を一致させる工程とを含み、上記リガンド担持体は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されていると共に、上記表面は金属を備えており、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質であることを特徴としている。
【0039】
上記構成によれば、目的の上記生体関連物質を含む溶液を用いて行った場合の測定結果と対照の上記生体関連物質を含む溶液を用いて行った場合の測定結果とを比較し、当該測定結果を一致させることができる。換言すれば、目的の上記生体関連物質の糖鎖に対する特異性と、対照の上記生体関連物質の糖鎖に対する特異性とを比較し、当該特異性を一致させることができる。そのため、上記生体関連物質の糖鎖に対する特異性の観点から、目的の上記生体関連物質をスクリーニングすることができる。
【0040】
また、上記密度で上記リガンド担持体が固定されているリガンド担持体を交換することなく、同じリガンド担持体を用いて、上記目的の生体関連物質または、上記対照の生体関連物質と糖鎖との相互作用の測定を連続して複数回行うことができる。そのため、網羅的な生体関連物質と糖鎖との相互作用の測定を再現性よく実施することができる。その結果、上記測定の結果について迅速に正確性の高い比較をすることができる。従って、正確性の高い生体関連物質のスクリーニングを行うことができる。
【0041】
また、本発明に係る生体関連物質のパターニング方法は、リガンド担持体に、2種類以上の生体関連物質を含む溶液を別々に接触させて、それぞれの生体関連物質と糖鎖との相互作用の測定を行う工程と、上記測定結果を比較し、分類する工程と、を含み、上記リガンド担持体は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されていると共に、上記表面は金属を備えており、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質であることを特徴としている。
【0042】
上記構成によれば、上記生体関連物質の糖鎖に対する特異性を比較し、糖鎖に対する特異性のパターンによって分類することができる。換言すれば、一方の上記生体関連物質の糖鎖に対する相互作用の強さと、他方の上記生体関連物質の糖鎖に対する相互作用の強さとを比較し、それらの傾向によって上記生体関連物質を分類することで、パターニングすることができる。
【0043】
また、上記密度で上記リガンド担持体が固定されているリガンド担持体を交換することなく、同じリガンド担持体を用いて、上記目的の生体関連物質または、上記対照の生体関連物質と糖鎖との相互作用の測定を連続して複数回行うことができる。そのため、網羅的な生体関連物質と糖鎖との相互作用の測定を再現性よく実施することができる。その結果、上記測定の結果について迅速に正確性の高い比較をすることができる。従って、正確性の高い上記生体関連物質のパターニングを行うことができる。
【0044】
本発明に係る方法において、上記リンカー化合物が、一般式(1)
【0045】
【化1】

【0046】
(式中、nは0以上6以下の整数)にて表される構造を備え、上記Xとして、末端に芳香族アミノ基を有するとともに、主鎖に炭素−窒素結合を有していてもよい炭化水素誘導鎖を、1鎖又は4鎖含んでなる多分岐構造部位である構造を備え、上記Yとして、硫黄原子を含む炭化水素構造を備えているリンカー化合物であることが好ましい。
【0047】
上記構成によれば、上記リンカー化合物は分子内に1〜4個の芳香族アミノ基を有している。また、当該アミノ基と還元末端を有する糖鎖とを還元アミノ化反応を行うことにより簡便に結合することができる。したがって、上記リンカー化合物を用いることにより、1個のリンカー化合物内に1〜4個の糖鎖が結合した構成のリガンド複合体を作製することができる。
【0048】
また、本発明に係る方法は、上記ウイルスが、インフルエンザウイルス、ヘルペスウイルス、ノロウイルス、HTLV-1ウイルス、エイズウイルス、ロタウイルス、SARSウイルス、または、B型肝炎ウイルスであり、上記細胞が、肝細胞または、肝臓癌、肺癌、胃癌、小腸癌、大腸癌、すい臓癌、脾臓癌および腎臓癌からなる群より選ばれる1以上の癌細胞であり、上記細菌が、大腸菌、ヘリコバクターピロリ菌、緑膿菌、乳酸菌および連鎖球菌からなる群より選ばれる1以上の細菌であることが好ましい。
【0049】
上記構成によれば、上述の生体関連物質と糖鎖との相互作用を測定することができる。また、上述の生体関連物質の同定や差別化を行うこともできる。その結果、上述の生体関連物質と相互作用する糖鎖を同定することができる。さらに、上述の生体関連物質と相互作用する共通の糖鎖を同定することもできる。
【0050】
また、本発明に係る方法では、上記生体関連物質が、インフルエンザウイルスまたはヘルペスウイルスであり、上記糖鎖が、Galβ1−4Glc、Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4Glc、Neu5Acα2−6Galβ1−4Glc、Neu5Acα2−3Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−4GlcNAcβ1−6Glc、GlcAβ1−3GalNAc4Sβ1−6Glc、GlcAβ1−3GalNAc6Sβ1−6Glc、GlcA2Sβ1−3GalNAc6Sβ1−6Glc、GlcAβ1−3GalNAc4S6Sβ1−6Glc、GlcNS6Sα1−4IdoA2Sα1−6Glc、GlcNSα1−4IdoA2Sα1−6Glc、GlcNS6Sα1−4GlcA2Sβ1−6Glc、およびGlcNSα1−4GlcAβ1−6Glcからなる群より選ばれる1以上の糖鎖であることが好ましい。
【0051】
上記構成によれば、インフルエンザウイルスまたはヘルペスウイルスと上記糖鎖との相互作用を網羅的にリアルタイムで直接、測定することができる。さらに1回の測定を低コストで迅速に行うことができる。
【0052】
なお、Neu5Acα2−6Galβ1−4Glc、Neu5Acα2−6Galβ1−3GlcNAcβ1−6Glc、およびNeu5Acα2−6Galβ1−4GlcNAcβ1−6Glcは、主にヒトに感染するインフルエンザウイルスと相互作用する陽性対照の糖鎖である。また、Neu5Acα2−3Galβ1−4Glc、Neu5Acα2−3Galβ1−3GlcNAcβ1−6Glc、およびNeu5Acα2−3Galβ1−4GlcNAcβ1−6Glcは、主に鳥類や馬科に感染するインフルエンザウイルスと相互作用する陽性対照の糖鎖である。さらに、Galβ1−4Glc、およびGalβ1−4GlcNAcβ1−6Glcは、インフルエンザウイルスと相互作用する陰性対照の糖鎖である。
【0053】
そのため、上記のいずれかの糖鎖または、上記糖鎖を複数有する上記リガンド担持体を用いて各インフルエンザウイルスとの相互作用を測定することで、インフルエンザウイルスの宿主特異性を調べることができる。また、インフルエンザウイルスの同定や差別化を行うこともできる。
【0054】
また、ヘパリンの部分構造であるGlcNS6Sα1−4IdoA2Sα1−6Glc、GlcNSα1−4IdoA2Sα1−6Glc、GlcNS6Sα1−4GlcA2Sβ1−6Glc、およびGlcNSα1−4GlcAβ1−6Glcを、またコンドロイチンの部分構造であるGlcAβ1−3GalNAc6Sβ1−6Glc、GlcA2Sβ1−3GalNAc6Sβ1−6Glc、およびGlcAβ1−3GalNAc4S6Sβ1−6Glcは、ヘルペスウイルスと相互作用する陽性対照の糖鎖であるため、これらの糖鎖のいずれか、または、これらの糖鎖を複数有する上記リガンド担持体を用いてヘルペスウイルスとの相互作用を測定することで、ヘルペスウイルスの型の違いを調べることができる。
【0055】
また、本発明に係る方法を実施するためのキットは、リガンド複合体が支持体の表面に固定されたリガンド担持体を備えた、本発明に係る方法を実施するためのキットであって、上記リガンド複合体は、硫黄元素を有するリンカー化合物に糖鎖が結合している構造を備え、上記表面は金属を備えることを特徴としている。
【0056】
上記構成によれば、上記キットには上記リガンド担持体が含まれるため、本発明に係る方法を簡便に行うことができる。
【0057】
また、本発明に係るキットの上記糖鎖は、Galβ1−4Glc、Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4Glc、Neu5Acα2−6Galβ1−4Glc、Neu5Acα2−3Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−4GlcNAcβ1−6Glc、GlcAβ1−3GalNAc4Sβ1−6Glc、GlcAβ1−3GalNAc6Sβ1−6Glc、GlcA2Sβ1−3GalNAc6Sβ1−6Glc、GlcAβ1−3GalNAc4S6Sβ1−6Glc、GlcNS6Sα1−4IdoA2Sα1−6Glc、GlcNSα1−4IdoA2Sα1−6Glc、GlcNS6Sα1−4GlcA2Sβ1−6Glc、およびGlcNSα1−4GlcAβ1−6Glcからなる群より選ばれる1以上の糖鎖であることが好ましい。
【0058】
上記構成によれば、上記リガンド担持体には、上述した、主にヒトに感染するインフルエンザウイルスと相互作用する陽性対照の糖鎖、主に鳥類や馬科に感染するインフルエンザウイルスと相互作用する陽性対照の糖鎖、インフルエンザウイルスと相互作用する陰性対照の糖鎖からなる群より選ばれる糖鎖が含まれる。
【0059】
また、上記構成によれば、上記リガンド担持体には、上述した、ヘルペスウイルスと相互作用する陽性対照の糖鎖が含まれる。
【0060】
そのため、生体関連物質としてインフルエンザウイルスまたはヘルペスウイルスを用いた場合に、インフルエンザウイルスまたはヘルペスウイルスと上記の糖鎖との相互作用を同時に低コストで網羅的にリアルタイムで測定することができる。
【0061】
また、インフルエンザウイルスまたはヘルペスウイルスの同定や差別化を行うこともできる。その結果、インフルエンザウイルスまたはヘルペスウイルスと相互作用する糖鎖を同定することができる。また、インフルエンザウイルスまたはヘルペスウイルスの宿主特異性を調べることもできる。
【発明の効果】
【0062】
本発明に係る生体関連物質と糖鎖との相互作用の測定方法は、以上のように、リガンド担持体に、生体関連物質を含む溶液を接触させる工程を含み、上記リガンド担持体は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されていると共に、上記表面は金属を備えており、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質であるという構成である。
【0063】
そのため、上記生体関連物質と糖鎖との相互作用を標識することなくリアルタイムで網羅的に1ステップで直接測定し数値化することができる。ゆえに、上記生体関連物質の糖鎖選択性を正確に評価することができるという効果を奏する。また、測定に用いる生体関連物質を多量に用意する必要がなく、微量な生体関連物質を測定に用いることができるという効果を奏する。
【0064】
また、本発明に係る生体関連物質の糖鎖選択性の評価方法は、リガンド担持体に、生体関連物質を含む溶液を接触させて、当該生体関連物質と糖鎖との相互作用の測定を行う工程と、上記測定の結果得られる上記生体関連物質の糖鎖に対する特異性を特定する工程とを含み、上記リガンド担持体は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されていると共に、上記表面は金属を備えており、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質であるという構成である。
【0065】
そのため、上記生体関連物質の多種多様な糖鎖に対する特異性を特定することができる。その結果、生体関連物質の糖鎖選択性の網羅的な評価をすることができる。
【0066】
また、本発明に係る生体関連物質のスクリーニング方法は、リガンド担持体に、目的の生体関連物質を含む溶液または、対照の生体関連物質を含む溶液を別々に接触させて、それぞれの生体関連物質と糖鎖との相互作用の測定を行う工程と、上記測定を上記目的の生体関連物質を含む溶液を用いて行った場合の結果と、上記測定を上記対照の生体関連物質を含む溶液を用いて行った場合の結果とを比較し、上記結果を一致させる工程とを含み、上記リガンド担持体は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されていると共に、上記表面は金属を備えており、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質であるという構成である。
【0067】
そのため、上記生体関連物質と糖鎖との相互作用の網羅的な測定結果を比較し、当該測定結果を一致させることで、上記生体関連物質の糖鎖に対する特異性の観点から、目的の上記生体関連物質を高い正確性で同定することができるという効果を奏する。
【0068】
また、本発明に係る生体関連物質のパターニング方法は、リガンド担持体に、2種類以上の生体関連物質を含む溶液を別々に接触させて、それぞれの生体関連物質と糖鎖との相互作用の測定を行う工程と、上記測定結果を比較し、分類する工程と、を含み、上記リガンド担持体は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されていると共に、上記表面は金属を備えており、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質であるという構成である。
【0069】
そのため、上記生体関連物質と糖鎖との相互作用の網羅的な測定結果を比較し、当該測定結果を分類させることで、上記生体関連物質の糖鎖に対する特異性の観点から、正確性の高い上記生体関連物質の差別化をすることができるという効果を奏する。
【0070】
また、本発明に係る上記方法を実施するためのキットは、リガンド複合体が支持体の表面に固定されたリガンド担持体を備えたキットであって、上記リガンド複合体は、硫黄元素を有するリンカー化合物に糖鎖が結合している構造を備え、上記表面は金属を備えるという構成である。
【0071】
そのため、本発明に係る方法を簡便に行うことができるという効果を奏する。
【図面の簡単な説明】
【0072】
【図1】図1は、表面プラズモン共鳴装置を用いて、糖鎖とインフルエンザウイルスとの相互作用の測定結果をグラフ化した図である。
【図2】糖鎖固定化金属ナノ粒子とインフルエンザウイルスとの混合液にスクロースを加えて遠心分離をした後の図である。
【図3】図3は、表面プラズモン共鳴装置を用いて、糖鎖とタンパク質との相互作用を測定した結果を示す図である。
【図4】図4は、インフルエンザウイルスに対する8種の糖鎖の反応量(図1に示した信号強度)を全て足した値を100%として、各糖鎖の反応の割合をグラフ化した図である。
【図5】図5は、表面プラズモン共鳴装置を用いて、糖鎖とヘルペスウイルスとの相互作用の測定結果をグラフ化した図である。
【図6】図6は、ヘルペスウイルスに対する8種の糖鎖の反応量(図5に示した信号強度)を全て足した値を100%として、各糖鎖の反応の割合をグラフ化した図である。
【発明を実施するための形態】
【0073】
以下、本発明について詳細に説明する。なお、本明細書中に記載された非特許文献および特許文献の全てが、本明細書中において参考として援用される。
【0074】
<支持体>
本発明に用いることのできる支持体は、表面に金属を備えるという構成である。そのような構成の支持体として、例えば上記支持体は、単一の材料からなる構成の支持体、1つの基板(第1の基板)の表面に別種類の少なくとも1つの材料からなる金属の薄膜(第1の層)を表面に形成している構成の支持体、または前記第1の基板と前記第1の層との間に少なくとも1つの他の介在層(第2の層、第3の層、等)が存在している構成の支持体を挙げることができる。
【0075】
なお、支持体の表面とは、本発明に用いることのできる生体関連物質を含む溶液と支持体とが接触することのできる箇所を指す。
【0076】
上記金属としては、金、銀、銅、アルミニウム、白金、酸化アルミニウム、SrTiO3、LaAlO3、NdGaO3、ZrO2等を用いることができる。また、上記第1の基板の材料としては、ガラス、水晶、金属(例えば金、銀、銅、アルミニウム、白金、酸化アルミニウム、SrTiO3、LaAlO3、NdGaO3、ZrO2等)、シリコン(例えば酸化珪素)、ポリマー樹脂(例えばポリエチレンテレフタレート、ポリカーボネート)、炭素(グラファイト)等を用いることができる。本発明に用いることのできる支持体の厚さは特に限定されないが、通常、前記第1の基板であれば、0.1mm〜30mm程度であり、好適には、0.1mm〜2mm程度である。
【0077】
上述した支持体を用いることにより、上記生体関連物質と糖鎖との相互作用の程度を表面プラズモン共鳴、プラズモン吸収、または水晶振動子等の信号量の大きさとして測定することができる。
【0078】
特に、上記表面プラズモン共鳴の信号量を測定する場合には、上記支持体は、前記第1の基板としてガラス、ポリマー樹脂、またはプラスティック等の透明な材料を用い、前記第1の層を有する支持体等であることが好ましい。前期第1の基板の上に前記第1の層を作製する方法としては、特に限定されず、真空蒸着、スパッタリング、電解メッキ、浸漬メッキ、金属箔の接合、化学吸着等従来公知の方法を用いて、前記第1の層を前期第1の基板の上に固定すればよい。具体例として、特許文献1に記載のセンサチップをあげることができる。
【0079】
また、プラズモン吸収の信号量を測定する場合には、上記支持体は、金属ナノ粒子のような単一の金属からなる構成の支持体であることが好ましい。上記金属ナノ粒子とは、粒子径が好ましくは1〜200nmであるコロイド状の金属粒子を意味する。上記金属ナノ粒子を得る方法としては、特に限定されず、例えば、従来公知の方法を用いて、塩化金属酸およびその塩類をメタノール、水やこれらの混合溶媒等に溶解させることで得ることができる。上記塩化金属酸およびその塩類の具体例としては、塩化金(III)ナトリウムを挙げることができる。
【0080】
また、水晶振動子の信号量を測定する場合には、上記支持体は、従来公知の水晶振動子を含むことが好ましい。そのような構成の支持体として、特開2005−84028号公報に公開されている水晶振動子の支持体を例示することができる。
【0081】
<リンカー化合物>
本発明に用いることのできるリンカー化合物としては、硫黄原子を有しており、且つ糖鎖と結合することができる構成であれば特に限定されない。例えば、上記糖鎖と結合することができる構成として、アミノ基等の官能基が導入されているリンカー化合物を挙げることができる。上記硫黄原子は、ジスルフィド結合(S−S結合)またはチオール基(SH基)のような状態であっても良い。そのようなリンカー化合物として具体的には、特許文献1に記載のリンカー化合物を用いることができる。
【0082】
また、本発明に用いることのできるリンカー化合物の具体例として、下記の一般式(1)で表される構造を備えたリンカー化合物を挙げることができる。なお、この構造中のYで示す構造中には、硫黄原子が含まれている。
【0083】
【化2】

【0084】
(式中、nは0以上6以下の整数)にて表される構造を備え、上記Xとして、末端に芳香族アミノ基を有するとともに主鎖に炭素−窒素結合を有していてもよい炭化水素誘導鎖を、1鎖又は4鎖含んでなる多分岐構造部位である構造を備えている。これによって、上記リンカー化合物は、上記支持体表面に複数の糖鎖を集合化して配列することができるとともに、末端に芳香族アミノ基を有していることによって、糖鎖を簡便に導入することができる。なお、上記一般式(1)において、nは0以上6以下の整数であれば限定されない。
【0085】
上記一般式(1)で表される構造を備えたリンカー化合物は、例えば上記リンカー化合物は、チオクト酸と、芳香族アミノ基末端との縮合反応を行うことによって製造される。
【0086】
<糖鎖>
本発明で用いることのできる糖鎖は、糖がグリコシド結合によって複数結合した化合物を意味する。上記糖としては、還元末端を有する糖であれば特に限定されずシアル酸や硫酸基を有する糖を好適に用いることができる。
【0087】
上記還元末端を有する糖とは例えば、マルトース、ラクトース、パノース、セロビオース、メリビオース、マンノオリゴ糖、キトオリゴ糖、ラミナリオリゴ糖を挙げることができる。上記シアル酸を有する糖としては、特に限定されず、シアリルラクトース等を挙げることができる。
【0088】
なお、上記糖鎖は、同一の糖からなる単一オリゴ糖であってもよいし、種々の糖やその誘導体からなる複合糖であってもよい。また、上記オリゴ糖は、いずれも、自然界から単離・精製して得られる種々の天然の糖であってもよく、人工的に合成された糖であってもよい。また、上記オリゴ糖は、多糖を分解して得られたものであってもよい。
【0089】
例えば、上記糖鎖として、Glc、GlcNAc、Gal、Glcα1−4Glc、Glcα1−4Glcα1−4Glc、Glcα1−6Glc、Glcα1−6Glcα1−6Glc、Glcβ1−3Glcβ1−3Glc、Glcβ1−4Glc、Glcβ1−6Glc、Galα1−6Glc、Galα1−4Galβ1−4Glc、Galβ1−3GalNAcα1−6Glc、Galβ1−4GlcNAcβ1−6Glc、Galβ1−4Glc、Galβ1−4[Fucα1−2]GlcNAcβ1−3Galβ1−4Glc、Manα1−2Man、Manα1−3Manα1−6Man、Manα1−6Man、Fucα1−2Galβ1−4Glc、Fucα1−6Glc、Fucβ1−6Glc、Xylβ1−6Glc、GlcNAcα1−6Glc、GlcNAcβ1−4GlcNAc、GlcNAcβ1−6Glc、GlcNAcβ1−3Galβ1−4GlcNAcβ1−3Galβ1−4Glc、GalNAcα1−6Glc、GalNAcβ1−3Gal、Neu5Acα2−3Galβ1−4Glc、Neu5Acα2−3Galβ1−4GlcNAc、Neu5Acα2−3Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−4Glc、Neu5Acα2−6Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−4GlcNAcβ1−6Glc、GlcNS6Sα1−4IdoA2Sβ1−6Glc、Galβ1−4GlcGalβ1−4GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4Glc、Neu5Acα2−6Galβ1−4Glc、Neu5Acα2−3Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−4GlcNAcβ1−6Glc、GlcAβ1−3GalNAc4Sβ1−6Glc、GlcAβ1−3GalNAc6Sβ1−6Glc、GlcA2Sβ1−3GalNAc6Sβ1−6Glc、GlcAβ1−3GalNAc4S6Sβ1−6Glc、GlcNS6Sα1−4IdoA2Sα1−6Glc、GlcNSα1−4IdoA2Sα1−6Glc、GlcNS6Sα1−4GlcA2Sβ1−6Glc、GlcNSα1−4GlcAβ1−6Glc等を挙げることができる。
【0090】
なお、本明細書において、略語「Glc」はグルコース(Glucose)を、略語「Gal」はガラクトース(Galactose)を、略語「Man」はマンノース(Mannose)を、略語「Fuc」はフコース(Fucose)を、略語「Xyl」はキシロース(Xylose)を、略語「NAc」はN-アセチル(N-Acetyl)を、略語「Ido」はイドース(Idose)を、略語「Neu5Ac」はN-アセチルノイラミン酸(N-Acetylneuraminic acid)を、略語「GlcA」はグルクロン酸(Glucuronic acid)を、略語「IdoA」はイズロン酸(Iduronic aid)を、糖鎖の化学式中に表される「S」はスルフォニル(硫酸基)をそれぞれ表す。例えば、GlcAβ1−3GalNAc4Sβ1−6Glcにおける「4S」は4−O−硫酸を表す。
【0091】
また、糖鎖の化学式における「α」または「β」は、還元末端側の糖の水酸基がα又はβの立体構造で隣り合う糖の水酸基と結合していることを示す。例えば、「α1−4」は還元末端側の糖の1位水酸基がαの立体構造で隣り合う糖の4位の水酸基と結合していることを示す。
【0092】
<リガンド複合体>
本発明に用いることのできるリガンド複合体は、上記<リンカー化合物>で述べたリンカー化合物と上記<糖鎖>で述べた糖鎖とが結合している構成である。上記リンカー化合物と上記糖鎖との結合方法としては、特に限定されず従来公知の方法を用いることができる。例えば、リンカー化合物が、上記一般式(1)で表される構造を備えたリンカー化合物である場合は、当該リンカー化合物は、アミノ基を有している。そのため、上記糖鎖の還元末端と当該アミノ基とを還元アミノ化反応を行うことにより両者を容易に結合させることができる。具体的には、下記の一般式(2)、(3)等で表される構造を備えたリガンド複合体を挙げることができる。
【0093】
【化3】

【0094】
【化4】

【0095】
<リガンド担持体>
本発明で用いることのできるリガンド担持体は、上記リガンド複合体が上記支持体上に固定されている構成である。
【0096】
上記リガンド複合体を上述した支持体上に固定する方法としては、特に限定されない。上記リガンド複合体は、硫黄元素を有するリンカー化合物に、糖鎖が結合している構成である。また、上記支持体は、表面に金属を備える構成である。そのため、上記リガンド複合体と、上記支持体とを接触させることで容易に、金属−硫黄(S)結合を形成し、上記支持体表面に上記リガンド複合体を固定することができる。
【0097】
例えば、上記固定の方法として、上記リガンド複合体を溶媒に溶解させることで作製したリガンド溶液を、上記表面に金属を備える支持体の表面にスポットする方法を挙げることができる。
【0098】
特に、従来公知のスポッター装置(例えば、東洋紡 SPRINTERスポッター)を用いてスポットすることにより、上記リガンド複合体を、好ましくは1〜50種類/cm2、より好ましくは1〜500種類/cm2となるように、表面に金属を備える支持体の表面にそれぞれ独立して固定することができる。なお、上記「1〜500種類」には、1種類および500種類も含まれる。
【0099】
多種類のリガンド複合体を集積すればするほど、一度の測定で、得られる測定結果が増える。そのため、測定に用いる生体関連物質の量を少なくすることができる。ゆえに、リガンド複合体を支持体の単位面積あたりに上記の種類固定することにより、微量な生体関連物質を測定することができる。
【0100】
この場合、スポットに用いられる上記リガンド溶液の量は、1nL〜1000nLであることがより好ましく、5nL〜30nLであることが更に好ましい。
【0101】
支持体表面に単位面積あたり上述の種類のリガンド複合体が固定されていることは、後述の表面プラズモン共鳴装置に上記リガンド担持体を装着して、上記リガンド担持体が固定されていないスポットと固定されているスポットとの表面プラズモン共鳴を測定することにより調べることができる。
【0102】
また、上記溶媒としては、特に限定されるものではないが、例えば、メタノール、水、ジメチルアセトアミド(DMAc)、グリセロールや、これらの混合溶媒等を挙げることができる。また、接触時間は、0.5時間〜12時間程度であればよく、上記リガンド溶液のリガンド複合体の濃度は、1μM〜1mMであればよい。さらに上記リガンド溶液と上記支持体の接触中は、当該リガンド溶液の蒸発を防ぐため、50〜80%、好ましくは、70〜80%の湿度を有する中で当該支持体を保存することが好ましい。上記湿度の調節方法は特に限定されず、例えば、従来公知の加湿器等を用いて湿度を調節することができる。
【0103】
また、上記金属ナノ粒子に上記リガンド複合体を固定する方法としては、特に限定されないが、例えば、金属ナノ粒子を含む溶液を上記リガンド複合体と混和することによって得ることができる。具体的には、金属ナノ粒子を含む溶液を上記リガンド複合体を含む溶液に添加して攪拌することによって、金属ナノ粒子にリガンド複合体を固定することができる。上記攪拌の時間は、30秒程度であればよく、上記リガンド溶液のリガンド複合体の濃度は、好ましくは、1μM〜10mMであればよく、より好ましくは10μM〜1mMであることが好ましい。このように金属ナノ粒子にリガンド複合体が固定されているリガンド担持体を以下、糖鎖固定化金属ナノ粒子という。
【0104】
なお、金属が塩として溶液に含まれているときは、上記リガンド複合体と混和する前に、還元剤を用いて金属を還元しておくことが好ましい。これにより、金属と上記リガンド複合体との結合を形成しやすくすることができる。還元剤としては、特に限定されるものではないが、例えば、水素化ホウ素ナトリウム、クエン酸およびその塩類、アスコルビン酸およびその塩類、リン、タンニン酸およびその塩類、エタノール、ヒドラジン等を用いることができる。
【0105】
金属を含む溶液の分散媒およびリガンド複合体を含む溶液に用いる溶媒としては、特に限定されるものではないが、例えば、メタノール、水やこれらの混合溶媒等を挙げることができる。また、上記混和によって得られたリガンド担持体を透析し、低分子の塩などを除くことによって、溶液状態で安定なリガンド担持体を得ることができる。
【0106】
上記糖鎖固定化金属ナノ粒子を調製するために用いる金属、還元剤、上記リガンド複合体の混合比は、特に限定されるものではないが、金属が塩化金酸およびその塩類である場合は、塩化金酸およびその塩類の溶液中の最終濃度が0.5mM〜10mMであることが好ましく、1mM〜5mMであることがさらに好ましい。
【0107】
還元剤としては、溶液中の最終濃度として金イオンのモル濃度の3〜10倍モル濃度であることが好ましく、4〜5倍モル濃度であることがさらに好ましい。
【0108】
また、上記リガンド複合体は溶液中の最終濃度として10μM〜1000μMであることが好ましく、50μM〜150μMであることがさらに好ましい。
【0109】
<生体関連物質>
本発明に係る測定方法は、生体関連物質と糖鎖との相互作用を測定することができればとくに限定されない。例えば、上述のリガンド担持体に、生体関連物質を含む溶液を接触させ、接触により生じる表面プラズモン共鳴、プラズモン吸収、または水晶振動子の信号量を測定することで、上記生体関連物質と上記糖鎖との相互作用を測定することができる。上記信号量は、生体関連物質と糖鎖との相互作用の強さによって変化する。すなわち、本明細書において、上記生体関連物質と糖鎖との相互作用を測定するとは、生体関連物質と糖鎖との間に生じる水素結合、疎水結合、イオン結合、ファンデルワールス結合からなる群より選ばれる1以上の結合の強さを測定することを意味する。
【0110】
一実施形態において、本発明に係る生体関連物質と糖鎖との相互作用の測定方法は、生体関連物質と、糖鎖との相互作用の測定方法であって、リガンド担持体に、生体関連物質を含む溶液を接触させる工程を含み、上記リガンド担持体は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されていると共に、上記表面は金属を備えており、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質である。
【0111】
上記「1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されている」とは、支持体1cm2あたり1〜500種類のリガンド複合体が支持体の表面に固定されており、リガンド複合体が固定されている領域が2つ以上存在する場合に、それぞれの領域に固定されているリガンド複合体同士が重なり合わないことを意味する。
【0112】
例えば、後述する実施例では、リガンド複合体を1.8cm四方のAu蒸着ガラス基板上にスポットしているが、ある一つのスポットに着目した場合、当該スポットに固定されているリガンド複合体は、他のスポットに固定されているリガンド複合体とは重なり合わない。すなわち、当該スポットに固定されているリガンド複合体は、他のスポットに固定されているリガンド複合体とは独立して支持体の表面に固定されている。
【0113】
支持体1cm2あたり1〜500種類であるから、支持体1cm2あたりに固定されているリガンド複合体は、1種類でも複数種でもよい。支持体1cm2あたりにリガンド複合体が複数種固定されている場合は、支持体1cm2あたりに固定されているリガンド複合体の全てが異なる種類であってもよいし、支持体1cm2あたりに、同じ種類のリガンド複合体が固定されている領域が複数含まれていてもよい。例えば、後述する実施例では、48種類のリガンド複合体を、1.8cm四方の支持体の96領域にスポットしている。
【0114】
なお、本明細書において「リガンド複合体」とは、<リガンド複合体>の項で述べたように、上記<リンカー化合物>の項で述べたリンカー化合物と、上記<糖鎖>の項で述べた糖鎖とが結合している構成である。したがって、リンカー化合物および糖鎖のうち、少なくとも一方が異なっていれば別の種類のリガンド複合体であるといえる。
【0115】
上記構成によれば、上記リガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されているため、生体関連物質と、糖鎖との相互作用は、液相(生体関連物質を含む溶液)と固相(独立して固定されている個々の糖鎖)との反応として測定できる。したがって、生体関連物質を含む溶液を1サンプル用いるだけで、支持体に固定されている全ての糖鎖との反応を網羅的に確認することができるため、生体関連物質のスクリーニングやパターニングを効率よく行うことができる。
【0116】
また、糖鎖は支持体に固定された固相として存在するため、上記液相を上記支持体に流しても、上記液相と混和されてしまうことはない。よって、生体関連物質と糖鎖との相互作用を測定した後は、生体関連物質と糖鎖とを簡単に分離し、生体関連物質を回収することができる。そして、回収した生体関連物質を、例えば上記支持体とは別個の支持体に固定された糖鎖との相互作用の測定のために再使用することができる。すなわち、測定する糖鎖の種類の数に関わらず、生体関連物質の検体(サンプル)としては1つ用意すれば足りることになり、少量の検体で多くの情報を得ることができ、非常に効率よく上記相互作用を測定することができる。そのため、少量の検体で生体関連物質のスクリーニングおよびパターニングを行うことができる。
【0117】
一方、例えば、ナノ粒子を支持体として、異なる糖鎖を結合させたナノ粒子を生体関連物質と相互作用させる場合は、ナノ粒子は液相(コロイド)であるため、上記相互作用は液相と液相との反応となり、生体関連物質とナノ粒子とは混和されてしまう。すなわち、本発明に係る測定方法のように、固相と液相との反応とはならない。それゆえ、本発明に係る測定方法のように、生体関連物質と、糖鎖との相互作用を測定した後に、生体関連物質と糖鎖とを簡単に分離し、生体関連物質を容易に回収することはできない。
【0118】
このように、ナノ粒子を支持体として、異なる糖鎖を結合させたナノ粒子を生体関連物質と相互作用させる場合は、生体関連物質の再利用を行うことができず、生体関連物質の検体を、測定する糖鎖の種類と同数だけ用意しなければならないことになる。そのため、多くの情報を得るためには多量の検体が必要となってしまう。したがって、生体関連物質のスクリーニングやパターニングを効率よく行うことはできない。
【0119】
さらに、一つのナノ粒子上に異なる糖鎖を複数結合させたとしても、生体関連物質とどの糖鎖とが相互作用したのかを確認することはできないため、生体関連物質のスクリーニングやパターニングを行うことはできない。
【0120】
本発明の方法は、後述する実施例に示すように、同じH3N2という構成のタンパク質を有するインフルエンザウイルス株を糖鎖に対する特異性の観点から株ごとに分類することができる。なお、上記H3とは、タイプ3のヘマグルチニンを表し、N2とはタイプ2のノイラミニナーゼを表し、ともに抗体によって決定されている。
【0121】
そして、上記インフルエンザウイルス株の糖鎖に対する特異性のパターンは、比例または反比例といった一定ではなく無差別的である。上記「糖鎖に対する特異性」とは、上記生体関連物質と糖鎖との相互作用の強さの傾向を意味する。
【0122】
例えば、A/Fukuoka/C29/85(H3N2)またはA/Guizhou/54/89(H3N2)の糖鎖に対する特異性のパターンを比べると、糖鎖がNeu5Acα2−6Galβ1−4GlcNAcβ1−6Glcである場合には、上述の2つのインフルエンザウイルスは同じくらいの強さで相互作用する。一方、糖鎖がNeu5Acα2−6Galβ1−4Glcである場合には、当該糖鎖に対してA/Fukuoka/C29/85(H3N2)は強く相互作用するが、A/Guizhou/54/89(H3N2)はほとんど相互作用しない。このことは、上記糖鎖に対する特異性のパターンは、単に抗体によって決定されている上記同じH3N2という構成のタンパク質の発現量によって決まっているものではないということを示していると考えられるし、抗体によって見分けがつけられないタンパク質の部位に変異が入っていることを示しているとも考えられる。
【0123】
一方、インフルエンザウイルスの構成成分は、脂質、糖鎖、およびタンパク質であることが知られている。そのため、上記実施例の結果および上記知見から、本発明に係る測定方法では、糖鎖とタンパク質との相互作用といった、一対一の相互作用の測定だけでなく、脂質、糖鎖、およびタンパク質からなる群より選ばれる1以上の構成成分と糖鎖との相互作用といった、一対複数の相互作用を測定することができ、その結果、単に糖と蛋白質との相互作用を検出するだけでなく、ウイルス株の識別まで行うことができるものと推測される。つまり、本発明に係る方法は、有するタンパク質の種類が同じ抗体型を示す生体関連物質であっても、別々に測定対象とすることができ、識別することができる。
【0124】
上記生体関連物質として、例えば、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセル等をあげることができる。上記ウイルスとしては、具体的には、インフルエンザウイルス、ヘルペスウイルス、ノロウイルス、HTLV−1ウイルス、エイズウイルス、B型肝炎ウイルス等を挙げることができる。
【0125】
上記タンパク質としては、具体的には、例えば動物レクチン、植物レクチン、酵素、成長因子、細胞内シグナル伝達因子、遺伝子制御因子、細胞外マトリックス構成因子、抗体等を挙げることができる。
【0126】
また、上記細胞としては、具体的には、癌細胞または非癌細胞をあげることができる。癌細胞としては、肝臓癌、脳腫瘍、肺癌、胃癌、小腸癌、大腸癌、すい臓癌、脾臓癌および腎臓癌等由来の癌細胞を用いることができ、癌細胞の中でも特に、肝臓癌、肺癌、胃癌、小腸癌、大腸癌、すい臓癌、脾臓癌および腎臓癌からなる群より選ばれる1以上の癌細胞であることが好ましい。また、上記非癌細胞としては、肝細胞等を用いることができる。
【0127】
また、上記細菌としては、大腸菌、ヘリコバクターピロリ菌、緑膿菌、乳酸菌、連鎖球菌等を挙げることができ、大腸菌の中では、O-157であることが特に好ましい。また、上記リポソームおよびミセルとしては、糖鎖を含むものであれば、生体試料由来のものであっても人工的に作製したものであっても良い。リポソームおよびミセルを生体試料より得る方法としては特に限定されないが、例えば、細胞または組織等の生体試料を、界面活性剤を含む溶液中で超音波処理等によって破砕することにより、当該溶液中に生体試料由来のリポソームおよびミセルを抽出し、得ることができる。
【0128】
また、リポソームを人工的に作製する方法としては、特に限定されないが、例えば、リン脂質等のリポソームを形成することのできる脂質と糖鎖とを含む溶液を攪拌・混合することによりリポソームを人工的に作製することができる。
【0129】
上記生体関連物質を含む溶液の上記生体関連物質の濃度は、0.1ng/ml〜10mg/mlであればよく、1μg/ml〜1mg/mlであることが好ましい。また、上記生体関連物質としてウイルスを用いる場合は、ウイルスの濃度の範囲は、1〜1010pfu/mlであることが好ましく、10〜100pfu/mlであることがより好ましい。上記pfuは、TCID50(50% tissue culture infection dose)法等の周知の方法を用いて調べることができる。さらに、インフルエンザウイルスを用いる場合は、インフルエンザウイルスの濃度の範囲は、1〜1000HAUであることが好ましく、10〜100HAUであることがより好ましい。ここで、上記HAUとは、インフルエンザウイルスの赤血球に対する凝集価である。上記HAUは、0.5%トリ血球溶液を用いる赤血球凝集反応を用いて調べることができる。
【0130】
また、上記生体関連物質として、細胞または、細菌を用いる場合は、それらの濃度の範囲は、103個/ml〜1010個/mlであることが好ましく、105個/ml〜107個/mlであることがより好ましい。細胞または細菌が上記の濃度にあるかどうか調べるには、例えばセルカウンター等の周知の方法を用いて調べることができる。
【0131】
本発明の測定方法は、表面プラズモン共鳴、プラズモン吸収、または水晶振動子の信号量を測定するため高感度である。そのため、測定に用いる生体関連物質は、極微量でよいという利点がある。
【0132】
上記ウイルスは従来公知の方法を用いて調製することできる。例えば、培養細胞に測定対象となるウイルスを播種した後、2〜4日間、37℃で放置する。その後、培養上清を30%と60%の比重の異なるスクロース溶液を重層したものに積層し、超遠心(24,000rpm,90分、15℃)を行う。次に、30/60%画分を回収することでウイルスを含む溶液を調製することができる。
【0133】
ここで、上記培養細胞としては、ウイルスが感染することができる培養細胞を適宜用いればよい。例えば、上記ウイルスがインフルエンザウイルスの場合は、上記培養細胞として、孵化鶏卵の羊膜膜内接種、またはMDCK細胞等を好適に用いることができる。
【0134】
また、上記細胞は、従来公知の方法を用いて調製することができる。例えば、測定対象となる細胞を、その細胞に適した周知の培養液と培養条件とで培養した後、目的の濃度になるように上記細胞を回収すればよい。回収の方法としては、特に限定されないが、浮遊細胞であれば、遠心することにより所望の濃度に調製する事ができる。また、接着細胞であれば、トリプシン等の酵素消化や、ピペッティング等の物理的な方法を用いて細胞を培養皿から剥がした後に、遠心することで所望の濃度に調製することができる。
【0135】
また、上記細菌は、従来公知の方法を用いて調製することができる。例えば、測定対象となる細菌を、その細菌に適した周知の培養液と培養条件とで培養した後、遠心分離等の方法を用いて上記細菌を回収すればよい。
【0136】
上述のようにして調製したウイルス、細胞、細菌等の生体関連物質に溶液を加えて希釈することで、上述した濃度の上記「生体関連物質を含む溶液」を調製することができる。上記溶液としては、リン酸緩衝溶液(Phosphate Buffered Saline(PBS)緩衝液pH 7.4)または、トリス緩衝溶液等の従来公知の緩衝溶液を好適に用いることができる。また、上記溶液には、塩化ナトリウム、塩化マグネシウム、EDTA、またはEGTA等の塩および/または、Tween 20、Triton−X、またはCHAPS等の界面活性剤が加えられていても良い。上記溶液中の上記界面活性剤の濃度としては、0.001〜10%が好ましく、0.005〜5%がより好ましい。
【0137】
生体関連物質と糖鎖との相互作用を測定する際には、上記生体関連物質を1種類含む溶液を1種類のみ用いて測定するか、上記生体関連物質を1種類含む溶液を2種類以上用いて別々に測定することができる。
【0138】
以下では、表面プラズモン共鳴、プラズモン吸収、または水晶振動子の信号量を測定する方法を用いた本発明に係る上記生体関連物質と糖鎖との相互作用の測定の実施形態についてそれぞれ説明する。
【0139】
<表面プラズモン共鳴>
上記表面プラズモン共鳴の信号量を測定する方法としては、特に限定されず、従来公知の方法を用いることができる。例えば、後述する表面プラズモン共鳴装置を用いることで容易に、上記表面プラズモン共鳴の信号量の測定をリアルタイムで行うことができる。
【0140】
即ち、上記生体関連物質と、糖鎖とが相互作用することによって生じた表面プラズモン共鳴の程度は、表面プラズモン共鳴装置を用いることで、信号量の大きさとして測定することができる。上記表面プラズモン共鳴は、上記リガンド複合体の糖鎖と上記生体関連物質との相互作用の強さによって変化するため、上記信号量の大きさを測定することにより、上記相互作用の程度を測定することができる。
【0141】
また、上記表面プラズモン共鳴は、レーザー光等を用いて物理現象を利用してリアルタイムで信号量として測定されるため、生体関連物質を標識することなくリアルタイムで直接的に測定することができる。また、当該相互作用を高感度で測定することができるため、用いる生体関連物質を含む溶液の量を少なくすることができる。さらに、上記測定の後、相互作用の強さを数値化することが好ましい。当該数値化によって、後述の生体関連物質の同定や生体関連物質の差別化を容易に行うことができる。
【0142】
具体的には、上述のリガンド担持体を表面プラズモン共鳴装置にセットする。上記表面プラズモン共鳴装置内では、上記リガンド担持体表面をランニングバッファーが流れていることが好ましい。当該表面プラズモン共鳴装置内に上記生体関連物質を含む溶液を注入し、上記ランニングバッファーの代わりに当該生体関連物質を含む溶液を流すことで、容易に上記リガンド担持体を上記生体関連物質を含む溶液に接触させることができるからである。当該接触の際に、上記生体関連物質を含む溶液中の上記生体関連物質と上記リガンド担持体に固定されたリガンド複合体の糖とが、相互作用すると表面プラズモン共鳴が生じる。そして、表面プラズモン共鳴の程度を信号量として測定する。その結果、上記生体関連物質と糖鎖との相互作用を測定することができる。
【0143】
上記生体関連物質を含む溶液の生体関連物質の濃度は上記<生体関連物質>で述べた濃度であることが好ましい。上記生体関連物質を含む溶液を注入する量としては、10〜5000μlであればよく、50〜300μlであることが更に好ましい。
【0144】
上記表面プラズモン共鳴装置としては、例えば、MultiSPRinter(東洋紡製)を挙げることができる。
【0145】
上記表面プラズモン共鳴装置にセットされる上記リガンド担持体の数は、特に限定されることなく、1つであってもよいし、複数であってもよい。また、リガンド担持体を複数セットする場合は、上記各リガンド担持体は、同一であってもよいし、異なっていてもよい。上記各リガンド担持体が異なるとは、各リガンド担持体に固定されているリガンド複合体や、リガンド担持体に含まれる支持体が、異なること等を意味する。上記リガンド複合体が異なるとは、リガンド複合体に含まれるリンカー化合物または糖鎖が異なることを意味する。
【0146】
上記ランニングバッファーとしては、リン酸緩衝溶液(Phosphate Buffered Saline(PBS)緩衝液pH 7.4)、トリス緩衝溶液等の従来公知の緩衝溶液を用いることができる。また、塩化ナトリウム、塩化マグネシウム、EDTA、またはEGTA等の塩および/または、Tween 20、Triton−X、またはCHAPS等の界面活性剤が加えられている上記緩衝溶液を上記ランニングバッファーとして用いても良い。上記緩衝溶液中の上記界面活性剤の濃度としては、0.001〜10%が好ましく、0.005〜5%がより好ましい。
【0147】
本実施形態においては、上記リガンド担持体と上記生体関連物質を含む溶液とを接触させる前に、上記リガンド担持体に付着している不純物を取り除くために、洗浄溶液を用いて、上記リガンド担持体を洗浄することが好ましい。上記洗浄溶液としては、特に限定されないが、例えば、水酸化ナトリウム水溶液または、水酸化カリウム等の塩基性水溶液や塩酸または硫酸等の酸性溶液、上記界面活性剤を含む緩衝溶液等を挙げることができる。
【0148】
上記塩基性溶液や酸性溶液の濃度としては、上記リガンド担持体(特に、糖鎖)が変性しない濃度であればよく、0.1mM〜100mMであることが好ましく、1mMから10mMであることがより好ましい。
【0149】
また、本実施形態においては、上記の表面プラズモン共鳴を測定することによって上記生体関連物質と糖鎖との相互作用の測定を行う操作を連続して複数回行うことが好ましい。
【0150】
上記「連続して複数回行う」とは、具体的には、一度、上記リガンド担持体と上記生体関連物質を含む溶液とを接触させて、上記生体関連物質と糖鎖との相互作用の測定を行った後に、さらに連続的に、上記リガンド担持体を、次の上記生体関連物質を含む溶液と接触させて、当該生体関連物質と糖鎖との相互作用の測定を行うことを意味する。
【0151】
この場合、一度目の測定の後に、上述した洗浄溶液で洗浄した後に、次の上記生体関連物質を含む溶液を流すことが好ましい。当該洗浄により一度目の測定の際に、糖鎖に結合した上記生体関連物質を除去することができる。次に糖鎖と接触させる上記生体関連物質を含む溶液としては、一度目の上記生体関連物質と同じ上記生体関連物を含むものを用いてもよいし、別の上記生体関連物質を含むものを用いてもよい。
【0152】
上記方法により、同一のリガンド担持体を用いて、複数の上記生体関連物質と糖鎖との相互作用を測定することができる。そのため、上記測定の結果について迅速に正確性の高い比較をすることができる。従って、後述の生体関連物質の同定や生体関連物質の差別化を正確に行うことができる。
【0153】
<プラズモン吸収>
プラズモン吸収の測定は、上記糖鎖固定化金属ナノ粒子を含む溶液と、上記生体関連物質を含む溶液とを混和することによって、糖鎖と上記生体関連物質とを相互作用させ、糖鎖−生体関連物質相互作用体を生成させる工程を含むものであれば特に限定されない。
【0154】
上記「糖鎖固定化金属ナノ粒子を含む溶液」とは、糖鎖固定化金属ナノ粒子が液体に分散している溶液を意味する。糖鎖固定化金属ナノ粒子を含んでいれば、他に塩などが含まれていてもよい。上記液体としては、例えば水や、リン酸緩衝溶液またはトリス緩衝溶液等の緩衝液を用いることができる。
【0155】
糖鎖固定化金属ナノ粒子を含む溶液と、上記生体関連物質を含む溶液とを混和する方法は、特に限定されるものではなく、糖鎖と上記生体関連物質とを相互作用させることができるものであればよい。例えば、マイクロプレートやエッペンドルフチューブなどに生体関連物質の希釈系列を作製し、糖鎖固定化金属ナノ粒子を含む溶液を添加して放置することにより混和を行うことができる。
【0156】
具体的には、最終濃度が好ましくは0.5mM〜10mMであり、より好ましくは1mM〜5mMである上記糖鎖固定化金属ナノ粒子を含む溶液と、上記<生体関連物質>で述べた濃度の生体関連物質を含む溶液とを混和する。上記糖鎖固定化金属ナノ粒子を含む溶液の量は、特に限定されないが、10〜1000μlであることが好ましい。また、上記生体関連物質含む溶液の量は、特に限定されないが、10〜1000μlであることが好ましい。
【0157】
上記「糖鎖−生体関連物質相互作用体」とは、糖と生体関連物質とが相互作用して特異的に結合し、その結果生成される凝集物を意味する。上記プラズモン吸収の測定方法は、糖鎖−生体関連物質相互作用を上記糖鎖−生体関連物質相互作用体の生成として目視でも観測することができる。糖と生体関連物質とが相互作用しない場合は、糖鎖−生体関連物質相互作用体は形成されない。
【0158】
ここで、凝集反応を観測することによって物質間の相互作用を測定する方法としては、例えば抗原抗体反応を用いたラテックス凝集法等を挙げることができる(「バイオ診断薬の開発・評価と企業」、CMCテクニカルライブラリー146、シーエムシー出版、P92−97,P109−113)。上記ラテックス凝集法は、ラテックス表面に抗体を固定化させておき、96穴のマイクロプレートを用いて試料抗原の希釈系列を作り、凝集を生じる最大希釈倍率を求め標準溶液と比較して測定するという方法である。糖鎖固定化金ナノ粒子を用いる場合は、一定波長の光で吸光度(プラズモン吸収の信号量)の変化として測定される。そのため当該方法を用いることにより上記生体関連物質と糖鎖との相互作用を数値化することができる。
【0159】
また、上述したプラズモン吸収の信号量の測定は、糖鎖−生体関連物質質相互作用を非標識で測定することができるので、標識を要する方法のような前処理を必要としない点で簡便である。さらに、標識効果が測定のばらつきに大きく影響するという問題も存在せず、再現性のよい測定を行うことができる。また、糖鎖−生体関連物質相互作用を目視でも観測することができるので、特別な装置も必要なく、非常に安価かつ容易に糖鎖−生体関連物質相互作用を測定し数値化することができる。
【0160】
また、本実施形態においても、上述の<表面プラズモン共鳴>で述べたように、上記のプラズモン吸収を測定することによって上記生体関連物質と糖鎖との相互作用の測定を行う操作を連続して複数回行うことが好ましい。具体的な方法は、上述の<表面プラズモン共鳴>で説明した方法と同様である。
【0161】
<水晶振動子>
上記水晶振動子の信号量の大きさを測定する方法としては、特に限定されず、特開2005−84028号公報等に記載の方法を用いることができる。
【0162】
例えば、水晶振動子の金属部分に上述したリガンド複合体を固定し、リガンド担持体を作製する。当該固定の方法は、上記の<リガンド担持体>で述べた方法を用いて固定することができる。その後、上記生体関連物質を含む溶液と、当該リガンド担持体とを接触させ、共振周波数(水晶振動子の信号量)を測定する。当該共振周波数の程度は、上記生体関連物質と糖鎖との相互作用によって変化するため、上記共振周波数をリアルタイムで測定することにより、上記生体関連物質と糖鎖との相互作用をリアルタイムで測定することができる。
【0163】
上記生体関連物質を含む溶液の生体関連物質の濃度は、上記<生体関連物質>で述べた濃度であることが好ましい。また、上記生体関連物質含む溶液の量は、特に限定されないが、10〜1000μlであることが好ましく、50〜500μlであることがより好ましい。
【0164】
また、本実施形態においても、上述の<表面プラズモン共鳴>で述べたように、上記の水晶振動子の信号量を測定することによって上記生体関連物質と糖鎖との相互作用の測定を行う操作を連続して複数回行うことが好ましい。具体的な方法は、上述の<表面プラズモン共鳴>で説明した方法と同様である。
【0165】
<生体関連物質の糖鎖選択性の評価方法>
本発明に係る生体関連物質の糖鎖選択性の評価方法とは、生体関連物質の糖鎖に対する特異性を評価することを意味する。ここで、上記「糖鎖に対する特異性」とは、上記生体関連物質と糖鎖との相互作用の強さの傾向を意味する。すなわち、生体関連物質と糖鎖との相互作用を測定することにより、上記生体関連物質の糖鎖に対する相互作用の強さを調べ、当該強さを特定することができる。その結果、その相互作用の強さの傾向を特定することができる。従って、上記生体関連物質の糖鎖選択性を評価することができる。
【0166】
そのため、本発明に係る生体関連物質の糖鎖選択性の評価方法は、リガンド担持体に、生体関連物質を含む溶液を接触させて、当該生体関連物質と糖鎖との相互作用の測定を行う工程と、上記測定の結果得られる上記生体関連物質の糖鎖に対する特異性を特定する工程とを含む。
【0167】
上記生体関連物質を含む溶液は、上記<生体関連物質>で述べた生体関連物質を含む溶液であれば特に限定されない。
【0168】
上記リガンド担持体としては、上記<リガンド担持体>で述べたリガンド担持体であれば特に限定されないが、リガンド担持体のリガンド複合体が多いほど、上記生体関連物質とリガンド複合体に結合している糖鎖との特異性を多く調べることができる。その結果、網羅的な評価を行うことができる。
【0169】
また、非標識の生体関連物質と糖鎖との相互作用の測定は、上述の表面プラズモン共鳴、プラズモン吸収、または水晶振動子の信号量を測定することにより行うことが好ましい。上記信号量を数値化することができるため、生体関連物質と糖鎖との相互作用の測定結果を数値化することができ、当該数値を比較することにより、上記生体関連物質と糖鎖との相互作用の強さを知ることができる。ゆえに、生体関連物質の糖鎖に対する特異性を簡便に正確に評価することができる。
【0170】
また、上記糖鎖選択性の評価は、絶対評価であってもよいし相対評価であってもよい。上記絶対評価とは、生体関連物質の糖鎖に対する特異性を、他の生体関連物質の糖鎖に対する特異性と比較することなく評価することである。上記相対評価とは、生体関連物質の糖鎖に対する特異性を、他の生体関連物質の糖鎖に対する特異性と比較して評価することである。
【0171】
上記生体関連物質の糖鎖選択性を評価することにより、生体関連物質の同定または差別化等を行うことができる。
【0172】
<生体関連物質のスクリーニング方法>
本発明に係る生体関連物質のスクリーニング方法とは、生体関連物質の糖鎖選択性を評価することにより、生体関連物質の糖鎖に対する特異性の観点から、目的の生体関連物質をスクリーニングする方法のことである。なお、上記「目的の生体関連物質」とは、スクリーニングされるべき生体関連物質を意味する。
【0173】
従って、本発明に係る生体関連物質のスクリーニング方法とは、リガンド担持体に、目的の生体関連物質を含む溶液または、対照の生体関連物質を含む溶液を別々に接触させて、それぞれの生体関連物質と糖鎖との相互作用の測定を行う工程と、上記測定を上記目的の生体関連物質を含む溶液を用いて行った場合の結果と、上記測定を上記対照の生体関連物質を含む溶液を用いて行った場合の結果とを比較し、上記結果を一致させる工程と、を含む。
【0174】
上記「目的の生体関連物質を含む溶液」とは、スクリーニングされるべき生体関連物質を含む水溶液を意味する。なお、上記「スクリーニングされるべき生体関連物質」としては、生体関連物質自体が知られていない未知の生体関連物質であっても、生体関連物質は知られているが糖鎖に対する特異性が知られていないような既知の生体関連物質であっても良い。また、上記「対照の生体関連物質を含む溶液」とは、上記目的の生体関連物質を同定するために、糖鎖に対する特異性が知られている生体関連物質を含む水溶液を意味する。
【0175】
上記リガンド担持体としては、上記<リガンド担持体>で述べたリガンド担持体であれば特に限定されないが、リガンド担持体が備えるリガンド複合体が多いほど、上記生体関連物質とリガンド複合体に結合している糖鎖との特異性を多く調べることができる。その結果、正確な同定を行うことができる。
【0176】
上記「リガンド担持体に、目的の生体関連物質を含む溶液または、対照の生体関連物質を含む溶液を別々に接触させて、それぞれの生体関連物質と糖鎖との相互作用の測定を行う工程」では、上記リガンド担持体を目的の生体関連物質を含む溶液に接触させた後に、上記リガンド担持体と同じ構成である別のリガンド担持体を対照の生体関連物質を含む溶液に接触させても良いし、上記リガンド担持体を目的の生体関連物質を含む溶液に接触された後に、連続的に対照の生体関連物質を含む溶液に接触させても良い。
【0177】
しかし、後者のほうが、より迅速で、正確な比較ができるためより好ましい。また、接触させる生体関連物質を含む溶液の順番は、特に限定されず、対照の生体関連物質を含む溶液の後に、目的の生体関連物質を含む溶液に接触させても良い。
【0178】
上記リガンド担持体と、目的の生体関連物質を含む溶液または対照の生体関連物質を含む溶液との接触によって生じた表面プラズモン共鳴、プラズモン吸収、または水晶振動子の信号量を測定することにより、上記目的の生体関連物質または上記対照の生体関連物質と糖鎖との相互作用の強さを数値化して検出することができる。
【0179】
上記「上記測定を上記目的の生体関連物質を含む溶液を用いて行った場合の結果と、上記測定を上記対照の生体関連物質を含む溶液を用いて行った場合の結果とを比較し、上記結果を一致させる工程」では、具体的には生体関連物質の糖鎖に対する特異性を比較し、当該特異性を一致させることが好ましい。すなわち、目的の生体関連物質の糖鎖に対する相互作用の強さと、対照の生体関連物質の糖鎖に対する相互作用の強さとを比較し一致させることで、目的の生体関連物質が対照の生体関連物質のどれと一致するのかを調べることができる。その結果、目的の生体関連物質をスクリーニングすることができる。
【0180】
<生体関連物質のパターニング方法>
本発明に係る生体関連物質のパターニングとは、上述した生体関連物質の糖鎖選択性を評価することにより、生体関連物質の糖鎖に対する特異性の観点から、生体関連物質を分類することである。
【0181】
そのため、本発明に係る生体関連物質のパターニング方法は、リガンド担持体に、2種類以上の上記生体関連物質を含む溶液を別々に接触させて、それぞれの上記生体関連物質と糖鎖との相互作用の測定を行う工程と、上記測定結果を比較し、分類する工程とを、含む。
【0182】
上記「リガンド担持体に、2種類以上の生体関連物質を含む溶液を別々に接触させて、それぞれの生体関連物質と糖鎖との相互作用の測定を行う工程」では、一方の生体関連物質を含む溶液を接触させた後に、上記リガンド担持体と同じ構成である別のリガンド担持体と別の生体関連物質を含む溶液を接触させても良いし、上記リガンド担持体を一方の生体関連物質を含む溶液に接触された後に、連続的に別の生体関連物質を含む溶液に接触させても良い。
【0183】
しかし、後者のほうが、より迅速で、正確な比較ができるためより好ましい。上記2種類以上の生体関連物質としては、同一の生体関連物質であっても良いし、別々の生体関連物質であっても良いが、差別化という観点から、別々の生体関連物質であることが好ましい。
【0184】
上記リガンド担持体としては、上記<リガンド担持体>で述べたリガンド担持体であれば特に限定されないが、リガンド担持体のリガンド複合体が多いほど、生体関連物質とリガンド複合体に結合している糖鎖との特異性を多く調べることができる。その結果、詳細なパターニングを行うことができる。
【0185】
上記リガンド担持体と、生体関連物質を含む溶液との接触によって生じた表面プラズモン共鳴、プラズモン吸収、または水晶振動子の信号量を測定することにより、生体関連物質との相互作用を測定することができる。
【0186】
上記「上記測定結果を比較し、分類する工程」では、具体的には生体関連物質の糖鎖に対する特異性を比較し、糖鎖に対する特異性のパターンによって分類することが好ましい。すなわち、一方の生体関連物質の糖鎖に対する相互作用の強さと、他方の生体関連物質の糖鎖に対する相互作用の強さとを比較し、それらの傾向によって生体関連物質を分類することで、パターニングをすることができる。
【0187】
<キット>
本発明に係る方法を実施するためのキットは、上述の<リガンド担持体>で説明したリガンド担持体が含まれている構成である。そのため、本発明に係る方法を簡便に行うことができる。また、上記キットには、上記表面プラズモン共鳴、上記プラズモン吸収、または水晶振動子等の信号量を測定するための、生体関連物質、上記ランニングバッファーや、上記洗浄溶液等の試薬類、または上述した表面プラズモン共鳴装置等が含まれていても良い。上記構成が含まれることによって、本発明に係る方法をより簡便に行うことができる。
【0188】
また、上記糖鎖として、Galβ1−4Glc、Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4Glc、Neu5Acα2−6Galβ1−4Glc、Neu5Acα2−3Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−4GlcNAcβ1−6Glc、GlcAβ1−3GalNAc6Sβ1−6Glc、GlcA2Sβ1−3GalNAc6Sβ1−6Glc、GlcAβ1−3GalNAc4S6Sβ1−6Glc、GlcNS6Sα1−4IdoA2Sα1−6Glc、GlcNSα1−4IdoA2Sα1−6Glc、GlcNS6Sα1−4GlcA2Sβ1−6Glc、およびGlcNSα1−4GlcAβ1−6Glcからなる群より選ばれる1以上の糖鎖を用いることもできる。すなわち上記リガンド担持体に含まれる糖鎖として、上記群より選ばれる1以上の糖鎖を少なくとも1種以上用いることができる。
【0189】
上記Neu5Acα2−6Galβ1−4Glc、Neu5Acα2−6Galβ1−3GlcNAcβ1−6Glc、またはNeu5Acα2−6Galβ1−4GlcNAcβ1−6Glcは、主にヒトに感染するインフルエンザウイルスと相互作用する陽性対照の糖鎖である。
【0190】
また、上記Neu5Acα2−3Galβ1−4Glc、Neu5Acα2−3Galβ1−3GlcNAcβ1−6Glc、または、Neu5Acα2−3Galβ1−4GlcNAcβ1−6Glcは、主に鳥類や馬科に感染するインフルエンザウイルスと相互作用する陽性対照の糖鎖である。
【0191】
さらに、上記Galβ1−4Glcまたは、Galβ1−4GlcNAcβ1−6Glcは、インフルエンザウイルスと相互作用する陰性対照の糖鎖である。
【0192】
従って、上記リガンド担持体を用いて、インフルエンザウイルスと上記糖鎖との相互作用を測定することで、当該インフルエンザウイルスが、ヒト、または馬科および鳥類のどれに感染することができるのかを調べることができる。
【0193】
また、ヘルペスウイルスは硫酸化された糖鎖と相互作用すると言われている(JOURNAL OF VIROLOGY Oct. 2000, P9106-9114、JOURNAL OF VIROLOGY June. 1996, P3461-3469)。そのため陽性対照として、ヘパリンの部分構造であるGlcNS6Sα1−4IdoA2Sα1−6Glc、GlcNSα1−4IdoA2Sα1−6Glc、GlcNS6Sα1−4GlcA2Sβ1−6Glc、およびGlcNSα1−4GlcAβ1−6Glcを、また同様にコンドロイチンの部分構造であるGlcAβ1−3GalNAc6Sβ1−6Glc、GlcA2Sβ1−3GalNAc6Sβ1−6Glc、およびGlcAβ1−3GalNAc4S6Sβ1−6Glcを用いた。
【0194】
陰性対照としては中性糖やシアル酸、例えば表2に含まれる糖鎖を用いた。
【0195】
上記リガンド担持体を用いて、ヘルペスウイルスと上記糖鎖との相互作用を測定することで、ヘルペスウイルスの型の違いを調べることができる。
【0196】
なお、本発明は以上説示した各構成に限定されるものではなく、特許請求の範囲に示した範囲内で種々の変更が可能であり、異なる実施形態にそれぞれ開示された技術的手段を適宜組み合わせて得られる実施形態についても本発明の技術的範囲に含まれる。
【実施例】
【0197】
以下、実施例により本発明を更に詳細に説明するが、本発明はこれらの実施例に限定されるものではない。
【0198】
〔製造例1:リガンド複合体の作製〕
下記の〔実施例1〕または〔実施例3〕で用いられたリガンド担持体に固定された各リガンド複合体をWO2005/077965号公報と同様の方法で作製した。
【0199】
まず、チオクト酸と、m−フェニレンジアミンとを含むリンカー化合物を作製した。その後、当該リンカー化合物と表1または表2に記載の糖鎖とを反応させて、還元アミノ化反応を行うことによりリガンド複合体を作製した。
【0200】
表1、表2、表3、表4はそれぞれ、〔実施例1〕、〔実施例3〕、〔実施例2〕、〔実施例4〕で用いられたリガンド担持体に固定された各リガンド複合体の糖鎖を示す。
【0201】
【表1】

【0202】
【表2】

【0203】
【表3】

【0204】
【表4】

【0205】
〔製造例2:リガンド担持体の作製〕
〔実施例1〕または〔実施例3〕で用いられたリガンド担持体を、以下の方法で作製した。まず始めに、Au蒸着ガラス基板(東洋紡製SPR−200)を小型UV/O3クリーナー(BioForce Nanosciences社製)にて20分間洗浄した。
【0206】
その後、上記〔製造例1〕で作製した表1または、表2に記載の糖鎖を有するリガンド複合体溶液を500μMに調製し、20μlずつ96穴プレートに分注した。次いで、当該プレートを、MultiSPRinter自動スポッター装置(東洋紡製)内に設置し、上記Au蒸着ガラス基板上にリガンド複合体を各配置にスポットした。その際のスポット量は約10nlであった。ここで、上記スポッターにより1.8cm四方のAu蒸着ガラス基板上に最大8×12箇所のスポットを形成する事ができる。
【0207】
リガンド複合体溶液をスポット後、70〜80%程度の湿度を有する状態で、12時間静置する事によりリガンド複合体を上記Au蒸着ガラス基板の表面に固定した。
【0208】
また、〔実施例2〕で用いられたリガンド担持体を以下の方法で作製した。1mMの塩化金(III)ナトリウムと5mMの水素化ホウ素ナトリウムとを激しく攪拌・混和し、金イオンを還元した。上記〔製造例1〕で作製した表3に記載のリガンド複合体を100μMになるように上記金ナノ粒子溶液に添加して激しく攪拌・混和し、粗糖鎖固定化金属ナノ粒子のコロイド溶液を調製した。
【0209】
次に、上記粗糖鎖固定化金属ナノ粒子のコロイド溶液を透析チューブ(MWCO:3,500)へ移し、水とPBS−T(0.05%)で透析して精製し、糖鎖固定化金属ナノ粒子(リガンド担持体)のコロイド溶液を得た。これら糖鎖固定化金属ナノ粒子のコロイド溶液の紫外可視吸収スペクトルを測定したところ最大吸収波長は525nmであった。
【0210】
〔実施例1:糖鎖とインフルエンザウイルス分離株との相互作用の測定〕
<インフルエンザウイルスの調製方法>
本実施例では、以下の分類名で分類された、インフルエンザウイルス分離株を使用した。A/Aichi/2/68(H3N2)、A/Fukuoka/C29/85(H3N2)、A/Guizhou/54/89(H3N2),A/Kitakyusyu/159/93(H3N2),A/Memphis/1/71(H3N2),A/Niigata/102/81(H3N2),A/Panama/2007/99(H3N2),A/Sydney/5/97(H3N2),A/Tokyo/6/73(H3N2),A/Wyoming/3/2003(H3N2),A/Yamanashi/2/77(H3N2),A/Beijing/262/95(H1N1),A/Okuda/57(H2N2),A/duck/HK/24/79(H3N2),A/duck/HK/313/4/78(H5N3)である。また、上記インフルエンザウイルス株は、兵庫医科大学から提供された。
【0211】
なお、上記分類名は、型/分離地及び種/分離番号/分離年(ヘマグルチニン(HA)およびノイラミニダーゼ(NA)の抗原型)を意味している。
【0212】
上記インフルエンザウイルス分離株は、以下の方法で調製した。即ち、MDCK細胞をMEMプレートに培養し、当該プレートに上記インフルエンザウイルス分離株を播種して、2〜4日間37℃で放置した。その後、上記プレートから、従来公知の方法を用いてインフルエンザウイルス分離株粗溶液を調製した。当該粗溶液を30%と60%の比重の異なるスクロース溶液を重層した上に積層した後、超遠心(24,000rpm、90分、15℃)を行い、生じた30/60%画分を採取することでインフルエンザウイルス分離株溶液を獲得した。得られた各インフルエンザウイルス分離株溶液の凝集価(HAU)を、0.5%トリ血球溶液を用いる赤血球凝集反応を用いて調べた。
【0213】
<糖鎖とインフルエンザウイルス分離株との相互作用の測定>
上記〔製造例2〕において作製したリガンド担持体と、上記インフルエンザウイルス分離株との相互作用を、表面プラズモン共鳴装置(東洋紡製 MultiSPRinter)を用いて以下の方法で測定した。
【0214】
まず始めに、上記リガンド担持体を上記表面プラズモン共鳴装置にセッティングした。その後、上記リガンド担持体を10mM NaOH水溶液で約10分洗浄した。インフルエンザウイルス分離溶液を加える前に、上記リガンド担持体表面を流れている溶液を0.05%Tween 20を含むPhosphate Buffered Saline(PBS)緩衝液pH7.4(以下、「PBS−T」と略記する)に置換した。測定温度は室温で測定を行った。
【0215】
PBS緩衝液を用いて、上記インフルエンザウイルス分離株のHAUを100HAUに合わせたインフルエンザウイルス分離株溶液を調製した。そして、流速150μl/minの速さで、上記溶液を5分間上記リガンド担持体の表面を流した。
【0216】
ここで、上記インフルエンザウイルス分離株と、上記リガンド担持体に固定されているリガンド複合体の糖鎖とが相互作用をした場合には、リガンド複合体のスポット位置において表面プラズモン共鳴が起こる。従って、上記表面プラズモン共鳴によって生じる信号量(輝度)をリアルタイムで測定することにより、上記相互作用をリアルタイムで測定することができる。
【0217】
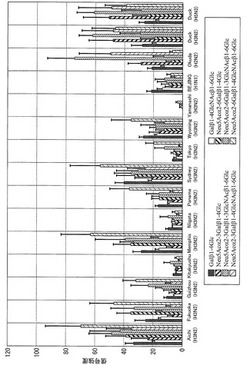
図1は、上述の糖鎖とインフルエンザウイルス分離株との相互作用の測定結果の数値をグラフ化したものである。
【0218】
図1によれば、上記インフルエンザウイルス分離株のそれぞれが、上記糖鎖に対して異なる特異性を有することを示している。
【0219】
さらに、同じA型でH3N2型のインフルエンザウイルスであっても、A/Aichi/2/68(H3N2)やA/Sydney/5/97(H3N2)のように上記糖鎖に対する特異性のパターンに差がないインフルエンザウイルス分離株や、A/Kitakyusyu/159/93(H3N2)や、A/Niigata/102/81(H3N2)や、A/Tokyo/6/73(H3N2)や、A/Yamanashi/2/77(H3N2)のように上記糖鎖との相互作用が弱いインフルエンザウイルス分離株に分類できることも示している。
【0220】
したがって、実施例1より、インフルエンザウイルス分離株と糖鎖との相互作用を測定し、当該インフルエンザウイルスの同定や差別化ができることが示された。
【0221】
〔実施例2〕
500μlの上記〔製造例2〕において作製した糖鎖固定化金属ナノ粒子(リガンド担持体)と、200HAUのインフルエンザウイルスとをチューブ内で、混合し30分間放置した。その後、その混合液に35%、40%、45%、50%、60%のスクロース溶液を各1.5mlずつ、この順で上記チューブに加えて24000rpmで90分間、15℃で遠心分離を行った。
【0222】
図2は、上記糖鎖固定化金属ナノ粒子とインフルエンザウイルスとの混合液に上記スクロースを加えて遠心分離をした後の図である。SGNPは、上記糖鎖固定化金属ナノ粒子に固定されている糖鎖を示し、Virusは、インフルエンザウイルスの有無を示している。また、Sideは、遠心後の上記チューブを横から見た図であり、Bottomは、遠心後の上記チューブを底面から見た図である。
【0223】
図2によれば、インフルエンザウイルスと糖鎖とが相互作用しているサンプルでは、遠心すると上記チューブの底面に凝集物が生じている。一方、糖鎖固定化金属ナノ粒子または、インフルエンザウイルスが入っていないサンプルや、インフルエンザウイルスと糖鎖とが相互作用しないサンプルでは、底面(Bottom)凝集物が生じてない。
【0224】
したがって、実施例2より、糖鎖固定化金属ナノ粒子とインフルエンザウイルスとを混合して時に、インフルエンザウイルスと糖鎖とが相互作用すると、糖鎖−インフルエンザウイルス相互作用体が生じて、凝集物を形成することが示された。
【0225】
〔実施例3〕−糖鎖とタンパク質との相互作用の測定
上記〔製造例2〕において作製したリガンド担持体と、タンパク質との相互作用を、表面プラズモン共鳴装置(東洋紡製 MultiSPRinter)を用いて以下の方法で測定した。
【0226】
まず始めに、上記リガンド担持体を上記表面プラズモン共鳴装置にセッティングした。その後、上記リガンド担持体を10mM NaOH水溶液で約10分洗浄した。タンパク質を加える前に、上記リガンド担持体表面を流れている溶液をPBS−Tに置換した。測定温度は室温で測定を行った。
【0227】
タンパク質を上記PBS−Tを用いて2.0μMの濃度の溶液をエッペンチューブに調製した。そして、流速150μl/minの速さで、上記溶液を5分間上記糖鎖固定測定媒体の表面を流した。
【0228】
ここで、タンパク質と、上記リガンド担持体に固定されているリガンド複合体の糖鎖とが相互作用をした場合には、リガンド複合体のスポット位置において表面プラズモン共鳴が起こる。従って、上記表面プラズモン共鳴によって生じる信号量(輝度)をリアルタイムで測定することで上記相互作用をリアルタイムで測定することができる。
【0229】
本実施例では、上記タンパク質として、コンカナバリンA(Con A)または、ヒママメレクチン(RCA120)、小麦胚芽レクチン(WGA)を用いた。また、ネガティブコントロールとして、ウシ胎児血清アルブミン(BSA)を用いた。
【0230】
図3は表面プラズモン共鳴装置を用いて、上述の各タンパク質と糖鎖との相互作用を測定した結果である。
【0231】
図3によれば、コンカナバリンA(Con A)を用いた場合には、上記リガンド担持体上に、輝度が向上するスポット位置があることが観測された。このことから、それら各スポット位置に固定されている糖鎖と、当該コンカナバリンA(Con A)とが相互作用することが明らかとなった。
【0232】
さらに、ヒママメレクチン(RCA120)、小麦胚芽レクチン(WGA)を用いた場合にも、上記リガンド担持体上に、輝度が向上するスポット位置がそれぞれあることが観測された。このことから、それら各スポット位置に固定されている糖鎖と、当該ヒママメレクチン(RCA120)、または小麦胚芽レクチン(WGA)とが相互作用することが明らかとなった。
【0233】
なお、上記輝度が向上するスポット位置は、それぞれのタンパク質によって特異的であることが明らかになった。
【0234】
一方、ウシ胎児血清アルブミン(BSA)を用いた場合には、同濃度であっても上記リガンド担持体に存在している各スポット位置において、当該スポット位置の輝度が上がらない事が観測された。
【0235】
従って、本実施例により、糖鎖とタンパク質との相互作用を測定し、糖鎖に対するタンパク質の特異性の評価ができることが検証された。
【0236】
〔実施例4:糖鎖とヘルペスウイルス分離株との相互作用の測定〕
<ヘルペスウイルスの調製方法>
本実施例では、HSV−1(CHR−3株)、HSV−2(MS株)という分類名で分類された、ヘルペスウイルス分離株を使用した。なお、上記ヘルペスウイルス分離株は、兵庫医科大学から提供された。
【0237】
上記ヘルペスウイルス分離株は、以下の方法で調製した。即ちVeroE6細胞をMEMプレートに培養し、当該プレートに上記ヘルペスウイルス分離株を播種して、2〜4日間37℃で放置した。その後、上記プレートから従来公知の方法を用いてヘルペスウイルス分離株粗溶液を調製した。
【0238】
当該粗溶液を30%と60%の比重の異なるスクロース溶液を重層した上に積層した後、超遠心(24,000rpm、90分、20℃)を行い、生じた30/60%画分を採取することでヘルペスウイルス分離株溶液を獲得した。得られた各ヘルペスウイルス分離株溶液の力価を、VeroE6細胞に対するPFU(plaque-forming unit;プラーク形成単位)を用いて調べた。
【0239】
<糖鎖とヘルペスウイルス分離株との相互作用の測定>
上記〔製造例2〕において作製したリガンド担持体と、上記ヘルペスウイルス株との相互作用を、表面プラズモン共鳴装置(東洋紡製 MultiSPRinter)を用いて以下の方法で測定した。
【0240】
まず初めに、上記リガンド担持体を上記表面プラズモン共鳴装置にセッティングした。その後、上記リガンド担持体を10mM NaOH水溶液で約10分洗浄した。ヘルペスウイルス分離株溶液を加える前に、上記リガンド担持体表面を流れている溶液を0.05%Tween 20を含むPhosphate Buffered Saline(PBS)緩衝液pH7.4(以下、「PBS−T」と略記する)に置換した。測定温度は室温で測定を行った。
【0241】
PBS−Tを用いて、上記ヘルペスウイルス分離株の濃度を2.4〜59.2μg/mlに合わせたヘルペスウイルス分離株溶液を調製した。そして、流速150μl/minの速さで、上記溶液を5分間上記リガンド担持体の表面に流した。
【0242】
ここで、上記ヘルペスウイルス分離株と、上記リガンド担持体に固定されているリガンド複合体の糖鎖とが相互作用をした場合には、リガンド複合体のスポット位置において表面プラズモン共鳴が起こる。従って、上記表面プラズモン共鳴によって生じる信号量(輝度)をリアルタイムで測定することにより、上記相互作用をリアルタイムで測定することができる。
【0243】
図5は、表面プラズモン共鳴装置を用いて、糖鎖とヘルペスウイルスとの相互作用の測定結果をグラフ化した図である。また、図6は、ヘルペスウイルスに対する8種の糖鎖の反応量(図5に示した信号強度)を全て足した値を100%として、各糖鎖の反応の割合をグラフ化、すなわちヘルペスウイルス分離株をパターニングした図である。
【0244】
図6によれば、上記ヘルペスウイルス分離株のそれぞれが、上記糖鎖に対して異なる特異性を有することを示している。すなわち、上記ヘルペスウイルス分離株の上記糖鎖に対する特異性によって、上記ヘルペスウイルス分離株をパターニングできることが分かる。
【0245】
したがって、実施例4より、ヘルペスウイルス分離株と糖鎖との相互作用を測定することにより、当該ヘルペスウイルスのスクリーニングやパターニングができることが検証された。
【0246】
発明の詳細な説明の項においてなされた具体的な実施態様または実施例は、あくまでも、本発明の技術内容を明らかにするものであって、そのような具体例にのみ限定して狭義に解釈されるべきものではなく、本発明の精神と次に記載する特許請求事項との範囲内で、いろいろと変更して実施することができるものである。
【産業上の利用可能性】
【0247】
本発明に係るタンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質と糖鎖との相互作用の測定方法は、糖鎖が1〜500種類/cm2となるように、それぞれ独立して固定されたリガンド担持体に生体関連物質を接触させる工程を含んでいる。
【0248】
ここで、上記接触によって生じた表面プラズモン共鳴、プラズモン吸収、または水晶振動子の信号量は、上記リガンド複合体の糖鎖とウイルスとの相互作用の強さによって変化するため、上記信号量を測定することにより、上記相互作用を測定することができる。さらに、糖鎖が単位面積あたりに上記のように固定化されているため、複数の糖鎖と上記生体関連物質との相互作用を同時に網羅的に測定することができる。また、上記信号量は、非標識でリアルタイムに得ることができる。そのため、生体関連物質と糖鎖との相互作用を同時且つ網羅的に非標識でリアルタイムに測定することができる。また、1回の測定を低コストで効率よく行うことができる。
【0249】
その上、リガンド担持体を交換することなく、同じリガンド担持体を用いて、上記生体関連物質と糖鎖との相互作用の測定を連続して複数回行うことができる。そのため、網羅的な生体関連物質と糖鎖との相互作用の測定を再現性よく実施することができる。
【0250】
よって本発明を、生体関連物質が関連する疾病に対する検査法、診断法、さらに予防薬や、上記疾病に対する治療薬を開発する医薬品産業、医療機器産業等に利用することができる。
【技術分野】
【0001】
本発明は、生体関連物質と糖鎖との相互作用の測定方法であって、特に、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質であって、上記生体関連物質と、多種多様な糖鎖との相互作用を非標識で、網羅的に迅速かつ直接にリアルタイムで数値化して測定する方法、および当該測定方法を用いた、上記生体関連物質の糖鎖選択性の評価方法、上記生体関連物質のスクリーニング方法、並びに上記生体関連物質のパターニングの方法、そしてこれらの方法を実施するためのキットに関するものである。
【背景技術】
【0002】
糖鎖は、糖がグリコシド結合で複数結合した化合物であり、糖鎖を構成している糖の種類や当該糖の配列を考えると、糖の組み合わせとしては無数の組み合わせがある。そのため糖鎖の種類は多種多様である。また、糖鎖はウイルス、細胞、細菌またはタンパク質といった様々な生体関連物質と相互作用することが知られている。ゆえに、糖鎖と上述の生体関連物質との相互作用が、生体の生理状態に及ぼす影響は大きい。
【0003】
例えば、生体関連物質であるインフルエンザウイルスやエイズウイルス、B型肝炎ウイルスはヒトに感染すると重篤な疾病を引き起こすが、その感染は、ヒトの細胞の細胞膜上の糖鎖と相互作用することがきっかけで始まることが知られている。そして、ウイルスによって相互作用する糖鎖は異なるため、ウイルスの人体への感染経路や人体に及ぼす症状に違いが生じる。
【0004】
例えば、非特許文献1に開示されているように、インフルエンザウイルスの各分離株においても、当該各分離株が相互作用する糖鎖は、糖鎖を構成している糖や、当該糖の配列によって異なることが明らかとなっている。一般的に、ヒトに感染することができるインフルエンザウイルスは、N−アセチルノイラミン酸α2,3−ガラクトース(NeuAcα2,3Gal)よりもN−アセチルノイラミン酸α2,6−ガラクトース(NeuAcα2,6Gal)と強く相互作用することが知られている。
【0005】
そのため、ウイルスと糖鎖との相互作用を網羅的に測定することが、ウイルス感染の予防や治療の戦略を立てる上で重要である。
【0006】
一方、糖鎖とタンパク質に代表される生体関連物質との相互作用は、従来から、酵素標識免疫測定法やウェスタンブロット法等を用いることにより検出されている。上記検出方法は、糖鎖に結合した生体関連物質を主に蛍光物質や、酵素や、抗体を用いることで検出する方法である。
【0007】
また、他の検出方法として、非特許文献2には、糖鎖マイクロアレイによる糖鎖とタンパク質との相互作用の検出方法が開示されている。その内容とは、即ち、化学的に糖鎖を修飾したアルブミンなどに代表される糖鎖修飾タンパク質を作製し、当該糖鎖修飾タンパク質をマイクロアレイ用の媒体上に固定することにより、糖鎖を間接的に上記媒体上に固定する。そして、上記媒体とタンパク質とを反応させた後、蛍光物質を用いて上記糖鎖と上記タンパク質との相互作用を検出するというものである。
【0008】
また、非特許文献3には、金ナノ粒子上に固定された糖鎖とタンパク質との相互作用の検出方法が開示されている。その内容とは、即ち、金ナノ粒子上にアルデヒド基を有するポリエチレングリコールを固定し、当該アルデヒド基と糖鎖とを反応させることにより当該糖鎖を間接的に上記金ナノ粒子上に固定する。そして、当該金ナノ粒子とタンパク質とを反応させた後、当該金ナノ粒子の表面プラズモンバンドの強度を測定することや、透過型電子顕微鏡図を撮影することにより、上記糖鎖と上記タンパク質との相互作用を検出するというものである。
【0009】
また、非特許文献4には、金ナノ粒子上に固定された糖鎖と別の金ナノ粒子上に間接的に固定された糖鎖との相互作用の検出方法が開示されている。その内容とは、即ち、チオール基を有する糖鎖−脂肪酸を作製し、当該糖鎖−脂肪酸を金ナノ粒子上に固定する。そして、当該金ナノ粒子同士を反応させた後、透過型電子顕微鏡図を撮影することにより、当該金ナノ粒子上に固定された上記糖鎖同士の相互作用を検出するというものである。
【0010】
また、非特許文献5には、糖鎖マイクロアレイによる糖鎖と、タンパク質やヒト血清や植物の細胞壁抽出物等の生体関連物質との相互作用の網羅的な検出方法が開示されている。その内容とは、糖鎖が固定されたマイクロアレイ用の媒体と生体関連物質とを反応させた後に、蛍光物質や抗体等を用いることにより、上記糖鎖と上記生体関連物質との相互作用を検出するというものである。
【0011】
また、特許文献1には、表面プラズモン共鳴による、タンパク質と糖鎖との相互作用の測定方法が開示されている。その内容とは、糖鎖が固定された媒体とタンパク質とを反応させ、反応で生じる表面プラズモン共鳴を測定することで、上記糖鎖とタンパク質との相互作用を測定するものである。
【0012】
また、非特許文献6には、インフルエンザウイルスと糖鎖との相互作用の検出方法が開示されている。その内容は、TLCに展開した糖鎖と相互作用したインフルエンザウイルスを、抗体を用いて検出するというものである。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】WO2005/077965号公報(2005年8月25日公開)
【非特許文献】
【0014】
【非特許文献1】VIROLOGY, 1997, 227, 493−499
【非特許文献2】Angew. Chem. Int. Ed. 2006, 45, 3607−3610
【非特許文献3】J. Am. Chem. Soc. 2001, 123, 8226−8230
【非特許文献4】Angew. Chem. Int. Ed. 2001, 40, No.12, 2258−2260
【非特許文献5】Curr. Opinon Struct. Biolog., 2003, 13, 637‐645
【非特許文献6】VIROLOGY, 1992, 189, 121−131
【発明の概要】
【発明が解決しようとする課題】
【0015】
上述のように、糖鎖と上述した生体関連物質との相互作用検出に関して、様々な方法が開発されている。
【0016】
しかしながら、上述の酵素標識免疫測定法、ウェスタンブロット法、非特許文献2、非特許文献5および非特許文献6に記載の方法を用いて生体関連物質を検出するためには、生体関連物質を蛍光物質、酵素、またはビオチン等で標識する必要や、生体関連物質に特異的な抗体を用いる必要がある。
【0017】
この場合、標識することによって以下の問題が生じる。第1は、標識によって、生体関連物質内にある糖鎖との相互作用に重要な部位がマスクされる可能性があることである。そのため、正確な相互作用の測定ができないことが起こりうる。第2は、生体関連物質を標識する場合には、十分な量の生体関連物質を獲得する必要があることである。そして、十分な量の生体関連物質を獲得するためには、莫大なコストが掛かかるため、経済的に好ましくない。
【0018】
また、抗体を用いる場合には、抗体と生体関連物質との特異性を検討しなければならないという煩雑な工程が増える。第3は、標識に用いる分子が生体関連物質と非特異的な結合をしないかどうかの詳細な検討が必要となる。
【0019】
そして、生体関連物質と糖鎖との相互作用の測定は、標識された抗体と、生体関連物質のタンパク質とを反応させた後に、さらに、当該抗体の標識を検出し測定するという複数のステップを必要とする。つまり、生体関連物質と糖鎖との結合を、標識された抗体および標識を介して間接的に測定するため、実際の生体関連物質と糖鎖との結合の強度をリアルタイムで詳細に調べることはできない。
【0020】
また、生体関連物質では、タンパク質に変異が起こることが知られている。タンパク質の変異はランダムに起こるため、タンパク質の抗原部位に変異の起こった生体関連物質と糖鎖との相互作用を、抗体を用いて測定することはできない。
【0021】
特にインフルエンザウイルスに関しては、タンパク質の変異によって誕生した変異体ウイルスに対する免疫がないために、感染率や感染後の死亡率が飛躍的に高くなるということが知られている。
【0022】
上述したようにインフルエンザウイルスの感染と糖鎖との相互作用は、密接な関連があるため、インフルエンザウイルスの感染を予防するために、インフルエンザウイルスと糖鎖との相互作用を測定することは重要である。しかし、非特許文献6に記載されているように、従来法では抗体を用いてインフルエンザウイルスと糖鎖との相互作用を測定しているため、タンパク質の抗原部位に変異の起こったインフルエンザウイルスと糖鎖との相互作用を測定することはできない。
【0023】
また、上述の酵素標識免疫測定法、ウェスタンブロット法、非特許文献2、非特許文献5および非特許文献6に記載の方法では、生体関連物質と反応済みの糖鎖を再生することが困難であるため、1回の検出について、一種類の生体関連物質を用いることしかできない。そのため、複数の生体関連物質を用いて、当該生体関連物質と糖鎖との相互作用を測定する場合には、異なるロットの糖鎖を用いなければならない。従って、上記測定の結果を比較する際には、ロット間性能の差が反映される恐れがあるため、正確性の高い比較をすることができない。その結果、糖鎖に対する特異性の観点から生体関連物質のスクリーニングやパターニングをすることができない。
【0024】
また、上記非特許文献3、非特許文献4、および非特許文献6に記載の方法では、支持体に糖鎖を固定するためには、特別なリンカー化合物が付加された糖鎖(糖鎖―リンカー化合物の複合体)を合成する必要がある。そして、その合成には複雑な反応を必要とするため、作製することのできる糖鎖―リンカー化合物の複合体の種類は限定されている。それゆえ、固定できる糖鎖の種類が少ない。ゆえに、一度の測定で多種多様な糖鎖と生体関連物質との相互作用を測定することはできない。
【0025】
そのため、糖鎖と多種多様な生体関連物質との相互作用を調べる際には、ある糖鎖と生体関連物質との相互作用を測定した後、別の糖鎖と当該生体関連物質との相互作用の測定を行うという工程を何度も繰り返して行うことが必要である。それゆえ、糖鎖と多種多様な生体関連物質との相互作用を測定するには、多くの時間を要するだけでなく、多量の生体関連物質を用意することも必要である。
【0026】
さらに、上記非特許文献2に記載の方法には、上記糖鎖修飾タンパク質自体が生体関連物質と相互作用する可能性があるため、予め糖鎖修飾タンパク質が上記生体関連物質と相互作用するかどうか詳細に検討する煩雑な工程が必要になるという問題がある。
【0027】
また、上記非特許文献3や非特許文献4に記載の方法には、糖鎖を上記金ナノ粒子に固定するためには、複数の複雑な工程を必要とするという問題がある。また、上記非特許文献5に記載の方法には、上記生体関連物質を標識せずに抗体などを用いて段階的に結合させる方法があるが、標識分子がない段階では結合性を測定することは不可能であるという問題がある。
【0028】
本発明は上記の問題に鑑みてなされたものであり、その目的は、微量の生体関連物質を用いて、生体関連物質と、糖鎖との相互作用を同時に非標識で、網羅的にリアルタイムで測定し、糖鎖に対する特異性の観点から生体関連物質をスクリーニングする方法やパターニングする方法を提供することにある。なお、本明細書においては、用語「スクリーニング」は用語「同定」と交換可能に用いられ、用語「パターニング」は用語「差別化」と交換可能に用いられる。また、本明細書において、用語「密度」とは、支持体の単位面積あたりに固定されているリガンド複合体の種類を意味する。
【課題を解決するための手段】
【0029】
本発明者らは、上記課題に鑑み鋭意検討した結果、ジスルフィド結合(S−S結合)またはチオール基(SH基)を有するリンカー化合物に、糖鎖が結合している構造を含むリガンド複合体を表面に金属を備える支持体の表面に固定させたリガンド担持体に、ウイルス、細胞、細菌、リポソーム、またはミセルといった生体関連物質を含む溶液を接触させることによって、上記生体関連物質と糖鎖との相互作用を測定できることを見出し、本発明を完成させるに至った。
【0030】
即ち、本発明に係る生体関連物質と糖鎖との相互作用の測定方法は、リガンド担持体に、生体関連物質を含む溶液を接触させる工程を含み、上記リガンド担持体は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されていると共に、上記表面は金属を備えており、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質であることを特徴としている。
【0031】
上記構成によれば、上記リガンド複合体を金属−硫黄結合により、容易に上記支持体に固定することができる。なお、上記リガンド複合体には糖鎖が含まれているから、糖鎖を、糖鎖の種類に関係なく、上記支持体表面に間接的に固定することができる。
【0032】
また、上記リガンド複合体が1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されているため、1回の測定で多種多様な糖鎖と上記生体関連物質との相互作用を同時に網羅的に測定することができる。そのため、測定に用いる生体関連物質の量を減らすことができる。ゆえに、生体関連物質を多量に用意する必要がなく、微量な生体関連物質を測定に用いることができる。また、1回の測定を低コストで効率的に行うことができる。
【0033】
また、上記支持体の表面は金属を備えるため、上記接触により生じる表面プラズモン共鳴、プラズモン吸収、または水晶振動子の信号量を簡便に測定することができる。そして、上記信号量は、上記リガンド複合体の糖鎖と上記生体関連物質との相互作用の強さによって変化するため、その信号量を測定することにより、上記相互作用を1ステップで、測定し数値化することができる。ゆえに上記生体関連物質の糖鎖選択性を正確に評価することができる。
【0034】
また、上記信号量は、レーザー光等を用いて物理現象を利用してリアルタイムで測定される。従って、上記生体関連物質を標識することなくリアルタイムで直接測定することができる。また、当該相互作用を高感度で測定することができるため、用いる上記生体関連物質の量を少なくすることができる。
【0035】
その上、リガンド担持体を交換することなく、同じリガンド担持体を用いて、上記生体関連物質と糖鎖との相互作用の測定を連続して複数回行うことができる。そのため、網羅的な生体関連物質と糖鎖との相互作用の測定を再現性よく実施することができる。
【0036】
また、本発明に係る生体関連物質の糖鎖選択性の評価方法は、リガンド担持体に、生体関連物質を含む溶液を接触させて、当該生体関連物質と糖鎖との相互作用の測定を行う工程と、上記測定の結果得られる上記生体関連物質の糖鎖に対する特異性を特定する工程とを含み、上記リガンド担持体は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されていると共に、上記表面は金属を備えており、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質であることを特徴としている。
【0037】
上記構成によれば、生体関連物質と糖鎖との相互作用を測定することにより、上記生体関連物質の糖鎖に対する相互作用の強さを調べ、当該強さを特定することができる。ここで、リガンド複合体は、上記の密度で支持体に固定されている。ゆえに、上記生体関連物質の多種多様な糖鎖に対する特異性を特定することができる。その結果、生体関連物質の糖鎖選択性の網羅的な評価をすることができる。
【0038】
また、本発明に係る生体関連物質のスクリーニング方法は、リガンド担持体に、目的の生体関連物質を含む溶液または、対照の生体関連物質を含む溶液を別々に接触させて、それぞれの生体関連物質と糖鎖との相互作用の測定を行う工程と、上記測定を上記目的の生体関連物質を含む溶液を用いて行った場合の結果と、上記測定を上記対照の生体関連物質を含む溶液を用いて行った場合の結果とを比較し、上記結果を一致させる工程とを含み、上記リガンド担持体は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されていると共に、上記表面は金属を備えており、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質であることを特徴としている。
【0039】
上記構成によれば、目的の上記生体関連物質を含む溶液を用いて行った場合の測定結果と対照の上記生体関連物質を含む溶液を用いて行った場合の測定結果とを比較し、当該測定結果を一致させることができる。換言すれば、目的の上記生体関連物質の糖鎖に対する特異性と、対照の上記生体関連物質の糖鎖に対する特異性とを比較し、当該特異性を一致させることができる。そのため、上記生体関連物質の糖鎖に対する特異性の観点から、目的の上記生体関連物質をスクリーニングすることができる。
【0040】
また、上記密度で上記リガンド担持体が固定されているリガンド担持体を交換することなく、同じリガンド担持体を用いて、上記目的の生体関連物質または、上記対照の生体関連物質と糖鎖との相互作用の測定を連続して複数回行うことができる。そのため、網羅的な生体関連物質と糖鎖との相互作用の測定を再現性よく実施することができる。その結果、上記測定の結果について迅速に正確性の高い比較をすることができる。従って、正確性の高い生体関連物質のスクリーニングを行うことができる。
【0041】
また、本発明に係る生体関連物質のパターニング方法は、リガンド担持体に、2種類以上の生体関連物質を含む溶液を別々に接触させて、それぞれの生体関連物質と糖鎖との相互作用の測定を行う工程と、上記測定結果を比較し、分類する工程と、を含み、上記リガンド担持体は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されていると共に、上記表面は金属を備えており、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質であることを特徴としている。
【0042】
上記構成によれば、上記生体関連物質の糖鎖に対する特異性を比較し、糖鎖に対する特異性のパターンによって分類することができる。換言すれば、一方の上記生体関連物質の糖鎖に対する相互作用の強さと、他方の上記生体関連物質の糖鎖に対する相互作用の強さとを比較し、それらの傾向によって上記生体関連物質を分類することで、パターニングすることができる。
【0043】
また、上記密度で上記リガンド担持体が固定されているリガンド担持体を交換することなく、同じリガンド担持体を用いて、上記目的の生体関連物質または、上記対照の生体関連物質と糖鎖との相互作用の測定を連続して複数回行うことができる。そのため、網羅的な生体関連物質と糖鎖との相互作用の測定を再現性よく実施することができる。その結果、上記測定の結果について迅速に正確性の高い比較をすることができる。従って、正確性の高い上記生体関連物質のパターニングを行うことができる。
【0044】
本発明に係る方法において、上記リンカー化合物が、一般式(1)
【0045】
【化1】

【0046】
(式中、nは0以上6以下の整数)にて表される構造を備え、上記Xとして、末端に芳香族アミノ基を有するとともに、主鎖に炭素−窒素結合を有していてもよい炭化水素誘導鎖を、1鎖又は4鎖含んでなる多分岐構造部位である構造を備え、上記Yとして、硫黄原子を含む炭化水素構造を備えているリンカー化合物であることが好ましい。
【0047】
上記構成によれば、上記リンカー化合物は分子内に1〜4個の芳香族アミノ基を有している。また、当該アミノ基と還元末端を有する糖鎖とを還元アミノ化反応を行うことにより簡便に結合することができる。したがって、上記リンカー化合物を用いることにより、1個のリンカー化合物内に1〜4個の糖鎖が結合した構成のリガンド複合体を作製することができる。
【0048】
また、本発明に係る方法は、上記ウイルスが、インフルエンザウイルス、ヘルペスウイルス、ノロウイルス、HTLV-1ウイルス、エイズウイルス、ロタウイルス、SARSウイルス、または、B型肝炎ウイルスであり、上記細胞が、肝細胞または、肝臓癌、肺癌、胃癌、小腸癌、大腸癌、すい臓癌、脾臓癌および腎臓癌からなる群より選ばれる1以上の癌細胞であり、上記細菌が、大腸菌、ヘリコバクターピロリ菌、緑膿菌、乳酸菌および連鎖球菌からなる群より選ばれる1以上の細菌であることが好ましい。
【0049】
上記構成によれば、上述の生体関連物質と糖鎖との相互作用を測定することができる。また、上述の生体関連物質の同定や差別化を行うこともできる。その結果、上述の生体関連物質と相互作用する糖鎖を同定することができる。さらに、上述の生体関連物質と相互作用する共通の糖鎖を同定することもできる。
【0050】
また、本発明に係る方法では、上記生体関連物質が、インフルエンザウイルスまたはヘルペスウイルスであり、上記糖鎖が、Galβ1−4Glc、Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4Glc、Neu5Acα2−6Galβ1−4Glc、Neu5Acα2−3Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−4GlcNAcβ1−6Glc、GlcAβ1−3GalNAc4Sβ1−6Glc、GlcAβ1−3GalNAc6Sβ1−6Glc、GlcA2Sβ1−3GalNAc6Sβ1−6Glc、GlcAβ1−3GalNAc4S6Sβ1−6Glc、GlcNS6Sα1−4IdoA2Sα1−6Glc、GlcNSα1−4IdoA2Sα1−6Glc、GlcNS6Sα1−4GlcA2Sβ1−6Glc、およびGlcNSα1−4GlcAβ1−6Glcからなる群より選ばれる1以上の糖鎖であることが好ましい。
【0051】
上記構成によれば、インフルエンザウイルスまたはヘルペスウイルスと上記糖鎖との相互作用を網羅的にリアルタイムで直接、測定することができる。さらに1回の測定を低コストで迅速に行うことができる。
【0052】
なお、Neu5Acα2−6Galβ1−4Glc、Neu5Acα2−6Galβ1−3GlcNAcβ1−6Glc、およびNeu5Acα2−6Galβ1−4GlcNAcβ1−6Glcは、主にヒトに感染するインフルエンザウイルスと相互作用する陽性対照の糖鎖である。また、Neu5Acα2−3Galβ1−4Glc、Neu5Acα2−3Galβ1−3GlcNAcβ1−6Glc、およびNeu5Acα2−3Galβ1−4GlcNAcβ1−6Glcは、主に鳥類や馬科に感染するインフルエンザウイルスと相互作用する陽性対照の糖鎖である。さらに、Galβ1−4Glc、およびGalβ1−4GlcNAcβ1−6Glcは、インフルエンザウイルスと相互作用する陰性対照の糖鎖である。
【0053】
そのため、上記のいずれかの糖鎖または、上記糖鎖を複数有する上記リガンド担持体を用いて各インフルエンザウイルスとの相互作用を測定することで、インフルエンザウイルスの宿主特異性を調べることができる。また、インフルエンザウイルスの同定や差別化を行うこともできる。
【0054】
また、ヘパリンの部分構造であるGlcNS6Sα1−4IdoA2Sα1−6Glc、GlcNSα1−4IdoA2Sα1−6Glc、GlcNS6Sα1−4GlcA2Sβ1−6Glc、およびGlcNSα1−4GlcAβ1−6Glcを、またコンドロイチンの部分構造であるGlcAβ1−3GalNAc6Sβ1−6Glc、GlcA2Sβ1−3GalNAc6Sβ1−6Glc、およびGlcAβ1−3GalNAc4S6Sβ1−6Glcは、ヘルペスウイルスと相互作用する陽性対照の糖鎖であるため、これらの糖鎖のいずれか、または、これらの糖鎖を複数有する上記リガンド担持体を用いてヘルペスウイルスとの相互作用を測定することで、ヘルペスウイルスの型の違いを調べることができる。
【0055】
また、本発明に係る方法を実施するためのキットは、リガンド複合体が支持体の表面に固定されたリガンド担持体を備えた、本発明に係る方法を実施するためのキットであって、上記リガンド複合体は、硫黄元素を有するリンカー化合物に糖鎖が結合している構造を備え、上記表面は金属を備えることを特徴としている。
【0056】
上記構成によれば、上記キットには上記リガンド担持体が含まれるため、本発明に係る方法を簡便に行うことができる。
【0057】
また、本発明に係るキットの上記糖鎖は、Galβ1−4Glc、Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4Glc、Neu5Acα2−6Galβ1−4Glc、Neu5Acα2−3Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−4GlcNAcβ1−6Glc、GlcAβ1−3GalNAc4Sβ1−6Glc、GlcAβ1−3GalNAc6Sβ1−6Glc、GlcA2Sβ1−3GalNAc6Sβ1−6Glc、GlcAβ1−3GalNAc4S6Sβ1−6Glc、GlcNS6Sα1−4IdoA2Sα1−6Glc、GlcNSα1−4IdoA2Sα1−6Glc、GlcNS6Sα1−4GlcA2Sβ1−6Glc、およびGlcNSα1−4GlcAβ1−6Glcからなる群より選ばれる1以上の糖鎖であることが好ましい。
【0058】
上記構成によれば、上記リガンド担持体には、上述した、主にヒトに感染するインフルエンザウイルスと相互作用する陽性対照の糖鎖、主に鳥類や馬科に感染するインフルエンザウイルスと相互作用する陽性対照の糖鎖、インフルエンザウイルスと相互作用する陰性対照の糖鎖からなる群より選ばれる糖鎖が含まれる。
【0059】
また、上記構成によれば、上記リガンド担持体には、上述した、ヘルペスウイルスと相互作用する陽性対照の糖鎖が含まれる。
【0060】
そのため、生体関連物質としてインフルエンザウイルスまたはヘルペスウイルスを用いた場合に、インフルエンザウイルスまたはヘルペスウイルスと上記の糖鎖との相互作用を同時に低コストで網羅的にリアルタイムで測定することができる。
【0061】
また、インフルエンザウイルスまたはヘルペスウイルスの同定や差別化を行うこともできる。その結果、インフルエンザウイルスまたはヘルペスウイルスと相互作用する糖鎖を同定することができる。また、インフルエンザウイルスまたはヘルペスウイルスの宿主特異性を調べることもできる。
【発明の効果】
【0062】
本発明に係る生体関連物質と糖鎖との相互作用の測定方法は、以上のように、リガンド担持体に、生体関連物質を含む溶液を接触させる工程を含み、上記リガンド担持体は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されていると共に、上記表面は金属を備えており、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質であるという構成である。
【0063】
そのため、上記生体関連物質と糖鎖との相互作用を標識することなくリアルタイムで網羅的に1ステップで直接測定し数値化することができる。ゆえに、上記生体関連物質の糖鎖選択性を正確に評価することができるという効果を奏する。また、測定に用いる生体関連物質を多量に用意する必要がなく、微量な生体関連物質を測定に用いることができるという効果を奏する。
【0064】
また、本発明に係る生体関連物質の糖鎖選択性の評価方法は、リガンド担持体に、生体関連物質を含む溶液を接触させて、当該生体関連物質と糖鎖との相互作用の測定を行う工程と、上記測定の結果得られる上記生体関連物質の糖鎖に対する特異性を特定する工程とを含み、上記リガンド担持体は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されていると共に、上記表面は金属を備えており、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質であるという構成である。
【0065】
そのため、上記生体関連物質の多種多様な糖鎖に対する特異性を特定することができる。その結果、生体関連物質の糖鎖選択性の網羅的な評価をすることができる。
【0066】
また、本発明に係る生体関連物質のスクリーニング方法は、リガンド担持体に、目的の生体関連物質を含む溶液または、対照の生体関連物質を含む溶液を別々に接触させて、それぞれの生体関連物質と糖鎖との相互作用の測定を行う工程と、上記測定を上記目的の生体関連物質を含む溶液を用いて行った場合の結果と、上記測定を上記対照の生体関連物質を含む溶液を用いて行った場合の結果とを比較し、上記結果を一致させる工程とを含み、上記リガンド担持体は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されていると共に、上記表面は金属を備えており、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質であるという構成である。
【0067】
そのため、上記生体関連物質と糖鎖との相互作用の網羅的な測定結果を比較し、当該測定結果を一致させることで、上記生体関連物質の糖鎖に対する特異性の観点から、目的の上記生体関連物質を高い正確性で同定することができるという効果を奏する。
【0068】
また、本発明に係る生体関連物質のパターニング方法は、リガンド担持体に、2種類以上の生体関連物質を含む溶液を別々に接触させて、それぞれの生体関連物質と糖鎖との相互作用の測定を行う工程と、上記測定結果を比較し、分類する工程と、を含み、上記リガンド担持体は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されていると共に、上記表面は金属を備えており、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質であるという構成である。
【0069】
そのため、上記生体関連物質と糖鎖との相互作用の網羅的な測定結果を比較し、当該測定結果を分類させることで、上記生体関連物質の糖鎖に対する特異性の観点から、正確性の高い上記生体関連物質の差別化をすることができるという効果を奏する。
【0070】
また、本発明に係る上記方法を実施するためのキットは、リガンド複合体が支持体の表面に固定されたリガンド担持体を備えたキットであって、上記リガンド複合体は、硫黄元素を有するリンカー化合物に糖鎖が結合している構造を備え、上記表面は金属を備えるという構成である。
【0071】
そのため、本発明に係る方法を簡便に行うことができるという効果を奏する。
【図面の簡単な説明】
【0072】
【図1】図1は、表面プラズモン共鳴装置を用いて、糖鎖とインフルエンザウイルスとの相互作用の測定結果をグラフ化した図である。
【図2】糖鎖固定化金属ナノ粒子とインフルエンザウイルスとの混合液にスクロースを加えて遠心分離をした後の図である。
【図3】図3は、表面プラズモン共鳴装置を用いて、糖鎖とタンパク質との相互作用を測定した結果を示す図である。
【図4】図4は、インフルエンザウイルスに対する8種の糖鎖の反応量(図1に示した信号強度)を全て足した値を100%として、各糖鎖の反応の割合をグラフ化した図である。
【図5】図5は、表面プラズモン共鳴装置を用いて、糖鎖とヘルペスウイルスとの相互作用の測定結果をグラフ化した図である。
【図6】図6は、ヘルペスウイルスに対する8種の糖鎖の反応量(図5に示した信号強度)を全て足した値を100%として、各糖鎖の反応の割合をグラフ化した図である。
【発明を実施するための形態】
【0073】
以下、本発明について詳細に説明する。なお、本明細書中に記載された非特許文献および特許文献の全てが、本明細書中において参考として援用される。
【0074】
<支持体>
本発明に用いることのできる支持体は、表面に金属を備えるという構成である。そのような構成の支持体として、例えば上記支持体は、単一の材料からなる構成の支持体、1つの基板(第1の基板)の表面に別種類の少なくとも1つの材料からなる金属の薄膜(第1の層)を表面に形成している構成の支持体、または前記第1の基板と前記第1の層との間に少なくとも1つの他の介在層(第2の層、第3の層、等)が存在している構成の支持体を挙げることができる。
【0075】
なお、支持体の表面とは、本発明に用いることのできる生体関連物質を含む溶液と支持体とが接触することのできる箇所を指す。
【0076】
上記金属としては、金、銀、銅、アルミニウム、白金、酸化アルミニウム、SrTiO3、LaAlO3、NdGaO3、ZrO2等を用いることができる。また、上記第1の基板の材料としては、ガラス、水晶、金属(例えば金、銀、銅、アルミニウム、白金、酸化アルミニウム、SrTiO3、LaAlO3、NdGaO3、ZrO2等)、シリコン(例えば酸化珪素)、ポリマー樹脂(例えばポリエチレンテレフタレート、ポリカーボネート)、炭素(グラファイト)等を用いることができる。本発明に用いることのできる支持体の厚さは特に限定されないが、通常、前記第1の基板であれば、0.1mm〜30mm程度であり、好適には、0.1mm〜2mm程度である。
【0077】
上述した支持体を用いることにより、上記生体関連物質と糖鎖との相互作用の程度を表面プラズモン共鳴、プラズモン吸収、または水晶振動子等の信号量の大きさとして測定することができる。
【0078】
特に、上記表面プラズモン共鳴の信号量を測定する場合には、上記支持体は、前記第1の基板としてガラス、ポリマー樹脂、またはプラスティック等の透明な材料を用い、前記第1の層を有する支持体等であることが好ましい。前期第1の基板の上に前記第1の層を作製する方法としては、特に限定されず、真空蒸着、スパッタリング、電解メッキ、浸漬メッキ、金属箔の接合、化学吸着等従来公知の方法を用いて、前記第1の層を前期第1の基板の上に固定すればよい。具体例として、特許文献1に記載のセンサチップをあげることができる。
【0079】
また、プラズモン吸収の信号量を測定する場合には、上記支持体は、金属ナノ粒子のような単一の金属からなる構成の支持体であることが好ましい。上記金属ナノ粒子とは、粒子径が好ましくは1〜200nmであるコロイド状の金属粒子を意味する。上記金属ナノ粒子を得る方法としては、特に限定されず、例えば、従来公知の方法を用いて、塩化金属酸およびその塩類をメタノール、水やこれらの混合溶媒等に溶解させることで得ることができる。上記塩化金属酸およびその塩類の具体例としては、塩化金(III)ナトリウムを挙げることができる。
【0080】
また、水晶振動子の信号量を測定する場合には、上記支持体は、従来公知の水晶振動子を含むことが好ましい。そのような構成の支持体として、特開2005−84028号公報に公開されている水晶振動子の支持体を例示することができる。
【0081】
<リンカー化合物>
本発明に用いることのできるリンカー化合物としては、硫黄原子を有しており、且つ糖鎖と結合することができる構成であれば特に限定されない。例えば、上記糖鎖と結合することができる構成として、アミノ基等の官能基が導入されているリンカー化合物を挙げることができる。上記硫黄原子は、ジスルフィド結合(S−S結合)またはチオール基(SH基)のような状態であっても良い。そのようなリンカー化合物として具体的には、特許文献1に記載のリンカー化合物を用いることができる。
【0082】
また、本発明に用いることのできるリンカー化合物の具体例として、下記の一般式(1)で表される構造を備えたリンカー化合物を挙げることができる。なお、この構造中のYで示す構造中には、硫黄原子が含まれている。
【0083】
【化2】

【0084】
(式中、nは0以上6以下の整数)にて表される構造を備え、上記Xとして、末端に芳香族アミノ基を有するとともに主鎖に炭素−窒素結合を有していてもよい炭化水素誘導鎖を、1鎖又は4鎖含んでなる多分岐構造部位である構造を備えている。これによって、上記リンカー化合物は、上記支持体表面に複数の糖鎖を集合化して配列することができるとともに、末端に芳香族アミノ基を有していることによって、糖鎖を簡便に導入することができる。なお、上記一般式(1)において、nは0以上6以下の整数であれば限定されない。
【0085】
上記一般式(1)で表される構造を備えたリンカー化合物は、例えば上記リンカー化合物は、チオクト酸と、芳香族アミノ基末端との縮合反応を行うことによって製造される。
【0086】
<糖鎖>
本発明で用いることのできる糖鎖は、糖がグリコシド結合によって複数結合した化合物を意味する。上記糖としては、還元末端を有する糖であれば特に限定されずシアル酸や硫酸基を有する糖を好適に用いることができる。
【0087】
上記還元末端を有する糖とは例えば、マルトース、ラクトース、パノース、セロビオース、メリビオース、マンノオリゴ糖、キトオリゴ糖、ラミナリオリゴ糖を挙げることができる。上記シアル酸を有する糖としては、特に限定されず、シアリルラクトース等を挙げることができる。
【0088】
なお、上記糖鎖は、同一の糖からなる単一オリゴ糖であってもよいし、種々の糖やその誘導体からなる複合糖であってもよい。また、上記オリゴ糖は、いずれも、自然界から単離・精製して得られる種々の天然の糖であってもよく、人工的に合成された糖であってもよい。また、上記オリゴ糖は、多糖を分解して得られたものであってもよい。
【0089】
例えば、上記糖鎖として、Glc、GlcNAc、Gal、Glcα1−4Glc、Glcα1−4Glcα1−4Glc、Glcα1−6Glc、Glcα1−6Glcα1−6Glc、Glcβ1−3Glcβ1−3Glc、Glcβ1−4Glc、Glcβ1−6Glc、Galα1−6Glc、Galα1−4Galβ1−4Glc、Galβ1−3GalNAcα1−6Glc、Galβ1−4GlcNAcβ1−6Glc、Galβ1−4Glc、Galβ1−4[Fucα1−2]GlcNAcβ1−3Galβ1−4Glc、Manα1−2Man、Manα1−3Manα1−6Man、Manα1−6Man、Fucα1−2Galβ1−4Glc、Fucα1−6Glc、Fucβ1−6Glc、Xylβ1−6Glc、GlcNAcα1−6Glc、GlcNAcβ1−4GlcNAc、GlcNAcβ1−6Glc、GlcNAcβ1−3Galβ1−4GlcNAcβ1−3Galβ1−4Glc、GalNAcα1−6Glc、GalNAcβ1−3Gal、Neu5Acα2−3Galβ1−4Glc、Neu5Acα2−3Galβ1−4GlcNAc、Neu5Acα2−3Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−4Glc、Neu5Acα2−6Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−4GlcNAcβ1−6Glc、GlcNS6Sα1−4IdoA2Sβ1−6Glc、Galβ1−4GlcGalβ1−4GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4Glc、Neu5Acα2−6Galβ1−4Glc、Neu5Acα2−3Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−4GlcNAcβ1−6Glc、GlcAβ1−3GalNAc4Sβ1−6Glc、GlcAβ1−3GalNAc6Sβ1−6Glc、GlcA2Sβ1−3GalNAc6Sβ1−6Glc、GlcAβ1−3GalNAc4S6Sβ1−6Glc、GlcNS6Sα1−4IdoA2Sα1−6Glc、GlcNSα1−4IdoA2Sα1−6Glc、GlcNS6Sα1−4GlcA2Sβ1−6Glc、GlcNSα1−4GlcAβ1−6Glc等を挙げることができる。
【0090】
なお、本明細書において、略語「Glc」はグルコース(Glucose)を、略語「Gal」はガラクトース(Galactose)を、略語「Man」はマンノース(Mannose)を、略語「Fuc」はフコース(Fucose)を、略語「Xyl」はキシロース(Xylose)を、略語「NAc」はN-アセチル(N-Acetyl)を、略語「Ido」はイドース(Idose)を、略語「Neu5Ac」はN-アセチルノイラミン酸(N-Acetylneuraminic acid)を、略語「GlcA」はグルクロン酸(Glucuronic acid)を、略語「IdoA」はイズロン酸(Iduronic aid)を、糖鎖の化学式中に表される「S」はスルフォニル(硫酸基)をそれぞれ表す。例えば、GlcAβ1−3GalNAc4Sβ1−6Glcにおける「4S」は4−O−硫酸を表す。
【0091】
また、糖鎖の化学式における「α」または「β」は、還元末端側の糖の水酸基がα又はβの立体構造で隣り合う糖の水酸基と結合していることを示す。例えば、「α1−4」は還元末端側の糖の1位水酸基がαの立体構造で隣り合う糖の4位の水酸基と結合していることを示す。
【0092】
<リガンド複合体>
本発明に用いることのできるリガンド複合体は、上記<リンカー化合物>で述べたリンカー化合物と上記<糖鎖>で述べた糖鎖とが結合している構成である。上記リンカー化合物と上記糖鎖との結合方法としては、特に限定されず従来公知の方法を用いることができる。例えば、リンカー化合物が、上記一般式(1)で表される構造を備えたリンカー化合物である場合は、当該リンカー化合物は、アミノ基を有している。そのため、上記糖鎖の還元末端と当該アミノ基とを還元アミノ化反応を行うことにより両者を容易に結合させることができる。具体的には、下記の一般式(2)、(3)等で表される構造を備えたリガンド複合体を挙げることができる。
【0093】
【化3】

【0094】
【化4】

【0095】
<リガンド担持体>
本発明で用いることのできるリガンド担持体は、上記リガンド複合体が上記支持体上に固定されている構成である。
【0096】
上記リガンド複合体を上述した支持体上に固定する方法としては、特に限定されない。上記リガンド複合体は、硫黄元素を有するリンカー化合物に、糖鎖が結合している構成である。また、上記支持体は、表面に金属を備える構成である。そのため、上記リガンド複合体と、上記支持体とを接触させることで容易に、金属−硫黄(S)結合を形成し、上記支持体表面に上記リガンド複合体を固定することができる。
【0097】
例えば、上記固定の方法として、上記リガンド複合体を溶媒に溶解させることで作製したリガンド溶液を、上記表面に金属を備える支持体の表面にスポットする方法を挙げることができる。
【0098】
特に、従来公知のスポッター装置(例えば、東洋紡 SPRINTERスポッター)を用いてスポットすることにより、上記リガンド複合体を、好ましくは1〜50種類/cm2、より好ましくは1〜500種類/cm2となるように、表面に金属を備える支持体の表面にそれぞれ独立して固定することができる。なお、上記「1〜500種類」には、1種類および500種類も含まれる。
【0099】
多種類のリガンド複合体を集積すればするほど、一度の測定で、得られる測定結果が増える。そのため、測定に用いる生体関連物質の量を少なくすることができる。ゆえに、リガンド複合体を支持体の単位面積あたりに上記の種類固定することにより、微量な生体関連物質を測定することができる。
【0100】
この場合、スポットに用いられる上記リガンド溶液の量は、1nL〜1000nLであることがより好ましく、5nL〜30nLであることが更に好ましい。
【0101】
支持体表面に単位面積あたり上述の種類のリガンド複合体が固定されていることは、後述の表面プラズモン共鳴装置に上記リガンド担持体を装着して、上記リガンド担持体が固定されていないスポットと固定されているスポットとの表面プラズモン共鳴を測定することにより調べることができる。
【0102】
また、上記溶媒としては、特に限定されるものではないが、例えば、メタノール、水、ジメチルアセトアミド(DMAc)、グリセロールや、これらの混合溶媒等を挙げることができる。また、接触時間は、0.5時間〜12時間程度であればよく、上記リガンド溶液のリガンド複合体の濃度は、1μM〜1mMであればよい。さらに上記リガンド溶液と上記支持体の接触中は、当該リガンド溶液の蒸発を防ぐため、50〜80%、好ましくは、70〜80%の湿度を有する中で当該支持体を保存することが好ましい。上記湿度の調節方法は特に限定されず、例えば、従来公知の加湿器等を用いて湿度を調節することができる。
【0103】
また、上記金属ナノ粒子に上記リガンド複合体を固定する方法としては、特に限定されないが、例えば、金属ナノ粒子を含む溶液を上記リガンド複合体と混和することによって得ることができる。具体的には、金属ナノ粒子を含む溶液を上記リガンド複合体を含む溶液に添加して攪拌することによって、金属ナノ粒子にリガンド複合体を固定することができる。上記攪拌の時間は、30秒程度であればよく、上記リガンド溶液のリガンド複合体の濃度は、好ましくは、1μM〜10mMであればよく、より好ましくは10μM〜1mMであることが好ましい。このように金属ナノ粒子にリガンド複合体が固定されているリガンド担持体を以下、糖鎖固定化金属ナノ粒子という。
【0104】
なお、金属が塩として溶液に含まれているときは、上記リガンド複合体と混和する前に、還元剤を用いて金属を還元しておくことが好ましい。これにより、金属と上記リガンド複合体との結合を形成しやすくすることができる。還元剤としては、特に限定されるものではないが、例えば、水素化ホウ素ナトリウム、クエン酸およびその塩類、アスコルビン酸およびその塩類、リン、タンニン酸およびその塩類、エタノール、ヒドラジン等を用いることができる。
【0105】
金属を含む溶液の分散媒およびリガンド複合体を含む溶液に用いる溶媒としては、特に限定されるものではないが、例えば、メタノール、水やこれらの混合溶媒等を挙げることができる。また、上記混和によって得られたリガンド担持体を透析し、低分子の塩などを除くことによって、溶液状態で安定なリガンド担持体を得ることができる。
【0106】
上記糖鎖固定化金属ナノ粒子を調製するために用いる金属、還元剤、上記リガンド複合体の混合比は、特に限定されるものではないが、金属が塩化金酸およびその塩類である場合は、塩化金酸およびその塩類の溶液中の最終濃度が0.5mM〜10mMであることが好ましく、1mM〜5mMであることがさらに好ましい。
【0107】
還元剤としては、溶液中の最終濃度として金イオンのモル濃度の3〜10倍モル濃度であることが好ましく、4〜5倍モル濃度であることがさらに好ましい。
【0108】
また、上記リガンド複合体は溶液中の最終濃度として10μM〜1000μMであることが好ましく、50μM〜150μMであることがさらに好ましい。
【0109】
<生体関連物質>
本発明に係る測定方法は、生体関連物質と糖鎖との相互作用を測定することができればとくに限定されない。例えば、上述のリガンド担持体に、生体関連物質を含む溶液を接触させ、接触により生じる表面プラズモン共鳴、プラズモン吸収、または水晶振動子の信号量を測定することで、上記生体関連物質と上記糖鎖との相互作用を測定することができる。上記信号量は、生体関連物質と糖鎖との相互作用の強さによって変化する。すなわち、本明細書において、上記生体関連物質と糖鎖との相互作用を測定するとは、生体関連物質と糖鎖との間に生じる水素結合、疎水結合、イオン結合、ファンデルワールス結合からなる群より選ばれる1以上の結合の強さを測定することを意味する。
【0110】
一実施形態において、本発明に係る生体関連物質と糖鎖との相互作用の測定方法は、生体関連物質と、糖鎖との相互作用の測定方法であって、リガンド担持体に、生体関連物質を含む溶液を接触させる工程を含み、上記リガンド担持体は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されていると共に、上記表面は金属を備えており、上記生体関連物質は、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質である。
【0111】
上記「1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されている」とは、支持体1cm2あたり1〜500種類のリガンド複合体が支持体の表面に固定されており、リガンド複合体が固定されている領域が2つ以上存在する場合に、それぞれの領域に固定されているリガンド複合体同士が重なり合わないことを意味する。
【0112】
例えば、後述する実施例では、リガンド複合体を1.8cm四方のAu蒸着ガラス基板上にスポットしているが、ある一つのスポットに着目した場合、当該スポットに固定されているリガンド複合体は、他のスポットに固定されているリガンド複合体とは重なり合わない。すなわち、当該スポットに固定されているリガンド複合体は、他のスポットに固定されているリガンド複合体とは独立して支持体の表面に固定されている。
【0113】
支持体1cm2あたり1〜500種類であるから、支持体1cm2あたりに固定されているリガンド複合体は、1種類でも複数種でもよい。支持体1cm2あたりにリガンド複合体が複数種固定されている場合は、支持体1cm2あたりに固定されているリガンド複合体の全てが異なる種類であってもよいし、支持体1cm2あたりに、同じ種類のリガンド複合体が固定されている領域が複数含まれていてもよい。例えば、後述する実施例では、48種類のリガンド複合体を、1.8cm四方の支持体の96領域にスポットしている。
【0114】
なお、本明細書において「リガンド複合体」とは、<リガンド複合体>の項で述べたように、上記<リンカー化合物>の項で述べたリンカー化合物と、上記<糖鎖>の項で述べた糖鎖とが結合している構成である。したがって、リンカー化合物および糖鎖のうち、少なくとも一方が異なっていれば別の種類のリガンド複合体であるといえる。
【0115】
上記構成によれば、上記リガンド複合体が、1〜500種類/cm2となるように、それぞれ独立して支持体の表面に固定されているため、生体関連物質と、糖鎖との相互作用は、液相(生体関連物質を含む溶液)と固相(独立して固定されている個々の糖鎖)との反応として測定できる。したがって、生体関連物質を含む溶液を1サンプル用いるだけで、支持体に固定されている全ての糖鎖との反応を網羅的に確認することができるため、生体関連物質のスクリーニングやパターニングを効率よく行うことができる。
【0116】
また、糖鎖は支持体に固定された固相として存在するため、上記液相を上記支持体に流しても、上記液相と混和されてしまうことはない。よって、生体関連物質と糖鎖との相互作用を測定した後は、生体関連物質と糖鎖とを簡単に分離し、生体関連物質を回収することができる。そして、回収した生体関連物質を、例えば上記支持体とは別個の支持体に固定された糖鎖との相互作用の測定のために再使用することができる。すなわち、測定する糖鎖の種類の数に関わらず、生体関連物質の検体(サンプル)としては1つ用意すれば足りることになり、少量の検体で多くの情報を得ることができ、非常に効率よく上記相互作用を測定することができる。そのため、少量の検体で生体関連物質のスクリーニングおよびパターニングを行うことができる。
【0117】
一方、例えば、ナノ粒子を支持体として、異なる糖鎖を結合させたナノ粒子を生体関連物質と相互作用させる場合は、ナノ粒子は液相(コロイド)であるため、上記相互作用は液相と液相との反応となり、生体関連物質とナノ粒子とは混和されてしまう。すなわち、本発明に係る測定方法のように、固相と液相との反応とはならない。それゆえ、本発明に係る測定方法のように、生体関連物質と、糖鎖との相互作用を測定した後に、生体関連物質と糖鎖とを簡単に分離し、生体関連物質を容易に回収することはできない。
【0118】
このように、ナノ粒子を支持体として、異なる糖鎖を結合させたナノ粒子を生体関連物質と相互作用させる場合は、生体関連物質の再利用を行うことができず、生体関連物質の検体を、測定する糖鎖の種類と同数だけ用意しなければならないことになる。そのため、多くの情報を得るためには多量の検体が必要となってしまう。したがって、生体関連物質のスクリーニングやパターニングを効率よく行うことはできない。
【0119】
さらに、一つのナノ粒子上に異なる糖鎖を複数結合させたとしても、生体関連物質とどの糖鎖とが相互作用したのかを確認することはできないため、生体関連物質のスクリーニングやパターニングを行うことはできない。
【0120】
本発明の方法は、後述する実施例に示すように、同じH3N2という構成のタンパク質を有するインフルエンザウイルス株を糖鎖に対する特異性の観点から株ごとに分類することができる。なお、上記H3とは、タイプ3のヘマグルチニンを表し、N2とはタイプ2のノイラミニナーゼを表し、ともに抗体によって決定されている。
【0121】
そして、上記インフルエンザウイルス株の糖鎖に対する特異性のパターンは、比例または反比例といった一定ではなく無差別的である。上記「糖鎖に対する特異性」とは、上記生体関連物質と糖鎖との相互作用の強さの傾向を意味する。
【0122】
例えば、A/Fukuoka/C29/85(H3N2)またはA/Guizhou/54/89(H3N2)の糖鎖に対する特異性のパターンを比べると、糖鎖がNeu5Acα2−6Galβ1−4GlcNAcβ1−6Glcである場合には、上述の2つのインフルエンザウイルスは同じくらいの強さで相互作用する。一方、糖鎖がNeu5Acα2−6Galβ1−4Glcである場合には、当該糖鎖に対してA/Fukuoka/C29/85(H3N2)は強く相互作用するが、A/Guizhou/54/89(H3N2)はほとんど相互作用しない。このことは、上記糖鎖に対する特異性のパターンは、単に抗体によって決定されている上記同じH3N2という構成のタンパク質の発現量によって決まっているものではないということを示していると考えられるし、抗体によって見分けがつけられないタンパク質の部位に変異が入っていることを示しているとも考えられる。
【0123】
一方、インフルエンザウイルスの構成成分は、脂質、糖鎖、およびタンパク質であることが知られている。そのため、上記実施例の結果および上記知見から、本発明に係る測定方法では、糖鎖とタンパク質との相互作用といった、一対一の相互作用の測定だけでなく、脂質、糖鎖、およびタンパク質からなる群より選ばれる1以上の構成成分と糖鎖との相互作用といった、一対複数の相互作用を測定することができ、その結果、単に糖と蛋白質との相互作用を検出するだけでなく、ウイルス株の識別まで行うことができるものと推測される。つまり、本発明に係る方法は、有するタンパク質の種類が同じ抗体型を示す生体関連物質であっても、別々に測定対象とすることができ、識別することができる。
【0124】
上記生体関連物質として、例えば、タンパク質、ウイルス、細胞、細菌、リポソーム、およびミセル等をあげることができる。上記ウイルスとしては、具体的には、インフルエンザウイルス、ヘルペスウイルス、ノロウイルス、HTLV−1ウイルス、エイズウイルス、B型肝炎ウイルス等を挙げることができる。
【0125】
上記タンパク質としては、具体的には、例えば動物レクチン、植物レクチン、酵素、成長因子、細胞内シグナル伝達因子、遺伝子制御因子、細胞外マトリックス構成因子、抗体等を挙げることができる。
【0126】
また、上記細胞としては、具体的には、癌細胞または非癌細胞をあげることができる。癌細胞としては、肝臓癌、脳腫瘍、肺癌、胃癌、小腸癌、大腸癌、すい臓癌、脾臓癌および腎臓癌等由来の癌細胞を用いることができ、癌細胞の中でも特に、肝臓癌、肺癌、胃癌、小腸癌、大腸癌、すい臓癌、脾臓癌および腎臓癌からなる群より選ばれる1以上の癌細胞であることが好ましい。また、上記非癌細胞としては、肝細胞等を用いることができる。
【0127】
また、上記細菌としては、大腸菌、ヘリコバクターピロリ菌、緑膿菌、乳酸菌、連鎖球菌等を挙げることができ、大腸菌の中では、O-157であることが特に好ましい。また、上記リポソームおよびミセルとしては、糖鎖を含むものであれば、生体試料由来のものであっても人工的に作製したものであっても良い。リポソームおよびミセルを生体試料より得る方法としては特に限定されないが、例えば、細胞または組織等の生体試料を、界面活性剤を含む溶液中で超音波処理等によって破砕することにより、当該溶液中に生体試料由来のリポソームおよびミセルを抽出し、得ることができる。
【0128】
また、リポソームを人工的に作製する方法としては、特に限定されないが、例えば、リン脂質等のリポソームを形成することのできる脂質と糖鎖とを含む溶液を攪拌・混合することによりリポソームを人工的に作製することができる。
【0129】
上記生体関連物質を含む溶液の上記生体関連物質の濃度は、0.1ng/ml〜10mg/mlであればよく、1μg/ml〜1mg/mlであることが好ましい。また、上記生体関連物質としてウイルスを用いる場合は、ウイルスの濃度の範囲は、1〜1010pfu/mlであることが好ましく、10〜100pfu/mlであることがより好ましい。上記pfuは、TCID50(50% tissue culture infection dose)法等の周知の方法を用いて調べることができる。さらに、インフルエンザウイルスを用いる場合は、インフルエンザウイルスの濃度の範囲は、1〜1000HAUであることが好ましく、10〜100HAUであることがより好ましい。ここで、上記HAUとは、インフルエンザウイルスの赤血球に対する凝集価である。上記HAUは、0.5%トリ血球溶液を用いる赤血球凝集反応を用いて調べることができる。
【0130】
また、上記生体関連物質として、細胞または、細菌を用いる場合は、それらの濃度の範囲は、103個/ml〜1010個/mlであることが好ましく、105個/ml〜107個/mlであることがより好ましい。細胞または細菌が上記の濃度にあるかどうか調べるには、例えばセルカウンター等の周知の方法を用いて調べることができる。
【0131】
本発明の測定方法は、表面プラズモン共鳴、プラズモン吸収、または水晶振動子の信号量を測定するため高感度である。そのため、測定に用いる生体関連物質は、極微量でよいという利点がある。
【0132】
上記ウイルスは従来公知の方法を用いて調製することできる。例えば、培養細胞に測定対象となるウイルスを播種した後、2〜4日間、37℃で放置する。その後、培養上清を30%と60%の比重の異なるスクロース溶液を重層したものに積層し、超遠心(24,000rpm,90分、15℃)を行う。次に、30/60%画分を回収することでウイルスを含む溶液を調製することができる。
【0133】
ここで、上記培養細胞としては、ウイルスが感染することができる培養細胞を適宜用いればよい。例えば、上記ウイルスがインフルエンザウイルスの場合は、上記培養細胞として、孵化鶏卵の羊膜膜内接種、またはMDCK細胞等を好適に用いることができる。
【0134】
また、上記細胞は、従来公知の方法を用いて調製することができる。例えば、測定対象となる細胞を、その細胞に適した周知の培養液と培養条件とで培養した後、目的の濃度になるように上記細胞を回収すればよい。回収の方法としては、特に限定されないが、浮遊細胞であれば、遠心することにより所望の濃度に調製する事ができる。また、接着細胞であれば、トリプシン等の酵素消化や、ピペッティング等の物理的な方法を用いて細胞を培養皿から剥がした後に、遠心することで所望の濃度に調製することができる。
【0135】
また、上記細菌は、従来公知の方法を用いて調製することができる。例えば、測定対象となる細菌を、その細菌に適した周知の培養液と培養条件とで培養した後、遠心分離等の方法を用いて上記細菌を回収すればよい。
【0136】
上述のようにして調製したウイルス、細胞、細菌等の生体関連物質に溶液を加えて希釈することで、上述した濃度の上記「生体関連物質を含む溶液」を調製することができる。上記溶液としては、リン酸緩衝溶液(Phosphate Buffered Saline(PBS)緩衝液pH 7.4)または、トリス緩衝溶液等の従来公知の緩衝溶液を好適に用いることができる。また、上記溶液には、塩化ナトリウム、塩化マグネシウム、EDTA、またはEGTA等の塩および/または、Tween 20、Triton−X、またはCHAPS等の界面活性剤が加えられていても良い。上記溶液中の上記界面活性剤の濃度としては、0.001〜10%が好ましく、0.005〜5%がより好ましい。
【0137】
生体関連物質と糖鎖との相互作用を測定する際には、上記生体関連物質を1種類含む溶液を1種類のみ用いて測定するか、上記生体関連物質を1種類含む溶液を2種類以上用いて別々に測定することができる。
【0138】
以下では、表面プラズモン共鳴、プラズモン吸収、または水晶振動子の信号量を測定する方法を用いた本発明に係る上記生体関連物質と糖鎖との相互作用の測定の実施形態についてそれぞれ説明する。
【0139】
<表面プラズモン共鳴>
上記表面プラズモン共鳴の信号量を測定する方法としては、特に限定されず、従来公知の方法を用いることができる。例えば、後述する表面プラズモン共鳴装置を用いることで容易に、上記表面プラズモン共鳴の信号量の測定をリアルタイムで行うことができる。
【0140】
即ち、上記生体関連物質と、糖鎖とが相互作用することによって生じた表面プラズモン共鳴の程度は、表面プラズモン共鳴装置を用いることで、信号量の大きさとして測定することができる。上記表面プラズモン共鳴は、上記リガンド複合体の糖鎖と上記生体関連物質との相互作用の強さによって変化するため、上記信号量の大きさを測定することにより、上記相互作用の程度を測定することができる。
【0141】
また、上記表面プラズモン共鳴は、レーザー光等を用いて物理現象を利用してリアルタイムで信号量として測定されるため、生体関連物質を標識することなくリアルタイムで直接的に測定することができる。また、当該相互作用を高感度で測定することができるため、用いる生体関連物質を含む溶液の量を少なくすることができる。さらに、上記測定の後、相互作用の強さを数値化することが好ましい。当該数値化によって、後述の生体関連物質の同定や生体関連物質の差別化を容易に行うことができる。
【0142】
具体的には、上述のリガンド担持体を表面プラズモン共鳴装置にセットする。上記表面プラズモン共鳴装置内では、上記リガンド担持体表面をランニングバッファーが流れていることが好ましい。当該表面プラズモン共鳴装置内に上記生体関連物質を含む溶液を注入し、上記ランニングバッファーの代わりに当該生体関連物質を含む溶液を流すことで、容易に上記リガンド担持体を上記生体関連物質を含む溶液に接触させることができるからである。当該接触の際に、上記生体関連物質を含む溶液中の上記生体関連物質と上記リガンド担持体に固定されたリガンド複合体の糖とが、相互作用すると表面プラズモン共鳴が生じる。そして、表面プラズモン共鳴の程度を信号量として測定する。その結果、上記生体関連物質と糖鎖との相互作用を測定することができる。
【0143】
上記生体関連物質を含む溶液の生体関連物質の濃度は上記<生体関連物質>で述べた濃度であることが好ましい。上記生体関連物質を含む溶液を注入する量としては、10〜5000μlであればよく、50〜300μlであることが更に好ましい。
【0144】
上記表面プラズモン共鳴装置としては、例えば、MultiSPRinter(東洋紡製)を挙げることができる。
【0145】
上記表面プラズモン共鳴装置にセットされる上記リガンド担持体の数は、特に限定されることなく、1つであってもよいし、複数であってもよい。また、リガンド担持体を複数セットする場合は、上記各リガンド担持体は、同一であってもよいし、異なっていてもよい。上記各リガンド担持体が異なるとは、各リガンド担持体に固定されているリガンド複合体や、リガンド担持体に含まれる支持体が、異なること等を意味する。上記リガンド複合体が異なるとは、リガンド複合体に含まれるリンカー化合物または糖鎖が異なることを意味する。
【0146】
上記ランニングバッファーとしては、リン酸緩衝溶液(Phosphate Buffered Saline(PBS)緩衝液pH 7.4)、トリス緩衝溶液等の従来公知の緩衝溶液を用いることができる。また、塩化ナトリウム、塩化マグネシウム、EDTA、またはEGTA等の塩および/または、Tween 20、Triton−X、またはCHAPS等の界面活性剤が加えられている上記緩衝溶液を上記ランニングバッファーとして用いても良い。上記緩衝溶液中の上記界面活性剤の濃度としては、0.001〜10%が好ましく、0.005〜5%がより好ましい。
【0147】
本実施形態においては、上記リガンド担持体と上記生体関連物質を含む溶液とを接触させる前に、上記リガンド担持体に付着している不純物を取り除くために、洗浄溶液を用いて、上記リガンド担持体を洗浄することが好ましい。上記洗浄溶液としては、特に限定されないが、例えば、水酸化ナトリウム水溶液または、水酸化カリウム等の塩基性水溶液や塩酸または硫酸等の酸性溶液、上記界面活性剤を含む緩衝溶液等を挙げることができる。
【0148】
上記塩基性溶液や酸性溶液の濃度としては、上記リガンド担持体(特に、糖鎖)が変性しない濃度であればよく、0.1mM〜100mMであることが好ましく、1mMから10mMであることがより好ましい。
【0149】
また、本実施形態においては、上記の表面プラズモン共鳴を測定することによって上記生体関連物質と糖鎖との相互作用の測定を行う操作を連続して複数回行うことが好ましい。
【0150】
上記「連続して複数回行う」とは、具体的には、一度、上記リガンド担持体と上記生体関連物質を含む溶液とを接触させて、上記生体関連物質と糖鎖との相互作用の測定を行った後に、さらに連続的に、上記リガンド担持体を、次の上記生体関連物質を含む溶液と接触させて、当該生体関連物質と糖鎖との相互作用の測定を行うことを意味する。
【0151】
この場合、一度目の測定の後に、上述した洗浄溶液で洗浄した後に、次の上記生体関連物質を含む溶液を流すことが好ましい。当該洗浄により一度目の測定の際に、糖鎖に結合した上記生体関連物質を除去することができる。次に糖鎖と接触させる上記生体関連物質を含む溶液としては、一度目の上記生体関連物質と同じ上記生体関連物を含むものを用いてもよいし、別の上記生体関連物質を含むものを用いてもよい。
【0152】
上記方法により、同一のリガンド担持体を用いて、複数の上記生体関連物質と糖鎖との相互作用を測定することができる。そのため、上記測定の結果について迅速に正確性の高い比較をすることができる。従って、後述の生体関連物質の同定や生体関連物質の差別化を正確に行うことができる。
【0153】
<プラズモン吸収>
プラズモン吸収の測定は、上記糖鎖固定化金属ナノ粒子を含む溶液と、上記生体関連物質を含む溶液とを混和することによって、糖鎖と上記生体関連物質とを相互作用させ、糖鎖−生体関連物質相互作用体を生成させる工程を含むものであれば特に限定されない。
【0154】
上記「糖鎖固定化金属ナノ粒子を含む溶液」とは、糖鎖固定化金属ナノ粒子が液体に分散している溶液を意味する。糖鎖固定化金属ナノ粒子を含んでいれば、他に塩などが含まれていてもよい。上記液体としては、例えば水や、リン酸緩衝溶液またはトリス緩衝溶液等の緩衝液を用いることができる。
【0155】
糖鎖固定化金属ナノ粒子を含む溶液と、上記生体関連物質を含む溶液とを混和する方法は、特に限定されるものではなく、糖鎖と上記生体関連物質とを相互作用させることができるものであればよい。例えば、マイクロプレートやエッペンドルフチューブなどに生体関連物質の希釈系列を作製し、糖鎖固定化金属ナノ粒子を含む溶液を添加して放置することにより混和を行うことができる。
【0156】
具体的には、最終濃度が好ましくは0.5mM〜10mMであり、より好ましくは1mM〜5mMである上記糖鎖固定化金属ナノ粒子を含む溶液と、上記<生体関連物質>で述べた濃度の生体関連物質を含む溶液とを混和する。上記糖鎖固定化金属ナノ粒子を含む溶液の量は、特に限定されないが、10〜1000μlであることが好ましい。また、上記生体関連物質含む溶液の量は、特に限定されないが、10〜1000μlであることが好ましい。
【0157】
上記「糖鎖−生体関連物質相互作用体」とは、糖と生体関連物質とが相互作用して特異的に結合し、その結果生成される凝集物を意味する。上記プラズモン吸収の測定方法は、糖鎖−生体関連物質相互作用を上記糖鎖−生体関連物質相互作用体の生成として目視でも観測することができる。糖と生体関連物質とが相互作用しない場合は、糖鎖−生体関連物質相互作用体は形成されない。
【0158】
ここで、凝集反応を観測することによって物質間の相互作用を測定する方法としては、例えば抗原抗体反応を用いたラテックス凝集法等を挙げることができる(「バイオ診断薬の開発・評価と企業」、CMCテクニカルライブラリー146、シーエムシー出版、P92−97,P109−113)。上記ラテックス凝集法は、ラテックス表面に抗体を固定化させておき、96穴のマイクロプレートを用いて試料抗原の希釈系列を作り、凝集を生じる最大希釈倍率を求め標準溶液と比較して測定するという方法である。糖鎖固定化金ナノ粒子を用いる場合は、一定波長の光で吸光度(プラズモン吸収の信号量)の変化として測定される。そのため当該方法を用いることにより上記生体関連物質と糖鎖との相互作用を数値化することができる。
【0159】
また、上述したプラズモン吸収の信号量の測定は、糖鎖−生体関連物質質相互作用を非標識で測定することができるので、標識を要する方法のような前処理を必要としない点で簡便である。さらに、標識効果が測定のばらつきに大きく影響するという問題も存在せず、再現性のよい測定を行うことができる。また、糖鎖−生体関連物質相互作用を目視でも観測することができるので、特別な装置も必要なく、非常に安価かつ容易に糖鎖−生体関連物質相互作用を測定し数値化することができる。
【0160】
また、本実施形態においても、上述の<表面プラズモン共鳴>で述べたように、上記のプラズモン吸収を測定することによって上記生体関連物質と糖鎖との相互作用の測定を行う操作を連続して複数回行うことが好ましい。具体的な方法は、上述の<表面プラズモン共鳴>で説明した方法と同様である。
【0161】
<水晶振動子>
上記水晶振動子の信号量の大きさを測定する方法としては、特に限定されず、特開2005−84028号公報等に記載の方法を用いることができる。
【0162】
例えば、水晶振動子の金属部分に上述したリガンド複合体を固定し、リガンド担持体を作製する。当該固定の方法は、上記の<リガンド担持体>で述べた方法を用いて固定することができる。その後、上記生体関連物質を含む溶液と、当該リガンド担持体とを接触させ、共振周波数(水晶振動子の信号量)を測定する。当該共振周波数の程度は、上記生体関連物質と糖鎖との相互作用によって変化するため、上記共振周波数をリアルタイムで測定することにより、上記生体関連物質と糖鎖との相互作用をリアルタイムで測定することができる。
【0163】
上記生体関連物質を含む溶液の生体関連物質の濃度は、上記<生体関連物質>で述べた濃度であることが好ましい。また、上記生体関連物質含む溶液の量は、特に限定されないが、10〜1000μlであることが好ましく、50〜500μlであることがより好ましい。
【0164】
また、本実施形態においても、上述の<表面プラズモン共鳴>で述べたように、上記の水晶振動子の信号量を測定することによって上記生体関連物質と糖鎖との相互作用の測定を行う操作を連続して複数回行うことが好ましい。具体的な方法は、上述の<表面プラズモン共鳴>で説明した方法と同様である。
【0165】
<生体関連物質の糖鎖選択性の評価方法>
本発明に係る生体関連物質の糖鎖選択性の評価方法とは、生体関連物質の糖鎖に対する特異性を評価することを意味する。ここで、上記「糖鎖に対する特異性」とは、上記生体関連物質と糖鎖との相互作用の強さの傾向を意味する。すなわち、生体関連物質と糖鎖との相互作用を測定することにより、上記生体関連物質の糖鎖に対する相互作用の強さを調べ、当該強さを特定することができる。その結果、その相互作用の強さの傾向を特定することができる。従って、上記生体関連物質の糖鎖選択性を評価することができる。
【0166】
そのため、本発明に係る生体関連物質の糖鎖選択性の評価方法は、リガンド担持体に、生体関連物質を含む溶液を接触させて、当該生体関連物質と糖鎖との相互作用の測定を行う工程と、上記測定の結果得られる上記生体関連物質の糖鎖に対する特異性を特定する工程とを含む。
【0167】
上記生体関連物質を含む溶液は、上記<生体関連物質>で述べた生体関連物質を含む溶液であれば特に限定されない。
【0168】
上記リガンド担持体としては、上記<リガンド担持体>で述べたリガンド担持体であれば特に限定されないが、リガンド担持体のリガンド複合体が多いほど、上記生体関連物質とリガンド複合体に結合している糖鎖との特異性を多く調べることができる。その結果、網羅的な評価を行うことができる。
【0169】
また、非標識の生体関連物質と糖鎖との相互作用の測定は、上述の表面プラズモン共鳴、プラズモン吸収、または水晶振動子の信号量を測定することにより行うことが好ましい。上記信号量を数値化することができるため、生体関連物質と糖鎖との相互作用の測定結果を数値化することができ、当該数値を比較することにより、上記生体関連物質と糖鎖との相互作用の強さを知ることができる。ゆえに、生体関連物質の糖鎖に対する特異性を簡便に正確に評価することができる。
【0170】
また、上記糖鎖選択性の評価は、絶対評価であってもよいし相対評価であってもよい。上記絶対評価とは、生体関連物質の糖鎖に対する特異性を、他の生体関連物質の糖鎖に対する特異性と比較することなく評価することである。上記相対評価とは、生体関連物質の糖鎖に対する特異性を、他の生体関連物質の糖鎖に対する特異性と比較して評価することである。
【0171】
上記生体関連物質の糖鎖選択性を評価することにより、生体関連物質の同定または差別化等を行うことができる。
【0172】
<生体関連物質のスクリーニング方法>
本発明に係る生体関連物質のスクリーニング方法とは、生体関連物質の糖鎖選択性を評価することにより、生体関連物質の糖鎖に対する特異性の観点から、目的の生体関連物質をスクリーニングする方法のことである。なお、上記「目的の生体関連物質」とは、スクリーニングされるべき生体関連物質を意味する。
【0173】
従って、本発明に係る生体関連物質のスクリーニング方法とは、リガンド担持体に、目的の生体関連物質を含む溶液または、対照の生体関連物質を含む溶液を別々に接触させて、それぞれの生体関連物質と糖鎖との相互作用の測定を行う工程と、上記測定を上記目的の生体関連物質を含む溶液を用いて行った場合の結果と、上記測定を上記対照の生体関連物質を含む溶液を用いて行った場合の結果とを比較し、上記結果を一致させる工程と、を含む。
【0174】
上記「目的の生体関連物質を含む溶液」とは、スクリーニングされるべき生体関連物質を含む水溶液を意味する。なお、上記「スクリーニングされるべき生体関連物質」としては、生体関連物質自体が知られていない未知の生体関連物質であっても、生体関連物質は知られているが糖鎖に対する特異性が知られていないような既知の生体関連物質であっても良い。また、上記「対照の生体関連物質を含む溶液」とは、上記目的の生体関連物質を同定するために、糖鎖に対する特異性が知られている生体関連物質を含む水溶液を意味する。
【0175】
上記リガンド担持体としては、上記<リガンド担持体>で述べたリガンド担持体であれば特に限定されないが、リガンド担持体が備えるリガンド複合体が多いほど、上記生体関連物質とリガンド複合体に結合している糖鎖との特異性を多く調べることができる。その結果、正確な同定を行うことができる。
【0176】
上記「リガンド担持体に、目的の生体関連物質を含む溶液または、対照の生体関連物質を含む溶液を別々に接触させて、それぞれの生体関連物質と糖鎖との相互作用の測定を行う工程」では、上記リガンド担持体を目的の生体関連物質を含む溶液に接触させた後に、上記リガンド担持体と同じ構成である別のリガンド担持体を対照の生体関連物質を含む溶液に接触させても良いし、上記リガンド担持体を目的の生体関連物質を含む溶液に接触された後に、連続的に対照の生体関連物質を含む溶液に接触させても良い。
【0177】
しかし、後者のほうが、より迅速で、正確な比較ができるためより好ましい。また、接触させる生体関連物質を含む溶液の順番は、特に限定されず、対照の生体関連物質を含む溶液の後に、目的の生体関連物質を含む溶液に接触させても良い。
【0178】
上記リガンド担持体と、目的の生体関連物質を含む溶液または対照の生体関連物質を含む溶液との接触によって生じた表面プラズモン共鳴、プラズモン吸収、または水晶振動子の信号量を測定することにより、上記目的の生体関連物質または上記対照の生体関連物質と糖鎖との相互作用の強さを数値化して検出することができる。
【0179】
上記「上記測定を上記目的の生体関連物質を含む溶液を用いて行った場合の結果と、上記測定を上記対照の生体関連物質を含む溶液を用いて行った場合の結果とを比較し、上記結果を一致させる工程」では、具体的には生体関連物質の糖鎖に対する特異性を比較し、当該特異性を一致させることが好ましい。すなわち、目的の生体関連物質の糖鎖に対する相互作用の強さと、対照の生体関連物質の糖鎖に対する相互作用の強さとを比較し一致させることで、目的の生体関連物質が対照の生体関連物質のどれと一致するのかを調べることができる。その結果、目的の生体関連物質をスクリーニングすることができる。
【0180】
<生体関連物質のパターニング方法>
本発明に係る生体関連物質のパターニングとは、上述した生体関連物質の糖鎖選択性を評価することにより、生体関連物質の糖鎖に対する特異性の観点から、生体関連物質を分類することである。
【0181】
そのため、本発明に係る生体関連物質のパターニング方法は、リガンド担持体に、2種類以上の上記生体関連物質を含む溶液を別々に接触させて、それぞれの上記生体関連物質と糖鎖との相互作用の測定を行う工程と、上記測定結果を比較し、分類する工程とを、含む。
【0182】
上記「リガンド担持体に、2種類以上の生体関連物質を含む溶液を別々に接触させて、それぞれの生体関連物質と糖鎖との相互作用の測定を行う工程」では、一方の生体関連物質を含む溶液を接触させた後に、上記リガンド担持体と同じ構成である別のリガンド担持体と別の生体関連物質を含む溶液を接触させても良いし、上記リガンド担持体を一方の生体関連物質を含む溶液に接触された後に、連続的に別の生体関連物質を含む溶液に接触させても良い。
【0183】
しかし、後者のほうが、より迅速で、正確な比較ができるためより好ましい。上記2種類以上の生体関連物質としては、同一の生体関連物質であっても良いし、別々の生体関連物質であっても良いが、差別化という観点から、別々の生体関連物質であることが好ましい。
【0184】
上記リガンド担持体としては、上記<リガンド担持体>で述べたリガンド担持体であれば特に限定されないが、リガンド担持体のリガンド複合体が多いほど、生体関連物質とリガンド複合体に結合している糖鎖との特異性を多く調べることができる。その結果、詳細なパターニングを行うことができる。
【0185】
上記リガンド担持体と、生体関連物質を含む溶液との接触によって生じた表面プラズモン共鳴、プラズモン吸収、または水晶振動子の信号量を測定することにより、生体関連物質との相互作用を測定することができる。
【0186】
上記「上記測定結果を比較し、分類する工程」では、具体的には生体関連物質の糖鎖に対する特異性を比較し、糖鎖に対する特異性のパターンによって分類することが好ましい。すなわち、一方の生体関連物質の糖鎖に対する相互作用の強さと、他方の生体関連物質の糖鎖に対する相互作用の強さとを比較し、それらの傾向によって生体関連物質を分類することで、パターニングをすることができる。
【0187】
<キット>
本発明に係る方法を実施するためのキットは、上述の<リガンド担持体>で説明したリガンド担持体が含まれている構成である。そのため、本発明に係る方法を簡便に行うことができる。また、上記キットには、上記表面プラズモン共鳴、上記プラズモン吸収、または水晶振動子等の信号量を測定するための、生体関連物質、上記ランニングバッファーや、上記洗浄溶液等の試薬類、または上述した表面プラズモン共鳴装置等が含まれていても良い。上記構成が含まれることによって、本発明に係る方法をより簡便に行うことができる。
【0188】
また、上記糖鎖として、Galβ1−4Glc、Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4Glc、Neu5Acα2−6Galβ1−4Glc、Neu5Acα2−3Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−4GlcNAcβ1−6Glc、GlcAβ1−3GalNAc6Sβ1−6Glc、GlcA2Sβ1−3GalNAc6Sβ1−6Glc、GlcAβ1−3GalNAc4S6Sβ1−6Glc、GlcNS6Sα1−4IdoA2Sα1−6Glc、GlcNSα1−4IdoA2Sα1−6Glc、GlcNS6Sα1−4GlcA2Sβ1−6Glc、およびGlcNSα1−4GlcAβ1−6Glcからなる群より選ばれる1以上の糖鎖を用いることもできる。すなわち上記リガンド担持体に含まれる糖鎖として、上記群より選ばれる1以上の糖鎖を少なくとも1種以上用いることができる。
【0189】
上記Neu5Acα2−6Galβ1−4Glc、Neu5Acα2−6Galβ1−3GlcNAcβ1−6Glc、またはNeu5Acα2−6Galβ1−4GlcNAcβ1−6Glcは、主にヒトに感染するインフルエンザウイルスと相互作用する陽性対照の糖鎖である。
【0190】
また、上記Neu5Acα2−3Galβ1−4Glc、Neu5Acα2−3Galβ1−3GlcNAcβ1−6Glc、または、Neu5Acα2−3Galβ1−4GlcNAcβ1−6Glcは、主に鳥類や馬科に感染するインフルエンザウイルスと相互作用する陽性対照の糖鎖である。
【0191】
さらに、上記Galβ1−4Glcまたは、Galβ1−4GlcNAcβ1−6Glcは、インフルエンザウイルスと相互作用する陰性対照の糖鎖である。
【0192】
従って、上記リガンド担持体を用いて、インフルエンザウイルスと上記糖鎖との相互作用を測定することで、当該インフルエンザウイルスが、ヒト、または馬科および鳥類のどれに感染することができるのかを調べることができる。
【0193】
また、ヘルペスウイルスは硫酸化された糖鎖と相互作用すると言われている(JOURNAL OF VIROLOGY Oct. 2000, P9106-9114、JOURNAL OF VIROLOGY June. 1996, P3461-3469)。そのため陽性対照として、ヘパリンの部分構造であるGlcNS6Sα1−4IdoA2Sα1−6Glc、GlcNSα1−4IdoA2Sα1−6Glc、GlcNS6Sα1−4GlcA2Sβ1−6Glc、およびGlcNSα1−4GlcAβ1−6Glcを、また同様にコンドロイチンの部分構造であるGlcAβ1−3GalNAc6Sβ1−6Glc、GlcA2Sβ1−3GalNAc6Sβ1−6Glc、およびGlcAβ1−3GalNAc4S6Sβ1−6Glcを用いた。
【0194】
陰性対照としては中性糖やシアル酸、例えば表2に含まれる糖鎖を用いた。
【0195】
上記リガンド担持体を用いて、ヘルペスウイルスと上記糖鎖との相互作用を測定することで、ヘルペスウイルスの型の違いを調べることができる。
【0196】
なお、本発明は以上説示した各構成に限定されるものではなく、特許請求の範囲に示した範囲内で種々の変更が可能であり、異なる実施形態にそれぞれ開示された技術的手段を適宜組み合わせて得られる実施形態についても本発明の技術的範囲に含まれる。
【実施例】
【0197】
以下、実施例により本発明を更に詳細に説明するが、本発明はこれらの実施例に限定されるものではない。
【0198】
〔製造例1:リガンド複合体の作製〕
下記の〔実施例1〕または〔実施例3〕で用いられたリガンド担持体に固定された各リガンド複合体をWO2005/077965号公報と同様の方法で作製した。
【0199】
まず、チオクト酸と、m−フェニレンジアミンとを含むリンカー化合物を作製した。その後、当該リンカー化合物と表1または表2に記載の糖鎖とを反応させて、還元アミノ化反応を行うことによりリガンド複合体を作製した。
【0200】
表1、表2、表3、表4はそれぞれ、〔実施例1〕、〔実施例3〕、〔実施例2〕、〔実施例4〕で用いられたリガンド担持体に固定された各リガンド複合体の糖鎖を示す。
【0201】
【表1】

【0202】
【表2】

【0203】
【表3】

【0204】
【表4】

【0205】
〔製造例2:リガンド担持体の作製〕
〔実施例1〕または〔実施例3〕で用いられたリガンド担持体を、以下の方法で作製した。まず始めに、Au蒸着ガラス基板(東洋紡製SPR−200)を小型UV/O3クリーナー(BioForce Nanosciences社製)にて20分間洗浄した。
【0206】
その後、上記〔製造例1〕で作製した表1または、表2に記載の糖鎖を有するリガンド複合体溶液を500μMに調製し、20μlずつ96穴プレートに分注した。次いで、当該プレートを、MultiSPRinter自動スポッター装置(東洋紡製)内に設置し、上記Au蒸着ガラス基板上にリガンド複合体を各配置にスポットした。その際のスポット量は約10nlであった。ここで、上記スポッターにより1.8cm四方のAu蒸着ガラス基板上に最大8×12箇所のスポットを形成する事ができる。
【0207】
リガンド複合体溶液をスポット後、70〜80%程度の湿度を有する状態で、12時間静置する事によりリガンド複合体を上記Au蒸着ガラス基板の表面に固定した。
【0208】
また、〔実施例2〕で用いられたリガンド担持体を以下の方法で作製した。1mMの塩化金(III)ナトリウムと5mMの水素化ホウ素ナトリウムとを激しく攪拌・混和し、金イオンを還元した。上記〔製造例1〕で作製した表3に記載のリガンド複合体を100μMになるように上記金ナノ粒子溶液に添加して激しく攪拌・混和し、粗糖鎖固定化金属ナノ粒子のコロイド溶液を調製した。
【0209】
次に、上記粗糖鎖固定化金属ナノ粒子のコロイド溶液を透析チューブ(MWCO:3,500)へ移し、水とPBS−T(0.05%)で透析して精製し、糖鎖固定化金属ナノ粒子(リガンド担持体)のコロイド溶液を得た。これら糖鎖固定化金属ナノ粒子のコロイド溶液の紫外可視吸収スペクトルを測定したところ最大吸収波長は525nmであった。
【0210】
〔実施例1:糖鎖とインフルエンザウイルス分離株との相互作用の測定〕
<インフルエンザウイルスの調製方法>
本実施例では、以下の分類名で分類された、インフルエンザウイルス分離株を使用した。A/Aichi/2/68(H3N2)、A/Fukuoka/C29/85(H3N2)、A/Guizhou/54/89(H3N2),A/Kitakyusyu/159/93(H3N2),A/Memphis/1/71(H3N2),A/Niigata/102/81(H3N2),A/Panama/2007/99(H3N2),A/Sydney/5/97(H3N2),A/Tokyo/6/73(H3N2),A/Wyoming/3/2003(H3N2),A/Yamanashi/2/77(H3N2),A/Beijing/262/95(H1N1),A/Okuda/57(H2N2),A/duck/HK/24/79(H3N2),A/duck/HK/313/4/78(H5N3)である。また、上記インフルエンザウイルス株は、兵庫医科大学から提供された。
【0211】
なお、上記分類名は、型/分離地及び種/分離番号/分離年(ヘマグルチニン(HA)およびノイラミニダーゼ(NA)の抗原型)を意味している。
【0212】
上記インフルエンザウイルス分離株は、以下の方法で調製した。即ち、MDCK細胞をMEMプレートに培養し、当該プレートに上記インフルエンザウイルス分離株を播種して、2〜4日間37℃で放置した。その後、上記プレートから、従来公知の方法を用いてインフルエンザウイルス分離株粗溶液を調製した。当該粗溶液を30%と60%の比重の異なるスクロース溶液を重層した上に積層した後、超遠心(24,000rpm、90分、15℃)を行い、生じた30/60%画分を採取することでインフルエンザウイルス分離株溶液を獲得した。得られた各インフルエンザウイルス分離株溶液の凝集価(HAU)を、0.5%トリ血球溶液を用いる赤血球凝集反応を用いて調べた。
【0213】
<糖鎖とインフルエンザウイルス分離株との相互作用の測定>
上記〔製造例2〕において作製したリガンド担持体と、上記インフルエンザウイルス分離株との相互作用を、表面プラズモン共鳴装置(東洋紡製 MultiSPRinter)を用いて以下の方法で測定した。
【0214】
まず始めに、上記リガンド担持体を上記表面プラズモン共鳴装置にセッティングした。その後、上記リガンド担持体を10mM NaOH水溶液で約10分洗浄した。インフルエンザウイルス分離溶液を加える前に、上記リガンド担持体表面を流れている溶液を0.05%Tween 20を含むPhosphate Buffered Saline(PBS)緩衝液pH7.4(以下、「PBS−T」と略記する)に置換した。測定温度は室温で測定を行った。
【0215】
PBS緩衝液を用いて、上記インフルエンザウイルス分離株のHAUを100HAUに合わせたインフルエンザウイルス分離株溶液を調製した。そして、流速150μl/minの速さで、上記溶液を5分間上記リガンド担持体の表面を流した。
【0216】
ここで、上記インフルエンザウイルス分離株と、上記リガンド担持体に固定されているリガンド複合体の糖鎖とが相互作用をした場合には、リガンド複合体のスポット位置において表面プラズモン共鳴が起こる。従って、上記表面プラズモン共鳴によって生じる信号量(輝度)をリアルタイムで測定することにより、上記相互作用をリアルタイムで測定することができる。
【0217】
図1は、上述の糖鎖とインフルエンザウイルス分離株との相互作用の測定結果の数値をグラフ化したものである。
【0218】
図1によれば、上記インフルエンザウイルス分離株のそれぞれが、上記糖鎖に対して異なる特異性を有することを示している。
【0219】
さらに、同じA型でH3N2型のインフルエンザウイルスであっても、A/Aichi/2/68(H3N2)やA/Sydney/5/97(H3N2)のように上記糖鎖に対する特異性のパターンに差がないインフルエンザウイルス分離株や、A/Kitakyusyu/159/93(H3N2)や、A/Niigata/102/81(H3N2)や、A/Tokyo/6/73(H3N2)や、A/Yamanashi/2/77(H3N2)のように上記糖鎖との相互作用が弱いインフルエンザウイルス分離株に分類できることも示している。
【0220】
したがって、実施例1より、インフルエンザウイルス分離株と糖鎖との相互作用を測定し、当該インフルエンザウイルスの同定や差別化ができることが示された。
【0221】
〔実施例2〕
500μlの上記〔製造例2〕において作製した糖鎖固定化金属ナノ粒子(リガンド担持体)と、200HAUのインフルエンザウイルスとをチューブ内で、混合し30分間放置した。その後、その混合液に35%、40%、45%、50%、60%のスクロース溶液を各1.5mlずつ、この順で上記チューブに加えて24000rpmで90分間、15℃で遠心分離を行った。
【0222】
図2は、上記糖鎖固定化金属ナノ粒子とインフルエンザウイルスとの混合液に上記スクロースを加えて遠心分離をした後の図である。SGNPは、上記糖鎖固定化金属ナノ粒子に固定されている糖鎖を示し、Virusは、インフルエンザウイルスの有無を示している。また、Sideは、遠心後の上記チューブを横から見た図であり、Bottomは、遠心後の上記チューブを底面から見た図である。
【0223】
図2によれば、インフルエンザウイルスと糖鎖とが相互作用しているサンプルでは、遠心すると上記チューブの底面に凝集物が生じている。一方、糖鎖固定化金属ナノ粒子または、インフルエンザウイルスが入っていないサンプルや、インフルエンザウイルスと糖鎖とが相互作用しないサンプルでは、底面(Bottom)凝集物が生じてない。
【0224】
したがって、実施例2より、糖鎖固定化金属ナノ粒子とインフルエンザウイルスとを混合して時に、インフルエンザウイルスと糖鎖とが相互作用すると、糖鎖−インフルエンザウイルス相互作用体が生じて、凝集物を形成することが示された。
【0225】
〔実施例3〕−糖鎖とタンパク質との相互作用の測定
上記〔製造例2〕において作製したリガンド担持体と、タンパク質との相互作用を、表面プラズモン共鳴装置(東洋紡製 MultiSPRinter)を用いて以下の方法で測定した。
【0226】
まず始めに、上記リガンド担持体を上記表面プラズモン共鳴装置にセッティングした。その後、上記リガンド担持体を10mM NaOH水溶液で約10分洗浄した。タンパク質を加える前に、上記リガンド担持体表面を流れている溶液をPBS−Tに置換した。測定温度は室温で測定を行った。
【0227】
タンパク質を上記PBS−Tを用いて2.0μMの濃度の溶液をエッペンチューブに調製した。そして、流速150μl/minの速さで、上記溶液を5分間上記糖鎖固定測定媒体の表面を流した。
【0228】
ここで、タンパク質と、上記リガンド担持体に固定されているリガンド複合体の糖鎖とが相互作用をした場合には、リガンド複合体のスポット位置において表面プラズモン共鳴が起こる。従って、上記表面プラズモン共鳴によって生じる信号量(輝度)をリアルタイムで測定することで上記相互作用をリアルタイムで測定することができる。
【0229】
本実施例では、上記タンパク質として、コンカナバリンA(Con A)または、ヒママメレクチン(RCA120)、小麦胚芽レクチン(WGA)を用いた。また、ネガティブコントロールとして、ウシ胎児血清アルブミン(BSA)を用いた。
【0230】
図3は表面プラズモン共鳴装置を用いて、上述の各タンパク質と糖鎖との相互作用を測定した結果である。
【0231】
図3によれば、コンカナバリンA(Con A)を用いた場合には、上記リガンド担持体上に、輝度が向上するスポット位置があることが観測された。このことから、それら各スポット位置に固定されている糖鎖と、当該コンカナバリンA(Con A)とが相互作用することが明らかとなった。
【0232】
さらに、ヒママメレクチン(RCA120)、小麦胚芽レクチン(WGA)を用いた場合にも、上記リガンド担持体上に、輝度が向上するスポット位置がそれぞれあることが観測された。このことから、それら各スポット位置に固定されている糖鎖と、当該ヒママメレクチン(RCA120)、または小麦胚芽レクチン(WGA)とが相互作用することが明らかとなった。
【0233】
なお、上記輝度が向上するスポット位置は、それぞれのタンパク質によって特異的であることが明らかになった。
【0234】
一方、ウシ胎児血清アルブミン(BSA)を用いた場合には、同濃度であっても上記リガンド担持体に存在している各スポット位置において、当該スポット位置の輝度が上がらない事が観測された。
【0235】
従って、本実施例により、糖鎖とタンパク質との相互作用を測定し、糖鎖に対するタンパク質の特異性の評価ができることが検証された。
【0236】
〔実施例4:糖鎖とヘルペスウイルス分離株との相互作用の測定〕
<ヘルペスウイルスの調製方法>
本実施例では、HSV−1(CHR−3株)、HSV−2(MS株)という分類名で分類された、ヘルペスウイルス分離株を使用した。なお、上記ヘルペスウイルス分離株は、兵庫医科大学から提供された。
【0237】
上記ヘルペスウイルス分離株は、以下の方法で調製した。即ちVeroE6細胞をMEMプレートに培養し、当該プレートに上記ヘルペスウイルス分離株を播種して、2〜4日間37℃で放置した。その後、上記プレートから従来公知の方法を用いてヘルペスウイルス分離株粗溶液を調製した。
【0238】
当該粗溶液を30%と60%の比重の異なるスクロース溶液を重層した上に積層した後、超遠心(24,000rpm、90分、20℃)を行い、生じた30/60%画分を採取することでヘルペスウイルス分離株溶液を獲得した。得られた各ヘルペスウイルス分離株溶液の力価を、VeroE6細胞に対するPFU(plaque-forming unit;プラーク形成単位)を用いて調べた。
【0239】
<糖鎖とヘルペスウイルス分離株との相互作用の測定>
上記〔製造例2〕において作製したリガンド担持体と、上記ヘルペスウイルス株との相互作用を、表面プラズモン共鳴装置(東洋紡製 MultiSPRinter)を用いて以下の方法で測定した。
【0240】
まず初めに、上記リガンド担持体を上記表面プラズモン共鳴装置にセッティングした。その後、上記リガンド担持体を10mM NaOH水溶液で約10分洗浄した。ヘルペスウイルス分離株溶液を加える前に、上記リガンド担持体表面を流れている溶液を0.05%Tween 20を含むPhosphate Buffered Saline(PBS)緩衝液pH7.4(以下、「PBS−T」と略記する)に置換した。測定温度は室温で測定を行った。
【0241】
PBS−Tを用いて、上記ヘルペスウイルス分離株の濃度を2.4〜59.2μg/mlに合わせたヘルペスウイルス分離株溶液を調製した。そして、流速150μl/minの速さで、上記溶液を5分間上記リガンド担持体の表面に流した。
【0242】
ここで、上記ヘルペスウイルス分離株と、上記リガンド担持体に固定されているリガンド複合体の糖鎖とが相互作用をした場合には、リガンド複合体のスポット位置において表面プラズモン共鳴が起こる。従って、上記表面プラズモン共鳴によって生じる信号量(輝度)をリアルタイムで測定することにより、上記相互作用をリアルタイムで測定することができる。
【0243】
図5は、表面プラズモン共鳴装置を用いて、糖鎖とヘルペスウイルスとの相互作用の測定結果をグラフ化した図である。また、図6は、ヘルペスウイルスに対する8種の糖鎖の反応量(図5に示した信号強度)を全て足した値を100%として、各糖鎖の反応の割合をグラフ化、すなわちヘルペスウイルス分離株をパターニングした図である。
【0244】
図6によれば、上記ヘルペスウイルス分離株のそれぞれが、上記糖鎖に対して異なる特異性を有することを示している。すなわち、上記ヘルペスウイルス分離株の上記糖鎖に対する特異性によって、上記ヘルペスウイルス分離株をパターニングできることが分かる。
【0245】
したがって、実施例4より、ヘルペスウイルス分離株と糖鎖との相互作用を測定することにより、当該ヘルペスウイルスのスクリーニングやパターニングができることが検証された。
【0246】
発明の詳細な説明の項においてなされた具体的な実施態様または実施例は、あくまでも、本発明の技術内容を明らかにするものであって、そのような具体例にのみ限定して狭義に解釈されるべきものではなく、本発明の精神と次に記載する特許請求事項との範囲内で、いろいろと変更して実施することができるものである。
【産業上の利用可能性】
【0247】
本発明に係るタンパク質、ウイルス、細胞、細菌、リポソーム、およびミセルからなる群より選ばれる1以上の生体関連物質と糖鎖との相互作用の測定方法は、糖鎖が1〜500種類/cm2となるように、それぞれ独立して固定されたリガンド担持体に生体関連物質を接触させる工程を含んでいる。
【0248】
ここで、上記接触によって生じた表面プラズモン共鳴、プラズモン吸収、または水晶振動子の信号量は、上記リガンド複合体の糖鎖とウイルスとの相互作用の強さによって変化するため、上記信号量を測定することにより、上記相互作用を測定することができる。さらに、糖鎖が単位面積あたりに上記のように固定化されているため、複数の糖鎖と上記生体関連物質との相互作用を同時に網羅的に測定することができる。また、上記信号量は、非標識でリアルタイムに得ることができる。そのため、生体関連物質と糖鎖との相互作用を同時且つ網羅的に非標識でリアルタイムに測定することができる。また、1回の測定を低コストで効率よく行うことができる。
【0249】
その上、リガンド担持体を交換することなく、同じリガンド担持体を用いて、上記生体関連物質と糖鎖との相互作用の測定を連続して複数回行うことができる。そのため、網羅的な生体関連物質と糖鎖との相互作用の測定を再現性よく実施することができる。
【0250】
よって本発明を、生体関連物質が関連する疾病に対する検査法、診断法、さらに予防薬や、上記疾病に対する治療薬を開発する医薬品産業、医療機器産業等に利用することができる。
【特許請求の範囲】
【請求項1】
ウイルスと糖鎖との相互作用の測定方法であって、
糖鎖固定化金属ナノ粒子を含む溶液と、ウイルスを含む溶液とを混和することによって、糖鎖−生体関連物質相互作用体を生成させる工程を含み、
上記糖鎖固定化金属ナノ粒子は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、金属−硫黄結合によって金属ナノ粒子に固定されてなることを特徴とする方法。
【請求項2】
上記ウイルスはインフルエンザウイルスまたはヘルペスウイルスであることを特徴とする請求項1に記載の方法。
【請求項3】
上記糖鎖は、Galβ1−4Glc、Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4Glc、Neu5Acα2−6Galβ1−4Glc、Neu5Acα2−3Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−4GlcNAcβ1−6Glc、GlcAβ1−3GalNAc4Sβ1−6Glc、GlcAβ1−3GalNAc6Sβ1−6Glc、GlcA2Sβ1−3GalNAc6Sβ1−6Glc、GlcAβ1−3GalNAc4S6Sβ1−6Glc、GlcNS6Sα1−4IdoA2Sα1−6Glc、GlcNSα1−4IdoA2Sα1−6Glc、GlcNS6Sα1−4GlcA2Sβ1−6Glc、およびGlcNSα1−4GlcAβ1−6Glcからなる群より選ばれる1以上の糖鎖であることを特徴とする請求項1に記載の方法。
【請求項4】
硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体であって、上記糖鎖は、Neu5Acα2−3Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4GlcNAcβ1−6Glc、GlcAβ1−3GalNAc4Sβ1−6Glc、GlcAβ1−3GalNAc6Sβ1−6Glc、GlcA2Sβ1−3GalNAc6Sβ1−6Glc、GlcAβ1−3GalNAc4S6Sβ1−6Glc、GlcNSα1−4IdoA2Sα1−6Glc、GlcNS6Sα1−4GlcA2Sβ1−6Glc、またはGlcNSα1−4GlcAβ1−6Glcであることを特徴とするリガンド複合体。
【請求項1】
ウイルスと糖鎖との相互作用の測定方法であって、
糖鎖固定化金属ナノ粒子を含む溶液と、ウイルスを含む溶液とを混和することによって、糖鎖−生体関連物質相互作用体を生成させる工程を含み、
上記糖鎖固定化金属ナノ粒子は、硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体が、金属−硫黄結合によって金属ナノ粒子に固定されてなることを特徴とする方法。
【請求項2】
上記ウイルスはインフルエンザウイルスまたはヘルペスウイルスであることを特徴とする請求項1に記載の方法。
【請求項3】
上記糖鎖は、Galβ1−4Glc、Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4Glc、Neu5Acα2−6Galβ1−4Glc、Neu5Acα2−3Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−4GlcNAcβ1−6Glc、GlcAβ1−3GalNAc4Sβ1−6Glc、GlcAβ1−3GalNAc6Sβ1−6Glc、GlcA2Sβ1−3GalNAc6Sβ1−6Glc、GlcAβ1−3GalNAc4S6Sβ1−6Glc、GlcNS6Sα1−4IdoA2Sα1−6Glc、GlcNSα1−4IdoA2Sα1−6Glc、GlcNS6Sα1−4GlcA2Sβ1−6Glc、およびGlcNSα1−4GlcAβ1−6Glcからなる群より選ばれる1以上の糖鎖であることを特徴とする請求項1に記載の方法。
【請求項4】
硫黄原子を有するリンカー化合物と糖鎖とが結合した構造を備えるリガンド複合体であって、上記糖鎖は、Neu5Acα2−3Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−6Galβ1−3GlcNAcβ1−6Glc、Neu5Acα2−3Galβ1−4GlcNAcβ1−6Glc、GlcAβ1−3GalNAc4Sβ1−6Glc、GlcAβ1−3GalNAc6Sβ1−6Glc、GlcA2Sβ1−3GalNAc6Sβ1−6Glc、GlcAβ1−3GalNAc4S6Sβ1−6Glc、GlcNSα1−4IdoA2Sα1−6Glc、GlcNS6Sα1−4GlcA2Sβ1−6Glc、またはGlcNSα1−4GlcAβ1−6Glcであることを特徴とするリガンド複合体。
【図1】


【図4】


【図5】


【図6】


【図2】


【図3】




【図4】


【図5】


【図6】


【図2】


【図3】


【公開番号】特開2013−40970(P2013−40970A)
【公開日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願番号】特願2012−260396(P2012−260396)
【出願日】平成24年11月28日(2012.11.28)
【分割の表示】特願2007−324036(P2007−324036)の分割
【原出願日】平成19年12月14日(2007.12.14)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2006年6月18日 第20回国際生化学・分子生物学会議 組織委員会発行の「20th IUBMB International Congress of Biochemistry and Molecular Biology and 11th FAOBMB Congress(講演要旨集)」に発表
【出願人】(503360115)独立行政法人科学技術振興機構 (1,734)
【出願人】(504258527)国立大学法人 鹿児島大学 (284)
【出願人】(505196288)
【公開日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願日】平成24年11月28日(2012.11.28)
【分割の表示】特願2007−324036(P2007−324036)の分割
【原出願日】平成19年12月14日(2007.12.14)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2006年6月18日 第20回国際生化学・分子生物学会議 組織委員会発行の「20th IUBMB International Congress of Biochemistry and Molecular Biology and 11th FAOBMB Congress(講演要旨集)」に発表
【出願人】(503360115)独立行政法人科学技術振興機構 (1,734)
【出願人】(504258527)国立大学法人 鹿児島大学 (284)
【出願人】(505196288)

[ Back to top ]

