ウイルスポリメラーゼインヒビター
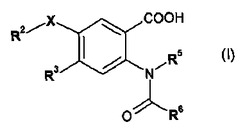
C型肝炎ウイルスNS5Bポリメラーゼのインヒビターとして有用な下記式(I)の化合物。
【化1】

(式中、X、R2、R3、R5及びR6は本出願で定義するとおりである。)
【化1】

(式中、X、R2、R3、R5及びR6は本出願で定義するとおりである。)
【発明の詳細な説明】
【技術分野】
【0001】
〔関連出願〕
この出願は、2006年8月17日提出の米国特許出願第60/822711号の利益を主張し、その開示を本明細書で援用する。
〔発明の分野〕
本発明は、C型肝炎ウイルス(HCV)感染症の治療のための化合物、組成物及び方法に関する。特に、本発明はC型肝炎ウイルスNS5Bポリメラーゼの新規インヒビター、該化合物を含有する医薬組成物及びこれらの化合物をHCV感染症の治療で使用する方法を提供する。
【背景技術】
【0002】
〔発明の背景〕
世界中で少なくとも1億3千万の人々がC型肝炎ウイルス(HCV)に感染している。急性HCV感染症は多くの場合慢性感染症に進行し、かつ慢性感染症が肝硬変及び肝細胞癌などの重症な肝臓疾患につながる感染個体もいる。
現在、慢性C型肝炎ウイルス感染症の標準的治療は、ペグ化インターフェロン-αとリバビリンの併用投与を含む。しかし、この療法は、多くの感染患者において検出できないレベルにHCV RNAを減らすのに有効でなく、かつ例えば発熱及び他のインフルエンザ様症状、うつ病、血小板減少症及び溶血性貧血などの耐えられない副作用を伴うことが多い。さらに、この治療に禁忌である状況が共存するHCV-感染患者もいる。
従って、C型肝炎ウイルス感染症の代替治療に対する要求が存在する。この要求を取り扱うための1つの考えられる戦略は、ウイルス又はウイルス複製に必須の宿主細胞の因子を不活化する有効な抗ウイルス薬の開発である。
HCVは、フラビウイルス(Flaviviridae)科のヘパシウイルス(Hepacivirus)属のエンベロープ型正鎖RNAウイルスである。単鎖HCV RNAゲノムは約9500のヌクレオチドの長さであり、5'及び3'非翻訳領域に隣接した単一の読み枠(ORF)を有する。HCVの5'非翻訳領域は、341のヌクレオチドの長さで、キャップ依存性翻訳開始の配列内リボース侵入部位(internal ribosome entry site)として機能する。読み枠は、約3000のアミノ酸の単一の大きいタンパク質であり、複数部位で細胞性及びウイルス性プロテアーゼによって切断されて成熟した構造及び非構造(NS2、NS3、NS4A、NS4B、NS5A、及びNS5B)タンパク質を生成する。ウイルス性NS2/3プロテアーゼはNS2-NS3接合部で切断し;さらにNS3-NS4A、NS4A-NS4B、NS4B-NS5A及びNS5A-NS5B切断部位で該ウイルス性NS3プロテアーゼがNS3の下流切断を媒介する。NS3タンパク質もヌクレオシドトリホスファターゼ及びRNAヘリカーゼ活性を示す。NS4Aタンパク質は、NS3プロテアーゼの補助因子として作用し、かつNS3及び他のウイルス性レプリカーゼ成分の膜局在化においても補助しうる。NS4B及びNS5Aリンタンパク質も該レプリカーゼの成分であると考えられるが、その特有の役割は未知である。NS5Bタンパク質は、RNA依存性RNAポリメラーゼ(RdRp)活性を有するHCVレプリカーゼの伸長サブユニットである。
新規かつ特異的な抗-HCV治療の開発は高い優先度であり、かつ複製に必須のウイルス特異性機能は、薬物開発のため最も魅力的な標的である。RNA依存性RNAポリメラーゼが哺乳動物に存在しないこと及びこの酵素がウイルスの複製に必須のようであるという事実は、NS5Bポリメラーゼが抗-HCV療法の理想的な標的であることを示唆しているだろう。最近、チンパンジーモデルにおいてNS5B活性を殺す突然変異がRNAの感染力を撤廃することが実証された(非特許文献1参照)。
特許文献1は、ペルオキシソーム増殖因子-活性化受容体α及び/又はγの活性を調節する、下記一般式の化合物を開示している。
【0003】
【化1】

同様の化合物が以下の文献に開示されている:非特許文献2〜4(非特許文献5に要約されている)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】国際公開第03/004458号パンフレット
【特許文献2】国際公開第99/07733号パンフレット
【特許文献3】国際公開第99/07734号パンフレット
【特許文献4】国際公開第00/09558号パンフレット
【特許文献5】国際公開第00/09543号パンフレット
【特許文献6】国際公開第00/59929号パンフレット
【特許文献7】国際公開第03/064416号パンフレット
【特許文献8】国際公開第03/064455号パンフレット
【特許文献9】国際公開第03/064456号パンフレット
【特許文献10】国際公開第2004/030670号パンフレット
【特許文献11】国際公開第2004/037855号パンフレット
【特許文献12】国際公開第2004/039833号パンフレット
【特許文献13】国際公開第2004/101602号パンフレット
【特許文献14】国際公開第2004/101605号パンフレット
【特許文献15】国際公開第2004/103996号パンフレット
【特許文献16】国際公開第2005/028501号パンフレット
【特許文献17】国際公開第2005/070955号パンフレット
【特許文献18】国際公開第2006/000085号パンフレット
【特許文献19】国際公開第2006/007700号パンフレット
【特許文献20】国際公開第2006/007708号パンフレット
【特許文献21】国際公開第02/060926号パンフレット
【特許文献22】国際公開第03/053349号パンフレット
【特許文献23】国際公開第03/099274号パンフレット
【特許文献24】国際公開第03/099316号パンフレット
【特許文献25】国際公開第2004/032827号パンフレット
【特許文献26】国際公開第2004/043339号パンフレット
【特許文献27】国際公開第2004/094452号パンフレット
【特許文献28】国際公開第2005/046712号パンフレット
【特許文献29】国際公開第2005/051410号パンフレット
【特許文献30】国際公開第2005/054430号パンフレット
【特許文献31】国際公開第2004/072243号パンフレット
【特許文献32】国際公開第2004/093798号パンフレット
【特許文献33】国際公開第2004/113365号パンフレット
【特許文献34】国際公開第2005/010029号パンフレット
【特許文献35】国際公開第2005/037214号パンフレット
【特許文献36】国際公開第01/77113号パンフレット
【特許文献37】国際公開第01/81325号パンフレット
【特許文献38】国際公開第02/08187号パンフレット
【特許文献39】国際公開第02/08198号パンフレット
【特許文献40】国際公開第02/08244号パンフレット
【特許文献41】国際公開第02/08256号パンフレット
【特許文献42】国際公開第02/48172号パンフレット
【特許文献43】国際公開第03/062228号パンフレット
【特許文献44】国際公開第03/062265号パンフレット
【特許文献45】国際公開第2005/021584号パンフレット
【特許文献46】国際公開第2005/030796号パンフレット
【特許文献47】国際公開第2005/058821号パンフレット
【特許文献48】国際公開第2005/051980号パンフレット
【特許文献49】国際公開第2005/085197号パンフレット
【特許文献50】国際公開第2005/085242号パンフレット
【特許文献51】国際公開第2005/085275号パンフレット
【特許文献52】国際公開第2005/087721号パンフレット
【特許文献53】国際公開第2005/087725号パンフレット
【特許文献54】国際公開第2005/087730号パンフレット
【特許文献55】国際公開第2005/087731号パンフレット
【特許文献56】国際公開第2005/107745号パンフレット
【特許文献57】国際公開第2005/113581号パンフレット
【特許文献58】国際公開第02/04425号パンフレット
【特許文献59】国際公開第03/007945号パンフレット
【特許文献60】国際公開第03/010140号パンフレット
【特許文献61】国際公開第03/010141号パンフレット
【特許文献62】国際公開第2004/064925号パンフレット
【特許文献63】国際公開第2004/065367号パンフレット
【特許文献64】国際公開第2005/080388号パンフレット
【特許文献65】国際公開第2006/007693号パンフレット
【特許文献66】国際公開第01/47883号パンフレット
【特許文献67】国際公開第03/000254号パンフレット
【特許文献68】国際公開第03/026587号パンフレット
【特許文献69】国際公開第03/101993号パンフレット
【特許文献70】国際公開第2004/087714号パンフレット
【特許文献71】国際公開第2005/012288号パンフレット
【特許文献72】国際公開第2005/014543号パンフレット
【特許文献73】国際公開第2005/049622号パンフレット
【特許文献74】国際公開第2005/121132号パンフレット
【非特許文献】
【0005】
【非特許文献1】Kolykhalov, A.A.; Mihalik, K.; Feinstone, S.M.; Rice, C.M.; 2000; J. Virol. 74: 2046-2051
【非特許文献2】Thor, M., et al, Bioorganic & Medicinal Chemistry Letters(2002) 12: 3565-3567
【非特許文献3】Ostberg, T., et al, Journal of Biological Chemistry(2004) 279(39): 41124-41130
【非特許文献4】Hemalatha, R., et al, E-Journal of Chemistry(2004) 1(5): 243-250
【非特許文献5】Chemical Abstracts 142: 190216
【非特許文献6】Protective Groups in Organic Chemistry”, John Wiley & Sons, New York(1981)
【非特許文献7】S.M. Birge et al., J. Pharm. Sci., 1977, 66, pp. 1-19
【非特許文献8】Design of Prodrugs, Bundgaard, H. Ed. Elsevier(1985)
【非特許文献9】Chiral Separation Techniques: A Practical Approach(2nd Ed.), G. Subramanian(ed.), Wiley-VCH, 2000
【非特許文献10】T.E. Beesley and R.P.W. Scott, Chiral Chromatography, John Wiley & Sons, 1999
【非特許文献11】Satinder Ahuja, Chiral Separations by Chromatography, Am. Chem. Soc., 2000
【非特許文献12】Remington: The Science and Practice of Pharmacy, 21st Edition, Lippincott Williams & Wilkins, 2005
【非特許文献13】L.V. Allen, N.G. Popovish and H.C. Ansel, Pharmaceutical Dosage Forms and Drug Delivery Systems, 8th ed., Lippincott Williams & Wilkins, 2004
【非特許文献14】Abdel-Magid, A. F.; Carson, K. G.; Harris, B. D.; Maryanoff, C. A.; Shah, R. D. J. Org. Chem. 1996, 61, 3849
【非特許文献15】W.C. Still et al., J. Org. Chem.,(1978), 43, 2923
【非特許文献16】Abdel-Magid, A. F.; Carson, K. G.; Harris, B. D.; Maryanoff, C. A.; Shah, R. D. J. Org. Chem. 1996, 61, 3849
【非特許文献17】Elizabeth Buck, E.; Song, Z. J. Organic Syntheses 82, 2005, 69
【非特許文献18】Takagi, K. Chem. Lett. 1985, 1307
【非特許文献19】Hennessy, E. J.; Buchwald, S. L. Org. Lett. 2002, 4, 269
【非特許文献20】Abdel-Magid, A. F.; Carson, K. G.; Harris, B. D.; Maryanoff, C. A.; Shah, R. D. J. Org. Chem. 1996, 61, 3849
【非特許文献21】Takagi, K. Chem. Lett.(1985), 14: 1307
【非特許文献22】Tanaka, K.; Suzuki, T.; Maeno, S.; Mitsuhashi, K. J. Heterocycl. Chem. 1986, 23, 1537
【非特許文献23】McKercher et al.,(2004) Nucleic Acids Res. 32: 422-431
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、HCVポリメラーゼに対する阻害活性を有する一連の新規化合物を提供する。特に、この発明の化合物は、HCVの、RNA依存性RNAポリメラーゼ、特にHCVによってコードされる酵素NS5BによるRNA合成を阻害する。この発明で提供する化合物のさらなる利点は、該化合物が他のポリメラーゼに対して低い乃至非常に低い活性であり、又は有意な活性がない場合さえあることである。当業者には、以下の説明及び実施例からこの発明のさらなる目的が明白になるだろう。
【課題を解決するための手段】
【0007】
本発明の一局面は、下記式(I)の化合物又はその塩若しくはエステルを提供する。
【化2】

【0008】
(式中:
XはO及びSから選択され;
R2は、任意に1〜5個のR20置換基で置換されていてもよいHetであり、ここで、R20は各場合独立に下記基:
a)ハロ、シアノ又はニトロ;
b)R7、-C(=O)-R7、-C(=O)-O-R7、-O-R7、-S-R7、-SO-R7、-SO2-R7、-(C1-6)アルキレン-R7、-(C1-6)アルキレン-C(=O)-R7、-(C1-6)アルキレン-C(=O)-O-R7、-(C1-6)アルキレン-O-R7、-(C1-6)アルキレン-S-R7、-(C1-6)アルキレン-SO-R7又は-(C1-6)アルキレン-SO2-R7
(ここで、R7は各場合独立にH、(C1-6)アルキル、(C2-6)アルケニル、(C2-6)アルキニル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、アリール及びHetから選択され;
前記(C1-6)アルキルは任意に、-OH、-O-(C1-6)アルキル、シアノ、COOH、-NH2、-NH(C1-4)アルキル、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル及び-N((C1-4)アルキル)2からそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;かつ
前記各アリール及びHetは任意に、下記基:
i)ハロ、シアノ、オキソ、チオキソ、イミノ、-OH、-O-(C1-6)アルキル、-O-(C1-6)ハロアルキル、(C3-7)シクロアルキル、(C1-6)ハロアルキル、-C(=O)-(C1-6)アルキル、-SO2(C1-6)アルキル、-C(=O)-NH2、-C(=O)-NH(C1-4)アルキル、-C(=O)-N((C1-4)アルキル)2、-C(=O)-NH(C3-7)シクロアルキル、-C(=O)-N((C1-4)アルキル)(C3-7)シクロアルキル、-NH2、-NH(C1-4)アルキル、-N((C1-4)アルキル)2、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル又は-NH-C(=O)(C1-4)アルキル;
ii)任意に-OH、-O-(C1-6)ハロアルキル、又は-O-(C1-6)アルキルで置換されていてもよい(C1-6)アルキル;及び
iii)アリール又はHet(各アリール及びHetは任意にハロ又は(C1-6)アルキルで置換されていてもよい)
からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);及び
c)-N(R8)R9、-C(=O)-N(R8)R9、-O-C(=O)-N(R8)R9、-SO2-N(R8)R9、-(C1-6)アルキレン-N(R8)R9、-(C1-6)アルキレン-C(=O)-N(R8)R9、-(C1-6)アルキレン-O-C(=O)-N(R8)R9、又は-(C1-6)アルキレン-SO2-N(R8)R9(ここで、
R8は、各場合独立にH、(C1-6)アルキル及び(C3-7)シクロアルキルから選択され;かつ
R9は、各場合独立にR7、-(C1-6)アルキレン-R7、-SO2-R7、-C(=O)-R7、-C(=O)OR7及び-C(=O)N(R8)R7から選択され;R7及びR8は前記定義どおりである)
から選択され;
【0009】
R3は、H、ハロ、(C1-4)アルキル、-O-(C1-4)アルキル、-S-(C1-4)アルキル、-NH2、-NH(C1-4)アルキル、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル及び-N((C1-4)アルキル)2から選択され;
R5は、H、(C1-6)アルキル、(C3-7)シクロアルキル又はHetであり;該(C1-6)アルキル及びHetはそれぞれ任意に、(C1-6)アルキル、Het、-OH、-COOH、-C(=O)-(C1-6)アルキル、-C(=O)-O-(C1-6)アルキル、-SO2(C1-6)アルキル及び-C(=O)-N(R51)R52からそれぞれ独立に選択される1〜4個の置換基で置換されていてもよく
(ここで、R51はH、(C1-6)アルキル又は(C3-7)シクロアルキルであり;かつ
R52はH、(C1-6)アルキル、(C3-7)シクロアルキル、アリール、Het、アリール-(C1-3)アルキル-又はHet-(C1-3)アルキル-であり;
該(C1-6)アルキル、(C3-7)シクロアルキル、アリール、Het、アリール-(C1-3)アルキル-及びHet-(C1-3)アルキル-はそれぞれ任意に、(C1-6)アルキル、(C1-6)ハロアルキル、ハロ、オキソ、-OH、-O(C1-6)アルキル、-NH2、-NH(C1-6)アルキル、-N((C1-6)アルキル)2、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル、-C(=O)(C1-6)アルキル及び-NHC(=O)-(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよく;
或いはR51とR52が、それらが結合しているNと一緒に結合して、任意にさらにそれぞれ独立にN、O及びSから選択される1〜3個のヘテロ原子を含有してよい4員〜7員のヘテロ環を形成し(ここで、各Sヘテロ原子は独立に、かつ可能な場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;
前記ヘテロ環は任意に、(C1-6)アルキル、(C1-6)ハロアルキル、ハロ、オキソ、-OH、-O(C1-6)アルキル、-NH2、-NH(C1-6)アルキル、-N((C1-6)アルキル)2、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル、-C(=O)(C1-6)アルキル及び-NHC(=O)-(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);
R6は(C3-7)シクロアルキル又はアリールであり;
【0010】
該(C3-7)シクロアルキル及びアリールはそれぞれ任意、ハロ、(C1-6)アルキル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、-OH、-SH、-O-(C1-4)アルキル及び-S-(C1-4)アルキルからそれぞれ独立に選択される1〜5個の置換基で置換されていてもよく;かつ
Hetは、O、N及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を有する4員〜7員の飽和、不飽和若しくは芳香族ヘテロ環、又は可能な限り、O、N及びSからそれぞれ独立に選択される1〜5個のヘテロ原子を有する7員〜14員の飽和、不飽和若しくは芳香族ヘテロ多環であり;ここで、各Nヘテロ原子は独立に、かつ可能な場合、さらに酸素原子に結合してN-オキシド基を形成するように酸化状態で存在してよく、各Sヘテロ原子は独立に、かつ可能な場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;
但し、R2が下記基:
【化3】

【0011】
から選択され;
XがOであり;R3がHであり;かつR5がHである場合、
R6は下記基でない。)
【化4】

【0012】
この発明の別の局面は、薬物としての式(I)の化合物、又はその医薬的に許容しうる塩若しくはエステルを提供する。
この発明のさらに別の局面は、治療的に有効な量の式(I)の化合物又はその医薬的に許容しうる塩若しくはエステル;及び1種以上の医薬的に許容しうる担体を含んでなる医薬組成物を提供する。
この局面の実施形態では、この発明の医薬組成物は、さらに少なくとも1種の他の抗ウイルス薬を含む。
本発明は、上述した医薬組成物の、C型肝炎ウイルスに感染しているか又は感染している危険のある哺乳動物のC型肝炎ウイルス感染症の治療のための使用をも提供する。
本発明のさらなる局面は、C型肝炎ウイルスに感染しているか又は感染している危険のある哺乳動物のC型肝炎ウイルス感染症の治療方法であって、前記哺乳動物に治療的に有効な量の式(I)の化合物、その医薬的に許容しうる塩若しくはエステル、又はその上述したような組成物を投与する工程を含んでなる方法に関する。
C型肝炎ウイルスに感染しているか又は感染している危険のある哺乳動物のC型肝炎ウイルス感染症の治療方法であって、前記哺乳動物に治療的に有効な量の式(I)の化合物又はその医薬的に許容しうる塩若しくはエステルと、少なくとも1種の他の抗ウイルス薬との組合せ;或いはその組成物を投与する工程を含んでなる方法に関する。
また、上述したような式(I)の化合物、又はその医薬的に許容しうる塩若しくはエステルの、C型肝炎ウイルスに感染しているか又は感染している危険のある哺乳動物のC型肝炎ウイルス感染症の治療用薬物の製造のための使用も、この発明の範囲内である。
この発明のさらなる局面は、C型肝炎ウイルス感染症の治療に有効な組成物;及び該組成物を用いて、C型肝炎ウイルスによる感染症を治療できることを示すラベルを含んでなり;前記組成物が、この発明の式(I)の化合物又はその医薬的に許容しうる塩若しくはエステルを含む、製品に関する。
この発明のさらに別の局面は、C型肝炎ウイルスの複製の阻害方法であって、C型肝炎ウイルスの複製が阻害される条件下で、前記ウイルスを有効量の式(I)の化合物、又はその塩若しくはエステルに曝露する工程を含んでなる方法に関する。
さらに、式(I)の化合物、又はその塩若しくはエステルの、C型肝炎ウイルスの複製を阻害するための使用が本発明の範囲に包含される。
【発明を実施するための形態】
【0013】
〔発明の詳細な説明〕
(定義)
本明細書では、特に断らない限り、以下の定義を適用する。
本明細書では、特に断らない限り、用語「置換基」は、そうでなければ少なくとも1つの水素原子に結合されるであろう、炭素原子、ヘテロ原子又は分子若しくはそのフラグメントの一部を形成しうるいずれかの他の原子に結合されうる原子、遊離基又は基を意味するものとする。特定の分子又はそのフラグメントの文脈で想定される置換基は、当業者にいは認識されるように、化学的に安定な化合物を生じさせる当該置換基である。
本明細書では、単独又は別の基と組み合わせた用語「(C1-n)アルキレン」(nは整数)は、1〜n個の炭素原子を含む非環式の直鎖若しくは分岐鎖の二価アルキル基を意味するものとする。「(C1-6)アルキレン」として、限定するものではないが、-CH2-、-CH2CH2-、及び下記基が挙げられる。
【化5】

【0014】
本明細書では、単独又は別の基と組み合わせた用語「(C2-n)アルケニル」(nは整数)は、2〜n個の炭素原子を含有し、その少なくとも2個が相互に二重結合でつながれている不飽和の非環式の直鎖若しくは分岐鎖基を意味するものとする。該基の例として、限定するものではないが、エテニル(ビニル)、1-プロペニル、2-プロペニル、及び1-ブテニルが挙げられる。特に断らない限り、用語「(C2-n)アルケニル」は、可能な場合、個々の立体異性体を包含するものと解釈し、限定するものではないが、(E)及び(Z)異性体、並びにその混合物が挙げられる。(C2-n)アルケニル基が置換される場合、特に断らない限り、当業者には分かるように、そうでなければ水素原子を持つであろう、該基のいずれの炭素原子上でも、該置換が化学的に安定な化合物を生じさせるように、置換されるものと解釈する。
本明細書では、単独又は別の基と組み合わせた用語「(C2-n)アルキニル」(nは整数)は、2〜n個の炭素原子を含有し、その少なくとも2個が相互に三重結合でつながれている不飽和の非環式の直鎖若しくは分岐鎖基を意味するものとする。該基の例として、限定するものではないが、エチニル、1-プロピニル、2-プロピニル及び1-ブチニルが挙げられる。(C2-n)アルキニル基が置換される場合、特に断らない限り、当業者には分かるように、そうでなければ水素原子を持つであろう、該基のいずれの炭素原子上でも、該置換が化学的に安定な化合物を生じさせるように、置換されるものと解釈する。
本明細書では、単独又は別の基と組み合わせた用語「(C3-m)シクロアルキル」(mは整数)は、3〜m個の炭素原子を含有するシクロアルキル置換基を意味するものとし、限定するものではないが、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル及びシクロヘプチルが挙げられる。
本明細書では、単独又は別の基と組み合わせた用語「(C3-m)シクロアルキル-(C1-n)アルキル-」(n及びmは両方とも整数)は、それ自体、前記定義どおりの3〜m個の炭素原子を含有するシクロアルキルで置換されている、前記定義どおりの1〜n個の炭素原子を有するアルキル基を意味するものとする。(C3-7)シクロアルキル-(C1-6)アルキル-の例として、限定するものではないが、シクロプロピルメチル、シクロブチルメチル、シクロペンチルメチル、シクロヘキシルメチル、1-シクロプロピルエチル、2-シクロプロピルエチル、1-シクロブチルエチル、2-シクロブチルエチル、1-シクロペンチルエチル、2-シクロペンチルエチル、1-シクロヘキシルエチル及び2-シクロヘキシルエチルが挙げられる。(C3-m)シクロアルキル-(C1-n)アルキル-基が置換される場合、特に断らない限り、置換基は、シクロアルキル若しくはそのアルキル部分又はその両方に結合しうるものと解釈する。
本明細書では、単独又は別の基と組み合わせた用語「アリール」は、6個の炭素原子を含有する炭素環式芳香族単環式基を意味し、さらに第2の5員又は6員炭素環式基(芳香族、飽和又は不飽和でよい)に縮合しうる。アリールとして、限定するものではないが、フェニル、インダニル、インデニル、1-ナフチル、2-ナフチル、テトラヒドロナフチル及びジヒドロナフチルが挙げられる。
本明細書では、単独又は別の基と組み合わせた用語「アリール-(C1-n)アルキル-」(nは整数)は、それ自体、前記定義どおりのアリールで置換されている、前記定義どおりの1〜n個の炭素原子を有するアルキル基を意味する。アリール-(C1-n)アルキル-の例として、限定するものではないが、フェニルメチル(ベンジル)、1-フェニルエチル、2-フェニルエチル及びフェニルプロピルが挙げられる。アリール-(C1-n)アルキル-基が置換される場合、特に断らない限り、置換基は、アリール若しくはそのアルキル部分又はその両方に結合しうるものと解釈する。
【0015】
本明細書では、単独又は別の基と組み合わせた用語「Het」は、O、N及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を有する4員〜7員の飽和、不飽和若しくは芳香族ヘテロ環、又は可能な限り、O、N及びSからそれぞれ独立に選択される1〜5個のヘテロ原子を有する7員〜14員の飽和、不飽和若しくは芳香族ヘテロ多環を意味し;特に断らない限り、各Nヘテロ原子は独立に、かつ可能な場合、さらに酸素原子に結合してN-オキシド基を形成するように酸化状態で存在してよく、かつ各Sヘテロ原子は独立に、かつ可能な場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在しうるものとする。Het基が置換される場合、置換基は、特に断らない限り、そうでなければ水素原子を持つであろう、Het基のいずれの炭素原子又はヘテロ原子にも結合しうるものと解釈する。
本明細書では、特に断らない限り、単独又は別の基と組み合わせた用語「Het-(C1-n)アルキル-」(nは整数)は、それ自体、前記定義どおりのHet置換基で置換されている、前記定義どおりの1〜n個の炭素原子を有するアルキル基を意味するものとする。Het-(C1-n)アルキル-の例として、限定するものではないが、チエニルメチル、フリルメチル、ピペリジニルエチル、2-ピリジニルメチル、3-ピリジニルメチル、4-ピリジニルメチル、キノリニルプロピル等が挙げられる。Het-(C1-n)アルキル-基が置換される場合、置換基は、特に断らない限り、Het若しくはそのアルキル部分又は両方に結合しうるものと解釈する。
本明細書では、用語「ヘテロ原子」はO、S又はNを意味するものとする。
本明細書では、特に断らない限り、単独又は別の基と組み合わせた用語「ヘテロ環」は、O、N及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する4員〜7員の飽和、不飽和若しくは芳香族ヘテロ環;又はそれから水素原子を除去して得られる一価基を意味するものとする。該ヘテロ環の例として、限定するものではないが、アゼチジン、ピロリジン、テトラヒドロフラン、テトラヒドロチオフェン、チアゾリジン、オキサゾリジン、ピロール、チオフェン、フラン、ピラゾール、イミダゾール、イソキサゾール、オキサゾール、イソチアゾール、チアゾール、トリアゾール、テトラゾール、ピペリジン、ピペラジン、アゼピン、ジアゼピン、ピラン、1,4-ジオキサン、4-モルフォリン、4-チオモルフォリン、ピリジン、ピリジン-N-オキシド、ピリダジン、ピラジン、ピリミジン、及び以下のヘテロ環:
【0016】
【化6】

並びにその飽和、不飽和及び芳香族誘導体が挙げられる。
本明細書では、特に断らない限り、単独又は別の基と組み合わせた用語「ヘテロ多環」は、1つ以上の他の環、例えば炭素環、ヘテロ環若しくはいずれかの他の環に縮合している、前記定義どおりのヘテロ環;又はそれから水素原子を除去して得られる一価基を意味するものとする。該ヘテロ多環の例として、限定するものではないが、インドール、イソインドール、ベンゾイミダゾール、ベンゾチオフェン、ベンゾフラン、ベンゾジオキソール、ベンゾチアゾール、キノリン、イソキノリン、ナフチリジン、及び下記ヘテロ多環:
【0017】
【化7】

並びにその飽和、不飽和及び芳香族誘導体が挙げられる。
【0018】
本明細書では、用語「ハロ」は、フルオロ、クロロ、ブロモ又はヨードから選択されるハロゲン置換基を意味するものとする。
本明細書では、単独又は別の基と組み合わせた用語「(C1-n)ハロアルキル」(nは整数)は、1個以上の水素原子がそれぞれハロ置換基と置き換わっている、前記定義どおりの1〜n個の炭素原子を有するアルキル基を意味するものとする。(C1-n)ハロアルキルの例として、限定するものではないが、クロロメチル、クロロエチル、ジクロロエチル、ブロモメチル、ブロモエチル、ジブロモエチル、フルオロメチル、ジフルオロメチル、トリフルオロメチル、フルオロエチル及びジフルオロエチルが挙げられる。
本明細書で相互交換可能に使用される、単独又は別の基と組み合わせた用語「-O-(C1-n)アルキル」又は「(C1-n)アルコキシ」(nは整数)は、酸素原子が、さらに前記定義どおりの1〜n個の炭素原子を有するアルキル基に結合していることを意味するものとする。-O-(C1-n)アルキルの例として、限定するものではないが、メトキシ(CH3O-)、エトキシ(CH3CH2O-)、プロポキシ(CH3CH2CH2O-)、1-メチルエトキシ(イソ-プロポキシ;(CH3)2CH-O-)及び1,1-ジメチルエトキシ(tert-ブトキシ;(CH3)3C-O-)が挙げられる。-O-(C1-n)アルキル基が置換される場合、その(C1-n)アルキル部分上で置換されるものと解釈する。
本明細書で相互交換可能に使用される、単独又は別の基と組み合わせた用語「-S-(C1-n)アルキル」又は「(C1-n)アルキルチオ」(nは整数)は、イオウ原子が、さらに前記定義どおりの1〜n個の炭素原子を有するアルキル基に結合していることを意味するものとする。-S-(C1-n)アルキルの例として、限定するものではないが、メチルチオ(CH3S-)、エチルチオ(CH3CH2S-)、プロピルチオ(CH3CH2CH2S-)、1-メチルエチルチオ(イソプロピルチオ; (CH3)2CH-S-)及び1,1-ジメチルエチルチオ(tert-ブチルチオ;(CH3)3C-S-)が挙げられる。-S-(C1-n)アルキル基又はその酸化誘導体、例えば-SO-(C1-n)アルキル基又は-SO2-(C1-n)アルキル基が置換される場合、それぞれその(C1-n)アルキル部分で置換されるものと解釈する。
本明細書では、用語「オキソ」は、置換基として二重結合(=O)によって炭素原子に結合している酸素原子を意味するものとする。
本明細書では、用語「チオキソ」は、置換基として二重結合(=S)によって炭素原子に結合しているイオウ原子を意味するものとする。
本明細書では、用語「イミノ」は、置換基として二重結合(=NH)によって炭素原子に結合しているNH基を意味するものとする。
本明細書では、用語「COOH」は、カルボキシル基(-C(=O)-OH)を意味するものとする。当業者には、カルボキシル基が官能基等価物で代用されうることが周知である。この発明で想定される該官能基等価物として、限定するものではないが、エステル、アミド、イミド、ボロン酸、ホスホン酸、リン酸、テトラゾール、トリアゾール、N-アシルスルファミド(RCONHSO2NR2)、及びN-アシルスルホンアミド(RCONHSO2R)が挙げられる。
【0019】
本明細書では、用語「能基等価物」は、同様の電子、混成又は結合特性を有する別の原子又は基に取って代わりうる原子又は基を意味するものとする。
本明細書では、用語「保護基」は、合成変換中に使用できる保護基を意味するものとし、限定するものではないが、非特許文献6、及びそのさらに最近の版に列挙される例が挙げられる。
サブ式では、次の記号を用いて被定義分子の残部に連結される結合を示す。
【化8】

【0020】
本明細書では、用語「その塩」は、本発明の化合物のいずれの酸付加塩及び/又は塩基付加塩をも意味するものとし、限定するものではないが、その医薬的に許容しうる塩が挙げられる。
本明細書では、用語「医薬的に許容しうる塩」は、ゾンデ医療判断の範囲内で、 過度の毒性、刺激、アレルギー反応等なしでヒト及び下等動物の組織と接触させて使うのに適し、合理的な利益/危険比で釣り合い、一般的に水若しくは油に可溶性又は分散性であり、かつその意図した用途に有効な、本発明の化合物の塩を意味するものとする。この用語は、医薬的に許容しうる酸付加塩及び医薬的に許容しうる塩基付加塩を包含する。好適な塩のリストは、例えば、非特許文献7で見つかる。
本明細書では、用語「医薬的に許容しうる酸付加塩」は、該遊離塩基の生物学的有効性及び特性を保持し、かつ生物学的又はそれ以外でも望ましくなくなく、無機酸(限定するものではないが、塩酸、臭化水素酸、硫酸、スルファミン酸、硝酸、リン酸が挙げられる)、及び有機酸(限定するものではないが、酢酸、トリフルオロ酢酸、アジピン酸、アスコルビン酸、アスパラギン酸、ベンゼンスルホン酸、安息香酸、酪酸、ショウノウ酸、ショウノウスルホン酸、ケイ皮酸、クエン酸、ジグルコン酸、エタンスルホン酸、グルタミン酸、グリコール酸、グリセロリン酸、ヘミスルフィン酸、ヘキサン酸、ギ酸、フマル酸、2-ヒドロキシエタンスルホン酸(イセチオン酸)、乳酸、ヒドロキシマレイン酸、リンゴ酸、マロン酸、マンデル酸、メシチレンスルホン酸、メタンスルホン酸、ナフタレンスルホン酸、ニコチン酸、2-ナフタレンスルホン酸、シュウ酸、パモン酸、ペクチン酸、フェニル酢酸、3-フェニルプロピオン酸、ピバル酸、プロピオン酸、ピルビン酸、サリチル酸、ステアリン酸、コハク酸、スルファニル酸、酒石酸、p-トルエンスルホン酸、ウンデカン酸などが挙げられる)と形成される当該塩を意味するものとする。
本明細書では、用語「医薬的に許容しうる塩基付加塩」は、該遊離酸の生物学的有効性及び特性を保持し、かつ生物学的又はそれ以外でも望ましくなくなく、無機塩基(限定するものではないが、アンモニア或いはアンモニウム又は金属カチオン、例えばナトリウム、カリウム、リチウム、カルシウム、マグネシウム、鉄、亜鉛、銅、マンガン、アルミニウム等の水酸化物、炭酸塩、又は炭酸水素塩が挙げられる)と形成される当該塩を意味するものとする。特に好ましくはアンモニウム、カリウム、ナトリウム、カルシウム、及びマグネシウム塩である。医薬的に許容しうる無毒の有機塩基から誘導される塩として、限定するものではないが、一級、二級、及び三級アミン、四級アミン化合物、置換アミン(天然に存在する置換アミンを含む)、環式アミン及び塩基性イオン交換樹脂、例えばメチルアミン、ジメチルアミン、トリメチルアミン、エチルアミン、ジエチルアミン、トリエチルアミン、イソプロピルアミン、トリプロピルアミン、トリブチルアミン、エタノールアミン、ジエタノールアミン、2-ジメチルアミノエタノール、2-ジエチルアミノエタノール、ジシクロヘキシルアミン、リジン、アルギニン、ヒスチジン、カフェイン、ヒドラバミン、コリン、ベタイン、エチレンジアミン、グルコサミン、メチルグルカミン、テオブロミン、プリン、ピペラジン、ピペリジン、N-エチルピペリジン、テトラメチルアンモニウム化合物、テトラエチルアンモニウム化合物、ピリジン、N,N-ジメチルアニリン、N-メチルピペリジン、N-メチルモルフォリン、ジシクロヘキシルアミン、ジベンジルアミン、N,N-ジベンジルフェネチルアミン、1-エフェナミン、N,N'-ジベンジルエチレンジアミン、ポリアミン樹脂などの塩が挙げられる。特に好ましい無毒の有機塩基は、イソプロピルアミン、ジエチルアミン、エタノールアミン、トリメチルアミン、ジシクロヘキシルアミン、コリン、及びカフェインである。
【0021】
本明細書では、用語「そのエステル」は、該分子のいずれかの-COOH置換基が-COOR置換基と置き換わっている、本発明の化合物のいずれのエステルをも意味するものとし、該エステルのR成分は、安定したエステル成分を形成するいずれかの炭素含有基であり、限定するものではないが、アルキル、アルケニル、アルキニル、シクロアルキル、シクロアルキルアルキル、アリール、アリールアルキル、ヘテロサイクリル、ヘテロサイクリルアルキル(それぞれ任意にさらに置換されていてもよい)が挙げられる。用語「そのエステル」は、限定するものではないが、その医薬的に許容しうるエステルを包含する。
本明細書では、用語「医薬的に許容しうるエステル」は、該分子のいずれかのCOOH置換基が-COOR置換基と置き換わっている、本発明の化合物のエステルであって、該エステルのR成分がアルキル(限定するものではないが、メチル、エチル、プロピル、1-メチルエチル、1,1-ジメチルエチル、ブチルが挙げられる);アルコキシアルキル(限定するものではないが、メトキシメチルが挙げられる);アシルオキシアルキル(限定するものではないが、アセトキシメチルが挙げられる);アリールアルキル(限定するものではないが、ベンジルが挙げられる);アリールオキシアルキル(限定するものではないが、フェノキシメチルが挙げられる);及び任意にハロゲン、(C1-4)アルキル又は(C1-4)アルコキシで置換されていてもよいアリール(限定するものではないが、フェニルが挙げられる)から選択されるエステルを意味するものとする。他の適切なエステルは、本明細書で援用される非特許文献8で見つかる。このような医薬的に許容しうるエステルは、哺乳動物に注入されると、通常、in vivo加水分解されて、本発明の化合物の酸形態に変換される。前記エステルについては、特に断らない限り、存在するいずれのアルキル成分も好ましくは1〜16個の炭素原子、さらに好ましくは1〜6個の炭素原子を含む。該エステル中に存在するいずれのアリール成分も、好ましくはフェニル基を含む。特に、エステルは(C1-16)アルキルエステル、無置換ベンジルエステル又は少なくとも1個のハロゲン、(C1-6)アルキル、(C1-6)アルコキシ、ニトロ若しくはトリフルオロメチルで置換されているベンジルエステルでよい。
【0022】
本明細書では、用語「哺乳動物」は、C型肝炎ウイルスに感染している疑いのあるヒト、及び非ヒト哺乳動物を包含するものとする。非ヒト哺乳動物として、限定するものではないが、例えばウシ、ブタ、ウマ、イヌ、ネコ、ウサギ、ラット及びマウス、並びに非家畜が挙げられる。
本明細書では、用語「治療」は、C型肝炎の症状を軽減若しくは排除するため、及び/又は患者のウイルス負荷を減らすために本発明の化合物又は組成物を投与することを意味するものとする。用語「治療」は、個体のC型肝炎ウイルスへの曝露後であるが、該疾患の症状の出現前、及び/又は血液中で該ウイルスが検出される前に、該疾患の症状の出現を予防し、及び/又は該ウイルスが血中で検出可能レベルに達するのを予防するために本発明の化合物又は組成物を投与することをも包含する。
用語「治療的に有効な量」とは、治療が必要な患者に投与するとき、本発明の化合物が効用を有する疾患状態、状況、又は障害の治療を達成するのに十分な本化合物の量を意味する。このような量は、研究者又は臨床医が求める組織系又は患者の生物学的又は医学的応答を刺激するのに十分な量であろう。治療的に有効な量を構成する本発明の化合物の量は、化合物とその生物学的活性、投与のために用いられる組成物、投与の時間、投与の経路、本該化合物の排泄の速度、治療の持続期間、治療される疾患状態又は障害とその重症度、本発明の化合物と組み合わせて又は同時に使用される薬物、並びに患者の年齢、体重、全身の健康、性別及び食餌などの因子によって変化するだろう。当業者は、自分自身の知識、最新技術、及びこの開示を顧慮して、日常的にこのような治療的に有効な量を決定することができる。
本明細書では、用語「抗ウイルス薬」は、哺乳動物においてウイルスの形成及び/又は複製を阻害するために有効な薬剤を意味するものとし、限定するものではないが、哺乳動物内におけるウイルスの形成及び/又は複製に必要な宿主又はウイルスの機構のどちらかを妨害する薬剤が挙げられる。
【0023】
〔好ましい実施形態〕
以下の好ましい実施形態で本発明の化合物の基及び置換基を詳細に説明する。
X:
X-A:一実施形態では、XはOである。
X-B:別の実施形態では、XはSである。
本明細書で述べるXのいずれの及びそれぞれ個々の定義も本明細書で述べるR2、R3、R5及びR6のいずれの及びそれぞれ個々の定義と組み合わせうる。
R2:
Het-A:一実施形態では、R2はHetであり、Hetは、O、N及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有する5員若しくは6員ヘテロ環、又はO、N及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有する9員若しくは10員二環式ヘテロ多環であり;このときHetは、任意に1〜5個のR20置換基(R20は前記定義どおり)で置換されていてもよい。
Het-B:別の実施形態では、R2はHetであり、Hetは、1若しくは2個のNヘテロ原子を含有する5員若しくは6員芳香族ヘテロ環、又は1若しくは2個のNヘテロ原子を含有する9員若しくは10員二環式ヘテロ多環であり;このときHetは、任意に1〜3個のR20置換基(R20は前記定義どおり)で置換されていてもよい。
Het-C:別の実施形態では、R2は、下記基から選択されるHetであり;
【0024】
【化9】

【0025】
このときHetは、任意に1〜3個のR20置換基(R20は前記定義どおり)で置換されていてもよい。
Het-D:別の実施形態では、R2は下記式のHetであり;
【化10】

【0026】
このときHetは、任意に1〜3個のR20置換基(R20は前記定義どおり)で置換されていてもよい。
Het-E:別の実施形態では、R2は下記式のHetであり;
【化11】

【0027】
式中、R23は前記定義どおりのR20である。
R20-A:一実施形態では、R20は下記基:
a)ハロ、シアノ又はニトロ;
b)R7、-(C1-6)アルキレン-R7、-C(=O)-R7、-O-R7、-C(=O)-O-R7、-(C1-6)アルキレン-O-R7、-S-R7、-SO2-R7、-(C1-6)アルキレン-S-R7又は-(C1-6)アルキレン-SO2-R7
(ここで、R7は各場合独立にH、(C1-6)アルキル、(C2-6)アルケニル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、アリール及びHetから選択され;前記Hetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する5員若しくは6員ヘテロ環であり、又はHetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する9員若しくは10員ヘテロ多環であり;各Nヘテロ原子は独立に、かつ可能な場合、さらに酸素原子に結合してN-オキシド基を形成するように酸化状態で存在してよく、及び各Sヘテロ原子は独立に、かつ可能な場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;かつ
前記(C1-6)アルキルは任意に、-OH、-O-(C1-6)アルキル及びCOOHからそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;かつ
前記アリール及びHetはそれぞれ任意に、ハロ、シアノ、オキソ、イミノ、-OH、-O-(C1-6)アルキル、-NH2、-NH(C1-4)アルキル、-N((C1-4)アルキル)2、-NH-C(=O)(C1-4)アルキル、(C1-6)アルキル及びHet(ここで、該Hetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する5員又は6員ヘテロ環である)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);及び
c)-N(R8)R9、-(C1-6)アルキレン-N(R8)R9又は-(C1-6)アルキレン-C(=O)-N(R8)R9
(式中、R8は、各場合独立にH及び(C1-6)アルキルから選択されれ;かつ
R9は、各場合独立にR7、-SO2-R7、-C(=O)-R7、-C(=O)OR7及び-C(=O)N(R8)R7から選択され;このときR7とR8は前記定義どおりである)
から選択される。
【0028】
R20-B:別の実施形態では、R20は下記基:
a)ハロ又はシアノ;
b)R7、-(C1-6)アルキレン-R7、-C(=O)-R7、-(C1-6)アルキレン-O-R7、-SO2-R7、-(C1-6)アルキレン-S-R7又は-(C1-6)アルキレン-SO2-R7
(ここで、R7は各場合独立にH、(C1-6)アルキル、(C2-6)アルケニル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、アリール及びHetから選択され;前記Hetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する5員若しくは6員ヘテロ環であり、又はHetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する9員若しくは10員ヘテロ多環であり;各Nヘテロ原子は独立に、かつ可能な場合、さらに酸素原子に結合してN-オキシド基を形成するように酸化状態で存在してよく、及び各Sヘテロ原子は独立に、かつ可能な場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;かつ
前記(C1-6)アルキルは任意に、-OH、-O-(C1-6)アルキル及びCOOHからそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;かつ
前記アリール及びHetはそれぞれ任意に、ハロ、シアノ、オキソ、イミノ、-OH、-O-(C1-6)アルキル、-NH2、-NH(C1-4)アルキル、-N((C1-4)アルキル)2、-NH-C(=O)(C1-4)アルキル、(C1-6)アルキル及びHet(ここで、該Hetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する5員又は6員ヘテロ環である)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);及び
c)-(C1-6)アルキレン-N(R8)R9又は-(C1-6)アルキレン-C(=O)-N(R8)R9
(式中、R8は各場合独立にH及び(C1-6)アルキルから選択され;かつ
R9は各場合独立にR7、-SO2-R7、-C(=O)-R7、-C(=O)OR7及び-C(=O)N(R8)R7から選択され;このときR7とR8は前記定義どおりである)
から選択される。
R20-C:別の実施形態では、R20は下記基:
a)ハロ又はシアノ;
b)R7、-CH2-R7、-C(=O)-R7、-CH2-O-R7、-SO2-R7、-CH2-S-R7又は-CH2-SO2-R7
(ここで、R7は各場合独立にH、(C1-6)アルキル、(C2-6)アルケニル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、フェニル及びHetから選択され;前記Hetは下記基:
【0029】
【化12】

【0030】
から選択され;かつ
前記(C1-6)アルキルは任意に、-OH、-O-(C1-6)アルキル及びCOOHからそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;かつ
前記フェニル及びHetはそれぞれ任意に、ハロ、シアノ、オキソ、イミノ、-OH、-O-(C1-6)アルキル、-NH2、-NH(C1-4)アルキル、-N((C1-4)アルキル)2、-NH-C(=O)(C1-4)アルキル、(C1-6)アルキル及び下記式
【化13】

【0031】
で表される基からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);及び
c)-CH2-N(R8)R9又は-CH2-C(=O)-N(R8)R9
(式中、R8は各場合独立にH及び(C1-6)アルキルから選択され;かつ
R9は各場合独立にR7、-SO2-R7、-C(=O)-R7、-C(=O)OR7及び-C(=O)N(R8)R7から選択され;このときR7とR8は前記定義どおりである)
から選択される。
R20-D:別の実施形態では、R20は下記基:
b)-(C1-3)アルキレン-R7、-(C1-3)アルキレン-O-R7、-(C1-3)アルキレン-S-R7又は-(C1-3)アルキレン-SO2-R7
(式中、R7はHetであり;前記Hetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する5員若しくは6員ヘテロ環であり、又はHetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する9員若しくは10員ヘテロ多環であり;各Nヘテロ原子は独立に、かつ可能な場合、さらに酸素原子に結合してN-オキシド基を形成するように酸化状態で存在してよく、及び各Sヘテロ原子は独立に、かつ可能な場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;
このとき前記Hetは任意に、ハロ、シアノ、オキソ、イミノ、-OH、-O-(C1-6)アルキル、-O-(C1-6)ハロアルキル、(C3-7)シクロアルキル、-NH2、-NH(C1-4)アルキル、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル、-N((C1-4)アルキル)2、-NH-C(=O)(C1-4)アルキル、(C1-6)アルキル及びHetからそれぞれ独立に選択される1〜3個の置換基で置換されていてもよく、前記Hetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する5員又は6員へテロ環である);及び
c)-(C1-3)アルキレン-N(R8)R9(式中、
R8は各場合独立にH、(C1-6)アルキル及び(C3-7)シクロアルキルから選択され;かつ
R9はR7で、R7は前記定義どおりである)
から選択される。
R20-E:別の実施形態では、R20は下記基:
b)-CH2-R7、-CH2CH2-R7、-CH2-O-R7、-CH2-S-R7又は-CH2-SO2-R7
(式中、R7はHetであり;前記Hetは下記基:
【0032】
【化14】

【0033】
から選択され;かつ
前記Hetは任意に、ハロ、シアノ、オキソ、イミノ、-OH、-O-(C1-6)アルキル、-NH2、-NH(C1-4)アルキル、-N((C1-4)アルキル)2、-NH-C(=O)(C1-4)アルキル、(C1-6)アルキル及び下記式
【化15】

【0034】
で表される基からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);及び
c)-CH2-N(R8)R9(式中、
R8は各場合独立にH及び(C1-6)アルキルから選択され;かつ
R9はR7で、R7は前記定義どおりである)
から選択される。
従って、R2の実施形態の例を下表に示す。ここで、各置換基は前記定義に従って定義される。
【0035】

【0036】
R2-J:一実施形態では、R2は下記基:
【化16】

【0037】
【化17】

【0038】
から選択され;
又はR2は下記式:
【化18】

【0039】
の基であり、
式中、R23は下記基:
【化19】

【0040】
【化20】

【0041】
【化21】

【0042】
【化22】

【0043】
【化23】

【0044】
から選択される。
本明細書で述べるR2のいずれの及びそれぞれ個々の定義も本明細書で述べるX、R3、R5及びR6のいずれの及びそれぞれ個々の定義とも組み合わせうる。
R3:
R3-A:一実施形態では、R3はH、ハロ、(C1-4)アルキル、-O-(C1-4)アルキル及び-N((C1-4)アルキル)2から選択される。
R3-B:別の実施形態では、R3はH及びハロから選択される。
R3-C:別の実施形態では、R3はH又はFである。
R3-D:別の実施形態では、R3はHである。
本明細書で述べるR3のいずれの及びそれぞれ個々の定義も本明細書で述べるX、R2、R5及びR6のいずれの及びそれぞれ個々の定義とも組み合わせうる。
R5:
R5-A:一実施形態では、R5は(C1-6)アルキルである。
R5-B:別の実施形態では、R5はメチル又は1-メチルエチルである。
R5-C:別の実施形態では、R5は1-メチルエチルである。
R5-D:別の実施形態では、R5はHet、-COOH又は-C(=O)-N(R51)R52で置換されている(C1-4)アルキルであり、このとき前記Hetは、1〜4個のNヘテロ原子を含有する5員若しくは6員ヘテロ環であり、又はHetは、1〜4個のNヘテロ原子を含有する9員若しくは10員二環式ヘテロ多環であり;
かつR51がH又は(C1-6)アルキルであり、かつR52がH、(C1-6)アルキル、(C3-7)シクロアルキル、Het及びHet-(C1-3)アルキル-から選択され
(ここで、前記(C1-6)アルキルは任意に、-O(C1-6)アルキル及び-N((C1-6)アルキル)2からそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;
かつ前記Het及びHet-(C1-3)アルキル-のHet部分はそれぞれ独立に、N、O及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有する5員又は6員ヘテロ環であり、該Het及びHet-(C1-3)アルキル-はそれぞれ独立に、ハロ、オキソ、-OH、(C1-6)アルキル、(C1-6)ハロアルキル、-(C=O)(C1-6)アルキル、-N((C1-6)アルキル)2及び-NH(C=O)(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);
或いはR51とR52が、それらが結合しているNと一緒に結合して、任意にさらにN、O及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有してよい4員〜7員ヘテロ環を形成している(ここで、各Sヘテロ原子は独立に、かつ可能場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;
このとき前記ヘテロ環は任意に、ハロ、オキソ、-OH、(C1-6)アルキル、(C1-6)ハロアルキル、-(C=O)(C1-6)アルキル、-N((C1-6)アルキル)2及び-NH(C=O)(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい)。
R5-E:別の実施形態では、R5は、Het、-COOH又は-C(=O)-N(R51)R52で置換されている(C1-2)アルキルであり;ここで、前記Hetは下記基
【化24】

【0045】
から選択され;
かつR51がH又は(C1-6)アルキルであり、かつR52がH、(C1-4)アルキル、(C3-6)シクロアルキル、Het及びHet-(C1-3)アルキル-から選択され(ここで、
前記(C1-6)アルキルは任意に、-O(C1-4)アルキル及び-N((C1-4)アルキル)2からそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;
かつ前記Het及びHet-(C1-3)アルキル-のHet部分はそれぞれ独立に下記基
【化25】

【0046】
から選択され;
該Het及びHet-(C1-3)アルキル-はそれぞれ任意に、ハロ、オキソ、-OH、(C1-6)アルキル、(C1-6)ハロアルキル、-(C=O)(C1-6)アルキル、-N((C1-6)アルキル)2及び-NH(C=O)(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);
或いはR51とR52、それらが結合しているNと一緒に結合して、下記式:
【化26】

【0047】
から選択されるヘテロ環を形成している(ここで、
前記ヘテロ環は任意に、ハロ、オキソ、-OH、(C1-6)アルキル、(C1-6)ハロアルキル、-(C=O)(C1-6)アルキル、-N((C1-6)アルキル)2及び-NH(C=O)(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい)。
R5-F:別の実施形態では、R5は-CH2-C(=O)-N(R51)R52であり;
このときR51がH又は(C1-6)アルキルであり、かつR52がH、(C1-6)アルキル、(C3-7)シクロアルキル、Het及びHet-(C1-3)アルキル-から選択され(ここで、
前記(C1-6)アルキルは任意に、-O(C1-6)アルキル及び-N((C1-6)アルキル)2からそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;
かつ前記Het及びHet-(C1-3)アルキル-のHet部分はそれぞれ独立に、N、O及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有する5員又は6員ヘテロ環であり、該Het及びHet-(C1-3)アルキル-はそれぞれ任意に、ハロ、オキソ、-OH、(C1-6)アルキル、(C1-6)ハロアルキル、-(C=O)(C1-6)アルキル、-N((C1-6)アルキル)2及び-NH(C=O)(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);
或いはR51とR52が、それらが結合しているNと一緒に結合して、任意にさらにN、O及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有してよい5員又は6員ヘテロ環を形成している(ここで、各Sヘテロ原子は独立に、かつ可能場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;
このとき前記ヘテロ環は任意に、ハロ、オキソ、-OH、(C1-6)アルキル、(C1-6)ハロアルキル、-(C=O)(C1-6)アルキル、-N((C1-6)アルキル)2及び-NH(C=O)(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい)。
R5-G:一実施形態では、R5が-CH2-C(=O)-N(R51)R52であり、このときR51はH又は(C1-6)アルキルであり、かつR52はH又は(C1-6)アルキルである。
R5-H:別の実施形態では、R5は、任意に、(C1-6)アルキル、-OH、-COOH、-C(=O)-(C1-6)アルキル、-C(=O)-O-(C1-6)アルキル、-C(=O)-NH-(C1-6)アルキル、-C(=O)-N((C1-6)アルキル)2、-C(=O)-NH(C3-7)シクロアルキル、-C(=O)-N((C1-4)アルキル)(C3-7)シクロアルキル及び-SO2(C1-6)アルキルからそれぞれ独立に選択される1〜4個の置換基で置換されていてもよいHetである。
R5-I:別の実施形態では、R5は、O、N及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有する5員又は6員の飽和ヘテロ環であり、該ヘテロ環は任意に、(C1-4)アルキル、-C(=O)-(C1-4)アルキル、-C(=O)-O-(C1-4)アルキル、-C(=O)-NH-(C1-4)アルキル、-C(=O)-N((C1-4)アルキル)2、-C(=O)-NH(C3-7)シクロアルキル、-C(=O)-N((C1-4)アルキル)(C3-7)シクロアルキル及び-SO2(C1-4)アルキルからそれぞれ独立に選択される1〜4個の置換基で置換されていてもよい。
R5-J:別の実施形態では、R5はH、メチル、エチル、プロピル、1-メチルエチル、
【0048】
【化27】

【0049】
から選択される。
本明細書で述べるR5のいずれの及びそれぞれ個々の定義も本明細書で述べるX、R2、R3及びR6のいずれの及びそれぞれ個々の定義とも組み合わせうる。
R6:
R6-A:一実施形態では、R6は、任意に、ハロ、(C1-6)アルキル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、-OH、-SH、-O-(C1-4)アルキル及び-S-(C1-4)アルキルからそれぞれ独立に選択される1〜5個の置換基で置換されていてもよい(C3-7)シクロアルキルである。
R6-B:別の実施形態では、R6は、任意に、-OH及び(C1-4)アルキルからそれぞれ独立に選択される1〜3個の置換基で置換されていてもよいシクロヘキシルである。
R6-C:さらに別の実施形態では、R6は下記基から選択される。
【0050】
【化28】

【0051】
R6-D:さらに別の実施形態では、R6は下記基である。
【化29】

【0052】
R6-E:代替実施形態では、R6は、任意に、ハロ、(C1-6)アルキル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、-OH、-SH、-O-(C1-4)アルキル及び-S-(C1-4)アルキルからそれぞれ独立に選択される1〜5個の置換基で置換されていてもよいアリールである。
但し、R2が下記基:
【化30】

【0053】
から選択され;
XがOであり;R3がHであり;かつR5がHの場合、
R6は下記基でない。
【化31】

【0054】
R6-F:別の代替実施形態では、R6は、任意に、ハロ、(C1-4)アルキル、(C3-7)シクロアルキル及び-S-(C1-4)アルキルからそれぞれ独立に選択される1〜3個の置換基で置換されていてもよいフェニルである。
但し、R2が下記基:
【化32】

【0055】
から選択され;
XがOであり;R3がHであり;かつR5がHの場合、
R6は下記基でない。
【化33】

【0056】
R6-G:さらに別の代替実施形態では、R6は、任意に、F、Cl、Br、メチル、エチル、シクロプロピル及び-S-CH3からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよいフェニルである。
但し、R2が下記基:
【化34】

【0057】
から選択され;
XがOであり;R3がHであり;かつR5がHの場合、
R6は下記基でない。
【化35】

R6-H:さらに別の実施形態では、R6は下記基:
【0058】
【化36】

【0059】
から選択される。
但し、R2が下記基:
【化37】

【0060】
から選択され;
XがOであり;R3がHであり;かつR5がHの場合、
R6は下記基でない。
【化38】

【0061】
本明細書で述べるR6のいずれの及びそれぞれ個々の定義も本明細書で述べるX、R2、R3及びR5のいずれの及びそれぞれ個々の定義とも組み合わせうる。
本発明の下位概念の好ましい実施形態の例を下表に示す。ここで、各実施形態の各置換基は、前記定義に従って定義される。
【0062】

【0063】
(表続き)

【0064】
本発明の最も好ましい化合物は、表1及び2に列挙したそれぞれ単一化合物である。
一般に、化合物名又は構造に特有の立体化学又は異性形が特に示されていない限り、全ての互変異性体及び異性形並びにその混合物、例えば、個々の幾何異性体、立体異性体、エナンチオマー、ジアステレオマー、ラセミ体、立体異性体のラセミ若しくは非ラセミ混合物、ジアステレオマーの混合物、又は化学構造若しくは化合物の前記形態のいずれの混合物をも意図している。
当該技術分野では、ある化合物の生物学的及び薬理学的活性が該化合物の立体化学に敏感であることは周知である。従って、例えば、エナンチオマーは、多くの場合、薬物動態学的特性、例えば代謝、タンパク質結合性など、及び薬理学的特性、例えば、表示される活性のタイプ、活性、毒性の程度などの差異を含め、顕著に異なる生物学的活性を示す。従って、当業者は、一方のエナンチオマーが他方のエナンチオマーより富んでいるか又は他方のエナンチオマーから分離されている場合、より活性であるか、又は有益な効果を示すことが分かるだろう。さらに、当業者は、この開示及び当該技術分野の知識から、本発明の化合物のエナンチオマーを分離し、濃厚にし、又は選択的に調製する方法を知っているだろう。
純粋な立体異性体、例えばエナンチオマー及びジアステレオマー、又は所望のエナンチオマー過剰率(ee) 若しくはエナンチオマー純度の混合物の調製は、当業者に既知の(a)エナンチオマーの分離若しくは分割、若しくは(b)エナンチオ選択的合成、又はその組合せの多くの方法の1つ以上で達成される。これらの分割法は、一般的にキラル認識に頼り、例えば、キラル固定相を用いるクロマトグラフィー、エナンチオ選択的ホスト-ゲスト合成、酵素的及び非酵素的な動的分割、又は自発性エナンチオ選択的結晶化が挙げられる。該方法は、本明細書で援用される非特許文献9、10及び11に一般的に開示されている。さらに、エナンチオマーの過剰率又は純度の定量のための同様に周知な方法、例えば、GC、HPLC、CE、又はNMR、並びに絶対配置及び配座の割当てのための方法、例えば、CD ORD、X線結晶学、又はNMRがある。
【0065】
本発明の化合物は、C型肝炎ウイルスNS5B RNA依存性RNAポリメラーゼのインヒビターなので、C型肝炎ウイルスRNAの複製を阻害するために使用しうる。
本発明の化合物を実験室試薬又は研究試薬としても使用できる。例えば、本発明の化合物を正のコントロールとして用いてアッセイを確証することができ、例えば、細胞ベースアッセイ及びin vitro又はin vivoウイルス複製アッセイの代わりをしうる。
本発明の化合物をプローブとして用いて、限定するものではないが、ポリメラーゼの作用機序、種々の条件下でポリメラーゼによって受けたコンホメーション変化及びポリメラーゼに結合するか又はそうでなくてもポリメラーゼと相互作用するエンティティーとの相互作用といったC型肝炎ウイルスNS5Bポリメラーゼの研究をすることもできる。
プローブとして使用する本発明の化合物を該化合物を直接又は間接的に認識できる標識で標識して、該化合物を検出、測定かつ定量しうる。本発明の化合物で使うために想定される標識として、限定するものではないが、蛍光標識、化学発光標識、比色標識、酵素マーカー、放射性同位体、アフィニティータグ及び光反応基が挙げられる。
プローブとして使用する本発明の化合物を、受容体に対する強力なアフィニティーを利用して、リガンドが結合しているエンティティーを溶液から抽出できるアフィニティータグで標識することもできる。アフィニティータグとして、限定するものではないが、ビオチン又はその誘導体、ヒスチジンポリペプチド、ポリアルギニン、アミラーゼ糖成分又は特異性抗体で認識可能に定義されたエピトープが挙げられる。
さらに、プローブとして使用する本発明の化合物を、光で活性化すると、不活性基からフリーラジカル等の反応性種に変換される光反応基で標識しうる。光反応基として、限定するものではないが、光親和性標識、例えばベンゾフェノン及びアジド基が挙げられる。
さらに、本発明の化合物を用いて物質のウイルス汚染を処理又は阻止し、ひいては該物質(例えば、血液、組織、外科用設備及び衣服、実験室の設備及び衣服、並びに血液収集装置及び材料)に接触するようになる実験室又は医療職員若しくは患者のウイルス感染の危険を減らすことができる。
【0066】
〔医薬組成物〕
本発明の化合物をC型肝炎ウイルス感染症の治療が必要な哺乳動物に、治療的に有効な量の本発明の化合物又はその医薬的に許容しうる塩若しくはエステルと、1種以上の通常の無毒の医薬的に許容しうる担体、アジュバント又はビヒクルを含んでなる医薬組成物として投与することができる。本組成物の特有の処方は、該化合物の溶解度及び化学的性質、選択される投与経路及び標準的な医薬プラクティスによって決まる。本発明の医薬組成物を経口又は全身投与することができる。
経口投与では、本化合物、又はその医薬的に許容しうる塩若しくはエステルを経口に許容しうる剤形でも処方しうる。該剤形として、限定するものではないが、水性懸濁液及び溶液、カプセル剤又は錠剤が挙げられる。全身投与では、限定するものではないが、皮下、皮内、静脈内、筋肉内、動脈内、滑膜内、胸骨内、くも膜下腔内、及び病巣内注射又は注入法による投与が挙げられ、医薬的に許容しうる無菌水性ビヒクル中の本化合物、又はその医薬的に許容しうる塩若しくはエステルの溶液として使うことが好ましい。
医薬的に許容しうる担体、アジュバント、ビヒクル、賦形剤及び添加剤並びに種々の投与態様に合わせて医薬組成物を処方する方法は当業者に周知であり、かつ本明細書で援用する非特許文献12及び13等の医薬テキストに記載されている。
投与量は、既知因子によって変わり、該因子としては、限定するものではないが、利用する特定化合物の活性と薬物動態学的特性及びその態様、投与の時間と経路;レシピエントの年齢、食餌、性別、体重及び全身の健康状態;症状の性質及び程度;該感染症の重症度及び経過;同時治療の種類;治療の頻度;所望効果;並びに治療医師の判断が挙げられる。一般に、如何なる有害又は有毒な副作用をも引き起こすことなく、一般に抗ウイルス的に有効な結果を与えるであろう用量レベルで本化合物を投与するのが最も望ましい。
活性成分の1日の用量は約0.01〜約200mg/kg(体重)であると予想され、約0.1〜50mg/kgの用量が好ましい。典型的に、この発明の医薬組成物は、1日約1〜約5回投与され、或いは連続注入として投与される。このような投与を慢性又は急性療法として使用できる。単体材料と併用して単一剤形を製造しうる活性成分の量は、治療する宿主と個々の投与態様によって変わるだろう。典型的製剤は、約5%〜約95%の活性化合物(w/w)を含むだろう。好ましくは、該製剤は、約20%〜約80%の活性化合物を含有する。
【0067】
〔併用療法〕
本発明の化合物、又はその医薬的に許容しうる塩若しくはエステルを少なくとも1種の追加の抗ウイルス薬と併用する併用療法が考慮される。追加薬剤をこの発明の化合物と併用して、単一剤形を作製しうる。或いは、これらの追加薬剤を、多剤剤形の一部として別々に、同時又は逐次投与しうる。
この発明の医薬組成物が本発明の化合物、又はその医薬的に許容しうる塩若しくはエステルと、1種以上の追加の抗ウイルス薬との組合せを含む場合、本化合物と追加薬剤の両方が、単剤療法で普通に投与される用量の約10〜100%、さらに好ましくは約10〜80%の用量レベルで存在すべきである。本発明の化合物と追加薬剤との間で相乗的に相互作用する場合、単剤療法で普通に投与される用量に比し、該組合せ中のいずれか又は全ての活性薬の用量を減らしてよい。
このような併用療法で使うために想定される抗ウイルス薬は、哺乳動物内でのウイルスの形成及び/又は複製を阻害するのに有効な薬剤(化合物又は生物学的製剤)を包含し、限定するものではないが、哺乳動物内でのウイルスの形成及び/又は複製に必要な宿主又はウイルスの機構のどちらかを妨害する薬剤が挙げられる。別の抗-HCV薬;HIVインヒビター:HAVインヒビター;及びHBVインヒビターから該薬剤を選択できる。
他の抗-HCV薬は、C型肝炎に関連する症状又は疾患の進行を減退又は阻止するために有効な当該薬剤を包含する。このような薬剤として、限定するものではないが、免疫調節薬、HCV NS3プロテアーゼのインヒビター、HCVプロテアーゼの他のインヒビター、HCVのライフサイクルにおける別の標的のインヒビター及び他の抗-HCV薬(限定するものではないが、リバビリン、アマンタジン、レボビリン(levovirin)及びビラミジン(viramidine)が挙げられる)が挙げられる。
免疫調節薬は、哺乳動物の免疫系反応を高めるか又は増強するのに有効な当該薬剤(化合物又は生物学的製剤)を包含する。免疫調節薬として、限定するものではないが、イノシン一リン酸デヒドロゲナーゼインヒビター、例えばVX-497(メリメポジブ(merimepodi), Vertex Pharmaceuticals)、クラスIインターフェロン、クラスIIインターフェロン、コンセンサスインターフェロン、アシアロ-インターフェロン、ペグ化インターフェロン及び複合インターフェロンが挙げられる。複合インターフェロンとしては、限定するものではないが、他のタンパク質(ヒトアルブミンが含まれるが、これに限定されない)と複合したインターフェロンが挙げられる。クラスIインターフェロンは、全てI型受容体に結合する1群のインターフェロンであり(天然及び合成的に生成されるクラスIインターフェロンの両方を含む)、クラスIIインターフェロンは、全てII型受容体に結合する。クラスIインターフェロンの例として、限定するものではないが、α-、β-、δ-、ω-、及びτ-インターフェロンが挙げられ、クラスIIインターフェロンの例として、限定するものではないが、γ-インターフェロンが挙げられる。
【0068】
HCV NS3プロテアーゼは、哺乳動物内のHCV NS3プロテアーゼの機能を阻害するのに有効な薬剤(化合物又は生物学的製剤)を包含する。HCV NS3プロテアーゼのインヒビターとして、限定するものではないが、特許文献2〜20(全てBoehringer Ingelheimによる)、特許文献21〜30(全てBMSによる)、特許文献31〜34(全てEnantaによる)、特許文献35(Intermune)、特許文献36〜57(全てScheringによる)に記載される当該化合物;及び候補製品VX-950、ITMN-191及びSCH-503034が挙げられる。
HCVポリメラーゼのインヒビターは、HCVポリメラーゼの機能を阻害するのに有効な薬剤(化合物又は生物学的製剤)を包含する。該インヒビターには、限定するものではないが、HCV NS5Bポリメラーゼの非-ヌクレオシド及びヌクレオシドインヒビターが含まれる。HCVポリメラーゼのインヒビターの例として、限定するものではないが、特許文献58〜65(全てBoehringer Ingelheimによる)、特許文献66(Japan Tobacco)、特許文献67(Japan Tobacco)、特許文献68(BMS)、特許文献69(Neogenesis)、特許文献70(IRBM)、特許文献71(Genelabs)、特許文献72(Japan Tobacco)、特許文献73(Japan Tobacco)、及び特許文献74(Shionogi)に記載される当該化合物;並びに候補製品XTL-2125、HCV 796、R-1626、R-7128、NM 283、VCH-759、GSK625433及びPF868554挙げられる。
【0069】
HCVのライフサイクルの別の標的のインヒビターは、HCV NS3プロテアーゼ又はHCVポリメラーゼの機能を阻害する以外にHCVの形成及び/又は複製を阻害するのに有効な薬剤(化合物又は生物学的製剤)を包含する。該薬剤は、HCVの形成及び/又は複製に必要な宿主又はHCVウイルスの機構のどちらかを妨害しうる。HCVのライフサイクルの別の標的のインヒビターとして、限定するものではないが、侵入インヒビター、ヘリカーゼ、NS2/3プロテアーゼ及び配列内リボース侵入部位(IRES)から選択される標的を阻害する薬剤並びに他のウイルス標的(限定するものではないが、NS5Aタンパク質及びNS4Bタンパク質が挙げられる)の機能を妨害する薬剤が挙げられる。
患者が、C型肝炎ウイルスと1種以上の他のウイルスに同時感染することが起こりうる。このような他のウイルスとして、限定するものではないが、ヒト免疫不全ウイルス(HIV)、A型肝炎ウイルス(HAV)及びB型肝炎ウイルス(HBV)が挙げられる。従って、本発明の化合物と、少なくとも1種のHIVインヒビター、HAVインヒビター及びHBVインヒビターとを共投与することによって、このような同時感染を治療するための併用療法も考えられる。
HIVインヒビターは、HIVの形成及び/又は複製を阻害するのに有効な薬剤(化合物又は生物学的製剤)を包含する。これには、限定するものではないが、哺乳動物内におけるHIVの形成及び/又は複製に必要な宿主又はウイルスの機構のどちらかを妨害する薬剤が含まれる。HIVインヒビターとして、限定するものではないが、以下のものが挙げられる。
・NRTI(ヌクレオシド又はヌクレオチド逆転写酵素インヒビター;限定するものではないが、ジドブジン、ジダノシン、ザルシタビン、スタブジン、ラミブジン、エムトリシタビン、アバカビル、及びテノフォビルが挙げられる);
・NNRTI(非-ヌクレオシド逆転写酵素インヒビター;限定するものではないが、ネビラピン、デラビルジン、エファビレンツ、エトラビリン(etravirine)、リルピビリン(rilpivirine)及びBILR 355が挙げられる);
・プロテアーゼインヒビター(限定するものではないが、リトナビル、チプラナビル、サキナビル、ネルフィナビル、インジナビル、アンプレナビル、ホスアンプレナビル、アタザナビル、ロピナビル、ダルナビル及びブレカナビル(brecanavir)が挙げられる);
・侵入インヒビター(限定するものではないが、以下の薬剤:
・CCR5アンタゴニスト(限定するものではないが、マラビロク(UK-427,857)及びTAK-652が挙げられる)、
・CXCR4アンタゴニスト(限定するものではないが、AMD-11070が挙げられる)、
・融合インヒビター(限定するものではないが、エンフュヴァタイド(T-20)が挙げられる)及び
・その他(限定するものではないが、BMS-488043が挙げられる)
が挙げられる);
・インテグラーゼインヒビター(限定するものではないが、MK-0518、c-1605、BMS-538158及びGS 9137が挙げられる);
・TATインヒビター;
・成熟インヒビター(限定するものではないが、ベビリマット(bevirimat)(PA-457)が挙げられる);及び
・免疫調節薬(限定するものではないが、レバミゾールが挙げられる)。
HAVインヒビターは、HAVの形成及び/又は複製を阻害するのに有効な薬剤(化合物又は生物学的製剤)を包含する。これには、限定するものではないが、哺乳動物内におけるHAVの形成及び/又は複製に必要な宿主又はウイルスの機構のどちらかを妨害する薬剤が含まれる。HAVインヒビターとして、限定するものではないが、A型肝炎ワクチンが挙げられる。
HBVインヒビターは、哺乳動物内におけるHBVの形成及び/又は複製を阻害するのに有効な薬剤(化合物又は生物学的製剤)を包含する。これには、限定するものではないが、哺乳動物内におけるHBVの形成及び/又は複製に必要な宿主又はウイルスの機構のどちらかを妨害する薬剤が含まれる。HBVインヒビターとして、限定するものではないが、HBVウイルスDNAポリメラーゼを阻害する薬剤及びHBVワクチンが挙げられる。
【0070】
従って、一実施形態によれば、この発明の医薬組成物は、治療的に有効な量の1種以上の抗ウイルス薬を含む。
さらなる実施形態は、1種以上の抗ウイルス薬と少なくとも1種の他の抗-HCV薬を含む、本発明の医薬組成物を提供する。
この発明の医薬組成物のさらに特定の実施形態によれば、前記少なくとも1種の他の抗-HCV薬は、少なくとも1種の免疫調節薬を含む。
この発明の医薬組成物の別のさらに特定の実施形態によれば、前記少なくとも1種の他の抗-HCV薬は、少なくとも1種の、HCVポリメラーゼの他のインヒビターを含む。
この発明の医薬組成物のさらに別のさらに特定の実施形態によれば、前記少なくとも1種の他の抗-HCV薬は、少なくとも1種の、HCV NS3プロテアーゼのインヒビターを含む。
この発明の医薬組成物のさらに別のさらに特定の実施形態によれば、前記少なくとも1種の他の抗-HCV薬は、少なくとも1種の、HCVのライフサイクルの別の標的のインヒビターを含む。
本明細書で引用した全ての文書は、あたかも各文書を個々に本発明に組み入れたかのように、参考文献として本発明に組み入れられる。さらに、発明の上記教示において、当業者は、本発明に一定の変更又は修正を生じさせることができ、それでもこれらの均等物は、本出願の添付請求項によって定義される本発明の範囲内であることが認められる。
【0071】
〔方法論及び合成〕
この発明の式(I)の化合物の合成は、下記スキーム1及び2(R2、X、R3、R5及びR6は本明細書の定義どおり)に概要が示される一般手順に従って好都合に達成される。本発明の化合物を調製しうる他の手順は技術上周知であり、或いは以下の実施例で述べられる。
【0072】
スキーム1:
【化39】

【0073】
式(II)(式中、R3aは本明細書の定義どおりのR3であるか又は本明細書の定義どおりのR3に変換しうる前駆基であり、Rはエステル保護基、例えばメチル又はエチルであり、LGは脱離基、例えばF又はClである)の中間体は商業的に入手可能であり、或いは技術上周知又は以下の実施例で述べる手順によって調製されうる。基R3aが前駆基である場合、技術上周知又は以下の実施例で述べる手順によって、式(I)の化合物の形成前の該スキームのいずれの化学的に好都合な中間段階においても、本明細書の定義どおりのR3に該基を変換することができる。
技術上周知又は以下の実施例で述べる反応条件を利用する、中間体(II)と式R2X-H(式中、R2及びXは本明細書の定義どおり)の反応物のカップリングが式(III)の中間体を与える。該反応条件として、限定するものではないが、SNAr反応条件及びウルマン(Ullman)カップリング条件が挙げられる。当業者は、本発明の化合物のR2基が、その置換パターンにおいて異なり、かつ該スキームのいずれの化学的に好都合な中間段階でも、技術上周知又は以下の実施例で述べる手順によって、あるR2基を別のR2基に変換しうると考えられることを認めるだろう。
周知の条件下で中間体(III)のニトロ基を還元して式(IV)の中間体、又は塩酸などの酸とのその塩を与える。技術上周知のいずれの適切な反応(限定するものではないが、アルキル化及び還元的アミノ化が挙げられる)によっても、式(IV)の中間体のアミノ基にR5基を付加させて、式(V)の中間体を与えうる。還元的アミノ化反応は式(IV)の中間体を、適宜置換されたアルデヒド若しくはケトン又はその適切な誘導体と反応させた後、ナトリウムトリアセトキシボロヒドリドで処理することによって好都合に行われる(非特許文献14参照)。アルデヒド及びケトンの適切な誘導体は技術上周知であり、限定するものではないが、エノールエーテル等が挙げられる。アルデヒド、ケトン、又はその適切な誘導体は商業的に入手可能であり、或いは技術上周知又は以下の実施例で述べる手順によって得られる。商業的に入手可能であるか或いは技術上周知又は以下の実施例で述べる手順によって得られる適切なアシル化剤で中間体(V)をアシル化する。次に、技術上周知又は以下の実施例で述べる手順によってエステル保護基Rを加水分解して式(I)の化合物を与える。
【0074】
これとは別に、式(IV)の中間体のアミノ基を前述したようにアシル化して式(VI)の中間体を与えうる。技術上周知又は以下の実施例で述べる手順による式(VI)の中間体のアミド窒素原子のアルキル化後、前述したとおりのエステル保護基の加水分解が式(I)の化合物を与える。
当業者は、本発明の化合物のR5及びR6基が、その置換パターンにおいて異なり、かつ該スキームのいずれの化学的に好都合な中間段階でも、技術上周知又は以下の実施例で述べる手順によって、あるR5基を別のR5基に変換しうるか、或いは、あるR6基を別のR6基に変換しうることが考えられることを認めるだろう。
これとは別に、以下のスキーム2に概要が示される手順によって、式(I)の化合物の調製を達成しうる。ここで、R2、X、R3、R5及びR6は本明細書の定義どおりであり、Rはエステル保護基、例えばメチル又はエチルであり、PGは、当業者に周知のXH官能に適した脱離基であり、限定するものではないが、ベンジル基が挙げられる。
【0075】
スキーム2:
【化40】

【0076】
式VIIの中間体は商業的に入手可能であり、或いは技術上周知又は以下の実施例で述べる手順によって調製されうる。ニトロ基のアミノ基への還元並びにR5及び-C(=O)R6基の導入を上述したように達成して式(XI)の中間体を得る。技術上周知又は以下の実施例で述べる手順でXH基を脱保護し、かつ結果として生じたフリーなフェノール又はチオールを、技術上周知又は以下の実施例で述べる手順を用いて式R2-LGの反応物(式中、LGは脱離基、例えばF又はClである)にカップリングさせることによって、式(XI)の中間体を式(I)の化合物に変換する。このような手順として、限定するものではないが、SNAr反応及びウルマンカップリング反応が挙げられる。最後に、前述したようにエステルを加水分解で脱保護する。
【実施例】
【0077】
本発明の他の特徴は、本発明の原理を例として実証する以下の非限定例から明らかになるだろう。
当業者には周知なように、反応化合物を空気又は湿気から保護する必要がある場合、不活性な雰囲気(窒素又はアルゴンが挙げられるが、これに限定されない)下で反応を行う。摂氏度(℃)で温度を与える。溶液のパーセンテージ及び比は、特に断らない限り、体積対体積の関係で表す。非特許文献15の手順に従ってシリカゲル(SiO2)上でフラッシュクロマトグラフィーを行う。エレクトロスプレー質量分析法を利用して質量スペクトル分析を記録する。CombiscreenTM ODS-AQ C18逆相カラム、YMC、50×4.6mm内径、5μM、220nMで120Å、下表に示す線形勾配による溶出(溶媒AはH2O中0.06%のTFAである;溶媒BはCH3CN中0.06%のTFAである)を用いて標準条件下で分析用HPLCを行う。
【0078】

【0079】
本明細書で使用する略語又は記号として以下のものが挙げられる。
Ac:アセチル;
AcCl:塩化アセチル;
AcOH:酢酸;
Ac2O:無水酢酸;
BINAP:2,2'-ビス(ジフェニルホスフィノ)-1,1'-ビナフチル;
Bn:ベンジル(フェニルメチル);
BnBr:臭化ベンジル;
BOC or Boc:tert-ブチルオキシカルボニル;
Bu:ブチル;
n-BuOAc:酢酸n-ブチル
DBU:1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン;
DCE:ジクロロエタン;
DCM:ジクロロメタン;
DIEA:ジイソプロピルエチルアミン;
DMAP:4-ジメチルアミノピリジン;
DME:ジメトキシエタン;
DMF:N,N-ジメチルホルムアミド;
DMSO:ジメチルスルホキシド;
EC50:50%有効濃度;
EEDQ:2-エトキシ-1-エトキシカルボニル-1,2-ジヒドロキノリン;
eq.:モル当量;
Et:エチル;
Et3N:トリエチルアミン;
Et2O:ジエチルエーテル;
EtOAc:酢酸エチル;
EtOH:エタノール;
【0080】
HPLC:高速液体クロマトグラフィー;
IC50:50% 阻害濃度;
iPr又はi-Pr:1-メチルエチル(イソ-プロピル);
Me:メチル;
MeCN:アセトニトリル;
MeI:ヨードメタン;
MeOH:メタノール;
MS:質量分析(MALDI-TOF:マトリックス支援レーザー脱離イオン化-飛行時間型(Matrix Assisted Laser Desorption Ionization-Time of Flight)、FAB:高速原子衝撃(Fast Atom Bombardment));
NIS:N-ヨードスクシンアミド;
NMP:N-メチルピロリドン;
NMR:核磁気共鳴分光法;
Ph:フェニル;
PG:保護基;
Pr:プロピル;
RT:室温(約18℃〜25℃);
TBTU:O-ベンゾトリアゾール-1-イル-N,N,N',N'-テトラメチルウロニウムテトラフルオロボレート;
tert-ブチル又はt-ブチル:1,1-ジメチルエチル;
TFA:トリフルオロ酢酸;
THF:テトラヒドロフラン;
TLC:薄層クロマトグラフィー。
【0081】
(実施例1A)
中間体1a9の調製
【化41】

【0082】
工程1:
MeOH(500mL)中の5-ヒドロキシ-2-ニトロ安息香酸1a1(50g,0.273mol)の混合物にSOCl2(40mL,65.2g,0.55mol)を30分にわたって滴加し、混合物を2時間加熱して還流させる。過剰のSOCl2(20mL,32.6g,0.27mol)を慎重に加えて加熱還流を一晩続ける。さらにSOCl2(20mL,32.6g,0.27mol)を加えて加熱還流を1時間続ける。反応混合物を室温に冷まして減圧下で濃縮する。残留物をEtOAc(600mL)で希釈し、飽和NaHCO3水溶液と食塩水で洗浄し、MgSO4上で乾燥させ、ろ過し、濃縮乾固させる。CH2Cl2とヘキサンから固体としてメチルエステル1a2を回収する。
工程2:
アセトン(500mL)中の化合物1a2(51.2g,0.26mol)、無水K2CO3(150g,1.09mol)及びPhCH2Br(39mL,56g,0.33mol)の混合物を室温で一晩撹拌する。混合物をろ過してろ液を濃縮し、EtOAc(1.5L)で希釈し、水と食塩水で洗浄し、MgSO4上で乾燥させ、ろ過し、濃縮乾固させる。化合物1a3をEtOAcとヘキサンから回収する。
工程3:
エタノール(1.2L)中の化合物1a3(68.4g,0.24mol)の撹拌混合物にFe粉末(150g,2.7mol)を添加後AcOH(65mL)を加える。混合物を4時間加熱して還流させてから、さらにFe粉末(75g,1.3mol)とAcOH(30mL)を加えて加熱還流を1.5時間続ける。混合物をろ過し、固体とろ液を別々に処理する。
固体を飽和NaHCO3水溶液及びEtOAcと混合し、固体NaHCO3を塩基性pHが得られるまで加える。混合物をCeliteTMでろ過してEtOAcですすぐ。水層をEtOAcで2回抽出し(2×1L)、有機層を混ぜ合わせる。
ろ液を減圧下で濃縮し、残留物をEtOAc(1L)で希釈して飽和NaHCO3水溶液を加える。混合物に固体NaHCO3をpHが塩基性になるまで加える。混合物をCeliteTMでろ過し、EtOAcですすぐ。
上記の固体及びろ液部分の処理から得られた有機相を混ぜ合わせてから食塩水で洗浄し、MgSO4上で乾燥させ、濃縮乾固させ、残留物をCH2Cl2とヘキサンから回収する。回収した残留物(46.7g,0.18mol)のEt2O(400mL)中の撹拌混合物にEt2O中の2M HCl(180mL,0.38mol)を加える。混合物を室温で2時間撹拌し、ろ過で化合物1a4を収集する。
工程4:
非特許文献16から使用手順を適合させる。化合物1a4(30g,0.1mol)とCH2Cl2(600mL)の混合物に2-メトキシプロペン(36mL,27g,0.38mol)を添加後、NaBH(OAc)3(43.2g,0.2mol)を加える。混合物をRTで7時間撹拌し、EtOAcで希釈し、飽和NaHCO3水溶液と食塩水で洗浄し、MgSO4上で乾燥させ、濃縮乾固させる。化合物1a5をEtOAcとヘキサンから回収する。
【0083】
工程5:
Ar雰囲気下で室温にて化合物1a6(43.4g,305mmol)と無水CH2Cl2(400mL)の混合物にCH2Cl2(305mL)中の(COCl)2(53.2mL,610mmol)を室温で1時間にわたって滴加する。混合物を室温で1時間撹拌し、無水DMF(1mL)を滴加する。混合物をRTで一晩撹拌し、減圧下で濃縮する。残留物をペンタンで希釈してろ過する。ろ液を2回減圧下で濃縮し、ペンタンで希釈してろ過してから減圧下で濃縮して酸塩化物1a7を得る。
工程6:
無水ピリジン(1.5L)中の化合物1a5(99.6g,0.32mol)の混合物に化合物1a7(100mL,100g,0.62mol)とDMAP(3.8g,0.03mol)を加える。混合物を60℃で一晩撹拌し、減圧下で濃縮する。残留物をEtOAc(3L)で希釈し、2M HCl水溶液(4×1L)、飽和NaHCO3水溶液(6×500mL)及び食塩水で洗浄し、MgSO4上で乾燥させ、ろ過し、濃縮乾固させて化合物1a8を得る。
工程7:
化合物1a8(130g,0.3mol)、MeOH(0.6L)及びEtOAc(1.5L)の混合物をAr下で慎重に10% Pd/C(15g)に加える。アルゴンを10分間撹拌しながら混合物じゅうに泡立たせてからH2を混合物中に泡立たせて撹拌を室温で8時間続ける。混合物をCeliteTMでろ過し、ろ液を減圧下で濃縮する。化合物1a9をヘキサンから収集する。
【0084】
(実施例1B)
中間体1b3の調製
【化42】

【0085】
工程1:
無水ピリジン(35mL)中の化合物1a4(実施例1A)(2.0g,6.8mmol)の混合物に化合物1a7(実施例1A)(1.65mL,10.2mmol)とDMAP(82mg,0.67mmol)を加える。混合物を50℃で1時間撹拌し、減圧下で濃縮する。残留物をEtOAc(300mL)で希釈し、2M HCl水溶液(5×200mL)、飽和NaHCO3水溶液(6×200mL)及び食塩水(200mL)で洗浄し、MgSO4上で乾燥させ、ろ過し、濃縮する。化合物1b1をDCM/ヘキサンから回収する。
工程2:
氷-水浴で冷却した化合物1b1(2.0g,5.24mmol)と無水DMF(30mL)の混合物にNaH(60%,0.25g,10.5mmol)を加えて混合物を40分撹拌する。CH3I(0.9mL,14.5mmol,2.8当量)を加えて混合物を室温で一晩撹拌する。混合物をEtOAc(600mL)で希釈し、飽和NH4Cl水溶液(3×300mL)、飽和NaHCO3水溶液(300mL)及び食塩水(300mL)で洗浄し、MgSO4上で乾燥させ、ろ過して濃縮する。粗生成物をISCO CombiFlashカラム(SiO2,ヘキサン/EtOAc:10/0→5/5)で精製して化合物1b2を得る。
工程3:
無水MeOH(33mL)と無水EtOAc(83mL)中の化合物1b2(2.07g,5.24.mmol)の混合物をAr雰囲気下で慎重にPd/C(10%,0.23g)に加える。Arを混合物じゅうに2分泡立たせてから室温で2.5時間撹拌しながらH2を混合物じゅうに泡立たせる。混合物をCeliteTMでろ過し、ろ液を濃縮する。固体フェノール1b3をジエチルエーテル/ヘキサン混合物(1/9,100mL)から得る。
【0086】
以下の実施例の方法を用いて、中間体1b3を式(I)の化合物に変換できる。
(実施例2A)
化合物1001(表1)の調製
【化43】

【0087】
フェノール1a9(実施例1A)(20mg,0.06mmol)を4-ヒドロキシテトラヒドロピラン(0.08mmol)及びトリフェニルホスフィン(20mg,0.08mmol)とTHF(1mL)中で混ぜ合わせる。ジイソプロピルアゾジカルボキシレート(0.02mL,0.10mmol)を加えて混合物を周囲温度で一晩撹拌する。NaOH水溶液(10N,0.06mL,0.6mmol)、水(0.06mL)及びメタノール(0.4mL)を加えて混合物を50℃に温めて2.5時間撹拌する。分取用HPLCで精製して化合物1001(表1)を得る。
【0088】
(実施例2B)
化合物1003(表1)の調製
【化44】

【0089】
フェノール1a9(実施例1A)(20mg,0.06mmol)を3-トリフルオロメチル-4-クロロピリジン(16mg,0.07mmol)及びK2CO3(31mg,0.22mmol)とDMSO(0.5mL)中で混ぜ合わせる。混合物を100℃に加熱して24時間撹拌する。NaOH水溶液(5N,0.12mL,0.6mmol)を加えて混合物を55℃に温めて1時間撹拌する。混合物をAcOHで酸性にして分取用HPLCで精製して化合物1003(表1)を得る。
【0090】
(実施例2C)
化合物1031(表1)の調製
【化45】

【0091】
DCM中のフェノール1a9(実施例1A)(60mg,0.18mmol)、3-チオフェンボロン酸(46mg,0.36mmol)、Cu(OAc)2(33mg,0.18mmol)、Et3N(0.13mL,0.90mmol)及び4Åの分子ふるい(50mg)の混合物を大気に開放しながら20時間撹拌する。混合物をEtOAcで希釈し、0.2NのHCl水溶液、飽和NaHCO3水溶液及び食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過して濃縮する。残留物をDMSO(4mL)に溶かしてNaOH水溶液(2.5N,1.0mL,2.5mmol)を加える。混合物を周囲温度で2時間撹拌してからAcOHで酸性にして分取用HPLCで精製して化合物1031(表1)を単離する。
【0092】
(実施例2D)
化合物2011(表2)の調製
【化46】

【0093】
工程1:
化合物2d1(39.01g,239mmol)と無水DMF(800mL)の混合物にAr下でN-ヨードスクシンイミド(4.89g,244mmol)と無水K2CO3(33.72g,244mmol)を加えて混合物を60℃で3時間撹拌する。混合物を周囲温度に冷まし、ろ過し、減圧下で濃縮する。残留物をDCM(1L)に溶かし、有機相を食塩水で洗浄する。2MのHClを添加して水相をpH 4に調整してからDCM(1L)で抽出する。混ぜ合わせた有機抽出液を食塩水(2L)で洗浄し、Na2SO4上で乾燥させる。混合物を約300mLに濃縮して冷蔵庫で一晩冷却する。沈殿した固体をろ過で除去し、乾燥させてヨウ化アリール2d2を得る。
工程2:
化合物2d2(115.7g,400mmol)とPhPOCl2(668.6g,343mmol)の混合物をN2下で136℃にて一晩撹拌してから室温に冷まして3Lの砕氷にゆっくり加える。水性混合物をpH 6に調整してろ過する。水性ろ液をDCM(3L)で抽出してから有機相を飽和NaHCO3と食塩水で洗浄し、Na2SO4上で乾燥させ、ろ過し、濃縮して化合物2d3を得る。
工程3:
化合物1a9(実施例1A)(62.7g,0.19mol)、化合物2d3(66.7g,0.22mol)、無水K2CO3(65g,0.47mol)及び無水DMSO(250mL)の混合物を100℃で2時間加熱する。混合物をRTに冷まし、ろ過して固体をEtOAcで洗浄する。ろ液をEtOAc(4L)で希釈し、飽和NH4Clと食塩水で洗浄し、MgSO4上で乾燥させ、濃縮する。残留物をシリカゲル上フラッシュクロマトグラフィーで精製して(95:5ヘキサン/EtOAc→7:3ヘキサン/EtOAc)ビアリールエーテル2d4を得る。
工程4:
化合物2d4(125mg,0.21mmol)、THF(6.0mL)、MeOH(3.0mL)及びH2O(1.0mL)の混合物にLiOH(5N,300μL,1.5mmol)を0℃で加える。混合物を0℃で15分反応させてから室温で一晩撹拌する。混合物をEtOAcで希釈し、1N HClで酸性にし、有機抽出物を水と食塩水で洗浄し、乾燥させ(MgSO4)、濃縮して化合物2011を得る。
【0094】
(実施例2E)
化合物1008(表1)の調製
【化47】

【0095】
工程1:
DMF(1mL)中の化合物2e1(64mg,0.30mmol)、モルフォリン(0.027mL,0.31mmol)及びトリエチルアミン(0.050mL,0.36mmol)の混合物を周囲温度で一晩撹拌する。次に混合物をEtOAcで希釈し、引き続き水(4×)と食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過かつ濃縮して中間体2e2を得る。
工程2:
実施例2Bの手順を用いて中間体2e2とフェノール1a9(実施例1A)をカップリングさせて化合物1008(表1)を合成する。
【0096】
(実施例2F)
化合物1010(表1)の調製
【化48】

【0097】
工程1:
DMF(1mL)中の化合物2e1(実施例2E)(32mg,0.15mmol)、4-ピリジルボロン酸(18mg,0.15mmol)、Cs2CO3(72mg,0.22mmol)及びPd(PPh3)4(9mg,0.01mmol)の混合物を脱気して100℃で一晩加熱する。混合物を水中に注ぎ、EtOAcで3回抽出する。合わせた有機抽出物を水(4×)と食塩水で洗浄し、MgSO4で乾燥させてからシリカゲルの短パッドに通して過剰のEtOAcで溶出する。濃縮後、粗生成物をフラッシュクロマトグラフィーで精製して(15→50% EtOAc-ヘキサン)化合物2f1を得る。
工程2:
実施例2Bの手順を用いて中間体2f1とフェノール1a9(実施例1A)をカップリングさせて化合物1010(表1)を合成する。
【0098】
(実施例3A)
化合物1028(表1)の調製
【化49】

【0099】
DMSO(1mL)中のフェノール1a9(実施例1A)(60mg,0.18mmol)、化合物3a1(22mg,0.15mmol)及びK2CO3(50mg,0.36mmol)の混合物を100℃で20時間撹拌する。モルフォリン(0.031mL,0.36mmol)を加えて混合物を100℃でさらに20時間撹拌する。この混合物を50℃に冷ましてNaOH水溶液(2.5N,0.72mL,1.8mmol)を加える。1時間後、混合物をTFAで酸性にし、分取用HPLCで精製して化合物1028(表1)を得る。
【0100】
(実施例3B)
化合物1007(表1)の調製
【化50】

【0101】
工程1:
フェノール1a9(実施例1A)(200mg,0.60mmol)と化合物3b1(90mg,0.72mmol)をDMSO(2mL)中で混ぜ合わせる。無水K2CO3(200mg,1.5mmol)を加えて混合物を100℃で1時間撹拌する。さらに化合物3b1(50mg,0.4mmol)を加えて撹拌を100℃で45分続ける。混合物を周囲温度に冷まし、EtOAcで希釈し、水(×2)と食塩水(×2)で洗浄する。有機相をNaCl及びNa2SO4の上で乾燥させ、ろ過し、真空中で濃縮する。フラッシュクロマトグラフィーで精製して(2:3 EtOAc/ヘキサン)中間体3b2を得る。
工程2:
アルデヒド3b2(160mg,0.36mmol)、DeoxofluorTM(0.12mL,0.65mmol)及び無水DCM(1mL)の混合物に無水MeOH(3μL,0.07mmol,0.2当量)を加えて混合物を周囲温度で30時間撹拌する。混合物をDCMで希釈し、飽和NaHCO3水溶液で慎重に洗浄する。有機層をNaCl/Na2SO4上で乾燥させ、ろ過かつ真空中で濃縮する。残留物をフラッシュクロマトグラフィーで精製し(2:3 EtOAc/ヘキサン)、精製残留物の一部(60mg,0.1mmol)をDMSO(1mL)中でNaOH水溶液(2.5M,0.28mL,0.7mmol)と混ぜ合わせる。混合物を周囲温度で1時間撹拌してから水(5mL)で希釈し、急速に撹拌される1NのHCl水溶液(100mL)に加える。結果として生じた固体を45μmのろ過膜に通して吸引ろ過で収集し、真空乾燥させてインヒビター1007(表1)を得る。
【0102】
(実施例3C)
化合物1029(表1)の調製
【化51】

【0103】
工程1:
化合物3c1(38mg,0.16mmol)と乾燥DMSO(1mL)の混合物にK2CO3(55mg,0.4mmol)とフェノール1a9(実施例1A)(53mg,0.16mmol)を連続的に加える。反応混合物を55℃で1時間15分、次いで70℃で16時間撹拌する。反応混合物を水中に注ぎ、EtOAc(3×)で抽出する。混ぜ合わせた有機抽出物を連続的に水(4×)と食塩水で洗浄し、MgSO4で乾燥させ、ろ過かつ濃縮して中間体3c2を得る。
工程2:
EtOAc(4mL)中の化合物3c2(83mg,0.15mmol)と炭素上10%のパラジウム(25mg)の混合物を1気圧のH2下で周囲温度にて一晩撹拌する。混合物をろ過かつ濃縮して化合物3c3を得る。
工程3:
ジアニリン3c3(39mg,0.08mmol)とDMF(1mL)の混合物に連続的にDIPEA(0.040mL,0.23mmol)、2-メトキシ酢酸(0.006mL,0.08mmol)及びHATU(35mg,0.09mmol)を加える。混合物を周囲温度で一晩撹拌してからEtOAcで希釈し、連続的に10%のクエン酸水溶液、水、飽和NaHCO3水溶液、水及び食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過かつ濃縮して中間体3c4を得る。
工程4:
化合物3c4(45mg,0.08mol)、メタノール(1mL)及び4N HCl/ジオキサン(1mL)の混合物を75℃で1時間加熱する。混合物を濃縮して残留物をDMSOに溶かす。NaOH水溶液(5N,0.16mL,0.78mmol)を加えて混合物を55℃で30分撹拌してからAcOH(300μL)を加える。混合物を分取用HPLCで精製して化合物1029(表1)を単離する。
【0104】
(実施例3D)
化合物1035(表1)の調製
【化52】

【0105】
工程1:
化合物3d1(508mg,2.3mmol)と乾燥DMSO(3mL)の混合物に連続的にCH3NH2・HCl(305mg,4.5mmol)とEt3N(0.79mL,5.6mmol)を加える。反応混合物を周囲温度で3.5時間撹拌してから70℃で一晩撹拌する。混合物を水中に注ぎ、EtOAc(3×)で抽出する。混ぜ合わせた有機層を水(4×)と食塩水で洗浄し、MgSO4で乾燥させ、ろ過かつ濃縮する。フラッシュクロマトグラフィー(2% EtOAc-ヘキサン)で精製して化合物3d2を得る。
工程2:
臭素(0.012mL,0.24mmol)をアニリン3d2(53mg,0.24mmol)と氷AcOH(0.5mL)の混合物に加える。混合物を70℃に加熱して5時間撹拌する。過剰のBr2(5μL,0.1mmol)を加えて70℃でさらに1時間撹拌を続ける。混合物を濃縮して化合物3d3を得る。
工程3:
化合物3d3(72mg,0.24mmol)と無水MeOHの混合物にSnCl2・2H2O(540mg,2.4mmol)を加え、混合物を3時間加熱して還流させてから濃縮する。残留物をEtOAcに取り、飽和NH4Cl水溶液中に注ぐ。水層を2回以上EtOAcで抽出し、混ぜ合わせた有機抽出物をCeliteTMの短パッドに通してろ過する。有機相を水と食塩水で洗浄し、MgSO4で乾燥させ、ろ過かつ濃縮して化合物3d4を得る。
工程4:
化合物3d4(60mg,0.22mmol)とDMF(1mL)の混合物に連続的にDIPEA(0.12mL,0.67mmol)、2-メトキシ酢酸(0.021mL,0.27mmol)及びHATU(100mg,0.27mmol)を加える。反応混合物を周囲温度で6時間撹拌してからEtOAcで希釈し、10%のクエン酸水溶液、水、飽和NaHCO3水溶液、水及び食塩水で連続的に洗浄する。有機相をMgSO4で乾燥させ、ろ過かつ濃縮して化合物3d5を得る。
工程5:
化合物3d5(76mg,0.22mmol)と氷AcOH(2mL)の混合物をJ-Kem(登録商標)オービタルシェイカー(250rpmに設定)上60℃で6時間加熱する。混合物を濃縮して残留物をフラッシュクロマトグラフィー(1:1→2:1 EtOAc/ヘキサン)で精製してベンゾイミダゾール3d6を得る。
工程6:
非特許文献17から以下の手順を適合させた。
N2でパージしたねじ蓋反応容器内で無水NMP(1mL)中のブロモベンゾイミダゾール3d6(41mg,0.13mmol)、フェノール1a9(実施例1A)(42mg,0.13mmol)、CuCl(3mg,0.03mmol)、Cs2CO3(83mg,0.25mmol)及び2,2,6,6-テトラメチルヘプタン-3,5-ジオン(0.003mL,0.01mmol)の混合物をJ-Kem(登録商標)オービタルシェイカー(270rpm)で120℃にて全部で20時間撹拌する。混合物をAcOHで酸性にして分取用HPLCで精製して化合物1035(表1)を得る。
【0106】
(実施例3E)
化合物1036(表1)の調製
【化53】

【0107】
工程1:
化合物3e1(100mg,0.45mmol)と乾燥DMF(2mL)の混合物に連続的にCs2CO3(218mg,0.67mol)とCH3I(0.042mL,0.67mmol)を加える。混合物を周囲温度で1時間撹拌し、水中に注ぎ、EtOAcで抽出する。有機抽出物を水(4×)と食塩水で洗浄し、MgSO4で乾燥させ、ろ過かつ濃縮して化合物3e2を得る。
工程2:
実施例3Dの工程3〜6の手順を用いて化合物3e2を化合物1036(表1)に変換する。
【0108】
(実施例4A)
化合物2010(表2)の調製
【化54】

【0109】
化合物2011(実施例2D)(40mg,0.07mmol)と無水DMF(2mL)の混合物にZn(CN)2(16mg,0.14mmol)とPd(PPh3)4(8.1mg,0.01mmol)を加える。Arを用いて混合物を脱気して110℃で一晩撹拌する。混合物をTFAで酸性にして分取用HPLCで精製して化合物2010(表2)を単離する。
【0110】
(実施例4B)
化合物2003(表2)の調製
【化55】

【0111】
ラセミBINAP(7.5mg,0.012mmol)とPd(OAc)2(2.7mg,0.012mmol)の混合物を乾燥トルエン(1.5mL)中で10分間超音波処理する。この混合物を乾燥トルエン(2mL)中の化合物2d4(実施例2D)(75mg,0.12mmol)、モルフォリン(13.9mg,0.16mmol)及びCs2CO3(0.20g,0.62mmol)の混合物と混ぜ合わせて生じた混合物を105℃で3.5時間撹拌する。混合物を周囲温度に冷まし、EtOAcで希釈し、水、飽和NaHCO3水溶液及び食塩水で洗浄し、乾燥させ(MgSO4)てろ過する。ろ液を減圧下で濃縮して残留物をTHF(3.0mL)、MeOH(1.5mL)及びH2O(0.5mL)と混合する。LiOH水溶液(5N,0.40mL,2.0mmol)を0℃で加えて混合物を周囲温度で一晩撹拌する。混合物をTFAで酸性にし、分取用HPLCで精製して化合物2003(表2)を得る。
【0112】
(実施例4C)
化合物2069(表2)の調製
【化56】

【0113】
工程1:
非特許文献18から以下の手順を適合させる。
無水DMF(2mL)中のヨードアレン2d4(実施例2D)(270mg,0.45mmol)の混合物にチオ尿素(54mg,0.71mmol)、NiBr2(11mg,0.05mmol)及びNaBH3CN(4.5mg,0.07mmol)を加える。混合物をマイクロ波内120℃で15分加熱し、周囲温度に冷ましてDMF(3ml)で希釈する。NaOH水溶液(0.5N,3mL)をゆっくり加えて混合物を15分激しく撹拌し、1NのHCl水溶液とEtOAcに分配する。有機相を水と食塩水で洗浄し、MgSO4で乾燥させ、ろ過し、減圧下で濃縮して化合物4c1を得る。
工程2:
MeCN(4mL)中の化合物4c1(205mg,0.4mmol)、DBU(0.090mL,0.6mmol)及びMeI(0.038mL,0.6mmol)の混合物を周囲温度で一晩撹拌する。混合物をEtOAc(50mL)で希釈し、1NのHCl水溶液、水、1NのNaOH水溶液、水、チオスルフェート水溶液及び食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮して化合物4c2を得る。
工程3:
LiOH水溶液(5N,0.18mL,0.9mmol)をTHF(4mL)、MeOH(2mL)及び水(0.1mL)中のメチルチオエーテル4c2(95mg,0.18mmol)の混合物に加える。混合物を周囲温度で4時間撹拌してから5時間50℃に加熱し、周囲温度に冷ます。混合物を1NのHClで酸性にし、EtOAcで希釈し、水と食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、 減圧下で濃縮する。残留物をアセトンと水の混合物(5:2;7mL)に取り、OxoneTM(572mg,0.93mmol)を加えて混合物を周囲温度で2.5日間撹拌する。次に、混合物をEtOAcとエーテル(3:2)で希釈し、1NのHCl水溶液、水及び食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。残留物をDMSOに取り、分取用HPLCで精製して化合物2069(表2)を得る。
【0114】
(実施例5A)
化合物2002(表2)の調製
【化57】

【0115】
無水DMF(3mL)中の化合物2011(実施例2D)(110mg,0.19mmol)の混合物に1-エトキシビニルトリ-n-ブチルスズ(0.085mL,0.25mmol)とビス(トリ-tert-ブチルホスフィノ)パラジウム(0)(9.7mg,0.02mmol)を加える。Arを用いて混合物を脱気して100℃で45分撹拌する。混合物を周囲温度に冷まし、MeCN(4mL)と1NのHCl(4mL)を加えて周囲温度で15分間撹拌を続ける。混合物を減圧下で濃縮し、生じた残留物にDMSO(4mL)を加える。混合物をろ過し、分取用HPLCで精製して化合物2002(表2)を単離する。
【0116】
(実施例5B)
化合物2004(表2)の調製
【化58】

【0117】
工程1:
実施例5Aで述べた手順を用いて中間体5b1を化合物2d4(実施例2D)から調製した。
工程2:
NaBH4(9.1mg,0.24mmol)を化合物5b1(50mg,0.10mmol)とMeOH(6mL)の混合物にゆっくり加え、混合物を周囲温度で一晩撹拌する。混合物をEtOAcで希釈し、1NのHCl、水、飽和NaHCO3水溶液及び食塩水で洗浄し、MgSO4で乾燥させ、ろ過し、減圧下で濃縮する。残留物をTHF(2mL)、MeOH(1mL)及び水(0.5mL)と混ぜ合わせてLiOH水溶液(5N,0.20mL,1.0mmol)を加える。混合物を周囲温度で一晩撹拌してからTFAで酸性にして濃縮する。残留物にDMSO(2ml)を加え、混合物を分取用HPLCで精製して化合物2004(表2)を得る。
【0118】
(実施例5C)
化合物2154(表2)の調製
【化59】

【0119】
EtOH(1mL)中の化合物5b1(実施例5B)(48mg,0.09mmol)、NaBH4(5.3mg,0.14mmol)、AcOH(0.050mL,0.88mmol)及びモルフォリン(0.010mL,0.11mmol)の混合物を20時間60℃で加熱する。過剰のNaBH4(2mg,0.05mmol)とモルフォリン(0.017mL,0.18mmol)を加え、撹拌を60℃でさらに20時間続ける。NaOH水溶液(2.5N,0.60mL,1.5mmol)を加えて混合物を50℃で1時間撹拌する。AcOHで酸性化後、混合物を分取用HPLCで精製して化合物2154(表2)を単離する。
【0120】
(実施例6A)
化合物2103(表2)の調製
【化60】

【0121】
工程1:
非特許文献19に記載のプロトコルから手順を適合させる。
無水THF(30mL)中の化合物2d4(実施例2D)(2.0g,3.3mmol)、マロン酸ジベンジル(2.5g,9.9mmol)、CuI(76mg,0.4mmol)、2-フェニルフェノール(68mg,0.4mmol)、Cs2CO3(4.1g,12.5mmol)の混合物をArで15分脱気してから70℃で16時間撹拌する、過剰のCuI(76mg,0.4mmol)と2-フェニルフェノール(68mg,0.4mmol)を加えて70℃でさらに20時間撹拌を続ける。混合物をEtOAcで希釈し、飽和NH4Cl水溶液と食塩水で洗浄して濃縮する。残留物をEtOH(20mL)に取り、10% Pd/C(0.4g)を加える。混合物を1気圧のH2下で周囲温度にて2時間撹拌し、CeliteTMのパッドに通してろ過する。ろ液を80℃で1時間撹拌し、周囲温度に冷まして減圧下で濃縮する。残留物をフラッシュクロマトグラフィー(1:1 EtOAc/ヘキサン)で精製して化合物6a1を得る。
工程2:
CH2Cl2(24mL)中の化合物6a1(900mg,1.7mmol)の混合物に塩化オキサリル(0.21mL,2.4mmol)とDMF(0.060mL,0.8mmol)を加えて混合物を室温で1時間撹拌する。混合物を濃縮して残留物をCH2Cl2(30mL)に取る。撹拌しながら、CH2N2(Et2O中0.35M,46mL,16mmol)を滴加し、撹拌を30分続ける。混合物を減圧下で濃縮して残留物をTHF(24mL)に取る。48%のHBr水溶液(1.8mL,16mmol)を加えて混合物を20分撹拌する。混合物を減圧下で濃縮し、EtOAcで希釈する。有機相を水、飽和NaHCO3水溶液及び食塩水で洗浄し、MgSO4上で乾燥させ、ろ過し、減圧下で濃縮して化合物6a2を得る。
工程3:
i-PrOH中のブロモケトン6a2(60mg,0.1mmol)とチオアセトアミド(14mg,0.19mmol)の混合物を70℃で1時間撹拌する。混合物を周囲温度に冷ましてNaOH(2.5N,0.18mL,0.44mmol)を加える。混合物を40℃で5時間撹拌してから水で希釈し、HClで酸性にする。ろ過で固体を集めて過剰の水で洗浄してからDMSOに取り、分取用HPLCで精製して化合物2103(表2)を得る。
【0122】
(実施例7A)
中間体7a5の調製
【化61】

【0123】
工程1:
無水THF(280mL)中の化合物2d4(実施例2D)(40g,66.2mmol)の混合物にビニルトリブチルスズ(23mL,25g,78.8mmol)とPdCl2(PPh3)2(4.8g,6.8mmol)を加える。混合物をArで5分脱気してから4〜6時間加熱して還流させる。減圧下で溶媒を除去し、残留物をフラッシュクロマトグラフィー(勾配19:1→3:2 ヘキサン/EtOAc)で精製して中間体7a1を得る。
工程2:
アセトン(710mL)中のアルケン7a1(40.3g,79.9mmol)の溶液にtert-BuOH(176mL)、水(88mL)、4-N-メチルモルフォリンオキシド一水和物(水中60%溶液,21mL,120mmol)とOsO4(t-BuOH中2.5wt%,13.3mL,1.06mmol)を加える。混合物を周囲温度で一晩撹拌してから濃縮してEtOAc(4L)に取る。有機相を2M HCl(2×1L)、水、飽和NaHCO3水溶液(1L)及び食塩水で洗浄する。有機相に活性炭とNa2SO4を加えて混合物を10分撹拌する。混合物をCeliteTMのパッドに通してろ過してから濃縮して中間体7a2を得る。
工程3:
THF(710mL)と水(270mL)中のジオール7a2(40.6g,75.4mmol)の冷却(0℃)混合物に過ヨウ素酸ナトリウム(25g,116.9mmol)を加える。混合物を0℃で5分放置してから室温で4時間撹拌を続ける。さらに過ヨウ素酸ナトリウム(3.3g,15.4mmol,0.2当量)を加えて撹拌を2時間続ける。混合物をエーテル/EtOAc(1.8L/3.6L)で希釈してから水と食塩水で洗浄し、Na2SO4上で乾燥させ、ろ過し、減圧下で濃縮する。残留物をフラッシュクロマトグラフィーで精製して中間体7a3を得る。
工程4:
アルデヒド7a3(30.7g,60.6mmol)とMeOH(300mL)の混合物にナトリウムボロヒドリド(4.4g,116mmol,2当量)をゆっくり加える。混合物を周囲温度で2時間撹拌してからEtOAcで希釈して1NのHCl、飽和NaHCO3水溶液及び食塩水で慎重に洗浄する。有機相をNa2SO4上で乾燥させ、ろ過し、減圧下で濃縮して中間体7a4を得る。
工程5:
アルコール7a4(19g,37.4mmol)、無水CH2Cl2(450mL)及びDMF(9mL)の混合物に塩化チオニル(5.5mL,8.1mmol)をゆっくり加える。混合物を周囲温度で30分撹拌してからEtOAc(1.5L)で希釈して飽和NaHCO3水溶液と食塩水で洗浄する。有機相をNa2SO4で乾燥させ、ろ過かつ濃縮して中間体7a5を得る。
【0124】
(実施例8A)
化合物2005(表2)の調製
【化62】

【0125】
エーテル(4mL)中のジアゾメタンをエーテル(2mL)中のアルケン7a1(実施例7A)(26mg,0.05mmol)の冷却(0℃)混合物にゆっくり加える。Pd(OAc)2(2mg,0.01mmol)を加えて混合物を周囲温度で1.5時間撹拌する。混合物を減圧下で濃縮し、残留物にTHF(2mL)、MeOH(1mL)及び水(0.2mL)を添加後、LiOH水溶液(5N,0.6mL,3.0mmol)を加える。混合物を周囲温度2.5日間撹拌する。DMSO(1.5mL)と過剰のLiOH水溶液(5N,0.3mL,1.5mmol)を加えて周囲温度で一晩撹拌を続ける。混合物をTFAで酸性にし、減圧下でで濃縮する。残留物を分取用HPLCで精製して化合物2005(表2)を単離する。
【0126】
(実施例8B)
化合物2007(表2)の調製
【化63】

【0127】
MeOH(2mL)とEtOAc(4mL)中のアルケン7a1(実施例7A)(23mg,0.05mmol)の混合物に10%のパラジウム(炭素上)(2mg)を加える。混合物をH2(約1気圧)下で2.5日間撹拌してからろ過し、濃縮乾固させる。残留物をTHF(2mL)、MeOH(1mL)及び水(0.2mL)に取る。LiOH水溶液(5N,0.4mL,2.0mmol)を加えて混合物を周囲温度で一晩撹拌する。DMSO(1.0mL)と過剰のLiOH水溶液(5N,0.2mL,1.0mmol)を加えて50℃で3時間撹拌を続ける。混合物をTFAで酸性にして減圧下で濃縮する。残留物を分取用HPLCで精製して化合物2007(表2)を単離する。
【0128】
(実施例9A)
化合物2120(表2)の調製
【化64】

【0129】
AcOH(0.5mL)中のアルデヒド7a3(実施例7A)(50mg,0.1mmol)と2-アミノピラジン(38mg,0.4mmol)の混合物を80℃で2時間撹拌する。混合物を周囲温度に冷まし、NaCNBH3(7.9mg,0.13mmol)を加えて混合物を15分撹拌してからN2流下で濃縮する。NaOH水溶液(2.5N,0.60mL,1.5mmol)を残留物に加えて混合物を50℃で2時間撹拌してから分取用HPLCで精製して化合物2120(表2)を単離する。
【0130】
(実施例10A)
化合物2026(表2)の調製
【化65】

【0131】
DMF(1mL)中の中間体7a5(実施例7A)(25mg,0.05mmol)、インドール(8.2mg,0.07mmol)、Cs2CO3(23mg,0.07mmol)及びKI(3mg,0.02mmol)の混合物をJ-Kem(登録商標)オービタルシェイカー(250rpm)上で70℃にて一晩撹拌する。DMSO(0.5mL)を添加後、NaOH水溶液(5N,0.10mL,0.5mmol)を加えて混合物を55℃で1時間撹拌する。混合物をAcOHで酸性にしてから分取用HPLCで精製して化合物2026(表2)を単離する。
【0132】
(実施例10B)
化合物2047及び2057(表2)の調製
【化66】

【0133】
工程1:
THF(1mL)中の化合物7a5(実施例7A)(25mg,0.05mmol)、3-ピロリジノール(0.006mL,0.07mmol)及びEt3N(0.010mL,0.07mmol)の混合物をJ-Kem(登録商標)オービタルシェイカー上で(250rpm)70℃にて一晩撹拌する。混合物をN2流下で濃縮してからDMSO(0.5mL)に取る。NaOH水溶液(5N,0.10mL,0.5mmol)を加えて混合物を55℃で1時間撹拌する。混合物をAcOHで酸性にし、分取用HPLCで精製して化合物2047(表2)を単離する。
工程2:
DCM/CH3CN(1:1,1mL)中の化合物2047(12mg,0.02mmol)とDess-Martinペルヨージナン(7.6mg,0.02mmol)の混合物を周囲温度で20時間撹拌する。追加分のDess-Martinペルヨージナン(7.6mg,0.02mmol)を加えてさらに20時間撹拌を続ける。混合物を減圧下で濃縮して残留物を分取用HPLCで精製して化合物2057(表2)を得る。
【0134】
(実施例10C)
化合物2153(表2)の調製
【化67】

【0135】
工程1:
化合物7a5(実施例7A)(9.5g,18.05mmol)、NaN3(2.16g,33.4mmol)及び60%(v/v)のアセトン-水(90mL)の混合物をAr下で一晩撹拌して還流させる。混合物を減圧下で濃縮して残留物をEtOAc(1L)で抽出し、水(4×)で洗浄する。有機相をMgSO4上で乾燥させ、ろ過し、減圧下で濃縮して化合物10c1を得る。
工程2:
メタノール(100mL)中の化合物10c1(9.68g,18.14mmol)の混合物じゅうに10分間アルゴンを泡立たせて混合物をAr下でPd/C(10%,1g)に加える。撹拌混合物じゅうに2.5時間H2を泡立たせる。混合物をCeliteTMに通してろ過し、MeOHですすぐ。ろ液を濃縮乾固させ、残留物をフラッシュカラムクロマトグラフィー(SiO2,MeOH/DCM:5/95)で精製して遊離アミンを単離する。このアミンとEt2O中2MのHCl溶液(30mL)の混合物を室温で1時間撹拌する。ろ過で塩酸塩10c2を収集し、ジエチルエーテルですすいで空気乾燥させる。
工程3:
化合物10c2(25mg,0.049mmol)とDMF(0.50mL)の混合物にシクロプロパンスルホニルクロリド(6.3μL,0.058mmol)とEt3N(16.9μL,0.121mmol)を加える。混合物をオービタルシェイカー上(350rpm)室温で一晩撹拌する。NaOH(5N,100μL,0.50mmol)を加え、混合物を50℃で1時間加熱してからAcOHで酸性にし、分取用HPLCで精製して化合物2153(表2)を得る。
【0136】
(実施例10D)
化合物2159(表2)の調製
【化68】

【0137】
DMF(0.5mL)中の化合物10c2(実施例10C)(25mg,0.046mmol,1当量)の混合物に(CH3)2CH-NCO(1.3当量)を加える。HPLC分析で判定した場合に完了するまで混合物を室温で撹拌する。5NのNaOH(0.1mL,10当量)を加え、混合物を50℃に1時間加熱してからAcOHで酸性にする。逆相HPLCで精製して化合物2159(表2)を得る。
【0138】
(実施例10E)
化合物2161(表2)の調製
【化69】

【0139】
THF(0.5mL)中の化合物10c2(実施例10C)(25mg,0.046mmol,1当量)の混合物にDIEA(12μL,1.5当量)を添加後、クロロギ酸エチル(5.3μL,1.2当量)を加える。混合物を室温で一晩撹拌してから減圧下で濃縮する。残留物をDMSO(0.5mL)と混合し、5NのNaOH(0.1mL,11当量)を加えて混合物を50℃で45分加熱する。AcOHを用いて混合物を酸性にし、逆相HPLCで精製して化合物2161(表2)を得る。
【0140】
(実施例10F)
化合物2188(表2)の調製
【化70】

【0141】
化合物10c2(実施例10C)(50mg,0.091mmol)とDCM(1mL)の混合物にクロロギ酸エチル(12μL,0.126mmol)を添加後、Et3N(40μL,0.287mmol)を加える。反応混合物を室温で一晩撹拌し、アルゴン流下で濃縮し、残留物をDMF(1mL)と混合する。混合物の半分をNaH(60%の油分散系,6mg,3.3当量)を含有するバイアルに加え、この混合物を室温で5分撹拌する。ヨードメタン(10μL,3.5当量)を加えて室温で5時間撹拌を続ける。5NのNaOH(10当量)を加えて混合物を室温でさらに14時間撹拌し、分取用HPLCで精製して化合物2188(表2)を得る。
【0142】
(実施例11A)
化合物2039(表2)の調製
【化71】

【0143】
中間体7a5(実施例7A)(25mg,0.05mmol)、2-メルカプトイミダゾール(7.0mg,0.07mmol)、Cs2CO3(23mg,0.07mmol)及びDMF(1mL)の混合物をJ-Kem(登録商標)オービタルシェイカー上(250rpm)70℃で一晩撹拌する。DMSO(0.5mL)を添加後、NaOH水溶液(5N,0.10mL,0.5mmol)を加えて混合物を55℃で1時間撹拌する。混合物をAcOHで酸性にしてから分取用HPLCで精製して化合物2039(表2)を単離する。
【0144】
(実施例11B)
化合物2071(表2)の調製
【化72】

【0145】
工程1:
無水DMF(1.5mL)中の中間体7a5(実施例7A)(55mg,0.1mmol)、KI(3mg,0.02mmol)、NaSMe(11mg,0.16mmol)及びEt3N(0.031mL,0.23mmol)の混合物を70℃で1.5時間撹拌してから周囲温度に冷ます。混合物をEtOAcで希釈し、1NのHCl水溶液、水、飽和NaHCO3水溶液及び食塩水で洗浄し、MgSO4で乾燥させ、ろ過し、減圧下で濃縮して化合物11b1を得る。
工程2:
アセトン/水(3:1;8mL)中の化合物11b1(52mg,0.1mmol)の混合物にOxoneTM(298mg,0.49mmol)を加える。混合物を周囲温度で2時間撹拌してからEtOAcで希釈し、水と食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。残留物をDMSO(2mL)、MeOH(1mL)及び水(0.2mL)の混合物に取る。LiOH水溶液(5N,0.20mL,1.0mmol)を加えて混合物を周囲温度で一晩、次いで50℃で4時間撹拌する。混合物を周囲温度に冷ましてからTFAで酸性にし、濃縮し、分取用HPLCで精製して化合物2071(表2)を単離する。
【0146】
(実施例12A)
化合物2084(表2)の調製
【化73】

【0147】
工程1:
CH2Cl2(2mL)中の化合物7a5(実施例7A)(30mg,0.06mmol)、FeCl3(9.7mg,0.06mmol)及びアニソール(6.1mg,0.06mmol)の混合物をマイクロ波内で100℃にて15分加熱する。混合物を濃縮してからDMSOに取り、分取用HPLCで精製して中間体12a1を単離する。
工程2:
化合物12a1(6mg,0.01mmol)、化合物1a7(実施例1A)(13mg,0.08mmol)及びピリジン(0.3mL)の混合物をマイクロ波内で180℃に12分加熱する。混合物を分取用HPLCで精製して化合物2084(表2)を単離する。
【0148】
(実施例13A)
化合物2056(表2)の調製
【化74】

【0149】
工程1:
非特許文献20から手順を適合させる。化合物13a1(10.0g,36mmol)とCH2Cl2(212mL)の混合物に2-メトキシプロペン(13.8mL,144mmol)を添加後、NaBH(OAc)3(15.3g,72mmol)とAcOH(8.2mL,144mmol)を加える。混合物を周囲温度で一晩撹拌してからEtOAcで希釈し、NaHCO3と食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。残留物をフラッシュクロマトグラフィー(1:9 EtOAc/ヘキサン)に供して化合物13a2単離する。
工程2:
無水ピリジン(160mL)中の化合物13a2(10.2g,32mmol)の混合物に化合物1a7(実施例1A)(11.3g,70mmol)とDMAP(約0.44g)を加える。混合物を80℃で2日間撹拌してからEtOAc(250mL)で希釈し、1N HCl、水、飽和NaHCO3水溶液及び食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。粗生成物をフラッシュクロマトグラフィー(1:4 EtOAc/ヘキサン)で精製してアミド13a3を得る。
工程3:
使用手順を非特許文献21から適合させる。
DMF(2mL)中の化合物13a3(100mg,0.23mmol)、NiBr2(5.7mg,0.03mmol)、チオ尿素(27mg,0.35mmol)及びNaCNBH3(2.2mg,0.04mmol)の混合物をマイクロ波内120℃で15分加熱する。NaOH水溶液(2.5N,2.0mL,1.0mmol)を加えて混合物を15分撹拌する。混合物をEtOAcで希釈し、1NのHCl水溶液と食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮して化合物13a4を得る。
工程4:
DMSO(1.0mL)中の化合物13a4(40mg,0.11mmol)、2-フルオロ-3-トリフルオロメチルピリジン(21mg,0.13mmol)及びK2CO3(55mg,0.40mmol)の混合物を100℃で20時間撹拌する。混合物を室温に冷ましてNaOH(2.5N,300μL,0.75mmol)を加える。混合物を40℃で1時間撹拌し、AcOHで酸性にし、分取用HPLCで精製して化合物2056(表2)を得る。
【0150】
(実施例14A)
化合物1004(表1)の調製
【化75】

【0151】
参考文献:非特許文献22
工程1:
化合物14a1(500mg,4.62mmol)と1-エトキシ-2,2,2-トリフルオロエタノール(667mg,4.63mmol)の混合物を80℃で2時間加熱してから冷ましてEt2Oで希釈する。混合物を1N HCl、水及び食塩水で洗浄し、有機抽出物を乾燥させ(MgSO4)、ろ過かつ濃縮して化合物14a2を得る。
工程2:
グリオキサール水溶液(40%,2.0g,13.8mmol)とn-BuOAc(10mL)の混合物をMgSO4上で乾燥させてろ過する。ろ液に化合物14a2(853mg,4.5mmol)、AcOH(50μL)及びMgSO4(462mg,3.8mmol)を加え、混合物を120℃で6時間加熱する。さらにグリオキサールグリオキサール水溶液(40%,27g,186mmol)をEtOAcで抽出し、EtOAc抽出物をMgSO4上で乾燥させ、n-BuOAc(10mL)を添加し、溶液を減圧下で濃縮して調製した)を加え、120℃での加熱をさらに3.5時間続ける。混合物をろ過かつ濃縮し、残留物を1N NaOHと混合し、CH2Cl2で洗浄する。水相を濃HClで酸性にしてpHを2にしてCH2Cl2で3回抽出する。混ぜ合わせた有機抽出物を水と食塩水で洗浄し、乾燥させ(MgSO4)、ろ過かつ濃縮する。残留物をフラッシュクロマトグラフィーで精製して化合物14a3を得る。
工程3:
NMP(1.0mL)中の化合物13a3(実施例13A)(39mg,0.088mmol)、化合物14a3(20mg,0.088mmol)、Cs2CO3(57mg,0.18mmol)、2,2,6,6-テトラメチルヘプタン-3,5-ジオン(2.0μL,0.01mmol)及びCuCl(4.4mg,0.044mmol)の混合物をN2雰囲気下J-Kem(登録商標)オービタルシェイカー上(275rpm)120℃で7時間撹拌する。NaOH水溶液(5N,176μL,0.88mmol)を加えて混合物を50℃で30分加熱する。AcOHを総量1.5mLまで加えて混合物をろ過し、分取用HPLCで精製して化合物1004(表1)を得る。
【0152】
(実施例15A)
化合物2196(表2)の調製
【化76】

【0153】
工程1:
MeOH(80mL)中のカルボン酸15a1(5.0g,27mmol)と濃H2SO4(4mL)の混合物を12時間撹拌して還流させる。混合物を減圧下で濃縮し、氷と飽和NaHCO3水溶液の混合物上に注ぐ。水性混合物をクエン酸で酸性にしてEtOAcで2回抽出する。混ぜ合わせた有機抽出物を水と食塩水で洗浄し、MgSO4で乾燥させ、ろ過し、減圧下で濃縮する。フラッシュクロマトグラフィー(3:7 EtOAc/ヘキサン)で精製してエステル15a2を得る。
工程2:
化合物15a2(10g,51mmol)、2-フルオロ-3-トリフルオロメチルピリジン(10g,61mmol)及びK2CO3(8.4g,61mmol)をアルゴン雰囲気下、無水DMSO(150mL)中で室温にて混合する。混合物を100℃で一晩撹拌し、室温に冷ましてEtOAc(3L)で希釈する。有機相を飽和NH4Cl溶液と食塩水で洗浄し、MgSO4上で乾燥させ、ろ過し、減圧下で濃縮する。残留物にEt2Oとヘキサンを加えて化合物15a3を得;ろ液を濃縮して残留物をフラッシュクロマトグラフィーで精製することによって、さらなる化合物15a3を得る。
工程3:
化合物15a3(12.5g,37mmol)、MeOH(600mL)及びPd/C(1.4g)の混合物をH2(1気圧)下で室温にて3.5時間撹拌する。混合物をCeliteTMに通してろ過し、MeOHですすぐ。ろ液を濃縮して残留物をフラッシュクロマトグラフィー(勾配;1/4→2/3 EtOAc/ヘキサン)で精製する。得られた遊離アニリンとCH2Cl2(250mL)の混合物を0℃に冷却してEt2O中2MのHCl(50mL)を加える。混合物を室温で1時間撹拌し、ろ過で塩酸塩15a4を収集し、Et2Oですすいで空気乾燥させる。
工程4:
CH2Cl2中の化合物15a4(2.1g,5.9mmol)と2-メトキシプロペン(2.3mL,24mmol)の混合物にNaBH(OAc)3(2.5g,12mmol)を少しずつ加える。混合物を周囲温度で30分撹拌してからEtOAcで希釈し、飽和NaHCO3水溶液と食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。残留物をヘキサン/エーテル中で摩砕後、ろ過し、洗浄し(ヘキサン)、乾燥させて化合物15a5を得る。
工程5:
塩化オキサリル(DCM中2M,0.16mL,0.32mmol)をDCM(1mL)中の4-クロロ-3-メチル安息香酸(27mg,0.16mmol)の混合物にゆっくり加える。DMF(1滴)を加えて混合物を周囲温度で30分撹拌し、減圧下で濃縮する。残留物をピリジン(0.5mL)と混合し、化合物15a5(30mg,0.08mmol)を加えて混合物を60℃で一晩撹拌する。NaOH水溶液(10N,0.096mL,0.96mmol)と水(0.2mL)を加えて混合物を周囲温度で一晩撹拌してからEtOAcで希釈し、1N HClと食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。分取用HPLCで精製して化合物2196(表2)を得る。
【0154】
(実施例16A)
化合物2124(表2)の調製
【化77】

【0155】
工程1:
DMF(20mL)中の化合物15a4(実施例15A)(2.0g,5.8mmol)、tert-ブチルブロモアセテート(4.3mL,29mmol)及びDIPEA(3.0mL,17mmol)の混合物を80℃で一晩撹拌する。混合物をEtOAcで希釈し、0.5NのKHSO4水溶液、飽和NaHCO3水溶液及び食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。残留物をフラッシュクロマトグラフィー(勾配;1:9→1:1 EtOAc/ヘキサン)で精製して化合物16a1を得る。
工程2:
無水ピリジン(20mL)中の16a1(1.6g,3.7mmol)とDMAP(0.45g,3.7mmol)の混合物に化合物1a7(実施例1A)(0.90g,5.6mmol)を加える。混合物を70℃で一晩撹拌してからEtOAcで希釈して1N HCl、飽和NaHCO3水溶液及び食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。1:9のEtOAc/ヘキサンと摩砕してアミド16a2を得る。
工程3:
化合物16a2(1.5g,2.8mmol)とDCM(20mL)の混合物に0℃にてトリフルオロ酢酸(5mL)をゆっくり加える。混合物を周囲温度に戻して一晩撹拌してから減圧下で濃縮する。残留物をDCMと混合し、2回濃縮してから水とアセトニトリルから凍結乾燥させて酸16a3を得る。
工程4:
DMF(0.5mL)中の化合物16a3(25mg,0.05mmol)とHATU(23mg,0.06mmol)の混合物にピロリジン(0.005mL,0.06mmol)を添加後、Et3N(0.030mL,0.22mmol)を加える。混合物をJ-Kem(登録商標)オービタルシェイカー上(250rpm)周囲温度で1時間撹拌する。NaOH水溶液(5N,0.10mL,0.5mmol)を加えて周囲温度で一晩撹拌を続ける。混合物をAcOH(0.1mL)で酸性にし、DMSO(1mL)で希釈し、分取用HPLCで精製して化合物2124(表2)を単離する。
【0156】
(実施例16B)
化合物2149(表2)の調製
【化78】

【0157】
DMF中の酸16a3(実施例16A)(50mg,0.1mmol)の混合物にHATU(51mg,0.14mmol)、フェニレンジアミン(11mg,0.11mmol)及びEt3N(0.063mL,0.45mmol)を加える。混合物を周囲温度で一晩撹拌してからEtOAcで希釈し、10%のクエン酸水溶液、水、飽和NaHCO3水溶液及び食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。残留物をAcOH(1mL)と混合し、100℃で1時間撹拌する。周囲温度に冷ました後、混合物をEtOAcで希釈して飽和NaHCO3水溶液、水及び食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。残留物(55mg,0.1mmol)をDMSO(2mL)、MeOH(1mL)及び水(0.15mL)と混ぜ合わせる。NaOH水溶液(10N,0.097mL,0.10mmol)を加えて混合物を周囲温度で一晩撹拌する。混合物をTFAで酸性にし、分取用HPLCで精製して化合物2149(表2)を単離する。
【0158】
(実施例17)
NS5B RNA依存性RNAポリメラーゼ活性の阻害:
以下に述べるプロトコルに従い、C型肝炎ウイルスRNA依存性ポリメラーゼ(NS5B)に対する阻害活性について本発明の代表化合物を試験する。
HCV His-NS5BΔ21ポリメラーゼ[配列番号1]はC-末端の21のアミノ酸を欠いており、非特許文献23に記載されているように、大腸菌株JM109(DE3)においてpETベースベクターからN-末端の6-ヒスチジンタグで発現させて精製する。この均一酵素製剤を-20℃で貯蔵緩衝液(25mM Tris/HCl pH 7.5, 300mM NaCl, 5mM DTT, 1M EDTA及び30%(v/v)グリセロール)に貯蔵する。
ホモポリマーのポリ(A)鋳型にアニールしたビオチン-オリゴ-(U)12RNAプライマーの伸長中の3H-UTPの取込みを測定するアッセイで前記精製His-NS5BΔ21ポリメラーゼを再構成する。まず試験化合物を添加後、基質、次に酵素を加える。反応の最後に、ストレプトアビジンシンチレーション近接アッセイ(scintillation proximity assay)(SPA)ビーズを添加し、捕獲された二重鎖RNA生成物由来の放射能TopCount装置(Packard)で定量する。
アッセイ反応の成分は以下のとおりである:20mM Tris-HCl pH 7.5、1mM TCEP、1mM EDTA、5mM MgCl2、0.01%w/v BSA、5%v/v DMSO、10μg/mLのPoly(A)、1μg/mLのビオチン-オリゴ-(U)12、333nM UTP、0.01mCi/mL(300nM)の3H-UTP、80単位/mLのRnasin、12.5nM His-NS5BΔ21ポリメラーゼ並びに広い濃度範囲にわたって段階希釈した試験インヒビター化合物。384-ウェルプレート内で1.5時間22℃でインキュベーションしてアッセイを行ってから、0.5MのEDTAと、ストレプトアビジン-被覆ビーズで捕獲された生成物との溶液でアッセイを停止する。各ウェルの底に6MのCsClを添加後、プレートを室温で90分間放置後、TopCountで60秒間カウントする。次に、計算した阻害%の値を用いて、SASの非線形回帰ルーチン(non-linear regression routine)NLIN手順によってIC50、傾斜係数(n)及び最大阻害(Imax)を決定する。
【0159】
〔実施例18〕
NS5B RNA依存性RNAポリメラーゼ阻害の特異性:
非特許文献23に記載されているようにポリオウイルスRNA依存性RNAポリメラーゼ及び子ウシ胸腺DNA依存性RNAポリメラーゼIIに対する阻害活性について本発明の代表化合物を試験する。
(実施例19)
細胞ベースルシフェラーゼレポーターHCV RNA複製アッセイ:
特許文献16に記載のアッセイを用いて、安定したサブゲノムHCVレプリコンを発現する細胞内におけるC型肝炎ウイルスRNA複製のインヒビターとしての活性について本発明の代表化合物を試験する。
【0160】
(化合物の表)
以下の表は、本発明の代表的な化合物を列挙する。下表1及び2に列挙される代表化合物を実施例33のNS5Bポリメラーゼ活性の阻害アッセイで試験すると、30μM未満のeIC50値を有することが分かる。
実施例に記載の標準的な分析用HPLC条件を用いて各化合物の保持時間(tR)を測定する。当業者に周知なように、保持時間値はその特有の測定条件に敏感である。従って、溶媒、流速、線形勾配などの同一条件を使用しても、例えば、異なるHPLC機器で測定した場合など、保持時間が変わりうる。同一機器で測定した場合でさえ、例えば、異なる個々のHPLCカラムを用いて測定した場合に値が変わることがあり、或いは、同一機器及び同一の個々カラムで測定した場合でさえ、例えば、異なる機会に取った個々の測定間で値が変わることがある。
【0161】
【表1】

【0162】
【表2】

【0163】
【表3】

【0164】
【表4】

【0165】
【表5】

【0166】
【表6】

【0167】
【表7】

【0168】
【表8】

【0169】
【表9】

【0170】
【表10】

【0171】
【表11】

【0172】
【表12】

【0173】
【表13】

【0174】
【表14】

【0175】
【表15】

【0176】
【表16】

【0177】
【表17】

【0178】
【表18】

【0179】
【表19】

【0180】
【表20】

【0181】
【表21】

【0182】
【表22】

【0183】
【表23】

【0184】
【表24】

【0185】
【表25】

【0186】
【表26】

【0187】
【表27】

【0188】
【表28】

【0189】
【表29】

【0190】
【表30】

【0191】
【表31】

【技術分野】
【0001】
〔関連出願〕
この出願は、2006年8月17日提出の米国特許出願第60/822711号の利益を主張し、その開示を本明細書で援用する。
〔発明の分野〕
本発明は、C型肝炎ウイルス(HCV)感染症の治療のための化合物、組成物及び方法に関する。特に、本発明はC型肝炎ウイルスNS5Bポリメラーゼの新規インヒビター、該化合物を含有する医薬組成物及びこれらの化合物をHCV感染症の治療で使用する方法を提供する。
【背景技術】
【0002】
〔発明の背景〕
世界中で少なくとも1億3千万の人々がC型肝炎ウイルス(HCV)に感染している。急性HCV感染症は多くの場合慢性感染症に進行し、かつ慢性感染症が肝硬変及び肝細胞癌などの重症な肝臓疾患につながる感染個体もいる。
現在、慢性C型肝炎ウイルス感染症の標準的治療は、ペグ化インターフェロン-αとリバビリンの併用投与を含む。しかし、この療法は、多くの感染患者において検出できないレベルにHCV RNAを減らすのに有効でなく、かつ例えば発熱及び他のインフルエンザ様症状、うつ病、血小板減少症及び溶血性貧血などの耐えられない副作用を伴うことが多い。さらに、この治療に禁忌である状況が共存するHCV-感染患者もいる。
従って、C型肝炎ウイルス感染症の代替治療に対する要求が存在する。この要求を取り扱うための1つの考えられる戦略は、ウイルス又はウイルス複製に必須の宿主細胞の因子を不活化する有効な抗ウイルス薬の開発である。
HCVは、フラビウイルス(Flaviviridae)科のヘパシウイルス(Hepacivirus)属のエンベロープ型正鎖RNAウイルスである。単鎖HCV RNAゲノムは約9500のヌクレオチドの長さであり、5'及び3'非翻訳領域に隣接した単一の読み枠(ORF)を有する。HCVの5'非翻訳領域は、341のヌクレオチドの長さで、キャップ依存性翻訳開始の配列内リボース侵入部位(internal ribosome entry site)として機能する。読み枠は、約3000のアミノ酸の単一の大きいタンパク質であり、複数部位で細胞性及びウイルス性プロテアーゼによって切断されて成熟した構造及び非構造(NS2、NS3、NS4A、NS4B、NS5A、及びNS5B)タンパク質を生成する。ウイルス性NS2/3プロテアーゼはNS2-NS3接合部で切断し;さらにNS3-NS4A、NS4A-NS4B、NS4B-NS5A及びNS5A-NS5B切断部位で該ウイルス性NS3プロテアーゼがNS3の下流切断を媒介する。NS3タンパク質もヌクレオシドトリホスファターゼ及びRNAヘリカーゼ活性を示す。NS4Aタンパク質は、NS3プロテアーゼの補助因子として作用し、かつNS3及び他のウイルス性レプリカーゼ成分の膜局在化においても補助しうる。NS4B及びNS5Aリンタンパク質も該レプリカーゼの成分であると考えられるが、その特有の役割は未知である。NS5Bタンパク質は、RNA依存性RNAポリメラーゼ(RdRp)活性を有するHCVレプリカーゼの伸長サブユニットである。
新規かつ特異的な抗-HCV治療の開発は高い優先度であり、かつ複製に必須のウイルス特異性機能は、薬物開発のため最も魅力的な標的である。RNA依存性RNAポリメラーゼが哺乳動物に存在しないこと及びこの酵素がウイルスの複製に必須のようであるという事実は、NS5Bポリメラーゼが抗-HCV療法の理想的な標的であることを示唆しているだろう。最近、チンパンジーモデルにおいてNS5B活性を殺す突然変異がRNAの感染力を撤廃することが実証された(非特許文献1参照)。
特許文献1は、ペルオキシソーム増殖因子-活性化受容体α及び/又はγの活性を調節する、下記一般式の化合物を開示している。
【0003】
【化1】

同様の化合物が以下の文献に開示されている:非特許文献2〜4(非特許文献5に要約されている)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】国際公開第03/004458号パンフレット
【特許文献2】国際公開第99/07733号パンフレット
【特許文献3】国際公開第99/07734号パンフレット
【特許文献4】国際公開第00/09558号パンフレット
【特許文献5】国際公開第00/09543号パンフレット
【特許文献6】国際公開第00/59929号パンフレット
【特許文献7】国際公開第03/064416号パンフレット
【特許文献8】国際公開第03/064455号パンフレット
【特許文献9】国際公開第03/064456号パンフレット
【特許文献10】国際公開第2004/030670号パンフレット
【特許文献11】国際公開第2004/037855号パンフレット
【特許文献12】国際公開第2004/039833号パンフレット
【特許文献13】国際公開第2004/101602号パンフレット
【特許文献14】国際公開第2004/101605号パンフレット
【特許文献15】国際公開第2004/103996号パンフレット
【特許文献16】国際公開第2005/028501号パンフレット
【特許文献17】国際公開第2005/070955号パンフレット
【特許文献18】国際公開第2006/000085号パンフレット
【特許文献19】国際公開第2006/007700号パンフレット
【特許文献20】国際公開第2006/007708号パンフレット
【特許文献21】国際公開第02/060926号パンフレット
【特許文献22】国際公開第03/053349号パンフレット
【特許文献23】国際公開第03/099274号パンフレット
【特許文献24】国際公開第03/099316号パンフレット
【特許文献25】国際公開第2004/032827号パンフレット
【特許文献26】国際公開第2004/043339号パンフレット
【特許文献27】国際公開第2004/094452号パンフレット
【特許文献28】国際公開第2005/046712号パンフレット
【特許文献29】国際公開第2005/051410号パンフレット
【特許文献30】国際公開第2005/054430号パンフレット
【特許文献31】国際公開第2004/072243号パンフレット
【特許文献32】国際公開第2004/093798号パンフレット
【特許文献33】国際公開第2004/113365号パンフレット
【特許文献34】国際公開第2005/010029号パンフレット
【特許文献35】国際公開第2005/037214号パンフレット
【特許文献36】国際公開第01/77113号パンフレット
【特許文献37】国際公開第01/81325号パンフレット
【特許文献38】国際公開第02/08187号パンフレット
【特許文献39】国際公開第02/08198号パンフレット
【特許文献40】国際公開第02/08244号パンフレット
【特許文献41】国際公開第02/08256号パンフレット
【特許文献42】国際公開第02/48172号パンフレット
【特許文献43】国際公開第03/062228号パンフレット
【特許文献44】国際公開第03/062265号パンフレット
【特許文献45】国際公開第2005/021584号パンフレット
【特許文献46】国際公開第2005/030796号パンフレット
【特許文献47】国際公開第2005/058821号パンフレット
【特許文献48】国際公開第2005/051980号パンフレット
【特許文献49】国際公開第2005/085197号パンフレット
【特許文献50】国際公開第2005/085242号パンフレット
【特許文献51】国際公開第2005/085275号パンフレット
【特許文献52】国際公開第2005/087721号パンフレット
【特許文献53】国際公開第2005/087725号パンフレット
【特許文献54】国際公開第2005/087730号パンフレット
【特許文献55】国際公開第2005/087731号パンフレット
【特許文献56】国際公開第2005/107745号パンフレット
【特許文献57】国際公開第2005/113581号パンフレット
【特許文献58】国際公開第02/04425号パンフレット
【特許文献59】国際公開第03/007945号パンフレット
【特許文献60】国際公開第03/010140号パンフレット
【特許文献61】国際公開第03/010141号パンフレット
【特許文献62】国際公開第2004/064925号パンフレット
【特許文献63】国際公開第2004/065367号パンフレット
【特許文献64】国際公開第2005/080388号パンフレット
【特許文献65】国際公開第2006/007693号パンフレット
【特許文献66】国際公開第01/47883号パンフレット
【特許文献67】国際公開第03/000254号パンフレット
【特許文献68】国際公開第03/026587号パンフレット
【特許文献69】国際公開第03/101993号パンフレット
【特許文献70】国際公開第2004/087714号パンフレット
【特許文献71】国際公開第2005/012288号パンフレット
【特許文献72】国際公開第2005/014543号パンフレット
【特許文献73】国際公開第2005/049622号パンフレット
【特許文献74】国際公開第2005/121132号パンフレット
【非特許文献】
【0005】
【非特許文献1】Kolykhalov, A.A.; Mihalik, K.; Feinstone, S.M.; Rice, C.M.; 2000; J. Virol. 74: 2046-2051
【非特許文献2】Thor, M., et al, Bioorganic & Medicinal Chemistry Letters(2002) 12: 3565-3567
【非特許文献3】Ostberg, T., et al, Journal of Biological Chemistry(2004) 279(39): 41124-41130
【非特許文献4】Hemalatha, R., et al, E-Journal of Chemistry(2004) 1(5): 243-250
【非特許文献5】Chemical Abstracts 142: 190216
【非特許文献6】Protective Groups in Organic Chemistry”, John Wiley & Sons, New York(1981)
【非特許文献7】S.M. Birge et al., J. Pharm. Sci., 1977, 66, pp. 1-19
【非特許文献8】Design of Prodrugs, Bundgaard, H. Ed. Elsevier(1985)
【非特許文献9】Chiral Separation Techniques: A Practical Approach(2nd Ed.), G. Subramanian(ed.), Wiley-VCH, 2000
【非特許文献10】T.E. Beesley and R.P.W. Scott, Chiral Chromatography, John Wiley & Sons, 1999
【非特許文献11】Satinder Ahuja, Chiral Separations by Chromatography, Am. Chem. Soc., 2000
【非特許文献12】Remington: The Science and Practice of Pharmacy, 21st Edition, Lippincott Williams & Wilkins, 2005
【非特許文献13】L.V. Allen, N.G. Popovish and H.C. Ansel, Pharmaceutical Dosage Forms and Drug Delivery Systems, 8th ed., Lippincott Williams & Wilkins, 2004
【非特許文献14】Abdel-Magid, A. F.; Carson, K. G.; Harris, B. D.; Maryanoff, C. A.; Shah, R. D. J. Org. Chem. 1996, 61, 3849
【非特許文献15】W.C. Still et al., J. Org. Chem.,(1978), 43, 2923
【非特許文献16】Abdel-Magid, A. F.; Carson, K. G.; Harris, B. D.; Maryanoff, C. A.; Shah, R. D. J. Org. Chem. 1996, 61, 3849
【非特許文献17】Elizabeth Buck, E.; Song, Z. J. Organic Syntheses 82, 2005, 69
【非特許文献18】Takagi, K. Chem. Lett. 1985, 1307
【非特許文献19】Hennessy, E. J.; Buchwald, S. L. Org. Lett. 2002, 4, 269
【非特許文献20】Abdel-Magid, A. F.; Carson, K. G.; Harris, B. D.; Maryanoff, C. A.; Shah, R. D. J. Org. Chem. 1996, 61, 3849
【非特許文献21】Takagi, K. Chem. Lett.(1985), 14: 1307
【非特許文献22】Tanaka, K.; Suzuki, T.; Maeno, S.; Mitsuhashi, K. J. Heterocycl. Chem. 1986, 23, 1537
【非特許文献23】McKercher et al.,(2004) Nucleic Acids Res. 32: 422-431
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、HCVポリメラーゼに対する阻害活性を有する一連の新規化合物を提供する。特に、この発明の化合物は、HCVの、RNA依存性RNAポリメラーゼ、特にHCVによってコードされる酵素NS5BによるRNA合成を阻害する。この発明で提供する化合物のさらなる利点は、該化合物が他のポリメラーゼに対して低い乃至非常に低い活性であり、又は有意な活性がない場合さえあることである。当業者には、以下の説明及び実施例からこの発明のさらなる目的が明白になるだろう。
【課題を解決するための手段】
【0007】
本発明の一局面は、下記式(I)の化合物又はその塩若しくはエステルを提供する。
【化2】

【0008】
(式中:
XはO及びSから選択され;
R2は、任意に1〜5個のR20置換基で置換されていてもよいHetであり、ここで、R20は各場合独立に下記基:
a)ハロ、シアノ又はニトロ;
b)R7、-C(=O)-R7、-C(=O)-O-R7、-O-R7、-S-R7、-SO-R7、-SO2-R7、-(C1-6)アルキレン-R7、-(C1-6)アルキレン-C(=O)-R7、-(C1-6)アルキレン-C(=O)-O-R7、-(C1-6)アルキレン-O-R7、-(C1-6)アルキレン-S-R7、-(C1-6)アルキレン-SO-R7又は-(C1-6)アルキレン-SO2-R7
(ここで、R7は各場合独立にH、(C1-6)アルキル、(C2-6)アルケニル、(C2-6)アルキニル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、アリール及びHetから選択され;
前記(C1-6)アルキルは任意に、-OH、-O-(C1-6)アルキル、シアノ、COOH、-NH2、-NH(C1-4)アルキル、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル及び-N((C1-4)アルキル)2からそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;かつ
前記各アリール及びHetは任意に、下記基:
i)ハロ、シアノ、オキソ、チオキソ、イミノ、-OH、-O-(C1-6)アルキル、-O-(C1-6)ハロアルキル、(C3-7)シクロアルキル、(C1-6)ハロアルキル、-C(=O)-(C1-6)アルキル、-SO2(C1-6)アルキル、-C(=O)-NH2、-C(=O)-NH(C1-4)アルキル、-C(=O)-N((C1-4)アルキル)2、-C(=O)-NH(C3-7)シクロアルキル、-C(=O)-N((C1-4)アルキル)(C3-7)シクロアルキル、-NH2、-NH(C1-4)アルキル、-N((C1-4)アルキル)2、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル又は-NH-C(=O)(C1-4)アルキル;
ii)任意に-OH、-O-(C1-6)ハロアルキル、又は-O-(C1-6)アルキルで置換されていてもよい(C1-6)アルキル;及び
iii)アリール又はHet(各アリール及びHetは任意にハロ又は(C1-6)アルキルで置換されていてもよい)
からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);及び
c)-N(R8)R9、-C(=O)-N(R8)R9、-O-C(=O)-N(R8)R9、-SO2-N(R8)R9、-(C1-6)アルキレン-N(R8)R9、-(C1-6)アルキレン-C(=O)-N(R8)R9、-(C1-6)アルキレン-O-C(=O)-N(R8)R9、又は-(C1-6)アルキレン-SO2-N(R8)R9(ここで、
R8は、各場合独立にH、(C1-6)アルキル及び(C3-7)シクロアルキルから選択され;かつ
R9は、各場合独立にR7、-(C1-6)アルキレン-R7、-SO2-R7、-C(=O)-R7、-C(=O)OR7及び-C(=O)N(R8)R7から選択され;R7及びR8は前記定義どおりである)
から選択され;
【0009】
R3は、H、ハロ、(C1-4)アルキル、-O-(C1-4)アルキル、-S-(C1-4)アルキル、-NH2、-NH(C1-4)アルキル、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル及び-N((C1-4)アルキル)2から選択され;
R5は、H、(C1-6)アルキル、(C3-7)シクロアルキル又はHetであり;該(C1-6)アルキル及びHetはそれぞれ任意に、(C1-6)アルキル、Het、-OH、-COOH、-C(=O)-(C1-6)アルキル、-C(=O)-O-(C1-6)アルキル、-SO2(C1-6)アルキル及び-C(=O)-N(R51)R52からそれぞれ独立に選択される1〜4個の置換基で置換されていてもよく
(ここで、R51はH、(C1-6)アルキル又は(C3-7)シクロアルキルであり;かつ
R52はH、(C1-6)アルキル、(C3-7)シクロアルキル、アリール、Het、アリール-(C1-3)アルキル-又はHet-(C1-3)アルキル-であり;
該(C1-6)アルキル、(C3-7)シクロアルキル、アリール、Het、アリール-(C1-3)アルキル-及びHet-(C1-3)アルキル-はそれぞれ任意に、(C1-6)アルキル、(C1-6)ハロアルキル、ハロ、オキソ、-OH、-O(C1-6)アルキル、-NH2、-NH(C1-6)アルキル、-N((C1-6)アルキル)2、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル、-C(=O)(C1-6)アルキル及び-NHC(=O)-(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよく;
或いはR51とR52が、それらが結合しているNと一緒に結合して、任意にさらにそれぞれ独立にN、O及びSから選択される1〜3個のヘテロ原子を含有してよい4員〜7員のヘテロ環を形成し(ここで、各Sヘテロ原子は独立に、かつ可能な場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;
前記ヘテロ環は任意に、(C1-6)アルキル、(C1-6)ハロアルキル、ハロ、オキソ、-OH、-O(C1-6)アルキル、-NH2、-NH(C1-6)アルキル、-N((C1-6)アルキル)2、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル、-C(=O)(C1-6)アルキル及び-NHC(=O)-(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);
R6は(C3-7)シクロアルキル又はアリールであり;
【0010】
該(C3-7)シクロアルキル及びアリールはそれぞれ任意、ハロ、(C1-6)アルキル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、-OH、-SH、-O-(C1-4)アルキル及び-S-(C1-4)アルキルからそれぞれ独立に選択される1〜5個の置換基で置換されていてもよく;かつ
Hetは、O、N及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を有する4員〜7員の飽和、不飽和若しくは芳香族ヘテロ環、又は可能な限り、O、N及びSからそれぞれ独立に選択される1〜5個のヘテロ原子を有する7員〜14員の飽和、不飽和若しくは芳香族ヘテロ多環であり;ここで、各Nヘテロ原子は独立に、かつ可能な場合、さらに酸素原子に結合してN-オキシド基を形成するように酸化状態で存在してよく、各Sヘテロ原子は独立に、かつ可能な場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;
但し、R2が下記基:
【化3】

【0011】
から選択され;
XがOであり;R3がHであり;かつR5がHである場合、
R6は下記基でない。)
【化4】

【0012】
この発明の別の局面は、薬物としての式(I)の化合物、又はその医薬的に許容しうる塩若しくはエステルを提供する。
この発明のさらに別の局面は、治療的に有効な量の式(I)の化合物又はその医薬的に許容しうる塩若しくはエステル;及び1種以上の医薬的に許容しうる担体を含んでなる医薬組成物を提供する。
この局面の実施形態では、この発明の医薬組成物は、さらに少なくとも1種の他の抗ウイルス薬を含む。
本発明は、上述した医薬組成物の、C型肝炎ウイルスに感染しているか又は感染している危険のある哺乳動物のC型肝炎ウイルス感染症の治療のための使用をも提供する。
本発明のさらなる局面は、C型肝炎ウイルスに感染しているか又は感染している危険のある哺乳動物のC型肝炎ウイルス感染症の治療方法であって、前記哺乳動物に治療的に有効な量の式(I)の化合物、その医薬的に許容しうる塩若しくはエステル、又はその上述したような組成物を投与する工程を含んでなる方法に関する。
C型肝炎ウイルスに感染しているか又は感染している危険のある哺乳動物のC型肝炎ウイルス感染症の治療方法であって、前記哺乳動物に治療的に有効な量の式(I)の化合物又はその医薬的に許容しうる塩若しくはエステルと、少なくとも1種の他の抗ウイルス薬との組合せ;或いはその組成物を投与する工程を含んでなる方法に関する。
また、上述したような式(I)の化合物、又はその医薬的に許容しうる塩若しくはエステルの、C型肝炎ウイルスに感染しているか又は感染している危険のある哺乳動物のC型肝炎ウイルス感染症の治療用薬物の製造のための使用も、この発明の範囲内である。
この発明のさらなる局面は、C型肝炎ウイルス感染症の治療に有効な組成物;及び該組成物を用いて、C型肝炎ウイルスによる感染症を治療できることを示すラベルを含んでなり;前記組成物が、この発明の式(I)の化合物又はその医薬的に許容しうる塩若しくはエステルを含む、製品に関する。
この発明のさらに別の局面は、C型肝炎ウイルスの複製の阻害方法であって、C型肝炎ウイルスの複製が阻害される条件下で、前記ウイルスを有効量の式(I)の化合物、又はその塩若しくはエステルに曝露する工程を含んでなる方法に関する。
さらに、式(I)の化合物、又はその塩若しくはエステルの、C型肝炎ウイルスの複製を阻害するための使用が本発明の範囲に包含される。
【発明を実施するための形態】
【0013】
〔発明の詳細な説明〕
(定義)
本明細書では、特に断らない限り、以下の定義を適用する。
本明細書では、特に断らない限り、用語「置換基」は、そうでなければ少なくとも1つの水素原子に結合されるであろう、炭素原子、ヘテロ原子又は分子若しくはそのフラグメントの一部を形成しうるいずれかの他の原子に結合されうる原子、遊離基又は基を意味するものとする。特定の分子又はそのフラグメントの文脈で想定される置換基は、当業者にいは認識されるように、化学的に安定な化合物を生じさせる当該置換基である。
本明細書では、単独又は別の基と組み合わせた用語「(C1-n)アルキレン」(nは整数)は、1〜n個の炭素原子を含む非環式の直鎖若しくは分岐鎖の二価アルキル基を意味するものとする。「(C1-6)アルキレン」として、限定するものではないが、-CH2-、-CH2CH2-、及び下記基が挙げられる。
【化5】

【0014】
本明細書では、単独又は別の基と組み合わせた用語「(C2-n)アルケニル」(nは整数)は、2〜n個の炭素原子を含有し、その少なくとも2個が相互に二重結合でつながれている不飽和の非環式の直鎖若しくは分岐鎖基を意味するものとする。該基の例として、限定するものではないが、エテニル(ビニル)、1-プロペニル、2-プロペニル、及び1-ブテニルが挙げられる。特に断らない限り、用語「(C2-n)アルケニル」は、可能な場合、個々の立体異性体を包含するものと解釈し、限定するものではないが、(E)及び(Z)異性体、並びにその混合物が挙げられる。(C2-n)アルケニル基が置換される場合、特に断らない限り、当業者には分かるように、そうでなければ水素原子を持つであろう、該基のいずれの炭素原子上でも、該置換が化学的に安定な化合物を生じさせるように、置換されるものと解釈する。
本明細書では、単独又は別の基と組み合わせた用語「(C2-n)アルキニル」(nは整数)は、2〜n個の炭素原子を含有し、その少なくとも2個が相互に三重結合でつながれている不飽和の非環式の直鎖若しくは分岐鎖基を意味するものとする。該基の例として、限定するものではないが、エチニル、1-プロピニル、2-プロピニル及び1-ブチニルが挙げられる。(C2-n)アルキニル基が置換される場合、特に断らない限り、当業者には分かるように、そうでなければ水素原子を持つであろう、該基のいずれの炭素原子上でも、該置換が化学的に安定な化合物を生じさせるように、置換されるものと解釈する。
本明細書では、単独又は別の基と組み合わせた用語「(C3-m)シクロアルキル」(mは整数)は、3〜m個の炭素原子を含有するシクロアルキル置換基を意味するものとし、限定するものではないが、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル及びシクロヘプチルが挙げられる。
本明細書では、単独又は別の基と組み合わせた用語「(C3-m)シクロアルキル-(C1-n)アルキル-」(n及びmは両方とも整数)は、それ自体、前記定義どおりの3〜m個の炭素原子を含有するシクロアルキルで置換されている、前記定義どおりの1〜n個の炭素原子を有するアルキル基を意味するものとする。(C3-7)シクロアルキル-(C1-6)アルキル-の例として、限定するものではないが、シクロプロピルメチル、シクロブチルメチル、シクロペンチルメチル、シクロヘキシルメチル、1-シクロプロピルエチル、2-シクロプロピルエチル、1-シクロブチルエチル、2-シクロブチルエチル、1-シクロペンチルエチル、2-シクロペンチルエチル、1-シクロヘキシルエチル及び2-シクロヘキシルエチルが挙げられる。(C3-m)シクロアルキル-(C1-n)アルキル-基が置換される場合、特に断らない限り、置換基は、シクロアルキル若しくはそのアルキル部分又はその両方に結合しうるものと解釈する。
本明細書では、単独又は別の基と組み合わせた用語「アリール」は、6個の炭素原子を含有する炭素環式芳香族単環式基を意味し、さらに第2の5員又は6員炭素環式基(芳香族、飽和又は不飽和でよい)に縮合しうる。アリールとして、限定するものではないが、フェニル、インダニル、インデニル、1-ナフチル、2-ナフチル、テトラヒドロナフチル及びジヒドロナフチルが挙げられる。
本明細書では、単独又は別の基と組み合わせた用語「アリール-(C1-n)アルキル-」(nは整数)は、それ自体、前記定義どおりのアリールで置換されている、前記定義どおりの1〜n個の炭素原子を有するアルキル基を意味する。アリール-(C1-n)アルキル-の例として、限定するものではないが、フェニルメチル(ベンジル)、1-フェニルエチル、2-フェニルエチル及びフェニルプロピルが挙げられる。アリール-(C1-n)アルキル-基が置換される場合、特に断らない限り、置換基は、アリール若しくはそのアルキル部分又はその両方に結合しうるものと解釈する。
【0015】
本明細書では、単独又は別の基と組み合わせた用語「Het」は、O、N及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を有する4員〜7員の飽和、不飽和若しくは芳香族ヘテロ環、又は可能な限り、O、N及びSからそれぞれ独立に選択される1〜5個のヘテロ原子を有する7員〜14員の飽和、不飽和若しくは芳香族ヘテロ多環を意味し;特に断らない限り、各Nヘテロ原子は独立に、かつ可能な場合、さらに酸素原子に結合してN-オキシド基を形成するように酸化状態で存在してよく、かつ各Sヘテロ原子は独立に、かつ可能な場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在しうるものとする。Het基が置換される場合、置換基は、特に断らない限り、そうでなければ水素原子を持つであろう、Het基のいずれの炭素原子又はヘテロ原子にも結合しうるものと解釈する。
本明細書では、特に断らない限り、単独又は別の基と組み合わせた用語「Het-(C1-n)アルキル-」(nは整数)は、それ自体、前記定義どおりのHet置換基で置換されている、前記定義どおりの1〜n個の炭素原子を有するアルキル基を意味するものとする。Het-(C1-n)アルキル-の例として、限定するものではないが、チエニルメチル、フリルメチル、ピペリジニルエチル、2-ピリジニルメチル、3-ピリジニルメチル、4-ピリジニルメチル、キノリニルプロピル等が挙げられる。Het-(C1-n)アルキル-基が置換される場合、置換基は、特に断らない限り、Het若しくはそのアルキル部分又は両方に結合しうるものと解釈する。
本明細書では、用語「ヘテロ原子」はO、S又はNを意味するものとする。
本明細書では、特に断らない限り、単独又は別の基と組み合わせた用語「ヘテロ環」は、O、N及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する4員〜7員の飽和、不飽和若しくは芳香族ヘテロ環;又はそれから水素原子を除去して得られる一価基を意味するものとする。該ヘテロ環の例として、限定するものではないが、アゼチジン、ピロリジン、テトラヒドロフラン、テトラヒドロチオフェン、チアゾリジン、オキサゾリジン、ピロール、チオフェン、フラン、ピラゾール、イミダゾール、イソキサゾール、オキサゾール、イソチアゾール、チアゾール、トリアゾール、テトラゾール、ピペリジン、ピペラジン、アゼピン、ジアゼピン、ピラン、1,4-ジオキサン、4-モルフォリン、4-チオモルフォリン、ピリジン、ピリジン-N-オキシド、ピリダジン、ピラジン、ピリミジン、及び以下のヘテロ環:
【0016】
【化6】

並びにその飽和、不飽和及び芳香族誘導体が挙げられる。
本明細書では、特に断らない限り、単独又は別の基と組み合わせた用語「ヘテロ多環」は、1つ以上の他の環、例えば炭素環、ヘテロ環若しくはいずれかの他の環に縮合している、前記定義どおりのヘテロ環;又はそれから水素原子を除去して得られる一価基を意味するものとする。該ヘテロ多環の例として、限定するものではないが、インドール、イソインドール、ベンゾイミダゾール、ベンゾチオフェン、ベンゾフラン、ベンゾジオキソール、ベンゾチアゾール、キノリン、イソキノリン、ナフチリジン、及び下記ヘテロ多環:
【0017】
【化7】

並びにその飽和、不飽和及び芳香族誘導体が挙げられる。
【0018】
本明細書では、用語「ハロ」は、フルオロ、クロロ、ブロモ又はヨードから選択されるハロゲン置換基を意味するものとする。
本明細書では、単独又は別の基と組み合わせた用語「(C1-n)ハロアルキル」(nは整数)は、1個以上の水素原子がそれぞれハロ置換基と置き換わっている、前記定義どおりの1〜n個の炭素原子を有するアルキル基を意味するものとする。(C1-n)ハロアルキルの例として、限定するものではないが、クロロメチル、クロロエチル、ジクロロエチル、ブロモメチル、ブロモエチル、ジブロモエチル、フルオロメチル、ジフルオロメチル、トリフルオロメチル、フルオロエチル及びジフルオロエチルが挙げられる。
本明細書で相互交換可能に使用される、単独又は別の基と組み合わせた用語「-O-(C1-n)アルキル」又は「(C1-n)アルコキシ」(nは整数)は、酸素原子が、さらに前記定義どおりの1〜n個の炭素原子を有するアルキル基に結合していることを意味するものとする。-O-(C1-n)アルキルの例として、限定するものではないが、メトキシ(CH3O-)、エトキシ(CH3CH2O-)、プロポキシ(CH3CH2CH2O-)、1-メチルエトキシ(イソ-プロポキシ;(CH3)2CH-O-)及び1,1-ジメチルエトキシ(tert-ブトキシ;(CH3)3C-O-)が挙げられる。-O-(C1-n)アルキル基が置換される場合、その(C1-n)アルキル部分上で置換されるものと解釈する。
本明細書で相互交換可能に使用される、単独又は別の基と組み合わせた用語「-S-(C1-n)アルキル」又は「(C1-n)アルキルチオ」(nは整数)は、イオウ原子が、さらに前記定義どおりの1〜n個の炭素原子を有するアルキル基に結合していることを意味するものとする。-S-(C1-n)アルキルの例として、限定するものではないが、メチルチオ(CH3S-)、エチルチオ(CH3CH2S-)、プロピルチオ(CH3CH2CH2S-)、1-メチルエチルチオ(イソプロピルチオ; (CH3)2CH-S-)及び1,1-ジメチルエチルチオ(tert-ブチルチオ;(CH3)3C-S-)が挙げられる。-S-(C1-n)アルキル基又はその酸化誘導体、例えば-SO-(C1-n)アルキル基又は-SO2-(C1-n)アルキル基が置換される場合、それぞれその(C1-n)アルキル部分で置換されるものと解釈する。
本明細書では、用語「オキソ」は、置換基として二重結合(=O)によって炭素原子に結合している酸素原子を意味するものとする。
本明細書では、用語「チオキソ」は、置換基として二重結合(=S)によって炭素原子に結合しているイオウ原子を意味するものとする。
本明細書では、用語「イミノ」は、置換基として二重結合(=NH)によって炭素原子に結合しているNH基を意味するものとする。
本明細書では、用語「COOH」は、カルボキシル基(-C(=O)-OH)を意味するものとする。当業者には、カルボキシル基が官能基等価物で代用されうることが周知である。この発明で想定される該官能基等価物として、限定するものではないが、エステル、アミド、イミド、ボロン酸、ホスホン酸、リン酸、テトラゾール、トリアゾール、N-アシルスルファミド(RCONHSO2NR2)、及びN-アシルスルホンアミド(RCONHSO2R)が挙げられる。
【0019】
本明細書では、用語「能基等価物」は、同様の電子、混成又は結合特性を有する別の原子又は基に取って代わりうる原子又は基を意味するものとする。
本明細書では、用語「保護基」は、合成変換中に使用できる保護基を意味するものとし、限定するものではないが、非特許文献6、及びそのさらに最近の版に列挙される例が挙げられる。
サブ式では、次の記号を用いて被定義分子の残部に連結される結合を示す。
【化8】

【0020】
本明細書では、用語「その塩」は、本発明の化合物のいずれの酸付加塩及び/又は塩基付加塩をも意味するものとし、限定するものではないが、その医薬的に許容しうる塩が挙げられる。
本明細書では、用語「医薬的に許容しうる塩」は、ゾンデ医療判断の範囲内で、 過度の毒性、刺激、アレルギー反応等なしでヒト及び下等動物の組織と接触させて使うのに適し、合理的な利益/危険比で釣り合い、一般的に水若しくは油に可溶性又は分散性であり、かつその意図した用途に有効な、本発明の化合物の塩を意味するものとする。この用語は、医薬的に許容しうる酸付加塩及び医薬的に許容しうる塩基付加塩を包含する。好適な塩のリストは、例えば、非特許文献7で見つかる。
本明細書では、用語「医薬的に許容しうる酸付加塩」は、該遊離塩基の生物学的有効性及び特性を保持し、かつ生物学的又はそれ以外でも望ましくなくなく、無機酸(限定するものではないが、塩酸、臭化水素酸、硫酸、スルファミン酸、硝酸、リン酸が挙げられる)、及び有機酸(限定するものではないが、酢酸、トリフルオロ酢酸、アジピン酸、アスコルビン酸、アスパラギン酸、ベンゼンスルホン酸、安息香酸、酪酸、ショウノウ酸、ショウノウスルホン酸、ケイ皮酸、クエン酸、ジグルコン酸、エタンスルホン酸、グルタミン酸、グリコール酸、グリセロリン酸、ヘミスルフィン酸、ヘキサン酸、ギ酸、フマル酸、2-ヒドロキシエタンスルホン酸(イセチオン酸)、乳酸、ヒドロキシマレイン酸、リンゴ酸、マロン酸、マンデル酸、メシチレンスルホン酸、メタンスルホン酸、ナフタレンスルホン酸、ニコチン酸、2-ナフタレンスルホン酸、シュウ酸、パモン酸、ペクチン酸、フェニル酢酸、3-フェニルプロピオン酸、ピバル酸、プロピオン酸、ピルビン酸、サリチル酸、ステアリン酸、コハク酸、スルファニル酸、酒石酸、p-トルエンスルホン酸、ウンデカン酸などが挙げられる)と形成される当該塩を意味するものとする。
本明細書では、用語「医薬的に許容しうる塩基付加塩」は、該遊離酸の生物学的有効性及び特性を保持し、かつ生物学的又はそれ以外でも望ましくなくなく、無機塩基(限定するものではないが、アンモニア或いはアンモニウム又は金属カチオン、例えばナトリウム、カリウム、リチウム、カルシウム、マグネシウム、鉄、亜鉛、銅、マンガン、アルミニウム等の水酸化物、炭酸塩、又は炭酸水素塩が挙げられる)と形成される当該塩を意味するものとする。特に好ましくはアンモニウム、カリウム、ナトリウム、カルシウム、及びマグネシウム塩である。医薬的に許容しうる無毒の有機塩基から誘導される塩として、限定するものではないが、一級、二級、及び三級アミン、四級アミン化合物、置換アミン(天然に存在する置換アミンを含む)、環式アミン及び塩基性イオン交換樹脂、例えばメチルアミン、ジメチルアミン、トリメチルアミン、エチルアミン、ジエチルアミン、トリエチルアミン、イソプロピルアミン、トリプロピルアミン、トリブチルアミン、エタノールアミン、ジエタノールアミン、2-ジメチルアミノエタノール、2-ジエチルアミノエタノール、ジシクロヘキシルアミン、リジン、アルギニン、ヒスチジン、カフェイン、ヒドラバミン、コリン、ベタイン、エチレンジアミン、グルコサミン、メチルグルカミン、テオブロミン、プリン、ピペラジン、ピペリジン、N-エチルピペリジン、テトラメチルアンモニウム化合物、テトラエチルアンモニウム化合物、ピリジン、N,N-ジメチルアニリン、N-メチルピペリジン、N-メチルモルフォリン、ジシクロヘキシルアミン、ジベンジルアミン、N,N-ジベンジルフェネチルアミン、1-エフェナミン、N,N'-ジベンジルエチレンジアミン、ポリアミン樹脂などの塩が挙げられる。特に好ましい無毒の有機塩基は、イソプロピルアミン、ジエチルアミン、エタノールアミン、トリメチルアミン、ジシクロヘキシルアミン、コリン、及びカフェインである。
【0021】
本明細書では、用語「そのエステル」は、該分子のいずれかの-COOH置換基が-COOR置換基と置き換わっている、本発明の化合物のいずれのエステルをも意味するものとし、該エステルのR成分は、安定したエステル成分を形成するいずれかの炭素含有基であり、限定するものではないが、アルキル、アルケニル、アルキニル、シクロアルキル、シクロアルキルアルキル、アリール、アリールアルキル、ヘテロサイクリル、ヘテロサイクリルアルキル(それぞれ任意にさらに置換されていてもよい)が挙げられる。用語「そのエステル」は、限定するものではないが、その医薬的に許容しうるエステルを包含する。
本明細書では、用語「医薬的に許容しうるエステル」は、該分子のいずれかのCOOH置換基が-COOR置換基と置き換わっている、本発明の化合物のエステルであって、該エステルのR成分がアルキル(限定するものではないが、メチル、エチル、プロピル、1-メチルエチル、1,1-ジメチルエチル、ブチルが挙げられる);アルコキシアルキル(限定するものではないが、メトキシメチルが挙げられる);アシルオキシアルキル(限定するものではないが、アセトキシメチルが挙げられる);アリールアルキル(限定するものではないが、ベンジルが挙げられる);アリールオキシアルキル(限定するものではないが、フェノキシメチルが挙げられる);及び任意にハロゲン、(C1-4)アルキル又は(C1-4)アルコキシで置換されていてもよいアリール(限定するものではないが、フェニルが挙げられる)から選択されるエステルを意味するものとする。他の適切なエステルは、本明細書で援用される非特許文献8で見つかる。このような医薬的に許容しうるエステルは、哺乳動物に注入されると、通常、in vivo加水分解されて、本発明の化合物の酸形態に変換される。前記エステルについては、特に断らない限り、存在するいずれのアルキル成分も好ましくは1〜16個の炭素原子、さらに好ましくは1〜6個の炭素原子を含む。該エステル中に存在するいずれのアリール成分も、好ましくはフェニル基を含む。特に、エステルは(C1-16)アルキルエステル、無置換ベンジルエステル又は少なくとも1個のハロゲン、(C1-6)アルキル、(C1-6)アルコキシ、ニトロ若しくはトリフルオロメチルで置換されているベンジルエステルでよい。
【0022】
本明細書では、用語「哺乳動物」は、C型肝炎ウイルスに感染している疑いのあるヒト、及び非ヒト哺乳動物を包含するものとする。非ヒト哺乳動物として、限定するものではないが、例えばウシ、ブタ、ウマ、イヌ、ネコ、ウサギ、ラット及びマウス、並びに非家畜が挙げられる。
本明細書では、用語「治療」は、C型肝炎の症状を軽減若しくは排除するため、及び/又は患者のウイルス負荷を減らすために本発明の化合物又は組成物を投与することを意味するものとする。用語「治療」は、個体のC型肝炎ウイルスへの曝露後であるが、該疾患の症状の出現前、及び/又は血液中で該ウイルスが検出される前に、該疾患の症状の出現を予防し、及び/又は該ウイルスが血中で検出可能レベルに達するのを予防するために本発明の化合物又は組成物を投与することをも包含する。
用語「治療的に有効な量」とは、治療が必要な患者に投与するとき、本発明の化合物が効用を有する疾患状態、状況、又は障害の治療を達成するのに十分な本化合物の量を意味する。このような量は、研究者又は臨床医が求める組織系又は患者の生物学的又は医学的応答を刺激するのに十分な量であろう。治療的に有効な量を構成する本発明の化合物の量は、化合物とその生物学的活性、投与のために用いられる組成物、投与の時間、投与の経路、本該化合物の排泄の速度、治療の持続期間、治療される疾患状態又は障害とその重症度、本発明の化合物と組み合わせて又は同時に使用される薬物、並びに患者の年齢、体重、全身の健康、性別及び食餌などの因子によって変化するだろう。当業者は、自分自身の知識、最新技術、及びこの開示を顧慮して、日常的にこのような治療的に有効な量を決定することができる。
本明細書では、用語「抗ウイルス薬」は、哺乳動物においてウイルスの形成及び/又は複製を阻害するために有効な薬剤を意味するものとし、限定するものではないが、哺乳動物内におけるウイルスの形成及び/又は複製に必要な宿主又はウイルスの機構のどちらかを妨害する薬剤が挙げられる。
【0023】
〔好ましい実施形態〕
以下の好ましい実施形態で本発明の化合物の基及び置換基を詳細に説明する。
X:
X-A:一実施形態では、XはOである。
X-B:別の実施形態では、XはSである。
本明細書で述べるXのいずれの及びそれぞれ個々の定義も本明細書で述べるR2、R3、R5及びR6のいずれの及びそれぞれ個々の定義と組み合わせうる。
R2:
Het-A:一実施形態では、R2はHetであり、Hetは、O、N及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有する5員若しくは6員ヘテロ環、又はO、N及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有する9員若しくは10員二環式ヘテロ多環であり;このときHetは、任意に1〜5個のR20置換基(R20は前記定義どおり)で置換されていてもよい。
Het-B:別の実施形態では、R2はHetであり、Hetは、1若しくは2個のNヘテロ原子を含有する5員若しくは6員芳香族ヘテロ環、又は1若しくは2個のNヘテロ原子を含有する9員若しくは10員二環式ヘテロ多環であり;このときHetは、任意に1〜3個のR20置換基(R20は前記定義どおり)で置換されていてもよい。
Het-C:別の実施形態では、R2は、下記基から選択されるHetであり;
【0024】
【化9】

【0025】
このときHetは、任意に1〜3個のR20置換基(R20は前記定義どおり)で置換されていてもよい。
Het-D:別の実施形態では、R2は下記式のHetであり;
【化10】

【0026】
このときHetは、任意に1〜3個のR20置換基(R20は前記定義どおり)で置換されていてもよい。
Het-E:別の実施形態では、R2は下記式のHetであり;
【化11】

【0027】
式中、R23は前記定義どおりのR20である。
R20-A:一実施形態では、R20は下記基:
a)ハロ、シアノ又はニトロ;
b)R7、-(C1-6)アルキレン-R7、-C(=O)-R7、-O-R7、-C(=O)-O-R7、-(C1-6)アルキレン-O-R7、-S-R7、-SO2-R7、-(C1-6)アルキレン-S-R7又は-(C1-6)アルキレン-SO2-R7
(ここで、R7は各場合独立にH、(C1-6)アルキル、(C2-6)アルケニル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、アリール及びHetから選択され;前記Hetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する5員若しくは6員ヘテロ環であり、又はHetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する9員若しくは10員ヘテロ多環であり;各Nヘテロ原子は独立に、かつ可能な場合、さらに酸素原子に結合してN-オキシド基を形成するように酸化状態で存在してよく、及び各Sヘテロ原子は独立に、かつ可能な場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;かつ
前記(C1-6)アルキルは任意に、-OH、-O-(C1-6)アルキル及びCOOHからそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;かつ
前記アリール及びHetはそれぞれ任意に、ハロ、シアノ、オキソ、イミノ、-OH、-O-(C1-6)アルキル、-NH2、-NH(C1-4)アルキル、-N((C1-4)アルキル)2、-NH-C(=O)(C1-4)アルキル、(C1-6)アルキル及びHet(ここで、該Hetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する5員又は6員ヘテロ環である)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);及び
c)-N(R8)R9、-(C1-6)アルキレン-N(R8)R9又は-(C1-6)アルキレン-C(=O)-N(R8)R9
(式中、R8は、各場合独立にH及び(C1-6)アルキルから選択されれ;かつ
R9は、各場合独立にR7、-SO2-R7、-C(=O)-R7、-C(=O)OR7及び-C(=O)N(R8)R7から選択され;このときR7とR8は前記定義どおりである)
から選択される。
【0028】
R20-B:別の実施形態では、R20は下記基:
a)ハロ又はシアノ;
b)R7、-(C1-6)アルキレン-R7、-C(=O)-R7、-(C1-6)アルキレン-O-R7、-SO2-R7、-(C1-6)アルキレン-S-R7又は-(C1-6)アルキレン-SO2-R7
(ここで、R7は各場合独立にH、(C1-6)アルキル、(C2-6)アルケニル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、アリール及びHetから選択され;前記Hetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する5員若しくは6員ヘテロ環であり、又はHetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する9員若しくは10員ヘテロ多環であり;各Nヘテロ原子は独立に、かつ可能な場合、さらに酸素原子に結合してN-オキシド基を形成するように酸化状態で存在してよく、及び各Sヘテロ原子は独立に、かつ可能な場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;かつ
前記(C1-6)アルキルは任意に、-OH、-O-(C1-6)アルキル及びCOOHからそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;かつ
前記アリール及びHetはそれぞれ任意に、ハロ、シアノ、オキソ、イミノ、-OH、-O-(C1-6)アルキル、-NH2、-NH(C1-4)アルキル、-N((C1-4)アルキル)2、-NH-C(=O)(C1-4)アルキル、(C1-6)アルキル及びHet(ここで、該Hetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する5員又は6員ヘテロ環である)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);及び
c)-(C1-6)アルキレン-N(R8)R9又は-(C1-6)アルキレン-C(=O)-N(R8)R9
(式中、R8は各場合独立にH及び(C1-6)アルキルから選択され;かつ
R9は各場合独立にR7、-SO2-R7、-C(=O)-R7、-C(=O)OR7及び-C(=O)N(R8)R7から選択され;このときR7とR8は前記定義どおりである)
から選択される。
R20-C:別の実施形態では、R20は下記基:
a)ハロ又はシアノ;
b)R7、-CH2-R7、-C(=O)-R7、-CH2-O-R7、-SO2-R7、-CH2-S-R7又は-CH2-SO2-R7
(ここで、R7は各場合独立にH、(C1-6)アルキル、(C2-6)アルケニル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、フェニル及びHetから選択され;前記Hetは下記基:
【0029】
【化12】

【0030】
から選択され;かつ
前記(C1-6)アルキルは任意に、-OH、-O-(C1-6)アルキル及びCOOHからそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;かつ
前記フェニル及びHetはそれぞれ任意に、ハロ、シアノ、オキソ、イミノ、-OH、-O-(C1-6)アルキル、-NH2、-NH(C1-4)アルキル、-N((C1-4)アルキル)2、-NH-C(=O)(C1-4)アルキル、(C1-6)アルキル及び下記式
【化13】

【0031】
で表される基からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);及び
c)-CH2-N(R8)R9又は-CH2-C(=O)-N(R8)R9
(式中、R8は各場合独立にH及び(C1-6)アルキルから選択され;かつ
R9は各場合独立にR7、-SO2-R7、-C(=O)-R7、-C(=O)OR7及び-C(=O)N(R8)R7から選択され;このときR7とR8は前記定義どおりである)
から選択される。
R20-D:別の実施形態では、R20は下記基:
b)-(C1-3)アルキレン-R7、-(C1-3)アルキレン-O-R7、-(C1-3)アルキレン-S-R7又は-(C1-3)アルキレン-SO2-R7
(式中、R7はHetであり;前記Hetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する5員若しくは6員ヘテロ環であり、又はHetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する9員若しくは10員ヘテロ多環であり;各Nヘテロ原子は独立に、かつ可能な場合、さらに酸素原子に結合してN-オキシド基を形成するように酸化状態で存在してよく、及び各Sヘテロ原子は独立に、かつ可能な場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;
このとき前記Hetは任意に、ハロ、シアノ、オキソ、イミノ、-OH、-O-(C1-6)アルキル、-O-(C1-6)ハロアルキル、(C3-7)シクロアルキル、-NH2、-NH(C1-4)アルキル、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル、-N((C1-4)アルキル)2、-NH-C(=O)(C1-4)アルキル、(C1-6)アルキル及びHetからそれぞれ独立に選択される1〜3個の置換基で置換されていてもよく、前記Hetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する5員又は6員へテロ環である);及び
c)-(C1-3)アルキレン-N(R8)R9(式中、
R8は各場合独立にH、(C1-6)アルキル及び(C3-7)シクロアルキルから選択され;かつ
R9はR7で、R7は前記定義どおりである)
から選択される。
R20-E:別の実施形態では、R20は下記基:
b)-CH2-R7、-CH2CH2-R7、-CH2-O-R7、-CH2-S-R7又は-CH2-SO2-R7
(式中、R7はHetであり;前記Hetは下記基:
【0032】
【化14】

【0033】
から選択され;かつ
前記Hetは任意に、ハロ、シアノ、オキソ、イミノ、-OH、-O-(C1-6)アルキル、-NH2、-NH(C1-4)アルキル、-N((C1-4)アルキル)2、-NH-C(=O)(C1-4)アルキル、(C1-6)アルキル及び下記式
【化15】

【0034】
で表される基からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);及び
c)-CH2-N(R8)R9(式中、
R8は各場合独立にH及び(C1-6)アルキルから選択され;かつ
R9はR7で、R7は前記定義どおりである)
から選択される。
従って、R2の実施形態の例を下表に示す。ここで、各置換基は前記定義に従って定義される。
【0035】

【0036】
R2-J:一実施形態では、R2は下記基:
【化16】

【0037】
【化17】

【0038】
から選択され;
又はR2は下記式:
【化18】

【0039】
の基であり、
式中、R23は下記基:
【化19】

【0040】
【化20】

【0041】
【化21】

【0042】
【化22】

【0043】
【化23】

【0044】
から選択される。
本明細書で述べるR2のいずれの及びそれぞれ個々の定義も本明細書で述べるX、R3、R5及びR6のいずれの及びそれぞれ個々の定義とも組み合わせうる。
R3:
R3-A:一実施形態では、R3はH、ハロ、(C1-4)アルキル、-O-(C1-4)アルキル及び-N((C1-4)アルキル)2から選択される。
R3-B:別の実施形態では、R3はH及びハロから選択される。
R3-C:別の実施形態では、R3はH又はFである。
R3-D:別の実施形態では、R3はHである。
本明細書で述べるR3のいずれの及びそれぞれ個々の定義も本明細書で述べるX、R2、R5及びR6のいずれの及びそれぞれ個々の定義とも組み合わせうる。
R5:
R5-A:一実施形態では、R5は(C1-6)アルキルである。
R5-B:別の実施形態では、R5はメチル又は1-メチルエチルである。
R5-C:別の実施形態では、R5は1-メチルエチルである。
R5-D:別の実施形態では、R5はHet、-COOH又は-C(=O)-N(R51)R52で置換されている(C1-4)アルキルであり、このとき前記Hetは、1〜4個のNヘテロ原子を含有する5員若しくは6員ヘテロ環であり、又はHetは、1〜4個のNヘテロ原子を含有する9員若しくは10員二環式ヘテロ多環であり;
かつR51がH又は(C1-6)アルキルであり、かつR52がH、(C1-6)アルキル、(C3-7)シクロアルキル、Het及びHet-(C1-3)アルキル-から選択され
(ここで、前記(C1-6)アルキルは任意に、-O(C1-6)アルキル及び-N((C1-6)アルキル)2からそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;
かつ前記Het及びHet-(C1-3)アルキル-のHet部分はそれぞれ独立に、N、O及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有する5員又は6員ヘテロ環であり、該Het及びHet-(C1-3)アルキル-はそれぞれ独立に、ハロ、オキソ、-OH、(C1-6)アルキル、(C1-6)ハロアルキル、-(C=O)(C1-6)アルキル、-N((C1-6)アルキル)2及び-NH(C=O)(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);
或いはR51とR52が、それらが結合しているNと一緒に結合して、任意にさらにN、O及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有してよい4員〜7員ヘテロ環を形成している(ここで、各Sヘテロ原子は独立に、かつ可能場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;
このとき前記ヘテロ環は任意に、ハロ、オキソ、-OH、(C1-6)アルキル、(C1-6)ハロアルキル、-(C=O)(C1-6)アルキル、-N((C1-6)アルキル)2及び-NH(C=O)(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい)。
R5-E:別の実施形態では、R5は、Het、-COOH又は-C(=O)-N(R51)R52で置換されている(C1-2)アルキルであり;ここで、前記Hetは下記基
【化24】

【0045】
から選択され;
かつR51がH又は(C1-6)アルキルであり、かつR52がH、(C1-4)アルキル、(C3-6)シクロアルキル、Het及びHet-(C1-3)アルキル-から選択され(ここで、
前記(C1-6)アルキルは任意に、-O(C1-4)アルキル及び-N((C1-4)アルキル)2からそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;
かつ前記Het及びHet-(C1-3)アルキル-のHet部分はそれぞれ独立に下記基
【化25】

【0046】
から選択され;
該Het及びHet-(C1-3)アルキル-はそれぞれ任意に、ハロ、オキソ、-OH、(C1-6)アルキル、(C1-6)ハロアルキル、-(C=O)(C1-6)アルキル、-N((C1-6)アルキル)2及び-NH(C=O)(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);
或いはR51とR52、それらが結合しているNと一緒に結合して、下記式:
【化26】

【0047】
から選択されるヘテロ環を形成している(ここで、
前記ヘテロ環は任意に、ハロ、オキソ、-OH、(C1-6)アルキル、(C1-6)ハロアルキル、-(C=O)(C1-6)アルキル、-N((C1-6)アルキル)2及び-NH(C=O)(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい)。
R5-F:別の実施形態では、R5は-CH2-C(=O)-N(R51)R52であり;
このときR51がH又は(C1-6)アルキルであり、かつR52がH、(C1-6)アルキル、(C3-7)シクロアルキル、Het及びHet-(C1-3)アルキル-から選択され(ここで、
前記(C1-6)アルキルは任意に、-O(C1-6)アルキル及び-N((C1-6)アルキル)2からそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;
かつ前記Het及びHet-(C1-3)アルキル-のHet部分はそれぞれ独立に、N、O及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有する5員又は6員ヘテロ環であり、該Het及びHet-(C1-3)アルキル-はそれぞれ任意に、ハロ、オキソ、-OH、(C1-6)アルキル、(C1-6)ハロアルキル、-(C=O)(C1-6)アルキル、-N((C1-6)アルキル)2及び-NH(C=O)(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);
或いはR51とR52が、それらが結合しているNと一緒に結合して、任意にさらにN、O及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有してよい5員又は6員ヘテロ環を形成している(ここで、各Sヘテロ原子は独立に、かつ可能場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;
このとき前記ヘテロ環は任意に、ハロ、オキソ、-OH、(C1-6)アルキル、(C1-6)ハロアルキル、-(C=O)(C1-6)アルキル、-N((C1-6)アルキル)2及び-NH(C=O)(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい)。
R5-G:一実施形態では、R5が-CH2-C(=O)-N(R51)R52であり、このときR51はH又は(C1-6)アルキルであり、かつR52はH又は(C1-6)アルキルである。
R5-H:別の実施形態では、R5は、任意に、(C1-6)アルキル、-OH、-COOH、-C(=O)-(C1-6)アルキル、-C(=O)-O-(C1-6)アルキル、-C(=O)-NH-(C1-6)アルキル、-C(=O)-N((C1-6)アルキル)2、-C(=O)-NH(C3-7)シクロアルキル、-C(=O)-N((C1-4)アルキル)(C3-7)シクロアルキル及び-SO2(C1-6)アルキルからそれぞれ独立に選択される1〜4個の置換基で置換されていてもよいHetである。
R5-I:別の実施形態では、R5は、O、N及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有する5員又は6員の飽和ヘテロ環であり、該ヘテロ環は任意に、(C1-4)アルキル、-C(=O)-(C1-4)アルキル、-C(=O)-O-(C1-4)アルキル、-C(=O)-NH-(C1-4)アルキル、-C(=O)-N((C1-4)アルキル)2、-C(=O)-NH(C3-7)シクロアルキル、-C(=O)-N((C1-4)アルキル)(C3-7)シクロアルキル及び-SO2(C1-4)アルキルからそれぞれ独立に選択される1〜4個の置換基で置換されていてもよい。
R5-J:別の実施形態では、R5はH、メチル、エチル、プロピル、1-メチルエチル、
【0048】
【化27】

【0049】
から選択される。
本明細書で述べるR5のいずれの及びそれぞれ個々の定義も本明細書で述べるX、R2、R3及びR6のいずれの及びそれぞれ個々の定義とも組み合わせうる。
R6:
R6-A:一実施形態では、R6は、任意に、ハロ、(C1-6)アルキル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、-OH、-SH、-O-(C1-4)アルキル及び-S-(C1-4)アルキルからそれぞれ独立に選択される1〜5個の置換基で置換されていてもよい(C3-7)シクロアルキルである。
R6-B:別の実施形態では、R6は、任意に、-OH及び(C1-4)アルキルからそれぞれ独立に選択される1〜3個の置換基で置換されていてもよいシクロヘキシルである。
R6-C:さらに別の実施形態では、R6は下記基から選択される。
【0050】
【化28】

【0051】
R6-D:さらに別の実施形態では、R6は下記基である。
【化29】

【0052】
R6-E:代替実施形態では、R6は、任意に、ハロ、(C1-6)アルキル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、-OH、-SH、-O-(C1-4)アルキル及び-S-(C1-4)アルキルからそれぞれ独立に選択される1〜5個の置換基で置換されていてもよいアリールである。
但し、R2が下記基:
【化30】

【0053】
から選択され;
XがOであり;R3がHであり;かつR5がHの場合、
R6は下記基でない。
【化31】

【0054】
R6-F:別の代替実施形態では、R6は、任意に、ハロ、(C1-4)アルキル、(C3-7)シクロアルキル及び-S-(C1-4)アルキルからそれぞれ独立に選択される1〜3個の置換基で置換されていてもよいフェニルである。
但し、R2が下記基:
【化32】

【0055】
から選択され;
XがOであり;R3がHであり;かつR5がHの場合、
R6は下記基でない。
【化33】

【0056】
R6-G:さらに別の代替実施形態では、R6は、任意に、F、Cl、Br、メチル、エチル、シクロプロピル及び-S-CH3からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよいフェニルである。
但し、R2が下記基:
【化34】

【0057】
から選択され;
XがOであり;R3がHであり;かつR5がHの場合、
R6は下記基でない。
【化35】

R6-H:さらに別の実施形態では、R6は下記基:
【0058】
【化36】

【0059】
から選択される。
但し、R2が下記基:
【化37】

【0060】
から選択され;
XがOであり;R3がHであり;かつR5がHの場合、
R6は下記基でない。
【化38】

【0061】
本明細書で述べるR6のいずれの及びそれぞれ個々の定義も本明細書で述べるX、R2、R3及びR5のいずれの及びそれぞれ個々の定義とも組み合わせうる。
本発明の下位概念の好ましい実施形態の例を下表に示す。ここで、各実施形態の各置換基は、前記定義に従って定義される。
【0062】

【0063】
(表続き)

【0064】
本発明の最も好ましい化合物は、表1及び2に列挙したそれぞれ単一化合物である。
一般に、化合物名又は構造に特有の立体化学又は異性形が特に示されていない限り、全ての互変異性体及び異性形並びにその混合物、例えば、個々の幾何異性体、立体異性体、エナンチオマー、ジアステレオマー、ラセミ体、立体異性体のラセミ若しくは非ラセミ混合物、ジアステレオマーの混合物、又は化学構造若しくは化合物の前記形態のいずれの混合物をも意図している。
当該技術分野では、ある化合物の生物学的及び薬理学的活性が該化合物の立体化学に敏感であることは周知である。従って、例えば、エナンチオマーは、多くの場合、薬物動態学的特性、例えば代謝、タンパク質結合性など、及び薬理学的特性、例えば、表示される活性のタイプ、活性、毒性の程度などの差異を含め、顕著に異なる生物学的活性を示す。従って、当業者は、一方のエナンチオマーが他方のエナンチオマーより富んでいるか又は他方のエナンチオマーから分離されている場合、より活性であるか、又は有益な効果を示すことが分かるだろう。さらに、当業者は、この開示及び当該技術分野の知識から、本発明の化合物のエナンチオマーを分離し、濃厚にし、又は選択的に調製する方法を知っているだろう。
純粋な立体異性体、例えばエナンチオマー及びジアステレオマー、又は所望のエナンチオマー過剰率(ee) 若しくはエナンチオマー純度の混合物の調製は、当業者に既知の(a)エナンチオマーの分離若しくは分割、若しくは(b)エナンチオ選択的合成、又はその組合せの多くの方法の1つ以上で達成される。これらの分割法は、一般的にキラル認識に頼り、例えば、キラル固定相を用いるクロマトグラフィー、エナンチオ選択的ホスト-ゲスト合成、酵素的及び非酵素的な動的分割、又は自発性エナンチオ選択的結晶化が挙げられる。該方法は、本明細書で援用される非特許文献9、10及び11に一般的に開示されている。さらに、エナンチオマーの過剰率又は純度の定量のための同様に周知な方法、例えば、GC、HPLC、CE、又はNMR、並びに絶対配置及び配座の割当てのための方法、例えば、CD ORD、X線結晶学、又はNMRがある。
【0065】
本発明の化合物は、C型肝炎ウイルスNS5B RNA依存性RNAポリメラーゼのインヒビターなので、C型肝炎ウイルスRNAの複製を阻害するために使用しうる。
本発明の化合物を実験室試薬又は研究試薬としても使用できる。例えば、本発明の化合物を正のコントロールとして用いてアッセイを確証することができ、例えば、細胞ベースアッセイ及びin vitro又はin vivoウイルス複製アッセイの代わりをしうる。
本発明の化合物をプローブとして用いて、限定するものではないが、ポリメラーゼの作用機序、種々の条件下でポリメラーゼによって受けたコンホメーション変化及びポリメラーゼに結合するか又はそうでなくてもポリメラーゼと相互作用するエンティティーとの相互作用といったC型肝炎ウイルスNS5Bポリメラーゼの研究をすることもできる。
プローブとして使用する本発明の化合物を該化合物を直接又は間接的に認識できる標識で標識して、該化合物を検出、測定かつ定量しうる。本発明の化合物で使うために想定される標識として、限定するものではないが、蛍光標識、化学発光標識、比色標識、酵素マーカー、放射性同位体、アフィニティータグ及び光反応基が挙げられる。
プローブとして使用する本発明の化合物を、受容体に対する強力なアフィニティーを利用して、リガンドが結合しているエンティティーを溶液から抽出できるアフィニティータグで標識することもできる。アフィニティータグとして、限定するものではないが、ビオチン又はその誘導体、ヒスチジンポリペプチド、ポリアルギニン、アミラーゼ糖成分又は特異性抗体で認識可能に定義されたエピトープが挙げられる。
さらに、プローブとして使用する本発明の化合物を、光で活性化すると、不活性基からフリーラジカル等の反応性種に変換される光反応基で標識しうる。光反応基として、限定するものではないが、光親和性標識、例えばベンゾフェノン及びアジド基が挙げられる。
さらに、本発明の化合物を用いて物質のウイルス汚染を処理又は阻止し、ひいては該物質(例えば、血液、組織、外科用設備及び衣服、実験室の設備及び衣服、並びに血液収集装置及び材料)に接触するようになる実験室又は医療職員若しくは患者のウイルス感染の危険を減らすことができる。
【0066】
〔医薬組成物〕
本発明の化合物をC型肝炎ウイルス感染症の治療が必要な哺乳動物に、治療的に有効な量の本発明の化合物又はその医薬的に許容しうる塩若しくはエステルと、1種以上の通常の無毒の医薬的に許容しうる担体、アジュバント又はビヒクルを含んでなる医薬組成物として投与することができる。本組成物の特有の処方は、該化合物の溶解度及び化学的性質、選択される投与経路及び標準的な医薬プラクティスによって決まる。本発明の医薬組成物を経口又は全身投与することができる。
経口投与では、本化合物、又はその医薬的に許容しうる塩若しくはエステルを経口に許容しうる剤形でも処方しうる。該剤形として、限定するものではないが、水性懸濁液及び溶液、カプセル剤又は錠剤が挙げられる。全身投与では、限定するものではないが、皮下、皮内、静脈内、筋肉内、動脈内、滑膜内、胸骨内、くも膜下腔内、及び病巣内注射又は注入法による投与が挙げられ、医薬的に許容しうる無菌水性ビヒクル中の本化合物、又はその医薬的に許容しうる塩若しくはエステルの溶液として使うことが好ましい。
医薬的に許容しうる担体、アジュバント、ビヒクル、賦形剤及び添加剤並びに種々の投与態様に合わせて医薬組成物を処方する方法は当業者に周知であり、かつ本明細書で援用する非特許文献12及び13等の医薬テキストに記載されている。
投与量は、既知因子によって変わり、該因子としては、限定するものではないが、利用する特定化合物の活性と薬物動態学的特性及びその態様、投与の時間と経路;レシピエントの年齢、食餌、性別、体重及び全身の健康状態;症状の性質及び程度;該感染症の重症度及び経過;同時治療の種類;治療の頻度;所望効果;並びに治療医師の判断が挙げられる。一般に、如何なる有害又は有毒な副作用をも引き起こすことなく、一般に抗ウイルス的に有効な結果を与えるであろう用量レベルで本化合物を投与するのが最も望ましい。
活性成分の1日の用量は約0.01〜約200mg/kg(体重)であると予想され、約0.1〜50mg/kgの用量が好ましい。典型的に、この発明の医薬組成物は、1日約1〜約5回投与され、或いは連続注入として投与される。このような投与を慢性又は急性療法として使用できる。単体材料と併用して単一剤形を製造しうる活性成分の量は、治療する宿主と個々の投与態様によって変わるだろう。典型的製剤は、約5%〜約95%の活性化合物(w/w)を含むだろう。好ましくは、該製剤は、約20%〜約80%の活性化合物を含有する。
【0067】
〔併用療法〕
本発明の化合物、又はその医薬的に許容しうる塩若しくはエステルを少なくとも1種の追加の抗ウイルス薬と併用する併用療法が考慮される。追加薬剤をこの発明の化合物と併用して、単一剤形を作製しうる。或いは、これらの追加薬剤を、多剤剤形の一部として別々に、同時又は逐次投与しうる。
この発明の医薬組成物が本発明の化合物、又はその医薬的に許容しうる塩若しくはエステルと、1種以上の追加の抗ウイルス薬との組合せを含む場合、本化合物と追加薬剤の両方が、単剤療法で普通に投与される用量の約10〜100%、さらに好ましくは約10〜80%の用量レベルで存在すべきである。本発明の化合物と追加薬剤との間で相乗的に相互作用する場合、単剤療法で普通に投与される用量に比し、該組合せ中のいずれか又は全ての活性薬の用量を減らしてよい。
このような併用療法で使うために想定される抗ウイルス薬は、哺乳動物内でのウイルスの形成及び/又は複製を阻害するのに有効な薬剤(化合物又は生物学的製剤)を包含し、限定するものではないが、哺乳動物内でのウイルスの形成及び/又は複製に必要な宿主又はウイルスの機構のどちらかを妨害する薬剤が挙げられる。別の抗-HCV薬;HIVインヒビター:HAVインヒビター;及びHBVインヒビターから該薬剤を選択できる。
他の抗-HCV薬は、C型肝炎に関連する症状又は疾患の進行を減退又は阻止するために有効な当該薬剤を包含する。このような薬剤として、限定するものではないが、免疫調節薬、HCV NS3プロテアーゼのインヒビター、HCVプロテアーゼの他のインヒビター、HCVのライフサイクルにおける別の標的のインヒビター及び他の抗-HCV薬(限定するものではないが、リバビリン、アマンタジン、レボビリン(levovirin)及びビラミジン(viramidine)が挙げられる)が挙げられる。
免疫調節薬は、哺乳動物の免疫系反応を高めるか又は増強するのに有効な当該薬剤(化合物又は生物学的製剤)を包含する。免疫調節薬として、限定するものではないが、イノシン一リン酸デヒドロゲナーゼインヒビター、例えばVX-497(メリメポジブ(merimepodi), Vertex Pharmaceuticals)、クラスIインターフェロン、クラスIIインターフェロン、コンセンサスインターフェロン、アシアロ-インターフェロン、ペグ化インターフェロン及び複合インターフェロンが挙げられる。複合インターフェロンとしては、限定するものではないが、他のタンパク質(ヒトアルブミンが含まれるが、これに限定されない)と複合したインターフェロンが挙げられる。クラスIインターフェロンは、全てI型受容体に結合する1群のインターフェロンであり(天然及び合成的に生成されるクラスIインターフェロンの両方を含む)、クラスIIインターフェロンは、全てII型受容体に結合する。クラスIインターフェロンの例として、限定するものではないが、α-、β-、δ-、ω-、及びτ-インターフェロンが挙げられ、クラスIIインターフェロンの例として、限定するものではないが、γ-インターフェロンが挙げられる。
【0068】
HCV NS3プロテアーゼは、哺乳動物内のHCV NS3プロテアーゼの機能を阻害するのに有効な薬剤(化合物又は生物学的製剤)を包含する。HCV NS3プロテアーゼのインヒビターとして、限定するものではないが、特許文献2〜20(全てBoehringer Ingelheimによる)、特許文献21〜30(全てBMSによる)、特許文献31〜34(全てEnantaによる)、特許文献35(Intermune)、特許文献36〜57(全てScheringによる)に記載される当該化合物;及び候補製品VX-950、ITMN-191及びSCH-503034が挙げられる。
HCVポリメラーゼのインヒビターは、HCVポリメラーゼの機能を阻害するのに有効な薬剤(化合物又は生物学的製剤)を包含する。該インヒビターには、限定するものではないが、HCV NS5Bポリメラーゼの非-ヌクレオシド及びヌクレオシドインヒビターが含まれる。HCVポリメラーゼのインヒビターの例として、限定するものではないが、特許文献58〜65(全てBoehringer Ingelheimによる)、特許文献66(Japan Tobacco)、特許文献67(Japan Tobacco)、特許文献68(BMS)、特許文献69(Neogenesis)、特許文献70(IRBM)、特許文献71(Genelabs)、特許文献72(Japan Tobacco)、特許文献73(Japan Tobacco)、及び特許文献74(Shionogi)に記載される当該化合物;並びに候補製品XTL-2125、HCV 796、R-1626、R-7128、NM 283、VCH-759、GSK625433及びPF868554挙げられる。
【0069】
HCVのライフサイクルの別の標的のインヒビターは、HCV NS3プロテアーゼ又はHCVポリメラーゼの機能を阻害する以外にHCVの形成及び/又は複製を阻害するのに有効な薬剤(化合物又は生物学的製剤)を包含する。該薬剤は、HCVの形成及び/又は複製に必要な宿主又はHCVウイルスの機構のどちらかを妨害しうる。HCVのライフサイクルの別の標的のインヒビターとして、限定するものではないが、侵入インヒビター、ヘリカーゼ、NS2/3プロテアーゼ及び配列内リボース侵入部位(IRES)から選択される標的を阻害する薬剤並びに他のウイルス標的(限定するものではないが、NS5Aタンパク質及びNS4Bタンパク質が挙げられる)の機能を妨害する薬剤が挙げられる。
患者が、C型肝炎ウイルスと1種以上の他のウイルスに同時感染することが起こりうる。このような他のウイルスとして、限定するものではないが、ヒト免疫不全ウイルス(HIV)、A型肝炎ウイルス(HAV)及びB型肝炎ウイルス(HBV)が挙げられる。従って、本発明の化合物と、少なくとも1種のHIVインヒビター、HAVインヒビター及びHBVインヒビターとを共投与することによって、このような同時感染を治療するための併用療法も考えられる。
HIVインヒビターは、HIVの形成及び/又は複製を阻害するのに有効な薬剤(化合物又は生物学的製剤)を包含する。これには、限定するものではないが、哺乳動物内におけるHIVの形成及び/又は複製に必要な宿主又はウイルスの機構のどちらかを妨害する薬剤が含まれる。HIVインヒビターとして、限定するものではないが、以下のものが挙げられる。
・NRTI(ヌクレオシド又はヌクレオチド逆転写酵素インヒビター;限定するものではないが、ジドブジン、ジダノシン、ザルシタビン、スタブジン、ラミブジン、エムトリシタビン、アバカビル、及びテノフォビルが挙げられる);
・NNRTI(非-ヌクレオシド逆転写酵素インヒビター;限定するものではないが、ネビラピン、デラビルジン、エファビレンツ、エトラビリン(etravirine)、リルピビリン(rilpivirine)及びBILR 355が挙げられる);
・プロテアーゼインヒビター(限定するものではないが、リトナビル、チプラナビル、サキナビル、ネルフィナビル、インジナビル、アンプレナビル、ホスアンプレナビル、アタザナビル、ロピナビル、ダルナビル及びブレカナビル(brecanavir)が挙げられる);
・侵入インヒビター(限定するものではないが、以下の薬剤:
・CCR5アンタゴニスト(限定するものではないが、マラビロク(UK-427,857)及びTAK-652が挙げられる)、
・CXCR4アンタゴニスト(限定するものではないが、AMD-11070が挙げられる)、
・融合インヒビター(限定するものではないが、エンフュヴァタイド(T-20)が挙げられる)及び
・その他(限定するものではないが、BMS-488043が挙げられる)
が挙げられる);
・インテグラーゼインヒビター(限定するものではないが、MK-0518、c-1605、BMS-538158及びGS 9137が挙げられる);
・TATインヒビター;
・成熟インヒビター(限定するものではないが、ベビリマット(bevirimat)(PA-457)が挙げられる);及び
・免疫調節薬(限定するものではないが、レバミゾールが挙げられる)。
HAVインヒビターは、HAVの形成及び/又は複製を阻害するのに有効な薬剤(化合物又は生物学的製剤)を包含する。これには、限定するものではないが、哺乳動物内におけるHAVの形成及び/又は複製に必要な宿主又はウイルスの機構のどちらかを妨害する薬剤が含まれる。HAVインヒビターとして、限定するものではないが、A型肝炎ワクチンが挙げられる。
HBVインヒビターは、哺乳動物内におけるHBVの形成及び/又は複製を阻害するのに有効な薬剤(化合物又は生物学的製剤)を包含する。これには、限定するものではないが、哺乳動物内におけるHBVの形成及び/又は複製に必要な宿主又はウイルスの機構のどちらかを妨害する薬剤が含まれる。HBVインヒビターとして、限定するものではないが、HBVウイルスDNAポリメラーゼを阻害する薬剤及びHBVワクチンが挙げられる。
【0070】
従って、一実施形態によれば、この発明の医薬組成物は、治療的に有効な量の1種以上の抗ウイルス薬を含む。
さらなる実施形態は、1種以上の抗ウイルス薬と少なくとも1種の他の抗-HCV薬を含む、本発明の医薬組成物を提供する。
この発明の医薬組成物のさらに特定の実施形態によれば、前記少なくとも1種の他の抗-HCV薬は、少なくとも1種の免疫調節薬を含む。
この発明の医薬組成物の別のさらに特定の実施形態によれば、前記少なくとも1種の他の抗-HCV薬は、少なくとも1種の、HCVポリメラーゼの他のインヒビターを含む。
この発明の医薬組成物のさらに別のさらに特定の実施形態によれば、前記少なくとも1種の他の抗-HCV薬は、少なくとも1種の、HCV NS3プロテアーゼのインヒビターを含む。
この発明の医薬組成物のさらに別のさらに特定の実施形態によれば、前記少なくとも1種の他の抗-HCV薬は、少なくとも1種の、HCVのライフサイクルの別の標的のインヒビターを含む。
本明細書で引用した全ての文書は、あたかも各文書を個々に本発明に組み入れたかのように、参考文献として本発明に組み入れられる。さらに、発明の上記教示において、当業者は、本発明に一定の変更又は修正を生じさせることができ、それでもこれらの均等物は、本出願の添付請求項によって定義される本発明の範囲内であることが認められる。
【0071】
〔方法論及び合成〕
この発明の式(I)の化合物の合成は、下記スキーム1及び2(R2、X、R3、R5及びR6は本明細書の定義どおり)に概要が示される一般手順に従って好都合に達成される。本発明の化合物を調製しうる他の手順は技術上周知であり、或いは以下の実施例で述べられる。
【0072】
スキーム1:
【化39】

【0073】
式(II)(式中、R3aは本明細書の定義どおりのR3であるか又は本明細書の定義どおりのR3に変換しうる前駆基であり、Rはエステル保護基、例えばメチル又はエチルであり、LGは脱離基、例えばF又はClである)の中間体は商業的に入手可能であり、或いは技術上周知又は以下の実施例で述べる手順によって調製されうる。基R3aが前駆基である場合、技術上周知又は以下の実施例で述べる手順によって、式(I)の化合物の形成前の該スキームのいずれの化学的に好都合な中間段階においても、本明細書の定義どおりのR3に該基を変換することができる。
技術上周知又は以下の実施例で述べる反応条件を利用する、中間体(II)と式R2X-H(式中、R2及びXは本明細書の定義どおり)の反応物のカップリングが式(III)の中間体を与える。該反応条件として、限定するものではないが、SNAr反応条件及びウルマン(Ullman)カップリング条件が挙げられる。当業者は、本発明の化合物のR2基が、その置換パターンにおいて異なり、かつ該スキームのいずれの化学的に好都合な中間段階でも、技術上周知又は以下の実施例で述べる手順によって、あるR2基を別のR2基に変換しうると考えられることを認めるだろう。
周知の条件下で中間体(III)のニトロ基を還元して式(IV)の中間体、又は塩酸などの酸とのその塩を与える。技術上周知のいずれの適切な反応(限定するものではないが、アルキル化及び還元的アミノ化が挙げられる)によっても、式(IV)の中間体のアミノ基にR5基を付加させて、式(V)の中間体を与えうる。還元的アミノ化反応は式(IV)の中間体を、適宜置換されたアルデヒド若しくはケトン又はその適切な誘導体と反応させた後、ナトリウムトリアセトキシボロヒドリドで処理することによって好都合に行われる(非特許文献14参照)。アルデヒド及びケトンの適切な誘導体は技術上周知であり、限定するものではないが、エノールエーテル等が挙げられる。アルデヒド、ケトン、又はその適切な誘導体は商業的に入手可能であり、或いは技術上周知又は以下の実施例で述べる手順によって得られる。商業的に入手可能であるか或いは技術上周知又は以下の実施例で述べる手順によって得られる適切なアシル化剤で中間体(V)をアシル化する。次に、技術上周知又は以下の実施例で述べる手順によってエステル保護基Rを加水分解して式(I)の化合物を与える。
【0074】
これとは別に、式(IV)の中間体のアミノ基を前述したようにアシル化して式(VI)の中間体を与えうる。技術上周知又は以下の実施例で述べる手順による式(VI)の中間体のアミド窒素原子のアルキル化後、前述したとおりのエステル保護基の加水分解が式(I)の化合物を与える。
当業者は、本発明の化合物のR5及びR6基が、その置換パターンにおいて異なり、かつ該スキームのいずれの化学的に好都合な中間段階でも、技術上周知又は以下の実施例で述べる手順によって、あるR5基を別のR5基に変換しうるか、或いは、あるR6基を別のR6基に変換しうることが考えられることを認めるだろう。
これとは別に、以下のスキーム2に概要が示される手順によって、式(I)の化合物の調製を達成しうる。ここで、R2、X、R3、R5及びR6は本明細書の定義どおりであり、Rはエステル保護基、例えばメチル又はエチルであり、PGは、当業者に周知のXH官能に適した脱離基であり、限定するものではないが、ベンジル基が挙げられる。
【0075】
スキーム2:
【化40】

【0076】
式VIIの中間体は商業的に入手可能であり、或いは技術上周知又は以下の実施例で述べる手順によって調製されうる。ニトロ基のアミノ基への還元並びにR5及び-C(=O)R6基の導入を上述したように達成して式(XI)の中間体を得る。技術上周知又は以下の実施例で述べる手順でXH基を脱保護し、かつ結果として生じたフリーなフェノール又はチオールを、技術上周知又は以下の実施例で述べる手順を用いて式R2-LGの反応物(式中、LGは脱離基、例えばF又はClである)にカップリングさせることによって、式(XI)の中間体を式(I)の化合物に変換する。このような手順として、限定するものではないが、SNAr反応及びウルマンカップリング反応が挙げられる。最後に、前述したようにエステルを加水分解で脱保護する。
【実施例】
【0077】
本発明の他の特徴は、本発明の原理を例として実証する以下の非限定例から明らかになるだろう。
当業者には周知なように、反応化合物を空気又は湿気から保護する必要がある場合、不活性な雰囲気(窒素又はアルゴンが挙げられるが、これに限定されない)下で反応を行う。摂氏度(℃)で温度を与える。溶液のパーセンテージ及び比は、特に断らない限り、体積対体積の関係で表す。非特許文献15の手順に従ってシリカゲル(SiO2)上でフラッシュクロマトグラフィーを行う。エレクトロスプレー質量分析法を利用して質量スペクトル分析を記録する。CombiscreenTM ODS-AQ C18逆相カラム、YMC、50×4.6mm内径、5μM、220nMで120Å、下表に示す線形勾配による溶出(溶媒AはH2O中0.06%のTFAである;溶媒BはCH3CN中0.06%のTFAである)を用いて標準条件下で分析用HPLCを行う。
【0078】

【0079】
本明細書で使用する略語又は記号として以下のものが挙げられる。
Ac:アセチル;
AcCl:塩化アセチル;
AcOH:酢酸;
Ac2O:無水酢酸;
BINAP:2,2'-ビス(ジフェニルホスフィノ)-1,1'-ビナフチル;
Bn:ベンジル(フェニルメチル);
BnBr:臭化ベンジル;
BOC or Boc:tert-ブチルオキシカルボニル;
Bu:ブチル;
n-BuOAc:酢酸n-ブチル
DBU:1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン;
DCE:ジクロロエタン;
DCM:ジクロロメタン;
DIEA:ジイソプロピルエチルアミン;
DMAP:4-ジメチルアミノピリジン;
DME:ジメトキシエタン;
DMF:N,N-ジメチルホルムアミド;
DMSO:ジメチルスルホキシド;
EC50:50%有効濃度;
EEDQ:2-エトキシ-1-エトキシカルボニル-1,2-ジヒドロキノリン;
eq.:モル当量;
Et:エチル;
Et3N:トリエチルアミン;
Et2O:ジエチルエーテル;
EtOAc:酢酸エチル;
EtOH:エタノール;
【0080】
HPLC:高速液体クロマトグラフィー;
IC50:50% 阻害濃度;
iPr又はi-Pr:1-メチルエチル(イソ-プロピル);
Me:メチル;
MeCN:アセトニトリル;
MeI:ヨードメタン;
MeOH:メタノール;
MS:質量分析(MALDI-TOF:マトリックス支援レーザー脱離イオン化-飛行時間型(Matrix Assisted Laser Desorption Ionization-Time of Flight)、FAB:高速原子衝撃(Fast Atom Bombardment));
NIS:N-ヨードスクシンアミド;
NMP:N-メチルピロリドン;
NMR:核磁気共鳴分光法;
Ph:フェニル;
PG:保護基;
Pr:プロピル;
RT:室温(約18℃〜25℃);
TBTU:O-ベンゾトリアゾール-1-イル-N,N,N',N'-テトラメチルウロニウムテトラフルオロボレート;
tert-ブチル又はt-ブチル:1,1-ジメチルエチル;
TFA:トリフルオロ酢酸;
THF:テトラヒドロフラン;
TLC:薄層クロマトグラフィー。
【0081】
(実施例1A)
中間体1a9の調製
【化41】

【0082】
工程1:
MeOH(500mL)中の5-ヒドロキシ-2-ニトロ安息香酸1a1(50g,0.273mol)の混合物にSOCl2(40mL,65.2g,0.55mol)を30分にわたって滴加し、混合物を2時間加熱して還流させる。過剰のSOCl2(20mL,32.6g,0.27mol)を慎重に加えて加熱還流を一晩続ける。さらにSOCl2(20mL,32.6g,0.27mol)を加えて加熱還流を1時間続ける。反応混合物を室温に冷まして減圧下で濃縮する。残留物をEtOAc(600mL)で希釈し、飽和NaHCO3水溶液と食塩水で洗浄し、MgSO4上で乾燥させ、ろ過し、濃縮乾固させる。CH2Cl2とヘキサンから固体としてメチルエステル1a2を回収する。
工程2:
アセトン(500mL)中の化合物1a2(51.2g,0.26mol)、無水K2CO3(150g,1.09mol)及びPhCH2Br(39mL,56g,0.33mol)の混合物を室温で一晩撹拌する。混合物をろ過してろ液を濃縮し、EtOAc(1.5L)で希釈し、水と食塩水で洗浄し、MgSO4上で乾燥させ、ろ過し、濃縮乾固させる。化合物1a3をEtOAcとヘキサンから回収する。
工程3:
エタノール(1.2L)中の化合物1a3(68.4g,0.24mol)の撹拌混合物にFe粉末(150g,2.7mol)を添加後AcOH(65mL)を加える。混合物を4時間加熱して還流させてから、さらにFe粉末(75g,1.3mol)とAcOH(30mL)を加えて加熱還流を1.5時間続ける。混合物をろ過し、固体とろ液を別々に処理する。
固体を飽和NaHCO3水溶液及びEtOAcと混合し、固体NaHCO3を塩基性pHが得られるまで加える。混合物をCeliteTMでろ過してEtOAcですすぐ。水層をEtOAcで2回抽出し(2×1L)、有機層を混ぜ合わせる。
ろ液を減圧下で濃縮し、残留物をEtOAc(1L)で希釈して飽和NaHCO3水溶液を加える。混合物に固体NaHCO3をpHが塩基性になるまで加える。混合物をCeliteTMでろ過し、EtOAcですすぐ。
上記の固体及びろ液部分の処理から得られた有機相を混ぜ合わせてから食塩水で洗浄し、MgSO4上で乾燥させ、濃縮乾固させ、残留物をCH2Cl2とヘキサンから回収する。回収した残留物(46.7g,0.18mol)のEt2O(400mL)中の撹拌混合物にEt2O中の2M HCl(180mL,0.38mol)を加える。混合物を室温で2時間撹拌し、ろ過で化合物1a4を収集する。
工程4:
非特許文献16から使用手順を適合させる。化合物1a4(30g,0.1mol)とCH2Cl2(600mL)の混合物に2-メトキシプロペン(36mL,27g,0.38mol)を添加後、NaBH(OAc)3(43.2g,0.2mol)を加える。混合物をRTで7時間撹拌し、EtOAcで希釈し、飽和NaHCO3水溶液と食塩水で洗浄し、MgSO4上で乾燥させ、濃縮乾固させる。化合物1a5をEtOAcとヘキサンから回収する。
【0083】
工程5:
Ar雰囲気下で室温にて化合物1a6(43.4g,305mmol)と無水CH2Cl2(400mL)の混合物にCH2Cl2(305mL)中の(COCl)2(53.2mL,610mmol)を室温で1時間にわたって滴加する。混合物を室温で1時間撹拌し、無水DMF(1mL)を滴加する。混合物をRTで一晩撹拌し、減圧下で濃縮する。残留物をペンタンで希釈してろ過する。ろ液を2回減圧下で濃縮し、ペンタンで希釈してろ過してから減圧下で濃縮して酸塩化物1a7を得る。
工程6:
無水ピリジン(1.5L)中の化合物1a5(99.6g,0.32mol)の混合物に化合物1a7(100mL,100g,0.62mol)とDMAP(3.8g,0.03mol)を加える。混合物を60℃で一晩撹拌し、減圧下で濃縮する。残留物をEtOAc(3L)で希釈し、2M HCl水溶液(4×1L)、飽和NaHCO3水溶液(6×500mL)及び食塩水で洗浄し、MgSO4上で乾燥させ、ろ過し、濃縮乾固させて化合物1a8を得る。
工程7:
化合物1a8(130g,0.3mol)、MeOH(0.6L)及びEtOAc(1.5L)の混合物をAr下で慎重に10% Pd/C(15g)に加える。アルゴンを10分間撹拌しながら混合物じゅうに泡立たせてからH2を混合物中に泡立たせて撹拌を室温で8時間続ける。混合物をCeliteTMでろ過し、ろ液を減圧下で濃縮する。化合物1a9をヘキサンから収集する。
【0084】
(実施例1B)
中間体1b3の調製
【化42】

【0085】
工程1:
無水ピリジン(35mL)中の化合物1a4(実施例1A)(2.0g,6.8mmol)の混合物に化合物1a7(実施例1A)(1.65mL,10.2mmol)とDMAP(82mg,0.67mmol)を加える。混合物を50℃で1時間撹拌し、減圧下で濃縮する。残留物をEtOAc(300mL)で希釈し、2M HCl水溶液(5×200mL)、飽和NaHCO3水溶液(6×200mL)及び食塩水(200mL)で洗浄し、MgSO4上で乾燥させ、ろ過し、濃縮する。化合物1b1をDCM/ヘキサンから回収する。
工程2:
氷-水浴で冷却した化合物1b1(2.0g,5.24mmol)と無水DMF(30mL)の混合物にNaH(60%,0.25g,10.5mmol)を加えて混合物を40分撹拌する。CH3I(0.9mL,14.5mmol,2.8当量)を加えて混合物を室温で一晩撹拌する。混合物をEtOAc(600mL)で希釈し、飽和NH4Cl水溶液(3×300mL)、飽和NaHCO3水溶液(300mL)及び食塩水(300mL)で洗浄し、MgSO4上で乾燥させ、ろ過して濃縮する。粗生成物をISCO CombiFlashカラム(SiO2,ヘキサン/EtOAc:10/0→5/5)で精製して化合物1b2を得る。
工程3:
無水MeOH(33mL)と無水EtOAc(83mL)中の化合物1b2(2.07g,5.24.mmol)の混合物をAr雰囲気下で慎重にPd/C(10%,0.23g)に加える。Arを混合物じゅうに2分泡立たせてから室温で2.5時間撹拌しながらH2を混合物じゅうに泡立たせる。混合物をCeliteTMでろ過し、ろ液を濃縮する。固体フェノール1b3をジエチルエーテル/ヘキサン混合物(1/9,100mL)から得る。
【0086】
以下の実施例の方法を用いて、中間体1b3を式(I)の化合物に変換できる。
(実施例2A)
化合物1001(表1)の調製
【化43】

【0087】
フェノール1a9(実施例1A)(20mg,0.06mmol)を4-ヒドロキシテトラヒドロピラン(0.08mmol)及びトリフェニルホスフィン(20mg,0.08mmol)とTHF(1mL)中で混ぜ合わせる。ジイソプロピルアゾジカルボキシレート(0.02mL,0.10mmol)を加えて混合物を周囲温度で一晩撹拌する。NaOH水溶液(10N,0.06mL,0.6mmol)、水(0.06mL)及びメタノール(0.4mL)を加えて混合物を50℃に温めて2.5時間撹拌する。分取用HPLCで精製して化合物1001(表1)を得る。
【0088】
(実施例2B)
化合物1003(表1)の調製
【化44】

【0089】
フェノール1a9(実施例1A)(20mg,0.06mmol)を3-トリフルオロメチル-4-クロロピリジン(16mg,0.07mmol)及びK2CO3(31mg,0.22mmol)とDMSO(0.5mL)中で混ぜ合わせる。混合物を100℃に加熱して24時間撹拌する。NaOH水溶液(5N,0.12mL,0.6mmol)を加えて混合物を55℃に温めて1時間撹拌する。混合物をAcOHで酸性にして分取用HPLCで精製して化合物1003(表1)を得る。
【0090】
(実施例2C)
化合物1031(表1)の調製
【化45】

【0091】
DCM中のフェノール1a9(実施例1A)(60mg,0.18mmol)、3-チオフェンボロン酸(46mg,0.36mmol)、Cu(OAc)2(33mg,0.18mmol)、Et3N(0.13mL,0.90mmol)及び4Åの分子ふるい(50mg)の混合物を大気に開放しながら20時間撹拌する。混合物をEtOAcで希釈し、0.2NのHCl水溶液、飽和NaHCO3水溶液及び食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過して濃縮する。残留物をDMSO(4mL)に溶かしてNaOH水溶液(2.5N,1.0mL,2.5mmol)を加える。混合物を周囲温度で2時間撹拌してからAcOHで酸性にして分取用HPLCで精製して化合物1031(表1)を単離する。
【0092】
(実施例2D)
化合物2011(表2)の調製
【化46】

【0093】
工程1:
化合物2d1(39.01g,239mmol)と無水DMF(800mL)の混合物にAr下でN-ヨードスクシンイミド(4.89g,244mmol)と無水K2CO3(33.72g,244mmol)を加えて混合物を60℃で3時間撹拌する。混合物を周囲温度に冷まし、ろ過し、減圧下で濃縮する。残留物をDCM(1L)に溶かし、有機相を食塩水で洗浄する。2MのHClを添加して水相をpH 4に調整してからDCM(1L)で抽出する。混ぜ合わせた有機抽出液を食塩水(2L)で洗浄し、Na2SO4上で乾燥させる。混合物を約300mLに濃縮して冷蔵庫で一晩冷却する。沈殿した固体をろ過で除去し、乾燥させてヨウ化アリール2d2を得る。
工程2:
化合物2d2(115.7g,400mmol)とPhPOCl2(668.6g,343mmol)の混合物をN2下で136℃にて一晩撹拌してから室温に冷まして3Lの砕氷にゆっくり加える。水性混合物をpH 6に調整してろ過する。水性ろ液をDCM(3L)で抽出してから有機相を飽和NaHCO3と食塩水で洗浄し、Na2SO4上で乾燥させ、ろ過し、濃縮して化合物2d3を得る。
工程3:
化合物1a9(実施例1A)(62.7g,0.19mol)、化合物2d3(66.7g,0.22mol)、無水K2CO3(65g,0.47mol)及び無水DMSO(250mL)の混合物を100℃で2時間加熱する。混合物をRTに冷まし、ろ過して固体をEtOAcで洗浄する。ろ液をEtOAc(4L)で希釈し、飽和NH4Clと食塩水で洗浄し、MgSO4上で乾燥させ、濃縮する。残留物をシリカゲル上フラッシュクロマトグラフィーで精製して(95:5ヘキサン/EtOAc→7:3ヘキサン/EtOAc)ビアリールエーテル2d4を得る。
工程4:
化合物2d4(125mg,0.21mmol)、THF(6.0mL)、MeOH(3.0mL)及びH2O(1.0mL)の混合物にLiOH(5N,300μL,1.5mmol)を0℃で加える。混合物を0℃で15分反応させてから室温で一晩撹拌する。混合物をEtOAcで希釈し、1N HClで酸性にし、有機抽出物を水と食塩水で洗浄し、乾燥させ(MgSO4)、濃縮して化合物2011を得る。
【0094】
(実施例2E)
化合物1008(表1)の調製
【化47】

【0095】
工程1:
DMF(1mL)中の化合物2e1(64mg,0.30mmol)、モルフォリン(0.027mL,0.31mmol)及びトリエチルアミン(0.050mL,0.36mmol)の混合物を周囲温度で一晩撹拌する。次に混合物をEtOAcで希釈し、引き続き水(4×)と食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過かつ濃縮して中間体2e2を得る。
工程2:
実施例2Bの手順を用いて中間体2e2とフェノール1a9(実施例1A)をカップリングさせて化合物1008(表1)を合成する。
【0096】
(実施例2F)
化合物1010(表1)の調製
【化48】

【0097】
工程1:
DMF(1mL)中の化合物2e1(実施例2E)(32mg,0.15mmol)、4-ピリジルボロン酸(18mg,0.15mmol)、Cs2CO3(72mg,0.22mmol)及びPd(PPh3)4(9mg,0.01mmol)の混合物を脱気して100℃で一晩加熱する。混合物を水中に注ぎ、EtOAcで3回抽出する。合わせた有機抽出物を水(4×)と食塩水で洗浄し、MgSO4で乾燥させてからシリカゲルの短パッドに通して過剰のEtOAcで溶出する。濃縮後、粗生成物をフラッシュクロマトグラフィーで精製して(15→50% EtOAc-ヘキサン)化合物2f1を得る。
工程2:
実施例2Bの手順を用いて中間体2f1とフェノール1a9(実施例1A)をカップリングさせて化合物1010(表1)を合成する。
【0098】
(実施例3A)
化合物1028(表1)の調製
【化49】

【0099】
DMSO(1mL)中のフェノール1a9(実施例1A)(60mg,0.18mmol)、化合物3a1(22mg,0.15mmol)及びK2CO3(50mg,0.36mmol)の混合物を100℃で20時間撹拌する。モルフォリン(0.031mL,0.36mmol)を加えて混合物を100℃でさらに20時間撹拌する。この混合物を50℃に冷ましてNaOH水溶液(2.5N,0.72mL,1.8mmol)を加える。1時間後、混合物をTFAで酸性にし、分取用HPLCで精製して化合物1028(表1)を得る。
【0100】
(実施例3B)
化合物1007(表1)の調製
【化50】

【0101】
工程1:
フェノール1a9(実施例1A)(200mg,0.60mmol)と化合物3b1(90mg,0.72mmol)をDMSO(2mL)中で混ぜ合わせる。無水K2CO3(200mg,1.5mmol)を加えて混合物を100℃で1時間撹拌する。さらに化合物3b1(50mg,0.4mmol)を加えて撹拌を100℃で45分続ける。混合物を周囲温度に冷まし、EtOAcで希釈し、水(×2)と食塩水(×2)で洗浄する。有機相をNaCl及びNa2SO4の上で乾燥させ、ろ過し、真空中で濃縮する。フラッシュクロマトグラフィーで精製して(2:3 EtOAc/ヘキサン)中間体3b2を得る。
工程2:
アルデヒド3b2(160mg,0.36mmol)、DeoxofluorTM(0.12mL,0.65mmol)及び無水DCM(1mL)の混合物に無水MeOH(3μL,0.07mmol,0.2当量)を加えて混合物を周囲温度で30時間撹拌する。混合物をDCMで希釈し、飽和NaHCO3水溶液で慎重に洗浄する。有機層をNaCl/Na2SO4上で乾燥させ、ろ過かつ真空中で濃縮する。残留物をフラッシュクロマトグラフィーで精製し(2:3 EtOAc/ヘキサン)、精製残留物の一部(60mg,0.1mmol)をDMSO(1mL)中でNaOH水溶液(2.5M,0.28mL,0.7mmol)と混ぜ合わせる。混合物を周囲温度で1時間撹拌してから水(5mL)で希釈し、急速に撹拌される1NのHCl水溶液(100mL)に加える。結果として生じた固体を45μmのろ過膜に通して吸引ろ過で収集し、真空乾燥させてインヒビター1007(表1)を得る。
【0102】
(実施例3C)
化合物1029(表1)の調製
【化51】

【0103】
工程1:
化合物3c1(38mg,0.16mmol)と乾燥DMSO(1mL)の混合物にK2CO3(55mg,0.4mmol)とフェノール1a9(実施例1A)(53mg,0.16mmol)を連続的に加える。反応混合物を55℃で1時間15分、次いで70℃で16時間撹拌する。反応混合物を水中に注ぎ、EtOAc(3×)で抽出する。混ぜ合わせた有機抽出物を連続的に水(4×)と食塩水で洗浄し、MgSO4で乾燥させ、ろ過かつ濃縮して中間体3c2を得る。
工程2:
EtOAc(4mL)中の化合物3c2(83mg,0.15mmol)と炭素上10%のパラジウム(25mg)の混合物を1気圧のH2下で周囲温度にて一晩撹拌する。混合物をろ過かつ濃縮して化合物3c3を得る。
工程3:
ジアニリン3c3(39mg,0.08mmol)とDMF(1mL)の混合物に連続的にDIPEA(0.040mL,0.23mmol)、2-メトキシ酢酸(0.006mL,0.08mmol)及びHATU(35mg,0.09mmol)を加える。混合物を周囲温度で一晩撹拌してからEtOAcで希釈し、連続的に10%のクエン酸水溶液、水、飽和NaHCO3水溶液、水及び食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過かつ濃縮して中間体3c4を得る。
工程4:
化合物3c4(45mg,0.08mol)、メタノール(1mL)及び4N HCl/ジオキサン(1mL)の混合物を75℃で1時間加熱する。混合物を濃縮して残留物をDMSOに溶かす。NaOH水溶液(5N,0.16mL,0.78mmol)を加えて混合物を55℃で30分撹拌してからAcOH(300μL)を加える。混合物を分取用HPLCで精製して化合物1029(表1)を単離する。
【0104】
(実施例3D)
化合物1035(表1)の調製
【化52】

【0105】
工程1:
化合物3d1(508mg,2.3mmol)と乾燥DMSO(3mL)の混合物に連続的にCH3NH2・HCl(305mg,4.5mmol)とEt3N(0.79mL,5.6mmol)を加える。反応混合物を周囲温度で3.5時間撹拌してから70℃で一晩撹拌する。混合物を水中に注ぎ、EtOAc(3×)で抽出する。混ぜ合わせた有機層を水(4×)と食塩水で洗浄し、MgSO4で乾燥させ、ろ過かつ濃縮する。フラッシュクロマトグラフィー(2% EtOAc-ヘキサン)で精製して化合物3d2を得る。
工程2:
臭素(0.012mL,0.24mmol)をアニリン3d2(53mg,0.24mmol)と氷AcOH(0.5mL)の混合物に加える。混合物を70℃に加熱して5時間撹拌する。過剰のBr2(5μL,0.1mmol)を加えて70℃でさらに1時間撹拌を続ける。混合物を濃縮して化合物3d3を得る。
工程3:
化合物3d3(72mg,0.24mmol)と無水MeOHの混合物にSnCl2・2H2O(540mg,2.4mmol)を加え、混合物を3時間加熱して還流させてから濃縮する。残留物をEtOAcに取り、飽和NH4Cl水溶液中に注ぐ。水層を2回以上EtOAcで抽出し、混ぜ合わせた有機抽出物をCeliteTMの短パッドに通してろ過する。有機相を水と食塩水で洗浄し、MgSO4で乾燥させ、ろ過かつ濃縮して化合物3d4を得る。
工程4:
化合物3d4(60mg,0.22mmol)とDMF(1mL)の混合物に連続的にDIPEA(0.12mL,0.67mmol)、2-メトキシ酢酸(0.021mL,0.27mmol)及びHATU(100mg,0.27mmol)を加える。反応混合物を周囲温度で6時間撹拌してからEtOAcで希釈し、10%のクエン酸水溶液、水、飽和NaHCO3水溶液、水及び食塩水で連続的に洗浄する。有機相をMgSO4で乾燥させ、ろ過かつ濃縮して化合物3d5を得る。
工程5:
化合物3d5(76mg,0.22mmol)と氷AcOH(2mL)の混合物をJ-Kem(登録商標)オービタルシェイカー(250rpmに設定)上60℃で6時間加熱する。混合物を濃縮して残留物をフラッシュクロマトグラフィー(1:1→2:1 EtOAc/ヘキサン)で精製してベンゾイミダゾール3d6を得る。
工程6:
非特許文献17から以下の手順を適合させた。
N2でパージしたねじ蓋反応容器内で無水NMP(1mL)中のブロモベンゾイミダゾール3d6(41mg,0.13mmol)、フェノール1a9(実施例1A)(42mg,0.13mmol)、CuCl(3mg,0.03mmol)、Cs2CO3(83mg,0.25mmol)及び2,2,6,6-テトラメチルヘプタン-3,5-ジオン(0.003mL,0.01mmol)の混合物をJ-Kem(登録商標)オービタルシェイカー(270rpm)で120℃にて全部で20時間撹拌する。混合物をAcOHで酸性にして分取用HPLCで精製して化合物1035(表1)を得る。
【0106】
(実施例3E)
化合物1036(表1)の調製
【化53】

【0107】
工程1:
化合物3e1(100mg,0.45mmol)と乾燥DMF(2mL)の混合物に連続的にCs2CO3(218mg,0.67mol)とCH3I(0.042mL,0.67mmol)を加える。混合物を周囲温度で1時間撹拌し、水中に注ぎ、EtOAcで抽出する。有機抽出物を水(4×)と食塩水で洗浄し、MgSO4で乾燥させ、ろ過かつ濃縮して化合物3e2を得る。
工程2:
実施例3Dの工程3〜6の手順を用いて化合物3e2を化合物1036(表1)に変換する。
【0108】
(実施例4A)
化合物2010(表2)の調製
【化54】

【0109】
化合物2011(実施例2D)(40mg,0.07mmol)と無水DMF(2mL)の混合物にZn(CN)2(16mg,0.14mmol)とPd(PPh3)4(8.1mg,0.01mmol)を加える。Arを用いて混合物を脱気して110℃で一晩撹拌する。混合物をTFAで酸性にして分取用HPLCで精製して化合物2010(表2)を単離する。
【0110】
(実施例4B)
化合物2003(表2)の調製
【化55】

【0111】
ラセミBINAP(7.5mg,0.012mmol)とPd(OAc)2(2.7mg,0.012mmol)の混合物を乾燥トルエン(1.5mL)中で10分間超音波処理する。この混合物を乾燥トルエン(2mL)中の化合物2d4(実施例2D)(75mg,0.12mmol)、モルフォリン(13.9mg,0.16mmol)及びCs2CO3(0.20g,0.62mmol)の混合物と混ぜ合わせて生じた混合物を105℃で3.5時間撹拌する。混合物を周囲温度に冷まし、EtOAcで希釈し、水、飽和NaHCO3水溶液及び食塩水で洗浄し、乾燥させ(MgSO4)てろ過する。ろ液を減圧下で濃縮して残留物をTHF(3.0mL)、MeOH(1.5mL)及びH2O(0.5mL)と混合する。LiOH水溶液(5N,0.40mL,2.0mmol)を0℃で加えて混合物を周囲温度で一晩撹拌する。混合物をTFAで酸性にし、分取用HPLCで精製して化合物2003(表2)を得る。
【0112】
(実施例4C)
化合物2069(表2)の調製
【化56】

【0113】
工程1:
非特許文献18から以下の手順を適合させる。
無水DMF(2mL)中のヨードアレン2d4(実施例2D)(270mg,0.45mmol)の混合物にチオ尿素(54mg,0.71mmol)、NiBr2(11mg,0.05mmol)及びNaBH3CN(4.5mg,0.07mmol)を加える。混合物をマイクロ波内120℃で15分加熱し、周囲温度に冷ましてDMF(3ml)で希釈する。NaOH水溶液(0.5N,3mL)をゆっくり加えて混合物を15分激しく撹拌し、1NのHCl水溶液とEtOAcに分配する。有機相を水と食塩水で洗浄し、MgSO4で乾燥させ、ろ過し、減圧下で濃縮して化合物4c1を得る。
工程2:
MeCN(4mL)中の化合物4c1(205mg,0.4mmol)、DBU(0.090mL,0.6mmol)及びMeI(0.038mL,0.6mmol)の混合物を周囲温度で一晩撹拌する。混合物をEtOAc(50mL)で希釈し、1NのHCl水溶液、水、1NのNaOH水溶液、水、チオスルフェート水溶液及び食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮して化合物4c2を得る。
工程3:
LiOH水溶液(5N,0.18mL,0.9mmol)をTHF(4mL)、MeOH(2mL)及び水(0.1mL)中のメチルチオエーテル4c2(95mg,0.18mmol)の混合物に加える。混合物を周囲温度で4時間撹拌してから5時間50℃に加熱し、周囲温度に冷ます。混合物を1NのHClで酸性にし、EtOAcで希釈し、水と食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、 減圧下で濃縮する。残留物をアセトンと水の混合物(5:2;7mL)に取り、OxoneTM(572mg,0.93mmol)を加えて混合物を周囲温度で2.5日間撹拌する。次に、混合物をEtOAcとエーテル(3:2)で希釈し、1NのHCl水溶液、水及び食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。残留物をDMSOに取り、分取用HPLCで精製して化合物2069(表2)を得る。
【0114】
(実施例5A)
化合物2002(表2)の調製
【化57】

【0115】
無水DMF(3mL)中の化合物2011(実施例2D)(110mg,0.19mmol)の混合物に1-エトキシビニルトリ-n-ブチルスズ(0.085mL,0.25mmol)とビス(トリ-tert-ブチルホスフィノ)パラジウム(0)(9.7mg,0.02mmol)を加える。Arを用いて混合物を脱気して100℃で45分撹拌する。混合物を周囲温度に冷まし、MeCN(4mL)と1NのHCl(4mL)を加えて周囲温度で15分間撹拌を続ける。混合物を減圧下で濃縮し、生じた残留物にDMSO(4mL)を加える。混合物をろ過し、分取用HPLCで精製して化合物2002(表2)を単離する。
【0116】
(実施例5B)
化合物2004(表2)の調製
【化58】

【0117】
工程1:
実施例5Aで述べた手順を用いて中間体5b1を化合物2d4(実施例2D)から調製した。
工程2:
NaBH4(9.1mg,0.24mmol)を化合物5b1(50mg,0.10mmol)とMeOH(6mL)の混合物にゆっくり加え、混合物を周囲温度で一晩撹拌する。混合物をEtOAcで希釈し、1NのHCl、水、飽和NaHCO3水溶液及び食塩水で洗浄し、MgSO4で乾燥させ、ろ過し、減圧下で濃縮する。残留物をTHF(2mL)、MeOH(1mL)及び水(0.5mL)と混ぜ合わせてLiOH水溶液(5N,0.20mL,1.0mmol)を加える。混合物を周囲温度で一晩撹拌してからTFAで酸性にして濃縮する。残留物にDMSO(2ml)を加え、混合物を分取用HPLCで精製して化合物2004(表2)を得る。
【0118】
(実施例5C)
化合物2154(表2)の調製
【化59】

【0119】
EtOH(1mL)中の化合物5b1(実施例5B)(48mg,0.09mmol)、NaBH4(5.3mg,0.14mmol)、AcOH(0.050mL,0.88mmol)及びモルフォリン(0.010mL,0.11mmol)の混合物を20時間60℃で加熱する。過剰のNaBH4(2mg,0.05mmol)とモルフォリン(0.017mL,0.18mmol)を加え、撹拌を60℃でさらに20時間続ける。NaOH水溶液(2.5N,0.60mL,1.5mmol)を加えて混合物を50℃で1時間撹拌する。AcOHで酸性化後、混合物を分取用HPLCで精製して化合物2154(表2)を単離する。
【0120】
(実施例6A)
化合物2103(表2)の調製
【化60】

【0121】
工程1:
非特許文献19に記載のプロトコルから手順を適合させる。
無水THF(30mL)中の化合物2d4(実施例2D)(2.0g,3.3mmol)、マロン酸ジベンジル(2.5g,9.9mmol)、CuI(76mg,0.4mmol)、2-フェニルフェノール(68mg,0.4mmol)、Cs2CO3(4.1g,12.5mmol)の混合物をArで15分脱気してから70℃で16時間撹拌する、過剰のCuI(76mg,0.4mmol)と2-フェニルフェノール(68mg,0.4mmol)を加えて70℃でさらに20時間撹拌を続ける。混合物をEtOAcで希釈し、飽和NH4Cl水溶液と食塩水で洗浄して濃縮する。残留物をEtOH(20mL)に取り、10% Pd/C(0.4g)を加える。混合物を1気圧のH2下で周囲温度にて2時間撹拌し、CeliteTMのパッドに通してろ過する。ろ液を80℃で1時間撹拌し、周囲温度に冷まして減圧下で濃縮する。残留物をフラッシュクロマトグラフィー(1:1 EtOAc/ヘキサン)で精製して化合物6a1を得る。
工程2:
CH2Cl2(24mL)中の化合物6a1(900mg,1.7mmol)の混合物に塩化オキサリル(0.21mL,2.4mmol)とDMF(0.060mL,0.8mmol)を加えて混合物を室温で1時間撹拌する。混合物を濃縮して残留物をCH2Cl2(30mL)に取る。撹拌しながら、CH2N2(Et2O中0.35M,46mL,16mmol)を滴加し、撹拌を30分続ける。混合物を減圧下で濃縮して残留物をTHF(24mL)に取る。48%のHBr水溶液(1.8mL,16mmol)を加えて混合物を20分撹拌する。混合物を減圧下で濃縮し、EtOAcで希釈する。有機相を水、飽和NaHCO3水溶液及び食塩水で洗浄し、MgSO4上で乾燥させ、ろ過し、減圧下で濃縮して化合物6a2を得る。
工程3:
i-PrOH中のブロモケトン6a2(60mg,0.1mmol)とチオアセトアミド(14mg,0.19mmol)の混合物を70℃で1時間撹拌する。混合物を周囲温度に冷ましてNaOH(2.5N,0.18mL,0.44mmol)を加える。混合物を40℃で5時間撹拌してから水で希釈し、HClで酸性にする。ろ過で固体を集めて過剰の水で洗浄してからDMSOに取り、分取用HPLCで精製して化合物2103(表2)を得る。
【0122】
(実施例7A)
中間体7a5の調製
【化61】

【0123】
工程1:
無水THF(280mL)中の化合物2d4(実施例2D)(40g,66.2mmol)の混合物にビニルトリブチルスズ(23mL,25g,78.8mmol)とPdCl2(PPh3)2(4.8g,6.8mmol)を加える。混合物をArで5分脱気してから4〜6時間加熱して還流させる。減圧下で溶媒を除去し、残留物をフラッシュクロマトグラフィー(勾配19:1→3:2 ヘキサン/EtOAc)で精製して中間体7a1を得る。
工程2:
アセトン(710mL)中のアルケン7a1(40.3g,79.9mmol)の溶液にtert-BuOH(176mL)、水(88mL)、4-N-メチルモルフォリンオキシド一水和物(水中60%溶液,21mL,120mmol)とOsO4(t-BuOH中2.5wt%,13.3mL,1.06mmol)を加える。混合物を周囲温度で一晩撹拌してから濃縮してEtOAc(4L)に取る。有機相を2M HCl(2×1L)、水、飽和NaHCO3水溶液(1L)及び食塩水で洗浄する。有機相に活性炭とNa2SO4を加えて混合物を10分撹拌する。混合物をCeliteTMのパッドに通してろ過してから濃縮して中間体7a2を得る。
工程3:
THF(710mL)と水(270mL)中のジオール7a2(40.6g,75.4mmol)の冷却(0℃)混合物に過ヨウ素酸ナトリウム(25g,116.9mmol)を加える。混合物を0℃で5分放置してから室温で4時間撹拌を続ける。さらに過ヨウ素酸ナトリウム(3.3g,15.4mmol,0.2当量)を加えて撹拌を2時間続ける。混合物をエーテル/EtOAc(1.8L/3.6L)で希釈してから水と食塩水で洗浄し、Na2SO4上で乾燥させ、ろ過し、減圧下で濃縮する。残留物をフラッシュクロマトグラフィーで精製して中間体7a3を得る。
工程4:
アルデヒド7a3(30.7g,60.6mmol)とMeOH(300mL)の混合物にナトリウムボロヒドリド(4.4g,116mmol,2当量)をゆっくり加える。混合物を周囲温度で2時間撹拌してからEtOAcで希釈して1NのHCl、飽和NaHCO3水溶液及び食塩水で慎重に洗浄する。有機相をNa2SO4上で乾燥させ、ろ過し、減圧下で濃縮して中間体7a4を得る。
工程5:
アルコール7a4(19g,37.4mmol)、無水CH2Cl2(450mL)及びDMF(9mL)の混合物に塩化チオニル(5.5mL,8.1mmol)をゆっくり加える。混合物を周囲温度で30分撹拌してからEtOAc(1.5L)で希釈して飽和NaHCO3水溶液と食塩水で洗浄する。有機相をNa2SO4で乾燥させ、ろ過かつ濃縮して中間体7a5を得る。
【0124】
(実施例8A)
化合物2005(表2)の調製
【化62】

【0125】
エーテル(4mL)中のジアゾメタンをエーテル(2mL)中のアルケン7a1(実施例7A)(26mg,0.05mmol)の冷却(0℃)混合物にゆっくり加える。Pd(OAc)2(2mg,0.01mmol)を加えて混合物を周囲温度で1.5時間撹拌する。混合物を減圧下で濃縮し、残留物にTHF(2mL)、MeOH(1mL)及び水(0.2mL)を添加後、LiOH水溶液(5N,0.6mL,3.0mmol)を加える。混合物を周囲温度2.5日間撹拌する。DMSO(1.5mL)と過剰のLiOH水溶液(5N,0.3mL,1.5mmol)を加えて周囲温度で一晩撹拌を続ける。混合物をTFAで酸性にし、減圧下でで濃縮する。残留物を分取用HPLCで精製して化合物2005(表2)を単離する。
【0126】
(実施例8B)
化合物2007(表2)の調製
【化63】

【0127】
MeOH(2mL)とEtOAc(4mL)中のアルケン7a1(実施例7A)(23mg,0.05mmol)の混合物に10%のパラジウム(炭素上)(2mg)を加える。混合物をH2(約1気圧)下で2.5日間撹拌してからろ過し、濃縮乾固させる。残留物をTHF(2mL)、MeOH(1mL)及び水(0.2mL)に取る。LiOH水溶液(5N,0.4mL,2.0mmol)を加えて混合物を周囲温度で一晩撹拌する。DMSO(1.0mL)と過剰のLiOH水溶液(5N,0.2mL,1.0mmol)を加えて50℃で3時間撹拌を続ける。混合物をTFAで酸性にして減圧下で濃縮する。残留物を分取用HPLCで精製して化合物2007(表2)を単離する。
【0128】
(実施例9A)
化合物2120(表2)の調製
【化64】

【0129】
AcOH(0.5mL)中のアルデヒド7a3(実施例7A)(50mg,0.1mmol)と2-アミノピラジン(38mg,0.4mmol)の混合物を80℃で2時間撹拌する。混合物を周囲温度に冷まし、NaCNBH3(7.9mg,0.13mmol)を加えて混合物を15分撹拌してからN2流下で濃縮する。NaOH水溶液(2.5N,0.60mL,1.5mmol)を残留物に加えて混合物を50℃で2時間撹拌してから分取用HPLCで精製して化合物2120(表2)を単離する。
【0130】
(実施例10A)
化合物2026(表2)の調製
【化65】

【0131】
DMF(1mL)中の中間体7a5(実施例7A)(25mg,0.05mmol)、インドール(8.2mg,0.07mmol)、Cs2CO3(23mg,0.07mmol)及びKI(3mg,0.02mmol)の混合物をJ-Kem(登録商標)オービタルシェイカー(250rpm)上で70℃にて一晩撹拌する。DMSO(0.5mL)を添加後、NaOH水溶液(5N,0.10mL,0.5mmol)を加えて混合物を55℃で1時間撹拌する。混合物をAcOHで酸性にしてから分取用HPLCで精製して化合物2026(表2)を単離する。
【0132】
(実施例10B)
化合物2047及び2057(表2)の調製
【化66】

【0133】
工程1:
THF(1mL)中の化合物7a5(実施例7A)(25mg,0.05mmol)、3-ピロリジノール(0.006mL,0.07mmol)及びEt3N(0.010mL,0.07mmol)の混合物をJ-Kem(登録商標)オービタルシェイカー上で(250rpm)70℃にて一晩撹拌する。混合物をN2流下で濃縮してからDMSO(0.5mL)に取る。NaOH水溶液(5N,0.10mL,0.5mmol)を加えて混合物を55℃で1時間撹拌する。混合物をAcOHで酸性にし、分取用HPLCで精製して化合物2047(表2)を単離する。
工程2:
DCM/CH3CN(1:1,1mL)中の化合物2047(12mg,0.02mmol)とDess-Martinペルヨージナン(7.6mg,0.02mmol)の混合物を周囲温度で20時間撹拌する。追加分のDess-Martinペルヨージナン(7.6mg,0.02mmol)を加えてさらに20時間撹拌を続ける。混合物を減圧下で濃縮して残留物を分取用HPLCで精製して化合物2057(表2)を得る。
【0134】
(実施例10C)
化合物2153(表2)の調製
【化67】

【0135】
工程1:
化合物7a5(実施例7A)(9.5g,18.05mmol)、NaN3(2.16g,33.4mmol)及び60%(v/v)のアセトン-水(90mL)の混合物をAr下で一晩撹拌して還流させる。混合物を減圧下で濃縮して残留物をEtOAc(1L)で抽出し、水(4×)で洗浄する。有機相をMgSO4上で乾燥させ、ろ過し、減圧下で濃縮して化合物10c1を得る。
工程2:
メタノール(100mL)中の化合物10c1(9.68g,18.14mmol)の混合物じゅうに10分間アルゴンを泡立たせて混合物をAr下でPd/C(10%,1g)に加える。撹拌混合物じゅうに2.5時間H2を泡立たせる。混合物をCeliteTMに通してろ過し、MeOHですすぐ。ろ液を濃縮乾固させ、残留物をフラッシュカラムクロマトグラフィー(SiO2,MeOH/DCM:5/95)で精製して遊離アミンを単離する。このアミンとEt2O中2MのHCl溶液(30mL)の混合物を室温で1時間撹拌する。ろ過で塩酸塩10c2を収集し、ジエチルエーテルですすいで空気乾燥させる。
工程3:
化合物10c2(25mg,0.049mmol)とDMF(0.50mL)の混合物にシクロプロパンスルホニルクロリド(6.3μL,0.058mmol)とEt3N(16.9μL,0.121mmol)を加える。混合物をオービタルシェイカー上(350rpm)室温で一晩撹拌する。NaOH(5N,100μL,0.50mmol)を加え、混合物を50℃で1時間加熱してからAcOHで酸性にし、分取用HPLCで精製して化合物2153(表2)を得る。
【0136】
(実施例10D)
化合物2159(表2)の調製
【化68】

【0137】
DMF(0.5mL)中の化合物10c2(実施例10C)(25mg,0.046mmol,1当量)の混合物に(CH3)2CH-NCO(1.3当量)を加える。HPLC分析で判定した場合に完了するまで混合物を室温で撹拌する。5NのNaOH(0.1mL,10当量)を加え、混合物を50℃に1時間加熱してからAcOHで酸性にする。逆相HPLCで精製して化合物2159(表2)を得る。
【0138】
(実施例10E)
化合物2161(表2)の調製
【化69】

【0139】
THF(0.5mL)中の化合物10c2(実施例10C)(25mg,0.046mmol,1当量)の混合物にDIEA(12μL,1.5当量)を添加後、クロロギ酸エチル(5.3μL,1.2当量)を加える。混合物を室温で一晩撹拌してから減圧下で濃縮する。残留物をDMSO(0.5mL)と混合し、5NのNaOH(0.1mL,11当量)を加えて混合物を50℃で45分加熱する。AcOHを用いて混合物を酸性にし、逆相HPLCで精製して化合物2161(表2)を得る。
【0140】
(実施例10F)
化合物2188(表2)の調製
【化70】

【0141】
化合物10c2(実施例10C)(50mg,0.091mmol)とDCM(1mL)の混合物にクロロギ酸エチル(12μL,0.126mmol)を添加後、Et3N(40μL,0.287mmol)を加える。反応混合物を室温で一晩撹拌し、アルゴン流下で濃縮し、残留物をDMF(1mL)と混合する。混合物の半分をNaH(60%の油分散系,6mg,3.3当量)を含有するバイアルに加え、この混合物を室温で5分撹拌する。ヨードメタン(10μL,3.5当量)を加えて室温で5時間撹拌を続ける。5NのNaOH(10当量)を加えて混合物を室温でさらに14時間撹拌し、分取用HPLCで精製して化合物2188(表2)を得る。
【0142】
(実施例11A)
化合物2039(表2)の調製
【化71】

【0143】
中間体7a5(実施例7A)(25mg,0.05mmol)、2-メルカプトイミダゾール(7.0mg,0.07mmol)、Cs2CO3(23mg,0.07mmol)及びDMF(1mL)の混合物をJ-Kem(登録商標)オービタルシェイカー上(250rpm)70℃で一晩撹拌する。DMSO(0.5mL)を添加後、NaOH水溶液(5N,0.10mL,0.5mmol)を加えて混合物を55℃で1時間撹拌する。混合物をAcOHで酸性にしてから分取用HPLCで精製して化合物2039(表2)を単離する。
【0144】
(実施例11B)
化合物2071(表2)の調製
【化72】

【0145】
工程1:
無水DMF(1.5mL)中の中間体7a5(実施例7A)(55mg,0.1mmol)、KI(3mg,0.02mmol)、NaSMe(11mg,0.16mmol)及びEt3N(0.031mL,0.23mmol)の混合物を70℃で1.5時間撹拌してから周囲温度に冷ます。混合物をEtOAcで希釈し、1NのHCl水溶液、水、飽和NaHCO3水溶液及び食塩水で洗浄し、MgSO4で乾燥させ、ろ過し、減圧下で濃縮して化合物11b1を得る。
工程2:
アセトン/水(3:1;8mL)中の化合物11b1(52mg,0.1mmol)の混合物にOxoneTM(298mg,0.49mmol)を加える。混合物を周囲温度で2時間撹拌してからEtOAcで希釈し、水と食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。残留物をDMSO(2mL)、MeOH(1mL)及び水(0.2mL)の混合物に取る。LiOH水溶液(5N,0.20mL,1.0mmol)を加えて混合物を周囲温度で一晩、次いで50℃で4時間撹拌する。混合物を周囲温度に冷ましてからTFAで酸性にし、濃縮し、分取用HPLCで精製して化合物2071(表2)を単離する。
【0146】
(実施例12A)
化合物2084(表2)の調製
【化73】

【0147】
工程1:
CH2Cl2(2mL)中の化合物7a5(実施例7A)(30mg,0.06mmol)、FeCl3(9.7mg,0.06mmol)及びアニソール(6.1mg,0.06mmol)の混合物をマイクロ波内で100℃にて15分加熱する。混合物を濃縮してからDMSOに取り、分取用HPLCで精製して中間体12a1を単離する。
工程2:
化合物12a1(6mg,0.01mmol)、化合物1a7(実施例1A)(13mg,0.08mmol)及びピリジン(0.3mL)の混合物をマイクロ波内で180℃に12分加熱する。混合物を分取用HPLCで精製して化合物2084(表2)を単離する。
【0148】
(実施例13A)
化合物2056(表2)の調製
【化74】

【0149】
工程1:
非特許文献20から手順を適合させる。化合物13a1(10.0g,36mmol)とCH2Cl2(212mL)の混合物に2-メトキシプロペン(13.8mL,144mmol)を添加後、NaBH(OAc)3(15.3g,72mmol)とAcOH(8.2mL,144mmol)を加える。混合物を周囲温度で一晩撹拌してからEtOAcで希釈し、NaHCO3と食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。残留物をフラッシュクロマトグラフィー(1:9 EtOAc/ヘキサン)に供して化合物13a2単離する。
工程2:
無水ピリジン(160mL)中の化合物13a2(10.2g,32mmol)の混合物に化合物1a7(実施例1A)(11.3g,70mmol)とDMAP(約0.44g)を加える。混合物を80℃で2日間撹拌してからEtOAc(250mL)で希釈し、1N HCl、水、飽和NaHCO3水溶液及び食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。粗生成物をフラッシュクロマトグラフィー(1:4 EtOAc/ヘキサン)で精製してアミド13a3を得る。
工程3:
使用手順を非特許文献21から適合させる。
DMF(2mL)中の化合物13a3(100mg,0.23mmol)、NiBr2(5.7mg,0.03mmol)、チオ尿素(27mg,0.35mmol)及びNaCNBH3(2.2mg,0.04mmol)の混合物をマイクロ波内120℃で15分加熱する。NaOH水溶液(2.5N,2.0mL,1.0mmol)を加えて混合物を15分撹拌する。混合物をEtOAcで希釈し、1NのHCl水溶液と食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮して化合物13a4を得る。
工程4:
DMSO(1.0mL)中の化合物13a4(40mg,0.11mmol)、2-フルオロ-3-トリフルオロメチルピリジン(21mg,0.13mmol)及びK2CO3(55mg,0.40mmol)の混合物を100℃で20時間撹拌する。混合物を室温に冷ましてNaOH(2.5N,300μL,0.75mmol)を加える。混合物を40℃で1時間撹拌し、AcOHで酸性にし、分取用HPLCで精製して化合物2056(表2)を得る。
【0150】
(実施例14A)
化合物1004(表1)の調製
【化75】

【0151】
参考文献:非特許文献22
工程1:
化合物14a1(500mg,4.62mmol)と1-エトキシ-2,2,2-トリフルオロエタノール(667mg,4.63mmol)の混合物を80℃で2時間加熱してから冷ましてEt2Oで希釈する。混合物を1N HCl、水及び食塩水で洗浄し、有機抽出物を乾燥させ(MgSO4)、ろ過かつ濃縮して化合物14a2を得る。
工程2:
グリオキサール水溶液(40%,2.0g,13.8mmol)とn-BuOAc(10mL)の混合物をMgSO4上で乾燥させてろ過する。ろ液に化合物14a2(853mg,4.5mmol)、AcOH(50μL)及びMgSO4(462mg,3.8mmol)を加え、混合物を120℃で6時間加熱する。さらにグリオキサールグリオキサール水溶液(40%,27g,186mmol)をEtOAcで抽出し、EtOAc抽出物をMgSO4上で乾燥させ、n-BuOAc(10mL)を添加し、溶液を減圧下で濃縮して調製した)を加え、120℃での加熱をさらに3.5時間続ける。混合物をろ過かつ濃縮し、残留物を1N NaOHと混合し、CH2Cl2で洗浄する。水相を濃HClで酸性にしてpHを2にしてCH2Cl2で3回抽出する。混ぜ合わせた有機抽出物を水と食塩水で洗浄し、乾燥させ(MgSO4)、ろ過かつ濃縮する。残留物をフラッシュクロマトグラフィーで精製して化合物14a3を得る。
工程3:
NMP(1.0mL)中の化合物13a3(実施例13A)(39mg,0.088mmol)、化合物14a3(20mg,0.088mmol)、Cs2CO3(57mg,0.18mmol)、2,2,6,6-テトラメチルヘプタン-3,5-ジオン(2.0μL,0.01mmol)及びCuCl(4.4mg,0.044mmol)の混合物をN2雰囲気下J-Kem(登録商標)オービタルシェイカー上(275rpm)120℃で7時間撹拌する。NaOH水溶液(5N,176μL,0.88mmol)を加えて混合物を50℃で30分加熱する。AcOHを総量1.5mLまで加えて混合物をろ過し、分取用HPLCで精製して化合物1004(表1)を得る。
【0152】
(実施例15A)
化合物2196(表2)の調製
【化76】

【0153】
工程1:
MeOH(80mL)中のカルボン酸15a1(5.0g,27mmol)と濃H2SO4(4mL)の混合物を12時間撹拌して還流させる。混合物を減圧下で濃縮し、氷と飽和NaHCO3水溶液の混合物上に注ぐ。水性混合物をクエン酸で酸性にしてEtOAcで2回抽出する。混ぜ合わせた有機抽出物を水と食塩水で洗浄し、MgSO4で乾燥させ、ろ過し、減圧下で濃縮する。フラッシュクロマトグラフィー(3:7 EtOAc/ヘキサン)で精製してエステル15a2を得る。
工程2:
化合物15a2(10g,51mmol)、2-フルオロ-3-トリフルオロメチルピリジン(10g,61mmol)及びK2CO3(8.4g,61mmol)をアルゴン雰囲気下、無水DMSO(150mL)中で室温にて混合する。混合物を100℃で一晩撹拌し、室温に冷ましてEtOAc(3L)で希釈する。有機相を飽和NH4Cl溶液と食塩水で洗浄し、MgSO4上で乾燥させ、ろ過し、減圧下で濃縮する。残留物にEt2Oとヘキサンを加えて化合物15a3を得;ろ液を濃縮して残留物をフラッシュクロマトグラフィーで精製することによって、さらなる化合物15a3を得る。
工程3:
化合物15a3(12.5g,37mmol)、MeOH(600mL)及びPd/C(1.4g)の混合物をH2(1気圧)下で室温にて3.5時間撹拌する。混合物をCeliteTMに通してろ過し、MeOHですすぐ。ろ液を濃縮して残留物をフラッシュクロマトグラフィー(勾配;1/4→2/3 EtOAc/ヘキサン)で精製する。得られた遊離アニリンとCH2Cl2(250mL)の混合物を0℃に冷却してEt2O中2MのHCl(50mL)を加える。混合物を室温で1時間撹拌し、ろ過で塩酸塩15a4を収集し、Et2Oですすいで空気乾燥させる。
工程4:
CH2Cl2中の化合物15a4(2.1g,5.9mmol)と2-メトキシプロペン(2.3mL,24mmol)の混合物にNaBH(OAc)3(2.5g,12mmol)を少しずつ加える。混合物を周囲温度で30分撹拌してからEtOAcで希釈し、飽和NaHCO3水溶液と食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。残留物をヘキサン/エーテル中で摩砕後、ろ過し、洗浄し(ヘキサン)、乾燥させて化合物15a5を得る。
工程5:
塩化オキサリル(DCM中2M,0.16mL,0.32mmol)をDCM(1mL)中の4-クロロ-3-メチル安息香酸(27mg,0.16mmol)の混合物にゆっくり加える。DMF(1滴)を加えて混合物を周囲温度で30分撹拌し、減圧下で濃縮する。残留物をピリジン(0.5mL)と混合し、化合物15a5(30mg,0.08mmol)を加えて混合物を60℃で一晩撹拌する。NaOH水溶液(10N,0.096mL,0.96mmol)と水(0.2mL)を加えて混合物を周囲温度で一晩撹拌してからEtOAcで希釈し、1N HClと食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。分取用HPLCで精製して化合物2196(表2)を得る。
【0154】
(実施例16A)
化合物2124(表2)の調製
【化77】

【0155】
工程1:
DMF(20mL)中の化合物15a4(実施例15A)(2.0g,5.8mmol)、tert-ブチルブロモアセテート(4.3mL,29mmol)及びDIPEA(3.0mL,17mmol)の混合物を80℃で一晩撹拌する。混合物をEtOAcで希釈し、0.5NのKHSO4水溶液、飽和NaHCO3水溶液及び食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。残留物をフラッシュクロマトグラフィー(勾配;1:9→1:1 EtOAc/ヘキサン)で精製して化合物16a1を得る。
工程2:
無水ピリジン(20mL)中の16a1(1.6g,3.7mmol)とDMAP(0.45g,3.7mmol)の混合物に化合物1a7(実施例1A)(0.90g,5.6mmol)を加える。混合物を70℃で一晩撹拌してからEtOAcで希釈して1N HCl、飽和NaHCO3水溶液及び食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。1:9のEtOAc/ヘキサンと摩砕してアミド16a2を得る。
工程3:
化合物16a2(1.5g,2.8mmol)とDCM(20mL)の混合物に0℃にてトリフルオロ酢酸(5mL)をゆっくり加える。混合物を周囲温度に戻して一晩撹拌してから減圧下で濃縮する。残留物をDCMと混合し、2回濃縮してから水とアセトニトリルから凍結乾燥させて酸16a3を得る。
工程4:
DMF(0.5mL)中の化合物16a3(25mg,0.05mmol)とHATU(23mg,0.06mmol)の混合物にピロリジン(0.005mL,0.06mmol)を添加後、Et3N(0.030mL,0.22mmol)を加える。混合物をJ-Kem(登録商標)オービタルシェイカー上(250rpm)周囲温度で1時間撹拌する。NaOH水溶液(5N,0.10mL,0.5mmol)を加えて周囲温度で一晩撹拌を続ける。混合物をAcOH(0.1mL)で酸性にし、DMSO(1mL)で希釈し、分取用HPLCで精製して化合物2124(表2)を単離する。
【0156】
(実施例16B)
化合物2149(表2)の調製
【化78】

【0157】
DMF中の酸16a3(実施例16A)(50mg,0.1mmol)の混合物にHATU(51mg,0.14mmol)、フェニレンジアミン(11mg,0.11mmol)及びEt3N(0.063mL,0.45mmol)を加える。混合物を周囲温度で一晩撹拌してからEtOAcで希釈し、10%のクエン酸水溶液、水、飽和NaHCO3水溶液及び食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。残留物をAcOH(1mL)と混合し、100℃で1時間撹拌する。周囲温度に冷ました後、混合物をEtOAcで希釈して飽和NaHCO3水溶液、水及び食塩水で洗浄する。有機相をMgSO4で乾燥させ、ろ過し、減圧下で濃縮する。残留物(55mg,0.1mmol)をDMSO(2mL)、MeOH(1mL)及び水(0.15mL)と混ぜ合わせる。NaOH水溶液(10N,0.097mL,0.10mmol)を加えて混合物を周囲温度で一晩撹拌する。混合物をTFAで酸性にし、分取用HPLCで精製して化合物2149(表2)を単離する。
【0158】
(実施例17)
NS5B RNA依存性RNAポリメラーゼ活性の阻害:
以下に述べるプロトコルに従い、C型肝炎ウイルスRNA依存性ポリメラーゼ(NS5B)に対する阻害活性について本発明の代表化合物を試験する。
HCV His-NS5BΔ21ポリメラーゼ[配列番号1]はC-末端の21のアミノ酸を欠いており、非特許文献23に記載されているように、大腸菌株JM109(DE3)においてpETベースベクターからN-末端の6-ヒスチジンタグで発現させて精製する。この均一酵素製剤を-20℃で貯蔵緩衝液(25mM Tris/HCl pH 7.5, 300mM NaCl, 5mM DTT, 1M EDTA及び30%(v/v)グリセロール)に貯蔵する。
ホモポリマーのポリ(A)鋳型にアニールしたビオチン-オリゴ-(U)12RNAプライマーの伸長中の3H-UTPの取込みを測定するアッセイで前記精製His-NS5BΔ21ポリメラーゼを再構成する。まず試験化合物を添加後、基質、次に酵素を加える。反応の最後に、ストレプトアビジンシンチレーション近接アッセイ(scintillation proximity assay)(SPA)ビーズを添加し、捕獲された二重鎖RNA生成物由来の放射能TopCount装置(Packard)で定量する。
アッセイ反応の成分は以下のとおりである:20mM Tris-HCl pH 7.5、1mM TCEP、1mM EDTA、5mM MgCl2、0.01%w/v BSA、5%v/v DMSO、10μg/mLのPoly(A)、1μg/mLのビオチン-オリゴ-(U)12、333nM UTP、0.01mCi/mL(300nM)の3H-UTP、80単位/mLのRnasin、12.5nM His-NS5BΔ21ポリメラーゼ並びに広い濃度範囲にわたって段階希釈した試験インヒビター化合物。384-ウェルプレート内で1.5時間22℃でインキュベーションしてアッセイを行ってから、0.5MのEDTAと、ストレプトアビジン-被覆ビーズで捕獲された生成物との溶液でアッセイを停止する。各ウェルの底に6MのCsClを添加後、プレートを室温で90分間放置後、TopCountで60秒間カウントする。次に、計算した阻害%の値を用いて、SASの非線形回帰ルーチン(non-linear regression routine)NLIN手順によってIC50、傾斜係数(n)及び最大阻害(Imax)を決定する。
【0159】
〔実施例18〕
NS5B RNA依存性RNAポリメラーゼ阻害の特異性:
非特許文献23に記載されているようにポリオウイルスRNA依存性RNAポリメラーゼ及び子ウシ胸腺DNA依存性RNAポリメラーゼIIに対する阻害活性について本発明の代表化合物を試験する。
(実施例19)
細胞ベースルシフェラーゼレポーターHCV RNA複製アッセイ:
特許文献16に記載のアッセイを用いて、安定したサブゲノムHCVレプリコンを発現する細胞内におけるC型肝炎ウイルスRNA複製のインヒビターとしての活性について本発明の代表化合物を試験する。
【0160】
(化合物の表)
以下の表は、本発明の代表的な化合物を列挙する。下表1及び2に列挙される代表化合物を実施例33のNS5Bポリメラーゼ活性の阻害アッセイで試験すると、30μM未満のeIC50値を有することが分かる。
実施例に記載の標準的な分析用HPLC条件を用いて各化合物の保持時間(tR)を測定する。当業者に周知なように、保持時間値はその特有の測定条件に敏感である。従って、溶媒、流速、線形勾配などの同一条件を使用しても、例えば、異なるHPLC機器で測定した場合など、保持時間が変わりうる。同一機器で測定した場合でさえ、例えば、異なる個々のHPLCカラムを用いて測定した場合に値が変わることがあり、或いは、同一機器及び同一の個々カラムで測定した場合でさえ、例えば、異なる機会に取った個々の測定間で値が変わることがある。
【0161】
【表1】

【0162】
【表2】

【0163】
【表3】

【0164】
【表4】

【0165】
【表5】

【0166】
【表6】

【0167】
【表7】

【0168】
【表8】

【0169】
【表9】

【0170】
【表10】

【0171】
【表11】

【0172】
【表12】

【0173】
【表13】

【0174】
【表14】

【0175】
【表15】

【0176】
【表16】

【0177】
【表17】

【0178】
【表18】

【0179】
【表19】

【0180】
【表20】

【0181】
【表21】

【0182】
【表22】

【0183】
【表23】

【0184】
【表24】

【0185】
【表25】

【0186】
【表26】

【0187】
【表27】

【0188】
【表28】

【0189】
【表29】

【0190】
【表30】

【0191】
【表31】

【特許請求の範囲】
【請求項1】
下記式(I)の化合物又はその塩若しくはエステル。
【化1】

(式中:
XはO及びSから選択され;
R2は、任意に1〜5個のR20置換基で置換されていてもよいHetであり、ここで、R20は各場合独立に下記基:
a)ハロ、シアノ又はニトロ;
b)R7、-C(=O)-R7、-C(=O)-O-R7、-O-R7、-S-R7、-SO-R7、-SO2-R7、-(C1-6)アルキレン-R7、-(C1-6)アルキレン-C(=O)-R7、-(C1-6)アルキレン-C(=O)-O-R7、-(C1-6)アルキレン-O-R7、-(C1-6)アルキレン-S-R7、-(C1-6)アルキレン-SO-R7又は-(C1-6)アルキレン-SO2-R7
(ここで、R7は各場合独立にH、(C1-6)アルキル、(C2-6)アルケニル、(C2-6)アルキニル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、アリール及びHetから選択され;
前記(C1-6)アルキルは任意に、-OH、-O-(C1-6)アルキル、シアノ、COOH、-NH2、-NH(C1-4)アルキル、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル及び-N((C1-4)アルキル)2からそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;かつ
前記各アリール及びHetは任意に、下記基:
i)ハロ、シアノ、オキソ、チオキソ、イミノ、-OH、-O-(C1-6)アルキル、-O-(C1-6)ハロアルキル、(C3-7)シクロアルキル、(C1-6)ハロアルキル、-C(=O)-(C1-6)アルキル、-SO2(C1-6)アルキル、-C(=O)-NH2、-C(=O)-NH(C1-4)アルキル、-C(=O)-N((C1-4)アルキル)2、-C(=O)-NH(C3-7)シクロアルキル、-C(=O)-N((C1-4)アルキル)(C3-7)シクロアルキル、-NH2、-NH(C1-4)アルキル、-N((C1-4)アルキル)2、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル又は-NH-C(=O)(C1-4)アルキル;
ii)任意に-OH、-O-(C1-6)ハロアルキル、又は-O-(C1-6)アルキルで置換されていてもよい(C1-6)アルキル;及び
iii)アリール又はHet(各アリール及びHetは任意にハロ又は(C1-6)アルキルで置換されていてもよい)
からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);及び
c)-N(R8)R9、-C(=O)-N(R8)R9、-O-C(=O)-N(R8)R9、-SO2-N(R8)R9、-(C1-6)アルキレン-N(R8)R9、-(C1-6)アルキレン-C(=O)-N(R8)R9、-(C1-6)アルキレン-O-C(=O)-N(R8)R9、又は-(C1-6)アルキレン-SO2-N(R8)R9(ここで、
R8は、各場合独立にH、(C1-6)アルキル及び(C3-7)シクロアルキルから選択され;かつ
R9は、各場合独立にR7、-(C1-6)アルキレン-R7、-SO2-R7、-C(=O)-R7、-C(=O)OR7及び-C(=O)N(R8)R7から選択され;R7及びR8は前記定義どおりである)
から選択され;
R3は、H、ハロ、(C1-4)アルキル、-O-(C1-4)アルキル、-S-(C1-4)アルキル、-NH2、-NH(C1-4)アルキル、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル及び-N((C1-4)アルキル)2から選択され;
R5は、H、(C1-6)アルキル、(C3-7)シクロアルキル又はHetであり;該(C1-6)アルキル及びHetはそれぞれ任意に、(C1-6)アルキル、Het、-OH、-COOH、-C(=O)-(C1-6)アルキル、-C(=O)-O-(C1-6)アルキル、-SO2(C1-6)アルキル及び-C(=O)-N(R51)R52からそれぞれ独立に選択される1〜4個の置換基で置換されていてもよく
(ここで、R51はH、(C1-6)アルキル又は(C3-7)シクロアルキルであり;かつ
R52はH、(C1-6)アルキル、(C3-7)シクロアルキル、アリール、Het、アリール-(C1-3)アルキル-又はHet-(C1-3)アルキル-であり;
該(C1-6)アルキル、(C3-7)シクロアルキル、アリール、Het、アリール-(C1-3)アルキル-及びHet-(C1-3)アルキル-はそれぞれ任意に、(C1-6)アルキル、(C1-6)ハロアルキル、ハロ、オキソ、-OH、-O(C1-6)アルキル、-NH2、-NH(C1-6)アルキル、-N((C1-6)アルキル)2、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル、-C(=O)(C1-6)アルキル及び-NHC(=O)-(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよく;
或いはR51とR52が、それらが結合しているNと一緒に結合して、任意にさらにそれぞれ独立にN、O及びSから選択される1〜3個のヘテロ原子を含有してよい4員〜7員のヘテロ環を形成し(ここで、各Sヘテロ原子は独立に、かつ可能な場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;
前記ヘテロ環は任意に、(C1-6)アルキル、(C1-6)ハロアルキル、ハロ、オキソ、-OH、-O(C1-6)アルキル、-NH2、-NH(C1-6)アルキル、-N((C1-6)アルキル)2、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル、-C(=O)(C1-6)アルキル及び-NHC(=O)-(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);
R6は(C3-7)シクロアルキル又はアリールであり;
該(C3-7)シクロアルキル及びアリールはそれぞれ任意、ハロ、(C1-6)アルキル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、-OH、-SH、-O-(C1-4)アルキル及び-S-(C1-4)アルキルからそれぞれ独立に選択される1〜5個の置換基で置換されていてもよく;かつ
Hetは、O、N及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を有する4員〜7員の飽和、不飽和若しくは芳香族ヘテロ環、又は可能な限り、O、N及びSからそれぞれ独立に選択される1〜5個のヘテロ原子を有する7員〜14員の飽和、不飽和若しくは芳香族ヘテロ多環であり;ここで、各Nヘテロ原子は独立に、かつ可能な場合、さらに酸素原子に結合してN-オキシド基を形成するように酸化状態で存在してよく、各Sヘテロ原子は独立に、かつ可能な場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;
但し、R2が下記基:
【化2】

から選択され;
XがOであり;R3がHであり;かつR5がHである場合、
R6は下記基でない。)
【化3】

【請求項2】
XがOである、請求項1に記載の化合物。
【請求項3】
XがSである、請求項1に記載の化合物。
【請求項4】
R2がHetであり、Hetは、O、N及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有する5員若しくは6員ヘテロ環、又はO、N及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有する9員若しくは10員二環式ヘテロ多環であり;このときHetは、任意に1〜5個のR20置換基(R20は請求項1の定義どおり)で置換されていてもよい、請求項1〜3のいずれか1項に記載の化合物。
【請求項5】
R2が下記式
【化4】

から選択されるHetであり;
このときHetは、任意に1〜3個のR20置換基(R20は請求項1の定義どおり)で置換されていてもよい、請求項4に記載の化合物。
【請求項6】
R2が下記式のHetであり;
【化5】

このときHetは、任意に1〜3個のR20置換基で置換されていてもよく;
R20は、下記基:
a)ハロ又はシアノ;
b)R7、-(C1-6)アルキレン-R7、-C(=O)-R7、-(C1-6)アルキレン-O-R7、-SO2-R7、-(C1-6)アルキレン-S-R7又は-(C1-6)アルキレン-SO2-R7
(ここで、R7は各場合独立にH、(C1-6)アルキル、(C2-6)アルケニル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、アリール及びHetから選択され;前記Hetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する5員若しくは6員ヘテロ環であり、又はHetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する9員若しくは10員ヘテロ多環であり;各Nヘテロ原子は独立に、かつ可能な場合、さらに酸素原子に結合してN-オキシド基を形成するように酸化状態で存在してよく、及び各Sヘテロ原子は独立に、かつ可能な場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;かつ
前記(C1-6)アルキルは任意に、-OH、-O-(C1-6)アルキル及びCOOHからそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;かつ
前記アリール及びHetはそれぞれ任意に、ハロ、シアノ、オキソ、イミノ、-OH、-O-(C1-6)アルキル、-NH2、-NH(C1-4)アルキル、-N((C1-4)アルキル)2、-NH-C(=O)(C1-4)アルキル、(C1-6)アルキル及びHet(ここで、該Hetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する5員又は6員ヘテロ環である)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);及び
c)-(C1-6)アルキレン-N(R8)R9又は-(C1-6)アルキレン-C(=O)-N(R8)R9
(式中、R8は各場合独立にH及び(C1-6)アルキルから選択され;かつ
R9は各場合独立にR7、-SO2-R7、-C(=O)-R7、-C(=O)OR7及び-C(=O)N(R8)R7から選択され;このときR7とR8は前記定義どおりである)
から選択される、請求項5に記載の化合物。
【請求項7】
R2が下記式:
【化6】

の基であり、式中、R23はR20であり;かつ
R20は請求項1の定義どおりである、請求項1に記載の化合物。
【請求項8】
R2が下記式:
【化7】

の基であり、式中、R23はR20であり;かつ
R20が下記基:
a)ハロ又はシアノ;
b)R7、-CH2-R7、-C(=O)-R7、-CH2-O-R7、-SO2-R7、-CH2-S-R7又は-CH2-SO2-R7
(ここで、R7は各場合独立にH、(C1-6)アルキル、(C2-6)アルケニル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、フェニル及びHetから選択され;前記Hetは下記基:
【化8】

から選択され;かつ
前記(C1-6)アルキルは任意に、-OH、-O-(C1-6)アルキル及びCOOHからそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;かつ
前記フェニル及びHetはそれぞれ任意に、ハロ、シアノ、オキソ、イミノ、-OH、-O-(C1-6)アルキル、-NH2、-NH(C1-4)アルキル、-N((C1-4)アルキル)2、-NH-C(=O)(C1-4)アルキル、(C1-6)アルキル及び下記式
【化9】

で表される基からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);及び
c)-CH2-N(R8)R9又は-CH2-C(=O)-N(R8)R9
(式中、R8は各場合独立にH及び(C1-6)アルキルから選択され;かつ
R9は各場合独立にR7、-SO2-R7、-C(=O)-R7、-C(=O)OR7及び-C(=O)N(R8)R7から選択され;このときR7とR8は前記定義どおりである)
から選択される、請求項6に記載の化合物。
【請求項9】
R2が下記式:
【化10】

の基であり、式中、R23はR20であり;かつ
R20が下記基:
b)-CH2-R7、-CH2CH2-R7、-CH2-O-R7、-CH2-S-R7又は-CH2-SO2-R7
(式中、R7はHetであり;前記Hetは下記基:
【化11】

から選択され;かつ
前記Hetは任意に、ハロ、シアノ、オキソ、イミノ、-OH、-O-(C1-6)アルキル、-NH2、-NH(C1-4)アルキル、-N((C1-4)アルキル)2、-NH-C(=O)(C1-4)アルキル、(C1-6)アルキル及び下記式
【化12】

で表される基からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);及び
c)-CH2-N(R8)R9(式中、
R8は各場合独立にH及び(C1-6)アルキルから選択され;かつ
R9はR7で、R7は前記定義どおりである)
から選択される、請求項6に記載の化合物。
【請求項10】
R3がH及びハロから選択される、請求項1〜9のいずれか1項に記載の化合物。
【請求項11】
R3がHである、請求項10に記載の化合物。
【請求項12】
R5が(C1-6)アルキルである、請求項1〜11のいずれか1項に記載の化合物。
【請求項13】
R5が1-メチルエチルである、請求項12に記載の化合物。
【請求項14】
R5が、Het、-COOH又は-C(=O)-N(R51)R52で置換されている(C1-4)アルキルであり、このとき前記Hetは、1〜4個のNヘテロ原子を含有する5員若しくは6員ヘテロ環であり、又はHetは、1〜4個のNヘテロ原子を含有する9員若しくは10員二環式ヘテロ多環であり;
かつR51がH又は(C1-6)アルキルであり、かつR52がH、(C1-6)アルキル、(C3-7)シクロアルキル、Het及びHet-(C1-3)アルキル-から選択され
(ここで、前記(C1-6)アルキルは任意に、-O(C1-6)アルキル及び-N((C1-6)アルキル)2からそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;
かつ前記Het及びHet-(C1-3)アルキル-のHet部分はそれぞれ独立に、N、O及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有する5員又は6員ヘテロ環であり、該Het及びHet-(C1-3)アルキル-はそれぞれ独立に、ハロ、オキソ、-OH、(C1-6)アルキル、(C1-6)ハロアルキル、-(C=O)(C1-6)アルキル、-N((C1-6)アルキル)2及び-NH(C=O)(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);
或いはR51とR52が、それらが結合しているNと一緒に結合して、任意にさらにN、O及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有してよい4員〜7員ヘテロ環を形成している(ここで、各Sヘテロ原子は独立に、かつ可能場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;
このとき前記ヘテロ環は任意に、ハロ、オキソ、-OH、(C1-6)アルキル、(C1-6)ハロアルキル、-(C=O)(C1-6)アルキル、-N((C1-6)アルキル)2及び-NH(C=O)(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい)、請求項1〜11のいずれか1項に記載の化合物。
【請求項15】
R6が、任意に、ハロ、(C1-6)アルキル、(C1-6)ハロアルキル、(C3-7)シクロアルキル。-OH、-SH、-O-(C1-4)アルキル及び-S-(C1-4)アルキルからそれぞれ独立に選択される1〜5個の置換基で置換されていてもよい(C3-7)シクロアルキルである、請求項1〜14のいずれか1項に記載の化合物。
【請求項16】
R6が下記基である、請求項15に記載の化合物。
【化13】

【請求項17】
R6が、任意に、ハロ、(C1-6)アルキル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、-OH、-SH、-O-(C1-4)アルキル及び-S-(C1-4)アルキルからそれぞれ独立に選択される1〜5個の置換基で置換されていてもよいアリールである、請求項1〜14のいずれか1項に記載の化合物。
(但し、R2が下記基:
【化14】

から選択され;
XがOであり;R3がHであり;かつR5がHである場合、
R6は下記基でない。)
【化15】

【請求項18】
R6が、任意に、ハロ、(C1-6)アルキル、(C3-7)シクロアルキル及び-S-(C1-4)アルキルからそれぞれ独立に選択される1〜3個の置換基で置換されていてもよいフェニルである、請求項17に記載の化合物。
(但し、R2が下記基:
【化16】

から選択され;
XがOであり;R3がHであり;かつR5がHである場合、
R6は下記基でない。)
【化17】

【請求項19】
薬物としての、請求項1〜18のいずれか1項に記載の化合物、又はその医薬的に許容しうる塩若しくはエステル。
【請求項20】
治療的に有効な量の請求項1〜18のいずれか1項に記載の化合物、又はその医薬的に許容しうる塩若しくはエステル;及び1種以上の医薬的に許容しうる担体を含んでなる医薬組成物。
【請求項21】
さらに少なくとも1種の他の抗ウイルス薬を含んでなる請求項20に記載の医薬組成物。
【請求項22】
請求項20又は21のいずれか1項に記載の組成物の、C型肝炎ウイルスに感染しているか又は感染している危険のある哺乳動物のC型肝炎ウイルス感染症の治療のための使用。
【請求項23】
C型肝炎ウイルスに感染しているか又は感染している危険のある哺乳動物のC型肝炎ウイルス感染症の治療方法であって、前記哺乳動物に、治療的に有効な量の請求項1〜18のいずれか1項に記載の化合物、その医薬的に許容しうる塩若しくはエステル、又はその組成物を投与する工程を含む前記方法。
【請求項24】
C型肝炎ウイルスに感染しているか又は感染している危険のある哺乳動物のC型肝炎ウイルス感染症の治療方法であって、前記哺乳動物に、治療的に有効な量の、請求項1〜18のいずれか1項に記載の化合物又はその医薬的に許容しうる塩若しくはエステルと、少なくとも1種の他の抗ウイルス薬との組合せ;又はその組成物を投与する工程を含む前記方法。
【請求項25】
請求項1〜18のいずれか1項に記載の化合物、又はその医薬的に許容しうる塩若しくはエステルの、C型肝炎ウイルスに感染しているか又は感染している危険のある哺乳動物のC型肝炎ウイルス感染症の治療のための使用。
【請求項26】
請求項1〜18のいずれか1項に記載の化合物、又はその医薬的に許容しうる塩若しくはエステルの、C型肝炎ウイルスに感染しているか又は感染している危険のある哺乳動物のC型肝炎ウイルス感染症の治療用薬物の製造のための使用。
【請求項27】
C型肝炎ウイルス感染症の治療に有効な組成物;及び前記組成物を用いてC型肝炎ウイルスによる感染を治療できることを示すラベルを含む包装材料を含んでなる製品であって、前記組成物が請求項1〜18のいずれか1項に記載の化合物又はその医薬的に許容しうる塩若しくはエステルを含む、前記製品。
【請求項28】
C型肝炎ウイルスの複製を阻害する方法であって、C型肝炎ウイルスの複製が阻害される条件下で、有効量の請求項1〜18のいずれか1項に記載の化合物、又はその医薬的に許容しうる塩若しくはエステルに前記ウイルスを曝露する工程を含んでなる前記方法。
【請求項29】
請求項1〜18のいずれか1項に記載の化合物、又はその医薬的に許容しうる塩若しくはエステルの、C型肝炎ウイルスの複製を阻害するための使用。
【請求項1】
下記式(I)の化合物又はその塩若しくはエステル。
【化1】

(式中:
XはO及びSから選択され;
R2は、任意に1〜5個のR20置換基で置換されていてもよいHetであり、ここで、R20は各場合独立に下記基:
a)ハロ、シアノ又はニトロ;
b)R7、-C(=O)-R7、-C(=O)-O-R7、-O-R7、-S-R7、-SO-R7、-SO2-R7、-(C1-6)アルキレン-R7、-(C1-6)アルキレン-C(=O)-R7、-(C1-6)アルキレン-C(=O)-O-R7、-(C1-6)アルキレン-O-R7、-(C1-6)アルキレン-S-R7、-(C1-6)アルキレン-SO-R7又は-(C1-6)アルキレン-SO2-R7
(ここで、R7は各場合独立にH、(C1-6)アルキル、(C2-6)アルケニル、(C2-6)アルキニル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、アリール及びHetから選択され;
前記(C1-6)アルキルは任意に、-OH、-O-(C1-6)アルキル、シアノ、COOH、-NH2、-NH(C1-4)アルキル、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル及び-N((C1-4)アルキル)2からそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;かつ
前記各アリール及びHetは任意に、下記基:
i)ハロ、シアノ、オキソ、チオキソ、イミノ、-OH、-O-(C1-6)アルキル、-O-(C1-6)ハロアルキル、(C3-7)シクロアルキル、(C1-6)ハロアルキル、-C(=O)-(C1-6)アルキル、-SO2(C1-6)アルキル、-C(=O)-NH2、-C(=O)-NH(C1-4)アルキル、-C(=O)-N((C1-4)アルキル)2、-C(=O)-NH(C3-7)シクロアルキル、-C(=O)-N((C1-4)アルキル)(C3-7)シクロアルキル、-NH2、-NH(C1-4)アルキル、-N((C1-4)アルキル)2、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル又は-NH-C(=O)(C1-4)アルキル;
ii)任意に-OH、-O-(C1-6)ハロアルキル、又は-O-(C1-6)アルキルで置換されていてもよい(C1-6)アルキル;及び
iii)アリール又はHet(各アリール及びHetは任意にハロ又は(C1-6)アルキルで置換されていてもよい)
からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);及び
c)-N(R8)R9、-C(=O)-N(R8)R9、-O-C(=O)-N(R8)R9、-SO2-N(R8)R9、-(C1-6)アルキレン-N(R8)R9、-(C1-6)アルキレン-C(=O)-N(R8)R9、-(C1-6)アルキレン-O-C(=O)-N(R8)R9、又は-(C1-6)アルキレン-SO2-N(R8)R9(ここで、
R8は、各場合独立にH、(C1-6)アルキル及び(C3-7)シクロアルキルから選択され;かつ
R9は、各場合独立にR7、-(C1-6)アルキレン-R7、-SO2-R7、-C(=O)-R7、-C(=O)OR7及び-C(=O)N(R8)R7から選択され;R7及びR8は前記定義どおりである)
から選択され;
R3は、H、ハロ、(C1-4)アルキル、-O-(C1-4)アルキル、-S-(C1-4)アルキル、-NH2、-NH(C1-4)アルキル、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル及び-N((C1-4)アルキル)2から選択され;
R5は、H、(C1-6)アルキル、(C3-7)シクロアルキル又はHetであり;該(C1-6)アルキル及びHetはそれぞれ任意に、(C1-6)アルキル、Het、-OH、-COOH、-C(=O)-(C1-6)アルキル、-C(=O)-O-(C1-6)アルキル、-SO2(C1-6)アルキル及び-C(=O)-N(R51)R52からそれぞれ独立に選択される1〜4個の置換基で置換されていてもよく
(ここで、R51はH、(C1-6)アルキル又は(C3-7)シクロアルキルであり;かつ
R52はH、(C1-6)アルキル、(C3-7)シクロアルキル、アリール、Het、アリール-(C1-3)アルキル-又はHet-(C1-3)アルキル-であり;
該(C1-6)アルキル、(C3-7)シクロアルキル、アリール、Het、アリール-(C1-3)アルキル-及びHet-(C1-3)アルキル-はそれぞれ任意に、(C1-6)アルキル、(C1-6)ハロアルキル、ハロ、オキソ、-OH、-O(C1-6)アルキル、-NH2、-NH(C1-6)アルキル、-N((C1-6)アルキル)2、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル、-C(=O)(C1-6)アルキル及び-NHC(=O)-(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよく;
或いはR51とR52が、それらが結合しているNと一緒に結合して、任意にさらにそれぞれ独立にN、O及びSから選択される1〜3個のヘテロ原子を含有してよい4員〜7員のヘテロ環を形成し(ここで、各Sヘテロ原子は独立に、かつ可能な場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;
前記ヘテロ環は任意に、(C1-6)アルキル、(C1-6)ハロアルキル、ハロ、オキソ、-OH、-O(C1-6)アルキル、-NH2、-NH(C1-6)アルキル、-N((C1-6)アルキル)2、-NH(C3-7)シクロアルキル、-N((C1-4)アルキル)(C3-7)シクロアルキル、-C(=O)(C1-6)アルキル及び-NHC(=O)-(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);
R6は(C3-7)シクロアルキル又はアリールであり;
該(C3-7)シクロアルキル及びアリールはそれぞれ任意、ハロ、(C1-6)アルキル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、-OH、-SH、-O-(C1-4)アルキル及び-S-(C1-4)アルキルからそれぞれ独立に選択される1〜5個の置換基で置換されていてもよく;かつ
Hetは、O、N及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を有する4員〜7員の飽和、不飽和若しくは芳香族ヘテロ環、又は可能な限り、O、N及びSからそれぞれ独立に選択される1〜5個のヘテロ原子を有する7員〜14員の飽和、不飽和若しくは芳香族ヘテロ多環であり;ここで、各Nヘテロ原子は独立に、かつ可能な場合、さらに酸素原子に結合してN-オキシド基を形成するように酸化状態で存在してよく、各Sヘテロ原子は独立に、かつ可能な場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;
但し、R2が下記基:
【化2】

から選択され;
XがOであり;R3がHであり;かつR5がHである場合、
R6は下記基でない。)
【化3】

【請求項2】
XがOである、請求項1に記載の化合物。
【請求項3】
XがSである、請求項1に記載の化合物。
【請求項4】
R2がHetであり、Hetは、O、N及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有する5員若しくは6員ヘテロ環、又はO、N及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有する9員若しくは10員二環式ヘテロ多環であり;このときHetは、任意に1〜5個のR20置換基(R20は請求項1の定義どおり)で置換されていてもよい、請求項1〜3のいずれか1項に記載の化合物。
【請求項5】
R2が下記式
【化4】

から選択されるHetであり;
このときHetは、任意に1〜3個のR20置換基(R20は請求項1の定義どおり)で置換されていてもよい、請求項4に記載の化合物。
【請求項6】
R2が下記式のHetであり;
【化5】

このときHetは、任意に1〜3個のR20置換基で置換されていてもよく;
R20は、下記基:
a)ハロ又はシアノ;
b)R7、-(C1-6)アルキレン-R7、-C(=O)-R7、-(C1-6)アルキレン-O-R7、-SO2-R7、-(C1-6)アルキレン-S-R7又は-(C1-6)アルキレン-SO2-R7
(ここで、R7は各場合独立にH、(C1-6)アルキル、(C2-6)アルケニル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、アリール及びHetから選択され;前記Hetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する5員若しくは6員ヘテロ環であり、又はHetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する9員若しくは10員ヘテロ多環であり;各Nヘテロ原子は独立に、かつ可能な場合、さらに酸素原子に結合してN-オキシド基を形成するように酸化状態で存在してよく、及び各Sヘテロ原子は独立に、かつ可能な場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;かつ
前記(C1-6)アルキルは任意に、-OH、-O-(C1-6)アルキル及びCOOHからそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;かつ
前記アリール及びHetはそれぞれ任意に、ハロ、シアノ、オキソ、イミノ、-OH、-O-(C1-6)アルキル、-NH2、-NH(C1-4)アルキル、-N((C1-4)アルキル)2、-NH-C(=O)(C1-4)アルキル、(C1-6)アルキル及びHet(ここで、該Hetは、N、O及びSからそれぞれ独立に選択される1〜4個のヘテロ原子を含有する5員又は6員ヘテロ環である)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);及び
c)-(C1-6)アルキレン-N(R8)R9又は-(C1-6)アルキレン-C(=O)-N(R8)R9
(式中、R8は各場合独立にH及び(C1-6)アルキルから選択され;かつ
R9は各場合独立にR7、-SO2-R7、-C(=O)-R7、-C(=O)OR7及び-C(=O)N(R8)R7から選択され;このときR7とR8は前記定義どおりである)
から選択される、請求項5に記載の化合物。
【請求項7】
R2が下記式:
【化6】

の基であり、式中、R23はR20であり;かつ
R20は請求項1の定義どおりである、請求項1に記載の化合物。
【請求項8】
R2が下記式:
【化7】

の基であり、式中、R23はR20であり;かつ
R20が下記基:
a)ハロ又はシアノ;
b)R7、-CH2-R7、-C(=O)-R7、-CH2-O-R7、-SO2-R7、-CH2-S-R7又は-CH2-SO2-R7
(ここで、R7は各場合独立にH、(C1-6)アルキル、(C2-6)アルケニル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、フェニル及びHetから選択され;前記Hetは下記基:
【化8】

から選択され;かつ
前記(C1-6)アルキルは任意に、-OH、-O-(C1-6)アルキル及びCOOHからそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;かつ
前記フェニル及びHetはそれぞれ任意に、ハロ、シアノ、オキソ、イミノ、-OH、-O-(C1-6)アルキル、-NH2、-NH(C1-4)アルキル、-N((C1-4)アルキル)2、-NH-C(=O)(C1-4)アルキル、(C1-6)アルキル及び下記式
【化9】

で表される基からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);及び
c)-CH2-N(R8)R9又は-CH2-C(=O)-N(R8)R9
(式中、R8は各場合独立にH及び(C1-6)アルキルから選択され;かつ
R9は各場合独立にR7、-SO2-R7、-C(=O)-R7、-C(=O)OR7及び-C(=O)N(R8)R7から選択され;このときR7とR8は前記定義どおりである)
から選択される、請求項6に記載の化合物。
【請求項9】
R2が下記式:
【化10】

の基であり、式中、R23はR20であり;かつ
R20が下記基:
b)-CH2-R7、-CH2CH2-R7、-CH2-O-R7、-CH2-S-R7又は-CH2-SO2-R7
(式中、R7はHetであり;前記Hetは下記基:
【化11】

から選択され;かつ
前記Hetは任意に、ハロ、シアノ、オキソ、イミノ、-OH、-O-(C1-6)アルキル、-NH2、-NH(C1-4)アルキル、-N((C1-4)アルキル)2、-NH-C(=O)(C1-4)アルキル、(C1-6)アルキル及び下記式
【化12】

で表される基からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);及び
c)-CH2-N(R8)R9(式中、
R8は各場合独立にH及び(C1-6)アルキルから選択され;かつ
R9はR7で、R7は前記定義どおりである)
から選択される、請求項6に記載の化合物。
【請求項10】
R3がH及びハロから選択される、請求項1〜9のいずれか1項に記載の化合物。
【請求項11】
R3がHである、請求項10に記載の化合物。
【請求項12】
R5が(C1-6)アルキルである、請求項1〜11のいずれか1項に記載の化合物。
【請求項13】
R5が1-メチルエチルである、請求項12に記載の化合物。
【請求項14】
R5が、Het、-COOH又は-C(=O)-N(R51)R52で置換されている(C1-4)アルキルであり、このとき前記Hetは、1〜4個のNヘテロ原子を含有する5員若しくは6員ヘテロ環であり、又はHetは、1〜4個のNヘテロ原子を含有する9員若しくは10員二環式ヘテロ多環であり;
かつR51がH又は(C1-6)アルキルであり、かつR52がH、(C1-6)アルキル、(C3-7)シクロアルキル、Het及びHet-(C1-3)アルキル-から選択され
(ここで、前記(C1-6)アルキルは任意に、-O(C1-6)アルキル及び-N((C1-6)アルキル)2からそれぞれ独立に選択される1又は2個の置換基で置換されていてもよく;
かつ前記Het及びHet-(C1-3)アルキル-のHet部分はそれぞれ独立に、N、O及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有する5員又は6員ヘテロ環であり、該Het及びHet-(C1-3)アルキル-はそれぞれ独立に、ハロ、オキソ、-OH、(C1-6)アルキル、(C1-6)ハロアルキル、-(C=O)(C1-6)アルキル、-N((C1-6)アルキル)2及び-NH(C=O)(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい);
或いはR51とR52が、それらが結合しているNと一緒に結合して、任意にさらにN、O及びSからそれぞれ独立に選択される1〜3個のヘテロ原子を含有してよい4員〜7員ヘテロ環を形成している(ここで、各Sヘテロ原子は独立に、かつ可能場合、さらに1又は2個の酸素原子に結合して基SO又はSO2を形成するように酸化状態で存在してよく;
このとき前記ヘテロ環は任意に、ハロ、オキソ、-OH、(C1-6)アルキル、(C1-6)ハロアルキル、-(C=O)(C1-6)アルキル、-N((C1-6)アルキル)2及び-NH(C=O)(C1-6)アルキル(前記(C1-6)アルキルは任意にOHで置換されていてもよい)からそれぞれ独立に選択される1〜3個の置換基で置換されていてもよい)、請求項1〜11のいずれか1項に記載の化合物。
【請求項15】
R6が、任意に、ハロ、(C1-6)アルキル、(C1-6)ハロアルキル、(C3-7)シクロアルキル。-OH、-SH、-O-(C1-4)アルキル及び-S-(C1-4)アルキルからそれぞれ独立に選択される1〜5個の置換基で置換されていてもよい(C3-7)シクロアルキルである、請求項1〜14のいずれか1項に記載の化合物。
【請求項16】
R6が下記基である、請求項15に記載の化合物。
【化13】

【請求項17】
R6が、任意に、ハロ、(C1-6)アルキル、(C1-6)ハロアルキル、(C3-7)シクロアルキル、-OH、-SH、-O-(C1-4)アルキル及び-S-(C1-4)アルキルからそれぞれ独立に選択される1〜5個の置換基で置換されていてもよいアリールである、請求項1〜14のいずれか1項に記載の化合物。
(但し、R2が下記基:
【化14】

から選択され;
XがOであり;R3がHであり;かつR5がHである場合、
R6は下記基でない。)
【化15】

【請求項18】
R6が、任意に、ハロ、(C1-6)アルキル、(C3-7)シクロアルキル及び-S-(C1-4)アルキルからそれぞれ独立に選択される1〜3個の置換基で置換されていてもよいフェニルである、請求項17に記載の化合物。
(但し、R2が下記基:
【化16】

から選択され;
XがOであり;R3がHであり;かつR5がHである場合、
R6は下記基でない。)
【化17】

【請求項19】
薬物としての、請求項1〜18のいずれか1項に記載の化合物、又はその医薬的に許容しうる塩若しくはエステル。
【請求項20】
治療的に有効な量の請求項1〜18のいずれか1項に記載の化合物、又はその医薬的に許容しうる塩若しくはエステル;及び1種以上の医薬的に許容しうる担体を含んでなる医薬組成物。
【請求項21】
さらに少なくとも1種の他の抗ウイルス薬を含んでなる請求項20に記載の医薬組成物。
【請求項22】
請求項20又は21のいずれか1項に記載の組成物の、C型肝炎ウイルスに感染しているか又は感染している危険のある哺乳動物のC型肝炎ウイルス感染症の治療のための使用。
【請求項23】
C型肝炎ウイルスに感染しているか又は感染している危険のある哺乳動物のC型肝炎ウイルス感染症の治療方法であって、前記哺乳動物に、治療的に有効な量の請求項1〜18のいずれか1項に記載の化合物、その医薬的に許容しうる塩若しくはエステル、又はその組成物を投与する工程を含む前記方法。
【請求項24】
C型肝炎ウイルスに感染しているか又は感染している危険のある哺乳動物のC型肝炎ウイルス感染症の治療方法であって、前記哺乳動物に、治療的に有効な量の、請求項1〜18のいずれか1項に記載の化合物又はその医薬的に許容しうる塩若しくはエステルと、少なくとも1種の他の抗ウイルス薬との組合せ;又はその組成物を投与する工程を含む前記方法。
【請求項25】
請求項1〜18のいずれか1項に記載の化合物、又はその医薬的に許容しうる塩若しくはエステルの、C型肝炎ウイルスに感染しているか又は感染している危険のある哺乳動物のC型肝炎ウイルス感染症の治療のための使用。
【請求項26】
請求項1〜18のいずれか1項に記載の化合物、又はその医薬的に許容しうる塩若しくはエステルの、C型肝炎ウイルスに感染しているか又は感染している危険のある哺乳動物のC型肝炎ウイルス感染症の治療用薬物の製造のための使用。
【請求項27】
C型肝炎ウイルス感染症の治療に有効な組成物;及び前記組成物を用いてC型肝炎ウイルスによる感染を治療できることを示すラベルを含む包装材料を含んでなる製品であって、前記組成物が請求項1〜18のいずれか1項に記載の化合物又はその医薬的に許容しうる塩若しくはエステルを含む、前記製品。
【請求項28】
C型肝炎ウイルスの複製を阻害する方法であって、C型肝炎ウイルスの複製が阻害される条件下で、有効量の請求項1〜18のいずれか1項に記載の化合物、又はその医薬的に許容しうる塩若しくはエステルに前記ウイルスを曝露する工程を含んでなる前記方法。
【請求項29】
請求項1〜18のいずれか1項に記載の化合物、又はその医薬的に許容しうる塩若しくはエステルの、C型肝炎ウイルスの複製を阻害するための使用。
【公表番号】特表2010−500978(P2010−500978A)
【公表日】平成22年1月14日(2010.1.14)
【国際特許分類】
【出願番号】特願2009−524051(P2009−524051)
【出願日】平成19年8月6日(2007.8.6)
【国際出願番号】PCT/CA2007/001363
【国際公開番号】WO2008/019477
【国際公開日】平成20年2月21日(2008.2.21)
【出願人】(503385923)ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング (976)
【Fターム(参考)】
【公表日】平成22年1月14日(2010.1.14)
【国際特許分類】
【出願日】平成19年8月6日(2007.8.6)
【国際出願番号】PCT/CA2007/001363
【国際公開番号】WO2008/019477
【国際公開日】平成20年2月21日(2008.2.21)
【出願人】(503385923)ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング (976)
【Fターム(参考)】
[ Back to top ]

