ウイルス又は病原菌由来の不活化抗原に対するアジュバント、及び分泌型IgA抗体誘導剤
【課題】 ウイルス又は病原菌由来の不活化抗原に対するアジュバントの提供
【解決手段】(1)キノコの菌糸体の熱水抽出物を主成分とすることを特徴とするウイルス又は病原菌由来の不活化抗原に対するアジュバント。
(2)ウイルス又は病原菌由来の不活化抗原と、このウイルス又は病原菌由来の不活化抗原に対するアジュバントを含むことを特徴とする分泌型IgA抗体誘導剤。
(3)ウイルス又は病原菌由来の不活化抗原と共にこのウイルス又は病原菌由来の不活化抗原に対するアジュバントを投与することを特徴とするウイルス又は病原菌特異的IgA抗体を誘導させる方法。
【解決手段】(1)キノコの菌糸体の熱水抽出物を主成分とすることを特徴とするウイルス又は病原菌由来の不活化抗原に対するアジュバント。
(2)ウイルス又は病原菌由来の不活化抗原と、このウイルス又は病原菌由来の不活化抗原に対するアジュバントを含むことを特徴とする分泌型IgA抗体誘導剤。
(3)ウイルス又は病原菌由来の不活化抗原と共にこのウイルス又は病原菌由来の不活化抗原に対するアジュバントを投与することを特徴とするウイルス又は病原菌特異的IgA抗体を誘導させる方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、キノコ(担子菌:Basidiomycota)菌糸体の熱水抽出物を含むウイルス又は病原菌由来の不活化抗原に対するアジュバント、及び
ウイルス又は病原菌由来の不活化抗原と前記アジュバントを含む分泌型IgA抗体誘導剤、並びに
前記アジュバントをウイルス又は病原菌由来の不活化抗原であるワクチンと共に投与することにより、ウイルス又は病原菌に特異的な分泌型IgA抗体の産生を誘導させる方法
に関する(以下、ウイルス又は病原菌由来の不活化抗原に対する(の免疫原生を高める)アジュバントを、単にアジュバントともいう)。
【背景技術】
【0002】
インフルエンザ等の呼吸器感染症の防御には、粘膜より分泌される特異的IgA抗体が非常に有効であることが知られている。特に型の異なるウイルスに対する交叉防御は、粘膜で分泌されるIgA抗体が主に担っており、インフルエンザウイルスに自然罹患した後に回復したヒトには、このIgA抗体が誘導されており、同亜型の変異型ウイルスの流行に対しても感染防御ができている。
【0003】
一方、未感染の個体におけるウイルス又は病原菌からの感染を防御する方法として、ウイルス又は病原菌由来の不活化抗原であるワクチンを接種し、意図的に抗体を誘導させる方法があり、そのようなものとしてインフルエンザワクチン、コレラワクチン、チフスワクチン、種痘ワクチン、BCGワクチン等などが知られている。
【0004】
ところで、そのなかでもインフルエンザ、重症急性呼吸器感染症候群(SARS)等の呼吸器疾患は、呼吸器官からの感染によるものであり、したがってそのワクチンの投与により呼吸器粘膜での免疫応答が求められている。しかしながら、現在用いられている皮下注射によるワクチンでは、粘膜免疫応答が得られず、交叉防御能を有する、より効果的なワクチンの開発が求められているのが現状である。特に、呼吸器粘膜における分泌型IgA抗体の誘導方法として、鼻腔投与(経鼻投与)による鼻粘膜へ抗原を接種する方法があるが、抗原の接種のみでは十分な抗体応答がみられず、より効果的な免疫応答発現のためには、ワクチンと同時に投与するアジュバントが必要となる。
【0005】
これまで、そのようなワクチンに対するアジュバント作用を有する物質が種々提案されてきており、例えば、最近では、イノシン酸とシチジル酸とからなるポリヌクレオチドコポリマーであるPoly(I:C)にアジュバント作用があることが報告されている(非特許文献1、特許文献1)。
又、セラミック化ホッキ貝の粉末にアジュバント作用があることも報告されている(特許文献1)。
【0006】
【非特許文献1】J. Clinical Investigation, 110(8), 1175-1184 (2002)
【特許文献2】特開2005−97267
【特許文献3】特開2005−314277
【0007】
本発明者らは、従来から、より効果的なアジュバント作用を有する物質、特に、天然資源によるアジュバント作用物質の検討を行ってきたが、今回、キノコ(担子菌:Basidiomycota)の菌糸体の熱水抽出物に、顕著なアジュバント作用を認めた。
すなわち、本発明者らは、粘膜免疫誘導のためのアジュバントとして、キノコ菌糸体の熱水抽出物を用い、鼻腔粘膜でのIgA抗体分泌と血清中のIgG抗体応答と、致死量のインフルエンザウイルスに対する感染防御を検討した結果、良好な粘膜でのIgA抗体分泌と血清中のIgG抗体応答が得られ、さらに致死量のインフルエンザウイルスに対する感染防御効果が認められた。
そのうえ、その免疫応答はワクチン株と亜型の異なるウイルスに対する抗体誘導でもあり、またワクチン株と亜型の異なるウイルスに対する感染防御も認められ、交叉防御能を確認するに至った。
【発明の開示】
【発明が解決しようとする課題】
【0008】
従って、本願発明は、
(イ)キノコ菌糸体の熱水抽出物を含むウイルス又は病原菌由来の不活化抗原用アジュバント、
(ロ)ウイルス又は病原菌由来の不活化抗原と、そのアジュバントとしてキノコ菌糸体の熱水抽出物を含む分泌型IgA抗体誘導剤、
(ハ)ウイルス又は病原菌由来の不活化抗原と共に、キノコ菌糸体の熱水抽出物をアジュバントとして投与する、ウイルス又は病原菌特異的IgA抗体を誘導させる方法、
を提供することを課題とする。
【課題を解決するための手段】
【0009】
本発明は、下記の請求項により構成されている。
<請求項1> キノコの菌糸体の熱水抽出物を主成分とすることを特徴とするウイルス又は病原菌由来の不活化抗原に対するアジュバント。
<請求項2> キノコがメシマコブ(Phellinus linteus)、カラカサタケモドキ(Macrolepita gracilenta)、マイタケ(Grifola frondosa)、又はシイタケ(Lentinula edodes)である請求項1記載のウイルス又は病原菌由来の不活化抗原に対するアジュバント。
<請求項3> ウイルスが水痘ウイルス、麻疹ウイルス、ムンプウイルス、ポリオウイルス、ロタウイルス、インフルエンザウイルス、アデノウイルス、ヘルペスウイルス、重症急性呼吸器感染症候群ウイルス又はHIVウイルスであり、又病原菌が百日咳菌、髄膜炎菌、インフルエンザb型菌、肺炎菌又はコレラ菌である請求項1記載のウイルス又は病原菌由来の不活化抗原に対するアジュバント。
<請求項4> ウイルス又は病原菌由来の不活化抗原と、請求項1〜請求項3記載のウイルス又は病原菌由来の不活化抗原に対するアジュバントを含むことを特徴とする分泌型IgA抗体誘導剤。
<請求項5> 呼吸器粘膜に投与する請求項4に記載の分泌型IgA抗体誘導剤。
<請求項6> ウイルス又は病原菌が水痘ウイルス、麻疹ウイルス、ムンプウイルス、ポリオウイルス、ロタウイルス、インフルエンザウイルス、アデノウイルス、ヘルペスウイルス、重症急性呼吸器感染症候群ウイルス又はHIVウイルスであり、又病原菌が百日咳菌、髄膜炎菌、インフルエンザb型菌、肺炎菌又はコレラ菌である請求項4又は請求項5に記載の分泌型IgA抗体誘導剤。
<請求項7> ウイルス又は病原菌由来の不活化抗原と共に請求項1〜請求項3記載のアジュバントを投与することを特徴とするウイルス又は病原菌特異的IgA抗体を誘導させる方法。
<請求項8> 呼吸器粘膜に投与する請求項7に記載のウイルス又は病原菌特異的分泌型IgA抗体を誘導させる方法。
<請求項9> ウイルスが水痘ウイルス、麻疹ウイルス、ムンプウイルス、ポリオウイルス、ロタウイルス、インフルエンザウイルス、アデノウイルス、ヘルペスウイルス、重症急性呼吸器感染症候群ウイルス又はHIVウイルスであり、又病原菌が百日咳菌、髄膜炎菌、インフルエンザb型菌、肺炎菌又はコレラ菌である請求項7に記載のウイルス、又は病原菌特異的IgA抗体を誘導させる方法。
【0010】
本願発明において、キノコとは担子菌(Basidiomycota)をいう。
【0011】
本願発明において、重症急性呼吸器感染症候群ウイルスとは、SARS(Severe Acute Respiratory Syndrome、コロナウイルスの一種)をいう。
【発明の効果】
【0012】
(イ)本願発明が提供するアジュバントは、キノコ菌糸体から熱水抽出物として容易に製造することができる。
(ロ)本願発明が提供するアジュバントは、ウイルス又は病原菌由来の不活化抗原(ワクチン)と共に投与することにより、ウイルス又は病原菌に特異的な分泌型IgA抗体の産生を多量に誘導させることができる。
(ハ)ウイルス又は病原菌由来の不活化抗原(ワクチン)と、本願発明が提供するアジュバントを、感染疾患を予防する分泌型IgA抗体誘導剤(アジュバント含有ワクチン)キットとして提供することができる。
(ニ)分泌型IgA抗体は、外分泌液中の主要な免疫グロブリンであり、粘膜表面の感染防御に役立っている病原菌特異的IgA抗体であって、唾液、鼻汁、腸、気管などの分泌液中、あるいは初乳中に多くみられ、また血清中にも存在する。
従って、本発明が提供する分泌型IgA抗体誘導剤は、このIgA抗体の産生を誘導することにより、ウイルス又は病原菌などの病原体による感染を防御することが可能となり、さらには感染予防のための分泌型IgA抗体誘導剤として提供することができる。
(ホ)PLキノコの菌糸体の熱水抽出物をアジュバントとして用いるワクチン投与は、ワクチン株と亜型の異なるウイルスに対しても感染防御、及び交叉防御能を発現させることが可能である。
【発明を実施するための最良の形態】
【0013】
*キノコの菌糸体の乾燥粉末の取得
大型タンク(1000L)を用いて、炭素源としてグルコースを4.0%、天然物由来窒素源イーストエキス及びポリぺプトンを各0.3%、KH2PO4及びNa2HPO4を各0.05%を含み、初発培地pH5.5の培養液に、各キノコの菌糸体を接種し、強制的に0.22μmフィルターを通した無菌空気を培地内へ通気し、温度28℃で45日間培養した。
この培養液を遠心分離して得られた菌糸体を凍結乾燥して各キノコの菌糸体の乾燥粉末を得た。
【0014】
*各キノコの菌糸体の熱水抽出物の取得
前記各キノコの菌糸体の乾燥粉末20gに、イオン交換水140mlを加え、105℃で60分、熱水抽出処理を行ない、不溶物を除去して各キノコの菌糸体の熱水抽出物を得た。この熱水抽出物を40℃以下で減圧濃縮し、熱水抽出物(固形分5%)を得た(図1参照)。
【0015】
一方、本願発明が提供する分泌型IgA抗体誘導剤により、ウイルス又は病原菌由来の不活化抗原に対するアジュバントと共に投与されるワクチン(ウイルス又は病原菌由来の不活化抗原)としては、身体中に接種されて、活性な免疫を生成する、通常感染性因子又は感染因子のある部分を含む抗原性懸濁液又は溶液である。ワクチンを構成する抗原性部分は、微生物(例えば、ウイルス又は細菌など)又は微生物から精製された天然の産生物、合成生成物又は遺伝子操作したタンパク質、ペプチド、多糖又は同様な産生物であってもよい。
【0016】
例えば、生ワクチンとしては、具体的には、BCG、種痘、ポリオ、はしか、風疹、おたふく風邪、牛痘、NDV、マレック病などをあげることができる。また、不活化ワクチンとしては、百日咳、ジフテリア(トキソイド)、破傷風(トキソイド)、インフルエンザ(HA)、日本脳炎、リケッチアなどをあげることができる。
【0017】
また、本発明にいう不活化抗原とは、感染能を失わせた抗原をいい、完全ウイルス粒子であるビリオン、不完全ウイルス粒子、ビリオン構成粒子、その翻訳後修飾体、ビリオン非構成タンパク質、その翻訳後修飾体、感染防御抗原、中和反応のエピトープなどを挙げられることができる。不活化は、例えば、物理的(例えば、X線照射、熱、超音波)、化学的(ホルマリン、水銀、アルコール、塩素)操作により行うことができる。
【0018】
本発明が提供する分泌型IgA抗体誘導剤の投与は、粘膜投与の形態により行うのが好ましい。脊椎動物における粘膜には、消化器、呼吸器、排出器、生殖器などの特に外通性の中腔器官の内壁が含まれる。したがって、本発明の好ましい投与形態である粘膜投与としては、例えば、鼻腔投与(経鼻投与)、口腔投与、膣内投与、上気道投与、肺胞投与などをあげることができる。そのなかでも鼻腔内粘膜投与が好ましい。鼻腔は特に、インフルエンザウイルスなどによる呼吸器感染症疾患の感染経路の門戸であることから、粘膜投与により分泌型IgA抗体反応を引き起こし、粘膜上皮細胞中に分泌型IgA抗体を産生させることは、呼吸器感染症の防御に結びつくものである。
【0019】
本発明の目的である分泌型IgA抗体の産生が誘導され、免疫防御を発揮する対象としての病原体は、宿主に対して疾患又は障害を発生し得る微生物である。具体的には、ヒトに対する病原体としては、例えば、ウイルス、細菌、真菌などをあげることができる。ウイルスはどのような種類のものでもよく、例えば、DNAウイルス、RNAウイルスなどがあげることできる。より具体的には、例えば、水痘ウイルス、麻疹ウイルス、ムンプウイルス、ポリオウイルス、ロタウイルス、インフルエンザウイルス、アデノウイルス、ヘルペスウイルス、重症急性呼吸器感染症候群(SARS)ウイルス(コロナウイルスの一種)、HIVウイルスが挙げられるが、それらに限定されない。このようなウイルスは、好ましくはインフルエンザウイルスである。
【0020】
また、本発明が対象とする細菌は、どのような細菌であってもよく、グラム陽性菌、グラム陰性菌があげられることができ、例えば、そのような細菌としては、百日咳菌、髄膜炎菌、インフルエンザb型菌、肺炎菌及びコレラ菌などがあげられる。
【0021】
本発明が提供する分泌型IgA抗体誘導剤の投与量は、投与する対象者の年齢、体重、投与方法により一概に限定し得ないが、通常成人1日当たり、経口投与の場合には、10〜1000mg程度であり、また粘膜投与、特に経鼻投与の場合には、0.1〜100mg、好ましくは、0.1〜10mg程度である。
【0022】
以下に本発明を、具体的実施(試験)例により説明する。
(1)供試材料
材料として、以下のものを使用した。
(イ)アジュバント(前記段落0014により調整したキノコの菌糸体の熱水抽出物)
(a)メシマコブ(Phellinus linteus、PLと表記)
(b)カラカサタケモドキ(Macrolepita gracilenta、MGRと表記)
(c)マイタケ(Grifola frondosa、GFと表記)
(d)シイタケ(Lentinula edodes、LEと表記)
(ロ)マウス:BALB/cマウス(6週齢、雌性)
(ハ)ウイルス:(a)インフルエンザウイルスH1N1(A/PR8)株(国立感染症研究所(東京)から入手)
:(b)Aタイプ株
:(c)Bタイプ株(Aタイプと同じ亜型内のグレードの異なる株)
:(d)Cタイプ株
(ニ)ワクチン:(a)インフルエンザウイルスH1N1(A/PR8)株
:(b)前記ウイルスAタイプ株のワクチン
(ホ)アジュバントのポジティブコントロールとしてPoly(I:C)
なお、「Poly(I:C)」とは、ポリイノシン酸(pI)とポリシチジン酸(pC)とを含む二本鎖RNAをいう(特許文献2参照)。
【0023】
(2)実施(試験)例
(イ)6週齢のBALB/c雌性マウスを、各群5匹ずつ用いた。PR8 HAワクチン1μgを、アジュバント(前記4種類のキノコ熱水抽出物、PL,MGR,GF,LE)5μg(5μl)と共に、それぞれのマウスの鼻に5μl接種し、更に3週間後に、同量のワクチンを同様のアジュバントと共に経鼻接種し、最終免疫(投与)の2週間後に、更に100pfuのPR8ウイルス(前記〔0023〕の(1)−(ハ)−(a))を、片鼻に1.2μlずつ注入し、ウイルス感染を行った。
アジュバントのポジティブコントロールとして、Poly(I:C)5μg投与群、及び5μgのPR8 HAワクチンのみの投与群をおいた。
感染3日後に肺洗浄液、及び血清を回収し、肺洗浄液中のIgG抗体を、ELISA法を用いて、また肺洗浄液中のウイルス価を、MDCK細胞を用いたプラークアッセイ法で測定した。
同様に、経鼻免疫したマウスに40LD50の致死量のウイルスを20μl感染してその体重変化と生存を観察した。
【0024】
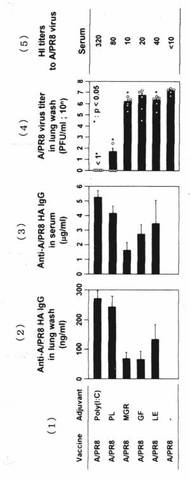
測定結果を図2、図3及び図4に示す。
図2(2)「Anti‐A/PR8 HA IgG in lung wash」は、「抗‐PR8 HA IgG(肺洗浄液中)」を表し、図2(3)「Anti‐A/PR8 HA IgG in serum」は、「抗‐PR8 HA IgG(血清中)」を表し、図2(4)「A/PR8 virus titer in lung wash」は、「肺洗浄液中のウイルス価」を表す。又、図2(5)「HI titers(HI価)」は、血中の抗体の中和の度合いを示す。
試験に供した、全てのキノコ(メシマコブ、カラカサタケモドキ、マイタケ、及びシイ
タケ)について、肺粘膜にIgG抗体の応答が認められた。すなわち、肺洗浄液中においても、又血清中においてもの抗−PR8 HA IgG量は、顕著に増加した(図2の(2)及び(3)参照)。
以上の結果から、キノコの菌糸体の熱水抽出物には、強力なアジュバント効果があることが確認された。
【0025】
(ロ)6週齢のBALB/c雌性マウスを、各群5匹ずつ用いた。
ウイルスAタイプ株のワクチン(前記〔0023〕の(1)−(2)−(b))1μgを、アジュバント(PL熱水抽出物)5μg(5μl)と共に、それぞれのマウスの鼻に5μl接種し、更に3週間後に、同量のワクチンを同様のアジュバントと共に経鼻接種した。
最終免疫(投与)の2週間後に、更に100pfuのAタイプ株、Bタイプ株、Cタイプ株(前記〔0023〕の(1)−(ハ)−(b),(c),及び(d))のウイルスを、片鼻に1.2μLずつ注入し、ウイルス感染を行った。
感染3日後に鼻腔洗浄液、及び血清を回収し、鼻腔洗浄液中のIgA抗体及び血清中のIgG抗体を、ELISA法を用いて、また鼻腔洗浄液中のウイルス価を、MDCK細胞を用いたプラークアッセイ法で測定した。
同様に、経鼻免疫したマウスに40LD50の致死量のAタイプ株、Bタイプ株、Cタイプ株ウイルスを20μL感染してその体重変化と生存を観察した。
【0026】
測定結果を図5、及び図6に示す。
これらの結果は、PL熱水抽出物をアジュバントとして用いるワクチン投与は、ワクチン株と亜型の異なるウイルスに対しても感染防御、及び交叉防御能を発現させることを示している。
【図面の簡単な説明】
【0027】
【図1】キノコ菌糸体からその熱水抽出物を得る工程を示す図である。
【図2】実施例において試験したキノコ熱水抽出物のアジュバント効果を示すデータである。(1)ワクチン名とアジュバントの種類を示す。(2)肺洗浄液中の抗−PR8 HAIgG量を示す(ng/ml)。(3)血清中の抗−PR8 HAIgG量を示す(μg/ml)。(4)肺洗浄液中のウイルス力価(PFU/ml;10n)を示す。(5)HI価(血中の抗体の中和の度合い)を示す。
【図3】体重変化を示す図である。
【図4】生存率を示す図である。
【図5】PL菌糸体の熱水抽出物の熱水抽出物のアジュバント効果を示すデータである。(1)鼻腔洗浄液中の抗−AタイプウイルスのIgA量を示す(U/ml)。(2)血清中の抗−AタイプウイルスのIgG量を示す(U/ml)。(3)Aタイプ(ウイルス)の鼻腔洗浄液中のウイルス力価(PFU/ml;10n)を示す。(4)Bタイプ(ウイルス)の鼻腔洗浄液中のウイルス力価(PFU/ml;10n)を示す。(5)Cタイプ(ウイルス)の鼻腔洗浄液中のウイルス力価(PFU/ml;10n)を示す。
【図6】生存率を示す図である。
【技術分野】
【0001】
本発明は、キノコ(担子菌:Basidiomycota)菌糸体の熱水抽出物を含むウイルス又は病原菌由来の不活化抗原に対するアジュバント、及び
ウイルス又は病原菌由来の不活化抗原と前記アジュバントを含む分泌型IgA抗体誘導剤、並びに
前記アジュバントをウイルス又は病原菌由来の不活化抗原であるワクチンと共に投与することにより、ウイルス又は病原菌に特異的な分泌型IgA抗体の産生を誘導させる方法
に関する(以下、ウイルス又は病原菌由来の不活化抗原に対する(の免疫原生を高める)アジュバントを、単にアジュバントともいう)。
【背景技術】
【0002】
インフルエンザ等の呼吸器感染症の防御には、粘膜より分泌される特異的IgA抗体が非常に有効であることが知られている。特に型の異なるウイルスに対する交叉防御は、粘膜で分泌されるIgA抗体が主に担っており、インフルエンザウイルスに自然罹患した後に回復したヒトには、このIgA抗体が誘導されており、同亜型の変異型ウイルスの流行に対しても感染防御ができている。
【0003】
一方、未感染の個体におけるウイルス又は病原菌からの感染を防御する方法として、ウイルス又は病原菌由来の不活化抗原であるワクチンを接種し、意図的に抗体を誘導させる方法があり、そのようなものとしてインフルエンザワクチン、コレラワクチン、チフスワクチン、種痘ワクチン、BCGワクチン等などが知られている。
【0004】
ところで、そのなかでもインフルエンザ、重症急性呼吸器感染症候群(SARS)等の呼吸器疾患は、呼吸器官からの感染によるものであり、したがってそのワクチンの投与により呼吸器粘膜での免疫応答が求められている。しかしながら、現在用いられている皮下注射によるワクチンでは、粘膜免疫応答が得られず、交叉防御能を有する、より効果的なワクチンの開発が求められているのが現状である。特に、呼吸器粘膜における分泌型IgA抗体の誘導方法として、鼻腔投与(経鼻投与)による鼻粘膜へ抗原を接種する方法があるが、抗原の接種のみでは十分な抗体応答がみられず、より効果的な免疫応答発現のためには、ワクチンと同時に投与するアジュバントが必要となる。
【0005】
これまで、そのようなワクチンに対するアジュバント作用を有する物質が種々提案されてきており、例えば、最近では、イノシン酸とシチジル酸とからなるポリヌクレオチドコポリマーであるPoly(I:C)にアジュバント作用があることが報告されている(非特許文献1、特許文献1)。
又、セラミック化ホッキ貝の粉末にアジュバント作用があることも報告されている(特許文献1)。
【0006】
【非特許文献1】J. Clinical Investigation, 110(8), 1175-1184 (2002)
【特許文献2】特開2005−97267
【特許文献3】特開2005−314277
【0007】
本発明者らは、従来から、より効果的なアジュバント作用を有する物質、特に、天然資源によるアジュバント作用物質の検討を行ってきたが、今回、キノコ(担子菌:Basidiomycota)の菌糸体の熱水抽出物に、顕著なアジュバント作用を認めた。
すなわち、本発明者らは、粘膜免疫誘導のためのアジュバントとして、キノコ菌糸体の熱水抽出物を用い、鼻腔粘膜でのIgA抗体分泌と血清中のIgG抗体応答と、致死量のインフルエンザウイルスに対する感染防御を検討した結果、良好な粘膜でのIgA抗体分泌と血清中のIgG抗体応答が得られ、さらに致死量のインフルエンザウイルスに対する感染防御効果が認められた。
そのうえ、その免疫応答はワクチン株と亜型の異なるウイルスに対する抗体誘導でもあり、またワクチン株と亜型の異なるウイルスに対する感染防御も認められ、交叉防御能を確認するに至った。
【発明の開示】
【発明が解決しようとする課題】
【0008】
従って、本願発明は、
(イ)キノコ菌糸体の熱水抽出物を含むウイルス又は病原菌由来の不活化抗原用アジュバント、
(ロ)ウイルス又は病原菌由来の不活化抗原と、そのアジュバントとしてキノコ菌糸体の熱水抽出物を含む分泌型IgA抗体誘導剤、
(ハ)ウイルス又は病原菌由来の不活化抗原と共に、キノコ菌糸体の熱水抽出物をアジュバントとして投与する、ウイルス又は病原菌特異的IgA抗体を誘導させる方法、
を提供することを課題とする。
【課題を解決するための手段】
【0009】
本発明は、下記の請求項により構成されている。
<請求項1> キノコの菌糸体の熱水抽出物を主成分とすることを特徴とするウイルス又は病原菌由来の不活化抗原に対するアジュバント。
<請求項2> キノコがメシマコブ(Phellinus linteus)、カラカサタケモドキ(Macrolepita gracilenta)、マイタケ(Grifola frondosa)、又はシイタケ(Lentinula edodes)である請求項1記載のウイルス又は病原菌由来の不活化抗原に対するアジュバント。
<請求項3> ウイルスが水痘ウイルス、麻疹ウイルス、ムンプウイルス、ポリオウイルス、ロタウイルス、インフルエンザウイルス、アデノウイルス、ヘルペスウイルス、重症急性呼吸器感染症候群ウイルス又はHIVウイルスであり、又病原菌が百日咳菌、髄膜炎菌、インフルエンザb型菌、肺炎菌又はコレラ菌である請求項1記載のウイルス又は病原菌由来の不活化抗原に対するアジュバント。
<請求項4> ウイルス又は病原菌由来の不活化抗原と、請求項1〜請求項3記載のウイルス又は病原菌由来の不活化抗原に対するアジュバントを含むことを特徴とする分泌型IgA抗体誘導剤。
<請求項5> 呼吸器粘膜に投与する請求項4に記載の分泌型IgA抗体誘導剤。
<請求項6> ウイルス又は病原菌が水痘ウイルス、麻疹ウイルス、ムンプウイルス、ポリオウイルス、ロタウイルス、インフルエンザウイルス、アデノウイルス、ヘルペスウイルス、重症急性呼吸器感染症候群ウイルス又はHIVウイルスであり、又病原菌が百日咳菌、髄膜炎菌、インフルエンザb型菌、肺炎菌又はコレラ菌である請求項4又は請求項5に記載の分泌型IgA抗体誘導剤。
<請求項7> ウイルス又は病原菌由来の不活化抗原と共に請求項1〜請求項3記載のアジュバントを投与することを特徴とするウイルス又は病原菌特異的IgA抗体を誘導させる方法。
<請求項8> 呼吸器粘膜に投与する請求項7に記載のウイルス又は病原菌特異的分泌型IgA抗体を誘導させる方法。
<請求項9> ウイルスが水痘ウイルス、麻疹ウイルス、ムンプウイルス、ポリオウイルス、ロタウイルス、インフルエンザウイルス、アデノウイルス、ヘルペスウイルス、重症急性呼吸器感染症候群ウイルス又はHIVウイルスであり、又病原菌が百日咳菌、髄膜炎菌、インフルエンザb型菌、肺炎菌又はコレラ菌である請求項7に記載のウイルス、又は病原菌特異的IgA抗体を誘導させる方法。
【0010】
本願発明において、キノコとは担子菌(Basidiomycota)をいう。
【0011】
本願発明において、重症急性呼吸器感染症候群ウイルスとは、SARS(Severe Acute Respiratory Syndrome、コロナウイルスの一種)をいう。
【発明の効果】
【0012】
(イ)本願発明が提供するアジュバントは、キノコ菌糸体から熱水抽出物として容易に製造することができる。
(ロ)本願発明が提供するアジュバントは、ウイルス又は病原菌由来の不活化抗原(ワクチン)と共に投与することにより、ウイルス又は病原菌に特異的な分泌型IgA抗体の産生を多量に誘導させることができる。
(ハ)ウイルス又は病原菌由来の不活化抗原(ワクチン)と、本願発明が提供するアジュバントを、感染疾患を予防する分泌型IgA抗体誘導剤(アジュバント含有ワクチン)キットとして提供することができる。
(ニ)分泌型IgA抗体は、外分泌液中の主要な免疫グロブリンであり、粘膜表面の感染防御に役立っている病原菌特異的IgA抗体であって、唾液、鼻汁、腸、気管などの分泌液中、あるいは初乳中に多くみられ、また血清中にも存在する。
従って、本発明が提供する分泌型IgA抗体誘導剤は、このIgA抗体の産生を誘導することにより、ウイルス又は病原菌などの病原体による感染を防御することが可能となり、さらには感染予防のための分泌型IgA抗体誘導剤として提供することができる。
(ホ)PLキノコの菌糸体の熱水抽出物をアジュバントとして用いるワクチン投与は、ワクチン株と亜型の異なるウイルスに対しても感染防御、及び交叉防御能を発現させることが可能である。
【発明を実施するための最良の形態】
【0013】
*キノコの菌糸体の乾燥粉末の取得
大型タンク(1000L)を用いて、炭素源としてグルコースを4.0%、天然物由来窒素源イーストエキス及びポリぺプトンを各0.3%、KH2PO4及びNa2HPO4を各0.05%を含み、初発培地pH5.5の培養液に、各キノコの菌糸体を接種し、強制的に0.22μmフィルターを通した無菌空気を培地内へ通気し、温度28℃で45日間培養した。
この培養液を遠心分離して得られた菌糸体を凍結乾燥して各キノコの菌糸体の乾燥粉末を得た。
【0014】
*各キノコの菌糸体の熱水抽出物の取得
前記各キノコの菌糸体の乾燥粉末20gに、イオン交換水140mlを加え、105℃で60分、熱水抽出処理を行ない、不溶物を除去して各キノコの菌糸体の熱水抽出物を得た。この熱水抽出物を40℃以下で減圧濃縮し、熱水抽出物(固形分5%)を得た(図1参照)。
【0015】
一方、本願発明が提供する分泌型IgA抗体誘導剤により、ウイルス又は病原菌由来の不活化抗原に対するアジュバントと共に投与されるワクチン(ウイルス又は病原菌由来の不活化抗原)としては、身体中に接種されて、活性な免疫を生成する、通常感染性因子又は感染因子のある部分を含む抗原性懸濁液又は溶液である。ワクチンを構成する抗原性部分は、微生物(例えば、ウイルス又は細菌など)又は微生物から精製された天然の産生物、合成生成物又は遺伝子操作したタンパク質、ペプチド、多糖又は同様な産生物であってもよい。
【0016】
例えば、生ワクチンとしては、具体的には、BCG、種痘、ポリオ、はしか、風疹、おたふく風邪、牛痘、NDV、マレック病などをあげることができる。また、不活化ワクチンとしては、百日咳、ジフテリア(トキソイド)、破傷風(トキソイド)、インフルエンザ(HA)、日本脳炎、リケッチアなどをあげることができる。
【0017】
また、本発明にいう不活化抗原とは、感染能を失わせた抗原をいい、完全ウイルス粒子であるビリオン、不完全ウイルス粒子、ビリオン構成粒子、その翻訳後修飾体、ビリオン非構成タンパク質、その翻訳後修飾体、感染防御抗原、中和反応のエピトープなどを挙げられることができる。不活化は、例えば、物理的(例えば、X線照射、熱、超音波)、化学的(ホルマリン、水銀、アルコール、塩素)操作により行うことができる。
【0018】
本発明が提供する分泌型IgA抗体誘導剤の投与は、粘膜投与の形態により行うのが好ましい。脊椎動物における粘膜には、消化器、呼吸器、排出器、生殖器などの特に外通性の中腔器官の内壁が含まれる。したがって、本発明の好ましい投与形態である粘膜投与としては、例えば、鼻腔投与(経鼻投与)、口腔投与、膣内投与、上気道投与、肺胞投与などをあげることができる。そのなかでも鼻腔内粘膜投与が好ましい。鼻腔は特に、インフルエンザウイルスなどによる呼吸器感染症疾患の感染経路の門戸であることから、粘膜投与により分泌型IgA抗体反応を引き起こし、粘膜上皮細胞中に分泌型IgA抗体を産生させることは、呼吸器感染症の防御に結びつくものである。
【0019】
本発明の目的である分泌型IgA抗体の産生が誘導され、免疫防御を発揮する対象としての病原体は、宿主に対して疾患又は障害を発生し得る微生物である。具体的には、ヒトに対する病原体としては、例えば、ウイルス、細菌、真菌などをあげることができる。ウイルスはどのような種類のものでもよく、例えば、DNAウイルス、RNAウイルスなどがあげることできる。より具体的には、例えば、水痘ウイルス、麻疹ウイルス、ムンプウイルス、ポリオウイルス、ロタウイルス、インフルエンザウイルス、アデノウイルス、ヘルペスウイルス、重症急性呼吸器感染症候群(SARS)ウイルス(コロナウイルスの一種)、HIVウイルスが挙げられるが、それらに限定されない。このようなウイルスは、好ましくはインフルエンザウイルスである。
【0020】
また、本発明が対象とする細菌は、どのような細菌であってもよく、グラム陽性菌、グラム陰性菌があげられることができ、例えば、そのような細菌としては、百日咳菌、髄膜炎菌、インフルエンザb型菌、肺炎菌及びコレラ菌などがあげられる。
【0021】
本発明が提供する分泌型IgA抗体誘導剤の投与量は、投与する対象者の年齢、体重、投与方法により一概に限定し得ないが、通常成人1日当たり、経口投与の場合には、10〜1000mg程度であり、また粘膜投与、特に経鼻投与の場合には、0.1〜100mg、好ましくは、0.1〜10mg程度である。
【0022】
以下に本発明を、具体的実施(試験)例により説明する。
(1)供試材料
材料として、以下のものを使用した。
(イ)アジュバント(前記段落0014により調整したキノコの菌糸体の熱水抽出物)
(a)メシマコブ(Phellinus linteus、PLと表記)
(b)カラカサタケモドキ(Macrolepita gracilenta、MGRと表記)
(c)マイタケ(Grifola frondosa、GFと表記)
(d)シイタケ(Lentinula edodes、LEと表記)
(ロ)マウス:BALB/cマウス(6週齢、雌性)
(ハ)ウイルス:(a)インフルエンザウイルスH1N1(A/PR8)株(国立感染症研究所(東京)から入手)
:(b)Aタイプ株
:(c)Bタイプ株(Aタイプと同じ亜型内のグレードの異なる株)
:(d)Cタイプ株
(ニ)ワクチン:(a)インフルエンザウイルスH1N1(A/PR8)株
:(b)前記ウイルスAタイプ株のワクチン
(ホ)アジュバントのポジティブコントロールとしてPoly(I:C)
なお、「Poly(I:C)」とは、ポリイノシン酸(pI)とポリシチジン酸(pC)とを含む二本鎖RNAをいう(特許文献2参照)。
【0023】
(2)実施(試験)例
(イ)6週齢のBALB/c雌性マウスを、各群5匹ずつ用いた。PR8 HAワクチン1μgを、アジュバント(前記4種類のキノコ熱水抽出物、PL,MGR,GF,LE)5μg(5μl)と共に、それぞれのマウスの鼻に5μl接種し、更に3週間後に、同量のワクチンを同様のアジュバントと共に経鼻接種し、最終免疫(投与)の2週間後に、更に100pfuのPR8ウイルス(前記〔0023〕の(1)−(ハ)−(a))を、片鼻に1.2μlずつ注入し、ウイルス感染を行った。
アジュバントのポジティブコントロールとして、Poly(I:C)5μg投与群、及び5μgのPR8 HAワクチンのみの投与群をおいた。
感染3日後に肺洗浄液、及び血清を回収し、肺洗浄液中のIgG抗体を、ELISA法を用いて、また肺洗浄液中のウイルス価を、MDCK細胞を用いたプラークアッセイ法で測定した。
同様に、経鼻免疫したマウスに40LD50の致死量のウイルスを20μl感染してその体重変化と生存を観察した。
【0024】
測定結果を図2、図3及び図4に示す。
図2(2)「Anti‐A/PR8 HA IgG in lung wash」は、「抗‐PR8 HA IgG(肺洗浄液中)」を表し、図2(3)「Anti‐A/PR8 HA IgG in serum」は、「抗‐PR8 HA IgG(血清中)」を表し、図2(4)「A/PR8 virus titer in lung wash」は、「肺洗浄液中のウイルス価」を表す。又、図2(5)「HI titers(HI価)」は、血中の抗体の中和の度合いを示す。
試験に供した、全てのキノコ(メシマコブ、カラカサタケモドキ、マイタケ、及びシイ
タケ)について、肺粘膜にIgG抗体の応答が認められた。すなわち、肺洗浄液中においても、又血清中においてもの抗−PR8 HA IgG量は、顕著に増加した(図2の(2)及び(3)参照)。
以上の結果から、キノコの菌糸体の熱水抽出物には、強力なアジュバント効果があることが確認された。
【0025】
(ロ)6週齢のBALB/c雌性マウスを、各群5匹ずつ用いた。
ウイルスAタイプ株のワクチン(前記〔0023〕の(1)−(2)−(b))1μgを、アジュバント(PL熱水抽出物)5μg(5μl)と共に、それぞれのマウスの鼻に5μl接種し、更に3週間後に、同量のワクチンを同様のアジュバントと共に経鼻接種した。
最終免疫(投与)の2週間後に、更に100pfuのAタイプ株、Bタイプ株、Cタイプ株(前記〔0023〕の(1)−(ハ)−(b),(c),及び(d))のウイルスを、片鼻に1.2μLずつ注入し、ウイルス感染を行った。
感染3日後に鼻腔洗浄液、及び血清を回収し、鼻腔洗浄液中のIgA抗体及び血清中のIgG抗体を、ELISA法を用いて、また鼻腔洗浄液中のウイルス価を、MDCK細胞を用いたプラークアッセイ法で測定した。
同様に、経鼻免疫したマウスに40LD50の致死量のAタイプ株、Bタイプ株、Cタイプ株ウイルスを20μL感染してその体重変化と生存を観察した。
【0026】
測定結果を図5、及び図6に示す。
これらの結果は、PL熱水抽出物をアジュバントとして用いるワクチン投与は、ワクチン株と亜型の異なるウイルスに対しても感染防御、及び交叉防御能を発現させることを示している。
【図面の簡単な説明】
【0027】
【図1】キノコ菌糸体からその熱水抽出物を得る工程を示す図である。
【図2】実施例において試験したキノコ熱水抽出物のアジュバント効果を示すデータである。(1)ワクチン名とアジュバントの種類を示す。(2)肺洗浄液中の抗−PR8 HAIgG量を示す(ng/ml)。(3)血清中の抗−PR8 HAIgG量を示す(μg/ml)。(4)肺洗浄液中のウイルス力価(PFU/ml;10n)を示す。(5)HI価(血中の抗体の中和の度合い)を示す。
【図3】体重変化を示す図である。
【図4】生存率を示す図である。
【図5】PL菌糸体の熱水抽出物の熱水抽出物のアジュバント効果を示すデータである。(1)鼻腔洗浄液中の抗−AタイプウイルスのIgA量を示す(U/ml)。(2)血清中の抗−AタイプウイルスのIgG量を示す(U/ml)。(3)Aタイプ(ウイルス)の鼻腔洗浄液中のウイルス力価(PFU/ml;10n)を示す。(4)Bタイプ(ウイルス)の鼻腔洗浄液中のウイルス力価(PFU/ml;10n)を示す。(5)Cタイプ(ウイルス)の鼻腔洗浄液中のウイルス力価(PFU/ml;10n)を示す。
【図6】生存率を示す図である。
【特許請求の範囲】
【請求項1】
キノコの菌糸体の熱水抽出物を主成分とすることを特徴とするウイルス又は病原菌由来の不活化抗原に対するアジュバント。
【請求項2】
キノコがメシマコブ(Phellinus linteus)、カラカサタケモドキ(Macrolepita gracilenta)、マイタケ(Grifola frondosa)、又はシイタケ(Lentinula edodes)である請求項1記載のウイルス又は病原菌由来の不活化抗原に対するアジュバント。
【請求項3】
ウイルスが水痘ウイルス、麻疹ウイルス、ムンプウイルス、ポリオウイルス、ロタウイルス、インフルエンザウイルス、アデノウイルス、ヘルペスウイルス、重症急性呼吸器感染症候群ウイルス又はHIVウイルスであり、又病原菌が百日咳菌、髄膜炎菌、インフルエンザb型菌、肺炎菌又はコレラ菌である請求項1記載のウイルス又は病原菌由来の不活化抗原に対するアジュバント。
【請求項4】
ウイルス又は病原菌由来の不活化抗原と、請求項1〜請求項3記載のウイルス又は病原菌由来の不活化抗原に対するアジュバントを含むことを特徴とする分泌型IgA抗体誘導剤。
【請求項5】
呼吸器粘膜に投与する請求項4に記載の分泌型IgA抗体誘導剤。
【請求項6】
ウイルス又は病原菌が水痘ウイルス、麻疹ウイルス、ムンプウイルス、ポリオウイルス、ロタウイルス、インフルエンザウイルス、アデノウイルス、ヘルペスウイルス、重症急性呼吸器感染症候群ウイルス又はHIVウイルスであり、又病原菌が百日咳菌、髄膜炎菌、インフルエンザb型菌、肺炎菌又はコレラ菌である請求項4又は請求項5に記載の分泌型IgA抗体誘導剤。
【請求項7】
ウイルス又は病原菌由来の不活化抗原と共に請求項1〜請求項3記載のアジュバントを投与することを特徴とするウイルス又は病原菌特異的IgA抗体を誘導させる方法。
【請求項8】
呼吸器粘膜に投与する請求項7に記載のウイルス又は病原菌特異的分泌型IgA抗体を誘導させる方法。
【請求項9】
ウイルスが水痘ウイルス、麻疹ウイルス、ムンプウイルス、ポリオウイルス、ロタウイルス、インフルエンザウイルス、アデノウイルス、ヘルペスウイルス、重症急性呼吸器感染症候群ウイルス又はHIVウイルスであり、又病原菌が百日咳菌、髄膜炎菌、インフルエンザb型菌、肺炎菌又はコレラ菌である請求項7に記載のウイルス、又は病原菌特異的IgA抗体を誘導させる方法。
【請求項1】
キノコの菌糸体の熱水抽出物を主成分とすることを特徴とするウイルス又は病原菌由来の不活化抗原に対するアジュバント。
【請求項2】
キノコがメシマコブ(Phellinus linteus)、カラカサタケモドキ(Macrolepita gracilenta)、マイタケ(Grifola frondosa)、又はシイタケ(Lentinula edodes)である請求項1記載のウイルス又は病原菌由来の不活化抗原に対するアジュバント。
【請求項3】
ウイルスが水痘ウイルス、麻疹ウイルス、ムンプウイルス、ポリオウイルス、ロタウイルス、インフルエンザウイルス、アデノウイルス、ヘルペスウイルス、重症急性呼吸器感染症候群ウイルス又はHIVウイルスであり、又病原菌が百日咳菌、髄膜炎菌、インフルエンザb型菌、肺炎菌又はコレラ菌である請求項1記載のウイルス又は病原菌由来の不活化抗原に対するアジュバント。
【請求項4】
ウイルス又は病原菌由来の不活化抗原と、請求項1〜請求項3記載のウイルス又は病原菌由来の不活化抗原に対するアジュバントを含むことを特徴とする分泌型IgA抗体誘導剤。
【請求項5】
呼吸器粘膜に投与する請求項4に記載の分泌型IgA抗体誘導剤。
【請求項6】
ウイルス又は病原菌が水痘ウイルス、麻疹ウイルス、ムンプウイルス、ポリオウイルス、ロタウイルス、インフルエンザウイルス、アデノウイルス、ヘルペスウイルス、重症急性呼吸器感染症候群ウイルス又はHIVウイルスであり、又病原菌が百日咳菌、髄膜炎菌、インフルエンザb型菌、肺炎菌又はコレラ菌である請求項4又は請求項5に記載の分泌型IgA抗体誘導剤。
【請求項7】
ウイルス又は病原菌由来の不活化抗原と共に請求項1〜請求項3記載のアジュバントを投与することを特徴とするウイルス又は病原菌特異的IgA抗体を誘導させる方法。
【請求項8】
呼吸器粘膜に投与する請求項7に記載のウイルス又は病原菌特異的分泌型IgA抗体を誘導させる方法。
【請求項9】
ウイルスが水痘ウイルス、麻疹ウイルス、ムンプウイルス、ポリオウイルス、ロタウイルス、インフルエンザウイルス、アデノウイルス、ヘルペスウイルス、重症急性呼吸器感染症候群ウイルス又はHIVウイルスであり、又病原菌が百日咳菌、髄膜炎菌、インフルエンザb型菌、肺炎菌又はコレラ菌である請求項7に記載のウイルス、又は病原菌特異的IgA抗体を誘導させる方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2008−273846(P2008−273846A)
【公開日】平成20年11月13日(2008.11.13)
【国際特許分類】
【出願番号】特願2007−115739(P2007−115739)
【出願日】平成19年4月25日(2007.4.25)
【出願人】(500003176)
【出願人】(500003165)
【出願人】(591222245)国立感染症研究所長 (48)
【Fターム(参考)】
【公開日】平成20年11月13日(2008.11.13)
【国際特許分類】
【出願日】平成19年4月25日(2007.4.25)
【出願人】(500003176)

【出願人】(500003165)

【出願人】(591222245)国立感染症研究所長 (48)
【Fターム(参考)】
[ Back to top ]

