ウイルス感染の予防又は治療のための化合物とその使用方法
本発明は、細胞のウイルス感染を予防する化合物及び方法である。本発明の化合物及び方法は、ウイルスの耐性を最小限に抑え、且つ、対象とするウイルスの数を最大にする。更に、該化合物及び方法は、非感染の細胞への毒性を最小限に抑える。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願の相互参照
本出願は、2007年2月28日に出願された米国仮出願第60/891,954号の優先権を主張する。この出願の全教示は、参照することにより全体が本明細書中に組み込まれる。
【背景技術】
【0002】
抗ウイルス剤の発見における大規模研究の結果、現在では臨床使用のために世界中で43個の抗ウイルス剤が承認されている。しかしながら、それらのほとんどはウイルスのDNAポリメラーゼをターゲットとしている。そのような偏りは、HSV‐1 DNAポリメラーゼが抗ウイルス剤のために特定された最初のターゲットであったからであろう。発見された2番目のターゲットは、ウイルス粒子の成熟化のために必要なウイルス性のプロテアーゼであった。より最近では、主要な取り組みは他のウイルス性タンパク質をターゲットとする薬剤に置かれている。重点はウイルス感染を阻害する薬剤にあり、その薬剤は、ウイルス感染のかなり初期の事象を妨げるものである。最初に成功した感染阻害物質は、HIV融合蛋白の再構成のペプチド阻害剤であるT‐20又はフューゼオン(fuzeon)であった。この薬剤は臨床的に使用されるが、併用療法のみである。さらに、その薬剤には既に耐性によって選択されている。より最近では、HIVの糖タンパクと細胞のレセプター又はコレセプターとの相互作用もターゲットとされている(例えば、CCR5コレセプターをターゲットとするvicriviroc‐SCH417690、TAK‐779、PRO‐140、UK‐427,857、GW873140及びAMD887、又は、CXCR4コレセプターをターゲットとするAMD3100及びAMD070)。しかしながら、これらのすべての感染阻害物質は重要な欠点を有する。例えば、ペプチド阻害剤は、生物学的利用率と安定性に乏しい。したがって、それらは使用直前に調製する必要があり、また、非経口投与によってのみ使用できる。コレセプター結合の阻害物質は、特異性が狭い(CCR5又はCXCR4栄養ウイルスのみ等)。さらに、レセプター結合の阻害物質は重要な細胞レセプターの活性化を阻害することもできる。したがって、主要な取り組みは、依然として、そのような欠点を克服できる新規のウイルス融合阻害物質の発見に注ぎ込まれている。
【0003】
現在のウイルス融合の阻害物質はウイルスと細胞タンパクとの相互作用をターゲットとしている。実際に、昔から、特異性や安全性を保証する全ての抗ウイルス剤がウイルスタンパクをターゲットとして開発された。これは、臨床で使用される43の抗ウイルス剤や現在開発中の他の薬剤の開発につながった長い年月をかけて検証された概念である。残念ながら、このアプローチにはいくつかの限界がある。ウイルスタンパクをターゲットとする薬剤にはすぐに耐性によって選択される。例えば、これは既にフューゼオンで起こり、CCR5‐gp41相互作用阻害剤でも起こっている。また、ヒトパピローマウイルスのような小さなゲノムのウイルスでは可能なウイルスターゲットの数も制限される。新たに特定されたウイルス病原体によってコードされるタンパクが最初に特徴づけされるべきとき、このアプローチはその病原体に対する薬剤の迅速な開発にも貢献しない。
【0004】
伝統的なアプローチに代わる手段として、最近、細胞タンパクをターゲットとする抗ウイルス剤の開発の可能性が検討されている。このアプローチはいくつかの潜在的な有用性を提供する。例えば、複数のウイルス機能に必要な細胞タンパクの阻害は耐性の選択を最小にするかもしれない。細胞タンパクの多くはウイルスの複製に最小のゲノムが必要である。さらに、細胞タンパクの多くは遠縁のウイルスの複製にも必要である。したがって、細胞タンパクをターゲットとする薬剤は、そのタンパクが完全に特徴付けられる前にでも新規な病原体に対して使用できる。しかしながら、そのようなターゲットは一般的に多くの感染していない細胞でも発現していることから、細胞タンパクをターゲットとすることは、好ましくないネガティブの副作用を導くかもしれない。
【発明の概要】
【発明が解決しようとする課題】
【0005】
本明細書には、細胞のウイルス感染を予防するための又はウイルスに感染した対象を治療するための化合物及び方法が記載されている。
【課題を解決するための手段】
【0006】
本明細書に記載された化合物と方法は、ウイルスの耐性を最小にし、ターゲットとするウイルスの数を最大にする。さらに、その化合物と方法は感染していない細胞に対する毒性を最小にする。本発明の利点については、一部は以下の説明中に示され、一部はこの説明から明白となり、又は以下に記載する実施形態により理解される。以下に記載された利点は、添付の特許請求の範囲で特に示された要素と組み合わせの手段によって実現され、達成される。以上の概要及び以下の詳細な説明は双方ともに単に説明のための例示であって、制限するものではないことが理解される。
【図面の簡単な説明】
【0007】
本明細書に組み込まれ、その一部を構成する添付図面は、以下に記載のいくつかの実施態様を例示する。
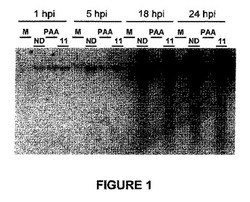
【図1】両親媒性ヌクレオシド誘導体であるdUY11がHSV‐1 DNA複製を阻害しないことを示すサザンブロット解析の図である。
【図2】両親媒性ヌクレオシド誘導体であるdUY11が子孫HSV‐1のDNAの放出を阻害しないことを示すサザンブロット解析の図である。
【図3】ウイルス感染におけるdUY11の抑制性を表すプラークアッセイを示す図である。
【図4】代表的な膜脂質と比較した両親媒性ヌクレオシド誘導体の化学構造と三次元構造を示す図である。
【図5】異なる両親媒性ヌクレオシド誘導体濃度に対するHSV‐1感染力をプロットした線グラフである。
【図6】IC50値が20nMであるdUY11濃度に対するHSV‐1感染力をプロットした線グラフである。
【図7】処理時間に対するHSV‐1感染力をプロットした線グラフである。
【図8】細胞のタイプに関係なく阻害するdUY11濃度に対するHSV‐1感染力をプロットした線グラフである。
【図9】dUY11で処理し、膜の色素(PKH26)で染色したモック感染細胞を示す図である。
【図10】dUY11を曝露した時間に対する相対細胞数をプロットした線グラフである。dUY11は細胞傷害性又は細胞増殖抑制性がない。
【図11】HSV‐1の結合性(A)及び感染力(B)を示す棒グラフ及び画像である。dUY11はHSV‐1結合を阻害しない。
【図12】ヘパリンの濃度を増加させたときの細胞に対するHSV‐1結合の競合を示す線グラフである。dUY11はHSV‐1ウイルスによる高親和性結合を阻害しない。
【図13】HSV‐1 ICP0 IEプロモーター制御下で、細胞ゲノムに再結合した赤色蛍光タンパク(RFP)レポータ遺伝子を含むVero細胞で発現している赤色蛍光タンパクの図(A)及び定量結果(B)を表す。dUY11はHSV‐1の細胞内への侵入を抑制する。
【図14】dUY11濃度に対するHSV‐1株KOS、HSV‐2株186、HSV‐2株333、VSV又はシンドビスの感染力をプロットした線グラフである。dUY11はHSV‐1,HSV‐2,VSV及びシンドビスウイルスの感染を阻害した。
【図15】ウイルス若しくは細胞の前処理又は感染後のみの細胞の処理に使用したdUY11濃度に対するHSV‐1 KOSの感染力をプロットした線グラフである。ウイルスの前処理に使用した場合にのみ、dUY11はHSV‐1感染を完全に阻害した。
【図16】両親媒性ヌクレオシド誘導体で24時間又は1時間だけ処理した細胞によって産生されるウイルスの感染力の低下を示し、薬剤の濃度に対してプロットした線グラフである。dUY11は子孫ウイルスの感染を阻害した。
【図17】異なる薬物で処理した細胞によって産生されるウイルスの感染力(ウイルス力価)の低下を示し、ACV,PAA又はdUY11の濃度に対してプロットした線グラフである。dUY11は薬剤耐性変異ウイルスの感染を阻害した。
【図18】マウスのHSV‐2 in vivo膣感染を防御するdUY11の能力を示すグラフである。dUY11を曝露したウイルスはマウスに感染しなかった。
【図19】dUY11を曝露したHSV‐2を感染させたマウスの腟領域、会陰領域及び肛門の写真である。dUYllを曝露したウイルスはマウスに感染しなかった。
【発明を実施するための形態】
【0008】
発明の詳細な説明
本発明の化合物、組成及び方法を開示し説明するが、以下で説明する実施形態は、特定の化合物、合成方法又は用途に限定されるものではなく、当然に、様々であることが理解される。また、本明細書で使用される用語は特定の実施形態について説明することのみを目的とし、限定を意図するものではないことも理解される。
【0009】
この明細書と添付の特許請求の範囲において、下記の意味を有することが定義される多くの用語について示す。
【0010】
この明細書と、添付の特許請求の範囲において、単数形の「a」、「an」及び「the」は、文中に特に明示のない限り、対象の複数形も含まれることに注意すべきである。したがって、例えば「医薬キャリア」という場合、そのようなキャリアの2種以上の混合物等が含まれる。
【0011】
「任意の」又は「任意に」は、その後に記載する事象又は状況が生じても、生じなくてもよいことを意味し、その記載は、その事象又は状況が生じる場合と生じない場合を含む。例えば「任意に低級アルキルを置換する」という句は、低級アルキルを置換しても置換しなくてもよいことを意味し、その記載は、置換されていない低級アルキルと置換された低級アルキルの両方を含む。
【0012】
組成物又は物における特定の要素又は成分の重量部という明細書及び結論のクレームの記載は、その組成物又は物における当該要素又は成分と、他の要素又は成分との間の重量部によって表される重さ関係を示す。したがって、2重量部の成分Xと5重量部の成分Yを含む化合物では、XとYは、2:5の重量比で存在しており、追加成分がその化合物に含まれているか否かに関わらず、この比率で存在する。
【0013】
そうでない旨が特に示されない限り、組成物の重量パーセントは組成物が含まれている製剤又は組成の総重量に基づいている。
【0014】
「被験体」は個体を意味する。被験体は霊長類又はヒトなどの哺乳動物であってもよい。「被験体」という用語には、限定はされないが、ネコ、イヌなどの飼いならされた動物、家畜(例えば、ウシ、ウマ、ブタ、ヒツジ、ヤギなど)、及び実験動物(例えば、マウス、ウサギ、ラット、モルモットなど)を含むことができる。
【0015】
「接触」とは1つ以上の物質が別の物質に密接な物理的接触をすることによって曝露される事例を意味する。例えば、接触には薬物などの物質と細胞又はウイルスとの接触を含むことができる。
【0016】
「治療」又は「治療すること」とは、好ましくない病気の症状を減少させるために、好ましくない病気(例えば、ウイルス感染)を持つ被験体又はシステムに対する組成物の投与を意味する。「予防」又は「予防すること」とは、好ましくない病気にかかる可能性を排除することを意味する。また、「予防」又は「予防すること」には、好ましくない病気にかかる可能性を減少させることが含まれる。
【0017】
「有効な量」とは、好ましい結果又は結果を得るのに必要な治療上の又は予防のための(予防薬)量を意味する。
【0018】
明細書及び結論のクレームに使用される化学種の残基は、実際に化学種から得るかどうかにかかわらず、特定の反応スキームやその後の処方で得られた化学種又は化学製品の一部をいう。例えば、1つ以上の‐OH基を含む糖類は式Z‐OHによって表すことができる。そこでは、Zは糖分子の残り(すなわち、残基)である。
【0019】
本明細書で使用される「アルキル基」という用語は、メチル基、エチル基、n‐プロピル基、イソプロピル基、n‐ブチル基、イソブチル基、t‐ブチル基、ペンチル基、ヘキシル基、ヘプチル基、オクチル基、デシル基、テトラデシル基、ヘキサデシル基、エイコシル基、テトラコシル基等の炭素原子が1〜24の分岐又は非分岐の飽和炭化水素基である。「低級アルキル」基は、1〜6の炭素原子を含むアルキル基である。
【0020】
本明細書で使用される「アリール基」という用語は、これには限定されないが、ベンゼン、ナフタリンなどの任意の炭素系芳香族基である。また、「芳香族」という用語には、芳香族基の環の中に組み込まれる1つ以上のヘテロ原子を有する芳香族基として定義される「ヘテロアリール基」が含まれる。ヘテロ原子の例には、これには限定されないが、窒素、酸素、硫黄、及びリンが含まれる。アリール基は、置換されるか又は非置換とすることができる。アリール基は、これには限定されないが、アルキル、アルキニル、アルケニル、アリール、ハロゲン化物、ニトロ、アミノ、エステル、ケトン、アルデヒド、ヒドロオキシ、カルボン酸、又はアルコキシルを含む1つ以上の基で置換できる。また、「アリール基」という用語には互いに縮合した2つ以上の芳香族基が含まれる。OLE_LINK5例えば、縮合アリール基はOLE_LINK53、4、5、6、7、又は8個のアリール環で構成されてもよい。縮合アリール基は上で説明した1つ以上の基で置換されるか又は非置換とすることができる。
【0021】
本明細書で使用される「ポリエーテル基」という用語は、式‐[(CHR)nO]m‐を有する基である。式中、Rは水素又は低級アルキル基、nは1〜20の整数、mは1〜100の整数である。ポリエーテル基の例には、ポリエチレンオキシド、ポリプロピレンオキシド、及びポリブチレンオキシドが含まれる。
【0022】
本明細書で使用される「ポリチオエーテル基」という用語は、OLE_LINK6OLE_LINK7式‐[(CHR)nS]m‐を有する基である。式中、Rは水素又は低級アルキル基、nは1〜20の整数、mは1〜100の整数である。
【0023】
本明細書で使用される「ポリイミノ基」という用語は、式‐[(CHR)nNR]m‐を有する基である。式中、それぞれのRは互いに独立して水素又は低級アルキル基であり、nは1〜20の整数、mは1〜100の整数である。
【0024】
出願書類を通して使用されるX,L,L’,R,Y,Z1,Z2,及びZ3などの変数は、そうでない旨が示されない限り、それまでに定義されたのと同じ変数である。
【0025】
I.化合物及びその作製
本明細書には、細胞へのウイルス感染を防ぐか、又は感染の確率を減少させる化合物が記載されている。本発明の一実施形態は、式I含む化合物又はその薬学的に許容できる塩若しくはエステルである。
X‐L‐Y (I)
式中、Xは糖類の残基を含み;
Lは平面状親水基を含むリンカーを含み;そして
Yは平面状疎水性基を含み、Yは直接又は間接的にLに結合している。
【0026】
詳細に式Iの各成分について議論する。Xに関して、Xは糖類の残基を含む。通常、糖類は1つ以上のヒドロキシル基を有する。したがって、Xは化合物Iの親水部分である。1つの実施形態では、糖類は単糖を含む。単糖は、直鎖の単糖又は環状構造(ヘミアセタール又はヘミケタール)であってもよい。したがって、単糖は単糖のフラノース型とピラノース型を含むことができる。本明細書で有用なペントース糖類の例としては、リボース、アラビノース、デオキシリボース、キシロース、リキソース、リブロース、又はキシルロースを含むが、これには制限されない。ヘキソースの例としては、グルコース、ガラクトース、マンノース、グロース、イドース、タロース、アロース、アルトロース、フラクトース、ソルボース、タガトース、プシコース、フコース、又はラムノースを含むが、これには制限されない。
【0027】
別の実施形態では、Xは二糖である。二糖はグリコシド共有結合によって互いに結合した二つの単糖ユニットで構成される。本明細書で有用な二糖の例には、スクロース、乳糖、トレハロース、又は麦芽糖が含まれるが、これには限定されない。更なる実施形態では、糖類はオリゴ糖又は多糖を含む。オリゴ糖と多糖はグリコシド結合によって互いに結合した単糖ユニットの長い鎖で構成される。二つの区別は鎖に存在する単糖ユニットの数に基づいている。オリゴ糖は2〜9の単糖ユニットを通常含んでおり、多糖は10以上の単糖ユニットを含んでいる。多糖の例には、グリコーゲン、でんぷん、セルロース、キチン、アミラーゼ、アミロペクチン、スタキオース、イヌリン、又はデキストリンが含まれるが、これには限定されない。また、多糖には、例えば、ヘパリン、コンドロイチン硫酸、ヒアルロナン、ヘパラン硫酸、デルマタン硫酸、又はケラタン硫酸などのグリコサミノグリカン(GAG)が含まれる。
【0028】
必要に応じて当技術分野で公知の技術を使用することにより、糖類に存在するヒドロキシル基のいずれも誘導体化することができる。例えば、ヒドロキシル基は、ポリエーテル基、ポリイミノ基、アセチル基、又はポリチオエーテル基で置換できる。したがって、必要に応じて糖類の親水性の量や程度を変えることができる。
【0029】
糖類XはリンカーLと共有結合している。リンカーLは平面状親水基である。リンカーは、通常、剛体平面である。例えば、リンカーにはプリン又はピリミジン残基が含まれる。また、リンカーは互いに共有結合した2つ以上の塩基対であってもよいと想定される。1つの実施形態では、X‐Lは以下のヌクレオシドのひとつであってもよい:アデノシン、デオキシアデノシン、グアノシン、デオキシグアノシン、5‐メチルウリジン、デオキシチミジン、ウリジン、デオキシウリジン、シチジン、又はデオキシシチジン。1つの実施形態では、式IのX‐Lは以下に示されるようにデオキシウリジン又はその誘導体の残基ではない。
【0030】
【化1】

【0031】
式中、Rは、例えばアセチル基などの水素基又は保護基である。
【0032】
別の実施形態では、リンカーには親水性アリール基が含まれる。例えば、アリール基は本明細書に定義されるようにヘテロアリル基であってもよい(例えば、ピリジル基)。他の実施形態では、アリール基の親水性を増加させる1つ以上の基でアリール基を置換できる。例えば、アリール基は、ヒドロキシル化アリール基又はその誘導体であってもよい。本明細書では、ヒドロキシル化アリール基は直接的に又は鎖を介して間接的に芳香族環に結合した1つ以上のヒドロキシル基を有する任意のアリール基と定義される。ヒドロキシル化アリール基の誘導体には、アリール基の親水性を修飾する(すなわち、増減する)任意の基が含まれる。例えば、ヒドロキシル基は、Xについて上記で議論したように、ポリエーテル基、ポリイミノ基、又はポリチオエーテル基で置換できる。
【0033】
式Iでは、Yには平面状疎水性基が含まれ、Yは直接又は間接的にLに結合している。1つの実施形態では、Yにはアリール基が含まれる。Yのアリール基にはいくつかの型が想定できる。例えば、アリール基は置換された又は非置換の縮合系であってもよい。縮合されたアリール基の例には、アントラセン、フェナンスレン、ナフタリン、ベンゾナフタレン、フッ素、又はカルバゾールが含まれるが、これには限定されない。他の実施形態では、アリール基は、より大きい分子の一部であってもよい。基の全体の疎水性を修飾するために1つ以上の異なった基でアリール基を置換できる。dUY7を除き本明細書で有用なアリール基の例を図4に示す。図5Cで示すようにdUY7はウイルス感染を阻害する能力を全く示さなかった。
【0034】
リンカーLは直接的又は間接的にYに結合できる。ここでの「直接的に結合」という語句は、Yがリンカーと共有結合していると定義される。反対に、ここでの「間接的に結合」という語句は、Yが二番目のリンカー(L’)を介してリンカーと共有結合していると定義される。二番目のリンカーL’には、アルキル基、アルケニル基、又はエーテル基(例えば、ポリエーテル)を含むことができるが、これには限定されない。1つの実施形態では、L’はアルキニル基である。例えば、L’は、プロパルギル基又はプロパルギルエーテル基であってもよい。図4の構造AとBに示すように、アルキニル基RC≡CはチミンのC5に結合し、Rがアリール基(すなわち、Y基)である。
【0035】
1つの実施形態では、化合物は式IIを含む化合物又はその誘導体である。
【0036】
【化2】

【0037】
式中、Z1、Z2及びZ3は、互いに独立してH又はOHであり;
Lはプリン又はピリミジンを含み;
Yはアリール基を含む。
【0038】
1つの実施形態では、ZはOHであり、Lはウラシル残基であり、Yは式IIのアリール基を含まれる。別の実施形態では、その化合物は式IIIA又はIIIBを有する。
【0039】
【化3】

【0040】
式中、Z1、Z2及びZ3は、互いに独立してH又はOHであり、Yはアリール基を含む。更なる実施形態では、Yは3個以上のアリール環を含む縮合されたアリール基を含む。そのアリール基の一例は、以下の構造を有する。
【0041】
【化4】

【0042】
式中、アリール基は置換されているか、非置換である。
【0043】
1つの実施形態では、この化合物は式IIIAを有し、式中、Z1がOHであり、Z2とZ3が水素であり、Yは以下の化学式を有するアリール基である。
【0044】
【化5】

【0045】
式中、アリール基は置換されているか、非置換である。この化合物は本明細書ではdUY11と呼ばれる。別の実施形態では、その化合物は式IIIAを有する。式中、Z1、Z2及びZ3は水素であり、Yは以下の化学式を有するアリール基である。
【0046】
【化6】

【0047】
式中、アリール基は置換されているか、非置換である。この化合物は本明細書ではdUY11と呼ばれる。更なる実施形態では、化合物は式IIIAを有する。式中、Z1とZ3はOHであり、Z2は水素であり、Yは以下の化学式を有するアリール基である。
【0048】
【化7】

【0049】
式中、アリール基は置換されているか、非置換である。この化合物は本明細書ではaUY11と呼ばれる。
【0050】
本明細書に記載された化合物のいずれもが存在又はその塩に変換することができる。1つの実施形態では、その塩は薬学的に許容できる塩である。その塩は、化学的又は薬学的に許容できる適切な量の塩基で遊離酸を処理することによって調製できる。代表的な化学的又は薬学的に許容できる塩基は、水酸化アンモニウム、水酸化ナトリウム、水酸化カリウム、リチウム水酸化物、消石灰、水酸化マグネシウム、水酸化第一鉄、亜鉛水酸化物、水酸化銅、水酸化アルミニウム、水酸化第二鉄、イソプロピルアミン、トリメチルアミン、ジエチルアミン、トリエチルアミン、トリプロピルアミン、エタノールアミン、2‐ジメチルアミノエタノール、2‐ジエチルアミノエタノール、リジン、アルギニン、ヒスチジン等である。1つの実施形態では、その反応は水中で、単独で又は不活性物質と組み合わせて、水混和性有機溶媒中で、約0℃〜約100℃の例えば室温などの温度で行われる。使用される塩基に対する化合物のモル比は、どの特定の塩においても求められる比を提供するように選ばれる。例えば、遊離酸出発物質のアンモニウム塩を調製するためには、塩を得るために、出発物質はおよそ等量の塩基で処理できる。
【0051】
別の実施形態では、本明細書に記載された化合物のいずれもが存在又はそのルイス塩基で塩に変換できる。化合物は適量のルイス塩基で処理できる。ルイス塩基の代表的なものは、水酸化アンモニウム、水酸化ナトリウム、水酸化カリウム、リチウム水酸化物、消石灰、水酸化マグネシウム、水酸化第一鉄、亜鉛水酸化物、水酸化銅、水酸化アルミニウム、水酸化第二鉄、イソプロピルアミン、トリメチルアミン、ジエチルアミン、トリエチルアミン、トリプロピルアミン、エタノールアミン、2‐ジメチルアミノエタノール、2‐ジエチルアミノエタノール、リジン、アルギニン、ヒスチジン、テトラヒドロフラン、エーテル、チオール試薬、アルコール類、チオールエーテル、カルボン酸エステル、フェノラート、アルコキシド、水などである。1つの実施形態では、その反応は水中で、単独で又は不活性物質と組み合わせて、水混和性有機溶媒中で、約0℃〜約100℃の例えば室温などの温度で行われる。使用される塩基に対する化合物のモル比は、どの特定の複合体においても求められる比を提供するように選ばれる。例えば、遊離酸出発物質のアンモニウム塩を調製するためには、複合体を得るために、出発物質はおよそ等量の化学的又は薬学的に許容されるルイス塩基で処理できる。
【0052】
化合物がカルボン酸基を有する場合、これらの基は当技術分野で公知の技術を用いて薬学的に許容されるエステル又はアミドに変換できる。さらに、エステルが存在している場合、そのエステルはエステル交換反応の技術を用いて薬学的に許容できるエステルに変換できる。
【0053】
本明細書に記載された化合物は、当技術分野で公知の技術を用いて合成できる。例えば、X‐Lがヌクレオシドであるときには、式Iを有する化合物を作るために、Y又はY‐L’にそれを結合できる。
【0054】
【化8】

【0055】
1つの実施形態では、X‐Lが式IVで表されるヌクレオシドであるときには、化合物Vを作るためにカップリング反応を使用できる。
【0056】
【化9】

【0057】
この実施形態では、Xは糖類であり、Halはヨウ化物などのハロゲンである。パラジウム触媒は、式Vを有する化合物を作るために、アルキンY‐C≡CHを化合物IVと結合するために使用される。
【0058】
II.医薬組成物
1つの実施形態では、上で説明した化合物のすべてが医薬組成物に製剤化できる。これらの医薬組成物は、当技術分野で公知の技術を用いて準備できる。1つの実施形態では、この組成物は、本明細書に記載された化合物と薬学的に許容できる担体を混合することによって調製できる。
【0059】
特定のケースにおいて、式Iを有する活性化合物の実際に好ましい量は、利用される特定の化合物、製剤化される特定の組成、適用方法、特定の部位、治療される被験体によって変化することが理解される。任意の宿主のための用量は、従来の考え、例えば、対象の化合物と既知の薬物の活性の差を普通に比較することや、適切な従来の薬理プロトコールによって決定できる。医薬化合物の用量を決定する技術分野で熟練した医師や調剤者は、標準の勧告(Physicians Desk Reference,Barnhart Publishing ‐1999)に従って用量を決定することについて全く問題がない。
【0060】
本明細書に記載された医薬組成物は、生物学的なシステムや存在が許容できるいずれの賦形剤でも製剤化できる。そのような賦形剤の例には、水、生理食塩水、リンガー液、デキストロース溶液、ハンクス溶液、及び他の水性の生理的にバランスのとれた塩溶液が含まれるが、これには限定されない。また、不揮発性油、オリーブ油や胡麻油などの植物油、トリグリセリド、プロピレン・グリコール、ポリエチレングリコール、及びオレイン酸エチルなどの注射可能な有機エステル等の非水性の媒体も使用できる。他に有用な製剤には、ナトリウムカルボキシメチルセルロース、ソルビトール、又はデキストランなどの粘着性を高める物質を含む懸濁液が含まれる。また、賦形剤は等張性と化学的安定性を高める物質などの少量の添加物を含むことができる。緩衝液の例には、リン酸緩衝液、重炭酸塩緩衝液、及びトリス緩衝液が含まれ、防腐剤の例には、チメロサール、クレゾール、ホルマリン、及びベンジル・アルコールが含まれる。
【0061】
医薬キャリアは当業者に公知である。これらは概してヒトへ投与するための標準的なキャリアであり、滅菌水、生理食塩水及び生理的pHの緩衝液などの溶液が含まれる。
【0062】
薬物輸送のための分子は医薬組成物内に製剤化できる。医薬組成物は選択された分子に加えて、キャリア、増粘剤、希釈剤、緩衝液、防腐剤、界面活性剤などを含むことができる。
【0063】
医薬組成物は、局所投与又は全身投与のどちらが望まれるかということや投与領域によって、多くの方法で投与することができる。投与は局所的(眼科的、膣内、直腸内、鼻腔内、気化を含む)であってもよい。局所投与のための製剤には、軟膏、ローション、クリーム、ジェル、液滴、座薬、スプレー、液体、及び粉末を含むことができる。従来の医薬キャリア、水溶液、粉末又は油性基剤、増粘剤などが必要とされたり望まれたりするであろう。
【0064】
投与のための調製物には、滅菌された水溶液又は非水溶液、懸濁液及び乳剤が含まれる。水溶性のキャリアの例には、水、アルコール/水溶液、生理食塩水及び緩衝液媒体を含む乳剤又は懸濁液が含まれる。開示された組成物と方法の付随的な使用が必要である場合、非経口用の媒体には、塩化ナトリウム溶液、リンガーデキストロース、デキストロースと塩化ナトリウム、乳酸加リンガー液、又は不揮発性油が含まれる。開示された組成物と方法の付随的な使用が必要である場合、静脈投与用の媒体には、液体及び栄養補充薬、電解質補充薬(リンガーデキストロースに基づくものなど)等が含まれる。また、防腐剤及び他の添加物として、例えば、抗菌剤、酸化防止剤、キレート剤及び不活性ガス等を示すことができる。
【0065】
また、医薬組成物には他の薬剤や生物活性を有する薬物を含むことができる。生物活性を有する薬物は、生物システムにおいて局所的に又は全身的に生物学的、生理学的又は治療的な効果を提供できる。その薬物はその他の機能として、例えば、感染又は炎症をコントロールしたり、細胞増殖や組織再生を促進したり、腫瘍の成長をコントロールしたり、鎮痛剤として作用したり、そして骨成長を促進したりすることができる。したがって、本明細書に記載された組成物を他の治療効果と組み合わせることによって、ウイルス感染を減少又は妨げる併用療法を想定することができる。
【0066】
III.使用方法
ウイルス感染の予防又は治療に関連するさまざまな適用において本明細書に記載した化合物と医薬組成物が使用できる。感染細胞からのウイルスを防ぐための方法には、上で定義された式X‐L‐Y(I)を含む化合物とウイルス又は既に感染した細胞との接触が含まれる。
【0067】
ウイルスは、外皮が宿主細胞に由来する脂質二重膜(エンベロープ)で覆われているかどうかによってエンベロープ型と非エンベロープ型にクラス分けされる。ウイルスエンベロープは細胞膜に由来しているが、これら2つの脂質二重膜には本質的な違いがある。機能的には、細胞膜は細胞内及び細胞外の環境を分けるために必要な選択性のある物理的なバリアであり、特定の分子の選択的な透過を許す。それに対して、ウイルスエンベロープの主な機能は、細胞膜と融合し、ウイルスタンパクの多くを宿主の免疫システムから隠すことである。ウイルスエンベロープは限られた環境下では物理的な防御を与えるが、エンベロープウイルスは非エンベロープウイルスに比べて物理的又は化学的な損傷に対してたいてい抵抗性が低い。構造的に、ウイルスエンベロープと細胞膜中の脂質組成及びタンパク組成は、曲率や可変性のようにいずれも異なっている。
【0068】
本明細書に記載された化合物は両親媒性と呼ぶことができ、分子の一部が親水性(X‐L)であり、別の部分が疎水性(Y)である。いかなる理論にも拘束されることを望むものではないが、本明細書に記載された化合物は細胞膜とエンベロープウイルスの融合を妨げ、最終的にウイルスの細胞内への侵入を防ぐと考えられる。本明細書に記載された化合物の疎水性部分(すなわち、Y)は脂質エンベロープの疎水性中心にそれ自身を挿入できる。親水性部分(すなわち、X)はエンベロープの表面上の極頭部(polar heads)と相互作用する。したがって、化合物はリン脂質の模倣物である。しかしながら、本明細書に記載された抗ウイルス化合物は、ウイルスエンベロープの外葉で自然に発生する脂質の形体よりもさらに著しい逆円錐形を有している。エンベロープの外葉の逆円錐形脂質は、膜間の融合に必要な曲率変化を抑制する。したがって、両親媒性化合物はウイルスエンベロープと細胞の原形質膜間の融合を抑制できる。化合物の式I(Y)の疎水性部分、親水性部分、及び一般的な分子形状は、細胞膜を越えてウイルスエンベロープと優先的に相互作用するために容易に最適化できる。また、本明細書に記載された化合物は、複製DNAへの取り込みを妨げるようにデザインできる。そのような修飾の例は、化合物ddUYllとaUYllで見られる(実施例参照)。ddUYllの場合には、糖部分のヒドロキシルがddUY11を作るためにdUY11から取り外された。aUYllでは、dUYllのデオキシリボース糖をアラビノ糖と交換した。
【0069】
ターゲットとされるウイルスは特定されない。ターゲットとされるウイルスには、例えば、ポックスウイルス、単純ヘルペスウイルス1型、2型(HSV‐1,HSV‐2)、インフルエンザウイルス、HIV、ヒトT細胞白血病ウイルス(HTLV)、エプスタイン‐バールウイルス(EBV)、ヒトサイトメガロウイルス(HCMV)、カポシ肉腫関連ヘルペスウイルス(KSHV)、水疱瘡ウイルス(VZV)、B型肝炎ウイルス、C型肝炎ウイルス、エボラウイルス、マールブルグウイルス、パラインフルエンザウイルス、ヒト呼吸器多核体ウイルス、ヘンドラウイルス、ニパウイルス、流行性耳下腺炎ウイルス、麻疹ウイルス、ハンタウイルス、ブニヤウイルス、リフトバレー出血熱ウイルス、シンノンブレウイルスを含むアレナウイルス、狂犬病ウイルス、東部、西部及びベネズエラ脳炎ウイルス、西ナイルウイルス、黄熱病ウイルス、デングウイルス、日本及びセントルイス脳炎ウイルス、コロナウイルス(例えば、SARSウイルス)、風疹ウイルスがなどのエンベロープウイルスを含むことができる。
【0070】
本明細書に記載された化合物は、ウイルス感染を防ぐか又は減少させるために使用できる。1つの実施形態では、本明細書に記載されているのは、被験体のウイルス感染を防ぐか又は感染の確率を減少するための方法である。その方法にはそのような治療を必要としている被験体に対して効果的な量の式Iを含む化合物を投与することが含まれる。上で説明した技術のいずれかを使用することで化合物を投与できる。1つの実施形態では、化合物は感染部位に適用される。「感染部位」という用語は、ウイルスに感染した被験体のウイルスと接触した体の1部分又はそれ以上の部分である。そのような感染部位の例には粘膜内層が含まれる(例えば、膣、直腸、鼻道)。したがって、1つの実施形態では、本明細書に記載された化合物は性行為感染症の抑制において予防的に用いることができる。この実施形態では、化合物は直接的又は間接的に膣や直腸に適用する局所製剤(例えば、ゲル、ローション、又はクリーム)として製剤化される。もう一つの実施形態では、本明細書に記載された化合物は呼吸器疾患の抑制において予防的に用いることができる。この実施形態では、化合物は呼吸器に適用できるスプレーとして製剤化できる。
【0071】
本明細書に記載された化合物はウイルス感染した被験体を治療するための治療法として使用できる。1つの実施形態では、その方法には、そのような治療を必要とする被験体に対する式X‐L‐Y(I)を含む有効量の化合物の投与が含まれる。本明細書に記載された化合物は、ウイルス感染の特性を減少させ、最終的に、ウイルスによって発症した疾病の症状と共にウイルスの拡大を減少させることができる。治療として使用されるときには、この化合物は経口、非経口、又は局所を含む多くの方法で投与できる。
【0072】
本明細書に記載された化合物は、環境において被験体が感染することから、ウイルス感染を防止し、感染確率を減少させるために使用できる。その方法には、式Iを含む1つ以上の化合物を用いた環境の汚染除去が含まれる。その環境には、ウイルスに接触したあらゆる装置や基材(例えば、医療用器具)が含まれる。例えば、本明細書に記載された化合物は、ウイルスと接触するところで1個以上のウイルスに曝露している基材にスプレーすることができる。別の例として、化合物は、基材に存在するすべてのウイルスを不活性化するために、基材が浸されている溶液又は基材の中(例えば、チューブ類や他の限られた空間)にある溶液の中に存在することができる。
【0073】
別の実施形態では、本明細書に記載された化合物はワクチンを生産するためのウイルスの不活性化に使用できる。その方法には、上で定義されるような式Iを含む1つ以上の化合物とウイルスの接触が含まれる。そして、当技術分野で公知の技術を用いて、ワクチンとして不活性化されたウイルスを投与できる。
【実施例】
【0074】
以下の実施例は、本明細書で説明され、クレームされた化合物、組成物及び方法がどのようにして作られ、評価されたかを、当業者に完全に開示及び説明するために提供される。これらは、純粋な例であることを意図するものであり、発明者が認識する本発明の範囲を限定することを意図するものではない。数値(例えば、量や温度など)に関して精度を確実にする試みがされているが、いくつかの誤りや逸脱は考慮されるべきである。特に断りのない限り、「部」は「重量部」、温度は「℃」又は周囲温度、圧力は大気圧又は大気圧近辺である。多くの反応条件の種類や組み合わせ、例えば、組成の濃度、必要とされる溶媒、溶媒混合物、温度、圧力、他の反応範囲があり、また記載された過程で得られた製品の純度と収量を最適化するために用いることのできる条件がある。そのような過程の条件を最適化するためには、繰り返される適切な実験のみが必要である。
【0075】
I.式Iを有する化合物の調製
a.手順1
【0076】
【化10】

【0077】
3‐(トリメリルシリルエチニル)エストロン(1)
DMF(10mL)に溶解した3‐O‐トリフルオロメチルスルフォニルエストロン(972mg,2.41mmol)を真空とアルゴン間を交互することによって3回脱気した。トリメチルシリルアセチレン(0.68mL,4.82mmol)、テトラキス(トリフェニルホスフィン)パラジウム(279mg,0.24mmol)、ヨウ化銅(I)(93mg,0.48mmol)及びトリエチルアミン(0.67mL,4.82mmol)を加え、混合物を48時間撹拌した。次いで混合物を水(100mL)とEtOAc(200mL)に注ぎ、有機層を水(4×100mL)、0.1M Na2EDTA溶液(2×100ml)、水(2×100mL)、塩水(100mL)で洗浄し、硫酸ナトリウムで乾燥させ、濃縮した。残留物をカラムクロマトグラフィー(シリカゲル、PhMe中1%から4%EtOAc)にかけ、無色固体の表記の生産物を得た。収量は、790mg(94%)、1H NMR(CDCl3):0.26(s,9H),0.94(s,3H),1.40‐1.71(m,6H),1.96‐2.58(m,7H),2.86‐2.95(m,2H),7.21‐7.30(m,3H)であった。
【0078】
3‐エチニルエストロン(2)
テトラブチルアンモニウムフルオリド三水和物(1.23g,3.9mmol)をアルゴン存在下で撹拌した3‐(トリメリルシリルエチニル)エストロン(697mg,1.95mmol)溶液に加えた。混合物を、室温で4時間撹拌し、濃縮した。残留物をカラムクロマトグラフィー(シリカゲル、PhMe中5%から7%EtOAc)にかけ、オフホワイト固体の表記の生産物を得た。収量は530mg(98%)、1H NMR(CDCl3):0.94(s,3H),1.41‐1.72(m,6H),1.95‐2.59(m,7H),2.88‐2.96(m,2H),3.04(s,1H),7.24‐7.33(m,3H)であった。
【0079】
3’,5’‐O‐テトライソプロピルジシロキサン‐1,3‐ジイル‐5‐(エストロン‐3‐イルエチニル)‐2’‐デオキシウリジン(3)
DMF(10mL)に溶解した3‐エチニルエストロン(61mg,0.215mmol)及び3’,5’‐O‐テトライソプロピルジシロキサン‐1,3‐ジイル‐5‐ヨード‐2’‐デオキシウリジン(117mg,0.196mmol)を真空とアルゴン間を交互することによって3回脱気した。テトラキス(トリフェニルホスフィン)パラジウム(23mg,0.02mmol)、ヨウ化銅(I)(4mg,0.04mmol)及びトリエチルアミン(0.10mL,0.39mmol)を加え、混合物を48時間撹拌した。次いで、混合物を水(100mL)とEtOAc(200mL)に注ぎ、有機層を水(4×100mL)、0.1M Na2EDTA溶液(2×100mL)、水(2×100mL)、塩水(100mL)で洗浄し、硫酸ナトリウムで乾燥させ、濃縮した。残留物をカラムクロマトグラフィー(シリカゲル、PhMe中10%EtOAc)にかけ、黄色固体の表記の生産物を得た。収量は79mg(54%)、1H NMR(CDCl3):0.85(s,3H),0.92‐1.18(m,28H),1.33‐1.62(m,6H),1.73‐1.81(m,1H),1.93‐2.52(m,8H),2.84‐2.97(m,2H),3.55‐3.84(m,1H),4.23‐4.29(s,2H),6.14(t,1H,J=6.6Hz),7.20(s,1H),7.32(d,1H,J=8.25),7.42(d,1H,J=8.25),8.33(s,1H)であった。
【0080】
5‐(エストロン‐3‐イルエチニル)‐2’‐デオキシウリジン(4)
3’,5’‐O‐テトライソプロピルジシロキサン‐1,3‐ジイル‐5‐(エストロン‐3‐イルエチニル)‐2’‐デオキシウリジン(70mg,0.093mmol)をTHF(1mL)に溶解し、トリエチルアミントリヒドロフルオリド(46μL,0.28mmol)で処理した。混合物を室温で24時間保持し、形成された沈殿を遠心によって分離した。固体をTHF‐MeOHから再結晶し、無色の表記化合物を得た。収量は44mg(94%)、1H NMR (CDCl3):0.85(s,3H),1.35‐1.64(m,6H),1.75‐1.84(m,1H),1.93‐2.49(m,8H),2.81‐2.97(m,2H),3.56‐3.85(m,3H),4.23‐4.29(s,2H),6.14(t,1H,J=6.6Hz),7.20(s,1H),7.32(d,1H,J=8.25),7.42(d,1H,J=8.25),8.34(s,1H)であった。
【0081】
b.手順2
【0082】
【化11】

【0083】
3’,5’‐O‐テトライソプロピルジシロキサン‐1,3‐ジイル‐5‐(エストロン‐3‐イルエチニル)‐アラビノ‐ウリジン(5)
DMF(7mL)に溶解した3‐エチニルエストロン(100mg,0.36mmol)及び3’,5’‐O‐テトライソプロピルジシロキサン‐1,3‐ジイル‐5‐ヨード‐アラビノ‐ウリジン(197mg,0.32mmol)を真空とアルゴン間を交互することによって3回脱気した。テトラキス(トリフェニルホスフィン)パラジウム(38mg,0.032mmol)、ヨウ化銅(I)(7mg,0.064mmol)及びトリエチルアミン(0.17mL,0.64mmol)を加え、混合物を48時間撹拌した。次いで、混合物を水(100mL)とEtOAc(200mL)に注ぎ、有機層を水(4×100ml)、0.1M Na2EDTA溶液(2×100mL)、水(2×100mL)、塩水(100mL)で洗浄し、硫酸ナトリウムで乾燥させ、濃縮した。残留物をカラムクロマトグラフィー(シリカゲル、PhMe中20%Me2CO)にかけ、黄色固体の表記の生産物を得た。収量は70mg(29%)であり、1H NMR(CDCl3):0.85(s,3H),0.92‐1.17(m,28H),1.35‐1.64(m,6H),1.74‐1.82(m,1H),1.92‐2.49(m,6H),2.81‐2.89(m,2H),3.66‐3.89(m,1H),3.88‐4.16(m,5H),6.08(d,1H,J=6.41Hz),7.17(s,1H),7.20(d,1H,J=8.25),7.33(d,1H,J=8.25),7.66(s,1H),11.7(br.s)であった。
【0084】
5‐(エストロン‐3‐イルエチニル)‐アラビノ‐デオキシウリジン(6)
3’,5’‐O‐テトライソプロピルジシロキサン‐1,3‐ジイル‐5‐(エストロン‐3‐イルエチニル)‐アラビノ‐ウリジン(70mg,0.091mmol)をTHF(1mL)に溶解し、トリエチルアミントリヒドロフルオリド(44μL,0.27mmol)で処理した。混合物を室温で24時間保持し、形成された沈殿を遠心によって分離した。無色固体。収量は41mg(87%)、1H NMR(CDCl3):0.85(s,3H),1.31‐1.62(m,6H),1.74‐1.83(m,1H),1.90‐2.51(m,6H),2.80‐2.90(m,2H),3.66‐3.89(m,2H),3.91‐4.13(m,6H),6.08(d,1H,J=6.41Hz),7.17(s,1H),7.20(d,1H,J=8.25),7.33(d,1H,J=8.25),7.62(s,1H),11.5(br.s)であった。
【0085】
c.手順3
【0086】
【化12】

【0087】
3’,5’‐O‐テトライソプロピルジシロキサン‐1,3‐ジイル‐5‐(ピレン‐2‐イルエチニル)‐2’‐デオキシウリジン(8)
DMF(10mL)に溶解した2‐エチニルピレン(345mg,1.53mmol)及び3’,5’‐O‐テトライソプロピルジシロキサン‐1,3‐ジイル‐5‐ヨード‐2’‐デオキシウリジン(758mg,1.27mmol)を真空とアルゴン間を交互することによって3回脱気した。テトラキス(トリフェニルホスフィン)パラジウム(147mg,0.127mmol)、ヨウ化銅(I)(48mg,0.25mmol)及びトリエチルアミン(0.35mL,2.54mmol)を加え、混合物を24時間撹拌した。次いで、混合物を水(100mL)とEtOAc(200mL)に注ぎ、有機層を水(4×100mL)、0.1M Na2EDTA溶液(2×100mL)、水(2×100mL)、塩水(100mL)で洗浄し、硫酸ナトリウムで乾燥させ、濃縮した。残留物をカラムクロマトグラフィー(シリカゲル、CHCl3中0%から5%EtOAc)にかけ、黄色固体の表記の生産物を得た。収量は402mg(49%)、1H NMR(CDCl3):0.90‐1.17(m,28H),2.19‐2.34(m,2H),3.64‐3.78(m,2H),3.84‐3.92(m,1H),4.30‐4.37(m,1H),6.22(t,1H,J=6.42Hz),8.09‐8.49(m,9H),8.62(s,1H),11.8(br.s)であった。
【0088】
5‐(ピレン‐2‐イルエチニル)‐2’‐デオキシウリジン(9)
THF(1mL)に3’,5’‐O‐テトライソプロピルジシロキサン‐1,3‐ジイル‐5‐(ピレン‐2‐イルエチニル)‐2’‐デオキシウリジン(200mg,0.29mmol)を溶解し、トリエチルアミントリヒドロフルオリド(0.14mL,0.86mmol)で処理した。混合物を室温で24時間保持し、沈殿をフィルターで分離した。固体をEtOHから再結晶し、無色の化合物を産生した。収量は、74mg(56%)、1H NMR(CDCl3):2.19‐2.34(m,2H),3.64‐3.76(m,2H),3.84‐3.91(m,1H),4.29‐4.34(m,1H),5.23‐5.32(m,2H),6.22(t,1H,J=6.42Hz),8.09‐8.48(m,9H),8.62(s,1H),11.9(br.s)であった。
【0089】
【化13】

【0090】
5‐(ペリレン‐3‐イルエチニル)‐5’‐O‐ピバロイル‐2’,3’‐ジデオキシウリジン
DMF(10mL)に溶解した5‐ヨード‐5’‐O‐ピバロイル‐2’,3’‐ジデオキシウリジン(442mg,1mmol)及び3‐ペリレニルアセチレン(345mg,1.25mmol)を真空とアルゴン間を交互することによって3回脱気した。次に、Pd(PPh3)4(115mg,0.1mmol)、CuI(38mg,0.2mmol)及びEt3N(0.278mL,2mmol)を加え、フラスコにアルゴンを満たし再度脱気し、混合物を周囲温度で43時間撹拌した。混合物を300mLのEtOAcで希釈し、200mLの水で3回洗浄し、硫酸ナトリウムで乾燥させ、濃縮した。0から2%のEtOH/CHCl3勾配を用いたシリカゲルカラムでクロマトグラフィーを行い、クロマトグラフィー上で均一な(Rf0.28,5%EtOH/CHCl3)オレンジ色の泡沫生産物を得た(545mg,96%)。1H‐NMR(DMSO‐d6):11.85(s,1H,NH),8.44(d,1Η,J7.8),8.39‐8.35(m,3Η),8.32(d,IH,J8.2)(ペリレニル),8.06(s,1H,H‐6),7.83‐7.81(m,2H),7.69‐7.60(m,2H),7.58‐7.53(m,2H)(ペリレニル),6.00(dd,1H,J1’2’α6.9J1’2’β4.6,H‐1’),4.37‐4.34(m,1H,H‐4’),4.32‐4.26(m,2H,H‐5’),2.42‐2.36(m,1H,H‐2’),2.17‐2.12(m,1H,H‐2’),2.06‐2.00(m,1H,H‐3’),1.90‐1.83(m,1H,H‐3’),1.17(s,9H,1Bu)であった。
【0091】
【化14】

【0092】
5‐(ペリレン‐3‐イルエチニル)‐2’,3’‐ジデオキシウリジン(ddUYll)
80mLのMeOHに懸濁した5‐(ペリレン‐3‐イルエチニル)‐5’‐O‐ピバロイル‐2’,3’‐ジデオキシウリジン(350mg,0.613mmol)に固体のKOH(310mg,5.517mmol)を加え、混合物を一晩撹拌した。次に、混合物を酢酸で中和し、MeOHを用いて減圧下で2回濃縮し、粗生産物を得た。粗生産物は0から3%のEtOH/CHCl3勾配を用いたシリカゲルカラムでクロマトグラフィーにより精製され、クロマトグラフィー上で均一な(Rf0.46,37.5%アセトン/CHCl3)オレンジ色の固体生産物を得た(130mg,43%)。1H‐NMR(DMSO‐d6):11.74(s,1H,NH),8.76(s,1Η,Η‐6),8.45(d,1H,J7.7),8.41‐8.38(m,2H),8.36(d,1H,J7.7),8.30(d,1H,J7.7),7.71‐7.54(m,6H)(ペリレニル),5.99‐5.98(m,1H,H‐1’),5.35(br.s,1H,OH),4.15‐4.10(m,1Η,Η‐4’),3.70(app.d,1H,H‐5’),3.63(app.d,1H,H‐5’),2.38‐2.31(m,1H,H‐2’),2.17‐2.13(m,1H,H‐2’),2.01‐1.94(m,1H,H‐3’),1.91‐1.86(m,1H,H‐3’)であった。
【0093】
【化15】

【0094】
5‐(ペリレン‐3‐イルエチニル)‐3’,5’‐O‐(テトライソプロピルジシロキサン‐1,3‐ジイル)‐アラビノ‐ウリジン
10mLのDMFに溶解した5‐ヨード‐3’,5’‐O‐(テトライソプロピルジシロキサン‐l,3‐ジイル)‐アラビノ‐ウリジン(612mg,1mmol)及び3‐ペリレニルアセチレン(373mg,1.35mmol)を真空とアルゴン間を交互することによって3回脱気した。次に、Pd(PPh3)4(115mg,0.1mmol)、CuI(38mg,0.2mmol)及びEt3N(0.278mL,2mmol)を加え、フラスコにアルゴンを満たし再度脱気し、混合物を周囲温度で43時間撹拌した。混合物を300mLのCHCl3で希釈し、200mLの水で3回洗浄し、有機層を硫酸ナトリウムで乾燥させ、減圧下で濃縮し、再度CHCl3を用いて2回濃縮した。0から3%のEtOH/CHCl3勾配を用いたシリカゲルカラムでのクロマトグラフィーによる精製によって、クロマトグラフィー上で均一な(Rf0.6,10%EtOH/CHCl3)オレンジ色の泡沫生産物を得た(245mg,32%)。1H‐NMR(DMSO‐d6):11.89(s,1H,NH),8.46(d,1Η,J7.3),8.43‐8.34(m,3Η),8.26(d,1H,J8.2),7.84(t,2H,J7.3)(ペリレニル),7.81(s,1H,H‐6),7.69‐7.64(m,2H),7.57(t,2H,J7.8)(ペリレニル),6.12(d,1H,J6.4,H‐1’),6.12(d,1H,J6.0,H‐2’),4.39(app.q,1H,H‐4’),4.14(app.t,1H,H‐3’),4.08(app.d,1H,H‐5’),3.93(app.d,1H,H‐5’),3.75(br.d,1H,OH),1.07‐0.95(m,28Η,iPr)であった。
【0095】
【化16】

【0096】
5‐(ペリレン‐3‐イルエチニル)‐アラビノ‐ウリジン(aUYll)
0.8mLのTHFに溶解した5‐(ペリレン‐3‐イルエチニル)‐3’,5’‐O‐(テトライソプロピルジシロキサン‐1,3‐ジイル)‐アラビノ‐ウリジン(220mg,0.289mmol)に純粋なEt3N・HF(0.118mL,0.723mmol)を加え、混合物を周囲温度で12時間撹拌した。次いで、生産物を沈殿させるために少量のメタノールを加え、フィルターで分離し、乾燥した。オレンジ色の固体(100mg,67%)で、Rf0.30(10%EtOH/CHCl3)であった。1H‐NMR(DMSO‐d6):12.00‐11.00(br.s,1H,NH),8.46(d,1Η,J7.7),8.43‐8.38(m,2Η),8.36(d,1H,J7.7),8.30(d,1H,J8.33)(ペリレニル),8.26(s,1H,H‐6),7.84(t,2H,J7.0),7.73(d,1H,J7.7),7.69(t,1H,J7.7),7.57(t,2H,J7.7)(ペリレニル),6.07(d,1H,J3.9,H‐1’),5.77‐5.68(br.s,1H),5.60‐5.48(br.s,1H),5.32‐5.20(br.s,1H)(OH),4.12‐4.09(app.s,1Η),4.03‐3.98(ap.s,1Η)(Η‐2’,H‐4’),3.82(app.d,1H,H‐5’),3.74‐3.67(m,2H,H‐3’,5’)であった。
【0097】
II.両親媒性のヌクレオシド誘導体はHSV‐1 DNAの複製又は感染細胞によるウイルスの放出を抑制しない。
ヌクレオシド又はヌクレオチド誘導体は、通常、ウイルスDNAポリメラーゼをターゲットとすることによってHSV‐1 DNAの複製を阻害する。両親媒性のヌクレオシド誘導体がウイルスDNAの複製又はウイルス遺伝子の発現のどちらを抑制したかを確認するために、両親媒性のヌクレオシド誘導体がHSV‐1 DNAの蓄積を抑制する能力を調べた。1細胞当たり5プラークユニット(PFU)の野生型のHSV‐1を、Vero細胞に1時間感染またはモック感染(M)させ、洗浄し、薬物を含まない(ND)培養液、400μMのホスホノ酢酸(PAA)、又は代表的な両親媒性のヌクレオシド誘導体であるdUYll(11)2μMを含む培養液を加えた(図4)。感染後1時間、5時間、18時間又は24時間(hpi)で細胞を回収し、DNAを単離して、アガロース電気泳動によって分離し、ニトロセルロース膜に転写し、HSV‐1の6kbのBamK断片を用いてハイブリダイゼーションを行った。サザンブロット分析(図1)は、感染後1時間、5時間、18時間と24時間の細胞内ウイルスDNAレベルを示している。dUYllはいずれの試験でもウイルスDNAの複製を阻害しなかった。
【0098】
次に、両親媒性のヌクレオシド誘導体が感染細胞によるHSV‐1ウイルスの放出を抑制する能力を検討した。1細胞当たり5PFUの野生型のHSV‐1を、Vero細胞に1時間感染またはモック感染(M)させ、洗浄し、薬物を含まない(ND)培養液、400μMのホスホノ酢酸、又は代表的な両親媒性のヌクレオシド誘導体であるdUYll(11)2μMを含む培養液を加えた。感染細胞の上清を感染後1時間、5時間、18時間又は24時間で回収し、DNAを単離して、アガロース電気泳動によって分離し、ニトロセルロース膜に転写し、HSV‐1の6kbのBamK断片を用いてハイブリダイゼーションを行った。サザンブロット分析(図2)は、感染後1時間、5時間、18時間と24時間の細胞外ウイルスDNAレベルを示している。dUYllはウイルスDNAの放出を阻害しなかった。これらの結果に基づくと、これらの両親媒性のヌクレオシド誘導体存在下においてウイルスDNAは複製され、感染した細胞から子孫ウイルスが放出される。
【0099】
III.両親媒性のヌクレオシド誘導体は成熟ウイルスの感染力を抑制する。
感染力とプラークアッセイ(図3)によりウイルス感染におけるdUY11の阻害特性が明らかとなった。HSV‐1接種液を2μMのdUY11(各パネルの左半分)又はDMSO媒体(各パネルの右半分)と共に0分間又は5分間、37℃で培養した。図(上のパネル)で示すように、処理したHSV‐1を0.5、5、50、500、5,000又は50,000PFUでVero細胞に感染させ、洗浄し、5%のウシ胎児血清(FBS)と2%のメチルセルロース(MC)を添加したダルベッコ変法イーグル培地(DMEM)を加えた。一番右のパネルに示されたサンプルは、dUY11非存在下で、未処理のウイルスを感染させ、2μMのdUY11を添加した1%MCを含むDMEM‐5%FBSを加えた(ポスト吸着)。dUYl1はウイルス感染力を阻害するが、ウイルス複製には影響がない。
【0100】
IV.抗ウイルス性の両親媒性ヌクレオシド誘導体の構造活性相関(SAR)試験
構造活性相関(SAR)試験には、抗ウイルス薬の発見において良好なモデルである単純ヘルペスウイルス1型(HSV‐1)の感染力における両親媒性、剛性及び分子形状の影響を調べることを適用した。図4は試験化合物の化学構造と三次元構造の直交図を示している。図5は異なる両親媒性ヌクレオシド誘導体の濃度に対してプロットしたHSV‐1の感染力の線グラフを示す。HSV‐1 KOS(200PFU)を0、2、7、20、70又は200μMのdUY2(黒丸)、dUY3(白い正方形)、dUY11(黒三角形)(A);dUY4(黒三角形)、dUY5(黒丸)、dUY6(白い正方形)、dUY8(白丸)(B);又は、dUY7(白丸)、dUY9(黒い正方形)、dUYl(白三角形)、aUYl(黒丸)(C)と共に、370Cで5分間インキュベートした。次に、事前に処理したウイルスをVero細胞に1時間感染させ、5%FBSと2%MCを添加した培養液で洗浄し、浸した。横軸の最大値は、(A)では70μM、(B)と(C)では200μMである。dUYll(C)で前処理されたウイルスの感染力の割合は、このスケールの軸に近すぎてほとんど見えない。エラーバーは3つ以上の実験の範囲を示している。剛性平面の疎水性部分を持つ逆円錐形の化合物間において、疎水性部分のサイズの減少は活性を低下させた(dUYll対dUY2,dUY3;図5A)。同じ大きさの疎水性誘導体をもつ化合物の活性は、逆円錐形状を弱める疎水性部分内の回転の柔軟性又は非平面性によって低下した(dUYl1対dUY4、dUY5、dUY6、dUY8;図5A,5B)。活性は、膜に逆円錐が適切に位置することを妨げるリンカー又は中心の疎水性部分内の2つの極性基によって壊された(dUY7,dUY9;図5C)。また、活性は1つの極性基によって阻害されたが、親水性部分の極性を上げることによって回復した(aUYl対dUYl;図5C)。疎水性部分の平面性と剛性と同様に両親媒性と逆円錐形は抗ウイルス活性のために重要である。
【0101】
V.HSV感染力におけるdUYll活性の特徴
図6は、dUYll濃度に対してHSV‐1感染力をプロットした線グラフである。HSV‐1 KOS(200PFU)を0,2,7,20,70,200又は700nMのdUY11とともに37℃で5分間インキュベートした。次に、そのようにして前処理したウイルスをVero細胞に1時間感染させ、5%FBS及び2%MCを添加した培養液で洗浄し、浸した。HSV‐1感染を50%阻害するdUY11濃度(IC50)は、グラフから20nMと算出された。エラーバーは10個の実験の範囲を示している。dUYllは、培養液中、ナノモル濃度範囲の低濃度で活性を示し、IC50は20nMであった。
【0102】
図7は、処理時間に対してHSV‐1感染力をプロットした線グラフである。HSV‐1 KOS(200PFU)を20nMのdUY11(IC50)とともに37℃で0,30,60,90,120,180,240又は300秒間インキュベートした。次に、そのようにして前処理したウイルスをVero細胞に1時間感染させ、5%FBS及び2%MCを添加した培養液で洗浄し、浸した。IC50値濃度のdUYllは220秒間で50%の感染を阻害した(図7)。エラーバーは2個の実験の範囲を示しているが、このスケールではほとんどのデータポイントで見えない。
【0103】
図8は、dUYl1濃度に対してHSV‐1感染力をプロットした線グラフである。HSV‐1 KOS(200PFU)を0,2,7,20,70,200又は700nMのdUY11とともに37℃で5分間インキュベートした。次に、そのようにして前処理したHSV‐1ウイルスをヒト包皮線維芽細胞(HFF)(黒丸)又はVero細胞(黒い正方形)に1時間感染させ、5%FBS及び2%MCを添加した培養液で洗浄し、浸した。IC50値はグラフからVero細胞では25nM、HFF細胞では20nMと算出された(A)。ウイルスが700nMのdUY11で前処理されたときには両細胞への感染は完全に阻害された(B)。エラーバーは3つ以上の実験の範囲を表す。予想されたように、dUYllによって処理されたウイルスはVero細胞とヒト包皮線維芽細胞で等しく非感染性であった。
【0104】
dUY11は生殖器感染からマウスを強く防御する非細胞障害性の化合物である(次のセクション参照)が、他にも2つのヌクレオシドベースの化合物が合成され、評価されている。修飾された化合物はddUYl1及びaUYl1と名づけられた(セクションI参照)。その化合物は培養細胞の感染でテストされた。aUYll及びddUYllともにdUYllとほぼ同じ活性を示し(表1)、いずれも細胞障害性はなかった。
【0105】
【表1】

【0106】
VI.dUYllは7,500以上の安全性指標を有し、主要な細胞増殖抑制作用もない。
2つのシリーズの実験は、dUYl1には細胞傷害又は細胞増殖抑制の作用がないことを明らかにした。最初の実験では、72時間の処理のうちdUYllを添加した新しい培養液に30分間だけ置き換えた。しかしながら、dUYllが細胞膜に局在していることが後で発見された(図9)。その結果、細胞膜あたりのdUYll分子の数は各細胞複製周期の後に半分減少すると考えられる。したがって、細胞毒性の分析を再度行い、24時間(これらの細胞のおよその倍加時間)ごとにdUYllを含む新しい培養液を加え、合計72時間曝露した。
【0107】
図10は、dUYllを曝露した時間に対して相対的な細胞数をプロットした線グラフである。Vero細胞を1時間モック感染させ、洗浄し、0(黒い正方形),7(黒三角),20(黒丸),70(白い正方形)又は150(白三角形)μMのdUY11を含む培養液で浸した。150μMは培養液中で長期間安定ではない。培養液は24時間ごとに0,7,20,70又は150μMのdUY11を添加した新しい培養液に置き換えた(上向きの矢印で示す)。24、48及び72時間に、生存及び非生存細胞をトリパンブルー色素排除試験で測定した。すべての時間のサンプルで非生存細胞の合計数は4%未満であった。エラーバーはOLE_LINK3OLE_LINK4(*)OLE_LINK3OLE_LINK4を除いて1つの実験の2サンプルの範囲を表す。(*)では1つの実験の1サンプルを2回数えた範囲を表す。dUYl1には細胞傷害性はなく、そのIC50値の7,500倍濃度以上でもわずかに細胞増殖抑制性が認められるだけであった。したがって、安全性指標(SI)は7,500以上であったが、dUY11を培養液中で均等に分散できた濃度(70,000nM以下)、又はより高濃度(150,000nM)でも細胞障害活性は50%に到達しなかったので、その値は算出できなかった。
【0108】
VII.両親媒性ヌクレオシド誘導体はウイルスの結合ではなく、ウイルスの侵入を阻害する。
感染前に両親媒性ヌクレオシド誘導体をHSV‐1ウイルスに前処理することによって感染は阻害された。したがって、これらのヌクレオシドは、例えば、細胞へのウイルスの結合を妨げることによってHSV‐1の感染力を阻害するかもしれない。あるいはまた、それらは細胞外ウイルスを破壊するのかもしれない(すなわち、殺ウイルス活性を持つ)。溶解したウイルスは細胞と結合しない。dUYl1で前処理されたHSV‐1ウイルスの結合性を評価した。図11は、HSV‐1の結合性(A)と感染力(B)を示す棒グラフとイメージ画像である。併行した試験では、[35]S‐メチオニンで標識(2.5×105PFUで、約4×105cpm)したHSV‐1 KOS(A)又は、非標識のHSV‐1 KOS(B)を、薬物なし(白棒)、7μMのdUYll(縞棒)又は100μg/mlヘパリン(黒棒)を用いて37℃で5分間、前処理した。次に、サンプルを氷で冷却した。サンプルを、薬物なし、7μMのdUYll又は100μg/mlヘパリンを添加した冷却無血清培地で希釈した(1:20,1:100)。そのようして前処理したウイルスをVero細胞に4℃で1時間感染させ、冷却した培養液で3回洗浄し、溶解した。結合したウイルスは液体シンチレーションによって定量化した。エラーバーは3つの実験の範囲を表す(A)。これらの結果に基づき、7μMのdUYllは感染を抑制した(図11B)が、ウイルス結合は阻害しなかった(図11A)。
【0109】
次に、dUYllの高親和性結合に影響する能力を評価した。図12は、ヘパリン濃度を増加したときの細胞へのHSV‐1結合の競合を示した線グラフである。[35]S‐メチオニン標識したHSV‐1(5×10PFUで約3.5×10cpm)を7μMのdUY11(黒い正方形)又は薬物なし(黒丸)により37℃で5分間前処理した。サンプルを氷中で冷却し、次いで、7μMのdUYllを加えた、又は加えなかった冷却無血清培地で希釈した(1:10)。Vero細胞に15分間吸着させた後、結合しなかったウイルスを洗浄した。さらに、低親和性結合のみによって結合しているウイルスを取り外すために結合したウイルスを0〜1,000μg/mlのヘパリンを添加した培養液を用いて1時間洗浄した。そして、これらの洗浄によって剥がれたウイルスを液体シンチレーションによって定量化した。エラーバーは2つの実験の範囲を表す。ヘパリンは、7μMのdUYllで前処理したHSV‐1ウイルスの結合及び未処理のウイルスの結合に有効に競合しなかった。このことは、前者のウイルスのほとんどが高親和性によって結合していることを示している(図12)。したがって、dUY11は殺ウイルス性ではなく、低親和性及び高親和性の結合のいずれも阻害しない。したがって、両親媒性ヌクレオシド誘導体は高親和性結合とウイルスDNA複製の間のステップを阻害する。
【0110】
次に、HSV‐1ウイルスの侵入におけるdUYl1の影響を調べた。HSV‐1ウイルスの侵入は、感染細胞へのVP16侵入などのいくつかの方法によって評価できる。VP16は、HSVの前初期(IE)遺伝子の転写活性に必要なHSV固有のウイルスタンパクである。したがって、VP16侵入は、HSV‐1 IEプロモーターで制御された細胞ゲノムに組み込まれた赤色蛍光タンパク(RFP)レポータ遺伝子を含む細胞を用いて評価できる。感染後のRFP発現は、VP16が核に到達したことを示す。したがって、そのことは、またHSVが細胞内に侵入したことを示している。
【0111】
図13は、HSV‐1 ICP0 IEプロモーターで制御される細胞ゲノムに組み込まれた赤色蛍光タンパク(RFP)レポータ遺伝子を含むVero細胞の赤色蛍光発現の図(A)と定量結果(B)を示している。DMSO媒体(左のパネル)又は2μMのdUY11(右のパネル)で前処理したHSV‐1 KOSウイルスを細胞に感染させた。図13Aに、24hpiにおける細胞を蛍光(上のパネル)又は可視光(下のパネル)で可視化した結果を示す。図13Bに、薬物なし、又はdUY11で前処理したUV不活性化HSV‐1 KOSウイルスを感染させた蛍光細胞の定量を示す(7つの実験のうち代表的な1つの実験で同様の細胞密度がある2つの顕微鏡視野から数えた)。
【0112】
HSV‐1 IEプロモーターの制御下でRFPを発現し、2μMのdUY11(結合を阻害しなかった濃度より3.5倍低い濃度)で前処理したHSV‐1ウイルスを感染させた細胞には蛍光は検出されなかった(図13)。したがって、dUY11は、ウイルス侵入の前で高親和性の結合後のステップを阻害する。この間で唯一知られているステップはウイルスエンベロープと細胞膜の融合である。
【0113】
VIII.両親媒性ヌクレオシド誘導体は、いくつかの他の関連のないエンベロープウイルスの感染を阻害する。
dUYllのターゲットがいくらかの保存された糖タンパクを有するウイルス間で保存されているかどうかを調べるために、HSVウイルス2型(HSV‐2)の2つの株におけるdUY11活性をテストした。ひとつ目は臨床的に単離された株であり、もう1つは実験室で適応させた株である(それぞれ、株186と株333)。dUYllのターゲットが遠縁のエンベロープウイルスのみに保存されているかどうかを調べるために、dUYll活性を水疱性口内炎ウイルス(VSV)及びシンドビス(SIN)でテストした。VSVとSINはHSV‐1又はHSV‐2で保存されていることが知られている糖タンパクがないRNAウイルスである。また、VSVとSINの糖タンパクはHSV‐1又はHSV‐2の糖タンパクとは異なった受容体を認識する。VSVのGタンパクは特異的な脂質であるホスファチジルセリンを認識し、結合する。一方、SINの糖タンパクはありふれた表面タンパクである高親和性ラミニン受容体に結合する。HSV‐1又はHSV‐2と異なり、VSVとSINは細胞膜と融合することにより取り込まれ、融合糖タンパク内での低いpHにより立体構造変換が誘導される。これらの立体構造変換により融合ペプチドが現れ、次に、融合ペプチドはターゲット膜に挿入され、ウイルスエンベロープ膜と細胞膜間の融合が誘引される。
【0114】
図14は、dUYll濃度に対するHSV‐1株KOS(黒丸)、HSV‐2株186(黒い正方形)、HSV‐2株333(白い正方形)、VSV(黒三角)又はSINウイルス(白三角)の感染力を示した線グラフである。ウイルス(200PFU)を0,0.007,0.02,0.07,0.2,0.7又は2μMのdUYllにより37℃で1時間インキュベートした。次いで、そのように前処理したウイルスをVero細胞に1時間感染させ、5%FBS及び2%MCを添加した培養液で洗浄し、浸した。IC50値はグラフより、VSVが6nM、HSV‐1が24nM、HSV‐2株186が49nM、SINが58nM、HSV‐2株333が65nMと算出された。エラーバーは2つ以上の実験の範囲を表す。dUYl1はHSV‐1と同様のIC50値で両方のHSV‐2株の感染を阻害し(図14)、このことは、dUY11のターゲットが保存された糖タンパク及びエンベロープの脂質組成を持つウイルス間で保存されていることを示している。また、dUY11は遠縁のエンベロープウイルスに対して同様のIC50値で阻害し、そのことは、dUY11のターゲットが非保存性のエンベロープタンパクを持つウイルス間でも保存されていることを示している。したがって、dUY11はその他の関連性の無いエンベロープウイルス間で保存されているウイルス融合のステップを阻害する。dUY11が高親和性の結合を阻害しないで、関連性の無いエンベロープウイルスの侵入を妨げることから、dUY11のターゲットはエンベロープの脂質二重膜と細胞間との融合であると考えられる。
【0115】
IX.両親媒性ヌクレオシド誘導体の主なターゲットは細胞膜ではなく、ウイルスエンベロープである。
ウイルスの取り込みにはウイルスエンベロープと細胞膜の2つの脂質二重膜間の融合が必要である。ウイルスをdUY11で前処理したときにウイルス感染が阻害された。したがって、このことはウイルスエンベロープがターゲットであることを示している。しかしながら、細胞膜もターゲットであるかもしれない。このシナリオにおいてdUYl1で前処理したウイルスは細胞膜内のターゲット部位に薬剤を輸送するであろう。そして、前処理した細胞は前処理したウイルスに比べてより効率的に感染を阻害するはずである。
【0116】
dUYllが、ウイルスエンベロープ又は細胞膜のどちらを優先的にターゲットとするかを確認するために実験を行った。図15は、dUY11濃度に対するHSV‐1 KOS感染力をプロットした線グラフである。HSV‐1 KOS(200PFU)を0,0.002,0.007,0.02,0.07,0.2,0.7,2,7,20又は70μMのdUY11とともに37℃で5分間インキュベートした。次に、そのようにして前処理したウイルスをVero細胞に1時間感染させ、5%のFBSと2%のMCを添加した培養液で洗浄し、浸した(黒い正方形)。あるいは、未処理のVero細胞(黒三角)、又は0,2,7,20、70μMのdUY11とともに37℃で60分に至るまで前処理したVero細胞(黒丸)に感染させるために未処理のウイルスサンプルを用いた。そして、前処理しなかった感染細胞を0,2,7,20又は70μMのdUY11と5%FBS及び2%MCを添加した培養液で浸した。グラフよりIC50値はウイルスの前処理で20nM(これらのスケールでは見えない)、細胞の前処理で5.4μM(A)と算出された。最大の阻害はウイルスの前処理で100%、細胞の前処理で75%であった(B)。x軸スケールの最大値は(A)で7μM、(B)で70μMである。エラーバーは3つ以上の実験の範囲を表す。
【0117】
感染前にウイルスを前処理したときにのみウイルス感染は完全に阻害された(IC50,20nM‐図15)。それに対して、細胞の前処理はHSV‐1の感染を減少させたが、270倍以上の高濃度で最大75%であった(IC50,5.4μM)。図3で示された結果と一致して、未処理のウイルスを感染させた後に、dUY11で細胞を処理してもHSV‐1の複製には影響はなかった。これらの結果は、両親媒性ヌクレオシド誘導体がターゲットとする主要な膜はウイルスエンベロープであることを示しており、さらに、これらの化合物がウイルスの複製を阻害しないことを証明する。
【0118】
X.両親媒性ヌクレオシド誘導体は処理された細胞から産生されるウイルスの感染を阻害する。
両親媒性化合物がウイルス膜と同様に細胞に挿入されるなら、それらは処理された細胞によって産生される子孫ウイルスの感染も阻害するかもしれない。図9はdUY11で処理され、膜の色素(PKH26)で染色されたモック感染細胞を示す。確かに、dUY11は細胞突起にはないが、原形質膜と細胞内膜に分布している。このことはdUY11が膜輸送を阻害しないことを示している。したがって、感染後に前記の化合物によって処理された感染細胞によって産生されたウイルスは未処理の細胞によって産生されるウイルスと同じようには、感染しないはずである。図16Aは、両親媒性ヌクレオシド誘導体で24時間処理した細胞によって産生されるウイルスの感染力低下を示し、薬物濃度に対してプロットした線グラフである。Vero細胞に3PFU/細胞の感染効率(MOI)でHSV‐1 KOSを感染させた。ウイルス接種源を除去した後、感染細胞を0,0.125,0.25,0.5,0.75,1,1.05,1.5,1.75又は2μMのdUYllで処理した。感染後24時間に細胞を回収し、ウイルス感染を標準のプラークアッセイによって評価した。エラーバーは3つ以上の実験の範囲を表す。dUY11存在下で産生されたウイルスは、未処理の細胞によって産生されたウイルスに比べて8桁低い感染力であった(図16A)。再度実験を行ったが、感染細胞へのdUY11の曝露をウイルス接種源の除去直後1時間だけに制限した(図16B)。細胞にHSV‐1を感染させ、感染細胞にdUYllをエンベロープ糖タンパクが発現する前である1時間だけ加えた。次に、感染細胞を薬物なしで22時間インキュベートし、子孫ウイルスの感染力を評価した。dUY11処理細胞から出芽したウイルスは、未処理の細胞から出芽したウイルスに比べて6桁低い感染力であった(図16B;IC50,3.9μM)。したがって、dUYllは膜脂質などウイルスに組み込まれている既存の細胞因子と相互作用する。
【0119】
処理された細胞によって産生されるウイルスの感染におけるdUY11の効果は、感染したウイルスが従来の抗ウイルス薬に対して感受性(すなわち、野生型)であるか、又は耐性であるかには関係がなかった。dUY11は、野生型、アシクロビル又はホスホノ酢酸耐性のHSV‐1耐性株(それぞれ、チミジンキナーゼ‐TK‐欠損株又はPAAr5株)に感染させた細胞によって産生されるウイルスの感染に対して等しく重要な抑制効果を持つ。
【0120】
図17は、異なった薬物で処理した細胞によって産生されるウイルスの感染力(又は、ウイルス力価)の低下を示し、ACV,PAA又はdUY11の濃度に対してプロットした線グラフである。3PFU/細胞のHSV‐1野生株(黒丸)、ACV耐性株(黒三角)、PAA耐性株(黒い正方形)をVero細胞に1時間感染させ、洗浄し、0,2.5,5,10,25又は50μMのACV(A)、0,25,50,100,250又は500μg/mlのPAA(B)、0,0.5,1.05,2又は10μMのdUY11(C)を含む培養液を加えた。24時間後に細胞を回収し、標準のプラークアッセイによりウイルス感染力(又は、ウイルス力価)を評価した。ウイルス感染力(又は、ウイルス力価)の低下は、異なる薬物で処理された細胞によって産生されるウイルスの感染力を、未処理の細胞によって産生されるウイルスの感染力で割ることによって算出した。エラーバーは2つの実験の範囲を表す。
【0121】
これらの実験は、さらに、両親媒性ヌクレオシド誘導体が、多くの他のヌクレオシド誘導体のようなウイルスDNAポリメラーゼのHSV‐1 TK又はピロリン酸結合部位(PAAのターゲット)をターゲットとしないことを証明している。
【0122】
XI.両親媒性ヌクレオシド誘導体のin vivo解析
本明細書に記載された両親媒性ヌクレオシド誘導体が、ウイルス伝播を阻害するかどうかを確認するために、性行為伝染ウイルス(HSV‐2)を用いた膣感染症モデルを使用した。1群5匹のマウスに70μMのdUY11又は溶媒に曝露した103又は3×l03のHSV‐2ウイルスを膣内に感染させた(図18A‐E及び図19A‐B)。図18A‐Eは、ウイルス排出、平均臨床スコア又は相対重量、溶媒(白い正方形)又はdUY11(黒い正方形)に曝露した1,000(点線)又は3,000(実線)のHSV‐2ウイルスを感染させた徴候マウス及び死亡マウスの累積数を示している。図19A‐Bは、すべての感染マウスの膣、会陰部位及び肛門の写真を示している。図19Aは、溶媒(左のパネル)又はdUY11(右のパネル)に曝露した3,000のHSV‐2ウイルスで感染させたマウスを示している。図19Bは、溶媒(左のパネル)又はdUY11(右のパネル)に曝露した1,000のHSV‐2ウイルスで感染させたマウスを示している。溶媒に曝露したウイルスを感染させたすべてのマウスが、感染後2〜4日目に104未満のウイルスを排出し、8日目まで低いレベルで推移し、明らかな感染の臨床的徴候が認められた(図18A‐D)。3×l03のウイルスを感染させた5匹すべてのマウス及び103のウイルスを感染させたマウスのうち3匹が病気の進行のため7〜9日目に安楽死させなければならなかった(図18Eと19A‐B)。dUYllに曝露した103又は3×l03のいずれかのウイルスを感染させた10匹のマウスは、すべて感染性ウイルスの排出は検出されず、臨床的徴候も認められなかった。したがって、dUYllはHSV‐2の膣感染を防御する。
【0123】
本明細書全体にわたって、様々な刊行物が参照される。これらの刊行物の開示は、本明細書に記載される本発明の化合物、組成物及び方法をより完全に記載するために、参照することによりその全体が本明細書中に組み込まれる。
【0124】
様々な変形及び変更を、本明細書に記載される本発明の化合物、組成物及び方法にすることができる。本明細書に記載された本発明の化合物、組成及び方法の他の実施態様は、本明細書に開示された本発明の化合物、組成及び方法の仕様及び実施の考察から明らかである。特定例及び実施例は例示であるとみなされることを意図する。
【技術分野】
【0001】
関連出願の相互参照
本出願は、2007年2月28日に出願された米国仮出願第60/891,954号の優先権を主張する。この出願の全教示は、参照することにより全体が本明細書中に組み込まれる。
【背景技術】
【0002】
抗ウイルス剤の発見における大規模研究の結果、現在では臨床使用のために世界中で43個の抗ウイルス剤が承認されている。しかしながら、それらのほとんどはウイルスのDNAポリメラーゼをターゲットとしている。そのような偏りは、HSV‐1 DNAポリメラーゼが抗ウイルス剤のために特定された最初のターゲットであったからであろう。発見された2番目のターゲットは、ウイルス粒子の成熟化のために必要なウイルス性のプロテアーゼであった。より最近では、主要な取り組みは他のウイルス性タンパク質をターゲットとする薬剤に置かれている。重点はウイルス感染を阻害する薬剤にあり、その薬剤は、ウイルス感染のかなり初期の事象を妨げるものである。最初に成功した感染阻害物質は、HIV融合蛋白の再構成のペプチド阻害剤であるT‐20又はフューゼオン(fuzeon)であった。この薬剤は臨床的に使用されるが、併用療法のみである。さらに、その薬剤には既に耐性によって選択されている。より最近では、HIVの糖タンパクと細胞のレセプター又はコレセプターとの相互作用もターゲットとされている(例えば、CCR5コレセプターをターゲットとするvicriviroc‐SCH417690、TAK‐779、PRO‐140、UK‐427,857、GW873140及びAMD887、又は、CXCR4コレセプターをターゲットとするAMD3100及びAMD070)。しかしながら、これらのすべての感染阻害物質は重要な欠点を有する。例えば、ペプチド阻害剤は、生物学的利用率と安定性に乏しい。したがって、それらは使用直前に調製する必要があり、また、非経口投与によってのみ使用できる。コレセプター結合の阻害物質は、特異性が狭い(CCR5又はCXCR4栄養ウイルスのみ等)。さらに、レセプター結合の阻害物質は重要な細胞レセプターの活性化を阻害することもできる。したがって、主要な取り組みは、依然として、そのような欠点を克服できる新規のウイルス融合阻害物質の発見に注ぎ込まれている。
【0003】
現在のウイルス融合の阻害物質はウイルスと細胞タンパクとの相互作用をターゲットとしている。実際に、昔から、特異性や安全性を保証する全ての抗ウイルス剤がウイルスタンパクをターゲットとして開発された。これは、臨床で使用される43の抗ウイルス剤や現在開発中の他の薬剤の開発につながった長い年月をかけて検証された概念である。残念ながら、このアプローチにはいくつかの限界がある。ウイルスタンパクをターゲットとする薬剤にはすぐに耐性によって選択される。例えば、これは既にフューゼオンで起こり、CCR5‐gp41相互作用阻害剤でも起こっている。また、ヒトパピローマウイルスのような小さなゲノムのウイルスでは可能なウイルスターゲットの数も制限される。新たに特定されたウイルス病原体によってコードされるタンパクが最初に特徴づけされるべきとき、このアプローチはその病原体に対する薬剤の迅速な開発にも貢献しない。
【0004】
伝統的なアプローチに代わる手段として、最近、細胞タンパクをターゲットとする抗ウイルス剤の開発の可能性が検討されている。このアプローチはいくつかの潜在的な有用性を提供する。例えば、複数のウイルス機能に必要な細胞タンパクの阻害は耐性の選択を最小にするかもしれない。細胞タンパクの多くはウイルスの複製に最小のゲノムが必要である。さらに、細胞タンパクの多くは遠縁のウイルスの複製にも必要である。したがって、細胞タンパクをターゲットとする薬剤は、そのタンパクが完全に特徴付けられる前にでも新規な病原体に対して使用できる。しかしながら、そのようなターゲットは一般的に多くの感染していない細胞でも発現していることから、細胞タンパクをターゲットとすることは、好ましくないネガティブの副作用を導くかもしれない。
【発明の概要】
【発明が解決しようとする課題】
【0005】
本明細書には、細胞のウイルス感染を予防するための又はウイルスに感染した対象を治療するための化合物及び方法が記載されている。
【課題を解決するための手段】
【0006】
本明細書に記載された化合物と方法は、ウイルスの耐性を最小にし、ターゲットとするウイルスの数を最大にする。さらに、その化合物と方法は感染していない細胞に対する毒性を最小にする。本発明の利点については、一部は以下の説明中に示され、一部はこの説明から明白となり、又は以下に記載する実施形態により理解される。以下に記載された利点は、添付の特許請求の範囲で特に示された要素と組み合わせの手段によって実現され、達成される。以上の概要及び以下の詳細な説明は双方ともに単に説明のための例示であって、制限するものではないことが理解される。
【図面の簡単な説明】
【0007】
本明細書に組み込まれ、その一部を構成する添付図面は、以下に記載のいくつかの実施態様を例示する。
【図1】両親媒性ヌクレオシド誘導体であるdUY11がHSV‐1 DNA複製を阻害しないことを示すサザンブロット解析の図である。
【図2】両親媒性ヌクレオシド誘導体であるdUY11が子孫HSV‐1のDNAの放出を阻害しないことを示すサザンブロット解析の図である。
【図3】ウイルス感染におけるdUY11の抑制性を表すプラークアッセイを示す図である。
【図4】代表的な膜脂質と比較した両親媒性ヌクレオシド誘導体の化学構造と三次元構造を示す図である。
【図5】異なる両親媒性ヌクレオシド誘導体濃度に対するHSV‐1感染力をプロットした線グラフである。
【図6】IC50値が20nMであるdUY11濃度に対するHSV‐1感染力をプロットした線グラフである。
【図7】処理時間に対するHSV‐1感染力をプロットした線グラフである。
【図8】細胞のタイプに関係なく阻害するdUY11濃度に対するHSV‐1感染力をプロットした線グラフである。
【図9】dUY11で処理し、膜の色素(PKH26)で染色したモック感染細胞を示す図である。
【図10】dUY11を曝露した時間に対する相対細胞数をプロットした線グラフである。dUY11は細胞傷害性又は細胞増殖抑制性がない。
【図11】HSV‐1の結合性(A)及び感染力(B)を示す棒グラフ及び画像である。dUY11はHSV‐1結合を阻害しない。
【図12】ヘパリンの濃度を増加させたときの細胞に対するHSV‐1結合の競合を示す線グラフである。dUY11はHSV‐1ウイルスによる高親和性結合を阻害しない。
【図13】HSV‐1 ICP0 IEプロモーター制御下で、細胞ゲノムに再結合した赤色蛍光タンパク(RFP)レポータ遺伝子を含むVero細胞で発現している赤色蛍光タンパクの図(A)及び定量結果(B)を表す。dUY11はHSV‐1の細胞内への侵入を抑制する。
【図14】dUY11濃度に対するHSV‐1株KOS、HSV‐2株186、HSV‐2株333、VSV又はシンドビスの感染力をプロットした線グラフである。dUY11はHSV‐1,HSV‐2,VSV及びシンドビスウイルスの感染を阻害した。
【図15】ウイルス若しくは細胞の前処理又は感染後のみの細胞の処理に使用したdUY11濃度に対するHSV‐1 KOSの感染力をプロットした線グラフである。ウイルスの前処理に使用した場合にのみ、dUY11はHSV‐1感染を完全に阻害した。
【図16】両親媒性ヌクレオシド誘導体で24時間又は1時間だけ処理した細胞によって産生されるウイルスの感染力の低下を示し、薬剤の濃度に対してプロットした線グラフである。dUY11は子孫ウイルスの感染を阻害した。
【図17】異なる薬物で処理した細胞によって産生されるウイルスの感染力(ウイルス力価)の低下を示し、ACV,PAA又はdUY11の濃度に対してプロットした線グラフである。dUY11は薬剤耐性変異ウイルスの感染を阻害した。
【図18】マウスのHSV‐2 in vivo膣感染を防御するdUY11の能力を示すグラフである。dUY11を曝露したウイルスはマウスに感染しなかった。
【図19】dUY11を曝露したHSV‐2を感染させたマウスの腟領域、会陰領域及び肛門の写真である。dUYllを曝露したウイルスはマウスに感染しなかった。
【発明を実施するための形態】
【0008】
発明の詳細な説明
本発明の化合物、組成及び方法を開示し説明するが、以下で説明する実施形態は、特定の化合物、合成方法又は用途に限定されるものではなく、当然に、様々であることが理解される。また、本明細書で使用される用語は特定の実施形態について説明することのみを目的とし、限定を意図するものではないことも理解される。
【0009】
この明細書と添付の特許請求の範囲において、下記の意味を有することが定義される多くの用語について示す。
【0010】
この明細書と、添付の特許請求の範囲において、単数形の「a」、「an」及び「the」は、文中に特に明示のない限り、対象の複数形も含まれることに注意すべきである。したがって、例えば「医薬キャリア」という場合、そのようなキャリアの2種以上の混合物等が含まれる。
【0011】
「任意の」又は「任意に」は、その後に記載する事象又は状況が生じても、生じなくてもよいことを意味し、その記載は、その事象又は状況が生じる場合と生じない場合を含む。例えば「任意に低級アルキルを置換する」という句は、低級アルキルを置換しても置換しなくてもよいことを意味し、その記載は、置換されていない低級アルキルと置換された低級アルキルの両方を含む。
【0012】
組成物又は物における特定の要素又は成分の重量部という明細書及び結論のクレームの記載は、その組成物又は物における当該要素又は成分と、他の要素又は成分との間の重量部によって表される重さ関係を示す。したがって、2重量部の成分Xと5重量部の成分Yを含む化合物では、XとYは、2:5の重量比で存在しており、追加成分がその化合物に含まれているか否かに関わらず、この比率で存在する。
【0013】
そうでない旨が特に示されない限り、組成物の重量パーセントは組成物が含まれている製剤又は組成の総重量に基づいている。
【0014】
「被験体」は個体を意味する。被験体は霊長類又はヒトなどの哺乳動物であってもよい。「被験体」という用語には、限定はされないが、ネコ、イヌなどの飼いならされた動物、家畜(例えば、ウシ、ウマ、ブタ、ヒツジ、ヤギなど)、及び実験動物(例えば、マウス、ウサギ、ラット、モルモットなど)を含むことができる。
【0015】
「接触」とは1つ以上の物質が別の物質に密接な物理的接触をすることによって曝露される事例を意味する。例えば、接触には薬物などの物質と細胞又はウイルスとの接触を含むことができる。
【0016】
「治療」又は「治療すること」とは、好ましくない病気の症状を減少させるために、好ましくない病気(例えば、ウイルス感染)を持つ被験体又はシステムに対する組成物の投与を意味する。「予防」又は「予防すること」とは、好ましくない病気にかかる可能性を排除することを意味する。また、「予防」又は「予防すること」には、好ましくない病気にかかる可能性を減少させることが含まれる。
【0017】
「有効な量」とは、好ましい結果又は結果を得るのに必要な治療上の又は予防のための(予防薬)量を意味する。
【0018】
明細書及び結論のクレームに使用される化学種の残基は、実際に化学種から得るかどうかにかかわらず、特定の反応スキームやその後の処方で得られた化学種又は化学製品の一部をいう。例えば、1つ以上の‐OH基を含む糖類は式Z‐OHによって表すことができる。そこでは、Zは糖分子の残り(すなわち、残基)である。
【0019】
本明細書で使用される「アルキル基」という用語は、メチル基、エチル基、n‐プロピル基、イソプロピル基、n‐ブチル基、イソブチル基、t‐ブチル基、ペンチル基、ヘキシル基、ヘプチル基、オクチル基、デシル基、テトラデシル基、ヘキサデシル基、エイコシル基、テトラコシル基等の炭素原子が1〜24の分岐又は非分岐の飽和炭化水素基である。「低級アルキル」基は、1〜6の炭素原子を含むアルキル基である。
【0020】
本明細書で使用される「アリール基」という用語は、これには限定されないが、ベンゼン、ナフタリンなどの任意の炭素系芳香族基である。また、「芳香族」という用語には、芳香族基の環の中に組み込まれる1つ以上のヘテロ原子を有する芳香族基として定義される「ヘテロアリール基」が含まれる。ヘテロ原子の例には、これには限定されないが、窒素、酸素、硫黄、及びリンが含まれる。アリール基は、置換されるか又は非置換とすることができる。アリール基は、これには限定されないが、アルキル、アルキニル、アルケニル、アリール、ハロゲン化物、ニトロ、アミノ、エステル、ケトン、アルデヒド、ヒドロオキシ、カルボン酸、又はアルコキシルを含む1つ以上の基で置換できる。また、「アリール基」という用語には互いに縮合した2つ以上の芳香族基が含まれる。OLE_LINK5例えば、縮合アリール基はOLE_LINK53、4、5、6、7、又は8個のアリール環で構成されてもよい。縮合アリール基は上で説明した1つ以上の基で置換されるか又は非置換とすることができる。
【0021】
本明細書で使用される「ポリエーテル基」という用語は、式‐[(CHR)nO]m‐を有する基である。式中、Rは水素又は低級アルキル基、nは1〜20の整数、mは1〜100の整数である。ポリエーテル基の例には、ポリエチレンオキシド、ポリプロピレンオキシド、及びポリブチレンオキシドが含まれる。
【0022】
本明細書で使用される「ポリチオエーテル基」という用語は、OLE_LINK6OLE_LINK7式‐[(CHR)nS]m‐を有する基である。式中、Rは水素又は低級アルキル基、nは1〜20の整数、mは1〜100の整数である。
【0023】
本明細書で使用される「ポリイミノ基」という用語は、式‐[(CHR)nNR]m‐を有する基である。式中、それぞれのRは互いに独立して水素又は低級アルキル基であり、nは1〜20の整数、mは1〜100の整数である。
【0024】
出願書類を通して使用されるX,L,L’,R,Y,Z1,Z2,及びZ3などの変数は、そうでない旨が示されない限り、それまでに定義されたのと同じ変数である。
【0025】
I.化合物及びその作製
本明細書には、細胞へのウイルス感染を防ぐか、又は感染の確率を減少させる化合物が記載されている。本発明の一実施形態は、式I含む化合物又はその薬学的に許容できる塩若しくはエステルである。
X‐L‐Y (I)
式中、Xは糖類の残基を含み;
Lは平面状親水基を含むリンカーを含み;そして
Yは平面状疎水性基を含み、Yは直接又は間接的にLに結合している。
【0026】
詳細に式Iの各成分について議論する。Xに関して、Xは糖類の残基を含む。通常、糖類は1つ以上のヒドロキシル基を有する。したがって、Xは化合物Iの親水部分である。1つの実施形態では、糖類は単糖を含む。単糖は、直鎖の単糖又は環状構造(ヘミアセタール又はヘミケタール)であってもよい。したがって、単糖は単糖のフラノース型とピラノース型を含むことができる。本明細書で有用なペントース糖類の例としては、リボース、アラビノース、デオキシリボース、キシロース、リキソース、リブロース、又はキシルロースを含むが、これには制限されない。ヘキソースの例としては、グルコース、ガラクトース、マンノース、グロース、イドース、タロース、アロース、アルトロース、フラクトース、ソルボース、タガトース、プシコース、フコース、又はラムノースを含むが、これには制限されない。
【0027】
別の実施形態では、Xは二糖である。二糖はグリコシド共有結合によって互いに結合した二つの単糖ユニットで構成される。本明細書で有用な二糖の例には、スクロース、乳糖、トレハロース、又は麦芽糖が含まれるが、これには限定されない。更なる実施形態では、糖類はオリゴ糖又は多糖を含む。オリゴ糖と多糖はグリコシド結合によって互いに結合した単糖ユニットの長い鎖で構成される。二つの区別は鎖に存在する単糖ユニットの数に基づいている。オリゴ糖は2〜9の単糖ユニットを通常含んでおり、多糖は10以上の単糖ユニットを含んでいる。多糖の例には、グリコーゲン、でんぷん、セルロース、キチン、アミラーゼ、アミロペクチン、スタキオース、イヌリン、又はデキストリンが含まれるが、これには限定されない。また、多糖には、例えば、ヘパリン、コンドロイチン硫酸、ヒアルロナン、ヘパラン硫酸、デルマタン硫酸、又はケラタン硫酸などのグリコサミノグリカン(GAG)が含まれる。
【0028】
必要に応じて当技術分野で公知の技術を使用することにより、糖類に存在するヒドロキシル基のいずれも誘導体化することができる。例えば、ヒドロキシル基は、ポリエーテル基、ポリイミノ基、アセチル基、又はポリチオエーテル基で置換できる。したがって、必要に応じて糖類の親水性の量や程度を変えることができる。
【0029】
糖類XはリンカーLと共有結合している。リンカーLは平面状親水基である。リンカーは、通常、剛体平面である。例えば、リンカーにはプリン又はピリミジン残基が含まれる。また、リンカーは互いに共有結合した2つ以上の塩基対であってもよいと想定される。1つの実施形態では、X‐Lは以下のヌクレオシドのひとつであってもよい:アデノシン、デオキシアデノシン、グアノシン、デオキシグアノシン、5‐メチルウリジン、デオキシチミジン、ウリジン、デオキシウリジン、シチジン、又はデオキシシチジン。1つの実施形態では、式IのX‐Lは以下に示されるようにデオキシウリジン又はその誘導体の残基ではない。
【0030】
【化1】

【0031】
式中、Rは、例えばアセチル基などの水素基又は保護基である。
【0032】
別の実施形態では、リンカーには親水性アリール基が含まれる。例えば、アリール基は本明細書に定義されるようにヘテロアリル基であってもよい(例えば、ピリジル基)。他の実施形態では、アリール基の親水性を増加させる1つ以上の基でアリール基を置換できる。例えば、アリール基は、ヒドロキシル化アリール基又はその誘導体であってもよい。本明細書では、ヒドロキシル化アリール基は直接的に又は鎖を介して間接的に芳香族環に結合した1つ以上のヒドロキシル基を有する任意のアリール基と定義される。ヒドロキシル化アリール基の誘導体には、アリール基の親水性を修飾する(すなわち、増減する)任意の基が含まれる。例えば、ヒドロキシル基は、Xについて上記で議論したように、ポリエーテル基、ポリイミノ基、又はポリチオエーテル基で置換できる。
【0033】
式Iでは、Yには平面状疎水性基が含まれ、Yは直接又は間接的にLに結合している。1つの実施形態では、Yにはアリール基が含まれる。Yのアリール基にはいくつかの型が想定できる。例えば、アリール基は置換された又は非置換の縮合系であってもよい。縮合されたアリール基の例には、アントラセン、フェナンスレン、ナフタリン、ベンゾナフタレン、フッ素、又はカルバゾールが含まれるが、これには限定されない。他の実施形態では、アリール基は、より大きい分子の一部であってもよい。基の全体の疎水性を修飾するために1つ以上の異なった基でアリール基を置換できる。dUY7を除き本明細書で有用なアリール基の例を図4に示す。図5Cで示すようにdUY7はウイルス感染を阻害する能力を全く示さなかった。
【0034】
リンカーLは直接的又は間接的にYに結合できる。ここでの「直接的に結合」という語句は、Yがリンカーと共有結合していると定義される。反対に、ここでの「間接的に結合」という語句は、Yが二番目のリンカー(L’)を介してリンカーと共有結合していると定義される。二番目のリンカーL’には、アルキル基、アルケニル基、又はエーテル基(例えば、ポリエーテル)を含むことができるが、これには限定されない。1つの実施形態では、L’はアルキニル基である。例えば、L’は、プロパルギル基又はプロパルギルエーテル基であってもよい。図4の構造AとBに示すように、アルキニル基RC≡CはチミンのC5に結合し、Rがアリール基(すなわち、Y基)である。
【0035】
1つの実施形態では、化合物は式IIを含む化合物又はその誘導体である。
【0036】
【化2】

【0037】
式中、Z1、Z2及びZ3は、互いに独立してH又はOHであり;
Lはプリン又はピリミジンを含み;
Yはアリール基を含む。
【0038】
1つの実施形態では、ZはOHであり、Lはウラシル残基であり、Yは式IIのアリール基を含まれる。別の実施形態では、その化合物は式IIIA又はIIIBを有する。
【0039】
【化3】

【0040】
式中、Z1、Z2及びZ3は、互いに独立してH又はOHであり、Yはアリール基を含む。更なる実施形態では、Yは3個以上のアリール環を含む縮合されたアリール基を含む。そのアリール基の一例は、以下の構造を有する。
【0041】
【化4】

【0042】
式中、アリール基は置換されているか、非置換である。
【0043】
1つの実施形態では、この化合物は式IIIAを有し、式中、Z1がOHであり、Z2とZ3が水素であり、Yは以下の化学式を有するアリール基である。
【0044】
【化5】

【0045】
式中、アリール基は置換されているか、非置換である。この化合物は本明細書ではdUY11と呼ばれる。別の実施形態では、その化合物は式IIIAを有する。式中、Z1、Z2及びZ3は水素であり、Yは以下の化学式を有するアリール基である。
【0046】
【化6】

【0047】
式中、アリール基は置換されているか、非置換である。この化合物は本明細書ではdUY11と呼ばれる。更なる実施形態では、化合物は式IIIAを有する。式中、Z1とZ3はOHであり、Z2は水素であり、Yは以下の化学式を有するアリール基である。
【0048】
【化7】

【0049】
式中、アリール基は置換されているか、非置換である。この化合物は本明細書ではaUY11と呼ばれる。
【0050】
本明細書に記載された化合物のいずれもが存在又はその塩に変換することができる。1つの実施形態では、その塩は薬学的に許容できる塩である。その塩は、化学的又は薬学的に許容できる適切な量の塩基で遊離酸を処理することによって調製できる。代表的な化学的又は薬学的に許容できる塩基は、水酸化アンモニウム、水酸化ナトリウム、水酸化カリウム、リチウム水酸化物、消石灰、水酸化マグネシウム、水酸化第一鉄、亜鉛水酸化物、水酸化銅、水酸化アルミニウム、水酸化第二鉄、イソプロピルアミン、トリメチルアミン、ジエチルアミン、トリエチルアミン、トリプロピルアミン、エタノールアミン、2‐ジメチルアミノエタノール、2‐ジエチルアミノエタノール、リジン、アルギニン、ヒスチジン等である。1つの実施形態では、その反応は水中で、単独で又は不活性物質と組み合わせて、水混和性有機溶媒中で、約0℃〜約100℃の例えば室温などの温度で行われる。使用される塩基に対する化合物のモル比は、どの特定の塩においても求められる比を提供するように選ばれる。例えば、遊離酸出発物質のアンモニウム塩を調製するためには、塩を得るために、出発物質はおよそ等量の塩基で処理できる。
【0051】
別の実施形態では、本明細書に記載された化合物のいずれもが存在又はそのルイス塩基で塩に変換できる。化合物は適量のルイス塩基で処理できる。ルイス塩基の代表的なものは、水酸化アンモニウム、水酸化ナトリウム、水酸化カリウム、リチウム水酸化物、消石灰、水酸化マグネシウム、水酸化第一鉄、亜鉛水酸化物、水酸化銅、水酸化アルミニウム、水酸化第二鉄、イソプロピルアミン、トリメチルアミン、ジエチルアミン、トリエチルアミン、トリプロピルアミン、エタノールアミン、2‐ジメチルアミノエタノール、2‐ジエチルアミノエタノール、リジン、アルギニン、ヒスチジン、テトラヒドロフラン、エーテル、チオール試薬、アルコール類、チオールエーテル、カルボン酸エステル、フェノラート、アルコキシド、水などである。1つの実施形態では、その反応は水中で、単独で又は不活性物質と組み合わせて、水混和性有機溶媒中で、約0℃〜約100℃の例えば室温などの温度で行われる。使用される塩基に対する化合物のモル比は、どの特定の複合体においても求められる比を提供するように選ばれる。例えば、遊離酸出発物質のアンモニウム塩を調製するためには、複合体を得るために、出発物質はおよそ等量の化学的又は薬学的に許容されるルイス塩基で処理できる。
【0052】
化合物がカルボン酸基を有する場合、これらの基は当技術分野で公知の技術を用いて薬学的に許容されるエステル又はアミドに変換できる。さらに、エステルが存在している場合、そのエステルはエステル交換反応の技術を用いて薬学的に許容できるエステルに変換できる。
【0053】
本明細書に記載された化合物は、当技術分野で公知の技術を用いて合成できる。例えば、X‐Lがヌクレオシドであるときには、式Iを有する化合物を作るために、Y又はY‐L’にそれを結合できる。
【0054】
【化8】

【0055】
1つの実施形態では、X‐Lが式IVで表されるヌクレオシドであるときには、化合物Vを作るためにカップリング反応を使用できる。
【0056】
【化9】

【0057】
この実施形態では、Xは糖類であり、Halはヨウ化物などのハロゲンである。パラジウム触媒は、式Vを有する化合物を作るために、アルキンY‐C≡CHを化合物IVと結合するために使用される。
【0058】
II.医薬組成物
1つの実施形態では、上で説明した化合物のすべてが医薬組成物に製剤化できる。これらの医薬組成物は、当技術分野で公知の技術を用いて準備できる。1つの実施形態では、この組成物は、本明細書に記載された化合物と薬学的に許容できる担体を混合することによって調製できる。
【0059】
特定のケースにおいて、式Iを有する活性化合物の実際に好ましい量は、利用される特定の化合物、製剤化される特定の組成、適用方法、特定の部位、治療される被験体によって変化することが理解される。任意の宿主のための用量は、従来の考え、例えば、対象の化合物と既知の薬物の活性の差を普通に比較することや、適切な従来の薬理プロトコールによって決定できる。医薬化合物の用量を決定する技術分野で熟練した医師や調剤者は、標準の勧告(Physicians Desk Reference,Barnhart Publishing ‐1999)に従って用量を決定することについて全く問題がない。
【0060】
本明細書に記載された医薬組成物は、生物学的なシステムや存在が許容できるいずれの賦形剤でも製剤化できる。そのような賦形剤の例には、水、生理食塩水、リンガー液、デキストロース溶液、ハンクス溶液、及び他の水性の生理的にバランスのとれた塩溶液が含まれるが、これには限定されない。また、不揮発性油、オリーブ油や胡麻油などの植物油、トリグリセリド、プロピレン・グリコール、ポリエチレングリコール、及びオレイン酸エチルなどの注射可能な有機エステル等の非水性の媒体も使用できる。他に有用な製剤には、ナトリウムカルボキシメチルセルロース、ソルビトール、又はデキストランなどの粘着性を高める物質を含む懸濁液が含まれる。また、賦形剤は等張性と化学的安定性を高める物質などの少量の添加物を含むことができる。緩衝液の例には、リン酸緩衝液、重炭酸塩緩衝液、及びトリス緩衝液が含まれ、防腐剤の例には、チメロサール、クレゾール、ホルマリン、及びベンジル・アルコールが含まれる。
【0061】
医薬キャリアは当業者に公知である。これらは概してヒトへ投与するための標準的なキャリアであり、滅菌水、生理食塩水及び生理的pHの緩衝液などの溶液が含まれる。
【0062】
薬物輸送のための分子は医薬組成物内に製剤化できる。医薬組成物は選択された分子に加えて、キャリア、増粘剤、希釈剤、緩衝液、防腐剤、界面活性剤などを含むことができる。
【0063】
医薬組成物は、局所投与又は全身投与のどちらが望まれるかということや投与領域によって、多くの方法で投与することができる。投与は局所的(眼科的、膣内、直腸内、鼻腔内、気化を含む)であってもよい。局所投与のための製剤には、軟膏、ローション、クリーム、ジェル、液滴、座薬、スプレー、液体、及び粉末を含むことができる。従来の医薬キャリア、水溶液、粉末又は油性基剤、増粘剤などが必要とされたり望まれたりするであろう。
【0064】
投与のための調製物には、滅菌された水溶液又は非水溶液、懸濁液及び乳剤が含まれる。水溶性のキャリアの例には、水、アルコール/水溶液、生理食塩水及び緩衝液媒体を含む乳剤又は懸濁液が含まれる。開示された組成物と方法の付随的な使用が必要である場合、非経口用の媒体には、塩化ナトリウム溶液、リンガーデキストロース、デキストロースと塩化ナトリウム、乳酸加リンガー液、又は不揮発性油が含まれる。開示された組成物と方法の付随的な使用が必要である場合、静脈投与用の媒体には、液体及び栄養補充薬、電解質補充薬(リンガーデキストロースに基づくものなど)等が含まれる。また、防腐剤及び他の添加物として、例えば、抗菌剤、酸化防止剤、キレート剤及び不活性ガス等を示すことができる。
【0065】
また、医薬組成物には他の薬剤や生物活性を有する薬物を含むことができる。生物活性を有する薬物は、生物システムにおいて局所的に又は全身的に生物学的、生理学的又は治療的な効果を提供できる。その薬物はその他の機能として、例えば、感染又は炎症をコントロールしたり、細胞増殖や組織再生を促進したり、腫瘍の成長をコントロールしたり、鎮痛剤として作用したり、そして骨成長を促進したりすることができる。したがって、本明細書に記載された組成物を他の治療効果と組み合わせることによって、ウイルス感染を減少又は妨げる併用療法を想定することができる。
【0066】
III.使用方法
ウイルス感染の予防又は治療に関連するさまざまな適用において本明細書に記載した化合物と医薬組成物が使用できる。感染細胞からのウイルスを防ぐための方法には、上で定義された式X‐L‐Y(I)を含む化合物とウイルス又は既に感染した細胞との接触が含まれる。
【0067】
ウイルスは、外皮が宿主細胞に由来する脂質二重膜(エンベロープ)で覆われているかどうかによってエンベロープ型と非エンベロープ型にクラス分けされる。ウイルスエンベロープは細胞膜に由来しているが、これら2つの脂質二重膜には本質的な違いがある。機能的には、細胞膜は細胞内及び細胞外の環境を分けるために必要な選択性のある物理的なバリアであり、特定の分子の選択的な透過を許す。それに対して、ウイルスエンベロープの主な機能は、細胞膜と融合し、ウイルスタンパクの多くを宿主の免疫システムから隠すことである。ウイルスエンベロープは限られた環境下では物理的な防御を与えるが、エンベロープウイルスは非エンベロープウイルスに比べて物理的又は化学的な損傷に対してたいてい抵抗性が低い。構造的に、ウイルスエンベロープと細胞膜中の脂質組成及びタンパク組成は、曲率や可変性のようにいずれも異なっている。
【0068】
本明細書に記載された化合物は両親媒性と呼ぶことができ、分子の一部が親水性(X‐L)であり、別の部分が疎水性(Y)である。いかなる理論にも拘束されることを望むものではないが、本明細書に記載された化合物は細胞膜とエンベロープウイルスの融合を妨げ、最終的にウイルスの細胞内への侵入を防ぐと考えられる。本明細書に記載された化合物の疎水性部分(すなわち、Y)は脂質エンベロープの疎水性中心にそれ自身を挿入できる。親水性部分(すなわち、X)はエンベロープの表面上の極頭部(polar heads)と相互作用する。したがって、化合物はリン脂質の模倣物である。しかしながら、本明細書に記載された抗ウイルス化合物は、ウイルスエンベロープの外葉で自然に発生する脂質の形体よりもさらに著しい逆円錐形を有している。エンベロープの外葉の逆円錐形脂質は、膜間の融合に必要な曲率変化を抑制する。したがって、両親媒性化合物はウイルスエンベロープと細胞の原形質膜間の融合を抑制できる。化合物の式I(Y)の疎水性部分、親水性部分、及び一般的な分子形状は、細胞膜を越えてウイルスエンベロープと優先的に相互作用するために容易に最適化できる。また、本明細書に記載された化合物は、複製DNAへの取り込みを妨げるようにデザインできる。そのような修飾の例は、化合物ddUYllとaUYllで見られる(実施例参照)。ddUYllの場合には、糖部分のヒドロキシルがddUY11を作るためにdUY11から取り外された。aUYllでは、dUYllのデオキシリボース糖をアラビノ糖と交換した。
【0069】
ターゲットとされるウイルスは特定されない。ターゲットとされるウイルスには、例えば、ポックスウイルス、単純ヘルペスウイルス1型、2型(HSV‐1,HSV‐2)、インフルエンザウイルス、HIV、ヒトT細胞白血病ウイルス(HTLV)、エプスタイン‐バールウイルス(EBV)、ヒトサイトメガロウイルス(HCMV)、カポシ肉腫関連ヘルペスウイルス(KSHV)、水疱瘡ウイルス(VZV)、B型肝炎ウイルス、C型肝炎ウイルス、エボラウイルス、マールブルグウイルス、パラインフルエンザウイルス、ヒト呼吸器多核体ウイルス、ヘンドラウイルス、ニパウイルス、流行性耳下腺炎ウイルス、麻疹ウイルス、ハンタウイルス、ブニヤウイルス、リフトバレー出血熱ウイルス、シンノンブレウイルスを含むアレナウイルス、狂犬病ウイルス、東部、西部及びベネズエラ脳炎ウイルス、西ナイルウイルス、黄熱病ウイルス、デングウイルス、日本及びセントルイス脳炎ウイルス、コロナウイルス(例えば、SARSウイルス)、風疹ウイルスがなどのエンベロープウイルスを含むことができる。
【0070】
本明細書に記載された化合物は、ウイルス感染を防ぐか又は減少させるために使用できる。1つの実施形態では、本明細書に記載されているのは、被験体のウイルス感染を防ぐか又は感染の確率を減少するための方法である。その方法にはそのような治療を必要としている被験体に対して効果的な量の式Iを含む化合物を投与することが含まれる。上で説明した技術のいずれかを使用することで化合物を投与できる。1つの実施形態では、化合物は感染部位に適用される。「感染部位」という用語は、ウイルスに感染した被験体のウイルスと接触した体の1部分又はそれ以上の部分である。そのような感染部位の例には粘膜内層が含まれる(例えば、膣、直腸、鼻道)。したがって、1つの実施形態では、本明細書に記載された化合物は性行為感染症の抑制において予防的に用いることができる。この実施形態では、化合物は直接的又は間接的に膣や直腸に適用する局所製剤(例えば、ゲル、ローション、又はクリーム)として製剤化される。もう一つの実施形態では、本明細書に記載された化合物は呼吸器疾患の抑制において予防的に用いることができる。この実施形態では、化合物は呼吸器に適用できるスプレーとして製剤化できる。
【0071】
本明細書に記載された化合物はウイルス感染した被験体を治療するための治療法として使用できる。1つの実施形態では、その方法には、そのような治療を必要とする被験体に対する式X‐L‐Y(I)を含む有効量の化合物の投与が含まれる。本明細書に記載された化合物は、ウイルス感染の特性を減少させ、最終的に、ウイルスによって発症した疾病の症状と共にウイルスの拡大を減少させることができる。治療として使用されるときには、この化合物は経口、非経口、又は局所を含む多くの方法で投与できる。
【0072】
本明細書に記載された化合物は、環境において被験体が感染することから、ウイルス感染を防止し、感染確率を減少させるために使用できる。その方法には、式Iを含む1つ以上の化合物を用いた環境の汚染除去が含まれる。その環境には、ウイルスに接触したあらゆる装置や基材(例えば、医療用器具)が含まれる。例えば、本明細書に記載された化合物は、ウイルスと接触するところで1個以上のウイルスに曝露している基材にスプレーすることができる。別の例として、化合物は、基材に存在するすべてのウイルスを不活性化するために、基材が浸されている溶液又は基材の中(例えば、チューブ類や他の限られた空間)にある溶液の中に存在することができる。
【0073】
別の実施形態では、本明細書に記載された化合物はワクチンを生産するためのウイルスの不活性化に使用できる。その方法には、上で定義されるような式Iを含む1つ以上の化合物とウイルスの接触が含まれる。そして、当技術分野で公知の技術を用いて、ワクチンとして不活性化されたウイルスを投与できる。
【実施例】
【0074】
以下の実施例は、本明細書で説明され、クレームされた化合物、組成物及び方法がどのようにして作られ、評価されたかを、当業者に完全に開示及び説明するために提供される。これらは、純粋な例であることを意図するものであり、発明者が認識する本発明の範囲を限定することを意図するものではない。数値(例えば、量や温度など)に関して精度を確実にする試みがされているが、いくつかの誤りや逸脱は考慮されるべきである。特に断りのない限り、「部」は「重量部」、温度は「℃」又は周囲温度、圧力は大気圧又は大気圧近辺である。多くの反応条件の種類や組み合わせ、例えば、組成の濃度、必要とされる溶媒、溶媒混合物、温度、圧力、他の反応範囲があり、また記載された過程で得られた製品の純度と収量を最適化するために用いることのできる条件がある。そのような過程の条件を最適化するためには、繰り返される適切な実験のみが必要である。
【0075】
I.式Iを有する化合物の調製
a.手順1
【0076】
【化10】

【0077】
3‐(トリメリルシリルエチニル)エストロン(1)
DMF(10mL)に溶解した3‐O‐トリフルオロメチルスルフォニルエストロン(972mg,2.41mmol)を真空とアルゴン間を交互することによって3回脱気した。トリメチルシリルアセチレン(0.68mL,4.82mmol)、テトラキス(トリフェニルホスフィン)パラジウム(279mg,0.24mmol)、ヨウ化銅(I)(93mg,0.48mmol)及びトリエチルアミン(0.67mL,4.82mmol)を加え、混合物を48時間撹拌した。次いで混合物を水(100mL)とEtOAc(200mL)に注ぎ、有機層を水(4×100mL)、0.1M Na2EDTA溶液(2×100ml)、水(2×100mL)、塩水(100mL)で洗浄し、硫酸ナトリウムで乾燥させ、濃縮した。残留物をカラムクロマトグラフィー(シリカゲル、PhMe中1%から4%EtOAc)にかけ、無色固体の表記の生産物を得た。収量は、790mg(94%)、1H NMR(CDCl3):0.26(s,9H),0.94(s,3H),1.40‐1.71(m,6H),1.96‐2.58(m,7H),2.86‐2.95(m,2H),7.21‐7.30(m,3H)であった。
【0078】
3‐エチニルエストロン(2)
テトラブチルアンモニウムフルオリド三水和物(1.23g,3.9mmol)をアルゴン存在下で撹拌した3‐(トリメリルシリルエチニル)エストロン(697mg,1.95mmol)溶液に加えた。混合物を、室温で4時間撹拌し、濃縮した。残留物をカラムクロマトグラフィー(シリカゲル、PhMe中5%から7%EtOAc)にかけ、オフホワイト固体の表記の生産物を得た。収量は530mg(98%)、1H NMR(CDCl3):0.94(s,3H),1.41‐1.72(m,6H),1.95‐2.59(m,7H),2.88‐2.96(m,2H),3.04(s,1H),7.24‐7.33(m,3H)であった。
【0079】
3’,5’‐O‐テトライソプロピルジシロキサン‐1,3‐ジイル‐5‐(エストロン‐3‐イルエチニル)‐2’‐デオキシウリジン(3)
DMF(10mL)に溶解した3‐エチニルエストロン(61mg,0.215mmol)及び3’,5’‐O‐テトライソプロピルジシロキサン‐1,3‐ジイル‐5‐ヨード‐2’‐デオキシウリジン(117mg,0.196mmol)を真空とアルゴン間を交互することによって3回脱気した。テトラキス(トリフェニルホスフィン)パラジウム(23mg,0.02mmol)、ヨウ化銅(I)(4mg,0.04mmol)及びトリエチルアミン(0.10mL,0.39mmol)を加え、混合物を48時間撹拌した。次いで、混合物を水(100mL)とEtOAc(200mL)に注ぎ、有機層を水(4×100mL)、0.1M Na2EDTA溶液(2×100mL)、水(2×100mL)、塩水(100mL)で洗浄し、硫酸ナトリウムで乾燥させ、濃縮した。残留物をカラムクロマトグラフィー(シリカゲル、PhMe中10%EtOAc)にかけ、黄色固体の表記の生産物を得た。収量は79mg(54%)、1H NMR(CDCl3):0.85(s,3H),0.92‐1.18(m,28H),1.33‐1.62(m,6H),1.73‐1.81(m,1H),1.93‐2.52(m,8H),2.84‐2.97(m,2H),3.55‐3.84(m,1H),4.23‐4.29(s,2H),6.14(t,1H,J=6.6Hz),7.20(s,1H),7.32(d,1H,J=8.25),7.42(d,1H,J=8.25),8.33(s,1H)であった。
【0080】
5‐(エストロン‐3‐イルエチニル)‐2’‐デオキシウリジン(4)
3’,5’‐O‐テトライソプロピルジシロキサン‐1,3‐ジイル‐5‐(エストロン‐3‐イルエチニル)‐2’‐デオキシウリジン(70mg,0.093mmol)をTHF(1mL)に溶解し、トリエチルアミントリヒドロフルオリド(46μL,0.28mmol)で処理した。混合物を室温で24時間保持し、形成された沈殿を遠心によって分離した。固体をTHF‐MeOHから再結晶し、無色の表記化合物を得た。収量は44mg(94%)、1H NMR (CDCl3):0.85(s,3H),1.35‐1.64(m,6H),1.75‐1.84(m,1H),1.93‐2.49(m,8H),2.81‐2.97(m,2H),3.56‐3.85(m,3H),4.23‐4.29(s,2H),6.14(t,1H,J=6.6Hz),7.20(s,1H),7.32(d,1H,J=8.25),7.42(d,1H,J=8.25),8.34(s,1H)であった。
【0081】
b.手順2
【0082】
【化11】

【0083】
3’,5’‐O‐テトライソプロピルジシロキサン‐1,3‐ジイル‐5‐(エストロン‐3‐イルエチニル)‐アラビノ‐ウリジン(5)
DMF(7mL)に溶解した3‐エチニルエストロン(100mg,0.36mmol)及び3’,5’‐O‐テトライソプロピルジシロキサン‐1,3‐ジイル‐5‐ヨード‐アラビノ‐ウリジン(197mg,0.32mmol)を真空とアルゴン間を交互することによって3回脱気した。テトラキス(トリフェニルホスフィン)パラジウム(38mg,0.032mmol)、ヨウ化銅(I)(7mg,0.064mmol)及びトリエチルアミン(0.17mL,0.64mmol)を加え、混合物を48時間撹拌した。次いで、混合物を水(100mL)とEtOAc(200mL)に注ぎ、有機層を水(4×100ml)、0.1M Na2EDTA溶液(2×100mL)、水(2×100mL)、塩水(100mL)で洗浄し、硫酸ナトリウムで乾燥させ、濃縮した。残留物をカラムクロマトグラフィー(シリカゲル、PhMe中20%Me2CO)にかけ、黄色固体の表記の生産物を得た。収量は70mg(29%)であり、1H NMR(CDCl3):0.85(s,3H),0.92‐1.17(m,28H),1.35‐1.64(m,6H),1.74‐1.82(m,1H),1.92‐2.49(m,6H),2.81‐2.89(m,2H),3.66‐3.89(m,1H),3.88‐4.16(m,5H),6.08(d,1H,J=6.41Hz),7.17(s,1H),7.20(d,1H,J=8.25),7.33(d,1H,J=8.25),7.66(s,1H),11.7(br.s)であった。
【0084】
5‐(エストロン‐3‐イルエチニル)‐アラビノ‐デオキシウリジン(6)
3’,5’‐O‐テトライソプロピルジシロキサン‐1,3‐ジイル‐5‐(エストロン‐3‐イルエチニル)‐アラビノ‐ウリジン(70mg,0.091mmol)をTHF(1mL)に溶解し、トリエチルアミントリヒドロフルオリド(44μL,0.27mmol)で処理した。混合物を室温で24時間保持し、形成された沈殿を遠心によって分離した。無色固体。収量は41mg(87%)、1H NMR(CDCl3):0.85(s,3H),1.31‐1.62(m,6H),1.74‐1.83(m,1H),1.90‐2.51(m,6H),2.80‐2.90(m,2H),3.66‐3.89(m,2H),3.91‐4.13(m,6H),6.08(d,1H,J=6.41Hz),7.17(s,1H),7.20(d,1H,J=8.25),7.33(d,1H,J=8.25),7.62(s,1H),11.5(br.s)であった。
【0085】
c.手順3
【0086】
【化12】

【0087】
3’,5’‐O‐テトライソプロピルジシロキサン‐1,3‐ジイル‐5‐(ピレン‐2‐イルエチニル)‐2’‐デオキシウリジン(8)
DMF(10mL)に溶解した2‐エチニルピレン(345mg,1.53mmol)及び3’,5’‐O‐テトライソプロピルジシロキサン‐1,3‐ジイル‐5‐ヨード‐2’‐デオキシウリジン(758mg,1.27mmol)を真空とアルゴン間を交互することによって3回脱気した。テトラキス(トリフェニルホスフィン)パラジウム(147mg,0.127mmol)、ヨウ化銅(I)(48mg,0.25mmol)及びトリエチルアミン(0.35mL,2.54mmol)を加え、混合物を24時間撹拌した。次いで、混合物を水(100mL)とEtOAc(200mL)に注ぎ、有機層を水(4×100mL)、0.1M Na2EDTA溶液(2×100mL)、水(2×100mL)、塩水(100mL)で洗浄し、硫酸ナトリウムで乾燥させ、濃縮した。残留物をカラムクロマトグラフィー(シリカゲル、CHCl3中0%から5%EtOAc)にかけ、黄色固体の表記の生産物を得た。収量は402mg(49%)、1H NMR(CDCl3):0.90‐1.17(m,28H),2.19‐2.34(m,2H),3.64‐3.78(m,2H),3.84‐3.92(m,1H),4.30‐4.37(m,1H),6.22(t,1H,J=6.42Hz),8.09‐8.49(m,9H),8.62(s,1H),11.8(br.s)であった。
【0088】
5‐(ピレン‐2‐イルエチニル)‐2’‐デオキシウリジン(9)
THF(1mL)に3’,5’‐O‐テトライソプロピルジシロキサン‐1,3‐ジイル‐5‐(ピレン‐2‐イルエチニル)‐2’‐デオキシウリジン(200mg,0.29mmol)を溶解し、トリエチルアミントリヒドロフルオリド(0.14mL,0.86mmol)で処理した。混合物を室温で24時間保持し、沈殿をフィルターで分離した。固体をEtOHから再結晶し、無色の化合物を産生した。収量は、74mg(56%)、1H NMR(CDCl3):2.19‐2.34(m,2H),3.64‐3.76(m,2H),3.84‐3.91(m,1H),4.29‐4.34(m,1H),5.23‐5.32(m,2H),6.22(t,1H,J=6.42Hz),8.09‐8.48(m,9H),8.62(s,1H),11.9(br.s)であった。
【0089】
【化13】

【0090】
5‐(ペリレン‐3‐イルエチニル)‐5’‐O‐ピバロイル‐2’,3’‐ジデオキシウリジン
DMF(10mL)に溶解した5‐ヨード‐5’‐O‐ピバロイル‐2’,3’‐ジデオキシウリジン(442mg,1mmol)及び3‐ペリレニルアセチレン(345mg,1.25mmol)を真空とアルゴン間を交互することによって3回脱気した。次に、Pd(PPh3)4(115mg,0.1mmol)、CuI(38mg,0.2mmol)及びEt3N(0.278mL,2mmol)を加え、フラスコにアルゴンを満たし再度脱気し、混合物を周囲温度で43時間撹拌した。混合物を300mLのEtOAcで希釈し、200mLの水で3回洗浄し、硫酸ナトリウムで乾燥させ、濃縮した。0から2%のEtOH/CHCl3勾配を用いたシリカゲルカラムでクロマトグラフィーを行い、クロマトグラフィー上で均一な(Rf0.28,5%EtOH/CHCl3)オレンジ色の泡沫生産物を得た(545mg,96%)。1H‐NMR(DMSO‐d6):11.85(s,1H,NH),8.44(d,1Η,J7.8),8.39‐8.35(m,3Η),8.32(d,IH,J8.2)(ペリレニル),8.06(s,1H,H‐6),7.83‐7.81(m,2H),7.69‐7.60(m,2H),7.58‐7.53(m,2H)(ペリレニル),6.00(dd,1H,J1’2’α6.9J1’2’β4.6,H‐1’),4.37‐4.34(m,1H,H‐4’),4.32‐4.26(m,2H,H‐5’),2.42‐2.36(m,1H,H‐2’),2.17‐2.12(m,1H,H‐2’),2.06‐2.00(m,1H,H‐3’),1.90‐1.83(m,1H,H‐3’),1.17(s,9H,1Bu)であった。
【0091】
【化14】

【0092】
5‐(ペリレン‐3‐イルエチニル)‐2’,3’‐ジデオキシウリジン(ddUYll)
80mLのMeOHに懸濁した5‐(ペリレン‐3‐イルエチニル)‐5’‐O‐ピバロイル‐2’,3’‐ジデオキシウリジン(350mg,0.613mmol)に固体のKOH(310mg,5.517mmol)を加え、混合物を一晩撹拌した。次に、混合物を酢酸で中和し、MeOHを用いて減圧下で2回濃縮し、粗生産物を得た。粗生産物は0から3%のEtOH/CHCl3勾配を用いたシリカゲルカラムでクロマトグラフィーにより精製され、クロマトグラフィー上で均一な(Rf0.46,37.5%アセトン/CHCl3)オレンジ色の固体生産物を得た(130mg,43%)。1H‐NMR(DMSO‐d6):11.74(s,1H,NH),8.76(s,1Η,Η‐6),8.45(d,1H,J7.7),8.41‐8.38(m,2H),8.36(d,1H,J7.7),8.30(d,1H,J7.7),7.71‐7.54(m,6H)(ペリレニル),5.99‐5.98(m,1H,H‐1’),5.35(br.s,1H,OH),4.15‐4.10(m,1Η,Η‐4’),3.70(app.d,1H,H‐5’),3.63(app.d,1H,H‐5’),2.38‐2.31(m,1H,H‐2’),2.17‐2.13(m,1H,H‐2’),2.01‐1.94(m,1H,H‐3’),1.91‐1.86(m,1H,H‐3’)であった。
【0093】
【化15】

【0094】
5‐(ペリレン‐3‐イルエチニル)‐3’,5’‐O‐(テトライソプロピルジシロキサン‐1,3‐ジイル)‐アラビノ‐ウリジン
10mLのDMFに溶解した5‐ヨード‐3’,5’‐O‐(テトライソプロピルジシロキサン‐l,3‐ジイル)‐アラビノ‐ウリジン(612mg,1mmol)及び3‐ペリレニルアセチレン(373mg,1.35mmol)を真空とアルゴン間を交互することによって3回脱気した。次に、Pd(PPh3)4(115mg,0.1mmol)、CuI(38mg,0.2mmol)及びEt3N(0.278mL,2mmol)を加え、フラスコにアルゴンを満たし再度脱気し、混合物を周囲温度で43時間撹拌した。混合物を300mLのCHCl3で希釈し、200mLの水で3回洗浄し、有機層を硫酸ナトリウムで乾燥させ、減圧下で濃縮し、再度CHCl3を用いて2回濃縮した。0から3%のEtOH/CHCl3勾配を用いたシリカゲルカラムでのクロマトグラフィーによる精製によって、クロマトグラフィー上で均一な(Rf0.6,10%EtOH/CHCl3)オレンジ色の泡沫生産物を得た(245mg,32%)。1H‐NMR(DMSO‐d6):11.89(s,1H,NH),8.46(d,1Η,J7.3),8.43‐8.34(m,3Η),8.26(d,1H,J8.2),7.84(t,2H,J7.3)(ペリレニル),7.81(s,1H,H‐6),7.69‐7.64(m,2H),7.57(t,2H,J7.8)(ペリレニル),6.12(d,1H,J6.4,H‐1’),6.12(d,1H,J6.0,H‐2’),4.39(app.q,1H,H‐4’),4.14(app.t,1H,H‐3’),4.08(app.d,1H,H‐5’),3.93(app.d,1H,H‐5’),3.75(br.d,1H,OH),1.07‐0.95(m,28Η,iPr)であった。
【0095】
【化16】

【0096】
5‐(ペリレン‐3‐イルエチニル)‐アラビノ‐ウリジン(aUYll)
0.8mLのTHFに溶解した5‐(ペリレン‐3‐イルエチニル)‐3’,5’‐O‐(テトライソプロピルジシロキサン‐1,3‐ジイル)‐アラビノ‐ウリジン(220mg,0.289mmol)に純粋なEt3N・HF(0.118mL,0.723mmol)を加え、混合物を周囲温度で12時間撹拌した。次いで、生産物を沈殿させるために少量のメタノールを加え、フィルターで分離し、乾燥した。オレンジ色の固体(100mg,67%)で、Rf0.30(10%EtOH/CHCl3)であった。1H‐NMR(DMSO‐d6):12.00‐11.00(br.s,1H,NH),8.46(d,1Η,J7.7),8.43‐8.38(m,2Η),8.36(d,1H,J7.7),8.30(d,1H,J8.33)(ペリレニル),8.26(s,1H,H‐6),7.84(t,2H,J7.0),7.73(d,1H,J7.7),7.69(t,1H,J7.7),7.57(t,2H,J7.7)(ペリレニル),6.07(d,1H,J3.9,H‐1’),5.77‐5.68(br.s,1H),5.60‐5.48(br.s,1H),5.32‐5.20(br.s,1H)(OH),4.12‐4.09(app.s,1Η),4.03‐3.98(ap.s,1Η)(Η‐2’,H‐4’),3.82(app.d,1H,H‐5’),3.74‐3.67(m,2H,H‐3’,5’)であった。
【0097】
II.両親媒性のヌクレオシド誘導体はHSV‐1 DNAの複製又は感染細胞によるウイルスの放出を抑制しない。
ヌクレオシド又はヌクレオチド誘導体は、通常、ウイルスDNAポリメラーゼをターゲットとすることによってHSV‐1 DNAの複製を阻害する。両親媒性のヌクレオシド誘導体がウイルスDNAの複製又はウイルス遺伝子の発現のどちらを抑制したかを確認するために、両親媒性のヌクレオシド誘導体がHSV‐1 DNAの蓄積を抑制する能力を調べた。1細胞当たり5プラークユニット(PFU)の野生型のHSV‐1を、Vero細胞に1時間感染またはモック感染(M)させ、洗浄し、薬物を含まない(ND)培養液、400μMのホスホノ酢酸(PAA)、又は代表的な両親媒性のヌクレオシド誘導体であるdUYll(11)2μMを含む培養液を加えた(図4)。感染後1時間、5時間、18時間又は24時間(hpi)で細胞を回収し、DNAを単離して、アガロース電気泳動によって分離し、ニトロセルロース膜に転写し、HSV‐1の6kbのBamK断片を用いてハイブリダイゼーションを行った。サザンブロット分析(図1)は、感染後1時間、5時間、18時間と24時間の細胞内ウイルスDNAレベルを示している。dUYllはいずれの試験でもウイルスDNAの複製を阻害しなかった。
【0098】
次に、両親媒性のヌクレオシド誘導体が感染細胞によるHSV‐1ウイルスの放出を抑制する能力を検討した。1細胞当たり5PFUの野生型のHSV‐1を、Vero細胞に1時間感染またはモック感染(M)させ、洗浄し、薬物を含まない(ND)培養液、400μMのホスホノ酢酸、又は代表的な両親媒性のヌクレオシド誘導体であるdUYll(11)2μMを含む培養液を加えた。感染細胞の上清を感染後1時間、5時間、18時間又は24時間で回収し、DNAを単離して、アガロース電気泳動によって分離し、ニトロセルロース膜に転写し、HSV‐1の6kbのBamK断片を用いてハイブリダイゼーションを行った。サザンブロット分析(図2)は、感染後1時間、5時間、18時間と24時間の細胞外ウイルスDNAレベルを示している。dUYllはウイルスDNAの放出を阻害しなかった。これらの結果に基づくと、これらの両親媒性のヌクレオシド誘導体存在下においてウイルスDNAは複製され、感染した細胞から子孫ウイルスが放出される。
【0099】
III.両親媒性のヌクレオシド誘導体は成熟ウイルスの感染力を抑制する。
感染力とプラークアッセイ(図3)によりウイルス感染におけるdUY11の阻害特性が明らかとなった。HSV‐1接種液を2μMのdUY11(各パネルの左半分)又はDMSO媒体(各パネルの右半分)と共に0分間又は5分間、37℃で培養した。図(上のパネル)で示すように、処理したHSV‐1を0.5、5、50、500、5,000又は50,000PFUでVero細胞に感染させ、洗浄し、5%のウシ胎児血清(FBS)と2%のメチルセルロース(MC)を添加したダルベッコ変法イーグル培地(DMEM)を加えた。一番右のパネルに示されたサンプルは、dUY11非存在下で、未処理のウイルスを感染させ、2μMのdUY11を添加した1%MCを含むDMEM‐5%FBSを加えた(ポスト吸着)。dUYl1はウイルス感染力を阻害するが、ウイルス複製には影響がない。
【0100】
IV.抗ウイルス性の両親媒性ヌクレオシド誘導体の構造活性相関(SAR)試験
構造活性相関(SAR)試験には、抗ウイルス薬の発見において良好なモデルである単純ヘルペスウイルス1型(HSV‐1)の感染力における両親媒性、剛性及び分子形状の影響を調べることを適用した。図4は試験化合物の化学構造と三次元構造の直交図を示している。図5は異なる両親媒性ヌクレオシド誘導体の濃度に対してプロットしたHSV‐1の感染力の線グラフを示す。HSV‐1 KOS(200PFU)を0、2、7、20、70又は200μMのdUY2(黒丸)、dUY3(白い正方形)、dUY11(黒三角形)(A);dUY4(黒三角形)、dUY5(黒丸)、dUY6(白い正方形)、dUY8(白丸)(B);又は、dUY7(白丸)、dUY9(黒い正方形)、dUYl(白三角形)、aUYl(黒丸)(C)と共に、370Cで5分間インキュベートした。次に、事前に処理したウイルスをVero細胞に1時間感染させ、5%FBSと2%MCを添加した培養液で洗浄し、浸した。横軸の最大値は、(A)では70μM、(B)と(C)では200μMである。dUYll(C)で前処理されたウイルスの感染力の割合は、このスケールの軸に近すぎてほとんど見えない。エラーバーは3つ以上の実験の範囲を示している。剛性平面の疎水性部分を持つ逆円錐形の化合物間において、疎水性部分のサイズの減少は活性を低下させた(dUYll対dUY2,dUY3;図5A)。同じ大きさの疎水性誘導体をもつ化合物の活性は、逆円錐形状を弱める疎水性部分内の回転の柔軟性又は非平面性によって低下した(dUYl1対dUY4、dUY5、dUY6、dUY8;図5A,5B)。活性は、膜に逆円錐が適切に位置することを妨げるリンカー又は中心の疎水性部分内の2つの極性基によって壊された(dUY7,dUY9;図5C)。また、活性は1つの極性基によって阻害されたが、親水性部分の極性を上げることによって回復した(aUYl対dUYl;図5C)。疎水性部分の平面性と剛性と同様に両親媒性と逆円錐形は抗ウイルス活性のために重要である。
【0101】
V.HSV感染力におけるdUYll活性の特徴
図6は、dUYll濃度に対してHSV‐1感染力をプロットした線グラフである。HSV‐1 KOS(200PFU)を0,2,7,20,70,200又は700nMのdUY11とともに37℃で5分間インキュベートした。次に、そのようにして前処理したウイルスをVero細胞に1時間感染させ、5%FBS及び2%MCを添加した培養液で洗浄し、浸した。HSV‐1感染を50%阻害するdUY11濃度(IC50)は、グラフから20nMと算出された。エラーバーは10個の実験の範囲を示している。dUYllは、培養液中、ナノモル濃度範囲の低濃度で活性を示し、IC50は20nMであった。
【0102】
図7は、処理時間に対してHSV‐1感染力をプロットした線グラフである。HSV‐1 KOS(200PFU)を20nMのdUY11(IC50)とともに37℃で0,30,60,90,120,180,240又は300秒間インキュベートした。次に、そのようにして前処理したウイルスをVero細胞に1時間感染させ、5%FBS及び2%MCを添加した培養液で洗浄し、浸した。IC50値濃度のdUYllは220秒間で50%の感染を阻害した(図7)。エラーバーは2個の実験の範囲を示しているが、このスケールではほとんどのデータポイントで見えない。
【0103】
図8は、dUYl1濃度に対してHSV‐1感染力をプロットした線グラフである。HSV‐1 KOS(200PFU)を0,2,7,20,70,200又は700nMのdUY11とともに37℃で5分間インキュベートした。次に、そのようにして前処理したHSV‐1ウイルスをヒト包皮線維芽細胞(HFF)(黒丸)又はVero細胞(黒い正方形)に1時間感染させ、5%FBS及び2%MCを添加した培養液で洗浄し、浸した。IC50値はグラフからVero細胞では25nM、HFF細胞では20nMと算出された(A)。ウイルスが700nMのdUY11で前処理されたときには両細胞への感染は完全に阻害された(B)。エラーバーは3つ以上の実験の範囲を表す。予想されたように、dUYllによって処理されたウイルスはVero細胞とヒト包皮線維芽細胞で等しく非感染性であった。
【0104】
dUY11は生殖器感染からマウスを強く防御する非細胞障害性の化合物である(次のセクション参照)が、他にも2つのヌクレオシドベースの化合物が合成され、評価されている。修飾された化合物はddUYl1及びaUYl1と名づけられた(セクションI参照)。その化合物は培養細胞の感染でテストされた。aUYll及びddUYllともにdUYllとほぼ同じ活性を示し(表1)、いずれも細胞障害性はなかった。
【0105】
【表1】

【0106】
VI.dUYllは7,500以上の安全性指標を有し、主要な細胞増殖抑制作用もない。
2つのシリーズの実験は、dUYl1には細胞傷害又は細胞増殖抑制の作用がないことを明らかにした。最初の実験では、72時間の処理のうちdUYllを添加した新しい培養液に30分間だけ置き換えた。しかしながら、dUYllが細胞膜に局在していることが後で発見された(図9)。その結果、細胞膜あたりのdUYll分子の数は各細胞複製周期の後に半分減少すると考えられる。したがって、細胞毒性の分析を再度行い、24時間(これらの細胞のおよその倍加時間)ごとにdUYllを含む新しい培養液を加え、合計72時間曝露した。
【0107】
図10は、dUYllを曝露した時間に対して相対的な細胞数をプロットした線グラフである。Vero細胞を1時間モック感染させ、洗浄し、0(黒い正方形),7(黒三角),20(黒丸),70(白い正方形)又は150(白三角形)μMのdUY11を含む培養液で浸した。150μMは培養液中で長期間安定ではない。培養液は24時間ごとに0,7,20,70又は150μMのdUY11を添加した新しい培養液に置き換えた(上向きの矢印で示す)。24、48及び72時間に、生存及び非生存細胞をトリパンブルー色素排除試験で測定した。すべての時間のサンプルで非生存細胞の合計数は4%未満であった。エラーバーはOLE_LINK3OLE_LINK4(*)OLE_LINK3OLE_LINK4を除いて1つの実験の2サンプルの範囲を表す。(*)では1つの実験の1サンプルを2回数えた範囲を表す。dUYl1には細胞傷害性はなく、そのIC50値の7,500倍濃度以上でもわずかに細胞増殖抑制性が認められるだけであった。したがって、安全性指標(SI)は7,500以上であったが、dUY11を培養液中で均等に分散できた濃度(70,000nM以下)、又はより高濃度(150,000nM)でも細胞障害活性は50%に到達しなかったので、その値は算出できなかった。
【0108】
VII.両親媒性ヌクレオシド誘導体はウイルスの結合ではなく、ウイルスの侵入を阻害する。
感染前に両親媒性ヌクレオシド誘導体をHSV‐1ウイルスに前処理することによって感染は阻害された。したがって、これらのヌクレオシドは、例えば、細胞へのウイルスの結合を妨げることによってHSV‐1の感染力を阻害するかもしれない。あるいはまた、それらは細胞外ウイルスを破壊するのかもしれない(すなわち、殺ウイルス活性を持つ)。溶解したウイルスは細胞と結合しない。dUYl1で前処理されたHSV‐1ウイルスの結合性を評価した。図11は、HSV‐1の結合性(A)と感染力(B)を示す棒グラフとイメージ画像である。併行した試験では、[35]S‐メチオニンで標識(2.5×105PFUで、約4×105cpm)したHSV‐1 KOS(A)又は、非標識のHSV‐1 KOS(B)を、薬物なし(白棒)、7μMのdUYll(縞棒)又は100μg/mlヘパリン(黒棒)を用いて37℃で5分間、前処理した。次に、サンプルを氷で冷却した。サンプルを、薬物なし、7μMのdUYll又は100μg/mlヘパリンを添加した冷却無血清培地で希釈した(1:20,1:100)。そのようして前処理したウイルスをVero細胞に4℃で1時間感染させ、冷却した培養液で3回洗浄し、溶解した。結合したウイルスは液体シンチレーションによって定量化した。エラーバーは3つの実験の範囲を表す(A)。これらの結果に基づき、7μMのdUYllは感染を抑制した(図11B)が、ウイルス結合は阻害しなかった(図11A)。
【0109】
次に、dUYllの高親和性結合に影響する能力を評価した。図12は、ヘパリン濃度を増加したときの細胞へのHSV‐1結合の競合を示した線グラフである。[35]S‐メチオニン標識したHSV‐1(5×10PFUで約3.5×10cpm)を7μMのdUY11(黒い正方形)又は薬物なし(黒丸)により37℃で5分間前処理した。サンプルを氷中で冷却し、次いで、7μMのdUYllを加えた、又は加えなかった冷却無血清培地で希釈した(1:10)。Vero細胞に15分間吸着させた後、結合しなかったウイルスを洗浄した。さらに、低親和性結合のみによって結合しているウイルスを取り外すために結合したウイルスを0〜1,000μg/mlのヘパリンを添加した培養液を用いて1時間洗浄した。そして、これらの洗浄によって剥がれたウイルスを液体シンチレーションによって定量化した。エラーバーは2つの実験の範囲を表す。ヘパリンは、7μMのdUYllで前処理したHSV‐1ウイルスの結合及び未処理のウイルスの結合に有効に競合しなかった。このことは、前者のウイルスのほとんどが高親和性によって結合していることを示している(図12)。したがって、dUY11は殺ウイルス性ではなく、低親和性及び高親和性の結合のいずれも阻害しない。したがって、両親媒性ヌクレオシド誘導体は高親和性結合とウイルスDNA複製の間のステップを阻害する。
【0110】
次に、HSV‐1ウイルスの侵入におけるdUYl1の影響を調べた。HSV‐1ウイルスの侵入は、感染細胞へのVP16侵入などのいくつかの方法によって評価できる。VP16は、HSVの前初期(IE)遺伝子の転写活性に必要なHSV固有のウイルスタンパクである。したがって、VP16侵入は、HSV‐1 IEプロモーターで制御された細胞ゲノムに組み込まれた赤色蛍光タンパク(RFP)レポータ遺伝子を含む細胞を用いて評価できる。感染後のRFP発現は、VP16が核に到達したことを示す。したがって、そのことは、またHSVが細胞内に侵入したことを示している。
【0111】
図13は、HSV‐1 ICP0 IEプロモーターで制御される細胞ゲノムに組み込まれた赤色蛍光タンパク(RFP)レポータ遺伝子を含むVero細胞の赤色蛍光発現の図(A)と定量結果(B)を示している。DMSO媒体(左のパネル)又は2μMのdUY11(右のパネル)で前処理したHSV‐1 KOSウイルスを細胞に感染させた。図13Aに、24hpiにおける細胞を蛍光(上のパネル)又は可視光(下のパネル)で可視化した結果を示す。図13Bに、薬物なし、又はdUY11で前処理したUV不活性化HSV‐1 KOSウイルスを感染させた蛍光細胞の定量を示す(7つの実験のうち代表的な1つの実験で同様の細胞密度がある2つの顕微鏡視野から数えた)。
【0112】
HSV‐1 IEプロモーターの制御下でRFPを発現し、2μMのdUY11(結合を阻害しなかった濃度より3.5倍低い濃度)で前処理したHSV‐1ウイルスを感染させた細胞には蛍光は検出されなかった(図13)。したがって、dUY11は、ウイルス侵入の前で高親和性の結合後のステップを阻害する。この間で唯一知られているステップはウイルスエンベロープと細胞膜の融合である。
【0113】
VIII.両親媒性ヌクレオシド誘導体は、いくつかの他の関連のないエンベロープウイルスの感染を阻害する。
dUYllのターゲットがいくらかの保存された糖タンパクを有するウイルス間で保存されているかどうかを調べるために、HSVウイルス2型(HSV‐2)の2つの株におけるdUY11活性をテストした。ひとつ目は臨床的に単離された株であり、もう1つは実験室で適応させた株である(それぞれ、株186と株333)。dUYllのターゲットが遠縁のエンベロープウイルスのみに保存されているかどうかを調べるために、dUYll活性を水疱性口内炎ウイルス(VSV)及びシンドビス(SIN)でテストした。VSVとSINはHSV‐1又はHSV‐2で保存されていることが知られている糖タンパクがないRNAウイルスである。また、VSVとSINの糖タンパクはHSV‐1又はHSV‐2の糖タンパクとは異なった受容体を認識する。VSVのGタンパクは特異的な脂質であるホスファチジルセリンを認識し、結合する。一方、SINの糖タンパクはありふれた表面タンパクである高親和性ラミニン受容体に結合する。HSV‐1又はHSV‐2と異なり、VSVとSINは細胞膜と融合することにより取り込まれ、融合糖タンパク内での低いpHにより立体構造変換が誘導される。これらの立体構造変換により融合ペプチドが現れ、次に、融合ペプチドはターゲット膜に挿入され、ウイルスエンベロープ膜と細胞膜間の融合が誘引される。
【0114】
図14は、dUYll濃度に対するHSV‐1株KOS(黒丸)、HSV‐2株186(黒い正方形)、HSV‐2株333(白い正方形)、VSV(黒三角)又はSINウイルス(白三角)の感染力を示した線グラフである。ウイルス(200PFU)を0,0.007,0.02,0.07,0.2,0.7又は2μMのdUYllにより37℃で1時間インキュベートした。次いで、そのように前処理したウイルスをVero細胞に1時間感染させ、5%FBS及び2%MCを添加した培養液で洗浄し、浸した。IC50値はグラフより、VSVが6nM、HSV‐1が24nM、HSV‐2株186が49nM、SINが58nM、HSV‐2株333が65nMと算出された。エラーバーは2つ以上の実験の範囲を表す。dUYl1はHSV‐1と同様のIC50値で両方のHSV‐2株の感染を阻害し(図14)、このことは、dUY11のターゲットが保存された糖タンパク及びエンベロープの脂質組成を持つウイルス間で保存されていることを示している。また、dUY11は遠縁のエンベロープウイルスに対して同様のIC50値で阻害し、そのことは、dUY11のターゲットが非保存性のエンベロープタンパクを持つウイルス間でも保存されていることを示している。したがって、dUY11はその他の関連性の無いエンベロープウイルス間で保存されているウイルス融合のステップを阻害する。dUY11が高親和性の結合を阻害しないで、関連性の無いエンベロープウイルスの侵入を妨げることから、dUY11のターゲットはエンベロープの脂質二重膜と細胞間との融合であると考えられる。
【0115】
IX.両親媒性ヌクレオシド誘導体の主なターゲットは細胞膜ではなく、ウイルスエンベロープである。
ウイルスの取り込みにはウイルスエンベロープと細胞膜の2つの脂質二重膜間の融合が必要である。ウイルスをdUY11で前処理したときにウイルス感染が阻害された。したがって、このことはウイルスエンベロープがターゲットであることを示している。しかしながら、細胞膜もターゲットであるかもしれない。このシナリオにおいてdUYl1で前処理したウイルスは細胞膜内のターゲット部位に薬剤を輸送するであろう。そして、前処理した細胞は前処理したウイルスに比べてより効率的に感染を阻害するはずである。
【0116】
dUYllが、ウイルスエンベロープ又は細胞膜のどちらを優先的にターゲットとするかを確認するために実験を行った。図15は、dUY11濃度に対するHSV‐1 KOS感染力をプロットした線グラフである。HSV‐1 KOS(200PFU)を0,0.002,0.007,0.02,0.07,0.2,0.7,2,7,20又は70μMのdUY11とともに37℃で5分間インキュベートした。次に、そのようにして前処理したウイルスをVero細胞に1時間感染させ、5%のFBSと2%のMCを添加した培養液で洗浄し、浸した(黒い正方形)。あるいは、未処理のVero細胞(黒三角)、又は0,2,7,20、70μMのdUY11とともに37℃で60分に至るまで前処理したVero細胞(黒丸)に感染させるために未処理のウイルスサンプルを用いた。そして、前処理しなかった感染細胞を0,2,7,20又は70μMのdUY11と5%FBS及び2%MCを添加した培養液で浸した。グラフよりIC50値はウイルスの前処理で20nM(これらのスケールでは見えない)、細胞の前処理で5.4μM(A)と算出された。最大の阻害はウイルスの前処理で100%、細胞の前処理で75%であった(B)。x軸スケールの最大値は(A)で7μM、(B)で70μMである。エラーバーは3つ以上の実験の範囲を表す。
【0117】
感染前にウイルスを前処理したときにのみウイルス感染は完全に阻害された(IC50,20nM‐図15)。それに対して、細胞の前処理はHSV‐1の感染を減少させたが、270倍以上の高濃度で最大75%であった(IC50,5.4μM)。図3で示された結果と一致して、未処理のウイルスを感染させた後に、dUY11で細胞を処理してもHSV‐1の複製には影響はなかった。これらの結果は、両親媒性ヌクレオシド誘導体がターゲットとする主要な膜はウイルスエンベロープであることを示しており、さらに、これらの化合物がウイルスの複製を阻害しないことを証明する。
【0118】
X.両親媒性ヌクレオシド誘導体は処理された細胞から産生されるウイルスの感染を阻害する。
両親媒性化合物がウイルス膜と同様に細胞に挿入されるなら、それらは処理された細胞によって産生される子孫ウイルスの感染も阻害するかもしれない。図9はdUY11で処理され、膜の色素(PKH26)で染色されたモック感染細胞を示す。確かに、dUY11は細胞突起にはないが、原形質膜と細胞内膜に分布している。このことはdUY11が膜輸送を阻害しないことを示している。したがって、感染後に前記の化合物によって処理された感染細胞によって産生されたウイルスは未処理の細胞によって産生されるウイルスと同じようには、感染しないはずである。図16Aは、両親媒性ヌクレオシド誘導体で24時間処理した細胞によって産生されるウイルスの感染力低下を示し、薬物濃度に対してプロットした線グラフである。Vero細胞に3PFU/細胞の感染効率(MOI)でHSV‐1 KOSを感染させた。ウイルス接種源を除去した後、感染細胞を0,0.125,0.25,0.5,0.75,1,1.05,1.5,1.75又は2μMのdUYllで処理した。感染後24時間に細胞を回収し、ウイルス感染を標準のプラークアッセイによって評価した。エラーバーは3つ以上の実験の範囲を表す。dUY11存在下で産生されたウイルスは、未処理の細胞によって産生されたウイルスに比べて8桁低い感染力であった(図16A)。再度実験を行ったが、感染細胞へのdUY11の曝露をウイルス接種源の除去直後1時間だけに制限した(図16B)。細胞にHSV‐1を感染させ、感染細胞にdUYllをエンベロープ糖タンパクが発現する前である1時間だけ加えた。次に、感染細胞を薬物なしで22時間インキュベートし、子孫ウイルスの感染力を評価した。dUY11処理細胞から出芽したウイルスは、未処理の細胞から出芽したウイルスに比べて6桁低い感染力であった(図16B;IC50,3.9μM)。したがって、dUYllは膜脂質などウイルスに組み込まれている既存の細胞因子と相互作用する。
【0119】
処理された細胞によって産生されるウイルスの感染におけるdUY11の効果は、感染したウイルスが従来の抗ウイルス薬に対して感受性(すなわち、野生型)であるか、又は耐性であるかには関係がなかった。dUY11は、野生型、アシクロビル又はホスホノ酢酸耐性のHSV‐1耐性株(それぞれ、チミジンキナーゼ‐TK‐欠損株又はPAAr5株)に感染させた細胞によって産生されるウイルスの感染に対して等しく重要な抑制効果を持つ。
【0120】
図17は、異なった薬物で処理した細胞によって産生されるウイルスの感染力(又は、ウイルス力価)の低下を示し、ACV,PAA又はdUY11の濃度に対してプロットした線グラフである。3PFU/細胞のHSV‐1野生株(黒丸)、ACV耐性株(黒三角)、PAA耐性株(黒い正方形)をVero細胞に1時間感染させ、洗浄し、0,2.5,5,10,25又は50μMのACV(A)、0,25,50,100,250又は500μg/mlのPAA(B)、0,0.5,1.05,2又は10μMのdUY11(C)を含む培養液を加えた。24時間後に細胞を回収し、標準のプラークアッセイによりウイルス感染力(又は、ウイルス力価)を評価した。ウイルス感染力(又は、ウイルス力価)の低下は、異なる薬物で処理された細胞によって産生されるウイルスの感染力を、未処理の細胞によって産生されるウイルスの感染力で割ることによって算出した。エラーバーは2つの実験の範囲を表す。
【0121】
これらの実験は、さらに、両親媒性ヌクレオシド誘導体が、多くの他のヌクレオシド誘導体のようなウイルスDNAポリメラーゼのHSV‐1 TK又はピロリン酸結合部位(PAAのターゲット)をターゲットとしないことを証明している。
【0122】
XI.両親媒性ヌクレオシド誘導体のin vivo解析
本明細書に記載された両親媒性ヌクレオシド誘導体が、ウイルス伝播を阻害するかどうかを確認するために、性行為伝染ウイルス(HSV‐2)を用いた膣感染症モデルを使用した。1群5匹のマウスに70μMのdUY11又は溶媒に曝露した103又は3×l03のHSV‐2ウイルスを膣内に感染させた(図18A‐E及び図19A‐B)。図18A‐Eは、ウイルス排出、平均臨床スコア又は相対重量、溶媒(白い正方形)又はdUY11(黒い正方形)に曝露した1,000(点線)又は3,000(実線)のHSV‐2ウイルスを感染させた徴候マウス及び死亡マウスの累積数を示している。図19A‐Bは、すべての感染マウスの膣、会陰部位及び肛門の写真を示している。図19Aは、溶媒(左のパネル)又はdUY11(右のパネル)に曝露した3,000のHSV‐2ウイルスで感染させたマウスを示している。図19Bは、溶媒(左のパネル)又はdUY11(右のパネル)に曝露した1,000のHSV‐2ウイルスで感染させたマウスを示している。溶媒に曝露したウイルスを感染させたすべてのマウスが、感染後2〜4日目に104未満のウイルスを排出し、8日目まで低いレベルで推移し、明らかな感染の臨床的徴候が認められた(図18A‐D)。3×l03のウイルスを感染させた5匹すべてのマウス及び103のウイルスを感染させたマウスのうち3匹が病気の進行のため7〜9日目に安楽死させなければならなかった(図18Eと19A‐B)。dUYllに曝露した103又は3×l03のいずれかのウイルスを感染させた10匹のマウスは、すべて感染性ウイルスの排出は検出されず、臨床的徴候も認められなかった。したがって、dUYllはHSV‐2の膣感染を防御する。
【0123】
本明細書全体にわたって、様々な刊行物が参照される。これらの刊行物の開示は、本明細書に記載される本発明の化合物、組成物及び方法をより完全に記載するために、参照することによりその全体が本明細書中に組み込まれる。
【0124】
様々な変形及び変更を、本明細書に記載される本発明の化合物、組成物及び方法にすることができる。本明細書に記載された本発明の化合物、組成及び方法の他の実施態様は、本明細書に開示された本発明の化合物、組成及び方法の仕様及び実施の考察から明らかである。特定例及び実施例は例示であるとみなされることを意図する。
【特許請求の範囲】
【請求項1】
式Iを含む化合物であって、
X‐L‐Y (I)
式中、Xは糖類の残基を含み、
Lは平面状親水基を含むリンカーを含み、そして
Yは平面状疎水性基を含み、Yが直接又は間接的にLに結合している化合物;又は、
該化合物の薬学的に許容できる塩若しくはエステルであって、
X‐Lがデオキシウリジン又はその誘導体の残基ではない化合物。
【請求項2】
前記糖類が単糖又は二糖を含む請求項1に記載の化合物。
【請求項3】
前記糖類がアラビノースを含む請求項1に記載の化合物。
【請求項4】
前記リンカーがプリン又はピリミジン残基を含む請求項1に記載の化合物。
【請求項5】
前記リンカーがヒドロキシル化アリール基又はその誘導体を含む請求項1に記載の化合物。
【請求項6】
Yがアリール基を含む請求項1に記載の化合物。
【請求項7】
前記アリール基が置換又は非置換の縮合芳香族を含む請求項6に記載の化合物。
【請求項8】
式IIを含む化合物又はその誘導体であって、
【化1】

式中、Z1、Z2及びZ3は、互いに独立してH又はOHであり;
Lはプリン又はピリミジンを含み;そして、
Yはアリール基を含む請求項1に記載の化合物。
【請求項9】
式IIIA又はIIIBを含む化合物であって、
【化2】

式中、Z1、Z2及びZ3は、互いに独立してH又はOHであり、Yはアリール基を含む請求項1に記載の化合物。
【請求項10】
Yが3個以上のアリール環を有する縮合されたアリール基を含む請求項9に記載の化合物。
【請求項11】
前記アリール基が以下の構造を有し、
【化3】

式中、アリール基が置換又は非置換である請求項9に記載の化合物。
【請求項12】
式IIIAを有する化合物であって、
式中、Z1がOHであり、Z2とZ3が水素であり、Yが以下の化学式を有するアリール基であって、
【化4】

該アリール基が置換又は非置換である請求項9に記載の化合物。
【請求項13】
式IIIAを有する化合物であって、
式中、Z1、Z2及びZ3は水素であり、Yが以下の化学式を有するアリール基であって、
【化5】

該アリール基が置換又は非置換である請求項9に記載の化合物。
【請求項14】
式IIIAを有する化合物であって、
式中、Z1とZ3はOHであり、Z2は水素であり、Yが以下の化学式を有するアリール基であって、
【化6】

該アリール基が置換又は非置換である請求項9に記載の化合物。
【請求項15】
請求項1に記載の化合物及び薬学的に許容できる担体を含む医薬組成物。
【請求項16】
局所用組成物を含む請求項15に記載の組成物。
【請求項17】
感染細胞からのウイルスを防ぐための方法であって、
式Iを含む化合物又はその薬学的に許容できる塩若しくはエステルと、ウイルスとの接触を含み、
X‐L‐Y (I)
式中、Xは糖類の残基を含み、
Lは平面状親水基を含むリンカーを含み、そして
Yは平面状疎水性基を含み、Yが直接又は間接的にLに結合している方法。
【請求項18】
前記ウイルスが、単純ヘルペスウイルス1型、2型(HSV‐1,HSV‐2)、ポックスウイルス、インフルエンザウイルス、HIV、ヒトT細胞白血病ウイルス(HTLV)、エプスタイン‐バールウイルス(EBV)、ヒトサイトメガロウイルス(HCMV)、カポシ肉腫関連ヘルペスウイルス(KSHV)、水疱瘡ウイルス(VZV)、B型肝炎ウイルス、C型肝炎ウイルス、ポックスウイルス、エボラウイルス、マールブルグウイルス、パラインフルエンザウイルス、ヒト呼吸器多核体ウイルス、ヘンドラウイルス、ニパウイルス、流行性耳下腺炎ウイルス、麻疹ウイルス、ハンタウイルス、ブニヤウイルス、リフトバレー出血熱ウイルス、シンノンブレウイルスを含むアレナウイルス、狂犬病ウイルス、東部、西部及びベネズエラ脳炎ウイルス、西ナイルウイルス、黄熱病ウイルス、デングウイルス、日本及びセントルイス脳炎ウイルス、コロナウイルス(例えば、SARSウイルス)又は風疹ウイルスを含む請求項17に記載の方法。
【請求項19】
前記ウイルスがエンベロープウイルスである請求項17に記載の方法。
【請求項20】
被験体の感染からウイルスを防ぐための方法であって、
該被験体に効果的な量の式Iを含む化合物又はその薬学的に許容できる塩若しくはエステルを投与することを含み、
X‐L‐Y (I)
式中、Xは糖類の残基を含み、
Lは平面状親水基を含むリンカーを含み、そして
Yは平面状疎水性基を含み、Yが直接又は間接的にLに結合している方法。
【請求項21】
前記化合物が、感染部位又は感染の可能性のある部位に適用される請求項20に記載の方法。
【請求項22】
前記化合物が、前記被験体の前記感染部位に局所的に適用される請求項21に記載の方法。
【請求項23】
前記ウイルスが、性行為感染症に由来する請求項20に記載の方法。
【請求項24】
前記ウイルスが、呼吸器疾患に由来する請求項20に記載の方法。
【請求項25】
ウイルスに感染した被験体を治療する方法であって、
効果的な量の式Iを含む化合物又はその薬学的に許容できる塩若しくはエステルを投与することを含み、
X‐L‐Y (I)
式中、Xは糖類の残基を含み、
Lは平面状親水基を含むリンカーを含み、そして
Yは平面状疎水性基を含み、Yが直接又は間接的にLに結合している方法。
【請求項26】
前記化合物が前記被験体に経口で投与される請求項25に記載の方法。
【請求項27】
前記化合物が前記被験体に非経口で投与される請求項25に記載の方法。
【請求項28】
被験体の感染から環境中のウイルスを防ぐための方法であって、
式Iを含む化合物又はその薬学的に許容できる塩を用いた該環境の汚染除去を含み、
X‐L‐Y (I)
式中、Xは糖類の残基を含み、
Lは平面状親水基を含むリンカーを含み、そして
Yは平面状疎水性基を含み、Yが直接又は間接的にLに結合している方法。
【請求項29】
ウイルスを不活性化するための方法であって、
不活性化したいウイルスを、式Iを含む化合物又はその薬学的に許容できる塩に接触させることを含み、
X‐L‐Y (I)
式中、Xは糖類の残基を含み、
Lは平面状親水基を含むリンカーを含み、そして
Yは平面状疎水性基を含み、Yが直接又は間接的にLに結合している方法。
【請求項30】
不活性化された前記ウイルスをワクチンとして被験体に投与できる請求項29に記載の方法。
【請求項1】
式Iを含む化合物であって、
X‐L‐Y (I)
式中、Xは糖類の残基を含み、
Lは平面状親水基を含むリンカーを含み、そして
Yは平面状疎水性基を含み、Yが直接又は間接的にLに結合している化合物;又は、
該化合物の薬学的に許容できる塩若しくはエステルであって、
X‐Lがデオキシウリジン又はその誘導体の残基ではない化合物。
【請求項2】
前記糖類が単糖又は二糖を含む請求項1に記載の化合物。
【請求項3】
前記糖類がアラビノースを含む請求項1に記載の化合物。
【請求項4】
前記リンカーがプリン又はピリミジン残基を含む請求項1に記載の化合物。
【請求項5】
前記リンカーがヒドロキシル化アリール基又はその誘導体を含む請求項1に記載の化合物。
【請求項6】
Yがアリール基を含む請求項1に記載の化合物。
【請求項7】
前記アリール基が置換又は非置換の縮合芳香族を含む請求項6に記載の化合物。
【請求項8】
式IIを含む化合物又はその誘導体であって、
【化1】

式中、Z1、Z2及びZ3は、互いに独立してH又はOHであり;
Lはプリン又はピリミジンを含み;そして、
Yはアリール基を含む請求項1に記載の化合物。
【請求項9】
式IIIA又はIIIBを含む化合物であって、
【化2】

式中、Z1、Z2及びZ3は、互いに独立してH又はOHであり、Yはアリール基を含む請求項1に記載の化合物。
【請求項10】
Yが3個以上のアリール環を有する縮合されたアリール基を含む請求項9に記載の化合物。
【請求項11】
前記アリール基が以下の構造を有し、
【化3】

式中、アリール基が置換又は非置換である請求項9に記載の化合物。
【請求項12】
式IIIAを有する化合物であって、
式中、Z1がOHであり、Z2とZ3が水素であり、Yが以下の化学式を有するアリール基であって、
【化4】

該アリール基が置換又は非置換である請求項9に記載の化合物。
【請求項13】
式IIIAを有する化合物であって、
式中、Z1、Z2及びZ3は水素であり、Yが以下の化学式を有するアリール基であって、
【化5】

該アリール基が置換又は非置換である請求項9に記載の化合物。
【請求項14】
式IIIAを有する化合物であって、
式中、Z1とZ3はOHであり、Z2は水素であり、Yが以下の化学式を有するアリール基であって、
【化6】

該アリール基が置換又は非置換である請求項9に記載の化合物。
【請求項15】
請求項1に記載の化合物及び薬学的に許容できる担体を含む医薬組成物。
【請求項16】
局所用組成物を含む請求項15に記載の組成物。
【請求項17】
感染細胞からのウイルスを防ぐための方法であって、
式Iを含む化合物又はその薬学的に許容できる塩若しくはエステルと、ウイルスとの接触を含み、
X‐L‐Y (I)
式中、Xは糖類の残基を含み、
Lは平面状親水基を含むリンカーを含み、そして
Yは平面状疎水性基を含み、Yが直接又は間接的にLに結合している方法。
【請求項18】
前記ウイルスが、単純ヘルペスウイルス1型、2型(HSV‐1,HSV‐2)、ポックスウイルス、インフルエンザウイルス、HIV、ヒトT細胞白血病ウイルス(HTLV)、エプスタイン‐バールウイルス(EBV)、ヒトサイトメガロウイルス(HCMV)、カポシ肉腫関連ヘルペスウイルス(KSHV)、水疱瘡ウイルス(VZV)、B型肝炎ウイルス、C型肝炎ウイルス、ポックスウイルス、エボラウイルス、マールブルグウイルス、パラインフルエンザウイルス、ヒト呼吸器多核体ウイルス、ヘンドラウイルス、ニパウイルス、流行性耳下腺炎ウイルス、麻疹ウイルス、ハンタウイルス、ブニヤウイルス、リフトバレー出血熱ウイルス、シンノンブレウイルスを含むアレナウイルス、狂犬病ウイルス、東部、西部及びベネズエラ脳炎ウイルス、西ナイルウイルス、黄熱病ウイルス、デングウイルス、日本及びセントルイス脳炎ウイルス、コロナウイルス(例えば、SARSウイルス)又は風疹ウイルスを含む請求項17に記載の方法。
【請求項19】
前記ウイルスがエンベロープウイルスである請求項17に記載の方法。
【請求項20】
被験体の感染からウイルスを防ぐための方法であって、
該被験体に効果的な量の式Iを含む化合物又はその薬学的に許容できる塩若しくはエステルを投与することを含み、
X‐L‐Y (I)
式中、Xは糖類の残基を含み、
Lは平面状親水基を含むリンカーを含み、そして
Yは平面状疎水性基を含み、Yが直接又は間接的にLに結合している方法。
【請求項21】
前記化合物が、感染部位又は感染の可能性のある部位に適用される請求項20に記載の方法。
【請求項22】
前記化合物が、前記被験体の前記感染部位に局所的に適用される請求項21に記載の方法。
【請求項23】
前記ウイルスが、性行為感染症に由来する請求項20に記載の方法。
【請求項24】
前記ウイルスが、呼吸器疾患に由来する請求項20に記載の方法。
【請求項25】
ウイルスに感染した被験体を治療する方法であって、
効果的な量の式Iを含む化合物又はその薬学的に許容できる塩若しくはエステルを投与することを含み、
X‐L‐Y (I)
式中、Xは糖類の残基を含み、
Lは平面状親水基を含むリンカーを含み、そして
Yは平面状疎水性基を含み、Yが直接又は間接的にLに結合している方法。
【請求項26】
前記化合物が前記被験体に経口で投与される請求項25に記載の方法。
【請求項27】
前記化合物が前記被験体に非経口で投与される請求項25に記載の方法。
【請求項28】
被験体の感染から環境中のウイルスを防ぐための方法であって、
式Iを含む化合物又はその薬学的に許容できる塩を用いた該環境の汚染除去を含み、
X‐L‐Y (I)
式中、Xは糖類の残基を含み、
Lは平面状親水基を含むリンカーを含み、そして
Yは平面状疎水性基を含み、Yが直接又は間接的にLに結合している方法。
【請求項29】
ウイルスを不活性化するための方法であって、
不活性化したいウイルスを、式Iを含む化合物又はその薬学的に許容できる塩に接触させることを含み、
X‐L‐Y (I)
式中、Xは糖類の残基を含み、
Lは平面状親水基を含むリンカーを含み、そして
Yは平面状疎水性基を含み、Yが直接又は間接的にLに結合している方法。
【請求項30】
不活性化された前記ウイルスをワクチンとして被験体に投与できる請求項29に記載の方法。
【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図1】




【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図1】


【公表番号】特表2010−520191(P2010−520191A)
【公表日】平成22年6月10日(2010.6.10)
【国際特許分類】
【出願番号】特願2009−551286(P2009−551286)
【出願日】平成20年2月27日(2008.2.27)
【国際出願番号】PCT/IB2008/001625
【国際公開番号】WO2008/104893
【国際公開日】平成20年9月4日(2008.9.4)
【出願人】(509012980)ザ ガバナーズ オブ ザ ユニバーシティ オブ アルバータ (2)
【Fターム(参考)】
【公表日】平成22年6月10日(2010.6.10)
【国際特許分類】
【出願日】平成20年2月27日(2008.2.27)
【国際出願番号】PCT/IB2008/001625
【国際公開番号】WO2008/104893
【国際公開日】平成20年9月4日(2008.9.4)
【出願人】(509012980)ザ ガバナーズ オブ ザ ユニバーシティ オブ アルバータ (2)
【Fターム(参考)】
[ Back to top ]

