ウイルス複製の選択的不活性化のための方法
【課題】宿主細胞を害することなく、宿主に感染したウイルスによる宿主翻訳系を阻害することのできる薬剤をスクリーニングするための方法、組成物及びキットを提供する。
【解決手段】候補薬剤が、ウイルス感染条件下での宿主RNAと比較した場合のウイルスRNAの優先的翻訳を可能にするかもしくは回避させるウイルス性もしくは細胞性構成成分と相互作用するか否かを決定し、そしてその薬剤とその構成成分とのいずれかの相互作用がウイルスのRNAの翻訳レベルを減少するか否かを決定することにより、抗ウイルス剤についてのスクリーニング方法、及びそれに使用される組成物。
【解決手段】候補薬剤が、ウイルス感染条件下での宿主RNAと比較した場合のウイルスRNAの優先的翻訳を可能にするかもしくは回避させるウイルス性もしくは細胞性構成成分と相互作用するか否かを決定し、そしてその薬剤とその構成成分とのいずれかの相互作用がウイルスのRNAの翻訳レベルを減少するか否かを決定することにより、抗ウイルス剤についてのスクリーニング方法、及びそれに使用される組成物。
【発明の詳細な説明】
【発明の開示】
【0001】
本発明は、ウイルス感染の治療に有用な薬剤のスクリーニングのための方法、このようなスクリーニング方法を用いて同定される新規の薬剤、および抗ウイルス剤としてのそれらの使用に関する。
【0002】
発明の背景
現在ではウイルス感染を防除するのに多様な薬剤が用いられている。これらの薬剤にはインターフェロンが含まれ、これは所定の選択されるウイルス性疾患の防除においていくらかの効果を有する天然に存在する蛋白質である。その上AZTのような薬剤が、ウイルスHIV−1により生じ、一般的にはAIDSと呼ばれる免疫不全性疾患の防除に用いられている。
【0003】
非特許文献1(Drug and Market Development、Vol 3、No.9、pp.174−180(2/15/93))は、抗ウイルス性薬物の開発を記載している。それは以下のように述べている。
大半の感染の薬物治療時に遭遇する難題はウイルス感染と比較すると見劣りがしてしまう。例えば、少なくとも理論的には(そしてしばしば実際に)宿主を害することなく細菌を攻撃することが可能である。しかしながら細菌とは異なり、ウイルスは細胞内で複製し、そして複製のために宿主の細胞性機構を利用する。その結果、抗ウイルス性治療の開発は、好ましくはウイルスの死滅化もしくは少なくともウイルス複製の阻止と、宿主を害さないかもしくは悪くても最低限の損傷のみを与えることとの間の折衷案を意味することがしばしばであり、これは利得の可能性により判断することができる。
【0004】
それは、以下に示すことを含むウイルスに特異的な現象を標的化することができるということを述べており、それらは:
*細胞膜へのウイルスの結合および細胞内への侵入、
*ウイルスの脱コート化、
*ウイルスの核酸合成、
*ウイルスの蛋白質合成および成熟、ならびに
*感染性粒子の組み立ておよび放出、である。
【0005】
ウイルスの蛋白質合成に関して著者は、具体的に以下のような記述を行っている。
核酸合成とは対照的に、ウイスルの蛋白質合成は宿主リボソーム(リボソームはmRNAの蛋白質への翻訳に必須な細胞構造物である)および大抵は宿主由来の補足因子を利用する。その結果、一般的には蛋白質合成インヒビターは、それらが抗ウイルス性効果を発揮するものであるのと同様に宿主毒性を示すようでもある。しかしながらアンチセンスオリゴヌクレオチドは、ウイルスの蛋白質合成を特異的に阻害する点で価値あるものである可能性がある。簡潔に述べると、アンチセンスオリゴヌクレオチドはmRNA(センス鎖)に相補的な短いDNA断片であり、そしてmRNAに結合することによりmRNAが指令する蛋白質合成を妨げることができる。RNA分子もセンスDNA鎖(およびそれらに対応するmRNA)のものに相補的な配列を含むように構築されている。アンチセンス構築物はインビトロでのウイルス性蛋白質合成を阻害することが示されているものの、インビボでのそれらの有効性は未だ決定的に証明されてはいない。オリゴヌクレオチド療法のための最近の試みにはとりわけ、ウイルス感染化細胞への輸送、インビボでのこのような分子の安定性、および体中全体への拡散が含まれる。
【0006】
リボソーム不活化因子は、ウイルス性蛋白質合成阻害のための他の研究方法を意味する。GLQ223(Genelabs社;Redwood City、CA)は、臨床試験中のリボソーム不活化因子である(GLQ223はトリコサンチン(キュウリ植物の誘導体)の精製製剤である)。リボソーム不活化因子は細胞の翻訳機構を邪魔して新規のウイルス蛋白質の産生を効果的に妨害するであろう。
【0007】
非特許文献2(Sonenburg、2 The New Biologist 402、1990)は、翻訳開始のレベルでのウイルス宿主相互作用を記載しており、そして2つの開始因子eIF−2およびeIF−4Fが数々のウイルス宿主相互作用における有意な役割を担っていることを述べている。彼は、「これらのウイルス−宿主相互作用の原因となる機構の理解はウイルス性疾患の将来の治療的研究方法にとっては非常に重大なものである」と述べている。
【非特許文献1】Drug and Market Development、Vol 3、No.9、pp.174−180(2/15/93)
【非特許文献2】Sonenburg、2 The New Biologist 402、1990
【0008】
発明の概要
本発明は、宿主細胞の感染中にウイルスにより使用される翻訳系を阻害するのに有効な薬剤をスクリーニングするための方法に関する。このスクリーニング方法は、有用である可能性のある薬剤を適切な巨大分子配列、例えばウイルス核酸配列もしくは関連蛋白質配列と接触させ、これらの薬剤がこれらの配列の使用を特異的に阻害しうるか否かを決定するプロトコールを利用する。ウイルスは宿主の翻訳系を借用するために多様な方法を使用し、そして本発明の方法により特異的に標的化することができるのはこれらの方法である。いったん単離したら、ウイルス特異的な薬剤を薬剤学的に許容される製剤中の治療的製品(もしくは予防的製品にさえ)に製剤することができ、そして未感染のウイルス宿主細胞に影響をほとんど及ぼさないかもしくは全く及ぼさずにウイルス性疾患の特異的治療に用いることができる。
【0009】
具体的には、一つの態様においては出願者は、宿主RNAに勝るウイルス性RNAの優先的翻訳の原因となる標的ウイルス核酸配列もしくはドメインを選択プロトコールに用いるスクリーニング方法を提供する。このようなウイルス核酸配列もしくはドメインの数々の具体例を、IRES要素、特異的ウイルス配列を含む5’−非翻訳領域、およびこのような配列を含む上流読み取り枠の形態で以下に提供するが、これらは他のウイルス核酸配列をこのようなプロトコールにおいて用いることができる一般方法を例示するためのみに用られるに過ぎない。細胞翻訳系内でのこれらのウイルス核酸配列の内のいずれか一つの使用は、抗ウイルス剤を発見することができる手法を提供する。
【0010】
出願人は、特許請求される方法は、Dinman and Wichner、66 J.Virol.3669、1992;Jacke et al.、331 Nature 280、1988;Wilson et al.、55 Cell 1159、1988;Inglis and Brierly、国際公開第90/14422号;およびGoodchild and Zamecnik、国際公開第87/09300号により記載されるようなフレームシフトに係わるウイルス性配列(これは、本明細書に特定される優先的に翻訳される標的核酸ではない)に対する薬剤の標的化を含みはしないということを特筆する。
【0011】
このようなウイルス核酸に結合し、そして/またはウイルス性メッセージの翻訳の有意な減少を引き起こすいずれかの薬剤は、本発明に有用である可能性がある。このような薬剤をスクリーニングして、それらがウイルス翻訳系に特異的であり、かつ未感染宿主細胞翻訳系に何の影響も及ぼさず、そのためこの薬剤を治療的もしくは予防的様式で使用することができるということを確認することができる。このような薬剤が宿主細胞系にいくらかの影響を有する場合であっても、これらはなおも、特にHIV−1感染のような命を脅かす疾患における治療的処置に有効であることが可能である。
【0012】
このような薬剤は、標的ウイルス核酸と直接的に相互作用することができるか、あるいは宿主RNAよりはむしろウイルスRNAの翻訳を充進するためにウイルスにより用いられる蛋白質のようなウイルス翻訳系の他の構成成分(すなわち、インビボでウイルスmRNAの翻訳を起こさせる核酸および/または蛋白質のいずれにせよ宿主および/またはウイルス構成成分のものである)と結合もしくは相互作用することができるかのいずれかである。しかしながら出願人は、有用な抗ウイルス剤として更に容易に製剤することかできる低分子量(10,000未満、好ましくは5,000未満、そして最も好ましくは1,000未満)の薬剤の同定を特に考慮している。従ってある好ましい態様においては、本発明はこのような低分子量の薬剤を特徴とする。
【0013】
従って第一態様においては、本発明は、抗ウイルス剤についてのスクリーニングのための方法を特徴とする。この方法には、ウイルス感染条件下での宿主RNAに比較するウイルスRNAの優先的翻訳を可能にする標的ウイルス翻訳核酸配列を提供することが含まれる。この方法は、この核酸へのある薬剤の結合を検出するための単純なアッセイを必要とすることがある。しかしながら標的ウイルス翻訳核酸配列はレポーターポリペプチドをコードするRNAに翻訳的に連結されることが好ましい。次にこの方法は、その薬剤の非存在下でのレポーターポリペプチドの合成を可能にする条件下で、標的ウイルス翻訳核酸配列を有望な抗ウイルス剤と接触させることを更に含む。この方法は最後に、その薬剤がレポーターポリペプチドの翻訳レベルを減少するか否かを決定することを含む。このレベルを減少させるいずれかの薬剤は有用な抗ウイルス剤である可能性がある。
【0014】
具体的にはこの方法は、ウイルス感染条件下で宿主RNAと比較するウイルスRNAの優先的翻訳を可能にするもしくは妨害するウイルス性もしくは細胞性構成成分と、ある有望な薬剤が相互作用を行うか否かを決定すること、ならびにその薬剤とその構成成分との相互作用がウイルスのRNAの翻訳レベルを減少させるか否かを決定することを含む。
【0015】
「スクリーニング」とは、多数の有用である可能性のある薬剤が本発明の方法で処理されるある過程を意味することが好ましい。これは一般的には、単一の薬剤を詳細に研究してその作用方法を決定する単一実験とは異なる過程である。
【0016】
標的ウイルス翻訳核酸配列とは、ウイルス感染条件下での翻訳に関連するRNAの優先的翻訳を可能にするいずれかの核酸を意味する。このような核酸は、関連するリボ核酸のキャップ非依存的翻訳を可能にするIRES要素、および関連するRNAのキャップ依存的な優先的翻訳を可能にするインフルエンザウイルスRNAの5’非翻訳領域により例示される。
【0017】
優先的翻訳とは、RNAが、ウイルス感染条件下で宿主細胞RNAより速く翻訳されるかまたはより高い収率の蛋白質で翻訳されることを意味する。さらに、宿主細胞RNAは、非感染条件下と比較してより遅い速度で翻訳されるかまたはより低い蛋白質収率で翻訳されるであろう。このような優先的翻訳は以下に記載されるように容易に検出することができる。大半のウイルスの場合では、ウイルス性蛋白質の優先的発現は、ウイルス性蛋白質の合成が、例えばウイルス感染化細胞におけるパルスラベル実験により検出されるように、少なくとも50%のデノボ総蛋白質合成を表すことを意味する。このような場合、ラベル化蛋白質をゲル電気泳動により分離したときウイルス蛋白質は通常主要バンドとして区別することができる。レトロウイルスの場合ではウイルス性蛋白質の優先的発現は、合成されるウイルス性蛋白質のレベルが合成されるウイルスRNAのレベルを不均衡に上回ること意味する(Cullen、Cell 46:973、1986)。このような不均衡な増加は、例えばRNA合成についてのノザンブロットおよびヌクレアーゼ保護アッセイ、ならびにラベル化蛋白質についての免疫沈降およびゲル電気泳動により、感染化細胞内におけるウイルス性RNAおよび蛋白質合成のレベルを定量することにより検出することができる。
【0018】
ウイルス感染条件とは単純にウイルスの翻訳系が作動するような標的ウイルスでの感染後の宿主細胞内での条件を意味する。このようなウイルス翻訳系は通常は宿主細胞蛋白質、核酸、および他の構成成分を含む。
レポーターポリペプチドとは単純に、所定の環境条件下における比色分析シグナルか、あるいは以下に記載するような通常の当業者によく知られる幾つかの他のシグナルのいずれかを提供することにより容易に検出可能なペプチドを意味する。
【0019】
好ましい態様においてはこの構成成分は蛋白質もしくは核酸であり、この構成成分はウイルスによりコードされるかもしくは宿主細胞によりコードされ、この構成成分はRNA配列ドメイン、DNA配列ドメイン、開始因子および伸長因子、停止因子、転写因子、リボソーム蛋白質、グリコシラーゼ、デグリコシラーゼ、ピレニル化および脱ピレニル化用酵素、トランスフェラーゼ、ポリメラーゼ、シンセターゼ、ADPリボシル化用酵素、ADPリボシラーゼ、キナーゼ、リパーゼ、ミリスチル化もしくは脱ミリスチル化用酵素、ホスホリラーゼ、プロテアーゼ、rRNA、tRNA、リボヌクレアーゼ、およびデオキシリボヌクレオアーゼから選択される巨大分子であり、ウイルス翻訳シグナル核酸配列は、IRES要素、5’もしくは3’非翻訳領域、および上流読み取り枠、もしくは宿主細胞がウイルスにより感染する際の宿主細胞mRNAに勝るウイルスmRNAの優先的翻訳を可能にするいずれかの他のウイルス標的翻訳核酸からなる群より選択され、そしてシグナルが選択されるウイルスは、ピコルナウイルスファミリー、A型、B型、およびC型肝炎ウイルス、インフルエンザウイルス、HIV、ヘルペスウイルス、およびサイトメガロウイルスから選択される。
【0020】
他の好ましい態様においては、配列ドメインはレポーターポリペプチドをコードするRNAに翻訳的に連結されており、そして第二決定段階はその薬剤がレポーターポリペプチドの翻訳レベルを変化させるか否かを決定することを含み、この構成成分は蛋白質もしくはポリペプチドであり、そしてこの決定段階は翻訳混合物中の構成成分にレポーターポリペプチドをコードするRNAを提供すること、およびその薬剤がこのミックス中のそのレポーターポリペプチドの発現を変化させるか否かを決定することを含む。
【0021】
より好ましい態様においては、この方法は更に、先の方法で活性な薬剤が非感染ウイルス宿主細胞の翻訳機構にほとんど影響を及ぼさないもしくは全く影響を及ぼさないか否かを決定し、そして更にその薬剤がインビボ条件下で活性であるか否かを決定することを含む。このような薬剤をその後に薬剤学的に許容される緩衝液中で製剤する。
【0022】
薬剤学的に許容される緩衝液とは、保存およびその後の投与のために調製される薬剤学的組成物中に用いることができ、薬剤学的に許容される担体もしくは賦形剤中に本明細書に記載される薬剤の薬剤学的有効量を含むいずれかの緩衝液を意味する。治療的使用のための許容される担体もしくは賦形剤は薬剤学的技術においてよく知られており、かつ例えばRemington’s Pharmaceutical Science、Mack Publishing Co.(A.R.Gennaro edit、1985)に記載される。保存料、安定化剤、色素、および矯味・矯臭剤さえもこの薬剤学的組成物中に提供することができる。例えば、安息香酸ナトリウム、ソルビン酸、およびp−ヒドロキシ安息香酸のエステルを保存料として添加することができる。同書物の1449頁。その上酸化防止剤および懸濁用試薬を使用することができる。同書物。
【0023】
第二態様においては、本発明は、ウイルス翻訳シグナル核酸配列を有するウイルスに感染している被検体を、ウイルス翻訳シグナル核酸配列に生来関連するウイルスRNAの翻訳を選択的に遮断することが可能な抗ウイルス剤の治療学的有効量をその被検体に投与することにより治療するための方法を特徴とする。
「治療学的有効量」とは、患者の疾患もしくは状態の内の一つもしくは複数の症状を緩和する(ある程度)量を意味する。その上「治療学的有効量」とは、ウイルス性疾患に関連するか、あるいはその原因である生理学的もしくは生化学的パラメータを部分的かもしくは完全かのいずれかで正常にもどす量を意味する。一般的にはこれはその分子の約1nモルと1_モルの間の量であり、そのEC50、ならびに患者に関連する年齢、サイズ、および疾患に依存する。
【0024】
第三の関連態様においては、本発明は、先に記載される方法により発見される新規の抗ウイルス剤を特徴とする。この態様はまた、先に記載されるように発見され、かつ薬剤学的に許容される製剤中に製剤される抗ウイルス剤を含む新規の薬剤学的組成物をも含む。
第四態様においては、本発明は、抗ウイルス剤を発見するためのレポーターコード化配列に翻訳的に連結される単離ウイルス核酸を含む核酸構築物の使用、および抗ウイルス剤スクリーニング方法におけるこれらの構築物の使用のためのキットを特徴とする。
【0025】
第五態様においては、本発明は、ウイルスmRNA翻訳系に関連する他の非核酸巨大分子の活性を調節する活性について抗ウイルス剤をスクリーニングする方法を特徴とする。例えば、薬剤をスクリーニングするための方法には、ある細胞中のp68キナーゼにその活性を発現させることができる試薬を例とするように、そのような巨大分子の活性を妨害するという点で巨大分子を阻害するのに役立つものを同定することを含む。本発明はまた、真核生物宿主細胞内のウイルスの複製を阻害するためにそのような薬剤を利用する方法を特徴とする。
【0026】
従って本発明は宿主真核生物細胞内におけるウイルス複製を阻害する方法を含み、この場合例えばこのウイルスは、宿主細胞のインターフェロン誘導化二本鎖RNA活性化プロテインキナーゼの活性化を妨害するウイルス性インヒビターを産生する。この方法は、細胞に対して、プロテインキナーゼの活性化を妨害するという点でのウイルス性インヒビターの効果を遮断することが可能な薬剤を投与することを含む。
【0027】
関連態様においては、本発明は、プロテインキナーゼへの二本鎖RNAの結合を遮断することが可能なウイルス性インヒビターを産生するウイルスを特徴とし、そして投与される薬剤は、プロテインキナーゼへのウイルス性インヒビターの結合を遮断することが可能なものである。
この薬剤は、例えば、プロテインキナーゼ、ウイルス性インヒビター、およびその薬剤からなる混合物を形成し、その混合物の構成成分をウイルス性インヒビターの非存在下でのそのプロテインキナーゼの自己リン酸化に有効な条件下でインキュベートし、そのプロテインキナーゼ活性の存在についてその混合物を調査し、そしてその薬剤がプロテインキナーゼ活性の阻害を妨害可能である際にはそれを選択することにより、選択することができる。
【0028】
具体的態様においては、このウイルスがアデノウイルスであり、かつウイルス性インヒビターがVAI RNA分子(VA1およびVA RNAIとしても知られる)であり;このウイルスがヒトの免疫不全症ウイルス(HIV)であり、かつウイルス性インヒビターがHIVゲノムのTAR領域であり;そしてこのウイルスがエプスタイン−バール(Epstein−Barr)ウイルスであり、かつウイルス性インヒビターがEBER−1 RNAである。
他の関連態様においては、ウイルス性インヒビターは、活性化形態においてプロテインキナーゼの活性化を遮断することができるか、あるいは既に活性化されているプロテインキナーゼの活性を遮断することが可能である宿主細胞のp58蛋白質を活性化するのに有効であり、そしてこの薬剤はp58蛋白質を介するキナーゼに対するウイルス性インヒビターの相互作用を遮断するものである。この薬剤は例えば、プロテインキナーゼ、p58蛋白質(活性形態)、およびその薬剤からなる混合物を形成し、そしてその後にその混合物の構成成分をp58蛋白質の非存在下でのそのプロテインキナーゼを自己リン酸化するのに有効な条件下でインキュベートし、その混合物をプロテインキナーゼ活性の存在について調査し、そしてその薬剤がp58が存在する際にプロテインキナーゼ活性の阻害を減少することが可能である場合にそれを選択することにより、選択することができる。
【0029】
他の関連態様においては、本発明は、宿主真核生物細胞内でのウイルス複製を阻害するのに有効な薬剤をスクリーニングするための方法を含み、この場合ではウイルスは、宿主細胞のインターフェロン誘導化二本鎖RNA活性化プロテインキナーゼの活性化を妨害するウイルス性インヒビターを産生することが可能であるものである。この方法は、そのプロテインキナーゼ、ウイルス性インヒビター、およびその検査されるべき薬剤を含む混合物を、そのウイルス性インヒビターがそのプロテインキナーゼの活性化を妨害するのに有効な条件下でインキュベートし、そして混合物におけるそのような妨害についての調査を行うことを含む。
他の関連態様においては、本発明の方法を、活性化形態においてはプロテインキナーゼの自己リン酸化を遮断するか、あるいはリン酸化されているキナーゼの活性を遮断するのに有効であるp58宿主蛋白質を活性化するのに有効であるウイルス性インヒビターを産生するウイルスのウイルス複製を遮断するのに有効な薬剤をスクリーニングするのに使用する。ここでは形成される混合物はp58宿主細胞蛋白質を含み、インキュベーション段階をこのプロテインキナーゼがp58の非存在下で自己リン酸化されるであろう条件下で実施し、そしてこの混合物をプロテインキナーゼ活性の阻害の減少について調査する。
【0030】
更に他の好ましい態様においては、本発明の方法は、(i)ウイルスmRNA構築物(このmRNA構築物は(a)内部リボソーム貫入部位(IRES)領域およびそのIRES領域の下流、第一レポーター蛋白質コーディング領域を含む)、(ii)リボソーム、および(iii)検査されるべき薬剤を含む蛋白質翻訳混合物を形成し、その翻訳混合物の構成成分を第一レポーター蛋白質コーディング領域からレポーター蛋白質を産生するのに有効な条件下でインキュベートし、そしてその混合物をこのような翻訳混合物により産生されるレポーター蛋白質の存在について調査することを含み、そしてこの薬剤の存在下で産生されるレポーター蛋白質がテスト薬剤の非存在下で産生されるレポーター蛋白質の量を下回る場合にはこの薬剤は有用な抗ウイルス剤である。
【0031】
このIRES領域がピコルナウイルスのIRES領域配列から取得され、このIRES配列が、エンテロウイルス、リノウイルス、カルジオウイルス、およびアフトウイルスのIRESA配列からなる群より選択され、このIRES領域が、A型肝炎ウイルスのIRES配列、B型肝炎ウイルス配列、およびC型肝炎ウイルスのIRES配列からなる群より選択され、この蛋白質翻訳混合物が無細胞抽出物であり、ウイルスmRNA構築物の5’末端が真核生物のmRNAの5’末端キャップおよび非翻訳領域(UTR)、ならびにそのキャップおよびUTR領域の下流、第二レポーター蛋白質を含み、そしてその翻訳混合物が、ある細胞中に含まれることが好ましい。
関連態様においては、この薬剤は宿主真核生物細胞内のウイルス複製を阻害するのに有効であり、この場合この宿主細胞は宿主細胞のインターフェロン誘導化二本鎖RNA活性化プロテインキナーゼの活性化を妨害するインヒビターを産生し、そしてこの方法は、プロテインキナーゼ、インヒビター、および検査されるべき薬剤を含む混合物を、インヒビターがプロテインキナーゼの活性化を妨害するのに有効な条件下でインキュベートし、そしてその混合物をそのような妨害について調査することを含む。
【0032】
この方法が、活性化形態においてはプロテインキナーゼの活性もしくは活性化を遮断するのに有効なp58宿主細胞蛋白質を活性化するのに有効なインヒビターを産生するウイルスのウイルス複製を遮断するのに有効な薬剤をスクリーニングすることにおける使用のためのものであり、そして形成される混合物がp58宿主細胞蛋白質を含み、そしてインキュベーションをこのプロテインキナーゼがp58の非存在下で活性化される条件下で実施し、そして調査はプロテインキナーゼ活性の阻害についてのその混合物の調査を含むことが好ましい。
本発明の他の特徴および利点は本発明の好ましい態様の以下の記載、および請求の範囲から明らかになるであろう。
【0033】
好ましい態様の説明
抗ウイルス剤
細菌のような一層複雑な生物体により生じる感染を治療するのに利用可能な多数の薬物があるとすると、いかに少数の薬物がウイルスとして知られる比較的単純な生物体の感染を治療するのに利用可能であるかが明白となる。実際に、大半のウイルス性疾患は本質的には未治療のままである。抗ウイルス剤の開発における主要な難題は、細菌とは異なり、ウイルスは宿主細胞内で複製し、そしてそれらの細胞の機構を複製のために利用して、それらの宿主と多くの栄養要求性および合成経路を共有することである。その結果、宿主までを害することなくウイルスの複製を撲滅もしくは停止させる薬剤を同定することは困難である。ヒトにおける使用のために認可されている抗ウイルス剤でさえも、それらの利用性を制限する副作用を有することがしばしばである。
【0034】
現存する抗ウイルス剤の大部分のものがヌクレオシドアナログ、あるいはヌクレオシドキナーゼあるいはポリメラーゼもしくはリバーストランスクリプターゼのような、ウイルス性遺伝物質の新しいコピーを産生するのに必要な酵素を介してそれらの効果を働かせる他の薬剤である。これらのアナログは典型的にはヌクレオチドアナログへと代謝され、これは例えばポリメラーゼを阻害するか、もしくはウイルス核酸の増殖の未成熟な鎖停止を生じることによりウイルス核酸の産生を阻害する。しかしながらウイルスと細胞の核酸代謝は非常に類似するため、ある程度宿主細胞酵素により用いられることがない抗ウイルス剤を発見することは困難である。このことが耐性であることが可能な抗ウイルス剤の用量を制限し、このことが次にはこの薬物の利用性を制限する可能性がある。
【0035】
ある薬物が有効用量で耐性を示す場合においてさえ、その有効性は、比較的迅速に突然変異を起こして同じように有効にはその薬物を利用せず、またはその薬物によりさほど阻害されない新版のウイルス酵素を進化させるウイルスの能力により著しく減少されることがある。
従って宿主による耐性が示される用量で効果的であり、かつウイルスにとって突然変異による回避を行うことがより困難であろう新規の抗ウイルス剤についての明確な必要性が存在する。
【0036】
本発明は、このような薬物を発見するため、かつ発見した薬物で疾病を治療するための新規の方法を提供する。本発明の方法は、ウイルスが感染する細胞内での蛋白質合成(メッセンジャーRNAの翻訳)の制御を多くのウイルスが借用するという所見に基づく。ウイルス性蛋白質は感染化宿主内において宿主蛋白質に勝って優先的に合成される。ウイルス性蛋白質のこの優先的合成はウイルスの複製にとって重要である。従って、蛋白質合成のウイルスの借用を減少もしくは予防する薬物が有効な抗ウイルス剤である。
【0037】
このような薬物は現行の抗ウイルス剤に勝る有意な利点を有する。先に記載するように、後者の大部分のものにとっての標的はウイルス核酸の合成に必要とされる酵素であり、そして宿主もまた核酸合成に作用する酵素を含むため、宿主のものをも攻撃することなくウイルスの酵素を攻撃することは困難である。類似の問題が、ウイルスおよび宿主細胞の両方により必要とされる物質の合成における活性触媒であるいずれかの薬剤標的について生じるらしい。本発明の方法においては、その薬剤の標的は合成経路内の活性触媒ではないために、これらの問題は回避される。それらの標的は、そのような経路内の触媒よりはむしろ合成経路(蛋白質合成)への優先的接近を確実に行うためウイルスにより用いられる装置である。ウイルスの宿主の攻撃の際にウイルスにより用いられる武器として、これらの装置は宿主内に類似物を有さない。従って、これらの装置を妨害する薬物は宿主において最少の副作用を有する。
【0038】
このような薬物は、2つの理由のために現行の薬物よりも更に有効である。第一に、これらの最少副作用は、それらより高い用量でこれらを使用することを可能にする。第二に、これらの薬物は、その標的が宿主相同物を有する薬剤について耐性であるよりはそれらの標的に対して本質的により障害的であることが可能であり、これは後者の薬剤の障害性が本質的に強すぎる場合には、それらは宿主相同物をある程度害することがあるためである。
ウイルスはまた、ウイルスの翻訳略奪装置を標的にする薬物に対する抵抗性を進化させることがさほど可能ではない。これらの装置は蛋白質合成に関連する宿主細胞構成成分との相互作用を必要とするはずであり、そしてこれらの相互作用を保持することの必要性は、ウイルスはそれらがその略奪用装置を突然変異させることが可能な範囲内にウイルスが制限されることを意味する。ウイルスがある薬剤を回避するために余りにもかけ離れて突然変異する場合には、ウイルスはもはや蛋白質合成を略奪することができないであろう。この制限はウイルスにとっては殊に問題となるものである。これは先に記載するように、略奪遮断剤は本質的にその標的に対して一層障害的である可能性があるため、ウイルスは略奪遮断剤を回避するためには、その標的が宿主相同物を有する合成酵素である薬物を回避するよりは一層大きな変化を必要とする可能性があるためである。
まとめると、本発明は現行のこのような薬物に勝る重要な利点、すなわち一層少ない副作用を有し、耐性ウイルスの進化の可能性が少ない新規の抗ウイルス剤を発見および利用するための手段を提供する。
【0039】
本発明の方法は、多くのウイルスはそれらが感染する細胞内の蛋白質合成の過程(mRNAの翻訳)の調節を借用するという所見に基づく。ウイルスは、ウイルスRNAの優先的翻訳を確実にする特別なウイルス核酸配列の使用(例えば、Pelletier et al.、Mol.Cell.Biol、8、1103−1112、1988;Trono et al.、Science 241、445−448;Sonenberg & Meerovitch、1990;Garfinkel & Katze、J.Biol.Chem.267、9383−9390、1992、を参照せよ)、これらの特別な配列との相互作用への細胞性蛋白質の補充(例えば、Jang SK & Wimmer E、Genes Dev.4、1560−1572、1990、を参照せよ)、翻訳もしくはその調節に関与する宿主細胞構成成分の修飾もしくは分解(例えば、Katze MG et al.、J.Virology 62、3710−3717、1988、Lee et al.、Proc.Natl.Acad.Sci.USA 87、6208−6212、1990、を参照せよ)、ならびに感染に反応して開始する細胞性防御の無能化(例えば、Katze MG、J.Interferon Res.12、241−248、1992、を参照せよ)、を初めとするがこれらには限定されない多様な機構を使用してこの借用を実施する。感染化細胞中の宿主細胞蛋白質と比較してウイルス蛋白質の優先的翻訳を確実にするためウイルスにより使用されるいずれかのこのような機構に本発明の方法を対応させることができる。
【0040】
これらの方法は、ウイルスにより用いられる、(i)p68プロテインキナーゼおよびインターフェロン誘導化二本鎖RNA活性化プロテインキナーゼを初めとする多様な名称により知られる宿主酵素のウイルス妨害、および(ii)ウイルスRNAの優先的翻訳の原因となるウイルス核酸配列、の2つの機構の記載により本明細書に例示される。これらの例の使用は、決して本発明の範囲を制限することを意図するものではない。
【0041】
p68プロテインキナーゼとして知られる蛋白質はインターフェロン誘導化二本鎖RNA活性化プロテインキナーゼである。このキナーゼは、典型的にはウイルス感染化細胞内に見いだされる二本鎖RNAにより活性化される。いったん活性化されたら、このキナーゼは開始因子eIF−2のアルファーサブユニットをリン酸化し、この現象は迅速に翻訳の開始段階を遮断するに至る。この効果は細胞中の蛋白質合成を遮断して細胞を死に追いやることであり、これは多細胞感染化生物体は耐えられるが、ウイルスは耐えられないものである。感染化細胞中の継続的翻訳を確実に行うためには、様々なウイルスがp68キナーゼの活性化を回避もしくは中和する様々な機構を進化させている(Katze、1992、中に総説が書かれている)。これらには、アデノウイルス(Mathews MB & Shenk T.、J.Virology 65、5657−5662、により総説が書かれている)、HIV(Edery et al.、Cell56、303−312、1989;Gunnery et al.、Proc.Natl.Acad.Sci.USA 87、8687−8691、1990;Roy et al.、J.Virology 65、632−640、1991)、およびエプスタイン−バールウイルス(Clarke et al.、Eur.J.Biochem 193、635−641、1990;Clarke et al.、Nucl.Acids Res.19、243−248、1991)により用いられ、そのキナーゼに結合し、かつ二本鎖RNA活性化因子の結合を回避させるウイルス性RNA、ワクシニアウイルスおよびレオウイルス(Watson et al.、Virology 185、206−216、1991;Imai and Jacobs、Proc.Natl.Acad.Sci.USA 85、7887−7891、1988)により用いられ、二本鎖RNAに結合し、かつそのキナーゼへの結合を防止するウイルス性蛋白質、ワクシニアウイルス(Beattie et al.、Virology 183、419−422、1991)により用いられ、そのキナーゼの偽基質として作用するウイルス性蛋白質、インフルエンザウイルス(Lee et al,1990)により用いられ、そのキナーゼの活性化を遮断し、かつ活性キナーゼを阻害するための細胞性蛋白質p58の補充、ならびにポリオウイルス(Blacket al.、J.Virology、67、791−800、1993)により用いられ、p68を分解するRNA(可能であればウイルス性の二本鎖RNA)との複合体への細胞性蛋白質の補充が含まれる。
【0042】
ウイルスと相互作用する、先程記載されたp68ならびにRNAおよび蛋白質は、感染化細胞内の翻訳の調節のウイルスによる占領および抑留において必要とされることが示されている広域な種類の巨大分子の例である。本発明は、この広域な種類内に含まれる他の巨大分子をも同様に適用する。当業者には、他のこのような巨大分子を同定すること、およびウイルスとこれらの巨大分子との間の相互作用を回避もしくは調節することが可能な化合物を選択するための方法を設計することを当業者に可能にさせる多様な方法が利用可能である。一般的には、必要とされるこれらの段階は、翻訳が感染中に所定のウイルスにより調節されているか否かを確認すること、翻訳への影響を媒介する特異的巨大分子(一つもしくは複数)を同定すること、関連する他の細胞性および/またはウイルス性構成成分を同定すること、これらの化合物間の相互作用の特徴を決定すること、ならびにこの相互作用の破壊もしくは調節を検出することができるスクリーニング方法を設計することを含む。これらの段階の具体的詳細をここでこれ以降に示す。用いられる方法の内の多くのものは、Ausubel et al.、(eds)Current Protocols in Molecular Biology、Wiley−Interscience、New York、1991、およびSambrook et al.、Molecular Cloning:A Laboratory Manual(2nd Ed.)、Cold Spring Harbor Laboratory Press、Cold Spring Harbor、New York、1989、のような引用文献内に収められている。
【0043】
ウイルスが翻訳に影響を及ぼすことの決定
特別なウイルスによる感染中に翻訳が影響を受けるか否かを決定するためには数々の方法を用いることができる。感染化および非感染化細胞内での蛋白質合成の全体的速度は、このような細胞をラベル化アミノ酸の存在下でインキュベートし、そしてこのラベル化前駆体の蛋白質内への取り込みを測定することにより測定することが可能である。ラベル化アミノ酸は典型的には、[35S]メチオニン、[35S]システイン、[3H]ロイシン、もしくは[14C]ロイシンのような放射活性同位体原子を含むものであることができ、そしてその利用に続き、典型的に、トリクロロ酢酸沈殿可能蛋白質内への放射活性の取り込みを測定することが可能である。蛋白質合成の全体的速度と同様に、開始および伸長のような翻訳の個々の段階の速度を、ポリソームプロフィルおよび推移時間決定のような標準的な方法を用いて測定することができる。未処理細胞を放射ラベル化基質と共にインキュベートすることの別法として、抽出物を未感染化および感染化細胞から作成し、そしてこれらの基質と共にインビトロ翻訳に利用して、内因性mRNAもしくはその細胞抽出物に添加されるテストmRNAの翻訳を調査することができる。
【0044】
翻訳におけるウイルスの効果に関する追加的な重要情報を、未感染化および感染化細胞において産生される蛋白質の種類および相対量を調査することにより取得することができる。このことは、これらの細胞を、先に記載する放射ラベル化アミノ酸の存在下でインキュベートし、そしてその後にポリアクリルアミドゲル電気泳動を使用して得られる放射ラベル化蛋白質を分離することにより達成することができる。分離された蛋白質をオートラジオグラフィーによるか、あるいはホスホルイメージャー(Phosphor Imager)装置を用いて検出し、そして電気泳動中、同じポリアクリルアミドゲル上に含まれる既知の分子量の標準ラベル化蛋白質との比較により分析することができる。速度決定の場合におけるのと同様に、蛋白質合成のこれらの研究を、未処理細胞それ自体ではなく細胞から作成される抽出物を使用して実施することもできる。
【0045】
巨大分子の同定
研究中のウイルスでの感染により翻訳が影響を受けていることの証拠をいったん取得したら、翻訳もしくはその調節過程において直接的もしくは間接的に関与することが知られる全ての巨大分子の活性および濃度を未感染化および感染化細胞、ならびに/またはそのような細胞から作成される抽出物中で比較することができる。取得される証拠が、開始もしくは伸長のような特定の翻訳段階における影響を指摘する場合には、最初にこの段階に関与することが知られる巨大分子に注意が向くであろう。
【0046】
翻訳におけるウイルスの影響に関与する構成成分を同定する他の研究法は、未感染化および感染化細胞から抽出物を作成し、そしてこれらの抽出物をインビトロ翻訳反応における影響を示す能力に基づいて分画化することである。すなわち、未感染化および感染化細胞からの抽出物を最初にインビトロ翻訳反応物内に並列に、しかし別々に添加し、そしてそれらの反応におけるそれらの抽出物の影響を比較する。その後にこの2つの種類の抽出物を当業者に知られる種々の方法を用いて並行して分画化し、そしてこの2つの抽出物からの対応分画をインビトロ翻訳反応におけるそれらの効果について並行して検査する。感染化細胞からの翻訳影響性構成成分を含むことが見いだされた分画をその後に、未感染化細胞からの対応する分画と並行して更に分画化し、そしてこの次回の分画化から取得される新規の分画もやはりインビトロ翻訳反応において検査する。この分画化およびテスト過程の反復繰り返しは、最終的に、翻訳に対するウイルスの観素される効果に関連する構成成分(一つもしくは複数)を含む感染化細胞からの比較的精製された分画を提供する。
【0047】
関連する他の構成成分の同定
翻訳上のウイルス効果の詳細な調査は、しばしばその活性もしくは濃度がウイルス感染中に調節される一つもしくは複数の細胞性構成成分を明らかにすることができる。例えばそれは、感染化細胞内で分解されるか、あるいはリン酸化、脱リン酸化、そうでなければその活性を変化させる方式で修飾化される開始因子、もしくは伸長因子、あるいはそれらのサブユニットを同定することができる。いったん一つのこのような効果が観察されたら、その効果は関与する追加的な細胞性および/またはウイルス性構成成分を同定するための更に別の調査のための方法を指摘する。
【0048】
翻訳における影響の原因となるウイルス性構成成分の同定は、天然に存在する突然変異体もしくは研究室で作成される突然変異体のいずれかである突然変異体ウイルスを調査することにより容易に行うことができる。後者は、突然変異誘発剤での化学的処理ならびにウイルス遺伝子もしくはウイルスゲノム内に挿入、置換、欠損、および点突然変異を作成するための分子生物学的技術の使用を初めとするがこれには限定されない当業者に知られる多様な方法により構築することができる。ウイルスと宿主細胞との翻訳の間の相互作用における多様な突然変異体の影響をその後に評定することができる。特別な突然変異体がウイルスが翻訳に及ぼす影響(一つもしくは複数)を変化もしくは消滅させる場合には、このことは、突然変異が生じる遺伝子もしくはゲノムはこれらの効果を媒介する上で重要であることの強い証拠を提供する。
【0049】
突然変異分析なしでさえも、インビトロ転写および翻訳方法を使用して、ウイルスゲノムもしくはRNA、あるいはそれらのサブセットもしくは断片、あるいはそのような分子の翻訳産物の添加が翻訳に影響を及ぼすか否かを決定することができる。
翻訳における影響に関与するウイルス構成成分はまた、個々のウイルス性構成成分もしくはそれらをコードする遺伝子/cDNA、あるいは構成成分もしくは遺伝子/cDNAの断片をインビトロ翻訳反応ではなく未処理細胞内に導入することにより同定することもできる。
この記載から、ウイルス感染化細胞において調節されていることが見いだされている構成成分と相互作用するウイルス性および細胞性構成成分を同定するためには多種多様な方法が当業者に利用可能であることが明らかである。
【0050】
構成成分間の相互作用
翻訳に影響を与える細胞性およびウイルス性構成成分間の相互作用の特徴決定を行うためには多くの異なる方法が利用可能である。pH、イオン強度、温度、存在するアニオンおよびカチオンの性質および混合物、2つの構成成分の相対的濃度、これらの構成成分の絶対的濃度、補因子の利用可能性、エネルギー源の利用可能性、脂質、核酸、炭水化物、他の蛋白質、および/または他の添加物の存在もしくは非存在を変化させるこのような相互作用の感受性は全て、構成成分間の相互作用の特徴についての情報を提供することができる。一つもしくは両方の構成成分における切断、添加、置換、欠損、反転、および点突然変異の影響も有益である。これらの構造の変化を既に記述した一連の方法においてテストして、それらの変化が異なる構成成分間の相互作用および/または翻訳におけるこれらの構成成分の影響を変化もしくは廃止させるか否かを決定することができる。
【0051】
有望な薬剤をスクリーニングするための方法
有望な薬剤を、翻訳におけるウイルス効果を破壊もしくは調節するそれらの能力についてスクリーニングするための方法を、ウイルス性および細胞性構成成分間の厳密な相互作用の詳細な知識なしでも設計することができるが、このような知識は確かに役に立つことが可能である。広域な範疇のインビトロでの選択方法においては、数々の種類の方法がテスト薬剤をスクリーニングするのに特に簡便および/または有用であるように思われる。これらは、二つもしくはそれを上回る数の構成成分間の結合相互作用を測定する方法、相互作用を行う構成成分の内の一つである酵素の活性を測定する方法、ならびにこれらの構成成分の内の一つの調節下に置かれている「レポーター」蛋白質、すなわちある酵素あるいは他の検出可能もしくは選択可能な蛋白質の活性もしくは発現を測定する方法を含むが、これらに限定はされない。
【0052】
このようなアッセイにおけるレポーターとしての使用に適する蛋白質には、β−ガラクトシダーゼ、ルシフェラーゼ、β−グルクロニダーゼ、クロラムフェニコールアシルトランスフェラーゼ、および分泌される胎児のアルカリホスファターゼのような容易にアッセイされる酵素、ホルモンおよびサイトカインのような免疫アッセイのために容易に利用可能な蛋白質、アデノシンデアミナーゼ、アミノグリコシドホスホトランスフェラーゼ(neo遺伝子の産物)、ジヒドロ葉酸レダクターゼ、ヒグロマイシン−B−ホスホトランスフェラーゼ、チミジンキナーゼ(HAT培地と共に使用する場合)、キサンチン−アニンホスホリボシルトランスフェラーゼ(XGPRT)のような、選択的増殖上の利点を細胞に付与する蛋白質、ならびに栄養要求性突然変異体から失われている生合成能を提供する蛋白質、チミジンキナーゼ(ブロモデオキシウリジンを含む培地と共に用いる場合)、およびオロチジン−5’−リン酸エステルデカルボキシラーゼ(5−フルオロオロト酸と共に用いる場合)のような非毒性基質を毒性産物へと転化する酵素を例とする増殖上の欠点を細胞に付与する蛋白質、ならびにリシン、コレラ毒、もしくはジフテリア毒のような毒素である蛋白質を含むが、これらには限定されない。
前述の記載から、翻訳におけるウイルス効果に関与する構成成分の同定、これらの構成成分間の相互作用の特徴決定、およびこれらの構成成分間の相互作用を調節もしくは廃止する構成成分を選択するためのスクリーニングテストの実施における各段階では、当業者は多種多様な方法からの選択を行うことが可能であることが明白である。
【0053】
プロテインキナーゼ
以下の記載は、本発明において有用な具体的スクリーニングプロトコールおよび関連プロトコールの更に詳細な概略である。この文節では、宿主真核生物細胞内でウイルス複製を阻害するのに有効な薬剤をスクリーニングするための方法を記載する。一つの詳細な実施例としては、選択される系は、ウイルスが、宿主細胞のインターフェロン誘導化二本鎖RNA活性化プロテインキナーゼの活性を妨害するウイルス性インヒビターを産生することが可能であるものである。しかしながら先に記載するように、この実施例は本発明内における制限ではなく、そして単に本発明の広域な範囲を例示するに過ぎない。
【0054】
この方法は一般的に、プロテインキナーゼ、ウイルス性インヒビター、およびテストされるべき化合物を、そのプロテインキナーゼの活性化のウイルス性インヒビター妨害を生じるのに有効な条件下でインキュベートし、そして妨害についてその混合物を調査する段階を含む。
【0055】
A.化合物のためのインビトロでのスクリーニング
ある実施例では、インキュベーション段階は、ウイルス性インヒビターの非存在下でp68キナーゼを活性化するのに有効な条件下でその混合物をインキュベートすることを含み、そして調査段階は、このインヒビターの存在下でのp68キナーゼの活性を調査することを含む。
インキュベーションは、例えば精製もしくは部分精製されたp68キナーゼ調製物を用いて実施することができ、そして調査段階は、そのキナーゼの自己リン酸化、あるいはそのキナーゼに対して提供されるeIF2−アルファーもしくはヒストン基質のリン酸化を測定することを含む。
【0056】
別法ではインキュベーションを、p68キナーゼを含むインビトロ翻訳混合物中で実施することができ、そして調査段階が、特異的mRNAの翻訳により産生されるレポーターポリペプチドの量を測定すること含む。第三の例においてはこの方法を、活性化形態においてはこのプロテインキナーゼの活性化を遮断するか、あるいは活性化されているキナーゼを阻害することが可能な宿主細胞構成成分を活性化するのに有効なウイルス性インヒビターを産生するあるウイルスのウイルス複製を遮断するのに有用な化合物をスクリーニングするために用いる。ここでは形成される混合物は宿主細胞構成成分(活性化形態をとる)を含み、インキュベーション段階を、活性化構成成分の非存在下でそのプロテインキナーゼが活性化される条件下で実施し、そして調査段階が、プロテインキナーゼ活性の阻害についてその混合物を調査することを含む。
【0057】
以下に示す実施例は、先に記載されるスクリーニング方法をより詳細に説明するが、決して本発明の範囲を制限することを意図するのではない。
実施例1:組換え大腸菌(E.coli)細胞からのp68プロテインキナーゼの調製
p68は、ヒトのp68キナーゼを発現する大腸菌(E.coli)から、公開される方法(Barber et al.、1991、Biochemistry 30:10356)に従って調製される。簡潔に記載すると、大腸菌(E.coli)株BL21(DE3)pLysSを、誘導可能プロモーターの調節下で野生型p68プロテインキナーゼのためのコーディング配列を含むプラスミドで形質転換させる。得られる大腸菌(E.coli)株を対数期まで増殖させ、その後に誘導化を行ってp68キナーゼを発現させる。細胞を遠心により収集し、そしてリゾチームにより溶菌させる。p68キナーゼを、公開される方法(Galabru et al.、1989、Eur.J.Biochem.178:581)に従って、セファロース(Sepharose)に結合されるp68キナーゼに対するモノクローナル抗体を使用する親和性クロマトグラフィーによりその溶菌液から精製する。
【0058】
実施例2:VAI RNAの調製
VAI RNAは公開される方法(Mellits et al.、1990)Nucl.Acids Res.18、5401)に従って調製される。簡潔に記載すると、本明細書ではpT7VAと略称されるプラスミドpT7VA/Ad21は、Ad2 VA RNA2の遺伝子の上流に融合されたT7 RNAポリメラーゼのプロモーターを含むクローニングベクターpUC119の誘導体である。このプラスミドをDra Iでの消化により直線化させて、VAI RNAの厳密なコピーであるランオフ転写物の調製を可能にする。転写は、37.5μg/mlのT7 RNAポリメラーゼ、50μg/mlの直線化pT7VA DNA、40mMのトリス−HCl、pH7.8、14mMのMgCl2、2mMのスペルミジン、5mMのジチオスレイトール(DTT)、4mMの各rNTP、および1単位/μlのRNasin(Promega社)を含む反応物中で実施する。40℃で90分インキュベートした後に、この反応を最終濃度20mMのEDTAの添加により停止させ、フェノール、次いでクロロホルムで抽出し、そしてRNAをエタノールで沈殿させる。VAI RNAは、再溶解させた沈殿物を変性させ、それを8%のポリアクリルアミド/7M尿素の配列決定用ゲル上で泳動させ、主要バンドを切り出し、そしてRNAを標準的な方法により回収することにより精製する。ラベル化VAI RNAを、[アルファー−32P]UTPもしくはビオチニル化−UTPのいずれかが含まれること以外は記載されるように転写を実施することにより調製する。
【0059】
実施例3:p58の調製
I.p58による阻害のためのアッセイ
このアッセイはp58の精製を記録することを可能にする。p58の精製過程中に単離された分画を、Triton X−100でのインターフェロン処理化293細胞の破壊により調製されたp68含有性細胞抽出物と混合し、そして20分間30℃でインキュベートする。その後にこのp68キナーゼを、293細胞からのヒトp68を認識するがp58の源であるインフルエンザウイルス感染化MDBK細胞中のウシ相同物は認識しない抗体を用いて免疫沈降させる。次に免疫沈降化させたp68の活性を、[ガンマー−32P]ATPを用い、そして基質として外因性ヒストンを添加して測定する。活性を定量化するためにヒストンをポリアクリルアミドゲル電気泳動に供し、そしてゲルから切り出す。精製の後期段階においては純粋なp68キナーゼおよびその天然の基質であるeIF−2を用いる追加的なアッセイを以下のように実施する。精製からの各分画を純粋なp68キナーゼと共に、10分間、30℃で、緩衝液C(17mMのトリス−HCl、pH7.5、75mMのKCl、0.1mMのEDTA、1.0mMのジエチオスレイトール、ml当たり8μgのアプロチニン、1.0mMのフッ化フェニルメチルスルホニル、2mMのMgCl2、2mMのMnCl2、ml当たり0.3mgのウシ血清アルブミン、8%のグリセロール)中で予備インキュベートする。その後に活性化因子であるポリ(I):ポリ(C)(0.010μg/ml)を1mMの[ガンマー−32P]ATP(424Ci/mモル;1Ci=37GBq)の存在下で添加し、そしてインキュベーションを追加的に10分間継続する。最後には、0.5μgの精製化eLF−2を添加し、そしてインキュベーションを更に10分間、30℃で継続する。この反応は、2×破壊用緩衝液(160Mmのトリス、pH6.8、1.0Mの2−メルカプトエタノール、4%のSDS、20%(vol/vol)のグリセロール)の添加により停止し、この混合物を沸騰させ、そしてリン酸化された蛋白質をSDS/14%ポリアクリルアミドゲル上で分析する。
【0060】
II.p58のクローニング
A.cDNAライブラリーのスクリーニング
精製化p58蛋白質から得られる3つのトリプシン消化ペプチドをミクロシークエンシングを行うことにより配列決定する。それらの配列の内の一つ(AEAYLIEEMYDEAIGDYETA)を用いて、縮重オリゴヌクレオチドプローブ(5′−GAA(G)GAA(G)ATGTAT(C)GAT(C)GAA(A)GC−3′)を設計した。これを用いてラムダ−ZapIIベクター(Stratagene社)中に作成されるMDBK細胞株からのcDNAライブラリーをスクリーニングした。ナイロンフィルター(Hybond−N;Amersham社、Arlingon Heights、IL)への二重プラーク転移を行った。その後にフィルターを、38℃で4時間、6×SSPE(1×SSPE=0.18MのNaCl/10mM NaPO4、pH7.4、1mMのEDTA、1%のSDS、0.2%のウシ血清アルブミン、0.2%のポリビニルピロリドン)、ml当たり100μgの超音波処理を施しかつ変性させたサケ精子DNA中で予備ハイブリダイズさせ、そして38℃で20時間、6×SSPE、1%のSDS、ml当たり100μgの超音波処理を施しかつ変性させたサケ精子DNA中で、32P−5’末端ラベル化プローブとハイブリダイズさせた。フィルターは6×SSPE、1%のSDS中で室温で10分間を2回、38℃で15分間で1回洗浄し、そして−70℃で増感用スクリーンを用いてKodak社のX−Omatフィルムに露出させた。陽性のファージプラークを同定し、そして別に行う数回のプラークハイブリッド形成により精製する。pBluescriptプラスミド(Stratagene社)を、製造元の説明書に従ってインビボで切り出した。4つの陽性クローンからのEcoR I断片をp58の部分的アミノ酸配列(QDYETA)のアンチセンス鎖に相当する縮重オリゴヌクレオチドプローブp58−3−2(5′−GCIGTT(C)TCA(G)TAA(G)TCT(C)TG−3′;Iはイノシンを表す)を用いるサザンブロットハイブリッド形成により分析した。1400bpの挿入断片を含む一つの陽性クローンを取得し、そして制限酵素マッピングにより分析した。M13mp18およびM13mp19内へとクローニングした後に、p58のcDNA配列を、セクアナーゼ(Sequenase)2.0(United States Biochemical社)を用いるジデオキシヌクレオチド鎖停止方法により決定した。配列番号17を参照せよ。配列データはGenetics Computer Group(GCG)社の配列分析プログラム(バージョン7.0)を用いて分析した。
【0061】
B.p58cDNAの3’末端領域の単離
単離された最初のクローンは長い読み取り枠を含んでいたが停止コドンが存在せず、3’末端が失われていることが示唆された。失われた3’末端領域を記載されるように(Innis、et al.、1990)RACE−PCR(cDNAの末端ポリメラーゼ連鎖反応の迅速増幅)を用いて単離した。MDBKポリ(A)+mRNA(1μg)をハイブリットプライマー(5′−GACTCGAGGATCCGAATTC−(T)17−3′)を用いて逆転写させた。cDNAプールをアダプタープライマー(5′−GACGCGACCATCCGAATTC−3′)およびp58遺伝子特異的プライマーP58−5(5′GCTGAAGAGCTCATCAAAG−3′)の存在下、記載される(Innis、et al.、1990)条件下で、RACE−PCRにより増幅した。サザンブロットにより増幅化産物を同定した後に、この産物をアガロースゲルから単離し、そしてM13mp18およびM13mp19内にクローン化して増幅化領域の配列決定を行った。このことにより1680bpを含む完全なp58のcDNAの再構成が可能になった。もともとの1400bpのcDNAも用いてMDBKcDNAライブラリーをスクリーニングし、そして5’−および3’−UTRを共に含む完全なコーディング配列を含む3140bpの他のクローンを導き出した。
【0062】
C.細菌中での融合蛋白質の発現
唯一のNde I部位(CATATG)を、インビトロ突然変異誘発キット(Bio−Rad社、Richmond、CA)を用いて、製造元のプロトコールに従って、p58遺伝子の開始用メチオニンコドンに導入した。部位特異的突然変異誘発後、p58遺伝子を含む1.6kbのNde I−BamH I断片を細菌の発現ベクターpET15b(Novatgen社、Madison、WI)内にクローン化させた。p58は、0.2mMのIPTGでの2時間30℃の誘導化後に大腸菌BL21(DE3)pLysS内でヒスチジン−付加融合蛋白質として発現させた。大半の融合蛋白質が不溶性分画内に見いだされた。この分画を6Mのグアニジン−HCl内で変性させた後に、融合蛋白質を、Ni(II)−カラムを用い、製造元の説明書に従って精製した。精製化蛋白質(0.1mg/ml)は、mlあたり0.1mgのウシ血清アルブミンを含む透析用緩衝液(20mMのトリス−HCl、pH7.5、1mMのDTT、0.1mMのEDTA、0.15MのNaCl、20%のグリセロール)中で約50倍に希釈し、そして透析用緩衝液内で4℃で6時間透析した後に再生させた。再生化蛋白質をアリコートに分け、そして−70℃で保存した。
【0063】
実施例4:スクリーニング方法:p58によるp68の不活化
2μlまでのp68キナーゼ分画(用いられる厳密な容積は精製の度合いに依存する)を、50mMのKCL、20mMのHEPES(pH7.4)、1.5mMのMgCl2、0.1mMのEDTA、1mMのDTT、10%のグリセロール、および1μMのPMSF、ml当たり0.1mgのウシ血清アルブミンおよび0.1mgのtRNAで10μlにまで希釈した。この希釈化キナーゼを、最終濃度で75mMのKCl、25mMのHEPES、(pH7.4)、10mMのMgCl2、1.0mMのジチオスレイトール、0.1mMのEDTA、0.1mMのATP、プロテアーゼインヒビター、および5〜10゜Ciの[ガンマー32P]ATP(>3,000Ci/mモル;Dupont社、NEN)を含む20μlの反応混合物に添加する。適切であらば反応混合物に、活性化因子としてレオウイルスの二本鎖(ds)RNAもしくは合成dsRNA(例えば、ポリI:C)、およびインヒビターとしてのp58を補充する。同じ反応内で用いる場合には,dsRNAとp58とを同時に酵素ミックスに添加する。この反応物を30℃で15〜25分間インキュベートし、その後にスロット−ブロットもしくはドット−ブロット装置中でニトロセルロースを通して濾過する。自己リン酸化によりp68キナーゼ内に取り込まれた32Pを液体シンチレーション計測もしくは露出化オートグラフィー用フィルムのレーザーデンシトメトリーにより定量する。典型的な一連のテストは以下の反応を含む。a)p68キナーゼ単独もしくはp58単独での対照反応、b)テスト化合物単独、あるいはp68キナーゼもしくp58のいずれかと一緒の対照反応、c)p68キナーゼとp58、ならびにd)p68キナーゼ、p58、およびテスト化合物。p68キナーゼへのp58インヒビターの結合を妨害するテスト化合物については、反応(d)で検出される自己リン酸化p68キナーゼの量は反応(c)で検出されるものより多くなる。
【0064】
実施例5:インビトロ翻訳アッセイ
以下の構成成分を連続的に12μlのミクロコッカスヌクレアーゼ処理化ウサギ網状赤血球溶菌物に添加する。2.5μlの50mCi/ml[35S]メチオニン、メチオニンを除く全てのアミノ酸1mMを含む2.5μlのアミノ酸混合物、2.5μlの50μg/ml VaI RNA、2.5μlの100ng/mlのレオウイルス二本鎖RNA、および2μlのテスト化合物もしくはH2O。この混合物を30℃で15〜20分間インキュベートして内因性p68キナーゼの活性化を可能にし、その後に1μlの特異的レポーター遺伝子mRNAを添加して10μg/mlの最終濃度を得る。その後にこの翻訳反応物を30分間30℃でインキュベートする。翻訳をSDS−PAGEおよびオートラジオグラフィーにより、CATもしくはルシフェラーゼ酵素アッセイ、あるいは用いたmRNAに適切な他のアッセイにより定量化する。典型的な一連のテストは以下の反応を含む。a)レオウイルスdsRNAもしくはVAI RNAを含まない対照反応、b)レオウイルスdsRNAを含むがVAI RNAを含まない対照反応、c)レオウイルスdsDNAおよびVAI RNA、ならびにd)レオウイルスdsRNA、VAI RNA、およびテスト化合物。VAI RNA機能を妨害するテスト化合物については、反応(d)での翻訳は反応(c)で検出されるものと比較すると減少している。
【0065】
実施例6:アデノウイルスの遺伝子産物VAI RNAの機能を妨害するアンチセンスオリゴデオキシヌクレオチド分子の同定
VAI RNAの既知の塩基配列、予想される二次構造(図1)、およびVA機能への様々なステムおよびループの相対的重要性に基づいて、出願者は数々のアンチセンスオリゴデオキシヌクレオチド分子を設計した(図2、3)。これらのアンチセンス種を先に記載されるインビトロ翻訳アッセイにおいて検査した。
【0066】
A.インビトロ翻訳アッセイ
インビトロ翻訳アッセイは96ウエルプレート内で実施した。ウサギ網状赤血球溶菌物をp68の源ならびにインビトロ翻訳系として使用した。p68はウサギ網状赤血球溶菌物内に存在し、そしてレオウイルスRNAのようなdsRNAの添加により活性化することができる。p68が活性化される際には翻訳が阻害される。
【0067】
VaI RNAは、本出願の主要部において記載されるように調製した(実施例2:VAI RNAの調製、を参照せよ)。以下の構成成分を順に添加し、そして指定されるように96ウエルプレートの各ウエル内でインキュベートした。
4μlのアンチセンスオリゴデオキシヌクレオチド(最終濃度はVAIRNAに対して20倍モル過剰)
2μlのVAI RNA(最終濃度=5μg/ml)
1mMの完全なアミノ酸混合物を補足してある20μlのウサギ網状赤血球溶菌物
*30℃で15分間インキュベートする。
2μlのレオウイルスdsRNA(最終濃度=10ng/ml)
*30℃で15分間インキュベートする。
2μlのルシフェラーゼmRNA(最終濃度:30ng/ml)
*30℃で15分間インキュベートする。
【0068】
各ウエルをDynatech社のML3000ルミノメーターおよびAnalytical Luminescence LAbs社のEnhaced Luciferase Assay Kitを用いてルシフェラーゼ活性について即座にアッセイした。設定値は:Enhaced Flash モード、Delay=2s、Integrate=5s、50μlの基質Bと同時に注入する50μlの基質A。
【0069】
以下の対照物をこのアッセイにおいてインキュベートした。H2Oを(−)により示されるmRNA、レオウイルRNA、もしくはVAI RNAに置き換えた。
【表1】

【0070】
対照1は、ルシフェラーゼmRNAなしで陽性ルシフェラーゼシグナルを生じるであろう溶菌物中のものの存在について検査した。対照2は、このアッセイの翻訳の正常レベルを確認した。対照3は、p68のレオウイスRNA活性化の結果である翻訳の阻害のレベルを確認した。対照4は、活性化因子であるレオウイスRNAの存在下でのp68のインヒビターとしてのVAI RNAの救済機能を決定した。典型的な結果を図4に示す。相対的光単位(Relative Light Unit)(「R.L.U.」)の産生はルシフェラーゼmRNAの添加に依存する(カラム1対2)。レオウイルスdsRNAをこのアッセイに添加する際には、この溶菌物中の内因性p68が活性化され、そして翻訳が阻害される(カラム3)。VAI RNAを添加した際には、翻訳が部分的に救済された(カラム4)。
【0071】
B.アンチセンスオリゴデオキシヌクレオチドの結果
アンチセンスオリゴデオキシヌクレオチド種をアッセイに添加し、これらの結果も図4に示す。ava1はVAI RNAの効果を完全に逆転させることが見いだされた(カラム5)。ava9およびava15はVAI RNA機能に対しては部分的に拮抗的(antagonistic)であった(カラム8、9)。ava2および3はVAI RNA機能に有意な影響を与えなかった(カラム6、7)。末端のステム領域に相補的な種を含む他のアンチセンス種はVAI RNA機能を妨害しなかった(データ非公開)。これらの後者の結果はava1による阻害の特異性を強調するが、それはVAI RNA分子の幾つかの部分に対するアンチセンスが遮断機能において有効でないためである。
【0072】
ava2はVAI RNAの中央ドメインの一部分に相補的である。VAI RNAのこの相補的領域は一本鎖であるためava2は容易にアニールすることが予期され、そして中央ドメインは機能にとって重要であることが示されているため(Mathews、M.B.and T.Shenk.1991.J.Virol.65:5657−5662。Mellits、K.H、T.Peery、and M.B.Mathews.1992.J.Virol.66:2369−2377)ava2はVAI機能を妨害することが予期される。しかしながら、ava2はVAI活性に影響を与えなかった(図4)。
【0073】
それとは対照的に、ava15はVAI RNAの二本鎖領域に相補的である。この領域はオリゴデオキシヌクレオチドの結合を容易に可能することは予期されず、しかし、アンチセンスオリゴデオキシヌクレオチドava15は実際にVAI RNA機能と拮抗する(図4)。出願者の方法を利用することにより、機能的であるものについてのオリゴヌクレオチドのスクリーニングを容易に達成することができる。より一般的には、ava2およびava15の両方の挙動の予期されぬ性質の、出願者のスクリーニング方法による容易な検出は、p68のウイルス性インヒビターの拮抗剤を同定するための方法の利用性を証明している。
【0074】
優先的翻訳を媒介する特異的ウイルス核酸配列
特異的ウイルス核酸配列がウイルスRNAの優先的翻訳の原因であるか否かを決定するためには、種々の研究方法が利用可能である。これらには、優先的翻訳の原因である可能性のあるウイルス性核酸配列に翻訳的に連結される検出可能なレポーターポリペプチドを有するキメラRNAを用いる研究、ウイルス核酸配列の天然の突然変異体および研究室の突然変異体の研究、ならびにトランスフェクション感染アッセイが含まれるが、これらに限定はされない。
【0075】
有利な初期研究方法は、ウイルスRNAの優先的翻訳の原因である可能性があるウイルス核酸配列に連結される検出可能なレポーターポリペプチドのためのコーディング配列を有するキメラRNAを構築することであることがしばしばである。その後の検出可能なレポーターポリペチドの産生を、ウイルス核酸配列が確実にその翻訳を行わない限りこのレポーターが産生されないであろう翻訳条件下で調査する。対照として、このレポーターがテスト中のウイルス核酸配列に連結されていない類似構築物からの検出可能なレポーターポリペプチドの産生も同一な翻訳条件下で調査されるであろう。追加的対照として、各テスト物に添加されるキメラRNAもしくは別法として第二RNAは、第一のものから識別され、かつ細胞性mRNAの正常翻訳を確実に行う原因となるRNA配列に翻訳的に連結される第二検出可能レポーターポリペプチドのためのコーディング配列を含むことができる。
【0076】
他の構成成分の同定
いったんウイルスRNAの優先的翻訳の原因になるものとしてウイルス核酸配列を同定したら、このウイルス核酸配列の作用に関連する細胞性および/またはウイルス性構成成分を同定するためには多様な方法が利用可能である。
【0077】
薬剤をスクリーニングするための方法の設計
ウイルスRNAの優先的翻訳を破壊もしくは調節する能力について薬剤をスクリーニングするための方法は、関連するウイルス性および細胞性物質間の厳密な相互作用の詳細な知識なしでも設計することができるが、このような知識は確かに有用である可能性がある。
従って例えば、薬剤を細胞性および/またはウイルス性蛋白質とウイルス核酸配列との間の結合を防止もしくは減少させる能力についてスクリーニングすることができる。他のそして好ましい種類のアッセイにおいては、薬剤を検査して、そのレポーターのためのコーディング配列がウイルスRNAの優先的翻訳の原因となるウイルス核酸配列に翻訳的に連結されるRNAからの検出可能なレポーターポリペプチドの翻訳におけるそれらの影響が決定される。
【0078】
先の記載は例示のためにのみ提供され、決して本発明の範囲を制限するものではない。当業者はウイルスRNAの優先的翻訳の原因となるウイルス核酸配列を同定するため、関連する他の細胞性およびウイルス性構成成分を同定するため、ウイルスRNAの優先的翻訳を可能にする様々なパートナー間の相互作用の特徴決定を行うため、そしてこのような相互作用を破壊もしくは廃止する能力について薬剤をスクリーニングするのに使用することができるテストを開発するためには多種多様な方法からの選択を行うことができることが明白である。
【0079】
以下のものは翻訳調節要素の活性を遮断する薬剤をスクリーニングするために用いられる方法の実施例である。
IRES要素のスクリーニング
IRES要素の活性を遮断する薬剤をスクリーニングするためのアッセイの開発は、2つの異なるレポーター遺伝子の存在を特徴とするジシストロン性(dicistronic)mRNAを構築することを必要とし、この場合一つの遺伝子の翻訳がIRES要素の調節下に置かれ、かつ他の遺伝子の翻訳が宿主細胞のキャップ構造(m7GpppG)および細胞性5’−UTR配列の調節下に置かれる。そのような構築物は、細胞非含有性アッセイもしくは細胞を基にするアッセイのいずれかを用いて、細胞がそれら自体のmRNAの翻訳を開始するのに使用する方法に不利な影響を及ぼすことなくIRES要素の活性を遮断するような薬剤を同定することを可能にする。従って本発明の好ましい態様は、利用者が、非特異的かつ毒性である可能性のある薬剤を同時に除去しながら所望の作用機構を有する薬剤を同定することを可能にする。
【0080】
ジシストロン性レポーター遺伝子構築物を、インビトロもしくはインビボ薬剤スクリーニングのいずれかのために使用することができる。インビトロ(無細胞)アッセイフォーマットにおいては、ジシストロン性mRNA構築物は、バクテリオファージT7もしくはSP6プロモーターにより例示される強力なプロモーターの調節下にあるその構築物の翻訳を指令するプラスミドDNA分子によりコードされている。予め形成されているキャップ構造の存在下で相同なRNAポリメラーゼ(例えば7もしくはSP6)を用いて精製およびインビトロ転写を行う場合には、このプラスミドは、「キャップを伴う」ジシストロン性レポーター構築物の大容量の合成を指令し、この構築物は一般的に実施される技術を用いて精製することができる。次にこのジシストロン性mRNAを、商業的供給元から購入するか、あるいは科学的刊行物において利用可能な方法に従って調製されるかのいずれかである真核生物インビトロ翻訳系内の鋳型として利用する。
【0081】
薬剤を、先のジシストロン性レポーター構成物を含む完全な細胞中でテストすることもできる。前記構築物を、1)その構築物の転写をSV40、CMVもしくは当業者により一般的に用いられる他のプロモーターのような強力な真核生物ウイルスプロモーターの調節下に置き、2)核内で作成されるRNAの正確なプロセシングおよび輸送を確実にするためにSV40のスプライスシグナルのようなスプライスシグナルを含むようにし、そして3)レポーターmRNAが3’ポリアデニル化分子として合成されるように、この構築物の3’端にSV40シグナルのようなポリアデニル化シグナルを含むようにすること、により培養真核生物細胞中での使用のために改変する。
【0082】
本発明に含まれるアッセイを用いて、新規の抗ウイルス剤を発見するために薬剤ライブラリーをスクリーニングすることができる。このようなライブラリーは、純粋な薬剤のコレクションもしくは薬剤混合物のコレクションのいずれかを含むことができる。純粋な薬剤の例には、蛋白質、ポリペプチド、ペプチド、核酸、オリゴヌクレオチド、炭水化物、脂質、合成もしくは半合成化学物質、および精製された天然産物が含まれるが、これらには限定されない。薬剤混合物の例には、原核生物もしくは真核生物細胞および組織の抽出物、ならびに発酵ブイヨンおよび細胞もしくは組織培養物上清が含まれるが、これらには限定されない。薬剤混合物の場合には、アッセイは所望の抗ウイルス活性を保持するこれらの未精製混合物を同定するのに用いられるばかりでなく、このアッセイは治療剤としての特徴決定および開発のための混合物から抗ウイルス性成分を精製する手段を提供をもする。具体的には、このように同定される混合物をその後に当業者に一般的に知られる方法により連続的に分画化することができる。得られる各サブフラクションを、純粋で生物学的に活性な薬剤が取得されるまで、もともとのアッセイを使用して抗ウイルス活性についてアッセイすることができる。
【0083】
好ましい態様においては、抗ウイルス活性を検出するために設計されたアッセイを、先に記載されるライブラリーと組み合わせる高い処理能力の薬剤発見用スクリーニングに用いる。このアッセイは、例えば96−ウエル変種の多重ウエルプレート内のような多重反応物の迅速調製および処理を可能にするいずれかのフォーマットで実施される。
他の態様においては、このアッセイを用いて、既に公有となっている技術、あるいはそうでなければ当業者に知られる技術のいずれかにより産生されるランダムペプチドもしくはオリゴヌクレオチドの広大なライブラリーをスクリーニングすることができる。サイズが大きいため、これらのライブラリーは主要薬剤の源でありそうであり、それはそれらが107〜1010の化学的実在物を含むことができるためである。
【0084】
以下の実施例は説明のためのものであって、決して本発明を制限することを意図するものではない。
実施例7:IRES要素RNA構築物の作成/単離
A.PCR反応
ポリメラーゼ連鎖反応(PCR)およびT7プロモーターをPCR断片の5’端に置くために設計されたプライマーを用いて、入手可能なプラスミドから選択されるIRES成分を増幅する。反応混合物は以下のものを含む。1μMのプライマー#1、1μMのプライマー#2、40μMのdATP、40μMのdGTP、40μMのdCTP、40μMのdTTP、4μg/mlの鋳型DNA、Taq DNAポリメラーゼ、10mMのトリス−HCl pH8.3、25℃、40mMのKCl、1.5mMのMgCl2、および0.01%(w/v)のゼラチン。
【0085】
この反応混合物(総容量100μl)を100μlの鉱油に重層する。鉱油中にチューブを浸し、そして断熱材中に入れ、空気バブルが出るようにさせる。パラメーター:94℃で2分、42℃で1分、72℃で1分、2秒の自動延長。できる限り大量の油性上層を取り出す。100μlのTEを添加し、そしてCHCl3で、次いでフェノール/CHCl3で、そして最後にCHCl3で抽出する。
30μlの3M NaOAcを添加する。600μlの氷冷EtOHを添加し、そして−20℃で数時間放置する。30分間14K rpmでマイクロフュージ内で遠心し、その後に5μlのH2O中に再懸濁する。
【0086】
C. pBLおよびpBCRLプラスミドの構築
転写鋳型pBLを、β−グロビンおよびルシフェラーゼ配列のPCR増幅産物をプラスミドベクターpUC19内に連結することにより構築した。β−グロビンのPCRプライマー(配列番号18、配列番号19)は、β−グロビンの5′非翻訳領域(「NTR」、未翻訳領域「UTR」としても引用される)を増幅し、そして5’EcoR I制限部位、5’T7プロモーター、および3’Kpn I制限部位を導入するように設計した。EcoR IおよびKpn I制限部位を用いてpUC19内への連結し、中間体プラスミドpBを作成した。ルシフェラーゼのPCRプライマー(配列番号20、配列番号21)を設計してルシフェラーゼのコーディング配列を増幅し、5’Pst I制限部位および3’ Hind III制限部位を導入し、pB内へ連結してpBLを作成した。CATのPCRプライマー(配列番号22、配列番号23)を設計してCATのコーディング配列を増幅し、5’Kpn I制限部位および3’Bam HI制限部位を導入し、pBL内へ連結して、pBCLを作成した。リノウイルス14の5’NTRのPCRプライマー(配列番号24、配列番号25)を設計してリノウイルスの5’NTSRを増幅し、5’Bam HI制限部位および3’Pst I制限部位を導入し、これを用いてこの増幅産物をpBCL内へ連結させた。_−グロビンの5’NTR、CAT、リノウイルスのIRES、およびルシフェラーゼ配列を含む得られるプラスミドを大腸菌DMI細胞内にトランスフォームすることにより、リノウイルスおよびルシフェラーゼの開始コドンは一直線に並ぶ。非メチル化プラスミドDNAを単離し、そしてBcl Iで消化し、この消化プラスミドを再連結させ、そして大腸菌DH5細胞内にトランスフォームさせてpBCRLを産生する。
【0087】
翻訳反応のたのキャップ付きRANの調製
プラスミドDNAからのT7ポリメラーゼ転写は以下のとおりであった。
200μlの反応物は、5μlのプラスミド、1mMの各NTP、5μgの切断化プラスミドDNA(20μl)、0.1%のDEPC H2O(128μl)、100mMのATP(2μl)、10mMのGTP(2μl)、100mMのUTP(2μl)、10mMのm7GpppG(20μμl)、RNasin(1μl)、5×プラスミド緩衝液(40μl)を含み、これを5分間37℃でインキュベートする。4μlのポリメラーゼ(2〜4μl)を添加し、60分、37℃でインキュベートする。10μlのRNase非含有性DNaseを添加し、37℃で1分間インキュベートする。5μlの500mM EDTAを添加する。フェノール/CHCl3抽出する。CHCl3抽出する。70μlの0.1%DEPC H2Oを添加する。30μlの3M NaOAc pH5.2を添加する。900μlのEtOHを添加する。−20℃で一晩、もしくは−80℃で30分間放置し、25μlのTE中に再懸濁する。A260を測定する。転写緩衝液:37℃における200mMのトリス pH8.0、50mMのMgCl2、25mMのDTT、5mMのスペルミジン、250pg/mlのBSA、0.1%のDEPC H2O(650μl)、1Mのトリス(200μl)、(pH8.0@37℃、pH8.4@25℃)、1MのDTT(25μl)、100mMのスペルミジン(50μl)、10μg/μlのBSA(25μl)、1MのMgCl2(50μl)、−20℃(1000μl)で保存する。
【0088】
トランスフェクションアッセイのためのモノ−およびジシストロン性プラスミドの構築
ジシストロン性プラスミド(pCMV−Luc−IRES−SEAP)を用いて細胞をトランスフェクトさせ、そしてテスト化合物の存在および非存在下でのインビボの翻訳のためのアッセイを行う。pCMV−Luc−IRES−SEAPは順に、SV40の複製起点、サイトメガロウイルス(CMV)のプロモーター、ルシフェラーゼのレポーター遺伝子、選択されるIRES要素、分泌されるアルカリホスファターゼ(SEAP)レポーター遺伝子、SV40のスプライス部位、およびSV40のポリAシグナルを含む。pUC118を基にする2つの構築物(pB−SEAPおよびpB−Luc−IRES−SEAP)を用いて構築物pCMV−Luc−IRES−SEAPを作成する。pB−SEAPは順に、T7のポリメラーゼプロモーター、β−グロビンの5’非翻訳領域、およびSEAPレポーター遺伝子を含む。pB−Luc−IRES−SEAPは順に、T7のポリメラーゼプロモーター、β−グロビンの5’非翻訳領域、ルシフェラーゼのレポーター遺伝子、選択されるIRES要素、およびSEAPレポーター遺伝子を含む。pB−SEAPおよびpB−Luc−IRES−SEAPの構築は、利用可能なプラスミドからβ−グロビンの5’NTR、ルシフェラーゼのコーディング配列、IRES要素、およびSEAPのコーディング配列を、非反復5’制限部位を含むプライマーを用いてPCR増幅することにより実施する。β−グロビンの5’NTRおよびSEAPのコーディング領域を含むPCR産物を制限消化し、そしてpUC118内に挿入してモノシストロン性構築物pB−SEAPを産生する。ジシストロン性プラスミドpB−Luc−IRES−SEAPは、制限消化させたモノシストロン性プラスミドと、選択されるIRES要素およびルシフェラーゼのコーディング領域を含む制限消化させたPCR産物とを連結することにより作成する。細胞をトランスフェクトするのに用いたジシストロン性プラスミド(pCMV−Luc−IRES−SEAP)は、pB−Luc−IRES−SEAPのLuc−IRES−SEAPコーディング領域を含む平滑末端化Kpn I−Apa I断片と、サイトメガロウイルス(CMV)のプロモーターを含みSV40の複製起点、スプライス部位、およびポリAシグナルを含むEco RV消化させたプラスミドベクターpcDNAI−neo(InVitrogen社)とを連結させることにより構築する。
【0089】
PCR
T7プロモーター、β−グロビンの5’NTR、ルシフェラーゼのレポーター遺伝子、IRES要素、およびSEAPのレポーター遺伝子を、先に記載されるポリメラーゼ連鎖反応(PCR)および以下に示すプライマーを用いて増幅する。
【0090】
【表2】

【0091】
実施例8:インビトロ翻訳スクリーニングアッセイ
テスト化合物を、IRES要素−蛋白質コーディング領域含有性構築物、ウイルス翻訳に必要な選択される細胞性結合蛋白質、および細胞性翻訳構成成分(リボソームなど)を含む無細胞系内においてウイルス性IRES指示蛋白質翻訳を阻害する能力についてスクリーニングする。
【0092】
A.インビトロ翻訳アッセイ
PUC118を基にする2つの構築物(pBLおよびpBCRL、既述)を用いてテスト化合物の存在および非存在下で翻訳についてのアッセイを行う。pBLは順に、T7ポリメラーゼのプロモーター、β−グロビンの5’非翻訳領域、およびルシフェラーゼのレポーター遺伝子を含む。pBCRLは順に、T7ポリメラーゼのプロモーター、β−グロビンの5’非翻訳領域、CATのレポーター遺伝子、IRES要素、およびルフェラーゼのレポーター遺伝子を含む。テスト化合物を、構築物pBCRLを用いるとIRES要素により作動されるルシフェラーゼ合成は阻害するが、構築物pBCRLを用いるとβ−グロビンの5’NTRにより作動されるCAT合成は阻害せず、かつ構築物pBLを用いるとβ−グロビンの5’NTRにより作動されるルシフェラーゼ合成を阻害しない能力についてスクリーニングする。
【0093】
B.翻訳用のHela S3のS10の調製:
材料/調製法
タイプBのホモジナイザーをEtOHおよびDEPC H2Oを用いてフード内ですすぐ。低張溶菌緩衝液:0.119gのHepes(500μl 1M)、0.049gのKOAc(250μl 2M)、0.016gのMgOAc(74μl 1M)、50mlにするまでのDEPC H2O。1MのKOHでpHを7.4に調節する。新規に調製した10mlのHepes緩衝液中の25μlの1M DTTを添加する。透析緩衝液:2.838gのHepes、8.833gのKOAc、1.5mlの1M MgOAc、1LにするまでのH2O(非−DEPC H2Oで十分であろう)。1MのKOHでpHを7.4に調節し、10mlのHepes緩衝液中の25mlの1M DTTを添加する。オートクレーブもしくはフィルター滅菌処理を行い、そして4℃に保存する。12000〜14000カットオフ型のチューブに入れて透析する。2×ロード用色素:125μLの1M トリス−HCl pH6.8、400μlの10%SDS、100μlのメルカプトエタノール、375μlの50%グリセロール。微量のブロモフェノールブルーを添加する。
【0094】
対数期にある2LのHeLa S3細胞を取得する(5×105細胞/ml)。細胞を氷冷PBSで3回洗浄する(各20mlのPBSで行い、最初の洗浄には10mlのPBS/L細胞、2回目の洗浄には15mlのPBS/L、そして3回目の洗浄には10mlのPBS/Lを用いる)。2K rpmで10分間遠心する。3度目の遠心には30mlのコレックス試験管およびHB4ローターを使用する。低張緩衝液で1.5×のパック化細胞容積にするように再懸濁させ、そして氷上で10分間膨潤させる。低張緩衝液(RNase非含有性):10mMのK−HEPES pH7.4 1M保存液、10mMのKOA 4M保存液、1.5mMのMgOAc(1M)保存液、2.5mMのDTT(使用前に添加する)。タイプBホモジナイザーの15〜45ストロークでホモジナイズする。10、15、20、25などのストローク後に肉眼的にかあるいは色素液排除アッセイのいずれかにより細胞破壊を確認する。細胞が破壊されていれば破片が見えるであろう。5分間2K rpmで遠心する(核を除去する)。上清を取り出し、そして20分間10K rpmで遠心する。滅菌コレックス試験管を使用する。2時間1L(100培容積)の透析緩衝液(10mMのK−HEPES、pH7.5、90mMのKOAc、1.5mMのMgOAc、2.5mMのDTT)に対して透析して除濁および緩衝液の置換を行う。2.5mlの1M DTTを使用直前に添加する。−80℃で一晩凍結させ、25℃で約30分間解凍させ、即座に氷上に置く。10K rpmで10分間、ミクロフュージ内で遠心する。200μlの50%グリセロール/800μl溶菌液上清を添加する。1mlの抽出物当たりに7.5μl(2mg/ml)のミクロコッカスヌクレアーゼおよび7.5μlの100mM CaCl2を添加する。25℃で5分間インキュベートする。15μLの200mM EGTA/mlの抽出物を添加する。150μl/試験管のアリコートに分け、−80℃に保存する。
【0095】
C.翻訳反応
10×翻訳ミックス:1mMのATP、50μMのGTP、10mMのクレアチンリン酸エステル、24μg/mlのCPK、18mMのHepes、2mMのDTT、24μg/mlのtRNA、12μMのアミノ酸ミックス、240μMのスペルミジン。アリコートに分け、そして−80℃に保存する。混合物は以下のものを含む。40μlの100mM ATP、6μlの40mM GTP、40μlの1Mクレアチンリン酸エステル(−20℃に保存)、Hepes中の10μlの10mg/mlのクレアチンホスホキナーゼ(−20℃に保存)、76μlのK−Hepes pH7.6、8μlの1M DTT(37℃で解凍)、10μlの10mg/mlのウシ肝臓のtRNA(Boehringer社)、50μlのアミノ酸ミックス−メチオニン、10μlの100mMスペルミジン、および250μlのH2Oで500μlにする。
【0096】
マスターミックス(新しく調製):混合物は以下のものを含む。150μlのミクロコッカスヌクレアーゼ処理化HeLa抽出物、50μlの翻訳ミックス、22μlの2M KOAc、3μlの50mMのMgOAc、16μlの20mM MgCl2、25μlの35S−met(20μCi/μl)。これは28回分の翻訳に十分な量であって、より少ない量の試料の場合には量を減らす。
【0097】
翻訳:混合物は以下のものを含む。8.0μlのマスターミックス、DEPC H2O中の4.5μlの1μM RNA、+/−10μlのテスト化合物。30℃で3時間インキュベートする。40μlの2×ロード色素、28μlのH2Oを添加し、5分間沸騰させ、20μlを12%のゲルに乗せ、固定、増強化、XRPフィルムへの露出を行う。増強化には1Mのサリチル酸ナトリウム16g/100mlを試す。
【0098】
D.ルシフェラーゼアッセイ
DeWet et al.(1987、Mol.Cell Biol.7、725−727)により記載されるとおり。D−ルシフェリンの1mM保存溶液は2.8mgのルシフェリン(酸非含有性−氷上および暗所に維持する)を9.8mlのH2Oに添加することにより調製し、ボルテックスミキサーにかけて塊を除去し、100μLの1M Na2HPO4を添加し(黄緑色を生じ、いくぶんかの沈殿を生じることがある)、100μlの1M NaH2PO4−H2Oを添加し(溶液は透明)、アリコートに分け、そして−20℃に保存する。1〜10mg/mlでH2O中のルシフェラーゼの保存液を作成し、アリコートに分け、−20℃に保存する。<1mg/mlでトリシン緩衝液、DTT、MgSO4、および0.1%のBSA中に溶解させた市販のルシフェラーゼをアリコートに分け、−20℃に保存する。トランスフェクトさせた細胞(非溶菌化)を−20℃に保存する。100μlの溶菌液をアリコートに分け、4℃に2〜4週間保存する。インビトロ翻訳物を−20℃に保存する。アッセイを実施するためには、350μlのアッセイ緩衝液を25℃で使用し、100μlの溶菌液からの10〜50μlの冷却細胞懸濁液、もしくは20μlのインビトロ翻訳反応物からの1〜10μlを添加する。100μlのルシフェラーゼ溶液を注入する。アッセイ緩衝液(新鮮なものを使用する):125μlの100mM ATP、75μlの1M MgSO4、4675μlの超音波処理用緩衝液(100mMのK2HPO4[二塩基物]pH7.8、1mMのDTT)。
【0099】
E.細胞性アッセイ
2つの異なるレポーター蛋白質の合成を指示するジシストロン性構築物を細胞内にトランスフェクトさせ、細胞をテスト化合物に露出し、その後にこれを各々のレポーター蛋白質を産生する能力についてテストする。両方のレポーター蛋白質の産生は可視化させるか、あるいは好ましくは同時にもしくは別法では連続して同じ細胞内で検出する。レポーター蛋白質は、ルシフェラーゼ、β−ガラクトシダーゼ、分泌胎児アルカリホスファターゼ、CAT、β−グルクロニダーゼの内のいずれかか、あるいは当業者に知られる他の適切な蛋白質でありうる。
【0100】
選択的にウイルスの翻訳を阻害する化合物はレポーター蛋白質2の産生を阻害するが、レポーター蛋白質1の産生は阻害せず、細胞にとって一般的に毒性である化合物はレポーター蛋白質1の合成、および恐らくはレポーター蛋白質2の合成を阻害する。
【0101】
実施例9:アンチセンスDNAオリゴヌクレオチドインヒビターでのリノウイルス翻訳の阻害
オリゴピリミジンの区域(tract)が全てのピコルナウイルスIRES要素の3’端付近に見いだされている(図5、nt572〜580)。様々なオリゴピリミジン区域のより厳密な調査により、下流のAUGトリプレットの存在が明らかになった(図5、nt591〜593)。この保存要素は「YnXmAUG」モチーフと称され、Ynは長さnのピリミジン区域に相当し、この式中nは4〜12に変化することができ、そして最も好ましくは5〜9のヌクレオチドであり、そしてXmは長さmのランダムスペーサー配列に相当し、この式中mは5〜30に変化し、そして最も好ましくは10〜20ヌクレオチドである(Jang et al.、44 Enzyme 292、1990)。
リノウイルスIRES要素により用いられる開始コドンは、「YnXmAUG」モチーフの約31ヌクレオチド下流に位置している。
【0102】
出願人は、リノウイルスIRES要素の3’端を標的とし、かつリノウイルスIRES−依存的翻訳を阻害するアンセンスデオキシオリゴヌクレオチドを設計した。IRESのこの領域は「YnXmAUG」モチーフおよび先に記載される保存化21塩基配列の両方を含むためにこの領域が選択され、そしてこれを図1に示す。リノウイルスIRES要素のアンチセンスデオキシオリゴヌクレオチド阻害は[35S]−メチオニン取り込みアッセイ(図7)およびルシフェラーゼ活性アッセイ(図8)を用いてアッセイした。この領域を標的にするアンチセンスオリゴヌクレオチドの例はアンチ−IRES−オリゴであり、これはリノウイルス14のIRESのnt518〜551にアニールする。アンチ−IRES−オリゴ(配列番号26)の配列は、5′AGTAGTCGGTCCCGTCCCGGAATTGCGCATTACG3′である。
【0103】
アンチ−IRES−オリゴの存在および非存在下でのモノシストロン性bLuc mRNA(図6A)およびジシストロン性のbCRL mRNA(図6B)の翻訳を測定した。予期されるように、アンチ−IRES−オリゴはbLuc mRNAからのルシフェラーゼの翻訳(図7、レーン5〜6に対してレーン3〜4におけるルシフェラーゼ翻訳を比較せよ)もしくはbCRLからのCATの翻訳(図7、レーン9〜10に対してレーン7〜8におけるCATの翻訳を比較せよ)を阻害しなかった。しかしながら、アンチ−IRESはbCEL mRNAからのルシフェラーゼの翻訳を劇的に阻害した(図7、レーン7〜8とレーン9〜10におけるルシフェラーゼ翻訳を比較せよ)。従って、アンチ−IRES−オリゴは特異的にリノウイルスIRES−依存的翻訳を阻害する。その上、修飾化核酸もしくは核酸アナログも本実施例の方法に利用することができる。
【0104】
ルシフェラーゼ活性アッセイを実施して、アンチ−IRES−オリゴによるbLおよびbCRLmRNAからのルシフェラーゼの翻訳阻害を定量化した。35S−メチオニン取り込みアッセイの結果と一致して、アンチ−IRES−オリゴはbL mRNAからのルシフェラーゼ翻訳を阻害しなかったが(図8、レーン2および3を比較せよ)、一方でこれはbCRL mRNAからのルシフェラーゼ翻訳を約95%阻害した(図8、レーン5および6を比較せよ)。対照デオキシオリゴヌクレオチド(対照−オリゴ、非表示)を、アンチ−IRES−オリゴに対して逆転させてあり、かつ相補的である配列を用いて合成した。従って対照デオキシオリゴヌクレオチドはおおよそ同じG−CおよびA−T組成を有するが、リノウイルス14のIRESのnt518〜551にアニールすることができない。対照−オリゴはbLもしくはbCRLのmRNAの翻訳に何の影響も及ぼさなかった(図8、レーン4とレーン2を、そしてレーン7とレーン5を比較せよ)。従ってアンチ−IRES−オリゴはリノウイルスのIRESにより作動される翻訳を特異的に阻害するように思われる。
【0105】
薬剤の投与
本発明の方法を実施する際には、組成物を単独もしくは互いに組み合わせてか、あるいは他の治療剤もしくは診断剤と組み合わせて用いることができる。これらの組成物はインビボで、通常は哺乳類において、好ましくはヒトにおいて、あるいはインビトロで利用することができる。これらをインビボで利用する際には、組成物を、非経口的、静脈内的、皮下的、筋肉内的、経結腸的、経直腸的、経膣的、経鼻的、経口的、経皮的、局所的、経眼的、腹膜内的を初めとする数々の方法において、もしくは数々の投与剤形態を利用する適切に製剤化される外科用移植片として哺乳類に投与することができる。当業者には容易に明白であろうが、投与すべき有用なインビボ用量および投与の特別な様式は、治療される哺乳類の種、利用する具体的な組成物、およびこれらの組成物を利用する特異的な用途に依存して変化するであろう。効果的な用量レベルとは所望される結果を達成するのに必要な用量レベルであり、この決定は当業者の技術範囲内に含まれるであろう。典型的には組成物の適応はより低い用量レベルで開始され、用量レベルを所望の効果が達成されるまで増加する。
【0106】
本発明の組成物のための用量は、所望の効果および治療上の指示に依存して広域な範囲に及ぶことができる。典型的には用量は、約0.01μlと100mg/kgとの間、好ましくは約0.01と10mg/kg(体重)との間であろう。投与は毎日もしくは必要に応じての経口投与であることが好ましい。
選択される事例においては、薬物輸送用賦形剤を全身的もしくは局所的投与のために利用することができる。これらは徐放性リザーバーとして作用するようにか、あるいは標的細胞に直接それらの内容物を輸送するように設計することができる。
【0107】
薬物の局所投与が有利であり、それは最少の全身的吸収を伴う投与部位での局在濃縮が可能になるためである。
薬剤を全身的に投与することもできる。全身吸収は、血流における薬物の蓄積およびその後の体全体への拡散を意味する。全身投与につながる投与経路には、経口投与、静脈内投与、皮下投与、腹膜内投与、経鼻投与、包膜内投与、および経眼投与がある。
本明細書に引用される全ての刊行物は、各刊行物内に列挙される核酸配列を含めて本明細書内の引用により本明細書に取り込まれる。他の態様は以下の請求の範囲内に含まれる。
【図面の簡単な説明】
【0108】
【図1】アデノウイルスVAI RNAの末端ステム、中央ドメイン、および先端ステムループを示す図である(MA、Y.およびM.B.Mathews.1993。Comparative analysis of the structure and function of adenovirus virus associated RNAs.J.Virol.67:6605−6617)。
【図2】VAI RNAの相補配列に対してアニールされるアンチセンスVA(ava)オリゴデオキシヌクレオチド種ava1、ava2、ava3、およびava9を示す図である。
【図3】アンチセンス種および相補的VAI RNA領域、すなわちVAIRNAアンチセンスオリゴデオキシヌクレオチド(ODN)の配列を示す図である。
【図4】インビトロ翻訳アッセイの結果を示す図である。カラム1:(−)mRNA;カラム2:(+)mRNA;カラム3:(+)mRNA、(+)レオウイルスdsRNA;カラム4:(+)mRNA、(+)レオウイルスdsRNA、(+)VAI RNA。カラム5〜9:(+)mRNA、(+)レオウイルスdsRNA、(+)VAI RNA、ならびに以下のアンチセンス:カラム5:ava1;カラム6:ava2;カラム7:ava3;カラム8:ava9;カラム9:ava15。
【図5】ヒトのリノウイルス14の5’NTR配列および予想される二次構造を示す図である(Le、S.−Y.、and Zuker,M.(1990)J.Mol.Biol.216、729−741)。ヌクレオチド(「nt」)625におけるポリ蛋白質のための開始用AUG開始コドンを影付きボックスとして示し、非開始用AUGコドンを影なしボックスとして示す。ピコルナウイルスの全てのIRES要素内に見いだされるYnXmAUGモチーフ、ならびにリノウイルスおよびエンテロウイルスの全てのIRES要素内に見いだされる21塩基の保存配列に下線を施してある。リノウイルスゲノム上のヌクレオチドの位置に番号による印を付けてある。
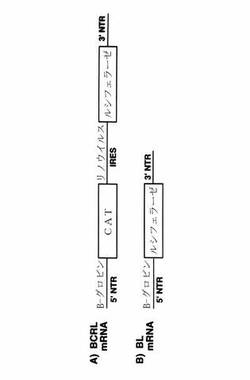
【図6】インビトロ翻訳研究のために用いられるmRNAの該略図を示す図である。A)CATレポーター遺伝子の翻訳から得られる_−グロビンの5’NTRを含むbCRLmRNA、およびルシフェラーゼレポーター遺伝子の翻訳から得られるリノウイルスのIRES。B)ルシフェラーゼレポーター遺伝子の翻訳から得られる_−グロビンの5’NTRを含むbLmRNA。実線は指示されるように、−グロビンの5’非翻訳領域(NTR)、リノウイルスのIRES、もしくは3’NTRを表す。ボックスはレポーター遺伝子CAT(クロラムフェニコールアセチルトランスフェラーゼ)およびルシフェラーゼを表す。
【図7】bLucおよびbCRLmRNAのインビトロ翻訳を示す図である。翻訳反応は、Lee、K.A.W.、and Sonenberg、N.(1982)Proc Natl.Acad.Sci、USA 79、3447、により記載されるように二重検査で実施した。レーンM、標識蛋白質;レーン1〜2、mRNAなし;レーン3〜4、bL mRNA;レーン5〜6、bL mRNAとアンチ−IRES−オリゴ:レーン7〜8、bCRL mRNA;レーン9〜10、bCRL mRNAとアンチ−IREAS−オリゴ。ルシフェラーゼおよびCAT翻訳産物に対応するバンドを、30、46、および69kDaの蛋白質マーカーと共に示す。
【図8】アンチセンス(アンチ−IRES−オリゴ)および対照(対照−オリゴ)デオキシオリゴヌクレオチドの非存在および存在下でのbLおよびbCRL mRNAの翻訳反応のルシフェラーゼ活性アッセイを示す図である。翻訳反応およびルシフェラーゼ活性アッセイは本文中に記載されるように実施した。2つの個別の複製物からの相対的光単位の平均値を求め、そしてbLおよびbCRL翻訳物からのルシフェラーゼ活性を比較のために100に標準化した。翻訳反応は、レーン1、mRNAなし;レーン2、bL mRNA;レーン3、bL mRNAとアンチ−IRES−オリゴ;レーン4、bL mRNAと対照−オリゴ;レーン5、bCRL mRNA;レーン6、bCRL mRNAとアンチ−IRES−オリゴ;レーン7、bCRL mRNAと対照−オリゴ、を含む。
【0109】
「配列表」
配列番号:1の情報:
(i) 配列の特徴:
(A) 配列の長さ: 46 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:1:
ATAGGTACCT AATACGACTC ACTATAGGGA CACTTGCTTT TGACAC 46
配列番号:2の情報:
(i) 配列の特徴:
(A) 配列の長さ: 29 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:2:
ATAGGGCCCC TCGAGGTCTG TTTTGGGGG 29
配列番号:3の情報:
(i) 配列の特徴:
(A) 配列の長さ: 26 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:3:
ATAGGATCCT TAAAACAGCG GATGGG 26
配列番号:4の情報:
(i) 配列の特徴:
(A) 配列の長さ: 20 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:4:
GGCGTCTTCC ATGATCACAG 20
配列番号:5の情報:
(i) 配列の特徴:
(A) 配列の長さ: 33 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:5:
ATAGGGCCCT GATCATGCTG CTGCTGCTGC TGC 33
配列番号:6の情報:
(i) 配列の特徴:
(A) 配列の長さ: 28 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:6:
ATAGTCGACT TAACCCGGGT GCGCGGCG 28
配列番号:7の情報:
(i) 配列の特徴:
(A) 配列の長さ: 27 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:7:
ATACTCGAGA TGGAAGACGC CAAAAAC 27
配列番号:8の情報:
(i) 配列の特徴:
(A) 配列の長さ: 29 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:8:
ATACCTAGGT TACAATTTGG ACTTTCCGC 29
配列番号:9の情報:
(i) 配列の特徴:
(A) 配列の長さ: 46 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:9:
ATAGGTACCT AATACGACTC ACTATAGGGA CACTTGCTTT TGACAC 46
配列番号:10の情報:
(i) 配列の特徴:
(A) 配列の長さ: 29 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:10:
ATAGGGCCCC TCGAGGTCTG TTTTGGGGG 29
配列番号:11の情報:
(i) 配列の特徴:
(A) 配列の長さ: 32 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:11:
ATAGGGCCCT GATCATGGAA GACGCCAAAA AC 32
配列番号:12の情報:
(i) 配列の特徴:
(A) 配列の長さ: 29 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:12:
ATAGTCGACT TACAATTTGG ACTTTCCGC 29
配列番号:13の情報:
(i) 配列の特徴:
(A) 配列の長さ: 32 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:13:
ATACTCGAGA TGAGCTTGGC GAGATTTTCA GG 32
配列番号:14の情報:
(i) 配列の特徴:
(A) 配列の長さ: 26 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:14:
ATACCTAGGT TACGCCCCGC CCTGCC 26
配列番号:15の情報:
(i) 配列の特徴:
(A) 配列の長さ: 26 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:15:
ATAGGATCCT TAAAACAGCG GATGGG 26
配列番号:16の情報:
(i) 配列の特徴:
(A) 配列の長さ: 20 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:16:
GGCGTCTTCC ATGATCACAG 20
配列番号:17の情報:
(i) 配列の特徴:
(A) 配列の長さ: 1515 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:17:
ATGGTGGCCC CCGGCTCTGT GACCAGCCGG CTGGGCTCGG TGTTCCCTTT CCTGCTGGTC 60
CTGGTGGACC TGCAGTACGA AGGTGCTGAA TGTGGAGTAA ATGCAGATGT TGAGAAGCAT 120
CTGGAATTGG GCAAGAAGCT GCTCGCAGCC GGACAGCTCG CGGATGCGTT ATCTCAGTTT 180
CACGCTGCAG TAGATGGTGA CCCTGATAAC TATATTGCTT ACTATCGGAG AGCTACTGTC 240
TTTTTAGCTA TGGGCAAATC AAAAGCAGCA CTTCCTGATT TAACTAAAGT GATTGAATTG 300
AAGATGGATT TCACTGCAGC AAGATTACAG AGAGGTCACT TATTACTCAA ACAAGGAAAA 360
CTTGATGAAG CAGAAGATGA TTTTAAAAAA GTGCTCAAGT CAAATCCAAG TGAAAATGAA 420
GAGAAGGAGG CCCAGTCCCA GCTTGTCAAA TCTGATGAAA TGCAGCGTCT GCGCTCACAA 480
GCACTGGATG CCTTTGAGAG CTCAGATTTT ACTGCTGCTA TAACCTTCCT TGATAAGATT 540
TTAGAGGTTT GTGTTTGGGA TGCAGAACTT CGAGAACTTC GAGCTGAATG TTTTATAAAA 600
GAAGGGGAAC CTAGGAAAGC GATAAGTGAC TTAAAAGCTT CATCAAAATT GAAAAACGAT 660
AATACTGAGG CATTTTATAA AATCAGCACA CTCTACTATG AACTAGGAGA CCATGAACTG 720
TCTCTCAGTG AAGTTCGTGA ATGTCTTAAA CTTGACCAGG ATCATAAAAG GTGTTTTGCA 780
CACTATAAAC AAGTAAAGAA ACTGAATAAG CTGATTGAGT CAGCTGAAGA GCTCATCAAA 840
GAAGGCAGGT ACACAGATGC AATCAGCAAA TATGAATCTG TCATGAAAAC AGAGCCAGGT 900
GTTCATGAAT ATACAATTCG TTCAAAAGAA AGGATTTGCC ACTGCTTTTC TAAGGATGAG 960
AAGCCTGTTG AAGCTATTCG AGTATGTTCA GAAGTTTTAC AGGTGGAACC TGACAACGTG 1020
AATGCTCTGA AAGACCGAGC AGAGGCCTAT TTAATAGAAG AAATGTATGA TGAAGCTATT 1080
CAGGATTATG AAACTGCTCA GGAACACAAT GAGAATGATC AGCAGATTCG AGAAGGTCTG 1140
GAGAAAGCAC AGAGGCTACT GAAACAGTCA CAGAGACGAG ATTATTACAA AATCTTGGGA 1200
GTAAAAAGAA ATGCCAAAAA GCAAGAAATC ATTAAAGCAT ACCGAAAATT AGCACTGCAG 1260
TGGCACCCAG ACAACTTCCA GAACGAAGAA GAAAAGAAAA AAGCTGAGAA GAAGTTCATT 1320
GACATAGCAG CTGCTAAAGA AGTCCTCTCC GATCCAGAAA TGAGGAAGAA GTTTGATGAC 1380
GGAGAAGACC CCCTGGACGC AGAGAGCCAA CAAGGAGGTG GCGGCAACCC TTTCCACAGG 1440
AGCTGGAACT CATGGCAAGG GTTCAGTCCC TTTAGCTCAG GCGGACCTTT TAGATTTAAA 1500
TTCCACTTCA ATTAA 1515
配列番号:18の情報:
(i) 配列の特徴:
(A) 配列の長さ: 47 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:18:
AATAGAATTC TAATACGACT CACTATAGGG ACACTTGCTT TTGACAC 47
配列番号:19の情報:
(i) 配列の特徴:
(A) 配列の長さ: 27 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:19:
ATAAGGTACC TCTGTCTGTT TTGGGGG 27
配列番号:20の情報:
(i) 配列の特徴:
(A) 配列の長さ: 39 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:20:
AATACTGCAG TGATCATGGA AGACGCCAAA AACATAAAG 39
配列番号:21の情報:
(i) 配列の特徴:
(A) 配列の長さ: 36 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:21:
AATAAAGCTT GGGCCCTTAC AATTTGGACT TTCCGC 36
配列番号:22の情報:
(i) 配列の特徴:
(A) 配列の長さ: 37 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:22:
AATAGGTACC ATGGAGAAAA AAATCACTGG ATATACC 37
配列番号:23の情報:
(i) 配列の特徴:
(A) 配列の長さ: 27 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:23:
AATAGGATCC TTACGCCCCG CCCTGCC 27
配列番号:24の情報:
(i) 配列の特徴:
(A) 配列の長さ: 27 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:24:
AATAGGATCC TTAAAACAGC GGATGGG 27
配列番号:25の情報:
(i) 配列の特徴:
(A) 配列の長さ: 48 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:25:
AAAACTGCAG CATGCTGATC ACAGTATATG TATATATATG CTGTGACC 48
配列番号:26の情報:
(i) 配列の特徴:
(A) 配列の長さ: 34 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:26:
AGTAGTCGGT CCCGTCCCGG AATTGCGCAT TACG 34
【発明の開示】
【0001】
本発明は、ウイルス感染の治療に有用な薬剤のスクリーニングのための方法、このようなスクリーニング方法を用いて同定される新規の薬剤、および抗ウイルス剤としてのそれらの使用に関する。
【0002】
発明の背景
現在ではウイルス感染を防除するのに多様な薬剤が用いられている。これらの薬剤にはインターフェロンが含まれ、これは所定の選択されるウイルス性疾患の防除においていくらかの効果を有する天然に存在する蛋白質である。その上AZTのような薬剤が、ウイルスHIV−1により生じ、一般的にはAIDSと呼ばれる免疫不全性疾患の防除に用いられている。
【0003】
非特許文献1(Drug and Market Development、Vol 3、No.9、pp.174−180(2/15/93))は、抗ウイルス性薬物の開発を記載している。それは以下のように述べている。
大半の感染の薬物治療時に遭遇する難題はウイルス感染と比較すると見劣りがしてしまう。例えば、少なくとも理論的には(そしてしばしば実際に)宿主を害することなく細菌を攻撃することが可能である。しかしながら細菌とは異なり、ウイルスは細胞内で複製し、そして複製のために宿主の細胞性機構を利用する。その結果、抗ウイルス性治療の開発は、好ましくはウイルスの死滅化もしくは少なくともウイルス複製の阻止と、宿主を害さないかもしくは悪くても最低限の損傷のみを与えることとの間の折衷案を意味することがしばしばであり、これは利得の可能性により判断することができる。
【0004】
それは、以下に示すことを含むウイルスに特異的な現象を標的化することができるということを述べており、それらは:
*細胞膜へのウイルスの結合および細胞内への侵入、
*ウイルスの脱コート化、
*ウイルスの核酸合成、
*ウイルスの蛋白質合成および成熟、ならびに
*感染性粒子の組み立ておよび放出、である。
【0005】
ウイルスの蛋白質合成に関して著者は、具体的に以下のような記述を行っている。
核酸合成とは対照的に、ウイスルの蛋白質合成は宿主リボソーム(リボソームはmRNAの蛋白質への翻訳に必須な細胞構造物である)および大抵は宿主由来の補足因子を利用する。その結果、一般的には蛋白質合成インヒビターは、それらが抗ウイルス性効果を発揮するものであるのと同様に宿主毒性を示すようでもある。しかしながらアンチセンスオリゴヌクレオチドは、ウイルスの蛋白質合成を特異的に阻害する点で価値あるものである可能性がある。簡潔に述べると、アンチセンスオリゴヌクレオチドはmRNA(センス鎖)に相補的な短いDNA断片であり、そしてmRNAに結合することによりmRNAが指令する蛋白質合成を妨げることができる。RNA分子もセンスDNA鎖(およびそれらに対応するmRNA)のものに相補的な配列を含むように構築されている。アンチセンス構築物はインビトロでのウイルス性蛋白質合成を阻害することが示されているものの、インビボでのそれらの有効性は未だ決定的に証明されてはいない。オリゴヌクレオチド療法のための最近の試みにはとりわけ、ウイルス感染化細胞への輸送、インビボでのこのような分子の安定性、および体中全体への拡散が含まれる。
【0006】
リボソーム不活化因子は、ウイルス性蛋白質合成阻害のための他の研究方法を意味する。GLQ223(Genelabs社;Redwood City、CA)は、臨床試験中のリボソーム不活化因子である(GLQ223はトリコサンチン(キュウリ植物の誘導体)の精製製剤である)。リボソーム不活化因子は細胞の翻訳機構を邪魔して新規のウイルス蛋白質の産生を効果的に妨害するであろう。
【0007】
非特許文献2(Sonenburg、2 The New Biologist 402、1990)は、翻訳開始のレベルでのウイルス宿主相互作用を記載しており、そして2つの開始因子eIF−2およびeIF−4Fが数々のウイルス宿主相互作用における有意な役割を担っていることを述べている。彼は、「これらのウイルス−宿主相互作用の原因となる機構の理解はウイルス性疾患の将来の治療的研究方法にとっては非常に重大なものである」と述べている。
【非特許文献1】Drug and Market Development、Vol 3、No.9、pp.174−180(2/15/93)
【非特許文献2】Sonenburg、2 The New Biologist 402、1990
【0008】
発明の概要
本発明は、宿主細胞の感染中にウイルスにより使用される翻訳系を阻害するのに有効な薬剤をスクリーニングするための方法に関する。このスクリーニング方法は、有用である可能性のある薬剤を適切な巨大分子配列、例えばウイルス核酸配列もしくは関連蛋白質配列と接触させ、これらの薬剤がこれらの配列の使用を特異的に阻害しうるか否かを決定するプロトコールを利用する。ウイルスは宿主の翻訳系を借用するために多様な方法を使用し、そして本発明の方法により特異的に標的化することができるのはこれらの方法である。いったん単離したら、ウイルス特異的な薬剤を薬剤学的に許容される製剤中の治療的製品(もしくは予防的製品にさえ)に製剤することができ、そして未感染のウイルス宿主細胞に影響をほとんど及ぼさないかもしくは全く及ぼさずにウイルス性疾患の特異的治療に用いることができる。
【0009】
具体的には、一つの態様においては出願者は、宿主RNAに勝るウイルス性RNAの優先的翻訳の原因となる標的ウイルス核酸配列もしくはドメインを選択プロトコールに用いるスクリーニング方法を提供する。このようなウイルス核酸配列もしくはドメインの数々の具体例を、IRES要素、特異的ウイルス配列を含む5’−非翻訳領域、およびこのような配列を含む上流読み取り枠の形態で以下に提供するが、これらは他のウイルス核酸配列をこのようなプロトコールにおいて用いることができる一般方法を例示するためのみに用られるに過ぎない。細胞翻訳系内でのこれらのウイルス核酸配列の内のいずれか一つの使用は、抗ウイルス剤を発見することができる手法を提供する。
【0010】
出願人は、特許請求される方法は、Dinman and Wichner、66 J.Virol.3669、1992;Jacke et al.、331 Nature 280、1988;Wilson et al.、55 Cell 1159、1988;Inglis and Brierly、国際公開第90/14422号;およびGoodchild and Zamecnik、国際公開第87/09300号により記載されるようなフレームシフトに係わるウイルス性配列(これは、本明細書に特定される優先的に翻訳される標的核酸ではない)に対する薬剤の標的化を含みはしないということを特筆する。
【0011】
このようなウイルス核酸に結合し、そして/またはウイルス性メッセージの翻訳の有意な減少を引き起こすいずれかの薬剤は、本発明に有用である可能性がある。このような薬剤をスクリーニングして、それらがウイルス翻訳系に特異的であり、かつ未感染宿主細胞翻訳系に何の影響も及ぼさず、そのためこの薬剤を治療的もしくは予防的様式で使用することができるということを確認することができる。このような薬剤が宿主細胞系にいくらかの影響を有する場合であっても、これらはなおも、特にHIV−1感染のような命を脅かす疾患における治療的処置に有効であることが可能である。
【0012】
このような薬剤は、標的ウイルス核酸と直接的に相互作用することができるか、あるいは宿主RNAよりはむしろウイルスRNAの翻訳を充進するためにウイルスにより用いられる蛋白質のようなウイルス翻訳系の他の構成成分(すなわち、インビボでウイルスmRNAの翻訳を起こさせる核酸および/または蛋白質のいずれにせよ宿主および/またはウイルス構成成分のものである)と結合もしくは相互作用することができるかのいずれかである。しかしながら出願人は、有用な抗ウイルス剤として更に容易に製剤することかできる低分子量(10,000未満、好ましくは5,000未満、そして最も好ましくは1,000未満)の薬剤の同定を特に考慮している。従ってある好ましい態様においては、本発明はこのような低分子量の薬剤を特徴とする。
【0013】
従って第一態様においては、本発明は、抗ウイルス剤についてのスクリーニングのための方法を特徴とする。この方法には、ウイルス感染条件下での宿主RNAに比較するウイルスRNAの優先的翻訳を可能にする標的ウイルス翻訳核酸配列を提供することが含まれる。この方法は、この核酸へのある薬剤の結合を検出するための単純なアッセイを必要とすることがある。しかしながら標的ウイルス翻訳核酸配列はレポーターポリペプチドをコードするRNAに翻訳的に連結されることが好ましい。次にこの方法は、その薬剤の非存在下でのレポーターポリペプチドの合成を可能にする条件下で、標的ウイルス翻訳核酸配列を有望な抗ウイルス剤と接触させることを更に含む。この方法は最後に、その薬剤がレポーターポリペプチドの翻訳レベルを減少するか否かを決定することを含む。このレベルを減少させるいずれかの薬剤は有用な抗ウイルス剤である可能性がある。
【0014】
具体的にはこの方法は、ウイルス感染条件下で宿主RNAと比較するウイルスRNAの優先的翻訳を可能にするもしくは妨害するウイルス性もしくは細胞性構成成分と、ある有望な薬剤が相互作用を行うか否かを決定すること、ならびにその薬剤とその構成成分との相互作用がウイルスのRNAの翻訳レベルを減少させるか否かを決定することを含む。
【0015】
「スクリーニング」とは、多数の有用である可能性のある薬剤が本発明の方法で処理されるある過程を意味することが好ましい。これは一般的には、単一の薬剤を詳細に研究してその作用方法を決定する単一実験とは異なる過程である。
【0016】
標的ウイルス翻訳核酸配列とは、ウイルス感染条件下での翻訳に関連するRNAの優先的翻訳を可能にするいずれかの核酸を意味する。このような核酸は、関連するリボ核酸のキャップ非依存的翻訳を可能にするIRES要素、および関連するRNAのキャップ依存的な優先的翻訳を可能にするインフルエンザウイルスRNAの5’非翻訳領域により例示される。
【0017】
優先的翻訳とは、RNAが、ウイルス感染条件下で宿主細胞RNAより速く翻訳されるかまたはより高い収率の蛋白質で翻訳されることを意味する。さらに、宿主細胞RNAは、非感染条件下と比較してより遅い速度で翻訳されるかまたはより低い蛋白質収率で翻訳されるであろう。このような優先的翻訳は以下に記載されるように容易に検出することができる。大半のウイルスの場合では、ウイルス性蛋白質の優先的発現は、ウイルス性蛋白質の合成が、例えばウイルス感染化細胞におけるパルスラベル実験により検出されるように、少なくとも50%のデノボ総蛋白質合成を表すことを意味する。このような場合、ラベル化蛋白質をゲル電気泳動により分離したときウイルス蛋白質は通常主要バンドとして区別することができる。レトロウイルスの場合ではウイルス性蛋白質の優先的発現は、合成されるウイルス性蛋白質のレベルが合成されるウイルスRNAのレベルを不均衡に上回ること意味する(Cullen、Cell 46:973、1986)。このような不均衡な増加は、例えばRNA合成についてのノザンブロットおよびヌクレアーゼ保護アッセイ、ならびにラベル化蛋白質についての免疫沈降およびゲル電気泳動により、感染化細胞内におけるウイルス性RNAおよび蛋白質合成のレベルを定量することにより検出することができる。
【0018】
ウイルス感染条件とは単純にウイルスの翻訳系が作動するような標的ウイルスでの感染後の宿主細胞内での条件を意味する。このようなウイルス翻訳系は通常は宿主細胞蛋白質、核酸、および他の構成成分を含む。
レポーターポリペプチドとは単純に、所定の環境条件下における比色分析シグナルか、あるいは以下に記載するような通常の当業者によく知られる幾つかの他のシグナルのいずれかを提供することにより容易に検出可能なペプチドを意味する。
【0019】
好ましい態様においてはこの構成成分は蛋白質もしくは核酸であり、この構成成分はウイルスによりコードされるかもしくは宿主細胞によりコードされ、この構成成分はRNA配列ドメイン、DNA配列ドメイン、開始因子および伸長因子、停止因子、転写因子、リボソーム蛋白質、グリコシラーゼ、デグリコシラーゼ、ピレニル化および脱ピレニル化用酵素、トランスフェラーゼ、ポリメラーゼ、シンセターゼ、ADPリボシル化用酵素、ADPリボシラーゼ、キナーゼ、リパーゼ、ミリスチル化もしくは脱ミリスチル化用酵素、ホスホリラーゼ、プロテアーゼ、rRNA、tRNA、リボヌクレアーゼ、およびデオキシリボヌクレオアーゼから選択される巨大分子であり、ウイルス翻訳シグナル核酸配列は、IRES要素、5’もしくは3’非翻訳領域、および上流読み取り枠、もしくは宿主細胞がウイルスにより感染する際の宿主細胞mRNAに勝るウイルスmRNAの優先的翻訳を可能にするいずれかの他のウイルス標的翻訳核酸からなる群より選択され、そしてシグナルが選択されるウイルスは、ピコルナウイルスファミリー、A型、B型、およびC型肝炎ウイルス、インフルエンザウイルス、HIV、ヘルペスウイルス、およびサイトメガロウイルスから選択される。
【0020】
他の好ましい態様においては、配列ドメインはレポーターポリペプチドをコードするRNAに翻訳的に連結されており、そして第二決定段階はその薬剤がレポーターポリペプチドの翻訳レベルを変化させるか否かを決定することを含み、この構成成分は蛋白質もしくはポリペプチドであり、そしてこの決定段階は翻訳混合物中の構成成分にレポーターポリペプチドをコードするRNAを提供すること、およびその薬剤がこのミックス中のそのレポーターポリペプチドの発現を変化させるか否かを決定することを含む。
【0021】
より好ましい態様においては、この方法は更に、先の方法で活性な薬剤が非感染ウイルス宿主細胞の翻訳機構にほとんど影響を及ぼさないもしくは全く影響を及ぼさないか否かを決定し、そして更にその薬剤がインビボ条件下で活性であるか否かを決定することを含む。このような薬剤をその後に薬剤学的に許容される緩衝液中で製剤する。
【0022】
薬剤学的に許容される緩衝液とは、保存およびその後の投与のために調製される薬剤学的組成物中に用いることができ、薬剤学的に許容される担体もしくは賦形剤中に本明細書に記載される薬剤の薬剤学的有効量を含むいずれかの緩衝液を意味する。治療的使用のための許容される担体もしくは賦形剤は薬剤学的技術においてよく知られており、かつ例えばRemington’s Pharmaceutical Science、Mack Publishing Co.(A.R.Gennaro edit、1985)に記載される。保存料、安定化剤、色素、および矯味・矯臭剤さえもこの薬剤学的組成物中に提供することができる。例えば、安息香酸ナトリウム、ソルビン酸、およびp−ヒドロキシ安息香酸のエステルを保存料として添加することができる。同書物の1449頁。その上酸化防止剤および懸濁用試薬を使用することができる。同書物。
【0023】
第二態様においては、本発明は、ウイルス翻訳シグナル核酸配列を有するウイルスに感染している被検体を、ウイルス翻訳シグナル核酸配列に生来関連するウイルスRNAの翻訳を選択的に遮断することが可能な抗ウイルス剤の治療学的有効量をその被検体に投与することにより治療するための方法を特徴とする。
「治療学的有効量」とは、患者の疾患もしくは状態の内の一つもしくは複数の症状を緩和する(ある程度)量を意味する。その上「治療学的有効量」とは、ウイルス性疾患に関連するか、あるいはその原因である生理学的もしくは生化学的パラメータを部分的かもしくは完全かのいずれかで正常にもどす量を意味する。一般的にはこれはその分子の約1nモルと1_モルの間の量であり、そのEC50、ならびに患者に関連する年齢、サイズ、および疾患に依存する。
【0024】
第三の関連態様においては、本発明は、先に記載される方法により発見される新規の抗ウイルス剤を特徴とする。この態様はまた、先に記載されるように発見され、かつ薬剤学的に許容される製剤中に製剤される抗ウイルス剤を含む新規の薬剤学的組成物をも含む。
第四態様においては、本発明は、抗ウイルス剤を発見するためのレポーターコード化配列に翻訳的に連結される単離ウイルス核酸を含む核酸構築物の使用、および抗ウイルス剤スクリーニング方法におけるこれらの構築物の使用のためのキットを特徴とする。
【0025】
第五態様においては、本発明は、ウイルスmRNA翻訳系に関連する他の非核酸巨大分子の活性を調節する活性について抗ウイルス剤をスクリーニングする方法を特徴とする。例えば、薬剤をスクリーニングするための方法には、ある細胞中のp68キナーゼにその活性を発現させることができる試薬を例とするように、そのような巨大分子の活性を妨害するという点で巨大分子を阻害するのに役立つものを同定することを含む。本発明はまた、真核生物宿主細胞内のウイルスの複製を阻害するためにそのような薬剤を利用する方法を特徴とする。
【0026】
従って本発明は宿主真核生物細胞内におけるウイルス複製を阻害する方法を含み、この場合例えばこのウイルスは、宿主細胞のインターフェロン誘導化二本鎖RNA活性化プロテインキナーゼの活性化を妨害するウイルス性インヒビターを産生する。この方法は、細胞に対して、プロテインキナーゼの活性化を妨害するという点でのウイルス性インヒビターの効果を遮断することが可能な薬剤を投与することを含む。
【0027】
関連態様においては、本発明は、プロテインキナーゼへの二本鎖RNAの結合を遮断することが可能なウイルス性インヒビターを産生するウイルスを特徴とし、そして投与される薬剤は、プロテインキナーゼへのウイルス性インヒビターの結合を遮断することが可能なものである。
この薬剤は、例えば、プロテインキナーゼ、ウイルス性インヒビター、およびその薬剤からなる混合物を形成し、その混合物の構成成分をウイルス性インヒビターの非存在下でのそのプロテインキナーゼの自己リン酸化に有効な条件下でインキュベートし、そのプロテインキナーゼ活性の存在についてその混合物を調査し、そしてその薬剤がプロテインキナーゼ活性の阻害を妨害可能である際にはそれを選択することにより、選択することができる。
【0028】
具体的態様においては、このウイルスがアデノウイルスであり、かつウイルス性インヒビターがVAI RNA分子(VA1およびVA RNAIとしても知られる)であり;このウイルスがヒトの免疫不全症ウイルス(HIV)であり、かつウイルス性インヒビターがHIVゲノムのTAR領域であり;そしてこのウイルスがエプスタイン−バール(Epstein−Barr)ウイルスであり、かつウイルス性インヒビターがEBER−1 RNAである。
他の関連態様においては、ウイルス性インヒビターは、活性化形態においてプロテインキナーゼの活性化を遮断することができるか、あるいは既に活性化されているプロテインキナーゼの活性を遮断することが可能である宿主細胞のp58蛋白質を活性化するのに有効であり、そしてこの薬剤はp58蛋白質を介するキナーゼに対するウイルス性インヒビターの相互作用を遮断するものである。この薬剤は例えば、プロテインキナーゼ、p58蛋白質(活性形態)、およびその薬剤からなる混合物を形成し、そしてその後にその混合物の構成成分をp58蛋白質の非存在下でのそのプロテインキナーゼを自己リン酸化するのに有効な条件下でインキュベートし、その混合物をプロテインキナーゼ活性の存在について調査し、そしてその薬剤がp58が存在する際にプロテインキナーゼ活性の阻害を減少することが可能である場合にそれを選択することにより、選択することができる。
【0029】
他の関連態様においては、本発明は、宿主真核生物細胞内でのウイルス複製を阻害するのに有効な薬剤をスクリーニングするための方法を含み、この場合ではウイルスは、宿主細胞のインターフェロン誘導化二本鎖RNA活性化プロテインキナーゼの活性化を妨害するウイルス性インヒビターを産生することが可能であるものである。この方法は、そのプロテインキナーゼ、ウイルス性インヒビター、およびその検査されるべき薬剤を含む混合物を、そのウイルス性インヒビターがそのプロテインキナーゼの活性化を妨害するのに有効な条件下でインキュベートし、そして混合物におけるそのような妨害についての調査を行うことを含む。
他の関連態様においては、本発明の方法を、活性化形態においてはプロテインキナーゼの自己リン酸化を遮断するか、あるいはリン酸化されているキナーゼの活性を遮断するのに有効であるp58宿主蛋白質を活性化するのに有効であるウイルス性インヒビターを産生するウイルスのウイルス複製を遮断するのに有効な薬剤をスクリーニングするのに使用する。ここでは形成される混合物はp58宿主細胞蛋白質を含み、インキュベーション段階をこのプロテインキナーゼがp58の非存在下で自己リン酸化されるであろう条件下で実施し、そしてこの混合物をプロテインキナーゼ活性の阻害の減少について調査する。
【0030】
更に他の好ましい態様においては、本発明の方法は、(i)ウイルスmRNA構築物(このmRNA構築物は(a)内部リボソーム貫入部位(IRES)領域およびそのIRES領域の下流、第一レポーター蛋白質コーディング領域を含む)、(ii)リボソーム、および(iii)検査されるべき薬剤を含む蛋白質翻訳混合物を形成し、その翻訳混合物の構成成分を第一レポーター蛋白質コーディング領域からレポーター蛋白質を産生するのに有効な条件下でインキュベートし、そしてその混合物をこのような翻訳混合物により産生されるレポーター蛋白質の存在について調査することを含み、そしてこの薬剤の存在下で産生されるレポーター蛋白質がテスト薬剤の非存在下で産生されるレポーター蛋白質の量を下回る場合にはこの薬剤は有用な抗ウイルス剤である。
【0031】
このIRES領域がピコルナウイルスのIRES領域配列から取得され、このIRES配列が、エンテロウイルス、リノウイルス、カルジオウイルス、およびアフトウイルスのIRESA配列からなる群より選択され、このIRES領域が、A型肝炎ウイルスのIRES配列、B型肝炎ウイルス配列、およびC型肝炎ウイルスのIRES配列からなる群より選択され、この蛋白質翻訳混合物が無細胞抽出物であり、ウイルスmRNA構築物の5’末端が真核生物のmRNAの5’末端キャップおよび非翻訳領域(UTR)、ならびにそのキャップおよびUTR領域の下流、第二レポーター蛋白質を含み、そしてその翻訳混合物が、ある細胞中に含まれることが好ましい。
関連態様においては、この薬剤は宿主真核生物細胞内のウイルス複製を阻害するのに有効であり、この場合この宿主細胞は宿主細胞のインターフェロン誘導化二本鎖RNA活性化プロテインキナーゼの活性化を妨害するインヒビターを産生し、そしてこの方法は、プロテインキナーゼ、インヒビター、および検査されるべき薬剤を含む混合物を、インヒビターがプロテインキナーゼの活性化を妨害するのに有効な条件下でインキュベートし、そしてその混合物をそのような妨害について調査することを含む。
【0032】
この方法が、活性化形態においてはプロテインキナーゼの活性もしくは活性化を遮断するのに有効なp58宿主細胞蛋白質を活性化するのに有効なインヒビターを産生するウイルスのウイルス複製を遮断するのに有効な薬剤をスクリーニングすることにおける使用のためのものであり、そして形成される混合物がp58宿主細胞蛋白質を含み、そしてインキュベーションをこのプロテインキナーゼがp58の非存在下で活性化される条件下で実施し、そして調査はプロテインキナーゼ活性の阻害についてのその混合物の調査を含むことが好ましい。
本発明の他の特徴および利点は本発明の好ましい態様の以下の記載、および請求の範囲から明らかになるであろう。
【0033】
好ましい態様の説明
抗ウイルス剤
細菌のような一層複雑な生物体により生じる感染を治療するのに利用可能な多数の薬物があるとすると、いかに少数の薬物がウイルスとして知られる比較的単純な生物体の感染を治療するのに利用可能であるかが明白となる。実際に、大半のウイルス性疾患は本質的には未治療のままである。抗ウイルス剤の開発における主要な難題は、細菌とは異なり、ウイルスは宿主細胞内で複製し、そしてそれらの細胞の機構を複製のために利用して、それらの宿主と多くの栄養要求性および合成経路を共有することである。その結果、宿主までを害することなくウイルスの複製を撲滅もしくは停止させる薬剤を同定することは困難である。ヒトにおける使用のために認可されている抗ウイルス剤でさえも、それらの利用性を制限する副作用を有することがしばしばである。
【0034】
現存する抗ウイルス剤の大部分のものがヌクレオシドアナログ、あるいはヌクレオシドキナーゼあるいはポリメラーゼもしくはリバーストランスクリプターゼのような、ウイルス性遺伝物質の新しいコピーを産生するのに必要な酵素を介してそれらの効果を働かせる他の薬剤である。これらのアナログは典型的にはヌクレオチドアナログへと代謝され、これは例えばポリメラーゼを阻害するか、もしくはウイルス核酸の増殖の未成熟な鎖停止を生じることによりウイルス核酸の産生を阻害する。しかしながらウイルスと細胞の核酸代謝は非常に類似するため、ある程度宿主細胞酵素により用いられることがない抗ウイルス剤を発見することは困難である。このことが耐性であることが可能な抗ウイルス剤の用量を制限し、このことが次にはこの薬物の利用性を制限する可能性がある。
【0035】
ある薬物が有効用量で耐性を示す場合においてさえ、その有効性は、比較的迅速に突然変異を起こして同じように有効にはその薬物を利用せず、またはその薬物によりさほど阻害されない新版のウイルス酵素を進化させるウイルスの能力により著しく減少されることがある。
従って宿主による耐性が示される用量で効果的であり、かつウイルスにとって突然変異による回避を行うことがより困難であろう新規の抗ウイルス剤についての明確な必要性が存在する。
【0036】
本発明は、このような薬物を発見するため、かつ発見した薬物で疾病を治療するための新規の方法を提供する。本発明の方法は、ウイルスが感染する細胞内での蛋白質合成(メッセンジャーRNAの翻訳)の制御を多くのウイルスが借用するという所見に基づく。ウイルス性蛋白質は感染化宿主内において宿主蛋白質に勝って優先的に合成される。ウイルス性蛋白質のこの優先的合成はウイルスの複製にとって重要である。従って、蛋白質合成のウイルスの借用を減少もしくは予防する薬物が有効な抗ウイルス剤である。
【0037】
このような薬物は現行の抗ウイルス剤に勝る有意な利点を有する。先に記載するように、後者の大部分のものにとっての標的はウイルス核酸の合成に必要とされる酵素であり、そして宿主もまた核酸合成に作用する酵素を含むため、宿主のものをも攻撃することなくウイルスの酵素を攻撃することは困難である。類似の問題が、ウイルスおよび宿主細胞の両方により必要とされる物質の合成における活性触媒であるいずれかの薬剤標的について生じるらしい。本発明の方法においては、その薬剤の標的は合成経路内の活性触媒ではないために、これらの問題は回避される。それらの標的は、そのような経路内の触媒よりはむしろ合成経路(蛋白質合成)への優先的接近を確実に行うためウイルスにより用いられる装置である。ウイルスの宿主の攻撃の際にウイルスにより用いられる武器として、これらの装置は宿主内に類似物を有さない。従って、これらの装置を妨害する薬物は宿主において最少の副作用を有する。
【0038】
このような薬物は、2つの理由のために現行の薬物よりも更に有効である。第一に、これらの最少副作用は、それらより高い用量でこれらを使用することを可能にする。第二に、これらの薬物は、その標的が宿主相同物を有する薬剤について耐性であるよりはそれらの標的に対して本質的により障害的であることが可能であり、これは後者の薬剤の障害性が本質的に強すぎる場合には、それらは宿主相同物をある程度害することがあるためである。
ウイルスはまた、ウイルスの翻訳略奪装置を標的にする薬物に対する抵抗性を進化させることがさほど可能ではない。これらの装置は蛋白質合成に関連する宿主細胞構成成分との相互作用を必要とするはずであり、そしてこれらの相互作用を保持することの必要性は、ウイルスはそれらがその略奪用装置を突然変異させることが可能な範囲内にウイルスが制限されることを意味する。ウイルスがある薬剤を回避するために余りにもかけ離れて突然変異する場合には、ウイルスはもはや蛋白質合成を略奪することができないであろう。この制限はウイルスにとっては殊に問題となるものである。これは先に記載するように、略奪遮断剤は本質的にその標的に対して一層障害的である可能性があるため、ウイルスは略奪遮断剤を回避するためには、その標的が宿主相同物を有する合成酵素である薬物を回避するよりは一層大きな変化を必要とする可能性があるためである。
まとめると、本発明は現行のこのような薬物に勝る重要な利点、すなわち一層少ない副作用を有し、耐性ウイルスの進化の可能性が少ない新規の抗ウイルス剤を発見および利用するための手段を提供する。
【0039】
本発明の方法は、多くのウイルスはそれらが感染する細胞内の蛋白質合成の過程(mRNAの翻訳)の調節を借用するという所見に基づく。ウイルスは、ウイルスRNAの優先的翻訳を確実にする特別なウイルス核酸配列の使用(例えば、Pelletier et al.、Mol.Cell.Biol、8、1103−1112、1988;Trono et al.、Science 241、445−448;Sonenberg & Meerovitch、1990;Garfinkel & Katze、J.Biol.Chem.267、9383−9390、1992、を参照せよ)、これらの特別な配列との相互作用への細胞性蛋白質の補充(例えば、Jang SK & Wimmer E、Genes Dev.4、1560−1572、1990、を参照せよ)、翻訳もしくはその調節に関与する宿主細胞構成成分の修飾もしくは分解(例えば、Katze MG et al.、J.Virology 62、3710−3717、1988、Lee et al.、Proc.Natl.Acad.Sci.USA 87、6208−6212、1990、を参照せよ)、ならびに感染に反応して開始する細胞性防御の無能化(例えば、Katze MG、J.Interferon Res.12、241−248、1992、を参照せよ)、を初めとするがこれらには限定されない多様な機構を使用してこの借用を実施する。感染化細胞中の宿主細胞蛋白質と比較してウイルス蛋白質の優先的翻訳を確実にするためウイルスにより使用されるいずれかのこのような機構に本発明の方法を対応させることができる。
【0040】
これらの方法は、ウイルスにより用いられる、(i)p68プロテインキナーゼおよびインターフェロン誘導化二本鎖RNA活性化プロテインキナーゼを初めとする多様な名称により知られる宿主酵素のウイルス妨害、および(ii)ウイルスRNAの優先的翻訳の原因となるウイルス核酸配列、の2つの機構の記載により本明細書に例示される。これらの例の使用は、決して本発明の範囲を制限することを意図するものではない。
【0041】
p68プロテインキナーゼとして知られる蛋白質はインターフェロン誘導化二本鎖RNA活性化プロテインキナーゼである。このキナーゼは、典型的にはウイルス感染化細胞内に見いだされる二本鎖RNAにより活性化される。いったん活性化されたら、このキナーゼは開始因子eIF−2のアルファーサブユニットをリン酸化し、この現象は迅速に翻訳の開始段階を遮断するに至る。この効果は細胞中の蛋白質合成を遮断して細胞を死に追いやることであり、これは多細胞感染化生物体は耐えられるが、ウイルスは耐えられないものである。感染化細胞中の継続的翻訳を確実に行うためには、様々なウイルスがp68キナーゼの活性化を回避もしくは中和する様々な機構を進化させている(Katze、1992、中に総説が書かれている)。これらには、アデノウイルス(Mathews MB & Shenk T.、J.Virology 65、5657−5662、により総説が書かれている)、HIV(Edery et al.、Cell56、303−312、1989;Gunnery et al.、Proc.Natl.Acad.Sci.USA 87、8687−8691、1990;Roy et al.、J.Virology 65、632−640、1991)、およびエプスタイン−バールウイルス(Clarke et al.、Eur.J.Biochem 193、635−641、1990;Clarke et al.、Nucl.Acids Res.19、243−248、1991)により用いられ、そのキナーゼに結合し、かつ二本鎖RNA活性化因子の結合を回避させるウイルス性RNA、ワクシニアウイルスおよびレオウイルス(Watson et al.、Virology 185、206−216、1991;Imai and Jacobs、Proc.Natl.Acad.Sci.USA 85、7887−7891、1988)により用いられ、二本鎖RNAに結合し、かつそのキナーゼへの結合を防止するウイルス性蛋白質、ワクシニアウイルス(Beattie et al.、Virology 183、419−422、1991)により用いられ、そのキナーゼの偽基質として作用するウイルス性蛋白質、インフルエンザウイルス(Lee et al,1990)により用いられ、そのキナーゼの活性化を遮断し、かつ活性キナーゼを阻害するための細胞性蛋白質p58の補充、ならびにポリオウイルス(Blacket al.、J.Virology、67、791−800、1993)により用いられ、p68を分解するRNA(可能であればウイルス性の二本鎖RNA)との複合体への細胞性蛋白質の補充が含まれる。
【0042】
ウイルスと相互作用する、先程記載されたp68ならびにRNAおよび蛋白質は、感染化細胞内の翻訳の調節のウイルスによる占領および抑留において必要とされることが示されている広域な種類の巨大分子の例である。本発明は、この広域な種類内に含まれる他の巨大分子をも同様に適用する。当業者には、他のこのような巨大分子を同定すること、およびウイルスとこれらの巨大分子との間の相互作用を回避もしくは調節することが可能な化合物を選択するための方法を設計することを当業者に可能にさせる多様な方法が利用可能である。一般的には、必要とされるこれらの段階は、翻訳が感染中に所定のウイルスにより調節されているか否かを確認すること、翻訳への影響を媒介する特異的巨大分子(一つもしくは複数)を同定すること、関連する他の細胞性および/またはウイルス性構成成分を同定すること、これらの化合物間の相互作用の特徴を決定すること、ならびにこの相互作用の破壊もしくは調節を検出することができるスクリーニング方法を設計することを含む。これらの段階の具体的詳細をここでこれ以降に示す。用いられる方法の内の多くのものは、Ausubel et al.、(eds)Current Protocols in Molecular Biology、Wiley−Interscience、New York、1991、およびSambrook et al.、Molecular Cloning:A Laboratory Manual(2nd Ed.)、Cold Spring Harbor Laboratory Press、Cold Spring Harbor、New York、1989、のような引用文献内に収められている。
【0043】
ウイルスが翻訳に影響を及ぼすことの決定
特別なウイルスによる感染中に翻訳が影響を受けるか否かを決定するためには数々の方法を用いることができる。感染化および非感染化細胞内での蛋白質合成の全体的速度は、このような細胞をラベル化アミノ酸の存在下でインキュベートし、そしてこのラベル化前駆体の蛋白質内への取り込みを測定することにより測定することが可能である。ラベル化アミノ酸は典型的には、[35S]メチオニン、[35S]システイン、[3H]ロイシン、もしくは[14C]ロイシンのような放射活性同位体原子を含むものであることができ、そしてその利用に続き、典型的に、トリクロロ酢酸沈殿可能蛋白質内への放射活性の取り込みを測定することが可能である。蛋白質合成の全体的速度と同様に、開始および伸長のような翻訳の個々の段階の速度を、ポリソームプロフィルおよび推移時間決定のような標準的な方法を用いて測定することができる。未処理細胞を放射ラベル化基質と共にインキュベートすることの別法として、抽出物を未感染化および感染化細胞から作成し、そしてこれらの基質と共にインビトロ翻訳に利用して、内因性mRNAもしくはその細胞抽出物に添加されるテストmRNAの翻訳を調査することができる。
【0044】
翻訳におけるウイルスの効果に関する追加的な重要情報を、未感染化および感染化細胞において産生される蛋白質の種類および相対量を調査することにより取得することができる。このことは、これらの細胞を、先に記載する放射ラベル化アミノ酸の存在下でインキュベートし、そしてその後にポリアクリルアミドゲル電気泳動を使用して得られる放射ラベル化蛋白質を分離することにより達成することができる。分離された蛋白質をオートラジオグラフィーによるか、あるいはホスホルイメージャー(Phosphor Imager)装置を用いて検出し、そして電気泳動中、同じポリアクリルアミドゲル上に含まれる既知の分子量の標準ラベル化蛋白質との比較により分析することができる。速度決定の場合におけるのと同様に、蛋白質合成のこれらの研究を、未処理細胞それ自体ではなく細胞から作成される抽出物を使用して実施することもできる。
【0045】
巨大分子の同定
研究中のウイルスでの感染により翻訳が影響を受けていることの証拠をいったん取得したら、翻訳もしくはその調節過程において直接的もしくは間接的に関与することが知られる全ての巨大分子の活性および濃度を未感染化および感染化細胞、ならびに/またはそのような細胞から作成される抽出物中で比較することができる。取得される証拠が、開始もしくは伸長のような特定の翻訳段階における影響を指摘する場合には、最初にこの段階に関与することが知られる巨大分子に注意が向くであろう。
【0046】
翻訳におけるウイルスの影響に関与する構成成分を同定する他の研究法は、未感染化および感染化細胞から抽出物を作成し、そしてこれらの抽出物をインビトロ翻訳反応における影響を示す能力に基づいて分画化することである。すなわち、未感染化および感染化細胞からの抽出物を最初にインビトロ翻訳反応物内に並列に、しかし別々に添加し、そしてそれらの反応におけるそれらの抽出物の影響を比較する。その後にこの2つの種類の抽出物を当業者に知られる種々の方法を用いて並行して分画化し、そしてこの2つの抽出物からの対応分画をインビトロ翻訳反応におけるそれらの効果について並行して検査する。感染化細胞からの翻訳影響性構成成分を含むことが見いだされた分画をその後に、未感染化細胞からの対応する分画と並行して更に分画化し、そしてこの次回の分画化から取得される新規の分画もやはりインビトロ翻訳反応において検査する。この分画化およびテスト過程の反復繰り返しは、最終的に、翻訳に対するウイルスの観素される効果に関連する構成成分(一つもしくは複数)を含む感染化細胞からの比較的精製された分画を提供する。
【0047】
関連する他の構成成分の同定
翻訳上のウイルス効果の詳細な調査は、しばしばその活性もしくは濃度がウイルス感染中に調節される一つもしくは複数の細胞性構成成分を明らかにすることができる。例えばそれは、感染化細胞内で分解されるか、あるいはリン酸化、脱リン酸化、そうでなければその活性を変化させる方式で修飾化される開始因子、もしくは伸長因子、あるいはそれらのサブユニットを同定することができる。いったん一つのこのような効果が観察されたら、その効果は関与する追加的な細胞性および/またはウイルス性構成成分を同定するための更に別の調査のための方法を指摘する。
【0048】
翻訳における影響の原因となるウイルス性構成成分の同定は、天然に存在する突然変異体もしくは研究室で作成される突然変異体のいずれかである突然変異体ウイルスを調査することにより容易に行うことができる。後者は、突然変異誘発剤での化学的処理ならびにウイルス遺伝子もしくはウイルスゲノム内に挿入、置換、欠損、および点突然変異を作成するための分子生物学的技術の使用を初めとするがこれには限定されない当業者に知られる多様な方法により構築することができる。ウイルスと宿主細胞との翻訳の間の相互作用における多様な突然変異体の影響をその後に評定することができる。特別な突然変異体がウイルスが翻訳に及ぼす影響(一つもしくは複数)を変化もしくは消滅させる場合には、このことは、突然変異が生じる遺伝子もしくはゲノムはこれらの効果を媒介する上で重要であることの強い証拠を提供する。
【0049】
突然変異分析なしでさえも、インビトロ転写および翻訳方法を使用して、ウイルスゲノムもしくはRNA、あるいはそれらのサブセットもしくは断片、あるいはそのような分子の翻訳産物の添加が翻訳に影響を及ぼすか否かを決定することができる。
翻訳における影響に関与するウイルス構成成分はまた、個々のウイルス性構成成分もしくはそれらをコードする遺伝子/cDNA、あるいは構成成分もしくは遺伝子/cDNAの断片をインビトロ翻訳反応ではなく未処理細胞内に導入することにより同定することもできる。
この記載から、ウイルス感染化細胞において調節されていることが見いだされている構成成分と相互作用するウイルス性および細胞性構成成分を同定するためには多種多様な方法が当業者に利用可能であることが明らかである。
【0050】
構成成分間の相互作用
翻訳に影響を与える細胞性およびウイルス性構成成分間の相互作用の特徴決定を行うためには多くの異なる方法が利用可能である。pH、イオン強度、温度、存在するアニオンおよびカチオンの性質および混合物、2つの構成成分の相対的濃度、これらの構成成分の絶対的濃度、補因子の利用可能性、エネルギー源の利用可能性、脂質、核酸、炭水化物、他の蛋白質、および/または他の添加物の存在もしくは非存在を変化させるこのような相互作用の感受性は全て、構成成分間の相互作用の特徴についての情報を提供することができる。一つもしくは両方の構成成分における切断、添加、置換、欠損、反転、および点突然変異の影響も有益である。これらの構造の変化を既に記述した一連の方法においてテストして、それらの変化が異なる構成成分間の相互作用および/または翻訳におけるこれらの構成成分の影響を変化もしくは廃止させるか否かを決定することができる。
【0051】
有望な薬剤をスクリーニングするための方法
有望な薬剤を、翻訳におけるウイルス効果を破壊もしくは調節するそれらの能力についてスクリーニングするための方法を、ウイルス性および細胞性構成成分間の厳密な相互作用の詳細な知識なしでも設計することができるが、このような知識は確かに役に立つことが可能である。広域な範疇のインビトロでの選択方法においては、数々の種類の方法がテスト薬剤をスクリーニングするのに特に簡便および/または有用であるように思われる。これらは、二つもしくはそれを上回る数の構成成分間の結合相互作用を測定する方法、相互作用を行う構成成分の内の一つである酵素の活性を測定する方法、ならびにこれらの構成成分の内の一つの調節下に置かれている「レポーター」蛋白質、すなわちある酵素あるいは他の検出可能もしくは選択可能な蛋白質の活性もしくは発現を測定する方法を含むが、これらに限定はされない。
【0052】
このようなアッセイにおけるレポーターとしての使用に適する蛋白質には、β−ガラクトシダーゼ、ルシフェラーゼ、β−グルクロニダーゼ、クロラムフェニコールアシルトランスフェラーゼ、および分泌される胎児のアルカリホスファターゼのような容易にアッセイされる酵素、ホルモンおよびサイトカインのような免疫アッセイのために容易に利用可能な蛋白質、アデノシンデアミナーゼ、アミノグリコシドホスホトランスフェラーゼ(neo遺伝子の産物)、ジヒドロ葉酸レダクターゼ、ヒグロマイシン−B−ホスホトランスフェラーゼ、チミジンキナーゼ(HAT培地と共に使用する場合)、キサンチン−アニンホスホリボシルトランスフェラーゼ(XGPRT)のような、選択的増殖上の利点を細胞に付与する蛋白質、ならびに栄養要求性突然変異体から失われている生合成能を提供する蛋白質、チミジンキナーゼ(ブロモデオキシウリジンを含む培地と共に用いる場合)、およびオロチジン−5’−リン酸エステルデカルボキシラーゼ(5−フルオロオロト酸と共に用いる場合)のような非毒性基質を毒性産物へと転化する酵素を例とする増殖上の欠点を細胞に付与する蛋白質、ならびにリシン、コレラ毒、もしくはジフテリア毒のような毒素である蛋白質を含むが、これらには限定されない。
前述の記載から、翻訳におけるウイルス効果に関与する構成成分の同定、これらの構成成分間の相互作用の特徴決定、およびこれらの構成成分間の相互作用を調節もしくは廃止する構成成分を選択するためのスクリーニングテストの実施における各段階では、当業者は多種多様な方法からの選択を行うことが可能であることが明白である。
【0053】
プロテインキナーゼ
以下の記載は、本発明において有用な具体的スクリーニングプロトコールおよび関連プロトコールの更に詳細な概略である。この文節では、宿主真核生物細胞内でウイルス複製を阻害するのに有効な薬剤をスクリーニングするための方法を記載する。一つの詳細な実施例としては、選択される系は、ウイルスが、宿主細胞のインターフェロン誘導化二本鎖RNA活性化プロテインキナーゼの活性を妨害するウイルス性インヒビターを産生することが可能であるものである。しかしながら先に記載するように、この実施例は本発明内における制限ではなく、そして単に本発明の広域な範囲を例示するに過ぎない。
【0054】
この方法は一般的に、プロテインキナーゼ、ウイルス性インヒビター、およびテストされるべき化合物を、そのプロテインキナーゼの活性化のウイルス性インヒビター妨害を生じるのに有効な条件下でインキュベートし、そして妨害についてその混合物を調査する段階を含む。
【0055】
A.化合物のためのインビトロでのスクリーニング
ある実施例では、インキュベーション段階は、ウイルス性インヒビターの非存在下でp68キナーゼを活性化するのに有効な条件下でその混合物をインキュベートすることを含み、そして調査段階は、このインヒビターの存在下でのp68キナーゼの活性を調査することを含む。
インキュベーションは、例えば精製もしくは部分精製されたp68キナーゼ調製物を用いて実施することができ、そして調査段階は、そのキナーゼの自己リン酸化、あるいはそのキナーゼに対して提供されるeIF2−アルファーもしくはヒストン基質のリン酸化を測定することを含む。
【0056】
別法ではインキュベーションを、p68キナーゼを含むインビトロ翻訳混合物中で実施することができ、そして調査段階が、特異的mRNAの翻訳により産生されるレポーターポリペプチドの量を測定すること含む。第三の例においてはこの方法を、活性化形態においてはこのプロテインキナーゼの活性化を遮断するか、あるいは活性化されているキナーゼを阻害することが可能な宿主細胞構成成分を活性化するのに有効なウイルス性インヒビターを産生するあるウイルスのウイルス複製を遮断するのに有用な化合物をスクリーニングするために用いる。ここでは形成される混合物は宿主細胞構成成分(活性化形態をとる)を含み、インキュベーション段階を、活性化構成成分の非存在下でそのプロテインキナーゼが活性化される条件下で実施し、そして調査段階が、プロテインキナーゼ活性の阻害についてその混合物を調査することを含む。
【0057】
以下に示す実施例は、先に記載されるスクリーニング方法をより詳細に説明するが、決して本発明の範囲を制限することを意図するのではない。
実施例1:組換え大腸菌(E.coli)細胞からのp68プロテインキナーゼの調製
p68は、ヒトのp68キナーゼを発現する大腸菌(E.coli)から、公開される方法(Barber et al.、1991、Biochemistry 30:10356)に従って調製される。簡潔に記載すると、大腸菌(E.coli)株BL21(DE3)pLysSを、誘導可能プロモーターの調節下で野生型p68プロテインキナーゼのためのコーディング配列を含むプラスミドで形質転換させる。得られる大腸菌(E.coli)株を対数期まで増殖させ、その後に誘導化を行ってp68キナーゼを発現させる。細胞を遠心により収集し、そしてリゾチームにより溶菌させる。p68キナーゼを、公開される方法(Galabru et al.、1989、Eur.J.Biochem.178:581)に従って、セファロース(Sepharose)に結合されるp68キナーゼに対するモノクローナル抗体を使用する親和性クロマトグラフィーによりその溶菌液から精製する。
【0058】
実施例2:VAI RNAの調製
VAI RNAは公開される方法(Mellits et al.、1990)Nucl.Acids Res.18、5401)に従って調製される。簡潔に記載すると、本明細書ではpT7VAと略称されるプラスミドpT7VA/Ad21は、Ad2 VA RNA2の遺伝子の上流に融合されたT7 RNAポリメラーゼのプロモーターを含むクローニングベクターpUC119の誘導体である。このプラスミドをDra Iでの消化により直線化させて、VAI RNAの厳密なコピーであるランオフ転写物の調製を可能にする。転写は、37.5μg/mlのT7 RNAポリメラーゼ、50μg/mlの直線化pT7VA DNA、40mMのトリス−HCl、pH7.8、14mMのMgCl2、2mMのスペルミジン、5mMのジチオスレイトール(DTT)、4mMの各rNTP、および1単位/μlのRNasin(Promega社)を含む反応物中で実施する。40℃で90分インキュベートした後に、この反応を最終濃度20mMのEDTAの添加により停止させ、フェノール、次いでクロロホルムで抽出し、そしてRNAをエタノールで沈殿させる。VAI RNAは、再溶解させた沈殿物を変性させ、それを8%のポリアクリルアミド/7M尿素の配列決定用ゲル上で泳動させ、主要バンドを切り出し、そしてRNAを標準的な方法により回収することにより精製する。ラベル化VAI RNAを、[アルファー−32P]UTPもしくはビオチニル化−UTPのいずれかが含まれること以外は記載されるように転写を実施することにより調製する。
【0059】
実施例3:p58の調製
I.p58による阻害のためのアッセイ
このアッセイはp58の精製を記録することを可能にする。p58の精製過程中に単離された分画を、Triton X−100でのインターフェロン処理化293細胞の破壊により調製されたp68含有性細胞抽出物と混合し、そして20分間30℃でインキュベートする。その後にこのp68キナーゼを、293細胞からのヒトp68を認識するがp58の源であるインフルエンザウイルス感染化MDBK細胞中のウシ相同物は認識しない抗体を用いて免疫沈降させる。次に免疫沈降化させたp68の活性を、[ガンマー−32P]ATPを用い、そして基質として外因性ヒストンを添加して測定する。活性を定量化するためにヒストンをポリアクリルアミドゲル電気泳動に供し、そしてゲルから切り出す。精製の後期段階においては純粋なp68キナーゼおよびその天然の基質であるeIF−2を用いる追加的なアッセイを以下のように実施する。精製からの各分画を純粋なp68キナーゼと共に、10分間、30℃で、緩衝液C(17mMのトリス−HCl、pH7.5、75mMのKCl、0.1mMのEDTA、1.0mMのジエチオスレイトール、ml当たり8μgのアプロチニン、1.0mMのフッ化フェニルメチルスルホニル、2mMのMgCl2、2mMのMnCl2、ml当たり0.3mgのウシ血清アルブミン、8%のグリセロール)中で予備インキュベートする。その後に活性化因子であるポリ(I):ポリ(C)(0.010μg/ml)を1mMの[ガンマー−32P]ATP(424Ci/mモル;1Ci=37GBq)の存在下で添加し、そしてインキュベーションを追加的に10分間継続する。最後には、0.5μgの精製化eLF−2を添加し、そしてインキュベーションを更に10分間、30℃で継続する。この反応は、2×破壊用緩衝液(160Mmのトリス、pH6.8、1.0Mの2−メルカプトエタノール、4%のSDS、20%(vol/vol)のグリセロール)の添加により停止し、この混合物を沸騰させ、そしてリン酸化された蛋白質をSDS/14%ポリアクリルアミドゲル上で分析する。
【0060】
II.p58のクローニング
A.cDNAライブラリーのスクリーニング
精製化p58蛋白質から得られる3つのトリプシン消化ペプチドをミクロシークエンシングを行うことにより配列決定する。それらの配列の内の一つ(AEAYLIEEMYDEAIGDYETA)を用いて、縮重オリゴヌクレオチドプローブ(5′−GAA(G)GAA(G)ATGTAT(C)GAT(C)GAA(A)GC−3′)を設計した。これを用いてラムダ−ZapIIベクター(Stratagene社)中に作成されるMDBK細胞株からのcDNAライブラリーをスクリーニングした。ナイロンフィルター(Hybond−N;Amersham社、Arlingon Heights、IL)への二重プラーク転移を行った。その後にフィルターを、38℃で4時間、6×SSPE(1×SSPE=0.18MのNaCl/10mM NaPO4、pH7.4、1mMのEDTA、1%のSDS、0.2%のウシ血清アルブミン、0.2%のポリビニルピロリドン)、ml当たり100μgの超音波処理を施しかつ変性させたサケ精子DNA中で予備ハイブリダイズさせ、そして38℃で20時間、6×SSPE、1%のSDS、ml当たり100μgの超音波処理を施しかつ変性させたサケ精子DNA中で、32P−5’末端ラベル化プローブとハイブリダイズさせた。フィルターは6×SSPE、1%のSDS中で室温で10分間を2回、38℃で15分間で1回洗浄し、そして−70℃で増感用スクリーンを用いてKodak社のX−Omatフィルムに露出させた。陽性のファージプラークを同定し、そして別に行う数回のプラークハイブリッド形成により精製する。pBluescriptプラスミド(Stratagene社)を、製造元の説明書に従ってインビボで切り出した。4つの陽性クローンからのEcoR I断片をp58の部分的アミノ酸配列(QDYETA)のアンチセンス鎖に相当する縮重オリゴヌクレオチドプローブp58−3−2(5′−GCIGTT(C)TCA(G)TAA(G)TCT(C)TG−3′;Iはイノシンを表す)を用いるサザンブロットハイブリッド形成により分析した。1400bpの挿入断片を含む一つの陽性クローンを取得し、そして制限酵素マッピングにより分析した。M13mp18およびM13mp19内へとクローニングした後に、p58のcDNA配列を、セクアナーゼ(Sequenase)2.0(United States Biochemical社)を用いるジデオキシヌクレオチド鎖停止方法により決定した。配列番号17を参照せよ。配列データはGenetics Computer Group(GCG)社の配列分析プログラム(バージョン7.0)を用いて分析した。
【0061】
B.p58cDNAの3’末端領域の単離
単離された最初のクローンは長い読み取り枠を含んでいたが停止コドンが存在せず、3’末端が失われていることが示唆された。失われた3’末端領域を記載されるように(Innis、et al.、1990)RACE−PCR(cDNAの末端ポリメラーゼ連鎖反応の迅速増幅)を用いて単離した。MDBKポリ(A)+mRNA(1μg)をハイブリットプライマー(5′−GACTCGAGGATCCGAATTC−(T)17−3′)を用いて逆転写させた。cDNAプールをアダプタープライマー(5′−GACGCGACCATCCGAATTC−3′)およびp58遺伝子特異的プライマーP58−5(5′GCTGAAGAGCTCATCAAAG−3′)の存在下、記載される(Innis、et al.、1990)条件下で、RACE−PCRにより増幅した。サザンブロットにより増幅化産物を同定した後に、この産物をアガロースゲルから単離し、そしてM13mp18およびM13mp19内にクローン化して増幅化領域の配列決定を行った。このことにより1680bpを含む完全なp58のcDNAの再構成が可能になった。もともとの1400bpのcDNAも用いてMDBKcDNAライブラリーをスクリーニングし、そして5’−および3’−UTRを共に含む完全なコーディング配列を含む3140bpの他のクローンを導き出した。
【0062】
C.細菌中での融合蛋白質の発現
唯一のNde I部位(CATATG)を、インビトロ突然変異誘発キット(Bio−Rad社、Richmond、CA)を用いて、製造元のプロトコールに従って、p58遺伝子の開始用メチオニンコドンに導入した。部位特異的突然変異誘発後、p58遺伝子を含む1.6kbのNde I−BamH I断片を細菌の発現ベクターpET15b(Novatgen社、Madison、WI)内にクローン化させた。p58は、0.2mMのIPTGでの2時間30℃の誘導化後に大腸菌BL21(DE3)pLysS内でヒスチジン−付加融合蛋白質として発現させた。大半の融合蛋白質が不溶性分画内に見いだされた。この分画を6Mのグアニジン−HCl内で変性させた後に、融合蛋白質を、Ni(II)−カラムを用い、製造元の説明書に従って精製した。精製化蛋白質(0.1mg/ml)は、mlあたり0.1mgのウシ血清アルブミンを含む透析用緩衝液(20mMのトリス−HCl、pH7.5、1mMのDTT、0.1mMのEDTA、0.15MのNaCl、20%のグリセロール)中で約50倍に希釈し、そして透析用緩衝液内で4℃で6時間透析した後に再生させた。再生化蛋白質をアリコートに分け、そして−70℃で保存した。
【0063】
実施例4:スクリーニング方法:p58によるp68の不活化
2μlまでのp68キナーゼ分画(用いられる厳密な容積は精製の度合いに依存する)を、50mMのKCL、20mMのHEPES(pH7.4)、1.5mMのMgCl2、0.1mMのEDTA、1mMのDTT、10%のグリセロール、および1μMのPMSF、ml当たり0.1mgのウシ血清アルブミンおよび0.1mgのtRNAで10μlにまで希釈した。この希釈化キナーゼを、最終濃度で75mMのKCl、25mMのHEPES、(pH7.4)、10mMのMgCl2、1.0mMのジチオスレイトール、0.1mMのEDTA、0.1mMのATP、プロテアーゼインヒビター、および5〜10゜Ciの[ガンマー32P]ATP(>3,000Ci/mモル;Dupont社、NEN)を含む20μlの反応混合物に添加する。適切であらば反応混合物に、活性化因子としてレオウイルスの二本鎖(ds)RNAもしくは合成dsRNA(例えば、ポリI:C)、およびインヒビターとしてのp58を補充する。同じ反応内で用いる場合には,dsRNAとp58とを同時に酵素ミックスに添加する。この反応物を30℃で15〜25分間インキュベートし、その後にスロット−ブロットもしくはドット−ブロット装置中でニトロセルロースを通して濾過する。自己リン酸化によりp68キナーゼ内に取り込まれた32Pを液体シンチレーション計測もしくは露出化オートグラフィー用フィルムのレーザーデンシトメトリーにより定量する。典型的な一連のテストは以下の反応を含む。a)p68キナーゼ単独もしくはp58単独での対照反応、b)テスト化合物単独、あるいはp68キナーゼもしくp58のいずれかと一緒の対照反応、c)p68キナーゼとp58、ならびにd)p68キナーゼ、p58、およびテスト化合物。p68キナーゼへのp58インヒビターの結合を妨害するテスト化合物については、反応(d)で検出される自己リン酸化p68キナーゼの量は反応(c)で検出されるものより多くなる。
【0064】
実施例5:インビトロ翻訳アッセイ
以下の構成成分を連続的に12μlのミクロコッカスヌクレアーゼ処理化ウサギ網状赤血球溶菌物に添加する。2.5μlの50mCi/ml[35S]メチオニン、メチオニンを除く全てのアミノ酸1mMを含む2.5μlのアミノ酸混合物、2.5μlの50μg/ml VaI RNA、2.5μlの100ng/mlのレオウイルス二本鎖RNA、および2μlのテスト化合物もしくはH2O。この混合物を30℃で15〜20分間インキュベートして内因性p68キナーゼの活性化を可能にし、その後に1μlの特異的レポーター遺伝子mRNAを添加して10μg/mlの最終濃度を得る。その後にこの翻訳反応物を30分間30℃でインキュベートする。翻訳をSDS−PAGEおよびオートラジオグラフィーにより、CATもしくはルシフェラーゼ酵素アッセイ、あるいは用いたmRNAに適切な他のアッセイにより定量化する。典型的な一連のテストは以下の反応を含む。a)レオウイルスdsRNAもしくはVAI RNAを含まない対照反応、b)レオウイルスdsRNAを含むがVAI RNAを含まない対照反応、c)レオウイルスdsDNAおよびVAI RNA、ならびにd)レオウイルスdsRNA、VAI RNA、およびテスト化合物。VAI RNA機能を妨害するテスト化合物については、反応(d)での翻訳は反応(c)で検出されるものと比較すると減少している。
【0065】
実施例6:アデノウイルスの遺伝子産物VAI RNAの機能を妨害するアンチセンスオリゴデオキシヌクレオチド分子の同定
VAI RNAの既知の塩基配列、予想される二次構造(図1)、およびVA機能への様々なステムおよびループの相対的重要性に基づいて、出願者は数々のアンチセンスオリゴデオキシヌクレオチド分子を設計した(図2、3)。これらのアンチセンス種を先に記載されるインビトロ翻訳アッセイにおいて検査した。
【0066】
A.インビトロ翻訳アッセイ
インビトロ翻訳アッセイは96ウエルプレート内で実施した。ウサギ網状赤血球溶菌物をp68の源ならびにインビトロ翻訳系として使用した。p68はウサギ網状赤血球溶菌物内に存在し、そしてレオウイルスRNAのようなdsRNAの添加により活性化することができる。p68が活性化される際には翻訳が阻害される。
【0067】
VaI RNAは、本出願の主要部において記載されるように調製した(実施例2:VAI RNAの調製、を参照せよ)。以下の構成成分を順に添加し、そして指定されるように96ウエルプレートの各ウエル内でインキュベートした。
4μlのアンチセンスオリゴデオキシヌクレオチド(最終濃度はVAIRNAに対して20倍モル過剰)
2μlのVAI RNA(最終濃度=5μg/ml)
1mMの完全なアミノ酸混合物を補足してある20μlのウサギ網状赤血球溶菌物
*30℃で15分間インキュベートする。
2μlのレオウイルスdsRNA(最終濃度=10ng/ml)
*30℃で15分間インキュベートする。
2μlのルシフェラーゼmRNA(最終濃度:30ng/ml)
*30℃で15分間インキュベートする。
【0068】
各ウエルをDynatech社のML3000ルミノメーターおよびAnalytical Luminescence LAbs社のEnhaced Luciferase Assay Kitを用いてルシフェラーゼ活性について即座にアッセイした。設定値は:Enhaced Flash モード、Delay=2s、Integrate=5s、50μlの基質Bと同時に注入する50μlの基質A。
【0069】
以下の対照物をこのアッセイにおいてインキュベートした。H2Oを(−)により示されるmRNA、レオウイルRNA、もしくはVAI RNAに置き換えた。
【表1】

【0070】
対照1は、ルシフェラーゼmRNAなしで陽性ルシフェラーゼシグナルを生じるであろう溶菌物中のものの存在について検査した。対照2は、このアッセイの翻訳の正常レベルを確認した。対照3は、p68のレオウイスRNA活性化の結果である翻訳の阻害のレベルを確認した。対照4は、活性化因子であるレオウイスRNAの存在下でのp68のインヒビターとしてのVAI RNAの救済機能を決定した。典型的な結果を図4に示す。相対的光単位(Relative Light Unit)(「R.L.U.」)の産生はルシフェラーゼmRNAの添加に依存する(カラム1対2)。レオウイルスdsRNAをこのアッセイに添加する際には、この溶菌物中の内因性p68が活性化され、そして翻訳が阻害される(カラム3)。VAI RNAを添加した際には、翻訳が部分的に救済された(カラム4)。
【0071】
B.アンチセンスオリゴデオキシヌクレオチドの結果
アンチセンスオリゴデオキシヌクレオチド種をアッセイに添加し、これらの結果も図4に示す。ava1はVAI RNAの効果を完全に逆転させることが見いだされた(カラム5)。ava9およびava15はVAI RNA機能に対しては部分的に拮抗的(antagonistic)であった(カラム8、9)。ava2および3はVAI RNA機能に有意な影響を与えなかった(カラム6、7)。末端のステム領域に相補的な種を含む他のアンチセンス種はVAI RNA機能を妨害しなかった(データ非公開)。これらの後者の結果はava1による阻害の特異性を強調するが、それはVAI RNA分子の幾つかの部分に対するアンチセンスが遮断機能において有効でないためである。
【0072】
ava2はVAI RNAの中央ドメインの一部分に相補的である。VAI RNAのこの相補的領域は一本鎖であるためava2は容易にアニールすることが予期され、そして中央ドメインは機能にとって重要であることが示されているため(Mathews、M.B.and T.Shenk.1991.J.Virol.65:5657−5662。Mellits、K.H、T.Peery、and M.B.Mathews.1992.J.Virol.66:2369−2377)ava2はVAI機能を妨害することが予期される。しかしながら、ava2はVAI活性に影響を与えなかった(図4)。
【0073】
それとは対照的に、ava15はVAI RNAの二本鎖領域に相補的である。この領域はオリゴデオキシヌクレオチドの結合を容易に可能することは予期されず、しかし、アンチセンスオリゴデオキシヌクレオチドava15は実際にVAI RNA機能と拮抗する(図4)。出願者の方法を利用することにより、機能的であるものについてのオリゴヌクレオチドのスクリーニングを容易に達成することができる。より一般的には、ava2およびava15の両方の挙動の予期されぬ性質の、出願者のスクリーニング方法による容易な検出は、p68のウイルス性インヒビターの拮抗剤を同定するための方法の利用性を証明している。
【0074】
優先的翻訳を媒介する特異的ウイルス核酸配列
特異的ウイルス核酸配列がウイルスRNAの優先的翻訳の原因であるか否かを決定するためには、種々の研究方法が利用可能である。これらには、優先的翻訳の原因である可能性のあるウイルス性核酸配列に翻訳的に連結される検出可能なレポーターポリペプチドを有するキメラRNAを用いる研究、ウイルス核酸配列の天然の突然変異体および研究室の突然変異体の研究、ならびにトランスフェクション感染アッセイが含まれるが、これらに限定はされない。
【0075】
有利な初期研究方法は、ウイルスRNAの優先的翻訳の原因である可能性があるウイルス核酸配列に連結される検出可能なレポーターポリペプチドのためのコーディング配列を有するキメラRNAを構築することであることがしばしばである。その後の検出可能なレポーターポリペチドの産生を、ウイルス核酸配列が確実にその翻訳を行わない限りこのレポーターが産生されないであろう翻訳条件下で調査する。対照として、このレポーターがテスト中のウイルス核酸配列に連結されていない類似構築物からの検出可能なレポーターポリペプチドの産生も同一な翻訳条件下で調査されるであろう。追加的対照として、各テスト物に添加されるキメラRNAもしくは別法として第二RNAは、第一のものから識別され、かつ細胞性mRNAの正常翻訳を確実に行う原因となるRNA配列に翻訳的に連結される第二検出可能レポーターポリペプチドのためのコーディング配列を含むことができる。
【0076】
他の構成成分の同定
いったんウイルスRNAの優先的翻訳の原因になるものとしてウイルス核酸配列を同定したら、このウイルス核酸配列の作用に関連する細胞性および/またはウイルス性構成成分を同定するためには多様な方法が利用可能である。
【0077】
薬剤をスクリーニングするための方法の設計
ウイルスRNAの優先的翻訳を破壊もしくは調節する能力について薬剤をスクリーニングするための方法は、関連するウイルス性および細胞性物質間の厳密な相互作用の詳細な知識なしでも設計することができるが、このような知識は確かに有用である可能性がある。
従って例えば、薬剤を細胞性および/またはウイルス性蛋白質とウイルス核酸配列との間の結合を防止もしくは減少させる能力についてスクリーニングすることができる。他のそして好ましい種類のアッセイにおいては、薬剤を検査して、そのレポーターのためのコーディング配列がウイルスRNAの優先的翻訳の原因となるウイルス核酸配列に翻訳的に連結されるRNAからの検出可能なレポーターポリペプチドの翻訳におけるそれらの影響が決定される。
【0078】
先の記載は例示のためにのみ提供され、決して本発明の範囲を制限するものではない。当業者はウイルスRNAの優先的翻訳の原因となるウイルス核酸配列を同定するため、関連する他の細胞性およびウイルス性構成成分を同定するため、ウイルスRNAの優先的翻訳を可能にする様々なパートナー間の相互作用の特徴決定を行うため、そしてこのような相互作用を破壊もしくは廃止する能力について薬剤をスクリーニングするのに使用することができるテストを開発するためには多種多様な方法からの選択を行うことができることが明白である。
【0079】
以下のものは翻訳調節要素の活性を遮断する薬剤をスクリーニングするために用いられる方法の実施例である。
IRES要素のスクリーニング
IRES要素の活性を遮断する薬剤をスクリーニングするためのアッセイの開発は、2つの異なるレポーター遺伝子の存在を特徴とするジシストロン性(dicistronic)mRNAを構築することを必要とし、この場合一つの遺伝子の翻訳がIRES要素の調節下に置かれ、かつ他の遺伝子の翻訳が宿主細胞のキャップ構造(m7GpppG)および細胞性5’−UTR配列の調節下に置かれる。そのような構築物は、細胞非含有性アッセイもしくは細胞を基にするアッセイのいずれかを用いて、細胞がそれら自体のmRNAの翻訳を開始するのに使用する方法に不利な影響を及ぼすことなくIRES要素の活性を遮断するような薬剤を同定することを可能にする。従って本発明の好ましい態様は、利用者が、非特異的かつ毒性である可能性のある薬剤を同時に除去しながら所望の作用機構を有する薬剤を同定することを可能にする。
【0080】
ジシストロン性レポーター遺伝子構築物を、インビトロもしくはインビボ薬剤スクリーニングのいずれかのために使用することができる。インビトロ(無細胞)アッセイフォーマットにおいては、ジシストロン性mRNA構築物は、バクテリオファージT7もしくはSP6プロモーターにより例示される強力なプロモーターの調節下にあるその構築物の翻訳を指令するプラスミドDNA分子によりコードされている。予め形成されているキャップ構造の存在下で相同なRNAポリメラーゼ(例えば7もしくはSP6)を用いて精製およびインビトロ転写を行う場合には、このプラスミドは、「キャップを伴う」ジシストロン性レポーター構築物の大容量の合成を指令し、この構築物は一般的に実施される技術を用いて精製することができる。次にこのジシストロン性mRNAを、商業的供給元から購入するか、あるいは科学的刊行物において利用可能な方法に従って調製されるかのいずれかである真核生物インビトロ翻訳系内の鋳型として利用する。
【0081】
薬剤を、先のジシストロン性レポーター構成物を含む完全な細胞中でテストすることもできる。前記構築物を、1)その構築物の転写をSV40、CMVもしくは当業者により一般的に用いられる他のプロモーターのような強力な真核生物ウイルスプロモーターの調節下に置き、2)核内で作成されるRNAの正確なプロセシングおよび輸送を確実にするためにSV40のスプライスシグナルのようなスプライスシグナルを含むようにし、そして3)レポーターmRNAが3’ポリアデニル化分子として合成されるように、この構築物の3’端にSV40シグナルのようなポリアデニル化シグナルを含むようにすること、により培養真核生物細胞中での使用のために改変する。
【0082】
本発明に含まれるアッセイを用いて、新規の抗ウイルス剤を発見するために薬剤ライブラリーをスクリーニングすることができる。このようなライブラリーは、純粋な薬剤のコレクションもしくは薬剤混合物のコレクションのいずれかを含むことができる。純粋な薬剤の例には、蛋白質、ポリペプチド、ペプチド、核酸、オリゴヌクレオチド、炭水化物、脂質、合成もしくは半合成化学物質、および精製された天然産物が含まれるが、これらには限定されない。薬剤混合物の例には、原核生物もしくは真核生物細胞および組織の抽出物、ならびに発酵ブイヨンおよび細胞もしくは組織培養物上清が含まれるが、これらには限定されない。薬剤混合物の場合には、アッセイは所望の抗ウイルス活性を保持するこれらの未精製混合物を同定するのに用いられるばかりでなく、このアッセイは治療剤としての特徴決定および開発のための混合物から抗ウイルス性成分を精製する手段を提供をもする。具体的には、このように同定される混合物をその後に当業者に一般的に知られる方法により連続的に分画化することができる。得られる各サブフラクションを、純粋で生物学的に活性な薬剤が取得されるまで、もともとのアッセイを使用して抗ウイルス活性についてアッセイすることができる。
【0083】
好ましい態様においては、抗ウイルス活性を検出するために設計されたアッセイを、先に記載されるライブラリーと組み合わせる高い処理能力の薬剤発見用スクリーニングに用いる。このアッセイは、例えば96−ウエル変種の多重ウエルプレート内のような多重反応物の迅速調製および処理を可能にするいずれかのフォーマットで実施される。
他の態様においては、このアッセイを用いて、既に公有となっている技術、あるいはそうでなければ当業者に知られる技術のいずれかにより産生されるランダムペプチドもしくはオリゴヌクレオチドの広大なライブラリーをスクリーニングすることができる。サイズが大きいため、これらのライブラリーは主要薬剤の源でありそうであり、それはそれらが107〜1010の化学的実在物を含むことができるためである。
【0084】
以下の実施例は説明のためのものであって、決して本発明を制限することを意図するものではない。
実施例7:IRES要素RNA構築物の作成/単離
A.PCR反応
ポリメラーゼ連鎖反応(PCR)およびT7プロモーターをPCR断片の5’端に置くために設計されたプライマーを用いて、入手可能なプラスミドから選択されるIRES成分を増幅する。反応混合物は以下のものを含む。1μMのプライマー#1、1μMのプライマー#2、40μMのdATP、40μMのdGTP、40μMのdCTP、40μMのdTTP、4μg/mlの鋳型DNA、Taq DNAポリメラーゼ、10mMのトリス−HCl pH8.3、25℃、40mMのKCl、1.5mMのMgCl2、および0.01%(w/v)のゼラチン。
【0085】
この反応混合物(総容量100μl)を100μlの鉱油に重層する。鉱油中にチューブを浸し、そして断熱材中に入れ、空気バブルが出るようにさせる。パラメーター:94℃で2分、42℃で1分、72℃で1分、2秒の自動延長。できる限り大量の油性上層を取り出す。100μlのTEを添加し、そしてCHCl3で、次いでフェノール/CHCl3で、そして最後にCHCl3で抽出する。
30μlの3M NaOAcを添加する。600μlの氷冷EtOHを添加し、そして−20℃で数時間放置する。30分間14K rpmでマイクロフュージ内で遠心し、その後に5μlのH2O中に再懸濁する。
【0086】
C. pBLおよびpBCRLプラスミドの構築
転写鋳型pBLを、β−グロビンおよびルシフェラーゼ配列のPCR増幅産物をプラスミドベクターpUC19内に連結することにより構築した。β−グロビンのPCRプライマー(配列番号18、配列番号19)は、β−グロビンの5′非翻訳領域(「NTR」、未翻訳領域「UTR」としても引用される)を増幅し、そして5’EcoR I制限部位、5’T7プロモーター、および3’Kpn I制限部位を導入するように設計した。EcoR IおよびKpn I制限部位を用いてpUC19内への連結し、中間体プラスミドpBを作成した。ルシフェラーゼのPCRプライマー(配列番号20、配列番号21)を設計してルシフェラーゼのコーディング配列を増幅し、5’Pst I制限部位および3’ Hind III制限部位を導入し、pB内へ連結してpBLを作成した。CATのPCRプライマー(配列番号22、配列番号23)を設計してCATのコーディング配列を増幅し、5’Kpn I制限部位および3’Bam HI制限部位を導入し、pBL内へ連結して、pBCLを作成した。リノウイルス14の5’NTRのPCRプライマー(配列番号24、配列番号25)を設計してリノウイルスの5’NTSRを増幅し、5’Bam HI制限部位および3’Pst I制限部位を導入し、これを用いてこの増幅産物をpBCL内へ連結させた。_−グロビンの5’NTR、CAT、リノウイルスのIRES、およびルシフェラーゼ配列を含む得られるプラスミドを大腸菌DMI細胞内にトランスフォームすることにより、リノウイルスおよびルシフェラーゼの開始コドンは一直線に並ぶ。非メチル化プラスミドDNAを単離し、そしてBcl Iで消化し、この消化プラスミドを再連結させ、そして大腸菌DH5細胞内にトランスフォームさせてpBCRLを産生する。
【0087】
翻訳反応のたのキャップ付きRANの調製
プラスミドDNAからのT7ポリメラーゼ転写は以下のとおりであった。
200μlの反応物は、5μlのプラスミド、1mMの各NTP、5μgの切断化プラスミドDNA(20μl)、0.1%のDEPC H2O(128μl)、100mMのATP(2μl)、10mMのGTP(2μl)、100mMのUTP(2μl)、10mMのm7GpppG(20μμl)、RNasin(1μl)、5×プラスミド緩衝液(40μl)を含み、これを5分間37℃でインキュベートする。4μlのポリメラーゼ(2〜4μl)を添加し、60分、37℃でインキュベートする。10μlのRNase非含有性DNaseを添加し、37℃で1分間インキュベートする。5μlの500mM EDTAを添加する。フェノール/CHCl3抽出する。CHCl3抽出する。70μlの0.1%DEPC H2Oを添加する。30μlの3M NaOAc pH5.2を添加する。900μlのEtOHを添加する。−20℃で一晩、もしくは−80℃で30分間放置し、25μlのTE中に再懸濁する。A260を測定する。転写緩衝液:37℃における200mMのトリス pH8.0、50mMのMgCl2、25mMのDTT、5mMのスペルミジン、250pg/mlのBSA、0.1%のDEPC H2O(650μl)、1Mのトリス(200μl)、(pH8.0@37℃、pH8.4@25℃)、1MのDTT(25μl)、100mMのスペルミジン(50μl)、10μg/μlのBSA(25μl)、1MのMgCl2(50μl)、−20℃(1000μl)で保存する。
【0088】
トランスフェクションアッセイのためのモノ−およびジシストロン性プラスミドの構築
ジシストロン性プラスミド(pCMV−Luc−IRES−SEAP)を用いて細胞をトランスフェクトさせ、そしてテスト化合物の存在および非存在下でのインビボの翻訳のためのアッセイを行う。pCMV−Luc−IRES−SEAPは順に、SV40の複製起点、サイトメガロウイルス(CMV)のプロモーター、ルシフェラーゼのレポーター遺伝子、選択されるIRES要素、分泌されるアルカリホスファターゼ(SEAP)レポーター遺伝子、SV40のスプライス部位、およびSV40のポリAシグナルを含む。pUC118を基にする2つの構築物(pB−SEAPおよびpB−Luc−IRES−SEAP)を用いて構築物pCMV−Luc−IRES−SEAPを作成する。pB−SEAPは順に、T7のポリメラーゼプロモーター、β−グロビンの5’非翻訳領域、およびSEAPレポーター遺伝子を含む。pB−Luc−IRES−SEAPは順に、T7のポリメラーゼプロモーター、β−グロビンの5’非翻訳領域、ルシフェラーゼのレポーター遺伝子、選択されるIRES要素、およびSEAPレポーター遺伝子を含む。pB−SEAPおよびpB−Luc−IRES−SEAPの構築は、利用可能なプラスミドからβ−グロビンの5’NTR、ルシフェラーゼのコーディング配列、IRES要素、およびSEAPのコーディング配列を、非反復5’制限部位を含むプライマーを用いてPCR増幅することにより実施する。β−グロビンの5’NTRおよびSEAPのコーディング領域を含むPCR産物を制限消化し、そしてpUC118内に挿入してモノシストロン性構築物pB−SEAPを産生する。ジシストロン性プラスミドpB−Luc−IRES−SEAPは、制限消化させたモノシストロン性プラスミドと、選択されるIRES要素およびルシフェラーゼのコーディング領域を含む制限消化させたPCR産物とを連結することにより作成する。細胞をトランスフェクトするのに用いたジシストロン性プラスミド(pCMV−Luc−IRES−SEAP)は、pB−Luc−IRES−SEAPのLuc−IRES−SEAPコーディング領域を含む平滑末端化Kpn I−Apa I断片と、サイトメガロウイルス(CMV)のプロモーターを含みSV40の複製起点、スプライス部位、およびポリAシグナルを含むEco RV消化させたプラスミドベクターpcDNAI−neo(InVitrogen社)とを連結させることにより構築する。
【0089】
PCR
T7プロモーター、β−グロビンの5’NTR、ルシフェラーゼのレポーター遺伝子、IRES要素、およびSEAPのレポーター遺伝子を、先に記載されるポリメラーゼ連鎖反応(PCR)および以下に示すプライマーを用いて増幅する。
【0090】
【表2】

【0091】
実施例8:インビトロ翻訳スクリーニングアッセイ
テスト化合物を、IRES要素−蛋白質コーディング領域含有性構築物、ウイルス翻訳に必要な選択される細胞性結合蛋白質、および細胞性翻訳構成成分(リボソームなど)を含む無細胞系内においてウイルス性IRES指示蛋白質翻訳を阻害する能力についてスクリーニングする。
【0092】
A.インビトロ翻訳アッセイ
PUC118を基にする2つの構築物(pBLおよびpBCRL、既述)を用いてテスト化合物の存在および非存在下で翻訳についてのアッセイを行う。pBLは順に、T7ポリメラーゼのプロモーター、β−グロビンの5’非翻訳領域、およびルシフェラーゼのレポーター遺伝子を含む。pBCRLは順に、T7ポリメラーゼのプロモーター、β−グロビンの5’非翻訳領域、CATのレポーター遺伝子、IRES要素、およびルフェラーゼのレポーター遺伝子を含む。テスト化合物を、構築物pBCRLを用いるとIRES要素により作動されるルシフェラーゼ合成は阻害するが、構築物pBCRLを用いるとβ−グロビンの5’NTRにより作動されるCAT合成は阻害せず、かつ構築物pBLを用いるとβ−グロビンの5’NTRにより作動されるルシフェラーゼ合成を阻害しない能力についてスクリーニングする。
【0093】
B.翻訳用のHela S3のS10の調製:
材料/調製法
タイプBのホモジナイザーをEtOHおよびDEPC H2Oを用いてフード内ですすぐ。低張溶菌緩衝液:0.119gのHepes(500μl 1M)、0.049gのKOAc(250μl 2M)、0.016gのMgOAc(74μl 1M)、50mlにするまでのDEPC H2O。1MのKOHでpHを7.4に調節する。新規に調製した10mlのHepes緩衝液中の25μlの1M DTTを添加する。透析緩衝液:2.838gのHepes、8.833gのKOAc、1.5mlの1M MgOAc、1LにするまでのH2O(非−DEPC H2Oで十分であろう)。1MのKOHでpHを7.4に調節し、10mlのHepes緩衝液中の25mlの1M DTTを添加する。オートクレーブもしくはフィルター滅菌処理を行い、そして4℃に保存する。12000〜14000カットオフ型のチューブに入れて透析する。2×ロード用色素:125μLの1M トリス−HCl pH6.8、400μlの10%SDS、100μlのメルカプトエタノール、375μlの50%グリセロール。微量のブロモフェノールブルーを添加する。
【0094】
対数期にある2LのHeLa S3細胞を取得する(5×105細胞/ml)。細胞を氷冷PBSで3回洗浄する(各20mlのPBSで行い、最初の洗浄には10mlのPBS/L細胞、2回目の洗浄には15mlのPBS/L、そして3回目の洗浄には10mlのPBS/Lを用いる)。2K rpmで10分間遠心する。3度目の遠心には30mlのコレックス試験管およびHB4ローターを使用する。低張緩衝液で1.5×のパック化細胞容積にするように再懸濁させ、そして氷上で10分間膨潤させる。低張緩衝液(RNase非含有性):10mMのK−HEPES pH7.4 1M保存液、10mMのKOA 4M保存液、1.5mMのMgOAc(1M)保存液、2.5mMのDTT(使用前に添加する)。タイプBホモジナイザーの15〜45ストロークでホモジナイズする。10、15、20、25などのストローク後に肉眼的にかあるいは色素液排除アッセイのいずれかにより細胞破壊を確認する。細胞が破壊されていれば破片が見えるであろう。5分間2K rpmで遠心する(核を除去する)。上清を取り出し、そして20分間10K rpmで遠心する。滅菌コレックス試験管を使用する。2時間1L(100培容積)の透析緩衝液(10mMのK−HEPES、pH7.5、90mMのKOAc、1.5mMのMgOAc、2.5mMのDTT)に対して透析して除濁および緩衝液の置換を行う。2.5mlの1M DTTを使用直前に添加する。−80℃で一晩凍結させ、25℃で約30分間解凍させ、即座に氷上に置く。10K rpmで10分間、ミクロフュージ内で遠心する。200μlの50%グリセロール/800μl溶菌液上清を添加する。1mlの抽出物当たりに7.5μl(2mg/ml)のミクロコッカスヌクレアーゼおよび7.5μlの100mM CaCl2を添加する。25℃で5分間インキュベートする。15μLの200mM EGTA/mlの抽出物を添加する。150μl/試験管のアリコートに分け、−80℃に保存する。
【0095】
C.翻訳反応
10×翻訳ミックス:1mMのATP、50μMのGTP、10mMのクレアチンリン酸エステル、24μg/mlのCPK、18mMのHepes、2mMのDTT、24μg/mlのtRNA、12μMのアミノ酸ミックス、240μMのスペルミジン。アリコートに分け、そして−80℃に保存する。混合物は以下のものを含む。40μlの100mM ATP、6μlの40mM GTP、40μlの1Mクレアチンリン酸エステル(−20℃に保存)、Hepes中の10μlの10mg/mlのクレアチンホスホキナーゼ(−20℃に保存)、76μlのK−Hepes pH7.6、8μlの1M DTT(37℃で解凍)、10μlの10mg/mlのウシ肝臓のtRNA(Boehringer社)、50μlのアミノ酸ミックス−メチオニン、10μlの100mMスペルミジン、および250μlのH2Oで500μlにする。
【0096】
マスターミックス(新しく調製):混合物は以下のものを含む。150μlのミクロコッカスヌクレアーゼ処理化HeLa抽出物、50μlの翻訳ミックス、22μlの2M KOAc、3μlの50mMのMgOAc、16μlの20mM MgCl2、25μlの35S−met(20μCi/μl)。これは28回分の翻訳に十分な量であって、より少ない量の試料の場合には量を減らす。
【0097】
翻訳:混合物は以下のものを含む。8.0μlのマスターミックス、DEPC H2O中の4.5μlの1μM RNA、+/−10μlのテスト化合物。30℃で3時間インキュベートする。40μlの2×ロード色素、28μlのH2Oを添加し、5分間沸騰させ、20μlを12%のゲルに乗せ、固定、増強化、XRPフィルムへの露出を行う。増強化には1Mのサリチル酸ナトリウム16g/100mlを試す。
【0098】
D.ルシフェラーゼアッセイ
DeWet et al.(1987、Mol.Cell Biol.7、725−727)により記載されるとおり。D−ルシフェリンの1mM保存溶液は2.8mgのルシフェリン(酸非含有性−氷上および暗所に維持する)を9.8mlのH2Oに添加することにより調製し、ボルテックスミキサーにかけて塊を除去し、100μLの1M Na2HPO4を添加し(黄緑色を生じ、いくぶんかの沈殿を生じることがある)、100μlの1M NaH2PO4−H2Oを添加し(溶液は透明)、アリコートに分け、そして−20℃に保存する。1〜10mg/mlでH2O中のルシフェラーゼの保存液を作成し、アリコートに分け、−20℃に保存する。<1mg/mlでトリシン緩衝液、DTT、MgSO4、および0.1%のBSA中に溶解させた市販のルシフェラーゼをアリコートに分け、−20℃に保存する。トランスフェクトさせた細胞(非溶菌化)を−20℃に保存する。100μlの溶菌液をアリコートに分け、4℃に2〜4週間保存する。インビトロ翻訳物を−20℃に保存する。アッセイを実施するためには、350μlのアッセイ緩衝液を25℃で使用し、100μlの溶菌液からの10〜50μlの冷却細胞懸濁液、もしくは20μlのインビトロ翻訳反応物からの1〜10μlを添加する。100μlのルシフェラーゼ溶液を注入する。アッセイ緩衝液(新鮮なものを使用する):125μlの100mM ATP、75μlの1M MgSO4、4675μlの超音波処理用緩衝液(100mMのK2HPO4[二塩基物]pH7.8、1mMのDTT)。
【0099】
E.細胞性アッセイ
2つの異なるレポーター蛋白質の合成を指示するジシストロン性構築物を細胞内にトランスフェクトさせ、細胞をテスト化合物に露出し、その後にこれを各々のレポーター蛋白質を産生する能力についてテストする。両方のレポーター蛋白質の産生は可視化させるか、あるいは好ましくは同時にもしくは別法では連続して同じ細胞内で検出する。レポーター蛋白質は、ルシフェラーゼ、β−ガラクトシダーゼ、分泌胎児アルカリホスファターゼ、CAT、β−グルクロニダーゼの内のいずれかか、あるいは当業者に知られる他の適切な蛋白質でありうる。
【0100】
選択的にウイルスの翻訳を阻害する化合物はレポーター蛋白質2の産生を阻害するが、レポーター蛋白質1の産生は阻害せず、細胞にとって一般的に毒性である化合物はレポーター蛋白質1の合成、および恐らくはレポーター蛋白質2の合成を阻害する。
【0101】
実施例9:アンチセンスDNAオリゴヌクレオチドインヒビターでのリノウイルス翻訳の阻害
オリゴピリミジンの区域(tract)が全てのピコルナウイルスIRES要素の3’端付近に見いだされている(図5、nt572〜580)。様々なオリゴピリミジン区域のより厳密な調査により、下流のAUGトリプレットの存在が明らかになった(図5、nt591〜593)。この保存要素は「YnXmAUG」モチーフと称され、Ynは長さnのピリミジン区域に相当し、この式中nは4〜12に変化することができ、そして最も好ましくは5〜9のヌクレオチドであり、そしてXmは長さmのランダムスペーサー配列に相当し、この式中mは5〜30に変化し、そして最も好ましくは10〜20ヌクレオチドである(Jang et al.、44 Enzyme 292、1990)。
リノウイルスIRES要素により用いられる開始コドンは、「YnXmAUG」モチーフの約31ヌクレオチド下流に位置している。
【0102】
出願人は、リノウイルスIRES要素の3’端を標的とし、かつリノウイルスIRES−依存的翻訳を阻害するアンセンスデオキシオリゴヌクレオチドを設計した。IRESのこの領域は「YnXmAUG」モチーフおよび先に記載される保存化21塩基配列の両方を含むためにこの領域が選択され、そしてこれを図1に示す。リノウイルスIRES要素のアンチセンスデオキシオリゴヌクレオチド阻害は[35S]−メチオニン取り込みアッセイ(図7)およびルシフェラーゼ活性アッセイ(図8)を用いてアッセイした。この領域を標的にするアンチセンスオリゴヌクレオチドの例はアンチ−IRES−オリゴであり、これはリノウイルス14のIRESのnt518〜551にアニールする。アンチ−IRES−オリゴ(配列番号26)の配列は、5′AGTAGTCGGTCCCGTCCCGGAATTGCGCATTACG3′である。
【0103】
アンチ−IRES−オリゴの存在および非存在下でのモノシストロン性bLuc mRNA(図6A)およびジシストロン性のbCRL mRNA(図6B)の翻訳を測定した。予期されるように、アンチ−IRES−オリゴはbLuc mRNAからのルシフェラーゼの翻訳(図7、レーン5〜6に対してレーン3〜4におけるルシフェラーゼ翻訳を比較せよ)もしくはbCRLからのCATの翻訳(図7、レーン9〜10に対してレーン7〜8におけるCATの翻訳を比較せよ)を阻害しなかった。しかしながら、アンチ−IRESはbCEL mRNAからのルシフェラーゼの翻訳を劇的に阻害した(図7、レーン7〜8とレーン9〜10におけるルシフェラーゼ翻訳を比較せよ)。従って、アンチ−IRES−オリゴは特異的にリノウイルスIRES−依存的翻訳を阻害する。その上、修飾化核酸もしくは核酸アナログも本実施例の方法に利用することができる。
【0104】
ルシフェラーゼ活性アッセイを実施して、アンチ−IRES−オリゴによるbLおよびbCRLmRNAからのルシフェラーゼの翻訳阻害を定量化した。35S−メチオニン取り込みアッセイの結果と一致して、アンチ−IRES−オリゴはbL mRNAからのルシフェラーゼ翻訳を阻害しなかったが(図8、レーン2および3を比較せよ)、一方でこれはbCRL mRNAからのルシフェラーゼ翻訳を約95%阻害した(図8、レーン5および6を比較せよ)。対照デオキシオリゴヌクレオチド(対照−オリゴ、非表示)を、アンチ−IRES−オリゴに対して逆転させてあり、かつ相補的である配列を用いて合成した。従って対照デオキシオリゴヌクレオチドはおおよそ同じG−CおよびA−T組成を有するが、リノウイルス14のIRESのnt518〜551にアニールすることができない。対照−オリゴはbLもしくはbCRLのmRNAの翻訳に何の影響も及ぼさなかった(図8、レーン4とレーン2を、そしてレーン7とレーン5を比較せよ)。従ってアンチ−IRES−オリゴはリノウイルスのIRESにより作動される翻訳を特異的に阻害するように思われる。
【0105】
薬剤の投与
本発明の方法を実施する際には、組成物を単独もしくは互いに組み合わせてか、あるいは他の治療剤もしくは診断剤と組み合わせて用いることができる。これらの組成物はインビボで、通常は哺乳類において、好ましくはヒトにおいて、あるいはインビトロで利用することができる。これらをインビボで利用する際には、組成物を、非経口的、静脈内的、皮下的、筋肉内的、経結腸的、経直腸的、経膣的、経鼻的、経口的、経皮的、局所的、経眼的、腹膜内的を初めとする数々の方法において、もしくは数々の投与剤形態を利用する適切に製剤化される外科用移植片として哺乳類に投与することができる。当業者には容易に明白であろうが、投与すべき有用なインビボ用量および投与の特別な様式は、治療される哺乳類の種、利用する具体的な組成物、およびこれらの組成物を利用する特異的な用途に依存して変化するであろう。効果的な用量レベルとは所望される結果を達成するのに必要な用量レベルであり、この決定は当業者の技術範囲内に含まれるであろう。典型的には組成物の適応はより低い用量レベルで開始され、用量レベルを所望の効果が達成されるまで増加する。
【0106】
本発明の組成物のための用量は、所望の効果および治療上の指示に依存して広域な範囲に及ぶことができる。典型的には用量は、約0.01μlと100mg/kgとの間、好ましくは約0.01と10mg/kg(体重)との間であろう。投与は毎日もしくは必要に応じての経口投与であることが好ましい。
選択される事例においては、薬物輸送用賦形剤を全身的もしくは局所的投与のために利用することができる。これらは徐放性リザーバーとして作用するようにか、あるいは標的細胞に直接それらの内容物を輸送するように設計することができる。
【0107】
薬物の局所投与が有利であり、それは最少の全身的吸収を伴う投与部位での局在濃縮が可能になるためである。
薬剤を全身的に投与することもできる。全身吸収は、血流における薬物の蓄積およびその後の体全体への拡散を意味する。全身投与につながる投与経路には、経口投与、静脈内投与、皮下投与、腹膜内投与、経鼻投与、包膜内投与、および経眼投与がある。
本明細書に引用される全ての刊行物は、各刊行物内に列挙される核酸配列を含めて本明細書内の引用により本明細書に取り込まれる。他の態様は以下の請求の範囲内に含まれる。
【図面の簡単な説明】
【0108】
【図1】アデノウイルスVAI RNAの末端ステム、中央ドメイン、および先端ステムループを示す図である(MA、Y.およびM.B.Mathews.1993。Comparative analysis of the structure and function of adenovirus virus associated RNAs.J.Virol.67:6605−6617)。
【図2】VAI RNAの相補配列に対してアニールされるアンチセンスVA(ava)オリゴデオキシヌクレオチド種ava1、ava2、ava3、およびava9を示す図である。
【図3】アンチセンス種および相補的VAI RNA領域、すなわちVAIRNAアンチセンスオリゴデオキシヌクレオチド(ODN)の配列を示す図である。
【図4】インビトロ翻訳アッセイの結果を示す図である。カラム1:(−)mRNA;カラム2:(+)mRNA;カラム3:(+)mRNA、(+)レオウイルスdsRNA;カラム4:(+)mRNA、(+)レオウイルスdsRNA、(+)VAI RNA。カラム5〜9:(+)mRNA、(+)レオウイルスdsRNA、(+)VAI RNA、ならびに以下のアンチセンス:カラム5:ava1;カラム6:ava2;カラム7:ava3;カラム8:ava9;カラム9:ava15。
【図5】ヒトのリノウイルス14の5’NTR配列および予想される二次構造を示す図である(Le、S.−Y.、and Zuker,M.(1990)J.Mol.Biol.216、729−741)。ヌクレオチド(「nt」)625におけるポリ蛋白質のための開始用AUG開始コドンを影付きボックスとして示し、非開始用AUGコドンを影なしボックスとして示す。ピコルナウイルスの全てのIRES要素内に見いだされるYnXmAUGモチーフ、ならびにリノウイルスおよびエンテロウイルスの全てのIRES要素内に見いだされる21塩基の保存配列に下線を施してある。リノウイルスゲノム上のヌクレオチドの位置に番号による印を付けてある。
【図6】インビトロ翻訳研究のために用いられるmRNAの該略図を示す図である。A)CATレポーター遺伝子の翻訳から得られる_−グロビンの5’NTRを含むbCRLmRNA、およびルシフェラーゼレポーター遺伝子の翻訳から得られるリノウイルスのIRES。B)ルシフェラーゼレポーター遺伝子の翻訳から得られる_−グロビンの5’NTRを含むbLmRNA。実線は指示されるように、−グロビンの5’非翻訳領域(NTR)、リノウイルスのIRES、もしくは3’NTRを表す。ボックスはレポーター遺伝子CAT(クロラムフェニコールアセチルトランスフェラーゼ)およびルシフェラーゼを表す。
【図7】bLucおよびbCRLmRNAのインビトロ翻訳を示す図である。翻訳反応は、Lee、K.A.W.、and Sonenberg、N.(1982)Proc Natl.Acad.Sci、USA 79、3447、により記載されるように二重検査で実施した。レーンM、標識蛋白質;レーン1〜2、mRNAなし;レーン3〜4、bL mRNA;レーン5〜6、bL mRNAとアンチ−IRES−オリゴ:レーン7〜8、bCRL mRNA;レーン9〜10、bCRL mRNAとアンチ−IREAS−オリゴ。ルシフェラーゼおよびCAT翻訳産物に対応するバンドを、30、46、および69kDaの蛋白質マーカーと共に示す。
【図8】アンチセンス(アンチ−IRES−オリゴ)および対照(対照−オリゴ)デオキシオリゴヌクレオチドの非存在および存在下でのbLおよびbCRL mRNAの翻訳反応のルシフェラーゼ活性アッセイを示す図である。翻訳反応およびルシフェラーゼ活性アッセイは本文中に記載されるように実施した。2つの個別の複製物からの相対的光単位の平均値を求め、そしてbLおよびbCRL翻訳物からのルシフェラーゼ活性を比較のために100に標準化した。翻訳反応は、レーン1、mRNAなし;レーン2、bL mRNA;レーン3、bL mRNAとアンチ−IRES−オリゴ;レーン4、bL mRNAと対照−オリゴ;レーン5、bCRL mRNA;レーン6、bCRL mRNAとアンチ−IRES−オリゴ;レーン7、bCRL mRNAと対照−オリゴ、を含む。
【0109】
「配列表」
配列番号:1の情報:
(i) 配列の特徴:
(A) 配列の長さ: 46 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:1:
ATAGGTACCT AATACGACTC ACTATAGGGA CACTTGCTTT TGACAC 46
配列番号:2の情報:
(i) 配列の特徴:
(A) 配列の長さ: 29 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:2:
ATAGGGCCCC TCGAGGTCTG TTTTGGGGG 29
配列番号:3の情報:
(i) 配列の特徴:
(A) 配列の長さ: 26 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:3:
ATAGGATCCT TAAAACAGCG GATGGG 26
配列番号:4の情報:
(i) 配列の特徴:
(A) 配列の長さ: 20 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:4:
GGCGTCTTCC ATGATCACAG 20
配列番号:5の情報:
(i) 配列の特徴:
(A) 配列の長さ: 33 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:5:
ATAGGGCCCT GATCATGCTG CTGCTGCTGC TGC 33
配列番号:6の情報:
(i) 配列の特徴:
(A) 配列の長さ: 28 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:6:
ATAGTCGACT TAACCCGGGT GCGCGGCG 28
配列番号:7の情報:
(i) 配列の特徴:
(A) 配列の長さ: 27 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:7:
ATACTCGAGA TGGAAGACGC CAAAAAC 27
配列番号:8の情報:
(i) 配列の特徴:
(A) 配列の長さ: 29 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:8:
ATACCTAGGT TACAATTTGG ACTTTCCGC 29
配列番号:9の情報:
(i) 配列の特徴:
(A) 配列の長さ: 46 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:9:
ATAGGTACCT AATACGACTC ACTATAGGGA CACTTGCTTT TGACAC 46
配列番号:10の情報:
(i) 配列の特徴:
(A) 配列の長さ: 29 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:10:
ATAGGGCCCC TCGAGGTCTG TTTTGGGGG 29
配列番号:11の情報:
(i) 配列の特徴:
(A) 配列の長さ: 32 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:11:
ATAGGGCCCT GATCATGGAA GACGCCAAAA AC 32
配列番号:12の情報:
(i) 配列の特徴:
(A) 配列の長さ: 29 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:12:
ATAGTCGACT TACAATTTGG ACTTTCCGC 29
配列番号:13の情報:
(i) 配列の特徴:
(A) 配列の長さ: 32 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:13:
ATACTCGAGA TGAGCTTGGC GAGATTTTCA GG 32
配列番号:14の情報:
(i) 配列の特徴:
(A) 配列の長さ: 26 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:14:
ATACCTAGGT TACGCCCCGC CCTGCC 26
配列番号:15の情報:
(i) 配列の特徴:
(A) 配列の長さ: 26 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:15:
ATAGGATCCT TAAAACAGCG GATGGG 26
配列番号:16の情報:
(i) 配列の特徴:
(A) 配列の長さ: 20 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:16:
GGCGTCTTCC ATGATCACAG 20
配列番号:17の情報:
(i) 配列の特徴:
(A) 配列の長さ: 1515 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:17:
ATGGTGGCCC CCGGCTCTGT GACCAGCCGG CTGGGCTCGG TGTTCCCTTT CCTGCTGGTC 60
CTGGTGGACC TGCAGTACGA AGGTGCTGAA TGTGGAGTAA ATGCAGATGT TGAGAAGCAT 120
CTGGAATTGG GCAAGAAGCT GCTCGCAGCC GGACAGCTCG CGGATGCGTT ATCTCAGTTT 180
CACGCTGCAG TAGATGGTGA CCCTGATAAC TATATTGCTT ACTATCGGAG AGCTACTGTC 240
TTTTTAGCTA TGGGCAAATC AAAAGCAGCA CTTCCTGATT TAACTAAAGT GATTGAATTG 300
AAGATGGATT TCACTGCAGC AAGATTACAG AGAGGTCACT TATTACTCAA ACAAGGAAAA 360
CTTGATGAAG CAGAAGATGA TTTTAAAAAA GTGCTCAAGT CAAATCCAAG TGAAAATGAA 420
GAGAAGGAGG CCCAGTCCCA GCTTGTCAAA TCTGATGAAA TGCAGCGTCT GCGCTCACAA 480
GCACTGGATG CCTTTGAGAG CTCAGATTTT ACTGCTGCTA TAACCTTCCT TGATAAGATT 540
TTAGAGGTTT GTGTTTGGGA TGCAGAACTT CGAGAACTTC GAGCTGAATG TTTTATAAAA 600
GAAGGGGAAC CTAGGAAAGC GATAAGTGAC TTAAAAGCTT CATCAAAATT GAAAAACGAT 660
AATACTGAGG CATTTTATAA AATCAGCACA CTCTACTATG AACTAGGAGA CCATGAACTG 720
TCTCTCAGTG AAGTTCGTGA ATGTCTTAAA CTTGACCAGG ATCATAAAAG GTGTTTTGCA 780
CACTATAAAC AAGTAAAGAA ACTGAATAAG CTGATTGAGT CAGCTGAAGA GCTCATCAAA 840
GAAGGCAGGT ACACAGATGC AATCAGCAAA TATGAATCTG TCATGAAAAC AGAGCCAGGT 900
GTTCATGAAT ATACAATTCG TTCAAAAGAA AGGATTTGCC ACTGCTTTTC TAAGGATGAG 960
AAGCCTGTTG AAGCTATTCG AGTATGTTCA GAAGTTTTAC AGGTGGAACC TGACAACGTG 1020
AATGCTCTGA AAGACCGAGC AGAGGCCTAT TTAATAGAAG AAATGTATGA TGAAGCTATT 1080
CAGGATTATG AAACTGCTCA GGAACACAAT GAGAATGATC AGCAGATTCG AGAAGGTCTG 1140
GAGAAAGCAC AGAGGCTACT GAAACAGTCA CAGAGACGAG ATTATTACAA AATCTTGGGA 1200
GTAAAAAGAA ATGCCAAAAA GCAAGAAATC ATTAAAGCAT ACCGAAAATT AGCACTGCAG 1260
TGGCACCCAG ACAACTTCCA GAACGAAGAA GAAAAGAAAA AAGCTGAGAA GAAGTTCATT 1320
GACATAGCAG CTGCTAAAGA AGTCCTCTCC GATCCAGAAA TGAGGAAGAA GTTTGATGAC 1380
GGAGAAGACC CCCTGGACGC AGAGAGCCAA CAAGGAGGTG GCGGCAACCC TTTCCACAGG 1440
AGCTGGAACT CATGGCAAGG GTTCAGTCCC TTTAGCTCAG GCGGACCTTT TAGATTTAAA 1500
TTCCACTTCA ATTAA 1515
配列番号:18の情報:
(i) 配列の特徴:
(A) 配列の長さ: 47 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:18:
AATAGAATTC TAATACGACT CACTATAGGG ACACTTGCTT TTGACAC 47
配列番号:19の情報:
(i) 配列の特徴:
(A) 配列の長さ: 27 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:19:
ATAAGGTACC TCTGTCTGTT TTGGGGG 27
配列番号:20の情報:
(i) 配列の特徴:
(A) 配列の長さ: 39 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:20:
AATACTGCAG TGATCATGGA AGACGCCAAA AACATAAAG 39
配列番号:21の情報:
(i) 配列の特徴:
(A) 配列の長さ: 36 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:21:
AATAAAGCTT GGGCCCTTAC AATTTGGACT TTCCGC 36
配列番号:22の情報:
(i) 配列の特徴:
(A) 配列の長さ: 37 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:22:
AATAGGTACC ATGGAGAAAA AAATCACTGG ATATACC 37
配列番号:23の情報:
(i) 配列の特徴:
(A) 配列の長さ: 27 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:23:
AATAGGATCC TTACGCCCCG CCCTGCC 27
配列番号:24の情報:
(i) 配列の特徴:
(A) 配列の長さ: 27 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:24:
AATAGGATCC TTAAAACAGC GGATGGG 27
配列番号:25の情報:
(i) 配列の特徴:
(A) 配列の長さ: 48 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:25:
AAAACTGCAG CATGCTGATC ACAGTATATG TATATATATG CTGTGACC 48
配列番号:26の情報:
(i) 配列の特徴:
(A) 配列の長さ: 34 塩基対
(B) 型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー::直鎖状
(xi) 配列:: SEQ ID NO:26:
AGTAGTCGGT CCCGTCCCGG AATTGCGCAT TACG 34
【特許請求の範囲】
【請求項1】
抗ウイルス剤を同定するためのスクリーニングアッセイに使用するための組成物であって、
ウイルスの内部リボソーム侵入部位(IRES)及びレポーター蛋白質をコードするポリヌクレオチドを含む組換え核酸を含み、前記IRESが前記ポリヌクレオチドに対して作動可能なように結合している組換え核酸含有細胞を含む組成物。
【請求項2】
前記組換え核酸が、前記IRESの上流の、前記レポーター蛋白質をコードするポリペプチドに作動可能に連結された非翻訳(UTR)領域を更に含む、請求項1記載の組成物。
【請求項3】
前記IRESが、A型肝炎ウイルス、B型肝炎ウイルス、インフルエンザウイルス、ヘルペスウイルス、又はサイトメガロウイルスからのIRESである、請求項1または2に記載の組成物。
【請求項4】
前記IRESが、エンテロウイルス、リノウイルス、カルジオウイルス、およびアフトウイルスからのIRESである、請求項1または2に記載の組成物。
【請求項5】
前記IRESがピコナルウイルスのIRESである、請求項1または2に記載の組成物。
【請求項6】
前記ウイルスのIRESがC型肝炎ウイルス(HCV)のIRESである、請求項1または2に記載の組成物。
【請求項7】
前記ウイルスのIRESがHIVのIRESである、請求項1または2に記載の組成物。
【請求項8】
前記組換え核酸がRNAである、請求項1から7のいずれか一項に記載の組成物。
【請求項9】
前記細胞が真核生物細胞である、請求項1から8のいずれか一項に記載の組成物。
【請求項10】
前記組換え核酸が、プロモータに作動可能なように結合している、請求項1から9のいずれか一項に記載の組成物。
【請求項11】
前記レポーター蛋白質が、増殖上の欠点を細胞に付与する、請求項1から10のいずれか一項に記載の組成物。
【請求項12】
前記レポーター蛋白質が、細胞に対して毒性である、請求項11に記載の組成物。
【請求項13】
前記レポーター蛋白質が、非毒性基質を細胞に対して毒性の産物へと転化する酵素である、請求項11に記載の組成物。
【請求項14】
抗ウイルス剤をスクリーニングする方法であって、
a)試験薬剤を請求項1から13のいずれか一項に記載の組成物と接触させ;そして
b)前記レポーター蛋白質の生産を評価することを含んでなり、
前記試験薬剤の存在下での前記レポーター蛋白質の生産が、前記試験薬剤の不存在下での同一細胞に比較して低下している場合に、当該試験薬剤が抗ウイルス剤であるとする方法。
【請求項15】
前記レポーター蛋白質の生産が、前記レポーター蛋白質の活性を評価することにより測定される、請求項14に記載の方法。
【請求項16】
前記レポーター蛋白質の生産が、前記細胞の増殖により測定される、請求項14に記載の方法。
【請求項1】
抗ウイルス剤を同定するためのスクリーニングアッセイに使用するための組成物であって、
ウイルスの内部リボソーム侵入部位(IRES)及びレポーター蛋白質をコードするポリヌクレオチドを含む組換え核酸を含み、前記IRESが前記ポリヌクレオチドに対して作動可能なように結合している組換え核酸含有細胞を含む組成物。
【請求項2】
前記組換え核酸が、前記IRESの上流の、前記レポーター蛋白質をコードするポリペプチドに作動可能に連結された非翻訳(UTR)領域を更に含む、請求項1記載の組成物。
【請求項3】
前記IRESが、A型肝炎ウイルス、B型肝炎ウイルス、インフルエンザウイルス、ヘルペスウイルス、又はサイトメガロウイルスからのIRESである、請求項1または2に記載の組成物。
【請求項4】
前記IRESが、エンテロウイルス、リノウイルス、カルジオウイルス、およびアフトウイルスからのIRESである、請求項1または2に記載の組成物。
【請求項5】
前記IRESがピコナルウイルスのIRESである、請求項1または2に記載の組成物。
【請求項6】
前記ウイルスのIRESがC型肝炎ウイルス(HCV)のIRESである、請求項1または2に記載の組成物。
【請求項7】
前記ウイルスのIRESがHIVのIRESである、請求項1または2に記載の組成物。
【請求項8】
前記組換え核酸がRNAである、請求項1から7のいずれか一項に記載の組成物。
【請求項9】
前記細胞が真核生物細胞である、請求項1から8のいずれか一項に記載の組成物。
【請求項10】
前記組換え核酸が、プロモータに作動可能なように結合している、請求項1から9のいずれか一項に記載の組成物。
【請求項11】
前記レポーター蛋白質が、増殖上の欠点を細胞に付与する、請求項1から10のいずれか一項に記載の組成物。
【請求項12】
前記レポーター蛋白質が、細胞に対して毒性である、請求項11に記載の組成物。
【請求項13】
前記レポーター蛋白質が、非毒性基質を細胞に対して毒性の産物へと転化する酵素である、請求項11に記載の組成物。
【請求項14】
抗ウイルス剤をスクリーニングする方法であって、
a)試験薬剤を請求項1から13のいずれか一項に記載の組成物と接触させ;そして
b)前記レポーター蛋白質の生産を評価することを含んでなり、
前記試験薬剤の存在下での前記レポーター蛋白質の生産が、前記試験薬剤の不存在下での同一細胞に比較して低下している場合に、当該試験薬剤が抗ウイルス剤であるとする方法。
【請求項15】
前記レポーター蛋白質の生産が、前記レポーター蛋白質の活性を評価することにより測定される、請求項14に記載の方法。
【請求項16】
前記レポーター蛋白質の生産が、前記細胞の増殖により測定される、請求項14に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2007−75116(P2007−75116A)
【公開日】平成19年3月29日(2007.3.29)
【国際特許分類】
【出願番号】特願2006−262354(P2006−262354)
【出願日】平成18年9月27日(2006.9.27)
【分割の表示】特願平6−522423の分割
【原出願日】平成6年4月1日(1994.4.1)
【出願人】(506291519)リジェル・ファーマシューティカルズ・インコーポレーテッド (1)
【Fターム(参考)】
【公開日】平成19年3月29日(2007.3.29)
【国際特許分類】
【出願日】平成18年9月27日(2006.9.27)
【分割の表示】特願平6−522423の分割
【原出願日】平成6年4月1日(1994.4.1)
【出願人】(506291519)リジェル・ファーマシューティカルズ・インコーポレーテッド (1)
【Fターム(参考)】
[ Back to top ]

