エクオール定量定性デバイス、エクオール定量定性キットおよびエクオール定量方法
【課題】容易かつ簡便にエクオールのみの定量または定性を行なえるエクオール定量定性デバイス、エクオール定量定性キットおよびエクオール定量方法を提供する。
【解決手段】検体中のエクオールaを定量または定性するため、基板40上に、検体、および、エクオール結合物質cに標識bを結合させた標識結合体dを導入する試料導入部10と、検体および標識結合体dを含んだ液体試料が通過でき、標識結合体dと免疫特異的に結合するエクオール様物質eを担持する第一検出部21、および、エクオール複合体f或いは標識結合体dと結合する捕捉物質gを担持する第二検出部22をこの順に備えた展開手段20と、液体を吸収する吸水部30と、を順次接触させて設けたエクオール定量定性デバイスX、エクオール定量定性デバイスXを備えたエクオール定量定性キット、および、エクオール定量定性デバイスXを利用するエクオール定量方法。
【解決手段】検体中のエクオールaを定量または定性するため、基板40上に、検体、および、エクオール結合物質cに標識bを結合させた標識結合体dを導入する試料導入部10と、検体および標識結合体dを含んだ液体試料が通過でき、標識結合体dと免疫特異的に結合するエクオール様物質eを担持する第一検出部21、および、エクオール複合体f或いは標識結合体dと結合する捕捉物質gを担持する第二検出部22をこの順に備えた展開手段20と、液体を吸収する吸水部30と、を順次接触させて設けたエクオール定量定性デバイスX、エクオール定量定性デバイスXを備えたエクオール定量定性キット、および、エクオール定量定性デバイスXを利用するエクオール定量方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、エクオールを定量または定性するデバイス、キットおよび方法に関する。
【背景技術】
【0002】
エクオールは、腸内細菌(エクオール産生菌)によって生成され、その生成には個人差の存在することが知られている。例えば日本人のエクオール産生者の割合は約50%であることも報告されている(特許文献1)。
【0003】
このような個人差が生じる理由として、腸内フローラによるイソフラボノイド代謝系の違いが指摘されている(特許文献2)。イソフラボノイド代謝産物の中でもエクオールは、大豆等に含まれるイソフラボノイドの一種のダイゼイン(Daidzein)やホルモノネチン(Formononetin)を、所定の腸内フローラ、即ちエクオール産生菌の働きによって代謝することにより生成されると言われている。
【0004】
エクオールは、ダイゼイン等よりもはるかに高いエストロゲン様活性を有することが知られている。このようにエストロゲン様活性を有することで、エクオールは乳ガン・前立腺ガン・更年期障害・骨粗鬆症等に対する予防効果を有することが示唆されている。つまり、エクオールの産生能を高めることが、大豆イソフラボノイドを有効利用する上で重要となる。
【0005】
特許文献2には、イソフラボノイドを含む試料中におけるエクオールの有無を容易に検査できるエクオールの検査方法、及びエクオール産生菌の有無を容易に検査できるエクオール産生菌の検査方法が記載してある。
腸内で代謝されたイソフラボノイドの一部(エクオールを含む)は、腸管で吸収され、血液を介して尿中に排泄される。例えば、健康な成人では、イソフラボノイドを摂食してから数時間から40時間後にかけて尿中に前記イソフラボノイドが検出され、そのうちエクオール検出のピークは30〜40時間程度が一般的である。従って、イソフラボノイドを摂取した人の血液又は尿を検査することにより、その人の腸内フローラの構成、即ちエクオール産生菌の有無または何らかの機能によるエクオール産生能力を把握することが可能となる。
【0006】
上記検査方法は、具体的には、尿や胃腸内容物に由来する試料を順相TLCにて分析する工程が実施される。分析工程では、展開後のイソフラボノイドを可視化させる可視化手段を用いて、TLCプレート上の各イソフラボノイドを同定している。
【0007】
通常、血液、尿中及び胃腸内容物の培養物に含まれるイソフラボノイドには、ゲニステインが存在しているケースが多い。ゲニステインは、逆相TLCの担体上ではエクオールと同等の展開移動度にスポットが検出されるため、エクオールの検出に際しては大きなノイズとなる。これに対し、特許文献2に記載の検査方法では順相TLCを用いることにより、ゲニステインを含む主要なイソフラボノイドとエクオールとをTLCプレート上で差別化できるため、ノイズのないエクオールの検査を実施することが可能となっている。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特許第3864317号公報
【特許文献2】特開2006−242602号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
特許文献1には、エクオール産生乳酸菌含有組成物が開示してあるのみで、エクオールの定量については記載がない。
一方、特許文献2に記載の検査方法は、尿等に由来する試料に含有されるエクオールを測定する方法で、大豆代謝能の診断に有効である。しかし、TLC法は測定作業に溶媒や専用容器や、エクオールのスポットを識別する経験、特に両端と中央では移動度に差が生じるため湾曲した移動を計算しながら識別する等の高度な技術を必要とする。さらに、当該検査方法はエクオールのみを定量しているわけではないため、他の物質由来のシグナルも見分けるために標準物質のマーカーが必要となり、手軽に作業ができるとは言い難かった。
【0010】
従って、本発明の目的は、容易かつ簡便にエクオールのみの定量または定性を行なえるエクオール定量定性デバイス、エクオール定量定性キットおよびエクオール定量方法を提供することにある。
【課題を解決するための手段】
【0011】
即ち、上記目的を達成するため、以下の[1]〜[8]に示す発明を提供する。
[1] 検体中のエクオールを定量または定性するため、基板上に、
前記検体、および、エクオールと免疫特異的に結合するエクオール結合物質に標識を結合させた標識結合体を導入する試料導入部と、
前記検体および前記標識結合体を含んだ液体試料が通過でき、前記標識結合体と免疫特異的に結合するエクオール様物質を担持する第一検出部、および、前記エクオールおよび前記標識結合体が免疫特異的に結合して形成したエクオール複合体或いは前記第一検出部で前記エクオール様物質と反応しなかった前記標識結合体と結合する捕捉物質を担持する第二検出部をこの順に備えた展開手段と、
液体を吸収する吸水部と、を順次接触させて設けてあるエクオール定量定性デバイス。
[2] 前記エクオール様物質がエクオール−BSAコンジュゲートである上記[1]に記載のエクオール定量定性デバイス。
[3] 上記[1]又は[2]に記載のエクオール定量定性デバイスと、エクオール結合物質として抗エクオール抗体と、を備えたエクオール定量定性キット。
[4] 前記エクオール結合物質に直接標識を結合させた標識結合体を備えた上記[3]に記載のエクオール定量定性キット。
[5] 前記直接標識が金コロイド標識である上記[4]に記載のエクオール定量定性キット。
【0012】
上記[1]〜[5]の構成によれば、エクオール定量定性デバイスを、少なくとも試料導入部と展開手段とを接触させ、展開手段と吸水部とを接触させて構成できる。当該吸水部は展開手段の下流に設けるため、試料導入部から導入した液体試料を吸水部の側に移相させることができる。展開手段は、検体および標識結合体を含んだ液体試料が毛管現象で通過する公知の材料で構成できる。
【0013】
液体試料の移相に伴い、第一検出部に担持されたエクオール様物質により標識結合体を捕捉することができ、第二検出部に担持された捕捉物質によって、エクオール複合体或いは第一検出部でエクオール様物質と反応しなかった標識結合体を捕捉することができる。当該エクオール複合体は、エクオールおよび標識結合体が免疫特異的に結合して形成される。従って、第二検出部に捕捉されたエクオール複合体からの標識強度を測定することでエクオールを定量することができる。
【0014】
エクオール様物質がエクオール−BSAコンジュゲートであれば、エクオールを第一検出部に固相化するのが容易となり、未反応の標識結合体を特異的に捕捉することができる。さらに、エクオール結合物質が抗エクオール抗体であれば、第二検出部にてエクオールを特異的に捕捉することができる。これらより、エクオール定量の精度が向上する。
【0015】
エクオール結合物質および標識結合体は、例えば、エクオール定量定性デバイスとは別異の試薬の態様で定量に供して、エクオール定量定性キットの一部とすることができる。
【0016】
標識結合体が金コロイドのような直接標識であれば、定量または定性結果を目視で直接観察できるため、エクオール定量または定性をオンサイトで簡便に行なうことができる。
【0017】
以上より、本発明のエクオール定量定性デバイスおよびエクオール定量定性キットでは、簡便な構造でエクオールのみを免疫学的に容易に定量または定性することができる。よって、例えば尿を検体として本発明のエクオール定量定性デバイスおよびエクオール定量定性キットを使用することで、被験者がイソフラボノイドをエクオールに代謝する能力の有無を容易かつ簡便に診断することができる。
【0018】
[6] 検体、および、エクオールと免疫特異的に結合するエクオール結合物質に標識を結合させた標識結合体を混合して液体試料を得る混合工程を行なった後、当該液体試料を流下させて、
前記標識結合体と免疫特異的に結合するエクオール様物質と反応させる第一反応工程と、
前記エクオールおよび前記標識結合体が結合して形成したエクオール複合体或いは前記第一反応工程で前記エクオール様物質と反応しなかった前記標識結合体と免疫特異的に結合する捕捉物質と反応させる第二反応工程と、
前記第一反応工程および前記第二反応工程で得られた標識強度の比を算出することにより前記検体中のエクオールを定量する定量工程と、を行なうエクオール定量方法。
【0019】
上記[6]の方法では、以下の一連の反応が起こる。
検体、および、エクオール結合物質に標識を結合させた標識結合体を混合して液体試料を得る混合工程を行なうと、検体中のエクオールと標識結合体とが免疫特異的に結合したエクオール複合体が形成される。エクオールと結合しない過剰の標識結合体は、フリーの状態で流下する。フリーの状態で流下した標識結合体は、エクオール様物質と免疫特異的に結合する(第一反応工程)。一方、エクオール複合体或いは第一反応工程でエクオール様物質と反応しなかった標識結合体は、捕捉物質と免疫特異的に結合する(第二反応工程)。
第一反応工程でエクオール様物質に捕捉された標識結合体の標識強度、および、第二反応工程で捕捉物質に捕捉されたエクオール複合体の標識強度の比を算出することにより検体中のエクオールを定量または定性する(定量工程)。
このとき、第一反応工程でエクオール様物質に捕捉された標識結合体の標識強度、および、第二反応工程で捕捉物質に捕捉されたエクオール複合体の標識強度の何れか一方のみの標識強度でエクオールを定量または定性してもよい。
発色によって可視化される標識を使用した場合は、可視化されたバンドの濃淡を判別することでエクオールの定性を行なうことができる。
【0020】
従って、本方法によってエクオールのみを容易かつ簡便に定量または定性することができる。例えば尿を検体として本発明のエクオール定量方法を行なうことで、被験者がイソフラボノールをエクオールに代謝する能力の有無を容易かつ簡便に診断することができる。
【図面の簡単な説明】
【0021】
【図1】本発明のエクオール定量定性デバイスおよびエクオール定量定性キットを示す斜視図である。
【図2】第一検出部での反応を模式的に示す斜視図である。
【図3】第二検出部での反応を模式的に示す斜視図である。
【図4】実施例1で作成した検量線を示すグラフである。
【図5】エクオール標準濃度と定量濃度との関係を示すグラフである。
【図6】実施例3で作成した検量線を示すグラフである。
【図7】別実施形態のエクオール定量定性デバイスおよびエクオール定量定性キットを示す斜視図である。
【図8】別実施形態で作成した検量線を示すグラフである。
【図9】エクオール、カルボキシメチルエクオールおよびエクオール−BSAコンジュゲートの構造を示す図である。
【発明を実施するための形態】
【0022】
以下、本発明の実施形態を図面に基づいて説明する。
本発明のエクオール定量定性デバイスは、例えば単層の展開マトリクス(展開手段)に試薬を担持させた免疫クロマトグラフィーである。当該エクオール定量定性デバイスは、固定相である展開手段の表面あるいは内部を、被検出物質を含んだ移動相(液体など)が通過することで、検体中に含まれる被検出物質(エクオール)を定量または定性する。
本実施形態では検体はエクオールが含まれる(又はエクオールが含まれていない)尿検体を使用する。
【0023】
<エクオール定量定性デバイスおよびエクオール定量定性キット>
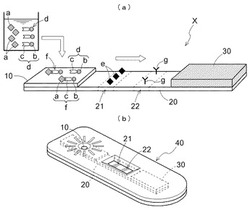
図1〜3に示したように、エクオール定量定性デバイスXは、検体中のエクオールaを定量または定性するため、基板40上に、検体、および、エクオールaと免疫特異的に結合するエクオール結合物質cに標識bを結合させた標識結合体dを導入する試料導入部10と、検体および標識結合体dを含んだ液体試料が通過でき、標識結合体dと免疫特異的に結合するエクオール様物質eを担持する第一検出部21、および、エクオールaおよび標識結合体dが免疫特異的に結合して形成したエクオール複合体f或いは第一検出部21でエクオール様物質eと反応しなかった標識結合体dと結合する捕捉物質gを担持する第二検出部22をこの順に備えた展開手段20と、液体を吸収する吸水部30と、を順次接触させて設けてある。
【0024】
(基板)
基板40は、試料導入部10・展開手段20・吸水部30を載置できるものであれば、どのような態様であってもよいが、ある程度の強度を有し、かつ吸水部30の吸水性を阻害しない材質を選択する必要がある。当該材質としては、例えば硬質塩化ビニル(PVC)が好適である。携行性を向上させるため、例えば95mm×30mm×5mm程度の大きさで薄板状に形成し、上基盤および下基盤を係合して、その内部に試料導入部10、展開手段20および吸水部30を封入するように構成するとよい。
当該基板40は、エクオール定量または定性の結果が視認できるよう例えば透明の部材で構成することができるが、これに限らず、当該結果を視認できる開口部を形成してもよい。
【0025】
(試料導入部)
試料導入部10は、検体を滴下する部位である。本実施形態では、グラスウールやニトロセルロースメンブレン等を例示するが、これに限るものではなく、毛管現象により下流側に移動相が流下する態様であればよい。
試料導入部10は単一のメンブレンで構成してもよい。しかし、試料導入部10はエクオールaおよび標識結合体dを導入する部位であることから、エクオールaを含む検体を滴下するメンブレンと、標識結合体dを滴下するメンブレンを別異に構成してもよい。
【0026】
(展開手段)
免疫クロマトグラフィー法とは、抗原抗体反応および毛管現象を利用した検査法である。そのため、展開手段20は、毛管現象により移動相(液体)・エクオールa・エクオール結合物質c・標識結合体d・エクオール複合体fなどの物質が流下する態様であればよい。例えば展開手段20は、ポアの直径が10〜200μm、厚さ100〜3000μmのニトロセルロースメンブレン・アセテート混ニトロセルロースメンブレン・ナイロンメンブレン・ポリエーテルスルホンメンブレン・ポリビニリデンジフルオライドメンブレンが好適に用いられ、特にニトロセルロースメンブレンが好ましい。当該ニトロセルロースメンブレンは、含水状態で透明または半透明となるため、標識強度を測定する妨げになり難い。
【0027】
当該展開手段20は、一方の端部を、試料導入部10の下流側と接触させるかオーバーラップさせるように配置し、他方の端部を、吸水部30の上流側と接触させるかオーバーラップさせるように配置する。このように配置することにより、試料導入部10に滴下した検体が、移動相と共に展開手段20を経て吸水部30の方向に流下することができる。
【0028】
展開手段20は、標識結合体dと免疫特異的に結合するエクオール様物質eを担持する第一検出部21、および、エクオールaおよび標識結合体dが免疫特異的に結合して形成したエクオール複合体f或いは第一検出部21でエクオール様物質eと反応しなかった標識結合体dと結合する捕捉物質gを担持する第二検出部22をこの順に備える。
【0029】
第一検出部21ではエクオール様物質eによって標識結合体dを捕捉することができ、第二検出部22では、捕捉物質gによって、エクオール複合体f或いは第一検出部21でエクオール様物質eと反応しなかった標識結合体dを捕捉することができる。
捕捉された標識結合体dおよびエクオール複合体fは標識化されているため、第一検出部21および第二検出部22の位置でバンドの態様で可視化することができ、エクオールの定量または定性が可能となる。
【0030】
(吸水部)
吸水部30は、隣接する展開手段20に存在する移動相である液体を吸水する。当該吸水部30が展開手段20の液体を吸水することで、検体導入部10に滴下した検体を、下流側に流下させることができる。
吸水部30は、例えば適当な大きさに切断した濾紙を、展開手段20の下流側に接触させるかオーバーラップさせるように配置する。
【0031】
(検体)
本明細書に記載の「検体」とは、定量または定性を行なうべき対象となる被検出物質を含む、或いは、含む可能性のある液体サンプルのことを指す。検体はどのような起源由来のものであってもよく、例えば細胞・培養物・組織・体液・尿・血清・血漿等のように、エクオールaを含有する可能性のある生検試料が検体として例示される。
【0032】
(エクオール結合物質)
エクオール結合物質cはエクオールaを認識し得る物質であり、エクオールaと親和性を有し、かつ選択的に結合し得る分子認識能を有する物質を意味する。エクオール結合物質cは、例えば、エクオール定量定性デバイスXとは別異の試薬の態様で定量に供する、或いは、エクオール定量定性デバイスXの例えば試料導入部10に予め担持させる等の態様で定量または定性に供することが可能である。当該試薬の態様で定量または定性に供する場合は、エクオール定量定性デバイスXおよび試薬により、エクオール定量定性キットを構成することができる。
【0033】
当該エクオール結合物質cは、例えばエクオールaと免疫特異的に結合する物質が例示される。
通常、「免疫化学的手法」は、例えば固相法によるイムノアッセイの手法を適用することにより液体試料中の被検出物質(エクオールa)の存在を検出あるいは定量的測定ができる。イムノアッセイとして公知の所謂「サンドイッチ法」では、例えば抗原のような標的となる被検出物質を、標識化抗体と固定化物質表面に固定化された抗体との間に挟むことにより特異的複合体を形成させ、被検出物質を捕捉することができる。
本発明の場合、検体に含まれるエクオールaは、エクオール結合物質cと結合して免疫複合体を形成することにより捕捉される。
【0034】
本実施形態では、エクオール結合物質cとして、抗エクオール抗体である場合を例示する。抗エクオール抗体は、エクオールに高い結合特異性を示し、ダイゼイン、ゲニステイン、O-デスメチルアンゴレンシンあるいは食品に含まれるポリフェノールなどの物質に交差反応性を極力有さないものが良い。抗エクオール抗体は、ポリクローナル抗体およびモノクローナル抗体の何れかを使用することができる。これら抗体は、以下のようにして作製することができる。
【0035】
使用する抗原は公知の方法に従って適当な溶液等に調製し、哺乳動物、例えばウサギやマウス等の動物に免疫を行えばよい。安定的な免疫を行ったり抗体価を高めるために抗原を適当なキャリアタンパク質とのコンジュゲートにして用いたり、アジュバント等を加えて免疫を行うのが好ましい。
免疫に際しての抗原の投与経路は特に限定されず、例えば皮下・腹腔内・静脈内あるいは筋肉内等のいずれの経路を用いてもよい。前記動物への抗原の投与は、例えば数日〜数週間おきに数回接種する方法が用いられるが、免疫する動物種によっては適宜調節される。免疫後、適宜試験的に採血を行って固相酵素免疫検定法(ELISA法)やウエスタンブロッティング等の方法で抗体価の上昇を確認し、十分に抗体価の上昇した動物から採血を行う。これに抗体の調製に用いられる適当な処理を行えばポリクローナル抗体を得ることができる。また、該動物の脾臓細胞とミエローマ細胞とを用いて公知の方法に従って融合させたハイブリドーマを用いることによりモノクローナル抗体を製造することもできる。モノクローナル抗体は、例えば以下の方法により取得することができる。
【0036】
まず、抗原の免疫により抗体価の高まった動物から抗体産生細胞を取得する。抗体産生細胞は、形質細胞及びその前駆細胞であるリンパ球であり、好ましくは脾臓・リンパ節・末梢血等から取得する。これらの細胞と融合させるミエローマとしては、一般的にはBALB/c等のマウスから得られた株化細胞が好ましく用いられる。細胞の融合は、抗体産生細胞とミエローマ細胞を適当な割合で混合し、適当な細胞融合培地、例えばRPMI1640やイスコフ改変ダルベッコ培地(IMDM)、あるいはダルベッコ改変イーグル培地(DMEM)等にポリエチレングリコール(PEG)を溶解したもの等を用いることにより行うことができる。また電気融合法によっても行うことができる。
ハイブリドーマは、ミエローマ細胞株が8−アザグアニン耐性株であることを利用して正常培地(HAT培地)中で適当時間培養することにより選択することができる。この選択方法は用いるミエローマ細胞株によって適宜変更することができる。選択されたハイブリドーマが産生する抗体の抗体価を解析し、抗体価の高い抗体を産生するハイブリドーマを限界希釈法等により分離し、分離した融合細胞を適当な培地で培養して得られる培養上清から硫安分画、アフィニティクロマトグラフィー等の適当な方法により精製してモノクローナル抗体を得ることができる。
【0037】
(標識結合体)
標識結合体dは、エクオールaと免疫特異的に結合するエクオール結合物質cに標識bを結合させたものである。
標識結合体dは、例えば、エクオール定量定性デバイスXとは別異の試薬の態様で定量または定性に供する、或いは、エクオール定量定性デバイスXの例えば試料導入部10に予め担持させる等の態様で定量または定性に供することが可能である。当該試薬の態様で定量または定性に供する場合は、エクオール定量定性デバイスXおよび試薬により、エクオール定量定性キットを構成することができる。
【0038】
標識bは、水・緩衝液等の検体溶解液に不溶性である粒子状物質であって、視覚によって検出可能な標識化物のことであり、直接標識または間接標識の何れを使用してもよい。
【0039】
直接標識とは直接観察できる標識であり、色調観察や発光や蛍光の強度等を測定することにより標識の存在を検出することができる標識をいう。直接標識に用いることができる標識物としては、金属ゾル・非金属ゾル・着色ラテックス粒子・着色リボゾーム・各種染料・各種顔料等の色素類・ルミノール誘導体・アクリジニウムエステル等の化学発光物質類・フルオレセイン・ローダミン等の蛍光物質類が挙げられる。
直接標識は、更なる工程を要さず判定結果を目視で観察することができる有色又は着色粒子による標識が好ましい。有色又は着色粒子としては金・銀・白金・プラチナ・銅のような金属コロイド、酸化鉄のような金属酸化物コロイド、硫黄・セレン等の非金属コロイド、顔料粒子・ラテックス粒子を染色したもの、リポソーム等が挙げられる。直接標識として特に金コロイドや着色ラテックスが、標識強度の視認性に優れ、かつ簡便に使用できるため、好ましい。有色又は着色粒子が毛管現象により展開手段20の多孔性物質中を移動するためには標識の粒子径が展開手段20のポアサイズより小さい必要がある。そのため、直接標識の平均粒径は1μm以下が好ましく、0.005〜1μm程度とすることが好ましい。
【0040】
間接標識としては、ペルオキシダーゼ・β−ガラクトシダーゼ・アルカリフォスファターゼ・グルコースオキシダーゼ等の酵素等が挙げられ、標識を視覚化するための工程を施すことによって標識の存在を検出することができる。
【0041】
例えば標識した抗体を使用した場合における免疫反応の結果、生成する特異的複合体中の被検出物質の量に応じて標識物質が存在することになる。未反応物を除去した後、標識物質の量を測定することで「被検出物質」を定量することができる。標識物質の定量は、標識物質の種類と共に種々の方法をとりうる。例えば、蛍光測定装置により蛍光物質の蛍光強度を測定する。測定された標識強度を、既知量の「被検出物質」を測定した場合の標識強度と比較することにより、液体試料中の被検出物質量を決定できる。
【0042】
(エクオール様物質)
エクオール様物質eは、標識結合体dと免疫特異的に結合する物質である。
上述したように、当該標識結合体dはエクオールaと免疫特異的に結合するエクオール結合物質cに標識を結合させたものであるため、エクオール様物質eは、エクオール結合物質cを認識し得る物質であり、エクオール結合物質cと親和性を有し、かつ選択的に結合し得る分子認識能を有する物質を意味する。
エクオール結合物質cが抗エクオール抗体である場合、当該エクオール様物質eは、エクオールa或いはエクオールaに構造が類似する物質とすることができる。即ち、エクオール様物質eがエクオールaに構造が類似する物質である場合は、当該物質は模擬抗原となる。
【0043】
本実施形態では、エクオール様物質eがエクオール−BSAコンジュゲート(図9(c))である場合を例示する。当該コンジュゲートは、エクオールをカルボキシメチル化しBSAを結合させたものである。エクオールは、BSAの59個のリシンにおける1〜複数箇所とアミド結合している。
エクオール−BSAコンジュゲートの態様とすることにより、エクオールaを容易に展開手段20上に固相化することができると共に、固相化したエクオールaが標識結合体dと結合して、当該標識結合体dを展開手段20上で捕捉することができる(図2)。この標識結合体dには標識bが結合しているため、この標識bを可視化することで、捕捉された標識結合体dを定量または定性することができる。
【0044】
しかし、エクオール様物質eはこれに限られるものではなく、標識結合体dと免疫特異的に結合する構造であれば、エクオールaと結合させる側鎖の構造は置換可能である。当該側鎖はBSAの他、例えばKLH(hemocyanin)、OVA(ovalbumin)、カゼイン、ポリエチレングリコール、ゼラチンなどが適用できる。また展開手段20に直接化学結合させても良い。
【0045】
(捕捉物質)
捕捉物質gは、エクオールaおよび標識結合体dが免疫特異的に結合して形成したエクオール複合体fと結合する物質である。捕捉物質gは、標識結合体dを認識する物質であり、エクオール結合物質cがエクオールと結合の有無を問わずエクオール複合体fおよび標識結合体dを認識し得る物質であり、エクオール複合体fおよび標識結合体dと親和性を有し、かつ選択的に結合し得る分子認識能を有する物質を意味する。
上述したように、標識結合体はエクオール結合物質に標識を結合させたものであるため、エクオール複合体は、エクオール・エクオール結合物質・標識で構成される。よって、捕捉物質は、エクオール複合体の状態で、例えばエクオール或いはエクオール結合物質に対して結合する物質を例示することができる。
本実施形態の捕捉物質gは、エクオール複合体fおよび第一検出部21でエクオール様物質eと反応しなかった標識結合体dと免疫特異的に結合するように作製した抗マウス抗体を例示する。
【0046】
<エクオール定量方法>
エクオール定量の際には、試料導入部10にエクオールを含んだ検体を添加し、当該検体を展開手段20に毛細管現象により展開させ、例えば競合型の抗原抗体反応(競合法)をサンドイッチ型の抗原抗体反応(サンドイッチ法)を利用して反応部位を発色させることにより、抗原の同定、存在の有無、または抗原量を測定する。
抗原抗体反応の形態は競合法、サンドイッチ型の抗原抗体反応(サンドイッチ法)の何れを利用してもよい。例えば、被検出物質の分子量が大きい場合にサンドイッチ法を利用し、被検出物質の分子量が小さい場合に競合法を利用する。
【0047】
具体的には、本発明のエクオール定量方法は、まず、検体、および、エクオールaと免疫特異的に結合するエクオール結合物質cに標識bを結合させた標識結合体dを混合して液体試料を得る混合工程(i)を行なう。その後、当該液体試料を流下させて、標識結合体dと免疫特異的に結合するエクオール様物質eと反応させる第一反応工程(ii)と、エクオールaおよび標識結合体dが結合して形成したエクオール複合体f或いは第一反応工程でエクオール様物質eと反応しなかった標識結合体dと免疫特異的に結合する捕捉物質gと反応させる第二反応工程(iii)と、を行なう。そして、第一反応工程および前記第二反応工程で得られた標識強度の比を算出することにより検体中のエクオールを定量する定量工程(iv)と、を行なう。
【0048】
エクオール産生者の場合、通常、成人の尿中には0.085〜1μmol/L以上のエクオールが含有される。そのため、混合工程(i)において、抗エクオール抗体は例えば0.01〜5μg程度で検体と混合すれば、過剰な抗エクオール抗体を消費せずに検体中に含まれるエクオールを迅速に定量することができるため、各定量にかかるコストを抑えることができる。
抗エクオール抗体の必要量の範囲は、展開手段20の材質、移動相の流速等を考慮して、適宜設定する。例えば、移動相の流速が早くなる材質で展開手段20を構成した場合、或いは、移動相の流速が遅くなる材質で展開手段20を構成した場合に応じて、検出試薬が十分に発色し得る最適な範囲を設定する。
【0049】
検体を試料導入部10にスポットした後、移動相が下流に流下するに従い、尿検体に含まれるエクオールが第一検出部21、第二検出部22を通過する。このとき、以下の一連の反応が起こる(図1〜3)。
【0050】
検体、および、エクオール結合物質cに標識bを結合させた標識結合体dを混合して液体試料を得る混合工程(i)を行なうと、検体中のエクオールaと標識結合体dとが免疫特異的に結合したエクオール複合体fが形成される(図1)。この状態で液体試料が流下して展開手段20の第一検出部21に到達する。エクオールaと結合しない過剰の標識結合体dは、フリーの状態で流下する。
【0051】
第一検出部21では、フリーの状態で流下した標識結合体dとエクオール様物質eとが免疫学的に結合する。このとき、当該標識結合体dは第一検出部21に捕捉される(第一反応工程(ii)、図2)。エクオール複合体fは、第一検出部21に捕捉されずに流下して第二検出部22に到達する。
【0052】
第二検出部22では、エクオール複合体fと捕捉物質gとが免疫学的に結合する。このとき、当該エクオール複合体fは第二検出部22に捕捉される(第二反応工程(iii)、図3)。また第一検出部21で補足できなかった標識結合体dも同時に第二検出部22にて捕捉される。
第一反応工程(ii)で第一検出部21に捕捉された標識結合体dの標識強度(A)、および、第二反応工程(iii)で第二検出部22に捕捉されたエクオール複合体fの標識強度(B)の比を算出することにより検体中のエクオールを定量する(定量工程(iv))。
【0053】
標識強度は、第一検出部21および第二検出部22の色変化を分光色差計等の装置を用いて読み取る他、目視によってある程度の強度を判定してもよい。
装置を用いて定量分析する場合には、検体を滴下した後、標識bの吸収波長における反射率の変化速度を測定する。算出された標識強度の比、および、既に作製してある検量線に基づいてエクオールを定量する。
一方、目視によって強度を判定する際には、標識によって第一検出部21および第二検出部22の位置で可視化されたバンド(図2(b)、図3(b))の濃淡を判別することでエクオールの定性を行なう。
【実施例】
【0054】
〔実施例1〕
本発明のエクオール定量定性デバイスXを使用して、既知濃度のエクオール標準溶液を用いて検量線を作成した。作成した検量線を元に算出したエクオール濃度がどの程度正確であるかを調べた。
【0055】
エクオール結合物質cとして抗エクオール抗体を使用し、当該抗エクオール抗体を金コロイドによって修飾することで標識結合体dを作製した。エクオール様物質eとしてエクオール−BSAコンジュゲートを作製し、捕捉物質gとして抗マウス抗体を使用した。以下に、詳細な定量の手順を説明する。
【0056】
抗エクオール抗体は、マウスをエクオール-KLHコンジュゲートによって免疫感作することにより作製する。当該エクオール-KLHコンジュゲートは、次のようにして作製した。
【0057】
まず、エクオール66mg(トロントリサーチケミカル社製、図9(a))、K2CO390mg、ベンジルブロモアセテート(benzylbromoacetate)を室温下で一昼夜置いた後、パラジウムカーボンと接触還元によりエステルの加水分解を行ない、これにより、カルボキシメチルエクオール(図9(b))が生成する。このカルボキシメチルエクオール20mg、EDC15mg、sulfo−NHS 21mgをDMF中で24時間反応させたのち、スカシ貝ヘモシアニン(Keyhole Limpet Hemocyanin、KLH)46mgの3mL PBS溶液と25℃で4時間反応させ、アミド結合によって結合したエクオール−KLHコンジュゲート(図9(c))を作製した。
上記と同様の手順でKLHの代わりにウシ血清アルブミン(BSA)を使うことでエクオール様物質eとしてエクオール−BSAコンジュゲートを作製した。
【0058】
エクオール-KLHコンジュゲート0.5mg/mL PBSを等量のアジュバンドとよく混和した後、0.15mLをマウスに腹腔内投与した。2週間ごとに2回追加免疫を行い、最終免疫を行った3日後に、当該マウスから脾臓を摘出し、ミエローマ細胞(P3U1)と融合させることでハイブリドーマを作出した。
これら細胞の融合は、脾臓細胞とミエローマ細胞を1:5で混合し、常法に従いPEGを用いて融合した。これをHAT培地で10〜14日間培養後ハイブリドーマを選択した。ハイブリドーマの細胞コロニーが形成されたウェルの培養上清で上述したELISA法によって上清の抗体価を測定し、抗体価の高い抗体を産生するハイブリドーマを限界希釈法により分離した。分離した融合細胞を10%DMEM培地で培養後、IgGカラムを用いて精製を行い、モノクローナル抗体(抗エクオール抗体)を得た。
【0059】
抗エクオール抗体に対して金コロイド(粒径40nm、BBI社製)を以下のようにして標識した。
10mLの金コロイド溶液(塩化金酸濃度として0.01%)を取り、100mM炭酸カリウムでpHを5.5に調整した。精製した抗エクオール抗体を2mMホウ酸ナトリウム溶液(pH9.2)で透析し、100μg/mLの濃度になるように調製した。pHを5.5に調整した金コロイド溶液に、最終濃度が10μg/mLとなる量の抗エクオール抗体を加え、金コロイドと抗エクオール抗体が十分結合されるように穏やかに撹拌した。5分後、10%BSAを1mL加え、穏やかに10分間撹拌した。全量を遠心(14000rpm、30分、4℃)した後、上清を廃棄し、沈殿している抗体結合金コロイド(標識結合体d)に、1%BSA、150mM塩化ナトリウムを含む10mMトリス塩酸緩衝液(pH8.5)1mLを加えて溶解させた。
【0060】
抗マウス抗体は、ウサギ由来抗マウスIgG抗体(キャペル社製)を使用した。
【0061】
マウスに投与したエクオール-BSAコンジュゲート1mg/mLを1cmにつき1μLとなるように展開手段20であるニトロセルロースメンブレン(日本ミリポア株式会社製)に塗布して乾燥(45℃、40分間)させ、第一検出部21とした。また、抗マウス抗体1mg/mLを1cmにつき1μLとなるようにニトロセルロースメンブレン20において第一検出部21の下流となる位置に塗布して乾燥させ、第二検出部22とした(図1)。
【0062】
金コロイド修飾済み抗エクオール抗体(標識結合体d)溶液(10mMトリス塩酸緩衝液(pH8.5))を試料導入部10に26μL塗布し、風乾した。また、エクオールa(シグマ社製)をリン酸バッファー(pH7.5)に溶解したエクオール標準溶液を、試料導入部10に100μL滴下して混合工程(i)を行ない、展開手段20に展開させた。当該エクオール標準溶液は、エクオールaの濃度を種々変更したサンプル1〜7を準備した。
エクオール標準溶液を展開手段20に展開させて第一反応工程(ii)および第二反応工程(iii)を順次行い、第一検出部21および第二検出部22における発色量をイムノメジャーPCB−SK100(アイシン精機株式会社製)にて測定した。
第一検出部21に捕捉された標識結合体dの標識強度(A)、および、第二検出部22に捕捉されエクオール複合体fの標識強度(B)を測定し、A/B比を算出した。結果を表1に示した。A/B比の結果に基づいて検量線を作成し(図4)、検量線から定量濃度を求めた(表1)。
【0063】
【表1】

【0064】
最小二乗法により上記結果をシグモイド曲線(d+((a-d)/(1+(x/c))^b))の式にあてはめ(a(上限)は1.705、b(IC50の傾き)は0.793、c(IC50濃度)は270.5、d(下限)は0.095)、検量線を得ることができた。
この検量線から定量濃度を求めた結果、定量濃度は、エクオール標準濃度と略一致し、検量線が有効であることが認められた。
【0065】
〔実施例2〕
実施例1のエクオール標準溶液は、溶媒としてリン酸バッファー(pH7.5)を使用した。本実施例では、当該リン酸バッファーに替えてヒト尿を使用すること以外は、実施例1と同様に行なった。
【0066】
尿は、大豆を一週間食していない状態で採取した。この尿99μLに対してエクオールを1μL加えたサンプル8〜14を準備し、それぞれの全量をエクオール定量定性デバイスXに展開し、発色量をイムノメジャーPCB−SK100にて測定し、前記検量線から定量濃度を算出した(表2)。サンプル8〜14ではエクオールaの濃度を種々変更した。
【0067】
【表2】

【0068】
検量線から定量濃度を求めた結果において、エクオール標準濃度と定量濃度との関係をグラフ化したものを図5に示した。
この結果、エクオール濃度が10nmol/L以上であれば、エクオール標準濃度と定量濃度とが略一致し、尿由来成分による阻害なく測定できることが認められた。
【0069】
例えば10〜1000nmol/Lのエクオール100μLを定量するためには、抗エクオール抗体(標識結合体d)が0.01〜5μg、エクオール-BSAコンジュゲート0.1〜5mg/mLが0.2〜5μL/cm2、抗マウス抗体が0.1〜5mg/mLが0.2〜5μL/cm2程度必要となる。
また、通常、成人の尿中には0.085〜1μmol/L以上のエクオールが含有される。そのため、混合工程aにおいて、抗エクオール抗体は例えば0.01〜5μg程度の量で検体と混合すれば、過剰な抗エクオール抗体を消費せずに検体中に含まれるエクオールを迅速に定量することができるため、各定量にかかるコストを抑えることができる。
【0070】
〔実施例3〕
本発明のエクオール定量定性デバイスXをオンサイトで簡便に使用するためには、エクオールが検出されたか否かを容易に目視できれば、熟練したオペレーターを必要とすることなく、簡便に使用できるデバイスとなる。本実施例では、上記実施例1,2と同様に発色量をイムノメジャーPCB−SK100にて測定し、前記検量線から濃度を算出するだけでなく、目視による判定を行なった。
【0071】
本実施例では、エクオール-BSAコンジュゲート0.2mg/mLの1cmにつき1μLを第一検出部21に固相化したこと以外は実施例2と同様に行った。エクオールaの濃度を種々変更したサンプル15〜21を準備し、それぞれの全量をエクオール定量定性デバイスXに展開して発色量をイムノメジャーPCB−SK100にて測定してA/B比を算出し(表3)、検量線(図6)を作成した。また、エクオールaの濃度を種々変更したサンプル22〜30を準備し、目視による確認の結果を示した(表4)。検量線は、上記結果をシグモイド曲線の式にあてはめて作成した(a(上限)は1.54、b(IC50の傾き)は0.59、c(IC50濃度)は1420.36、d(下限)は−0.90)。
【0072】
【表3】

【0073】
【表4】

【0074】
表4における「目視」欄は、第一検出部21を目視により標識の濃さを確認したものである。「+」は目視によって標識の色の確認が困難であって、競合型の抗原抗体反応では被検出物質(エクオール)が存在したことを示す。「−+」は目視によって標識の色の確認がやや困難であったことを示し、「−」は目視によって標識の色の確認が明確にでき、競合型の抗原抗体反応では被検出物質(エクオール)が存在したことを示している。
【0075】
この結果、エクオール濃度が100nmol/L以上であれば、目視判定が可能となることが示唆され、エクオール濃度が100nmol/L以上であれば、目視判定を確実に行なうことができるものと認められ、目視による定性判定が可能であると言えた。
【0076】
〔別実施の形態〕
上述した実施形態では、標識を直接標識(金コロイド)としてエクオールを定量する場合を例示した。しかし、これに限られるものではなく、標識を間接標識としてエクオールを定量することも可能である。以下に、間接標識としてアルカリフォスファターゼを使用した実施例について説明する(図7)。
【0077】
エクオール-BSAコンジュゲート(エクオール様物質e)1mg/mLの1cmにつき1mLを第一検出部21に固相化した。第二検出部22は、実施例1と同様に構成した。また、定法によってアルカリフォスファターゼを抗マウス抗体に結合させた標識結合体d’を作製した。
【0078】
抗エクオール抗体溶液(10mMトリス塩酸緩衝液(pH8.5))90μLと、エクオールa(シグマ社製)をリン酸バッファー(pH7.5)に溶解したエクオール標準溶液10μLとを混合(混合工程(i))して試料導入部10に滴下し、展開手段20に展開させた(第一反応工程(ii)、第二反応工程(iii))。当該エクオール標準溶液は、エクオールaの濃度を種々変更したサンプル31〜46を準備した。
【0079】
混合工程(i)では検体中のエクオールaと抗エクオール抗体(エクオール結合物質c)とが免疫学的に結合したエクオール複合体f’が形成される。
第一反応工程(ii)では、エクオール-BSAコンジュゲート(エクオール様物質e)とフリーの状態で流下した抗エクオール抗体とが免疫学的に結合し、抗エクオール抗体が第一検出部21に捕捉される。
第二反応工程(iii)ではエクオール複合体f’と抗マウス抗体(捕捉物質g)とが免疫学的に結合し、エクオール複合体f’が第二検出部22に捕捉される。
【0080】
15分後、アルカリフォスファターゼ修飾済抗マウス抗体(標識結合体d’)60μLを試料導入部10に滴下した(標識結合工程(v))。さらに15分後、アルカリフォスファターゼの発色基質であるBCIP/NBT(5-Bromo-4-Chloro-3'-Indolylphosphatase/nitro-blue tetrazolium chloride)(ロッシュ社製)60μLを試料導入部10に滴下した(呈色工程(vi))。
【0081】
標識結合工程(v)では、アルカリフォスファターゼ修飾済抗マウス抗体(標識結合体d’)が、第一検出部21に捕捉された抗エクオール抗体と結合し、第二検出部22に捕捉されたエクオール複合体f’と結合する。
呈色工程(vi)では、第一検出部21および第二検出部22に存在する標識結合体d’と発色基質とが反応して青紫色の色素を生成する。
【0082】
発色量をイムノメジャーPCB−SK100にて測定しA/B比を算出した(表5)。A/B比の結果に基づいて検量線を作成し(サンプルNo.31〜37、図8)、検量線から定量濃度を求めた。また、目視による確認の結果を示した(サンプルNo.38〜46、表6)。検量線は、上記結果をシグモイド曲線の式にあてはめて作成した(a(上限)は1.11、b(IC50の傾き)は0.28、c(IC50濃度)は0.18、d(下限)は−0.18)。
【0083】
【表5】

【0084】
【表6】

【0085】
この結果、標識を間接標識としてエクオールを定量する場合でも、目視判定を確実に行なうことができるものと認められた。
【産業上の利用可能性】
【0086】
本発明のエクオール定量定性デバイス、エクオール定量定性キットおよびエクオール定量方法は、エクオールの定量および定性に利用できる。
【符号の説明】
【0087】
X エクオール定量定性デバイス
10 試料導入部
20 展開手段
21 第一検出部
22 第二検出部
30 吸水部
40 基板
a エクオール
b 標識
c エクオール結合物質
d 標識結合体
e エクオール様物質
f エクオール複合体
g 捕捉物質
【技術分野】
【0001】
本発明は、エクオールを定量または定性するデバイス、キットおよび方法に関する。
【背景技術】
【0002】
エクオールは、腸内細菌(エクオール産生菌)によって生成され、その生成には個人差の存在することが知られている。例えば日本人のエクオール産生者の割合は約50%であることも報告されている(特許文献1)。
【0003】
このような個人差が生じる理由として、腸内フローラによるイソフラボノイド代謝系の違いが指摘されている(特許文献2)。イソフラボノイド代謝産物の中でもエクオールは、大豆等に含まれるイソフラボノイドの一種のダイゼイン(Daidzein)やホルモノネチン(Formononetin)を、所定の腸内フローラ、即ちエクオール産生菌の働きによって代謝することにより生成されると言われている。
【0004】
エクオールは、ダイゼイン等よりもはるかに高いエストロゲン様活性を有することが知られている。このようにエストロゲン様活性を有することで、エクオールは乳ガン・前立腺ガン・更年期障害・骨粗鬆症等に対する予防効果を有することが示唆されている。つまり、エクオールの産生能を高めることが、大豆イソフラボノイドを有効利用する上で重要となる。
【0005】
特許文献2には、イソフラボノイドを含む試料中におけるエクオールの有無を容易に検査できるエクオールの検査方法、及びエクオール産生菌の有無を容易に検査できるエクオール産生菌の検査方法が記載してある。
腸内で代謝されたイソフラボノイドの一部(エクオールを含む)は、腸管で吸収され、血液を介して尿中に排泄される。例えば、健康な成人では、イソフラボノイドを摂食してから数時間から40時間後にかけて尿中に前記イソフラボノイドが検出され、そのうちエクオール検出のピークは30〜40時間程度が一般的である。従って、イソフラボノイドを摂取した人の血液又は尿を検査することにより、その人の腸内フローラの構成、即ちエクオール産生菌の有無または何らかの機能によるエクオール産生能力を把握することが可能となる。
【0006】
上記検査方法は、具体的には、尿や胃腸内容物に由来する試料を順相TLCにて分析する工程が実施される。分析工程では、展開後のイソフラボノイドを可視化させる可視化手段を用いて、TLCプレート上の各イソフラボノイドを同定している。
【0007】
通常、血液、尿中及び胃腸内容物の培養物に含まれるイソフラボノイドには、ゲニステインが存在しているケースが多い。ゲニステインは、逆相TLCの担体上ではエクオールと同等の展開移動度にスポットが検出されるため、エクオールの検出に際しては大きなノイズとなる。これに対し、特許文献2に記載の検査方法では順相TLCを用いることにより、ゲニステインを含む主要なイソフラボノイドとエクオールとをTLCプレート上で差別化できるため、ノイズのないエクオールの検査を実施することが可能となっている。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特許第3864317号公報
【特許文献2】特開2006−242602号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
特許文献1には、エクオール産生乳酸菌含有組成物が開示してあるのみで、エクオールの定量については記載がない。
一方、特許文献2に記載の検査方法は、尿等に由来する試料に含有されるエクオールを測定する方法で、大豆代謝能の診断に有効である。しかし、TLC法は測定作業に溶媒や専用容器や、エクオールのスポットを識別する経験、特に両端と中央では移動度に差が生じるため湾曲した移動を計算しながら識別する等の高度な技術を必要とする。さらに、当該検査方法はエクオールのみを定量しているわけではないため、他の物質由来のシグナルも見分けるために標準物質のマーカーが必要となり、手軽に作業ができるとは言い難かった。
【0010】
従って、本発明の目的は、容易かつ簡便にエクオールのみの定量または定性を行なえるエクオール定量定性デバイス、エクオール定量定性キットおよびエクオール定量方法を提供することにある。
【課題を解決するための手段】
【0011】
即ち、上記目的を達成するため、以下の[1]〜[8]に示す発明を提供する。
[1] 検体中のエクオールを定量または定性するため、基板上に、
前記検体、および、エクオールと免疫特異的に結合するエクオール結合物質に標識を結合させた標識結合体を導入する試料導入部と、
前記検体および前記標識結合体を含んだ液体試料が通過でき、前記標識結合体と免疫特異的に結合するエクオール様物質を担持する第一検出部、および、前記エクオールおよび前記標識結合体が免疫特異的に結合して形成したエクオール複合体或いは前記第一検出部で前記エクオール様物質と反応しなかった前記標識結合体と結合する捕捉物質を担持する第二検出部をこの順に備えた展開手段と、
液体を吸収する吸水部と、を順次接触させて設けてあるエクオール定量定性デバイス。
[2] 前記エクオール様物質がエクオール−BSAコンジュゲートである上記[1]に記載のエクオール定量定性デバイス。
[3] 上記[1]又は[2]に記載のエクオール定量定性デバイスと、エクオール結合物質として抗エクオール抗体と、を備えたエクオール定量定性キット。
[4] 前記エクオール結合物質に直接標識を結合させた標識結合体を備えた上記[3]に記載のエクオール定量定性キット。
[5] 前記直接標識が金コロイド標識である上記[4]に記載のエクオール定量定性キット。
【0012】
上記[1]〜[5]の構成によれば、エクオール定量定性デバイスを、少なくとも試料導入部と展開手段とを接触させ、展開手段と吸水部とを接触させて構成できる。当該吸水部は展開手段の下流に設けるため、試料導入部から導入した液体試料を吸水部の側に移相させることができる。展開手段は、検体および標識結合体を含んだ液体試料が毛管現象で通過する公知の材料で構成できる。
【0013】
液体試料の移相に伴い、第一検出部に担持されたエクオール様物質により標識結合体を捕捉することができ、第二検出部に担持された捕捉物質によって、エクオール複合体或いは第一検出部でエクオール様物質と反応しなかった標識結合体を捕捉することができる。当該エクオール複合体は、エクオールおよび標識結合体が免疫特異的に結合して形成される。従って、第二検出部に捕捉されたエクオール複合体からの標識強度を測定することでエクオールを定量することができる。
【0014】
エクオール様物質がエクオール−BSAコンジュゲートであれば、エクオールを第一検出部に固相化するのが容易となり、未反応の標識結合体を特異的に捕捉することができる。さらに、エクオール結合物質が抗エクオール抗体であれば、第二検出部にてエクオールを特異的に捕捉することができる。これらより、エクオール定量の精度が向上する。
【0015】
エクオール結合物質および標識結合体は、例えば、エクオール定量定性デバイスとは別異の試薬の態様で定量に供して、エクオール定量定性キットの一部とすることができる。
【0016】
標識結合体が金コロイドのような直接標識であれば、定量または定性結果を目視で直接観察できるため、エクオール定量または定性をオンサイトで簡便に行なうことができる。
【0017】
以上より、本発明のエクオール定量定性デバイスおよびエクオール定量定性キットでは、簡便な構造でエクオールのみを免疫学的に容易に定量または定性することができる。よって、例えば尿を検体として本発明のエクオール定量定性デバイスおよびエクオール定量定性キットを使用することで、被験者がイソフラボノイドをエクオールに代謝する能力の有無を容易かつ簡便に診断することができる。
【0018】
[6] 検体、および、エクオールと免疫特異的に結合するエクオール結合物質に標識を結合させた標識結合体を混合して液体試料を得る混合工程を行なった後、当該液体試料を流下させて、
前記標識結合体と免疫特異的に結合するエクオール様物質と反応させる第一反応工程と、
前記エクオールおよび前記標識結合体が結合して形成したエクオール複合体或いは前記第一反応工程で前記エクオール様物質と反応しなかった前記標識結合体と免疫特異的に結合する捕捉物質と反応させる第二反応工程と、
前記第一反応工程および前記第二反応工程で得られた標識強度の比を算出することにより前記検体中のエクオールを定量する定量工程と、を行なうエクオール定量方法。
【0019】
上記[6]の方法では、以下の一連の反応が起こる。
検体、および、エクオール結合物質に標識を結合させた標識結合体を混合して液体試料を得る混合工程を行なうと、検体中のエクオールと標識結合体とが免疫特異的に結合したエクオール複合体が形成される。エクオールと結合しない過剰の標識結合体は、フリーの状態で流下する。フリーの状態で流下した標識結合体は、エクオール様物質と免疫特異的に結合する(第一反応工程)。一方、エクオール複合体或いは第一反応工程でエクオール様物質と反応しなかった標識結合体は、捕捉物質と免疫特異的に結合する(第二反応工程)。
第一反応工程でエクオール様物質に捕捉された標識結合体の標識強度、および、第二反応工程で捕捉物質に捕捉されたエクオール複合体の標識強度の比を算出することにより検体中のエクオールを定量または定性する(定量工程)。
このとき、第一反応工程でエクオール様物質に捕捉された標識結合体の標識強度、および、第二反応工程で捕捉物質に捕捉されたエクオール複合体の標識強度の何れか一方のみの標識強度でエクオールを定量または定性してもよい。
発色によって可視化される標識を使用した場合は、可視化されたバンドの濃淡を判別することでエクオールの定性を行なうことができる。
【0020】
従って、本方法によってエクオールのみを容易かつ簡便に定量または定性することができる。例えば尿を検体として本発明のエクオール定量方法を行なうことで、被験者がイソフラボノールをエクオールに代謝する能力の有無を容易かつ簡便に診断することができる。
【図面の簡単な説明】
【0021】
【図1】本発明のエクオール定量定性デバイスおよびエクオール定量定性キットを示す斜視図である。
【図2】第一検出部での反応を模式的に示す斜視図である。
【図3】第二検出部での反応を模式的に示す斜視図である。
【図4】実施例1で作成した検量線を示すグラフである。
【図5】エクオール標準濃度と定量濃度との関係を示すグラフである。
【図6】実施例3で作成した検量線を示すグラフである。
【図7】別実施形態のエクオール定量定性デバイスおよびエクオール定量定性キットを示す斜視図である。
【図8】別実施形態で作成した検量線を示すグラフである。
【図9】エクオール、カルボキシメチルエクオールおよびエクオール−BSAコンジュゲートの構造を示す図である。
【発明を実施するための形態】
【0022】
以下、本発明の実施形態を図面に基づいて説明する。
本発明のエクオール定量定性デバイスは、例えば単層の展開マトリクス(展開手段)に試薬を担持させた免疫クロマトグラフィーである。当該エクオール定量定性デバイスは、固定相である展開手段の表面あるいは内部を、被検出物質を含んだ移動相(液体など)が通過することで、検体中に含まれる被検出物質(エクオール)を定量または定性する。
本実施形態では検体はエクオールが含まれる(又はエクオールが含まれていない)尿検体を使用する。
【0023】
<エクオール定量定性デバイスおよびエクオール定量定性キット>
図1〜3に示したように、エクオール定量定性デバイスXは、検体中のエクオールaを定量または定性するため、基板40上に、検体、および、エクオールaと免疫特異的に結合するエクオール結合物質cに標識bを結合させた標識結合体dを導入する試料導入部10と、検体および標識結合体dを含んだ液体試料が通過でき、標識結合体dと免疫特異的に結合するエクオール様物質eを担持する第一検出部21、および、エクオールaおよび標識結合体dが免疫特異的に結合して形成したエクオール複合体f或いは第一検出部21でエクオール様物質eと反応しなかった標識結合体dと結合する捕捉物質gを担持する第二検出部22をこの順に備えた展開手段20と、液体を吸収する吸水部30と、を順次接触させて設けてある。
【0024】
(基板)
基板40は、試料導入部10・展開手段20・吸水部30を載置できるものであれば、どのような態様であってもよいが、ある程度の強度を有し、かつ吸水部30の吸水性を阻害しない材質を選択する必要がある。当該材質としては、例えば硬質塩化ビニル(PVC)が好適である。携行性を向上させるため、例えば95mm×30mm×5mm程度の大きさで薄板状に形成し、上基盤および下基盤を係合して、その内部に試料導入部10、展開手段20および吸水部30を封入するように構成するとよい。
当該基板40は、エクオール定量または定性の結果が視認できるよう例えば透明の部材で構成することができるが、これに限らず、当該結果を視認できる開口部を形成してもよい。
【0025】
(試料導入部)
試料導入部10は、検体を滴下する部位である。本実施形態では、グラスウールやニトロセルロースメンブレン等を例示するが、これに限るものではなく、毛管現象により下流側に移動相が流下する態様であればよい。
試料導入部10は単一のメンブレンで構成してもよい。しかし、試料導入部10はエクオールaおよび標識結合体dを導入する部位であることから、エクオールaを含む検体を滴下するメンブレンと、標識結合体dを滴下するメンブレンを別異に構成してもよい。
【0026】
(展開手段)
免疫クロマトグラフィー法とは、抗原抗体反応および毛管現象を利用した検査法である。そのため、展開手段20は、毛管現象により移動相(液体)・エクオールa・エクオール結合物質c・標識結合体d・エクオール複合体fなどの物質が流下する態様であればよい。例えば展開手段20は、ポアの直径が10〜200μm、厚さ100〜3000μmのニトロセルロースメンブレン・アセテート混ニトロセルロースメンブレン・ナイロンメンブレン・ポリエーテルスルホンメンブレン・ポリビニリデンジフルオライドメンブレンが好適に用いられ、特にニトロセルロースメンブレンが好ましい。当該ニトロセルロースメンブレンは、含水状態で透明または半透明となるため、標識強度を測定する妨げになり難い。
【0027】
当該展開手段20は、一方の端部を、試料導入部10の下流側と接触させるかオーバーラップさせるように配置し、他方の端部を、吸水部30の上流側と接触させるかオーバーラップさせるように配置する。このように配置することにより、試料導入部10に滴下した検体が、移動相と共に展開手段20を経て吸水部30の方向に流下することができる。
【0028】
展開手段20は、標識結合体dと免疫特異的に結合するエクオール様物質eを担持する第一検出部21、および、エクオールaおよび標識結合体dが免疫特異的に結合して形成したエクオール複合体f或いは第一検出部21でエクオール様物質eと反応しなかった標識結合体dと結合する捕捉物質gを担持する第二検出部22をこの順に備える。
【0029】
第一検出部21ではエクオール様物質eによって標識結合体dを捕捉することができ、第二検出部22では、捕捉物質gによって、エクオール複合体f或いは第一検出部21でエクオール様物質eと反応しなかった標識結合体dを捕捉することができる。
捕捉された標識結合体dおよびエクオール複合体fは標識化されているため、第一検出部21および第二検出部22の位置でバンドの態様で可視化することができ、エクオールの定量または定性が可能となる。
【0030】
(吸水部)
吸水部30は、隣接する展開手段20に存在する移動相である液体を吸水する。当該吸水部30が展開手段20の液体を吸水することで、検体導入部10に滴下した検体を、下流側に流下させることができる。
吸水部30は、例えば適当な大きさに切断した濾紙を、展開手段20の下流側に接触させるかオーバーラップさせるように配置する。
【0031】
(検体)
本明細書に記載の「検体」とは、定量または定性を行なうべき対象となる被検出物質を含む、或いは、含む可能性のある液体サンプルのことを指す。検体はどのような起源由来のものであってもよく、例えば細胞・培養物・組織・体液・尿・血清・血漿等のように、エクオールaを含有する可能性のある生検試料が検体として例示される。
【0032】
(エクオール結合物質)
エクオール結合物質cはエクオールaを認識し得る物質であり、エクオールaと親和性を有し、かつ選択的に結合し得る分子認識能を有する物質を意味する。エクオール結合物質cは、例えば、エクオール定量定性デバイスXとは別異の試薬の態様で定量に供する、或いは、エクオール定量定性デバイスXの例えば試料導入部10に予め担持させる等の態様で定量または定性に供することが可能である。当該試薬の態様で定量または定性に供する場合は、エクオール定量定性デバイスXおよび試薬により、エクオール定量定性キットを構成することができる。
【0033】
当該エクオール結合物質cは、例えばエクオールaと免疫特異的に結合する物質が例示される。
通常、「免疫化学的手法」は、例えば固相法によるイムノアッセイの手法を適用することにより液体試料中の被検出物質(エクオールa)の存在を検出あるいは定量的測定ができる。イムノアッセイとして公知の所謂「サンドイッチ法」では、例えば抗原のような標的となる被検出物質を、標識化抗体と固定化物質表面に固定化された抗体との間に挟むことにより特異的複合体を形成させ、被検出物質を捕捉することができる。
本発明の場合、検体に含まれるエクオールaは、エクオール結合物質cと結合して免疫複合体を形成することにより捕捉される。
【0034】
本実施形態では、エクオール結合物質cとして、抗エクオール抗体である場合を例示する。抗エクオール抗体は、エクオールに高い結合特異性を示し、ダイゼイン、ゲニステイン、O-デスメチルアンゴレンシンあるいは食品に含まれるポリフェノールなどの物質に交差反応性を極力有さないものが良い。抗エクオール抗体は、ポリクローナル抗体およびモノクローナル抗体の何れかを使用することができる。これら抗体は、以下のようにして作製することができる。
【0035】
使用する抗原は公知の方法に従って適当な溶液等に調製し、哺乳動物、例えばウサギやマウス等の動物に免疫を行えばよい。安定的な免疫を行ったり抗体価を高めるために抗原を適当なキャリアタンパク質とのコンジュゲートにして用いたり、アジュバント等を加えて免疫を行うのが好ましい。
免疫に際しての抗原の投与経路は特に限定されず、例えば皮下・腹腔内・静脈内あるいは筋肉内等のいずれの経路を用いてもよい。前記動物への抗原の投与は、例えば数日〜数週間おきに数回接種する方法が用いられるが、免疫する動物種によっては適宜調節される。免疫後、適宜試験的に採血を行って固相酵素免疫検定法(ELISA法)やウエスタンブロッティング等の方法で抗体価の上昇を確認し、十分に抗体価の上昇した動物から採血を行う。これに抗体の調製に用いられる適当な処理を行えばポリクローナル抗体を得ることができる。また、該動物の脾臓細胞とミエローマ細胞とを用いて公知の方法に従って融合させたハイブリドーマを用いることによりモノクローナル抗体を製造することもできる。モノクローナル抗体は、例えば以下の方法により取得することができる。
【0036】
まず、抗原の免疫により抗体価の高まった動物から抗体産生細胞を取得する。抗体産生細胞は、形質細胞及びその前駆細胞であるリンパ球であり、好ましくは脾臓・リンパ節・末梢血等から取得する。これらの細胞と融合させるミエローマとしては、一般的にはBALB/c等のマウスから得られた株化細胞が好ましく用いられる。細胞の融合は、抗体産生細胞とミエローマ細胞を適当な割合で混合し、適当な細胞融合培地、例えばRPMI1640やイスコフ改変ダルベッコ培地(IMDM)、あるいはダルベッコ改変イーグル培地(DMEM)等にポリエチレングリコール(PEG)を溶解したもの等を用いることにより行うことができる。また電気融合法によっても行うことができる。
ハイブリドーマは、ミエローマ細胞株が8−アザグアニン耐性株であることを利用して正常培地(HAT培地)中で適当時間培養することにより選択することができる。この選択方法は用いるミエローマ細胞株によって適宜変更することができる。選択されたハイブリドーマが産生する抗体の抗体価を解析し、抗体価の高い抗体を産生するハイブリドーマを限界希釈法等により分離し、分離した融合細胞を適当な培地で培養して得られる培養上清から硫安分画、アフィニティクロマトグラフィー等の適当な方法により精製してモノクローナル抗体を得ることができる。
【0037】
(標識結合体)
標識結合体dは、エクオールaと免疫特異的に結合するエクオール結合物質cに標識bを結合させたものである。
標識結合体dは、例えば、エクオール定量定性デバイスXとは別異の試薬の態様で定量または定性に供する、或いは、エクオール定量定性デバイスXの例えば試料導入部10に予め担持させる等の態様で定量または定性に供することが可能である。当該試薬の態様で定量または定性に供する場合は、エクオール定量定性デバイスXおよび試薬により、エクオール定量定性キットを構成することができる。
【0038】
標識bは、水・緩衝液等の検体溶解液に不溶性である粒子状物質であって、視覚によって検出可能な標識化物のことであり、直接標識または間接標識の何れを使用してもよい。
【0039】
直接標識とは直接観察できる標識であり、色調観察や発光や蛍光の強度等を測定することにより標識の存在を検出することができる標識をいう。直接標識に用いることができる標識物としては、金属ゾル・非金属ゾル・着色ラテックス粒子・着色リボゾーム・各種染料・各種顔料等の色素類・ルミノール誘導体・アクリジニウムエステル等の化学発光物質類・フルオレセイン・ローダミン等の蛍光物質類が挙げられる。
直接標識は、更なる工程を要さず判定結果を目視で観察することができる有色又は着色粒子による標識が好ましい。有色又は着色粒子としては金・銀・白金・プラチナ・銅のような金属コロイド、酸化鉄のような金属酸化物コロイド、硫黄・セレン等の非金属コロイド、顔料粒子・ラテックス粒子を染色したもの、リポソーム等が挙げられる。直接標識として特に金コロイドや着色ラテックスが、標識強度の視認性に優れ、かつ簡便に使用できるため、好ましい。有色又は着色粒子が毛管現象により展開手段20の多孔性物質中を移動するためには標識の粒子径が展開手段20のポアサイズより小さい必要がある。そのため、直接標識の平均粒径は1μm以下が好ましく、0.005〜1μm程度とすることが好ましい。
【0040】
間接標識としては、ペルオキシダーゼ・β−ガラクトシダーゼ・アルカリフォスファターゼ・グルコースオキシダーゼ等の酵素等が挙げられ、標識を視覚化するための工程を施すことによって標識の存在を検出することができる。
【0041】
例えば標識した抗体を使用した場合における免疫反応の結果、生成する特異的複合体中の被検出物質の量に応じて標識物質が存在することになる。未反応物を除去した後、標識物質の量を測定することで「被検出物質」を定量することができる。標識物質の定量は、標識物質の種類と共に種々の方法をとりうる。例えば、蛍光測定装置により蛍光物質の蛍光強度を測定する。測定された標識強度を、既知量の「被検出物質」を測定した場合の標識強度と比較することにより、液体試料中の被検出物質量を決定できる。
【0042】
(エクオール様物質)
エクオール様物質eは、標識結合体dと免疫特異的に結合する物質である。
上述したように、当該標識結合体dはエクオールaと免疫特異的に結合するエクオール結合物質cに標識を結合させたものであるため、エクオール様物質eは、エクオール結合物質cを認識し得る物質であり、エクオール結合物質cと親和性を有し、かつ選択的に結合し得る分子認識能を有する物質を意味する。
エクオール結合物質cが抗エクオール抗体である場合、当該エクオール様物質eは、エクオールa或いはエクオールaに構造が類似する物質とすることができる。即ち、エクオール様物質eがエクオールaに構造が類似する物質である場合は、当該物質は模擬抗原となる。
【0043】
本実施形態では、エクオール様物質eがエクオール−BSAコンジュゲート(図9(c))である場合を例示する。当該コンジュゲートは、エクオールをカルボキシメチル化しBSAを結合させたものである。エクオールは、BSAの59個のリシンにおける1〜複数箇所とアミド結合している。
エクオール−BSAコンジュゲートの態様とすることにより、エクオールaを容易に展開手段20上に固相化することができると共に、固相化したエクオールaが標識結合体dと結合して、当該標識結合体dを展開手段20上で捕捉することができる(図2)。この標識結合体dには標識bが結合しているため、この標識bを可視化することで、捕捉された標識結合体dを定量または定性することができる。
【0044】
しかし、エクオール様物質eはこれに限られるものではなく、標識結合体dと免疫特異的に結合する構造であれば、エクオールaと結合させる側鎖の構造は置換可能である。当該側鎖はBSAの他、例えばKLH(hemocyanin)、OVA(ovalbumin)、カゼイン、ポリエチレングリコール、ゼラチンなどが適用できる。また展開手段20に直接化学結合させても良い。
【0045】
(捕捉物質)
捕捉物質gは、エクオールaおよび標識結合体dが免疫特異的に結合して形成したエクオール複合体fと結合する物質である。捕捉物質gは、標識結合体dを認識する物質であり、エクオール結合物質cがエクオールと結合の有無を問わずエクオール複合体fおよび標識結合体dを認識し得る物質であり、エクオール複合体fおよび標識結合体dと親和性を有し、かつ選択的に結合し得る分子認識能を有する物質を意味する。
上述したように、標識結合体はエクオール結合物質に標識を結合させたものであるため、エクオール複合体は、エクオール・エクオール結合物質・標識で構成される。よって、捕捉物質は、エクオール複合体の状態で、例えばエクオール或いはエクオール結合物質に対して結合する物質を例示することができる。
本実施形態の捕捉物質gは、エクオール複合体fおよび第一検出部21でエクオール様物質eと反応しなかった標識結合体dと免疫特異的に結合するように作製した抗マウス抗体を例示する。
【0046】
<エクオール定量方法>
エクオール定量の際には、試料導入部10にエクオールを含んだ検体を添加し、当該検体を展開手段20に毛細管現象により展開させ、例えば競合型の抗原抗体反応(競合法)をサンドイッチ型の抗原抗体反応(サンドイッチ法)を利用して反応部位を発色させることにより、抗原の同定、存在の有無、または抗原量を測定する。
抗原抗体反応の形態は競合法、サンドイッチ型の抗原抗体反応(サンドイッチ法)の何れを利用してもよい。例えば、被検出物質の分子量が大きい場合にサンドイッチ法を利用し、被検出物質の分子量が小さい場合に競合法を利用する。
【0047】
具体的には、本発明のエクオール定量方法は、まず、検体、および、エクオールaと免疫特異的に結合するエクオール結合物質cに標識bを結合させた標識結合体dを混合して液体試料を得る混合工程(i)を行なう。その後、当該液体試料を流下させて、標識結合体dと免疫特異的に結合するエクオール様物質eと反応させる第一反応工程(ii)と、エクオールaおよび標識結合体dが結合して形成したエクオール複合体f或いは第一反応工程でエクオール様物質eと反応しなかった標識結合体dと免疫特異的に結合する捕捉物質gと反応させる第二反応工程(iii)と、を行なう。そして、第一反応工程および前記第二反応工程で得られた標識強度の比を算出することにより検体中のエクオールを定量する定量工程(iv)と、を行なう。
【0048】
エクオール産生者の場合、通常、成人の尿中には0.085〜1μmol/L以上のエクオールが含有される。そのため、混合工程(i)において、抗エクオール抗体は例えば0.01〜5μg程度で検体と混合すれば、過剰な抗エクオール抗体を消費せずに検体中に含まれるエクオールを迅速に定量することができるため、各定量にかかるコストを抑えることができる。
抗エクオール抗体の必要量の範囲は、展開手段20の材質、移動相の流速等を考慮して、適宜設定する。例えば、移動相の流速が早くなる材質で展開手段20を構成した場合、或いは、移動相の流速が遅くなる材質で展開手段20を構成した場合に応じて、検出試薬が十分に発色し得る最適な範囲を設定する。
【0049】
検体を試料導入部10にスポットした後、移動相が下流に流下するに従い、尿検体に含まれるエクオールが第一検出部21、第二検出部22を通過する。このとき、以下の一連の反応が起こる(図1〜3)。
【0050】
検体、および、エクオール結合物質cに標識bを結合させた標識結合体dを混合して液体試料を得る混合工程(i)を行なうと、検体中のエクオールaと標識結合体dとが免疫特異的に結合したエクオール複合体fが形成される(図1)。この状態で液体試料が流下して展開手段20の第一検出部21に到達する。エクオールaと結合しない過剰の標識結合体dは、フリーの状態で流下する。
【0051】
第一検出部21では、フリーの状態で流下した標識結合体dとエクオール様物質eとが免疫学的に結合する。このとき、当該標識結合体dは第一検出部21に捕捉される(第一反応工程(ii)、図2)。エクオール複合体fは、第一検出部21に捕捉されずに流下して第二検出部22に到達する。
【0052】
第二検出部22では、エクオール複合体fと捕捉物質gとが免疫学的に結合する。このとき、当該エクオール複合体fは第二検出部22に捕捉される(第二反応工程(iii)、図3)。また第一検出部21で補足できなかった標識結合体dも同時に第二検出部22にて捕捉される。
第一反応工程(ii)で第一検出部21に捕捉された標識結合体dの標識強度(A)、および、第二反応工程(iii)で第二検出部22に捕捉されたエクオール複合体fの標識強度(B)の比を算出することにより検体中のエクオールを定量する(定量工程(iv))。
【0053】
標識強度は、第一検出部21および第二検出部22の色変化を分光色差計等の装置を用いて読み取る他、目視によってある程度の強度を判定してもよい。
装置を用いて定量分析する場合には、検体を滴下した後、標識bの吸収波長における反射率の変化速度を測定する。算出された標識強度の比、および、既に作製してある検量線に基づいてエクオールを定量する。
一方、目視によって強度を判定する際には、標識によって第一検出部21および第二検出部22の位置で可視化されたバンド(図2(b)、図3(b))の濃淡を判別することでエクオールの定性を行なう。
【実施例】
【0054】
〔実施例1〕
本発明のエクオール定量定性デバイスXを使用して、既知濃度のエクオール標準溶液を用いて検量線を作成した。作成した検量線を元に算出したエクオール濃度がどの程度正確であるかを調べた。
【0055】
エクオール結合物質cとして抗エクオール抗体を使用し、当該抗エクオール抗体を金コロイドによって修飾することで標識結合体dを作製した。エクオール様物質eとしてエクオール−BSAコンジュゲートを作製し、捕捉物質gとして抗マウス抗体を使用した。以下に、詳細な定量の手順を説明する。
【0056】
抗エクオール抗体は、マウスをエクオール-KLHコンジュゲートによって免疫感作することにより作製する。当該エクオール-KLHコンジュゲートは、次のようにして作製した。
【0057】
まず、エクオール66mg(トロントリサーチケミカル社製、図9(a))、K2CO390mg、ベンジルブロモアセテート(benzylbromoacetate)を室温下で一昼夜置いた後、パラジウムカーボンと接触還元によりエステルの加水分解を行ない、これにより、カルボキシメチルエクオール(図9(b))が生成する。このカルボキシメチルエクオール20mg、EDC15mg、sulfo−NHS 21mgをDMF中で24時間反応させたのち、スカシ貝ヘモシアニン(Keyhole Limpet Hemocyanin、KLH)46mgの3mL PBS溶液と25℃で4時間反応させ、アミド結合によって結合したエクオール−KLHコンジュゲート(図9(c))を作製した。
上記と同様の手順でKLHの代わりにウシ血清アルブミン(BSA)を使うことでエクオール様物質eとしてエクオール−BSAコンジュゲートを作製した。
【0058】
エクオール-KLHコンジュゲート0.5mg/mL PBSを等量のアジュバンドとよく混和した後、0.15mLをマウスに腹腔内投与した。2週間ごとに2回追加免疫を行い、最終免疫を行った3日後に、当該マウスから脾臓を摘出し、ミエローマ細胞(P3U1)と融合させることでハイブリドーマを作出した。
これら細胞の融合は、脾臓細胞とミエローマ細胞を1:5で混合し、常法に従いPEGを用いて融合した。これをHAT培地で10〜14日間培養後ハイブリドーマを選択した。ハイブリドーマの細胞コロニーが形成されたウェルの培養上清で上述したELISA法によって上清の抗体価を測定し、抗体価の高い抗体を産生するハイブリドーマを限界希釈法により分離した。分離した融合細胞を10%DMEM培地で培養後、IgGカラムを用いて精製を行い、モノクローナル抗体(抗エクオール抗体)を得た。
【0059】
抗エクオール抗体に対して金コロイド(粒径40nm、BBI社製)を以下のようにして標識した。
10mLの金コロイド溶液(塩化金酸濃度として0.01%)を取り、100mM炭酸カリウムでpHを5.5に調整した。精製した抗エクオール抗体を2mMホウ酸ナトリウム溶液(pH9.2)で透析し、100μg/mLの濃度になるように調製した。pHを5.5に調整した金コロイド溶液に、最終濃度が10μg/mLとなる量の抗エクオール抗体を加え、金コロイドと抗エクオール抗体が十分結合されるように穏やかに撹拌した。5分後、10%BSAを1mL加え、穏やかに10分間撹拌した。全量を遠心(14000rpm、30分、4℃)した後、上清を廃棄し、沈殿している抗体結合金コロイド(標識結合体d)に、1%BSA、150mM塩化ナトリウムを含む10mMトリス塩酸緩衝液(pH8.5)1mLを加えて溶解させた。
【0060】
抗マウス抗体は、ウサギ由来抗マウスIgG抗体(キャペル社製)を使用した。
【0061】
マウスに投与したエクオール-BSAコンジュゲート1mg/mLを1cmにつき1μLとなるように展開手段20であるニトロセルロースメンブレン(日本ミリポア株式会社製)に塗布して乾燥(45℃、40分間)させ、第一検出部21とした。また、抗マウス抗体1mg/mLを1cmにつき1μLとなるようにニトロセルロースメンブレン20において第一検出部21の下流となる位置に塗布して乾燥させ、第二検出部22とした(図1)。
【0062】
金コロイド修飾済み抗エクオール抗体(標識結合体d)溶液(10mMトリス塩酸緩衝液(pH8.5))を試料導入部10に26μL塗布し、風乾した。また、エクオールa(シグマ社製)をリン酸バッファー(pH7.5)に溶解したエクオール標準溶液を、試料導入部10に100μL滴下して混合工程(i)を行ない、展開手段20に展開させた。当該エクオール標準溶液は、エクオールaの濃度を種々変更したサンプル1〜7を準備した。
エクオール標準溶液を展開手段20に展開させて第一反応工程(ii)および第二反応工程(iii)を順次行い、第一検出部21および第二検出部22における発色量をイムノメジャーPCB−SK100(アイシン精機株式会社製)にて測定した。
第一検出部21に捕捉された標識結合体dの標識強度(A)、および、第二検出部22に捕捉されエクオール複合体fの標識強度(B)を測定し、A/B比を算出した。結果を表1に示した。A/B比の結果に基づいて検量線を作成し(図4)、検量線から定量濃度を求めた(表1)。
【0063】
【表1】

【0064】
最小二乗法により上記結果をシグモイド曲線(d+((a-d)/(1+(x/c))^b))の式にあてはめ(a(上限)は1.705、b(IC50の傾き)は0.793、c(IC50濃度)は270.5、d(下限)は0.095)、検量線を得ることができた。
この検量線から定量濃度を求めた結果、定量濃度は、エクオール標準濃度と略一致し、検量線が有効であることが認められた。
【0065】
〔実施例2〕
実施例1のエクオール標準溶液は、溶媒としてリン酸バッファー(pH7.5)を使用した。本実施例では、当該リン酸バッファーに替えてヒト尿を使用すること以外は、実施例1と同様に行なった。
【0066】
尿は、大豆を一週間食していない状態で採取した。この尿99μLに対してエクオールを1μL加えたサンプル8〜14を準備し、それぞれの全量をエクオール定量定性デバイスXに展開し、発色量をイムノメジャーPCB−SK100にて測定し、前記検量線から定量濃度を算出した(表2)。サンプル8〜14ではエクオールaの濃度を種々変更した。
【0067】
【表2】

【0068】
検量線から定量濃度を求めた結果において、エクオール標準濃度と定量濃度との関係をグラフ化したものを図5に示した。
この結果、エクオール濃度が10nmol/L以上であれば、エクオール標準濃度と定量濃度とが略一致し、尿由来成分による阻害なく測定できることが認められた。
【0069】
例えば10〜1000nmol/Lのエクオール100μLを定量するためには、抗エクオール抗体(標識結合体d)が0.01〜5μg、エクオール-BSAコンジュゲート0.1〜5mg/mLが0.2〜5μL/cm2、抗マウス抗体が0.1〜5mg/mLが0.2〜5μL/cm2程度必要となる。
また、通常、成人の尿中には0.085〜1μmol/L以上のエクオールが含有される。そのため、混合工程aにおいて、抗エクオール抗体は例えば0.01〜5μg程度の量で検体と混合すれば、過剰な抗エクオール抗体を消費せずに検体中に含まれるエクオールを迅速に定量することができるため、各定量にかかるコストを抑えることができる。
【0070】
〔実施例3〕
本発明のエクオール定量定性デバイスXをオンサイトで簡便に使用するためには、エクオールが検出されたか否かを容易に目視できれば、熟練したオペレーターを必要とすることなく、簡便に使用できるデバイスとなる。本実施例では、上記実施例1,2と同様に発色量をイムノメジャーPCB−SK100にて測定し、前記検量線から濃度を算出するだけでなく、目視による判定を行なった。
【0071】
本実施例では、エクオール-BSAコンジュゲート0.2mg/mLの1cmにつき1μLを第一検出部21に固相化したこと以外は実施例2と同様に行った。エクオールaの濃度を種々変更したサンプル15〜21を準備し、それぞれの全量をエクオール定量定性デバイスXに展開して発色量をイムノメジャーPCB−SK100にて測定してA/B比を算出し(表3)、検量線(図6)を作成した。また、エクオールaの濃度を種々変更したサンプル22〜30を準備し、目視による確認の結果を示した(表4)。検量線は、上記結果をシグモイド曲線の式にあてはめて作成した(a(上限)は1.54、b(IC50の傾き)は0.59、c(IC50濃度)は1420.36、d(下限)は−0.90)。
【0072】
【表3】

【0073】
【表4】

【0074】
表4における「目視」欄は、第一検出部21を目視により標識の濃さを確認したものである。「+」は目視によって標識の色の確認が困難であって、競合型の抗原抗体反応では被検出物質(エクオール)が存在したことを示す。「−+」は目視によって標識の色の確認がやや困難であったことを示し、「−」は目視によって標識の色の確認が明確にでき、競合型の抗原抗体反応では被検出物質(エクオール)が存在したことを示している。
【0075】
この結果、エクオール濃度が100nmol/L以上であれば、目視判定が可能となることが示唆され、エクオール濃度が100nmol/L以上であれば、目視判定を確実に行なうことができるものと認められ、目視による定性判定が可能であると言えた。
【0076】
〔別実施の形態〕
上述した実施形態では、標識を直接標識(金コロイド)としてエクオールを定量する場合を例示した。しかし、これに限られるものではなく、標識を間接標識としてエクオールを定量することも可能である。以下に、間接標識としてアルカリフォスファターゼを使用した実施例について説明する(図7)。
【0077】
エクオール-BSAコンジュゲート(エクオール様物質e)1mg/mLの1cmにつき1mLを第一検出部21に固相化した。第二検出部22は、実施例1と同様に構成した。また、定法によってアルカリフォスファターゼを抗マウス抗体に結合させた標識結合体d’を作製した。
【0078】
抗エクオール抗体溶液(10mMトリス塩酸緩衝液(pH8.5))90μLと、エクオールa(シグマ社製)をリン酸バッファー(pH7.5)に溶解したエクオール標準溶液10μLとを混合(混合工程(i))して試料導入部10に滴下し、展開手段20に展開させた(第一反応工程(ii)、第二反応工程(iii))。当該エクオール標準溶液は、エクオールaの濃度を種々変更したサンプル31〜46を準備した。
【0079】
混合工程(i)では検体中のエクオールaと抗エクオール抗体(エクオール結合物質c)とが免疫学的に結合したエクオール複合体f’が形成される。
第一反応工程(ii)では、エクオール-BSAコンジュゲート(エクオール様物質e)とフリーの状態で流下した抗エクオール抗体とが免疫学的に結合し、抗エクオール抗体が第一検出部21に捕捉される。
第二反応工程(iii)ではエクオール複合体f’と抗マウス抗体(捕捉物質g)とが免疫学的に結合し、エクオール複合体f’が第二検出部22に捕捉される。
【0080】
15分後、アルカリフォスファターゼ修飾済抗マウス抗体(標識結合体d’)60μLを試料導入部10に滴下した(標識結合工程(v))。さらに15分後、アルカリフォスファターゼの発色基質であるBCIP/NBT(5-Bromo-4-Chloro-3'-Indolylphosphatase/nitro-blue tetrazolium chloride)(ロッシュ社製)60μLを試料導入部10に滴下した(呈色工程(vi))。
【0081】
標識結合工程(v)では、アルカリフォスファターゼ修飾済抗マウス抗体(標識結合体d’)が、第一検出部21に捕捉された抗エクオール抗体と結合し、第二検出部22に捕捉されたエクオール複合体f’と結合する。
呈色工程(vi)では、第一検出部21および第二検出部22に存在する標識結合体d’と発色基質とが反応して青紫色の色素を生成する。
【0082】
発色量をイムノメジャーPCB−SK100にて測定しA/B比を算出した(表5)。A/B比の結果に基づいて検量線を作成し(サンプルNo.31〜37、図8)、検量線から定量濃度を求めた。また、目視による確認の結果を示した(サンプルNo.38〜46、表6)。検量線は、上記結果をシグモイド曲線の式にあてはめて作成した(a(上限)は1.11、b(IC50の傾き)は0.28、c(IC50濃度)は0.18、d(下限)は−0.18)。
【0083】
【表5】

【0084】
【表6】

【0085】
この結果、標識を間接標識としてエクオールを定量する場合でも、目視判定を確実に行なうことができるものと認められた。
【産業上の利用可能性】
【0086】
本発明のエクオール定量定性デバイス、エクオール定量定性キットおよびエクオール定量方法は、エクオールの定量および定性に利用できる。
【符号の説明】
【0087】
X エクオール定量定性デバイス
10 試料導入部
20 展開手段
21 第一検出部
22 第二検出部
30 吸水部
40 基板
a エクオール
b 標識
c エクオール結合物質
d 標識結合体
e エクオール様物質
f エクオール複合体
g 捕捉物質
【特許請求の範囲】
【請求項1】
検体中のエクオールを定量または定性するため、基板上に、
前記検体、および、エクオールと免疫特異的に結合するエクオール結合物質に標識を結合させた標識結合体を導入する試料導入部と、
前記検体および前記標識結合体を含んだ液体試料が通過でき、前記標識結合体と免疫特異的に結合するエクオール様物質を担持する第一検出部、および、前記エクオールおよび前記標識結合体が免疫特異的に結合して形成したエクオール複合体或いは前記第一検出部で前記エクオール様物質と反応しなかった前記標識結合体と結合する捕捉物質を担持する第二検出部をこの順に備えた展開手段と、
液体を吸収する吸水部と、を順次接触させて設けてあるエクオール定量定性デバイス。
【請求項2】
前記エクオール様物質がエクオール−BSAコンジュゲートである請求項1に記載のエクオール定量定性デバイス。
【請求項3】
請求項1又は2に記載のエクオール定量定性デバイスと、エクオール結合物質として抗エクオール抗体と、を備えたエクオール定量定性キット。
【請求項4】
前記エクオール結合物質に直接標識を結合させた標識結合体を備えた請求項3に記載のエクオール定量定性キット。
【請求項5】
前記直接標識が金コロイド標識である請求項4に記載のエクオール定量定性キット。
【請求項6】
検体、および、エクオールと免疫特異的に結合するエクオール結合物質に標識を結合させた標識結合体を混合して液体試料を得る混合工程を行なった後、当該液体試料を流下させて、
前記標識結合体と免疫特異的に結合するエクオール様物質と反応させる第一反応工程と、
前記エクオールおよび前記標識結合体が結合して形成したエクオール複合体或いは前記第一反応工程で前記エクオール様物質と反応しなかった前記標識結合体と免疫特異的に結合する捕捉物質と反応させる第二反応工程と、
前記第一反応工程および前記第二反応工程で得られた標識強度の比を算出することにより前記検体中のエクオールを定量する定量工程と、を行なうエクオール定量方法。
【請求項1】
検体中のエクオールを定量または定性するため、基板上に、
前記検体、および、エクオールと免疫特異的に結合するエクオール結合物質に標識を結合させた標識結合体を導入する試料導入部と、
前記検体および前記標識結合体を含んだ液体試料が通過でき、前記標識結合体と免疫特異的に結合するエクオール様物質を担持する第一検出部、および、前記エクオールおよび前記標識結合体が免疫特異的に結合して形成したエクオール複合体或いは前記第一検出部で前記エクオール様物質と反応しなかった前記標識結合体と結合する捕捉物質を担持する第二検出部をこの順に備えた展開手段と、
液体を吸収する吸水部と、を順次接触させて設けてあるエクオール定量定性デバイス。
【請求項2】
前記エクオール様物質がエクオール−BSAコンジュゲートである請求項1に記載のエクオール定量定性デバイス。
【請求項3】
請求項1又は2に記載のエクオール定量定性デバイスと、エクオール結合物質として抗エクオール抗体と、を備えたエクオール定量定性キット。
【請求項4】
前記エクオール結合物質に直接標識を結合させた標識結合体を備えた請求項3に記載のエクオール定量定性キット。
【請求項5】
前記直接標識が金コロイド標識である請求項4に記載のエクオール定量定性キット。
【請求項6】
検体、および、エクオールと免疫特異的に結合するエクオール結合物質に標識を結合させた標識結合体を混合して液体試料を得る混合工程を行なった後、当該液体試料を流下させて、
前記標識結合体と免疫特異的に結合するエクオール様物質と反応させる第一反応工程と、
前記エクオールおよび前記標識結合体が結合して形成したエクオール複合体或いは前記第一反応工程で前記エクオール様物質と反応しなかった前記標識結合体と免疫特異的に結合する捕捉物質と反応させる第二反応工程と、
前記第一反応工程および前記第二反応工程で得られた標識強度の比を算出することにより前記検体中のエクオールを定量する定量工程と、を行なうエクオール定量方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2011−106886(P2011−106886A)
【公開日】平成23年6月2日(2011.6.2)
【国際特許分類】
【出願番号】特願2009−260360(P2009−260360)
【出願日】平成21年11月13日(2009.11.13)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 掲載年月日 平成21年9月18日(Available online 18 Sep.2009) 掲載アドレス 〔アブストラクト〕 http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B8JGN−4X83JY6−1&_user=10&_coverDate=09%2F18%2F2009&_alid=1053482376&_rdoc=2&_fmt=high&_orig=search&_cdi=43675&_sort=r&_docanchor=&view=c&_ct=19&_acct=C000050221&_version=1&_urlVersion=0&_userid=10&md5=b6e7cc0453097c18afeb82312dd4ee49 〔論文〕 上記アブストラクト掲載ページにおける「Purchase the full−text article」ボタンのリンク先である、http://www.sciencedirect.com/science?_ob=MImg&_imagekey=B8JGN−4X83JY6−1−5&_cdi=43675&_user=10&_orig=search&_coverDate=11%2F19%2F2009&_sk=999979995&view=c&wchp=dGLzVlz−zSkzV&md5=4788c9054959c19bafed00c32d2d93df&ie=/sdarticle.pdfのページにおいて「User Name」及び「Password」を入力し、「Submit」ボタンをクリックして表示されるページ
【出願人】(000000011)アイシン精機株式会社 (5,421)
【出願人】(509152079)株式会社ヘルスケアシステムズ (7)
【公開日】平成23年6月2日(2011.6.2)
【国際特許分類】
【出願日】平成21年11月13日(2009.11.13)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 掲載年月日 平成21年9月18日(Available online 18 Sep.2009) 掲載アドレス 〔アブストラクト〕 http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B8JGN−4X83JY6−1&_user=10&_coverDate=09%2F18%2F2009&_alid=1053482376&_rdoc=2&_fmt=high&_orig=search&_cdi=43675&_sort=r&_docanchor=&view=c&_ct=19&_acct=C000050221&_version=1&_urlVersion=0&_userid=10&md5=b6e7cc0453097c18afeb82312dd4ee49 〔論文〕 上記アブストラクト掲載ページにおける「Purchase the full−text article」ボタンのリンク先である、http://www.sciencedirect.com/science?_ob=MImg&_imagekey=B8JGN−4X83JY6−1−5&_cdi=43675&_user=10&_orig=search&_coverDate=11%2F19%2F2009&_sk=999979995&view=c&wchp=dGLzVlz−zSkzV&md5=4788c9054959c19bafed00c32d2d93df&ie=/sdarticle.pdfのページにおいて「User Name」及び「Password」を入力し、「Submit」ボタンをクリックして表示されるページ
【出願人】(000000011)アイシン精機株式会社 (5,421)
【出願人】(509152079)株式会社ヘルスケアシステムズ (7)
[ Back to top ]

