エステル類の製造方法
本発明は、合成ピレスロイド殺虫剤の製造方法に関する。

{R1、R2、R3及びArは、明細書で規定された通りである}
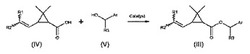
本方法は、触媒の存在下で、カルボン酸(IV)とアルコール(V)をカップリングする工程を伴う。

{R1、R2、R3及びArは、明細書で規定された通りである}
本方法は、触媒の存在下で、カルボン酸(IV)とアルコール(V)をカップリングする工程を伴う。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、殺虫剤として有用な特定のピレスロイド化合物の製造方法、並びにそのような化合物の合成に有用な中間体の製造方法に関する。
【背景技術】
【0002】
式(I):
【化1】

{式中、R1及びR2の一方は、式:W−(CF2)m−(式中、Wは、水素、フッ素又は塩素の原子を表し、mは、1又は2の値を有する)の基を表し、そしてR1及びR2の他方は、フッ素、塩素又は臭素の原子を表し、そしてR3は、水素の原子又はシアノ若しくはエチニル基を表す}
の合成ピレスロイド殺虫剤が、英国特許第2000764号明細書に開示されている。
【0003】
式(II):
【化2】

{式中、R1及びR2は、それぞれメチル、ハロメチル、及びハロから選択され;Xは、酸素、硫黄、スルホニル又は基NR4(式中、R4は、水素、低級アルキル又は低級カルボン酸アシルを表す)であり;R3は、低級アルキル、低級アルケニル又はベンジルであり;mは、0〜1の値であり、そしてnは、1〜4の値を有する}
の合成ピレスロイド殺虫剤が、米国特許第4405640号明細書に開示されている。
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、これらの及び他のピレスロイド類の製造方法を提供することを課題とする。
【課題を解決するための手段】
【0005】
驚くべきことに、後述するように、触媒の存在下で、対応するアルコール及びカルボン酸をカップリングすることにより、これらの化合物が有利に得られることが今では分かっている。
【0006】
本発明は、ジルコニウム含有触媒、ハフニウム含有触媒、鉄含有触媒、コバルト含有触媒、スズ含有触媒、チタン含有触媒、アンモニウム塩触媒及びボロン酸含有触媒から選択される触媒の存在下で、式(IV):
【化3】

のカルボン酸に式(V):
【化4】

のアルコールを反応させる工程を含む、式(III):
【化5】

{式中、
R1は、水素、アルキル、ハロアルキル、又はハロゲンであり;
R2は、水素、アルキル、ハロアルキル、又はハロゲンであり;
R3は、水素、ハロゲン、ヒドロキシル、ニトロ、シアノ、所望により置換されているアルキル、所望により置換されているアルケニル、又は所望により置換されているアルキニルであり;
Arは、所望により置換されているアリール基である}
の化合物の製造方法を提供する。
【発明を実施するための形態】
【0007】
好ましくは、R1及びR2は、独立して、水素、ハロゲン、C1−C4アルキル及びC1−C4ハロアルキルから選択される。
【0008】
好ましくは、R3は、水素、ハロゲン、ヒドロキシル、ニトロ、シアノ、C1−C4アルキル及びC1−C4ハロアルキル、より好ましくは水素、シアノ又はC3−C4アルキニルから選択される。
【0009】
好ましくは、Arは、水素、ハロゲン、ヒドロキシル、ニトロ、シアノ、C1−C4アルキル、C1−C4ハロアルキル、及びフェノキシから選択される1つ以上の基で置換されているフェニルである。
【0010】
ハロは、フルオロ、クロロ又はブロモである。
【0011】
各アルキル部分は、直鎖又は分岐鎖であり、例えば、メチル、エチル、n−プロピル、n‐ブチル、n−ペンチル、n−ヘキシル、イソプロピル、n‐ブチル、sec−ブチル、イソブチル、tert‐ブチル又はネオペンチルである。好ましいアルキル基は、1〜6個の炭素原子を有する。
【0012】
ハロアルキルとは、少なくとも1個の水素原子がハロ原子へ置換されている、上記で規定されているようなアルキル部分をいう。
【0013】
アリールとは、フェニル又はナフチル基をいう。
【0014】
ヘテロアリールとは、一又は二環式の環系をいい、各環は、5〜7員環の原子、及び独立してO、N及びSから選択される1〜3個のヘテロ原子を含む。ヘテロアリール基の例は、ピリジン、ピロール、フラン、ピラゾール、イミダゾール及びオキサゾールである。
【0015】
アルケニルとは、少なくとも1個の炭素−炭素二重結合を含む、炭素及び水素原子から成る直鎖又は分岐鎖の基をいう。例は、エテニル基、プロパ−1−エニル、プロパ−2−エニル、ブタ−1−エニル、ブタ−2−エニル及びブタ−3−エニルである。cis及びtrans基の両方が考えられる。好ましいアルケニル基は、2〜6個の炭素原子を有する。
【0016】
アルキニルとは、少なくとも1個の炭素−炭素三重結合を含む、炭素及び水素原子から成る直鎖又は分岐鎖の基をいう。例は、エチニル、プロパ−1−ニル、プロパ−2−ニル、ブタ−1−ニル、ブタ−2−ニル及びブタ−3−ニルである。好ましいアルキニル基は、2〜6個の炭素原子を有する。
【0017】
シクロアルキルとしては、シクロプロピル、シクロブチル、シクロペンチル及びシクロヘキシルが挙げられる。
【0018】
存在する場合には、アリール又はヘテロアリール上の各任意の置換基は、独立して、好ましくは、アルキル、アルケニル、アルキニル、アルコキシル、アルケニルオキシ、アリールオキシ、チオアルキル、アミノ、アルキルアミノ、ジアルキルアミノ、アラルキル、アセトアミド、n−アルキルアセトアミド、アルキルスルホニル、ハロ、ヒドロキシル、シアノ及びニトロから選択される。1個から最大可能数までの置換基が存在してよい。
【0019】
好ましくは、R1及びR2の一方は、ハロであり、そして他方は、ハロアルキルである。より好ましくは、R1及びR2の一方は、クロロであり、そして他方は、ハロアルキル、例えば、ハロ−C1−C4アルキルである。より好ましくは、R1及びR2の一方は、ハロであり、そして他方は、トリフルオロメチルである。最も好ましくは、R1及びR2の一方は、クロロであり、そして他方は、トリフルオロメチルである。
【0020】
好ましくは、シクロプロパン環上の置換基は、cis−立体化学である。つまり、式(III)の化合物は、立体化学(IIIa):
【化6】

を有する。
【0021】
好ましくは、式(III)の化合物は、式(IIIb):
【化7】

を有する。
【0022】
とても好ましくは、式(III)の化合物は、式(IIIc):
【化8】

を有する。
【0023】
好ましい実施形態では、Arは、所望により置換されているフェニル基である。
【0024】
非常に好ましい実施形態では、Arは、フェノキシフェニル基である。より好ましくは、Arは、3−フェノキシフェニル基である。この実施形態では、R3が、シアノ又はエチニルであることが好ましい。R3がシアノであることがより好ましい。
【0025】
例えば、R1及びR2の一方はハロであり、他方はハロ−C1−C4アルキルであり;
R3は、シアノ又はエチニルであり;
Arは、フェノキシフェニル基である。
【0026】
非常に好ましくは、式(III)の化合物は、式(IIId):
【化9】

を有する。
【0027】
代替的な好ましい実施形態では、Arは、式(VI)
【化10】

{式中、R4は、アルキル、アルケニル、アルキニル、アルコキシル、アルケニルオキシ、アリールオキシ、チオアルキル、アミノ、アルキルアミノ、ジアルキルアミノ、アラルキル、アセトアミド、n−アルキルアセトアミド、アルキルスルホニル、ハロ、ヒドロキシル、シアノ及びニトロから選択される}
の基である。好ましくは、R4は、1〜4個の炭素原子のアルキル、3〜5個の炭素原子のアルケニル、メトキシ、エトキシ、アリルオキシ、エチルチオ、エタンスルホニル、ベンジル、ジメチルアミノ、エチルアミノ、アセトアミド又はn−メチルアセトアミドである。
【0028】
非常に好ましくは、R4はメチルである。好ましくは、R4は、4位に位置する。
【0029】
この実施形態では、R3が水素であることが好ましい。
【0030】
例えば、R1及びR2の一方はハロであり、他方がハロ−C1−C4アルキルであり;
R3は、水素であり;
Arは、式(VI):
【化11】

{式中、R4は、1〜4個の炭素原子のアルキル、3〜5個の炭素原子のアルケニル、メトキシ、エトキシ、アリルオキシ、エチルチオ、エタンスルホニル、ベンジル、ジメチルアミノ、エチルアミノ、アセトアミド又はn−メチルアセトアミドである}
の基である。
【0031】
非常に好ましくは、式(III)の化合物は、式(IIIe):
【化12】

を有する。
【0032】
非常に好ましい実施形態によれば、本発明は、ジルコニウム含有触媒、ハフニウム含有触媒、鉄含有触媒、コバルト含有触媒、スズ含有触媒、チタン含有触媒、アンモニウム塩触媒及びボロン酸含有触媒から選択される触媒の存在下で、下記:
【化13】

の通り、式(VIII)のカルボン酸に式(IX)のアルコールを反応させる工程を含む、テフルトリン(VII):
【化14】

の製造方法を提供する。
【0033】
別の非常に好ましい実施形態によれば、本発明は、ジルコニウム含有触媒、ハフニウム含有触媒、鉄含有触媒、コバルト含有触媒、スズ含有触媒、チタン含有触媒、アンモニウム塩触媒及びボロン酸含有触媒から選択される触媒の存在下で、下記:
【化15】

の通り、式(VIII)のカルボン酸に式(XI)のアルコールを反応させる工程を含む、ラムダシハロトリン(X):
【化16】

の製造方法を提供する。
【0034】
化合物(XI)は、in situで生成されることができる。
【0035】
また、本発明は、実質的に本明細書では実施例を参考にして説明されるようなプロセスにも関する。
【0036】
また、本発明は、本明細書で説明されるプロセスにより得ることができる化合物にも関する。また、本発明は、本明細書で説明されるプロセスにより得ることができる化合物にも関する。
【0037】
光学異性体
本発明のプロセスは、化合物の光学異性体を多く含む形態又は純形態を調製するために、使用されることができる。好ましい実施形態では、本発明は、ガンマシハロトリン(S)−a−シアノ−3−フェノキシベンジル(Z)−(lR,3R)−3−(2−クロロ−3,3,3−トリフルオロ−1−プロペニル)−2,2−ジメチルシクロプロパンカルボキシレート)(XIV):
【化17】

の製造方法を提供する。
【0038】
溶媒
本発明の反応は、所望により(そして好ましくは)、適切な溶媒中で行われる。適切な溶媒としては、限定されるものではないが、直鎖、分岐鎖又は環状の脂肪族炭化水素(例えば、リグロイン又はシクロヘキサン、ペンタン、ヘキサン、ヘプタン、オクタンなど)、並びに芳香族溶媒(例えば、ベンゼン、トルエン、キシレン、モノクロロベンゼン、ジクロロベンゼン、トリクロロベンゼンなど)が挙げられる。
【0039】
好ましい溶媒はキシレンである。
【0040】
温度
本発明の反応は、反応の適切な速度が達成されるような温度で行なわれることができる。好ましくは、本反応は、0℃〜200℃の温度で行われる。より好ましくは、本反応は、50℃〜180℃の温度で行われる。より好ましくは、本反応は、100℃〜170℃の温度で行われる。より好ましくは、本反応は、130℃〜150℃の温度で行われる。
【0041】
水の除去
好ましくは、反応混合物からの水(例えば、反応の完了前の水の除去)が考えられる。水は、連続的に反応物から除去されることができる。適切な方法は、水の共沸除去である。水の共沸除去を行なうための適切な装置が、当業者に知られているであろう。生成物への工業的に有用な転化を達成するために、水の除去が非常に好ましいことが分かった。
【0042】
触媒
触媒の好ましい種類は、i)ジルコニウム含有触媒、ii)ハフニウム含有触媒、iii)鉄含有触媒、iv)コバルト含有触媒、v)スズ含有触媒、vi)チタン含有触媒、vii)アンモニウム塩触媒及びボロン酸含有触媒である。
【0043】
好ましくは、触媒は、ジルコニウム含有触媒である。好ましいジルコニウム含有触媒は、ジルコニウム(IV)化合物である。より好ましいものは、ジルコニウム(IV)ハロゲン化物、ジルコニウム(IV)酸ハロゲン化物、ジルコニウム(IV)アルコキシド類、ジルコノセンジクロリド、及びこれらの種類の触媒の溶媒和物、特にテトラヒドロフラン複合体である。特に好ましいものは、ZrCl4、ZrOCl2、Zr(OiPr4)、ジルコノセンジクロリド、ZrBr4、及びZrCl4・(THF)2である。
【0044】
最も好ましい触媒はZrCl4である。
【0045】
好ましいハフニウム含有触媒は、ハフニウム(IV)化合物である。より好ましいものは、ハフニウム(IV)ハロゲン化物及びそれらの溶媒和物である。さらに好ましいものは、HfCl4及びHfCl4・(THF)2である。
【0046】
好ましい鉄含有触媒は、鉄(III)化合物である。より好ましいものは、鉄(III)ハロゲン化物である。さらに好ましいものはFeCl3である。
【0047】
好ましいコバルト含有触媒はK5CoW12O40である。
【0048】
好ましいスズ含有触媒は、スズ(IV)化合物である。より好ましいものは、スズ(IV)ハロゲン化物である。さらに好ましいものはSnCl4である。
【0049】
好ましいチタン化合物は、チタン(IV)化合物である。より好ましいものは、チタン(IV)ハロゲン化物及びチタン(IV)アルコキシドである。さらに好ましいものはTi(OiPr)4及びTiCl4である。
【0050】
好ましいアンモニウム塩触媒はPh2NH2OTfである。
【0051】
ボロン酸含有触媒のためのボロン酸の例としては、ホウ酸、フェニルボロン酸、2−メチルフェニルボロン酸、3−メチルフェニルボロン酸、4−メチルフェニルボロン酸、2,3−ジメチルフェニルボロン酸、4−ジメチルフェニルボロン酸、2,5−ジメチルフェニルボロン酸、2−エチルフェニルボロン酸、4−n‐プロピルフェニルボロン酸、4−イソプロピルフェニルボロン酸、4−n‐ブチルフェニルボロン酸、4−tert‐ブチルフェニルボロン酸、1−ナフチルボロン酸、2−ナフチルボロン酸、2−ビフェニルボロン酸、3−ビフェニルボロン酸、4−ビフェニルボロン酸、2−フルオロ−4−ビフェニルボロン酸、2−フルオレニルボロン酸、9−フルオレニルボロン酸、9−フェナントレニルボロン酸、
【0052】
9−アントラセニルボロン酸、1−ピレニルボロン酸、2−トリフルオロメチルフェニルボロン酸、3−トリフルオロメチルフェニルボロン酸、4−トリフルオロフェニルボロン酸、3,5−ビス(トリフルオロメチル)フェニルボロン酸、2−メトキシフェニルボロン酸、3−メトキシフェニルボロン酸、4−メトキシフェニルボロン酸、2,5−ジメトキシフェニルボロン酸、4,5−ジメトキシフェニルボロン酸、2,4−ジメトキシフェニルボロン酸、2−エトキシフェニルボロン酸、3−エトキシフェニルボロン酸、4−エトキシフェニルボロン酸、4−フェノキシボロン酸、4−メチレンジオキシフェニルボロン酸、2−フルオロフェニルボロン酸、3−フルオロフェニルボロン酸、4−フルオロフェニルボロン酸、2,4−ジフルオロフェニルボロン酸、2,5−ジフルオロフェニルボロン酸、4,5−ジフルオロフェニルボロン酸、3,5−ジフルオロフェニルボロン酸、2−ホルミルフェニルボロン酸、3−ホルミルフェニルボロン酸、4−ホルミルフェニルボロン酸、
【0053】
3−ホルミル−4−メトキシフェニルボロン酸、2−シアノフェニルボロン酸、3−シアノフェニルボロン酸、4−シアノフェニルボロン酸、3−ニトロフェニルボロン酸、3−アセチルフェニルボロン酸、4−アセチルフェニルボロン酸、3−トリフルオロアセチルフェニルボロン酸、4−トリフルオロアセチルフェニルボロン酸、4−メチルチオフェニルボロン酸、4−ビニルフェニルボロン酸、3−カルボキシフェニルボロン酸、4−カルボキシフェニルボロン酸、3−アミノフェニルボロン酸、2−(N,N−ジメチルアミノ)フェニルボロン酸、3−(N,N−ジメチルアミノ)フェニルボロン酸、4−(N,N−ジメチルアミノ)フェニルボロン酸、2−(N,N−ジエチルアミノ)フェニルボロン酸、3−(N,N−ジエチルアミノ)フェニルボロン酸、4−(N,N−ジエチルアミノ)フェニルボロン酸、
【0054】
2−(N,N−ジメチルアミノメチル)フェニルボロン酸、フラン−2−ボロン酸、フラン−3−ボロン酸、4−ホルミル−2−フランボロン酸、ジベンゾフラン−4−ボロン酸、ベンゾフラン−2−ボロン酸、チオフェン−2−ボロン酸、チオフェン−3−ボロン酸、5−メチルチオフェン−2−ボロン酸、5−クロロチオフェン−2−ボロン酸、4−メチルチオフェン−2−ボロン酸、5−メチルチオフェン−2−ボロン酸、2−アセチルチオフェン−5−ボロン酸、5−メチルチオフェン−2−ボロン酸、ベンゾチオフェン−2−ボロン酸、ジベンゾチオフェン−4−ボロン酸、ピリジン−3−ボロン酸、ピリジン−4−ボロン酸、ピリミジン−5−ボロン酸、キノリン−8−ボロン酸、イソキノリン−4−ボロン酸、4−ベンゼンビス(ボロン酸)、フェニルボロン酸−ピナコールエステル、及び4−シアノフェニルボロン酸−ピナコールエステルが挙げられる。
【0055】
ボロン酸の好ましい種類は、アリールボロン酸、例えば、2−(N,N−ジメチルアミノメチル)フェニルボロン酸及び3,5−トリフルオロメチルフェニルボロン酸である。別の好ましいボロン酸はホウ酸である。
【0056】
好ましくは、触媒は、ジルコニウム含有触媒、ハフニウム含有触媒、アンモニウム塩触媒又はボロン酸含有触媒、特にジルコニウム含有触媒又はアンモニウム塩触媒である。より好ましくは、触媒はジルコニウム含有触媒である。
【0057】
好ましくは、触媒は、ZrCl4若しくはその溶媒和物、HfCl4若しくはその溶媒和物、Ph2NH2+OTf−又はホウ酸を含むか、又はそれらから成る。より好ましくは、触媒は、ZrCl4若しくはその溶媒和物又はPh2NH2+OTf−を含むか、又はそれらから成る。
【0058】
通常、一種類の触媒が、反応に使用されるであろう。しかし、本発明は、一種類以上の触媒が、例えば、別々に、連続して又は同時に使用される反応も含む。例えば、一種類以上のジルコニウム触媒が使用されるか、又はジルコニウム触媒は、ボロン酸触媒と併用されることができる。
【0059】
触媒の量
好ましくは、利用される触媒の量は、カルボン酸(IV)の量を基準として、50モル%以下である。より好ましくは、利用される触媒の量は、カルボン酸(IV)の量を基準として、25モル%以下である。より好ましくは、利用される触媒の量は、カルボン酸(IV)を基準として、15モル%以下である。
【0060】
好ましくは、利用される触媒の量は、カルボン酸(IV)の量を基準として、少なくとも0.01モル%である。より好ましくは、利用される触媒の量は、カルボン酸(IV)の量を基準として、少なくとも0.1モル%である。より好ましくは、利用される触媒の量は、カルボン酸(IV)の量を基準として、少なくとも1モル%である。より好ましくは、利用される触媒の量は、カルボン酸(IV)の量を基準として、少なくとも5モル%である。
【0061】
好ましくは、利用される触媒の量は、カルボン酸(IV)の量を基準として、0.01〜50モル%である。より好ましくは、利用される触媒の量は、カルボン酸(IV)の量を基準として、0.1〜25モル%である。より好ましくは、利用される触媒の量は、カルボン酸(IV)の量を基準として、5〜15モル%である。
【0062】
好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、50モル%以下である。より好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、25モル%以下である。より好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、15モル%以下である。
【0063】
好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、少なくとも0.01モル%である。より好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、少なくとも0.1モル%である。より好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、少なくとも1モル%である。より好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、少なくとも5モル%である。
【0064】
好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、0.01〜50モル%である。より好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、0.1〜25モル%である。より好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、5〜15モル%である。
【0065】
出発材料の合成
カルボン酸(IV)及びアルコール(V)を調製する適切な方法が、米国特許第4405640号明細書及び英国特許第2000764号明細書に開示されている。他の方法が当業者にとって自明であろう。
【0066】
生成物の検査及び単離
反応混合物の検査は、合成有機化学の周知の手順に従って行なわれる。例えば、水性検査は、水(又は他の水溶液)の添加、及び適切な有機溶媒による所望の生成物の抽出により行なわれることができる。
【0067】
また、本生成物は、例えば減圧下の、蒸留により、存在する任意の溶媒を除去することにより、単離されることができる。
【0068】
本生成物の精製は、複数の方法、例えば、蒸留、再結晶及びクロマトグラフィーのいずれか1つにより、行なわれることができる。
【0069】
本発明は、下記の非限定的な実施例により、今では説明されるであろう。当業者は、反応物並びに反応条件及び技術の両方について、その手順から適切な変更点を直ぐに理解するであろう。
【0070】
本明細書で記述された全文献は、参照により全体で本明細書に援用される。全ての態様及び好ましい性質は、それが明らかに可能でない場合を除いて、互いに組み合わせることができる。
【実施例】
【0071】
実施例1
反応シークエンス
【化18】

【0072】
【表1】

【0073】
少量のジルコニウムテトラクロリド(1モル%)の存在下において、140℃で3時間のPP890酸(VIII)及びTFX−OH(IX)の反応が、非常に僅かな転化(2%)を与えた。さらなる触媒(10モル%)の追加によって、所望のテフルトリン生成物(VII)への清浄かつ急速な転化が起こった。
【0074】
本物の材料とのGCMS及びNMR比較により、生成物の特性を確認した。
【0075】
さらなる実験の詳細:
【0076】
【表2】

【0077】
手順
250mlの3つ口丸底フラスコに、攪拌子、温度計、油浴、濃縮器、コンデンサー、及び3Aモレキュラーシーブ8〜12メッシュ(及び10mlのキシレン)を充填したDean & Stark装置を取り付けた。その系を窒素でパージして、周囲に排出した。
【0078】
TFXOH(8.0g)、PP890(9.8g)、キシレン(100ml)及びZrCl4(0.01g)をフラスコに入れた。混合物を加熱還流(145℃)して、その温度で5時間保持した。さらに、ZrCl4触媒(0.09g)を入れて、Dean & Stark容器中の液体を未使用キシレンに変えて、そして混合物をさらに4.5時間還流した。
【0079】
反応をGCによって監視した:
【0080】
1時間後の転化率(0.1当量の触媒)=65%
3時間後の転化率(0.1当量の触媒)=90%
4.5時間後の転化率(0.1当量の触媒)=99%
【0081】
反応分の一部分(20ml)を水(2×10ml)で洗浄し、乾燥(MgSO4)して、真空下で濃縮した。GC、GCMS及びNMRにより生成物の特性を確認した。
【0082】
実施例2
反応シークエンス
【化19】

【0083】
利用される基質を変えて、実施例1の手順を繰り返した。
【0084】
【表3】

【0085】
シハロトリンに必要なシアノヒドリンは、容易に入手できないものであり、in situで生成する。マンデロニトリルは、容易に入手できるだけでなく、構造的に類似しているので、それをシハロトリン製剤のモデルとして使用した。
【0086】
触媒の不存在下では、反応がほとんど起きなかった(140℃で3時間後に2%の転化率)。
【0087】
ジルコニウムテトラクロリド触媒の存在下で、有意な転化が達成された(10モル%)。
【0088】
実施例3
反応シークエンス
【化20】

【0089】
【表4】

【0090】
50mlの3つ口丸底フラスコに、攪拌子、温度計、油浴、濃縮器、コンデンサー、及び3Aモレキュラーシーブ8〜12メッシュ(及び10mlのキシレン)を充填したDean & Stark装置を取り付けた。その系を窒素でパージして、周囲に排出した。
【0091】
3−フェノキシベンジルアルデヒドシアンドヒドリン(cyandohydrin)(0.66g)、PP890(0.5g)、キシレン(20ml)及びジフェニルアンモニウムトリフラート触媒(67mg)をフラスコに入れた。混合物を加熱還流(約143℃以下)して、その温度で10時間保持した。GCによって反応を監視した。
【0092】
転化率=10時間後に(2つのシハロトリン異性体の)40%
【0093】
GC/MS:生成物は、本物の材料によって見つけられたものと同じ保持時間、分子イオン(M+449)及びフラグメンテーションパターンを有した。
【0094】
NMR:NMRデータは、本物の材料のものと一致した。
【0095】
実施例4
反応シークエンス
【化21】

【0096】
実施例3で説明した条件を用いて、PP890による3−フェノキシベンジルアルデヒドシアノヒドリンの直接アシル化を行なった。触媒の選択をスクリーニングした:
【0097】
【表5】

【0098】
触媒の存在下では、シハロトリンが首尾よく形成されたが、触媒なしでは反応が観察されなかった。使用された3つの触媒の全ては、所望の生成物への幾つかの転化率を与えたが、ジフェニルアンモニウムトリフラートが、明らかに最も有効であった。
【0099】
ラセミ体のシアノヒドリン及びPP890を使用して、ジアステレオマーの1:1混合物として生成物を形成した:
【化22】

【0100】
生成物を単離して、NMR及びGC/MSにより特性化した。この材料のための特別なデータは、所望の生成物と一致した。
【0101】
ホウ酸及びジフェニルアンモニウムトリフラートを触媒として使用したときに、GCMSにより、2つの長い保持時間の不純物が見られた。この2つの不純物は、それらが互いに異性体であることを示している同一分子量を有していた。それらの分子量(MW467)は、所望の生成物のもの(MW449)より18高かった。したがって、それらは、対象分子の水和誘導体、例えば、ニトリル基がアミドに加水分解された生成物類似体:
【化23】

であるようだ。
【0102】
触媒同士で観察された異なる挙動は、使用された窒素パージにおける差のためであると考えられる。効率の弱いパージが、ホウ酸及びトリフラートの実験において使用されたので、それが幾つかの水の侵入を許してしまったのであろう(そして、生成物の加水分解が起こったのであろう)。
【技術分野】
【0001】
本発明は、殺虫剤として有用な特定のピレスロイド化合物の製造方法、並びにそのような化合物の合成に有用な中間体の製造方法に関する。
【背景技術】
【0002】
式(I):
【化1】

{式中、R1及びR2の一方は、式:W−(CF2)m−(式中、Wは、水素、フッ素又は塩素の原子を表し、mは、1又は2の値を有する)の基を表し、そしてR1及びR2の他方は、フッ素、塩素又は臭素の原子を表し、そしてR3は、水素の原子又はシアノ若しくはエチニル基を表す}
の合成ピレスロイド殺虫剤が、英国特許第2000764号明細書に開示されている。
【0003】
式(II):
【化2】

{式中、R1及びR2は、それぞれメチル、ハロメチル、及びハロから選択され;Xは、酸素、硫黄、スルホニル又は基NR4(式中、R4は、水素、低級アルキル又は低級カルボン酸アシルを表す)であり;R3は、低級アルキル、低級アルケニル又はベンジルであり;mは、0〜1の値であり、そしてnは、1〜4の値を有する}
の合成ピレスロイド殺虫剤が、米国特許第4405640号明細書に開示されている。
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、これらの及び他のピレスロイド類の製造方法を提供することを課題とする。
【課題を解決するための手段】
【0005】
驚くべきことに、後述するように、触媒の存在下で、対応するアルコール及びカルボン酸をカップリングすることにより、これらの化合物が有利に得られることが今では分かっている。
【0006】
本発明は、ジルコニウム含有触媒、ハフニウム含有触媒、鉄含有触媒、コバルト含有触媒、スズ含有触媒、チタン含有触媒、アンモニウム塩触媒及びボロン酸含有触媒から選択される触媒の存在下で、式(IV):
【化3】

のカルボン酸に式(V):
【化4】

のアルコールを反応させる工程を含む、式(III):
【化5】

{式中、
R1は、水素、アルキル、ハロアルキル、又はハロゲンであり;
R2は、水素、アルキル、ハロアルキル、又はハロゲンであり;
R3は、水素、ハロゲン、ヒドロキシル、ニトロ、シアノ、所望により置換されているアルキル、所望により置換されているアルケニル、又は所望により置換されているアルキニルであり;
Arは、所望により置換されているアリール基である}
の化合物の製造方法を提供する。
【発明を実施するための形態】
【0007】
好ましくは、R1及びR2は、独立して、水素、ハロゲン、C1−C4アルキル及びC1−C4ハロアルキルから選択される。
【0008】
好ましくは、R3は、水素、ハロゲン、ヒドロキシル、ニトロ、シアノ、C1−C4アルキル及びC1−C4ハロアルキル、より好ましくは水素、シアノ又はC3−C4アルキニルから選択される。
【0009】
好ましくは、Arは、水素、ハロゲン、ヒドロキシル、ニトロ、シアノ、C1−C4アルキル、C1−C4ハロアルキル、及びフェノキシから選択される1つ以上の基で置換されているフェニルである。
【0010】
ハロは、フルオロ、クロロ又はブロモである。
【0011】
各アルキル部分は、直鎖又は分岐鎖であり、例えば、メチル、エチル、n−プロピル、n‐ブチル、n−ペンチル、n−ヘキシル、イソプロピル、n‐ブチル、sec−ブチル、イソブチル、tert‐ブチル又はネオペンチルである。好ましいアルキル基は、1〜6個の炭素原子を有する。
【0012】
ハロアルキルとは、少なくとも1個の水素原子がハロ原子へ置換されている、上記で規定されているようなアルキル部分をいう。
【0013】
アリールとは、フェニル又はナフチル基をいう。
【0014】
ヘテロアリールとは、一又は二環式の環系をいい、各環は、5〜7員環の原子、及び独立してO、N及びSから選択される1〜3個のヘテロ原子を含む。ヘテロアリール基の例は、ピリジン、ピロール、フラン、ピラゾール、イミダゾール及びオキサゾールである。
【0015】
アルケニルとは、少なくとも1個の炭素−炭素二重結合を含む、炭素及び水素原子から成る直鎖又は分岐鎖の基をいう。例は、エテニル基、プロパ−1−エニル、プロパ−2−エニル、ブタ−1−エニル、ブタ−2−エニル及びブタ−3−エニルである。cis及びtrans基の両方が考えられる。好ましいアルケニル基は、2〜6個の炭素原子を有する。
【0016】
アルキニルとは、少なくとも1個の炭素−炭素三重結合を含む、炭素及び水素原子から成る直鎖又は分岐鎖の基をいう。例は、エチニル、プロパ−1−ニル、プロパ−2−ニル、ブタ−1−ニル、ブタ−2−ニル及びブタ−3−ニルである。好ましいアルキニル基は、2〜6個の炭素原子を有する。
【0017】
シクロアルキルとしては、シクロプロピル、シクロブチル、シクロペンチル及びシクロヘキシルが挙げられる。
【0018】
存在する場合には、アリール又はヘテロアリール上の各任意の置換基は、独立して、好ましくは、アルキル、アルケニル、アルキニル、アルコキシル、アルケニルオキシ、アリールオキシ、チオアルキル、アミノ、アルキルアミノ、ジアルキルアミノ、アラルキル、アセトアミド、n−アルキルアセトアミド、アルキルスルホニル、ハロ、ヒドロキシル、シアノ及びニトロから選択される。1個から最大可能数までの置換基が存在してよい。
【0019】
好ましくは、R1及びR2の一方は、ハロであり、そして他方は、ハロアルキルである。より好ましくは、R1及びR2の一方は、クロロであり、そして他方は、ハロアルキル、例えば、ハロ−C1−C4アルキルである。より好ましくは、R1及びR2の一方は、ハロであり、そして他方は、トリフルオロメチルである。最も好ましくは、R1及びR2の一方は、クロロであり、そして他方は、トリフルオロメチルである。
【0020】
好ましくは、シクロプロパン環上の置換基は、cis−立体化学である。つまり、式(III)の化合物は、立体化学(IIIa):
【化6】

を有する。
【0021】
好ましくは、式(III)の化合物は、式(IIIb):
【化7】

を有する。
【0022】
とても好ましくは、式(III)の化合物は、式(IIIc):
【化8】

を有する。
【0023】
好ましい実施形態では、Arは、所望により置換されているフェニル基である。
【0024】
非常に好ましい実施形態では、Arは、フェノキシフェニル基である。より好ましくは、Arは、3−フェノキシフェニル基である。この実施形態では、R3が、シアノ又はエチニルであることが好ましい。R3がシアノであることがより好ましい。
【0025】
例えば、R1及びR2の一方はハロであり、他方はハロ−C1−C4アルキルであり;
R3は、シアノ又はエチニルであり;
Arは、フェノキシフェニル基である。
【0026】
非常に好ましくは、式(III)の化合物は、式(IIId):
【化9】

を有する。
【0027】
代替的な好ましい実施形態では、Arは、式(VI)
【化10】

{式中、R4は、アルキル、アルケニル、アルキニル、アルコキシル、アルケニルオキシ、アリールオキシ、チオアルキル、アミノ、アルキルアミノ、ジアルキルアミノ、アラルキル、アセトアミド、n−アルキルアセトアミド、アルキルスルホニル、ハロ、ヒドロキシル、シアノ及びニトロから選択される}
の基である。好ましくは、R4は、1〜4個の炭素原子のアルキル、3〜5個の炭素原子のアルケニル、メトキシ、エトキシ、アリルオキシ、エチルチオ、エタンスルホニル、ベンジル、ジメチルアミノ、エチルアミノ、アセトアミド又はn−メチルアセトアミドである。
【0028】
非常に好ましくは、R4はメチルである。好ましくは、R4は、4位に位置する。
【0029】
この実施形態では、R3が水素であることが好ましい。
【0030】
例えば、R1及びR2の一方はハロであり、他方がハロ−C1−C4アルキルであり;
R3は、水素であり;
Arは、式(VI):
【化11】

{式中、R4は、1〜4個の炭素原子のアルキル、3〜5個の炭素原子のアルケニル、メトキシ、エトキシ、アリルオキシ、エチルチオ、エタンスルホニル、ベンジル、ジメチルアミノ、エチルアミノ、アセトアミド又はn−メチルアセトアミドである}
の基である。
【0031】
非常に好ましくは、式(III)の化合物は、式(IIIe):
【化12】

を有する。
【0032】
非常に好ましい実施形態によれば、本発明は、ジルコニウム含有触媒、ハフニウム含有触媒、鉄含有触媒、コバルト含有触媒、スズ含有触媒、チタン含有触媒、アンモニウム塩触媒及びボロン酸含有触媒から選択される触媒の存在下で、下記:
【化13】

の通り、式(VIII)のカルボン酸に式(IX)のアルコールを反応させる工程を含む、テフルトリン(VII):
【化14】

の製造方法を提供する。
【0033】
別の非常に好ましい実施形態によれば、本発明は、ジルコニウム含有触媒、ハフニウム含有触媒、鉄含有触媒、コバルト含有触媒、スズ含有触媒、チタン含有触媒、アンモニウム塩触媒及びボロン酸含有触媒から選択される触媒の存在下で、下記:
【化15】

の通り、式(VIII)のカルボン酸に式(XI)のアルコールを反応させる工程を含む、ラムダシハロトリン(X):
【化16】

の製造方法を提供する。
【0034】
化合物(XI)は、in situで生成されることができる。
【0035】
また、本発明は、実質的に本明細書では実施例を参考にして説明されるようなプロセスにも関する。
【0036】
また、本発明は、本明細書で説明されるプロセスにより得ることができる化合物にも関する。また、本発明は、本明細書で説明されるプロセスにより得ることができる化合物にも関する。
【0037】
光学異性体
本発明のプロセスは、化合物の光学異性体を多く含む形態又は純形態を調製するために、使用されることができる。好ましい実施形態では、本発明は、ガンマシハロトリン(S)−a−シアノ−3−フェノキシベンジル(Z)−(lR,3R)−3−(2−クロロ−3,3,3−トリフルオロ−1−プロペニル)−2,2−ジメチルシクロプロパンカルボキシレート)(XIV):
【化17】

の製造方法を提供する。
【0038】
溶媒
本発明の反応は、所望により(そして好ましくは)、適切な溶媒中で行われる。適切な溶媒としては、限定されるものではないが、直鎖、分岐鎖又は環状の脂肪族炭化水素(例えば、リグロイン又はシクロヘキサン、ペンタン、ヘキサン、ヘプタン、オクタンなど)、並びに芳香族溶媒(例えば、ベンゼン、トルエン、キシレン、モノクロロベンゼン、ジクロロベンゼン、トリクロロベンゼンなど)が挙げられる。
【0039】
好ましい溶媒はキシレンである。
【0040】
温度
本発明の反応は、反応の適切な速度が達成されるような温度で行なわれることができる。好ましくは、本反応は、0℃〜200℃の温度で行われる。より好ましくは、本反応は、50℃〜180℃の温度で行われる。より好ましくは、本反応は、100℃〜170℃の温度で行われる。より好ましくは、本反応は、130℃〜150℃の温度で行われる。
【0041】
水の除去
好ましくは、反応混合物からの水(例えば、反応の完了前の水の除去)が考えられる。水は、連続的に反応物から除去されることができる。適切な方法は、水の共沸除去である。水の共沸除去を行なうための適切な装置が、当業者に知られているであろう。生成物への工業的に有用な転化を達成するために、水の除去が非常に好ましいことが分かった。
【0042】
触媒
触媒の好ましい種類は、i)ジルコニウム含有触媒、ii)ハフニウム含有触媒、iii)鉄含有触媒、iv)コバルト含有触媒、v)スズ含有触媒、vi)チタン含有触媒、vii)アンモニウム塩触媒及びボロン酸含有触媒である。
【0043】
好ましくは、触媒は、ジルコニウム含有触媒である。好ましいジルコニウム含有触媒は、ジルコニウム(IV)化合物である。より好ましいものは、ジルコニウム(IV)ハロゲン化物、ジルコニウム(IV)酸ハロゲン化物、ジルコニウム(IV)アルコキシド類、ジルコノセンジクロリド、及びこれらの種類の触媒の溶媒和物、特にテトラヒドロフラン複合体である。特に好ましいものは、ZrCl4、ZrOCl2、Zr(OiPr4)、ジルコノセンジクロリド、ZrBr4、及びZrCl4・(THF)2である。
【0044】
最も好ましい触媒はZrCl4である。
【0045】
好ましいハフニウム含有触媒は、ハフニウム(IV)化合物である。より好ましいものは、ハフニウム(IV)ハロゲン化物及びそれらの溶媒和物である。さらに好ましいものは、HfCl4及びHfCl4・(THF)2である。
【0046】
好ましい鉄含有触媒は、鉄(III)化合物である。より好ましいものは、鉄(III)ハロゲン化物である。さらに好ましいものはFeCl3である。
【0047】
好ましいコバルト含有触媒はK5CoW12O40である。
【0048】
好ましいスズ含有触媒は、スズ(IV)化合物である。より好ましいものは、スズ(IV)ハロゲン化物である。さらに好ましいものはSnCl4である。
【0049】
好ましいチタン化合物は、チタン(IV)化合物である。より好ましいものは、チタン(IV)ハロゲン化物及びチタン(IV)アルコキシドである。さらに好ましいものはTi(OiPr)4及びTiCl4である。
【0050】
好ましいアンモニウム塩触媒はPh2NH2OTfである。
【0051】
ボロン酸含有触媒のためのボロン酸の例としては、ホウ酸、フェニルボロン酸、2−メチルフェニルボロン酸、3−メチルフェニルボロン酸、4−メチルフェニルボロン酸、2,3−ジメチルフェニルボロン酸、4−ジメチルフェニルボロン酸、2,5−ジメチルフェニルボロン酸、2−エチルフェニルボロン酸、4−n‐プロピルフェニルボロン酸、4−イソプロピルフェニルボロン酸、4−n‐ブチルフェニルボロン酸、4−tert‐ブチルフェニルボロン酸、1−ナフチルボロン酸、2−ナフチルボロン酸、2−ビフェニルボロン酸、3−ビフェニルボロン酸、4−ビフェニルボロン酸、2−フルオロ−4−ビフェニルボロン酸、2−フルオレニルボロン酸、9−フルオレニルボロン酸、9−フェナントレニルボロン酸、
【0052】
9−アントラセニルボロン酸、1−ピレニルボロン酸、2−トリフルオロメチルフェニルボロン酸、3−トリフルオロメチルフェニルボロン酸、4−トリフルオロフェニルボロン酸、3,5−ビス(トリフルオロメチル)フェニルボロン酸、2−メトキシフェニルボロン酸、3−メトキシフェニルボロン酸、4−メトキシフェニルボロン酸、2,5−ジメトキシフェニルボロン酸、4,5−ジメトキシフェニルボロン酸、2,4−ジメトキシフェニルボロン酸、2−エトキシフェニルボロン酸、3−エトキシフェニルボロン酸、4−エトキシフェニルボロン酸、4−フェノキシボロン酸、4−メチレンジオキシフェニルボロン酸、2−フルオロフェニルボロン酸、3−フルオロフェニルボロン酸、4−フルオロフェニルボロン酸、2,4−ジフルオロフェニルボロン酸、2,5−ジフルオロフェニルボロン酸、4,5−ジフルオロフェニルボロン酸、3,5−ジフルオロフェニルボロン酸、2−ホルミルフェニルボロン酸、3−ホルミルフェニルボロン酸、4−ホルミルフェニルボロン酸、
【0053】
3−ホルミル−4−メトキシフェニルボロン酸、2−シアノフェニルボロン酸、3−シアノフェニルボロン酸、4−シアノフェニルボロン酸、3−ニトロフェニルボロン酸、3−アセチルフェニルボロン酸、4−アセチルフェニルボロン酸、3−トリフルオロアセチルフェニルボロン酸、4−トリフルオロアセチルフェニルボロン酸、4−メチルチオフェニルボロン酸、4−ビニルフェニルボロン酸、3−カルボキシフェニルボロン酸、4−カルボキシフェニルボロン酸、3−アミノフェニルボロン酸、2−(N,N−ジメチルアミノ)フェニルボロン酸、3−(N,N−ジメチルアミノ)フェニルボロン酸、4−(N,N−ジメチルアミノ)フェニルボロン酸、2−(N,N−ジエチルアミノ)フェニルボロン酸、3−(N,N−ジエチルアミノ)フェニルボロン酸、4−(N,N−ジエチルアミノ)フェニルボロン酸、
【0054】
2−(N,N−ジメチルアミノメチル)フェニルボロン酸、フラン−2−ボロン酸、フラン−3−ボロン酸、4−ホルミル−2−フランボロン酸、ジベンゾフラン−4−ボロン酸、ベンゾフラン−2−ボロン酸、チオフェン−2−ボロン酸、チオフェン−3−ボロン酸、5−メチルチオフェン−2−ボロン酸、5−クロロチオフェン−2−ボロン酸、4−メチルチオフェン−2−ボロン酸、5−メチルチオフェン−2−ボロン酸、2−アセチルチオフェン−5−ボロン酸、5−メチルチオフェン−2−ボロン酸、ベンゾチオフェン−2−ボロン酸、ジベンゾチオフェン−4−ボロン酸、ピリジン−3−ボロン酸、ピリジン−4−ボロン酸、ピリミジン−5−ボロン酸、キノリン−8−ボロン酸、イソキノリン−4−ボロン酸、4−ベンゼンビス(ボロン酸)、フェニルボロン酸−ピナコールエステル、及び4−シアノフェニルボロン酸−ピナコールエステルが挙げられる。
【0055】
ボロン酸の好ましい種類は、アリールボロン酸、例えば、2−(N,N−ジメチルアミノメチル)フェニルボロン酸及び3,5−トリフルオロメチルフェニルボロン酸である。別の好ましいボロン酸はホウ酸である。
【0056】
好ましくは、触媒は、ジルコニウム含有触媒、ハフニウム含有触媒、アンモニウム塩触媒又はボロン酸含有触媒、特にジルコニウム含有触媒又はアンモニウム塩触媒である。より好ましくは、触媒はジルコニウム含有触媒である。
【0057】
好ましくは、触媒は、ZrCl4若しくはその溶媒和物、HfCl4若しくはその溶媒和物、Ph2NH2+OTf−又はホウ酸を含むか、又はそれらから成る。より好ましくは、触媒は、ZrCl4若しくはその溶媒和物又はPh2NH2+OTf−を含むか、又はそれらから成る。
【0058】
通常、一種類の触媒が、反応に使用されるであろう。しかし、本発明は、一種類以上の触媒が、例えば、別々に、連続して又は同時に使用される反応も含む。例えば、一種類以上のジルコニウム触媒が使用されるか、又はジルコニウム触媒は、ボロン酸触媒と併用されることができる。
【0059】
触媒の量
好ましくは、利用される触媒の量は、カルボン酸(IV)の量を基準として、50モル%以下である。より好ましくは、利用される触媒の量は、カルボン酸(IV)の量を基準として、25モル%以下である。より好ましくは、利用される触媒の量は、カルボン酸(IV)を基準として、15モル%以下である。
【0060】
好ましくは、利用される触媒の量は、カルボン酸(IV)の量を基準として、少なくとも0.01モル%である。より好ましくは、利用される触媒の量は、カルボン酸(IV)の量を基準として、少なくとも0.1モル%である。より好ましくは、利用される触媒の量は、カルボン酸(IV)の量を基準として、少なくとも1モル%である。より好ましくは、利用される触媒の量は、カルボン酸(IV)の量を基準として、少なくとも5モル%である。
【0061】
好ましくは、利用される触媒の量は、カルボン酸(IV)の量を基準として、0.01〜50モル%である。より好ましくは、利用される触媒の量は、カルボン酸(IV)の量を基準として、0.1〜25モル%である。より好ましくは、利用される触媒の量は、カルボン酸(IV)の量を基準として、5〜15モル%である。
【0062】
好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、50モル%以下である。より好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、25モル%以下である。より好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、15モル%以下である。
【0063】
好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、少なくとも0.01モル%である。より好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、少なくとも0.1モル%である。より好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、少なくとも1モル%である。より好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、少なくとも5モル%である。
【0064】
好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、0.01〜50モル%である。より好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、0.1〜25モル%である。より好ましくは、利用される触媒の量は、アルコール(V)の量を基準として、5〜15モル%である。
【0065】
出発材料の合成
カルボン酸(IV)及びアルコール(V)を調製する適切な方法が、米国特許第4405640号明細書及び英国特許第2000764号明細書に開示されている。他の方法が当業者にとって自明であろう。
【0066】
生成物の検査及び単離
反応混合物の検査は、合成有機化学の周知の手順に従って行なわれる。例えば、水性検査は、水(又は他の水溶液)の添加、及び適切な有機溶媒による所望の生成物の抽出により行なわれることができる。
【0067】
また、本生成物は、例えば減圧下の、蒸留により、存在する任意の溶媒を除去することにより、単離されることができる。
【0068】
本生成物の精製は、複数の方法、例えば、蒸留、再結晶及びクロマトグラフィーのいずれか1つにより、行なわれることができる。
【0069】
本発明は、下記の非限定的な実施例により、今では説明されるであろう。当業者は、反応物並びに反応条件及び技術の両方について、その手順から適切な変更点を直ぐに理解するであろう。
【0070】
本明細書で記述された全文献は、参照により全体で本明細書に援用される。全ての態様及び好ましい性質は、それが明らかに可能でない場合を除いて、互いに組み合わせることができる。
【実施例】
【0071】
実施例1
反応シークエンス
【化18】

【0072】
【表1】

【0073】
少量のジルコニウムテトラクロリド(1モル%)の存在下において、140℃で3時間のPP890酸(VIII)及びTFX−OH(IX)の反応が、非常に僅かな転化(2%)を与えた。さらなる触媒(10モル%)の追加によって、所望のテフルトリン生成物(VII)への清浄かつ急速な転化が起こった。
【0074】
本物の材料とのGCMS及びNMR比較により、生成物の特性を確認した。
【0075】
さらなる実験の詳細:
【0076】
【表2】

【0077】
手順
250mlの3つ口丸底フラスコに、攪拌子、温度計、油浴、濃縮器、コンデンサー、及び3Aモレキュラーシーブ8〜12メッシュ(及び10mlのキシレン)を充填したDean & Stark装置を取り付けた。その系を窒素でパージして、周囲に排出した。
【0078】
TFXOH(8.0g)、PP890(9.8g)、キシレン(100ml)及びZrCl4(0.01g)をフラスコに入れた。混合物を加熱還流(145℃)して、その温度で5時間保持した。さらに、ZrCl4触媒(0.09g)を入れて、Dean & Stark容器中の液体を未使用キシレンに変えて、そして混合物をさらに4.5時間還流した。
【0079】
反応をGCによって監視した:
【0080】
1時間後の転化率(0.1当量の触媒)=65%
3時間後の転化率(0.1当量の触媒)=90%
4.5時間後の転化率(0.1当量の触媒)=99%
【0081】
反応分の一部分(20ml)を水(2×10ml)で洗浄し、乾燥(MgSO4)して、真空下で濃縮した。GC、GCMS及びNMRにより生成物の特性を確認した。
【0082】
実施例2
反応シークエンス
【化19】

【0083】
利用される基質を変えて、実施例1の手順を繰り返した。
【0084】
【表3】

【0085】
シハロトリンに必要なシアノヒドリンは、容易に入手できないものであり、in situで生成する。マンデロニトリルは、容易に入手できるだけでなく、構造的に類似しているので、それをシハロトリン製剤のモデルとして使用した。
【0086】
触媒の不存在下では、反応がほとんど起きなかった(140℃で3時間後に2%の転化率)。
【0087】
ジルコニウムテトラクロリド触媒の存在下で、有意な転化が達成された(10モル%)。
【0088】
実施例3
反応シークエンス
【化20】

【0089】
【表4】

【0090】
50mlの3つ口丸底フラスコに、攪拌子、温度計、油浴、濃縮器、コンデンサー、及び3Aモレキュラーシーブ8〜12メッシュ(及び10mlのキシレン)を充填したDean & Stark装置を取り付けた。その系を窒素でパージして、周囲に排出した。
【0091】
3−フェノキシベンジルアルデヒドシアンドヒドリン(cyandohydrin)(0.66g)、PP890(0.5g)、キシレン(20ml)及びジフェニルアンモニウムトリフラート触媒(67mg)をフラスコに入れた。混合物を加熱還流(約143℃以下)して、その温度で10時間保持した。GCによって反応を監視した。
【0092】
転化率=10時間後に(2つのシハロトリン異性体の)40%
【0093】
GC/MS:生成物は、本物の材料によって見つけられたものと同じ保持時間、分子イオン(M+449)及びフラグメンテーションパターンを有した。
【0094】
NMR:NMRデータは、本物の材料のものと一致した。
【0095】
実施例4
反応シークエンス
【化21】

【0096】
実施例3で説明した条件を用いて、PP890による3−フェノキシベンジルアルデヒドシアノヒドリンの直接アシル化を行なった。触媒の選択をスクリーニングした:
【0097】
【表5】

【0098】
触媒の存在下では、シハロトリンが首尾よく形成されたが、触媒なしでは反応が観察されなかった。使用された3つの触媒の全ては、所望の生成物への幾つかの転化率を与えたが、ジフェニルアンモニウムトリフラートが、明らかに最も有効であった。
【0099】
ラセミ体のシアノヒドリン及びPP890を使用して、ジアステレオマーの1:1混合物として生成物を形成した:
【化22】

【0100】
生成物を単離して、NMR及びGC/MSにより特性化した。この材料のための特別なデータは、所望の生成物と一致した。
【0101】
ホウ酸及びジフェニルアンモニウムトリフラートを触媒として使用したときに、GCMSにより、2つの長い保持時間の不純物が見られた。この2つの不純物は、それらが互いに異性体であることを示している同一分子量を有していた。それらの分子量(MW467)は、所望の生成物のもの(MW449)より18高かった。したがって、それらは、対象分子の水和誘導体、例えば、ニトリル基がアミドに加水分解された生成物類似体:
【化23】

であるようだ。
【0102】
触媒同士で観察された異なる挙動は、使用された窒素パージにおける差のためであると考えられる。効率の弱いパージが、ホウ酸及びトリフラートの実験において使用されたので、それが幾つかの水の侵入を許してしまったのであろう(そして、生成物の加水分解が起こったのであろう)。
【特許請求の範囲】
【請求項1】
ジルコニウム含有触媒、ハフニウム含有触媒、鉄含有触媒、コバルト含有触媒、スズ含有触媒、チタン含有触媒、アンモニウム塩触媒、及びボロン酸含有触媒から選択された触媒の存在下で、式(IV):
【化1】

のカルボン酸に式(V):
【化2】

のアルコールを反応させる工程を含む、式(III):
【化3】

{式中、
R1は、水素、アルキル、ハロアルキル、又はハロゲンであり;
R2は、水素、アルキル、ハロアルキル、又はハロゲンであり;
R3は、水素、シアノ又はアルキニルであり;
Arは、所望により置換されているアリール又はヘテロアリール基である}
の化合物の製造方法。
【請求項2】
触媒が、ジルコニウム化合物、ハフニウム化合物、アンモニウム塩又はボロン酸化合物である、請求項1に記載の方法。
【請求項3】
触媒がジルコニウム(IV)化合物である、請求項2に記載の方法。
【請求項4】
触媒が、ZrCl4又はその溶媒和物である、請求項3に記載の方法。
【請求項5】
触媒が、ZrCl4若しくはその溶媒和物、HfCl4若しくはその溶媒和物、Ph2NH2+OTf−又はホウ酸である、請求項1に記載の方法。
【請求項6】
R1及びR2は、独立して、水素、ハロゲン、C1−C4アルキル及びC1−C4ハロアルキルから選択される、請求項1〜5のいずれか1項に記載の方法。
【請求項7】
R3は、水素、シアノ又はC3−C4アルキニルから選択される、請求項1〜6のいずれか1項に記載の方法。
【請求項8】
Arが、水素、ハロゲン、ヒドロキシル、ニトロ、シアノ、C1−C4アルキル、C1−C4ハロアルキル、及びフェノキシから選択される1つ以上の基で置換されているフェニルである、請求項1〜7のいずれか1項に記載の方法。
【請求項9】
式(IV)のカルボン酸が、式(VIII):
【化4】

を有する、請求項1〜8のいずれか1項に記載の方法。
【請求項10】
式(V)のアルコールが、式(IX):
【化5】

を有する、請求項1〜9のいずれか1項に記載の方法。
【請求項11】
式(V)のアルコールが、式(XI):
【化6】

を有する、請求項1〜9のいずれか1項に記載の方法。
【請求項12】
テフルトリン(VII):
【化7】

を製造するための請求項10に記載の方法。
【請求項13】
ラムダシハロトリン(X):
【化8】

を製造するための請求項11に記載の方法。
【請求項14】
ガンマシハロトリン(XIV):
【化9】

を製造するための請求項11に記載の方法。
【請求項1】
ジルコニウム含有触媒、ハフニウム含有触媒、鉄含有触媒、コバルト含有触媒、スズ含有触媒、チタン含有触媒、アンモニウム塩触媒、及びボロン酸含有触媒から選択された触媒の存在下で、式(IV):
【化1】

のカルボン酸に式(V):
【化2】

のアルコールを反応させる工程を含む、式(III):
【化3】

{式中、
R1は、水素、アルキル、ハロアルキル、又はハロゲンであり;
R2は、水素、アルキル、ハロアルキル、又はハロゲンであり;
R3は、水素、シアノ又はアルキニルであり;
Arは、所望により置換されているアリール又はヘテロアリール基である}
の化合物の製造方法。
【請求項2】
触媒が、ジルコニウム化合物、ハフニウム化合物、アンモニウム塩又はボロン酸化合物である、請求項1に記載の方法。
【請求項3】
触媒がジルコニウム(IV)化合物である、請求項2に記載の方法。
【請求項4】
触媒が、ZrCl4又はその溶媒和物である、請求項3に記載の方法。
【請求項5】
触媒が、ZrCl4若しくはその溶媒和物、HfCl4若しくはその溶媒和物、Ph2NH2+OTf−又はホウ酸である、請求項1に記載の方法。
【請求項6】
R1及びR2は、独立して、水素、ハロゲン、C1−C4アルキル及びC1−C4ハロアルキルから選択される、請求項1〜5のいずれか1項に記載の方法。
【請求項7】
R3は、水素、シアノ又はC3−C4アルキニルから選択される、請求項1〜6のいずれか1項に記載の方法。
【請求項8】
Arが、水素、ハロゲン、ヒドロキシル、ニトロ、シアノ、C1−C4アルキル、C1−C4ハロアルキル、及びフェノキシから選択される1つ以上の基で置換されているフェニルである、請求項1〜7のいずれか1項に記載の方法。
【請求項9】
式(IV)のカルボン酸が、式(VIII):
【化4】

を有する、請求項1〜8のいずれか1項に記載の方法。
【請求項10】
式(V)のアルコールが、式(IX):
【化5】

を有する、請求項1〜9のいずれか1項に記載の方法。
【請求項11】
式(V)のアルコールが、式(XI):
【化6】

を有する、請求項1〜9のいずれか1項に記載の方法。
【請求項12】
テフルトリン(VII):
【化7】

を製造するための請求項10に記載の方法。
【請求項13】
ラムダシハロトリン(X):
【化8】

を製造するための請求項11に記載の方法。
【請求項14】
ガンマシハロトリン(XIV):
【化9】

を製造するための請求項11に記載の方法。
【公表番号】特表2011−520827(P2011−520827A)
【公表日】平成23年7月21日(2011.7.21)
【国際特許分類】
【出願番号】特願2011−508879(P2011−508879)
【出願日】平成21年5月11日(2009.5.11)
【国際出願番号】PCT/EP2009/055649
【国際公開番号】WO2009/138373
【国際公開日】平成21年11月19日(2009.11.19)
【出願人】(500371307)シンジェンタ リミテッド (141)
【出願人】(500584309)シンジェンタ パーティシペーションズ アクチェンゲゼルシャフト (352)
【Fターム(参考)】
【公表日】平成23年7月21日(2011.7.21)
【国際特許分類】
【出願日】平成21年5月11日(2009.5.11)
【国際出願番号】PCT/EP2009/055649
【国際公開番号】WO2009/138373
【国際公開日】平成21年11月19日(2009.11.19)
【出願人】(500371307)シンジェンタ リミテッド (141)
【出願人】(500584309)シンジェンタ パーティシペーションズ アクチェンゲゼルシャフト (352)
【Fターム(参考)】
[ Back to top ]

