エタノール産生のための組み換えホスト細胞及び培地
【課題】生育及びエタノールの高収率産生のために最適化されている組み換えホスト細胞、及びこれら細胞の作製及び使用方法を提供する。これら組み換え微生物によるエタノールの経済的な産生のために最適化されている新規な培地を提供する。
【解決手段】生育及びエタノールを高収率で産生するために最適化されている、オリゴサッカライドを分解するのに適している組み換えホスト細胞、及びこれらの細胞の作製及使用方法。組み換え微生物による経済的なエタノール産生のための、尿素様化合物を含有する最小培地。新規な単離されたポリヌクレオチド配列、ポリペプチド配列、ベクター及び抗体。
【解決手段】生育及びエタノールを高収率で産生するために最適化されている、オリゴサッカライドを分解するのに適している組み換えホスト細胞、及びこれらの細胞の作製及使用方法。組み換え微生物による経済的なエタノール産生のための、尿素様化合物を含有する最小培地。新規な単離されたポリヌクレオチド配列、ポリペプチド配列、ベクター及び抗体。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願)
本発明は、2005年7月1日出願の米国特許仮出願第60/696,076号の優先権を主張し、その全ての内容を参照として本明細書に明確に組み込む。
【0002】
(米国政府との利害関係に関する声明)
本発明に対する資金は、米国農務省の助成金第01−35504−10669号、及び米国エネルギー省のFG02−96ER20222号に基づき、米国政府により一部が提供された。米国政府は、本発明に対するある特定の権利及び資格を有している。
【背景技術】
【0003】
自動車用燃料としてエタノールの使用は、石油ベースの燃料に対してよりクリーンな燃焼で再生可能な代替をもたらす[1]。エタノール生産のために最近用いられている技術は、別の市場を有している、サトウキビ汁(糖蜜)及びコーンスターチのような食用穀物をベースにしている[2]。これら原料のコストは、総生産コストの40%に相当すると予測されている[3]。一方、食用ではないリグノセルロースバイオマスは、石油と対抗できるコストで入手できる[4]。リグノセルロース糖をエタノールに変換するための改良された微生物の継続的な開発により、石油への依存の減少及び現存の植物原料からの新規な製造の可能性がもたらされる。
【0004】
クレブシエラ・オキシトカ(Klebsiella oxytoca)のエタノール産生株が開発されている[5,6]。これらの菌株は、リグノセルロースバイオマス由来の各種糖単量体(グロコース、キシロース及びアラビノースのような)を代謝することが示されている[5〜7]。このような菌株は、セルロースでの同時糖化発酵(SSF)処理においてよく機能することができる[8〜10]。K.オキシトカP2として知られているK・オキシトカのエタノール産生株は、オリゴサッカライドのエタノールへの変換に関与する酵素である、ピルビン酸デカルボキシラーゼ(pdc)及びアルコールデヒドロゲナーゼ(adhB)をコードするザイモモナス・モビリス(Zymomonas mobilis)の遺伝子を含有していることが記載されている。これらの遺伝子は、P2株のゲノム中に染色体上で組み込まれている。
【0005】
大腸菌(Escherichia coli)の類似株と対照的に、K.オキシトカは、セロビオース、セロトリオース、キシロビオース、キシロトリオース及びアラビノシドを包含する、リグノセルロースバイオマスから多くの可溶性生成物を代謝するという潜在的な能力を有している[6、14、15]。pH5.2(菌体酵素にほぼ最適な)でリグノセルロースから不完全に加水分解された生成物を効率的に代謝するK.オキシトカP2の能力は、同時糖化発酵(SSF)処理時に更なる利点を提供する[8]。これらの条件下で、K.オキシトカP2は、サッカロミセス・セレビジア(Saccharomyces cerevisiae)が同等の発酵速度及び収率を達成するのに必要とする菌体セルロースの半分以下を必要とするだけである[9]。
【0006】
高いエタノール産生及び収率を支援する、メタノール産生の細菌を生育するための安価な工業用培地の入手が、バイオマス原料からのエタノール生産にとって必須である[17、18]。しかしながら、穀物とは異なって、セルロースバイオマスの加水分解物は、本質的に栄養が乏しいので、これを補給しなけらばならない[16]。従って、エタノール産生のためのK.オキシトカP2の以前の使用では、酵母抽出物及びDifco Tryptone(登録商標)のような実験室用の栄養物を含有する、複合の生育培地中での細胞の培養を必要としていた。しかしながら、リグノセルロースからエタノールのような汎用化学品の商業的な生産にこのような栄養物を使用することは実用的ではない。
【発明の概要】
【発明が解決しようとする課題】
【0007】
組み換えエタノール産生の細菌株をエタノール源として提供する可能性を実現化するためには、安価な最小培地中での生育時に効率的にエタノールを産生できる細菌のような新規及び改良された株、並びにこれらの細胞を支援できる新規な培地が、明らかに必要である。
【課題を解決するための手段】
【0008】
本発明は、生育及びエタノールの高収率産生のために最適化されている組み換えホスト細胞、及びこれら細胞の作製及び使用に関する。本発明は更に、組み換え微生物によるエタノールの経済的な産生のために最適化されている新規な培地に関する。
【0009】
微生物よる発酵時に、培地中の糖含有基質は、エタノール及び多くの不要な副生成物に変換される。本発明による組み換え細胞は、エタノール以外の1つ又はそれ以上の生成物の産生の原因となる遺伝子を制御(例えば、下方規制)するように遺伝子操作によって改変され、これにより突然変異していない親株に比べて、これらの細胞による糖からのエタノール産生を増大させる。組み換え細菌の新規及び改良された株は、安価な試薬を含有する最小生育培地中での発酵に適した条件下で生育させる場合、優れたエタノール産生及び収率を達成することができる。ある特定の株は、最適化培地の特定な態様において、優れたエタノール産生のために最適化される。エタノール産生のために最適化されたシステムは、選択最適化最小培地と選択培地中での使用のために最適化された組み換えホスト細胞を組み合わせたものである。好ましいシステムは、リグノセルロースをサッカライド源として用いるSSFによる効率的なエタノール産生に適している。
【0010】
従って、本発明の一態様は、
(a)糖をエタノールに変換する酵素をコードする非相同性ポリヌクレオチド配列(ここにおいて、ホスト細胞は、細菌による主要発酵生成物としてのエタノールの産生を促進するのに十分な機能レベルで、非相同性ポリヌクレオチド配列を発現する)、及び
(b)細胞の代謝経路において、糖からエタノール以外の生成物を産生するタンパク質をコードする少なくとも1つのポリヌクレオチド配列中の突然変異(ここにおける突然変異は、前記突然変異がない細胞によるエタノール産生に比べて、この細胞による増大したエタノール産生をもたらす)、
を含んでなる、サッカライドを分解するのに適している組み換えホスト細胞である。
組み換えホスト細胞のある態様では、この突然変異は、欠失、挿入又は塩基置換の突然変異である。
【0011】
本発明による組み換えホスト細胞は、細菌、真菌若しくは酵母のような単細胞又は多細胞の微生物、並びに線虫、昆虫、は虫類、鳥、両生動物、及び哺乳動物類を含む高等真核生物を包含する適当なホスト生物から作製することができる。酵母ホスト細胞は、例えば、サッカロミセス属(Saccharomyces)、シゾサッカロミセス属(Schizosaccharomyces)、ハンゼヌラ属(Hansenula)、パチオソレン属(Pachyosolen)、クルベロミセス属(Kluyveromyces)、デバリオミセス属(Debaryomyces)、ヤロウイア属(Yarrowia)及びピキア属(Pichia)由来である。細菌性ホスト細胞は、グラム陽性及びグラム陰性細菌から選ばれる。好ましいグラム陰性細菌は、エルウィニア属(Erwinia)及びクレブシエラ属(Klebsiella)の株のような腸内細菌である。グラム陽性細菌性ホスト細胞は、バチルス属(Bacillus)、ゲオバチルス属(Geobacillus)、クロストリジウム属(Clostridium)、連鎖球菌(Streptococcus)及びセルロモナス属(Cellulomonas)を包含する。
【0012】
本発明による細菌性ホスト細胞のある態様では、非相同性ポリヌクレオチド配列が、糖のエタノールへの変換に関与する酵素である、アルコールデヒドロゲナーゼ及び/又はピルビン酸デカルボキシラーゼをコードする。
【0013】
組み換え細胞のある態様は、クレブシエラ・オキシトカ(Klebsiella oxytoca)由来ののもので、これは尿素を窒素源として用いる固有の能力を有している。これらの株は、尿素様化合物を決められた窒素源として含有する最小培地で用いるためのホスト生物として特に適している。このような適しているホスト株の1つは、クレブシエラ・オキシトカP2株(ATCC55307)である。
【0014】
上記のように、本発明による組み換えホスト細胞は、細胞の代謝経路において糖からエタノール以外の生成物を産生するタンパク質をコードする少なくとも1つのポリヌクレオチド配列中に突然変異を含んでいる。細胞の種々の態様では、エタノール以外の生成物は、ホルメート、ラクテート、スクシネート、アセテート、アセトイン、ブタンジオール、2,3−ブタンジオール、キシリトール、ブチレート、ピルベート、プロピオネート、イソプロピルアルコール、1−プロパノール、2−プロパノール、プロパンジオール、シトレート、グルタメート及びアセトンから選ばれる。
【0015】
組み換え細胞の一態様では、代謝経路は、ブタンジオール経路である。この経路からもたらされる糖代謝の副生成物は、アセトイン及び2,3−ブタンジオールであって、これらはそれぞれαーアセトラクテート・デカルボキシラーゼ及びαーアセトラクテート・シンターゼによって産生される。従って、ある態様では、細胞は、ブタンジオール代謝経路に関与する酵素をコードする少なくとも1つのポリヌクレオチド配列中に突然変異を含んでいる。突然変異したポリヌクレオチド配列は、budA、budB、budR若しくはbudC遺伝子、又はこれらのホモログ若しくは機能的変異体のヌクレオチド配列を含有することができる。ある態様では、budA及びbudB遺伝子の片方又は両方に欠失突然変異を含んでいる。この欠失突然変異は、細胞において酵素αーアセトラクテート・デカルボキシラーゼ及びαーアセトラクテート・シンターゼのうちの少なくとも片方、好ましくは両方の発現を低減又は消去して、この細胞によるエタノール産生を、突然変異がない細胞によるエタノール産生に比べて増大させる。
【0016】
上記細菌株の何れも、遺伝子組み換え用の遺伝子を得るために、そしてある態様では変更の遺伝子配列を含有するDNA断片の再挿入を行うためのホストとして供用するために、使用することができる。
【0017】
本発明による組み換え細菌性ホスト細胞のある好ましい態様は、BW15(NRRLB−30857)、BW19(NRRLB−30858)及びBW21(NRRLB−30859)を包含するクレブシエラ・オキシトカ株によって代表され、これらは国立農業利用研究センター(National Center for Agricultural Utilization Research;Peoria, IL, USA)の農業研究サービス培養コレクション(Agricultural Reserch Service Culture Collection; ARSCC)に2005年6月28日付けで寄託された。
【0018】
他の態様では、本発明は、サッカライド源からエタノールを産生する方法を提供する。サッカライド源を、上記のような本発明による組み換えホスト細胞に接触させて、サッカライド源からエタノールを産生する。
【0019】
本発明は更に、サッカライド源からエタノールを産生するために最適化した組み換えホスト細胞を作製する方法を提供する。この方法は、
(a)エタノール産生の親ホスト細胞を、親細胞によってエタノールを産生するのに適した条件下で、選択培地及びオリゴサッカライド源に接触させること、
(b)選択された条件下の培地中で前記サッカライド源から産生されるエタノールのレベルを測定すること、
(c)選択された条件下の培地中で増大した発現を有する望ましくない副生成物を同定するために、サッカライド源から産生されるエタノール以外の少なくとも1つの生成物のレベルを測定すること、そして
(d)代謝経路において、望ましくない副生成物を産生するタンパク質をコードする遺伝子のポリヌクレオチド配列を突然変異させ(ここにおける突然変異は、代謝経路中の少なくとも1つの遺伝子産物の発現を低減又は消去して、突然変異なしの親細胞によるエタノール産生に比べて、前記細胞によるエタノール産生を増大させる)、これによりサッカライド源からのエタノール産生を最適化した組み換えホスト細胞を作製すること;
を含んでなる。
【0020】
本方法のある態様は更に、遺伝子の突然変異を包含する単離されたポリヌクレオチド断片を作製すること、及びこの突然変異したポリヌクレオチド断片を親細胞へ導入することを含んでなる。この方法のある態様では、突然変異は欠失、挿入、又は塩基置換である。
【0021】
本方法のある態様では、細胞は、最小培地でエタノールを産生するように最適化される。上記の適切なホスト細胞は何れも、本方法で最適化されるための親ホスト細胞株として使用することができる。
【0022】
更なる別な態様では、本発明は、サッカライドを分解するのに適した組み換えホスト細胞による生育及びエタノール産生を支援する新規な最小培地を提供する。本発明による培地は、決められた窒素源;コーンスティープリカー(CSL)、酵母自己消化物及び/又は抽出物、トウモロコシ加工副産物、大豆加工副産物又は使用済みの発酵培養液のような複合の窒素源;ホスフェイト源;及びマグネシウム源を包含する。
【0023】
最小培地のある態様は、尿素様化合物を決められた窒素源として含んでいる。本発明による尿素をベースとする最小培地の各種態様では、尿素窒素の濃度が、約0.1〜100mM、好ましくは約2.0〜20mM、そしてより好ましくは約8〜12mMである。低い製造コストとするために、本発明の最小培地は、複合の窒素源、例えばコーンスティープリカー(CSL)の低濃度を含有することもできる。幾つかの態様では、CSLの濃度は、約0.1〜100g/L、好ましくは約1〜20g/L、そしてより好ましくは約5〜10g/Lである。
【0024】
最小培地のある態様は、サッカライドを分解するのに適している組み換えホスト細胞による、生育及びエタノール産生を支援するために最適化されている。例えば、ある培地は、これらを同時糖化発酵での使用に適合できるように、酸性pHでの生育及びエタノール産生を支援するように最適化される。
【0025】
本発明によるある培地は、上記の方法で作製された本明細書に記載の組み換えホスト細胞による、生育及びエタノール産生を支援するように最適化されている。1つの好ましい態様は、クレブシエラ・オキシトカの組み換え株による、生育及びエタノール産生を支援するように最適化された培地である。
【0026】
本発明による培地は、サッカライド源を更に包含することができる。ある態様では、サッカライド源は、リグノセルロースを包含する。本発明の新規な培地における尿素様化合物の使用は、細菌培養の生育培地で通常用いられている、ペプトンのようなタンパク性の窒素源及びアンモニアのような低分子の窒素源に比べて、その窒素源としてのコストが比較的低いので、特に利点がある。
【0027】
単離されたポリヌクレオチド配列、これらの配列を含んでいるベクター及び単離されたポリペプチド配列も、本発明の範囲である。これらの配列は、本発明による単離されたポリヌクレオチド配列を発現する組み換えホスト細胞の構築、及びこれらの配列に突然変異を含んでいる組み換えホスト細胞の構築を含む、多くの用途で有用である。
【0028】
多様な態様では、本発明は、単離されたポリペプチドを提供する。従って、一態様では、本発明は、SEQ ID NO:6又は7のアミノ酸配列を包含するポリペプチドの断片を提供し、ここにおける断片は、SEQ ID NO:6又は7の少なくとも15個の連続したアミノ酸を含んでいる。
【0029】
別な態様は、SEQ ID NO:6又は7のアミノ酸配列を包含するポリペプチドの天然型対立遺伝子多型であり、ここにおけるポリペプチドは、厳しい条件下でSEQ ID NO:3又は4を含有する核酸分子にハイブリダイズする、核酸分子によってコードされる。
【0030】
他の態様は、SEQ ID NO:3又は4のヌクレオチド配列を包含する核酸に対して少なくとも60%同一であるヌクレオチド配列を包含する、核酸分子によってコードされるポリペプチド;及びSEQ ID NO:6又は7のアミノ酸配列に対して少なくとも50%同一のアミノ酸配列を包含するポリペプチドを含む。
【0031】
本発明の別の態様は、α−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼタンパク質のうちの少なくとも1つをコードする細菌遺伝子のポリヌクレオチド中に欠失突然変異を包含する、ベクターである。このベクターは、細菌性ホスト細胞に組み入れられると、このタンパク質の発現を低減又は消去することができる。
【0032】
本発明は更に、本発明のタンパク質/ポリペプチドに特異的に結合する、モノクローナル抗体又はポリクローナル抗体のような、抗体を特徴とする。
【0033】
ある態様では、突然変異したポリヌクレオチド配列は、クレブシエラ種のbudA及びbudBから選ばれる遺伝子に由来する。このポリヌクレオチド配列は、budA及びbudBの両方での欠失突然変異を含むことができる。
【0034】
このタイプの好ましいベクターは、α−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼタンパク質をコードする細菌性遺伝子のポリヌクレオチド配列中に欠失突然変異を包含し、ここにおけるベクターは、細菌性ホスト細胞に組み入れられる場合、これら遺伝子産物の発現を低減又は消去することができる。
【0035】
このようなベクターの一態様は、SEQ ID NO:5に対して少なくとも80%同一である、突然変異したbudABポリヌクレオチド配列を包含する。別の態様は、SEQ ID NO:8に対して少なくとも80%同一である、突然変異したbudABポリヌクレオチド配列を包含する。
【0036】
本発明によるベクターの特別な態様は、ポリヌクレオチド配列が、クレブシエラ種のbudA及びbudBから選ばれる遺伝子に由来する、プラスミドである。典型的なプラスミドは、本明細書ではpLOI3310又はpLOI3313と示される。
【0037】
本発明の更なる態様は、サッカライドを分解するのに適している組み換えホスト細胞によるサッカライド源からのエタノール産生に最適化されているシステムである。このシステムは、
(a)選択条件下でのホスト細胞による最適な生育及びエタノール産生を支援する選択培地;
(b)サッカライド源;及び
(c)選択培地及び条件でのエタノール産生のために最適化されている組み換えホスト細胞(この細胞は、
糖をエタノールに変換する酵素をコードする非相同性ポリヌクレオチド配列(ここにおいて、当該細胞は、当該ホスト細胞による主要発酵生成物としてのエタノールの産生を促進するのに十分な機能レベルで、当該非相同性ポリヌクレオチド配列を発現する);及び
当該細胞の代謝経路において、前記条件下及び培地中で当該サッカライド源からエタノール以外の生成物を産生するタンパク質をコードする少なくとも1つのポリヌクレオチド配列中の突然変異(ここにおける突然変異は、当該タンパク質の発現を低減又は消去し、これにより当該ホスト細胞によるエタノール産生を、突然変異がない細胞によるエタノール産生に比べて増大させて、エタノール産生を最適化する)を包含する)、
を含んでなる。
【0038】
このシステムの一態様では、発酵反応が、最小培地中で行われる。ある態様では、この最小培地は、上記のような尿素ベースの培地である。
【0039】
本発明による選択培地中でのエタノール産生に最適化された適切な組み換えホスト細胞の何れも、このシステムで使用できる。
【0040】
このシステムのある態様では、サッカライド源が、リグノセルロースを包含する。
【0041】
リグノセルロースをサッカライド源として用いる、SSFで使用するのに適している本発明のあるシステムでは、選択培地が上記のような尿素ベースの最小培地であり、そして組み換えホスト細胞が、ブタンジオール経路でのタンパク質をコードする遺伝子中に欠失突然変異を包含するクレブシエラ・オキシトカの株である。
【0042】
更に別の態様では、本発明は、本発明の方法又はシステムによる組み換えホスト細胞の使用についての説明書と共に包装されている、上記の組み換えホスト細胞を包含するキットを提供する。
本発明の他の態様及び利点は以下で論じる。
【図面の簡単な説明】
【0043】
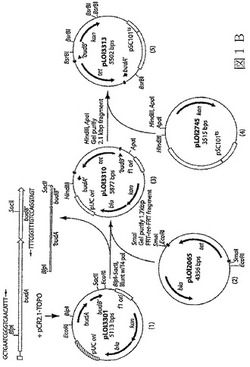
【図1A】図1は、本発明の態様によるブタンジオール経路のbudAB遺伝子を欠如した、エタノール産生の組み換え細菌の構築で用いるベクター構築物及び工程を示す説明図である。 図1Aは、オペロン及び転写調節を示す略図である。○で囲んである+印は、budABオペロンの発現が低いpHで増大し、そしてBudR及びFnrによって正に調節されることを示す。
【図1B】図1B(左上部)は、クローンbudAB’に用いられるPCRプライマーを示す。この図の下部において、本発明の態様による最小培地でのエタノール産生のために最適化された、エタノール産生の組み換え細菌の構築に用いるプラスミド(例えば、pLOI3301)が、図式的に示され、番号で示されている。
【図2−1】図2A〜2Dは、本発明の態様による各種最小培地及び90g/Lのグルコースを含有するL培地での、エタノール産生の微生物K.オキシトカP2の組み換え株による発酵を示す4つのグラフである。図2A及び2Bは、LB培地及びアンモニア窒素を含有する培地での結果を示す。記号:▲−LB;○−M9+Fe;■−0.5%CSL+M。
【図2−2】図2A〜2Dは、本発明の態様による各種最小培地及び90g/Lのグルコースを含有するL培地での、エタノール産生の微生物K.オキシトカP2の組み換え株による発酵を示す4つのグラフである。図2C及び2Dは、尿素窒素を用いた培地での結果を示す。記号:○−U−M9+Fe;■−U−0.5%CSL+M;●−OUN1。標準誤差は、n≧3でデータに含まれている。
【図3】図3A及びBは、本発明の態様によるK.オキシトカP2株に最適化した尿素ベースの最小培地(OUM1)での、K.オキシトカP2によるグルコースのエタノールへの発酵の態様を示す。データは、各種濃度のコーンスティープリカー(図3A)及び尿素(図3B)を包含する培地で、48時間のフラスコ培養による生育(斜線の棒、OD550)及びエタノール産生(塗りつぶした棒)を示している。標準誤差は、n≧3でデータに含まれている。
【図4】図4A及び4Bは、K.オキシトカのエタノール産生株による生育及びエタノール産生(90g/Lグルコース)における、budAB遺伝子の欠失生成物の効果を示す2つのグラフである。図4Aは生育を示し;図4Bはエタノール産生を示す。記号:○−BW21株(ΔbudAB);●−P2株(親)。標準誤差は、n≧3でデータに含まれている。改善されたエタノール産生は、糖基質からエタノール以外の生成物を産生する競合の代謝経路に関わる、budAB遺伝子が欠如している突然変異株によって達成された。
【図5】図5は、本発明の態様による組み換え細菌(親株P2、及びbudAB欠失のある突然変異株BW21)による、エタノールの収率及び生産性の比較を示している。欠失の株によるエタノール産生は、親株の産生を上回っている。
【0044】
(発明の詳細な説明)
I.定義
本明細書で用いる「組み換えホスト細胞」、「組み換え微生物」などの用語は、遺伝子操作、例えば、トランスフェクトされるような非相同性ポリヌクレオチド配列を取り込むことができる遺伝子操作に、適しているか又は操作しやすい細胞、又はそのように操作されている細胞を包含するように意図されている。前記細胞は、微生物又は高度な真核細胞であり得る。前記用語は、もともとトランスフェクトされている細胞の子孫を含むように意図されている。ある態様では、細胞は、細菌の細胞、例えば、グラム陽性細菌の細胞又はグラム陰性細菌の細胞である。後者の用語は、エシェリキア属、赤痢菌、シトロバクター属、サルモネラ属、クレブシエラ属、エンテロバクター属、エルウィニア属、クルイベラ属、セラチア属、セデセア属、モルガネラ属、ハフニア属、エドワードシエラ属、プロビデンシア属、プロテウス属及びエルシニア属のような、腸内細菌科(family Enterobacteriaceae)の条件嫌気性のグラム陰性細胞の全てを含むように意図されている。好ましい組み換えホストは、大腸菌又はクレブシエラ・オキシトカの細胞である。
【0045】
「非相同性ポリヌクレオチドセグメント」又は「非相同性ポリヌクレオチド配列」という用語は、1つ又はそれ以上のポリペプチド又はポリペプチドの部分若しくは断片をコードするポリヌクレオチドセグメントを含むように意図されている。非相同性ポリヌクレオチドセグメントは、何れかの供給源、例えば真核生物、原核生物、ウィルス、又は合成ポリヌクレオチド断片から由来していてもよい。「非相同性ポリヌクレオチド配列」という用語は、生命体に自然に存在していないポリヌクレオチド配列、例えば生命体に導入された配列も示すことができる。一態様では、ポリヌクレオチド配列の遺伝子は、糖質のエタノールへの生物変換の少なくとも一工程に関与する。従って、この用語は、アルコールデヒドロゲナーゼ、ピルビン酸デカルボキシラーゼ、分泌タンパク質(複数を含む)、又はポリサッカラーゼ(例えば、エンドグルカナーゼ又はエクソグルカナーゼのようなグルカナーゼ)、セロビオヒドロラーゼ、β−グルコシダーゼ、エンド−1,4−β−キシラナーゼ、β−キシロシダーゼ、α−グルクロニダーゼ、α−L−アラビノフラノシダーゼ、アセチルエステラーゼ、アセチルキシランエステラーゼ、α−アミラーゼ、β−アミラーゼ、グルコアミラーゼ、プルラナーゼ、β−グルカナーゼ、ヘミセルラーゼ、アラビノシダーゼ、マンナナーゼ、ペクチンヒドロラーゼ、又はペクチン酸リアーゼのような、ポリペプチドをコードする遺伝子の何れかを含むように意図されている。
【0046】
「ポリサッカラーゼ」、「セルラーゼ」又は「グルカナーゼ」という用語は、本明細書では互換的に使用され、結合糖成分、例えば、ジサッカライド、トリサッカライド、オリゴサッカライド(本明細書では複合糖とも呼ばれる複合糖質、例えば、セルロース、へミセルロース及びペクチンを含む、セロオリゴサッカライド及びリグノセルロースを包含する)の何れかを、触媒的な分解又は脱重合できるポリペプチドを含むように意図されている。この用語は、グルカナーゼのようなセルラーゼを包含するように意図されているが、好ましくは、エンドグルカナーゼを含み、これらに限定されないが、例えば、エクソグルカナーゼ、β−グルコシダーゼ、セロビオヒドロラーゼ、エンド−1,4−β−キシラナーゼ、β−キシロシダーゼ、α−グルクロニダーゼ、α−L−アラビノフラノシダーゼ、アセチルエステラーゼ、アセチルキシランエステラーゼ、α−アミラーゼ、β−アミラーゼ、グルコアミラーゼ、プルラナーゼ、β−グルカナーゼ、ヘミセルラーゼ、アラビノシダーゼ、マンナナーゼ、ペクチンヒドロラーゼ、ペクチン酸リアーゼ又はこれらのセルラーゼの何れかの組み合わせも含むように意図されている。
【0047】
「エンドグルカナーゼ」という用語は、一般にポリマー基質内の内部β1−4グルコシル結合を加水分解し、そして鎖の末端にある結合を優先的に加水分解しないセルラーゼを包含するように意図されている。
「サッカライド」、「サッカライド源」、「オリゴサッカライド源」、「オリゴサッカライド」、「複合セルロース」、「複合糖質」、「複合糖」、「ポリサッカライド」、「糖源」、「発酵性糖源」などの用語は、1つ又はそれ以上の糖分子を包含する何れかの糖質源を含むように意図されている。
【0048】
本明細書で用いるような用語「サッカライド」という用語は、例えば、ジサッカライド、トリサッカライド、オリゴサッカライド及びポリサッカライドを含む。これらの糖質は、何れかの未処理植物原料又は何れかの加工植物原料からの由来であってもよい。例としては、1つ又はそれ以上の結合の糖質部分、すなわち1個の糖残基を包含する、木材、紙、パルプ、植物由来の繊維又は合成繊維である。
【0049】
一つの具体的なサッカライド源は、「リグノセルロース」であり、これは、殆どの植物材料の乾燥重量の約90%に相当し、そして糖質、例えば、セルロース、ヘミセルロース、ペクチン及び芳香族ポリマー(例えば、リグニン)を含む。セルロースは、リグノセルロースの乾燥重量の30%〜50%を占め、そしてセロビオース(グルコースの2量体)のホモポリマーである。同様に、ヘミセルロースは、リグノセルロースの乾燥重量の20%〜50%を占め、そしてアセチル及びグルクロニル側鎖を含有するペントース(キシロース、アラビノース)及びヘキソース(グルコース、マンノース、ガラクトース)糖の混合物を含む複合ポリマーである。ペクチンは、リグノセルロースの乾燥重量の1%〜20%を占め、そしてグルクロン酸のメチル化ホモポリマーである。
【0050】
その他のサッカライド源は、カルボキシメチルセルロース(CMC)、非晶性セルロース(例えば、酸膨張セルロース(acid-swollen cellulose))、及びセロオリゴサッカライドセロビオース、セロトリオース、セロテトラオース、及びセロペンタオースを含む。セルロース、例えば、非晶性セルロースは、紙又はパルプ源(例えば、それらの廃液を含む)又は例えば、トウモロコシの茎、大豆可溶分、又はビートパルプのような農業副産物からの由来であってよい。上記糖質ポリマーの何れか一つ又はそれらの組み合わせは、本発明の生成物及び方法による発酵によって、解重合及び続くエタノールへの生物変換のための糖源になり得る。
【0051】
「核酸」という用語は、例えば、ポリペプチドをコードするオープンリーディングフレームを含み、そして更に非コード調節配列及びイントロンを含むことができるポリヌクレオチド配列の核酸分子を包含するように意図されている。本発明による核酸分子は、DNA分子(例えば、線状、環状、cDNA又は染色体のDNA)、RNA分子(例えば、tRNA、rRNA、mRNA)及びヌクレオチド類似体を用いて産生されたDNA又はRNAの類似体を包含する。核酸分子は、一本鎖又は二本鎖であってもよいが、二本鎖DNAの方が有利である。
【0052】
本発明の「単離された」核酸分子は、核酸由来の生命体の染色体DNA中の核酸分子の元来側面にある配列(つまり、核酸分子の5’及び3’末端に位置する配列)を有していない核酸分子を包含する。多くの態様では、単離された核酸分子は、核酸分子が由来する微生物の染色体DNA中の核酸分子の元来側面にあるヌクレオチド配列の約10kb、5kb、4kb、3kb、2kb、1kb、0.5kb、0.1kb、50bp、25bp又は10bp以下を含有することができる。更に、cDNA分子のような、単離された核酸分子は、組み換え技術で作製される場合には他の細胞物質が実質的になくてよく、又は化学的に合成される場合には化学前駆物質又は他の化学品が実質的になくてよい。
【0053】
本明細書で用いる「遺伝子」という用語は、例えば、ポリペプチドをコードする連続オープンリーディングフレーム(ORF)のようなコーディング配列を包含してもよく、又はそれ自身が生体内で機能を有していてもよい、酵素又はその他のポリペプチド分子を直接合成することができる核酸である。生体内の遺伝子は、本明細書で明示されるように、オペロンに集合させることができ、ここにおけるオペロンは、遺伝子間DNAによって他の遺伝子及び/又はオペロンから分離される。オペロン中に含まれる個々の遺伝子は、個々の遺伝子の間にある遺伝子間DNAなしで、重なり合うことができる。遺伝子の一態様は、ブタンジオールの代謝経路に関わるタンパク質、α−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼをそれぞれコードする、クレブシエラのbudA及びbudBのような機能的な遺伝子座又はオペロンに位置する1つ又はそれ以上の遺伝子である。更に、「遺伝子」という用語は、選択された目的のための特定の遺伝子を包含するように意図されている。遺伝子は、ホスト細胞に内因性であってもよいし、例えばエピソームに保持されたプラスミド又はゲノムに安定に組み入れられたプラスミド(又はその断片)のように、ホスト細胞に組み換え技術によって導入されていてもよい。
【0054】
本明細書に記載されているような「単離された遺伝子」は、遺伝子が由来する生命体の染色体DNA中の遺伝子の元来側面にある配列を実質的に含まない(すなわち、第2若しくは別個のポリペプチド又はRNA分子、隣接する構造配列等、をコードする隣接コーディング配列を含まない)遺伝子を包含し、そして5’及び3’調節配列、例えば、プロモーター配列及び/又は終結配列を包含していてもよい。一態様では、単離された遺伝子は、ポリペプチドを主にコードする配列(例えば、ポリペプチドをコードする配列)を包含する。
【0055】
本明細書で用いる「ホモログ」という用語は、ポリペプチド、又は野生型ポリペプチド若しくは本明細書に記載のポリペプチドのアミノ酸配列に対して少なくとも約30〜35%、有利には少なくとも約35〜40%、より有利には約40〜50%、そして更に有利には少なくとも約60%、70%、80%、90%又はそれ以上の同一性を共有し、そして野生型ポリペプチド又はポリペプチドと実質的に同等な機能又は生物学的活性を有しているポリペプチドを含む。従って、「ホモログ」という用語は、「機能的な変異体」を、更には「オーソログ」(異なった種から得られる同等の遺伝子)をも包含するように意図されている。
【0056】
例えば、budA又はbudBホモログは、それぞれSEQID NO:6及びSEQID NO:7で示されているアミノ酸配列を有するポリペプチドに対して、少なくとも約30〜35%、有利には少なくとも約35〜40%、より有利には約40〜50%、そして更に有利には少なくとも約60%、70%、80%、90%又はそれ以上の同一性を共有し、そしてSEQID NO:6又はSEQID NO:7と示されているアミノ酸配列を有するペプチドと実質的に同等な機能又は生物学的活性(すなわち機能的に同等である)を有している(例えば、実質的に同等なα−アセトラクターゼ・デカルボキシラーゼ又はα−アセトラクターゼ・シンターゼ活性を有している)。核酸の遺伝子産物、又は本発明によるそのホモログの機能活性の測定法は公知であって、以下の実施例に記載されている。
【0057】
一態様では、遺伝子は、糖質を生物変換してエタノール以外の生成物を産生する少なくとも一つの工程に関わる。このような生成物を本明細書では、「副生成物」又は「発酵副生成物」と呼ぶ。副生成物は、糖質(サッカライド)基質をエタノール産生に利用される以外の競合の代謝経路に転換することによって収量を減少させるので、エタノール発酵反応においては一般に望ましくない。従って、一態様では、後者の経路(例えば、ブタンジオール経路)に関わる酵素のようなタンパク質をコードする遺伝子は、細胞から除くのが望ましい目標であるので本発明では重要である。微生物中にあって糖質のエタノール以外の生成物への生物変換に関わる遺伝子の例は、細菌のbudA及びbudBであって、これらは糖質源からブタンジオール及びアセトインの合成に関わる、α−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼをそれぞれコードする。その他の重要な遺伝子は、糖発酵のその他の望ましくない副生成物(これらに限定されないが、ホルメート、ラクテート、スクシネート、アセテート、アセトイン、キシリトール、ブチレート、ピルベート、プロピオネート、イソプロピルアルコール、1−プロパノール、2−プロパノール、プロパンジオール、シトレート、グルタメート及びアセトンを含む)を産生する代謝経路に関わるものを包含する。
【0058】
本明細書で用いる「対立遺伝子多型(複数を含む)」は、機能的な及び非機能的なタンパク質の両方を包含する。機能的な対立遺伝子多型は一般に、SEQ ID NO:6又は7の1つ又はそれ以上のアミノ酸の同類置換のみを含むか、又はタンパク質の非臨界領域中の非臨界残基において置換、欠失又は挿入を含む。非機能的な対立遺伝子多型は一般に、SEQ ID NO:6又は7のアミノ酸の非同類置換、欠失、又は挿入若しくは中途切断を含むか、又は臨界的残基又は臨界的領域における置換、挿入又は欠失を含む。
【0059】
本発明のポリヌクレオチド又はアミノ酸配列は更に、その他の系統群メンバー又は関連する配列、例えば、遺伝子がクローン化されていない生体内のbudA及びbudBに関連する遺伝子を同定するために、公共のデータベースで検索するための「クエリー配列」として用いることができる。このような検索は、「Altschul, et al. (1990) J. Mol. Biol. 215;403-10」のNBLAST及びXBLASTプログラム(バージョン2.0)を用いて実施することができる。BLASTヌクレオチド検索は、本発明のポリヌクレオチド分子と相同なヌクレオチド配列を求めるために、NBLASTプログラム(スコア=100、語長=12)で実行することができる。BLASTタンパク検索は、本発明のポリヌクレオチド分子と相同なアミノ酸配列を求めるために、XBLASTプログラム(スコア=50、語長=3)で実行することができる。比較するためのギャップ配列を得るためには、「Altschul et al., (1997) Nucleic Acids Res. 25 (17):3389-3402」に記載のようにして、Gapped BLASTを用いることできる。BLAST及びGapped BLASTプログラムを用いるときは、それぞれのプログラムのデフォルトパラメータ(例えば、XBLAST及びNBLAST)を用いることができる。「http://www.ncbi.nlm.nih.gov」を参照されたい。
【0060】
本明細書で用いる「突然変異」は、1つ又はそれ以上の染色体の異常、又は遺伝子を作っているDNA配列の変化の何れかに関わる、生体の遺伝因子における比較的永久的な変化を示すように意図されている。本明細書で用いるような突然変異は、DNA配列の欠失又は挿入によるか、1つ又はそれ以上の塩基の変換(例えば、点突然変異)によるか、重複、ミスセンス、反復又はナンセンス突然変異によるかの何れかによって作製されたDNA配列の変化を包含する。挿入、欠失及び塩基置換の突然変異を作製する方法は、当該技術分野で公知であり、そして例えば、「Sambrook et al. 」[26] の論文に記載されている。
【0061】
「発酵(fermentation)」及び「発酵する(fermenting)」という用語は、複合糖を分解又は解重合して、この糖残渣をエタノール、アセテート及びスクシネートに生物変換することを含むように意図されている。この用語は、エタノールが、特に主要な発酵生成物として糖質から産生される、酵素の処理工程(例えば、細胞性又は無細胞性(例えば、溶解又は精製されたポリペプチド混合物)を包含するように意図されている。
【0062】
「同時糖化発酵」又は「SSF」という用語は、複合糖の分解又は解重合、及び発酵によるその糖残基のエタノールへの生物変換を同時に行うための、1つ又はそれ以上の組み換えホスト(又は、それらの抽出物(精製又は未精製の抽出物を含む))の使用を含むことを意図している。SSFは、バイオマスを分解して、最終的に細菌でエタノールに変換されるポリサッカライドにすることができる、公知の方法である。バイオマスの分解が自然に起こるものと見なすと、SSFは、菌類(又は菌類から抽出されるセルラーゼのような酵素)の活性と、エタノール産生の細菌(又はそれから誘導される酵素)の活性を組み合わせて、リグノセルロースのような糖源をエタノールに最終的に変換可能な単糖に分解する。SSF反応は一般に、高価な菌体酵素の使用を最適化するために酸性のpHで実施される。
【0063】
「転写制御」という用語は、転写のレベルで遺伝子の発現を調節する能力を含むように意図されている。好ましい態様では、転写及びそれによる遺伝子の発現は、対象の遺伝子のコード領域の5’末端付近に代用プロモーターを置換又は付加することによって調節し、これにより遺伝子発現の変化をもたらす。好ましい態様では、1つ又はそれ以上の遺伝子の転写制御は、このような遺伝子の最適発現、例えば好ましい比率をもたらすように改変される。この用語は、当該技術分野で認識されているような誘導の転写制御も含む。
【0064】
「発現」という用語は、少なくともmRNA生成レベルでの遺伝子の発現、及びポリペプチドレベルでもよい遺伝子の発現を含むように意図されている。
【0065】
「発現生成物」という用語は、発現された遺伝子により得られた生成物、例えばポリペプチド又はタンパク質を含むように意図されている。
【0066】
「増大した発現」及び「低減した発現」という用語は、少なくともmRNA生成レベルでの遺伝子の発現、そして好ましくはポリペプチド又はタンパク質発現のレベルでの遺伝子発現における変化(それぞれ、上方制御及び下方制御)を含むように意図されている。
【0067】
ポリペプチドに関する「増大した産生」及び「低減又は消滅した産生」という用語はポリペプチドの酵素活性レベルでの、ポリペプチド発現量における増大若しくは低減、又はそれらの組み合わせを含むように意図されている。
【0068】
「活性」及び「酵素活性」という用語は、互換的に用いられ、そして好ましい条件下で生成される場合に選択されたポリペプチドによって通常もたらされる機能的な活性の何れをも含むように意図されている。α−アセトラクテート・デカルボキシラーゼ酵素(budAによってコードされる)の活性は、例えば、糖質源からアセトイン生成物を産生することである。α−アセトラクテート・デカルボキシラーゼのような活性を検出するための技術は、当該技術分野において公知であり(例えば、「Blomqvist et al.」 [35] を参照されたい)、そして本明細書の実施例に記載されている。
【0069】
「由来(の)」という用語は、表記された原料からポリヌクレオチド断片の単離(全部又は部分)、又は表記された原料からポリヌクレオチドの精製を含むように意図されている。この用語は、例えば、直接的なクローニング、PCR増幅、又は表示されたポリヌクレオチド原料に関連する配列由来の若しくはそれに基づく人工的な合成を含むように意図されている。本明細書に記載の検討において、例えば、ブタンジオール経路に関連する遺伝子産物をコードするヌクレオチド配列は、細菌クレブシエラ・オキシトカのゲノムDNAから増幅されたbudA及びbudB由来である。
【0070】
「エタノール産生の」という用語は、糖質から主要発酵生成物としてエタノールを産生する微生物の能力を含むように意図されている。この用語は、これらに限定されないが、天然由来のエタノール産生の微生物、天然由来の又は導入された突然変異を有する微生物、及び遺伝子的に改変された微生物を含む。
【0071】
「エタノール非産生の」という用語は、糖質から主要な非気体の発酵生成物としてエタノールを産生できない細胞を含むように意図されている。この用語は、非気体の発酵生成物の総量の40%より少ない、例えば20%、30%、40%を包含する少量発酵生成物としてエタノールを産生する微生物を含むように意図されている。
【0072】
「主要発酵生成物」という用語は、非気体発酵生成物の総量の約40%、50%、60%、70%、80%、85%、90%、91%、92%、93%、94%、95%より多くを含有する非気体発酵生成物を含むように意図されている。主要発酵生成物は、最も多い非気体生成物である。本発明のある態様では、主要発酵生成物が、エタノールである。更なる態様では、主要発酵生成物が、最小塩培地で生育するホストによって産生される。
【0073】
本明細書で用いる「少量発酵生成物」という用語は、非気体生成物の総量の40%より少ない、例えば20%、30%、40%を含有する非気体発酵生成物を含むように意図されている。
【0074】
「グラム陰性細菌」及び「グラム陽性細菌」という用語は、これらの用語の当該技術分野で認識されている定義のものを含むように意図されている。一般に、グラム陰性細菌は、例えば、エシェリキア属、赤痢菌、シトロバクター属、サルモネラ属、クレブシエラ属、エンテロバクター属、エルウィニア属、クルイベラ属、セラチア属、セデセア属、モルガネラ属、ハフニア属、エドワードシエラ属、プロビデンシア属、プロテウス属及びエルシニア属よりなる、腸内細菌科を包含する。その他のグラム陰性細菌は、これらに限定されないが、アシネトバクター属(Acinetobacter)、グルコノバクター属(Gluconobacter)、ジオバクター属(Geobacter)及びシェワネラ属(Shewanella)を包含する。グラム陽性細菌は、これらに限定されないが、バチルス属、ゲオバチルス属、クロストリジウム属、連鎖球菌、セルロモナス属、コリネバクテリウム属(Corynebacterium)、ラクトバチルス属(Lactobacillus)、ラクトコッカス属(Lactococcus)、オエノコッカス属(Oenococcus)及び真正細菌(Eubacterium)を含む。
【0075】
「決められた窒素源」という用語は、個別の窒素源、すなわち、本発明で使用するのに適している窒素源として提供可能な、単一の化学物質を意味するように意図されている。決められた窒素源の例としては、例えば、尿素及びアンモニアを含む。ある態様では、2つ又はそれ以上の決められた窒素源を用いることができる。
【0076】
「決められた窒素源」と区別される「複合の窒素源」という用語は、本発明で使用するのに適している窒素源を共に提供する、化学物質の混合物を含むように意図されている。
【0077】
「尿素」という用語は、式:(NH2)2COを有する有機化合物を示す。本明細書で用いる「尿素様化合物」という用語は、一般式:R1N−(C=O)−NR2を有する尿素の多様な類縁体/誘導体を含む。尿素様化合物及びこれらの化合物の製造方法は、例えば、Muziらの米国特許第6,875,764号(2005)に記載されており、この開示の全ては本明細書に参照として取り込まれている。
【0078】
II.発酵の副生成物をもたらす代謝経路のタンパク質をコードする遺伝子において突然変異を包含する組み換えホスト細胞
検討したように、本発明はサッカライドを分解するのに適している、新規及び改良された組み換えホスト細胞に関する。この細胞は、発酵の不要な副生成物産生の代謝経路に関連する1つ又はそれ以上の遺伝子における突然変異を包含する。これらの経路の変動は、サッカライド出発原料のより多くの割合を、他の不要な発酵生成物ではなく、エタノールへ変換させる。
【0079】
従って、ある態様では、本発明は、サッカライドを分解するのに適した組み換えホスト細胞を提供する。この細胞は、糖をエタノールに変換する酵素をコードする非相同なポリヌクレオチド配列を含有している。このホスト細胞は、主要発酵生成物としてエタノールの産生を促進するのに十分な機能レベルで非相同なポリヌクレオチド配列を発現する。組み換えホスト細胞は更に、糖源からエタノール以外の生成物を産生する、細胞の代謝経路のタンパク質をコードする少なくとも1つのポリヌクレオチド配列中に突然変異を包含する。この突然変異の存在は、代謝経路の少なくとも1つのタンパク質の発現を低減又は消去し、これによりこの突然変異なしの組み換え細胞によるエタノール産生に比べて、この細胞によるエタノール産生を増大させる。
【0080】
サッカライドの分解に適している組み換えホスト細胞は、線虫、昆虫、は虫類、鳥、両生動物、及び哺乳動物のような高等真核生物の細胞であってよい。細胞は、細菌、酵母若しくは真菌のような単細胞又は多細胞微生物の細胞であってもよい。本発明による組み換え酵母細胞は、例えば、サッカロミセス属、シゾサッカロミセス属、ハンゼヌラ属、パチオソレン属、クルベロミセス属、デバリオミセス属、ヤロウイア属及びピキア属由来のものである。
【0081】
本発明による幾つかの細菌性ホスト細胞は、グラム陽性細菌由来である。この細胞のある具体例は、例えば、バチルス属、ゲオバチルス属、クロストリジウム属、連鎖球菌及びセルロモナス属由来である。
【0082】
その他の細菌性ホスト細胞は、グラム陰性細菌由来である。ある態様では、この細菌は条件的嫌気性である。好ましい条件的嫌気性細胞は、腸内細菌科から選ばれ、これらに限定されないが、エシェリキア属、赤痢菌、シトロバクター属、サルモネラ属、クレブシエラ属、エンテロバクター属、エルウィニア属、クルイベラ属、セラチア属、セデセア属、モルガネラ属、ハフニア属、エドワードシエラ属、プロビデンシア属、プロテウス属、及びエルシニア属を含む。
【0083】
検討したように、本発明の組み換えホスト細胞は、糖をエタノールに変換する酵素をコードする非相同性ポリヌクレオチド配列の1つ又はそれ以上を包含する。従って、これらの細胞は、エタノール産生である。エタノール産生の組み換えホスト細胞の構築に用いるためのに適切なポリヌクレオチド配列は、例えば、ザイモモナス・モビリスのような、細菌の天然由来のエタノール産生株の遺伝子をコードすることができる。糖をエタノールに変換する2つの好ましい非相同性遺伝子は、アルコールデヒドロゲナーゼ(adh)及びピルビン酸デカルボキシラーゼ(pdc)を包含する。本発明の組み換え細胞は、これらの遺伝子の片方又は両方を包含し、そして更に糖のエタノールへの変換を補助するポリサッカラーゼのような酵素をコードするその他の非相同性ヌクレオチド配列を含んでいてもよい。好ましい非相同性遺伝子は、細菌の染色体中に組み込まれる。
【0084】
エタノール産生の組み換えホスト細胞を作製する方法は、分子生物学の分野で公知である。適当な材料、方法及び組み換えホスト生物は、例えば、参照として本明細書に組み込まれている、米国特許第6,849,434号、同第6,333,181号、同第5,821,093号、同第5,482,846号、同第5,424,202号、同第5,028,539号、同第5,000,000号、同第5,487,989号、同第5,554,520号、及び同第5,162,516号に記載されており、そして本発明を実施するために利用することができる。
【0085】
ある態様では、組み換えホスト細胞は、腸内細菌科由来のエタノール産生のグラム陰性細菌である。例えば、参照として本明細書に組み込まれている米国特許第5,821,093号のエタノール産生のホストは、ホストに適しており、そして特に、以下で検討する、大腸菌KO4株(ATCC55123)、KO11(ATCC55124)、KO12(ATCC55125)及びクレブシエラ・オキシトカP2株(ATCC55307)を含む。あるいは、本発明のエタノール非産生のホストは、糖をエタノールに変換する1つ又はそれ以上の適当な酵素をコードする非相同性ポリヌクレオチド配列を付加することによって、エタノール産生のホストに変換することができる。
【0086】
本発明の幾つかの態様では、エタノール産生の組み換えホスト細胞が、エルウィニア属又はクレブシエラ属由来である。クレブシエラ・オキシトカ由来の組み換えホストは、ペントースとヘキソースの共発酵の効率、毒素に対する抵抗、複合サッカライドを解重合する酵素の産生(真菌性セルラーゼ添加による解重合の必要性を避けるか若しくは減じる)及び環境耐性を含む多くの便宜性を有していて、リグノセルロースのSSFに特に適している。
【0087】
エタノール産生性クレブシエラ属ホスト細胞に適しているものの1つは、K.オキシトカM5A1の誘導体のK.オキシトカP2(「Wood, et al. (1992) Appl. Environ. Microbiol. 58:2103-2110」及び米国特許第5,821,093号を参照されたい)である。有利なことに、K.オキシトカ株は、尿素を窒素源として使用できる固有の能力を有している。一態様では、エタノール産生の組み換え細菌は、少なくとも1つのエンドグルカナーゼ(例えば、EGY又はEGZ)をコードする少なくとも1つの非相同性ポリヌクレオチド断片(例えば、エルウィニア属由来のcelY又はcelZ)を含有している。より好ましくは、エタノール産生の組み換えホスト細胞が、エンドグルカナーゼをコードする1つ又はそれ以上の非相同性ポリヌクレオチド断片を含有している。例えば、米国特許出願公開第2004/015990号公報に記載されているような、celY及びcelZは、機能的に組み込まれ、発現され、そしてエタノール産生の株K.オキシトカP2から分泌されて、同時にサッカライド基質(例えば結晶性セルロース)からエタノールを産生することができる。
【0088】
上記で検討したように、SSFによるエタノール産生の工程は、組み換えホスト細胞によりエタノール以外の不要な発酵副生成物の産生が伴うことは公知である。基質である糖の、エタノール以外の生成物を産生する別の代謝経路への転換は、別の経路がない場合の理論的な可能性より低い生産性及び収率をもたらす。本発明による組み換えホスト細胞は、不要な副生成物の産生能力を減少した又は産生できないことの効果によって、この問題を低減するように改変される。この細胞の各種態様では、選択された発酵副生成物を産生する能力を低減又は消去するように、改変される。組み換えホスト細胞のある態様は、これらに限定されないが、ホルメート、ラクテート、スクシネート、アセテート、アセトイン、ブタンジオール、2,3−ブタンジオール、キシリトール、ブチレート、ピルベート、プロピオネート、イソプロピルアルコール、1−プロパノール、2−プロパノール及びアセトンを包含する、副生成物を産生できないことである。
【0089】
上記のように不要な副生成物の産生を不能にするために、本発明による組み換えホスト細胞の幾つかの具体例は、糖原料からエタノール以外の生成物を産生する、細胞中の代謝経路のタンパク質をコードする1つ又はそれ以上のポリヌクレオチド配列中に欠失突然変異を含有している。この細胞の幾つかの具体例は、細胞において糖からホルメート、ラクテート、スクシネート、アセテート、アセトイン、ブタンジオール、2,3−ブタンジオール、キシリトール、ブチレート、ピルベート、プロピオネート、イソプロピルアルコール、1−プロパノール、2−プロパノール、又はアセトンを産生する1つ又はそれ以上の代謝経路に関わるタンパク質をコードするポリヌクレオチド配列中に欠失突然変異を有している。
【0090】
欠失突然変異に関する本発明の一態様は、細胞の選択された代謝経路と関連すると知られている、「はじき出し(knocking out)」遺伝子に関する。細菌細胞のような細胞に存在する、選択された代謝生成物を産生する生物化学的な経路についての解明が進んでいる。糖からのエタノール以外の生成物(例えば、ホルメート、ラクテート、スクシネート、アセテート、アセトイン及び2,3−ブタンジオールのような生成物)を産生するための細菌のような細胞に存在する代謝経路は報告されており、例えば、化学文献の検索によって容易に確認することができる。
【0091】
ホルメート、ラクテート、スクシネート、アセテート、アセトイン、ブタンジオール、2,3−ブタンジオール、キシリトール、ブチレート、ピルベート、プロピオネート、イソプロピルアルコール、1−プロパノール、2−プロパノール又はアセトンを産生する代謝経路に関わるタンパク質又はその機能的な断片をコードする遺伝子のノックアウトは、糖発酵のこのような不要な副生成物の産生ができない組み換えホストをもたらす。
【0092】
組み換えホスト細胞の幾つかの態様では、欠失突然変異は、ブタンジオール代謝経路に関わる酵素をコードする少なくとも1つのポリヌクレオチド配列中にある。この経路は、細菌細胞により糖原料からアセトイン及び2,3−ブタンジオールの産生をもたらす。幾つかの態様では、欠失突然変異が、酵素α−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼをそれぞれコードする、budA及びbudBの片方又は両方にある。ブタンジオール経路によるこれらの副生成物の産生は、これら2つの酵素の作用によって引き起こされる。これらの酵素の発現を低減又は消去する欠失突然変異は、糖原料からアセトイン及び2,3−ブタンジオールの産生ができないエタノール産生の組み換えホスト細胞をもたらし、これにより、この突然変異が存在しない組み換え細胞と比べて、糖原料からの増大したエタノール産生を示す。
【0093】
本発明によって提供されるホスト細胞のある態様は、budA及びbudB遺伝子の両方に欠失突然変異を含有しているエタノール産生の組み換え細菌である。これらの遺伝子に欠失を保持する1つの好ましいホスト細胞は、K.オキシトカBW21と称されている、K.オクトシカP2の変異株である。以下に示すように、この株は窒素源として尿素様化合物を含有する最小培地でのエタノール産生に有利に用いることができ、そして酸性のpH範囲の培地で行われる発酵反応で用いるのに特に適している。
【0094】
III.単離された核酸分子及びポリペプチド
別の態様では、本発明は、酵素α−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼをそれぞれコードする、budA及びbudB遺伝子配列を包含する単離された核酸分子を特徴としている。この核酸は、グラム陰性及びグラム陽性の細菌、例えば、グラム陰性細菌であるクレブシエラ・オキシトカ由来である。
【0095】
単離されたゲノム核酸は、ブタンジオール経路の上記遺伝子(すなわち、budA及びbudB)、及び調節領域(例えば、プロモーター(複数を含む)及びリボソーム結合部位(複数を含む))を包含する側面にある領域、更にエタノール産生に関わる、例えば、アルコールデヒドロゲナーゼ(adh)及びピルビン酸デカルボキシラーゼ(pdc)のような他の関連する遺伝子を包含することを特徴とする。
【0096】
検討したように、本発明は、とりわけクレブシエラ株由来のbudA及びbudB遺伝子のそれぞれをコードする配列の全長若しくは部分を、コードする新規な核酸を提供する。これらの遺伝子は、これらの遺伝子によってコードされる酵素の活性からもたらされる不要な発酵副生成物の増大した産生を発見することによって単離された。より具体的には、これら副生成物の産生が、上記のOUMのような望ましい、安価な生育培地中で実施される発酵反応において、エタノール産生の細菌中で増大することが、実証された。
【0097】
これらの生成物の産生を消去するために、エタノール産生の生成細胞の副生成物を作る能力を消去するために遺伝学的戦略を立てた。一例として、budA及びbudBの一部をコードする遺伝子を最初にクレブシエラ・オキシトカからクローンした。次いで単離された配列を、効力がないようにするために、budB遺伝子の大きな断片を除去する遺伝子操作を実施した。budA及びbudB遺伝子はこれまで、クレブシエラ・オキシトカから単離されたことがない。従って、本発明はある態様で、新規なDNA配列、及びこれらのDNA配列に基づく予測アミノ酸配列を提供する。
【0098】
本発明による新規な核酸の一態様は、SEQ ID NO:3又は4に記載されているヌクレオチド配列を包含する単離された核酸分子である。SEQ ID NO:3として本明細書で示されている核酸は、タンパク生成物であるα−アセトラクテート・デカルボキシラーゼをコードする、クレブシエラ・オキシトカのbudA遺伝子からの推定全長コード配列に対応する。SEQ ID NO:4として本明細書で示されている核酸は、タンパク生成物であるα−アセトラクテート・シンターゼをコードする、同種のbudB遺伝子からの部分コード配列に対応する。
【0099】
本発明のその他の新規な配列は、SEQ ID NO:3及び4に対応する推定アミノ酸配列であり(以下に記載する)、これらは本明細書でそれぞれSEQ ID NO:6及び7で示されている。
【0100】
本発明による核酸の一態様は、SEQ ID NO:6又は7と記載されているアミノ酸配列を包含するポリペプチドをコードする単離された核酸分子である。
【0101】
本発明は更に、SEQ ID NO:6又は7と記載されているアミノ酸配列を包含するポリペプチドの天然型対立遺伝子多型をコードする単離された核酸分子である。
【0102】
別の態様では、単離された核酸分子は、SEQ ID NO:6又は7と記載されているアミノ酸配列を包含するポリペプチドのホモログをコードする。更なるbudA及びbudBの核酸配列は、SEQ ID NO:6又はSEQ ID NO:7と記載されているアミノ酸配列を含有しているポリペプチドのホモログをコードする(例えば、SEQ ID NO:6又はSEQ ID NO:7と記載されているアミノ酸配列を含有しているポリペプチドに対して、少なくとも30%、40%、50%、60%、70%、80%、90%、95%又はそれ以上同一であり、このポリペプチドと実質的に同一の活性を有するポリペプチドをコードする)ものである。
【0103】
更なる他の態様は、以下の単離された核酸分子を含む。一態様は、SEQ ID NO:3若しくは4のヌクレオチド配列又はそれらの相補体に対して、少なくとも60%同一であるヌクレオチド配列を包含する核酸分子である。多くの態様では、本発明の単離された核酸分子は、本明細書でSEQ ID NO:3又はSEQ ID NO:4と記載されている核酸配列に対して、少なくとも約60〜65%、有利には少なくとも約70〜75%、より好ましくは少なくとも約80〜85%、そしてより有利には少なくとも約90〜95%又はそれ以上同一であるヌクレオチド配列を包含する。
【0104】
更なる別な態様は、SEQ ID NO:3若しくは4のヌクレオチド配列又はそれらの相補体を包含する核酸の、少なくとも100個のヌクレオチド断片を包含する核酸分子である。
【0105】
本発明による核酸分子は、SEQ ID NO:6又は7のアミノ酸配列に対して、少なくとも50%同一であるアミノ酸配列を包含するポリペプチドをコードするものであってもよい。
【0106】
別の態様は、SEQ ID NO:6又は7のアミノ酸配列を包含するポリペプチドの断片をコードする核酸分子であって、ここにおける断片は、SEQ ID NO:6又は7のアミノ酸配列の少なくとも15個の連続したアミノ酸残基を包含する。
【0107】
別の態様では、単離された核酸分子は、厳しい条件下で、SEQ ID NO:3又はSEQ ID NO:4と記載される核酸配列を有している核酸分子にハイブリダイズする。別の態様では、単離されたbudA又はbudBの核酸分子は、SEQ ID NO:6又はSEQ ID NO:7のアミノ酸配列を有するポリペプチドをコードするヌクレオチド配列を有する核酸分子の全部又は部分にハイブリダイズする。
【0108】
適当なハイブリダイゼーション条件は、当業者に公知であり、そして例えば、「Current Protocols in Molecular Biology, Ausubel et al., eds., John Wiley & Sons, Inc. (1995), sections 2, 4 and 6」に見い出すことができる。更なる厳しい条件は、「Molecular Cloning: A Laboratory Manual, Sambrook et al., Cold Spring Harbor Press, Cold Spring Harbor, NY (1989), chapters 7, 9 and 11」に見い出すことができる。
【0109】
厳しいハイブリダイゼーション条件の、特別な限定されない例として、約65〜70℃で、4×塩化ナトリウム/クエン酸ナトリウム(SSC)中のハイブリダイゼーション(又は、約42〜50℃で、4×SSC+50%のホルムアミド中のハイブリダイゼーション)、次いで約65〜70℃で、1×SSC中で1回又はそれ以上の洗浄を含む。非常に厳しいハイブリダイゼーション条件の、特別な限定されない例として、約65〜70℃で、1×SSC中のハイブリダイゼーション(又は、約42〜50℃で、1×SSC+50%のホルムアミド中のハイブリダイゼーション)、次いで約65〜70℃で、0.3×SSC中で1回又はそれ以上の洗浄を含む。低い程度の厳しいハイブリダイゼーション条件の、特別な限定されない例として、約50〜60℃で、4×SSC中のハイブリダイゼーション(又は、約40〜45℃で、6×SSC+50%のホルムアミド中の代替のハイブリダイゼーション)、次いで約50〜60℃で、2×SSC中で1回又はそれ以上の洗浄を含む。上記の値の中間の範囲、例えば、65〜70℃又は42〜50℃も本発明に含まれるものと意図されている。SSPE(1×SSPEは、0.15MのNaCl、10mMのNaH2PO4及び1.25mMのEDTA、pH7.4である)を、ハイブリダイゼーション及び緩衝液の洗浄で、SSC(1×SSCは、0.15MのNaCl及び15mMのクエン酸ナトリウムである)と置き換えることができ、ハイブリダイゼーションが完了した後、洗浄をそれぞれ15分間実施する。
【0110】
長さ50塩基対より少ないと予測されるハイブリッドのためのハイブリダイゼーション温度は、ハイブリッドの溶解温度(Tm)よりも5〜10℃低くすべきであり、このTmは、以下の式に従って決められる。
長さ18塩基対より少ないハイブリッドのためには、Tm(℃)=2(Aの数+T塩基数)+4(Gの数+C塩基数)。
長さ18〜49塩基対の範囲のハイブリッドのためには、Tm(℃)=81.5+16.6(log10[Na+])+0.41(G(%)+C)−600/N)。ここにおけるNは、ハイブリッド中の塩基の数であり、そして[Na+]は、ハイブリダイゼーション緩衝液中のナトリウムイオンの濃度(1×SSC=0.165Mに対する[Na+])である。
【0111】
当業者には認識されているが、追加の試薬を、膜(例えば、ニトロセルロース又はナイロン膜)への核酸分子の非特異的ハイブリダイゼーションを低減するために、ハイブリダイゼーション及び/又は洗浄緩衝液に加えることができる。試薬には、これらに限定されないが、ブロッキング剤(例えば、BSA又はサケ若しくはニシン精子担体のDNA)、洗浄剤(例えば、SDS)、キレート剤(例えば、EDTA)、フィコール(Ficoll)、PVP等が含まれる。ナイロン膜を使用する場合、具体的な、追加の限定されない厳しいハイブリダイゼーション条件は、約65℃における0.25〜0.5MのNaH2PO4、7%のSDS中でのハイブリダイゼーション、次いで65℃における0.02MのNaH2PO4、1%のSDS(またあるいは、0.2×SSC、1%のSDS)で1回又はそれ以上の洗浄である。例えば、「Church and Gilbert (1984) Proc. Natl. Acad. Sci. USA 81:1991-1995」を参照されたい。
【0112】
別の態様では、単離された核酸分子は、本明細書に記載のbudA又はbudBのヌクレオチド配列に相補的な(例えば、SEQ ID NO:3又はSEQ ID NO:4に記載のヌクレオチド配列に相補的な)ヌクレオチド配列を包含する。
【0113】
本発明の更なる他の態様は、突然変異budA又はbudBの核酸分子又は遺伝子を特徴としている。一般に、本明細書に記載されているような突然変異の核酸分子又は突然変異の遺伝子は、この突然変異でコードされ得るポリペプチド又はペプチドが、野生型の核酸分子又は遺伝子によってコードされるポリペプチド又はペプチドとは異なった活性を示すように、少なくとも1つの改変(例えば、塩基置換、挿入、欠失)を含むヌクレオチド配列を有している核酸分子又は遺伝子を包含する。
【0114】
本発明による単離された突然変異の核酸分子の一態様は、SEQ ID NO:5に記載されているクレブシエラ・オキシトカから突然変異したbudABヌクレオチド配列を包含する。突然変異したクレブシエラbudABヌクレオチド配列を包含する核酸の別の種類では、突然変異した(欠失した)budA及びbudBコード配列が、突然変異budA及びbudB遺伝子の間に挿入された、FRT部位が側面にあるテトラサイクリン遺伝子によって分離される。後者の配置を包含するDNA構築物は、本明細書でSEQ ID NO:8として示されている。以下の実施例4及び5も参照されたい。
【0115】
本発明の核酸分子(例えば、SEQ ID NO:3又はSEQ ID NO:4のヌクレオチド配列を有している核酸分子)は、標準的な分子生物学技術及び本明細書で提供されている配列情報を用いて単離することができる。例えば、核酸分子は、標準的なハイブリダイゼーション及びクローニング技術を用いて単離できる(例えば、「Sambrook, J., Fritsh, E.F., and Maniatis T. Molecular Cloning: A Laboratory Manual 2nd, ed., Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989」に記載のように)か、又はSEQ ID NO:3又はSEQ ID NO:4の配列に基づいて設計された合成オリゴヌクレオチドプライマーを用いるポリメラーゼ連鎖反応によって単離することができる。budAの推定全長コード配列及びbudBの部分コード配列を包含するクレブシエラ・オキシトカ及び関連する株からのDNA断片の増幅に適しているプライマーは、本明細書にSEQ ID NO:1及びSEQ ID NO:2と記載されているヌクレオチド配列を有していてもよい。本発明の核酸は、鋳型としてのcDNA、mRNA又はその代替のゲノムDNA、及び適当なオリゴヌクレオチドプライマーを用い、標準的なPCR増幅技術に従って増幅することができる。適切なPCRプライマーは、例えば、SEQ ID NO:1及び2を有するように、設計できる。
【0116】
突然変異核酸分子又は突然変異遺伝子は、改良されたα−アセトラクテート・デカルボキシラーゼ又はα−アセトラクテート・シンターゼの活性、例えば、基質親和性、熱安定性、種々のpHでの活性;又はコドンの使用(例えば、受容ホスト細胞中での改善された発現のため)を有するポリペプチドをコードすることができる。
【0117】
あるいは、本発明による突然変異核酸分子又は突然変異遺伝子は、α−アセトラクテート・デカルボキシラーゼ又はα−アセトラクテート・シンターゼ活性を低減させた、又は活性のないポリペプチドをコードすることができる。α−アセトラクテート・デカルボキシラーゼ又はα−アセトラクテート・シンターゼの発現又は活性が欠損している、クレブシエラ・オキシトカ由来の突然変異したbudABポリペプチドをコードする突然変異核酸分子は、SEQ ID NO:5又は8の配列を有することができる。α−アセトラクテート・デカルボキシラーゼ又はα−アセトラクテート・シンターゼの低減した活性又は活性がない状態を検出する方法は、公知であるか、又は例えば以下の実施例に記載されている。
【0118】
本発明は更に、異種ポリペプチドをコードする上記の核酸分子及びヌクレオチド配列の何れかを包含する単離された核酸分子を含む。ある態様では、本発明の異種ポリヌクレオチド配列は、グラム陽性又はグラム陰性細菌由来の、単離されたピルビン酸デカルボキシラーゼ(pdc)核酸配列又は遺伝子、及び/又は単離されたアルコールデヒドロゲナーゼ(adh)核酸配列又は遺伝子を包含する核酸を特徴としている。有利には、このpdc核酸又は遺伝子は、グルコノバクター属、リゾビウム属(Rhizobium)、ブラディリゾビウム属(Bradyrhizobium)、アルカリゲネス属(Alcaligenes)、ロドバクター属(Rhodobacter)、ロドコッカス属(Rhodococcus)、アゾスピリルム属(Azospirillum)、ロドスピリルム属(Rhodospirillum)、スフィンゴモナス属(Sphingomonas)、バークホルデリア属(Burkholderia)、デスルフォモナス属(Desulfomonas)、ゲオスピリルム属(Geospirillum)、スクシノモナス属(Succinomonas)、アエロモナス属(Aeromonas)、シュワネラ属(Shewanella)、ハロクロマチウム属(Halochromatium)、シトロバクター属、エシェリキア属、クレブシエラ属、ザイモモナス属(例えば、ザイモモナス・モビリス)、ザイモバクター属(Zymobacter)(例えば、ザイモバクター・パルメ(Zymobacter palmae))、及び酢酸菌属(Acetobacter)(例えば、酢酸菌パストリアヌス菌(Acetobacter pasteurianus))よりなる群から選ばれるグラム陰性微生物由来である。
【0119】
他の態様では、pdc核酸又は遺伝子は、フィブロバクター属(Fibrobacter)、アシドバクター属(Acidbacter)、バクテロイデス属(Bacteroides)、スフィンゴバクテリウム属(Sphingobacterium)、アクチノミセス属(Actinomyces)、コリネバクテリウム属、ノカルジア属(Nocardia)、ロドコッカス属、プロピオニバクテリウム属(Propionibacterium)、ビフィドバクテリウム属(Bifidobacterium)、バチルス属、ゲオバチルス属、パエニバチルス属(Paenibacillus)、スルホバチルス属(Sulfobacillus)、クロストリジウム属、アナエロバクター属(Anaerobacter)、真正細菌、連鎖球菌、ラクトバチルス属、ロイコノストック属(Leuconostoc)、エンテロコッカス属(Enterococcus)、ラクトコッカス属、サーモビフィダ属(Thermobifida)、セルロモナス属、及びサルシナ属(Sarcina)(例えば、サリシナ・ベントリキュリ(Sarcina ventriculi))よりなる群から選ばれるグラム陽性微生物由来である。
【0120】
上記で検討のように、本発明の別な態様は、新規な単離されたポリペプチド(例えば、ブタンジオール代謝経路で活性な単離された酵素、例えばクレブシエラ・オキシトカ由来のα−アセトラクテート・デカルボキシラーゼ又はα−アセトラクテート・シンターゼ)を特徴としている。一態様では、ポリペプチドは、組み換えDNA技術によって作製されて、本発明の微生物から、標準的なポリペプチド精製技術を用いる適切な精製スキームによって単離できる。別の態様では、ポリペプチドは標準的なペプチド合成技術を用いて、化学的に合成される。
【0121】
単離又は精製されたポリペプチド(例えば、単離又は精製されたα−アセトラクテート・デカルボキシラーゼ又はα−アセトラクテート・シンターゼ)は、ポリペプチドが由来している微生物からの細胞物質又はその他の夾雑ポリペプチドを実質的に含まない、また化学合成の場合には化学的な前駆物質又はその他の化学物質を実質的に含まない。一態様では、単離又は精製されたポリペプチドは、約30%(乾燥重量で)以下の夾雑ポリペプチド又は化学物質、より有利には約20%以下の夾雑ポリペプチド又は化学物質、更により有利には約10%以下の夾雑ポリペプチド又は化学物質、そして最も有利には約5%以下の夾雑ポリペプチド又は化学物質を有している。
【0122】
一態様では、本発明の単離されたポリペプチド(例えば、単離されたα−アセトラクテート・デカルボキシラーゼ又は単離されたα−アセトラクテート・シンターゼ酵素)は、それぞれSEQ ID NO:6又はSEQ ID NO:7に示されているようなアミノ酸配列を包含する。
【0123】
別の態様では、本発明の単離されたポリペプチドは、SEQ ID NO:6又はSEQ ID NO:7に記載されているポリペプチドの少なくとも1つのホモログである(例えば、SEQ ID NO:6又はSEQ ID NO:7のアミノ酸配列に対して、少なくとも約30〜40%同一の、有利には少なくとも約40〜50%同一の、より有利には少なくとも約50〜60%同一の、更により有利には少なくとも約60〜70%、70〜80%、80〜90%、90〜95%又はそれ以上同一のアミノ酸配列を包含し、そしてそれぞれSEQ ID NO:6又はSEQ ID NO:7のアミノ酸配列によってコードされるポリペプチドと実質的に同じ活性を有している)。
【0124】
2つのアミノ酸配列又は2つの核酸の同一性の割合を測定するために、最適な比較を目的として配列を整列させる(例えば、第1のアミノ酸又は核酸配列にギャップを導入することで、第2のアミノ酸又は核酸配列と最適な位置合わせができる)。第1配列の位置が、第2配列中の対応する位置と同じアミノ酸残基又はヌクレオチドで占められている場合、この分子はその位置で同一である。2つの配列間の同一性の割合は、配列が共有する同一性の位置数の関数である(すなわち、同一性(%)=同一性の位置の数/位置の総数×100)であり、最適な位置合わせとするために必要なギャップの数及びそのギャップの大きさを計算に取り入れることが有利である。
【0125】
配列の比較及び2つの配列間の同一性の割合の測定は、数学アルゴリズムを用いて実行することができる。配列の比較に用いられる数学アルゴリズムの、特別な非限定的な例は、KarlinとAltschulのアルゴリズム(Karlin and Altschul (1990) Proc. Natl. Acad. Sci. USA 87:2246-68)であり、「Karlin and Altschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-77」として改良されている。このようなアルゴリズムは、AltschulらのNBLAST及びXBLASTプログラム(バージョン2.0;Altschul et al. (1990) J.Mol. Biol. 215:403-10)に組み込まれる。本発明の核酸分子に相同な核酸配列を得るために、NBLASTプログラム(スコア=100、語長=12)でBLASTヌクレオチド検索を実施することができる。本発明のポリペプチド分子に相同なアミノ酸配列を求めるために、XBLASTプログラム(スコア=50,語長=3)でBLASTポリペプチド検索を実施することができる。比較のためのギャップのある位置合わせを得るために、「Altschul et al. (1997) Nucleic Acids Research 25 (17):3389-3402」に記載のように、Gapped BLASTを用いることができる。BLAST及びGapped BLASTプログラムを使用する場合は、それぞれのプログラムのデフォルト・パラメータ(例えば、XBLAST及びNBLAST)を用いることができる。「http://www.ncbi.nlm.nih.gov」を参照されたい。配列の比較に用いられる数学アルゴリズムの、別に特殊なその他の非限定的な例は、MyersとMillerのアルゴリズム(Myers and Miller (1988) Comput Appl Biosci. 4:11-17)である。このようなアルゴリズムは、例えば、GENESTREAMネットワークサーバー(IGH Montpellier, France) で、又はISRECサーバーで得られる、ALIGNプログラムに組み込まれる。アミノ酸配列を比較するためにALIGNプログラムを使用する場合は、PAM120の重量残渣表、12ギャップ長ペナルティー及び4ギャップペナルティー(PAM120 weight residue table, a gap length penalty of 12 and a gap penalty of 4)を用いることができる。
【0126】
別の態様では、2つのアミノ酸配列間の同一性の割合は、Blossom62マトリックス又はPAM250マトリックスの何れか、並びに12、10、8、6又は4のgap weight及び2、3又は4のlength weightを用いる、GCGソフトウェアーパッケージ中のGAPプログラムを使用して測定することができる。更なる別の態様では、2つの核酸配列間の同一性の割合は、gap weight:50及びlength weight:3を用いる、GCGソフトウェアーパッケージ(「http://www.gcg.com」で利用可能)中のGAPプログラムを使用して得ることができる。
【0127】
IV.ベクター
本発明は更に、プラスミドベクターを包含するベクター(例えば、組み換えベクター)を特徴としている。本発明によるベクターは、本明細書に記載の核酸分子(例えば、単離の又は組み換えの核酸分子及び/又は遺伝子)を含有している。特に、組み換えベクターは、本明細書に記載のような細菌遺伝子産物、有利にはbudA及びbudB遺伝子産物(例えば、SEQ ID NO:3又は4)、又はホスト細胞においてこれらの遺伝子産物の発現を低減又は消去する、突然変異のbudA及びbudB配列(例えば、SEQ ID NO:5又は8)をコードする核酸配列を包含することを特徴としている。これらの配列は、より有利には、グラム陰性又はグラム陽性細菌のbudA及びbudB遺伝子産物であり、更により有利には、クレブシエラ属又はエルウィニア属由来のbudA及びbudB遺伝子産物である。
【0128】
本発明によるベクターの一態様は、α−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼタンパク質のうちの少なくとも1つをコードする細菌遺伝子中に突然変異を包含するポリヌクレオチド配列を含み、ここにおけるベクターは、細菌ホスト細胞に組み入れられると、当該タンパク質の発現を低減又は消去することができる。
【0129】
ベクターの一態様では、ポリヌクレオチド配列が、SEQ ID NO:3又は4に記載されているヌクレオチド、又は以下に述べるようなその機能的断片を包含する、単離された核酸分子中に突然変異を包含している。この突然変異は、欠失、挿入又は塩基置換の突然変異であってよい。
【0130】
好ましい一態様では、ポリヌクレオチド配列中の突然変異は、欠失突然変異である。このタイプのベクターの幾つかの種類は、SEQ ID NO:5又は8に記載されているようなクレブシエラ・オキシトカ由来の突然変異budABポリヌクレオチド配列を包含する。その他のベクターは、SEQ ID NO:5又は8に少なくとも80%の同一性があるポリヌクレオチド配列に突然変異を包含する。
【0131】
本発明によるベクターの別な好ましい態様は、SEQ ID NO:5又は8に記載されている、突然変異budABポリヌクレオチド配列を包含するプラスミドベクターである。pLOI3310又はpLOI3313と呼ばれている、このタイプのプラスミドの例が、本明細書に記載されている。例えば、以下の実施例4及び5を参照されたい。
【0132】
本発明によるベクターの別な態様は、クレブシエラ・オキシトカ由来のタンパク質α−アセトラクテート・デカルボキシラーゼをコードする、SEQ ID NO:3に記載のポリヌクレオチド配列を包含する。
【0133】
組み換えベクター(例えば、プラスミド、ファージ、プラスミド、ウィルス、コスミド又はその他の精製された核酸ベクター)は、組み換えベクターが由来する野生型又は天然型核酸分子に含まれるものよりも、より大きな、より小さな又は異なった核酸分子を含有するように、変更、修正又は改変することができる。有利には、この組み換えベクターは、本明細書で定義されているような調節配列、例えば、プロモーター配列、終結配列及び/又は人工リボソーム結合部位(RBSs)に操作して結合できる、budA及びbudB遺伝子、又はbudA及びbudB遺伝子又はその突然変異を含んでいる組み換え核酸分子を包含する。
【0134】
一般に、budA及びbudB遺伝子又は突然変異は、ヌクレオチド配列の発現(例えば、増強された、増大した、構成的な、定常的な、弱めた、低減した又は抑制された発現)、有利にはヌクレオチド配列によってコードされる遺伝子産物の発現(例えば、組み換え核酸分子が、本明細書で定義されているような、組み換えベクター中に含まれ、これが微生物に組み込まれているとき)を許容する形で、調節配列に操作して結合できる。
【0135】
この調節配列は、他の核酸配列の発現に影響を及ぼす(例えば、調節又は規制する)核酸配列を包含する。一態様では、調節配列は、目的の調節配列及び遺伝子で自然界に見られる、例えば天然の位置及び/又は方向で観察されるように、目的の特別の遺伝子に関連する類似又は同一の位置及び/又は方向にある組み換え核酸分子又は組み換えベクター中に含まれる。例えば、目的の遺伝子は、天然の生命体中の目的の遺伝子に付随又は隣接している調節配列に操作して結合できる(例えば、「天然の」調節配列に、例えば「天然の」プロモーターに操作して結合できる)、組み換え核酸分子又はベクター中に包含されていてもよい。あるいは、目的となる遺伝子は、天然の生命体中の他の(例えば、異なった)遺伝子に付随もしくは隣接している調節配列に操作して結合できる、組み換え核酸分子又はベクター中に包含されていてもよい。
【0136】
あるいは、目的となる遺伝子は、別の生命体由来の調節配列に操作して結合できる、組み換え核酸分子又はベクター中に包含されていてもよい。例えば、その他の微生物由来の調節配列(例えば、その他の細菌の調節配列、バクテリオファージ調節配列など)は、目的の特別な遺伝子と操作して結合することができる。
【0137】
一態様では、調節配列が、非天然の又は非天然由来の配列(例えば、化学的に合成された配列を含む、改変された、突然変異した、置換された、誘導体化された又は削除された配列)である。有利な調節配列は、プロモーター、エンハンサー、終結シグナル、抗終結シグナル及びその他の発現制御因子(例えば、転写mRNA中にある、レプレッサー又は誘導物質が結合する配列、及び/又は転写及び/又は翻訳の調節ポリペプチドの結合部位)を含む。このような調節配列は、例えば、「Sambrook, J., Fritsh, E.F., and Maniatis, T. Molecular Cloning: A Laboratory Manual. 2nd, ed., Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory press, Cold Spring Harbor, NY 1989」に記載されている。
【0138】
調節配列は、微生物中でヌクレオチド配列の構成的発現を指示するもの(例えば、構成的プロモーター又は強力構成的プロモーター);微生物中でヌクレオチド配列の誘導発現を指示するもの(例えば、誘導プロモーター、例えばキシロース誘導プロモーター);及び微生物中でヌクレオチド配列の発現を減衰又は抑制するもの(例えば、減衰シグナル又は抑制配列)を包含する。調節配列を除去又は欠失することにより目的となる遺伝子の発現を調節することも、本発明の範囲内である。例えば、負の転写調節に含まれる配列を、目的の遺伝子の発現を増大させるように除去することができる。
【0139】
一態様では、本発明の組み換え核酸分子又は組み換えベクターは、プロモーター又はプロモーター配列に操作して結合できる、少なくとも一つの細菌性budA又はbudB遺伝子産物をコードする核酸配列又は遺伝子を含む。本発明の有利なプロモーターは、天然のプロモーター、代理プロモーター(surrogate promotor)及び/又はバクテリオファージプロモーターを含む。一態様では、プロモーターは、生化学的なハウスキーピング遺伝子に関係するプロモーター又はエタノール産生の経路に関係するプロモーターである。別の態様では、プロモーターは、バクテリオファージプロモーターである。その他のプロモーターは、バチルス(例えば、バチルス・サブティリス)中で高レベルの発現を促進する、tef(翻訳伸長因子(TEF)プロモーター)及びpyc(ピルビン酸カルボキシラーゼ(PYC)プロモーター)を含む。例えば、グラム陽性細菌中で使用するための更なる有利なプロモーターは、これらに限定されないが、amyEプロモーター又はファージSP02プロモーターを含む。例えば、グラム陰性細菌中で使用するための更なる有利なプロモーターは、これらに限定されないが、tac、trp、tet、trp−tet、lpp、lac、lpp−lac、lacIq、T7、T5、T3、gal、trc、ara、SP6、λ−PR又はλ−PLを含む。
【0140】
その他の態様では、本発明の組み換え核酸分子又は組み換えベクターは、終結配列(複数を含む)(例えば、転写終結配列)を含む。一般に、終結配列は、遺伝子の転写を終結するのに役立つ調節配列を示す。終結配列(又は、タンデム転写終結因子)は更に、核酸分解酵素に対して、mRNAを安定化させる(例えば、mRNAに構造を加えることにより)のに役立てることができる。
【0141】
更なる他の態様では、本発明の組み換え核酸分子又は組み換えベクターは、当該配列を含有しているベクターの検出ができる配列(すなわち、検出可能及び/又は選択可能なマーカー)、例えば、栄養要求性変異に打ち勝つ配列、例えば、ura3又はilvE、蛍光マーカー、及び/又は比色分析用マーカー(例えば、lacZ/β−ガラクトシダーゼ)、及び/又は抗生物質耐性遺伝子(例えば、bla又はtet)を含む。
【0142】
本発明のbudA及びbudB遺伝子のうちの何れか1つは、1つ又はそれ以上のエタノール産生の遺伝子(例えば、アルコールデヒドロゲナーゼ(つまり、adh)及びピルビン酸デカルボキシラーゼ(pdc))並びに/又は例えば、米国特許第5,821,093号;5,482,846号;5,424,202号;5,028,539号;5,000,000号;5,487,989号;5,554,520号及び5,162,516号に記載されているような、糖の発酵又は発酵に続く糖の分解に適した遺伝子産物をコードする遺伝子も包含する、ベクター中に導入することができる。このような2つ又はそれ以上の遺伝子は、別の調節因子(例えばプロモーター)、共通の調節因子(複数を含む)、天然の調節因子(複数を含む)、又はこれらの組み合わせを用いて、それぞれ独立して発現することができる。
【0143】
V.遺伝子欠損を包含する組み換えホスト細胞を作製する方法
上記に検討のように、本発明による組み換えホスト細胞は、サッカライドの発酵時にエタノール以外の生成物を産生することになる、代謝経路由来のタンパク質をコードする1つ又はそれ以上のポリヌクレオチド配列中に突然変異を包含する。欠失突然変異のような突然変異を包含する微生物を作製する遺伝子法は、当該技術分野で公知である。PCRベースの遺伝子のクローニング、プラスミドの構築及び遺伝子分析のような遺伝子構築物の単離及び操作するための遺伝子技術はよく確立されていて、分子生物学の技術分野では日常的である。例えば、「Ausubel et al., 1987; Miller, 1992」及び「Sanbrook and Russell, 2001」[24〜26] のような方法論の論文を参照されたい。除去可能な抗生物質耐性遺伝子の使用を含む、染色体の欠失[22]及び組み込みを作製する方法も、記載されている[27〜29]。
【0144】
改良されたエタノール産生の特質を有する模範的な組み換えホスト細胞を作製する方法の使用を、更に以下の実施例4及び5に示す。これらの実施例は、K.オキシトカ由来のブタンジオール経路(budAB)中で遺伝子のPCRによるクローニングすること、これらの遺伝子中に欠失突然変異(ノックアウト)を作製すること、そしてこの突然変異を含有するDNA構築物をK.オキシトカP2の染色体に組み入れて、K.オキシトカB15、B19及びBW21と呼ばれる、改良された株を提供すること、の詳細な記述を提供する。B15及びB19株は、FRT側面のテトラサイクリン遺伝子の側面にある突然変異budAB配列、すなわち、本明細書でSEQ ID NO:8と示されているポリヌクレオチド配列を包含する(以下の実施例5も参照されたい)。BW21株は、BW15及びBW19株と同じ突然変異budAB配列を包含する(すなわち、本明細書でSEQ ID NO:5と呼ばれている突然変異budAB配列)が;FRT側面のテトラサイクリン遺伝子を欠損している。この遺伝子は、FLPリコンビナーゼを用いて除去した(実施例5も参照されたい)。このBW21株をテストし、親株のP2に比べて優れたエタノール産生の性質を示すことを明らかにした。
【0145】
更なる別の態様では、本発明は、サッカライド源からエタノールを産生するのに最適である組み換えホスト細胞を作製する方法を提供する。この方法は次の工程を包含している。
(a)エタノール産生の親ホスト細胞を、親細胞によるエタノール産生に適している条件下で、選択生育培地及びサッカライド源と接触させること、
(b)選択された条件下で、オリゴサッカライド源からのエタノール産生のレベルを測定すること、
(c)当該条件下で増大した発現を有する望ましくない副生成物を同定するために、サッカライド源から産生されるエタノール以外の生成物のうちの少なくとも1つ、好ましくは全てのレベルを測定すること、
(d)代謝経路において、前記の望ましくない副生成物を産生するタンパク質をコードする遺伝子のポリヌクレオチド配列を突然変異させ(ここにおける突然変異は、代謝経路中の少なくとも1つの遺伝子産物の発現を低減又は消去して、突然変異なしの親細胞によるエタノール産生に比べて、選択培地中での突然変異細胞によるエタノール産生を増大させる)、これにより選択培地中でのエタノール産生を最適化した組み換えホスト細胞を作製すること。
【0146】
この方法のある態様は更に、遺伝子の突然変異を包含する単離されたポリヌクレオチド断片を作製すること、及び突然変異ポリヌクレオチド断片を親細胞に導入することを包含する。
【0147】
有利には、この方法は、特別な培養条件下、特別な選択培地中での最適なエタノール産生のために特注される組み換えホスト細胞を構築するために提供される。特別な培地での生育によるエタノール産生の親ホスト細胞中で上方調節された副生成物の確認を含む、この方法の工程(c)は、親細胞の更なる遺伝子操作によって標的となりそして欠失される、対応する代謝経路を確認するために用いられる。
【0148】
この方法のある態様では、細胞が、最小培地でのエタノール産生のために最適化される。上記での検討のように、細菌のような組み換えホスト細胞によるエタノールの産生で用いられる生育培地のコストは、総生産コストにおいて大変重要な因子である。生産コストを抑制するために、最新の取り組みが、安価な原料由来の必須栄養素の最小量を含有する「最小培地」の開発をもたらした。(例えば、「最適化尿素培地」(OUM)と呼ばれる、本明細書で開示された新規な尿素ベースの最小培地を含む、SSFに適している幾つかの最小培地の組成を示している、以下のVI章及び表2を参照されたい。) この方法の一態様は、OUMでのエタノール産生のために最適化された細胞、例えばSSFに好ましいpHである、酸性のpHでのこの培地中で上方調節されるブタンジオール産生をコードするbudAB遺伝子中に欠失を包含する、K.オキシトカBW21を作製する。
【0149】
VI.最小培地
別の態様では、本発明は、サッカライドを分解するのに適した組み換えホスト細胞による生育及びエタノール産生を支援する最小培地を提供する。本発明の最小培地は以下の主要成分を含有している。
決められた窒素源
複合の窒素源
ホスフェイト源
マグネシウム源
任意に、FeCl2及びNiCl2のような金属イオン源が、クレブシエラ・オキシトカの誘導体のような、ある特定のエタノール産生の細菌株の酵素活性に有用なコファクターとして、培地のある態様に加えられる。
【0150】
本発明による最小培地のある態様では、決められた窒素源が、尿素様化合物である。尿素窒素の濃度範囲は、約0.1〜100mM、好ましくは約2.0〜20mM、そしてより好ましくは約8〜12mMである。
【0151】
最小培地中で使用する複合の窒素源は、これらに限定されないが、コーンスティープリカー(CSL)、酵母自己消化物及び/又は抽出物、トウモロコシ加工副産物、大豆加工副産物、及び使用済みの発酵培養液(例えば酵母、ストレプトミセス、バチルスなどの微生物を用いる発酵液から)を含む多様な源から選ぶことができる。
【0152】
最小培地のある態様は、コーンスティープリカー(CSL)を複合の窒素源として包含する。これらの培地においてCSLの好ましい濃度範囲は、約0.1〜100g/L、好ましくは約1〜20g/L、そしてより好ましくは約5〜10g/Lである。
【0153】
本明細書に記載の検討から、総ホスフェイト及びマグネシウムのような他の成分の濃度範囲は、エタノールの産生に対してあまり重要ではないということが確認されている。これらの成分の最小有効濃度は、尿素及びCSLについての上記のような実験に基づいて確認できるであろう。一般に、総ホスフェイトの有利な濃度は、約10〜100mM、そして好ましくは約10〜12mMである。好ましいマグネシウムの濃度は、約0.1〜5.0mMの範囲、そしてより好ましくは約0.25〜1.0mMの範囲である。
【0154】
一態様では、サッカライドを分解するのに適した組み換えホスト細胞による生育及びエタノール産生を支援するように最適化された最小培地を提供する。この培地のある態様は、選択された組み換えホスト細胞及び発酵の条件のために最適化される。使用されるエタノール産生の株にもよるが、最小培地の主要成分の濃度は、認容できる細胞の生育、及び糖基質の発酵時にエタノール産生の株による高レベルのエタノール産生に調和する成分の最小濃度を測定することにより費用効率に対して最適化される。(例えば、エタノール産生のK.オキシトカ株と共に使用されるのに特に適した尿素ベースの最小培地の最適化に関する、以下の実施例1〜3並びに表2及び3に記載の検討を参照されたい。)
【0155】
本発明による最適化培地のある態様は、リグノセルロースバイオマスのSSFで用いられる方法及び条件に適している。上記に検討のように、動物には食べられないリグノセルロースは、エタノール産生用の豊富で安価な出発物質である。リグノセルロースの豊富な原料は、茎、葉、殻、さや、穂軸などの植物残渣、さらに木材、木材チップ、木材パルプ及び古紙も含む廃棄物に見い出せる。SSFは、リグノセルロースバイオマスをサッカライド源として用いて実施することができる。SSF工程において、リグノセルロースを加水分解する菌体酵素(一般にセルラーゼ及びキシラナーゼ)によって可溶性の生成物が産生される。リグノセルロース生成物から生じる可溶性の生成物は、セロビオース、セロトリオース、キシロビオース、キシロトリオース及びアラビノシドを含有する。これらの可溶性の糖生成物は、同時に組み換え細菌のようなエタノール産生の微生物によってエタノールに変換される。重要なことは、SSF反応を酸性のpHで行う必要があるので、この菌体酵素が、酸性のpH(pH5.0近辺)で最適な性能を示すことである。
【0156】
上記に検討のように、エタノール産生用バイオマスの安価な原料としてのリグノセルロースの有利性に対する反論は、SSF工程で使用するエタノール産生の細菌を支援するのに必要な栄養素が乏しいという不便性である。本発明は、一態様において、例えば、エタノール産生の細菌及びリグノセルロース出発物質でのSSFで使用するために適している改善された最小培地を提供することによって、この問題に対処している。
【0157】
この培地は、細菌のエタノール産生の株の最大の生育及びエタノール産生を支援し、そしてアンモニア及び(NH4)2SO4のような単純な化学試薬を含む、従来使用されている窒素源を、総窒素源として尿素及び尿素様化合物の低レベルと置き換えることにより最小のコストにするように最適化されている。これらの化合物の置き換えは、他の窒素源の使用に対して重要なコスト利点を提供する。
【0158】
「最適化尿素培地1」(OUM1)と称する、本発明による特に好ましい態様の最小培地は、下記の成分を示された濃度で包含する。
NH2CONH2(尿素) 10.0mM
CSL 10.0g/L
KH2PO4 10.7mM
Na2HPO4 1.3mM
CaCl2 1mM
MgSO4 1mM
FeCl2 0.074mM
NiCl2 0.0068mM
発酵反応に用いるために、サッカライド源、例えば上記のような糖源であるグルコース(例えば、90g/Lで)又はリグノセルロース源を加える。
【0159】
VII.組み換えホスト細胞によるサッカライド源の発酵時における最適なエタノール産生の方法及びシステム
本発明の上記の最適化最小培地、並びに最大のエタノール産生及び最小の副生成物産生のために遺伝子操作で最適化した組み換え微生物を、有利に組み合わせてエタノール産生のシステムにできる。
【0160】
従って、別の態様では、本発明は、サッカライドを分解するのに適した組み換えホスト細胞によって、サッカライド源からエタノールを産生するために最適化されたシステムを提供する。このシステムは以下の要素を包含する:
(a)選択条件下でのホスト細胞による最適な生育及びエタノール産生を支援する選択培地;
(b)サッカライド源;及び
(c)選択培地及び条件でのエタノール産生のために最適化された組み換えホスト細胞、
この細胞は:
糖をエタノールに変換する酵素をコードする非相同性ポリヌクレオチド配列(ここにおける細胞は、当該ホスト細胞による主要発酵生成物としてのエタノールの産生を促進するのに十分な機能レベルで、当該非相同性ポリヌクレオチド配列を発現する)、及び
当該細胞の代謝経路において、前記条件下及び培地中で当該オリゴサッカライド源からエタノール以外の生成物を産生するタンパク質をコードする少なくとも1つのポリヌクレオチド配列中の突然変異(ここにおける突然変異は、当該タンパク質の発現を低減又は消去し、これにより当該ホスト細胞によるエタノール産生を、突然変異がない細胞によるエタノール産生に比べて増大させて、エタノール産生を最適化する)を包含する。
【0161】
商業的利用に好ましいシステムの態様では、選択培地は、上記のような本発明による尿素ベースの最小培地のような、最小培地である。
【0162】
エタノール産生のために最適化された適切なホスト細胞は何れも、本システムで使用することができ、適切なサッカライド又はオリゴサッカライド源の何れも使用することができる。好ましい安価なサッカライド源は、リグノセルロース原料である。上記に検討のように、SSF反応は、菌体酵素の性能を最適化するために、酸性のpH範囲で最適に実施される。しかしながら、酸性条件は、細菌による発酵において、好ましいpHでの不要な副生成物の増大した産生及びそれに付随するエタノールの減少した産生のような、有害な影響を有する。
【0163】
本発明による最適化されたシステムでは、生育の条件(pHのような)又は最小培地自体の有害な影響は、特別な培地と、当該培地中での生育及びエタノール産生を特に最適化した組み換え細菌とを組み合わせることによって最小化することができる。例えば、特別な培地中でホストの望ましくない代謝経路が特別な培養条件下で改変される(例えば、上方調節される)ことが知られているならば、培地を、改変された経路を標的とする遺伝子的改変(例えば、欠失突然変異)を包含する選択された組み換えホスト細胞と組み合わせるように、システムを設計することができ、それによってこのような条件下で望ましくない生成物を低減又は消去することができる。従って、このシステムは、特別な最小培地中での発酵反応時のエタノール産生のために最適化される。
【0164】
本発明の最適化されたシステムの好ましい態様は、本明細書に記載のような新規なOUM培地、BW21株のような最適化された組み換えクレブシエラ・オキシトカ株、及び糖源であるリグノセルロースの組み合わせである。エタノール産生のためのこの最適化システムは、リグノセルロースを含有するバイオマスからエタノールを産生する魅力ある安価な方法を提供する。
【0165】
SSFによるバイオマスの発酵の最適なエタノール産生の組み換え細菌株は、クレブシエラ・オキシトカP2である。SSFによるバイオマスの発酵のために最適化された本発明の組み換えホスト細胞の例は、ブタンジオール経路(アセトイン及び2,3−ブタンジオール)の副生成物を消去する欠失突然変異を有する点で親株と異なる、BW21と称するクレブシエラ・オキシトカP2由来の改善されたエタノール産生の株である。本明細書の検討で示されるように、この経路は、決められた窒素源として尿素を含有する好ましい最小培地(OUM1)中での発酵検討において、P2細胞を発育させて用いると、この経路が特異的に上方調節される。最適化されたBW21細胞中では、このような不要な遺伝子産物の発現が、遺伝子の欠失によって消去される。BW21細胞によるエタノール産生のアッセイは、これらの細胞が、酸性pHでの最小培地中で、親株P2よりも、更にL培地(Luria broth)のような富栄養培地中で生育させた場合よりも、エタノールを産生する優れた能力を有していることを実証した。従って、尿素様化合物を包含する最適な最小培地を、この特別な培地でエタノール産生に最適化された組み換えクレブシエラ株と組み合わせることにより、エタノール産生が、SSFに適した条件の酸性pHでのシステムで、より高価な培地を用いて達成できるレベルまで最適化された。
【0166】
更なる態様では、本発明は、本発明の方法又はシステムによる組み換えホスト細胞を使用するための使用説明書と共に包装した、上記のような組み換えホスト細胞を包含するキットを提供する。
上記の方法の実施に一般的に有用な材料及び方法が更に、下記及び以下の実施例に記載されている。
(実施例)
【0167】
本発明を以下の実施例を参照して更に説明するが、これは限定するものとして解釈されるものではない。
材料及び方法
以下の材料及び方法は次の実施例を通して用いられる。
1a.株及びプラスミド
表1は、本発明の組み換え微生物を構築するために使用される生命体及びプラスミドを記載する。
【0168】
【表1】

【0169】
1b.生育培地及び条件
エタノール産生の株を、2%のグルコース及びクロラムフェニコール(1日おきに、40又は600mg/L)を含有するL寒天培地(Luria agar)[24]上、アルゴン雰囲気下で保持した。その他の株を、糖を添加していないL寒天プレート上で適当な抗生物質と共に保持した。特に断りのない限り、アンピシリン(50mg/L)、カナマイシン(50mg/L)、アプラマイシン(50mg/L)及びテトラサイクリン(12.5mg/L)を選択のために使用した。温度条件付きレプリコンのプラスミドを含有している株を30℃で生育させた。その他の全ての株は、指摘されたものを除いて、37℃で保持した。プラスミド調製物を、−20℃で保存した。保存培養は、グリセロール中、−75℃で保存した。
【0170】
1c.遺伝子法
PCRベースの遺伝子のクローニング、プラスミドの構築及び遺伝子分析について、標準的な方法を用いた[24〜26]。組み込み、染色体の欠失、組み込み、及び移動可能な抗生物質抵抗遺伝子の使用についての方法を、既述のようにして用いた[22、27〜29]。大腸菌DH5αを、構築のために使用した。
【0171】
1d.budA及びbudB遺伝子の欠失
α−アセトラクテート・デカルボキシラーゼ(budA)及びα−アセトラクテート・シンターゼ(budB)の5’末端を含有するDNA断片を、鋳型としてのK.オキシトカ由来のゲノムDNA及びTaqPCRマスターミックス(Qiagen)を用いるPCRで増幅した。94℃で3分間の初期変性の後、DNAを30サイクル増幅した(94℃で30秒間の変性、55℃で30秒間のアニーリング、及び72℃で70秒間の伸長)。72℃で10分間の最終伸長も含まれている。
【0172】
budAB’DNA断片を次のプライマー:
フォワードプライマー:5’GCTGAATCGGGTCAACATTT−3’(SEQ ID NO:1)
リバースプライマー:5’−TTTCGGTTTGTCCAGGTAGT−3’(SEQ ID NO:2)
を用いて増幅して、pCR2.1−TOPOにクローンした。pLOI3301と呼ばれる、この断片の配列を決定して、GenBankに寄託した(受入番号:AY722056)。
【0173】
budABに欠失を含有するDNA断片を調製するために、クローニング/欠失の以下の方法を用いた。この方法では、budA及びbudB遺伝子の中央領域を欠失して、2つのFRT部位が側面に位置したテトラサイクリン遺伝子で置き換えた。budA及びbudBを欠失させて得られた構築物(budA’FRT−tet−FRT’budB)(SEQ ID NO:8)を、温度条件付きベクターであるpSC101tsに組み込んで、エタノール産生の細菌に安定に形質転換するために用いた。
【0174】
図1は、エタノール産生の細菌に導入された場合に、発酵によるブタンジオール生成物の消去をもたらす、budABに欠失突然変異を包含する例示構築物(pLOI3301、pLOI3310及びpLOI3313)を、調製する工程を示す概略図である。図1の更に詳細な説明及びこれらのプラスミドを作製するのに用いられる方法は、以下、特に実施例4に見い出される。
【0175】
1e.クレブシエラ・オキシトカP2からのBW21株の作製
上の1dに記載のように調製された、budA及びbudBに欠失突然変異を含有しているDNA構築物を、これらの構築物で形質転換された組み換え細菌を作製するために使用した。例えば、エタノール産生のクレブシエラ・オキシトカM5A1株の形質転換を記載している実施例5を、参照されたい。次いで、バクテリオファージP1(大腸菌のファージ)を、K.オキシトカM5A1中に構築されているbudAB染色体欠失をP2株に形質導入してBW21株を作製するために用いた。
【0176】
1f.budAのアセトイン生成物の存在しないことをスクリーニングすることによるブタンジオール経路の評価
株は、ボーグ・プロスカウル(Vogues-Proskaur;VP)寒天法の変法を用いて、アセトイン産生についてスクリーニングしたが、この方法は、着色生成物の限界拡散によって感度を増強するために、ペトリプレートの代わりにマイクロタイタープレートを用い、「Blomqvist, et al.」[35]に記載されている。各ウェルに1mlの培地(1リットル当たり、2.5gのディフコバクトペプトン(Difco Bactopeptone)、1.0gのディフコ酵母抽出物、10gのグルコース、1.0gのピルビン酸ナトリウム及び25gの寒天)を入れて、接種した。24時間後に、αーナフトールを5%含有する2.5NのNaOH溶液を200μLずつ各ウェルに加えた。室温で1時間着色を観察した。赤色着色がないことで、アセトイン(budA活性の生成物)のないことを確認した。更なる確認は、発酵生成物のHPLC分析でなされた。
【0177】
2a.エタノール産生の細菌のための最小培地
公知の培地及び本明細書で開発された(最適化尿素培地1、OUM1)培地の両方の成分を、表2に要約した。
【0178】
【表2】

【0179】
それぞれの培地を、50g/L(278mM)のグルコース又は90g/L(500mM)のグルコースの何れかを用いる発酵反応でテストした。成分は、Fisher Scientific社又はSigma Chemical社の何れかから入手した。無機塩類は、試薬用の等級であった。尿素は、工業用の等級であった。M9培地は、既述[30]のように調製して、更に鉄要求性Z.モビリス アルコールデヒドロゲナーゼ[31]の適切なレベルを確保するために0.07mMのFeCl3を補充した。エタノール産生の大腸菌用のコーンスティープリカー(CSL)培地(0.5%CSL+M)は、既に記載されている[32]。M9及び0.5%CSL+M培地の両方は、K.オキシトカM5A1のエタノール産生の誘導体用の培地を最適化するための出発点として用いた。尿素を窒素源として使用する場合に、ウレアーゼ活性のために0.007mMのNiCl2を添加した。CSLのレベルは、乾燥重量ベースで示した。CSLの原液は、既述[33]のようにして調製し、滅菌した。
【0180】
全ての培地の最適化の検討で、K.オキシトカP2を用いた。新たに生育したプレート(24時間)から単離されたコロニーを、1mlの脱イオンH2Oに再懸濁して、75mlの培地(50g/Lグルコース)を含有する125mlのフラスコに接種(約50μLの接種材料)するために用いた。生育及びエタノール産生を、24時間及び48時間後に観察した。
【0181】
2b.発酵条件
種培養物(250mlフラスコ中に150ml)を、50g/Lのグルコースを含有する培地で35℃(120rpm)で16時間生育させた。細胞を遠心分離(5000×g、5分間)して採取し、乾燥細胞重量で33mg/Lの初期濃度(OD550nm=0.1)を示す接種材料として用いた。発酵に用いるそれぞれの培地は、種生育にも用いたが、低いグルコース濃度(50g/L)で用いた。発酵容器は、既述されており[34]、350ml(90g/Lのグルコース)の初期容量を含有していた。培養物を、35℃(150rpm)で培養した。培養液を、2NのKOHを自動的に添加してpH5.2に保持した(指示があるときを除いて)。
【0182】
2c.分析方法
ボシュロムスペクトロニク(Bosch & Lomb Spectronic)70分光光度計を用いるOD550nmの測定により、細胞集団を評価した。この測定器では、1単位のOD550nmが、0.33mg(乾燥重量)/Lの細胞密度に相当する。K.オキシトカについての細胞密度の測定は、細胞の凝集性による大きな誤差を有している。エタノールは、既述[11]のように、バリアン(Varian)モデル3400Xを用いるガスクロマトグラフィーで測定した。その他の発酵生成物は、二重検出器(屈折率及びUV210nm)[33]を備えた、ヒューレットパッカード(Hewlett-Packard)モデル1090のシリーズIIクロマトグラフ及びバイオラードアミネックス(Bio-Rad Aminex)87Hイオンパーティションカラム(45℃;4mMのH2SO4;0.4ml/min;10μLの注入容量)を用いる、高速液体クロマトグラフィー(HPLC)によって測定した。炭素バランスは、既述[29,36]のように計算した。発酵培地としてLBを用いた場合は、細胞集団は、複合培地成分から単独に作製されたものと仮定して、炭素バランスの計算に含めなかった。
【実施例1】
【0183】
K.オキシトカP2による生育及びエタノール産生のための最小培地
本実施例は、クレブシエラ株のような組み換えエタノール産生の細菌による生育及びエタノール産生のために最適化された、単独の窒素源として尿素を包含する新規な最小培地(OUM1)の開発について記載する。この新規な培地は、K.オキシトカP2株を用いて、その生育及びエタノール産生の能力を幾つかの公知の培地と比較して、開発しそして最適化された。
【0184】
比較の目的で用いた既述の培地は、次の通りである:
L培地(LB)(Ausubel et al., 1989);
M9培地(+Fe)(Neidhardt et al., 1974);
U−M9(+Fe)、ここでは、NH4Clが、当量窒素の尿素に置き換わっている;
0.5%のコーンスティープリカー、CSL+M(Martinez et al., 1999);
U−0.5%のCSL+M、ここでは、(NH4)2SO4が、当量窒素の尿素に置き換わっている。
この新規な培地を、本明細書では「最適化尿素培地1号」(OUM1)と称する。
上記培地のそれぞれの組成は、上記表2に示す。
【0185】
最適化培地を開発するための最初の検討において、生育及びエタノール産生の能力を、M9(+Fe)及び0.5%のCSL+M培地中でのpH5.2にてテストしたK.オキシトカP2で比較した。ここで、後者の培地は、単独の窒素源としてアンモニアを有している。pH5.2でのLB培地は、性能の基準を提供する対照として含まれている。図2A及び2Bを参照すると、予想通りに[32]、LB培地が、最も高い細胞収率(図2A)及び最も速いエタノール産生(図2B)を支援した。同等のレベルのエタノールが、0.5%CSL+M及びLBで産生された(図2B)。
【0186】
表3は、M9及びCSL+M培地の両方における、エタノール産生及び収率について、アンモニアを尿素に置き換えた効果を示している。見られるように、この交換は、エタノール産生において少しの減少をもたらした(M9については、76%に対して71%;CSL+Mについては、83%に対して78%)。表3でも見られるように、一般に、エタノール産生及び収率は、窒素源に関わらず、培地の栄養豊富度によって増加する(LB>0.5%のCSL+M>M9+Fe)。
【0187】
【表3】

【実施例2】
【0188】
決められた窒素源として尿素を包含する最適化された最小培地
本実施例は、エタノール産生の細菌と共に用いる尿素を包含する最適化された最小培地を開発するための方法を記し、そして「OUM1」と称する培地のような態様の処方を提供する。
【0189】
OUM1と称する尿素ベースの培地(尿素を唯一の決められた窒素源として有している)を、上記のような方法を用いて、90g/LのグルコースでpH5.2にてpH制御した発酵でテストした。この培地でのエタノール産生は、M9(+Fe)及びCSL+M培地の尿素含有の処方よりも僅かに優れていて、高濃度の窒素、ホスフェート及びCSLが必要ないということを確認した(図2C及び2D)。
【0190】
細胞生育検討の結果は、最大細胞密度が、M9(+Fe)及び0.5%のCSL+M培地中(図2A)及びOUM1培地中(図2C)で全く同じであること示し、これらのそれぞれの培地中では低濃度の窒素(M9中の19.0mM)及びホスフェート(0.5%のCSL+M中の10.3mM)で十分であることを示唆した。
【0191】
M9(+Fe)及び0.5%のCSL+Mの組成物に基づいて、OUM1培地中の異なった濃度の栄養素:ホスフェート(12〜72mM)、マグネシウム(0.25〜1.0mM)、CSL(0〜15g/L)、及び尿素窒素(2.5〜15mM):を評価するようにフラスコ実験を設計した。コーンスティープリカー及び尿素の多種の濃度の結果を、それぞれ図3A及び3Bに示す。規定の範囲内では、CSL及び尿素のみが明確な最適条件、すなわちそれぞれ10g/L及び10mMを有していることを、このデータが示した。他の成分の全てのレベルで、48時間後に同じ濃度のエタノール(13.9±1.3g/L)が産生された。低濃度でも十分であると考えられるが、12mMのPO4−3、1mMのMgSO4及び1mMのCaCl2を最適化尿素培地(OUM1)用に選択した。(OUM1培地の完全な処方については、表2を参照されたい)。
【実施例3】
【0192】
エタノール力価及び発酵副生成物の産生における酸性pHの効果。
上記のように、ある特定タイプの発酵反応、例えば、発酵する糖がリグノセルロース原料由来である反応では、菌体ヒドロラーゼ及びセルラーゼが最適な性能を示す範囲である酸性のpHで、反応を実施することが望ましい。本実施例は、新たに開発された培地OUM1を含む、種々の培地中で生育するエタノール産生の細菌P2株による発酵で、pHがエタノール及び副産物の産生に及ぼす影響を記載する。
【0193】
再び表3を参照すると、OUM1培地で生育するP2株による、グルコースからのエタノール産生の結果が、既述の培地で生育するこれらの細胞の結果と比較されている。表3で示すように、OUM1培地のエタノール力価は一般に、pH5.2ではLB培地で得られるものと同等であった。
【0194】
しかしながら、これらの検討においては、全ての培地でのエタノール力価は、既報の富栄養培地、例えば、より中性のpHでのL培地(LB)よりも低いpH5.2でのものであることに注意されたい[5、6]。エタノール産生での低いpHの悪影響は、LB及びOUM1培地での発酵について確認された。表3に示すように、LB培地でP2株は、pH6.0及び6.8ではそれぞれ100%及び98%の収率でエタノールを産生したのに対して、pH5.2では収率が85%に低下した。
【0195】
表3で示される発酵実験において、グルコース基質から作られる不要な副生成物(エタノールに加えて)、すなわち、ホルメート、ラクテート、スクシネート、アセテート、アセトイン及び2,3−ブタンジオールについてのレベルも測定した。pH5.2の全ての培地でP2株によって副生成物が産生されるが、2,3−ブタンジオール経路から予想外に高い濃度(72mM)の生成物が、このpHでOUM1培地にて産生したことが見い出された(表3)。LB培地及びOUM1培地の両方で、pH5.2での発酵は、pH6.8に比べてより高い割合の中性の副生成物(アセトイン及び2,3−ブタンジオール)を含有していた。より具体的には、OUM1培地では、中性の副生成物のレベルが、pH6.8よりもpH5.2で4.5倍高かった。対照的に、pH6.8のOUM1培地では、ブタンジオール+アセトインのレベルが減少した(72mMに対して16mM)のに対し、アセテート及びホルメートの濃度はpH6.8で増加した(それぞれ、9mMに対して47mM、及び<1mMに対して44mM)。OUM1培地の結果とは異なって、LB培地では、中性の副生成物は、pH5.2及びpH6.8で比較的一定を保持していた(38mMに対して31mM)のに対し、酸性副生成物は減少した(表3)。
【0196】
理論に制約されるものではないが、P2株による2,3−ブタンジオール経路からの中性の副生成物の増大した生成は、OUM1培地の組成及び低pHの両方に関連していると思われる。この知見は、K.オキシトカの野生株にある対応する酵素の報告されている活性と一致すると思われる。例えば、2,3−ブタンジオール経路の副生成物の生成に関連する酵素活性は、低pHに応答して増大することが知られている[35、37、38]。より中性に近いpHでは、ピルビン酸ギ酸リアーゼ、酢酸キナーゼ、及び乳酸デヒドロゲナーゼのような酸発生の活性が、より酸性の生成物を産生する[39]。
【実施例4】
【0197】
エタノール産生の細菌中のbudABオペロンの欠失のための構築
本実施例は、細菌(クレブシエラ・オキシトカ)由来の、budA遺伝子の推定全長cDNA配列、及びbudB遺伝子の部分cDNA配列の単離を、そしてブタンジオール経路にあるこれらの遺伝子が崩壊しているDNA断片の構築物を記載している。細菌細胞への導入に続く、これらの構築は、細胞によるサッカライドの発酵時に不要な2,3−ブタンジオール及びアセトインの産生を消去するために有用である。
【0198】
budA及びbudB遺伝子は、隣接してK.オキシトカゲノム中にあり、そして一緒にしてbudABと称する。2つの遺伝子はそれぞれ、2,3−ブタンジオール及びアセトインの産生に関わる2つの酵素、すなわちα−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼをコードする。本実施例では、K.オキシトカM5A1のbudAB遺伝子における欠失を構築し、そしてK.オキシトカP2株に形質導入してBW21株を作製する。一般に、BW21のような欠失突然変異株を構築するために用いられる方法は、前記、材料及び方法の1a〜c項に記載されている。budAB欠失のある新しい株を構築するために用いられるプラスミド及び菌株は、前記の表1に挙げられている。
【0199】
budAB遺伝子は、K.オキシトカに今まで記載されていなかった。しかしながら、2つの関連する生命体、すなわちエンテロバクター・アエロゲネス(Enterobacter aerogenes)及びルールテラ・テリゲナ(Roultella terrigena)(正式にはクレブシエラ・テリゲナ[35、37])由来の同種の遺伝子は知られている。これらの配列及びK.ニューモニエ(K. pneumoniae)の部分(注釈なし)ゲノム[40]に基づいて、上記のプライマー(SEQ ID NO:1及び2)を、budAB’を含有するDNA断片のPCR増幅のために設計した。
【0200】
図1は、budオペロン及びこのK.オキシトカのオペロンに伴う2,3ブタンジオール発酵経路を欠失させるのに用いられるプラスミドの構築の過程を示す概念図である。挿入図(図1A)は、オペロンの図表示である。図1Aに示すように、このオペロンの発現は、低いpHで増大され、そしてBudR及びFnrによって正に調節される。
【0201】
上記の方法に記載のように、α−アセトラクテート・デカルボキシラーゼの推定全長コード配列(budA)(SEQ ID NO:3)及びα−アセトラクテート・シンターゼ(budB)(SEQ ID NO:4)の5’末端を包含する部分コード配列を含有するDNA断片を、K.オキシトカ由来のゲノムDNAを鋳型として用い、PCRで増幅した。(SEQ ID NO:3及び4によってコードされるポリペプチドの予測されるアミノ酸配列は、それぞれSEQ ID NO:6及び7に示されている)。図1Bの左上図は、指定されたPCRプライマー(SEQ ID NO:1及び2)で増幅されたK.オキシトカのbudA及びbudBの比率を示している。
【0202】
図1Bの下部を参照すると、budABを含有する増幅されたDNA断片は、PCRクローニングベクターpCR2.1−TOPO(表1に記載)にクローンされて、pLOI301(pCR2.1budAB’;図1Bの(1)で示されている)を生成する。
【0203】
budAB遺伝子産物を消去するために、budAB’断片の中央部を大きく欠失させて2つのFRT(Flp recombinase Recognition Target)部位に隣接するtet遺伝子で置き換え、pLOI3310(budA’−FRT−tet−FRT−'budB’;図1B、(3))を生成した。切断budA及びbudB配列、並びに介在するFRT隣接テトラサイクリン遺伝子(budA’−FRT−tet−FRT−'budB’)を含有する核酸構築物を、本明細書でSEQ ID NO:8と称する。budAB配列の中央部の欠失、及びtet含有構築物による置換は、2つのFRT配列が側面にあるtet遺伝子を含有しているpLOI2065(図1B、(2))を用い、当該技術分野で公知の標準的な技術によって実施した(「Underwood et al., 2002」;表1も参照されたい)。側面のFRT部位は、染色体の組み込み後のマーカー除去を促進するために含有した[20、21、27]。
【0204】
引き続く組み込み時のノイズを最小化するために、pLOI3310由来のbudA’−FRT−tet−FRT−'budB’を包含する2.1kbpのHindIII−ApaI断片を、pLOI2745の対応する部位に結合させた(図1B、(4))。このベクターは、温度条件付きpSC101レプリコンを含有している(更に詳細には、表1を参照されたい)。得られた5502bpのプラスミドを、pLOI3313(pLOI2745(budA’−FRT−tet−FRT−'budB’))と称した(図1B、(5))。
【実施例5】
【0205】
budAB欠失があるエタノール産生の組み換えクレブシエラ細菌株の作製
上記の実施例3及び表3で明確にしたように、発酵反応時にエタノール産生の組み換えK.オキシトカP2株は、OUM1発酵培地中にて酸性pHで生育させると、低下したエタノール産生及びブタンジオール経路の副生成物の増大した産生を示す。上記に検討したように、budAB遺伝子は、2,3−ブタンジオール及びアセトインの産生に関わる2つの酵素、すなわちα−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼをそれぞれコードする。本実施例は、突然変異細胞中でbudAB遺伝子産物の発現の消去をもたらす、budAB遺伝子における欠失突然変異を含んでいる、P2株由来の新規なエタノール産生のK.オキシトカ株であるBW21株の作製について記載する。
【0206】
budA’−FRT−tet−FRT−'budB’断片の、エタノール産生に有用なクレブシエラ株への組み込みのために、上記実施例4に記載のpLOI3313プラスミドを、線形化し、PCR増幅のための鋳型として用いた。budAB欠失を含むPCR生成物を、Redリコンビナーゼ(pLOI3421;表1を参照されたい)の存在下に、エレクトロポレーションによって、K.オキシトカ株M5A1株に組み込んだ。
【0207】
budAB遺伝子産物の機能的な欠失を確認するために、10個のクローンを、5%のグルコースを含有する最適化された尿素培地(OUM1;上記の表2を参照されたい)で生育させて、アセトイン及び2,3−ブタンジオールの有無について、方法1f項に記載のようにして選別した。これらの生成物が検出可能な濃度で存在しないことで、「欠失クローン」とも称されるが、うまく形質転換された細胞中でのbudAB経路の欠失が確認された。クローンにおけるbudABの欠損は、PCR分析によっても確認された。
【0208】
ブタンジオール経路に欠失を有するK.オキシトカ(P2のような)のエタノール産生の株を構築するために、K.オキシトカM5A1株(BW15と称する)の1個のクローンを選択して、上記のように、バクテリオファージP1を用いてK.オキシトカP2に形質導入するためのドナーとして用いた。得られた10個の形質導入株を、上記のようにアセトイン及びブタンジオールについて選別した。更なる検討のために1個の欠失クローンを選択して、BW19と称した。次いで、FLPリコンビナーゼ(pFT−K)を用いる標準的な操作で、FRTが側面にあるtet遺伝子を除去した。budAB欠失を有しているがFRTが側面にあるtetを欠いている、得られた株を、K.オキシトカBW21と称した。FRTが側面にあるtet遺伝子を除去した後の細胞に残存する切断budA及びbudB配列を包含する単離された核酸断片を、本明細書でSEQ ID NO:5と称する。
【実施例6】
【0209】
budABの欠失のエタノール産生の細菌によるエタノールの収率の増加
本実施例は、新たに開発されたエタノール産生のK,オキシトカBW21株(実施例5に記載)による、グルコース発酵の改善されたエタノール産生及び副生成物の低減された産生について、親株であるK.オキシトカP2と比較して、記載する。
【0210】
再度表3を参照すると、OUM1(90g/Lのグルコースを用いて)中での細胞の生育による発酵のエタノール及び副生成物の産生について、budAB欠失の効果(親のP2株に対してBW21株)について、比較がなされている。
【0211】
表及び先に検討のように、pH5.2で行われた親株P2による発酵において、ブタンジオール経路(1モルの生成物当たり2モルのピルベート)からの不要な副生成物(アセトイン+2,3−ブタンジオール)が、エタノール産生に利用できるグルコースの約14%から産生された。まさに対照的に、BW21株におけるアセトラクテート・シンターゼ及びアセトラクテート・デカルボキシラーゼをコードする遺伝子の欠失は、これらの副生成物の両方を実質的に消去した(表3)。ラクテート及びアセテートの濃度も、親株P2におけるよりBW21株では低かった。
【0212】
pH5.2でのOUM1培地で、BW21株による副生成物の減少は、P2株に比べてエタノール力価及び収率の12%増加を伴った(表3及び図4を参照されたい)。図4のグラフは、OUM1培地でのK.オキシトカ株BW21及びP2による細胞生育(4A)及びエタノール産生(4B)の比較を示している。BW21及びP2の生育比率は実質的に同じであるが、エタノール産生がBW21株で一貫して高かった。
【0213】
図5は、3つの尿素含有の培地、すなわちU−M9、U−0.5%のCSL+M、及びOUM1(培地処方に関しては、表2を参照されたい)中で生育する親株P2、及びOUM1培地で生育する、budAB欠失のBW21株についての、エタノール収率(グルコース1グラム当たりのグラム数で示す)及びエタノール生産性(エタノール産生の最大及び平均容積比として、1時間当たりのエタノールのmMで示す)の比較を示す。平均の生産性は、最初の72時間について計算した。エタノール収率は、72時間後に計算した。最大容積生産性は、発酵の初期、8時間〜24時間の範囲に現れた。
【0214】
重要なことに、図5に見られるように、エタノールの収率及び生産性は、OUM1培地で生育するBW21株が、テストしたどの培地で生育している親株P2よりも、一貫して高かった。
【実施例7】
【0215】
OUM1培地でのbudAB遺伝子欠損の組み換え細菌によるエタノールの経済的な産生
上記のように、生成物の収率及び細菌培養培地のような生産材料に関わるコストは、エタノールのような汎用化学製品の経済性において重要な因子である。K.オキシトカは、この細菌が元来尿素を窒素源として使用する能力を有しているので、エタノール産生の細菌として有利な選択肢である。同等の窒素原料として、尿素は通常、アンモニウム塩のコストの約半分で市販されている。窒素源としての尿素の使用は、更に付加的な利点を有している。アンモニウム塩の代謝と異なって、尿素の代謝は、培地の酸性化を助長しない[41]ので、pHを調節するために必要な塩基の量を減少させる。
【0216】
OUM1と称される、本明細書に記載の新規な培地は、その他の塩及びコーンスティープリカーが低濃度であるという潜在的な節約を更に提供する。重量ベースで、OUM1培地は、0.5%のCSL、0.06%の尿素及び0.2%の無機塩、更に発酵性寒天から構成されている。このような発酵で用いる低いpHは、真菌性セルラーゼ及びキシラナーゼが、一般にpH5付近で最適条件を示す[42]ので、リグノセルロース原料に対して特に適している。
【0217】
本明細書で確認したように、SSFのための低いpHのこれら利点にもかかわらず、酸性のpHで発酵反応を行う不利な点は、エタノール産生の細菌のブタンジオール(及びアセトイン)産生のための経路が低いpHで活性化されて[43]、副生成物の増加及びエタノール収率の低下をもたらすことである。しかしながら、本明細書で実証したように、この経路に特異的に関与する2つの遺伝子(budAB)に欠失を有する、改良されたエタノール産生の組み換え細菌株の構築によって、この問題はうまく克服することができる。上記で示したように、これらの遺伝子の欠失によるブタンジオール反応生成物の消去は、親株P2よりも12%高いエタノール収率を実現する、改善されたエタノール産生のクレブシエラ株(BW21株で例示される)をもたらした。最も意義深いことに、OUM1中でのpH5.2で、BW21によるグルコースからのエタノール産生は、LB培地での親株(P2株)のそれを、実質的に48時間後に達成し、上回った。従って、この新規な株は、この生命体による安価な試薬からのエタノールの産生に最適化された新規な最小培地と共に、バイオマスからの手頃な価格の、再生可能なエネルギー源を作り出すという目標において、重大な進展をもたらす。
【0218】
引例
引例の概説は、本発明の正しい評価を高めるであろうと信じる。以下の文献は、下に示した番号で本明細書を通して参照されている。
【0219】
1. Biobased Industrial Products, Priorities for Research and Commercialization; Arntzen, C.E.; Dale B. E. (co-chairs). National Academy Press: Washington, D. C. 1999.
2. Zaldivar, J.; Nielsen J.; Olson L. Fuel Ethanol Production from Lignocellulose: a Challenge for Metabolic Engineering and Process Integration. Appl. Microbiol. Biotechnol. 2001, 56, 17-34.
3. Von Sivers M.; Zacchi G.; Olson L.; Hahn-Hagerdal B. Cost Analysis of Ethanol from Willow Using Recombinant Escherichia coli. Biotechnol. Prog. 1994, 10, 555-560
4. Wyman, C. E. Potential Synergies and Challenges in Refining Cellulosic Biomass to Fuels, Chemicals, and Power. Biotechnol. Prog. 2003, 19, 254-262.
5. Ohta, K.; Beall D.S.; Mejia J.P.; Shanmugan K.T.; Ingram L.O. Metabolic Engineering of Klebsiella oxytoca M5A1 for Ethanol Production from Xylose and Glucose. Appl. Environ. Microbiol. 1991, 57, 2810-2815.
6. Wood, B. E.; Ingram L. O. Ethanol Production from Cellobiose, Amorphous Cellulose and Crystalline Cellulose by Recombinant Klebsiella oxytoca Containing Chromosomally Integrated Zymomonas mobilis Genes for Ethanol Production and Plasmids Expressing Thermostable Cellulase Genes from Clostridium thermocellum. Appl. Environ. Microbiol. 1992, 58, 2103-2110.
7. Bothast, R.J.; Saha B,; Flosenzier A.V.; Ingram L.O. Fermentation of L-arabinose D-xylose and D-glucose by Ethanologenic Recombinant Klebsiella oxytoca strain P2. Biotechnol Lett. 1994, 16, 401-406.
8. Doran J.B.; Aldrich H.C.; Ingram L.O. Saccharification and Fermentation of Sugar-cane Bagasse by Klebsiella oxytoca P2 Containing Chromosomally Integrated Genes Encoding the Zymomonas mobilis Ethanol Pathway. Biotechnol. Bioengin. 1994, 44, 240-247.
9. Brooks, T.A.; Ingram L.O. Conversion of Mixed Waste Office Paper to Ethanol by Genetically Engineered Klebsiella oxytoca strain P2. Biotechnol. Prog. 1995, 11, 619-625.
10. Wood, B.E.; Aldrich H.C.; Ingram L.O. Ultrasound Stimulates Ethanol Production During the Simultaneous Saccharification and Fermentation of Mixed Waste Office Paper. Biotechnol. Prog. 1997, 13, 232-237.
11. Ohta, K.; Beall D.S.; Mejia J.P.; Shanmugam K.T.; Ingram L.O. Genetic Improvement of Escherichia coli for Ethanol Production: Chromosomal Integration of Zymomonas mobilis Genes Encoding Pyruvate Decarboxylase and Alcohol Dehydrogenase II. Appl. Environ. Microbiol. 1991, 57, 893-900.
12. Linsay, S.E.; Bothast R.J.; Ingram L.O.. Improved Strains of Recombinant Escherichia coli of Ethanol Production from Sugar Mixtures. Appl. Microbiol. Biotechnol. 1995, 43, 70-75.
13. Yomano, L.P.; York S.W.; Ingram L.O. Isolation and Characterization of Ethanol Tolerant Mutants of Escherichia coli KO11 for Fuel Ethanol Production. J. Ind. Microbiol. 1998, 20, 132-138.
14. Burchhardt, G.; Ingram L.O. Conversion of Xylan to Ethanol by Ethanologenic Strains of Escherichia coli and Klebsiella oxytoca. Appl. Environ. Microbiol. 1992, 58, 1128-1133.
15. Qian Y.; Yomano L.P.; Preston J.F.; Aldrich H.C.; Ingram L.O. Cloning, Characterization, and Functional Expression of the Klebsiella oxytoca Xylodextrin Utilization Operon (xynTB) in Escherichia coli. Appl. Environ. Microbiol. 2003, 69, 5957-5967
16. Kadam, K.L.; Newman M.M. Development of a Low-cost Fermentation Medium for Ethanol Production from Biomass. Appl. Microbiol. Biotechnol. 1997, 47, 625-629.
17. Ingram, L.O.; Gomez P.F.; Lai X.; Moniruzzaman M.; Wood B.E.; Yomano L.P.; York S.W. Metabolic Engineering of Bacteria for Ethanol Production. Biotechnol. Bioengin. 1998, 58, 204-214.
18. Zhang, J.; Greasham R. Chemically Defined Media for Commercial Fermentations. Appl. Microbiol. Biotechnol. 1999, 51, 407-421.
19. Orskov, I. In Bergey's Manual of Systematic Bacteriology, Vol.1, Kreig, N.R.; Holt J. G. Eds,; Williams and Wilkins, Baltimore, MD, 1984. 461-465.
20. Underwood, S. A; Zhou S,; Causey T.B.; Yomano L.P.; Shanmugam K.T.; Ingram L.O. Genetic Changes to Optimize Carbon Partitioning Between Ethanol and Biosynthesis in Ethanologenic Escherichia coli. Appl. Environ. Microbiol. 2002, 68, 1715-1727.
21. Posfai, G.; Koob M.; Kirkpatrick H.A.; Blattner F.R. Versatile Insertion Plasmids for Targeted Genome Manipulations in Bacteria: Isolation, Deletion, and Rescue of the Pathogenicity Island LEE of the Escherichia coli O157: H7 Genome. J. Bacteriol. 1997, 179, 4426-4428.
22. Datsenko, K.A.; Wanner B.L. One-step Inactivation of Chromosomal Genes in Escherichia coli K-12 Using PCR Products. PNAS. 2000, 97, 6640-6645.
23. Bolndelet-Rouault, M.H.; Weiser J.; Lebrihi A.; Branny P.; Pernodet J.l. Antibiotic Resistance Gene Cassette Derived from the Ω Interposon for Use in E. coli and Streptomyces. Gene 1997, 190, 315-317.
24. Current Protocols in Molecular Biology. Ausubel, F.M.; Brent R.; Kingston R.E.; Moore D.D; Deidman J.G.; Smith J.A; Struhl K Eds.; John Wiley & Sons, Inc.: New York, N.Y. 1987.
25. Miller, J.H. A Short Course in Bacterial Genetics: a Laboratory Manual and Handbook for Escherichia coli and Related Bacteria; Cold Spring Harbor Laboratory Press: Plainview, N.Y. 1992.
26. Sambrook, J.; Russell D.W. Molecular Cloning: a Laboratory Manual;. Cold Spring Harbor Laboratory Press: Cold Spring Harbor, NY, 2001.
27. Martinez-Morales, F.; Borges A.C.; Martinez A.; Shanmugam K.T.; Ingram L.O. Chromosomal Integration of Heterologous DNA in Eschrichia coli with Precise Removal of Markers and Replicons Used During Construction. J. Bacteriol. 1999, 181, 7143-7148.
28. Zhou S.; Causey T.B.; Hasona A.; Shanmugam K.T.; Ingram L.O. Production of Optically Pure D-Lactic Acid in Mineral Salts Medium by Metabolically Engineered Escherichia coli W3110. Appl Environ Microbiol. 2003, 69, 399-407
29. Causey, T.B.; Shanmugam K.T.; Yomano L.P.; Ingram L.O. Engineering Escherichia coli for Efficient Conversion of Glucose to Pyruvate. PNAS. 2004, 101, 2235-2240.
30. Neidhardt, F.C.; Bloch P.L.; Smith D.F. Culture Media for Enterobacteria. J. Bacteriol. 1974, 119, 736-747.
31. Scopes, R.K. An Iron-Activated Alcohol Dehydrogenase. FEBS Lett. 1983, 156, 303-306.
32. Martinez, A.; York S.W.; Yomano L.P.; Pineda V.L.; Davis F.C.; Shelton J.C.; Ingram L.O. Biosynthetic Burden and Plasmid Burden Limit Expression of Chromosomally Integrated Heterologous Genes (pdc, adhB) in Escherichia coli. Biotechnol Prog. 1999, 15, 891-897.
33. Underwood, S.A.; Buszko M.L.; Shanmugam K.T.; Ingram L.O. Flux Through Citrate Synthase Limits the Growth of Ethanologenic Escherichia coli KO11 During Xylose Fermentation. Appl. Envron. Microbiol. 2002, 68, 1071-1081.
34. Beall, D.S., Ohta K, Ingram L.O. Parametric Studies of Ethanol Producfrom from Xylose and Other Sugars by Recombinant Escherichia coli. Biotechnol. Bioeng. 1991, 38, 296-303.
35. Blomqvist, K.; Nikkola M.; Lehtovaara P.; Suihko M.; Airaksinen U.; Straby K.B.; Knowles J.K.; Penttila M.E. Characterization of the 2,3-butanediol Operons from Klebsiella terrigena and Enterobacter aerogenes. J. Bacteriol. 1993, 175, 1392-1404.
36. Zabriskie, D.W.; Armiger W.B.; Phillips D.H.; Albano P.A. Traders Guide to Fermentation Media Formulation; Traders Protein. Memphis, TN. 1984.
37. Mayer, D.; Schlensog V.; Bock A. Identification of the Transcriptional Activator Controlling the Butanediol Fermentation Pathway in Klebsiella terrigena. J. Bacteriol. 1995, 177, 5261-5269.
38. Yang, Y.; Peredelchuk M.; Bennet G.N.; San K. Effect of Variation of Klebsiella pneumoniae Acetolactate Synthase Expression on Metabolic Flux Redistribution in Escherichia coli. Biotechnol. Bioengin. 2000, 69, 150-159.
39. Tolan, J.S.; Finn, R.K Fermentation of D-Xylose to Ethanol by Genetically Modified Klebsiella planticola. Appl. Environ. Microbiol. 1987, 53, 2039-2044
40. Washington University Klebsiella pneumoniae genome sequencing project home page. http://genome.wustl.edu/projects/bacterial/kpneumoniae (Accessed Nov. 2003)
41. Teixeira de Mattos, M.J.; Neijssel O.M. Bioenergetic Consequences of Microbial Adaptation to Low-nutrient Environments. J. Biotechnol. 1997, 59, 117-126.
42. Nieves, R.A.; Ehrman C.I.; Adney W.S.; Elander R.T.; Himmel M.E. Technical Communication: Survey and Analysis of Commercial Cellulase Preparations Suitable for Biomass Conversion to Ethanol. World J. Microbiol. Biotechnol. 1998, 14, 301-304.
43. Johansen, L.; Bryn K.; Stormer F.C. Physical and Biochemical Rose of the Butanediol Pathway in Aerobacter (Enterobacter) aerogenes. J. Bacteriol. 1975, 123, 1124-1130.
【0220】
引例による援用
本明細書に開示された全ての特許、公開された特許出願及びその他の引例は、それらの全てを参照して本明細書に特別に取り込まれている。
【0221】
均等物
本明細書に記載の本発明の具体的な態様の多くの均等物を、当業者は認識できるであろう、又は単なる通常の実験を用いて確認できるであろう。このような均等物は、本願の特許請求の範囲に含まれるように意図されている。
【受託番号】
【0222】
NRRL B−30857
NRRL B−30858
NRRL B−30859
【技術分野】
【0001】
(関連出願)
本発明は、2005年7月1日出願の米国特許仮出願第60/696,076号の優先権を主張し、その全ての内容を参照として本明細書に明確に組み込む。
【0002】
(米国政府との利害関係に関する声明)
本発明に対する資金は、米国農務省の助成金第01−35504−10669号、及び米国エネルギー省のFG02−96ER20222号に基づき、米国政府により一部が提供された。米国政府は、本発明に対するある特定の権利及び資格を有している。
【背景技術】
【0003】
自動車用燃料としてエタノールの使用は、石油ベースの燃料に対してよりクリーンな燃焼で再生可能な代替をもたらす[1]。エタノール生産のために最近用いられている技術は、別の市場を有している、サトウキビ汁(糖蜜)及びコーンスターチのような食用穀物をベースにしている[2]。これら原料のコストは、総生産コストの40%に相当すると予測されている[3]。一方、食用ではないリグノセルロースバイオマスは、石油と対抗できるコストで入手できる[4]。リグノセルロース糖をエタノールに変換するための改良された微生物の継続的な開発により、石油への依存の減少及び現存の植物原料からの新規な製造の可能性がもたらされる。
【0004】
クレブシエラ・オキシトカ(Klebsiella oxytoca)のエタノール産生株が開発されている[5,6]。これらの菌株は、リグノセルロースバイオマス由来の各種糖単量体(グロコース、キシロース及びアラビノースのような)を代謝することが示されている[5〜7]。このような菌株は、セルロースでの同時糖化発酵(SSF)処理においてよく機能することができる[8〜10]。K.オキシトカP2として知られているK・オキシトカのエタノール産生株は、オリゴサッカライドのエタノールへの変換に関与する酵素である、ピルビン酸デカルボキシラーゼ(pdc)及びアルコールデヒドロゲナーゼ(adhB)をコードするザイモモナス・モビリス(Zymomonas mobilis)の遺伝子を含有していることが記載されている。これらの遺伝子は、P2株のゲノム中に染色体上で組み込まれている。
【0005】
大腸菌(Escherichia coli)の類似株と対照的に、K.オキシトカは、セロビオース、セロトリオース、キシロビオース、キシロトリオース及びアラビノシドを包含する、リグノセルロースバイオマスから多くの可溶性生成物を代謝するという潜在的な能力を有している[6、14、15]。pH5.2(菌体酵素にほぼ最適な)でリグノセルロースから不完全に加水分解された生成物を効率的に代謝するK.オキシトカP2の能力は、同時糖化発酵(SSF)処理時に更なる利点を提供する[8]。これらの条件下で、K.オキシトカP2は、サッカロミセス・セレビジア(Saccharomyces cerevisiae)が同等の発酵速度及び収率を達成するのに必要とする菌体セルロースの半分以下を必要とするだけである[9]。
【0006】
高いエタノール産生及び収率を支援する、メタノール産生の細菌を生育するための安価な工業用培地の入手が、バイオマス原料からのエタノール生産にとって必須である[17、18]。しかしながら、穀物とは異なって、セルロースバイオマスの加水分解物は、本質的に栄養が乏しいので、これを補給しなけらばならない[16]。従って、エタノール産生のためのK.オキシトカP2の以前の使用では、酵母抽出物及びDifco Tryptone(登録商標)のような実験室用の栄養物を含有する、複合の生育培地中での細胞の培養を必要としていた。しかしながら、リグノセルロースからエタノールのような汎用化学品の商業的な生産にこのような栄養物を使用することは実用的ではない。
【発明の概要】
【発明が解決しようとする課題】
【0007】
組み換えエタノール産生の細菌株をエタノール源として提供する可能性を実現化するためには、安価な最小培地中での生育時に効率的にエタノールを産生できる細菌のような新規及び改良された株、並びにこれらの細胞を支援できる新規な培地が、明らかに必要である。
【課題を解決するための手段】
【0008】
本発明は、生育及びエタノールの高収率産生のために最適化されている組み換えホスト細胞、及びこれら細胞の作製及び使用に関する。本発明は更に、組み換え微生物によるエタノールの経済的な産生のために最適化されている新規な培地に関する。
【0009】
微生物よる発酵時に、培地中の糖含有基質は、エタノール及び多くの不要な副生成物に変換される。本発明による組み換え細胞は、エタノール以外の1つ又はそれ以上の生成物の産生の原因となる遺伝子を制御(例えば、下方規制)するように遺伝子操作によって改変され、これにより突然変異していない親株に比べて、これらの細胞による糖からのエタノール産生を増大させる。組み換え細菌の新規及び改良された株は、安価な試薬を含有する最小生育培地中での発酵に適した条件下で生育させる場合、優れたエタノール産生及び収率を達成することができる。ある特定の株は、最適化培地の特定な態様において、優れたエタノール産生のために最適化される。エタノール産生のために最適化されたシステムは、選択最適化最小培地と選択培地中での使用のために最適化された組み換えホスト細胞を組み合わせたものである。好ましいシステムは、リグノセルロースをサッカライド源として用いるSSFによる効率的なエタノール産生に適している。
【0010】
従って、本発明の一態様は、
(a)糖をエタノールに変換する酵素をコードする非相同性ポリヌクレオチド配列(ここにおいて、ホスト細胞は、細菌による主要発酵生成物としてのエタノールの産生を促進するのに十分な機能レベルで、非相同性ポリヌクレオチド配列を発現する)、及び
(b)細胞の代謝経路において、糖からエタノール以外の生成物を産生するタンパク質をコードする少なくとも1つのポリヌクレオチド配列中の突然変異(ここにおける突然変異は、前記突然変異がない細胞によるエタノール産生に比べて、この細胞による増大したエタノール産生をもたらす)、
を含んでなる、サッカライドを分解するのに適している組み換えホスト細胞である。
組み換えホスト細胞のある態様では、この突然変異は、欠失、挿入又は塩基置換の突然変異である。
【0011】
本発明による組み換えホスト細胞は、細菌、真菌若しくは酵母のような単細胞又は多細胞の微生物、並びに線虫、昆虫、は虫類、鳥、両生動物、及び哺乳動物類を含む高等真核生物を包含する適当なホスト生物から作製することができる。酵母ホスト細胞は、例えば、サッカロミセス属(Saccharomyces)、シゾサッカロミセス属(Schizosaccharomyces)、ハンゼヌラ属(Hansenula)、パチオソレン属(Pachyosolen)、クルベロミセス属(Kluyveromyces)、デバリオミセス属(Debaryomyces)、ヤロウイア属(Yarrowia)及びピキア属(Pichia)由来である。細菌性ホスト細胞は、グラム陽性及びグラム陰性細菌から選ばれる。好ましいグラム陰性細菌は、エルウィニア属(Erwinia)及びクレブシエラ属(Klebsiella)の株のような腸内細菌である。グラム陽性細菌性ホスト細胞は、バチルス属(Bacillus)、ゲオバチルス属(Geobacillus)、クロストリジウム属(Clostridium)、連鎖球菌(Streptococcus)及びセルロモナス属(Cellulomonas)を包含する。
【0012】
本発明による細菌性ホスト細胞のある態様では、非相同性ポリヌクレオチド配列が、糖のエタノールへの変換に関与する酵素である、アルコールデヒドロゲナーゼ及び/又はピルビン酸デカルボキシラーゼをコードする。
【0013】
組み換え細胞のある態様は、クレブシエラ・オキシトカ(Klebsiella oxytoca)由来ののもので、これは尿素を窒素源として用いる固有の能力を有している。これらの株は、尿素様化合物を決められた窒素源として含有する最小培地で用いるためのホスト生物として特に適している。このような適しているホスト株の1つは、クレブシエラ・オキシトカP2株(ATCC55307)である。
【0014】
上記のように、本発明による組み換えホスト細胞は、細胞の代謝経路において糖からエタノール以外の生成物を産生するタンパク質をコードする少なくとも1つのポリヌクレオチド配列中に突然変異を含んでいる。細胞の種々の態様では、エタノール以外の生成物は、ホルメート、ラクテート、スクシネート、アセテート、アセトイン、ブタンジオール、2,3−ブタンジオール、キシリトール、ブチレート、ピルベート、プロピオネート、イソプロピルアルコール、1−プロパノール、2−プロパノール、プロパンジオール、シトレート、グルタメート及びアセトンから選ばれる。
【0015】
組み換え細胞の一態様では、代謝経路は、ブタンジオール経路である。この経路からもたらされる糖代謝の副生成物は、アセトイン及び2,3−ブタンジオールであって、これらはそれぞれαーアセトラクテート・デカルボキシラーゼ及びαーアセトラクテート・シンターゼによって産生される。従って、ある態様では、細胞は、ブタンジオール代謝経路に関与する酵素をコードする少なくとも1つのポリヌクレオチド配列中に突然変異を含んでいる。突然変異したポリヌクレオチド配列は、budA、budB、budR若しくはbudC遺伝子、又はこれらのホモログ若しくは機能的変異体のヌクレオチド配列を含有することができる。ある態様では、budA及びbudB遺伝子の片方又は両方に欠失突然変異を含んでいる。この欠失突然変異は、細胞において酵素αーアセトラクテート・デカルボキシラーゼ及びαーアセトラクテート・シンターゼのうちの少なくとも片方、好ましくは両方の発現を低減又は消去して、この細胞によるエタノール産生を、突然変異がない細胞によるエタノール産生に比べて増大させる。
【0016】
上記細菌株の何れも、遺伝子組み換え用の遺伝子を得るために、そしてある態様では変更の遺伝子配列を含有するDNA断片の再挿入を行うためのホストとして供用するために、使用することができる。
【0017】
本発明による組み換え細菌性ホスト細胞のある好ましい態様は、BW15(NRRLB−30857)、BW19(NRRLB−30858)及びBW21(NRRLB−30859)を包含するクレブシエラ・オキシトカ株によって代表され、これらは国立農業利用研究センター(National Center for Agricultural Utilization Research;Peoria, IL, USA)の農業研究サービス培養コレクション(Agricultural Reserch Service Culture Collection; ARSCC)に2005年6月28日付けで寄託された。
【0018】
他の態様では、本発明は、サッカライド源からエタノールを産生する方法を提供する。サッカライド源を、上記のような本発明による組み換えホスト細胞に接触させて、サッカライド源からエタノールを産生する。
【0019】
本発明は更に、サッカライド源からエタノールを産生するために最適化した組み換えホスト細胞を作製する方法を提供する。この方法は、
(a)エタノール産生の親ホスト細胞を、親細胞によってエタノールを産生するのに適した条件下で、選択培地及びオリゴサッカライド源に接触させること、
(b)選択された条件下の培地中で前記サッカライド源から産生されるエタノールのレベルを測定すること、
(c)選択された条件下の培地中で増大した発現を有する望ましくない副生成物を同定するために、サッカライド源から産生されるエタノール以外の少なくとも1つの生成物のレベルを測定すること、そして
(d)代謝経路において、望ましくない副生成物を産生するタンパク質をコードする遺伝子のポリヌクレオチド配列を突然変異させ(ここにおける突然変異は、代謝経路中の少なくとも1つの遺伝子産物の発現を低減又は消去して、突然変異なしの親細胞によるエタノール産生に比べて、前記細胞によるエタノール産生を増大させる)、これによりサッカライド源からのエタノール産生を最適化した組み換えホスト細胞を作製すること;
を含んでなる。
【0020】
本方法のある態様は更に、遺伝子の突然変異を包含する単離されたポリヌクレオチド断片を作製すること、及びこの突然変異したポリヌクレオチド断片を親細胞へ導入することを含んでなる。この方法のある態様では、突然変異は欠失、挿入、又は塩基置換である。
【0021】
本方法のある態様では、細胞は、最小培地でエタノールを産生するように最適化される。上記の適切なホスト細胞は何れも、本方法で最適化されるための親ホスト細胞株として使用することができる。
【0022】
更なる別な態様では、本発明は、サッカライドを分解するのに適した組み換えホスト細胞による生育及びエタノール産生を支援する新規な最小培地を提供する。本発明による培地は、決められた窒素源;コーンスティープリカー(CSL)、酵母自己消化物及び/又は抽出物、トウモロコシ加工副産物、大豆加工副産物又は使用済みの発酵培養液のような複合の窒素源;ホスフェイト源;及びマグネシウム源を包含する。
【0023】
最小培地のある態様は、尿素様化合物を決められた窒素源として含んでいる。本発明による尿素をベースとする最小培地の各種態様では、尿素窒素の濃度が、約0.1〜100mM、好ましくは約2.0〜20mM、そしてより好ましくは約8〜12mMである。低い製造コストとするために、本発明の最小培地は、複合の窒素源、例えばコーンスティープリカー(CSL)の低濃度を含有することもできる。幾つかの態様では、CSLの濃度は、約0.1〜100g/L、好ましくは約1〜20g/L、そしてより好ましくは約5〜10g/Lである。
【0024】
最小培地のある態様は、サッカライドを分解するのに適している組み換えホスト細胞による、生育及びエタノール産生を支援するために最適化されている。例えば、ある培地は、これらを同時糖化発酵での使用に適合できるように、酸性pHでの生育及びエタノール産生を支援するように最適化される。
【0025】
本発明によるある培地は、上記の方法で作製された本明細書に記載の組み換えホスト細胞による、生育及びエタノール産生を支援するように最適化されている。1つの好ましい態様は、クレブシエラ・オキシトカの組み換え株による、生育及びエタノール産生を支援するように最適化された培地である。
【0026】
本発明による培地は、サッカライド源を更に包含することができる。ある態様では、サッカライド源は、リグノセルロースを包含する。本発明の新規な培地における尿素様化合物の使用は、細菌培養の生育培地で通常用いられている、ペプトンのようなタンパク性の窒素源及びアンモニアのような低分子の窒素源に比べて、その窒素源としてのコストが比較的低いので、特に利点がある。
【0027】
単離されたポリヌクレオチド配列、これらの配列を含んでいるベクター及び単離されたポリペプチド配列も、本発明の範囲である。これらの配列は、本発明による単離されたポリヌクレオチド配列を発現する組み換えホスト細胞の構築、及びこれらの配列に突然変異を含んでいる組み換えホスト細胞の構築を含む、多くの用途で有用である。
【0028】
多様な態様では、本発明は、単離されたポリペプチドを提供する。従って、一態様では、本発明は、SEQ ID NO:6又は7のアミノ酸配列を包含するポリペプチドの断片を提供し、ここにおける断片は、SEQ ID NO:6又は7の少なくとも15個の連続したアミノ酸を含んでいる。
【0029】
別な態様は、SEQ ID NO:6又は7のアミノ酸配列を包含するポリペプチドの天然型対立遺伝子多型であり、ここにおけるポリペプチドは、厳しい条件下でSEQ ID NO:3又は4を含有する核酸分子にハイブリダイズする、核酸分子によってコードされる。
【0030】
他の態様は、SEQ ID NO:3又は4のヌクレオチド配列を包含する核酸に対して少なくとも60%同一であるヌクレオチド配列を包含する、核酸分子によってコードされるポリペプチド;及びSEQ ID NO:6又は7のアミノ酸配列に対して少なくとも50%同一のアミノ酸配列を包含するポリペプチドを含む。
【0031】
本発明の別の態様は、α−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼタンパク質のうちの少なくとも1つをコードする細菌遺伝子のポリヌクレオチド中に欠失突然変異を包含する、ベクターである。このベクターは、細菌性ホスト細胞に組み入れられると、このタンパク質の発現を低減又は消去することができる。
【0032】
本発明は更に、本発明のタンパク質/ポリペプチドに特異的に結合する、モノクローナル抗体又はポリクローナル抗体のような、抗体を特徴とする。
【0033】
ある態様では、突然変異したポリヌクレオチド配列は、クレブシエラ種のbudA及びbudBから選ばれる遺伝子に由来する。このポリヌクレオチド配列は、budA及びbudBの両方での欠失突然変異を含むことができる。
【0034】
このタイプの好ましいベクターは、α−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼタンパク質をコードする細菌性遺伝子のポリヌクレオチド配列中に欠失突然変異を包含し、ここにおけるベクターは、細菌性ホスト細胞に組み入れられる場合、これら遺伝子産物の発現を低減又は消去することができる。
【0035】
このようなベクターの一態様は、SEQ ID NO:5に対して少なくとも80%同一である、突然変異したbudABポリヌクレオチド配列を包含する。別の態様は、SEQ ID NO:8に対して少なくとも80%同一である、突然変異したbudABポリヌクレオチド配列を包含する。
【0036】
本発明によるベクターの特別な態様は、ポリヌクレオチド配列が、クレブシエラ種のbudA及びbudBから選ばれる遺伝子に由来する、プラスミドである。典型的なプラスミドは、本明細書ではpLOI3310又はpLOI3313と示される。
【0037】
本発明の更なる態様は、サッカライドを分解するのに適している組み換えホスト細胞によるサッカライド源からのエタノール産生に最適化されているシステムである。このシステムは、
(a)選択条件下でのホスト細胞による最適な生育及びエタノール産生を支援する選択培地;
(b)サッカライド源;及び
(c)選択培地及び条件でのエタノール産生のために最適化されている組み換えホスト細胞(この細胞は、
糖をエタノールに変換する酵素をコードする非相同性ポリヌクレオチド配列(ここにおいて、当該細胞は、当該ホスト細胞による主要発酵生成物としてのエタノールの産生を促進するのに十分な機能レベルで、当該非相同性ポリヌクレオチド配列を発現する);及び
当該細胞の代謝経路において、前記条件下及び培地中で当該サッカライド源からエタノール以外の生成物を産生するタンパク質をコードする少なくとも1つのポリヌクレオチド配列中の突然変異(ここにおける突然変異は、当該タンパク質の発現を低減又は消去し、これにより当該ホスト細胞によるエタノール産生を、突然変異がない細胞によるエタノール産生に比べて増大させて、エタノール産生を最適化する)を包含する)、
を含んでなる。
【0038】
このシステムの一態様では、発酵反応が、最小培地中で行われる。ある態様では、この最小培地は、上記のような尿素ベースの培地である。
【0039】
本発明による選択培地中でのエタノール産生に最適化された適切な組み換えホスト細胞の何れも、このシステムで使用できる。
【0040】
このシステムのある態様では、サッカライド源が、リグノセルロースを包含する。
【0041】
リグノセルロースをサッカライド源として用いる、SSFで使用するのに適している本発明のあるシステムでは、選択培地が上記のような尿素ベースの最小培地であり、そして組み換えホスト細胞が、ブタンジオール経路でのタンパク質をコードする遺伝子中に欠失突然変異を包含するクレブシエラ・オキシトカの株である。
【0042】
更に別の態様では、本発明は、本発明の方法又はシステムによる組み換えホスト細胞の使用についての説明書と共に包装されている、上記の組み換えホスト細胞を包含するキットを提供する。
本発明の他の態様及び利点は以下で論じる。
【図面の簡単な説明】
【0043】
【図1A】図1は、本発明の態様によるブタンジオール経路のbudAB遺伝子を欠如した、エタノール産生の組み換え細菌の構築で用いるベクター構築物及び工程を示す説明図である。 図1Aは、オペロン及び転写調節を示す略図である。○で囲んである+印は、budABオペロンの発現が低いpHで増大し、そしてBudR及びFnrによって正に調節されることを示す。
【図1B】図1B(左上部)は、クローンbudAB’に用いられるPCRプライマーを示す。この図の下部において、本発明の態様による最小培地でのエタノール産生のために最適化された、エタノール産生の組み換え細菌の構築に用いるプラスミド(例えば、pLOI3301)が、図式的に示され、番号で示されている。
【図2−1】図2A〜2Dは、本発明の態様による各種最小培地及び90g/Lのグルコースを含有するL培地での、エタノール産生の微生物K.オキシトカP2の組み換え株による発酵を示す4つのグラフである。図2A及び2Bは、LB培地及びアンモニア窒素を含有する培地での結果を示す。記号:▲−LB;○−M9+Fe;■−0.5%CSL+M。
【図2−2】図2A〜2Dは、本発明の態様による各種最小培地及び90g/Lのグルコースを含有するL培地での、エタノール産生の微生物K.オキシトカP2の組み換え株による発酵を示す4つのグラフである。図2C及び2Dは、尿素窒素を用いた培地での結果を示す。記号:○−U−M9+Fe;■−U−0.5%CSL+M;●−OUN1。標準誤差は、n≧3でデータに含まれている。
【図3】図3A及びBは、本発明の態様によるK.オキシトカP2株に最適化した尿素ベースの最小培地(OUM1)での、K.オキシトカP2によるグルコースのエタノールへの発酵の態様を示す。データは、各種濃度のコーンスティープリカー(図3A)及び尿素(図3B)を包含する培地で、48時間のフラスコ培養による生育(斜線の棒、OD550)及びエタノール産生(塗りつぶした棒)を示している。標準誤差は、n≧3でデータに含まれている。
【図4】図4A及び4Bは、K.オキシトカのエタノール産生株による生育及びエタノール産生(90g/Lグルコース)における、budAB遺伝子の欠失生成物の効果を示す2つのグラフである。図4Aは生育を示し;図4Bはエタノール産生を示す。記号:○−BW21株(ΔbudAB);●−P2株(親)。標準誤差は、n≧3でデータに含まれている。改善されたエタノール産生は、糖基質からエタノール以外の生成物を産生する競合の代謝経路に関わる、budAB遺伝子が欠如している突然変異株によって達成された。
【図5】図5は、本発明の態様による組み換え細菌(親株P2、及びbudAB欠失のある突然変異株BW21)による、エタノールの収率及び生産性の比較を示している。欠失の株によるエタノール産生は、親株の産生を上回っている。
【0044】
(発明の詳細な説明)
I.定義
本明細書で用いる「組み換えホスト細胞」、「組み換え微生物」などの用語は、遺伝子操作、例えば、トランスフェクトされるような非相同性ポリヌクレオチド配列を取り込むことができる遺伝子操作に、適しているか又は操作しやすい細胞、又はそのように操作されている細胞を包含するように意図されている。前記細胞は、微生物又は高度な真核細胞であり得る。前記用語は、もともとトランスフェクトされている細胞の子孫を含むように意図されている。ある態様では、細胞は、細菌の細胞、例えば、グラム陽性細菌の細胞又はグラム陰性細菌の細胞である。後者の用語は、エシェリキア属、赤痢菌、シトロバクター属、サルモネラ属、クレブシエラ属、エンテロバクター属、エルウィニア属、クルイベラ属、セラチア属、セデセア属、モルガネラ属、ハフニア属、エドワードシエラ属、プロビデンシア属、プロテウス属及びエルシニア属のような、腸内細菌科(family Enterobacteriaceae)の条件嫌気性のグラム陰性細胞の全てを含むように意図されている。好ましい組み換えホストは、大腸菌又はクレブシエラ・オキシトカの細胞である。
【0045】
「非相同性ポリヌクレオチドセグメント」又は「非相同性ポリヌクレオチド配列」という用語は、1つ又はそれ以上のポリペプチド又はポリペプチドの部分若しくは断片をコードするポリヌクレオチドセグメントを含むように意図されている。非相同性ポリヌクレオチドセグメントは、何れかの供給源、例えば真核生物、原核生物、ウィルス、又は合成ポリヌクレオチド断片から由来していてもよい。「非相同性ポリヌクレオチド配列」という用語は、生命体に自然に存在していないポリヌクレオチド配列、例えば生命体に導入された配列も示すことができる。一態様では、ポリヌクレオチド配列の遺伝子は、糖質のエタノールへの生物変換の少なくとも一工程に関与する。従って、この用語は、アルコールデヒドロゲナーゼ、ピルビン酸デカルボキシラーゼ、分泌タンパク質(複数を含む)、又はポリサッカラーゼ(例えば、エンドグルカナーゼ又はエクソグルカナーゼのようなグルカナーゼ)、セロビオヒドロラーゼ、β−グルコシダーゼ、エンド−1,4−β−キシラナーゼ、β−キシロシダーゼ、α−グルクロニダーゼ、α−L−アラビノフラノシダーゼ、アセチルエステラーゼ、アセチルキシランエステラーゼ、α−アミラーゼ、β−アミラーゼ、グルコアミラーゼ、プルラナーゼ、β−グルカナーゼ、ヘミセルラーゼ、アラビノシダーゼ、マンナナーゼ、ペクチンヒドロラーゼ、又はペクチン酸リアーゼのような、ポリペプチドをコードする遺伝子の何れかを含むように意図されている。
【0046】
「ポリサッカラーゼ」、「セルラーゼ」又は「グルカナーゼ」という用語は、本明細書では互換的に使用され、結合糖成分、例えば、ジサッカライド、トリサッカライド、オリゴサッカライド(本明細書では複合糖とも呼ばれる複合糖質、例えば、セルロース、へミセルロース及びペクチンを含む、セロオリゴサッカライド及びリグノセルロースを包含する)の何れかを、触媒的な分解又は脱重合できるポリペプチドを含むように意図されている。この用語は、グルカナーゼのようなセルラーゼを包含するように意図されているが、好ましくは、エンドグルカナーゼを含み、これらに限定されないが、例えば、エクソグルカナーゼ、β−グルコシダーゼ、セロビオヒドロラーゼ、エンド−1,4−β−キシラナーゼ、β−キシロシダーゼ、α−グルクロニダーゼ、α−L−アラビノフラノシダーゼ、アセチルエステラーゼ、アセチルキシランエステラーゼ、α−アミラーゼ、β−アミラーゼ、グルコアミラーゼ、プルラナーゼ、β−グルカナーゼ、ヘミセルラーゼ、アラビノシダーゼ、マンナナーゼ、ペクチンヒドロラーゼ、ペクチン酸リアーゼ又はこれらのセルラーゼの何れかの組み合わせも含むように意図されている。
【0047】
「エンドグルカナーゼ」という用語は、一般にポリマー基質内の内部β1−4グルコシル結合を加水分解し、そして鎖の末端にある結合を優先的に加水分解しないセルラーゼを包含するように意図されている。
「サッカライド」、「サッカライド源」、「オリゴサッカライド源」、「オリゴサッカライド」、「複合セルロース」、「複合糖質」、「複合糖」、「ポリサッカライド」、「糖源」、「発酵性糖源」などの用語は、1つ又はそれ以上の糖分子を包含する何れかの糖質源を含むように意図されている。
【0048】
本明細書で用いるような用語「サッカライド」という用語は、例えば、ジサッカライド、トリサッカライド、オリゴサッカライド及びポリサッカライドを含む。これらの糖質は、何れかの未処理植物原料又は何れかの加工植物原料からの由来であってもよい。例としては、1つ又はそれ以上の結合の糖質部分、すなわち1個の糖残基を包含する、木材、紙、パルプ、植物由来の繊維又は合成繊維である。
【0049】
一つの具体的なサッカライド源は、「リグノセルロース」であり、これは、殆どの植物材料の乾燥重量の約90%に相当し、そして糖質、例えば、セルロース、ヘミセルロース、ペクチン及び芳香族ポリマー(例えば、リグニン)を含む。セルロースは、リグノセルロースの乾燥重量の30%〜50%を占め、そしてセロビオース(グルコースの2量体)のホモポリマーである。同様に、ヘミセルロースは、リグノセルロースの乾燥重量の20%〜50%を占め、そしてアセチル及びグルクロニル側鎖を含有するペントース(キシロース、アラビノース)及びヘキソース(グルコース、マンノース、ガラクトース)糖の混合物を含む複合ポリマーである。ペクチンは、リグノセルロースの乾燥重量の1%〜20%を占め、そしてグルクロン酸のメチル化ホモポリマーである。
【0050】
その他のサッカライド源は、カルボキシメチルセルロース(CMC)、非晶性セルロース(例えば、酸膨張セルロース(acid-swollen cellulose))、及びセロオリゴサッカライドセロビオース、セロトリオース、セロテトラオース、及びセロペンタオースを含む。セルロース、例えば、非晶性セルロースは、紙又はパルプ源(例えば、それらの廃液を含む)又は例えば、トウモロコシの茎、大豆可溶分、又はビートパルプのような農業副産物からの由来であってよい。上記糖質ポリマーの何れか一つ又はそれらの組み合わせは、本発明の生成物及び方法による発酵によって、解重合及び続くエタノールへの生物変換のための糖源になり得る。
【0051】
「核酸」という用語は、例えば、ポリペプチドをコードするオープンリーディングフレームを含み、そして更に非コード調節配列及びイントロンを含むことができるポリヌクレオチド配列の核酸分子を包含するように意図されている。本発明による核酸分子は、DNA分子(例えば、線状、環状、cDNA又は染色体のDNA)、RNA分子(例えば、tRNA、rRNA、mRNA)及びヌクレオチド類似体を用いて産生されたDNA又はRNAの類似体を包含する。核酸分子は、一本鎖又は二本鎖であってもよいが、二本鎖DNAの方が有利である。
【0052】
本発明の「単離された」核酸分子は、核酸由来の生命体の染色体DNA中の核酸分子の元来側面にある配列(つまり、核酸分子の5’及び3’末端に位置する配列)を有していない核酸分子を包含する。多くの態様では、単離された核酸分子は、核酸分子が由来する微生物の染色体DNA中の核酸分子の元来側面にあるヌクレオチド配列の約10kb、5kb、4kb、3kb、2kb、1kb、0.5kb、0.1kb、50bp、25bp又は10bp以下を含有することができる。更に、cDNA分子のような、単離された核酸分子は、組み換え技術で作製される場合には他の細胞物質が実質的になくてよく、又は化学的に合成される場合には化学前駆物質又は他の化学品が実質的になくてよい。
【0053】
本明細書で用いる「遺伝子」という用語は、例えば、ポリペプチドをコードする連続オープンリーディングフレーム(ORF)のようなコーディング配列を包含してもよく、又はそれ自身が生体内で機能を有していてもよい、酵素又はその他のポリペプチド分子を直接合成することができる核酸である。生体内の遺伝子は、本明細書で明示されるように、オペロンに集合させることができ、ここにおけるオペロンは、遺伝子間DNAによって他の遺伝子及び/又はオペロンから分離される。オペロン中に含まれる個々の遺伝子は、個々の遺伝子の間にある遺伝子間DNAなしで、重なり合うことができる。遺伝子の一態様は、ブタンジオールの代謝経路に関わるタンパク質、α−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼをそれぞれコードする、クレブシエラのbudA及びbudBのような機能的な遺伝子座又はオペロンに位置する1つ又はそれ以上の遺伝子である。更に、「遺伝子」という用語は、選択された目的のための特定の遺伝子を包含するように意図されている。遺伝子は、ホスト細胞に内因性であってもよいし、例えばエピソームに保持されたプラスミド又はゲノムに安定に組み入れられたプラスミド(又はその断片)のように、ホスト細胞に組み換え技術によって導入されていてもよい。
【0054】
本明細書に記載されているような「単離された遺伝子」は、遺伝子が由来する生命体の染色体DNA中の遺伝子の元来側面にある配列を実質的に含まない(すなわち、第2若しくは別個のポリペプチド又はRNA分子、隣接する構造配列等、をコードする隣接コーディング配列を含まない)遺伝子を包含し、そして5’及び3’調節配列、例えば、プロモーター配列及び/又は終結配列を包含していてもよい。一態様では、単離された遺伝子は、ポリペプチドを主にコードする配列(例えば、ポリペプチドをコードする配列)を包含する。
【0055】
本明細書で用いる「ホモログ」という用語は、ポリペプチド、又は野生型ポリペプチド若しくは本明細書に記載のポリペプチドのアミノ酸配列に対して少なくとも約30〜35%、有利には少なくとも約35〜40%、より有利には約40〜50%、そして更に有利には少なくとも約60%、70%、80%、90%又はそれ以上の同一性を共有し、そして野生型ポリペプチド又はポリペプチドと実質的に同等な機能又は生物学的活性を有しているポリペプチドを含む。従って、「ホモログ」という用語は、「機能的な変異体」を、更には「オーソログ」(異なった種から得られる同等の遺伝子)をも包含するように意図されている。
【0056】
例えば、budA又はbudBホモログは、それぞれSEQID NO:6及びSEQID NO:7で示されているアミノ酸配列を有するポリペプチドに対して、少なくとも約30〜35%、有利には少なくとも約35〜40%、より有利には約40〜50%、そして更に有利には少なくとも約60%、70%、80%、90%又はそれ以上の同一性を共有し、そしてSEQID NO:6又はSEQID NO:7と示されているアミノ酸配列を有するペプチドと実質的に同等な機能又は生物学的活性(すなわち機能的に同等である)を有している(例えば、実質的に同等なα−アセトラクターゼ・デカルボキシラーゼ又はα−アセトラクターゼ・シンターゼ活性を有している)。核酸の遺伝子産物、又は本発明によるそのホモログの機能活性の測定法は公知であって、以下の実施例に記載されている。
【0057】
一態様では、遺伝子は、糖質を生物変換してエタノール以外の生成物を産生する少なくとも一つの工程に関わる。このような生成物を本明細書では、「副生成物」又は「発酵副生成物」と呼ぶ。副生成物は、糖質(サッカライド)基質をエタノール産生に利用される以外の競合の代謝経路に転換することによって収量を減少させるので、エタノール発酵反応においては一般に望ましくない。従って、一態様では、後者の経路(例えば、ブタンジオール経路)に関わる酵素のようなタンパク質をコードする遺伝子は、細胞から除くのが望ましい目標であるので本発明では重要である。微生物中にあって糖質のエタノール以外の生成物への生物変換に関わる遺伝子の例は、細菌のbudA及びbudBであって、これらは糖質源からブタンジオール及びアセトインの合成に関わる、α−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼをそれぞれコードする。その他の重要な遺伝子は、糖発酵のその他の望ましくない副生成物(これらに限定されないが、ホルメート、ラクテート、スクシネート、アセテート、アセトイン、キシリトール、ブチレート、ピルベート、プロピオネート、イソプロピルアルコール、1−プロパノール、2−プロパノール、プロパンジオール、シトレート、グルタメート及びアセトンを含む)を産生する代謝経路に関わるものを包含する。
【0058】
本明細書で用いる「対立遺伝子多型(複数を含む)」は、機能的な及び非機能的なタンパク質の両方を包含する。機能的な対立遺伝子多型は一般に、SEQ ID NO:6又は7の1つ又はそれ以上のアミノ酸の同類置換のみを含むか、又はタンパク質の非臨界領域中の非臨界残基において置換、欠失又は挿入を含む。非機能的な対立遺伝子多型は一般に、SEQ ID NO:6又は7のアミノ酸の非同類置換、欠失、又は挿入若しくは中途切断を含むか、又は臨界的残基又は臨界的領域における置換、挿入又は欠失を含む。
【0059】
本発明のポリヌクレオチド又はアミノ酸配列は更に、その他の系統群メンバー又は関連する配列、例えば、遺伝子がクローン化されていない生体内のbudA及びbudBに関連する遺伝子を同定するために、公共のデータベースで検索するための「クエリー配列」として用いることができる。このような検索は、「Altschul, et al. (1990) J. Mol. Biol. 215;403-10」のNBLAST及びXBLASTプログラム(バージョン2.0)を用いて実施することができる。BLASTヌクレオチド検索は、本発明のポリヌクレオチド分子と相同なヌクレオチド配列を求めるために、NBLASTプログラム(スコア=100、語長=12)で実行することができる。BLASTタンパク検索は、本発明のポリヌクレオチド分子と相同なアミノ酸配列を求めるために、XBLASTプログラム(スコア=50、語長=3)で実行することができる。比較するためのギャップ配列を得るためには、「Altschul et al., (1997) Nucleic Acids Res. 25 (17):3389-3402」に記載のようにして、Gapped BLASTを用いることできる。BLAST及びGapped BLASTプログラムを用いるときは、それぞれのプログラムのデフォルトパラメータ(例えば、XBLAST及びNBLAST)を用いることができる。「http://www.ncbi.nlm.nih.gov」を参照されたい。
【0060】
本明細書で用いる「突然変異」は、1つ又はそれ以上の染色体の異常、又は遺伝子を作っているDNA配列の変化の何れかに関わる、生体の遺伝因子における比較的永久的な変化を示すように意図されている。本明細書で用いるような突然変異は、DNA配列の欠失又は挿入によるか、1つ又はそれ以上の塩基の変換(例えば、点突然変異)によるか、重複、ミスセンス、反復又はナンセンス突然変異によるかの何れかによって作製されたDNA配列の変化を包含する。挿入、欠失及び塩基置換の突然変異を作製する方法は、当該技術分野で公知であり、そして例えば、「Sambrook et al. 」[26] の論文に記載されている。
【0061】
「発酵(fermentation)」及び「発酵する(fermenting)」という用語は、複合糖を分解又は解重合して、この糖残渣をエタノール、アセテート及びスクシネートに生物変換することを含むように意図されている。この用語は、エタノールが、特に主要な発酵生成物として糖質から産生される、酵素の処理工程(例えば、細胞性又は無細胞性(例えば、溶解又は精製されたポリペプチド混合物)を包含するように意図されている。
【0062】
「同時糖化発酵」又は「SSF」という用語は、複合糖の分解又は解重合、及び発酵によるその糖残基のエタノールへの生物変換を同時に行うための、1つ又はそれ以上の組み換えホスト(又は、それらの抽出物(精製又は未精製の抽出物を含む))の使用を含むことを意図している。SSFは、バイオマスを分解して、最終的に細菌でエタノールに変換されるポリサッカライドにすることができる、公知の方法である。バイオマスの分解が自然に起こるものと見なすと、SSFは、菌類(又は菌類から抽出されるセルラーゼのような酵素)の活性と、エタノール産生の細菌(又はそれから誘導される酵素)の活性を組み合わせて、リグノセルロースのような糖源をエタノールに最終的に変換可能な単糖に分解する。SSF反応は一般に、高価な菌体酵素の使用を最適化するために酸性のpHで実施される。
【0063】
「転写制御」という用語は、転写のレベルで遺伝子の発現を調節する能力を含むように意図されている。好ましい態様では、転写及びそれによる遺伝子の発現は、対象の遺伝子のコード領域の5’末端付近に代用プロモーターを置換又は付加することによって調節し、これにより遺伝子発現の変化をもたらす。好ましい態様では、1つ又はそれ以上の遺伝子の転写制御は、このような遺伝子の最適発現、例えば好ましい比率をもたらすように改変される。この用語は、当該技術分野で認識されているような誘導の転写制御も含む。
【0064】
「発現」という用語は、少なくともmRNA生成レベルでの遺伝子の発現、及びポリペプチドレベルでもよい遺伝子の発現を含むように意図されている。
【0065】
「発現生成物」という用語は、発現された遺伝子により得られた生成物、例えばポリペプチド又はタンパク質を含むように意図されている。
【0066】
「増大した発現」及び「低減した発現」という用語は、少なくともmRNA生成レベルでの遺伝子の発現、そして好ましくはポリペプチド又はタンパク質発現のレベルでの遺伝子発現における変化(それぞれ、上方制御及び下方制御)を含むように意図されている。
【0067】
ポリペプチドに関する「増大した産生」及び「低減又は消滅した産生」という用語はポリペプチドの酵素活性レベルでの、ポリペプチド発現量における増大若しくは低減、又はそれらの組み合わせを含むように意図されている。
【0068】
「活性」及び「酵素活性」という用語は、互換的に用いられ、そして好ましい条件下で生成される場合に選択されたポリペプチドによって通常もたらされる機能的な活性の何れをも含むように意図されている。α−アセトラクテート・デカルボキシラーゼ酵素(budAによってコードされる)の活性は、例えば、糖質源からアセトイン生成物を産生することである。α−アセトラクテート・デカルボキシラーゼのような活性を検出するための技術は、当該技術分野において公知であり(例えば、「Blomqvist et al.」 [35] を参照されたい)、そして本明細書の実施例に記載されている。
【0069】
「由来(の)」という用語は、表記された原料からポリヌクレオチド断片の単離(全部又は部分)、又は表記された原料からポリヌクレオチドの精製を含むように意図されている。この用語は、例えば、直接的なクローニング、PCR増幅、又は表示されたポリヌクレオチド原料に関連する配列由来の若しくはそれに基づく人工的な合成を含むように意図されている。本明細書に記載の検討において、例えば、ブタンジオール経路に関連する遺伝子産物をコードするヌクレオチド配列は、細菌クレブシエラ・オキシトカのゲノムDNAから増幅されたbudA及びbudB由来である。
【0070】
「エタノール産生の」という用語は、糖質から主要発酵生成物としてエタノールを産生する微生物の能力を含むように意図されている。この用語は、これらに限定されないが、天然由来のエタノール産生の微生物、天然由来の又は導入された突然変異を有する微生物、及び遺伝子的に改変された微生物を含む。
【0071】
「エタノール非産生の」という用語は、糖質から主要な非気体の発酵生成物としてエタノールを産生できない細胞を含むように意図されている。この用語は、非気体の発酵生成物の総量の40%より少ない、例えば20%、30%、40%を包含する少量発酵生成物としてエタノールを産生する微生物を含むように意図されている。
【0072】
「主要発酵生成物」という用語は、非気体発酵生成物の総量の約40%、50%、60%、70%、80%、85%、90%、91%、92%、93%、94%、95%より多くを含有する非気体発酵生成物を含むように意図されている。主要発酵生成物は、最も多い非気体生成物である。本発明のある態様では、主要発酵生成物が、エタノールである。更なる態様では、主要発酵生成物が、最小塩培地で生育するホストによって産生される。
【0073】
本明細書で用いる「少量発酵生成物」という用語は、非気体生成物の総量の40%より少ない、例えば20%、30%、40%を含有する非気体発酵生成物を含むように意図されている。
【0074】
「グラム陰性細菌」及び「グラム陽性細菌」という用語は、これらの用語の当該技術分野で認識されている定義のものを含むように意図されている。一般に、グラム陰性細菌は、例えば、エシェリキア属、赤痢菌、シトロバクター属、サルモネラ属、クレブシエラ属、エンテロバクター属、エルウィニア属、クルイベラ属、セラチア属、セデセア属、モルガネラ属、ハフニア属、エドワードシエラ属、プロビデンシア属、プロテウス属及びエルシニア属よりなる、腸内細菌科を包含する。その他のグラム陰性細菌は、これらに限定されないが、アシネトバクター属(Acinetobacter)、グルコノバクター属(Gluconobacter)、ジオバクター属(Geobacter)及びシェワネラ属(Shewanella)を包含する。グラム陽性細菌は、これらに限定されないが、バチルス属、ゲオバチルス属、クロストリジウム属、連鎖球菌、セルロモナス属、コリネバクテリウム属(Corynebacterium)、ラクトバチルス属(Lactobacillus)、ラクトコッカス属(Lactococcus)、オエノコッカス属(Oenococcus)及び真正細菌(Eubacterium)を含む。
【0075】
「決められた窒素源」という用語は、個別の窒素源、すなわち、本発明で使用するのに適している窒素源として提供可能な、単一の化学物質を意味するように意図されている。決められた窒素源の例としては、例えば、尿素及びアンモニアを含む。ある態様では、2つ又はそれ以上の決められた窒素源を用いることができる。
【0076】
「決められた窒素源」と区別される「複合の窒素源」という用語は、本発明で使用するのに適している窒素源を共に提供する、化学物質の混合物を含むように意図されている。
【0077】
「尿素」という用語は、式:(NH2)2COを有する有機化合物を示す。本明細書で用いる「尿素様化合物」という用語は、一般式:R1N−(C=O)−NR2を有する尿素の多様な類縁体/誘導体を含む。尿素様化合物及びこれらの化合物の製造方法は、例えば、Muziらの米国特許第6,875,764号(2005)に記載されており、この開示の全ては本明細書に参照として取り込まれている。
【0078】
II.発酵の副生成物をもたらす代謝経路のタンパク質をコードする遺伝子において突然変異を包含する組み換えホスト細胞
検討したように、本発明はサッカライドを分解するのに適している、新規及び改良された組み換えホスト細胞に関する。この細胞は、発酵の不要な副生成物産生の代謝経路に関連する1つ又はそれ以上の遺伝子における突然変異を包含する。これらの経路の変動は、サッカライド出発原料のより多くの割合を、他の不要な発酵生成物ではなく、エタノールへ変換させる。
【0079】
従って、ある態様では、本発明は、サッカライドを分解するのに適した組み換えホスト細胞を提供する。この細胞は、糖をエタノールに変換する酵素をコードする非相同なポリヌクレオチド配列を含有している。このホスト細胞は、主要発酵生成物としてエタノールの産生を促進するのに十分な機能レベルで非相同なポリヌクレオチド配列を発現する。組み換えホスト細胞は更に、糖源からエタノール以外の生成物を産生する、細胞の代謝経路のタンパク質をコードする少なくとも1つのポリヌクレオチド配列中に突然変異を包含する。この突然変異の存在は、代謝経路の少なくとも1つのタンパク質の発現を低減又は消去し、これによりこの突然変異なしの組み換え細胞によるエタノール産生に比べて、この細胞によるエタノール産生を増大させる。
【0080】
サッカライドの分解に適している組み換えホスト細胞は、線虫、昆虫、は虫類、鳥、両生動物、及び哺乳動物のような高等真核生物の細胞であってよい。細胞は、細菌、酵母若しくは真菌のような単細胞又は多細胞微生物の細胞であってもよい。本発明による組み換え酵母細胞は、例えば、サッカロミセス属、シゾサッカロミセス属、ハンゼヌラ属、パチオソレン属、クルベロミセス属、デバリオミセス属、ヤロウイア属及びピキア属由来のものである。
【0081】
本発明による幾つかの細菌性ホスト細胞は、グラム陽性細菌由来である。この細胞のある具体例は、例えば、バチルス属、ゲオバチルス属、クロストリジウム属、連鎖球菌及びセルロモナス属由来である。
【0082】
その他の細菌性ホスト細胞は、グラム陰性細菌由来である。ある態様では、この細菌は条件的嫌気性である。好ましい条件的嫌気性細胞は、腸内細菌科から選ばれ、これらに限定されないが、エシェリキア属、赤痢菌、シトロバクター属、サルモネラ属、クレブシエラ属、エンテロバクター属、エルウィニア属、クルイベラ属、セラチア属、セデセア属、モルガネラ属、ハフニア属、エドワードシエラ属、プロビデンシア属、プロテウス属、及びエルシニア属を含む。
【0083】
検討したように、本発明の組み換えホスト細胞は、糖をエタノールに変換する酵素をコードする非相同性ポリヌクレオチド配列の1つ又はそれ以上を包含する。従って、これらの細胞は、エタノール産生である。エタノール産生の組み換えホスト細胞の構築に用いるためのに適切なポリヌクレオチド配列は、例えば、ザイモモナス・モビリスのような、細菌の天然由来のエタノール産生株の遺伝子をコードすることができる。糖をエタノールに変換する2つの好ましい非相同性遺伝子は、アルコールデヒドロゲナーゼ(adh)及びピルビン酸デカルボキシラーゼ(pdc)を包含する。本発明の組み換え細胞は、これらの遺伝子の片方又は両方を包含し、そして更に糖のエタノールへの変換を補助するポリサッカラーゼのような酵素をコードするその他の非相同性ヌクレオチド配列を含んでいてもよい。好ましい非相同性遺伝子は、細菌の染色体中に組み込まれる。
【0084】
エタノール産生の組み換えホスト細胞を作製する方法は、分子生物学の分野で公知である。適当な材料、方法及び組み換えホスト生物は、例えば、参照として本明細書に組み込まれている、米国特許第6,849,434号、同第6,333,181号、同第5,821,093号、同第5,482,846号、同第5,424,202号、同第5,028,539号、同第5,000,000号、同第5,487,989号、同第5,554,520号、及び同第5,162,516号に記載されており、そして本発明を実施するために利用することができる。
【0085】
ある態様では、組み換えホスト細胞は、腸内細菌科由来のエタノール産生のグラム陰性細菌である。例えば、参照として本明細書に組み込まれている米国特許第5,821,093号のエタノール産生のホストは、ホストに適しており、そして特に、以下で検討する、大腸菌KO4株(ATCC55123)、KO11(ATCC55124)、KO12(ATCC55125)及びクレブシエラ・オキシトカP2株(ATCC55307)を含む。あるいは、本発明のエタノール非産生のホストは、糖をエタノールに変換する1つ又はそれ以上の適当な酵素をコードする非相同性ポリヌクレオチド配列を付加することによって、エタノール産生のホストに変換することができる。
【0086】
本発明の幾つかの態様では、エタノール産生の組み換えホスト細胞が、エルウィニア属又はクレブシエラ属由来である。クレブシエラ・オキシトカ由来の組み換えホストは、ペントースとヘキソースの共発酵の効率、毒素に対する抵抗、複合サッカライドを解重合する酵素の産生(真菌性セルラーゼ添加による解重合の必要性を避けるか若しくは減じる)及び環境耐性を含む多くの便宜性を有していて、リグノセルロースのSSFに特に適している。
【0087】
エタノール産生性クレブシエラ属ホスト細胞に適しているものの1つは、K.オキシトカM5A1の誘導体のK.オキシトカP2(「Wood, et al. (1992) Appl. Environ. Microbiol. 58:2103-2110」及び米国特許第5,821,093号を参照されたい)である。有利なことに、K.オキシトカ株は、尿素を窒素源として使用できる固有の能力を有している。一態様では、エタノール産生の組み換え細菌は、少なくとも1つのエンドグルカナーゼ(例えば、EGY又はEGZ)をコードする少なくとも1つの非相同性ポリヌクレオチド断片(例えば、エルウィニア属由来のcelY又はcelZ)を含有している。より好ましくは、エタノール産生の組み換えホスト細胞が、エンドグルカナーゼをコードする1つ又はそれ以上の非相同性ポリヌクレオチド断片を含有している。例えば、米国特許出願公開第2004/015990号公報に記載されているような、celY及びcelZは、機能的に組み込まれ、発現され、そしてエタノール産生の株K.オキシトカP2から分泌されて、同時にサッカライド基質(例えば結晶性セルロース)からエタノールを産生することができる。
【0088】
上記で検討したように、SSFによるエタノール産生の工程は、組み換えホスト細胞によりエタノール以外の不要な発酵副生成物の産生が伴うことは公知である。基質である糖の、エタノール以外の生成物を産生する別の代謝経路への転換は、別の経路がない場合の理論的な可能性より低い生産性及び収率をもたらす。本発明による組み換えホスト細胞は、不要な副生成物の産生能力を減少した又は産生できないことの効果によって、この問題を低減するように改変される。この細胞の各種態様では、選択された発酵副生成物を産生する能力を低減又は消去するように、改変される。組み換えホスト細胞のある態様は、これらに限定されないが、ホルメート、ラクテート、スクシネート、アセテート、アセトイン、ブタンジオール、2,3−ブタンジオール、キシリトール、ブチレート、ピルベート、プロピオネート、イソプロピルアルコール、1−プロパノール、2−プロパノール及びアセトンを包含する、副生成物を産生できないことである。
【0089】
上記のように不要な副生成物の産生を不能にするために、本発明による組み換えホスト細胞の幾つかの具体例は、糖原料からエタノール以外の生成物を産生する、細胞中の代謝経路のタンパク質をコードする1つ又はそれ以上のポリヌクレオチド配列中に欠失突然変異を含有している。この細胞の幾つかの具体例は、細胞において糖からホルメート、ラクテート、スクシネート、アセテート、アセトイン、ブタンジオール、2,3−ブタンジオール、キシリトール、ブチレート、ピルベート、プロピオネート、イソプロピルアルコール、1−プロパノール、2−プロパノール、又はアセトンを産生する1つ又はそれ以上の代謝経路に関わるタンパク質をコードするポリヌクレオチド配列中に欠失突然変異を有している。
【0090】
欠失突然変異に関する本発明の一態様は、細胞の選択された代謝経路と関連すると知られている、「はじき出し(knocking out)」遺伝子に関する。細菌細胞のような細胞に存在する、選択された代謝生成物を産生する生物化学的な経路についての解明が進んでいる。糖からのエタノール以外の生成物(例えば、ホルメート、ラクテート、スクシネート、アセテート、アセトイン及び2,3−ブタンジオールのような生成物)を産生するための細菌のような細胞に存在する代謝経路は報告されており、例えば、化学文献の検索によって容易に確認することができる。
【0091】
ホルメート、ラクテート、スクシネート、アセテート、アセトイン、ブタンジオール、2,3−ブタンジオール、キシリトール、ブチレート、ピルベート、プロピオネート、イソプロピルアルコール、1−プロパノール、2−プロパノール又はアセトンを産生する代謝経路に関わるタンパク質又はその機能的な断片をコードする遺伝子のノックアウトは、糖発酵のこのような不要な副生成物の産生ができない組み換えホストをもたらす。
【0092】
組み換えホスト細胞の幾つかの態様では、欠失突然変異は、ブタンジオール代謝経路に関わる酵素をコードする少なくとも1つのポリヌクレオチド配列中にある。この経路は、細菌細胞により糖原料からアセトイン及び2,3−ブタンジオールの産生をもたらす。幾つかの態様では、欠失突然変異が、酵素α−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼをそれぞれコードする、budA及びbudBの片方又は両方にある。ブタンジオール経路によるこれらの副生成物の産生は、これら2つの酵素の作用によって引き起こされる。これらの酵素の発現を低減又は消去する欠失突然変異は、糖原料からアセトイン及び2,3−ブタンジオールの産生ができないエタノール産生の組み換えホスト細胞をもたらし、これにより、この突然変異が存在しない組み換え細胞と比べて、糖原料からの増大したエタノール産生を示す。
【0093】
本発明によって提供されるホスト細胞のある態様は、budA及びbudB遺伝子の両方に欠失突然変異を含有しているエタノール産生の組み換え細菌である。これらの遺伝子に欠失を保持する1つの好ましいホスト細胞は、K.オキシトカBW21と称されている、K.オクトシカP2の変異株である。以下に示すように、この株は窒素源として尿素様化合物を含有する最小培地でのエタノール産生に有利に用いることができ、そして酸性のpH範囲の培地で行われる発酵反応で用いるのに特に適している。
【0094】
III.単離された核酸分子及びポリペプチド
別の態様では、本発明は、酵素α−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼをそれぞれコードする、budA及びbudB遺伝子配列を包含する単離された核酸分子を特徴としている。この核酸は、グラム陰性及びグラム陽性の細菌、例えば、グラム陰性細菌であるクレブシエラ・オキシトカ由来である。
【0095】
単離されたゲノム核酸は、ブタンジオール経路の上記遺伝子(すなわち、budA及びbudB)、及び調節領域(例えば、プロモーター(複数を含む)及びリボソーム結合部位(複数を含む))を包含する側面にある領域、更にエタノール産生に関わる、例えば、アルコールデヒドロゲナーゼ(adh)及びピルビン酸デカルボキシラーゼ(pdc)のような他の関連する遺伝子を包含することを特徴とする。
【0096】
検討したように、本発明は、とりわけクレブシエラ株由来のbudA及びbudB遺伝子のそれぞれをコードする配列の全長若しくは部分を、コードする新規な核酸を提供する。これらの遺伝子は、これらの遺伝子によってコードされる酵素の活性からもたらされる不要な発酵副生成物の増大した産生を発見することによって単離された。より具体的には、これら副生成物の産生が、上記のOUMのような望ましい、安価な生育培地中で実施される発酵反応において、エタノール産生の細菌中で増大することが、実証された。
【0097】
これらの生成物の産生を消去するために、エタノール産生の生成細胞の副生成物を作る能力を消去するために遺伝学的戦略を立てた。一例として、budA及びbudBの一部をコードする遺伝子を最初にクレブシエラ・オキシトカからクローンした。次いで単離された配列を、効力がないようにするために、budB遺伝子の大きな断片を除去する遺伝子操作を実施した。budA及びbudB遺伝子はこれまで、クレブシエラ・オキシトカから単離されたことがない。従って、本発明はある態様で、新規なDNA配列、及びこれらのDNA配列に基づく予測アミノ酸配列を提供する。
【0098】
本発明による新規な核酸の一態様は、SEQ ID NO:3又は4に記載されているヌクレオチド配列を包含する単離された核酸分子である。SEQ ID NO:3として本明細書で示されている核酸は、タンパク生成物であるα−アセトラクテート・デカルボキシラーゼをコードする、クレブシエラ・オキシトカのbudA遺伝子からの推定全長コード配列に対応する。SEQ ID NO:4として本明細書で示されている核酸は、タンパク生成物であるα−アセトラクテート・シンターゼをコードする、同種のbudB遺伝子からの部分コード配列に対応する。
【0099】
本発明のその他の新規な配列は、SEQ ID NO:3及び4に対応する推定アミノ酸配列であり(以下に記載する)、これらは本明細書でそれぞれSEQ ID NO:6及び7で示されている。
【0100】
本発明による核酸の一態様は、SEQ ID NO:6又は7と記載されているアミノ酸配列を包含するポリペプチドをコードする単離された核酸分子である。
【0101】
本発明は更に、SEQ ID NO:6又は7と記載されているアミノ酸配列を包含するポリペプチドの天然型対立遺伝子多型をコードする単離された核酸分子である。
【0102】
別の態様では、単離された核酸分子は、SEQ ID NO:6又は7と記載されているアミノ酸配列を包含するポリペプチドのホモログをコードする。更なるbudA及びbudBの核酸配列は、SEQ ID NO:6又はSEQ ID NO:7と記載されているアミノ酸配列を含有しているポリペプチドのホモログをコードする(例えば、SEQ ID NO:6又はSEQ ID NO:7と記載されているアミノ酸配列を含有しているポリペプチドに対して、少なくとも30%、40%、50%、60%、70%、80%、90%、95%又はそれ以上同一であり、このポリペプチドと実質的に同一の活性を有するポリペプチドをコードする)ものである。
【0103】
更なる他の態様は、以下の単離された核酸分子を含む。一態様は、SEQ ID NO:3若しくは4のヌクレオチド配列又はそれらの相補体に対して、少なくとも60%同一であるヌクレオチド配列を包含する核酸分子である。多くの態様では、本発明の単離された核酸分子は、本明細書でSEQ ID NO:3又はSEQ ID NO:4と記載されている核酸配列に対して、少なくとも約60〜65%、有利には少なくとも約70〜75%、より好ましくは少なくとも約80〜85%、そしてより有利には少なくとも約90〜95%又はそれ以上同一であるヌクレオチド配列を包含する。
【0104】
更なる別な態様は、SEQ ID NO:3若しくは4のヌクレオチド配列又はそれらの相補体を包含する核酸の、少なくとも100個のヌクレオチド断片を包含する核酸分子である。
【0105】
本発明による核酸分子は、SEQ ID NO:6又は7のアミノ酸配列に対して、少なくとも50%同一であるアミノ酸配列を包含するポリペプチドをコードするものであってもよい。
【0106】
別の態様は、SEQ ID NO:6又は7のアミノ酸配列を包含するポリペプチドの断片をコードする核酸分子であって、ここにおける断片は、SEQ ID NO:6又は7のアミノ酸配列の少なくとも15個の連続したアミノ酸残基を包含する。
【0107】
別の態様では、単離された核酸分子は、厳しい条件下で、SEQ ID NO:3又はSEQ ID NO:4と記載される核酸配列を有している核酸分子にハイブリダイズする。別の態様では、単離されたbudA又はbudBの核酸分子は、SEQ ID NO:6又はSEQ ID NO:7のアミノ酸配列を有するポリペプチドをコードするヌクレオチド配列を有する核酸分子の全部又は部分にハイブリダイズする。
【0108】
適当なハイブリダイゼーション条件は、当業者に公知であり、そして例えば、「Current Protocols in Molecular Biology, Ausubel et al., eds., John Wiley & Sons, Inc. (1995), sections 2, 4 and 6」に見い出すことができる。更なる厳しい条件は、「Molecular Cloning: A Laboratory Manual, Sambrook et al., Cold Spring Harbor Press, Cold Spring Harbor, NY (1989), chapters 7, 9 and 11」に見い出すことができる。
【0109】
厳しいハイブリダイゼーション条件の、特別な限定されない例として、約65〜70℃で、4×塩化ナトリウム/クエン酸ナトリウム(SSC)中のハイブリダイゼーション(又は、約42〜50℃で、4×SSC+50%のホルムアミド中のハイブリダイゼーション)、次いで約65〜70℃で、1×SSC中で1回又はそれ以上の洗浄を含む。非常に厳しいハイブリダイゼーション条件の、特別な限定されない例として、約65〜70℃で、1×SSC中のハイブリダイゼーション(又は、約42〜50℃で、1×SSC+50%のホルムアミド中のハイブリダイゼーション)、次いで約65〜70℃で、0.3×SSC中で1回又はそれ以上の洗浄を含む。低い程度の厳しいハイブリダイゼーション条件の、特別な限定されない例として、約50〜60℃で、4×SSC中のハイブリダイゼーション(又は、約40〜45℃で、6×SSC+50%のホルムアミド中の代替のハイブリダイゼーション)、次いで約50〜60℃で、2×SSC中で1回又はそれ以上の洗浄を含む。上記の値の中間の範囲、例えば、65〜70℃又は42〜50℃も本発明に含まれるものと意図されている。SSPE(1×SSPEは、0.15MのNaCl、10mMのNaH2PO4及び1.25mMのEDTA、pH7.4である)を、ハイブリダイゼーション及び緩衝液の洗浄で、SSC(1×SSCは、0.15MのNaCl及び15mMのクエン酸ナトリウムである)と置き換えることができ、ハイブリダイゼーションが完了した後、洗浄をそれぞれ15分間実施する。
【0110】
長さ50塩基対より少ないと予測されるハイブリッドのためのハイブリダイゼーション温度は、ハイブリッドの溶解温度(Tm)よりも5〜10℃低くすべきであり、このTmは、以下の式に従って決められる。
長さ18塩基対より少ないハイブリッドのためには、Tm(℃)=2(Aの数+T塩基数)+4(Gの数+C塩基数)。
長さ18〜49塩基対の範囲のハイブリッドのためには、Tm(℃)=81.5+16.6(log10[Na+])+0.41(G(%)+C)−600/N)。ここにおけるNは、ハイブリッド中の塩基の数であり、そして[Na+]は、ハイブリダイゼーション緩衝液中のナトリウムイオンの濃度(1×SSC=0.165Mに対する[Na+])である。
【0111】
当業者には認識されているが、追加の試薬を、膜(例えば、ニトロセルロース又はナイロン膜)への核酸分子の非特異的ハイブリダイゼーションを低減するために、ハイブリダイゼーション及び/又は洗浄緩衝液に加えることができる。試薬には、これらに限定されないが、ブロッキング剤(例えば、BSA又はサケ若しくはニシン精子担体のDNA)、洗浄剤(例えば、SDS)、キレート剤(例えば、EDTA)、フィコール(Ficoll)、PVP等が含まれる。ナイロン膜を使用する場合、具体的な、追加の限定されない厳しいハイブリダイゼーション条件は、約65℃における0.25〜0.5MのNaH2PO4、7%のSDS中でのハイブリダイゼーション、次いで65℃における0.02MのNaH2PO4、1%のSDS(またあるいは、0.2×SSC、1%のSDS)で1回又はそれ以上の洗浄である。例えば、「Church and Gilbert (1984) Proc. Natl. Acad. Sci. USA 81:1991-1995」を参照されたい。
【0112】
別の態様では、単離された核酸分子は、本明細書に記載のbudA又はbudBのヌクレオチド配列に相補的な(例えば、SEQ ID NO:3又はSEQ ID NO:4に記載のヌクレオチド配列に相補的な)ヌクレオチド配列を包含する。
【0113】
本発明の更なる他の態様は、突然変異budA又はbudBの核酸分子又は遺伝子を特徴としている。一般に、本明細書に記載されているような突然変異の核酸分子又は突然変異の遺伝子は、この突然変異でコードされ得るポリペプチド又はペプチドが、野生型の核酸分子又は遺伝子によってコードされるポリペプチド又はペプチドとは異なった活性を示すように、少なくとも1つの改変(例えば、塩基置換、挿入、欠失)を含むヌクレオチド配列を有している核酸分子又は遺伝子を包含する。
【0114】
本発明による単離された突然変異の核酸分子の一態様は、SEQ ID NO:5に記載されているクレブシエラ・オキシトカから突然変異したbudABヌクレオチド配列を包含する。突然変異したクレブシエラbudABヌクレオチド配列を包含する核酸の別の種類では、突然変異した(欠失した)budA及びbudBコード配列が、突然変異budA及びbudB遺伝子の間に挿入された、FRT部位が側面にあるテトラサイクリン遺伝子によって分離される。後者の配置を包含するDNA構築物は、本明細書でSEQ ID NO:8として示されている。以下の実施例4及び5も参照されたい。
【0115】
本発明の核酸分子(例えば、SEQ ID NO:3又はSEQ ID NO:4のヌクレオチド配列を有している核酸分子)は、標準的な分子生物学技術及び本明細書で提供されている配列情報を用いて単離することができる。例えば、核酸分子は、標準的なハイブリダイゼーション及びクローニング技術を用いて単離できる(例えば、「Sambrook, J., Fritsh, E.F., and Maniatis T. Molecular Cloning: A Laboratory Manual 2nd, ed., Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989」に記載のように)か、又はSEQ ID NO:3又はSEQ ID NO:4の配列に基づいて設計された合成オリゴヌクレオチドプライマーを用いるポリメラーゼ連鎖反応によって単離することができる。budAの推定全長コード配列及びbudBの部分コード配列を包含するクレブシエラ・オキシトカ及び関連する株からのDNA断片の増幅に適しているプライマーは、本明細書にSEQ ID NO:1及びSEQ ID NO:2と記載されているヌクレオチド配列を有していてもよい。本発明の核酸は、鋳型としてのcDNA、mRNA又はその代替のゲノムDNA、及び適当なオリゴヌクレオチドプライマーを用い、標準的なPCR増幅技術に従って増幅することができる。適切なPCRプライマーは、例えば、SEQ ID NO:1及び2を有するように、設計できる。
【0116】
突然変異核酸分子又は突然変異遺伝子は、改良されたα−アセトラクテート・デカルボキシラーゼ又はα−アセトラクテート・シンターゼの活性、例えば、基質親和性、熱安定性、種々のpHでの活性;又はコドンの使用(例えば、受容ホスト細胞中での改善された発現のため)を有するポリペプチドをコードすることができる。
【0117】
あるいは、本発明による突然変異核酸分子又は突然変異遺伝子は、α−アセトラクテート・デカルボキシラーゼ又はα−アセトラクテート・シンターゼ活性を低減させた、又は活性のないポリペプチドをコードすることができる。α−アセトラクテート・デカルボキシラーゼ又はα−アセトラクテート・シンターゼの発現又は活性が欠損している、クレブシエラ・オキシトカ由来の突然変異したbudABポリペプチドをコードする突然変異核酸分子は、SEQ ID NO:5又は8の配列を有することができる。α−アセトラクテート・デカルボキシラーゼ又はα−アセトラクテート・シンターゼの低減した活性又は活性がない状態を検出する方法は、公知であるか、又は例えば以下の実施例に記載されている。
【0118】
本発明は更に、異種ポリペプチドをコードする上記の核酸分子及びヌクレオチド配列の何れかを包含する単離された核酸分子を含む。ある態様では、本発明の異種ポリヌクレオチド配列は、グラム陽性又はグラム陰性細菌由来の、単離されたピルビン酸デカルボキシラーゼ(pdc)核酸配列又は遺伝子、及び/又は単離されたアルコールデヒドロゲナーゼ(adh)核酸配列又は遺伝子を包含する核酸を特徴としている。有利には、このpdc核酸又は遺伝子は、グルコノバクター属、リゾビウム属(Rhizobium)、ブラディリゾビウム属(Bradyrhizobium)、アルカリゲネス属(Alcaligenes)、ロドバクター属(Rhodobacter)、ロドコッカス属(Rhodococcus)、アゾスピリルム属(Azospirillum)、ロドスピリルム属(Rhodospirillum)、スフィンゴモナス属(Sphingomonas)、バークホルデリア属(Burkholderia)、デスルフォモナス属(Desulfomonas)、ゲオスピリルム属(Geospirillum)、スクシノモナス属(Succinomonas)、アエロモナス属(Aeromonas)、シュワネラ属(Shewanella)、ハロクロマチウム属(Halochromatium)、シトロバクター属、エシェリキア属、クレブシエラ属、ザイモモナス属(例えば、ザイモモナス・モビリス)、ザイモバクター属(Zymobacter)(例えば、ザイモバクター・パルメ(Zymobacter palmae))、及び酢酸菌属(Acetobacter)(例えば、酢酸菌パストリアヌス菌(Acetobacter pasteurianus))よりなる群から選ばれるグラム陰性微生物由来である。
【0119】
他の態様では、pdc核酸又は遺伝子は、フィブロバクター属(Fibrobacter)、アシドバクター属(Acidbacter)、バクテロイデス属(Bacteroides)、スフィンゴバクテリウム属(Sphingobacterium)、アクチノミセス属(Actinomyces)、コリネバクテリウム属、ノカルジア属(Nocardia)、ロドコッカス属、プロピオニバクテリウム属(Propionibacterium)、ビフィドバクテリウム属(Bifidobacterium)、バチルス属、ゲオバチルス属、パエニバチルス属(Paenibacillus)、スルホバチルス属(Sulfobacillus)、クロストリジウム属、アナエロバクター属(Anaerobacter)、真正細菌、連鎖球菌、ラクトバチルス属、ロイコノストック属(Leuconostoc)、エンテロコッカス属(Enterococcus)、ラクトコッカス属、サーモビフィダ属(Thermobifida)、セルロモナス属、及びサルシナ属(Sarcina)(例えば、サリシナ・ベントリキュリ(Sarcina ventriculi))よりなる群から選ばれるグラム陽性微生物由来である。
【0120】
上記で検討のように、本発明の別な態様は、新規な単離されたポリペプチド(例えば、ブタンジオール代謝経路で活性な単離された酵素、例えばクレブシエラ・オキシトカ由来のα−アセトラクテート・デカルボキシラーゼ又はα−アセトラクテート・シンターゼ)を特徴としている。一態様では、ポリペプチドは、組み換えDNA技術によって作製されて、本発明の微生物から、標準的なポリペプチド精製技術を用いる適切な精製スキームによって単離できる。別の態様では、ポリペプチドは標準的なペプチド合成技術を用いて、化学的に合成される。
【0121】
単離又は精製されたポリペプチド(例えば、単離又は精製されたα−アセトラクテート・デカルボキシラーゼ又はα−アセトラクテート・シンターゼ)は、ポリペプチドが由来している微生物からの細胞物質又はその他の夾雑ポリペプチドを実質的に含まない、また化学合成の場合には化学的な前駆物質又はその他の化学物質を実質的に含まない。一態様では、単離又は精製されたポリペプチドは、約30%(乾燥重量で)以下の夾雑ポリペプチド又は化学物質、より有利には約20%以下の夾雑ポリペプチド又は化学物質、更により有利には約10%以下の夾雑ポリペプチド又は化学物質、そして最も有利には約5%以下の夾雑ポリペプチド又は化学物質を有している。
【0122】
一態様では、本発明の単離されたポリペプチド(例えば、単離されたα−アセトラクテート・デカルボキシラーゼ又は単離されたα−アセトラクテート・シンターゼ酵素)は、それぞれSEQ ID NO:6又はSEQ ID NO:7に示されているようなアミノ酸配列を包含する。
【0123】
別の態様では、本発明の単離されたポリペプチドは、SEQ ID NO:6又はSEQ ID NO:7に記載されているポリペプチドの少なくとも1つのホモログである(例えば、SEQ ID NO:6又はSEQ ID NO:7のアミノ酸配列に対して、少なくとも約30〜40%同一の、有利には少なくとも約40〜50%同一の、より有利には少なくとも約50〜60%同一の、更により有利には少なくとも約60〜70%、70〜80%、80〜90%、90〜95%又はそれ以上同一のアミノ酸配列を包含し、そしてそれぞれSEQ ID NO:6又はSEQ ID NO:7のアミノ酸配列によってコードされるポリペプチドと実質的に同じ活性を有している)。
【0124】
2つのアミノ酸配列又は2つの核酸の同一性の割合を測定するために、最適な比較を目的として配列を整列させる(例えば、第1のアミノ酸又は核酸配列にギャップを導入することで、第2のアミノ酸又は核酸配列と最適な位置合わせができる)。第1配列の位置が、第2配列中の対応する位置と同じアミノ酸残基又はヌクレオチドで占められている場合、この分子はその位置で同一である。2つの配列間の同一性の割合は、配列が共有する同一性の位置数の関数である(すなわち、同一性(%)=同一性の位置の数/位置の総数×100)であり、最適な位置合わせとするために必要なギャップの数及びそのギャップの大きさを計算に取り入れることが有利である。
【0125】
配列の比較及び2つの配列間の同一性の割合の測定は、数学アルゴリズムを用いて実行することができる。配列の比較に用いられる数学アルゴリズムの、特別な非限定的な例は、KarlinとAltschulのアルゴリズム(Karlin and Altschul (1990) Proc. Natl. Acad. Sci. USA 87:2246-68)であり、「Karlin and Altschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-77」として改良されている。このようなアルゴリズムは、AltschulらのNBLAST及びXBLASTプログラム(バージョン2.0;Altschul et al. (1990) J.Mol. Biol. 215:403-10)に組み込まれる。本発明の核酸分子に相同な核酸配列を得るために、NBLASTプログラム(スコア=100、語長=12)でBLASTヌクレオチド検索を実施することができる。本発明のポリペプチド分子に相同なアミノ酸配列を求めるために、XBLASTプログラム(スコア=50,語長=3)でBLASTポリペプチド検索を実施することができる。比較のためのギャップのある位置合わせを得るために、「Altschul et al. (1997) Nucleic Acids Research 25 (17):3389-3402」に記載のように、Gapped BLASTを用いることができる。BLAST及びGapped BLASTプログラムを使用する場合は、それぞれのプログラムのデフォルト・パラメータ(例えば、XBLAST及びNBLAST)を用いることができる。「http://www.ncbi.nlm.nih.gov」を参照されたい。配列の比較に用いられる数学アルゴリズムの、別に特殊なその他の非限定的な例は、MyersとMillerのアルゴリズム(Myers and Miller (1988) Comput Appl Biosci. 4:11-17)である。このようなアルゴリズムは、例えば、GENESTREAMネットワークサーバー(IGH Montpellier, France) で、又はISRECサーバーで得られる、ALIGNプログラムに組み込まれる。アミノ酸配列を比較するためにALIGNプログラムを使用する場合は、PAM120の重量残渣表、12ギャップ長ペナルティー及び4ギャップペナルティー(PAM120 weight residue table, a gap length penalty of 12 and a gap penalty of 4)を用いることができる。
【0126】
別の態様では、2つのアミノ酸配列間の同一性の割合は、Blossom62マトリックス又はPAM250マトリックスの何れか、並びに12、10、8、6又は4のgap weight及び2、3又は4のlength weightを用いる、GCGソフトウェアーパッケージ中のGAPプログラムを使用して測定することができる。更なる別の態様では、2つの核酸配列間の同一性の割合は、gap weight:50及びlength weight:3を用いる、GCGソフトウェアーパッケージ(「http://www.gcg.com」で利用可能)中のGAPプログラムを使用して得ることができる。
【0127】
IV.ベクター
本発明は更に、プラスミドベクターを包含するベクター(例えば、組み換えベクター)を特徴としている。本発明によるベクターは、本明細書に記載の核酸分子(例えば、単離の又は組み換えの核酸分子及び/又は遺伝子)を含有している。特に、組み換えベクターは、本明細書に記載のような細菌遺伝子産物、有利にはbudA及びbudB遺伝子産物(例えば、SEQ ID NO:3又は4)、又はホスト細胞においてこれらの遺伝子産物の発現を低減又は消去する、突然変異のbudA及びbudB配列(例えば、SEQ ID NO:5又は8)をコードする核酸配列を包含することを特徴としている。これらの配列は、より有利には、グラム陰性又はグラム陽性細菌のbudA及びbudB遺伝子産物であり、更により有利には、クレブシエラ属又はエルウィニア属由来のbudA及びbudB遺伝子産物である。
【0128】
本発明によるベクターの一態様は、α−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼタンパク質のうちの少なくとも1つをコードする細菌遺伝子中に突然変異を包含するポリヌクレオチド配列を含み、ここにおけるベクターは、細菌ホスト細胞に組み入れられると、当該タンパク質の発現を低減又は消去することができる。
【0129】
ベクターの一態様では、ポリヌクレオチド配列が、SEQ ID NO:3又は4に記載されているヌクレオチド、又は以下に述べるようなその機能的断片を包含する、単離された核酸分子中に突然変異を包含している。この突然変異は、欠失、挿入又は塩基置換の突然変異であってよい。
【0130】
好ましい一態様では、ポリヌクレオチド配列中の突然変異は、欠失突然変異である。このタイプのベクターの幾つかの種類は、SEQ ID NO:5又は8に記載されているようなクレブシエラ・オキシトカ由来の突然変異budABポリヌクレオチド配列を包含する。その他のベクターは、SEQ ID NO:5又は8に少なくとも80%の同一性があるポリヌクレオチド配列に突然変異を包含する。
【0131】
本発明によるベクターの別な好ましい態様は、SEQ ID NO:5又は8に記載されている、突然変異budABポリヌクレオチド配列を包含するプラスミドベクターである。pLOI3310又はpLOI3313と呼ばれている、このタイプのプラスミドの例が、本明細書に記載されている。例えば、以下の実施例4及び5を参照されたい。
【0132】
本発明によるベクターの別な態様は、クレブシエラ・オキシトカ由来のタンパク質α−アセトラクテート・デカルボキシラーゼをコードする、SEQ ID NO:3に記載のポリヌクレオチド配列を包含する。
【0133】
組み換えベクター(例えば、プラスミド、ファージ、プラスミド、ウィルス、コスミド又はその他の精製された核酸ベクター)は、組み換えベクターが由来する野生型又は天然型核酸分子に含まれるものよりも、より大きな、より小さな又は異なった核酸分子を含有するように、変更、修正又は改変することができる。有利には、この組み換えベクターは、本明細書で定義されているような調節配列、例えば、プロモーター配列、終結配列及び/又は人工リボソーム結合部位(RBSs)に操作して結合できる、budA及びbudB遺伝子、又はbudA及びbudB遺伝子又はその突然変異を含んでいる組み換え核酸分子を包含する。
【0134】
一般に、budA及びbudB遺伝子又は突然変異は、ヌクレオチド配列の発現(例えば、増強された、増大した、構成的な、定常的な、弱めた、低減した又は抑制された発現)、有利にはヌクレオチド配列によってコードされる遺伝子産物の発現(例えば、組み換え核酸分子が、本明細書で定義されているような、組み換えベクター中に含まれ、これが微生物に組み込まれているとき)を許容する形で、調節配列に操作して結合できる。
【0135】
この調節配列は、他の核酸配列の発現に影響を及ぼす(例えば、調節又は規制する)核酸配列を包含する。一態様では、調節配列は、目的の調節配列及び遺伝子で自然界に見られる、例えば天然の位置及び/又は方向で観察されるように、目的の特別の遺伝子に関連する類似又は同一の位置及び/又は方向にある組み換え核酸分子又は組み換えベクター中に含まれる。例えば、目的の遺伝子は、天然の生命体中の目的の遺伝子に付随又は隣接している調節配列に操作して結合できる(例えば、「天然の」調節配列に、例えば「天然の」プロモーターに操作して結合できる)、組み換え核酸分子又はベクター中に包含されていてもよい。あるいは、目的となる遺伝子は、天然の生命体中の他の(例えば、異なった)遺伝子に付随もしくは隣接している調節配列に操作して結合できる、組み換え核酸分子又はベクター中に包含されていてもよい。
【0136】
あるいは、目的となる遺伝子は、別の生命体由来の調節配列に操作して結合できる、組み換え核酸分子又はベクター中に包含されていてもよい。例えば、その他の微生物由来の調節配列(例えば、その他の細菌の調節配列、バクテリオファージ調節配列など)は、目的の特別な遺伝子と操作して結合することができる。
【0137】
一態様では、調節配列が、非天然の又は非天然由来の配列(例えば、化学的に合成された配列を含む、改変された、突然変異した、置換された、誘導体化された又は削除された配列)である。有利な調節配列は、プロモーター、エンハンサー、終結シグナル、抗終結シグナル及びその他の発現制御因子(例えば、転写mRNA中にある、レプレッサー又は誘導物質が結合する配列、及び/又は転写及び/又は翻訳の調節ポリペプチドの結合部位)を含む。このような調節配列は、例えば、「Sambrook, J., Fritsh, E.F., and Maniatis, T. Molecular Cloning: A Laboratory Manual. 2nd, ed., Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory press, Cold Spring Harbor, NY 1989」に記載されている。
【0138】
調節配列は、微生物中でヌクレオチド配列の構成的発現を指示するもの(例えば、構成的プロモーター又は強力構成的プロモーター);微生物中でヌクレオチド配列の誘導発現を指示するもの(例えば、誘導プロモーター、例えばキシロース誘導プロモーター);及び微生物中でヌクレオチド配列の発現を減衰又は抑制するもの(例えば、減衰シグナル又は抑制配列)を包含する。調節配列を除去又は欠失することにより目的となる遺伝子の発現を調節することも、本発明の範囲内である。例えば、負の転写調節に含まれる配列を、目的の遺伝子の発現を増大させるように除去することができる。
【0139】
一態様では、本発明の組み換え核酸分子又は組み換えベクターは、プロモーター又はプロモーター配列に操作して結合できる、少なくとも一つの細菌性budA又はbudB遺伝子産物をコードする核酸配列又は遺伝子を含む。本発明の有利なプロモーターは、天然のプロモーター、代理プロモーター(surrogate promotor)及び/又はバクテリオファージプロモーターを含む。一態様では、プロモーターは、生化学的なハウスキーピング遺伝子に関係するプロモーター又はエタノール産生の経路に関係するプロモーターである。別の態様では、プロモーターは、バクテリオファージプロモーターである。その他のプロモーターは、バチルス(例えば、バチルス・サブティリス)中で高レベルの発現を促進する、tef(翻訳伸長因子(TEF)プロモーター)及びpyc(ピルビン酸カルボキシラーゼ(PYC)プロモーター)を含む。例えば、グラム陽性細菌中で使用するための更なる有利なプロモーターは、これらに限定されないが、amyEプロモーター又はファージSP02プロモーターを含む。例えば、グラム陰性細菌中で使用するための更なる有利なプロモーターは、これらに限定されないが、tac、trp、tet、trp−tet、lpp、lac、lpp−lac、lacIq、T7、T5、T3、gal、trc、ara、SP6、λ−PR又はλ−PLを含む。
【0140】
その他の態様では、本発明の組み換え核酸分子又は組み換えベクターは、終結配列(複数を含む)(例えば、転写終結配列)を含む。一般に、終結配列は、遺伝子の転写を終結するのに役立つ調節配列を示す。終結配列(又は、タンデム転写終結因子)は更に、核酸分解酵素に対して、mRNAを安定化させる(例えば、mRNAに構造を加えることにより)のに役立てることができる。
【0141】
更なる他の態様では、本発明の組み換え核酸分子又は組み換えベクターは、当該配列を含有しているベクターの検出ができる配列(すなわち、検出可能及び/又は選択可能なマーカー)、例えば、栄養要求性変異に打ち勝つ配列、例えば、ura3又はilvE、蛍光マーカー、及び/又は比色分析用マーカー(例えば、lacZ/β−ガラクトシダーゼ)、及び/又は抗生物質耐性遺伝子(例えば、bla又はtet)を含む。
【0142】
本発明のbudA及びbudB遺伝子のうちの何れか1つは、1つ又はそれ以上のエタノール産生の遺伝子(例えば、アルコールデヒドロゲナーゼ(つまり、adh)及びピルビン酸デカルボキシラーゼ(pdc))並びに/又は例えば、米国特許第5,821,093号;5,482,846号;5,424,202号;5,028,539号;5,000,000号;5,487,989号;5,554,520号及び5,162,516号に記載されているような、糖の発酵又は発酵に続く糖の分解に適した遺伝子産物をコードする遺伝子も包含する、ベクター中に導入することができる。このような2つ又はそれ以上の遺伝子は、別の調節因子(例えばプロモーター)、共通の調節因子(複数を含む)、天然の調節因子(複数を含む)、又はこれらの組み合わせを用いて、それぞれ独立して発現することができる。
【0143】
V.遺伝子欠損を包含する組み換えホスト細胞を作製する方法
上記に検討のように、本発明による組み換えホスト細胞は、サッカライドの発酵時にエタノール以外の生成物を産生することになる、代謝経路由来のタンパク質をコードする1つ又はそれ以上のポリヌクレオチド配列中に突然変異を包含する。欠失突然変異のような突然変異を包含する微生物を作製する遺伝子法は、当該技術分野で公知である。PCRベースの遺伝子のクローニング、プラスミドの構築及び遺伝子分析のような遺伝子構築物の単離及び操作するための遺伝子技術はよく確立されていて、分子生物学の技術分野では日常的である。例えば、「Ausubel et al., 1987; Miller, 1992」及び「Sanbrook and Russell, 2001」[24〜26] のような方法論の論文を参照されたい。除去可能な抗生物質耐性遺伝子の使用を含む、染色体の欠失[22]及び組み込みを作製する方法も、記載されている[27〜29]。
【0144】
改良されたエタノール産生の特質を有する模範的な組み換えホスト細胞を作製する方法の使用を、更に以下の実施例4及び5に示す。これらの実施例は、K.オキシトカ由来のブタンジオール経路(budAB)中で遺伝子のPCRによるクローニングすること、これらの遺伝子中に欠失突然変異(ノックアウト)を作製すること、そしてこの突然変異を含有するDNA構築物をK.オキシトカP2の染色体に組み入れて、K.オキシトカB15、B19及びBW21と呼ばれる、改良された株を提供すること、の詳細な記述を提供する。B15及びB19株は、FRT側面のテトラサイクリン遺伝子の側面にある突然変異budAB配列、すなわち、本明細書でSEQ ID NO:8と示されているポリヌクレオチド配列を包含する(以下の実施例5も参照されたい)。BW21株は、BW15及びBW19株と同じ突然変異budAB配列を包含する(すなわち、本明細書でSEQ ID NO:5と呼ばれている突然変異budAB配列)が;FRT側面のテトラサイクリン遺伝子を欠損している。この遺伝子は、FLPリコンビナーゼを用いて除去した(実施例5も参照されたい)。このBW21株をテストし、親株のP2に比べて優れたエタノール産生の性質を示すことを明らかにした。
【0145】
更なる別の態様では、本発明は、サッカライド源からエタノールを産生するのに最適である組み換えホスト細胞を作製する方法を提供する。この方法は次の工程を包含している。
(a)エタノール産生の親ホスト細胞を、親細胞によるエタノール産生に適している条件下で、選択生育培地及びサッカライド源と接触させること、
(b)選択された条件下で、オリゴサッカライド源からのエタノール産生のレベルを測定すること、
(c)当該条件下で増大した発現を有する望ましくない副生成物を同定するために、サッカライド源から産生されるエタノール以外の生成物のうちの少なくとも1つ、好ましくは全てのレベルを測定すること、
(d)代謝経路において、前記の望ましくない副生成物を産生するタンパク質をコードする遺伝子のポリヌクレオチド配列を突然変異させ(ここにおける突然変異は、代謝経路中の少なくとも1つの遺伝子産物の発現を低減又は消去して、突然変異なしの親細胞によるエタノール産生に比べて、選択培地中での突然変異細胞によるエタノール産生を増大させる)、これにより選択培地中でのエタノール産生を最適化した組み換えホスト細胞を作製すること。
【0146】
この方法のある態様は更に、遺伝子の突然変異を包含する単離されたポリヌクレオチド断片を作製すること、及び突然変異ポリヌクレオチド断片を親細胞に導入することを包含する。
【0147】
有利には、この方法は、特別な培養条件下、特別な選択培地中での最適なエタノール産生のために特注される組み換えホスト細胞を構築するために提供される。特別な培地での生育によるエタノール産生の親ホスト細胞中で上方調節された副生成物の確認を含む、この方法の工程(c)は、親細胞の更なる遺伝子操作によって標的となりそして欠失される、対応する代謝経路を確認するために用いられる。
【0148】
この方法のある態様では、細胞が、最小培地でのエタノール産生のために最適化される。上記での検討のように、細菌のような組み換えホスト細胞によるエタノールの産生で用いられる生育培地のコストは、総生産コストにおいて大変重要な因子である。生産コストを抑制するために、最新の取り組みが、安価な原料由来の必須栄養素の最小量を含有する「最小培地」の開発をもたらした。(例えば、「最適化尿素培地」(OUM)と呼ばれる、本明細書で開示された新規な尿素ベースの最小培地を含む、SSFに適している幾つかの最小培地の組成を示している、以下のVI章及び表2を参照されたい。) この方法の一態様は、OUMでのエタノール産生のために最適化された細胞、例えばSSFに好ましいpHである、酸性のpHでのこの培地中で上方調節されるブタンジオール産生をコードするbudAB遺伝子中に欠失を包含する、K.オキシトカBW21を作製する。
【0149】
VI.最小培地
別の態様では、本発明は、サッカライドを分解するのに適した組み換えホスト細胞による生育及びエタノール産生を支援する最小培地を提供する。本発明の最小培地は以下の主要成分を含有している。
決められた窒素源
複合の窒素源
ホスフェイト源
マグネシウム源
任意に、FeCl2及びNiCl2のような金属イオン源が、クレブシエラ・オキシトカの誘導体のような、ある特定のエタノール産生の細菌株の酵素活性に有用なコファクターとして、培地のある態様に加えられる。
【0150】
本発明による最小培地のある態様では、決められた窒素源が、尿素様化合物である。尿素窒素の濃度範囲は、約0.1〜100mM、好ましくは約2.0〜20mM、そしてより好ましくは約8〜12mMである。
【0151】
最小培地中で使用する複合の窒素源は、これらに限定されないが、コーンスティープリカー(CSL)、酵母自己消化物及び/又は抽出物、トウモロコシ加工副産物、大豆加工副産物、及び使用済みの発酵培養液(例えば酵母、ストレプトミセス、バチルスなどの微生物を用いる発酵液から)を含む多様な源から選ぶことができる。
【0152】
最小培地のある態様は、コーンスティープリカー(CSL)を複合の窒素源として包含する。これらの培地においてCSLの好ましい濃度範囲は、約0.1〜100g/L、好ましくは約1〜20g/L、そしてより好ましくは約5〜10g/Lである。
【0153】
本明細書に記載の検討から、総ホスフェイト及びマグネシウムのような他の成分の濃度範囲は、エタノールの産生に対してあまり重要ではないということが確認されている。これらの成分の最小有効濃度は、尿素及びCSLについての上記のような実験に基づいて確認できるであろう。一般に、総ホスフェイトの有利な濃度は、約10〜100mM、そして好ましくは約10〜12mMである。好ましいマグネシウムの濃度は、約0.1〜5.0mMの範囲、そしてより好ましくは約0.25〜1.0mMの範囲である。
【0154】
一態様では、サッカライドを分解するのに適した組み換えホスト細胞による生育及びエタノール産生を支援するように最適化された最小培地を提供する。この培地のある態様は、選択された組み換えホスト細胞及び発酵の条件のために最適化される。使用されるエタノール産生の株にもよるが、最小培地の主要成分の濃度は、認容できる細胞の生育、及び糖基質の発酵時にエタノール産生の株による高レベルのエタノール産生に調和する成分の最小濃度を測定することにより費用効率に対して最適化される。(例えば、エタノール産生のK.オキシトカ株と共に使用されるのに特に適した尿素ベースの最小培地の最適化に関する、以下の実施例1〜3並びに表2及び3に記載の検討を参照されたい。)
【0155】
本発明による最適化培地のある態様は、リグノセルロースバイオマスのSSFで用いられる方法及び条件に適している。上記に検討のように、動物には食べられないリグノセルロースは、エタノール産生用の豊富で安価な出発物質である。リグノセルロースの豊富な原料は、茎、葉、殻、さや、穂軸などの植物残渣、さらに木材、木材チップ、木材パルプ及び古紙も含む廃棄物に見い出せる。SSFは、リグノセルロースバイオマスをサッカライド源として用いて実施することができる。SSF工程において、リグノセルロースを加水分解する菌体酵素(一般にセルラーゼ及びキシラナーゼ)によって可溶性の生成物が産生される。リグノセルロース生成物から生じる可溶性の生成物は、セロビオース、セロトリオース、キシロビオース、キシロトリオース及びアラビノシドを含有する。これらの可溶性の糖生成物は、同時に組み換え細菌のようなエタノール産生の微生物によってエタノールに変換される。重要なことは、SSF反応を酸性のpHで行う必要があるので、この菌体酵素が、酸性のpH(pH5.0近辺)で最適な性能を示すことである。
【0156】
上記に検討のように、エタノール産生用バイオマスの安価な原料としてのリグノセルロースの有利性に対する反論は、SSF工程で使用するエタノール産生の細菌を支援するのに必要な栄養素が乏しいという不便性である。本発明は、一態様において、例えば、エタノール産生の細菌及びリグノセルロース出発物質でのSSFで使用するために適している改善された最小培地を提供することによって、この問題に対処している。
【0157】
この培地は、細菌のエタノール産生の株の最大の生育及びエタノール産生を支援し、そしてアンモニア及び(NH4)2SO4のような単純な化学試薬を含む、従来使用されている窒素源を、総窒素源として尿素及び尿素様化合物の低レベルと置き換えることにより最小のコストにするように最適化されている。これらの化合物の置き換えは、他の窒素源の使用に対して重要なコスト利点を提供する。
【0158】
「最適化尿素培地1」(OUM1)と称する、本発明による特に好ましい態様の最小培地は、下記の成分を示された濃度で包含する。
NH2CONH2(尿素) 10.0mM
CSL 10.0g/L
KH2PO4 10.7mM
Na2HPO4 1.3mM
CaCl2 1mM
MgSO4 1mM
FeCl2 0.074mM
NiCl2 0.0068mM
発酵反応に用いるために、サッカライド源、例えば上記のような糖源であるグルコース(例えば、90g/Lで)又はリグノセルロース源を加える。
【0159】
VII.組み換えホスト細胞によるサッカライド源の発酵時における最適なエタノール産生の方法及びシステム
本発明の上記の最適化最小培地、並びに最大のエタノール産生及び最小の副生成物産生のために遺伝子操作で最適化した組み換え微生物を、有利に組み合わせてエタノール産生のシステムにできる。
【0160】
従って、別の態様では、本発明は、サッカライドを分解するのに適した組み換えホスト細胞によって、サッカライド源からエタノールを産生するために最適化されたシステムを提供する。このシステムは以下の要素を包含する:
(a)選択条件下でのホスト細胞による最適な生育及びエタノール産生を支援する選択培地;
(b)サッカライド源;及び
(c)選択培地及び条件でのエタノール産生のために最適化された組み換えホスト細胞、
この細胞は:
糖をエタノールに変換する酵素をコードする非相同性ポリヌクレオチド配列(ここにおける細胞は、当該ホスト細胞による主要発酵生成物としてのエタノールの産生を促進するのに十分な機能レベルで、当該非相同性ポリヌクレオチド配列を発現する)、及び
当該細胞の代謝経路において、前記条件下及び培地中で当該オリゴサッカライド源からエタノール以外の生成物を産生するタンパク質をコードする少なくとも1つのポリヌクレオチド配列中の突然変異(ここにおける突然変異は、当該タンパク質の発現を低減又は消去し、これにより当該ホスト細胞によるエタノール産生を、突然変異がない細胞によるエタノール産生に比べて増大させて、エタノール産生を最適化する)を包含する。
【0161】
商業的利用に好ましいシステムの態様では、選択培地は、上記のような本発明による尿素ベースの最小培地のような、最小培地である。
【0162】
エタノール産生のために最適化された適切なホスト細胞は何れも、本システムで使用することができ、適切なサッカライド又はオリゴサッカライド源の何れも使用することができる。好ましい安価なサッカライド源は、リグノセルロース原料である。上記に検討のように、SSF反応は、菌体酵素の性能を最適化するために、酸性のpH範囲で最適に実施される。しかしながら、酸性条件は、細菌による発酵において、好ましいpHでの不要な副生成物の増大した産生及びそれに付随するエタノールの減少した産生のような、有害な影響を有する。
【0163】
本発明による最適化されたシステムでは、生育の条件(pHのような)又は最小培地自体の有害な影響は、特別な培地と、当該培地中での生育及びエタノール産生を特に最適化した組み換え細菌とを組み合わせることによって最小化することができる。例えば、特別な培地中でホストの望ましくない代謝経路が特別な培養条件下で改変される(例えば、上方調節される)ことが知られているならば、培地を、改変された経路を標的とする遺伝子的改変(例えば、欠失突然変異)を包含する選択された組み換えホスト細胞と組み合わせるように、システムを設計することができ、それによってこのような条件下で望ましくない生成物を低減又は消去することができる。従って、このシステムは、特別な最小培地中での発酵反応時のエタノール産生のために最適化される。
【0164】
本発明の最適化されたシステムの好ましい態様は、本明細書に記載のような新規なOUM培地、BW21株のような最適化された組み換えクレブシエラ・オキシトカ株、及び糖源であるリグノセルロースの組み合わせである。エタノール産生のためのこの最適化システムは、リグノセルロースを含有するバイオマスからエタノールを産生する魅力ある安価な方法を提供する。
【0165】
SSFによるバイオマスの発酵の最適なエタノール産生の組み換え細菌株は、クレブシエラ・オキシトカP2である。SSFによるバイオマスの発酵のために最適化された本発明の組み換えホスト細胞の例は、ブタンジオール経路(アセトイン及び2,3−ブタンジオール)の副生成物を消去する欠失突然変異を有する点で親株と異なる、BW21と称するクレブシエラ・オキシトカP2由来の改善されたエタノール産生の株である。本明細書の検討で示されるように、この経路は、決められた窒素源として尿素を含有する好ましい最小培地(OUM1)中での発酵検討において、P2細胞を発育させて用いると、この経路が特異的に上方調節される。最適化されたBW21細胞中では、このような不要な遺伝子産物の発現が、遺伝子の欠失によって消去される。BW21細胞によるエタノール産生のアッセイは、これらの細胞が、酸性pHでの最小培地中で、親株P2よりも、更にL培地(Luria broth)のような富栄養培地中で生育させた場合よりも、エタノールを産生する優れた能力を有していることを実証した。従って、尿素様化合物を包含する最適な最小培地を、この特別な培地でエタノール産生に最適化された組み換えクレブシエラ株と組み合わせることにより、エタノール産生が、SSFに適した条件の酸性pHでのシステムで、より高価な培地を用いて達成できるレベルまで最適化された。
【0166】
更なる態様では、本発明は、本発明の方法又はシステムによる組み換えホスト細胞を使用するための使用説明書と共に包装した、上記のような組み換えホスト細胞を包含するキットを提供する。
上記の方法の実施に一般的に有用な材料及び方法が更に、下記及び以下の実施例に記載されている。
(実施例)
【0167】
本発明を以下の実施例を参照して更に説明するが、これは限定するものとして解釈されるものではない。
材料及び方法
以下の材料及び方法は次の実施例を通して用いられる。
1a.株及びプラスミド
表1は、本発明の組み換え微生物を構築するために使用される生命体及びプラスミドを記載する。
【0168】
【表1】

【0169】
1b.生育培地及び条件
エタノール産生の株を、2%のグルコース及びクロラムフェニコール(1日おきに、40又は600mg/L)を含有するL寒天培地(Luria agar)[24]上、アルゴン雰囲気下で保持した。その他の株を、糖を添加していないL寒天プレート上で適当な抗生物質と共に保持した。特に断りのない限り、アンピシリン(50mg/L)、カナマイシン(50mg/L)、アプラマイシン(50mg/L)及びテトラサイクリン(12.5mg/L)を選択のために使用した。温度条件付きレプリコンのプラスミドを含有している株を30℃で生育させた。その他の全ての株は、指摘されたものを除いて、37℃で保持した。プラスミド調製物を、−20℃で保存した。保存培養は、グリセロール中、−75℃で保存した。
【0170】
1c.遺伝子法
PCRベースの遺伝子のクローニング、プラスミドの構築及び遺伝子分析について、標準的な方法を用いた[24〜26]。組み込み、染色体の欠失、組み込み、及び移動可能な抗生物質抵抗遺伝子の使用についての方法を、既述のようにして用いた[22、27〜29]。大腸菌DH5αを、構築のために使用した。
【0171】
1d.budA及びbudB遺伝子の欠失
α−アセトラクテート・デカルボキシラーゼ(budA)及びα−アセトラクテート・シンターゼ(budB)の5’末端を含有するDNA断片を、鋳型としてのK.オキシトカ由来のゲノムDNA及びTaqPCRマスターミックス(Qiagen)を用いるPCRで増幅した。94℃で3分間の初期変性の後、DNAを30サイクル増幅した(94℃で30秒間の変性、55℃で30秒間のアニーリング、及び72℃で70秒間の伸長)。72℃で10分間の最終伸長も含まれている。
【0172】
budAB’DNA断片を次のプライマー:
フォワードプライマー:5’GCTGAATCGGGTCAACATTT−3’(SEQ ID NO:1)
リバースプライマー:5’−TTTCGGTTTGTCCAGGTAGT−3’(SEQ ID NO:2)
を用いて増幅して、pCR2.1−TOPOにクローンした。pLOI3301と呼ばれる、この断片の配列を決定して、GenBankに寄託した(受入番号:AY722056)。
【0173】
budABに欠失を含有するDNA断片を調製するために、クローニング/欠失の以下の方法を用いた。この方法では、budA及びbudB遺伝子の中央領域を欠失して、2つのFRT部位が側面に位置したテトラサイクリン遺伝子で置き換えた。budA及びbudBを欠失させて得られた構築物(budA’FRT−tet−FRT’budB)(SEQ ID NO:8)を、温度条件付きベクターであるpSC101tsに組み込んで、エタノール産生の細菌に安定に形質転換するために用いた。
【0174】
図1は、エタノール産生の細菌に導入された場合に、発酵によるブタンジオール生成物の消去をもたらす、budABに欠失突然変異を包含する例示構築物(pLOI3301、pLOI3310及びpLOI3313)を、調製する工程を示す概略図である。図1の更に詳細な説明及びこれらのプラスミドを作製するのに用いられる方法は、以下、特に実施例4に見い出される。
【0175】
1e.クレブシエラ・オキシトカP2からのBW21株の作製
上の1dに記載のように調製された、budA及びbudBに欠失突然変異を含有しているDNA構築物を、これらの構築物で形質転換された組み換え細菌を作製するために使用した。例えば、エタノール産生のクレブシエラ・オキシトカM5A1株の形質転換を記載している実施例5を、参照されたい。次いで、バクテリオファージP1(大腸菌のファージ)を、K.オキシトカM5A1中に構築されているbudAB染色体欠失をP2株に形質導入してBW21株を作製するために用いた。
【0176】
1f.budAのアセトイン生成物の存在しないことをスクリーニングすることによるブタンジオール経路の評価
株は、ボーグ・プロスカウル(Vogues-Proskaur;VP)寒天法の変法を用いて、アセトイン産生についてスクリーニングしたが、この方法は、着色生成物の限界拡散によって感度を増強するために、ペトリプレートの代わりにマイクロタイタープレートを用い、「Blomqvist, et al.」[35]に記載されている。各ウェルに1mlの培地(1リットル当たり、2.5gのディフコバクトペプトン(Difco Bactopeptone)、1.0gのディフコ酵母抽出物、10gのグルコース、1.0gのピルビン酸ナトリウム及び25gの寒天)を入れて、接種した。24時間後に、αーナフトールを5%含有する2.5NのNaOH溶液を200μLずつ各ウェルに加えた。室温で1時間着色を観察した。赤色着色がないことで、アセトイン(budA活性の生成物)のないことを確認した。更なる確認は、発酵生成物のHPLC分析でなされた。
【0177】
2a.エタノール産生の細菌のための最小培地
公知の培地及び本明細書で開発された(最適化尿素培地1、OUM1)培地の両方の成分を、表2に要約した。
【0178】
【表2】

【0179】
それぞれの培地を、50g/L(278mM)のグルコース又は90g/L(500mM)のグルコースの何れかを用いる発酵反応でテストした。成分は、Fisher Scientific社又はSigma Chemical社の何れかから入手した。無機塩類は、試薬用の等級であった。尿素は、工業用の等級であった。M9培地は、既述[30]のように調製して、更に鉄要求性Z.モビリス アルコールデヒドロゲナーゼ[31]の適切なレベルを確保するために0.07mMのFeCl3を補充した。エタノール産生の大腸菌用のコーンスティープリカー(CSL)培地(0.5%CSL+M)は、既に記載されている[32]。M9及び0.5%CSL+M培地の両方は、K.オキシトカM5A1のエタノール産生の誘導体用の培地を最適化するための出発点として用いた。尿素を窒素源として使用する場合に、ウレアーゼ活性のために0.007mMのNiCl2を添加した。CSLのレベルは、乾燥重量ベースで示した。CSLの原液は、既述[33]のようにして調製し、滅菌した。
【0180】
全ての培地の最適化の検討で、K.オキシトカP2を用いた。新たに生育したプレート(24時間)から単離されたコロニーを、1mlの脱イオンH2Oに再懸濁して、75mlの培地(50g/Lグルコース)を含有する125mlのフラスコに接種(約50μLの接種材料)するために用いた。生育及びエタノール産生を、24時間及び48時間後に観察した。
【0181】
2b.発酵条件
種培養物(250mlフラスコ中に150ml)を、50g/Lのグルコースを含有する培地で35℃(120rpm)で16時間生育させた。細胞を遠心分離(5000×g、5分間)して採取し、乾燥細胞重量で33mg/Lの初期濃度(OD550nm=0.1)を示す接種材料として用いた。発酵に用いるそれぞれの培地は、種生育にも用いたが、低いグルコース濃度(50g/L)で用いた。発酵容器は、既述されており[34]、350ml(90g/Lのグルコース)の初期容量を含有していた。培養物を、35℃(150rpm)で培養した。培養液を、2NのKOHを自動的に添加してpH5.2に保持した(指示があるときを除いて)。
【0182】
2c.分析方法
ボシュロムスペクトロニク(Bosch & Lomb Spectronic)70分光光度計を用いるOD550nmの測定により、細胞集団を評価した。この測定器では、1単位のOD550nmが、0.33mg(乾燥重量)/Lの細胞密度に相当する。K.オキシトカについての細胞密度の測定は、細胞の凝集性による大きな誤差を有している。エタノールは、既述[11]のように、バリアン(Varian)モデル3400Xを用いるガスクロマトグラフィーで測定した。その他の発酵生成物は、二重検出器(屈折率及びUV210nm)[33]を備えた、ヒューレットパッカード(Hewlett-Packard)モデル1090のシリーズIIクロマトグラフ及びバイオラードアミネックス(Bio-Rad Aminex)87Hイオンパーティションカラム(45℃;4mMのH2SO4;0.4ml/min;10μLの注入容量)を用いる、高速液体クロマトグラフィー(HPLC)によって測定した。炭素バランスは、既述[29,36]のように計算した。発酵培地としてLBを用いた場合は、細胞集団は、複合培地成分から単独に作製されたものと仮定して、炭素バランスの計算に含めなかった。
【実施例1】
【0183】
K.オキシトカP2による生育及びエタノール産生のための最小培地
本実施例は、クレブシエラ株のような組み換えエタノール産生の細菌による生育及びエタノール産生のために最適化された、単独の窒素源として尿素を包含する新規な最小培地(OUM1)の開発について記載する。この新規な培地は、K.オキシトカP2株を用いて、その生育及びエタノール産生の能力を幾つかの公知の培地と比較して、開発しそして最適化された。
【0184】
比較の目的で用いた既述の培地は、次の通りである:
L培地(LB)(Ausubel et al., 1989);
M9培地(+Fe)(Neidhardt et al., 1974);
U−M9(+Fe)、ここでは、NH4Clが、当量窒素の尿素に置き換わっている;
0.5%のコーンスティープリカー、CSL+M(Martinez et al., 1999);
U−0.5%のCSL+M、ここでは、(NH4)2SO4が、当量窒素の尿素に置き換わっている。
この新規な培地を、本明細書では「最適化尿素培地1号」(OUM1)と称する。
上記培地のそれぞれの組成は、上記表2に示す。
【0185】
最適化培地を開発するための最初の検討において、生育及びエタノール産生の能力を、M9(+Fe)及び0.5%のCSL+M培地中でのpH5.2にてテストしたK.オキシトカP2で比較した。ここで、後者の培地は、単独の窒素源としてアンモニアを有している。pH5.2でのLB培地は、性能の基準を提供する対照として含まれている。図2A及び2Bを参照すると、予想通りに[32]、LB培地が、最も高い細胞収率(図2A)及び最も速いエタノール産生(図2B)を支援した。同等のレベルのエタノールが、0.5%CSL+M及びLBで産生された(図2B)。
【0186】
表3は、M9及びCSL+M培地の両方における、エタノール産生及び収率について、アンモニアを尿素に置き換えた効果を示している。見られるように、この交換は、エタノール産生において少しの減少をもたらした(M9については、76%に対して71%;CSL+Mについては、83%に対して78%)。表3でも見られるように、一般に、エタノール産生及び収率は、窒素源に関わらず、培地の栄養豊富度によって増加する(LB>0.5%のCSL+M>M9+Fe)。
【0187】
【表3】

【実施例2】
【0188】
決められた窒素源として尿素を包含する最適化された最小培地
本実施例は、エタノール産生の細菌と共に用いる尿素を包含する最適化された最小培地を開発するための方法を記し、そして「OUM1」と称する培地のような態様の処方を提供する。
【0189】
OUM1と称する尿素ベースの培地(尿素を唯一の決められた窒素源として有している)を、上記のような方法を用いて、90g/LのグルコースでpH5.2にてpH制御した発酵でテストした。この培地でのエタノール産生は、M9(+Fe)及びCSL+M培地の尿素含有の処方よりも僅かに優れていて、高濃度の窒素、ホスフェート及びCSLが必要ないということを確認した(図2C及び2D)。
【0190】
細胞生育検討の結果は、最大細胞密度が、M9(+Fe)及び0.5%のCSL+M培地中(図2A)及びOUM1培地中(図2C)で全く同じであること示し、これらのそれぞれの培地中では低濃度の窒素(M9中の19.0mM)及びホスフェート(0.5%のCSL+M中の10.3mM)で十分であることを示唆した。
【0191】
M9(+Fe)及び0.5%のCSL+Mの組成物に基づいて、OUM1培地中の異なった濃度の栄養素:ホスフェート(12〜72mM)、マグネシウム(0.25〜1.0mM)、CSL(0〜15g/L)、及び尿素窒素(2.5〜15mM):を評価するようにフラスコ実験を設計した。コーンスティープリカー及び尿素の多種の濃度の結果を、それぞれ図3A及び3Bに示す。規定の範囲内では、CSL及び尿素のみが明確な最適条件、すなわちそれぞれ10g/L及び10mMを有していることを、このデータが示した。他の成分の全てのレベルで、48時間後に同じ濃度のエタノール(13.9±1.3g/L)が産生された。低濃度でも十分であると考えられるが、12mMのPO4−3、1mMのMgSO4及び1mMのCaCl2を最適化尿素培地(OUM1)用に選択した。(OUM1培地の完全な処方については、表2を参照されたい)。
【実施例3】
【0192】
エタノール力価及び発酵副生成物の産生における酸性pHの効果。
上記のように、ある特定タイプの発酵反応、例えば、発酵する糖がリグノセルロース原料由来である反応では、菌体ヒドロラーゼ及びセルラーゼが最適な性能を示す範囲である酸性のpHで、反応を実施することが望ましい。本実施例は、新たに開発された培地OUM1を含む、種々の培地中で生育するエタノール産生の細菌P2株による発酵で、pHがエタノール及び副産物の産生に及ぼす影響を記載する。
【0193】
再び表3を参照すると、OUM1培地で生育するP2株による、グルコースからのエタノール産生の結果が、既述の培地で生育するこれらの細胞の結果と比較されている。表3で示すように、OUM1培地のエタノール力価は一般に、pH5.2ではLB培地で得られるものと同等であった。
【0194】
しかしながら、これらの検討においては、全ての培地でのエタノール力価は、既報の富栄養培地、例えば、より中性のpHでのL培地(LB)よりも低いpH5.2でのものであることに注意されたい[5、6]。エタノール産生での低いpHの悪影響は、LB及びOUM1培地での発酵について確認された。表3に示すように、LB培地でP2株は、pH6.0及び6.8ではそれぞれ100%及び98%の収率でエタノールを産生したのに対して、pH5.2では収率が85%に低下した。
【0195】
表3で示される発酵実験において、グルコース基質から作られる不要な副生成物(エタノールに加えて)、すなわち、ホルメート、ラクテート、スクシネート、アセテート、アセトイン及び2,3−ブタンジオールについてのレベルも測定した。pH5.2の全ての培地でP2株によって副生成物が産生されるが、2,3−ブタンジオール経路から予想外に高い濃度(72mM)の生成物が、このpHでOUM1培地にて産生したことが見い出された(表3)。LB培地及びOUM1培地の両方で、pH5.2での発酵は、pH6.8に比べてより高い割合の中性の副生成物(アセトイン及び2,3−ブタンジオール)を含有していた。より具体的には、OUM1培地では、中性の副生成物のレベルが、pH6.8よりもpH5.2で4.5倍高かった。対照的に、pH6.8のOUM1培地では、ブタンジオール+アセトインのレベルが減少した(72mMに対して16mM)のに対し、アセテート及びホルメートの濃度はpH6.8で増加した(それぞれ、9mMに対して47mM、及び<1mMに対して44mM)。OUM1培地の結果とは異なって、LB培地では、中性の副生成物は、pH5.2及びpH6.8で比較的一定を保持していた(38mMに対して31mM)のに対し、酸性副生成物は減少した(表3)。
【0196】
理論に制約されるものではないが、P2株による2,3−ブタンジオール経路からの中性の副生成物の増大した生成は、OUM1培地の組成及び低pHの両方に関連していると思われる。この知見は、K.オキシトカの野生株にある対応する酵素の報告されている活性と一致すると思われる。例えば、2,3−ブタンジオール経路の副生成物の生成に関連する酵素活性は、低pHに応答して増大することが知られている[35、37、38]。より中性に近いpHでは、ピルビン酸ギ酸リアーゼ、酢酸キナーゼ、及び乳酸デヒドロゲナーゼのような酸発生の活性が、より酸性の生成物を産生する[39]。
【実施例4】
【0197】
エタノール産生の細菌中のbudABオペロンの欠失のための構築
本実施例は、細菌(クレブシエラ・オキシトカ)由来の、budA遺伝子の推定全長cDNA配列、及びbudB遺伝子の部分cDNA配列の単離を、そしてブタンジオール経路にあるこれらの遺伝子が崩壊しているDNA断片の構築物を記載している。細菌細胞への導入に続く、これらの構築は、細胞によるサッカライドの発酵時に不要な2,3−ブタンジオール及びアセトインの産生を消去するために有用である。
【0198】
budA及びbudB遺伝子は、隣接してK.オキシトカゲノム中にあり、そして一緒にしてbudABと称する。2つの遺伝子はそれぞれ、2,3−ブタンジオール及びアセトインの産生に関わる2つの酵素、すなわちα−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼをコードする。本実施例では、K.オキシトカM5A1のbudAB遺伝子における欠失を構築し、そしてK.オキシトカP2株に形質導入してBW21株を作製する。一般に、BW21のような欠失突然変異株を構築するために用いられる方法は、前記、材料及び方法の1a〜c項に記載されている。budAB欠失のある新しい株を構築するために用いられるプラスミド及び菌株は、前記の表1に挙げられている。
【0199】
budAB遺伝子は、K.オキシトカに今まで記載されていなかった。しかしながら、2つの関連する生命体、すなわちエンテロバクター・アエロゲネス(Enterobacter aerogenes)及びルールテラ・テリゲナ(Roultella terrigena)(正式にはクレブシエラ・テリゲナ[35、37])由来の同種の遺伝子は知られている。これらの配列及びK.ニューモニエ(K. pneumoniae)の部分(注釈なし)ゲノム[40]に基づいて、上記のプライマー(SEQ ID NO:1及び2)を、budAB’を含有するDNA断片のPCR増幅のために設計した。
【0200】
図1は、budオペロン及びこのK.オキシトカのオペロンに伴う2,3ブタンジオール発酵経路を欠失させるのに用いられるプラスミドの構築の過程を示す概念図である。挿入図(図1A)は、オペロンの図表示である。図1Aに示すように、このオペロンの発現は、低いpHで増大され、そしてBudR及びFnrによって正に調節される。
【0201】
上記の方法に記載のように、α−アセトラクテート・デカルボキシラーゼの推定全長コード配列(budA)(SEQ ID NO:3)及びα−アセトラクテート・シンターゼ(budB)(SEQ ID NO:4)の5’末端を包含する部分コード配列を含有するDNA断片を、K.オキシトカ由来のゲノムDNAを鋳型として用い、PCRで増幅した。(SEQ ID NO:3及び4によってコードされるポリペプチドの予測されるアミノ酸配列は、それぞれSEQ ID NO:6及び7に示されている)。図1Bの左上図は、指定されたPCRプライマー(SEQ ID NO:1及び2)で増幅されたK.オキシトカのbudA及びbudBの比率を示している。
【0202】
図1Bの下部を参照すると、budABを含有する増幅されたDNA断片は、PCRクローニングベクターpCR2.1−TOPO(表1に記載)にクローンされて、pLOI301(pCR2.1budAB’;図1Bの(1)で示されている)を生成する。
【0203】
budAB遺伝子産物を消去するために、budAB’断片の中央部を大きく欠失させて2つのFRT(Flp recombinase Recognition Target)部位に隣接するtet遺伝子で置き換え、pLOI3310(budA’−FRT−tet−FRT−'budB’;図1B、(3))を生成した。切断budA及びbudB配列、並びに介在するFRT隣接テトラサイクリン遺伝子(budA’−FRT−tet−FRT−'budB’)を含有する核酸構築物を、本明細書でSEQ ID NO:8と称する。budAB配列の中央部の欠失、及びtet含有構築物による置換は、2つのFRT配列が側面にあるtet遺伝子を含有しているpLOI2065(図1B、(2))を用い、当該技術分野で公知の標準的な技術によって実施した(「Underwood et al., 2002」;表1も参照されたい)。側面のFRT部位は、染色体の組み込み後のマーカー除去を促進するために含有した[20、21、27]。
【0204】
引き続く組み込み時のノイズを最小化するために、pLOI3310由来のbudA’−FRT−tet−FRT−'budB’を包含する2.1kbpのHindIII−ApaI断片を、pLOI2745の対応する部位に結合させた(図1B、(4))。このベクターは、温度条件付きpSC101レプリコンを含有している(更に詳細には、表1を参照されたい)。得られた5502bpのプラスミドを、pLOI3313(pLOI2745(budA’−FRT−tet−FRT−'budB’))と称した(図1B、(5))。
【実施例5】
【0205】
budAB欠失があるエタノール産生の組み換えクレブシエラ細菌株の作製
上記の実施例3及び表3で明確にしたように、発酵反応時にエタノール産生の組み換えK.オキシトカP2株は、OUM1発酵培地中にて酸性pHで生育させると、低下したエタノール産生及びブタンジオール経路の副生成物の増大した産生を示す。上記に検討したように、budAB遺伝子は、2,3−ブタンジオール及びアセトインの産生に関わる2つの酵素、すなわちα−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼをそれぞれコードする。本実施例は、突然変異細胞中でbudAB遺伝子産物の発現の消去をもたらす、budAB遺伝子における欠失突然変異を含んでいる、P2株由来の新規なエタノール産生のK.オキシトカ株であるBW21株の作製について記載する。
【0206】
budA’−FRT−tet−FRT−'budB’断片の、エタノール産生に有用なクレブシエラ株への組み込みのために、上記実施例4に記載のpLOI3313プラスミドを、線形化し、PCR増幅のための鋳型として用いた。budAB欠失を含むPCR生成物を、Redリコンビナーゼ(pLOI3421;表1を参照されたい)の存在下に、エレクトロポレーションによって、K.オキシトカ株M5A1株に組み込んだ。
【0207】
budAB遺伝子産物の機能的な欠失を確認するために、10個のクローンを、5%のグルコースを含有する最適化された尿素培地(OUM1;上記の表2を参照されたい)で生育させて、アセトイン及び2,3−ブタンジオールの有無について、方法1f項に記載のようにして選別した。これらの生成物が検出可能な濃度で存在しないことで、「欠失クローン」とも称されるが、うまく形質転換された細胞中でのbudAB経路の欠失が確認された。クローンにおけるbudABの欠損は、PCR分析によっても確認された。
【0208】
ブタンジオール経路に欠失を有するK.オキシトカ(P2のような)のエタノール産生の株を構築するために、K.オキシトカM5A1株(BW15と称する)の1個のクローンを選択して、上記のように、バクテリオファージP1を用いてK.オキシトカP2に形質導入するためのドナーとして用いた。得られた10個の形質導入株を、上記のようにアセトイン及びブタンジオールについて選別した。更なる検討のために1個の欠失クローンを選択して、BW19と称した。次いで、FLPリコンビナーゼ(pFT−K)を用いる標準的な操作で、FRTが側面にあるtet遺伝子を除去した。budAB欠失を有しているがFRTが側面にあるtetを欠いている、得られた株を、K.オキシトカBW21と称した。FRTが側面にあるtet遺伝子を除去した後の細胞に残存する切断budA及びbudB配列を包含する単離された核酸断片を、本明細書でSEQ ID NO:5と称する。
【実施例6】
【0209】
budABの欠失のエタノール産生の細菌によるエタノールの収率の増加
本実施例は、新たに開発されたエタノール産生のK,オキシトカBW21株(実施例5に記載)による、グルコース発酵の改善されたエタノール産生及び副生成物の低減された産生について、親株であるK.オキシトカP2と比較して、記載する。
【0210】
再度表3を参照すると、OUM1(90g/Lのグルコースを用いて)中での細胞の生育による発酵のエタノール及び副生成物の産生について、budAB欠失の効果(親のP2株に対してBW21株)について、比較がなされている。
【0211】
表及び先に検討のように、pH5.2で行われた親株P2による発酵において、ブタンジオール経路(1モルの生成物当たり2モルのピルベート)からの不要な副生成物(アセトイン+2,3−ブタンジオール)が、エタノール産生に利用できるグルコースの約14%から産生された。まさに対照的に、BW21株におけるアセトラクテート・シンターゼ及びアセトラクテート・デカルボキシラーゼをコードする遺伝子の欠失は、これらの副生成物の両方を実質的に消去した(表3)。ラクテート及びアセテートの濃度も、親株P2におけるよりBW21株では低かった。
【0212】
pH5.2でのOUM1培地で、BW21株による副生成物の減少は、P2株に比べてエタノール力価及び収率の12%増加を伴った(表3及び図4を参照されたい)。図4のグラフは、OUM1培地でのK.オキシトカ株BW21及びP2による細胞生育(4A)及びエタノール産生(4B)の比較を示している。BW21及びP2の生育比率は実質的に同じであるが、エタノール産生がBW21株で一貫して高かった。
【0213】
図5は、3つの尿素含有の培地、すなわちU−M9、U−0.5%のCSL+M、及びOUM1(培地処方に関しては、表2を参照されたい)中で生育する親株P2、及びOUM1培地で生育する、budAB欠失のBW21株についての、エタノール収率(グルコース1グラム当たりのグラム数で示す)及びエタノール生産性(エタノール産生の最大及び平均容積比として、1時間当たりのエタノールのmMで示す)の比較を示す。平均の生産性は、最初の72時間について計算した。エタノール収率は、72時間後に計算した。最大容積生産性は、発酵の初期、8時間〜24時間の範囲に現れた。
【0214】
重要なことに、図5に見られるように、エタノールの収率及び生産性は、OUM1培地で生育するBW21株が、テストしたどの培地で生育している親株P2よりも、一貫して高かった。
【実施例7】
【0215】
OUM1培地でのbudAB遺伝子欠損の組み換え細菌によるエタノールの経済的な産生
上記のように、生成物の収率及び細菌培養培地のような生産材料に関わるコストは、エタノールのような汎用化学製品の経済性において重要な因子である。K.オキシトカは、この細菌が元来尿素を窒素源として使用する能力を有しているので、エタノール産生の細菌として有利な選択肢である。同等の窒素原料として、尿素は通常、アンモニウム塩のコストの約半分で市販されている。窒素源としての尿素の使用は、更に付加的な利点を有している。アンモニウム塩の代謝と異なって、尿素の代謝は、培地の酸性化を助長しない[41]ので、pHを調節するために必要な塩基の量を減少させる。
【0216】
OUM1と称される、本明細書に記載の新規な培地は、その他の塩及びコーンスティープリカーが低濃度であるという潜在的な節約を更に提供する。重量ベースで、OUM1培地は、0.5%のCSL、0.06%の尿素及び0.2%の無機塩、更に発酵性寒天から構成されている。このような発酵で用いる低いpHは、真菌性セルラーゼ及びキシラナーゼが、一般にpH5付近で最適条件を示す[42]ので、リグノセルロース原料に対して特に適している。
【0217】
本明細書で確認したように、SSFのための低いpHのこれら利点にもかかわらず、酸性のpHで発酵反応を行う不利な点は、エタノール産生の細菌のブタンジオール(及びアセトイン)産生のための経路が低いpHで活性化されて[43]、副生成物の増加及びエタノール収率の低下をもたらすことである。しかしながら、本明細書で実証したように、この経路に特異的に関与する2つの遺伝子(budAB)に欠失を有する、改良されたエタノール産生の組み換え細菌株の構築によって、この問題はうまく克服することができる。上記で示したように、これらの遺伝子の欠失によるブタンジオール反応生成物の消去は、親株P2よりも12%高いエタノール収率を実現する、改善されたエタノール産生のクレブシエラ株(BW21株で例示される)をもたらした。最も意義深いことに、OUM1中でのpH5.2で、BW21によるグルコースからのエタノール産生は、LB培地での親株(P2株)のそれを、実質的に48時間後に達成し、上回った。従って、この新規な株は、この生命体による安価な試薬からのエタノールの産生に最適化された新規な最小培地と共に、バイオマスからの手頃な価格の、再生可能なエネルギー源を作り出すという目標において、重大な進展をもたらす。
【0218】
引例
引例の概説は、本発明の正しい評価を高めるであろうと信じる。以下の文献は、下に示した番号で本明細書を通して参照されている。
【0219】
1. Biobased Industrial Products, Priorities for Research and Commercialization; Arntzen, C.E.; Dale B. E. (co-chairs). National Academy Press: Washington, D. C. 1999.
2. Zaldivar, J.; Nielsen J.; Olson L. Fuel Ethanol Production from Lignocellulose: a Challenge for Metabolic Engineering and Process Integration. Appl. Microbiol. Biotechnol. 2001, 56, 17-34.
3. Von Sivers M.; Zacchi G.; Olson L.; Hahn-Hagerdal B. Cost Analysis of Ethanol from Willow Using Recombinant Escherichia coli. Biotechnol. Prog. 1994, 10, 555-560
4. Wyman, C. E. Potential Synergies and Challenges in Refining Cellulosic Biomass to Fuels, Chemicals, and Power. Biotechnol. Prog. 2003, 19, 254-262.
5. Ohta, K.; Beall D.S.; Mejia J.P.; Shanmugan K.T.; Ingram L.O. Metabolic Engineering of Klebsiella oxytoca M5A1 for Ethanol Production from Xylose and Glucose. Appl. Environ. Microbiol. 1991, 57, 2810-2815.
6. Wood, B. E.; Ingram L. O. Ethanol Production from Cellobiose, Amorphous Cellulose and Crystalline Cellulose by Recombinant Klebsiella oxytoca Containing Chromosomally Integrated Zymomonas mobilis Genes for Ethanol Production and Plasmids Expressing Thermostable Cellulase Genes from Clostridium thermocellum. Appl. Environ. Microbiol. 1992, 58, 2103-2110.
7. Bothast, R.J.; Saha B,; Flosenzier A.V.; Ingram L.O. Fermentation of L-arabinose D-xylose and D-glucose by Ethanologenic Recombinant Klebsiella oxytoca strain P2. Biotechnol Lett. 1994, 16, 401-406.
8. Doran J.B.; Aldrich H.C.; Ingram L.O. Saccharification and Fermentation of Sugar-cane Bagasse by Klebsiella oxytoca P2 Containing Chromosomally Integrated Genes Encoding the Zymomonas mobilis Ethanol Pathway. Biotechnol. Bioengin. 1994, 44, 240-247.
9. Brooks, T.A.; Ingram L.O. Conversion of Mixed Waste Office Paper to Ethanol by Genetically Engineered Klebsiella oxytoca strain P2. Biotechnol. Prog. 1995, 11, 619-625.
10. Wood, B.E.; Aldrich H.C.; Ingram L.O. Ultrasound Stimulates Ethanol Production During the Simultaneous Saccharification and Fermentation of Mixed Waste Office Paper. Biotechnol. Prog. 1997, 13, 232-237.
11. Ohta, K.; Beall D.S.; Mejia J.P.; Shanmugam K.T.; Ingram L.O. Genetic Improvement of Escherichia coli for Ethanol Production: Chromosomal Integration of Zymomonas mobilis Genes Encoding Pyruvate Decarboxylase and Alcohol Dehydrogenase II. Appl. Environ. Microbiol. 1991, 57, 893-900.
12. Linsay, S.E.; Bothast R.J.; Ingram L.O.. Improved Strains of Recombinant Escherichia coli of Ethanol Production from Sugar Mixtures. Appl. Microbiol. Biotechnol. 1995, 43, 70-75.
13. Yomano, L.P.; York S.W.; Ingram L.O. Isolation and Characterization of Ethanol Tolerant Mutants of Escherichia coli KO11 for Fuel Ethanol Production. J. Ind. Microbiol. 1998, 20, 132-138.
14. Burchhardt, G.; Ingram L.O. Conversion of Xylan to Ethanol by Ethanologenic Strains of Escherichia coli and Klebsiella oxytoca. Appl. Environ. Microbiol. 1992, 58, 1128-1133.
15. Qian Y.; Yomano L.P.; Preston J.F.; Aldrich H.C.; Ingram L.O. Cloning, Characterization, and Functional Expression of the Klebsiella oxytoca Xylodextrin Utilization Operon (xynTB) in Escherichia coli. Appl. Environ. Microbiol. 2003, 69, 5957-5967
16. Kadam, K.L.; Newman M.M. Development of a Low-cost Fermentation Medium for Ethanol Production from Biomass. Appl. Microbiol. Biotechnol. 1997, 47, 625-629.
17. Ingram, L.O.; Gomez P.F.; Lai X.; Moniruzzaman M.; Wood B.E.; Yomano L.P.; York S.W. Metabolic Engineering of Bacteria for Ethanol Production. Biotechnol. Bioengin. 1998, 58, 204-214.
18. Zhang, J.; Greasham R. Chemically Defined Media for Commercial Fermentations. Appl. Microbiol. Biotechnol. 1999, 51, 407-421.
19. Orskov, I. In Bergey's Manual of Systematic Bacteriology, Vol.1, Kreig, N.R.; Holt J. G. Eds,; Williams and Wilkins, Baltimore, MD, 1984. 461-465.
20. Underwood, S. A; Zhou S,; Causey T.B.; Yomano L.P.; Shanmugam K.T.; Ingram L.O. Genetic Changes to Optimize Carbon Partitioning Between Ethanol and Biosynthesis in Ethanologenic Escherichia coli. Appl. Environ. Microbiol. 2002, 68, 1715-1727.
21. Posfai, G.; Koob M.; Kirkpatrick H.A.; Blattner F.R. Versatile Insertion Plasmids for Targeted Genome Manipulations in Bacteria: Isolation, Deletion, and Rescue of the Pathogenicity Island LEE of the Escherichia coli O157: H7 Genome. J. Bacteriol. 1997, 179, 4426-4428.
22. Datsenko, K.A.; Wanner B.L. One-step Inactivation of Chromosomal Genes in Escherichia coli K-12 Using PCR Products. PNAS. 2000, 97, 6640-6645.
23. Bolndelet-Rouault, M.H.; Weiser J.; Lebrihi A.; Branny P.; Pernodet J.l. Antibiotic Resistance Gene Cassette Derived from the Ω Interposon for Use in E. coli and Streptomyces. Gene 1997, 190, 315-317.
24. Current Protocols in Molecular Biology. Ausubel, F.M.; Brent R.; Kingston R.E.; Moore D.D; Deidman J.G.; Smith J.A; Struhl K Eds.; John Wiley & Sons, Inc.: New York, N.Y. 1987.
25. Miller, J.H. A Short Course in Bacterial Genetics: a Laboratory Manual and Handbook for Escherichia coli and Related Bacteria; Cold Spring Harbor Laboratory Press: Plainview, N.Y. 1992.
26. Sambrook, J.; Russell D.W. Molecular Cloning: a Laboratory Manual;. Cold Spring Harbor Laboratory Press: Cold Spring Harbor, NY, 2001.
27. Martinez-Morales, F.; Borges A.C.; Martinez A.; Shanmugam K.T.; Ingram L.O. Chromosomal Integration of Heterologous DNA in Eschrichia coli with Precise Removal of Markers and Replicons Used During Construction. J. Bacteriol. 1999, 181, 7143-7148.
28. Zhou S.; Causey T.B.; Hasona A.; Shanmugam K.T.; Ingram L.O. Production of Optically Pure D-Lactic Acid in Mineral Salts Medium by Metabolically Engineered Escherichia coli W3110. Appl Environ Microbiol. 2003, 69, 399-407
29. Causey, T.B.; Shanmugam K.T.; Yomano L.P.; Ingram L.O. Engineering Escherichia coli for Efficient Conversion of Glucose to Pyruvate. PNAS. 2004, 101, 2235-2240.
30. Neidhardt, F.C.; Bloch P.L.; Smith D.F. Culture Media for Enterobacteria. J. Bacteriol. 1974, 119, 736-747.
31. Scopes, R.K. An Iron-Activated Alcohol Dehydrogenase. FEBS Lett. 1983, 156, 303-306.
32. Martinez, A.; York S.W.; Yomano L.P.; Pineda V.L.; Davis F.C.; Shelton J.C.; Ingram L.O. Biosynthetic Burden and Plasmid Burden Limit Expression of Chromosomally Integrated Heterologous Genes (pdc, adhB) in Escherichia coli. Biotechnol Prog. 1999, 15, 891-897.
33. Underwood, S.A.; Buszko M.L.; Shanmugam K.T.; Ingram L.O. Flux Through Citrate Synthase Limits the Growth of Ethanologenic Escherichia coli KO11 During Xylose Fermentation. Appl. Envron. Microbiol. 2002, 68, 1071-1081.
34. Beall, D.S., Ohta K, Ingram L.O. Parametric Studies of Ethanol Producfrom from Xylose and Other Sugars by Recombinant Escherichia coli. Biotechnol. Bioeng. 1991, 38, 296-303.
35. Blomqvist, K.; Nikkola M.; Lehtovaara P.; Suihko M.; Airaksinen U.; Straby K.B.; Knowles J.K.; Penttila M.E. Characterization of the 2,3-butanediol Operons from Klebsiella terrigena and Enterobacter aerogenes. J. Bacteriol. 1993, 175, 1392-1404.
36. Zabriskie, D.W.; Armiger W.B.; Phillips D.H.; Albano P.A. Traders Guide to Fermentation Media Formulation; Traders Protein. Memphis, TN. 1984.
37. Mayer, D.; Schlensog V.; Bock A. Identification of the Transcriptional Activator Controlling the Butanediol Fermentation Pathway in Klebsiella terrigena. J. Bacteriol. 1995, 177, 5261-5269.
38. Yang, Y.; Peredelchuk M.; Bennet G.N.; San K. Effect of Variation of Klebsiella pneumoniae Acetolactate Synthase Expression on Metabolic Flux Redistribution in Escherichia coli. Biotechnol. Bioengin. 2000, 69, 150-159.
39. Tolan, J.S.; Finn, R.K Fermentation of D-Xylose to Ethanol by Genetically Modified Klebsiella planticola. Appl. Environ. Microbiol. 1987, 53, 2039-2044
40. Washington University Klebsiella pneumoniae genome sequencing project home page. http://genome.wustl.edu/projects/bacterial/kpneumoniae (Accessed Nov. 2003)
41. Teixeira de Mattos, M.J.; Neijssel O.M. Bioenergetic Consequences of Microbial Adaptation to Low-nutrient Environments. J. Biotechnol. 1997, 59, 117-126.
42. Nieves, R.A.; Ehrman C.I.; Adney W.S.; Elander R.T.; Himmel M.E. Technical Communication: Survey and Analysis of Commercial Cellulase Preparations Suitable for Biomass Conversion to Ethanol. World J. Microbiol. Biotechnol. 1998, 14, 301-304.
43. Johansen, L.; Bryn K.; Stormer F.C. Physical and Biochemical Rose of the Butanediol Pathway in Aerobacter (Enterobacter) aerogenes. J. Bacteriol. 1975, 123, 1124-1130.
【0220】
引例による援用
本明細書に開示された全ての特許、公開された特許出願及びその他の引例は、それらの全てを参照して本明細書に特別に取り込まれている。
【0221】
均等物
本明細書に記載の本発明の具体的な態様の多くの均等物を、当業者は認識できるであろう、又は単なる通常の実験を用いて確認できるであろう。このような均等物は、本願の特許請求の範囲に含まれるように意図されている。
【受託番号】
【0222】
NRRL B−30857
NRRL B−30858
NRRL B−30859
【特許請求の範囲】
【請求項1】
(a)糖をエタノールに変換する酵素をコードする非相同性ポリヌクレオチド配列(ここにおいて、当該ホスト細胞は、当該細胞による主要発酵生成物としてのエタノールの産生を促進するのに十分な機能レベルで、当該非相同性ポリヌクレオチド配列を発現する)、及び
(b)当該細胞の代謝経路において、糖からエタノール以外の生成物を産生するタンパク質をコードする少なくとも1つのポリヌクレオチド配列中の突然変異(ここにおける突然変異は、突然変異がない細胞によるエタノール産生に比べて、当該細胞による増大したエタノール産生をもたらす)、
を含んでなる、サッカライドを分解するのに適している組み換えホスト細胞。
【請求項2】
前記突然変異のポリヌクレオチド配列が、非相同性ヌクレオチド配列を含んでなる、請求項1に記載の組み換えホスト細胞。
【請求項3】
前記突然変異が、欠失、挿入又は塩基置換の突然変異である、請求項1に記載の組み換えホスト細胞。
【請求項4】
前記細胞が、線虫、昆虫、は虫類、鳥、両生動物、及び哺乳動物よりなる群から選ばれる高等真核生物のものである、請求項1に記載の組み換えホスト細胞。
【請求項5】
前記細胞が、単細胞又は多細胞微生物のものである、請求項1に記載の組み換えホスト細胞。
【請求項6】
前記微生物が、細菌である、請求項5に記載の組み換えホスト細胞。
【請求項7】
前記微生物が、真菌又は酵母である、請求項5に記載の組み換えホスト細胞。
【請求項8】
前記酵母が、サッカロミセス属(Saccharomyces)、シゾサッカロミセス属(Schizosaccharomyces)、ハンゼヌラ属(Hansenula)、パチオソレン属(Pachyosolen)、クルベロミセス属(Kluyveromyces)、デバリオミセス属(Debaryomyces)、ヤロウイア属(Yarrowia)及びピキア属(Pichia)よりなる群から選ばれる、請求項7に記載の組み換えホスト細胞。
【請求項9】
前記細菌が、グラム陰性細菌よりなる群から選ばれる、請求項6に記載の組み換えホスト細胞。
【請求項10】
前記細菌が、グラム陽性細菌よりなる群から選ばれる、請求項6に記載の組み換えホスト細胞。
【請求項11】
前記細菌が、条件的嫌気性である、請求項9に記載の組み換えホスト細胞。
【請求項12】
ホスト細胞が、腸内細菌科(family Enterobacteriaceae)から選ばれる、請求項11に記載の組み換えホスト細胞。
【請求項13】
前記細菌が、エシェリキア属(Escherichia)、赤痢菌(Shigella)、シトロバクター属(Citrobacter)、サルモネラ属(Salmonella)、クレブシエラ属(Klebsiella)、エンテロバクター属(Enterobacter)、エルウィニア属(Erwinia)、クルイベラ属(Kluyvera)、セラチア属(Serratia)、セデセア属(Cedecea)、モルガネラ属(Morganella)、ハフニア属(Hafnia)、エドワードシエラ属(Edwardsiella)、プロビデンシア属(Providencia)、プロテウス属(Proteus)及びエルシニア属(Yersinia)よりなる群から選ばれる、請求項12に記載の組み換えホスト細胞。
【請求項14】
前記細菌が、エルウィニア属及びクレブシエラ属よりなる群から選ばれる、請求項13に記載の組み換えホスト細胞。
【請求項15】
前記細菌が、クレブシエラ・オキシトカ(Klebsiella oxytoca)株よりなる群から選ばれる、請求項14に記載の組み換えホスト細胞。
【請求項16】
前記ホスト細菌が、クレブシエラ・オキシトカP2株(ATCC55307)である、請求項15に記載の組み換え細菌性ホスト細胞。
【請求項17】
前記細菌が、バチルス属(Bacillus)、ゲオバチルス属(Geobacillus)、クロストリジウム属(Clostridium)、連鎖球菌(Streptococcus)及びセルロモナス属(Cellulomonas)よりなる群から選ばれる、請求項10に記載の組み換えホスト細胞。
【請求項18】
前記非相同性ポリヌクレオチド配列が、アルコールデヒドロゲナーゼ及び/又はピルビン酸デカルボキシラーゼをコードする、前記請求項の何れか一項に記載の組み換えホスト細胞。
【請求項19】
前記アルコールデヒドロゲナーゼ及びピルビン酸デカルボキシラーゼが、ザイモモナス属(Zymomonas)由来である、請求項18に記載の組み換えホスト細胞。
【請求項20】
前記ザイモモナス属が、ザイモモナス・モビリス(Zymomonas mobilis)である、請求項19に記載の組み換えホスト細胞。
【請求項21】
(a)アルコールデヒドロゲナーゼ及びピルビン酸デカルボキシラーゼを、コードする非相同性ポリヌクレオチド配列(ここにおいて、当該細菌は、当該細菌による主要発酵生成物としてのエタノールの産生を促進するのに十分な機能レベルで、当該非相同性ポリヌクレオチド配列を発現する)、及び
(b)当該細胞の代謝経路において、糖からエタノール以外の生成物を産生するタンパク質をコードする少なくとも1つのポリヌクレオチド配列中の突然変異(ここにおける突然変異は、当該タンパク質の発現を減少又は消去し、これにより突然変異がない組み換え細菌性ホスト細胞によるエタノール産生に比べて、前記組み換え細菌性ホスト細胞によるエタノール産生を増大させる)、
を含んでなる、サッカライドを分解するのに適している組み換え細菌性ホスト細胞。
【請求項22】
前記突然変異のポリヌクレオチド配列が、非相同性ヌクレオチド配列を含んでなる、請求項21に記載の組み換え細菌性ホスト細胞。
【請求項23】
前記突然変異が、欠失、挿入又は塩基置換の突然変異である、請求項21に記載の組み換え細菌性ホスト細胞。
【請求項24】
前記突然変異が、欠失突然変異である、請求項21に記載の組み換え細菌性ホスト細胞。
【請求項25】
前記細菌が、グラム陰性細菌よりなる群から選ばれる、請求項21に記載の組み換え細菌性ホスト細胞。
【請求項26】
前記細菌が、グラム陽性細菌よりなる群から選ばれる、請求項21に記載の組み換え細菌性ホスト細胞。
【請求項27】
前記細菌が、条件的嫌気性である、請求項25に記載の組み換え細菌性ホスト細胞。
【請求項28】
ホスト細胞が、腸内細菌科から選ばれる、請求項27に記載の組み換え細菌性ホスト細胞。
【請求項29】
前記細菌が、エシェリキア属、赤痢菌、シトロバクター属、サルモネラ属、クレブシエラ属、エンテロバクター属、エルウィニア属、クルイベラ属、セラチア属、セデセア属、モルガネラ属、ハフニア属、エドワードシエラ属、プロビデンシア属、プロテウス属及びエルシニア属よりなる群から選ばれる、請求項28に記載の組み換え細菌性ホスト細胞。
【請求項30】
前記細菌が、エルウィニア属及びクレブシエラ属よりなる群から選ばれる、請求項29に記載の組み換え細菌性ホスト細胞。
【請求項31】
前記細菌が、クレブシエラ・オキシトカ株よりなる群から選ばれる、請求項30に記載の組み換え細菌性ホスト細胞。
【請求項32】
前記ホスト細菌が、クレブシエラ・オキシトカP2株(ATCC55307)である、請求項31に記載の組み換え細菌性ホスト細胞。
【請求項33】
前記細菌が、バチルス属、ゲオバチルス属、クロストリジウム属、連鎖球菌及びセルロモナス属よりなる群から選ばれる、請求項26に記載の組み換え細菌性ホスト細胞。
【請求項34】
前記エタノール以外の生成物が、ホルメート、ラクテート、スクシネート、アセテート、アセトイン、ブタンジオール、2,3−ブタンジオール、キシリトール、ブチレート、ピルベート、プロピオネート、イソプロピルアルコール、1−プロパノール、2−プロパノール、プロパンジオール、シトレート、グルタメート及びアセトンよりなる群から選ばれる、請求項1〜33の何れか一項に記載の組み換えホスト細胞。
【請求項35】
前記ポリヌクレオチド配列が、budA、budB、budR及びbudC、並びにそれらのホモログ、オーソログ及び機能的断片よりなる群から選ばれる遺伝子由来のヌクレオチド配列を含んでなる、請求項21に記載の組み換えホスト細胞。
【請求項36】
当該突然変異が、当該細胞中でのブタンジオールを産生する代謝経路に関わる酵素をコードする少なくとも1つのポリヌクレオチド配列中にある、請求項35に記載の組み換え細菌性ホスト細胞。
【請求項37】
当該突然変異が、budA及びbudBの遺伝子のうちの片方又は両方の中にある、請求項31に記載の組み換え細菌性ホスト細胞。
【請求項38】
前記突然変異が、当該細胞中でのα−アセトラクテート・デカルボキシラーゼ又はα−アセトラクテート・シンターゼの発現を低減又は消去する、請求項37に記載の組み換え細菌性ホスト細胞。
【請求項39】
前記突然変異が、当該細胞中でのα−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼの発現を低減又は消去する、請求項37に記載の組み換え細菌性ホスト細胞。
【請求項40】
当該非相同性ポリヌクレオチド配列が、アルコールデヒドロゲナーゼ及び/又はピルビン酸デカルボキシラーゼをコードする、請求項35〜39の何れか一項に記載の組み換え細菌性ホスト細胞。
【請求項41】
前記アルコールデヒドロゲナーゼ及びピルビン酸デカルボキシラーゼが、ザイモモナス属由来である、請求項40に記載の組み換え細菌性ホスト細胞。
【請求項42】
前記ザイモモナス属が、ザイモモナス・モビリスである、請求項41に記載の組み換え細菌性ホスト細胞。
【請求項43】
BW15(NRRLB−30857)、BW19(NRRLB−30858)及びBW21(NRRLB−30859)よりなる群から選ばれるクレブシエラ・オキシトカ株で示される、組み換え細菌性ホスト細胞。
【請求項44】
(a)アルコールデヒドロゲナーゼ及びピルビン酸デカルボキシラーゼをコードする非相同性ポリヌクレオチド配列(ここにおいて、当該ホスト細胞は、当該細胞による主要発酵生成物としてのエタノールの産生を促進するのに十分な機能レベルで、当該非相同性ポリヌクレオチド配列を発現する)、及び
(b)当該代謝経路において、当該細胞でブタンジオールを産生するタンパク質をコードする少なくとも1つのポリヌクレオチド配列中の欠失突然変異(ここにおける突然変異は、当該タンパク質の発現を低減又は消去し、これにより突然変異がない細胞によるエタノール産生に比べて、当該細胞によるエタノール産生を増大させる)
を含んでなる、細菌性ホスト細胞がクレブシエラ・オキシトカである、組み換え細菌性ホスト細胞。
【請求項45】
サッカライド源を前記請求項の何れか一項に記載の組み換えホスト細胞と接触させ、これによりサッカライド源からエタノールを産生することを含んでなる、サッカライド源からエタノールを産生する方法。
【請求項46】
前記組み換えホスト細胞を得ることを更に含んでなる、請求項45に記載の方法。
【請求項47】
(a)エタノール産生の親ホスト細胞に、当該親細胞によってエタノールを産生するのに適した条件下で、選択培地及びサッカライド源を接触させること、
(b)前記条件下及び培地中で、サッカライド源から産生されるエタノールのレベルを測定すること、
(c)前記条件下及び培地中で増大した発現を有する望ましくない副生成物を同定するために、前記サッカライド源から産生されるエタノール以外の少なくとも1つの生成物のレベルを測定すること、そして
(d)代謝経路において、前記の望ましくない副生成物を産生する遺伝子産物をコードする遺伝子のポリヌクレオチド配列を突然変異させ(ここにおける突然変異は、代謝経路中の少なくとも1つの遺伝子産物の発現を低減又は消去して、突然変異なしの親細胞によるエタノール産生に比べて、当該細胞によるエタノール産生を増大させる)、これによりサッカライド源からのエタノール産生を最適化した組み換えホスト細胞を作製すること、
を含んでなる、サッカライド源からのエタノール産生を最適化した組み換えホスト細胞を作製する方法。
【請求項48】
遺伝子中に突然変異を包含する単離されたポリヌクレオチド断片を作製し、そしてこの突然変異したポリヌクレオチド断片を親細胞中に導入することを、更に含んでなる、請求項47に記載の方法。
【請求項49】
前記突然変異が、欠失、挿入又は塩基置換の突然変異を含んでなる、請求項47又は48に記載の方法。
【請求項50】
前記細胞が、最小培地でのエタノール産生に最適化されている、請求項49に記載の方法。
【請求項51】
前記細胞が、線虫、昆虫、は虫類、鳥、両生動物、及び哺乳動物よりなる群から選ばれる高等真核生物のものである、請求項47又は48に記載の方法。
【請求項52】
細胞が、単細胞又は多細胞微生物のものである、請求項47又は48に記載の方法。
【請求項53】
前記微生物が、細菌である、請求項52に記載の方法。
【請求項54】
前記微生物が、真菌又は酵母である、請求項52に記載の方法。
【請求項55】
前記酵母が、サッカロミセス属、シゾサッカロミセス属、ハンゼヌラ属、パチオソレン属、クルベロミセス属、デバリオミセス属、ヤロウイア属及びピキア属よりなる群から選ばれる、請求項54に記載の方法。
【請求項56】
前記細菌が、グラム陰性細菌よりなる群から選ばれる、請求項53に記載の方法。
【請求項57】
前記細菌が、グラム陽性細菌よりなる群から選ばれる、請求項53に記載の方法。
【請求項58】
前記細菌が、条件的嫌気性である、請求項56に記載の方法。
【請求項59】
ホスト細胞が、腸内細菌科から選ばれる、請求項58に記載の方法。
【請求項60】
前記細菌が、エシェリキア属、赤痢菌、シトロバクター属、サルモネラ属、クレブシエラ属、エンテロバクター属、エルウィニア属、クルイベラ属、セラチア属、セデセア属、モルガネラ属、ハフニア属、エドワードシエラ属、プロビデンシア属、プロテウス属及びエルシニア属よりなる群から選ばれる、請求項59に記載の方法。
【請求項61】
前記細菌が、エルウィニア属及びクレブシエラ属よりなる群から選ばれる、請求項60に記載の方法。
【請求項62】
前記細菌が、クレブシエラ・オキシトカ株よりなる群から選ばれる、請求項61に記載の方法。
【請求項63】
前記ホスト細菌が、クレブシエラ・オキシトカP2株(ATCC 55307)である、請求項62に記載の方法。
【請求項64】
前記細菌が、バチルス属、ゲオバチルス属、クロストリジウム属、連鎖球菌及びセルロモナス属よりなる群から選ばれる、請求項57に記載の方法。
【請求項65】
請求項47又は48に記載の方法で作製される、請求項1〜39の何れか一項に記載の組み換えホスト細胞。
【請求項66】
決められた窒素源;
複合の窒素源;
ホスフェイト源;及び
マグネシウム源:
を含んでなる、サッカライドを分解するのに適している組み換えホスト細胞による生育及びエタノール産生を支援する最小培地。
【請求項67】
決められた窒素源が、尿素様化合物である、請求項66に記載の最小培地。
【請求項68】
決められた窒素源が、尿素である、請求項67に記載の最小培地。
【請求項69】
複合の窒素源が、コーンスティープリカー(CSL)、酵母自己消化物及び/又は抽出物、トウモロコシ加工副産物、大豆加工副産物、及び使用済みの発酵培養液よりなる群から選ばれる、請求項65、66又は67に記載の最小培地。
【請求項70】
尿素窒素の濃度が、約0.1mM〜約100mMである、請求項67に記載の最小培地。
【請求項71】
尿素窒素の濃度が、約2mM〜約20mMである、請求項70に記載の最小培地。
【請求項72】
尿素窒素の濃度が、約8mM〜約12mMである、請求項71に記載の最小培地。
【請求項73】
前記CSLの濃度が、約0.1g/L〜約100g/Lである、請求項69に記載の最小培地。
【請求項74】
前記CSLの濃度が、約1g/L〜約20g/Lである、請求項73に記載の最小培地。
【請求項75】
前記CSLの濃度が、約5g/L〜約10g/Lである、請求項74に記載の最小培地。
【請求項76】
総ホスフェイト濃度が、約1mM〜約100mMである、請求項66〜75の何れか1項に記載の最小培地。
【請求項77】
ホスフェイト濃度が、約10mM〜約12mMである、請求項76に記載の最小培地。
【請求項78】
マグネシウム濃度が、約0.1mM〜約5.0mMである、請求項66〜77の何れか一項に記載の最小培地。
【請求項79】
マグネシウム濃度が、約0.25mM〜約1.0mMである、請求項78に記載の最小培地。
【請求項80】
サッカライドを分解するのに適している組み換えホスト細胞による生育及びエタノール産生を支援するために最適化された、請求項66〜79の何れか一項に記載の最小培地。
【請求項81】
酸性のpHでの生育及びエタノール産生を支援するために最適化された、請求項80に記載の最小培地。
【請求項82】
請求項1〜45の何れか一項に記載の組み換えホスト細胞による生育及びエタノール産生を支援するために最適化された、請求項66〜81の何れか一項に記載の最小培地。
【請求項83】
クレブシエラ・オキシトカ株による生育及びエタノール産生を支援するために最適化された、請求項80に記載の最小培地。
【請求項84】
更にサッカライド源を含んでなる、請求項66〜83の何れか一項に記載の最小培地。
【請求項85】
サッカライド源が、リグノセルロースを含んでなる、請求項84に記載の最小培地。
【請求項86】
SEQ ID NO:3又は4に記載のヌクレオチド配列を含んでなる、単離された核酸分子。
【請求項87】
SEQ ID NO:6又は7に記載のアミノ酸配列を包含するポリペプチドをコードする、単離された核酸分子。
【請求項88】
SEQ ID NO:6又は7に記載のアミノ酸配列を包含するポリペプチドの天然型の対立遺伝子多型をコードする、単離された核酸分子。
【請求項89】
SEQ ID NO:6又は7に記載のアミノ酸配列を包含するポリペプチドのホモログをコードする、単離された核酸分子。
【請求項90】
(a)SEQ ID NO:3若しくは4、又はこれらの補体のヌクレオチド配列に対して少なくとも60%同一である、ヌクレオチド配列を含んでなる、核酸分子、
(b)SEQ ID NO:3若しくは4、又はこれらの補体のヌクレオチド配列を包含する核酸の少なくとも100個のヌクレオチド断片を含んでなる、核酸分子、
(c)SEQ ID NO:6又は7のアミノ酸配列に対して少なくとも50%同一のアミノ酸配列を含んでなる、ポリペプチドをコードする核酸分子、及び
(d)SEQ ID NO:6又は7のアミノ酸配列を包含するポリペプチドの断片(ここにおける断片は、SEQ ID NO:6又は7のアミノ酸配列の少なくとも15個の連続したアミノ酸残基を包含する)をコードする、核酸分子、
よりなる群から選ばれる、単離された核酸分子。
【請求項91】
厳しい条件下で、請求項86〜89の何れか一項に記載の核酸分子にハイブリダイズする、単離された核酸分子。
【請求項92】
請求項86〜91の何れか一項に記載の核酸分子のヌクレオチド配列に相補的である、ヌクレオチド配列を含んでなる、単離された核酸分子。
【請求項93】
請求項86〜92の何れか一項に記載の核酸分子及び非相同性ポリペプチドをコードするヌクレオチド配列を含んでなる、単離された核酸分子。
【請求項94】
SEQ ID NO:5又は8に記載のヌクレオチド配列を含んでなる、単離された核酸分子。
【請求項95】
(a)SEQ ID NO:6又は7のアミノ酸配列を包含するポリペプチドの断片(ここにおける断片は、SEQ ID NO:6又は7のアミノ酸の少なくとも15個の連続したアミノ酸残基を包含する)、
(b)SEQ ID NO:6又は7のアミノ酸配列を包含するポリペプチドの天然型の対立遺伝子多型(ここにおけるポリペプチドは、厳しい条件下でSEQ ID NO:3又は4を含む核酸分子にハイブリダイズする、核酸分子によってコードされる)、
(c)SEQ ID NO:3又は4のヌクレオチド配列を包含する核酸に対して少なくとも60%同一であるヌクレオチド配列を含んでなる、核酸分子によってコードされるポリペプチド、及び
(d)SEQ ID NO:6又は7のアミノ酸配列に対して少なくとも50%同一のアミノ酸配列を含んでなる、ポリペプチド、
よりなる群から選ばれる、単離されたポリペプチド。
【請求項96】
α−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼタンパク質のうちの少なくとも1つをコードする細菌遺伝子中に突然変異を包含するポリヌクレオチド配列を含んでなる、ベクター(ここにおける当該ベクターは、細菌性ホスト細胞に組み入れられた場合に前記タンパク質の発現を低減又は消去する)。
【請求項97】
ポリヌクレオチド配列が、SEQ ID NO:3又は4に記載のヌクレオチド配列、又はその機能的断片を包含する単離された核酸分子中に突然変異を含んでなる、請求項96に記載のベクター。
【請求項98】
突然変異が、欠失突然変異である、請求項97に記載のベクター。
【請求項99】
SEQ ID NO:5又は8に記載のポリヌクレオチド配列を含んでなる、請求項98に記載のベクター。
【請求項100】
SEQ ID NO:5又は8に対して少なくとも80%同一であるポリヌクレオチド配列中に突然変異を含んでなる、請求項99に記載のベクター。
【請求項101】
SEQ ID NO:5に記載のポリヌクレオチド配列を含んでなる、請求項96又は97に記載のベクター。
【請求項102】
pLOI3310又はpLOI3313と命名されている、請求項98又は99に記載のプラスミドベクター。
【請求項103】
請求項86〜89の何れか一項に記載の単離された核酸配列を含んでなる、ベクター。
【請求項104】
(a)選択条件下での当該ホスト細胞による最適な生育及びエタノール産生を支援する選択培地、
(b)サッカライド源、及び
(c)選択培地及び条件でのエタノール産生のために最適化された組み換えホスト細胞(この細胞は、
糖をエタノールに変換する酵素をコードする非相同性ポリヌクレオチド配列(ここにおける細胞は、当該ホスト細胞による主要発酵生成物としてのエタノールの産生を促進するのに十分な機能レベルで、当該非相同性ポリヌクレオチド配列を発現する)、及び
当該細胞の代謝経路において、前記条件下及び培地中で当該オリゴサッカライド源からエタノール以外の生成物を産生するタンパク質をコードする少なくとも1つのポリヌクレオチド配列中の突然変異(ここにおける突然変異は、当該タンパク質の発現を低減又は消去し、これにより当該ホスト細胞によるエタノール産生を、突然変異がない細胞によるエタノール産生に比べて増大させて、エタノール産生を最適化する)を包含する)、
を含んでなる、オリゴサッカライドを分解するのに適している組み換えホスト細胞によるオリゴサッカライド源からエタノールを産生するために最適化されているシステム。
【請求項105】
前記選択培地が、最小培地である、請求項104に記載のシステム。
【請求項106】
前記最小培地が、請求項66〜85の何れか一項に記載の培地である、請求項105に記載のシステム。
【請求項107】
前記組み換えホスト細胞が、請求項1〜44の何れか一項に記載の細胞である、請求項105に記載のシステム。
【請求項108】
サッカライド源が、リグノセルロースを含んでなる、請求項104に記載のシステム。
【請求項109】
選択培地が請求項66に記載の最小培地であり、そして組み換えホスト細胞が、ブタンジオール経路のタンパク質をコードする遺伝子における欠失突然変異を包含する、クレブシエラ・オキシトカ株である、請求項108に記載のシステム。
【請求項110】
培地のpHが、酸性の範囲である、請求項108又は109に記載のシステム。
【請求項111】
請求項45〜64及び104〜110の何れか一項に記載の方法又はシステムに従って、組み換えホスト細胞を使用するための説明書と共に包装されている、請求項1〜45の何れか一項に記載の組み換えホスト細胞を含んでなる、キット。
【請求項1】
(a)糖をエタノールに変換する酵素をコードする非相同性ポリヌクレオチド配列(ここにおいて、当該ホスト細胞は、当該細胞による主要発酵生成物としてのエタノールの産生を促進するのに十分な機能レベルで、当該非相同性ポリヌクレオチド配列を発現する)、及び
(b)当該細胞の代謝経路において、糖からエタノール以外の生成物を産生するタンパク質をコードする少なくとも1つのポリヌクレオチド配列中の突然変異(ここにおける突然変異は、突然変異がない細胞によるエタノール産生に比べて、当該細胞による増大したエタノール産生をもたらす)、
を含んでなる、サッカライドを分解するのに適している組み換えホスト細胞。
【請求項2】
前記突然変異のポリヌクレオチド配列が、非相同性ヌクレオチド配列を含んでなる、請求項1に記載の組み換えホスト細胞。
【請求項3】
前記突然変異が、欠失、挿入又は塩基置換の突然変異である、請求項1に記載の組み換えホスト細胞。
【請求項4】
前記細胞が、線虫、昆虫、は虫類、鳥、両生動物、及び哺乳動物よりなる群から選ばれる高等真核生物のものである、請求項1に記載の組み換えホスト細胞。
【請求項5】
前記細胞が、単細胞又は多細胞微生物のものである、請求項1に記載の組み換えホスト細胞。
【請求項6】
前記微生物が、細菌である、請求項5に記載の組み換えホスト細胞。
【請求項7】
前記微生物が、真菌又は酵母である、請求項5に記載の組み換えホスト細胞。
【請求項8】
前記酵母が、サッカロミセス属(Saccharomyces)、シゾサッカロミセス属(Schizosaccharomyces)、ハンゼヌラ属(Hansenula)、パチオソレン属(Pachyosolen)、クルベロミセス属(Kluyveromyces)、デバリオミセス属(Debaryomyces)、ヤロウイア属(Yarrowia)及びピキア属(Pichia)よりなる群から選ばれる、請求項7に記載の組み換えホスト細胞。
【請求項9】
前記細菌が、グラム陰性細菌よりなる群から選ばれる、請求項6に記載の組み換えホスト細胞。
【請求項10】
前記細菌が、グラム陽性細菌よりなる群から選ばれる、請求項6に記載の組み換えホスト細胞。
【請求項11】
前記細菌が、条件的嫌気性である、請求項9に記載の組み換えホスト細胞。
【請求項12】
ホスト細胞が、腸内細菌科(family Enterobacteriaceae)から選ばれる、請求項11に記載の組み換えホスト細胞。
【請求項13】
前記細菌が、エシェリキア属(Escherichia)、赤痢菌(Shigella)、シトロバクター属(Citrobacter)、サルモネラ属(Salmonella)、クレブシエラ属(Klebsiella)、エンテロバクター属(Enterobacter)、エルウィニア属(Erwinia)、クルイベラ属(Kluyvera)、セラチア属(Serratia)、セデセア属(Cedecea)、モルガネラ属(Morganella)、ハフニア属(Hafnia)、エドワードシエラ属(Edwardsiella)、プロビデンシア属(Providencia)、プロテウス属(Proteus)及びエルシニア属(Yersinia)よりなる群から選ばれる、請求項12に記載の組み換えホスト細胞。
【請求項14】
前記細菌が、エルウィニア属及びクレブシエラ属よりなる群から選ばれる、請求項13に記載の組み換えホスト細胞。
【請求項15】
前記細菌が、クレブシエラ・オキシトカ(Klebsiella oxytoca)株よりなる群から選ばれる、請求項14に記載の組み換えホスト細胞。
【請求項16】
前記ホスト細菌が、クレブシエラ・オキシトカP2株(ATCC55307)である、請求項15に記載の組み換え細菌性ホスト細胞。
【請求項17】
前記細菌が、バチルス属(Bacillus)、ゲオバチルス属(Geobacillus)、クロストリジウム属(Clostridium)、連鎖球菌(Streptococcus)及びセルロモナス属(Cellulomonas)よりなる群から選ばれる、請求項10に記載の組み換えホスト細胞。
【請求項18】
前記非相同性ポリヌクレオチド配列が、アルコールデヒドロゲナーゼ及び/又はピルビン酸デカルボキシラーゼをコードする、前記請求項の何れか一項に記載の組み換えホスト細胞。
【請求項19】
前記アルコールデヒドロゲナーゼ及びピルビン酸デカルボキシラーゼが、ザイモモナス属(Zymomonas)由来である、請求項18に記載の組み換えホスト細胞。
【請求項20】
前記ザイモモナス属が、ザイモモナス・モビリス(Zymomonas mobilis)である、請求項19に記載の組み換えホスト細胞。
【請求項21】
(a)アルコールデヒドロゲナーゼ及びピルビン酸デカルボキシラーゼを、コードする非相同性ポリヌクレオチド配列(ここにおいて、当該細菌は、当該細菌による主要発酵生成物としてのエタノールの産生を促進するのに十分な機能レベルで、当該非相同性ポリヌクレオチド配列を発現する)、及び
(b)当該細胞の代謝経路において、糖からエタノール以外の生成物を産生するタンパク質をコードする少なくとも1つのポリヌクレオチド配列中の突然変異(ここにおける突然変異は、当該タンパク質の発現を減少又は消去し、これにより突然変異がない組み換え細菌性ホスト細胞によるエタノール産生に比べて、前記組み換え細菌性ホスト細胞によるエタノール産生を増大させる)、
を含んでなる、サッカライドを分解するのに適している組み換え細菌性ホスト細胞。
【請求項22】
前記突然変異のポリヌクレオチド配列が、非相同性ヌクレオチド配列を含んでなる、請求項21に記載の組み換え細菌性ホスト細胞。
【請求項23】
前記突然変異が、欠失、挿入又は塩基置換の突然変異である、請求項21に記載の組み換え細菌性ホスト細胞。
【請求項24】
前記突然変異が、欠失突然変異である、請求項21に記載の組み換え細菌性ホスト細胞。
【請求項25】
前記細菌が、グラム陰性細菌よりなる群から選ばれる、請求項21に記載の組み換え細菌性ホスト細胞。
【請求項26】
前記細菌が、グラム陽性細菌よりなる群から選ばれる、請求項21に記載の組み換え細菌性ホスト細胞。
【請求項27】
前記細菌が、条件的嫌気性である、請求項25に記載の組み換え細菌性ホスト細胞。
【請求項28】
ホスト細胞が、腸内細菌科から選ばれる、請求項27に記載の組み換え細菌性ホスト細胞。
【請求項29】
前記細菌が、エシェリキア属、赤痢菌、シトロバクター属、サルモネラ属、クレブシエラ属、エンテロバクター属、エルウィニア属、クルイベラ属、セラチア属、セデセア属、モルガネラ属、ハフニア属、エドワードシエラ属、プロビデンシア属、プロテウス属及びエルシニア属よりなる群から選ばれる、請求項28に記載の組み換え細菌性ホスト細胞。
【請求項30】
前記細菌が、エルウィニア属及びクレブシエラ属よりなる群から選ばれる、請求項29に記載の組み換え細菌性ホスト細胞。
【請求項31】
前記細菌が、クレブシエラ・オキシトカ株よりなる群から選ばれる、請求項30に記載の組み換え細菌性ホスト細胞。
【請求項32】
前記ホスト細菌が、クレブシエラ・オキシトカP2株(ATCC55307)である、請求項31に記載の組み換え細菌性ホスト細胞。
【請求項33】
前記細菌が、バチルス属、ゲオバチルス属、クロストリジウム属、連鎖球菌及びセルロモナス属よりなる群から選ばれる、請求項26に記載の組み換え細菌性ホスト細胞。
【請求項34】
前記エタノール以外の生成物が、ホルメート、ラクテート、スクシネート、アセテート、アセトイン、ブタンジオール、2,3−ブタンジオール、キシリトール、ブチレート、ピルベート、プロピオネート、イソプロピルアルコール、1−プロパノール、2−プロパノール、プロパンジオール、シトレート、グルタメート及びアセトンよりなる群から選ばれる、請求項1〜33の何れか一項に記載の組み換えホスト細胞。
【請求項35】
前記ポリヌクレオチド配列が、budA、budB、budR及びbudC、並びにそれらのホモログ、オーソログ及び機能的断片よりなる群から選ばれる遺伝子由来のヌクレオチド配列を含んでなる、請求項21に記載の組み換えホスト細胞。
【請求項36】
当該突然変異が、当該細胞中でのブタンジオールを産生する代謝経路に関わる酵素をコードする少なくとも1つのポリヌクレオチド配列中にある、請求項35に記載の組み換え細菌性ホスト細胞。
【請求項37】
当該突然変異が、budA及びbudBの遺伝子のうちの片方又は両方の中にある、請求項31に記載の組み換え細菌性ホスト細胞。
【請求項38】
前記突然変異が、当該細胞中でのα−アセトラクテート・デカルボキシラーゼ又はα−アセトラクテート・シンターゼの発現を低減又は消去する、請求項37に記載の組み換え細菌性ホスト細胞。
【請求項39】
前記突然変異が、当該細胞中でのα−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼの発現を低減又は消去する、請求項37に記載の組み換え細菌性ホスト細胞。
【請求項40】
当該非相同性ポリヌクレオチド配列が、アルコールデヒドロゲナーゼ及び/又はピルビン酸デカルボキシラーゼをコードする、請求項35〜39の何れか一項に記載の組み換え細菌性ホスト細胞。
【請求項41】
前記アルコールデヒドロゲナーゼ及びピルビン酸デカルボキシラーゼが、ザイモモナス属由来である、請求項40に記載の組み換え細菌性ホスト細胞。
【請求項42】
前記ザイモモナス属が、ザイモモナス・モビリスである、請求項41に記載の組み換え細菌性ホスト細胞。
【請求項43】
BW15(NRRLB−30857)、BW19(NRRLB−30858)及びBW21(NRRLB−30859)よりなる群から選ばれるクレブシエラ・オキシトカ株で示される、組み換え細菌性ホスト細胞。
【請求項44】
(a)アルコールデヒドロゲナーゼ及びピルビン酸デカルボキシラーゼをコードする非相同性ポリヌクレオチド配列(ここにおいて、当該ホスト細胞は、当該細胞による主要発酵生成物としてのエタノールの産生を促進するのに十分な機能レベルで、当該非相同性ポリヌクレオチド配列を発現する)、及び
(b)当該代謝経路において、当該細胞でブタンジオールを産生するタンパク質をコードする少なくとも1つのポリヌクレオチド配列中の欠失突然変異(ここにおける突然変異は、当該タンパク質の発現を低減又は消去し、これにより突然変異がない細胞によるエタノール産生に比べて、当該細胞によるエタノール産生を増大させる)
を含んでなる、細菌性ホスト細胞がクレブシエラ・オキシトカである、組み換え細菌性ホスト細胞。
【請求項45】
サッカライド源を前記請求項の何れか一項に記載の組み換えホスト細胞と接触させ、これによりサッカライド源からエタノールを産生することを含んでなる、サッカライド源からエタノールを産生する方法。
【請求項46】
前記組み換えホスト細胞を得ることを更に含んでなる、請求項45に記載の方法。
【請求項47】
(a)エタノール産生の親ホスト細胞に、当該親細胞によってエタノールを産生するのに適した条件下で、選択培地及びサッカライド源を接触させること、
(b)前記条件下及び培地中で、サッカライド源から産生されるエタノールのレベルを測定すること、
(c)前記条件下及び培地中で増大した発現を有する望ましくない副生成物を同定するために、前記サッカライド源から産生されるエタノール以外の少なくとも1つの生成物のレベルを測定すること、そして
(d)代謝経路において、前記の望ましくない副生成物を産生する遺伝子産物をコードする遺伝子のポリヌクレオチド配列を突然変異させ(ここにおける突然変異は、代謝経路中の少なくとも1つの遺伝子産物の発現を低減又は消去して、突然変異なしの親細胞によるエタノール産生に比べて、当該細胞によるエタノール産生を増大させる)、これによりサッカライド源からのエタノール産生を最適化した組み換えホスト細胞を作製すること、
を含んでなる、サッカライド源からのエタノール産生を最適化した組み換えホスト細胞を作製する方法。
【請求項48】
遺伝子中に突然変異を包含する単離されたポリヌクレオチド断片を作製し、そしてこの突然変異したポリヌクレオチド断片を親細胞中に導入することを、更に含んでなる、請求項47に記載の方法。
【請求項49】
前記突然変異が、欠失、挿入又は塩基置換の突然変異を含んでなる、請求項47又は48に記載の方法。
【請求項50】
前記細胞が、最小培地でのエタノール産生に最適化されている、請求項49に記載の方法。
【請求項51】
前記細胞が、線虫、昆虫、は虫類、鳥、両生動物、及び哺乳動物よりなる群から選ばれる高等真核生物のものである、請求項47又は48に記載の方法。
【請求項52】
細胞が、単細胞又は多細胞微生物のものである、請求項47又は48に記載の方法。
【請求項53】
前記微生物が、細菌である、請求項52に記載の方法。
【請求項54】
前記微生物が、真菌又は酵母である、請求項52に記載の方法。
【請求項55】
前記酵母が、サッカロミセス属、シゾサッカロミセス属、ハンゼヌラ属、パチオソレン属、クルベロミセス属、デバリオミセス属、ヤロウイア属及びピキア属よりなる群から選ばれる、請求項54に記載の方法。
【請求項56】
前記細菌が、グラム陰性細菌よりなる群から選ばれる、請求項53に記載の方法。
【請求項57】
前記細菌が、グラム陽性細菌よりなる群から選ばれる、請求項53に記載の方法。
【請求項58】
前記細菌が、条件的嫌気性である、請求項56に記載の方法。
【請求項59】
ホスト細胞が、腸内細菌科から選ばれる、請求項58に記載の方法。
【請求項60】
前記細菌が、エシェリキア属、赤痢菌、シトロバクター属、サルモネラ属、クレブシエラ属、エンテロバクター属、エルウィニア属、クルイベラ属、セラチア属、セデセア属、モルガネラ属、ハフニア属、エドワードシエラ属、プロビデンシア属、プロテウス属及びエルシニア属よりなる群から選ばれる、請求項59に記載の方法。
【請求項61】
前記細菌が、エルウィニア属及びクレブシエラ属よりなる群から選ばれる、請求項60に記載の方法。
【請求項62】
前記細菌が、クレブシエラ・オキシトカ株よりなる群から選ばれる、請求項61に記載の方法。
【請求項63】
前記ホスト細菌が、クレブシエラ・オキシトカP2株(ATCC 55307)である、請求項62に記載の方法。
【請求項64】
前記細菌が、バチルス属、ゲオバチルス属、クロストリジウム属、連鎖球菌及びセルロモナス属よりなる群から選ばれる、請求項57に記載の方法。
【請求項65】
請求項47又は48に記載の方法で作製される、請求項1〜39の何れか一項に記載の組み換えホスト細胞。
【請求項66】
決められた窒素源;
複合の窒素源;
ホスフェイト源;及び
マグネシウム源:
を含んでなる、サッカライドを分解するのに適している組み換えホスト細胞による生育及びエタノール産生を支援する最小培地。
【請求項67】
決められた窒素源が、尿素様化合物である、請求項66に記載の最小培地。
【請求項68】
決められた窒素源が、尿素である、請求項67に記載の最小培地。
【請求項69】
複合の窒素源が、コーンスティープリカー(CSL)、酵母自己消化物及び/又は抽出物、トウモロコシ加工副産物、大豆加工副産物、及び使用済みの発酵培養液よりなる群から選ばれる、請求項65、66又は67に記載の最小培地。
【請求項70】
尿素窒素の濃度が、約0.1mM〜約100mMである、請求項67に記載の最小培地。
【請求項71】
尿素窒素の濃度が、約2mM〜約20mMである、請求項70に記載の最小培地。
【請求項72】
尿素窒素の濃度が、約8mM〜約12mMである、請求項71に記載の最小培地。
【請求項73】
前記CSLの濃度が、約0.1g/L〜約100g/Lである、請求項69に記載の最小培地。
【請求項74】
前記CSLの濃度が、約1g/L〜約20g/Lである、請求項73に記載の最小培地。
【請求項75】
前記CSLの濃度が、約5g/L〜約10g/Lである、請求項74に記載の最小培地。
【請求項76】
総ホスフェイト濃度が、約1mM〜約100mMである、請求項66〜75の何れか1項に記載の最小培地。
【請求項77】
ホスフェイト濃度が、約10mM〜約12mMである、請求項76に記載の最小培地。
【請求項78】
マグネシウム濃度が、約0.1mM〜約5.0mMである、請求項66〜77の何れか一項に記載の最小培地。
【請求項79】
マグネシウム濃度が、約0.25mM〜約1.0mMである、請求項78に記載の最小培地。
【請求項80】
サッカライドを分解するのに適している組み換えホスト細胞による生育及びエタノール産生を支援するために最適化された、請求項66〜79の何れか一項に記載の最小培地。
【請求項81】
酸性のpHでの生育及びエタノール産生を支援するために最適化された、請求項80に記載の最小培地。
【請求項82】
請求項1〜45の何れか一項に記載の組み換えホスト細胞による生育及びエタノール産生を支援するために最適化された、請求項66〜81の何れか一項に記載の最小培地。
【請求項83】
クレブシエラ・オキシトカ株による生育及びエタノール産生を支援するために最適化された、請求項80に記載の最小培地。
【請求項84】
更にサッカライド源を含んでなる、請求項66〜83の何れか一項に記載の最小培地。
【請求項85】
サッカライド源が、リグノセルロースを含んでなる、請求項84に記載の最小培地。
【請求項86】
SEQ ID NO:3又は4に記載のヌクレオチド配列を含んでなる、単離された核酸分子。
【請求項87】
SEQ ID NO:6又は7に記載のアミノ酸配列を包含するポリペプチドをコードする、単離された核酸分子。
【請求項88】
SEQ ID NO:6又は7に記載のアミノ酸配列を包含するポリペプチドの天然型の対立遺伝子多型をコードする、単離された核酸分子。
【請求項89】
SEQ ID NO:6又は7に記載のアミノ酸配列を包含するポリペプチドのホモログをコードする、単離された核酸分子。
【請求項90】
(a)SEQ ID NO:3若しくは4、又はこれらの補体のヌクレオチド配列に対して少なくとも60%同一である、ヌクレオチド配列を含んでなる、核酸分子、
(b)SEQ ID NO:3若しくは4、又はこれらの補体のヌクレオチド配列を包含する核酸の少なくとも100個のヌクレオチド断片を含んでなる、核酸分子、
(c)SEQ ID NO:6又は7のアミノ酸配列に対して少なくとも50%同一のアミノ酸配列を含んでなる、ポリペプチドをコードする核酸分子、及び
(d)SEQ ID NO:6又は7のアミノ酸配列を包含するポリペプチドの断片(ここにおける断片は、SEQ ID NO:6又は7のアミノ酸配列の少なくとも15個の連続したアミノ酸残基を包含する)をコードする、核酸分子、
よりなる群から選ばれる、単離された核酸分子。
【請求項91】
厳しい条件下で、請求項86〜89の何れか一項に記載の核酸分子にハイブリダイズする、単離された核酸分子。
【請求項92】
請求項86〜91の何れか一項に記載の核酸分子のヌクレオチド配列に相補的である、ヌクレオチド配列を含んでなる、単離された核酸分子。
【請求項93】
請求項86〜92の何れか一項に記載の核酸分子及び非相同性ポリペプチドをコードするヌクレオチド配列を含んでなる、単離された核酸分子。
【請求項94】
SEQ ID NO:5又は8に記載のヌクレオチド配列を含んでなる、単離された核酸分子。
【請求項95】
(a)SEQ ID NO:6又は7のアミノ酸配列を包含するポリペプチドの断片(ここにおける断片は、SEQ ID NO:6又は7のアミノ酸の少なくとも15個の連続したアミノ酸残基を包含する)、
(b)SEQ ID NO:6又は7のアミノ酸配列を包含するポリペプチドの天然型の対立遺伝子多型(ここにおけるポリペプチドは、厳しい条件下でSEQ ID NO:3又は4を含む核酸分子にハイブリダイズする、核酸分子によってコードされる)、
(c)SEQ ID NO:3又は4のヌクレオチド配列を包含する核酸に対して少なくとも60%同一であるヌクレオチド配列を含んでなる、核酸分子によってコードされるポリペプチド、及び
(d)SEQ ID NO:6又は7のアミノ酸配列に対して少なくとも50%同一のアミノ酸配列を含んでなる、ポリペプチド、
よりなる群から選ばれる、単離されたポリペプチド。
【請求項96】
α−アセトラクテート・デカルボキシラーゼ及びα−アセトラクテート・シンターゼタンパク質のうちの少なくとも1つをコードする細菌遺伝子中に突然変異を包含するポリヌクレオチド配列を含んでなる、ベクター(ここにおける当該ベクターは、細菌性ホスト細胞に組み入れられた場合に前記タンパク質の発現を低減又は消去する)。
【請求項97】
ポリヌクレオチド配列が、SEQ ID NO:3又は4に記載のヌクレオチド配列、又はその機能的断片を包含する単離された核酸分子中に突然変異を含んでなる、請求項96に記載のベクター。
【請求項98】
突然変異が、欠失突然変異である、請求項97に記載のベクター。
【請求項99】
SEQ ID NO:5又は8に記載のポリヌクレオチド配列を含んでなる、請求項98に記載のベクター。
【請求項100】
SEQ ID NO:5又は8に対して少なくとも80%同一であるポリヌクレオチド配列中に突然変異を含んでなる、請求項99に記載のベクター。
【請求項101】
SEQ ID NO:5に記載のポリヌクレオチド配列を含んでなる、請求項96又は97に記載のベクター。
【請求項102】
pLOI3310又はpLOI3313と命名されている、請求項98又は99に記載のプラスミドベクター。
【請求項103】
請求項86〜89の何れか一項に記載の単離された核酸配列を含んでなる、ベクター。
【請求項104】
(a)選択条件下での当該ホスト細胞による最適な生育及びエタノール産生を支援する選択培地、
(b)サッカライド源、及び
(c)選択培地及び条件でのエタノール産生のために最適化された組み換えホスト細胞(この細胞は、
糖をエタノールに変換する酵素をコードする非相同性ポリヌクレオチド配列(ここにおける細胞は、当該ホスト細胞による主要発酵生成物としてのエタノールの産生を促進するのに十分な機能レベルで、当該非相同性ポリヌクレオチド配列を発現する)、及び
当該細胞の代謝経路において、前記条件下及び培地中で当該オリゴサッカライド源からエタノール以外の生成物を産生するタンパク質をコードする少なくとも1つのポリヌクレオチド配列中の突然変異(ここにおける突然変異は、当該タンパク質の発現を低減又は消去し、これにより当該ホスト細胞によるエタノール産生を、突然変異がない細胞によるエタノール産生に比べて増大させて、エタノール産生を最適化する)を包含する)、
を含んでなる、オリゴサッカライドを分解するのに適している組み換えホスト細胞によるオリゴサッカライド源からエタノールを産生するために最適化されているシステム。
【請求項105】
前記選択培地が、最小培地である、請求項104に記載のシステム。
【請求項106】
前記最小培地が、請求項66〜85の何れか一項に記載の培地である、請求項105に記載のシステム。
【請求項107】
前記組み換えホスト細胞が、請求項1〜44の何れか一項に記載の細胞である、請求項105に記載のシステム。
【請求項108】
サッカライド源が、リグノセルロースを含んでなる、請求項104に記載のシステム。
【請求項109】
選択培地が請求項66に記載の最小培地であり、そして組み換えホスト細胞が、ブタンジオール経路のタンパク質をコードする遺伝子における欠失突然変異を包含する、クレブシエラ・オキシトカ株である、請求項108に記載のシステム。
【請求項110】
培地のpHが、酸性の範囲である、請求項108又は109に記載のシステム。
【請求項111】
請求項45〜64及び104〜110の何れか一項に記載の方法又はシステムに従って、組み換えホスト細胞を使用するための説明書と共に包装されている、請求項1〜45の何れか一項に記載の組み換えホスト細胞を含んでなる、キット。
【図1A】


【図1B】


【図2−1】


【図2−2】


【図3】


【図4】


【図5】




【図1B】


【図2−1】


【図2−2】


【図3】


【図4】


【図5】


【公開番号】特開2012−196219(P2012−196219A)
【公開日】平成24年10月18日(2012.10.18)
【国際特許分類】
【出願番号】特願2012−116679(P2012−116679)
【出願日】平成24年5月22日(2012.5.22)
【分割の表示】特願2008−520306(P2008−520306)の分割
【原出願日】平成18年6月30日(2006.6.30)
【出願人】(508004579)ザ ユニバーシティー オブ フロリダ リサーチ ファンデーション インク (3)
【Fターム(参考)】
【公開日】平成24年10月18日(2012.10.18)
【国際特許分類】
【出願日】平成24年5月22日(2012.5.22)
【分割の表示】特願2008−520306(P2008−520306)の分割
【原出願日】平成18年6月30日(2006.6.30)
【出願人】(508004579)ザ ユニバーシティー オブ フロリダ リサーチ ファンデーション インク (3)
【Fターム(参考)】
[ Back to top ]

