エネルギー移動を用いた蛍光物質による核酸検出法
【課題】 本発明は核酸配列に対する特異性を有し、固相上に限らず溶液中においても標的核酸配列存在下において、二本鎖を形成した場合のみ蛍光発光が増強される化合物(プローブ、プライマー))を提供するものである。
【解決手段】 蛍光物質及びエネルギー吸収能を有する官能基を含む化合物であって、標的核酸配列の増幅検出、標的核酸配列の変異の種類を識別するものであり、式(I)または(II)で表される構造を少なくとも一つ含むことを特徴とする化合物。
【解決手段】 蛍光物質及びエネルギー吸収能を有する官能基を含む化合物であって、標的核酸配列の増幅検出、標的核酸配列の変異の種類を識別するものであり、式(I)または(II)で表される構造を少なくとも一つ含むことを特徴とする化合物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は蛍光物質とエネルギー吸収能を有する官能基を含有する核酸検出化合物(プローブ)であり、また、核酸増幅のためのプライマー、増幅産物の検出、標的核酸の変異の種類の識別に用いることが可能である。更に詳細には蛍光物質とエネルギー吸収能を有する官能基を含有するプライマーは一本鎖の状態では蛍光発光がエネルギー吸収能を有する官能基により消光されるが、標的核酸存在下、あるいは核酸増幅のプライマーとして作用したときに二本鎖核酸となり蛍光物質とエネルギー吸収能を有する官能基とが離れることで蛍光発光が増強されることで、核酸増幅を検出、標的核酸の変異の種類の識別するものである。
【背景技術】
【0002】
遺伝子診断等において標的となる核酸を検出する際には蛍光物質を用いる手法が普及している。具体的には一本鎖あるいは二本鎖構造の核酸にインターカレートする蛍光物質や、二本鎖核酸と特異的に会合し、その上で蛍光発光を増強する修飾ペプチドなどが知られている(特許文献1)。
【0003】
しかしながら、これらの手法は核酸そのものに特異性はあるものの、配列に対する特異性は無く核酸の有無を検出するに留まってしまう。
【0004】
また、蛍光物質で標識された核酸を増幅した標的配列とハイブリダイズさせることで検出する方法があるが、二本鎖形成反応後にハイブリダイズしていないものを洗浄するなどして取り除くために標的配列が固層上になくてはならない等の制約がある。他にも核酸配列中に蛍光色素と消光物質を組み込む方式では天然と大きく異なる構造を挿入するために核酸複製酵素を阻害してしまい、例えばPCRプライマーのように用いることは出来ない(非特許文献1、2)。
【0005】
これらとは別にチアゾールオレンジ並びにチアゾールオレンジ誘導体を用いて蛍光発光と消光を制御するプライマーも報告されており有用なものである(特許文献2、非特許文献3)。しかし、反応の原理的な観点から蛍光色素の選定には制約がある。後述するARMS法の基本原理については特許文献3に開示されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2005−289810号公報
【特許文献2】特開2009−171935号公報
【特許文献3】特許285386号公報
【非特許文献】
【0007】
【非特許文献1】Shinozuka, K., Seto, Y., Sawai, H. (1994) J. CHEM. SOC., CHEM.COMMUN. 1377-1378.
【非特許文献2】Yamane, A. (2002) Nucleic Acids Reserch, 30, e97.
【非特許文献3】Shuji, I., Takeshi, K., Mizue, Y., Akimitsu, O. (2010) Angew. Chem.Int. Ed. 48, 6480-6484.
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は核酸配列に対する特異性を有し、固相上に限らず溶液中においても標的核酸配列存在下において、二本鎖形成した場合のみ蛍光発光が増強される化合物(プローブ)を提供するものである。また、本発明によって得られるプローブは核酸増幅の際にはプライマーとして用いることが可能であり、プライマーとして作用したプローブのみ蛍光発光が増強されるものである。更に蛍光物質の選択は自由なものとし、輝度で表される蛍光強度も高いプローブを提供するものである。
【課題を解決するための手段】
【0009】
(1) 蛍光物質及びエネルギー吸収能を有する官能基を含む化合物であって、標的核酸配列が増幅したことを検出、標的核酸配列の変異の種類を識別、するものであり、下記式(I)または(II)で表される構造を少なくとも一つ含むことを特徴とする化合物。
【化1】

式(I)
【化2】

式(II)
式(I)及び(II)中、Fは蛍光物質であり、Iはエネルギー吸収能を有する官能基であり、式(II)においてI同士は同一でも異なっていてもよく、Xはリンカーであり主鎖の長さ及び構造は任意であり、主鎖中にはC、O、N、S、P及びSiを含んでも含まなくてもよく、主鎖中に単結合、二重結合、三重結合、アミド結合、エステル結合、ジスルフィド結合、エーテル結合、チオアミド結合、チオエーテル結合、チオエステル結合及びイミノ基を含んでも含まなくてもよく、Bは核酸塩基骨格(アデニン、グアニン、シトシン、チミンまたはウラシル)または修飾及び人工核酸塩基であり、Rはデオキシリボース骨格、リボース骨格及びそれらの誘導体であり、Pはリン酸ジエステル骨格及びチオリン酸ジエステル骨格、あるいはそれらの誘導体であり、式(I)及び(II)中のX、B、R、Pはそれぞれ同一でも異なっていてもよく、l、m、nは1〜3の整数を表し、mとnの数は同一でも異なっていてもよい核酸類縁体である。
【0010】
前記エネルギー吸収能を有する官能基Iは一般式(III)−(a)〜(l)のいずれかからなることを特徴とする(1)に記載の化合物。
【化3】

式(III)
【0011】
(3) 前記蛍光物質は前記式(I)及び(II)におけるXと結合するための結合部を有していることを特徴とする(1)または(2)に記載の化合物。
【0012】
(4)前記化合物は、核酸増幅用プライマーとして用いることもでき、かつ、標的核酸配列が増幅したことを検出、特定の標的核酸配列を識別、するプローブとして用いることもできることを特徴とする(1)から(3)のいずれかに記載の化合物。
【0013】
(5)(1)から(3)のいずれか一項に記載の化合物をプライマーとして使用するときにおいて、全長が15〜25残基であることを特徴とするプライマー。
【0014】
(6)前記標的核酸配列を増幅し、増幅した核酸を検出する際に使用するプライマーセットにおいて、プライマーセットを構成するプライマーの少なくとも一つのプライマーは(1)から(5)のいずれかの化合物であることを特徴とするプライマーセット。
【0015】
(7)標的核酸配列の増幅は、
(a)標的塩基配列を含む塩基配列からなる標的核酸を有する核酸試料に、前記標的塩基配列に相補的な少なくとも1種の、(1)から(6)いずれか一項に記載の化合物がプライマーとしてアニールする工程と、
(b)前記核酸試料中の標的塩基配列を鋳型として用い、前記標的核酸にアニールさせた前記プライマーから伸長産物を合成し、前記標的核酸を増幅する工程と、
(c)前記伸長産物を検出する工程
からなることを特徴とする標的核酸の検出方法。
【0016】
(8)前記工程(c)は前記工程(b)と同時に行われる工程であって、前記プライマーからの伸長産物である標的核酸が二本鎖核酸構造を形成しており、当該二本鎖核酸構造によって前記プライマーがプローブとして作用し、前記標的核酸を検出することを特徴とする(7)に記載の標的核酸の検出方法。
【0017】
(9)前記工程(c)は前記工程(b)の後に行われる工程であって、前記プライマーからの伸長産物である標的核酸が二本鎖核酸構造を形成しており、当該二本鎖核酸構造によって前記プライマーがプローブとして作用し、融解曲線を利用して前記標的核酸を検出することを特徴とする(7)に記載の標的核酸の検出方法。
【0018】
(10)(1)から(3)のいずれか一項に記載の化合物をプローブとして用い、複数の異なる塩基配列を有する核酸の中から特定の標的核酸を選択することを特長とする、核酸の識別方法。
【0019】
(11)(1)から(3)いずれか一項に記載の化合物をプライマーとして用いるときに、ARMS法と併用し、プライマーの蛍光発光−消光を検出することで、鋳型とした標的核酸配列の変異の種類を識別することを特徴とする(10)に記載の標的核酸配列の変異の種類の識別方法。
【発明の効果】
【0020】
本発明は上記課題を解決するために蛍光物質とエネルギー吸収能を有する官能基を含有する核酸検出プローブを合成し用いることとした。本発明は一本鎖の状態で蛍光発光がエネルギー吸収能を有する官能基により消光されるが、標的核酸存在下では二本鎖核酸となり蛍光物質とエネルギー吸収能を有する官能基とが離れるために蛍光発光が増強される仕組みを有するものである。これにより溶液中であっても目的の核酸配列の有無を蛍光強度の増強でしらせ、それ以外の場合では発光が抑制されるため、固相上での洗浄操作などを必要としない。
【0021】
また、本発明のプローブは蛍光物質等の修飾位置が塩基部分とすることで酵素反応を阻害しないよう考慮してあるため核酸増幅のプライマーとして用いることが可能である。更に本発明においては、蛍光発光−消光に複数の原理を採用することで輝度により表される蛍光強度も高いプローブを使用できる。
【0022】
本発明により配列特異的に認識して蛍光強度が増強されることにより標的となる核酸を簡便に検出することが可能となる。また、本発明は核酸増幅法のプライマーとして用いることが可能であり、目的配列の増幅反応の進行をリアルタイムに検知することが容易なものとなる。
【図面の簡単な説明】
【0023】
【図1】本発明の原理を模式的に示す図である。
【図2】本願発明のうち、プライマーとして機能する概要を示す図である。
【図3】本願発明のうち、プローブとして機能する概要を示す図である。
【図4】核酸ODN2合成の概要を示す図である。
【図5】核酸ODN2の化合物と本願発明の対応例を示す図である。
【図6】核酸ODN4合成の概要を示す図である。
【図7】実験1の測定結果(融解曲線)を示す図である。
【図8】実験1の融解曲線の負の一次微分曲線を示す図である。
【図9】実験2の測定結果(融解曲線)を示す図である
【図10】実験2の融解曲線の負の一次微分曲線を示す図である。
【発明を実施するための形態】
【0024】
本発明において、「標的塩基配列を識別する」とは、識別の対象となる試料核酸が、標的塩基配列を有する核酸であるか否かを識別することを意味する。なお、標的塩基配列は、塩基変異部位を含有し、かつ、ハイブリダイゼーション法により検出が可能な程度に塩基配列が明らかになっているものであれば、特に限定されるものではない。
【0025】
本発明において、核酸とは、DNA又はRNAであれば特に限定されるものではなく、天然のものであってもよく、合成されたものであってもよい。天然の核酸として、例えば、生物から回収されたゲノムDNA、mRNA、tRNA、rRNA、hnRNA等がある。また、合成された核酸として、β−シアノエチルホスフォロアミダイト法DNA固相合成法等の公知の化学的合成法により合成されたDNAや、PCR等の公知の核酸増幅法により合成された核酸、逆転写反応により合成されたcDNA等がある。
【0026】
本発明において、核酸類縁体とは、非天然の核酸であり、天然の核酸であるDNAやRNAと同様の機能を有するものをいう。すなわち、核酸類縁体は、DNA等と同様にリン酸ジエステル結合により鎖を形成することができ、かつ、核酸類縁体を用いて形成されたプライマーやプローブは、天然の核酸のみを用いて形成されたプライマーやプローブと同様に、PCRやハイブリダイゼーションに用いることができる。このような核酸類縁体として、例えば、天然の核酸に官能基を導入して修飾したものが挙げられる。すなわち、DNA鎖に後述する蛍光物質あるいはエネルギー吸収能を有する置換基を導入したプローブは、核酸類縁体である。核酸類縁体としては、その他、PNA(ポリアミドヌクレオチド誘導体)、LNA(BNA)、ENA(2’−O,4’−C−Ethylene−bridged nucleic acids)、及びこれらの複合体等がある。ここで、PNAは、DNAやRNAのリン酸と5炭糖からなる主鎖をポリアミド鎖に置換したものである。又、LNA(BNA)は、リボヌクレオシドの2’部位の酸素原子と4’部位の炭素原子がメチレンを介して結合している2つの環状構造を持つ化合物である。
【0027】
本発明において、試料核酸とは、標的塩基配列との配列の同一性の有無を識別する対象の1本鎖核酸を意味する。本発明において用いられる試料核酸は特に限定されるものではなく、動物、植物、微生物、培養細胞等の生物から抽出された核酸であってもよく、核酸増幅反応により増幅された核酸であってもよい。増幅産物が2本鎖核酸である場合には、熱変性処理や化学変性処理等により1本鎖化した後に用いることができる。このような核酸増幅反応としては、例えば、PCR法、LAMP法、SMAP法、NASBA法、RCA法等が挙げられる。また、動物等からの核酸の抽出は、フェノール/クロロホルム法等の公知の手法により行うことができる。
【0028】
なお、本発明において遺伝子変異とは、同一生物種の個体間において存在する遺伝子の塩基配列の相違を意味し、変異部位とは、塩基配列中の相違する部位を意味する。具体的には、塩基配列中の1又は複数の塩基が置換・欠失・挿入されていることにより、塩基配列の相違は生じる。このような遺伝子変異として、例えば、SNPやCNV(Copy Number variation)多型、塩基欠損変異、塩基挿入変異、転座変異等が挙げられる。また、本発明において遺伝子変異とは、SNP等の遺伝子多型のような先天的な変異に加えて、同一個体中の細胞間において存在する遺伝子の塩基配列の相違である体細胞変異等のように後天的な変異も含む。
【0029】
本発明で残基とは、塩基(残塩基)、糖鎖、ポリペプチド、塩基配列、官能基、置換基など、本発明の反応に関与しないか、反応をしなくとも本発明の反応に影響を及ぼさない部分や、通常の状態で残基となっているもの(例えば、ペプチド結合やアミノ酸のNH2末端やCOOH末端、核酸やRNAなどの糖鎖の5’や3’端)等を指す。残基の存在する場所は、鎖状化合物(高分子)の主鎖や側鎖の末端部分に限らず、化合物などの形状、反応結果などによるものであり、本発明では特に場所の指定はない。
【0030】
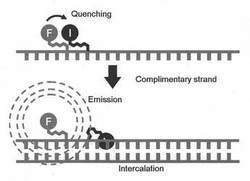
本発明の化合物をプライマーやプローブとして使用するときは、図1及び図2、図3に示すように一本鎖(プライマーやプローブ)の状態では、蛍光物質がエネルギー吸収能を有する官能基(以下、消光物質、インターカレーターということがある。)と接触したり、距離が近いことによりエネルギー移動が抑制されることにより消光されるが、二本鎖構造を形成することにより蛍光物質あるいはエネルギー吸収能を有する官能基の少なくとも一方、あるいは両方が塩基間あるいは二本鎖構造(二本鎖核酸)の主溝もしくは副溝に入り込み(インターカレーション、インターカレートという。)、蛍光物質とエネルギー吸収能を有する官能基とが離れることで、消光が解消され蛍光強度が増すものである。
【0031】
本発明において、本発明の化合物をプライマーとして用いるということは、本化合物を遺伝子増幅反応に使用し、本化合物が標的核酸にアニールできるように塩基配列を作成し、標的核酸と相補な塩基の伸長反応を行なうことで、本発明の化合物が蛍光を発して核酸の検出を行なうものである。
この概念を図2に示す。図2は、本発明化合物をプライマー(PCRプライマー1)として使用する例である。
【0032】
このとき、本化合物のPCRプライマー1がアニールする核酸(例えばセンス核酸)と相補な核酸(例えばアンチセンス核酸)にアニールする、PCRプライマー2とを組み合わせ、いわゆる、フォワードとリバースのプライマーセットとして使用することができる。
プライマーセットは、1組だけでなく複数組、複数種を同時に使用することも可能である。
例えば、複数の標的核酸を同時に増幅するといった、マルチプレックスPCRにも本化合物をプライマーセットとして、利用することができる。
【0033】
このような態様で使用すると、従来のように遺伝子増幅をした後に別途プローブと反応させるという工程を省略して、標的核酸を検出することが可能となる。このとき、プライマーはプローブの機能を併せ持つことになる。
すなわち、PCRプライマー1が伸びていくに従い、新たな二本鎖が生成され、PCRプライマー1に組み込まれているインターカレーター(消光物質)が、当該二本鎖とインターカレーションを起こし、消光状態が解消され、蛍光発光を起こすことで、目的の核酸が増幅されたことが確認できる。
PCRに使用する試薬(ポリメラーゼなどの酵素)や伸長反応の基質(dNTP)、各種塩類などは増幅対象によって適宜選択して使用することができる。
【0034】
本願化合物をプライマーとして使用するときは、下記に示すようにプライマーの設計によっては、アニールしただけで蛍光発光させたり、二本鎖が伸長してから蛍光発光するようにすることもできる。
本願化合物をプローブとして使用するときは、標的核酸にアニールした段階で発光が起こるようにプローブを設計することができる。
【0035】
本発明において、本発明の化合物をプローブとして用いるということは、標的核酸の特定の塩基配列に相補となる塩基配列で本発明の化合物を作成し、標的核酸とライゲーションすることで、本化合物が蛍光を発することで標的核酸の特定配列を識別するものである。
本発明の化合物をプローブとして用いる際の概要を図3に示す。図3のように、本願発明の化合物をプローブとして使用する場合、複数の核酸の混合物の中から、特定の塩基配列を有する核酸を識別(選別)することができる。図3では標的核酸として、核酸配列2を識別するプローブを例としている。
このような場合、核酸配列2が存在していればプローブとアニールすることで蛍光発光が起き、発光強度によって核酸配列2の量を計測することも可能となる。
このように使用することで、複数の核酸から目的とする核酸配列を有するものだけを識別(検出)することが可能となる。
【0036】
本化合物を使用する場合、蛍光物質(F)と消光物質(I)の組み合わせによって、消光する距離、すなわち蛍光物質や消光物質を結合している塩基の間に存在する塩基の数(式(I)、(II)での、l、m、nの値)が異なることがある。
また、蛍光物質(F)、消光物質(I)の他に、リンカー(X)の長さや構造によっても、消光状態が解消する条件が異なるため、必要に応じて蛍光物質(F)、消光物質(I)、リンカー(X)の種類と長さ・構造、FとIの距離を適宜設計することができる。
【0037】
本発明の化合物は、下記式(I)または(II)で表される構造を少なくとも一つ含むものである。
【化1】

式(I)
【0038】
【化2】

式(II)
【0039】
式(I)及び(II)中、Fは蛍光物質であり、Iはエネルギー吸収能を有する官能基であり、式(II)においてI同士は同一でも異なっていてもよく、Xはリンカーであり主鎖の長さ及び構造は任意であり、主鎖中にはC、O、N、S、P及びSiを含んでも含まなくてもよく、主鎖中に単結合、二重結合、三重結合、アミド結合、エステル結合、ジスルフィド結合、エーテル結合、チオアミド結合、チオエーテル結合、チオエステル結合及びイミノ基を含んでも含まなくてもよく、Bは核酸塩基骨格(アデニン、グアニン、シトシン、チミンまたはウラシル)または修飾及び人工核酸塩基であり、Rはデオキシリボース骨格、リボース骨格及びそれらの誘導体であり、Pはリン酸ジエステル骨格及びチオリン酸ジエステル骨格、あるいはそれらの誘導体であり、式(I)及び(II)中のX、B、R、Pはそれぞれ同一でも異なっていてもよく、l、m、nは1〜3の整数を表し、mとnの数は同一でも異なっていてもよい核酸類縁体である。
【0040】
一般式(I)及び(II)中、Bは天然又は人工の核酸塩基である。天然の核酸塩基は、アデニン、グアニン、シトシン、チミン、又はウラシルである。人工の核酸塩基は、天然の核酸塩基と同様の機能を有し、他の天然の核酸塩基と塩基対を形成することが可能である化合物をいい、核酸類縁体も含まれる。本発明においては、歪みが生じ難い核酸塩基であることが好ましく、核酸の水素結合に関連する部位への修飾は施されていない核酸塩基であることが特に好ましい。
【0041】
エネルギー吸収能を有する官能基Iは一般式(III)−(a)〜(l)のいずれかからなる。
【化3】

式(III)
【0042】
前記エネルギー吸収能を有する官能基Iは一般式(III)−(a)〜(l)のいずれかからなり、この様な官能基としては単結合、二重結合、三重結合、アミド結合、エステル結合、ジスルフィド結合、エーテル結合、チオアミド結合、チオエーテル結合、チオエステル結合、スルフォニル基、リン酸基、カルボニル基及びイミノ基であり、これらの官能基が炭素数1〜10のアルキレン基の末端もしくは側鎖に結合した基などが挙げられる。また、Xはリンカーであり主鎖の長さ及び構造は任意であり、主鎖中にはC、O、N、S、P及びSiを含んでも含まなくてもよい。
【0043】
前記蛍光物質(F)は前記式(I)及び(II)におけるXと結合するための結合部を有していてもよく、この様な結合部としては単結合、二重結合、三重結合、アミド結合、エステル結合、ジスルフィド結合、エーテル結合、チオアミド結合、チオエーテル結合、チオエステル結合、スルフォニル基、リン酸基、カルボニル基及びイミノ基であり、これらの結合部が炭素数1〜10のアルキレン基の末端もしくは側鎖に結合した基などが挙げられる。また、Xはリンカーであり主鎖の長さ及び構造は任意であり、主鎖中にはC、O、N、S、及びSiを含んでも含まなくてもよい。また、この結合部は、上記の構造や原子を含む官能基であってもよい。
【0044】
消光物質(I)は、二本鎖構造へのインターカレーションを行なうことができる大きさであることが必要である。このため二から四員環を主骨格とすることが好ましい。
【0045】
式(I)、(II)で蛍光物質が有するリンカーXと結合するための官能基、及び式(III)に含まれる官能基としては、炭素−炭素間で単結合、二重結合、三重結合しているもの、炭素−ヘテロ原子間で単結合、二重結合、三重結合しているもの、あるいは、炭素−ヘテロ原子−炭素間で単結合、二重結合、三重結合しているもの、それらを含んだ原子団が挙げられる。結合している炭素数、ヘテロ原子数は任意の整数を取ることができる。ここでいうヘテロ原子とは、炭素原子、水素原子以外の原子を指す。
また、上記構造の官能基が炭素数1〜10のアルキレン鎖の末端もしくは側鎖に結合しているものも含まれる。
【0046】
また、あまり側鎖が多かったり側鎖を構成する原子団が大きい場合、核酸の伸長反応時に核酸の接近を妨げ、反応効率(反応時間)が悪化することがあるため、主鎖の長さ(主鎖を構成する原子数)よりも短いことが好ましい。
リンカーXの主鎖は、炭素原子だけでなく、炭素原子、水素原子以外のヘテロ原子を含んでも良い。ヘテロ原子を含む場合、電子(エネルギー)移動を起こすことができる、炭素と同じ外殻電子構造を持つ原子(元素)や、非共有電子対を有する原子、空軌道を持つ原子が好ましい。例として周期律表で炭素と同じ4B族や、生体内でも電子伝達に寄与することが知られている、5B族、6B族の原子が挙げられる。具体的には、炭素(C)、ケイ素(Si)、窒素(N)、リン(P)、酸素(O)、硫黄(S)が挙げられる。
【0047】
本発明における蛍光物質(蛍光色素)は300〜800nmの範囲に蛍光発光を示す化合物が好ましい。このような蛍光物質の例としては、FAM、Cy2、Cy3、Cy3.5、Cy5、Cy5.5、Alexa Fluor 488、Alexa Fluor 532、JOE、ROX、TAMRAが挙げられる。
また、自ら合成した蛍光物質を使用することもできる。
【0048】
本発明において用いられる蛍光物質とエネルギー吸収能を有する官能基を含有する化合物をプローブとして利用することができる。
本化合物をプローブとして使用するためには化学合成法等の公知の核酸合成反応により、合成することができる。なお、化学合成法としては、トリエステル法、亜リン酸法等が挙げられる。例えば、液相法又は不溶性の担体を使った固相合成法等を利用した通常の自動合成機(APPLIEDBIOSYSTEMS社392等)を使用して1本鎖のDNAを合成することができる。
例えば図5に示すように、消光物質Iの導入位置に修飾塩基(図5中NH2のついた塩基)を含む、塩基配列を先に合成し、その後リンカーXや消光物質Iを導入して目的の塩基配列を合成することができる。
また、先にリンカーXや消光物質Iのついた塩基を合成し、その他の塩基を追加して目的の塩基配列を合成しても良い。
プライマーについても、プローブと同様に合成することができる。以下、プローブを例として説明するが、プライマーにも適用することが可能である。
【0049】
本発明のプローブは、標的塩基配列の識別性能に優れているため、遺伝子変異の識別に好適に用いることができる。具体的には、遺伝子変異の変異部位を含む領域の塩基配列を標的塩基配列とする。なお、標的塩基配列は、1個の塩基変異部位のみを有していてもよく、2個以上の塩基変異部位を有していてもよい。
【0050】
本発明のプローブ配列中において蛍光物質とエネルギー吸収能を有する官能基の割合は1:1で機能するが好ましくは1:2であり、一本鎖状態時の蛍光強度がより効果的に抑制される。このため、蛍光を発したときとの差がより大きくなるので測定・検出に有効である。
【0051】
この場合、蛍光物質とエネルギー吸収能を有する官能基の割合とは、プローブ1個(1本)あたりについている、それぞれの原子団、(蛍光物質及び、式(III)の化合物)で示される化合物の個数の割合をいう。例えば、あるプローブに、蛍光物質が1つ(1分子)と消光物質(式(III)の化合物)の中から選ばれる原子団が1つ含まれている場合を、1:1という。
【0052】
本発明の識別方法において、標的となる遺伝子変異としては、がん関連遺伝子、遺伝病に関連する遺伝子、薬剤の代謝や効き目に関する遺伝子、ウィルス遺伝子、及び細菌遺伝子における変異と呼ばれるものである。がん関連遺伝子としては、例えばK−ras遺伝子、BRAF遺伝子、PTEN遺伝子、ALK遺伝子、EGFR遺伝子、N−ras遺伝子、p53遺伝子、BRCA1遺伝子、BRCA2遺伝子、又はAPC遺伝子等が挙げられる。遺伝病に関連する遺伝子としては、各種先天性代謝異常症等との関連が報告されている遺伝子等が挙げられる。薬剤の代謝に関しては薬剤の代謝に関わる酵素であるシトクロムP450やトランスポーター等の遺伝子が挙げられる。ウィルス遺伝子、細菌遺伝子としては、例えばC型肝炎ウィルス、B型肝炎ウィルス等の遺伝子が挙げられる。さらに、病気等の原因とは必ずしも直接は関係のないヒト白血球抗原遺伝子であるHLA等も移植の適合性や薬の副作用等と関連して重要である。さらに、ミトコンドリアにコードされている遺伝子変異も病気との関連が示唆されており、これらの遺伝子の変異も標的となりうる。
【0053】
本発明の識別方法は、その高い識別精度から、臨床検査等においても有用である。医療現場における遺伝子検査の実用性を考えた場合に、識別精度の改善は非常に重要である。本発明の識別方法により、SNP等の生殖細胞変異のみならず、体細胞変異も高精度に識別することができる。
【0054】
例えば、K−rasはシグナル伝達系のタンパク質であり、プロトオンコ―ジーンである。多くのがん細胞においてK−ras遺伝子に変異が生じていることが報告されている。特にK−ras遺伝子のコドン12、13にアミノ酸置換を伴う変異が顕著に見られ、13種類の変異パターンが存在することが知られている。最近、K−ras遺伝子に変異がある患者では、抗がん剤であるEGFR抗体薬(セツキシマブ、パニツムマブ)等が効力を発揮できないことが次々に明らかとなっている。このような抗がん剤治療は副作用のみならず高額な費用を要する。したがって、治療前にK−ras変異の検査を行い、効く患者のみを選別して治療することがオーダーメード医療の一環として提案されている。
【0055】
また、EGFR抗体薬であるセツキシマブは、大腸がん治療薬として使用されている。大腸がんの年間罹患数は10万人弱であり、平成17年の死亡者数は4万800人であった。食生活の欧米化により増え続ける傾向にあり、4年後には40,000人の大腸がん患者がEGFR抗体薬治療の対象となるとのEGFR抗体薬のメーカーによる試算もある。当該試算が正しければ、K−rasの検査市場は日本国内だけで4年後には4億円を越すものと予想される。
【0056】
しかしながら、従来の識別法では、体細胞変異を十分な精度で識別することは困難であり、擬陽性が多い、と言う問題があった。本発明の識別方法は、体細胞変異をも非常に精度よく識別可能であることから、臨床検査における精度改善のみならず、擬陽性の低減による医療費の削減にも資することが期待できる。
【0057】
本発明の標的塩基配列識別用キットは、標的塩基配列を識別する方法に用いられるキットであって、前記一般式(I)もしくは前記一般式(II)で表される構造を有する核酸類縁体であるプローブであり、標的塩基配列からなる標的核酸に対して、ハイブリダイズし核酸増幅のためのプライマーとして作用する。本発明の標的塩基配列識別用キットは、本発明によるプローブに加え緩衝剤、塩、有機溶媒等の反応液に添加する試薬や、標識物質の標識を検出するための試薬等を組み合わせても良い。このように、本発明の識別方法に必要な試薬等をキット化することにより、より簡便かつ短時間で標的塩基配列の識別を行うことができる。
【0058】
本化合物がプライマーとして作用するとき、標的塩基配列を有する標的核酸が二本鎖である場合、二本鎖の一方(標的塩基配列:例えばセンス鎖)に相補なプライマーの他に、アンチセンス鎖に相補なプライマーも含む、プライマーセットとして使用しても良い。
また、複数の核酸が混合している試料の中から複数の標的核酸を増幅する場合にも、各標的核酸に相補なプライマーをそれぞれ含む、プライマーセットとして使用しても良い。
【0059】
本発明の標的塩基配列識別用キットは、特に、遺伝子変異の特定の遺伝子型の変異部位を含む領域と相同的な塩基配列を標的塩基配列とし、遺伝子変異を検出するために用いられることが好ましい。
【0060】
本化合物をプローブとして使用する場合、図3に示すように特定の標的塩基配列を有する核酸を識別することが可能である。
複数の核酸の混合物の中に本化合物をプローブとして投入し、核酸を一本鎖に解離(変性)させる。これは、一本鎖になった核酸とプローブの結合(ハイブリダイゼーション)に影響を生じにくい方法で行なえば良いが、熱を加えて行なう方法が好ましい。
一本鎖になった核酸とプローブが結合することで蛍光発光が起こり、標的塩基配列を有する核酸を識別することができる。
標的塩基配列がSNPであれば、特定の遺伝子型の変異部を識別することができる。
識別対象の核酸は、通常のPCRなどの増幅方法で増やしたものを使用することもできるし、本化合物をプローブとして使用して増幅し、増幅したことを確認し、さらに本化合物をプローブとして追加して識別を行なうこともできる。
また、常法により抽出された核酸等を増幅せずに試料とすることもできる。
【実施例】
【0061】
以下、本発明を実施例によりさらに説明するが、本発明は下記例に制限されない。
【実施例1】
【0062】
ODN 2(配列番号4) 合成
図4に示すようにピレン修飾された核酸ODN 2の合成を行った。ODN 1(配列番号3:70μlMのナフタレンジイミド誘導体(2 mg含有DMF溶液、50 μl:約80mM相当)、0.1 M炭酸水素ナトリウムとなるような100 μlの反応溶液を調整し37℃条件下で2時間静置した。DMFはジメチルホルムアミドのことをさす。
【0063】
ODN 2 精製
以降、特に断りがない場合は、TEAAは酢酸トリエチルアミン、TEABはトリエチルアンモニウムバイカーボネートをさす。
Sephadexカラムにて50 mM TEAB bufferを用いて図4に示した反応溶液の精製をSephadexカラムにて行った。主だったピークを分取した後に一昼夜かけて凍結乾燥することで溶媒を除去した。乾燥により得られたペレット状のものをそれぞれ超純水 (100 μl) に溶かし込んだ後、HPLCにて精製した。溶離液はA液として50 mM TEAA buffer、B液として50% アセトニトリル−50 mM TEAA buffer水溶液を用いて、0分から28分までの間にB液の割合を30%から90%に変化させて、カラム温度を30℃に保ち精製を実行した。
収集したフラクションを分取した後に凍結乾燥により溶媒を除去し、再度Sephadexカラムにて残留しているTEAA bufferを除去して凍結乾燥を行った。乾燥したオリゴDNAを超純水 (100 μl)に溶解させて、更に凍結乾燥させることでTEAA bufferを完全に除去した。
得られたODN2と本願発明の化合物との対応を図5に示す。
【0064】
ODN 4 (配列番号6)合成
図6に示すようにピレンを二つ導入した核酸ODN 4の合成を行った。ODN 3(配列番号5:70 μlMのナフタレンジイミド誘導体(2 mg含有DMF溶液、50 μl:約80mM相当)、0.1 M炭酸水素ナトリウムとなるような100 μlの反応溶液を調整し37℃条件下で2時間静置した。
【0065】
ODN 4精製
Sephadexカラムにて50 mM TEAB bufferを用いて図6に示した反応溶液の精製をSephadexカラムにて行った。主だったピークを分取した後に一昼夜かけて凍結乾燥することで溶媒を除去した。乾燥により得られたペレット状のものをそれぞれ超純水 (100 μl) に溶かし込んだ後、HPLCにて精製した。溶離液はA液として50 mM TEAA buffer、B液として50% アセトニトリル−50 mM TEAA buffer水溶液を用いて、0分から28分までの間にB液の割合を30%から90%に変化させて、カラム温度を30℃に保ち精製を実行した。
収集したフラクションを分取した後に凍結乾燥により溶媒を除去し、再度Sephadexカラムにて残留しているTEAA bufferを除去して凍結乾燥を行った。乾燥したオリゴDNAを超純水 (100 μl)に溶解させて、更に凍結乾燥させることでTEAA bufferを完全に除去した。
【0066】
<実験:ARMS法による核酸配列の識別>
<実験1>
先に合成したODN 2,4をそれぞれARMS法のプライマーとして用いて、核酸増幅のプライマー及び核酸配列の識別が可能であることを示す。標的とする配列はワルファリンの至適投与量に関連する遺伝子であるビタミンKエポキシド還元酵素複合体1(VKORC1)のイントロン1領域の1173位における遺伝子多型(1173C>T)を識別対象とした。
【0067】
表1に示されるように、VKORC1の上記遺伝子多型を検出するARMSプライマーとしてODN 2及び共通のR−プライマー(配列番号7)を用いた。検出プライマーは5’末端から数えて10番目の塩基にフルオレセイン修飾したチミジン、12番目の塩基にピレン修飾したシチジンを導入したものである。鋳型となるゲノムDNAとしてはCoriell社から購入したものを用いた。表1中、1173位を太字で示し、ミスマッチ塩基導入部位に下線を付した。また、「Pyrene」はピレンを、「6−FAM」は6−フルオロセインを意味している。
【0068】
【表1】

【0069】
鋳型として、VKORC1の遺伝子多型であるCアレル(配列番号1)、またはTアレル(配列番号2)を、検出用プライマーとしてODN 2、R-プライマーを混合した反応液を表2記載の組成となるように調整した。上記反応液をリアルタイムPCRシステム(Roche社製、「LightCycler(登録商標)」)にセットし、95℃で1分間保持し、DNAポリメラーゼの抗体を変性させた後、62℃20秒、95℃5秒の2ステップPCRを55サイクル行い、95℃から40℃まで融解曲線解析を行った。なお、鋳型に蒸留水(D.W.)を用いたものをネガティブコントロールとした。結果を図7に示す。核酸増幅反応0サイクル目の蛍光強度をF0として各サイクルの蛍光強度Fiを下記の式(IV)に代入して蛍光強度変化率ΔFを表した。
図8は、実験1の結果を融解曲線の負の一次微分曲線で示した図である。
【0070】
【数1】

式(IV)
【0071】
【表2】

【0072】
ODN2が二本鎖を形成すると、エネルギー吸収物質であるピレンが二本鎖核酸にインターカレートし、エネルギー吸収量が小さくなるため、6−フルオロセインからの蛍光強度が大きくなる。
融解曲線とは、温度を低温から徐々に上げることにより、増幅された二本鎖核酸が一本鎖状態に変性するまでの蛍光強度を測定して得られる曲線をいう。融解曲線の負の一次微分曲線は温度変化に対する蛍光変化量を示すもので、変化量が最大のところが二本鎖DNAのTmとなる。
実験1において、ODN 2からの伸長産物は、83℃から86℃の範囲で一本鎖状態と二本鎖状態の変化量が最も多いことが既に分かっている。よって、融解曲線の負の一次微分曲線において83℃から86℃の範囲でピークが見られる場合には、ODN 2から伸長反応が起きたと判断することができる。
実験1のODN 2、R−プライマーのセットでCアレルあるいはTアレルを鋳型として用いた場合、Cアレル特異的な増幅が確認された。
【0073】
<実験2>
鋳型として、VKORC1の遺伝子多型であるCアレル、またはTアレルを、検出用プライマーとしてODN 4、R−プライマーを混合した反応液を表3記載の組成となるように調整した。上記反応液をリアルタイムPCRシステム(Roche社製、「LightCycler(登録商標)」)にセットし、95℃で1分間保持し、DNAポリメラーゼの抗体を変性させた後、62℃20秒、95℃5秒の2ステップPCRを55サイクル行い、95℃から40℃まで融解曲線解析を行った。なお、鋳型に蒸留水(D.W.)を用いたものをネガティブコントロールとした。結果を図9に示す。図10は、実験2の結果を融解曲線の負の一次微分曲線で示した図である。
【0074】
【表3】

【0075】
ODN4が、二本鎖を形成すると、エネルギー吸収物質であるピレンが二本鎖核酸にインターカレートし、エネルギー吸収量が小さくなるため、6−フルオロセインからの蛍光強度が大きくなる。
融解曲線とは、温度を低温から徐々に上げることにより、増幅された二本鎖核酸が一本鎖状態に変性するまでの蛍光強度を測定して得られる曲線をいう。融解曲線の負の一次微分曲線は温度変化に対する蛍光変化量を示すもので、変化量が最大のところが二本鎖DNAのTmとなる。
【0076】
実験1において、ODN 4からの伸長産物は、83℃から86℃の範囲で一本鎖状態と二本鎖状態の変化量が最も多いことが既に分かっている。よって、融解曲線の負の一次微分曲線において83℃から86℃の範囲でピークが見られる場合には、ODN 2から伸長反応が起きたと判断することができる。
実験2のODN 4、R−プライマーのセットでCアレルあるいはTアレルを鋳型として用いた場合、Cアレル特異的な増幅が確認された。
【符号の説明】
【0077】
F 蛍光物質
I エネルギー吸収能を有する官能基
【技術分野】
【0001】
本発明は蛍光物質とエネルギー吸収能を有する官能基を含有する核酸検出化合物(プローブ)であり、また、核酸増幅のためのプライマー、増幅産物の検出、標的核酸の変異の種類の識別に用いることが可能である。更に詳細には蛍光物質とエネルギー吸収能を有する官能基を含有するプライマーは一本鎖の状態では蛍光発光がエネルギー吸収能を有する官能基により消光されるが、標的核酸存在下、あるいは核酸増幅のプライマーとして作用したときに二本鎖核酸となり蛍光物質とエネルギー吸収能を有する官能基とが離れることで蛍光発光が増強されることで、核酸増幅を検出、標的核酸の変異の種類の識別するものである。
【背景技術】
【0002】
遺伝子診断等において標的となる核酸を検出する際には蛍光物質を用いる手法が普及している。具体的には一本鎖あるいは二本鎖構造の核酸にインターカレートする蛍光物質や、二本鎖核酸と特異的に会合し、その上で蛍光発光を増強する修飾ペプチドなどが知られている(特許文献1)。
【0003】
しかしながら、これらの手法は核酸そのものに特異性はあるものの、配列に対する特異性は無く核酸の有無を検出するに留まってしまう。
【0004】
また、蛍光物質で標識された核酸を増幅した標的配列とハイブリダイズさせることで検出する方法があるが、二本鎖形成反応後にハイブリダイズしていないものを洗浄するなどして取り除くために標的配列が固層上になくてはならない等の制約がある。他にも核酸配列中に蛍光色素と消光物質を組み込む方式では天然と大きく異なる構造を挿入するために核酸複製酵素を阻害してしまい、例えばPCRプライマーのように用いることは出来ない(非特許文献1、2)。
【0005】
これらとは別にチアゾールオレンジ並びにチアゾールオレンジ誘導体を用いて蛍光発光と消光を制御するプライマーも報告されており有用なものである(特許文献2、非特許文献3)。しかし、反応の原理的な観点から蛍光色素の選定には制約がある。後述するARMS法の基本原理については特許文献3に開示されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2005−289810号公報
【特許文献2】特開2009−171935号公報
【特許文献3】特許285386号公報
【非特許文献】
【0007】
【非特許文献1】Shinozuka, K., Seto, Y., Sawai, H. (1994) J. CHEM. SOC., CHEM.COMMUN. 1377-1378.
【非特許文献2】Yamane, A. (2002) Nucleic Acids Reserch, 30, e97.
【非特許文献3】Shuji, I., Takeshi, K., Mizue, Y., Akimitsu, O. (2010) Angew. Chem.Int. Ed. 48, 6480-6484.
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は核酸配列に対する特異性を有し、固相上に限らず溶液中においても標的核酸配列存在下において、二本鎖形成した場合のみ蛍光発光が増強される化合物(プローブ)を提供するものである。また、本発明によって得られるプローブは核酸増幅の際にはプライマーとして用いることが可能であり、プライマーとして作用したプローブのみ蛍光発光が増強されるものである。更に蛍光物質の選択は自由なものとし、輝度で表される蛍光強度も高いプローブを提供するものである。
【課題を解決するための手段】
【0009】
(1) 蛍光物質及びエネルギー吸収能を有する官能基を含む化合物であって、標的核酸配列が増幅したことを検出、標的核酸配列の変異の種類を識別、するものであり、下記式(I)または(II)で表される構造を少なくとも一つ含むことを特徴とする化合物。
【化1】

式(I)
【化2】

式(II)
式(I)及び(II)中、Fは蛍光物質であり、Iはエネルギー吸収能を有する官能基であり、式(II)においてI同士は同一でも異なっていてもよく、Xはリンカーであり主鎖の長さ及び構造は任意であり、主鎖中にはC、O、N、S、P及びSiを含んでも含まなくてもよく、主鎖中に単結合、二重結合、三重結合、アミド結合、エステル結合、ジスルフィド結合、エーテル結合、チオアミド結合、チオエーテル結合、チオエステル結合及びイミノ基を含んでも含まなくてもよく、Bは核酸塩基骨格(アデニン、グアニン、シトシン、チミンまたはウラシル)または修飾及び人工核酸塩基であり、Rはデオキシリボース骨格、リボース骨格及びそれらの誘導体であり、Pはリン酸ジエステル骨格及びチオリン酸ジエステル骨格、あるいはそれらの誘導体であり、式(I)及び(II)中のX、B、R、Pはそれぞれ同一でも異なっていてもよく、l、m、nは1〜3の整数を表し、mとnの数は同一でも異なっていてもよい核酸類縁体である。
【0010】
前記エネルギー吸収能を有する官能基Iは一般式(III)−(a)〜(l)のいずれかからなることを特徴とする(1)に記載の化合物。
【化3】

式(III)
【0011】
(3) 前記蛍光物質は前記式(I)及び(II)におけるXと結合するための結合部を有していることを特徴とする(1)または(2)に記載の化合物。
【0012】
(4)前記化合物は、核酸増幅用プライマーとして用いることもでき、かつ、標的核酸配列が増幅したことを検出、特定の標的核酸配列を識別、するプローブとして用いることもできることを特徴とする(1)から(3)のいずれかに記載の化合物。
【0013】
(5)(1)から(3)のいずれか一項に記載の化合物をプライマーとして使用するときにおいて、全長が15〜25残基であることを特徴とするプライマー。
【0014】
(6)前記標的核酸配列を増幅し、増幅した核酸を検出する際に使用するプライマーセットにおいて、プライマーセットを構成するプライマーの少なくとも一つのプライマーは(1)から(5)のいずれかの化合物であることを特徴とするプライマーセット。
【0015】
(7)標的核酸配列の増幅は、
(a)標的塩基配列を含む塩基配列からなる標的核酸を有する核酸試料に、前記標的塩基配列に相補的な少なくとも1種の、(1)から(6)いずれか一項に記載の化合物がプライマーとしてアニールする工程と、
(b)前記核酸試料中の標的塩基配列を鋳型として用い、前記標的核酸にアニールさせた前記プライマーから伸長産物を合成し、前記標的核酸を増幅する工程と、
(c)前記伸長産物を検出する工程
からなることを特徴とする標的核酸の検出方法。
【0016】
(8)前記工程(c)は前記工程(b)と同時に行われる工程であって、前記プライマーからの伸長産物である標的核酸が二本鎖核酸構造を形成しており、当該二本鎖核酸構造によって前記プライマーがプローブとして作用し、前記標的核酸を検出することを特徴とする(7)に記載の標的核酸の検出方法。
【0017】
(9)前記工程(c)は前記工程(b)の後に行われる工程であって、前記プライマーからの伸長産物である標的核酸が二本鎖核酸構造を形成しており、当該二本鎖核酸構造によって前記プライマーがプローブとして作用し、融解曲線を利用して前記標的核酸を検出することを特徴とする(7)に記載の標的核酸の検出方法。
【0018】
(10)(1)から(3)のいずれか一項に記載の化合物をプローブとして用い、複数の異なる塩基配列を有する核酸の中から特定の標的核酸を選択することを特長とする、核酸の識別方法。
【0019】
(11)(1)から(3)いずれか一項に記載の化合物をプライマーとして用いるときに、ARMS法と併用し、プライマーの蛍光発光−消光を検出することで、鋳型とした標的核酸配列の変異の種類を識別することを特徴とする(10)に記載の標的核酸配列の変異の種類の識別方法。
【発明の効果】
【0020】
本発明は上記課題を解決するために蛍光物質とエネルギー吸収能を有する官能基を含有する核酸検出プローブを合成し用いることとした。本発明は一本鎖の状態で蛍光発光がエネルギー吸収能を有する官能基により消光されるが、標的核酸存在下では二本鎖核酸となり蛍光物質とエネルギー吸収能を有する官能基とが離れるために蛍光発光が増強される仕組みを有するものである。これにより溶液中であっても目的の核酸配列の有無を蛍光強度の増強でしらせ、それ以外の場合では発光が抑制されるため、固相上での洗浄操作などを必要としない。
【0021】
また、本発明のプローブは蛍光物質等の修飾位置が塩基部分とすることで酵素反応を阻害しないよう考慮してあるため核酸増幅のプライマーとして用いることが可能である。更に本発明においては、蛍光発光−消光に複数の原理を採用することで輝度により表される蛍光強度も高いプローブを使用できる。
【0022】
本発明により配列特異的に認識して蛍光強度が増強されることにより標的となる核酸を簡便に検出することが可能となる。また、本発明は核酸増幅法のプライマーとして用いることが可能であり、目的配列の増幅反応の進行をリアルタイムに検知することが容易なものとなる。
【図面の簡単な説明】
【0023】
【図1】本発明の原理を模式的に示す図である。
【図2】本願発明のうち、プライマーとして機能する概要を示す図である。
【図3】本願発明のうち、プローブとして機能する概要を示す図である。
【図4】核酸ODN2合成の概要を示す図である。
【図5】核酸ODN2の化合物と本願発明の対応例を示す図である。
【図6】核酸ODN4合成の概要を示す図である。
【図7】実験1の測定結果(融解曲線)を示す図である。
【図8】実験1の融解曲線の負の一次微分曲線を示す図である。
【図9】実験2の測定結果(融解曲線)を示す図である
【図10】実験2の融解曲線の負の一次微分曲線を示す図である。
【発明を実施するための形態】
【0024】
本発明において、「標的塩基配列を識別する」とは、識別の対象となる試料核酸が、標的塩基配列を有する核酸であるか否かを識別することを意味する。なお、標的塩基配列は、塩基変異部位を含有し、かつ、ハイブリダイゼーション法により検出が可能な程度に塩基配列が明らかになっているものであれば、特に限定されるものではない。
【0025】
本発明において、核酸とは、DNA又はRNAであれば特に限定されるものではなく、天然のものであってもよく、合成されたものであってもよい。天然の核酸として、例えば、生物から回収されたゲノムDNA、mRNA、tRNA、rRNA、hnRNA等がある。また、合成された核酸として、β−シアノエチルホスフォロアミダイト法DNA固相合成法等の公知の化学的合成法により合成されたDNAや、PCR等の公知の核酸増幅法により合成された核酸、逆転写反応により合成されたcDNA等がある。
【0026】
本発明において、核酸類縁体とは、非天然の核酸であり、天然の核酸であるDNAやRNAと同様の機能を有するものをいう。すなわち、核酸類縁体は、DNA等と同様にリン酸ジエステル結合により鎖を形成することができ、かつ、核酸類縁体を用いて形成されたプライマーやプローブは、天然の核酸のみを用いて形成されたプライマーやプローブと同様に、PCRやハイブリダイゼーションに用いることができる。このような核酸類縁体として、例えば、天然の核酸に官能基を導入して修飾したものが挙げられる。すなわち、DNA鎖に後述する蛍光物質あるいはエネルギー吸収能を有する置換基を導入したプローブは、核酸類縁体である。核酸類縁体としては、その他、PNA(ポリアミドヌクレオチド誘導体)、LNA(BNA)、ENA(2’−O,4’−C−Ethylene−bridged nucleic acids)、及びこれらの複合体等がある。ここで、PNAは、DNAやRNAのリン酸と5炭糖からなる主鎖をポリアミド鎖に置換したものである。又、LNA(BNA)は、リボヌクレオシドの2’部位の酸素原子と4’部位の炭素原子がメチレンを介して結合している2つの環状構造を持つ化合物である。
【0027】
本発明において、試料核酸とは、標的塩基配列との配列の同一性の有無を識別する対象の1本鎖核酸を意味する。本発明において用いられる試料核酸は特に限定されるものではなく、動物、植物、微生物、培養細胞等の生物から抽出された核酸であってもよく、核酸増幅反応により増幅された核酸であってもよい。増幅産物が2本鎖核酸である場合には、熱変性処理や化学変性処理等により1本鎖化した後に用いることができる。このような核酸増幅反応としては、例えば、PCR法、LAMP法、SMAP法、NASBA法、RCA法等が挙げられる。また、動物等からの核酸の抽出は、フェノール/クロロホルム法等の公知の手法により行うことができる。
【0028】
なお、本発明において遺伝子変異とは、同一生物種の個体間において存在する遺伝子の塩基配列の相違を意味し、変異部位とは、塩基配列中の相違する部位を意味する。具体的には、塩基配列中の1又は複数の塩基が置換・欠失・挿入されていることにより、塩基配列の相違は生じる。このような遺伝子変異として、例えば、SNPやCNV(Copy Number variation)多型、塩基欠損変異、塩基挿入変異、転座変異等が挙げられる。また、本発明において遺伝子変異とは、SNP等の遺伝子多型のような先天的な変異に加えて、同一個体中の細胞間において存在する遺伝子の塩基配列の相違である体細胞変異等のように後天的な変異も含む。
【0029】
本発明で残基とは、塩基(残塩基)、糖鎖、ポリペプチド、塩基配列、官能基、置換基など、本発明の反応に関与しないか、反応をしなくとも本発明の反応に影響を及ぼさない部分や、通常の状態で残基となっているもの(例えば、ペプチド結合やアミノ酸のNH2末端やCOOH末端、核酸やRNAなどの糖鎖の5’や3’端)等を指す。残基の存在する場所は、鎖状化合物(高分子)の主鎖や側鎖の末端部分に限らず、化合物などの形状、反応結果などによるものであり、本発明では特に場所の指定はない。
【0030】
本発明の化合物をプライマーやプローブとして使用するときは、図1及び図2、図3に示すように一本鎖(プライマーやプローブ)の状態では、蛍光物質がエネルギー吸収能を有する官能基(以下、消光物質、インターカレーターということがある。)と接触したり、距離が近いことによりエネルギー移動が抑制されることにより消光されるが、二本鎖構造を形成することにより蛍光物質あるいはエネルギー吸収能を有する官能基の少なくとも一方、あるいは両方が塩基間あるいは二本鎖構造(二本鎖核酸)の主溝もしくは副溝に入り込み(インターカレーション、インターカレートという。)、蛍光物質とエネルギー吸収能を有する官能基とが離れることで、消光が解消され蛍光強度が増すものである。
【0031】
本発明において、本発明の化合物をプライマーとして用いるということは、本化合物を遺伝子増幅反応に使用し、本化合物が標的核酸にアニールできるように塩基配列を作成し、標的核酸と相補な塩基の伸長反応を行なうことで、本発明の化合物が蛍光を発して核酸の検出を行なうものである。
この概念を図2に示す。図2は、本発明化合物をプライマー(PCRプライマー1)として使用する例である。
【0032】
このとき、本化合物のPCRプライマー1がアニールする核酸(例えばセンス核酸)と相補な核酸(例えばアンチセンス核酸)にアニールする、PCRプライマー2とを組み合わせ、いわゆる、フォワードとリバースのプライマーセットとして使用することができる。
プライマーセットは、1組だけでなく複数組、複数種を同時に使用することも可能である。
例えば、複数の標的核酸を同時に増幅するといった、マルチプレックスPCRにも本化合物をプライマーセットとして、利用することができる。
【0033】
このような態様で使用すると、従来のように遺伝子増幅をした後に別途プローブと反応させるという工程を省略して、標的核酸を検出することが可能となる。このとき、プライマーはプローブの機能を併せ持つことになる。
すなわち、PCRプライマー1が伸びていくに従い、新たな二本鎖が生成され、PCRプライマー1に組み込まれているインターカレーター(消光物質)が、当該二本鎖とインターカレーションを起こし、消光状態が解消され、蛍光発光を起こすことで、目的の核酸が増幅されたことが確認できる。
PCRに使用する試薬(ポリメラーゼなどの酵素)や伸長反応の基質(dNTP)、各種塩類などは増幅対象によって適宜選択して使用することができる。
【0034】
本願化合物をプライマーとして使用するときは、下記に示すようにプライマーの設計によっては、アニールしただけで蛍光発光させたり、二本鎖が伸長してから蛍光発光するようにすることもできる。
本願化合物をプローブとして使用するときは、標的核酸にアニールした段階で発光が起こるようにプローブを設計することができる。
【0035】
本発明において、本発明の化合物をプローブとして用いるということは、標的核酸の特定の塩基配列に相補となる塩基配列で本発明の化合物を作成し、標的核酸とライゲーションすることで、本化合物が蛍光を発することで標的核酸の特定配列を識別するものである。
本発明の化合物をプローブとして用いる際の概要を図3に示す。図3のように、本願発明の化合物をプローブとして使用する場合、複数の核酸の混合物の中から、特定の塩基配列を有する核酸を識別(選別)することができる。図3では標的核酸として、核酸配列2を識別するプローブを例としている。
このような場合、核酸配列2が存在していればプローブとアニールすることで蛍光発光が起き、発光強度によって核酸配列2の量を計測することも可能となる。
このように使用することで、複数の核酸から目的とする核酸配列を有するものだけを識別(検出)することが可能となる。
【0036】
本化合物を使用する場合、蛍光物質(F)と消光物質(I)の組み合わせによって、消光する距離、すなわち蛍光物質や消光物質を結合している塩基の間に存在する塩基の数(式(I)、(II)での、l、m、nの値)が異なることがある。
また、蛍光物質(F)、消光物質(I)の他に、リンカー(X)の長さや構造によっても、消光状態が解消する条件が異なるため、必要に応じて蛍光物質(F)、消光物質(I)、リンカー(X)の種類と長さ・構造、FとIの距離を適宜設計することができる。
【0037】
本発明の化合物は、下記式(I)または(II)で表される構造を少なくとも一つ含むものである。
【化1】

式(I)
【0038】
【化2】

式(II)
【0039】
式(I)及び(II)中、Fは蛍光物質であり、Iはエネルギー吸収能を有する官能基であり、式(II)においてI同士は同一でも異なっていてもよく、Xはリンカーであり主鎖の長さ及び構造は任意であり、主鎖中にはC、O、N、S、P及びSiを含んでも含まなくてもよく、主鎖中に単結合、二重結合、三重結合、アミド結合、エステル結合、ジスルフィド結合、エーテル結合、チオアミド結合、チオエーテル結合、チオエステル結合及びイミノ基を含んでも含まなくてもよく、Bは核酸塩基骨格(アデニン、グアニン、シトシン、チミンまたはウラシル)または修飾及び人工核酸塩基であり、Rはデオキシリボース骨格、リボース骨格及びそれらの誘導体であり、Pはリン酸ジエステル骨格及びチオリン酸ジエステル骨格、あるいはそれらの誘導体であり、式(I)及び(II)中のX、B、R、Pはそれぞれ同一でも異なっていてもよく、l、m、nは1〜3の整数を表し、mとnの数は同一でも異なっていてもよい核酸類縁体である。
【0040】
一般式(I)及び(II)中、Bは天然又は人工の核酸塩基である。天然の核酸塩基は、アデニン、グアニン、シトシン、チミン、又はウラシルである。人工の核酸塩基は、天然の核酸塩基と同様の機能を有し、他の天然の核酸塩基と塩基対を形成することが可能である化合物をいい、核酸類縁体も含まれる。本発明においては、歪みが生じ難い核酸塩基であることが好ましく、核酸の水素結合に関連する部位への修飾は施されていない核酸塩基であることが特に好ましい。
【0041】
エネルギー吸収能を有する官能基Iは一般式(III)−(a)〜(l)のいずれかからなる。
【化3】

式(III)
【0042】
前記エネルギー吸収能を有する官能基Iは一般式(III)−(a)〜(l)のいずれかからなり、この様な官能基としては単結合、二重結合、三重結合、アミド結合、エステル結合、ジスルフィド結合、エーテル結合、チオアミド結合、チオエーテル結合、チオエステル結合、スルフォニル基、リン酸基、カルボニル基及びイミノ基であり、これらの官能基が炭素数1〜10のアルキレン基の末端もしくは側鎖に結合した基などが挙げられる。また、Xはリンカーであり主鎖の長さ及び構造は任意であり、主鎖中にはC、O、N、S、P及びSiを含んでも含まなくてもよい。
【0043】
前記蛍光物質(F)は前記式(I)及び(II)におけるXと結合するための結合部を有していてもよく、この様な結合部としては単結合、二重結合、三重結合、アミド結合、エステル結合、ジスルフィド結合、エーテル結合、チオアミド結合、チオエーテル結合、チオエステル結合、スルフォニル基、リン酸基、カルボニル基及びイミノ基であり、これらの結合部が炭素数1〜10のアルキレン基の末端もしくは側鎖に結合した基などが挙げられる。また、Xはリンカーであり主鎖の長さ及び構造は任意であり、主鎖中にはC、O、N、S、及びSiを含んでも含まなくてもよい。また、この結合部は、上記の構造や原子を含む官能基であってもよい。
【0044】
消光物質(I)は、二本鎖構造へのインターカレーションを行なうことができる大きさであることが必要である。このため二から四員環を主骨格とすることが好ましい。
【0045】
式(I)、(II)で蛍光物質が有するリンカーXと結合するための官能基、及び式(III)に含まれる官能基としては、炭素−炭素間で単結合、二重結合、三重結合しているもの、炭素−ヘテロ原子間で単結合、二重結合、三重結合しているもの、あるいは、炭素−ヘテロ原子−炭素間で単結合、二重結合、三重結合しているもの、それらを含んだ原子団が挙げられる。結合している炭素数、ヘテロ原子数は任意の整数を取ることができる。ここでいうヘテロ原子とは、炭素原子、水素原子以外の原子を指す。
また、上記構造の官能基が炭素数1〜10のアルキレン鎖の末端もしくは側鎖に結合しているものも含まれる。
【0046】
また、あまり側鎖が多かったり側鎖を構成する原子団が大きい場合、核酸の伸長反応時に核酸の接近を妨げ、反応効率(反応時間)が悪化することがあるため、主鎖の長さ(主鎖を構成する原子数)よりも短いことが好ましい。
リンカーXの主鎖は、炭素原子だけでなく、炭素原子、水素原子以外のヘテロ原子を含んでも良い。ヘテロ原子を含む場合、電子(エネルギー)移動を起こすことができる、炭素と同じ外殻電子構造を持つ原子(元素)や、非共有電子対を有する原子、空軌道を持つ原子が好ましい。例として周期律表で炭素と同じ4B族や、生体内でも電子伝達に寄与することが知られている、5B族、6B族の原子が挙げられる。具体的には、炭素(C)、ケイ素(Si)、窒素(N)、リン(P)、酸素(O)、硫黄(S)が挙げられる。
【0047】
本発明における蛍光物質(蛍光色素)は300〜800nmの範囲に蛍光発光を示す化合物が好ましい。このような蛍光物質の例としては、FAM、Cy2、Cy3、Cy3.5、Cy5、Cy5.5、Alexa Fluor 488、Alexa Fluor 532、JOE、ROX、TAMRAが挙げられる。
また、自ら合成した蛍光物質を使用することもできる。
【0048】
本発明において用いられる蛍光物質とエネルギー吸収能を有する官能基を含有する化合物をプローブとして利用することができる。
本化合物をプローブとして使用するためには化学合成法等の公知の核酸合成反応により、合成することができる。なお、化学合成法としては、トリエステル法、亜リン酸法等が挙げられる。例えば、液相法又は不溶性の担体を使った固相合成法等を利用した通常の自動合成機(APPLIEDBIOSYSTEMS社392等)を使用して1本鎖のDNAを合成することができる。
例えば図5に示すように、消光物質Iの導入位置に修飾塩基(図5中NH2のついた塩基)を含む、塩基配列を先に合成し、その後リンカーXや消光物質Iを導入して目的の塩基配列を合成することができる。
また、先にリンカーXや消光物質Iのついた塩基を合成し、その他の塩基を追加して目的の塩基配列を合成しても良い。
プライマーについても、プローブと同様に合成することができる。以下、プローブを例として説明するが、プライマーにも適用することが可能である。
【0049】
本発明のプローブは、標的塩基配列の識別性能に優れているため、遺伝子変異の識別に好適に用いることができる。具体的には、遺伝子変異の変異部位を含む領域の塩基配列を標的塩基配列とする。なお、標的塩基配列は、1個の塩基変異部位のみを有していてもよく、2個以上の塩基変異部位を有していてもよい。
【0050】
本発明のプローブ配列中において蛍光物質とエネルギー吸収能を有する官能基の割合は1:1で機能するが好ましくは1:2であり、一本鎖状態時の蛍光強度がより効果的に抑制される。このため、蛍光を発したときとの差がより大きくなるので測定・検出に有効である。
【0051】
この場合、蛍光物質とエネルギー吸収能を有する官能基の割合とは、プローブ1個(1本)あたりについている、それぞれの原子団、(蛍光物質及び、式(III)の化合物)で示される化合物の個数の割合をいう。例えば、あるプローブに、蛍光物質が1つ(1分子)と消光物質(式(III)の化合物)の中から選ばれる原子団が1つ含まれている場合を、1:1という。
【0052】
本発明の識別方法において、標的となる遺伝子変異としては、がん関連遺伝子、遺伝病に関連する遺伝子、薬剤の代謝や効き目に関する遺伝子、ウィルス遺伝子、及び細菌遺伝子における変異と呼ばれるものである。がん関連遺伝子としては、例えばK−ras遺伝子、BRAF遺伝子、PTEN遺伝子、ALK遺伝子、EGFR遺伝子、N−ras遺伝子、p53遺伝子、BRCA1遺伝子、BRCA2遺伝子、又はAPC遺伝子等が挙げられる。遺伝病に関連する遺伝子としては、各種先天性代謝異常症等との関連が報告されている遺伝子等が挙げられる。薬剤の代謝に関しては薬剤の代謝に関わる酵素であるシトクロムP450やトランスポーター等の遺伝子が挙げられる。ウィルス遺伝子、細菌遺伝子としては、例えばC型肝炎ウィルス、B型肝炎ウィルス等の遺伝子が挙げられる。さらに、病気等の原因とは必ずしも直接は関係のないヒト白血球抗原遺伝子であるHLA等も移植の適合性や薬の副作用等と関連して重要である。さらに、ミトコンドリアにコードされている遺伝子変異も病気との関連が示唆されており、これらの遺伝子の変異も標的となりうる。
【0053】
本発明の識別方法は、その高い識別精度から、臨床検査等においても有用である。医療現場における遺伝子検査の実用性を考えた場合に、識別精度の改善は非常に重要である。本発明の識別方法により、SNP等の生殖細胞変異のみならず、体細胞変異も高精度に識別することができる。
【0054】
例えば、K−rasはシグナル伝達系のタンパク質であり、プロトオンコ―ジーンである。多くのがん細胞においてK−ras遺伝子に変異が生じていることが報告されている。特にK−ras遺伝子のコドン12、13にアミノ酸置換を伴う変異が顕著に見られ、13種類の変異パターンが存在することが知られている。最近、K−ras遺伝子に変異がある患者では、抗がん剤であるEGFR抗体薬(セツキシマブ、パニツムマブ)等が効力を発揮できないことが次々に明らかとなっている。このような抗がん剤治療は副作用のみならず高額な費用を要する。したがって、治療前にK−ras変異の検査を行い、効く患者のみを選別して治療することがオーダーメード医療の一環として提案されている。
【0055】
また、EGFR抗体薬であるセツキシマブは、大腸がん治療薬として使用されている。大腸がんの年間罹患数は10万人弱であり、平成17年の死亡者数は4万800人であった。食生活の欧米化により増え続ける傾向にあり、4年後には40,000人の大腸がん患者がEGFR抗体薬治療の対象となるとのEGFR抗体薬のメーカーによる試算もある。当該試算が正しければ、K−rasの検査市場は日本国内だけで4年後には4億円を越すものと予想される。
【0056】
しかしながら、従来の識別法では、体細胞変異を十分な精度で識別することは困難であり、擬陽性が多い、と言う問題があった。本発明の識別方法は、体細胞変異をも非常に精度よく識別可能であることから、臨床検査における精度改善のみならず、擬陽性の低減による医療費の削減にも資することが期待できる。
【0057】
本発明の標的塩基配列識別用キットは、標的塩基配列を識別する方法に用いられるキットであって、前記一般式(I)もしくは前記一般式(II)で表される構造を有する核酸類縁体であるプローブであり、標的塩基配列からなる標的核酸に対して、ハイブリダイズし核酸増幅のためのプライマーとして作用する。本発明の標的塩基配列識別用キットは、本発明によるプローブに加え緩衝剤、塩、有機溶媒等の反応液に添加する試薬や、標識物質の標識を検出するための試薬等を組み合わせても良い。このように、本発明の識別方法に必要な試薬等をキット化することにより、より簡便かつ短時間で標的塩基配列の識別を行うことができる。
【0058】
本化合物がプライマーとして作用するとき、標的塩基配列を有する標的核酸が二本鎖である場合、二本鎖の一方(標的塩基配列:例えばセンス鎖)に相補なプライマーの他に、アンチセンス鎖に相補なプライマーも含む、プライマーセットとして使用しても良い。
また、複数の核酸が混合している試料の中から複数の標的核酸を増幅する場合にも、各標的核酸に相補なプライマーをそれぞれ含む、プライマーセットとして使用しても良い。
【0059】
本発明の標的塩基配列識別用キットは、特に、遺伝子変異の特定の遺伝子型の変異部位を含む領域と相同的な塩基配列を標的塩基配列とし、遺伝子変異を検出するために用いられることが好ましい。
【0060】
本化合物をプローブとして使用する場合、図3に示すように特定の標的塩基配列を有する核酸を識別することが可能である。
複数の核酸の混合物の中に本化合物をプローブとして投入し、核酸を一本鎖に解離(変性)させる。これは、一本鎖になった核酸とプローブの結合(ハイブリダイゼーション)に影響を生じにくい方法で行なえば良いが、熱を加えて行なう方法が好ましい。
一本鎖になった核酸とプローブが結合することで蛍光発光が起こり、標的塩基配列を有する核酸を識別することができる。
標的塩基配列がSNPであれば、特定の遺伝子型の変異部を識別することができる。
識別対象の核酸は、通常のPCRなどの増幅方法で増やしたものを使用することもできるし、本化合物をプローブとして使用して増幅し、増幅したことを確認し、さらに本化合物をプローブとして追加して識別を行なうこともできる。
また、常法により抽出された核酸等を増幅せずに試料とすることもできる。
【実施例】
【0061】
以下、本発明を実施例によりさらに説明するが、本発明は下記例に制限されない。
【実施例1】
【0062】
ODN 2(配列番号4) 合成
図4に示すようにピレン修飾された核酸ODN 2の合成を行った。ODN 1(配列番号3:70μlMのナフタレンジイミド誘導体(2 mg含有DMF溶液、50 μl:約80mM相当)、0.1 M炭酸水素ナトリウムとなるような100 μlの反応溶液を調整し37℃条件下で2時間静置した。DMFはジメチルホルムアミドのことをさす。
【0063】
ODN 2 精製
以降、特に断りがない場合は、TEAAは酢酸トリエチルアミン、TEABはトリエチルアンモニウムバイカーボネートをさす。
Sephadexカラムにて50 mM TEAB bufferを用いて図4に示した反応溶液の精製をSephadexカラムにて行った。主だったピークを分取した後に一昼夜かけて凍結乾燥することで溶媒を除去した。乾燥により得られたペレット状のものをそれぞれ超純水 (100 μl) に溶かし込んだ後、HPLCにて精製した。溶離液はA液として50 mM TEAA buffer、B液として50% アセトニトリル−50 mM TEAA buffer水溶液を用いて、0分から28分までの間にB液の割合を30%から90%に変化させて、カラム温度を30℃に保ち精製を実行した。
収集したフラクションを分取した後に凍結乾燥により溶媒を除去し、再度Sephadexカラムにて残留しているTEAA bufferを除去して凍結乾燥を行った。乾燥したオリゴDNAを超純水 (100 μl)に溶解させて、更に凍結乾燥させることでTEAA bufferを完全に除去した。
得られたODN2と本願発明の化合物との対応を図5に示す。
【0064】
ODN 4 (配列番号6)合成
図6に示すようにピレンを二つ導入した核酸ODN 4の合成を行った。ODN 3(配列番号5:70 μlMのナフタレンジイミド誘導体(2 mg含有DMF溶液、50 μl:約80mM相当)、0.1 M炭酸水素ナトリウムとなるような100 μlの反応溶液を調整し37℃条件下で2時間静置した。
【0065】
ODN 4精製
Sephadexカラムにて50 mM TEAB bufferを用いて図6に示した反応溶液の精製をSephadexカラムにて行った。主だったピークを分取した後に一昼夜かけて凍結乾燥することで溶媒を除去した。乾燥により得られたペレット状のものをそれぞれ超純水 (100 μl) に溶かし込んだ後、HPLCにて精製した。溶離液はA液として50 mM TEAA buffer、B液として50% アセトニトリル−50 mM TEAA buffer水溶液を用いて、0分から28分までの間にB液の割合を30%から90%に変化させて、カラム温度を30℃に保ち精製を実行した。
収集したフラクションを分取した後に凍結乾燥により溶媒を除去し、再度Sephadexカラムにて残留しているTEAA bufferを除去して凍結乾燥を行った。乾燥したオリゴDNAを超純水 (100 μl)に溶解させて、更に凍結乾燥させることでTEAA bufferを完全に除去した。
【0066】
<実験:ARMS法による核酸配列の識別>
<実験1>
先に合成したODN 2,4をそれぞれARMS法のプライマーとして用いて、核酸増幅のプライマー及び核酸配列の識別が可能であることを示す。標的とする配列はワルファリンの至適投与量に関連する遺伝子であるビタミンKエポキシド還元酵素複合体1(VKORC1)のイントロン1領域の1173位における遺伝子多型(1173C>T)を識別対象とした。
【0067】
表1に示されるように、VKORC1の上記遺伝子多型を検出するARMSプライマーとしてODN 2及び共通のR−プライマー(配列番号7)を用いた。検出プライマーは5’末端から数えて10番目の塩基にフルオレセイン修飾したチミジン、12番目の塩基にピレン修飾したシチジンを導入したものである。鋳型となるゲノムDNAとしてはCoriell社から購入したものを用いた。表1中、1173位を太字で示し、ミスマッチ塩基導入部位に下線を付した。また、「Pyrene」はピレンを、「6−FAM」は6−フルオロセインを意味している。
【0068】
【表1】

【0069】
鋳型として、VKORC1の遺伝子多型であるCアレル(配列番号1)、またはTアレル(配列番号2)を、検出用プライマーとしてODN 2、R-プライマーを混合した反応液を表2記載の組成となるように調整した。上記反応液をリアルタイムPCRシステム(Roche社製、「LightCycler(登録商標)」)にセットし、95℃で1分間保持し、DNAポリメラーゼの抗体を変性させた後、62℃20秒、95℃5秒の2ステップPCRを55サイクル行い、95℃から40℃まで融解曲線解析を行った。なお、鋳型に蒸留水(D.W.)を用いたものをネガティブコントロールとした。結果を図7に示す。核酸増幅反応0サイクル目の蛍光強度をF0として各サイクルの蛍光強度Fiを下記の式(IV)に代入して蛍光強度変化率ΔFを表した。
図8は、実験1の結果を融解曲線の負の一次微分曲線で示した図である。
【0070】
【数1】

式(IV)
【0071】
【表2】

【0072】
ODN2が二本鎖を形成すると、エネルギー吸収物質であるピレンが二本鎖核酸にインターカレートし、エネルギー吸収量が小さくなるため、6−フルオロセインからの蛍光強度が大きくなる。
融解曲線とは、温度を低温から徐々に上げることにより、増幅された二本鎖核酸が一本鎖状態に変性するまでの蛍光強度を測定して得られる曲線をいう。融解曲線の負の一次微分曲線は温度変化に対する蛍光変化量を示すもので、変化量が最大のところが二本鎖DNAのTmとなる。
実験1において、ODN 2からの伸長産物は、83℃から86℃の範囲で一本鎖状態と二本鎖状態の変化量が最も多いことが既に分かっている。よって、融解曲線の負の一次微分曲線において83℃から86℃の範囲でピークが見られる場合には、ODN 2から伸長反応が起きたと判断することができる。
実験1のODN 2、R−プライマーのセットでCアレルあるいはTアレルを鋳型として用いた場合、Cアレル特異的な増幅が確認された。
【0073】
<実験2>
鋳型として、VKORC1の遺伝子多型であるCアレル、またはTアレルを、検出用プライマーとしてODN 4、R−プライマーを混合した反応液を表3記載の組成となるように調整した。上記反応液をリアルタイムPCRシステム(Roche社製、「LightCycler(登録商標)」)にセットし、95℃で1分間保持し、DNAポリメラーゼの抗体を変性させた後、62℃20秒、95℃5秒の2ステップPCRを55サイクル行い、95℃から40℃まで融解曲線解析を行った。なお、鋳型に蒸留水(D.W.)を用いたものをネガティブコントロールとした。結果を図9に示す。図10は、実験2の結果を融解曲線の負の一次微分曲線で示した図である。
【0074】
【表3】

【0075】
ODN4が、二本鎖を形成すると、エネルギー吸収物質であるピレンが二本鎖核酸にインターカレートし、エネルギー吸収量が小さくなるため、6−フルオロセインからの蛍光強度が大きくなる。
融解曲線とは、温度を低温から徐々に上げることにより、増幅された二本鎖核酸が一本鎖状態に変性するまでの蛍光強度を測定して得られる曲線をいう。融解曲線の負の一次微分曲線は温度変化に対する蛍光変化量を示すもので、変化量が最大のところが二本鎖DNAのTmとなる。
【0076】
実験1において、ODN 4からの伸長産物は、83℃から86℃の範囲で一本鎖状態と二本鎖状態の変化量が最も多いことが既に分かっている。よって、融解曲線の負の一次微分曲線において83℃から86℃の範囲でピークが見られる場合には、ODN 2から伸長反応が起きたと判断することができる。
実験2のODN 4、R−プライマーのセットでCアレルあるいはTアレルを鋳型として用いた場合、Cアレル特異的な増幅が確認された。
【符号の説明】
【0077】
F 蛍光物質
I エネルギー吸収能を有する官能基
【特許請求の範囲】
【請求項1】
蛍光物質及びエネルギー吸収能を有する官能基を含む化合物であって、標的核酸配列が増幅したことを検出、標的核酸配列の変異の種類を識別、するものであり、下記式(I)または(II)で表される構造を少なくとも一つ含むことを特徴とする化合物。
【化1】

式(I)
【化2】

式(II)
式(I)及び(II)中、Fは蛍光物質であり、Iはエネルギー吸収能を有する官能基であり、式(II)においてI同士は同一でも異なっていてもよく、Xはリンカーであり主鎖の長さ及び構造は任意であり、主鎖中にはC、O、N、S、P及びSiを含んでも含まなくてもよく、主鎖中に単結合、二重結合、三重結合、アミド結合、エステル結合、ジスルフィド結合、エーテル結合、チオアミド結合、チオエーテル結合、チオエステル結合及びイミノ基を含んでも含まなくてもよく、Bは核酸塩基骨格(アデニン、グアニン、シトシン、チミンまたはウラシル)または修飾及び人工核酸塩基であり、Rはデオキシリボース骨格、リボース骨格及びそれらの誘導体であり、Pはリン酸ジエステル骨格及びチオリン酸ジエステル骨格、あるいはそれらの誘導体であり、式(I)及び(II)中のX、B、R、Pはそれぞれ同一でも異なっていてもよく、l、m、nは1〜3の整数を表し、mとnの数は同一でも異なっていてもよい核酸類縁体である。
【請求項2】
前記エネルギー吸収能を有する官能基Iは一般式(III)−(a)〜(l)のいずれかからなることを特徴とする請求項1に記載の化合物。
【化3】

式(III)
【請求項3】
前記蛍光物質は前記式(I)及び(II)におけるXと結合するための結合部を有していることを特徴とする請求項1または2に記載の化合物。
【請求項4】
前記化合物は、核酸増幅用プライマーとして用いることもでき、かつ、標的核酸配列が増幅したことを検出、特定の標的核酸配列を識別、するプローブとして用いることもできることを特徴とする請求項1から3のいずれかに記載の化合物。
【請求項5】
請求項1から3のいずれか一項に記載の化合物をプライマーとして使用するときにおいて、全長が15〜25残基であることを特徴とするプライマー。
【請求項6】
前記標的核酸配列を増幅し、増幅した核酸を検出する際に使用するプライマーセットにおいて、プライマーセットを構成するプライマーの少なくとも一つのプライマーは請求項1から5のいずれかの化合物であることを特徴とするプライマーセット。
【請求項7】
標的核酸配列の増幅は、
(a)標的塩基配列を含む塩基配列からなる標的核酸を有する核酸試料に、前記標的塩基配列に相補的な少なくとも1種の、請求項1から6いずれか一項に記載の化合物がプライマーとしてアニールする工程と、
(b)前記核酸試料中の標的塩基配列を鋳型として用い、前記標的核酸にアニールさせた前記プライマーから伸長産物を合成し、前記標的核酸を増幅する工程と、
(c)前記伸長産物を検出する工程
からなることを特徴とする標的核酸の検出方法。
【請求項8】
前記工程(c)は前記工程(b)と同時に行われる工程であって、前記プライマーからの伸長産物である標的核酸が二本鎖核酸構造を形成しており、当該二本鎖核酸構造によって前記プライマーがプローブとして作用し、前記標的核酸を検出することを特徴とする請求項7に記載の標的核酸の検出方法。
【請求項9】
前記工程(c)は前記工程(b)の後に行われる工程であって、前記プライマーからの伸長産物である標的核酸が二本鎖核酸構造を形成しており、当該二本鎖核酸構造によって前記プライマーがプローブとして作用し、融解曲線を利用して前記標的核酸を検出することを特徴とする請求項7に記載の標的核酸の検出方法。
【請求項10】
請求項1から3のいずれか一項に記載の化合物をプローブとして用い、複数の異なる塩基配列を有する核酸の中から特定の標的核酸を選択することを特長とする、核酸の識別方法。
【請求項11】
請求項1から3いずれか一項に記載の化合物をプライマーとして用いるときに、ARMS法と併用し、プライマーの蛍光発光−消光を検出することで、鋳型とした標的核酸配列の変異の種類を識別することを特徴とする請求項10に記載の標的核酸配列の変異の種類の識別方法。
【請求項1】
蛍光物質及びエネルギー吸収能を有する官能基を含む化合物であって、標的核酸配列が増幅したことを検出、標的核酸配列の変異の種類を識別、するものであり、下記式(I)または(II)で表される構造を少なくとも一つ含むことを特徴とする化合物。
【化1】

式(I)
【化2】

式(II)
式(I)及び(II)中、Fは蛍光物質であり、Iはエネルギー吸収能を有する官能基であり、式(II)においてI同士は同一でも異なっていてもよく、Xはリンカーであり主鎖の長さ及び構造は任意であり、主鎖中にはC、O、N、S、P及びSiを含んでも含まなくてもよく、主鎖中に単結合、二重結合、三重結合、アミド結合、エステル結合、ジスルフィド結合、エーテル結合、チオアミド結合、チオエーテル結合、チオエステル結合及びイミノ基を含んでも含まなくてもよく、Bは核酸塩基骨格(アデニン、グアニン、シトシン、チミンまたはウラシル)または修飾及び人工核酸塩基であり、Rはデオキシリボース骨格、リボース骨格及びそれらの誘導体であり、Pはリン酸ジエステル骨格及びチオリン酸ジエステル骨格、あるいはそれらの誘導体であり、式(I)及び(II)中のX、B、R、Pはそれぞれ同一でも異なっていてもよく、l、m、nは1〜3の整数を表し、mとnの数は同一でも異なっていてもよい核酸類縁体である。
【請求項2】
前記エネルギー吸収能を有する官能基Iは一般式(III)−(a)〜(l)のいずれかからなることを特徴とする請求項1に記載の化合物。
【化3】

式(III)
【請求項3】
前記蛍光物質は前記式(I)及び(II)におけるXと結合するための結合部を有していることを特徴とする請求項1または2に記載の化合物。
【請求項4】
前記化合物は、核酸増幅用プライマーとして用いることもでき、かつ、標的核酸配列が増幅したことを検出、特定の標的核酸配列を識別、するプローブとして用いることもできることを特徴とする請求項1から3のいずれかに記載の化合物。
【請求項5】
請求項1から3のいずれか一項に記載の化合物をプライマーとして使用するときにおいて、全長が15〜25残基であることを特徴とするプライマー。
【請求項6】
前記標的核酸配列を増幅し、増幅した核酸を検出する際に使用するプライマーセットにおいて、プライマーセットを構成するプライマーの少なくとも一つのプライマーは請求項1から5のいずれかの化合物であることを特徴とするプライマーセット。
【請求項7】
標的核酸配列の増幅は、
(a)標的塩基配列を含む塩基配列からなる標的核酸を有する核酸試料に、前記標的塩基配列に相補的な少なくとも1種の、請求項1から6いずれか一項に記載の化合物がプライマーとしてアニールする工程と、
(b)前記核酸試料中の標的塩基配列を鋳型として用い、前記標的核酸にアニールさせた前記プライマーから伸長産物を合成し、前記標的核酸を増幅する工程と、
(c)前記伸長産物を検出する工程
からなることを特徴とする標的核酸の検出方法。
【請求項8】
前記工程(c)は前記工程(b)と同時に行われる工程であって、前記プライマーからの伸長産物である標的核酸が二本鎖核酸構造を形成しており、当該二本鎖核酸構造によって前記プライマーがプローブとして作用し、前記標的核酸を検出することを特徴とする請求項7に記載の標的核酸の検出方法。
【請求項9】
前記工程(c)は前記工程(b)の後に行われる工程であって、前記プライマーからの伸長産物である標的核酸が二本鎖核酸構造を形成しており、当該二本鎖核酸構造によって前記プライマーがプローブとして作用し、融解曲線を利用して前記標的核酸を検出することを特徴とする請求項7に記載の標的核酸の検出方法。
【請求項10】
請求項1から3のいずれか一項に記載の化合物をプローブとして用い、複数の異なる塩基配列を有する核酸の中から特定の標的核酸を選択することを特長とする、核酸の識別方法。
【請求項11】
請求項1から3いずれか一項に記載の化合物をプライマーとして用いるときに、ARMS法と併用し、プライマーの蛍光発光−消光を検出することで、鋳型とした標的核酸配列の変異の種類を識別することを特徴とする請求項10に記載の標的核酸配列の変異の種類の識別方法。
【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図1】


【図2】


【図3】




【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図1】


【図2】


【図3】


【公開番号】特開2012−147722(P2012−147722A)
【公開日】平成24年8月9日(2012.8.9)
【国際特許分類】
【出願番号】特願2011−8719(P2011−8719)
【出願日】平成23年1月19日(2011.1.19)
【出願人】(000003193)凸版印刷株式会社 (10,630)
【Fターム(参考)】
【公開日】平成24年8月9日(2012.8.9)
【国際特許分類】
【出願日】平成23年1月19日(2011.1.19)
【出願人】(000003193)凸版印刷株式会社 (10,630)
【Fターム(参考)】
[ Back to top ]

