エピガロカテキンガレート重合体を有効成分とするグルコシルトランスフェラーゼ阻害剤
【課題】嗜好性が高く、安全性も高いグルコシルトランスフェラーゼ阻害剤または抗う蝕剤を提供すること。
【解決手段】エピガロカテキンガレートの重合体またはその塩を有するグルコシルトランスフェラーゼ阻害剤または抗う蝕剤。特に、クマロン環の6位および/または8位でメチレン基を介して結合した化合物であるエピガロカテキンガレート重合体を含む上記剤。
【解決手段】エピガロカテキンガレートの重合体またはその塩を有するグルコシルトランスフェラーゼ阻害剤または抗う蝕剤。特に、クマロン環の6位および/または8位でメチレン基を介して結合した化合物であるエピガロカテキンガレート重合体を含む上記剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、エピガロカテキンガレート重合体を有効成分とするグルコシルトランスフェラーゼ阻害剤、およびこれを添加した飲食品に関する。
【背景技術】
【0002】
う蝕の原因については過去に種々の仮説が提唱されたが、現在ではミラー(Miller)の化学細菌説に基づく細菌感染症の一種であると認められている。この説によれば、う蝕の発生機構は以下の通りである。即ち、口腔連鎖球菌、特にストレプトコッカス・ミュータンス(Streptococcus mutans、以下「S・ミュータンス」と略称する。)が産生するグルコシルトランスフェラーゼ(糖転移酵素、GTF)が、口中のショ糖を基質として、粘着性で不溶性の多糖(グルカン)を生成する。S・ミュータンスの菌体は、生成したグルカンによって、歯表面に付着して菌塊(プラーク)を形成する。プラーク中では、S・ミュータンスを始め種々の微生物が共生・繁殖しているが、これら微生物の代謝によって有機酸が産生され、この有機酸の作用でプラーク内部のpHが低下し、歯のエナメル質表面に脱灰が生じてう蝕が発生し、進行する。また、歯垢形成は、う蝕のほかに、歯周病や口臭の原因となるとされている。
【0003】
このようにS・ミュータンスを中心とする口腔連鎖球菌によって形成される歯垢がう蝕の原因となっていることから、歯垢形成を抑えることが、ひいてはう蝕の発生を予防する有効な手段となりうる。
【0004】
近年、抗う蝕作用を有する物質として、植物などに含まれるカテキン類が注目されている。特許文献1には、フラボノイド(カテキン類の一種)をペルオキシダーゼで処理することにより製造される800〜5000の分子量を有するフラボノイド重合物は、処理前に比べて、グルコシルトランスフェラーゼの阻害作用が増強されることが報告されている。
【0005】
また、非特許文献1には、フラボノイド重合物が、ストレプトコッカス・ソブリヌス(Streptococcus sobrinus)由来のグルコシルトランスフェラーゼの活性を、2.5μg/mLで50%阻害することが報告されている。
【0006】
また、特許文献2には、フラバノン類/フラバノール類の還元物あるいはロイコシアニジン類をカテキン類と縮合させることにより製造される重量分子量が1000〜10000のフラボノイド重合物に、グルコシルトランスフェラーゼの阻害作用がみられることが報告されている。
【0007】
しかし、これらのフラボノイド重合物は、フラボノイドの3〜5量体の混合物または2〜3量体の混合物であって、混合物中に含まれる種々の化合物の単離は行なわれておらず、したがって化合物単体の各々に関してのグルコシルトランスフェラーゼ阻害活性に関しては明らかにされていない。
【0008】
日常飲食する茶の中では、非発酵茶である緑茶に由来するカテキン類の混合物にグルコシルトランスフェラーゼ阻害作用がみられることが報告されている(非特許文献2)。しかし、ラットを用いた試験では、充分な抗う蝕作用が得られなかったことも報告されている。
【0009】
また、半発酵茶であるウーロン茶やその精製品に、グルコシルトランスフェラーゼ阻害活性がみられることが報告されている(特許文献3、非特許文献3、非特許文献4、および非特許文献5)。また、緑茶や烏龍茶、紅茶を加熱処理することでグルコシルトランスフェラーゼ阻害活性が増強されることや(特許文献4)、カテキン類を加熱処理することでグルコシルトランスフェラーゼ阻害活性が増強されることが知られている(特許文献5)。
【0010】
しかし、いずれの場合にも、茶由来の混合物のうち、どの化合物に活性があるのかについては明らかにされていない。
【特許文献1】特開平6−247959号公報
【特許文献2】特開平7−242556号公報
【特許文献3】特開平6−279302号公報
【特許文献4】特開平3−284625号公報
【特許文献5】特開平3−284671号公報
【非特許文献1】FEMS Microbiology Letters 143 (1996) 35-40, Hamada S. et al.
【非特許文献2】Caries Res. 25 (1991) 438-443, Otake S. et al.
【非特許文献3】Applied and Environmental Microbiology, 59, No.4 (1993) 968-973, Nakahara K. et al.
【非特許文献4】The Nippon Dental review No.622 (August 1994) 179-189, Ooshima T. and Hamada S.
【非特許文献5】FEMS Microbiology Letters 228 (2003) 73-80, , Matsumoto M. et al.
【発明の開示】
【発明が解決しようとする課題】
【0011】
上記のとおり、グルコシルトランスフェラーゼ阻害活性を有する植物抽出物等に関する報告はなされているが、いずれの場合にも、植物抽出物由来の混合物に活性がみられることが報告されるのみであって、具体的な活性成分(化合物)は明らかとされておらず、活性成分の同定が望まれていた。また、嗜好性の低い植物由来の成分を飲食品に利用すると、飲食品の香味および安全性を害することが予想されるので、嗜好性の高い植物由来の活性成分を探索することが望まれていた。
【課題を解決するための手段】
【0012】
本発明者らは、飲食物として利用することを考慮し、日常飲用されている茶に含まれる成分に着目し鋭意検討したところ、ウーロン茶などに含まれるカテキン類の一種である(−)−エピガロカテキン−3−O−ガレート(以下、EGCGともよぶ)を重合して得られたEGCG重合体に、中でも、特にEGCG3量体に強いグルコシルトランスフェラーゼ阻害活性がみられることを見出し、本発明に至った。
【0013】
すなわち、本発明は以下のとおりである。
1. エピガロカテキンガレート3量体またはその塩を有効成分とするグルコシルトランスフェラーゼ阻害剤。
2. 前記エピガロカテキンガレート3量体が、クロマン環の6位および/または8位でメチレン基を介して結合した化合物である、上記1に記載のグルコシルトランスフェラーゼ阻害剤。
3. 前記エピガロカテキンガレート3量体が、次式(I):
【0014】
【化1】

を有する化合物、次式(II):
【0015】
【化2】

を有する化合物、および次式(III):
【0016】
【化3】

を有する化合物
(式(I)〜(III)中、Rは次式(A):
【0017】
【化4】

で表されるガロイル基である)
からなる群から選択される化合物である、上記2に記載のグルコシルトランスフェラーゼ阻害剤。
4. 次式(IV):
【0018】
【化5】

で表される化合物を有効成分とするグルコシルトランスフェラーゼ阻害剤。
5. エピガロカテキンガレート3量体またはその塩を有効成分とする抗う蝕剤。
6. 前記エピガロカテキンガレート3量体が、クロマン環の6位および/または8位でメチレン基を介して結合した化合物である、上記5に記載の抗う蝕剤。
7. 前記エピガロカテキンガレート3量体が、前記式(I)を有する化合物、前記式(II)を有する化合物、および前記式(III)を有する化合物(式(I)〜(III)中、Rは前記式(A)で表されるガロイル基である)からなる群から選択される化合物である、上記6に記載の抗う蝕剤。
8. 前記式(IV)で表される化合物を有効成分とする抗う蝕剤。
9. 上記1〜8のいずれかに記載のグルコシルトランスフェラーゼ阻害剤または抗う蝕剤を添加した飲食品。
10. 前記飲食品が茶飲料である、上記9に記載の飲食品。
11. 上記1〜8のいずれかに記載のグルコシルトランスフェラーゼ阻害剤または抗う蝕剤を添加した口腔衛生剤。
【発明の効果】
【0019】
本発明者らにより、(−)−エピガロカテキン−3−O−ガレート(EGCG)重合体、特に特定のEGCG2量体および3量体に、高いグルコシルトランスフェラーゼ阻害作用がみられることが見出された。上記のとおり、グルコシルトランスフェラーゼ(以下、GTFともいう)は口中で歯垢の原因となるグルカンを生成するので、GTFの活性を阻害することにより、う蝕を予防することができる。したがって、本発明のGTF阻害剤は、抗う蝕剤として用いることができる。また、本発明のGTF阻害剤は、歯垢の原因となるグルカンの生成を抑えるので、口臭を抑える効果も期待できる。さらに、本発明のGTF阻害剤は、ウーロン茶などの日常飲食する飲食品に含まれるEGCGに由来するため、嗜好性が高く、人体に対して高い安全性を有する。また、このGTF阻害剤を飲食品に一定量含有させることにより、飲食品の香味を過度に損なうことなく、嗜好性の高い、安全な、抗う蝕作用を有する飲食品を提供することができる。
【発明を実施するための最良の形態】
【0020】
<エピガロカテキンガレート重合体>
(−)−エピカロカテキン−3−O−ガレート(EGCG)は、緑茶などの茶に含まれるカテキン類のうちの主要な成分の1つであり、次の式:
【0021】
【化6】

により表される構造を有する化合物である。
【0022】
本発明のGTF阻害剤に含まれる有効成分は、上記EGCGの重合体である。本発明には、特に、EGCGがそのクマロン環の6位および/または8位でメチレン基を介して2または3個結合した構造を有するEGCG重合体を好ましく用いることができる。そのようなEGCG重合体の具体例としては、次の式(I)、式(II)、および式(III):
【0023】
【化7】

【0024】
【化8】

【0025】
【化9】

により表されるEGCG3量体(式(I)〜(III)中、Rはガロイル基である)、および次式(IV):
【0026】
【化10】

で表されるEGCG2量体などが挙げられる。
【0027】
式(I)の化合物は、EGCGの結合様式に基づいて、EGCG8:8EGCG6:8EGCGと表記することができる(以下、本明細書では、ウーロンホモビスフラバン−トリマー−1、OHBF−Tri−1、またはTri−1とよぶ)。同様に、式(II)の化合物は、EGCG6:8EGCG6:8EGCGと表記することができる(以下、本明細書では、ウーロンホモビスフラバン−トリマー−2、OHBF−Tri−2、またはTri−2とよぶ)。また、式(III)の化合物は、EGCG8:8EGCG6:6EGCGと表記することができる(以下、本明細書では、ウーロンホモビスフラバン−トリマー−4、OHBF−Tri−4、またはTri−4とよぶ)。式(IV)の化合物は、EGCG6:8EGCGと表記することができる。式(IV)の化合物はウーロン茶などに含まれる化合物であることが報告されており、ウーロンホモビスフラバン−B(OHBF−B)として知られている。なお、式(II)および(III)の化合物は、新規化合物である。
【0028】
上記のEGCG重合体は、エピガロカテキンガレートを、溶媒中、酸の存在下でホルムアルデヒドと反応させることによって製造することができる。
【0029】
反応に使用することができる溶媒としては、例えば、メタノール、エタノール、n−プロパノール、およびイソプロパノール等のアルコール類が挙げられる。溶媒の使用量については特に制限はないが、例えば、1質量部のエピガロカテキンガレートに対して20〜200質量部の溶媒を用いることができる。
【0030】
酸としては、例えば、塩酸、硫酸、および硝酸等の無機酸、ならびに、蟻酸および酢酸等の有機酸などを用いることができる。酸の使用量については特に制限はないが、例えば、1モルのエピガロカテキンガレートに対して、0.01〜2モルの酸を用いることができる。
【0031】
ホルムアルデヒドは、例えば、1モルのEGCGに対して、1〜100モルで用いることができる。
【0032】
反応の温度および時間は、用いる溶媒量等によって変わりうるが、例えば、反応温度は、−10〜50℃、反応時間は10分〜12時間である。典型的には、反応温度は室温(25℃程度)である。
【0033】
EGCGとホルムアルデヒドとの反応によって得られる生成物は、通例、メチレン基によるクロマン環の連結様式が異なる化合物の少なくとも二種の化合物を含有する混合物である。例えば、HP−20(三菱化学株式会社製)などのスチレン系吸着樹脂や、Shephadex LH−20のようなデキストラン系樹脂によるオープンカラムクロマトグラフィー、ならびに高速液体クロマトグラフィー(HPLC)などの公知の生成方法を用いることにより、このような混合物から、式(I)〜(IV)の各化合物を単離することができる。
【0034】
なお、式(I)の化合物(OHBF−Tri−1)の調製方法は、特許文献(WO2005/116005)に、「三量体(4)」の合成および精製方法として、記載されている。また、式(IV)の化合物(OHBF−B)の調製方法は、文献(Chem.Pharm.Bull 37(12), 3255-3563(1989))に記載されている。
【0035】
本発明のグルコシルトランスフェラーゼ阻害剤に用いられるEGCG重合体は、塩の形態であってもよい。そのような塩としては、医薬的にまたは食品として許容可能な塩であれば特に制限されず、例えば、リチウム塩、ナトリウム塩、カリウム塩、カルシウム塩、およびマグネシウム塩などの周期表の1族または2族の金属元素の塩を挙げることができる。このような金属塩は、例えば、EGCGのフェノール性水酸基において形成することができる。
【0036】
例えば、EGCG3量体のナトリウム塩は、EGCG3量体と金属ナトリウムまたは水素化ナトリウムとを、非プロトン性溶媒中で反応させて、EGCG3量体に含まれる水酸基(−OH)をナトリウムアルコキシド基(−ONa)に変換することによって製造することができる。この際、金属ナトリウムまたは水素化ナトリウムの使用量を調節することで、EGCG3量体に含まれる水酸基のすべてをナトリウムアルコキシド基に変換することができ、また、水酸基の一部のみをナトリウムアルコキシド基に変換することもできる。
【0037】
これらのEGCG重合体は合成によって得ることもできるが、実施例5に後述する通り、烏龍茶中にも存在することが判明した。そのため、本発明のGTF阻害剤の有効成分であるEGCG重合体は、Camellia sinensis [A1]の葉を原料とする茶類、好ましくは烏龍茶、紅茶等の発酵茶や焙じ茶から抽出および精製することによって、単離することもできる。
【0038】
<EGCG重合体を有効成分とするGTF阻害剤または抗う蝕剤>
本発明者らにより、EGCG重合体、特に上記の式(I)の化合物であるウーロンホモビスフラバン−トリマー−1、式(II)の化合物であるウーロンホモビスフラバン−トリマー−2、式(III)の化合物であるウーロンホモビスフラバン−トリマー−4、および式(IV)の化合物であるウーロンホモビスフラバン−Bに高いグルコシルトランスフェラーゼ阻害作用がみられることが見出された。
【0039】
グルコシルトランスフェラーゼ阻害作用の測定は、背景技術に示した先行文献等に記載されるいずれの評価法を用いても行なうことができる。例えば、Streptococcus mutansなどから調製したグルコシルトランスフェラーゼを、ショ糖を含む水溶液中に添加し、口腔内と同程度の温度(約37℃)で、24時間未満、好ましくは16〜20時間程度インキュベートして、酵素反応によりショ糖からグルカンを生成させる。グルカンは水に不溶であるため、得られた反応液の濁度(例えば波長550nmにおける濁度)を測定することにより、グルカンの生成量を評価することができる。グルカンの生成量が少ない(すなわち、濁度が低い)場合は、グルカンの生成量が多い(すなわち、濁度が高い)場合に比べて、グルコシルトランスフェラーゼの活性がより阻害されているといえる。
【0040】
本発明のグルコシルトランスフェラーゼ阻害剤は、グルコシルトランスフェラーゼ(GTF)の活性を阻害することにより、口中で歯垢の原因となるグルカンの生成を抑えることができるから、抗う蝕剤として用いることができる。
【0041】
本発明のグルコシルトランスフェラーゼ阻害剤または抗う蝕剤は、ウーロン茶などの日常飲食する飲食品に含まれるEGCGに由来するため、嗜好性が高く、人体に対して高い安全性を有する。
【0042】
<飲食品>
本発明のグルコシルトランスフェラーゼ阻害剤または抗う蝕剤は、虫歯予防などの抗う蝕を目的として、各種飲食品に添加することができる。本発明のグルコシルトランスフェラーゼ阻害剤または抗う蝕剤を添加する飲食品の例としては、清涼飲料、茶飲料、液状強壮剤、健康飲料、栄養補給飲料、スポーツドリンク、炭酸飲料(これら飲料の濃縮原液および調製用粉末を含む)などの飲料や、ガム、キャンディー、ゼリー、錠菓、健康食品、栄養補給食品、サプリメントなどの食品が揚げられる。
【0043】
飲食品への添加量は、所望の効果が得られる範囲であれば特に限定されず、飲食品の味、色、香りなどの点を考慮することにより適宜決定できる。例えば、抗う蝕を目的とした飲料を調製する場合、飲料中に0.01〜1000ppm程度の濃度でEGCG重合体を添加することができる。また、EGCG重合体を固形の食品に添加する場合、固形食品の重量に対して、0.01〜5000μg/g程度のEGCG重合体を添加することができる。
【0044】
<口腔衛生剤>
本発明のグルコシルトランスフェラーゼ阻害剤または抗う蝕剤は、グルコシルトランスフェラーゼ(GTF)の活性を阻害することにより、口中で歯垢の原因となるグルカンの生成を抑えることができるため、虫歯予防および口臭予防などの口腔衛生剤に用いることができる。本発明における口腔衛生剤の例としては、歯磨、洗口液、トローチなどが挙げられる。これらの口腔衛生剤は、当業界で慣用される担体を用いて、慣用の手法で製造することができる。担体の例としては、製剤素材として慣用の各種有機または無機担体物質を用いることができる。また、必要に応じて、防腐剤、抗酸化剤、着色料、甘味剤などの製剤添加物を配合することもできる。本発明のGTF阻害剤または抗う蝕剤の口腔衛生剤への添加量は、口腔衛生剤の形態などに応じて適宜決定できるが、例えば、口腔衛生剤中に、0.0001〜10重量%程度の濃度となるように、EGCG重合体を含有させることができる。
【0045】
本発明を以下の実施例によってさらに詳しく説明するが、本発明はこれらによって制限されるものではない。
【実施例1】
【0046】
EGCG重合体の合成および精製
ア.合成とオープンカラムによる分画:
6gの(−)−エピガロカテキン−3−O−ガレート(EGCG)(ロッシュ社、Teavigo(登録商標))を0.02N HClを含む120mlのエタノールに溶解し、4%ホルムアルデヒドのエタノール溶液180mlを加え、室温で4時間、撹拌した。反応終了後、純水で10倍に希釈し、吸着樹脂CHP−20Pカラム(600ml、37−75μm、三菱化学株式会社)に負荷した。1200mlの水で洗浄後、900mlの25%CH3CN、1200mlの30%CH3CNで順次溶出し、25%CH3CN溶出画分は300mlずつ3フラクション(fr.1からfr.3)に分け、30%CH3CN溶出画分は300mlずつ4フラクション(fr.4からfr.7)に分画した。
【0047】
イ.分取HPLC条件:
CHP−20Pカラム精製で得られた分画物をさらに逆相の分取HPLCで精製した。
<条件>
カラム: Develosil ODS−HG−5(5cmφx50cm、野村化学株式会社)
移動相:A:0.05%TFA/H2O、B:90%CH3CN/0.05%TFA/H2O
流速:32ml/min
グラジエントプログラム:A80%/B20%でアイソクラティック(30min)、A80%/B20%からA60%/B40%へグラジエント(100min)、A60%/B40%でアイソクラティック(20min)
検出:A280nm
サンプル:CHP−20Pカラム精製で得られたfr.2からfr.7を、それぞれ20%CH3CNに溶解し、数回に分けて全量を負荷した。
【0048】
上記の分析条件おいて、保持時間113分(化合物1)、120分(化合物2)、130分(化合物3)、および保持時間85分(化合物4)、保持時間106分(化合物5)、保持時間104分(化合物6)に相当する各ピークを集めた。
【0049】
ウ.化合物の構造解析:
分取HPLCで単離した化合物について、MSおよびNMR測定を行った。このうち、化合物4〜6のMSをQ−TOF Premier(Micromass社製、UK)により、ネガティブ、Vモードで測定したところ、それぞれm/z927.160、927.163、1397.248の[M−H]-のイオンピークが認められた。また、化合物4のNMRスペクトルデータは文献(Chem. Pharm. Bull 37(12), 3255−3563(1989))に記載のウーロンホモビスフラバン−AのNMRスペクトルデータと一致した。化合物5のNMRスペクトルデータは文献(Chem. Pharm. Bull 37(12), 3255−3563(1989))に記載のウーロンホモビスフラバン−BのNMRスペクトルデータと一致した。さらに、化合物6のNMRスペクトルデータから、化合物6は、上記の式(I)の化合物、すなわち、ウーロンホモビスフラバン−トリマー−1であることがわかった。これらの結果から、化合物4はEGCG8:8EGCGの結合様式を有するEGCG2量体であるウーロンホモビスフラバン−A(OHBF−A)であり、化合物5はEGCG6:8EGCGの結合様式を有するEGCG2量体であるウーロンホモビスフラバン−B(OHBF−B)であり、化合物6はEGCG8:8EGCG6:8EGCGの結合様式を有するEGCG3量体であるウーロンホモビスフラバン−トリマー−1(本願では、OHBF−Tri−1またはTri−1ともよぶ)であることが確認された。なお、上記のEGCG間の6:8または8:8と記した結合はEGCGのA環の6位または8位の炭素が間にメチレン基を挟んで架橋した状態を表す。上記の各化合物の構造式を以下に示す。
【0050】
【化11】

【0051】
【化12】

【0052】
【化13】

化合物1から化合物3については、以下のMS、NMRにより構造解析を行った。MSはQ−TOF Premier (Micromass社製、UK)でイオン源にZスプレーイオンソースをつけたESIを用い、ネガティブ、Vモードで測定した。Cone volt.:45V、Capillary voltage:3KV、Desolvation Temp:180℃、ロックスプレーによる質量補正を行い、リファレンスにはロイシンエンケファリン(m/z554.2615[M−H]-)を用いた。
【0053】
その結果、化合物2はm/z1397.2479[M−H]-の分子イオンを与え、分子式C68H54O33(err.:0.7ppm)、化合物3はm/z1397.2509[M−H]-の分子イオンを与え、分子式C68H54O33(err.:2.9ppm)と算出され、EGCG3分子が2つのメチレンにより架橋された物質であると推定された。また、化合物1はm/z1867.3100[M−H]-の分子イオンおよび2価の933.1151[M−2H]2-を与え、分子式C91H72O44(err.:−11.7ppm)と算出され、EGCG4分子が3つのメチレンにより架橋された物質であると推定された。
【0054】
NMRは、化合物2についてはCD2OHに溶解し、化合物3についてはDMSO−d6((CD3)2SO)に溶解して測定を行った。化合物2は、CD3OHのプロトンと13Cの残存ピークであるδ3.30およびδ48.97を内部標準とし、化合物3は、DMSO−d6の1Hの2.50ppmと13Cの残存ピークδ39.43を内部標準とした。測定項目は1HNMR、13CNMR、1H{13C}−HSQC、1H{13C}−HMBC、TOCSYおよびDQF−COSYをDMX−750spectrometer(BRUKER BIOSPIN,Germany)で測定した。NMRの結果、化合物2はEGCG6:8EGCG6:8EGCGの結合様式を有する上記式(II)の化合物(すなわち、ウーロンホモビスフラバン−トリマー−2、本願では、OHBF−Tri−2またはTri−2ともよぶ)であり、化合物3はEGCG8:8EGCG6:6EGCGの結合様式を有する上記式(III)の化合物(すなわち、ウーロンホモビスフラバン−トリマー−4、本願では、OHBF−Tri−4またはTri−4ともよぶ)であることが明らかとなった。化合物2の1HNMR、13CNMRスペクトルを図1および2に、また化合物3の1HNMR、13CNMRスペクトルを図3および4に示す。
【0055】
化合物2:
ウーロンホモビスフラバン−トリマー−2(CD3OH中)の1HNMRは、δ 6.95, 6.92, 6.90, 6.60, 6.54, 6.44, 6.08, 6.02, 5.57, 5.55, 5.49, 5.18, 5.12, 4.91, 3.86, 3.83, 3.81, 3.76, 3.03, 3.01, 2.94, 2.89, 2.89, 2.82のシグナル、13CNMRは、δ 167.72, 167.46, 167.37, 156.29, 155.25, 155.08, 154.79, 154.43, 153.64, 152.91, 151.64, 151.20, 147.00, 146.93, 146.38, 146.38, 146.34, 146.29, 140.03, 139.89, 139.89, 134.65, 134.48, 133.85, 130.64, 129.29, 129.10, 121.33, 121.14, 121.14, 110.31, 110.24, 110.24, 109.19, 108.07, 107.42, 107.05, 107.02, 106.79, 106.10, 101.59, 101.00, 100.45, 97.23, 96.71, 80.07, 79.94, 78.45, 70.00, 69.32, 69.28, 27.21, 27.21, 26.81, 17.91, 17.91のシグナルが認められた。
【0056】
化合物3:
ウーロンホモビスフラバン−トリマー−4(DMSO−d6中)の1HNMRは、δ 10.46, 9.18, 9.16, 9.16, 9.12, 9.06, 9.05, 8.90, 8.88, 8.84, 8.72, 8.69, 8.69, 8.46, 8.34, 8.05, 8.02, 8.00, 6.81, 6.78, 6.78, 6.52, 6.47, 6.35, 6.03, 5.93, 5.48, 5.46, 5.39, 5.04, 4.95, 4.89, 4.05, 3.95, 3.56, 3.56, 3.06, 3.00, 2.98, 2.76, 2.71, 2.67のシグナル、13CNMRは、δ 165.11, 165.09, 164.99, 157.66, 154.29, 153.82, 153.48, 153.07, 152.68, 152.23, 152.18, 150.88, 145.56, 145.52, 145.50, 145.26, 145.24, 145.23, 138.43, 138.43, 138.39, 132.34, 132.23, 132.19, 128.34, 128.34, 128.23, 119.17, 119.12, 119.04, 110.35, 110.31, 110.29, 109.19, 108.59, 108.56, 108.51, 106.97, 106.63, 105.26, 105.26, 105.13, 104.73, 101.28, 99.44, 99.41, 98.21, 97.34, 97.15, 96.03, 79.48, 79.07, 78.47, 69.95, 69.39, 69.28, 27.18, 26.98, 26.58, 18.16, 17.13のシグナルが認められた。
【0057】
また、化合物1はDMSO−d6に溶解し、1Hと13Cの残存ピークδ2.50、δ39.43を内部標準としてNMR測定を行った。測定項目は1HNMR、13CNMR、1H{13C}−HSQC、1H{13C}−HMBC、TOCSYおよびDQF−COSYをDMX−750spectrometer(BRUKER BIOSPIN,Germany)で測定した。NMRの結果、化合物1はEGCG8:6EGCG8:8EGCG6:8EGCGの結合様式を有するEGCG4量体である化合物(ウーロンホモビスフラバン−テトラマー−2、本願では、OHBF−Tet−2またはTet−2ともよぶ)であることが明らかになった。化合物1の1HNMR、13CNMRスペクトルを図5および図6に示す。
【0058】
化合物1:
ウーロンホモビスフラバン−テトラマー−2は1HNMR(DMSO−d6)は、δ 9.91, 9.25, 9.16, 8.09, 7.22, 6.81, 6.76, 6.74, 6.52, 5.94, 5.50, 5.38, 4.77, 4.52, 3.95, 3.95, 3.80, 3.54, 2.80, 2.74, 2.73, 2.67のシグナル、13CNMRは、δ 165.08, 165.01, 154.06, 152.83, 152.35, 151.45, 150.78, 150.26, 145.52, 145.52, 145.24, 145.18, 138.49, 138.44, 132.21, 132.10, 128.42, 127.63, 119.05, 118.95, 108.58, 108.46, 108.46, 106.95, 105.74, 104.92, 104.06, 98.32, 97.81, 76.59, 75.94, 66.69, 66.35,26.33, 25.26, 16.72, 15.99のシグナルが認められた。
【0059】
上記の通り同定された各化合物の構造式を以下に示す。
【0060】
【化14】

【0061】
【化15】

【0062】
【化16】

以上の合成および精製手順により得られた各化合物の収量は、ウーロンホモビスフラバン−A(984mg)、ウーロンホモビスフラバン−B(374mg)、ウーロンホモビスフラバン−トリマー−1(468mg)、ウーロンホモビスフラバン−トリマー−2(73mg)、ウーロンホモビスフラバン−トリマー−4(12mg)、およびウーロンホモビスフラバン−テトラマー−2(44mg)であった。
【実施例2】
【0063】
リコンビナントグルコシルトランスフェラーゼ(rGTF)の調製
rGTFを、論文M.matsumoto et al, FEMS Microbiology Letters 228 (2003) 73-80に記載の方法に準じて調製した。すなわち、Streptococcus mutansのグルコシルトランスフェラーゼB(GTFB)をコードする遺伝子を含むプラスミドpSK6を保有するEscherichiacoli XL-2株を、アンピシリン100μg/mLおよびテトラサイクリン7.5μg/mL含有Luria Bertani液体培地中で37℃で16時間振盪培養した。培地を遠心分離して菌体を集め、菌体を冷却した10mMリン酸緩衝液(pH6.5)に懸濁した後、超音波発生機(UD201型、トミー精工、東京)で氷冷下で菌体を破砕した。破砕後、12,000x gで30分間遠心分離することにより沈査を取り除いた。得られた上清をリコンビナントグルコシルトランスフェラーゼB(rGTFB)として後の実験に用いた。
【0064】
同様に、Streptococcus mutansのグルコシルトランスフェラーゼC(GTFC)をコードする遺伝子を含むプラスミドpSK6を保有するEscherichiacoli XL-2株を用いて、リコンビナントグルコシルトランスフェラーゼC(rGTFC)を調製し、後の実験に用いた。
【0065】
rGTFBは比活性が503mU/mg proteinのものを用い、rGTFCは比活性が6.3〜22.3mU/mg proteinのものを混合して用いた。ここで、活性1Uは、1分間に、スクロース由来のグルコース1.0mMをグルカンへと転換した際の酵素活性を示す。タンパク質の定量は、ビシンコニン酸法(BCA法)(BCAプロテインアッセイキット、PIERCE社)を用いて行なった。
【実施例3】
【0066】
グルコシルトランスフェラーゼ阻害作用の評価(1)
実施例1により得られたウーロンホモビスフラバンA(OHBF−A)、ウーロンホモビスフラバンB(OHBF−B)、およびウーロンホモビスフラバン−トリマー−1(Tri−1)、ならびに論文(Hashimoto, F. Nonaka, G. Nishioka, I. Chem. Pharm. Bull. 36 (5), 1676-1684 (1988))に準じて調製したテアシネンシンA(TSN−A)の各々についてのグルコシルトランスフェラーゼ(GTF)阻害作用を、以下の手順により評価した。なお、ここで比較として用いたテアシネンシンA(TSN−A)は、EGCGのB環の2’位同士が対称的に結合した物質であり、以下の構造を有する:
【0067】
【化17】

1%スクロース含有0.1%デキストランT10を含む0.1M KPB(pH6.0)2mLに、実施例2により得られたrGTFBまたはrGTFC(15mU相当量)と、上記の各サンプル(0.1mg/mL、最終濃度)を混和し、37℃で一晩インキュベートした。得られた反応液の濁度(550nm)を測定することにより、非水溶性グルカンの生成量を測定した。非水溶性グルカンの生成量がより少ない(すなわち、濁度がより低い)ことは、グルコシルトランスフェラーゼの活性がより阻害されたことを示す。結果を図7および図8に示す。なお、図中のコントロール(Cont)は、上記サンプルを混和しない場合の濁度を示す。
【0068】
図7および8に示されるとおり、OHBF−Aは、GTFBの活性を阻害したものの、GTFCについては、逆に、活性をやや強めることがわかった。また、TSN−Aは、GTFBの活性にほとんど影響を及ぼさず、GTFCについては、逆に、活性を非常に強めることがわかった。一方、OHBF−BおよびOHBF−Tri−1は、GTFBとGTFCの両方について、活性を阻害することがわかった。特に、3量体であるOHBF−Tri−1は、2量体である他の化合物に比べて、GTFBおよびGTFCの両者の活性を最も強く阻害することがわかった。
【実施例4】
【0069】
グルコシルトランスフェラーゼ阻害作用の評価(2)
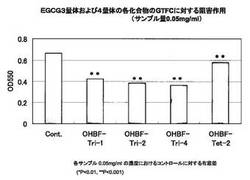
実施例1により得られたウーロンホモビスフラバン−トリマー−1(OHBF−Tri−1)、ウーロンホモビスフラバン−トリマー−2(OHBF−Tri−2)、ウーロンホモビスフラバン−トリマー−4(OHBF−Tri−4)、およびウーロンホモビスフラバン−テトラマー−2(OHBF−Tet−2)の各々についてのグルコシルトランスフェラーゼ(GTF)阻害作用を、以下の手順により評価した。
【0070】
1%スクロース含有0.1%デキストランT10を含む0.1M KPB(pH6.0)2mLに、実施例2により得られたrGTFBまたはrGTFC(15mU相当量)と、上記の各サンプル(0.05mg/mL、最終濃度)を混和し、37℃で一晩インキュベートした。得られた反応液の濁度(550nm)を測定することにより、非水溶性グルカンの生成量を測定した。非水溶性グルカンの生成量がより少ない(すなわち、濁度がより低い)ことは、グルコシルトランスフェラーゼの活性がより阻害されたことを示す。結果を図9および図10に示す。なお、図中のコントロール(Cont)は、上記サンプルを混和しない場合の濁度を示す。
【0071】
図9および10に示されるとおり、EGCG4量体であるTet−2は、GTFCの活性を有意に阻害したものの、GTFBに対しては有意な阻害効果が認められなかった。一方、EGCG3量体であるTri−1、Tri−2、およびTri−4の各々については、GTFBおよびGTFCに対して有意な阻害作用が認められ、GTFCの阻害活性に関しては、ECGC4量体であるTet−2のGTFCの阻害活性よりも高かった。
【0072】
以上の結果より、EGCG3量体であるTri−1、Tri−2、およびTri−4、ならびにEGCG2量体であるOHBF−Bに高いGTF阻害作用がみられることが判った。特に、EGCG3量体であるTri−1、Tri−2、およびTri−4は、EGCGの2量体であるOHBF−A、OHBF−B、およびTSN−A、ならびにEGCGの4量体であるTet−2に比べて、高いGTF阻害作用を有することがわかった。
【実施例5】
【0073】
LC−MS/MSによる重合ポリフェノールの定量
トリマーおよびテトラマーのLC−MS/MSの測定条件とサントリー黒烏龍茶の定量
EGCG重合物のLC−MS/MSの測定は、4000 Q TRAP(アプライド社製)で、ターボイオンスプレーを用い、以下の条件で測定した。Collision energy:46eV(nega.)、Ionspray voltage:4500V、Temp:450℃。
【0074】
各化合物のMRM(multiple reaction monitoring)における測定チャンネルはウーロンホモビスフラバン−トリマー類は、698.40/168.90(nega.2価)で、標準物質にはウーロンホモビスフラバン−トリマー−1を用いた。ウーロンホモビスフラバン−テトラマー類は、933.16/168.90(nega.2価)で標準物質にはウーロンホモビスフラバン−テトラマー−2を用いた。以下の測定条件で行った。
カラム:Develosil C30−UG−3(野村化学、3mmφ×150mm)
流速:0.3ml/min、
カラム温度:40℃
移動相A:0.1%HCOOH/H2O
移動相B:0.1%HCOOH/CH3CN
グラジエントプログラム:A91%/B9%(0min)→A40%/B60%(17min)→A15%/B85%(17.1min)、続いてA15%/B85%でアイソクラティック(17.1〜19min)
これらの化合物は黒烏龍茶中に微量しか含まれないため、直接定量することは不可能であった。そこで、黒烏龍茶(殺菌前)をCHP−20Pカラム(三菱化学株式会社)でステップワイズに分画し、各フラクションの定量を行った後、各フラクションに検出された濃度を合算して茶中の濃度とした。黒烏龍茶中の濃度は、トリマー類は検出された5成分をウーロンホモビスフラバン−トリマー−1換算で合算し、172ng/mlであった。テトラマー類は検出された4成分を合算し、ウーロンホモビスフラバン−テトラマー−2換算で55ng/mlであった。
【図面の簡単な説明】
【0075】
【図1】図1は、化合物2の1HNMRスペクトルを示す。
【図2】図2は、化合物2の13CNMRスペクトルを示す。
【図3】図3は、化合物3の1HNMRスペクトルを示す。
【図4】図4は、化合物3の13CNMRスペクトルを示す。
【図5】図5は、化合物1の1HNMRスペクトルを示す。
【図6】図6は、化合物1の13CNMRスペクトルを示す。
【図7】図7は、EGCG2量体および3量体の各化合物のグルコシルトランスフェラーゼBに対する阻害作用の評価結果を示す。
【図8】図8は、EGCG2量体および3量体の各化合物のグルコシルトランスフェラーゼCに対する阻害作用の評価結果を示す。
【図9】図9は、EGCG3量体および4量体の各化合物のグルコシルトランスフェラーゼBに対する阻害作用の評価結果を示す。
【図10】図10は、EGCG3量体および4量体の各化合物のグルコシルトランスフェラーゼCに対する阻害作用の評価結果を示す。
【技術分野】
【0001】
本発明は、エピガロカテキンガレート重合体を有効成分とするグルコシルトランスフェラーゼ阻害剤、およびこれを添加した飲食品に関する。
【背景技術】
【0002】
う蝕の原因については過去に種々の仮説が提唱されたが、現在ではミラー(Miller)の化学細菌説に基づく細菌感染症の一種であると認められている。この説によれば、う蝕の発生機構は以下の通りである。即ち、口腔連鎖球菌、特にストレプトコッカス・ミュータンス(Streptococcus mutans、以下「S・ミュータンス」と略称する。)が産生するグルコシルトランスフェラーゼ(糖転移酵素、GTF)が、口中のショ糖を基質として、粘着性で不溶性の多糖(グルカン)を生成する。S・ミュータンスの菌体は、生成したグルカンによって、歯表面に付着して菌塊(プラーク)を形成する。プラーク中では、S・ミュータンスを始め種々の微生物が共生・繁殖しているが、これら微生物の代謝によって有機酸が産生され、この有機酸の作用でプラーク内部のpHが低下し、歯のエナメル質表面に脱灰が生じてう蝕が発生し、進行する。また、歯垢形成は、う蝕のほかに、歯周病や口臭の原因となるとされている。
【0003】
このようにS・ミュータンスを中心とする口腔連鎖球菌によって形成される歯垢がう蝕の原因となっていることから、歯垢形成を抑えることが、ひいてはう蝕の発生を予防する有効な手段となりうる。
【0004】
近年、抗う蝕作用を有する物質として、植物などに含まれるカテキン類が注目されている。特許文献1には、フラボノイド(カテキン類の一種)をペルオキシダーゼで処理することにより製造される800〜5000の分子量を有するフラボノイド重合物は、処理前に比べて、グルコシルトランスフェラーゼの阻害作用が増強されることが報告されている。
【0005】
また、非特許文献1には、フラボノイド重合物が、ストレプトコッカス・ソブリヌス(Streptococcus sobrinus)由来のグルコシルトランスフェラーゼの活性を、2.5μg/mLで50%阻害することが報告されている。
【0006】
また、特許文献2には、フラバノン類/フラバノール類の還元物あるいはロイコシアニジン類をカテキン類と縮合させることにより製造される重量分子量が1000〜10000のフラボノイド重合物に、グルコシルトランスフェラーゼの阻害作用がみられることが報告されている。
【0007】
しかし、これらのフラボノイド重合物は、フラボノイドの3〜5量体の混合物または2〜3量体の混合物であって、混合物中に含まれる種々の化合物の単離は行なわれておらず、したがって化合物単体の各々に関してのグルコシルトランスフェラーゼ阻害活性に関しては明らかにされていない。
【0008】
日常飲食する茶の中では、非発酵茶である緑茶に由来するカテキン類の混合物にグルコシルトランスフェラーゼ阻害作用がみられることが報告されている(非特許文献2)。しかし、ラットを用いた試験では、充分な抗う蝕作用が得られなかったことも報告されている。
【0009】
また、半発酵茶であるウーロン茶やその精製品に、グルコシルトランスフェラーゼ阻害活性がみられることが報告されている(特許文献3、非特許文献3、非特許文献4、および非特許文献5)。また、緑茶や烏龍茶、紅茶を加熱処理することでグルコシルトランスフェラーゼ阻害活性が増強されることや(特許文献4)、カテキン類を加熱処理することでグルコシルトランスフェラーゼ阻害活性が増強されることが知られている(特許文献5)。
【0010】
しかし、いずれの場合にも、茶由来の混合物のうち、どの化合物に活性があるのかについては明らかにされていない。
【特許文献1】特開平6−247959号公報
【特許文献2】特開平7−242556号公報
【特許文献3】特開平6−279302号公報
【特許文献4】特開平3−284625号公報
【特許文献5】特開平3−284671号公報
【非特許文献1】FEMS Microbiology Letters 143 (1996) 35-40, Hamada S. et al.
【非特許文献2】Caries Res. 25 (1991) 438-443, Otake S. et al.
【非特許文献3】Applied and Environmental Microbiology, 59, No.4 (1993) 968-973, Nakahara K. et al.
【非特許文献4】The Nippon Dental review No.622 (August 1994) 179-189, Ooshima T. and Hamada S.
【非特許文献5】FEMS Microbiology Letters 228 (2003) 73-80, , Matsumoto M. et al.
【発明の開示】
【発明が解決しようとする課題】
【0011】
上記のとおり、グルコシルトランスフェラーゼ阻害活性を有する植物抽出物等に関する報告はなされているが、いずれの場合にも、植物抽出物由来の混合物に活性がみられることが報告されるのみであって、具体的な活性成分(化合物)は明らかとされておらず、活性成分の同定が望まれていた。また、嗜好性の低い植物由来の成分を飲食品に利用すると、飲食品の香味および安全性を害することが予想されるので、嗜好性の高い植物由来の活性成分を探索することが望まれていた。
【課題を解決するための手段】
【0012】
本発明者らは、飲食物として利用することを考慮し、日常飲用されている茶に含まれる成分に着目し鋭意検討したところ、ウーロン茶などに含まれるカテキン類の一種である(−)−エピガロカテキン−3−O−ガレート(以下、EGCGともよぶ)を重合して得られたEGCG重合体に、中でも、特にEGCG3量体に強いグルコシルトランスフェラーゼ阻害活性がみられることを見出し、本発明に至った。
【0013】
すなわち、本発明は以下のとおりである。
1. エピガロカテキンガレート3量体またはその塩を有効成分とするグルコシルトランスフェラーゼ阻害剤。
2. 前記エピガロカテキンガレート3量体が、クロマン環の6位および/または8位でメチレン基を介して結合した化合物である、上記1に記載のグルコシルトランスフェラーゼ阻害剤。
3. 前記エピガロカテキンガレート3量体が、次式(I):
【0014】
【化1】

を有する化合物、次式(II):
【0015】
【化2】

を有する化合物、および次式(III):
【0016】
【化3】

を有する化合物
(式(I)〜(III)中、Rは次式(A):
【0017】
【化4】

で表されるガロイル基である)
からなる群から選択される化合物である、上記2に記載のグルコシルトランスフェラーゼ阻害剤。
4. 次式(IV):
【0018】
【化5】

で表される化合物を有効成分とするグルコシルトランスフェラーゼ阻害剤。
5. エピガロカテキンガレート3量体またはその塩を有効成分とする抗う蝕剤。
6. 前記エピガロカテキンガレート3量体が、クロマン環の6位および/または8位でメチレン基を介して結合した化合物である、上記5に記載の抗う蝕剤。
7. 前記エピガロカテキンガレート3量体が、前記式(I)を有する化合物、前記式(II)を有する化合物、および前記式(III)を有する化合物(式(I)〜(III)中、Rは前記式(A)で表されるガロイル基である)からなる群から選択される化合物である、上記6に記載の抗う蝕剤。
8. 前記式(IV)で表される化合物を有効成分とする抗う蝕剤。
9. 上記1〜8のいずれかに記載のグルコシルトランスフェラーゼ阻害剤または抗う蝕剤を添加した飲食品。
10. 前記飲食品が茶飲料である、上記9に記載の飲食品。
11. 上記1〜8のいずれかに記載のグルコシルトランスフェラーゼ阻害剤または抗う蝕剤を添加した口腔衛生剤。
【発明の効果】
【0019】
本発明者らにより、(−)−エピガロカテキン−3−O−ガレート(EGCG)重合体、特に特定のEGCG2量体および3量体に、高いグルコシルトランスフェラーゼ阻害作用がみられることが見出された。上記のとおり、グルコシルトランスフェラーゼ(以下、GTFともいう)は口中で歯垢の原因となるグルカンを生成するので、GTFの活性を阻害することにより、う蝕を予防することができる。したがって、本発明のGTF阻害剤は、抗う蝕剤として用いることができる。また、本発明のGTF阻害剤は、歯垢の原因となるグルカンの生成を抑えるので、口臭を抑える効果も期待できる。さらに、本発明のGTF阻害剤は、ウーロン茶などの日常飲食する飲食品に含まれるEGCGに由来するため、嗜好性が高く、人体に対して高い安全性を有する。また、このGTF阻害剤を飲食品に一定量含有させることにより、飲食品の香味を過度に損なうことなく、嗜好性の高い、安全な、抗う蝕作用を有する飲食品を提供することができる。
【発明を実施するための最良の形態】
【0020】
<エピガロカテキンガレート重合体>
(−)−エピカロカテキン−3−O−ガレート(EGCG)は、緑茶などの茶に含まれるカテキン類のうちの主要な成分の1つであり、次の式:
【0021】
【化6】

により表される構造を有する化合物である。
【0022】
本発明のGTF阻害剤に含まれる有効成分は、上記EGCGの重合体である。本発明には、特に、EGCGがそのクマロン環の6位および/または8位でメチレン基を介して2または3個結合した構造を有するEGCG重合体を好ましく用いることができる。そのようなEGCG重合体の具体例としては、次の式(I)、式(II)、および式(III):
【0023】
【化7】

【0024】
【化8】

【0025】
【化9】

により表されるEGCG3量体(式(I)〜(III)中、Rはガロイル基である)、および次式(IV):
【0026】
【化10】

で表されるEGCG2量体などが挙げられる。
【0027】
式(I)の化合物は、EGCGの結合様式に基づいて、EGCG8:8EGCG6:8EGCGと表記することができる(以下、本明細書では、ウーロンホモビスフラバン−トリマー−1、OHBF−Tri−1、またはTri−1とよぶ)。同様に、式(II)の化合物は、EGCG6:8EGCG6:8EGCGと表記することができる(以下、本明細書では、ウーロンホモビスフラバン−トリマー−2、OHBF−Tri−2、またはTri−2とよぶ)。また、式(III)の化合物は、EGCG8:8EGCG6:6EGCGと表記することができる(以下、本明細書では、ウーロンホモビスフラバン−トリマー−4、OHBF−Tri−4、またはTri−4とよぶ)。式(IV)の化合物は、EGCG6:8EGCGと表記することができる。式(IV)の化合物はウーロン茶などに含まれる化合物であることが報告されており、ウーロンホモビスフラバン−B(OHBF−B)として知られている。なお、式(II)および(III)の化合物は、新規化合物である。
【0028】
上記のEGCG重合体は、エピガロカテキンガレートを、溶媒中、酸の存在下でホルムアルデヒドと反応させることによって製造することができる。
【0029】
反応に使用することができる溶媒としては、例えば、メタノール、エタノール、n−プロパノール、およびイソプロパノール等のアルコール類が挙げられる。溶媒の使用量については特に制限はないが、例えば、1質量部のエピガロカテキンガレートに対して20〜200質量部の溶媒を用いることができる。
【0030】
酸としては、例えば、塩酸、硫酸、および硝酸等の無機酸、ならびに、蟻酸および酢酸等の有機酸などを用いることができる。酸の使用量については特に制限はないが、例えば、1モルのエピガロカテキンガレートに対して、0.01〜2モルの酸を用いることができる。
【0031】
ホルムアルデヒドは、例えば、1モルのEGCGに対して、1〜100モルで用いることができる。
【0032】
反応の温度および時間は、用いる溶媒量等によって変わりうるが、例えば、反応温度は、−10〜50℃、反応時間は10分〜12時間である。典型的には、反応温度は室温(25℃程度)である。
【0033】
EGCGとホルムアルデヒドとの反応によって得られる生成物は、通例、メチレン基によるクロマン環の連結様式が異なる化合物の少なくとも二種の化合物を含有する混合物である。例えば、HP−20(三菱化学株式会社製)などのスチレン系吸着樹脂や、Shephadex LH−20のようなデキストラン系樹脂によるオープンカラムクロマトグラフィー、ならびに高速液体クロマトグラフィー(HPLC)などの公知の生成方法を用いることにより、このような混合物から、式(I)〜(IV)の各化合物を単離することができる。
【0034】
なお、式(I)の化合物(OHBF−Tri−1)の調製方法は、特許文献(WO2005/116005)に、「三量体(4)」の合成および精製方法として、記載されている。また、式(IV)の化合物(OHBF−B)の調製方法は、文献(Chem.Pharm.Bull 37(12), 3255-3563(1989))に記載されている。
【0035】
本発明のグルコシルトランスフェラーゼ阻害剤に用いられるEGCG重合体は、塩の形態であってもよい。そのような塩としては、医薬的にまたは食品として許容可能な塩であれば特に制限されず、例えば、リチウム塩、ナトリウム塩、カリウム塩、カルシウム塩、およびマグネシウム塩などの周期表の1族または2族の金属元素の塩を挙げることができる。このような金属塩は、例えば、EGCGのフェノール性水酸基において形成することができる。
【0036】
例えば、EGCG3量体のナトリウム塩は、EGCG3量体と金属ナトリウムまたは水素化ナトリウムとを、非プロトン性溶媒中で反応させて、EGCG3量体に含まれる水酸基(−OH)をナトリウムアルコキシド基(−ONa)に変換することによって製造することができる。この際、金属ナトリウムまたは水素化ナトリウムの使用量を調節することで、EGCG3量体に含まれる水酸基のすべてをナトリウムアルコキシド基に変換することができ、また、水酸基の一部のみをナトリウムアルコキシド基に変換することもできる。
【0037】
これらのEGCG重合体は合成によって得ることもできるが、実施例5に後述する通り、烏龍茶中にも存在することが判明した。そのため、本発明のGTF阻害剤の有効成分であるEGCG重合体は、Camellia sinensis [A1]の葉を原料とする茶類、好ましくは烏龍茶、紅茶等の発酵茶や焙じ茶から抽出および精製することによって、単離することもできる。
【0038】
<EGCG重合体を有効成分とするGTF阻害剤または抗う蝕剤>
本発明者らにより、EGCG重合体、特に上記の式(I)の化合物であるウーロンホモビスフラバン−トリマー−1、式(II)の化合物であるウーロンホモビスフラバン−トリマー−2、式(III)の化合物であるウーロンホモビスフラバン−トリマー−4、および式(IV)の化合物であるウーロンホモビスフラバン−Bに高いグルコシルトランスフェラーゼ阻害作用がみられることが見出された。
【0039】
グルコシルトランスフェラーゼ阻害作用の測定は、背景技術に示した先行文献等に記載されるいずれの評価法を用いても行なうことができる。例えば、Streptococcus mutansなどから調製したグルコシルトランスフェラーゼを、ショ糖を含む水溶液中に添加し、口腔内と同程度の温度(約37℃)で、24時間未満、好ましくは16〜20時間程度インキュベートして、酵素反応によりショ糖からグルカンを生成させる。グルカンは水に不溶であるため、得られた反応液の濁度(例えば波長550nmにおける濁度)を測定することにより、グルカンの生成量を評価することができる。グルカンの生成量が少ない(すなわち、濁度が低い)場合は、グルカンの生成量が多い(すなわち、濁度が高い)場合に比べて、グルコシルトランスフェラーゼの活性がより阻害されているといえる。
【0040】
本発明のグルコシルトランスフェラーゼ阻害剤は、グルコシルトランスフェラーゼ(GTF)の活性を阻害することにより、口中で歯垢の原因となるグルカンの生成を抑えることができるから、抗う蝕剤として用いることができる。
【0041】
本発明のグルコシルトランスフェラーゼ阻害剤または抗う蝕剤は、ウーロン茶などの日常飲食する飲食品に含まれるEGCGに由来するため、嗜好性が高く、人体に対して高い安全性を有する。
【0042】
<飲食品>
本発明のグルコシルトランスフェラーゼ阻害剤または抗う蝕剤は、虫歯予防などの抗う蝕を目的として、各種飲食品に添加することができる。本発明のグルコシルトランスフェラーゼ阻害剤または抗う蝕剤を添加する飲食品の例としては、清涼飲料、茶飲料、液状強壮剤、健康飲料、栄養補給飲料、スポーツドリンク、炭酸飲料(これら飲料の濃縮原液および調製用粉末を含む)などの飲料や、ガム、キャンディー、ゼリー、錠菓、健康食品、栄養補給食品、サプリメントなどの食品が揚げられる。
【0043】
飲食品への添加量は、所望の効果が得られる範囲であれば特に限定されず、飲食品の味、色、香りなどの点を考慮することにより適宜決定できる。例えば、抗う蝕を目的とした飲料を調製する場合、飲料中に0.01〜1000ppm程度の濃度でEGCG重合体を添加することができる。また、EGCG重合体を固形の食品に添加する場合、固形食品の重量に対して、0.01〜5000μg/g程度のEGCG重合体を添加することができる。
【0044】
<口腔衛生剤>
本発明のグルコシルトランスフェラーゼ阻害剤または抗う蝕剤は、グルコシルトランスフェラーゼ(GTF)の活性を阻害することにより、口中で歯垢の原因となるグルカンの生成を抑えることができるため、虫歯予防および口臭予防などの口腔衛生剤に用いることができる。本発明における口腔衛生剤の例としては、歯磨、洗口液、トローチなどが挙げられる。これらの口腔衛生剤は、当業界で慣用される担体を用いて、慣用の手法で製造することができる。担体の例としては、製剤素材として慣用の各種有機または無機担体物質を用いることができる。また、必要に応じて、防腐剤、抗酸化剤、着色料、甘味剤などの製剤添加物を配合することもできる。本発明のGTF阻害剤または抗う蝕剤の口腔衛生剤への添加量は、口腔衛生剤の形態などに応じて適宜決定できるが、例えば、口腔衛生剤中に、0.0001〜10重量%程度の濃度となるように、EGCG重合体を含有させることができる。
【0045】
本発明を以下の実施例によってさらに詳しく説明するが、本発明はこれらによって制限されるものではない。
【実施例1】
【0046】
EGCG重合体の合成および精製
ア.合成とオープンカラムによる分画:
6gの(−)−エピガロカテキン−3−O−ガレート(EGCG)(ロッシュ社、Teavigo(登録商標))を0.02N HClを含む120mlのエタノールに溶解し、4%ホルムアルデヒドのエタノール溶液180mlを加え、室温で4時間、撹拌した。反応終了後、純水で10倍に希釈し、吸着樹脂CHP−20Pカラム(600ml、37−75μm、三菱化学株式会社)に負荷した。1200mlの水で洗浄後、900mlの25%CH3CN、1200mlの30%CH3CNで順次溶出し、25%CH3CN溶出画分は300mlずつ3フラクション(fr.1からfr.3)に分け、30%CH3CN溶出画分は300mlずつ4フラクション(fr.4からfr.7)に分画した。
【0047】
イ.分取HPLC条件:
CHP−20Pカラム精製で得られた分画物をさらに逆相の分取HPLCで精製した。
<条件>
カラム: Develosil ODS−HG−5(5cmφx50cm、野村化学株式会社)
移動相:A:0.05%TFA/H2O、B:90%CH3CN/0.05%TFA/H2O
流速:32ml/min
グラジエントプログラム:A80%/B20%でアイソクラティック(30min)、A80%/B20%からA60%/B40%へグラジエント(100min)、A60%/B40%でアイソクラティック(20min)
検出:A280nm
サンプル:CHP−20Pカラム精製で得られたfr.2からfr.7を、それぞれ20%CH3CNに溶解し、数回に分けて全量を負荷した。
【0048】
上記の分析条件おいて、保持時間113分(化合物1)、120分(化合物2)、130分(化合物3)、および保持時間85分(化合物4)、保持時間106分(化合物5)、保持時間104分(化合物6)に相当する各ピークを集めた。
【0049】
ウ.化合物の構造解析:
分取HPLCで単離した化合物について、MSおよびNMR測定を行った。このうち、化合物4〜6のMSをQ−TOF Premier(Micromass社製、UK)により、ネガティブ、Vモードで測定したところ、それぞれm/z927.160、927.163、1397.248の[M−H]-のイオンピークが認められた。また、化合物4のNMRスペクトルデータは文献(Chem. Pharm. Bull 37(12), 3255−3563(1989))に記載のウーロンホモビスフラバン−AのNMRスペクトルデータと一致した。化合物5のNMRスペクトルデータは文献(Chem. Pharm. Bull 37(12), 3255−3563(1989))に記載のウーロンホモビスフラバン−BのNMRスペクトルデータと一致した。さらに、化合物6のNMRスペクトルデータから、化合物6は、上記の式(I)の化合物、すなわち、ウーロンホモビスフラバン−トリマー−1であることがわかった。これらの結果から、化合物4はEGCG8:8EGCGの結合様式を有するEGCG2量体であるウーロンホモビスフラバン−A(OHBF−A)であり、化合物5はEGCG6:8EGCGの結合様式を有するEGCG2量体であるウーロンホモビスフラバン−B(OHBF−B)であり、化合物6はEGCG8:8EGCG6:8EGCGの結合様式を有するEGCG3量体であるウーロンホモビスフラバン−トリマー−1(本願では、OHBF−Tri−1またはTri−1ともよぶ)であることが確認された。なお、上記のEGCG間の6:8または8:8と記した結合はEGCGのA環の6位または8位の炭素が間にメチレン基を挟んで架橋した状態を表す。上記の各化合物の構造式を以下に示す。
【0050】
【化11】

【0051】
【化12】

【0052】
【化13】

化合物1から化合物3については、以下のMS、NMRにより構造解析を行った。MSはQ−TOF Premier (Micromass社製、UK)でイオン源にZスプレーイオンソースをつけたESIを用い、ネガティブ、Vモードで測定した。Cone volt.:45V、Capillary voltage:3KV、Desolvation Temp:180℃、ロックスプレーによる質量補正を行い、リファレンスにはロイシンエンケファリン(m/z554.2615[M−H]-)を用いた。
【0053】
その結果、化合物2はm/z1397.2479[M−H]-の分子イオンを与え、分子式C68H54O33(err.:0.7ppm)、化合物3はm/z1397.2509[M−H]-の分子イオンを与え、分子式C68H54O33(err.:2.9ppm)と算出され、EGCG3分子が2つのメチレンにより架橋された物質であると推定された。また、化合物1はm/z1867.3100[M−H]-の分子イオンおよび2価の933.1151[M−2H]2-を与え、分子式C91H72O44(err.:−11.7ppm)と算出され、EGCG4分子が3つのメチレンにより架橋された物質であると推定された。
【0054】
NMRは、化合物2についてはCD2OHに溶解し、化合物3についてはDMSO−d6((CD3)2SO)に溶解して測定を行った。化合物2は、CD3OHのプロトンと13Cの残存ピークであるδ3.30およびδ48.97を内部標準とし、化合物3は、DMSO−d6の1Hの2.50ppmと13Cの残存ピークδ39.43を内部標準とした。測定項目は1HNMR、13CNMR、1H{13C}−HSQC、1H{13C}−HMBC、TOCSYおよびDQF−COSYをDMX−750spectrometer(BRUKER BIOSPIN,Germany)で測定した。NMRの結果、化合物2はEGCG6:8EGCG6:8EGCGの結合様式を有する上記式(II)の化合物(すなわち、ウーロンホモビスフラバン−トリマー−2、本願では、OHBF−Tri−2またはTri−2ともよぶ)であり、化合物3はEGCG8:8EGCG6:6EGCGの結合様式を有する上記式(III)の化合物(すなわち、ウーロンホモビスフラバン−トリマー−4、本願では、OHBF−Tri−4またはTri−4ともよぶ)であることが明らかとなった。化合物2の1HNMR、13CNMRスペクトルを図1および2に、また化合物3の1HNMR、13CNMRスペクトルを図3および4に示す。
【0055】
化合物2:
ウーロンホモビスフラバン−トリマー−2(CD3OH中)の1HNMRは、δ 6.95, 6.92, 6.90, 6.60, 6.54, 6.44, 6.08, 6.02, 5.57, 5.55, 5.49, 5.18, 5.12, 4.91, 3.86, 3.83, 3.81, 3.76, 3.03, 3.01, 2.94, 2.89, 2.89, 2.82のシグナル、13CNMRは、δ 167.72, 167.46, 167.37, 156.29, 155.25, 155.08, 154.79, 154.43, 153.64, 152.91, 151.64, 151.20, 147.00, 146.93, 146.38, 146.38, 146.34, 146.29, 140.03, 139.89, 139.89, 134.65, 134.48, 133.85, 130.64, 129.29, 129.10, 121.33, 121.14, 121.14, 110.31, 110.24, 110.24, 109.19, 108.07, 107.42, 107.05, 107.02, 106.79, 106.10, 101.59, 101.00, 100.45, 97.23, 96.71, 80.07, 79.94, 78.45, 70.00, 69.32, 69.28, 27.21, 27.21, 26.81, 17.91, 17.91のシグナルが認められた。
【0056】
化合物3:
ウーロンホモビスフラバン−トリマー−4(DMSO−d6中)の1HNMRは、δ 10.46, 9.18, 9.16, 9.16, 9.12, 9.06, 9.05, 8.90, 8.88, 8.84, 8.72, 8.69, 8.69, 8.46, 8.34, 8.05, 8.02, 8.00, 6.81, 6.78, 6.78, 6.52, 6.47, 6.35, 6.03, 5.93, 5.48, 5.46, 5.39, 5.04, 4.95, 4.89, 4.05, 3.95, 3.56, 3.56, 3.06, 3.00, 2.98, 2.76, 2.71, 2.67のシグナル、13CNMRは、δ 165.11, 165.09, 164.99, 157.66, 154.29, 153.82, 153.48, 153.07, 152.68, 152.23, 152.18, 150.88, 145.56, 145.52, 145.50, 145.26, 145.24, 145.23, 138.43, 138.43, 138.39, 132.34, 132.23, 132.19, 128.34, 128.34, 128.23, 119.17, 119.12, 119.04, 110.35, 110.31, 110.29, 109.19, 108.59, 108.56, 108.51, 106.97, 106.63, 105.26, 105.26, 105.13, 104.73, 101.28, 99.44, 99.41, 98.21, 97.34, 97.15, 96.03, 79.48, 79.07, 78.47, 69.95, 69.39, 69.28, 27.18, 26.98, 26.58, 18.16, 17.13のシグナルが認められた。
【0057】
また、化合物1はDMSO−d6に溶解し、1Hと13Cの残存ピークδ2.50、δ39.43を内部標準としてNMR測定を行った。測定項目は1HNMR、13CNMR、1H{13C}−HSQC、1H{13C}−HMBC、TOCSYおよびDQF−COSYをDMX−750spectrometer(BRUKER BIOSPIN,Germany)で測定した。NMRの結果、化合物1はEGCG8:6EGCG8:8EGCG6:8EGCGの結合様式を有するEGCG4量体である化合物(ウーロンホモビスフラバン−テトラマー−2、本願では、OHBF−Tet−2またはTet−2ともよぶ)であることが明らかになった。化合物1の1HNMR、13CNMRスペクトルを図5および図6に示す。
【0058】
化合物1:
ウーロンホモビスフラバン−テトラマー−2は1HNMR(DMSO−d6)は、δ 9.91, 9.25, 9.16, 8.09, 7.22, 6.81, 6.76, 6.74, 6.52, 5.94, 5.50, 5.38, 4.77, 4.52, 3.95, 3.95, 3.80, 3.54, 2.80, 2.74, 2.73, 2.67のシグナル、13CNMRは、δ 165.08, 165.01, 154.06, 152.83, 152.35, 151.45, 150.78, 150.26, 145.52, 145.52, 145.24, 145.18, 138.49, 138.44, 132.21, 132.10, 128.42, 127.63, 119.05, 118.95, 108.58, 108.46, 108.46, 106.95, 105.74, 104.92, 104.06, 98.32, 97.81, 76.59, 75.94, 66.69, 66.35,26.33, 25.26, 16.72, 15.99のシグナルが認められた。
【0059】
上記の通り同定された各化合物の構造式を以下に示す。
【0060】
【化14】

【0061】
【化15】

【0062】
【化16】

以上の合成および精製手順により得られた各化合物の収量は、ウーロンホモビスフラバン−A(984mg)、ウーロンホモビスフラバン−B(374mg)、ウーロンホモビスフラバン−トリマー−1(468mg)、ウーロンホモビスフラバン−トリマー−2(73mg)、ウーロンホモビスフラバン−トリマー−4(12mg)、およびウーロンホモビスフラバン−テトラマー−2(44mg)であった。
【実施例2】
【0063】
リコンビナントグルコシルトランスフェラーゼ(rGTF)の調製
rGTFを、論文M.matsumoto et al, FEMS Microbiology Letters 228 (2003) 73-80に記載の方法に準じて調製した。すなわち、Streptococcus mutansのグルコシルトランスフェラーゼB(GTFB)をコードする遺伝子を含むプラスミドpSK6を保有するEscherichiacoli XL-2株を、アンピシリン100μg/mLおよびテトラサイクリン7.5μg/mL含有Luria Bertani液体培地中で37℃で16時間振盪培養した。培地を遠心分離して菌体を集め、菌体を冷却した10mMリン酸緩衝液(pH6.5)に懸濁した後、超音波発生機(UD201型、トミー精工、東京)で氷冷下で菌体を破砕した。破砕後、12,000x gで30分間遠心分離することにより沈査を取り除いた。得られた上清をリコンビナントグルコシルトランスフェラーゼB(rGTFB)として後の実験に用いた。
【0064】
同様に、Streptococcus mutansのグルコシルトランスフェラーゼC(GTFC)をコードする遺伝子を含むプラスミドpSK6を保有するEscherichiacoli XL-2株を用いて、リコンビナントグルコシルトランスフェラーゼC(rGTFC)を調製し、後の実験に用いた。
【0065】
rGTFBは比活性が503mU/mg proteinのものを用い、rGTFCは比活性が6.3〜22.3mU/mg proteinのものを混合して用いた。ここで、活性1Uは、1分間に、スクロース由来のグルコース1.0mMをグルカンへと転換した際の酵素活性を示す。タンパク質の定量は、ビシンコニン酸法(BCA法)(BCAプロテインアッセイキット、PIERCE社)を用いて行なった。
【実施例3】
【0066】
グルコシルトランスフェラーゼ阻害作用の評価(1)
実施例1により得られたウーロンホモビスフラバンA(OHBF−A)、ウーロンホモビスフラバンB(OHBF−B)、およびウーロンホモビスフラバン−トリマー−1(Tri−1)、ならびに論文(Hashimoto, F. Nonaka, G. Nishioka, I. Chem. Pharm. Bull. 36 (5), 1676-1684 (1988))に準じて調製したテアシネンシンA(TSN−A)の各々についてのグルコシルトランスフェラーゼ(GTF)阻害作用を、以下の手順により評価した。なお、ここで比較として用いたテアシネンシンA(TSN−A)は、EGCGのB環の2’位同士が対称的に結合した物質であり、以下の構造を有する:
【0067】
【化17】

1%スクロース含有0.1%デキストランT10を含む0.1M KPB(pH6.0)2mLに、実施例2により得られたrGTFBまたはrGTFC(15mU相当量)と、上記の各サンプル(0.1mg/mL、最終濃度)を混和し、37℃で一晩インキュベートした。得られた反応液の濁度(550nm)を測定することにより、非水溶性グルカンの生成量を測定した。非水溶性グルカンの生成量がより少ない(すなわち、濁度がより低い)ことは、グルコシルトランスフェラーゼの活性がより阻害されたことを示す。結果を図7および図8に示す。なお、図中のコントロール(Cont)は、上記サンプルを混和しない場合の濁度を示す。
【0068】
図7および8に示されるとおり、OHBF−Aは、GTFBの活性を阻害したものの、GTFCについては、逆に、活性をやや強めることがわかった。また、TSN−Aは、GTFBの活性にほとんど影響を及ぼさず、GTFCについては、逆に、活性を非常に強めることがわかった。一方、OHBF−BおよびOHBF−Tri−1は、GTFBとGTFCの両方について、活性を阻害することがわかった。特に、3量体であるOHBF−Tri−1は、2量体である他の化合物に比べて、GTFBおよびGTFCの両者の活性を最も強く阻害することがわかった。
【実施例4】
【0069】
グルコシルトランスフェラーゼ阻害作用の評価(2)
実施例1により得られたウーロンホモビスフラバン−トリマー−1(OHBF−Tri−1)、ウーロンホモビスフラバン−トリマー−2(OHBF−Tri−2)、ウーロンホモビスフラバン−トリマー−4(OHBF−Tri−4)、およびウーロンホモビスフラバン−テトラマー−2(OHBF−Tet−2)の各々についてのグルコシルトランスフェラーゼ(GTF)阻害作用を、以下の手順により評価した。
【0070】
1%スクロース含有0.1%デキストランT10を含む0.1M KPB(pH6.0)2mLに、実施例2により得られたrGTFBまたはrGTFC(15mU相当量)と、上記の各サンプル(0.05mg/mL、最終濃度)を混和し、37℃で一晩インキュベートした。得られた反応液の濁度(550nm)を測定することにより、非水溶性グルカンの生成量を測定した。非水溶性グルカンの生成量がより少ない(すなわち、濁度がより低い)ことは、グルコシルトランスフェラーゼの活性がより阻害されたことを示す。結果を図9および図10に示す。なお、図中のコントロール(Cont)は、上記サンプルを混和しない場合の濁度を示す。
【0071】
図9および10に示されるとおり、EGCG4量体であるTet−2は、GTFCの活性を有意に阻害したものの、GTFBに対しては有意な阻害効果が認められなかった。一方、EGCG3量体であるTri−1、Tri−2、およびTri−4の各々については、GTFBおよびGTFCに対して有意な阻害作用が認められ、GTFCの阻害活性に関しては、ECGC4量体であるTet−2のGTFCの阻害活性よりも高かった。
【0072】
以上の結果より、EGCG3量体であるTri−1、Tri−2、およびTri−4、ならびにEGCG2量体であるOHBF−Bに高いGTF阻害作用がみられることが判った。特に、EGCG3量体であるTri−1、Tri−2、およびTri−4は、EGCGの2量体であるOHBF−A、OHBF−B、およびTSN−A、ならびにEGCGの4量体であるTet−2に比べて、高いGTF阻害作用を有することがわかった。
【実施例5】
【0073】
LC−MS/MSによる重合ポリフェノールの定量
トリマーおよびテトラマーのLC−MS/MSの測定条件とサントリー黒烏龍茶の定量
EGCG重合物のLC−MS/MSの測定は、4000 Q TRAP(アプライド社製)で、ターボイオンスプレーを用い、以下の条件で測定した。Collision energy:46eV(nega.)、Ionspray voltage:4500V、Temp:450℃。
【0074】
各化合物のMRM(multiple reaction monitoring)における測定チャンネルはウーロンホモビスフラバン−トリマー類は、698.40/168.90(nega.2価)で、標準物質にはウーロンホモビスフラバン−トリマー−1を用いた。ウーロンホモビスフラバン−テトラマー類は、933.16/168.90(nega.2価)で標準物質にはウーロンホモビスフラバン−テトラマー−2を用いた。以下の測定条件で行った。
カラム:Develosil C30−UG−3(野村化学、3mmφ×150mm)
流速:0.3ml/min、
カラム温度:40℃
移動相A:0.1%HCOOH/H2O
移動相B:0.1%HCOOH/CH3CN
グラジエントプログラム:A91%/B9%(0min)→A40%/B60%(17min)→A15%/B85%(17.1min)、続いてA15%/B85%でアイソクラティック(17.1〜19min)
これらの化合物は黒烏龍茶中に微量しか含まれないため、直接定量することは不可能であった。そこで、黒烏龍茶(殺菌前)をCHP−20Pカラム(三菱化学株式会社)でステップワイズに分画し、各フラクションの定量を行った後、各フラクションに検出された濃度を合算して茶中の濃度とした。黒烏龍茶中の濃度は、トリマー類は検出された5成分をウーロンホモビスフラバン−トリマー−1換算で合算し、172ng/mlであった。テトラマー類は検出された4成分を合算し、ウーロンホモビスフラバン−テトラマー−2換算で55ng/mlであった。
【図面の簡単な説明】
【0075】
【図1】図1は、化合物2の1HNMRスペクトルを示す。
【図2】図2は、化合物2の13CNMRスペクトルを示す。
【図3】図3は、化合物3の1HNMRスペクトルを示す。
【図4】図4は、化合物3の13CNMRスペクトルを示す。
【図5】図5は、化合物1の1HNMRスペクトルを示す。
【図6】図6は、化合物1の13CNMRスペクトルを示す。
【図7】図7は、EGCG2量体および3量体の各化合物のグルコシルトランスフェラーゼBに対する阻害作用の評価結果を示す。
【図8】図8は、EGCG2量体および3量体の各化合物のグルコシルトランスフェラーゼCに対する阻害作用の評価結果を示す。
【図9】図9は、EGCG3量体および4量体の各化合物のグルコシルトランスフェラーゼBに対する阻害作用の評価結果を示す。
【図10】図10は、EGCG3量体および4量体の各化合物のグルコシルトランスフェラーゼCに対する阻害作用の評価結果を示す。
【特許請求の範囲】
【請求項1】
エピガロカテキンガレート3量体またはその塩を有効成分とするグルコシルトランスフェラーゼ阻害剤。
【請求項2】
前記エピガロカテキンガレート3量体が、クロマン環の6位および/または8位でメチレン基を介して結合した化合物である、請求項1に記載のグルコシルトランスフェラーゼ阻害剤。
【請求項3】
前記エピガロカテキンガレート3量体が、次式(I):
【化1】

を有する化合物、次式(II):
【化2】

を有する化合物、および次式(III):
【化3】

を有する化合物
(式(I)〜(III)中、Rは次式(A):
【化4】

で表されるガロイル基である)
からなる群から選択される化合物である、請求項2に記載のグルコシルトランスフェラーゼ阻害剤。
【請求項4】
次式(IV):
【化5】

で表される化合物を有効成分とするグルコシルトランスフェラーゼ阻害剤。
【請求項5】
エピガロカテキンガレート3量体またはその塩を有効成分とする抗う蝕剤。
【請求項6】
前記エピガロカテキンガレート3量体が、クロマン環の6位および/または8位でメチレン基を介して結合した化合物である、請求項5に記載の抗う蝕剤。
【請求項7】
前記エピガロカテキンガレート3量体が、次式(I):
【化6】

を有する化合物、次式(II):
【化7】

を有する化合物、および次式(III):
【化8】

を有する化合物
(式(I)〜(III)中、Rは次式(A):
【化9】

で表されるガロイル基である)
からなる群から選択される化合物である、請求項6に記載の抗う蝕剤。
【請求項8】
次式(IV):
【化10】

で表される化合物を有効成分とする抗う蝕剤。
【請求項9】
請求項1〜8のいずれかに記載のグルコシルトランスフェラーゼ阻害剤または抗う蝕剤を添加した飲食品。
【請求項10】
前記飲食品が茶飲料である、請求項9に記載の飲食品。
【請求項11】
請求項1〜8のいずれかに記載のグルコシルトランスフェラーゼ阻害剤または抗う蝕剤を添加した口腔衛生剤。
【請求項1】
エピガロカテキンガレート3量体またはその塩を有効成分とするグルコシルトランスフェラーゼ阻害剤。
【請求項2】
前記エピガロカテキンガレート3量体が、クロマン環の6位および/または8位でメチレン基を介して結合した化合物である、請求項1に記載のグルコシルトランスフェラーゼ阻害剤。
【請求項3】
前記エピガロカテキンガレート3量体が、次式(I):
【化1】

を有する化合物、次式(II):
【化2】

を有する化合物、および次式(III):
【化3】

を有する化合物
(式(I)〜(III)中、Rは次式(A):
【化4】

で表されるガロイル基である)
からなる群から選択される化合物である、請求項2に記載のグルコシルトランスフェラーゼ阻害剤。
【請求項4】
次式(IV):
【化5】

で表される化合物を有効成分とするグルコシルトランスフェラーゼ阻害剤。
【請求項5】
エピガロカテキンガレート3量体またはその塩を有効成分とする抗う蝕剤。
【請求項6】
前記エピガロカテキンガレート3量体が、クロマン環の6位および/または8位でメチレン基を介して結合した化合物である、請求項5に記載の抗う蝕剤。
【請求項7】
前記エピガロカテキンガレート3量体が、次式(I):
【化6】

を有する化合物、次式(II):
【化7】

を有する化合物、および次式(III):
【化8】

を有する化合物
(式(I)〜(III)中、Rは次式(A):
【化9】

で表されるガロイル基である)
からなる群から選択される化合物である、請求項6に記載の抗う蝕剤。
【請求項8】
次式(IV):
【化10】

で表される化合物を有効成分とする抗う蝕剤。
【請求項9】
請求項1〜8のいずれかに記載のグルコシルトランスフェラーゼ阻害剤または抗う蝕剤を添加した飲食品。
【請求項10】
前記飲食品が茶飲料である、請求項9に記載の飲食品。
【請求項11】
請求項1〜8のいずれかに記載のグルコシルトランスフェラーゼ阻害剤または抗う蝕剤を添加した口腔衛生剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2010−53110(P2010−53110A)
【公開日】平成22年3月11日(2010.3.11)
【国際特許分類】
【出願番号】特願2008−222851(P2008−222851)
【出願日】平成20年8月29日(2008.8.29)
【出願人】(309007911)サントリーホールディングス株式会社 (307)
【Fターム(参考)】
【公開日】平成22年3月11日(2010.3.11)
【国際特許分類】
【出願日】平成20年8月29日(2008.8.29)
【出願人】(309007911)サントリーホールディングス株式会社 (307)
【Fターム(参考)】
[ Back to top ]

