エピメタボリックシフター(コエンザイムQ10)を使用した疾患の処置方法
コエンザイムQ10を使用してヒトにおいて腫瘍性障害を処置するための方法および処方物が記載される。
Notice: Undefined index: DEJ in /mnt/www/gzt_disp.php on line 298
【特許請求の範囲】
【請求項1】
ヒトにおいて腫瘍性障害を処置または予防するための方法であって、処置または予防が生じるように、ヒトにコエンザイムQ10(CoQ10)を局所投与する工程を含む、方法。
【請求項2】
CoQ10が、腫瘍性障害の癌性細胞においてアポトーシスまたは細胞死の機構を誘導する、請求項1に記載の方法。
【請求項3】
CoQ10が、腫瘍性障害の癌性細胞において血管形成を阻害する、請求項1に記載の方法。
【請求項4】
CoQ10が、腫瘍性障害の癌性細胞中の微小環境内の免疫関連エレメントの調節を誘導する、請求項1に記載の方法。
【請求項5】
CoQ10が、腫瘍性障害の癌性細胞において細胞周期制御の変化を誘導する、請求項1に記載の方法。
【請求項6】
局所投与が、処置されている障害についてヒトにおいて有効性をもたらすように選択された用量により行われる、請求項1に記載の方法。
【請求項7】
前記障害の処置または予防が、酸化型のコエンザイムQ10により生じる、請求項1または6に記載の方法。
【請求項8】
ヒトの集団が処置され、前記集団の少なくとも25%に、組織病理学、臨床的観察、写真解析、CTスキャン、MRI造影、癌についての血液、血清、もしくは血漿マーカーを含む当該分野で認識されている終点により測定した場合に、症候の縮小が認められる、請求項1〜7のいずれか1項に記載の方法。
【請求項9】
ヒトの集団が処置され、前記集団の少なくとも25%が、処置されている障害について治療効果のある全身性コエンザイムQ10レベルを有していた、請求項1〜7のいずれか1項に記載の方法。
【請求項10】
前記処置されている腫瘍性障害が、治療有効レベルの有効成分が全身に送達されるという見込みで通常は局所投与により処置される障害ではない、請求項1〜7のいずれか1項に記載の方法。
【請求項11】
処置されているヒトの組織中のコエンザイムQ10の濃度が、健康な状態または正常な状態の典型であるヒト組織の対照基準のコエンザイムQ10濃度とは異なる、請求項1〜7のいずれか1項に記載の方法。
【請求項12】
前記ヒトに投与されるコエンザイムQ10の形態が、ヒトの体内の体循環において見られる主要な形態とは異なる、請求項1〜7のいずれか1項に記載の方法。
【請求項13】
前記処置が、HNF4−α、Bcl−xl、Bcl−xS、BNIP−2、Bcl−2、Birc6、Bcl−2−L11(Bim)、XIAP、BRAF、Bax、c−Jun、Bmf、PUMA、cMyc、トランスアルドラーゼ1、COQ1、COQ3、COQ6、プレニルトランスフェラーゼ、4−ヒドロキシ安息香酸、好中球細胞質因子2、一酸化窒素合成酵素2A、スーパーオキシドジスムターゼ2、VDAC、Baxチャンネル、ANT、チトクロームc、複合体1、複合体II、複合体III、複合体IV、Foxo 3a、DJ−1、IDH−1、Cpt1C、およびCamキナーゼII、ならびに、表2〜4および6〜28に列挙する遺伝子のうちの任意の1つもしくは複数からなる群より選択されるタンパク質とのコエンザイムQ10の相互作用により生じる、請求項1〜12のいずれか1項に記載の方法。
【請求項14】
コエンザイムQ10が、局所用基剤中で、皮膚1平方センチメートルあたり約0.01ミリグラム〜約0.5ミリグラムの範囲のコエンザイムQ10の用量で標的組織に対して適用される、請求項6に記載の方法。
【請求項15】
コエンザイムQ10が、局所用基剤中で、皮膚1平方センチメートルあたり約0.09ミリグラム〜約0.15ミリグラムの範囲のコエンザイムQ10の用量で標的組織に対して適用される、請求項6に記載の方法。
【請求項16】
コエンザイムQ10が、局所用基剤中で、皮膚1平方センチメートルあたり約0.12ミリグラムのコエンザイムQ10の用量で標的組織に対して適用される、請求項6に記載の方法。
【請求項17】
前記腫瘍性障害が扁平上皮細胞癌である、請求項14〜16のいずれか1項に記載の方法。
【請求項18】
前記腫瘍性障害が基底細胞癌である、請求項14〜16のいずれか1項に記載の方法。
【請求項19】
前記腫瘍性障害がSCCであり、前記方法が、前癌病変である日光性角化症のSCCへの進行を予防する、請求項14〜16のいずれか1項に記載の方法。
【請求項20】
前記腫瘍性障害が黒色腫である、請求項6に記載の方法。
【請求項21】
コエンザイムQ10が、6週間以上にわたり24時間あたり1回または複数回局所適用される、請求項14〜20のいずれか1項に記載の方法。
【請求項22】
コエンザイムQ10が、皮膚1平方センチメートルあたり0.5ミリグラム〜10ミリグラムのCoQ10クリームの投薬量でCoQ10クリームの形態で投与され、ここでは、前記CoQ10クリームに1%〜5%のコエンザイムQ10が含まれる、請求項6に記載の方法。
【請求項23】
前記CoQ10クリームに約3%のコエンザイムQ10が含まれる、請求項22に記載の方法。
【請求項24】
コエンザイムQ10が、皮膚1平方センチメートルあたり3ミリグラム〜5ミリグラムのCoQ10クリームの投薬量でCoQ10クリームの形態で投与され、ここでは、前記CoQ10クリームに1%〜5%のコエンザイムQ10が含まれる、請求項6に記載の方法。
【請求項25】
前記CoQ10クリームに約3%のコエンザイムQ10が含まれる、請求項24に記載の方法。
【請求項26】
ヒトにおいて攻撃性腫瘍性障害を処置または予防するための方法であって、攻撃性腫瘍性障害の処置または予防が生じるように、攻撃性が低いもしくは非攻撃性の腫瘍性障害に使用または選択される投薬計画よりも低い選択された用量で、コエンザイムQ10をヒトに投与する工程を含む、方法。
【請求項27】
前記攻撃性腫瘍性障害が、膵臓癌、肝細胞癌、ユーイング肉腫、転移性乳癌、転移性黒色腫、脳癌(星状細胞腫、神経膠芽腫)、神経内分泌癌、結腸癌、肺癌、骨肉腫、アンドロゲン依存性前立腺癌、卵巣癌、および非ホジキンリンパ腫からなる群より選択される、請求項26に記載の方法。
【請求項28】
ヒトにおいて非攻撃性腫瘍性障害を処置または予防するための方法であって、非攻撃性腫瘍性障害の処置または予防が生じるように、攻撃性腫瘍性障害に使用もしくは選択される投薬計画よりも高い選択された用量で、コエンザイムQ10をヒトに投与する工程を含む、方法。
【請求項29】
前記非攻撃性腫瘍性障害が、非転移性乳癌、アンドロゲン依存性前立腺癌、小細胞性肺癌、および急性リンパ球性白血病からなる群より選択される、請求項28に記載の方法。
【請求項30】
ヒトにおいて腫瘍性障害を処置または予防するための方法であって、腫瘍性障害の処置が生じるように、コエンザイムQ10をヒトに投与する工程を含み、ここでは、コエンザイムQ10は、処置の間、その酸化型で維持されるように投与される、方法。
【請求項31】
以下の工程を含む、ヒトにおいてグルコースの嫌気的使用を遮断するため、およびミトコンドリアの酸化的リン酸化を増大させるための方法:
(1)腫瘍性障害に罹患しているヒト被検体を選択する工程、および
(2)前記ヒトに治療有効量のコエンザイムQ10またはコエンザイムQ10の生合成経路の中間体を投与し、それにより、グルコースの嫌気的使用を遮断し、ミトコンドリアの酸化的リン酸化を増大させる工程。
【請求項32】
(1)HNF4−α、Bcl−xl、Bcl−xS、BNIP−2、Bcl−2、Birc6、Bcl−2−L11(Bim)、XIAP、BRAF、Bax、c−Jun、Bmf、PUMA、cMyc、トランスアルドラーゼ1、COQ1、COQ3、COQ6、プレニルトランスフェラーゼ、4−ヒドロキシ安息香酸、好中球細胞質因子2、一酸化窒素合成酵素2A、スーパーオキシドジスムターゼ2、VDAC、Baxチャンネル、ANT、チトクロームc、複合体1、複合体II、複合体III、複合体IV、Foxo 3a、DJ−1、IDH−1、Cpt1C、およびCamキナーゼIIからなる群より選択される1つまたは複数の遺伝子の発現をアップレギュレーションさせる工程、ならびに/あるいは
(2)HNF4−α、Bcl−xl、Bcl−xS、BNIP−2、Bcl−2、Birc6、Bcl−2−L11(Bim)、XIAP、BRAF、Bax、c−Jun、Bmf、PUMA、cMyc、トランスアルドラーゼ1、COQ1、COQ3、COQ6、プレニルトランスフェラーゼ、4−ヒドロキシ安息香酸、好中球細胞質因子2、一酸化窒素合成酵素2A、スーパーオキシドジスムターゼ2、VDAC、Baxチャンネル、ANT、チトクロームc、複合体1、複合体II、複合体III、複合体IV、Foxo 3a、DJ−1、IDH−1、Cpt1C、およびCamキナーゼIIからなる群より選択される1つまたは複数の遺伝子の発現をダウンレギュレーションさせる工程をさらに含み、
それにより、グルコースの嫌気的使用を遮断し、ミトコンドリアの酸化的リン酸化を増大させる、請求項31に記載の方法。
【請求項33】
以下の工程を含む、ヒトにおいてグルコースの嫌気的使用を遮断するため、およびミトコンドリアの酸化的リン酸化を増大させるための方法:
(1)攻撃性腫瘍性障害に罹患しているヒト被検体を選択する工程、および
(2)前記ヒトに治療有効量のコエンザイムQ10またはコエンザイムQ10の生合成経路の中間体を投与し、それにより、グルコースの嫌気的使用を遮断し、ミトコンドリアの酸化的リン酸化を増大させる工程。
【請求項34】
前記攻撃性腫瘍性障害が、膵臓癌、肝細胞癌、ユーイング肉腫、転移性乳癌、転移性黒色腫、脳癌(星状細胞腫、神経膠芽腫)、神経内分泌癌、結腸癌、肺癌、骨肉腫、アンドロゲン依存性前立腺癌、卵巣癌、および非ホジキンリンパ腫からなる群より選択される、請求項27に記載の方法。
【請求項35】
以下の工程を含む、ヒトにおいてグルコースの嫌気的使用を遮断するため、およびミトコンドリアの酸化的リン酸化を増大させるための方法:
(1)非攻撃性腫瘍性障害に罹患しているヒト被検体を選択する工程、および
(2)前記ヒトに治療有効量のコエンザイムQ10またはコエンザイムQ10の生合成経路の中間体を投与し、それにより、グルコースの嫌気的使用を遮断し、ミトコンドリアの酸化的リン酸化を増大させる工程。
【請求項36】
前記非攻撃性腫瘍性障害が、非転移性乳癌、アンドロゲン依存性前立腺癌、小細胞性肺癌、および急性リンパ球性白血病からなる群より選択される、請求項29に記載の方法。
【請求項37】
前記中間体が以下を含む、請求項31、33、または35に記載の方法:
(a)ベンゾキノンまたはベンゾキノン環の生合成を容易にする少なくとも1つの分子、ならびに
(b)イソプレノイドユニットの合成および/またはイソプレノイドユニットのベンゾキノン環への結合を容易にする少なくとも1つの分子。
【請求項38】
ベンゾキノン環の生合成を容易にする前記少なくとも1つの分子が:L−フェニルアラニン、DL−フェニルアラニン、D−フェニルアラニン、L−チロシン、DL−チロシン、D−チロシン、4−ヒドロキシ−フェニルピルビン酸、3−メトキシ−4−ヒドロキシマンデル酸(バニリンマンデル酸またはVMA)、バニリン酸、ピリドキシン、またはパンテノールを備える、請求項37に記載の方法。
【請求項39】
イソプレノイドユニットの合成および/またはイソプレノイドユニットのベンゾキノン環への結合を容易にする前記少なくとも1つの分子が:酢酸フェニル、4−ヒドロキシベンゾエート、メバロン酸、アセチルグリシン、アセチル−CoA、またはファルネシルを備える、請求項37に記載の方法。
【請求項40】
前記中間体が以下を含む、請求項31、33、または35に記載の方法:
(a)L−フェニルアラニン、L−チロシン、および4−ヒドロキシフェニルピルビン酸の1つ以上;ならびに
(b)4−ヒドロキシベンゾエート、酢酸フェニル、およびベンゾキノンの1つ以上。
【請求項41】
前記中間体が以下のとおりである、請求項31、33、または35に記載の方法:
(a)Bcl−2発現を阻害するおよび/もしくはカスパーゼ−3発現を増進する;ならびに/または
(b)細胞増殖を阻害する。
【請求項42】
ヒトにおいて腫瘍性障害を処置するための方法であって、ヒトの細胞膜の透過性が調節され、処置が生じるような投薬計画において、その必要があるヒトにコエンザイムQ10を投与する工程を含む、方法。
【請求項43】
前記処置が、以下からなる群より選択されるタンパク質とのCoQ10の相互作用を介して生じる、請求項26、28、30、31、33、および42のいずれか1項に記載の方法:HNF4−α、Bcl−xl、Bcl−xS、BNIP−2、Bcl−2、Birc6、Bcl−2−L11(Bim)、XIAP、BRAF、Bax、c−Jun、Bmf、PUMA、cMyc、トランスアルドラーゼ1、COQ1、COQ3、COQ6、プレニルトランスフェラーゼ、4−ヒドロキシ安息香酸、好中球細胞質因子2、一酸化窒素合成酵素2A、スーパーオキシドジスムターゼ2、VDAC、Baxチャンネル、ANT、チトクロームc、複合体1、複合体II、複合体III、複合体IV、Foxo 3a、DJ−1、IDH−1、Cpt1C、およびCamキナーゼII、ならびに、表2〜4および6〜28に列挙する遺伝子のうちの任意の1つもしくは複数。
【請求項44】
前記腫瘍性障害が、白血病、リンパ腫、黒色腫、癌腫、および肉腫からなる群より選択される、請求項1、26、28、30、31、33、および42のいずれか1項に記載の方法。
【請求項45】
外科手術、放射線療法、ホルモン療法、抗体療法、成長因子を用いた療法、サイトカイン、および化学療法から成る群より選択される処置レジメンをさらに備える、請求項1〜44のいずれか1項に記載の方法。
【請求項46】
以下の工程を含む、コエンザイムQ10クリーム3%を調製する方法:
(1)相A、相B、相C、相D、および相Eを調製する工程;ならびに、
(2)3%CoQ10クリームの水中油エマルジョンが形成されるように、相A、B、C、D、およびEを混合する工程。
【請求項47】
以下のとおりである、請求項46に記載の方法:
(1)相Aの成分には、4.00%w/wのアルキルC12〜15安息香酸NF、2.00%w/wのセチルアルコールNF、4.5%w/wのステアリン酸グリセリル/PEG−100、および1.50%w/wのステアリルアルコールNFが含まれ;
(2)相Bの成分には、5.00%w/wのジエチレングリコールモノエチルエーテルNF、2.00%w/wのグリセリンUSP、1.50%w/wのプロピレングリコールUSP、0.475%w/wのフェノキシエタノールNF、16.725%w/wの精製水USP、および40.00%w/wの2%カルボマー分散液が含まれ;
(3)相Cの成分には、0.50%w/wの乳酸USP、2.00%w/wの乳酸ナトリウム溶液USP、1.30%w/wのトロラミンNF、および2.50%w/wの精製水USPが含まれ;
(4)相Dの成分には、1.00%w/wの二酸化チタンUSPが含まれ;
(5)相Eの成分には、15%w/wのCoQ10 21%濃縮物が含まれ;
ここでは、重量百分率は、CoQ10クリーム3%全体に対する百分率である。
【請求項48】
以下のとおりである、請求項46に記載の方法:
(1)相Aの成分には、4.00%w/wのカプリル/カプリン酸トリグリセリド、2.00%w/wのセチルアルコールNF、4.5%のステアリン酸グリセリル/PEG−100、および1.5%w/wのステアリルアルコールNFが含まれ;
(2)相Bの成分には、5.00%w/wのジエチレングリコールモノエチルエーテルNF、2.00%w/wのグリセリンUSP、1.50%w/wのプロピレングリコールUSP、0.475%w/wのフェノキシエタノールNF、16.725%w/wの精製水USP、および40.00%w/wの2%カルボマー分散液が含まれ;
(3)相Cの成分には、0.50%w/wの乳酸USP、2.00%w/wの乳酸ナトリウム溶液USP、1.30%w/wのトリエタノールアミンNF、および2.50%w/wの精製水USPが含まれ;
(4)相Dの成分には、1.00%w/wの二酸化チタンUSPが含まれ;
(5)相Eの成分には、15%w/wのCoQ10 21%濃縮物が含まれ;
ここでは、各成分の重量百分率は、CoQ10クリーム3%全体に対する百分率である。
【請求項49】
以下のとおりである、請求項47または48のいずれか1項に記載の方法:
(1)相Aの成分が適切な容器に添加され、水浴中で70〜80℃に加熱される;
(2)カルボマー分散液を含まない相Bの成分が適切な容器に添加され、混合された相Bが形成されるように混合される;
(3)相Cの成分が適切な容器に添加され、水浴中で70〜80℃に加熱される;
(4)相Eの成分が適切な容器に入れられ、融解した相Eが形成されるように、水浴を使用して50〜60℃で融解させられる;
(5)カルボマー分散液がMix Tankに添加され、混合しながら70〜80℃に加熱される;
(6)混合された相BがMix Tankに添加され、その間、温度が70〜80℃で維持される;
(7)相Cの成分がMix Tankに添加され、その間、温度が70〜80℃で維持される;
(8)相Dの成分がMix Tankに添加され、混合され、ホモジナイズされる;ここでは、上記方法には以下の工程がさらに含まれる:
(a)ホモジナイズを停止し、Mix Tankの内容物を50〜60℃に冷却する工程;
(b)混合を中断し、融解させた相EをMix Tankに添加して、分散液を形成させる工程;
(c)分散液が滑らかで均一になるまで、混合を再開する工程;ならびに
(d)Mix Tankの内容物を45〜50℃に冷却する工程。
【請求項50】
CoQ10クリーム3%を含有している薬学的組成物であって、前記クリームが以下を含む、薬学的組成物;
(1)前記組成物の4.00%w/wのC12〜15アルキル安息香酸、前記組成物の2.00%w/wのセチルアルコール、1.5%w/wのステアリルアルコール、4.5%w/wのステアリン酸グリセリルおよびPEG−100を有している相A;
(2)2.000%w/wのグリセリン、1.5%w/wのプロピレングリコール、5.0%w/wのエトキシジグリコール、0.475%w/wのフェノキシエタノール、40.00%w/wのカルボマー分散液、16.725%w/wの精製水を有している相B;
(3)1.300%w/wのトリエタノールアミン、0.500%w/wの乳酸、2.000%w/wの乳酸ナトリウム溶液、2.5%w/wの水を有している相C;
(4)1.000%w/wの二酸化チタンを有している相D;ならびに
(5)15.000%w/wのCoQ10 21%濃縮物を有している相E。
【請求項51】
前記カルボマー分散液に、水、フェノキシエタノール、プロピレングリコール、およびカルボマー940が含まれている、請求項50に記載の薬学的組成物。
【請求項52】
CoQ10クリーム3%を含有している薬学的組成物であって、前記クリームが以下を含む、薬学的組成物;
(1)前記組成物の4.00%w/wのカプリル/カプリン酸トリグリセリド、前記組成物の2.00%w/wのセチルアルコール、1.5%w/wのステアリルアルコール、4.5%w/wのステアリン酸グリセリルおよびPEG−100を有している相A;
(2)2.000%w/wのグリセリン、1.5%w/wのプロピレングリコール、5.0%w/wのエトキシジグリコール、0.475%w/wのフェノキシエタノール、40.00%w/wのカルボマー分散液、16.725%w/wの精製水を有している相B;
(3)1.300%w/wのトリエタノールアミン、0.500%w/wの乳酸、2.000%w/wの乳酸ナトリウム溶液、2.5%w/wの水を有している相C;
(4)1.000%w/wの二酸化チタンを有している相D;ならびに
(5)15.000%w/wのCoQ10 21%濃縮物を有している相E。
【請求項53】
CoQ10クリーム1.5%を含有している薬学的組成物であって、前記クリームが以下を含む、薬学的組成物;
(1)5.000%w/wのC12〜15アルキル安息香酸、2.000%w/wのセチルアルコール、1.5%w/wのステアリルアルコール、4.500%w/wのステアリン酸グリセリルおよびPEG−100を有している相A;
(2)2.000%w/wのグリセリン、1.750%w/wのプロピレングリコール、5.000%w/wのエトキシジグリコール、0.463%w/wのフェノキシエタノール、50%w/wのカルボマー分散液、および11.377%w/wの精製水を有している相B;
(3)1.3%w/wのトリエタノールアミン、0.400%w/wの乳酸、2.000%w/wの乳酸ナトリウム溶液、および4.210%w/wの水を有している相C;
(4)1.000%w/wの二酸化チタンを有している相D;ならびに
(5)1.500%w/wのCoQ10 21%濃縮物を有している相E。
【請求項54】
CoQ10クリーム1.5%を含有している薬学的組成物であって、前記クリームが以下を含む、薬学的組成物;
(1)5.000%w/wのカプリル/カプリン酸トリグリセリド、2.000%w/wのセチルアルコール、1.5%w/wのステアリルアルコール、4.500%w/wのステアリン酸グリセリルおよびステアリン酸PEG−100を有している相A;
(2)2.000%w/wのグリセリン、1.750%w/wのプロピレン、5.000%w/wのエトキシジグリコール、0.463%w/wのフェノキシエタノール、50%w/wのカルボマー分散液、および11.377%w/wの精製水を有している相B;
(3)1.3%w/wのトリエタノールアミン、0.400%w/wの乳酸、2.000%w/wの乳酸ナトリウム溶液、および4.210%w/wの水を有している相C;
(4)1.000%w/wの二酸化チタンを有している相D;ならびに
(5)1.500%w/wのCoQ10 21%濃縮物を有している相E。
【請求項55】
前記カルボマー分散液が、水、フェノキシエタノール、およびプロピレングリコールを含む、請求項53に記載の薬学的組成物。
【請求項56】
ヒトにおいてCoQ10反応性障害を処置または予防するための方法であって、処置または予防が生じるように、ヒトにコエンザイムQ10(CoQ10)を局所投与する工程を含む、方法。
【請求項57】
CoQ10反応性障害が腫瘍性障害である、請求項56に記載の方法。
【請求項1】
ヒトにおいて腫瘍性障害を処置または予防するための方法であって、処置または予防が生じるように、ヒトにコエンザイムQ10(CoQ10)を局所投与する工程を含む、方法。
【請求項2】
CoQ10が、腫瘍性障害の癌性細胞においてアポトーシスまたは細胞死の機構を誘導する、請求項1に記載の方法。
【請求項3】
CoQ10が、腫瘍性障害の癌性細胞において血管形成を阻害する、請求項1に記載の方法。
【請求項4】
CoQ10が、腫瘍性障害の癌性細胞中の微小環境内の免疫関連エレメントの調節を誘導する、請求項1に記載の方法。
【請求項5】
CoQ10が、腫瘍性障害の癌性細胞において細胞周期制御の変化を誘導する、請求項1に記載の方法。
【請求項6】
局所投与が、処置されている障害についてヒトにおいて有効性をもたらすように選択された用量により行われる、請求項1に記載の方法。
【請求項7】
前記障害の処置または予防が、酸化型のコエンザイムQ10により生じる、請求項1または6に記載の方法。
【請求項8】
ヒトの集団が処置され、前記集団の少なくとも25%に、組織病理学、臨床的観察、写真解析、CTスキャン、MRI造影、癌についての血液、血清、もしくは血漿マーカーを含む当該分野で認識されている終点により測定した場合に、症候の縮小が認められる、請求項1〜7のいずれか1項に記載の方法。
【請求項9】
ヒトの集団が処置され、前記集団の少なくとも25%が、処置されている障害について治療効果のある全身性コエンザイムQ10レベルを有していた、請求項1〜7のいずれか1項に記載の方法。
【請求項10】
前記処置されている腫瘍性障害が、治療有効レベルの有効成分が全身に送達されるという見込みで通常は局所投与により処置される障害ではない、請求項1〜7のいずれか1項に記載の方法。
【請求項11】
処置されているヒトの組織中のコエンザイムQ10の濃度が、健康な状態または正常な状態の典型であるヒト組織の対照基準のコエンザイムQ10濃度とは異なる、請求項1〜7のいずれか1項に記載の方法。
【請求項12】
前記ヒトに投与されるコエンザイムQ10の形態が、ヒトの体内の体循環において見られる主要な形態とは異なる、請求項1〜7のいずれか1項に記載の方法。
【請求項13】
前記処置が、HNF4−α、Bcl−xl、Bcl−xS、BNIP−2、Bcl−2、Birc6、Bcl−2−L11(Bim)、XIAP、BRAF、Bax、c−Jun、Bmf、PUMA、cMyc、トランスアルドラーゼ1、COQ1、COQ3、COQ6、プレニルトランスフェラーゼ、4−ヒドロキシ安息香酸、好中球細胞質因子2、一酸化窒素合成酵素2A、スーパーオキシドジスムターゼ2、VDAC、Baxチャンネル、ANT、チトクロームc、複合体1、複合体II、複合体III、複合体IV、Foxo 3a、DJ−1、IDH−1、Cpt1C、およびCamキナーゼII、ならびに、表2〜4および6〜28に列挙する遺伝子のうちの任意の1つもしくは複数からなる群より選択されるタンパク質とのコエンザイムQ10の相互作用により生じる、請求項1〜12のいずれか1項に記載の方法。
【請求項14】
コエンザイムQ10が、局所用基剤中で、皮膚1平方センチメートルあたり約0.01ミリグラム〜約0.5ミリグラムの範囲のコエンザイムQ10の用量で標的組織に対して適用される、請求項6に記載の方法。
【請求項15】
コエンザイムQ10が、局所用基剤中で、皮膚1平方センチメートルあたり約0.09ミリグラム〜約0.15ミリグラムの範囲のコエンザイムQ10の用量で標的組織に対して適用される、請求項6に記載の方法。
【請求項16】
コエンザイムQ10が、局所用基剤中で、皮膚1平方センチメートルあたり約0.12ミリグラムのコエンザイムQ10の用量で標的組織に対して適用される、請求項6に記載の方法。
【請求項17】
前記腫瘍性障害が扁平上皮細胞癌である、請求項14〜16のいずれか1項に記載の方法。
【請求項18】
前記腫瘍性障害が基底細胞癌である、請求項14〜16のいずれか1項に記載の方法。
【請求項19】
前記腫瘍性障害がSCCであり、前記方法が、前癌病変である日光性角化症のSCCへの進行を予防する、請求項14〜16のいずれか1項に記載の方法。
【請求項20】
前記腫瘍性障害が黒色腫である、請求項6に記載の方法。
【請求項21】
コエンザイムQ10が、6週間以上にわたり24時間あたり1回または複数回局所適用される、請求項14〜20のいずれか1項に記載の方法。
【請求項22】
コエンザイムQ10が、皮膚1平方センチメートルあたり0.5ミリグラム〜10ミリグラムのCoQ10クリームの投薬量でCoQ10クリームの形態で投与され、ここでは、前記CoQ10クリームに1%〜5%のコエンザイムQ10が含まれる、請求項6に記載の方法。
【請求項23】
前記CoQ10クリームに約3%のコエンザイムQ10が含まれる、請求項22に記載の方法。
【請求項24】
コエンザイムQ10が、皮膚1平方センチメートルあたり3ミリグラム〜5ミリグラムのCoQ10クリームの投薬量でCoQ10クリームの形態で投与され、ここでは、前記CoQ10クリームに1%〜5%のコエンザイムQ10が含まれる、請求項6に記載の方法。
【請求項25】
前記CoQ10クリームに約3%のコエンザイムQ10が含まれる、請求項24に記載の方法。
【請求項26】
ヒトにおいて攻撃性腫瘍性障害を処置または予防するための方法であって、攻撃性腫瘍性障害の処置または予防が生じるように、攻撃性が低いもしくは非攻撃性の腫瘍性障害に使用または選択される投薬計画よりも低い選択された用量で、コエンザイムQ10をヒトに投与する工程を含む、方法。
【請求項27】
前記攻撃性腫瘍性障害が、膵臓癌、肝細胞癌、ユーイング肉腫、転移性乳癌、転移性黒色腫、脳癌(星状細胞腫、神経膠芽腫)、神経内分泌癌、結腸癌、肺癌、骨肉腫、アンドロゲン依存性前立腺癌、卵巣癌、および非ホジキンリンパ腫からなる群より選択される、請求項26に記載の方法。
【請求項28】
ヒトにおいて非攻撃性腫瘍性障害を処置または予防するための方法であって、非攻撃性腫瘍性障害の処置または予防が生じるように、攻撃性腫瘍性障害に使用もしくは選択される投薬計画よりも高い選択された用量で、コエンザイムQ10をヒトに投与する工程を含む、方法。
【請求項29】
前記非攻撃性腫瘍性障害が、非転移性乳癌、アンドロゲン依存性前立腺癌、小細胞性肺癌、および急性リンパ球性白血病からなる群より選択される、請求項28に記載の方法。
【請求項30】
ヒトにおいて腫瘍性障害を処置または予防するための方法であって、腫瘍性障害の処置が生じるように、コエンザイムQ10をヒトに投与する工程を含み、ここでは、コエンザイムQ10は、処置の間、その酸化型で維持されるように投与される、方法。
【請求項31】
以下の工程を含む、ヒトにおいてグルコースの嫌気的使用を遮断するため、およびミトコンドリアの酸化的リン酸化を増大させるための方法:
(1)腫瘍性障害に罹患しているヒト被検体を選択する工程、および
(2)前記ヒトに治療有効量のコエンザイムQ10またはコエンザイムQ10の生合成経路の中間体を投与し、それにより、グルコースの嫌気的使用を遮断し、ミトコンドリアの酸化的リン酸化を増大させる工程。
【請求項32】
(1)HNF4−α、Bcl−xl、Bcl−xS、BNIP−2、Bcl−2、Birc6、Bcl−2−L11(Bim)、XIAP、BRAF、Bax、c−Jun、Bmf、PUMA、cMyc、トランスアルドラーゼ1、COQ1、COQ3、COQ6、プレニルトランスフェラーゼ、4−ヒドロキシ安息香酸、好中球細胞質因子2、一酸化窒素合成酵素2A、スーパーオキシドジスムターゼ2、VDAC、Baxチャンネル、ANT、チトクロームc、複合体1、複合体II、複合体III、複合体IV、Foxo 3a、DJ−1、IDH−1、Cpt1C、およびCamキナーゼIIからなる群より選択される1つまたは複数の遺伝子の発現をアップレギュレーションさせる工程、ならびに/あるいは
(2)HNF4−α、Bcl−xl、Bcl−xS、BNIP−2、Bcl−2、Birc6、Bcl−2−L11(Bim)、XIAP、BRAF、Bax、c−Jun、Bmf、PUMA、cMyc、トランスアルドラーゼ1、COQ1、COQ3、COQ6、プレニルトランスフェラーゼ、4−ヒドロキシ安息香酸、好中球細胞質因子2、一酸化窒素合成酵素2A、スーパーオキシドジスムターゼ2、VDAC、Baxチャンネル、ANT、チトクロームc、複合体1、複合体II、複合体III、複合体IV、Foxo 3a、DJ−1、IDH−1、Cpt1C、およびCamキナーゼIIからなる群より選択される1つまたは複数の遺伝子の発現をダウンレギュレーションさせる工程をさらに含み、
それにより、グルコースの嫌気的使用を遮断し、ミトコンドリアの酸化的リン酸化を増大させる、請求項31に記載の方法。
【請求項33】
以下の工程を含む、ヒトにおいてグルコースの嫌気的使用を遮断するため、およびミトコンドリアの酸化的リン酸化を増大させるための方法:
(1)攻撃性腫瘍性障害に罹患しているヒト被検体を選択する工程、および
(2)前記ヒトに治療有効量のコエンザイムQ10またはコエンザイムQ10の生合成経路の中間体を投与し、それにより、グルコースの嫌気的使用を遮断し、ミトコンドリアの酸化的リン酸化を増大させる工程。
【請求項34】
前記攻撃性腫瘍性障害が、膵臓癌、肝細胞癌、ユーイング肉腫、転移性乳癌、転移性黒色腫、脳癌(星状細胞腫、神経膠芽腫)、神経内分泌癌、結腸癌、肺癌、骨肉腫、アンドロゲン依存性前立腺癌、卵巣癌、および非ホジキンリンパ腫からなる群より選択される、請求項27に記載の方法。
【請求項35】
以下の工程を含む、ヒトにおいてグルコースの嫌気的使用を遮断するため、およびミトコンドリアの酸化的リン酸化を増大させるための方法:
(1)非攻撃性腫瘍性障害に罹患しているヒト被検体を選択する工程、および
(2)前記ヒトに治療有効量のコエンザイムQ10またはコエンザイムQ10の生合成経路の中間体を投与し、それにより、グルコースの嫌気的使用を遮断し、ミトコンドリアの酸化的リン酸化を増大させる工程。
【請求項36】
前記非攻撃性腫瘍性障害が、非転移性乳癌、アンドロゲン依存性前立腺癌、小細胞性肺癌、および急性リンパ球性白血病からなる群より選択される、請求項29に記載の方法。
【請求項37】
前記中間体が以下を含む、請求項31、33、または35に記載の方法:
(a)ベンゾキノンまたはベンゾキノン環の生合成を容易にする少なくとも1つの分子、ならびに
(b)イソプレノイドユニットの合成および/またはイソプレノイドユニットのベンゾキノン環への結合を容易にする少なくとも1つの分子。
【請求項38】
ベンゾキノン環の生合成を容易にする前記少なくとも1つの分子が:L−フェニルアラニン、DL−フェニルアラニン、D−フェニルアラニン、L−チロシン、DL−チロシン、D−チロシン、4−ヒドロキシ−フェニルピルビン酸、3−メトキシ−4−ヒドロキシマンデル酸(バニリンマンデル酸またはVMA)、バニリン酸、ピリドキシン、またはパンテノールを備える、請求項37に記載の方法。
【請求項39】
イソプレノイドユニットの合成および/またはイソプレノイドユニットのベンゾキノン環への結合を容易にする前記少なくとも1つの分子が:酢酸フェニル、4−ヒドロキシベンゾエート、メバロン酸、アセチルグリシン、アセチル−CoA、またはファルネシルを備える、請求項37に記載の方法。
【請求項40】
前記中間体が以下を含む、請求項31、33、または35に記載の方法:
(a)L−フェニルアラニン、L−チロシン、および4−ヒドロキシフェニルピルビン酸の1つ以上;ならびに
(b)4−ヒドロキシベンゾエート、酢酸フェニル、およびベンゾキノンの1つ以上。
【請求項41】
前記中間体が以下のとおりである、請求項31、33、または35に記載の方法:
(a)Bcl−2発現を阻害するおよび/もしくはカスパーゼ−3発現を増進する;ならびに/または
(b)細胞増殖を阻害する。
【請求項42】
ヒトにおいて腫瘍性障害を処置するための方法であって、ヒトの細胞膜の透過性が調節され、処置が生じるような投薬計画において、その必要があるヒトにコエンザイムQ10を投与する工程を含む、方法。
【請求項43】
前記処置が、以下からなる群より選択されるタンパク質とのCoQ10の相互作用を介して生じる、請求項26、28、30、31、33、および42のいずれか1項に記載の方法:HNF4−α、Bcl−xl、Bcl−xS、BNIP−2、Bcl−2、Birc6、Bcl−2−L11(Bim)、XIAP、BRAF、Bax、c−Jun、Bmf、PUMA、cMyc、トランスアルドラーゼ1、COQ1、COQ3、COQ6、プレニルトランスフェラーゼ、4−ヒドロキシ安息香酸、好中球細胞質因子2、一酸化窒素合成酵素2A、スーパーオキシドジスムターゼ2、VDAC、Baxチャンネル、ANT、チトクロームc、複合体1、複合体II、複合体III、複合体IV、Foxo 3a、DJ−1、IDH−1、Cpt1C、およびCamキナーゼII、ならびに、表2〜4および6〜28に列挙する遺伝子のうちの任意の1つもしくは複数。
【請求項44】
前記腫瘍性障害が、白血病、リンパ腫、黒色腫、癌腫、および肉腫からなる群より選択される、請求項1、26、28、30、31、33、および42のいずれか1項に記載の方法。
【請求項45】
外科手術、放射線療法、ホルモン療法、抗体療法、成長因子を用いた療法、サイトカイン、および化学療法から成る群より選択される処置レジメンをさらに備える、請求項1〜44のいずれか1項に記載の方法。
【請求項46】
以下の工程を含む、コエンザイムQ10クリーム3%を調製する方法:
(1)相A、相B、相C、相D、および相Eを調製する工程;ならびに、
(2)3%CoQ10クリームの水中油エマルジョンが形成されるように、相A、B、C、D、およびEを混合する工程。
【請求項47】
以下のとおりである、請求項46に記載の方法:
(1)相Aの成分には、4.00%w/wのアルキルC12〜15安息香酸NF、2.00%w/wのセチルアルコールNF、4.5%w/wのステアリン酸グリセリル/PEG−100、および1.50%w/wのステアリルアルコールNFが含まれ;
(2)相Bの成分には、5.00%w/wのジエチレングリコールモノエチルエーテルNF、2.00%w/wのグリセリンUSP、1.50%w/wのプロピレングリコールUSP、0.475%w/wのフェノキシエタノールNF、16.725%w/wの精製水USP、および40.00%w/wの2%カルボマー分散液が含まれ;
(3)相Cの成分には、0.50%w/wの乳酸USP、2.00%w/wの乳酸ナトリウム溶液USP、1.30%w/wのトロラミンNF、および2.50%w/wの精製水USPが含まれ;
(4)相Dの成分には、1.00%w/wの二酸化チタンUSPが含まれ;
(5)相Eの成分には、15%w/wのCoQ10 21%濃縮物が含まれ;
ここでは、重量百分率は、CoQ10クリーム3%全体に対する百分率である。
【請求項48】
以下のとおりである、請求項46に記載の方法:
(1)相Aの成分には、4.00%w/wのカプリル/カプリン酸トリグリセリド、2.00%w/wのセチルアルコールNF、4.5%のステアリン酸グリセリル/PEG−100、および1.5%w/wのステアリルアルコールNFが含まれ;
(2)相Bの成分には、5.00%w/wのジエチレングリコールモノエチルエーテルNF、2.00%w/wのグリセリンUSP、1.50%w/wのプロピレングリコールUSP、0.475%w/wのフェノキシエタノールNF、16.725%w/wの精製水USP、および40.00%w/wの2%カルボマー分散液が含まれ;
(3)相Cの成分には、0.50%w/wの乳酸USP、2.00%w/wの乳酸ナトリウム溶液USP、1.30%w/wのトリエタノールアミンNF、および2.50%w/wの精製水USPが含まれ;
(4)相Dの成分には、1.00%w/wの二酸化チタンUSPが含まれ;
(5)相Eの成分には、15%w/wのCoQ10 21%濃縮物が含まれ;
ここでは、各成分の重量百分率は、CoQ10クリーム3%全体に対する百分率である。
【請求項49】
以下のとおりである、請求項47または48のいずれか1項に記載の方法:
(1)相Aの成分が適切な容器に添加され、水浴中で70〜80℃に加熱される;
(2)カルボマー分散液を含まない相Bの成分が適切な容器に添加され、混合された相Bが形成されるように混合される;
(3)相Cの成分が適切な容器に添加され、水浴中で70〜80℃に加熱される;
(4)相Eの成分が適切な容器に入れられ、融解した相Eが形成されるように、水浴を使用して50〜60℃で融解させられる;
(5)カルボマー分散液がMix Tankに添加され、混合しながら70〜80℃に加熱される;
(6)混合された相BがMix Tankに添加され、その間、温度が70〜80℃で維持される;
(7)相Cの成分がMix Tankに添加され、その間、温度が70〜80℃で維持される;
(8)相Dの成分がMix Tankに添加され、混合され、ホモジナイズされる;ここでは、上記方法には以下の工程がさらに含まれる:
(a)ホモジナイズを停止し、Mix Tankの内容物を50〜60℃に冷却する工程;
(b)混合を中断し、融解させた相EをMix Tankに添加して、分散液を形成させる工程;
(c)分散液が滑らかで均一になるまで、混合を再開する工程;ならびに
(d)Mix Tankの内容物を45〜50℃に冷却する工程。
【請求項50】
CoQ10クリーム3%を含有している薬学的組成物であって、前記クリームが以下を含む、薬学的組成物;
(1)前記組成物の4.00%w/wのC12〜15アルキル安息香酸、前記組成物の2.00%w/wのセチルアルコール、1.5%w/wのステアリルアルコール、4.5%w/wのステアリン酸グリセリルおよびPEG−100を有している相A;
(2)2.000%w/wのグリセリン、1.5%w/wのプロピレングリコール、5.0%w/wのエトキシジグリコール、0.475%w/wのフェノキシエタノール、40.00%w/wのカルボマー分散液、16.725%w/wの精製水を有している相B;
(3)1.300%w/wのトリエタノールアミン、0.500%w/wの乳酸、2.000%w/wの乳酸ナトリウム溶液、2.5%w/wの水を有している相C;
(4)1.000%w/wの二酸化チタンを有している相D;ならびに
(5)15.000%w/wのCoQ10 21%濃縮物を有している相E。
【請求項51】
前記カルボマー分散液に、水、フェノキシエタノール、プロピレングリコール、およびカルボマー940が含まれている、請求項50に記載の薬学的組成物。
【請求項52】
CoQ10クリーム3%を含有している薬学的組成物であって、前記クリームが以下を含む、薬学的組成物;
(1)前記組成物の4.00%w/wのカプリル/カプリン酸トリグリセリド、前記組成物の2.00%w/wのセチルアルコール、1.5%w/wのステアリルアルコール、4.5%w/wのステアリン酸グリセリルおよびPEG−100を有している相A;
(2)2.000%w/wのグリセリン、1.5%w/wのプロピレングリコール、5.0%w/wのエトキシジグリコール、0.475%w/wのフェノキシエタノール、40.00%w/wのカルボマー分散液、16.725%w/wの精製水を有している相B;
(3)1.300%w/wのトリエタノールアミン、0.500%w/wの乳酸、2.000%w/wの乳酸ナトリウム溶液、2.5%w/wの水を有している相C;
(4)1.000%w/wの二酸化チタンを有している相D;ならびに
(5)15.000%w/wのCoQ10 21%濃縮物を有している相E。
【請求項53】
CoQ10クリーム1.5%を含有している薬学的組成物であって、前記クリームが以下を含む、薬学的組成物;
(1)5.000%w/wのC12〜15アルキル安息香酸、2.000%w/wのセチルアルコール、1.5%w/wのステアリルアルコール、4.500%w/wのステアリン酸グリセリルおよびPEG−100を有している相A;
(2)2.000%w/wのグリセリン、1.750%w/wのプロピレングリコール、5.000%w/wのエトキシジグリコール、0.463%w/wのフェノキシエタノール、50%w/wのカルボマー分散液、および11.377%w/wの精製水を有している相B;
(3)1.3%w/wのトリエタノールアミン、0.400%w/wの乳酸、2.000%w/wの乳酸ナトリウム溶液、および4.210%w/wの水を有している相C;
(4)1.000%w/wの二酸化チタンを有している相D;ならびに
(5)1.500%w/wのCoQ10 21%濃縮物を有している相E。
【請求項54】
CoQ10クリーム1.5%を含有している薬学的組成物であって、前記クリームが以下を含む、薬学的組成物;
(1)5.000%w/wのカプリル/カプリン酸トリグリセリド、2.000%w/wのセチルアルコール、1.5%w/wのステアリルアルコール、4.500%w/wのステアリン酸グリセリルおよびステアリン酸PEG−100を有している相A;
(2)2.000%w/wのグリセリン、1.750%w/wのプロピレン、5.000%w/wのエトキシジグリコール、0.463%w/wのフェノキシエタノール、50%w/wのカルボマー分散液、および11.377%w/wの精製水を有している相B;
(3)1.3%w/wのトリエタノールアミン、0.400%w/wの乳酸、2.000%w/wの乳酸ナトリウム溶液、および4.210%w/wの水を有している相C;
(4)1.000%w/wの二酸化チタンを有している相D;ならびに
(5)1.500%w/wのCoQ10 21%濃縮物を有している相E。
【請求項55】
前記カルボマー分散液が、水、フェノキシエタノール、およびプロピレングリコールを含む、請求項53に記載の薬学的組成物。
【請求項56】
ヒトにおいてCoQ10反応性障害を処置または予防するための方法であって、処置または予防が生じるように、ヒトにコエンザイムQ10(CoQ10)を局所投与する工程を含む、方法。
【請求項57】
CoQ10反応性障害が腫瘍性障害である、請求項56に記載の方法。
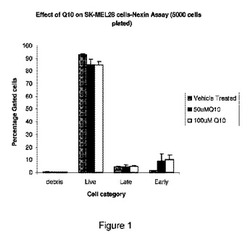
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13A】


【図13B】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【図39】


【図40】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13A】


【図13B】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【図39】


【図40】


【公表番号】特表2012−526829(P2012−526829A)
【公表日】平成24年11月1日(2012.11.1)
【国際特許分類】
【出願番号】特願2012−510959(P2012−510959)
【出願日】平成22年5月11日(2010.5.11)
【国際出願番号】PCT/US2010/034453
【国際公開番号】WO2010/132507
【国際公開日】平成22年11月18日(2010.11.18)
【出願人】(511181278)バーグ バイオシステムズ,エルエルシー (7)
【Fターム(参考)】
【公表日】平成24年11月1日(2012.11.1)
【国際特許分類】
【出願日】平成22年5月11日(2010.5.11)
【国際出願番号】PCT/US2010/034453
【国際公開番号】WO2010/132507
【国際公開日】平成22年11月18日(2010.11.18)
【出願人】(511181278)バーグ バイオシステムズ,エルエルシー (7)
【Fターム(参考)】
[ Back to top ]

