エプスタイン−バールウイルスペプチド及び該ペプチドに対する抗体
【課題】 この発明は、エプスタイン−バールウイルス(EBV)感染の血清診断に有用な特異的試薬を得ることを目的とする。
【解決手段】 本発明は、エプスタイン−バールウイルス(EBV)に対する抗体と免疫化学的に反応するペプチド、該ペプチドに対する(モノクローナル)抗体、及びモノクローナル抗体を産生し得る細胞系に係わる。本発明は更に、EBVまたは抗EBV抗体を検出する免疫学的な試薬及び方法にも係わる。
【解決手段】 本発明は、エプスタイン−バールウイルス(EBV)に対する抗体と免疫化学的に反応するペプチド、該ペプチドに対する(モノクローナル)抗体、及びモノクローナル抗体を産生し得る細胞系に係わる。本発明は更に、EBVまたは抗EBV抗体を検出する免疫学的な試薬及び方法にも係わる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、エプスタイン−バールウイルス(EBV)に対する抗体と免疫化学的に反応するペプチド、該ペプチドに対する(モノクローナル)抗体、及びモノクローナル抗体を産生し得る細胞系に係わる。本発明は更に、EBVまたは抗EBV抗体を検出する免疫学的な試薬及び方法にも係わる。
【背景技術】
【0002】
エプスタイン−バールウイルスは、最初バーキットリンパ腫(BL)のアフリカ(風土病即ちe)型に関連して発見された遍在性ヒトヘルペスウイルスである。このウイルスは後に上咽頭癌(NPC)との関連でも見出され、また伝染性単核細胞症(IM)の原因物質であることが判明した。感染は普通幼児期早期に起こり、その場合通常は無症状で、時に軽微な症状を伴う。しかし、青年期や成人期の感染はIMを誘発する恐れが有り、IMは末梢血中に異型リンパ球が存在することを特徴とする。異型リンパ球の多くはTリンパ球であるが、EBVに感染したBリンパ球の小集団も含まれる。Bリンパ球の感染はin vitroで生起させることも可能である。in vitroで感染させた細胞は形質転換され、培養すると無限に増殖するようになるが、これは‘不死化’、‘潜伏感染した’、または‘増殖転換された(growth transformed)’と呼称されている。知られているかぎりでは、EBVに感染した個体は総て終生潜伏感染したままである。このことは、循環末梢血リンパ球中に少数のEBVゲノム陽性転換B細胞が終生継続して存在すること、及び中咽頭においてウイルスが周期的に継続して放出されることに基づく。
【0003】
大抵の場合、EBV感染はリンパ系増殖疾患を誘発し、この疾患は一時的に衰弱をもたらし得るが常に良性で、かつ自己限定性である。しかし、或る種の免疫抑制個体では完全に悪性な疾患が誘発される恐れが有る。このような事態は強度に免疫抑制された個体、特にシクロスポリンAで治療されている、臓器移植を受けた小児において、またはHIV感染個体が日和見感染した場合、もしくは遺伝的にXLP(X染色体関連リンパ系増殖症候群)遺伝子を有する雄性個体が感染した場合に生起する。これらの場合に誘発される悪性疾患は、EBV感染B細胞のポリクローナル増殖に起因する。加えて、上記のような患者では口内毛様白斑症(oral hairy leukoplakia)の病変においてウイルスの非抑制的な上皮複製が検出され得る。即ち、EBV感染の抑制では免疫応答が中心的な役割を果たす。
【0004】
先に述べたように、EBVはヘルペスウイルスの一つである。このウイルスは次の構造的特徴を有する。
―EBVゲノムは線状2本鎖DNA分子(172,000塩基対)から成る。
―ビリオンは、正二十面体キャプシドによって囲繞されたコア(タンパク質及びDNA)と、キャプシドを包囲する膜エンベロープとから成る。正二十面体キャプシドは六量体及び五量体キャプソメアによって構成されている。膜エンベロープは、その外表面にスパイクを具えたタンパク質/脂質二重層膜から成る。キャプシドシェルとエンベロープとの間隙は、テグメントと呼称される非晶質タンパク質で満たされている。
―あらゆるヘルペスウイルス同様、EBVもその宿主において、一次感染後終生にわたる潜伏感染を確立し得る。このような潜伏期はウイルスとヒト宿主との、宿主の免疫系によって制御された完全なバランスを表わすものである。
【0005】
これまで、ほとんどの生化学的及び生物学的研究はEBVの三つの原型株、即ちB95−8(マーモセット細胞系で産生される形質転換ウイルス)、P3HR1(バーキットリンパ腫細胞系で産生される非形質転換ウイルス)及びRaji(バーキットリンパ腫細胞系中の潜伏ウイルス)について行なわれてきた。
【0006】
最近数年の間に、原型ウイルス株B95−8の全DNA配列が決定された。この配列の分析の結果、80を越える読み取り枠(ORF)が同定された(Baer等, Nature 310, pp.207−211, 1984)。
【0007】
EBVの生物学的研究では研究者に特別の問題が提起され、なぜならこのウイルスの生物学的特性(潜伏感染)が従来のウイルス分析に適さないからである。そのうえ、EBVが有効に感染する細胞及び宿主の範囲はヒト(及び数種の比較的高等な霊長類)のBリンパ球及び上皮細胞に限られており、これらの細胞は通常in vitro培養が不可能である。加えて、ウイルスがその中で溶解複製する完全許容型の細胞が存在しないことが、大量のウイルスを生産する可能性を甚だしく制限している。
【0008】
B95−8、P3HR1及びRaji単離物のDNA分子は、詳細な制限エンドヌクレアーゼ地図作成、大腸菌(E. coli)プラスミド及びλファージへのクローニング、並びにヌクレオチド配列決定のための原型とされている。
【0009】
EBVゲノムは、ユニークかつタンデム反復型のDNA要素によって構成されたただ1個の2本鎖DNA分子から成る。DNA分子の各末端は幾つかの末端配列を有し、これらの配列によってゲノムの共有結合及び環化が可能となる。ウイルス粒子中では、EBVゲノムは線状形態でのみ検出され得る。これに対して、潜伏感染細胞の核中では前記ゲノムは環状エピソームとして存在し、場合によっては宿主細胞の染色体に組み込まれる。
【0010】
EBVゲノムは内部反復配列IR1〜IR4によって五つのユニークな領域に分割される。U2及びU3領域は異なるEBV単離物間で著しく変化し、U2領域はEBVのP3HR1株ではほぼ完全に欠失する。
【0011】
EBV読み取り枠の命名は、当該読み取り枠のウイルスゲノム中での位置に基づく。名称は、発現が開始されるBamHIまたはEcoRI制限断片の頭文字で始まる。名称中の第三の文字はLまたはRであり、これは発現が標準的な地図上で左方向であるか右方向であるかに依る。(従ってBLLF2なら、BamHI制限断片Lにおいて開始する第二の左方向読み取り枠である)。
【0012】
EBV生産サイクルにおけるウイルス抗原の血清学的分類は、様々な蛍光利用技術に基づく。
【0013】
固定した潜伏感染B細胞(例えばRaji細胞)の核中に抗補体(anti−complement)免疫蛍光法で特異的に検出される抗原は、エプスタイン−バール核抗原(EBNA)として分類される。
【0014】
ウイルス遺伝子発現を化学的因子またはウイルス因子によって活性化すると、その合成がウイルスDNA合成の抑制によって遮断されない一群の初期抗原(EA)が検出される。用いる固定液の種類(メタノールまたはアセトン)に応じて異なる2組のEA、即ちEAR及びEADが検出され得る。EAは間接免疫蛍光法によって、誘導細胞の細胞質及び核中に検出され得る。ウイルスDNA合成の開始に続いて(かつそれに依存して)ウイルス構造タンパク質(VCA)が合成され、このタンパク質は間接免疫蛍光法によって、ウイルス産生細胞(例えばP3HR1細胞)の細胞質及び核中に検出され得る。生存可能な感染細胞の表面では、ウイルス産生のために誘導された1組の抗原(MA)が間接免疫蛍光法によって検出され得る。これらの抗原はウイルスエンベロープ上にも見出され得、ウイルス中和のための重要な標的である。
【0015】
ヒト血清におけるEBV特異的抗体の検出は、Henle及びHenleが述べている血清学的技術(Human Pathology 5, pp.551−565, 1974)によって通常のように行ない得る。
【0016】
生化学的データ及び免疫蛍光法データに基づき、異なる5群の抗原分子を区別することが可能である。異なるウイルスポリペプチドがその分子量によって示され、その独自の表記を可能にするべく、あらゆるEBVタンパク質に共通する命名法は確立されていない。
【0017】
異なる5群の抗原は次のとおりである。
A.潜伏状態の間に発現される抗原群(EBNA及びLMP)。
B.ゲノム活性化、及びウイルス複製の初期誘導の原因となる抗原群(IEA)。
C.IEA遺伝子産物によって誘導される、ウイルスDNAの複製に必要な抗原群で、そのほとんどがウイルス酵素である抗原群(EA)。
D.ウイルス粒子の構造構成要素であり、ウイルス複製サイクル後期においてウイルスDNA合成開始後に発現される抗原群(VCA)。
E.感染細胞の細胞膜において発現される抗原群(MA)。
【0018】
エプスタイン−バール初期抗原(EBV−EA)
EBV初期抗原(EA)はウイルスDNA合成開始前のEBV産生細胞において発現され、そのような細胞をウイルスDNAポリメラーゼの阻害剤(例えばホスホノ酢酸)で処理した場合に特異的に研究可能である。あるいは他の場合には、EAはEBVに頓挫感染した細胞や、IUdRもしくはBUdR、またはTPA及びブチレートなどの化学薬剤で活性化された、EBV産生体でないリンパ芽球様(lymphoblastoid)細胞(例えばRaji細胞)において検出され得る。
【0019】
EA抗原は、宿主の巨大分子合成の停止とウイルスDNA合成の開始との両方に必要な一群のウイルスタンパク質を表わす。
【0020】
総てのEA複合タンパク質の正確な性質は現在でも未知であるが、その幾つかの構成要素については、近年その分子構造が解明されている。
【0021】
ヒトの血清とモノクローナル抗体との両方を用いる免疫蛍光(IF)分析によって、アセトン及びメタノールなどの固定液に対する感度の異なる2組の初期抗原が説明される。一方のIFパターンは拡散型(D)で、核と細胞質との両方が染色されるが、他方のIFパターンは細胞質中の繊維状物質のみに限定される(R)。R型構成要素はメタノールまたはエタノール固定によって破壊されるが アセトンには耐性であり、一方D型構成要素はこれらの固定液に対して耐性であることが判明した。
【0022】
EA−D複合体は少なくとも、EBVゲノムによってコードされる次のタンパク質: DNAポリメラーゼ関連タンパク質P47−54(BMRF1)、主要DNA結合タンパク質P138(BALF2)、DNAポリメラーゼp110(BALF5)、アルカリDNアーゼp55(BGLF5)、チミジンキナーゼP65(BXLF1)及び初期トランスアクティベーターP52(BMLF1)を含む。
【0023】
EA−R複合体は少なくとも次のEBVタンパク質: リボヌクレオチドレダクターゼ大型サブユニットP85(BORF2)、RR小型サブユニットp30(BaRF1)及びBcl−2相同体P17(BHRF1)を含む。
【0024】
EBV−EA複合タンパク質に対する抗体は通常、活性な(急性または慢性)EBV感染下に有る患者において検出され得、その際抗EA−R抗体は見掛け上健康な供血者においてより頻繁に検出され得る。
【0025】
急性期の単核細胞症においてEA−D複合タンパク質に対するIgG、IgM及びIgAクラスの抗体が検出され、これらのうちIgM及びIgAは回復期にIgGより急速に消失した。(重篤な)慢性EBV感染ではEA−D複合体とEA−R複合体との両方に対するIgG抗体が高力価で見出され、時にはIgAも見出されるが、IgMは存在しない。上咽頭癌ではEA−Dに対するIgGとIgAとの両方が高力価で見出され、その際IgAは診断上、また予後においても疾患監視のために重要である。これに対して、別のEBV関連悪性疾患であるバーキットリンパ腫はしばしば、EA−R構成要素に対する高力価のIgGとの間に関連性を有する。
【0026】
大抵の場合、上述の抗体応答は、EA発現を誘導し、アセトンまたはメタノールで固定した様々なEBV細胞系において間接免疫蛍光技術を用いて研究されている。分子をより良く解明する血清学的研究は最近始められたばかりである。
【0027】
現在、EA−D及びEA−R複合体に対する上記のように異なる免疫応答の(1種以上の)基礎機構は解明されておらず、また様々なEBV疾患症候群においてヒト抗体により検出されるのがEA−Dタンパク質とEA−Rタンパク質とのいずれであるかも明らかに解明されてはいない。
【0028】
先に述べたように、EA−D及びEA−R複合体成分の分子特性の幾つかは近年或る程度説明されてきており、そのコーディング読み取り枠のウイルスゲノム上での位置も特定されている。
【0029】
しかし、これらの構成要素をEBV産生細胞から生産することは煩雑であり、また細胞培養におけるこれらのタンパク質の発現レベルの低さから収量は低い。このような事実によって、面倒でかつ主観的なIFに基づく血清学的試験に替わるものとしての、より単純な診断法の開発が妨げられてきた。
【0030】
解明した構成要素を代替宿主系において発現させることが開示されているが、この方法を診断試験に通常のように適用するには、潜在的に干渉性である宿主タンパク質(例えばE. coli)を除去するための高レベルの精製が必要となる。
【0031】
現在、EBV特異的な血清診断は、どちらかというと主観的な免疫蛍光試験によって行なわれる。より単純かつ一律な診断法(例えばELISA)への進歩は妨げられ、なぜならウイルス抗原の大量生産及び精製は標準的なウイルス産生細胞系を用いては不可能であるからである。
【0032】
上記のような生産及び精製を行なう唯一の方策は、別様に調製される(1種以上の)EBV抗原を用いることである。前記EBV抗原は遺伝子操作技術または合成ペプチド技術によって調製し得る。
【0033】
様々な段階のEBV感染において確実な診断を可能にする特異的でかつ高感度の方法を開発するには、免疫優性(immuno−dominant)なウイルスタンパク質とそのエピトープとを同定することがきわめて重要である。
【0034】
今回、EBV−EA(D) P47−54(BMRF1)の幾つかの免疫反応性(ペプチド)ドメインが該タンパク質のC末端領域に局在することが患者の血清を用いて見出されたが、個体によっては前記タンパク質のいずれか他の箇所に位置するドメインに対する抗体も有する(図1)。
【0035】
EBV−EA(D) P138(BALF2)の免疫反応性(ペプチド)ドメインは該タンパク質の複数の部位に配置されており、そのほとんどはアミノ酸配列490〜600と、C末端のアミノ酸配列1000〜1128とに限定される(図2)。
【発明の開示】
【発明が解決しようとする課題】
【0036】
本発明は、診断試験において完全なタンパク質に替わり得る、EAタンパク質の免疫優性ドメインに相当する合成ペプチドフラグメントを解明することを目的とする。
【0037】
合成ペプチドは、化学的に十分解明されている、即ち診断アッセイへの適用に十分適した、高収量で容易かつ再現可能な生産が可能であるという利点を有し、比較的高い再現性の下に製造及び使用され得る。
【課題を解決するための手段】
【0038】
本発明は、エプスタイン−バールウイルスに対する抗体と免疫化学的に反応する、EA−p47−54タンパク質の少なくとも一部を含むペプチドであって、配列番号1、2、4または5に示したアミノ酸配列の少なくとも一部を含むペプチドを提供する。
【0039】
本発明はまた、エプスタイン−バールウイルスに対する抗体と免疫化学的に反応する、EA−p47−54タンパク質の少なくとも一部を含むペプチドであって、配列番号5に示したアミノ酸配列の少なくとも一部と連結された、配列番号4に示したアミノ酸配列の少なくとも一部を含むペプチドも提供する。
【0040】
本発明は、配列番号6に示したアミノ酸配列の少なくとも一部を含むペプチドも提供する。
【0041】
更に本発明は、エプスタイン−バールウイルスに対する抗体と免疫化学的に反応する、EA−p138タンパク質の少なくとも一部を含むペプチドであって、配列番号7、8、9または10に示したアミノ酸配列の少なくとも一部を含むペプチドも提供する。
【0042】
天然EBVとは異なり、本発明によるペプチドには、その起源が非感染性で安全であるという一大利点が有る。
【0043】
本発明によるペプチドとそのフラグメントは、試料中のEBVまたはEBV抗体の存在を測定する診断法に用いるのに特に適当であることが判明した。そのうえ、本発明によるペプチドとそのフラグメントは適当な医薬投与形態でEBV関連疾患の治療に用いることができる。このようにして得られる、活性成分としペプチドまたはそのフラグメントを含有するワクチンの製造は当業者には公知である。
【0044】
免疫試薬に含有させる本発明によるペプチドは、現在入手可能なEA(D)試薬に比較して改善された反応性及び特異性(性能)を有する。
【0045】
従って、上記のような免疫試薬を血清学的試験に用いることによって、活性EBV感染下に有る患者のより優れた鑑別診断を可能にするアッセイの開発が可能となる。
【0046】
本発明者は、特定のEA(D)ペプチドに対する抗体の存在が活性EBV感染と相関するということも発見した。
【0047】
EBV−EA(D) P47−54及びEBV−EA(D) P138由来の選択ドメインは、活性EBV感染下に有る患者における抗体検出に用い得る。前記抗体は健康な個体には実質的に存在しない。
【0048】
このことは、世界各地出身の健康なEBV血清反応陽性供血者の血清をEA(D) P47−54及びP138由来のペプチドに対するIgG反応性に関して分析することにより更に証明される(図5)。
【0049】
図5から、(無症状の)EBV潜伏感染下に有る健康なEBV血清反応陽性供血者は特定のEA(D)ペプチドに対する抗体をまれにしか有しないと結論することができる。
【0050】
本発明者は、様々なEBV疾患においてEA(D)に対するIgG、IgM及びIgA抗体サブクラスを検出するのに本発明によるペプチドを単独でも、また組み合わせても用い得ることも発見した。
【0051】
伝染性単核細胞症(IM)患者の血清中にEBV−VCA及びEBV−EA(D)反応性IgM抗体を検出することは、感染の急性期及び回復初期を示すものであり、従って重要な診断パラメーターである。IgG抗EA(D)抗体はIMの急性期に一時的に存在し、回復期には低い、もしくは検出不能なレベルまで減少する。IgG−EA(D)は、慢性または再活性化EBV感染下に有る患者、及びEBV関連悪性疾患に罹患した患者から成る特定グループでは再出現する場合も有る。従って、IgG抗EA(D)の存在は、様々な臨床環境での(再)活性EBV感染診断のためのマーカーとして有用である。
【0052】
最後に、IgA抗EA(D)の検出は或る種のEBV関連悪性疾患に関連し、この検出は上咽頭癌において診断上、また予後においても有用であることが判明した。
【0053】
本明細書中に用いた‘ペプチド’という語は、生物活性を有するアミノ酸の分子鎖を意味し、特定長の産物を意味するものではない。従って特に、タンパク質、融合タンパク質またはペプチド、オリゴペプチド及びポリペプチドが含まれる。
【0054】
必要であれば、本発明によるペプチドは例えばグリコシル化、アミド化、カルボキシル化またはリン酸化によりin vivoまたはin vitroで修飾可能である。従って、本発明によるペプチドの例えば酸付加塩、アミド、エステル、特にC末端エステル、及びN−アシル誘導体などの機能性変形例も本発明の一部とみなす。本発明に含まれる特定のタンパク質またはポリペプチドには自然の改変が存在することも有り得ると理解される。そのような改変は、配列全体の中にみられる(一つ以上の)アミノ酸の相違によって、または(1個以上の)アミノ酸の欠失、置換、挿入、逆位または付加によって明示され得る。生物活性及び免疫活性を実質的に変更しないと考えられるアミノ酸置換が開示されている。関連するアミノ酸間でのアミノ酸置換、もしくは進化の過程でしばしば生起した置換は特に、Ser/Ala、Ser/Gly、Asp/Gly、Asp/Asn、Ile/Valである(M. D. Dayhof, “Atlas of protein sequence and structure,” Nat. Biomed. Res. Found., vol.5, suppl.3, Washington D. C., 1978参照)。この情報に基づき、Lipman及びPearsonは迅速かつ高感度のタンパク質比較法を開発し(Science 227, pp.1434−1441, 1985)、相同タンパク質同士の機能類似度を測定した。
【0055】
本明細書中に用いた‘少なくとも一部’という語は、本発明のペプチドのサブ配列から成るアミノ酸配列を意味する。上記一部もしくはフラグメントとは、EBV−EAタンパク質の免疫原決定基を1個以上有するペプチドのことである。フラグメントは特に前駆体分子の酵素切断によって製造され得、その際DNAには制限エンドヌクレアーゼ、ポリペプチドにはプロテアーゼが用いられる。他の方法にはフラグメントの化学合成や、DNAフラグメントによるペプチドフラグメントの発現などが有る。
【0056】
本発明によるペプチドの、1個以上のエピトープを有する適当な免疫原フラグメントは国際特許出願公開第86/06487号、H. M. Geysen等, Proc. Natl. Acad. Sci. 81, pp.3998−4002, 1984及びH. M. Geysen等, J. Immunol. Meth. 102, pp.259−274, 1987に開示された、いわゆるpepscan法に基づく方法によって見出すことができ、その際完全な当該ポリペプチドの部分配列に対応する一連の部分重複ペプチドを合成し、それらの抗体との反応性を調べる。
【0057】
加えて、ペプチドの幾つかの領域を理論的な要件に基づきエピトープと呼称し得るが、前記理論的要件の予測的な価値は限られる。上記領域の決定は、Hopp及びWoodsによる親水性基準(Proc. Natl. Acad. Sci. 78, pp.3824−3828, 1981)とChou及びFasmanによる二次構造アスペクト(Advances in Enzymology 47, pp.45−148, 1987)との組み合わせに基づく。
【0058】
本発明によるペプチドまたはそのフラグメントは、公知の有機化学的ペプチド合成方法のいずれかで、または組み換えDNA技術を用いて調製できる。
【0059】
有機化学的ペプチド合成方法は、必要なアミノ酸同士を均質相中で、またはいわゆる固相を用いて縮合反応により結合させることを含む。
【0060】
縮合反応は、
a) 遊離カルボキシル基を有し、その他の反応性基は保護されている化合物(アミノ酸、ペプチド)を、遊離アミノ基を有し、その他の反応性基は保護されている化合物(アミノ酸、ペプチド)と、縮合剤存在下に縮合させるか、または
b) 活性化されたカルボキシル基を有し、その他の反応性基は遊離であるか、または保護されている化合物(アミノ酸、ペプチド)を、遊離アミノ基を有し、その他の反応性基は遊離であるか、または保護されている化合物(アミノ酸、ペプチド)と縮合させる
ことによって実施し得る。
【0061】
カルボキシル基の活性化は特に、カルボキシル基を酸ハロゲン化物、アジド、酸無水物、イミダゾリド、またはN−ヒドロキシ−スクシンイミド、N−ヒドロキシ−ベンゾトリアゾールもしくはp−ニトロフェニルエステルなどの活性化エステルに変換することによって行なう。
【0062】
上記縮合反応を生起させる最も普通の方法は、カルボジイミド法、アジド法、混合酸無水物法、並びにE. Gross及びJ. Meienhofer編, The Peptides, Analysis, Synthesis, Biology, vols.1−3, Academic Press Inc., 1979, 1980, 1981に記載されているような活性化エステルを用いる方法である。
【0063】
本発明による上述のペプチドの適当なフラグメントを、‘固相法’を用いて調製する方法は、例えばJ. Amer. Chem. Soc. 85, p.2149, 1963及びInt. J. Peptide Protein Res. 35, pp.161−214, 1990に記載されている。調製するべきペプチドのアミノ酸の結合は普通、カルボキシル末端側から始まる。この方法の場合、反応性基を担持するか、またはその上に反応性基が導入され得る固相が必要である。固相は、例えばベンゼン及びジビニルベンゼンと反応性クロロメチル基とのコポリマーか、またはヒドロキシメチルもしくはアミン官能基と反応する性質を付与されたポリマー固相であり得る。
【0064】
特に適当な固相は、例えばJ. Am. Chem. Soc. 95, p.1328, 1974にWangが述べているp−アルコキシベンジルアルコール樹脂(4−ヒドロキシ−メチル−フェノキシ−メチル−コポリスチレン−1%ジビニルベンゼン樹脂)である。合成後、ペプチドは上記固相から穏和条件下に分離され得る。
【0065】
所望のアミノ酸配列の合成後、続いて樹脂からペプチドを、例えばトリフルオロメタンスルホン酸、またはトリフルオロ酢酸に溶解させたメタンスルホン酸で分離する。ペプチドは、低級アルコール、好ましくはメタノールまたはエタノールを用いるエステル交換反応によっても支持体から分離でき、この場合ペプチドの低級アルキルエステルが直接生成する。同様に、アンモニアを用いる分離によって本発明によるペプチドのアミドが得られる。
【0066】
縮合反応に関与しない反応性基は、先に述べたように、酸、塩基を用いる加水分解または還元によってきわめて容易に再度除去することができる基によって有効に保護する。即ち、カルボキシル基であれば、例えばメタノール、エタノール、t−ブタノール、ベンジルアルコールまたはp−ニトロベンジルアルコールとのエステル化、及び固体支持体に結合したアミンによって有効に保護し得る。
【0067】
アミノ基を有効に保護し得る基は、エトキシカルボニル、ベンジルオキシカルボニル、t−ブトキシ−カルボニル(t−boc)もしくはp−メトキシ−ベンジルオキシカルボニル基であるか、またはベンゼン−スルホニルもしくはp−トルエン−スルホニル基などの、スルホン酸に由来する酸基であるが、置換または非置換アリールまたはアラルキル基、例えばベンジル及びトリフェニルメチルや、オルト−ニトロフェニル−スルフェニル及び2−ベンゾイル−1−メチル−ビニルなどの基のような他の基を用いることも可能である。特に適当なα−アミノ保護基は、例えば塩基感受性の9−フルオレニル−メトキシカルボニル(Fmoc)基(Carpino及びHan, J. Amer. Chem. Soc. 92, p.5748, 1970)である。
【0068】
用い得る保護基についてのより広範な記述が、Gross, Udenfriend及びMeienhofer編, The Peptides, Analysis, Synthesis, Biology, vols.1−9, Academic Press Inc., 1979−1987中に見出され得る。
【0069】
リシンのε−アミノ基を保護することも必要であり、またアルギニンのグアニジン基は保護することが適当である。このような保護に通常用いられる保護基は、リシンの場合はBoc基、アルギニンの場合はPmc基、Pms基、Mbs基またはMtr基である。
【0070】
保護基は、当該基の性質に応じて様々な通常方法で、例えばトリフルオロ酢酸を用いて、または水素とパラジウムなどの触媒とを用いる穏和な還元によって、または氷酢酸中のHBrを用いて除去可能である。
【0071】
本発明による免疫反応性ペプチドは、複数を組み合わせてただ1個の分子とすることもできる。2個以上のペプチドを共有結合させて混成ペプチドまたは複合ペプチドとすることは、例えば先に述べた方法を用いてペプチド配列を固相ペプチド合成することにより可能であり、その際個々のペプチドのアミノ酸配列は互いに整列させる。個々のペプチド配列間にはリンカー配列を挿入することもできる。そのようなリンカー配列は、例えばグリシンの2〜5残基の伸長部(stretch)であり得る。
【0072】
混成または複合ペプチドは、フラグメント縮合技術を用いる固相合成によっても調製可能である。(その配列が本発明の個々のペプチドの配列に対応し得る)複数のフラグメントを個別に調製及び精製するこの方法は、比較的長い混成または複合ペプチド配列を合成する場合に好ましい。比較的長いペプチドを調製する方法は当業者に公知であり、例えばThe Peptides, Analysis, Synthesis, Biology, vols.1−9(上記参照)に記載されている。
【0073】
あるいは他の場合には、適宜修飾した本発明のペプチド同士を結合させることによって混成または複合ペプチドを調製し得る。
【0074】
システインアミノ酸を欠いた2個の異なるペプチド配列を結合させる好ましい方法ではペプチドを、カルボキシル末端かまたはアミノ末端に付加的なシステイン残基を有する誘導体に変換する。その後、一方のペプチドを単一システインチオール官能基において2,2′−ジチオジピリジンで活性化する。得られたピリジル−ジチオ−ペプチド誘導体を、システインチオール基を有する第二のペプチドと反応させて、個別のペプチドがジスルフィド結合によって連結された混成ペプチドを得る。
【0075】
他の多くの混成ペプチド調製方法も実施可能である。タンパク質−タンパク質結合の分野で開発された化学的方法も用い得る。このような方法についてはMeans及びFeeney(Bioconj. Chem. 1, pp.2−12, 1990)を参照されたい。例えば、良く知られたホモまたはヘテロ二官能架橋剤を用いれば、個々のペプチドをジスルフィド結合、またはチオエーテル結合、またはアミド結合等で結合させることができる。
【0076】
先に触れたように、本発明によるペプチドは組み換えDNA技術を用いても調製し得る。この可能性は、ペプチドを反復配列中に(‘タンデムに’)組み込む場合、またはペプチドを(はるかに大きい)タンパク質またはポリペプチドの構成要素として、もしくは例えばβ−ガラクトシダーゼ(の一部)との融合タンパク質として調製し得る場合特に重要である。従って、上記のようなペプチドも本発明の範囲内である。この調製方法では、組み換えDNAの構成要素として、本発明によるペプチドをコードする核酸配列であってしかも、天然のEBVゲノムにおいて該配列に隣接(flank)する核酸セグメントを実質的に含まない核酸配列を用いる。
【0077】
上記方法は、宿主として適当な微生物において調製したい1種以上のペプチドをコードする核酸配列を含む組み換えポリヌクレオチドを発現させることにより所望のペプチドを調製することを含む。
【0078】
本発明によるペプチドをコードする核酸配列は、該配列が天然には会合または連結しない様々な複製実現DNA配列と連結させていわゆる組み換えベクター分子とすることができ、この分子は適当な宿主の形質転換に用い得る。有用な組み換えベクター分子は好ましくは、例えばプラスミド、バクテリオファージ、コスミドまたはウイルスに由来する。
【0079】
核酸配列のクローニングに用い得る特異的ベクターまたはクローニングビヒクルは当業者に公知であり、特にpBR322、様々なpUC、pGEMおよびBluescriptプラスミドなどのプラスミドベクター、バクテリオファージ、例えばkgt−Wes、Charon 28及びM13由来ファージ、またはSV40、アデノウイルスもしくはポリオーマウイルスなどのウイルスベクターを含む(R. L. Rodriquez及びD. T. Denhardt編, Vectors: A survey of molecular cloning vectors and their uses, Butterworths, 1988; J. A. Lenstra等, Arch. Virol. 110, pp.1−24, 1990も参照されたい)。組み換えベクター分子の構築に用いるべき方法は当業者に公知であり、特にT. Maniatis等が提示している(Molecular Cloning: A Laboratory Manual, second edition, Cold Spring Harbor Laboratory, 1989)。
【0080】
例えば、本発明によるペプチドをコードする核酸配列をクローニングベクターに挿入することは、遺伝子と所望のクローニングビヒクルとの両方を(1種以上の)同じ制限酵素で切断すれば、それによって相補的DNA末端が形成されるので容易に実施可能となる。
【0081】
組み換えベクター分子は、pBR322のアンピシリン及びテトラサイクリン耐性、並びにpUC8のアンピシリン耐性及びβ−ガラクトシダーゼのα−ペプチドをコードする領域の活性のような、所望の形質転換体の選択に用い得る1種以上のマーカー活性を付加的に有していてもよい。
【0082】
当然ながら、形質転換宿主が1個以上の免疫原決定基を有するポリペプチドを産生するかぎり、クローニングベクターの選択した部位に挿入するヌクレオチド配列は本発明のペプチドをコードする完全な核酸配列の断片しか含まなくてもよいと理解されるべきである。
【0083】
本発明のペプチドに対する抗体も本発明の一部である。
【0084】
上述のように調製したペプチドまたはそのフラグメントは、ポリクローナルとモノクローナルとの両方の抗体の製造に用い得る。本発明によるペプチドに対するモノクローナル抗体は、当業者には容易に製造可能である。
【0085】
従って、本発明のモノクローナル抗体はEBV感染診断のための新規な手段を提供する。
【0086】
本発明の好ましい抗体は、EBV−EA p47−54タンパク質のエピトープに結合するモノクローナル抗体であり、前記エピトープはthe European Collection of Animal Cell Cultrue(ECACC), Porton Down(UK)に受託番号第95051619号、同第95051620号、同第95051621号及び同第95051622号の下に寄託されたハイブリドーマ細胞系が産生するモノクローナル抗体によって認識される。
【0087】
本発明のモノクローナル抗体を分泌し得る不死化細胞系も本発明の一部である。
【0088】
モノクローナル抗体を産生する細胞系の製造は、例えばKohler及びMilsteinの技術[Kohler及びMilsteinは、モノクローナル抗体産生ハイブリドーマの形成をもたらす技術を創案した(G. Kohler及びC. Milstein, Nature 256, pp.495−497, 1975; Eur. J. Immunol. 6, pp.511−519, 1976)]、エプスタイン−バールウイルスを用いる形質転換、もしくはオンコジーンDNAでのBリンパ球の直接形質転換、またはヒトBリンパ球とヒトもしくはマウス−ヒト雑種骨髄腫細胞系である融合相手との直接融合、もしくはEBV形質転換B細胞系と前記骨髄腫細胞系との直接融合によって実施し得る。
【0089】
本発明の好ましい細胞系は、受託番号95051619、95051620、95051621及び95051622でEuropean Collection of Animal Cell Cultures, Porton Down (UK)に寄託された細胞系である。
【0090】
これらのハイブリドーマ細胞系は、骨髄腫細胞を、EBV産生細胞由来のEBV−EAタンパク質を予め接種したマウスに由来するリンパ球と融合させて産生された。
【0091】
EBV−EA(D)複合体のタンパク質に対するモノクローナル抗体は、精製目的のために、またこれらのタンパク質の機能研究のための様々な生化学/免疫分析技術のために、細胞及び細胞抽出物でのEA(D)発現をin vivo及びin vitroの両方で検出するのに有用な手段である。
【0092】
EBV−EAタンパク質に対するモノクローナル抗体が産生され、BMRF1によってコードされるEA(D)タンパク質P47−54の特定のペプチドドメイン内のエピトープと反応することが判明した。
【0093】
これらのモノクローナル抗体の2種(EBV.OT13N及びEBV.OT14Eと称する)のためのP47−54タンパク質上の結合ドメインはそれぞれAA位置340−346及び346−350にマッピングされた(図8A)。
【0094】
このような抗体を使用して、潜伏感染細胞(図8B、レーンX50/7)ではなく、増殖感染細胞(図8B、レーンVCA及びEA)で発現されるBMRF1によってコードされるP47−54タンパク質をインタクトなリン酸化及び非リン酸化形態で検出することができる。抗体はEBV P47−54に特異的であり、EBV陰性細胞の細胞成分とは交差反応しない(図8B、レーンBJAB)。
【0095】
EBV−EAタンパク質に対するモノクローナル抗体が産生され、BALF2によってコードされるEA(D)タンパク質P138の特定ペプチドドメイン内のエピトープと反応することが判明した。
【0096】
これらのモノクローナル抗体の2種(EBV.OT13B及びEBV.OT13Dと称する)のためのP138タンパク質上の結合ドメインはそれぞれAA位置515−521及び1092−1098にマッピングされた(図9A)。
【0097】
このような抗体を使用して、潜伏感染細胞(図9B、レーンX50/7)ではなく、増殖感染細胞(図9B、レーンVCA及びEA)で発現される、BALF2によってコードされるP138タンパク質をインタクトな形態で検出することができる。抗体はEBV P138に特異的であり、EBV陰性細胞の細胞成分とは交差反応しない(図9B、レーンBJAB)。
【0098】
本発明は更に、試験液又は組織試料中の全長タンパク質の検出を目的とする免疫学的及び生化学的方法での前記ペプチドに対する抗体の使用を包含する。
【0099】
本発明以前では、EBV感染細胞の初期抗原の検出は、ヒト血清を抗EBV−EA抗体源として使用する間接免疫蛍光法(IIF)を用いて実施されていた。擬陽性反応や擬陰性反応が頻繁に見られるために、これは複雑である。
【0100】
EBV.OT13B、13D、13N、14E抗体によって、間接免疫蛍光法や同様の技術による種々のEBV感染細胞中のEBV−EAの高感度検出が可能となる。
【0101】
本発明のペプチドに対するモノクローナル及びポリクローナル抗体は、組織試料中のその場での検出のための診断や免疫細胞化学法に非常に適しており、中和抗体は受動免疫治療に非常に有用である。
【0102】
問題のモノクローナル抗体の「人体適応化(humanizing)」も本発明の一部となる。「人体に適応した」モノクローナル抗体の産生技術は当業界では公知である。
【0103】
本発明のペプチド又は抗体を1種以上含む免疫化学試薬も本発明の一部である。
【0104】
本発明の「免疫化学試薬」という用語は通常、本発明の1種以上のペプチド及び適切な支持体又は標識物質からなる。
【0105】
使用できる支持体は例えば、マイクロ試験ウェル又はキュベットの内壁、管又は細管、膜、フィルター、試験ストリップ又は粒子[例えばラテックス粒子、アルデヒド粒子(例えば活性アルデヒド表面基を有するセラミック磁化性粒子)]の表面、赤血球、色素ゾル、金属ゾル又はゾル粒子としての金属化合物,BSA又はKLHのようなキャリヤータンパク質である。
【0106】
使用できる標識物質はとりわけ、放射性同位体、蛍光化合物、酵素、色素ゾル、金属ゾル又はゾル粒子としての金属化合物である。
【0107】
試料中のEBVに対する抗体の検出方法では、本発明の免疫化学試薬を試料と接触させる。その後、試料中のペプチドと抗体との間に生成した免疫複合体の存在を検出し、この検出によって試料中のEBV抗体の存在を確認し、定量することができる。
【0108】
免疫化学試薬の種類や更なる特徴によっては、生起する免疫化学反応はいわゆるサンドイッチ反応、凝集反応、競合反応又は阻害反応である。
【0109】
試料中のEBV検出のために、本発明のペプチドを1種以上含む本発明の免疫化学試薬を試料及び抗EBVと接触させ、その後、生成した免疫複合体の存在を検出し、これから試料中のEBVの存在を調べることができる。
【0110】
試料中EBVの特に適した検出方法は、標識物質を備えた本発明のペプチドと(試料中に存在する)EBV抗原との間の競合反応に基づき、ペプチド及び抗原は固体支持体に結合したEBVに対する抗体と競合する。
【0111】
本発明は更に、本発明の抗体を試料と接触させた後に、生成した免疫複合体の存在を検出し、これが試料中のエプスタイン−バールウイルスの存在の尺度となることを特徴とする試料中のエプスタイン−バールウイルスの検出方法を包含する。
【0112】
本発明の試験キットは、上述したような免疫化学試薬を主成分として含んでいる。EBV抗体検出のためのサンドイッチ反応を実施する際に、試験キットは例えば、固体支持体(例えばマイクロ試験ウェルの内壁)に被覆された本発明のペプチド、及び本発明の標識ペプチド又は標識抗抗体を含み得る。
【0113】
競合反応実施のために、試験キットは、固体支持体に被覆された本発明のペプチド、及びEBVに対する標識抗体、好ましくは前記ペプチドに対するモノクローナル抗体を含み得る。
【0114】
凝集反応では、試験キットは、粒子又はゾルに被覆された本発明のペプチドを含み得る免疫化学試薬を包含する。
【0115】
試験キットの他の実施態様は例えば、固体支持体に被覆されたEBVに対する抗体上の結合部位に対する検出すべきEBV抗原との競合反応で本発明の標識ペプチドを免疫化学試薬として使用することである。
【0116】
(実施例)
以下の実施例で本発明を更に詳しく説明する。
【0117】
実施例に記載のペプチドコードは、下記のように定義する。
#496(P47−54):配列番号1
#497(P47−54):配列番号2
#498(P47−54):配列番号3
#499(P47−54):配列番号4
#500(P47−54):配列番号5
#501(P47−54):配列番号6
G−34−R(P138):配列番号7
D−28−S(P138):配列番号8
A−27−G(P138):配列番号9
G−21−V(P138):配列番号10
【実施例1】
【0118】
EBV−EA(D)P47−54(BMRF1)上の免疫反応性(ペプチド)ドメインの局在。
【0119】
長さが12アミノ酸(AA)で、完全BMRF1読み取り枠のAA配列の11AAが重複したペプチドを、最初にGeijsen等が記載したように(P.N.A.S.,USA,83(1994)p.3998−4002)、化学的に活性化したピン上で自動化固相ペプチド合成によって合成した。
【0120】
Middeldorp及びMeloenが記載する方法(J. Virol. Meth. 21(1988)p.147ー159)で、EBV特異抗体の免疫反応性を調べた。
【0121】
活性EBV感染した個体の4つの血清でのこのようなPEPSCAN分析の結果を図1に示す。
【0122】
大半の血清が、タンパク質のC末端領域に位置する領域(ドメイン)と反応性の抗体を含んでいたが、タンパク質の他のドメインに対する抗体を更に有する個体もあることがこの図から判明し得る。
【0123】
EBV患者血清の別の試料では同様のデータが見出されたが、健康な対照の血清ではこのような反応性は見出されなかった。
【実施例2】
【0124】
BV−EA(D)P138(BALF2)上の免疫反応性(ペプチド)ドメインの局在。
【0125】
BALF2の全読み取り枠に由来するペプチドを実施例1に記載のように合成して分析した。
【0126】
1個のEBV患者血清の結果を図2に示す。
【0127】
抗体反応性領域がタンパク質AA配列上の複数の部位に見出され、大半がAA490−600及びAA1000−1128のC末端に局限されることがこの図から判明し得る。
【0128】
EBV患者の別の血清でも同様のデータが見出された。
【実施例3】
【0129】
ヒト血清抗体との反応性の改善のためのEBV−EA(D)P47−54由来の可溶性合成ペプチドの使用。
標準的な固相法((J. Amer. Chem. Soc. 85, 2149(1963);Int. J. Peptide Protein Res. 35, 161−214(1990))を用いて特定のペプチド(配列表を参照されたい)を合成して、複数のPEPSCAN反応性ドメインを組み合わせて単一分子とした。これらのペプチドを、通常は被覆用緩衝液中1μg/mlで、96ウェルミクロELISAプレートのウェル中で固相上に被覆し、未結合位置を被覆用緩衝液中1%ウシ血清アルブミンでブロックした。
【0130】
全ての場合で、ペプチドを0.1M炭酸塩緩衝液(pH9.6)中で固相上に被覆した。
【0131】
ウェルを0.05%Tween−20を含む0.1Mリン酸緩衝食塩水(pH7.4)で洗浄した後に、標準的な手順を用いてヒト血清の血清希釈液(通常1:100)で抗体反応性を分析した。
【0132】
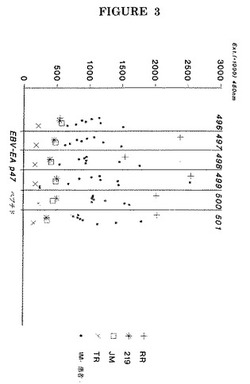
このような分析の結果を図3に示す。
【0133】
ペプチド#499のC末端にシステイン残基を導入し、ペプチド#500のN末端にシステイン残基を導入してペプチド#501(ペプチドの#499と#500とを組み合わせたもの)を構築して、これらのペプチドをジスルフィド結合で結合する。ペプチドの組み合わせ又は結合については他の同様の技術(例えば標準的な固相合成による)が公知である。標準的な固相合成技術を使用する場合、2個のシステイン残基の導入は不要であり、従ってこれら2個の残基をアミノ酸配列から除去することができる(配列番号6;AA20及び21)。
【0134】
ペプチドの#500及び#501が、EBV感染患者の血清との陽性抗EA(D)反応と、EBVに潜伏感染した(JM及び219)又はEBV陰性(TR)の健康な対照ドナーの血清との陰性反応との間の最良の識別を示していることがこの図から判明し得る。ペプチドの#496及び#497は、当業者によって抗体反応性AA配列を含むことが判明している(J. Clin. Lab. Anal. 1(1987)p.140−145)、P47−54ペプチドのN末端伸長である基準ペプチド#498と同様の性能を示した。
【0135】
従って、特にペプチドの#500及び#501は、抗EA(D)抗体検出のために改善された反応性を示す新たな試薬となる。
【実施例4】
【0136】
ヒト血清抗体との反応性を改善するためのEBV−EA(D) P138由来の合成ペプチドの使用。
【0137】
特定の合成ペプチド試薬を実施例3に記載した同様の方法で製造してP138(配列表を参照されたい)の免疫反応性ドメインを含ませ、これらを標準的な手順を用いてELISAで試験した。
【0138】
いずれの場合も、炭酸塩緩衝液(pH9.6)を用いてペプチドを固相上に被覆し、血清は1:100の希釈度で試験した。
【0139】
図4AはペプチドをpH9.6で固相に被覆した実験の結果を示し、図4BはpH9.6ではなくpH7.2で被覆すると、これらのペプチドの一つの反応性が改善されることを示している。
【0140】
これらの研究から、(被覆条件に依存して)EBV−EA(D) P138由来の特定ペプチドを使用して、とりわけEBV患者の血清で抗EA(D)抗体を検出できることが判明し得る。EBVに潜伏感染した健康な対照の血清は、EBV血清陰性ドナーと同様の陰性反応を示す。
【実施例5】
【0141】
感度改善のための単一アッセイでの選択ペプチドの組み合わせ
特定試薬の付加的な利点は、単一アッセイに種々のEA(D)タンパク質のペプチドを組み合わて、抗EA(D)抗体検出の総感度を改善できることである。
【0142】
これは、単独で又は1:1で組み合わせて同一ウェル内に被覆したペプチド#501(P47−54;配列番号6)及びG−34−R(P138;配列番号7)に対する無作為の単核細胞症患者の血清IgG反応性を示した図5で分かる。
【0143】
更には、図6−図7には単一アッセイでの特定ペプチドの組み合わせが明示されている(実施例3−4による臨床環境でのIgM、IgG及びIgA抗EA(D)の検出は図7A−Cに明示されている)。
【0144】
特定のペプチドを組み合わせると抗EA(D)抗体の検出感度が増したことがこれらの図面から明白である。
【実施例6】
【0145】
モノクローナル抗体EBV.OT13B、EBV.OT13D、EBV.OT13N及びEBV.OT14Eのイムノブロット分析。
【0146】
還元条件下で変性SDS−PAGEによって、数個の核抽出物(ウイルス構造タンパク質の発現のために誘導されたHH514細胞の核抽出物(VCA)、ウイルスDNA複製をPAAにより阻止してEAタンパク質の発現のために誘導されたHH514細胞の核抽出物(EA)、潜伏期EBV遺伝子のみを発現するX50/7細胞の核抽出物(X50/7)及びEBV陰性バーキットリンパ腫細胞系BJABの核抽出物(BJAB))を分離し、当業界で公知の標準的な手順でニトロセルロースシートに移した。
【0147】
このイムノブロットから、上述のEBV核抽出物で、モノクローナル抗体EBV.OT13B(図9B)、EBV.OT13D(図9D)、EBV.OT13N(図8B)及びEBV.OT14E(図8B)を用いてイムノブロット分析を実施した。
【0148】
【表1】






【図面の簡単な説明】
【0149】
【図1】4人の活性EBV感染患者の血清中IgG抗体と、11アミノ酸が重複してEBV−EA(D) P47−54(BMRF1)の完全AA配列を示す個々の12量体ペプチドとの結合の同定。
【図2】1人の活性EBV感染患者の血清中IgG抗体と、11アミノ酸が重複してEBV−EA(D) P138(BALF2)の完全AA配列を示す個々の12量体ペプチドとの結合の同定。
【図3】EA(D)P47−54の免疫反応性ドメインの組み合わせを示す個々の合成ペプチドに対する(IgG)抗体の検出。ペプチド配列は配列表に記載する。JM及び219:健康で血清陽性のEBV対照ドナーの血清。TR:健康で血清陰性のEBV対照ドナーの血清。IM:単核細胞症患者の血清。RR:重症慢性EBV感染患者の血清。
【図4A】EA(D)P138の免疫反応性ドメインの組み合わせを示す個々の合成ペプチドに対する(IgG)抗体の検出。ペプチド配列は同定表に記載し、上述したようなP138 AA位置を示す。JM及びQCD219:健康で血清陽性のEBV対照ドナーの血清。TR:健康で血清陰性のEBV対照ドナーの血清。IM:単核細胞症患者の血清。RR:重症慢性EBV感染患者の血清。
【図4B】pH9.6(0.1M炭酸塩緩衝液)又はpH7.2(0.1Mリン酸塩緩衝液)で被覆したP138由来ペプチドG−21−V(配列番号10)及びG−34−R(配列番号7)を用いて行った図4Aと同一の分析。
【図5】EA(D)複合体又はそれを組み合わせたものの個々の成分に対する(IgG)抗体の検出。この図では、ペプチド#501(P47−54;配列番号6)及びG−34−R(P138;配列番号7)を別個に又は1:1で組み合わせて固相上に直接被覆した。無作為の38人の単核細胞症患者の血清を1:100の希釈度で使用した。
【図6A】香港(A)及びUSA(B)の健康な血液ドナー集団で、EA(D)P47−54及びP138(即ち#500(配列番号5)及びG−34−R(配列番号7))由来の特定ペプチドを別個に又は1:1で組み合わせて用いたEBV−EA(D)に対するIgG抗体の検出。
【図6B】香港(A)及びUSA(B)の健康な血液ドナー集団で、EA(D)P47−54及びP138(即ち#500(配列番号5)及びG−34−R(配列番号7))由来の特定ペプチドを別個に又は1:1で組み合わせて用いたEBV−EA(D)に対するIgG抗体の検出。
【図7A】別個に固相上に被覆した又は1:1で組み合わせて同一ウェルに被覆した特定ペプチド(即ちP47−54の場合は#501(配列番号6)及びP138の場合はG−34−R(配列番号7))を用いた38人の単核細胞症患者の血清中のEBV−EA(D)P47−54及びP138に対するIgM抗体の検出。
【図7B】前記試薬を用いた38人の単核細胞症患者の血清中のIgG抗体の検出。
【図7C】前記試薬を用いた38人の上咽頭癌患者の血清中のIgA抗体の検出。
【図8A】重複する12量体ペプチドによるPEPSCAN技術を用いた、BMRF1によってコードされるEBV EA(D)P47−54上でのEBV.OT13N及びEBV.OT14Eの結合ドメインの同定。
【図8B】EBV.OT13N及びEBV.OT14Eによるイムノブロット染色。M=分子量マーカー。VCA=ウイルス構造タンパク質の発現のために誘導されたHH514細胞の核抽出物。EA=ウイルスDNA複製をPAAで阻止してEAタンパク質の発現のために誘導されたHH514細胞の核抽出物。X50/7=潜伏期EBV遺伝子のみを発現するX50/7細胞の核抽出物。BJAB=EBV陰性バーキットリンパ腫細胞系BJABの核抽出物。
【図9A】重複する12量体ペプチドによるPEPSCAN技術を用いた、BALF2によってコードされるEBV EA(D)P138上でのEBV.OT13Bの結合ドメインの同定。
【図9B】EBV.OT13Bによるイムノブロット染色。M=分子量マーカー。VCA=ウイルス構造タンパク質の発現のために誘導されたHH514細胞の核抽出物。EA=ウイルスDNA複製をPAAで阻止してEAタンパク質の発現のために誘導されたHH514細胞の核抽出物。X50/7=潜伏期EBV遺伝子のみを発現するX50/7細胞の核抽出物。BJAB=EBV陰性バーキットリンパ腫細胞系BJABの核抽出物。
【図9C】重複する12量体ペプチドによるPEPSCAN技術を用いた、BALF2によってコードされるEBV EA(D)P138上でのEBV.OT13Dの結合ドメインの同定。
【図9D】EBV.OT13Dによるイムノブロット染色。M=分子量マーカー。VCA=ウイルス構造タンパク質の発現のために誘導されたHH514細胞の核抽出物。EA=ウイルスDNA複製をPAAで阻止してEAタンパク質の発現のために誘導されたHH514細胞の核抽出物。X50/7=潜伏期EBV遺伝子のみを発現するX50/7細胞の核抽出物。BJAB=EBV陰性バーキットリンパ腫細胞系BJABの核抽出物。
【技術分野】
【0001】
本発明は、エプスタイン−バールウイルス(EBV)に対する抗体と免疫化学的に反応するペプチド、該ペプチドに対する(モノクローナル)抗体、及びモノクローナル抗体を産生し得る細胞系に係わる。本発明は更に、EBVまたは抗EBV抗体を検出する免疫学的な試薬及び方法にも係わる。
【背景技術】
【0002】
エプスタイン−バールウイルスは、最初バーキットリンパ腫(BL)のアフリカ(風土病即ちe)型に関連して発見された遍在性ヒトヘルペスウイルスである。このウイルスは後に上咽頭癌(NPC)との関連でも見出され、また伝染性単核細胞症(IM)の原因物質であることが判明した。感染は普通幼児期早期に起こり、その場合通常は無症状で、時に軽微な症状を伴う。しかし、青年期や成人期の感染はIMを誘発する恐れが有り、IMは末梢血中に異型リンパ球が存在することを特徴とする。異型リンパ球の多くはTリンパ球であるが、EBVに感染したBリンパ球の小集団も含まれる。Bリンパ球の感染はin vitroで生起させることも可能である。in vitroで感染させた細胞は形質転換され、培養すると無限に増殖するようになるが、これは‘不死化’、‘潜伏感染した’、または‘増殖転換された(growth transformed)’と呼称されている。知られているかぎりでは、EBVに感染した個体は総て終生潜伏感染したままである。このことは、循環末梢血リンパ球中に少数のEBVゲノム陽性転換B細胞が終生継続して存在すること、及び中咽頭においてウイルスが周期的に継続して放出されることに基づく。
【0003】
大抵の場合、EBV感染はリンパ系増殖疾患を誘発し、この疾患は一時的に衰弱をもたらし得るが常に良性で、かつ自己限定性である。しかし、或る種の免疫抑制個体では完全に悪性な疾患が誘発される恐れが有る。このような事態は強度に免疫抑制された個体、特にシクロスポリンAで治療されている、臓器移植を受けた小児において、またはHIV感染個体が日和見感染した場合、もしくは遺伝的にXLP(X染色体関連リンパ系増殖症候群)遺伝子を有する雄性個体が感染した場合に生起する。これらの場合に誘発される悪性疾患は、EBV感染B細胞のポリクローナル増殖に起因する。加えて、上記のような患者では口内毛様白斑症(oral hairy leukoplakia)の病変においてウイルスの非抑制的な上皮複製が検出され得る。即ち、EBV感染の抑制では免疫応答が中心的な役割を果たす。
【0004】
先に述べたように、EBVはヘルペスウイルスの一つである。このウイルスは次の構造的特徴を有する。
―EBVゲノムは線状2本鎖DNA分子(172,000塩基対)から成る。
―ビリオンは、正二十面体キャプシドによって囲繞されたコア(タンパク質及びDNA)と、キャプシドを包囲する膜エンベロープとから成る。正二十面体キャプシドは六量体及び五量体キャプソメアによって構成されている。膜エンベロープは、その外表面にスパイクを具えたタンパク質/脂質二重層膜から成る。キャプシドシェルとエンベロープとの間隙は、テグメントと呼称される非晶質タンパク質で満たされている。
―あらゆるヘルペスウイルス同様、EBVもその宿主において、一次感染後終生にわたる潜伏感染を確立し得る。このような潜伏期はウイルスとヒト宿主との、宿主の免疫系によって制御された完全なバランスを表わすものである。
【0005】
これまで、ほとんどの生化学的及び生物学的研究はEBVの三つの原型株、即ちB95−8(マーモセット細胞系で産生される形質転換ウイルス)、P3HR1(バーキットリンパ腫細胞系で産生される非形質転換ウイルス)及びRaji(バーキットリンパ腫細胞系中の潜伏ウイルス)について行なわれてきた。
【0006】
最近数年の間に、原型ウイルス株B95−8の全DNA配列が決定された。この配列の分析の結果、80を越える読み取り枠(ORF)が同定された(Baer等, Nature 310, pp.207−211, 1984)。
【0007】
EBVの生物学的研究では研究者に特別の問題が提起され、なぜならこのウイルスの生物学的特性(潜伏感染)が従来のウイルス分析に適さないからである。そのうえ、EBVが有効に感染する細胞及び宿主の範囲はヒト(及び数種の比較的高等な霊長類)のBリンパ球及び上皮細胞に限られており、これらの細胞は通常in vitro培養が不可能である。加えて、ウイルスがその中で溶解複製する完全許容型の細胞が存在しないことが、大量のウイルスを生産する可能性を甚だしく制限している。
【0008】
B95−8、P3HR1及びRaji単離物のDNA分子は、詳細な制限エンドヌクレアーゼ地図作成、大腸菌(E. coli)プラスミド及びλファージへのクローニング、並びにヌクレオチド配列決定のための原型とされている。
【0009】
EBVゲノムは、ユニークかつタンデム反復型のDNA要素によって構成されたただ1個の2本鎖DNA分子から成る。DNA分子の各末端は幾つかの末端配列を有し、これらの配列によってゲノムの共有結合及び環化が可能となる。ウイルス粒子中では、EBVゲノムは線状形態でのみ検出され得る。これに対して、潜伏感染細胞の核中では前記ゲノムは環状エピソームとして存在し、場合によっては宿主細胞の染色体に組み込まれる。
【0010】
EBVゲノムは内部反復配列IR1〜IR4によって五つのユニークな領域に分割される。U2及びU3領域は異なるEBV単離物間で著しく変化し、U2領域はEBVのP3HR1株ではほぼ完全に欠失する。
【0011】
EBV読み取り枠の命名は、当該読み取り枠のウイルスゲノム中での位置に基づく。名称は、発現が開始されるBamHIまたはEcoRI制限断片の頭文字で始まる。名称中の第三の文字はLまたはRであり、これは発現が標準的な地図上で左方向であるか右方向であるかに依る。(従ってBLLF2なら、BamHI制限断片Lにおいて開始する第二の左方向読み取り枠である)。
【0012】
EBV生産サイクルにおけるウイルス抗原の血清学的分類は、様々な蛍光利用技術に基づく。
【0013】
固定した潜伏感染B細胞(例えばRaji細胞)の核中に抗補体(anti−complement)免疫蛍光法で特異的に検出される抗原は、エプスタイン−バール核抗原(EBNA)として分類される。
【0014】
ウイルス遺伝子発現を化学的因子またはウイルス因子によって活性化すると、その合成がウイルスDNA合成の抑制によって遮断されない一群の初期抗原(EA)が検出される。用いる固定液の種類(メタノールまたはアセトン)に応じて異なる2組のEA、即ちEAR及びEADが検出され得る。EAは間接免疫蛍光法によって、誘導細胞の細胞質及び核中に検出され得る。ウイルスDNA合成の開始に続いて(かつそれに依存して)ウイルス構造タンパク質(VCA)が合成され、このタンパク質は間接免疫蛍光法によって、ウイルス産生細胞(例えばP3HR1細胞)の細胞質及び核中に検出され得る。生存可能な感染細胞の表面では、ウイルス産生のために誘導された1組の抗原(MA)が間接免疫蛍光法によって検出され得る。これらの抗原はウイルスエンベロープ上にも見出され得、ウイルス中和のための重要な標的である。
【0015】
ヒト血清におけるEBV特異的抗体の検出は、Henle及びHenleが述べている血清学的技術(Human Pathology 5, pp.551−565, 1974)によって通常のように行ない得る。
【0016】
生化学的データ及び免疫蛍光法データに基づき、異なる5群の抗原分子を区別することが可能である。異なるウイルスポリペプチドがその分子量によって示され、その独自の表記を可能にするべく、あらゆるEBVタンパク質に共通する命名法は確立されていない。
【0017】
異なる5群の抗原は次のとおりである。
A.潜伏状態の間に発現される抗原群(EBNA及びLMP)。
B.ゲノム活性化、及びウイルス複製の初期誘導の原因となる抗原群(IEA)。
C.IEA遺伝子産物によって誘導される、ウイルスDNAの複製に必要な抗原群で、そのほとんどがウイルス酵素である抗原群(EA)。
D.ウイルス粒子の構造構成要素であり、ウイルス複製サイクル後期においてウイルスDNA合成開始後に発現される抗原群(VCA)。
E.感染細胞の細胞膜において発現される抗原群(MA)。
【0018】
エプスタイン−バール初期抗原(EBV−EA)
EBV初期抗原(EA)はウイルスDNA合成開始前のEBV産生細胞において発現され、そのような細胞をウイルスDNAポリメラーゼの阻害剤(例えばホスホノ酢酸)で処理した場合に特異的に研究可能である。あるいは他の場合には、EAはEBVに頓挫感染した細胞や、IUdRもしくはBUdR、またはTPA及びブチレートなどの化学薬剤で活性化された、EBV産生体でないリンパ芽球様(lymphoblastoid)細胞(例えばRaji細胞)において検出され得る。
【0019】
EA抗原は、宿主の巨大分子合成の停止とウイルスDNA合成の開始との両方に必要な一群のウイルスタンパク質を表わす。
【0020】
総てのEA複合タンパク質の正確な性質は現在でも未知であるが、その幾つかの構成要素については、近年その分子構造が解明されている。
【0021】
ヒトの血清とモノクローナル抗体との両方を用いる免疫蛍光(IF)分析によって、アセトン及びメタノールなどの固定液に対する感度の異なる2組の初期抗原が説明される。一方のIFパターンは拡散型(D)で、核と細胞質との両方が染色されるが、他方のIFパターンは細胞質中の繊維状物質のみに限定される(R)。R型構成要素はメタノールまたはエタノール固定によって破壊されるが アセトンには耐性であり、一方D型構成要素はこれらの固定液に対して耐性であることが判明した。
【0022】
EA−D複合体は少なくとも、EBVゲノムによってコードされる次のタンパク質: DNAポリメラーゼ関連タンパク質P47−54(BMRF1)、主要DNA結合タンパク質P138(BALF2)、DNAポリメラーゼp110(BALF5)、アルカリDNアーゼp55(BGLF5)、チミジンキナーゼP65(BXLF1)及び初期トランスアクティベーターP52(BMLF1)を含む。
【0023】
EA−R複合体は少なくとも次のEBVタンパク質: リボヌクレオチドレダクターゼ大型サブユニットP85(BORF2)、RR小型サブユニットp30(BaRF1)及びBcl−2相同体P17(BHRF1)を含む。
【0024】
EBV−EA複合タンパク質に対する抗体は通常、活性な(急性または慢性)EBV感染下に有る患者において検出され得、その際抗EA−R抗体は見掛け上健康な供血者においてより頻繁に検出され得る。
【0025】
急性期の単核細胞症においてEA−D複合タンパク質に対するIgG、IgM及びIgAクラスの抗体が検出され、これらのうちIgM及びIgAは回復期にIgGより急速に消失した。(重篤な)慢性EBV感染ではEA−D複合体とEA−R複合体との両方に対するIgG抗体が高力価で見出され、時にはIgAも見出されるが、IgMは存在しない。上咽頭癌ではEA−Dに対するIgGとIgAとの両方が高力価で見出され、その際IgAは診断上、また予後においても疾患監視のために重要である。これに対して、別のEBV関連悪性疾患であるバーキットリンパ腫はしばしば、EA−R構成要素に対する高力価のIgGとの間に関連性を有する。
【0026】
大抵の場合、上述の抗体応答は、EA発現を誘導し、アセトンまたはメタノールで固定した様々なEBV細胞系において間接免疫蛍光技術を用いて研究されている。分子をより良く解明する血清学的研究は最近始められたばかりである。
【0027】
現在、EA−D及びEA−R複合体に対する上記のように異なる免疫応答の(1種以上の)基礎機構は解明されておらず、また様々なEBV疾患症候群においてヒト抗体により検出されるのがEA−Dタンパク質とEA−Rタンパク質とのいずれであるかも明らかに解明されてはいない。
【0028】
先に述べたように、EA−D及びEA−R複合体成分の分子特性の幾つかは近年或る程度説明されてきており、そのコーディング読み取り枠のウイルスゲノム上での位置も特定されている。
【0029】
しかし、これらの構成要素をEBV産生細胞から生産することは煩雑であり、また細胞培養におけるこれらのタンパク質の発現レベルの低さから収量は低い。このような事実によって、面倒でかつ主観的なIFに基づく血清学的試験に替わるものとしての、より単純な診断法の開発が妨げられてきた。
【0030】
解明した構成要素を代替宿主系において発現させることが開示されているが、この方法を診断試験に通常のように適用するには、潜在的に干渉性である宿主タンパク質(例えばE. coli)を除去するための高レベルの精製が必要となる。
【0031】
現在、EBV特異的な血清診断は、どちらかというと主観的な免疫蛍光試験によって行なわれる。より単純かつ一律な診断法(例えばELISA)への進歩は妨げられ、なぜならウイルス抗原の大量生産及び精製は標準的なウイルス産生細胞系を用いては不可能であるからである。
【0032】
上記のような生産及び精製を行なう唯一の方策は、別様に調製される(1種以上の)EBV抗原を用いることである。前記EBV抗原は遺伝子操作技術または合成ペプチド技術によって調製し得る。
【0033】
様々な段階のEBV感染において確実な診断を可能にする特異的でかつ高感度の方法を開発するには、免疫優性(immuno−dominant)なウイルスタンパク質とそのエピトープとを同定することがきわめて重要である。
【0034】
今回、EBV−EA(D) P47−54(BMRF1)の幾つかの免疫反応性(ペプチド)ドメインが該タンパク質のC末端領域に局在することが患者の血清を用いて見出されたが、個体によっては前記タンパク質のいずれか他の箇所に位置するドメインに対する抗体も有する(図1)。
【0035】
EBV−EA(D) P138(BALF2)の免疫反応性(ペプチド)ドメインは該タンパク質の複数の部位に配置されており、そのほとんどはアミノ酸配列490〜600と、C末端のアミノ酸配列1000〜1128とに限定される(図2)。
【発明の開示】
【発明が解決しようとする課題】
【0036】
本発明は、診断試験において完全なタンパク質に替わり得る、EAタンパク質の免疫優性ドメインに相当する合成ペプチドフラグメントを解明することを目的とする。
【0037】
合成ペプチドは、化学的に十分解明されている、即ち診断アッセイへの適用に十分適した、高収量で容易かつ再現可能な生産が可能であるという利点を有し、比較的高い再現性の下に製造及び使用され得る。
【課題を解決するための手段】
【0038】
本発明は、エプスタイン−バールウイルスに対する抗体と免疫化学的に反応する、EA−p47−54タンパク質の少なくとも一部を含むペプチドであって、配列番号1、2、4または5に示したアミノ酸配列の少なくとも一部を含むペプチドを提供する。
【0039】
本発明はまた、エプスタイン−バールウイルスに対する抗体と免疫化学的に反応する、EA−p47−54タンパク質の少なくとも一部を含むペプチドであって、配列番号5に示したアミノ酸配列の少なくとも一部と連結された、配列番号4に示したアミノ酸配列の少なくとも一部を含むペプチドも提供する。
【0040】
本発明は、配列番号6に示したアミノ酸配列の少なくとも一部を含むペプチドも提供する。
【0041】
更に本発明は、エプスタイン−バールウイルスに対する抗体と免疫化学的に反応する、EA−p138タンパク質の少なくとも一部を含むペプチドであって、配列番号7、8、9または10に示したアミノ酸配列の少なくとも一部を含むペプチドも提供する。
【0042】
天然EBVとは異なり、本発明によるペプチドには、その起源が非感染性で安全であるという一大利点が有る。
【0043】
本発明によるペプチドとそのフラグメントは、試料中のEBVまたはEBV抗体の存在を測定する診断法に用いるのに特に適当であることが判明した。そのうえ、本発明によるペプチドとそのフラグメントは適当な医薬投与形態でEBV関連疾患の治療に用いることができる。このようにして得られる、活性成分としペプチドまたはそのフラグメントを含有するワクチンの製造は当業者には公知である。
【0044】
免疫試薬に含有させる本発明によるペプチドは、現在入手可能なEA(D)試薬に比較して改善された反応性及び特異性(性能)を有する。
【0045】
従って、上記のような免疫試薬を血清学的試験に用いることによって、活性EBV感染下に有る患者のより優れた鑑別診断を可能にするアッセイの開発が可能となる。
【0046】
本発明者は、特定のEA(D)ペプチドに対する抗体の存在が活性EBV感染と相関するということも発見した。
【0047】
EBV−EA(D) P47−54及びEBV−EA(D) P138由来の選択ドメインは、活性EBV感染下に有る患者における抗体検出に用い得る。前記抗体は健康な個体には実質的に存在しない。
【0048】
このことは、世界各地出身の健康なEBV血清反応陽性供血者の血清をEA(D) P47−54及びP138由来のペプチドに対するIgG反応性に関して分析することにより更に証明される(図5)。
【0049】
図5から、(無症状の)EBV潜伏感染下に有る健康なEBV血清反応陽性供血者は特定のEA(D)ペプチドに対する抗体をまれにしか有しないと結論することができる。
【0050】
本発明者は、様々なEBV疾患においてEA(D)に対するIgG、IgM及びIgA抗体サブクラスを検出するのに本発明によるペプチドを単独でも、また組み合わせても用い得ることも発見した。
【0051】
伝染性単核細胞症(IM)患者の血清中にEBV−VCA及びEBV−EA(D)反応性IgM抗体を検出することは、感染の急性期及び回復初期を示すものであり、従って重要な診断パラメーターである。IgG抗EA(D)抗体はIMの急性期に一時的に存在し、回復期には低い、もしくは検出不能なレベルまで減少する。IgG−EA(D)は、慢性または再活性化EBV感染下に有る患者、及びEBV関連悪性疾患に罹患した患者から成る特定グループでは再出現する場合も有る。従って、IgG抗EA(D)の存在は、様々な臨床環境での(再)活性EBV感染診断のためのマーカーとして有用である。
【0052】
最後に、IgA抗EA(D)の検出は或る種のEBV関連悪性疾患に関連し、この検出は上咽頭癌において診断上、また予後においても有用であることが判明した。
【0053】
本明細書中に用いた‘ペプチド’という語は、生物活性を有するアミノ酸の分子鎖を意味し、特定長の産物を意味するものではない。従って特に、タンパク質、融合タンパク質またはペプチド、オリゴペプチド及びポリペプチドが含まれる。
【0054】
必要であれば、本発明によるペプチドは例えばグリコシル化、アミド化、カルボキシル化またはリン酸化によりin vivoまたはin vitroで修飾可能である。従って、本発明によるペプチドの例えば酸付加塩、アミド、エステル、特にC末端エステル、及びN−アシル誘導体などの機能性変形例も本発明の一部とみなす。本発明に含まれる特定のタンパク質またはポリペプチドには自然の改変が存在することも有り得ると理解される。そのような改変は、配列全体の中にみられる(一つ以上の)アミノ酸の相違によって、または(1個以上の)アミノ酸の欠失、置換、挿入、逆位または付加によって明示され得る。生物活性及び免疫活性を実質的に変更しないと考えられるアミノ酸置換が開示されている。関連するアミノ酸間でのアミノ酸置換、もしくは進化の過程でしばしば生起した置換は特に、Ser/Ala、Ser/Gly、Asp/Gly、Asp/Asn、Ile/Valである(M. D. Dayhof, “Atlas of protein sequence and structure,” Nat. Biomed. Res. Found., vol.5, suppl.3, Washington D. C., 1978参照)。この情報に基づき、Lipman及びPearsonは迅速かつ高感度のタンパク質比較法を開発し(Science 227, pp.1434−1441, 1985)、相同タンパク質同士の機能類似度を測定した。
【0055】
本明細書中に用いた‘少なくとも一部’という語は、本発明のペプチドのサブ配列から成るアミノ酸配列を意味する。上記一部もしくはフラグメントとは、EBV−EAタンパク質の免疫原決定基を1個以上有するペプチドのことである。フラグメントは特に前駆体分子の酵素切断によって製造され得、その際DNAには制限エンドヌクレアーゼ、ポリペプチドにはプロテアーゼが用いられる。他の方法にはフラグメントの化学合成や、DNAフラグメントによるペプチドフラグメントの発現などが有る。
【0056】
本発明によるペプチドの、1個以上のエピトープを有する適当な免疫原フラグメントは国際特許出願公開第86/06487号、H. M. Geysen等, Proc. Natl. Acad. Sci. 81, pp.3998−4002, 1984及びH. M. Geysen等, J. Immunol. Meth. 102, pp.259−274, 1987に開示された、いわゆるpepscan法に基づく方法によって見出すことができ、その際完全な当該ポリペプチドの部分配列に対応する一連の部分重複ペプチドを合成し、それらの抗体との反応性を調べる。
【0057】
加えて、ペプチドの幾つかの領域を理論的な要件に基づきエピトープと呼称し得るが、前記理論的要件の予測的な価値は限られる。上記領域の決定は、Hopp及びWoodsによる親水性基準(Proc. Natl. Acad. Sci. 78, pp.3824−3828, 1981)とChou及びFasmanによる二次構造アスペクト(Advances in Enzymology 47, pp.45−148, 1987)との組み合わせに基づく。
【0058】
本発明によるペプチドまたはそのフラグメントは、公知の有機化学的ペプチド合成方法のいずれかで、または組み換えDNA技術を用いて調製できる。
【0059】
有機化学的ペプチド合成方法は、必要なアミノ酸同士を均質相中で、またはいわゆる固相を用いて縮合反応により結合させることを含む。
【0060】
縮合反応は、
a) 遊離カルボキシル基を有し、その他の反応性基は保護されている化合物(アミノ酸、ペプチド)を、遊離アミノ基を有し、その他の反応性基は保護されている化合物(アミノ酸、ペプチド)と、縮合剤存在下に縮合させるか、または
b) 活性化されたカルボキシル基を有し、その他の反応性基は遊離であるか、または保護されている化合物(アミノ酸、ペプチド)を、遊離アミノ基を有し、その他の反応性基は遊離であるか、または保護されている化合物(アミノ酸、ペプチド)と縮合させる
ことによって実施し得る。
【0061】
カルボキシル基の活性化は特に、カルボキシル基を酸ハロゲン化物、アジド、酸無水物、イミダゾリド、またはN−ヒドロキシ−スクシンイミド、N−ヒドロキシ−ベンゾトリアゾールもしくはp−ニトロフェニルエステルなどの活性化エステルに変換することによって行なう。
【0062】
上記縮合反応を生起させる最も普通の方法は、カルボジイミド法、アジド法、混合酸無水物法、並びにE. Gross及びJ. Meienhofer編, The Peptides, Analysis, Synthesis, Biology, vols.1−3, Academic Press Inc., 1979, 1980, 1981に記載されているような活性化エステルを用いる方法である。
【0063】
本発明による上述のペプチドの適当なフラグメントを、‘固相法’を用いて調製する方法は、例えばJ. Amer. Chem. Soc. 85, p.2149, 1963及びInt. J. Peptide Protein Res. 35, pp.161−214, 1990に記載されている。調製するべきペプチドのアミノ酸の結合は普通、カルボキシル末端側から始まる。この方法の場合、反応性基を担持するか、またはその上に反応性基が導入され得る固相が必要である。固相は、例えばベンゼン及びジビニルベンゼンと反応性クロロメチル基とのコポリマーか、またはヒドロキシメチルもしくはアミン官能基と反応する性質を付与されたポリマー固相であり得る。
【0064】
特に適当な固相は、例えばJ. Am. Chem. Soc. 95, p.1328, 1974にWangが述べているp−アルコキシベンジルアルコール樹脂(4−ヒドロキシ−メチル−フェノキシ−メチル−コポリスチレン−1%ジビニルベンゼン樹脂)である。合成後、ペプチドは上記固相から穏和条件下に分離され得る。
【0065】
所望のアミノ酸配列の合成後、続いて樹脂からペプチドを、例えばトリフルオロメタンスルホン酸、またはトリフルオロ酢酸に溶解させたメタンスルホン酸で分離する。ペプチドは、低級アルコール、好ましくはメタノールまたはエタノールを用いるエステル交換反応によっても支持体から分離でき、この場合ペプチドの低級アルキルエステルが直接生成する。同様に、アンモニアを用いる分離によって本発明によるペプチドのアミドが得られる。
【0066】
縮合反応に関与しない反応性基は、先に述べたように、酸、塩基を用いる加水分解または還元によってきわめて容易に再度除去することができる基によって有効に保護する。即ち、カルボキシル基であれば、例えばメタノール、エタノール、t−ブタノール、ベンジルアルコールまたはp−ニトロベンジルアルコールとのエステル化、及び固体支持体に結合したアミンによって有効に保護し得る。
【0067】
アミノ基を有効に保護し得る基は、エトキシカルボニル、ベンジルオキシカルボニル、t−ブトキシ−カルボニル(t−boc)もしくはp−メトキシ−ベンジルオキシカルボニル基であるか、またはベンゼン−スルホニルもしくはp−トルエン−スルホニル基などの、スルホン酸に由来する酸基であるが、置換または非置換アリールまたはアラルキル基、例えばベンジル及びトリフェニルメチルや、オルト−ニトロフェニル−スルフェニル及び2−ベンゾイル−1−メチル−ビニルなどの基のような他の基を用いることも可能である。特に適当なα−アミノ保護基は、例えば塩基感受性の9−フルオレニル−メトキシカルボニル(Fmoc)基(Carpino及びHan, J. Amer. Chem. Soc. 92, p.5748, 1970)である。
【0068】
用い得る保護基についてのより広範な記述が、Gross, Udenfriend及びMeienhofer編, The Peptides, Analysis, Synthesis, Biology, vols.1−9, Academic Press Inc., 1979−1987中に見出され得る。
【0069】
リシンのε−アミノ基を保護することも必要であり、またアルギニンのグアニジン基は保護することが適当である。このような保護に通常用いられる保護基は、リシンの場合はBoc基、アルギニンの場合はPmc基、Pms基、Mbs基またはMtr基である。
【0070】
保護基は、当該基の性質に応じて様々な通常方法で、例えばトリフルオロ酢酸を用いて、または水素とパラジウムなどの触媒とを用いる穏和な還元によって、または氷酢酸中のHBrを用いて除去可能である。
【0071】
本発明による免疫反応性ペプチドは、複数を組み合わせてただ1個の分子とすることもできる。2個以上のペプチドを共有結合させて混成ペプチドまたは複合ペプチドとすることは、例えば先に述べた方法を用いてペプチド配列を固相ペプチド合成することにより可能であり、その際個々のペプチドのアミノ酸配列は互いに整列させる。個々のペプチド配列間にはリンカー配列を挿入することもできる。そのようなリンカー配列は、例えばグリシンの2〜5残基の伸長部(stretch)であり得る。
【0072】
混成または複合ペプチドは、フラグメント縮合技術を用いる固相合成によっても調製可能である。(その配列が本発明の個々のペプチドの配列に対応し得る)複数のフラグメントを個別に調製及び精製するこの方法は、比較的長い混成または複合ペプチド配列を合成する場合に好ましい。比較的長いペプチドを調製する方法は当業者に公知であり、例えばThe Peptides, Analysis, Synthesis, Biology, vols.1−9(上記参照)に記載されている。
【0073】
あるいは他の場合には、適宜修飾した本発明のペプチド同士を結合させることによって混成または複合ペプチドを調製し得る。
【0074】
システインアミノ酸を欠いた2個の異なるペプチド配列を結合させる好ましい方法ではペプチドを、カルボキシル末端かまたはアミノ末端に付加的なシステイン残基を有する誘導体に変換する。その後、一方のペプチドを単一システインチオール官能基において2,2′−ジチオジピリジンで活性化する。得られたピリジル−ジチオ−ペプチド誘導体を、システインチオール基を有する第二のペプチドと反応させて、個別のペプチドがジスルフィド結合によって連結された混成ペプチドを得る。
【0075】
他の多くの混成ペプチド調製方法も実施可能である。タンパク質−タンパク質結合の分野で開発された化学的方法も用い得る。このような方法についてはMeans及びFeeney(Bioconj. Chem. 1, pp.2−12, 1990)を参照されたい。例えば、良く知られたホモまたはヘテロ二官能架橋剤を用いれば、個々のペプチドをジスルフィド結合、またはチオエーテル結合、またはアミド結合等で結合させることができる。
【0076】
先に触れたように、本発明によるペプチドは組み換えDNA技術を用いても調製し得る。この可能性は、ペプチドを反復配列中に(‘タンデムに’)組み込む場合、またはペプチドを(はるかに大きい)タンパク質またはポリペプチドの構成要素として、もしくは例えばβ−ガラクトシダーゼ(の一部)との融合タンパク質として調製し得る場合特に重要である。従って、上記のようなペプチドも本発明の範囲内である。この調製方法では、組み換えDNAの構成要素として、本発明によるペプチドをコードする核酸配列であってしかも、天然のEBVゲノムにおいて該配列に隣接(flank)する核酸セグメントを実質的に含まない核酸配列を用いる。
【0077】
上記方法は、宿主として適当な微生物において調製したい1種以上のペプチドをコードする核酸配列を含む組み換えポリヌクレオチドを発現させることにより所望のペプチドを調製することを含む。
【0078】
本発明によるペプチドをコードする核酸配列は、該配列が天然には会合または連結しない様々な複製実現DNA配列と連結させていわゆる組み換えベクター分子とすることができ、この分子は適当な宿主の形質転換に用い得る。有用な組み換えベクター分子は好ましくは、例えばプラスミド、バクテリオファージ、コスミドまたはウイルスに由来する。
【0079】
核酸配列のクローニングに用い得る特異的ベクターまたはクローニングビヒクルは当業者に公知であり、特にpBR322、様々なpUC、pGEMおよびBluescriptプラスミドなどのプラスミドベクター、バクテリオファージ、例えばkgt−Wes、Charon 28及びM13由来ファージ、またはSV40、アデノウイルスもしくはポリオーマウイルスなどのウイルスベクターを含む(R. L. Rodriquez及びD. T. Denhardt編, Vectors: A survey of molecular cloning vectors and their uses, Butterworths, 1988; J. A. Lenstra等, Arch. Virol. 110, pp.1−24, 1990も参照されたい)。組み換えベクター分子の構築に用いるべき方法は当業者に公知であり、特にT. Maniatis等が提示している(Molecular Cloning: A Laboratory Manual, second edition, Cold Spring Harbor Laboratory, 1989)。
【0080】
例えば、本発明によるペプチドをコードする核酸配列をクローニングベクターに挿入することは、遺伝子と所望のクローニングビヒクルとの両方を(1種以上の)同じ制限酵素で切断すれば、それによって相補的DNA末端が形成されるので容易に実施可能となる。
【0081】
組み換えベクター分子は、pBR322のアンピシリン及びテトラサイクリン耐性、並びにpUC8のアンピシリン耐性及びβ−ガラクトシダーゼのα−ペプチドをコードする領域の活性のような、所望の形質転換体の選択に用い得る1種以上のマーカー活性を付加的に有していてもよい。
【0082】
当然ながら、形質転換宿主が1個以上の免疫原決定基を有するポリペプチドを産生するかぎり、クローニングベクターの選択した部位に挿入するヌクレオチド配列は本発明のペプチドをコードする完全な核酸配列の断片しか含まなくてもよいと理解されるべきである。
【0083】
本発明のペプチドに対する抗体も本発明の一部である。
【0084】
上述のように調製したペプチドまたはそのフラグメントは、ポリクローナルとモノクローナルとの両方の抗体の製造に用い得る。本発明によるペプチドに対するモノクローナル抗体は、当業者には容易に製造可能である。
【0085】
従って、本発明のモノクローナル抗体はEBV感染診断のための新規な手段を提供する。
【0086】
本発明の好ましい抗体は、EBV−EA p47−54タンパク質のエピトープに結合するモノクローナル抗体であり、前記エピトープはthe European Collection of Animal Cell Cultrue(ECACC), Porton Down(UK)に受託番号第95051619号、同第95051620号、同第95051621号及び同第95051622号の下に寄託されたハイブリドーマ細胞系が産生するモノクローナル抗体によって認識される。
【0087】
本発明のモノクローナル抗体を分泌し得る不死化細胞系も本発明の一部である。
【0088】
モノクローナル抗体を産生する細胞系の製造は、例えばKohler及びMilsteinの技術[Kohler及びMilsteinは、モノクローナル抗体産生ハイブリドーマの形成をもたらす技術を創案した(G. Kohler及びC. Milstein, Nature 256, pp.495−497, 1975; Eur. J. Immunol. 6, pp.511−519, 1976)]、エプスタイン−バールウイルスを用いる形質転換、もしくはオンコジーンDNAでのBリンパ球の直接形質転換、またはヒトBリンパ球とヒトもしくはマウス−ヒト雑種骨髄腫細胞系である融合相手との直接融合、もしくはEBV形質転換B細胞系と前記骨髄腫細胞系との直接融合によって実施し得る。
【0089】
本発明の好ましい細胞系は、受託番号95051619、95051620、95051621及び95051622でEuropean Collection of Animal Cell Cultures, Porton Down (UK)に寄託された細胞系である。
【0090】
これらのハイブリドーマ細胞系は、骨髄腫細胞を、EBV産生細胞由来のEBV−EAタンパク質を予め接種したマウスに由来するリンパ球と融合させて産生された。
【0091】
EBV−EA(D)複合体のタンパク質に対するモノクローナル抗体は、精製目的のために、またこれらのタンパク質の機能研究のための様々な生化学/免疫分析技術のために、細胞及び細胞抽出物でのEA(D)発現をin vivo及びin vitroの両方で検出するのに有用な手段である。
【0092】
EBV−EAタンパク質に対するモノクローナル抗体が産生され、BMRF1によってコードされるEA(D)タンパク質P47−54の特定のペプチドドメイン内のエピトープと反応することが判明した。
【0093】
これらのモノクローナル抗体の2種(EBV.OT13N及びEBV.OT14Eと称する)のためのP47−54タンパク質上の結合ドメインはそれぞれAA位置340−346及び346−350にマッピングされた(図8A)。
【0094】
このような抗体を使用して、潜伏感染細胞(図8B、レーンX50/7)ではなく、増殖感染細胞(図8B、レーンVCA及びEA)で発現されるBMRF1によってコードされるP47−54タンパク質をインタクトなリン酸化及び非リン酸化形態で検出することができる。抗体はEBV P47−54に特異的であり、EBV陰性細胞の細胞成分とは交差反応しない(図8B、レーンBJAB)。
【0095】
EBV−EAタンパク質に対するモノクローナル抗体が産生され、BALF2によってコードされるEA(D)タンパク質P138の特定ペプチドドメイン内のエピトープと反応することが判明した。
【0096】
これらのモノクローナル抗体の2種(EBV.OT13B及びEBV.OT13Dと称する)のためのP138タンパク質上の結合ドメインはそれぞれAA位置515−521及び1092−1098にマッピングされた(図9A)。
【0097】
このような抗体を使用して、潜伏感染細胞(図9B、レーンX50/7)ではなく、増殖感染細胞(図9B、レーンVCA及びEA)で発現される、BALF2によってコードされるP138タンパク質をインタクトな形態で検出することができる。抗体はEBV P138に特異的であり、EBV陰性細胞の細胞成分とは交差反応しない(図9B、レーンBJAB)。
【0098】
本発明は更に、試験液又は組織試料中の全長タンパク質の検出を目的とする免疫学的及び生化学的方法での前記ペプチドに対する抗体の使用を包含する。
【0099】
本発明以前では、EBV感染細胞の初期抗原の検出は、ヒト血清を抗EBV−EA抗体源として使用する間接免疫蛍光法(IIF)を用いて実施されていた。擬陽性反応や擬陰性反応が頻繁に見られるために、これは複雑である。
【0100】
EBV.OT13B、13D、13N、14E抗体によって、間接免疫蛍光法や同様の技術による種々のEBV感染細胞中のEBV−EAの高感度検出が可能となる。
【0101】
本発明のペプチドに対するモノクローナル及びポリクローナル抗体は、組織試料中のその場での検出のための診断や免疫細胞化学法に非常に適しており、中和抗体は受動免疫治療に非常に有用である。
【0102】
問題のモノクローナル抗体の「人体適応化(humanizing)」も本発明の一部となる。「人体に適応した」モノクローナル抗体の産生技術は当業界では公知である。
【0103】
本発明のペプチド又は抗体を1種以上含む免疫化学試薬も本発明の一部である。
【0104】
本発明の「免疫化学試薬」という用語は通常、本発明の1種以上のペプチド及び適切な支持体又は標識物質からなる。
【0105】
使用できる支持体は例えば、マイクロ試験ウェル又はキュベットの内壁、管又は細管、膜、フィルター、試験ストリップ又は粒子[例えばラテックス粒子、アルデヒド粒子(例えば活性アルデヒド表面基を有するセラミック磁化性粒子)]の表面、赤血球、色素ゾル、金属ゾル又はゾル粒子としての金属化合物,BSA又はKLHのようなキャリヤータンパク質である。
【0106】
使用できる標識物質はとりわけ、放射性同位体、蛍光化合物、酵素、色素ゾル、金属ゾル又はゾル粒子としての金属化合物である。
【0107】
試料中のEBVに対する抗体の検出方法では、本発明の免疫化学試薬を試料と接触させる。その後、試料中のペプチドと抗体との間に生成した免疫複合体の存在を検出し、この検出によって試料中のEBV抗体の存在を確認し、定量することができる。
【0108】
免疫化学試薬の種類や更なる特徴によっては、生起する免疫化学反応はいわゆるサンドイッチ反応、凝集反応、競合反応又は阻害反応である。
【0109】
試料中のEBV検出のために、本発明のペプチドを1種以上含む本発明の免疫化学試薬を試料及び抗EBVと接触させ、その後、生成した免疫複合体の存在を検出し、これから試料中のEBVの存在を調べることができる。
【0110】
試料中EBVの特に適した検出方法は、標識物質を備えた本発明のペプチドと(試料中に存在する)EBV抗原との間の競合反応に基づき、ペプチド及び抗原は固体支持体に結合したEBVに対する抗体と競合する。
【0111】
本発明は更に、本発明の抗体を試料と接触させた後に、生成した免疫複合体の存在を検出し、これが試料中のエプスタイン−バールウイルスの存在の尺度となることを特徴とする試料中のエプスタイン−バールウイルスの検出方法を包含する。
【0112】
本発明の試験キットは、上述したような免疫化学試薬を主成分として含んでいる。EBV抗体検出のためのサンドイッチ反応を実施する際に、試験キットは例えば、固体支持体(例えばマイクロ試験ウェルの内壁)に被覆された本発明のペプチド、及び本発明の標識ペプチド又は標識抗抗体を含み得る。
【0113】
競合反応実施のために、試験キットは、固体支持体に被覆された本発明のペプチド、及びEBVに対する標識抗体、好ましくは前記ペプチドに対するモノクローナル抗体を含み得る。
【0114】
凝集反応では、試験キットは、粒子又はゾルに被覆された本発明のペプチドを含み得る免疫化学試薬を包含する。
【0115】
試験キットの他の実施態様は例えば、固体支持体に被覆されたEBVに対する抗体上の結合部位に対する検出すべきEBV抗原との競合反応で本発明の標識ペプチドを免疫化学試薬として使用することである。
【0116】
(実施例)
以下の実施例で本発明を更に詳しく説明する。
【0117】
実施例に記載のペプチドコードは、下記のように定義する。
#496(P47−54):配列番号1
#497(P47−54):配列番号2
#498(P47−54):配列番号3
#499(P47−54):配列番号4
#500(P47−54):配列番号5
#501(P47−54):配列番号6
G−34−R(P138):配列番号7
D−28−S(P138):配列番号8
A−27−G(P138):配列番号9
G−21−V(P138):配列番号10
【実施例1】
【0118】
EBV−EA(D)P47−54(BMRF1)上の免疫反応性(ペプチド)ドメインの局在。
【0119】
長さが12アミノ酸(AA)で、完全BMRF1読み取り枠のAA配列の11AAが重複したペプチドを、最初にGeijsen等が記載したように(P.N.A.S.,USA,83(1994)p.3998−4002)、化学的に活性化したピン上で自動化固相ペプチド合成によって合成した。
【0120】
Middeldorp及びMeloenが記載する方法(J. Virol. Meth. 21(1988)p.147ー159)で、EBV特異抗体の免疫反応性を調べた。
【0121】
活性EBV感染した個体の4つの血清でのこのようなPEPSCAN分析の結果を図1に示す。
【0122】
大半の血清が、タンパク質のC末端領域に位置する領域(ドメイン)と反応性の抗体を含んでいたが、タンパク質の他のドメインに対する抗体を更に有する個体もあることがこの図から判明し得る。
【0123】
EBV患者血清の別の試料では同様のデータが見出されたが、健康な対照の血清ではこのような反応性は見出されなかった。
【実施例2】
【0124】
BV−EA(D)P138(BALF2)上の免疫反応性(ペプチド)ドメインの局在。
【0125】
BALF2の全読み取り枠に由来するペプチドを実施例1に記載のように合成して分析した。
【0126】
1個のEBV患者血清の結果を図2に示す。
【0127】
抗体反応性領域がタンパク質AA配列上の複数の部位に見出され、大半がAA490−600及びAA1000−1128のC末端に局限されることがこの図から判明し得る。
【0128】
EBV患者の別の血清でも同様のデータが見出された。
【実施例3】
【0129】
ヒト血清抗体との反応性の改善のためのEBV−EA(D)P47−54由来の可溶性合成ペプチドの使用。
標準的な固相法((J. Amer. Chem. Soc. 85, 2149(1963);Int. J. Peptide Protein Res. 35, 161−214(1990))を用いて特定のペプチド(配列表を参照されたい)を合成して、複数のPEPSCAN反応性ドメインを組み合わせて単一分子とした。これらのペプチドを、通常は被覆用緩衝液中1μg/mlで、96ウェルミクロELISAプレートのウェル中で固相上に被覆し、未結合位置を被覆用緩衝液中1%ウシ血清アルブミンでブロックした。
【0130】
全ての場合で、ペプチドを0.1M炭酸塩緩衝液(pH9.6)中で固相上に被覆した。
【0131】
ウェルを0.05%Tween−20を含む0.1Mリン酸緩衝食塩水(pH7.4)で洗浄した後に、標準的な手順を用いてヒト血清の血清希釈液(通常1:100)で抗体反応性を分析した。
【0132】
このような分析の結果を図3に示す。
【0133】
ペプチド#499のC末端にシステイン残基を導入し、ペプチド#500のN末端にシステイン残基を導入してペプチド#501(ペプチドの#499と#500とを組み合わせたもの)を構築して、これらのペプチドをジスルフィド結合で結合する。ペプチドの組み合わせ又は結合については他の同様の技術(例えば標準的な固相合成による)が公知である。標準的な固相合成技術を使用する場合、2個のシステイン残基の導入は不要であり、従ってこれら2個の残基をアミノ酸配列から除去することができる(配列番号6;AA20及び21)。
【0134】
ペプチドの#500及び#501が、EBV感染患者の血清との陽性抗EA(D)反応と、EBVに潜伏感染した(JM及び219)又はEBV陰性(TR)の健康な対照ドナーの血清との陰性反応との間の最良の識別を示していることがこの図から判明し得る。ペプチドの#496及び#497は、当業者によって抗体反応性AA配列を含むことが判明している(J. Clin. Lab. Anal. 1(1987)p.140−145)、P47−54ペプチドのN末端伸長である基準ペプチド#498と同様の性能を示した。
【0135】
従って、特にペプチドの#500及び#501は、抗EA(D)抗体検出のために改善された反応性を示す新たな試薬となる。
【実施例4】
【0136】
ヒト血清抗体との反応性を改善するためのEBV−EA(D) P138由来の合成ペプチドの使用。
【0137】
特定の合成ペプチド試薬を実施例3に記載した同様の方法で製造してP138(配列表を参照されたい)の免疫反応性ドメインを含ませ、これらを標準的な手順を用いてELISAで試験した。
【0138】
いずれの場合も、炭酸塩緩衝液(pH9.6)を用いてペプチドを固相上に被覆し、血清は1:100の希釈度で試験した。
【0139】
図4AはペプチドをpH9.6で固相に被覆した実験の結果を示し、図4BはpH9.6ではなくpH7.2で被覆すると、これらのペプチドの一つの反応性が改善されることを示している。
【0140】
これらの研究から、(被覆条件に依存して)EBV−EA(D) P138由来の特定ペプチドを使用して、とりわけEBV患者の血清で抗EA(D)抗体を検出できることが判明し得る。EBVに潜伏感染した健康な対照の血清は、EBV血清陰性ドナーと同様の陰性反応を示す。
【実施例5】
【0141】
感度改善のための単一アッセイでの選択ペプチドの組み合わせ
特定試薬の付加的な利点は、単一アッセイに種々のEA(D)タンパク質のペプチドを組み合わて、抗EA(D)抗体検出の総感度を改善できることである。
【0142】
これは、単独で又は1:1で組み合わせて同一ウェル内に被覆したペプチド#501(P47−54;配列番号6)及びG−34−R(P138;配列番号7)に対する無作為の単核細胞症患者の血清IgG反応性を示した図5で分かる。
【0143】
更には、図6−図7には単一アッセイでの特定ペプチドの組み合わせが明示されている(実施例3−4による臨床環境でのIgM、IgG及びIgA抗EA(D)の検出は図7A−Cに明示されている)。
【0144】
特定のペプチドを組み合わせると抗EA(D)抗体の検出感度が増したことがこれらの図面から明白である。
【実施例6】
【0145】
モノクローナル抗体EBV.OT13B、EBV.OT13D、EBV.OT13N及びEBV.OT14Eのイムノブロット分析。
【0146】
還元条件下で変性SDS−PAGEによって、数個の核抽出物(ウイルス構造タンパク質の発現のために誘導されたHH514細胞の核抽出物(VCA)、ウイルスDNA複製をPAAにより阻止してEAタンパク質の発現のために誘導されたHH514細胞の核抽出物(EA)、潜伏期EBV遺伝子のみを発現するX50/7細胞の核抽出物(X50/7)及びEBV陰性バーキットリンパ腫細胞系BJABの核抽出物(BJAB))を分離し、当業界で公知の標準的な手順でニトロセルロースシートに移した。
【0147】
このイムノブロットから、上述のEBV核抽出物で、モノクローナル抗体EBV.OT13B(図9B)、EBV.OT13D(図9D)、EBV.OT13N(図8B)及びEBV.OT14E(図8B)を用いてイムノブロット分析を実施した。
【0148】
【表1】






【図面の簡単な説明】
【0149】
【図1】4人の活性EBV感染患者の血清中IgG抗体と、11アミノ酸が重複してEBV−EA(D) P47−54(BMRF1)の完全AA配列を示す個々の12量体ペプチドとの結合の同定。
【図2】1人の活性EBV感染患者の血清中IgG抗体と、11アミノ酸が重複してEBV−EA(D) P138(BALF2)の完全AA配列を示す個々の12量体ペプチドとの結合の同定。
【図3】EA(D)P47−54の免疫反応性ドメインの組み合わせを示す個々の合成ペプチドに対する(IgG)抗体の検出。ペプチド配列は配列表に記載する。JM及び219:健康で血清陽性のEBV対照ドナーの血清。TR:健康で血清陰性のEBV対照ドナーの血清。IM:単核細胞症患者の血清。RR:重症慢性EBV感染患者の血清。
【図4A】EA(D)P138の免疫反応性ドメインの組み合わせを示す個々の合成ペプチドに対する(IgG)抗体の検出。ペプチド配列は同定表に記載し、上述したようなP138 AA位置を示す。JM及びQCD219:健康で血清陽性のEBV対照ドナーの血清。TR:健康で血清陰性のEBV対照ドナーの血清。IM:単核細胞症患者の血清。RR:重症慢性EBV感染患者の血清。
【図4B】pH9.6(0.1M炭酸塩緩衝液)又はpH7.2(0.1Mリン酸塩緩衝液)で被覆したP138由来ペプチドG−21−V(配列番号10)及びG−34−R(配列番号7)を用いて行った図4Aと同一の分析。
【図5】EA(D)複合体又はそれを組み合わせたものの個々の成分に対する(IgG)抗体の検出。この図では、ペプチド#501(P47−54;配列番号6)及びG−34−R(P138;配列番号7)を別個に又は1:1で組み合わせて固相上に直接被覆した。無作為の38人の単核細胞症患者の血清を1:100の希釈度で使用した。
【図6A】香港(A)及びUSA(B)の健康な血液ドナー集団で、EA(D)P47−54及びP138(即ち#500(配列番号5)及びG−34−R(配列番号7))由来の特定ペプチドを別個に又は1:1で組み合わせて用いたEBV−EA(D)に対するIgG抗体の検出。
【図6B】香港(A)及びUSA(B)の健康な血液ドナー集団で、EA(D)P47−54及びP138(即ち#500(配列番号5)及びG−34−R(配列番号7))由来の特定ペプチドを別個に又は1:1で組み合わせて用いたEBV−EA(D)に対するIgG抗体の検出。
【図7A】別個に固相上に被覆した又は1:1で組み合わせて同一ウェルに被覆した特定ペプチド(即ちP47−54の場合は#501(配列番号6)及びP138の場合はG−34−R(配列番号7))を用いた38人の単核細胞症患者の血清中のEBV−EA(D)P47−54及びP138に対するIgM抗体の検出。
【図7B】前記試薬を用いた38人の単核細胞症患者の血清中のIgG抗体の検出。
【図7C】前記試薬を用いた38人の上咽頭癌患者の血清中のIgA抗体の検出。
【図8A】重複する12量体ペプチドによるPEPSCAN技術を用いた、BMRF1によってコードされるEBV EA(D)P47−54上でのEBV.OT13N及びEBV.OT14Eの結合ドメインの同定。
【図8B】EBV.OT13N及びEBV.OT14Eによるイムノブロット染色。M=分子量マーカー。VCA=ウイルス構造タンパク質の発現のために誘導されたHH514細胞の核抽出物。EA=ウイルスDNA複製をPAAで阻止してEAタンパク質の発現のために誘導されたHH514細胞の核抽出物。X50/7=潜伏期EBV遺伝子のみを発現するX50/7細胞の核抽出物。BJAB=EBV陰性バーキットリンパ腫細胞系BJABの核抽出物。
【図9A】重複する12量体ペプチドによるPEPSCAN技術を用いた、BALF2によってコードされるEBV EA(D)P138上でのEBV.OT13Bの結合ドメインの同定。
【図9B】EBV.OT13Bによるイムノブロット染色。M=分子量マーカー。VCA=ウイルス構造タンパク質の発現のために誘導されたHH514細胞の核抽出物。EA=ウイルスDNA複製をPAAで阻止してEAタンパク質の発現のために誘導されたHH514細胞の核抽出物。X50/7=潜伏期EBV遺伝子のみを発現するX50/7細胞の核抽出物。BJAB=EBV陰性バーキットリンパ腫細胞系BJABの核抽出物。
【図9C】重複する12量体ペプチドによるPEPSCAN技術を用いた、BALF2によってコードされるEBV EA(D)P138上でのEBV.OT13Dの結合ドメインの同定。
【図9D】EBV.OT13Dによるイムノブロット染色。M=分子量マーカー。VCA=ウイルス構造タンパク質の発現のために誘導されたHH514細胞の核抽出物。EA=ウイルスDNA複製をPAAで阻止してEAタンパク質の発現のために誘導されたHH514細胞の核抽出物。X50/7=潜伏期EBV遺伝子のみを発現するX50/7細胞の核抽出物。BJAB=EBV陰性バーキットリンパ腫細胞系BJABの核抽出物。
【特許請求の範囲】
【請求項1】
エプスタイン−バールウイルスに対する抗体と免疫化学的に反応する、EA−p47−54タンパク質の少なくとも一部を含むペプチドであって、配列番号1、2、4または5に示したアミノ酸配列の少なくとも一部を含むことを特徴とするペプチド。
【請求項2】
エプスタイン−バールウイルスに対する抗体と免疫化学的に反応する、EA−p47−54タンパク質の少なくとも一部を含むペプチドであって、配列番号5に示したアミノ酸配列の少なくとも一部と連結された、配列番号4に示したアミノ酸配列の少なくとも一部を含むことを特徴とするペプチド。
【請求項3】
配列番号6に示したアミノ酸配列の少なくとも一部を含むことを特徴とする請求項2に記載のペプチド。
【請求項4】
エプスタイン−バールウイルスに対する抗体と免疫化学的に反応する、EA−p138タンパク質の少なくとも一部を含むペプチドであって、配列番号7、8、9または10に示したアミノ酸配列の少なくとも一部を含むことを特徴とするペプチド。
【請求項5】
請求項1から4のいずれか1項に記載のペプチドをコードする核酸配列。
【請求項6】
請求項5に記載の核酸配列を含む組み換えベクター分子。
【請求項7】
請求項6に記載の組み換えベクターで形質転換またはトランスフェクトされた宿主細胞。
【請求項8】
請求項1から4のいずれか1項に記載のペプチドに対する抗体。
【請求項9】
モノクローナル抗体であることを特徴とする請求項8に記載の抗体。
【請求項10】
EBV−EA p47−54タンパク質のエピトープに結合するモノクローナル抗体であって、前記エピトープはthe European Collection of Animal Cell Cultrue(ECACC), Porton Down(UK)に受託番号第95051622号及び同第95051621号の下にそれぞれ寄託された、ハイブリドーマ細胞系によって産生されるモノクローナル抗体EBV.OT14EまたはEBV.OT13Nによって認識されることを特徴とするモノクローナル抗体。
【請求項11】
EBV−EA p138タンパク質のエピトープに結合するモノクローナル抗体であって、前記エピトープはthe European Collection of Animal Cell Cultrue(ECACC), Porton Down(UK)に受託番号第95051619号及び同第95051620号の下にそれぞれ寄託された、ハイブリドーマ細胞系によって産生されるモノクローナル抗体EBV.OT13BまたはEBV.OT13Dによって認識されることを特徴とするモノクローナル抗体。
【請求項12】
請求項10または11に記載のモノクローナル抗体を産生し得る不死化細胞系。
【請求項13】
the European Collection of Animal Cell Cultrue(ECACC), Porton Down(UK)に受託番号第95051619号、同第95051620号、同第95051621号または同第95051622号の下に寄託された不死化細胞系。
【請求項14】
請求項1から4に記載のペプチドのうちの1種以上を含有する免疫化学試薬。
【請求項15】
請求項8から11のいずれか1項に記載の抗体を含有する免疫化学試薬。
【請求項16】
試料中のエプスタイン−バールウイルスを検出する方法であって、試料を請求項8から11のいずれか1項に記載の抗体と接触させ、その後形成された免疫複合体の存在を検出することを含む方法。
【請求項17】
試験液体中の抗エプスタイン−バールウイルス抗体を検出する方法であって、請求項14に記載の免疫化学試薬を試験液体と接触させ、試験液体中に形成された免疫複合体の存在を検出することを特徴とする方法。
【請求項18】
試験液体中のエプスタイン−バールウイルスを検出する方法であって、請求項14に記載の免疫化学試薬を試験液体と接触させ、これに抗エプスタイン−バールウイルス抗体を接触させ、形成された免疫複合体の存在を検出することを特徴とする方法。
【請求項19】
請求項16から18のいずれか1項に記載の方法を実施するための試験キット。
【請求項1】
エプスタイン−バールウイルスに対する抗体と免疫化学的に反応する、EA−p47−54タンパク質の少なくとも一部を含むペプチドであって、配列番号1、2、4または5に示したアミノ酸配列の少なくとも一部を含むことを特徴とするペプチド。
【請求項2】
エプスタイン−バールウイルスに対する抗体と免疫化学的に反応する、EA−p47−54タンパク質の少なくとも一部を含むペプチドであって、配列番号5に示したアミノ酸配列の少なくとも一部と連結された、配列番号4に示したアミノ酸配列の少なくとも一部を含むことを特徴とするペプチド。
【請求項3】
配列番号6に示したアミノ酸配列の少なくとも一部を含むことを特徴とする請求項2に記載のペプチド。
【請求項4】
エプスタイン−バールウイルスに対する抗体と免疫化学的に反応する、EA−p138タンパク質の少なくとも一部を含むペプチドであって、配列番号7、8、9または10に示したアミノ酸配列の少なくとも一部を含むことを特徴とするペプチド。
【請求項5】
請求項1から4のいずれか1項に記載のペプチドをコードする核酸配列。
【請求項6】
請求項5に記載の核酸配列を含む組み換えベクター分子。
【請求項7】
請求項6に記載の組み換えベクターで形質転換またはトランスフェクトされた宿主細胞。
【請求項8】
請求項1から4のいずれか1項に記載のペプチドに対する抗体。
【請求項9】
モノクローナル抗体であることを特徴とする請求項8に記載の抗体。
【請求項10】
EBV−EA p47−54タンパク質のエピトープに結合するモノクローナル抗体であって、前記エピトープはthe European Collection of Animal Cell Cultrue(ECACC), Porton Down(UK)に受託番号第95051622号及び同第95051621号の下にそれぞれ寄託された、ハイブリドーマ細胞系によって産生されるモノクローナル抗体EBV.OT14EまたはEBV.OT13Nによって認識されることを特徴とするモノクローナル抗体。
【請求項11】
EBV−EA p138タンパク質のエピトープに結合するモノクローナル抗体であって、前記エピトープはthe European Collection of Animal Cell Cultrue(ECACC), Porton Down(UK)に受託番号第95051619号及び同第95051620号の下にそれぞれ寄託された、ハイブリドーマ細胞系によって産生されるモノクローナル抗体EBV.OT13BまたはEBV.OT13Dによって認識されることを特徴とするモノクローナル抗体。
【請求項12】
請求項10または11に記載のモノクローナル抗体を産生し得る不死化細胞系。
【請求項13】
the European Collection of Animal Cell Cultrue(ECACC), Porton Down(UK)に受託番号第95051619号、同第95051620号、同第95051621号または同第95051622号の下に寄託された不死化細胞系。
【請求項14】
請求項1から4に記載のペプチドのうちの1種以上を含有する免疫化学試薬。
【請求項15】
請求項8から11のいずれか1項に記載の抗体を含有する免疫化学試薬。
【請求項16】
試料中のエプスタイン−バールウイルスを検出する方法であって、試料を請求項8から11のいずれか1項に記載の抗体と接触させ、その後形成された免疫複合体の存在を検出することを含む方法。
【請求項17】
試験液体中の抗エプスタイン−バールウイルス抗体を検出する方法であって、請求項14に記載の免疫化学試薬を試験液体と接触させ、試験液体中に形成された免疫複合体の存在を検出することを特徴とする方法。
【請求項18】
試験液体中のエプスタイン−バールウイルスを検出する方法であって、請求項14に記載の免疫化学試薬を試験液体と接触させ、これに抗エプスタイン−バールウイルス抗体を接触させ、形成された免疫複合体の存在を検出することを特徴とする方法。
【請求項19】
請求項16から18のいずれか1項に記載の方法を実施するための試験キット。
【図1】


【図2】


【図3】


【図4A】


【図4B】


【図5】


【図6A】


【図6B】


【図7A】


【図7B】


【図7C】


【図8A】


【図8B】


【図9A】


【図9B】


【図9C】


【図9D】




【図2】


【図3】


【図4A】


【図4B】


【図5】


【図6A】


【図6B】


【図7A】


【図7B】


【図7C】


【図8A】


【図8B】


【図9A】


【図9B】


【図9C】


【図9D】


【公開番号】特開2008−188017(P2008−188017A)
【公開日】平成20年8月21日(2008.8.21)
【国際特許分類】
【出願番号】特願2008−60578(P2008−60578)
【出願日】平成20年3月11日(2008.3.11)
【分割の表示】特願平8−144537の分割
【原出願日】平成8年6月6日(1996.6.6)
【出願人】(394010986)アクゾ・ノベル・エヌ・ベー (31)
【Fターム(参考)】
【公開日】平成20年8月21日(2008.8.21)
【国際特許分類】
【出願日】平成20年3月11日(2008.3.11)
【分割の表示】特願平8−144537の分割
【原出願日】平成8年6月6日(1996.6.6)
【出願人】(394010986)アクゾ・ノベル・エヌ・ベー (31)
【Fターム(参考)】
[ Back to top ]

