エラスチン由来ペプチドの製造方法、及びエラスチン由来ペプチド
【課題】エラスチンを、酵素的に分解して得られるエラスチン由来ペプチドの収量を向上させる方法の提供。
【解決手段】エラスチンを含有する肉を細断してアルカリ分解したのち、濾過により不溶物を回収し、この不溶物にサーモリシンとパパインを添加してエラスチンを分解する、エラスチン由来ペプチドの製造方法。エラスチンを含有する肉として、マグロの心臓動脈球を使用する。不溶物にサーモリシンとパパインを添加した後、65℃〜70℃で加熱し、次いで80℃で加熱する。
【解決手段】エラスチンを含有する肉を細断してアルカリ分解したのち、濾過により不溶物を回収し、この不溶物にサーモリシンとパパインを添加してエラスチンを分解する、エラスチン由来ペプチドの製造方法。エラスチンを含有する肉として、マグロの心臓動脈球を使用する。不溶物にサーモリシンとパパインを添加した後、65℃〜70℃で加熱し、次いで80℃で加熱する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、エラスチンからペプチドを製造する方法に関し、特に酵素によりエラスチンを分解するエラスチン由来ペプチドの製造方法、及びエラスチン由来ペプチドに関する。
【背景技術】
【0002】
エラスチンは、動脈、腱、皮膚などの生体内における伸縮性に富む組織に存在する繊維状タンパク質である。コラーゲンとともに細胞外部においてゲル状の細胞外マトリックスを形成している。コラーゲンが規則正しい三本鎖らせんを形成し、長くて丈夫な構造であるのに対し、エラスチンは、はっきりした構造をもたず、架橋をつくって結びつき、ゴムに似た弾性繊維を形成する。
このようなエラスチンの弾性により、皮膚などの組織は柔軟に伸縮することができるようになっている。
【0003】
また、このようなエラスチンを分解して得られるエラスチン由来のペプチドには、皮下領域において毛細血管静脈の集中度を増加させ、また内皮細胞密度を増加させる機能があるとの報告があり(特許文献1の段落0028)、皮膚外用剤としての有効利用が提案されている。
【0004】
また、エラスチン由来ペプチドには、デスモシン、イソデスモシンという他のタンパク質には、ほとんど見られない特有のアミノ酸が含まれていることから、これを含有するペプチドによる生理活性効果等が期待されている。
さらに、このような特有の効能や特徴的なアミノ酸を含有しているエラスチンを、食品として利用することも期待されている。
このような状況において、エラスチン由来ペプチドを効率的に生産する技術の開発が求められている。
【0005】
一方、エラスチンは、マグロなどの魚肉の心臓動脈球に多く含まれていることが知られているが、心臓動脈球は、魚肉全体においてごくわずかな量しか含まれておらず、キハダマグロの場合で、0.027%(270ppm)程度しか含まれていないと言われている。
また、エラスチンは、この心臓動脈球から数%しか精製できないことから、その収量を向上させる技術は、極めて有効なものである。
【0006】
また、エラスチンは、溶けにくいタンパク質であることでも知られている。このため、エラスチンは、一般に熱アルカリ抽出法を用いて、エラスチンを含有する肉からエラスチン以外のタンパク質を分解除去することで、精製することが可能である。
そして、精製したエラスチンをさらに分解してエラスチンペプチドを得る場合、エラスチンをシュウ酸又はアルカリエタノールを用いて分解することなどが行われている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特表2002−506041号公報
【特許文献2】特開2008−74846号公報
【特許文献3】特開2003−300821号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、エラスチン由来ペプチドを食品に利用する場合、その食品の製造工程においては、できるだけ穏やかな処理によりエラスチンを分解することが好ましく、シュウ酸やアルカリエタノールを用いるよりも、タンパク質分解酵素を使用して、より食品に適した条件により、酵素的に分解することが望ましい。
【0009】
しかし、従来、酵素によりエラスチンを分解して得られたエラスチン由来ペプチドの収量は、原料に対して非常に少なく、その収量を増加させることが期待されている。
そこで、本発明者らは、エラスチンをより効率的に分解可能な酵素を探索するとともに、適切な反応条件を見出すべく鋭意研究を行った結果、パパインとサーモリシンを組み合わせて用いることで、エラスチンの分解効率を向上させることに成功した。
【0010】
ここで、特許文献1には、エラスチンをサーモリシンにより分解して、エラスチン由来ペプチドを得ることが記載されている(段落0005参照)。また、特許文献2には、エラスチンをパパインにより分解して、エラスチン由来ペプチドを得ることが記載されている(段落0015参照)。
しかしながら、これらのいずれの特許文献にもサーモリシンとパパインを組み合わせることで、それぞれを単独で使用するよりもエラスチンを効率的に分解できることについては、記載も示唆もされていない。
【0011】
一方、特許文献3には、エラスチンとともに、サーモリシンとパパインについても記載されている(段落0001,0012参照)。
しかしながら、本文献では、これらの酵素によりエラスチンを分解することは記載されておらず、貝肉におけるタンパク質をサーモリシンやパパインにより分解して除去し、得られた酸性ムコ多糖にエラスチンを添加して、皮膚外用剤とする構成が開示されているにすぎない。
【0012】
このように、サーモリシン及びパパインを組み合わせることで、エラスチンの分解効率を向上させることについては、いずれの先行技術文献にも記載も示唆もされておらず、またその他の文献にもこれについて記載のあるものは見いだせなかった。
【0013】
本発明は、上記事情に鑑みなされたものであり、不溶性のエラスチンを、サーモリシンとパパインを組み合わせることで、より効率的に分解し、エラスチン由来ペプチドの収量を向上させることが可能なエラスチン由来ペプチドの製造方法、及びエラスチン由来ペプチドを提供することを目的とする。
【課題を解決するための手段】
【0014】
本発明のエラスチン由来ペプチドの製造方法は、エラスチンを含有する肉を細断してアルカリ分解したのち、濾過により不溶物を回収し、この不溶物にサーモリシンとパパインを添加してエラスチンを分解する方法としてある。
また、本発明のエラスチン由来ペプチドは、エラスチンを含有する肉を粉砕してアルカリ分解したのち、濾過により回収された不溶物をサーモリシンとパパインにより分解してなる構成としてある。
【発明の効果】
【0015】
本発明によれば、不溶性のエラスチンに対して、サーモリシンとパパインを組み合わせて添加することで、エラスチンの分解効率を向上させることができ、エラスチン由来ペプチドの収量を増加させることが可能となる。
【図面の簡単な説明】
【0016】
【図1】本発明の実施形態におけるエラスチン由来ペプチドの製造方法を示す概略工程図である。
【図2】本発明の実施形態におけるエラスチン由来ペプチドの製造方法により製造されたエラスチン由来ペプチドのアミノ酸組成を示す図である。
【図3】サーモリシン及びパパインと、その他の酵素によるエラスチン由来ペプチドの収量を示す図である。
【図4】反応温度がエラスチン由来ペプチドの収量に及ぼす影響を示す図である。
【図5】酵素の比率がエラスチン由来ペプチドの収量に及ぼす影響を示す図である。
【図6】酵素添加量と反応温度の比率がエラスチン由来ペプチドの収量に及ぼす影響を示す図である。
【図7】反応時間がエラスチン由来ペプチドの収量に及ぼす影響を示す図である。
【図8】二段階加熱による反応時間がエラスチン由来ペプチドの収量に及ぼす影響を示す図である。
【発明を実施するための形態】
【0017】
以下、本発明の実施形態について具体的に説明する。
(エラスチンを含有する肉)
本実施形態で使用するエラスチンを含有する肉としては、魚肉や哺乳動物、鳥類等の各種生物の肉を用いることができ、特に限定されるものではないが、エラスチンを多く含有するマグロの心臓動脈球を好適に使用することができる。
上記の通り、キハダマグロ一匹において、心臓動脈球は、全重量の約0.027重量%(270ppm)含まれている。
【0018】
(サーモリシン)
サーモリシンは、耐熱性のタンパク質分解酵素である。このサーモリシンとしては、例えば大和化成株式会社製のサモアーゼ(R)PC10Fを用いることができる。
このサモアーゼ(R)は、高温細菌性の一種(Bacillus stearothermophilus (Bacillus thermoproteolyticus Rokko))由来のエンド型プロテアーゼであり、優れた耐熱性を備えており、至適温度は65℃〜70℃、至適pHは7.0〜8.5である。
【0019】
(パパイン)
パパインは、耐熱性のタンパク質分解酵素であり、サーモリシンよりもさらに高い至適温度を有している。このパパインとしては、例えば天野エンザイム株式会社製のパパインW-40を用いることができる。
このパパインは、Carica papaya L.から抽出されたものであり、至適温度は80℃、至適pHは微酸性〜中性である。
【0020】
(製造方法)
次に、本発明のエラスチン由来ペプチドの製造方法について、図1を参照して説明する。同図は、本実施形態のエラスチン由来ペプチドの製造方法を示す概略工程図である。なお、本発明は、以下の製造方法に限定されるものではなく、サーモリシンとパパインを使用してエラスチンを分解するものであれば良い。
【0021】
(1)粉砕工程
マグロの心臓動脈球を、ミンサーを用いて細断する。ダイスは直径4.8mmのものを好適に使用することができる。
【0022】
(2)熱アルカリ分解工程
得られたマグロの心臓動脈球のミンチに対して、3倍の重量の0.1N NaOH水溶液を加えて、80℃で1時間加熱する。これによって、エラスチン以外のタンパク質を溶解させる。
その後、NaOHと等mol数のクエン酸を添加して中和させる。
【0023】
(3)濾過工程
次に、30メッシュ網で濾過し、エラスチンが含まれる不溶物を回収する。さらに、この不溶物を3回水洗いし、再度30メッシュ網で濾過して、その不溶物を回収する。
【0024】
(4)エラスチン分解工程
次に、回収された不溶物の3倍の重量の水を添加し、サーモリシンとパパインを合わせて、原料の心臓動脈球の重量に対して1.0重量%添加する。このとき、サーモリシンとパパインの割合は特に限定されるものではないが、原料の心臓動脈球の重量に対して、サーモリシンを0.25重量%〜0.75重量%にするとともに、パパインを0.75重量%〜0.25重量%とする場合に、好適にエラスチンを分解することができる。例えば、サーモリシンとパパインを、それぞれ0.5重量%ずつにすることができる。
また、サーモリシン及びパパインを合わせた添加量は、1.0重量%に限定されるものではなく、0.1重量%以上であれば、エラスチンを好適に分解することができる。
【0025】
次に、回収された不溶物に対して3倍量の水とサーモリシン及びパパインを添加した混合液を、65℃〜70℃で1〜5時間加熱し(第一段階の加熱)、次いで80℃で1〜4時間加熱することが好ましい(第二段階の加熱)。特に、65℃〜70℃で3〜5時間加熱した後に、次いで80℃で4時間加熱することが好ましい。
このとき、混合液のpHは、微酸性〜中性であることが好ましい。本実施形態では、熱アルカリ分解工程における中和処理により、混合液のpHは、微酸性〜中性に維持されている。
【0026】
次に、第二段階の加熱が終了して得られた溶液を、90℃で20分間加熱し、サーモリシンとパパインを失活させる。
【0027】
(5)後処理工程
次に、ミンチの重量に対して0.5重量%の珪藻土を添加して攪拌することで、不溶物を凝集させ、溶液の上清を回収することで、不純物を除去する。
さらに、その上清の固形量の10重量%になるように、活性炭素を添加して、常温で1時間静置し、脱臭脱色を行う。
次いで、珪藻土を用いて、濾過を行う。
そして、殺菌処理を行った後、濃縮してスプレードライにより乾燥させ、エラスチン由来ペプチド粉末を得る。
【0028】
このようなエラスチン由来ペプチド粉末は、食品の成分として、好適に用いることが可能である。そのほか、当該エラスチン由来ペプチドを、食品以外の成分として、例えば飲料や、化粧品、皮膚外用剤、その他各種医薬品などの成分として使用することも可能である。
【0029】
図2は、以上のような本実施形態のエラスチン由来ペプチドの製造方法を用いて、キハダマグロの心臓動脈球におけるエラスチンを分解して得られたエラスチン由来ペプチドのアミノ酸組成を示す図である。
同図に示すように、本実施形態の製造方法によりキハダマグロの心臓動脈球からエラスチン由来ペプチドを得た場合、そのアミノ酸組成は、アスパラギン酸2.07mol%、トレオニン6.98mol%、セリン2.90mol%、グルタミン酸3.56mol%、グリシン44.36mol%、アラニン8.34mol%、バリン6.88mol%、1/2−シスチン0.10mol%、メチオニン0.07mol%、イソロイシン1.37mol%、ロイシン3.56mol%、チロシン2.78mol%、フェニルアラニン2.31mol%、ヒスチジン0.40mol%、リジン1.06mol%、イソデスモシン0.06mol%、デスモシン0.04mol%、アルギニン2.23mol%、ヒドロキシプロリン0.65mol%、プロリン10.25mol%となっている。エラスチンに特異的に含まれるアミノ酸であるデスモシン、イソデスモシンを含むことから本ペプチドがエラスチンに由来しているということが分かる。
ただし、本実施形態のエラスチン由来ペプチドは、このアミノ酸組成のものに限定されるものではない。すなわち、本実施形態のエラスチン由来ペプチドの製造方法を使用して、その他のマグロや他の動物等からエラスチン由来ペプチドを製造した場合には、その生物に特徴的なアミノ酸組成が示されるものと考えられる。
【実施例】
【0030】
以下、酵素の種類や反応条件がエラスチン由来ペプチドの収量に及ぼす影響を検証するために行った実施例及び比較例について説明する。
<実験1.酵素の種類がエラスチン由来ペプチドの収量に及ぼす影響>
(実施例1)
キハダマグロから取り出した心臓動脈球266gを、ミンサー(ダイスの直径4.8mm)を用いて細断した。得られたミンチに対して、3倍量の0.1N水酸化ナトリウム水溶液(800ml)を加え、80℃で1時間加熱して、エラスチン以外のタンパク質を分解した。そして、NaOHと等mol数のクエン酸(15.4g)を添加して中和させた。
【0031】
次いで、溶液を30メッシュ網で濾過し、エラスチンが含まれる不溶物を回収し、不溶物を3回水洗いした後、再度30メッシュ網で濾過して、その不溶物を回収した。
この不溶物を水洗して、サンプルミルによりホモジナイズした結果、精製したエラスチンの粉砕物206gが得られた。
【0032】
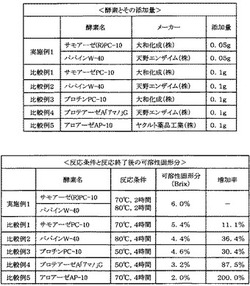
次に、この精製したエラスチンのうち10gに対して1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、図3に示すように、サーモリシン(サモアーゼ(R)PC-10:大和化成株式会社製。以下の実施例及び比較例において同様。)0.05gと、パパイン(パパインW-40:天野エンザイム株式会社製。以下の実施例及び比較例において同様。)0.05gとを添加した。
【0033】
そして、この混合液を70℃で2時間加熱した後、次いで80℃で2時間加熱した。
得られた溶液に対して、可溶性固形分(Brix)を測定した結果、6.0%であった。このうち、1.0%は、添加した酵素(0.1g)とリン酸緩衝液とによるものであり、残り(実施例1では5.0%)が、溶液中に含まれるエラスチン由来ペプチド量を示している。これは、以下の実施例及び比較例でも同様である。
【0034】
(比較例1)
精製したエラスチン10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、図3に示すように、サーモリシンを0.1g添加し、70℃で4時間加熱した点以外は、実施例1と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、5.4%であった。
【0035】
(比較例2)
精製したエラスチン10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、図3に示すように、パパインを0.1g添加し、80℃で4時間加熱した点以外は、実施例1と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、4.4%であった。
【0036】
(比較例3)
精製したエラスチン10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、図3に示すように、プロチンPC-10(大和化成株式会社製)を0.1g添加し、50℃で4時間加熱した点以外は、実施例1と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、4.6%であった。
【0037】
(比較例4)
精製したエラスチン10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、図3に示すように、プロテアーゼA「アマノ」G(天野エンザイム株式会社製)を0.1g添加し、50℃で4時間加熱した点以外は、実施例1と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、3.2%であった。
【0038】
(比較例5)
精製したエラスチン10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、図3に示すように、アロアーゼAP-10(ヤクルト製薬工業株式会社製)を0.1g添加し、70℃で4時間加熱した点以外は、実施例1と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、2.0%であった。
【0039】
実施例1は、比較例1〜5に対して、エラスチン由来ペプチドの収量が、それぞれ約11%,36%,30%,88%,200%増加している。
ここで、サーモリシンを単独で使用した場合と、パパインと併用した場合とでは、収量の差は約11%であるが、エラスチン由来ペプチドの場合、この差は非常に大きい。
すなわち、上述したように、キハダマグロを原料にした場合、エラスチンを多く含む心臓動脈球は、およそ0.027重量%しか得られず、抽出されたエラスチンは、希少なものである(現在1kg当たり十数万円で取引されている)。したがって、さらにこれを分解して得られるエラスチン由来ペプチドもまた大変希少であり、約11%の収量の差は、当該分野では非常に大きなものである。
【0040】
<実験2.反応温度がエラスチン由来ペプチドの収量に及ぼす影響>
(実施例2)
実施例1と同様にして、新たに精製したエラスチンを得た。この精製したエラスチンのうち10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、図4に示すように、サーモリシン0.05gと、パパイン0.05gとを添加した。
そして、実施例1と同様に、この混合液を70℃で2時間加熱した後、次いで80℃で2時間加熱した。
得られた溶液に対して、可溶性固形分(Brix)を測定した結果、7.0%であった。なお、本実施例は、実施例1と同条件であるが、可溶性固形分(Brix)の測定結果が異なっているのは、キハダマグロから取り出した心臓動脈球の水分含有量が一定していないからである。このため、可溶性固形分(Brix)による測定結果は、各実験内において相対的に比較するために使用する。
【0041】
(実施例3)
サーモリシンとパパインを添加した混合液を60℃で4時間加熱した点以外は、実施例2と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、6.6%であった。
【0042】
(実施例4)
サーモリシンとパパインを添加した混合液を70℃で4時間加熱した点以外は、実施例2と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、7.0%であった。
【0043】
(実施例5)
サーモリシンとパパインを添加した混合液を80℃で4時間加熱した点以外は、実施例2と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、7.0%であった。
【0044】
実施例2〜5において示される通り、加熱時間を全体で4時間とした場合には、加熱温度がサーモリシン及びパパインの至適温度ではない実施例3では、エラスチン由来ペプチドの収量は相対的に少なかったが、加熱温度がサーモリシン及び/又はパパインの至適温度であるその他の実施例では、エラスチン由来ペプチドの収量に差は見られなかった。
【0045】
<実験3.酵素の比率がエラスチン由来ペプチドの収量に及ぼす影響>
(実施例6)
実施例1と同様にして、新たに精製したエラスチンを得た。この精製したエラスチンのうち10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、図5に示すように、サーモリシン0.025gと、パパイン0.075gとを添加した。
そして、実施例1と同様に、この混合液を70℃で2時間加熱した後、次いで80℃で2時間加熱した。
得られた溶液に対して、可溶性固形分(Brix)を測定した結果、7.2%であった。
【0046】
(実施例7)
サーモリシンとパパインを、それぞれ0.05gずつ添加した点以外は、実施例6と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、7.0%であった。
【0047】
(実施例8)
サーモリシンを0.075g、及びパパインを0.025g添加した点以外は、実施例6と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、7.0%であった。
【0048】
サーモリシンとパパインの添加比率を、実施例6〜8のように、原料の心臓動脈球の重量に対して、サーモリシン0.25重量%〜0.75重量%、パパイン0.75重量%〜0.25重量%の範囲で変えても、エラスチン由来ペプチドの収量にほとんど差は見られなかった。
【0049】
<実験4.反応温度の比率がエラスチン由来ペプチドの収量に及ぼす影響>
(実施例9)
実施例1と同様にして、新たに精製したエラスチンを得た。この精製したエラスチンのうち10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、図6に示すように、サーモリシン0.05gと、パパイン0.05gとを添加した。
そして、この混合液を80℃で8時間加熱した。
得られた溶液に対して、可溶性固形分(Brix)を測定した結果、8.4%であった。
【0050】
(実施例10)
サーモリシンとパパインを添加した混合液を70℃で2時間加熱した後、次いで80℃で6時間加熱した点以外は、実施例9と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、8.6%であった。
【0051】
(実施例11)
サーモリシンとパパインを添加した混合液を70℃で4時間加熱した後、次いで80℃で4時間加熱した点以外は、実施例9と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、9.0%であった。
【0052】
(実施例12)
サーモリシンとパパインを添加した混合液を70℃で6時間加熱した後、次いで80℃で2時間加熱した点以外は、実施例9と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、8.2%であった。
【0053】
(実施例13)
サーモリシンとパパインを添加した混合液を70℃で8時間加熱した点以外は、実施例9と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、7.6%であった。
【0054】
上述した実験2では、反応時間が4時間の場合、加熱温度条件によりエラスチン由来ペプチドの収量に差は見られなかったが、反応時間をより長くした結果、まずサーモリシンの至適温度内である70℃で反応させた後、次いでパパインの至適温度である80℃で反応させることで、エラスチンがより効率的に分解されることが明らかとなった。
【0055】
<実験5.反応時間がエラスチン由来ペプチドの収量に及ぼす影響>
(実施例14)
実施例1と同様にして、新たに精製したエラスチンを得た。この精製したエラスチンのうち10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、サーモリシン0.05gと、パパイン0.05gとを添加した。
そして、この混合液を70℃で7時間加熱し、1時間ごとに溶液の可溶性固形分(Brix)を測定した。その結果を図7に示す。
同図に示すように、反応開始から1時間目までは、可溶性固形分は急激に増加し、その後は緩やかに上昇した。また、5時間以上反応させても可溶性固形分は増えなかった。このことから、酵素を十分に添加して反応温度を70℃とした場合、反応時間は1時間以上5時間以下とすることが適切であることがわかる。
【0056】
<実験6.二段階加熱による反応時間がエラスチン由来ペプチドの収量に及ぼす影響>
(実施例15)
実施例1と同様にして、新たに精製したエラスチンを得た。この精製したエラスチンのうち10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、サーモリシン0.05gと、パパイン0.05gとを添加した。
そして、この混合液を70℃で3時間加熱した後、次いで80℃で5時間加熱し、1時間ごとに溶液の可溶性固形分(Brix)を測定した。その結果を図8に示す。
【0057】
同図に示すように、70℃で3時間加熱した後、80℃に温度を上げた場合、可溶性固形分は反応開始から1時間目まで急激に増加した後は緩やかに上昇した。また、80℃での最初の1時間(3時間目〜4時間目)にやや大きく増加した後、4時間目までは緩やかに増加し、4時間以上反応させても増加は見られなかった。
このことから、酵素を十分に添加して70℃で3時間加熱した後、80℃に温度を上げた場合は、80℃での加熱時間は1時間以上4時間以下とすることが適切であると考えられる。
【0058】
以上の実験結果から、サーモリシンとパパインを組み合わせて用いることで、エラスチンの分解効率をより向上させ得ることが明らかとなった。すなわち、これらをそれぞれ単独で使用する場合と比較して、サーモリシンのみの場合に対して約11%、パパインのみの場合に対して約36%の収量の向上が見られた。
また、実施例14では、収量が急激に増加した後の反応1時間目の可溶性固形分が6.8%であるのに対して、可溶性固形分の増加が停止した反応5時間目の可溶性固形分は8.2%であり、この間の収量の増加は、約21%となっている。
これに対して、実施例15では、収量が急激に増加した後の反応1時間目の可溶性固形分が6.0%であるのに対して、反応7時間目(80℃で3時間目)の可溶性固形分は8.8%であり、この間の収量を約42%増加させることができている。
このように、70℃のみの場合では5時間で可溶性固形分の増加が停止したのに対し、70℃と80℃の二段階で反応させることによって、7時間に亘って可溶性固形分を増加させることができ、その分エラスチン由来ペプチドの収量を大きく増加させることが可能となっている。
【産業上の利用可能性】
【0059】
本発明は、食品の成分等として利用するためのエラスチン由来ペプチドの製造において好適に利用することが可能である。
【技術分野】
【0001】
本発明は、エラスチンからペプチドを製造する方法に関し、特に酵素によりエラスチンを分解するエラスチン由来ペプチドの製造方法、及びエラスチン由来ペプチドに関する。
【背景技術】
【0002】
エラスチンは、動脈、腱、皮膚などの生体内における伸縮性に富む組織に存在する繊維状タンパク質である。コラーゲンとともに細胞外部においてゲル状の細胞外マトリックスを形成している。コラーゲンが規則正しい三本鎖らせんを形成し、長くて丈夫な構造であるのに対し、エラスチンは、はっきりした構造をもたず、架橋をつくって結びつき、ゴムに似た弾性繊維を形成する。
このようなエラスチンの弾性により、皮膚などの組織は柔軟に伸縮することができるようになっている。
【0003】
また、このようなエラスチンを分解して得られるエラスチン由来のペプチドには、皮下領域において毛細血管静脈の集中度を増加させ、また内皮細胞密度を増加させる機能があるとの報告があり(特許文献1の段落0028)、皮膚外用剤としての有効利用が提案されている。
【0004】
また、エラスチン由来ペプチドには、デスモシン、イソデスモシンという他のタンパク質には、ほとんど見られない特有のアミノ酸が含まれていることから、これを含有するペプチドによる生理活性効果等が期待されている。
さらに、このような特有の効能や特徴的なアミノ酸を含有しているエラスチンを、食品として利用することも期待されている。
このような状況において、エラスチン由来ペプチドを効率的に生産する技術の開発が求められている。
【0005】
一方、エラスチンは、マグロなどの魚肉の心臓動脈球に多く含まれていることが知られているが、心臓動脈球は、魚肉全体においてごくわずかな量しか含まれておらず、キハダマグロの場合で、0.027%(270ppm)程度しか含まれていないと言われている。
また、エラスチンは、この心臓動脈球から数%しか精製できないことから、その収量を向上させる技術は、極めて有効なものである。
【0006】
また、エラスチンは、溶けにくいタンパク質であることでも知られている。このため、エラスチンは、一般に熱アルカリ抽出法を用いて、エラスチンを含有する肉からエラスチン以外のタンパク質を分解除去することで、精製することが可能である。
そして、精製したエラスチンをさらに分解してエラスチンペプチドを得る場合、エラスチンをシュウ酸又はアルカリエタノールを用いて分解することなどが行われている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特表2002−506041号公報
【特許文献2】特開2008−74846号公報
【特許文献3】特開2003−300821号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、エラスチン由来ペプチドを食品に利用する場合、その食品の製造工程においては、できるだけ穏やかな処理によりエラスチンを分解することが好ましく、シュウ酸やアルカリエタノールを用いるよりも、タンパク質分解酵素を使用して、より食品に適した条件により、酵素的に分解することが望ましい。
【0009】
しかし、従来、酵素によりエラスチンを分解して得られたエラスチン由来ペプチドの収量は、原料に対して非常に少なく、その収量を増加させることが期待されている。
そこで、本発明者らは、エラスチンをより効率的に分解可能な酵素を探索するとともに、適切な反応条件を見出すべく鋭意研究を行った結果、パパインとサーモリシンを組み合わせて用いることで、エラスチンの分解効率を向上させることに成功した。
【0010】
ここで、特許文献1には、エラスチンをサーモリシンにより分解して、エラスチン由来ペプチドを得ることが記載されている(段落0005参照)。また、特許文献2には、エラスチンをパパインにより分解して、エラスチン由来ペプチドを得ることが記載されている(段落0015参照)。
しかしながら、これらのいずれの特許文献にもサーモリシンとパパインを組み合わせることで、それぞれを単独で使用するよりもエラスチンを効率的に分解できることについては、記載も示唆もされていない。
【0011】
一方、特許文献3には、エラスチンとともに、サーモリシンとパパインについても記載されている(段落0001,0012参照)。
しかしながら、本文献では、これらの酵素によりエラスチンを分解することは記載されておらず、貝肉におけるタンパク質をサーモリシンやパパインにより分解して除去し、得られた酸性ムコ多糖にエラスチンを添加して、皮膚外用剤とする構成が開示されているにすぎない。
【0012】
このように、サーモリシン及びパパインを組み合わせることで、エラスチンの分解効率を向上させることについては、いずれの先行技術文献にも記載も示唆もされておらず、またその他の文献にもこれについて記載のあるものは見いだせなかった。
【0013】
本発明は、上記事情に鑑みなされたものであり、不溶性のエラスチンを、サーモリシンとパパインを組み合わせることで、より効率的に分解し、エラスチン由来ペプチドの収量を向上させることが可能なエラスチン由来ペプチドの製造方法、及びエラスチン由来ペプチドを提供することを目的とする。
【課題を解決するための手段】
【0014】
本発明のエラスチン由来ペプチドの製造方法は、エラスチンを含有する肉を細断してアルカリ分解したのち、濾過により不溶物を回収し、この不溶物にサーモリシンとパパインを添加してエラスチンを分解する方法としてある。
また、本発明のエラスチン由来ペプチドは、エラスチンを含有する肉を粉砕してアルカリ分解したのち、濾過により回収された不溶物をサーモリシンとパパインにより分解してなる構成としてある。
【発明の効果】
【0015】
本発明によれば、不溶性のエラスチンに対して、サーモリシンとパパインを組み合わせて添加することで、エラスチンの分解効率を向上させることができ、エラスチン由来ペプチドの収量を増加させることが可能となる。
【図面の簡単な説明】
【0016】
【図1】本発明の実施形態におけるエラスチン由来ペプチドの製造方法を示す概略工程図である。
【図2】本発明の実施形態におけるエラスチン由来ペプチドの製造方法により製造されたエラスチン由来ペプチドのアミノ酸組成を示す図である。
【図3】サーモリシン及びパパインと、その他の酵素によるエラスチン由来ペプチドの収量を示す図である。
【図4】反応温度がエラスチン由来ペプチドの収量に及ぼす影響を示す図である。
【図5】酵素の比率がエラスチン由来ペプチドの収量に及ぼす影響を示す図である。
【図6】酵素添加量と反応温度の比率がエラスチン由来ペプチドの収量に及ぼす影響を示す図である。
【図7】反応時間がエラスチン由来ペプチドの収量に及ぼす影響を示す図である。
【図8】二段階加熱による反応時間がエラスチン由来ペプチドの収量に及ぼす影響を示す図である。
【発明を実施するための形態】
【0017】
以下、本発明の実施形態について具体的に説明する。
(エラスチンを含有する肉)
本実施形態で使用するエラスチンを含有する肉としては、魚肉や哺乳動物、鳥類等の各種生物の肉を用いることができ、特に限定されるものではないが、エラスチンを多く含有するマグロの心臓動脈球を好適に使用することができる。
上記の通り、キハダマグロ一匹において、心臓動脈球は、全重量の約0.027重量%(270ppm)含まれている。
【0018】
(サーモリシン)
サーモリシンは、耐熱性のタンパク質分解酵素である。このサーモリシンとしては、例えば大和化成株式会社製のサモアーゼ(R)PC10Fを用いることができる。
このサモアーゼ(R)は、高温細菌性の一種(Bacillus stearothermophilus (Bacillus thermoproteolyticus Rokko))由来のエンド型プロテアーゼであり、優れた耐熱性を備えており、至適温度は65℃〜70℃、至適pHは7.0〜8.5である。
【0019】
(パパイン)
パパインは、耐熱性のタンパク質分解酵素であり、サーモリシンよりもさらに高い至適温度を有している。このパパインとしては、例えば天野エンザイム株式会社製のパパインW-40を用いることができる。
このパパインは、Carica papaya L.から抽出されたものであり、至適温度は80℃、至適pHは微酸性〜中性である。
【0020】
(製造方法)
次に、本発明のエラスチン由来ペプチドの製造方法について、図1を参照して説明する。同図は、本実施形態のエラスチン由来ペプチドの製造方法を示す概略工程図である。なお、本発明は、以下の製造方法に限定されるものではなく、サーモリシンとパパインを使用してエラスチンを分解するものであれば良い。
【0021】
(1)粉砕工程
マグロの心臓動脈球を、ミンサーを用いて細断する。ダイスは直径4.8mmのものを好適に使用することができる。
【0022】
(2)熱アルカリ分解工程
得られたマグロの心臓動脈球のミンチに対して、3倍の重量の0.1N NaOH水溶液を加えて、80℃で1時間加熱する。これによって、エラスチン以外のタンパク質を溶解させる。
その後、NaOHと等mol数のクエン酸を添加して中和させる。
【0023】
(3)濾過工程
次に、30メッシュ網で濾過し、エラスチンが含まれる不溶物を回収する。さらに、この不溶物を3回水洗いし、再度30メッシュ網で濾過して、その不溶物を回収する。
【0024】
(4)エラスチン分解工程
次に、回収された不溶物の3倍の重量の水を添加し、サーモリシンとパパインを合わせて、原料の心臓動脈球の重量に対して1.0重量%添加する。このとき、サーモリシンとパパインの割合は特に限定されるものではないが、原料の心臓動脈球の重量に対して、サーモリシンを0.25重量%〜0.75重量%にするとともに、パパインを0.75重量%〜0.25重量%とする場合に、好適にエラスチンを分解することができる。例えば、サーモリシンとパパインを、それぞれ0.5重量%ずつにすることができる。
また、サーモリシン及びパパインを合わせた添加量は、1.0重量%に限定されるものではなく、0.1重量%以上であれば、エラスチンを好適に分解することができる。
【0025】
次に、回収された不溶物に対して3倍量の水とサーモリシン及びパパインを添加した混合液を、65℃〜70℃で1〜5時間加熱し(第一段階の加熱)、次いで80℃で1〜4時間加熱することが好ましい(第二段階の加熱)。特に、65℃〜70℃で3〜5時間加熱した後に、次いで80℃で4時間加熱することが好ましい。
このとき、混合液のpHは、微酸性〜中性であることが好ましい。本実施形態では、熱アルカリ分解工程における中和処理により、混合液のpHは、微酸性〜中性に維持されている。
【0026】
次に、第二段階の加熱が終了して得られた溶液を、90℃で20分間加熱し、サーモリシンとパパインを失活させる。
【0027】
(5)後処理工程
次に、ミンチの重量に対して0.5重量%の珪藻土を添加して攪拌することで、不溶物を凝集させ、溶液の上清を回収することで、不純物を除去する。
さらに、その上清の固形量の10重量%になるように、活性炭素を添加して、常温で1時間静置し、脱臭脱色を行う。
次いで、珪藻土を用いて、濾過を行う。
そして、殺菌処理を行った後、濃縮してスプレードライにより乾燥させ、エラスチン由来ペプチド粉末を得る。
【0028】
このようなエラスチン由来ペプチド粉末は、食品の成分として、好適に用いることが可能である。そのほか、当該エラスチン由来ペプチドを、食品以外の成分として、例えば飲料や、化粧品、皮膚外用剤、その他各種医薬品などの成分として使用することも可能である。
【0029】
図2は、以上のような本実施形態のエラスチン由来ペプチドの製造方法を用いて、キハダマグロの心臓動脈球におけるエラスチンを分解して得られたエラスチン由来ペプチドのアミノ酸組成を示す図である。
同図に示すように、本実施形態の製造方法によりキハダマグロの心臓動脈球からエラスチン由来ペプチドを得た場合、そのアミノ酸組成は、アスパラギン酸2.07mol%、トレオニン6.98mol%、セリン2.90mol%、グルタミン酸3.56mol%、グリシン44.36mol%、アラニン8.34mol%、バリン6.88mol%、1/2−シスチン0.10mol%、メチオニン0.07mol%、イソロイシン1.37mol%、ロイシン3.56mol%、チロシン2.78mol%、フェニルアラニン2.31mol%、ヒスチジン0.40mol%、リジン1.06mol%、イソデスモシン0.06mol%、デスモシン0.04mol%、アルギニン2.23mol%、ヒドロキシプロリン0.65mol%、プロリン10.25mol%となっている。エラスチンに特異的に含まれるアミノ酸であるデスモシン、イソデスモシンを含むことから本ペプチドがエラスチンに由来しているということが分かる。
ただし、本実施形態のエラスチン由来ペプチドは、このアミノ酸組成のものに限定されるものではない。すなわち、本実施形態のエラスチン由来ペプチドの製造方法を使用して、その他のマグロや他の動物等からエラスチン由来ペプチドを製造した場合には、その生物に特徴的なアミノ酸組成が示されるものと考えられる。
【実施例】
【0030】
以下、酵素の種類や反応条件がエラスチン由来ペプチドの収量に及ぼす影響を検証するために行った実施例及び比較例について説明する。
<実験1.酵素の種類がエラスチン由来ペプチドの収量に及ぼす影響>
(実施例1)
キハダマグロから取り出した心臓動脈球266gを、ミンサー(ダイスの直径4.8mm)を用いて細断した。得られたミンチに対して、3倍量の0.1N水酸化ナトリウム水溶液(800ml)を加え、80℃で1時間加熱して、エラスチン以外のタンパク質を分解した。そして、NaOHと等mol数のクエン酸(15.4g)を添加して中和させた。
【0031】
次いで、溶液を30メッシュ網で濾過し、エラスチンが含まれる不溶物を回収し、不溶物を3回水洗いした後、再度30メッシュ網で濾過して、その不溶物を回収した。
この不溶物を水洗して、サンプルミルによりホモジナイズした結果、精製したエラスチンの粉砕物206gが得られた。
【0032】
次に、この精製したエラスチンのうち10gに対して1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、図3に示すように、サーモリシン(サモアーゼ(R)PC-10:大和化成株式会社製。以下の実施例及び比較例において同様。)0.05gと、パパイン(パパインW-40:天野エンザイム株式会社製。以下の実施例及び比較例において同様。)0.05gとを添加した。
【0033】
そして、この混合液を70℃で2時間加熱した後、次いで80℃で2時間加熱した。
得られた溶液に対して、可溶性固形分(Brix)を測定した結果、6.0%であった。このうち、1.0%は、添加した酵素(0.1g)とリン酸緩衝液とによるものであり、残り(実施例1では5.0%)が、溶液中に含まれるエラスチン由来ペプチド量を示している。これは、以下の実施例及び比較例でも同様である。
【0034】
(比較例1)
精製したエラスチン10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、図3に示すように、サーモリシンを0.1g添加し、70℃で4時間加熱した点以外は、実施例1と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、5.4%であった。
【0035】
(比較例2)
精製したエラスチン10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、図3に示すように、パパインを0.1g添加し、80℃で4時間加熱した点以外は、実施例1と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、4.4%であった。
【0036】
(比較例3)
精製したエラスチン10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、図3に示すように、プロチンPC-10(大和化成株式会社製)を0.1g添加し、50℃で4時間加熱した点以外は、実施例1と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、4.6%であった。
【0037】
(比較例4)
精製したエラスチン10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、図3に示すように、プロテアーゼA「アマノ」G(天野エンザイム株式会社製)を0.1g添加し、50℃で4時間加熱した点以外は、実施例1と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、3.2%であった。
【0038】
(比較例5)
精製したエラスチン10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、図3に示すように、アロアーゼAP-10(ヤクルト製薬工業株式会社製)を0.1g添加し、70℃で4時間加熱した点以外は、実施例1と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、2.0%であった。
【0039】
実施例1は、比較例1〜5に対して、エラスチン由来ペプチドの収量が、それぞれ約11%,36%,30%,88%,200%増加している。
ここで、サーモリシンを単独で使用した場合と、パパインと併用した場合とでは、収量の差は約11%であるが、エラスチン由来ペプチドの場合、この差は非常に大きい。
すなわち、上述したように、キハダマグロを原料にした場合、エラスチンを多く含む心臓動脈球は、およそ0.027重量%しか得られず、抽出されたエラスチンは、希少なものである(現在1kg当たり十数万円で取引されている)。したがって、さらにこれを分解して得られるエラスチン由来ペプチドもまた大変希少であり、約11%の収量の差は、当該分野では非常に大きなものである。
【0040】
<実験2.反応温度がエラスチン由来ペプチドの収量に及ぼす影響>
(実施例2)
実施例1と同様にして、新たに精製したエラスチンを得た。この精製したエラスチンのうち10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、図4に示すように、サーモリシン0.05gと、パパイン0.05gとを添加した。
そして、実施例1と同様に、この混合液を70℃で2時間加熱した後、次いで80℃で2時間加熱した。
得られた溶液に対して、可溶性固形分(Brix)を測定した結果、7.0%であった。なお、本実施例は、実施例1と同条件であるが、可溶性固形分(Brix)の測定結果が異なっているのは、キハダマグロから取り出した心臓動脈球の水分含有量が一定していないからである。このため、可溶性固形分(Brix)による測定結果は、各実験内において相対的に比較するために使用する。
【0041】
(実施例3)
サーモリシンとパパインを添加した混合液を60℃で4時間加熱した点以外は、実施例2と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、6.6%であった。
【0042】
(実施例4)
サーモリシンとパパインを添加した混合液を70℃で4時間加熱した点以外は、実施例2と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、7.0%であった。
【0043】
(実施例5)
サーモリシンとパパインを添加した混合液を80℃で4時間加熱した点以外は、実施例2と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、7.0%であった。
【0044】
実施例2〜5において示される通り、加熱時間を全体で4時間とした場合には、加熱温度がサーモリシン及びパパインの至適温度ではない実施例3では、エラスチン由来ペプチドの収量は相対的に少なかったが、加熱温度がサーモリシン及び/又はパパインの至適温度であるその他の実施例では、エラスチン由来ペプチドの収量に差は見られなかった。
【0045】
<実験3.酵素の比率がエラスチン由来ペプチドの収量に及ぼす影響>
(実施例6)
実施例1と同様にして、新たに精製したエラスチンを得た。この精製したエラスチンのうち10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、図5に示すように、サーモリシン0.025gと、パパイン0.075gとを添加した。
そして、実施例1と同様に、この混合液を70℃で2時間加熱した後、次いで80℃で2時間加熱した。
得られた溶液に対して、可溶性固形分(Brix)を測定した結果、7.2%であった。
【0046】
(実施例7)
サーモリシンとパパインを、それぞれ0.05gずつ添加した点以外は、実施例6と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、7.0%であった。
【0047】
(実施例8)
サーモリシンを0.075g、及びパパインを0.025g添加した点以外は、実施例6と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、7.0%であった。
【0048】
サーモリシンとパパインの添加比率を、実施例6〜8のように、原料の心臓動脈球の重量に対して、サーモリシン0.25重量%〜0.75重量%、パパイン0.75重量%〜0.25重量%の範囲で変えても、エラスチン由来ペプチドの収量にほとんど差は見られなかった。
【0049】
<実験4.反応温度の比率がエラスチン由来ペプチドの収量に及ぼす影響>
(実施例9)
実施例1と同様にして、新たに精製したエラスチンを得た。この精製したエラスチンのうち10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、図6に示すように、サーモリシン0.05gと、パパイン0.05gとを添加した。
そして、この混合液を80℃で8時間加熱した。
得られた溶液に対して、可溶性固形分(Brix)を測定した結果、8.4%であった。
【0050】
(実施例10)
サーモリシンとパパインを添加した混合液を70℃で2時間加熱した後、次いで80℃で6時間加熱した点以外は、実施例9と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、8.6%であった。
【0051】
(実施例11)
サーモリシンとパパインを添加した混合液を70℃で4時間加熱した後、次いで80℃で4時間加熱した点以外は、実施例9と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、9.0%であった。
【0052】
(実施例12)
サーモリシンとパパインを添加した混合液を70℃で6時間加熱した後、次いで80℃で2時間加熱した点以外は、実施例9と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、8.2%であった。
【0053】
(実施例13)
サーモリシンとパパインを添加した混合液を70℃で8時間加熱した点以外は、実施例9と同様にして行った。
その結果、得られた溶液の可溶性固形分(Brix)は、7.6%であった。
【0054】
上述した実験2では、反応時間が4時間の場合、加熱温度条件によりエラスチン由来ペプチドの収量に差は見られなかったが、反応時間をより長くした結果、まずサーモリシンの至適温度内である70℃で反応させた後、次いでパパインの至適温度である80℃で反応させることで、エラスチンがより効率的に分解されることが明らかとなった。
【0055】
<実験5.反応時間がエラスチン由来ペプチドの収量に及ぼす影響>
(実施例14)
実施例1と同様にして、新たに精製したエラスチンを得た。この精製したエラスチンのうち10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、サーモリシン0.05gと、パパイン0.05gとを添加した。
そして、この混合液を70℃で7時間加熱し、1時間ごとに溶液の可溶性固形分(Brix)を測定した。その結果を図7に示す。
同図に示すように、反応開始から1時間目までは、可溶性固形分は急激に増加し、その後は緩やかに上昇した。また、5時間以上反応させても可溶性固形分は増えなかった。このことから、酵素を十分に添加して反応温度を70℃とした場合、反応時間は1時間以上5時間以下とすることが適切であることがわかる。
【0056】
<実験6.二段階加熱による反応時間がエラスチン由来ペプチドの収量に及ぼす影響>
(実施例15)
実施例1と同様にして、新たに精製したエラスチンを得た。この精製したエラスチンのうち10gに対して、1/15Nのリン酸緩衝液(pH7.0)を30ml加えた後、サーモリシン0.05gと、パパイン0.05gとを添加した。
そして、この混合液を70℃で3時間加熱した後、次いで80℃で5時間加熱し、1時間ごとに溶液の可溶性固形分(Brix)を測定した。その結果を図8に示す。
【0057】
同図に示すように、70℃で3時間加熱した後、80℃に温度を上げた場合、可溶性固形分は反応開始から1時間目まで急激に増加した後は緩やかに上昇した。また、80℃での最初の1時間(3時間目〜4時間目)にやや大きく増加した後、4時間目までは緩やかに増加し、4時間以上反応させても増加は見られなかった。
このことから、酵素を十分に添加して70℃で3時間加熱した後、80℃に温度を上げた場合は、80℃での加熱時間は1時間以上4時間以下とすることが適切であると考えられる。
【0058】
以上の実験結果から、サーモリシンとパパインを組み合わせて用いることで、エラスチンの分解効率をより向上させ得ることが明らかとなった。すなわち、これらをそれぞれ単独で使用する場合と比較して、サーモリシンのみの場合に対して約11%、パパインのみの場合に対して約36%の収量の向上が見られた。
また、実施例14では、収量が急激に増加した後の反応1時間目の可溶性固形分が6.8%であるのに対して、可溶性固形分の増加が停止した反応5時間目の可溶性固形分は8.2%であり、この間の収量の増加は、約21%となっている。
これに対して、実施例15では、収量が急激に増加した後の反応1時間目の可溶性固形分が6.0%であるのに対して、反応7時間目(80℃で3時間目)の可溶性固形分は8.8%であり、この間の収量を約42%増加させることができている。
このように、70℃のみの場合では5時間で可溶性固形分の増加が停止したのに対し、70℃と80℃の二段階で反応させることによって、7時間に亘って可溶性固形分を増加させることができ、その分エラスチン由来ペプチドの収量を大きく増加させることが可能となっている。
【産業上の利用可能性】
【0059】
本発明は、食品の成分等として利用するためのエラスチン由来ペプチドの製造において好適に利用することが可能である。
【特許請求の範囲】
【請求項1】
エラスチンを含有する肉を細断してアルカリ分解したのち、濾過により不溶物を回収し、この不溶物にサーモリシンとパパインを添加してエラスチンを分解することを特徴とするエラスチン由来ペプチドの製造方法。
【請求項2】
前記エラスチンを含有する肉が、マグロの心臓動脈球であることを特徴とする請求項1記載のエラスチン由来ペプチドの製造方法。
【請求項3】
前記不溶物にサーモリシンとパパインを添加し、65〜70℃で加熱したのちに、次いで80℃で加熱することを特徴とする請求項1又は2記載のエラスチン由来ペプチドの製造方法。
【請求項4】
エラスチンを含有する肉を細断してアルカリ分解したのち、濾過により回収された不溶物をサーモリシンとパパインにより分解してなることを特徴とするエラスチン由来ペプチド。
【請求項1】
エラスチンを含有する肉を細断してアルカリ分解したのち、濾過により不溶物を回収し、この不溶物にサーモリシンとパパインを添加してエラスチンを分解することを特徴とするエラスチン由来ペプチドの製造方法。
【請求項2】
前記エラスチンを含有する肉が、マグロの心臓動脈球であることを特徴とする請求項1記載のエラスチン由来ペプチドの製造方法。
【請求項3】
前記不溶物にサーモリシンとパパインを添加し、65〜70℃で加熱したのちに、次いで80℃で加熱することを特徴とする請求項1又は2記載のエラスチン由来ペプチドの製造方法。
【請求項4】
エラスチンを含有する肉を細断してアルカリ分解したのち、濾過により回収された不溶物をサーモリシンとパパインにより分解してなることを特徴とするエラスチン由来ペプチド。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2010−239919(P2010−239919A)
【公開日】平成22年10月28日(2010.10.28)
【国際特許分類】
【出願番号】特願2009−94154(P2009−94154)
【出願日】平成21年4月8日(2009.4.8)
【出願人】(591273960)はごろもフーズ株式会社 (7)
【Fターム(参考)】
【公開日】平成22年10月28日(2010.10.28)
【国際特許分類】
【出願日】平成21年4月8日(2009.4.8)
【出願人】(591273960)はごろもフーズ株式会社 (7)
【Fターム(参考)】
[ Back to top ]

