エリスロフレシンA、B、C及びD
【課題】天然の動植物、微生物等の体内に含まれる化学物質として見出されたもののうち人体に有用な効果をもたらす新規な化学物質、およびそれを用いた薬剤の提供。
【解決手段】マメ科植物Erythrophleum succirubrumから新規化学物質エリストフレシンA(下記化学式で提示)、B、CおよびDを有機溶媒による抽出単離し、これらの有する細胞増殖阻害作用を癌治療薬として利用したこれらを有効成分とした薬剤。

【解決手段】マメ科植物Erythrophleum succirubrumから新規化学物質エリストフレシンA(下記化学式で提示)、B、CおよびDを有機溶媒による抽出単離し、これらの有する細胞増殖阻害作用を癌治療薬として利用したこれらを有効成分とした薬剤。

【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規化合物であるエリスロフレシンA、B、C及びDに関し、更には、これらを用いた薬剤に関する。
【背景技術】
【0002】
現在の我々の生活において、天然の動植物、微生物等の体内に含まれる化学物質(以下「天然物」という。)として見出されたもののうち人体に有用な効果をもたらすものは生薬、医薬品の有効成分として使用されている。また、このようなものは更に有用な医薬品を開発するための研究材料としても様々な役割を有しており、非常に重要なものとなっている。
【0003】
このように、人体に有益な効果をもたらす天然物の探索に関する報告としては、例えば下記非特許文献1に、変形菌からビスインドール化合物、ナフトキノン化合物、グリセリド化合物等を抽出した報告がある。
【0004】
【非特許文献1】石橋正己、“未利用菌類の資源化:変形菌からの天然物探索”、有機合成化学協会誌、2003年、第61巻、第2号、152〜163頁
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかしながら一方で、天然物の探索が多数の者によって行なわれているにもかかわらず、探索の材料として検討、調査されたものは、地球上の全生物種の中で10%にも満たないといわれている。
【0006】
本発明は、新規な化学物質を資源として提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明の一手段に係るエリスロフレシンAは、下記式で示される。
【化1】

【0008】
また、本発明の他の一手段に係るエリスロフレシンBは、下記式で示される。
【化2】

【0009】
また、本発明の他の一手段に係るエリスロフレシンCは、下記式で示される。
【化3】

【0010】
また、本発明の他の一手段に係るエリスロフレシンDは、下記式で示される。
【化4】

【0011】
また、本発明の他の一手段に係る薬剤は、下記式で示されるエリスロフレシンA及びその塩の少なくともいずれかを有効成分として含有する。
【化5】

【0012】
また、本発明の他の一手段に係る薬剤は、下記式で示されるエリスロフレシンB及びその塩の少なくともいずれかを有効成分として含有する。
【化6】

【0013】
また、本発明の他の一手段に係る薬剤は、下記式で示されるエリスロフレシンC及びその塩の少なくともいずれかを有効成分として含有する。
【化7】

【0014】
また、本発明の他の一手段に係る薬剤は、下記式で示されるエリスロフレシンD及びその塩の少なくともいずれかを有効成分として含有する。
【化8】

【0015】
なお、上記の薬剤は、限定されるわけではないが、癌の治療薬として有用であることが期待される。
【発明の効果】
【0016】
本発明により、新規な化学物質を資源として提供することができる。特に、本発明に係る化学物質は、癌細胞に対し細胞増殖抑制作用を発揮するため、例えば癌の治療薬として利用が期待される。
【発明を実施するための最良の形態】
【0017】
以下、本発明の実施形態について説明するが、本発明は多くの異なる形態による実施が可能であり、以下に示す実施形態についての記載にのみ狭く解釈されるものではない。
【0018】
本発明の一形態に係るエリスロフレシンA、B、C及びDは、下記にそれぞれ示される。
【化9】

【化10】

【化11】

【化12】

【0019】
本実施形態に係るエリスロフレシンA、B、C及びDは、後述の実施例から明らかなように、マメ科植物Erythrophleum succirubrumから抽出することができるが、これに限定されず、合成することが可能である。
【0020】
本実施形態に係るエリスロフレシンA、B、C及びDは、癌細胞に対し細胞増殖抑制作用を発揮するため、薬剤、例えば癌の治療薬として利用が期待される。なおエリスロフレシンA、B、C及びDを癌の治療薬として利用する場合、エリスロフレシンA、B、C及びD並びにこれらの塩のうち少なくともいずれかを有効成分として含有しておくことが好ましい。
【0021】
また、本実施形態に係る癌の治療薬は、上記エリスロフレシンA、B、C及びD並びにこれらの塩のうち少なくともいずれかの他、薬学的に許容しうる通常の担体、結合剤、安定化剤、賦形剤、希釈剤(例えば蒸留水)、pH緩衝剤(例えばリン酸緩衝生理食塩水)、崩壊剤、可溶化剤、溶解補助剤、等張剤等の各種調剤用配合成分を含有させることができる。
【0022】
またこの癌の治療薬は、患者の性別、体重、症状に見合った適切な投与量を経口的又は非経口的に投与することができる。経口的な投与としては、通常用いられる投与形態、例えば粉末、顆粒、錠剤、カプセル剤、液剤、懸濁液、油剤、乳化剤等の投与形態を採用することができる。また、非経口的な投与としては、通常用いられる投与形態、例えば上記の液剤、懸濁液等にしたものを直接患部に投与する方法、注射等により投与する形態を採用することができる。
【実施例】
【0023】
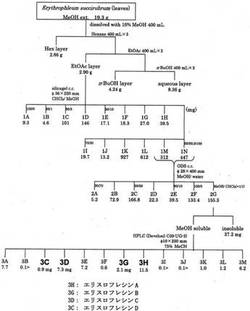
本実施例では、マメ科植物Erythrophleum succirubrumからエリスロフレシンA、B、C及びDを抽出し、検討した結果を示す。図1に、エリスロフレシンA、B、C及びDの単離についてのスキームの概略を示しておく。
【0024】
まず、マメ科植物Erythrophleum succirubrumの葉部19.3gを、n−ヘキサン、酢酸エチル、ブタノールを用いて溶媒分配を行い、各可溶部を得た。
【0025】
上記可溶部のうち、得られた酢酸エチル可溶部について、Silica gel PSQ 100Bを担体とするカラム(φ36×220mm)に付し、クロロホルム、メタノールを用いて溶出し、溶出順に1Aから1Nの各画分を得た。また、上記溶出した1Mと1Nを併せて、得られたフラクションについてCromatorex ODSを担体とするカラム(φ28×400mm)に付し、フラクション2Aから2Nを得た。このうちのフラクション2Gのメタノール可溶部を、下記表1に示すHPLC条件(1)を用いてHPLCによる分画を行い、エリスロフレシンA(11.5mg)、B(2.1mg)、C(7.3mg)及びD(0.9mg)をそれぞれ単離した。
【表1】

【0026】
(エリスロフレシンA)
エリスロフレシンAは白色非結晶固体として単離された。エリスロフレシンAに対してFABMS(positive)を行い、[M+H]+と推測されるm/z711のピーク、[M+Na]+と推測されるm/z733のピーク、[M+K]+と推測されるm/z749のピーク、をそれぞれ観測した。また、13C NMR、DEPTにより、分子式をC41H58O10と決定した。
【0027】
また、エリスロフレシンAに対して赤外吸収測定(以下「IR測定」という。)を行い、赤外吸収スペクトル(以下「IRスペクトル」という。)を得た。この結果、3449、1709cm−1、1645cm−1にそれぞれ吸収をそれぞれ観測した。
【0028】
また、エリスロフレシンAに対して紫外吸収測定(以下「UV測定」という。)を行い、紫外吸収スペクトル(以下「UVスペクトル」という。)を得た。この紫外吸収測定は、メタノールを溶媒として、セル長を1cmとして行なった。この結果、223nmに吸収ピークを有しており、共役二重結合化合物であることが推定できた。
【0029】
また、エリスロフレシンAに対し、旋光角[α]Dの測定を行った。この結果、旋光角は−98.3度であり、光学活性を有することが確認できた。なお下記表2に、旋光角、FABMS、HRFABMS、UV測定、IR測定の結果を示しておく。
【表2】

【0030】
また、エリスロフレシンAに対し、1H NMR及び13C NMRの測定も行った。この結果を表3に示す。1H NMRでは6個のメチル基由来のシグナル、2個のメトキシ基由来のシグナルが観測された。また、2H分のオレフィンプロトンシグナル及び3本のオキシメチンのシグナルも観測された。また、13C NMRでは6個のメチル基に由来する炭素シグナル、2個のメトキシ基に由来する炭素シグナル、及び5個のカルボニル基に由来する炭素シグナルが観測された。また13C NMRでは41個の炭素シグナルが観測されたこと、及び1H及び13C NMRスペクトルにおいて多くのシグナルがペアとして観測されたことから、本化合物はジテルペンの二量体構造を有することが示唆された。なお、エリスロフレシンAの1H NMR及び13C NMRの結果について下記表3に示しておく。
【表3】

【0031】
また、エリスロフレシンAに対し、COSYスペクトル、HMQCスペクトル等の二次元NMRスペクトルを用い、各プロトンシグナル及び各炭素シグナルを帰属した。更にHMBCスペクトルの解析により、本化合物はcassaine型ジテルペンであるcassiminic acid及びノルジテルペンNorerythrofordin Aのメチルエステルを分子内に有することが判明した。さらに、norerythrofordin Aのメチルエステルの3’位からCassimic asidの16位にHMBC相関が観測された。以上の結果より、本化合物の平面構造は、下記化学式に示すようNorerythrofordin Aのメチルエステル体とCassimic acidがエステル結合した新規ジテルペン二量体であることが明らかとなった。本化合物の立体化学については、各種のNOE実験及び化学シフト、結合定数の文献値との比較により、cassimic acid及びnorerythrofordin Aと同一の立体配置を有すると推定した。
【化13】

【0032】
以上、エリスロフレシンAの構造を上記式で示すように決定した。
【0033】
(エリスロフレシンB)
エリスロフレシンBは白色非結晶固体として単離された。エリスロフレシンBに対してFABMS(positive)を行い、[M+H]+と推測されるm/z769のピークを、[M+Na]+と推測されるm/z791のピークを観測し、更に13C NMR及びDEPTより分子式をC43H60O12と決定した。
【0034】
また、エリスロフレシンBに対してIR測定を行い、IRスペクトルを得た。この結果は非常に上記エリスロフレシンAに類似しており、3463、1717、1646cm−1にそれぞれ吸収をそれぞれ観測した。
【0035】
また、エリスロフレシンBに対してUV測定を行い、UVスペクトルを得た。このUV測定は、メタノールを溶媒として、セル長を1cmとして行なった。この結果は上記エリスロフレシンAに類似していた。すなわち222nmに吸収ピークを有しており、共役二重結合化合物であることが推定できた。
【0036】
また、エリスロフレシンBに対し、旋光角[α]Dの測定を行った。この結果、旋光角は−111.3度であり、光学活性を有することが確認できた。なお下記表4に、旋光角、高分解FABMS、UV測定、IR測定の結果を示しておく。
【表4】

【0037】
また、エリスロフレシンBに対し、1H NMR及び13C NMRの測定も行った。この結果は上記表3に示された通りである。1H NMR及び13C NMRの測定により、エリスロフレシンBはエリスロフレシンAとよく類似していることがわかり、本化合物はエリスロフレシンAと同様、cassaine型ジテルペンの二量体構造を有することが示唆された。ただし、1H NMRにおいて、新たに1個のメトキシ基に由来するシグナルが観測された。また13C NMRにおいて新たに1個のメトキシ基に由来する炭素シグナル、1個のカルボキシル基に由来する炭素シグナルがそれぞれ観測された。これらの結果及びエリスロフレシンAとエリスロフレシンBの分子量の差が58であることを考慮すると、新たに観測されたシグナルは、1個のメトキシカルボニル基に由来するものと考えられた。各種二次元NMRの詳細な解析を行い、特にHMBCスペクトルにおいて3’位及び5’位のプロトンから19のカルボニル炭素への相関が観測され、更にメトキシ基に由来するプロトン(21’位)からも19’位のカルボニル炭素への相関が観測され、更にメトキシ基に由来するプロトン(21’位)からも19’位カルボニル炭素への相関が観測されたことから、メトキシカルボニル基は、4’位に結合していることが判明した。以上の結果より、エリスロフレシンBの構造を下記式で示すように決定した。
【化14】

【0038】
(エリスロフレシンC)
エリスロフレシンCは白色非結晶固体として単離された。エリスロフレシンCに対してFABMS(positive)を行い、[M+H]+と推測されるm/z754のピークを、[M+Na]+と推測されるm/z776のピークを、[M+K]+と推測されるm/z792のピークを、それぞれ観測した。分子量が753であることから、エリスロフレシンCは、分子内に窒素原子を含むことが示唆された。また、MSデータ、13C NMR及びDEPTより本化合物の分子式をC43H63NO10と決定した。
【0039】
また、エリスロフレシンCに対してIR測定を行い、IRスペクトルを得た。この結果、3448、1714cm−1に吸収を観測した。
【0040】
また、フザニンCに対しUV測定を行い、UVスペクトルを得た。この紫外吸収測定は、メタノールを溶媒として、セル長を1cmとして行なった。この結果、204nmに吸収ピークを有しており、芳香族化合物又は共役二重結合化合物であることが推定できた。
【0041】
また、エリスロフレシンCに対し、旋光角[α]Dの測定を行った。この結果、旋光角は−73.1度であり、光学活性を有することが確認できた。なお下記表5に、旋光角、高分解FABMS、UV測定、IR測定の結果を示しておく。
【表5】

【0042】
また、エリスロフレシンCに対し、1H NMR及び13C NMRの測定も行った。この結果を表6に示しておく。
【表6】

【0043】
1H NMR及び13C NMRのスペクトルは、いずれもエリスロフレシンAに類似していたことから、本化合物はエリスロフレシンAと同様にcassaine型ジテルペンとノルcassaine型ジテルペンの二量体構造を有することが示唆された。しかし、エリスロフレシンAの1H NMRでは構成するモノマーであるnorerythrofordin Aのメチルエステルのメトキシ基が観測されたのに対して、エリスロフレシンCの1H NMRでは観測されず、その代りに窒素に隣接したメチルプロトン、窒素に隣接したメチレンプロトン、及びオキシメチレンプロトンのシグナルが新たに観測された。また、13C NMRにおいても窒素に隣接したメチル基、窒素が隣接したメチレン、及びオキシメチレンに由来する炭素シグナルがそれぞれ観測された。更に、COSYスペクトルにおいて、窒素に隣接したメチレンプロトンとオキシメチレンプロトンに相関が観測されたこと、またhHMBCスペクトルにおいて窒素に隣接したメチルプロトン及び窒素が隣接したメチレンプロトンから16’位のカルボニル炭素への相関が観測されたことより、エリスロフレシンCでは16’位に(2−hydroxyethyl(methyl)amino)基が結合していることが判明した。
【0044】
以上の結果より、エリスロフレシンCの構造を下記式で示すように決定した。
【化15】

【0045】
(エリスロフレシンD)
エリスロフレシンDも白色非結晶固体として単離された。エリスロフレシンDに対してFABMS(positive)を行い、[M+H]+と推測されるm/z812のピークを、[M+Na]+と推測されるm/z834のピークを、それぞれ観測した。この結果、分子式をC45H65NO12と決定した。
【0046】
また、エリスロフレシンDに対してIR測定を行った。この結果、3545、1716cm−1、に吸収ピークを観測した。
【0047】
また、エリスロフレシンDに対しUV測定を行い、UVスペクトルを得た。この紫外吸収測定は、メタノールを溶媒として、セル長を1cmとして行なった。この結果、218nm、に吸収ピークを有しており、芳香族化合物又は共役二重結合化合物であることが推定できた。
【0048】
また、エリスロフレシンDに対し、旋光角[α]Dの測定を行った。この結果、旋光角は−54.9度であり、光学活性を有することが確認できた。なお下記表7に、旋光角、HREIBMS、UV測定、IR測定の結果を示しておく。
【表7】

【0049】
また、エリスロフレシンDに対し、1H NMR及び13C NMRの測定も行った。この結果は上記表6に示されている。1H NMR及び13C NMRのスペクトルを比較したところ1’から11’位及び18’から21’位まではエリスロフレシンBとよく類似し、12’から17’位及び22’から24’位まではエリスロフレシンCとよく類似していた。これよりエリスロフレシンDは、4’位にメチルエステルを有し、16’位に(2−hydroxyethyl)(methyl)amino基が結合した構造を有することが判明した。
以上の結果より、エリスロフレシンDの構造を下記式で示すように決定した。
【化16】

【0050】
(細胞増殖阻害活性)
次に、上記単離したエリスロフレシンA、B及びCについて、ヒト胃がん細胞株AGSに対するTRAIL耐性克服作用を検討した。この結果を図2乃至図4に示す。この結果、エリスロフレシンA、B、CはTRAIL(100ng/mL)との併用処理により優位に細胞生存率の低下を示した。従ってこれらの化合物はTRAIL耐性克服作用を有することを確認した。特にエリスロフレシンA、Cは、10μg/mLの濃度でこれらの化合物の単独処理に比べて、TRAIL(100ng/mL)併用処理により各々36%及び37%細胞生存率を低下させることができることを確認した。念のためエリスロフレシンA、B及びCに関する細胞生存率に関する結果を図5に示しておく。
【産業上の利用可能性】
【0051】
本発明は新規化合物を有効成分とし、薬剤として産業上の利用可能性を有する。
【図面の簡単な説明】
【0052】
【図1】実施例におけるエリスロフレシンA、B、C及びDの単離スキームの概略を示す図である。
【図2】エリスロフレシンAのTRAIL耐性克服作用を示す図である。
【図3】エリスロフレシンBのTRAIL耐性克服作用を示す図である。
【図4】エリスロフレシンCのTRAIL耐性克服作用を示す図である。
【図5】エリスロフレシンA、B、Cの細胞生存率に関する結果を示す図。
【技術分野】
【0001】
本発明は、新規化合物であるエリスロフレシンA、B、C及びDに関し、更には、これらを用いた薬剤に関する。
【背景技術】
【0002】
現在の我々の生活において、天然の動植物、微生物等の体内に含まれる化学物質(以下「天然物」という。)として見出されたもののうち人体に有用な効果をもたらすものは生薬、医薬品の有効成分として使用されている。また、このようなものは更に有用な医薬品を開発するための研究材料としても様々な役割を有しており、非常に重要なものとなっている。
【0003】
このように、人体に有益な効果をもたらす天然物の探索に関する報告としては、例えば下記非特許文献1に、変形菌からビスインドール化合物、ナフトキノン化合物、グリセリド化合物等を抽出した報告がある。
【0004】
【非特許文献1】石橋正己、“未利用菌類の資源化:変形菌からの天然物探索”、有機合成化学協会誌、2003年、第61巻、第2号、152〜163頁
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかしながら一方で、天然物の探索が多数の者によって行なわれているにもかかわらず、探索の材料として検討、調査されたものは、地球上の全生物種の中で10%にも満たないといわれている。
【0006】
本発明は、新規な化学物質を資源として提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明の一手段に係るエリスロフレシンAは、下記式で示される。
【化1】

【0008】
また、本発明の他の一手段に係るエリスロフレシンBは、下記式で示される。
【化2】

【0009】
また、本発明の他の一手段に係るエリスロフレシンCは、下記式で示される。
【化3】

【0010】
また、本発明の他の一手段に係るエリスロフレシンDは、下記式で示される。
【化4】

【0011】
また、本発明の他の一手段に係る薬剤は、下記式で示されるエリスロフレシンA及びその塩の少なくともいずれかを有効成分として含有する。
【化5】

【0012】
また、本発明の他の一手段に係る薬剤は、下記式で示されるエリスロフレシンB及びその塩の少なくともいずれかを有効成分として含有する。
【化6】

【0013】
また、本発明の他の一手段に係る薬剤は、下記式で示されるエリスロフレシンC及びその塩の少なくともいずれかを有効成分として含有する。
【化7】

【0014】
また、本発明の他の一手段に係る薬剤は、下記式で示されるエリスロフレシンD及びその塩の少なくともいずれかを有効成分として含有する。
【化8】

【0015】
なお、上記の薬剤は、限定されるわけではないが、癌の治療薬として有用であることが期待される。
【発明の効果】
【0016】
本発明により、新規な化学物質を資源として提供することができる。特に、本発明に係る化学物質は、癌細胞に対し細胞増殖抑制作用を発揮するため、例えば癌の治療薬として利用が期待される。
【発明を実施するための最良の形態】
【0017】
以下、本発明の実施形態について説明するが、本発明は多くの異なる形態による実施が可能であり、以下に示す実施形態についての記載にのみ狭く解釈されるものではない。
【0018】
本発明の一形態に係るエリスロフレシンA、B、C及びDは、下記にそれぞれ示される。
【化9】

【化10】

【化11】

【化12】

【0019】
本実施形態に係るエリスロフレシンA、B、C及びDは、後述の実施例から明らかなように、マメ科植物Erythrophleum succirubrumから抽出することができるが、これに限定されず、合成することが可能である。
【0020】
本実施形態に係るエリスロフレシンA、B、C及びDは、癌細胞に対し細胞増殖抑制作用を発揮するため、薬剤、例えば癌の治療薬として利用が期待される。なおエリスロフレシンA、B、C及びDを癌の治療薬として利用する場合、エリスロフレシンA、B、C及びD並びにこれらの塩のうち少なくともいずれかを有効成分として含有しておくことが好ましい。
【0021】
また、本実施形態に係る癌の治療薬は、上記エリスロフレシンA、B、C及びD並びにこれらの塩のうち少なくともいずれかの他、薬学的に許容しうる通常の担体、結合剤、安定化剤、賦形剤、希釈剤(例えば蒸留水)、pH緩衝剤(例えばリン酸緩衝生理食塩水)、崩壊剤、可溶化剤、溶解補助剤、等張剤等の各種調剤用配合成分を含有させることができる。
【0022】
またこの癌の治療薬は、患者の性別、体重、症状に見合った適切な投与量を経口的又は非経口的に投与することができる。経口的な投与としては、通常用いられる投与形態、例えば粉末、顆粒、錠剤、カプセル剤、液剤、懸濁液、油剤、乳化剤等の投与形態を採用することができる。また、非経口的な投与としては、通常用いられる投与形態、例えば上記の液剤、懸濁液等にしたものを直接患部に投与する方法、注射等により投与する形態を採用することができる。
【実施例】
【0023】
本実施例では、マメ科植物Erythrophleum succirubrumからエリスロフレシンA、B、C及びDを抽出し、検討した結果を示す。図1に、エリスロフレシンA、B、C及びDの単離についてのスキームの概略を示しておく。
【0024】
まず、マメ科植物Erythrophleum succirubrumの葉部19.3gを、n−ヘキサン、酢酸エチル、ブタノールを用いて溶媒分配を行い、各可溶部を得た。
【0025】
上記可溶部のうち、得られた酢酸エチル可溶部について、Silica gel PSQ 100Bを担体とするカラム(φ36×220mm)に付し、クロロホルム、メタノールを用いて溶出し、溶出順に1Aから1Nの各画分を得た。また、上記溶出した1Mと1Nを併せて、得られたフラクションについてCromatorex ODSを担体とするカラム(φ28×400mm)に付し、フラクション2Aから2Nを得た。このうちのフラクション2Gのメタノール可溶部を、下記表1に示すHPLC条件(1)を用いてHPLCによる分画を行い、エリスロフレシンA(11.5mg)、B(2.1mg)、C(7.3mg)及びD(0.9mg)をそれぞれ単離した。
【表1】

【0026】
(エリスロフレシンA)
エリスロフレシンAは白色非結晶固体として単離された。エリスロフレシンAに対してFABMS(positive)を行い、[M+H]+と推測されるm/z711のピーク、[M+Na]+と推測されるm/z733のピーク、[M+K]+と推測されるm/z749のピーク、をそれぞれ観測した。また、13C NMR、DEPTにより、分子式をC41H58O10と決定した。
【0027】
また、エリスロフレシンAに対して赤外吸収測定(以下「IR測定」という。)を行い、赤外吸収スペクトル(以下「IRスペクトル」という。)を得た。この結果、3449、1709cm−1、1645cm−1にそれぞれ吸収をそれぞれ観測した。
【0028】
また、エリスロフレシンAに対して紫外吸収測定(以下「UV測定」という。)を行い、紫外吸収スペクトル(以下「UVスペクトル」という。)を得た。この紫外吸収測定は、メタノールを溶媒として、セル長を1cmとして行なった。この結果、223nmに吸収ピークを有しており、共役二重結合化合物であることが推定できた。
【0029】
また、エリスロフレシンAに対し、旋光角[α]Dの測定を行った。この結果、旋光角は−98.3度であり、光学活性を有することが確認できた。なお下記表2に、旋光角、FABMS、HRFABMS、UV測定、IR測定の結果を示しておく。
【表2】

【0030】
また、エリスロフレシンAに対し、1H NMR及び13C NMRの測定も行った。この結果を表3に示す。1H NMRでは6個のメチル基由来のシグナル、2個のメトキシ基由来のシグナルが観測された。また、2H分のオレフィンプロトンシグナル及び3本のオキシメチンのシグナルも観測された。また、13C NMRでは6個のメチル基に由来する炭素シグナル、2個のメトキシ基に由来する炭素シグナル、及び5個のカルボニル基に由来する炭素シグナルが観測された。また13C NMRでは41個の炭素シグナルが観測されたこと、及び1H及び13C NMRスペクトルにおいて多くのシグナルがペアとして観測されたことから、本化合物はジテルペンの二量体構造を有することが示唆された。なお、エリスロフレシンAの1H NMR及び13C NMRの結果について下記表3に示しておく。
【表3】

【0031】
また、エリスロフレシンAに対し、COSYスペクトル、HMQCスペクトル等の二次元NMRスペクトルを用い、各プロトンシグナル及び各炭素シグナルを帰属した。更にHMBCスペクトルの解析により、本化合物はcassaine型ジテルペンであるcassiminic acid及びノルジテルペンNorerythrofordin Aのメチルエステルを分子内に有することが判明した。さらに、norerythrofordin Aのメチルエステルの3’位からCassimic asidの16位にHMBC相関が観測された。以上の結果より、本化合物の平面構造は、下記化学式に示すようNorerythrofordin Aのメチルエステル体とCassimic acidがエステル結合した新規ジテルペン二量体であることが明らかとなった。本化合物の立体化学については、各種のNOE実験及び化学シフト、結合定数の文献値との比較により、cassimic acid及びnorerythrofordin Aと同一の立体配置を有すると推定した。
【化13】

【0032】
以上、エリスロフレシンAの構造を上記式で示すように決定した。
【0033】
(エリスロフレシンB)
エリスロフレシンBは白色非結晶固体として単離された。エリスロフレシンBに対してFABMS(positive)を行い、[M+H]+と推測されるm/z769のピークを、[M+Na]+と推測されるm/z791のピークを観測し、更に13C NMR及びDEPTより分子式をC43H60O12と決定した。
【0034】
また、エリスロフレシンBに対してIR測定を行い、IRスペクトルを得た。この結果は非常に上記エリスロフレシンAに類似しており、3463、1717、1646cm−1にそれぞれ吸収をそれぞれ観測した。
【0035】
また、エリスロフレシンBに対してUV測定を行い、UVスペクトルを得た。このUV測定は、メタノールを溶媒として、セル長を1cmとして行なった。この結果は上記エリスロフレシンAに類似していた。すなわち222nmに吸収ピークを有しており、共役二重結合化合物であることが推定できた。
【0036】
また、エリスロフレシンBに対し、旋光角[α]Dの測定を行った。この結果、旋光角は−111.3度であり、光学活性を有することが確認できた。なお下記表4に、旋光角、高分解FABMS、UV測定、IR測定の結果を示しておく。
【表4】

【0037】
また、エリスロフレシンBに対し、1H NMR及び13C NMRの測定も行った。この結果は上記表3に示された通りである。1H NMR及び13C NMRの測定により、エリスロフレシンBはエリスロフレシンAとよく類似していることがわかり、本化合物はエリスロフレシンAと同様、cassaine型ジテルペンの二量体構造を有することが示唆された。ただし、1H NMRにおいて、新たに1個のメトキシ基に由来するシグナルが観測された。また13C NMRにおいて新たに1個のメトキシ基に由来する炭素シグナル、1個のカルボキシル基に由来する炭素シグナルがそれぞれ観測された。これらの結果及びエリスロフレシンAとエリスロフレシンBの分子量の差が58であることを考慮すると、新たに観測されたシグナルは、1個のメトキシカルボニル基に由来するものと考えられた。各種二次元NMRの詳細な解析を行い、特にHMBCスペクトルにおいて3’位及び5’位のプロトンから19のカルボニル炭素への相関が観測され、更にメトキシ基に由来するプロトン(21’位)からも19’位のカルボニル炭素への相関が観測され、更にメトキシ基に由来するプロトン(21’位)からも19’位カルボニル炭素への相関が観測されたことから、メトキシカルボニル基は、4’位に結合していることが判明した。以上の結果より、エリスロフレシンBの構造を下記式で示すように決定した。
【化14】

【0038】
(エリスロフレシンC)
エリスロフレシンCは白色非結晶固体として単離された。エリスロフレシンCに対してFABMS(positive)を行い、[M+H]+と推測されるm/z754のピークを、[M+Na]+と推測されるm/z776のピークを、[M+K]+と推測されるm/z792のピークを、それぞれ観測した。分子量が753であることから、エリスロフレシンCは、分子内に窒素原子を含むことが示唆された。また、MSデータ、13C NMR及びDEPTより本化合物の分子式をC43H63NO10と決定した。
【0039】
また、エリスロフレシンCに対してIR測定を行い、IRスペクトルを得た。この結果、3448、1714cm−1に吸収を観測した。
【0040】
また、フザニンCに対しUV測定を行い、UVスペクトルを得た。この紫外吸収測定は、メタノールを溶媒として、セル長を1cmとして行なった。この結果、204nmに吸収ピークを有しており、芳香族化合物又は共役二重結合化合物であることが推定できた。
【0041】
また、エリスロフレシンCに対し、旋光角[α]Dの測定を行った。この結果、旋光角は−73.1度であり、光学活性を有することが確認できた。なお下記表5に、旋光角、高分解FABMS、UV測定、IR測定の結果を示しておく。
【表5】

【0042】
また、エリスロフレシンCに対し、1H NMR及び13C NMRの測定も行った。この結果を表6に示しておく。
【表6】

【0043】
1H NMR及び13C NMRのスペクトルは、いずれもエリスロフレシンAに類似していたことから、本化合物はエリスロフレシンAと同様にcassaine型ジテルペンとノルcassaine型ジテルペンの二量体構造を有することが示唆された。しかし、エリスロフレシンAの1H NMRでは構成するモノマーであるnorerythrofordin Aのメチルエステルのメトキシ基が観測されたのに対して、エリスロフレシンCの1H NMRでは観測されず、その代りに窒素に隣接したメチルプロトン、窒素に隣接したメチレンプロトン、及びオキシメチレンプロトンのシグナルが新たに観測された。また、13C NMRにおいても窒素に隣接したメチル基、窒素が隣接したメチレン、及びオキシメチレンに由来する炭素シグナルがそれぞれ観測された。更に、COSYスペクトルにおいて、窒素に隣接したメチレンプロトンとオキシメチレンプロトンに相関が観測されたこと、またhHMBCスペクトルにおいて窒素に隣接したメチルプロトン及び窒素が隣接したメチレンプロトンから16’位のカルボニル炭素への相関が観測されたことより、エリスロフレシンCでは16’位に(2−hydroxyethyl(methyl)amino)基が結合していることが判明した。
【0044】
以上の結果より、エリスロフレシンCの構造を下記式で示すように決定した。
【化15】

【0045】
(エリスロフレシンD)
エリスロフレシンDも白色非結晶固体として単離された。エリスロフレシンDに対してFABMS(positive)を行い、[M+H]+と推測されるm/z812のピークを、[M+Na]+と推測されるm/z834のピークを、それぞれ観測した。この結果、分子式をC45H65NO12と決定した。
【0046】
また、エリスロフレシンDに対してIR測定を行った。この結果、3545、1716cm−1、に吸収ピークを観測した。
【0047】
また、エリスロフレシンDに対しUV測定を行い、UVスペクトルを得た。この紫外吸収測定は、メタノールを溶媒として、セル長を1cmとして行なった。この結果、218nm、に吸収ピークを有しており、芳香族化合物又は共役二重結合化合物であることが推定できた。
【0048】
また、エリスロフレシンDに対し、旋光角[α]Dの測定を行った。この結果、旋光角は−54.9度であり、光学活性を有することが確認できた。なお下記表7に、旋光角、HREIBMS、UV測定、IR測定の結果を示しておく。
【表7】

【0049】
また、エリスロフレシンDに対し、1H NMR及び13C NMRの測定も行った。この結果は上記表6に示されている。1H NMR及び13C NMRのスペクトルを比較したところ1’から11’位及び18’から21’位まではエリスロフレシンBとよく類似し、12’から17’位及び22’から24’位まではエリスロフレシンCとよく類似していた。これよりエリスロフレシンDは、4’位にメチルエステルを有し、16’位に(2−hydroxyethyl)(methyl)amino基が結合した構造を有することが判明した。
以上の結果より、エリスロフレシンDの構造を下記式で示すように決定した。
【化16】

【0050】
(細胞増殖阻害活性)
次に、上記単離したエリスロフレシンA、B及びCについて、ヒト胃がん細胞株AGSに対するTRAIL耐性克服作用を検討した。この結果を図2乃至図4に示す。この結果、エリスロフレシンA、B、CはTRAIL(100ng/mL)との併用処理により優位に細胞生存率の低下を示した。従ってこれらの化合物はTRAIL耐性克服作用を有することを確認した。特にエリスロフレシンA、Cは、10μg/mLの濃度でこれらの化合物の単独処理に比べて、TRAIL(100ng/mL)併用処理により各々36%及び37%細胞生存率を低下させることができることを確認した。念のためエリスロフレシンA、B及びCに関する細胞生存率に関する結果を図5に示しておく。
【産業上の利用可能性】
【0051】
本発明は新規化合物を有効成分とし、薬剤として産業上の利用可能性を有する。
【図面の簡単な説明】
【0052】
【図1】実施例におけるエリスロフレシンA、B、C及びDの単離スキームの概略を示す図である。
【図2】エリスロフレシンAのTRAIL耐性克服作用を示す図である。
【図3】エリスロフレシンBのTRAIL耐性克服作用を示す図である。
【図4】エリスロフレシンCのTRAIL耐性克服作用を示す図である。
【図5】エリスロフレシンA、B、Cの細胞生存率に関する結果を示す図。
【特許請求の範囲】
【請求項1】
下記式で示されるエリスロフレシンA。
【化1】

【請求項2】
下記式で示されるエリスロフレシンB。
【化2】

【請求項3】
下記式で示されるエリスロフレシンC。
【化3】

【請求項4】
下記式で示されるエリスロフレシンD。
【化4】

【請求項5】
下記式で示されるエリスロフレシンA及びその塩の少なくともいずれかを有効成分として含有する薬剤。
【化5】

【請求項6】
下記式で示されるエリスロフレシンB及びその塩の少なくともいずれかを有効成分として含有する薬剤。
【化6】

【請求項7】
下記式で示されるエリスロフレシンC及びその塩の少なくともいずれかを有効成分として含有する薬剤。
【化7】

【請求項8】
下記式で示されるエリスロフレシンD及びその塩の少なくともいずれかを有効成分として含有する薬剤。
【化8】

【請求項9】
癌の治療薬である請求項4、5、6又は7記載の薬剤。
【請求項1】
下記式で示されるエリスロフレシンA。
【化1】

【請求項2】
下記式で示されるエリスロフレシンB。
【化2】

【請求項3】
下記式で示されるエリスロフレシンC。
【化3】

【請求項4】
下記式で示されるエリスロフレシンD。
【化4】

【請求項5】
下記式で示されるエリスロフレシンA及びその塩の少なくともいずれかを有効成分として含有する薬剤。
【化5】

【請求項6】
下記式で示されるエリスロフレシンB及びその塩の少なくともいずれかを有効成分として含有する薬剤。
【化6】

【請求項7】
下記式で示されるエリスロフレシンC及びその塩の少なくともいずれかを有効成分として含有する薬剤。
【化7】

【請求項8】
下記式で示されるエリスロフレシンD及びその塩の少なくともいずれかを有効成分として含有する薬剤。
【化8】

【請求項9】
癌の治療薬である請求項4、5、6又は7記載の薬剤。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2010−254638(P2010−254638A)
【公開日】平成22年11月11日(2010.11.11)
【国際特許分類】
【出願番号】特願2009−108489(P2009−108489)
【出願日】平成21年4月27日(2009.4.27)
【出願人】(304021831)国立大学法人 千葉大学 (601)
【Fターム(参考)】
【公開日】平成22年11月11日(2010.11.11)
【国際特許分類】
【出願日】平成21年4月27日(2009.4.27)
【出願人】(304021831)国立大学法人 千葉大学 (601)
【Fターム(参考)】
[ Back to top ]

