エルゴチオネインの製造方法
【課題】エルゴチオネインを産生する能力の高いタモギタケの培養方法を改善することにより、エルゴチオネインをさらに高い収量で製造する方法を提供する。
【解決手段】タモギタケの菌糸体を培養し、生成した菌糸体からエルゴチオネインを抽出することを含むエルゴチオネインの製造方法であって、培養を、メチオニンを含む培地内で行う。培地が、さらに、システイン及び/又はヒスチジンを含むことが好ましい。メチオニンンの濃度は、0.5mM以上15mM未満であることが好ましい。
【解決手段】タモギタケの菌糸体を培養し、生成した菌糸体からエルゴチオネインを抽出することを含むエルゴチオネインの製造方法であって、培養を、メチオニンを含む培地内で行う。培地が、さらに、システイン及び/又はヒスチジンを含むことが好ましい。メチオニンンの濃度は、0.5mM以上15mM未満であることが好ましい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、エルゴチオネインの製造方法に関し、より詳細には、タモギタケの菌糸体からエルゴチオネインを高い収量で製造する方法に関する。
【背景技術】
【0002】
エルゴチオネイン(Ergothioneine)は、1909年にM、C、Tanretによって麦角(ergot)から初めて単離されたアミノ酸の一種である。チオ(thio)は硫黄原子を意味するところ、エルゴチオネインは、麦角から単離されたイオウ原子を含む化合物として命名されたことになる。
【0003】
1911年に、G.BargerとA.J.Ewrnsが、エルゴチオネインの化学構造を、化学式1に示すチオールヒスチジンのベタインであると決定した。
【化1】

【0004】
この化合物は、1920年代になって、意外にも動物の血液中に存在することが明らかとなった。現在、エルゴチオネインは、図1に示す経路でヒスチジンから生合成される。エルゴチオネイン中のイオウ原子は、システインから供給される。
【0005】
エルゴチオネインは、抗酸化作用や抗老化作用が有することが知られており(非特許文献1及び2)、化粧品、食品、医薬、飼料等へ利用されている。
【0006】
エルゴチオネインは、哺乳類の体内では合成されない。したがって、エルゴチオネインを外部から摂取する必要がある。エルゴチオネインの製造方法としては、化学合成法、エルゴチオネインを含有する子のう菌や担子菌、動物血液等から抽出する方法、エルゴチオネインを産生する子のう菌や担子菌を培養後、エルゴチオネインを抽出精製する方法、発酵法等ある。
【0007】
例えば、特開2007−300916(エルゴチオネインの製造方法、特許文献1)及び特開2008−110988(エルゴチオネインの製造方法、特許文献2)には、エルゴチオネイン含有のきのこを溶媒中で粉砕しつつ抽出したエルゴチオネイン含有抽出物を、吸着クロマトグラフィで分画後、分画液のうちエルゴチオネインを含有する液を高速液体クロマトグラフィによって分離精製する、エルゴチオネインの製造方法が開示されている。エルゴチオネイン含有のきのこは、タモギタケ、ヒラタケ、エリンギ及びエノキタケが好ましい。これらの製造方法によれば、エルゴチオネインを高収量かつ安全に得られるとされる。
【0008】
特開2009−161498(エルゴチオネインの製造方法、特許文献3)には、これまでにエルゴチオネイン生産能を有することが知られていないフミツキタケ属、オオイチョウタケ属、スギタケ属又はキシメジ属のキノコよりエルゴチオネインを抽出する、エルゴチオネインの製造方法が開示されている。特開2009−249356(エルゴチオネインの製造方法、特許文献4)には、これまでにエルゴチオネイン生産能を有することが知られていないエノキタケ属、サンゴハリタケ属、シメジ属、ブナハリタケ属、キコブタケ属又はショウゲンジ属のキノコよりエルゴチオネインを抽出する、エルゴチオネインの製造方法が開示されている。これらの製造方法によれば、エルゴチオネイン生産能力の高いキノコからエルゴチオネインを効率的に製造できるとされる。
【0009】
特開2009−159920(菌糸体培養によるエルゴチオネインの製造方法、特許文献5)には、キノコを菌糸体培養し、生成した菌糸体からエルゴチオネインを抽出することを特徴とする、エルゴチオネインの製造方法が開示される。マイタケ属に属するアンニンコウ、ハラタケ属に属するヒメマツタケにおいて、子実体と比較して菌糸体のエルゴチオネイン含量が有意に高いとされる。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2007−300916
【特許文献2】特開2008−110988
【特許文献3】特開2009−161498
【特許文献4】特開2009−249356
【特許文献5】特開2009−159920
【非特許文献】
【0011】
【非特許文献1】岡野由利、「希少アミノ酸エルゴチオネインは皮膚の老化を抑制する」、Fragrance Journal 2008−3、pp81−85
【非特許文献2】Dong KK, et.al.“A comparison of the relative antioxidant potency of L−ergothioneine and idebenone” J Cosmet Dermatol. 2007 Sep;6(3):183−8
【発明の概要】
【発明が解決しようとする課題】
【0012】
従来技術に知られるとおり、エルゴチオネインは、キシメジ科ヒラタケ属のタモギタケ(Pleurotus cornucopiae var. citrinopileatus)に高含有される。タモギタケは、食用キノコであり、安全である。そこで、本発明の目的は、エルゴチオネインの産生能力の高いタモギタケの培養方法を改善することにより、エルゴチオネインをさらに高い収量で製造する方法を提供することにある。
【課題を解決するための手段】
【0013】
本発明者は、上記課題を鋭意検討した結果、培地中にメチオニンを添加すると、エルゴチオネインの収量が増加することを発見し、本発明に至った。すなわち、本発明は、タモギタケの菌糸体を培養し、生成した菌糸体からエルゴチオネインを抽出することを含むエルゴチオネインの製造方法であって、前記培養を、メチオニンを含む培地内で行うことを特徴とする、前記製造方法を提供する。エルゴチオネインの生合成にはヒスチジンと硫黄原子を有するシステインが関与することがわかっている。今回、原料であるこれらの成分の添加では増収がかなわず、メチオニンの添加が有効であることは、従来技術から予想のつかない全く意外なことである。
【0014】
本発明者は、メチオニンとシステイン及び/又はヒスチジンとの併用には、エルゴチオネイン収量増の相乗的効果があることを発見した。したがって、前記培地は、さらに、システイン及び/又はヒスチジンを含むことが好ましい。
【0015】
メチオニンンの濃度は、0.5mM以上15mM未満であることが好ましい。
【発明の効果】
【0016】
本発明のエルゴチオネインの製造方法によれば、培地中にメチオニンを添加したために、タモギタケ菌糸体の液体培養においてエルゴチオネインの総収量が顕著に増加する。本発明の製法によれば、エルゴチオネインを安全かつ安価に提供できる。得られたエルゴチオネインは、シワ防止、皮膚老化防止、真皮コラーゲン減少抑制、MMP−1活性抑制、育毛等の機能を有する化粧品、医薬品、食品等の有効成分として使用が期待される。
【0017】
さらに、メチオニンの存在下でヒスチジン及び/又はシステインを添加すると、エルゴチオネインの収量が顕著に増加する。
【0018】
培地中へのメチオニンの添加濃度を0.5mM以上15mM未満とすることで、エルゴチオネインの最も効率的な増収が可能である。
【図面の簡単な説明】
【0019】
【図1】本発明の製造方法によって得られたエルゴチオネインのHPLCクロマトグラム(波長:254nm)を示す。
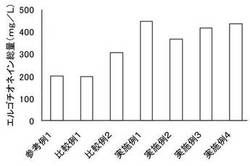
【図2】タモギタケ菌糸体の液体培養において、FEM培地へのアミノ酸の添加とエルゴチオネイン収量の関係を示すグラフである。メチオニンを添加した実施例1は、無添加(参考例1)、ヒスチジン添加(比較例1)やシステイン添加(比較例2)と比べて、エルゴチオネイン収量が顕著に増加する。さらに、メチオニン存在下でシステイン及び/又はヒスチジンを添加した実施例2〜4では、これらの併用による相乗効果が見られる。
【図3】FEM培地中のメチオニンの添加濃度と、タモギタケ菌糸体中のエルゴチオネイン含量との関係を示すグラフである。メチオニン濃度が0.5mM以上で、エルゴチオネインの収量が増加し、10mM付近で最高値に達する。
【図4】現在、判明しているエルゴチオネインの生合成経路を示す。図中、Aはヒスチジン、Bはヘルシニン、Cはシステイン、そして、Dはエルゴチオネインを示す。
【発明を実施するための形態】
【0020】
本発明のエルゴチオネインの製造方法の一実施態様を以下に詳細に説明する。本発明の製法は、タモギタケの菌糸体を培養し、生成した菌糸体からエルゴチオネインを抽出する工程を含む。培養は液体培養が好ましい。
【0021】
タモギタケの菌株をポテトデキストロース寒天(PDA)培地、酵母エキス寒天培地、麦芽エキス寒天培地等で平面培養したものを保存菌株とする。タモギタケの菌株は特に制限されないが、例えば北海道に自生する野生種より分離し、継代したもの(合同会社クリエーション保有)等が挙げられる。
【0022】
上記保存菌株を平面培養した菌そうからタモギタケを抜き取り、液体培地表面に接種する。培地としては、例えばFGM培地(25gグルコース、2g酵母エキス、1gグルタミン酸、0.5mビオチン、0.lgチアミン、2gKH2PO4、0.5gMgSO4、5mL0.1M−FeCl3、5mL0.1M−MnSO4/1L)、酵母エキス培地、麦芽エキス培地等が挙げられる。振とう培養したものをホモゲナイザー等で撹拌することにより、液体種菌を得る。
【0023】
上記液体種菌を例えば120℃の温度で15分間殺菌し、放冷したものをFGM培地等に加え、通常、20〜30℃、好ましくは23〜27℃の温度で5〜20日間、好ましくは12〜17日間の一次培養を行う。
【0024】
上記一次培養後、さらにメチオニンを添加し、20〜30℃、好ましくは23〜27℃の温度で、さらに5〜20日間、好ましくは12〜17日間の二次培養を行う。ここで、メチオニンの添加濃度は、通常、0.5mM以上でよく、好ましくは0.5mM以上であり、さらに好ましくは1mM以上、特に好ましくは5mM以上である。添加濃度の上限は、15mM以上の添加では濃度に見合った効果が得られないことから、15mM未満が好ましい。
【0025】
エルゴチオネインの増収を図るために、上記メチオニンを添加する際に、ヒスチジン、システイン、シスチン及びタウリンからなる群から選ばれる少なくとも一種(以下、ヒスチジン等という)を添加することが好ましく、特に好ましくは、ヒスチジン及び/又はシステインを添加する。メチオニンとヒスチジン等とを併用する場合のメチオニンの添加濃度は、0.5〜50mMが好ましくは、さらに好ましくは5〜20mMである。ヒスチジン等の添加濃度は、0.5〜50mMが好ましく、さらに好ましくは5〜20mMである。
【0026】
培養期間が終了したら、菌糸体からエルゴチオネインを抽出する。抽出には、ろ別した菌糸体をそのまま用いてもよく、あるいは、ろ別した菌糸体を乾燥後、粉砕してから用いてもよい。乾燥には、凍結乾燥、天日乾燥、熱風乾燥、真空乾燥、通気乾燥、減圧乾燥等が用いられる。
【0027】
抽出溶媒には、メタノール、エタノール、イソプロパノール、アセトン等の有機溶媒及び水や熱水を用いることができる。好ましくは、メタノール、エタノール等である。抽出溶媒を加えた後、適宜、超音波処理をかけながらエルゴチオネインを抽出する。抽出温度は、通常、10〜30℃、好ましくは22〜27℃である。
【0028】
得られた抽出液を、遠心分離、フィルタろ過、限外ろ過、ゲルろ過、溶媒抽出、クロマトグラフィ(吸着クロマトグラフィ、疎水クロマトグラフィ、陽イオン交換クロマトグラフィ、陰イオン交換クロマトグラフィ、逆相クロマトグラフィ等)、結晶化、活性炭処理等の常法により精製することができる。例えば、抽出液を遠心分離し、上澄み部を0.45μmのろ紙でろ過する。このろ過物を凍結乾燥等の乾燥手段にかけて乾燥物として保存することも可能である。
【0029】
精製したエルゴチオネインの定量は、例えば高速液体クロマトグラフィ(HPLC)、逆相HPLC等を用いることができる。測定条件は、例えば後述の参考例1に示すものが挙げられる。
【実施例】
【0030】
以下に、本発明の実施例を示すことにより、本発明をより詳細に説明する。しかし、本発明は、以下の実施例に限定されるものではない。
〔参考例1及び2〕菌種試験
1.菌株
タモギタケ(Pleurotus cornucopiae var. citrinopileatus)の菌糸体(北海道に自生する野生種より分離し、継代したもの(合同会社クリエーション保有))及びシイタケ(Lentinula edodes)の菌糸体(福岡県に自生する野生種より分離し、継代したもの(合同会社クリエーション保有))を、それぞれ、ポテトデキストロース寒天(PDA)培地で平面培養したものを保存菌株とした。
【0031】
2.一次培養
基本培地としてFGM培地(25gグルコース、2g酵母エキス、1gグルタミン酸、0.5mビオチン、0.lgチアミン、2gKH2PO4、0.5gMgSO4、5mL0.1M−FeCl3、5mL0.1M−MnSO4/1L)200mLを500ml容三角フラスコに加えた。予め平面培養した菌そうから、タモギタケ又はシイタケの直径5mmのディスクを抜き取り、液体培地表面に接種した。25℃、100rpmで1日間振とう培養したものを、ホモゲナイザーで10000rpm×10秒間、撹拌した。これを、液体種菌として用いた。
【0032】
上記液体種菌を120℃、1.2kg/cm2で15分間殺菌し、放冷した100m1のFGM培地に5mlの液体種菌を加え、14日間の一次培養を行った。
【0033】
3.エルゴチオネインの精製
上記培養期間が終了した時点で、菌糸体をろ別し、凍結乾燥した。この試料を粉砕後、10倍量の80%メタノールを加え、超音波で90分間抽出を行った。抽出液を4℃、12000rpm×5分間、遠心分離し、上澄み部を0.45μmのメンブランでろ過した。
【0034】
培養期間が終了した時点で、菌糸体をろ別し、凍結乾燥した。この試料を粉砕後、10倍量の80%メタノールを加え、超音波で90分間抽出を行った。抽出液を4℃、12000rpm×5分間、遠心分離し、上澄み部を0.45μmのメンブランでろ過した。
【0035】
4.エルゴチオネイン含量の測定
エルゴチオネイン含量の測定のために、HPLC分析を行った。測定条件は、以下のとおりである。
HPLC分析装置:JASCO PU−2089、日本分光株式会社製
カラム:JASCO Crestpak C18S 4.6mm×150mn
移動相:50mM−リン酸ナトリウム緩衝液、3%アセトニトリル、0、1%トリエチルアミン、
流量:1mL/min
カラム温度:40℃
波長:254mm (JASCO GNB−2075UV)
【0036】
図1に参考例1のタモギタケ菌糸体から得られたエルゴチオネインのHPLCクロマトグラムを示す。吸収スペクトルから求めたエルゴチオネイン含量を表1に示す。
【0037】
【表1】

【0038】
表1の結果から、キノコの菌糸体の液体培養からエルゴチオネインを抽出する場合、その菌種はタモギタケが良いことが再確認された。
【0039】
〔実施例1〜4〕アミノ酸添加試験
タモギタケの液体培養において、前駆体やそれに関連する化合物を培養液中に添加して、菌糸体量やエルゴチオネインの含有量を検討した。参考例1のタモギタケの一次培養液に、さらに、表2に示すアミノ酸を表2に示す濃度で添加して、14日間の二次培養を行った。得られた二次培養液からのエルゴチオネインの精製と含量測定を、参考例1と同様の手順で行った。結果を表2及び図2に示す。
【0040】
【表2】

【0041】
表2及び図2の結果から、以下のことがわかる。参考例1と比較例1との対比では、エルゴチオネインの生合成の原料であるヒスチジンを培地に添加しても、エルゴチオネインの収量は増加しない。同じく、参考例1と比較例2との対比では、エルゴチオネインの原料であるシステインを添加すると、収量が若干増加する。一方、メチオニンを添加した実施例1では、システインの場合よりも格段に増加する。図1に示すように、エルゴチオネインの生合成の原料はヒスチジンとシステインであるところ、原料に関与しないメチオニンの添加がエルゴチオネインの収量増に寄与することは全く意外なことである。
【0042】
さらに、実施例2〜4では、メチオニン(実施例1)、システイン(比較例2)及びヒスチジン(比較例1)から予想されるよりも高い収量を得た。例えば、実施例2の収量の相加平均値は、202+(448-202)/2+(199−202)/2=323mg/Lと予想されるところ、実際は、368mgLとなり、相加平均よりも14%アップした。同様に、実施例3の予想収量は377mg/Lとなるところ、実際は416mg/Lと相加平均値より11%アップした。実施例4の予想収量は375mg/Lとなるところ、実際は437mg/Lと相加平均値より15%アップした。このように、メチオニンとシステイン及び/又はヒスチジンとの併用は、エルゴチオネインの収量増に相乗的に作用することが今回判明した。
【0043】
〔実施例5〜9〕メチオニンの添加濃度試験
メチオニンの最適添加濃度を検討した。参考例1のタモギタケの一次培養物に、メチオニンを表3に示す濃度で添加し、さらに14日間の二次培養を行った。
【0044】
二次培養液のエルゴチオネイン含量を、参考例1と同様の手順で測定した。結果を表3及び図3に示す。
【0045】
【表3】

【0046】
表3及び図3から、メチオニンの添加濃度の下限は、0.5mM以上であり、好ましくは1mM以上、さらに好ましくは5mM以上であることが判明した。添加濃度の上限について15mMの添加で濃度に見合った効果が得られないことから、15mM未満が好ましいことが判明した。
【技術分野】
【0001】
本発明は、エルゴチオネインの製造方法に関し、より詳細には、タモギタケの菌糸体からエルゴチオネインを高い収量で製造する方法に関する。
【背景技術】
【0002】
エルゴチオネイン(Ergothioneine)は、1909年にM、C、Tanretによって麦角(ergot)から初めて単離されたアミノ酸の一種である。チオ(thio)は硫黄原子を意味するところ、エルゴチオネインは、麦角から単離されたイオウ原子を含む化合物として命名されたことになる。
【0003】
1911年に、G.BargerとA.J.Ewrnsが、エルゴチオネインの化学構造を、化学式1に示すチオールヒスチジンのベタインであると決定した。
【化1】

【0004】
この化合物は、1920年代になって、意外にも動物の血液中に存在することが明らかとなった。現在、エルゴチオネインは、図1に示す経路でヒスチジンから生合成される。エルゴチオネイン中のイオウ原子は、システインから供給される。
【0005】
エルゴチオネインは、抗酸化作用や抗老化作用が有することが知られており(非特許文献1及び2)、化粧品、食品、医薬、飼料等へ利用されている。
【0006】
エルゴチオネインは、哺乳類の体内では合成されない。したがって、エルゴチオネインを外部から摂取する必要がある。エルゴチオネインの製造方法としては、化学合成法、エルゴチオネインを含有する子のう菌や担子菌、動物血液等から抽出する方法、エルゴチオネインを産生する子のう菌や担子菌を培養後、エルゴチオネインを抽出精製する方法、発酵法等ある。
【0007】
例えば、特開2007−300916(エルゴチオネインの製造方法、特許文献1)及び特開2008−110988(エルゴチオネインの製造方法、特許文献2)には、エルゴチオネイン含有のきのこを溶媒中で粉砕しつつ抽出したエルゴチオネイン含有抽出物を、吸着クロマトグラフィで分画後、分画液のうちエルゴチオネインを含有する液を高速液体クロマトグラフィによって分離精製する、エルゴチオネインの製造方法が開示されている。エルゴチオネイン含有のきのこは、タモギタケ、ヒラタケ、エリンギ及びエノキタケが好ましい。これらの製造方法によれば、エルゴチオネインを高収量かつ安全に得られるとされる。
【0008】
特開2009−161498(エルゴチオネインの製造方法、特許文献3)には、これまでにエルゴチオネイン生産能を有することが知られていないフミツキタケ属、オオイチョウタケ属、スギタケ属又はキシメジ属のキノコよりエルゴチオネインを抽出する、エルゴチオネインの製造方法が開示されている。特開2009−249356(エルゴチオネインの製造方法、特許文献4)には、これまでにエルゴチオネイン生産能を有することが知られていないエノキタケ属、サンゴハリタケ属、シメジ属、ブナハリタケ属、キコブタケ属又はショウゲンジ属のキノコよりエルゴチオネインを抽出する、エルゴチオネインの製造方法が開示されている。これらの製造方法によれば、エルゴチオネイン生産能力の高いキノコからエルゴチオネインを効率的に製造できるとされる。
【0009】
特開2009−159920(菌糸体培養によるエルゴチオネインの製造方法、特許文献5)には、キノコを菌糸体培養し、生成した菌糸体からエルゴチオネインを抽出することを特徴とする、エルゴチオネインの製造方法が開示される。マイタケ属に属するアンニンコウ、ハラタケ属に属するヒメマツタケにおいて、子実体と比較して菌糸体のエルゴチオネイン含量が有意に高いとされる。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2007−300916
【特許文献2】特開2008−110988
【特許文献3】特開2009−161498
【特許文献4】特開2009−249356
【特許文献5】特開2009−159920
【非特許文献】
【0011】
【非特許文献1】岡野由利、「希少アミノ酸エルゴチオネインは皮膚の老化を抑制する」、Fragrance Journal 2008−3、pp81−85
【非特許文献2】Dong KK, et.al.“A comparison of the relative antioxidant potency of L−ergothioneine and idebenone” J Cosmet Dermatol. 2007 Sep;6(3):183−8
【発明の概要】
【発明が解決しようとする課題】
【0012】
従来技術に知られるとおり、エルゴチオネインは、キシメジ科ヒラタケ属のタモギタケ(Pleurotus cornucopiae var. citrinopileatus)に高含有される。タモギタケは、食用キノコであり、安全である。そこで、本発明の目的は、エルゴチオネインの産生能力の高いタモギタケの培養方法を改善することにより、エルゴチオネインをさらに高い収量で製造する方法を提供することにある。
【課題を解決するための手段】
【0013】
本発明者は、上記課題を鋭意検討した結果、培地中にメチオニンを添加すると、エルゴチオネインの収量が増加することを発見し、本発明に至った。すなわち、本発明は、タモギタケの菌糸体を培養し、生成した菌糸体からエルゴチオネインを抽出することを含むエルゴチオネインの製造方法であって、前記培養を、メチオニンを含む培地内で行うことを特徴とする、前記製造方法を提供する。エルゴチオネインの生合成にはヒスチジンと硫黄原子を有するシステインが関与することがわかっている。今回、原料であるこれらの成分の添加では増収がかなわず、メチオニンの添加が有効であることは、従来技術から予想のつかない全く意外なことである。
【0014】
本発明者は、メチオニンとシステイン及び/又はヒスチジンとの併用には、エルゴチオネイン収量増の相乗的効果があることを発見した。したがって、前記培地は、さらに、システイン及び/又はヒスチジンを含むことが好ましい。
【0015】
メチオニンンの濃度は、0.5mM以上15mM未満であることが好ましい。
【発明の効果】
【0016】
本発明のエルゴチオネインの製造方法によれば、培地中にメチオニンを添加したために、タモギタケ菌糸体の液体培養においてエルゴチオネインの総収量が顕著に増加する。本発明の製法によれば、エルゴチオネインを安全かつ安価に提供できる。得られたエルゴチオネインは、シワ防止、皮膚老化防止、真皮コラーゲン減少抑制、MMP−1活性抑制、育毛等の機能を有する化粧品、医薬品、食品等の有効成分として使用が期待される。
【0017】
さらに、メチオニンの存在下でヒスチジン及び/又はシステインを添加すると、エルゴチオネインの収量が顕著に増加する。
【0018】
培地中へのメチオニンの添加濃度を0.5mM以上15mM未満とすることで、エルゴチオネインの最も効率的な増収が可能である。
【図面の簡単な説明】
【0019】
【図1】本発明の製造方法によって得られたエルゴチオネインのHPLCクロマトグラム(波長:254nm)を示す。
【図2】タモギタケ菌糸体の液体培養において、FEM培地へのアミノ酸の添加とエルゴチオネイン収量の関係を示すグラフである。メチオニンを添加した実施例1は、無添加(参考例1)、ヒスチジン添加(比較例1)やシステイン添加(比較例2)と比べて、エルゴチオネイン収量が顕著に増加する。さらに、メチオニン存在下でシステイン及び/又はヒスチジンを添加した実施例2〜4では、これらの併用による相乗効果が見られる。
【図3】FEM培地中のメチオニンの添加濃度と、タモギタケ菌糸体中のエルゴチオネイン含量との関係を示すグラフである。メチオニン濃度が0.5mM以上で、エルゴチオネインの収量が増加し、10mM付近で最高値に達する。
【図4】現在、判明しているエルゴチオネインの生合成経路を示す。図中、Aはヒスチジン、Bはヘルシニン、Cはシステイン、そして、Dはエルゴチオネインを示す。
【発明を実施するための形態】
【0020】
本発明のエルゴチオネインの製造方法の一実施態様を以下に詳細に説明する。本発明の製法は、タモギタケの菌糸体を培養し、生成した菌糸体からエルゴチオネインを抽出する工程を含む。培養は液体培養が好ましい。
【0021】
タモギタケの菌株をポテトデキストロース寒天(PDA)培地、酵母エキス寒天培地、麦芽エキス寒天培地等で平面培養したものを保存菌株とする。タモギタケの菌株は特に制限されないが、例えば北海道に自生する野生種より分離し、継代したもの(合同会社クリエーション保有)等が挙げられる。
【0022】
上記保存菌株を平面培養した菌そうからタモギタケを抜き取り、液体培地表面に接種する。培地としては、例えばFGM培地(25gグルコース、2g酵母エキス、1gグルタミン酸、0.5mビオチン、0.lgチアミン、2gKH2PO4、0.5gMgSO4、5mL0.1M−FeCl3、5mL0.1M−MnSO4/1L)、酵母エキス培地、麦芽エキス培地等が挙げられる。振とう培養したものをホモゲナイザー等で撹拌することにより、液体種菌を得る。
【0023】
上記液体種菌を例えば120℃の温度で15分間殺菌し、放冷したものをFGM培地等に加え、通常、20〜30℃、好ましくは23〜27℃の温度で5〜20日間、好ましくは12〜17日間の一次培養を行う。
【0024】
上記一次培養後、さらにメチオニンを添加し、20〜30℃、好ましくは23〜27℃の温度で、さらに5〜20日間、好ましくは12〜17日間の二次培養を行う。ここで、メチオニンの添加濃度は、通常、0.5mM以上でよく、好ましくは0.5mM以上であり、さらに好ましくは1mM以上、特に好ましくは5mM以上である。添加濃度の上限は、15mM以上の添加では濃度に見合った効果が得られないことから、15mM未満が好ましい。
【0025】
エルゴチオネインの増収を図るために、上記メチオニンを添加する際に、ヒスチジン、システイン、シスチン及びタウリンからなる群から選ばれる少なくとも一種(以下、ヒスチジン等という)を添加することが好ましく、特に好ましくは、ヒスチジン及び/又はシステインを添加する。メチオニンとヒスチジン等とを併用する場合のメチオニンの添加濃度は、0.5〜50mMが好ましくは、さらに好ましくは5〜20mMである。ヒスチジン等の添加濃度は、0.5〜50mMが好ましく、さらに好ましくは5〜20mMである。
【0026】
培養期間が終了したら、菌糸体からエルゴチオネインを抽出する。抽出には、ろ別した菌糸体をそのまま用いてもよく、あるいは、ろ別した菌糸体を乾燥後、粉砕してから用いてもよい。乾燥には、凍結乾燥、天日乾燥、熱風乾燥、真空乾燥、通気乾燥、減圧乾燥等が用いられる。
【0027】
抽出溶媒には、メタノール、エタノール、イソプロパノール、アセトン等の有機溶媒及び水や熱水を用いることができる。好ましくは、メタノール、エタノール等である。抽出溶媒を加えた後、適宜、超音波処理をかけながらエルゴチオネインを抽出する。抽出温度は、通常、10〜30℃、好ましくは22〜27℃である。
【0028】
得られた抽出液を、遠心分離、フィルタろ過、限外ろ過、ゲルろ過、溶媒抽出、クロマトグラフィ(吸着クロマトグラフィ、疎水クロマトグラフィ、陽イオン交換クロマトグラフィ、陰イオン交換クロマトグラフィ、逆相クロマトグラフィ等)、結晶化、活性炭処理等の常法により精製することができる。例えば、抽出液を遠心分離し、上澄み部を0.45μmのろ紙でろ過する。このろ過物を凍結乾燥等の乾燥手段にかけて乾燥物として保存することも可能である。
【0029】
精製したエルゴチオネインの定量は、例えば高速液体クロマトグラフィ(HPLC)、逆相HPLC等を用いることができる。測定条件は、例えば後述の参考例1に示すものが挙げられる。
【実施例】
【0030】
以下に、本発明の実施例を示すことにより、本発明をより詳細に説明する。しかし、本発明は、以下の実施例に限定されるものではない。
〔参考例1及び2〕菌種試験
1.菌株
タモギタケ(Pleurotus cornucopiae var. citrinopileatus)の菌糸体(北海道に自生する野生種より分離し、継代したもの(合同会社クリエーション保有))及びシイタケ(Lentinula edodes)の菌糸体(福岡県に自生する野生種より分離し、継代したもの(合同会社クリエーション保有))を、それぞれ、ポテトデキストロース寒天(PDA)培地で平面培養したものを保存菌株とした。
【0031】
2.一次培養
基本培地としてFGM培地(25gグルコース、2g酵母エキス、1gグルタミン酸、0.5mビオチン、0.lgチアミン、2gKH2PO4、0.5gMgSO4、5mL0.1M−FeCl3、5mL0.1M−MnSO4/1L)200mLを500ml容三角フラスコに加えた。予め平面培養した菌そうから、タモギタケ又はシイタケの直径5mmのディスクを抜き取り、液体培地表面に接種した。25℃、100rpmで1日間振とう培養したものを、ホモゲナイザーで10000rpm×10秒間、撹拌した。これを、液体種菌として用いた。
【0032】
上記液体種菌を120℃、1.2kg/cm2で15分間殺菌し、放冷した100m1のFGM培地に5mlの液体種菌を加え、14日間の一次培養を行った。
【0033】
3.エルゴチオネインの精製
上記培養期間が終了した時点で、菌糸体をろ別し、凍結乾燥した。この試料を粉砕後、10倍量の80%メタノールを加え、超音波で90分間抽出を行った。抽出液を4℃、12000rpm×5分間、遠心分離し、上澄み部を0.45μmのメンブランでろ過した。
【0034】
培養期間が終了した時点で、菌糸体をろ別し、凍結乾燥した。この試料を粉砕後、10倍量の80%メタノールを加え、超音波で90分間抽出を行った。抽出液を4℃、12000rpm×5分間、遠心分離し、上澄み部を0.45μmのメンブランでろ過した。
【0035】
4.エルゴチオネイン含量の測定
エルゴチオネイン含量の測定のために、HPLC分析を行った。測定条件は、以下のとおりである。
HPLC分析装置:JASCO PU−2089、日本分光株式会社製
カラム:JASCO Crestpak C18S 4.6mm×150mn
移動相:50mM−リン酸ナトリウム緩衝液、3%アセトニトリル、0、1%トリエチルアミン、
流量:1mL/min
カラム温度:40℃
波長:254mm (JASCO GNB−2075UV)
【0036】
図1に参考例1のタモギタケ菌糸体から得られたエルゴチオネインのHPLCクロマトグラムを示す。吸収スペクトルから求めたエルゴチオネイン含量を表1に示す。
【0037】
【表1】

【0038】
表1の結果から、キノコの菌糸体の液体培養からエルゴチオネインを抽出する場合、その菌種はタモギタケが良いことが再確認された。
【0039】
〔実施例1〜4〕アミノ酸添加試験
タモギタケの液体培養において、前駆体やそれに関連する化合物を培養液中に添加して、菌糸体量やエルゴチオネインの含有量を検討した。参考例1のタモギタケの一次培養液に、さらに、表2に示すアミノ酸を表2に示す濃度で添加して、14日間の二次培養を行った。得られた二次培養液からのエルゴチオネインの精製と含量測定を、参考例1と同様の手順で行った。結果を表2及び図2に示す。
【0040】
【表2】

【0041】
表2及び図2の結果から、以下のことがわかる。参考例1と比較例1との対比では、エルゴチオネインの生合成の原料であるヒスチジンを培地に添加しても、エルゴチオネインの収量は増加しない。同じく、参考例1と比較例2との対比では、エルゴチオネインの原料であるシステインを添加すると、収量が若干増加する。一方、メチオニンを添加した実施例1では、システインの場合よりも格段に増加する。図1に示すように、エルゴチオネインの生合成の原料はヒスチジンとシステインであるところ、原料に関与しないメチオニンの添加がエルゴチオネインの収量増に寄与することは全く意外なことである。
【0042】
さらに、実施例2〜4では、メチオニン(実施例1)、システイン(比較例2)及びヒスチジン(比較例1)から予想されるよりも高い収量を得た。例えば、実施例2の収量の相加平均値は、202+(448-202)/2+(199−202)/2=323mg/Lと予想されるところ、実際は、368mgLとなり、相加平均よりも14%アップした。同様に、実施例3の予想収量は377mg/Lとなるところ、実際は416mg/Lと相加平均値より11%アップした。実施例4の予想収量は375mg/Lとなるところ、実際は437mg/Lと相加平均値より15%アップした。このように、メチオニンとシステイン及び/又はヒスチジンとの併用は、エルゴチオネインの収量増に相乗的に作用することが今回判明した。
【0043】
〔実施例5〜9〕メチオニンの添加濃度試験
メチオニンの最適添加濃度を検討した。参考例1のタモギタケの一次培養物に、メチオニンを表3に示す濃度で添加し、さらに14日間の二次培養を行った。
【0044】
二次培養液のエルゴチオネイン含量を、参考例1と同様の手順で測定した。結果を表3及び図3に示す。
【0045】
【表3】

【0046】
表3及び図3から、メチオニンの添加濃度の下限は、0.5mM以上であり、好ましくは1mM以上、さらに好ましくは5mM以上であることが判明した。添加濃度の上限について15mMの添加で濃度に見合った効果が得られないことから、15mM未満が好ましいことが判明した。
【特許請求の範囲】
【請求項1】
タモギタケの菌糸体を培養し、生成した菌糸体からエルゴチオネインを抽出することを含むエルゴチオネインの製造方法であって、前記培養を、メチオニンを含む培地内で行うことを特徴とする、前記製造方法。
【請求項2】
前記培地が、さらに、システイン及び/又はヒスチジンを含むことを特徴とする、請求項1に記載のエルゴチオネインの製造方法。
【請求項3】
前記メチオニンンの濃度が、0.5mM以上15mM未満であることを特徴とする、請求項1又は2に記載のエルゴチオネインの製造方法。
【請求項1】
タモギタケの菌糸体を培養し、生成した菌糸体からエルゴチオネインを抽出することを含むエルゴチオネインの製造方法であって、前記培養を、メチオニンを含む培地内で行うことを特徴とする、前記製造方法。
【請求項2】
前記培地が、さらに、システイン及び/又はヒスチジンを含むことを特徴とする、請求項1に記載のエルゴチオネインの製造方法。
【請求項3】
前記メチオニンンの濃度が、0.5mM以上15mM未満であることを特徴とする、請求項1又は2に記載のエルゴチオネインの製造方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2012−105618(P2012−105618A)
【公開日】平成24年6月7日(2012.6.7)
【国際特許分類】
【出願番号】特願2010−258567(P2010−258567)
【出願日】平成22年11月19日(2010.11.19)
【特許番号】特許第4865083号(P4865083)
【特許公報発行日】平成24年2月1日(2012.2.1)
【出願人】(510047878)
【Fターム(参考)】
【公開日】平成24年6月7日(2012.6.7)
【国際特許分類】
【出願日】平成22年11月19日(2010.11.19)
【特許番号】特許第4865083号(P4865083)
【特許公報発行日】平成24年2月1日(2012.2.1)
【出願人】(510047878)

【Fターム(参考)】
[ Back to top ]

