エレクトロスプレー質量分析を用いたマイクロアレイの読取りのためのサンプリングプローブ
【課題】エレクトロスプレーを基にした自動サンプリングシステムおよび分析方法によって、被分析物を有する表面アレイスポットから試料を得る。
【解決手段】システムは、少なくとも1個のプローブを含み、そのプローブは、少なくとも1種の溶離溶媒を複数のスポットのそれぞれに流すための入口と、前記被分析物を前記スポットから送出するための出口とを含む。スポットに対してプローブを移動させていずれのスポットのサンプリングも可能にするために、自動位置決めシステムが設けられている。プローブに流動連通する投入口を有するエレクトロスプレーイオン源が、被分析物を受けて、被分析物からイオンを発生させる。イオン源は、被分析物を同定する分析のための構造、好ましくは質量分析計に発生したイオンを提供する。プローブは、アレイスポット表面の周囲に沿って密閉シールを形成する表面接触プローブであってもよい。
【解決手段】システムは、少なくとも1個のプローブを含み、そのプローブは、少なくとも1種の溶離溶媒を複数のスポットのそれぞれに流すための入口と、前記被分析物を前記スポットから送出するための出口とを含む。スポットに対してプローブを移動させていずれのスポットのサンプリングも可能にするために、自動位置決めシステムが設けられている。プローブに流動連通する投入口を有するエレクトロスプレーイオン源が、被分析物を受けて、被分析物からイオンを発生させる。イオン源は、被分析物を同定する分析のための構造、好ましくは質量分析計に発生したイオンを提供する。プローブは、アレイスポット表面の周囲に沿って密閉シールを形成する表面接触プローブであってもよい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は一般に、測定物質の運搬、イオン化、その後の分析のための方法および装置に関し、より具体的にはエレクトロスプレー質量分析を利用してアレイ上の複数の試料スポットを分析する方法および装置に関する。
【背景技術】
【0002】
細胞、組織または生物体全体の蛋白質補体の研究はプロテオミクスと呼ばれている。プロテオミクスは、大きな関心を呼んでおり、新しい分析技術が可能になったことで、近年になって大部分がかなりの進歩を遂げた。プロテオミクスの1つのテーマは、生物学的システムが刺激に応答する際のシステム内の蛋白質発現をモニタリングすることである。現在では、2次元ゲル電気泳動(2−DE)はそのような蛋白質補体を測定するための最も一般的で力強い原理である。このアプローチは、複数の試料中にある何千もの蛋白質の発現プロファイリングを支援することができる。
【図面の簡単な説明】
【0028】
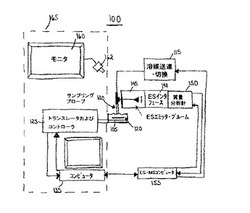
【図1】本発明の実施形態の表面アレイ読取りのためのサンプリングプローブ/ES−MSを示す図。
【図2】(a)は本発明の実施形態の表面接触プローブ、(b)は本発明の実施形態の液絡プローブを示す図。
【図3】ES−MSマイクロアレイ読取りのための原形の液絡プローブおよび付随のシステムの写真を示す図。
【図4】ガラススライド上の4つの平行なアレイスポットからのアポミオグロビン(16951Da)0.5pmol/スポットについて図3で示されたサンプリングプローブおよびシステムを用いてES−MSシステムによって発生されたピーク過渡信号を示す図。
【図5】タンデム質量分析を用いた蛋白質全体からの複数のアミノ酸「配列タグ」の生成を示す質量スペクトルを示す図。
【発明を実施するための最良の形態】
【0029】
表面アレイ内の複数のスポットのいずれかに配置された少なくとも1種の被分析物を検出するシステムが、少なくとも1個のサンプリングプローブを含む。自動位置決め装置は、好ましくはアレイスポットに対してサンプリングプローブを位置あわせし、他のアレイスポットにステッピング動作してその検出工程を自動的に反復し得るように設けられている。そのプローブは、少なくとも1種の溶離溶媒をアレイスポットのいずれかに流動させて被分析物を運搬するための入口と、被分析物をスポットから被分析物をイオン化させるためのエレクトロスプレーイオン源に送出するための出口とを含む。イオンを分析するための構造は、好ましくは質量分析計であり、ES源によって発生するイオンを分析することによって被分析物を同定する。したがって本発明では、一般にアレイサンプリングの従来方法にとって必要だった複雑で多くは信頼性のない外因的標識分析法が必要ない。
【0030】
本発明を利用して、事実上、該当するいずれの表面をサンプリングしてもよい。したがって本発明は、広範囲の潜在的用途を有する。蛋白質マイクロアレイは、そのような用途の1つである。蛋白質マイクロアレイ技術は、急速に成長し急速に拡大する市場である。本発明の幾つかの一般的使用としては、蛋白質間相互作用および薬物発見をはじめとする蛋白質精製、蛋白質発現プロファイリングおよび蛋白質相互作用プロファイリングが挙げられる。この分野の成長の障害となるものは、アレイの感受性分子特異性検出方法の同定であり、これは複雑で多くの場合信頼性外因的標識方法を必要としない。特に、本発明は、被分析物を検出するための標識化を必要としない。
【0031】
蛋白質アレイに関しては、基質表面は、捕捉材料の固定された1つ以上の領域で被覆されてもよい。例えば蛋白質アレイは、複雑な混合物から対応する抗原を捕捉する、アレイ表面に共有結合的に固定された抗体を含んでもよい。異なるスポットは表面に異なる捕捉材料を有してもよい。多くの異なる種類の捕捉材料物質を、抗体、レセプター、リガンド、核酸(例えばDNA)、炭水化物、ゲル(例えば等電点電気泳動ゲル)を含むアレイ基板、および陽イオン、陰イオン、疎水性、親水性表面などのクロマトグラフィー表面に結合させてもよい。分子刷込み材料を捕捉材料として用いてもよい。広範囲の特異性を有し、全種の蛋白質に結合するように表面を設計させることもできるが、それ以外に、特異性が高く、複雑な試料の1種または数種のみの蛋白質に結合するよう設計することもできる。
【0032】
捕捉工程の後、被分析物を捕捉材料に結合させてアレイ上に配置する。その後、好ましくはアレイを適切な洗浄溶媒で洗浄して非特異的結合を減少させる。乾燥工程を利用した後、MALDIのように強力なレーザー光を短時間あてて、アレイ表面の一部から残留蛋白質を脱離させるのではなく、本発明は、1種以上の溶媒を用いて一般にスポットエリア全域から残留蛋白質または他の結合した被分析物を脱離させるものであり、マトリックスの適用や付随の乾燥工程を必要としない。その後、エレクトロスプレーイオン化を利用して被分析物をイオン化し、質量分析などのいずれかの適切な分析技術を用いて発生したイオンを分析する。質量分析は一般には好ましいが、イオン移動性またはイオン移動性と質量分析の組合せが用いられてもよい。ミネソタ州セントポールのTSIインコーポレーティッドから得られるDUSTRAKモデル8520(ITI−044)などの光散乱検出器を分析に用いてもよい。
【0033】
図1は、本発明の実施形態による表面アレイ読取りのためのES−MSサンプリングシステム100を示している。表面アレイ120は、基板(図示しない)上に配置されており、基板は台105上に配置されている。表面アレイ120は複数の離れた相互作用スポット(図示しない)を含む。各スポットは一般に約1mm2未満の面積を有している。システム100は、約0.04mm2の小さなスポット面積、より好ましくは約0.01mm2の小さなスポット面積をサンプリングするように適合されている。
【0034】
アレイ120は、好ましくは表面に捕捉材料を配置させた蛋白質アレイであるが、薄層クロマトグラフィープレート、SDSポリアクリルアミドゲル電気泳動(SDS−PAGE)、等電点電気泳動ゲルおよび固相抽出材料などのいずれの表面アレイであってもよい。例えばスポットは、核酸または抗体などの固定された捕捉材料を表面に有する1個以上の領域を含んでもよい。
【0035】
アレイ基板(図示しない)は、典型的には不活性の無孔性材料である。例えば、シリコン、様々なプラスチックまたはアルミナなどの材料の上に配置されたSiO2の表面層、ガラスが一般に基板材料として用いられてもよい。
【0036】
システム100は1個のサンプリングプローブ130を備えているように示されており、一般には連続読取りシステムとして記載されるが、システムは並列の多重化システムとして構成されてもよい。多重化プローブシステムは試料の処理量を増やすことができる。例えば市販のESシステムには8個までの番号付き噴霧機(indexed sprayers)が設けられている。各噴霧機は各噴霧器からの試料流れを周期的に迅速にサンプリングすることによって平行して運転することができる。単一の質量分析システムが用いられると仮定すると、いずれか1つのエミッターからの噴霧がサンプリングされる時間の合計は、噴霧器の数の逆数を掛けた数に減少する。
【0037】
別の実施形態においては、表面アレイ120の離れたアレイ位置に専用の噴霧器を設けることができる。これは、ESノズルの市販された微細加工アレイによって近々可能になり、表面アレイのより迅速な完全自動化連続読取りが得られる。
【0038】
トランスレータおよびコントローラ125は、好ましくは走査型電気化学顕微鏡(SECM)165と一体化された圧電式トランスレータおよびコントローラであり、アレイ120上に含まれるアレイスポットのいずれかに対してサンプリングプローブ130を位置合わせして、各スポット間をステッピング動作するために設けられる。SECM165は、走査型トンネル顕微鏡および原子力顕微鏡に関係する走査プローブ顕微鏡(SPM)の1種である。SPMは、画像化される表面の上部に小さなプローブチップを走査またはラスタ走査することによって運転される。SECMでは、電気化学活性チップによって電解質溶液中で画像化される。
【0039】
SECMシステムは、実質的に平坦な表面について再現性のあるx、yおよびz位置制御を行うことができ、分解能が1nmを超え、xおよびy走査距離が5cmである。システムはテキサス州オースチンのCHインスツルメンツ社から得られる。この位置分解能および走査距離は、現在用いられる事実上全ての表面装置について十分なものであり、線寸法が約100:mと小さなサイズの相互作用位置を備えた大きく高密な表面アレイを精密かつ完全にサンプリングすることができる。同様の仕様を持つ別の位置決め装置をSECMの代わりに用いてもよい。
【0040】
SECM165は、好ましくはビデオ顕微鏡162およびビデオモニター160、圧電式トランスレータおよびコントローラ125、ならびにSECMコンピュータ135を含む。SECMコンピュータ135は、サンプリングプローブ130とチップアレイ120との相互作用を管理し、アレイ表面に対してサンプリングプローブ130を空間的に位置決めして、被捕捉材料を得てESイオン源145に送達する。サンプリングプローブ130はチップアレイ120に対して移動することができ、またはチップアレイ120は、サンプリングプローブ130に対して移動して、それらを接触させることができる。
【0041】
溶媒送達システム115は、溶離溶媒を含む流体を提供するように適合されている。圧力の差が、流体を推進する。1つの実施形態において、正圧を利用して、流体を推進することができる。しかし一般には、正圧にせずに、アウトプット(output)にかけられた真空を利用することもできる。本明細書で用いられる用語「正圧」は、システムを通過する流体を所望の流速で送達するのに必要な、大気圧を超える圧力を指す。
【0042】
シリンジポンプ、ガス圧または他のポンプシステムを利用してもよい。先に示したように、真空を利用してもよい。真空を利用する1つの実施形態において、ベンチュリ真空効果によって液体を外部に引き出すよう、圧力によって生じる流れを適合させることができる。
【0043】
流体は適切な流体管を通した送達システム115によってサンプリングプローブ130の入口に送達され、そこで溶離溶媒を表面アレイスポットに送出して捕捉された被分析物を離脱させる。その後、溶離溶媒と一緒の被分析物は、サンプリングプローブ130によって、プローブの出口に送出されてスポットを離れ、被分析物をイオン化するためのエレクトロスプレーイオンに送出される。
【0044】
基板(図示しない)は、典型的には無孔性材料で形成されているが、アレイ基板は有孔性材料で形成されていて、各相互作用スポットの位置が有孔性媒体上にあってもよい。つまり、スポットの位置する表面が実質的に有孔である場合、溶媒は、溶媒送達システム115によってアレイを通して交互に押出されて、被分析物を適切なプローブに運搬してもよい。
【0045】
ESイオン源145は、サンプリングプローブ130によって供給された被分析物に由来するイオンを生成し、質量分析計150に供給する。質量分析計は、エレクトロスプレーインターフェース148を含む。質量分析計150は、好ましくは特定の使用目的に応じた走査速度、質量精度、イオン間化学などの必要な性能係数に基づいて選択される。質量分析計150は、好ましくはタンデム質量分析計である。
【0046】
ESイオン源145および質量分析計150は、好ましくは、ES−MSコンピュータ155などによって、コンピュータ制御されている。ES−MSコンピュータ155は、SECMコンピュータ135と分離されていても、またはそれと一体化されていてもよい。
【0047】
本発明を利用するES−MSサンプリングは、MALDI−MSに比較して複数の重要な利点を付与する。ES−MSは、試料を液体溶液中の質量分析計150に導入し、そのため表面アレイ120を液体環境においたままアレイ上の各ポイントで相互作用する成分をサンプリングすることができる。MALDI−MSでは、アレイスポットの分析のために、相互作用が生じるネイティブな液体環境から取り出し、化学マトリックスを適用して脱離およびイオン化を促進し、その後の乾燥工程に入る必要がある。
【0048】
本発明を利用して、相互作用スポット上の材料全てを回収して、質量分析計150に送出することが潜在的に可能であるが、MALDI−MSのようにレーザービームと相互作用するフラクションが少量ではない。その上、ES−MSは、分子量が増加しても、MALDI−MSのように検出レベルが低下することはなかった。その上、最大で約60kDaの分子量までは、質量分解能が低いほどほどの質量分析計であっても、良好な、もしくは+0.002%より良好な(例えば牛アルブミンで+1.3Da)の質量精度を得ることができる。直交イオン注入飛行時間型(O−TOF)またはフーリエ変換質量分析計(FTMS)を具備したESなどのより高性能の質量分析計を選択することによって、より良好な質量測定が得られる。
【0049】
つまり、本発明を用いれば、蛋白質を2種の基本的方法で同定することができる。最初の例は、蛋白質の混合物が存在する場合であっても実施可能な高精度分子量測定に基づいている。適切な機器としては、FTMSおよびO−TOFが挙げられる。イオン間化学および計測を利用して、比較的複雑な蛋白質混合物を分析することもできる。混合物の分析は、MALDI−MS法の利点と考えられる。第2の例では、蛋白質全体のタンデム質量分析から生成した配列タグに基づいて、蛋白質が同定される。FTMS、O−TOFまたはイオン間計測を利用して、配列タグを生成させてもよい。蛋白質同定のこの「トップダウン」アプローチは、MALDI−MSによるチップ読取りでの蛋白質同定で求められる時間のかかる酵素消化法を必要としない。
【0050】
同定のために表面アレイの表面から脱離した被捕捉被分析物(例えば蛋白質)を運搬するサンプリングプローブ130は、好ましくは同軸キャピラリープローブなどのミニチュア多管プローブである。プローブは、溶離溶媒または他の流体の流れを受けるための少なくとも1本の流体管を含む。少なくとも1本の他の流体管は、プローブ130からの流体アウトプットを含み、流体アウトプットは被分析物および1種以上の他の流体を含む。正圧を利用して流体を移動させる場合、典型的な正圧の範囲は、流速、管の口径および長さに依存する。しかし、数psiが一般に最小値で、2000〜3000psiが、一般に最大値である。
【0051】
ES−MSに適合させた、2種の基本的なサンプリングプローブの設計が、図2(a)および2(b)にそれぞれ示した表面接触プローブおよび液絡プローブである。有利には、表面接触プローブは、ほとんどの生物学的相互作用に好ましい自然な設定である液体環境に、スポットを保持させることができる。ES−MSは、試料を液体溶液中の質量分析計に導入するため、表面アレイ120を液体環境においたまま、アレイ上の各ポイントで相互作用する成分をサンプリングすることができる。表面接触プローブは、本明細書に記載の液絡プローブなど他のプローブ設計に比較して、使用され得る溶離溶媒の範囲が拡大する。例えば、液絡プローブは一般に、表面のメニスカスを保持するために表面張力の高い液体を必要とする。表面接触プローブでは、そのような要件はない。
【0052】
適切な圧力差を利用して、流体をプローブ200のアウトプットに推進することができる。例えばアウトプットを真空に吸引しながら、プローブのインプットを大気圧に保持してもよい。あるいはプローブのインプットで正圧を利用してもよい。
【0053】
表面接触プローブ200を、単一の表面アレイスポット210の相対的に上の位置にある位置1と、下の位置にある位置2を図2(a)に示している。示されたスポット210は、固定された捕捉蛋白質206に結合した被捕捉蛋白質208を含み、固定された蛋白質は、ガラス基板などのマイクロアレイ基板材料215上に配置している。プローブ200が位置2にある時に、読取りを実施する。読取りの後、プローブ200がスポット210から離れて(例えば上昇して)位置1に達し、その後、適切な自動位置決め装置が側方に移動して、サンプリングプローブ200を別のアレイスポットと再度、位置合わせする。プローブ200は再度、位置2に降下し、その後次のスポットがサンプリングされる。
【0054】
プローブ200は、好ましくは寸法を合わせることによって個々のアレイスポットを完全に取り囲むのに十分大きく、表面アレイ上の隣接するスポットに達しない程度に十分小さな面積を有している。つまり、表面接触プローブ200は、読取りの際(位置2)サンプリングされているスポットを、表面アレイ上の残余のアレイスポットから隔離させる。オーリング222または他のシーリング装置を用いて、サンプリングの際にひとつのスポットへの流体の流れを隔離することによって、プローブ200に1つのスポットのみをサンプリングさせることができる。
【0055】
表面サンプリングプローブ200は、図1のシステム115などの適切な溶媒送達および切換えシステムから、試薬、洗浄溶媒および溶離溶媒などの流体を流すための外側の管212を備えた同軸プローブとして示されている。2本以上、例えば1本は試薬、1本は洗浄溶媒、そして1本は溶離溶媒とする3本の管を、プローブ200から流体を流すための1本以上の流体管と共に用いることができる。管は事実上、いずれの形状であってもよい。
【0056】
好ましくは、洗浄溶媒およびその後、溶離溶媒を外側の同軸管212に流すことによって、これらの流体をサンプリングプローブ内からスポット上に連続塗布する。この形態では、溶離溶媒がアレイスポット表面上とその上部を流動して、親和力または他の結合相互作用を崩壊させ、サンプリングプローブ200の内側の管214を通して相互作用成分をエレクトロスプレーイオン源(図示しない)に溶離する。エレクトロスプレーイオン源(図示しない)は、好ましくは、被分析物の同定のために質量分析計(図示しない)とインターフェースによって連結している。
【0057】
表面サンプリングプローブ200は、他のプローブ設計を上回る重要な利点を有している。表面接触プローブ200は、表面アレイ上の離れたスポットを、溶離前の外部環境と隔離することができるため、アレイの読取りは、表面アレイが溶液中にあっても実行することができる。この特徴は一般に、他のプローブ設計では混合および希釈の問題があるために得られない。更にこの設計は、アレイ上の所定のスポットを分析する際に、外部の溶媒が隣接するアレイスポットに導入されるのを防ぐ。
【0058】
液絡プローブ250と呼ばれる第2のプローブ環境が、図2(b)に示されている。このプローブ250は、表面接触プローブ200と同様の正圧溶媒送達概念を利用するが、スポット表面210への接触は、図2(b)に示されるとおりの液架橋255または液絡である。スポット表面210は、固定された捕捉蛋白質206に結合した被捕捉蛋白質208を含み、固定された蛋白質は、ガラス基板などのマイクロアレイ基板材料215上に配置されている。
【0059】
プローブ200と同様に、液絡プローブ250は、好ましくは個々のアレイスポットを取り囲む位置になり得るよう十分大きく、サンプリング時に表面アレイ上の隣接するスポットに達しない程度に十分小さくなるように寸法を合わせている。プローブ250への溶媒の流れと、ESの空気圧噴霧化との均衡を保つことよって、所望なら溶媒が連続的に流れ得る自己吸引プローブが得られる。1つのスポットを分析する際に外部溶媒を導入すると、他のスポットが分析される時間に、他のスポットで得られた結果が影響を受ける可能性があるため、液絡プローブ250を使用するには、液体溶液を含まないアレイで分析を行うことを必要としてもよい。加えて、溶液中で分析すると、アレイが浸漬された溶媒が溶離溶媒を希釈する可能性がある。
【0060】
サンプリングプローブ250は、図1のシステム115などの適切な溶媒送達および切換えシステムから、試薬、洗浄溶媒および溶離溶媒などの流体を流すための外側の管262を備えた同軸プローブとして示されている。プローブ250は、被分析物をエレクトロスプレーイオン源(図示しない)に送達するための内側の管264を含む。プローブ200と同様に、2本以上の管を使用することができ、管は事実上、いずれの形状であってもよい。エレクトロスプレーイオン源(図示しない)は、好ましくは、被分析物の同定のために質量分析計(図示しない)とインターフェースで連結されている。1つのスポットからの読取り(例えば、個々の相互作用)の後、サンプリングプローブ200または250が、コンピュータ制御(例えば図1の135および155)の下でアレイ表面から分離されて次のスポットにステッピング動作し、その工程を反復してもよい。液絡部は、適切な走査速度で、表面に保持されながらプローブ200とともに軌道を進むようにしてもよい。これは、薄層クロマトグラフィー(TLC)プレートの読取りを促進する。
【0061】
プローブ200または250のいずれかを用いて、サンプリングスポットを通して各スポットの試薬を工程に連続して運ぶことによって、蛋白質の相互作用、洗浄、および相互作用の崩壊/溶離工程を、それぞれ特定のアレイスポットで行うことができる。例えば、蛋白質をアレイ上に配置された捕捉材料に固定するために、最初に蛋白質が送達され、その後洗浄サイクル、その後溶離溶媒工程を行ってもよい。
【0062】
各スポットは、同一または異なる相互作用物質を用いて、1回以上テストされてもよい。その上、チップを取り巻く液体環境中で容易に分析されるが、「乾燥した」アレイ上で分析を行ってもよい。
【0063】
再度、図1を参照すると、好ましくはエレクトロスプレーインターフェース148を含む質量分析計150を用いて、ESイオン源145からそこに送達される相互作用物質を同定する。これは、分子量のみに基づいて、またはタンデム質量分析によって実行することができる。高分解能の精密な質量測定またはイオン間化学の技術によって促進され得る蛋白質全体のタンデム質量分析を用い、オンラインデータベース検索による蛋白質同定のための配列タグを生成させることができる。
【0064】
蛋白質溶解的消化(proteolytic digest)からのペプチド同定と次の蛋白質データベース検索との組合わせは、複雑な混合物から個々の蛋白質を同定するための強力なツールとなり得る。これは、MALDI−MSチップ読取りによる陽性蛋白質同定に用いられる典型的な手順である。しかしこの手順は、1〜数時間かかる可能性がある。本明細書に記載されたアプローチは、迅速な(分析時間が1秒未満)気相アプローチによって蛋白質同定データを与える。
【0065】
ES−MSでの蛋白質の多重荷電によって、高分子量イオンの解離が促進され、解離生成物の分析によって構造情報が決定される。こうして、酵素消化が不要になる。インタクトな蛋白質の破砕で得られた配列情報のある生成物イオンは、マン他(Mann et al.[1])によって記載された「配列タグ」に類似した生成物イオンスペクトルで同定することができる。MALDI−MSでは、蛋白質イオンが、ほとんど排他的に単一荷電である。それゆえ同様の手順は、一般には可能でない。
【0066】
生成物イオンの電荷状態は、単一から親蛋白質イオンの電荷まで変動し得るため、親イオンの多重荷電は、タンデム質量分析の生成物イオンスペクトルを複雑にする。それゆえ生成物イオンスペクトルは、典型的には様々な質量および電荷のイオンで構成されている。2個以上のイオン間の質量電荷比の開きを測定することによって、この複雑さを克服する可能性が与えられる。これは、例えばFTMS計測によって提供されるような高分解能の精密質量分析能か、またはイオン間プロトン移動化学のいずれかによって実施することができる、後者の場合、生成物イオン集合体全体が、イオン間反応を受け、それによって生成物イオンスペクトルが生じ、単一荷電イオンが優位を占め、ピーク間のm/z間隔がより容易に測定される。
【0067】
液絡概念250を用いたサンプリングプローブの試作品を組立ててテストした。実際のセットアップの図を、図3に示している。原理証明として、ガラス顕微鏡スライドの表面から、蛋白質アポミオグロビンのサンプリングに成功した。溶液中の蛋白質0.5pmolの試料を、ポリテトラフルオロエチレングリッドによって印付けられたスライドの正方形エリア(1mmx1mm)にスポットし、放置して乾燥させた。サンプリングした蛋白質を、質量分析計に溶離して、ピークの過渡変化を生成させた。ピーク過渡変化の終了時に、プローブが表面から持ち上がり次のスポットに移動して、溶離を繰り返した。
【0068】
図4は、スライド上の4つの異なるスポットから蛋白質を溶離するために記録されたピーク過渡変化を示している。このシグナルを生成させるためにモニタリングされたシグナルは、15個のプロトンの電荷、即ちm/z1131.2で(M+15H)+を含む多重荷電蛋白質のシグナルであった。
【0069】
記載されたシステム100を用いると、各アレイ位置の読取りは、典型的な質量分析計では約30秒、または10x10(100スポット)チップアレイでは約50秒を要すると予測される。これは、およそ図4で示された溶離の時間枠である。この読取りは、MALDI−MSを用いてアレイを読取る理論的時間(8.3分または約5秒/スポット)に比べ相対的に長い。しかし、MALDI−MSに必要な酵素消化の時間は1〜数時間と考えられるため、この読取り時間は非常に競合的である。読取り時間は、ESイオン源の電気回路に応じて異なる。試料表面から質量分析計までの移動ラインを通して試料を溶離し、そのライオンを洗浄してアレイ位置分析間のキャリーオーバーを防ぐ必要性によって、読取り時間の大部分が生じる。読取り時の試料の流速は、おそらく最低で約1.0μL/分であろう。
【0070】
例として、図2(b)に示された液絡プローブ200の最適化のためには、内径50μmの10cm長キャピラリーを組込んで、約0.2μLの低容量を得ることになる。1.0μL/分では、この容量をフラッシュするのに約12秒しかかからない。試料全体を溶離して、サンプリングキャピラリーを洗浄するには、一般に複数の溶離容量が必要となる。蛋白質が溶離されると溶媒の流動速度が上昇するため、浄化時間が減少し、そのため読取り時間も減少し得る。
【0071】
先に記載したとおり、イオン間プロトン移動化学では、全体的な生成物イオン集合体がイオン間反応を受けて生成物イオンスペクトルを生成し、それによって単一荷電イオンが優位を占め、ピーク間のm/z間隔がより容易に測定される。近年になり、蛋白質同定のためのイオン間プロトン移動化学的アプローチの実行性の証明が、大腸菌分解産物中のバクテリオファージMS2の同定によって報告された[2]。複雑なマトリックス中のインタクトなウイルスコート蛋白質の多重荷電イオンの衝突活性化によって生じた配列タグを用いて(次にイオン間プロトン移動反応を行って容易に解釈される単一荷電生成物イオンの質量スペクトルを生成させると)、MS2ウイルスの存在を、データベース検索によって容易に検出することができる。これは、図5のデータに示されている。図5に示すように、異なるm/zを有するアミノ酸断片の形態の複数の溶解性配列タグが示される。本発明を利用して、チップ表面から質量分析計までの蛋白質の移動によって生じ得る過渡的な蛋白質信号によって、同質のデータを得ることができる。
【0072】
サンプリングプローブ/ES MS技術は、短いペプチド、インタクトな蛋白質または蛋白質断片、医薬剤候補物質、DNAまたは抗体など、事実上いずれの種類の蛋白質捕捉アレイにも適合性がなければならない。これらは、市販されたものか、またはこのサンプリング技術を用いて社内で製造してもよい。
【0073】
本発明の好ましい実施形態を例示して説明したが、それが本発明を限定するものではないことは明白であろう。当業者は、特許請求の範囲に記載されるとおり、本発明の精神および範囲を逸脱することなく、多数の修正、変更、変形、代替および均等物を得るであろう。
【0074】
参照文献
1.Mann, M.; Wilm. M. 「Error−Tolerant Identification of Peptides in Sequence Databases by Peptide Sequence Tags」 Anal. Chem. 1994, 66, 4390−4399.
2.Cargile, B. J.;McLuckey, S. A.;Stephenson, Jr. J. L. 「Identification of Bacteriophage MS2 Coat Protein from E. Coil Lysates via Ion Trap Collisional Activation of Intact Protein Ions」Anal. Chem. 2001, 73,1277−1285.
【技術分野】
【0001】
本発明は一般に、測定物質の運搬、イオン化、その後の分析のための方法および装置に関し、より具体的にはエレクトロスプレー質量分析を利用してアレイ上の複数の試料スポットを分析する方法および装置に関する。
【背景技術】
【0002】
細胞、組織または生物体全体の蛋白質補体の研究はプロテオミクスと呼ばれている。プロテオミクスは、大きな関心を呼んでおり、新しい分析技術が可能になったことで、近年になって大部分がかなりの進歩を遂げた。プロテオミクスの1つのテーマは、生物学的システムが刺激に応答する際のシステム内の蛋白質発現をモニタリングすることである。現在では、2次元ゲル電気泳動(2−DE)はそのような蛋白質補体を測定するための最も一般的で力強い原理である。このアプローチは、複数の試料中にある何千もの蛋白質の発現プロファイリングを支援することができる。
【図面の簡単な説明】
【0028】
【図1】本発明の実施形態の表面アレイ読取りのためのサンプリングプローブ/ES−MSを示す図。
【図2】(a)は本発明の実施形態の表面接触プローブ、(b)は本発明の実施形態の液絡プローブを示す図。
【図3】ES−MSマイクロアレイ読取りのための原形の液絡プローブおよび付随のシステムの写真を示す図。
【図4】ガラススライド上の4つの平行なアレイスポットからのアポミオグロビン(16951Da)0.5pmol/スポットについて図3で示されたサンプリングプローブおよびシステムを用いてES−MSシステムによって発生されたピーク過渡信号を示す図。
【図5】タンデム質量分析を用いた蛋白質全体からの複数のアミノ酸「配列タグ」の生成を示す質量スペクトルを示す図。
【発明を実施するための最良の形態】
【0029】
表面アレイ内の複数のスポットのいずれかに配置された少なくとも1種の被分析物を検出するシステムが、少なくとも1個のサンプリングプローブを含む。自動位置決め装置は、好ましくはアレイスポットに対してサンプリングプローブを位置あわせし、他のアレイスポットにステッピング動作してその検出工程を自動的に反復し得るように設けられている。そのプローブは、少なくとも1種の溶離溶媒をアレイスポットのいずれかに流動させて被分析物を運搬するための入口と、被分析物をスポットから被分析物をイオン化させるためのエレクトロスプレーイオン源に送出するための出口とを含む。イオンを分析するための構造は、好ましくは質量分析計であり、ES源によって発生するイオンを分析することによって被分析物を同定する。したがって本発明では、一般にアレイサンプリングの従来方法にとって必要だった複雑で多くは信頼性のない外因的標識分析法が必要ない。
【0030】
本発明を利用して、事実上、該当するいずれの表面をサンプリングしてもよい。したがって本発明は、広範囲の潜在的用途を有する。蛋白質マイクロアレイは、そのような用途の1つである。蛋白質マイクロアレイ技術は、急速に成長し急速に拡大する市場である。本発明の幾つかの一般的使用としては、蛋白質間相互作用および薬物発見をはじめとする蛋白質精製、蛋白質発現プロファイリングおよび蛋白質相互作用プロファイリングが挙げられる。この分野の成長の障害となるものは、アレイの感受性分子特異性検出方法の同定であり、これは複雑で多くの場合信頼性外因的標識方法を必要としない。特に、本発明は、被分析物を検出するための標識化を必要としない。
【0031】
蛋白質アレイに関しては、基質表面は、捕捉材料の固定された1つ以上の領域で被覆されてもよい。例えば蛋白質アレイは、複雑な混合物から対応する抗原を捕捉する、アレイ表面に共有結合的に固定された抗体を含んでもよい。異なるスポットは表面に異なる捕捉材料を有してもよい。多くの異なる種類の捕捉材料物質を、抗体、レセプター、リガンド、核酸(例えばDNA)、炭水化物、ゲル(例えば等電点電気泳動ゲル)を含むアレイ基板、および陽イオン、陰イオン、疎水性、親水性表面などのクロマトグラフィー表面に結合させてもよい。分子刷込み材料を捕捉材料として用いてもよい。広範囲の特異性を有し、全種の蛋白質に結合するように表面を設計させることもできるが、それ以外に、特異性が高く、複雑な試料の1種または数種のみの蛋白質に結合するよう設計することもできる。
【0032】
捕捉工程の後、被分析物を捕捉材料に結合させてアレイ上に配置する。その後、好ましくはアレイを適切な洗浄溶媒で洗浄して非特異的結合を減少させる。乾燥工程を利用した後、MALDIのように強力なレーザー光を短時間あてて、アレイ表面の一部から残留蛋白質を脱離させるのではなく、本発明は、1種以上の溶媒を用いて一般にスポットエリア全域から残留蛋白質または他の結合した被分析物を脱離させるものであり、マトリックスの適用や付随の乾燥工程を必要としない。その後、エレクトロスプレーイオン化を利用して被分析物をイオン化し、質量分析などのいずれかの適切な分析技術を用いて発生したイオンを分析する。質量分析は一般には好ましいが、イオン移動性またはイオン移動性と質量分析の組合せが用いられてもよい。ミネソタ州セントポールのTSIインコーポレーティッドから得られるDUSTRAKモデル8520(ITI−044)などの光散乱検出器を分析に用いてもよい。
【0033】
図1は、本発明の実施形態による表面アレイ読取りのためのES−MSサンプリングシステム100を示している。表面アレイ120は、基板(図示しない)上に配置されており、基板は台105上に配置されている。表面アレイ120は複数の離れた相互作用スポット(図示しない)を含む。各スポットは一般に約1mm2未満の面積を有している。システム100は、約0.04mm2の小さなスポット面積、より好ましくは約0.01mm2の小さなスポット面積をサンプリングするように適合されている。
【0034】
アレイ120は、好ましくは表面に捕捉材料を配置させた蛋白質アレイであるが、薄層クロマトグラフィープレート、SDSポリアクリルアミドゲル電気泳動(SDS−PAGE)、等電点電気泳動ゲルおよび固相抽出材料などのいずれの表面アレイであってもよい。例えばスポットは、核酸または抗体などの固定された捕捉材料を表面に有する1個以上の領域を含んでもよい。
【0035】
アレイ基板(図示しない)は、典型的には不活性の無孔性材料である。例えば、シリコン、様々なプラスチックまたはアルミナなどの材料の上に配置されたSiO2の表面層、ガラスが一般に基板材料として用いられてもよい。
【0036】
システム100は1個のサンプリングプローブ130を備えているように示されており、一般には連続読取りシステムとして記載されるが、システムは並列の多重化システムとして構成されてもよい。多重化プローブシステムは試料の処理量を増やすことができる。例えば市販のESシステムには8個までの番号付き噴霧機(indexed sprayers)が設けられている。各噴霧機は各噴霧器からの試料流れを周期的に迅速にサンプリングすることによって平行して運転することができる。単一の質量分析システムが用いられると仮定すると、いずれか1つのエミッターからの噴霧がサンプリングされる時間の合計は、噴霧器の数の逆数を掛けた数に減少する。
【0037】
別の実施形態においては、表面アレイ120の離れたアレイ位置に専用の噴霧器を設けることができる。これは、ESノズルの市販された微細加工アレイによって近々可能になり、表面アレイのより迅速な完全自動化連続読取りが得られる。
【0038】
トランスレータおよびコントローラ125は、好ましくは走査型電気化学顕微鏡(SECM)165と一体化された圧電式トランスレータおよびコントローラであり、アレイ120上に含まれるアレイスポットのいずれかに対してサンプリングプローブ130を位置合わせして、各スポット間をステッピング動作するために設けられる。SECM165は、走査型トンネル顕微鏡および原子力顕微鏡に関係する走査プローブ顕微鏡(SPM)の1種である。SPMは、画像化される表面の上部に小さなプローブチップを走査またはラスタ走査することによって運転される。SECMでは、電気化学活性チップによって電解質溶液中で画像化される。
【0039】
SECMシステムは、実質的に平坦な表面について再現性のあるx、yおよびz位置制御を行うことができ、分解能が1nmを超え、xおよびy走査距離が5cmである。システムはテキサス州オースチンのCHインスツルメンツ社から得られる。この位置分解能および走査距離は、現在用いられる事実上全ての表面装置について十分なものであり、線寸法が約100:mと小さなサイズの相互作用位置を備えた大きく高密な表面アレイを精密かつ完全にサンプリングすることができる。同様の仕様を持つ別の位置決め装置をSECMの代わりに用いてもよい。
【0040】
SECM165は、好ましくはビデオ顕微鏡162およびビデオモニター160、圧電式トランスレータおよびコントローラ125、ならびにSECMコンピュータ135を含む。SECMコンピュータ135は、サンプリングプローブ130とチップアレイ120との相互作用を管理し、アレイ表面に対してサンプリングプローブ130を空間的に位置決めして、被捕捉材料を得てESイオン源145に送達する。サンプリングプローブ130はチップアレイ120に対して移動することができ、またはチップアレイ120は、サンプリングプローブ130に対して移動して、それらを接触させることができる。
【0041】
溶媒送達システム115は、溶離溶媒を含む流体を提供するように適合されている。圧力の差が、流体を推進する。1つの実施形態において、正圧を利用して、流体を推進することができる。しかし一般には、正圧にせずに、アウトプット(output)にかけられた真空を利用することもできる。本明細書で用いられる用語「正圧」は、システムを通過する流体を所望の流速で送達するのに必要な、大気圧を超える圧力を指す。
【0042】
シリンジポンプ、ガス圧または他のポンプシステムを利用してもよい。先に示したように、真空を利用してもよい。真空を利用する1つの実施形態において、ベンチュリ真空効果によって液体を外部に引き出すよう、圧力によって生じる流れを適合させることができる。
【0043】
流体は適切な流体管を通した送達システム115によってサンプリングプローブ130の入口に送達され、そこで溶離溶媒を表面アレイスポットに送出して捕捉された被分析物を離脱させる。その後、溶離溶媒と一緒の被分析物は、サンプリングプローブ130によって、プローブの出口に送出されてスポットを離れ、被分析物をイオン化するためのエレクトロスプレーイオンに送出される。
【0044】
基板(図示しない)は、典型的には無孔性材料で形成されているが、アレイ基板は有孔性材料で形成されていて、各相互作用スポットの位置が有孔性媒体上にあってもよい。つまり、スポットの位置する表面が実質的に有孔である場合、溶媒は、溶媒送達システム115によってアレイを通して交互に押出されて、被分析物を適切なプローブに運搬してもよい。
【0045】
ESイオン源145は、サンプリングプローブ130によって供給された被分析物に由来するイオンを生成し、質量分析計150に供給する。質量分析計は、エレクトロスプレーインターフェース148を含む。質量分析計150は、好ましくは特定の使用目的に応じた走査速度、質量精度、イオン間化学などの必要な性能係数に基づいて選択される。質量分析計150は、好ましくはタンデム質量分析計である。
【0046】
ESイオン源145および質量分析計150は、好ましくは、ES−MSコンピュータ155などによって、コンピュータ制御されている。ES−MSコンピュータ155は、SECMコンピュータ135と分離されていても、またはそれと一体化されていてもよい。
【0047】
本発明を利用するES−MSサンプリングは、MALDI−MSに比較して複数の重要な利点を付与する。ES−MSは、試料を液体溶液中の質量分析計150に導入し、そのため表面アレイ120を液体環境においたままアレイ上の各ポイントで相互作用する成分をサンプリングすることができる。MALDI−MSでは、アレイスポットの分析のために、相互作用が生じるネイティブな液体環境から取り出し、化学マトリックスを適用して脱離およびイオン化を促進し、その後の乾燥工程に入る必要がある。
【0048】
本発明を利用して、相互作用スポット上の材料全てを回収して、質量分析計150に送出することが潜在的に可能であるが、MALDI−MSのようにレーザービームと相互作用するフラクションが少量ではない。その上、ES−MSは、分子量が増加しても、MALDI−MSのように検出レベルが低下することはなかった。その上、最大で約60kDaの分子量までは、質量分解能が低いほどほどの質量分析計であっても、良好な、もしくは+0.002%より良好な(例えば牛アルブミンで+1.3Da)の質量精度を得ることができる。直交イオン注入飛行時間型(O−TOF)またはフーリエ変換質量分析計(FTMS)を具備したESなどのより高性能の質量分析計を選択することによって、より良好な質量測定が得られる。
【0049】
つまり、本発明を用いれば、蛋白質を2種の基本的方法で同定することができる。最初の例は、蛋白質の混合物が存在する場合であっても実施可能な高精度分子量測定に基づいている。適切な機器としては、FTMSおよびO−TOFが挙げられる。イオン間化学および計測を利用して、比較的複雑な蛋白質混合物を分析することもできる。混合物の分析は、MALDI−MS法の利点と考えられる。第2の例では、蛋白質全体のタンデム質量分析から生成した配列タグに基づいて、蛋白質が同定される。FTMS、O−TOFまたはイオン間計測を利用して、配列タグを生成させてもよい。蛋白質同定のこの「トップダウン」アプローチは、MALDI−MSによるチップ読取りでの蛋白質同定で求められる時間のかかる酵素消化法を必要としない。
【0050】
同定のために表面アレイの表面から脱離した被捕捉被分析物(例えば蛋白質)を運搬するサンプリングプローブ130は、好ましくは同軸キャピラリープローブなどのミニチュア多管プローブである。プローブは、溶離溶媒または他の流体の流れを受けるための少なくとも1本の流体管を含む。少なくとも1本の他の流体管は、プローブ130からの流体アウトプットを含み、流体アウトプットは被分析物および1種以上の他の流体を含む。正圧を利用して流体を移動させる場合、典型的な正圧の範囲は、流速、管の口径および長さに依存する。しかし、数psiが一般に最小値で、2000〜3000psiが、一般に最大値である。
【0051】
ES−MSに適合させた、2種の基本的なサンプリングプローブの設計が、図2(a)および2(b)にそれぞれ示した表面接触プローブおよび液絡プローブである。有利には、表面接触プローブは、ほとんどの生物学的相互作用に好ましい自然な設定である液体環境に、スポットを保持させることができる。ES−MSは、試料を液体溶液中の質量分析計に導入するため、表面アレイ120を液体環境においたまま、アレイ上の各ポイントで相互作用する成分をサンプリングすることができる。表面接触プローブは、本明細書に記載の液絡プローブなど他のプローブ設計に比較して、使用され得る溶離溶媒の範囲が拡大する。例えば、液絡プローブは一般に、表面のメニスカスを保持するために表面張力の高い液体を必要とする。表面接触プローブでは、そのような要件はない。
【0052】
適切な圧力差を利用して、流体をプローブ200のアウトプットに推進することができる。例えばアウトプットを真空に吸引しながら、プローブのインプットを大気圧に保持してもよい。あるいはプローブのインプットで正圧を利用してもよい。
【0053】
表面接触プローブ200を、単一の表面アレイスポット210の相対的に上の位置にある位置1と、下の位置にある位置2を図2(a)に示している。示されたスポット210は、固定された捕捉蛋白質206に結合した被捕捉蛋白質208を含み、固定された蛋白質は、ガラス基板などのマイクロアレイ基板材料215上に配置している。プローブ200が位置2にある時に、読取りを実施する。読取りの後、プローブ200がスポット210から離れて(例えば上昇して)位置1に達し、その後、適切な自動位置決め装置が側方に移動して、サンプリングプローブ200を別のアレイスポットと再度、位置合わせする。プローブ200は再度、位置2に降下し、その後次のスポットがサンプリングされる。
【0054】
プローブ200は、好ましくは寸法を合わせることによって個々のアレイスポットを完全に取り囲むのに十分大きく、表面アレイ上の隣接するスポットに達しない程度に十分小さな面積を有している。つまり、表面接触プローブ200は、読取りの際(位置2)サンプリングされているスポットを、表面アレイ上の残余のアレイスポットから隔離させる。オーリング222または他のシーリング装置を用いて、サンプリングの際にひとつのスポットへの流体の流れを隔離することによって、プローブ200に1つのスポットのみをサンプリングさせることができる。
【0055】
表面サンプリングプローブ200は、図1のシステム115などの適切な溶媒送達および切換えシステムから、試薬、洗浄溶媒および溶離溶媒などの流体を流すための外側の管212を備えた同軸プローブとして示されている。2本以上、例えば1本は試薬、1本は洗浄溶媒、そして1本は溶離溶媒とする3本の管を、プローブ200から流体を流すための1本以上の流体管と共に用いることができる。管は事実上、いずれの形状であってもよい。
【0056】
好ましくは、洗浄溶媒およびその後、溶離溶媒を外側の同軸管212に流すことによって、これらの流体をサンプリングプローブ内からスポット上に連続塗布する。この形態では、溶離溶媒がアレイスポット表面上とその上部を流動して、親和力または他の結合相互作用を崩壊させ、サンプリングプローブ200の内側の管214を通して相互作用成分をエレクトロスプレーイオン源(図示しない)に溶離する。エレクトロスプレーイオン源(図示しない)は、好ましくは、被分析物の同定のために質量分析計(図示しない)とインターフェースによって連結している。
【0057】
表面サンプリングプローブ200は、他のプローブ設計を上回る重要な利点を有している。表面接触プローブ200は、表面アレイ上の離れたスポットを、溶離前の外部環境と隔離することができるため、アレイの読取りは、表面アレイが溶液中にあっても実行することができる。この特徴は一般に、他のプローブ設計では混合および希釈の問題があるために得られない。更にこの設計は、アレイ上の所定のスポットを分析する際に、外部の溶媒が隣接するアレイスポットに導入されるのを防ぐ。
【0058】
液絡プローブ250と呼ばれる第2のプローブ環境が、図2(b)に示されている。このプローブ250は、表面接触プローブ200と同様の正圧溶媒送達概念を利用するが、スポット表面210への接触は、図2(b)に示されるとおりの液架橋255または液絡である。スポット表面210は、固定された捕捉蛋白質206に結合した被捕捉蛋白質208を含み、固定された蛋白質は、ガラス基板などのマイクロアレイ基板材料215上に配置されている。
【0059】
プローブ200と同様に、液絡プローブ250は、好ましくは個々のアレイスポットを取り囲む位置になり得るよう十分大きく、サンプリング時に表面アレイ上の隣接するスポットに達しない程度に十分小さくなるように寸法を合わせている。プローブ250への溶媒の流れと、ESの空気圧噴霧化との均衡を保つことよって、所望なら溶媒が連続的に流れ得る自己吸引プローブが得られる。1つのスポットを分析する際に外部溶媒を導入すると、他のスポットが分析される時間に、他のスポットで得られた結果が影響を受ける可能性があるため、液絡プローブ250を使用するには、液体溶液を含まないアレイで分析を行うことを必要としてもよい。加えて、溶液中で分析すると、アレイが浸漬された溶媒が溶離溶媒を希釈する可能性がある。
【0060】
サンプリングプローブ250は、図1のシステム115などの適切な溶媒送達および切換えシステムから、試薬、洗浄溶媒および溶離溶媒などの流体を流すための外側の管262を備えた同軸プローブとして示されている。プローブ250は、被分析物をエレクトロスプレーイオン源(図示しない)に送達するための内側の管264を含む。プローブ200と同様に、2本以上の管を使用することができ、管は事実上、いずれの形状であってもよい。エレクトロスプレーイオン源(図示しない)は、好ましくは、被分析物の同定のために質量分析計(図示しない)とインターフェースで連結されている。1つのスポットからの読取り(例えば、個々の相互作用)の後、サンプリングプローブ200または250が、コンピュータ制御(例えば図1の135および155)の下でアレイ表面から分離されて次のスポットにステッピング動作し、その工程を反復してもよい。液絡部は、適切な走査速度で、表面に保持されながらプローブ200とともに軌道を進むようにしてもよい。これは、薄層クロマトグラフィー(TLC)プレートの読取りを促進する。
【0061】
プローブ200または250のいずれかを用いて、サンプリングスポットを通して各スポットの試薬を工程に連続して運ぶことによって、蛋白質の相互作用、洗浄、および相互作用の崩壊/溶離工程を、それぞれ特定のアレイスポットで行うことができる。例えば、蛋白質をアレイ上に配置された捕捉材料に固定するために、最初に蛋白質が送達され、その後洗浄サイクル、その後溶離溶媒工程を行ってもよい。
【0062】
各スポットは、同一または異なる相互作用物質を用いて、1回以上テストされてもよい。その上、チップを取り巻く液体環境中で容易に分析されるが、「乾燥した」アレイ上で分析を行ってもよい。
【0063】
再度、図1を参照すると、好ましくはエレクトロスプレーインターフェース148を含む質量分析計150を用いて、ESイオン源145からそこに送達される相互作用物質を同定する。これは、分子量のみに基づいて、またはタンデム質量分析によって実行することができる。高分解能の精密な質量測定またはイオン間化学の技術によって促進され得る蛋白質全体のタンデム質量分析を用い、オンラインデータベース検索による蛋白質同定のための配列タグを生成させることができる。
【0064】
蛋白質溶解的消化(proteolytic digest)からのペプチド同定と次の蛋白質データベース検索との組合わせは、複雑な混合物から個々の蛋白質を同定するための強力なツールとなり得る。これは、MALDI−MSチップ読取りによる陽性蛋白質同定に用いられる典型的な手順である。しかしこの手順は、1〜数時間かかる可能性がある。本明細書に記載されたアプローチは、迅速な(分析時間が1秒未満)気相アプローチによって蛋白質同定データを与える。
【0065】
ES−MSでの蛋白質の多重荷電によって、高分子量イオンの解離が促進され、解離生成物の分析によって構造情報が決定される。こうして、酵素消化が不要になる。インタクトな蛋白質の破砕で得られた配列情報のある生成物イオンは、マン他(Mann et al.[1])によって記載された「配列タグ」に類似した生成物イオンスペクトルで同定することができる。MALDI−MSでは、蛋白質イオンが、ほとんど排他的に単一荷電である。それゆえ同様の手順は、一般には可能でない。
【0066】
生成物イオンの電荷状態は、単一から親蛋白質イオンの電荷まで変動し得るため、親イオンの多重荷電は、タンデム質量分析の生成物イオンスペクトルを複雑にする。それゆえ生成物イオンスペクトルは、典型的には様々な質量および電荷のイオンで構成されている。2個以上のイオン間の質量電荷比の開きを測定することによって、この複雑さを克服する可能性が与えられる。これは、例えばFTMS計測によって提供されるような高分解能の精密質量分析能か、またはイオン間プロトン移動化学のいずれかによって実施することができる、後者の場合、生成物イオン集合体全体が、イオン間反応を受け、それによって生成物イオンスペクトルが生じ、単一荷電イオンが優位を占め、ピーク間のm/z間隔がより容易に測定される。
【0067】
液絡概念250を用いたサンプリングプローブの試作品を組立ててテストした。実際のセットアップの図を、図3に示している。原理証明として、ガラス顕微鏡スライドの表面から、蛋白質アポミオグロビンのサンプリングに成功した。溶液中の蛋白質0.5pmolの試料を、ポリテトラフルオロエチレングリッドによって印付けられたスライドの正方形エリア(1mmx1mm)にスポットし、放置して乾燥させた。サンプリングした蛋白質を、質量分析計に溶離して、ピークの過渡変化を生成させた。ピーク過渡変化の終了時に、プローブが表面から持ち上がり次のスポットに移動して、溶離を繰り返した。
【0068】
図4は、スライド上の4つの異なるスポットから蛋白質を溶離するために記録されたピーク過渡変化を示している。このシグナルを生成させるためにモニタリングされたシグナルは、15個のプロトンの電荷、即ちm/z1131.2で(M+15H)+を含む多重荷電蛋白質のシグナルであった。
【0069】
記載されたシステム100を用いると、各アレイ位置の読取りは、典型的な質量分析計では約30秒、または10x10(100スポット)チップアレイでは約50秒を要すると予測される。これは、およそ図4で示された溶離の時間枠である。この読取りは、MALDI−MSを用いてアレイを読取る理論的時間(8.3分または約5秒/スポット)に比べ相対的に長い。しかし、MALDI−MSに必要な酵素消化の時間は1〜数時間と考えられるため、この読取り時間は非常に競合的である。読取り時間は、ESイオン源の電気回路に応じて異なる。試料表面から質量分析計までの移動ラインを通して試料を溶離し、そのライオンを洗浄してアレイ位置分析間のキャリーオーバーを防ぐ必要性によって、読取り時間の大部分が生じる。読取り時の試料の流速は、おそらく最低で約1.0μL/分であろう。
【0070】
例として、図2(b)に示された液絡プローブ200の最適化のためには、内径50μmの10cm長キャピラリーを組込んで、約0.2μLの低容量を得ることになる。1.0μL/分では、この容量をフラッシュするのに約12秒しかかからない。試料全体を溶離して、サンプリングキャピラリーを洗浄するには、一般に複数の溶離容量が必要となる。蛋白質が溶離されると溶媒の流動速度が上昇するため、浄化時間が減少し、そのため読取り時間も減少し得る。
【0071】
先に記載したとおり、イオン間プロトン移動化学では、全体的な生成物イオン集合体がイオン間反応を受けて生成物イオンスペクトルを生成し、それによって単一荷電イオンが優位を占め、ピーク間のm/z間隔がより容易に測定される。近年になり、蛋白質同定のためのイオン間プロトン移動化学的アプローチの実行性の証明が、大腸菌分解産物中のバクテリオファージMS2の同定によって報告された[2]。複雑なマトリックス中のインタクトなウイルスコート蛋白質の多重荷電イオンの衝突活性化によって生じた配列タグを用いて(次にイオン間プロトン移動反応を行って容易に解釈される単一荷電生成物イオンの質量スペクトルを生成させると)、MS2ウイルスの存在を、データベース検索によって容易に検出することができる。これは、図5のデータに示されている。図5に示すように、異なるm/zを有するアミノ酸断片の形態の複数の溶解性配列タグが示される。本発明を利用して、チップ表面から質量分析計までの蛋白質の移動によって生じ得る過渡的な蛋白質信号によって、同質のデータを得ることができる。
【0072】
サンプリングプローブ/ES MS技術は、短いペプチド、インタクトな蛋白質または蛋白質断片、医薬剤候補物質、DNAまたは抗体など、事実上いずれの種類の蛋白質捕捉アレイにも適合性がなければならない。これらは、市販されたものか、またはこのサンプリング技術を用いて社内で製造してもよい。
【0073】
本発明の好ましい実施形態を例示して説明したが、それが本発明を限定するものではないことは明白であろう。当業者は、特許請求の範囲に記載されるとおり、本発明の精神および範囲を逸脱することなく、多数の修正、変更、変形、代替および均等物を得るであろう。
【0074】
参照文献
1.Mann, M.; Wilm. M. 「Error−Tolerant Identification of Peptides in Sequence Databases by Peptide Sequence Tags」 Anal. Chem. 1994, 66, 4390−4399.
2.Cargile, B. J.;McLuckey, S. A.;Stephenson, Jr. J. L. 「Identification of Bacteriophage MS2 Coat Protein from E. Coil Lysates via Ion Trap Collisional Activation of Intact Protein Ions」Anal. Chem. 2001, 73,1277−1285.
【特許請求の範囲】
【請求項1】
表面アレイ上、または表面アレイ内に配置された被分析物を分析する方法において、
少なくとも1種の被分析物を保持するスポットを少なくとも1個含む表面アレイを用意する工程と、
溶離溶媒が前記被分析物の少なくとも一部を前記スポットから送出するように、少なくとも1種の溶離溶媒を前記スポット全体に流動させる工程と、
エレクトロスプレーイオン源を用いて、前記送出される被分析物の少なくとも一部を複数のイオン断片にイオン化する工程と、
前記複数のイオン断片を分析して前記被分析物を分析する工程とを備え、
前記スポットの周囲に密閉された囲いを形成するように適合された多軸表面接触プローブを含む少なくとも1個のプローブが前記流動工程で用いられ、
前記表面接触プローブは前記密閉された囲いを形成するためのオーリングシールを含む方法。
【請求項2】
分析のために複数のスポットを含む表面アレイから試料を得る自動サンプリングシステムにおいて、
少なくとも1種の被分析物を有する前記複数のスポットの内の関連するスポットに少なくとも1種の溶離溶媒を流すための入口を含む少なくとも1個のプローブであって、前記被分析物を前記スポットから送出するための出口を更に含む前記少なくとも1個のプローブと、
前記スポットに対して前記プローブを移動させて前記スポットのいずれかをサンプリングする自動位置決めシステムと、
前記被分析物を受けて、前記被分析物からイオンを発生するために前記プローブに流動連通するインプットを有するエレクトロスプレーイオン源と、
前記エレクトロスプレーイオン源のために前記イオンを受けて前記イオンを分析するための構造とを備え、
前記プローブは前記スポットの周囲に密閉された囲いを形成するように適合された多軸表面接触プローブを含み、
前記表面接触プローブは前記密閉された囲いを形成するためのオーリングシールを含む、前記自動サンプリングシステム。
【請求項3】
分析のためにスポットの表面アレイから試料を得るための多軸サンプリングプローブであって、
少なくとも1種の溶離溶媒を少なくとも1種の被分析物を有する複数のスポットのそれぞれに流すための入口と、前記測定物質を前記スポットから送出するための出口とを含み、前記スポットの周囲の密閉された囲いを形成するためのオーリングシールを含む前記多軸サンプリングプローブ。
【請求項1】
表面アレイ上、または表面アレイ内に配置された被分析物を分析する方法において、
少なくとも1種の被分析物を保持するスポットを少なくとも1個含む表面アレイを用意する工程と、
溶離溶媒が前記被分析物の少なくとも一部を前記スポットから送出するように、少なくとも1種の溶離溶媒を前記スポット全体に流動させる工程と、
エレクトロスプレーイオン源を用いて、前記送出される被分析物の少なくとも一部を複数のイオン断片にイオン化する工程と、
前記複数のイオン断片を分析して前記被分析物を分析する工程とを備え、
前記スポットの周囲に密閉された囲いを形成するように適合された多軸表面接触プローブを含む少なくとも1個のプローブが前記流動工程で用いられ、
前記表面接触プローブは前記密閉された囲いを形成するためのオーリングシールを含む方法。
【請求項2】
分析のために複数のスポットを含む表面アレイから試料を得る自動サンプリングシステムにおいて、
少なくとも1種の被分析物を有する前記複数のスポットの内の関連するスポットに少なくとも1種の溶離溶媒を流すための入口を含む少なくとも1個のプローブであって、前記被分析物を前記スポットから送出するための出口を更に含む前記少なくとも1個のプローブと、
前記スポットに対して前記プローブを移動させて前記スポットのいずれかをサンプリングする自動位置決めシステムと、
前記被分析物を受けて、前記被分析物からイオンを発生するために前記プローブに流動連通するインプットを有するエレクトロスプレーイオン源と、
前記エレクトロスプレーイオン源のために前記イオンを受けて前記イオンを分析するための構造とを備え、
前記プローブは前記スポットの周囲に密閉された囲いを形成するように適合された多軸表面接触プローブを含み、
前記表面接触プローブは前記密閉された囲いを形成するためのオーリングシールを含む、前記自動サンプリングシステム。
【請求項3】
分析のためにスポットの表面アレイから試料を得るための多軸サンプリングプローブであって、
少なくとも1種の溶離溶媒を少なくとも1種の被分析物を有する複数のスポットのそれぞれに流すための入口と、前記測定物質を前記スポットから送出するための出口とを含み、前記スポットの周囲の密閉された囲いを形成するためのオーリングシールを含む前記多軸サンプリングプローブ。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2009−133868(P2009−133868A)
【公開日】平成21年6月18日(2009.6.18)
【国際特許分類】
【出願番号】特願2009−53183(P2009−53183)
【出願日】平成21年3月6日(2009.3.6)
【分割の表示】特願2003−586909(P2003−586909)の分割
【原出願日】平成15年4月9日(2003.4.9)
【出願人】(301027074)ユーティ―バテル エルエルシー (19)
【Fターム(参考)】
【公開日】平成21年6月18日(2009.6.18)
【国際特許分類】
【出願日】平成21年3月6日(2009.3.6)
【分割の表示】特願2003−586909(P2003−586909)の分割
【原出願日】平成15年4月9日(2003.4.9)
【出願人】(301027074)ユーティ―バテル エルエルシー (19)
【Fターム(参考)】
[ Back to top ]

