エロンガーゼ遺伝子及びそれらの使用
【課題】ポリ不飽和酸の伸長に関与する4つの遺伝子(即ち「エロンガーゼ」)の同定及びそれらの使用。
【解決手段】これらの遺伝子のうちの2つは、モノ不飽和脂肪酸の伸長にも関与している。特に、エロンガーゼは、γリノレン酸(GLA)のジホモガンマリノレン酸(DGLA)への変換及びDGLA又は20:4n−3のエイコサペンタエン酸(EPA)への変換において利用される。DGLAは、薬学的組成物、栄養組成物、動物飼料及び化粧品のようなその他の製品へ添加されうる、アラキドン酸(AA)、ドコサヘキサエン酸(DHA)、EPA、アドレン酸、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸のようなポリ不飽和脂肪酸の製造において利用されうる。
【解決手段】これらの遺伝子のうちの2つは、モノ不飽和脂肪酸の伸長にも関与している。特に、エロンガーゼは、γリノレン酸(GLA)のジホモガンマリノレン酸(DGLA)への変換及びDGLA又は20:4n−3のエイコサペンタエン酸(EPA)への変換において利用される。DGLAは、薬学的組成物、栄養組成物、動物飼料及び化粧品のようなその他の製品へ添加されうる、アラキドン酸(AA)、ドコサヘキサエン酸(DHA)、EPA、アドレン酸、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸のようなポリ不飽和脂肪酸の製造において利用されうる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、長鎖ポリ不飽和脂肪酸の伸長に関与するいくつかの遺伝子(即ち「エロンガーゼ(elongase)」)の同定及びそれらの使用に関する。特に、エロンガーゼ酵素は、脂肪酸の他の脂肪酸への変換において利用される。例えば、エロンガーゼは、ガンマリノレン酸(GLA)のジホモ−γ−リノレン酸(DGLA、20:3n−6)への変換及びステアリドン酸(stearidonic acid)(STA、18:4n−3)の(n−3)−エイコサテトラエン酸(20:4n−3)への変換を触媒する。エロンガーゼは、アラキドン酸(AA、20:4n−6)のアドレン酸(ADA、22:4n−6)への変換、エイコサペンタエン酸(EPA、20:5n−3)のω3−ドコサペンタエン酸(22:5n−3)への変換及びα−リノレン酸(ALA、18:3n−3)の20:3n−3への変換も触媒する。例えば、DGLAは、薬学的組成物、栄養組成物、動物飼料及び化粧品のようなその他の製品へ添加されうる、アラキドン酸(AA)のようなその他のポリ不飽和脂肪酸(PUFA)の製造において利用されうる。
【背景技術】
【0002】
(背景情報)
過去に同定されたエロンガーゼは、それらが作用する基質に関して異なっている。さらに、それらは、動物及び植物の両方に存在する。哺乳動物において見出されるものは、飽和脂肪酸、モノ不飽和脂肪酸及びポリ不飽和脂肪酸に作用する能力を有する。対照的に、植物において見出されるものは、飽和脂肪酸又はモノ不飽和脂肪酸に特異的である。従って、植物においてポリ不飽和脂肪酸を生成させるためには、PUFA特異的なエロンガーゼが必要である。
【0003】
植物においても動物においても、伸長過程は、4段階のメカニズムの結果であると考えられている(Lassnerら,The Plant Cell 8:281−292(1996))。CoAが、アシル・キャリヤーである。第1段階は、マロニル−CoAと長鎖アシル−CoAとの縮合を含み、それにより二酸化酸素と、アシル部分の2炭素原子が伸長されたβ−ケトアシル−CoAとが生じる。続く反応には、β−ヒドロキシアシル−CoAへの還元、エノイル−CoAへの脱水及び第二の還元が含まれ、それにより伸長されたアシル−CoAが生じる。最初の縮合反応は、基質特異的な段階であるのみならず、律速段階でもある。
【0004】
前述のように、エロンガーゼ、より具体的に、PUFAを基質として利用するエロンガーゼは、多くの重要な機能を有する長鎖ポリ不飽和脂肪酸の生成において重要である。例えば、PUFAは、細胞膜の重要な成分であり、細胞膜にリン脂質の形態で見出される。PUFAは、哺乳動物のプロスタサイクリン、エイコサノイド、ロイコトリエン及びプロスタグランジンの前駆体としてもはたらく。さらに、PUFAは、発達中の幼児の脳の適切な発達、並びに組織の形成及び修復に必要である。PUFAの生物学的重要性を考慮して、それら及びそれらの生成に至る中間体を効率的に製造すべく、努力がなされている。
【0005】
エロンガーゼ(elo)(図1参照)を含む多数の酵素が、PUFAの生合成に関与している。例えば、リノレン酸(LA、18:2−△9,12又は18:2n−6)は、△12デサチュレースにより、オレイン酸(OA、18:1−△9又は18:1n−9)から生成される。GLA(18:3−△6,9,12)は、△6−デサチュラーゼにより、リノレン酸から生成される。AA(20:4−△5,8,11,14)は、△5−デサチュラーゼにより、ジホモ−γ−リノレン酸(DGLA、20:3−△8,11,14)から生成される。前述のように、DGLAは、エロンガーゼにより、GLAから生成される。
【0006】
動物は、Δ9位より先を不飽和化することができず、従ってオレイン酸をリノレン酸に変換することができないことに注意しなければならない。同様に、動物は、Δ15デサチュラーゼ活性を欠いているため、α−リノレン酸(ALA、18:3−△9,12,15又は18:3n−3)を合成することができない。しかし、α−リノレン酸は、哺乳動物及び藻類においては、Δ6−デサチュラーゼ(PCT公開第96/13591号参照:米国特許第5,552,306号も参照のこと)により、ステアリドン酸(STA、18:4−Δ6,9,12,15)へ変換され、続いて(n−3)−エイコサテトラエン酸(20:4−Δ8,11,14,17又は20:4n−3)へ伸長されうる。このポリ不飽和脂肪酸(即ち、20:4−Δ8,11,14,17)は、次いで、Δ5−デサチュラーゼにより、エイコサペンタエン酸(EPA、20:5−Δ5,8,11,14,17)へと変換されうる。真菌及び植物を含むその他の真核生物は、12位(PCT公開第94/11516号及び米国特許第5,443,974号を参照のこと)及び15位(PCT公開第93/11245号参照)の炭素を不飽和化する酵素を有する。従って、動物の主要なポリ不飽和脂肪酸は、食事、並びに/又はリノール酸もしくはα−リノレン酸の不飽和化及び伸長に由来する。哺乳動物が、これらの必須長鎖脂肪酸を生成させることができないことを考慮すると、これらの脂肪酸を天然に生成させる種から、PUFA生合成に関与している遺伝子を単離し、商業的な品質の一つ又は複数のPUFAの製造を提供するように改変されうる、微生物、植物又は動物の系において、これらの遺伝子を発現させることは非常に重要である。従って、エロンガーゼ酵素、その酵素をコードする遺伝子及びこの酵素を製造する組み換え法が、明らかに必要とされている。さらに、天然に存在する油よりも高いレベルのPUFAを含有する油、及び新規なPUFAが濃縮された油が必要とされている。そのような油は、エロンガーゼ遺伝子の単離及び発現によってのみ作製されうる。
【0007】
最も重要な長鎖PUFAの一つは、前述のように、アラキドン酸(AA)である。AAは、繊維状真菌に見出され、肝臓及び副腎を含む哺乳動物の組織からも精製されうる。前述のように、AAのDGLAからの生成は、Δ5−デサチュラーゼにより触媒され、DGLAのγ−リノレン酸(GLA)からの生成は、エロンガーゼにより触媒される。しかし、本発明以前には、長鎖PUFA、特に、AA、エイコサペンタエン酸(EPA)、アドレン酸、ドコサヘキサエン酸(DHA、22:6n−3)、ω3−ドコサペンタエン酸(22:5n−3)又はω6−ドコサペンタエン酸(22:5n−6)の生成のための経路において、基質脂肪酸に対する活性を有するエロンガーゼは、同定されていなかった。
【0008】
2つの遺伝子が、エロンガーゼ遺伝子に関する本研究において重要であると考えられた。特に、ホホバβ−ケトアシル−補酵素Aシンターゼ(KCS)又はホホバKCS(ジェンバンク(GenBank)登録番号U37088)は、脂肪酸アシル−CoA伸長経路の最初の反応(即ち、マロニル−CoAと長鎖アシル−CoAとの縮合(Lassner ら,The Plant Cell 8:281−292(1996)))を触媒する。ホホバKCSの基質選択性は、18:0、20:0、20:1、18:1、22:1、22:0及び16:0である。サッカロミセス・セレビシエ(Saccharomcyes cerevisiae)エロンガーゼ(ELO2)も、長鎖の飽和脂肪酸及びモノ不飽和脂肪酸の変換を触媒し、高レベルの22:0、24:0を生成させ、18:0、18:1、20:0、20:1、22:0、22:1及び24:1も生成させる(Ohら,The Journal of Biological Chemistry 272(28):17376−17384(1997);ELO2の配列を含むヌクレオチド配列に関しては、米国特許第5,484,724号の参照のこと;実施例Vに記載されているグリコシル化阻害因子の配列の考察に関しては、PCT公開第88/07577号を参照のこと)。これらの2つの遺伝子間の相同性の考慮に基づき、PUFA−エロンガーゼ活性に関する発現スクリーニングにより、モルチエレラ・アルピナ(Mortierella alpina)における長鎖PUFA特異的エロンガーゼの研究を開始した。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】国際公開第96/13591号
【特許文献2】米国特許第5,552,306号明細書
【特許文献3】国際公開第94/11516号
【特許文献4】米国特許第5,443,974号明細書
【特許文献5】国際公開第93/11245号
【特許文献6】米国特許第5,484,724号明細書
【特許文献7】国際公開第88/07577号
【非特許文献】
【0010】
【非特許文献1】Lassnerら,The Plant Cell 8:281−292(1996)
【非特許文献2】Ohら,The Journal of Biological Chemistry 272(28):17376−17384(1997)
【発明の概要】
【0011】
本発明は、配列番号1(図6)に示されたヌクレオチド配列の少なくとも約50%と一致するか、又は相補的である、単離されたヌクレオチド配列に関する。この単離された配列は、配列番号1により表されうる。その配列は、ポリ不飽和脂肪酸又はモノ不飽和脂肪酸を基質として利用する、機能的活性を有するエロンガーゼをコードする。特に、その配列は、モルチエレラ属の真菌に由来するものであってよく、特に、モルチエレラ・アルピナから単離されうる。
【0012】
本発明は、前記ヌクレオチド配列によりコードされる精製されたタンパク質も含み、さらに、ポリ不飽和脂肪酸又はモノ不飽和脂肪酸を伸長し、かつ前記ヌクレオチド配列によりコードされる精製されたタンパク質のアミノ酸配列と少なくとも約50%のアミノ酸類似性を有する、精製されたポリペプチドも含む。
【0013】
さらに、本発明は、a)配列番号1(図6)により表されたヌクレオチド配列を単離する工程、b)i)プロモーター、およびii)該プロモーターと機能的に連結された単離されたヌクレオチド配列を含むベクターを構築する工程、並びにc)エロンガーゼ酵素の発現にとって十分な時間及び条件で、宿主細胞へベクターを導入する工程を含む、エロンガーゼ酵素を製造する方法を包含する。宿主細胞は、真核細胞であっても、又は原核細胞であってもよい。
【0014】
原核細胞は、例えば、大腸菌(E. coli)細胞、シアノバクテリア細胞又は枯草菌(B. subtilis)細胞でありうる。真核細胞は、例えば、真核細胞の適当な例には、哺乳動物細胞、昆虫細胞、植物細胞及び真菌細胞でありうる。真菌細胞は、例えば哺乳動物細胞、昆虫細胞、植物細胞又は真菌細胞でありうる。真菌細胞は、例えば、サッカロミセス種(Saccharomyces spp.)、カンジダ種(Candida spp.)、リポミセス種(Lipomyces spp.)、ヤロウイア種(Yarrowia spp.)、クルイベロミセス種(Kluyveromyces spp.)、ハンセヌラ種(Hansenula spp.)、アスペルギルス種(Aspergillus spp.)、ペニシリウム種(Penicillium spp.)、ノイロスポラ種(Neurospora spp.)、トリコデルマ種(Trichoderma spp.)又はピキア種(Pichia spp.)でありうる。特に、真菌細胞は、サッカロミセス種、特にサッカロミセス・セレビシエ、カンジダ種、ハンセヌラ種、又はピキア種のような酵母細胞でありうる。
【0015】
本発明は、a)プロモーター、およびb)該プロモーターと機能的に連結された配列番号1(図6)により表されるヌクレオチド配列を含むベクターも含み、さらに、このベクターを含む宿主細胞も含む。宿主は、真核細胞であっても、又は原核細胞であってもよい。原核細胞の適当な例には、大腸菌細胞、シアノバクテリア細胞、又は枯草菌細胞が含まれる。真核細胞の適当な例には、哺乳動物細胞、昆虫細胞、植物細胞及び真菌細胞が含まれる。真菌細胞は、例えば、サッカロミセス種、カンジダ種、リポミセス種、ヤロウイア種、クルイベロミセス種、ハンセヌラ種、アスペルギルス種、ペニシリウム種、ニューロスポラ種、トリコデルマ種及びピキア種でありうる。特に、真菌細胞は、例えば、例えばサッカロミセス種、特にサッカロミセス・セレビシエ、カンジダ種、ハンセヌラ種及びピキア種のような酵母細胞でありうる。
【0016】
本発明は、ベクターのヌクレオチド配列の発現により、植物細胞、植物又は植物組織によるモノ不飽和脂肪酸及びポリ不飽和脂肪酸からなる群より選択される少なくとも一つの脂肪酸の生成が引き起こされる、前記ベクターを含む植物細胞、植物又は植物組織を含む。ポリ不飽和脂肪酸は、例えば、ジホモ−γ−リノレン酸(DGLA)、20:4n−3及びアドレン酸(ADA)でありうる。本発明は、植物細胞、植物又は植物組織により発現された一つ又は複数の植物油又は脂肪酸も含む。さらに、本発明は、ベクターのヌクレオチド配列の発現により、トランスジェニック植物の種子におけるポリ不飽和脂肪酸の生成が引き起こされる、前記ベクターを含むトランスジェニック植物を包含する。
【0017】
さらに、本発明は、プロモーターと機能的に連結されたエロンガーゼをコードするDNA配列を含むゲノムを有する、ヒト以外のトランスジェニック哺乳動物を含む。DNA配列は、配列番号1(図6)により表されうる。本発明は、少なくとも一つのエロンガーゼ、又は例えばDGLA、ω6−ドコサペンタエン酸、ADA及び/もしくは20:4n−3(図1参照)のようなそれらの生成物を検出可能なレベルで含む、ヒト以外のトランスジェニック動物により産生された体液(例えば、乳汁)も含む。
【0018】
さらに、本発明は、a)配列番号1(図6)により表されるヌクレオチド配列を単離する工程、b)単離されたヌクレオチド配列を含むベクターを構築する工程、c)単離されたヌクレオチド配列によりコードされるエロンガーゼ酵素の発現にとって十分な時間及び条件で、宿主細胞へベクターを導入する工程、並びにd)基質を「生成物」ポリ不飽和脂肪酸へ変換するため、発現されたエロンガーゼ酵素を「基質」ポリ不飽和脂肪酸へ曝露する工程を含む、ポリ不飽和脂肪酸を製造するための方法を含む。基質ポリ不飽和脂肪酸は、例えば、γ−リノレン酸(GLA)、ステアリドン酸(STA)及びアラキドン酸(AA)からなる群より選択され、生成物ポリ不飽和脂肪酸は、例えば、それぞれDGLA、20:4n−3及びADAからなる群より選択されうる。本発明は、生成物ポリ不飽和脂肪酸を「第二生成物」ポリ不飽和脂肪酸へ変換するため、生成物ポリ不飽和脂肪酸を、少なくとも一つのデサチュラーゼへ曝露する工程をさらに含みうる。生成物ポリ不飽和脂肪酸は、例えばDGLA、20:4n−3及びADAからなる群より選択されうる。第二生成物ポリ不飽和脂肪酸は、例えば、それぞれAA、エイコサペンタエン酸(EPA)、ω6−ドコサペンタエン酸からなる群より選択され、少なくとも一つのデサチュラーゼは、AA又はEPAの製造に関してはΔ5−デサチュラーゼであり、ω6−ドコサペンタエン酸の製造に関してはΔ4−デサチュラーゼである。この方法は、第二生成物ポリ不飽和脂肪酸を「最終」ポリ不飽和脂肪酸へ変換するため、少なくとも一つのエロンガーゼ及び少なくとも一つの付加的なデサチュラーゼからなる群より選択される一つ又は複数の酵素へ、第二生成物ポリ不飽和脂肪酸を曝露する工程をさらに含みうる。最終ポリ不飽和脂肪酸は、例えば、ドコサヘキサエン酸(DHA)、AA、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。
【0019】
又、本発明は、前記方法に従い製造された生成物ポリ不飽和脂肪酸、前記方法に従い製造された第二生成物ポリ不飽和脂肪酸及び前記方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む栄養組成物を含む。生成物ポリ不飽和脂肪酸は、例えばDGLA、20:4n−3及びADAからなる群より選択されうる。第二生成物ポリ不飽和脂肪酸は、例えば、AA、EPA又はω6−ドコサペンタエン酸でありうる。最終ポリ不飽和脂肪酸は、例えば、DHA、アドレン酸、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。栄養組成物は、例えば、幼児用調合物、栄養補助食品又は食品代用物であってよく、ヒト又は動物へ投与されることができ、経口的又は非経口的に投与されうる。栄養組成物は、ココヤシ油、ダイズ油、カノーラ油、モノグリセリド、ジグリセリド、トリグリセリド、グルコース、食用ラクトース、電気透析されたホエー、電気透析されたスキムミルク、乳清、ダイズ・タンパク質、タンパク質加水分解物、ヒマワリ油、ベニバナ油、コーン油及びアマ油からなる群より選択される、少なくとも一つの多量養素をさらに含みうる。栄養組成物は、ビタミンA、ビタミンC、ビタミンD、ビタミンE及びビタミンB複合体からなる群より選択される少なくとも一つのビタミン、並びにカルシウム、マグネシウム、亜鉛、マンガン、ナトリウム、カリウム、リン、銅、塩素、ヨウ素、セレン及び鉄からなる群より選択される少なくとも一つの無機物も含みうる。
【0020】
さらに、本発明は、1)前記方法に従い製造された生成物ポリ不飽和脂肪酸、請求項32の前記方法に従い製造された第二生成物ポリ不飽和脂肪酸及び前記方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸と、2)薬学的に許容される担体とを含む薬学的組成物を包含する。この組成物は、ヒト又は動物へ投与されうる。この組成物は、ビタミン、無機物、塩、炭水化物、アミノ酸、遊離脂肪酸、保存料、賦形剤、抗ヒスタミン、増殖因子、抗生物質、希釈剤、リン脂質、抗酸化剤及びフェノール化合物からなる群より選択される少なくとも一つの要素をさらに含みうる。この組成物は、経口、非経口、局所、直腸内、筋肉内、皮下、皮内、又はその他の任意の適当な手段により、投与されうる。
【0021】
本発明は、前記方法に従い製造された生成物ポリ不飽和脂肪酸、前記方法に従い製造された第二生成物ポリ不飽和脂肪酸及び前記方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む動物飼料も含む。生成物ポリ不飽和脂肪酸は、例えばDGLA、20:4n−3及びADAでありうる。第二生成物ポリ不飽和脂肪酸は、例えば、AA、EPA又はω6−ドコサペンタエン酸でありうる。最終ポリ不飽和脂肪酸は、例えば、DHA、アドレン酸、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。
【0022】
さらに、本発明は、前記方法に従い製造された生成物ポリ不飽和脂肪酸、前記方法に従い製造された第二生成物ポリ不飽和脂肪酸及び前記方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む化粧品も含む。
【0023】
さらに、本発明は、予防又は治療を行うために十分な量で前記栄養組成物を患者に投与することを含む、ポリ不飽和脂肪酸の不十分な摂取又は生成により引き起こされる状態を予防又は治療する方法を含む。
【0024】
本発明は、配列番号2(図22)に示されたヌクレオチド配列の少なくとも約35%と一致するか、又は相補的である、単離されたヌクレオチド配列も含む。この配列は、配列番号2により表されうる。その配列は、ポリ不飽和脂肪酸を基質として利用する、機能的活性を有するエロンガーゼをコードする。この配列は、例えば、モルチエレラ属の真菌に由来するものであってよい。特に、それは、M.アルピナに由来するものであってよい。
【0025】
さらに、本発明は、前記ヌクレオチド配列によりコードされる精製されたタンパク質を含み、さらに、ポリ不飽和脂肪酸を伸長し、かつ精製されたタンパク質のアミノ酸配列と少なくとも約30%のアミノ酸類似性を有する、精製されたポリペプチドを含む。
【0026】
本発明は、前記のようなエロンガーゼ酵素を製造する方法も含む。ベクターへ挿入される配列は、配列番号2(図22)により表される。宿主細胞は、原核細胞であっても、又は真核細胞であってもよい。適当な例は、前記と同様である。
【0027】
本発明は、a)プロモーター、およびb)該プロモーターと機能的に連結された配列番号2(図22)により表されるヌクレオチド配列を含むベクターも含み、さらに、このベクターを含む宿主細胞も含む。この場合にも、宿主細胞は、原核細胞であっても、又は真核細胞であってもよい。適当な例は、前記と同様である。
【0028】
本発明は、ベクターのヌクレオチド配列の発現により、植物細胞、植物又は植物組織によるポリ不飽和脂肪酸の生成が引き起こされる、前記ベクターを含む植物細胞、植物又は植物組織も含む。ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3又はADAでありうる。さらに、本発明は、植物細胞、植物又は植物組織により発現された一つ又は複数の植物油又は脂肪酸を含む。
【0029】
さらに、本発明は、ベクターのヌクレオチド配列(配列番号2)の発現により、トランスジェニック植物の種子におけるポリ不飽和脂肪酸の生成が引き起こされる、前記ベクターを含むトランスジェニック植物も含む。
【0030】
本発明は、プロモーターと機能的に連結されたエロンガーゼをコードするDNA配列(配列番号2)を含むゲノムを有する、ヒト以外のトランスジェニック哺乳動物も含む。本発明は、少なくとも一つのエロンガーゼ又はそれらの生成物を検出可能なレベルで含む、ヒト以外のトランスジェニック動物により産生された体液も含む。
【0031】
本発明は、a)配列番号2(図22)により表されるヌクレオチド配列を単離する工程、b)単離されたヌクレオチド配列を含むベクターを構築する工程、c)単離されたヌクレオチド配列によりコードされるエロンガーゼ酵素の発現にとって十分な時間及び条件で、宿主細胞へベクターを導入する工程、並びにd)基質を生成物ポリ不飽和脂肪酸へ変換するため、発現されたエロンガーゼ酵素を基質ポリ不飽和脂肪酸へ曝露する工程を含む、ポリ不飽和脂肪酸を製造するための方法も含む。基質ポリ不飽和脂肪酸は、例えば、GLA、STA及びAAであり、生成物ポリ不飽和脂肪酸は、例えば、それぞれDGLA、20:4n−3又はω6−ドコサペンタエン酸でありうる。本発明は、生成物ポリ不飽和脂肪酸を第二生成物ポリ不飽和脂肪酸へ変換するため、発現されたエロンガーゼ酵素を、少なくとも一つのデサチュラーゼへ曝露する工程をさらに含みうる。生成物ポリ不飽和脂肪酸は、例えばDGLA、20:4n−3又はADAであり、第二生成物ポリ不飽和脂肪酸は、例えば、それぞれAA、EPA又はω6−ドコサペンタエン酸であり、少なくとも一つのデサチュラーゼは、AA又はEPAの製造に関してはΔ5−デサチュラーゼであり、ω6−ドコサペンタエン酸の製造に関してはΔ4−デサチュラーゼである。この方法は、第二生成物ポリ不飽和脂肪酸を最終ポリ不飽和脂肪酸へ変換するため、少なくとも一つのエロンガーゼ及び少なくとも一つの付加的なデサチュラーゼからなる群より選択される一つ又は複数の酵素へ、第二生成物ポリ不飽和脂肪酸を曝露する工程をさらに含みうる。最終ポリ不飽和脂肪酸は、例えば、ドコサヘキサエン酸、AA、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。
【0032】
本発明は、配列番号2に関して記載された方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号2に関して記載された方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号2に関して記載された方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む栄養組成物を含む。生成物ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3及びADAからなる群より選択されうる。第二生成物ポリ不飽和脂肪酸は、例えば、AA、EPA及びω6−ドコサペンタエン酸からなる群より選択されうる。最終ポリ不飽和脂肪酸は、例えば、DHA、AA、ω6−ドコサペンタエン酸及びω3−ドコサペンタエン酸からなる群より選択されうる。投与、特徴、成分等に関する組成物のその他の属性は、前記と同様である。
【0033】
本発明は、1)配列番号2に関する前述の方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号2に関する前記の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号2に関する前記の方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸と、2)薬学的に許容される担体とを含む薬学的組成物も含む。前記の薬学的組成物の特徴(例えば、投与、成分等)が、この組成物にも適合する。
【0034】
本発明は、配列番号2に関して記載された方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号2に関する前記の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号2に関して記載された方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む動物飼料も含む。生成物ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3又はADAでありうる。第二生成物ポリ不飽和脂肪酸は、例えば、AA、EPA又はω6−ドコサペンタエン酸でありうる。最終ポリ不飽和脂肪酸は、例えば、DHA、アドレン酸、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。
【0035】
本発明は、配列番号2に関する前記の方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号2に関する前記の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号2に関する前記の方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む化粧品も含む。
【0036】
さらに、本発明は、予防又は治療を行うために十分な量で、直前に記載された栄養組成物を患者に投与することを含む、ポリ不飽和脂肪酸の不十分な摂取又は生成により引き起こされる状態を予防又は治療する方法を含む。
【0037】
さらに、本発明は、配列番号3(図43)に示されたヌクレオチド配列の少なくとも約35%と一致するか、又は相補的である、単離されたヌクレオチド配列も含む。この配列は、配列番号3により表されるものでありうる。この配列は、ポリ不飽和脂肪酸又はモノ不飽和脂肪酸を基質として利用する、機能的活性を有するエロンガーゼをコードする。この配列は、例えばヒトのような哺乳動物に由来する。
【0038】
本発明は、このヌクレオチド配列によりコードされる精製されたタンパク質も含む。また、本発明は、ポリ不飽和脂肪酸又はモノ不飽和脂肪酸を伸長し、かつこの精製されたタンパク質のアミノ酸配列と少なくとも約30%のアミノ酸類似性を有する、精製されたポリペプチドを含む。
【0039】
さらに、本発明は、a)配列番号3(図43)により表されるヌクレオチド配列を単離する工程、b)i)プロモーター、およびii)該プロモーターと機能的に連結された単離されたヌクレオチド配列を含むベクターを構築する工程、並びにc)エロンガーゼ酵素の発現にとって十分な時間及び条件で、宿主細胞へ該ベクターを導入する工程を含む、エロンガーゼ酵素を製造する方法を含む。宿主細胞は、配列番号1又は2を利用した対応する方法に関する前記の細胞と同様でありうる。
【0040】
本発明は、a)プロモーター、およびb)該プロモーターと機能的に連結された配列番号3(図43)により表されたヌクレオチド配列を含むベクターも含み、さらに、このベクターを含む宿主細胞も含む。宿主細胞は、前記の細胞と同様でありうる。
【0041】
本発明は、ベクターのヌクレオチド配列の発現により、植物細胞、植物又は植物組織によるモノ不飽和脂肪酸及びポリ不飽和脂肪酸からなる群より選択される少なくとも一つの脂肪酸の生成が引き起こされる、前記ベクターを含む植物細胞、植物又は植物組織も含む。ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3又はADAでありうる。本発明は、植物細胞、植物又は植物組織により発現された一つ又は複数の植物油又は酸も含む。
【0042】
本発明は、ベクターのヌクレオチド配列の発現により、トランスジェニック植物の種子におけるポリ不飽和脂肪酸の生成が引き起こされる、配列番号3を含むベクターを含むトランスジェニック植物も含む。
【0043】
さらに、本発明は、プロモーターと機能的に連結されたエロンガーゼをコードするヒトDNA配列を含むゲノムを有する、ヒト以外のトランスジェニック哺乳動物を含む。DNA配列は、配列番号3(図43)により表される。本発明は、少なくとも一つのエロンガーゼ又はそれらの生成物を検出可能なレベルで含む、ヒト以外のトランスジェニック哺乳動物により産生された体液も含む。
【0044】
本発明は、a)配列番号3(図43)により表されるヌクレオチド配列を単離する工程、b)該ヌクレオチド配列を含むベクターを構築する工程、c)単離されたヌクレオチド配列によりコードされるエロンガーゼ酵素の発現にとって十分な時間及び条件で、宿主細胞へベクターを導入する工程、並びにd)基質を生成物ポリ不飽和脂肪酸へ変換するため、発現されたエロンガーゼ酵素を基質ポリ不飽和脂肪酸へ曝露する工程を含む、ポリ不飽和脂肪酸を製造するための方法も包含する。基質ポリ不飽和脂肪酸は、例えば、GLA、STA又はAAであり、生成物ポリ不飽和脂肪酸は、例えば、それぞれDGLA、20:4n−3又はADAでありうる。この方法は、生成物ポリ不飽和脂肪酸を第二生成物ポリ不飽和脂肪酸へ変換するため、生成物ポリ不飽和脂肪酸を、少なくとも一つのデサチュラーゼへ曝露する工程をさらに含みうる。生成物ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3及びADAであり、第二生成物ポリ不飽和脂肪酸は、例えば、それぞれAA、EPA及びω6−ドコサペンタエン酸であり、少なくとも一つのデサチュラーゼは、AA又はEPAの生成に関してはΔ5−デサチュラーゼであり、ω6−ドコサペンタエン酸の生成に関してはΔ4−デサチュラーゼである。この方法は、第二生成物ポリ不飽和脂肪酸を最終ポリ不飽和脂肪酸へ変換するため、少なくとも一つのエロンガーゼ及び少なくとも一つの付加的なデサチュラーゼからなる群より選択される一つ又は複数の酵素へ、第二生成物ポリ不飽和脂肪酸を曝露する工程をさらに含みうる。最終ポリ不飽和脂肪酸は、例えば、DHA、ADA、ω6−ドコサペンタエン酸及びω3−ドコサペンタエン酸でありうる。
【0045】
例えば、配列番号3に関する前述の方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号3に関する前述の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号3に関する前述の方法に従い製造された最終ポリ不飽和脂肪酸でありうる、少なくとも一つのポリ不飽和脂肪酸を含む栄養組成物。生成物ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3又はADAでありうる。第二生成物ポリ不飽和脂肪酸は、AA、EPA又はω6−ドコサペンタエン酸からなる群より選択されうる。最終ポリ不飽和脂肪酸は、例えば、DHA、ADA、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。組成物のその他の特性又は特徴(例えば、投与、成分等)は、他の栄養組成物に関する前述のものと同様である。
【0046】
さらに、本発明は、1)配列番号3に関する前記の方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号3に関する前記の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号3に関する前記の方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸と、2)薬学的に許容される担体とを含む薬学的組成物も含む。組成物のその他の特性(例えば、投与、付加的成分等)は、他の薬学的組成物に関する前述のものと同様である。
【0047】
本発明は、配列番号3に関する前述の方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号3に関する前述の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号3に関する前述の方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む動物飼料も含む。生成物ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3又はADAでありうる。ポリ不飽和脂肪酸は、例えば、AA、EPA又はω6−ドコサペンタエン酸でありうる。最終ポリ不飽和脂肪酸は、例えば、DHA、ADA、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。
【0048】
また、本発明は、配列番号3に関する前述の方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号3に関する前述の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号3に関する前述の方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む化粧品を含む。
【0049】
予防又は治療を行うために十分な量で、配列番号3に関する前述の栄養組成物を患者に投与することを含む、ポリ不飽和脂肪酸の不十分な摂取又は生成により引き起こされる状態を予防又は治療する方法。
【0050】
さらに、本発明は、配列番号4(図46)に示されたヌクレオチド配列の少なくとも約35%と一致するか、又は相補的である、単離されたヌクレオチド配列を含む。この配列は、配列番号4により表されうる。この配列は、ポリ不飽和脂肪酸を基質として利用する、機能的活性を有するエロンガーゼをコードする。この配列は、セノラブディティス(Caenorhabditis)属の線虫に由来し、又はそれから単離され、特にC.エレガンス(C. elegans)から単離されうる。
【0051】
本発明は、前記ヌクレオチド配列によりコードされる精製されたタンパク質を含む。本発明は、ポリ不飽和脂肪酸を伸長し、かつこの精製されたタンパク質のアミノ酸配列と少なくとも約30%のアミノ酸類似性を有する精製されたポリペプチドも含む。
【0052】
さらに、本発明は、a)配列番号4(図46)により表されるヌクレオチド配列を単離する工程、b)i)プロモーター、およびii)該プロモーターと機能的に連結された単離されたヌクレオチド配列を含むベクターを構築する工程、並びにc)エロンガーゼ酵素の発現にとって十分な時間及び条件で、宿主細胞へベクターを導入する工程を含む、エロンガーゼ酵素を製造する方法を含む。宿主細胞の特性は、配列番号1、配列番号2及び配列番号3に関する前記の特性と同様である。
【0053】
本発明は、a)プロモーター、およびb)該プロモーターと機能的に連結された配列番号4(図46)により表されるヌクレオチド配列を含むベクターも包含し、さらに、このベクターを含む宿主細胞も包含する。宿主細胞は、配列番号1、配列番号2及び配列番号3のための前述の宿主細胞に関する前述の特性と同一の特性を有する。
【0054】
さらに、本発明は、ベクターの該ヌクレオチド配列の発現により、植物細胞、植物又は植物組織によるポリ不飽和脂肪酸の生成が引き起こされる、配列番号4を含む前記ベクターを含む植物細胞、植物又は植物組織を含む。ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3又はADAでありうる。本発明は、植物細胞、植物又は植物組織により発現された一つ又は複数の植物油又は脂肪酸も含む。
【0055】
本発明は、ベクターのヌクレオチド配列の発現により、トランスジェニック植物の種子におけるポリ不飽和脂肪酸の生成が引き起こされる、配列番号4に相当するヌクレオチド配列を含む前記ベクターを含むトランスジェニック植物も含む。
【0056】
さらに、本発明は、プロモーターと機能的に連結されたエロンガーゼをコードするC.エレガンスDNA配列を含むゲノムを有する、ヒト以外のトランスジェニック哺乳動物を含む。そのDNA配列は、配列番号4(図46)により表されうる。本発明は、少なくとも一つのエロンガーゼ又はそれらの生成物を検出可能なレベルで含む、請求項187のヒト以外のトランスジェニック哺乳動物により産生された体液も含む。
【0057】
本発明は、a)配列番号4(図46)により表されるヌクレオチド配列を単離する工程、b)単離されたヌクレオチド配列を含むベクターを構築する工程、c)単離されたヌクレオチド配列によりコードされるエロンガーゼ酵素の発現にとって十分な時間及び条件で、宿主細胞へベクターを導入する工程、並びにd)基質を生成物ポリ不飽和脂肪酸へ変換するため、発現されたエロンガーゼ酵素を基質ポリ不飽和脂肪酸へ曝露する工程を含む、ポリ不飽和脂肪酸を製造するための方法も含む。基質ポリ不飽和脂肪酸は、例えば、GLA、STA又はAAであり、生成物ポリ不飽和脂肪酸は、例えば、それぞれDGLA、20:4n−3又はADAでありうる。この方法は、該生成物ポリ不飽和脂肪酸を第二生成物ポリ不飽和脂肪酸へ変換するため、発現されたエロンガーゼ酵素を、少なくとも一つのデサチュラーゼへ曝露する工程をさらに含みうる。生成物ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3又はADAであり、第二生成物ポリ不飽和脂肪酸は、例えば、それぞれAA、EPA又はω6−ドコサペンタエン酸であり、少なくとも一つのデサチュラーゼは、AA又はEPAの製造に関してはΔ5−デサチュラーゼであり、ω6−ドコサペンタエン酸の製造に関してはΔ4−デサチュラーゼである。この方法は、第二生成物ポリ不飽和脂肪酸を最終ポリ不飽和脂肪酸へ変換するため、少なくとも一つのエロンガーゼ及び少なくとも一つの付加的なデサチュラーゼからなる群より選択される一つ又は複数の酵素へ、第二生成物ポリ不飽和脂肪酸を曝露する工程をさらに含みうる。最終ポリ不飽和脂肪酸は、例えば、DHA、ADA、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。
【0058】
本発明は、配列番号4に関する前記の方法に従い製造された該ポリ不飽和脂肪酸、配列番号4に関する前記の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号4に関する前述の方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む栄養組成物も含む。生成物ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3又はADAでありうる。第二生成物ポリ不飽和脂肪酸は、例えば、AA、EPA又はω6−ドコサペンタエン酸でありうる。最終ポリ不飽和脂肪酸は、例えば、DHA、ADA、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。組成物のその他の特徴は、前記の栄養組成物に関して記述されたものと同様である。
【0059】
さらに、本発明は、1)配列番号4に関する前述の方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号4に関する前述の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号4に関する前述の方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸と、2)薬学的に許容される担体とを含む薬学的組成物を含む。組成物は、他の薬学的組成物に関する前記の特性と同様の特性(例えば、投与、追加要素等)を有する。
【0060】
本発明は、配列番号4に関する前記の方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号4に関する前述の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号4に関する前記の方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む動物飼料も含む。生成物ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3又はADAでありうる。第二生成物ポリ不飽和脂肪酸は、例えば、AA、EPA又はω6−ドコサペンタエン酸でありうる。最終ポリ不飽和脂肪酸は、例えば、DHA、ADA、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。
【0061】
さらに、本発明は、配列番号4に関する前述の方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号4に関する前述の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号4に関する前記の方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択されるポリ不飽和脂肪酸を含む化粧品を含む。
【0062】
さらに、本発明は、予防又は治療を行うために十分な量で、配列番号4に関して記述された栄養組成物を患者に投与することを含む、ポリ不飽和脂肪酸の不十分な摂取又は生成により引き起こされる状態を予防又は治療する方法を包含する。
【0063】
本明細書において言及された米国特許及び公開物は全て、参照として完全に本明細書に組み込まれる。
【図面の簡単な説明】
【0064】
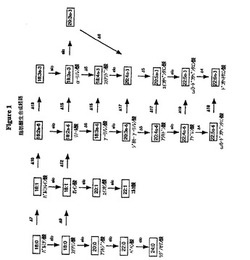
【図1】様々な脂肪酸生合成経路を示す図である。エロンガーゼの役割に注意されたい。
【図2】ホホバKCS及びELO2のアミノ酸配列の類似性(%)及び同一性(%)を示す図である。
【図3】図2のホホバKCS配列(下線部がプライマー配列)と相同なS.セレビシエELO2配列を示す図である。
【図4】図4Aは、MAELO cDNAを含有するpRAE−2の物理的地図を示す図である。図4Bは、酵母におけるエロンガーゼ酵素産生に使用された構成性発現ベクターpRAE−5の物理的地図を示す図である。
【図5】クローンpRAE−5及びpRAE−6のヌクレオチド配列の比較を示す図である。
【図6】モルチエレラ・アルピナ・エロンガーゼ(MAELO)の全長ヌクレオチド配列を示す図である。
【図7】MAELO(図6参照)から翻訳されたモルチエレラ・アルピナ・エロンガーゼのアミノ酸配列を示す図である。
【図8】3つのエロンガーゼ、S.セレビシエELO2(GNS1)とS.セレビシエELO3(SUR4)と図7に示された翻訳されたMAELO配列とのアミノ酸配列アラインメントを示す図である。
【図9】MAELOのヌクレオチド配列とS.セレビシエ由来のELO2のヌクレオチド配列との比較を示す図である。
【図10A】パン酵母において発現されたMAELOのPUFAエロンガーゼ活性を示す図である。
【図10B】パン酵母において発現されたMAELOのPUFAエロンガーゼ活性を示す図である。
【図11】AAを生成するようM.アルピナ由来のΔ5−デサチュラーゼcDNAと共に共発現された場合のMAELOのPUFAエロンガーゼ活性を示す図である。
【図12】MAELOのPUFAエロンガーゼ活性と、パン酵母におけるS.セレビシエ由来のELO2の過剰発現との比較を示す図である。
【図13】GenEMBLデータベースのC.エレガンス・ヌクレオチド配列由来のアミノ酸配列と、翻訳されたMAELOとの3つの異なる比較を示す図である。
【図14】GenEMBLデータベースのC.エレガンス・ヌクレオチド配列由来のアミノ酸配列と、翻訳されたMAELOとの3つの異なる比較を示す図である。
【図15】GenEMBLデータベースのC.エレガンス・ヌクレオチド配列由来のアミノ酸配列と、翻訳されたMAELOとの3つの異なる比較を示す図である。
【図16】GenEMBLデータベースの2つの異なる哺乳動物配列のアミノ酸翻訳と、翻訳されたMAELOとの比較を示す図である。
【図17】翻訳されたDNA配列(公開されたPCT出願第88/07577号を参照)と、データベース検索において検出されたMAELO由来のアミノ酸配列との比較を示す図である。
【図18】M.アルピナ由来のΔ5−デサチュラーゼの全長ヌクレオチド配列を示す図である。
【図19】MAD708プールの一次GC−FAME分析を示す図である。DGLA(C20:3n−6)ピークの検出に注意されたい。
【図20】酵母中の5つのMAD708クローンの、GLAを基質として用いたPUFAエロンガーゼ活性を示す図である。全てのクローンが明白なエロンガーゼ活性を有する。
【図21】プラスミドpRPB2のDNA配列決定分析を示す図である。分析により957bp長のオープン・リーディング・フレームが明らかとなった。
【図22】GLAエロンガーゼ活性のためGLELOと名付けられた、プラスミドpRPB2に含まれるM.アルピナcDNAの全長ヌクレオチド配列を示す図である。
【図23】GLELO(図22参照)から翻訳されたM.アルピナ・エロンガーゼのアミノ酸配列を示す図である。
【図24】GLAを補足した場合の、334(pRPB2)の誘導された培養物におけるn−6 PUFAエロンガーゼ活性を示す図である。
【図25】25μmの他の脂肪酸基質を補足した場合の、334(pRPB2)の誘導された培養物におけるn−3及びn−6 PUFAエロンガーゼ活性を示す図である。
【図26】図26Aは、AAを生成するようM.アルピナのΔ5−デサチュラーゼcDNAと共に共発現された場合の、GLELOのGLAを基質として用いたエロンガーゼ活性を示す図である。図26Bは、EPAを生成するようM.アルピナのΔ5−デサチュラーゼcDNAと共に共発現された場合の、GLELOのSTAを基質として用いたエロンガーゼ活性を示す図である。
【図27】翻訳されたGLELO配列(図23参照)と翻訳されたMAELO配列(図7参照)との比較を示す図である。
【図28】4つのエロンガーゼのアミノ酸配列、即ちGLELO(図23参照)、MAELO配列(図7参照)、S.セレビシエELO2(GNS1)及びS.セレビシエELO3(SUR4)の翻訳されたアミノ酸配列の比較を示す図である。ヒスチジン・ボックスが下線で示されている。
【図29】翻訳されたMAELO配列と翻訳された推定ヒト・ホモログHS1配列とのアラインメントを示す図である。
【図30】翻訳されたMAELO配列と翻訳された推定ヒト・ホモログHS2配列とのアラインメントを示す図である。
【図31】翻訳されたMAELO配列と翻訳された推定マウス・ホモログMM2配列とのアラインメントを示す図である。
【図32】翻訳されたMAELOと翻訳された推定マウス・ホモログAI225632配列とのアラインメントを示す図である。
【図33】翻訳されたGLELO配列と翻訳された推定ヒト・ホモログAI815960配列とのアラインメントを示す図である。
【図34】翻訳されたGLELO配列と翻訳された推定ヒト・ホモログHS1配列とのアラインメントを示す図である。
【図35】翻訳されたGLELO配列と翻訳された推定ヒト・ホモログAC004050配列とのアラインメントを示す図である。
【図36】翻訳されたGLELO配列と翻訳された推定マウス・ホモログMM2配列とのアラインメントを示す図である。
【図37】翻訳されたGLELO配列と翻訳された推定マウス・ホモログAI225632配列とのアラインメントを示す図である。
【図38】翻訳されたGLELO配列と翻訳された推定マウス・ホモログU97107とのアラインメントを示す図である。
【図39】翻訳されたGLELO配列と翻訳された推定C.エレガンスU68749(F56H11.4)ホモログ配列とのアラインメントを示す図である。
【図40】翻訳されたMAELO配列と翻訳された推定C.エレガンスU68749(F56H11.4)ホモログ配列とのアラインメントを示す図である。
【図41】翻訳されたGLELO配列と翻訳された推定キイロショウジョウバエ・ホモログ配列DM1とのアラインメントを示す図である。
【図42】翻訳されたMAELO配列と翻訳された推定キイロショウジョウバエ・ホモログ配列DM1とのアラインメントを示す図である。
【図43】ヒト・エロンガーゼHSELO1の全長ヌクレオチド配列を示す図である。
【図44】ヒト・エロンガーゼHSELO1の推定アミノ酸配列を示す図である。
【図45】GLA又はAAを補足した場合の、334(pRAE−58−A1)の誘導された培養物のエロンガーゼ活性(PUFA及びその他)を示す図である。
【図46】C.エレガンス・エロンガーゼCEELOの全長ヌクレオチド配列を示す図である。
【図47】C.エレガンス・エロンガーゼCEELOの推定アミノ酸配列を示す図である。
【図48】GLA又はAAを補足した場合の、334(pRET−21)及び334(pRET−22)の誘導された培養物のPUFAエロンガーゼ活性を示す図である。
【図49】推定ヒト・エロンガーゼ遺伝子HS3の全長ヌクレオチド配列を示す図である。
【図50】推定ヒト・エロンガーゼ酵素HS3の推定アミノ酸配列を示す図である。
【0065】
(発明の詳細な説明)
本発明は、モルチエレラ・アルピナ由来の2つのエロンガーゼcDNAのヌクレオチド配列及び対応するアミノ酸配列に関し、さらにヒト由来のエロンガーゼcDNAのヌクレオチド配列及び対応するアミノ酸配列、並びにC.エレガンス由来のエロンガーゼcDNAのヌクレオチド配列及び対応するアミノ酸配列に関する。さらに、本発明は、cDNAの使用、及び遺伝子によりコードされるタンパク質の使用も含む。例えば、遺伝子及び対応する酵素は、薬学的組成物、栄養組成物及びその他の有用な製品へ添加されうる、DGLA、AA、ADA、EPA及び/又はDHAのような、ポリ不飽和脂肪酸及び/又はモノ不飽和脂肪酸の製造において使用されうる。
【0066】
エロンガーゼ遺伝子及びそれらによりコードされる酵素
前述のように、エロンガーゼcDNAによりコードされるエロンガーゼ酵素は、様々なポリ不飽和脂肪酸、特に20〜24個の炭素を含むPUFAの生成に必須である。本発明に関して、単離されたM.アルピナ・エロンガーゼcDNA(MAELO)のヌクレオチド配列は、図6に示され、このヌクレオチド配列によりコードされる対応する精製されたタンパク質又は酵素のアミノ酸配列は、図7に示されている。さらに、単離されたGLAエロンガーゼcDNA(GLELO)のヌクレオチド配列は、図22に示され、このヌクレオチド配列によりコードされる対応する精製されたタンパク質又は酵素のアミノ酸配列は、図23に示されている。単離されたヒト配列1(HSELO1)エロンガーゼのヌクレオチド配列は、図43に示され、この配列によりコードされる対応する精製されたタンパク質又は酵素のアミノ酸配列は、図44に示されている。さらに、単離されたC.エレガンス・エロンガーゼcDNA(CEELO1)のヌクレオチド配列は、図46に示され、それによりコードされる対応する精製されたタンパク質又は酵素のアミノ酸配列は、図47に示されている。
【0067】
例として、本発明のcDNAによりコードされる単離されたエロンガーゼは、GLAをDGLAへ、又はSTAを20:4n−3へ、又はAAをADAへ伸長する。次いで、DGLAからのアラキドン酸の生成、又は20:4n−3からのEPAの生成が、Δ5−デサチュラーゼにより触媒される。従って、AA(又はEPA)、DGLA(又は20:4n−3)、ADA(又はω3−ドコサペンタエン酸)は、いずれも、少なくとも一つのエロンガーゼcDNA及びそれらによりコードされる酵素が存在しない場合には合成されえない。
【0068】
本発明は、配列番号1のヌクレオチド(即ち、本明細書に記載されたMAELO cDNAのヌクレオチド配列(図6参照))の少なくとも約50%、好ましくは少なくとも約60%、より好ましくは少なくとも約70%と一致する(即ち、同一性を有する)か、又は相補的な配列を有するヌクレオチド配列(及び対応するコードされるタンパク質)も包含することに注意されたい。さらに、本発明は、配列番号2のヌクレオチド(即ち、本明細書に記載されたGLELO cDNAのヌクレオチド配列(図22参照))の少なくとも約35%、好ましくは少なくとも約45%、より好ましくは少なくとも約55%と一致する(即ち、同一性を有する)か、又は相補的な配列を有するヌクレオチド配列(及び対応するコードされるタンパク質)も含む。さらに、本発明は、配列番号3のヌクレオチド(即ち、本明細書に記載されたヒト配列1(HSELO1)cDNAのヌクレオチド配列(図43参照))の少なくとも約35%、好ましくは少なくとも約45%、より好ましくは少なくとも約55%と一致する(即ち、同一性を有する)か、又は相補的な配列を有するヌクレオチド配列(及び対応するコードされたタンパク質)も含む。さらに、本発明は、配列番号4のヌクレオチド(即ち、本明細書に記載されたC.エレガンスcDNA、CEELO1のヌクレオチド配列(図46参照))の少なくとも約35%、好ましくは少なくとも約45%、より好ましくは少なくとも約55%と一致する(即ち、同一性を有する)か、又は相補的な配列を有するヌクレオチド配列(及び対応するコードされるタンパク質)も含む。そのような配列は、モルチエレラ以外の起源(例えば、真核生物(例えば、トラウストキトリウム種(Thraustochytrium spp.)(例えば、トラウストキトリウム・アウレウム(Thraustochytrium aureum)及びトラウストキトリウム・ロセウム(Thraustochytrium roseum))、シゾキトリウム種(Schizochytrium spp.)(例えば、シゾキトリウム・アグレガツム(Schizochytrium aggregatum))、コニディオボルス種(Conidiobolus spp.)(例えば、コニディオボルス・ナノデス(Conidiobolus nanodes))、エントモルフトラ種(Entomorphthora spp.)(例えば、エントモルフトラ・エキシタリス(Entomorphthora exitalis))、サプロレグニア種(Saprolegnia spp.)(例えば、サプロレグニア・パラシティカ(Saprolegnia parasitica)及びサプロレグニア・ディクリナ(Saprolegnia diclina))、レプトミツス種(Leptomitus spp.)(例えば、レプトミツス・ラクテウス(Leptomitus lacteus))、エントモフトラ種(Entomophthora spp.)、ピチウム種(Pythium spp.)、ポルフィリディウム種(Porphyridium spp.)(例えば、ポルフィリジウム・クルエンツム(Porphyridium cruentum))、コニディオボルス種(Conidiobolus spp.)、フィトフトラ種(Phytophathora spp.)、ペニシリウム種、コイドスポリウム種(Coidosporium spp.)、ムコール種(Mucor spp.)(例えば、ムコール・サーシネロイデス(Mucor circinelloides)及びムコール・ジャバニクス(Mucor javanicus))、フザリウム種(Fusarium spp.)、アスペルギルス種及びロドトルラ種(Rhodotorula spp.))、酵母(例えば、ディポダスコプシス・ユニヌクレアタ(Dipodascopsis uninucleata))、哺乳動物以外の生物、例えばハエ(キイロショウジョウバエ(Drosophila melanogaster))又はセノラブディティス種(例えば、セノラブディティス・エレガンス)、又は哺乳動物(例えば、ヒトもしくはマウス))に由来するものでありうる。そのような配列は、アルピナ種以外のモルチエレラ属に属する種、例えば、モルチエレラ・エロンガタ(Mortierella elongata)、モルチエレラ・エキシグア(Mortierella exigua)、モルチエレラ・イザベリナ(Mortierella isabellina)、モルチエレラ・ヒグロフィラ(Mortierella hygrophila)及びモルチエレラ・ラマニアナ(Mortierella ramanniana)、va.アングリスポラ(va. angulispora)に由来するものであってもよい。さらに、本発明は、本発明のヌクレオチド配列(即ち、配列番号1(MAELO)、配列番号2(GLELO)、配列番号3(HSELO1)及び配列番号4(CEELO1))及びモルチエレラ以外の起源に由来する、前記の相補性又は一致性/同一性を有する配列の断片及び誘導体も包含する。前記配列の機能的等価物(即ち、エロンガーゼ活性を有する配列)も、本発明に包含される。
【0069】
本発明の目的のために「相補性」を2個のDNAセグメント間の関連性の程度と定義する。これは適当な条件下で1個のDNAセグメントのセンス鎖が別のDNAセグメントのアンチセンス鎖とハイブリダイズして2重らせんを形成する能力を測定することにより決定する。2重らせんではアデニンが一方の鎖に現れるともう一方の鎖にはいつもチミンが現れる。同様に一方の鎖にグアニンが現れるともう一方の鎖にはいつもシトシンが現れる。2個のDNAセグメントのヌクレオチド配列間の関連性が大きいほど2個のDNAセグメントの鎖間でハイブリッド2本鎖を形成する能力が大きくなる。
【0070】
2個のヌクレオチド配列間の「同一性」を、2個のDNAセグメントの同一鎖(センスまたはアンチセンスのいずれか)間の同一性、対応性または同等性の程度と定義する。同一性%が大きくなるほど、鎖間の対応性、同一性または同等性が高くなる。
【0071】
2個のアミノ酸配列間の「類似性」を、両方の配列における一連の同等および保存アミノ酸残基の存在と定義する。2個のアミノ酸配列間の類似性の程度が高いほど、2個の配列の対応性、同一性または同等性が高くなる。(2個のアミノ酸配列間の「同一性」を両配列における一連の正確に類似したまたは不変のアミノ酸残基の存在と定義する)
「相補性」、「同一性」および「類似性」の定義は当業者に周知である。
【0072】
本発明はまたポリ不飽和およびモノ不飽和脂肪酸を伸長し、前記タンパク質のアミノ酸配列に対して少なくとも約50%のアミノ酸類似性を有し(例えば図7(MAELO)を参照のこと)、また前記ヌクレオチド配列によりコードされる精製ポリペプチドをも含む。さらに、本発明はポリ不飽和脂肪酸を伸長し、前記のタンパク質のアミノ酸配列に対して少なくとも約30%のアミノ酸類似性を有し(例えば図23(GLELO)を参照のこと)、また前記ヌクレオチド配列によりコードされる精製ポリペプチドをも含む。さらに、本発明はまたポリ不飽和およびモノ不飽和脂肪酸を伸長し、前記のタンパク質のアミノ酸配列に対して少なくとも約30%のアミノ酸類似性を有し(例えば図44(HSELO1)を参照のこと)、また前記ヌクレオチド配列によりコードされる精製ポリペプチドをも含む。また、本発明はポリ不飽和脂肪酸を伸長し、前記のタンパク質のアミノ酸配列に対して少なくとも約30%のアミノ酸類似性を有し(例えば図47(CEELO1)を参照のこと)、また前記ヌクレオチド配列によりコードされる精製ポリペプチドをも含む。
【0073】
本発明はまたPUFAエロンガーゼ活性をコードし、穏やかなストリンジェント条件下で図6に示す配列番号1(MAELO)および/または図22に示す配列番号2(GLELO)および/または図43に示す配列番号3(HSELO1)および/または図46に示す配列番号4(CEELO1)により表されるヌクレオチド配列に対応するまたは相補的であるヌクレオチド配列を有する核酸にハイブリダイズできる単離されたヌクレオチド配列をも包含する。適当な温度およびイオン強度条件下で核酸分子の1本鎖形態が別の核酸分子にアニーリングできる場合、核酸分子は別の核酸分子に「ハイブリダイズできる」(Sambrookら、「Molecular Cloning:A Laboratory Manual」第2版(1989)、コールド・スプリング・ハーバー・ラボラトリー・プレス、コールド・スプリング・ハーバー、ニューヨーク州)。温度およびイオン強度はハイブリダイゼーションの「ストリンジェンシー」により決定する。「ハイブリダイゼーション」には相補的な配列を含有する2個の核酸が必要である。しかしながら、ハイブリダイゼーションの厳密性に応じて塩基間の誤対合を生じ得る。核酸をハイブリダイズするのに適当な厳密性は核酸の長さおよび相補性の程度に依存する。このような変動要因は当業界で周知である。より具体的には、2個のヌクレオチド配列間の類似性または相同性が高くなるほど、これらの配列を有する核酸のハイブリッドのTm(融解温度)値が高くなる。100ヌクレオチド以上の長さのハイブリッドに関しては、Tmを算出するための方程式が誘導されている(前記で引用したSambrookらを参照のこと)。短い核酸でのハイブリダイゼーションに関しては、誤対合の位置がより重要であり、オリゴヌクレオチドの長さがその特異性を決定する(前記で引用したSambrookらを参照のこと)。
【0074】
エロンガーゼ酵素の生成
一度エロンガーゼをコードする遺伝子を単離すると、次いでそれをベクター、プラスミドまたは構築物を使用して原核または真核宿主細胞のいずれかに導入できる。
【0075】
ベクター例えばバクテリオファージ、コスミドまたはプラスミドはエロンガーゼをコード化するヌクレオチド配列および宿主細胞中で機能し、ヌクレオチド配列によりコードされるエロンガーゼの発現を誘導できるいずれかのプロモーターを含むことができる。プロモーターはヌクレオチド配列と関連して機能できるかまたはヌクレオチド配列と機能的に連結できる。(プロモーターがコーディング配列の転写または発現に影響する場合、プロモーターはコーディング配列と「機能的に連結している」と言える。)適当なプロモーターには例えばアルコールデヒドロゲナーゼ、グリセロアルデヒド−3−ホスフェート・デヒドロゲナーゼ、ホスフォグルコイソメラーゼ、ホスフォグリセレートキナーゼ、酸ホスファターゼ、T7、TP1、ラクターゼ、メタロチオネイン、サイトメガロウィルス前初期、乳清酸性タンパク質、グルコアミラーゼ、およびガラクトースの存在下で活性化されるプロモーター、例えばGAL1およびGAL10などがある。さらに、その他のタンパク質、オリゴ糖、脂質等をコードするヌクレオチド配列もまたベクターおよびポリアデニル化シグナル(例えばSV−40T抗原、卵アルブミンまたはウシ成長ホルモンのポリAシグナル)のようなその他の制御配列に含まれ得る。構築物に存在する配列の選択は望ましい発現生成物および宿主細胞の特性に依存する。
【0076】
前記するように、一度ベクターを構築すると、次いで当業者に周知の方法、例えばトランスフェクション、形質転換およびエレクトロポレーション(Sambrookら、「Molecular Cloning:A Laboratory Manual」第2版(1989)1ないし3巻、コールド・スプリング・ハーバー・ラボラトリー・プレスを参照のこと)により、これを選択した宿主細胞に導入できる。次いでPUFAの発現を可能にする適当な条件下で宿主細胞を培養し、次いで回収し、精製する。
【0077】
2個またはそれ以上のcDNAのヌクレオチド配列を含んでなる一つの構築物またはベクターを用いる場合、独特のトリグリセリドまたはオイルを設計できることにも留意すべきである(例えばMAELO、GLELO、HSELO1および/またはCEELO1)。次いでこのベクターを1個の宿主細胞に導入できる。別法として、各々の配列を別個のベクターに導入できる。次いでこれらのベクターを各々2個の宿主細胞に、または1個の宿主細胞に導入できる。
【0078】
適当な原核細胞宿主の例としては、例えば大腸菌(Escherichia coli)、枯草菌(Bacillus subtilis)のような細菌、およびスピルリナ(Spirulina)種(すなわち青緑藻)のようなシアノバクテリアなどが挙げられる。適当な真核細胞宿主の例としては、例えば哺乳動物細胞、植物細胞、酵母細胞、例えばサッカロミセス(Saccharomyces)種、リポミセス(Lipomyces)種、カンジダ(Candida)種例えばヤロウィア(Yarrowia)(カンジダ)種、クルイベロミセス(Kluyveromyces)種、ピチア(Pichi)種、トリコデルマ(Trichoderma)種もしくはハンセヌラ(Hansenula)種、または糸状菌細胞のような真菌細胞、例えばアスペルギルス(Aspergillus)、ニューロスポラ(Neurospora)およびペニシリウム(Penicillium)などが挙げられる。好ましくはビール酵母菌(Saccharomyces cerevisiae)(パン酵母)細胞を用いる。
【0079】
宿主細胞における発現は一過性のまたは安定した方法で行うことができる。一過性の発現は宿主細胞で機能する発現シグナルを含有する導入構築物から生じることができるが、この構築物は複製せず、宿主細胞に組み込まれることはまれであるか、または宿主細胞は増殖性でない。一過性の発現はまた目的の遺伝子に機能的に連結した制御可能なプロモーターの活性を誘導することにより達成することもできるが、このような誘導システムでは発現レベルの基底値がたびたび低くなる。安定した発現は宿主ゲノムに組み込むことができるかまたは宿主細胞において自発的に複製される構築物の導入により達成できる。発現構築物に位置するかまたは発現構築物でトランスフェクトされた選別可能なマーカーを使用し、続いてマーカーを発現する細胞を選別することにより、目的の遺伝子の安定発現を選択することができる。組み込みにより安定発現が得られた場合、構築物の組み込み部位を宿主ゲノム内に無作為に生じることができるか、または宿主座との組換えを標的化するのに十分な宿主ゲノムとの相同性領域を含有する構築物を使用することにより構築物の組み込み部位を標的化できる。構築物が内在性の座を標的にする場合、転写または翻訳制御領域の全てまたは一部が内在性の座により提供できる。
【0080】
前記のヌクレオチド配列の一つまたは両方によりコードされる目的の酵素(すなわちエロンガーゼ)を発現するために、トランスジェニックマウスをも用いることができる。より具体的には、一度前記の構築物を作ると、これを胚の前核に挿入できる。次いで胚を受体の雌に移植できる。別法として、核の移送法をも利用できる(Schniekeら、Science、278:2130−2133(1997))。次いで妊娠および出産してもよい(例えば米国特許第5750176号、米国特許第5700671号を参照のこと)。次いで子孫の乳、組織またはその他の体液サンプルは非トランスジェニック動物に通常見出されるレベルに比較して変化したレベルのPUFAを含有するはずである。レベルが変化したまたは増加したPUFA生成、およびエロンガーゼ酵素をコードする一つのまたは複数の遺伝子のゲノムへの組み込みに関して次世代をモニター観察できる。宿主として利用される哺乳動物は例えばマウス、ラット、ウサギ、ブタ、ヤギ、ヒツジ、ウマおよびウシからなる群から選択できる。しかしながら、目的の酵素をコードするDNAをゲノムに組み込む能力を有すればいずれの哺乳動物を用いてもよい。
【0081】
エロンガーゼポリペプチドを発現するために、機能的な転写および翻訳開始および終止領域をエロンガーゼポリペプチドをコードするDNAに機能できるように結合する。転写および翻訳開始および終止領域を、発現すべきDNAを含む種々の非排他的供給源、望ましい系において発現可能であると知られているかもしくは考えられている遺伝子、発現ベクター、化学合成から、または宿主細胞の内在性の座から誘導する。植物組織および/または植物の部分における発現はとりわけ組織または部分が種子、葉、果実、花、根等のような初期に収穫されたものである場合、特定の有効性を呈する。特異的な制御配列例えば米国特許第5463174号、4943674号、51066739号、5175095号、5420034号、5188958号および5589379号の配列を利用することにより発現を植物のその位置に標的化できる。また別に、発現したタンパク質は、直接かまたはさらに修飾して宿主植物からの液体分画に混合することができる生成物を生成する酵素でよい。一つのまたは複数のエロンガーゼ遺伝子の発現、またはアンチセンスエロンガーゼ転写物は植物部分および/または植物組織に見出される特異的PUFAまたはその誘導体のレベルを変化させることができる。望ましいPUFAを高い比率で含有するか、またはPUFA組成物がヒト母乳によりよく類似している組織および/または植物部分を作るために、エロンガーゼコーディング領域を単独でまたはその他の遺伝子をと共に発現できる(Prietoら、PCT公開WO95/24494)。開始領域が得られる遺伝子の3’領域から、または異なる遺伝子から終止領域を誘導できる。多くの終止領域が周知であり、同一および異なる属および種の種々の宿主において満足できるものであることが解っている。終止領域は通常いずれかの特別な特性のためというよりむしろ利便性から選択する。
【0082】
前記したように植物(例えばグリシン・マックス(Glycine max)(大豆)またはブラシカ・ナプス(Brassica napus)カノーラ))、植物組織、トウモロコシ、ジャガイモ、ヒマワリ、紅花または麻を各々エロンガーゼ酵素発現のための宿主または宿主細胞として用いることもでき、またポリ不飽和脂肪酸の生成に利用することができる。より具体的には、望ましいPUFAを種子に発現できる。種子油の単離方法は当業界で周知である。このように、PUFA供給源の提供に加え、エロンガーゼ遺伝子および恐らくデサチュラーゼ遺伝子の発現により種子油成分を操作して栄養組成物、薬学的組成物、動物飼料および化粧品に加えることができる種子油を提供できる。再度、一時的にエロンガーゼ遺伝子が十分に発現できる条件下で、機能的にプロモータに結合したエロンガーゼをコードするDNA配列を含んでなるベクターを植物組織または植物に導入する。ベクターは別の酵素例えばΔ4−デサチュラーゼ、Δ5−デサチュラーゼ、Δ6−デサチュラーゼ、Δ8−デサチュラーゼ、Δ9−デサチュラーゼ、Δ10−デサチュラーゼ、Δ12−デサチュラーゼ、Δ13−デサチュラーゼ、Δ15−デサチュラーゼ、Δ17−デサチュラーゼおよび/またはΔ19−デサチュラーゼをコードする1個またはそれ以上の遺伝子をも含んでなってよい。植物組織または植物は酵素が作用する関連基質(例えばDGLA、GLA、STA、AA、ADA、EPA、20:4n−3、等)を生成できるか、またはこのような基質を生成する酵素をコードするベクターを植物組織、植物細胞、植物、または目的の宿主細胞に導入できる。加えて、適当な酵素を発現する植物組織に基質をスプレーできる。これらの種々の技術を用いることにより、植物細胞、植物組織、植物または目的の宿主細胞を用いてPUFA(例えばDGLA、AAもしくはADAのようなn−6不飽和脂肪酸、またはEPA、もしくはDHAのようなn−3脂肪酸)を生成できる。本発明はまた前記したベクターを含んでなるトランスジェニック植物をも包含し、この場合ベクターのヌクレオチド配列の発現の結果、例えばトランスジェニック植物の種子にポリ不飽和脂肪酸を生成することにも注目すべきである。
【0083】
天然かまたはトランスジェニックのいずれかにより宿主細胞が生成できる基質、および続いて宿主細胞に導入されるベクターに存在するDNA配列によりコードされ得る酵素を図1に示す。
【0084】
前記を鑑み、本発明はまた1)エロンガーゼcDNAの望ましいヌクレオチド配列を単離する工程;2)該ヌクレオチド配列を含んでなるベクターを構築する工程;および3)エロンガーゼ酵素を生成するのに十分な時間および条件下で該ベクターを宿主細胞に導入する工程;からなる前記のエロンガーゼ酵素の一つを生成する方法をも包含する。
【0085】
本発明はまたエロンガーゼが酸をポリ不飽和脂肪酸に変換するように酸を前記のように生成したエロンガーゼに曝露することからなるポリ不飽和脂肪酸の生成方法をも包含する。例えばGLAをエロンガーゼに曝露するとGLAはDGLAに変換される。次いでDGLAをΔ5−デサチュラーゼに曝露すると、これはDGLAをAAに変換する。次いでΔ17−デサチュラーゼを用いてAAをEPAに変換でき、またエロンガーゼおよびΔ4−デサチュラーゼを用いてDHAに変換できる。別法として、エロンガーゼを用いて18:4n−3を20:4n−3に変換し、これをΔ5−デサチュラーゼに曝露してEPAに変換できる。またエロンガーゼを用いて18:3n−3を20:3n−3に変換し、これをまたΔ8−デサチュラーゼにより20:4n−3に変換できる。このようにエロンガーゼをポリ不飽和脂肪酸の生成に用いることができ、またこれを特定の有益な目的のために使用することができる。(いくつかの生合成経路でエロンガーゼが果たす多くの重要な役割の説明に関して図1を参照のこと。)
エロンガーゼ遺伝子およびそれによりコードされる酵素の使用
前記するように単離されたエロンガーゼcDNAおよびそれによりコードされる対応するエロンガーゼ酵素(または精製ポリペプチド)には多くの用途がある。例えば各々のcDNAおよび対応する酵素をポリ不飽和脂肪酸、例えばDGLA、AA、ADA、20:4n−3またはEPAの生成において間接的または直接的に使用できる。(「直接的」とは酵素が直接的に酸を別の酸に変換する状況を包含することを意味し、後者の酸は組成物において利用される(例えばGLAのDGLAへの変換)。)「間接的」とはエロンガーゼにより脂肪酸を別の脂肪酸(すなわち経路中間体)に(例えばGLAをDGLAに)変換する状況を包含することを意味し、次いでエロンガーゼ以外の酵素を用いて後者の脂肪酸を別の脂肪酸に(例えばΔ5−デサチュラーゼによりDGLAをAAに)変換する。これらのポリ不飽和脂肪酸(すなわちエロンガーゼ酵素の活性により直接的または間接的のいずれかにより生成されたもの)を例えば栄養組成物、薬学的組成物、化粧品および動物用飼料に添加することができ、これらはすべて本発明に包含される。これらの用途に関しては以下に詳細に記載する。
【0086】
栄養組成物
本発明は栄養組成物を包含する。本発明の目的のためのこのような組成物には経腸または非経口摂取を含むヒト摂取用のいずれかの食物または調製物が含まれ、これは体内に取り込まれると(a)栄養を与える、もしくは組織を作り上げる、もしくはエネルギーを供給するおよび/または(b)十分な栄養状態もしくは代謝機能を維持、回復もしくは補助する。
【0087】
本発明の栄養組成物は各々のエロンガーゼ遺伝子を用いて生成した少なくとも一つのエロンガーゼ酵素を用いて生成し、固体または液体のいずれかの形態でよい少なくとも一つの油または酸を含んでなる。加えて、組成物は特定の用途に望ましい量の食用多量要素、ビタミンおよびミネラルを含んでよい。このような成分の量は、組成物を正常で健康な幼児、子供に使用することを意図しているのか、それとも特定の代謝状態を伴う成人のような特別な必要性を有する(すなわち代謝障害)成人に使用することを意図しているのかに依存して変動する。
【0088】
組成物に加えることができる多量要素の例としては食用脂肪、炭水化物およびタンパク質などがあるが、これらに限定するものではない。このような食用脂肪の例としてはココナッツ油、大豆油並びにモノおよびジグリセリドなどが挙げられるが、これらに限定するものではない。このような炭水化物の例としてはグルコース、食用乳糖および加水分解デンプンなどが挙げられるが、これらに限定するものではない。加えて、本発明の栄養組成物において用いることができるタンパク質の例としては大豆タンパク質、電気透析乳清、電気透析スキムミルク、乳清、またはこれらのタンパク質の加水分解物などが挙げられるが、これらに限定するものではない。
【0089】
ビタミンおよびミネラルに関しては、以下のものを本発明の栄養組成物に添加してよい:カルシウム、リン、カリウム、ナトリウム、塩化物、マグネシウム、マンガン、鉄、銅、亜鉛、セレニウム、ヨウ素並びにビタミンA、E、D、CおよびB複合体。その他のこのようなビタミンおよびミネラルを添加してもよい。
【0090】
本発明の栄養組成物に用いられる成分は供給源を半精製または精製したものである。半精製または精製したとは天然物の精製により、または合成により調製された物質を意味する。
【0091】
本発明の栄養組成物の例としては幼児調合物、栄養補助食品、食品代用物、および再水和組成物などが挙げられるが、これらに限定するものではない。特定の目的の栄養組成物には、幼児用の経腸または非経口補助食品、幼児専用調合物、高齢者用の補助食品、並びに胃腸障害および/または吸収不良を有する者の補助食品に利用するものなどが挙げられるが、これらに限定するものではない。
【0092】
本発明の栄養組成物はまた食事に補充する必要がない場合でも食物に添加してよい。例えば、マーガリン、調製バター、チーズ、ミルク、ヨーグルト、チョコレート、キャンディー、スナック類、サラダ油、調理用油、調理用脂肪、肉、魚および飲料などのいかなる型の食品に添加してもよいが、これらに限定するものではない。
【0093】
本発明の好ましい実施態様では、栄養組成物は経腸栄養剤であり、より好ましくは成人または小児科用の経腸栄養剤である。ストレスを経験しているかまたは慢性もしくは急性の疾病状態のために特に必要性のある成人または子供にこの組成物を投与できる。組成物は本発明に従って生成したポリ不飽和脂肪酸に加えて、前記するような多量要素、ビタミンおよびミネラルを含んでなってよい。多量要素は人乳に存在するのと等価の量で、またはエネルギーを基準にして、すなわちカロリー当たりを基準にして存在してよい。
【0094】
液体または固体経腸または非経口栄養剤を処方する方法は当業界で周知である。(以下の実施例も参照のこと。)
例えば経腸処方を滅菌し、次いでそのまま供給できるよう(ready−to−feed:RTF用)にするかまたは濃縮液体もしくは粉末として保存する。粉末は前記するように調製した処方をスプレー乾燥して調製でき、濃縮物を再水和することにより再構成する。成人および小児科栄養調合物は当業界で周知であり、市販により入手できる(例えば、ロス・プロダクツ・ディビジョン、アボット・ラボラトリーズ、コロンバス、オハイオ州のSimilac(登録商標)、Ensure(登録商標)、Jevity(登録商標)、およびAlimentum(登録商標))。本発明に従って製造される油または脂肪酸をこれらの処方のいずれかに添加してよい。
【0095】
本発明の栄養組成物のエネルギー密度は、液体の形態では約0.6kcalから約3kcal/mlの範囲でよい。固体または粉末の形態では栄養補助食品は約1.2から9kcal/g以上、好ましくは約3ないし7kcal/gを含んでよい。一般に、液体製品のオスモル濃度は700ミリオスモル以下、より好ましくは660ミリオスモル以下にすべきである。
【0096】
栄養剤は前記するように本発明に従って製造したPUFAに加えて、多量要素、ビタミンおよびミネラルを含んでよい。これらの付加的な成分が存在することにより個体がこれらの要素の1日最低必要量を摂取するのを助ける。PUFAの供給に加えて亜鉛、銅、葉酸および抗酸化剤を組成物に添加するのも望ましい。これらの物質はストレスをうけた免疫系を高め、それにより組成物を摂取している個体がさらなる利益を享受することになると考えられる。薬学的組成物もまたこれらの要素を補給しうる。
【0097】
より好ましい実施態様では、栄養組成物は、抗酸化剤および少なくとも一つのPUFAに加えて、少なくとも炭水化物の5重量%が消化しにくいオリゴ糖である炭水化物供給源を含んでなる。より好ましい実施態様では栄養組成物はさらにタンパク質、タウリンおよびカルニチンを含んでなる。
【0098】
前記するように、静脈内投与を行っている患者用に、または栄養失調もしくはその他の症状もしくは疾病状態の予防もしくは治療のために、本発明に従って製造したPUFAまたはその誘導体を食品代用物または栄養補助食品、とりわけ幼児調合物に添加してよい。背景としてヒトの母乳は約0.15%から約0.36%のDHA、約0.03%から約0.13%のEPA。約0.30%から約0.88%のAA、約0.22%から約0.67%のDGLA、および約0.27%から約1.04%のGLAからなる脂肪酸プロフィールを有することに留意すべきである。従って、本発明に従って製造したDGLA、AA、EPAおよび/またはデコサヘキサエノン酸(DHA)のような脂肪酸を用いて例えばヒトの母乳のPUFA含量をよりよく模写するために幼児調合物の組成を変化させるか、またはヒト以外の哺乳動物の乳に通常見出されるPUFAの存在を変化させることができる。とりわけ薬理学的に、または栄養補助食品、特に母乳代用品もしくは補助食品において使用するための組成物は一つまたはそれ以上のAA、DGLAおよびGLAを含んでなるのが好ましい。より好ましくは、油ブレンドは約0.3から30%のAA、約0.2から30%のDGLA、および/または約0.2から約30%のGLAからなる。
【0099】
非経口用栄養組成物はトリグリセリドとして算出した脂肪酸を約2から約30重量%含んでなり、これは本発明に包含される。好ましい組成物ではGLAとして全PUFA組成物の約1から約25重量%含まれる(米国特許第5196198号)。その他のビタミン、とりわけビタミンA、D、EおよびL−カルニチンのような脂溶性ビタミンを含んでもよい。望む場合、アルファ・トコフェロールのような保存剤を約0.1重量%の量で加えてもよい。
【0100】
加えて、AA、DGLAおよびGLAの比率は特定の最終使用目的に適合させることができる。母乳補助食品または代用品として処方する場合、一つまたはそれ以上のAA、DGLAおよびGLAを含んでなる組成物が各々約1:19:30から約6:1:0.2の比率で提供される。例えば、動物の乳はAA:DGLA:GLAの比率が1:19:30から6:1:0.2の範囲で変動し、好ましくは約1:1:1、1:2:1、1:1:4の中間的な比率も含まれる。宿主細胞において一緒に製造した場合、GLAおよびDGLAのような前駆体基質のAAへの変換率および%を調整してPUFAの比率を正確に調節できる。例えばDGLAのAAへの変換率を5%から10%にしてAAのDGLAに対する比率を約1:19にでき、一方変換率を約75%から80%にしてAAのDGLAに対する比率を約6:1にできる。このように、細胞培養系においても宿主動物においても、エロンガーゼ発現およびその他のデサチュラーゼ発現の時期、程度および特異性を制御してPUFAレベルおよび比率を調節できる。次いで本発明に従って製造したPUFA/酸(例えばAAおよびDGLA)を望ましい濃度および比率で別のPUFA/酸(例えばGLA)と組み合わせてよい。
【0101】
加えて、本発明に従って製造したPUFAまたはそれらを含有する宿主細胞を動物用補助食品として用いて動物の組織または乳脂肪酸組成をヒトまたは動物の摂取により望ましいものに変化させることもできる。
【0102】
薬学的組成物
本発明はまた本明細書に記載した方法に従って、少なくとも一つのエロンガーゼcDNA(すなわちMAELO、GLELO、HSELO1またはCEELO)を用いて製造した一つまたはそれ以上の脂肪酸および/または得られた油を含んでなる薬学的組成物をも包含する。より具体的にはこのような薬学的組成物は一つまたはそれ以上の酸および/または油、ならびに標準的で周知の無毒性の医薬的に許容される担体、アジュバントまたはベヒクル例えばリン酸緩衝生理食塩水、水、エタノール、ポリオール、植物油、湿潤剤または水/油エマルションのようなエマルションを含んでなってよい。組成物は液体または固体の形態でよい。例えば、組成物を錠剤、カプセル、摂取可能な液体または粉末、注射可能なまたは局所用軟膏またはクリームの形態でよい。例えば分散液の場合、必要な粒子径を維持することにより、および界面活性剤を使用することにより適当な流動性を維持できる。等張化剤、例えば糖、塩化ナトリウム等を含有するのも望ましい。このような不活性希釈剤に加え、組成物はまたアジュバント、例えば湿潤化剤、乳化および懸濁化剤、甘味剤、香味剤並びに芳香剤をも含有できる。
【0103】
懸濁液は活性化合物に加えて例えばエトキシル化イソステアリルアルコール、ポリオキシエチレンソルビトールおよびソルビタンエステル、微結晶性セルロース、アルミニウムメタヒドロキシド、ベントナイト、寒天およびトラガカントまたはこれらの基質の混合物を含んでなってよい。
【0104】
錠剤およびカプセルのような固体投与形態は当業界で周知の技術を用いて調製できる。例えば、本発明に従って製造されたPUFAをラクトース、スクロース、およびコーンスターチのような慣用される錠剤基剤をアカシア、コーンスターチまたはゼラチンのような結合剤、ジャガイモデンプンまたはアルギン酸のような崩壊剤、およびステアリン酸またはステアリン酸マグネシウムのような潤滑剤と組み合わせて錠剤化できる。これらの賦形剤を抗酸化剤および適当なPUFAと共にゼラチンカプセルに組み入れてカプセルを調製できる。抗酸化剤およびPUFA成分は前記したガイドラインに適合しなければいけない。
【0105】
静脈内投与用には本発明に従って製造したPUFAまたはその誘導体をIntralipids(登録商標)のような市販の処方に組み入れてよい。典型的な正常の成人血漿脂肪酸プロフィールは6.64から9.46%のAA、1.45から3.11%のDGLAおよび0.02から0.08%のGLAからなる。患者の正常な脂肪酸プロファイルを達成するために、これらのPUFAまたはその代謝前駆体を単独でまたはその他のPUFAと組み合わせて、投与できる。望む場合、処方の各々の成分を別個に、キットの形態で1回または多数回投与用に提供できる。特定の脂肪酸の典型的な投与量は1日0.1mgから20g(100gまで)、好ましくは1日10mgから1、2、5または10gである。
【0106】
本発明の薬学的組成物の可能な投与経路には例えば経腸(例えば経口および直腸経路)および非経口経路等がある。例えば、液体調製物を例えば経口または直腸経路で投与できる。加えて、均質な混合物を水に完全に分散し、滅菌条件下で生理学的に許容される希釈剤、保存剤、緩衝液またはプロペラントと混合してスプレーまたは吸入剤を形成できる。
【0107】
投与経路はもちろん望まれる効果に依存する。例えば、組成物を荒れて乾燥した、または加齢皮膚の処置または外傷のあるまたは火傷した皮膚の処置、または疾病もしくは症状の影響を受けた皮膚もしくは髪の処置に用いる場合、恐らく局所的に適用できる。
【0108】
患者に投与すべき組成物の用量は当業者により決定でき、患者の体重、患者の年齢、患者の免疫状態等に依存する。
【0109】
形態に関しては、組成物を例えば溶液、分散液、懸濁液、エマルションまたは次いで再構築するための滅菌粉末にできる。
【0110】
本発明はまた本明細書に記載した薬学的および/または栄養組成物を用いた種々障害の処置をも包含する。とりわけ、本発明の組成物を用いて血管形成後の再狭窄を処置することができる。さらに、本発明の組成物を用いて炎症、リウマチ性関節炎、喘息および乾癬の症状を処置することもできる。PUFAがカルシウム代謝に関与し得ることも実証されており;従って、本発明の組成物を恐らく骨粗鬆症および腎臓または尿路結石の処置または予防に利用することができる。
【0111】
加えて、本発明の組成物を癌の処置にも用いることができる。悪性細胞が脂肪酸組成を変化させていることが明らかになっている。脂肪酸の添加がその成長を遅延させ、細胞死を招き、化学療法剤の感受性を高めることが示されている。さらに本発明の組成物はまた癌に関連する悪液質の処置にも有益である。
【0112】
本発明の組成物を用いて糖尿病を処置することもできる(米国特許第4826877号およびHorrobinら、Am.J.Clin.Nutr.57(補):732S−737Sを参照のこと)。糖尿病の動物では脂肪酸代謝および組成が変化していることが明らかにされている。
【0113】
さらに、エロンガーゼ酵素を使用して直接的かまたは間接的のいずれかにより製造したPUFAを含んでなる本発明の組成物を、湿疹の処置、血圧低下および数学的な試験スコアの改善にも用いることができる。加えて、本発明の組成物を血小板凝集の阻止、血管拡張の誘発、コレステロール値の低下、血管壁平滑筋および繊維組織の増殖の阻止(Brennerら、Adv.Exp.Med.Biol.83:85−101(1976))、消化管出血およびその他の非ステロイド性抗炎症薬の副作用の低減または予防(米国特許第4666701号)、子宮内膜症および月経前症候群の予防または処置(米国特許第4758592号)、並びに筋肉脊髄炎およびウイルス感染後の慢性疲労の処置(米国特許第5116871号)に用いることができる。
【0114】
さらに本発明の組成物の用途にはAIDS、多発性硬化症および炎症性皮膚障害の処置、並びに一般的な健康状態の保持における使用も含まれる。
【0115】
加えて、本発明の組成物を化粧用の目的に利用することもできる。これを、混合物を形成するように既存の化粧用組成物に加えるか、または単独の組成物として用いることができる。
【0116】
獣医学的適用
前記の薬学的および栄養組成物をヒトと同様に動物(すなわち家畜または家畜以外の動物)に関連して利用できることも注目すべきである。動物はヒトと同じ必要性および状況を多く経験するからである。例えば、本発明の油または酸を動物用栄養補助食餌、動物用食餌代用品、動物用ビタミンに、または動物用局所用軟膏に利用することができる。
【0117】
本発明を以下の実施例を用いて説明するが、これらは本発明を限定するものではない。
【0118】
実施例1
モルチエレラ・アルピナ(Mortierella alpina)で用いるコドンの決定
1000のランダムcDNAクローンの5’末端をモルチエレラ・アルピナ(Mortierella alpina)cDNAライブラリーからシークエンシングした。配列をファストAアルゴリズムを用いるGCG(ジェネティックス・コンピューター・グループ(マジソン、ウィスコンシン州))を用いて6個の読み枠で翻訳し(PearsonおよびLipman、Proc.Natl.Acad.Sci.USA、85:2444−2448(1988))、クエリー配列と同型の配列群(核酸またはタンパク質)の類似性を、とりわけスイスポート・データベース(ジェネバイオ、ジュネーブ、スイス)を用いて調べた。既知遺伝子に対するタンパク質配列相同性に基づいて多くのクローンを推定ハウスキーピング遺伝子として同定した。データベースの既知ハウスキーピング遺伝子に適合する21個のM.アルピナ(M.alpina)cDNA配列を選別した(以下の表1を参照のこと)。これらの21個の配列およびM.アルピナΔ5−(図18を参照のこと)、Δ6−およびΔ12−デサチュラーゼ配列全長に基づいてM.アルピナコドンバイアスの表(表2を参照のこと)を作った。M.アルピナcDNA配列によってコードされる推定タンパク質および既知タンパク質配列間のファストA整列化がいくつかの区域で弱いので、相同性の強い区域のコドンのみを用いた。
【0119】
【表1】

【0120】
【表2】

【0121】
実施例II
M.アルピナのエロンガーゼ様cDNA全長のクローニング
ホホバ由来のβ−ケトアシル補酵素Aシンターゼ(KCS)およびビール酵母菌(Saccharomyces cerevisiae)エロンガーゼ(ELO2)を並べてアミノ酸相同性の区域を決定した(図2を参照のこと)。コドンバイアスを二つのエロンガーゼ間の相同性アミノ酸に対応する配列の区域に適用し、この配列の偏りに基づいてプライマーを設計した(図3を参照のこと)。M11M.アルピナcDNAライブラリーから挿入物の大きさの平均が1.1キロ塩基対である約6x105のクローンを含むcDNAを切除した(Knutzonら、J.Biol.Chem.273:29360−29366(1998))。内在プライマーRO339(5’−TTG GAG AGG AGG AAG CGA CCA CCG AAG ATG ATG−3’)およびベクター順行プライマーRO317(5’−CAC ACA GGA AAC AGC TAT GAC CAT GAT TAC G−3’)を用いて切除したcDNAを増幅した。切除したM.アルピナcDNAライブラリー300ng、各プライマー50ピコモル、10倍バッファー10μl、10mM PCRヌクレオチド・ミックス(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)、およびTaqポリメラーゼ1.0ユニット;を含有する100μlの容量でポリメラーゼ連鎖反応(PCR)を実施した。パーキン・エルマー9600(ノーウォーク、コネチカット州)の熱循環器条件は以下のとおりである:94℃で2分間、次いで94℃で1分間を30サイクル、58℃で2分間、および72℃で3分間。続いて72℃で2分間さらにPCRを延長した。
【0122】
PCR増幅生成物をゲルに流し、約360塩基対の増幅フラグメントのゲルを精製し、ABI 373ADNAシークエンサー(パーキン・エルマー、フォスター・シティー、カリフォルニア州)を用いて単離したフラグメントを直接的にシークエンシングした。GCGの配列分析パッケージを用いて得られた配列を既知配列と比較した。ファストAアルゴリズムを用いるGCG分析プログラムで、6個の読み枠全てで配列を翻訳した(PearsonおよびLipman、前記で引用)。タンパク質のスイスポートデータベース(ジェネバイオ、ジュネーブ、スイス)を検索した。ビール酵母菌ELO2(GNS1)に対する推定タンパク質配列の相同性に基づき、この翻訳したcDNAフラグメントを推定エロンガーゼの一部であると同定し、これは63個のアミノ酸において41.3%の同一性を有した。
【0123】
推定エロンガーゼ配列およびM.アルピナcDNAライブラリーの構築に使用したベクター、pZL1(ライフ・テクノロジーズ・インコーポレーティッド、ガイザースブルグ、メリーランド州)配列に基づいて新規プライマーを設計した。前記した条件を用いて、BamHI制限部位を加えた(下線)プライマーRO350(5’−CAT CTC ATG GAT CCG CCA TGG CCG CCG CAA TCT TG−3’)、およびベクター逆行プライマーRO352(5’−ACG CGT ACG TAA AGC TTG−3’)を使用してM.アルピナ切除したcDNAライブラリーを再度PCR増幅し、M.アルピナエロンガーゼcDNAの全長を単離した。約1.5キロ塩基対のPCR増幅フラグメントの末端をT4 DNAポリメラーゼ(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)で埋め、ブラント末端を作り、pCR−ブラントベクター(インビトロゲン・コーポレーション、カールスバッド。カリフォルニア州)にクローン化した。これにより2個のクローン、pRAE−1およびpRAE−2を得た(図4Aを参照のこと)。(ブダペスト条約の条件下、1998年8月28日、プラスミドDNA pRAE−2をアメリカン・タイプ・カルチャー・コレクション、10801ボウルバード大学、マナサス、バージニア州20110−2209に寄託し、寄託番号:ATCC 203166が付与された。)これらのベクターからのエロンガーゼcDNAをEcoRIフレグメントとして切断し、EcoRI消化pYX242(ノバゲン、マジソン、カリフォルニア州)ベクターにクローン化した。pRAE−5およびpRAE−6クローン(図4Bを参照のこと)は各々pRAE−1およびpRAE−2に由来するエロンガーゼcDNAを有する。(ブダペスト条約の条件下、1998年8月28日、プラスミドDNA pRAE−5をアメリカン・タイプ・カルチャー・コレクション、10801ボウルバード大学、マナサス、バージニア州20110−2209に寄託し、寄託番号:ATCC 203167が付与された。)pRAE−5およびpRAE−6のシークエンシングによりpRAE−5のエロンガーゼ遺伝子の5’未翻訳領域は16塩基対であり、pRAE−6のエロンガーゼ遺伝子よりも短い(図5を参照のこと)。完全なM.アルピナエロンガーゼcDNA配列はMAELOと称し、pRAE−2より得られた(図6を参照のこと)。図7はMAELOの翻訳により得られたアミノ酸である。前記したように翻訳MAELOでスイスポートデータベースを再度検索した:MAELOはビール酵母菌GNS1(ELO2)と317個のアミノ酸において44.3%の同一性を有し、ビール酵母菌SUR4(ELO3)と318個のアミノ酸において44.7%の同一性を有する。3個のエロンガーゼ間のファストA整列化を図8に示す。ヌクレオチドレベルでは(図9を参照のこと)、MAELOビール酵母菌GNS1(ELO2)と549塩基対の重複において57.4%の同一性を有する。しかしながら、954塩基対の完全MAELO遺伝子およびビール酵母菌GNS1(ELO2)間の同一性は33.0%である。
【0124】
実施例III
パン酵母におけるM.アルピナエロンガーゼcDNAの発現
pRAE−5およびpRAE−6構築物をビール酵母菌334に形質転換し(Hovelandら、Gene、83:57−64(1989))、エロンガーゼ活性についてスクリーニングした。pYES2ベクター(インビトロゲン・コーポレーション、カールスバッド、カリフォルニア州)のホホバKCS遺伝子を含有するプラスミドpCGN7875(カルジーン、エルエルシー、デービス、カリフォルニア州)を陽性対照として用いた。M.アルピナエロンガーゼ(MAELO)におけるエロンガーゼ活性を検出するために用いた基質はGLAであり、ホホバKCSの基質はオレイン酸(OA)であった。陰性対照株はpYX242ベクターを含有するビール酵母菌334であった。選択培地(Ausubelら、Short Protocols in Molecular Biology、13章:3−5(1992))中、特定の基質を存在させて培養物を25℃で40ないし48時間成長させた。pYES2にクローン化したホホバKCS遺伝子の発現はGAL1プロモーターの調節下にあり、一方pYX242のプロモーターはTP1であり、これは構成要素である。従って、334(pCGN7875)および334(pYES2)培養物はガラクトースにより誘導される。各細胞ペレットの脂質分画のGC−FAME分析は前記するように実施した(Knutzonら、前記で引用)。
【0125】
異なる実験により得られたエロンガーゼ活性を図10Aおよび10Bで提供する。ホホバKCSはモノ不飽和脂肪酸18:1n−9長鎖を20:1n−9に伸長する。M.アルピナエロンガーゼ(MAELO)並びにビール酵母菌ELO2およびELO3間のアミノ酸相同性により、これらの遺伝子によりコードされたタンパク質は類似の基質特異性を有することが示唆された。M.アルピナエロンガーゼの活性、モノ不飽和脂肪酸および飽和脂肪酸長鎖の伸長(MAELO)は18:1n−9の20:1n−9への変換、また24:0の合成においても認められる。調節株、334(pYX242)では20:1および24:0の量は非常に少ししか、または全く検出されなかった(図10Aを参照のこと)。M.アルピナエロンガーゼ(MAELO)はまた少なくとも一つのPUFAに作用し、18:3n−6(GLA)を20:3n−6(DGLA)に変換する。全脂質における20:3n−6のパーセンテージは、対照334(pYX242)と比較した場合、M.アルピナエロンガーゼ(MAELO)cDNAを有する334(pRAE−5)および334(pRAE−6)において高い。製造した20:3n−6のパーセンテージは334(pYX242)で0.092%であり、対して334(pRAE−5)では0.324%であり、334(pRAE−6)で0.269%であった(図10Aおよび10Bの括弧に示す)。脂肪酸プロフィールにおけるこの差異はまた生成した20:3n−6の全量にも認められる。334(pYX242)により20:3n−6が0.226μgしか生成されなかったが、一方334(pRAE−5)および334(pRAE−6)では各々20:3n−6が2.504μg、および20:3n−6が1.006μg生成された。また、基質を加えない場合、20:3n−6のレベルは検出されなかった。
【0126】
一旦M.アルピナエロンガーゼ(MAELO)により20:3n−6を生じると、Δ5−デサチュラーゼは望ましい発現系においてそれをAAに変換できる。この仮説を試験するために、pRAE−5およびpRAE−4構築物(プラスミドを含有するΔ5−デサチュラーゼ)をビール酵母菌334に同時形質転換し、AA生成に関してスクリーニングした。使用した基質はGLA(18:3n−6) 25μMであった。M.アルピナエロンガーゼ(MAELO)が酵母において活性である場合、次いで基質をDGLA(20:3n−6)に変換し、これをΔ5−デサチュラーゼがAA(20:4n−6)に変換する。図11に示す結果よりAAの生成、すなわちM.アルピナエロンガーゼ(MAELO)の活性が確認される。
【0127】
エロンガーゼと共に、酵母におけるΔ5−、Δ6−およびΔ12−デサチュラーゼの発現により脂肪酸の外来性の供給を必要とせずにAAを生成(図1を参照のこと)するはずである。
【0128】
実施例IV
パン酵母におけるM.アルピナエロンガーゼcDNA MAELOおよびビール酵母菌エロンガーゼELO2の発現の比較
制限部位(下線部)BamHIおよびHindIII(各々)を組み込んだプライマーRO514(5’−GGC TAT GGA TCC ATG AAT TCA CTC GTT ACT CAA TAT G−3’)およびRO515(5’−CCT GCC AAG CTT TTA CCT TTT TCT TCT GTG TTG AG−3)を用いて、酵母エロンガーゼをコード化するELO2遺伝子をビール酵母菌ゲノムライブラリー(オリジーン、ロックビル、メリーランド州)からクローン化した。ELO2遺伝子をBamHIおよびHindIII部位でベクターpYX242にクローン化し、これをpRELOと称し、ビール酵母菌宿主334に形質転換し(Hovelandら、前記で引用)、PUFAエロンガーゼ活性に関してスクリーニングした。陰性対照としてベクタープラスミドを用い、PUFAエロンガーゼ活性を比較するために334(pRAE−5)を成長させた。培地中ガラクトースを含まず、基質として25μM GLAを添加して、前記するように培養物を成長させた。図12は334(pRAE−5)により生成された20:3n−6またはDGLA(18:3n−6またはGLAから伸長)の量を示すが、これは変化していないベクターpYX242を含む陰性対照の約4倍になり、一方2個の別個のクローン334(pRELO−1)および334(pRELO−2)は陰性対照の2倍にしかならなかった。加えて、生成したDGLAを全脂質のパーセントとして表現した場合(図12の括弧に示す)、クローン334(pRELO−1)および334(pRELO−2)は各々DGLA0.153%および0.2%を生成し、一方334(pYX242)はDGLA0.185%を生成した。このようにこれらの株は全て類似のパーゼンテージのDGLAを生成した。しかしながら、株334(pRAE−5)はDGLA0.279%を生成し、334(pYX242)(陰性対照)より50.8%増加している。これらのデータは、ビール酵母菌エロンガーゼ遺伝子ELO2が酵母において過剰発現する場合においてさえ、GLAをDGLAに効果的に伸長しないことを示している。対照、334(pYX242)に比較して高量のDGLAが生成されることから明白であるように、M.アルピナPUFAエロンガーゼ活性はこの変換に関して特異的である。
【0129】
実施例V
MAELOを用いる別の供給源に由来するエロンガーゼの同定
TファストAアルゴリズム(PersonおよびLipman、前記で引用)を用いてクエリーペプチド配列および6個の読み枠の各々に翻訳されたデータベースDNA配列間の類似性を検索した。GCGのGenEMBLデータベース(6/98)でGCGのTファストA検索に翻訳されたMAELOをクエリーとして用い、翻訳MAELOに対するアミノ酸類似性の比較に基づいて別の潜在性エロンガーゼ配列を同定した。例えば図13および14において、2個の整列化は染色体IIIおよびMAELOに由来する2個の異なるシー・エレガンス(C.elegans)配列の翻訳の間に示されている。シー・エレガンスDNA配列(ジェンバンク受入番号:Z68749)はGNS1(ELO2)との類似性を意味すると注釈されており、一方さらにシー・エレガンスDNA配列(ジェンバンク受入番号:U61954)はGNS1およびSUR4(ELO3)の両方に類似することが示されている。これらはスプライシングされたDNSフラグメントであり、ここではイントロンはゲノム配列から除去されており、エクソンが集められ翻訳されている。シー・エレガンスの推定PUFAエロンガーゼおよび翻訳MAELO間の同一アミノ酸の量は約30%である。これは脂肪酸代謝において共通する機能、例えばPUFAエロンガーゼを示している。図15は染色体IIIに由来する翻訳シー・エレガンス配列(ジェンバンク受入番号:AF003134)の別の実例である。DNA配列がビール酵母菌ELO2に対してDNA相同性を有することが同定された。このDNA配列およびそのアミノ酸翻訳をさらに検査し、翻訳MAELOと相同性があることが決定された。従って、シー・エレガンスはPUFAエロンガーゼを含有し得る。
【0130】
図16は各々マウスおよびヒトに由来する、翻訳MAELOを有する翻訳DNA配列の整列化を示す。マウス配列CIG30(ジェンバンク受入番号:U97107)を褐色脂肪組織から単離し、「酵母SUR4タンパク質に類似する」と報告されている。図16に示すように、U97107の翻訳のアミノ酸番号130ないし152は翻訳MAELOに対し高度の類似性を有する。染色体4に由来するヒト配列(ジェンバンク受入番号:AC004050)はHTGS(ハイ・スループット・ゲノム・シークエンス)による。この配列に注釈はない。しかしながら、翻訳AC004050は翻訳MAELOと150個のアミノ酸において28.7%の相同性を有した。この遺伝子フラグメントは、翻訳MAELOに対するアミノ酸類似性に基づくと、ヒトPUFAエロンガーゼのフラグメントであり得る。
【0131】
図17は翻訳MAELOおよび哺乳動物配列(ジェンバンク受入番号:I05465、PCT番号WO88/07577)のアミノ酸整列化を示しており、これはこの配列の発現物に由来するタンパク質がポリコスリル化阻害因子であることを主張している。二つのタンパク質間のアミノ酸同一性は関連する機能、例えばPUFAエロンガーゼ活性があり得ることを意味している。
【0132】
別の翻訳DNA配列および翻訳MAELOに対するそれの相同性に関するこれらの実例は前記の実施例のいずれかが潜在的にPUFAエロンガーゼになり得ることを説明している。これらの実施例は可能なエロンガーゼ全てを包含するものではない。しかしながら、MAELOまたはそのアミノ酸翻訳をデータベース検索のクエリーとして使用してPUFAエロンガーゼ活性を有する別の遺伝子を同定することができる。
【0133】
実施例VI
プラークハイブリダイゼーション法を用いるM.アルピナcDNAライブラリースクリーニング
M.アルピナに由来するさらなるPUFAエロンガーゼ遺伝子を単離するために、慣用的なプラークハイブリダイゼーション法を用いてラムダベクターに作成したM.アルピナcDNAライブラリーをスクリーニングした。MAELOヌクレオチド配列に基づいてDNAプローブを作り、これを用いてλジプロックスベクター(Knutzonら、J.Biol.Chem.273:29360−29366(1998))に作成したM7+8M.アルピナcDNAライブラリーをスクリーニングした。
【0134】
ライブラリーをスクリーニングするためのDNAプローブを作るために、MAELO cDNAをNspIおよびPvuI制限エンドヌクレアーゼで消化した。平均約300塩基対の大きさの小型DNAフラグメント3個を作り、プローブとして使用した。フラグメント化したMAELO cDNAの混合物を用いる原理はM.アルピナに存在する種々PUFAエロンガーゼに保存されているアミノ酸配列の共通の領域またはドメインがあるであろうという仮定に基づいている。標準的なプロトコル(Sambrookら、Molecular Cloning、第2版、コールド・スプリング・ハーバー(1989))に準じ、プラークハイブリダイゼーション技術により、MAELO DNAプローブを用いてcDNAライブラリーをスクリーニングした。
【0135】
簡単には、50000個の1次クローンをプレートし、ナイロン膜に移した。膜を変性し、20% ホルムアミド、0.2% PVP、BSA、フィコール、0.1% SDSおよび0.5M NaClを含有するハイブリダイゼーションバッファー中、アルファ32P−dCTP標識MAELO DNAプローブで一晩ハイブリダイズした。37℃で0.5X SSCを用いてフィルターを洗浄し、オートラジオグラフィー用にX線フィルムに曝露した。この手順を3回繰り返した。繰り返しハイブリダイズした4個のクローン(F1、F2、F3およびF4と称する)を取り、7% DMSOを含有するSMバッファー(Sambrookら、前記で引用)に懸濁した。
【0136】
各候補の最も大きいオープン・リーディング・フレームを酵母発現ベクターpYX242(ノバゲン・インコーポレーティッド、マジソン、ウィスコンシン州)にサブクローン化した。cDNAクローンF1およびF3をEcoRI部位でpYX242にサブクローン化し、一方F2およびF4をNcoI/HindIII部位でサブクローン化した。酵母で発現するために、各候補を含有する組換えpYX242をSC334に形質転換した(Hovelandら、前記で引用)。エロンガーゼ活性および基質特異性を決定するために、実施例IIIに記載のGLA基質25μMの存在下、ロイシンを欠く最低培地で各cDNAクローンを含有するSC334を成長させた。Knutzonら(J.Biol.Chem.273:29360−29366(1998))に記載されるように脂肪酸分析を実施した。その結果、GLAのDGLAへの変換においてこれら4個のcDNAクローンはいずれも有意な活性を呈しないことが示された。このように、さらなるPUFAエロンガーゼの同定には、ハイブリダイゼーション法は成功しないようである。
【0137】
実施例VII
酵母におけるM.アルピナの直接cDNA発現ライブラリーの構築
MAELO以外のPUFAエロンガーゼ遺伝子を同定するために、異なる方法でM.アルピナcDNAライブラリーをスクリーニングした。とりわけ、パン酵母がデサチュラーゼおよびエロンガーゼの各々を欠如しているために長鎖PUFAを生成することができないので、ビール酵母菌にM.アルピナの発現cDNAライブラリーを構築する試みを行った。ビール酵母菌におけるcDNAライブラリーを発現するために、GAL1プロモーターを含有するベクターpYES2(ノバゲン・インコーポレーティッド、マジソン、ウィスコンシン州)を選択した。
【0138】
cDNAを作成する慣用的な方法(すなわちDNA混合物をライゲートしたcDNA/ベクターの宿主細胞への形質転換)は酵母においては困難である。なぜならばライゲートしたDNA混合物の直接的エレクトロポレーションによる形質転換効率は精製スーパーコイル化プラズミドDNAの効率に比較して非常に低い。しかしながらこの方法の主に優れた点は中間体として大腸菌(E.coli)にライブラリーを作成した場合に起こる1次クローンの増幅を避けられることである。スクリーニングされるコロニー数が制限されるために、cDNA/ベクターライゲーション混合物を用いて異なるビール酵母菌株において形質転換する効率を最初に最適化することが決まっている。得られた最もよい結果ではビール酵母菌株SC334におけるライゲートしたDNAのμgあたり4ないし5x105の形質転換体を生じた(Hovelandら、前記で引用)。
【0139】
酵母に直接的M.アルピナcDNA発現ライブラリーを作成するために、全RNAを真菌類から単離した。M.アルピナ真菌類(ATCC番号:32221)をコーンミール寒天(ディフコ・ラボラトリーズ、デトロイト、ミシガン州)上にプレートし、室温で3ないし4日間成長させた。一度菌類の成長が可視化されると、これをジャガイモデキストローズブロス50mlに接種し、室温で非常にゆっくりと振盪して胞子を形成させる。一度胞子が可視化されると、培養物50mlをジャガイモデキストロースの培養物1lに接種し、胞子を72時間成長させた。滅菌ガーゼを通してろ過した後、さらにRNA抽出するためにすぐに細胞を液体窒素で凍結した。熱フェノール/LiCl抽出法(Sambrookら、前記で引用)を用いて細胞ペレット36gから全RNAを調製した。10mM EDTA、1% SDSおよび200mM 酢酸ナトリウムの溶液(pH4.8)中で細胞ペレットをホモジナイズした。ホモジネートにフェノールおよびクロロホルムを加え、水層を抽出した。再度フェノールおよびクロロホルムで水層を戻し抽出した。次いで4M 塩化リチウム等量を加えた。氷上で3時間サンプルをエタノール沈殿させ、遠心によりペレットを得た。RNAペレットを70%エタノールで洗浄し、DEPC処理した水に再懸濁した。分光測光法により全RNAを定量し、アガロースゲル電気泳動により可視化し、28Sおよび18Sリボソームのバンドの存在を確認した。細胞ペレット36gから全RNA約15mgを得た。
【0140】
標準的なプロトコル(Sambrookら、Molecular Cloning、第2版、コールド・スプリング・ハーバー(1989))に準じてライブラリーを構築した。オリゴdTセルロース・アフィニティー精製を用いて全RNAからメッセンジャーRNAを調製した。AMV逆転写酵素を用いてXhoI制限部位を含有するオリゴdTプライマーでメッセンジャーRNAを逆転写した。cDNAの第1の鎖を合成した後、大腸菌DNAポリメラーゼ、大腸菌DNAリガーゼおよびRNアーゼ Hを添加してcDNAの第2の鎖を合成した。
【0141】
T4 DNAリガーゼによりEcoRIアダプタをブラント末端化したcDNAにライゲートした。T4ポリヌクレオチドキナーゼを用いてcDNAサンプルをキナーゼ処理し、XhoIで消化し、カラムバッファーで希釈し、セファクリルS−400カラムに通した。高塩濃度バッファーによりDNAサンプルを希釈した。400ないし5000塩基対のDNAを含有するサンプルをプールし、これをpYES2ベクター(インビトロゲン・コーポレーション、カールスバッド、カリフォルニア州)へのライゲーションに用いた。T4 DNAリガーゼを用いてEcoRI/XhoI消化pYES2ベクターにcDNAをライゲートした。酵母の直接的形質転換には多量のライゲート化DNA(2ないし3μg)が必要であるので、大容量のライゲーション反応を実施した。
【0142】
cDNA/pYES2ライゲート化混合物で酵母細胞を直接形質転換するために、LiAc TRAFO法を用いてコンピーテントSC334細胞を調製した(Gietzら、Mol.Cell.Biol.5:255−269(1995))。簡単には、プレートからのSC334の新鮮培養物をYPD培地50mlに接種した。30℃で振盪しながら600でのODが1.0に達するまで培養物を成長させた。この出発物質30mlをYPD液体培地300mlに接種し、培養物の細胞数が〜3ないし5x106セル/mlに達するまで(約3ないし4時間)振盪しながらインキュベートした。細胞を収穫し、滅菌水で洗浄した。全細胞ペレットを新しく調製した1X TE/LイAc(0.1M LiAc)1.5mlに再懸濁した。すぐにこれらの細胞を形質転換に用いた。
【0143】
コンピーテントSC334細胞750μlを15mlファルコンチューブに等分した。cDNA/pYES2ライゲートしたDNAの約2μgを担体DNAと共に細胞に加え、穏やかに混合した。滅菌した40%PEG/LiAc3mlを細胞に加え、穏やかにしかし完全に混合した。振盪しながら30℃で30分間細胞をインキュベートし、続いて42℃で15分間熱ショックを与えた。細胞を冷却し、ペレット化し、1X TE5mlに再懸濁した。前記の細胞の100μlアリコートをウラシル不含の150mm選択寒天プレート50個にプレートし(Ausubel、前記で引用)、30℃で3日間インキュベートした。全部で8x105個の1次クローンを得た。5個のコロニーをウラシル不含の最低培地1mlにプールし(Ausubelら、前記で引用)、貯蔵用にグリセロールを添加した。全部で5000個のプールをスクリーニング用に作った。
【0144】
実施例VIII
酵母におけるMAD(M.アルピナ直接)スクリーニング
ライブラリーにおけるcDNAの平均の大きさを決定することによりライブラリーの品質を分析した。ライブラリーのスクリーニングがcDNAの発現に基づいているので、ライブラリーに存在するcDNAの平均の大きさを決定することが重要である。最も長いcDNAを含有する発現ライブラリーを選択するのが、目的のcDNA全長を単離するために最も適切であろう。この目標のために、実施例VIIに記載するように、無作為に選択したプールを選択寒天プレートにプレートし、個々のコロニーを得た。40個の異なる酵母コロニーを無作為に取り、各コロニーをウラシル不含の選択液体培地5mlに接種し(実施例VIIに記載するように)、30℃で24時間、振盪しながら成長させた。ビーズ・ビーティング法(Hoffmanら、Gene、57:267(1987))を以下のように適応させてこれらのコロニーからプラスミドDNAを抽出した:
100mM NaCl、10mMトリス、pH8.0、1mM EDTAおよび0.1% SDS溶液0.5ml中培養物5mlからのペレットを溶解した。等量の滅菌0.5mmガラスビーズを加え、3分間手動で攪拌した。同じバッファー200μlを加え、混合物をさらに1分間攪拌した。サンプルを高回転で2分間遠心し、次いで新しいチューブに細胞抽出物を移した。等容量のフェノール/CHCl3をサンプルに加え、攪拌し、再度2分間遠心した。水層を2回再抽出し、0.3M酢酸ナトリウムおよび約2.5容量のエタノールを用いて−20℃で30分間沈殿させた。70%エタノールで沈殿物を洗浄し、水に再懸濁した。RNAおよびいかなるタンパク質夾雑物をも排除するために、製造者プロトコルに準じてQIAプレップ・スピン・ミニプレット・キットを用いて(キアゲン・インコーポレーティッド、バレンシア、カリフォルニア州)、40個の異なるサンプルから単離したプラスミドDNAをさらに精製した。次いでEcoRIおよびXhoI制限エンドヌクレアーゼでプラスミドDNAサンプルを制限してcDNAフラグメントを放出し、1%アガロースゲル上で消化物を分析した。その結果、直接ライブラリーのcDNAの大部分が0.8キロ塩基対から1.5キロ塩基対の長さで変動することが示された。
【0145】
ライブラリーをスクリーニングするために、グリセロール保存物を解凍し、約0.5mlをウラシル不含(Ausubelら、前記で引用)の液体選択培地5mlに加え、30℃で24時間成長させた。次いで培養物を2%ガラクトースおよび25μlGLA(エロンガーゼ酵素の基質)を含むウラシル不含液体選択培地50mlに移して25℃で24時間攪拌した。各々の誘導培養物の細胞ペレット中の脂質含量のGC−FAME分析を前記のように実施した(Knutzonら、前記で引用)。MAELO(ウラシル不含選択培地中で成長したpYX242のpRAE−5)を各バッチのランにおける陽性対照として用いた。MAELOはは一貫してGLAの1.5%をDGLAに変換できる(実施例IIIを参照のこと)。
【0146】
実施例IX
潜在PUFAエロンガーゼをコードするcDNAの同定
GC−FAME分析により約750個の個々のプールをスクリーニングおよび分析した後、実施例VIIIに記載するように、5個のコロニーからなる1個のプール(すなわちMAD708)がGLAのDGLAへの変換における有意な酵素活性を有すると考えられた。DGLA/GLA比率に関してこの活性はM.アルピナエロンガーゼ活性(MAELO)よりも約5倍の高いことが認められた(図19)。同じアッセイ条件下でプールを再度試験し、最初の知見を確認した。反復試験によりGLAがDGLAに9.5%変換され、M.エアルピナエロンガーゼ活性(MAELO)より約5倍高かった。これらの結果よりMAD708プールが、基質であるGLAに特異的なエロンガーゼ候補を含有することが強く示された。MAD708が異なる5個のクローンからなる1個のプールであるので、このプールからエロンガーゼ活性をコードする個々のcDNAクローンを単離する必要があった。そのために元来のMAD708グリセロール貯蔵物をウラシル不含の選択培地寒天プレートにプレートした(Ausubelら、前記で引用)。30個の個々のコロニーを取り、実施例VIIIに前記するように、GLAの存在下ウラシル不含で2%ガラクトースを含む液体選択培地で成長させた。次いで各培養物から得られた細胞ペレットを陽性対照が334(pRAE−5)(pYX242のMAELO)の脂肪GC−FAME分析(Knutzonら、前記で引用)に供した。酵母のMAD708発現プールからの30個の個々のクローンの脂肪酸分析により、30個のクローンのうち5個がGLAのDGLAへの変換においてエロンガーゼ活性を示すことが明らかにされた。活性クローンMAD708−2、MAD708−10、MAD708−18、MAD708−19およびMAD708−30の脂肪酸プロフィールを図20に示す。この図に示されるように、MAD708−2、10および30が最もDGLAを生成し、MAELO(pRAE−5)の約25倍以上である。これらの3個は41%ないし49%の範囲でGLAをDGLAに変換する。その他のクローン、MAD708−18およびMAD708−19は8%および21%GLAをDGLAに変換する。全てのMAD708クローンはエロンガーゼをコードするMAELOに関して高いパーセンテージてGLAをDGLAに変換する(3.4%)。
【0147】
実施例X
エロンガーゼをコードするcDNAの特性化
実施例VIIIに記載するように、ビーズビーティング法により有意なGLA特異性エロンガーゼ活性を呈するSC334酵母クローン(MAD708プール)からプラスミドDNAを抽出した。cDNA挿入物の大きさを決定するために、陽性エロンガーゼクローンから得た各プラスミドDNAを鋳型として用いてPCRを実施した。順行プライマーRO541(5’−GAC TAC TAG CAG CTG TAA TAC−3’)および逆行プライマーRO540(5’−GTG AAT GTA AGC GTG ACA TAA −3’)はpYES2ベクターのマルチクローニング部位にあり、EcoRIおよびXhoI部位内のcDNA挿入物を増幅するのに使用した。プラスミドDNA 4マイクロl、各プライマー50ピコモル、10Xバッファー5μl、10μM PCRヌクレオチドミックス(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)1μlおよびハイ・ファイブ・Taqポリメラーゼ(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)0.5μl含有する50μl容量中PCRを実施した。増幅は以下のように実施した:94℃で2分間変性、次いで94℃で1分間、55℃で2分間、および72℃で3分間、30サイクル、増幅の最後に72℃で7分間延長。PCR増幅生成物を1%アガロースゲル上で分析し、エロンガーゼcDNAの大きさが約1.0ないし1.2キロ塩基対であることが示された。潜在エロンガーゼcDNAを含有するプラスミドDNAをpRPB2、pRPB10、pRPB18、pRPB19およびpRPB30と称する。pYES2ベクターのEoRIおよびXhoI部位でcDNAライブラリーを作成したので、前記プラスミドをEcoRIおよびXhoIで消化することにより各プラスミドに存在するcDNAの大きさをさらに確認した。
【0148】
cDNAクローンの長期保存用およびDNAシークエンシング用に酵母から単離したプラスミドDNAを大腸菌で再増幅した。製造者プロトコルに従って、大腸菌TOP10(インビトロゲン・コーポレーション、カールスバッド、カリフォルニア州)細胞をpRPB組換えプラスミドで形質転換した。各プラスミドDNAから得た形質転換体をアンピシリン(50μg/ml)含有LBに接種し、振盪しながら37℃で一晩成長させた。製造者プロトコルに従ってQIAプレップ・スピン・ミニプレップ(キアゲン・インコーポレーティッド、バレンシア、カリフォルニア州)を用いてこれらの培養物からプラスミドDNAを単離した。次いで精製プラスミドDNAを用いて5’および3’の両末端よりシークエンシングした。製造者プロトコルに従って373AストレッチABI自動DNAシークエンサー(パーキン・エルマー、フォスター・シティー、カリフォルニア州)を用いてDNAシークエンシングを実施した。シークエンシングに用いたプライマーはpYES2ベクターのマルチクローニング部位に含まれる順行プライマーRO541(5’−GAT TAC TAG CAG CTG TAA TAC−3’)および逆行プライマーRO540(5’−GTG AAT GTA AGC GTG ACA TAA −3’)である。得られたヌクレオチド配列を分析するためにシークエンサー・ソフトウェア・プログラム(ジーン・コード・コーポレーション、アン・アルボア、ミシガン州)に移した。DNA配列分析により5個のエロンガーゼcDNA全てが301ヌクレオチドの共通重複と同等のヌクレオチドを含有することが示された。各DNA配列は5’末端の初めに推定出発部位を、3’末端でポリAテールを有する停止コドンを含有する。DNA配列をさらに確認するために内部の順行プライマーRO728(5’−GAG ACT TTG AGC GGT TCG−3’)およびRO730(5’−TCT CTG CTG CGT TGA ACT CG−3’)を逆行プライマーRO729(5’−AAA GCT CTT GAC CTC GAA C−3’)およびRO731(5’−AAC TTG ATG AAC GAC ACG TG−3’)と共にcDNA内に設計し、pRPB2のシークエンシングに用いた。なぜならばこの候補は最も高いエロンガーゼ活性を有するからである。シークエンサープログラムにより全ヌクレオチド配列を分析し、pRPB2の全cDNA配列から推測される最も長いオープン・リーディング・フレームは957塩基対の長さであると考えられた(図22)。次いで推測されるオープン・リディング・フレームを対応するアミノ酸配列に翻訳し、予測される配列を図23に示す。M.アルピナから同定されたcDNAによりコードされたエロンガーゼは318アミノ酸長のタンパク質であると考えられ、これは翻訳MAELOの大きさとほとんど同等である。この新規エロンガーゼを「GLELO」と称し、そのコード化タンパク質を「GLAエロンガーゼ」と命名した。
【0149】
ブダペスト条約の条件下、1999年7月22日にプラスミドDNA pRPB2をアメリカン・カルチャー・コレクション、10801 ボウルバード大学、マナサス、バージニア州20110−2209に寄託した。これにはATCC寄託番号:PTA−402が付与された。
【0150】
実施例XI
GLAエロンガーゼ(GLELO)の生化学的特性
A.GLAエロンガーゼ活性の確認
pRPB2組換えプラスミドによりコードされたGLAエロンガーゼの活性をさらに確認するために、pRPB2プラスミドを含有する酵母クローンSC334でエロンガーゼ活性スクリーニングを繰り返した。またこの実験を行うことにより一貫した脂質抽出を確実にし、4つの別個の実験を平均化することによりGLAエロンガーゼ活性を検出できた。pRPBを含有するビール酵母菌334グリセロール貯蔵物をウアシル不含の最低培地寒天プレートにプレートした。個々のコロニーを無作為に取り、実施例VIIIに記載するように、ウラシル不含の最低培地で成長させた。4個の別個の培養物を組み合わせ、5mlアリコートを用いて4個の別個の培養物50mlに接種した。次いでGLAの存在下培養物を成長させ、実施例VIIIに記載するように、pYES2を含有するビール酵母菌334の陰性対照と共に脂肪酸分析に供した。25μM GLAを含む334(pRPB2)の4個の別個の培養物の平均エロンガーゼ活性を図24に示す。334(pRPB2)の4個の別個のサンプルの各々のGLAエロンガーゼ活性は62%のGLAのDGLAへの平均変換に一致すると考えられた。
【0151】
B.GLAエロンガーゼに関するGLELO基質特異性の決定
GLAエロンガーゼの基質特異性を分析するために、334(pRPB2)の培養物をGLAに加えて別の脂肪酸基質(例えばSA(18:0)、OA(18:1)、LA(18:2n−6)、AA(20:4n−6)、ADA(22:4n−6)、ALA(18:3n−3)、STA(18:4n−3)、およびEPA(20:5n−3))で試験した。同等のアッセイ条件下でエロンガーゼ酵素により利用される唯一の別の基質はn−3経路の脂肪酸、STAであった。GLAエロンガーゼは73%のSTAを20:4n−3に変換できた(図25)。これらの実験より、GLAエロンガーゼがGLAとSTAの両方に基質特異性を有すると結論づけられ、これはこれがn−6およびn−3経路の両方でエロンガーゼ活性を有していることを示している。
【0152】
C.酵母における菌類のGLELOおよびΔ5−デサチュラーゼ遺伝子の同時発現
望ましい同時発現系において一度GLAエロンガーゼによりDGLA(20:3n−6)を生成すると、Δ5−デサチュラーゼがそれをAA(20:4n−6)に変換できる。図1で表されるように、この反応図式はEcoRI部位でクローン化されたプラスミドpRPB2およびpRPB31(Δ5−デサチュラーゼcDNAを含有する組換えプラスミドpYX242)(図18)を用いてビール酵母菌334を同時形質転換することにより試験できる。同時形質転換した酵母培養物に25μM GLAを補充し、AA合成に関して分析した。エロンガーゼおよびΔ5−デサチュラーゼ酵素の両方を発現する場合、GLA基質はDGLAに変換され、これは次いでAAに変換される。26Aの結果はGLAエロンガーゼおよびΔ5−デサチュラーゼのGLA基質に及ぼす一連の作用の結果、平均27%のGLAをAAに変換する。従って、GLAエロンガーゼはn−6PUFA合成経路において別の酵素と働いて望ましい脂肪酸を生成することができる。
【0153】
前記の変換がn−3経路でも真実であるかどうかを決定するために、25μM STAの存在下同様の同時発現実験を実施した。再度両酵素を発現する場合、STA基質は20:4n−3に変換され、これがΔ5−デサチュラーゼによりEPA(20:5n−3)に変換される。図26BではEPAの生成(約40%)が観察されたことを示している。再度、GLAエロンガーゼがn−3経路においてΔ5−デサチュラーゼと共に働いて望ましい脂肪酸を生成できることが示された。
【0154】
実施例XII
GLELOおよびその他の菌類のエロンガーゼ間の配列比較
GCGの配列分析パッケージ(実施例Iを参照のこと)を用いてGLELO配列を既知タンパク質配列と比較した。GLELOオープン・リーディング・フレームのヌクレオチド配列が最初に翻訳され、これをクエリー配列として用いてファストAアルゴリズム(実施例Iを参照のこと)を用いるスイスポートデータベース(実施例Iを参照のこと)を検索した。アミノ酸配列類似性に基づき、ビール酵母菌YJT6(未知の注釈を付したEST)と189個のアミノ酸重複において33.9%の同一性、ビール酵母菌ELO2(GNS1)と295個のアミノ酸重複において25.8%の同一性、およびビール酵母菌ELO3(SUR4)と313個のアミノ酸重複において25.2%の同一性で最も適合することが見出された。GLELOのMAELOとのファストA整列化により275個のアミノ酸において30.9%の同一性が示された(図27)。発展的なペア化した整列化を用い(実施例Iを参照のこと)、前記のエロンガーゼと共に用いてGCGパイルアッププログラムにより、関連する配列群から多数の配列整列化を作った。パイルアップの結果により、エロンガーゼには推定ヒスチジンボックスを含む多くの保存領域があり、これには下線を付してある(Knutzonら、J.Biol.Chem.273:29360−29366(1998))(図28)。このように、GLELOはMAELOと類似性を有するが、基質優先性は恐らくコード化されたエロンガーゼにおける差異によるものであろう。GLAエロンガーゼはM.アルピナよりも高いパーセンテージでGLAをDGLAに変換できる。加えてビール酵母菌におけるMAELOの発現はGLAのDGLAへの伸長に加え、飽和およびモノ不飽和脂肪酸の伸長を呈する(実施例IIIを参照のこと)。
【0155】
実施例XIII
哺乳動物におけるM.アルピナMAELO相同性の同定
MAELO翻訳配列を用いてアボット・ラボラトリーズ、100アボット・パーク・ロード、アボット・パーク、イリノイ州60064のユニファイド・ヒューマン・トランスクリプト・データベースを検索した。ベーシック・ローカル・整列化・サーチ・ツール(BLAST)(Altschulら、Nuc.Acids.Res.25:3389−3402(1997))を用いてデータベースを検索した。このツールは「クエリーがタンパク質であるかDNAであるかにかかわらず、全ての可能な配列データベースのずべてを探るために設計された一連の類似性検索プログラムである」。具体的には、ツブラストン(tblastn)アルゴリズムを用いた(すなわち6個の読み枠で翻訳されたヌクレオチドデータベースに対するタンパク質クエリー検索)。ユニファイド・ヒューマン・トランスクリプト・データベースにおけるコンティグ(CC)配列は共通のドメインおよび発現配列タグ(EST)のIncyte LIFESEQ(登録商標)データベース(インサイト・ファーマシューティカルズ・インコーポレーティッド、3174ポーター・ドライブ、パロ・アルト、カリフォルニア州94304)(規定した配列相同性に基づいてクラスター化し、重複配列に基づいてアセンブルする)に由来する発現配列タグ(EST)cDNAの群を代表するコンセンサス配列である。このデータベースからの2個の配列、CC067284R1およびCC1484548T1は各々翻訳MAELO配列を有し、242個のアミノ酸重複において28%の同一性、266個のアミノ酸重複において28.6%の同一性を有した。2個の誘導および編集した配列を各々hs1およびhs2と称し、GCGの配列分析ソフトウェアパッケージにコピーした(実施例Iを参照のこと)。ファストAアルゴリズムを用いて翻訳MAELO配列を翻訳HS1(242個のアミノ酸において28.5%の同一性)および翻訳HS2(266個のアミノ酸において28.2%の同一性)cDNA配列と整列化し、各々図29および30に示した。HS1 cDNAヌクレオチド配列はまた844塩基対においてI05465ヌクレオチド配列と86.9%の同一性を有した(実施例Vを参照のこと)。翻訳HS2 cDNA配列は受入番号:W74824のジェンバンクからのアミノ酸配列と100%の同一性を有した(公開PCT出願WO9839448を参照のこと)。
【0156】
ナショナル・センター・フォー・バイオテクノロジー・インフォメーション(NCBI、http://www.ncbi.nlm.nih.gov/)を用いてAC004050(TファストA検索で同定されたヒト配列、実施例Vを参照のこと)から翻訳された28個のアミノ酸配列(DTIFIILRKQKLIFLHWYHHITVLLYSW)を有するツブラストンを用いるデータベース検索を行った。このアミノ酸配列はヒスチジンボックス(下線部)を含み、これはデサチュラーゼ(Knutzonら、前記で引用)並びにMAELOおよびGLELOの両方のPUFAエロンガーゼの注目すべきモチーフを有する(図28を参照のこと)。実施例Vにおいて前記した翻訳マウス配列(ジェンバンク受入番号:U97107)および翻訳シー・エレガンス配列(ジェンバンク受入番号:U41011)はこの28個のアミノ酸クエリーと高度に適合する。翻訳U41011をクエリーとして用いてNCBIマウスESTデータベースを再度ツブラストンで検索した。さらなるマウス配列を同定し(ジェンバンク受入番号:AF014033.1)、「脂肪酸伸長における関与が推定される」と注釈した。マウスESTデータベースを翻訳AF014033.1でツブラストン検索することによりこれらの長い配列(ジェンバンク受入番号:AA591034、AA189549、およびAA839346)を同定し、mm2と称する1個の配列と組み合わせた。翻訳mm2およびMAELOのファストA整列化(実施例Iを参照のこと)を図31に示す。関連するが同一ではない別のマウス配列(ジェンバンク受入番号:AI225632)をもAF014033.1でマウスESTデータベースのツブラストン検索において同定した。MAELOに対する翻訳AI225632のファストA整列化を図32に示す。翻訳MM2およびAI225632の両方の翻訳MAELOとの同一性パーセントは各々191個および115個のアミノ酸重複において30.4%である。これらの2個の翻訳マウス配列と翻訳MAELOとのアミノ酸同一性のレベルより、これらがPUFAエロンガーゼの推定相同体であることが確認される。
【0157】
実施例XIV
哺乳動物におけるM.アルピナGLELO相同体の同定
クエリーとして翻訳GLELOを用いて、タンパク質配列を6個の読み枠の各々において翻訳されているデータベースDNA配列と比較するTファストAアルゴリズムを使用した。GCGのジーンEMBLデータベースを用いて、翻訳GLELOに対するアミノ酸類似性に基づいて別の潜在するエロンガーゼ配列を同定した。3個のヒト配列がGLELOアミノ酸配列に適合することが解った。これらの配列はジェンバンク受入番号:1)AI815960、2)AL034374および3)AC004050を有する。AI815960、ホモ・サピエンEST配列は144個のアミノ酸重複において翻訳GLELOと40.3%の同一性を有する(図33を参照のこと)。ヒトゲノムの翻訳領域、AL034374は染色体VIに由来し、60個のアミノ酸重複において翻訳GLELOと46.7%の同一性を有する(図33を参照のこと)。AL034374における相同領域は翻訳MAELOと相同性を有することが示されているHS1アミノ酸配列の一部であると考えられる(実施例XIIIを参照のこと)。従って、HS1配列はMAELO(図29を参照のこと)とGLELO(図34を参照のこと)の両方と類似性を有する。染色体IVに由来するヒトゲノム配列AC004050の翻訳領域は89個のアミノ酸重複において翻訳GLELOと34.8%の同一性を有する(図35を参照のこと)。GLELOとこれらのヒト配列間のアミノ酸同一性により、これらのヒト配列に由来するタンパク質がPUFAエロンガーゼ活性のような機能と関連し得ることが示される。
【0158】
GLELOに類似するマウスcDNAを同定するために、翻訳GLELOをクエリーとして用い、ジーンEMBLでTファストA検索を実施した。TファストA検索により翻訳GLELOに高度に適合する3個のマウス配列を同定した:(ジェンバンク受入番号:1)AF104033、2)AI595258および3)U97107)。AF104033には「酵母ELO3(SUR4)に相同である推定脂肪酸エロンガーゼを有するMUELタンパク質」と注釈し、これはMM2の配列の一部である。MM2配列は最初AF104033マウス配列から誘導したが、最終的にはさらなるマウスESTデータベース検索により全MM2配列を得、これもまた翻訳MAELOと相同であることが示された(実施例XIIIおよび図31を参照のこと)。ファストAを用いてこのMM2アミノ酸配列を翻訳GLELO配列と整列化した場合、211個のアミノ酸重複において34.6%の同一性が見出され(図36を参照のこと)、このことはMM2もまたGLELOと相同であることを示している。AI595258は酵母ELO3エロンガーゼと5’類似性を有するマウスcDNAクローンであり、マウスEST cDNA AI225632の一部である。AI225632マウス配列はAI595258よりも長い配列であり、翻訳MAELOと類似性を有することが示された(図32を参照のこと)。AI225632をまた翻訳GLELOとも整列化し、ファストAアルゴリズムを図37に示す。199個のアミノ酸重複において35.3%の同一性が見出された。第3の配列、U97107はマウス配列であり、「酵母ELO3(SUR4)遺伝子に類似する」と注釈されている。翻訳GLELOのU97107との整列化を図38に示すが、ここでは279個のアミノ酸重複において23.7%の同一性が見出された。前記するように、ファストA整列化に基づいてU97107の領域はまたMAELOと高度な相同性を有することも見出された(実施例Vおよび図16を参照のこと)。
【0159】
前記の検索により、クエリーとしてMAELOまたはGLELOのいずれかを用いて同一のヒトおよびマウス配列が得られることが明白に示された。
【0160】
実施例XV
別のPUFA生成生物におけるM.アルピナGLELOおよびMAELO相同体の同定
A)カエノルハブディティス・エレガンス
シー・エレガンスの染色体配列から推測される推定アミノ酸配列(ジェンバンク受入番号:U41011)は、GLAエロンガーゼ(GLELO)およびM.アルピナエロンガーゼ(MAELO)の両方とアミノ酸類似性を有するマウスMM2推定PUFAエロンガーゼに含まれる部分配列を同定できる。従ってGLELOまたはMAELOのシー・エレガンス相同体が線虫データベースに存在するかもしれないと考えられる。GLELOおよびMAELO配列に由来する推定アミノ酸配列をクエリーとして用いて別個に線虫データベースを検索した。BLAST検索(実施例XIIIを参照のこと)をウォームペップ16(ブラストプ(blastp)はヌクレオチド配列データベースに対してアミノ酸クエリー配列を比較する)およびウォームペップ16cDNA(ツブラストン)データベース(これはシー・エレガンスゲノムシクエンシングプロジェクトまたはESTおよびその対応するcDNA配列から得られるタンパク質およびcDNAを予測する)で実施した。これらの配列データはシー・エレガンスシークエンシング群により作られ、サンガー・センターおよびゲノム・シークエンシング・センターにより統合され、ftp://ftp.sanger.ac.uk/pub/databases/wormpep/より入手できる。少なくとも7個の推定シー・エレガンス翻訳ハイブリダイゼーションをGLELOおよびMAELOの両方の翻訳アミノ酸配列に相同であるアミノ酸配列により同定した。推定アミノ酸を含有するこれらのゲノム配列のジェンバンク受入番号はZ19154、U68749(2個の推定タンパク質(F56H11.4およびF56H11.3(ウォームペップ受入番号)))、U41011、U61954(2個の推定タンパク質(F41H10.7およびF41H10.8(ウォームペップ受入番号)))およびZ81058であると同定された。これらの下線部分は翻訳MAELOをクエリーとして用いる前記の検索において同定された(実施例Vを参照のこと)。実例として、翻訳GLELOおよびMAELOを有する翻訳U68749(F56H11.4)のファストAアミノ酸整列化を図39および40に示す。翻訳U68749(F56H11.4)は約200個のアミノ酸重複においてM.アルピナエロンガーゼおよびGLAエロンガーゼの両方と25ないし30%の同一性を有する(図39、40を参照のこと)。7個の翻訳推定シー・エレガンスcDNAの全てに関して、翻訳GLELOに対するファストA整列化により200個のアミノ酸重複で同一性が25ないし30%であり、一方翻訳MAELOに関しては同一性は少なくとも188個のアミノ酸重複において26ないし34%であった。整列化の類似性により翻訳GLELOまたはMAELOのいずれかを用いてエロンガーゼ活性を有するシー・エレガンス由来の潜在遺伝子を同定できる。
【0161】
B)ドロソフィラ・メラノガスター(Drosohila melanogaster)
NCBI(実施例XIIIを参照のこと)による「その他のEST」データベースのブラストン検索(ヌクレオチドデータベースに対してヌクレオチドクエリー配列を比較する)において、ゲノム配列U41011(シー・エレガンス)の翻訳推定cDNAはドロソフィラ・メラノガスター(Drosohila melanogaster)EST(受入番号:AI134173)と高度に適合し、重複DNA ESTフラグメント(受入番号:AI517255)と共にアセンブルした。GCGのファストAを用いて2個の重複配列に由来する翻訳DNAフラグメントDM1を翻訳GLELOおよびMAELO(図41および42を参照のこと)と整列化した(実施例Iを参照のこと)。整列化により206個のアミノ酸重複においてGLAエロンガーゼと27.2%の同一性が示され、237個のアミノ酸重複においてM.アルピナエロンガーゼと30%の同一性が示された。このように、アミノ酸類似性に基づいて、DM1をPUFAエロンガーゼ様活性を有するGLELOまたはMAELOに対する潜在相同体であり得る。さらに、データベース検索のためのクエリーとしてGLELOおよびMAELOのDNA配列を用いて、ドロソフィラからPUFAエロンガーゼ活性を有する相同体を同定できる。
【0162】
実施例XVI
ヒトPUFAエロンガーゼ相同体のクローニングおよび発現
翻訳GLELOおよび/またはMAELOに対するアミノ酸類似性に基づいて、多くの潜在PUFAエロンガーゼを同定した。これらの配列の潜在エロンガーゼ活性を決定するために、次いで、本実施例で示すように、タンパク質全長をコードするcDNAを同定し、クローン化し、発現した。
【0163】
推定HS1配列に基づいてプライマーRO719(5’−GGT TCT CCC ATG GAA CAT TTT GAT GCA TC−3’)およびRO720(5’−GGT TTC AAA GCT TTG ACT TCA ATC CTT CCG−3’)を設計し、これを用いてヒト肝臓マラソン・レディーcDNA(クロンテック・ラボラトリーズ・インコーポレーティッド、パロ・アルト、カリフォルニア州)を増幅した。ヒト肝臓マラソン・レディーcDNA 5μl、各プライマー50ピコモル、10mM PCRヌクレオチドミックス(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)1μl、10X バッファー5μlおよびアドバンテージ・クレンTaq・ポリメラーゼ・ミックス(クロンテック・ラボラトリーズ・インコーポレーティッド、パロ・アルト、カリフォルニア州)を含有する50μl容量で、ポリメラーゼ連鎖反応(PCR)を実施した。パーキン・エルマー9600(ノーウォーク、コネチカット州)の熱循環器条件は以下のとおりであった:94℃で2分間、次いで94℃、1分間を30サイクル、58℃で2分間、および72℃で3分間。続いてさらに72℃で7分間PCRのサイクルを延長した。
【0164】
PCR増幅生成物をゲルに流し、約960塩基対の増幅フラグメントがゲル精製され、T4 DNAポリメラーゼ(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)でフラグメントの末端を埋め、製造者プロトコルに従ってpCRブラントベクター(インビトロゲン・コーポレーション、カールスバッド、カリフォルニア州)にクローン化した。新規プラスミドをpRAE−52と称し、ABI 373AストレッチDNAシークエンサー(パーキン・エルマー、フォスター・シティー、カリフォルニア州)を用いて、このクローンにおける推定PUFAエロンガーゼcDNAをシークエンシングした。プラスミドpRAE−52のこの推定PUFAエロンガーゼcDNA配列を図43に示し、翻訳配列を図44に示す。
【0165】
次いでプラスミドpRAE−52の推定PUFAエロンガーゼcDNAをNcoI/HindIIIで消化し、ゲル精製し、pYX242(NcoI/HindIII)にライゲートした。新規プラスミドをpRAE−58−A1と称した。(ブダペスト条約の条件下、1999年8月19日にプラスミド58−A1をアメリカン・タイプ・オブ・カルチャー・コレクション、10801ボウルバード大学、マナサス、バージニア州20110−2209に寄託し、寄託番号 が付与された。)
構築物pRAE−58−A1をビール酵母菌334(Hovelandら、前記で引用)に形質転換し、エロンガーゼ活性に関してスクリーニングした。陰性対照株はpYX242ベクターを含有するビール酵母菌であった。25μM GLAまたはAA存在下、選択培地(Ausubelら、前記で引用)で培養物を30℃で24時間成長させた。この研究においてDGLAまたはアドレン酸(ADA、22:4n−6)は各々ヒトエロンガーゼ活性の生成が予測されている。基質としてGLAを用いた場合、ヒトエロンガーゼcDNAを含有する酵母細胞に含まれるDGLAレベルは上昇しており、対照細胞と比較すると各々全脂肪酸の2.75%対0.09%であった(図45を参照のこと)。基質としてAAを用いた場合、、ヒトエロンガーゼcDNAを含有する酵母細胞に含まれるADAレベルは対照細胞と比較して上昇しており、各々全脂肪酸の未検出対1.21%であった。このように、ヒトエロンガーゼは18および20炭素鎖長のPUFAを共にその各々の伸長脂肪酸に変換する。
【0166】
ヒトエロンガーゼcDNAを含有する酵母細胞はまた対照株に比較して18:1n−7、20:1n−7、20:1n−9および18:1n−5などのモノ不飽和脂肪酸のレベルをも上昇させた。従って、これらの結果より同定されたヒトエロンガーゼはPUFAおよびモノ不飽和脂肪酸を基質として利用できることが示された。このように、このヒト配列HSELO1、およびそれにコードされるタンパク質は基質特異性とは独立してエロンガーゼ活性を有する。
【0167】
実施例XVII
シー・エレガンスPUFAエロンガーゼのクローニングおよび発現
いくつかの推定シー・エレガンスエロンガーゼで、翻訳GLELOおよびMAELOの両方に対してアミノ酸相同性が確立されている。ヒトcDNA配列を有するので、cDNAクローニングおよび酵母における発現により、これが本当にPUFAエロンガーゼであるかどうかを決定した。制限部位EcoRIおよびSalI(下線部)を有するプライマーRO738(5’−AAT CAG GAA TTC ATG GCT CAG CAT CCG CTC GTT CAA C−3’)およびRO739(5’−CCG CTT GTC GAC TTA GTT GTT CTT CTT CTT TGG CAC−3’)は各々、ゲノム配列U68749(ウォームペップcDNA受入番号:F56H11.4)に含まれる推定cDNA配列に基づいた。切除シー・エレガンスライブラリーcDNA(オリジーン・テクノロジーズ・インコーポレーティッド、ロックビル、メリーランド州)250ng、各プライマー50ピコモル、10X反応バッファー(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)10μl、10mM PCRヌクレオチドミックス1μl(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)およびTaqポリメラーゼ(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)2.5ユニットを含有する100μl容量でPCR増幅を行った。パーキン・エルマー9600(ノーウォーク、コネチカット州)の熱循環器条件は以下のとおりであった:95℃で5分間、次いで94℃、30秒間を25サイクル、55℃で2分間、および72℃で2分間。続いてさらに72℃で7分間PCRのサイクルを延長した。
【0168】
PCR増幅生成物をアガロースゲルから精製し、EcoRIおよびSalIで切断し、製造者プロトコルに従ってラピッド・ライゲーション・キット(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)を用いてpYX242にライゲートし、大腸菌Top10細胞(インビトロゲン・コーポレーション、カールスバッド、カリフォルニア州)に形質転換した。新規プラスミドをpRET−21およびpRET−22(ライゲーションによる2個の個々のクローン)と称し、373AストレッチDNAシークエンサーABI(パーキン・エルマー、フォスター・シティー、カリフォルニア州)でシークエンシングし、cDNA配列を同定した。推定エロンガーゼを含有するプラスミドpRET−22の867個の塩基のcDNAヌクレオチド配列を図46に示し、288個のアミノ酸の翻訳配列を図47に示す。(ブダペスト条約の条件下、1999年8月19日にプラスミドpRET−22をアメリカン・タイプ・オブ・カルチャー・コレクション、10801ボウルバード大学、マナサス、バージニア州20110−2209に寄託し、寄託番号 が付与された。)
前記するようにプラスミドpRET−21および−22をビール酵母菌334に形質転換し(実施例IIIを参照のこと)、得られた酵母培養物(334(pRET−21)および334(pRET−22))を50μM GLAおよびAAの存在下、ロイシン不含の選択培地100ml中(Ausubelら、前記で引用)20℃で48時間成長させた。細胞ペレットを収集し、脂肪酸分析に供し、結果を図48に示す。GLAの伸長により生成されると予測されるDGLAが2個のサンプルにおいて全脂質の平均1.79%見出され、これに対して陰性対照(プラスミドpYX242を含有する334)では0.13%であり、このことはpRET−21およびpRET−22の両方によりコードされる酵素がGLAエロンガーゼ活性を有していることが示された。334(pRET−21)および334(pRET−22)によるGLAのDGLAへの変換パーセントは各々11.1%および19.4%であり、平均15.25%であった。興味深いことに、AAまたは外因性の脂肪酸はほとんど全く伸長が観察されなかった(図48)。これらの結果によりこの新規に同定されたシー・エレガンスcDNA、CEELO1によりコードされるエロンガーゼはGLAをDGLAに特異的に伸長でき、このことにより、これがGLAエロンガーゼのシー・エレガンス相同体であり得ることが示唆される。
【0169】
実施例VIII
AC004050に基づく推定ヒトエロンガーゼcDNAの単離
AC004050配列に基づいて推定エロンガーゼcDNAの全長を単離するために、プライマーRP735(5’−CCT CCT GAA TTC CAQA CAC TAT TCA GCT TTC−3’)およびRO73(5’−TAA TAC GAC TCA CTA TAG GG−3’)を用いてヒト肝臓マラソン・レディーcDNA(クロンテック・ラボラトリーズ・インコーポレーティッド、パロ・アルト、カリフォルニア州)をPCR増幅した。製造者のプロトコルに従って、Advantage(登録商標) cDNA PCRキット(クロンテック・ラボラトリーズ・インコーポレーティッド、パロ・アルト、カリフォルニア州)を用いて、ヒト肝臓マラソン・レディーcDNA5μlおよび各プライマー50ピコモルでPCRを実施した。パーキン・エルマー9600(ノーウォーク、コネチカット州)の熱循環器条件は以下のとおりであった:94℃で2分間、次いで94℃、1分間を30サイクル、58℃で2分間、および72℃で3分間。続いてさらに72℃で7分間PCRのサイクルを延長した。
【0170】
PCR増幅生成物をゲルに流し、約1キロ塩基対の増幅フラグメントをゲル精製し、製造者の指示書に従って、フラグメントの末端をT4 DNAポリメラーゼ(ベーリンガー・マンハイム・コーポレーション、カールスバッド、カリフォルニア州)で埋めた。新規プラスミドをpRAE−59と称し、このプラスミドの推定PUFAエロンガーゼcDNAをHS3と称し、ABI 373Aストレッチ・シークエンサー(パーキン・エルマー、フォスター・シティー、カリフォルニア州)を用いてシークエンシングした。推定PUFAエロンガーゼcDNA配列HS3を図49に示し、翻訳配列を図50に示す。
【0171】
栄養組成物
発明の詳細な説明に記載のPUFAを、種々の栄養補助剤、乳児用粉乳、栄養代替剤、および他の栄養溶液に利用することができる。
【0172】
I.特殊調製粉乳
A.Isomil(登録商標)(鉄を含むダイズ製剤):
用途:牛乳に対してアレルギーまたは感受性を示す乳児、小児、および成人用の飲料。ラクトースを避けるべき疾患(ラクターゼ欠乏症、乳糖不耐症、およびガラクトース血症)の患者に与えるため。
【0173】
特徴:
−牛乳タンパク質のアレルギーまたは過敏症の症状を予防するためのダイズタンパク質単離物。
【0174】
−ラクトース関連の下痢を予防するための無ラクトース処方物。
【0175】
−浸透性下痢のリスクを減少させるための低浸透性(240mOs/kg水)。
【0176】
−炭水化物吸収を促進し、損傷した腸の過剰な吸収のリスクを減少させるように設計された2種の炭水化物(dual carbohydrates)。
【0177】
−鉄欠乏症の予防を補助するための100カロリーあたり1.8mgの鉄(硫酸第一鉄として)。
【0178】
−推奨レベルのビタミンおよびミネラル。
【0179】
−推奨レベルの必須脂肪酸を得るための植物油。
【0180】
−乳白色、ミルク様濃度、および好ましい香り。
成分:(Pareve)85%水、4.9%コーンシロップ、2.6%糖(スクロース)、2.1%ダイズ油、1.9%ダイズタンパク質単離物、1.4%ココナッツ油、0.15%クエン酸カルシウム、0.11%三塩基性リン酸カルシウム、クエン酸カリウム、塩基性リン酸カリウム、塩化カリウム、モノおよびジグリセリド、ダイズレシチン、カラゲナン、アスコルビン酸、L−メチオニン、塩化マグネシウム、二塩基性リン酸カリウム、塩化カルシウム、塩化コリン、タウリン、硫酸第一鉄、m−イノシトール、α−酢酸トコフェロール、硫酸亜鉛、L−カルニチン、ナイアシンアミド、パントテン酸カルシウム、硫酸銅、パルミチン酸ビタミンA、チアミンクロリド塩酸塩、リボフラビン、塩酸ピリドキシン、葉酸、硫酸マンガン、ヨウ化カリウム、フィロキノン、ビオチン、セレン酸ナトリウム、ビタミンD3、およびシアノコバラミン。
【0181】
B.Isomil(登録商標)DF(下痢用ダイズ処方物)。
【0182】
用途:乳児および幼児の食事管理用の短期摂食
特徴:特に下痢管理用のダイズ繊維由来の添加食物繊維を含む最初の乳児の処方物。
【0183】
−乳児の軽症または重症の下痢による軟らかい、水様便の持続期間を減少させることが臨床的に示されている。
【0184】
−乳児の栄養必要量を栄養的に完全に満たす。
【0185】
−乳児の全必須アミノ酸必要量を満たすか超える添加L−メチオニンを含むダイズタンパク単離物。
【0186】
−ラクトース関連の下痢を予防する無ラクトース処方物。
【0187】
−浸透圧性下痢のリスクを減少させる低浸透性(240 mOsm/kg水)。
【0188】
−炭水化物吸収を促進し、損傷した腸の過剰な吸収のリスクを減少させるように設計された2種の炭水化物。
【0189】
−Commitee of Nutrition of the American Academiy of Pediatricsに推奨され、Infant Formula Actで必要とされるビタミンおよびミネラルレベルを満たすか超えている。
【0190】
−鉄欠乏症の予防を補助するための100カロリーあたり1.8mgの鉄(硫酸第一鉄として)。
【0191】
−推奨レベルの必須脂肪酸を得るための植物油。
【0192】
成分:(Pareve)86%水、4.8%コーンシロップ、2.5%糖(スクロース)、2.1%ダイズ油、2.0%ダイズタンパク質単離物、1.4%ココナッツ油、0.77%ダイズ食物繊維、0.12%クエン酸カルシウム、0.11%三塩基性リン酸カルシウム、0.1%クエン酸カリウム、塩化カリウム、塩基性リン酸カリウム、モノおよびジグリセリド、ダイズレシチン、カラゲナン、塩化マグネシウム、アスコルビン酸、L−メチオニン、二塩基性リン酸カリウム、塩化ナトリウム、塩化コリン、タウリン、硫酸第一鉄、m−イノシトール、α−酢酸トコフェロール、硫酸亜鉛、L−カルニチン、ナイアシンアミド、パントテン酸カルシウム、硫酸銅、パルミチン酸ビタミンA、チアミンクロリド塩酸塩、リボフラビン、塩酸ピリドキシン、葉酸、硫酸マンガン、ヨウ化カリウム、フィロキノン、ビオチン、セレン酸ナトリウム、ビタミンD3、およびシアノコバラミン。
【0193】
C.Isomil(登録商標)SF(鉄を含む無スクロースダイズ製剤)
用途:牛乳タンパク質に対してアレルギーまたは感受性を示すかスクロース不耐の乳児、小児、および成人用の飲料。ラクトースおよびスクロースを避けるべき疾患の患者に与えるため。
【0194】
特徴:
−牛乳タンパク質のアレルギーまたは過敏症の症状を予防するためのダイズタンパク質単離物。
【0195】
−ラクトース関連の下痢を予防するための無ラクトース処方物(炭水化物源は、Polycose(登録商標)Glucose Polymerである)。
【0196】
−スクロース不耐患者用にスクロースを含まない。
【0197】
−浸透圧性下痢のリスクを減少させる低浸透性(180 mOsm/kg水)。
【0198】
−鉄欠乏症の予防を補助するための100カロリーあたり1.8mgの鉄(硫酸第一鉄として)。
【0199】
−推奨レベルのビタミンおよびミネラル。
【0200】
−推奨レベルの必須脂肪酸を得るための植物油。
【0201】
−乳白色、ミルク様濃度、および好ましい香り。
【0202】
成分:(Pareve)75%水、11.8%加水分解コーンスターチ、4.1%ダイズ油、4.1%ダイズタンパク質単離物、2.8%ココナッツ油、1.0%改変コーンスターチ、4.9%コーンシロップ、0.38%三塩基性リン酸カルシウム、0.17%クエン酸カリウム、0.13%塩化カリウム、モノおよびジグリセリド、ダイズレシチン、塩化マグネシウム、アスコルビン酸、L−メチオニン、炭酸カルシウム、塩化ナトリウム、塩化コリン、カラゲナン、タウリン、硫酸第一鉄、m−イノシトール、α−酢酸トコフェロール、硫酸亜鉛、L−カルニチン、ナイアシンアミド、パントテン酸カルシウム、硫酸銅、パルミチン酸ビタミンA、チアミンクロリド塩酸塩、リボフラビン、塩酸ピリドキシン、葉酸、硫酸マンガン、ヨウ化カリウム、フィロキノン、ビオチン、セレン酸ナトリウム、ビタミンD3、およびシアノコバラミン。
【0203】
D.Isomil(登録商標)20(調製済みの鉄を含むダイズ処方物(20Cal/オンス))
用途:ダイズ食が望ましい場合。
【0204】
成分:(Pareve)85%水、4.9%コーンシロップ、2.6%糖(スクロース)、2.1%ダイズ油、1.9%ダイズタンパク質単離物、1.4%ココナッツ油、0.15%クエン酸カルシウム、0.11%三塩基性リン酸カルシウム、クエン酸カリウム、塩基性リン酸カリウム、塩化カリウム、モノおよびジグリセリド、ダイズレシチン、カラゲナン、アスコルビン酸、L−メチオニン、塩化マグネシウム、二塩基性リン酸カリウム、塩化ナトリウム、塩化コリン、タウリン、硫酸第一鉄、m−イノシトール、α−酢酸トコフェロール、硫酸亜鉛、L−カルニチン、ナイアシンアミド、パントテン酸カルシウム、硫酸銅、パルミチン酸ビタミンA、チアミンクロリド塩酸塩、リボフラビン、塩酸ピリドキシン、葉酸、硫酸マンガン、ヨウ化カリウム、フィロキノン、ビオチン、セレン酸ナトリウム、ビタミンD3、およびシアノコバラミン。
【0205】
E.Similac(登録商標)(乳児用処方物)
用途:乳児用処方物が必要な場合。1歳未満の乳児に母乳栄養を継続できないと診断された場合、母乳栄養の補助食品が必要な場合、または母乳栄養不適用の場合の日常の摂食。
【0206】
特徴:
−ミルク関連腸出血のリスクを減少させる、良好な成長に適切な質および量の熱変性タンパク質。
【0207】
−容易に吸収される必須リノール酸が得られる植物油の混合物(2種類を均質化)由来の脂肪。
【0208】
−人乳と類似の比率のラクトースとしての炭水化物。
【0209】
−器官の発達に対するストレスを最小にするための低腎臓溶質負荷。
【0210】
−粉末、濃縮液、または調製済み処方物。
【0211】
成分:(Pareve)蒸留水、脱脂乳、ラクトース、ダイズ油、ココナッツ油、モノおよびジグリセリド、ダイズレシチン、アスコルビン酸、カラゲナン、塩化コリン、タウリン、m−イノシトール、α−酢酸トコフェロール、硫酸亜鉛、ナイアシンアミド、硫酸第一鉄、パントテン酸カルシウム、硫酸銅、パルミチン酸ビタミンA、チアミンクロリド塩酸塩、リボフラビン、塩酸ピリドキシン、葉酸、硫酸マンガン、フィロキノン、ビオチン、セレン酸ナトリウム、ビタミンD3、およびシアノコバラミン。
【0212】
F.Similac(登録商標)NeoCare(鉄を含む未熟乳児用処方物)
用途:退院後の未熟幼児の特別に栄養を必要とする場合。Similac NeoCareは、成長の遅れを取り戻すのを促進し、発達を支持するために必要な付加的なカロリー、タンパク質、ビタミン、およびミネラルを未熟児が得られるように開発された栄養的に完全な処方物である。
【0213】
特徴:
−カロリーおよびビタミン補助の必要性を減少させる。標準期間の処方物(20 Cal/オンス)よりカロリーが高い(22 Cal/オンス)。
【0214】
−未熟児の消化を特別に補助する中鎖トリグリセリド(MCTオイル)を含む、高吸収性脂肪酸混合物。
【0215】
−病院で開始される栄養補助を拡張するための100カロリーあたり高レベルのタンパク質、ビタミン、およびミネラルを含む。
【0216】
−骨鉱化作用改良用のより大量のカルシウムおよびリンを含む。
【0217】
成分:固体コーンシロップ、脱脂乳、ラクトース、ホエイタンパク濃縮物、ダイズ油、高オレイン酸ベニバナ油、分留ココナッツ油(中鎖トリグリセリド)、ココナッツ油、クエン酸カリウム、三塩基性リン酸カルシウム、炭酸カルシウム、アスコルビン酸、塩化マグネシウム、塩化カリウム、塩化ナトリウム、タウリン、硫酸第一鉄、m−イノシトール、塩化コリン、アスコルビン酸パルミテート、L−カルニチン、α−酢酸トコフェロール、硫酸亜鉛、ナイアシンアミド、混合トコフェロール、クエン酸ナトリウム、パントテン酸カルシウム、硫酸銅、チアミンクロリド塩酸塩、ビタミンAパルミテート、β−カロテン、リボフラビン、塩酸ピリドキシン、葉酸、硫酸マンガン、フィロキノン、ビオチン、セレン酸ナトリウム、ビタミンD3、およびシアノコバラミン。
【0218】
G.Similac Natural Care(調製済み低鉄人乳強化剤(24 Cal/オンス))。
【0219】
用途:人乳と混合するか低出生時体重の乳児に人乳と共にを与えるために設計されている。
【0220】
成分:蒸留水、脱脂乳、加水分解コーンスターチ、ラクトース、分留ココナッツ油(中鎖トリグリセリド)、ホエイタンパク質濃縮物、ダイズ油、ココナッツ油、三塩基性リン酸カルシウム、クエン酸カリウム、塩化マグネシウム、クエン酸ナトリウム、アスコルビン酸、炭酸カルシウム、モノおよびジグリセリド、ダイズレシチン、カラゲナン、塩化コリン、m−イノシトール、タウリン、ナイアシンアミド、L−カルニチン、α−酢酸トコフェロール、硫酸亜鉛、塩化カリウム、パントテン酸カルシウム、硫酸第一鉄、硫酸銅、リボフラビン、ビタミンAパルミテート、チアミンクロリド塩酸塩、塩酸ピリドキシン、ビオチン、葉酸、硫酸マンガン、フィロキノン、ビタミンD3、セレン酸ナトリウム、およびシアノコバラミン。
【0221】
本発明の種々のPUFAを、上記の乳児用処方物および他の当業者に公知の乳児用処方物と置換するか添加することができる。
【0222】
II.栄養処方物
A.ENSURE(登録商標)
用途:ENSUREは、主に、適切な量を食事中または食間に使用する経口栄養補助剤または食事の代わりとして用いるように設計された低残渣流動食である。ENSUREは、無ラクトースおよび無グルテンであり、低コレステロール食を含む加工食(modified diet)としての使用に適切である。主に経口補助剤であるが、チューブによって摂取させることができる。
【0223】
患者の健康状態:
−加工食を摂取している患者。
【0224】
−栄養危険性を有する高齢患者。
【0225】
−無意識に体重減少している患者。
【0226】
−疾患または手術から回復中の患者。
【0227】
−低残渣食を必要とする患者。
【0228】
成分:蒸留水、糖(スクロース)、マルトデキストリン(トウモロコシ)、カゼイン酸カルシウムおよびカゼイン酸ナトリウム、高オレイン酸ベニバナ油、ダイズタンパク質単離物、ダイズ油、カノーラ油、クエン酸カリウム、三塩基性リン酸カルシウム、クエン酸ナトリウム、塩化マグネシウム、二塩基性リン酸マグネシウム、人工香料、塩化ナトリウム、ダイズレシチン、コリンクロリド、アスコルビン酸、カラゲナン、硫酸亜鉛、硫酸第一鉄、α−酢酸トコフェロール、Gellanガム、ナイアシンアミド、パントテン酸カルシウム、硫化マンガン、硫酸銅、ビタミンAパルミテート、チアミンクロリド塩酸塩、塩酸ピリドキシン、リボフラビン、葉酸、モリブデン酸ナトリウム、塩化クロム、ビオチン、ヨウ化カリウム、セレン酸ナトリウム。
【0229】
B.ENSURE(登録商標)BARS
用途:ENSURE BARSは、食間または食事中に使用される完全にバランスの取れた栄養素である。ENSURE BARSは、他のスナックより美味で、栄養豊富である。ENSURE BARSは、バーあたり1g未満のラクトースを含み、チョコレート味のブラウニー風味は、グルテンを含まない(ハニーグラハムクランチ風味は、グルテンを含む)。
【0230】
患者の健康状態:
−付加的にカロリー、タンパク質、ビタミン、およびミネラルを必要とする患者。
【0231】
−十分なカロリーおよび栄養素を摂取できない患者に特に有用である。
【0232】
−咀嚼および嚥下することができる患者。
【0233】
−ビーナッツアレルギーまたは任意の型のナッツアレルギーを有する患者には使用しない。
【0234】
成分:ハニーグラハムクランチ−−高フルクトースコーンシロップ、ダイズタンパク質、黒砂糖、ハチミツ、マルトデキストリン(トウモロコシ)、Crisp Rice(製粉したコメ、糖(スクロース)、塩(塩化ナトリウム)、および麦芽)、カラスムギのふすま、部分水素付加綿実油およびダイズ油、ダイズ多糖類、グリセリン、ホエイタンパク質濃縮物、ポリデキストリン、フルクトース、カゼイン酸カルシウム、コカ粉末、人工香料、カノーラ油、高オレイン酸ベニバナ油、脱脂粉乳、ホエイ粉末、ダイズレシチン、およびトウモロコシ油。ナッツを加工する施設で製造される。
【0235】
ビタミンおよびミネラル:三塩基性リン酸カルシウム、二塩基性リン酸カリウム、酸化マグネシウム、塩(塩化ナトリウム)、塩化カリウム、アスコルビン酸、オルトリン酸第二鉄、α−酢酸トコフェロール、ナイアシンアミド、酸化鉛、パントテン酸カルシウム、グルコン酸銅、硫酸マンガン、リボフラン、β−カロテン、塩酸ピリドキシン、チアミン硝酸塩、葉酸、ビオチン、塩化クロム、ヨウ化カリウム、セレン酸ナトリウム、モリブデン酸ナトリウム、フィロキノン、ビタミンD3、およびシアノコバラミン。
【0236】
タンパク質:ハニーグラハムクランチ−タンパク質供給源は、ダイズタンパク質単離物とミルクタンパク質との混合物である。
【0237】
ダイズタンパク質単離物 74%
ミルクタンパク質 26%
脂肪:ハニーグラハムクランチ−脂肪供給源は、部分的水素付加綿実油、ダイズ油、カノーラ油、高オレイン酸ベニバナ油、およびダイズレシチンとの混合物である。
部分的水素付加綿実油およびダイズ油 76%
カノーラ油 8%
高オレイン酸ベニバナ油 8%
トウモロコシ油 4%
ダイズレシチン 4%
炭水化物:ハニーグラハムクランチ−炭素供給源は、高フルクトースコーンシロップ、黒砂糖、マルトデキストリン、ハチミツ、クリスプライス(crisp rice)、グリセリン、ダイズ多糖類、およびカラスムギふすまの組み合わせである。
【0238】
高フルクトースコーンシロップ 24%
黒砂糖 21%
マルトデキストリン 12%
ハチミツ 11%
crisp rice 9%
グリセリン 9%
ダイズ多糖類 7%
カラスムギふすま 7%
C.ENSURE(登録商標)HIGH PROTEIN
用途:ENSUREHIGH PROTEINは、食事で付加的なカロリー、タンパク質、ビタミン、およびミネラルを必要とする患者用に設計された濃縮高タンパク質流動食である。これは、食事中もしくは食間の経口補助剤として、または適切な量を食事の代わりとして使用することができる。ENSURE HIGH PROTEINは、無ラクトースおよび無グルテンであり、一般的な手術または臀部骨折から回復しつつある患者および圧迫潰瘍のリスクを負う患者への使用に適切である。
【0239】
患者の健康状態:
−付加的なカロリー、タンパク質、ビタミン、およびミネラルを必要とする患者(一般的な手術または臀部骨折から回復しつつある患者および圧迫潰瘍のリスクを負う患者および低コレステロール食患者など)。
【0240】
特徴:
−低飽和脂肪。
【0241】
−1回の食事あたり全脂質の6gの脂質およびコレステロールの5mg未満を含む。
【0242】
−コクがあり、軟らかい。
【0243】
−タンパク質、カルシウム、ならびに他の必須ビタミンおよびミネラルの優れた供給源である。
【0244】
−低コレステロール食用である。
【0245】
−無ラクトースで容易に消化される。
【0246】
成分:バニラシュープレーム:蒸留水、糖(スクロース)、マルトデキストリン(トウモロコシ)、カゼイン酸カルシウムおよびカゼイン酸ナトリウム、高オレイン酸ベニバナ油、ダイズタンパク質単離物、ダイズ油、カノーラ油、クエン酸カリウム、三塩基性リン酸カルシウム、クエン酸ナトリウム、塩化マグネシウム、二塩基性リン酸マグネシウム、人工香料、塩化ナトリウム、ダイズレシチン、塩化コリン、アスコルビン酸、カラゲナン、硫酸亜鉛、硫酸第一鉄、α−酢酸トコフェロール、Gellanガム、ナイアシンアミド、パントテン酸カルシウム、硫酸マンガン、硫酸銅、パルミチン酸ビタミンA、チアミンクロリド塩酸塩、塩酸ピリドキシン、リボフラビン、葉酸、モリブデン酸ナトリウム、塩化クロム、ビオチン、ヨウ化カリウム、セレン酸ナトリウム、フィロキノン、ビタミンD3、およびシアノコバラミン。
【0247】
タンパク質:タンパク質供給源は、2つの生物学的に価値の高いタンパク質(カゼインおよびダイズ)の混合物である。
【0248】
カゼイン酸ナトリウムおよびカゼイン酸カルシウム 85%
タンパク質単離物 15%
脂肪:脂肪供給源は、3つのオイル(高オレイン酸ベニバナ油、カノーラ油、およびダイズ油)の混合物である。
【0249】
高オレイン酸ベニバナ油 40%
カノーラ油 30%
ダイズ油 30%
ENSURE HIGH PROTEIN中の脂肪レベルは、米国心臓病協会(AHA)のガイドラインを満たす。ENSURE HIGH PROTEIN中の6gの脂肪は、全カロリーの24%を占め、そのうち2.6%の脂肪は飽和脂肪酸に由来し、7.9%はポリ不飽和脂肪酸に由来する。これらの値は、AHAガイドライン(脂肪由来の全カロリーの30%未満、飽和脂肪酸由来の10%未満のカロリー、およびポリ不飽和脂肪酸由来の全カロリーの10%未満)の範囲内である。
【0250】
炭水化物:ENSURE HIGH PROTEINは、マルトデキストリンとスクロースとの組み合わせを含む。ほのかに甘い、種々の風味(バニラシュプリーム、チョコレートロイヤル、ワイルドベリー、およびバナナ)ならびにペカン、チェリー、ストロベリー、レモン、およびオレンジの香りのVARI−FLAVORS(登録商標)Flavor Pacsは、風味に関する不快感を避ける一助となり、患者の服薬遵守の援助となる。
バニラおよび他のチョコレート以外の風味は以下である。
【0251】
スクロース 60%
マルトデキストリン 40%
チョコレート:
スクロース 70%
マルトデキストリン 30%
D.ENSURE(登録商標)LIGHT
用途:ENSURE LIGHTは、食事中または食間に用いる経口栄養補助剤として使用するために設計された低脂肪流動食である。ENSURE LIGHTは、無ラクトースおよび無グルテンであり、低コレステロール食を含む加工食としての使用に適切である。
【0252】
患者の健康状態:
−ENSUREより50%低い脂肪および20%低いカロリーを含む栄養補助食品中に付加的な栄養を必要とする正常な体重または超過体重の患者用。
【0253】
−正確で必要な付加的栄養素を摂ることができない健常な成人。
【0254】
特徴:
−低脂肪および低飽和脂肪
−1回の食事あたり3gの全脂肪および5mg未満のコレステロールを含む。
【0255】
−コクがあり、軟らかい。
【0256】
−カルシウムおよび他の必須ビタミンならびにミネラルの優れた供給源である。
【0257】
−低コレステロール食である。
【0258】
−無ラクトースであり、容易に消化される。
【0259】
成分:フレンチバニラ:蒸留水、マルトデキストリン(トウモロコシ)、糖(スクロース)、カゼイン酸カルシウム、高オレイン酸ベニバナ油、カノーラ油、塩化マグネシウム、クエン酸カリウム、二塩基性リン酸カリウム、二塩基性リン酸マグネシウム、天然香料および人工香料、三塩基性リン酸カルシウム、Gellanガム、塩化コリン、ダイズレシチン、カラゲナン、塩(塩化ナトリウム)、アスコルビン酸、セルロースガム、硫酸第一鉄、α−酢酸トコフェロール、硫酸亜鉛、ナイアシンアミド、硫酸マンガン、パントテン酸カルシウム、硫酸銅、チアミンクロリド塩酸塩、パルミチン酸ビタミンA、塩酸ピリドキシン、リボフラビン、塩化クロム、葉酸、モリブデン酸ナトリウム、ビオチン、ヨウ化カリウム、セレン酸ナトリウム、フィロキノン、ビタミンD3、およびシアノコバラミン。
【0260】
タンパク質:
タンパク質供給源は、カゼイン酸カルシウムである。
【0261】
カゼイン酸カルシウム 100%
脂肪:脂肪供給源は、2つのオイル(高オレイン酸ベニバナ油およびカノーラ油)の混合物である。
【0262】
高オレイン酸ベニバナ油 70%
カノーラ油 30%
ENSURE LIGHT中の脂肪レベルは、米国心臓病協会(AHA)のガイドラインを満たす。ENSURE LIGHT中の3gの脂肪は、全カロリーの13.5%を占め、そのうち1.4%の脂肪は飽和脂肪酸に由来し、2.6%はポリ不飽和脂肪酸に由来する。これらの値は、AHAガイドライン(脂肪由来の全カロリーの30%未満、飽和脂肪酸由来の10%未満のカロリー、およびポリ不飽和脂肪酸由来の全カロリーの10%未満)の範囲内である。
【0263】
炭水化物:ENSURE LIGHTは、マルトデキストリンとスクロースとの組み合わせを含む。チョコレート風味はコーンシロップなどを含む。ほのかに甘い種々の風味(フレンチバニラ、チョコレートシュプリーム、ストロベリースワール)ならびにペカン、チェリー、ストロベリー、レモン、およびオレンジの香りのVARI−FLAVORS(登録商標)Flavor Pacsは、風味に関する不快感を避ける一助となり、患者の服薬遵守の援助となる。
バニラおよび他のチョコレート以外の風味は以下である。
【0264】
スクロース 51%
マルトデキストリン 49%
チョコレート
スクロース 47.0%
コーンシロップ 26.5%
マルトデキストリン 26.5%
ビタミンおよびミネラル:食事あたり8オンスのENSURE LIGHTで、24種類の重要なビタミンおよびミネラルのRDIの少なくとも24%が得られる。
【0265】
カフェイン:チョコレート香料には、8オンスあたり2.1mgのカフェインを含む。
【0266】
E.ENSURE PLUS(登録商標)
用途:ENSURE PLUSは、付加的なカロリーおよび栄養素が必要であるが、通常のタンパク質濃度が必要な場合の、高カロリーの低残渣流動食である。これは、主に、食事中または食間に使用する経口栄養補助食品としてまたは適切な量を食事の代わりとして使用するように設計されている。ENSURE PLUSは、無ラクトースおよび無グルテンである。主に経口補助剤であるが、チューブによって摂取させることができる。
【0267】
患者の健康状態:
−限られた体積で付加的なカロリーおよび栄養素が必要であるが、通常のタンパク質濃度が必要な患者。
【0268】
−健常な体重に増加させるか維持することを必要とする患者。
【0269】
特徴:
−コクがあり、軟らかい。
【0270】
−必須ビタミンおよびミネラルの良好な供給源である。
【0271】
成分:バニラ:蒸留水、コーンシロップ、マルトデキストリン(トウモロコシ)、トウモロコシ油、カゼイン酸ナトリウムおよびカゼイン酸カルシウム、糖(スクロース)、ダイズタンパク質単離物、塩化マグネシウム、クエン酸カリウム、三塩基性リン酸カルシウム、ダイズレシチン、天然香料および人工香料、クエン酸ナトリウム、塩化カリウム、塩化コリン、アスコルビン酸、カラゲナン、硫酸亜鉛、硫酸第一鉄、α−酢酸トコフェロール、ナイアシンアミド、パントテン酸カルシウム、硫酸マンガン、硫酸銅、チアミンクロリド塩酸塩、塩酸ピリドキシン、リボフラビン、パルミチン酸ビタミンA、葉酸、ビオチン、塩化クロム、モリブデン酸ナトリウム、ヨウ化カリウム、セレン酸ナトリウム、フィロキノン、シアノコバラミン、およびビタミンD3。
【0272】
タンパク質:タンパク質供給源は、2つの生物学的に価値の高いタンパク質(カゼインおよびダイズ)の混合物である。
カゼイン酸ナトリウムおよびカゼイン酸カルシウム 84%
タンパク質単離物 16%
脂肪:脂肪源はトウモロコシ油である。
【0273】
トウモロコシ油 100%
炭水化物:ENSURE PLUSは、マルトデキストリンとスクロースとの組み合わせである。ほのかに甘い、種々の風味(バニラ、チョコレート、ストロベリー、コーヒー、バターペカン、およびエッグノッグ)ならびにペカン、チェリー、ストロベリー、レモン、およびオレンジの香りのVARI−FLAVORS(登録商標)Flavor Pacsは、風味に関する不快感を避ける一助となり、患者の服薬遵守の援助となる。
【0274】
バニラ、ストロベリー、バターペカン、およびコーヒー風味は以下を含む。
【0275】
コーンシロップ 39%
マルトデキストリン 38%
スクロース 23%
チョコレートおよびエッグノッグ風味は以下を含む。
【0276】
コーンシロップ 36%
マルトデキストリン 34%
スクロース 30%
ビタミンおよびミネラル:食事あたり8オンスのENSURE PLUSで、25種類の重要なビタミンおよびミネラルのRDIの少なくとも15%が得られる。
【0277】
カフェイン:チョコレート香料には、8オンスあたり3.1mgのカフェインを含む。コーヒー香料には微量のカフェインを含む。
【0278】
F.ENSURE PLUS(登録商標)HN
用途:ENSURE PLUS HNは、高カロリーおよび高タンパク質を必要とするか摂取体積が制限される患者用に設計された、栄養的に完全な高カロリーおよび高窒素流動食である。これは、経口での栄養補給またはチューブによる全栄養支持に有用であり得る。ENSURE PLUS HNは、無ラクトースおよび無グルテンである。
【0279】
患者の健康状態:
−手術後または損傷後などのカロリーおよびタンパク質の増加が必要な患者。
【0280】
−摂取体積が制限され、すぐに満腹になる患者。
【0281】
特徴:
−補助または全栄養補給に使用される。
【0282】
−経口またはチューブによる食物摂取用。
【0283】
−1.5 CaVmL。
【0284】
−高窒素。
【0285】
−カロリー密度が高い。
【0286】
成分:バニラ:蒸留水、マルトデキストリン(トウモロコシ)、カゼイン酸ナトリウムおよびカゼイン酸カルシウム、トウモロコシ油、糖(スクロース)、ダイズタンパク質単離物、塩化マグネシウム、クエン酸カリウム、三塩基性リン酸カルシウム、ダイズレシチン、天然香料および人工香料、クエン酸ナトリウム、塩化コリン、アスコルビン酸、タウリン、L−カルニチン、硫酸亜鉛、硫酸第一鉄、α−酢酸トコフェロール、ナイアシンアミド、カラゲナン、パントテン酸カルシウム、硫酸マンガン、硫酸銅、チアミンクロリド塩酸塩、塩酸ピリドキシン、リボフラビン、パルミチン酸ビタミンA、葉酸、ビオチン、塩化クロム、モリブデン酸ナトリウム、ヨウ化カリウム、セレン酸ナトリウム、フィロキノン、シアノコバラミン、およびビタミンD3。
【0287】
G.ENSURE(登録商標)POWDER
用途:ENSURE POWDER(水で再生される)は、主に、食事中または食間に使用される経口栄養補助剤として設計された低残渣流動食である。ENSURE POWDERは、無ラクトースおよび無グルテンであり、低カロリー食を含む加工食としての使用に適切である。
【0288】
患者の健康状態:
−加工食を摂取している患者。
【0289】
−栄養危険性を有する高齢患者。
【0290】
−疾患/手術から回復中の患者。
【0291】
−低残渣食を必要とする患者。
【0292】
特徴:
−便利で混合が容易。
【0293】
−低飽和脂肪。
【0294】
−1回の食事あたり9gの全脂肪および5mg未満のコレステロールを含む。
【0295】
−高ビタミンおよびミネラル。
【0296】
−低コレステロール食。
【0297】
−無ラクトースで消化しやすい。
【0298】
成分:蒸留水、コーンシロップ、マルトデキストリン(トウモロコシ)、糖(スクロース)、トウモロコシ油、カゼイン酸ナトリウムおよびカゼイン酸カルシウム、ダイズタンパク質単離物、人工香料、クエン酸カリウム、塩化マグネシウム、クエン酸ナトリウム、三塩基性リン酸カルシウム、塩化カリウム、ダイズレシチン、アスコルビン酸、塩化コリン、硫酸亜鉛、硫酸第一鉄、α−酢酸トコフェロール、ナイアシンアミド、パントテン酸カルシウム、硫酸マンガン、チアミンクロリド塩酸塩、硫酸銅、塩酸ピリドキシン、リボフラビン、パルミチン酸ビタミンA、葉酸、ビオチン、モリブデン酸ナトリウム、塩化クロム、ヨウ化カリウム、セレン酸ナトリウム、フィロキノン、ビタミンD3、およびシアノコバラミン。
【0299】
タンパク質:タンパク質供給源は、2つの生物学的に価値の高いタンパク質(カゼインおよびダイズ)である。
【0300】
カゼイン酸ナトリウムおよびカゼイン酸カルシウム 84%
タンパク質単離物 16%
脂肪:脂肪供給源はトウモロコシ油である。
【0301】
トウモロコシ油 100%
炭水化物:ENSURE POWDERは、コーンシロップ、マルトデキストリンとスクロースとの組み合わせである。ENSURE POWDERのほのかに甘さならびにペカン、チェリー、ストロベリー、レモン、およびオレンジの香りのVARI−FLAVORS(登録商標)Flavor Pacsは、風味に関する不快感を避ける一助となり、患者の服薬遵守の援助となる。
【0302】
バニラ:
コーンシロップ 35%
マルトデキストリン 35%
スクロース 30%
H.ENSURE(登録商標)PUDDING
用途:ENSURE PUDDINGは、食事中および食間に使用される非液体形態のバランスのとれた栄養素を得るための栄養密度の高い補助食品である。これは、継続的な加工食(たとえば、軟らかい、ピューレ状、または完全な液体)を摂取している患者および嚥下障害患者に適切である。ENSURE PUDDINGは、無グルテンである。
【0303】
患者の健康状態:
−継続的な加工食(例えば、軟らかい、ピューレ状、または完全な液体)を摂取している患者。
【0304】
−嚥下障害患者。
【0305】
特徴:
−コクがあり、軟らかく、味がよい。
【0306】
−必須ビタミン、およびミネラルの良好な供給源である。
【0307】
−冷蔵不要で便利。
【0308】
−無グルテン。
【0309】
5オンスあたりの栄養プロフィールは、250カロリー、タンパク質10.9%、全脂肪34.9%、炭水化物54.2%である。
【0310】
成分:脱脂乳、水、糖(スクロース)、部分的に水素負荷したダイズ油、加工食品デンプン、硫酸マグネシウム、ステアロイルラクチリン酸ナトリウム、二塩基性リン酸ナトリウム、人工香料、アスコルビン酸、硫酸亜鉛、硫酸第一鉄、α−酢酸トコフェロール、塩酸コリン、ナイアシンアミド、硫酸マンガン、パントテン酸カルシウム、FD&C Yellow #5、クエン酸カリウム、硫酸銅、ビタミンAパルミテート、チアミンクロリド塩酸塩、塩酸ピリドキシン、リボフラビン、FD&C Yellow #6、葉酸、ビオチン、フィロキノン、ビタミンD3、およびシアノコバラミン。
【0311】
タンパク質:タンパク質供給源は、脱脂乳である。
【0312】
脱脂乳 100%
脂肪:脂肪供給源は、水素付加ダイズ油である。
【0313】
水素付加ダイズ油 100%
炭水化物:ENSURE PUDDINGは、スクロースと加工食品デンプンの組み合わせである。ほのかな甘さおよび多種の風味(バニラ、チョコレート、バタースカッチ、およびタピオカ)は、風味に関する不快感を避ける一助となる。製品には、1回の食事あたり9.2グラムのラクトースを含む。
【0314】
バニラおよび他のチョコレート以外の風味は以下である。
【0315】
スクロース 56%
ラクトース 27%
加工食品デンプン 17%
チョコレート:
スクロース 58%
ラクトース 26%
加工食品デンプン 16%
I.ENSURE(登録商標)WITH FIBER。
【0316】
用途:ENSURE WITH FIBERは、食物繊維および栄養素を強化することに利点を有し得る患者用に設計された、食物繊維を含む栄養的に完全な流動食である。ENSURE WITH FIBERは、低残渣食を必要としない患者に適切である。これは、経口およびチューブによって摂取させることができ、通常の食事の栄養補助剤として、または適切な量を食事の代わりとして与えることができる。ENSURE WITH FIBERは、無ラクトースおよび無グルテンであり、低コレステロール食を含む加工食としての使用に適切である。
【0317】
患者の健康状態:
−食物繊維および栄養素を強化することに利点を有しうる患者用。
【0318】
特徴:
−低飽和脂肪酸、高ビタミンおよび高ミネラルの新規の進歩した処方物。
【0319】
−1回の食事あたり6gの全脂肪および5mg未満のコレステロールを含む。
【0320】
−コクがあり、軟らかい。
【0321】
−良好な繊維の供給源。
【0322】
−必須ビタミンおよびミネラルの優れた供給源。
【0323】
−低コレステロール食。
【0324】
−ラクトースおよびグルテンを含まない。
【0325】
成分:蒸留水、マルトデキストリン(トウモロコシ)、糖(スクロース)、カゼイン酸ナトリウムおよびカゼイン酸カルシウム、カラスムギ繊維、高オレイン酸ベニバナ油、カノーラ油、ダイズタンパク質単離物、トウモロコシ油、ダイズ繊維、三塩基性リン酸カルシウム、塩化マグネシウム、クエン酸カリウム、セルロースゲル、ダイズレシチン、二塩基性リン酸カリウム、クエン酸ナトリウム、天然および人工香料、塩化コリン、リン酸マグネシウム、アスコルビン酸、セルロースガム、塩化カリウム、カラゲナン、硫酸第一鉄、α−酢酸トコフェロール、硫酸亜鉛、ナイアシンアミド、硫酸マンガン、パントテン酸カルシウム、硫酸銅、パルミチン酸ビタミンA、チアミンクロリド塩酸塩、塩酸ピリドキシン、リボフラビン、葉酸、塩化クロム、ビオチン、モリブデン酸ナトリウム、ヨウ化カリウム、セレン酸ナトリウム、フィロキノン、ビタミンD3、およびシアノコバラミン。
【0326】
タンパク質:タンパク質供給源は、2つの生物学的に価値の高いタンパク質(カゼインおよびダイズ)の混合物である。
【0327】
カゼイン酸ナトリウムおよびカゼイン酸カルシウム 80%
タンパク質単離物 20%
脂肪:脂肪供給源は、3つのオイル(高オレイン酸ベニバナ油、カノーラ油、およびダイズ油)の混合物である。
【0328】
高オレイン酸ベニバナ油 40%
カノーラ油 40%
ダイズ油 20%
ENSURE WITH FIBER中の脂肪レベルは、米国心臓病協会(AHA)のガイドラインを満たす。ENSURE WITH FIBER中の6gの脂肪は、全カロリーの22%を占め、そのうち2.01%の脂肪は飽和脂肪酸に由来し、6.7%はポリ不飽和脂肪酸に由来する。これらの値は、AHAガイドライン(脂肪由来の全カロリーの30%以下、飽和脂肪酸由来の10%以下のカロリー、およびポリ不飽和脂肪酸由来の全カロリーの10%以下)の範囲内である。
【0329】
炭水化物:ENSURE WITH FIBERは、マルトデキストリンとスクロースとの組み合わせを含む。ほのかに甘く、種々の風味(バニラ、チョコレート、およびバターペカン)ならびにペカン、チェリー、ストロベリー、レモン、およびオレンジの香りのVARI−FLAVORS(登録商標)Flavor Pacsは、風味に関する不快感を避ける一助となり、患者の服薬遵守の援助となる。
【0330】
バニラおよび他のチョコレート以外の風味は以下である。
【0331】
マルトデキストリン 66%
スクロース 25%
カラスムギ繊維 7%
ダイズ繊維 2%
チョコレート
マルトデキストリン 55%
スクロース 36%
カラスムギ繊維 7%
ダイズ繊維 2%
繊維:ENSURE WITH FIBERで使用される繊維混合物は、カラスムギ繊維およびダイズ繊維からなる。この混合物により、8オンス缶あたり全食物繊維の約4グラムが得られる。不溶性繊維:可溶性繊維は95:5である。
【0332】
上記および当業者に公知の種々の栄養補助剤を、本発明で作製したPUFAと置換および/または補充することができる。
【0333】
J.OxepaTM栄養製品。
【0334】
Oxepaは、ARDS患者またはその疑いのある患者の食事管理用に設計された、低炭水化物でカロリー密度が高い経腸栄養製品である。これは、エイコサペンタエン酸(魚油由来のEPA)、γ−リノレン酸(ルリヂサ油由来のGLA)を含み、抗酸化レベルを高めた特許油混合物を含む固有の成分の組み合わせである。
【0335】
カロリー分布:
エネルギーの必要量を満たすために必要な体積を最小にするために、カロリー密度は高い(1.5 Cal/mL(355 Cal/8オンス))。
【0336】
【表3】

【0337】
脂肪:
−Oxepaは、8オンスの食事(93.7g/L)あたり22.2gの脂肪を含む。
【0338】
−脂肪供給源は、31.8%カノーラ油、25%中鎖トリグリセリド(MCT)、20%ルリヂサ油、20%魚油、および3.2%ダイズレシチンとのオイル混合物である。Oxepaの典型的な脂肪酸プロフィールを、表Vに示す。
【0339】
−表VIに示すように、Oxepaによれば、バランスの取れた量のポリ不飽和脂肪酸、一不飽和脂肪酸、および飽和脂肪酸が得られる。
【0340】
−中鎖トリグリセリド(MCT)(脂肪混合物の25%)は、胆汁酸によって乳化されることなく腸管によって吸収されるので、胃排出の一助となる。
【0341】
OxepaTM栄養製品の種々の脂肪酸構成成分を、本発明で作製したPUFAと置換および/または補充することができる。
【0342】
【表4】

脂肪酸は、全脂肪の約95%に相当する。
【0343】
【表5】

【0344】
炭水化物:
−炭水化物含有量は、8オンス(105.5g/L)の1回の食事あたり25.0gである。
【0345】
−炭水化物供給源は、45%マルトデキストリン(炭水化物複合体)および55%スクロース(単糖類)であり、これらは共に容易に消化吸収される。
【0346】
−Oxepaの高脂肪および低炭水化物成分を、二酸化炭素(CO2)生成が最小になるように設計する。高CO2レベルは、人工呼吸器に依存している患者の離乳を複雑にし得る。低レベルの炭水化物はまた、ストレス誘導性高血糖症患者に有用であり得る。
【0347】
−Oxepaは、無ラクトースである。
【0348】
食物炭水化物、タンパク質由来のアミノ酸、および脂肪のグリセロール部分を、体内のグルコースと変換することができる。この過程の間中、グルコース依存性組織(中枢神経系および赤血球など)の炭水化物要求が満たされる。しかし、炭水化物を含まない食事は、ケトーシス、組織タンパク質の過剰な異化、および体液および電解質の欠乏を誘導し得る。これらの効果を、カロリー摂取が適切である場合、50gから00gの消化しやすい炭水化物の毎日の注射によって予防することができる。Oxepa中の炭水化物レベルはまた、エネルギー要求が満たされる場合、糖新生を最小にするのに十分である。
【0349】
タンパク質:
−Oxepaは、8オンスの1回の食事(62.5g/L)あたり14.8gのタンパク質を含む。
【0350】
−全カロリー/窒素比(150:1)は、ストレス患者の要求を満たす。
【0351】
−Oxepaによれば、呼吸困難を誘発することなく同化作用の促進および除脂肪体重の維持に十分なタンパク質が得られる。高タンパク質の摂取は、胚不全患者に重要である。タンパク質は、CO2産生に対してほとんど効果がないにもかかわらず、高タンパク質食は、人工呼吸器の運転性を向上させる。
【0352】
−Oxepaのタンパク質供給源は、86.8%のカゼイン酸ナトリウムおよび13.2%のカゼイン酸カルシウムである。
【0353】
−Oxepaにおけるタンパク質系のアミノ酸プロフィールは、科学アカデミーによって設定された高品質のタンパク質の基準を満たすか超える。
【0354】
*Oxepaは、無グルテンである。
【0355】
【表6】




【技術分野】
【0001】
本発明は、長鎖ポリ不飽和脂肪酸の伸長に関与するいくつかの遺伝子(即ち「エロンガーゼ(elongase)」)の同定及びそれらの使用に関する。特に、エロンガーゼ酵素は、脂肪酸の他の脂肪酸への変換において利用される。例えば、エロンガーゼは、ガンマリノレン酸(GLA)のジホモ−γ−リノレン酸(DGLA、20:3n−6)への変換及びステアリドン酸(stearidonic acid)(STA、18:4n−3)の(n−3)−エイコサテトラエン酸(20:4n−3)への変換を触媒する。エロンガーゼは、アラキドン酸(AA、20:4n−6)のアドレン酸(ADA、22:4n−6)への変換、エイコサペンタエン酸(EPA、20:5n−3)のω3−ドコサペンタエン酸(22:5n−3)への変換及びα−リノレン酸(ALA、18:3n−3)の20:3n−3への変換も触媒する。例えば、DGLAは、薬学的組成物、栄養組成物、動物飼料及び化粧品のようなその他の製品へ添加されうる、アラキドン酸(AA)のようなその他のポリ不飽和脂肪酸(PUFA)の製造において利用されうる。
【背景技術】
【0002】
(背景情報)
過去に同定されたエロンガーゼは、それらが作用する基質に関して異なっている。さらに、それらは、動物及び植物の両方に存在する。哺乳動物において見出されるものは、飽和脂肪酸、モノ不飽和脂肪酸及びポリ不飽和脂肪酸に作用する能力を有する。対照的に、植物において見出されるものは、飽和脂肪酸又はモノ不飽和脂肪酸に特異的である。従って、植物においてポリ不飽和脂肪酸を生成させるためには、PUFA特異的なエロンガーゼが必要である。
【0003】
植物においても動物においても、伸長過程は、4段階のメカニズムの結果であると考えられている(Lassnerら,The Plant Cell 8:281−292(1996))。CoAが、アシル・キャリヤーである。第1段階は、マロニル−CoAと長鎖アシル−CoAとの縮合を含み、それにより二酸化酸素と、アシル部分の2炭素原子が伸長されたβ−ケトアシル−CoAとが生じる。続く反応には、β−ヒドロキシアシル−CoAへの還元、エノイル−CoAへの脱水及び第二の還元が含まれ、それにより伸長されたアシル−CoAが生じる。最初の縮合反応は、基質特異的な段階であるのみならず、律速段階でもある。
【0004】
前述のように、エロンガーゼ、より具体的に、PUFAを基質として利用するエロンガーゼは、多くの重要な機能を有する長鎖ポリ不飽和脂肪酸の生成において重要である。例えば、PUFAは、細胞膜の重要な成分であり、細胞膜にリン脂質の形態で見出される。PUFAは、哺乳動物のプロスタサイクリン、エイコサノイド、ロイコトリエン及びプロスタグランジンの前駆体としてもはたらく。さらに、PUFAは、発達中の幼児の脳の適切な発達、並びに組織の形成及び修復に必要である。PUFAの生物学的重要性を考慮して、それら及びそれらの生成に至る中間体を効率的に製造すべく、努力がなされている。
【0005】
エロンガーゼ(elo)(図1参照)を含む多数の酵素が、PUFAの生合成に関与している。例えば、リノレン酸(LA、18:2−△9,12又は18:2n−6)は、△12デサチュレースにより、オレイン酸(OA、18:1−△9又は18:1n−9)から生成される。GLA(18:3−△6,9,12)は、△6−デサチュラーゼにより、リノレン酸から生成される。AA(20:4−△5,8,11,14)は、△5−デサチュラーゼにより、ジホモ−γ−リノレン酸(DGLA、20:3−△8,11,14)から生成される。前述のように、DGLAは、エロンガーゼにより、GLAから生成される。
【0006】
動物は、Δ9位より先を不飽和化することができず、従ってオレイン酸をリノレン酸に変換することができないことに注意しなければならない。同様に、動物は、Δ15デサチュラーゼ活性を欠いているため、α−リノレン酸(ALA、18:3−△9,12,15又は18:3n−3)を合成することができない。しかし、α−リノレン酸は、哺乳動物及び藻類においては、Δ6−デサチュラーゼ(PCT公開第96/13591号参照:米国特許第5,552,306号も参照のこと)により、ステアリドン酸(STA、18:4−Δ6,9,12,15)へ変換され、続いて(n−3)−エイコサテトラエン酸(20:4−Δ8,11,14,17又は20:4n−3)へ伸長されうる。このポリ不飽和脂肪酸(即ち、20:4−Δ8,11,14,17)は、次いで、Δ5−デサチュラーゼにより、エイコサペンタエン酸(EPA、20:5−Δ5,8,11,14,17)へと変換されうる。真菌及び植物を含むその他の真核生物は、12位(PCT公開第94/11516号及び米国特許第5,443,974号を参照のこと)及び15位(PCT公開第93/11245号参照)の炭素を不飽和化する酵素を有する。従って、動物の主要なポリ不飽和脂肪酸は、食事、並びに/又はリノール酸もしくはα−リノレン酸の不飽和化及び伸長に由来する。哺乳動物が、これらの必須長鎖脂肪酸を生成させることができないことを考慮すると、これらの脂肪酸を天然に生成させる種から、PUFA生合成に関与している遺伝子を単離し、商業的な品質の一つ又は複数のPUFAの製造を提供するように改変されうる、微生物、植物又は動物の系において、これらの遺伝子を発現させることは非常に重要である。従って、エロンガーゼ酵素、その酵素をコードする遺伝子及びこの酵素を製造する組み換え法が、明らかに必要とされている。さらに、天然に存在する油よりも高いレベルのPUFAを含有する油、及び新規なPUFAが濃縮された油が必要とされている。そのような油は、エロンガーゼ遺伝子の単離及び発現によってのみ作製されうる。
【0007】
最も重要な長鎖PUFAの一つは、前述のように、アラキドン酸(AA)である。AAは、繊維状真菌に見出され、肝臓及び副腎を含む哺乳動物の組織からも精製されうる。前述のように、AAのDGLAからの生成は、Δ5−デサチュラーゼにより触媒され、DGLAのγ−リノレン酸(GLA)からの生成は、エロンガーゼにより触媒される。しかし、本発明以前には、長鎖PUFA、特に、AA、エイコサペンタエン酸(EPA)、アドレン酸、ドコサヘキサエン酸(DHA、22:6n−3)、ω3−ドコサペンタエン酸(22:5n−3)又はω6−ドコサペンタエン酸(22:5n−6)の生成のための経路において、基質脂肪酸に対する活性を有するエロンガーゼは、同定されていなかった。
【0008】
2つの遺伝子が、エロンガーゼ遺伝子に関する本研究において重要であると考えられた。特に、ホホバβ−ケトアシル−補酵素Aシンターゼ(KCS)又はホホバKCS(ジェンバンク(GenBank)登録番号U37088)は、脂肪酸アシル−CoA伸長経路の最初の反応(即ち、マロニル−CoAと長鎖アシル−CoAとの縮合(Lassner ら,The Plant Cell 8:281−292(1996)))を触媒する。ホホバKCSの基質選択性は、18:0、20:0、20:1、18:1、22:1、22:0及び16:0である。サッカロミセス・セレビシエ(Saccharomcyes cerevisiae)エロンガーゼ(ELO2)も、長鎖の飽和脂肪酸及びモノ不飽和脂肪酸の変換を触媒し、高レベルの22:0、24:0を生成させ、18:0、18:1、20:0、20:1、22:0、22:1及び24:1も生成させる(Ohら,The Journal of Biological Chemistry 272(28):17376−17384(1997);ELO2の配列を含むヌクレオチド配列に関しては、米国特許第5,484,724号の参照のこと;実施例Vに記載されているグリコシル化阻害因子の配列の考察に関しては、PCT公開第88/07577号を参照のこと)。これらの2つの遺伝子間の相同性の考慮に基づき、PUFA−エロンガーゼ活性に関する発現スクリーニングにより、モルチエレラ・アルピナ(Mortierella alpina)における長鎖PUFA特異的エロンガーゼの研究を開始した。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】国際公開第96/13591号
【特許文献2】米国特許第5,552,306号明細書
【特許文献3】国際公開第94/11516号
【特許文献4】米国特許第5,443,974号明細書
【特許文献5】国際公開第93/11245号
【特許文献6】米国特許第5,484,724号明細書
【特許文献7】国際公開第88/07577号
【非特許文献】
【0010】
【非特許文献1】Lassnerら,The Plant Cell 8:281−292(1996)
【非特許文献2】Ohら,The Journal of Biological Chemistry 272(28):17376−17384(1997)
【発明の概要】
【0011】
本発明は、配列番号1(図6)に示されたヌクレオチド配列の少なくとも約50%と一致するか、又は相補的である、単離されたヌクレオチド配列に関する。この単離された配列は、配列番号1により表されうる。その配列は、ポリ不飽和脂肪酸又はモノ不飽和脂肪酸を基質として利用する、機能的活性を有するエロンガーゼをコードする。特に、その配列は、モルチエレラ属の真菌に由来するものであってよく、特に、モルチエレラ・アルピナから単離されうる。
【0012】
本発明は、前記ヌクレオチド配列によりコードされる精製されたタンパク質も含み、さらに、ポリ不飽和脂肪酸又はモノ不飽和脂肪酸を伸長し、かつ前記ヌクレオチド配列によりコードされる精製されたタンパク質のアミノ酸配列と少なくとも約50%のアミノ酸類似性を有する、精製されたポリペプチドも含む。
【0013】
さらに、本発明は、a)配列番号1(図6)により表されたヌクレオチド配列を単離する工程、b)i)プロモーター、およびii)該プロモーターと機能的に連結された単離されたヌクレオチド配列を含むベクターを構築する工程、並びにc)エロンガーゼ酵素の発現にとって十分な時間及び条件で、宿主細胞へベクターを導入する工程を含む、エロンガーゼ酵素を製造する方法を包含する。宿主細胞は、真核細胞であっても、又は原核細胞であってもよい。
【0014】
原核細胞は、例えば、大腸菌(E. coli)細胞、シアノバクテリア細胞又は枯草菌(B. subtilis)細胞でありうる。真核細胞は、例えば、真核細胞の適当な例には、哺乳動物細胞、昆虫細胞、植物細胞及び真菌細胞でありうる。真菌細胞は、例えば哺乳動物細胞、昆虫細胞、植物細胞又は真菌細胞でありうる。真菌細胞は、例えば、サッカロミセス種(Saccharomyces spp.)、カンジダ種(Candida spp.)、リポミセス種(Lipomyces spp.)、ヤロウイア種(Yarrowia spp.)、クルイベロミセス種(Kluyveromyces spp.)、ハンセヌラ種(Hansenula spp.)、アスペルギルス種(Aspergillus spp.)、ペニシリウム種(Penicillium spp.)、ノイロスポラ種(Neurospora spp.)、トリコデルマ種(Trichoderma spp.)又はピキア種(Pichia spp.)でありうる。特に、真菌細胞は、サッカロミセス種、特にサッカロミセス・セレビシエ、カンジダ種、ハンセヌラ種、又はピキア種のような酵母細胞でありうる。
【0015】
本発明は、a)プロモーター、およびb)該プロモーターと機能的に連結された配列番号1(図6)により表されるヌクレオチド配列を含むベクターも含み、さらに、このベクターを含む宿主細胞も含む。宿主は、真核細胞であっても、又は原核細胞であってもよい。原核細胞の適当な例には、大腸菌細胞、シアノバクテリア細胞、又は枯草菌細胞が含まれる。真核細胞の適当な例には、哺乳動物細胞、昆虫細胞、植物細胞及び真菌細胞が含まれる。真菌細胞は、例えば、サッカロミセス種、カンジダ種、リポミセス種、ヤロウイア種、クルイベロミセス種、ハンセヌラ種、アスペルギルス種、ペニシリウム種、ニューロスポラ種、トリコデルマ種及びピキア種でありうる。特に、真菌細胞は、例えば、例えばサッカロミセス種、特にサッカロミセス・セレビシエ、カンジダ種、ハンセヌラ種及びピキア種のような酵母細胞でありうる。
【0016】
本発明は、ベクターのヌクレオチド配列の発現により、植物細胞、植物又は植物組織によるモノ不飽和脂肪酸及びポリ不飽和脂肪酸からなる群より選択される少なくとも一つの脂肪酸の生成が引き起こされる、前記ベクターを含む植物細胞、植物又は植物組織を含む。ポリ不飽和脂肪酸は、例えば、ジホモ−γ−リノレン酸(DGLA)、20:4n−3及びアドレン酸(ADA)でありうる。本発明は、植物細胞、植物又は植物組織により発現された一つ又は複数の植物油又は脂肪酸も含む。さらに、本発明は、ベクターのヌクレオチド配列の発現により、トランスジェニック植物の種子におけるポリ不飽和脂肪酸の生成が引き起こされる、前記ベクターを含むトランスジェニック植物を包含する。
【0017】
さらに、本発明は、プロモーターと機能的に連結されたエロンガーゼをコードするDNA配列を含むゲノムを有する、ヒト以外のトランスジェニック哺乳動物を含む。DNA配列は、配列番号1(図6)により表されうる。本発明は、少なくとも一つのエロンガーゼ、又は例えばDGLA、ω6−ドコサペンタエン酸、ADA及び/もしくは20:4n−3(図1参照)のようなそれらの生成物を検出可能なレベルで含む、ヒト以外のトランスジェニック動物により産生された体液(例えば、乳汁)も含む。
【0018】
さらに、本発明は、a)配列番号1(図6)により表されるヌクレオチド配列を単離する工程、b)単離されたヌクレオチド配列を含むベクターを構築する工程、c)単離されたヌクレオチド配列によりコードされるエロンガーゼ酵素の発現にとって十分な時間及び条件で、宿主細胞へベクターを導入する工程、並びにd)基質を「生成物」ポリ不飽和脂肪酸へ変換するため、発現されたエロンガーゼ酵素を「基質」ポリ不飽和脂肪酸へ曝露する工程を含む、ポリ不飽和脂肪酸を製造するための方法を含む。基質ポリ不飽和脂肪酸は、例えば、γ−リノレン酸(GLA)、ステアリドン酸(STA)及びアラキドン酸(AA)からなる群より選択され、生成物ポリ不飽和脂肪酸は、例えば、それぞれDGLA、20:4n−3及びADAからなる群より選択されうる。本発明は、生成物ポリ不飽和脂肪酸を「第二生成物」ポリ不飽和脂肪酸へ変換するため、生成物ポリ不飽和脂肪酸を、少なくとも一つのデサチュラーゼへ曝露する工程をさらに含みうる。生成物ポリ不飽和脂肪酸は、例えばDGLA、20:4n−3及びADAからなる群より選択されうる。第二生成物ポリ不飽和脂肪酸は、例えば、それぞれAA、エイコサペンタエン酸(EPA)、ω6−ドコサペンタエン酸からなる群より選択され、少なくとも一つのデサチュラーゼは、AA又はEPAの製造に関してはΔ5−デサチュラーゼであり、ω6−ドコサペンタエン酸の製造に関してはΔ4−デサチュラーゼである。この方法は、第二生成物ポリ不飽和脂肪酸を「最終」ポリ不飽和脂肪酸へ変換するため、少なくとも一つのエロンガーゼ及び少なくとも一つの付加的なデサチュラーゼからなる群より選択される一つ又は複数の酵素へ、第二生成物ポリ不飽和脂肪酸を曝露する工程をさらに含みうる。最終ポリ不飽和脂肪酸は、例えば、ドコサヘキサエン酸(DHA)、AA、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。
【0019】
又、本発明は、前記方法に従い製造された生成物ポリ不飽和脂肪酸、前記方法に従い製造された第二生成物ポリ不飽和脂肪酸及び前記方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む栄養組成物を含む。生成物ポリ不飽和脂肪酸は、例えばDGLA、20:4n−3及びADAからなる群より選択されうる。第二生成物ポリ不飽和脂肪酸は、例えば、AA、EPA又はω6−ドコサペンタエン酸でありうる。最終ポリ不飽和脂肪酸は、例えば、DHA、アドレン酸、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。栄養組成物は、例えば、幼児用調合物、栄養補助食品又は食品代用物であってよく、ヒト又は動物へ投与されることができ、経口的又は非経口的に投与されうる。栄養組成物は、ココヤシ油、ダイズ油、カノーラ油、モノグリセリド、ジグリセリド、トリグリセリド、グルコース、食用ラクトース、電気透析されたホエー、電気透析されたスキムミルク、乳清、ダイズ・タンパク質、タンパク質加水分解物、ヒマワリ油、ベニバナ油、コーン油及びアマ油からなる群より選択される、少なくとも一つの多量養素をさらに含みうる。栄養組成物は、ビタミンA、ビタミンC、ビタミンD、ビタミンE及びビタミンB複合体からなる群より選択される少なくとも一つのビタミン、並びにカルシウム、マグネシウム、亜鉛、マンガン、ナトリウム、カリウム、リン、銅、塩素、ヨウ素、セレン及び鉄からなる群より選択される少なくとも一つの無機物も含みうる。
【0020】
さらに、本発明は、1)前記方法に従い製造された生成物ポリ不飽和脂肪酸、請求項32の前記方法に従い製造された第二生成物ポリ不飽和脂肪酸及び前記方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸と、2)薬学的に許容される担体とを含む薬学的組成物を包含する。この組成物は、ヒト又は動物へ投与されうる。この組成物は、ビタミン、無機物、塩、炭水化物、アミノ酸、遊離脂肪酸、保存料、賦形剤、抗ヒスタミン、増殖因子、抗生物質、希釈剤、リン脂質、抗酸化剤及びフェノール化合物からなる群より選択される少なくとも一つの要素をさらに含みうる。この組成物は、経口、非経口、局所、直腸内、筋肉内、皮下、皮内、又はその他の任意の適当な手段により、投与されうる。
【0021】
本発明は、前記方法に従い製造された生成物ポリ不飽和脂肪酸、前記方法に従い製造された第二生成物ポリ不飽和脂肪酸及び前記方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む動物飼料も含む。生成物ポリ不飽和脂肪酸は、例えばDGLA、20:4n−3及びADAでありうる。第二生成物ポリ不飽和脂肪酸は、例えば、AA、EPA又はω6−ドコサペンタエン酸でありうる。最終ポリ不飽和脂肪酸は、例えば、DHA、アドレン酸、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。
【0022】
さらに、本発明は、前記方法に従い製造された生成物ポリ不飽和脂肪酸、前記方法に従い製造された第二生成物ポリ不飽和脂肪酸及び前記方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む化粧品も含む。
【0023】
さらに、本発明は、予防又は治療を行うために十分な量で前記栄養組成物を患者に投与することを含む、ポリ不飽和脂肪酸の不十分な摂取又は生成により引き起こされる状態を予防又は治療する方法を含む。
【0024】
本発明は、配列番号2(図22)に示されたヌクレオチド配列の少なくとも約35%と一致するか、又は相補的である、単離されたヌクレオチド配列も含む。この配列は、配列番号2により表されうる。その配列は、ポリ不飽和脂肪酸を基質として利用する、機能的活性を有するエロンガーゼをコードする。この配列は、例えば、モルチエレラ属の真菌に由来するものであってよい。特に、それは、M.アルピナに由来するものであってよい。
【0025】
さらに、本発明は、前記ヌクレオチド配列によりコードされる精製されたタンパク質を含み、さらに、ポリ不飽和脂肪酸を伸長し、かつ精製されたタンパク質のアミノ酸配列と少なくとも約30%のアミノ酸類似性を有する、精製されたポリペプチドを含む。
【0026】
本発明は、前記のようなエロンガーゼ酵素を製造する方法も含む。ベクターへ挿入される配列は、配列番号2(図22)により表される。宿主細胞は、原核細胞であっても、又は真核細胞であってもよい。適当な例は、前記と同様である。
【0027】
本発明は、a)プロモーター、およびb)該プロモーターと機能的に連結された配列番号2(図22)により表されるヌクレオチド配列を含むベクターも含み、さらに、このベクターを含む宿主細胞も含む。この場合にも、宿主細胞は、原核細胞であっても、又は真核細胞であってもよい。適当な例は、前記と同様である。
【0028】
本発明は、ベクターのヌクレオチド配列の発現により、植物細胞、植物又は植物組織によるポリ不飽和脂肪酸の生成が引き起こされる、前記ベクターを含む植物細胞、植物又は植物組織も含む。ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3又はADAでありうる。さらに、本発明は、植物細胞、植物又は植物組織により発現された一つ又は複数の植物油又は脂肪酸を含む。
【0029】
さらに、本発明は、ベクターのヌクレオチド配列(配列番号2)の発現により、トランスジェニック植物の種子におけるポリ不飽和脂肪酸の生成が引き起こされる、前記ベクターを含むトランスジェニック植物も含む。
【0030】
本発明は、プロモーターと機能的に連結されたエロンガーゼをコードするDNA配列(配列番号2)を含むゲノムを有する、ヒト以外のトランスジェニック哺乳動物も含む。本発明は、少なくとも一つのエロンガーゼ又はそれらの生成物を検出可能なレベルで含む、ヒト以外のトランスジェニック動物により産生された体液も含む。
【0031】
本発明は、a)配列番号2(図22)により表されるヌクレオチド配列を単離する工程、b)単離されたヌクレオチド配列を含むベクターを構築する工程、c)単離されたヌクレオチド配列によりコードされるエロンガーゼ酵素の発現にとって十分な時間及び条件で、宿主細胞へベクターを導入する工程、並びにd)基質を生成物ポリ不飽和脂肪酸へ変換するため、発現されたエロンガーゼ酵素を基質ポリ不飽和脂肪酸へ曝露する工程を含む、ポリ不飽和脂肪酸を製造するための方法も含む。基質ポリ不飽和脂肪酸は、例えば、GLA、STA及びAAであり、生成物ポリ不飽和脂肪酸は、例えば、それぞれDGLA、20:4n−3又はω6−ドコサペンタエン酸でありうる。本発明は、生成物ポリ不飽和脂肪酸を第二生成物ポリ不飽和脂肪酸へ変換するため、発現されたエロンガーゼ酵素を、少なくとも一つのデサチュラーゼへ曝露する工程をさらに含みうる。生成物ポリ不飽和脂肪酸は、例えばDGLA、20:4n−3又はADAであり、第二生成物ポリ不飽和脂肪酸は、例えば、それぞれAA、EPA又はω6−ドコサペンタエン酸であり、少なくとも一つのデサチュラーゼは、AA又はEPAの製造に関してはΔ5−デサチュラーゼであり、ω6−ドコサペンタエン酸の製造に関してはΔ4−デサチュラーゼである。この方法は、第二生成物ポリ不飽和脂肪酸を最終ポリ不飽和脂肪酸へ変換するため、少なくとも一つのエロンガーゼ及び少なくとも一つの付加的なデサチュラーゼからなる群より選択される一つ又は複数の酵素へ、第二生成物ポリ不飽和脂肪酸を曝露する工程をさらに含みうる。最終ポリ不飽和脂肪酸は、例えば、ドコサヘキサエン酸、AA、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。
【0032】
本発明は、配列番号2に関して記載された方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号2に関して記載された方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号2に関して記載された方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む栄養組成物を含む。生成物ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3及びADAからなる群より選択されうる。第二生成物ポリ不飽和脂肪酸は、例えば、AA、EPA及びω6−ドコサペンタエン酸からなる群より選択されうる。最終ポリ不飽和脂肪酸は、例えば、DHA、AA、ω6−ドコサペンタエン酸及びω3−ドコサペンタエン酸からなる群より選択されうる。投与、特徴、成分等に関する組成物のその他の属性は、前記と同様である。
【0033】
本発明は、1)配列番号2に関する前述の方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号2に関する前記の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号2に関する前記の方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸と、2)薬学的に許容される担体とを含む薬学的組成物も含む。前記の薬学的組成物の特徴(例えば、投与、成分等)が、この組成物にも適合する。
【0034】
本発明は、配列番号2に関して記載された方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号2に関する前記の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号2に関して記載された方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む動物飼料も含む。生成物ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3又はADAでありうる。第二生成物ポリ不飽和脂肪酸は、例えば、AA、EPA又はω6−ドコサペンタエン酸でありうる。最終ポリ不飽和脂肪酸は、例えば、DHA、アドレン酸、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。
【0035】
本発明は、配列番号2に関する前記の方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号2に関する前記の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号2に関する前記の方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む化粧品も含む。
【0036】
さらに、本発明は、予防又は治療を行うために十分な量で、直前に記載された栄養組成物を患者に投与することを含む、ポリ不飽和脂肪酸の不十分な摂取又は生成により引き起こされる状態を予防又は治療する方法を含む。
【0037】
さらに、本発明は、配列番号3(図43)に示されたヌクレオチド配列の少なくとも約35%と一致するか、又は相補的である、単離されたヌクレオチド配列も含む。この配列は、配列番号3により表されるものでありうる。この配列は、ポリ不飽和脂肪酸又はモノ不飽和脂肪酸を基質として利用する、機能的活性を有するエロンガーゼをコードする。この配列は、例えばヒトのような哺乳動物に由来する。
【0038】
本発明は、このヌクレオチド配列によりコードされる精製されたタンパク質も含む。また、本発明は、ポリ不飽和脂肪酸又はモノ不飽和脂肪酸を伸長し、かつこの精製されたタンパク質のアミノ酸配列と少なくとも約30%のアミノ酸類似性を有する、精製されたポリペプチドを含む。
【0039】
さらに、本発明は、a)配列番号3(図43)により表されるヌクレオチド配列を単離する工程、b)i)プロモーター、およびii)該プロモーターと機能的に連結された単離されたヌクレオチド配列を含むベクターを構築する工程、並びにc)エロンガーゼ酵素の発現にとって十分な時間及び条件で、宿主細胞へ該ベクターを導入する工程を含む、エロンガーゼ酵素を製造する方法を含む。宿主細胞は、配列番号1又は2を利用した対応する方法に関する前記の細胞と同様でありうる。
【0040】
本発明は、a)プロモーター、およびb)該プロモーターと機能的に連結された配列番号3(図43)により表されたヌクレオチド配列を含むベクターも含み、さらに、このベクターを含む宿主細胞も含む。宿主細胞は、前記の細胞と同様でありうる。
【0041】
本発明は、ベクターのヌクレオチド配列の発現により、植物細胞、植物又は植物組織によるモノ不飽和脂肪酸及びポリ不飽和脂肪酸からなる群より選択される少なくとも一つの脂肪酸の生成が引き起こされる、前記ベクターを含む植物細胞、植物又は植物組織も含む。ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3又はADAでありうる。本発明は、植物細胞、植物又は植物組織により発現された一つ又は複数の植物油又は酸も含む。
【0042】
本発明は、ベクターのヌクレオチド配列の発現により、トランスジェニック植物の種子におけるポリ不飽和脂肪酸の生成が引き起こされる、配列番号3を含むベクターを含むトランスジェニック植物も含む。
【0043】
さらに、本発明は、プロモーターと機能的に連結されたエロンガーゼをコードするヒトDNA配列を含むゲノムを有する、ヒト以外のトランスジェニック哺乳動物を含む。DNA配列は、配列番号3(図43)により表される。本発明は、少なくとも一つのエロンガーゼ又はそれらの生成物を検出可能なレベルで含む、ヒト以外のトランスジェニック哺乳動物により産生された体液も含む。
【0044】
本発明は、a)配列番号3(図43)により表されるヌクレオチド配列を単離する工程、b)該ヌクレオチド配列を含むベクターを構築する工程、c)単離されたヌクレオチド配列によりコードされるエロンガーゼ酵素の発現にとって十分な時間及び条件で、宿主細胞へベクターを導入する工程、並びにd)基質を生成物ポリ不飽和脂肪酸へ変換するため、発現されたエロンガーゼ酵素を基質ポリ不飽和脂肪酸へ曝露する工程を含む、ポリ不飽和脂肪酸を製造するための方法も包含する。基質ポリ不飽和脂肪酸は、例えば、GLA、STA又はAAであり、生成物ポリ不飽和脂肪酸は、例えば、それぞれDGLA、20:4n−3又はADAでありうる。この方法は、生成物ポリ不飽和脂肪酸を第二生成物ポリ不飽和脂肪酸へ変換するため、生成物ポリ不飽和脂肪酸を、少なくとも一つのデサチュラーゼへ曝露する工程をさらに含みうる。生成物ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3及びADAであり、第二生成物ポリ不飽和脂肪酸は、例えば、それぞれAA、EPA及びω6−ドコサペンタエン酸であり、少なくとも一つのデサチュラーゼは、AA又はEPAの生成に関してはΔ5−デサチュラーゼであり、ω6−ドコサペンタエン酸の生成に関してはΔ4−デサチュラーゼである。この方法は、第二生成物ポリ不飽和脂肪酸を最終ポリ不飽和脂肪酸へ変換するため、少なくとも一つのエロンガーゼ及び少なくとも一つの付加的なデサチュラーゼからなる群より選択される一つ又は複数の酵素へ、第二生成物ポリ不飽和脂肪酸を曝露する工程をさらに含みうる。最終ポリ不飽和脂肪酸は、例えば、DHA、ADA、ω6−ドコサペンタエン酸及びω3−ドコサペンタエン酸でありうる。
【0045】
例えば、配列番号3に関する前述の方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号3に関する前述の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号3に関する前述の方法に従い製造された最終ポリ不飽和脂肪酸でありうる、少なくとも一つのポリ不飽和脂肪酸を含む栄養組成物。生成物ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3又はADAでありうる。第二生成物ポリ不飽和脂肪酸は、AA、EPA又はω6−ドコサペンタエン酸からなる群より選択されうる。最終ポリ不飽和脂肪酸は、例えば、DHA、ADA、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。組成物のその他の特性又は特徴(例えば、投与、成分等)は、他の栄養組成物に関する前述のものと同様である。
【0046】
さらに、本発明は、1)配列番号3に関する前記の方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号3に関する前記の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号3に関する前記の方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸と、2)薬学的に許容される担体とを含む薬学的組成物も含む。組成物のその他の特性(例えば、投与、付加的成分等)は、他の薬学的組成物に関する前述のものと同様である。
【0047】
本発明は、配列番号3に関する前述の方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号3に関する前述の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号3に関する前述の方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む動物飼料も含む。生成物ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3又はADAでありうる。ポリ不飽和脂肪酸は、例えば、AA、EPA又はω6−ドコサペンタエン酸でありうる。最終ポリ不飽和脂肪酸は、例えば、DHA、ADA、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。
【0048】
また、本発明は、配列番号3に関する前述の方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号3に関する前述の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号3に関する前述の方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む化粧品を含む。
【0049】
予防又は治療を行うために十分な量で、配列番号3に関する前述の栄養組成物を患者に投与することを含む、ポリ不飽和脂肪酸の不十分な摂取又は生成により引き起こされる状態を予防又は治療する方法。
【0050】
さらに、本発明は、配列番号4(図46)に示されたヌクレオチド配列の少なくとも約35%と一致するか、又は相補的である、単離されたヌクレオチド配列を含む。この配列は、配列番号4により表されうる。この配列は、ポリ不飽和脂肪酸を基質として利用する、機能的活性を有するエロンガーゼをコードする。この配列は、セノラブディティス(Caenorhabditis)属の線虫に由来し、又はそれから単離され、特にC.エレガンス(C. elegans)から単離されうる。
【0051】
本発明は、前記ヌクレオチド配列によりコードされる精製されたタンパク質を含む。本発明は、ポリ不飽和脂肪酸を伸長し、かつこの精製されたタンパク質のアミノ酸配列と少なくとも約30%のアミノ酸類似性を有する精製されたポリペプチドも含む。
【0052】
さらに、本発明は、a)配列番号4(図46)により表されるヌクレオチド配列を単離する工程、b)i)プロモーター、およびii)該プロモーターと機能的に連結された単離されたヌクレオチド配列を含むベクターを構築する工程、並びにc)エロンガーゼ酵素の発現にとって十分な時間及び条件で、宿主細胞へベクターを導入する工程を含む、エロンガーゼ酵素を製造する方法を含む。宿主細胞の特性は、配列番号1、配列番号2及び配列番号3に関する前記の特性と同様である。
【0053】
本発明は、a)プロモーター、およびb)該プロモーターと機能的に連結された配列番号4(図46)により表されるヌクレオチド配列を含むベクターも包含し、さらに、このベクターを含む宿主細胞も包含する。宿主細胞は、配列番号1、配列番号2及び配列番号3のための前述の宿主細胞に関する前述の特性と同一の特性を有する。
【0054】
さらに、本発明は、ベクターの該ヌクレオチド配列の発現により、植物細胞、植物又は植物組織によるポリ不飽和脂肪酸の生成が引き起こされる、配列番号4を含む前記ベクターを含む植物細胞、植物又は植物組織を含む。ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3又はADAでありうる。本発明は、植物細胞、植物又は植物組織により発現された一つ又は複数の植物油又は脂肪酸も含む。
【0055】
本発明は、ベクターのヌクレオチド配列の発現により、トランスジェニック植物の種子におけるポリ不飽和脂肪酸の生成が引き起こされる、配列番号4に相当するヌクレオチド配列を含む前記ベクターを含むトランスジェニック植物も含む。
【0056】
さらに、本発明は、プロモーターと機能的に連結されたエロンガーゼをコードするC.エレガンスDNA配列を含むゲノムを有する、ヒト以外のトランスジェニック哺乳動物を含む。そのDNA配列は、配列番号4(図46)により表されうる。本発明は、少なくとも一つのエロンガーゼ又はそれらの生成物を検出可能なレベルで含む、請求項187のヒト以外のトランスジェニック哺乳動物により産生された体液も含む。
【0057】
本発明は、a)配列番号4(図46)により表されるヌクレオチド配列を単離する工程、b)単離されたヌクレオチド配列を含むベクターを構築する工程、c)単離されたヌクレオチド配列によりコードされるエロンガーゼ酵素の発現にとって十分な時間及び条件で、宿主細胞へベクターを導入する工程、並びにd)基質を生成物ポリ不飽和脂肪酸へ変換するため、発現されたエロンガーゼ酵素を基質ポリ不飽和脂肪酸へ曝露する工程を含む、ポリ不飽和脂肪酸を製造するための方法も含む。基質ポリ不飽和脂肪酸は、例えば、GLA、STA又はAAであり、生成物ポリ不飽和脂肪酸は、例えば、それぞれDGLA、20:4n−3又はADAでありうる。この方法は、該生成物ポリ不飽和脂肪酸を第二生成物ポリ不飽和脂肪酸へ変換するため、発現されたエロンガーゼ酵素を、少なくとも一つのデサチュラーゼへ曝露する工程をさらに含みうる。生成物ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3又はADAであり、第二生成物ポリ不飽和脂肪酸は、例えば、それぞれAA、EPA又はω6−ドコサペンタエン酸であり、少なくとも一つのデサチュラーゼは、AA又はEPAの製造に関してはΔ5−デサチュラーゼであり、ω6−ドコサペンタエン酸の製造に関してはΔ4−デサチュラーゼである。この方法は、第二生成物ポリ不飽和脂肪酸を最終ポリ不飽和脂肪酸へ変換するため、少なくとも一つのエロンガーゼ及び少なくとも一つの付加的なデサチュラーゼからなる群より選択される一つ又は複数の酵素へ、第二生成物ポリ不飽和脂肪酸を曝露する工程をさらに含みうる。最終ポリ不飽和脂肪酸は、例えば、DHA、ADA、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。
【0058】
本発明は、配列番号4に関する前記の方法に従い製造された該ポリ不飽和脂肪酸、配列番号4に関する前記の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号4に関する前述の方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む栄養組成物も含む。生成物ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3又はADAでありうる。第二生成物ポリ不飽和脂肪酸は、例えば、AA、EPA又はω6−ドコサペンタエン酸でありうる。最終ポリ不飽和脂肪酸は、例えば、DHA、ADA、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。組成物のその他の特徴は、前記の栄養組成物に関して記述されたものと同様である。
【0059】
さらに、本発明は、1)配列番号4に関する前述の方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号4に関する前述の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号4に関する前述の方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸と、2)薬学的に許容される担体とを含む薬学的組成物を含む。組成物は、他の薬学的組成物に関する前記の特性と同様の特性(例えば、投与、追加要素等)を有する。
【0060】
本発明は、配列番号4に関する前記の方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号4に関する前述の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号4に関する前記の方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択される、少なくとも一つのポリ不飽和脂肪酸を含む動物飼料も含む。生成物ポリ不飽和脂肪酸は、例えば、DGLA、20:4n−3又はADAでありうる。第二生成物ポリ不飽和脂肪酸は、例えば、AA、EPA又はω6−ドコサペンタエン酸でありうる。最終ポリ不飽和脂肪酸は、例えば、DHA、ADA、ω6−ドコサペンタエン酸又はω3−ドコサペンタエン酸でありうる。
【0061】
さらに、本発明は、配列番号4に関する前述の方法に従い製造された生成物ポリ不飽和脂肪酸、配列番号4に関する前述の方法に従い製造された第二生成物ポリ不飽和脂肪酸及び配列番号4に関する前記の方法に従い製造された最終ポリ不飽和脂肪酸からなる群より選択されるポリ不飽和脂肪酸を含む化粧品を含む。
【0062】
さらに、本発明は、予防又は治療を行うために十分な量で、配列番号4に関して記述された栄養組成物を患者に投与することを含む、ポリ不飽和脂肪酸の不十分な摂取又は生成により引き起こされる状態を予防又は治療する方法を包含する。
【0063】
本明細書において言及された米国特許及び公開物は全て、参照として完全に本明細書に組み込まれる。
【図面の簡単な説明】
【0064】
【図1】様々な脂肪酸生合成経路を示す図である。エロンガーゼの役割に注意されたい。
【図2】ホホバKCS及びELO2のアミノ酸配列の類似性(%)及び同一性(%)を示す図である。
【図3】図2のホホバKCS配列(下線部がプライマー配列)と相同なS.セレビシエELO2配列を示す図である。
【図4】図4Aは、MAELO cDNAを含有するpRAE−2の物理的地図を示す図である。図4Bは、酵母におけるエロンガーゼ酵素産生に使用された構成性発現ベクターpRAE−5の物理的地図を示す図である。
【図5】クローンpRAE−5及びpRAE−6のヌクレオチド配列の比較を示す図である。
【図6】モルチエレラ・アルピナ・エロンガーゼ(MAELO)の全長ヌクレオチド配列を示す図である。
【図7】MAELO(図6参照)から翻訳されたモルチエレラ・アルピナ・エロンガーゼのアミノ酸配列を示す図である。
【図8】3つのエロンガーゼ、S.セレビシエELO2(GNS1)とS.セレビシエELO3(SUR4)と図7に示された翻訳されたMAELO配列とのアミノ酸配列アラインメントを示す図である。
【図9】MAELOのヌクレオチド配列とS.セレビシエ由来のELO2のヌクレオチド配列との比較を示す図である。
【図10A】パン酵母において発現されたMAELOのPUFAエロンガーゼ活性を示す図である。
【図10B】パン酵母において発現されたMAELOのPUFAエロンガーゼ活性を示す図である。
【図11】AAを生成するようM.アルピナ由来のΔ5−デサチュラーゼcDNAと共に共発現された場合のMAELOのPUFAエロンガーゼ活性を示す図である。
【図12】MAELOのPUFAエロンガーゼ活性と、パン酵母におけるS.セレビシエ由来のELO2の過剰発現との比較を示す図である。
【図13】GenEMBLデータベースのC.エレガンス・ヌクレオチド配列由来のアミノ酸配列と、翻訳されたMAELOとの3つの異なる比較を示す図である。
【図14】GenEMBLデータベースのC.エレガンス・ヌクレオチド配列由来のアミノ酸配列と、翻訳されたMAELOとの3つの異なる比較を示す図である。
【図15】GenEMBLデータベースのC.エレガンス・ヌクレオチド配列由来のアミノ酸配列と、翻訳されたMAELOとの3つの異なる比較を示す図である。
【図16】GenEMBLデータベースの2つの異なる哺乳動物配列のアミノ酸翻訳と、翻訳されたMAELOとの比較を示す図である。
【図17】翻訳されたDNA配列(公開されたPCT出願第88/07577号を参照)と、データベース検索において検出されたMAELO由来のアミノ酸配列との比較を示す図である。
【図18】M.アルピナ由来のΔ5−デサチュラーゼの全長ヌクレオチド配列を示す図である。
【図19】MAD708プールの一次GC−FAME分析を示す図である。DGLA(C20:3n−6)ピークの検出に注意されたい。
【図20】酵母中の5つのMAD708クローンの、GLAを基質として用いたPUFAエロンガーゼ活性を示す図である。全てのクローンが明白なエロンガーゼ活性を有する。
【図21】プラスミドpRPB2のDNA配列決定分析を示す図である。分析により957bp長のオープン・リーディング・フレームが明らかとなった。
【図22】GLAエロンガーゼ活性のためGLELOと名付けられた、プラスミドpRPB2に含まれるM.アルピナcDNAの全長ヌクレオチド配列を示す図である。
【図23】GLELO(図22参照)から翻訳されたM.アルピナ・エロンガーゼのアミノ酸配列を示す図である。
【図24】GLAを補足した場合の、334(pRPB2)の誘導された培養物におけるn−6 PUFAエロンガーゼ活性を示す図である。
【図25】25μmの他の脂肪酸基質を補足した場合の、334(pRPB2)の誘導された培養物におけるn−3及びn−6 PUFAエロンガーゼ活性を示す図である。
【図26】図26Aは、AAを生成するようM.アルピナのΔ5−デサチュラーゼcDNAと共に共発現された場合の、GLELOのGLAを基質として用いたエロンガーゼ活性を示す図である。図26Bは、EPAを生成するようM.アルピナのΔ5−デサチュラーゼcDNAと共に共発現された場合の、GLELOのSTAを基質として用いたエロンガーゼ活性を示す図である。
【図27】翻訳されたGLELO配列(図23参照)と翻訳されたMAELO配列(図7参照)との比較を示す図である。
【図28】4つのエロンガーゼのアミノ酸配列、即ちGLELO(図23参照)、MAELO配列(図7参照)、S.セレビシエELO2(GNS1)及びS.セレビシエELO3(SUR4)の翻訳されたアミノ酸配列の比較を示す図である。ヒスチジン・ボックスが下線で示されている。
【図29】翻訳されたMAELO配列と翻訳された推定ヒト・ホモログHS1配列とのアラインメントを示す図である。
【図30】翻訳されたMAELO配列と翻訳された推定ヒト・ホモログHS2配列とのアラインメントを示す図である。
【図31】翻訳されたMAELO配列と翻訳された推定マウス・ホモログMM2配列とのアラインメントを示す図である。
【図32】翻訳されたMAELOと翻訳された推定マウス・ホモログAI225632配列とのアラインメントを示す図である。
【図33】翻訳されたGLELO配列と翻訳された推定ヒト・ホモログAI815960配列とのアラインメントを示す図である。
【図34】翻訳されたGLELO配列と翻訳された推定ヒト・ホモログHS1配列とのアラインメントを示す図である。
【図35】翻訳されたGLELO配列と翻訳された推定ヒト・ホモログAC004050配列とのアラインメントを示す図である。
【図36】翻訳されたGLELO配列と翻訳された推定マウス・ホモログMM2配列とのアラインメントを示す図である。
【図37】翻訳されたGLELO配列と翻訳された推定マウス・ホモログAI225632配列とのアラインメントを示す図である。
【図38】翻訳されたGLELO配列と翻訳された推定マウス・ホモログU97107とのアラインメントを示す図である。
【図39】翻訳されたGLELO配列と翻訳された推定C.エレガンスU68749(F56H11.4)ホモログ配列とのアラインメントを示す図である。
【図40】翻訳されたMAELO配列と翻訳された推定C.エレガンスU68749(F56H11.4)ホモログ配列とのアラインメントを示す図である。
【図41】翻訳されたGLELO配列と翻訳された推定キイロショウジョウバエ・ホモログ配列DM1とのアラインメントを示す図である。
【図42】翻訳されたMAELO配列と翻訳された推定キイロショウジョウバエ・ホモログ配列DM1とのアラインメントを示す図である。
【図43】ヒト・エロンガーゼHSELO1の全長ヌクレオチド配列を示す図である。
【図44】ヒト・エロンガーゼHSELO1の推定アミノ酸配列を示す図である。
【図45】GLA又はAAを補足した場合の、334(pRAE−58−A1)の誘導された培養物のエロンガーゼ活性(PUFA及びその他)を示す図である。
【図46】C.エレガンス・エロンガーゼCEELOの全長ヌクレオチド配列を示す図である。
【図47】C.エレガンス・エロンガーゼCEELOの推定アミノ酸配列を示す図である。
【図48】GLA又はAAを補足した場合の、334(pRET−21)及び334(pRET−22)の誘導された培養物のPUFAエロンガーゼ活性を示す図である。
【図49】推定ヒト・エロンガーゼ遺伝子HS3の全長ヌクレオチド配列を示す図である。
【図50】推定ヒト・エロンガーゼ酵素HS3の推定アミノ酸配列を示す図である。
【0065】
(発明の詳細な説明)
本発明は、モルチエレラ・アルピナ由来の2つのエロンガーゼcDNAのヌクレオチド配列及び対応するアミノ酸配列に関し、さらにヒト由来のエロンガーゼcDNAのヌクレオチド配列及び対応するアミノ酸配列、並びにC.エレガンス由来のエロンガーゼcDNAのヌクレオチド配列及び対応するアミノ酸配列に関する。さらに、本発明は、cDNAの使用、及び遺伝子によりコードされるタンパク質の使用も含む。例えば、遺伝子及び対応する酵素は、薬学的組成物、栄養組成物及びその他の有用な製品へ添加されうる、DGLA、AA、ADA、EPA及び/又はDHAのような、ポリ不飽和脂肪酸及び/又はモノ不飽和脂肪酸の製造において使用されうる。
【0066】
エロンガーゼ遺伝子及びそれらによりコードされる酵素
前述のように、エロンガーゼcDNAによりコードされるエロンガーゼ酵素は、様々なポリ不飽和脂肪酸、特に20〜24個の炭素を含むPUFAの生成に必須である。本発明に関して、単離されたM.アルピナ・エロンガーゼcDNA(MAELO)のヌクレオチド配列は、図6に示され、このヌクレオチド配列によりコードされる対応する精製されたタンパク質又は酵素のアミノ酸配列は、図7に示されている。さらに、単離されたGLAエロンガーゼcDNA(GLELO)のヌクレオチド配列は、図22に示され、このヌクレオチド配列によりコードされる対応する精製されたタンパク質又は酵素のアミノ酸配列は、図23に示されている。単離されたヒト配列1(HSELO1)エロンガーゼのヌクレオチド配列は、図43に示され、この配列によりコードされる対応する精製されたタンパク質又は酵素のアミノ酸配列は、図44に示されている。さらに、単離されたC.エレガンス・エロンガーゼcDNA(CEELO1)のヌクレオチド配列は、図46に示され、それによりコードされる対応する精製されたタンパク質又は酵素のアミノ酸配列は、図47に示されている。
【0067】
例として、本発明のcDNAによりコードされる単離されたエロンガーゼは、GLAをDGLAへ、又はSTAを20:4n−3へ、又はAAをADAへ伸長する。次いで、DGLAからのアラキドン酸の生成、又は20:4n−3からのEPAの生成が、Δ5−デサチュラーゼにより触媒される。従って、AA(又はEPA)、DGLA(又は20:4n−3)、ADA(又はω3−ドコサペンタエン酸)は、いずれも、少なくとも一つのエロンガーゼcDNA及びそれらによりコードされる酵素が存在しない場合には合成されえない。
【0068】
本発明は、配列番号1のヌクレオチド(即ち、本明細書に記載されたMAELO cDNAのヌクレオチド配列(図6参照))の少なくとも約50%、好ましくは少なくとも約60%、より好ましくは少なくとも約70%と一致する(即ち、同一性を有する)か、又は相補的な配列を有するヌクレオチド配列(及び対応するコードされるタンパク質)も包含することに注意されたい。さらに、本発明は、配列番号2のヌクレオチド(即ち、本明細書に記載されたGLELO cDNAのヌクレオチド配列(図22参照))の少なくとも約35%、好ましくは少なくとも約45%、より好ましくは少なくとも約55%と一致する(即ち、同一性を有する)か、又は相補的な配列を有するヌクレオチド配列(及び対応するコードされるタンパク質)も含む。さらに、本発明は、配列番号3のヌクレオチド(即ち、本明細書に記載されたヒト配列1(HSELO1)cDNAのヌクレオチド配列(図43参照))の少なくとも約35%、好ましくは少なくとも約45%、より好ましくは少なくとも約55%と一致する(即ち、同一性を有する)か、又は相補的な配列を有するヌクレオチド配列(及び対応するコードされたタンパク質)も含む。さらに、本発明は、配列番号4のヌクレオチド(即ち、本明細書に記載されたC.エレガンスcDNA、CEELO1のヌクレオチド配列(図46参照))の少なくとも約35%、好ましくは少なくとも約45%、より好ましくは少なくとも約55%と一致する(即ち、同一性を有する)か、又は相補的な配列を有するヌクレオチド配列(及び対応するコードされるタンパク質)も含む。そのような配列は、モルチエレラ以外の起源(例えば、真核生物(例えば、トラウストキトリウム種(Thraustochytrium spp.)(例えば、トラウストキトリウム・アウレウム(Thraustochytrium aureum)及びトラウストキトリウム・ロセウム(Thraustochytrium roseum))、シゾキトリウム種(Schizochytrium spp.)(例えば、シゾキトリウム・アグレガツム(Schizochytrium aggregatum))、コニディオボルス種(Conidiobolus spp.)(例えば、コニディオボルス・ナノデス(Conidiobolus nanodes))、エントモルフトラ種(Entomorphthora spp.)(例えば、エントモルフトラ・エキシタリス(Entomorphthora exitalis))、サプロレグニア種(Saprolegnia spp.)(例えば、サプロレグニア・パラシティカ(Saprolegnia parasitica)及びサプロレグニア・ディクリナ(Saprolegnia diclina))、レプトミツス種(Leptomitus spp.)(例えば、レプトミツス・ラクテウス(Leptomitus lacteus))、エントモフトラ種(Entomophthora spp.)、ピチウム種(Pythium spp.)、ポルフィリディウム種(Porphyridium spp.)(例えば、ポルフィリジウム・クルエンツム(Porphyridium cruentum))、コニディオボルス種(Conidiobolus spp.)、フィトフトラ種(Phytophathora spp.)、ペニシリウム種、コイドスポリウム種(Coidosporium spp.)、ムコール種(Mucor spp.)(例えば、ムコール・サーシネロイデス(Mucor circinelloides)及びムコール・ジャバニクス(Mucor javanicus))、フザリウム種(Fusarium spp.)、アスペルギルス種及びロドトルラ種(Rhodotorula spp.))、酵母(例えば、ディポダスコプシス・ユニヌクレアタ(Dipodascopsis uninucleata))、哺乳動物以外の生物、例えばハエ(キイロショウジョウバエ(Drosophila melanogaster))又はセノラブディティス種(例えば、セノラブディティス・エレガンス)、又は哺乳動物(例えば、ヒトもしくはマウス))に由来するものでありうる。そのような配列は、アルピナ種以外のモルチエレラ属に属する種、例えば、モルチエレラ・エロンガタ(Mortierella elongata)、モルチエレラ・エキシグア(Mortierella exigua)、モルチエレラ・イザベリナ(Mortierella isabellina)、モルチエレラ・ヒグロフィラ(Mortierella hygrophila)及びモルチエレラ・ラマニアナ(Mortierella ramanniana)、va.アングリスポラ(va. angulispora)に由来するものであってもよい。さらに、本発明は、本発明のヌクレオチド配列(即ち、配列番号1(MAELO)、配列番号2(GLELO)、配列番号3(HSELO1)及び配列番号4(CEELO1))及びモルチエレラ以外の起源に由来する、前記の相補性又は一致性/同一性を有する配列の断片及び誘導体も包含する。前記配列の機能的等価物(即ち、エロンガーゼ活性を有する配列)も、本発明に包含される。
【0069】
本発明の目的のために「相補性」を2個のDNAセグメント間の関連性の程度と定義する。これは適当な条件下で1個のDNAセグメントのセンス鎖が別のDNAセグメントのアンチセンス鎖とハイブリダイズして2重らせんを形成する能力を測定することにより決定する。2重らせんではアデニンが一方の鎖に現れるともう一方の鎖にはいつもチミンが現れる。同様に一方の鎖にグアニンが現れるともう一方の鎖にはいつもシトシンが現れる。2個のDNAセグメントのヌクレオチド配列間の関連性が大きいほど2個のDNAセグメントの鎖間でハイブリッド2本鎖を形成する能力が大きくなる。
【0070】
2個のヌクレオチド配列間の「同一性」を、2個のDNAセグメントの同一鎖(センスまたはアンチセンスのいずれか)間の同一性、対応性または同等性の程度と定義する。同一性%が大きくなるほど、鎖間の対応性、同一性または同等性が高くなる。
【0071】
2個のアミノ酸配列間の「類似性」を、両方の配列における一連の同等および保存アミノ酸残基の存在と定義する。2個のアミノ酸配列間の類似性の程度が高いほど、2個の配列の対応性、同一性または同等性が高くなる。(2個のアミノ酸配列間の「同一性」を両配列における一連の正確に類似したまたは不変のアミノ酸残基の存在と定義する)
「相補性」、「同一性」および「類似性」の定義は当業者に周知である。
【0072】
本発明はまたポリ不飽和およびモノ不飽和脂肪酸を伸長し、前記タンパク質のアミノ酸配列に対して少なくとも約50%のアミノ酸類似性を有し(例えば図7(MAELO)を参照のこと)、また前記ヌクレオチド配列によりコードされる精製ポリペプチドをも含む。さらに、本発明はポリ不飽和脂肪酸を伸長し、前記のタンパク質のアミノ酸配列に対して少なくとも約30%のアミノ酸類似性を有し(例えば図23(GLELO)を参照のこと)、また前記ヌクレオチド配列によりコードされる精製ポリペプチドをも含む。さらに、本発明はまたポリ不飽和およびモノ不飽和脂肪酸を伸長し、前記のタンパク質のアミノ酸配列に対して少なくとも約30%のアミノ酸類似性を有し(例えば図44(HSELO1)を参照のこと)、また前記ヌクレオチド配列によりコードされる精製ポリペプチドをも含む。また、本発明はポリ不飽和脂肪酸を伸長し、前記のタンパク質のアミノ酸配列に対して少なくとも約30%のアミノ酸類似性を有し(例えば図47(CEELO1)を参照のこと)、また前記ヌクレオチド配列によりコードされる精製ポリペプチドをも含む。
【0073】
本発明はまたPUFAエロンガーゼ活性をコードし、穏やかなストリンジェント条件下で図6に示す配列番号1(MAELO)および/または図22に示す配列番号2(GLELO)および/または図43に示す配列番号3(HSELO1)および/または図46に示す配列番号4(CEELO1)により表されるヌクレオチド配列に対応するまたは相補的であるヌクレオチド配列を有する核酸にハイブリダイズできる単離されたヌクレオチド配列をも包含する。適当な温度およびイオン強度条件下で核酸分子の1本鎖形態が別の核酸分子にアニーリングできる場合、核酸分子は別の核酸分子に「ハイブリダイズできる」(Sambrookら、「Molecular Cloning:A Laboratory Manual」第2版(1989)、コールド・スプリング・ハーバー・ラボラトリー・プレス、コールド・スプリング・ハーバー、ニューヨーク州)。温度およびイオン強度はハイブリダイゼーションの「ストリンジェンシー」により決定する。「ハイブリダイゼーション」には相補的な配列を含有する2個の核酸が必要である。しかしながら、ハイブリダイゼーションの厳密性に応じて塩基間の誤対合を生じ得る。核酸をハイブリダイズするのに適当な厳密性は核酸の長さおよび相補性の程度に依存する。このような変動要因は当業界で周知である。より具体的には、2個のヌクレオチド配列間の類似性または相同性が高くなるほど、これらの配列を有する核酸のハイブリッドのTm(融解温度)値が高くなる。100ヌクレオチド以上の長さのハイブリッドに関しては、Tmを算出するための方程式が誘導されている(前記で引用したSambrookらを参照のこと)。短い核酸でのハイブリダイゼーションに関しては、誤対合の位置がより重要であり、オリゴヌクレオチドの長さがその特異性を決定する(前記で引用したSambrookらを参照のこと)。
【0074】
エロンガーゼ酵素の生成
一度エロンガーゼをコードする遺伝子を単離すると、次いでそれをベクター、プラスミドまたは構築物を使用して原核または真核宿主細胞のいずれかに導入できる。
【0075】
ベクター例えばバクテリオファージ、コスミドまたはプラスミドはエロンガーゼをコード化するヌクレオチド配列および宿主細胞中で機能し、ヌクレオチド配列によりコードされるエロンガーゼの発現を誘導できるいずれかのプロモーターを含むことができる。プロモーターはヌクレオチド配列と関連して機能できるかまたはヌクレオチド配列と機能的に連結できる。(プロモーターがコーディング配列の転写または発現に影響する場合、プロモーターはコーディング配列と「機能的に連結している」と言える。)適当なプロモーターには例えばアルコールデヒドロゲナーゼ、グリセロアルデヒド−3−ホスフェート・デヒドロゲナーゼ、ホスフォグルコイソメラーゼ、ホスフォグリセレートキナーゼ、酸ホスファターゼ、T7、TP1、ラクターゼ、メタロチオネイン、サイトメガロウィルス前初期、乳清酸性タンパク質、グルコアミラーゼ、およびガラクトースの存在下で活性化されるプロモーター、例えばGAL1およびGAL10などがある。さらに、その他のタンパク質、オリゴ糖、脂質等をコードするヌクレオチド配列もまたベクターおよびポリアデニル化シグナル(例えばSV−40T抗原、卵アルブミンまたはウシ成長ホルモンのポリAシグナル)のようなその他の制御配列に含まれ得る。構築物に存在する配列の選択は望ましい発現生成物および宿主細胞の特性に依存する。
【0076】
前記するように、一度ベクターを構築すると、次いで当業者に周知の方法、例えばトランスフェクション、形質転換およびエレクトロポレーション(Sambrookら、「Molecular Cloning:A Laboratory Manual」第2版(1989)1ないし3巻、コールド・スプリング・ハーバー・ラボラトリー・プレスを参照のこと)により、これを選択した宿主細胞に導入できる。次いでPUFAの発現を可能にする適当な条件下で宿主細胞を培養し、次いで回収し、精製する。
【0077】
2個またはそれ以上のcDNAのヌクレオチド配列を含んでなる一つの構築物またはベクターを用いる場合、独特のトリグリセリドまたはオイルを設計できることにも留意すべきである(例えばMAELO、GLELO、HSELO1および/またはCEELO1)。次いでこのベクターを1個の宿主細胞に導入できる。別法として、各々の配列を別個のベクターに導入できる。次いでこれらのベクターを各々2個の宿主細胞に、または1個の宿主細胞に導入できる。
【0078】
適当な原核細胞宿主の例としては、例えば大腸菌(Escherichia coli)、枯草菌(Bacillus subtilis)のような細菌、およびスピルリナ(Spirulina)種(すなわち青緑藻)のようなシアノバクテリアなどが挙げられる。適当な真核細胞宿主の例としては、例えば哺乳動物細胞、植物細胞、酵母細胞、例えばサッカロミセス(Saccharomyces)種、リポミセス(Lipomyces)種、カンジダ(Candida)種例えばヤロウィア(Yarrowia)(カンジダ)種、クルイベロミセス(Kluyveromyces)種、ピチア(Pichi)種、トリコデルマ(Trichoderma)種もしくはハンセヌラ(Hansenula)種、または糸状菌細胞のような真菌細胞、例えばアスペルギルス(Aspergillus)、ニューロスポラ(Neurospora)およびペニシリウム(Penicillium)などが挙げられる。好ましくはビール酵母菌(Saccharomyces cerevisiae)(パン酵母)細胞を用いる。
【0079】
宿主細胞における発現は一過性のまたは安定した方法で行うことができる。一過性の発現は宿主細胞で機能する発現シグナルを含有する導入構築物から生じることができるが、この構築物は複製せず、宿主細胞に組み込まれることはまれであるか、または宿主細胞は増殖性でない。一過性の発現はまた目的の遺伝子に機能的に連結した制御可能なプロモーターの活性を誘導することにより達成することもできるが、このような誘導システムでは発現レベルの基底値がたびたび低くなる。安定した発現は宿主ゲノムに組み込むことができるかまたは宿主細胞において自発的に複製される構築物の導入により達成できる。発現構築物に位置するかまたは発現構築物でトランスフェクトされた選別可能なマーカーを使用し、続いてマーカーを発現する細胞を選別することにより、目的の遺伝子の安定発現を選択することができる。組み込みにより安定発現が得られた場合、構築物の組み込み部位を宿主ゲノム内に無作為に生じることができるか、または宿主座との組換えを標的化するのに十分な宿主ゲノムとの相同性領域を含有する構築物を使用することにより構築物の組み込み部位を標的化できる。構築物が内在性の座を標的にする場合、転写または翻訳制御領域の全てまたは一部が内在性の座により提供できる。
【0080】
前記のヌクレオチド配列の一つまたは両方によりコードされる目的の酵素(すなわちエロンガーゼ)を発現するために、トランスジェニックマウスをも用いることができる。より具体的には、一度前記の構築物を作ると、これを胚の前核に挿入できる。次いで胚を受体の雌に移植できる。別法として、核の移送法をも利用できる(Schniekeら、Science、278:2130−2133(1997))。次いで妊娠および出産してもよい(例えば米国特許第5750176号、米国特許第5700671号を参照のこと)。次いで子孫の乳、組織またはその他の体液サンプルは非トランスジェニック動物に通常見出されるレベルに比較して変化したレベルのPUFAを含有するはずである。レベルが変化したまたは増加したPUFA生成、およびエロンガーゼ酵素をコードする一つのまたは複数の遺伝子のゲノムへの組み込みに関して次世代をモニター観察できる。宿主として利用される哺乳動物は例えばマウス、ラット、ウサギ、ブタ、ヤギ、ヒツジ、ウマおよびウシからなる群から選択できる。しかしながら、目的の酵素をコードするDNAをゲノムに組み込む能力を有すればいずれの哺乳動物を用いてもよい。
【0081】
エロンガーゼポリペプチドを発現するために、機能的な転写および翻訳開始および終止領域をエロンガーゼポリペプチドをコードするDNAに機能できるように結合する。転写および翻訳開始および終止領域を、発現すべきDNAを含む種々の非排他的供給源、望ましい系において発現可能であると知られているかもしくは考えられている遺伝子、発現ベクター、化学合成から、または宿主細胞の内在性の座から誘導する。植物組織および/または植物の部分における発現はとりわけ組織または部分が種子、葉、果実、花、根等のような初期に収穫されたものである場合、特定の有効性を呈する。特異的な制御配列例えば米国特許第5463174号、4943674号、51066739号、5175095号、5420034号、5188958号および5589379号の配列を利用することにより発現を植物のその位置に標的化できる。また別に、発現したタンパク質は、直接かまたはさらに修飾して宿主植物からの液体分画に混合することができる生成物を生成する酵素でよい。一つのまたは複数のエロンガーゼ遺伝子の発現、またはアンチセンスエロンガーゼ転写物は植物部分および/または植物組織に見出される特異的PUFAまたはその誘導体のレベルを変化させることができる。望ましいPUFAを高い比率で含有するか、またはPUFA組成物がヒト母乳によりよく類似している組織および/または植物部分を作るために、エロンガーゼコーディング領域を単独でまたはその他の遺伝子をと共に発現できる(Prietoら、PCT公開WO95/24494)。開始領域が得られる遺伝子の3’領域から、または異なる遺伝子から終止領域を誘導できる。多くの終止領域が周知であり、同一および異なる属および種の種々の宿主において満足できるものであることが解っている。終止領域は通常いずれかの特別な特性のためというよりむしろ利便性から選択する。
【0082】
前記したように植物(例えばグリシン・マックス(Glycine max)(大豆)またはブラシカ・ナプス(Brassica napus)カノーラ))、植物組織、トウモロコシ、ジャガイモ、ヒマワリ、紅花または麻を各々エロンガーゼ酵素発現のための宿主または宿主細胞として用いることもでき、またポリ不飽和脂肪酸の生成に利用することができる。より具体的には、望ましいPUFAを種子に発現できる。種子油の単離方法は当業界で周知である。このように、PUFA供給源の提供に加え、エロンガーゼ遺伝子および恐らくデサチュラーゼ遺伝子の発現により種子油成分を操作して栄養組成物、薬学的組成物、動物飼料および化粧品に加えることができる種子油を提供できる。再度、一時的にエロンガーゼ遺伝子が十分に発現できる条件下で、機能的にプロモータに結合したエロンガーゼをコードするDNA配列を含んでなるベクターを植物組織または植物に導入する。ベクターは別の酵素例えばΔ4−デサチュラーゼ、Δ5−デサチュラーゼ、Δ6−デサチュラーゼ、Δ8−デサチュラーゼ、Δ9−デサチュラーゼ、Δ10−デサチュラーゼ、Δ12−デサチュラーゼ、Δ13−デサチュラーゼ、Δ15−デサチュラーゼ、Δ17−デサチュラーゼおよび/またはΔ19−デサチュラーゼをコードする1個またはそれ以上の遺伝子をも含んでなってよい。植物組織または植物は酵素が作用する関連基質(例えばDGLA、GLA、STA、AA、ADA、EPA、20:4n−3、等)を生成できるか、またはこのような基質を生成する酵素をコードするベクターを植物組織、植物細胞、植物、または目的の宿主細胞に導入できる。加えて、適当な酵素を発現する植物組織に基質をスプレーできる。これらの種々の技術を用いることにより、植物細胞、植物組織、植物または目的の宿主細胞を用いてPUFA(例えばDGLA、AAもしくはADAのようなn−6不飽和脂肪酸、またはEPA、もしくはDHAのようなn−3脂肪酸)を生成できる。本発明はまた前記したベクターを含んでなるトランスジェニック植物をも包含し、この場合ベクターのヌクレオチド配列の発現の結果、例えばトランスジェニック植物の種子にポリ不飽和脂肪酸を生成することにも注目すべきである。
【0083】
天然かまたはトランスジェニックのいずれかにより宿主細胞が生成できる基質、および続いて宿主細胞に導入されるベクターに存在するDNA配列によりコードされ得る酵素を図1に示す。
【0084】
前記を鑑み、本発明はまた1)エロンガーゼcDNAの望ましいヌクレオチド配列を単離する工程;2)該ヌクレオチド配列を含んでなるベクターを構築する工程;および3)エロンガーゼ酵素を生成するのに十分な時間および条件下で該ベクターを宿主細胞に導入する工程;からなる前記のエロンガーゼ酵素の一つを生成する方法をも包含する。
【0085】
本発明はまたエロンガーゼが酸をポリ不飽和脂肪酸に変換するように酸を前記のように生成したエロンガーゼに曝露することからなるポリ不飽和脂肪酸の生成方法をも包含する。例えばGLAをエロンガーゼに曝露するとGLAはDGLAに変換される。次いでDGLAをΔ5−デサチュラーゼに曝露すると、これはDGLAをAAに変換する。次いでΔ17−デサチュラーゼを用いてAAをEPAに変換でき、またエロンガーゼおよびΔ4−デサチュラーゼを用いてDHAに変換できる。別法として、エロンガーゼを用いて18:4n−3を20:4n−3に変換し、これをΔ5−デサチュラーゼに曝露してEPAに変換できる。またエロンガーゼを用いて18:3n−3を20:3n−3に変換し、これをまたΔ8−デサチュラーゼにより20:4n−3に変換できる。このようにエロンガーゼをポリ不飽和脂肪酸の生成に用いることができ、またこれを特定の有益な目的のために使用することができる。(いくつかの生合成経路でエロンガーゼが果たす多くの重要な役割の説明に関して図1を参照のこと。)
エロンガーゼ遺伝子およびそれによりコードされる酵素の使用
前記するように単離されたエロンガーゼcDNAおよびそれによりコードされる対応するエロンガーゼ酵素(または精製ポリペプチド)には多くの用途がある。例えば各々のcDNAおよび対応する酵素をポリ不飽和脂肪酸、例えばDGLA、AA、ADA、20:4n−3またはEPAの生成において間接的または直接的に使用できる。(「直接的」とは酵素が直接的に酸を別の酸に変換する状況を包含することを意味し、後者の酸は組成物において利用される(例えばGLAのDGLAへの変換)。)「間接的」とはエロンガーゼにより脂肪酸を別の脂肪酸(すなわち経路中間体)に(例えばGLAをDGLAに)変換する状況を包含することを意味し、次いでエロンガーゼ以外の酵素を用いて後者の脂肪酸を別の脂肪酸に(例えばΔ5−デサチュラーゼによりDGLAをAAに)変換する。これらのポリ不飽和脂肪酸(すなわちエロンガーゼ酵素の活性により直接的または間接的のいずれかにより生成されたもの)を例えば栄養組成物、薬学的組成物、化粧品および動物用飼料に添加することができ、これらはすべて本発明に包含される。これらの用途に関しては以下に詳細に記載する。
【0086】
栄養組成物
本発明は栄養組成物を包含する。本発明の目的のためのこのような組成物には経腸または非経口摂取を含むヒト摂取用のいずれかの食物または調製物が含まれ、これは体内に取り込まれると(a)栄養を与える、もしくは組織を作り上げる、もしくはエネルギーを供給するおよび/または(b)十分な栄養状態もしくは代謝機能を維持、回復もしくは補助する。
【0087】
本発明の栄養組成物は各々のエロンガーゼ遺伝子を用いて生成した少なくとも一つのエロンガーゼ酵素を用いて生成し、固体または液体のいずれかの形態でよい少なくとも一つの油または酸を含んでなる。加えて、組成物は特定の用途に望ましい量の食用多量要素、ビタミンおよびミネラルを含んでよい。このような成分の量は、組成物を正常で健康な幼児、子供に使用することを意図しているのか、それとも特定の代謝状態を伴う成人のような特別な必要性を有する(すなわち代謝障害)成人に使用することを意図しているのかに依存して変動する。
【0088】
組成物に加えることができる多量要素の例としては食用脂肪、炭水化物およびタンパク質などがあるが、これらに限定するものではない。このような食用脂肪の例としてはココナッツ油、大豆油並びにモノおよびジグリセリドなどが挙げられるが、これらに限定するものではない。このような炭水化物の例としてはグルコース、食用乳糖および加水分解デンプンなどが挙げられるが、これらに限定するものではない。加えて、本発明の栄養組成物において用いることができるタンパク質の例としては大豆タンパク質、電気透析乳清、電気透析スキムミルク、乳清、またはこれらのタンパク質の加水分解物などが挙げられるが、これらに限定するものではない。
【0089】
ビタミンおよびミネラルに関しては、以下のものを本発明の栄養組成物に添加してよい:カルシウム、リン、カリウム、ナトリウム、塩化物、マグネシウム、マンガン、鉄、銅、亜鉛、セレニウム、ヨウ素並びにビタミンA、E、D、CおよびB複合体。その他のこのようなビタミンおよびミネラルを添加してもよい。
【0090】
本発明の栄養組成物に用いられる成分は供給源を半精製または精製したものである。半精製または精製したとは天然物の精製により、または合成により調製された物質を意味する。
【0091】
本発明の栄養組成物の例としては幼児調合物、栄養補助食品、食品代用物、および再水和組成物などが挙げられるが、これらに限定するものではない。特定の目的の栄養組成物には、幼児用の経腸または非経口補助食品、幼児専用調合物、高齢者用の補助食品、並びに胃腸障害および/または吸収不良を有する者の補助食品に利用するものなどが挙げられるが、これらに限定するものではない。
【0092】
本発明の栄養組成物はまた食事に補充する必要がない場合でも食物に添加してよい。例えば、マーガリン、調製バター、チーズ、ミルク、ヨーグルト、チョコレート、キャンディー、スナック類、サラダ油、調理用油、調理用脂肪、肉、魚および飲料などのいかなる型の食品に添加してもよいが、これらに限定するものではない。
【0093】
本発明の好ましい実施態様では、栄養組成物は経腸栄養剤であり、より好ましくは成人または小児科用の経腸栄養剤である。ストレスを経験しているかまたは慢性もしくは急性の疾病状態のために特に必要性のある成人または子供にこの組成物を投与できる。組成物は本発明に従って生成したポリ不飽和脂肪酸に加えて、前記するような多量要素、ビタミンおよびミネラルを含んでなってよい。多量要素は人乳に存在するのと等価の量で、またはエネルギーを基準にして、すなわちカロリー当たりを基準にして存在してよい。
【0094】
液体または固体経腸または非経口栄養剤を処方する方法は当業界で周知である。(以下の実施例も参照のこと。)
例えば経腸処方を滅菌し、次いでそのまま供給できるよう(ready−to−feed:RTF用)にするかまたは濃縮液体もしくは粉末として保存する。粉末は前記するように調製した処方をスプレー乾燥して調製でき、濃縮物を再水和することにより再構成する。成人および小児科栄養調合物は当業界で周知であり、市販により入手できる(例えば、ロス・プロダクツ・ディビジョン、アボット・ラボラトリーズ、コロンバス、オハイオ州のSimilac(登録商標)、Ensure(登録商標)、Jevity(登録商標)、およびAlimentum(登録商標))。本発明に従って製造される油または脂肪酸をこれらの処方のいずれかに添加してよい。
【0095】
本発明の栄養組成物のエネルギー密度は、液体の形態では約0.6kcalから約3kcal/mlの範囲でよい。固体または粉末の形態では栄養補助食品は約1.2から9kcal/g以上、好ましくは約3ないし7kcal/gを含んでよい。一般に、液体製品のオスモル濃度は700ミリオスモル以下、より好ましくは660ミリオスモル以下にすべきである。
【0096】
栄養剤は前記するように本発明に従って製造したPUFAに加えて、多量要素、ビタミンおよびミネラルを含んでよい。これらの付加的な成分が存在することにより個体がこれらの要素の1日最低必要量を摂取するのを助ける。PUFAの供給に加えて亜鉛、銅、葉酸および抗酸化剤を組成物に添加するのも望ましい。これらの物質はストレスをうけた免疫系を高め、それにより組成物を摂取している個体がさらなる利益を享受することになると考えられる。薬学的組成物もまたこれらの要素を補給しうる。
【0097】
より好ましい実施態様では、栄養組成物は、抗酸化剤および少なくとも一つのPUFAに加えて、少なくとも炭水化物の5重量%が消化しにくいオリゴ糖である炭水化物供給源を含んでなる。より好ましい実施態様では栄養組成物はさらにタンパク質、タウリンおよびカルニチンを含んでなる。
【0098】
前記するように、静脈内投与を行っている患者用に、または栄養失調もしくはその他の症状もしくは疾病状態の予防もしくは治療のために、本発明に従って製造したPUFAまたはその誘導体を食品代用物または栄養補助食品、とりわけ幼児調合物に添加してよい。背景としてヒトの母乳は約0.15%から約0.36%のDHA、約0.03%から約0.13%のEPA。約0.30%から約0.88%のAA、約0.22%から約0.67%のDGLA、および約0.27%から約1.04%のGLAからなる脂肪酸プロフィールを有することに留意すべきである。従って、本発明に従って製造したDGLA、AA、EPAおよび/またはデコサヘキサエノン酸(DHA)のような脂肪酸を用いて例えばヒトの母乳のPUFA含量をよりよく模写するために幼児調合物の組成を変化させるか、またはヒト以外の哺乳動物の乳に通常見出されるPUFAの存在を変化させることができる。とりわけ薬理学的に、または栄養補助食品、特に母乳代用品もしくは補助食品において使用するための組成物は一つまたはそれ以上のAA、DGLAおよびGLAを含んでなるのが好ましい。より好ましくは、油ブレンドは約0.3から30%のAA、約0.2から30%のDGLA、および/または約0.2から約30%のGLAからなる。
【0099】
非経口用栄養組成物はトリグリセリドとして算出した脂肪酸を約2から約30重量%含んでなり、これは本発明に包含される。好ましい組成物ではGLAとして全PUFA組成物の約1から約25重量%含まれる(米国特許第5196198号)。その他のビタミン、とりわけビタミンA、D、EおよびL−カルニチンのような脂溶性ビタミンを含んでもよい。望む場合、アルファ・トコフェロールのような保存剤を約0.1重量%の量で加えてもよい。
【0100】
加えて、AA、DGLAおよびGLAの比率は特定の最終使用目的に適合させることができる。母乳補助食品または代用品として処方する場合、一つまたはそれ以上のAA、DGLAおよびGLAを含んでなる組成物が各々約1:19:30から約6:1:0.2の比率で提供される。例えば、動物の乳はAA:DGLA:GLAの比率が1:19:30から6:1:0.2の範囲で変動し、好ましくは約1:1:1、1:2:1、1:1:4の中間的な比率も含まれる。宿主細胞において一緒に製造した場合、GLAおよびDGLAのような前駆体基質のAAへの変換率および%を調整してPUFAの比率を正確に調節できる。例えばDGLAのAAへの変換率を5%から10%にしてAAのDGLAに対する比率を約1:19にでき、一方変換率を約75%から80%にしてAAのDGLAに対する比率を約6:1にできる。このように、細胞培養系においても宿主動物においても、エロンガーゼ発現およびその他のデサチュラーゼ発現の時期、程度および特異性を制御してPUFAレベルおよび比率を調節できる。次いで本発明に従って製造したPUFA/酸(例えばAAおよびDGLA)を望ましい濃度および比率で別のPUFA/酸(例えばGLA)と組み合わせてよい。
【0101】
加えて、本発明に従って製造したPUFAまたはそれらを含有する宿主細胞を動物用補助食品として用いて動物の組織または乳脂肪酸組成をヒトまたは動物の摂取により望ましいものに変化させることもできる。
【0102】
薬学的組成物
本発明はまた本明細書に記載した方法に従って、少なくとも一つのエロンガーゼcDNA(すなわちMAELO、GLELO、HSELO1またはCEELO)を用いて製造した一つまたはそれ以上の脂肪酸および/または得られた油を含んでなる薬学的組成物をも包含する。より具体的にはこのような薬学的組成物は一つまたはそれ以上の酸および/または油、ならびに標準的で周知の無毒性の医薬的に許容される担体、アジュバントまたはベヒクル例えばリン酸緩衝生理食塩水、水、エタノール、ポリオール、植物油、湿潤剤または水/油エマルションのようなエマルションを含んでなってよい。組成物は液体または固体の形態でよい。例えば、組成物を錠剤、カプセル、摂取可能な液体または粉末、注射可能なまたは局所用軟膏またはクリームの形態でよい。例えば分散液の場合、必要な粒子径を維持することにより、および界面活性剤を使用することにより適当な流動性を維持できる。等張化剤、例えば糖、塩化ナトリウム等を含有するのも望ましい。このような不活性希釈剤に加え、組成物はまたアジュバント、例えば湿潤化剤、乳化および懸濁化剤、甘味剤、香味剤並びに芳香剤をも含有できる。
【0103】
懸濁液は活性化合物に加えて例えばエトキシル化イソステアリルアルコール、ポリオキシエチレンソルビトールおよびソルビタンエステル、微結晶性セルロース、アルミニウムメタヒドロキシド、ベントナイト、寒天およびトラガカントまたはこれらの基質の混合物を含んでなってよい。
【0104】
錠剤およびカプセルのような固体投与形態は当業界で周知の技術を用いて調製できる。例えば、本発明に従って製造されたPUFAをラクトース、スクロース、およびコーンスターチのような慣用される錠剤基剤をアカシア、コーンスターチまたはゼラチンのような結合剤、ジャガイモデンプンまたはアルギン酸のような崩壊剤、およびステアリン酸またはステアリン酸マグネシウムのような潤滑剤と組み合わせて錠剤化できる。これらの賦形剤を抗酸化剤および適当なPUFAと共にゼラチンカプセルに組み入れてカプセルを調製できる。抗酸化剤およびPUFA成分は前記したガイドラインに適合しなければいけない。
【0105】
静脈内投与用には本発明に従って製造したPUFAまたはその誘導体をIntralipids(登録商標)のような市販の処方に組み入れてよい。典型的な正常の成人血漿脂肪酸プロフィールは6.64から9.46%のAA、1.45から3.11%のDGLAおよび0.02から0.08%のGLAからなる。患者の正常な脂肪酸プロファイルを達成するために、これらのPUFAまたはその代謝前駆体を単独でまたはその他のPUFAと組み合わせて、投与できる。望む場合、処方の各々の成分を別個に、キットの形態で1回または多数回投与用に提供できる。特定の脂肪酸の典型的な投与量は1日0.1mgから20g(100gまで)、好ましくは1日10mgから1、2、5または10gである。
【0106】
本発明の薬学的組成物の可能な投与経路には例えば経腸(例えば経口および直腸経路)および非経口経路等がある。例えば、液体調製物を例えば経口または直腸経路で投与できる。加えて、均質な混合物を水に完全に分散し、滅菌条件下で生理学的に許容される希釈剤、保存剤、緩衝液またはプロペラントと混合してスプレーまたは吸入剤を形成できる。
【0107】
投与経路はもちろん望まれる効果に依存する。例えば、組成物を荒れて乾燥した、または加齢皮膚の処置または外傷のあるまたは火傷した皮膚の処置、または疾病もしくは症状の影響を受けた皮膚もしくは髪の処置に用いる場合、恐らく局所的に適用できる。
【0108】
患者に投与すべき組成物の用量は当業者により決定でき、患者の体重、患者の年齢、患者の免疫状態等に依存する。
【0109】
形態に関しては、組成物を例えば溶液、分散液、懸濁液、エマルションまたは次いで再構築するための滅菌粉末にできる。
【0110】
本発明はまた本明細書に記載した薬学的および/または栄養組成物を用いた種々障害の処置をも包含する。とりわけ、本発明の組成物を用いて血管形成後の再狭窄を処置することができる。さらに、本発明の組成物を用いて炎症、リウマチ性関節炎、喘息および乾癬の症状を処置することもできる。PUFAがカルシウム代謝に関与し得ることも実証されており;従って、本発明の組成物を恐らく骨粗鬆症および腎臓または尿路結石の処置または予防に利用することができる。
【0111】
加えて、本発明の組成物を癌の処置にも用いることができる。悪性細胞が脂肪酸組成を変化させていることが明らかになっている。脂肪酸の添加がその成長を遅延させ、細胞死を招き、化学療法剤の感受性を高めることが示されている。さらに本発明の組成物はまた癌に関連する悪液質の処置にも有益である。
【0112】
本発明の組成物を用いて糖尿病を処置することもできる(米国特許第4826877号およびHorrobinら、Am.J.Clin.Nutr.57(補):732S−737Sを参照のこと)。糖尿病の動物では脂肪酸代謝および組成が変化していることが明らかにされている。
【0113】
さらに、エロンガーゼ酵素を使用して直接的かまたは間接的のいずれかにより製造したPUFAを含んでなる本発明の組成物を、湿疹の処置、血圧低下および数学的な試験スコアの改善にも用いることができる。加えて、本発明の組成物を血小板凝集の阻止、血管拡張の誘発、コレステロール値の低下、血管壁平滑筋および繊維組織の増殖の阻止(Brennerら、Adv.Exp.Med.Biol.83:85−101(1976))、消化管出血およびその他の非ステロイド性抗炎症薬の副作用の低減または予防(米国特許第4666701号)、子宮内膜症および月経前症候群の予防または処置(米国特許第4758592号)、並びに筋肉脊髄炎およびウイルス感染後の慢性疲労の処置(米国特許第5116871号)に用いることができる。
【0114】
さらに本発明の組成物の用途にはAIDS、多発性硬化症および炎症性皮膚障害の処置、並びに一般的な健康状態の保持における使用も含まれる。
【0115】
加えて、本発明の組成物を化粧用の目的に利用することもできる。これを、混合物を形成するように既存の化粧用組成物に加えるか、または単独の組成物として用いることができる。
【0116】
獣医学的適用
前記の薬学的および栄養組成物をヒトと同様に動物(すなわち家畜または家畜以外の動物)に関連して利用できることも注目すべきである。動物はヒトと同じ必要性および状況を多く経験するからである。例えば、本発明の油または酸を動物用栄養補助食餌、動物用食餌代用品、動物用ビタミンに、または動物用局所用軟膏に利用することができる。
【0117】
本発明を以下の実施例を用いて説明するが、これらは本発明を限定するものではない。
【0118】
実施例1
モルチエレラ・アルピナ(Mortierella alpina)で用いるコドンの決定
1000のランダムcDNAクローンの5’末端をモルチエレラ・アルピナ(Mortierella alpina)cDNAライブラリーからシークエンシングした。配列をファストAアルゴリズムを用いるGCG(ジェネティックス・コンピューター・グループ(マジソン、ウィスコンシン州))を用いて6個の読み枠で翻訳し(PearsonおよびLipman、Proc.Natl.Acad.Sci.USA、85:2444−2448(1988))、クエリー配列と同型の配列群(核酸またはタンパク質)の類似性を、とりわけスイスポート・データベース(ジェネバイオ、ジュネーブ、スイス)を用いて調べた。既知遺伝子に対するタンパク質配列相同性に基づいて多くのクローンを推定ハウスキーピング遺伝子として同定した。データベースの既知ハウスキーピング遺伝子に適合する21個のM.アルピナ(M.alpina)cDNA配列を選別した(以下の表1を参照のこと)。これらの21個の配列およびM.アルピナΔ5−(図18を参照のこと)、Δ6−およびΔ12−デサチュラーゼ配列全長に基づいてM.アルピナコドンバイアスの表(表2を参照のこと)を作った。M.アルピナcDNA配列によってコードされる推定タンパク質および既知タンパク質配列間のファストA整列化がいくつかの区域で弱いので、相同性の強い区域のコドンのみを用いた。
【0119】
【表1】

【0120】
【表2】

【0121】
実施例II
M.アルピナのエロンガーゼ様cDNA全長のクローニング
ホホバ由来のβ−ケトアシル補酵素Aシンターゼ(KCS)およびビール酵母菌(Saccharomyces cerevisiae)エロンガーゼ(ELO2)を並べてアミノ酸相同性の区域を決定した(図2を参照のこと)。コドンバイアスを二つのエロンガーゼ間の相同性アミノ酸に対応する配列の区域に適用し、この配列の偏りに基づいてプライマーを設計した(図3を参照のこと)。M11M.アルピナcDNAライブラリーから挿入物の大きさの平均が1.1キロ塩基対である約6x105のクローンを含むcDNAを切除した(Knutzonら、J.Biol.Chem.273:29360−29366(1998))。内在プライマーRO339(5’−TTG GAG AGG AGG AAG CGA CCA CCG AAG ATG ATG−3’)およびベクター順行プライマーRO317(5’−CAC ACA GGA AAC AGC TAT GAC CAT GAT TAC G−3’)を用いて切除したcDNAを増幅した。切除したM.アルピナcDNAライブラリー300ng、各プライマー50ピコモル、10倍バッファー10μl、10mM PCRヌクレオチド・ミックス(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)、およびTaqポリメラーゼ1.0ユニット;を含有する100μlの容量でポリメラーゼ連鎖反応(PCR)を実施した。パーキン・エルマー9600(ノーウォーク、コネチカット州)の熱循環器条件は以下のとおりである:94℃で2分間、次いで94℃で1分間を30サイクル、58℃で2分間、および72℃で3分間。続いて72℃で2分間さらにPCRを延長した。
【0122】
PCR増幅生成物をゲルに流し、約360塩基対の増幅フラグメントのゲルを精製し、ABI 373ADNAシークエンサー(パーキン・エルマー、フォスター・シティー、カリフォルニア州)を用いて単離したフラグメントを直接的にシークエンシングした。GCGの配列分析パッケージを用いて得られた配列を既知配列と比較した。ファストAアルゴリズムを用いるGCG分析プログラムで、6個の読み枠全てで配列を翻訳した(PearsonおよびLipman、前記で引用)。タンパク質のスイスポートデータベース(ジェネバイオ、ジュネーブ、スイス)を検索した。ビール酵母菌ELO2(GNS1)に対する推定タンパク質配列の相同性に基づき、この翻訳したcDNAフラグメントを推定エロンガーゼの一部であると同定し、これは63個のアミノ酸において41.3%の同一性を有した。
【0123】
推定エロンガーゼ配列およびM.アルピナcDNAライブラリーの構築に使用したベクター、pZL1(ライフ・テクノロジーズ・インコーポレーティッド、ガイザースブルグ、メリーランド州)配列に基づいて新規プライマーを設計した。前記した条件を用いて、BamHI制限部位を加えた(下線)プライマーRO350(5’−CAT CTC ATG GAT CCG CCA TGG CCG CCG CAA TCT TG−3’)、およびベクター逆行プライマーRO352(5’−ACG CGT ACG TAA AGC TTG−3’)を使用してM.アルピナ切除したcDNAライブラリーを再度PCR増幅し、M.アルピナエロンガーゼcDNAの全長を単離した。約1.5キロ塩基対のPCR増幅フラグメントの末端をT4 DNAポリメラーゼ(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)で埋め、ブラント末端を作り、pCR−ブラントベクター(インビトロゲン・コーポレーション、カールスバッド。カリフォルニア州)にクローン化した。これにより2個のクローン、pRAE−1およびpRAE−2を得た(図4Aを参照のこと)。(ブダペスト条約の条件下、1998年8月28日、プラスミドDNA pRAE−2をアメリカン・タイプ・カルチャー・コレクション、10801ボウルバード大学、マナサス、バージニア州20110−2209に寄託し、寄託番号:ATCC 203166が付与された。)これらのベクターからのエロンガーゼcDNAをEcoRIフレグメントとして切断し、EcoRI消化pYX242(ノバゲン、マジソン、カリフォルニア州)ベクターにクローン化した。pRAE−5およびpRAE−6クローン(図4Bを参照のこと)は各々pRAE−1およびpRAE−2に由来するエロンガーゼcDNAを有する。(ブダペスト条約の条件下、1998年8月28日、プラスミドDNA pRAE−5をアメリカン・タイプ・カルチャー・コレクション、10801ボウルバード大学、マナサス、バージニア州20110−2209に寄託し、寄託番号:ATCC 203167が付与された。)pRAE−5およびpRAE−6のシークエンシングによりpRAE−5のエロンガーゼ遺伝子の5’未翻訳領域は16塩基対であり、pRAE−6のエロンガーゼ遺伝子よりも短い(図5を参照のこと)。完全なM.アルピナエロンガーゼcDNA配列はMAELOと称し、pRAE−2より得られた(図6を参照のこと)。図7はMAELOの翻訳により得られたアミノ酸である。前記したように翻訳MAELOでスイスポートデータベースを再度検索した:MAELOはビール酵母菌GNS1(ELO2)と317個のアミノ酸において44.3%の同一性を有し、ビール酵母菌SUR4(ELO3)と318個のアミノ酸において44.7%の同一性を有する。3個のエロンガーゼ間のファストA整列化を図8に示す。ヌクレオチドレベルでは(図9を参照のこと)、MAELOビール酵母菌GNS1(ELO2)と549塩基対の重複において57.4%の同一性を有する。しかしながら、954塩基対の完全MAELO遺伝子およびビール酵母菌GNS1(ELO2)間の同一性は33.0%である。
【0124】
実施例III
パン酵母におけるM.アルピナエロンガーゼcDNAの発現
pRAE−5およびpRAE−6構築物をビール酵母菌334に形質転換し(Hovelandら、Gene、83:57−64(1989))、エロンガーゼ活性についてスクリーニングした。pYES2ベクター(インビトロゲン・コーポレーション、カールスバッド、カリフォルニア州)のホホバKCS遺伝子を含有するプラスミドpCGN7875(カルジーン、エルエルシー、デービス、カリフォルニア州)を陽性対照として用いた。M.アルピナエロンガーゼ(MAELO)におけるエロンガーゼ活性を検出するために用いた基質はGLAであり、ホホバKCSの基質はオレイン酸(OA)であった。陰性対照株はpYX242ベクターを含有するビール酵母菌334であった。選択培地(Ausubelら、Short Protocols in Molecular Biology、13章:3−5(1992))中、特定の基質を存在させて培養物を25℃で40ないし48時間成長させた。pYES2にクローン化したホホバKCS遺伝子の発現はGAL1プロモーターの調節下にあり、一方pYX242のプロモーターはTP1であり、これは構成要素である。従って、334(pCGN7875)および334(pYES2)培養物はガラクトースにより誘導される。各細胞ペレットの脂質分画のGC−FAME分析は前記するように実施した(Knutzonら、前記で引用)。
【0125】
異なる実験により得られたエロンガーゼ活性を図10Aおよび10Bで提供する。ホホバKCSはモノ不飽和脂肪酸18:1n−9長鎖を20:1n−9に伸長する。M.アルピナエロンガーゼ(MAELO)並びにビール酵母菌ELO2およびELO3間のアミノ酸相同性により、これらの遺伝子によりコードされたタンパク質は類似の基質特異性を有することが示唆された。M.アルピナエロンガーゼの活性、モノ不飽和脂肪酸および飽和脂肪酸長鎖の伸長(MAELO)は18:1n−9の20:1n−9への変換、また24:0の合成においても認められる。調節株、334(pYX242)では20:1および24:0の量は非常に少ししか、または全く検出されなかった(図10Aを参照のこと)。M.アルピナエロンガーゼ(MAELO)はまた少なくとも一つのPUFAに作用し、18:3n−6(GLA)を20:3n−6(DGLA)に変換する。全脂質における20:3n−6のパーセンテージは、対照334(pYX242)と比較した場合、M.アルピナエロンガーゼ(MAELO)cDNAを有する334(pRAE−5)および334(pRAE−6)において高い。製造した20:3n−6のパーセンテージは334(pYX242)で0.092%であり、対して334(pRAE−5)では0.324%であり、334(pRAE−6)で0.269%であった(図10Aおよび10Bの括弧に示す)。脂肪酸プロフィールにおけるこの差異はまた生成した20:3n−6の全量にも認められる。334(pYX242)により20:3n−6が0.226μgしか生成されなかったが、一方334(pRAE−5)および334(pRAE−6)では各々20:3n−6が2.504μg、および20:3n−6が1.006μg生成された。また、基質を加えない場合、20:3n−6のレベルは検出されなかった。
【0126】
一旦M.アルピナエロンガーゼ(MAELO)により20:3n−6を生じると、Δ5−デサチュラーゼは望ましい発現系においてそれをAAに変換できる。この仮説を試験するために、pRAE−5およびpRAE−4構築物(プラスミドを含有するΔ5−デサチュラーゼ)をビール酵母菌334に同時形質転換し、AA生成に関してスクリーニングした。使用した基質はGLA(18:3n−6) 25μMであった。M.アルピナエロンガーゼ(MAELO)が酵母において活性である場合、次いで基質をDGLA(20:3n−6)に変換し、これをΔ5−デサチュラーゼがAA(20:4n−6)に変換する。図11に示す結果よりAAの生成、すなわちM.アルピナエロンガーゼ(MAELO)の活性が確認される。
【0127】
エロンガーゼと共に、酵母におけるΔ5−、Δ6−およびΔ12−デサチュラーゼの発現により脂肪酸の外来性の供給を必要とせずにAAを生成(図1を参照のこと)するはずである。
【0128】
実施例IV
パン酵母におけるM.アルピナエロンガーゼcDNA MAELOおよびビール酵母菌エロンガーゼELO2の発現の比較
制限部位(下線部)BamHIおよびHindIII(各々)を組み込んだプライマーRO514(5’−GGC TAT GGA TCC ATG AAT TCA CTC GTT ACT CAA TAT G−3’)およびRO515(5’−CCT GCC AAG CTT TTA CCT TTT TCT TCT GTG TTG AG−3)を用いて、酵母エロンガーゼをコード化するELO2遺伝子をビール酵母菌ゲノムライブラリー(オリジーン、ロックビル、メリーランド州)からクローン化した。ELO2遺伝子をBamHIおよびHindIII部位でベクターpYX242にクローン化し、これをpRELOと称し、ビール酵母菌宿主334に形質転換し(Hovelandら、前記で引用)、PUFAエロンガーゼ活性に関してスクリーニングした。陰性対照としてベクタープラスミドを用い、PUFAエロンガーゼ活性を比較するために334(pRAE−5)を成長させた。培地中ガラクトースを含まず、基質として25μM GLAを添加して、前記するように培養物を成長させた。図12は334(pRAE−5)により生成された20:3n−6またはDGLA(18:3n−6またはGLAから伸長)の量を示すが、これは変化していないベクターpYX242を含む陰性対照の約4倍になり、一方2個の別個のクローン334(pRELO−1)および334(pRELO−2)は陰性対照の2倍にしかならなかった。加えて、生成したDGLAを全脂質のパーセントとして表現した場合(図12の括弧に示す)、クローン334(pRELO−1)および334(pRELO−2)は各々DGLA0.153%および0.2%を生成し、一方334(pYX242)はDGLA0.185%を生成した。このようにこれらの株は全て類似のパーゼンテージのDGLAを生成した。しかしながら、株334(pRAE−5)はDGLA0.279%を生成し、334(pYX242)(陰性対照)より50.8%増加している。これらのデータは、ビール酵母菌エロンガーゼ遺伝子ELO2が酵母において過剰発現する場合においてさえ、GLAをDGLAに効果的に伸長しないことを示している。対照、334(pYX242)に比較して高量のDGLAが生成されることから明白であるように、M.アルピナPUFAエロンガーゼ活性はこの変換に関して特異的である。
【0129】
実施例V
MAELOを用いる別の供給源に由来するエロンガーゼの同定
TファストAアルゴリズム(PersonおよびLipman、前記で引用)を用いてクエリーペプチド配列および6個の読み枠の各々に翻訳されたデータベースDNA配列間の類似性を検索した。GCGのGenEMBLデータベース(6/98)でGCGのTファストA検索に翻訳されたMAELOをクエリーとして用い、翻訳MAELOに対するアミノ酸類似性の比較に基づいて別の潜在性エロンガーゼ配列を同定した。例えば図13および14において、2個の整列化は染色体IIIおよびMAELOに由来する2個の異なるシー・エレガンス(C.elegans)配列の翻訳の間に示されている。シー・エレガンスDNA配列(ジェンバンク受入番号:Z68749)はGNS1(ELO2)との類似性を意味すると注釈されており、一方さらにシー・エレガンスDNA配列(ジェンバンク受入番号:U61954)はGNS1およびSUR4(ELO3)の両方に類似することが示されている。これらはスプライシングされたDNSフラグメントであり、ここではイントロンはゲノム配列から除去されており、エクソンが集められ翻訳されている。シー・エレガンスの推定PUFAエロンガーゼおよび翻訳MAELO間の同一アミノ酸の量は約30%である。これは脂肪酸代謝において共通する機能、例えばPUFAエロンガーゼを示している。図15は染色体IIIに由来する翻訳シー・エレガンス配列(ジェンバンク受入番号:AF003134)の別の実例である。DNA配列がビール酵母菌ELO2に対してDNA相同性を有することが同定された。このDNA配列およびそのアミノ酸翻訳をさらに検査し、翻訳MAELOと相同性があることが決定された。従って、シー・エレガンスはPUFAエロンガーゼを含有し得る。
【0130】
図16は各々マウスおよびヒトに由来する、翻訳MAELOを有する翻訳DNA配列の整列化を示す。マウス配列CIG30(ジェンバンク受入番号:U97107)を褐色脂肪組織から単離し、「酵母SUR4タンパク質に類似する」と報告されている。図16に示すように、U97107の翻訳のアミノ酸番号130ないし152は翻訳MAELOに対し高度の類似性を有する。染色体4に由来するヒト配列(ジェンバンク受入番号:AC004050)はHTGS(ハイ・スループット・ゲノム・シークエンス)による。この配列に注釈はない。しかしながら、翻訳AC004050は翻訳MAELOと150個のアミノ酸において28.7%の相同性を有した。この遺伝子フラグメントは、翻訳MAELOに対するアミノ酸類似性に基づくと、ヒトPUFAエロンガーゼのフラグメントであり得る。
【0131】
図17は翻訳MAELOおよび哺乳動物配列(ジェンバンク受入番号:I05465、PCT番号WO88/07577)のアミノ酸整列化を示しており、これはこの配列の発現物に由来するタンパク質がポリコスリル化阻害因子であることを主張している。二つのタンパク質間のアミノ酸同一性は関連する機能、例えばPUFAエロンガーゼ活性があり得ることを意味している。
【0132】
別の翻訳DNA配列および翻訳MAELOに対するそれの相同性に関するこれらの実例は前記の実施例のいずれかが潜在的にPUFAエロンガーゼになり得ることを説明している。これらの実施例は可能なエロンガーゼ全てを包含するものではない。しかしながら、MAELOまたはそのアミノ酸翻訳をデータベース検索のクエリーとして使用してPUFAエロンガーゼ活性を有する別の遺伝子を同定することができる。
【0133】
実施例VI
プラークハイブリダイゼーション法を用いるM.アルピナcDNAライブラリースクリーニング
M.アルピナに由来するさらなるPUFAエロンガーゼ遺伝子を単離するために、慣用的なプラークハイブリダイゼーション法を用いてラムダベクターに作成したM.アルピナcDNAライブラリーをスクリーニングした。MAELOヌクレオチド配列に基づいてDNAプローブを作り、これを用いてλジプロックスベクター(Knutzonら、J.Biol.Chem.273:29360−29366(1998))に作成したM7+8M.アルピナcDNAライブラリーをスクリーニングした。
【0134】
ライブラリーをスクリーニングするためのDNAプローブを作るために、MAELO cDNAをNspIおよびPvuI制限エンドヌクレアーゼで消化した。平均約300塩基対の大きさの小型DNAフラグメント3個を作り、プローブとして使用した。フラグメント化したMAELO cDNAの混合物を用いる原理はM.アルピナに存在する種々PUFAエロンガーゼに保存されているアミノ酸配列の共通の領域またはドメインがあるであろうという仮定に基づいている。標準的なプロトコル(Sambrookら、Molecular Cloning、第2版、コールド・スプリング・ハーバー(1989))に準じ、プラークハイブリダイゼーション技術により、MAELO DNAプローブを用いてcDNAライブラリーをスクリーニングした。
【0135】
簡単には、50000個の1次クローンをプレートし、ナイロン膜に移した。膜を変性し、20% ホルムアミド、0.2% PVP、BSA、フィコール、0.1% SDSおよび0.5M NaClを含有するハイブリダイゼーションバッファー中、アルファ32P−dCTP標識MAELO DNAプローブで一晩ハイブリダイズした。37℃で0.5X SSCを用いてフィルターを洗浄し、オートラジオグラフィー用にX線フィルムに曝露した。この手順を3回繰り返した。繰り返しハイブリダイズした4個のクローン(F1、F2、F3およびF4と称する)を取り、7% DMSOを含有するSMバッファー(Sambrookら、前記で引用)に懸濁した。
【0136】
各候補の最も大きいオープン・リーディング・フレームを酵母発現ベクターpYX242(ノバゲン・インコーポレーティッド、マジソン、ウィスコンシン州)にサブクローン化した。cDNAクローンF1およびF3をEcoRI部位でpYX242にサブクローン化し、一方F2およびF4をNcoI/HindIII部位でサブクローン化した。酵母で発現するために、各候補を含有する組換えpYX242をSC334に形質転換した(Hovelandら、前記で引用)。エロンガーゼ活性および基質特異性を決定するために、実施例IIIに記載のGLA基質25μMの存在下、ロイシンを欠く最低培地で各cDNAクローンを含有するSC334を成長させた。Knutzonら(J.Biol.Chem.273:29360−29366(1998))に記載されるように脂肪酸分析を実施した。その結果、GLAのDGLAへの変換においてこれら4個のcDNAクローンはいずれも有意な活性を呈しないことが示された。このように、さらなるPUFAエロンガーゼの同定には、ハイブリダイゼーション法は成功しないようである。
【0137】
実施例VII
酵母におけるM.アルピナの直接cDNA発現ライブラリーの構築
MAELO以外のPUFAエロンガーゼ遺伝子を同定するために、異なる方法でM.アルピナcDNAライブラリーをスクリーニングした。とりわけ、パン酵母がデサチュラーゼおよびエロンガーゼの各々を欠如しているために長鎖PUFAを生成することができないので、ビール酵母菌にM.アルピナの発現cDNAライブラリーを構築する試みを行った。ビール酵母菌におけるcDNAライブラリーを発現するために、GAL1プロモーターを含有するベクターpYES2(ノバゲン・インコーポレーティッド、マジソン、ウィスコンシン州)を選択した。
【0138】
cDNAを作成する慣用的な方法(すなわちDNA混合物をライゲートしたcDNA/ベクターの宿主細胞への形質転換)は酵母においては困難である。なぜならばライゲートしたDNA混合物の直接的エレクトロポレーションによる形質転換効率は精製スーパーコイル化プラズミドDNAの効率に比較して非常に低い。しかしながらこの方法の主に優れた点は中間体として大腸菌(E.coli)にライブラリーを作成した場合に起こる1次クローンの増幅を避けられることである。スクリーニングされるコロニー数が制限されるために、cDNA/ベクターライゲーション混合物を用いて異なるビール酵母菌株において形質転換する効率を最初に最適化することが決まっている。得られた最もよい結果ではビール酵母菌株SC334におけるライゲートしたDNAのμgあたり4ないし5x105の形質転換体を生じた(Hovelandら、前記で引用)。
【0139】
酵母に直接的M.アルピナcDNA発現ライブラリーを作成するために、全RNAを真菌類から単離した。M.アルピナ真菌類(ATCC番号:32221)をコーンミール寒天(ディフコ・ラボラトリーズ、デトロイト、ミシガン州)上にプレートし、室温で3ないし4日間成長させた。一度菌類の成長が可視化されると、これをジャガイモデキストローズブロス50mlに接種し、室温で非常にゆっくりと振盪して胞子を形成させる。一度胞子が可視化されると、培養物50mlをジャガイモデキストロースの培養物1lに接種し、胞子を72時間成長させた。滅菌ガーゼを通してろ過した後、さらにRNA抽出するためにすぐに細胞を液体窒素で凍結した。熱フェノール/LiCl抽出法(Sambrookら、前記で引用)を用いて細胞ペレット36gから全RNAを調製した。10mM EDTA、1% SDSおよび200mM 酢酸ナトリウムの溶液(pH4.8)中で細胞ペレットをホモジナイズした。ホモジネートにフェノールおよびクロロホルムを加え、水層を抽出した。再度フェノールおよびクロロホルムで水層を戻し抽出した。次いで4M 塩化リチウム等量を加えた。氷上で3時間サンプルをエタノール沈殿させ、遠心によりペレットを得た。RNAペレットを70%エタノールで洗浄し、DEPC処理した水に再懸濁した。分光測光法により全RNAを定量し、アガロースゲル電気泳動により可視化し、28Sおよび18Sリボソームのバンドの存在を確認した。細胞ペレット36gから全RNA約15mgを得た。
【0140】
標準的なプロトコル(Sambrookら、Molecular Cloning、第2版、コールド・スプリング・ハーバー(1989))に準じてライブラリーを構築した。オリゴdTセルロース・アフィニティー精製を用いて全RNAからメッセンジャーRNAを調製した。AMV逆転写酵素を用いてXhoI制限部位を含有するオリゴdTプライマーでメッセンジャーRNAを逆転写した。cDNAの第1の鎖を合成した後、大腸菌DNAポリメラーゼ、大腸菌DNAリガーゼおよびRNアーゼ Hを添加してcDNAの第2の鎖を合成した。
【0141】
T4 DNAリガーゼによりEcoRIアダプタをブラント末端化したcDNAにライゲートした。T4ポリヌクレオチドキナーゼを用いてcDNAサンプルをキナーゼ処理し、XhoIで消化し、カラムバッファーで希釈し、セファクリルS−400カラムに通した。高塩濃度バッファーによりDNAサンプルを希釈した。400ないし5000塩基対のDNAを含有するサンプルをプールし、これをpYES2ベクター(インビトロゲン・コーポレーション、カールスバッド、カリフォルニア州)へのライゲーションに用いた。T4 DNAリガーゼを用いてEcoRI/XhoI消化pYES2ベクターにcDNAをライゲートした。酵母の直接的形質転換には多量のライゲート化DNA(2ないし3μg)が必要であるので、大容量のライゲーション反応を実施した。
【0142】
cDNA/pYES2ライゲート化混合物で酵母細胞を直接形質転換するために、LiAc TRAFO法を用いてコンピーテントSC334細胞を調製した(Gietzら、Mol.Cell.Biol.5:255−269(1995))。簡単には、プレートからのSC334の新鮮培養物をYPD培地50mlに接種した。30℃で振盪しながら600でのODが1.0に達するまで培養物を成長させた。この出発物質30mlをYPD液体培地300mlに接種し、培養物の細胞数が〜3ないし5x106セル/mlに達するまで(約3ないし4時間)振盪しながらインキュベートした。細胞を収穫し、滅菌水で洗浄した。全細胞ペレットを新しく調製した1X TE/LイAc(0.1M LiAc)1.5mlに再懸濁した。すぐにこれらの細胞を形質転換に用いた。
【0143】
コンピーテントSC334細胞750μlを15mlファルコンチューブに等分した。cDNA/pYES2ライゲートしたDNAの約2μgを担体DNAと共に細胞に加え、穏やかに混合した。滅菌した40%PEG/LiAc3mlを細胞に加え、穏やかにしかし完全に混合した。振盪しながら30℃で30分間細胞をインキュベートし、続いて42℃で15分間熱ショックを与えた。細胞を冷却し、ペレット化し、1X TE5mlに再懸濁した。前記の細胞の100μlアリコートをウラシル不含の150mm選択寒天プレート50個にプレートし(Ausubel、前記で引用)、30℃で3日間インキュベートした。全部で8x105個の1次クローンを得た。5個のコロニーをウラシル不含の最低培地1mlにプールし(Ausubelら、前記で引用)、貯蔵用にグリセロールを添加した。全部で5000個のプールをスクリーニング用に作った。
【0144】
実施例VIII
酵母におけるMAD(M.アルピナ直接)スクリーニング
ライブラリーにおけるcDNAの平均の大きさを決定することによりライブラリーの品質を分析した。ライブラリーのスクリーニングがcDNAの発現に基づいているので、ライブラリーに存在するcDNAの平均の大きさを決定することが重要である。最も長いcDNAを含有する発現ライブラリーを選択するのが、目的のcDNA全長を単離するために最も適切であろう。この目標のために、実施例VIIに記載するように、無作為に選択したプールを選択寒天プレートにプレートし、個々のコロニーを得た。40個の異なる酵母コロニーを無作為に取り、各コロニーをウラシル不含の選択液体培地5mlに接種し(実施例VIIに記載するように)、30℃で24時間、振盪しながら成長させた。ビーズ・ビーティング法(Hoffmanら、Gene、57:267(1987))を以下のように適応させてこれらのコロニーからプラスミドDNAを抽出した:
100mM NaCl、10mMトリス、pH8.0、1mM EDTAおよび0.1% SDS溶液0.5ml中培養物5mlからのペレットを溶解した。等量の滅菌0.5mmガラスビーズを加え、3分間手動で攪拌した。同じバッファー200μlを加え、混合物をさらに1分間攪拌した。サンプルを高回転で2分間遠心し、次いで新しいチューブに細胞抽出物を移した。等容量のフェノール/CHCl3をサンプルに加え、攪拌し、再度2分間遠心した。水層を2回再抽出し、0.3M酢酸ナトリウムおよび約2.5容量のエタノールを用いて−20℃で30分間沈殿させた。70%エタノールで沈殿物を洗浄し、水に再懸濁した。RNAおよびいかなるタンパク質夾雑物をも排除するために、製造者プロトコルに準じてQIAプレップ・スピン・ミニプレット・キットを用いて(キアゲン・インコーポレーティッド、バレンシア、カリフォルニア州)、40個の異なるサンプルから単離したプラスミドDNAをさらに精製した。次いでEcoRIおよびXhoI制限エンドヌクレアーゼでプラスミドDNAサンプルを制限してcDNAフラグメントを放出し、1%アガロースゲル上で消化物を分析した。その結果、直接ライブラリーのcDNAの大部分が0.8キロ塩基対から1.5キロ塩基対の長さで変動することが示された。
【0145】
ライブラリーをスクリーニングするために、グリセロール保存物を解凍し、約0.5mlをウラシル不含(Ausubelら、前記で引用)の液体選択培地5mlに加え、30℃で24時間成長させた。次いで培養物を2%ガラクトースおよび25μlGLA(エロンガーゼ酵素の基質)を含むウラシル不含液体選択培地50mlに移して25℃で24時間攪拌した。各々の誘導培養物の細胞ペレット中の脂質含量のGC−FAME分析を前記のように実施した(Knutzonら、前記で引用)。MAELO(ウラシル不含選択培地中で成長したpYX242のpRAE−5)を各バッチのランにおける陽性対照として用いた。MAELOはは一貫してGLAの1.5%をDGLAに変換できる(実施例IIIを参照のこと)。
【0146】
実施例IX
潜在PUFAエロンガーゼをコードするcDNAの同定
GC−FAME分析により約750個の個々のプールをスクリーニングおよび分析した後、実施例VIIIに記載するように、5個のコロニーからなる1個のプール(すなわちMAD708)がGLAのDGLAへの変換における有意な酵素活性を有すると考えられた。DGLA/GLA比率に関してこの活性はM.アルピナエロンガーゼ活性(MAELO)よりも約5倍の高いことが認められた(図19)。同じアッセイ条件下でプールを再度試験し、最初の知見を確認した。反復試験によりGLAがDGLAに9.5%変換され、M.エアルピナエロンガーゼ活性(MAELO)より約5倍高かった。これらの結果よりMAD708プールが、基質であるGLAに特異的なエロンガーゼ候補を含有することが強く示された。MAD708が異なる5個のクローンからなる1個のプールであるので、このプールからエロンガーゼ活性をコードする個々のcDNAクローンを単離する必要があった。そのために元来のMAD708グリセロール貯蔵物をウラシル不含の選択培地寒天プレートにプレートした(Ausubelら、前記で引用)。30個の個々のコロニーを取り、実施例VIIIに前記するように、GLAの存在下ウラシル不含で2%ガラクトースを含む液体選択培地で成長させた。次いで各培養物から得られた細胞ペレットを陽性対照が334(pRAE−5)(pYX242のMAELO)の脂肪GC−FAME分析(Knutzonら、前記で引用)に供した。酵母のMAD708発現プールからの30個の個々のクローンの脂肪酸分析により、30個のクローンのうち5個がGLAのDGLAへの変換においてエロンガーゼ活性を示すことが明らかにされた。活性クローンMAD708−2、MAD708−10、MAD708−18、MAD708−19およびMAD708−30の脂肪酸プロフィールを図20に示す。この図に示されるように、MAD708−2、10および30が最もDGLAを生成し、MAELO(pRAE−5)の約25倍以上である。これらの3個は41%ないし49%の範囲でGLAをDGLAに変換する。その他のクローン、MAD708−18およびMAD708−19は8%および21%GLAをDGLAに変換する。全てのMAD708クローンはエロンガーゼをコードするMAELOに関して高いパーセンテージてGLAをDGLAに変換する(3.4%)。
【0147】
実施例X
エロンガーゼをコードするcDNAの特性化
実施例VIIIに記載するように、ビーズビーティング法により有意なGLA特異性エロンガーゼ活性を呈するSC334酵母クローン(MAD708プール)からプラスミドDNAを抽出した。cDNA挿入物の大きさを決定するために、陽性エロンガーゼクローンから得た各プラスミドDNAを鋳型として用いてPCRを実施した。順行プライマーRO541(5’−GAC TAC TAG CAG CTG TAA TAC−3’)および逆行プライマーRO540(5’−GTG AAT GTA AGC GTG ACA TAA −3’)はpYES2ベクターのマルチクローニング部位にあり、EcoRIおよびXhoI部位内のcDNA挿入物を増幅するのに使用した。プラスミドDNA 4マイクロl、各プライマー50ピコモル、10Xバッファー5μl、10μM PCRヌクレオチドミックス(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)1μlおよびハイ・ファイブ・Taqポリメラーゼ(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)0.5μl含有する50μl容量中PCRを実施した。増幅は以下のように実施した:94℃で2分間変性、次いで94℃で1分間、55℃で2分間、および72℃で3分間、30サイクル、増幅の最後に72℃で7分間延長。PCR増幅生成物を1%アガロースゲル上で分析し、エロンガーゼcDNAの大きさが約1.0ないし1.2キロ塩基対であることが示された。潜在エロンガーゼcDNAを含有するプラスミドDNAをpRPB2、pRPB10、pRPB18、pRPB19およびpRPB30と称する。pYES2ベクターのEoRIおよびXhoI部位でcDNAライブラリーを作成したので、前記プラスミドをEcoRIおよびXhoIで消化することにより各プラスミドに存在するcDNAの大きさをさらに確認した。
【0148】
cDNAクローンの長期保存用およびDNAシークエンシング用に酵母から単離したプラスミドDNAを大腸菌で再増幅した。製造者プロトコルに従って、大腸菌TOP10(インビトロゲン・コーポレーション、カールスバッド、カリフォルニア州)細胞をpRPB組換えプラスミドで形質転換した。各プラスミドDNAから得た形質転換体をアンピシリン(50μg/ml)含有LBに接種し、振盪しながら37℃で一晩成長させた。製造者プロトコルに従ってQIAプレップ・スピン・ミニプレップ(キアゲン・インコーポレーティッド、バレンシア、カリフォルニア州)を用いてこれらの培養物からプラスミドDNAを単離した。次いで精製プラスミドDNAを用いて5’および3’の両末端よりシークエンシングした。製造者プロトコルに従って373AストレッチABI自動DNAシークエンサー(パーキン・エルマー、フォスター・シティー、カリフォルニア州)を用いてDNAシークエンシングを実施した。シークエンシングに用いたプライマーはpYES2ベクターのマルチクローニング部位に含まれる順行プライマーRO541(5’−GAT TAC TAG CAG CTG TAA TAC−3’)および逆行プライマーRO540(5’−GTG AAT GTA AGC GTG ACA TAA −3’)である。得られたヌクレオチド配列を分析するためにシークエンサー・ソフトウェア・プログラム(ジーン・コード・コーポレーション、アン・アルボア、ミシガン州)に移した。DNA配列分析により5個のエロンガーゼcDNA全てが301ヌクレオチドの共通重複と同等のヌクレオチドを含有することが示された。各DNA配列は5’末端の初めに推定出発部位を、3’末端でポリAテールを有する停止コドンを含有する。DNA配列をさらに確認するために内部の順行プライマーRO728(5’−GAG ACT TTG AGC GGT TCG−3’)およびRO730(5’−TCT CTG CTG CGT TGA ACT CG−3’)を逆行プライマーRO729(5’−AAA GCT CTT GAC CTC GAA C−3’)およびRO731(5’−AAC TTG ATG AAC GAC ACG TG−3’)と共にcDNA内に設計し、pRPB2のシークエンシングに用いた。なぜならばこの候補は最も高いエロンガーゼ活性を有するからである。シークエンサープログラムにより全ヌクレオチド配列を分析し、pRPB2の全cDNA配列から推測される最も長いオープン・リーディング・フレームは957塩基対の長さであると考えられた(図22)。次いで推測されるオープン・リディング・フレームを対応するアミノ酸配列に翻訳し、予測される配列を図23に示す。M.アルピナから同定されたcDNAによりコードされたエロンガーゼは318アミノ酸長のタンパク質であると考えられ、これは翻訳MAELOの大きさとほとんど同等である。この新規エロンガーゼを「GLELO」と称し、そのコード化タンパク質を「GLAエロンガーゼ」と命名した。
【0149】
ブダペスト条約の条件下、1999年7月22日にプラスミドDNA pRPB2をアメリカン・カルチャー・コレクション、10801 ボウルバード大学、マナサス、バージニア州20110−2209に寄託した。これにはATCC寄託番号:PTA−402が付与された。
【0150】
実施例XI
GLAエロンガーゼ(GLELO)の生化学的特性
A.GLAエロンガーゼ活性の確認
pRPB2組換えプラスミドによりコードされたGLAエロンガーゼの活性をさらに確認するために、pRPB2プラスミドを含有する酵母クローンSC334でエロンガーゼ活性スクリーニングを繰り返した。またこの実験を行うことにより一貫した脂質抽出を確実にし、4つの別個の実験を平均化することによりGLAエロンガーゼ活性を検出できた。pRPBを含有するビール酵母菌334グリセロール貯蔵物をウアシル不含の最低培地寒天プレートにプレートした。個々のコロニーを無作為に取り、実施例VIIIに記載するように、ウラシル不含の最低培地で成長させた。4個の別個の培養物を組み合わせ、5mlアリコートを用いて4個の別個の培養物50mlに接種した。次いでGLAの存在下培養物を成長させ、実施例VIIIに記載するように、pYES2を含有するビール酵母菌334の陰性対照と共に脂肪酸分析に供した。25μM GLAを含む334(pRPB2)の4個の別個の培養物の平均エロンガーゼ活性を図24に示す。334(pRPB2)の4個の別個のサンプルの各々のGLAエロンガーゼ活性は62%のGLAのDGLAへの平均変換に一致すると考えられた。
【0151】
B.GLAエロンガーゼに関するGLELO基質特異性の決定
GLAエロンガーゼの基質特異性を分析するために、334(pRPB2)の培養物をGLAに加えて別の脂肪酸基質(例えばSA(18:0)、OA(18:1)、LA(18:2n−6)、AA(20:4n−6)、ADA(22:4n−6)、ALA(18:3n−3)、STA(18:4n−3)、およびEPA(20:5n−3))で試験した。同等のアッセイ条件下でエロンガーゼ酵素により利用される唯一の別の基質はn−3経路の脂肪酸、STAであった。GLAエロンガーゼは73%のSTAを20:4n−3に変換できた(図25)。これらの実験より、GLAエロンガーゼがGLAとSTAの両方に基質特異性を有すると結論づけられ、これはこれがn−6およびn−3経路の両方でエロンガーゼ活性を有していることを示している。
【0152】
C.酵母における菌類のGLELOおよびΔ5−デサチュラーゼ遺伝子の同時発現
望ましい同時発現系において一度GLAエロンガーゼによりDGLA(20:3n−6)を生成すると、Δ5−デサチュラーゼがそれをAA(20:4n−6)に変換できる。図1で表されるように、この反応図式はEcoRI部位でクローン化されたプラスミドpRPB2およびpRPB31(Δ5−デサチュラーゼcDNAを含有する組換えプラスミドpYX242)(図18)を用いてビール酵母菌334を同時形質転換することにより試験できる。同時形質転換した酵母培養物に25μM GLAを補充し、AA合成に関して分析した。エロンガーゼおよびΔ5−デサチュラーゼ酵素の両方を発現する場合、GLA基質はDGLAに変換され、これは次いでAAに変換される。26Aの結果はGLAエロンガーゼおよびΔ5−デサチュラーゼのGLA基質に及ぼす一連の作用の結果、平均27%のGLAをAAに変換する。従って、GLAエロンガーゼはn−6PUFA合成経路において別の酵素と働いて望ましい脂肪酸を生成することができる。
【0153】
前記の変換がn−3経路でも真実であるかどうかを決定するために、25μM STAの存在下同様の同時発現実験を実施した。再度両酵素を発現する場合、STA基質は20:4n−3に変換され、これがΔ5−デサチュラーゼによりEPA(20:5n−3)に変換される。図26BではEPAの生成(約40%)が観察されたことを示している。再度、GLAエロンガーゼがn−3経路においてΔ5−デサチュラーゼと共に働いて望ましい脂肪酸を生成できることが示された。
【0154】
実施例XII
GLELOおよびその他の菌類のエロンガーゼ間の配列比較
GCGの配列分析パッケージ(実施例Iを参照のこと)を用いてGLELO配列を既知タンパク質配列と比較した。GLELOオープン・リーディング・フレームのヌクレオチド配列が最初に翻訳され、これをクエリー配列として用いてファストAアルゴリズム(実施例Iを参照のこと)を用いるスイスポートデータベース(実施例Iを参照のこと)を検索した。アミノ酸配列類似性に基づき、ビール酵母菌YJT6(未知の注釈を付したEST)と189個のアミノ酸重複において33.9%の同一性、ビール酵母菌ELO2(GNS1)と295個のアミノ酸重複において25.8%の同一性、およびビール酵母菌ELO3(SUR4)と313個のアミノ酸重複において25.2%の同一性で最も適合することが見出された。GLELOのMAELOとのファストA整列化により275個のアミノ酸において30.9%の同一性が示された(図27)。発展的なペア化した整列化を用い(実施例Iを参照のこと)、前記のエロンガーゼと共に用いてGCGパイルアッププログラムにより、関連する配列群から多数の配列整列化を作った。パイルアップの結果により、エロンガーゼには推定ヒスチジンボックスを含む多くの保存領域があり、これには下線を付してある(Knutzonら、J.Biol.Chem.273:29360−29366(1998))(図28)。このように、GLELOはMAELOと類似性を有するが、基質優先性は恐らくコード化されたエロンガーゼにおける差異によるものであろう。GLAエロンガーゼはM.アルピナよりも高いパーセンテージでGLAをDGLAに変換できる。加えてビール酵母菌におけるMAELOの発現はGLAのDGLAへの伸長に加え、飽和およびモノ不飽和脂肪酸の伸長を呈する(実施例IIIを参照のこと)。
【0155】
実施例XIII
哺乳動物におけるM.アルピナMAELO相同性の同定
MAELO翻訳配列を用いてアボット・ラボラトリーズ、100アボット・パーク・ロード、アボット・パーク、イリノイ州60064のユニファイド・ヒューマン・トランスクリプト・データベースを検索した。ベーシック・ローカル・整列化・サーチ・ツール(BLAST)(Altschulら、Nuc.Acids.Res.25:3389−3402(1997))を用いてデータベースを検索した。このツールは「クエリーがタンパク質であるかDNAであるかにかかわらず、全ての可能な配列データベースのずべてを探るために設計された一連の類似性検索プログラムである」。具体的には、ツブラストン(tblastn)アルゴリズムを用いた(すなわち6個の読み枠で翻訳されたヌクレオチドデータベースに対するタンパク質クエリー検索)。ユニファイド・ヒューマン・トランスクリプト・データベースにおけるコンティグ(CC)配列は共通のドメインおよび発現配列タグ(EST)のIncyte LIFESEQ(登録商標)データベース(インサイト・ファーマシューティカルズ・インコーポレーティッド、3174ポーター・ドライブ、パロ・アルト、カリフォルニア州94304)(規定した配列相同性に基づいてクラスター化し、重複配列に基づいてアセンブルする)に由来する発現配列タグ(EST)cDNAの群を代表するコンセンサス配列である。このデータベースからの2個の配列、CC067284R1およびCC1484548T1は各々翻訳MAELO配列を有し、242個のアミノ酸重複において28%の同一性、266個のアミノ酸重複において28.6%の同一性を有した。2個の誘導および編集した配列を各々hs1およびhs2と称し、GCGの配列分析ソフトウェアパッケージにコピーした(実施例Iを参照のこと)。ファストAアルゴリズムを用いて翻訳MAELO配列を翻訳HS1(242個のアミノ酸において28.5%の同一性)および翻訳HS2(266個のアミノ酸において28.2%の同一性)cDNA配列と整列化し、各々図29および30に示した。HS1 cDNAヌクレオチド配列はまた844塩基対においてI05465ヌクレオチド配列と86.9%の同一性を有した(実施例Vを参照のこと)。翻訳HS2 cDNA配列は受入番号:W74824のジェンバンクからのアミノ酸配列と100%の同一性を有した(公開PCT出願WO9839448を参照のこと)。
【0156】
ナショナル・センター・フォー・バイオテクノロジー・インフォメーション(NCBI、http://www.ncbi.nlm.nih.gov/)を用いてAC004050(TファストA検索で同定されたヒト配列、実施例Vを参照のこと)から翻訳された28個のアミノ酸配列(DTIFIILRKQKLIFLHWYHHITVLLYSW)を有するツブラストンを用いるデータベース検索を行った。このアミノ酸配列はヒスチジンボックス(下線部)を含み、これはデサチュラーゼ(Knutzonら、前記で引用)並びにMAELOおよびGLELOの両方のPUFAエロンガーゼの注目すべきモチーフを有する(図28を参照のこと)。実施例Vにおいて前記した翻訳マウス配列(ジェンバンク受入番号:U97107)および翻訳シー・エレガンス配列(ジェンバンク受入番号:U41011)はこの28個のアミノ酸クエリーと高度に適合する。翻訳U41011をクエリーとして用いてNCBIマウスESTデータベースを再度ツブラストンで検索した。さらなるマウス配列を同定し(ジェンバンク受入番号:AF014033.1)、「脂肪酸伸長における関与が推定される」と注釈した。マウスESTデータベースを翻訳AF014033.1でツブラストン検索することによりこれらの長い配列(ジェンバンク受入番号:AA591034、AA189549、およびAA839346)を同定し、mm2と称する1個の配列と組み合わせた。翻訳mm2およびMAELOのファストA整列化(実施例Iを参照のこと)を図31に示す。関連するが同一ではない別のマウス配列(ジェンバンク受入番号:AI225632)をもAF014033.1でマウスESTデータベースのツブラストン検索において同定した。MAELOに対する翻訳AI225632のファストA整列化を図32に示す。翻訳MM2およびAI225632の両方の翻訳MAELOとの同一性パーセントは各々191個および115個のアミノ酸重複において30.4%である。これらの2個の翻訳マウス配列と翻訳MAELOとのアミノ酸同一性のレベルより、これらがPUFAエロンガーゼの推定相同体であることが確認される。
【0157】
実施例XIV
哺乳動物におけるM.アルピナGLELO相同体の同定
クエリーとして翻訳GLELOを用いて、タンパク質配列を6個の読み枠の各々において翻訳されているデータベースDNA配列と比較するTファストAアルゴリズムを使用した。GCGのジーンEMBLデータベースを用いて、翻訳GLELOに対するアミノ酸類似性に基づいて別の潜在するエロンガーゼ配列を同定した。3個のヒト配列がGLELOアミノ酸配列に適合することが解った。これらの配列はジェンバンク受入番号:1)AI815960、2)AL034374および3)AC004050を有する。AI815960、ホモ・サピエンEST配列は144個のアミノ酸重複において翻訳GLELOと40.3%の同一性を有する(図33を参照のこと)。ヒトゲノムの翻訳領域、AL034374は染色体VIに由来し、60個のアミノ酸重複において翻訳GLELOと46.7%の同一性を有する(図33を参照のこと)。AL034374における相同領域は翻訳MAELOと相同性を有することが示されているHS1アミノ酸配列の一部であると考えられる(実施例XIIIを参照のこと)。従って、HS1配列はMAELO(図29を参照のこと)とGLELO(図34を参照のこと)の両方と類似性を有する。染色体IVに由来するヒトゲノム配列AC004050の翻訳領域は89個のアミノ酸重複において翻訳GLELOと34.8%の同一性を有する(図35を参照のこと)。GLELOとこれらのヒト配列間のアミノ酸同一性により、これらのヒト配列に由来するタンパク質がPUFAエロンガーゼ活性のような機能と関連し得ることが示される。
【0158】
GLELOに類似するマウスcDNAを同定するために、翻訳GLELOをクエリーとして用い、ジーンEMBLでTファストA検索を実施した。TファストA検索により翻訳GLELOに高度に適合する3個のマウス配列を同定した:(ジェンバンク受入番号:1)AF104033、2)AI595258および3)U97107)。AF104033には「酵母ELO3(SUR4)に相同である推定脂肪酸エロンガーゼを有するMUELタンパク質」と注釈し、これはMM2の配列の一部である。MM2配列は最初AF104033マウス配列から誘導したが、最終的にはさらなるマウスESTデータベース検索により全MM2配列を得、これもまた翻訳MAELOと相同であることが示された(実施例XIIIおよび図31を参照のこと)。ファストAを用いてこのMM2アミノ酸配列を翻訳GLELO配列と整列化した場合、211個のアミノ酸重複において34.6%の同一性が見出され(図36を参照のこと)、このことはMM2もまたGLELOと相同であることを示している。AI595258は酵母ELO3エロンガーゼと5’類似性を有するマウスcDNAクローンであり、マウスEST cDNA AI225632の一部である。AI225632マウス配列はAI595258よりも長い配列であり、翻訳MAELOと類似性を有することが示された(図32を参照のこと)。AI225632をまた翻訳GLELOとも整列化し、ファストAアルゴリズムを図37に示す。199個のアミノ酸重複において35.3%の同一性が見出された。第3の配列、U97107はマウス配列であり、「酵母ELO3(SUR4)遺伝子に類似する」と注釈されている。翻訳GLELOのU97107との整列化を図38に示すが、ここでは279個のアミノ酸重複において23.7%の同一性が見出された。前記するように、ファストA整列化に基づいてU97107の領域はまたMAELOと高度な相同性を有することも見出された(実施例Vおよび図16を参照のこと)。
【0159】
前記の検索により、クエリーとしてMAELOまたはGLELOのいずれかを用いて同一のヒトおよびマウス配列が得られることが明白に示された。
【0160】
実施例XV
別のPUFA生成生物におけるM.アルピナGLELOおよびMAELO相同体の同定
A)カエノルハブディティス・エレガンス
シー・エレガンスの染色体配列から推測される推定アミノ酸配列(ジェンバンク受入番号:U41011)は、GLAエロンガーゼ(GLELO)およびM.アルピナエロンガーゼ(MAELO)の両方とアミノ酸類似性を有するマウスMM2推定PUFAエロンガーゼに含まれる部分配列を同定できる。従ってGLELOまたはMAELOのシー・エレガンス相同体が線虫データベースに存在するかもしれないと考えられる。GLELOおよびMAELO配列に由来する推定アミノ酸配列をクエリーとして用いて別個に線虫データベースを検索した。BLAST検索(実施例XIIIを参照のこと)をウォームペップ16(ブラストプ(blastp)はヌクレオチド配列データベースに対してアミノ酸クエリー配列を比較する)およびウォームペップ16cDNA(ツブラストン)データベース(これはシー・エレガンスゲノムシクエンシングプロジェクトまたはESTおよびその対応するcDNA配列から得られるタンパク質およびcDNAを予測する)で実施した。これらの配列データはシー・エレガンスシークエンシング群により作られ、サンガー・センターおよびゲノム・シークエンシング・センターにより統合され、ftp://ftp.sanger.ac.uk/pub/databases/wormpep/より入手できる。少なくとも7個の推定シー・エレガンス翻訳ハイブリダイゼーションをGLELOおよびMAELOの両方の翻訳アミノ酸配列に相同であるアミノ酸配列により同定した。推定アミノ酸を含有するこれらのゲノム配列のジェンバンク受入番号はZ19154、U68749(2個の推定タンパク質(F56H11.4およびF56H11.3(ウォームペップ受入番号)))、U41011、U61954(2個の推定タンパク質(F41H10.7およびF41H10.8(ウォームペップ受入番号)))およびZ81058であると同定された。これらの下線部分は翻訳MAELOをクエリーとして用いる前記の検索において同定された(実施例Vを参照のこと)。実例として、翻訳GLELOおよびMAELOを有する翻訳U68749(F56H11.4)のファストAアミノ酸整列化を図39および40に示す。翻訳U68749(F56H11.4)は約200個のアミノ酸重複においてM.アルピナエロンガーゼおよびGLAエロンガーゼの両方と25ないし30%の同一性を有する(図39、40を参照のこと)。7個の翻訳推定シー・エレガンスcDNAの全てに関して、翻訳GLELOに対するファストA整列化により200個のアミノ酸重複で同一性が25ないし30%であり、一方翻訳MAELOに関しては同一性は少なくとも188個のアミノ酸重複において26ないし34%であった。整列化の類似性により翻訳GLELOまたはMAELOのいずれかを用いてエロンガーゼ活性を有するシー・エレガンス由来の潜在遺伝子を同定できる。
【0161】
B)ドロソフィラ・メラノガスター(Drosohila melanogaster)
NCBI(実施例XIIIを参照のこと)による「その他のEST」データベースのブラストン検索(ヌクレオチドデータベースに対してヌクレオチドクエリー配列を比較する)において、ゲノム配列U41011(シー・エレガンス)の翻訳推定cDNAはドロソフィラ・メラノガスター(Drosohila melanogaster)EST(受入番号:AI134173)と高度に適合し、重複DNA ESTフラグメント(受入番号:AI517255)と共にアセンブルした。GCGのファストAを用いて2個の重複配列に由来する翻訳DNAフラグメントDM1を翻訳GLELOおよびMAELO(図41および42を参照のこと)と整列化した(実施例Iを参照のこと)。整列化により206個のアミノ酸重複においてGLAエロンガーゼと27.2%の同一性が示され、237個のアミノ酸重複においてM.アルピナエロンガーゼと30%の同一性が示された。このように、アミノ酸類似性に基づいて、DM1をPUFAエロンガーゼ様活性を有するGLELOまたはMAELOに対する潜在相同体であり得る。さらに、データベース検索のためのクエリーとしてGLELOおよびMAELOのDNA配列を用いて、ドロソフィラからPUFAエロンガーゼ活性を有する相同体を同定できる。
【0162】
実施例XVI
ヒトPUFAエロンガーゼ相同体のクローニングおよび発現
翻訳GLELOおよび/またはMAELOに対するアミノ酸類似性に基づいて、多くの潜在PUFAエロンガーゼを同定した。これらの配列の潜在エロンガーゼ活性を決定するために、次いで、本実施例で示すように、タンパク質全長をコードするcDNAを同定し、クローン化し、発現した。
【0163】
推定HS1配列に基づいてプライマーRO719(5’−GGT TCT CCC ATG GAA CAT TTT GAT GCA TC−3’)およびRO720(5’−GGT TTC AAA GCT TTG ACT TCA ATC CTT CCG−3’)を設計し、これを用いてヒト肝臓マラソン・レディーcDNA(クロンテック・ラボラトリーズ・インコーポレーティッド、パロ・アルト、カリフォルニア州)を増幅した。ヒト肝臓マラソン・レディーcDNA 5μl、各プライマー50ピコモル、10mM PCRヌクレオチドミックス(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)1μl、10X バッファー5μlおよびアドバンテージ・クレンTaq・ポリメラーゼ・ミックス(クロンテック・ラボラトリーズ・インコーポレーティッド、パロ・アルト、カリフォルニア州)を含有する50μl容量で、ポリメラーゼ連鎖反応(PCR)を実施した。パーキン・エルマー9600(ノーウォーク、コネチカット州)の熱循環器条件は以下のとおりであった:94℃で2分間、次いで94℃、1分間を30サイクル、58℃で2分間、および72℃で3分間。続いてさらに72℃で7分間PCRのサイクルを延長した。
【0164】
PCR増幅生成物をゲルに流し、約960塩基対の増幅フラグメントがゲル精製され、T4 DNAポリメラーゼ(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)でフラグメントの末端を埋め、製造者プロトコルに従ってpCRブラントベクター(インビトロゲン・コーポレーション、カールスバッド、カリフォルニア州)にクローン化した。新規プラスミドをpRAE−52と称し、ABI 373AストレッチDNAシークエンサー(パーキン・エルマー、フォスター・シティー、カリフォルニア州)を用いて、このクローンにおける推定PUFAエロンガーゼcDNAをシークエンシングした。プラスミドpRAE−52のこの推定PUFAエロンガーゼcDNA配列を図43に示し、翻訳配列を図44に示す。
【0165】
次いでプラスミドpRAE−52の推定PUFAエロンガーゼcDNAをNcoI/HindIIIで消化し、ゲル精製し、pYX242(NcoI/HindIII)にライゲートした。新規プラスミドをpRAE−58−A1と称した。(ブダペスト条約の条件下、1999年8月19日にプラスミド58−A1をアメリカン・タイプ・オブ・カルチャー・コレクション、10801ボウルバード大学、マナサス、バージニア州20110−2209に寄託し、寄託番号 が付与された。)
構築物pRAE−58−A1をビール酵母菌334(Hovelandら、前記で引用)に形質転換し、エロンガーゼ活性に関してスクリーニングした。陰性対照株はpYX242ベクターを含有するビール酵母菌であった。25μM GLAまたはAA存在下、選択培地(Ausubelら、前記で引用)で培養物を30℃で24時間成長させた。この研究においてDGLAまたはアドレン酸(ADA、22:4n−6)は各々ヒトエロンガーゼ活性の生成が予測されている。基質としてGLAを用いた場合、ヒトエロンガーゼcDNAを含有する酵母細胞に含まれるDGLAレベルは上昇しており、対照細胞と比較すると各々全脂肪酸の2.75%対0.09%であった(図45を参照のこと)。基質としてAAを用いた場合、、ヒトエロンガーゼcDNAを含有する酵母細胞に含まれるADAレベルは対照細胞と比較して上昇しており、各々全脂肪酸の未検出対1.21%であった。このように、ヒトエロンガーゼは18および20炭素鎖長のPUFAを共にその各々の伸長脂肪酸に変換する。
【0166】
ヒトエロンガーゼcDNAを含有する酵母細胞はまた対照株に比較して18:1n−7、20:1n−7、20:1n−9および18:1n−5などのモノ不飽和脂肪酸のレベルをも上昇させた。従って、これらの結果より同定されたヒトエロンガーゼはPUFAおよびモノ不飽和脂肪酸を基質として利用できることが示された。このように、このヒト配列HSELO1、およびそれにコードされるタンパク質は基質特異性とは独立してエロンガーゼ活性を有する。
【0167】
実施例XVII
シー・エレガンスPUFAエロンガーゼのクローニングおよび発現
いくつかの推定シー・エレガンスエロンガーゼで、翻訳GLELOおよびMAELOの両方に対してアミノ酸相同性が確立されている。ヒトcDNA配列を有するので、cDNAクローニングおよび酵母における発現により、これが本当にPUFAエロンガーゼであるかどうかを決定した。制限部位EcoRIおよびSalI(下線部)を有するプライマーRO738(5’−AAT CAG GAA TTC ATG GCT CAG CAT CCG CTC GTT CAA C−3’)およびRO739(5’−CCG CTT GTC GAC TTA GTT GTT CTT CTT CTT TGG CAC−3’)は各々、ゲノム配列U68749(ウォームペップcDNA受入番号:F56H11.4)に含まれる推定cDNA配列に基づいた。切除シー・エレガンスライブラリーcDNA(オリジーン・テクノロジーズ・インコーポレーティッド、ロックビル、メリーランド州)250ng、各プライマー50ピコモル、10X反応バッファー(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)10μl、10mM PCRヌクレオチドミックス1μl(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)およびTaqポリメラーゼ(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)2.5ユニットを含有する100μl容量でPCR増幅を行った。パーキン・エルマー9600(ノーウォーク、コネチカット州)の熱循環器条件は以下のとおりであった:95℃で5分間、次いで94℃、30秒間を25サイクル、55℃で2分間、および72℃で2分間。続いてさらに72℃で7分間PCRのサイクルを延長した。
【0168】
PCR増幅生成物をアガロースゲルから精製し、EcoRIおよびSalIで切断し、製造者プロトコルに従ってラピッド・ライゲーション・キット(ベーリンガー・マンハイム・コーポレーション、インディアナポリス、インディアナ州)を用いてpYX242にライゲートし、大腸菌Top10細胞(インビトロゲン・コーポレーション、カールスバッド、カリフォルニア州)に形質転換した。新規プラスミドをpRET−21およびpRET−22(ライゲーションによる2個の個々のクローン)と称し、373AストレッチDNAシークエンサーABI(パーキン・エルマー、フォスター・シティー、カリフォルニア州)でシークエンシングし、cDNA配列を同定した。推定エロンガーゼを含有するプラスミドpRET−22の867個の塩基のcDNAヌクレオチド配列を図46に示し、288個のアミノ酸の翻訳配列を図47に示す。(ブダペスト条約の条件下、1999年8月19日にプラスミドpRET−22をアメリカン・タイプ・オブ・カルチャー・コレクション、10801ボウルバード大学、マナサス、バージニア州20110−2209に寄託し、寄託番号 が付与された。)
前記するようにプラスミドpRET−21および−22をビール酵母菌334に形質転換し(実施例IIIを参照のこと)、得られた酵母培養物(334(pRET−21)および334(pRET−22))を50μM GLAおよびAAの存在下、ロイシン不含の選択培地100ml中(Ausubelら、前記で引用)20℃で48時間成長させた。細胞ペレットを収集し、脂肪酸分析に供し、結果を図48に示す。GLAの伸長により生成されると予測されるDGLAが2個のサンプルにおいて全脂質の平均1.79%見出され、これに対して陰性対照(プラスミドpYX242を含有する334)では0.13%であり、このことはpRET−21およびpRET−22の両方によりコードされる酵素がGLAエロンガーゼ活性を有していることが示された。334(pRET−21)および334(pRET−22)によるGLAのDGLAへの変換パーセントは各々11.1%および19.4%であり、平均15.25%であった。興味深いことに、AAまたは外因性の脂肪酸はほとんど全く伸長が観察されなかった(図48)。これらの結果によりこの新規に同定されたシー・エレガンスcDNA、CEELO1によりコードされるエロンガーゼはGLAをDGLAに特異的に伸長でき、このことにより、これがGLAエロンガーゼのシー・エレガンス相同体であり得ることが示唆される。
【0169】
実施例VIII
AC004050に基づく推定ヒトエロンガーゼcDNAの単離
AC004050配列に基づいて推定エロンガーゼcDNAの全長を単離するために、プライマーRP735(5’−CCT CCT GAA TTC CAQA CAC TAT TCA GCT TTC−3’)およびRO73(5’−TAA TAC GAC TCA CTA TAG GG−3’)を用いてヒト肝臓マラソン・レディーcDNA(クロンテック・ラボラトリーズ・インコーポレーティッド、パロ・アルト、カリフォルニア州)をPCR増幅した。製造者のプロトコルに従って、Advantage(登録商標) cDNA PCRキット(クロンテック・ラボラトリーズ・インコーポレーティッド、パロ・アルト、カリフォルニア州)を用いて、ヒト肝臓マラソン・レディーcDNA5μlおよび各プライマー50ピコモルでPCRを実施した。パーキン・エルマー9600(ノーウォーク、コネチカット州)の熱循環器条件は以下のとおりであった:94℃で2分間、次いで94℃、1分間を30サイクル、58℃で2分間、および72℃で3分間。続いてさらに72℃で7分間PCRのサイクルを延長した。
【0170】
PCR増幅生成物をゲルに流し、約1キロ塩基対の増幅フラグメントをゲル精製し、製造者の指示書に従って、フラグメントの末端をT4 DNAポリメラーゼ(ベーリンガー・マンハイム・コーポレーション、カールスバッド、カリフォルニア州)で埋めた。新規プラスミドをpRAE−59と称し、このプラスミドの推定PUFAエロンガーゼcDNAをHS3と称し、ABI 373Aストレッチ・シークエンサー(パーキン・エルマー、フォスター・シティー、カリフォルニア州)を用いてシークエンシングした。推定PUFAエロンガーゼcDNA配列HS3を図49に示し、翻訳配列を図50に示す。
【0171】
栄養組成物
発明の詳細な説明に記載のPUFAを、種々の栄養補助剤、乳児用粉乳、栄養代替剤、および他の栄養溶液に利用することができる。
【0172】
I.特殊調製粉乳
A.Isomil(登録商標)(鉄を含むダイズ製剤):
用途:牛乳に対してアレルギーまたは感受性を示す乳児、小児、および成人用の飲料。ラクトースを避けるべき疾患(ラクターゼ欠乏症、乳糖不耐症、およびガラクトース血症)の患者に与えるため。
【0173】
特徴:
−牛乳タンパク質のアレルギーまたは過敏症の症状を予防するためのダイズタンパク質単離物。
【0174】
−ラクトース関連の下痢を予防するための無ラクトース処方物。
【0175】
−浸透性下痢のリスクを減少させるための低浸透性(240mOs/kg水)。
【0176】
−炭水化物吸収を促進し、損傷した腸の過剰な吸収のリスクを減少させるように設計された2種の炭水化物(dual carbohydrates)。
【0177】
−鉄欠乏症の予防を補助するための100カロリーあたり1.8mgの鉄(硫酸第一鉄として)。
【0178】
−推奨レベルのビタミンおよびミネラル。
【0179】
−推奨レベルの必須脂肪酸を得るための植物油。
【0180】
−乳白色、ミルク様濃度、および好ましい香り。
成分:(Pareve)85%水、4.9%コーンシロップ、2.6%糖(スクロース)、2.1%ダイズ油、1.9%ダイズタンパク質単離物、1.4%ココナッツ油、0.15%クエン酸カルシウム、0.11%三塩基性リン酸カルシウム、クエン酸カリウム、塩基性リン酸カリウム、塩化カリウム、モノおよびジグリセリド、ダイズレシチン、カラゲナン、アスコルビン酸、L−メチオニン、塩化マグネシウム、二塩基性リン酸カリウム、塩化カルシウム、塩化コリン、タウリン、硫酸第一鉄、m−イノシトール、α−酢酸トコフェロール、硫酸亜鉛、L−カルニチン、ナイアシンアミド、パントテン酸カルシウム、硫酸銅、パルミチン酸ビタミンA、チアミンクロリド塩酸塩、リボフラビン、塩酸ピリドキシン、葉酸、硫酸マンガン、ヨウ化カリウム、フィロキノン、ビオチン、セレン酸ナトリウム、ビタミンD3、およびシアノコバラミン。
【0181】
B.Isomil(登録商標)DF(下痢用ダイズ処方物)。
【0182】
用途:乳児および幼児の食事管理用の短期摂食
特徴:特に下痢管理用のダイズ繊維由来の添加食物繊維を含む最初の乳児の処方物。
【0183】
−乳児の軽症または重症の下痢による軟らかい、水様便の持続期間を減少させることが臨床的に示されている。
【0184】
−乳児の栄養必要量を栄養的に完全に満たす。
【0185】
−乳児の全必須アミノ酸必要量を満たすか超える添加L−メチオニンを含むダイズタンパク単離物。
【0186】
−ラクトース関連の下痢を予防する無ラクトース処方物。
【0187】
−浸透圧性下痢のリスクを減少させる低浸透性(240 mOsm/kg水)。
【0188】
−炭水化物吸収を促進し、損傷した腸の過剰な吸収のリスクを減少させるように設計された2種の炭水化物。
【0189】
−Commitee of Nutrition of the American Academiy of Pediatricsに推奨され、Infant Formula Actで必要とされるビタミンおよびミネラルレベルを満たすか超えている。
【0190】
−鉄欠乏症の予防を補助するための100カロリーあたり1.8mgの鉄(硫酸第一鉄として)。
【0191】
−推奨レベルの必須脂肪酸を得るための植物油。
【0192】
成分:(Pareve)86%水、4.8%コーンシロップ、2.5%糖(スクロース)、2.1%ダイズ油、2.0%ダイズタンパク質単離物、1.4%ココナッツ油、0.77%ダイズ食物繊維、0.12%クエン酸カルシウム、0.11%三塩基性リン酸カルシウム、0.1%クエン酸カリウム、塩化カリウム、塩基性リン酸カリウム、モノおよびジグリセリド、ダイズレシチン、カラゲナン、塩化マグネシウム、アスコルビン酸、L−メチオニン、二塩基性リン酸カリウム、塩化ナトリウム、塩化コリン、タウリン、硫酸第一鉄、m−イノシトール、α−酢酸トコフェロール、硫酸亜鉛、L−カルニチン、ナイアシンアミド、パントテン酸カルシウム、硫酸銅、パルミチン酸ビタミンA、チアミンクロリド塩酸塩、リボフラビン、塩酸ピリドキシン、葉酸、硫酸マンガン、ヨウ化カリウム、フィロキノン、ビオチン、セレン酸ナトリウム、ビタミンD3、およびシアノコバラミン。
【0193】
C.Isomil(登録商標)SF(鉄を含む無スクロースダイズ製剤)
用途:牛乳タンパク質に対してアレルギーまたは感受性を示すかスクロース不耐の乳児、小児、および成人用の飲料。ラクトースおよびスクロースを避けるべき疾患の患者に与えるため。
【0194】
特徴:
−牛乳タンパク質のアレルギーまたは過敏症の症状を予防するためのダイズタンパク質単離物。
【0195】
−ラクトース関連の下痢を予防するための無ラクトース処方物(炭水化物源は、Polycose(登録商標)Glucose Polymerである)。
【0196】
−スクロース不耐患者用にスクロースを含まない。
【0197】
−浸透圧性下痢のリスクを減少させる低浸透性(180 mOsm/kg水)。
【0198】
−鉄欠乏症の予防を補助するための100カロリーあたり1.8mgの鉄(硫酸第一鉄として)。
【0199】
−推奨レベルのビタミンおよびミネラル。
【0200】
−推奨レベルの必須脂肪酸を得るための植物油。
【0201】
−乳白色、ミルク様濃度、および好ましい香り。
【0202】
成分:(Pareve)75%水、11.8%加水分解コーンスターチ、4.1%ダイズ油、4.1%ダイズタンパク質単離物、2.8%ココナッツ油、1.0%改変コーンスターチ、4.9%コーンシロップ、0.38%三塩基性リン酸カルシウム、0.17%クエン酸カリウム、0.13%塩化カリウム、モノおよびジグリセリド、ダイズレシチン、塩化マグネシウム、アスコルビン酸、L−メチオニン、炭酸カルシウム、塩化ナトリウム、塩化コリン、カラゲナン、タウリン、硫酸第一鉄、m−イノシトール、α−酢酸トコフェロール、硫酸亜鉛、L−カルニチン、ナイアシンアミド、パントテン酸カルシウム、硫酸銅、パルミチン酸ビタミンA、チアミンクロリド塩酸塩、リボフラビン、塩酸ピリドキシン、葉酸、硫酸マンガン、ヨウ化カリウム、フィロキノン、ビオチン、セレン酸ナトリウム、ビタミンD3、およびシアノコバラミン。
【0203】
D.Isomil(登録商標)20(調製済みの鉄を含むダイズ処方物(20Cal/オンス))
用途:ダイズ食が望ましい場合。
【0204】
成分:(Pareve)85%水、4.9%コーンシロップ、2.6%糖(スクロース)、2.1%ダイズ油、1.9%ダイズタンパク質単離物、1.4%ココナッツ油、0.15%クエン酸カルシウム、0.11%三塩基性リン酸カルシウム、クエン酸カリウム、塩基性リン酸カリウム、塩化カリウム、モノおよびジグリセリド、ダイズレシチン、カラゲナン、アスコルビン酸、L−メチオニン、塩化マグネシウム、二塩基性リン酸カリウム、塩化ナトリウム、塩化コリン、タウリン、硫酸第一鉄、m−イノシトール、α−酢酸トコフェロール、硫酸亜鉛、L−カルニチン、ナイアシンアミド、パントテン酸カルシウム、硫酸銅、パルミチン酸ビタミンA、チアミンクロリド塩酸塩、リボフラビン、塩酸ピリドキシン、葉酸、硫酸マンガン、ヨウ化カリウム、フィロキノン、ビオチン、セレン酸ナトリウム、ビタミンD3、およびシアノコバラミン。
【0205】
E.Similac(登録商標)(乳児用処方物)
用途:乳児用処方物が必要な場合。1歳未満の乳児に母乳栄養を継続できないと診断された場合、母乳栄養の補助食品が必要な場合、または母乳栄養不適用の場合の日常の摂食。
【0206】
特徴:
−ミルク関連腸出血のリスクを減少させる、良好な成長に適切な質および量の熱変性タンパク質。
【0207】
−容易に吸収される必須リノール酸が得られる植物油の混合物(2種類を均質化)由来の脂肪。
【0208】
−人乳と類似の比率のラクトースとしての炭水化物。
【0209】
−器官の発達に対するストレスを最小にするための低腎臓溶質負荷。
【0210】
−粉末、濃縮液、または調製済み処方物。
【0211】
成分:(Pareve)蒸留水、脱脂乳、ラクトース、ダイズ油、ココナッツ油、モノおよびジグリセリド、ダイズレシチン、アスコルビン酸、カラゲナン、塩化コリン、タウリン、m−イノシトール、α−酢酸トコフェロール、硫酸亜鉛、ナイアシンアミド、硫酸第一鉄、パントテン酸カルシウム、硫酸銅、パルミチン酸ビタミンA、チアミンクロリド塩酸塩、リボフラビン、塩酸ピリドキシン、葉酸、硫酸マンガン、フィロキノン、ビオチン、セレン酸ナトリウム、ビタミンD3、およびシアノコバラミン。
【0212】
F.Similac(登録商標)NeoCare(鉄を含む未熟乳児用処方物)
用途:退院後の未熟幼児の特別に栄養を必要とする場合。Similac NeoCareは、成長の遅れを取り戻すのを促進し、発達を支持するために必要な付加的なカロリー、タンパク質、ビタミン、およびミネラルを未熟児が得られるように開発された栄養的に完全な処方物である。
【0213】
特徴:
−カロリーおよびビタミン補助の必要性を減少させる。標準期間の処方物(20 Cal/オンス)よりカロリーが高い(22 Cal/オンス)。
【0214】
−未熟児の消化を特別に補助する中鎖トリグリセリド(MCTオイル)を含む、高吸収性脂肪酸混合物。
【0215】
−病院で開始される栄養補助を拡張するための100カロリーあたり高レベルのタンパク質、ビタミン、およびミネラルを含む。
【0216】
−骨鉱化作用改良用のより大量のカルシウムおよびリンを含む。
【0217】
成分:固体コーンシロップ、脱脂乳、ラクトース、ホエイタンパク濃縮物、ダイズ油、高オレイン酸ベニバナ油、分留ココナッツ油(中鎖トリグリセリド)、ココナッツ油、クエン酸カリウム、三塩基性リン酸カルシウム、炭酸カルシウム、アスコルビン酸、塩化マグネシウム、塩化カリウム、塩化ナトリウム、タウリン、硫酸第一鉄、m−イノシトール、塩化コリン、アスコルビン酸パルミテート、L−カルニチン、α−酢酸トコフェロール、硫酸亜鉛、ナイアシンアミド、混合トコフェロール、クエン酸ナトリウム、パントテン酸カルシウム、硫酸銅、チアミンクロリド塩酸塩、ビタミンAパルミテート、β−カロテン、リボフラビン、塩酸ピリドキシン、葉酸、硫酸マンガン、フィロキノン、ビオチン、セレン酸ナトリウム、ビタミンD3、およびシアノコバラミン。
【0218】
G.Similac Natural Care(調製済み低鉄人乳強化剤(24 Cal/オンス))。
【0219】
用途:人乳と混合するか低出生時体重の乳児に人乳と共にを与えるために設計されている。
【0220】
成分:蒸留水、脱脂乳、加水分解コーンスターチ、ラクトース、分留ココナッツ油(中鎖トリグリセリド)、ホエイタンパク質濃縮物、ダイズ油、ココナッツ油、三塩基性リン酸カルシウム、クエン酸カリウム、塩化マグネシウム、クエン酸ナトリウム、アスコルビン酸、炭酸カルシウム、モノおよびジグリセリド、ダイズレシチン、カラゲナン、塩化コリン、m−イノシトール、タウリン、ナイアシンアミド、L−カルニチン、α−酢酸トコフェロール、硫酸亜鉛、塩化カリウム、パントテン酸カルシウム、硫酸第一鉄、硫酸銅、リボフラビン、ビタミンAパルミテート、チアミンクロリド塩酸塩、塩酸ピリドキシン、ビオチン、葉酸、硫酸マンガン、フィロキノン、ビタミンD3、セレン酸ナトリウム、およびシアノコバラミン。
【0221】
本発明の種々のPUFAを、上記の乳児用処方物および他の当業者に公知の乳児用処方物と置換するか添加することができる。
【0222】
II.栄養処方物
A.ENSURE(登録商標)
用途:ENSUREは、主に、適切な量を食事中または食間に使用する経口栄養補助剤または食事の代わりとして用いるように設計された低残渣流動食である。ENSUREは、無ラクトースおよび無グルテンであり、低コレステロール食を含む加工食(modified diet)としての使用に適切である。主に経口補助剤であるが、チューブによって摂取させることができる。
【0223】
患者の健康状態:
−加工食を摂取している患者。
【0224】
−栄養危険性を有する高齢患者。
【0225】
−無意識に体重減少している患者。
【0226】
−疾患または手術から回復中の患者。
【0227】
−低残渣食を必要とする患者。
【0228】
成分:蒸留水、糖(スクロース)、マルトデキストリン(トウモロコシ)、カゼイン酸カルシウムおよびカゼイン酸ナトリウム、高オレイン酸ベニバナ油、ダイズタンパク質単離物、ダイズ油、カノーラ油、クエン酸カリウム、三塩基性リン酸カルシウム、クエン酸ナトリウム、塩化マグネシウム、二塩基性リン酸マグネシウム、人工香料、塩化ナトリウム、ダイズレシチン、コリンクロリド、アスコルビン酸、カラゲナン、硫酸亜鉛、硫酸第一鉄、α−酢酸トコフェロール、Gellanガム、ナイアシンアミド、パントテン酸カルシウム、硫化マンガン、硫酸銅、ビタミンAパルミテート、チアミンクロリド塩酸塩、塩酸ピリドキシン、リボフラビン、葉酸、モリブデン酸ナトリウム、塩化クロム、ビオチン、ヨウ化カリウム、セレン酸ナトリウム。
【0229】
B.ENSURE(登録商標)BARS
用途:ENSURE BARSは、食間または食事中に使用される完全にバランスの取れた栄養素である。ENSURE BARSは、他のスナックより美味で、栄養豊富である。ENSURE BARSは、バーあたり1g未満のラクトースを含み、チョコレート味のブラウニー風味は、グルテンを含まない(ハニーグラハムクランチ風味は、グルテンを含む)。
【0230】
患者の健康状態:
−付加的にカロリー、タンパク質、ビタミン、およびミネラルを必要とする患者。
【0231】
−十分なカロリーおよび栄養素を摂取できない患者に特に有用である。
【0232】
−咀嚼および嚥下することができる患者。
【0233】
−ビーナッツアレルギーまたは任意の型のナッツアレルギーを有する患者には使用しない。
【0234】
成分:ハニーグラハムクランチ−−高フルクトースコーンシロップ、ダイズタンパク質、黒砂糖、ハチミツ、マルトデキストリン(トウモロコシ)、Crisp Rice(製粉したコメ、糖(スクロース)、塩(塩化ナトリウム)、および麦芽)、カラスムギのふすま、部分水素付加綿実油およびダイズ油、ダイズ多糖類、グリセリン、ホエイタンパク質濃縮物、ポリデキストリン、フルクトース、カゼイン酸カルシウム、コカ粉末、人工香料、カノーラ油、高オレイン酸ベニバナ油、脱脂粉乳、ホエイ粉末、ダイズレシチン、およびトウモロコシ油。ナッツを加工する施設で製造される。
【0235】
ビタミンおよびミネラル:三塩基性リン酸カルシウム、二塩基性リン酸カリウム、酸化マグネシウム、塩(塩化ナトリウム)、塩化カリウム、アスコルビン酸、オルトリン酸第二鉄、α−酢酸トコフェロール、ナイアシンアミド、酸化鉛、パントテン酸カルシウム、グルコン酸銅、硫酸マンガン、リボフラン、β−カロテン、塩酸ピリドキシン、チアミン硝酸塩、葉酸、ビオチン、塩化クロム、ヨウ化カリウム、セレン酸ナトリウム、モリブデン酸ナトリウム、フィロキノン、ビタミンD3、およびシアノコバラミン。
【0236】
タンパク質:ハニーグラハムクランチ−タンパク質供給源は、ダイズタンパク質単離物とミルクタンパク質との混合物である。
【0237】
ダイズタンパク質単離物 74%
ミルクタンパク質 26%
脂肪:ハニーグラハムクランチ−脂肪供給源は、部分的水素付加綿実油、ダイズ油、カノーラ油、高オレイン酸ベニバナ油、およびダイズレシチンとの混合物である。
部分的水素付加綿実油およびダイズ油 76%
カノーラ油 8%
高オレイン酸ベニバナ油 8%
トウモロコシ油 4%
ダイズレシチン 4%
炭水化物:ハニーグラハムクランチ−炭素供給源は、高フルクトースコーンシロップ、黒砂糖、マルトデキストリン、ハチミツ、クリスプライス(crisp rice)、グリセリン、ダイズ多糖類、およびカラスムギふすまの組み合わせである。
【0238】
高フルクトースコーンシロップ 24%
黒砂糖 21%
マルトデキストリン 12%
ハチミツ 11%
crisp rice 9%
グリセリン 9%
ダイズ多糖類 7%
カラスムギふすま 7%
C.ENSURE(登録商標)HIGH PROTEIN
用途:ENSUREHIGH PROTEINは、食事で付加的なカロリー、タンパク質、ビタミン、およびミネラルを必要とする患者用に設計された濃縮高タンパク質流動食である。これは、食事中もしくは食間の経口補助剤として、または適切な量を食事の代わりとして使用することができる。ENSURE HIGH PROTEINは、無ラクトースおよび無グルテンであり、一般的な手術または臀部骨折から回復しつつある患者および圧迫潰瘍のリスクを負う患者への使用に適切である。
【0239】
患者の健康状態:
−付加的なカロリー、タンパク質、ビタミン、およびミネラルを必要とする患者(一般的な手術または臀部骨折から回復しつつある患者および圧迫潰瘍のリスクを負う患者および低コレステロール食患者など)。
【0240】
特徴:
−低飽和脂肪。
【0241】
−1回の食事あたり全脂質の6gの脂質およびコレステロールの5mg未満を含む。
【0242】
−コクがあり、軟らかい。
【0243】
−タンパク質、カルシウム、ならびに他の必須ビタミンおよびミネラルの優れた供給源である。
【0244】
−低コレステロール食用である。
【0245】
−無ラクトースで容易に消化される。
【0246】
成分:バニラシュープレーム:蒸留水、糖(スクロース)、マルトデキストリン(トウモロコシ)、カゼイン酸カルシウムおよびカゼイン酸ナトリウム、高オレイン酸ベニバナ油、ダイズタンパク質単離物、ダイズ油、カノーラ油、クエン酸カリウム、三塩基性リン酸カルシウム、クエン酸ナトリウム、塩化マグネシウム、二塩基性リン酸マグネシウム、人工香料、塩化ナトリウム、ダイズレシチン、塩化コリン、アスコルビン酸、カラゲナン、硫酸亜鉛、硫酸第一鉄、α−酢酸トコフェロール、Gellanガム、ナイアシンアミド、パントテン酸カルシウム、硫酸マンガン、硫酸銅、パルミチン酸ビタミンA、チアミンクロリド塩酸塩、塩酸ピリドキシン、リボフラビン、葉酸、モリブデン酸ナトリウム、塩化クロム、ビオチン、ヨウ化カリウム、セレン酸ナトリウム、フィロキノン、ビタミンD3、およびシアノコバラミン。
【0247】
タンパク質:タンパク質供給源は、2つの生物学的に価値の高いタンパク質(カゼインおよびダイズ)の混合物である。
【0248】
カゼイン酸ナトリウムおよびカゼイン酸カルシウム 85%
タンパク質単離物 15%
脂肪:脂肪供給源は、3つのオイル(高オレイン酸ベニバナ油、カノーラ油、およびダイズ油)の混合物である。
【0249】
高オレイン酸ベニバナ油 40%
カノーラ油 30%
ダイズ油 30%
ENSURE HIGH PROTEIN中の脂肪レベルは、米国心臓病協会(AHA)のガイドラインを満たす。ENSURE HIGH PROTEIN中の6gの脂肪は、全カロリーの24%を占め、そのうち2.6%の脂肪は飽和脂肪酸に由来し、7.9%はポリ不飽和脂肪酸に由来する。これらの値は、AHAガイドライン(脂肪由来の全カロリーの30%未満、飽和脂肪酸由来の10%未満のカロリー、およびポリ不飽和脂肪酸由来の全カロリーの10%未満)の範囲内である。
【0250】
炭水化物:ENSURE HIGH PROTEINは、マルトデキストリンとスクロースとの組み合わせを含む。ほのかに甘い、種々の風味(バニラシュプリーム、チョコレートロイヤル、ワイルドベリー、およびバナナ)ならびにペカン、チェリー、ストロベリー、レモン、およびオレンジの香りのVARI−FLAVORS(登録商標)Flavor Pacsは、風味に関する不快感を避ける一助となり、患者の服薬遵守の援助となる。
バニラおよび他のチョコレート以外の風味は以下である。
【0251】
スクロース 60%
マルトデキストリン 40%
チョコレート:
スクロース 70%
マルトデキストリン 30%
D.ENSURE(登録商標)LIGHT
用途:ENSURE LIGHTは、食事中または食間に用いる経口栄養補助剤として使用するために設計された低脂肪流動食である。ENSURE LIGHTは、無ラクトースおよび無グルテンであり、低コレステロール食を含む加工食としての使用に適切である。
【0252】
患者の健康状態:
−ENSUREより50%低い脂肪および20%低いカロリーを含む栄養補助食品中に付加的な栄養を必要とする正常な体重または超過体重の患者用。
【0253】
−正確で必要な付加的栄養素を摂ることができない健常な成人。
【0254】
特徴:
−低脂肪および低飽和脂肪
−1回の食事あたり3gの全脂肪および5mg未満のコレステロールを含む。
【0255】
−コクがあり、軟らかい。
【0256】
−カルシウムおよび他の必須ビタミンならびにミネラルの優れた供給源である。
【0257】
−低コレステロール食である。
【0258】
−無ラクトースであり、容易に消化される。
【0259】
成分:フレンチバニラ:蒸留水、マルトデキストリン(トウモロコシ)、糖(スクロース)、カゼイン酸カルシウム、高オレイン酸ベニバナ油、カノーラ油、塩化マグネシウム、クエン酸カリウム、二塩基性リン酸カリウム、二塩基性リン酸マグネシウム、天然香料および人工香料、三塩基性リン酸カルシウム、Gellanガム、塩化コリン、ダイズレシチン、カラゲナン、塩(塩化ナトリウム)、アスコルビン酸、セルロースガム、硫酸第一鉄、α−酢酸トコフェロール、硫酸亜鉛、ナイアシンアミド、硫酸マンガン、パントテン酸カルシウム、硫酸銅、チアミンクロリド塩酸塩、パルミチン酸ビタミンA、塩酸ピリドキシン、リボフラビン、塩化クロム、葉酸、モリブデン酸ナトリウム、ビオチン、ヨウ化カリウム、セレン酸ナトリウム、フィロキノン、ビタミンD3、およびシアノコバラミン。
【0260】
タンパク質:
タンパク質供給源は、カゼイン酸カルシウムである。
【0261】
カゼイン酸カルシウム 100%
脂肪:脂肪供給源は、2つのオイル(高オレイン酸ベニバナ油およびカノーラ油)の混合物である。
【0262】
高オレイン酸ベニバナ油 70%
カノーラ油 30%
ENSURE LIGHT中の脂肪レベルは、米国心臓病協会(AHA)のガイドラインを満たす。ENSURE LIGHT中の3gの脂肪は、全カロリーの13.5%を占め、そのうち1.4%の脂肪は飽和脂肪酸に由来し、2.6%はポリ不飽和脂肪酸に由来する。これらの値は、AHAガイドライン(脂肪由来の全カロリーの30%未満、飽和脂肪酸由来の10%未満のカロリー、およびポリ不飽和脂肪酸由来の全カロリーの10%未満)の範囲内である。
【0263】
炭水化物:ENSURE LIGHTは、マルトデキストリンとスクロースとの組み合わせを含む。チョコレート風味はコーンシロップなどを含む。ほのかに甘い種々の風味(フレンチバニラ、チョコレートシュプリーム、ストロベリースワール)ならびにペカン、チェリー、ストロベリー、レモン、およびオレンジの香りのVARI−FLAVORS(登録商標)Flavor Pacsは、風味に関する不快感を避ける一助となり、患者の服薬遵守の援助となる。
バニラおよび他のチョコレート以外の風味は以下である。
【0264】
スクロース 51%
マルトデキストリン 49%
チョコレート
スクロース 47.0%
コーンシロップ 26.5%
マルトデキストリン 26.5%
ビタミンおよびミネラル:食事あたり8オンスのENSURE LIGHTで、24種類の重要なビタミンおよびミネラルのRDIの少なくとも24%が得られる。
【0265】
カフェイン:チョコレート香料には、8オンスあたり2.1mgのカフェインを含む。
【0266】
E.ENSURE PLUS(登録商標)
用途:ENSURE PLUSは、付加的なカロリーおよび栄養素が必要であるが、通常のタンパク質濃度が必要な場合の、高カロリーの低残渣流動食である。これは、主に、食事中または食間に使用する経口栄養補助食品としてまたは適切な量を食事の代わりとして使用するように設計されている。ENSURE PLUSは、無ラクトースおよび無グルテンである。主に経口補助剤であるが、チューブによって摂取させることができる。
【0267】
患者の健康状態:
−限られた体積で付加的なカロリーおよび栄養素が必要であるが、通常のタンパク質濃度が必要な患者。
【0268】
−健常な体重に増加させるか維持することを必要とする患者。
【0269】
特徴:
−コクがあり、軟らかい。
【0270】
−必須ビタミンおよびミネラルの良好な供給源である。
【0271】
成分:バニラ:蒸留水、コーンシロップ、マルトデキストリン(トウモロコシ)、トウモロコシ油、カゼイン酸ナトリウムおよびカゼイン酸カルシウム、糖(スクロース)、ダイズタンパク質単離物、塩化マグネシウム、クエン酸カリウム、三塩基性リン酸カルシウム、ダイズレシチン、天然香料および人工香料、クエン酸ナトリウム、塩化カリウム、塩化コリン、アスコルビン酸、カラゲナン、硫酸亜鉛、硫酸第一鉄、α−酢酸トコフェロール、ナイアシンアミド、パントテン酸カルシウム、硫酸マンガン、硫酸銅、チアミンクロリド塩酸塩、塩酸ピリドキシン、リボフラビン、パルミチン酸ビタミンA、葉酸、ビオチン、塩化クロム、モリブデン酸ナトリウム、ヨウ化カリウム、セレン酸ナトリウム、フィロキノン、シアノコバラミン、およびビタミンD3。
【0272】
タンパク質:タンパク質供給源は、2つの生物学的に価値の高いタンパク質(カゼインおよびダイズ)の混合物である。
カゼイン酸ナトリウムおよびカゼイン酸カルシウム 84%
タンパク質単離物 16%
脂肪:脂肪源はトウモロコシ油である。
【0273】
トウモロコシ油 100%
炭水化物:ENSURE PLUSは、マルトデキストリンとスクロースとの組み合わせである。ほのかに甘い、種々の風味(バニラ、チョコレート、ストロベリー、コーヒー、バターペカン、およびエッグノッグ)ならびにペカン、チェリー、ストロベリー、レモン、およびオレンジの香りのVARI−FLAVORS(登録商標)Flavor Pacsは、風味に関する不快感を避ける一助となり、患者の服薬遵守の援助となる。
【0274】
バニラ、ストロベリー、バターペカン、およびコーヒー風味は以下を含む。
【0275】
コーンシロップ 39%
マルトデキストリン 38%
スクロース 23%
チョコレートおよびエッグノッグ風味は以下を含む。
【0276】
コーンシロップ 36%
マルトデキストリン 34%
スクロース 30%
ビタミンおよびミネラル:食事あたり8オンスのENSURE PLUSで、25種類の重要なビタミンおよびミネラルのRDIの少なくとも15%が得られる。
【0277】
カフェイン:チョコレート香料には、8オンスあたり3.1mgのカフェインを含む。コーヒー香料には微量のカフェインを含む。
【0278】
F.ENSURE PLUS(登録商標)HN
用途:ENSURE PLUS HNは、高カロリーおよび高タンパク質を必要とするか摂取体積が制限される患者用に設計された、栄養的に完全な高カロリーおよび高窒素流動食である。これは、経口での栄養補給またはチューブによる全栄養支持に有用であり得る。ENSURE PLUS HNは、無ラクトースおよび無グルテンである。
【0279】
患者の健康状態:
−手術後または損傷後などのカロリーおよびタンパク質の増加が必要な患者。
【0280】
−摂取体積が制限され、すぐに満腹になる患者。
【0281】
特徴:
−補助または全栄養補給に使用される。
【0282】
−経口またはチューブによる食物摂取用。
【0283】
−1.5 CaVmL。
【0284】
−高窒素。
【0285】
−カロリー密度が高い。
【0286】
成分:バニラ:蒸留水、マルトデキストリン(トウモロコシ)、カゼイン酸ナトリウムおよびカゼイン酸カルシウム、トウモロコシ油、糖(スクロース)、ダイズタンパク質単離物、塩化マグネシウム、クエン酸カリウム、三塩基性リン酸カルシウム、ダイズレシチン、天然香料および人工香料、クエン酸ナトリウム、塩化コリン、アスコルビン酸、タウリン、L−カルニチン、硫酸亜鉛、硫酸第一鉄、α−酢酸トコフェロール、ナイアシンアミド、カラゲナン、パントテン酸カルシウム、硫酸マンガン、硫酸銅、チアミンクロリド塩酸塩、塩酸ピリドキシン、リボフラビン、パルミチン酸ビタミンA、葉酸、ビオチン、塩化クロム、モリブデン酸ナトリウム、ヨウ化カリウム、セレン酸ナトリウム、フィロキノン、シアノコバラミン、およびビタミンD3。
【0287】
G.ENSURE(登録商標)POWDER
用途:ENSURE POWDER(水で再生される)は、主に、食事中または食間に使用される経口栄養補助剤として設計された低残渣流動食である。ENSURE POWDERは、無ラクトースおよび無グルテンであり、低カロリー食を含む加工食としての使用に適切である。
【0288】
患者の健康状態:
−加工食を摂取している患者。
【0289】
−栄養危険性を有する高齢患者。
【0290】
−疾患/手術から回復中の患者。
【0291】
−低残渣食を必要とする患者。
【0292】
特徴:
−便利で混合が容易。
【0293】
−低飽和脂肪。
【0294】
−1回の食事あたり9gの全脂肪および5mg未満のコレステロールを含む。
【0295】
−高ビタミンおよびミネラル。
【0296】
−低コレステロール食。
【0297】
−無ラクトースで消化しやすい。
【0298】
成分:蒸留水、コーンシロップ、マルトデキストリン(トウモロコシ)、糖(スクロース)、トウモロコシ油、カゼイン酸ナトリウムおよびカゼイン酸カルシウム、ダイズタンパク質単離物、人工香料、クエン酸カリウム、塩化マグネシウム、クエン酸ナトリウム、三塩基性リン酸カルシウム、塩化カリウム、ダイズレシチン、アスコルビン酸、塩化コリン、硫酸亜鉛、硫酸第一鉄、α−酢酸トコフェロール、ナイアシンアミド、パントテン酸カルシウム、硫酸マンガン、チアミンクロリド塩酸塩、硫酸銅、塩酸ピリドキシン、リボフラビン、パルミチン酸ビタミンA、葉酸、ビオチン、モリブデン酸ナトリウム、塩化クロム、ヨウ化カリウム、セレン酸ナトリウム、フィロキノン、ビタミンD3、およびシアノコバラミン。
【0299】
タンパク質:タンパク質供給源は、2つの生物学的に価値の高いタンパク質(カゼインおよびダイズ)である。
【0300】
カゼイン酸ナトリウムおよびカゼイン酸カルシウム 84%
タンパク質単離物 16%
脂肪:脂肪供給源はトウモロコシ油である。
【0301】
トウモロコシ油 100%
炭水化物:ENSURE POWDERは、コーンシロップ、マルトデキストリンとスクロースとの組み合わせである。ENSURE POWDERのほのかに甘さならびにペカン、チェリー、ストロベリー、レモン、およびオレンジの香りのVARI−FLAVORS(登録商標)Flavor Pacsは、風味に関する不快感を避ける一助となり、患者の服薬遵守の援助となる。
【0302】
バニラ:
コーンシロップ 35%
マルトデキストリン 35%
スクロース 30%
H.ENSURE(登録商標)PUDDING
用途:ENSURE PUDDINGは、食事中および食間に使用される非液体形態のバランスのとれた栄養素を得るための栄養密度の高い補助食品である。これは、継続的な加工食(たとえば、軟らかい、ピューレ状、または完全な液体)を摂取している患者および嚥下障害患者に適切である。ENSURE PUDDINGは、無グルテンである。
【0303】
患者の健康状態:
−継続的な加工食(例えば、軟らかい、ピューレ状、または完全な液体)を摂取している患者。
【0304】
−嚥下障害患者。
【0305】
特徴:
−コクがあり、軟らかく、味がよい。
【0306】
−必須ビタミン、およびミネラルの良好な供給源である。
【0307】
−冷蔵不要で便利。
【0308】
−無グルテン。
【0309】
5オンスあたりの栄養プロフィールは、250カロリー、タンパク質10.9%、全脂肪34.9%、炭水化物54.2%である。
【0310】
成分:脱脂乳、水、糖(スクロース)、部分的に水素負荷したダイズ油、加工食品デンプン、硫酸マグネシウム、ステアロイルラクチリン酸ナトリウム、二塩基性リン酸ナトリウム、人工香料、アスコルビン酸、硫酸亜鉛、硫酸第一鉄、α−酢酸トコフェロール、塩酸コリン、ナイアシンアミド、硫酸マンガン、パントテン酸カルシウム、FD&C Yellow #5、クエン酸カリウム、硫酸銅、ビタミンAパルミテート、チアミンクロリド塩酸塩、塩酸ピリドキシン、リボフラビン、FD&C Yellow #6、葉酸、ビオチン、フィロキノン、ビタミンD3、およびシアノコバラミン。
【0311】
タンパク質:タンパク質供給源は、脱脂乳である。
【0312】
脱脂乳 100%
脂肪:脂肪供給源は、水素付加ダイズ油である。
【0313】
水素付加ダイズ油 100%
炭水化物:ENSURE PUDDINGは、スクロースと加工食品デンプンの組み合わせである。ほのかな甘さおよび多種の風味(バニラ、チョコレート、バタースカッチ、およびタピオカ)は、風味に関する不快感を避ける一助となる。製品には、1回の食事あたり9.2グラムのラクトースを含む。
【0314】
バニラおよび他のチョコレート以外の風味は以下である。
【0315】
スクロース 56%
ラクトース 27%
加工食品デンプン 17%
チョコレート:
スクロース 58%
ラクトース 26%
加工食品デンプン 16%
I.ENSURE(登録商標)WITH FIBER。
【0316】
用途:ENSURE WITH FIBERは、食物繊維および栄養素を強化することに利点を有し得る患者用に設計された、食物繊維を含む栄養的に完全な流動食である。ENSURE WITH FIBERは、低残渣食を必要としない患者に適切である。これは、経口およびチューブによって摂取させることができ、通常の食事の栄養補助剤として、または適切な量を食事の代わりとして与えることができる。ENSURE WITH FIBERは、無ラクトースおよび無グルテンであり、低コレステロール食を含む加工食としての使用に適切である。
【0317】
患者の健康状態:
−食物繊維および栄養素を強化することに利点を有しうる患者用。
【0318】
特徴:
−低飽和脂肪酸、高ビタミンおよび高ミネラルの新規の進歩した処方物。
【0319】
−1回の食事あたり6gの全脂肪および5mg未満のコレステロールを含む。
【0320】
−コクがあり、軟らかい。
【0321】
−良好な繊維の供給源。
【0322】
−必須ビタミンおよびミネラルの優れた供給源。
【0323】
−低コレステロール食。
【0324】
−ラクトースおよびグルテンを含まない。
【0325】
成分:蒸留水、マルトデキストリン(トウモロコシ)、糖(スクロース)、カゼイン酸ナトリウムおよびカゼイン酸カルシウム、カラスムギ繊維、高オレイン酸ベニバナ油、カノーラ油、ダイズタンパク質単離物、トウモロコシ油、ダイズ繊維、三塩基性リン酸カルシウム、塩化マグネシウム、クエン酸カリウム、セルロースゲル、ダイズレシチン、二塩基性リン酸カリウム、クエン酸ナトリウム、天然および人工香料、塩化コリン、リン酸マグネシウム、アスコルビン酸、セルロースガム、塩化カリウム、カラゲナン、硫酸第一鉄、α−酢酸トコフェロール、硫酸亜鉛、ナイアシンアミド、硫酸マンガン、パントテン酸カルシウム、硫酸銅、パルミチン酸ビタミンA、チアミンクロリド塩酸塩、塩酸ピリドキシン、リボフラビン、葉酸、塩化クロム、ビオチン、モリブデン酸ナトリウム、ヨウ化カリウム、セレン酸ナトリウム、フィロキノン、ビタミンD3、およびシアノコバラミン。
【0326】
タンパク質:タンパク質供給源は、2つの生物学的に価値の高いタンパク質(カゼインおよびダイズ)の混合物である。
【0327】
カゼイン酸ナトリウムおよびカゼイン酸カルシウム 80%
タンパク質単離物 20%
脂肪:脂肪供給源は、3つのオイル(高オレイン酸ベニバナ油、カノーラ油、およびダイズ油)の混合物である。
【0328】
高オレイン酸ベニバナ油 40%
カノーラ油 40%
ダイズ油 20%
ENSURE WITH FIBER中の脂肪レベルは、米国心臓病協会(AHA)のガイドラインを満たす。ENSURE WITH FIBER中の6gの脂肪は、全カロリーの22%を占め、そのうち2.01%の脂肪は飽和脂肪酸に由来し、6.7%はポリ不飽和脂肪酸に由来する。これらの値は、AHAガイドライン(脂肪由来の全カロリーの30%以下、飽和脂肪酸由来の10%以下のカロリー、およびポリ不飽和脂肪酸由来の全カロリーの10%以下)の範囲内である。
【0329】
炭水化物:ENSURE WITH FIBERは、マルトデキストリンとスクロースとの組み合わせを含む。ほのかに甘く、種々の風味(バニラ、チョコレート、およびバターペカン)ならびにペカン、チェリー、ストロベリー、レモン、およびオレンジの香りのVARI−FLAVORS(登録商標)Flavor Pacsは、風味に関する不快感を避ける一助となり、患者の服薬遵守の援助となる。
【0330】
バニラおよび他のチョコレート以外の風味は以下である。
【0331】
マルトデキストリン 66%
スクロース 25%
カラスムギ繊維 7%
ダイズ繊維 2%
チョコレート
マルトデキストリン 55%
スクロース 36%
カラスムギ繊維 7%
ダイズ繊維 2%
繊維:ENSURE WITH FIBERで使用される繊維混合物は、カラスムギ繊維およびダイズ繊維からなる。この混合物により、8オンス缶あたり全食物繊維の約4グラムが得られる。不溶性繊維:可溶性繊維は95:5である。
【0332】
上記および当業者に公知の種々の栄養補助剤を、本発明で作製したPUFAと置換および/または補充することができる。
【0333】
J.OxepaTM栄養製品。
【0334】
Oxepaは、ARDS患者またはその疑いのある患者の食事管理用に設計された、低炭水化物でカロリー密度が高い経腸栄養製品である。これは、エイコサペンタエン酸(魚油由来のEPA)、γ−リノレン酸(ルリヂサ油由来のGLA)を含み、抗酸化レベルを高めた特許油混合物を含む固有の成分の組み合わせである。
【0335】
カロリー分布:
エネルギーの必要量を満たすために必要な体積を最小にするために、カロリー密度は高い(1.5 Cal/mL(355 Cal/8オンス))。
【0336】
【表3】

【0337】
脂肪:
−Oxepaは、8オンスの食事(93.7g/L)あたり22.2gの脂肪を含む。
【0338】
−脂肪供給源は、31.8%カノーラ油、25%中鎖トリグリセリド(MCT)、20%ルリヂサ油、20%魚油、および3.2%ダイズレシチンとのオイル混合物である。Oxepaの典型的な脂肪酸プロフィールを、表Vに示す。
【0339】
−表VIに示すように、Oxepaによれば、バランスの取れた量のポリ不飽和脂肪酸、一不飽和脂肪酸、および飽和脂肪酸が得られる。
【0340】
−中鎖トリグリセリド(MCT)(脂肪混合物の25%)は、胆汁酸によって乳化されることなく腸管によって吸収されるので、胃排出の一助となる。
【0341】
OxepaTM栄養製品の種々の脂肪酸構成成分を、本発明で作製したPUFAと置換および/または補充することができる。
【0342】
【表4】

脂肪酸は、全脂肪の約95%に相当する。
【0343】
【表5】

【0344】
炭水化物:
−炭水化物含有量は、8オンス(105.5g/L)の1回の食事あたり25.0gである。
【0345】
−炭水化物供給源は、45%マルトデキストリン(炭水化物複合体)および55%スクロース(単糖類)であり、これらは共に容易に消化吸収される。
【0346】
−Oxepaの高脂肪および低炭水化物成分を、二酸化炭素(CO2)生成が最小になるように設計する。高CO2レベルは、人工呼吸器に依存している患者の離乳を複雑にし得る。低レベルの炭水化物はまた、ストレス誘導性高血糖症患者に有用であり得る。
【0347】
−Oxepaは、無ラクトースである。
【0348】
食物炭水化物、タンパク質由来のアミノ酸、および脂肪のグリセロール部分を、体内のグルコースと変換することができる。この過程の間中、グルコース依存性組織(中枢神経系および赤血球など)の炭水化物要求が満たされる。しかし、炭水化物を含まない食事は、ケトーシス、組織タンパク質の過剰な異化、および体液および電解質の欠乏を誘導し得る。これらの効果を、カロリー摂取が適切である場合、50gから00gの消化しやすい炭水化物の毎日の注射によって予防することができる。Oxepa中の炭水化物レベルはまた、エネルギー要求が満たされる場合、糖新生を最小にするのに十分である。
【0349】
タンパク質:
−Oxepaは、8オンスの1回の食事(62.5g/L)あたり14.8gのタンパク質を含む。
【0350】
−全カロリー/窒素比(150:1)は、ストレス患者の要求を満たす。
【0351】
−Oxepaによれば、呼吸困難を誘発することなく同化作用の促進および除脂肪体重の維持に十分なタンパク質が得られる。高タンパク質の摂取は、胚不全患者に重要である。タンパク質は、CO2産生に対してほとんど効果がないにもかかわらず、高タンパク質食は、人工呼吸器の運転性を向上させる。
【0352】
−Oxepaのタンパク質供給源は、86.8%のカゼイン酸ナトリウムおよび13.2%のカゼイン酸カルシウムである。
【0353】
−Oxepaにおけるタンパク質系のアミノ酸プロフィールは、科学アカデミーによって設定された高品質のタンパク質の基準を満たすか超える。
【0354】
*Oxepaは、無グルテンである。
【0355】
【表6】




【特許請求の範囲】
【請求項1】
配列番号1(図6)に示すヌクレオチド配列の約50%に一致するまたは相補的である単離ヌクレオチド配列。
【請求項2】
前記配列が配列番号1で表されることを特徴とする請求項1に記載の単離ヌクレオチド配列。
【請求項3】
前記配列が、ポリ不飽和脂肪酸またはモノ不飽和脂肪酸を基質として利用する機能的に活性なエロンガーゼをコードすることを特徴とする請求項1または2に記載の単離ヌクレオチド配列。
【請求項4】
前記配列がMortirella属の真菌から誘導されることを特徴とする請求項1に記載のヌクレオチド配列。
【請求項5】
前記真菌がalpina種であることを特徴とする請求項4に記載のヌクレオチド配列。
【請求項6】
請求項1または2に記載の前記ヌクレオチド配列によってコードされた精製タンパク質。
【請求項7】
ポリ不飽和脂肪酸またはモノ不飽和脂肪酸を伸張させる精製タンパク質であり、かつ請求項6に記載の前記精製タンパク質のアミノ酸配列と約50%のアミノ酸類似性を有する精製ポリペプチド。
【請求項8】
a)配列番号1(図6)で表される前記ヌクレオチド配列を単離する工程と、
b)i)プロモーター、およびii)該プロモーターに機能的に連結した前記単離ヌクレオチド配列を含むベクターを構築する工程と、
c)前記エロンガーゼ酵素の発現に十分な時間および条件の下で、前記ベクターを宿主細胞に導入する工程とを含むエロンガーゼ酵素の製造方法。
【請求項9】
前記宿主細胞が真核細胞または原核細胞から成る群から選択されることを特徴とする請求項8に記載の方法。
【請求項10】
前記原核細胞が、E.coli、CyanobacteriaおよびB.subtilisから成る群から選択されることを特徴とする請求項9に記載の方法。
【請求項11】
前記真核細胞が、哺乳動物細胞、昆虫細胞、植物細胞および真菌細胞から成る群から選択されることを特徴とする請求項9に記載の方法。
【請求項12】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Lipomyces starkey、Yarrowia spp.、Kluyveromyces spp.、Hansenula spp.、Aspergillus spp.、Penicillium spp.、Neurospora spp.、Trichoderma spp.およびPichia spp.から成る群から選択されることを特徴とする請求項11に記載の方法。
【請求項13】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Hansenula spp.およびPichia spp.から成る群から選択された酵母菌細胞であることを特徴とする請求項11に記載の方法。
【請求項14】
前記酵母菌細胞が、Saccharomyces cerevisiaeであることを特徴とする請求項13に記載の方法。
【請求項15】
a)プロモーターおよびb)該ブロモーターに機能的に連結した配列番号1(図6)によって表されるヌクレオチド配列を含むベクター。
【請求項16】
請求項15に記載の前記ベクターを含む宿主細胞。
【請求項17】
前記宿主細胞が真核細胞または原核細胞から成る群から選択されることを特徴とする請求項16に記載の宿主細胞。
【請求項18】
前記原核細胞が、E.coli、CyanobacteriaおよびB.subtilisから成る群から選択されることを特徴とする請求項17に記載の宿主細胞。
【請求項19】
前記真核細胞が、哺乳動物細胞、昆虫細胞、植物細胞および真菌細胞を含む群から選択されることを特徴とする請求項17に記載の宿主細胞。
【請求項20】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Lipomyces starkey、Yarrowia spp.、Kluyveromyces spp.、Hansenula spp.、Aspergillus spp.、Penicillium spp.、Neurospora spp.、Trichoderma spp.およびPichia spp.から成る群から選択されることを特徴とする請求項19に記載の宿主細胞。
【請求項21】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Hansenula spp.およびPichia spp.から成る群から選択された酵母菌細胞であることを特徴とする請求項20に記載の宿主細胞。
【請求項22】
前記宿主細胞が、Saccharomyces cerevisiaeであることを特徴とする請求項21に記載の宿主細胞。
【請求項23】
請求項15に記載のベクターを含む植物細胞、植物または植物組織であって、前記ベクターの前記ヌクレオチド配列の発現が、前記植物細胞、植物または植物組織による、モノ不飽和脂肪酸およびポリ不飽和脂肪酸から成る群から選択された少なくとも一つの脂肪酸の生成をもたらすことを特徴とする、前記植物細胞、植物または植物であって、前記植物細胞、植物または植物組織。
【請求項24】
前記ポリ不飽和脂肪酸が、ジホモ−γ−リノレン酸(DGLA)、20:4n−3およびアドレニン酸(ADA)から成る群から選択されることを特徴とする請求項23に記載の植物細胞、植物または植物組織。
【請求項25】
請求項23に記載の植物細胞、植物または植物組織によって発現される一つまたは複数の植物油または脂肪酸。
【請求項26】
請求項15に記載の前記ベクターを含むトランスジェニック植物であって、前記ベクターの前記ヌクレオチド配列の発現が、前記トランスジェニック植物の種子中にポリ不飽和脂肪酸の生成をもたらすことを特徴とするトランスジェニック植物。
【請求項27】
そのゲノムが、プロモーターに機能的に連結したエロンガーゼをコードするDNA配列を含むヒト以外のトランスジェニック哺乳動物。
【請求項28】
前記DNA配列が配列番号1(図6)によって表されることを特徴とする請求項27に記載のヒト以外のトランスジェニック哺乳動物。
【請求項29】
請求項28に記載の前記ヒト以外のトランスジェニック哺乳動物によって生成される体液であって、前記体液が、検出可能なレベルの少なくとも一つのエロンガーゼまたはその生成物を含むことを特徴とする前記体液。
【請求項30】
a)配列番号1(図6)で表される前記ヌクレオチド配列を単離する工程と、
b)前記単離ヌクレオチド配列を含むベクターを構築する工程と、
c)前記単離ヌクレオチド配列によってコードされたエロンガーゼ酵素の発現に十分な時間および条件の下で、前記ベクターを宿主細胞に導入する工程と、
d)基質ポリ不飽和脂肪酸を生成物ポリ不飽和脂肪酸に変換するために、前記基質に前記発現エロンガーゼ酵素を曝露させる工程、とを含むポリ不飽和脂肪酸の製造方法。
【請求項31】
前記の基質ポリ不飽和脂肪酸が、γ−リノレン酸(GLA)、ステアリドン酸(STA)およびアラキドン酸(AA)から成る群から選択されること、そして前記の生成物ポリ不飽和脂肪酸が、それぞれDGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項30に記載の方法。
【請求項32】
前記の生成物ポリ不飽和脂肪酸を別のポリ不飽和脂肪酸に変換するために、前記生成物ポリ不飽和脂肪酸を少なくとも一つのデサチュラーゼ(desaturase)に曝露する工程をさらに含むことを特徴とする請求項30に記載の方法。
【請求項33】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されること、そして別のポリ不飽和脂肪酸が、それぞれAA、エイコサペンタエン酸(EPA)、ω6−ドコサペンタエン酸から成る群から選択されること、そして少なくとも一つの前記デサチュラーゼが、AAまたはEPAの生成に関してはΔ5−デサチュラーゼであり、ω6−ドコサペンタエン酸の生成に関してはΔ4−デサチュラーゼであることを特徴とする請求項32に記載の方法。
【請求項34】
前記別のポリ不飽和脂肪酸を最終ポリ不飽和脂肪酸に変換するために、前記別の不飽和ポリ脂肪酸を、少なくとも一つのエロンガーゼと、少なくとも一つの付加的なデサチュラーゼとから成る群から選択された一つまたは複数の酵素に曝露する工程をさらに含むことを特徴とする請求項32に記載の方法。
【請求項35】
最終ポリ不飽和脂肪酸が、ドコサヘキサエン酸(DHA)、AA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることことを特徴とする請求項34に記載の方法。
【請求項36】
請求項30に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項32に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項34に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸を含むことを特徴とする栄養組成物。
【請求項37】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項36に記載の栄養組成物。
【請求項38】
前記別のポリ不飽和脂肪酸が、AA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項36に記載の栄養組成物。
【請求項39】
前記最終ポリ不飽和脂肪酸が、DHA、アドレニン酸、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項36に記載の栄養組成物。
【請求項40】
前記栄養組成物が、幼児用調合物、栄養補助食品および食品代用物から成る群から選択されることを特徴とする請求項36に記載の栄養組成物。
【請求項41】
前記栄養組成物がヒトまたは動物に投与されることを特徴とする請求項40に記載の栄養組成物。
【請求項42】
前記栄養組成物が、経口的または非経口的に投与されることを特徴とする請求項41に記載の栄養組成物。
【請求項43】
前記栄養組成物が、ココナッツ油、大豆油、カノラ油、モノグリセリド、ジグリセリド、トリグリセリド、グルコース、食用ラクトース、電気透析ホエー、電気透析スキムミルク、乳清、大豆タンパク、タンパク質加水分解物、ヒマワリ油、サフラワー油、コーン油および亜麻油から成る群から選択された少なくとも一つのマクロ栄養物をさらに含むことを特徴とする請求項40に記載の栄養組成物。
【請求項44】
ビタミンA、C、D、EおよびB複合体から成る群から選択された少なくとも一つのビタミンと、カルシウム、マグネシウム、亜鉛、マンガン、ナトリウム、カリウム、リン、銅、塩化物、ヨウ素、セレンおよび鉄から成る群から選択された少なくとも一つのミネラルとをさらに含むことを特徴とする請求項43に記載の栄養組成物。
【請求項45】
1)請求項30に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項32に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項34に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸と、2)薬学的に許容される担体とを含む薬学的組成物。
【請求項46】
前記薬学的組成物がヒトまたは動物に投与されることを特徴とする請求項45に記載の薬学的組成物。
【請求項47】
前記薬学的組成物が、ビタミン、ミネラル、塩、炭水化物、アミノ酸、遊離脂肪酸、保存料、賦形剤、抗ヒスタミン、成長因子、抗生物質、希釈剤、リン脂質、酸化防止剤およびフェノール性化合物から成る群から選択された少なくとも一つの要素をさらに含むことを特徴とする請求項45に記載の薬学的組成物。
【請求項48】
請求項30に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項32に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項34に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸を含む動物飼料。
【請求項49】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項48に記載の動物飼料。
【請求項50】
前記別のポリ不飽和脂肪酸が、AA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項48に記載の動物飼料。
【請求項51】
前記最終ポリ不飽和脂肪酸が、DHA、ADA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項48に記載の動物飼料。
【請求項52】
請求項30に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項32に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項34に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択されたポリ不飽和脂肪酸を含む化粧品。
【請求項53】
ポリ不飽和脂肪酸の摂取量の不足によって起こる状態を防止または治療する方法であって、前記防止または治療に有効な量の、請求項36に記載の前記栄養組成物を前記患者に投与することを含む前記防止または治療方法。
【請求項54】
配列番号2(図22)に示されたヌクレオチド配列の少なくとも約35%に一致するまたは相補的である単離ヌクレオチド配列。
【請求項55】
前記配列が配列番号2で表されることを特徴とする請求項54に記載の単離ヌクレオチド配列。
【請求項56】
前記配列が、ポリ不飽和脂肪酸を基質として利用する機能的に活性なエロンガーゼをコードすることを特徴とする請求項54または55に記載の単離ヌクレオチド配列。
【請求項57】
前記配列がMortirella属の真菌から誘導されることを特徴とする請求項55に記載のヌクレオチド配列。
【請求項58】
前記真菌がalpina種であることを特徴とする請求項57に記載のヌクレオチド配列。
【請求項59】
請求項54または55記載の前記ヌクレオチド配列によってコードされた精製タンパク質。
【請求項60】
ポリ不飽和脂肪酸を伸張させる精製タンパク質であり、かつ請求項59に記載の前記精製タンパク質のアミノ酸配列と少なくとも約30%のアミノ酸類似性を有する精製ポリペプチド。
【請求項61】
a)配列番号2(図22)で表される前記ヌクレオチド配列を単離する工程と、
b)i)プロモーター、およびii)該ブロモーターに機能的に連結した前記単離ヌクレオチド配列を含むベクターを構築する工程と、
c)前記エロンガーゼ酵素の発現に十分な時間および条件の下で、前記ベクターを宿主細胞に導入する工程とを含むエロンガーゼ酵素の製造方法。
【請求項62】
前記宿主細胞が真核細胞または原核細胞から成る群から選択されることを特徴とする請求項61に記載の方法。
【請求項63】
前記原核細胞が、E.coli、CyanobacteriaおよびB.subtilisから成る群から選択されることを特徴とする請求項62に記載の方法。
【請求項64】
前記真核細胞が、哺乳動物細胞、昆虫細胞、植物細胞および真菌細胞から成る群から選択されることを特徴とする請求項62に記載の方法。
【請求項65】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Lipomyces starkey、Yarrowia spp.、Kluyveromyces spp.、Hansenula spp.、Aspergillus spp.、Penicillium spp.、Neurospora spp.、Trichoderma spp.およびPichia spp.から成る群から選択されることを特徴とする請求項64に記載の方法。
【請求項66】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Hansenula spp.およびPichia spp.から成る群から選択された酵母菌細胞であることを特徴とする請求項65に記載の方法。
【請求項67】
前記酵母菌細胞が、Saccharomyces cerevisiaeであることを特徴とする請求項66に記載の方法。
【請求項68】
a)プロモーター、およびb)該プロモーターに機能的に連結した配列番号2(図22)によって表されるヌクレオチド配列を含むベクター。
【請求項69】
請求項68に記載の前記ベクターを含む宿主細胞。
【請求項70】
前記宿主細胞が真核細胞または原核細胞から成る群から選択されることを特徴とする請求項69に記載の宿主細胞。
【請求項71】
前記原核細胞が、E.coli、CyanobacteriaおよびB.subtilisから成る群から選択されることを特徴とする請求項70に記載の宿主細胞。
【請求項72】
前記真核細胞が、哺乳動物細胞、昆虫細胞、植物細胞および真菌細胞を含む群から選択されることを特徴とする請求項70に記載の宿主細胞。
【請求項73】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Lipomyces starkey、Yarrowia spp.、Kluyveromyces spp.、Hansenula spp.、Aspergillus spp.、Penicillium spp.、Neurospora spp.、Trichoderma spp.およびPichia spp.から成る群から選択されることを特徴とする請求項72に記載の宿主細胞。
【請求項74】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Hansenula spp.およびPichia spp.から成る群から選択された酵母菌細胞であることを特徴とする請求項73に記載の宿主細胞。
【請求項75】
前記宿主細胞が、Saccharomyces cerevisiaeであることを特徴とする請求項74に記載の宿主細胞。
【請求項76】
請求項68に記載のベクターを含む植物細胞、植物または植物組織であって、前記ベクターの前記ヌクレオチド配列の発現が、前記植物細胞、植物または植物組織によるポリ不飽和脂肪酸の生成をもたらすことを特徴とする、前記植物細胞、植物または植物組織。
【請求項77】
前記ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項76に記載の植物細胞、植物または植物組織。
【請求項78】
請求項76に記載の植物細胞、植物または植物組織によって発現される一つまたは複数の植物油または脂肪酸。
【請求項79】
請求項68に記載のベクターを含むトランスジェニック植物であって、前記ベクターの前記ヌクレオチド配列の発現が、前記トランスジェニック植物の種子中にポリ不飽和脂肪酸の生成をもたらすことを特徴とするトランスジェニック植物。
【請求項80】
そのゲノムが、プロモーターに機能的に連結したエロンガーゼをコードするM.alpina由来のDNA配列を含むヒト以外のトランスジェニック哺乳動物。
【請求項81】
前記DNA配列が配列番号2(図22)によって表されることを特徴とする請求項80に記載のヒト以外のトランスジェニック哺乳動物。
【請求項82】
請求項81に記載の前記ヒト以外のトランスジェニック哺乳動物によって生成される体液であって、前記体液が、検出可能なレベルの少なくとも一つのエロンガーゼまたはその生成物を含むことを特徴とする前記体液。
【請求項83】
a)配列番号2(図22)で表される前記ヌクレオチド配列を単離する工程と、
b)前記単離ヌクレオチド配列を含むベクターを構築する工程と、
c)前記単離ヌクレオチド配列によってコードされたエロンガーゼ酵素の発現に十分な時間および条件の下で、前記ベクターを宿主細胞に導入する工程と、
d)基質ポリ不飽和脂肪酸を生成物ポリ不飽和脂肪酸に変換するために、前記基質に前記発現エロンガーゼ酵素を曝露する工程、とを含むポリ不飽和脂肪酸の製造方法。
【請求項84】
前記基質ポリ不飽和脂肪酸が、GLA、STAおよびAAから成る群から選択されること、そして前記の生成物ポリ不飽和脂肪酸が、それぞれDGLA、20:4n−3およびω6−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項83に記載の方法。
【請求項85】
前記の生成物ポリ不飽和脂肪酸を別のポリ不飽和脂肪酸に変換するために、前記の発現されたエロンガーゼ酵素を少なくとも一つのデサチュラーゼに曝露する工程をさらに含むことを特徴とする請求項83に記載の方法。
【請求項86】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されること、そして別のポリ不飽和脂肪酸が、それぞれAA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されること、そして少なくとも一つの前記デサチュラーゼが、AAまたはEPAの生成に関してはΔ5−デサチュラーゼであり、ω6−ドコサペンタエン酸の生成に関してはΔ4−デサチュラーゼであることを特徴とする請求項85に記載の方法。
【請求項87】
前記別のポリ不飽和脂肪酸を最終ポリ不飽和脂肪酸に変換するために、前記別の不飽和ポリ脂肪酸を、少なくとも一つのエロンガーゼと、少なくとも一つの付加的なデサチュラーゼとから成る群から選択された一つまたは複数の酵素に曝露する工程をさらに含むことを特徴とする請求項86に記載の方法。
【請求項88】
最終ポリ不飽和脂肪酸が、ドコサヘキサエン酸、AA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることことを特徴とする請求項87に記載の方法。
【請求項89】
請求項83に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項85に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項87に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸を含むことを特徴とする栄養組成物。
【請求項90】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項89に記載の栄養組成物。
【請求項91】
前記別のポリ不飽和脂肪酸が、AA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項89に記載の栄養組成物。
【請求項92】
前記最終ポリ不飽和脂肪酸が、DHA、AA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項89に記載の栄養組成物。
【請求項93】
前記栄養組成物が、幼児用調合物、栄養補助食品および食品代用物から成る群から選択されることを特徴とする請求項89に記載の栄養組成物。
【請求項94】
前記栄養組成物がヒトまたは動物に投与されることを特徴とする請求項93に記載の栄養組成物。
【請求項95】
前記栄養組成物が、経口的または非経口的に投与されることを特徴とする請求項94に記載の栄養組成物。
【請求項96】
前記栄養組成物が、ココナッツ油、大豆油、カノラ油、モノグリセリド、ジグリセリド、トリグリセリド、グルコース、食用ラクトース、電気透析ホエー、電気透析スキムミルク、乳清、大豆タンパク、タンパク質加水分解物、ヒマワリ油、サフラワー油、コーン油および亜麻油から成る群から選択された少なくとも一つのマクロ栄養物をさらに含むことを特徴とする請求項93に記載の栄養組成物。
【請求項97】
ビタミンA、C、D、EおよびB複合体から成る群から選択された少なくとも一つのビタミンと、カルシウム、マグネシウム、亜鉛、マンガン、ナトリウム、カリウム、リン、銅、塩化物、ヨウ素、セレンおよび鉄から成る群から選択された少なくとも一つのミネラルとをさらに含むことを特徴とする請求項96に記載の栄養組成物。
【請求項98】
1)請求項83に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項85に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項87に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸と、2)薬学的に許容される担体とを含む薬学的組成物。
【請求項99】
前記薬学的組成物がヒトまたは動物に投与されることを特徴とする請求項98に記載の薬学的組成物。
【請求項100】
前記薬学的組成物が、ビタミン、ミネラル、塩、炭水化物、アミノ酸、遊離脂肪酸、保存料、賦形剤、抗ヒスタミン、成長因子、抗生物質、希釈剤、リン脂質、酸化防止剤およびフェノール性化合物から成る群から選択された少なくとも一つの要素をさらに含むことを特徴とする請求項98に記載の薬学的組成物。
【請求項101】
請求項83に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項85に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項87に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸を含む動物飼料。
【請求項102】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項101に記載の動物飼料。
【請求項103】
前記別のポリ不飽和脂肪酸が、AA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項101に記載の動物飼料。
【請求項104】
前記最終ポリ不飽和脂肪酸が、DHA、アドレニン酸、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項101に記載の栄養組成物。
【請求項105】
請求項83に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項85に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項87に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択されたポリ不飽和脂肪酸を含む化粧品。
【請求項106】
ポリ不飽和脂肪酸の摂取量の不足によって起こる状態を防止または治療する方法であって、前記治療に有効な量の、請求項89に記載の前記栄養組成物を前記患者に投与することを含む前記防止または治療方法。
【請求項107】
配列番号3(図43)に示されたヌクレオチド配列の少なくとも約35%に一致するまたは相補的である単離ヌクレオチド配列。
【請求項108】
前記配列が配列番号3で表されることを特徴とする請求項107に記載の単離ヌクレオチド配列。
【請求項109】
前記配列が、ポリ不飽和脂肪酸またはモノ不飽和脂肪酸を基質として利用する機能的に活性なエロンガーゼをコードすることを特徴とする請求項107または108に記載の単離ヌクレオチド配列。
【請求項110】
前記配列が哺乳類から誘導されることを特徴とする請求項109に記載のヌクレオチド配列。
【請求項111】
前記哺乳動物がヒトであることを特徴とする請求項110に記載のヌクレオチド配列。
【請求項112】
請求項107または108記載の前記ヌクレオチド配列によってコードされた精製タンパク質。
【請求項113】
ポリ不飽和脂肪酸またはモノ不飽和脂肪酸を伸張させる精製ポリペプチドであり、かつ請求項112に記載の前記精製タンパク質のアミノ酸配列と少なくとも約30%のアミノ酸類似性を有する精製ポリペプチド。
【請求項114】
a)配列番号3(図43)で表される前記ヌクレオチド配列を単離する工程と、
b)i)プロモーター、およびii)該プロモーターに機能的に連結した前記単離ヌクレオチド配列を含むベクターを構築する工程と、
c)前記エロンガーゼ酵素の発現に十分な時間および条件の下で、前記ベクターを宿主細胞に導入する工程とを含むエロンガーゼ酵素の製造方法。
【請求項115】
前記宿主細胞が真核細胞または原核細胞から成る群から選択されることを特徴とする請求項114に記載の方法。
【請求項116】
前記原核細胞が、E.coli、CyanobacteriaおよびB.subtilisから成る群から選択されることを特徴とする請求項115に記載の方法。
【請求項117】
前記真核細胞が、哺乳動物細胞、昆虫細胞、植物細胞および真菌細胞から成る群から選択されることを特徴とする請求項115に記載の方法。
【請求項118】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Lipomyces starkey、Yarrowia spp.、Kluyveromyces spp.、Hansenula spp.、Aspergillus spp.、Penicillium spp.、Neurospora spp.、Trichoderma spp.およびPichia spp.から成る群から選択されることを特徴とする請求項117に記載の方法。
【請求項119】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Hansenula spp.およびPichia spp.から成る群から選択された酵母菌細胞であることを特徴とする請求項118に記載の方法。
【請求項120】
前記酵母菌細胞が、Saccharomyces cerevisiaeであることを特徴とする請求項119に記載の方法。
【請求項121】
a)プロモーター、およびb)該プロモーターに機能的に連結した配列番号3(図43)によって表されるヌクレオチド配列を含むベクター。
【請求項122】
請求項121に記載の前記ベクターを含む宿主細胞。
【請求項123】
前記宿主細胞が真核細胞または原核細胞から成る群から選択されることを特徴とする請求項122に記載の宿主細胞。
【請求項124】
前記原核細胞が、E.coli、CyanobacteriaおよびB.subtilisから成る群から選択されることを特徴とする請求項123に記載の宿主細胞。
【請求項125】
前記真核細胞が、哺乳動物細胞、昆虫細胞、植物細胞および真菌細胞を含む群から選択されることを特徴とする請求項123に記載の宿主細胞。
【請求項126】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Lipomyces starkey、Yarrowia spp.、Kluyveromyces spp.、Hansenula spp.、Aspergillus spp.、Penicillium spp.、Neurospora spp.、Trichoderma spp.およびPichia spp.から成る群から選択されることを特徴とする請求項125に記載の宿主細胞。
【請求項127】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Hansenula spp.およびPichia spp.から成る群から選択された酵母菌細胞であることを特徴とする請求項126に記載の宿主細胞。
【請求項128】
前記宿主細胞が、Saccharomyces cerevisiaeであることを特徴とする請求項127に記載の宿主細胞。
【請求項129】
前記ベクターの前記ヌクレオチド配列の発現が、前記植物細胞、植物または植物組織によるモノ不飽和脂肪酸およびポリ不飽和脂肪酸から成る群から選択された少なくとも一つの脂肪酸の生成をもたらすことを特徴とする、請求項121に記載の前記ベクターを含む植物細胞、植物または植物組織。
【請求項130】
前記ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項129に記載の植物細胞、植物または植物組織。
【請求項131】
請求項130に記載の植物細胞、植物または植物組織によって発現される一つまたは複数の植物油または脂肪酸。
【請求項132】
請求項121に記載のベクターを含むトランスジェニック植物であって、前記ベクターの前記ヌクレオチド配列の発現が、前記トランスジェニック植物の種子中にポリ不飽和脂肪酸の生成をもたらすことを特徴とするトランスジェニック植物。
【請求項133】
そのゲノムが、プロモーターに機能的に連結したエロンガーゼをコードするヒトDNA配列を含むヒト以外のトランスジェニック哺乳動物。
【請求項134】
前記DNA配列が配列番号3(図43)によって表されることを特徴とする請求項133に記載のヒト以外のトランスジェニック哺乳動物。
【請求項135】
請求項134に記載の前記ヒト以外のトランスジェニック哺乳動物によって生成される体液であって、前記体液が、検出可能なレベルの少なくとも一つのエロンガーゼまたはその生成物を含むことを特徴とする前記体液。
【請求項136】
a)配列番号3(図43)で表される前記ヌクレオチド配列を単離する工程と、
b)前記単離ヌクレオチド配列を含むベクターを構築する工程と、
c)前記単離ヌクレオチド配列によってコードされたエロンガーゼ酵素の発現に十分な時間および条件の下で、前記ベクターを宿主細胞に導入する工程と、
d)基質ポリ不飽和脂肪酸を生成物ポリ不飽和脂肪酸に変換するために、前記基質に前記発現エロンガーゼ酵素を曝露する工程、とを含むポリ不飽和脂肪酸の製造方法。
【請求項137】
前記基質ポリ不飽和脂肪酸が、GLA、STAおよびAAから成る群から選択されること、そして前記の生成物ポリ不飽和脂肪酸が、それぞれDGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項136に記載の方法。
【請求項138】
前記の生成物ポリ不飽和脂肪酸を別のポリ不飽和脂肪酸に変換するために、発現された前記の不飽和脂肪酸を少なくとも一つのデサチュラーゼに曝露する工程をさらに含むことを特徴とする請求項136に記載の方法。
【請求項139】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されること、そして別のポリ不飽和脂肪酸が、それぞれAA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されること、そして少なくとも一つの前記デサチュラーゼが、AAまたはEPAの生成に関してはΔ5−デサチュラーゼであり、ω6−ドコサペンタエン酸の生成に関してはΔ4−デサチュラーゼであることを特徴とする請求項138に記載の方法。
【請求項140】
前記別のポリ不飽和脂肪酸を最終ポリ不飽和脂肪酸に変換するために、前記別の不飽和ポリ脂肪酸を、少なくとも一つのエロンガーゼと少なくとも一つの付加的なデサチュラーゼから成る群から選択された一つまたは複数の酵素に曝露する工程をさらに含むことを特徴とする請求項138に記載の方法。
【請求項141】
最終ポリ不飽和脂肪酸が、DHA、ADA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることことを特徴とする請求項140に記載の方法。
【請求項142】
請求項136に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項138に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項140に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸を含むことを特徴とする栄養組成物。
【請求項143】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項142に記載の栄養組成物。
【請求項144】
前記別のポリ不飽和脂肪酸が、AA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項142に記載の栄養組成物。
【請求項145】
前記最終ポリ不飽和脂肪酸が、DHA、AA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項142に記載の栄養組成物。
【請求項146】
前記栄養組成物が、幼児用調合物、栄養補助食品および食品代用物から成る群から選択されることを特徴とする請求項142に記載の栄養組成物。
【請求項147】
前記栄養組成物がヒトまたは動物に投与されることを特徴とする請求項146に記載の栄養組成物。
【請求項148】
前記栄養組成物が、経口的または非経口的に投与されることを特徴とする請求項147に記載の栄養組成物。
【請求項149】
前記栄養組成物が、ココナッツ油、大豆油、カノラ油、モノグリセリド、ジグリセリド、トリグリセリド、グルコース、食用ラクトース、電気透析ホエー、電気透析スキムミルク、乳清、大豆タンパク、タンパク質加水分解物、ヒマワリ油、サフラワー油、コーン油および亜麻油から成る群から選択された少なくとも一つのマクロ栄養物をさらに含むことを特徴とする請求項143に記載の栄養組成物。
【請求項150】
ビタミンA、C、D、EおよびB複合体から成る群から選択された少なくとも一つのビタミンと、カルシウム、マグネシウム、亜鉛、マンガン、ナトリウム、カリウム、リン、銅、塩化物、ヨウ素、セレンおよび鉄から成る群から選択された少なくとも一つのミネラルとをさらに含むことを特徴とする請求項149に記載の栄養組成物。
【請求項151】
1)請求項136に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項138に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項140に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸と、2)薬学的に許容される担体とを含む薬学的組成物。
【請求項152】
前記薬学的組成物がヒトまたは動物に投与されることを特徴とする請求項151に記載の薬学的組成物。
【請求項153】
前記薬学的組成物が、ビタミン、ミネラル、塩、炭水化物、アミノ酸、遊離脂肪酸、保存料、賦形剤、抗ヒスタミン、成長因子、抗生物質、希釈剤、リン脂質、酸化防止剤およびフェノール性化合物から成る群から選択された少なくとも一つの要素をさらに含むことを特徴とする請求項151に記載の薬学的組成物。
【請求項154】
請求項136に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項138に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項140に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸を含む動物飼料。
【請求項155】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項154に記載の動物飼料。
【請求項156】
前記別のポリ不飽和脂肪酸が、AA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項154に記載の動物飼料。
【請求項157】
前記最終ポリ不飽和脂肪酸が、DHA、ADA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項154に記載の栄養組成物。
【請求項158】
請求項136に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項138に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項140に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択されたポリ不飽和脂肪酸を含む化粧品。
【請求項159】
ポリ不飽和脂肪酸の摂取量の不足によって起こる状態を防止または治療する方法であって、前記治療に有効な量の、請求項142に記載の前記栄養物を前記患者に投与することを含む前記防止または治療方法。
【請求項160】
配列番号4(図46)に示されたヌクレオチド配列の少なくとも約35%に一致するまたは相補的である単離ヌクレオチド配列。
【請求項161】
前記配列が配列番号4で表されることを特徴とする請求項160に記載の単離ヌクレオチド配列。
【請求項162】
前記配列が、ポリ不飽和脂肪酸を基質として利用する機能的に活性なエロンガーゼをコードすることを特徴とする請求項160または161に記載の単離ヌクレオチド配列。
【請求項163】
前記配列がCaenorhabditis属の線虫(nematode)から誘導されることを特徴とする請求項162に記載のヌクレオチド配列。
【請求項164】
前記線虫がelegans種であることを特徴とする請求項163に記載のヌクレオチド配列。
【請求項165】
請求項160または161記載の前記ヌクレオチド配列によってコードされた精製タンパク質。
【請求項166】
ポリ不飽和脂肪酸を伸張させる精製ポリペプチドであり、かつ請求項165に記載の前記精製タンパク質のアミノ酸配列と少なくとも約30%のアミノ酸類似性を有する精製ポリペプチド。
【請求項167】
a)配列番号4(図46)で表される前記ヌクレオチド配列を単離する工程と、
b)i)プロモーター、およびii)該プロモーターに機能的に連結した前記単離ヌクレオチド配列を含むベクターを構築する工程と、
c)前記エロンガーゼ酵素の発現に十分な時間および条件の下で、前記ベクターを宿主細胞に導入する工程とを含むエロンガーゼ酵素の製造方法。
【請求項168】
前記宿主細胞が真核細胞または原核細胞から成る群から選択されることを特徴とする請求項167に記載の方法。
【請求項169】
前記原核細胞が、E.coli、CyanobacteriaおよびB.subtilisから成る群から選択されることを特徴とする請求項168に記載の方法。
【請求項170】
前記真核細胞が、哺乳動物細胞、昆虫細胞、植物細胞および真菌細胞から成る群から選択されることを特徴とする請求項168に記載の方法。
【請求項171】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Lipomyces starkey、Yarrowia spp.、Kluyveromyces spp.、Hansenula spp.、Aspergillus spp.、Penicillium spp.、Neurospora spp.、Trichoderma spp.およびPichia spp.から成る群から選択されることを特徴とする請求項170に記載の方法。
【請求項172】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Hansenula spp.およびPichia spp.から成る群から選択された酵母菌細胞であることを特徴とする請求項171に記載の方法。
【請求項173】
前記酵母菌細胞が、Saccharomyces cerevisiaeであることを特徴とする請求項172に記載の方法。
【請求項174】
a)プロモーター、およびb)該プロモーターに機能的に連結した配列番号4(図46)によって表されるヌクレオチド配列を含むベクター。
【請求項175】
請求項174に記載の前記ベクターを含む宿主細胞。
【請求項176】
前記宿主細胞が真核細胞または原核細胞から成る群から選択されることを特徴とする請求項175に記載の宿主細胞。
【請求項177】
前記原核細胞が、E.coli、CyanobacteriaおよびB.subtilisから成る群から選択されることを特徴とする請求項176に記載の宿主細胞。
【請求項178】
前記真核細胞が、哺乳動物細胞、昆虫細胞、植物細胞および真菌細胞を含む群から選択されることを特徴とする請求項176に記載の宿主細胞。
【請求項179】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Lipomyces starkey、Yarrowia spp.、Kluyveromyces spp.、Hansenula spp.、Aspergillus spp.、Penicillium spp.、Neurospora spp.、Trichoderma spp.およびPichia spp.から成る群から選択されることを特徴とする請求項178に記載の宿主細胞。
【請求項180】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Hansenula spp.およびPichia spp.から成る群から選択された酵母菌細胞であることを特徴とする請求項179に記載の宿主細胞。
【請求項181】
前記宿主細胞が、Saccharomyces cerevisiaeであることを特徴とする請求項1180に記載の宿主細胞。
【請求項182】
前記ベクターの前記ヌクレオチド配列の発現が、前記植物細胞、植物または植物組織によるポリ不飽和脂肪酸の生成をもたらすことを特徴とする、請求項174に記載の前記ベクターを含む植物細胞、植物または植物組織。
【請求項183】
前記ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項182に記載の植物細胞、植物または植物組織。
【請求項184】
請求項182に記載の植物細胞、植物または植物組織によって発現される一つまたは複数の植物油または脂肪酸。
【請求項185】
請求項174に記載のベクターを含むトランスジェニック植物であって、前記ベクターの前記ヌクレオチド配列の発現が、前記トランスジェニック植物の種子中にポリ不飽和脂肪酸の生成をもたらすことを特徴とするトランスジェニック植物。
【請求項186】
そのゲノムが、プロモーターに機能的に連結したエロンガーゼをコードする、C.elegansからのDNA配列を含むヒト以外のトランスジェニック哺乳動物。
【請求項187】
前記DNA配列が配列番号4(図46)によって表されることを特徴とする請求項186に記載のヒト以外のトランスジェニック哺乳動物。
【請求項188】
請求項187に記載の前記ヒト以外のトランスジェニック哺乳動物によって生成される体液であって、前記体液が、検出可能なレベルの少なくとも一つのエロンガーゼまたはその生成物を含むことを特徴とする前記体液。
【請求項189】
a)配列番号4(図46)で表される前記ヌクレオチド配列を単離する工程と、
b)前記単離ヌクレオチド配列を含むベクターを構築する工程と、
c)前記単離ヌクレオチド配列によってコードされたエロンガーゼ酵素の発現に十分な時間および条件の下で、前記ベクターを宿主細胞に導入する工程と、
d)基質ポリ不飽和脂肪酸を生成物ポリ不飽和脂肪酸に変換するために、前記基質に前記発現エロンガーゼ酵素を曝露する工程、とを含むポリ不飽和脂肪酸の製造方法。
【請求項190】
前記基質ポリ不飽和脂肪酸が、GLA、STAおよびAAから成る群から選択されること、そして前記の生成物ポリ不飽和脂肪酸が、それぞれDGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項189に記載の方法。
【請求項191】
前記の生成物ポリ不飽和脂肪酸を別のポリ不飽和脂肪酸に変換するために、前記の発現されたエロンガーゼ酵素を少なくとも一つのデサチュラーゼに曝露する工程をさらに含むことを特徴とする請求項189に記載の方法。
【請求項192】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されること、そして別のポリ不飽和脂肪酸が、それぞれAA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されること、そして少なくとも一つの前記デサチュラーゼが、AAまたはEPAの生成に関してはΔ5−デサチュラーゼであり、ω6−ドコサペンタエン酸の生成に関してはΔ4−デサチュラーゼであることを特徴とする請求項191に記載の方法。
【請求項193】
前記別のポリ不飽和脂肪酸を最終ポリ不飽和脂肪酸に変換するために、前記別の不飽和ポリ脂肪酸を、少なくとも一つのエロンガーゼと少なくとも一つの付加的なデサチュラーゼから成る群から選択された一つまたは複数の酵素に曝露する工程をさらに含むことを特徴とする請求項192に記載の方法。
【請求項194】
最終ポリ不飽和脂肪酸が、DHA、ADA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることことを特徴とする請求項193に記載の方法。
【請求項195】
請求項189に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項191に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項193に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸を含むことを特徴とする栄養組成物。
【請求項196】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項195に記載の栄養組成物。
【請求項197】
前記別のポリ不飽和脂肪酸が、AA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項195に記載の栄養組成物。
【請求項198】
前記最終ポリ不飽和脂肪酸が、DHA、AA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項195に記載の栄養組成物。
【請求項199】
前記栄養組成物が、幼児用調合物、栄養補助食品および食品代用物から成る群から選択されることを特徴とする請求項195に記載の栄養組成物。
【請求項200】
前記栄養組成物がヒトまたは動物に投与されることを特徴とする請求項199に記載の栄養組成物。
【請求項201】
前記栄養組成物が、経口的または非経口的に投与されることを特徴とする請求項200に記載の栄養組成物。
【請求項202】
前記栄養組成物が、ココナッツ油、大豆油、カノラ油、モノグリセリド、ジグリセリド、トリグリセリド、グルコース、食用ラクトース、電気透析ホエー、電気透析スキムミルク、乳清、大豆タンパク、タンパク質加水分解物、ヒマワリ油、サフラワー油、コーン油および亜麻油から成る群から選択された少なくとも一つのマクロ栄養物をさらに含むことを特徴とする請求項199に記載の栄養組成物。
【請求項203】
ビタミンA、C、D、EおよびB複合体から成る群から選択された少なくとも一つのビタミンと、カルシウム、マグネシウム、亜鉛、マンガン、ナトリウム、カリウム、リン、銅、塩化物、ヨウ素、セレンおよび鉄から成る群から選択された少なくとも一つのミネラルとをさらに含むことを特徴とする請求項202に記載の栄養組成物。
【請求項204】
1)請求項189に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項191に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項193に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸と、2)薬学的に許容される担体とを含む薬学的組成物。
【請求項205】
前記薬学的組成物がヒトまたは動物に投与されることを特徴とする請求項204に記載の薬学的組成物。
【請求項206】
前記薬学的組成物が、ビタミン、ミネラル、塩、炭水化物、アミノ酸、遊離脂肪酸、保存料、賦形剤、抗ヒスタミン、成長因子、抗生物質、希釈剤、リン脂質、酸化防止剤およびフェノール性化合物から成る群から選択された少なくとも一つの要素をさらに含むことを特徴とする請求項203に記載の薬学的組成物。
【請求項207】
請求項189に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項191に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項193に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸を含む動物飼料。
【請求項208】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項207に記載の動物飼料。
【請求項209】
前記別のポリ不飽和脂肪酸が、AA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項207に記載の動物飼料。
【請求項210】
前記最終ポリ不飽和脂肪酸が、DHA、ADA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項207に記載の栄養組成物。
【請求項211】
請求項189に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項191に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項193に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択されたポリ不飽和脂肪酸を含む化粧品。
【請求項212】
ポリ不飽和脂肪酸の摂取量の不足によって起こる状態を防止または治療する方法であって、前記防止または治療に有効な量の、請求項195に記載の前記栄養物を前記患者に投与することを含む前記防止または治療方法。
【請求項1】
配列番号1(図6)に示すヌクレオチド配列の約50%に一致するまたは相補的である単離ヌクレオチド配列。
【請求項2】
前記配列が配列番号1で表されることを特徴とする請求項1に記載の単離ヌクレオチド配列。
【請求項3】
前記配列が、ポリ不飽和脂肪酸またはモノ不飽和脂肪酸を基質として利用する機能的に活性なエロンガーゼをコードすることを特徴とする請求項1または2に記載の単離ヌクレオチド配列。
【請求項4】
前記配列がMortirella属の真菌から誘導されることを特徴とする請求項1に記載のヌクレオチド配列。
【請求項5】
前記真菌がalpina種であることを特徴とする請求項4に記載のヌクレオチド配列。
【請求項6】
請求項1または2に記載の前記ヌクレオチド配列によってコードされた精製タンパク質。
【請求項7】
ポリ不飽和脂肪酸またはモノ不飽和脂肪酸を伸張させる精製タンパク質であり、かつ請求項6に記載の前記精製タンパク質のアミノ酸配列と約50%のアミノ酸類似性を有する精製ポリペプチド。
【請求項8】
a)配列番号1(図6)で表される前記ヌクレオチド配列を単離する工程と、
b)i)プロモーター、およびii)該プロモーターに機能的に連結した前記単離ヌクレオチド配列を含むベクターを構築する工程と、
c)前記エロンガーゼ酵素の発現に十分な時間および条件の下で、前記ベクターを宿主細胞に導入する工程とを含むエロンガーゼ酵素の製造方法。
【請求項9】
前記宿主細胞が真核細胞または原核細胞から成る群から選択されることを特徴とする請求項8に記載の方法。
【請求項10】
前記原核細胞が、E.coli、CyanobacteriaおよびB.subtilisから成る群から選択されることを特徴とする請求項9に記載の方法。
【請求項11】
前記真核細胞が、哺乳動物細胞、昆虫細胞、植物細胞および真菌細胞から成る群から選択されることを特徴とする請求項9に記載の方法。
【請求項12】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Lipomyces starkey、Yarrowia spp.、Kluyveromyces spp.、Hansenula spp.、Aspergillus spp.、Penicillium spp.、Neurospora spp.、Trichoderma spp.およびPichia spp.から成る群から選択されることを特徴とする請求項11に記載の方法。
【請求項13】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Hansenula spp.およびPichia spp.から成る群から選択された酵母菌細胞であることを特徴とする請求項11に記載の方法。
【請求項14】
前記酵母菌細胞が、Saccharomyces cerevisiaeであることを特徴とする請求項13に記載の方法。
【請求項15】
a)プロモーターおよびb)該ブロモーターに機能的に連結した配列番号1(図6)によって表されるヌクレオチド配列を含むベクター。
【請求項16】
請求項15に記載の前記ベクターを含む宿主細胞。
【請求項17】
前記宿主細胞が真核細胞または原核細胞から成る群から選択されることを特徴とする請求項16に記載の宿主細胞。
【請求項18】
前記原核細胞が、E.coli、CyanobacteriaおよびB.subtilisから成る群から選択されることを特徴とする請求項17に記載の宿主細胞。
【請求項19】
前記真核細胞が、哺乳動物細胞、昆虫細胞、植物細胞および真菌細胞を含む群から選択されることを特徴とする請求項17に記載の宿主細胞。
【請求項20】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Lipomyces starkey、Yarrowia spp.、Kluyveromyces spp.、Hansenula spp.、Aspergillus spp.、Penicillium spp.、Neurospora spp.、Trichoderma spp.およびPichia spp.から成る群から選択されることを特徴とする請求項19に記載の宿主細胞。
【請求項21】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Hansenula spp.およびPichia spp.から成る群から選択された酵母菌細胞であることを特徴とする請求項20に記載の宿主細胞。
【請求項22】
前記宿主細胞が、Saccharomyces cerevisiaeであることを特徴とする請求項21に記載の宿主細胞。
【請求項23】
請求項15に記載のベクターを含む植物細胞、植物または植物組織であって、前記ベクターの前記ヌクレオチド配列の発現が、前記植物細胞、植物または植物組織による、モノ不飽和脂肪酸およびポリ不飽和脂肪酸から成る群から選択された少なくとも一つの脂肪酸の生成をもたらすことを特徴とする、前記植物細胞、植物または植物であって、前記植物細胞、植物または植物組織。
【請求項24】
前記ポリ不飽和脂肪酸が、ジホモ−γ−リノレン酸(DGLA)、20:4n−3およびアドレニン酸(ADA)から成る群から選択されることを特徴とする請求項23に記載の植物細胞、植物または植物組織。
【請求項25】
請求項23に記載の植物細胞、植物または植物組織によって発現される一つまたは複数の植物油または脂肪酸。
【請求項26】
請求項15に記載の前記ベクターを含むトランスジェニック植物であって、前記ベクターの前記ヌクレオチド配列の発現が、前記トランスジェニック植物の種子中にポリ不飽和脂肪酸の生成をもたらすことを特徴とするトランスジェニック植物。
【請求項27】
そのゲノムが、プロモーターに機能的に連結したエロンガーゼをコードするDNA配列を含むヒト以外のトランスジェニック哺乳動物。
【請求項28】
前記DNA配列が配列番号1(図6)によって表されることを特徴とする請求項27に記載のヒト以外のトランスジェニック哺乳動物。
【請求項29】
請求項28に記載の前記ヒト以外のトランスジェニック哺乳動物によって生成される体液であって、前記体液が、検出可能なレベルの少なくとも一つのエロンガーゼまたはその生成物を含むことを特徴とする前記体液。
【請求項30】
a)配列番号1(図6)で表される前記ヌクレオチド配列を単離する工程と、
b)前記単離ヌクレオチド配列を含むベクターを構築する工程と、
c)前記単離ヌクレオチド配列によってコードされたエロンガーゼ酵素の発現に十分な時間および条件の下で、前記ベクターを宿主細胞に導入する工程と、
d)基質ポリ不飽和脂肪酸を生成物ポリ不飽和脂肪酸に変換するために、前記基質に前記発現エロンガーゼ酵素を曝露させる工程、とを含むポリ不飽和脂肪酸の製造方法。
【請求項31】
前記の基質ポリ不飽和脂肪酸が、γ−リノレン酸(GLA)、ステアリドン酸(STA)およびアラキドン酸(AA)から成る群から選択されること、そして前記の生成物ポリ不飽和脂肪酸が、それぞれDGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項30に記載の方法。
【請求項32】
前記の生成物ポリ不飽和脂肪酸を別のポリ不飽和脂肪酸に変換するために、前記生成物ポリ不飽和脂肪酸を少なくとも一つのデサチュラーゼ(desaturase)に曝露する工程をさらに含むことを特徴とする請求項30に記載の方法。
【請求項33】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されること、そして別のポリ不飽和脂肪酸が、それぞれAA、エイコサペンタエン酸(EPA)、ω6−ドコサペンタエン酸から成る群から選択されること、そして少なくとも一つの前記デサチュラーゼが、AAまたはEPAの生成に関してはΔ5−デサチュラーゼであり、ω6−ドコサペンタエン酸の生成に関してはΔ4−デサチュラーゼであることを特徴とする請求項32に記載の方法。
【請求項34】
前記別のポリ不飽和脂肪酸を最終ポリ不飽和脂肪酸に変換するために、前記別の不飽和ポリ脂肪酸を、少なくとも一つのエロンガーゼと、少なくとも一つの付加的なデサチュラーゼとから成る群から選択された一つまたは複数の酵素に曝露する工程をさらに含むことを特徴とする請求項32に記載の方法。
【請求項35】
最終ポリ不飽和脂肪酸が、ドコサヘキサエン酸(DHA)、AA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることことを特徴とする請求項34に記載の方法。
【請求項36】
請求項30に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項32に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項34に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸を含むことを特徴とする栄養組成物。
【請求項37】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項36に記載の栄養組成物。
【請求項38】
前記別のポリ不飽和脂肪酸が、AA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項36に記載の栄養組成物。
【請求項39】
前記最終ポリ不飽和脂肪酸が、DHA、アドレニン酸、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項36に記載の栄養組成物。
【請求項40】
前記栄養組成物が、幼児用調合物、栄養補助食品および食品代用物から成る群から選択されることを特徴とする請求項36に記載の栄養組成物。
【請求項41】
前記栄養組成物がヒトまたは動物に投与されることを特徴とする請求項40に記載の栄養組成物。
【請求項42】
前記栄養組成物が、経口的または非経口的に投与されることを特徴とする請求項41に記載の栄養組成物。
【請求項43】
前記栄養組成物が、ココナッツ油、大豆油、カノラ油、モノグリセリド、ジグリセリド、トリグリセリド、グルコース、食用ラクトース、電気透析ホエー、電気透析スキムミルク、乳清、大豆タンパク、タンパク質加水分解物、ヒマワリ油、サフラワー油、コーン油および亜麻油から成る群から選択された少なくとも一つのマクロ栄養物をさらに含むことを特徴とする請求項40に記載の栄養組成物。
【請求項44】
ビタミンA、C、D、EおよびB複合体から成る群から選択された少なくとも一つのビタミンと、カルシウム、マグネシウム、亜鉛、マンガン、ナトリウム、カリウム、リン、銅、塩化物、ヨウ素、セレンおよび鉄から成る群から選択された少なくとも一つのミネラルとをさらに含むことを特徴とする請求項43に記載の栄養組成物。
【請求項45】
1)請求項30に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項32に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項34に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸と、2)薬学的に許容される担体とを含む薬学的組成物。
【請求項46】
前記薬学的組成物がヒトまたは動物に投与されることを特徴とする請求項45に記載の薬学的組成物。
【請求項47】
前記薬学的組成物が、ビタミン、ミネラル、塩、炭水化物、アミノ酸、遊離脂肪酸、保存料、賦形剤、抗ヒスタミン、成長因子、抗生物質、希釈剤、リン脂質、酸化防止剤およびフェノール性化合物から成る群から選択された少なくとも一つの要素をさらに含むことを特徴とする請求項45に記載の薬学的組成物。
【請求項48】
請求項30に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項32に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項34に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸を含む動物飼料。
【請求項49】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項48に記載の動物飼料。
【請求項50】
前記別のポリ不飽和脂肪酸が、AA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項48に記載の動物飼料。
【請求項51】
前記最終ポリ不飽和脂肪酸が、DHA、ADA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項48に記載の動物飼料。
【請求項52】
請求項30に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項32に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項34に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択されたポリ不飽和脂肪酸を含む化粧品。
【請求項53】
ポリ不飽和脂肪酸の摂取量の不足によって起こる状態を防止または治療する方法であって、前記防止または治療に有効な量の、請求項36に記載の前記栄養組成物を前記患者に投与することを含む前記防止または治療方法。
【請求項54】
配列番号2(図22)に示されたヌクレオチド配列の少なくとも約35%に一致するまたは相補的である単離ヌクレオチド配列。
【請求項55】
前記配列が配列番号2で表されることを特徴とする請求項54に記載の単離ヌクレオチド配列。
【請求項56】
前記配列が、ポリ不飽和脂肪酸を基質として利用する機能的に活性なエロンガーゼをコードすることを特徴とする請求項54または55に記載の単離ヌクレオチド配列。
【請求項57】
前記配列がMortirella属の真菌から誘導されることを特徴とする請求項55に記載のヌクレオチド配列。
【請求項58】
前記真菌がalpina種であることを特徴とする請求項57に記載のヌクレオチド配列。
【請求項59】
請求項54または55記載の前記ヌクレオチド配列によってコードされた精製タンパク質。
【請求項60】
ポリ不飽和脂肪酸を伸張させる精製タンパク質であり、かつ請求項59に記載の前記精製タンパク質のアミノ酸配列と少なくとも約30%のアミノ酸類似性を有する精製ポリペプチド。
【請求項61】
a)配列番号2(図22)で表される前記ヌクレオチド配列を単離する工程と、
b)i)プロモーター、およびii)該ブロモーターに機能的に連結した前記単離ヌクレオチド配列を含むベクターを構築する工程と、
c)前記エロンガーゼ酵素の発現に十分な時間および条件の下で、前記ベクターを宿主細胞に導入する工程とを含むエロンガーゼ酵素の製造方法。
【請求項62】
前記宿主細胞が真核細胞または原核細胞から成る群から選択されることを特徴とする請求項61に記載の方法。
【請求項63】
前記原核細胞が、E.coli、CyanobacteriaおよびB.subtilisから成る群から選択されることを特徴とする請求項62に記載の方法。
【請求項64】
前記真核細胞が、哺乳動物細胞、昆虫細胞、植物細胞および真菌細胞から成る群から選択されることを特徴とする請求項62に記載の方法。
【請求項65】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Lipomyces starkey、Yarrowia spp.、Kluyveromyces spp.、Hansenula spp.、Aspergillus spp.、Penicillium spp.、Neurospora spp.、Trichoderma spp.およびPichia spp.から成る群から選択されることを特徴とする請求項64に記載の方法。
【請求項66】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Hansenula spp.およびPichia spp.から成る群から選択された酵母菌細胞であることを特徴とする請求項65に記載の方法。
【請求項67】
前記酵母菌細胞が、Saccharomyces cerevisiaeであることを特徴とする請求項66に記載の方法。
【請求項68】
a)プロモーター、およびb)該プロモーターに機能的に連結した配列番号2(図22)によって表されるヌクレオチド配列を含むベクター。
【請求項69】
請求項68に記載の前記ベクターを含む宿主細胞。
【請求項70】
前記宿主細胞が真核細胞または原核細胞から成る群から選択されることを特徴とする請求項69に記載の宿主細胞。
【請求項71】
前記原核細胞が、E.coli、CyanobacteriaおよびB.subtilisから成る群から選択されることを特徴とする請求項70に記載の宿主細胞。
【請求項72】
前記真核細胞が、哺乳動物細胞、昆虫細胞、植物細胞および真菌細胞を含む群から選択されることを特徴とする請求項70に記載の宿主細胞。
【請求項73】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Lipomyces starkey、Yarrowia spp.、Kluyveromyces spp.、Hansenula spp.、Aspergillus spp.、Penicillium spp.、Neurospora spp.、Trichoderma spp.およびPichia spp.から成る群から選択されることを特徴とする請求項72に記載の宿主細胞。
【請求項74】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Hansenula spp.およびPichia spp.から成る群から選択された酵母菌細胞であることを特徴とする請求項73に記載の宿主細胞。
【請求項75】
前記宿主細胞が、Saccharomyces cerevisiaeであることを特徴とする請求項74に記載の宿主細胞。
【請求項76】
請求項68に記載のベクターを含む植物細胞、植物または植物組織であって、前記ベクターの前記ヌクレオチド配列の発現が、前記植物細胞、植物または植物組織によるポリ不飽和脂肪酸の生成をもたらすことを特徴とする、前記植物細胞、植物または植物組織。
【請求項77】
前記ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項76に記載の植物細胞、植物または植物組織。
【請求項78】
請求項76に記載の植物細胞、植物または植物組織によって発現される一つまたは複数の植物油または脂肪酸。
【請求項79】
請求項68に記載のベクターを含むトランスジェニック植物であって、前記ベクターの前記ヌクレオチド配列の発現が、前記トランスジェニック植物の種子中にポリ不飽和脂肪酸の生成をもたらすことを特徴とするトランスジェニック植物。
【請求項80】
そのゲノムが、プロモーターに機能的に連結したエロンガーゼをコードするM.alpina由来のDNA配列を含むヒト以外のトランスジェニック哺乳動物。
【請求項81】
前記DNA配列が配列番号2(図22)によって表されることを特徴とする請求項80に記載のヒト以外のトランスジェニック哺乳動物。
【請求項82】
請求項81に記載の前記ヒト以外のトランスジェニック哺乳動物によって生成される体液であって、前記体液が、検出可能なレベルの少なくとも一つのエロンガーゼまたはその生成物を含むことを特徴とする前記体液。
【請求項83】
a)配列番号2(図22)で表される前記ヌクレオチド配列を単離する工程と、
b)前記単離ヌクレオチド配列を含むベクターを構築する工程と、
c)前記単離ヌクレオチド配列によってコードされたエロンガーゼ酵素の発現に十分な時間および条件の下で、前記ベクターを宿主細胞に導入する工程と、
d)基質ポリ不飽和脂肪酸を生成物ポリ不飽和脂肪酸に変換するために、前記基質に前記発現エロンガーゼ酵素を曝露する工程、とを含むポリ不飽和脂肪酸の製造方法。
【請求項84】
前記基質ポリ不飽和脂肪酸が、GLA、STAおよびAAから成る群から選択されること、そして前記の生成物ポリ不飽和脂肪酸が、それぞれDGLA、20:4n−3およびω6−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項83に記載の方法。
【請求項85】
前記の生成物ポリ不飽和脂肪酸を別のポリ不飽和脂肪酸に変換するために、前記の発現されたエロンガーゼ酵素を少なくとも一つのデサチュラーゼに曝露する工程をさらに含むことを特徴とする請求項83に記載の方法。
【請求項86】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されること、そして別のポリ不飽和脂肪酸が、それぞれAA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されること、そして少なくとも一つの前記デサチュラーゼが、AAまたはEPAの生成に関してはΔ5−デサチュラーゼであり、ω6−ドコサペンタエン酸の生成に関してはΔ4−デサチュラーゼであることを特徴とする請求項85に記載の方法。
【請求項87】
前記別のポリ不飽和脂肪酸を最終ポリ不飽和脂肪酸に変換するために、前記別の不飽和ポリ脂肪酸を、少なくとも一つのエロンガーゼと、少なくとも一つの付加的なデサチュラーゼとから成る群から選択された一つまたは複数の酵素に曝露する工程をさらに含むことを特徴とする請求項86に記載の方法。
【請求項88】
最終ポリ不飽和脂肪酸が、ドコサヘキサエン酸、AA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることことを特徴とする請求項87に記載の方法。
【請求項89】
請求項83に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項85に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項87に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸を含むことを特徴とする栄養組成物。
【請求項90】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項89に記載の栄養組成物。
【請求項91】
前記別のポリ不飽和脂肪酸が、AA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項89に記載の栄養組成物。
【請求項92】
前記最終ポリ不飽和脂肪酸が、DHA、AA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項89に記載の栄養組成物。
【請求項93】
前記栄養組成物が、幼児用調合物、栄養補助食品および食品代用物から成る群から選択されることを特徴とする請求項89に記載の栄養組成物。
【請求項94】
前記栄養組成物がヒトまたは動物に投与されることを特徴とする請求項93に記載の栄養組成物。
【請求項95】
前記栄養組成物が、経口的または非経口的に投与されることを特徴とする請求項94に記載の栄養組成物。
【請求項96】
前記栄養組成物が、ココナッツ油、大豆油、カノラ油、モノグリセリド、ジグリセリド、トリグリセリド、グルコース、食用ラクトース、電気透析ホエー、電気透析スキムミルク、乳清、大豆タンパク、タンパク質加水分解物、ヒマワリ油、サフラワー油、コーン油および亜麻油から成る群から選択された少なくとも一つのマクロ栄養物をさらに含むことを特徴とする請求項93に記載の栄養組成物。
【請求項97】
ビタミンA、C、D、EおよびB複合体から成る群から選択された少なくとも一つのビタミンと、カルシウム、マグネシウム、亜鉛、マンガン、ナトリウム、カリウム、リン、銅、塩化物、ヨウ素、セレンおよび鉄から成る群から選択された少なくとも一つのミネラルとをさらに含むことを特徴とする請求項96に記載の栄養組成物。
【請求項98】
1)請求項83に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項85に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項87に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸と、2)薬学的に許容される担体とを含む薬学的組成物。
【請求項99】
前記薬学的組成物がヒトまたは動物に投与されることを特徴とする請求項98に記載の薬学的組成物。
【請求項100】
前記薬学的組成物が、ビタミン、ミネラル、塩、炭水化物、アミノ酸、遊離脂肪酸、保存料、賦形剤、抗ヒスタミン、成長因子、抗生物質、希釈剤、リン脂質、酸化防止剤およびフェノール性化合物から成る群から選択された少なくとも一つの要素をさらに含むことを特徴とする請求項98に記載の薬学的組成物。
【請求項101】
請求項83に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項85に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項87に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸を含む動物飼料。
【請求項102】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項101に記載の動物飼料。
【請求項103】
前記別のポリ不飽和脂肪酸が、AA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項101に記載の動物飼料。
【請求項104】
前記最終ポリ不飽和脂肪酸が、DHA、アドレニン酸、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項101に記載の栄養組成物。
【請求項105】
請求項83に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項85に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項87に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択されたポリ不飽和脂肪酸を含む化粧品。
【請求項106】
ポリ不飽和脂肪酸の摂取量の不足によって起こる状態を防止または治療する方法であって、前記治療に有効な量の、請求項89に記載の前記栄養組成物を前記患者に投与することを含む前記防止または治療方法。
【請求項107】
配列番号3(図43)に示されたヌクレオチド配列の少なくとも約35%に一致するまたは相補的である単離ヌクレオチド配列。
【請求項108】
前記配列が配列番号3で表されることを特徴とする請求項107に記載の単離ヌクレオチド配列。
【請求項109】
前記配列が、ポリ不飽和脂肪酸またはモノ不飽和脂肪酸を基質として利用する機能的に活性なエロンガーゼをコードすることを特徴とする請求項107または108に記載の単離ヌクレオチド配列。
【請求項110】
前記配列が哺乳類から誘導されることを特徴とする請求項109に記載のヌクレオチド配列。
【請求項111】
前記哺乳動物がヒトであることを特徴とする請求項110に記載のヌクレオチド配列。
【請求項112】
請求項107または108記載の前記ヌクレオチド配列によってコードされた精製タンパク質。
【請求項113】
ポリ不飽和脂肪酸またはモノ不飽和脂肪酸を伸張させる精製ポリペプチドであり、かつ請求項112に記載の前記精製タンパク質のアミノ酸配列と少なくとも約30%のアミノ酸類似性を有する精製ポリペプチド。
【請求項114】
a)配列番号3(図43)で表される前記ヌクレオチド配列を単離する工程と、
b)i)プロモーター、およびii)該プロモーターに機能的に連結した前記単離ヌクレオチド配列を含むベクターを構築する工程と、
c)前記エロンガーゼ酵素の発現に十分な時間および条件の下で、前記ベクターを宿主細胞に導入する工程とを含むエロンガーゼ酵素の製造方法。
【請求項115】
前記宿主細胞が真核細胞または原核細胞から成る群から選択されることを特徴とする請求項114に記載の方法。
【請求項116】
前記原核細胞が、E.coli、CyanobacteriaおよびB.subtilisから成る群から選択されることを特徴とする請求項115に記載の方法。
【請求項117】
前記真核細胞が、哺乳動物細胞、昆虫細胞、植物細胞および真菌細胞から成る群から選択されることを特徴とする請求項115に記載の方法。
【請求項118】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Lipomyces starkey、Yarrowia spp.、Kluyveromyces spp.、Hansenula spp.、Aspergillus spp.、Penicillium spp.、Neurospora spp.、Trichoderma spp.およびPichia spp.から成る群から選択されることを特徴とする請求項117に記載の方法。
【請求項119】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Hansenula spp.およびPichia spp.から成る群から選択された酵母菌細胞であることを特徴とする請求項118に記載の方法。
【請求項120】
前記酵母菌細胞が、Saccharomyces cerevisiaeであることを特徴とする請求項119に記載の方法。
【請求項121】
a)プロモーター、およびb)該プロモーターに機能的に連結した配列番号3(図43)によって表されるヌクレオチド配列を含むベクター。
【請求項122】
請求項121に記載の前記ベクターを含む宿主細胞。
【請求項123】
前記宿主細胞が真核細胞または原核細胞から成る群から選択されることを特徴とする請求項122に記載の宿主細胞。
【請求項124】
前記原核細胞が、E.coli、CyanobacteriaおよびB.subtilisから成る群から選択されることを特徴とする請求項123に記載の宿主細胞。
【請求項125】
前記真核細胞が、哺乳動物細胞、昆虫細胞、植物細胞および真菌細胞を含む群から選択されることを特徴とする請求項123に記載の宿主細胞。
【請求項126】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Lipomyces starkey、Yarrowia spp.、Kluyveromyces spp.、Hansenula spp.、Aspergillus spp.、Penicillium spp.、Neurospora spp.、Trichoderma spp.およびPichia spp.から成る群から選択されることを特徴とする請求項125に記載の宿主細胞。
【請求項127】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Hansenula spp.およびPichia spp.から成る群から選択された酵母菌細胞であることを特徴とする請求項126に記載の宿主細胞。
【請求項128】
前記宿主細胞が、Saccharomyces cerevisiaeであることを特徴とする請求項127に記載の宿主細胞。
【請求項129】
前記ベクターの前記ヌクレオチド配列の発現が、前記植物細胞、植物または植物組織によるモノ不飽和脂肪酸およびポリ不飽和脂肪酸から成る群から選択された少なくとも一つの脂肪酸の生成をもたらすことを特徴とする、請求項121に記載の前記ベクターを含む植物細胞、植物または植物組織。
【請求項130】
前記ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項129に記載の植物細胞、植物または植物組織。
【請求項131】
請求項130に記載の植物細胞、植物または植物組織によって発現される一つまたは複数の植物油または脂肪酸。
【請求項132】
請求項121に記載のベクターを含むトランスジェニック植物であって、前記ベクターの前記ヌクレオチド配列の発現が、前記トランスジェニック植物の種子中にポリ不飽和脂肪酸の生成をもたらすことを特徴とするトランスジェニック植物。
【請求項133】
そのゲノムが、プロモーターに機能的に連結したエロンガーゼをコードするヒトDNA配列を含むヒト以外のトランスジェニック哺乳動物。
【請求項134】
前記DNA配列が配列番号3(図43)によって表されることを特徴とする請求項133に記載のヒト以外のトランスジェニック哺乳動物。
【請求項135】
請求項134に記載の前記ヒト以外のトランスジェニック哺乳動物によって生成される体液であって、前記体液が、検出可能なレベルの少なくとも一つのエロンガーゼまたはその生成物を含むことを特徴とする前記体液。
【請求項136】
a)配列番号3(図43)で表される前記ヌクレオチド配列を単離する工程と、
b)前記単離ヌクレオチド配列を含むベクターを構築する工程と、
c)前記単離ヌクレオチド配列によってコードされたエロンガーゼ酵素の発現に十分な時間および条件の下で、前記ベクターを宿主細胞に導入する工程と、
d)基質ポリ不飽和脂肪酸を生成物ポリ不飽和脂肪酸に変換するために、前記基質に前記発現エロンガーゼ酵素を曝露する工程、とを含むポリ不飽和脂肪酸の製造方法。
【請求項137】
前記基質ポリ不飽和脂肪酸が、GLA、STAおよびAAから成る群から選択されること、そして前記の生成物ポリ不飽和脂肪酸が、それぞれDGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項136に記載の方法。
【請求項138】
前記の生成物ポリ不飽和脂肪酸を別のポリ不飽和脂肪酸に変換するために、発現された前記の不飽和脂肪酸を少なくとも一つのデサチュラーゼに曝露する工程をさらに含むことを特徴とする請求項136に記載の方法。
【請求項139】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されること、そして別のポリ不飽和脂肪酸が、それぞれAA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されること、そして少なくとも一つの前記デサチュラーゼが、AAまたはEPAの生成に関してはΔ5−デサチュラーゼであり、ω6−ドコサペンタエン酸の生成に関してはΔ4−デサチュラーゼであることを特徴とする請求項138に記載の方法。
【請求項140】
前記別のポリ不飽和脂肪酸を最終ポリ不飽和脂肪酸に変換するために、前記別の不飽和ポリ脂肪酸を、少なくとも一つのエロンガーゼと少なくとも一つの付加的なデサチュラーゼから成る群から選択された一つまたは複数の酵素に曝露する工程をさらに含むことを特徴とする請求項138に記載の方法。
【請求項141】
最終ポリ不飽和脂肪酸が、DHA、ADA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることことを特徴とする請求項140に記載の方法。
【請求項142】
請求項136に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項138に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項140に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸を含むことを特徴とする栄養組成物。
【請求項143】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項142に記載の栄養組成物。
【請求項144】
前記別のポリ不飽和脂肪酸が、AA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項142に記載の栄養組成物。
【請求項145】
前記最終ポリ不飽和脂肪酸が、DHA、AA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項142に記載の栄養組成物。
【請求項146】
前記栄養組成物が、幼児用調合物、栄養補助食品および食品代用物から成る群から選択されることを特徴とする請求項142に記載の栄養組成物。
【請求項147】
前記栄養組成物がヒトまたは動物に投与されることを特徴とする請求項146に記載の栄養組成物。
【請求項148】
前記栄養組成物が、経口的または非経口的に投与されることを特徴とする請求項147に記載の栄養組成物。
【請求項149】
前記栄養組成物が、ココナッツ油、大豆油、カノラ油、モノグリセリド、ジグリセリド、トリグリセリド、グルコース、食用ラクトース、電気透析ホエー、電気透析スキムミルク、乳清、大豆タンパク、タンパク質加水分解物、ヒマワリ油、サフラワー油、コーン油および亜麻油から成る群から選択された少なくとも一つのマクロ栄養物をさらに含むことを特徴とする請求項143に記載の栄養組成物。
【請求項150】
ビタミンA、C、D、EおよびB複合体から成る群から選択された少なくとも一つのビタミンと、カルシウム、マグネシウム、亜鉛、マンガン、ナトリウム、カリウム、リン、銅、塩化物、ヨウ素、セレンおよび鉄から成る群から選択された少なくとも一つのミネラルとをさらに含むことを特徴とする請求項149に記載の栄養組成物。
【請求項151】
1)請求項136に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項138に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項140に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸と、2)薬学的に許容される担体とを含む薬学的組成物。
【請求項152】
前記薬学的組成物がヒトまたは動物に投与されることを特徴とする請求項151に記載の薬学的組成物。
【請求項153】
前記薬学的組成物が、ビタミン、ミネラル、塩、炭水化物、アミノ酸、遊離脂肪酸、保存料、賦形剤、抗ヒスタミン、成長因子、抗生物質、希釈剤、リン脂質、酸化防止剤およびフェノール性化合物から成る群から選択された少なくとも一つの要素をさらに含むことを特徴とする請求項151に記載の薬学的組成物。
【請求項154】
請求項136に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項138に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項140に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸を含む動物飼料。
【請求項155】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項154に記載の動物飼料。
【請求項156】
前記別のポリ不飽和脂肪酸が、AA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項154に記載の動物飼料。
【請求項157】
前記最終ポリ不飽和脂肪酸が、DHA、ADA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項154に記載の栄養組成物。
【請求項158】
請求項136に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項138に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項140に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択されたポリ不飽和脂肪酸を含む化粧品。
【請求項159】
ポリ不飽和脂肪酸の摂取量の不足によって起こる状態を防止または治療する方法であって、前記治療に有効な量の、請求項142に記載の前記栄養物を前記患者に投与することを含む前記防止または治療方法。
【請求項160】
配列番号4(図46)に示されたヌクレオチド配列の少なくとも約35%に一致するまたは相補的である単離ヌクレオチド配列。
【請求項161】
前記配列が配列番号4で表されることを特徴とする請求項160に記載の単離ヌクレオチド配列。
【請求項162】
前記配列が、ポリ不飽和脂肪酸を基質として利用する機能的に活性なエロンガーゼをコードすることを特徴とする請求項160または161に記載の単離ヌクレオチド配列。
【請求項163】
前記配列がCaenorhabditis属の線虫(nematode)から誘導されることを特徴とする請求項162に記載のヌクレオチド配列。
【請求項164】
前記線虫がelegans種であることを特徴とする請求項163に記載のヌクレオチド配列。
【請求項165】
請求項160または161記載の前記ヌクレオチド配列によってコードされた精製タンパク質。
【請求項166】
ポリ不飽和脂肪酸を伸張させる精製ポリペプチドであり、かつ請求項165に記載の前記精製タンパク質のアミノ酸配列と少なくとも約30%のアミノ酸類似性を有する精製ポリペプチド。
【請求項167】
a)配列番号4(図46)で表される前記ヌクレオチド配列を単離する工程と、
b)i)プロモーター、およびii)該プロモーターに機能的に連結した前記単離ヌクレオチド配列を含むベクターを構築する工程と、
c)前記エロンガーゼ酵素の発現に十分な時間および条件の下で、前記ベクターを宿主細胞に導入する工程とを含むエロンガーゼ酵素の製造方法。
【請求項168】
前記宿主細胞が真核細胞または原核細胞から成る群から選択されることを特徴とする請求項167に記載の方法。
【請求項169】
前記原核細胞が、E.coli、CyanobacteriaおよびB.subtilisから成る群から選択されることを特徴とする請求項168に記載の方法。
【請求項170】
前記真核細胞が、哺乳動物細胞、昆虫細胞、植物細胞および真菌細胞から成る群から選択されることを特徴とする請求項168に記載の方法。
【請求項171】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Lipomyces starkey、Yarrowia spp.、Kluyveromyces spp.、Hansenula spp.、Aspergillus spp.、Penicillium spp.、Neurospora spp.、Trichoderma spp.およびPichia spp.から成る群から選択されることを特徴とする請求項170に記載の方法。
【請求項172】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Hansenula spp.およびPichia spp.から成る群から選択された酵母菌細胞であることを特徴とする請求項171に記載の方法。
【請求項173】
前記酵母菌細胞が、Saccharomyces cerevisiaeであることを特徴とする請求項172に記載の方法。
【請求項174】
a)プロモーター、およびb)該プロモーターに機能的に連結した配列番号4(図46)によって表されるヌクレオチド配列を含むベクター。
【請求項175】
請求項174に記載の前記ベクターを含む宿主細胞。
【請求項176】
前記宿主細胞が真核細胞または原核細胞から成る群から選択されることを特徴とする請求項175に記載の宿主細胞。
【請求項177】
前記原核細胞が、E.coli、CyanobacteriaおよびB.subtilisから成る群から選択されることを特徴とする請求項176に記載の宿主細胞。
【請求項178】
前記真核細胞が、哺乳動物細胞、昆虫細胞、植物細胞および真菌細胞を含む群から選択されることを特徴とする請求項176に記載の宿主細胞。
【請求項179】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Lipomyces starkey、Yarrowia spp.、Kluyveromyces spp.、Hansenula spp.、Aspergillus spp.、Penicillium spp.、Neurospora spp.、Trichoderma spp.およびPichia spp.から成る群から選択されることを特徴とする請求項178に記載の宿主細胞。
【請求項180】
前記真菌細胞が、Saccharomyces spp.、Candida spp.、Hansenula spp.およびPichia spp.から成る群から選択された酵母菌細胞であることを特徴とする請求項179に記載の宿主細胞。
【請求項181】
前記宿主細胞が、Saccharomyces cerevisiaeであることを特徴とする請求項1180に記載の宿主細胞。
【請求項182】
前記ベクターの前記ヌクレオチド配列の発現が、前記植物細胞、植物または植物組織によるポリ不飽和脂肪酸の生成をもたらすことを特徴とする、請求項174に記載の前記ベクターを含む植物細胞、植物または植物組織。
【請求項183】
前記ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項182に記載の植物細胞、植物または植物組織。
【請求項184】
請求項182に記載の植物細胞、植物または植物組織によって発現される一つまたは複数の植物油または脂肪酸。
【請求項185】
請求項174に記載のベクターを含むトランスジェニック植物であって、前記ベクターの前記ヌクレオチド配列の発現が、前記トランスジェニック植物の種子中にポリ不飽和脂肪酸の生成をもたらすことを特徴とするトランスジェニック植物。
【請求項186】
そのゲノムが、プロモーターに機能的に連結したエロンガーゼをコードする、C.elegansからのDNA配列を含むヒト以外のトランスジェニック哺乳動物。
【請求項187】
前記DNA配列が配列番号4(図46)によって表されることを特徴とする請求項186に記載のヒト以外のトランスジェニック哺乳動物。
【請求項188】
請求項187に記載の前記ヒト以外のトランスジェニック哺乳動物によって生成される体液であって、前記体液が、検出可能なレベルの少なくとも一つのエロンガーゼまたはその生成物を含むことを特徴とする前記体液。
【請求項189】
a)配列番号4(図46)で表される前記ヌクレオチド配列を単離する工程と、
b)前記単離ヌクレオチド配列を含むベクターを構築する工程と、
c)前記単離ヌクレオチド配列によってコードされたエロンガーゼ酵素の発現に十分な時間および条件の下で、前記ベクターを宿主細胞に導入する工程と、
d)基質ポリ不飽和脂肪酸を生成物ポリ不飽和脂肪酸に変換するために、前記基質に前記発現エロンガーゼ酵素を曝露する工程、とを含むポリ不飽和脂肪酸の製造方法。
【請求項190】
前記基質ポリ不飽和脂肪酸が、GLA、STAおよびAAから成る群から選択されること、そして前記の生成物ポリ不飽和脂肪酸が、それぞれDGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項189に記載の方法。
【請求項191】
前記の生成物ポリ不飽和脂肪酸を別のポリ不飽和脂肪酸に変換するために、前記の発現されたエロンガーゼ酵素を少なくとも一つのデサチュラーゼに曝露する工程をさらに含むことを特徴とする請求項189に記載の方法。
【請求項192】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されること、そして別のポリ不飽和脂肪酸が、それぞれAA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されること、そして少なくとも一つの前記デサチュラーゼが、AAまたはEPAの生成に関してはΔ5−デサチュラーゼであり、ω6−ドコサペンタエン酸の生成に関してはΔ4−デサチュラーゼであることを特徴とする請求項191に記載の方法。
【請求項193】
前記別のポリ不飽和脂肪酸を最終ポリ不飽和脂肪酸に変換するために、前記別の不飽和ポリ脂肪酸を、少なくとも一つのエロンガーゼと少なくとも一つの付加的なデサチュラーゼから成る群から選択された一つまたは複数の酵素に曝露する工程をさらに含むことを特徴とする請求項192に記載の方法。
【請求項194】
最終ポリ不飽和脂肪酸が、DHA、ADA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることことを特徴とする請求項193に記載の方法。
【請求項195】
請求項189に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項191に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項193に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸を含むことを特徴とする栄養組成物。
【請求項196】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項195に記載の栄養組成物。
【請求項197】
前記別のポリ不飽和脂肪酸が、AA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項195に記載の栄養組成物。
【請求項198】
前記最終ポリ不飽和脂肪酸が、DHA、AA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項195に記載の栄養組成物。
【請求項199】
前記栄養組成物が、幼児用調合物、栄養補助食品および食品代用物から成る群から選択されることを特徴とする請求項195に記載の栄養組成物。
【請求項200】
前記栄養組成物がヒトまたは動物に投与されることを特徴とする請求項199に記載の栄養組成物。
【請求項201】
前記栄養組成物が、経口的または非経口的に投与されることを特徴とする請求項200に記載の栄養組成物。
【請求項202】
前記栄養組成物が、ココナッツ油、大豆油、カノラ油、モノグリセリド、ジグリセリド、トリグリセリド、グルコース、食用ラクトース、電気透析ホエー、電気透析スキムミルク、乳清、大豆タンパク、タンパク質加水分解物、ヒマワリ油、サフラワー油、コーン油および亜麻油から成る群から選択された少なくとも一つのマクロ栄養物をさらに含むことを特徴とする請求項199に記載の栄養組成物。
【請求項203】
ビタミンA、C、D、EおよびB複合体から成る群から選択された少なくとも一つのビタミンと、カルシウム、マグネシウム、亜鉛、マンガン、ナトリウム、カリウム、リン、銅、塩化物、ヨウ素、セレンおよび鉄から成る群から選択された少なくとも一つのミネラルとをさらに含むことを特徴とする請求項202に記載の栄養組成物。
【請求項204】
1)請求項189に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項191に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項193に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸と、2)薬学的に許容される担体とを含む薬学的組成物。
【請求項205】
前記薬学的組成物がヒトまたは動物に投与されることを特徴とする請求項204に記載の薬学的組成物。
【請求項206】
前記薬学的組成物が、ビタミン、ミネラル、塩、炭水化物、アミノ酸、遊離脂肪酸、保存料、賦形剤、抗ヒスタミン、成長因子、抗生物質、希釈剤、リン脂質、酸化防止剤およびフェノール性化合物から成る群から選択された少なくとも一つの要素をさらに含むことを特徴とする請求項203に記載の薬学的組成物。
【請求項207】
請求項189に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項191に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項193に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択された少なくとも一つのポリ不飽和脂肪酸を含む動物飼料。
【請求項208】
前記生成物ポリ不飽和脂肪酸が、DGLA、20:4n−3およびADAから成る群から選択されることを特徴とする請求項207に記載の動物飼料。
【請求項209】
前記別のポリ不飽和脂肪酸が、AA、EPAおよびω6−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項207に記載の動物飼料。
【請求項210】
前記最終ポリ不飽和脂肪酸が、DHA、ADA、ω6−ドコサペンタエン酸およびω3−ドコサペンタエン酸から成る群から選択されることを特徴とする請求項207に記載の栄養組成物。
【請求項211】
請求項189に記載の方法に従って製造された前記生成物ポリ不飽和脂肪酸と、請求項191に記載の方法に従って製造された前記別のポリ不飽和脂肪酸と、請求項193に記載の方法に従って製造された前記最終ポリ不飽和脂肪酸とから成る群から選択されたポリ不飽和脂肪酸を含む化粧品。
【請求項212】
ポリ不飽和脂肪酸の摂取量の不足によって起こる状態を防止または治療する方法であって、前記防止または治療に有効な量の、請求項195に記載の前記栄養物を前記患者に投与することを含む前記防止または治療方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10A】


【図10B】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【図39】


【図40】


【図41】


【図42】


【図43】


【図44】


【図45】


【図46】


【図47】


【図48】


【図49】


【図50】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10A】


【図10B】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【図39】


【図40】


【図41】


【図42】


【図43】


【図44】


【図45】


【図46】


【図47】


【図48】


【図49】


【図50】


【公開番号】特開2011−139703(P2011−139703A)
【公開日】平成23年7月21日(2011.7.21)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−14983(P2011−14983)
【出願日】平成23年1月27日(2011.1.27)
【分割の表示】特願2000−567706(P2000−567706)の分割
【原出願日】平成11年8月30日(1999.8.30)
【出願人】(391008788)アボット・ラボラトリーズ (650)
【氏名又は名称原語表記】ABBOTT LABORATORIES
【Fターム(参考)】
【公開日】平成23年7月21日(2011.7.21)
【国際特許分類】
【出願番号】特願2011−14983(P2011−14983)
【出願日】平成23年1月27日(2011.1.27)
【分割の表示】特願2000−567706(P2000−567706)の分割
【原出願日】平成11年8月30日(1999.8.30)
【出願人】(391008788)アボット・ラボラトリーズ (650)
【氏名又は名称原語表記】ABBOTT LABORATORIES
【Fターム(参考)】
[ Back to top ]

