オキアミの水溶性抽出物の薬理用途
【課題】 オキアミに含まれる新規な成分が有する薬理用途を提供すること。
【解決手段】 本発明によれば、オキアミに含まれる成分が有する新規な薬理用途として、オキアミの水溶性抽出物を有効成分とする抗肥満剤を提供することができる。その抗肥満効果は、例えば、PPARγ遺伝子の発現抑制作用、C/EBPα遺伝子の発現抑制作用、脂肪細胞における脂肪蓄積抑制作用、体重増加抑制作用に基づく。
【解決手段】 本発明によれば、オキアミに含まれる成分が有する新規な薬理用途として、オキアミの水溶性抽出物を有効成分とする抗肥満剤を提供することができる。その抗肥満効果は、例えば、PPARγ遺伝子の発現抑制作用、C/EBPα遺伝子の発現抑制作用、脂肪細胞における脂肪蓄積抑制作用、体重増加抑制作用に基づく。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、オキアミの水溶性抽出物の薬理用途に関する。
【背景技術】
【0002】
オキアミ(Euphausiacea)は、養殖魚のエサや釣りのエサなどとして利用されている海洋生物であることは周知の通りである。その食用資源としての価値は今のところそれほど注目されてはいないが、オキアミの一種であるツノナシオキアミ(Euphausia pacifica)は、三陸地方ではイサダと呼ばれ、食用として馴染み深い。
【0003】
近年、海洋生物に含まれる成分が持つ薬理作用についての関心が高まっている。オキアミについても、特許文献1において、そのエタノール抽出物が、摂食抑制に関わる因子の一つであるレプチンの脂肪細胞からの分泌促進作用に基づいて肥満の予防や治療に有効であると提案されている。しかしながら、特許文献1においては、オキアミのエタノール抽出物がインビボ実験において体重増加抑制作用などを持つことは確認されておらず、その有用性は不明である。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2008−239500号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
そこで本発明は、オキアミに含まれる新規な成分が有する薬理用途を提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明者らは上記の点に鑑みて鋭意研究を重ねた結果、オキアミの水溶性抽出物が、脂肪細胞の分化に不可欠なタンパク質をコードする遺伝子の発現抑制作用、脂肪細胞における脂肪蓄積抑制作用、体重増加抑制作用を持ち、肥満の予防や治療に有効であることを見出した。
【0007】
上記の知見に基づいてなされた本発明は、請求項1記載の通り、オキアミの水溶性抽出物を有効成分とするPPARγ遺伝子の発現抑制剤である。
また、本発明は、請求項2記載の通り、オキアミの水溶性抽出物を有効成分とするC/EBPα遺伝子の発現抑制剤である。
また、本発明は、請求項3記載の通り、オキアミの水溶性抽出物を有効成分とする脂肪細胞における脂肪蓄積抑制剤である。
また、本発明は、請求項4記載の通り、オキアミの水溶性抽出物を有効成分とする体重増加抑制剤である。
また、本発明は、請求項5記載の通り、オキアミの水溶性抽出物を有効成分とする抗肥満剤である。
また、本発明は、請求項6記載の通り、オキアミの水溶性抽出物を含んでなる飲食品である。
また、本発明は、請求項7記載の通り、オキアミの水溶性抽出物を含んでなる医薬品である。
また、本発明は、請求項8記載の通り、オキアミの水溶性抽出物を含んでなる動物用餌である。
【発明の効果】
【0008】
本発明によれば、オキアミに含まれる新規な成分が有する薬理用途として、オキアミの水溶性抽出物を有効成分とする抗肥満剤を提供することができる。本発明のオキアミの水溶性抽出物と特許文献1に記載のオキアミのエタノール抽出物は、肥満の予防や治療を目的とする有効成分である点において共通する。しかしながら、特許文献1に記載のオキアミのエタノール抽出物は、レプチンが持つ摂食抑制作用などによって効果を期待するものであるのに対し、本発明のオキアミの水溶性抽出物は、後述する実施例から明らかなようにレプチン分泌促進作用を持たないことから、その効果はレプチンが持つ摂食抑制作用などによるものではない。従って、本発明のオキアミの水溶性抽出物と特許文献1に記載のオキアミのエタノール抽出物は、成分的にも作用的にも全く異なるものである。
【図面の簡単な説明】
【0009】
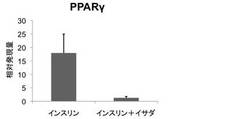
【図1】実施例1におけるオキアミの水溶性抽出物のPPARγ遺伝子の発現抑制作用を示すグラフである。
【図2】同、C/EBPα遺伝子の発現抑制作用を示すグラフである。
【図3】同、脂肪細胞における脂肪蓄積抑制作用を示す写真である。
【図4】同、マウスの体重増加抑制作用を示すグラフである。
【図5】実施例1における各群のマウスの18週間における1日あたりの平均摂餌量を示すグラフである。
【発明を実施するための形態】
【0010】
本発明において、PPARγ(Peroxisome Proliferator−Activated Receptor γ:ペルオキシソーム増殖因子活性化受容体γ)は、核内受容体型の転写調節因子として機能するタンパク質であって、脂肪細胞の分化において中心的役割を果たしていることが知られており、C/EBPαは、ロイシンジッパー型転写因子として機能するタンパク質であって、PPARγとともに脂肪細胞の分化のマスターレギュレーターであることが知られている(PPARγとC/EBPαについては必要であれば例えばStephane Gesta,Yu−Hua Tesng,C.Ronald Kahn.Developmental Origin of Fat:Tracking Obesity to Its Source.Cell 131:242−256(2007)を参照のこと)。オキアミの水溶性抽出物は、これらのタンパク質をコードする遺伝子の発現抑制作用を持つので、脂肪細胞の分化を抑制することによる抗肥満効果を期待することができる。また、オキアミの水溶性抽出物は、脂肪細胞における脂肪蓄積抑制作用や体重増加抑制作用を持つ。
【0011】
オキアミの水溶性抽出物は、例えば、オキアミに水や湯を加えてホモジナイズし、得られたペースト状物を遠心分離することで得られる上清や、上清をろ過することで得られるろ液として得ることができる。こうして得られた液状の水溶性抽出物は、そのまま液状物として用いてもよいし、乾燥や濃縮を行って固形物や半固形物や粉末などにして用いてもよい。また、上記のようにして得られた液状の水溶性抽出物をさらにゲルろ過やイオンクロマトグラフィーなどによって精製し、得られた画分を水溶性抽出物として用いてもよい。なお、原料として用いるオキアミは特に限定されるものではなく、三陸地方でイサダと呼ばれているツノナシオキアミの他、ナンキョクオキアミ(Euphausia superba)などであってもよい。オキアミは生のものを用いてもよいし、凍結したものを用いてもよい。また、オキアミの乾物や塩蔵物を用いてもよい。
【0012】
本発明におけるオキアミの水溶性抽出物は、例えば、健康食品やサプリメントなどを含む飲食品や医薬品などの形態で人体に対して経口的に投与することができる。これらの形態における製剤組成は特に限定されるものではなく、自体公知の一般的なものを採用することができる。その投与量は、適用対象者の年齢や性別、症状の程度などに基づいて適宜決定することができ、適切な投与量を投与することにより、ヒトに対して抗肥満効果をもたらすことができる。また、オキアミの水溶性抽出物は、ウシやブタなどの家畜やニワトリなどの家禽の飼料、イヌやネコなどのペットフードといった動物用餌に添加し、これらの動物に対する肥満の予防や治療のための有効成分として用いてもよい。
【実施例】
【0013】
以下、本発明を実施例によって詳細に説明するが、本発明は以下の記載に限定して解釈されるものではない。
【0014】
実施例1:
(1)オキアミの水溶性抽出物の調製
三陸地方で漁獲されたイサダ(ツノナシオキアミ)の真空冷凍パック(−25℃凍結保存)13kg分を、パックのままボイル加熱して解凍した後、解凍されたイサダに蒸留水を添加し(重量比でイサダ3に対して1の割合)、カッターミキサーを用いて5分間ホモジナイズしてペースト状物を得た。得られたペースト状物を8000rpmで30分間遠心分離し、得られた上清をろ紙(5A)を用いてろ過することで、約9Lの薄黄色のろ液をオキアミの水溶性抽出物として得た。また、このろ液に対して凍結乾燥を行った後、得られた凍結乾燥物を粉砕することで、オキアミの水溶性抽出物の薄赤色の粉末を得た。
【0015】
(2)オキアミの水溶性抽出物のPPARγ遺伝子およびC/EBPα遺伝子の発現抑制作用
(実験方法)
タイプIコラーゲンコートされた24穴培養プレート(コーニング社)に、1穴あたり1×105個のマウス脂肪前駆細胞:3T3−F442A(DSファーマバイオメディカル社)を加え、10%ウシ胎児血清(インビトロジェン社)および10μg/mLウシインスリン(シグマ社)を含むダルベッコ変法イーグル培地(インビトロジェン社)で9日間培養し、脂肪細胞へ分化誘導した。培養開始7日後の細胞よりRNeasy kit(キアゲン社)を用いてRNAを回収した。回収したRNAを鋳型にしてPrimeScript RT reagent kit(タカラ社)を用いてcDNAを合成した。4ngのcDNAに、フォワードプライマーとリバースプライマーをそれぞれ2μMずつとFast SYBER Green Mix(アプライドバイオシステムズ社)を加え、StepOne plus(アプライドバイオシステムズ社)を用いて、PPARγ遺伝子の定量的PCRを行った。また、同様にして、C/EBPα遺伝子の定量的PCRを行った。得られたデータはRPLP0遺伝子の定量的PCRのデータでノーマライズを行い、分化誘導前の3T3−F442A細胞に対するmRNAの相対的発現量をΔΔCT法にて算出し、遺伝子発現の指標とした。なお、RNA精製、cDNA合成、定量的PCRはキット付属の使用説明書の記載に従って行った。PPARγ遺伝子の定量的PCRは、配列番号1で示されるフォワードプライマー:5’−TGCCTTCGCTGATGCACTGCC−3’と配列番号2で示されるリバースプライマー:5’−CACGGAGAGGTCCACAGAGCTGA−3’を用いて行った。C/EBPα遺伝子の定量的PCRは、配列番号3で示されるフォワードプライマー:5’−CCAACCCCATCCCCAACGGC−3’と配列番号4で示されるリバースプライマー:5’−GAAGCGGTCCAGCCCTGCTC−3’を用いて行った。RPLP0遺伝子の定量的PCRは、配列番号5で示されるフォワードプライマー:5’−TTTGGGCATCACCACGAAAA−3’と配列番号6で示されるリバースプライマー:5’−GGACACCCTCCAGAAAGCGA−3’を用いて行った。
【0016】
(実験結果)
培地に、(1)で得たオキアミの水溶性抽出物の粉末を500μg/mLの濃度で加えて培養を行った場合と、コントロールとして同容量のリン酸緩衝生理食塩水を加えて培養を行った場合のそれぞれにおけるPPARγ遺伝子の発現結果を図1に、C/EBPα遺伝子の発現結果を図2にそれぞれ示す(縦軸は脂肪細胞への分化誘導前(day0)の細胞における発現量を1とした時の相対値)。図1と図2から明らかなように、培地にオキアミの水溶性抽出物を加えて培養を行った場合(インスリン+イサダ)、リン酸緩衝生理食塩水を加えて培養を行った場合(インスリン)に比較して、PPARγ遺伝子およびC/EBPα遺伝子の発現が顕著に抑制されたことから、オキアミの水溶性抽出物は、脂肪細胞の分化を抑制することによる抗肥満効果が期待できることがわかった。
【0017】
(3)オキアミの水溶性抽出物の脂肪細胞における脂肪蓄積抑制作用
(実験方法)
(2)と同様の方法で3T3−F442A細胞を9日間培養し、脂肪細胞へ分化誘導した。培養開始9日後の細胞をリン酸緩衝液で1度洗浄した後、10%ホルマリン溶液(シグマ社)を加え室温で10分間固定した。固定した細胞をリン酸緩衝液で2度洗浄した後、蒸留水で60%に希釈したイソプロパノールを加え、1度洗浄した。その後、180mg/mLのOil Red O(シグマ社)染色液を加え、室温で40分間染色した。染色後の細胞を60%イソプロパノールで1度、リン酸緩衝液で2度洗浄し、倒立顕微鏡(ニコン社)を用い、400倍の倍率で観察した。
【0018】
(実験結果)
培地に、(1)で得たオキアミの水溶性抽出物の粉末を500μg/mLの濃度で加えて培養を行った場合と、コントロールとして同容量のリン酸緩衝生理食塩水を加えて培養を行った場合のそれぞれにおける脂肪細胞のOil Red O染色像を図3に示す。図3から明らかなように、培地にオキアミの水溶性抽出物を加えて培養を行った場合(B)、リン酸緩衝生理食塩水を加えて培養を行った場合(A)に比較して、Oil Red Oによって染色されるトリグリセリドを蓄積した脂肪細胞の数は顕著に少ないことから、オキアミの水溶性抽出物は、脂肪細胞における脂肪蓄積抑制作用を持つことがわかった。
【0019】
(4)オキアミの水溶性抽出物の体重増加抑制作用
(実験方法)
4週齢のC57BL/6系統雄性マウス(日本チャールズリバー社)を実験動物として用いた。マウスを、(a)通常餌であるRodent Diets with 10kcal% Fat(リサーチダイエット社)を摂取させる群:10%fat、(b)通常餌に(1)で得たオキアミの水溶性抽出物の粉末を1%添加した餌を摂取させる群:10%fat+1%イサダ、(c)高脂肪餌であるRodent Diets with 45kcal% Fat(リサーチダイエット社)を摂取させる群:45%fat、(d)高脂肪餌に(1)で得たオキアミの水溶性抽出物の粉末を1%添加した餌を摂取させる群:45%fat+1%イサダ、に分けて飼育を行い(各群5匹)、3日ごとにマウスの体重と餌の摂取量を測定した。また、実験開始から18週後の各群のマウスの心臓から採血を行い、4℃において1200gで10分間遠心分離を行うことで得た上清(血清)中のレプチン濃度を、森永生科学研究所社のレプチン測定キットを用いて測定した。
【0020】
(実験結果)
実験開始から18週間における、各群のマウスの体重増加率(縦軸は実験開始時の体重を1とした時の相対値)を図4に、各群のマウスの1日あたりの平均摂餌量(摂取カロリー)を図5にそれぞれ示す。また、実験開始から18週後の各群のマウスの血清中のレプチン濃度を表1に示す。図4から明らかなように、通常餌を摂取させた場合でも高脂肪餌を摂取させた場合でも、オキアミの水溶性抽出物を添加することで、体重増加が抑制されたが(a群対b群、c群対d群)、体重増加の抑制効果は、通常餌を摂取させた場合よりも高脂肪餌を摂取させた場合の方が優れていたことから、オキアミの水溶性抽出物は、とりわけ高脂肪食摂取下での体重増加の抑制に有効であることがわかった。また、図5から明らかなように、通常餌を摂取させた場合でも高脂肪餌を摂取させた場合でも、オキアミの水溶性抽出物を添加したことによる摂餌量の顕著な低下は認められなかった。さらに、表1から明らかなように、通常餌を摂取させた場合に対して高脂肪餌を摂取させた場合において有意に上昇した血清中のレプチン濃度は、高脂肪餌にオキアミの水溶性抽出物を添加することによって有意に低下した。また、通常餌にオキアミの水溶性抽出物を添加することによって、血清中のレプチン濃度は低下する傾向にあった。以上の結果から、オキアミの水溶性抽出物が持つ体重増加抑制作用は、レプチン分泌の促進作用に基づく摂食抑制作用などによるものではないことがわかった。
【0021】
【表1】

【0022】
実施例2:
実施例1の(1)と同様にして得たナンキョクオキアミの水溶性抽出物も、程度の違いはあるが、実施例1の(2)と(3)の作用を持っていた。
【0023】
比較例1:
クロロホルムとメタノールの混合溶媒(v/v1:2)を用いて得たオキアミの脂溶性抽出物は、実施例1の(2)と(3)の作用を持っていなかった。
【0024】
製剤例1:錠剤
以下の成分組成からなる肥満の予防や治療のための錠剤を自体公知の方法で製造した。
実施例1で得たオキアミの水溶性抽出物の粉末 1
乳糖 80
ステアリン酸マグネシウム 19(単位:重量%)
【0025】
製剤例2:ビスケット
以下の成分組成からなる肥満の予防や治療のためのビスケットを自体公知の方法で製造した。
実施例1で得たオキアミの水溶性抽出物の粉末 1
薄力粉 32
全卵 16
バター 16
砂糖 24
水 10
ベーキングパウダー 1(単位:重量%)
【産業上の利用可能性】
【0026】
本発明は、オキアミに含まれる新規な成分が有する薬理用途として、オキアミの水溶性抽出物を有効成分とする抗肥満剤を提供することができる点において産業上の利用可能性を有する。
【技術分野】
【0001】
本発明は、オキアミの水溶性抽出物の薬理用途に関する。
【背景技術】
【0002】
オキアミ(Euphausiacea)は、養殖魚のエサや釣りのエサなどとして利用されている海洋生物であることは周知の通りである。その食用資源としての価値は今のところそれほど注目されてはいないが、オキアミの一種であるツノナシオキアミ(Euphausia pacifica)は、三陸地方ではイサダと呼ばれ、食用として馴染み深い。
【0003】
近年、海洋生物に含まれる成分が持つ薬理作用についての関心が高まっている。オキアミについても、特許文献1において、そのエタノール抽出物が、摂食抑制に関わる因子の一つであるレプチンの脂肪細胞からの分泌促進作用に基づいて肥満の予防や治療に有効であると提案されている。しかしながら、特許文献1においては、オキアミのエタノール抽出物がインビボ実験において体重増加抑制作用などを持つことは確認されておらず、その有用性は不明である。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2008−239500号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
そこで本発明は、オキアミに含まれる新規な成分が有する薬理用途を提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明者らは上記の点に鑑みて鋭意研究を重ねた結果、オキアミの水溶性抽出物が、脂肪細胞の分化に不可欠なタンパク質をコードする遺伝子の発現抑制作用、脂肪細胞における脂肪蓄積抑制作用、体重増加抑制作用を持ち、肥満の予防や治療に有効であることを見出した。
【0007】
上記の知見に基づいてなされた本発明は、請求項1記載の通り、オキアミの水溶性抽出物を有効成分とするPPARγ遺伝子の発現抑制剤である。
また、本発明は、請求項2記載の通り、オキアミの水溶性抽出物を有効成分とするC/EBPα遺伝子の発現抑制剤である。
また、本発明は、請求項3記載の通り、オキアミの水溶性抽出物を有効成分とする脂肪細胞における脂肪蓄積抑制剤である。
また、本発明は、請求項4記載の通り、オキアミの水溶性抽出物を有効成分とする体重増加抑制剤である。
また、本発明は、請求項5記載の通り、オキアミの水溶性抽出物を有効成分とする抗肥満剤である。
また、本発明は、請求項6記載の通り、オキアミの水溶性抽出物を含んでなる飲食品である。
また、本発明は、請求項7記載の通り、オキアミの水溶性抽出物を含んでなる医薬品である。
また、本発明は、請求項8記載の通り、オキアミの水溶性抽出物を含んでなる動物用餌である。
【発明の効果】
【0008】
本発明によれば、オキアミに含まれる新規な成分が有する薬理用途として、オキアミの水溶性抽出物を有効成分とする抗肥満剤を提供することができる。本発明のオキアミの水溶性抽出物と特許文献1に記載のオキアミのエタノール抽出物は、肥満の予防や治療を目的とする有効成分である点において共通する。しかしながら、特許文献1に記載のオキアミのエタノール抽出物は、レプチンが持つ摂食抑制作用などによって効果を期待するものであるのに対し、本発明のオキアミの水溶性抽出物は、後述する実施例から明らかなようにレプチン分泌促進作用を持たないことから、その効果はレプチンが持つ摂食抑制作用などによるものではない。従って、本発明のオキアミの水溶性抽出物と特許文献1に記載のオキアミのエタノール抽出物は、成分的にも作用的にも全く異なるものである。
【図面の簡単な説明】
【0009】
【図1】実施例1におけるオキアミの水溶性抽出物のPPARγ遺伝子の発現抑制作用を示すグラフである。
【図2】同、C/EBPα遺伝子の発現抑制作用を示すグラフである。
【図3】同、脂肪細胞における脂肪蓄積抑制作用を示す写真である。
【図4】同、マウスの体重増加抑制作用を示すグラフである。
【図5】実施例1における各群のマウスの18週間における1日あたりの平均摂餌量を示すグラフである。
【発明を実施するための形態】
【0010】
本発明において、PPARγ(Peroxisome Proliferator−Activated Receptor γ:ペルオキシソーム増殖因子活性化受容体γ)は、核内受容体型の転写調節因子として機能するタンパク質であって、脂肪細胞の分化において中心的役割を果たしていることが知られており、C/EBPαは、ロイシンジッパー型転写因子として機能するタンパク質であって、PPARγとともに脂肪細胞の分化のマスターレギュレーターであることが知られている(PPARγとC/EBPαについては必要であれば例えばStephane Gesta,Yu−Hua Tesng,C.Ronald Kahn.Developmental Origin of Fat:Tracking Obesity to Its Source.Cell 131:242−256(2007)を参照のこと)。オキアミの水溶性抽出物は、これらのタンパク質をコードする遺伝子の発現抑制作用を持つので、脂肪細胞の分化を抑制することによる抗肥満効果を期待することができる。また、オキアミの水溶性抽出物は、脂肪細胞における脂肪蓄積抑制作用や体重増加抑制作用を持つ。
【0011】
オキアミの水溶性抽出物は、例えば、オキアミに水や湯を加えてホモジナイズし、得られたペースト状物を遠心分離することで得られる上清や、上清をろ過することで得られるろ液として得ることができる。こうして得られた液状の水溶性抽出物は、そのまま液状物として用いてもよいし、乾燥や濃縮を行って固形物や半固形物や粉末などにして用いてもよい。また、上記のようにして得られた液状の水溶性抽出物をさらにゲルろ過やイオンクロマトグラフィーなどによって精製し、得られた画分を水溶性抽出物として用いてもよい。なお、原料として用いるオキアミは特に限定されるものではなく、三陸地方でイサダと呼ばれているツノナシオキアミの他、ナンキョクオキアミ(Euphausia superba)などであってもよい。オキアミは生のものを用いてもよいし、凍結したものを用いてもよい。また、オキアミの乾物や塩蔵物を用いてもよい。
【0012】
本発明におけるオキアミの水溶性抽出物は、例えば、健康食品やサプリメントなどを含む飲食品や医薬品などの形態で人体に対して経口的に投与することができる。これらの形態における製剤組成は特に限定されるものではなく、自体公知の一般的なものを採用することができる。その投与量は、適用対象者の年齢や性別、症状の程度などに基づいて適宜決定することができ、適切な投与量を投与することにより、ヒトに対して抗肥満効果をもたらすことができる。また、オキアミの水溶性抽出物は、ウシやブタなどの家畜やニワトリなどの家禽の飼料、イヌやネコなどのペットフードといった動物用餌に添加し、これらの動物に対する肥満の予防や治療のための有効成分として用いてもよい。
【実施例】
【0013】
以下、本発明を実施例によって詳細に説明するが、本発明は以下の記載に限定して解釈されるものではない。
【0014】
実施例1:
(1)オキアミの水溶性抽出物の調製
三陸地方で漁獲されたイサダ(ツノナシオキアミ)の真空冷凍パック(−25℃凍結保存)13kg分を、パックのままボイル加熱して解凍した後、解凍されたイサダに蒸留水を添加し(重量比でイサダ3に対して1の割合)、カッターミキサーを用いて5分間ホモジナイズしてペースト状物を得た。得られたペースト状物を8000rpmで30分間遠心分離し、得られた上清をろ紙(5A)を用いてろ過することで、約9Lの薄黄色のろ液をオキアミの水溶性抽出物として得た。また、このろ液に対して凍結乾燥を行った後、得られた凍結乾燥物を粉砕することで、オキアミの水溶性抽出物の薄赤色の粉末を得た。
【0015】
(2)オキアミの水溶性抽出物のPPARγ遺伝子およびC/EBPα遺伝子の発現抑制作用
(実験方法)
タイプIコラーゲンコートされた24穴培養プレート(コーニング社)に、1穴あたり1×105個のマウス脂肪前駆細胞:3T3−F442A(DSファーマバイオメディカル社)を加え、10%ウシ胎児血清(インビトロジェン社)および10μg/mLウシインスリン(シグマ社)を含むダルベッコ変法イーグル培地(インビトロジェン社)で9日間培養し、脂肪細胞へ分化誘導した。培養開始7日後の細胞よりRNeasy kit(キアゲン社)を用いてRNAを回収した。回収したRNAを鋳型にしてPrimeScript RT reagent kit(タカラ社)を用いてcDNAを合成した。4ngのcDNAに、フォワードプライマーとリバースプライマーをそれぞれ2μMずつとFast SYBER Green Mix(アプライドバイオシステムズ社)を加え、StepOne plus(アプライドバイオシステムズ社)を用いて、PPARγ遺伝子の定量的PCRを行った。また、同様にして、C/EBPα遺伝子の定量的PCRを行った。得られたデータはRPLP0遺伝子の定量的PCRのデータでノーマライズを行い、分化誘導前の3T3−F442A細胞に対するmRNAの相対的発現量をΔΔCT法にて算出し、遺伝子発現の指標とした。なお、RNA精製、cDNA合成、定量的PCRはキット付属の使用説明書の記載に従って行った。PPARγ遺伝子の定量的PCRは、配列番号1で示されるフォワードプライマー:5’−TGCCTTCGCTGATGCACTGCC−3’と配列番号2で示されるリバースプライマー:5’−CACGGAGAGGTCCACAGAGCTGA−3’を用いて行った。C/EBPα遺伝子の定量的PCRは、配列番号3で示されるフォワードプライマー:5’−CCAACCCCATCCCCAACGGC−3’と配列番号4で示されるリバースプライマー:5’−GAAGCGGTCCAGCCCTGCTC−3’を用いて行った。RPLP0遺伝子の定量的PCRは、配列番号5で示されるフォワードプライマー:5’−TTTGGGCATCACCACGAAAA−3’と配列番号6で示されるリバースプライマー:5’−GGACACCCTCCAGAAAGCGA−3’を用いて行った。
【0016】
(実験結果)
培地に、(1)で得たオキアミの水溶性抽出物の粉末を500μg/mLの濃度で加えて培養を行った場合と、コントロールとして同容量のリン酸緩衝生理食塩水を加えて培養を行った場合のそれぞれにおけるPPARγ遺伝子の発現結果を図1に、C/EBPα遺伝子の発現結果を図2にそれぞれ示す(縦軸は脂肪細胞への分化誘導前(day0)の細胞における発現量を1とした時の相対値)。図1と図2から明らかなように、培地にオキアミの水溶性抽出物を加えて培養を行った場合(インスリン+イサダ)、リン酸緩衝生理食塩水を加えて培養を行った場合(インスリン)に比較して、PPARγ遺伝子およびC/EBPα遺伝子の発現が顕著に抑制されたことから、オキアミの水溶性抽出物は、脂肪細胞の分化を抑制することによる抗肥満効果が期待できることがわかった。
【0017】
(3)オキアミの水溶性抽出物の脂肪細胞における脂肪蓄積抑制作用
(実験方法)
(2)と同様の方法で3T3−F442A細胞を9日間培養し、脂肪細胞へ分化誘導した。培養開始9日後の細胞をリン酸緩衝液で1度洗浄した後、10%ホルマリン溶液(シグマ社)を加え室温で10分間固定した。固定した細胞をリン酸緩衝液で2度洗浄した後、蒸留水で60%に希釈したイソプロパノールを加え、1度洗浄した。その後、180mg/mLのOil Red O(シグマ社)染色液を加え、室温で40分間染色した。染色後の細胞を60%イソプロパノールで1度、リン酸緩衝液で2度洗浄し、倒立顕微鏡(ニコン社)を用い、400倍の倍率で観察した。
【0018】
(実験結果)
培地に、(1)で得たオキアミの水溶性抽出物の粉末を500μg/mLの濃度で加えて培養を行った場合と、コントロールとして同容量のリン酸緩衝生理食塩水を加えて培養を行った場合のそれぞれにおける脂肪細胞のOil Red O染色像を図3に示す。図3から明らかなように、培地にオキアミの水溶性抽出物を加えて培養を行った場合(B)、リン酸緩衝生理食塩水を加えて培養を行った場合(A)に比較して、Oil Red Oによって染色されるトリグリセリドを蓄積した脂肪細胞の数は顕著に少ないことから、オキアミの水溶性抽出物は、脂肪細胞における脂肪蓄積抑制作用を持つことがわかった。
【0019】
(4)オキアミの水溶性抽出物の体重増加抑制作用
(実験方法)
4週齢のC57BL/6系統雄性マウス(日本チャールズリバー社)を実験動物として用いた。マウスを、(a)通常餌であるRodent Diets with 10kcal% Fat(リサーチダイエット社)を摂取させる群:10%fat、(b)通常餌に(1)で得たオキアミの水溶性抽出物の粉末を1%添加した餌を摂取させる群:10%fat+1%イサダ、(c)高脂肪餌であるRodent Diets with 45kcal% Fat(リサーチダイエット社)を摂取させる群:45%fat、(d)高脂肪餌に(1)で得たオキアミの水溶性抽出物の粉末を1%添加した餌を摂取させる群:45%fat+1%イサダ、に分けて飼育を行い(各群5匹)、3日ごとにマウスの体重と餌の摂取量を測定した。また、実験開始から18週後の各群のマウスの心臓から採血を行い、4℃において1200gで10分間遠心分離を行うことで得た上清(血清)中のレプチン濃度を、森永生科学研究所社のレプチン測定キットを用いて測定した。
【0020】
(実験結果)
実験開始から18週間における、各群のマウスの体重増加率(縦軸は実験開始時の体重を1とした時の相対値)を図4に、各群のマウスの1日あたりの平均摂餌量(摂取カロリー)を図5にそれぞれ示す。また、実験開始から18週後の各群のマウスの血清中のレプチン濃度を表1に示す。図4から明らかなように、通常餌を摂取させた場合でも高脂肪餌を摂取させた場合でも、オキアミの水溶性抽出物を添加することで、体重増加が抑制されたが(a群対b群、c群対d群)、体重増加の抑制効果は、通常餌を摂取させた場合よりも高脂肪餌を摂取させた場合の方が優れていたことから、オキアミの水溶性抽出物は、とりわけ高脂肪食摂取下での体重増加の抑制に有効であることがわかった。また、図5から明らかなように、通常餌を摂取させた場合でも高脂肪餌を摂取させた場合でも、オキアミの水溶性抽出物を添加したことによる摂餌量の顕著な低下は認められなかった。さらに、表1から明らかなように、通常餌を摂取させた場合に対して高脂肪餌を摂取させた場合において有意に上昇した血清中のレプチン濃度は、高脂肪餌にオキアミの水溶性抽出物を添加することによって有意に低下した。また、通常餌にオキアミの水溶性抽出物を添加することによって、血清中のレプチン濃度は低下する傾向にあった。以上の結果から、オキアミの水溶性抽出物が持つ体重増加抑制作用は、レプチン分泌の促進作用に基づく摂食抑制作用などによるものではないことがわかった。
【0021】
【表1】

【0022】
実施例2:
実施例1の(1)と同様にして得たナンキョクオキアミの水溶性抽出物も、程度の違いはあるが、実施例1の(2)と(3)の作用を持っていた。
【0023】
比較例1:
クロロホルムとメタノールの混合溶媒(v/v1:2)を用いて得たオキアミの脂溶性抽出物は、実施例1の(2)と(3)の作用を持っていなかった。
【0024】
製剤例1:錠剤
以下の成分組成からなる肥満の予防や治療のための錠剤を自体公知の方法で製造した。
実施例1で得たオキアミの水溶性抽出物の粉末 1
乳糖 80
ステアリン酸マグネシウム 19(単位:重量%)
【0025】
製剤例2:ビスケット
以下の成分組成からなる肥満の予防や治療のためのビスケットを自体公知の方法で製造した。
実施例1で得たオキアミの水溶性抽出物の粉末 1
薄力粉 32
全卵 16
バター 16
砂糖 24
水 10
ベーキングパウダー 1(単位:重量%)
【産業上の利用可能性】
【0026】
本発明は、オキアミに含まれる新規な成分が有する薬理用途として、オキアミの水溶性抽出物を有効成分とする抗肥満剤を提供することができる点において産業上の利用可能性を有する。
【特許請求の範囲】
【請求項1】
オキアミの水溶性抽出物を有効成分とするPPARγ遺伝子の発現抑制剤。
【請求項2】
オキアミの水溶性抽出物を有効成分とするC/EBPα遺伝子の発現抑制剤。
【請求項3】
オキアミの水溶性抽出物を有効成分とする脂肪細胞における脂肪蓄積抑制剤。
【請求項4】
オキアミの水溶性抽出物を有効成分とする体重増加抑制剤。
【請求項5】
オキアミの水溶性抽出物を有効成分とする抗肥満剤。
【請求項6】
オキアミの水溶性抽出物を含んでなる飲食品。
【請求項7】
オキアミの水溶性抽出物を含んでなる医薬品。
【請求項8】
オキアミの水溶性抽出物を含んでなる動物用餌。
【請求項1】
オキアミの水溶性抽出物を有効成分とするPPARγ遺伝子の発現抑制剤。
【請求項2】
オキアミの水溶性抽出物を有効成分とするC/EBPα遺伝子の発現抑制剤。
【請求項3】
オキアミの水溶性抽出物を有効成分とする脂肪細胞における脂肪蓄積抑制剤。
【請求項4】
オキアミの水溶性抽出物を有効成分とする体重増加抑制剤。
【請求項5】
オキアミの水溶性抽出物を有効成分とする抗肥満剤。
【請求項6】
オキアミの水溶性抽出物を含んでなる飲食品。
【請求項7】
オキアミの水溶性抽出物を含んでなる医薬品。
【請求項8】
オキアミの水溶性抽出物を含んでなる動物用餌。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2012−153646(P2012−153646A)
【公開日】平成24年8月16日(2012.8.16)
【国際特許分類】
【出願番号】特願2011−14276(P2011−14276)
【出願日】平成23年1月26日(2011.1.26)
【出願人】(390025793)岩手県 (38)
【出願人】(507148456)学校法人 岩手医科大学 (19)
【Fターム(参考)】
【公開日】平成24年8月16日(2012.8.16)
【国際特許分類】
【出願日】平成23年1月26日(2011.1.26)
【出願人】(390025793)岩手県 (38)
【出願人】(507148456)学校法人 岩手医科大学 (19)
【Fターム(参考)】
[ Back to top ]

