オキシアパタイト構造を有する黄色蛍光体、製造方法並びにその白色発光ダイオード装置
【課題】主な発光領域の波長が長く、比較的に赤色光領域に偏る黄色蛍光体を提供する。
【解決手段】(A1−xEux)8−yB2+y(PO4)6−y(SiO4)y(O1−zSz)2の一般式を有し、AとEuは2価の金属イオンであり、Bは3価の金属イオンであり、0<x≦0.6、0≦y≦6、0≦z≦1であり、オキシアパタイト構造を有する黄色蛍光体。前記Aはアルカリ土類金属、Mn又はZnであってもよく、BはIIIA族金属、希土類金属又はBiであってもよい。この蛍光体を用いて白色発光ダイオードを製造する場合、赤色光領域における演色性を改善でき、品質のよい白色光が得られる。
【解決手段】(A1−xEux)8−yB2+y(PO4)6−y(SiO4)y(O1−zSz)2の一般式を有し、AとEuは2価の金属イオンであり、Bは3価の金属イオンであり、0<x≦0.6、0≦y≦6、0≦z≦1であり、オキシアパタイト構造を有する黄色蛍光体。前記Aはアルカリ土類金属、Mn又はZnであってもよく、BはIIIA族金属、希土類金属又はBiであってもよい。この蛍光体を用いて白色発光ダイオードを製造する場合、赤色光領域における演色性を改善でき、品質のよい白色光が得られる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は黄色蛍光体に関し、特にオキシアパタイト形態の黄色蛍光体に関する。
【背景技術】
【0002】
20世紀の初頭にInGaNに基づくフォトルミネッセンスチップが開発されて以来、商業応用上の白色発光ダイオード(white light−emitting diodes;WLEDs)は著しい進展を遂げた。InGaNチップの発生する青色光、及びY3Al5O12:Ce3+(YAG:Ce3+)を主とする材料の発生する黄色光を結合することによって得られた白色光は、すでに白熱灯を超えて、さらに伝統的な蛍光灯と並んで優れている。伝統的な光源に比べて、白色発光ダイオードは、省エネであり、耐用性よく、環境にやさしい光源である。しかしながら、白色発光ダイオードの光色品質は、日常照明と関係がある白色光色相調整(white hue tunability)、色温度及び演色(color rendering)性質に対する改良がなお必要である。
【0003】
現在、白色発光ダイオードに用いる蛍光体の大部分は、白色光の最適要求に達することができず、赤色光領域における演色性もかなり不十分である。そのため、白色発光ダイオードのために新しい材料を見出して、白色光品質に対する要求を満たす必要がある。
【発明の概要】
【課題を解決するための手段】
【0004】
そのため、本発明の一態様において、(A1−xEux)8−yB2+y(PO4)6−y(SiO4)y(O1−zSz)2の化学一般式を有し、AとEuは2価の金属イオンであり、Bは3価の金属イオンであり、0<x≦0.6、0≦y≦6、0≦z≦1である、オキシアパタイト構造を有する黄色蛍光体を提供する。前記Aは、アルカリ土類金属、Mn又はZnであってもよく、Bは、IIIA族金属、希土類金属又はBiであってもよい。
【0005】
本発明の一実施例によれば、y=z=0である場合、前記黄色蛍光体は、(A1−xEux)8B2(PO4)6O2の化学一般式を有する。
【0006】
本発明のまた他の実施例によれば、y=6かつz=0である場合、前記黄色蛍光体は、(A1−xEux)2B8(SiO4)6O2の化学一般式を有する。
【0007】
本発明のまた一つの実施例によれば、y=0かつz=1である場合、前記黄色蛍光体は、(A1−xEux)8B2(PO4)6S2の化学一般式を有する。
【0008】
本発明のさらに一つの実施例によれば、y=6かつz=1である場合、前記黄色蛍光体は、(A1−xEux)2B8(SiO4)6S2の化学一般式を有する。
【0009】
本発明のまた他の態様において、青色蛍光体と、前記黄色蛍光体のいずれかとを含む白色発光ダイオードを提供する。
【0010】
本発明のまた一つの態様において、以下の各ステップを含む前記黄色蛍光体の製造方法を提供する。まず、化学量論比に合った必要な元素の原料を秤量し、前記黄色蛍光体の金属原料は金属酸化物又は金属炭酸塩であり、リン酸原料はリン酸水素二アンモニウム又はリン酸二水素アンモニウムであり、ケイ酸原料は酸化ケイ素を含み、硫黄原料は硫黄粉末を含む。そして、秤量された前記原料を均一に混合してから、純オキシアパタイト晶相を有する生成物を得るまで、当該混合された原料を焼成し、焼成雰囲気は酸素を有し、焼成温度は1200〜1400℃である。アンモニア及び900〜1200℃の温度において、Eu3+をEu2+に還元して、前記黄色蛍光体を得る。
【0011】
本発明の一実施例によれば、還元ステップの前に、焼成された生成物を均質化してもよい。
【発明の効果】
【0012】
前記黄色蛍光体の主な発光領域の波長は長く、比較的に赤色光領域に偏る。そのため、前記黄色蛍光体により白色発光ダイオードを製造する場合、白色発光ダイオードの発生する白色光は、赤色光領域における演色性を改善でき、品質のよい白色光が得られる。
【0013】
前記発明内容は本開示内容の簡略な要約を提供して、読者に本開示内容を基本的に理解させる。この発明内容は本開示内容に対する完全な記述ではなく、また、その用意は本発明の実施例の重要・肝心なモジュールを指定、又は本発明の範囲を限定するものではない。以下の実施形態を参照すれば、当業者は本発明の基本的な精神及びその他の発明目的、並びに本発明で採用された技術手段と実施態様を、容易に了解できる。
【図面の簡単な説明】
【0014】
下記の図面の説明は、本発明の前記またはその他の目的、特徴、利点及び実施例をより分かりやすくするためのものである。
【0015】
【図1】オキシアパタイト構造を有する黄色蛍光体の調製プロセスを示す図である。
【図2】Ca8La2(PO4)6O2:xEu2+の粉末X線回折スペクトルである。
【図3】Ca8La2(PO4)6O2:xEu2+の光励起スペクトルである。
【図4】Ca8La2(PO4)6O2:xEu2+のフォトルミネッセンススペクトルである。
【図5】Ca8La2(PO4)6O2:xEu2+のUV−Visの固体反射スペクトルである。
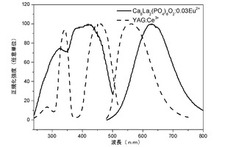
【図6】Ca8La2(PO4)6O2:0.03Eu2+と黄色光商品YAG:Ce3+との光励起及びフォトルミネッセンススペクトルの比較である。
【図7A】実験例1の光励起及びフォトルミネッセンススペクトルを示す。
【図7B】実験例2の光励起及びフォトルミネッセンススペクトルを示す。
【図7C】実験例3の光励起及びフォトルミネッセンススペクトルを示す。
【図7D】実験例4の光励起及びフォトルミネッセンススペクトルを示す。
【図7E】実験例5の光励起及びフォトルミネッセンススペクトルを示す。
【図8A】実験例6の光励起及びフォトルミネッセンススペクトルを示す。
【図8B】実験例7の光励起及びフォトルミネッセンススペクトルを示す。
【図8C】実験例8の光励起及びフォトルミネッセンススペクトルを示す。
【図8D】実験例9の光励起及びフォトルミネッセンススペクトルを示す。
【図8E】実験例10の光励起及びフォトルミネッセンススペクトルを示す。
【図8F】実験例11の光励起及びフォトルミネッセンススペクトルを示す。
【図8G】実験例12の光励起及びフォトルミネッセンススペクトルを示す。
【図8H】実験例13の光励起及びフォトルミネッセンススペクトルを示す。
【図9】実験例14の光励起及びフォトルミネッセンススペクトルを示す。
【図10】実験例15の光励起及びフォトルミネッセンススペクトルを示す。
【図11】実験例16〜24の白色発光ダイオードの発光スペクトルを示す。
【発明を実施するための形態】
【0016】
ユウロピウム(Europium;Eu)は、ランタノイド元素であり、一般的に3価の化合物を形成し、4f7のような比較的に安定な電子配置を有するが、その励起と発光が線形であるため、蛍光体での応用について、限界がある。2価のユウロピウムの励起と発光は広帯域であるので、発光ダイオードに広く応用されている。発光への応用において、2価のユウロピウムイオンは、それが位置する結晶格子の構造によって、異なる色の発光を有し、一般的には青色光に偏る。
【0017】
発光への応用において、アパタイト(apatite)は高効率なホスト(host)材料であり、現在、Ca8M2(PO4)6O2の化学一般式を有し、Mが3価の希土類金属イオンである種々の希土類金属を含むオキシアパタイト(oxyapatite)材料の合成ができる。この一連のCa8M2(PO4)6O2の化合物において、異なる3価の希土類金属イオンを利用して、可視光或いは近赤外光のような波長が異なる光源とすることができる。
【0018】
なお、前記オキシアパタイト構造におけるリン酸基部分は、ケイ酸基に一部または全部置換されてもよい。ケイ酸基に全部置換されたオキシアパタイト構造は、ケイ酸オキシアパタイト(silicate oxyapatite)構造と呼ばれ、Ca2M8(SiO4)6O2の化学一般式を有し、Mが3価の希土類金属イオンであり、一般的に3価の希土類金属イオンにより発光する。Ca2M8(SiO4)6O2の構造において、六つのCa2+が六つのM3+に置換され、六つのケイ酸基により増加された六つの負電荷とのバランスを取る。
【0019】
[オキシアパタイト構造を有する黄色蛍光体]
ここで、(A1−xEux)8−yB2+y(PO4)6−y(SiO4)y(O1−zSz)2の化学一般式を有する、オキシアパタイト構造を有する黄色蛍光体を提供する。Euは2価のイオンであり、Aも2価の金属イオンであり、両者は前記オキシアパタイト構造におけるカルシウムイオンを置換する。そのため、Aは、アルカリ土類金属、Zn又はMnであってもよい。Bは、3価の金属イオンであり、前記オキシアパタイト構造における希土類金属イオンを置換する。そのため、BはIIIA族金属、希土類金属又はBiであってもよく、IIIA族金属としては、例えば、Al、Ga、Inであってもよく、希土類金属としては、例えば、Sc、Y及びLa、Ce、Pr、Nd、Pm、Sm、Eu、Gd、Tb、Dy、Ho、Er、Tm、Yb又はLuのようなランタノイド元素であってもよい。上記の化学式で、x、y、zの数値範囲はそれぞれ0<x≦0.6、0≦y≦6、0≦z≦1である。リン酸基とケイ酸基は結晶格子における同様な位置を占め、OとSとも結晶格子における同様な位置を占める。
【0020】
特別な場合においては、(A1−xEux)8−yB2+y(PO4)6−y(SiO4)y(O1−zSz)2の化学式を簡略化でき、以下の表1に示す。
【表1】

【0021】
一部の文献においては、前記オキシアパタイト構造の化学一般式Ca8M2(PO4)6O2における各種の元素の数を2で割り、Ca4M(PO4)3Oのような化学一般式に簡略化するので、オキシアパタイト構造を有する前記黄色蛍光体の化学一般式は、同様の方法で簡略化してもよい。簡略化された一般式は、(A1−xEux)4−dB1+d(PO4)3−d(SiO4)d(O1−zSz)で表し、xとzの数値範囲は上記と同様に、0<x≦0.6、0≦z≦1であり、dの数値範囲は0≦d≦3である。
【0022】
[オキシアパタイト構造を有する黄色蛍光体の製造方法]
ここで、前記(A1−xEux)8−yB2+y(PO4)6−y(SiO4)y(O1−zSz)2の黄色蛍光体の製造方法も提供し、図1は、オキシアパタイト構造を有する黄色蛍光体の調製プロセスを示すフロー図である。
【0023】
図1のステップ110で、合成しようとする前記黄色蛍光体の化学式によって、化学量論比に合った原料をそれぞれ秤量する。Eu、A及びBの金属イオンについては、対応する金属酸化物を選択してその供給源としてもよい。Eu、A及びBの金属イオンに炭酸塩があれば、対応する金属炭酸塩を選択してその供給源としてもよい。一例として、カルシウムイオンは、酸化カルシウム又は炭酸カルシウムを選択してその供給源としてもよく、ユウロピウムイオンはEu2O3を選択してその供給源としてもよい。リン酸基の方では、リン酸水素二アンモニウム又はリン酸二水素アンモニウムを選択してその供給源としてもよい。ケイ酸基の方では、酸化ケイ素を選択してその供給源としてもよい。硫黄は、直接的に硫黄粉末を選択してその供給源としてもよい。
【0024】
そして、ステップ120で、例えばすり砕くなどの混合方法を用いて、必要な原料を均一に混合する。ステップ130において、純オキシアパタイト晶相を有する生成物を得るまで、酸素含有雰囲気(例えば空気)において、混合された原料を1200〜1400℃の温度において焼成(calcine)する。ステップ130の焼成は酸素含有雰囲気において行われたので、生成物におけるユウロピウムイオンはすべてEu3+であるため、オキシアパタイト構造におけるカルシウムイオンの位置を占めているEu3+をEu2+に還元する必要がある。
【0025】
ステップ140において、後の還元反応をより完全かつ迅速にするために、ステップ130で得られた生成物を再び均質化する必要があり、例えば再びすり砕いてもよい。そして、ステップ150において、均質化された生成物をアンモニア及び900〜1200℃の温度において約10時間程度還元する。
【0026】
[実施例1:Ca8La2(PO4)6O2に割合が異なるEu2+をドーピングする]
まず、Ca8La2(PO4)6O2に割合が異なるEu2+をドーピングしてCa2+を置換し、一連の(Ca1−xEux)8La2(PO4)6O2の蛍光体(この実施例では、Ca8La2(PO4)6O2:xEu2+と記す)を形成し、そのフォトルミネッセンス特性を観測した。この実験例では、(A1−xEux)8−yB2+y(PO4)6−y(SiO4)y(O1−zSz)2におけるA2+はCa2+であり、B3+はLa3+であり、y=z=0であり、xはそれぞれ0、0.001、0.003、0.005、0.007、0.010、0.020、0.030、0.050、0.070及び0.100である。
【0027】
図2、図3、図4、図5は、それぞれこの一連の化合物の粉末X線回折スペクトル、光励起スペクトル、フォトルミネッセンススペクトル、UV−Visの固体反射スペクトルである。図2から分かるように、Eu2+のドーピング量が10mol%になっても、Ca8La2(PO4)6O2の結晶格子構造は変わらない。
【0028】
図3の光励起スペクトルは、630nmで監視したものである。図3から分かるように、450nmの青色光において、x値が0.030である場合(即ち、Eu2+のドーピング割合が3mol%である場合)、吸収最大値を有する。図4のフォトルミネッセンススペクトルは、450nmで励起して得られたものである。図4から分かるように、xが0.030である場合、625nm付近に最大発光強度を有する。図5から分かるように、500nm以下の領域において、Eu2+がドーピングされたCa8La2(PO4)6O2のすべては、相当的に強い吸収強度を有する。逆に、Eu2+がドーピングされなかったCa8La2(PO4)6O2は、500nm以下の領域において、光吸収現象を殆ど有さない。
【0029】
図6は、Ca8La2(PO4)6O2:0.03Eu2+と黄色光商品Y3Al5O12:Ce3+(ここで、YAG:Ce3+と記す)との光励起及びフォトルミネッセンススペクトルの比較であり、実線がCa8La2(PO4)6O2:0.03Eu2+のスペクトルであり、破線がYAG:Ce3+のスペクトルである。図6から分かるように、Ca8La2(PO4)6O2:0.03Eu2+は広い光励起スペクトルとフォトルミネッセンススペクトルを有し、発光波長が比較的に赤色光領域に偏り、そのため、従来のYAG:Ce3+が赤色光領域における演色性が低いの問題を解決できる。
【0030】
[実施例2:異なるA2+により(A1−xEux)8B2(PO4)6O2を合成する]
y=z=0である場合、(A1−xEux)8B2(PO4)6O2の化学一般式が得られる。この合成された実験例において、A2+は、89mol%のCa2+及び10mol%のMg2+、Sr2+、Ba2+、Mn2+、Zn2+を有し、Eu2+のドーピング割合は1mol%である。B3+は全部La2+である。
【0031】
表2において、前記Mg2+、Sr2+、Ba2+、Mn2+、Zn2+の8配位のイオン半径及び前記実験例のフォトルミネッセンスの関連データを示す。表2のデータから分かるように、置換されたA2+のイオン半径は89pm〜142pmにそれぞれあるが、その発光範囲及び発光位置の波長が大体同じである。この結果は、異なるA2+イオンで置換することが(Ca0.89A0.1Eu0.01)8La2(PO4)6O2の光励起及びフォトルミネッセンス特性に与えた影響が大きくないことを示した。
【0032】
図7A〜7Eはそれぞれ実験例1〜5の光励起及びフォトルミネッセンススペクトルを示す。図7A〜7Eから分かるように、実験例3の(Ca0.89Mn0.1Eu0.01)8La2(PO4)6O2の光励起及びフォトルミネッセンススペクトルは比較的特別である他、実験例1、実験例2、実験例4、実験例5の光励起及びフォトルミネッセンススペクトルの形はほぼ同じである。この結果は、異なるA2+イオンで置換することが(Ca0.89A0.1Eu0.01)8La2(PO4)6O2の光励起及びフォトルミネッセンス特性に与えた影響が大きくないことを再び示した。
【表2】

【0033】
[実施例3:異なるB3+により(A1−xEux)8B2(PO4)6O2を合成する]
y=z=0である場合、(A1−xEux)8B2(PO4)6O2の化学一般式が得られる。この合成された実験例において、A2+は全部Ca2+であり、Eu2+のドーピング割合は1mol%である。B3+部分は、90mol%がLa3+であり、10mol%がそれぞれAl3+、Ga3+、Sc3+、In3+、Lu3+、Y3+、Gd3+或いはBi3+である。
【0034】
表3において、前記Al3+、Ga3+、Sc3+、In3+、Lu3+、Y3+、Gd3+或いはBi3+の6配位イオン半径及び前記実験例のフォトルミネッセンスの関連データを示す。表3のデータから分かるように、置換されたB3+のイオン半径は53.5pm〜103pmにあるが、その発光範囲及び発光位置の波長が大体同じである。この結果は、異なるB3+イオンで置換することが(Ca0.99Eu0.01)8(La0.9B0.1)2(PO4)6O2の光励起及びフォトルミネッセンス特性に与えた影響が大きくないことを示した。
【表3】

【0035】
図8A〜8Hは、それぞれ実験例6〜13の光励起及びフォトルミネッセンススペクトルを示す。図8A〜8Hから分かるように、実験例13の(Ca0.99Eu0.01)8(La0.9Bi0.1)2(PO4)6O2の光励起及びフォトルミネッセンススペクトルが比較的に特別である他、実験例6〜12の光励起及びフォトルミネッセンススペクトルの形状とほぼ同じであり、前記実験例2〜5ともほぼ同じである。この結果は、異なるB3+イオンで置換することが(Ca0.99Eu0.01)8(La0.9B0.1)2(PO4)6O2の光励起及びフォトルミネッセンス特性に与えた影響が大きくないことを再び示した。
【0036】
[実施例4:ケイ酸基により置換された(A1−xEux)8−yB2+y(PO4)6−y(SiO4)yO2]
z=0である場合、(A1−xEux)8−yB2+y(PO4)6−y(SiO4)yO2の化学一般式が得られる。この合成された実験例において、A2+がCa2+であり、Eu2+のドーピング割合が1mol%であり、B3+がLa3+であり、y=1である。そのため、得られた化学式は(Ca0.99Eu0.01)7La3(PO4)5(SiO4)O2であり、そのフォトルミネッセンスの関連データを表4に示す。図9は、実験例14の光励起及びフォトルミネッセンススペクトルを示す。
【0037】
表4及び図9から分かるように、(Ca0.99Eu0.01)7La3(PO4)5(SiO4)O2は前記実験例1〜13のフォトルミネッセンスのデータとの差異が大きくなく、ケイ酸基によりリン酸基を置換した後、この一連の化合物の光励起及びフォトルミネッセンス特性に与えた影響が大きくないことを示した。
【表4】

【0038】
[実施例5:S2−により置換された(A1−xEux)8B2(PO4)6(O1−zSz)2]
y=0である場合、(A1−xEux)8B2(PO4)6(O1−zSz)2の化学一般式が得られる。この合成された実験例において、A2+がCa2+であり、Eu2+のドーピング割合が1mol%であり、B3+がLa3+であり、z=0.1である。そのため、得られた化学式が(Ca0.99Eu0.01)8La2(PO4)6(O0.9S0.1)2であり、そのフォトルミネッセンスの関連データを表5に示す。図10は、実験例15の光励起及びフォトルミネッセンススペクトルを示す。
【表5】

【0039】
表5及び図10から分かるように、(Ca0.99Eu0.01)8La2(PO4)6(O0.9S0.1)2は前記実験例1〜13のフォトルミネッセンスのデータとの差異が大きくなく、S2−によりO2−を置換した後、この一連の化合物の光励起及びフォトルミネッセンス特性に与えた影響が大きくないことを示した。
【0040】
[実施例6:濃度が異なる(Ca0.97Eu0.03)8La2(PO4)6O2の白色発光ダイオードにおける応用]
この実施例で、460nmの青色光を発生できるInGaN青色光チップを用いて、その封止剤に濃度が異なる(Ca0.97Eu0.03)8La2(PO4)6O2をドーピングして、白色発光ダイオードを形成した。白色発光ダイオードの(Ca0.97Eu0.03)8La2(PO4)6O2のドーピング濃度を表6に示す。
【表6】

【0041】
図11は、実験例16〜24の白色発光ダイオードの発光スペクトルを示し、表6は実験例16〜24の白色発光ダイオードの発生する白色光の色度座標値を示す。図11及び表6のデータから分かるように、封止剤における(Ca0.97Eu0.03)8La2(PO4)6O2の蛍光粉のドーピング濃度が徐々に減少する場合、460nm付近の青色光チップの相対発光強度は徐々に増加し、625nm付近の黄色蛍光粉の相対発光強度は徐々に減少した。そのため、白色発光ダイオードの発生する白色光の色度座標値は、蛍光粉のドーピング量の減少に伴い、(0.586, 0.405)のオレンジ光から、(0.277, 0.192)の冷白色光に調整できる。
【0042】
一般的に言えば、前記各実験例のオキシアパタイト構造を有する黄色蛍光体の主な発光領域の波長が長く、比較的に赤色光領域に偏る。そのため、前記黄色蛍光体により白色発光ダイオードを製造する場合、白色発光ダイオードの発生する白色光の赤色光領域における演色性を改善でき、品質のよい白色光が得られる。
【0043】
本発明では実施形態を前述のとおり開示したが、これは本発明を限定するものではなく、当業者であれば、本発明の精神と範囲から逸脱しない限り、多様の変動及び修飾を加えることができるため、本発明は、特許請求の範囲の記載によって限定される。
【符号の説明】
【0044】
110、120、130、140、150…ステップ
【技術分野】
【0001】
本発明は黄色蛍光体に関し、特にオキシアパタイト形態の黄色蛍光体に関する。
【背景技術】
【0002】
20世紀の初頭にInGaNに基づくフォトルミネッセンスチップが開発されて以来、商業応用上の白色発光ダイオード(white light−emitting diodes;WLEDs)は著しい進展を遂げた。InGaNチップの発生する青色光、及びY3Al5O12:Ce3+(YAG:Ce3+)を主とする材料の発生する黄色光を結合することによって得られた白色光は、すでに白熱灯を超えて、さらに伝統的な蛍光灯と並んで優れている。伝統的な光源に比べて、白色発光ダイオードは、省エネであり、耐用性よく、環境にやさしい光源である。しかしながら、白色発光ダイオードの光色品質は、日常照明と関係がある白色光色相調整(white hue tunability)、色温度及び演色(color rendering)性質に対する改良がなお必要である。
【0003】
現在、白色発光ダイオードに用いる蛍光体の大部分は、白色光の最適要求に達することができず、赤色光領域における演色性もかなり不十分である。そのため、白色発光ダイオードのために新しい材料を見出して、白色光品質に対する要求を満たす必要がある。
【発明の概要】
【課題を解決するための手段】
【0004】
そのため、本発明の一態様において、(A1−xEux)8−yB2+y(PO4)6−y(SiO4)y(O1−zSz)2の化学一般式を有し、AとEuは2価の金属イオンであり、Bは3価の金属イオンであり、0<x≦0.6、0≦y≦6、0≦z≦1である、オキシアパタイト構造を有する黄色蛍光体を提供する。前記Aは、アルカリ土類金属、Mn又はZnであってもよく、Bは、IIIA族金属、希土類金属又はBiであってもよい。
【0005】
本発明の一実施例によれば、y=z=0である場合、前記黄色蛍光体は、(A1−xEux)8B2(PO4)6O2の化学一般式を有する。
【0006】
本発明のまた他の実施例によれば、y=6かつz=0である場合、前記黄色蛍光体は、(A1−xEux)2B8(SiO4)6O2の化学一般式を有する。
【0007】
本発明のまた一つの実施例によれば、y=0かつz=1である場合、前記黄色蛍光体は、(A1−xEux)8B2(PO4)6S2の化学一般式を有する。
【0008】
本発明のさらに一つの実施例によれば、y=6かつz=1である場合、前記黄色蛍光体は、(A1−xEux)2B8(SiO4)6S2の化学一般式を有する。
【0009】
本発明のまた他の態様において、青色蛍光体と、前記黄色蛍光体のいずれかとを含む白色発光ダイオードを提供する。
【0010】
本発明のまた一つの態様において、以下の各ステップを含む前記黄色蛍光体の製造方法を提供する。まず、化学量論比に合った必要な元素の原料を秤量し、前記黄色蛍光体の金属原料は金属酸化物又は金属炭酸塩であり、リン酸原料はリン酸水素二アンモニウム又はリン酸二水素アンモニウムであり、ケイ酸原料は酸化ケイ素を含み、硫黄原料は硫黄粉末を含む。そして、秤量された前記原料を均一に混合してから、純オキシアパタイト晶相を有する生成物を得るまで、当該混合された原料を焼成し、焼成雰囲気は酸素を有し、焼成温度は1200〜1400℃である。アンモニア及び900〜1200℃の温度において、Eu3+をEu2+に還元して、前記黄色蛍光体を得る。
【0011】
本発明の一実施例によれば、還元ステップの前に、焼成された生成物を均質化してもよい。
【発明の効果】
【0012】
前記黄色蛍光体の主な発光領域の波長は長く、比較的に赤色光領域に偏る。そのため、前記黄色蛍光体により白色発光ダイオードを製造する場合、白色発光ダイオードの発生する白色光は、赤色光領域における演色性を改善でき、品質のよい白色光が得られる。
【0013】
前記発明内容は本開示内容の簡略な要約を提供して、読者に本開示内容を基本的に理解させる。この発明内容は本開示内容に対する完全な記述ではなく、また、その用意は本発明の実施例の重要・肝心なモジュールを指定、又は本発明の範囲を限定するものではない。以下の実施形態を参照すれば、当業者は本発明の基本的な精神及びその他の発明目的、並びに本発明で採用された技術手段と実施態様を、容易に了解できる。
【図面の簡単な説明】
【0014】
下記の図面の説明は、本発明の前記またはその他の目的、特徴、利点及び実施例をより分かりやすくするためのものである。
【0015】
【図1】オキシアパタイト構造を有する黄色蛍光体の調製プロセスを示す図である。
【図2】Ca8La2(PO4)6O2:xEu2+の粉末X線回折スペクトルである。
【図3】Ca8La2(PO4)6O2:xEu2+の光励起スペクトルである。
【図4】Ca8La2(PO4)6O2:xEu2+のフォトルミネッセンススペクトルである。
【図5】Ca8La2(PO4)6O2:xEu2+のUV−Visの固体反射スペクトルである。
【図6】Ca8La2(PO4)6O2:0.03Eu2+と黄色光商品YAG:Ce3+との光励起及びフォトルミネッセンススペクトルの比較である。
【図7A】実験例1の光励起及びフォトルミネッセンススペクトルを示す。
【図7B】実験例2の光励起及びフォトルミネッセンススペクトルを示す。
【図7C】実験例3の光励起及びフォトルミネッセンススペクトルを示す。
【図7D】実験例4の光励起及びフォトルミネッセンススペクトルを示す。
【図7E】実験例5の光励起及びフォトルミネッセンススペクトルを示す。
【図8A】実験例6の光励起及びフォトルミネッセンススペクトルを示す。
【図8B】実験例7の光励起及びフォトルミネッセンススペクトルを示す。
【図8C】実験例8の光励起及びフォトルミネッセンススペクトルを示す。
【図8D】実験例9の光励起及びフォトルミネッセンススペクトルを示す。
【図8E】実験例10の光励起及びフォトルミネッセンススペクトルを示す。
【図8F】実験例11の光励起及びフォトルミネッセンススペクトルを示す。
【図8G】実験例12の光励起及びフォトルミネッセンススペクトルを示す。
【図8H】実験例13の光励起及びフォトルミネッセンススペクトルを示す。
【図9】実験例14の光励起及びフォトルミネッセンススペクトルを示す。
【図10】実験例15の光励起及びフォトルミネッセンススペクトルを示す。
【図11】実験例16〜24の白色発光ダイオードの発光スペクトルを示す。
【発明を実施するための形態】
【0016】
ユウロピウム(Europium;Eu)は、ランタノイド元素であり、一般的に3価の化合物を形成し、4f7のような比較的に安定な電子配置を有するが、その励起と発光が線形であるため、蛍光体での応用について、限界がある。2価のユウロピウムの励起と発光は広帯域であるので、発光ダイオードに広く応用されている。発光への応用において、2価のユウロピウムイオンは、それが位置する結晶格子の構造によって、異なる色の発光を有し、一般的には青色光に偏る。
【0017】
発光への応用において、アパタイト(apatite)は高効率なホスト(host)材料であり、現在、Ca8M2(PO4)6O2の化学一般式を有し、Mが3価の希土類金属イオンである種々の希土類金属を含むオキシアパタイト(oxyapatite)材料の合成ができる。この一連のCa8M2(PO4)6O2の化合物において、異なる3価の希土類金属イオンを利用して、可視光或いは近赤外光のような波長が異なる光源とすることができる。
【0018】
なお、前記オキシアパタイト構造におけるリン酸基部分は、ケイ酸基に一部または全部置換されてもよい。ケイ酸基に全部置換されたオキシアパタイト構造は、ケイ酸オキシアパタイト(silicate oxyapatite)構造と呼ばれ、Ca2M8(SiO4)6O2の化学一般式を有し、Mが3価の希土類金属イオンであり、一般的に3価の希土類金属イオンにより発光する。Ca2M8(SiO4)6O2の構造において、六つのCa2+が六つのM3+に置換され、六つのケイ酸基により増加された六つの負電荷とのバランスを取る。
【0019】
[オキシアパタイト構造を有する黄色蛍光体]
ここで、(A1−xEux)8−yB2+y(PO4)6−y(SiO4)y(O1−zSz)2の化学一般式を有する、オキシアパタイト構造を有する黄色蛍光体を提供する。Euは2価のイオンであり、Aも2価の金属イオンであり、両者は前記オキシアパタイト構造におけるカルシウムイオンを置換する。そのため、Aは、アルカリ土類金属、Zn又はMnであってもよい。Bは、3価の金属イオンであり、前記オキシアパタイト構造における希土類金属イオンを置換する。そのため、BはIIIA族金属、希土類金属又はBiであってもよく、IIIA族金属としては、例えば、Al、Ga、Inであってもよく、希土類金属としては、例えば、Sc、Y及びLa、Ce、Pr、Nd、Pm、Sm、Eu、Gd、Tb、Dy、Ho、Er、Tm、Yb又はLuのようなランタノイド元素であってもよい。上記の化学式で、x、y、zの数値範囲はそれぞれ0<x≦0.6、0≦y≦6、0≦z≦1である。リン酸基とケイ酸基は結晶格子における同様な位置を占め、OとSとも結晶格子における同様な位置を占める。
【0020】
特別な場合においては、(A1−xEux)8−yB2+y(PO4)6−y(SiO4)y(O1−zSz)2の化学式を簡略化でき、以下の表1に示す。
【表1】

【0021】
一部の文献においては、前記オキシアパタイト構造の化学一般式Ca8M2(PO4)6O2における各種の元素の数を2で割り、Ca4M(PO4)3Oのような化学一般式に簡略化するので、オキシアパタイト構造を有する前記黄色蛍光体の化学一般式は、同様の方法で簡略化してもよい。簡略化された一般式は、(A1−xEux)4−dB1+d(PO4)3−d(SiO4)d(O1−zSz)で表し、xとzの数値範囲は上記と同様に、0<x≦0.6、0≦z≦1であり、dの数値範囲は0≦d≦3である。
【0022】
[オキシアパタイト構造を有する黄色蛍光体の製造方法]
ここで、前記(A1−xEux)8−yB2+y(PO4)6−y(SiO4)y(O1−zSz)2の黄色蛍光体の製造方法も提供し、図1は、オキシアパタイト構造を有する黄色蛍光体の調製プロセスを示すフロー図である。
【0023】
図1のステップ110で、合成しようとする前記黄色蛍光体の化学式によって、化学量論比に合った原料をそれぞれ秤量する。Eu、A及びBの金属イオンについては、対応する金属酸化物を選択してその供給源としてもよい。Eu、A及びBの金属イオンに炭酸塩があれば、対応する金属炭酸塩を選択してその供給源としてもよい。一例として、カルシウムイオンは、酸化カルシウム又は炭酸カルシウムを選択してその供給源としてもよく、ユウロピウムイオンはEu2O3を選択してその供給源としてもよい。リン酸基の方では、リン酸水素二アンモニウム又はリン酸二水素アンモニウムを選択してその供給源としてもよい。ケイ酸基の方では、酸化ケイ素を選択してその供給源としてもよい。硫黄は、直接的に硫黄粉末を選択してその供給源としてもよい。
【0024】
そして、ステップ120で、例えばすり砕くなどの混合方法を用いて、必要な原料を均一に混合する。ステップ130において、純オキシアパタイト晶相を有する生成物を得るまで、酸素含有雰囲気(例えば空気)において、混合された原料を1200〜1400℃の温度において焼成(calcine)する。ステップ130の焼成は酸素含有雰囲気において行われたので、生成物におけるユウロピウムイオンはすべてEu3+であるため、オキシアパタイト構造におけるカルシウムイオンの位置を占めているEu3+をEu2+に還元する必要がある。
【0025】
ステップ140において、後の還元反応をより完全かつ迅速にするために、ステップ130で得られた生成物を再び均質化する必要があり、例えば再びすり砕いてもよい。そして、ステップ150において、均質化された生成物をアンモニア及び900〜1200℃の温度において約10時間程度還元する。
【0026】
[実施例1:Ca8La2(PO4)6O2に割合が異なるEu2+をドーピングする]
まず、Ca8La2(PO4)6O2に割合が異なるEu2+をドーピングしてCa2+を置換し、一連の(Ca1−xEux)8La2(PO4)6O2の蛍光体(この実施例では、Ca8La2(PO4)6O2:xEu2+と記す)を形成し、そのフォトルミネッセンス特性を観測した。この実験例では、(A1−xEux)8−yB2+y(PO4)6−y(SiO4)y(O1−zSz)2におけるA2+はCa2+であり、B3+はLa3+であり、y=z=0であり、xはそれぞれ0、0.001、0.003、0.005、0.007、0.010、0.020、0.030、0.050、0.070及び0.100である。
【0027】
図2、図3、図4、図5は、それぞれこの一連の化合物の粉末X線回折スペクトル、光励起スペクトル、フォトルミネッセンススペクトル、UV−Visの固体反射スペクトルである。図2から分かるように、Eu2+のドーピング量が10mol%になっても、Ca8La2(PO4)6O2の結晶格子構造は変わらない。
【0028】
図3の光励起スペクトルは、630nmで監視したものである。図3から分かるように、450nmの青色光において、x値が0.030である場合(即ち、Eu2+のドーピング割合が3mol%である場合)、吸収最大値を有する。図4のフォトルミネッセンススペクトルは、450nmで励起して得られたものである。図4から分かるように、xが0.030である場合、625nm付近に最大発光強度を有する。図5から分かるように、500nm以下の領域において、Eu2+がドーピングされたCa8La2(PO4)6O2のすべては、相当的に強い吸収強度を有する。逆に、Eu2+がドーピングされなかったCa8La2(PO4)6O2は、500nm以下の領域において、光吸収現象を殆ど有さない。
【0029】
図6は、Ca8La2(PO4)6O2:0.03Eu2+と黄色光商品Y3Al5O12:Ce3+(ここで、YAG:Ce3+と記す)との光励起及びフォトルミネッセンススペクトルの比較であり、実線がCa8La2(PO4)6O2:0.03Eu2+のスペクトルであり、破線がYAG:Ce3+のスペクトルである。図6から分かるように、Ca8La2(PO4)6O2:0.03Eu2+は広い光励起スペクトルとフォトルミネッセンススペクトルを有し、発光波長が比較的に赤色光領域に偏り、そのため、従来のYAG:Ce3+が赤色光領域における演色性が低いの問題を解決できる。
【0030】
[実施例2:異なるA2+により(A1−xEux)8B2(PO4)6O2を合成する]
y=z=0である場合、(A1−xEux)8B2(PO4)6O2の化学一般式が得られる。この合成された実験例において、A2+は、89mol%のCa2+及び10mol%のMg2+、Sr2+、Ba2+、Mn2+、Zn2+を有し、Eu2+のドーピング割合は1mol%である。B3+は全部La2+である。
【0031】
表2において、前記Mg2+、Sr2+、Ba2+、Mn2+、Zn2+の8配位のイオン半径及び前記実験例のフォトルミネッセンスの関連データを示す。表2のデータから分かるように、置換されたA2+のイオン半径は89pm〜142pmにそれぞれあるが、その発光範囲及び発光位置の波長が大体同じである。この結果は、異なるA2+イオンで置換することが(Ca0.89A0.1Eu0.01)8La2(PO4)6O2の光励起及びフォトルミネッセンス特性に与えた影響が大きくないことを示した。
【0032】
図7A〜7Eはそれぞれ実験例1〜5の光励起及びフォトルミネッセンススペクトルを示す。図7A〜7Eから分かるように、実験例3の(Ca0.89Mn0.1Eu0.01)8La2(PO4)6O2の光励起及びフォトルミネッセンススペクトルは比較的特別である他、実験例1、実験例2、実験例4、実験例5の光励起及びフォトルミネッセンススペクトルの形はほぼ同じである。この結果は、異なるA2+イオンで置換することが(Ca0.89A0.1Eu0.01)8La2(PO4)6O2の光励起及びフォトルミネッセンス特性に与えた影響が大きくないことを再び示した。
【表2】

【0033】
[実施例3:異なるB3+により(A1−xEux)8B2(PO4)6O2を合成する]
y=z=0である場合、(A1−xEux)8B2(PO4)6O2の化学一般式が得られる。この合成された実験例において、A2+は全部Ca2+であり、Eu2+のドーピング割合は1mol%である。B3+部分は、90mol%がLa3+であり、10mol%がそれぞれAl3+、Ga3+、Sc3+、In3+、Lu3+、Y3+、Gd3+或いはBi3+である。
【0034】
表3において、前記Al3+、Ga3+、Sc3+、In3+、Lu3+、Y3+、Gd3+或いはBi3+の6配位イオン半径及び前記実験例のフォトルミネッセンスの関連データを示す。表3のデータから分かるように、置換されたB3+のイオン半径は53.5pm〜103pmにあるが、その発光範囲及び発光位置の波長が大体同じである。この結果は、異なるB3+イオンで置換することが(Ca0.99Eu0.01)8(La0.9B0.1)2(PO4)6O2の光励起及びフォトルミネッセンス特性に与えた影響が大きくないことを示した。
【表3】

【0035】
図8A〜8Hは、それぞれ実験例6〜13の光励起及びフォトルミネッセンススペクトルを示す。図8A〜8Hから分かるように、実験例13の(Ca0.99Eu0.01)8(La0.9Bi0.1)2(PO4)6O2の光励起及びフォトルミネッセンススペクトルが比較的に特別である他、実験例6〜12の光励起及びフォトルミネッセンススペクトルの形状とほぼ同じであり、前記実験例2〜5ともほぼ同じである。この結果は、異なるB3+イオンで置換することが(Ca0.99Eu0.01)8(La0.9B0.1)2(PO4)6O2の光励起及びフォトルミネッセンス特性に与えた影響が大きくないことを再び示した。
【0036】
[実施例4:ケイ酸基により置換された(A1−xEux)8−yB2+y(PO4)6−y(SiO4)yO2]
z=0である場合、(A1−xEux)8−yB2+y(PO4)6−y(SiO4)yO2の化学一般式が得られる。この合成された実験例において、A2+がCa2+であり、Eu2+のドーピング割合が1mol%であり、B3+がLa3+であり、y=1である。そのため、得られた化学式は(Ca0.99Eu0.01)7La3(PO4)5(SiO4)O2であり、そのフォトルミネッセンスの関連データを表4に示す。図9は、実験例14の光励起及びフォトルミネッセンススペクトルを示す。
【0037】
表4及び図9から分かるように、(Ca0.99Eu0.01)7La3(PO4)5(SiO4)O2は前記実験例1〜13のフォトルミネッセンスのデータとの差異が大きくなく、ケイ酸基によりリン酸基を置換した後、この一連の化合物の光励起及びフォトルミネッセンス特性に与えた影響が大きくないことを示した。
【表4】

【0038】
[実施例5:S2−により置換された(A1−xEux)8B2(PO4)6(O1−zSz)2]
y=0である場合、(A1−xEux)8B2(PO4)6(O1−zSz)2の化学一般式が得られる。この合成された実験例において、A2+がCa2+であり、Eu2+のドーピング割合が1mol%であり、B3+がLa3+であり、z=0.1である。そのため、得られた化学式が(Ca0.99Eu0.01)8La2(PO4)6(O0.9S0.1)2であり、そのフォトルミネッセンスの関連データを表5に示す。図10は、実験例15の光励起及びフォトルミネッセンススペクトルを示す。
【表5】

【0039】
表5及び図10から分かるように、(Ca0.99Eu0.01)8La2(PO4)6(O0.9S0.1)2は前記実験例1〜13のフォトルミネッセンスのデータとの差異が大きくなく、S2−によりO2−を置換した後、この一連の化合物の光励起及びフォトルミネッセンス特性に与えた影響が大きくないことを示した。
【0040】
[実施例6:濃度が異なる(Ca0.97Eu0.03)8La2(PO4)6O2の白色発光ダイオードにおける応用]
この実施例で、460nmの青色光を発生できるInGaN青色光チップを用いて、その封止剤に濃度が異なる(Ca0.97Eu0.03)8La2(PO4)6O2をドーピングして、白色発光ダイオードを形成した。白色発光ダイオードの(Ca0.97Eu0.03)8La2(PO4)6O2のドーピング濃度を表6に示す。
【表6】

【0041】
図11は、実験例16〜24の白色発光ダイオードの発光スペクトルを示し、表6は実験例16〜24の白色発光ダイオードの発生する白色光の色度座標値を示す。図11及び表6のデータから分かるように、封止剤における(Ca0.97Eu0.03)8La2(PO4)6O2の蛍光粉のドーピング濃度が徐々に減少する場合、460nm付近の青色光チップの相対発光強度は徐々に増加し、625nm付近の黄色蛍光粉の相対発光強度は徐々に減少した。そのため、白色発光ダイオードの発生する白色光の色度座標値は、蛍光粉のドーピング量の減少に伴い、(0.586, 0.405)のオレンジ光から、(0.277, 0.192)の冷白色光に調整できる。
【0042】
一般的に言えば、前記各実験例のオキシアパタイト構造を有する黄色蛍光体の主な発光領域の波長が長く、比較的に赤色光領域に偏る。そのため、前記黄色蛍光体により白色発光ダイオードを製造する場合、白色発光ダイオードの発生する白色光の赤色光領域における演色性を改善でき、品質のよい白色光が得られる。
【0043】
本発明では実施形態を前述のとおり開示したが、これは本発明を限定するものではなく、当業者であれば、本発明の精神と範囲から逸脱しない限り、多様の変動及び修飾を加えることができるため、本発明は、特許請求の範囲の記載によって限定される。
【符号の説明】
【0044】
110、120、130、140、150…ステップ
【特許請求の範囲】
【請求項1】
(A1−xEux)8−yB2+y(PO4)6−y(SiO4)y(O1−zSz)2の化学一般式を有し、AとEuは2価の金属イオンであり、Bは3価の金属イオンであり、0<x≦0.6、0≦y≦6、0≦z≦1である、オキシアパタイト構造を有する黄色蛍光体。
【請求項2】
y=z=0である場合、前記黄色蛍光体は、(A1−xEux)8B2(PO4)6O2の化学一般式を有する請求項1に記載の黄色蛍光体。
【請求項3】
y=6かつz=0である場合、前記黄色蛍光体は、(A1−xEux)2B8(SiO4)6O2の化学一般式を有する請求項1に記載の黄色蛍光体。
【請求項4】
y=0かつz=1である場合、前記黄色蛍光体は、(A1−xEux)8B2(PO4)6S2の化学一般式を有する請求項1に記載の黄色蛍光体。
【請求項5】
y=6かつz=1である場合、前記黄色蛍光体は、(A1−xEux)2B8(SiO4)6S2の化学一般式を有する請求項1に記載の黄色蛍光体。
【請求項6】
Aは、アルカリ土類金属、Mn又はZnである請求項1乃至5の何れか一項に記載の黄色蛍光体。
【請求項7】
Bは、IIIA族金属、希土類金属又はBiである請求項1乃至5何れか一項に記載の黄色蛍光体。
【請求項8】
青色蛍光体と、
(A1−xEux)8−yB2+y(PO4)6−y(SiO4)y(O1−zSz)2の化学一般式を有し、AとEuは2価の金属イオンであり、Bは3価の金属イオンであり、0<x≦0.6、0≦y≦6、0≦z≦1である黄色蛍光体と、
を含む白色発光ダイオード。
【請求項9】
Aは、アルカリ土類金属、Mn又はZnである請求項8に記載の白色発光ダイオード。
【請求項10】
Bは、IIIA族金属、希土類金属又はBiである請求項8に記載の白色発光ダイオード。
【請求項11】
請求項1に記載の黄色蛍光体の製造方法であって、
化学量論比に合う必要な元素の原料を秤量し、前記黄色蛍光体の金属原料は金属酸化物又は金属炭酸塩であり、リン酸原料はリン酸水素二アンモニウム又はリン酸二水素アンモニウムであり、ケイ酸原料は酸化ケイ素を含み、硫黄原料は硫黄粉末を含む秤量ステップと、
秤量された前記原料を均一に混合する混合ステップと、
純オキシアパタイト晶相を有する生成物を得るまで、混合された前記原料を焼成し、焼成雰囲気は酸素を有し、焼成温度は1200〜1400℃である焼成ステップと、
アンモニア及び900〜1200℃の温度において、Eu3+をEu2+に還元して、請求項1に記載の黄色蛍光体を得る還元ステップと、
を含む黄色蛍光体の製造方法。
【請求項12】
還元ステップの前に、焼成された生成物を均質化する均質化ステップをさらに含む請求項11に記載の製造方法。
【請求項1】
(A1−xEux)8−yB2+y(PO4)6−y(SiO4)y(O1−zSz)2の化学一般式を有し、AとEuは2価の金属イオンであり、Bは3価の金属イオンであり、0<x≦0.6、0≦y≦6、0≦z≦1である、オキシアパタイト構造を有する黄色蛍光体。
【請求項2】
y=z=0である場合、前記黄色蛍光体は、(A1−xEux)8B2(PO4)6O2の化学一般式を有する請求項1に記載の黄色蛍光体。
【請求項3】
y=6かつz=0である場合、前記黄色蛍光体は、(A1−xEux)2B8(SiO4)6O2の化学一般式を有する請求項1に記載の黄色蛍光体。
【請求項4】
y=0かつz=1である場合、前記黄色蛍光体は、(A1−xEux)8B2(PO4)6S2の化学一般式を有する請求項1に記載の黄色蛍光体。
【請求項5】
y=6かつz=1である場合、前記黄色蛍光体は、(A1−xEux)2B8(SiO4)6S2の化学一般式を有する請求項1に記載の黄色蛍光体。
【請求項6】
Aは、アルカリ土類金属、Mn又はZnである請求項1乃至5の何れか一項に記載の黄色蛍光体。
【請求項7】
Bは、IIIA族金属、希土類金属又はBiである請求項1乃至5何れか一項に記載の黄色蛍光体。
【請求項8】
青色蛍光体と、
(A1−xEux)8−yB2+y(PO4)6−y(SiO4)y(O1−zSz)2の化学一般式を有し、AとEuは2価の金属イオンであり、Bは3価の金属イオンであり、0<x≦0.6、0≦y≦6、0≦z≦1である黄色蛍光体と、
を含む白色発光ダイオード。
【請求項9】
Aは、アルカリ土類金属、Mn又はZnである請求項8に記載の白色発光ダイオード。
【請求項10】
Bは、IIIA族金属、希土類金属又はBiである請求項8に記載の白色発光ダイオード。
【請求項11】
請求項1に記載の黄色蛍光体の製造方法であって、
化学量論比に合う必要な元素の原料を秤量し、前記黄色蛍光体の金属原料は金属酸化物又は金属炭酸塩であり、リン酸原料はリン酸水素二アンモニウム又はリン酸二水素アンモニウムであり、ケイ酸原料は酸化ケイ素を含み、硫黄原料は硫黄粉末を含む秤量ステップと、
秤量された前記原料を均一に混合する混合ステップと、
純オキシアパタイト晶相を有する生成物を得るまで、混合された前記原料を焼成し、焼成雰囲気は酸素を有し、焼成温度は1200〜1400℃である焼成ステップと、
アンモニア及び900〜1200℃の温度において、Eu3+をEu2+に還元して、請求項1に記載の黄色蛍光体を得る還元ステップと、
を含む黄色蛍光体の製造方法。
【請求項12】
還元ステップの前に、焼成された生成物を均質化する均質化ステップをさらに含む請求項11に記載の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7A】


【図7B】


【図7C】


【図7D】


【図7E】


【図8A】


【図8B】


【図8C】


【図8D】


【図8E】


【図8F】


【図8G】


【図8H】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7A】


【図7B】


【図7C】


【図7D】


【図7E】


【図8A】


【図8B】


【図8C】


【図8D】


【図8E】


【図8F】


【図8G】


【図8H】


【図9】


【図10】


【図11】


【公開番号】特開2012−131969(P2012−131969A)
【公開日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願番号】特願2011−91822(P2011−91822)
【出願日】平成23年4月18日(2011.4.18)
【出願人】(598139748)國立交通大學 (92)
【Fターム(参考)】
【公開日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願日】平成23年4月18日(2011.4.18)
【出願人】(598139748)國立交通大學 (92)
【Fターム(参考)】
[ Back to top ]

