オピオイド拮抗薬による薬物誘発性嘔気の治療
本発明は、抗レトロウイルス剤の投与に関連する胃腸副作用をオピオイド拮抗薬の併用投与によって治療する方法を提供する。
【発明の詳細な説明】
【発明の詳細な説明】
【0001】
(関連出願との相互参照)
本出願は、2007年12月5日に出願された米国仮出願第60/992,555号の権利を主張する;該出願の内容は、その全体を参考として本明細書に合体させる。
(序文)
ヒト免疫不全ウイルス(HIV)による感染症は、後天性免疫不全症候群(AIDS)に進行し得、世界的に何百万という人々に影響を与えている致死的な疾患である(SandeおよびVolberding、1999年;Selgelid、2005年)。患者がタイミング良く治療を受けなかった場合、その疾患は、免疫機能障害および日和見感染のために、病的状態となり死亡に至り得る。ウイルス量を減じ且つ平均余命を改善するために、治療ガイドラインは、患者が多くの場合複雑な薬物療法に長期間従うことを求めている(Proctor等、1999年;Bartlett、2004年)。そのようなコンプライアンス(応諾または順守)に対する主な障害は、治療誘発性副作用である。副作用は、生活の質を損なうのみならず、コンプライアンスに負のインパクトを与える(Carr、2002年)。嘔気および嘔吐は、コンプライアンスに影響を与え得る薬物誘発性副作用の例である(Gartland、2001年;Lichterfeld等、2002年;Barlett、2004年)。そのような副作用は、薬物の有用性を多くの場合制限し、薬物の使用を受入れ難いものにさえし得る。
【0002】
数多くの抗嘔気および抗嘔吐組成物が存在しているが、これらの組成物は、多くの場合、それら組成物独自の望ましくない患者副作用を発生させている。その結果は、多くの場合、患者が、彼女または彼が緩和することを求めている症状と治療の副作用間で選択する状況におかれていることである。望ましいのは、副作用を殆ど有さず且つ治療薬の使用を可能にして症状または疾病を有効に治療する有効な抗嘔気および抗嘔吐製剤を有することである。
【0003】
(発明の概要)
当該原理、即ち、本発明を使用する方法は、ウイルス感染症、とりわけ、レトロウイルス感染症、例えば、HIVの治療におけるある種の薬物、とりわけ、抗レトロウイルス薬の投与に関連する胃腸副作用を緩和することを含む。例えば、HIVを治療するのに使用されている種々の抗レトロウイルス薬群の中には、プロテアーゼ阻害薬が存在する。プロテアーゼ阻害薬は、嘔気および嘔吐のような有害な胃腸副作用を誘発させる(ElperinおよびSax、1996年)。詳細には、本発明によれば、プロテアーゼ阻害薬のような抗レトロウイルス剤を使用しての、例えば、HIVのようなレトロウイルス感染症の治療に関連する作用のような、嘔気、嘔吐および他の有害胃腸作用を、限定するものではないが、末梢抑制性オピオイド拮抗薬、例えば、メチルナルトレキソンのようなオピオイド拮抗薬を投与することによって緩和する、例えば、軽減する、抑制する、弱化するまたは低減する方法を提供する。
【0004】
1つの実施態様においては、本発明は、抗レトロウイルス剤、とりわけプロテアーゼ阻害薬およびオピオイド拮抗薬を併用投与することによる胃腸障害の治療方法を提供する。具体的な実施態様においては、HIVのリトナビルによる治療によって誘発された嘔気および嘔吐を、末梢オピオイド拮抗薬メチルナルトレキソンのようなオピオイド拮抗薬を投与することによって緩和する。
本発明に従う方法において使用するオピオイド拮抗薬としては、一般に、数種の化合物群に属する複素環アミン化合物がある。例えば、1つの適切な群は、モルフィナンの第三級誘導体類、とりわけ、ノルオキシモルホンの第三級誘導体類である。1つの実施態様においては、ノルオキシモルホンの第三級誘導体は、例えば、ナロキソンまたはナルトレキソンである。
【0005】
ある種の実施態様においては、オピオイド拮抗薬は、末梢オピオイド拮抗薬である。適切な末梢オピオイド拮抗薬は、一般に、数種の化合物群に属する複素環アミン化合物である。例えば、1つの適切な群は、モルフィナンの第四級誘導体類、とりわけ、ノルオキシモルホンの第四級誘導体類である。1つの実施態様においては、ノルオキシモルホンの第四級誘導体は、例えば、N-メチルナルトレキソン(または、簡単にメチルナルトレキソン)、N-メチルナロキソン、N-メチルナロルフィン、N-ジアリルノルモルヒネ、N-アリルレバロルファンまたはN-メチルナルメフェンである。もう1つの群は、N置換ピペリジン類である。1つの実施態様においては、N-ピペリジンは、例えば、アルビモパンのようなピペリジン-N-アルキルカルボニレート(alkylcarbonylate)である。本発明の方法において価値のあり得るさらにもう1つの化合物群は、ベンゾモルファンの第四級誘導体類である。
【0006】
本発明のある種の実施態様においては、オピオイド拮抗薬は、μ-オピオイド拮抗薬であり得る。他の実施態様においては、オピオイド拮抗薬は、κ-オピオイド拮抗薬であり得る。また、本発明は、μ-拮抗薬類の組合せ、κ-拮抗薬の組合せ、並びにμ-およびκ-拮抗薬の組合せ、例えば、メチルナルトレキソンとアルビモパンの組合せまたはナルトレキソンとメチルナルトレキソンの組合せのような、2種以上のオピオイド拮抗薬の投与にも及ぶ。
【0007】
本発明は、添付図面と関連して本明細書に示す特定の実施態様の詳細な説明を参照することによってより一層良好に理解し認識し得るであろう。
【図面の簡単な説明】
【0008】
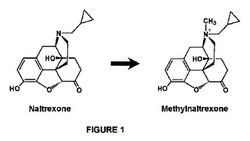
【図1】ナルトレキソンおよびメチルナルトレキソンの化学構造、並びにナルトレキソンのメチルナルトレキソンへの変換反応を示す。
【図2】ラットにおけるカオリン摂取に対するリトナビルによる治療の投与量関連効果を示すグラフである。
【図3】ラットにおけるリトナビルによって誘発されたカオリン摂取に対するナロキソンによる事前治療の投与量関連効果を示すグラフである。(NLX = ナロキソン;RIT = リトナビル)。
【図4】ナルトレキソン治療対対照(無治療)を比較する、時間0から120時間までのカオリン摂取における曲線下領域(AUC)のグラフである。
【図5】ラットにおけるリトナビルによって誘発されたカオリン摂取に対するメチルナルトレキソンによる事前治療の投与量関連効果のグラフである。(MNTX = メチルナロキソン;RIT = リトナビル)。
【図6】メチルナルトレキソン治療対対照(無治療)を比較する、時間0から120時間までのカオリン摂取における曲線下領域(AUC)のグラフである。
【図7】血漿サンプル中のメチルナルトレキソンとナルトレキソンのHPLCクロマトグラムを示し、図中、(A)は、メチルナルトレキソンとナルトレキソンの標準血漿抽出物のクロマトグラムであり;(B)は、投与後に検出したメチルナルトレキソンの高濃度を示すクロマトグラムであり:(C)は、投与後120分でのメチルナルトレキソンレベルを示すクロマトグラムである。(MNTX = メチルナルトレキソン;NTX = ナルトレキソン)。
【0009】
(詳細な説明)
本発明は、抗レトロウイルス剤、とりわけ、リトナビルのようなプロテアーゼ阻害薬とオピオイド拮抗薬との組合せを使用する組成物および方法を提供する。本発明に従う方法は、例えば、プロテアーゼ阻害薬によりHIVの治療に関連する胃腸有害副作用を治療することを含む。下記の実施例において説明しているように、リトナビルとメチルナルトレキソン(MNTX)のようなオピオイド拮抗薬との併用は、予期に反して、リトナビルの胃腸副作用を治療した。
【0010】
本発明の少なくとも1つの実施態様を説明する前に、本発明は、その応用において、実施例において例示しているような以下の説明において示す詳細に限定するものではないことを理解すべきである。そのような説明および実施例によって、特許請求の範囲に示す本発明の範囲を限定するつもりはない。本発明は、他の実施態様も可能であり、或いは種々の方法で実行または実施し得る。下記の詳細な説明は、薬物としてリトナビルを使用する実施態様を参照して本発明を説明しているが、嘔気および他の胃腸作用が有害な副作用である他のプロテアーゼ阻害薬またはそれらの組合せも本発明の原理に従って使用するのに適切であり得ることを理解すべきである。
【0011】
さらに、本明細書において引用したあらゆる特許または特許文献のようなあらゆる文献が従来技術を構成することを容認するものではない。とりわけ、特に断らない限り、本明細書における如何なる文献への参照もこれらの文献のいずれかが米国またはどこか他の国における共通の一般的知識の1部を構成しているという容認を構成しているものではないことを理解すべきである。文献についての議論はいずれもそれら文献の著者が主張していることを説明しているのであり、出願人は、本明細書において引用したいずれの文献の正確性および適切性を問題にする権利を留保する。
【0012】
本開示の全体に亘って、本発明の種々の局面を範囲方式で提示し得る。範囲方式での説明は単に便宜および簡素化のためであると理解すべきであり、本発明の範囲に対する柔軟性のない限定と解釈すべきではない。従って、当業者であれば理解しているように、あらゆる目的において、とりわけ、明細を提示する点において、本明細書において開示する全ての範囲は、あらゆる可能性のある下位範囲、それら下位範囲の組合せ、並びにその範囲内の全ての整数値および分数値も包含する。1つの例としては、20%〜40%の範囲は、20%〜32.5%と32.5%〜40%、20%〜27.5%と27.5%〜40%等の範囲に分解し得る。さらに、記載した範囲は、いずれも、その範囲を少なくとも等分の半分、3分の1、4分の1、5分の1、10分の1等に分解することを十分に説明し且つ可能であるものとして容易に認識し得るであろう。非限定的な例としては、本明細書において記載した範囲は、下位の3分の1、中位の3分の1、および上位の3分の1等に容易に分解し得る。また、当業者であれば理解しているように、“まで(up to)”、“少なくとも(at least)”、“よりも大きい(greater than)”、“よりも少ない(less than)”“よりも多い(more than)”等の全ての用語は、掲げた数を含み、上述したように、下位範囲に実質的に分解し得る範囲を称する。同様に、本明細書において開示する全ての比率も、その広い比率内に属する全ての下位比率を包含する。これらは、具体的に意図することの単なる例である。さらにまた、第1の指示数と第2の指示数との“間の範囲”および第1の指示数から第2の指示数“まで”の“範囲”なる用語は、本明細書においては互換的に使用する。
【0013】
また、本明細書における“含む(comprising)”、“含む(including)”、“有する(having)”およびこれらの変化形の使用は、その後に記載する細目およびそれらの等価物並びに追加の細目を包含することを意味し、例えば、最終結果に影響を与えない他の工程、成分および要素は付加し得る。また、これらの用語は、“からなる”および“本質的にからなる”なる用語にも及ぶ。“本質的にからなる”の使用は、上記組成物または方法がさらなる成分および/または工程を含み得るが、そのさらなる成分および/または工程が特許請求する組成物または方法の基本的および新規な特徴を実質的に変えない場合のみであることを意味する。
【0014】
特に定義しない限り、全ての科学および技術用語は、本明細書においては、通常の用法に従って使用し、本発明が属する技術における通常の熟練者が一般的に理解しているのと同じ意味を有する。しかしながら、本明細書において使用するとき、下記の定義は、上記熟練者が本発明を理解する助けにおいて有用であり得る:
“対象者”は、哺乳類、例えば、ヒト、マウス、イヌ、ネコ、ラットを称する。
“アルキル”は、飽和であり且つ直鎖、枝分れまたは環状であり得、鎖内に1〜約10個の炭素原子を有する1価の脂肪族炭化水素基、並びにそれらの鎖の全ての組合せおよび下位組合せを称する。典型的なアルキル基としては、限定するものではないが、メチル、エチル、n-プロピル、イソプロピル、ブチル、イソブチル、sec-ブチル、tert-ブチル、ペンチル、シクロプロピル、シクロブチル、シクロペンチルおよびシクロヘキシルがある。
“低級アルキル”は、1〜約6個の炭素原子を有するアルキル基を称する。
【0015】
“アルケニル”は、少なくとも1個の炭素-炭素二重結合を含有し且つ鎖内に2〜約10個の炭素原子を有する1価の脂肪族炭化水素基、並びにそれらの鎖の全ての組合せおよび下位組合せを称する。典型的なアルケニル基としては、限定するものではないが、ビニル、プロペニル、ブテニル、ペンテニル、ヘキセニルおよびヘプテニルがある。
“アルキニル”は、少なくとも1個の炭素-炭素三重結合を含有し且つ鎖内に2〜約10個の炭素原子を有する1価の脂肪族炭化水素基、並びにそれらの鎖の組合せおよび下位組合せを称する。典型的なアルキニル基としては、限定するものではないが、エチニル、プロピニル、ブチニル、ペンチニル、ヘキシニルおよびヘプチニルがある。
【0016】
“アルキレン”は、1〜6個の炭素原子を含有する2価の脂肪族炭化水素基、例えば、-CH2-(メチレン)、並びにそれらの鎖の全ての組合せおよび下位組合せを称する。アルキレン基は、直鎖、枝分れまたは環状であり得る。必要に応じて、アルキレン基に沿って1個以上の酸素原子、イオウ原子または必要に応じて置換した窒素原子を装入することができ、窒素置換基は、上述したようなアルキル基を有する。
“アルケニレン”は、少なくとも1個の炭素-炭素二重結合を含有し、直鎖、枝分れまたは環状であり得る2価のアルキレン基を称する。典型的なアルケニレン基としては、限定するものではないが、エテニレン(-CH=CH-)およびプロペニレン(-CH=CHCH2-)がある。
【0017】
“シクロアルキル”は、約3〜約10個の炭素を有する飽和の単環式または二環式炭化水素環、並びにそれらの環の全ての組合せおよび下位組合せを称する。シクロアルキル基は、必要に応じて、1個以上のシクロアルキル基置換基によって置換し得る。典型的なシクロアルキル基としては、限定するものではないが、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシルおよびシクロヘプチルがある。
“アシル”は、アルキルが上述したとおりであるアルキル-CO基を意味する。典型的なアシル基としては、限定するものではないが、アセチル、プロパノイル、2-メチルプロパノイル、ブタノイルおよびパルミトイルがある。
【0018】
“アリール”は、約6〜約10個の炭素を含有する芳香族炭素環基、並びにそれらの環の全ての組合せおよび下位組合せを称する。アリール基は、必要に応じて、1個もしくは2個またはそれ以上のアリール基置換基によって置換し得る。典型的なアリール基としては、限定するものではないが、フェニルおよびナフチルがある。
“アリール置換アルキル”は、必要に応じて置換されたアリール基、好ましくは必要に応じて置換されたフェニル環によって末端炭素において置換された線状アルキル基、好ましくは低級アルキル基を称する。典型的なアリール置換アルキル基としては、例えば、フェニルメチル、フェニルエチル、および3(4-メチルフェニル)プロピルがある。
【0019】
“複素環”は、約4〜約10員を含有する単環式または多環式環系の炭素環基、並びにこれらの環の全ての組合せおよび下位組合せを称し、環の1以上の員が炭素以外の元素、例えば、窒素、酸素またはイオウである。複素環基は、芳香族または非芳香族であり得る。典型的な複素環基としては、例えば、ピロールおよびピペリジン基がある。
“ハロ”は、フルオロ、クロロ、ブロモまたはヨードを称する。
【0020】
オピオイド拮抗薬に関しての“末梢”とは、中枢神経系外部の生理系および成分に主として作用するオピオイド拮抗薬を称する。換言すれば、これらのオピオイド拮抗薬は、減少した中枢神経系(CNS)活性を示すか或いは中枢神経系活性を実質的に示さない。例えば、これらのオピオイド拮抗薬は、オピオイドの中枢作用を抑制する有効量では血液脳関門を容易には通過しない、即ち、これらのオピオイド拮抗薬は、末梢に投与したとき、オピオイドの鎮痛効果を有効には抑制しない、即ち、これらのオピオイド拮抗薬は、オピオイドの鎮痛効果を低下させない。本発明の方法において使用する末梢オピオイド拮抗薬化合物は、CNS中では約5〜15%よりも低い薬理活性を適切に示す;約0%CNS活性(即ち、無活性)が最も適している。末梢オピオイド拮抗薬の非中枢作用特性は、多くの場合、その分子または種の電荷、極性および/またはサイズに関連している。例えば、本明細書において説明するような末梢作用性第四級アミンオピオイド拮抗薬は正帯電しており、一方、中枢作用性第三級アミンオピオイド拮抗薬は中性分子である。本発明において有用な末梢オピオイド拮抗薬は、典型的に、μ-およびκ-オピオイド拮抗薬である。
【0021】
用語“製薬上許容し得る”または“薬理学上許容し得る”とは、ヒトのような対象者に投与したときに、有害な、アレルギー性のまたは他の厄介な反応を発生させない分子存在物または組成物に言及することを意味する。本発明に従うオピオイド拮抗薬は、遊離塩基として、中性でまたは塩形で製剤化し得る。“製薬上許容し得る塩”とは、製薬上許容し得且つ親化合物の所望の薬理活性を有している塩を称する。そのような塩は、治療用途において許容し得る性質を有する本発明に従う化合物の無毒性の通常の塩および第四級アンモニウム塩である。そのような塩は、例えば、無機または有機の塩基または酸から調製し得る。例えば、酸付加塩としては、酢酸塩、アスコルビン酸塩、安息香酸塩、重硫酸塩、塩化物、クエン酸塩、乳酸塩、マレイン酸塩、シュウ酸塩、スルホン酸塩、酒石酸塩等があり得る。塩基塩としては、カリウムおよびナトリウム塩のようなアルカリ金属塩、カルシウムおよびマグネシウム塩のようなアルカリ土類金属、並びにエタノールアミン、ジエタノールアミン、トリエタノールアミン、N-メチルグルカミン等のような有機塩基とのアンモニウム塩があり得る。さらに、塩基性窒素含有基は、低級アルキルハロゲン化物、例えば、メチル、エチル、プロピルおよびブチルの塩化物、臭化物およびヨウ化物、並びに長鎖ハロゲン化物および硫酸ジアルキルまたはジアミルのような薬剤によって第四級化し得る。文脈上そうでないことを明白に指摘しない限り、本明細書において使用するときの“本発明の化合物(compounds of the invention)”、“本発明の化合物(a compound of the invention)”または“本発明に従う化合物”のような用語は、関連化合物の化学的に生成可能な製薬上許容し得る塩を包含するものとする。適切な製薬上許容し得る塩についてのさらなる情報は、Remington: The Science and Practice of Pharmacy, 21st ed., Lippincott Williams and Wilkens, Philadelphia, PAにおいて見出し得る;該文献は、参考として本明細書に合体させる。
【0022】
本明細書において使用する用語“治療する”または“治療”は、症状の予防、治療、緩和;症状の減退、軽減または低減;および、症状の進行の抑制または阻止のような病状または病態のあらゆる管理手段を包含する。
本明細書において使用するとき、用語“副作用”は、対象者に投与したときの薬物の目的または所望の作用以外の作用を言及することを意味する。副作用は、有益で或いは望ましくなく、即ち、有害であり得る。本発明の場合、望ましくない作用は、多くの場合、リトナビルのような抗レトロウイルス剤の投与後に生じる。そのような副作用としては、嘔気、嘔吐、下痢および腹痛のような胃腸副作用がある。
本明細書において使用するとき、用語“有効性”は、レトロウイルス感染症、例えば、HIVをそのような感染症に罹患している対象者において治療する抗レトロウイルス剤の能力または効力を言及することを意味する。また、有効性は、所定の強度の特定の効果を発生させるのに必要とする薬物の投与量として表すこともできる。
【0023】
本発明の方法の以下の説明においては、処理工程は、特に断らない限り、室温および大気圧下に実施する。
本発明によれば、レトロウイルスによる感染症、主としてHIVを治療するのにとりわけ重要な抗レトロウイルス剤は、プロテアーゼ阻害薬である。プロテアーゼ(ペプチダーゼとしても知られている)は、タンパク質を特定のペプチド結合において開裂させる酵素である。多くの生物学的機能は、プロテアーゼおよびその相補的プロテアーゼ阻害薬が制御または介在する。
【0024】
レトロウイルスのゲノムは、polおよびgag遺伝子産生物のような1種以上のポリタンパク質プレカーサーのタンパク質分解プロセッシングに関与するプロテアーゼをコード化している。(Wellink, Arch. Virol. 98 1 (1988)を参照されたい)。レトロウイルスプロテアーゼは、最も一般的には、gagプレカーサーをコアタンパク質中にプロセッシングし、さらにまた、polプレカーサーを逆転写酵素およびレトロウイルスプロテアーゼ中にプロセッシングする。これらのプレカーサーポリタンパク質のレトロウイルスプロテアーゼによる正確なプロセッシングが、新たな感染性ビリオンの集合にとっては必要である。プロテアーゼ欠落ウイルスを産生する生体外突然変異生成が、感染性を欠如する未成熟コア形の産生をもたらすことは証明されている。(Crawford, J. Virol. 53 899 (1985);Katoh, et al., Virology 145 280 (1985)を参照されたい)。従って、レトロウイルスプロテアーゼ阻害は、抗ウイルス治療において魅力的なターゲットを提供する。(Mitsuya, Nature 325 775 (1987)を参照されたい)。
【0025】
数種のプロテアーゼ阻害薬を、有効な抗レトロウイルス剤として使用する;しかしながら、これらの薬剤は、数種の有害作用、とりわけ、胃腸副作用を発生させる。治療プロトコールのコンプライアンスはHIVおよびAIDS患者における有効な抗ウイルス治療のための前提条件であるので、薬物誘発性副作用はは、コンプライアンスを妨げ得る。今日まで、プロテアーゼ阻害薬が胃腸作用、例えば、嘔気および/または嘔吐を発生させるメカニズムは研究されていない。抗嘔気剤の使用は嘔気および嘔吐を軽減するのに幾分か有効であるが、これらの有害な胃腸作用は、プロテアーゼ阻害薬治療プロトコールにおいては問題のままである。
【0026】
プロテアーゼ阻害薬は、ペプチド性および非ペプチド性として分類されている。ペプチド性プロテアーゼ阻害薬としては、アンプレナビル、アタザナビル、ホスアンプレナビル(活性アンプレナビルに代謝する)、インジナビル、ロピナビル、ネルフィナビル、リトナビルおよびセクイナビルがある。非ペプチド性プロテアーゼ阻害薬としては、ダルナビルおよびチプラナビルがある。とりわけ興味あるのはリトナビルであり、このものは、単独で強力なプロテアーゼ阻害薬であり、さらにまた、低投与量で使用して他のプロテアーゼ阻害薬の活性を増強する、例えば、リトナビルとロピナビルの併用。リトナビルは、下記の式(A)で示されるように、トリペプチドである:
【化1】

【0027】
リトナビルは、本来、HIVプロテアーゼの阻害薬として設計されたが、他のプロテアーゼ阻害薬の有効性を増強することも見出された。とりわけ、リトナビルは、シトクロムP450-3A4 (CYP3A4)、即ち、プロテアーゼ阻害薬の代謝に関与する肝臓酵素を阻害する。リトナビルおよび/またはリトナビルによって増強された他のプロテアーゼ阻害薬によるHIVプロテアーゼの阻害は、非感染性ウイルス粒子の増大をもたらし、HIV症状の軽減を生じる。しかしながら、リトナビルの副作用は、嘔気および嘔吐である。
【0028】
後の実施例において説明するように、本発明者は、リトナビル誘発性のようなプロテアーゼ阻害薬誘発性の嘔気および嘔吐に対するオピオイドレセプター拮抗薬の効果を評価した。ナロキソン(中枢作用性オピオイド拮抗薬)およびメチルナルトレキソン(末梢作用性オピオイド拮抗薬)の双方がリトナビル誘発性嘔気および嘔吐を軽減することを見出した。
従って、本発明に従うオピオイド拮抗薬としては、中枢および末梢作用性オピオイド拮抗薬の双方がある。とりわけ価値を有する拮抗薬は、適切には、末梢抑制性オピオイド拮抗薬であることを意図している。とりわけ適切なのは、μ-オピオイド拮抗薬、とりわけ、末梢μ-オピオイド拮抗薬であり得る。
【0029】
オピオイド拮抗薬は、その拮抗薬特性を保持しながら構造的に変化し得る化合物群を構成する。これらの化合物としては、第三級および第四級モルフィナン類、とりわけ、ノルオキシモルホン誘導体;N-置換ピペリジン類、とりわけ、ピペリジン-N-アルキルカルボキシレート;並びに、第三級および第四級ベンゾモルファン類およびノルモルフィナン誘導体類、とりわけ、6-カルボキシ-ノルモルフィナン誘導体がある。第三級化合物拮抗薬は、かなり脂溶性であり、血液脳関門を容易に通過する。
【0030】
血液脳関門を通過し且つ中枢(および末梢)活性であるオピオイド拮抗薬の例としては、例えば、ナロキソン、ナルトレキソン(各々、Baxter Pharmaceutical Products社から商業的に入手可能である)、およびナルメフェン(例えば、Dupont Pharma社から入手可能)がある。一方、末梢抑制性拮抗薬は、典型的に帯電性で極性でありおよび/または高分子量を有し、そのような性質は、これら拮抗薬の血液脳関門の通過を妨げる。例えば、メチルナルトレキソンは、第三級オピオイド拮抗薬であるナルトレキソンの第四級誘導体である(図1)。メチル基をナルトレキソンに付加することにより、より高い極性およびより低い脂溶性を有する化合物が形成される。従って、メチルナルトレキソンは、血液脳関門を通過しなくて、末梢に位置するレセプターが典型的に介在する望ましくない胃腸副作用を遮断するポテンシャルを有する。
【0031】
本発明において使用するのに適する末梢オピオイド拮抗薬は、第四級モルフィナン誘導体、とりわけ、下記の式(I)の第四級ノルオキシモルフォンである化合物であり得る:
【化2】

(式中、Rは、アルキル、アルケニル、アルキニル、アリール、シクロアルキル置換アルキルまたはアリール置換アルキルであり;X-は、アニオン、とりわけ、クロリド、ブロミド、イオジドまたはメチルサルフェートアニオンである)。
式(I)のノルオキシモルホン誘導体は、例えば、米国特許第4,176,186号の手順に従って調製し得る;該特許は、参考として本明細書に合体させる。また、米国特許第4,719,215号、第4,861,781号、第5,102,887号、第5,972,954号および第6,274,591号;米国特許出願第2002/0028825号および第2003/0022909号;並びPCT公開公報WO 99/22737号およびWO 98/25613号も参照されたい;これらは、全て参考として本明細書に合体させる。
【0032】
とりわけ価値のある式(I)の化合物は、下記の式(II)で示されるような、RがシクロプロピルメチルであるN-メチルナルトレキソン(または、簡潔にメチルナルトレキソン)である:
【化3】

(式中、X-は、上述したとおりである)。
【0033】
上述したように、メチルナルトレキソンは、オピオイド拮抗薬ナルトレキソンの第四級誘導体である。メチルナルトレキソンは、塩(例えば、N-メチルナルトレキソンブロミド)として存在し、従って、用語“メチルナルトレキソン”または“MNTX”は、本明細書において使用するとき、そのような塩も包含する。従って、“メチルナルトレキソン”または“MNTX”としては、具体的には、限定するものではないが、メチルナルトレキソンのブロミド塩、クロリド塩、イオジド塩、炭酸塩および硫酸塩がある。文献においてMNTXのブロミド塩について使用している種々の名称としては、例えば、メチルナルトレキソンブロミド、N-メチルナルトレキソンブロミド、ナルトレキソンメトブロミド、ナルトレキソンメチルブロミド、SC-37359、MRZ-2663-BR,およびN-シクロプロピルメチルノルオキシ-モルヒネ-メトブロミドがある。
【0034】
メチルナルトレキソンは、例えば、ミズーリ州セントルイスのMallinckrodt Pharmaceuticals社から商業的に入手可能である。メチルナルトレキソンは、水に自由溶解性の白色結晶粉末として、典型的にはブロミド塩として提供されている。提供されたときの化合物は、逆相HPLCにより99.4%純粋であり、同じ方法による0.011%未満の第四級化されていないナルトレキソンを含有している。メチルナルトレキソンは、例えば、約5mg/mLの濃度の滅菌溶液として調製し得る。
【0035】
他の適切な末梢オピオイド拮抗薬としては、N-置換ピペリジン類、とりわけ、下記の式(III)によって示されるようなピペリジン-N-アルキルカルボキシレートがあり得る:
【化4】

(式中、R1は、水素またはアルキルであり;R2は、水素、アルキルまたはアルケニルであり;R3は、水素、アルキル、アルケニル、アリール、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキル、シクロアルケニル置換アルキルまたはアリール置換アルキルであり;R4は、水素、アルキルまたはアルケニルであり;Aは、OR5またはNR6R7であり;R5は、水素、アルキル、アルケニル、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキル、シクロアルケニル置換アルキルまたはアリール置換アルキルであり;R6は、水素またはアルキルであり;R7は、水素、アルキル、アルケニル、アリール、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキル、シクロアルケニル置換アルキルまたはアリール置換アルキル、またはアルキレン置換Bであるか、或いは、R6とR7が結合している窒素原子と一緒に、R6とR7は、ピロールまたはピペリジンから選ばれる複素環を形成しており;Bは、下記:
【化5】

(式中、R8は、水素またはアルキルであり;R9は、水素、アルキル、アルケニル、アリール、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキル、シクロアルケニル置換アルキルまたはアリール置換アルキルあるか、或いは、R8とR9が結合している窒素原子と一緒に、R8とR9は、ピロールまたはピペリジンから選ばれる複素環を形成しており;Wは、OR10、NR11R12またはOEであり;R10は、水素、アルキル、アルケニル、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキル、シクロアルケニル置換アルケニルまたはアリール置換アルキルであり;R11は、水素またはアルキルであり;R12は、水素、アルキル、アルケニル、アリール、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキル、シクロアルケニル置換アルキルまたはアリール置換アルキル、またはアルキレン置換C(=O)Yであるか、或いは、R11とR12が結合している窒素原子と一緒に、R6とR7は、ピロールまたはピペリジンから選ばれる複素環を形成しており;Eは、下記:
【化6】

、アルキレン置換(C=O)Dまたは-R13OC(=O)R14であり;R13は、アルキル置換アルキレンであり;R14は、アルキルであり;Dは、OR15またはNR16R17であり;R15は、水素、アルキル、アルケニル、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキル、シクロアルケニル置換アルキルまたはアリール置換アルキルであり;R16は、水素、アルキル、アルケニル、アリール、アリール置換アルキル、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキルまたはシクロアルケニル置換アルキルであり;R17は、水素またはアルキルであり;或いは、R16とR17が結合している窒素原子と一緒に、R16とR17は、ピロールまたはピペリジンから選ばれる複素環を形成しており;
Yは、OR18またはNR19R20であり;R18は、水素、アルキル、アルケニル、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキル、シクロアルケニル置換アルキルまたはアリール置換アルキルであり;R19は、水素またはアルキルであり;R20は、水素、アルキル、アルケニル、アリール、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキル、シクロアルケニル置換アルキルまたはアリール置換アルキルであるか、或いは、R19とR20が結合している窒素原子と一緒に、R19とR20は、ピロールまたはピペリジンから選ばれる複素環を形成しており;R21は、水素またはアルキルである)
であり;そして、nは、0〜4である)。
【0036】
価値を有し得る特定のピペリジン-N-アルキルカルボキシレートは、式(IV)として下記に示されるアルビモパンのようなN-アルキルアミノ-3,4,4置換ピペリジンである:
【化7】

【0037】
適切なN-置換ピペリジン類は、米国特許第5,270,328号、第6,451,806号、第6,469,030号に開示されているようにして調製し得る;これらの米国特許は、全て参考として本明細書に合体させる。アルビモパンは、ペンシルベニア州エクストンのAdolor社から入手し得る。そのような化合物は、適度の高分子量、両性イオン形、および血液脳関門の透過を阻止する極性を有する。
【0038】
さらに他の適切な末梢オピオイド拮抗薬化合物としては、第四級ベンゾモルファン化合物があり得る。本発明の方法において使用することのできる第四級ベンゾモルファン化合物は、下記の式(V)を有する:
【化8】

(式中、R1は、水素、アシルまたはアセトキシであり;R1は、アルキルまたはアルケニルであり;Rは、アルキル、アルケニルまたはアルキニルであり;X-は、アニオン、とりわけ、クロリド、ブロミド、イオジドまたはメチルサルフェートアニオンである)。
【0039】
本発明の方法において使用することのできるベンゾモルファン化合物の特定の第四級誘導体としては、式(V)の以下の化合物がある:2’-ヒドロキシ-5,9-ジメチル-2,2-ジアリル-6,7-ベンゾモルファニウム-ブロミド、2’-ヒドロキシ-5,9-ジメチル-2-n-プロピル-2-アリル-6,7-ベンゾモルファニウム-ブロミド、2’-ヒドロキシ-5,9-ジメチル-2-n-プロピル-2-プロパルギル-6,7-ベンゾモルファニウム-ブロミド、および2’-アセトキシ-5,9-ジメチル-2-n-プロピル-2-アリル-6,7-ベンゾモルファニウム-ブロミド。
本発明の方法において使用することのできる他の第四級ベンゾモルファン化合物は、例えば、米国特許第3,723,440号に記載されている;該米国特許の内容全体を参考として本明細書に合体させる。
【0040】
他の末梢オピオイド拮抗薬は、“6-Carboxy-Normorphinan Derivatives, Synthesis and Uses Thereof”と題する米国出願第11/888,955号に記載されているような、6-カルボキシ-ノルモルフィナン誘導体、とりわけ、N-メチル-C-ノルモルフィナン誘導体があり得る;上記米国出願は、その全体を参考として本明細書に合体させる。
上述したように、本発明の化合物は、製薬上許容し得る塩として適切に存在し得、製剤化し得る。
【0041】
本発明の方法において使用する化合物は、プロドラッグ形で存在し得る。本明細書において使用するとき、“プロドラッグ”は、そのようなプロドラッグを哺乳類対象者に投与したとき、式(I)〜(V)または他の式に従う活性親薬物を放出するかまたはこれら活性親薬物に転換する任意の薬剤或いは本発明の方法において生体内使用される活性薬物または他の化合物に生体内で代謝される化合物を包含するものとする。プロドラッグは調合薬の多くの望ましい性質(例えば、溶解性、生体利用性、製造性等)を増強することが知られているので、本発明の幾つかの方法において使用する化合物は、必要に応じて、プロドラッグ形で伝達し得る。従って、本発明は、プロドラッグの伝達方法を意図する。本発明において使用する化合物のプロドラッグは、その化合物中に存在する官能基を、修飾物を一般的な操作でまたは生体内で開裂させて親化合物にするような方法で修飾することによって調製し得る。
【0042】
従って、プロドラッグとしては、例えば、ヒドロキシ、アミノまたはカルボキシ基を任意の基に結合させている本明細書において開示する化合物があり、上記の任意の基が、当該プロドラッグを哺乳類対象者に投与したとき、開裂して遊離のヒドロキシル、遊離のアミノまたはカルボン酸をそれぞれ形成する。他の例としては、限定するものではないが、アルコールおよびアミン官能基のアセテート、ホルメートおよびベンゾエート誘導体;並びに、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、sec-ブチル、tert-ブチル、シクロプロピル、フェニル、ベンジルおよびフェネチルエステル等のような、アルキル、炭素環、アリールおよびアルキルアリールエステル類がある。
【0043】
説明したように、本発明の方法において使用する化合物は、当業者にとって周知の多くの方法で調製し得る。本発明に関連して開示する製剤は、ミリグラム、グラム、多グラム、キログラム、多キログラムまたは商業的製薬規模のような任意の規模で実施することを意図する。
本発明の方法において使用する化合物は、1個以上の非対称形置換炭素原子を含有し得、また、光学活性またはラセミ形で単離し得る。従って、構造体の全てのキラル、ジアステレオマー、ラセミ形、エピマー形および全ての幾何異性体形を、特定の立体化学または異性体形を特に示さない限り意図する。当該技術において、そのような光学活性形を如何にして調製し分離するかは周知である。例えば、立体異性体の混合物は、限定するものではないが、ラセミ形の分解;標準、逆相およびキラルクロマトグラフィー;選択的塩形成、再結晶化等のような標準方法によって、或いはキラル出発物質からのキラル合成によって、或いはターゲットキラル中心の慎重な合成によって調製し得る。
【0044】
本発明の幾つかの実施態様においては、オピオイド拮抗薬は、μ-オピオイド拮抗薬であり得る。他の実施態様においては、オピオイド拮抗薬は、κ-オピオイド拮抗薬であり得る。また、本発明は、μ-オピオイド拮抗薬類の組合せ、κ-オピオイド拮抗薬類の組合せおよびμ-オピオイド拮抗薬とκ-オピオイド拮抗薬との組合せ、例えば、メチルナルトレキソンとアルビモパンの組合せのような2種以上のオピオイド拮抗薬の投与も包含する。
例証した実施態様において、本発明者は、メチルナルトレキソンおよびナルトレキソンがプロテアーゼ阻害薬誘発性嘔気および嘔吐を有意に軽減することを見出した。メチルナルトレキソンおよび他の末梢抑制性オピオイド拮抗薬は、概して、プロテアーゼ阻害薬誘発性嘔気および嘔吐の治療において、そのような治療を施した場合に、とりわけオピオイド治療からの鎮静作用に影響を及ぼすことなく臨床的価値を有する。
【0045】
後の実施例において説明しているように、ラット異食症(pika)モデルを使用して嘔気および嘔吐の症状を評価した。ラットは、クレーのような非栄養物質系の種々の嘔吐刺激飼料、即ち、異食行動(pika behavior)と称する現象に接触した。そのように、ラットにおける異食行動は、ヒトおよび他の種における嘔気および嘔吐と同様である(Mitchell等、1976年; Takeda等、1993年)。ラットにおける異食行動は、ヒトおよび他の種におけるのと同様に、セロトニンおよびドーパミンに関連するメカニズムおよびレセプターによって介在される(Takeda等、1993年;Takeda等、1995年)。ラット異食症モデルは、広く使用されており、抗嘔吐薬を試験する幾つかの研究において検証されている(Takeda等、1995年;Aung等、2004年)。リトナビルによって誘発される投与量依存性異食応答は、既に実証されている(Aung等、2005年)。以下で実証しているように、本発明者は、上記異食症モデルを使用してメチルナルトレキソンおよびナルトレキソンによる治療がリトナビル誘発性異食症を有意に軽減することを実証した。
【0046】
メチルナルトレキソンによる囓歯類の治療においては、メチルナルトレキソンが、呼気14CO2試験によって測定したとき、脱メチル化によって部分的に代謝され得ることが示唆されている(Kotake等、1989年)。しかしながら、全身メチルナルトレキソン投与は、放射熱テイルフリックアッセイ(radiant-heat tail-flick assay)に供したラットにおけるモルヒネ誘発性鎮痛作用に拮抗してなく、胃腸管運動のモルヒネ誘発性低下にはメチルナルトレキソンが投与量関連の形で拮抗作用していた(Gmerek等、1986年)。HPLCを使用してメチルナルトレキソン投与後の血漿ナルトレキソンレベルを測定した。検出可能なナルトレキソン量は最高のメチルナルトレキソン投与量において見出せず、試験した投与量においては、メチルナルトレキソンは脱メチル化されなかったことを示唆していた。
【0047】
本発明の方法は、一般に、医学的に許容し得る任意の投与方式、例えば、有効量の活性化合物を、臨床的に許容し得ない有害作用を生じることなく発出させる任意の方式を使用して実施し得る。そのような投与方式としては、経口、直腸、局所(粉末、軟膏、液滴、経皮パッチ、またはイオントフォレーゼ装置によるような)、経皮、舌下、筋肉内、注入、静脈内、肺、筋肉内、腔内、エアゾールとして、耳内(例えば、点耳剤による)、鼻腔内、吸入、眼内または皮下がある。
さらに、上記オピオイド拮抗薬は、腸溶コーティーングした錠剤またはカプセル剤としても投与し得る。ある種の実施態様においては、上記オピオイド拮抗薬は、低速注入法によって、または持続放出もしくは制御放出方法によって、または凍結乾燥粉末として投与する。
【0048】
投与したとき、本発明の化合物は、製薬上許容し得る量で且つ製薬上許容し得る組成物即ち製剤中で投与する。そのような製剤は、一般的には、塩、緩衝剤、保存剤、および任意成分としての他の治療成分を含有し得る。
医薬において使用する場合、上記塩は製薬上許容し得るべきであるが、製薬上許容し得ない塩は、便宜上使用してその製薬上許容し得る塩を調製することができ、本発明の範囲から除外するものではない。そのような薬理学上許容し得且つ製薬上許容し得る塩としては、限定するものではないが、以下の酸から調製した塩がある:塩酸、臭化水素酸、硫酸、硝酸、リン酸、マレイン酸、酢酸、サリチル酸、p-トルエンスルホン酸、酒石酸、クエン酸、メタンスルホン酸、ギ酸、コハク酸、ナフタレン-2-スルホン酸、パモン酸、3-ヒドロキシ-2-ナフタレンカルボン酸およびベンゼンスルホン酸。
【0049】
適切な緩衝剤としては、限定するものではないが、酢酸およびその塩(1〜2%(質量/容量))、クエン酸およびその塩(1〜3%(質量/容量))、ホウ酸およびその塩(0.5〜2.5%(質量/容量))、並びにリン酸およびその塩(0.8〜2%(質量/容量))がある。
適切な保存剤としては、限定するものではないが、ベンズアルコニウムクロリド(0.003〜0.03%(質量/容量))、クロロブタノール(0.3〜0.9%(質量/容量))、パラベン類(0.01〜0.25%(質量/容量))、およびチメロサール(0.004〜0.02%(質量/容量))がある。
【0050】
投与の容易さのために、上記オピオイド拮抗薬の製薬組成物は、潤滑剤、希釈剤、結合剤、担体および崩壊剤のような1種以上の製薬上許容し得る賦形剤も含有し得る。他の助剤としては、例えば、安定剤、湿潤剤、乳化剤、浸透圧に影響を与えるための塩類;着色、香味および/または芳香活性化合物がある。
【0051】
製薬上許容し得る担体または賦形剤とは、無毒で固体、半固体または液体の充填剤、希釈剤、カプセル化材料、或いは任意のタイプの配合助剤を称する。例えば、適切な製薬上許容し得る担体、希釈剤、溶媒またはビヒクルとしては、限定するものではないが、水:塩(緩衝)溶液;アルコール類;アラビアゴム;鉱油および植物油;ベンジルアルコール;ポリエチレングリコール;ゼラチン;ラクトース、アミロースまたは澱粉のような炭水化物類;ステアリン酸マグネシウム;タルク;ケイ酸;粘稠パラフィン;植物油;脂肪酸モノグリセリドおよびジグリセリド;ペンタエリスリトール脂肪酸エステル;ヒドロキシルメチルセルロース;ポリビニルピロリドン等がある。適切な流動性は、例えば、レシチンのようなコーティーング物質を使用することによって、分散液の場合には必要な粒度を維持することによって、また、界面活性剤を使用することによって維持し得る。微生物の作用の防止は、種々の抗菌剤、例えば、パラベン、クロロブタノール、フェノール、ソルビン酸等のような抗細菌剤または抗真菌剤を含ませることによって確保し得る。
【0052】
製薬上許容し得る固形担体を使用する場合、本発明の方法において使用するのに適する化合物の投与剤形は、錠剤、カプセル剤、粉末剤、坐薬、またはトローチ剤であり得る。液体担体を使用する場合、軟質ゼラチンカプセル剤、経皮パッチ、エアゾールスプレー、局所クリーム、シロップまたは液体懸濁液、エマルジョンまたは溶液が投与剤形であり得る。
非経口投与においては、とりわけ適しているのは、注射用の滅菌溶液、好ましくは非水性または水性溶液、並びに分散液、懸濁液またはエマルジョン、或いは坐薬のようなインプラントである。アンプル剤は、多くの場合、便利な単位投与量である。また、注射用デポー剤形も適切であり得、薬物のマイクロカプセルマトリックスをポリラクチド-ポリグリコリド、ポリ(オルソエステル)およびポリ(酸無水物)のような生分解性ポリマー中に形成させることによって製造し得る。薬物対ポリマー比および使用する特定のポリマーの性質に応じて、薬物放出速度を調整し得る。
腸内投与においては、とりわけ適しているのは、錠剤、糖衣剤、液剤、ドロップ剤、坐薬、または軟質ゼラチンカプセルのようなカプセル剤である、甘味化ビヒクルを使用するシロップ剤またはエリキシル剤等も使用し得る。
【0053】
説明したように、他の伝達系としては、持続放出、遅延放出または徐放伝達系があり得る。そのような系は、本発明の化合物の繰返しの投与を回避して、患者および医師への利便性を高め且つ化合物の血漿レベルの持続を維持し得る。多くのタイプの制御放出伝達系が利用し得、当業者にとって既知である。持続または制御放出組成物は、リポソームまたは活性成分が段階的に分解可能なコーティーングによってマイクロカプセル化、多層コーティーング等によるようして保護されている組成物として製剤化し得る。そのように、本発明に従うオピオイド拮抗薬は、腸溶性コーティーング錠剤またはカプセル剤として投与することができる。ある種の実施態様においては、オピオイド拮抗薬は、低速注入法によってまたは持続放出または制御放出方法によってまたは凍結乾燥粉末として投与する。
【0054】
例えば、本発明の化合物は、生分解性ポリマーのような製薬上許容し得る持続放出性マトリックスと混合して治療用組成物を調製し得る。持続放出性マトリックスは、本発明において使用する場合、酵素または酸-塩基加水分解によりまたは溶解により分解し得る材料(通常はポリマー)から製造したマトリックスである。体内に挿入した時点で、上記マトリックスは、酵素および体液に従って作用する。持続放出性マトリックスは、望ましくは、生体適合性材料、例えば、リポソーム類;ポリラクチド(ポリ乳酸)、ポリグリコリド(グリコール酸のポリマー)、ポリラクチド コ-グリコリド(乳酸とグリコール酸のコポリマー)、ポリ酸無水物、ポリ(オルソ)エステル、多糖類、ポリアミノ酸、ヒアルロン酸、コラーゲン、硫酸コンドロイチン、ポリヌクレオチド類、ポリビニルプロピレン、ポリビニルピロリドンおよびシリコーンのようなポリマー系;カルボン酸、脂肪酸、リン脂質、アミノ酸、および脂質(例えば、ステロール)のような非ポリマー系;ヒドロゲル放出系;シラスティック系;ペプチド系;インプラント類等から選択する。特定の例としては、限定するものではないが、(a) 米国特許第4,452,775号、第4,675,189号および第5,736,152号(参考としてそれら全体を本明細書に合体させる)において見出せる、多糖類をマトリックス内の形で含ませている浸食性の系;および、(b) 米国特許第3,854,480号、第5,133,974号および第5,407,686号(参考としてそれら全体を本明細書に合体させる)に記載されているような、活性成分がポリマーから制御された速度で浸透する拡散系がある。さらに、ポンプ系硬質ワイヤー型伝達装置(pump-based hard-wired delivery system)も使用することができ、これらの数種は、インプランテーション用に適応化されている。適切な腸溶性コーティーングは、PCT公報 WO 98/25613号および米国特許第6,274,591号(共に、参考として本明細書に合体させる)に記載されている。また、持続または制御放出組成物は、活性成分が段階的に分解可能なコーティーングによってマイクロカプセル化、多層コーティーング等によるようして保護されている組成物として製剤化し得る。
【0055】
特定的にメチルナルトレキソンに関して、水性製剤は、キレート化剤、緩衝剤、酸化防止剤、および任意成分としての等張剤を、好ましくは3.0〜3.5に調整したpHで含み得る。オートクレーブ処理および長期保存に対して安定である製剤は、第2004/0266806号として公開され、“Pharmaceutical Formulation”と題する米国特許出願第10/821811号に記載されている;該米国特許出願の開示は、参考として本明細書に合体させる。また、増大した保存期間を有するメチルナルトレキソンの製剤は、“Formulations for Parenteral Delivery of Compounds and Uses Thereof”と題する国際特許公開公報WO 2008/19115に記載されている(該国際出願も参考として本明細書に合体させる)。メチルナルトレキソンの凍結乾燥製剤は、米国特許出願第11/899,724号に記載されており、メチルナルトレキソンを含有する粒子を含む製剤は、米国特許第6,419,959号に記載されている;これらの出願および特許の各々は、参考として本明細書に合体させる。メチルナルトレキソンの経皮伝達に適する製剤は、国際特許公開公報第2007/41544号に記載されている(該国際出願も参考として本明細書に合体させる)。
【0056】
1つの実施態様においては、本発明の化合物は、化合物の連続投与処方を対象者に提供する投与処方、例えば、オピオイド拮抗薬の最低血漿レベルを維持する、好ましくは、通常の処方による薬物レベルの乱高下(spikes and troughs)を排除する処方で投与する。適切には、連続投与は、上記化合物を、原則毎日または原則制御放出でもって、本明細書において開示しているいずれかの伝達方法によって対象者に投与することによって達成し得る。1つの実施態様においては、連続投与は、対象者への連続注入を使用して、或いは経時的な化合物の放出を容易にするメカニズム、例えば、経皮パッチによってまたは持続放出製剤によって達成し得る。適切には、本発明の化合物は、対象者に、リトナビルのようなプロテアーゼ阻害薬による治療によって誘発された嘔気、嘔吐および他の有害胃腸作用を抑制または軽減するのに有効な対象者血漿中化合物濃度を維持するに十分な量で連続放出させる。
【0057】
本発明に従う化合物は、単独投与または他の治療薬との併用投与のいずれであれ、抗嘔気および抗嘔吐有効量で投与する。しかしながら、本発明の化合物および組成物の総投与量は、担当医によって、健全な医学的判断の範囲内で決定されるであろうことを理解されたい。いずれかの特定の患者に対する特定の治療有効量レベルは、治療する障害および障害の重篤度;使用する特定の化合物の活性;使用する特定の組成物;患者の年齢、体重、総体的健康、性別および食餌;投与時間;投与経路;使用する特定の化合物の排出速度;治療期間;使用する特定の化合物と併用しているまたは同時使用している薬物;および、医療技術において周知の同様な要因のような種々の要因に依存する。例えば、1つの方法は、化合物の投与量を所望の知慮効果を達成するのに必要なレベルよりも低いレベルで出発し、投与量を所望の効果が得られるまで次第に増大させることである。
【0058】
必要に応じて、有効投与日量は、投与目的において、複数投与量に分割し得る。従って、単回投与組成物は、投与日量を構成するそのような量またはその約量を含有し得る。当業者であれば、良好な医療行為および個々の患者の臨床症状によって決定するような有効投与量および併用投与処方(本明細書において説明しているような)を容易に最適化し得るであろう。
【0059】
一般に、上記オピオイド拮抗薬、とりわけ、末梢拮抗薬の経口投与量は、1日当り約0.01〜約80mg/kg体重の範囲である。1〜20mg/kg体重の範囲内の経口投与量によって所望の結果が得られるものと期待される。一般に、静脈内および皮下投与のような非経口投与は、約0.001〜5mg/kg体重の範囲である。0.05〜0.5mg/kg体重の範囲の投与量によって所望の結果が得られるものと期待される。投与量は、投与方式に応じて、局所または全身の所望の薬物量を達成するように適切に調整し得る。例えば、腸溶性コーティーング製剤中のオピオイド拮抗薬の経口投与における投与量は非コーティーング経口投与量の10〜30%であると予想される。患者の応答がそのような投与量では不十分である場合には、幾分高めの投与量(または、効果的には、異なるより局在的な伝達経路による30%よりも高い投与量)を、患者耐容性が許容する範囲内で使用し得る。1日当りの複数回投与は、化合物の適切な全身レベルを達成するために意図する。適切なシステムレベルは、例えば、当業者にとって既知の一般的HPLC法を使用しての患者の血漿薬物レベルを測定することによって判定することができる。
【0060】
本発明の例証した実施態様においては、オピオイド拮抗薬は、抗レトロウイルス剤、例えば、リトナビルまたは抗レトロウイルス剤の組合せと併用投与する。用語“併用投与”とは、2以上の薬剤を患者または対象者に投与する任意の投与経路による併用治療を称することを意味する。また、複数の薬剤の併用投与は、併用療法または併用治療と称し得る。これらの薬剤は、同じ投与製剤または別々の製剤中に存在し得る。2以上の活性剤による併用治療においては、これらの活性剤が別々の投与製剤中に存在する場合、これらの活性剤は同時に投与してもよく、或いはこれらの活性剤は、時間差により別々に投与してもよい。これらの薬剤は、これらの薬剤を、両薬剤が体内で有効な濃度を達成するのを可能にする十分な形で投与する限りにおいて、同時にまたは連続して投与し得る(例えば、1つの薬剤は他の薬剤の投与の直後に続き得、或いは、これらの薬剤はバラバラに投与し得る、例えば、1つの薬剤をある時点で投与し、その後、他の薬剤を後の時点で、例えば、1週間内に投与してもよい)。また、これらの薬剤は、異なる経路によっても投与し得る、例えば、1つの薬剤は静脈内投与し、一方、第2の薬剤は筋肉内、静脈内または経口投与する。換言すれば、本発明に従うオピオイド拮抗薬化合物の、例えば、リトナビルまたはリトナビルと1種以上の他のプロテアーゼ阻害薬の組合せとの併用投与は、適切には、オピオイド拮抗薬と、プロテアーゼ阻害薬、例えば、リトナビルまたはリトナビルと他のプロテアーゼ阻害薬とのようなプロテアーゼ阻害薬の組合せとを含有する併用製薬製剤であって、その製剤が末梢オピオイド拮抗薬の原則毎日または断続での投与に、また、プロテアーゼ阻害薬、例えば、リトナビルの原則毎日または断続での投与に適応化されているものと考えられる。従って、オピオイド拮抗薬は、プロテアーゼ阻害薬、例えば、リトナビルの投与の前、同時または後に投与し得る。例証した実施態様においては、とりわけ適切なのは、リトナビルの投与前のオピオイド拮抗薬の投与である。
【0061】
また、併用投与可能な薬剤は、例えば、単一製剤または単一錠剤におけるような混合物として製剤化し得る。これらの製剤は、例えば、米国特許第6,277,384号;第6,261,599号、第5,958,452号;およびPCT公開公報WO 98/25613号に記載されている製剤のように、非経口または経口であり得る;これらの米国特許等の各々は、参考として本明細書に合体させる。
【0062】
本発明を以下の実施例によりさらに説明するが、これらの実施例は、本発明の範囲を限定するものと解釈すべきではない。
(実施例)
【0063】
実施例1 嘔気のための動物モデル
ラットは、異食症として知られている、カオリン(クレーの1種)のような非栄養物質の摂取増大として現れる摂食習慣の変化による嘔吐刺激に反応する(Mitchell等、 1976年;Takeda等、1993年;Takeda等、1995年)。本発明者は、カオリン摂取量を嘔気の尺度として実験動物において定量し、薬物誘発異食摂取が選択した薬剤によって軽減され得ることを観察した(Aung等、2003年;Aung等、2005年)。
本明細書において説明する実験プロトコールは、シカゴ大学のInstitutional Animal Care and Use Committee即ちIACUCによって承認された。
【0064】
実施例2 生体内試験
体重150〜300gの成獣雄ラット(インディアナ州インディアナポリスのHarlan Sprague Dawley社)を使用した。動物全てを、標準の隔離ケージ(45cm×35cm×25cm)内に、12時間明/12時間暗サイクルによる環境的に制御された条件において囲った。各ラットは、試験の全体に亘って連続して利用可能な別々の容器に入れた水、標準ラット飼料(ウィスコンシン州マジソンのHarlan-Teklad社)およびカオリン(下記参照)に自由に接触可能にした。
観測開始(0日)の前に、3日間の順応期間があった。
【0065】
カオリンの調製
カオリンペレットを、以前に開示された方法に基づいて製造した(Mitchell等、 1976年;Takeda等、1995年)。要するに、99gの薬理学級カオリン(即ち、水和ケイ酸アルミニウム;ニュージャージー州フェアローンのFisher社)を1gのアカシア(Fisher社)と、即ち、99:1の比で、蒸留水と一緒に混合して濃厚ペーストを調製した。カオリンペーストをステンレススチールトレー上で圧延し、正規のラット飼料ペレットと同様な形状およびサイズの切片に切断した。ペレットをスチールトレー上に置き、室温で72時間完全に乾燥させた。
【0066】
異食行動(カオリン摂取)の測定
リトナビルが使用したプロテアーゼ阻害薬であり、ラットを4群に分割した。4群、即ち、ビヒクル+ビヒクル、ビヒクル+リトナビル、ナロキソン+リトナビル、およびメチルナルトレキソン+リトナビルの各群において6〜7匹のラットが存在していた。ラットは、リトナビル、20mg/kg (イリノイ州ノースシカゴのAbbott Laboratories社)を、二日連続の朝(0時および24時)、強制飼養(gavage)チューブによって経口により受けた(Denissen等、1997年;Yamaji等、1999年;Shibata等、2002年)。ビヒクル、ナロキソン0.1mg/kgもしくは0.3mg/kg (ミズーリ州セントルイスのSigma社)、またはメチルナルトレキソン0.3mg/kg、1.0mg/kgもしくは3.0mg/kg (ミズーリ州セントルイスのMallinckrodt Chemicals社)の事前処置は、20mg/kgのリトナビル投与の30分前に、腹腔内投与した(Aung等、2003年)。各ラットは、15分、2時間およびその後毎日、試験薬投与後の情動不安、呼吸困難または下痢のような苦痛徴候について直接観察した。
【0067】
試驗中、カオリンおよび飼料ペレットを直近0.1gまで秤量し、前日からの残存カオリンと飼料を集めた後、毎朝同時に容器内で取り換えた。カオリンと飼料の摂取を5日間24時間毎に測定した。カオリンおよび飼料ペレットを直近0.1gまで秤量し、ケ−ジ内の容器に毎朝入れた。前日からの残存カオリンと飼料を集め、72時間乾燥させ、秤量した。毎日のカオリンと飼料の摂取を、最初のリトナビル治療後の5日間測定した。
【0068】
血液サンプル採取
ある試験において、血液サンプルを、血漿ナルトレキソンレベル、即ち、メチルナルトレキソンの可能性ある脱メチル化の指標を測定するために採取した(Kotake等、1989年)。ラットを拘束し、尾静脈を露出させた。尾を温水に浸して血管の拡張を助けた。小さなゴムバンドを尾の基部の周りに置いた。血液サンプルは、静脈内に入れた小ニードルのハブ中に挿入したミクロヘマトクリットチューブを使用して採取した。血液サンプルは、メチルナルトレキソンの最初の投与後0分、10分、20分、30分、60分、90分または120分で採取した。
【0069】
ナルトレキソンおよびメチルナルトレキソン濃度の測定
血漿ナルトレキソンおよびメチルナルトレキソンレベルを、以前に報告された方法から適応化した高性能液体クロマトグラフィー(HPLC)により測定した(Osinski等、2002年)。ナルトレキソンとメチルナルトレキソンは、固相抽出(SPE)法により、血漿から分離した。水に希釈した血漿サンプル(100〜200μl)を、n-プロパノールと水で状態調節しているSPEカラム(Varian CBAカラム、100mg;カリフォルニア州ハーバーシティー)に通した。分析物を、カラムから、2:1の割合で調製したn-プロパノールと水溶液中のトリフルオロ酢酸(25mM)との混合物によって溶出させた。溶出液を、55℃の窒素流中で蒸発乾固させた。残留物を移動相中で再構成し、ナイロンHPCLシリンジフィルターにより濾過し、分析に供した。HPLC分析においては、電気化学検出器が、電気活性化合物の自動化分析クロマトグラフィーにおいて高感度を有している。HPLCシステム(Shimadzu Corporation社;日本国京都)および電気化学検出器(ESA Coulochem社、モデル5100A;マサチューセッツ州チェルムスフォード)は、LC-10ADポンプ、SCL-10Aシステムコントローラー、およびサンプル冷却器を備えたSIL-10Aオートインジェクターからなっていた。電気化学検出器は、以下の設定で稼動した:検出器1、+360mV;検出2、+600mV;ガードセル(guard cell)、+650mV。データは、EZChrom 2-2 HPLCソフトウェアを使用して収集した。移動相においては、リン酸ナトリウム 30mM、酢酸ナトリウム 20mM、メタノール6%、テトラヒドロフラン1%、pH 4.2を使用した。システムは、5〜100ng/mLの範囲で毎日較正した。血漿サンプルにおける実用検出限界は、約2ng/mL (100pg/注入)であった。
【0070】
統計分析
データは、平均±標準誤差(S.E.)で表した。濃度曲線下の領域(AUC)を算出した。データは、2つの因子としての群および時間による二元分散分析(ANOVA)を使用して分析した。統計的有意性は、P < 0.05であるとみなした。
上記試験の結果を、以下に説明する。
【0071】
リトナビル誘発性嘔気および嘔吐に対するナロキソンの効果
塩水処置したラットにおいては、1.0g未満のカオリンが連続5日において毎日摂取されていた。10または20mg/kgの経口リトナビルの投与後、カオリン摂取は、24時間〜48時間で投与量関連の形で有意に増加した(図2;P < 0.01)。30mg/kgにおいては、カオリン摂取はさらには増加していないが、高投与量での毒性作用の可能性を示唆しており、このことは、飼料摂取の低下によって裏付けされている。この試験において使用したリトナビル投与量は、20mg/kgであった。
図3は、カオリン摂取におけるリトナビル誘発増加が、ナロキソンによる0.1または0.3mg/kgの事前処置によって緩和されていることを示している(P < 0.01)。時間0から120時間までのカオリン摂取における曲線下領域(AUC)は、以下のとおりであった:ビヒクル+ビヒクル、87±8.1g・hr;0.3mg/kgナロキソン+ビヒクル、86±9.2g・hr;ビヒクル+リトナビル、351±18.2g・hr;0.1mg/kgナロキソン+リトナビル、264±16.7g・hr;および、0.3mg/kgナロキソン+リトナビル、205±11.3g・hr (図4)。ナロキソンは、リトナビルによって誘発されたカオリン摂取を有意に低下させていた(ビヒクルに比較してP < 0.01)。ナロキソン(0.3mg/kg)単独は、カオリン摂取に有意には影響していなかった。
【0072】
リトナビル誘発性嘔気および嘔吐に対するメチルナルトレキソンの効果
リトナビル後のカオリン摂取に対するメチルナルトレキソンによる事前処置の効果を図5に示している。リトナビルにより誘発されたカオリン摂取は、メチルナルトレキソンによって投与量依存の形で緩和されている(P < 0.01)。時間0から120時間までのカオリン摂取におけるAUCは、以下のとおりであった:ビヒクル+ビヒクル、92±8.6g・hr;ビヒクル+リトナビル、360±15.7g・hr;メチルナルトレキソン(0.3mg/kg)+リトナビル、302±13.2g・hr;メチルナルトレキソン(1.0mg/kg)+リトナビル、242±14.9g・hr;および、メチルナルトレキソン(3.0mg/kg)+リトナビル、168±11.5g・hr(図6)。
メチルナルトレキソン(3.0mg/kg)単独によっては、カオリン摂取は、有意には影響を受けてなかった。全ての試験群において、飼料摂取は有意には影響を受けてなかった。
【0073】
ナルトレキソンのHPLC分析
メチルナルトレキソン(3.0mg/kg)に関連しての検出可能なナルトレキソンは見出せなかった。対照的に、メチルナルトレキソンレベルは、その投与後に検出された。クロマトグラムを図7に示している。しかしながら、全ての測定時点において、ナルトレキソン量は、(B)および(C)において示すように検出されなかった。
要するに、本発明は、抗レトロウイルス剤、例えば、プロテアーゼ阻害薬によって誘発された嘔気および嘔吐のような薬物誘発性胃腸副作用を、オピオイド拮抗薬、とりわけ、メチルナルトレキソンのような末梢抑制性オピオイド拮抗薬を使用して治療する方法を提供する。
【0074】
今回、本発明を種々の特定の実施態様および方法に関連して説明してきた。しかしながら、多くの変更および修正を本発明の精神および範囲内に留まりながらなし得ることを理解すべきである。
全ての刊行物、特許および特許出願は、各々の個々の刊行物、特許または特許出願が詳細に且つ個々に参考として示されているのとあたかも同じ範囲内で、本明細書に参考として明確に合体させる。本開示と合体させた特許、刊行物および文献との間で不一致がある場合、本開示が支配すべきである。
【0075】
参考文献



【発明の詳細な説明】
【0001】
(関連出願との相互参照)
本出願は、2007年12月5日に出願された米国仮出願第60/992,555号の権利を主張する;該出願の内容は、その全体を参考として本明細書に合体させる。
(序文)
ヒト免疫不全ウイルス(HIV)による感染症は、後天性免疫不全症候群(AIDS)に進行し得、世界的に何百万という人々に影響を与えている致死的な疾患である(SandeおよびVolberding、1999年;Selgelid、2005年)。患者がタイミング良く治療を受けなかった場合、その疾患は、免疫機能障害および日和見感染のために、病的状態となり死亡に至り得る。ウイルス量を減じ且つ平均余命を改善するために、治療ガイドラインは、患者が多くの場合複雑な薬物療法に長期間従うことを求めている(Proctor等、1999年;Bartlett、2004年)。そのようなコンプライアンス(応諾または順守)に対する主な障害は、治療誘発性副作用である。副作用は、生活の質を損なうのみならず、コンプライアンスに負のインパクトを与える(Carr、2002年)。嘔気および嘔吐は、コンプライアンスに影響を与え得る薬物誘発性副作用の例である(Gartland、2001年;Lichterfeld等、2002年;Barlett、2004年)。そのような副作用は、薬物の有用性を多くの場合制限し、薬物の使用を受入れ難いものにさえし得る。
【0002】
数多くの抗嘔気および抗嘔吐組成物が存在しているが、これらの組成物は、多くの場合、それら組成物独自の望ましくない患者副作用を発生させている。その結果は、多くの場合、患者が、彼女または彼が緩和することを求めている症状と治療の副作用間で選択する状況におかれていることである。望ましいのは、副作用を殆ど有さず且つ治療薬の使用を可能にして症状または疾病を有効に治療する有効な抗嘔気および抗嘔吐製剤を有することである。
【0003】
(発明の概要)
当該原理、即ち、本発明を使用する方法は、ウイルス感染症、とりわけ、レトロウイルス感染症、例えば、HIVの治療におけるある種の薬物、とりわけ、抗レトロウイルス薬の投与に関連する胃腸副作用を緩和することを含む。例えば、HIVを治療するのに使用されている種々の抗レトロウイルス薬群の中には、プロテアーゼ阻害薬が存在する。プロテアーゼ阻害薬は、嘔気および嘔吐のような有害な胃腸副作用を誘発させる(ElperinおよびSax、1996年)。詳細には、本発明によれば、プロテアーゼ阻害薬のような抗レトロウイルス剤を使用しての、例えば、HIVのようなレトロウイルス感染症の治療に関連する作用のような、嘔気、嘔吐および他の有害胃腸作用を、限定するものではないが、末梢抑制性オピオイド拮抗薬、例えば、メチルナルトレキソンのようなオピオイド拮抗薬を投与することによって緩和する、例えば、軽減する、抑制する、弱化するまたは低減する方法を提供する。
【0004】
1つの実施態様においては、本発明は、抗レトロウイルス剤、とりわけプロテアーゼ阻害薬およびオピオイド拮抗薬を併用投与することによる胃腸障害の治療方法を提供する。具体的な実施態様においては、HIVのリトナビルによる治療によって誘発された嘔気および嘔吐を、末梢オピオイド拮抗薬メチルナルトレキソンのようなオピオイド拮抗薬を投与することによって緩和する。
本発明に従う方法において使用するオピオイド拮抗薬としては、一般に、数種の化合物群に属する複素環アミン化合物がある。例えば、1つの適切な群は、モルフィナンの第三級誘導体類、とりわけ、ノルオキシモルホンの第三級誘導体類である。1つの実施態様においては、ノルオキシモルホンの第三級誘導体は、例えば、ナロキソンまたはナルトレキソンである。
【0005】
ある種の実施態様においては、オピオイド拮抗薬は、末梢オピオイド拮抗薬である。適切な末梢オピオイド拮抗薬は、一般に、数種の化合物群に属する複素環アミン化合物である。例えば、1つの適切な群は、モルフィナンの第四級誘導体類、とりわけ、ノルオキシモルホンの第四級誘導体類である。1つの実施態様においては、ノルオキシモルホンの第四級誘導体は、例えば、N-メチルナルトレキソン(または、簡単にメチルナルトレキソン)、N-メチルナロキソン、N-メチルナロルフィン、N-ジアリルノルモルヒネ、N-アリルレバロルファンまたはN-メチルナルメフェンである。もう1つの群は、N置換ピペリジン類である。1つの実施態様においては、N-ピペリジンは、例えば、アルビモパンのようなピペリジン-N-アルキルカルボニレート(alkylcarbonylate)である。本発明の方法において価値のあり得るさらにもう1つの化合物群は、ベンゾモルファンの第四級誘導体類である。
【0006】
本発明のある種の実施態様においては、オピオイド拮抗薬は、μ-オピオイド拮抗薬であり得る。他の実施態様においては、オピオイド拮抗薬は、κ-オピオイド拮抗薬であり得る。また、本発明は、μ-拮抗薬類の組合せ、κ-拮抗薬の組合せ、並びにμ-およびκ-拮抗薬の組合せ、例えば、メチルナルトレキソンとアルビモパンの組合せまたはナルトレキソンとメチルナルトレキソンの組合せのような、2種以上のオピオイド拮抗薬の投与にも及ぶ。
【0007】
本発明は、添付図面と関連して本明細書に示す特定の実施態様の詳細な説明を参照することによってより一層良好に理解し認識し得るであろう。
【図面の簡単な説明】
【0008】
【図1】ナルトレキソンおよびメチルナルトレキソンの化学構造、並びにナルトレキソンのメチルナルトレキソンへの変換反応を示す。
【図2】ラットにおけるカオリン摂取に対するリトナビルによる治療の投与量関連効果を示すグラフである。
【図3】ラットにおけるリトナビルによって誘発されたカオリン摂取に対するナロキソンによる事前治療の投与量関連効果を示すグラフである。(NLX = ナロキソン;RIT = リトナビル)。
【図4】ナルトレキソン治療対対照(無治療)を比較する、時間0から120時間までのカオリン摂取における曲線下領域(AUC)のグラフである。
【図5】ラットにおけるリトナビルによって誘発されたカオリン摂取に対するメチルナルトレキソンによる事前治療の投与量関連効果のグラフである。(MNTX = メチルナロキソン;RIT = リトナビル)。
【図6】メチルナルトレキソン治療対対照(無治療)を比較する、時間0から120時間までのカオリン摂取における曲線下領域(AUC)のグラフである。
【図7】血漿サンプル中のメチルナルトレキソンとナルトレキソンのHPLCクロマトグラムを示し、図中、(A)は、メチルナルトレキソンとナルトレキソンの標準血漿抽出物のクロマトグラムであり;(B)は、投与後に検出したメチルナルトレキソンの高濃度を示すクロマトグラムであり:(C)は、投与後120分でのメチルナルトレキソンレベルを示すクロマトグラムである。(MNTX = メチルナルトレキソン;NTX = ナルトレキソン)。
【0009】
(詳細な説明)
本発明は、抗レトロウイルス剤、とりわけ、リトナビルのようなプロテアーゼ阻害薬とオピオイド拮抗薬との組合せを使用する組成物および方法を提供する。本発明に従う方法は、例えば、プロテアーゼ阻害薬によりHIVの治療に関連する胃腸有害副作用を治療することを含む。下記の実施例において説明しているように、リトナビルとメチルナルトレキソン(MNTX)のようなオピオイド拮抗薬との併用は、予期に反して、リトナビルの胃腸副作用を治療した。
【0010】
本発明の少なくとも1つの実施態様を説明する前に、本発明は、その応用において、実施例において例示しているような以下の説明において示す詳細に限定するものではないことを理解すべきである。そのような説明および実施例によって、特許請求の範囲に示す本発明の範囲を限定するつもりはない。本発明は、他の実施態様も可能であり、或いは種々の方法で実行または実施し得る。下記の詳細な説明は、薬物としてリトナビルを使用する実施態様を参照して本発明を説明しているが、嘔気および他の胃腸作用が有害な副作用である他のプロテアーゼ阻害薬またはそれらの組合せも本発明の原理に従って使用するのに適切であり得ることを理解すべきである。
【0011】
さらに、本明細書において引用したあらゆる特許または特許文献のようなあらゆる文献が従来技術を構成することを容認するものではない。とりわけ、特に断らない限り、本明細書における如何なる文献への参照もこれらの文献のいずれかが米国またはどこか他の国における共通の一般的知識の1部を構成しているという容認を構成しているものではないことを理解すべきである。文献についての議論はいずれもそれら文献の著者が主張していることを説明しているのであり、出願人は、本明細書において引用したいずれの文献の正確性および適切性を問題にする権利を留保する。
【0012】
本開示の全体に亘って、本発明の種々の局面を範囲方式で提示し得る。範囲方式での説明は単に便宜および簡素化のためであると理解すべきであり、本発明の範囲に対する柔軟性のない限定と解釈すべきではない。従って、当業者であれば理解しているように、あらゆる目的において、とりわけ、明細を提示する点において、本明細書において開示する全ての範囲は、あらゆる可能性のある下位範囲、それら下位範囲の組合せ、並びにその範囲内の全ての整数値および分数値も包含する。1つの例としては、20%〜40%の範囲は、20%〜32.5%と32.5%〜40%、20%〜27.5%と27.5%〜40%等の範囲に分解し得る。さらに、記載した範囲は、いずれも、その範囲を少なくとも等分の半分、3分の1、4分の1、5分の1、10分の1等に分解することを十分に説明し且つ可能であるものとして容易に認識し得るであろう。非限定的な例としては、本明細書において記載した範囲は、下位の3分の1、中位の3分の1、および上位の3分の1等に容易に分解し得る。また、当業者であれば理解しているように、“まで(up to)”、“少なくとも(at least)”、“よりも大きい(greater than)”、“よりも少ない(less than)”“よりも多い(more than)”等の全ての用語は、掲げた数を含み、上述したように、下位範囲に実質的に分解し得る範囲を称する。同様に、本明細書において開示する全ての比率も、その広い比率内に属する全ての下位比率を包含する。これらは、具体的に意図することの単なる例である。さらにまた、第1の指示数と第2の指示数との“間の範囲”および第1の指示数から第2の指示数“まで”の“範囲”なる用語は、本明細書においては互換的に使用する。
【0013】
また、本明細書における“含む(comprising)”、“含む(including)”、“有する(having)”およびこれらの変化形の使用は、その後に記載する細目およびそれらの等価物並びに追加の細目を包含することを意味し、例えば、最終結果に影響を与えない他の工程、成分および要素は付加し得る。また、これらの用語は、“からなる”および“本質的にからなる”なる用語にも及ぶ。“本質的にからなる”の使用は、上記組成物または方法がさらなる成分および/または工程を含み得るが、そのさらなる成分および/または工程が特許請求する組成物または方法の基本的および新規な特徴を実質的に変えない場合のみであることを意味する。
【0014】
特に定義しない限り、全ての科学および技術用語は、本明細書においては、通常の用法に従って使用し、本発明が属する技術における通常の熟練者が一般的に理解しているのと同じ意味を有する。しかしながら、本明細書において使用するとき、下記の定義は、上記熟練者が本発明を理解する助けにおいて有用であり得る:
“対象者”は、哺乳類、例えば、ヒト、マウス、イヌ、ネコ、ラットを称する。
“アルキル”は、飽和であり且つ直鎖、枝分れまたは環状であり得、鎖内に1〜約10個の炭素原子を有する1価の脂肪族炭化水素基、並びにそれらの鎖の全ての組合せおよび下位組合せを称する。典型的なアルキル基としては、限定するものではないが、メチル、エチル、n-プロピル、イソプロピル、ブチル、イソブチル、sec-ブチル、tert-ブチル、ペンチル、シクロプロピル、シクロブチル、シクロペンチルおよびシクロヘキシルがある。
“低級アルキル”は、1〜約6個の炭素原子を有するアルキル基を称する。
【0015】
“アルケニル”は、少なくとも1個の炭素-炭素二重結合を含有し且つ鎖内に2〜約10個の炭素原子を有する1価の脂肪族炭化水素基、並びにそれらの鎖の全ての組合せおよび下位組合せを称する。典型的なアルケニル基としては、限定するものではないが、ビニル、プロペニル、ブテニル、ペンテニル、ヘキセニルおよびヘプテニルがある。
“アルキニル”は、少なくとも1個の炭素-炭素三重結合を含有し且つ鎖内に2〜約10個の炭素原子を有する1価の脂肪族炭化水素基、並びにそれらの鎖の組合せおよび下位組合せを称する。典型的なアルキニル基としては、限定するものではないが、エチニル、プロピニル、ブチニル、ペンチニル、ヘキシニルおよびヘプチニルがある。
【0016】
“アルキレン”は、1〜6個の炭素原子を含有する2価の脂肪族炭化水素基、例えば、-CH2-(メチレン)、並びにそれらの鎖の全ての組合せおよび下位組合せを称する。アルキレン基は、直鎖、枝分れまたは環状であり得る。必要に応じて、アルキレン基に沿って1個以上の酸素原子、イオウ原子または必要に応じて置換した窒素原子を装入することができ、窒素置換基は、上述したようなアルキル基を有する。
“アルケニレン”は、少なくとも1個の炭素-炭素二重結合を含有し、直鎖、枝分れまたは環状であり得る2価のアルキレン基を称する。典型的なアルケニレン基としては、限定するものではないが、エテニレン(-CH=CH-)およびプロペニレン(-CH=CHCH2-)がある。
【0017】
“シクロアルキル”は、約3〜約10個の炭素を有する飽和の単環式または二環式炭化水素環、並びにそれらの環の全ての組合せおよび下位組合せを称する。シクロアルキル基は、必要に応じて、1個以上のシクロアルキル基置換基によって置換し得る。典型的なシクロアルキル基としては、限定するものではないが、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシルおよびシクロヘプチルがある。
“アシル”は、アルキルが上述したとおりであるアルキル-CO基を意味する。典型的なアシル基としては、限定するものではないが、アセチル、プロパノイル、2-メチルプロパノイル、ブタノイルおよびパルミトイルがある。
【0018】
“アリール”は、約6〜約10個の炭素を含有する芳香族炭素環基、並びにそれらの環の全ての組合せおよび下位組合せを称する。アリール基は、必要に応じて、1個もしくは2個またはそれ以上のアリール基置換基によって置換し得る。典型的なアリール基としては、限定するものではないが、フェニルおよびナフチルがある。
“アリール置換アルキル”は、必要に応じて置換されたアリール基、好ましくは必要に応じて置換されたフェニル環によって末端炭素において置換された線状アルキル基、好ましくは低級アルキル基を称する。典型的なアリール置換アルキル基としては、例えば、フェニルメチル、フェニルエチル、および3(4-メチルフェニル)プロピルがある。
【0019】
“複素環”は、約4〜約10員を含有する単環式または多環式環系の炭素環基、並びにこれらの環の全ての組合せおよび下位組合せを称し、環の1以上の員が炭素以外の元素、例えば、窒素、酸素またはイオウである。複素環基は、芳香族または非芳香族であり得る。典型的な複素環基としては、例えば、ピロールおよびピペリジン基がある。
“ハロ”は、フルオロ、クロロ、ブロモまたはヨードを称する。
【0020】
オピオイド拮抗薬に関しての“末梢”とは、中枢神経系外部の生理系および成分に主として作用するオピオイド拮抗薬を称する。換言すれば、これらのオピオイド拮抗薬は、減少した中枢神経系(CNS)活性を示すか或いは中枢神経系活性を実質的に示さない。例えば、これらのオピオイド拮抗薬は、オピオイドの中枢作用を抑制する有効量では血液脳関門を容易には通過しない、即ち、これらのオピオイド拮抗薬は、末梢に投与したとき、オピオイドの鎮痛効果を有効には抑制しない、即ち、これらのオピオイド拮抗薬は、オピオイドの鎮痛効果を低下させない。本発明の方法において使用する末梢オピオイド拮抗薬化合物は、CNS中では約5〜15%よりも低い薬理活性を適切に示す;約0%CNS活性(即ち、無活性)が最も適している。末梢オピオイド拮抗薬の非中枢作用特性は、多くの場合、その分子または種の電荷、極性および/またはサイズに関連している。例えば、本明細書において説明するような末梢作用性第四級アミンオピオイド拮抗薬は正帯電しており、一方、中枢作用性第三級アミンオピオイド拮抗薬は中性分子である。本発明において有用な末梢オピオイド拮抗薬は、典型的に、μ-およびκ-オピオイド拮抗薬である。
【0021】
用語“製薬上許容し得る”または“薬理学上許容し得る”とは、ヒトのような対象者に投与したときに、有害な、アレルギー性のまたは他の厄介な反応を発生させない分子存在物または組成物に言及することを意味する。本発明に従うオピオイド拮抗薬は、遊離塩基として、中性でまたは塩形で製剤化し得る。“製薬上許容し得る塩”とは、製薬上許容し得且つ親化合物の所望の薬理活性を有している塩を称する。そのような塩は、治療用途において許容し得る性質を有する本発明に従う化合物の無毒性の通常の塩および第四級アンモニウム塩である。そのような塩は、例えば、無機または有機の塩基または酸から調製し得る。例えば、酸付加塩としては、酢酸塩、アスコルビン酸塩、安息香酸塩、重硫酸塩、塩化物、クエン酸塩、乳酸塩、マレイン酸塩、シュウ酸塩、スルホン酸塩、酒石酸塩等があり得る。塩基塩としては、カリウムおよびナトリウム塩のようなアルカリ金属塩、カルシウムおよびマグネシウム塩のようなアルカリ土類金属、並びにエタノールアミン、ジエタノールアミン、トリエタノールアミン、N-メチルグルカミン等のような有機塩基とのアンモニウム塩があり得る。さらに、塩基性窒素含有基は、低級アルキルハロゲン化物、例えば、メチル、エチル、プロピルおよびブチルの塩化物、臭化物およびヨウ化物、並びに長鎖ハロゲン化物および硫酸ジアルキルまたはジアミルのような薬剤によって第四級化し得る。文脈上そうでないことを明白に指摘しない限り、本明細書において使用するときの“本発明の化合物(compounds of the invention)”、“本発明の化合物(a compound of the invention)”または“本発明に従う化合物”のような用語は、関連化合物の化学的に生成可能な製薬上許容し得る塩を包含するものとする。適切な製薬上許容し得る塩についてのさらなる情報は、Remington: The Science and Practice of Pharmacy, 21st ed., Lippincott Williams and Wilkens, Philadelphia, PAにおいて見出し得る;該文献は、参考として本明細書に合体させる。
【0022】
本明細書において使用する用語“治療する”または“治療”は、症状の予防、治療、緩和;症状の減退、軽減または低減;および、症状の進行の抑制または阻止のような病状または病態のあらゆる管理手段を包含する。
本明細書において使用するとき、用語“副作用”は、対象者に投与したときの薬物の目的または所望の作用以外の作用を言及することを意味する。副作用は、有益で或いは望ましくなく、即ち、有害であり得る。本発明の場合、望ましくない作用は、多くの場合、リトナビルのような抗レトロウイルス剤の投与後に生じる。そのような副作用としては、嘔気、嘔吐、下痢および腹痛のような胃腸副作用がある。
本明細書において使用するとき、用語“有効性”は、レトロウイルス感染症、例えば、HIVをそのような感染症に罹患している対象者において治療する抗レトロウイルス剤の能力または効力を言及することを意味する。また、有効性は、所定の強度の特定の効果を発生させるのに必要とする薬物の投与量として表すこともできる。
【0023】
本発明の方法の以下の説明においては、処理工程は、特に断らない限り、室温および大気圧下に実施する。
本発明によれば、レトロウイルスによる感染症、主としてHIVを治療するのにとりわけ重要な抗レトロウイルス剤は、プロテアーゼ阻害薬である。プロテアーゼ(ペプチダーゼとしても知られている)は、タンパク質を特定のペプチド結合において開裂させる酵素である。多くの生物学的機能は、プロテアーゼおよびその相補的プロテアーゼ阻害薬が制御または介在する。
【0024】
レトロウイルスのゲノムは、polおよびgag遺伝子産生物のような1種以上のポリタンパク質プレカーサーのタンパク質分解プロセッシングに関与するプロテアーゼをコード化している。(Wellink, Arch. Virol. 98 1 (1988)を参照されたい)。レトロウイルスプロテアーゼは、最も一般的には、gagプレカーサーをコアタンパク質中にプロセッシングし、さらにまた、polプレカーサーを逆転写酵素およびレトロウイルスプロテアーゼ中にプロセッシングする。これらのプレカーサーポリタンパク質のレトロウイルスプロテアーゼによる正確なプロセッシングが、新たな感染性ビリオンの集合にとっては必要である。プロテアーゼ欠落ウイルスを産生する生体外突然変異生成が、感染性を欠如する未成熟コア形の産生をもたらすことは証明されている。(Crawford, J. Virol. 53 899 (1985);Katoh, et al., Virology 145 280 (1985)を参照されたい)。従って、レトロウイルスプロテアーゼ阻害は、抗ウイルス治療において魅力的なターゲットを提供する。(Mitsuya, Nature 325 775 (1987)を参照されたい)。
【0025】
数種のプロテアーゼ阻害薬を、有効な抗レトロウイルス剤として使用する;しかしながら、これらの薬剤は、数種の有害作用、とりわけ、胃腸副作用を発生させる。治療プロトコールのコンプライアンスはHIVおよびAIDS患者における有効な抗ウイルス治療のための前提条件であるので、薬物誘発性副作用はは、コンプライアンスを妨げ得る。今日まで、プロテアーゼ阻害薬が胃腸作用、例えば、嘔気および/または嘔吐を発生させるメカニズムは研究されていない。抗嘔気剤の使用は嘔気および嘔吐を軽減するのに幾分か有効であるが、これらの有害な胃腸作用は、プロテアーゼ阻害薬治療プロトコールにおいては問題のままである。
【0026】
プロテアーゼ阻害薬は、ペプチド性および非ペプチド性として分類されている。ペプチド性プロテアーゼ阻害薬としては、アンプレナビル、アタザナビル、ホスアンプレナビル(活性アンプレナビルに代謝する)、インジナビル、ロピナビル、ネルフィナビル、リトナビルおよびセクイナビルがある。非ペプチド性プロテアーゼ阻害薬としては、ダルナビルおよびチプラナビルがある。とりわけ興味あるのはリトナビルであり、このものは、単独で強力なプロテアーゼ阻害薬であり、さらにまた、低投与量で使用して他のプロテアーゼ阻害薬の活性を増強する、例えば、リトナビルとロピナビルの併用。リトナビルは、下記の式(A)で示されるように、トリペプチドである:
【化1】

【0027】
リトナビルは、本来、HIVプロテアーゼの阻害薬として設計されたが、他のプロテアーゼ阻害薬の有効性を増強することも見出された。とりわけ、リトナビルは、シトクロムP450-3A4 (CYP3A4)、即ち、プロテアーゼ阻害薬の代謝に関与する肝臓酵素を阻害する。リトナビルおよび/またはリトナビルによって増強された他のプロテアーゼ阻害薬によるHIVプロテアーゼの阻害は、非感染性ウイルス粒子の増大をもたらし、HIV症状の軽減を生じる。しかしながら、リトナビルの副作用は、嘔気および嘔吐である。
【0028】
後の実施例において説明するように、本発明者は、リトナビル誘発性のようなプロテアーゼ阻害薬誘発性の嘔気および嘔吐に対するオピオイドレセプター拮抗薬の効果を評価した。ナロキソン(中枢作用性オピオイド拮抗薬)およびメチルナルトレキソン(末梢作用性オピオイド拮抗薬)の双方がリトナビル誘発性嘔気および嘔吐を軽減することを見出した。
従って、本発明に従うオピオイド拮抗薬としては、中枢および末梢作用性オピオイド拮抗薬の双方がある。とりわけ価値を有する拮抗薬は、適切には、末梢抑制性オピオイド拮抗薬であることを意図している。とりわけ適切なのは、μ-オピオイド拮抗薬、とりわけ、末梢μ-オピオイド拮抗薬であり得る。
【0029】
オピオイド拮抗薬は、その拮抗薬特性を保持しながら構造的に変化し得る化合物群を構成する。これらの化合物としては、第三級および第四級モルフィナン類、とりわけ、ノルオキシモルホン誘導体;N-置換ピペリジン類、とりわけ、ピペリジン-N-アルキルカルボキシレート;並びに、第三級および第四級ベンゾモルファン類およびノルモルフィナン誘導体類、とりわけ、6-カルボキシ-ノルモルフィナン誘導体がある。第三級化合物拮抗薬は、かなり脂溶性であり、血液脳関門を容易に通過する。
【0030】
血液脳関門を通過し且つ中枢(および末梢)活性であるオピオイド拮抗薬の例としては、例えば、ナロキソン、ナルトレキソン(各々、Baxter Pharmaceutical Products社から商業的に入手可能である)、およびナルメフェン(例えば、Dupont Pharma社から入手可能)がある。一方、末梢抑制性拮抗薬は、典型的に帯電性で極性でありおよび/または高分子量を有し、そのような性質は、これら拮抗薬の血液脳関門の通過を妨げる。例えば、メチルナルトレキソンは、第三級オピオイド拮抗薬であるナルトレキソンの第四級誘導体である(図1)。メチル基をナルトレキソンに付加することにより、より高い極性およびより低い脂溶性を有する化合物が形成される。従って、メチルナルトレキソンは、血液脳関門を通過しなくて、末梢に位置するレセプターが典型的に介在する望ましくない胃腸副作用を遮断するポテンシャルを有する。
【0031】
本発明において使用するのに適する末梢オピオイド拮抗薬は、第四級モルフィナン誘導体、とりわけ、下記の式(I)の第四級ノルオキシモルフォンである化合物であり得る:
【化2】

(式中、Rは、アルキル、アルケニル、アルキニル、アリール、シクロアルキル置換アルキルまたはアリール置換アルキルであり;X-は、アニオン、とりわけ、クロリド、ブロミド、イオジドまたはメチルサルフェートアニオンである)。
式(I)のノルオキシモルホン誘導体は、例えば、米国特許第4,176,186号の手順に従って調製し得る;該特許は、参考として本明細書に合体させる。また、米国特許第4,719,215号、第4,861,781号、第5,102,887号、第5,972,954号および第6,274,591号;米国特許出願第2002/0028825号および第2003/0022909号;並びPCT公開公報WO 99/22737号およびWO 98/25613号も参照されたい;これらは、全て参考として本明細書に合体させる。
【0032】
とりわけ価値のある式(I)の化合物は、下記の式(II)で示されるような、RがシクロプロピルメチルであるN-メチルナルトレキソン(または、簡潔にメチルナルトレキソン)である:
【化3】

(式中、X-は、上述したとおりである)。
【0033】
上述したように、メチルナルトレキソンは、オピオイド拮抗薬ナルトレキソンの第四級誘導体である。メチルナルトレキソンは、塩(例えば、N-メチルナルトレキソンブロミド)として存在し、従って、用語“メチルナルトレキソン”または“MNTX”は、本明細書において使用するとき、そのような塩も包含する。従って、“メチルナルトレキソン”または“MNTX”としては、具体的には、限定するものではないが、メチルナルトレキソンのブロミド塩、クロリド塩、イオジド塩、炭酸塩および硫酸塩がある。文献においてMNTXのブロミド塩について使用している種々の名称としては、例えば、メチルナルトレキソンブロミド、N-メチルナルトレキソンブロミド、ナルトレキソンメトブロミド、ナルトレキソンメチルブロミド、SC-37359、MRZ-2663-BR,およびN-シクロプロピルメチルノルオキシ-モルヒネ-メトブロミドがある。
【0034】
メチルナルトレキソンは、例えば、ミズーリ州セントルイスのMallinckrodt Pharmaceuticals社から商業的に入手可能である。メチルナルトレキソンは、水に自由溶解性の白色結晶粉末として、典型的にはブロミド塩として提供されている。提供されたときの化合物は、逆相HPLCにより99.4%純粋であり、同じ方法による0.011%未満の第四級化されていないナルトレキソンを含有している。メチルナルトレキソンは、例えば、約5mg/mLの濃度の滅菌溶液として調製し得る。
【0035】
他の適切な末梢オピオイド拮抗薬としては、N-置換ピペリジン類、とりわけ、下記の式(III)によって示されるようなピペリジン-N-アルキルカルボキシレートがあり得る:
【化4】

(式中、R1は、水素またはアルキルであり;R2は、水素、アルキルまたはアルケニルであり;R3は、水素、アルキル、アルケニル、アリール、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキル、シクロアルケニル置換アルキルまたはアリール置換アルキルであり;R4は、水素、アルキルまたはアルケニルであり;Aは、OR5またはNR6R7であり;R5は、水素、アルキル、アルケニル、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキル、シクロアルケニル置換アルキルまたはアリール置換アルキルであり;R6は、水素またはアルキルであり;R7は、水素、アルキル、アルケニル、アリール、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキル、シクロアルケニル置換アルキルまたはアリール置換アルキル、またはアルキレン置換Bであるか、或いは、R6とR7が結合している窒素原子と一緒に、R6とR7は、ピロールまたはピペリジンから選ばれる複素環を形成しており;Bは、下記:
【化5】

(式中、R8は、水素またはアルキルであり;R9は、水素、アルキル、アルケニル、アリール、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキル、シクロアルケニル置換アルキルまたはアリール置換アルキルあるか、或いは、R8とR9が結合している窒素原子と一緒に、R8とR9は、ピロールまたはピペリジンから選ばれる複素環を形成しており;Wは、OR10、NR11R12またはOEであり;R10は、水素、アルキル、アルケニル、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキル、シクロアルケニル置換アルケニルまたはアリール置換アルキルであり;R11は、水素またはアルキルであり;R12は、水素、アルキル、アルケニル、アリール、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキル、シクロアルケニル置換アルキルまたはアリール置換アルキル、またはアルキレン置換C(=O)Yであるか、或いは、R11とR12が結合している窒素原子と一緒に、R6とR7は、ピロールまたはピペリジンから選ばれる複素環を形成しており;Eは、下記:
【化6】

、アルキレン置換(C=O)Dまたは-R13OC(=O)R14であり;R13は、アルキル置換アルキレンであり;R14は、アルキルであり;Dは、OR15またはNR16R17であり;R15は、水素、アルキル、アルケニル、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキル、シクロアルケニル置換アルキルまたはアリール置換アルキルであり;R16は、水素、アルキル、アルケニル、アリール、アリール置換アルキル、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキルまたはシクロアルケニル置換アルキルであり;R17は、水素またはアルキルであり;或いは、R16とR17が結合している窒素原子と一緒に、R16とR17は、ピロールまたはピペリジンから選ばれる複素環を形成しており;
Yは、OR18またはNR19R20であり;R18は、水素、アルキル、アルケニル、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキル、シクロアルケニル置換アルキルまたはアリール置換アルキルであり;R19は、水素またはアルキルであり;R20は、水素、アルキル、アルケニル、アリール、シクロアルキル、シクロアルケニル、シクロアルキル置換アルキル、シクロアルケニル置換アルキルまたはアリール置換アルキルであるか、或いは、R19とR20が結合している窒素原子と一緒に、R19とR20は、ピロールまたはピペリジンから選ばれる複素環を形成しており;R21は、水素またはアルキルである)
であり;そして、nは、0〜4である)。
【0036】
価値を有し得る特定のピペリジン-N-アルキルカルボキシレートは、式(IV)として下記に示されるアルビモパンのようなN-アルキルアミノ-3,4,4置換ピペリジンである:
【化7】

【0037】
適切なN-置換ピペリジン類は、米国特許第5,270,328号、第6,451,806号、第6,469,030号に開示されているようにして調製し得る;これらの米国特許は、全て参考として本明細書に合体させる。アルビモパンは、ペンシルベニア州エクストンのAdolor社から入手し得る。そのような化合物は、適度の高分子量、両性イオン形、および血液脳関門の透過を阻止する極性を有する。
【0038】
さらに他の適切な末梢オピオイド拮抗薬化合物としては、第四級ベンゾモルファン化合物があり得る。本発明の方法において使用することのできる第四級ベンゾモルファン化合物は、下記の式(V)を有する:
【化8】

(式中、R1は、水素、アシルまたはアセトキシであり;R1は、アルキルまたはアルケニルであり;Rは、アルキル、アルケニルまたはアルキニルであり;X-は、アニオン、とりわけ、クロリド、ブロミド、イオジドまたはメチルサルフェートアニオンである)。
【0039】
本発明の方法において使用することのできるベンゾモルファン化合物の特定の第四級誘導体としては、式(V)の以下の化合物がある:2’-ヒドロキシ-5,9-ジメチル-2,2-ジアリル-6,7-ベンゾモルファニウム-ブロミド、2’-ヒドロキシ-5,9-ジメチル-2-n-プロピル-2-アリル-6,7-ベンゾモルファニウム-ブロミド、2’-ヒドロキシ-5,9-ジメチル-2-n-プロピル-2-プロパルギル-6,7-ベンゾモルファニウム-ブロミド、および2’-アセトキシ-5,9-ジメチル-2-n-プロピル-2-アリル-6,7-ベンゾモルファニウム-ブロミド。
本発明の方法において使用することのできる他の第四級ベンゾモルファン化合物は、例えば、米国特許第3,723,440号に記載されている;該米国特許の内容全体を参考として本明細書に合体させる。
【0040】
他の末梢オピオイド拮抗薬は、“6-Carboxy-Normorphinan Derivatives, Synthesis and Uses Thereof”と題する米国出願第11/888,955号に記載されているような、6-カルボキシ-ノルモルフィナン誘導体、とりわけ、N-メチル-C-ノルモルフィナン誘導体があり得る;上記米国出願は、その全体を参考として本明細書に合体させる。
上述したように、本発明の化合物は、製薬上許容し得る塩として適切に存在し得、製剤化し得る。
【0041】
本発明の方法において使用する化合物は、プロドラッグ形で存在し得る。本明細書において使用するとき、“プロドラッグ”は、そのようなプロドラッグを哺乳類対象者に投与したとき、式(I)〜(V)または他の式に従う活性親薬物を放出するかまたはこれら活性親薬物に転換する任意の薬剤或いは本発明の方法において生体内使用される活性薬物または他の化合物に生体内で代謝される化合物を包含するものとする。プロドラッグは調合薬の多くの望ましい性質(例えば、溶解性、生体利用性、製造性等)を増強することが知られているので、本発明の幾つかの方法において使用する化合物は、必要に応じて、プロドラッグ形で伝達し得る。従って、本発明は、プロドラッグの伝達方法を意図する。本発明において使用する化合物のプロドラッグは、その化合物中に存在する官能基を、修飾物を一般的な操作でまたは生体内で開裂させて親化合物にするような方法で修飾することによって調製し得る。
【0042】
従って、プロドラッグとしては、例えば、ヒドロキシ、アミノまたはカルボキシ基を任意の基に結合させている本明細書において開示する化合物があり、上記の任意の基が、当該プロドラッグを哺乳類対象者に投与したとき、開裂して遊離のヒドロキシル、遊離のアミノまたはカルボン酸をそれぞれ形成する。他の例としては、限定するものではないが、アルコールおよびアミン官能基のアセテート、ホルメートおよびベンゾエート誘導体;並びに、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、sec-ブチル、tert-ブチル、シクロプロピル、フェニル、ベンジルおよびフェネチルエステル等のような、アルキル、炭素環、アリールおよびアルキルアリールエステル類がある。
【0043】
説明したように、本発明の方法において使用する化合物は、当業者にとって周知の多くの方法で調製し得る。本発明に関連して開示する製剤は、ミリグラム、グラム、多グラム、キログラム、多キログラムまたは商業的製薬規模のような任意の規模で実施することを意図する。
本発明の方法において使用する化合物は、1個以上の非対称形置換炭素原子を含有し得、また、光学活性またはラセミ形で単離し得る。従って、構造体の全てのキラル、ジアステレオマー、ラセミ形、エピマー形および全ての幾何異性体形を、特定の立体化学または異性体形を特に示さない限り意図する。当該技術において、そのような光学活性形を如何にして調製し分離するかは周知である。例えば、立体異性体の混合物は、限定するものではないが、ラセミ形の分解;標準、逆相およびキラルクロマトグラフィー;選択的塩形成、再結晶化等のような標準方法によって、或いはキラル出発物質からのキラル合成によって、或いはターゲットキラル中心の慎重な合成によって調製し得る。
【0044】
本発明の幾つかの実施態様においては、オピオイド拮抗薬は、μ-オピオイド拮抗薬であり得る。他の実施態様においては、オピオイド拮抗薬は、κ-オピオイド拮抗薬であり得る。また、本発明は、μ-オピオイド拮抗薬類の組合せ、κ-オピオイド拮抗薬類の組合せおよびμ-オピオイド拮抗薬とκ-オピオイド拮抗薬との組合せ、例えば、メチルナルトレキソンとアルビモパンの組合せのような2種以上のオピオイド拮抗薬の投与も包含する。
例証した実施態様において、本発明者は、メチルナルトレキソンおよびナルトレキソンがプロテアーゼ阻害薬誘発性嘔気および嘔吐を有意に軽減することを見出した。メチルナルトレキソンおよび他の末梢抑制性オピオイド拮抗薬は、概して、プロテアーゼ阻害薬誘発性嘔気および嘔吐の治療において、そのような治療を施した場合に、とりわけオピオイド治療からの鎮静作用に影響を及ぼすことなく臨床的価値を有する。
【0045】
後の実施例において説明しているように、ラット異食症(pika)モデルを使用して嘔気および嘔吐の症状を評価した。ラットは、クレーのような非栄養物質系の種々の嘔吐刺激飼料、即ち、異食行動(pika behavior)と称する現象に接触した。そのように、ラットにおける異食行動は、ヒトおよび他の種における嘔気および嘔吐と同様である(Mitchell等、1976年; Takeda等、1993年)。ラットにおける異食行動は、ヒトおよび他の種におけるのと同様に、セロトニンおよびドーパミンに関連するメカニズムおよびレセプターによって介在される(Takeda等、1993年;Takeda等、1995年)。ラット異食症モデルは、広く使用されており、抗嘔吐薬を試験する幾つかの研究において検証されている(Takeda等、1995年;Aung等、2004年)。リトナビルによって誘発される投与量依存性異食応答は、既に実証されている(Aung等、2005年)。以下で実証しているように、本発明者は、上記異食症モデルを使用してメチルナルトレキソンおよびナルトレキソンによる治療がリトナビル誘発性異食症を有意に軽減することを実証した。
【0046】
メチルナルトレキソンによる囓歯類の治療においては、メチルナルトレキソンが、呼気14CO2試験によって測定したとき、脱メチル化によって部分的に代謝され得ることが示唆されている(Kotake等、1989年)。しかしながら、全身メチルナルトレキソン投与は、放射熱テイルフリックアッセイ(radiant-heat tail-flick assay)に供したラットにおけるモルヒネ誘発性鎮痛作用に拮抗してなく、胃腸管運動のモルヒネ誘発性低下にはメチルナルトレキソンが投与量関連の形で拮抗作用していた(Gmerek等、1986年)。HPLCを使用してメチルナルトレキソン投与後の血漿ナルトレキソンレベルを測定した。検出可能なナルトレキソン量は最高のメチルナルトレキソン投与量において見出せず、試験した投与量においては、メチルナルトレキソンは脱メチル化されなかったことを示唆していた。
【0047】
本発明の方法は、一般に、医学的に許容し得る任意の投与方式、例えば、有効量の活性化合物を、臨床的に許容し得ない有害作用を生じることなく発出させる任意の方式を使用して実施し得る。そのような投与方式としては、経口、直腸、局所(粉末、軟膏、液滴、経皮パッチ、またはイオントフォレーゼ装置によるような)、経皮、舌下、筋肉内、注入、静脈内、肺、筋肉内、腔内、エアゾールとして、耳内(例えば、点耳剤による)、鼻腔内、吸入、眼内または皮下がある。
さらに、上記オピオイド拮抗薬は、腸溶コーティーングした錠剤またはカプセル剤としても投与し得る。ある種の実施態様においては、上記オピオイド拮抗薬は、低速注入法によって、または持続放出もしくは制御放出方法によって、または凍結乾燥粉末として投与する。
【0048】
投与したとき、本発明の化合物は、製薬上許容し得る量で且つ製薬上許容し得る組成物即ち製剤中で投与する。そのような製剤は、一般的には、塩、緩衝剤、保存剤、および任意成分としての他の治療成分を含有し得る。
医薬において使用する場合、上記塩は製薬上許容し得るべきであるが、製薬上許容し得ない塩は、便宜上使用してその製薬上許容し得る塩を調製することができ、本発明の範囲から除外するものではない。そのような薬理学上許容し得且つ製薬上許容し得る塩としては、限定するものではないが、以下の酸から調製した塩がある:塩酸、臭化水素酸、硫酸、硝酸、リン酸、マレイン酸、酢酸、サリチル酸、p-トルエンスルホン酸、酒石酸、クエン酸、メタンスルホン酸、ギ酸、コハク酸、ナフタレン-2-スルホン酸、パモン酸、3-ヒドロキシ-2-ナフタレンカルボン酸およびベンゼンスルホン酸。
【0049】
適切な緩衝剤としては、限定するものではないが、酢酸およびその塩(1〜2%(質量/容量))、クエン酸およびその塩(1〜3%(質量/容量))、ホウ酸およびその塩(0.5〜2.5%(質量/容量))、並びにリン酸およびその塩(0.8〜2%(質量/容量))がある。
適切な保存剤としては、限定するものではないが、ベンズアルコニウムクロリド(0.003〜0.03%(質量/容量))、クロロブタノール(0.3〜0.9%(質量/容量))、パラベン類(0.01〜0.25%(質量/容量))、およびチメロサール(0.004〜0.02%(質量/容量))がある。
【0050】
投与の容易さのために、上記オピオイド拮抗薬の製薬組成物は、潤滑剤、希釈剤、結合剤、担体および崩壊剤のような1種以上の製薬上許容し得る賦形剤も含有し得る。他の助剤としては、例えば、安定剤、湿潤剤、乳化剤、浸透圧に影響を与えるための塩類;着色、香味および/または芳香活性化合物がある。
【0051】
製薬上許容し得る担体または賦形剤とは、無毒で固体、半固体または液体の充填剤、希釈剤、カプセル化材料、或いは任意のタイプの配合助剤を称する。例えば、適切な製薬上許容し得る担体、希釈剤、溶媒またはビヒクルとしては、限定するものではないが、水:塩(緩衝)溶液;アルコール類;アラビアゴム;鉱油および植物油;ベンジルアルコール;ポリエチレングリコール;ゼラチン;ラクトース、アミロースまたは澱粉のような炭水化物類;ステアリン酸マグネシウム;タルク;ケイ酸;粘稠パラフィン;植物油;脂肪酸モノグリセリドおよびジグリセリド;ペンタエリスリトール脂肪酸エステル;ヒドロキシルメチルセルロース;ポリビニルピロリドン等がある。適切な流動性は、例えば、レシチンのようなコーティーング物質を使用することによって、分散液の場合には必要な粒度を維持することによって、また、界面活性剤を使用することによって維持し得る。微生物の作用の防止は、種々の抗菌剤、例えば、パラベン、クロロブタノール、フェノール、ソルビン酸等のような抗細菌剤または抗真菌剤を含ませることによって確保し得る。
【0052】
製薬上許容し得る固形担体を使用する場合、本発明の方法において使用するのに適する化合物の投与剤形は、錠剤、カプセル剤、粉末剤、坐薬、またはトローチ剤であり得る。液体担体を使用する場合、軟質ゼラチンカプセル剤、経皮パッチ、エアゾールスプレー、局所クリーム、シロップまたは液体懸濁液、エマルジョンまたは溶液が投与剤形であり得る。
非経口投与においては、とりわけ適しているのは、注射用の滅菌溶液、好ましくは非水性または水性溶液、並びに分散液、懸濁液またはエマルジョン、或いは坐薬のようなインプラントである。アンプル剤は、多くの場合、便利な単位投与量である。また、注射用デポー剤形も適切であり得、薬物のマイクロカプセルマトリックスをポリラクチド-ポリグリコリド、ポリ(オルソエステル)およびポリ(酸無水物)のような生分解性ポリマー中に形成させることによって製造し得る。薬物対ポリマー比および使用する特定のポリマーの性質に応じて、薬物放出速度を調整し得る。
腸内投与においては、とりわけ適しているのは、錠剤、糖衣剤、液剤、ドロップ剤、坐薬、または軟質ゼラチンカプセルのようなカプセル剤である、甘味化ビヒクルを使用するシロップ剤またはエリキシル剤等も使用し得る。
【0053】
説明したように、他の伝達系としては、持続放出、遅延放出または徐放伝達系があり得る。そのような系は、本発明の化合物の繰返しの投与を回避して、患者および医師への利便性を高め且つ化合物の血漿レベルの持続を維持し得る。多くのタイプの制御放出伝達系が利用し得、当業者にとって既知である。持続または制御放出組成物は、リポソームまたは活性成分が段階的に分解可能なコーティーングによってマイクロカプセル化、多層コーティーング等によるようして保護されている組成物として製剤化し得る。そのように、本発明に従うオピオイド拮抗薬は、腸溶性コーティーング錠剤またはカプセル剤として投与することができる。ある種の実施態様においては、オピオイド拮抗薬は、低速注入法によってまたは持続放出または制御放出方法によってまたは凍結乾燥粉末として投与する。
【0054】
例えば、本発明の化合物は、生分解性ポリマーのような製薬上許容し得る持続放出性マトリックスと混合して治療用組成物を調製し得る。持続放出性マトリックスは、本発明において使用する場合、酵素または酸-塩基加水分解によりまたは溶解により分解し得る材料(通常はポリマー)から製造したマトリックスである。体内に挿入した時点で、上記マトリックスは、酵素および体液に従って作用する。持続放出性マトリックスは、望ましくは、生体適合性材料、例えば、リポソーム類;ポリラクチド(ポリ乳酸)、ポリグリコリド(グリコール酸のポリマー)、ポリラクチド コ-グリコリド(乳酸とグリコール酸のコポリマー)、ポリ酸無水物、ポリ(オルソ)エステル、多糖類、ポリアミノ酸、ヒアルロン酸、コラーゲン、硫酸コンドロイチン、ポリヌクレオチド類、ポリビニルプロピレン、ポリビニルピロリドンおよびシリコーンのようなポリマー系;カルボン酸、脂肪酸、リン脂質、アミノ酸、および脂質(例えば、ステロール)のような非ポリマー系;ヒドロゲル放出系;シラスティック系;ペプチド系;インプラント類等から選択する。特定の例としては、限定するものではないが、(a) 米国特許第4,452,775号、第4,675,189号および第5,736,152号(参考としてそれら全体を本明細書に合体させる)において見出せる、多糖類をマトリックス内の形で含ませている浸食性の系;および、(b) 米国特許第3,854,480号、第5,133,974号および第5,407,686号(参考としてそれら全体を本明細書に合体させる)に記載されているような、活性成分がポリマーから制御された速度で浸透する拡散系がある。さらに、ポンプ系硬質ワイヤー型伝達装置(pump-based hard-wired delivery system)も使用することができ、これらの数種は、インプランテーション用に適応化されている。適切な腸溶性コーティーングは、PCT公報 WO 98/25613号および米国特許第6,274,591号(共に、参考として本明細書に合体させる)に記載されている。また、持続または制御放出組成物は、活性成分が段階的に分解可能なコーティーングによってマイクロカプセル化、多層コーティーング等によるようして保護されている組成物として製剤化し得る。
【0055】
特定的にメチルナルトレキソンに関して、水性製剤は、キレート化剤、緩衝剤、酸化防止剤、および任意成分としての等張剤を、好ましくは3.0〜3.5に調整したpHで含み得る。オートクレーブ処理および長期保存に対して安定である製剤は、第2004/0266806号として公開され、“Pharmaceutical Formulation”と題する米国特許出願第10/821811号に記載されている;該米国特許出願の開示は、参考として本明細書に合体させる。また、増大した保存期間を有するメチルナルトレキソンの製剤は、“Formulations for Parenteral Delivery of Compounds and Uses Thereof”と題する国際特許公開公報WO 2008/19115に記載されている(該国際出願も参考として本明細書に合体させる)。メチルナルトレキソンの凍結乾燥製剤は、米国特許出願第11/899,724号に記載されており、メチルナルトレキソンを含有する粒子を含む製剤は、米国特許第6,419,959号に記載されている;これらの出願および特許の各々は、参考として本明細書に合体させる。メチルナルトレキソンの経皮伝達に適する製剤は、国際特許公開公報第2007/41544号に記載されている(該国際出願も参考として本明細書に合体させる)。
【0056】
1つの実施態様においては、本発明の化合物は、化合物の連続投与処方を対象者に提供する投与処方、例えば、オピオイド拮抗薬の最低血漿レベルを維持する、好ましくは、通常の処方による薬物レベルの乱高下(spikes and troughs)を排除する処方で投与する。適切には、連続投与は、上記化合物を、原則毎日または原則制御放出でもって、本明細書において開示しているいずれかの伝達方法によって対象者に投与することによって達成し得る。1つの実施態様においては、連続投与は、対象者への連続注入を使用して、或いは経時的な化合物の放出を容易にするメカニズム、例えば、経皮パッチによってまたは持続放出製剤によって達成し得る。適切には、本発明の化合物は、対象者に、リトナビルのようなプロテアーゼ阻害薬による治療によって誘発された嘔気、嘔吐および他の有害胃腸作用を抑制または軽減するのに有効な対象者血漿中化合物濃度を維持するに十分な量で連続放出させる。
【0057】
本発明に従う化合物は、単独投与または他の治療薬との併用投与のいずれであれ、抗嘔気および抗嘔吐有効量で投与する。しかしながら、本発明の化合物および組成物の総投与量は、担当医によって、健全な医学的判断の範囲内で決定されるであろうことを理解されたい。いずれかの特定の患者に対する特定の治療有効量レベルは、治療する障害および障害の重篤度;使用する特定の化合物の活性;使用する特定の組成物;患者の年齢、体重、総体的健康、性別および食餌;投与時間;投与経路;使用する特定の化合物の排出速度;治療期間;使用する特定の化合物と併用しているまたは同時使用している薬物;および、医療技術において周知の同様な要因のような種々の要因に依存する。例えば、1つの方法は、化合物の投与量を所望の知慮効果を達成するのに必要なレベルよりも低いレベルで出発し、投与量を所望の効果が得られるまで次第に増大させることである。
【0058】
必要に応じて、有効投与日量は、投与目的において、複数投与量に分割し得る。従って、単回投与組成物は、投与日量を構成するそのような量またはその約量を含有し得る。当業者であれば、良好な医療行為および個々の患者の臨床症状によって決定するような有効投与量および併用投与処方(本明細書において説明しているような)を容易に最適化し得るであろう。
【0059】
一般に、上記オピオイド拮抗薬、とりわけ、末梢拮抗薬の経口投与量は、1日当り約0.01〜約80mg/kg体重の範囲である。1〜20mg/kg体重の範囲内の経口投与量によって所望の結果が得られるものと期待される。一般に、静脈内および皮下投与のような非経口投与は、約0.001〜5mg/kg体重の範囲である。0.05〜0.5mg/kg体重の範囲の投与量によって所望の結果が得られるものと期待される。投与量は、投与方式に応じて、局所または全身の所望の薬物量を達成するように適切に調整し得る。例えば、腸溶性コーティーング製剤中のオピオイド拮抗薬の経口投与における投与量は非コーティーング経口投与量の10〜30%であると予想される。患者の応答がそのような投与量では不十分である場合には、幾分高めの投与量(または、効果的には、異なるより局在的な伝達経路による30%よりも高い投与量)を、患者耐容性が許容する範囲内で使用し得る。1日当りの複数回投与は、化合物の適切な全身レベルを達成するために意図する。適切なシステムレベルは、例えば、当業者にとって既知の一般的HPLC法を使用しての患者の血漿薬物レベルを測定することによって判定することができる。
【0060】
本発明の例証した実施態様においては、オピオイド拮抗薬は、抗レトロウイルス剤、例えば、リトナビルまたは抗レトロウイルス剤の組合せと併用投与する。用語“併用投与”とは、2以上の薬剤を患者または対象者に投与する任意の投与経路による併用治療を称することを意味する。また、複数の薬剤の併用投与は、併用療法または併用治療と称し得る。これらの薬剤は、同じ投与製剤または別々の製剤中に存在し得る。2以上の活性剤による併用治療においては、これらの活性剤が別々の投与製剤中に存在する場合、これらの活性剤は同時に投与してもよく、或いはこれらの活性剤は、時間差により別々に投与してもよい。これらの薬剤は、これらの薬剤を、両薬剤が体内で有効な濃度を達成するのを可能にする十分な形で投与する限りにおいて、同時にまたは連続して投与し得る(例えば、1つの薬剤は他の薬剤の投与の直後に続き得、或いは、これらの薬剤はバラバラに投与し得る、例えば、1つの薬剤をある時点で投与し、その後、他の薬剤を後の時点で、例えば、1週間内に投与してもよい)。また、これらの薬剤は、異なる経路によっても投与し得る、例えば、1つの薬剤は静脈内投与し、一方、第2の薬剤は筋肉内、静脈内または経口投与する。換言すれば、本発明に従うオピオイド拮抗薬化合物の、例えば、リトナビルまたはリトナビルと1種以上の他のプロテアーゼ阻害薬の組合せとの併用投与は、適切には、オピオイド拮抗薬と、プロテアーゼ阻害薬、例えば、リトナビルまたはリトナビルと他のプロテアーゼ阻害薬とのようなプロテアーゼ阻害薬の組合せとを含有する併用製薬製剤であって、その製剤が末梢オピオイド拮抗薬の原則毎日または断続での投与に、また、プロテアーゼ阻害薬、例えば、リトナビルの原則毎日または断続での投与に適応化されているものと考えられる。従って、オピオイド拮抗薬は、プロテアーゼ阻害薬、例えば、リトナビルの投与の前、同時または後に投与し得る。例証した実施態様においては、とりわけ適切なのは、リトナビルの投与前のオピオイド拮抗薬の投与である。
【0061】
また、併用投与可能な薬剤は、例えば、単一製剤または単一錠剤におけるような混合物として製剤化し得る。これらの製剤は、例えば、米国特許第6,277,384号;第6,261,599号、第5,958,452号;およびPCT公開公報WO 98/25613号に記載されている製剤のように、非経口または経口であり得る;これらの米国特許等の各々は、参考として本明細書に合体させる。
【0062】
本発明を以下の実施例によりさらに説明するが、これらの実施例は、本発明の範囲を限定するものと解釈すべきではない。
(実施例)
【0063】
実施例1 嘔気のための動物モデル
ラットは、異食症として知られている、カオリン(クレーの1種)のような非栄養物質の摂取増大として現れる摂食習慣の変化による嘔吐刺激に反応する(Mitchell等、 1976年;Takeda等、1993年;Takeda等、1995年)。本発明者は、カオリン摂取量を嘔気の尺度として実験動物において定量し、薬物誘発異食摂取が選択した薬剤によって軽減され得ることを観察した(Aung等、2003年;Aung等、2005年)。
本明細書において説明する実験プロトコールは、シカゴ大学のInstitutional Animal Care and Use Committee即ちIACUCによって承認された。
【0064】
実施例2 生体内試験
体重150〜300gの成獣雄ラット(インディアナ州インディアナポリスのHarlan Sprague Dawley社)を使用した。動物全てを、標準の隔離ケージ(45cm×35cm×25cm)内に、12時間明/12時間暗サイクルによる環境的に制御された条件において囲った。各ラットは、試験の全体に亘って連続して利用可能な別々の容器に入れた水、標準ラット飼料(ウィスコンシン州マジソンのHarlan-Teklad社)およびカオリン(下記参照)に自由に接触可能にした。
観測開始(0日)の前に、3日間の順応期間があった。
【0065】
カオリンの調製
カオリンペレットを、以前に開示された方法に基づいて製造した(Mitchell等、 1976年;Takeda等、1995年)。要するに、99gの薬理学級カオリン(即ち、水和ケイ酸アルミニウム;ニュージャージー州フェアローンのFisher社)を1gのアカシア(Fisher社)と、即ち、99:1の比で、蒸留水と一緒に混合して濃厚ペーストを調製した。カオリンペーストをステンレススチールトレー上で圧延し、正規のラット飼料ペレットと同様な形状およびサイズの切片に切断した。ペレットをスチールトレー上に置き、室温で72時間完全に乾燥させた。
【0066】
異食行動(カオリン摂取)の測定
リトナビルが使用したプロテアーゼ阻害薬であり、ラットを4群に分割した。4群、即ち、ビヒクル+ビヒクル、ビヒクル+リトナビル、ナロキソン+リトナビル、およびメチルナルトレキソン+リトナビルの各群において6〜7匹のラットが存在していた。ラットは、リトナビル、20mg/kg (イリノイ州ノースシカゴのAbbott Laboratories社)を、二日連続の朝(0時および24時)、強制飼養(gavage)チューブによって経口により受けた(Denissen等、1997年;Yamaji等、1999年;Shibata等、2002年)。ビヒクル、ナロキソン0.1mg/kgもしくは0.3mg/kg (ミズーリ州セントルイスのSigma社)、またはメチルナルトレキソン0.3mg/kg、1.0mg/kgもしくは3.0mg/kg (ミズーリ州セントルイスのMallinckrodt Chemicals社)の事前処置は、20mg/kgのリトナビル投与の30分前に、腹腔内投与した(Aung等、2003年)。各ラットは、15分、2時間およびその後毎日、試験薬投与後の情動不安、呼吸困難または下痢のような苦痛徴候について直接観察した。
【0067】
試驗中、カオリンおよび飼料ペレットを直近0.1gまで秤量し、前日からの残存カオリンと飼料を集めた後、毎朝同時に容器内で取り換えた。カオリンと飼料の摂取を5日間24時間毎に測定した。カオリンおよび飼料ペレットを直近0.1gまで秤量し、ケ−ジ内の容器に毎朝入れた。前日からの残存カオリンと飼料を集め、72時間乾燥させ、秤量した。毎日のカオリンと飼料の摂取を、最初のリトナビル治療後の5日間測定した。
【0068】
血液サンプル採取
ある試験において、血液サンプルを、血漿ナルトレキソンレベル、即ち、メチルナルトレキソンの可能性ある脱メチル化の指標を測定するために採取した(Kotake等、1989年)。ラットを拘束し、尾静脈を露出させた。尾を温水に浸して血管の拡張を助けた。小さなゴムバンドを尾の基部の周りに置いた。血液サンプルは、静脈内に入れた小ニードルのハブ中に挿入したミクロヘマトクリットチューブを使用して採取した。血液サンプルは、メチルナルトレキソンの最初の投与後0分、10分、20分、30分、60分、90分または120分で採取した。
【0069】
ナルトレキソンおよびメチルナルトレキソン濃度の測定
血漿ナルトレキソンおよびメチルナルトレキソンレベルを、以前に報告された方法から適応化した高性能液体クロマトグラフィー(HPLC)により測定した(Osinski等、2002年)。ナルトレキソンとメチルナルトレキソンは、固相抽出(SPE)法により、血漿から分離した。水に希釈した血漿サンプル(100〜200μl)を、n-プロパノールと水で状態調節しているSPEカラム(Varian CBAカラム、100mg;カリフォルニア州ハーバーシティー)に通した。分析物を、カラムから、2:1の割合で調製したn-プロパノールと水溶液中のトリフルオロ酢酸(25mM)との混合物によって溶出させた。溶出液を、55℃の窒素流中で蒸発乾固させた。残留物を移動相中で再構成し、ナイロンHPCLシリンジフィルターにより濾過し、分析に供した。HPLC分析においては、電気化学検出器が、電気活性化合物の自動化分析クロマトグラフィーにおいて高感度を有している。HPLCシステム(Shimadzu Corporation社;日本国京都)および電気化学検出器(ESA Coulochem社、モデル5100A;マサチューセッツ州チェルムスフォード)は、LC-10ADポンプ、SCL-10Aシステムコントローラー、およびサンプル冷却器を備えたSIL-10Aオートインジェクターからなっていた。電気化学検出器は、以下の設定で稼動した:検出器1、+360mV;検出2、+600mV;ガードセル(guard cell)、+650mV。データは、EZChrom 2-2 HPLCソフトウェアを使用して収集した。移動相においては、リン酸ナトリウム 30mM、酢酸ナトリウム 20mM、メタノール6%、テトラヒドロフラン1%、pH 4.2を使用した。システムは、5〜100ng/mLの範囲で毎日較正した。血漿サンプルにおける実用検出限界は、約2ng/mL (100pg/注入)であった。
【0070】
統計分析
データは、平均±標準誤差(S.E.)で表した。濃度曲線下の領域(AUC)を算出した。データは、2つの因子としての群および時間による二元分散分析(ANOVA)を使用して分析した。統計的有意性は、P < 0.05であるとみなした。
上記試験の結果を、以下に説明する。
【0071】
リトナビル誘発性嘔気および嘔吐に対するナロキソンの効果
塩水処置したラットにおいては、1.0g未満のカオリンが連続5日において毎日摂取されていた。10または20mg/kgの経口リトナビルの投与後、カオリン摂取は、24時間〜48時間で投与量関連の形で有意に増加した(図2;P < 0.01)。30mg/kgにおいては、カオリン摂取はさらには増加していないが、高投与量での毒性作用の可能性を示唆しており、このことは、飼料摂取の低下によって裏付けされている。この試験において使用したリトナビル投与量は、20mg/kgであった。
図3は、カオリン摂取におけるリトナビル誘発増加が、ナロキソンによる0.1または0.3mg/kgの事前処置によって緩和されていることを示している(P < 0.01)。時間0から120時間までのカオリン摂取における曲線下領域(AUC)は、以下のとおりであった:ビヒクル+ビヒクル、87±8.1g・hr;0.3mg/kgナロキソン+ビヒクル、86±9.2g・hr;ビヒクル+リトナビル、351±18.2g・hr;0.1mg/kgナロキソン+リトナビル、264±16.7g・hr;および、0.3mg/kgナロキソン+リトナビル、205±11.3g・hr (図4)。ナロキソンは、リトナビルによって誘発されたカオリン摂取を有意に低下させていた(ビヒクルに比較してP < 0.01)。ナロキソン(0.3mg/kg)単独は、カオリン摂取に有意には影響していなかった。
【0072】
リトナビル誘発性嘔気および嘔吐に対するメチルナルトレキソンの効果
リトナビル後のカオリン摂取に対するメチルナルトレキソンによる事前処置の効果を図5に示している。リトナビルにより誘発されたカオリン摂取は、メチルナルトレキソンによって投与量依存の形で緩和されている(P < 0.01)。時間0から120時間までのカオリン摂取におけるAUCは、以下のとおりであった:ビヒクル+ビヒクル、92±8.6g・hr;ビヒクル+リトナビル、360±15.7g・hr;メチルナルトレキソン(0.3mg/kg)+リトナビル、302±13.2g・hr;メチルナルトレキソン(1.0mg/kg)+リトナビル、242±14.9g・hr;および、メチルナルトレキソン(3.0mg/kg)+リトナビル、168±11.5g・hr(図6)。
メチルナルトレキソン(3.0mg/kg)単独によっては、カオリン摂取は、有意には影響を受けてなかった。全ての試験群において、飼料摂取は有意には影響を受けてなかった。
【0073】
ナルトレキソンのHPLC分析
メチルナルトレキソン(3.0mg/kg)に関連しての検出可能なナルトレキソンは見出せなかった。対照的に、メチルナルトレキソンレベルは、その投与後に検出された。クロマトグラムを図7に示している。しかしながら、全ての測定時点において、ナルトレキソン量は、(B)および(C)において示すように検出されなかった。
要するに、本発明は、抗レトロウイルス剤、例えば、プロテアーゼ阻害薬によって誘発された嘔気および嘔吐のような薬物誘発性胃腸副作用を、オピオイド拮抗薬、とりわけ、メチルナルトレキソンのような末梢抑制性オピオイド拮抗薬を使用して治療する方法を提供する。
【0074】
今回、本発明を種々の特定の実施態様および方法に関連して説明してきた。しかしながら、多くの変更および修正を本発明の精神および範囲内に留まりながらなし得ることを理解すべきである。
全ての刊行物、特許および特許出願は、各々の個々の刊行物、特許または特許出願が詳細に且つ個々に参考として示されているのとあたかも同じ範囲内で、本明細書に参考として明確に合体させる。本開示と合体させた特許、刊行物および文献との間で不一致がある場合、本開示が支配すべきである。
【0075】
参考文献



【特許請求の範囲】
【請求項1】
抗レトロウイルス剤による治療に関連する有害な胃腸副作用を患っている患者に、該抗レトロウイルス剤と併用して、薬物誘発性胃腸副作用を治療するのに十分な量のオピオイド拮抗薬を投与することを特徴とする抗レトロウイルス剤による治療に関連する有害な胃腸副作用の治療方法。
【請求項2】
前記副作用が、嘔気もしくは嘔吐または両方である、請求項1記載の方法。
【請求項3】
前記オピオイド拮抗薬を、前記抗レトロウイルス剤を投与する前に投与する、請求項1記載の方法。
【請求項4】
前記抗レトロウイルス剤が、プロテアーゼ阻害薬である、請求項1記載の方法。
【請求項5】
前記プロテアーゼ阻害薬が、リトナビルである、請求項4記載の方法。
【請求項6】
前記オピオイド拮抗薬が、ナロキソンである、請求項1記載の方法。
【請求項7】
前記オピオイド拮抗薬が、末梢オピオイド拮抗薬である、請求項1記載の方法。
【請求項8】
前記末梢オピオイド拮抗薬が、メチルナルトレキソンである、請求項7記載の方法。
【請求項9】
前記末梢オピオイド拮抗薬が、ピペリジン-N-アルキルカルボキシレート化合物である、請求項7記載の方法。
【請求項10】
前記末梢オピオイド拮抗薬が、第四級モルフィナン化合物である、請求項7記載の方法。
【請求項11】
前記第四級モルフィナン化合物が、N-メチルナルトレキソン、N-メチルナロキソン、N-メチルナロルフィン、N-ジアリルノルモルヒネ、N-アリルレバロルファン、およびN-メチルナルメフェンからなる群から選ばれる化合物の第四級塩を含む、請求項10記載の方法。
【請求項12】
前記オピオイド拮抗薬が、μ-オピオイド拮抗薬、κ-オピオイド拮抗薬またはこれらの組合せである、請求項1記載の方法。
【請求項13】
HIV感染ヒト対象者への抗レトロウイルス剤の投与に関連する有害な胃腸副作用の治療方法であって、前記ヒト対象者に、リトナビルまたはリトナビルと他のプロテアーゼ阻害薬との組合せである抗レトロウイルス有効量のプロテアーゼ阻害薬および前記有害副作用を治療するのに有効な量のオピオイド拮抗薬を併用投与することを特徴とする前記治療方法。
【請求項14】
前記有害副作用が、嘔気、嘔吐、下痢、腹痛またはこれらの組合せである、請求項13記載の方法。
【請求項15】
前記オピオイド拮抗薬が、第四級モルフィナン化合物である、請求項13記載の方法。
【請求項16】
前記第四級モルフィナン化合物が、N-メチルナルトレキソン、N-メチルナロキソン、N-メチルナロルフィン、N-ジアリルノルモルヒネ、N-アリルレバロルファン、およびN-メチルナルメフェンからなる群から選ばれる化合物の第四級塩を含む、請求項15記載の方法。
【請求項17】
第四級モルフィナン化合物の第四級塩が、N-メチルナルトレキソンである、請求項16記載の方法。
【請求項18】
有効量のオピオイド拮抗薬を投与することを特徴とする、有効量のリトナビルまたはリトナビルと他のプロテアーゼ阻害薬との組合せのそれを必要とするHIV感染患者への投与後の嘔気および嘔吐の治療方法。
【請求項19】
前記オピオイド拮抗薬を、前記リトナビルまたは他のプロテアーゼ阻害薬との組合せを投与する前に投与する、請求項18記載の方法。
【請求項20】
前記オピオイド拮抗薬の投与が、経口、舌下、筋肉内、皮下、静脈内、および経皮である、請求項18記載の方法。
【請求項21】
投与が、経口である、請求項20記載の方法。
【請求項22】
前記オピオイド拮抗薬が、メチルナルトレキソンである、請求項18記載の方法。
【請求項23】
メチルナルトレキソンの有効量が、1日当り約0.001mg/kg体重〜約80mg/kg体重、1日当り約0.05mg/kg体重〜約50mg/kg体重または1日当り約1mg/kg体重〜約20mg/kg体重である、請求項22記載の方法。
【請求項24】
そのような治療を必要とするヒト対象者におけるレトロウイルス感染症の治療方法であって、抗レトロウイルス量のリトナビルまたはリトナビルと他のプロテアーゼ阻害薬との組合せおよび前記対象者におけるリトナビルまたは組合せ誘発性胃腸副作用の頻度および/または重篤度を弱化するのに有効な量のオピオイド拮抗薬を併用投与することを特徴とする前記治療方法。
【請求項1】
抗レトロウイルス剤による治療に関連する有害な胃腸副作用を患っている患者に、該抗レトロウイルス剤と併用して、薬物誘発性胃腸副作用を治療するのに十分な量のオピオイド拮抗薬を投与することを特徴とする抗レトロウイルス剤による治療に関連する有害な胃腸副作用の治療方法。
【請求項2】
前記副作用が、嘔気もしくは嘔吐または両方である、請求項1記載の方法。
【請求項3】
前記オピオイド拮抗薬を、前記抗レトロウイルス剤を投与する前に投与する、請求項1記載の方法。
【請求項4】
前記抗レトロウイルス剤が、プロテアーゼ阻害薬である、請求項1記載の方法。
【請求項5】
前記プロテアーゼ阻害薬が、リトナビルである、請求項4記載の方法。
【請求項6】
前記オピオイド拮抗薬が、ナロキソンである、請求項1記載の方法。
【請求項7】
前記オピオイド拮抗薬が、末梢オピオイド拮抗薬である、請求項1記載の方法。
【請求項8】
前記末梢オピオイド拮抗薬が、メチルナルトレキソンである、請求項7記載の方法。
【請求項9】
前記末梢オピオイド拮抗薬が、ピペリジン-N-アルキルカルボキシレート化合物である、請求項7記載の方法。
【請求項10】
前記末梢オピオイド拮抗薬が、第四級モルフィナン化合物である、請求項7記載の方法。
【請求項11】
前記第四級モルフィナン化合物が、N-メチルナルトレキソン、N-メチルナロキソン、N-メチルナロルフィン、N-ジアリルノルモルヒネ、N-アリルレバロルファン、およびN-メチルナルメフェンからなる群から選ばれる化合物の第四級塩を含む、請求項10記載の方法。
【請求項12】
前記オピオイド拮抗薬が、μ-オピオイド拮抗薬、κ-オピオイド拮抗薬またはこれらの組合せである、請求項1記載の方法。
【請求項13】
HIV感染ヒト対象者への抗レトロウイルス剤の投与に関連する有害な胃腸副作用の治療方法であって、前記ヒト対象者に、リトナビルまたはリトナビルと他のプロテアーゼ阻害薬との組合せである抗レトロウイルス有効量のプロテアーゼ阻害薬および前記有害副作用を治療するのに有効な量のオピオイド拮抗薬を併用投与することを特徴とする前記治療方法。
【請求項14】
前記有害副作用が、嘔気、嘔吐、下痢、腹痛またはこれらの組合せである、請求項13記載の方法。
【請求項15】
前記オピオイド拮抗薬が、第四級モルフィナン化合物である、請求項13記載の方法。
【請求項16】
前記第四級モルフィナン化合物が、N-メチルナルトレキソン、N-メチルナロキソン、N-メチルナロルフィン、N-ジアリルノルモルヒネ、N-アリルレバロルファン、およびN-メチルナルメフェンからなる群から選ばれる化合物の第四級塩を含む、請求項15記載の方法。
【請求項17】
第四級モルフィナン化合物の第四級塩が、N-メチルナルトレキソンである、請求項16記載の方法。
【請求項18】
有効量のオピオイド拮抗薬を投与することを特徴とする、有効量のリトナビルまたはリトナビルと他のプロテアーゼ阻害薬との組合せのそれを必要とするHIV感染患者への投与後の嘔気および嘔吐の治療方法。
【請求項19】
前記オピオイド拮抗薬を、前記リトナビルまたは他のプロテアーゼ阻害薬との組合せを投与する前に投与する、請求項18記載の方法。
【請求項20】
前記オピオイド拮抗薬の投与が、経口、舌下、筋肉内、皮下、静脈内、および経皮である、請求項18記載の方法。
【請求項21】
投与が、経口である、請求項20記載の方法。
【請求項22】
前記オピオイド拮抗薬が、メチルナルトレキソンである、請求項18記載の方法。
【請求項23】
メチルナルトレキソンの有効量が、1日当り約0.001mg/kg体重〜約80mg/kg体重、1日当り約0.05mg/kg体重〜約50mg/kg体重または1日当り約1mg/kg体重〜約20mg/kg体重である、請求項22記載の方法。
【請求項24】
そのような治療を必要とするヒト対象者におけるレトロウイルス感染症の治療方法であって、抗レトロウイルス量のリトナビルまたはリトナビルと他のプロテアーゼ阻害薬との組合せおよび前記対象者におけるリトナビルまたは組合せ誘発性胃腸副作用の頻度および/または重篤度を弱化するのに有効な量のオピオイド拮抗薬を併用投与することを特徴とする前記治療方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7A】


【図7B】


【図7C】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7A】


【図7B】


【図7C】


【公表番号】特表2011−506339(P2011−506339A)
【公表日】平成23年3月3日(2011.3.3)
【国際特許分類】
【出願番号】特願2010−537105(P2010−537105)
【出願日】平成20年12月5日(2008.12.5)
【国際出願番号】PCT/US2008/085662
【国際公開番号】WO2009/076195
【国際公開日】平成21年6月18日(2009.6.18)
【出願人】(501242712)ザ ユニヴァーシティー オヴ シカゴ (19)
【Fターム(参考)】
【公表日】平成23年3月3日(2011.3.3)
【国際特許分類】
【出願日】平成20年12月5日(2008.12.5)
【国際出願番号】PCT/US2008/085662
【国際公開番号】WO2009/076195
【国際公開日】平成21年6月18日(2009.6.18)
【出願人】(501242712)ザ ユニヴァーシティー オヴ シカゴ (19)
【Fターム(参考)】
[ Back to top ]

