オルガネラの光学的特性の検出方法、およびこの検出に用いる測定キット
【課題】 本発明は、オルガネラの新規な光学的特性の検出方法を提供することを目的とする。
【解決手段】 本発明のオルガネラの光学的特性の検出方法は、オルガネラを担体に吸着させる工程、およびオルガネラの透過光を検出する工程を含んでいる。ここで、オルガネラは吸着剤を用いて吸着させることができる。吸着剤としてはポリフェノール蛋白質を用いることができる。オルガネラとしてはミトコンドリアを用いることができる。容器としては、光透過部を有する容器を用いることができる。透過光を検出する工程は、等吸収点の波長の透過光を検出する工程とすることができる。
【解決手段】 本発明のオルガネラの光学的特性の検出方法は、オルガネラを担体に吸着させる工程、およびオルガネラの透過光を検出する工程を含んでいる。ここで、オルガネラは吸着剤を用いて吸着させることができる。吸着剤としてはポリフェノール蛋白質を用いることができる。オルガネラとしてはミトコンドリアを用いることができる。容器としては、光透過部を有する容器を用いることができる。透過光を検出する工程は、等吸収点の波長の透過光を検出する工程とすることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、オルガネラの新規な光学的特性の検出方法に関する。また、本発明は、このオルガネラの光学的特性の検出に用いる新規な測定キットに関する。
【背景技術】
【0002】
従来、オルガネラで起こる物質やイオンの出入りによる、オルガネラの体積変化を測定する方法が知られている。
【0003】
オルガネラの体積変化を測定する1つの方法としては、緩衝液に懸濁したオルガネラの吸光度あるいは光散乱を測定する方法がある。ミトコンドリアの膜透過性遷移孔の形成による体積変化に関しては、Zamzamiらの解説が報告されている(非特許文献1参照。)。
【0004】
オルガネラの体積変化を測定する他の方法としては、電子顕微鏡によりオルガネラの像を撮影する方法がある。この方法は、広範囲に用いられており、多くの教科書や論文に記載されている(例えば、非特許文献2参照。)。
【0005】
ミトコンドリア内膜に生じる膜透過性遷移孔の形成を検出する方法としては、上述のオルガネラの体積変化を測定する方法以外に、以下のような方法が知られている。
【0006】
1つの方法としては、ミトコンドリア膜電位の消失を検出する方法がある(例えば、非特許文献1参照。)。
他の方法としては、ミトコンドリア内・外のカルシウムイオン濃度測定による検出方法がある(例えば、特許文献1参照。)。
他の方法としては、ミトコンドリアからのアポトーシス誘導因子(シトクロムcなど)の放出を検出する方法がある(例えば、非特許文献3参照。)。
【0007】
なお、発明者は、本発明に関連する技術内容を開示している(例えば、非特許文献4〜8参照。)。
【特許文献1】特開2002-247999
【非特許文献1】Zamzami, N.他3名 (2001)、Methods in Cell Biology 65 (Mitochondria) Edited by Pon, L.A. and Schon E.A., 147-158)
【非特許文献2】Shinohara Y, Bandou S, KoraS, Kitamura S, Inazumi S, Terada H. 1998. Cationic uncouplers of oxidative phosphorylationare inducers of mitochondrial permeability transition. FEBS Letters. 428: 89-92
【非特許文献3】石坂瑠美 細胞質へのシトクロムc遊離の測定、2001、新ミトコンドリア学(共立出版、内海耕慥・井上正康 監修
【非特許文献4】Nakayama, S., T. Sakuyama, S. Mitaku, and Y. Ohta. 2002. Fluorescence imaging of metabolic responses in single mitochondria. Biochem. Biophys. Res. Commun.290:23-28
【非特許文献5】Hattori, T., Watanabe, K., Uechi, Y., Yoshioka, H. and Ohta Y. 2005, “Repetitive transient depolarizations of the inner mitochondrial membrane induced by proton pumping. “ Biophys. J. 88,2340-2349
【非特許文献6】太田善浩 生物における物理の有用性−物理は生命現象の理解にいかに役立つか? 2004、数理科学42:79-83
【非特許文献7】太田善浩、服部友裕 2002、“単一ミトコンドリアの膜電位計測” 日本物理学会誌 57: 592-595
【非特許文献8】渡辺功一、作山孝法、フーラハン美由紀、太田善浩、1999、“蛍光顕微鏡による単離ミトコンドリアの観察方法” 生物物理39:258-260
【発明の開示】
【発明が解決しようとする課題】
【0008】
しかしながら、上述したミトコンドリア内膜に生じる膜透過性遷移孔の形成を検出する方法には、以下に述べる問題点がある。
【0009】
オルガネラの体積変化を測定する方法の問題点を説明する。
オルガネラの体積変化を測定する1つの方法としての、緩衝液に懸濁したオルガネラの吸光度あるいは光散乱を測定する方法には、つぎの問題点がある。すなわち、測定に多量の試料が必要であるため、遺伝子改変等が行いやすい継代培養細胞から単離したオルガネラでは試料が少なく測定が困難である。また、個々のオルガネラで異なったタイミングで生じる体積変化でも全て平均化されるため、体積が変化しても検出されない場合がある。また、オルガネラで生じる他の現象と体積変化を同じオルガネラで測定できないので、両者の関係を正確には同定できない。そこで、解決すべき課題として、単一のオルガネラの体積を、時々刻々測定することができる方法の開発が望まれる。
【0010】
オルガネラの体積変化を測定する他の方法としての、電子顕微鏡によりオルガネラの像を撮影する方法には、つぎの問題点がある。すなわち、水分を除去した測定になるため、体積の経時変化を捉えることができない。そこで、解決すべき課題として、緩衝液中でオルガネラが活動している状態で、体積変化を測定することができる方法の開発が望まれる。
【0011】
上述のオルガネラの体積変化を測定する方法以外の方法、すなわち、ミトコンドリア膜電位の消失を検出する方法、ミトコンドリア内・外のカルシウムイオン(以下、Ca2+)濃度測定による検出方法、および、ミトコンドリアからのアポトーシス誘導因子(シトクロムcなど)の放出を検出する方法には、つぎの問題点がある。すなわち、蛍光色素や抗体を用いるなど、測定に高価な試薬が必要であり、また工程が多段階にわたり、検出方法が複雑である。そこで、解決すべき課題として、試薬や抗体をできるだけ使わないで、膜透過性遷移を検出することができる方法の開発が望まれる。
【0012】
本発明は、このような課題に鑑みてなされたものであり、オルガネラの新規な光学的特性の検出方法を提供することを目的とする。
また、本発明は、このオルガネラの光学的特性の検出に用いる新規な測定キットを提供することを目的とする。
【課題を解決するための手段】
【0013】
上記課題を解決し、本発明の目的を達成するため、本発明のオルガネラの光学的特性の検出方法は、オルガネラを担体に吸着させる工程を有することを特徴とする。
【0014】
ここで、オルガネラは吸着剤を用いて吸着させることができる。吸着剤としてはポリフェノール蛋白質を用いることができる。オルガネラとしてはミトコンドリアを用いることができる。担体としては、光透過部を有する容器を用いることができる。この検出方法は、オルガネラの透過率、蛍光強度、蛍光波長特性、蛍光偏光度、透過光波長特性、透過光の偏光度、または屈折率を検出する工程を含めることができる。透過光を検出する工程は、等吸収点の波長の透過光を検出する工程とすることができる。
【0015】
本発明のオルガネラの光学的特性の検出に用いる測定キットは、吸着剤と容器とを有することを特徴とする。
【0016】
ここで、吸着剤としてはポリフェノール蛋白質を用いることができる。容器としては、光透過部を有する容器を用いることができる。この測定キットには、緩衝液を含めることができる。
【0017】
本発明のオルガネラの光学的特性の検出に用いる測定キットは、吸着剤をコーティングした容器と、緩衝液とを有することを特徴とする。
【0018】
ここで、吸着剤としてはポリフェノール蛋白質を用いることができる。容器しては、光透過部を有する容器を用いることができる。
【発明の効果】
【0019】
本発明は、以下に記載されるような効果を奏する。
本発明は、オルガネラを担体に吸着させる工程を有するので、オルガネラの新規な光学的特性の検出方法を提供することができる。
【0020】
本発明は、吸着剤と容器とを有するので、オルガネラの光学的特性の検出に用いる新規な測定キットを提供することができる。
【0021】
本発明は、吸着剤をコーティングした容器と、緩衝液とを有するので、オルガネラの光学的特性の検出に用いる新規な測定キットを提供することができる。
【発明を実施するための最良の形態】
【0022】
以下、本発明を実施するための最良の形態について説明する。
まず、オルガネラの光学的特性の検出方法にかかる発明を実施するための最良の形態について説明する。
【0023】
オルガネラの光学的特性の検出方法において、最初の操作では、吸着剤を担体にコーティングする。
【0024】
担体としては、光透過部を有する容器(培養皿)を用いることができる。具体的には、光透過部を有する培養皿として、ガラスベースディッシュ、底面部がガラスのマイクロプレート、カバーガラスにシリコンを吸着させた容器などを用いることができる。
【0025】
吸着剤としてはポリフェノール蛋白質を用いることができる。吸着剤はこのポリフェノール蛋白質に限定されない。このほか、ニトロセルロース膜などを用いることができる。
【0026】
コーティングの方法は、吸着剤の希釈液を、光透過部を有する培養皿に滴下し、培養皿の光透過部に満遍なく行き渡るように培養皿をゆすり、その後所定温度で所定時間放置する。その後、培養皿の表面を超純水で洗浄する。
【0027】
コーティングの方法は、上述の方法に限定されない。このほか、吸着剤をスポット状に滴下し、その後所定温度で所定時間放置するなどの方法を採用することができる。
【0028】
つぎの操作では、吸着剤でコーティングした培養皿にオルガネラを吸着させる。
オルガネラとしては、ミトコンドリアを用いることができる。オルガネラは、このミトコンドリアに限定されない。このほか、核、小胞体、ゴルジ体、リソソーム、ペルオキシソーム、エンドソーム、葉緑体などを用いることができる。
【0029】
オルガネラの調製方法は、一般的な方法を採用することができる。具体的には、遠心分離法、密度勾配遠心分離法などを採用することができる。
【0030】
オルガネラを培養皿に吸着させる方法は、オルガネラを懸濁した緩衝液1を培養皿の光透過部に加え、培養皿の光透過部に満遍なく行き渡るようにゆすり、所定温度で所定時間放置する。つぎに、オルガネラを吸着させた培養皿表面を、緩衝液2で洗浄し付着したゴミや吸着されなかったオルガネラを洗い落とす。
【0031】
緩衝液1としては、組成(10mM Tris-HCl、250mM sucrose、0.5mM EDTA、0.1 mM dithiothreitol、1mM β-NAD、pH 7.4)に調製した緩衝液を用いることができる。緩衝液1は上述の緩衝液に限定されない。このほか、緩衝能をもつ物質としてHepesやMopsなど、浸透圧を整える物質としてmannitolやKClなど、2価の金属イオンのキレート剤としてEGTAなどを上記の代わりに用いることができる。また、目的に応じて、SucroseやDithiothreitol、EDTA、β-NAD+は除くこともできる。
【0032】
緩衝液2としては、組成(10mM Tris-HCl、250mM sucrose、0.5mM EDTA、0.1 mM dithiothreitol、pH 7.4)に調製した緩衝液を用いることができる。緩衝液2は上述の緩衝液に限定されない。このほか、緩衝能をもつ物質としてHepesやMopsなど、浸透圧を整える物質としてmannitolやKClなど、2価の金属イオンのキレート剤としてEGTAなどを上記の代わりに用いることができる。また、目的に応じて、SucroseやDithiothreitol、EDTAは除くこともできる。
【0033】
オルガネラを培養皿に吸着させる場合、温度は0 〜10 ℃の範囲にあることが好ましい。温度が0 ℃以上であると、水が凍らないという利点がある。温度が10 ℃以下であると、オルガネラの活性が低下しないという利点がある。
【0034】
オルガネラを培養皿に吸着させる場合、吸着時間は1〜4時間の範囲にあることが好ましい。吸着時間が1時間以上であると、十分量のオルガネラが担体に吸着するという利点がある。吸着時間が4時間以下であると、オルガネラの活性が低下しないという利点がある。
【0035】
オルガネラを培養皿に吸着させる方法は、上述したオルガネラを懸濁した緩衝液1を培養皿に加え、所定温度で所定時間放置する方法に限定されない。このほか、遠心操作による吸着などの方法を採用することができる。
【0036】
つぎの操作では、培養皿に吸着させたオルガネラを緩衝液2に浸し、所定温度で所定時間放置する。
【0037】
所定温度は15〜37℃の範囲内にあることが好ましい。所定温度が15℃以上であると、オルガネラの生理活性が高いという利点がある。所定温度が37℃以下であると、オルガネラの生理活性を失われにくいという利点がある。
【0038】
所定時間は5〜30分の範囲内にあることが好ましい。所定時間が5分以上であると、一定温度に達するという利点がある。所定時間が30分以下であると、生理活性が低下しにくいという利点がある。
【0039】
つぎの操作では、オルガネラの透過光を検出する。オルガネラの透過光を検出する方法を具体的に説明する。
【0040】
最初に、顕微鏡のステージに培養皿を置き、光透過部上の一つのオルガネラに目視で焦点を合わせる。
【0041】
顕微鏡としては、倒立顕微鏡、正立顕微鏡などを採用することができる。
顕微鏡の対物レンズの倍率については、後述する。
【0042】
オルガネラに焦点を合わせる方法は、上述の目視による方法に限定されるものではない。このほか焦点を合わせる方法としては、オートフォーカス機能を用いる方法やカバーガラスと対物レンズの距離を一定にする方法などを採用することができる。
【0043】
つぎに、顕微鏡の光軸方向に所定間隔ごとに所定範囲で透過光像を取得する。この理由は、基盤のたわみや対物レンズの移動、更には体積変化に伴うピントがあう位置のずれによる吸光度の変化を、対物レンズを光軸方向に動かすことで補正するためである。
【0044】
透過光を検出する波長は、ヘム蛋白質の等吸収点の波長を採用する。等吸収点の波長を採用する理由は、オルガネラ内部に存在するヘム蛋白質の酸化・還元状態が変化しても、光の透過率が変化しない波長で測定するためである。ミトコンドリアの場合は、540nmが等吸収点に相当する。
【0045】
透過光を検出する波長は、ヘム蛋白質の等吸収点の波長に限定されるものではない。このほか透過光を検出する波長としては、蛋白質や補酵素の状態が変化したり、代謝による物質の化学変化が起きたりしても吸光度が変わらない波長などを採用することができる。
【0046】
対物レンズを移動させる機器としては、ステップモーターやピエゾドライブなどを採用することができる。
【0047】
対物レンズ移動の所定間隔は0.1〜1μmの範囲内にあることが好ましい。所定間隔が0.1μm以上であると、対物レンズの移動による吸光度の変化が検出しやすいという利点がある。所定間隔が1μm以下であると、吸光度が最大になる位置を、精度よく見つけることができるという利点がある。
【0048】
対物レンズ移動の所定範囲は、焦点を合わせた位置から±1〜±200μmの範囲内にあることが好ましい。所定範囲が±1μm以上であると、カバーガラスを含む光学系の歪みによって試料が対物レンズ光軸方向に移動したり、オルガネラの膨化によって焦点の位置が異なったりしても、焦点を合わせることができるという利点がある。所定範囲が±200μm以下であると、対物レンズが移動しても、カバーガラスにぶつからないという利点がある。
【0049】
透過光像取得は、CCDカメラを用いて行う。
【0050】
CCDカメラとしては、冷却CCDカメラ、非冷却型のCCDカメラ、SITカメラなどを採用することができる。
【0051】
顕微鏡の対物レンズの倍率、およびCCDカメラの1ピクセルの大きさは、以下のように選定する。
【0052】
オルガネラの透過光検出領域を、CCDカメラの画像における、オルガネラの平均直径に対する、同心円の直径の割合を%表示した値と定義する。
【0053】
オルガネラの透過光検出領域は10〜60%の範囲内にあることが好ましい。透過光検出領域が10%以上であると、コントラストが弱い画像でも中心部を選びやすいという利点がある。透過光検出領域が60%以下であると、境界が不鮮明な場合でもオルガネラ内部の情報を取得しやすいという利点がある。
【0054】
CCDカメラの画像において、上記の透過光検出領域に含まれるピクセル数は4以上であることが好ましい。透過光検出領域に含まれるピクセル数が4以上であると、オルガネラ内部で平面的に偏らずに領域を取得できるという利点がある。
【0055】
CCDカメラによる測定においては、同じ1ピクセルの出力の再現性の差が1%以内に抑えられていることが好ましい。出力の再現性の差が1%以内であると、わずかな吸光度の変化が測定しやすいという利点がある。
【0056】
顕微鏡の光軸方向に所定間隔ごとに所定範囲で透過光像を取得する操作を、所定時間間隔で繰り返し、所定時間行う。
【0057】
透過光像を取得する所定時間間隔は1秒〜1分の範囲内にあることが好ましい。所定時間間隔が1秒以上であると、取得画像の数が少なく画像解析の時間が短縮できるという利点がある。所定時間間隔が1分以下であると、変化している途中の画像を撮影できる可能性が大きいという利点がある。
【0058】
透過光像を取得する所定時間は5〜30分の範囲内にあることが好ましい。所定時間が5分以上であると、1つのオルガネラの体積変化を、初めから終わりまで測定しやすいという利点がある。所定時間が30分以下であると、測定終了時までにオルガネラが失活しにくいという利点がある。
【0059】
必要に応じて、所定時刻に目的にあった試薬を添加・撹拌する。
試薬を添加する所定時刻は、透過光像取得開始後1〜10分の範囲内にあることが好ましい。所定時刻が1分以降であると、試薬添加前の定常状態を正確に評価しやすいという利点がある。所定時刻が10分以前であると、測定終了時でもオルガネラが生理活性を失いにくいという利点がある。
【0060】
ミトコンドリアを膨化させるために添加する試薬としては、塩化カルシウム、アトラクチロシド、CCCP、過酸化水素などの酸化剤などを採用することができる。
【0061】
透過光を検出する方法は、上記のように顕微鏡とCCDカメラを用いる方法に限定されるものではない。このほか透過光を検出する方法としては、顕微鏡とSITカメラなどを採用することができる。
【0062】
つぎの操作では、オルガネラの吸光度を算出する。
具体的には、吸光度を算出しようとする単一または複数のオルガネラを対象に、各オルガネラについて、各時刻について、以下の方法により透過光強度比を求め、この透過光強度比に基づき吸光度を求める。
【0063】
透過光強度としては、透過光像の輝度からCCDカメラに光が全くあたっていないときの出力値を減じた値を採用した。この値は、実際の透過光の強さに比例する。
【0064】
単一のオルガネラについて、そのオルガネラの透過光検出領域内に含まれる全てのピクセルの輝度を測定し、これらの算術平均値をそのオルガネラの透過光強度とする。その理由は、算術平均を用いることにより、ノイズの値が軽減されるからである。
【0065】
また、基準となる透過光強度は、そのオルガネラの近傍であって、他のオルガネラが存在しない領域の平均の輝度を採用する。
【0066】
単一のオルガネラについて、基準となる透過光強度に対するそのオルガネラの透過光強度の比率を、そのオルガネラの透過光強度比と定義する。この透過光強度比を、対物レンズ移動の所定間隔ごとに求める。
【0067】
そして、求められた透過光強度比のうち、もっとも小さな値をそのオルガネラの透過率とする。その理由は、透過光強度比が最小になる点が、そのオルガネラの像のコントラストが最も良い点、すなわち焦点があった位置になるからである。
【0068】
単一のオルガネラの吸光度は次の式により求める。
吸光度=−log(透過率)
これにより、単一のオルガネラの吸光度について、その時間的な変化を測定することができる。
【0069】
以上、オルガネラの光学的特性として、オルガネラの透過率について説明した。オルガネラの光学的特性は、オルガネラの透過率に限定されるものではない。このほかオルガネラの光学的特性としては、蛍光強度、蛍光波長特性、蛍光偏光度、透過光波長特性、透過光の偏光度、屈折率などを挙げることができる。
【0070】
また、単一のオルガネラについて、次のような事象を測定することができる。
【0071】
核でのmRNAの合成、また、転写制御因子間の蛋白質間相互作用
核における遺伝情報の発現の指標となるmRNAの合成や、mRNAの合成を制御する転写制御因子間の相互作用を測定することで、遺伝子の発現メカニズムを調べることができる。
【0072】
小胞体における蛋白質合成、およびmRNAやtRNAと蛋白質合成系の蛋白質との相互作用
粗面小胞体の表面に結合しているリボソームでは、核で合成されたmRNAの情報に基づき、tRNAの運んできたアミノ酸をつなげて蛋白質を合成する。このときの、mRNA やtRNAと蛋白質合成系の蛋白質との相互作用を測定することで、蛋白質合成のメカニズムを知ることができる。
【0073】
ミトコンドリアからの細胞死誘導因子の放出
ミトコンドリア外膜の内側に存在する細胞死誘導因子は、ミトコンドリアの体積が増加すると外膜が損傷を受け、ミトコンドリアの外側に放出される。この結果、細胞では細胞死の過程が不可逆的に進行する。このミトコンドリア細胞死誘導因子がミトコンドリアから放出されるメカニズムを調べることができる。
【0074】
リソソームにおける蛋白質分解とpHや体積の変化
細胞外から取り込んだ蛋白質などをリソソームでは分解し、細胞の栄養などにしている。また、リソソームでは内部を酸性にすることで、蛋白質を分解する酵素の働きを活発にしている。この、リソソームで蛋白質が分解される過程や、その内部のpHの変化及び、分解された物質の出入りにともなう浸透圧の変化が起こす体積の変化などが観察できる。
【0075】
以上のことから、本発明を実施するための最良の形態によれば、オルガネラを担体に吸着させる工程を有するので、オルガネラの新規な光学的特性の検出方法を提供することができる。
【0076】
なお、本発明は上述の発明を実施するための最良の形態に限らず本発明の要旨を逸脱することなくその他種々の構成を採り得ることはもちろんである。
【0077】
つぎに、オルガネラの光学的特性の検出に用いる測定キットにかかる発明を実施するための最良の形態について説明する。
【0078】
測定キットには、吸着剤が含まれる。吸着剤は、上述したとおりである。
測定キットには、容器が含まれる。容器は、上述したとおりである。容器は、あらかじめ吸着剤をコーティングしたものであってもよい。
測定キットには、緩衝液1が含まれる。緩衝液1は、上述したとおりである。
測定キットには、緩衝液2が含まれる。緩衝液2は、上述したとおりである。
【0079】
測定キットは、吸着剤と容器とを有することが好ましい。また、測定キットは、さらに、緩衝液1および緩衝液2を有することがさらに好ましい。
【0080】
測定キットは、吸着剤をコーティングした容器、緩衝液1、および緩衝液2を有することが好ましい。
【0081】
以上のことから、本発明を実施するための最良の形態によれば、吸着剤と容器とを有するので、オルガネラの光学的特性の検出に用いる新規な測定キットを提供することができる。
【0082】
また、本発明を実施するための最良の形態によれば、吸着剤をコーティングした容器と、緩衝液とを有するので、オルガネラの光学的特性の検出に用いる新規な測定キットを提供することができる。
【0083】
なお、本発明は上述の発明を実施するための最良の形態に限らず本発明の要旨を逸脱することなくその他種々の構成を採り得ることはもちろんである。
【実施例】
【0084】
つぎに、本発明にかかる実施例について具体的に説明する。ただし、本発明はこれら実施例に限定されるものではないことはもちろんである。
【0085】
実施例1
吸着ミトコンドリアの膨潤(体積増大)の測定について説明する。
最初に、ポリフェノール蛋白質(BD Bioscience社、BD cell-TakTMCell and Tissue Adhesive)を100 mM NaHCO3水溶液で50倍に希釈する。つぎに、ガラスベースディッシュ(旭テクノグラス社製、ガラスベースディッシュ)の底面中央のカバーガラス部分(直径35mmの培養皿の底面中央の直径12 mmの部分)に、上記で用意した希釈ポリフェノール蛋白質水溶液を200μlのせ、室温で30分間放置する。つぎに、ポリフェノール蛋白質をのせたガラス面を超純水で3回洗浄する。
【0086】
ガラスベースディッシュのガラス面に、緩衝液1(10mM Tris-HCl、250mM sucrose、0.5mM EDTA、0.1 mM dithiothreitol、1mM β-NAD、pH 7.4)で懸濁したミトコンドリア懸濁液(蛋白質0.02mg/ml)を200μlにのせ、氷上で2〜3時間放置する。つぎに、ガラスに吸着していないミトコンドリアを、4℃の緩衝液2(10mM Tris-HCl、250mM sucrose、0.5mM EDTA、0.1mM dithiothreitol、pH 7.4)で洗浄して取り除く。つぎに、ガラスに吸着したミトコンドリアを緩衝液2に浸し、30分間室温で放置する。
【0087】
顕微鏡(オリンパス光学社製、IX-71)のステージ上にミトコンドリアが吸着したディッシュを静置し、吸着しているミトコンドリアに目視で焦点をあわせる。対物レンズを移動させる機器(Ludl社製、Z軸ステップモーター)を用いて、目視で焦点をあわせた位置を中心(原点)として、光軸方向に±5μmの範囲で1μmごとに対物レンズを動かし、それぞれの対物レンズの位置でミトコンドリアの透過光像を取得する。1分毎に20分間この操作を繰り返す。
【0088】
測定には、倍率が40倍以上の対物レンズと1ピクセルのサイズが6.9μm x 6.9μmの冷却CCDカメラ(Roper Industries社製、PentaMax 1317K)を用いる。用いる波長は、ミトコンドリアに含まれる物質の酸化還元状態の変化で吸光度が変化しない、等吸収点(540nm)である。
【0089】
1分毎に取得した各ミトコンドリアの画像で、ミトコンドリアのある場所の透過光強度とその近くのミトコンドリアのない場所の透過光強度の比(ミトコンドリアの箇所の透過光強度/ミトコンドリアのない場所の透過光強度)を求める。なお、実施例においては、各ミトコンドリア内で一番暗くなる4ピクセルの領域をとり、その4ピクセルの透過光強度の平均値を当該ミトコンドリアのその画像での透過光強度とする。なお、ミトコンドリアの透過光検出領域は15%である。また、この透過光検出領域に含まれるピクセル数は4である。
【0090】
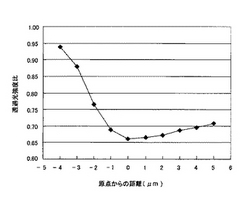
縦軸に透過光強度比、横軸に光軸に沿った目盛り上の位置をとり、グラフにおける比の極小値を、当該ミトコンドリアに対するその時刻の光の透過率として求める。図1は、光軸方向に対物レンズを動かした時の透過光強度比の変化を示す図である。測定中にミトコンドリアを貼り付けたガラスが少しずつ撓み、この値が見かけ上変わる。そこで、対物レンズを光軸方向(ガラスに対して垂直方向)に動かして測定し、透過光強度比の極小値を求めることにより、ガラスのたわみ、ミトコンドリアの揺動・体積変化、対物レンズの位置のずれなどによる透過光強度の変化を補正する。
【0091】
縦軸に透過率から求めた吸光度、横軸に時間をとり、膜透過性遷移による吸光度の減少を検出する。図2は、ミトコンドリアの吸光度変化(平均値)を示す図である。吸光度は、単一のミトコンドリア50個についてそれぞれ測定した吸光度の平均値である。図2において、Aの線が実施例1の結果を示すものである。
【0092】
実施例2
吸着ミトコンドリアのCa2+添加による膨潤(体積増大)の測定について説明する。
測定開始300秒で50μMのCa2+(塩化カルシウム)を添加し、膨化を誘導した。これ以外の条件は、実施例1と同様である。図2のBの線が実施例2の結果を示すものである。図2の矢印の示してある時刻にCa2+を添加した。
【0093】
実施例3
膨化の阻害剤(シクロスポリンA、2μM)の存在下で、測定開始300秒で50μMのCa2+を添加した。これ以外の条件は、実施例1と同様である。図2のCの線が実施例3の結果を示すものである。図2の矢印の示してある時刻にCa2+を添加した。
【0094】
実施例4
測定開始300秒で50μMのCa2+を添加し、膨化を誘導した。条件は実施例2と同様である。ただし、単一のミトコンドリア3つについて、吸光度を測定した。図3は、ミトコンドリアの吸光度変化(単一)を示す図である。図3の矢印の示してある時刻にCa2+を添加した。図3において、Aの線はCa2+添加後すぐに膨化を始めたミトコンドリアを示している。Bの線は、Ca2+添加後少ししてから膨化を始めたミトコンドリアを示している。Cの線は、Ca2+を添加しても膨化しなかったミトコンドリアを示している。
【0095】
以上のことから、本実施例によれば、以下に示すような効果が得られる。
【0096】
オルガネラの物質、イオン、水の輸送に関わっている蛋白質の機能解明(創薬の新しいターゲットの発見)
オルガネラの体積は小さく、オルガネラ蛋白質、特に物質やイオン輸送に関わる蛋白質の働きによる浸透圧の変化により随時変化し、その変化がオルガネラの活性を調節しているとも考えられている。そのため、本発明によりこれらの蛋白質の機能を高い精度で測定することは極めて有用である。ゲノムの解読によって蛋白質のアミノ酸配列が解明し、また、プロテオーム解析の技術が発展し蛋白質の発現プロファイルが分かるようになった現在、蛋白質の生理的機能を効率よく測定する方法の開発が求められている。しかしながら、オルガネラの蛋白質、特に物質やイオン輸送に関わる蛋白質に関しては、その蛋白質が関与する生理現象を高い精度で測定する方法が存在しなかったため、機能が未知の蛋白質が多く存在すると考えられており、本方法はそれらの問題を解決するのに役立つことが期待される。オルガネラは細胞にとって必須の役割を果たしていることから、これらは、人の病気や健康に深く関わることも考えられ、創薬の新しいターゲットとして期待される。
【0097】
細胞死抑制剤の効率的スクリーニング
従来法では、薬物の効果を調べるのに数億から数十億個という多くのミトコンドリア必要とした。本方法は、原理的には1個のミトコンドリアで薬物の効果を測定できるため、薬物の影響を調べるのに使用するミトコンドリアの数を、大幅に減少させることができる。そのため、多くの薬物の中から、細胞死の原因となるミトコンドリアの体積の増加を抑制する薬物を効率的に見つける作業に役立つ。特に、ミトコンドリアは細胞死の制御を行っている器官であるため、抗がん剤などの細胞死を誘導する薬物や、脳梗塞や心筋梗塞による虚血再還流障害時の細胞死を軽減する薬物を見つけるのに、本方法が役立つことが期待される。
【0098】
細胞死抑制・促進蛋白質の同定
病気には、細胞死が関わるものが少なくない。細胞死を起こす細胞内信号の多くはミトコンドリアを経由して下流に伝わるので、ミトコンドリアは細胞死において重要な位置を占める。本発明の実施例で挙げたミトコンドリア膜透過性遷移は、細胞死の信号伝達の際にミトコンドリアに生じる変化であり、細胞死を不可逆な過程にする現象であることが知られている。そのため、ミトコンドリア膜透過性遷移の阻害は細胞死を抑制することが多く、細胞死を制御する薬物を開発する上で、膜透過性遷移の検出は極めて有効な方法である。本発明の実施例で挙げた膜透過性遷移の検出方法は、従来法と比べ高感度・簡易・迅速に膜透過性遷移を検出することを可能にしており、細胞死に影響を与える薬物を調べる上で極めて有効な有用な方法である。参考までに、細胞死が関与する疾患を挙げると、アルツハイマー病、脊髄性筋萎縮症(spinal muscular artophy)、筋萎縮性側索硬化症(ALS)、パーキンソン病、ハンチントン病、網膜色素変性症や緑内障、小脳変性、新生児黄疸などの神経変性疾患、筋ジストロフィー、脳卒中等による脳虚血及びその後の遅発性神経細胞死(DND)、心筋梗塞等による虚血性心疾患(心筋虚血と再灌流傷害)、ウイルス性心筋炎、自己免疫性心筋炎(拡張型心筋症や慢性心筋炎等)、肥大心および不全心にみられる心筋障害/細胞死、不整脈源性右室心筋症、アルコール性肝炎やウイルス性肝炎、糸球体腎炎や溶血性尿毒症症候群などの腎疾患、後天性免疫不全症候群(AIDS)、中毒性表皮壊死融解(toxic epidermal necrolysis;TEN)、多形滲出性紅斑などの炎症性皮膚疾患や脱毛症ならびに移植片宿主反応、さらには放射線による障害や、抗癌剤・抗ウイルス薬等の他、アジ化ナトリウム、青酸カリウム等の毒性薬物による障害、敗血症、再生不良性貧血などの骨髄異形成症、インスリン依存性糖尿病、クロイツフェルト・ヤコブ病などのプリオン病などがある。また、細胞死が阻害された疾患として、カポジ肉腫などの癌が挙げられる。
【0099】
疾患に加えて、細胞死は医療や研究の妨げとなっている。例えば、臓器移植の血液再還流時には、活性酸素や化学物質による細胞死や拒絶反応による細胞死が生じる。また、初代培養細胞は細胞が臓器にあるときの性質をもった研究上有用な細胞であるが、これらは細胞死を起こしやすく、培養の難しいものも少なくない。ミトコンドリアを標的とした細胞死抑制剤の開発は、これらの問題を克服するのにも役立つ。
【0100】
ミトコンドリアは細胞死を起こす器官であるだけではなく、その機能異常が多くの疾患と関連することが報告されている。例えば、老化、糖尿病、アルコール性肝炎、パーキンソン病、慢性疲労、肥満などである。本発明の実施例で示した膜蛋白質輸送活性の測定方法は、ミトコンドリアの機能異常を極めて高い精度で検出することを可能にするものであり、上記の疾病の予防、症状の軽減などにつながる化学物質の検出に有用である。
【産業上の利用可能性】
【0101】
本発明から考えられる他の利用可能性、応用分野などを説明する。
本発明を利用することにより、オルガネラを標的とする薬物の開発が効率的になり、製薬会社や食品会社の競争力が増すことが期待される。また、本発明の実施に必要なキットを作成し、医薬品開発業者だけはなく、多くの医療関係者や基礎研究者等に販売することができる。現在、ミトコンドリア活性測定には、ミトコンドリア膜電位測定試薬、シトクロム酸化酵素活性測定試薬、ATP定量試薬などが市販されている。本発明の製品化により上記の製品を用いた測定方法を内包する形でも、幅広く提供できるため、ミトコンドリアを標的とした市場規模は十分にある。
【図面の簡単な説明】
【0102】
【図1】光軸方向に対物レンズを動かした時の透過光強度比の変化を示す図である。
【図2】ミトコンドリアの吸光度変化(平均値)を示す図である。
【図3】ミトコンドリアの吸光度変化(単一)を示す図である。
【技術分野】
【0001】
本発明は、オルガネラの新規な光学的特性の検出方法に関する。また、本発明は、このオルガネラの光学的特性の検出に用いる新規な測定キットに関する。
【背景技術】
【0002】
従来、オルガネラで起こる物質やイオンの出入りによる、オルガネラの体積変化を測定する方法が知られている。
【0003】
オルガネラの体積変化を測定する1つの方法としては、緩衝液に懸濁したオルガネラの吸光度あるいは光散乱を測定する方法がある。ミトコンドリアの膜透過性遷移孔の形成による体積変化に関しては、Zamzamiらの解説が報告されている(非特許文献1参照。)。
【0004】
オルガネラの体積変化を測定する他の方法としては、電子顕微鏡によりオルガネラの像を撮影する方法がある。この方法は、広範囲に用いられており、多くの教科書や論文に記載されている(例えば、非特許文献2参照。)。
【0005】
ミトコンドリア内膜に生じる膜透過性遷移孔の形成を検出する方法としては、上述のオルガネラの体積変化を測定する方法以外に、以下のような方法が知られている。
【0006】
1つの方法としては、ミトコンドリア膜電位の消失を検出する方法がある(例えば、非特許文献1参照。)。
他の方法としては、ミトコンドリア内・外のカルシウムイオン濃度測定による検出方法がある(例えば、特許文献1参照。)。
他の方法としては、ミトコンドリアからのアポトーシス誘導因子(シトクロムcなど)の放出を検出する方法がある(例えば、非特許文献3参照。)。
【0007】
なお、発明者は、本発明に関連する技術内容を開示している(例えば、非特許文献4〜8参照。)。
【特許文献1】特開2002-247999
【非特許文献1】Zamzami, N.他3名 (2001)、Methods in Cell Biology 65 (Mitochondria) Edited by Pon, L.A. and Schon E.A., 147-158)
【非特許文献2】Shinohara Y, Bandou S, KoraS, Kitamura S, Inazumi S, Terada H. 1998. Cationic uncouplers of oxidative phosphorylationare inducers of mitochondrial permeability transition. FEBS Letters. 428: 89-92
【非特許文献3】石坂瑠美 細胞質へのシトクロムc遊離の測定、2001、新ミトコンドリア学(共立出版、内海耕慥・井上正康 監修
【非特許文献4】Nakayama, S., T. Sakuyama, S. Mitaku, and Y. Ohta. 2002. Fluorescence imaging of metabolic responses in single mitochondria. Biochem. Biophys. Res. Commun.290:23-28
【非特許文献5】Hattori, T., Watanabe, K., Uechi, Y., Yoshioka, H. and Ohta Y. 2005, “Repetitive transient depolarizations of the inner mitochondrial membrane induced by proton pumping. “ Biophys. J. 88,2340-2349
【非特許文献6】太田善浩 生物における物理の有用性−物理は生命現象の理解にいかに役立つか? 2004、数理科学42:79-83
【非特許文献7】太田善浩、服部友裕 2002、“単一ミトコンドリアの膜電位計測” 日本物理学会誌 57: 592-595
【非特許文献8】渡辺功一、作山孝法、フーラハン美由紀、太田善浩、1999、“蛍光顕微鏡による単離ミトコンドリアの観察方法” 生物物理39:258-260
【発明の開示】
【発明が解決しようとする課題】
【0008】
しかしながら、上述したミトコンドリア内膜に生じる膜透過性遷移孔の形成を検出する方法には、以下に述べる問題点がある。
【0009】
オルガネラの体積変化を測定する方法の問題点を説明する。
オルガネラの体積変化を測定する1つの方法としての、緩衝液に懸濁したオルガネラの吸光度あるいは光散乱を測定する方法には、つぎの問題点がある。すなわち、測定に多量の試料が必要であるため、遺伝子改変等が行いやすい継代培養細胞から単離したオルガネラでは試料が少なく測定が困難である。また、個々のオルガネラで異なったタイミングで生じる体積変化でも全て平均化されるため、体積が変化しても検出されない場合がある。また、オルガネラで生じる他の現象と体積変化を同じオルガネラで測定できないので、両者の関係を正確には同定できない。そこで、解決すべき課題として、単一のオルガネラの体積を、時々刻々測定することができる方法の開発が望まれる。
【0010】
オルガネラの体積変化を測定する他の方法としての、電子顕微鏡によりオルガネラの像を撮影する方法には、つぎの問題点がある。すなわち、水分を除去した測定になるため、体積の経時変化を捉えることができない。そこで、解決すべき課題として、緩衝液中でオルガネラが活動している状態で、体積変化を測定することができる方法の開発が望まれる。
【0011】
上述のオルガネラの体積変化を測定する方法以外の方法、すなわち、ミトコンドリア膜電位の消失を検出する方法、ミトコンドリア内・外のカルシウムイオン(以下、Ca2+)濃度測定による検出方法、および、ミトコンドリアからのアポトーシス誘導因子(シトクロムcなど)の放出を検出する方法には、つぎの問題点がある。すなわち、蛍光色素や抗体を用いるなど、測定に高価な試薬が必要であり、また工程が多段階にわたり、検出方法が複雑である。そこで、解決すべき課題として、試薬や抗体をできるだけ使わないで、膜透過性遷移を検出することができる方法の開発が望まれる。
【0012】
本発明は、このような課題に鑑みてなされたものであり、オルガネラの新規な光学的特性の検出方法を提供することを目的とする。
また、本発明は、このオルガネラの光学的特性の検出に用いる新規な測定キットを提供することを目的とする。
【課題を解決するための手段】
【0013】
上記課題を解決し、本発明の目的を達成するため、本発明のオルガネラの光学的特性の検出方法は、オルガネラを担体に吸着させる工程を有することを特徴とする。
【0014】
ここで、オルガネラは吸着剤を用いて吸着させることができる。吸着剤としてはポリフェノール蛋白質を用いることができる。オルガネラとしてはミトコンドリアを用いることができる。担体としては、光透過部を有する容器を用いることができる。この検出方法は、オルガネラの透過率、蛍光強度、蛍光波長特性、蛍光偏光度、透過光波長特性、透過光の偏光度、または屈折率を検出する工程を含めることができる。透過光を検出する工程は、等吸収点の波長の透過光を検出する工程とすることができる。
【0015】
本発明のオルガネラの光学的特性の検出に用いる測定キットは、吸着剤と容器とを有することを特徴とする。
【0016】
ここで、吸着剤としてはポリフェノール蛋白質を用いることができる。容器としては、光透過部を有する容器を用いることができる。この測定キットには、緩衝液を含めることができる。
【0017】
本発明のオルガネラの光学的特性の検出に用いる測定キットは、吸着剤をコーティングした容器と、緩衝液とを有することを特徴とする。
【0018】
ここで、吸着剤としてはポリフェノール蛋白質を用いることができる。容器しては、光透過部を有する容器を用いることができる。
【発明の効果】
【0019】
本発明は、以下に記載されるような効果を奏する。
本発明は、オルガネラを担体に吸着させる工程を有するので、オルガネラの新規な光学的特性の検出方法を提供することができる。
【0020】
本発明は、吸着剤と容器とを有するので、オルガネラの光学的特性の検出に用いる新規な測定キットを提供することができる。
【0021】
本発明は、吸着剤をコーティングした容器と、緩衝液とを有するので、オルガネラの光学的特性の検出に用いる新規な測定キットを提供することができる。
【発明を実施するための最良の形態】
【0022】
以下、本発明を実施するための最良の形態について説明する。
まず、オルガネラの光学的特性の検出方法にかかる発明を実施するための最良の形態について説明する。
【0023】
オルガネラの光学的特性の検出方法において、最初の操作では、吸着剤を担体にコーティングする。
【0024】
担体としては、光透過部を有する容器(培養皿)を用いることができる。具体的には、光透過部を有する培養皿として、ガラスベースディッシュ、底面部がガラスのマイクロプレート、カバーガラスにシリコンを吸着させた容器などを用いることができる。
【0025】
吸着剤としてはポリフェノール蛋白質を用いることができる。吸着剤はこのポリフェノール蛋白質に限定されない。このほか、ニトロセルロース膜などを用いることができる。
【0026】
コーティングの方法は、吸着剤の希釈液を、光透過部を有する培養皿に滴下し、培養皿の光透過部に満遍なく行き渡るように培養皿をゆすり、その後所定温度で所定時間放置する。その後、培養皿の表面を超純水で洗浄する。
【0027】
コーティングの方法は、上述の方法に限定されない。このほか、吸着剤をスポット状に滴下し、その後所定温度で所定時間放置するなどの方法を採用することができる。
【0028】
つぎの操作では、吸着剤でコーティングした培養皿にオルガネラを吸着させる。
オルガネラとしては、ミトコンドリアを用いることができる。オルガネラは、このミトコンドリアに限定されない。このほか、核、小胞体、ゴルジ体、リソソーム、ペルオキシソーム、エンドソーム、葉緑体などを用いることができる。
【0029】
オルガネラの調製方法は、一般的な方法を採用することができる。具体的には、遠心分離法、密度勾配遠心分離法などを採用することができる。
【0030】
オルガネラを培養皿に吸着させる方法は、オルガネラを懸濁した緩衝液1を培養皿の光透過部に加え、培養皿の光透過部に満遍なく行き渡るようにゆすり、所定温度で所定時間放置する。つぎに、オルガネラを吸着させた培養皿表面を、緩衝液2で洗浄し付着したゴミや吸着されなかったオルガネラを洗い落とす。
【0031】
緩衝液1としては、組成(10mM Tris-HCl、250mM sucrose、0.5mM EDTA、0.1 mM dithiothreitol、1mM β-NAD、pH 7.4)に調製した緩衝液を用いることができる。緩衝液1は上述の緩衝液に限定されない。このほか、緩衝能をもつ物質としてHepesやMopsなど、浸透圧を整える物質としてmannitolやKClなど、2価の金属イオンのキレート剤としてEGTAなどを上記の代わりに用いることができる。また、目的に応じて、SucroseやDithiothreitol、EDTA、β-NAD+は除くこともできる。
【0032】
緩衝液2としては、組成(10mM Tris-HCl、250mM sucrose、0.5mM EDTA、0.1 mM dithiothreitol、pH 7.4)に調製した緩衝液を用いることができる。緩衝液2は上述の緩衝液に限定されない。このほか、緩衝能をもつ物質としてHepesやMopsなど、浸透圧を整える物質としてmannitolやKClなど、2価の金属イオンのキレート剤としてEGTAなどを上記の代わりに用いることができる。また、目的に応じて、SucroseやDithiothreitol、EDTAは除くこともできる。
【0033】
オルガネラを培養皿に吸着させる場合、温度は0 〜10 ℃の範囲にあることが好ましい。温度が0 ℃以上であると、水が凍らないという利点がある。温度が10 ℃以下であると、オルガネラの活性が低下しないという利点がある。
【0034】
オルガネラを培養皿に吸着させる場合、吸着時間は1〜4時間の範囲にあることが好ましい。吸着時間が1時間以上であると、十分量のオルガネラが担体に吸着するという利点がある。吸着時間が4時間以下であると、オルガネラの活性が低下しないという利点がある。
【0035】
オルガネラを培養皿に吸着させる方法は、上述したオルガネラを懸濁した緩衝液1を培養皿に加え、所定温度で所定時間放置する方法に限定されない。このほか、遠心操作による吸着などの方法を採用することができる。
【0036】
つぎの操作では、培養皿に吸着させたオルガネラを緩衝液2に浸し、所定温度で所定時間放置する。
【0037】
所定温度は15〜37℃の範囲内にあることが好ましい。所定温度が15℃以上であると、オルガネラの生理活性が高いという利点がある。所定温度が37℃以下であると、オルガネラの生理活性を失われにくいという利点がある。
【0038】
所定時間は5〜30分の範囲内にあることが好ましい。所定時間が5分以上であると、一定温度に達するという利点がある。所定時間が30分以下であると、生理活性が低下しにくいという利点がある。
【0039】
つぎの操作では、オルガネラの透過光を検出する。オルガネラの透過光を検出する方法を具体的に説明する。
【0040】
最初に、顕微鏡のステージに培養皿を置き、光透過部上の一つのオルガネラに目視で焦点を合わせる。
【0041】
顕微鏡としては、倒立顕微鏡、正立顕微鏡などを採用することができる。
顕微鏡の対物レンズの倍率については、後述する。
【0042】
オルガネラに焦点を合わせる方法は、上述の目視による方法に限定されるものではない。このほか焦点を合わせる方法としては、オートフォーカス機能を用いる方法やカバーガラスと対物レンズの距離を一定にする方法などを採用することができる。
【0043】
つぎに、顕微鏡の光軸方向に所定間隔ごとに所定範囲で透過光像を取得する。この理由は、基盤のたわみや対物レンズの移動、更には体積変化に伴うピントがあう位置のずれによる吸光度の変化を、対物レンズを光軸方向に動かすことで補正するためである。
【0044】
透過光を検出する波長は、ヘム蛋白質の等吸収点の波長を採用する。等吸収点の波長を採用する理由は、オルガネラ内部に存在するヘム蛋白質の酸化・還元状態が変化しても、光の透過率が変化しない波長で測定するためである。ミトコンドリアの場合は、540nmが等吸収点に相当する。
【0045】
透過光を検出する波長は、ヘム蛋白質の等吸収点の波長に限定されるものではない。このほか透過光を検出する波長としては、蛋白質や補酵素の状態が変化したり、代謝による物質の化学変化が起きたりしても吸光度が変わらない波長などを採用することができる。
【0046】
対物レンズを移動させる機器としては、ステップモーターやピエゾドライブなどを採用することができる。
【0047】
対物レンズ移動の所定間隔は0.1〜1μmの範囲内にあることが好ましい。所定間隔が0.1μm以上であると、対物レンズの移動による吸光度の変化が検出しやすいという利点がある。所定間隔が1μm以下であると、吸光度が最大になる位置を、精度よく見つけることができるという利点がある。
【0048】
対物レンズ移動の所定範囲は、焦点を合わせた位置から±1〜±200μmの範囲内にあることが好ましい。所定範囲が±1μm以上であると、カバーガラスを含む光学系の歪みによって試料が対物レンズ光軸方向に移動したり、オルガネラの膨化によって焦点の位置が異なったりしても、焦点を合わせることができるという利点がある。所定範囲が±200μm以下であると、対物レンズが移動しても、カバーガラスにぶつからないという利点がある。
【0049】
透過光像取得は、CCDカメラを用いて行う。
【0050】
CCDカメラとしては、冷却CCDカメラ、非冷却型のCCDカメラ、SITカメラなどを採用することができる。
【0051】
顕微鏡の対物レンズの倍率、およびCCDカメラの1ピクセルの大きさは、以下のように選定する。
【0052】
オルガネラの透過光検出領域を、CCDカメラの画像における、オルガネラの平均直径に対する、同心円の直径の割合を%表示した値と定義する。
【0053】
オルガネラの透過光検出領域は10〜60%の範囲内にあることが好ましい。透過光検出領域が10%以上であると、コントラストが弱い画像でも中心部を選びやすいという利点がある。透過光検出領域が60%以下であると、境界が不鮮明な場合でもオルガネラ内部の情報を取得しやすいという利点がある。
【0054】
CCDカメラの画像において、上記の透過光検出領域に含まれるピクセル数は4以上であることが好ましい。透過光検出領域に含まれるピクセル数が4以上であると、オルガネラ内部で平面的に偏らずに領域を取得できるという利点がある。
【0055】
CCDカメラによる測定においては、同じ1ピクセルの出力の再現性の差が1%以内に抑えられていることが好ましい。出力の再現性の差が1%以内であると、わずかな吸光度の変化が測定しやすいという利点がある。
【0056】
顕微鏡の光軸方向に所定間隔ごとに所定範囲で透過光像を取得する操作を、所定時間間隔で繰り返し、所定時間行う。
【0057】
透過光像を取得する所定時間間隔は1秒〜1分の範囲内にあることが好ましい。所定時間間隔が1秒以上であると、取得画像の数が少なく画像解析の時間が短縮できるという利点がある。所定時間間隔が1分以下であると、変化している途中の画像を撮影できる可能性が大きいという利点がある。
【0058】
透過光像を取得する所定時間は5〜30分の範囲内にあることが好ましい。所定時間が5分以上であると、1つのオルガネラの体積変化を、初めから終わりまで測定しやすいという利点がある。所定時間が30分以下であると、測定終了時までにオルガネラが失活しにくいという利点がある。
【0059】
必要に応じて、所定時刻に目的にあった試薬を添加・撹拌する。
試薬を添加する所定時刻は、透過光像取得開始後1〜10分の範囲内にあることが好ましい。所定時刻が1分以降であると、試薬添加前の定常状態を正確に評価しやすいという利点がある。所定時刻が10分以前であると、測定終了時でもオルガネラが生理活性を失いにくいという利点がある。
【0060】
ミトコンドリアを膨化させるために添加する試薬としては、塩化カルシウム、アトラクチロシド、CCCP、過酸化水素などの酸化剤などを採用することができる。
【0061】
透過光を検出する方法は、上記のように顕微鏡とCCDカメラを用いる方法に限定されるものではない。このほか透過光を検出する方法としては、顕微鏡とSITカメラなどを採用することができる。
【0062】
つぎの操作では、オルガネラの吸光度を算出する。
具体的には、吸光度を算出しようとする単一または複数のオルガネラを対象に、各オルガネラについて、各時刻について、以下の方法により透過光強度比を求め、この透過光強度比に基づき吸光度を求める。
【0063】
透過光強度としては、透過光像の輝度からCCDカメラに光が全くあたっていないときの出力値を減じた値を採用した。この値は、実際の透過光の強さに比例する。
【0064】
単一のオルガネラについて、そのオルガネラの透過光検出領域内に含まれる全てのピクセルの輝度を測定し、これらの算術平均値をそのオルガネラの透過光強度とする。その理由は、算術平均を用いることにより、ノイズの値が軽減されるからである。
【0065】
また、基準となる透過光強度は、そのオルガネラの近傍であって、他のオルガネラが存在しない領域の平均の輝度を採用する。
【0066】
単一のオルガネラについて、基準となる透過光強度に対するそのオルガネラの透過光強度の比率を、そのオルガネラの透過光強度比と定義する。この透過光強度比を、対物レンズ移動の所定間隔ごとに求める。
【0067】
そして、求められた透過光強度比のうち、もっとも小さな値をそのオルガネラの透過率とする。その理由は、透過光強度比が最小になる点が、そのオルガネラの像のコントラストが最も良い点、すなわち焦点があった位置になるからである。
【0068】
単一のオルガネラの吸光度は次の式により求める。
吸光度=−log(透過率)
これにより、単一のオルガネラの吸光度について、その時間的な変化を測定することができる。
【0069】
以上、オルガネラの光学的特性として、オルガネラの透過率について説明した。オルガネラの光学的特性は、オルガネラの透過率に限定されるものではない。このほかオルガネラの光学的特性としては、蛍光強度、蛍光波長特性、蛍光偏光度、透過光波長特性、透過光の偏光度、屈折率などを挙げることができる。
【0070】
また、単一のオルガネラについて、次のような事象を測定することができる。
【0071】
核でのmRNAの合成、また、転写制御因子間の蛋白質間相互作用
核における遺伝情報の発現の指標となるmRNAの合成や、mRNAの合成を制御する転写制御因子間の相互作用を測定することで、遺伝子の発現メカニズムを調べることができる。
【0072】
小胞体における蛋白質合成、およびmRNAやtRNAと蛋白質合成系の蛋白質との相互作用
粗面小胞体の表面に結合しているリボソームでは、核で合成されたmRNAの情報に基づき、tRNAの運んできたアミノ酸をつなげて蛋白質を合成する。このときの、mRNA やtRNAと蛋白質合成系の蛋白質との相互作用を測定することで、蛋白質合成のメカニズムを知ることができる。
【0073】
ミトコンドリアからの細胞死誘導因子の放出
ミトコンドリア外膜の内側に存在する細胞死誘導因子は、ミトコンドリアの体積が増加すると外膜が損傷を受け、ミトコンドリアの外側に放出される。この結果、細胞では細胞死の過程が不可逆的に進行する。このミトコンドリア細胞死誘導因子がミトコンドリアから放出されるメカニズムを調べることができる。
【0074】
リソソームにおける蛋白質分解とpHや体積の変化
細胞外から取り込んだ蛋白質などをリソソームでは分解し、細胞の栄養などにしている。また、リソソームでは内部を酸性にすることで、蛋白質を分解する酵素の働きを活発にしている。この、リソソームで蛋白質が分解される過程や、その内部のpHの変化及び、分解された物質の出入りにともなう浸透圧の変化が起こす体積の変化などが観察できる。
【0075】
以上のことから、本発明を実施するための最良の形態によれば、オルガネラを担体に吸着させる工程を有するので、オルガネラの新規な光学的特性の検出方法を提供することができる。
【0076】
なお、本発明は上述の発明を実施するための最良の形態に限らず本発明の要旨を逸脱することなくその他種々の構成を採り得ることはもちろんである。
【0077】
つぎに、オルガネラの光学的特性の検出に用いる測定キットにかかる発明を実施するための最良の形態について説明する。
【0078】
測定キットには、吸着剤が含まれる。吸着剤は、上述したとおりである。
測定キットには、容器が含まれる。容器は、上述したとおりである。容器は、あらかじめ吸着剤をコーティングしたものであってもよい。
測定キットには、緩衝液1が含まれる。緩衝液1は、上述したとおりである。
測定キットには、緩衝液2が含まれる。緩衝液2は、上述したとおりである。
【0079】
測定キットは、吸着剤と容器とを有することが好ましい。また、測定キットは、さらに、緩衝液1および緩衝液2を有することがさらに好ましい。
【0080】
測定キットは、吸着剤をコーティングした容器、緩衝液1、および緩衝液2を有することが好ましい。
【0081】
以上のことから、本発明を実施するための最良の形態によれば、吸着剤と容器とを有するので、オルガネラの光学的特性の検出に用いる新規な測定キットを提供することができる。
【0082】
また、本発明を実施するための最良の形態によれば、吸着剤をコーティングした容器と、緩衝液とを有するので、オルガネラの光学的特性の検出に用いる新規な測定キットを提供することができる。
【0083】
なお、本発明は上述の発明を実施するための最良の形態に限らず本発明の要旨を逸脱することなくその他種々の構成を採り得ることはもちろんである。
【実施例】
【0084】
つぎに、本発明にかかる実施例について具体的に説明する。ただし、本発明はこれら実施例に限定されるものではないことはもちろんである。
【0085】
実施例1
吸着ミトコンドリアの膨潤(体積増大)の測定について説明する。
最初に、ポリフェノール蛋白質(BD Bioscience社、BD cell-TakTMCell and Tissue Adhesive)を100 mM NaHCO3水溶液で50倍に希釈する。つぎに、ガラスベースディッシュ(旭テクノグラス社製、ガラスベースディッシュ)の底面中央のカバーガラス部分(直径35mmの培養皿の底面中央の直径12 mmの部分)に、上記で用意した希釈ポリフェノール蛋白質水溶液を200μlのせ、室温で30分間放置する。つぎに、ポリフェノール蛋白質をのせたガラス面を超純水で3回洗浄する。
【0086】
ガラスベースディッシュのガラス面に、緩衝液1(10mM Tris-HCl、250mM sucrose、0.5mM EDTA、0.1 mM dithiothreitol、1mM β-NAD、pH 7.4)で懸濁したミトコンドリア懸濁液(蛋白質0.02mg/ml)を200μlにのせ、氷上で2〜3時間放置する。つぎに、ガラスに吸着していないミトコンドリアを、4℃の緩衝液2(10mM Tris-HCl、250mM sucrose、0.5mM EDTA、0.1mM dithiothreitol、pH 7.4)で洗浄して取り除く。つぎに、ガラスに吸着したミトコンドリアを緩衝液2に浸し、30分間室温で放置する。
【0087】
顕微鏡(オリンパス光学社製、IX-71)のステージ上にミトコンドリアが吸着したディッシュを静置し、吸着しているミトコンドリアに目視で焦点をあわせる。対物レンズを移動させる機器(Ludl社製、Z軸ステップモーター)を用いて、目視で焦点をあわせた位置を中心(原点)として、光軸方向に±5μmの範囲で1μmごとに対物レンズを動かし、それぞれの対物レンズの位置でミトコンドリアの透過光像を取得する。1分毎に20分間この操作を繰り返す。
【0088】
測定には、倍率が40倍以上の対物レンズと1ピクセルのサイズが6.9μm x 6.9μmの冷却CCDカメラ(Roper Industries社製、PentaMax 1317K)を用いる。用いる波長は、ミトコンドリアに含まれる物質の酸化還元状態の変化で吸光度が変化しない、等吸収点(540nm)である。
【0089】
1分毎に取得した各ミトコンドリアの画像で、ミトコンドリアのある場所の透過光強度とその近くのミトコンドリアのない場所の透過光強度の比(ミトコンドリアの箇所の透過光強度/ミトコンドリアのない場所の透過光強度)を求める。なお、実施例においては、各ミトコンドリア内で一番暗くなる4ピクセルの領域をとり、その4ピクセルの透過光強度の平均値を当該ミトコンドリアのその画像での透過光強度とする。なお、ミトコンドリアの透過光検出領域は15%である。また、この透過光検出領域に含まれるピクセル数は4である。
【0090】
縦軸に透過光強度比、横軸に光軸に沿った目盛り上の位置をとり、グラフにおける比の極小値を、当該ミトコンドリアに対するその時刻の光の透過率として求める。図1は、光軸方向に対物レンズを動かした時の透過光強度比の変化を示す図である。測定中にミトコンドリアを貼り付けたガラスが少しずつ撓み、この値が見かけ上変わる。そこで、対物レンズを光軸方向(ガラスに対して垂直方向)に動かして測定し、透過光強度比の極小値を求めることにより、ガラスのたわみ、ミトコンドリアの揺動・体積変化、対物レンズの位置のずれなどによる透過光強度の変化を補正する。
【0091】
縦軸に透過率から求めた吸光度、横軸に時間をとり、膜透過性遷移による吸光度の減少を検出する。図2は、ミトコンドリアの吸光度変化(平均値)を示す図である。吸光度は、単一のミトコンドリア50個についてそれぞれ測定した吸光度の平均値である。図2において、Aの線が実施例1の結果を示すものである。
【0092】
実施例2
吸着ミトコンドリアのCa2+添加による膨潤(体積増大)の測定について説明する。
測定開始300秒で50μMのCa2+(塩化カルシウム)を添加し、膨化を誘導した。これ以外の条件は、実施例1と同様である。図2のBの線が実施例2の結果を示すものである。図2の矢印の示してある時刻にCa2+を添加した。
【0093】
実施例3
膨化の阻害剤(シクロスポリンA、2μM)の存在下で、測定開始300秒で50μMのCa2+を添加した。これ以外の条件は、実施例1と同様である。図2のCの線が実施例3の結果を示すものである。図2の矢印の示してある時刻にCa2+を添加した。
【0094】
実施例4
測定開始300秒で50μMのCa2+を添加し、膨化を誘導した。条件は実施例2と同様である。ただし、単一のミトコンドリア3つについて、吸光度を測定した。図3は、ミトコンドリアの吸光度変化(単一)を示す図である。図3の矢印の示してある時刻にCa2+を添加した。図3において、Aの線はCa2+添加後すぐに膨化を始めたミトコンドリアを示している。Bの線は、Ca2+添加後少ししてから膨化を始めたミトコンドリアを示している。Cの線は、Ca2+を添加しても膨化しなかったミトコンドリアを示している。
【0095】
以上のことから、本実施例によれば、以下に示すような効果が得られる。
【0096】
オルガネラの物質、イオン、水の輸送に関わっている蛋白質の機能解明(創薬の新しいターゲットの発見)
オルガネラの体積は小さく、オルガネラ蛋白質、特に物質やイオン輸送に関わる蛋白質の働きによる浸透圧の変化により随時変化し、その変化がオルガネラの活性を調節しているとも考えられている。そのため、本発明によりこれらの蛋白質の機能を高い精度で測定することは極めて有用である。ゲノムの解読によって蛋白質のアミノ酸配列が解明し、また、プロテオーム解析の技術が発展し蛋白質の発現プロファイルが分かるようになった現在、蛋白質の生理的機能を効率よく測定する方法の開発が求められている。しかしながら、オルガネラの蛋白質、特に物質やイオン輸送に関わる蛋白質に関しては、その蛋白質が関与する生理現象を高い精度で測定する方法が存在しなかったため、機能が未知の蛋白質が多く存在すると考えられており、本方法はそれらの問題を解決するのに役立つことが期待される。オルガネラは細胞にとって必須の役割を果たしていることから、これらは、人の病気や健康に深く関わることも考えられ、創薬の新しいターゲットとして期待される。
【0097】
細胞死抑制剤の効率的スクリーニング
従来法では、薬物の効果を調べるのに数億から数十億個という多くのミトコンドリア必要とした。本方法は、原理的には1個のミトコンドリアで薬物の効果を測定できるため、薬物の影響を調べるのに使用するミトコンドリアの数を、大幅に減少させることができる。そのため、多くの薬物の中から、細胞死の原因となるミトコンドリアの体積の増加を抑制する薬物を効率的に見つける作業に役立つ。特に、ミトコンドリアは細胞死の制御を行っている器官であるため、抗がん剤などの細胞死を誘導する薬物や、脳梗塞や心筋梗塞による虚血再還流障害時の細胞死を軽減する薬物を見つけるのに、本方法が役立つことが期待される。
【0098】
細胞死抑制・促進蛋白質の同定
病気には、細胞死が関わるものが少なくない。細胞死を起こす細胞内信号の多くはミトコンドリアを経由して下流に伝わるので、ミトコンドリアは細胞死において重要な位置を占める。本発明の実施例で挙げたミトコンドリア膜透過性遷移は、細胞死の信号伝達の際にミトコンドリアに生じる変化であり、細胞死を不可逆な過程にする現象であることが知られている。そのため、ミトコンドリア膜透過性遷移の阻害は細胞死を抑制することが多く、細胞死を制御する薬物を開発する上で、膜透過性遷移の検出は極めて有効な方法である。本発明の実施例で挙げた膜透過性遷移の検出方法は、従来法と比べ高感度・簡易・迅速に膜透過性遷移を検出することを可能にしており、細胞死に影響を与える薬物を調べる上で極めて有効な有用な方法である。参考までに、細胞死が関与する疾患を挙げると、アルツハイマー病、脊髄性筋萎縮症(spinal muscular artophy)、筋萎縮性側索硬化症(ALS)、パーキンソン病、ハンチントン病、網膜色素変性症や緑内障、小脳変性、新生児黄疸などの神経変性疾患、筋ジストロフィー、脳卒中等による脳虚血及びその後の遅発性神経細胞死(DND)、心筋梗塞等による虚血性心疾患(心筋虚血と再灌流傷害)、ウイルス性心筋炎、自己免疫性心筋炎(拡張型心筋症や慢性心筋炎等)、肥大心および不全心にみられる心筋障害/細胞死、不整脈源性右室心筋症、アルコール性肝炎やウイルス性肝炎、糸球体腎炎や溶血性尿毒症症候群などの腎疾患、後天性免疫不全症候群(AIDS)、中毒性表皮壊死融解(toxic epidermal necrolysis;TEN)、多形滲出性紅斑などの炎症性皮膚疾患や脱毛症ならびに移植片宿主反応、さらには放射線による障害や、抗癌剤・抗ウイルス薬等の他、アジ化ナトリウム、青酸カリウム等の毒性薬物による障害、敗血症、再生不良性貧血などの骨髄異形成症、インスリン依存性糖尿病、クロイツフェルト・ヤコブ病などのプリオン病などがある。また、細胞死が阻害された疾患として、カポジ肉腫などの癌が挙げられる。
【0099】
疾患に加えて、細胞死は医療や研究の妨げとなっている。例えば、臓器移植の血液再還流時には、活性酸素や化学物質による細胞死や拒絶反応による細胞死が生じる。また、初代培養細胞は細胞が臓器にあるときの性質をもった研究上有用な細胞であるが、これらは細胞死を起こしやすく、培養の難しいものも少なくない。ミトコンドリアを標的とした細胞死抑制剤の開発は、これらの問題を克服するのにも役立つ。
【0100】
ミトコンドリアは細胞死を起こす器官であるだけではなく、その機能異常が多くの疾患と関連することが報告されている。例えば、老化、糖尿病、アルコール性肝炎、パーキンソン病、慢性疲労、肥満などである。本発明の実施例で示した膜蛋白質輸送活性の測定方法は、ミトコンドリアの機能異常を極めて高い精度で検出することを可能にするものであり、上記の疾病の予防、症状の軽減などにつながる化学物質の検出に有用である。
【産業上の利用可能性】
【0101】
本発明から考えられる他の利用可能性、応用分野などを説明する。
本発明を利用することにより、オルガネラを標的とする薬物の開発が効率的になり、製薬会社や食品会社の競争力が増すことが期待される。また、本発明の実施に必要なキットを作成し、医薬品開発業者だけはなく、多くの医療関係者や基礎研究者等に販売することができる。現在、ミトコンドリア活性測定には、ミトコンドリア膜電位測定試薬、シトクロム酸化酵素活性測定試薬、ATP定量試薬などが市販されている。本発明の製品化により上記の製品を用いた測定方法を内包する形でも、幅広く提供できるため、ミトコンドリアを標的とした市場規模は十分にある。
【図面の簡単な説明】
【0102】
【図1】光軸方向に対物レンズを動かした時の透過光強度比の変化を示す図である。
【図2】ミトコンドリアの吸光度変化(平均値)を示す図である。
【図3】ミトコンドリアの吸光度変化(単一)を示す図である。
【特許請求の範囲】
【請求項1】
オルガネラを担体に吸着させる工程を有する
ことを特徴とするオルガネラの光学的特性の検出方法。
【請求項2】
吸着剤を用いて吸着させる
ことを特徴とする請求項1記載のオルガネラの光学的特性の検出方法。
【請求項3】
吸着剤はポリフェノール蛋白質である
ことを特徴とする請求項2記載のオルガネラの光学的特性の検出方法。
【請求項4】
オルガネラはミトコンドリアである
ことを特徴とする請求項1記載のオルガネラの光学的特性の検出方法。
【請求項5】
担体は、光透過部を有する容器である
ことを特徴とする請求項1記載のオルガネラの光学的特性の検出方法。
【請求項6】
オルガネラの透過率、蛍光強度、蛍光波長特性、蛍光偏光度、透過光波長特性、透過光の偏光度、または屈折率を検出する工程を有する
ことを特徴とする請求項1記載のオルガネラの光学的特性の検出方法。
【請求項7】
オルガネラの透過光を検出する工程を有する
ことを特徴とする請求項1記載のオルガネラの光学的特性の検出方法。
【請求項8】
等吸収点の波長の透過光を検出する工程を有する
ことを特徴とする請求項7記載のオルガネラの光学的特性の検出方法。
【請求項9】
吸着剤と容器とを有する
ことを特徴とするオルガネラの光学的特性の検出に用いる測定キット。
【請求項10】
吸着剤はポリフェノール蛋白質である
ことを特徴とする請求項9記載のオルガネラの光学的特性の検出に用いる測定キット。
【請求項11】
容器は、光透過部を有する容器である
ことを特徴とする請求項9記載のオルガネラの光学的特性の検出に用いる測定キット。
【請求項12】
緩衝液を有する
ことを特徴とする請求項9記載のオルガネラの光学的特性の検出に用いる測定キット。
【請求項13】
吸着剤をコーティングした容器と、緩衝液とを有する
ことを特徴とするオルガネラの光学的特性の検出に用いる測定キット。
【請求項14】
吸着剤はポリフェノール蛋白質である
ことを特徴とする請求項13記載のオルガネラの光学的特性の検出に用いる測定キット。
【請求項15】
容器は、光透過部を有する容器である
ことを特徴とする請求項13記載のオルガネラの光学的特性の検出に用いる測定キット。
【請求項1】
オルガネラを担体に吸着させる工程を有する
ことを特徴とするオルガネラの光学的特性の検出方法。
【請求項2】
吸着剤を用いて吸着させる
ことを特徴とする請求項1記載のオルガネラの光学的特性の検出方法。
【請求項3】
吸着剤はポリフェノール蛋白質である
ことを特徴とする請求項2記載のオルガネラの光学的特性の検出方法。
【請求項4】
オルガネラはミトコンドリアである
ことを特徴とする請求項1記載のオルガネラの光学的特性の検出方法。
【請求項5】
担体は、光透過部を有する容器である
ことを特徴とする請求項1記載のオルガネラの光学的特性の検出方法。
【請求項6】
オルガネラの透過率、蛍光強度、蛍光波長特性、蛍光偏光度、透過光波長特性、透過光の偏光度、または屈折率を検出する工程を有する
ことを特徴とする請求項1記載のオルガネラの光学的特性の検出方法。
【請求項7】
オルガネラの透過光を検出する工程を有する
ことを特徴とする請求項1記載のオルガネラの光学的特性の検出方法。
【請求項8】
等吸収点の波長の透過光を検出する工程を有する
ことを特徴とする請求項7記載のオルガネラの光学的特性の検出方法。
【請求項9】
吸着剤と容器とを有する
ことを特徴とするオルガネラの光学的特性の検出に用いる測定キット。
【請求項10】
吸着剤はポリフェノール蛋白質である
ことを特徴とする請求項9記載のオルガネラの光学的特性の検出に用いる測定キット。
【請求項11】
容器は、光透過部を有する容器である
ことを特徴とする請求項9記載のオルガネラの光学的特性の検出に用いる測定キット。
【請求項12】
緩衝液を有する
ことを特徴とする請求項9記載のオルガネラの光学的特性の検出に用いる測定キット。
【請求項13】
吸着剤をコーティングした容器と、緩衝液とを有する
ことを特徴とするオルガネラの光学的特性の検出に用いる測定キット。
【請求項14】
吸着剤はポリフェノール蛋白質である
ことを特徴とする請求項13記載のオルガネラの光学的特性の検出に用いる測定キット。
【請求項15】
容器は、光透過部を有する容器である
ことを特徴とする請求項13記載のオルガネラの光学的特性の検出に用いる測定キット。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2006−296201(P2006−296201A)
【公開日】平成18年11月2日(2006.11.2)
【国際特許分類】
【出願番号】特願2005−117743(P2005−117743)
【出願日】平成17年4月15日(2005.4.15)
【出願人】(504132881)国立大学法人東京農工大学 (595)
【Fターム(参考)】
【公開日】平成18年11月2日(2006.11.2)
【国際特許分類】
【出願日】平成17年4月15日(2005.4.15)
【出願人】(504132881)国立大学法人東京農工大学 (595)
【Fターム(参考)】
[ Back to top ]

