オートタキシン測定による膵疾患の検査方法および検査薬
【課題】膵疾患が疑われる患者において非癌膵疾患と膵臓癌との診断や判別が可能な簡便な検査方法および検査薬を提供すること。
【解決手段】健常者と比較し非癌膵疾患患者ではオートタキシン濃度が低値を示すこと、および膵疾患において非癌膵疾患患者では膵臓癌患者と比較しオートタキシン濃度が低値を示すことを利用した膵疾患の検査方法、ならびに前記方法を利用した検査薬により、前記課題を解決する。
【解決手段】健常者と比較し非癌膵疾患患者ではオートタキシン濃度が低値を示すこと、および膵疾患において非癌膵疾患患者では膵臓癌患者と比較しオートタキシン濃度が低値を示すことを利用した膵疾患の検査方法、ならびに前記方法を利用した検査薬により、前記課題を解決する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はヒト検体中のオートタキシン濃度の測定による膵疾患の検査方法および検査薬に関する。
【背景技術】
【0002】
ヒトオートタキシンは、1992年M.L.StrackeらによってA2058ヒト黒色腫細胞培養培地から細胞運動性を惹起する物質として単離された分子量約125KDaの糖蛋白質である(非特許文献1)。オートタキシンはそのリゾホスホリパーゼD活性によりリゾホスファチジルコリンを基質としリゾホスファチジン酸(LPA)を産生する。生体内ではLPAが癌の増殖、転移に関与していることが多くの研究者により示され(非特許文献2から4)、その産生酵素であるオートタキシンと様々な疾病との因果関係が研究されている。最近になり、ヒトオートタキシンを定量する手法が確立され(特許文献1、非特許文献5)、様々な疾患の診断マーカーとして期待されている。
【0003】
オートタキシンはそのLPA産生能から癌あるいは癌転移との関連が注目され現在も盛んに研究されている。1992年に癌との関連を示した特許が出願され(特許文献2および3)、その後ヒトテラトカルシノーマ(非特許文献6)、肺の非小細胞癌(非特許文献7)、甲状腺癌(非特許文献8)、乳癌(非特許文献9)、多型膠芽腫(非特許文献10および11)、前立腺癌(非特許文献12)、ホジキンリンパ腫(非特許文献13)など多種多様な癌においてオートタキシンの関与が報告されている。しかしながら、これら報告はいずれも臓器における発現に関する報告である。
【0004】
一方、体液中のオートタキシン濃度の上昇に関する報告は、卵巣癌患者血清で差が認められない報告(非特許文献14)、前立腺癌患者血清で差が認められない報告(非特許文献15)など否定的な報告が多く、肯定的な報告としては、卵巣癌患者腹水中でオートタキシン濃度の上昇が示された論文や悪性腫瘍の一つである悪性リンパ腫患者で血清オートタキシン濃度が高値を示す報告がある(特許文献1、非特許文献16)。これら報告から、健常者血清のオートタキシン濃度は比較的高く、癌細胞がオートタキシンを産生しても血清濃度を上昇させるに至るほどではないことを示唆しており、腹水中の卵巣癌細胞や血液中に癌細胞が存在する悪性リンパ腫でのみ血清オートタキシン濃度の上昇が検出された結果であることが示唆される。したがって、癌における体液中のオートタキシン濃度の上昇は極めて限定的な癌にのみ検出可能であるといえる。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】WO2008/016186号
【特許文献2】米国公開2006/0275865号公報
【特許文献3】加国登録2128215号公報
【非特許文献】
【0006】
【非特許文献1】J.Biol.Chem.、256、2524、1992
【非特許文献2】Nat.Rev.Cancer、3、582、2003
【非特許文献3】Int.J.Cancer、10、109、833、2004
【非特許文献4】Blood、106、2138、2005
【非特許文献5】Clin.Chim.Acta、388、51、2008
【非特許文献6】Biochem.Biophys.Res.Commun.、218、714、1996
【非特許文献7】Am.J.Respir.Cell Mol.Biol.、21216、1999
【非特許文献8】Int.J.Cancer、109、833、2004
【非特許文献9】Clin.Exp.Metastasis、19、603、2002
【非特許文献10】Neoplasia、7、7、2005
【非特許文献11】J.Biol.Chem.、281、17492、2006
【非特許文献12】J.Cell Physiol.、210、111、2007
【非特許文献13】Blood、106、2138、2005
【非特許文献14】Life Sci.、80、1641、2007
【非特許文献15】Ann.Clin.Biochem.、44、549、2007
【非特許文献16】Brit.J.Haematol、143、60、2008
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の目的は、血清マーカー検査、画像検査により様々な膵疾患が疑われる患者において非癌膵疾患および膵臓癌の診断や判別が可能な簡便な検査方法ならびに検査薬を提供することである。
【課題を解決するための手段】
【0008】
前述したように、従来からヒト組織または体液中のオートタキシン濃度が様々な疾病により変動することを示唆する報告がある。しかしながら、これまではオートタキシンを定量する方法がなかったため、様々な疾病との因果関係の解析がなされてこなかった。近年、本発明者により得られた特許文献1に記載の測定方法により、血清などのヒト検体中のオートタキシン濃度を簡便、短時間、かつ信頼性高く定量することが可能となった。特許文献1に記載の測定方法はリゾホスホリパーゼD活性測定値と極めて良好な相関性を示すことが確認されており、いずれの手法においてもオートタキシン濃度の測定が可能である(非特許文献5)。そこで、特許文献1に記載の測定方法およびリゾホスホリパーゼD活性測定を用い鋭意検討を重ねた結果、健常者、非癌膵疾患、膵臓癌において血液中のオートタキシン濃度およびリゾホスホリパーゼD活性に差が生じることを見いだし、本発明を完成するに至った。
【0009】
詳しくは、本願は下記の発明を包含する:
(1)ヒト検体中のオートタキシン濃度を測定することによる膵疾患の検査方法。
(2)前記方法が、膵疾患が疑われる患者に対して行われる、(1)に記載の方法。
(3)膵疾患が膵臓癌以外の非癌膵疾患である(1)又は(2)に記載の検査方法。
(4)非癌膵疾患が慢性膵炎、急性膵炎、膵嚢胞性疾患のいずれかである(2)に記載の検査方法。
(5)ヒト検体中のオートタキシン濃度を測定し、その値が同性の健常者群のオートタキシン濃度から算出したカットオフ値に対し低値を示した場合に膵臓癌以外の非癌膵疾患を罹患するとすることを特徴とする、(1)から(4)のいずれかに記載の検査方法。
(6)膵疾患が膵臓癌である(2)に記載の検査方法。
(7)ヒト検体中のオートタキシン濃度を測定し、その値が同性の非癌膵疾患患者群のオートタキシン濃度から算出したカットオフ値に対し高値を示した場合に膵臓癌を罹患するとすることを特徴とする、(6)に記載の検査方法。
(8)血清検査または画像診断と、(1)から(7)のいずれかに記載の検査方法とを組み合わせた膵疾患の検査方法。
(9)血清検査がCA19−9、CA−50、DU−PAN−2、Span−1、CSLEX、sialyl SSEA−1、ST−439、STN、CA72−4、CA−125、CEA、hCGのいずれかの腫瘍マーカーを用いた検査である(8)に記載の検査方法。
(10)血清検査がアミラーゼ、リパーゼ、エステラーゼ1、アルカリ性ホスファターゼ、γGTP、血糖、ヘモグロビンA1c、インスリンのいずれかの血清マーカーを用いた検査である(8)に記載の検査方法。
(11)ヒト検体が全血もしくは血球、血清、血漿などのヒト血液成分またはヒト細胞もしくは組織の抽出液である(1)から(10)のいずれかに記載の検査方法。
(12)ヒト検体中のオートタキシン濃度を測定し、その測定値を男性健常者または女性健常者の統計学的数値で補正して得られるオートタキシン指数を用いて検査する膵疾患の検査方法。
(13)統計学的数値がオートタキシン濃度測定値の平均値、中央値、95パーセンタイル上限値のいずれかである(12)に記載の検査方法。
(14)前記方法が、膵疾患が疑われる患者に対して行われる、(12)又は(13)に記載の方法。
(15)膵疾患が膵臓癌以外の非癌膵疾患である(12)から(14)のいずれかに記載の検査方法。
(16)非癌膵疾患が慢性膵炎、急性膵炎、膵嚢胞性疾患のいずれかである(15)に記載の検査方法。
(17)ヒト検体中のオートタキシン濃度を測定し、その値が健常者群のオートタキシン濃度から算出したカットオフ値に対し低値を示した場合に膵臓癌以外の非癌膵疾患を罹患するとすることを特徴とする、(12)から(16)のいずれかに記載の検査方法。
(18)膵疾患が膵臓癌である(14)に記載の検査方法。
(19)ヒト検体中のオートタキシン濃度を測定し、その値が同性の非癌膵疾患患者群のオートタキシン濃度から算出したカットオフ値に対し高値を示した場合に膵臓癌を罹患するとすることを特徴とする、(18)に記載の検査方法。
(20)抗体を用いた免疫化学的方法でオートタキシン濃度を測定する(1)から(19)のいずれかに記載の検査方法。
(21)ヒト検体中のオートタキシン濃度を測定する方法がリゾホスホリパーゼD活性を測定する方法である(1)から(19)のいずれかに記載の検査方法。
(22)(20)または(21)に記載の検査方法を利用した膵疾患の検査薬。
【発明の効果】
【0010】
本発明は、ヒト検体中のオートタキシン濃度を測定すること、そして対照群のオートタキシン濃度と比較することにより膵疾患を検査することが可能である。特に健常者群のオートタキシン濃度と比較した場合に、ヒト検体中のオートタキシン濃度の低下により非癌膵疾患を検査できる。一方で、膵疾患が疑われる患者において、非癌膵疾患患者群のオートタキシン濃度と比較することにより患者検体中のオートタキシン濃度から非癌膵疾患と膵臓癌との判別ができる。
【0011】
本発明の検査方法を実施するにあたり、ヒト検体中のオートタキシン濃度の測定はオートタキシンの有する酵素活性であるリゾホスホリパーゼD活性の測定でも可能であるし、特許文献1に記載の方法を用いた免疫学的定量試薬で測定することも可能である。免疫学的定量試薬でオートタキシン濃度を測定する場合、検体中に含まれる内在性の測定妨害因子や競合酵素の影響を受けることなく、かつ短時間でオートタキシンを定量可能であり、小規模医療施設においても簡便、低コストで検査可能な試薬を提供することが可能である。
【0012】
さらに、本発明の検査方法に既存の血清検査または画像診断とを組み合わせることで、血清検査または画像検査単一の検査による診断と比較し、より高い精度で膵疾患を検査することが可能となる。
【図面の簡単な説明】
【0013】
【図1】健常者血清中における、自動免疫測定装置AIAによるオートタキシン濃度定量値(縦軸)とリゾホスホリパーゼD活性測定値(横軸)との相関性を示す。
【図2】男性健常者および女性健常者血清中のリゾホスホリパーゼD活性測定値の分布を示す。
【図3】男性健常者および女性健常者血清中のオートタキシン指数(lysoPLD index)の分布を示す。
【図4】非癌膵疾患および膵臓癌患者血清中のオートタキシン濃度(縦軸)とリゾホスホリパーゼD活性(横軸)との相関性を示す。
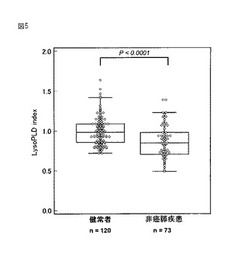
【図5】健常者および非癌膵疾患患者のオートタキシン指数(lysoPLD index)をBox−and−Whisker Plotで示した図。2群の有意差検定はMann−Whitney試験にて実施した。
【図6】膵臓癌および非癌膵疾患患者のオートタキシン指数(lysoPLD index)をBox−and−Whisker Plotで示した図。2群の有意差検定はMann−Whitney試験にて実施した。
【発明を実施するための形態】
【0014】
以下本発明を詳細に説明する。
本発明者は、オートタキシン濃度と膵疾患との関係について鋭意検討した。その結果、膵疾患において健常者と比較し非癌膵疾患患者ではオートタキシン濃度が低値を示すこと、膵臓癌患者ではオートタキシン濃度が高値を示す例はあっても低値は示さないことを、それぞれ見いだした。本結果よりヒト検体中のオートタキシン濃度を測定することにより非癌膵疾患および膵臓癌の診断、ならびに膵疾患が疑われる患者において非癌膵疾患と膵臓癌との判別が可能なことを見いだした。本発明は、たとえば血液検査にて、全血中または血球、血清、血漿などのヒト血液成分中のオートタキシン濃度を簡便に測定することにより膵疾患の診断を可能にする技術および試薬を提供するものである。
【0015】
さらに、本発明の検査方法と、既存の血清検査または画像診断とを組み合わせることにより、さらに高精度な膵疾患の診断が期待できる。既存の血清検査としては、CA19−9、CA−50、DU−PAN−2、Span−1、CSLEX、sialyl SSEA−1、ST−439、STN、CA72−4、CA−125、CEA、hCGなど従来から用いられている腫瘍マーカーによる検査や、アミラーゼ、リパーゼ、エステラーゼ1、アルカリ性ホスファターゼ、γGTP、血糖、ヘモグロビンA1c、インスリンなどの従来から用いられる血清マーカーによる検査が例示できる。
【0016】
なお、男性のオートタキシン濃度と女性のオートタキシン濃度とには有意差が存在する(特願2009−298048号)。そのため、測定したヒト検体中のオートタキシン濃度を、あらかじめ測定した男性健常者または女性健常者のオートタキシン濃度で補正して得られるオートタキシン指数を用いて膵疾患を検査すると、男女の性差を考慮しなくて済む点で好ましい。なお、測定したヒト検体中のオートタキシン濃度を補正するのに用いる、男性健常者または女性健常者のオートタキシン濃度は、男性健常者または女性健常者のオートタキシン濃度測定値の平均値であってもよいし、中央値であってもよいし、95パーセンタイル上限値であってもよい。オートタキシン指数は、オートタキシン濃度をリゾホスホリパーゼD活性に基づき測定した場合には、lysoPLD indexとし、オートタキシン濃度を免疫学的定量試薬で測定する場合には、ATX indexとする。以下の実施例2及び実施例3において記載されるように、免疫学的定量試薬で測定したオートタキシン濃度とリゾホスホリパーゼD活性とは極めて高い相関性を有することから、lyspoPLD indexとATX indexとは同視することができる。
【0017】
本発明に係る検査方法は、ヒト検体中のオートタキシン濃度又は指数を測定し、その値が健常者群測定値からなる正常値範囲より算出したカットオフ値より低値を示した場合に非癌膵疾患を罹患する、とする。これにより、非癌膵疾患を診断することが可能になる。このようなカットオフ値は、当業者であれば健常者群と非癌膵疾患群におけるオートタキシン濃度又は指数の分布を参照して任意に決定することができる。カットオフ値の決定法は、例えば血清中のオートタキシン濃度または指数の95%パーセンタイル値下限をカットオフ値に設定することや、オートタキシン濃度または指数を用いたROC曲線による統計的解析で設定可能である。また、膵疾患が疑われる患者において、ヒト検体中のオートタキシン濃度又は指数を測定し、その値が非癌膵疾患群の測定値範囲より算出したカットオフ値より高値を示した場合に膵臓癌を罹患する、とする。これにより、非癌膵疾患と膵臓癌との判別が可能である。膵疾患が疑われる患者とは、好ましくは膵疾患を患っている患者のことをいう。このような、カットオフ値は、当業者であれば、非癌膵疾患群と膵臓癌患者群におけるオートタキシン濃度又は指数の分布を参照して任意に決定することができる。カットオフ値の決定法は、例えば血清中のオートタキシン濃度または指数の95%パーセンタイル値上限をカットオフ値に設定することや、オートタキシン濃度または指数を用いたROC曲線による統計的解析で設定可能である。
【実施例】
【0018】
以下に本発明をさらに詳細に説明するために実施例を示すが、これら実施例は本発明の一例を示すものであり、本発明は実施例に限定されるものではない。なお、実施例で使用した血清検体の採取および測定は東京大学医学部附属病院で実施し、研究倫理について東京大学大学院医学研究科倫理委員会での承認のもと実施した。また、オートタキシン濃度の測定は特許文献1の方法に基づき自動免疫測定装置AIAシリーズ(東ソー社製)を用い実施し、リゾホスホリパーゼD活性測定法も特許文献1に記載されている。これらの測定方法を以下に詳述する。
【0019】
血清中ヒトオートタキシンの濃度測定
ヒトオートタキシンモノクローナル抗体R10.23を固相用抗体として用い、ヒトオートタキシンモノクローナル抗体R10.21を二次抗体として用いた2ステップ2抗体サンドイッチELISAにより、血清中のヒトオートタキシンを測定した。固相用抗体R10.23はペプシン消化によりF(ab)2化し使用した。R10.23を96穴イムノプレート(NUNC社製)に2μg/mL濃度で50μL/ウェルにて添加し、一昼夜、4℃にてプレートに結合させた。TBSにより3回洗浄後、3% BSAを含むTBSを250μL/ウェルで添加し2時間ブロッキング処理を行った。TBSにより3回洗浄後、ヒトオートタキシン標準品(0、0.34、0.675、1.35、2.70、5.40μg/mL)ならびに濃度未知のヒト血清をELISAアッセイ緩衝液で1/5に希釈し50μL/ウェルにて添加した。室温で2時間反応後、TBSTにより4回洗浄し、0.8μg/mLのビオチン標識R10.21を含むELISAアッセイ緩衝液を50μL/ウェル添加した。室温で2時間放置後、TBSTにより4回洗浄し、1000倍希釈したHRP標識ストレプトアビジン(Zymed社製)を含むELISA緩衝液を50μL/ウェル添加した。1時間室温放置後、TBSTにより6回洗浄し、TMB基質を50μL/ウェルで添加した。室温30分後、1N−リン酸により反応を停止し450nmの吸光度を測定した。ヒトオートタキシンの標準品による検量線の回帰を、3次回帰により行った。ヒトオートタキシン濃度依存的に450nmの吸光度上昇が確認された。本検量線を用い未知濃度のヒト血清で得られた450nmの吸光度より検体中のヒトオートタキシンの濃度を算出した。
【0020】
血清中のリゾホスホリパーゼD活性の濃度測定
リゾホスフォリパーゼD活性測定はFEBS letters 571,197−204,2004を若干変更し行った。具体的には、サンプル20μLと2mMのリゾホスファチジルコリン(14:0−リゾホスファチジルコリン)、100mM Tris−HCl、500mM NaCl、5mM MgCl2、0.05% Triton X−100(pH9.0)を含む基質溶液20μLを混合し、37℃にて6時間から一昼夜反応させた。続いて本酵素反応により生成したコリンを定量するため、0.5mM TOOS(N−エチル−N−(2−ヒドロキシ−3−スルフォプロピル)−3−メチルアニリン)、10Unit/mL 西洋ワサビペルオキシダーゼ、0.01% Triton X−100、100mM Tris−HCl(pH8.0)からなるR1溶液150μLを加え5分間放置した後、1mM 4−アミノアンチピリン、10Unit/mL コリンオキシダーゼ、0.01% Triton X−100、100mM Tris−HCl(pH8.0)からなるR2溶液50μLを加えた。30分後、生成したコリンを550nmの吸光度で測定し、既知濃度の塩化コリンを基準にしてリゾホスホリパーゼD活性値とした。
【0021】
実施例1:健常者検体のオートタキシン濃度の定量
患者検体測定に先立ち、コントロール群として健常者血清のオートタキシン濃度を測定した。血液は採血7日前より投薬のない健常な成人ボランティアからインフォームドコンセントを得た後、肘前中静脈より採取し、室温15分放置後、1500×gにて5分間遠心分離することにより血清を取得し測定した。
【0022】
男性74名(23歳から65歳)、女性46名(21歳から60歳)の健常者血清中のオートタキシン濃度を自動免疫測定装置にて実施した。120名全員のオートタキシン濃度測定値は0.731±0.176mg/L(算術平均値±標準偏差)であり、95パーセンタイルからなる参考基準範囲は0.468mg/Lから1.134mg/Lであった。なお、男性健常者のオートタキシン測定値は0.656±0.121mg/L、中央値0.641mg/L、95パーセンタイル参考基準範囲0.438mg/Lから0.914mg/Lであり、女性健常者のオートタキシン測定値は0.852±0.184mg/L、中央値0.820mg/L、95パーセンタイル参考基準範囲0.625mg/Lから1.323mg/Lであった。
【0023】
実施例2:健常者検体のリゾホスホリパーゼD活性測定
実施例1と同一検体のリゾホスホリパーゼD活性を測定した。120名全員のリゾホスホリパーゼD活性測定値は3.56±0.80nmol/(L・min)(算術平均値±標準偏差)であり、中央値3.46nmol/(L・min)、95パーセンタイルからなる参考基準範囲は3.28nmol/(L・min)から3.55nmol/(L・min)であった。実施例1で測定したオートタキシン定量値との相関性は相関係数r=0.946と極めて良好であり、免疫測定によるオートタキシン濃度とリゾホスホリパーゼD活性測定値とはともに同等の診断が可能なことを示している(図1)。なお、男性健常者のリゾホスホリパーゼD活性測定値は3.18±0.55nmol/(L・min)、中央値3.17nmol/(L・min)、95パーセンタイル参考基準範囲2.97nmol/(L・min)から3.32nmol/(L・min)であり、女性健常者のリゾホスホリパーゼD活性測定値は4.15±0.79nmol/(L・min)、中央値4.00nmol/(L・min)、95パーセンタイル参考基準範囲3.80nmol/(L・min)から4.48nmol/(L・min)であった(図2)。女性血清中リゾホスホリパーゼD活性は男性に比べ明らかに高濃度であり、Mann−Whitney U testではP<0.0001の有意差を示した。
【0024】
図2の結果からも分かるように検体測定時には男女の性差を考慮する必要があった。そこで以降の評価は、検体測定値を男女それぞれの平均値である3.18nmol/(L・min)(男性)または4.15nmol/(L・min)(女性)で除する(リゾホスホリパーゼD活性測定値[nmol/(L・min)]÷男性健常者または女性健常者平均値[nmol/(L・min)])ことで男女性差を補正したオートタキシン指数(lysoPLD index)を用い実施した。性差補正後のそれぞれのlysoPLD index分布は、男性健常者においては1.001±0.173、中央値0.995、95パーセンタイル参考基準範囲0.930から1.040であった。一方、女性健常者においては1.002±0.189、中央値0.965、95パーセンタイル参考基準範囲0.912から1.050であった(図3)。
【0025】
実施例3:膵疾患患者血清中のオートタキシン濃度とリゾホスホリパーゼD活性値
膵疾患患者の血清中のオートタキシン濃度とリゾホスホリパーゼD活性測定値とを測定し検証した。検体は膵臓癌患者検体9例と非癌膵疾患2例、計11例用いた。測定した11検体における血清中のオートタキシン濃度とリゾホスホリパーゼD活性測定値との相関性はr=0.983と非常に良好な相関性を示した(図4)。また図4より得られた相関式は、
オートタキシン濃度[μg/L]=
2.163×リゾホスホリパーゼD活性[nmol/(L・min)]+0.0654
であり、健常者(図1)における相関式、
オートタキシン濃度[μg/L]=
2.072×リゾホスホリパーゼD活性[nmol/(L・min)]−0.0057
と大きな差が認められなかった。よって、健常者同様、膵疾患を評価する際にも、オートタキシン濃度とリゾホスホリパーゼD活性測定値、いずれを用いても問題ないことがわかる。
【0026】
実施例4:非癌膵疾患の診断
健常者120例および非癌膵疾患患者73例について血清中のリゾホスホリパーゼD活性を測定し、オートタキシン指数(lysoPLD index)を算出比較した。なお、非癌膵疾患患者は慢性膵炎、急性膵炎、膵嚢胞性疾患よりなる。結果、健常者のlysoPLD indexと比較し、非癌膵疾患患者のlysoPLD indexは有意に低値を示した(Mann−Whitney試験)。前記結果より、オートタキシン濃度、リゾホスホリパーゼD活性測定値またはlysoPLD indexにより非癌膵疾患の診断が可能なことがわかる。
【0027】
実施例5:非癌膵疾患と膵臓癌の判別
膵臓癌患者103例および非癌膵疾患患者73例について血清リゾホスホリパーゼD活性を測定し、オートタキシン指数(lysoPLD index)を算出比較した。非癌膵疾患患者は慢性膵炎、急性膵炎、膵嚢胞性疾患よりなる。結果、膵臓癌患者のlysoPLD indexと比較し、非癌膵疾患患者のlysoPLD indexは有意に低値を示した(Mann−Whitney試験)。前記結果より、オートタキシン濃度、リゾホスホリパーゼD活性測定値またはlysoPLD indexにより膵疾患が疑われる患者において非癌膵疾患と膵臓癌の判別が可能なことがわかる。
【技術分野】
【0001】
本発明はヒト検体中のオートタキシン濃度の測定による膵疾患の検査方法および検査薬に関する。
【背景技術】
【0002】
ヒトオートタキシンは、1992年M.L.StrackeらによってA2058ヒト黒色腫細胞培養培地から細胞運動性を惹起する物質として単離された分子量約125KDaの糖蛋白質である(非特許文献1)。オートタキシンはそのリゾホスホリパーゼD活性によりリゾホスファチジルコリンを基質としリゾホスファチジン酸(LPA)を産生する。生体内ではLPAが癌の増殖、転移に関与していることが多くの研究者により示され(非特許文献2から4)、その産生酵素であるオートタキシンと様々な疾病との因果関係が研究されている。最近になり、ヒトオートタキシンを定量する手法が確立され(特許文献1、非特許文献5)、様々な疾患の診断マーカーとして期待されている。
【0003】
オートタキシンはそのLPA産生能から癌あるいは癌転移との関連が注目され現在も盛んに研究されている。1992年に癌との関連を示した特許が出願され(特許文献2および3)、その後ヒトテラトカルシノーマ(非特許文献6)、肺の非小細胞癌(非特許文献7)、甲状腺癌(非特許文献8)、乳癌(非特許文献9)、多型膠芽腫(非特許文献10および11)、前立腺癌(非特許文献12)、ホジキンリンパ腫(非特許文献13)など多種多様な癌においてオートタキシンの関与が報告されている。しかしながら、これら報告はいずれも臓器における発現に関する報告である。
【0004】
一方、体液中のオートタキシン濃度の上昇に関する報告は、卵巣癌患者血清で差が認められない報告(非特許文献14)、前立腺癌患者血清で差が認められない報告(非特許文献15)など否定的な報告が多く、肯定的な報告としては、卵巣癌患者腹水中でオートタキシン濃度の上昇が示された論文や悪性腫瘍の一つである悪性リンパ腫患者で血清オートタキシン濃度が高値を示す報告がある(特許文献1、非特許文献16)。これら報告から、健常者血清のオートタキシン濃度は比較的高く、癌細胞がオートタキシンを産生しても血清濃度を上昇させるに至るほどではないことを示唆しており、腹水中の卵巣癌細胞や血液中に癌細胞が存在する悪性リンパ腫でのみ血清オートタキシン濃度の上昇が検出された結果であることが示唆される。したがって、癌における体液中のオートタキシン濃度の上昇は極めて限定的な癌にのみ検出可能であるといえる。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】WO2008/016186号
【特許文献2】米国公開2006/0275865号公報
【特許文献3】加国登録2128215号公報
【非特許文献】
【0006】
【非特許文献1】J.Biol.Chem.、256、2524、1992
【非特許文献2】Nat.Rev.Cancer、3、582、2003
【非特許文献3】Int.J.Cancer、10、109、833、2004
【非特許文献4】Blood、106、2138、2005
【非特許文献5】Clin.Chim.Acta、388、51、2008
【非特許文献6】Biochem.Biophys.Res.Commun.、218、714、1996
【非特許文献7】Am.J.Respir.Cell Mol.Biol.、21216、1999
【非特許文献8】Int.J.Cancer、109、833、2004
【非特許文献9】Clin.Exp.Metastasis、19、603、2002
【非特許文献10】Neoplasia、7、7、2005
【非特許文献11】J.Biol.Chem.、281、17492、2006
【非特許文献12】J.Cell Physiol.、210、111、2007
【非特許文献13】Blood、106、2138、2005
【非特許文献14】Life Sci.、80、1641、2007
【非特許文献15】Ann.Clin.Biochem.、44、549、2007
【非特許文献16】Brit.J.Haematol、143、60、2008
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の目的は、血清マーカー検査、画像検査により様々な膵疾患が疑われる患者において非癌膵疾患および膵臓癌の診断や判別が可能な簡便な検査方法ならびに検査薬を提供することである。
【課題を解決するための手段】
【0008】
前述したように、従来からヒト組織または体液中のオートタキシン濃度が様々な疾病により変動することを示唆する報告がある。しかしながら、これまではオートタキシンを定量する方法がなかったため、様々な疾病との因果関係の解析がなされてこなかった。近年、本発明者により得られた特許文献1に記載の測定方法により、血清などのヒト検体中のオートタキシン濃度を簡便、短時間、かつ信頼性高く定量することが可能となった。特許文献1に記載の測定方法はリゾホスホリパーゼD活性測定値と極めて良好な相関性を示すことが確認されており、いずれの手法においてもオートタキシン濃度の測定が可能である(非特許文献5)。そこで、特許文献1に記載の測定方法およびリゾホスホリパーゼD活性測定を用い鋭意検討を重ねた結果、健常者、非癌膵疾患、膵臓癌において血液中のオートタキシン濃度およびリゾホスホリパーゼD活性に差が生じることを見いだし、本発明を完成するに至った。
【0009】
詳しくは、本願は下記の発明を包含する:
(1)ヒト検体中のオートタキシン濃度を測定することによる膵疾患の検査方法。
(2)前記方法が、膵疾患が疑われる患者に対して行われる、(1)に記載の方法。
(3)膵疾患が膵臓癌以外の非癌膵疾患である(1)又は(2)に記載の検査方法。
(4)非癌膵疾患が慢性膵炎、急性膵炎、膵嚢胞性疾患のいずれかである(2)に記載の検査方法。
(5)ヒト検体中のオートタキシン濃度を測定し、その値が同性の健常者群のオートタキシン濃度から算出したカットオフ値に対し低値を示した場合に膵臓癌以外の非癌膵疾患を罹患するとすることを特徴とする、(1)から(4)のいずれかに記載の検査方法。
(6)膵疾患が膵臓癌である(2)に記載の検査方法。
(7)ヒト検体中のオートタキシン濃度を測定し、その値が同性の非癌膵疾患患者群のオートタキシン濃度から算出したカットオフ値に対し高値を示した場合に膵臓癌を罹患するとすることを特徴とする、(6)に記載の検査方法。
(8)血清検査または画像診断と、(1)から(7)のいずれかに記載の検査方法とを組み合わせた膵疾患の検査方法。
(9)血清検査がCA19−9、CA−50、DU−PAN−2、Span−1、CSLEX、sialyl SSEA−1、ST−439、STN、CA72−4、CA−125、CEA、hCGのいずれかの腫瘍マーカーを用いた検査である(8)に記載の検査方法。
(10)血清検査がアミラーゼ、リパーゼ、エステラーゼ1、アルカリ性ホスファターゼ、γGTP、血糖、ヘモグロビンA1c、インスリンのいずれかの血清マーカーを用いた検査である(8)に記載の検査方法。
(11)ヒト検体が全血もしくは血球、血清、血漿などのヒト血液成分またはヒト細胞もしくは組織の抽出液である(1)から(10)のいずれかに記載の検査方法。
(12)ヒト検体中のオートタキシン濃度を測定し、その測定値を男性健常者または女性健常者の統計学的数値で補正して得られるオートタキシン指数を用いて検査する膵疾患の検査方法。
(13)統計学的数値がオートタキシン濃度測定値の平均値、中央値、95パーセンタイル上限値のいずれかである(12)に記載の検査方法。
(14)前記方法が、膵疾患が疑われる患者に対して行われる、(12)又は(13)に記載の方法。
(15)膵疾患が膵臓癌以外の非癌膵疾患である(12)から(14)のいずれかに記載の検査方法。
(16)非癌膵疾患が慢性膵炎、急性膵炎、膵嚢胞性疾患のいずれかである(15)に記載の検査方法。
(17)ヒト検体中のオートタキシン濃度を測定し、その値が健常者群のオートタキシン濃度から算出したカットオフ値に対し低値を示した場合に膵臓癌以外の非癌膵疾患を罹患するとすることを特徴とする、(12)から(16)のいずれかに記載の検査方法。
(18)膵疾患が膵臓癌である(14)に記載の検査方法。
(19)ヒト検体中のオートタキシン濃度を測定し、その値が同性の非癌膵疾患患者群のオートタキシン濃度から算出したカットオフ値に対し高値を示した場合に膵臓癌を罹患するとすることを特徴とする、(18)に記載の検査方法。
(20)抗体を用いた免疫化学的方法でオートタキシン濃度を測定する(1)から(19)のいずれかに記載の検査方法。
(21)ヒト検体中のオートタキシン濃度を測定する方法がリゾホスホリパーゼD活性を測定する方法である(1)から(19)のいずれかに記載の検査方法。
(22)(20)または(21)に記載の検査方法を利用した膵疾患の検査薬。
【発明の効果】
【0010】
本発明は、ヒト検体中のオートタキシン濃度を測定すること、そして対照群のオートタキシン濃度と比較することにより膵疾患を検査することが可能である。特に健常者群のオートタキシン濃度と比較した場合に、ヒト検体中のオートタキシン濃度の低下により非癌膵疾患を検査できる。一方で、膵疾患が疑われる患者において、非癌膵疾患患者群のオートタキシン濃度と比較することにより患者検体中のオートタキシン濃度から非癌膵疾患と膵臓癌との判別ができる。
【0011】
本発明の検査方法を実施するにあたり、ヒト検体中のオートタキシン濃度の測定はオートタキシンの有する酵素活性であるリゾホスホリパーゼD活性の測定でも可能であるし、特許文献1に記載の方法を用いた免疫学的定量試薬で測定することも可能である。免疫学的定量試薬でオートタキシン濃度を測定する場合、検体中に含まれる内在性の測定妨害因子や競合酵素の影響を受けることなく、かつ短時間でオートタキシンを定量可能であり、小規模医療施設においても簡便、低コストで検査可能な試薬を提供することが可能である。
【0012】
さらに、本発明の検査方法に既存の血清検査または画像診断とを組み合わせることで、血清検査または画像検査単一の検査による診断と比較し、より高い精度で膵疾患を検査することが可能となる。
【図面の簡単な説明】
【0013】
【図1】健常者血清中における、自動免疫測定装置AIAによるオートタキシン濃度定量値(縦軸)とリゾホスホリパーゼD活性測定値(横軸)との相関性を示す。
【図2】男性健常者および女性健常者血清中のリゾホスホリパーゼD活性測定値の分布を示す。
【図3】男性健常者および女性健常者血清中のオートタキシン指数(lysoPLD index)の分布を示す。
【図4】非癌膵疾患および膵臓癌患者血清中のオートタキシン濃度(縦軸)とリゾホスホリパーゼD活性(横軸)との相関性を示す。
【図5】健常者および非癌膵疾患患者のオートタキシン指数(lysoPLD index)をBox−and−Whisker Plotで示した図。2群の有意差検定はMann−Whitney試験にて実施した。
【図6】膵臓癌および非癌膵疾患患者のオートタキシン指数(lysoPLD index)をBox−and−Whisker Plotで示した図。2群の有意差検定はMann−Whitney試験にて実施した。
【発明を実施するための形態】
【0014】
以下本発明を詳細に説明する。
本発明者は、オートタキシン濃度と膵疾患との関係について鋭意検討した。その結果、膵疾患において健常者と比較し非癌膵疾患患者ではオートタキシン濃度が低値を示すこと、膵臓癌患者ではオートタキシン濃度が高値を示す例はあっても低値は示さないことを、それぞれ見いだした。本結果よりヒト検体中のオートタキシン濃度を測定することにより非癌膵疾患および膵臓癌の診断、ならびに膵疾患が疑われる患者において非癌膵疾患と膵臓癌との判別が可能なことを見いだした。本発明は、たとえば血液検査にて、全血中または血球、血清、血漿などのヒト血液成分中のオートタキシン濃度を簡便に測定することにより膵疾患の診断を可能にする技術および試薬を提供するものである。
【0015】
さらに、本発明の検査方法と、既存の血清検査または画像診断とを組み合わせることにより、さらに高精度な膵疾患の診断が期待できる。既存の血清検査としては、CA19−9、CA−50、DU−PAN−2、Span−1、CSLEX、sialyl SSEA−1、ST−439、STN、CA72−4、CA−125、CEA、hCGなど従来から用いられている腫瘍マーカーによる検査や、アミラーゼ、リパーゼ、エステラーゼ1、アルカリ性ホスファターゼ、γGTP、血糖、ヘモグロビンA1c、インスリンなどの従来から用いられる血清マーカーによる検査が例示できる。
【0016】
なお、男性のオートタキシン濃度と女性のオートタキシン濃度とには有意差が存在する(特願2009−298048号)。そのため、測定したヒト検体中のオートタキシン濃度を、あらかじめ測定した男性健常者または女性健常者のオートタキシン濃度で補正して得られるオートタキシン指数を用いて膵疾患を検査すると、男女の性差を考慮しなくて済む点で好ましい。なお、測定したヒト検体中のオートタキシン濃度を補正するのに用いる、男性健常者または女性健常者のオートタキシン濃度は、男性健常者または女性健常者のオートタキシン濃度測定値の平均値であってもよいし、中央値であってもよいし、95パーセンタイル上限値であってもよい。オートタキシン指数は、オートタキシン濃度をリゾホスホリパーゼD活性に基づき測定した場合には、lysoPLD indexとし、オートタキシン濃度を免疫学的定量試薬で測定する場合には、ATX indexとする。以下の実施例2及び実施例3において記載されるように、免疫学的定量試薬で測定したオートタキシン濃度とリゾホスホリパーゼD活性とは極めて高い相関性を有することから、lyspoPLD indexとATX indexとは同視することができる。
【0017】
本発明に係る検査方法は、ヒト検体中のオートタキシン濃度又は指数を測定し、その値が健常者群測定値からなる正常値範囲より算出したカットオフ値より低値を示した場合に非癌膵疾患を罹患する、とする。これにより、非癌膵疾患を診断することが可能になる。このようなカットオフ値は、当業者であれば健常者群と非癌膵疾患群におけるオートタキシン濃度又は指数の分布を参照して任意に決定することができる。カットオフ値の決定法は、例えば血清中のオートタキシン濃度または指数の95%パーセンタイル値下限をカットオフ値に設定することや、オートタキシン濃度または指数を用いたROC曲線による統計的解析で設定可能である。また、膵疾患が疑われる患者において、ヒト検体中のオートタキシン濃度又は指数を測定し、その値が非癌膵疾患群の測定値範囲より算出したカットオフ値より高値を示した場合に膵臓癌を罹患する、とする。これにより、非癌膵疾患と膵臓癌との判別が可能である。膵疾患が疑われる患者とは、好ましくは膵疾患を患っている患者のことをいう。このような、カットオフ値は、当業者であれば、非癌膵疾患群と膵臓癌患者群におけるオートタキシン濃度又は指数の分布を参照して任意に決定することができる。カットオフ値の決定法は、例えば血清中のオートタキシン濃度または指数の95%パーセンタイル値上限をカットオフ値に設定することや、オートタキシン濃度または指数を用いたROC曲線による統計的解析で設定可能である。
【実施例】
【0018】
以下に本発明をさらに詳細に説明するために実施例を示すが、これら実施例は本発明の一例を示すものであり、本発明は実施例に限定されるものではない。なお、実施例で使用した血清検体の採取および測定は東京大学医学部附属病院で実施し、研究倫理について東京大学大学院医学研究科倫理委員会での承認のもと実施した。また、オートタキシン濃度の測定は特許文献1の方法に基づき自動免疫測定装置AIAシリーズ(東ソー社製)を用い実施し、リゾホスホリパーゼD活性測定法も特許文献1に記載されている。これらの測定方法を以下に詳述する。
【0019】
血清中ヒトオートタキシンの濃度測定
ヒトオートタキシンモノクローナル抗体R10.23を固相用抗体として用い、ヒトオートタキシンモノクローナル抗体R10.21を二次抗体として用いた2ステップ2抗体サンドイッチELISAにより、血清中のヒトオートタキシンを測定した。固相用抗体R10.23はペプシン消化によりF(ab)2化し使用した。R10.23を96穴イムノプレート(NUNC社製)に2μg/mL濃度で50μL/ウェルにて添加し、一昼夜、4℃にてプレートに結合させた。TBSにより3回洗浄後、3% BSAを含むTBSを250μL/ウェルで添加し2時間ブロッキング処理を行った。TBSにより3回洗浄後、ヒトオートタキシン標準品(0、0.34、0.675、1.35、2.70、5.40μg/mL)ならびに濃度未知のヒト血清をELISAアッセイ緩衝液で1/5に希釈し50μL/ウェルにて添加した。室温で2時間反応後、TBSTにより4回洗浄し、0.8μg/mLのビオチン標識R10.21を含むELISAアッセイ緩衝液を50μL/ウェル添加した。室温で2時間放置後、TBSTにより4回洗浄し、1000倍希釈したHRP標識ストレプトアビジン(Zymed社製)を含むELISA緩衝液を50μL/ウェル添加した。1時間室温放置後、TBSTにより6回洗浄し、TMB基質を50μL/ウェルで添加した。室温30分後、1N−リン酸により反応を停止し450nmの吸光度を測定した。ヒトオートタキシンの標準品による検量線の回帰を、3次回帰により行った。ヒトオートタキシン濃度依存的に450nmの吸光度上昇が確認された。本検量線を用い未知濃度のヒト血清で得られた450nmの吸光度より検体中のヒトオートタキシンの濃度を算出した。
【0020】
血清中のリゾホスホリパーゼD活性の濃度測定
リゾホスフォリパーゼD活性測定はFEBS letters 571,197−204,2004を若干変更し行った。具体的には、サンプル20μLと2mMのリゾホスファチジルコリン(14:0−リゾホスファチジルコリン)、100mM Tris−HCl、500mM NaCl、5mM MgCl2、0.05% Triton X−100(pH9.0)を含む基質溶液20μLを混合し、37℃にて6時間から一昼夜反応させた。続いて本酵素反応により生成したコリンを定量するため、0.5mM TOOS(N−エチル−N−(2−ヒドロキシ−3−スルフォプロピル)−3−メチルアニリン)、10Unit/mL 西洋ワサビペルオキシダーゼ、0.01% Triton X−100、100mM Tris−HCl(pH8.0)からなるR1溶液150μLを加え5分間放置した後、1mM 4−アミノアンチピリン、10Unit/mL コリンオキシダーゼ、0.01% Triton X−100、100mM Tris−HCl(pH8.0)からなるR2溶液50μLを加えた。30分後、生成したコリンを550nmの吸光度で測定し、既知濃度の塩化コリンを基準にしてリゾホスホリパーゼD活性値とした。
【0021】
実施例1:健常者検体のオートタキシン濃度の定量
患者検体測定に先立ち、コントロール群として健常者血清のオートタキシン濃度を測定した。血液は採血7日前より投薬のない健常な成人ボランティアからインフォームドコンセントを得た後、肘前中静脈より採取し、室温15分放置後、1500×gにて5分間遠心分離することにより血清を取得し測定した。
【0022】
男性74名(23歳から65歳)、女性46名(21歳から60歳)の健常者血清中のオートタキシン濃度を自動免疫測定装置にて実施した。120名全員のオートタキシン濃度測定値は0.731±0.176mg/L(算術平均値±標準偏差)であり、95パーセンタイルからなる参考基準範囲は0.468mg/Lから1.134mg/Lであった。なお、男性健常者のオートタキシン測定値は0.656±0.121mg/L、中央値0.641mg/L、95パーセンタイル参考基準範囲0.438mg/Lから0.914mg/Lであり、女性健常者のオートタキシン測定値は0.852±0.184mg/L、中央値0.820mg/L、95パーセンタイル参考基準範囲0.625mg/Lから1.323mg/Lであった。
【0023】
実施例2:健常者検体のリゾホスホリパーゼD活性測定
実施例1と同一検体のリゾホスホリパーゼD活性を測定した。120名全員のリゾホスホリパーゼD活性測定値は3.56±0.80nmol/(L・min)(算術平均値±標準偏差)であり、中央値3.46nmol/(L・min)、95パーセンタイルからなる参考基準範囲は3.28nmol/(L・min)から3.55nmol/(L・min)であった。実施例1で測定したオートタキシン定量値との相関性は相関係数r=0.946と極めて良好であり、免疫測定によるオートタキシン濃度とリゾホスホリパーゼD活性測定値とはともに同等の診断が可能なことを示している(図1)。なお、男性健常者のリゾホスホリパーゼD活性測定値は3.18±0.55nmol/(L・min)、中央値3.17nmol/(L・min)、95パーセンタイル参考基準範囲2.97nmol/(L・min)から3.32nmol/(L・min)であり、女性健常者のリゾホスホリパーゼD活性測定値は4.15±0.79nmol/(L・min)、中央値4.00nmol/(L・min)、95パーセンタイル参考基準範囲3.80nmol/(L・min)から4.48nmol/(L・min)であった(図2)。女性血清中リゾホスホリパーゼD活性は男性に比べ明らかに高濃度であり、Mann−Whitney U testではP<0.0001の有意差を示した。
【0024】
図2の結果からも分かるように検体測定時には男女の性差を考慮する必要があった。そこで以降の評価は、検体測定値を男女それぞれの平均値である3.18nmol/(L・min)(男性)または4.15nmol/(L・min)(女性)で除する(リゾホスホリパーゼD活性測定値[nmol/(L・min)]÷男性健常者または女性健常者平均値[nmol/(L・min)])ことで男女性差を補正したオートタキシン指数(lysoPLD index)を用い実施した。性差補正後のそれぞれのlysoPLD index分布は、男性健常者においては1.001±0.173、中央値0.995、95パーセンタイル参考基準範囲0.930から1.040であった。一方、女性健常者においては1.002±0.189、中央値0.965、95パーセンタイル参考基準範囲0.912から1.050であった(図3)。
【0025】
実施例3:膵疾患患者血清中のオートタキシン濃度とリゾホスホリパーゼD活性値
膵疾患患者の血清中のオートタキシン濃度とリゾホスホリパーゼD活性測定値とを測定し検証した。検体は膵臓癌患者検体9例と非癌膵疾患2例、計11例用いた。測定した11検体における血清中のオートタキシン濃度とリゾホスホリパーゼD活性測定値との相関性はr=0.983と非常に良好な相関性を示した(図4)。また図4より得られた相関式は、
オートタキシン濃度[μg/L]=
2.163×リゾホスホリパーゼD活性[nmol/(L・min)]+0.0654
であり、健常者(図1)における相関式、
オートタキシン濃度[μg/L]=
2.072×リゾホスホリパーゼD活性[nmol/(L・min)]−0.0057
と大きな差が認められなかった。よって、健常者同様、膵疾患を評価する際にも、オートタキシン濃度とリゾホスホリパーゼD活性測定値、いずれを用いても問題ないことがわかる。
【0026】
実施例4:非癌膵疾患の診断
健常者120例および非癌膵疾患患者73例について血清中のリゾホスホリパーゼD活性を測定し、オートタキシン指数(lysoPLD index)を算出比較した。なお、非癌膵疾患患者は慢性膵炎、急性膵炎、膵嚢胞性疾患よりなる。結果、健常者のlysoPLD indexと比較し、非癌膵疾患患者のlysoPLD indexは有意に低値を示した(Mann−Whitney試験)。前記結果より、オートタキシン濃度、リゾホスホリパーゼD活性測定値またはlysoPLD indexにより非癌膵疾患の診断が可能なことがわかる。
【0027】
実施例5:非癌膵疾患と膵臓癌の判別
膵臓癌患者103例および非癌膵疾患患者73例について血清リゾホスホリパーゼD活性を測定し、オートタキシン指数(lysoPLD index)を算出比較した。非癌膵疾患患者は慢性膵炎、急性膵炎、膵嚢胞性疾患よりなる。結果、膵臓癌患者のlysoPLD indexと比較し、非癌膵疾患患者のlysoPLD indexは有意に低値を示した(Mann−Whitney試験)。前記結果より、オートタキシン濃度、リゾホスホリパーゼD活性測定値またはlysoPLD indexにより膵疾患が疑われる患者において非癌膵疾患と膵臓癌の判別が可能なことがわかる。
【特許請求の範囲】
【請求項1】
ヒト検体中のオートタキシン濃度又はオートタキシン指数を用いることによる膵疾患の検査方法。
【請求項2】
前記オートタキシン指数が、オートタキシン濃度の測定値を男性健常者または女性健常者の統計学的数値で補正することにより得られる、請求項1に記載の方法。
【請求項3】
前記統計学的数値がオートタキシン濃度測定値の平均値、中央値、95パーセンタイル上限値のいずれかである請求項2に記載の検査方法。
【請求項4】
前記方法が、膵疾患が疑われる患者に対して行われる、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
膵疾患が膵臓癌以外の非癌膵疾患である請求項1〜4のいずれか一項に記載の検査方法。
【請求項6】
ヒト検体中のオートタキシン濃度又はオートタキシン指数を測定し、その値が健常者群のオートタキシン濃度又はオートタキシン指数から算出したカットオフ値に対し低値を示した場合に膵臓癌以外の非癌膵疾患を罹患するとすることを特徴とする、請求項5に記載の検査方法。
【請求項7】
非癌膵疾患が慢性膵炎、急性膵炎、膵嚢胞性疾患のいずれかである請求項5又は6に記載の検査方法。
【請求項8】
膵疾患が膵臓癌である請求項4に記載の検査方法。
【請求項9】
ヒト検体中のオートタキシン濃度又はオートタキシン指数を測定し、その値が非癌膵疾患患者群のオートタキシン濃度又はオートタキシン指数から算出したカットオフ値に対し高値を示した場合に膵臓癌を罹患するとすることを特徴とする、請求項8に記載の検査方法。
【請求項10】
血清検査または画像診断と、請求項1から9のいずれかに記載の検査方法とを組み合わせた膵疾患の検査方法。
【請求項11】
血清検査がCA19−9、CA−50、DU−PAN−2、Span−1、CSLEX、sialyl SSEA−1、ST−439、STN、CA72−4、CA−125、CEA、hCGのいずれかの腫瘍マーカーを用いた検査である請求項10に記載の検査方法。
【請求項12】
血清検査がアミラーゼ、リパーゼ、エステラーゼ1、アルカリ性ホスファターゼ、γGTP、血糖、ヘモグロビンA1c、インスリンのいずれかの血清マーカーを用いた検査である請求項10に記載の検査方法。
【請求項13】
ヒト検体が全血もしくは血球、血清、血漿などのヒト血液成分またはヒト細胞もしくは組織の抽出液である請求項1から12のいずれかに記載の検査方法。
【請求項14】
抗体を用いた免疫化学的方法でオートタキシン濃度を測定する請求項1から13のいずれかに記載の検査方法。
【請求項15】
ヒト検体中のオートタキシン濃度を測定する方法がリゾホスホリパーゼD活性を測定する方法である請求項1から13のいずれかに記載の検査方法。
【請求項16】
請求項14または15に記載の検査方法を利用した膵疾患の検査薬。
【請求項1】
ヒト検体中のオートタキシン濃度又はオートタキシン指数を用いることによる膵疾患の検査方法。
【請求項2】
前記オートタキシン指数が、オートタキシン濃度の測定値を男性健常者または女性健常者の統計学的数値で補正することにより得られる、請求項1に記載の方法。
【請求項3】
前記統計学的数値がオートタキシン濃度測定値の平均値、中央値、95パーセンタイル上限値のいずれかである請求項2に記載の検査方法。
【請求項4】
前記方法が、膵疾患が疑われる患者に対して行われる、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
膵疾患が膵臓癌以外の非癌膵疾患である請求項1〜4のいずれか一項に記載の検査方法。
【請求項6】
ヒト検体中のオートタキシン濃度又はオートタキシン指数を測定し、その値が健常者群のオートタキシン濃度又はオートタキシン指数から算出したカットオフ値に対し低値を示した場合に膵臓癌以外の非癌膵疾患を罹患するとすることを特徴とする、請求項5に記載の検査方法。
【請求項7】
非癌膵疾患が慢性膵炎、急性膵炎、膵嚢胞性疾患のいずれかである請求項5又は6に記載の検査方法。
【請求項8】
膵疾患が膵臓癌である請求項4に記載の検査方法。
【請求項9】
ヒト検体中のオートタキシン濃度又はオートタキシン指数を測定し、その値が非癌膵疾患患者群のオートタキシン濃度又はオートタキシン指数から算出したカットオフ値に対し高値を示した場合に膵臓癌を罹患するとすることを特徴とする、請求項8に記載の検査方法。
【請求項10】
血清検査または画像診断と、請求項1から9のいずれかに記載の検査方法とを組み合わせた膵疾患の検査方法。
【請求項11】
血清検査がCA19−9、CA−50、DU−PAN−2、Span−1、CSLEX、sialyl SSEA−1、ST−439、STN、CA72−4、CA−125、CEA、hCGのいずれかの腫瘍マーカーを用いた検査である請求項10に記載の検査方法。
【請求項12】
血清検査がアミラーゼ、リパーゼ、エステラーゼ1、アルカリ性ホスファターゼ、γGTP、血糖、ヘモグロビンA1c、インスリンのいずれかの血清マーカーを用いた検査である請求項10に記載の検査方法。
【請求項13】
ヒト検体が全血もしくは血球、血清、血漿などのヒト血液成分またはヒト細胞もしくは組織の抽出液である請求項1から12のいずれかに記載の検査方法。
【請求項14】
抗体を用いた免疫化学的方法でオートタキシン濃度を測定する請求項1から13のいずれかに記載の検査方法。
【請求項15】
ヒト検体中のオートタキシン濃度を測定する方法がリゾホスホリパーゼD活性を測定する方法である請求項1から13のいずれかに記載の検査方法。
【請求項16】
請求項14または15に記載の検査方法を利用した膵疾患の検査薬。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2012−52875(P2012−52875A)
【公開日】平成24年3月15日(2012.3.15)
【国際特許分類】
【出願番号】特願2010−194658(P2010−194658)
【出願日】平成22年8月31日(2010.8.31)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
【公開日】平成24年3月15日(2012.3.15)
【国際特許分類】
【出願日】平成22年8月31日(2010.8.31)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
[ Back to top ]

