カチオン性PEG脂質および使用方法
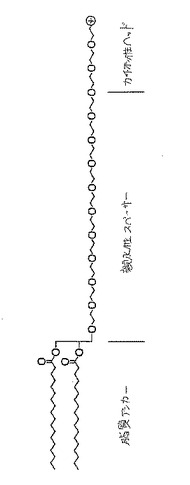
【課題】核酸の細胞内送達を増加する方法、及び、高いトランスフェクション力価およびトランスフェクション効率を有する人工ウイルスを提供する。
【解決手段】細胞の取り込みを増大させるために、末端カチオン性ポリ(エチレングリコール)−脂質接合体のようなカチオン性ポリマー−脂質接合体(CPL)に、脂質部分;親水性ポリマー;およびポリカチオン性部分を含ませる。従来型のステルスリポソーまたは他の脂質ベースの処方物に組み込まれ得る。
【解決手段】細胞の取り込みを増大させるために、末端カチオン性ポリ(エチレングリコール)−脂質接合体のようなカチオン性ポリマー−脂質接合体(CPL)に、脂質部分;親水性ポリマー;およびポリカチオン性部分を含ませる。従来型のステルスリポソーまたは他の脂質ベースの処方物に組み込まれ得る。
Notice: Undefined index: DEJ in /mnt/www/gzt_disp.php on line 298
【特許請求の範囲】
【請求項1】
式I:
【化1】

の一般式を有する化合物であって、ここで:
Aは脂質部分であり;
Wは親水性ポリマーであり;そして
Yはポリカチオン性部分である、化合物。
【請求項2】
前記親水性ポリマーが、非免疫原性であるか、または弱い免疫原性である、請求項1に記載の化合物。
【請求項3】
請求項1に記載の化合物であって、ここで、
Wが、PEG、ポリアミド、ポリ乳酸、ポリグリコール酸、ポリ乳酸/ポリグリコール酸コポリマーおよびこれらの組合わせからなる群から選択されるポリマーであり、該ポリマーが約250〜約700ダルトンの分子量を有する、化合物。
【請求項4】
Yが、少なくとも1つの塩基性アミノ酸またはその誘導体を含む、請求項1に記載の化合物。
【請求項5】
Yが、選択されたpHで、少なくとも4つの正電荷を有する、請求項1に記載の化合物。
【請求項6】
Yが、選択されたpHで、少なくとも8つの正電荷を有する、請求項1に記載の化合物。
【請求項7】
Yが、リジン、アルギニン、アスパラギン、グルタミン、これらの誘導体およびこれらの組合わせからなる群から選択されるメンバーである、請求項4に記載の化合物。
【請求項8】
請求項2に記載の化合物であって、ここで、
Aが、ジアシルグリセロールイル部分、ジアルキルグリセロールイル部分、N−N−ジアルキルアミノ部分、1,2−ジアシルオキシ−3−アミノプロパン部分および1,2−ジアルキル−3−アミノプロパン部分からなる群から選択されるメンバーである、化合物。
【請求項9】
WがPEGである、請求項3に記載の化合物。
【請求項10】
Wがポリアミドポリマーである、請求項3に記載の化合物。
【請求項11】
Wが約250〜約2000ダルトンの分子量を有する、請求項3に記載の化合物。
【請求項12】
式II:
【化2】

の一般式を有する化合物であって、ここで、
Aは、脂質部分であり;
Xは、単結合、または前記脂質を少なくとも1つのエチレンオキシドユニットに共有結合する官能基からなる群から選択されるメンバーであり;
Yは、ポリカチオン性部分であり;
Zは、単結合、または該少なくとも1つのエチレンオキシドユニットをカチオン性基に共有結合する官能基からなる群から選択されるメンバーであり;そして
nは、約6〜約50の間の値を有する整数である、化合物。
【請求項13】
請求項12に記載の化合物であって、ここで、
Xは、単結合、ホスファチジルエタノールアミノ、ホスファチジルエタノールアミド、ホスホロ、ホスホ、ホスホエタノールアミノ、ホスホエタノールアミド、カルボニル、カルバメート、カルボキシル、カーボネート、アミド、チオアミド、酸素、硫黄およびNRからなる群から選択されるメンバーであり、ここで、Rは水素またはアルキル基である、化合物。
【請求項14】
請求項12に記載の化合物であって、
Zは、単結合、ホスホ、ホスホエタノールアミノ、ホスホエタノールアミド、カルボニル、カルバメート、カルボキシル、アミド、チオアミド、およびNRからなる群から選択されるメンバーであり、ここで、Rは水素またはアルキル基である、化合物。
【請求項15】
請求項12に記載の化合物であって、ここで、
Aはジアシルグリセロールイル部分であり;
Xはホスホエタノールアミドであり;
ZはNRであり、ここでRは水素原子であり;そして
Yは、約1〜約10の塩基性アミノ酸またはその誘導体からなる群から選択されるメンバーである、化合物。
【請求項16】
請求項15に記載の化合物であって、ここで、
Aは2つの脂肪族アシル鎖を有するジアシルグリセロールイル部分であり、ここで、各アシル鎖は、独立して2〜30の間の炭素長であり、そして飽和されているか、または変化する飽和度を有するかのいずれかである、化合物。
【請求項17】
請求項15に記載の化合物であって、ここで、
Yは、リジン、アルギニン、アスパラギン、グルタミン、これらの誘導体およびこれらの組合わせからなる群から選択されるメンバーである、化合物。
【請求項18】
請求項15に記載の化合物であって、ここで、
Aは、2つの脂肪族アシル鎖を有するジアシルグリセロールイル部分であって、ここで、各アシル鎖は飽和したC−18炭素鎖であり;そして
Yは、4つのリジン残基またはその誘導体を有するカチオン性基である、化合物。
【請求項19】
脂質ベースの薬物処方物であって、該処方物は、以下:
(a)式I:
【化3】

の一般式を有する化合物であって、ここで、
Aは脂質部分であり;
Wは親水性ポリマーであり;
Yはポリカチオン性部分である、化合物;
(b)生物活性剤;および
(c)第2脂質、
を含む、処方物。
【請求項20】
Yが非免疫原性または弱い免疫原性である、請求項19に記載の処方物。
【請求項21】
請求項19に記載の処方物であって、ここで、
Wは、PEG、ポリアミド、ポリ乳酸、ポリグリコール酸、ポリ乳酸/ポリグリコール酸コポリマーおよびこれらの組合わせからなる群から選択されるポリマーであり、該ポリマーは約250〜約7000ダルトンの分子量を有する、処方物。
【請求項22】
WがPEGである、請求項19に記載の処方物。
【請求項23】
前記PEGが約250〜約3000の分子量を有する、請求項22に記載の処方物。
【請求項24】
前記PEGが約250〜約1000の分子量を有する、請求項22に記載の処方物。
【請求項25】
前記第2脂質がPEG脂質であり、そしてWが該PEG脂質のPEGよりも小さな分子量を有する、請求項22に記載の処方物。
【請求項26】
前記第2脂質がPEG3400脂質であり、そして前記式Iの化合物が以下の式:
A−PEG1000−Y
を有する、請求項22に記載の処方物。
【請求項27】
前記第2脂質がPEG2000脂質であり、そして前記式Iの化合物が以下の式:
A−PEG1000−Y
を有する、請求項22に記載の処方物。
【請求項28】
前記第2脂質がPEG脂質であり、そしてWが該PEG脂質のPEGより大きな分子量を有する、請求項22に記載の処方物。
【請求項29】
前記第2脂質がPEG1000脂質であり、そして前記式Iの化合物が以下の式:
A−PEG3400−Y
を有する、請求項22に記載の処方物。
【請求項30】
前記第2脂質がPEG1000脂質であり、そして前記式Iの化合物が以下の式:
A−PEG2000−Y
を有する、請求項22に記載の処方物。
【請求項31】
前記生物活性剤が、抗腫瘍薬を含む、請求抗19に記載の処方物。
【請求項32】
請求項31に記載の処方物であって、ここで、前記抗腫瘍薬が、アクチノマイシンD、ビンクリスチン、ビンブラスチン、シスチンアラビノシド、アントラサイクリン、アルキル化剤、白金化合物、代謝拮抗物質、ヌクレオシドアナログ、メトトレキサート、プリンアナログ、およびピリミジンアナログからなる群から選択されるメンバーである、処方物。
【請求項33】
前記生物活性剤が核酸を含む、請求項19に記載の処方物。
【請求項34】
前記生物活性剤が、遺伝子構築物またはオリゴヌクレオチドである、請求項33に記載の処方物。
【請求項35】
二層構造の安定化成分をさらに含む、請求項19に記載の処方物。
【請求項36】
前記二層構造の安定化成分がPEG脂質であり、ここで、該PEG脂質のPEGが、前記ポリマーWよりも大きな分子量を有する、請求項35に記載の処方物。
【請求項37】
前記二層構造の安定化成分がATTA脂質であり、ここで、該ATTA脂質のATTAが、前記親水性ポリマーよりも大きな分子量を有する、請求項35に記載の処方物。
【請求項38】
WがPEGである、請求項21に記載の処方物。
【請求項39】
脂質ベースの薬物処方物であって、該処方物は、以下:
(a)式II:
【化4】

の一般式を有する化合物であって、ここで
Aは、脂質部分であり;
Xは、単結合、または該疎水性脂質を少なくとも1つのエチレンオキシドユニットもしくは単結合に共有結合する官能基からなる群から選択されるメンバーであり;
Yは、ポリカチオン性部分であり;
Zは、単結合、または該少なくとも1つのエチレンオキシドユニットをカチオン性ヘッド基または単結合に共有結合する官能基からなる群から選択されるメンバーであり;そして
nは、約6〜約50の範囲の整数である、化合物;
(b)生物活性剤;および
(c)第2脂質、
を含む、処方物。
【請求項40】
請求項39に記載の処方物であって、ここで、
Aは、ジアシルグリセロールイル部分、ジアルキルグリセロールイル部分、N−N−ジアルキルアミノ部分、1,2−ジアシルオキシ−3−アミノプロパン部分および1,2−ジアルキル−3−アミノプロパン部分からなる群から選択されるメンバーである、処方物。
【請求項41】
請求項39に記載の処方物であって、ここで、
Xは、単結合、ホスファチジルエタノールアミノ、ホスファチジルエタノールアミド、ホスホロ、ホスホ、ホスホエタノールアミノ、ホスホエタノールアミド、カルボニル、カルバメート、カルボキシル、カーボネート、アミド、チオアミド、酸素、硫黄、NRからなる群から選択されるメンバーであり、ここで、Rは、水素アルキル基である、処方物。
【請求項42】
請求項39に記載の処方物であって、ここで、
Zは、単結合、ホスホ、ホスホエタノールアミノ、ホスホエタノールアミド、カルボニル、カルバメート、カルボキシル、アミド、チオアミド、アミノ基、NRからなる群から選択されるメンバーであり、ここで、Rは、水素原子またはアルキル基からなる群から選択されるメンバーである、処方物。
【請求項43】
請求項19に記載の処方物であって、ここで、該処方物が、リポソーム、ミセル、ビロゾーム、脂質−核酸粒子、核酸複合体およびこれらの混合物からなる群から選択されるメンバーの形態である、処方物。
【請求項44】
前記脂質ベースの薬物処方物がリポソームである、請求項43に記載の処方物。
【請求項45】
請求項44に記載の処方物であって、ここで、前記脂質ベースの薬物処方物が、約0.05〜約0.5ミクロンの範囲の平均サイズを有するリポソームであって、ここで、前記生物活性剤が遺伝子構築物またはオリゴヌクレオチドである、処方物。
【請求項46】
脂質ベースの薬物処方物の細胞内送達を増加する方法であって、該方法は、以下:
請求項1に記載の化合物を、該脂質ベースの薬物処方物に組み入れる工程であって、これによって、請求項1に記載の化合物を有さない処方物と比較して、該脂質ベースの薬物処方物の細胞内送達を増加する工程、
を包含する、方法。
【請求項47】
前記送達がインビボである、請求項46に記載の方法。
【請求項48】
前記増加が少なくとも10倍である、請求項46に記載の方法。
【請求項49】
非経口投与される脂質ベースの薬物処方物の一部である薬物の、標的細胞への送達を増加する方法であって、該方法は、以下:
該脂質ベースの薬物処方物に、約0.1〜20モルパーセントの請求項1に記載の化合物を組み入れる工程、
を包含する、方法。
【請求項50】
哺乳動物に生物活性剤を投与する方法であって、該方法は、以下:
小胞形成脂質または小胞取り込み脂質あるいはこれらの混合物、および0.1〜20モルパーセントの間の請求項1に記載の化合物、ならびに薬学的に受容可能な量の生物活性剤を含む脂質ベースの薬物処方物の懸濁液を調製する工程、ならびに該脂質ベースの薬物処方物を該哺乳動物に非経口投与する工程、
を包含する、方法。
【請求項51】
脂質ベースの薬物処方物で細胞をトランスフェクトする方法であって、該方法は、以下:
該細胞に、約0.1〜約20モルパーセントの請求項1に記載の化合物を有する脂質ベースの薬物処方物を接触させる工程、
を包含する、方法。
【請求項52】
脂質ベースの薬物処方物での細胞のトランスフェクトを増加する方法であって、該方法は、以下:
該細胞を、約0.1〜約20モルパーセントの請求項1に記載の化合物を有する脂質ベースの薬物処方物と接触させる工程であって、ここで、該脂質ベースの処方物のトランスフェクション効率が、請求項1に記載の化合物を有さない脂質ベースの薬物処方物と比較して、増加されている、工程
を包含する、方法。
【請求項53】
高いトランスフェクション力価およびトランスフェクション効率を有する人工ウイルスであって、該人工ウイルスは、以下:
核酸をパッケージングおよび保護するための微小容器であって、ここで、該核酸は、血清ヌクレアーゼによる分解から保護され、該微小容器は、式I:
【化5】

の化合物を含み、ここで:
Aは、脂質部分であり;
Wは、親水性ポリマーであり;そして
Yは、ポリカチオン性部分である、微小容器、
を含む、人工ウイルス。
【請求項54】
請求項53に記載の人工ウイルスであって、Yが、それに結合するリガンドを有する、人工ウイルス。
【請求項1】
式I:
【化1】

の一般式を有する化合物であって、ここで:
Aは脂質部分であり;
Wは親水性ポリマーであり;そして
Yはポリカチオン性部分である、化合物。
【請求項2】
前記親水性ポリマーが、非免疫原性であるか、または弱い免疫原性である、請求項1に記載の化合物。
【請求項3】
請求項1に記載の化合物であって、ここで、
Wが、PEG、ポリアミド、ポリ乳酸、ポリグリコール酸、ポリ乳酸/ポリグリコール酸コポリマーおよびこれらの組合わせからなる群から選択されるポリマーであり、該ポリマーが約250〜約700ダルトンの分子量を有する、化合物。
【請求項4】
Yが、少なくとも1つの塩基性アミノ酸またはその誘導体を含む、請求項1に記載の化合物。
【請求項5】
Yが、選択されたpHで、少なくとも4つの正電荷を有する、請求項1に記載の化合物。
【請求項6】
Yが、選択されたpHで、少なくとも8つの正電荷を有する、請求項1に記載の化合物。
【請求項7】
Yが、リジン、アルギニン、アスパラギン、グルタミン、これらの誘導体およびこれらの組合わせからなる群から選択されるメンバーである、請求項4に記載の化合物。
【請求項8】
請求項2に記載の化合物であって、ここで、
Aが、ジアシルグリセロールイル部分、ジアルキルグリセロールイル部分、N−N−ジアルキルアミノ部分、1,2−ジアシルオキシ−3−アミノプロパン部分および1,2−ジアルキル−3−アミノプロパン部分からなる群から選択されるメンバーである、化合物。
【請求項9】
WがPEGである、請求項3に記載の化合物。
【請求項10】
Wがポリアミドポリマーである、請求項3に記載の化合物。
【請求項11】
Wが約250〜約2000ダルトンの分子量を有する、請求項3に記載の化合物。
【請求項12】
式II:
【化2】

の一般式を有する化合物であって、ここで、
Aは、脂質部分であり;
Xは、単結合、または前記脂質を少なくとも1つのエチレンオキシドユニットに共有結合する官能基からなる群から選択されるメンバーであり;
Yは、ポリカチオン性部分であり;
Zは、単結合、または該少なくとも1つのエチレンオキシドユニットをカチオン性基に共有結合する官能基からなる群から選択されるメンバーであり;そして
nは、約6〜約50の間の値を有する整数である、化合物。
【請求項13】
請求項12に記載の化合物であって、ここで、
Xは、単結合、ホスファチジルエタノールアミノ、ホスファチジルエタノールアミド、ホスホロ、ホスホ、ホスホエタノールアミノ、ホスホエタノールアミド、カルボニル、カルバメート、カルボキシル、カーボネート、アミド、チオアミド、酸素、硫黄およびNRからなる群から選択されるメンバーであり、ここで、Rは水素またはアルキル基である、化合物。
【請求項14】
請求項12に記載の化合物であって、
Zは、単結合、ホスホ、ホスホエタノールアミノ、ホスホエタノールアミド、カルボニル、カルバメート、カルボキシル、アミド、チオアミド、およびNRからなる群から選択されるメンバーであり、ここで、Rは水素またはアルキル基である、化合物。
【請求項15】
請求項12に記載の化合物であって、ここで、
Aはジアシルグリセロールイル部分であり;
Xはホスホエタノールアミドであり;
ZはNRであり、ここでRは水素原子であり;そして
Yは、約1〜約10の塩基性アミノ酸またはその誘導体からなる群から選択されるメンバーである、化合物。
【請求項16】
請求項15に記載の化合物であって、ここで、
Aは2つの脂肪族アシル鎖を有するジアシルグリセロールイル部分であり、ここで、各アシル鎖は、独立して2〜30の間の炭素長であり、そして飽和されているか、または変化する飽和度を有するかのいずれかである、化合物。
【請求項17】
請求項15に記載の化合物であって、ここで、
Yは、リジン、アルギニン、アスパラギン、グルタミン、これらの誘導体およびこれらの組合わせからなる群から選択されるメンバーである、化合物。
【請求項18】
請求項15に記載の化合物であって、ここで、
Aは、2つの脂肪族アシル鎖を有するジアシルグリセロールイル部分であって、ここで、各アシル鎖は飽和したC−18炭素鎖であり;そして
Yは、4つのリジン残基またはその誘導体を有するカチオン性基である、化合物。
【請求項19】
脂質ベースの薬物処方物であって、該処方物は、以下:
(a)式I:
【化3】

の一般式を有する化合物であって、ここで、
Aは脂質部分であり;
Wは親水性ポリマーであり;
Yはポリカチオン性部分である、化合物;
(b)生物活性剤;および
(c)第2脂質、
を含む、処方物。
【請求項20】
Yが非免疫原性または弱い免疫原性である、請求項19に記載の処方物。
【請求項21】
請求項19に記載の処方物であって、ここで、
Wは、PEG、ポリアミド、ポリ乳酸、ポリグリコール酸、ポリ乳酸/ポリグリコール酸コポリマーおよびこれらの組合わせからなる群から選択されるポリマーであり、該ポリマーは約250〜約7000ダルトンの分子量を有する、処方物。
【請求項22】
WがPEGである、請求項19に記載の処方物。
【請求項23】
前記PEGが約250〜約3000の分子量を有する、請求項22に記載の処方物。
【請求項24】
前記PEGが約250〜約1000の分子量を有する、請求項22に記載の処方物。
【請求項25】
前記第2脂質がPEG脂質であり、そしてWが該PEG脂質のPEGよりも小さな分子量を有する、請求項22に記載の処方物。
【請求項26】
前記第2脂質がPEG3400脂質であり、そして前記式Iの化合物が以下の式:
A−PEG1000−Y
を有する、請求項22に記載の処方物。
【請求項27】
前記第2脂質がPEG2000脂質であり、そして前記式Iの化合物が以下の式:
A−PEG1000−Y
を有する、請求項22に記載の処方物。
【請求項28】
前記第2脂質がPEG脂質であり、そしてWが該PEG脂質のPEGより大きな分子量を有する、請求項22に記載の処方物。
【請求項29】
前記第2脂質がPEG1000脂質であり、そして前記式Iの化合物が以下の式:
A−PEG3400−Y
を有する、請求項22に記載の処方物。
【請求項30】
前記第2脂質がPEG1000脂質であり、そして前記式Iの化合物が以下の式:
A−PEG2000−Y
を有する、請求項22に記載の処方物。
【請求項31】
前記生物活性剤が、抗腫瘍薬を含む、請求抗19に記載の処方物。
【請求項32】
請求項31に記載の処方物であって、ここで、前記抗腫瘍薬が、アクチノマイシンD、ビンクリスチン、ビンブラスチン、シスチンアラビノシド、アントラサイクリン、アルキル化剤、白金化合物、代謝拮抗物質、ヌクレオシドアナログ、メトトレキサート、プリンアナログ、およびピリミジンアナログからなる群から選択されるメンバーである、処方物。
【請求項33】
前記生物活性剤が核酸を含む、請求項19に記載の処方物。
【請求項34】
前記生物活性剤が、遺伝子構築物またはオリゴヌクレオチドである、請求項33に記載の処方物。
【請求項35】
二層構造の安定化成分をさらに含む、請求項19に記載の処方物。
【請求項36】
前記二層構造の安定化成分がPEG脂質であり、ここで、該PEG脂質のPEGが、前記ポリマーWよりも大きな分子量を有する、請求項35に記載の処方物。
【請求項37】
前記二層構造の安定化成分がATTA脂質であり、ここで、該ATTA脂質のATTAが、前記親水性ポリマーよりも大きな分子量を有する、請求項35に記載の処方物。
【請求項38】
WがPEGである、請求項21に記載の処方物。
【請求項39】
脂質ベースの薬物処方物であって、該処方物は、以下:
(a)式II:
【化4】

の一般式を有する化合物であって、ここで
Aは、脂質部分であり;
Xは、単結合、または該疎水性脂質を少なくとも1つのエチレンオキシドユニットもしくは単結合に共有結合する官能基からなる群から選択されるメンバーであり;
Yは、ポリカチオン性部分であり;
Zは、単結合、または該少なくとも1つのエチレンオキシドユニットをカチオン性ヘッド基または単結合に共有結合する官能基からなる群から選択されるメンバーであり;そして
nは、約6〜約50の範囲の整数である、化合物;
(b)生物活性剤;および
(c)第2脂質、
を含む、処方物。
【請求項40】
請求項39に記載の処方物であって、ここで、
Aは、ジアシルグリセロールイル部分、ジアルキルグリセロールイル部分、N−N−ジアルキルアミノ部分、1,2−ジアシルオキシ−3−アミノプロパン部分および1,2−ジアルキル−3−アミノプロパン部分からなる群から選択されるメンバーである、処方物。
【請求項41】
請求項39に記載の処方物であって、ここで、
Xは、単結合、ホスファチジルエタノールアミノ、ホスファチジルエタノールアミド、ホスホロ、ホスホ、ホスホエタノールアミノ、ホスホエタノールアミド、カルボニル、カルバメート、カルボキシル、カーボネート、アミド、チオアミド、酸素、硫黄、NRからなる群から選択されるメンバーであり、ここで、Rは、水素アルキル基である、処方物。
【請求項42】
請求項39に記載の処方物であって、ここで、
Zは、単結合、ホスホ、ホスホエタノールアミノ、ホスホエタノールアミド、カルボニル、カルバメート、カルボキシル、アミド、チオアミド、アミノ基、NRからなる群から選択されるメンバーであり、ここで、Rは、水素原子またはアルキル基からなる群から選択されるメンバーである、処方物。
【請求項43】
請求項19に記載の処方物であって、ここで、該処方物が、リポソーム、ミセル、ビロゾーム、脂質−核酸粒子、核酸複合体およびこれらの混合物からなる群から選択されるメンバーの形態である、処方物。
【請求項44】
前記脂質ベースの薬物処方物がリポソームである、請求項43に記載の処方物。
【請求項45】
請求項44に記載の処方物であって、ここで、前記脂質ベースの薬物処方物が、約0.05〜約0.5ミクロンの範囲の平均サイズを有するリポソームであって、ここで、前記生物活性剤が遺伝子構築物またはオリゴヌクレオチドである、処方物。
【請求項46】
脂質ベースの薬物処方物の細胞内送達を増加する方法であって、該方法は、以下:
請求項1に記載の化合物を、該脂質ベースの薬物処方物に組み入れる工程であって、これによって、請求項1に記載の化合物を有さない処方物と比較して、該脂質ベースの薬物処方物の細胞内送達を増加する工程、
を包含する、方法。
【請求項47】
前記送達がインビボである、請求項46に記載の方法。
【請求項48】
前記増加が少なくとも10倍である、請求項46に記載の方法。
【請求項49】
非経口投与される脂質ベースの薬物処方物の一部である薬物の、標的細胞への送達を増加する方法であって、該方法は、以下:
該脂質ベースの薬物処方物に、約0.1〜20モルパーセントの請求項1に記載の化合物を組み入れる工程、
を包含する、方法。
【請求項50】
哺乳動物に生物活性剤を投与する方法であって、該方法は、以下:
小胞形成脂質または小胞取り込み脂質あるいはこれらの混合物、および0.1〜20モルパーセントの間の請求項1に記載の化合物、ならびに薬学的に受容可能な量の生物活性剤を含む脂質ベースの薬物処方物の懸濁液を調製する工程、ならびに該脂質ベースの薬物処方物を該哺乳動物に非経口投与する工程、
を包含する、方法。
【請求項51】
脂質ベースの薬物処方物で細胞をトランスフェクトする方法であって、該方法は、以下:
該細胞に、約0.1〜約20モルパーセントの請求項1に記載の化合物を有する脂質ベースの薬物処方物を接触させる工程、
を包含する、方法。
【請求項52】
脂質ベースの薬物処方物での細胞のトランスフェクトを増加する方法であって、該方法は、以下:
該細胞を、約0.1〜約20モルパーセントの請求項1に記載の化合物を有する脂質ベースの薬物処方物と接触させる工程であって、ここで、該脂質ベースの処方物のトランスフェクション効率が、請求項1に記載の化合物を有さない脂質ベースの薬物処方物と比較して、増加されている、工程
を包含する、方法。
【請求項53】
高いトランスフェクション力価およびトランスフェクション効率を有する人工ウイルスであって、該人工ウイルスは、以下:
核酸をパッケージングおよび保護するための微小容器であって、ここで、該核酸は、血清ヌクレアーゼによる分解から保護され、該微小容器は、式I:
【化5】

の化合物を含み、ここで:
Aは、脂質部分であり;
Wは、親水性ポリマーであり;そして
Yは、ポリカチオン性部分である、微小容器、
を含む、人工ウイルス。
【請求項54】
請求項53に記載の人工ウイルスであって、Yが、それに結合するリガンドを有する、人工ウイルス。
【図1】


【図2a】


【図2b】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8a】


【図8b】


【図8c】


【図9a】


【図9b】


【図9c】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16a】


【図16b】


【図17a】


【図17b】


【図17c】


【図18a】


【図18b】


【図19a】


【図19b】


【図20】


【図21】


【図22】


【図23a】


【図23b】


【図23c】


【図24a】


【図24b】


【図24c】


【図25a】


【図25b】


【図26】


【図27】


【図28a】


【図28b】


【図28c】


【図28d】


【図29a】


【図29b】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37a】


【図37b】


【図38】


【図39】


【図40】




【図2a】


【図2b】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8a】


【図8b】


【図8c】


【図9a】


【図9b】


【図9c】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16a】


【図16b】


【図17a】


【図17b】


【図17c】


【図18a】


【図18b】


【図19a】


【図19b】


【図20】


【図21】


【図22】


【図23a】


【図23b】


【図23c】


【図24a】


【図24b】


【図24c】


【図25a】


【図25b】


【図26】


【図27】


【図28a】


【図28b】


【図28c】


【図28d】


【図29a】


【図29b】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37a】


【図37b】


【図38】


【図39】


【図40】


【公開番号】特開2012−122075(P2012−122075A)
【公開日】平成24年6月28日(2012.6.28)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−17765(P2012−17765)
【出願日】平成24年1月31日(2012.1.31)
【分割の表示】特願2000−611949(P2000−611949)の分割
【原出願日】平成12年4月20日(2000.4.20)
【出願人】(300066874)ザ・ユニバーシティ・オブ・ブリティッシュ・コロンビア (24)
【Fターム(参考)】
【公開日】平成24年6月28日(2012.6.28)
【国際特許分類】
【出願番号】特願2012−17765(P2012−17765)
【出願日】平成24年1月31日(2012.1.31)
【分割の表示】特願2000−611949(P2000−611949)の分割
【原出願日】平成12年4月20日(2000.4.20)
【出願人】(300066874)ザ・ユニバーシティ・オブ・ブリティッシュ・コロンビア (24)
【Fターム(参考)】
[ Back to top ]

