カビの形態観察方法
【課題】カビの形態観察に使用できるカビの形態観察方法を提供する。
【解決手段】カビを接種した液体透過性フィルム上で、当該カビを培養し、上記液体透過性フィルムを顕微鏡観察に供し、カビの形態観察を行う。上記液体透過性フィルムは膜厚が50μm〜1mm、直径1μm〜10μmの孔を有し、顕微鏡観察が可能な光透過性であり、寒天培地のような固体培地上に配置して使用することができる。培養過程または培養終了後に、生育したカビを有する液体透過性フィルムを顕微鏡観察に供する。
【解決手段】カビを接種した液体透過性フィルム上で、当該カビを培養し、上記液体透過性フィルムを顕微鏡観察に供し、カビの形態観察を行う。上記液体透過性フィルムは膜厚が50μm〜1mm、直径1μm〜10μmの孔を有し、顕微鏡観察が可能な光透過性であり、寒天培地のような固体培地上に配置して使用することができる。培養過程または培養終了後に、生育したカビを有する液体透過性フィルムを顕微鏡観察に供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、例えばカビの同定及び分類において行われるカビの形態観察方法に関する。
【背景技術】
【0002】
カビの同定及び分類は、分生子形成過程や微細な形態の違いによって行われる。そのため、カビの同定及び分類には、分類同定に必要な形態の観察が可能な状態にカビを培養させた後、その形態を保持したまま顕微鏡観察することが必須である。しかしながら、カビの形態は崩壊しやすく、他の微生物や培養細胞に使用される通常の顕微鏡観察方法を使用することができない。
【0003】
そこで、従来よりカビの顕微鏡観察には、スライド培養方法が使用されている(非特許文献1)。例えば、非特許文献1第114頁に示されるように、スライド培養方法では、先ず滅菌済み容器やスライドガラス等から構成される培養装置を用意する。一方、寒天培地を準備し、寒天片を切り出し、容器中のスライドガラス上に載せる。次いで、寒天片の四辺にカビを接種し、寒天片上にカバーガラスを載せ、当該カビを培養する。この培養によって、スライドガラス上にカビが生育することとなる。培養終了後、スライドガラスから寒天片とカバーガラスを取り除き、新しいカバーガラスを、スライドガラス上で生育したカビに載せる。このようにして作製された標本を光学顕微鏡で観察することにより、形態を保持したまま、カビの顕微鏡観察を行うことができる。しかしながら、上述したスライド培養方法は操作が煩雑で熟練した技術を要し、簡便に行うことができない。
【0004】
一方、微生物以外の動物細胞の簡便な顕微鏡観察方法では、液体培地中に細胞が接着する膜を浸漬し、細胞を膜上で培養後、細胞を担持する膜を取り出し、固定、包理、切片作製及び染色等の操作の後に透過型電子顕微鏡により観察する。あるいは、細胞を膜上で培養後、細胞を担持する膜を液体培地中に浸漬したまま、透過型光学顕微鏡で、又は細胞を染色した後、落射型光学顕微鏡で、顕微鏡観察を行う方法も知られている(非特許文献2及び3)。
【0005】
また、カビ以外の微生物では、細菌の内部構造変化を電子顕微鏡にて観察する方法の一つとして、寒天培地上にろ紙などの膜を配置し、その膜上で細菌を培養した後に、細菌を担持する膜を取り出し、洗浄、固定、包理、切片作製及び染色等の操作を行った後に観察する方法が知られている(非特許文献3)。
【0006】
前述のようにカビを分類同定する目的で顕微鏡観察する場合は、観察に必要な形態が得られるようにカビを培養した後、形態を崩壊することなく標本を作製する必要があるため、従来の動物細胞や細菌で行われている方法をそのままカビに適用することはできない。
【0007】
以上のように、これまでに、例えばカビの同定及び分類の目的のために、カビの形態を保持したまま、簡便に顕微鏡観察できる方法は知られていなかった。
【0008】
【非特許文献1】高鳥浩介監修, 「カビ検査マニュアルカラー図譜」, 株式会社テクノシステム, 2002年
【非特許文献2】藤田晢也監修, 石川春律及び高松哲郎編集, 「新しい光学顕微鏡」, 学際企画, 1996年
【非特許文献3】山田英智, 石川春律及び野々村禎昭, 「微生物学における電子顕微鏡技術」, 学会出版センター, 1982年
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、上述した実情を鑑み、カビの形態観察方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
上記課題を解決するため鋭意研究を行った結果、カビを接種した液体透過性フィルム上で、当該カビを培養し、上記液体透過性フィルムを、顕微鏡観察に供することで、カビの形態を維持したまま(または崩壊することなく)観察を行うことができることを見出し、本発明を完成するに至った。
【0011】
本発明は以下を包含する。
(1)カビを接種した液体透過性フィルム上で、当該カビを培養する第1工程と、上記液体透過性フィルムを顕微鏡観察に供し、カビの形態観察を行う第2工程とを含むことを特徴とするカビの形態観察方法。
(2)上記第1工程では、培地成分が含浸された上記液体透過性フィルムを用いることを特徴とする、(1)記載のカビの形態観察方法。
(3)上記第1工程では、上記液体透過性フィルムが培地上に配置されていることを特徴とする、(1)記載のカビの形態観察方法。
(4)上記液体透過性フィルムが光透過性であることを特徴とする、(1)〜(3)のいずれか1記載のカビの形態観察方法。
(5)上記液体透過性フィルムの膜厚が50μm〜1mmである、(1)〜(4)のいずれか1記載のカビの形態観察方法。
(6)上記液体透過性フィルムが直径0.1μm〜10μmの孔を有する、(1)〜(5)のいずれか1記載のカビの形態観察方法。
(7)上記顕微鏡が光学顕微鏡であることを特徴とする、(1)〜(6)のいずれか1記載のカビの形態観察方法。
(8)上記培地が固体培地であることを特徴とする、(3)〜(7)のいずれか1記載のカビの形態観察方法。
(9)上記(1)〜(8)のいずれか1記載のカビの形態観察方法で使用するためのフィルム。
(10)(9)記載のフィルムを含むことを特徴とするカビ形態観察用キット。
【発明の効果】
【0012】
本発明により、カビを観察に必要な典型的な形態となるように培養し、その形態を崩壊することなく、より簡便にカビの形態観察が可能となる方法が提供される。本発明に係るカビの形態観察方法によれば、例えばカビの同定及び分類を目的とした形態観察が可能である。
【発明を実施するための最良の形態】
【0013】
以下、本発明を詳細に説明する。
本発明に係るカビの形態観察方法は、カビの形態観察を目的に、カビを培養し、カビの形態を維持したまま観察する方法である。本方法におけるカビの培養方法は、先ず液体透過性フィルムにカビの生育できる培地成分を含む液体を含浸させる。次いで、含浸させた液体透過性フィルム上にカビを接種し、培養する。又は、カビを液体透過性フィルムに接種した後に、当該液体透過性フィルムに培地成分を含浸させても良い。あるいは、先ず液体透過性フィルムを培地上に配置する。次いで、配置した液体透過性フィルム上にカビを接種し、培養する。又は、カビを液体透過性フィルムに接種した後に、液体透過性フィルムを培地上に配置してもよい。さらに本発明に係るカビの形態観察方法では、培養過程又は培養終了後に液体透過性フィルムを、顕微鏡観察に供する。このようにして、顕微鏡下で液体透過性フィルム上に生育したカビの形態観察を行う。
【0014】
ここで、液体透過性フィルムとは、カビの生育に必須な培地成分又は水、アルコール、オイルなどを保持、透過または浸透することができるフィルムを意味する。本発明で使用する液体透過性フィルムの形状は、例えば膜状、繊維状、網状、フィルム状、紙状、不織布状などであってよい。素材は、例えば、ポリプロピレン(PP)、ポリスチレン(PS)、ポリ塩化ビニル(PVC)、メタクリル酸メチル(MMA)、アクリロニトリル-ブタジエン-スチレン共重合体(ABS)、スチレンアクリロニトリル(SAN)、ポリカーボネート(PC)、ポリテレフタル酸エチレン(PET)、ポリテトラフルオロエチレン(PTFE)、フッ化ビニリデン(PVDF)、ポリエステル(PES)、グラスファイバー、セルロース、ナイロン等であってよい。
【0015】
液体透過性フィルムの膜厚は、取り扱いのしやすさと光学顕微鏡観察の場合に観察に必要な光を透過させる点から、50μm〜1mmであることが好ましく、特に好ましくは100〜500μmである。
【0016】
また、液体透過性フィルムは、液体を透過すべく、孔を有することが好ましい。孔の直径は、カビの胞子の大きさに応じて、0.1μm〜10μm、特に好ましくは0.2〜5μmである。
【0017】
なお、例えば、アイソポアメンブレン(ミリポア社製)、オムニポアメンブレン(ミリポア社製)及びサイクロポアメンブレン(ワットマン社製)等の市販製品を、本発明における液体透過性フィルムとして使用することができる。
【0018】
本発明において、光学顕微鏡を用いてカビの形態観察を行う場合には、液体透過性フィルムは光透過性であることを要する。光透過性は、カビの光学顕微鏡観察を行うことができる程度以上のものであればよく、例えば、観察に用いる光学顕微鏡に液体透過性フィルムのみを供し、顕微鏡観察に十分必要な光量が透過するか否かでその光透過性を評価することができる。
【0019】
本発明において、形態観察対象のカビは、いずれの属、種に属するものであってよく、例えば、アルタナリア(Alternaria)属、アスペルギルス(Aspergillus)属、クラドスポリウム(Cladosporium)属、フザリウム(Fusarium)属、ペシロミセス(Paecilomyces)属、ペニシリウム(Penicillium)属、フォーマ(Phoma)属、ユーロチウム(Eurotium)属、ケトミウム(Chaetomium)属、ムコール(Mucor)属及びビソクラミス(Byssochlamys)属に属するカビなどが挙げられる。
【0020】
また、本発明においては、顕微鏡によるカビの形態観察を可能にする培地を使用する。このような培地は、形態観察対象のカビの属、種又は株に応じて、準備することができる。培地は、例えば寒天培地の様な固体培地及び液体培地のいずれであってもよい。固体培地としては、例えばポテトデキストロース寒天培地(PDA培地)、グルコース・ペプトン寒天培地を用いることが出来る。また、目的のカビの特性にあわせて、例えば、胞子産生性の低いカビには、オートミール寒天培地、コーンミール寒天培地、ジャガイモ・ニンジン寒天培地など胞子産生性の良い培地を使用することが出来る。好稠性カビなどには、高濃度のショ糖を含むM40Y寒天培地、高濃度のグリセリンを含むDG-18培地などを、また病原性カビには、サブロー・ブドウ糖寒天培地、植物性病原菌類には野菜ジュースを含むV-8ジュース寒天培地などを用いることができる。液体培地としては、例えば上記寒天培地から成分として寒天を除いたものを用いることができる。
【0021】
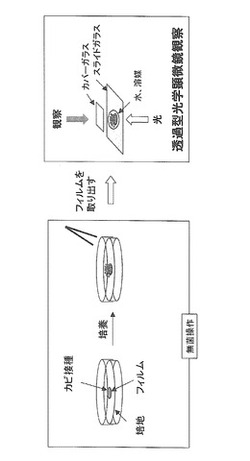
培地表面上に液体透過性フィルムを配置した場合を示した図1に基づいて、さらに本発明を具体的に説明する。なお、カビの接種及び培養は、無菌操作で行う。
【0022】
本発明に係るカビの形態観察方法では、先ずシャーレや培養プレート等の培養容器に培地を準備し、培地表面に液体透過性フィルムを配置する。固体培地を使用する場合は、液体透過性フィルムをそのまま培地表面上に配置することができる。液体培地を使用する場合には、液体培地と上部空間の界面に液体透過性フィルムを配置できるように、液体透過性フィルムを支持体で固定する。支持体の一例としては、台座を挙げることができる。台座としては、いかなる材質のものであってよく、例えば、布、紙、革、プラスチック、ガラス、金属などを使用する。なお、台座の形状は、液体透過性フィルムを液体培地界面に配置できるものであればよく、例えば台座の主面が液体培地界面付近の位置となるような円筒状である。また、台座は、シャーレや培養プレートの培養容器などと一体型になっていてもよい。具体的には、液体培地を含有するシャーレや培養プレートの培養容器中に、台座主面を上向きになるように台座を配置する。この際、台座主面を液体培地表面の高さと合わせ、液体透過性フィルムが培地成分を含浸できるように台座を配置する。
【0023】
次いで、液体透過性フィルム上にカビを接種し、培養する。接種段階のカビの形態としては、胞子、菌糸のどちらでもよい。接種方法としては、例えば、カビを白金耳等の器具を用いて、液体透過性フィルムの表面に接種する方法や胞子懸濁液を作製し、その懸濁液を液体透過性フィルムの表面に滴下する方法などが挙げられる。また、接種するカビの量としては、例えば、液体透過性フィルム当たり1〜10000cfu/cm2、好ましくは10〜1000cfu/cm2である。
【0024】
なお、カビを液体透過性フィルムに接種した後に、液体透過性フィルムを培地上に配置してもよい。
【0025】
カビの培養条件は、カビの種類に応じて適宜決定することができるが、例えば温度:20〜35℃(好ましくは25〜30℃)、湿度:80〜100%(好ましくは85〜100%)が挙げられる。あるいは、特定の生育条件下で生育するカビについては、当該カビの生育条件下で培養することができる。例えば好冷性のカビは5℃前後で培養することができる。好温性カビの場合は、40〜50℃で培養することが望ましい。また、好乾性のカビは湿度65%程度から培養することもできる。
【0026】
次いで、培養過程又は培養終了後に、生育したカビを有する液体透過性フィルムを、顕微鏡観察に供する。図1では、透過型光学顕微鏡を用いた場合の顕微鏡観察を示す。図1に示すように、培地上から液体透過性フィルムを取り出し、スライドガラスに配置し、水、溶媒等を滴下し、その上からカバーガラスを載せることで、標本を作製する。そして、一般的な光学顕微鏡操作により、作製した標本を光学顕微鏡観察に供する。このような光学顕微鏡観察により、カビの形態を崩壊させる事なく観察することができ、カビの同定及び分類等を行うことができる。
【0027】
なお、図1では、培地表面上に液体透過性フィルムを配置した場合を説明したが、本発明に係るカビの形態観察方法では、培地成分を含浸させた液体透過性フィルムをシャーレや培養プレート等の容器にそのまま配置してもよい。
【0028】
また、図1では、透過型光学顕微鏡を用いた場合を説明したが、透過型光学顕微鏡以外に、例えば落射型光学顕微鏡、透過型電子顕微鏡、走査型電子顕微鏡等の顕微鏡を用いてもよい。このような顕微鏡を用いる場合には、一般的な顕微鏡操作に準じて、カビの形態観察を行うことができる。
【0029】
以上のように説明した本発明に係るカビの形態観察方法によれば、例えば、分生子、分生子形成細胞、頂のう(分生子の先端膨大部)、メトレ(梗子、支持細胞)及び分岐の位置を、形態を保持したまま、観察することができる。特に、本発明に係るカビの形態観察方法によれば、分生子の形態を崩壊することなく、分生子形成過程やその微細な形態の違いを判別し、カビの同定及び分類を行うことができる。
【0030】
また、培養過程において、各段階でカビが生育する液体透過性フィルムを部分的に切り出し、顕微鏡観察に供することで、培養過程におけるカビの形態変化を観察することができる。あるいは、カビを接種した複数枚の液体透過性フィルムを用意し、培養する。培養過程の各段階で順次、当該液体透過性フィルムを1枚ずつ顕微鏡観察に供することで、培養過程におけるカビの形態変化を観察することができる。
【0031】
本発明に係るカビ形態観察用キットは、上述した液体透過性フィルムを含んでなるキットである。本発明に係るカビ形態観察用キットは、液体透過性フィルム以外に、例えば、上述した顕微鏡によるカビの形態観察を可能にする培地、カビの生育に必須な成分等を含むことができる。
【実施例】
【0032】
以下、実施例を用いて本発明をより詳細に説明するが、本発明の技術的範囲はこれら実施例に限定されるものではない。
【0033】
〔実施例1〕光学顕微鏡によるクラドスポリウム属に属するカビの形態観察
光学顕微鏡を用いて、クラドスポリウム・クラドスポリオイデス(Cladosporium cladosporioides)の形態観察を行った。
【0034】
まず、PDA寒天培地にて25℃、湿度100%下で、クラドスポリウム・クラドスポリオイデスを10日間培養した。10日間の培養後、白金耳を用いて、クラドスポリウム・クラドスポリオイデスの胞子100cfu/cm2を、PDA寒天培地上に配置したミリポアフィルター(ミリポア社製、ポアサイズ(直径) 0.22μm、アイソポアメンブレン)に接種した。
【0035】
次いで、ミリポアフィルター上でクラドスポリウム・クラドスポリオイデスを25℃、湿度100%下で7日間培養した。培養後にミリポアフィルターをスライドガラス上に切り出し、アルコールを滴下し、その上からカバーガラスを静かにのせて、光学顕微鏡(カメラ:ライカDMLBHC、デジタルカメラシステム:Pixera Penguin 600CL)にて観察を行った。
【0036】
上記のようにして観察された光学顕微鏡写真を図2に示す。比較としては、例えば上述の非特許文献1(「カビ検査マニュアルカラー図譜」)第21頁に開示の従来のカビの顕微鏡観察方法に従ったクラドスポリウム・クラドスポリオイデスのスライド培養標本及び直接標本の光学顕微鏡写真が挙げられる。なお、上述の直接標本は、PDA寒天培地にて25℃、湿度100%下で、クラドスポリウム・クラドスポリオイデスを10日間培養し、培地上に生育したクラドスポリウム・クラドスポリオイデスの胞子を白金耳でかきとり、スライドガラスに塗布し、アルコールを滴下しその上からカバーグラスを静かにのせて作製した標本である。図2の光学顕微鏡写真と非特許文献1第21頁に記載のクラドスポリウム・クラドスポリオイデスのスライド培養標本及び直接標本の光学顕微鏡写真との比較から判るように、本発明の手法を用いることで、カビの形態観察に必要な分生子の形態を崩壊することなく標本が作製されており、従来のカビの形態観察方法と同様に、分生子形成過程やその微細な形態の違いを判別し、カビの同定及び分類が可能である。
【0037】
〔実施例2〕走査型電子顕微鏡によるアスペルギルス属、クラドスポリウム属及びペニシリウム属に属するカビの形態観察
走査型電子顕微鏡を用いて、(a)アスペルギルス・ニガー(Aspergillus niger)、(b)クラドスポリウム・クラドスポリオイデス及び(c)ペニシリウム・シトリヌム(Penicillium citrinum)の形態観察を行った。
【0038】
PDA寒天培地にて25℃、湿度100%下で、アスペルギルス・ニガー、クラドスポリウム・クラドスポリオイデス及びペニシリウム・シトリヌムをそれぞれ10日間培養した。10日間の培養後、白金耳を用いて、それぞれのカビの胞子(100cfu/cm2)をPDA寒天培地上に配置したミリポアフィルター(ミリポア社製、ポアサイズ0.22μm、アイソポアメンブレン)に接種した。
【0039】
次いで、ミリポアフィルター上でそれぞれのカビを25℃、湿度100%下で7日間培養した後、フィルターを取り出し、2.5%グルタルアルデヒド溶液にて前固定(22時間)を行い、その後、リン酸緩衝液を用いて室温で1時間攪拌しながら洗浄した(途中、緩衝液2回交換)。その後、当該フィルター上のカビ(以下、「試料」という)を、1%オスミウム酸溶液を用いて4℃で1時間固定した後、イオン交換水を用いて室温で1時間攪拌しながら洗浄し、次いでエタノール上昇系列にて脱水した(50%、70%、80%、90%、95%のエタノールを各10分、さらに100%エタノールにて15分×3セット、室温で攪拌しながら脱水。試料を乾燥させないように溶液を少量残して交換)。
【0040】
その後、t-ブチルアルコールにて、試料が浸漬する溶液を室温で1時間かけて置換(途中、3回液交換)した後、冷凍庫にて凍結した。
【0041】
さらに、試料室温度-10℃に設定したフリーズドライヤーES-2030(日立)に、凍結した試料をキャリアーごとセットして、試料を乾燥させた(約20〜30分)。次いで、乾燥した試料を破壊しないように取り出し、試料台へのせ、イオンスパッターE-1030(日立)にてW.D.30mm、放電電流20mA、放電時間80秒間で白金パラジウムをコーティングし、走査型電子顕微鏡H-4000(日立)にて観察した。
【0042】
上記のようにして観察された走査型電子顕微鏡写真を図3に示す。図3において、(a)の写真はアスペルギルス・ニガーであり、(b)の写真はクラドスポリウム・クラドスポリオイデスであり、(c)の写真はペニシリウム・シトリヌムである。
【0043】
図3から判るように、本発明の手法を用いることで分生子の形態を崩壊することなく標本が作製されており、走査型電子顕微鏡によっても分生子形成過程やその微細な形態の違いを判別し、カビの同定及び分類を行うことができる。
【図面の簡単な説明】
【0044】
【図1】図1は、本発明に係るカビの形態観察方法を示す。
【図2】図2は、クラドスポリウム属に属するカビの光学顕微鏡写真を示す。
【図3】図3は、アスペルギルス属、クラドスポリウム属及びペニシリウム属に属するカビの走査型電子顕微鏡写真を示す。
【技術分野】
【0001】
本発明は、例えばカビの同定及び分類において行われるカビの形態観察方法に関する。
【背景技術】
【0002】
カビの同定及び分類は、分生子形成過程や微細な形態の違いによって行われる。そのため、カビの同定及び分類には、分類同定に必要な形態の観察が可能な状態にカビを培養させた後、その形態を保持したまま顕微鏡観察することが必須である。しかしながら、カビの形態は崩壊しやすく、他の微生物や培養細胞に使用される通常の顕微鏡観察方法を使用することができない。
【0003】
そこで、従来よりカビの顕微鏡観察には、スライド培養方法が使用されている(非特許文献1)。例えば、非特許文献1第114頁に示されるように、スライド培養方法では、先ず滅菌済み容器やスライドガラス等から構成される培養装置を用意する。一方、寒天培地を準備し、寒天片を切り出し、容器中のスライドガラス上に載せる。次いで、寒天片の四辺にカビを接種し、寒天片上にカバーガラスを載せ、当該カビを培養する。この培養によって、スライドガラス上にカビが生育することとなる。培養終了後、スライドガラスから寒天片とカバーガラスを取り除き、新しいカバーガラスを、スライドガラス上で生育したカビに載せる。このようにして作製された標本を光学顕微鏡で観察することにより、形態を保持したまま、カビの顕微鏡観察を行うことができる。しかしながら、上述したスライド培養方法は操作が煩雑で熟練した技術を要し、簡便に行うことができない。
【0004】
一方、微生物以外の動物細胞の簡便な顕微鏡観察方法では、液体培地中に細胞が接着する膜を浸漬し、細胞を膜上で培養後、細胞を担持する膜を取り出し、固定、包理、切片作製及び染色等の操作の後に透過型電子顕微鏡により観察する。あるいは、細胞を膜上で培養後、細胞を担持する膜を液体培地中に浸漬したまま、透過型光学顕微鏡で、又は細胞を染色した後、落射型光学顕微鏡で、顕微鏡観察を行う方法も知られている(非特許文献2及び3)。
【0005】
また、カビ以外の微生物では、細菌の内部構造変化を電子顕微鏡にて観察する方法の一つとして、寒天培地上にろ紙などの膜を配置し、その膜上で細菌を培養した後に、細菌を担持する膜を取り出し、洗浄、固定、包理、切片作製及び染色等の操作を行った後に観察する方法が知られている(非特許文献3)。
【0006】
前述のようにカビを分類同定する目的で顕微鏡観察する場合は、観察に必要な形態が得られるようにカビを培養した後、形態を崩壊することなく標本を作製する必要があるため、従来の動物細胞や細菌で行われている方法をそのままカビに適用することはできない。
【0007】
以上のように、これまでに、例えばカビの同定及び分類の目的のために、カビの形態を保持したまま、簡便に顕微鏡観察できる方法は知られていなかった。
【0008】
【非特許文献1】高鳥浩介監修, 「カビ検査マニュアルカラー図譜」, 株式会社テクノシステム, 2002年
【非特許文献2】藤田晢也監修, 石川春律及び高松哲郎編集, 「新しい光学顕微鏡」, 学際企画, 1996年
【非特許文献3】山田英智, 石川春律及び野々村禎昭, 「微生物学における電子顕微鏡技術」, 学会出版センター, 1982年
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、上述した実情を鑑み、カビの形態観察方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
上記課題を解決するため鋭意研究を行った結果、カビを接種した液体透過性フィルム上で、当該カビを培養し、上記液体透過性フィルムを、顕微鏡観察に供することで、カビの形態を維持したまま(または崩壊することなく)観察を行うことができることを見出し、本発明を完成するに至った。
【0011】
本発明は以下を包含する。
(1)カビを接種した液体透過性フィルム上で、当該カビを培養する第1工程と、上記液体透過性フィルムを顕微鏡観察に供し、カビの形態観察を行う第2工程とを含むことを特徴とするカビの形態観察方法。
(2)上記第1工程では、培地成分が含浸された上記液体透過性フィルムを用いることを特徴とする、(1)記載のカビの形態観察方法。
(3)上記第1工程では、上記液体透過性フィルムが培地上に配置されていることを特徴とする、(1)記載のカビの形態観察方法。
(4)上記液体透過性フィルムが光透過性であることを特徴とする、(1)〜(3)のいずれか1記載のカビの形態観察方法。
(5)上記液体透過性フィルムの膜厚が50μm〜1mmである、(1)〜(4)のいずれか1記載のカビの形態観察方法。
(6)上記液体透過性フィルムが直径0.1μm〜10μmの孔を有する、(1)〜(5)のいずれか1記載のカビの形態観察方法。
(7)上記顕微鏡が光学顕微鏡であることを特徴とする、(1)〜(6)のいずれか1記載のカビの形態観察方法。
(8)上記培地が固体培地であることを特徴とする、(3)〜(7)のいずれか1記載のカビの形態観察方法。
(9)上記(1)〜(8)のいずれか1記載のカビの形態観察方法で使用するためのフィルム。
(10)(9)記載のフィルムを含むことを特徴とするカビ形態観察用キット。
【発明の効果】
【0012】
本発明により、カビを観察に必要な典型的な形態となるように培養し、その形態を崩壊することなく、より簡便にカビの形態観察が可能となる方法が提供される。本発明に係るカビの形態観察方法によれば、例えばカビの同定及び分類を目的とした形態観察が可能である。
【発明を実施するための最良の形態】
【0013】
以下、本発明を詳細に説明する。
本発明に係るカビの形態観察方法は、カビの形態観察を目的に、カビを培養し、カビの形態を維持したまま観察する方法である。本方法におけるカビの培養方法は、先ず液体透過性フィルムにカビの生育できる培地成分を含む液体を含浸させる。次いで、含浸させた液体透過性フィルム上にカビを接種し、培養する。又は、カビを液体透過性フィルムに接種した後に、当該液体透過性フィルムに培地成分を含浸させても良い。あるいは、先ず液体透過性フィルムを培地上に配置する。次いで、配置した液体透過性フィルム上にカビを接種し、培養する。又は、カビを液体透過性フィルムに接種した後に、液体透過性フィルムを培地上に配置してもよい。さらに本発明に係るカビの形態観察方法では、培養過程又は培養終了後に液体透過性フィルムを、顕微鏡観察に供する。このようにして、顕微鏡下で液体透過性フィルム上に生育したカビの形態観察を行う。
【0014】
ここで、液体透過性フィルムとは、カビの生育に必須な培地成分又は水、アルコール、オイルなどを保持、透過または浸透することができるフィルムを意味する。本発明で使用する液体透過性フィルムの形状は、例えば膜状、繊維状、網状、フィルム状、紙状、不織布状などであってよい。素材は、例えば、ポリプロピレン(PP)、ポリスチレン(PS)、ポリ塩化ビニル(PVC)、メタクリル酸メチル(MMA)、アクリロニトリル-ブタジエン-スチレン共重合体(ABS)、スチレンアクリロニトリル(SAN)、ポリカーボネート(PC)、ポリテレフタル酸エチレン(PET)、ポリテトラフルオロエチレン(PTFE)、フッ化ビニリデン(PVDF)、ポリエステル(PES)、グラスファイバー、セルロース、ナイロン等であってよい。
【0015】
液体透過性フィルムの膜厚は、取り扱いのしやすさと光学顕微鏡観察の場合に観察に必要な光を透過させる点から、50μm〜1mmであることが好ましく、特に好ましくは100〜500μmである。
【0016】
また、液体透過性フィルムは、液体を透過すべく、孔を有することが好ましい。孔の直径は、カビの胞子の大きさに応じて、0.1μm〜10μm、特に好ましくは0.2〜5μmである。
【0017】
なお、例えば、アイソポアメンブレン(ミリポア社製)、オムニポアメンブレン(ミリポア社製)及びサイクロポアメンブレン(ワットマン社製)等の市販製品を、本発明における液体透過性フィルムとして使用することができる。
【0018】
本発明において、光学顕微鏡を用いてカビの形態観察を行う場合には、液体透過性フィルムは光透過性であることを要する。光透過性は、カビの光学顕微鏡観察を行うことができる程度以上のものであればよく、例えば、観察に用いる光学顕微鏡に液体透過性フィルムのみを供し、顕微鏡観察に十分必要な光量が透過するか否かでその光透過性を評価することができる。
【0019】
本発明において、形態観察対象のカビは、いずれの属、種に属するものであってよく、例えば、アルタナリア(Alternaria)属、アスペルギルス(Aspergillus)属、クラドスポリウム(Cladosporium)属、フザリウム(Fusarium)属、ペシロミセス(Paecilomyces)属、ペニシリウム(Penicillium)属、フォーマ(Phoma)属、ユーロチウム(Eurotium)属、ケトミウム(Chaetomium)属、ムコール(Mucor)属及びビソクラミス(Byssochlamys)属に属するカビなどが挙げられる。
【0020】
また、本発明においては、顕微鏡によるカビの形態観察を可能にする培地を使用する。このような培地は、形態観察対象のカビの属、種又は株に応じて、準備することができる。培地は、例えば寒天培地の様な固体培地及び液体培地のいずれであってもよい。固体培地としては、例えばポテトデキストロース寒天培地(PDA培地)、グルコース・ペプトン寒天培地を用いることが出来る。また、目的のカビの特性にあわせて、例えば、胞子産生性の低いカビには、オートミール寒天培地、コーンミール寒天培地、ジャガイモ・ニンジン寒天培地など胞子産生性の良い培地を使用することが出来る。好稠性カビなどには、高濃度のショ糖を含むM40Y寒天培地、高濃度のグリセリンを含むDG-18培地などを、また病原性カビには、サブロー・ブドウ糖寒天培地、植物性病原菌類には野菜ジュースを含むV-8ジュース寒天培地などを用いることができる。液体培地としては、例えば上記寒天培地から成分として寒天を除いたものを用いることができる。
【0021】
培地表面上に液体透過性フィルムを配置した場合を示した図1に基づいて、さらに本発明を具体的に説明する。なお、カビの接種及び培養は、無菌操作で行う。
【0022】
本発明に係るカビの形態観察方法では、先ずシャーレや培養プレート等の培養容器に培地を準備し、培地表面に液体透過性フィルムを配置する。固体培地を使用する場合は、液体透過性フィルムをそのまま培地表面上に配置することができる。液体培地を使用する場合には、液体培地と上部空間の界面に液体透過性フィルムを配置できるように、液体透過性フィルムを支持体で固定する。支持体の一例としては、台座を挙げることができる。台座としては、いかなる材質のものであってよく、例えば、布、紙、革、プラスチック、ガラス、金属などを使用する。なお、台座の形状は、液体透過性フィルムを液体培地界面に配置できるものであればよく、例えば台座の主面が液体培地界面付近の位置となるような円筒状である。また、台座は、シャーレや培養プレートの培養容器などと一体型になっていてもよい。具体的には、液体培地を含有するシャーレや培養プレートの培養容器中に、台座主面を上向きになるように台座を配置する。この際、台座主面を液体培地表面の高さと合わせ、液体透過性フィルムが培地成分を含浸できるように台座を配置する。
【0023】
次いで、液体透過性フィルム上にカビを接種し、培養する。接種段階のカビの形態としては、胞子、菌糸のどちらでもよい。接種方法としては、例えば、カビを白金耳等の器具を用いて、液体透過性フィルムの表面に接種する方法や胞子懸濁液を作製し、その懸濁液を液体透過性フィルムの表面に滴下する方法などが挙げられる。また、接種するカビの量としては、例えば、液体透過性フィルム当たり1〜10000cfu/cm2、好ましくは10〜1000cfu/cm2である。
【0024】
なお、カビを液体透過性フィルムに接種した後に、液体透過性フィルムを培地上に配置してもよい。
【0025】
カビの培養条件は、カビの種類に応じて適宜決定することができるが、例えば温度:20〜35℃(好ましくは25〜30℃)、湿度:80〜100%(好ましくは85〜100%)が挙げられる。あるいは、特定の生育条件下で生育するカビについては、当該カビの生育条件下で培養することができる。例えば好冷性のカビは5℃前後で培養することができる。好温性カビの場合は、40〜50℃で培養することが望ましい。また、好乾性のカビは湿度65%程度から培養することもできる。
【0026】
次いで、培養過程又は培養終了後に、生育したカビを有する液体透過性フィルムを、顕微鏡観察に供する。図1では、透過型光学顕微鏡を用いた場合の顕微鏡観察を示す。図1に示すように、培地上から液体透過性フィルムを取り出し、スライドガラスに配置し、水、溶媒等を滴下し、その上からカバーガラスを載せることで、標本を作製する。そして、一般的な光学顕微鏡操作により、作製した標本を光学顕微鏡観察に供する。このような光学顕微鏡観察により、カビの形態を崩壊させる事なく観察することができ、カビの同定及び分類等を行うことができる。
【0027】
なお、図1では、培地表面上に液体透過性フィルムを配置した場合を説明したが、本発明に係るカビの形態観察方法では、培地成分を含浸させた液体透過性フィルムをシャーレや培養プレート等の容器にそのまま配置してもよい。
【0028】
また、図1では、透過型光学顕微鏡を用いた場合を説明したが、透過型光学顕微鏡以外に、例えば落射型光学顕微鏡、透過型電子顕微鏡、走査型電子顕微鏡等の顕微鏡を用いてもよい。このような顕微鏡を用いる場合には、一般的な顕微鏡操作に準じて、カビの形態観察を行うことができる。
【0029】
以上のように説明した本発明に係るカビの形態観察方法によれば、例えば、分生子、分生子形成細胞、頂のう(分生子の先端膨大部)、メトレ(梗子、支持細胞)及び分岐の位置を、形態を保持したまま、観察することができる。特に、本発明に係るカビの形態観察方法によれば、分生子の形態を崩壊することなく、分生子形成過程やその微細な形態の違いを判別し、カビの同定及び分類を行うことができる。
【0030】
また、培養過程において、各段階でカビが生育する液体透過性フィルムを部分的に切り出し、顕微鏡観察に供することで、培養過程におけるカビの形態変化を観察することができる。あるいは、カビを接種した複数枚の液体透過性フィルムを用意し、培養する。培養過程の各段階で順次、当該液体透過性フィルムを1枚ずつ顕微鏡観察に供することで、培養過程におけるカビの形態変化を観察することができる。
【0031】
本発明に係るカビ形態観察用キットは、上述した液体透過性フィルムを含んでなるキットである。本発明に係るカビ形態観察用キットは、液体透過性フィルム以外に、例えば、上述した顕微鏡によるカビの形態観察を可能にする培地、カビの生育に必須な成分等を含むことができる。
【実施例】
【0032】
以下、実施例を用いて本発明をより詳細に説明するが、本発明の技術的範囲はこれら実施例に限定されるものではない。
【0033】
〔実施例1〕光学顕微鏡によるクラドスポリウム属に属するカビの形態観察
光学顕微鏡を用いて、クラドスポリウム・クラドスポリオイデス(Cladosporium cladosporioides)の形態観察を行った。
【0034】
まず、PDA寒天培地にて25℃、湿度100%下で、クラドスポリウム・クラドスポリオイデスを10日間培養した。10日間の培養後、白金耳を用いて、クラドスポリウム・クラドスポリオイデスの胞子100cfu/cm2を、PDA寒天培地上に配置したミリポアフィルター(ミリポア社製、ポアサイズ(直径) 0.22μm、アイソポアメンブレン)に接種した。
【0035】
次いで、ミリポアフィルター上でクラドスポリウム・クラドスポリオイデスを25℃、湿度100%下で7日間培養した。培養後にミリポアフィルターをスライドガラス上に切り出し、アルコールを滴下し、その上からカバーガラスを静かにのせて、光学顕微鏡(カメラ:ライカDMLBHC、デジタルカメラシステム:Pixera Penguin 600CL)にて観察を行った。
【0036】
上記のようにして観察された光学顕微鏡写真を図2に示す。比較としては、例えば上述の非特許文献1(「カビ検査マニュアルカラー図譜」)第21頁に開示の従来のカビの顕微鏡観察方法に従ったクラドスポリウム・クラドスポリオイデスのスライド培養標本及び直接標本の光学顕微鏡写真が挙げられる。なお、上述の直接標本は、PDA寒天培地にて25℃、湿度100%下で、クラドスポリウム・クラドスポリオイデスを10日間培養し、培地上に生育したクラドスポリウム・クラドスポリオイデスの胞子を白金耳でかきとり、スライドガラスに塗布し、アルコールを滴下しその上からカバーグラスを静かにのせて作製した標本である。図2の光学顕微鏡写真と非特許文献1第21頁に記載のクラドスポリウム・クラドスポリオイデスのスライド培養標本及び直接標本の光学顕微鏡写真との比較から判るように、本発明の手法を用いることで、カビの形態観察に必要な分生子の形態を崩壊することなく標本が作製されており、従来のカビの形態観察方法と同様に、分生子形成過程やその微細な形態の違いを判別し、カビの同定及び分類が可能である。
【0037】
〔実施例2〕走査型電子顕微鏡によるアスペルギルス属、クラドスポリウム属及びペニシリウム属に属するカビの形態観察
走査型電子顕微鏡を用いて、(a)アスペルギルス・ニガー(Aspergillus niger)、(b)クラドスポリウム・クラドスポリオイデス及び(c)ペニシリウム・シトリヌム(Penicillium citrinum)の形態観察を行った。
【0038】
PDA寒天培地にて25℃、湿度100%下で、アスペルギルス・ニガー、クラドスポリウム・クラドスポリオイデス及びペニシリウム・シトリヌムをそれぞれ10日間培養した。10日間の培養後、白金耳を用いて、それぞれのカビの胞子(100cfu/cm2)をPDA寒天培地上に配置したミリポアフィルター(ミリポア社製、ポアサイズ0.22μm、アイソポアメンブレン)に接種した。
【0039】
次いで、ミリポアフィルター上でそれぞれのカビを25℃、湿度100%下で7日間培養した後、フィルターを取り出し、2.5%グルタルアルデヒド溶液にて前固定(22時間)を行い、その後、リン酸緩衝液を用いて室温で1時間攪拌しながら洗浄した(途中、緩衝液2回交換)。その後、当該フィルター上のカビ(以下、「試料」という)を、1%オスミウム酸溶液を用いて4℃で1時間固定した後、イオン交換水を用いて室温で1時間攪拌しながら洗浄し、次いでエタノール上昇系列にて脱水した(50%、70%、80%、90%、95%のエタノールを各10分、さらに100%エタノールにて15分×3セット、室温で攪拌しながら脱水。試料を乾燥させないように溶液を少量残して交換)。
【0040】
その後、t-ブチルアルコールにて、試料が浸漬する溶液を室温で1時間かけて置換(途中、3回液交換)した後、冷凍庫にて凍結した。
【0041】
さらに、試料室温度-10℃に設定したフリーズドライヤーES-2030(日立)に、凍結した試料をキャリアーごとセットして、試料を乾燥させた(約20〜30分)。次いで、乾燥した試料を破壊しないように取り出し、試料台へのせ、イオンスパッターE-1030(日立)にてW.D.30mm、放電電流20mA、放電時間80秒間で白金パラジウムをコーティングし、走査型電子顕微鏡H-4000(日立)にて観察した。
【0042】
上記のようにして観察された走査型電子顕微鏡写真を図3に示す。図3において、(a)の写真はアスペルギルス・ニガーであり、(b)の写真はクラドスポリウム・クラドスポリオイデスであり、(c)の写真はペニシリウム・シトリヌムである。
【0043】
図3から判るように、本発明の手法を用いることで分生子の形態を崩壊することなく標本が作製されており、走査型電子顕微鏡によっても分生子形成過程やその微細な形態の違いを判別し、カビの同定及び分類を行うことができる。
【図面の簡単な説明】
【0044】
【図1】図1は、本発明に係るカビの形態観察方法を示す。
【図2】図2は、クラドスポリウム属に属するカビの光学顕微鏡写真を示す。
【図3】図3は、アスペルギルス属、クラドスポリウム属及びペニシリウム属に属するカビの走査型電子顕微鏡写真を示す。
【特許請求の範囲】
【請求項1】
カビを接種した液体透過性フィルム上で、当該カビを培養する第1工程と、
上記液体透過性フィルムを顕微鏡観察に供し、カビの形態観察を行う第2工程と、
を含むことを特徴とするカビの形態観察方法。
【請求項2】
上記第1工程では、培地成分が含浸された上記液体透過性フィルムを用いることを特徴とする、請求項1記載のカビの形態観察方法。
【請求項3】
上記第1工程では、上記液体透過性フィルムが培地上に配置されていることを特徴とする、請求項1記載のカビの形態観察方法。
【請求項4】
上記液体透過性フィルムが光透過性であることを特徴とする、請求項1〜3のいずれか1項記載のカビの形態観察方法。
【請求項5】
上記液体透過性フィルムの膜厚が50μm〜1mmである、請求項1〜4のいずれか1項記載のカビの形態観察方法。
【請求項6】
上記液体透過性フィルムが直径0.1μm〜10μmの孔を有する、請求項1〜5のいずれか1項記載のカビの形態観察方法。
【請求項7】
上記顕微鏡が光学顕微鏡であることを特徴とする、請求項1〜6のいずれか1項記載のカビの形態観察方法。
【請求項8】
上記培地が固体培地であることを特徴とする、請求項3〜7のいずれか1項記載のカビの形態観察方法。
【請求項9】
請求項1〜8のいずれか1項記載のカビの形態観察方法で使用するためのフィルム。
【請求項10】
請求項9記載のフィルムを含むことを特徴とするカビ形態観察用キット。
【請求項1】
カビを接種した液体透過性フィルム上で、当該カビを培養する第1工程と、
上記液体透過性フィルムを顕微鏡観察に供し、カビの形態観察を行う第2工程と、
を含むことを特徴とするカビの形態観察方法。
【請求項2】
上記第1工程では、培地成分が含浸された上記液体透過性フィルムを用いることを特徴とする、請求項1記載のカビの形態観察方法。
【請求項3】
上記第1工程では、上記液体透過性フィルムが培地上に配置されていることを特徴とする、請求項1記載のカビの形態観察方法。
【請求項4】
上記液体透過性フィルムが光透過性であることを特徴とする、請求項1〜3のいずれか1項記載のカビの形態観察方法。
【請求項5】
上記液体透過性フィルムの膜厚が50μm〜1mmである、請求項1〜4のいずれか1項記載のカビの形態観察方法。
【請求項6】
上記液体透過性フィルムが直径0.1μm〜10μmの孔を有する、請求項1〜5のいずれか1項記載のカビの形態観察方法。
【請求項7】
上記顕微鏡が光学顕微鏡であることを特徴とする、請求項1〜6のいずれか1項記載のカビの形態観察方法。
【請求項8】
上記培地が固体培地であることを特徴とする、請求項3〜7のいずれか1項記載のカビの形態観察方法。
【請求項9】
請求項1〜8のいずれか1項記載のカビの形態観察方法で使用するためのフィルム。
【請求項10】
請求項9記載のフィルムを含むことを特徴とするカビ形態観察用キット。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2007−195454(P2007−195454A)
【公開日】平成19年8月9日(2007.8.9)
【国際特許分類】
【出願番号】特願2006−17701(P2006−17701)
【出願日】平成18年1月26日(2006.1.26)
【出願人】(000000918)花王株式会社 (8,290)
【Fターム(参考)】
【公開日】平成19年8月9日(2007.8.9)
【国際特許分類】
【出願日】平成18年1月26日(2006.1.26)
【出願人】(000000918)花王株式会社 (8,290)
【Fターム(参考)】
[ Back to top ]

