カプセル内視鏡
【課題】内視鏡としての役目を果たした後、狭窄した消化管でも通過に支障がない程度に、内視鏡本体が細分化された部品となり、体外に排泄されることが保証されるカプセル内視鏡を提供すること。
【解決手段】カプセル殻と当該カプセル殻内に収容された内視鏡本体とを有するカプセル内視鏡であって、前記カプセル殻が消化管内の体液によって分解可能な材料からなるカプセル内視鏡。前記材料は腸溶性材料であることが好ましい。
【解決手段】カプセル殻と当該カプセル殻内に収容された内視鏡本体とを有するカプセル内視鏡であって、前記カプセル殻が消化管内の体液によって分解可能な材料からなるカプセル内視鏡。前記材料は腸溶性材料であることが好ましい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、カプセル内視鏡に関する。詳しくは、カプセル内視鏡による検査に付随する、消化管に対する障害の危険性を回避することができる、安全性の高いカプセル内視鏡に関する。
【背景技術】
【0002】
内視鏡を食道経由で消化管に挿入し、病変の有無を直接観察して検査することは信頼性が高いが、この方法での検査には大掛かりな施設が必要であるとともに、患者や術者の負担も大きい。患者の負担を軽減するために、経口用の医薬品のように飲み込むことが可能なカプセル型内視鏡が開発されている(特許文献1および2)。
【0003】
カプセル内視鏡を経口的に体内に送達させて消化管内腔の表面を記録する診断方法では、消化管の内腔をカプセル内視鏡が通過しうることが原則である。しかし、手術による消化管の引きつれ、消化管癌による内腔の狭窄、さらには周辺内臓からの癌浸潤や圧迫などにより、カプセル内視鏡が消化管内腔を閉塞して当該内視鏡が原因の腸閉塞を起こすことが知られている。腸閉塞症は、生命にかかわる緊急事態を誘発し、手術により救命することも少なくない。日常生活においては合併症により食物の通過障害を繰り返し、稀に緊急手術により救命される患者が存在することから、カプセル内視鏡の普及は、同時に腸閉塞症の頻発の危険性が予測される。
【特許文献1】特開2005−193066号公報
【特許文献2】特開2001−137182号公報
【発明の開示】
【発明が解決しようとする課題】
【0004】
したがって、本発明の目的は、内視鏡としての役目を果たした後、狭窄した消化管でも通過に支障がない程度に、内視鏡本体が細分化された部品となり、体外に排泄されることが保証されるカプセル内視鏡を提供することにある。
【課題を解決するための手段】
【0005】
本発明者は、上記問題点に鑑み、鋭意検討した結果、カプセル内視鏡において、消化管内で分解可能な材料をカプセル殻の素材として使用することに着目し、本発明を完成するに至った。即ち、本発明は、以下に示す通りである。
【0006】
〔1〕 カプセル殻と当該カプセル殻内に収容された内視鏡本体とを有するカプセル内視鏡であって、前記カプセル殻が消化管内の体液によって分解可能な材料からなるカプセル内視鏡。
〔2〕 前記材料が腸溶性材料である前記〔1〕に記載のカプセル内視鏡。
【発明の効果】
【0007】
本発明のカプセル内視鏡によると、内視鏡としての役目を果たした後、消化管を通過中にカプセル殻が分解されるとともにカプセル殻内部に収容されている内視鏡本体が部品単位に分解して、細分化された構成部品となるので、腸管等を安全に通過して糞便中に混入されて体外に排出される。本発明のカプセル内視鏡を用いることによって、胃がん等の消化器がんの早期発見等を、苦痛なく安全に短時間で行うことができる。これにより、進行がんの減少に貢献し、医療費負担の減少が期待される。また、近年増加中の大腸癌の発見にも貢献することが期待される。また、本発明のカプセル内視鏡によると、消化管内腔の狭窄患者や腹部手術既往患者等に対する従来のカプセル内視鏡による腸閉塞の発生を回避することができる。
【発明を実施するための最良の形態】
【0008】
本発明のカプセル内視鏡は、カプセル殻と当該カプセル殻内に収容された内視鏡本体とから構成され、そのカプセル殻を構成する材料を、消化管内の体液によって分解可能な材料としたことに特徴がある。
【0009】
本発明においてカプセル殻は、内視鏡を水密的に収容するものであり、消化管内の体液によって分解可能な材料からなるものである。当該材料としては、例えば腸溶性の材料、特に腸溶性の高分子材料が好適であり、かかる高分子材料としては、例えば、ゼラチン、低置換度ヒドロキシプロピルセルロース(L−HPC)、ヒドロキシプロピルセルロース(HPC)、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルメチルセルロースフタレート(HPMCP)、ヒドロキシプロピルメチルセルロースアセテートサクシネート(HPMCAS)、結晶セルロース、カルボキシメチルセルロース(CMC)、カルボキシメチルエチルセルロース(CMEC)、メタクリル酸コポリマー、アクリル酸エチル・メタクリル酸メチルコポリマー、セルロースアセテートフタレート(CAP)、セルロースアセテートサクシネート(CAS)、セルロースアセテートトリメリレート(CAT)、メチルセルロースフタレート、セルロースベンゾエートフタレート、セルロースアセテートマレート、スターチアセテートフタレート(SAP)、アミロースアセテートフタレート(AAP)、デキストリン、ガラクトース、フルクトース等の糖類、ポリビニルアルコールフタレート(PVAP)、ポリビニルアセテートフタレート、ポリビニルプロピオネートフタレート、マレイン酸コポリマーがあげられる。HPMCP、CMEC、メタクリル酸コポリマー、アクリル酸エチル・メタクリル酸メチルコポリマーなどが腸溶性の高分子材料として汎用され、好ましい。これらは単独で用いてもよく、2種以上を組合せて用いてもよい。
【0010】
本発明のカプセル内視鏡において、該内視鏡を投与後、カプセル殻の消化管内における分解は、検査対象とされる消化管によって異なるが、内視鏡の投与を午前9:00に開始した場合、通常12:00〜24:00、好ましくは16:00〜24:00、特に好ましくは20:00〜24:00の時間内である。かかるカプセル殻は、その材料の選択、その厚み等の調整などによって調製することができる。以下に説明する各検査対象消化管の適用においても同様の調整によって、調製することができる。
【0011】
本発明のカプセル内視鏡を食道乃至胃の検査に使用する場合、胃の中は酸性(pH1〜3.5程度)であるので、食道乃至胃の検査のみを目的としたカプセル内視鏡は、アルカリ性環境(pH5〜7程度)の十二指腸に移動した時点からカプセル殻が分解することが好ましい。この場合、前記材料としては、ヒドロキシプロピルメチルセルロースフタレート(HPMCP)、カルボキシメチルエチルセルロース(CMEC)、ポリビニルアセテートフタレート(PVAP)等の腸溶性高分子が好適なものとしてあげられる。
【0012】
本発明のカプセル内視鏡を十二指腸の検査に使用する場合、当該内視鏡が十二指腸に達するまでと、達した後適宜な時間カプセルの形状が保持され、その後に分解することが好ましい。この場合、前記生体分解性材料としてヒドロキシプロピルメチルセルロースフタレート(HPMCP)、カルボキシメチルエチルセルロース(CMEC)等を用い、コーティング量を増やしてカプセルを厚めに形成することで、十二指腸内でカプセルの形状が保持可能である。また、Eudragit(登録商標、Rohm Pharma社、メタクリル酸コポリマー)は、各種グレードによって溶解pHが異なり、適当なグレード品を選択して用いることで十二指腸での使用に適するカプセルを形成することができる。また、後述する小腸の検査に使用可能なカプセル内視鏡は、十二指腸内での検査にも適用可能である。
【0013】
本発明のカプセル内視鏡を小腸の検査に用いる場合、当該内視鏡が小腸に達するまでと、達した後適宜な時間カプセルの形状が保持され、その後に分解することが好ましい。この場合、小腸下部のpHは約7〜8となるため、pH6以上で溶解可能な材料が好ましい。かかる材料としては、セルロースアセテートフタレート(CAP)、ヒドロキシプロピルメチルセルロースアセテートサクシネート(HPMCAS)、Eudragit(登録商標、Rohm Pharma社)などがあげられる。
【0014】
本発明のカプセル内視鏡を大腸の検査に用いる場合、当該内視鏡が大腸に達するまでと、到達した後適宜な時間カプセルの形状が保持され、その後に分解することが好ましい。カプセル内視鏡が大腸に到達する前に回腸部を通過するが、小腸内のpHは消化液および腸内細菌によりpH6〜7となり、回腸のpHは大腸内視鏡による実測値でさらにアルカリ性で、pH8〜9であった。大腸を標的にカプセルを分解させる方法の一例として、カプセルの内側を溶解pHの低い層(例えば、pH5以上で溶解可能な層)でコーティングし、さらにその上から溶解pHの高い層(例えば、pH6以上で溶解可能な層)でコーティングする二層コーティングがあげられる。この場合、内側の層には、HPMCP、CMEC、PVAPなどが用いられ、外側の層には、CAP、HPMCAS、Eudragit(登録商標、Rohm Pharma社)などが用いられる。
【0015】
カプセル殻の形状としては、内視鏡を収容可能で、かつ、食道を経由して消化管に送達可能な大きさと形であれば特に限定されるものではないが、中空の、球状、半球状、円筒状(例えば、軸方向外方に半球状に突き出す形状)などがあげられる。大きさは、飲み込み易さの観点から、球状または半球状の場合、半径が約0.2〜1cm、円筒状の場合、中心方向長が約0.2〜1cm、軸方向長が約1〜3cmが好ましい。あるいは、経口医薬品に用いられる硬カプセル剤の規格に準じて、000号(容量1.37mL)から5号(容量0.13mL)までの大きさであってもよい。カプセル殻は、撮影目的のために、少なくとも一部が透明であることが好ましい。
【0016】
本発明において内視鏡本体とは、前記カプセル殻内部に収容され、消化管内腔を撮影可能な部材から構成されるものである。かかる部材としては、特に限定されるものではないが、C−MOS、CCDなどの撮像素子などの撮像手段;LEDなどの照明素子などの照明手段;撮像素子で撮像した信号を処理して記憶させ、体外に送信される信号に変換される一連の回路などがあげられる。さらには、内視鏡本体は、前記に加えて、電池、磁場反応装置(磁性酸化鉄片:体外から交流磁場の方向操作によりカプセル進行方向誘導に使用する)などの電源や、体外との信号を送受信するアンテナ等の部材を有していてもよい。
内視鏡本体を構成する部品は、ヒトに対して有害反応を生起しない材料によって構成される。例えば、撮像素子、電気配線には金の使用が好適であり、また、レンズとしては生体適合プラスチックレンズが、電源としてはボタン型電池(人体適合型、日立マクセル製)を使用することが好ましい。さらに好ましい態様は、電源を外部から供給する内視鏡である。この場合、電力の供給は、体外より交流磁場環境を作り、フレミングの法則に基づいてカプセル内で起電反応を誘導して電源として利用する方法が想定される。
【0017】
内視鏡本体は、カプセル殻が分解した後、CCD等の撮像素子は金で配線されているため、生体に問題はない。基板の接続部分は、腸内のpH依存的に剥離するように設計することにより、内視鏡本体も個別に分解されうる。
【0018】
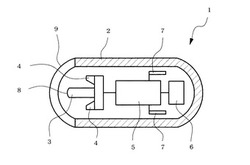
以下、本発明の実施例を説明する。図1-Aは、本発明のカプセル内視鏡の一具体例を示す。カプセル内視鏡1は、カプセル殻2とその内部に内視鏡本体を収納した構造である。内視鏡本体は、CCDからなる撮像素子3、LEDからなる照明素子4、撮像素子3で撮像した信号を処理して記憶させ、体外に送信される信号に変換される回路5、電源6およびアンテナ7から構成される。また、撮像素子3には、その先端にカメラ部レンズ8が取り付けられている。レンズ8に対向するカプセル殻2の範囲は、透明窓部分9である(図1-A、1-B)。
【0019】
本発明のカプセル内視鏡は、一般的な検査スケジュールに従って、以下のようにして使用される。被験者は、検査前日、繊維の少ない消化のよい夕食を摂取し、21時以降、水分摂取以外は禁止される。
検査当日、被験者は、6時に洗腸液(ニフレックまたはマグコロール等)に水2Lと消泡剤を混ぜ、約1時間かけてゆっくり内服する。以後は絶飲食する。9時に、カプセル内視鏡を内服する。11時から水のみ経口摂取することができる。小腸が検査対象の場合、13時頃から軽食を摂取することができる。
カプセル内視鏡は、18時頃、小腸を通過する予定であり、体外から伝送される内視鏡映像からカプセル内視鏡の局在を確認することができる。小腸が検査対象の場合、18時頃に検査が終了する。胃が検査対象の場合は、18時以前に、大腸が検査対象の場合は、18時以降に検査が終了する。上述した磁場反応装置を有するカプセル内視鏡の場合は、体外からの交流磁場の方向操作により、カプセルの進行を調節して、検査終了時刻を調整することも可能である。
検査終了後、排便時にカプセル内視鏡またはその構成部品の排泄の有無を確認する。また、検査終了1週間以内に、腹部X線検査により、カプセル内視鏡の排泄を確認する。
【0020】
作用
本発明のカプセル内視鏡は外套を形成するカプセルの分解により、それに応じて各部品は分離して微細なものとなり、通常食品が通過する消化管であれば閉塞または障害を与える危険性は少ない。
【図面の簡単な説明】
【0021】
【図1−A】本発明の一具体例にかかるカプセル内視鏡を概略的に示す縦断面図である。
【図1−B】本発明の一具体例にかかるカプセル内視鏡の斜視図である。
【符号の説明】
【0022】
1 カプセル内視鏡
2 カプセル殻
3 撮像素子
4 照明素子
5 回路
6 電源
7 アンテナ
8 カメラ部レンズ
9 カプセル殻透明窓部分
【技術分野】
【0001】
本発明は、カプセル内視鏡に関する。詳しくは、カプセル内視鏡による検査に付随する、消化管に対する障害の危険性を回避することができる、安全性の高いカプセル内視鏡に関する。
【背景技術】
【0002】
内視鏡を食道経由で消化管に挿入し、病変の有無を直接観察して検査することは信頼性が高いが、この方法での検査には大掛かりな施設が必要であるとともに、患者や術者の負担も大きい。患者の負担を軽減するために、経口用の医薬品のように飲み込むことが可能なカプセル型内視鏡が開発されている(特許文献1および2)。
【0003】
カプセル内視鏡を経口的に体内に送達させて消化管内腔の表面を記録する診断方法では、消化管の内腔をカプセル内視鏡が通過しうることが原則である。しかし、手術による消化管の引きつれ、消化管癌による内腔の狭窄、さらには周辺内臓からの癌浸潤や圧迫などにより、カプセル内視鏡が消化管内腔を閉塞して当該内視鏡が原因の腸閉塞を起こすことが知られている。腸閉塞症は、生命にかかわる緊急事態を誘発し、手術により救命することも少なくない。日常生活においては合併症により食物の通過障害を繰り返し、稀に緊急手術により救命される患者が存在することから、カプセル内視鏡の普及は、同時に腸閉塞症の頻発の危険性が予測される。
【特許文献1】特開2005−193066号公報
【特許文献2】特開2001−137182号公報
【発明の開示】
【発明が解決しようとする課題】
【0004】
したがって、本発明の目的は、内視鏡としての役目を果たした後、狭窄した消化管でも通過に支障がない程度に、内視鏡本体が細分化された部品となり、体外に排泄されることが保証されるカプセル内視鏡を提供することにある。
【課題を解決するための手段】
【0005】
本発明者は、上記問題点に鑑み、鋭意検討した結果、カプセル内視鏡において、消化管内で分解可能な材料をカプセル殻の素材として使用することに着目し、本発明を完成するに至った。即ち、本発明は、以下に示す通りである。
【0006】
〔1〕 カプセル殻と当該カプセル殻内に収容された内視鏡本体とを有するカプセル内視鏡であって、前記カプセル殻が消化管内の体液によって分解可能な材料からなるカプセル内視鏡。
〔2〕 前記材料が腸溶性材料である前記〔1〕に記載のカプセル内視鏡。
【発明の効果】
【0007】
本発明のカプセル内視鏡によると、内視鏡としての役目を果たした後、消化管を通過中にカプセル殻が分解されるとともにカプセル殻内部に収容されている内視鏡本体が部品単位に分解して、細分化された構成部品となるので、腸管等を安全に通過して糞便中に混入されて体外に排出される。本発明のカプセル内視鏡を用いることによって、胃がん等の消化器がんの早期発見等を、苦痛なく安全に短時間で行うことができる。これにより、進行がんの減少に貢献し、医療費負担の減少が期待される。また、近年増加中の大腸癌の発見にも貢献することが期待される。また、本発明のカプセル内視鏡によると、消化管内腔の狭窄患者や腹部手術既往患者等に対する従来のカプセル内視鏡による腸閉塞の発生を回避することができる。
【発明を実施するための最良の形態】
【0008】
本発明のカプセル内視鏡は、カプセル殻と当該カプセル殻内に収容された内視鏡本体とから構成され、そのカプセル殻を構成する材料を、消化管内の体液によって分解可能な材料としたことに特徴がある。
【0009】
本発明においてカプセル殻は、内視鏡を水密的に収容するものであり、消化管内の体液によって分解可能な材料からなるものである。当該材料としては、例えば腸溶性の材料、特に腸溶性の高分子材料が好適であり、かかる高分子材料としては、例えば、ゼラチン、低置換度ヒドロキシプロピルセルロース(L−HPC)、ヒドロキシプロピルセルロース(HPC)、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルメチルセルロースフタレート(HPMCP)、ヒドロキシプロピルメチルセルロースアセテートサクシネート(HPMCAS)、結晶セルロース、カルボキシメチルセルロース(CMC)、カルボキシメチルエチルセルロース(CMEC)、メタクリル酸コポリマー、アクリル酸エチル・メタクリル酸メチルコポリマー、セルロースアセテートフタレート(CAP)、セルロースアセテートサクシネート(CAS)、セルロースアセテートトリメリレート(CAT)、メチルセルロースフタレート、セルロースベンゾエートフタレート、セルロースアセテートマレート、スターチアセテートフタレート(SAP)、アミロースアセテートフタレート(AAP)、デキストリン、ガラクトース、フルクトース等の糖類、ポリビニルアルコールフタレート(PVAP)、ポリビニルアセテートフタレート、ポリビニルプロピオネートフタレート、マレイン酸コポリマーがあげられる。HPMCP、CMEC、メタクリル酸コポリマー、アクリル酸エチル・メタクリル酸メチルコポリマーなどが腸溶性の高分子材料として汎用され、好ましい。これらは単独で用いてもよく、2種以上を組合せて用いてもよい。
【0010】
本発明のカプセル内視鏡において、該内視鏡を投与後、カプセル殻の消化管内における分解は、検査対象とされる消化管によって異なるが、内視鏡の投与を午前9:00に開始した場合、通常12:00〜24:00、好ましくは16:00〜24:00、特に好ましくは20:00〜24:00の時間内である。かかるカプセル殻は、その材料の選択、その厚み等の調整などによって調製することができる。以下に説明する各検査対象消化管の適用においても同様の調整によって、調製することができる。
【0011】
本発明のカプセル内視鏡を食道乃至胃の検査に使用する場合、胃の中は酸性(pH1〜3.5程度)であるので、食道乃至胃の検査のみを目的としたカプセル内視鏡は、アルカリ性環境(pH5〜7程度)の十二指腸に移動した時点からカプセル殻が分解することが好ましい。この場合、前記材料としては、ヒドロキシプロピルメチルセルロースフタレート(HPMCP)、カルボキシメチルエチルセルロース(CMEC)、ポリビニルアセテートフタレート(PVAP)等の腸溶性高分子が好適なものとしてあげられる。
【0012】
本発明のカプセル内視鏡を十二指腸の検査に使用する場合、当該内視鏡が十二指腸に達するまでと、達した後適宜な時間カプセルの形状が保持され、その後に分解することが好ましい。この場合、前記生体分解性材料としてヒドロキシプロピルメチルセルロースフタレート(HPMCP)、カルボキシメチルエチルセルロース(CMEC)等を用い、コーティング量を増やしてカプセルを厚めに形成することで、十二指腸内でカプセルの形状が保持可能である。また、Eudragit(登録商標、Rohm Pharma社、メタクリル酸コポリマー)は、各種グレードによって溶解pHが異なり、適当なグレード品を選択して用いることで十二指腸での使用に適するカプセルを形成することができる。また、後述する小腸の検査に使用可能なカプセル内視鏡は、十二指腸内での検査にも適用可能である。
【0013】
本発明のカプセル内視鏡を小腸の検査に用いる場合、当該内視鏡が小腸に達するまでと、達した後適宜な時間カプセルの形状が保持され、その後に分解することが好ましい。この場合、小腸下部のpHは約7〜8となるため、pH6以上で溶解可能な材料が好ましい。かかる材料としては、セルロースアセテートフタレート(CAP)、ヒドロキシプロピルメチルセルロースアセテートサクシネート(HPMCAS)、Eudragit(登録商標、Rohm Pharma社)などがあげられる。
【0014】
本発明のカプセル内視鏡を大腸の検査に用いる場合、当該内視鏡が大腸に達するまでと、到達した後適宜な時間カプセルの形状が保持され、その後に分解することが好ましい。カプセル内視鏡が大腸に到達する前に回腸部を通過するが、小腸内のpHは消化液および腸内細菌によりpH6〜7となり、回腸のpHは大腸内視鏡による実測値でさらにアルカリ性で、pH8〜9であった。大腸を標的にカプセルを分解させる方法の一例として、カプセルの内側を溶解pHの低い層(例えば、pH5以上で溶解可能な層)でコーティングし、さらにその上から溶解pHの高い層(例えば、pH6以上で溶解可能な層)でコーティングする二層コーティングがあげられる。この場合、内側の層には、HPMCP、CMEC、PVAPなどが用いられ、外側の層には、CAP、HPMCAS、Eudragit(登録商標、Rohm Pharma社)などが用いられる。
【0015】
カプセル殻の形状としては、内視鏡を収容可能で、かつ、食道を経由して消化管に送達可能な大きさと形であれば特に限定されるものではないが、中空の、球状、半球状、円筒状(例えば、軸方向外方に半球状に突き出す形状)などがあげられる。大きさは、飲み込み易さの観点から、球状または半球状の場合、半径が約0.2〜1cm、円筒状の場合、中心方向長が約0.2〜1cm、軸方向長が約1〜3cmが好ましい。あるいは、経口医薬品に用いられる硬カプセル剤の規格に準じて、000号(容量1.37mL)から5号(容量0.13mL)までの大きさであってもよい。カプセル殻は、撮影目的のために、少なくとも一部が透明であることが好ましい。
【0016】
本発明において内視鏡本体とは、前記カプセル殻内部に収容され、消化管内腔を撮影可能な部材から構成されるものである。かかる部材としては、特に限定されるものではないが、C−MOS、CCDなどの撮像素子などの撮像手段;LEDなどの照明素子などの照明手段;撮像素子で撮像した信号を処理して記憶させ、体外に送信される信号に変換される一連の回路などがあげられる。さらには、内視鏡本体は、前記に加えて、電池、磁場反応装置(磁性酸化鉄片:体外から交流磁場の方向操作によりカプセル進行方向誘導に使用する)などの電源や、体外との信号を送受信するアンテナ等の部材を有していてもよい。
内視鏡本体を構成する部品は、ヒトに対して有害反応を生起しない材料によって構成される。例えば、撮像素子、電気配線には金の使用が好適であり、また、レンズとしては生体適合プラスチックレンズが、電源としてはボタン型電池(人体適合型、日立マクセル製)を使用することが好ましい。さらに好ましい態様は、電源を外部から供給する内視鏡である。この場合、電力の供給は、体外より交流磁場環境を作り、フレミングの法則に基づいてカプセル内で起電反応を誘導して電源として利用する方法が想定される。
【0017】
内視鏡本体は、カプセル殻が分解した後、CCD等の撮像素子は金で配線されているため、生体に問題はない。基板の接続部分は、腸内のpH依存的に剥離するように設計することにより、内視鏡本体も個別に分解されうる。
【0018】
以下、本発明の実施例を説明する。図1-Aは、本発明のカプセル内視鏡の一具体例を示す。カプセル内視鏡1は、カプセル殻2とその内部に内視鏡本体を収納した構造である。内視鏡本体は、CCDからなる撮像素子3、LEDからなる照明素子4、撮像素子3で撮像した信号を処理して記憶させ、体外に送信される信号に変換される回路5、電源6およびアンテナ7から構成される。また、撮像素子3には、その先端にカメラ部レンズ8が取り付けられている。レンズ8に対向するカプセル殻2の範囲は、透明窓部分9である(図1-A、1-B)。
【0019】
本発明のカプセル内視鏡は、一般的な検査スケジュールに従って、以下のようにして使用される。被験者は、検査前日、繊維の少ない消化のよい夕食を摂取し、21時以降、水分摂取以外は禁止される。
検査当日、被験者は、6時に洗腸液(ニフレックまたはマグコロール等)に水2Lと消泡剤を混ぜ、約1時間かけてゆっくり内服する。以後は絶飲食する。9時に、カプセル内視鏡を内服する。11時から水のみ経口摂取することができる。小腸が検査対象の場合、13時頃から軽食を摂取することができる。
カプセル内視鏡は、18時頃、小腸を通過する予定であり、体外から伝送される内視鏡映像からカプセル内視鏡の局在を確認することができる。小腸が検査対象の場合、18時頃に検査が終了する。胃が検査対象の場合は、18時以前に、大腸が検査対象の場合は、18時以降に検査が終了する。上述した磁場反応装置を有するカプセル内視鏡の場合は、体外からの交流磁場の方向操作により、カプセルの進行を調節して、検査終了時刻を調整することも可能である。
検査終了後、排便時にカプセル内視鏡またはその構成部品の排泄の有無を確認する。また、検査終了1週間以内に、腹部X線検査により、カプセル内視鏡の排泄を確認する。
【0020】
作用
本発明のカプセル内視鏡は外套を形成するカプセルの分解により、それに応じて各部品は分離して微細なものとなり、通常食品が通過する消化管であれば閉塞または障害を与える危険性は少ない。
【図面の簡単な説明】
【0021】
【図1−A】本発明の一具体例にかかるカプセル内視鏡を概略的に示す縦断面図である。
【図1−B】本発明の一具体例にかかるカプセル内視鏡の斜視図である。
【符号の説明】
【0022】
1 カプセル内視鏡
2 カプセル殻
3 撮像素子
4 照明素子
5 回路
6 電源
7 アンテナ
8 カメラ部レンズ
9 カプセル殻透明窓部分
【特許請求の範囲】
【請求項1】
カプセル殻と当該カプセル殻内に収容された内視鏡本体とを有するカプセル内視鏡であって、前記カプセル殻が消化管内の体液によって分解可能な材料からなるカプセル内視鏡。
【請求項2】
前記材料が腸溶性材料である請求項1に記載のカプセル内視鏡。
【請求項1】
カプセル殻と当該カプセル殻内に収容された内視鏡本体とを有するカプセル内視鏡であって、前記カプセル殻が消化管内の体液によって分解可能な材料からなるカプセル内視鏡。
【請求項2】
前記材料が腸溶性材料である請求項1に記載のカプセル内視鏡。
【図1−A】


【図1−B】




【図1−B】


【公開番号】特開2008−12094(P2008−12094A)
【公開日】平成20年1月24日(2008.1.24)
【国際特許分類】
【出願番号】特願2006−186574(P2006−186574)
【出願日】平成18年7月6日(2006.7.6)
【出願人】(594124052)
【出願人】(000006677)アステラス製薬株式会社 (274)
【Fターム(参考)】
【公開日】平成20年1月24日(2008.1.24)
【国際特許分類】
【出願日】平成18年7月6日(2006.7.6)
【出願人】(594124052)

【出願人】(000006677)アステラス製薬株式会社 (274)
【Fターム(参考)】
[ Back to top ]

