カルコゲン化合物粉の製造方法
【課題】カルコゲン化合物の生成で配位子を用いる方法では金属元素の種類により配位子を変えて金属錯体を形成する必要があり、ナノ結晶が三元系や四元系の場合は困難で、配位子を含んだ排水の処理に問題があった。高沸点溶媒でカルコゲン化反応の温度に昇温する際、例えば硝酸塩のCu(NO3)2、In(NO3)3をアンモニア水溶液によりCuとInの水酸化物を共沈させる金属水酸化物又は脱水反応後の酸化物状態では、カルコゲン化反応において局所的に金属酸化物が発生し、CuInSe系の化合物が単相で生成できない。
【解決手段】還元性溶媒中に金属の水酸化物、酸化物、シュウ酸塩の1種以上、およびSe、Te、Sの1種以上を含むカルコゲン源を添加し200℃以上に加熱することにより三元系や四元系であるものを含むカルコゲン化合物(金属元素の1種以上とSe、S、Teから選択される元素の1種以上を構成元素とする化合物)のナノ粒子が得られる。
【解決手段】還元性溶媒中に金属の水酸化物、酸化物、シュウ酸塩の1種以上、およびSe、Te、Sの1種以上を含むカルコゲン源を添加し200℃以上に加熱することにより三元系や四元系であるものを含むカルコゲン化合物(金属元素の1種以上とSe、S、Teから選択される元素の1種以上を構成元素とする化合物)のナノ粒子が得られる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、薄膜太陽電池の光吸収層、蛍光体、ペルチェ素子用の電極膜の形成等に用いられるカルコゲン系元素を含んだカルコゲン化合物粉の製造方法に関し、特に、安価で安全にカルコゲン化合物粉を生成するカルコゲン化合物粉の製造方法に関する。
【背景技術】
【0002】
金属化合物のナノサイズ粉として、例えば半導体ナノ結晶、特に、テルル化カドミウム(CdTe)、セレン化カドミウム(CdSe)、及び硫化カドミウム(CdS)、銅インジウムガリウムセレン(CuInGaSe)、銅インジウムセレン(CuInSe)等は、径のサイズ効果による光吸収スペクトルの制御や発光の制御が可能な他に、化合物のバンドギャップの制御が固溶体の形成により可能であるために太陽電池への応用にも近年、研究開発が活発に行われている。
【0003】
カルコゲン化合物のナノ粒子であるCdSeナノ結晶の合成方法の一例としてジメチルカドミウム(Cd(CH3)2)をカドミウム前駆物質として使用するCdSeナノ結晶の合成は、Murrayらの最初の報告(非特許文献1参照。)以降、開発されてきた。なお、本願で、カルコゲン化合物とは、金属元素の1種以上とSe、S、Teから選択される元素の1種以上を構成元素とする化合物を示す。Barbera−Guillemらは、Murrayらの方法を使用したナノ結晶の生成のための連続流動法を開示している(特許文献1参照。)。
【0004】
この合成方法は、非常に毒性が高く、発火性であり、高価であり、そして室温で不安定であるジメチルカドミウムなどの有機金属化合物を前駆物質として使用する必要がある。Cd(CH3)2を前駆物質として使用するナノ結晶合成に必要な標準的注入温度(340から360℃)では、発火性を有するCd(CH3)2が、大量に発生するので、安全上の対策にコストがかかる等の課題がある。これらの理由から、Cd(CH3)2が関連する合成方法は実験及び条件が非常に制限され、そのため大規模合成には適していない。同様に他のカルコゲン元素を含んだ半導体ナノ結晶を作製する場合にも、アルキル金属化合物や金属アルコキシドを用いた場合も蒸気圧は高く、爆発の危険性もあり、またガスが毒性を持つので安全上の対策にコストがかかる課題がある。
【0005】
そのため、安価で非発火性の材料として金属酸化物または金属塩を前駆物質として使用し、金属酸化物または金属塩を配位子及び配位溶媒と混合させて溶解性金属錯体を生成させ、元素カルコゲン前駆物質(セレン(Se)、テルル(Te)、または硫黄(S)など)を加えて、ナノ結晶が生成される方法も知られている(特許文献2参照。)。このような金属錯体の陽イオン種としての配位子は、長鎖脂肪アミンまたは脂肪酸、ホスホン酸、及びホスフィンオキシドが挙げられる。これらの群に含まれる具体的な種類としては、ドデシルアミン(DA)、ヘキサデシルアミン(HA)、オクタデシルアミン(OA)、ステアリン酸(SA)、ラウリン酸(LA)、ヘキシルホスホン酸(HPA)、テトラデシルホスホン酸(TDPA)、及びトリオクチルホスフィンオキシド(TOPO)が挙げられる。
【0006】
この際、配位子の融点が高すぎる場合、その配位子は高温で固体のままであるので、有用な配位溶媒としては機能しない。この場合、このような配位子は別の溶媒と併用する必要がある。このような配位子を持つ金属錯体を形成するために、加熱させることにより金属酸化物または塩は、安定な溶解性金属錯体に変化させている。そこで、金属錯体は前駆物質種を配位子単独と混合することによって生成可能であり、また溶媒が使用される場合には、溶解性錯体は前駆物質種を配位子/溶媒分子と混合することによって生成可能である。
【0007】
例えば、金属元素がカドミウムであるカルコゲン化合物粉を合成する場合では、酸化カドミウム(CdO)または酢酸カドミウム(Cd(Ac)2)に、ホスホン酸またはカルボン酸などの配位子が加えられる場合、得られるカドミウム錯体は、それぞれホスホン酸カドミウムまたはカルボン酸カドミウムのいずれかである。最後に、カルコゲン元素の前駆物質(Se、Te、またはSなど)が、溶解したカドミウム錯体に加えられて、制御可能な速度でナノ結晶(カルコゲン化合物粉)の生成が終了される。例えば、CdOがカドミウムの原料物質として使用される場合、カルコゲン元素の前駆物質を変えることによってCdSe、CdTe、CdS、またはその他の種類の金属元素がカドミウムであるカルコゲン化合物粉(ナノ結晶)を合成することが可能である。
【特許文献1】米国特許第6,179,912号明細書
【特許文献2】特表2004−510678号公報
【非特許文献1】Journal of the American Chemical Society(1993)、115、8706−8715
【発明の開示】
【発明が解決しようとする課題】
【0008】
ところが、このような配位子を用いた合成方法では、金属元素の種類により配位子を変えて金属錯体を形成する必要があり、合成するカルコゲン化合物が2セレン化銅ガリウム(CuGaSe2)や2セレン化銅インジウム(CuInSe2)のような三元系やCuIn1−xGaxSe2のような四元系の場合には目的とするカルコゲン化合物を得ることが困難であった。また二元系のセレン化第一銅(Cu2Se)のような化合物の場合には配位子の選定が難しい場合もある。更に配位子を含んだ排水の処理に問題が生じていた。例えばヘキシルホスホン酸(HPA)、テトラデシルホスホン酸(TDPA)、及びトリオクチルホスフィンオキシド(TOPO)はいずれにしても毒性を持つため、排水中に含まれるこれらの化合物を除去する排水処理が必要で、排水処理コストが高い課題があった。また、三元系以上のカルコゲン化合物を得ることが困難であった。
【0009】
ジメチルカドミウムなどの有機金属化合物を前駆物質として使用する製法の場合には、前記有機金属化合物が、高価であること、更に、有毒性、発火性を有し、安全対策コストがかさむ課題があった。
【課題を解決するための手段】
【0010】
本発明は、係る課題に鑑みてなされたものであり、溶媒に金属水酸化物または金属酸化物の金属化合物粉末と、硫黄、セレン、テルルから選択される単体、または前記元素群から選択される1種以上を含む化合物を添加して混合溶媒を生成する工程と、該混合溶媒を200℃〜500℃の温度で加熱する工程と、を具備することにより解決するものである。
【0011】
また、前記溶媒が、還元性溶媒であることを特徴とするものである。
【0012】
また、前記混合溶媒は、220℃〜400℃で加熱することを特徴とするものである。
【0013】
また、前記金属化合物粉末が、遷移金属元素、III族金属元素、及びVI族金属元素からなる群より選択される化合物を含むことを特徴とするものである。
【0014】
また、前記遷移金属元素が、Fe、Co、Cu、Cr、Mn、Ni、Cd、Zn、Ti、V、La、Ce、Pr、Nd、Sm、Eu、Gd、Dy、Er、Ybの中、1種以上を含むことを特徴とするものである。
【0015】
また、前記III族金属元素が、Al、Ga、Tl及びInを含むことを特徴とするものである。
【0016】
また、前記VI族金属元素がSn及びPbを含むことを特徴とするものである。
【0017】
また、前記還元性溶媒は、沸点が220℃から400℃の範囲のアルコール系溶媒であることを特徴とするものである。
【0018】
また、前記金属酸化物は、70℃〜300℃の範囲内で前記金属水酸化物を加熱する水酸化物の脱水反応によって得られることを特徴とするものである。
【0019】
また、前記金属化合物粉末は、金属塩を溶媒に溶解し、アルカリを添加して生成することを特徴とするものである。
【0020】
更に、前記金属塩が、金属ハロゲン化物、金属カルボン酸塩、金属炭酸塩、金属硝酸塩、金属硫酸塩のいずれかの群より選択されることを特徴とするものである。
【発明の効果】
【0021】
本発明によれば、安価な金属塩を原料として、金属の1種以上と硫黄、セレン、テルルから選択される1種以上の化合物(カルコゲン化合物)のナノ粒子粉(ナノ結晶粉)を生成することができる。原料として有機金属を使用せず、また金属錯体を中間体としないため、製造コストが安価で、且つ排水中に有機系の毒性物質が排出しない安全な方法で、高い結晶性を有し、TEM粒子径が40nm以下のナノ粒子であるカルコゲン化合物粉を製造する方法を提供できる。
【発明を実施するための最良の形態】
【0022】
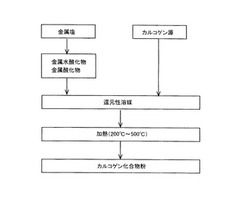
以下、本実施形態を、図1から図35を参照して詳細に説明する。図1は本実施形態のカルコゲン化合物粉の製造方法を示すフロー図である。
【0023】
本実施形態のカルコゲン化合物粉の製造方法は、金属水酸化物または金属酸化物の1種以上からなる金属化合物粉末と還元性溶媒とを混合し、硫黄(S)、セレン(Se)、テルル(Te)から選択される1種以上からなる(単体または)化合物を添加して混合溶媒を生成する工程と、前記混合溶媒を200℃〜500℃の温度で加熱する工程と、を有する。この方法により、平均粒径が40nm以下であるカルコゲン化合物粉を得ることができる。
【0024】
原料となる金属化合物粉末は、金属水酸化物または金属酸化物の粉末を使用できる。金属水酸化物は、金属塩を溶媒に溶解し、アルカリを添加して生成できる。また、金属酸化物の粉末は、金属水酸化物を酸化(脱水)して得ることができる。
【0025】
以下、金属塩を出発原料とした場合を例に説明するが、金属水酸化物または金属酸化物の金属化合物粉末を出発原料とすることもできる。
【0026】
すなわち本実施形態は、金属塩を溶媒に溶解し、アルカリを添加して金属の水酸化物を沈殿させた後に、デカンテーションや遠心沈降、ろ過等を行い、必要に応じて水洗し、乾燥して金属水酸化物を得る。または金属水酸化物を酸化(脱水)して金属酸化物の金属化合物粉末を得たもの、もしくは出発原料として水酸化物や酸化物の金属化合物粉末を還元性溶媒に混合し、還元性溶媒にカルコゲン源を添加した状態で加熱し、所定のカルコゲン化合物を生成するものである。使用する金属化合物およびカルコゲン源の種類を選択することにより、多様なカルコゲン化合物粉を得ることができる。
【0027】
本実施形態の金属塩は、金属ハロゲン化物、金属カルボン酸塩、金属炭酸塩、金属硝酸塩、金属硫酸塩のいずれかの群より選択される。
【0028】
具体的には、出発原料となる金属塩として、例えばハロゲン化金属塩としては、塩化第二銅(CuCl2)、塩化カドミウム(CdCl3)、塩化インジウム(InCl3)、臭化銅(CuBr2)、ヨウ化銅(CuI2)等の金属塩化物、金属臭化物、金属ヨウ化物、金属フッ化物が代表的に挙げられ、金属の強酸塩として、硫酸銅(CuSO4)、硝酸第二銅(Cu(NO3)2)、硫酸インジウム(In2(SO4)3)のような硫酸塩、硝酸塩が挙げられる。その他には、酢酸塩、蟻酸塩、シュウ酸塩等のカルボン酸を用いた酢酸銅(Cu(CH3COO)2)、蟻酸第二銅(Cu(HCOO)2)、シュウ酸銅(Cu(COO)2)等の金属塩がある。これらの塩類に結晶水を含んだものでも良い。
【0029】
金属塩に含まれる金属元素の種類としては、3d、4f系の遷移金属元素またはIII族金属元素またはVI族金属元素の中から少なくとも一種以上含んだものである。3d、4f系の遷移金属元素としては、鉄(Fe)、コバルト(Co)、銅(Cu)、クロム(Cr)、マンガン(Mn)、ニッケル(Ni)、カドミウム(Cd)、亜鉛(Zn)、チタン(Ti)、バナジウム(V)、ランタン(La)、セリウム(Ce)、プラセオジム(Pr)、ネオジム(Nd)、サマリウム(Sm)、ユウロピウム(Eu)、ガドリニウム(Gd)、ジスプロシウム(Dy)、エルビウム(Er)、イッテルビウム(Yb)が挙げられる。またIII族金属元素としては、アルミニウム(Al)、ガリウム(Ga)、タリウム(Tl)及びインジウム(In)が挙げられる。またVI族金属元素としては、スズ(Sn)及び鉛(Pb)が挙げられる。
【0030】
これらの金属塩を水やアルコール等の極性溶媒に溶解させる。その後、アルカリを添加することにより中和して金属水酸化物を生成する。詳細には、アンモニア水溶液、水酸化ナトリウム、水酸化カリウム、またはアミノ基を持つアルカリ性有機化合物によって金属水酸化物として沈殿させる。この際、得ようとするカルコゲン化合物が複数の金属元素を含有する化合物の場合、金属塩の構成として、前記カルコゲン化合物と同じ金属元素比を有する金属水酸化物の沈殿を得るために、少なくとも二種以上の金属塩を用いて金属水酸化物の生成をおこなう。具体的に例えば、CuInSe2を作製する場合には、銅(Cu)とインジウム(In)の原子比が1対1になるように、銅の塩とインジウムの塩を原料として用い、金属水酸化物を生成する。このため、例えば硝酸塩のCu(NO3)2と三硝酸インジウム(In(NO3)3)を水酸化ナトリウム水溶液により、CuとInの水酸化物として生成させる。また、銅の水酸化物とインジウムの水酸化物を別々に生成させ、それらを使用することも、可能である。
【0031】
これらの金属水酸化物を含むスラリーを遠心脱水機、高速遠心沈降管、またはフィルタープレス、ヌッチェ等により反応副産物を含んだ溶媒を一度除去して、水やエタノール等の極性溶媒に再分散して、更に溶媒を除去するという操作を繰り返し、洗浄を行う。洗浄は、残液(ろ液)の導電率が10−1Sm以下になるまで繰り返すことが望ましい。特にアルカリ金属は残留すると揮発しないために不純物元素として残ることになるので問題となる。
【0032】
洗浄を行うことにより反応不純物を除去できる。本実施形態の中和におけるpHの終了点はアルカリ性であることが好ましい。そのpHは特に限定されるものではないが、例えば10以上でも良い。また、水洗によるろ液の導電率が低いほど良いが、pHが中性に近付くと金属水酸化物自体が溶出するために組成が変わるので、前記ろ液のpHは、7.5以上に維持することが望ましい。
【0033】
その後金属水酸化物を例えば70℃から90℃で乾燥させ、金属水酸化物の粉末(金属化合物粉末)を得る。この際、乾燥温度は、特に限定されず、真空乾燥にすることにより乾燥温度を下げることが出来る。また乾燥温度は200℃以上であっても良い。
【0034】
また、上記の金属水酸化物を加熱し、酸化して金属酸化物の粉末(金属化合物粉末)を生成してもよい。
【0035】
具体的には、洗浄によってろ液の導電率を10−1Sm以下にした、金属水酸化物を含むスラリーの含水率を50パーセント以下に調整し、このスラリー(またはケーキ)を再度、溶媒に分散させる。
【0036】
金属水酸化物を含む溶媒を空気、窒素、アルゴン等のガスを導入して水を外部に蒸発させ(バブリングし)、溶媒の温度を70℃〜300℃の範囲内で加熱することで、溶媒中の金属水酸化物は、金属酸化物、もしくは金属酸化物と金属水酸化物の混合物となり、凝集している金属水酸化物が解離して、溶媒中に一次粒子のサイズとして1nm〜200nmの粉が未焼結の状態で存在する状態とすることができる。
【0037】
この際、溶媒分子自体を前記の粒子に化学結合、もしくは物理吸着の形態で包むことにより溶媒中に分散させても良い。もしくは溶媒に界面活性剤を添加して溶媒に対して前記の粒子を分散させても良い。このように溶媒に分散した粒子においては、粒子に表面処理や粒子と他の反応処理において、粒子間の凝集や焼結を防ぐことが出来るので望ましい。
【0038】
この酸化時の反応は溶媒中に水を放出するので、上記の如くバブリングでも良いが、オートクレーブ中で高温にして酸化反応を促進させても良い。
【0039】
また、ここでは金属水酸化物を洗浄した後に金属酸化物を生成した場合を例に示したが、金属水酸化物を生成してから同一溶媒中にて加熱して金属酸化物を生成した後に、洗浄操作を行っても良い。また、金属水酸化物生成とカルコゲン化反応を同一溶媒中でおこなう場合、カルコゲン化反応の後で洗浄操作を行っても良い。いずれの段階においても洗浄を行うことにより反応不純物を適正に除去できる。
【0040】
次に、金属水酸化物あるいは金属酸化物の金属化合物粉末と還元性溶媒を混合し、S、Se、Teから選択される単体、または前記元素群から選択される1種以上を含む化合物を添加して混合溶媒を生成し、これを加熱する。
【0041】
ここで、還元性溶媒とは、金属水酸化物あるいは金属酸化物の金属化合物粉末(以下金属化合物粉末)と、S、Se、Teから選択される単体、または前記元素群から選択される1種以上を含む化合物を溶媒中に共存させ、加熱した際、前記金属化合物から酸素原子を奪い、結果としてカルコゲン化合物を生成する能力を有する溶媒を指す。還元性溶媒としては、その沸点が、200℃以上であるものが好適であり、220℃以上であるものが特に好適である。後述するように、カルコゲン化合物を得るためには、還元性溶媒を200℃以上、好ましくは220℃以上に加熱する必要があり、還元性溶媒の沸点が前記温度範囲であれば、常圧下でカルコゲン化合物を得る反応を行なえる。反応を加圧下で行なう場合には、沸点が200℃未満の溶媒も使用できる。
【0042】
還元性溶媒の一例として、沸点が100℃から400℃の範囲のアルコール系溶媒が挙げられる。カルコゲン化反応を常圧でおこなうためには、沸点は200℃以上であることが好ましく、220℃以上であることが更に好ましく、カルコゲン化合物の収率も考慮すると250℃以上が一層好ましい。
【0043】
具体的には、還元性溶媒のとして、一価アルコール、または二価アルコールのグリコールがある。一価アルコールとしては、例えば、ブチルアルコール、アミルアルコール、ヘキシルアルコール、ヘプチルアルコール、オクチルアルコール、デシルアルコール、ノニルアルコール、シクロペンタノール、ベンジルアルコール、シンナミルアルコール等がある。グリコール系の溶媒としては、グリセリン、エチレングリコール、ジエチレングリコール、トリエチレングリコール、プロピレングリコール、トリメチレングリコール、ブタンジオール、ペンタンジオール、ヘキサンジオール、ヘプタンジオール、オクタンジオール、ノナンジオール、デカンジオール、ベンズピナコール、ヒドロベンゾイル、シクロペンダジオール、シクロヘキサンジオール、シクロヘキサンジオール、グリコール酸アミド、ジエチレングリコールジメチルエーテル、ジエチレングリコールジエチルエーテル、プロピレングリコールモノエチルエーテル、ジエチレングリコールジブチルエーテル、酢酸ジエチレングリコールモノブチルエーテル、プロピレングリコールモノメチルエーテルアセタート等があり、分子量の大きいものではポリエチレングリコール、ポリエチレングリコールエステル、ポリエチレングリコールエーテルがある。特にグリコール、ジオール系のものは水酸基を二つ持つものであるため、極性を持ち、粉の分散性に寄与するので望ましい。このような溶媒としては、例えば−CH2−CHOH、または−CHR−CHOH、−CR1R2−CHOH、=CHCHOH、=CRCHOH (R、R1、R2:側鎖)を分子中に含まれるもので、且つ溶媒の沸点は少なくとも100℃以上のものである。更にはアルデヒド基−CHOを持つ有機化合物も同様な効果を持ち、例えば、脂肪族飽和アルデヒドとして、ラウリンアルデヒド、トリデシルアルデヒド、ミリスチンアルデヒド、カプロンアルデヒド、ヘプトアルデヒド、ペンタデシルアルデヒド、パルミチンアルデヒド、マルガリンアルデヒド、ステアリンアルデヒドが挙げられ、脂肪族ジアルデヒドとしては例えばスクシンジアルデヒドがあり、脂肪族不飽和アルデヒドとして、クロトンアルデヒド、更には芳香族アルデヒドには、ベンズアルデヒド、トルアルデヒド、サリチルアルデヒド、シンナムアルデヒド、ナフトアルデヒド等があり、複素環式アルデヒドにはフルフラールが挙げられる。アミン系の還元性溶媒としては、ヘキシルアミン、ヘブチンアミン、オクチルアミン、ウンデシルアミン、トリデシルアミン、テトラデシルアミン、ペンタデシルアミン、セチルアミン、ジブチルアミン、ジアミルアミン、シクロヘキシルアミン、アニリン、ナフチルアミン、トルイジン等がある。
【0044】
また、還元性溶媒に金属化合物粉末とともに添加される、S、Se、Teから選択される単体、または前記元素群から選択される1種以上を含む化合物(以下、カルコゲン源)としては、前記元素の合金の粉末、または水素化カルコゲン化合物、またはカルコゲン元素の有機金属を用いることができる。
【0045】
前記合金とは、Se、Te、及びSからなる群より二つ以上選択された元素を構成元素とする合金である。
【0046】
水素化カルコゲン化合物としては、セレン化水素(H2Se)、硫化水素(H2S)、テルル化水素(H2Te)等が代表的に挙げられ、カルコゲン元素の有機金属としては、一般的にはアルキルセレノール、アリールセレノール、セレン化ジアルキル、セレン化ジアリール、ハロゲン化アルキルセレニド、ハロゲン化アリールセレニド、ジアルキルセレノキシド、ジアリールセレノキシド、セレノン、アルキルセレニン酸、アリールセレニン酸、セレノン酸、セレノケトン、セレノ酸、セレノフェン等がある。例えばジアルキルセレンの例としてはSe(CH3)2、(C2H5)2Se、(C4H9)2Se、(C6H13)2Se等が代表的な化合物である。これらのカルコゲン系元素(Se、S、Te)の単体、合金、化合物を1種以上を用いることができる。
【0047】
そして、上記カルコゲン源と、金属化合物粉末および還元性溶媒との混合溶媒を、200℃〜500℃の温度で加熱する。これにより、カルコゲン源と、金属化合物粉末および還元性溶媒との混合溶媒をカルコゲン化反応させ、カルコゲン化合物粉を容易に得ることができる。前記の加熱温度(カルコゲン化反応のための温度:以下、反応温度)は、低いとカルコゲン化合物の生成が十分でない場合があり、400℃以上にしても、得られるカルコゲン化合物の生成状態に大きな変化が見られないことから、好ましくは、220℃〜400℃、更に好ましくは、250℃〜400℃の範囲である。
【0048】
本実施形態では、エチルアルコールなどに比べて高い沸点の還元性溶媒を前記温度領域(200℃〜500℃)まで加熱することにより、溶媒が還元剤として働き、金属化合物粉末を還元するとともに、カルコゲン源のSe、Te、Sと還元された金属を反応させることにより、カルコゲン化合物粉を容易に得ることができるものと考えられる。また、これにより作成したカルコゲン化合物粉の粒子は、粒子径が1nm〜200nmのサイズとなり、焼結や粒子間結合のない粉が得られる。前記金属化合物粉末の粒径を調整することにより、粒子径が1nm〜40nmのカルコゲン化合物分を得ることができる。
【0049】
尚、後の実施例からも明らかであるが、混合溶媒の加熱温度は、高温になるほど、良好な結果が得られる。しかし、混合溶媒(還元性溶媒)が沸騰するまで高温にすると、カルコゲン化反応は進むが、還元性溶媒が熱分解したり、もしくは蒸発してしまう為に反応が不安定になる。従って、混合溶媒の加熱温度(反応温度)は、混合溶媒が沸騰する温度より低温とする。具体的には、本実施形態の混合溶媒の加熱温度(反応温度)は、カルコゲン化合物の収率の観点から、220℃以上が好ましく、250℃以上が更に好ましい。反応温度の上限温度は溶媒の沸点以下とするのが好ましく、具体的には500℃以下とするのが好ましい。
【0050】
例えば、本実施形態により、CuInSe系のカルコゲン化合物を得ようとする場合の一例を示すと以下のとおりである。Cu(NO3)2、In(NO3)3を含む水溶液に水酸化ナトリウム水溶液を添加することにより得たCuとInの金属水酸化物を(酸化した後)、還元性溶媒と混合し、金属Se粉末を溶媒に加えて、220℃〜400℃に加熱する。これにより、カルコゲン化合物を生成する反応(以下、カルコゲン化反応)が著しく促進し、CuInSe系の化合物が容易に形成される。
【0051】
このような反応において、他のカルコゲン元素を用いて反応させる場合においても同様な効果が得られた。より詳細には、他のCdSe系やCuInGaSe系、セレン化銅(CuSe)系、セレン化テルル(TeSe)系、セレン化亜鉛(ZnSe)系、セレン化ガリウム(GaSe)系、セレン化インジウム(InSe)系、セレン化コバルト(CoSe)系、セレン化サマリウム(SmSe)系、セレン化マンガン(MnSe)系、セレン化スズ(SnSe)系、セレン化セリウム(CeSe)系等においてもSe化反応において同様な効果が得られた。また、Fe、Co、Cu、Cr、Mn、Ni、Cd、Zn、Ti、V、La、Ce、Pr、Nd、Sm、Eu、Gd、Dy、Er、Yb、Al、Ga、Tl及びInSn及びPbにおいても、カルコゲン化反応において同様な効果が得られた。カルコゲン化反応時は反応による水の放出があり、還元性溶媒に窒素やアルゴンを用いてバブリングすることにより反応が容易に進行し、且つ目的のカルコゲン元素を含んだ化合物の単相になりやすい。ガス流量が大きいと、蒸気圧の高いカルコゲン元素がカルコゲン化反応の系外に運ばれる可能性があるので、適度な量がある。
【0052】
尚、金属化合物粉末と還元性溶媒、およびカルコゲン源の混合、添加の順は上記の例に限らない。すなわち、金属塩から金属水酸化物を生成する工程において、金属塩の溶解液として純水に、還元性溶媒を加えたものを用いてもよい。また、金属水酸化物から金属酸化物を生成(酸化)する工程の溶媒として、高沸点溶媒を用いてもよい。更に、金属水酸化物から金属酸化物を生成(酸化)する工程の溶媒として、高沸点溶媒を用い、更に、カルコゲン源を添加する際に還元性溶媒を追加してもよい。
【0053】
また、添加するカルコゲン源は、粉状でなくてもよく、例えばセレン化水素(H2Se)などのガスを、供給してもよい。上記の如く、金属化合物粉末と還元性溶媒を混合し加熱する際に、窒素などを用いてバブリングすると反応が進行しやすくなるので、このバブリングのガスと共にガス化したカルコゲン源を供給してもよい。
【0054】
尚、カルコゲン化反応に加圧装置を用いれば、常圧での沸点が200℃より低温の還元性溶媒であっても使用することができる。
【0055】
本実施形態におけるカルコゲン化反応開始時の金属化合物の液中の固形分濃度は薄いと分散しやすく凝集が少ないが、1反応当たりの製造量が少なくなり、逆に固形分濃度が濃いと得られるカルコゲン化合物粒子間の結合や凝集が起こりやすくなるので、カルコゲン化反応開始時の金属化合物の固形分濃度としては、0.1質量%〜50質量%範囲にあることが良い。更に好ましくは0.1質量%〜10質量%の範囲である。
【0056】
また、カルコゲン反応時に添加するカルコゲン源の量は、金属化合物の量に対する当量以上とすることができる。カルコゲン化反応温度が高い場合、カルコゲン化反応が完了する前にカルコゲン源が反応系外に蒸発してしまう可能性があるが、当量以上に添加することにより、前記蒸発によるロスを補うことが出来る。当量以上に添加した場合でも、余剰のカルコゲン源は、カルコゲン反応後、蒸発により混合溶媒から失われるので、適宜カルコゲン源の添加量、カルコゲン化反応の温度、時間等を調整すればよい。カルゴゲン源は、余剰に添加しすぎても不経済なので、当量の1倍〜1.3倍を添加するのが好ましい。
【0057】
本願では以下、過剰に添加、と記載した場合には、当量の1倍超、1.3倍以下の量を添加すること意味する。
【0058】
このように作製したカルコゲン化合物粉は、溶媒置換法により目的の溶媒に分散させることが出来る。この際、溶媒置換しやすいように粒子表面に界面活性剤を付着させ、この界面活性剤により目的の溶媒に分散しやすいようにすることが出来る。
【0059】
具体的には、界面活性剤としてアニオン系、カチオン系、ノニオン系等の種類には限定されず、溶媒中のpHを制御することにより粒子表面の電荷状態をプラスまたはマイナス側に帯電させて、帯電状態の極性と逆側に電荷を持つ界面活性剤を選択することにより、界面活性剤を適度に吸着させることが出来る。具体的にはpHを酸性側になるように制御した場合には、粒子表面はプラス側に帯電しやすく、この場合にはCOO−やSO3−等の官能基を持つ有機分子が吸着しやすくなる。このように溶媒中で解離しやすくアニオンになりやすいものとしてスルホン基、スルフィノ基等の官能基を持つものがあるが、解離しないで分子の極性に関与するR1R2SO2のようなものでも分散に効果がある。逆にアルカリ性側に溶媒のpHを変化させた場合には、−NH2や−NRH等のアミノ基を持つものが吸着しやすくなり、粒子表面の帯電状態に合わせて界面活性剤を選択することが望ましい。場合によっては、粒子の表面に−OHがあれば、界面活性剤のカルボシキル基とエステル結合させて、化学結合させることでも良い。もしくはSi、Al、Ti等のカップリング剤を不純物濃度が問題とならない場合には使用することが出来る。
【0060】
以下に図2から図35を参照して実施例を詳細に示す。
【実施例1】
【0061】
実施例1では、金属塩から金属水酸化物を経て金属酸化物の金属化合物粉末を生成し、還元性溶媒と混合させてカルコゲン源を添加し、加熱した。尚、実施例1では金属水酸化物から金属酸化物を生成(酸化)する工程の高い沸点の溶媒としてトリエチレングリコール(Triethyleneglycol:TEG)を用い、更に、カルコゲン源を添加する際に還元性溶媒を追加した。
【0062】
すなわち、Cu2Se粒子を合成するために、金属塩として硝酸銅0.05molを純水に溶かした溶液150mlを250mlのフラスコに入れた。続いてフラスコ内を300rpmで直径5cmの羽を回転させ攪拌した状態で、水酸化ナトリウムの10N溶液を滴下して中和しpHを8.5で終了させ、水酸化銅を生成した。この後、ヌッチェを用いてろ過した後、純水でケーキを再分散して、更にろ過を繰り返し、ろ液の導電率を10−1Sm−1以下にした。この時、水酸化銅が分散した液のpHが7に近づくと水酸化銅が溶解するため、pH7.5程度に留めた。この後、金属水酸化物のケーキを70℃で乾燥させた。洗浄が終了した水酸化銅の形態を透過型電子顕微鏡(Transmission Electron Microscope、以下TEM)で観察した結果、非常に細かい粒子が凝集したような形態であった。
【0063】
前記の乾燥させた水酸化銅5gを250mlの三口のフラスコに投入し、高い沸点溶媒としてトリエチレングリコール(TEG)75gに加えて、300rpmで直径5cmの羽を回転させ攪拌し、空気を100ml/minでバブリングした。この状態で図2に示す80℃から300℃の10種類の温度(酸化加熱温度)でそれぞれ、3時間加熱し、銅化合物を得た。
【0064】
図2は、10種類の各加熱温度(酸化加熱温度)で作製した前記銅化合物(試料1から試料10)の粒径(平均粒径:D50、以下同様)やおよび化合物の生成状態を確認した結果を示す。ここで、粒径は、レーザー散乱による粒度分布測定器を用いて測定し、状態は、X線回折のピーク位置および高さから、水酸化銅/酸化銅のおおよその比率について確認した。この結果、酸化加熱温度が120℃以上であれば、粒径が3μm以下で、酸化銅を主体とした粒子が得られることが分かった。粒径はレーザー散乱による粒度分布測定器を用いたために、一次粒子と、一次粒子が凝集している二次粒子を同時に測定している。
【0065】
図2において、レーザー散乱による粒度分布測定器を用いて測定した平均粒径(D50)が2μm以下の場合を○、2μmを超え3μm以下の場合を△、3μmを超える場合を×と評価した。
【0066】
図2より酸化加熱温度が高いほど平均粒径が小さくなり、分散が進行していることが分かる。前記銅化合物の一次粒径をTEM観察により確認した結果、酸化加熱温度150℃以上の場合、一次粒子の粒径は30nm程度であり、一次粒子は非常に細かいものが出来ており、それが凝集したものとなっていた。逆に、酸化加熱温度が110℃以下と低い場合、酸化銅の比率が低く、二次粒径が大きい。この結果から、二次粒径の小さい金属酸化物を主体とした金属化合物粒子を得るには、酸化加熱温度は高いほうが好ましく、金属が銅の場合、酸化加熱温度は120℃以上が好ましい。
【0067】
次に200℃の酸化加熱温度で処理した粒子を含む混合溶媒を遠心沈降法により固液分離した。遠心機(国産遠心機(株) H−103N)を用いて3000rpmで30分間、遠心分離により、固液分離し、固形分(金属化合物粉末)を3g取り出し、この金属化合物粉末に対して、カルコゲン源としてSe粉を添加した。カルコゲン源は、CuとSeの原子比(Cu:Se)が2:1.2になるようにSe粉を過剰に添加した。そしてTEG(還元性溶媒)50gに加え、混合溶媒とした。250mlの三口のフラスコに投入し、300rpmで直径5cmの羽を回転させ攪拌し、窒素を100ml/minでバブリングした。この状態で150℃〜300℃の図3に示した10種類の温度(反応温度)でそれぞれ、5時間加熱し、反応(カルコゲン化反応)させ、カルコゲン化合物粉を生成させた。洗浄乾燥はイソプロピルアルコールで洗浄及びろ過を繰り返してろ液の導電率を10−1Sm−1以下にし、60℃で真空乾燥させた。
【0068】
図3にその結果を示す。図3ではX線解析装置(X-Ray Diffractometer、以下XRD、株式会社リガク製 RAD−rX)による結晶解析を中心に行い、試料1から試料10についてカルコゲン化合物(Cu2Se)の生成状態を調べ、カルコゲン化合物の生成に必要なカルコゲン化反応の反応温度を調べた。この際、X線回折は50kV 100mAの条件で測定を行ない、目的とするカルコゲン化合物のピーク強度のうち最も高いピーク高さを、それ以外の物質によるピーク強度のうち最も高いピーク高さで割った値(以下、ピーク強度比)を求めた。ピーク強度比が、15以上あれば、目的とするカルコゲン化合物が高純度で得られた(目的物の単相が得られた)と判定し、図3において○で示した。ピーク強度比が5以上であれば、目的とするカルコゲン化合物の含有量が高い物質が得られたと判定し、図3において、△で示した。ピーク強度比が5未満の場合は、目的とするカルコゲン化合物の含有量が低いと判定し、×で示した。前記評価基準は、他の実施例でも同様である。この結果、高純度のカルコゲン化合物を生成させるには、カルコゲン化反応には少なくとも220℃以上の反応温度が必要なことが分かった。
【0069】
図4は、得られたカルコゲン化合物のX線回折結果を示すグラフであり、図4(A)が試料8の結果であり、図4(B)が試料4の結果である。縦軸がピーク強度[cps]であり、横軸が回折角(2θ)[°]である。
【0070】
図4(A)を参照して、試料8では、CuSeであることを示すピーク以外のピークは認められなかった。一方、図4(B)の如く、試料4では、試料8(図4(A))で認められたCuSeのピークはほとんど認められなかった。
【0071】
また、試料8、試料9、試料10で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は7nm〜12nmであった。DTEMは、TEM像を、日本電子株式会社製JEM−2010、にて10万倍で撮影し、全粒子のうち、100個の粒子の粒子径を測定し、その平均値とした。
【0072】
得られたカルコゲン化合物のいくつかについて、蛍光X線による組成分析をおこなった。蛍光X線分析は、装置として、日本電子株式会社製JSX−3201を使用して測定をおこなった。
【0073】
図5はその分析結果であり、試料8、9、10について分析した結果を構成元素の原子比で示した。これによると目的とする組成比(Cu:Se=1:1)に近いカルコゲン化合物が得られていることが、確認された。
(比較例)
実施例1の比較として、TEGに代えて還元性のないラウリン酸を加えた。すなわち、
カルコゲン化反応に使用する溶媒をTEGからラウリン酸に変更し、カルコゲン化反応時の加熱時間を10時間とした以外は、実施例1と同様の方法でカルコゲン化合物の合成を試みた。ただし、酸化加熱温度は、200℃とし、カルコゲン化反応温度は、220℃とした。
【0074】
図6には、実施例1と同様の評価をおこなった結果を示す。還元性溶媒をTEGからラウリン酸に変えて行った場合にはCu2Seが充分に生成出来なかった。
【実施例2】
【0075】
実施例1においてはCu2Se粒子を合成することを行ったが、実施例2では金属塩として硝酸銅および硝酸インジウムを用いて、CuInSe2の合成を行った。
【0076】
CuとInの原子比(Cu:In)が1:1の組成になるように硝酸銅0.01molと硝酸インジウム0.01molを純水に溶かした溶液150mlを250mlのフラスコに入れた。続いてフラスコ内を300rpmで直径5cmの羽を回転させ、攪拌した状態で、水酸化ナトリウムの10N溶液を滴下して中和しpHを8.5で終了させ、金属水酸化物の共沈物を生成した。この後、ヌッチェを用いてろ過した後、純水でケーキを再分散して、更にろ過を繰り返し、ろ液の導電率が10−1Sm−1以下にした。この時、金属水酸化物が分散した液のpHが7に近づくと水酸化銅が溶解するため、pH7.5程度に留めた。この後、金属水酸化物のケーキを70℃で乾燥させた。乾燥物2gを250mlの三口のフラスコに投入し、更に還元性溶媒であるトリエチレングリコール(TEG)75gに加えて、300rpmで直径5cmの羽を回転させ攪拌し、空気を100ml/minでバブリングした。この状態で80℃から300℃の図7に示した10種類の温度(酸化加熱温度)でそれぞれ、1時間加熱し、金属化合物粉末を作製し、実施例1と同様の評価をおこなった。
【0077】
図7は、10種類の各酸化加熱温度で作製した試料1から試料10の粒径および化合物の生成状態を確認した結果を示す。粒径の測定方法及び状態の確認方法は実施例1と同様である。
【0078】
酸化加熱温度が高いほど平均粒径が小さくなり、分散が進行していることが分かる。前記金属化合物の一次粒径をTEM観察により確認した結果、酸化加熱温度150℃以上の場合、一次粒子の粒径は20nm程度であり、一次粒子は非常に細かいものが出来ており、それが凝集したものとなっている。逆に、酸化加熱温度が110℃以下と低い場合、金属酸化物の比率が低く、二次粒径が大きい。この結果から、二次粒径の小さい金属酸化物を主体とした金属化合物粒子を得るには、酸化加熱温度は高いほうが好ましく、金属が銅とインジウムである場合、酸化加熱温度は120℃以上が好ましい。
【0079】
次に250℃の酸化加熱温度で処理した粒子を含む混合溶媒を遠心沈降法により固液分離した。遠心機(国産遠心機(株) H−103N)を用いて3000rpmで30分間、遠心分離により、固液分離し、固形分(金属化合物粉末)を2g取り出し、この金属化合物粉末に対して、CuとSeの原子比(Cu:Se)が1:2.2になるようにSe粉(カルコゲン源)を過剰に添加してTEG100gに加え、混合溶媒とした。250mlの三口のフラスコに投入し、300rpmで直径5cmの羽を回転させ攪拌し、窒素を100ml/minでバブリングした。この状態で150℃〜300℃の図8に示した10種類の反応温度でそれぞれ、5時間加熱し、反応(カルコゲン化反応)させ、カルコゲン化合物粉(CuInSe2)を生成させ、実施例1と同様の評価をおこなった。洗浄乾燥はエチルアルコールで洗浄及びろ過を繰り返してろ液の導電率を10−1Sm−1以下にし、80℃で大気中乾燥させた。
【0080】
図8は、実施例1と同様の方法で、図8に示す10種類の反応温度で生成した各試料についてX線解析装置を用いてカルコゲン化合物の生成状態を調べ、カルコゲン化反応の反応温度を調べた結果を示す。X線回折の評価結果より、CuInSe2が得られたことを確認した。高純度のカルコゲン化合物を生成させるには、カルコゲン化反応時に少なくとも220℃以上の反応温度が必要なことが分かった。
【0081】
また、試料8、試料9、試料10で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は7nm〜12nmであった。
【0082】
図9は、得られたカルコゲン化合物(試料8)のX線解析結果を示すグラフであり、縦軸がピーク強度[cps]であり、横軸が回折角(2θ)[°]である。この結果より、試料8では、CuInSe2であることを示すピーク以外のピークは認められなかった。
【0083】
更に、得られたカルコゲン化合物のいくつかについて、蛍光X線による組成分析をおこなった。
【0084】
図10は分析結果であり、試料8、9、10について分析した結果を構成元素の原子比で示した。これによると目的とする組成比(Cu:In:Se=1:1:2)に近いカルコゲン化合物が得られていることが、確認された。
【0085】
実施例2において、TEGに代わる還元性溶媒として、エチレングリコール、ジエチレングリコール、プロピレングリコール、トリメチレングリコール、ブタンジオール、ペンタンジオール、ヘキサンジオール、ヘプタンジオール、オクタンジオール、ノナンジオール、デカンジオール、ベンズピナコール、ヒドロベンゾイル、シクロペンダジオール、シクロヘキサンジオール、シクロヘキサンジオール、グリコール酸アミド、ジエチレングリコールジメチルエーテル、ナフチルアミン、ドデシルアミンを用いて、カルコゲン化反応温度を溶媒温度をそれぞれの沸点として、生成物の状態を調べた結果、実施例2の試料8と同様にDTEMが7nm〜12nmであるカルコゲン化合物が得られた。
【実施例3】
【0086】
実施例3では金属水酸化物を加熱して酸化する工程をおこなわなかった以外は、実施例2と同様の方法で、CuInSe2の合成を行った。
【0087】
CuとInの原子比(Cu:In)が1:1の組成になるように硝酸銅0.01molと硝酸インジウム0.01molを純水に溶かした溶液150mlを250mlのフラスコに入れた。続いてフラスコ内を300rpmで直径5cmの羽を回転させ、攪拌した状態で、水酸化ナトリウムの10N溶液を滴下して中和しpHを8.5で終了させ、金属水酸化物の共沈物を生成した。
【0088】
この後、ヌッチェを用いてろ過した後、純水でケーキを再分散して、更にろ過を繰り返し、ろ液の導電率が10−1Sm−1以下にした。この時、金属水酸化物が分散した液のpHが7に近づくと水酸化銅が溶解するため、pH7.5程度に留めた。この後、金属水酸化物のケーキ全量を250mlの三口のフラスコに投入し、更に還元性溶媒であるトリエチレングリコール(TEG)100gに加えて、CuとSeの原子比(Cu:Se)が1:2.2になるようにSe粉(カルコゲン源)を過剰に添加して混合溶媒とし、300rpmで直径5cmの羽を回転して攪拌し、窒素を200ml/minでバブリングした。この状態で昇温速度を1℃/minで150℃から300℃の図11に示した10種類の温度まで、それぞれ昇温し、その温度で5時間保持したカルコゲン化反応の条件で、混合溶媒の温度を変えて加熱した試料1から試料10を作製した。各反応温度で作製した試料1から試料10を実施例1と同様に評価した。
【0089】
図11は、この結果を示す。X線回折の評価結果より、CuInSe2が得られたことを確認した。高純度のカルコゲン化合物(CuInSe2)を生成させるには、カルコゲン化反応時に少なくとも220℃以上の反応温度が必要なことが分かった。また、試料8、9、10で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は6nm〜12nmであった。
【0090】
図12は実施例1と同様の方法によるカルコゲン化合物(試料8)のX線解析結果を示すグラフであり、図13は実施例1と同様の方法による蛍光X線の分析結果である。これらより、試料8では、CuInSe2であることを示すピーク以外のピークは認められず(図12)、試料8、9、10について、目的とする組成比(Cu:In:Se=1:1:2)に近いカルコゲン化合物が得られていることが、確認された(図13)。
【0091】
尚、図12に認められる20°〜25°の範囲にあるピークは、測定治具の接着材料に起因するものであることがわかっている。
【実施例4】
【0092】
実施例4では、金属化合物粉末から金属水酸化物を生成する際の溶媒に還元性溶媒を用いた。すなわち、CuとInの原子比(Cu:In)が1:1の組成になるように塩化銅0.01molと塩化インジウム0.01molを30mlの純水と100gのTEG(還元性溶媒)の混合溶液に溶かし、この溶液を250mlのフラスコに入れた。続いてフラスコ内を300rpmで直径5cmの羽を回転させ攪拌した状態で、濃度20パーセントの水酸化カリウム水溶液を滴下して中和しpHを8.5で終了させ、金属水酸化物の共沈物を生成した。この後、CuとSeの原子比(Cu:Se)が1:2.2になるようにSe粉(カルコゲン源)を過剰に添加して混合溶媒とし、窒素を200ml/minでバブリングした。この状態で120℃まで昇温し、2時間保持した後、昇温速度を1℃/minで150から300℃の図14に示した10種類の温度までそれぞれ昇温し、その温度で10時間保持したカルコゲン化反応の条件で、混合溶媒の温度を変えて加熱した試料を作製した。洗浄乾燥はメチルアルコールで洗浄及びろ過を繰り返してろ液の導電率を10−1Sm−1以下にし、60℃で窒素中乾燥させた。各反応温度で作製した試料1から試料10を実施例1と同様に評価した。
【0093】
図14は、この結果を示す。X線回折の評価結果より、CuInSe2が得られたことを確認した。高純度のカルコゲン化合物(CuInSe2)を生成させるには、カルコゲン化反応時に少なくとも220℃以上の反応温度が必要なことが分かった。また、試料8、試料9、試料10で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は7nm〜12nmであった。
【0094】
図15は実施例1と同様の方法によるカルコゲン化合物(試料8)のX線解析結果を示すグラフであり、図16は実施例1と同様の方法による蛍光X線の分析結果である。これらより、試料8では、CuInSe2であることを示すピーク以外のピークは認められず(図15)、試料8、9、10について、目的とする組成比(Cu:In:Se=1:1:2)に近いカルコゲン化合物が得られていることが、確認された(図16)。
【0095】
尚、図15に認められる20°〜25°の範囲にあるピークは、測定治具の接着材料に起因するものであることがわかっている。
【実施例5】
【0096】
実施例5では、金属水酸化物の生成の際に還元性溶媒を用い、ガス化したカルコゲン源を、還元性溶液のバブリングのガスと共に供給した。すなわち、CuとInの原子比(Cu:In)が1:1の組成になるように塩化銅0.01molと塩化インジウム0.01molを30mlの純水と100gのTEG(還元性溶媒)の混合溶液に溶かし、この溶液を250mlのフラスコに入れた。続いてフラスコ内を300rpmで直径5cmの羽を回転して攪拌した状態で、濃度20パーセントのアンモニア水を滴下して中和しpHを8.5で滴下を終了させ、金属水酸化物の共沈物を生成した。この後、水素化Seガス(カルコゲン源)と窒素の体積比が1:1の混合ガスを200ml/minで混合溶媒をバブリングして添加した。このバブリングをした状態で120℃まで昇温し、2時間保持した後、昇温速度を1℃/minで140から300℃の図8に示した10種類の温度まで、それぞれ昇温し、その温度で10時間保持したカルコゲン化反応の条件で、混合溶媒の温度を変えて加熱した試料を作製した。カルコゲン化反応後の洗浄乾燥は、実施例1と同様に実施した。各反応温度で作製した試料1から試料11を実施例1と同様に評価した。
【0097】
図17は、この結果を示す。X線回折の評価結果より、CuInSe2が得られたことを確認した。高純度のカルコゲン化合物(CuInSe2)を生成させるには、カルコゲン化反応時に少なくとも220℃以上の反応温度が必要なことが分かった。また、試料9、10、11で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は8nm〜14nmであった。
【0098】
図18は実施例1と同様の方法による蛍光X線の分析結果である。これらより試料9、10、11について、目的とする組成比(Cu:In:Se=1:1:2)に近いカルコゲン化合物が得られていることが、確認された。
【実施例6】
【0099】
実施例5と同様の方法で、CdSeを作製するために、塩化カドミウム0.01molを30mlの純水と100gのTEG(還元性溶媒)の混合溶液に溶かし、この溶液を250mlのフラスコに入れた。続いてフラスコ内を300rpmで直径5cmの羽を回転し攪拌した状態で、濃度20パーセントの水酸化ナトリウム水溶液を滴下して中和し、pHを8.5で滴下を終了させ、金属水酸化物を生成した。この後、水素化Seガス(カルコゲン源)と窒素の体積比が1:1の混合ガスを200ml/minで混合溶媒をバブリングして添加した。このバブリングした状態で120℃まで昇温し、2時間保持した後、昇温速度を1℃/minで80℃から260℃の図19に示した13種類の温度まで、それぞれ昇温し、その温度で10時間保持したカルコゲン化反応の条件で、混合溶媒の反応温度を変えて加熱した試料を作製した。
【0100】
この試料1から試料13を遠心沈降法により固液分離した。遠心機(国産遠心機株式会社製 H−103N)を用いて3000rpmで30分間、遠心分離により、固液分離し、固形分を純水に分散させる洗浄を5回繰返しおこい、再度固液分離して得られた固形分について、実施例1と同様に評価をおこなった。
【0101】
図19は、この結果を示す。X線回折の評価結果より、CdSeが得られたことを確認した。十分な量のカルコゲン化合物(CdSe)を生成させるには、カルコゲン化反応時に少なくとも200℃以上の反応温度が必要なことが分かった。また、試料11、試料12、試料13で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は6nm〜10nmであった。
【0102】
前記の中和反応において、水酸化ナトリウムをアンモニア水溶液に替えて、他の条件を同一にして行った結果も図19の結果と同様であった。カルコゲン化合物の洗浄を遠心沈降法及び純水洗浄から、ヌッチェによるろ過実施後、固形分を純水に分散させることを5回繰返し、再度ろ過すること以外は他の条件を同一にしておこなった結果も図19の結果と同様であった。
【0103】
図20は実施例1と同様の方法による試料11、12、13についての蛍光X線の分析結果である。これにより、試料11、12、13について、目的とする組成比(Cd:Se=1:1)に近いカルコゲン化合物が得られていることが、確認された。
【0104】
実施例6において、塩化カドミウムに変えてFe、Co、Cu、Cr、Mn、Ni、Zn、Ti、V、La、Ce、Pr、Nd、Sm、Eu、Gd、Dy、Er、Ybのそれぞれの塩化物を用いて、水酸化ナトリウムによる中和反応を行い、その他の条件を同一とした場合、同様なカルコゲン化合物粉が出来るかを調べた結果、各元素に対して混合溶媒の加熱温度(カルコゲン化反応の反応温度)が220℃以上で、カルコゲン化合物粉が得られた。
【0105】
また、図21は、実施例6において、セレン化水素の代わりに(C2H5)2Seを用いて同様な試験を行い、実施例1と同様に評価をおこなった結果を示す。この結果、カルコゲン化反応時の加熱温度を220℃以上にすることによりCdSeのDTEMが15nm〜20nmである粒子が作製できた。
【実施例7】
【0106】
実施例7では、金属水酸化物から金属酸化物を生成する際の溶媒にプロピレングリコール(Propyleneglycol:PEG)を用い、CuIn0.7Ga0.3Se2の合成を行った。Cu、InとGaが原子比(Cu:In:Ga)で1:0.7:0.3の組成になるように硝酸銅0.01molと硝酸インジウム0.007mol、硝酸ガリウム0.003molを純水200mlに溶かした溶液を250mlのフラスコに入れた。続いてフラスコ内を300rpmで直径5cmの羽を回転し攪拌した状態で、水酸化ナトリウムの1N溶液を滴下して中和しpHを8.5で滴下を終了させ、金属水酸化物の共沈物を生成した。この後、ヌッチェを用いてろ過してケーキを得た後、純水でケーキを再分散して、更にろ過を繰り返し、ろ液の導電率が10−2Sm−1以下にした。この時、pHが7に近づくと水酸化銅が溶解するため、pH7.5程度に留めた。この後、金属水酸化物のケーキを90℃で真空乾燥させた。この乾燥後の金属水酸化物5gを250mlの三口のフラスコに投入し、更に還元性溶媒であるプロピレングリコール(PEG)75gに加えて、300rpmで直径5cmの羽を回転し攪拌した。この後、窒素を100ml/minでバブリングした。この状態で80℃から300℃の図22に示した10種類の酸化加熱温度で、それぞれ1時間、温度を変えて加熱し金属化合物の試料を作製し、洗浄乾燥はイソプロピルアルコールで洗浄及びろ過を繰り返してろ液の導電率を10−1Sm−1以下にし、80℃で窒素中乾燥させた。実施例1と同様の方法で評価した。
【0107】
図22は、各酸化加熱温度で作製した試料1から試料10の評価結果を示す。酸化加熱温度が高いほど平均粒径が小さくなり、分散が進行していることが分かる。前記金属化合物の一次粒径をTEM観察により確認した結果、酸化加熱温度150℃以上の場合、一次粒子の粒径は10nm程度であり、一次粒子は非常に細かいものが出来ており、それが凝集したものとなっている。逆に、酸化加熱温度が110℃以下と低い場合、金属酸化物の比率が低く、二次粒径が大きい。この結果から、二次粒径の小さい金属酸化物を主体とした金属化合物粒子を得るには、酸化加熱温度は高いほうが好ましく、金属が銅とガリウムとインジウムである場合、酸化加熱温度は120℃以上が好ましい
次に250℃の酸化加熱温度で処理を行った金属化合物を含んだ溶媒に対して、CuとSeの原子比(Cu:Se)が1:2.2になるようにSe粉(カルコゲン源)を過剰に添加し、混合溶媒とした。引き続き250mlの三口のフラスコの中の溶媒を300rpmで直径5cmの羽を回転させ攪拌し、窒素を100ml/minでバブリングした。この状態で150℃〜340℃の間の図23に示した11種類の反応温度で10時間、混合溶媒を加熱して、カルコゲン化合物の生成を試みた。洗浄乾燥はエチルアルコールで洗浄及びろ過を繰り返してろ液の導電率を10−1Sm−1以下にし、室温で大気中乾燥させた。得られた試料1から試料10のカルコゲン化合物を実施例1と同様の方法で評価した。
【0108】
図23は、この結果を示す。X線回折の評価結果より、CuIn0.7Ga0.3Se2が得られたことを確認した。十分な量のカルコゲン化合物(CuIn0.7Ga0.3Se2)を生成させるには、カルコゲン化反応時に少なくとも220℃以上の反応温度が必要なことが分かった。また、試料8、試料9、試料10で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は10nm〜15nmであった。
【0109】
図24は実施例1と同様の方法によるカルコゲン化合物(試料8)のX線解析結果を示すグラフであり、図25は実施例1と同様の方法による蛍光X線の分析結果である。これらより、試料8では、CuIn0.7Ga0.3Se2であることを示すピーク以外のピークは認められず(図24)、試料8、9、10について、目的とする組成比(Cu:In:Ga:Se=1:0.7:0.3:2)に近いカルコゲン化合物が得られていることが、確認された(図25)。
【0110】
尚、図24に認められる20°〜25°の範囲にあるピークは、測定治具の接着材料に起因するものであることがわかっている。
【実施例8】
【0111】
実施例8では、添加するSe粉(カルコゲン源)の量をCuとSeの原子比(Cu:Se)で1:2とした以外は、実施例7と同様の方法により試験をおこない、実施例1と同様に評価した。
【0112】
図26は、各酸化加熱温度で作製した試料1から試料10の評価結果を示す。実施例7と同様の結果が得られた。
【0113】
図27は、試料1から試料10についての実施例1と同様のX線回折の評価方法によるカルコゲン化反応により得られた生成物の評価結果を示す。X線回折の評価結果より、CuIn0.7Ga0.3Se2が得られたことを確認した。十分な量のカルコゲン化合物(CuIn0.7Ga0.3Se2)を生成させるには、カルコゲン化反応時に少なくとも220℃以上の反応温度が必要なことが分かった。また、試料8、試料9、試料10で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は7nm〜12nmであった。
【0114】
図28は実施例1と同様の方法による蛍光X線の分析結果である。これらより、試料8、9、10について、目的とする組成比(Cu:In:Ga:Se=1:0.7:0.3:2)に近いカルコゲン化合物が得られていることが、確認された。
【実施例9】
【0115】
実施例8のCuIn0.7Ga0.3Se2の合成において、カルコゲン源としてSe粉末の代わりにSeS(添加するSeS粉(カルコゲン源)の量をCuに対する原子比は、Cu:Se:Sで1:1:1)を用いて試験を行った。他の条件は同一とした。
【0116】
図29は、試料1から試料10についての実施例1と同様のX線回折の評価方法による、カルコゲン化反応により得られた生成物の評価結果を示す。X線回折の評価結果より、CuIn0.7Ga0.3SeSが得られたことを確認した。十分な量のカルコゲン化合物(CuIn0.7Ga0.3SeS)を生成させるには、カルコゲン化反応時に少なくとも220℃以上の反応温度が必要なことが分かった。また、試料8、試料9、試料10で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は12nm〜20nmであった。
【0117】
図30は実施例1と同様の方法による試料9、10、11についての蛍光X線の分析結果である。これらより、試料9、10、11について、目的とする組成比(Cu:In:Ga:S:Se=1:0.7:0.3:1:1)に近いカルコゲン化合物が得られていることが、確認された。
【実施例10】
【0118】
実施例10では金属塩から金属水酸化物を生成する際に還元性溶媒を用い、CuIn0.7Ga0.3Se2の合成を行った。CuとIn、Gaの原子比(Cu:In:Ga)が1:0.7:0.3の組成になるように塩化銅0.01molと塩化インジウム0.007mol、塩化ガリウム0.003molを純水50mlとTEG(還元性溶媒)100gを混合した溶液に溶かし、その溶液を250mlのフラスコに入れた。続いてフラスコ内を300rpmで直径5cmの羽を回転し攪拌した状態で、水酸化ナトリウムの1N溶液を滴下して中和し、pHを8.5で滴下を終了させ、金属水酸化物の共沈物を生成した。次に300rpmで直径5cmの羽を回転し攪拌したまま、窒素を100ml/minでバブリングし、CuとSeの原子比(Cu:Se)が1:2.5になるようにSe粉(カルコゲン源)を過剰に添加し、混合溶媒とした。この状態で150℃〜300℃の図31に示した10種類の反応温度で10時間、混合溶媒を加熱して、カルコゲン化合物の生成を試みた。この後、反応性生物を含む混合溶媒をヌッチェを用いてろ過した後、純水でケーキを再分散して、更に前記のろ過を繰り返し、ろ液の導電率が10−1Sm−1以下にして、得られたケーキを真空乾燥して、カルコゲン化合物粉(試料1から試料10)を得た。この粉を実施例1と同様の方法で評価した。
【0119】
図31は、上記で得た試料1から試料10(カルコゲン化反応により得られた生成物)を実施例1と同様のX線回折で評価した評価結果を示す。X線回折の評価結果より、CuIn0.7Ga0.3Se2が得られたことを確認した。十分な量のカルコゲン化合物(CuIn0.7Ga0.3Se2)を生成させるには、カルコゲン化反応時に少なくとも220℃以上の反応温度が必要なことが分かった。また、試料8、9、10で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は7nm〜13nmであった。
【0120】
図32は実施例1と同様の方法による試料9、試料10、試料11についての蛍光X線の分析結果である。これにより、試料9、試料10、試料11について、目的とする組成比(Cu:In:Ga:Se=1:0.7:0.3:2)に近いカルコゲン化合物が得られていることが、確認された。
【実施例11】
【0121】
CuとInの原子比(Cu:In)が1:1の組成になるように硝酸銅0.01molと硝酸インジウム0.01molを純水200mlに溶かした溶液を250mlのフラスコに入れた。続いてフラスコ内を300rpmで直径5cmの羽を回転し攪拌した状態で、溶液温度20℃のシュウ酸の飽和溶液を滴下して沈殿させ、シュウ酸塩の共沈物を生成した。前記シュウ酸溶液の滴下は、液のpHが8.5になるまで続けた。この後、この共沈物と溶液をヌッチェを用いてろ過しシュウ酸塩のケーキを得た。この後、シュウ酸塩のケーキを50℃で真空乾燥させた。この乾燥したシュウ酸塩5gを250mlの三口のフラスコに投入し、更に還元性溶媒であるプロピレングリコール(PEG)75gを加えて、300rpmで直径5cmの羽を回転し攪拌し、窒素で100ml/minでバブリングし、CuとSeの原子比(Cu:Se)が1:2.1になるようにSe粉(カルコゲン源)を過剰に添加し、混合溶媒とした。この状態で150℃〜300℃の図33に示した10種類の反応温度で10時間混合溶媒を加熱して、カルコゲン化合物の生成を試みた。この後、反応性生物を含む混合溶媒をヌッチェを用いてろ過しケーキを得た後、純水でケーキを再分散して、更にろ過を繰り返し、ろ液の導電率が10−2Sm−1以下にして粉を真空乾燥した。得られたカルコゲン化合物粉(試料1から試料10)を実施例1と同様の方法で評価した。
【0122】
図33は、この結果を示す。X線回折の評価結果より、CuIn0.5Ga0.5Se2が得られたことを確認した。十分な量のカルコゲン化合物(CuIn0.5Ga0.5Se2)を生成させるには、カルコゲン化反応時に少なくとも220℃以上の反応温度が必要なことが分かった。また、試料8、試料9、試料10で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は7nm〜13nmであった。
【0123】
図34は実施例1と同様の方法によるカルコゲン化合物(試料8)のX線解析結果を示すグラフであり、図35は実施例1と同様の方法による蛍光X線の分析結果である。これらより、試料8では、CuIn0.5Ga0.5Se2であることを示すピーク以外のピークは認められず(図34)、試料9、10、11について、目的とする組成比(Cu:In:Ga:Se=1:0.5:0.5:2)に近いカルコゲン化合物が得られていることが、確認された(図35)。
【図面の簡単な説明】
【0124】
【図1】本発明の実施形態を説明するフロー図である。
【図2】本発明の実施例1による試料の粒径および状態を評価した結果である。
【図3】本発明の実施例1によるカルコゲン化合物の生成状態を評価した結果である。
【図4】本発明の実施例1によるカルコゲン化合物のX線回折結果を示すグラフである。
【図5】本発明の実施例1によるカルコゲン化合物の蛍光X線による分析の結果である。
【図6】本発明の実施例1の比較例についてカルコゲン化合物の生成状態を評価した結果である。
【図7】本発明の実施例2による試料の粒径および状態を評価した結果である。
【図8】本発明の実施例2によるカルコゲン化合物の生成状態を評価した結果である。
【図9】本発明の実施例2によるカルコゲン化合物のX線回折結果を示すグラフである。
【図10】本発明の実施例2によるカルコゲン化合物の蛍光X線による分析の結果である。
【図11】本発明の実施例3によるカルコゲン化合物の生成状態を評価した結果である。
【図12】本発明の実施例3によるカルコゲン化合物のX線回折結果を示すグラフである。
【図13】本発明の実施例3によるカルコゲン化合物の蛍光X線による分析の結果である。
【図14】本発明の実施例4によるカルコゲン化合物の生成状態を評価した結果である。
【図15】本発明の実施例4によるカルコゲン化合物のX線回折結果を示すグラフである。
【図16】本発明の実施例4によるカルコゲン化合物の蛍光X線による分析の結果である。
【図17】本発明の実施例5によるカルコゲン化合物の生成状態を評価した結果である。
【図18】本発明の実施例5によるカルコゲン化合物の蛍光X線による分析の結果である。
【図19】本発明の実施例6によるカルコゲン化合物の生成状態を評価した結果である。
【図20】本発明の実施例6によるカルコゲン化合物の蛍光X線による分析の結果である。
【図21】本発明の実施例6によるカルコゲン化合物の生成状態を評価した結果である。
【図22】本発明の実施例7による試料の粒径および状態を評価した結果である。
【図23】本発明の実施例7によるカルコゲン化合物の生成状態を評価した結果である。
【図24】本発明の実施例7によるカルコゲン化合物のX線回折結果を示すグラフである。
【図25】本発明の実施例7によるカルコゲン化合物の蛍光X線による分析の結果である。
【図26】本発明の実施例8による試料の粒径および状態を評価した結果である。
【図27】本発明の実施例8によるカルコゲン化合物の生成状態を評価した結果である。
【図28】本発明の実施例8によるカルコゲン化合物の蛍光X線による分析の結果である。
【図29】本発明の実施例9によるカルコゲン化合物の生成状態を評価した結果である。
【図30】本発明の実施例9によるカルコゲン化合物の蛍光X線による分析の結果である。
【図31】本発明の実施例10によるカルコゲン化合物の生成状態を評価した結果である。
【図32】本発明の実施例10によるカルコゲン化合物の蛍光X線による分析の結果である。
【図33】本発明の実施例11によるカルコゲン化合物の生成状態を評価した結果である。
【図34】本発明の実施例11によるカルコゲン化合物のX線回折結果を示すグラフである。
【図35】本発明の実施例11によるカルコゲン化合物の蛍光X線による分析の結果である。
【技術分野】
【0001】
本発明は、薄膜太陽電池の光吸収層、蛍光体、ペルチェ素子用の電極膜の形成等に用いられるカルコゲン系元素を含んだカルコゲン化合物粉の製造方法に関し、特に、安価で安全にカルコゲン化合物粉を生成するカルコゲン化合物粉の製造方法に関する。
【背景技術】
【0002】
金属化合物のナノサイズ粉として、例えば半導体ナノ結晶、特に、テルル化カドミウム(CdTe)、セレン化カドミウム(CdSe)、及び硫化カドミウム(CdS)、銅インジウムガリウムセレン(CuInGaSe)、銅インジウムセレン(CuInSe)等は、径のサイズ効果による光吸収スペクトルの制御や発光の制御が可能な他に、化合物のバンドギャップの制御が固溶体の形成により可能であるために太陽電池への応用にも近年、研究開発が活発に行われている。
【0003】
カルコゲン化合物のナノ粒子であるCdSeナノ結晶の合成方法の一例としてジメチルカドミウム(Cd(CH3)2)をカドミウム前駆物質として使用するCdSeナノ結晶の合成は、Murrayらの最初の報告(非特許文献1参照。)以降、開発されてきた。なお、本願で、カルコゲン化合物とは、金属元素の1種以上とSe、S、Teから選択される元素の1種以上を構成元素とする化合物を示す。Barbera−Guillemらは、Murrayらの方法を使用したナノ結晶の生成のための連続流動法を開示している(特許文献1参照。)。
【0004】
この合成方法は、非常に毒性が高く、発火性であり、高価であり、そして室温で不安定であるジメチルカドミウムなどの有機金属化合物を前駆物質として使用する必要がある。Cd(CH3)2を前駆物質として使用するナノ結晶合成に必要な標準的注入温度(340から360℃)では、発火性を有するCd(CH3)2が、大量に発生するので、安全上の対策にコストがかかる等の課題がある。これらの理由から、Cd(CH3)2が関連する合成方法は実験及び条件が非常に制限され、そのため大規模合成には適していない。同様に他のカルコゲン元素を含んだ半導体ナノ結晶を作製する場合にも、アルキル金属化合物や金属アルコキシドを用いた場合も蒸気圧は高く、爆発の危険性もあり、またガスが毒性を持つので安全上の対策にコストがかかる課題がある。
【0005】
そのため、安価で非発火性の材料として金属酸化物または金属塩を前駆物質として使用し、金属酸化物または金属塩を配位子及び配位溶媒と混合させて溶解性金属錯体を生成させ、元素カルコゲン前駆物質(セレン(Se)、テルル(Te)、または硫黄(S)など)を加えて、ナノ結晶が生成される方法も知られている(特許文献2参照。)。このような金属錯体の陽イオン種としての配位子は、長鎖脂肪アミンまたは脂肪酸、ホスホン酸、及びホスフィンオキシドが挙げられる。これらの群に含まれる具体的な種類としては、ドデシルアミン(DA)、ヘキサデシルアミン(HA)、オクタデシルアミン(OA)、ステアリン酸(SA)、ラウリン酸(LA)、ヘキシルホスホン酸(HPA)、テトラデシルホスホン酸(TDPA)、及びトリオクチルホスフィンオキシド(TOPO)が挙げられる。
【0006】
この際、配位子の融点が高すぎる場合、その配位子は高温で固体のままであるので、有用な配位溶媒としては機能しない。この場合、このような配位子は別の溶媒と併用する必要がある。このような配位子を持つ金属錯体を形成するために、加熱させることにより金属酸化物または塩は、安定な溶解性金属錯体に変化させている。そこで、金属錯体は前駆物質種を配位子単独と混合することによって生成可能であり、また溶媒が使用される場合には、溶解性錯体は前駆物質種を配位子/溶媒分子と混合することによって生成可能である。
【0007】
例えば、金属元素がカドミウムであるカルコゲン化合物粉を合成する場合では、酸化カドミウム(CdO)または酢酸カドミウム(Cd(Ac)2)に、ホスホン酸またはカルボン酸などの配位子が加えられる場合、得られるカドミウム錯体は、それぞれホスホン酸カドミウムまたはカルボン酸カドミウムのいずれかである。最後に、カルコゲン元素の前駆物質(Se、Te、またはSなど)が、溶解したカドミウム錯体に加えられて、制御可能な速度でナノ結晶(カルコゲン化合物粉)の生成が終了される。例えば、CdOがカドミウムの原料物質として使用される場合、カルコゲン元素の前駆物質を変えることによってCdSe、CdTe、CdS、またはその他の種類の金属元素がカドミウムであるカルコゲン化合物粉(ナノ結晶)を合成することが可能である。
【特許文献1】米国特許第6,179,912号明細書
【特許文献2】特表2004−510678号公報
【非特許文献1】Journal of the American Chemical Society(1993)、115、8706−8715
【発明の開示】
【発明が解決しようとする課題】
【0008】
ところが、このような配位子を用いた合成方法では、金属元素の種類により配位子を変えて金属錯体を形成する必要があり、合成するカルコゲン化合物が2セレン化銅ガリウム(CuGaSe2)や2セレン化銅インジウム(CuInSe2)のような三元系やCuIn1−xGaxSe2のような四元系の場合には目的とするカルコゲン化合物を得ることが困難であった。また二元系のセレン化第一銅(Cu2Se)のような化合物の場合には配位子の選定が難しい場合もある。更に配位子を含んだ排水の処理に問題が生じていた。例えばヘキシルホスホン酸(HPA)、テトラデシルホスホン酸(TDPA)、及びトリオクチルホスフィンオキシド(TOPO)はいずれにしても毒性を持つため、排水中に含まれるこれらの化合物を除去する排水処理が必要で、排水処理コストが高い課題があった。また、三元系以上のカルコゲン化合物を得ることが困難であった。
【0009】
ジメチルカドミウムなどの有機金属化合物を前駆物質として使用する製法の場合には、前記有機金属化合物が、高価であること、更に、有毒性、発火性を有し、安全対策コストがかさむ課題があった。
【課題を解決するための手段】
【0010】
本発明は、係る課題に鑑みてなされたものであり、溶媒に金属水酸化物または金属酸化物の金属化合物粉末と、硫黄、セレン、テルルから選択される単体、または前記元素群から選択される1種以上を含む化合物を添加して混合溶媒を生成する工程と、該混合溶媒を200℃〜500℃の温度で加熱する工程と、を具備することにより解決するものである。
【0011】
また、前記溶媒が、還元性溶媒であることを特徴とするものである。
【0012】
また、前記混合溶媒は、220℃〜400℃で加熱することを特徴とするものである。
【0013】
また、前記金属化合物粉末が、遷移金属元素、III族金属元素、及びVI族金属元素からなる群より選択される化合物を含むことを特徴とするものである。
【0014】
また、前記遷移金属元素が、Fe、Co、Cu、Cr、Mn、Ni、Cd、Zn、Ti、V、La、Ce、Pr、Nd、Sm、Eu、Gd、Dy、Er、Ybの中、1種以上を含むことを特徴とするものである。
【0015】
また、前記III族金属元素が、Al、Ga、Tl及びInを含むことを特徴とするものである。
【0016】
また、前記VI族金属元素がSn及びPbを含むことを特徴とするものである。
【0017】
また、前記還元性溶媒は、沸点が220℃から400℃の範囲のアルコール系溶媒であることを特徴とするものである。
【0018】
また、前記金属酸化物は、70℃〜300℃の範囲内で前記金属水酸化物を加熱する水酸化物の脱水反応によって得られることを特徴とするものである。
【0019】
また、前記金属化合物粉末は、金属塩を溶媒に溶解し、アルカリを添加して生成することを特徴とするものである。
【0020】
更に、前記金属塩が、金属ハロゲン化物、金属カルボン酸塩、金属炭酸塩、金属硝酸塩、金属硫酸塩のいずれかの群より選択されることを特徴とするものである。
【発明の効果】
【0021】
本発明によれば、安価な金属塩を原料として、金属の1種以上と硫黄、セレン、テルルから選択される1種以上の化合物(カルコゲン化合物)のナノ粒子粉(ナノ結晶粉)を生成することができる。原料として有機金属を使用せず、また金属錯体を中間体としないため、製造コストが安価で、且つ排水中に有機系の毒性物質が排出しない安全な方法で、高い結晶性を有し、TEM粒子径が40nm以下のナノ粒子であるカルコゲン化合物粉を製造する方法を提供できる。
【発明を実施するための最良の形態】
【0022】
以下、本実施形態を、図1から図35を参照して詳細に説明する。図1は本実施形態のカルコゲン化合物粉の製造方法を示すフロー図である。
【0023】
本実施形態のカルコゲン化合物粉の製造方法は、金属水酸化物または金属酸化物の1種以上からなる金属化合物粉末と還元性溶媒とを混合し、硫黄(S)、セレン(Se)、テルル(Te)から選択される1種以上からなる(単体または)化合物を添加して混合溶媒を生成する工程と、前記混合溶媒を200℃〜500℃の温度で加熱する工程と、を有する。この方法により、平均粒径が40nm以下であるカルコゲン化合物粉を得ることができる。
【0024】
原料となる金属化合物粉末は、金属水酸化物または金属酸化物の粉末を使用できる。金属水酸化物は、金属塩を溶媒に溶解し、アルカリを添加して生成できる。また、金属酸化物の粉末は、金属水酸化物を酸化(脱水)して得ることができる。
【0025】
以下、金属塩を出発原料とした場合を例に説明するが、金属水酸化物または金属酸化物の金属化合物粉末を出発原料とすることもできる。
【0026】
すなわち本実施形態は、金属塩を溶媒に溶解し、アルカリを添加して金属の水酸化物を沈殿させた後に、デカンテーションや遠心沈降、ろ過等を行い、必要に応じて水洗し、乾燥して金属水酸化物を得る。または金属水酸化物を酸化(脱水)して金属酸化物の金属化合物粉末を得たもの、もしくは出発原料として水酸化物や酸化物の金属化合物粉末を還元性溶媒に混合し、還元性溶媒にカルコゲン源を添加した状態で加熱し、所定のカルコゲン化合物を生成するものである。使用する金属化合物およびカルコゲン源の種類を選択することにより、多様なカルコゲン化合物粉を得ることができる。
【0027】
本実施形態の金属塩は、金属ハロゲン化物、金属カルボン酸塩、金属炭酸塩、金属硝酸塩、金属硫酸塩のいずれかの群より選択される。
【0028】
具体的には、出発原料となる金属塩として、例えばハロゲン化金属塩としては、塩化第二銅(CuCl2)、塩化カドミウム(CdCl3)、塩化インジウム(InCl3)、臭化銅(CuBr2)、ヨウ化銅(CuI2)等の金属塩化物、金属臭化物、金属ヨウ化物、金属フッ化物が代表的に挙げられ、金属の強酸塩として、硫酸銅(CuSO4)、硝酸第二銅(Cu(NO3)2)、硫酸インジウム(In2(SO4)3)のような硫酸塩、硝酸塩が挙げられる。その他には、酢酸塩、蟻酸塩、シュウ酸塩等のカルボン酸を用いた酢酸銅(Cu(CH3COO)2)、蟻酸第二銅(Cu(HCOO)2)、シュウ酸銅(Cu(COO)2)等の金属塩がある。これらの塩類に結晶水を含んだものでも良い。
【0029】
金属塩に含まれる金属元素の種類としては、3d、4f系の遷移金属元素またはIII族金属元素またはVI族金属元素の中から少なくとも一種以上含んだものである。3d、4f系の遷移金属元素としては、鉄(Fe)、コバルト(Co)、銅(Cu)、クロム(Cr)、マンガン(Mn)、ニッケル(Ni)、カドミウム(Cd)、亜鉛(Zn)、チタン(Ti)、バナジウム(V)、ランタン(La)、セリウム(Ce)、プラセオジム(Pr)、ネオジム(Nd)、サマリウム(Sm)、ユウロピウム(Eu)、ガドリニウム(Gd)、ジスプロシウム(Dy)、エルビウム(Er)、イッテルビウム(Yb)が挙げられる。またIII族金属元素としては、アルミニウム(Al)、ガリウム(Ga)、タリウム(Tl)及びインジウム(In)が挙げられる。またVI族金属元素としては、スズ(Sn)及び鉛(Pb)が挙げられる。
【0030】
これらの金属塩を水やアルコール等の極性溶媒に溶解させる。その後、アルカリを添加することにより中和して金属水酸化物を生成する。詳細には、アンモニア水溶液、水酸化ナトリウム、水酸化カリウム、またはアミノ基を持つアルカリ性有機化合物によって金属水酸化物として沈殿させる。この際、得ようとするカルコゲン化合物が複数の金属元素を含有する化合物の場合、金属塩の構成として、前記カルコゲン化合物と同じ金属元素比を有する金属水酸化物の沈殿を得るために、少なくとも二種以上の金属塩を用いて金属水酸化物の生成をおこなう。具体的に例えば、CuInSe2を作製する場合には、銅(Cu)とインジウム(In)の原子比が1対1になるように、銅の塩とインジウムの塩を原料として用い、金属水酸化物を生成する。このため、例えば硝酸塩のCu(NO3)2と三硝酸インジウム(In(NO3)3)を水酸化ナトリウム水溶液により、CuとInの水酸化物として生成させる。また、銅の水酸化物とインジウムの水酸化物を別々に生成させ、それらを使用することも、可能である。
【0031】
これらの金属水酸化物を含むスラリーを遠心脱水機、高速遠心沈降管、またはフィルタープレス、ヌッチェ等により反応副産物を含んだ溶媒を一度除去して、水やエタノール等の極性溶媒に再分散して、更に溶媒を除去するという操作を繰り返し、洗浄を行う。洗浄は、残液(ろ液)の導電率が10−1Sm以下になるまで繰り返すことが望ましい。特にアルカリ金属は残留すると揮発しないために不純物元素として残ることになるので問題となる。
【0032】
洗浄を行うことにより反応不純物を除去できる。本実施形態の中和におけるpHの終了点はアルカリ性であることが好ましい。そのpHは特に限定されるものではないが、例えば10以上でも良い。また、水洗によるろ液の導電率が低いほど良いが、pHが中性に近付くと金属水酸化物自体が溶出するために組成が変わるので、前記ろ液のpHは、7.5以上に維持することが望ましい。
【0033】
その後金属水酸化物を例えば70℃から90℃で乾燥させ、金属水酸化物の粉末(金属化合物粉末)を得る。この際、乾燥温度は、特に限定されず、真空乾燥にすることにより乾燥温度を下げることが出来る。また乾燥温度は200℃以上であっても良い。
【0034】
また、上記の金属水酸化物を加熱し、酸化して金属酸化物の粉末(金属化合物粉末)を生成してもよい。
【0035】
具体的には、洗浄によってろ液の導電率を10−1Sm以下にした、金属水酸化物を含むスラリーの含水率を50パーセント以下に調整し、このスラリー(またはケーキ)を再度、溶媒に分散させる。
【0036】
金属水酸化物を含む溶媒を空気、窒素、アルゴン等のガスを導入して水を外部に蒸発させ(バブリングし)、溶媒の温度を70℃〜300℃の範囲内で加熱することで、溶媒中の金属水酸化物は、金属酸化物、もしくは金属酸化物と金属水酸化物の混合物となり、凝集している金属水酸化物が解離して、溶媒中に一次粒子のサイズとして1nm〜200nmの粉が未焼結の状態で存在する状態とすることができる。
【0037】
この際、溶媒分子自体を前記の粒子に化学結合、もしくは物理吸着の形態で包むことにより溶媒中に分散させても良い。もしくは溶媒に界面活性剤を添加して溶媒に対して前記の粒子を分散させても良い。このように溶媒に分散した粒子においては、粒子に表面処理や粒子と他の反応処理において、粒子間の凝集や焼結を防ぐことが出来るので望ましい。
【0038】
この酸化時の反応は溶媒中に水を放出するので、上記の如くバブリングでも良いが、オートクレーブ中で高温にして酸化反応を促進させても良い。
【0039】
また、ここでは金属水酸化物を洗浄した後に金属酸化物を生成した場合を例に示したが、金属水酸化物を生成してから同一溶媒中にて加熱して金属酸化物を生成した後に、洗浄操作を行っても良い。また、金属水酸化物生成とカルコゲン化反応を同一溶媒中でおこなう場合、カルコゲン化反応の後で洗浄操作を行っても良い。いずれの段階においても洗浄を行うことにより反応不純物を適正に除去できる。
【0040】
次に、金属水酸化物あるいは金属酸化物の金属化合物粉末と還元性溶媒を混合し、S、Se、Teから選択される単体、または前記元素群から選択される1種以上を含む化合物を添加して混合溶媒を生成し、これを加熱する。
【0041】
ここで、還元性溶媒とは、金属水酸化物あるいは金属酸化物の金属化合物粉末(以下金属化合物粉末)と、S、Se、Teから選択される単体、または前記元素群から選択される1種以上を含む化合物を溶媒中に共存させ、加熱した際、前記金属化合物から酸素原子を奪い、結果としてカルコゲン化合物を生成する能力を有する溶媒を指す。還元性溶媒としては、その沸点が、200℃以上であるものが好適であり、220℃以上であるものが特に好適である。後述するように、カルコゲン化合物を得るためには、還元性溶媒を200℃以上、好ましくは220℃以上に加熱する必要があり、還元性溶媒の沸点が前記温度範囲であれば、常圧下でカルコゲン化合物を得る反応を行なえる。反応を加圧下で行なう場合には、沸点が200℃未満の溶媒も使用できる。
【0042】
還元性溶媒の一例として、沸点が100℃から400℃の範囲のアルコール系溶媒が挙げられる。カルコゲン化反応を常圧でおこなうためには、沸点は200℃以上であることが好ましく、220℃以上であることが更に好ましく、カルコゲン化合物の収率も考慮すると250℃以上が一層好ましい。
【0043】
具体的には、還元性溶媒のとして、一価アルコール、または二価アルコールのグリコールがある。一価アルコールとしては、例えば、ブチルアルコール、アミルアルコール、ヘキシルアルコール、ヘプチルアルコール、オクチルアルコール、デシルアルコール、ノニルアルコール、シクロペンタノール、ベンジルアルコール、シンナミルアルコール等がある。グリコール系の溶媒としては、グリセリン、エチレングリコール、ジエチレングリコール、トリエチレングリコール、プロピレングリコール、トリメチレングリコール、ブタンジオール、ペンタンジオール、ヘキサンジオール、ヘプタンジオール、オクタンジオール、ノナンジオール、デカンジオール、ベンズピナコール、ヒドロベンゾイル、シクロペンダジオール、シクロヘキサンジオール、シクロヘキサンジオール、グリコール酸アミド、ジエチレングリコールジメチルエーテル、ジエチレングリコールジエチルエーテル、プロピレングリコールモノエチルエーテル、ジエチレングリコールジブチルエーテル、酢酸ジエチレングリコールモノブチルエーテル、プロピレングリコールモノメチルエーテルアセタート等があり、分子量の大きいものではポリエチレングリコール、ポリエチレングリコールエステル、ポリエチレングリコールエーテルがある。特にグリコール、ジオール系のものは水酸基を二つ持つものであるため、極性を持ち、粉の分散性に寄与するので望ましい。このような溶媒としては、例えば−CH2−CHOH、または−CHR−CHOH、−CR1R2−CHOH、=CHCHOH、=CRCHOH (R、R1、R2:側鎖)を分子中に含まれるもので、且つ溶媒の沸点は少なくとも100℃以上のものである。更にはアルデヒド基−CHOを持つ有機化合物も同様な効果を持ち、例えば、脂肪族飽和アルデヒドとして、ラウリンアルデヒド、トリデシルアルデヒド、ミリスチンアルデヒド、カプロンアルデヒド、ヘプトアルデヒド、ペンタデシルアルデヒド、パルミチンアルデヒド、マルガリンアルデヒド、ステアリンアルデヒドが挙げられ、脂肪族ジアルデヒドとしては例えばスクシンジアルデヒドがあり、脂肪族不飽和アルデヒドとして、クロトンアルデヒド、更には芳香族アルデヒドには、ベンズアルデヒド、トルアルデヒド、サリチルアルデヒド、シンナムアルデヒド、ナフトアルデヒド等があり、複素環式アルデヒドにはフルフラールが挙げられる。アミン系の還元性溶媒としては、ヘキシルアミン、ヘブチンアミン、オクチルアミン、ウンデシルアミン、トリデシルアミン、テトラデシルアミン、ペンタデシルアミン、セチルアミン、ジブチルアミン、ジアミルアミン、シクロヘキシルアミン、アニリン、ナフチルアミン、トルイジン等がある。
【0044】
また、還元性溶媒に金属化合物粉末とともに添加される、S、Se、Teから選択される単体、または前記元素群から選択される1種以上を含む化合物(以下、カルコゲン源)としては、前記元素の合金の粉末、または水素化カルコゲン化合物、またはカルコゲン元素の有機金属を用いることができる。
【0045】
前記合金とは、Se、Te、及びSからなる群より二つ以上選択された元素を構成元素とする合金である。
【0046】
水素化カルコゲン化合物としては、セレン化水素(H2Se)、硫化水素(H2S)、テルル化水素(H2Te)等が代表的に挙げられ、カルコゲン元素の有機金属としては、一般的にはアルキルセレノール、アリールセレノール、セレン化ジアルキル、セレン化ジアリール、ハロゲン化アルキルセレニド、ハロゲン化アリールセレニド、ジアルキルセレノキシド、ジアリールセレノキシド、セレノン、アルキルセレニン酸、アリールセレニン酸、セレノン酸、セレノケトン、セレノ酸、セレノフェン等がある。例えばジアルキルセレンの例としてはSe(CH3)2、(C2H5)2Se、(C4H9)2Se、(C6H13)2Se等が代表的な化合物である。これらのカルコゲン系元素(Se、S、Te)の単体、合金、化合物を1種以上を用いることができる。
【0047】
そして、上記カルコゲン源と、金属化合物粉末および還元性溶媒との混合溶媒を、200℃〜500℃の温度で加熱する。これにより、カルコゲン源と、金属化合物粉末および還元性溶媒との混合溶媒をカルコゲン化反応させ、カルコゲン化合物粉を容易に得ることができる。前記の加熱温度(カルコゲン化反応のための温度:以下、反応温度)は、低いとカルコゲン化合物の生成が十分でない場合があり、400℃以上にしても、得られるカルコゲン化合物の生成状態に大きな変化が見られないことから、好ましくは、220℃〜400℃、更に好ましくは、250℃〜400℃の範囲である。
【0048】
本実施形態では、エチルアルコールなどに比べて高い沸点の還元性溶媒を前記温度領域(200℃〜500℃)まで加熱することにより、溶媒が還元剤として働き、金属化合物粉末を還元するとともに、カルコゲン源のSe、Te、Sと還元された金属を反応させることにより、カルコゲン化合物粉を容易に得ることができるものと考えられる。また、これにより作成したカルコゲン化合物粉の粒子は、粒子径が1nm〜200nmのサイズとなり、焼結や粒子間結合のない粉が得られる。前記金属化合物粉末の粒径を調整することにより、粒子径が1nm〜40nmのカルコゲン化合物分を得ることができる。
【0049】
尚、後の実施例からも明らかであるが、混合溶媒の加熱温度は、高温になるほど、良好な結果が得られる。しかし、混合溶媒(還元性溶媒)が沸騰するまで高温にすると、カルコゲン化反応は進むが、還元性溶媒が熱分解したり、もしくは蒸発してしまう為に反応が不安定になる。従って、混合溶媒の加熱温度(反応温度)は、混合溶媒が沸騰する温度より低温とする。具体的には、本実施形態の混合溶媒の加熱温度(反応温度)は、カルコゲン化合物の収率の観点から、220℃以上が好ましく、250℃以上が更に好ましい。反応温度の上限温度は溶媒の沸点以下とするのが好ましく、具体的には500℃以下とするのが好ましい。
【0050】
例えば、本実施形態により、CuInSe系のカルコゲン化合物を得ようとする場合の一例を示すと以下のとおりである。Cu(NO3)2、In(NO3)3を含む水溶液に水酸化ナトリウム水溶液を添加することにより得たCuとInの金属水酸化物を(酸化した後)、還元性溶媒と混合し、金属Se粉末を溶媒に加えて、220℃〜400℃に加熱する。これにより、カルコゲン化合物を生成する反応(以下、カルコゲン化反応)が著しく促進し、CuInSe系の化合物が容易に形成される。
【0051】
このような反応において、他のカルコゲン元素を用いて反応させる場合においても同様な効果が得られた。より詳細には、他のCdSe系やCuInGaSe系、セレン化銅(CuSe)系、セレン化テルル(TeSe)系、セレン化亜鉛(ZnSe)系、セレン化ガリウム(GaSe)系、セレン化インジウム(InSe)系、セレン化コバルト(CoSe)系、セレン化サマリウム(SmSe)系、セレン化マンガン(MnSe)系、セレン化スズ(SnSe)系、セレン化セリウム(CeSe)系等においてもSe化反応において同様な効果が得られた。また、Fe、Co、Cu、Cr、Mn、Ni、Cd、Zn、Ti、V、La、Ce、Pr、Nd、Sm、Eu、Gd、Dy、Er、Yb、Al、Ga、Tl及びInSn及びPbにおいても、カルコゲン化反応において同様な効果が得られた。カルコゲン化反応時は反応による水の放出があり、還元性溶媒に窒素やアルゴンを用いてバブリングすることにより反応が容易に進行し、且つ目的のカルコゲン元素を含んだ化合物の単相になりやすい。ガス流量が大きいと、蒸気圧の高いカルコゲン元素がカルコゲン化反応の系外に運ばれる可能性があるので、適度な量がある。
【0052】
尚、金属化合物粉末と還元性溶媒、およびカルコゲン源の混合、添加の順は上記の例に限らない。すなわち、金属塩から金属水酸化物を生成する工程において、金属塩の溶解液として純水に、還元性溶媒を加えたものを用いてもよい。また、金属水酸化物から金属酸化物を生成(酸化)する工程の溶媒として、高沸点溶媒を用いてもよい。更に、金属水酸化物から金属酸化物を生成(酸化)する工程の溶媒として、高沸点溶媒を用い、更に、カルコゲン源を添加する際に還元性溶媒を追加してもよい。
【0053】
また、添加するカルコゲン源は、粉状でなくてもよく、例えばセレン化水素(H2Se)などのガスを、供給してもよい。上記の如く、金属化合物粉末と還元性溶媒を混合し加熱する際に、窒素などを用いてバブリングすると反応が進行しやすくなるので、このバブリングのガスと共にガス化したカルコゲン源を供給してもよい。
【0054】
尚、カルコゲン化反応に加圧装置を用いれば、常圧での沸点が200℃より低温の還元性溶媒であっても使用することができる。
【0055】
本実施形態におけるカルコゲン化反応開始時の金属化合物の液中の固形分濃度は薄いと分散しやすく凝集が少ないが、1反応当たりの製造量が少なくなり、逆に固形分濃度が濃いと得られるカルコゲン化合物粒子間の結合や凝集が起こりやすくなるので、カルコゲン化反応開始時の金属化合物の固形分濃度としては、0.1質量%〜50質量%範囲にあることが良い。更に好ましくは0.1質量%〜10質量%の範囲である。
【0056】
また、カルコゲン反応時に添加するカルコゲン源の量は、金属化合物の量に対する当量以上とすることができる。カルコゲン化反応温度が高い場合、カルコゲン化反応が完了する前にカルコゲン源が反応系外に蒸発してしまう可能性があるが、当量以上に添加することにより、前記蒸発によるロスを補うことが出来る。当量以上に添加した場合でも、余剰のカルコゲン源は、カルコゲン反応後、蒸発により混合溶媒から失われるので、適宜カルコゲン源の添加量、カルコゲン化反応の温度、時間等を調整すればよい。カルゴゲン源は、余剰に添加しすぎても不経済なので、当量の1倍〜1.3倍を添加するのが好ましい。
【0057】
本願では以下、過剰に添加、と記載した場合には、当量の1倍超、1.3倍以下の量を添加すること意味する。
【0058】
このように作製したカルコゲン化合物粉は、溶媒置換法により目的の溶媒に分散させることが出来る。この際、溶媒置換しやすいように粒子表面に界面活性剤を付着させ、この界面活性剤により目的の溶媒に分散しやすいようにすることが出来る。
【0059】
具体的には、界面活性剤としてアニオン系、カチオン系、ノニオン系等の種類には限定されず、溶媒中のpHを制御することにより粒子表面の電荷状態をプラスまたはマイナス側に帯電させて、帯電状態の極性と逆側に電荷を持つ界面活性剤を選択することにより、界面活性剤を適度に吸着させることが出来る。具体的にはpHを酸性側になるように制御した場合には、粒子表面はプラス側に帯電しやすく、この場合にはCOO−やSO3−等の官能基を持つ有機分子が吸着しやすくなる。このように溶媒中で解離しやすくアニオンになりやすいものとしてスルホン基、スルフィノ基等の官能基を持つものがあるが、解離しないで分子の極性に関与するR1R2SO2のようなものでも分散に効果がある。逆にアルカリ性側に溶媒のpHを変化させた場合には、−NH2や−NRH等のアミノ基を持つものが吸着しやすくなり、粒子表面の帯電状態に合わせて界面活性剤を選択することが望ましい。場合によっては、粒子の表面に−OHがあれば、界面活性剤のカルボシキル基とエステル結合させて、化学結合させることでも良い。もしくはSi、Al、Ti等のカップリング剤を不純物濃度が問題とならない場合には使用することが出来る。
【0060】
以下に図2から図35を参照して実施例を詳細に示す。
【実施例1】
【0061】
実施例1では、金属塩から金属水酸化物を経て金属酸化物の金属化合物粉末を生成し、還元性溶媒と混合させてカルコゲン源を添加し、加熱した。尚、実施例1では金属水酸化物から金属酸化物を生成(酸化)する工程の高い沸点の溶媒としてトリエチレングリコール(Triethyleneglycol:TEG)を用い、更に、カルコゲン源を添加する際に還元性溶媒を追加した。
【0062】
すなわち、Cu2Se粒子を合成するために、金属塩として硝酸銅0.05molを純水に溶かした溶液150mlを250mlのフラスコに入れた。続いてフラスコ内を300rpmで直径5cmの羽を回転させ攪拌した状態で、水酸化ナトリウムの10N溶液を滴下して中和しpHを8.5で終了させ、水酸化銅を生成した。この後、ヌッチェを用いてろ過した後、純水でケーキを再分散して、更にろ過を繰り返し、ろ液の導電率を10−1Sm−1以下にした。この時、水酸化銅が分散した液のpHが7に近づくと水酸化銅が溶解するため、pH7.5程度に留めた。この後、金属水酸化物のケーキを70℃で乾燥させた。洗浄が終了した水酸化銅の形態を透過型電子顕微鏡(Transmission Electron Microscope、以下TEM)で観察した結果、非常に細かい粒子が凝集したような形態であった。
【0063】
前記の乾燥させた水酸化銅5gを250mlの三口のフラスコに投入し、高い沸点溶媒としてトリエチレングリコール(TEG)75gに加えて、300rpmで直径5cmの羽を回転させ攪拌し、空気を100ml/minでバブリングした。この状態で図2に示す80℃から300℃の10種類の温度(酸化加熱温度)でそれぞれ、3時間加熱し、銅化合物を得た。
【0064】
図2は、10種類の各加熱温度(酸化加熱温度)で作製した前記銅化合物(試料1から試料10)の粒径(平均粒径:D50、以下同様)やおよび化合物の生成状態を確認した結果を示す。ここで、粒径は、レーザー散乱による粒度分布測定器を用いて測定し、状態は、X線回折のピーク位置および高さから、水酸化銅/酸化銅のおおよその比率について確認した。この結果、酸化加熱温度が120℃以上であれば、粒径が3μm以下で、酸化銅を主体とした粒子が得られることが分かった。粒径はレーザー散乱による粒度分布測定器を用いたために、一次粒子と、一次粒子が凝集している二次粒子を同時に測定している。
【0065】
図2において、レーザー散乱による粒度分布測定器を用いて測定した平均粒径(D50)が2μm以下の場合を○、2μmを超え3μm以下の場合を△、3μmを超える場合を×と評価した。
【0066】
図2より酸化加熱温度が高いほど平均粒径が小さくなり、分散が進行していることが分かる。前記銅化合物の一次粒径をTEM観察により確認した結果、酸化加熱温度150℃以上の場合、一次粒子の粒径は30nm程度であり、一次粒子は非常に細かいものが出来ており、それが凝集したものとなっていた。逆に、酸化加熱温度が110℃以下と低い場合、酸化銅の比率が低く、二次粒径が大きい。この結果から、二次粒径の小さい金属酸化物を主体とした金属化合物粒子を得るには、酸化加熱温度は高いほうが好ましく、金属が銅の場合、酸化加熱温度は120℃以上が好ましい。
【0067】
次に200℃の酸化加熱温度で処理した粒子を含む混合溶媒を遠心沈降法により固液分離した。遠心機(国産遠心機(株) H−103N)を用いて3000rpmで30分間、遠心分離により、固液分離し、固形分(金属化合物粉末)を3g取り出し、この金属化合物粉末に対して、カルコゲン源としてSe粉を添加した。カルコゲン源は、CuとSeの原子比(Cu:Se)が2:1.2になるようにSe粉を過剰に添加した。そしてTEG(還元性溶媒)50gに加え、混合溶媒とした。250mlの三口のフラスコに投入し、300rpmで直径5cmの羽を回転させ攪拌し、窒素を100ml/minでバブリングした。この状態で150℃〜300℃の図3に示した10種類の温度(反応温度)でそれぞれ、5時間加熱し、反応(カルコゲン化反応)させ、カルコゲン化合物粉を生成させた。洗浄乾燥はイソプロピルアルコールで洗浄及びろ過を繰り返してろ液の導電率を10−1Sm−1以下にし、60℃で真空乾燥させた。
【0068】
図3にその結果を示す。図3ではX線解析装置(X-Ray Diffractometer、以下XRD、株式会社リガク製 RAD−rX)による結晶解析を中心に行い、試料1から試料10についてカルコゲン化合物(Cu2Se)の生成状態を調べ、カルコゲン化合物の生成に必要なカルコゲン化反応の反応温度を調べた。この際、X線回折は50kV 100mAの条件で測定を行ない、目的とするカルコゲン化合物のピーク強度のうち最も高いピーク高さを、それ以外の物質によるピーク強度のうち最も高いピーク高さで割った値(以下、ピーク強度比)を求めた。ピーク強度比が、15以上あれば、目的とするカルコゲン化合物が高純度で得られた(目的物の単相が得られた)と判定し、図3において○で示した。ピーク強度比が5以上であれば、目的とするカルコゲン化合物の含有量が高い物質が得られたと判定し、図3において、△で示した。ピーク強度比が5未満の場合は、目的とするカルコゲン化合物の含有量が低いと判定し、×で示した。前記評価基準は、他の実施例でも同様である。この結果、高純度のカルコゲン化合物を生成させるには、カルコゲン化反応には少なくとも220℃以上の反応温度が必要なことが分かった。
【0069】
図4は、得られたカルコゲン化合物のX線回折結果を示すグラフであり、図4(A)が試料8の結果であり、図4(B)が試料4の結果である。縦軸がピーク強度[cps]であり、横軸が回折角(2θ)[°]である。
【0070】
図4(A)を参照して、試料8では、CuSeであることを示すピーク以外のピークは認められなかった。一方、図4(B)の如く、試料4では、試料8(図4(A))で認められたCuSeのピークはほとんど認められなかった。
【0071】
また、試料8、試料9、試料10で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は7nm〜12nmであった。DTEMは、TEM像を、日本電子株式会社製JEM−2010、にて10万倍で撮影し、全粒子のうち、100個の粒子の粒子径を測定し、その平均値とした。
【0072】
得られたカルコゲン化合物のいくつかについて、蛍光X線による組成分析をおこなった。蛍光X線分析は、装置として、日本電子株式会社製JSX−3201を使用して測定をおこなった。
【0073】
図5はその分析結果であり、試料8、9、10について分析した結果を構成元素の原子比で示した。これによると目的とする組成比(Cu:Se=1:1)に近いカルコゲン化合物が得られていることが、確認された。
(比較例)
実施例1の比較として、TEGに代えて還元性のないラウリン酸を加えた。すなわち、
カルコゲン化反応に使用する溶媒をTEGからラウリン酸に変更し、カルコゲン化反応時の加熱時間を10時間とした以外は、実施例1と同様の方法でカルコゲン化合物の合成を試みた。ただし、酸化加熱温度は、200℃とし、カルコゲン化反応温度は、220℃とした。
【0074】
図6には、実施例1と同様の評価をおこなった結果を示す。還元性溶媒をTEGからラウリン酸に変えて行った場合にはCu2Seが充分に生成出来なかった。
【実施例2】
【0075】
実施例1においてはCu2Se粒子を合成することを行ったが、実施例2では金属塩として硝酸銅および硝酸インジウムを用いて、CuInSe2の合成を行った。
【0076】
CuとInの原子比(Cu:In)が1:1の組成になるように硝酸銅0.01molと硝酸インジウム0.01molを純水に溶かした溶液150mlを250mlのフラスコに入れた。続いてフラスコ内を300rpmで直径5cmの羽を回転させ、攪拌した状態で、水酸化ナトリウムの10N溶液を滴下して中和しpHを8.5で終了させ、金属水酸化物の共沈物を生成した。この後、ヌッチェを用いてろ過した後、純水でケーキを再分散して、更にろ過を繰り返し、ろ液の導電率が10−1Sm−1以下にした。この時、金属水酸化物が分散した液のpHが7に近づくと水酸化銅が溶解するため、pH7.5程度に留めた。この後、金属水酸化物のケーキを70℃で乾燥させた。乾燥物2gを250mlの三口のフラスコに投入し、更に還元性溶媒であるトリエチレングリコール(TEG)75gに加えて、300rpmで直径5cmの羽を回転させ攪拌し、空気を100ml/minでバブリングした。この状態で80℃から300℃の図7に示した10種類の温度(酸化加熱温度)でそれぞれ、1時間加熱し、金属化合物粉末を作製し、実施例1と同様の評価をおこなった。
【0077】
図7は、10種類の各酸化加熱温度で作製した試料1から試料10の粒径および化合物の生成状態を確認した結果を示す。粒径の測定方法及び状態の確認方法は実施例1と同様である。
【0078】
酸化加熱温度が高いほど平均粒径が小さくなり、分散が進行していることが分かる。前記金属化合物の一次粒径をTEM観察により確認した結果、酸化加熱温度150℃以上の場合、一次粒子の粒径は20nm程度であり、一次粒子は非常に細かいものが出来ており、それが凝集したものとなっている。逆に、酸化加熱温度が110℃以下と低い場合、金属酸化物の比率が低く、二次粒径が大きい。この結果から、二次粒径の小さい金属酸化物を主体とした金属化合物粒子を得るには、酸化加熱温度は高いほうが好ましく、金属が銅とインジウムである場合、酸化加熱温度は120℃以上が好ましい。
【0079】
次に250℃の酸化加熱温度で処理した粒子を含む混合溶媒を遠心沈降法により固液分離した。遠心機(国産遠心機(株) H−103N)を用いて3000rpmで30分間、遠心分離により、固液分離し、固形分(金属化合物粉末)を2g取り出し、この金属化合物粉末に対して、CuとSeの原子比(Cu:Se)が1:2.2になるようにSe粉(カルコゲン源)を過剰に添加してTEG100gに加え、混合溶媒とした。250mlの三口のフラスコに投入し、300rpmで直径5cmの羽を回転させ攪拌し、窒素を100ml/minでバブリングした。この状態で150℃〜300℃の図8に示した10種類の反応温度でそれぞれ、5時間加熱し、反応(カルコゲン化反応)させ、カルコゲン化合物粉(CuInSe2)を生成させ、実施例1と同様の評価をおこなった。洗浄乾燥はエチルアルコールで洗浄及びろ過を繰り返してろ液の導電率を10−1Sm−1以下にし、80℃で大気中乾燥させた。
【0080】
図8は、実施例1と同様の方法で、図8に示す10種類の反応温度で生成した各試料についてX線解析装置を用いてカルコゲン化合物の生成状態を調べ、カルコゲン化反応の反応温度を調べた結果を示す。X線回折の評価結果より、CuInSe2が得られたことを確認した。高純度のカルコゲン化合物を生成させるには、カルコゲン化反応時に少なくとも220℃以上の反応温度が必要なことが分かった。
【0081】
また、試料8、試料9、試料10で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は7nm〜12nmであった。
【0082】
図9は、得られたカルコゲン化合物(試料8)のX線解析結果を示すグラフであり、縦軸がピーク強度[cps]であり、横軸が回折角(2θ)[°]である。この結果より、試料8では、CuInSe2であることを示すピーク以外のピークは認められなかった。
【0083】
更に、得られたカルコゲン化合物のいくつかについて、蛍光X線による組成分析をおこなった。
【0084】
図10は分析結果であり、試料8、9、10について分析した結果を構成元素の原子比で示した。これによると目的とする組成比(Cu:In:Se=1:1:2)に近いカルコゲン化合物が得られていることが、確認された。
【0085】
実施例2において、TEGに代わる還元性溶媒として、エチレングリコール、ジエチレングリコール、プロピレングリコール、トリメチレングリコール、ブタンジオール、ペンタンジオール、ヘキサンジオール、ヘプタンジオール、オクタンジオール、ノナンジオール、デカンジオール、ベンズピナコール、ヒドロベンゾイル、シクロペンダジオール、シクロヘキサンジオール、シクロヘキサンジオール、グリコール酸アミド、ジエチレングリコールジメチルエーテル、ナフチルアミン、ドデシルアミンを用いて、カルコゲン化反応温度を溶媒温度をそれぞれの沸点として、生成物の状態を調べた結果、実施例2の試料8と同様にDTEMが7nm〜12nmであるカルコゲン化合物が得られた。
【実施例3】
【0086】
実施例3では金属水酸化物を加熱して酸化する工程をおこなわなかった以外は、実施例2と同様の方法で、CuInSe2の合成を行った。
【0087】
CuとInの原子比(Cu:In)が1:1の組成になるように硝酸銅0.01molと硝酸インジウム0.01molを純水に溶かした溶液150mlを250mlのフラスコに入れた。続いてフラスコ内を300rpmで直径5cmの羽を回転させ、攪拌した状態で、水酸化ナトリウムの10N溶液を滴下して中和しpHを8.5で終了させ、金属水酸化物の共沈物を生成した。
【0088】
この後、ヌッチェを用いてろ過した後、純水でケーキを再分散して、更にろ過を繰り返し、ろ液の導電率が10−1Sm−1以下にした。この時、金属水酸化物が分散した液のpHが7に近づくと水酸化銅が溶解するため、pH7.5程度に留めた。この後、金属水酸化物のケーキ全量を250mlの三口のフラスコに投入し、更に還元性溶媒であるトリエチレングリコール(TEG)100gに加えて、CuとSeの原子比(Cu:Se)が1:2.2になるようにSe粉(カルコゲン源)を過剰に添加して混合溶媒とし、300rpmで直径5cmの羽を回転して攪拌し、窒素を200ml/minでバブリングした。この状態で昇温速度を1℃/minで150℃から300℃の図11に示した10種類の温度まで、それぞれ昇温し、その温度で5時間保持したカルコゲン化反応の条件で、混合溶媒の温度を変えて加熱した試料1から試料10を作製した。各反応温度で作製した試料1から試料10を実施例1と同様に評価した。
【0089】
図11は、この結果を示す。X線回折の評価結果より、CuInSe2が得られたことを確認した。高純度のカルコゲン化合物(CuInSe2)を生成させるには、カルコゲン化反応時に少なくとも220℃以上の反応温度が必要なことが分かった。また、試料8、9、10で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は6nm〜12nmであった。
【0090】
図12は実施例1と同様の方法によるカルコゲン化合物(試料8)のX線解析結果を示すグラフであり、図13は実施例1と同様の方法による蛍光X線の分析結果である。これらより、試料8では、CuInSe2であることを示すピーク以外のピークは認められず(図12)、試料8、9、10について、目的とする組成比(Cu:In:Se=1:1:2)に近いカルコゲン化合物が得られていることが、確認された(図13)。
【0091】
尚、図12に認められる20°〜25°の範囲にあるピークは、測定治具の接着材料に起因するものであることがわかっている。
【実施例4】
【0092】
実施例4では、金属化合物粉末から金属水酸化物を生成する際の溶媒に還元性溶媒を用いた。すなわち、CuとInの原子比(Cu:In)が1:1の組成になるように塩化銅0.01molと塩化インジウム0.01molを30mlの純水と100gのTEG(還元性溶媒)の混合溶液に溶かし、この溶液を250mlのフラスコに入れた。続いてフラスコ内を300rpmで直径5cmの羽を回転させ攪拌した状態で、濃度20パーセントの水酸化カリウム水溶液を滴下して中和しpHを8.5で終了させ、金属水酸化物の共沈物を生成した。この後、CuとSeの原子比(Cu:Se)が1:2.2になるようにSe粉(カルコゲン源)を過剰に添加して混合溶媒とし、窒素を200ml/minでバブリングした。この状態で120℃まで昇温し、2時間保持した後、昇温速度を1℃/minで150から300℃の図14に示した10種類の温度までそれぞれ昇温し、その温度で10時間保持したカルコゲン化反応の条件で、混合溶媒の温度を変えて加熱した試料を作製した。洗浄乾燥はメチルアルコールで洗浄及びろ過を繰り返してろ液の導電率を10−1Sm−1以下にし、60℃で窒素中乾燥させた。各反応温度で作製した試料1から試料10を実施例1と同様に評価した。
【0093】
図14は、この結果を示す。X線回折の評価結果より、CuInSe2が得られたことを確認した。高純度のカルコゲン化合物(CuInSe2)を生成させるには、カルコゲン化反応時に少なくとも220℃以上の反応温度が必要なことが分かった。また、試料8、試料9、試料10で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は7nm〜12nmであった。
【0094】
図15は実施例1と同様の方法によるカルコゲン化合物(試料8)のX線解析結果を示すグラフであり、図16は実施例1と同様の方法による蛍光X線の分析結果である。これらより、試料8では、CuInSe2であることを示すピーク以外のピークは認められず(図15)、試料8、9、10について、目的とする組成比(Cu:In:Se=1:1:2)に近いカルコゲン化合物が得られていることが、確認された(図16)。
【0095】
尚、図15に認められる20°〜25°の範囲にあるピークは、測定治具の接着材料に起因するものであることがわかっている。
【実施例5】
【0096】
実施例5では、金属水酸化物の生成の際に還元性溶媒を用い、ガス化したカルコゲン源を、還元性溶液のバブリングのガスと共に供給した。すなわち、CuとInの原子比(Cu:In)が1:1の組成になるように塩化銅0.01molと塩化インジウム0.01molを30mlの純水と100gのTEG(還元性溶媒)の混合溶液に溶かし、この溶液を250mlのフラスコに入れた。続いてフラスコ内を300rpmで直径5cmの羽を回転して攪拌した状態で、濃度20パーセントのアンモニア水を滴下して中和しpHを8.5で滴下を終了させ、金属水酸化物の共沈物を生成した。この後、水素化Seガス(カルコゲン源)と窒素の体積比が1:1の混合ガスを200ml/minで混合溶媒をバブリングして添加した。このバブリングをした状態で120℃まで昇温し、2時間保持した後、昇温速度を1℃/minで140から300℃の図8に示した10種類の温度まで、それぞれ昇温し、その温度で10時間保持したカルコゲン化反応の条件で、混合溶媒の温度を変えて加熱した試料を作製した。カルコゲン化反応後の洗浄乾燥は、実施例1と同様に実施した。各反応温度で作製した試料1から試料11を実施例1と同様に評価した。
【0097】
図17は、この結果を示す。X線回折の評価結果より、CuInSe2が得られたことを確認した。高純度のカルコゲン化合物(CuInSe2)を生成させるには、カルコゲン化反応時に少なくとも220℃以上の反応温度が必要なことが分かった。また、試料9、10、11で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は8nm〜14nmであった。
【0098】
図18は実施例1と同様の方法による蛍光X線の分析結果である。これらより試料9、10、11について、目的とする組成比(Cu:In:Se=1:1:2)に近いカルコゲン化合物が得られていることが、確認された。
【実施例6】
【0099】
実施例5と同様の方法で、CdSeを作製するために、塩化カドミウム0.01molを30mlの純水と100gのTEG(還元性溶媒)の混合溶液に溶かし、この溶液を250mlのフラスコに入れた。続いてフラスコ内を300rpmで直径5cmの羽を回転し攪拌した状態で、濃度20パーセントの水酸化ナトリウム水溶液を滴下して中和し、pHを8.5で滴下を終了させ、金属水酸化物を生成した。この後、水素化Seガス(カルコゲン源)と窒素の体積比が1:1の混合ガスを200ml/minで混合溶媒をバブリングして添加した。このバブリングした状態で120℃まで昇温し、2時間保持した後、昇温速度を1℃/minで80℃から260℃の図19に示した13種類の温度まで、それぞれ昇温し、その温度で10時間保持したカルコゲン化反応の条件で、混合溶媒の反応温度を変えて加熱した試料を作製した。
【0100】
この試料1から試料13を遠心沈降法により固液分離した。遠心機(国産遠心機株式会社製 H−103N)を用いて3000rpmで30分間、遠心分離により、固液分離し、固形分を純水に分散させる洗浄を5回繰返しおこい、再度固液分離して得られた固形分について、実施例1と同様に評価をおこなった。
【0101】
図19は、この結果を示す。X線回折の評価結果より、CdSeが得られたことを確認した。十分な量のカルコゲン化合物(CdSe)を生成させるには、カルコゲン化反応時に少なくとも200℃以上の反応温度が必要なことが分かった。また、試料11、試料12、試料13で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は6nm〜10nmであった。
【0102】
前記の中和反応において、水酸化ナトリウムをアンモニア水溶液に替えて、他の条件を同一にして行った結果も図19の結果と同様であった。カルコゲン化合物の洗浄を遠心沈降法及び純水洗浄から、ヌッチェによるろ過実施後、固形分を純水に分散させることを5回繰返し、再度ろ過すること以外は他の条件を同一にしておこなった結果も図19の結果と同様であった。
【0103】
図20は実施例1と同様の方法による試料11、12、13についての蛍光X線の分析結果である。これにより、試料11、12、13について、目的とする組成比(Cd:Se=1:1)に近いカルコゲン化合物が得られていることが、確認された。
【0104】
実施例6において、塩化カドミウムに変えてFe、Co、Cu、Cr、Mn、Ni、Zn、Ti、V、La、Ce、Pr、Nd、Sm、Eu、Gd、Dy、Er、Ybのそれぞれの塩化物を用いて、水酸化ナトリウムによる中和反応を行い、その他の条件を同一とした場合、同様なカルコゲン化合物粉が出来るかを調べた結果、各元素に対して混合溶媒の加熱温度(カルコゲン化反応の反応温度)が220℃以上で、カルコゲン化合物粉が得られた。
【0105】
また、図21は、実施例6において、セレン化水素の代わりに(C2H5)2Seを用いて同様な試験を行い、実施例1と同様に評価をおこなった結果を示す。この結果、カルコゲン化反応時の加熱温度を220℃以上にすることによりCdSeのDTEMが15nm〜20nmである粒子が作製できた。
【実施例7】
【0106】
実施例7では、金属水酸化物から金属酸化物を生成する際の溶媒にプロピレングリコール(Propyleneglycol:PEG)を用い、CuIn0.7Ga0.3Se2の合成を行った。Cu、InとGaが原子比(Cu:In:Ga)で1:0.7:0.3の組成になるように硝酸銅0.01molと硝酸インジウム0.007mol、硝酸ガリウム0.003molを純水200mlに溶かした溶液を250mlのフラスコに入れた。続いてフラスコ内を300rpmで直径5cmの羽を回転し攪拌した状態で、水酸化ナトリウムの1N溶液を滴下して中和しpHを8.5で滴下を終了させ、金属水酸化物の共沈物を生成した。この後、ヌッチェを用いてろ過してケーキを得た後、純水でケーキを再分散して、更にろ過を繰り返し、ろ液の導電率が10−2Sm−1以下にした。この時、pHが7に近づくと水酸化銅が溶解するため、pH7.5程度に留めた。この後、金属水酸化物のケーキを90℃で真空乾燥させた。この乾燥後の金属水酸化物5gを250mlの三口のフラスコに投入し、更に還元性溶媒であるプロピレングリコール(PEG)75gに加えて、300rpmで直径5cmの羽を回転し攪拌した。この後、窒素を100ml/minでバブリングした。この状態で80℃から300℃の図22に示した10種類の酸化加熱温度で、それぞれ1時間、温度を変えて加熱し金属化合物の試料を作製し、洗浄乾燥はイソプロピルアルコールで洗浄及びろ過を繰り返してろ液の導電率を10−1Sm−1以下にし、80℃で窒素中乾燥させた。実施例1と同様の方法で評価した。
【0107】
図22は、各酸化加熱温度で作製した試料1から試料10の評価結果を示す。酸化加熱温度が高いほど平均粒径が小さくなり、分散が進行していることが分かる。前記金属化合物の一次粒径をTEM観察により確認した結果、酸化加熱温度150℃以上の場合、一次粒子の粒径は10nm程度であり、一次粒子は非常に細かいものが出来ており、それが凝集したものとなっている。逆に、酸化加熱温度が110℃以下と低い場合、金属酸化物の比率が低く、二次粒径が大きい。この結果から、二次粒径の小さい金属酸化物を主体とした金属化合物粒子を得るには、酸化加熱温度は高いほうが好ましく、金属が銅とガリウムとインジウムである場合、酸化加熱温度は120℃以上が好ましい
次に250℃の酸化加熱温度で処理を行った金属化合物を含んだ溶媒に対して、CuとSeの原子比(Cu:Se)が1:2.2になるようにSe粉(カルコゲン源)を過剰に添加し、混合溶媒とした。引き続き250mlの三口のフラスコの中の溶媒を300rpmで直径5cmの羽を回転させ攪拌し、窒素を100ml/minでバブリングした。この状態で150℃〜340℃の間の図23に示した11種類の反応温度で10時間、混合溶媒を加熱して、カルコゲン化合物の生成を試みた。洗浄乾燥はエチルアルコールで洗浄及びろ過を繰り返してろ液の導電率を10−1Sm−1以下にし、室温で大気中乾燥させた。得られた試料1から試料10のカルコゲン化合物を実施例1と同様の方法で評価した。
【0108】
図23は、この結果を示す。X線回折の評価結果より、CuIn0.7Ga0.3Se2が得られたことを確認した。十分な量のカルコゲン化合物(CuIn0.7Ga0.3Se2)を生成させるには、カルコゲン化反応時に少なくとも220℃以上の反応温度が必要なことが分かった。また、試料8、試料9、試料10で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は10nm〜15nmであった。
【0109】
図24は実施例1と同様の方法によるカルコゲン化合物(試料8)のX線解析結果を示すグラフであり、図25は実施例1と同様の方法による蛍光X線の分析結果である。これらより、試料8では、CuIn0.7Ga0.3Se2であることを示すピーク以外のピークは認められず(図24)、試料8、9、10について、目的とする組成比(Cu:In:Ga:Se=1:0.7:0.3:2)に近いカルコゲン化合物が得られていることが、確認された(図25)。
【0110】
尚、図24に認められる20°〜25°の範囲にあるピークは、測定治具の接着材料に起因するものであることがわかっている。
【実施例8】
【0111】
実施例8では、添加するSe粉(カルコゲン源)の量をCuとSeの原子比(Cu:Se)で1:2とした以外は、実施例7と同様の方法により試験をおこない、実施例1と同様に評価した。
【0112】
図26は、各酸化加熱温度で作製した試料1から試料10の評価結果を示す。実施例7と同様の結果が得られた。
【0113】
図27は、試料1から試料10についての実施例1と同様のX線回折の評価方法によるカルコゲン化反応により得られた生成物の評価結果を示す。X線回折の評価結果より、CuIn0.7Ga0.3Se2が得られたことを確認した。十分な量のカルコゲン化合物(CuIn0.7Ga0.3Se2)を生成させるには、カルコゲン化反応時に少なくとも220℃以上の反応温度が必要なことが分かった。また、試料8、試料9、試料10で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は7nm〜12nmであった。
【0114】
図28は実施例1と同様の方法による蛍光X線の分析結果である。これらより、試料8、9、10について、目的とする組成比(Cu:In:Ga:Se=1:0.7:0.3:2)に近いカルコゲン化合物が得られていることが、確認された。
【実施例9】
【0115】
実施例8のCuIn0.7Ga0.3Se2の合成において、カルコゲン源としてSe粉末の代わりにSeS(添加するSeS粉(カルコゲン源)の量をCuに対する原子比は、Cu:Se:Sで1:1:1)を用いて試験を行った。他の条件は同一とした。
【0116】
図29は、試料1から試料10についての実施例1と同様のX線回折の評価方法による、カルコゲン化反応により得られた生成物の評価結果を示す。X線回折の評価結果より、CuIn0.7Ga0.3SeSが得られたことを確認した。十分な量のカルコゲン化合物(CuIn0.7Ga0.3SeS)を生成させるには、カルコゲン化反応時に少なくとも220℃以上の反応温度が必要なことが分かった。また、試料8、試料9、試料10で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は12nm〜20nmであった。
【0117】
図30は実施例1と同様の方法による試料9、10、11についての蛍光X線の分析結果である。これらより、試料9、10、11について、目的とする組成比(Cu:In:Ga:S:Se=1:0.7:0.3:1:1)に近いカルコゲン化合物が得られていることが、確認された。
【実施例10】
【0118】
実施例10では金属塩から金属水酸化物を生成する際に還元性溶媒を用い、CuIn0.7Ga0.3Se2の合成を行った。CuとIn、Gaの原子比(Cu:In:Ga)が1:0.7:0.3の組成になるように塩化銅0.01molと塩化インジウム0.007mol、塩化ガリウム0.003molを純水50mlとTEG(還元性溶媒)100gを混合した溶液に溶かし、その溶液を250mlのフラスコに入れた。続いてフラスコ内を300rpmで直径5cmの羽を回転し攪拌した状態で、水酸化ナトリウムの1N溶液を滴下して中和し、pHを8.5で滴下を終了させ、金属水酸化物の共沈物を生成した。次に300rpmで直径5cmの羽を回転し攪拌したまま、窒素を100ml/minでバブリングし、CuとSeの原子比(Cu:Se)が1:2.5になるようにSe粉(カルコゲン源)を過剰に添加し、混合溶媒とした。この状態で150℃〜300℃の図31に示した10種類の反応温度で10時間、混合溶媒を加熱して、カルコゲン化合物の生成を試みた。この後、反応性生物を含む混合溶媒をヌッチェを用いてろ過した後、純水でケーキを再分散して、更に前記のろ過を繰り返し、ろ液の導電率が10−1Sm−1以下にして、得られたケーキを真空乾燥して、カルコゲン化合物粉(試料1から試料10)を得た。この粉を実施例1と同様の方法で評価した。
【0119】
図31は、上記で得た試料1から試料10(カルコゲン化反応により得られた生成物)を実施例1と同様のX線回折で評価した評価結果を示す。X線回折の評価結果より、CuIn0.7Ga0.3Se2が得られたことを確認した。十分な量のカルコゲン化合物(CuIn0.7Ga0.3Se2)を生成させるには、カルコゲン化反応時に少なくとも220℃以上の反応温度が必要なことが分かった。また、試料8、9、10で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は7nm〜13nmであった。
【0120】
図32は実施例1と同様の方法による試料9、試料10、試料11についての蛍光X線の分析結果である。これにより、試料9、試料10、試料11について、目的とする組成比(Cu:In:Ga:Se=1:0.7:0.3:2)に近いカルコゲン化合物が得られていることが、確認された。
【実施例11】
【0121】
CuとInの原子比(Cu:In)が1:1の組成になるように硝酸銅0.01molと硝酸インジウム0.01molを純水200mlに溶かした溶液を250mlのフラスコに入れた。続いてフラスコ内を300rpmで直径5cmの羽を回転し攪拌した状態で、溶液温度20℃のシュウ酸の飽和溶液を滴下して沈殿させ、シュウ酸塩の共沈物を生成した。前記シュウ酸溶液の滴下は、液のpHが8.5になるまで続けた。この後、この共沈物と溶液をヌッチェを用いてろ過しシュウ酸塩のケーキを得た。この後、シュウ酸塩のケーキを50℃で真空乾燥させた。この乾燥したシュウ酸塩5gを250mlの三口のフラスコに投入し、更に還元性溶媒であるプロピレングリコール(PEG)75gを加えて、300rpmで直径5cmの羽を回転し攪拌し、窒素で100ml/minでバブリングし、CuとSeの原子比(Cu:Se)が1:2.1になるようにSe粉(カルコゲン源)を過剰に添加し、混合溶媒とした。この状態で150℃〜300℃の図33に示した10種類の反応温度で10時間混合溶媒を加熱して、カルコゲン化合物の生成を試みた。この後、反応性生物を含む混合溶媒をヌッチェを用いてろ過しケーキを得た後、純水でケーキを再分散して、更にろ過を繰り返し、ろ液の導電率が10−2Sm−1以下にして粉を真空乾燥した。得られたカルコゲン化合物粉(試料1から試料10)を実施例1と同様の方法で評価した。
【0122】
図33は、この結果を示す。X線回折の評価結果より、CuIn0.5Ga0.5Se2が得られたことを確認した。十分な量のカルコゲン化合物(CuIn0.5Ga0.5Se2)を生成させるには、カルコゲン化反応時に少なくとも220℃以上の反応温度が必要なことが分かった。また、試料8、試料9、試料10で作製したカルコゲン化合物粉の粒径をTEMで調べた結果、いずれも平均粒径(DTEM)は7nm〜13nmであった。
【0123】
図34は実施例1と同様の方法によるカルコゲン化合物(試料8)のX線解析結果を示すグラフであり、図35は実施例1と同様の方法による蛍光X線の分析結果である。これらより、試料8では、CuIn0.5Ga0.5Se2であることを示すピーク以外のピークは認められず(図34)、試料9、10、11について、目的とする組成比(Cu:In:Ga:Se=1:0.5:0.5:2)に近いカルコゲン化合物が得られていることが、確認された(図35)。
【図面の簡単な説明】
【0124】
【図1】本発明の実施形態を説明するフロー図である。
【図2】本発明の実施例1による試料の粒径および状態を評価した結果である。
【図3】本発明の実施例1によるカルコゲン化合物の生成状態を評価した結果である。
【図4】本発明の実施例1によるカルコゲン化合物のX線回折結果を示すグラフである。
【図5】本発明の実施例1によるカルコゲン化合物の蛍光X線による分析の結果である。
【図6】本発明の実施例1の比較例についてカルコゲン化合物の生成状態を評価した結果である。
【図7】本発明の実施例2による試料の粒径および状態を評価した結果である。
【図8】本発明の実施例2によるカルコゲン化合物の生成状態を評価した結果である。
【図9】本発明の実施例2によるカルコゲン化合物のX線回折結果を示すグラフである。
【図10】本発明の実施例2によるカルコゲン化合物の蛍光X線による分析の結果である。
【図11】本発明の実施例3によるカルコゲン化合物の生成状態を評価した結果である。
【図12】本発明の実施例3によるカルコゲン化合物のX線回折結果を示すグラフである。
【図13】本発明の実施例3によるカルコゲン化合物の蛍光X線による分析の結果である。
【図14】本発明の実施例4によるカルコゲン化合物の生成状態を評価した結果である。
【図15】本発明の実施例4によるカルコゲン化合物のX線回折結果を示すグラフである。
【図16】本発明の実施例4によるカルコゲン化合物の蛍光X線による分析の結果である。
【図17】本発明の実施例5によるカルコゲン化合物の生成状態を評価した結果である。
【図18】本発明の実施例5によるカルコゲン化合物の蛍光X線による分析の結果である。
【図19】本発明の実施例6によるカルコゲン化合物の生成状態を評価した結果である。
【図20】本発明の実施例6によるカルコゲン化合物の蛍光X線による分析の結果である。
【図21】本発明の実施例6によるカルコゲン化合物の生成状態を評価した結果である。
【図22】本発明の実施例7による試料の粒径および状態を評価した結果である。
【図23】本発明の実施例7によるカルコゲン化合物の生成状態を評価した結果である。
【図24】本発明の実施例7によるカルコゲン化合物のX線回折結果を示すグラフである。
【図25】本発明の実施例7によるカルコゲン化合物の蛍光X線による分析の結果である。
【図26】本発明の実施例8による試料の粒径および状態を評価した結果である。
【図27】本発明の実施例8によるカルコゲン化合物の生成状態を評価した結果である。
【図28】本発明の実施例8によるカルコゲン化合物の蛍光X線による分析の結果である。
【図29】本発明の実施例9によるカルコゲン化合物の生成状態を評価した結果である。
【図30】本発明の実施例9によるカルコゲン化合物の蛍光X線による分析の結果である。
【図31】本発明の実施例10によるカルコゲン化合物の生成状態を評価した結果である。
【図32】本発明の実施例10によるカルコゲン化合物の蛍光X線による分析の結果である。
【図33】本発明の実施例11によるカルコゲン化合物の生成状態を評価した結果である。
【図34】本発明の実施例11によるカルコゲン化合物のX線回折結果を示すグラフである。
【図35】本発明の実施例11によるカルコゲン化合物の蛍光X線による分析の結果である。
【特許請求の範囲】
【請求項1】
溶媒に金属水酸化物または金属酸化物の金属化合物粉末と、硫黄、セレン、テルルから選択される単体、または前記元素群から選択される1種以上を含む化合物を添加して混合溶媒を生成する工程と、
該混合溶媒を200℃〜500℃の温度で加熱する工程と、
を具備することを特徴とするカルコゲン化合物粉の製造方法。
【請求項2】
前記溶媒が、還元性溶媒であることを特徴とする請求項1に記載のカルコゲン化合物粉の製造方法。
【請求項3】
前記混合溶媒は、220℃〜400℃で加熱することを特徴とする請求項1または請求項2に記載のカルコゲン化合物粉の製造方法。
【請求項4】
前記金属化合物粉末が、遷移金属元素、III族金属元素、及びVI族金属元素からなる群より選択される化合物を含むことを特徴とする請求項1から請求項3のいずれかに記載のカルコゲン化合物粉の製造方法。
【請求項5】
前記遷移金属元素が、Fe、Co、Cu、Cr、Mn、Ni、Cd、Zn、Ti、V、La、Ce、Pr、Nd、Sm、Eu、Gd、Dy、Er、Ybの中、1種以上を含むことを特徴とする請求項4に記載のカルコゲン化合物粉の製造方法。
【請求項6】
前記III族金属元素が、Al、Ga、Tl及びInを含むことを特徴とする請求項4に記載のカルコゲン化合物粉の製造方法。
【請求項7】
前記VI族金属元素がSn及びPbを含むことを特徴とする請求項4に記載のカルコゲン化合物粉の製造方法。
【請求項8】
前記溶媒は、沸点が220℃から400℃の範囲のアルコール系溶媒であることを特徴とする請求項1から請求項3のいずれかに記載のカルコゲン化合物粉の製造方法。
【請求項9】
前記金属酸化物は、70℃〜300℃の範囲内で前記金属水酸化物を加熱する水酸化物の脱水反応によって得られることを特徴とする請求項1から請求項3のいずれかに記載のカルコゲン化合物粉の製造方法。
【請求項10】
前記金属化合物粉末は、金属塩を溶媒に溶解し、アルカリを添加して生成することを特徴とする請求項1から請求項3のいずれかに記載のカルコゲン化合物粉の製造方法。
【請求項11】
前記金属塩が、金属ハロゲン化物、金属カルボン酸塩、金属炭酸塩、金属硝酸塩、金属硫酸塩のいずれかの群より選択されることを特徴とする請求項10に記載のカルコゲン化合物粉の製造方法。
【請求項1】
溶媒に金属水酸化物または金属酸化物の金属化合物粉末と、硫黄、セレン、テルルから選択される単体、または前記元素群から選択される1種以上を含む化合物を添加して混合溶媒を生成する工程と、
該混合溶媒を200℃〜500℃の温度で加熱する工程と、
を具備することを特徴とするカルコゲン化合物粉の製造方法。
【請求項2】
前記溶媒が、還元性溶媒であることを特徴とする請求項1に記載のカルコゲン化合物粉の製造方法。
【請求項3】
前記混合溶媒は、220℃〜400℃で加熱することを特徴とする請求項1または請求項2に記載のカルコゲン化合物粉の製造方法。
【請求項4】
前記金属化合物粉末が、遷移金属元素、III族金属元素、及びVI族金属元素からなる群より選択される化合物を含むことを特徴とする請求項1から請求項3のいずれかに記載のカルコゲン化合物粉の製造方法。
【請求項5】
前記遷移金属元素が、Fe、Co、Cu、Cr、Mn、Ni、Cd、Zn、Ti、V、La、Ce、Pr、Nd、Sm、Eu、Gd、Dy、Er、Ybの中、1種以上を含むことを特徴とする請求項4に記載のカルコゲン化合物粉の製造方法。
【請求項6】
前記III族金属元素が、Al、Ga、Tl及びInを含むことを特徴とする請求項4に記載のカルコゲン化合物粉の製造方法。
【請求項7】
前記VI族金属元素がSn及びPbを含むことを特徴とする請求項4に記載のカルコゲン化合物粉の製造方法。
【請求項8】
前記溶媒は、沸点が220℃から400℃の範囲のアルコール系溶媒であることを特徴とする請求項1から請求項3のいずれかに記載のカルコゲン化合物粉の製造方法。
【請求項9】
前記金属酸化物は、70℃〜300℃の範囲内で前記金属水酸化物を加熱する水酸化物の脱水反応によって得られることを特徴とする請求項1から請求項3のいずれかに記載のカルコゲン化合物粉の製造方法。
【請求項10】
前記金属化合物粉末は、金属塩を溶媒に溶解し、アルカリを添加して生成することを特徴とする請求項1から請求項3のいずれかに記載のカルコゲン化合物粉の製造方法。
【請求項11】
前記金属塩が、金属ハロゲン化物、金属カルボン酸塩、金属炭酸塩、金属硝酸塩、金属硫酸塩のいずれかの群より選択されることを特徴とする請求項10に記載のカルコゲン化合物粉の製造方法。
【図1】


【図2】


【図3】


【図5】


【図6】


【図7】


【図8】


【図10】


【図11】


【図13】


【図14】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図35】


【図4】


【図9】


【図12】


【図15】


【図24】


【図34】




【図2】


【図3】


【図5】


【図6】


【図7】


【図8】


【図10】


【図11】


【図13】


【図14】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図35】


【図4】


【図9】


【図12】


【図15】


【図24】


【図34】


【公開番号】特開2010−105887(P2010−105887A)
【公開日】平成22年5月13日(2010.5.13)
【国際特許分類】
【出願番号】特願2008−281793(P2008−281793)
【出願日】平成20年10月31日(2008.10.31)
【出願人】(506334182)DOWAエレクトロニクス株式会社 (336)
【Fターム(参考)】
【公開日】平成22年5月13日(2010.5.13)
【国際特許分類】
【出願日】平成20年10月31日(2008.10.31)
【出願人】(506334182)DOWAエレクトロニクス株式会社 (336)
【Fターム(参考)】
[ Back to top ]

