カルバゾリル基を含有する有機エレクトロルミネッセンス素子用電荷輸送材料およびその用途
【課題】高いTgを有しながらも、分子が結晶化しにくく、有機EL素子用材料として用いた場合に、低電圧駆動、長寿命であるなどの優れた特性を有する有機EL素子用電荷輸送材料を提供する。
【解決手段】下記一般式[1]で表されるカルバゾリル基を有する有機エレクトロルミネッセンス素子用電荷輸送材料。一般式[1]

(式中、Xは、フルオレン基を有する連結基を表す。)
【解決手段】下記一般式[1]で表されるカルバゾリル基を有する有機エレクトロルミネッセンス素子用電荷輸送材料。一般式[1]

(式中、Xは、フルオレン基を有する連結基を表す。)
【発明の詳細な説明】
【技術分野】
【0001】
本発明は新規なカルバゾリル含有有機エレクトロルミネッセンス素子用材料に関し、さらに詳しくは、有機エレクトロルミネッセンス素子(以下有機EL素子と略記)に用いた場合、分子の結晶性が低く、かつ、ガラス転移温度(Tg)が高いため、優れた性能(低電圧駆動、長寿命、高安定性)を有するカルバゾリル含有有機エレクトロルミネッセンス素子用電荷輸送材料に関する。
【背景技術】
【0002】
従来、カルバゾ−ル誘導体は各種機能材料、電子材料への応用が検討されてきた。カルバゾ−ル骨格が、正孔輸送性の性質を有すること、耐熱性の高い構造であることを利用して、例えば、電子写真感光体の電荷輸送材料や有機EL素子用材料等への応用が検討されている。代表的なものとしては、ポリビニルカルバゾ−ル(PVK)や、N,N’−ジカルバゾリル−4,4’−ビフェニル(CBP)は有機EL素子用材料として広く検討されている(非特許文献1,2参照)。通常高温環境下で有機EL素子を駆動させたり、保管したりすると、発光色の変化、発光効率の低下、駆動電圧の上昇、発光寿命の短時間化等の悪影響が生じる。これを防ぐためには材料のガラス転移温度(Tg)を高くする必要がある。PVKやCBPのようなカルバゾ−ル類はTgが比較的高く、耐熱性を有しているものの、対称性の高い構造故、真空蒸着や、スピンコ−ティングなどで薄膜を形成した際に、膜の安定性が低く、容易に結晶化してしまい、素子の寿命が極端に短いという問題点を有していた。
【0003】
このような状況の中、N−エチルカルバゾ−ルの3位をアミノ基で置換したアミン化合物が開示されている(非特許文献3,4,特許文献1参照)。これらのジアミン化合物は、正孔注入材料、正孔輸送材料として適正なIpを有していることと、カルバゾ−ル環の非対称性によって非結晶性となっているため、高い膜安定性を有しているが、一方でTgがそれほど高くなく、耐熱性に劣りEL素子として十分な寿命特性が得られなかった。
【0004】
また、低分子のカルバゾリル基を有する誘導体としては、2価の連結基で結ばれたチオフェン誘導体やナフタレン誘導体、フルオレン誘導体、スピロ誘導体が報告されている(特許文献2〜3参照)。しかし、これら誘導体を用いて作成した有機EL素子は、発光寿命が短く、色純度が優れていないという問題点を有している。
【0005】
【非特許文献1】Applied Physics Letters,2001年発行,78巻,278頁
【非特許文献2】Journal of the American Chemicaal Society 2001年発行,123巻,4304頁
【非特許文献3】European Polymer Journal 2005年発行,41巻,1821頁
【非特許文献4】Environmental and Chemical Physics 2002年発行, 24巻, 30頁
【特許文献1】特表2004−536134号公報
【特許文献2】WO03/090502号公報
【特許文献3】特表2004−217557号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明の課題は、高いTgを有しながらも、分子が結晶化しにくく、有機EL素子用材料として用いた場合に、低電圧駆動、長寿命であり、かつ、昇華法等による精製の際、有機材料に対するダメ−ジが少なく、精製も容易であるなどの優れた特性を有する有機EL素子用電荷輸送材料を提供することである。
【課題を解決するための手段】
【0007】
本発明者らは、前記諸問題を解決するために、鋭意研究を重ねた結果、本発明に至った。
すなわち本発明は、下記一般式[1]で表されるカルバゾリル基を有する有機EL素子用電荷輸送材料に関する。
【0008】
一般式[1]
【化1】

【0009】
(式中、Xは、一般式[2]または[3]で表される連結基を表す。
Ar1およびAr2は、それぞれ独立に、置換もしくは未置換の1価の芳香族炭化水素基、または、置換もしくは未置換の1価の芳香族複素環基を表す。
R1〜R14は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。)
【0010】
一般式[2]
【化2】

【0011】
(式中、R15およびR16は、それぞれ独立に、水素原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表し、
R17〜R22は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。)
【0012】
一般式[3]
【化3】

【0013】
(式中、R23〜R36は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。)
【0014】
また、本発明は、Ar1およびAr2が、それぞれ独立に、下記一般式[4]で表される置換もしくは未置換のフェニル基である有機エレクトロルミネッセンス素子用電荷輸送材料に関する。
【0015】
一般式[4]
【化4】

【0016】
(式中、R37〜R41は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換もしくは未置換の置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。また、R37〜R41は、隣接した置換基同士が結合し、新たな環を形成しても良い。)
【0017】
また、本発明は、R37〜R41が水素原子である上記のカルバゾリル基を有する有機EL素子用電荷輸送材料に関する。
【0018】
また、本発明は、正孔注入材料または正孔輸送材料である、上記のカルバゾリル基を有する有機EL素子用電荷輸送材料に関する。
【0019】
また、本発明は、一対の電極間に、正孔注入層および/または正孔輸送層を有する有機エレクトロルミネッセンス素子において、前記正孔注入層および/または正孔輸送層が、上記の有機EL素子用材料であることに関する。
【発明の効果】
【0020】
本発明の有機EL素子用材料を有機EL素子用材料として用いた有機EL素子は、薄膜の安定性が非常に高く、低い駆動電圧で発光し、かつ、長寿命であるため、壁掛けテレビ等のフラットパネルディスプレイや平面発光体として好適に使用することができ、複写機やプリンタ−等の光源、液晶ディスプレイや計器類等の光源、表示板、標識灯等への応用が可能である。
【発明を実施するための最良の形態】
【0021】
以下、詳細にわたって本発明を説明する。
【0022】
一般式[1]におけるR1〜R14は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。
【0023】
ここで、ハロゲン原子としては、フッ素原子、塩素原子、臭素原子、ヨウ素原子が挙げられる。
【0024】
ここで、1価の脂肪族炭化水素基としては、炭素数1〜18の1価の脂肪族炭化水素基を指し、そのようなものとしては、アルキル基、アルケニル基、アルキニル基、シクロアルキル基が挙げられる。
【0025】
また、アルキル基としては、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、ペンチル基、イソペンチル基、ヘキシル基、ヘプチル基、オクチル基、デシル基、ドデシル基、ペンタデシル基、オクタデシル基といった炭素数1〜18のアルキル基が挙げられる。
【0026】
また、アルケニル基としては、ビニル基、1−プロペニル基、2−プロペニル基、イソプロペニル基、1−ブテニル基、2−ブテニル基、3−ブテニル基、1−オクテニル基、1−デセニル基、1−オクタデセニル基といった炭素数2〜18のアルケニル基が挙げられる。
【0027】
また、アルキニル基としては、エチニル基、1−プロピニル基、2−プロピニル基、1−ブチニル基、2−ブチニル基、3−ブチニル基、1−オクチニル基、1−デシニル基、1−オクタデシニル基といった炭素数2〜18のアルキニル基が挙げられる。
【0028】
また、シクロアルキル基としては、シクロプロピル基、シクロブチル基、シクロペンチル基、シクロヘキシル基、シクロヘプチル基、シクロオクチル基、シクロオクタデシル基といった炭素数3〜18のシクロアルキル基が挙げられる。
【0029】
さらに、1価の芳香族炭化水素基としては、1価の単環、縮合環、環集合炭化水素基が挙げられる。ここで、1価の単環芳香族炭化水素基としては、フェニル基、o−トリル基、m−トリル基、p−トリル基、2,4−キシリル基、p−クメニル基、メシチル基等の炭素数6〜18の1価の単環芳香族炭化水素基が挙げられる。
【0030】
また、1価の縮合環炭化水素基としては、1−ナフチル基、2−ナフチル基、1−アンスリル基、2−アンスリル基、5−アンスリル基、1−フェナンスリル基、9−フェナンスリル基、1−アセナフチル基、2−アズレニル基、1−ピレニル基、2−トリフェニレル基等の炭素数10〜18の1価の縮合環炭化水素基が挙げられる。
【0031】
また、1価の環集合炭化水素基としては、o−ビフェニリル基、m−ビフェニリル基、p−ビフェニリル基等の炭素数12〜18の1価の環集合炭化水素基が挙げられる。
【0032】
また、1価の脂肪族複素環基としては、2−ピラゾリノ基、ピペリジノ基、モルホリノ基、2−モルホリニル基といった炭素数3〜18の1価の脂肪族複素環基が挙げられる。
【0033】
また、1価の芳香族複素環基としては、トリアゾリル基、3−オキサジアゾリル基、2−フラニル基、3−フラニル基、2−フリル基、3−フリル基、2−チエニル基、3−チエニル基、1−ピロ−リル基、2−ピロ−リル基、3−ピロ−リル基、2−ピリジル基、3−ピリジル基、4−ピリジル基、2−ピラジル基、2−オキサゾリル基、3−イソオキサゾリル基、2−チアゾリル基、3−イソチアゾリル基、2−イミダゾリル基、3−ピラゾリル基、2−キノリル基、3−キノリル基、4−キノリル基、5−キノリル基、6−キノリル基、7−キノリル基、8−キノリル基、1−イソキノリル基、2−キノキサリニル基、2−ベンゾフリル基、2−ベンゾチエニル基、N−インドリル基、N−カルバゾリル基、N−アクリジニル基、2−チオフェニル基、3−チオフェニル基、ビピリジル基、フェナントロリル基といった炭素数2〜18の1価の芳香族複素環基が挙げられる。
【0034】
また、アルコキシル基としては、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基、tert−ブトキシ基、オクチルオキシ基、tert−オクチルオキシ基といった炭素数1〜8のアルコキシル基が挙げられる。
【0035】
また、アリ−ルオキシ基としては、フェノキシ基、4−tert−ブチルフェノキシ基、1−ナフチルオキシ基、2−ナフチルオキシ基、9−アンスリルオキシ基といった炭素数6〜14のアリ−ルオキシ基が挙げられる。
【0036】
また、アルキルチオ基としては、メチルチオ基、エチルチオ基、tert−ブチルチオ基、ヘキシルチオ基、オクチルチオ基といった炭素数1〜8のアルキルチオ基が挙げられる。
【0037】
また、アリ−ルチオ基としては、フェニルチオ基、2−メチルフェニルチオ基、4−tert−ブチルフェニルチオ基といった炭素数6〜14のアリ−ルチオ基が挙げられる。
【0038】
また、置換アミノ基としては、N−メチルアミノ基、N−エチルアミノ基、N,N−ジエチルアミノ基、N,N−ジイソプロピルアミノ基、N,N−ジブチルアミノ基、N−ベンジルアミノ基、N,N−ジベンジルアミノ基、N−フェニルアミノ基、N−フェニル−N−メチルアミノ基、N,N−ジフェニルアミノ基、N,N−ビス(m−トリル)アミノ基、N,N−ビス(p−トリル)アミノ基、N,N−ビス(p−ビフェニリル)アミノ基、ビス[4−(4−メチル)ビフェニリル]アミノ基、N−α−ナフチル−N−フェニルアミノ基、N−β−ナフチル−N−フェニルアミノ基等の炭素数2〜26の置換アミノ基が挙げられる。
【0039】
また、アシル基としては、アセチル基、プロピオニル基、ピバロイル基、シクロヘキシルカルボニル基、ベンゾイル基、トルオイル基、アニソイル基、シンナモイル基等の炭素数2〜14のアシル基が挙げられる。
【0040】
また、アルコキシカルボニル基としては、メトキシカルボニル基、エトキシカルボニル基、ベンジルオキシカルボニル基等の炭素数2〜14のアルコキシカルボニル基が挙げられる。
【0041】
また、アリ−ルオキシカルボニル基としては、フェノキシカルボニル基、ナフチルオキシカルボニル基等の炭素数2〜14のアリ−ルオキシカルボニル基が挙げられる。
【0042】
また、アルキルスルホニル基としては、メシル基、エチルスルホニル基、プロピルスルホニル基等の炭素数2〜14のアルキルスルホニル基が挙げられる。
【0043】
また、アリ−ルスルホニル基としては、ベンゼンスルホニル基、p−トルエンスルホニル基等の炭素数2〜14のアリ−ルスルホニル基が挙げられる。
【0044】
これらR1〜R14における、1価の脂肪族炭化水素基、芳香族炭化水素基、脂肪族複素環基、芳香族複素環基は、さらに他の置換基によって置換されていても良い。そのような置換基としては、ハロゲン原子、シアノ基、アルコキシル基、アリ−ルオキシ基、アルキルチオ基、アリ−ルチオ基、置換アミノ基、アシル基、アルコキシカルボニル基、アリ−ルオキシカルボニル基、アルキルスルホニル基、アリ−ルスルホニル基等が挙げられる。これらの置環基の例としては、前述のものが挙げられる。
【0045】
一般式[1]における、Ar1およびAr2は、それぞれ独立に、置換もしくは未置換の1価の芳香族炭化水素基、または、置換もしくは未置換の1価の芳香族複素環基を表す。ここで、1価の芳香族炭化水素基、1価の芳香族複素環基は、先に示したR1〜R14における、1価の芳香族炭化水素基、1価の芳香族複素環基と同義である。
【0046】
Ar1として好ましいものとしては、置換もしくは未置換の炭素数10〜18の1価の芳香族炭化水素基、一般式[4]で表される置換もしくは未置換のフェニル基が挙げられる。
【0047】
ここで、炭素数10〜18の1価の芳香族炭化水素基としては、R1〜R14における1価の芳香族炭化水素基で説明したもののうち該当する炭素数のものと同義である。
【0048】
一般式[2]中のR15およびR16は、それぞれ独立に、水素原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表し、R17〜R22は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換もしくは未置換の置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。
【0049】
ここで、R15〜R22における、ハロゲン原子、1価の脂肪族炭化水素基、1価の芳香族炭化水素基1価の脂肪族複素環基、1価の芳香族複素環基、シアノ基、アルコキシル基、アリ−ルオキシ基、アルキルチオ基、アリ−ルチオ基、置換アミノ基、アシル基、アルコキシカルボニル基、アリ−ルオキシカルボニル基、アルキルスルホニル基、アリ−ルスルホニル基としては、R1〜R14における、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、アルコキシル基、アリ−ルオキシ基、アルキルチオ基、アリ−ルチオ基、置換アミノ基、アシル基、アルコキシカルボニル基、アリ−ルオキシカルボニル基、アルキルスルホニル基、アリ−ルスルホニル基と同義である。
【0050】
またR15〜R22が有してもよい置換基としては、前述のR1〜R14が有してもよい置換基が挙げられる。
【0051】
一般式[2]中のR15およびR16として、好ましいものとしては、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基が挙げられ、さらに好ましいものは、置換もしくは未置換の1価の芳香族炭化水素基が挙げられる。
【0052】
一般式[2]中のR17〜R22として、好ましいものとしては、水素原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基が挙げられ、さらに好ましいものは、水素原子、置換もしくは未置換の1価の芳香族炭化水素基が挙げられ、特に好ましいものは、水素原子が挙げられる。
【0053】
一般式[3]中のR23〜R36は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。
【0054】
ここで、R23〜R36における、ハロゲン原子、1価の脂肪族炭化水素基、1価の芳香族炭化水素基、1価の脂肪族複素環基、1価の芳香族複素環基、シアノ基、アルコキシル基、アリ−ルオキシ基、アルキルチオ基、アリ−ルチオ基、置換アミノ基、アシル基、アルコキシカルボニル基、アリ−ルオキシカルボニル基、アルキルスルホニル基、アリ−ルスルホニル基としては、R1〜R14における、ハロゲン原子、1価の脂肪族炭化水素基、1価の芳香族炭化水素基、1価の脂肪族複素環基、1価の芳香族複素環基、シアノ基、アルコキシル基、アリ−ルオキシ基、アルキルチオ基、アリ−ルチオ基、置換アミノ基、アシル基、アルコキシカルボニル基、アリ−ルオキシカルボニル基、アルキルスルホニル基、アリ−ルスルホニル基と同義である。
【0055】
またR23〜R36が有してもよい置換基としては、前述のR1〜R14が有してもよい置換基が挙げられる。
【0056】
一般式[3]中のR23〜R36として、好ましいものとしては、水素原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基が挙げられ、さらに好ましいものは、水素原子、置換もしくは未置換の1価の芳香族炭化水素基が挙げられ、特に好ましいものは、水素原子が挙げられる。
【0057】
一般式[4]中のR37〜R41は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。
【0058】
また、R37〜R41における、ハロゲン原子、1価の脂肪族炭化水素基、1価の芳香族炭化水素基、1価の脂肪族複素環基、1価の芳香族複素環基、シアノ基、アルコキシル基、アリ−ルオキシ基、アルキルチオ基、アリ−ルチオ基、置換アミノ基、アシル基、アルコキシカルボニル基、アリ−ルオキシカルボニル基、アルキルスルホニル基、または、アリ−ルスルホニル基は、R1〜R14における、ハロゲン原子、1価の脂肪族炭化水素基、1価の芳香族炭化水素基、1価の脂肪族複素環基、1価の芳香族複素環基、シアノ基、アルコキシル基、アリ−ルオキシ基、アルキルチオ基、アリ−ルチオ基、置換アミノ基、アシル基、アルコキシカルボニル基、アリ−ルオキシカルボニル基、アルキルスルホニル基、または、アリ−ルスルホニル基と同義である。
【0059】
また、R37〜R41が有してもよい置換基としては、前述のR1〜R14が有してもよい置換基が挙げられる。
【0060】
また、R37〜R41は、隣接した置換基同士が結合し、新たな環を形成しても良い。形成される新たな環としては、1−ナフチル基や2−ナフチル基、キノリル基等が挙げられる。
【0061】
次に、カルバゾリル基のもつ優位性を説明する。
【0062】
一般的に、カルバゾ−ル化合物は、結合を有さないジフェニルアミノ化合物と比較してその構造が強固であり、熱安定性が高い傾向にある(化5参照)。
【0063】
【化5】

【0064】
カルバゾ−ル化合物においては、窒素上のもうひとつの結合位置にはアルキル基を配したN−アルキル化合物が良く知られているが、本発明の化合物は、この位置に結合している置換基(=Ar1)が、芳香族基、または、複素芳香族基であることを特徴のひとつとしている。芳香族基や複素芳香族基は、さらに、安定性を高める効果が大きく、その中でも、安定性を高める効果が期待できるのが、Ar1が一般式[4]、すなわち、フェニル基である場合である。
【0065】
ところで、3位で結合したカルバゾリル基の効果について触れておく。通常、アミノ基は電子ドナ−として働くが、カルバゾ−ルの窒素原子は、窒素原子上に結合した置換基に対してはドナ−性をほとんど有さない。これはカルバゾ−ル環が平面性を有していて、かつ、非常に嵩高い置換基となってしまっているためであり、窒素原子上の置換基と平面構造をとりにくい事に起因していると考えられる。逆に、3位で結合したカルバゾ−ル環は環の平面性があるため、そのベンゼン環部分に対しては電子ドナ−性となりうる(化6参照)。
【0066】
【化6】

【0067】
このような理由から、本発明のカルバゾリル基を有する有機EL素子用材料は、イオン化ポテンシャルの小さな化合物(有機分子の基底状態がより高いレベルにある化合物)となりやすく、有機EL素子を作成する際には、正孔注入輸送性の高い化合物とすることが可能である。
【0068】
さらに、3位で結合したカルバゾ−ル環は、窒素原子上で結合したカルバゾ−ル環に比較して、分子の対称性が低いので、分子の結晶性が低くなり、アモルファス性が高くなるため、薄膜形成した際の安定性向上にも大きく寄与することが可能である。
【0069】
特に、本発明の有機EL素子用材料は、アモルファス性が高く、その結果として結晶化が起こりにくい。この性状は、有機EL素子用の材料として用いる場合、薄膜の安定性が向上し、有機EL素子寿命が長くなる。
【0070】
また、蒸着法により、有機EL素子を作成する際も、分子量が大きいと、蒸着によって素子を作成する場合の蒸着性が悪くなる懸念があるが、本発明の有機EL素子用材料は、蒸着時の有機化合物に対するダメ−ジも少なく、容易に素子作成が可能である。塗布法により、有機EL素子を作成する際も、汎用性有機溶媒に対する溶解性が高いため、広範囲な溶媒での使用が可能となる。
【0071】
本発明の化合物の具体例を、以下の表1に示すが、本発明は、この例に限定されるものではない。
【0072】
表1
【表1】

【0073】
【表1】

【0074】
【表1】

【0075】
【表1】

【0076】
【表1】

【0077】
【表1】

【0078】
【表1】

【0079】
【表1】

【0080】
【表1】

【0081】
【表1】

【0082】
【表1】

【0083】
【表1】

【0084】
本発明の有機EL素子用素子用材料は、種々の用途に用いることができるが、特に好ましくは、有機EL材料(有機EL用正孔注入/輸送材料)として用いられる。
【0085】
ここで、本発明の有機EL素子用正孔注入/輸送材料を用いて作成することができる有機EL素子について詳細に説明する。
【0086】
有機EL素子は、陽極と陰極間に一層または多層の有機層を形成した素子から構成されるが、ここで、一層型有機EL素子とは、陽極と陰極との間に発光層のみからなる素子を指す。一方、多層型有機EL素子とは、発光層の他に、発光層への正孔や電子の注入を容易にしたり、発光層内での正孔と電子との再結合を円滑に行わせることを目的として、正孔注入層、正孔輸送層、正孔阻止層、電子注入層などを積層させたものを指す。したがって、多層型有機EL素子の代表的な素子構成としては、(1)陽極/正孔注入層/発光層/陰極、(2)陽極/正孔注入層/正孔輸送層/発光層/陰極、(3)陽極/正孔注入層/発光層/電子注入層/陰極、(4)陽極/正孔注入層/正孔輸送層/発光層/電子注入層/陰極、(5)陽極/正孔注入層/発光層/正孔阻止層/電子注入層/陰極、(6)陽極/正孔注入層/正孔輸送層/発光層/正孔阻止層/電子注入層/陰極、(7)陽極/発光層/正孔阻止層/電子注入層/陰極、(8)陽極/発光層/電子注入層/陰極等の多層構成で積層した素子構成が考えられる。
【0087】
また、上述した各有機層は、それぞれ二層以上の層構成により形成されても良く、いくつかの層が繰り返し積層されていても良い。そのような例として、近年、光取り出し効率の向上を目的に、上記、多層型有機EL素子の一部の層を多層化する「マルチ・フォトン・エミッション」と呼ばれる素子構成が提案されている。これは例えば、ガラス基板/陽極/正孔輸送層/電子輸送性発光層/電子注入層/電荷発生層/発光ユニット/陰極から構成される有機EL素子に於いて、電荷発生層と発光ユニットの部分を複数層積層するといった方法があげられる。
【0088】
本発明の有機EL素子用正孔注入/輸送材料は、単一の化合物での使用はもちろんのこと、2種類以上の化合物を組み合わせて、すなわち混合、共蒸着、積層するなどして使用することが可能である。
【0089】
本発明の有機EL素子用材料と組み合わせて良い正孔注入材料や正孔輸送材料としては、具体的には、例えばトリアゾ−ル誘導体(米国特許3,112,197号明細書等参照)、オキサジアゾ−ル誘導体(米国特許3,189,447号明細書等参照)、イミダゾ−ル誘導体(特公昭37−16096号公報等参照)、ポリアリ−ルアルカン誘導体(米国特許3,615,402号明細書、同第3,820,989号明細書、同第3,542,544号明細書、特公昭45−555号公報、同51−10983号公報、特開昭51−93224号公報、同55−17105号公報、同56−4148号公報、同55−108667号公報、同55−156953号公報、同56−36656号公報等参照)、ピラゾリン誘導体およびピラゾロン誘導体(米国特許第3,180,729号明細書、同第4,278,746号明細書、特開昭55−88064号公報、同55−88065号公報、同49−105537号公報、同55−51086号公報、同56−80051号公報、同56−88141号公報、同57−45545号公報、同54−112637号公報、同55−74546号公報等参照)、フェニレンジアミン誘導体(米国特許第3,615,404号明細書、特公昭51−10105号公報、同46−3712号公報、同47−25336号公報、特開昭54−53435号公報、同54−110536号公報、同54−119925号公報等参照)、アリ−ルアミン誘導体(米国特許第3,567,450号明細書、同第3,180,703号明細書、同第3,240,597号明細書、同第3,658,520号明細書、同第4,232,103号明細書、同第4,175,961号明細書、同第4,012,376号明細書、特公昭49−35702号公報、同39−27577号公報、特開昭55−144250号公報、同56−119132号公報、同56−22437号公報、西独特許第1,110,518号明細書等参照)、アミノ置換カルコン誘導体(米国特許第3,526,501号明細書等参照)、オキサゾ−ル誘導体(米国特許第3,257,203号明細書等に開示のもの)、スチリルアントラセン誘導体(特開昭56−46234号公報等参照)、フルオレノン誘導体(特開昭54−110837号公報等参照)、ヒドラゾン誘導体(米国特許第3,717,462号明細書、特開昭54−59143号公報、同55−52063号公報、同55−52064号公報、同55−46760号公報、同55−85495号公報、同57−11350号公報、同57−148749号公報、特開平2−311591号公報等参照)、スチルベン誘導体(特開昭61−210363号公報、同第61−228451号公報、同61−14642号公報、同61−72255号公報、同62−47646号公報、同62−36674号公報、同62−10652号公報、同62−30255号公報、同60−93455号公報、同60−94462号公報、同60−174749号公報、同60−175052号公報等参照)、シラザン誘導体(米国特許第4,950,950号明細書)、ポリシラン系(特開平2−204996号公報)、アニリン系共重合体(特開平2−282263号公報)、特開平1−211399号公報に開示されている導電性高分子オリゴマ−(特にチオフェンオリゴマ−)等を挙げることができる。
【0090】
また、正孔注入材料や正孔輸送材料としては上記のものを使用することができるが、ポルフィリン化合物(特開昭63−2956965号公報)、芳香族第三級アミン化合物およびスチリルアミン化合物(米国特許第4,127,412号明細書、特開昭53−27033号公報、同54−58445号公報、同54−149634号公報、同54−64299号公報、同55−79450号公報、同55−144250号公報、同56−119132号公報、同61−295558号公報、同61−98353号公報、同63−295695号公報等参照)を用いることもできる。例えば、米国特許第5,061,569号に記載されている2個の縮合芳香族環を分子内に有する4,4’−ビス(N−(1−ナフチル)−N−フェニルアミノ)ビフェニル等や、特開平4−308688号公報に記載されているトリフェニルアミンユニットが3つスタ−バ−スト型に連結された4,4’,4”−トリス(N−(3−メチルフェニル)−N−フェニルアミノ)トリフェニルアミン等を挙げることができる。また、正孔注入材料として銅フタロシアニンや水素フタロシアニン等のフタロシアニン誘導体もあげられる。さらに、その他、芳香族ジメチリデン系化合物、p型Si、p型SiC等の無機化合物も正孔注入材料や正孔輸送材料の材料として使用することができる。
【0091】
芳香族三級アミン誘導体の具体例としては、例えば、N,N’−ジフェニル−N,N’−(3−メチルフェニル)−1,1’−ビフェニル−4,4’−ジアミン、N,N,N’,N’−(4−メチルフェニル)−1,1’−フェニル−4,4’−ジアミン、N,N,N’,N’−(4−メチルフェニル)−1,1’−ビフェニル−4,4’−ジアミン、N,N’−ジフェニル−N,N’−ジナフチル−1,1’−ビフェニル−4,4’−ジアミン、N,N’−(メチルフェニル)−N,N’−(4−N−ブチルフェニル)−フェナントレン−9,10−ジアミン、N,N−ビス(4−ジ−4−トリルアミノフェニル)−4−フェニル−シクロヘキサン、N,N’−ビス(4’−ジフェニルアミノ−4−ビフェニリル)−N,N’−ジフェニルベンジジン、N,N’−ビス(4’−ジフェニルアミノ−4−フェニル)−N,N’−ジフェニルベンジジン、N,N’−ビス(4’−ジフェニルアミノ−4−フェニル)−N,N’−ジ(1−ナフチル)ベンジジン、N,N’−ビス(4’−フェニル(1−ナフチル)アミノ−4−フェニル)−N,N’−ジフェニルベンジジン、N,N’−ビス(4’−フェニル(1−ナフチル)アミノ−4−フェニル)−N,N’−ジ(1−ナフチル)ベンジジン等があげられ、これらは正孔注入材料、正孔輸送材料いずれにも使用することができる。
【0092】
本発明の化合物(有機EL素子用電荷輸送材料)とともに用いる正孔注入材料、正孔輸送材料はさらに以下一般式[5]〜[10]のようなものを用いることが出来る。
【0093】
一般式[5]
【化7】

【0094】
(式中、Ra11〜Ra14は、それぞれ独立に、水素原子、アルコキシル基、もしくはシアノ基を表すが、全てが同時に水素原子となることはない。)
【0095】
ここで、アルコキシル基としては、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基、tert−ブトキシ基、オクチルオキシ基、tert−オクチルオキシ基、2−ボルニルオキシ基、2−イソボルニルオキシ基、1−アダマンチルオキシ基等の炭素数1〜18のアルコキシル基があげられる。特にRa11〜Ra14の好ましい組み合わせとしては、Ra11〜Ra14が全てメトキシ基、エトキシ基、もしくはシアノ基の場合であることが好ましい。
【0096】
一般式[6]
【化8】

【0097】
(式中、Z21は連結基であり、単結合、2価の脂肪族炭化水素基、2価の芳香族炭化水素基、酸素原子、硫黄原子のいずれかを表す。Ra21〜Ra26は、それぞれ独立に、1価の芳香族炭化水素基を表す。)
【0098】
Z21の連結基としては、単結合、ビニレン基、o−フェニレン基、m−フェニレン基、p−フェニレン基、1,4−ナフチレン基、2,6−ナフチレン基、9,10−フェナントリレン基、9,10−アンスリレン基が好ましく、単結合、ビニレン基、p−フェニレン基、1,4−ナフチレン基がさらに好ましい。また、Ra21〜Ra26としては、フェニル基、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基より選ばれる1価の芳香族炭化水素基が好ましい。
【0099】
一般式[7]
【化9】

【0100】
(式中、Z31は連結基であり、単結合、2価の脂肪族炭化水素基、2価の芳香族炭化水素基、酸素原子、硫黄原子のいずれかを表す。Ra31〜Ra36は、それぞれ独立に、1価の芳香族炭化水素基を表す。)
【0101】
Z31の連結基としては、単結合、ビニレン基、o−フェニレン基、m−フェニレン基、p−フェニレン基、1,4−ナフチレン基、2,6−ナフチレン基、9,10−フェナントリレン基、9,10−アンスリレン基が好ましく、単結合、ビニレン基、p−フェニレン基、1,4−ナフチレン基がさらに好ましい。また、Ra31〜Ra36としては、フェニル基、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基より選ばれる1価の芳香族炭化水素基が好ましい。
【0102】
一般式[8]
【0103】
【化10】

【0104】
(式中、Ra41〜Ra48は、それぞれ独立に、1価の芳香族炭化水素基を表す。)
【0105】
Ra41〜Ra48としては、フェニル基、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基より選ばれる1価の芳香族炭化水素基が好ましい。
【0106】
一般式[9]
【化11】

【0107】
(式中、Ra51〜Ra56は、それぞれ独立に、1価の芳香族炭化水素基を表す。)
【0108】
Ra51〜Ra56としては、フェニル基、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基より選ばれる1価の芳香族炭化水素基が好ましい。
【0109】
一般式[10]
【化12】

【0110】
(式中、Ra61〜Ra64は、それぞれ独立に、1価の芳香族炭化水素基を表し、pは1〜4の整数を表す。)
【0111】
Ra61〜Ra64としては、フェニル基、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基より選ばれる1価の芳香族炭化水素基が好ましい。
【0112】
以上述べた一般式[5]〜[10]で示した化合物は、特に正孔注入材料として、本発明の有機EL素子用材料と組み合わせることにより好適に用いられる。以下の表2に特に好ましい例を示す。
【0113】
表2
【表2】

【0114】
【表2】

【0115】
【表2】

【0116】
【表2】

【0117】
また、本発明の有機EL素子用材料と共に用いることが出来る正孔輸送材料としては、下記表3に示す公知の化合物があげられる。
【0118】
表3
【表3】

【0119】
【表3】

【0120】
【表3】

【0121】
【表3】

【0122】
【表3】

【0123】
【表3】

【0124】
【表3】

【0125】
この正孔注入層を形成するには、上述の化合物を、例えば真空蒸着法、スピンコ−ト法、キャスト法、LB法等の公知の方法により薄膜化するが、正孔注入層の膜厚は、特に制限はないが、通常は5nm〜5μmである。
【0126】
一方、電子注入層には、発光層に対して優れた電子注入効果を示し、かつ陰極界面との密着性と薄膜形成性に優れた電子注入層を形成できる電子注入材料が用いられる。そのような電子注入材料の例としては、金属錯体化合物、含窒素五員環誘導体、フルオレノン誘導体、アントラキノジメタン誘導体、ジフェノキノン誘導体、チオピランジオキシド誘導体、ペリレンテトラカルボン酸誘導体、フレオレニリデンメタン誘導体、アントロン誘導体、シロ−ル誘導体、トリアリ−ルホスフィンオキシド誘導体、カルシウムアセチルアセトナ−ト、酢酸ナトリウムなどがあげられる。また、セシウム等の金属をバソフェナントロリンにド−プした無機/有機複合材料(高分子学会予稿集,第50巻,4号,660頁,2001年発行)や、第50回応用物理学関連連合講演会講演予稿集、No.3、1402頁、2003年発行記載のBCP、TPP、T5MPyTZ等も電子注入材料の例としてあげられるが、素子作成に必要な薄膜を形成し、陰極からの電子を注入できて、電子を輸送できる材料であれば、特にこれらに限定されるものではない。
【0127】
上記電子注入材料の中でも特に効果的な電子注入材料としては、金属錯体化合物、含窒素五員環誘導体、シロ−ル誘導体、トリアリ−ルホスフィンオキシド誘導体があげられる。本発明に使用可能な好ましい金属錯体化合物としては、8−ヒドロキシキノリンまたはその誘導体の金属錯体が好適である。8−ヒドロキシキノリンまたはその誘導体の金属錯体の具体例としては、トリス(8−ヒドロキシキノリナ−ト)アルミニウム、トリス(2−メチル−8−ヒドロキシキノリナ−ト)アルミニウム、トリス(4−メチル−8−ヒドロキシキノリナ−ト)アルミニウム、トリス(5−メチル−8−ヒドロキシキノリナ−ト)アルミニウム、トリス(5−フェニル−8−ヒドロキシキノリナ−ト)アルミニウム、ビス(8−ヒドロキシキノリナ−ト)(1−ナフトラ−ト)アルミニウム、ビス(8−ヒドロキシキノリナ−ト)(2−ナフトラ−ト)アルミニウム、ビス(8−ヒドロキシキノリナ−ト)(フェノラ−ト)アルミニウム、ビス(8−ヒドロキシキノリナ−ト)(4−シアノ−1−ナフトラ−ト)アルミニウム、ビス(4−メチル−8−ヒドロキシキノリナ−ト)(1−ナフトラ−ト)アルミニウム、ビス(5−メチル−8−ヒドロキシキノリナ−ト)(2−ナフトラ−ト)アルミニウム、ビス(5−フェニル−8−ヒドロキシキノリナ−ト)(フェノラ−ト)アルミニウム、ビス(5−シアノ−8−ヒドロキシキノリナ−ト)(4−シアノ−1−ナフトラ−ト)アルミニウム、ビス(8−ヒドロキシキノリナ−ト)クロロアルミニウム、ビス(8−ヒドロキシキノリナ−ト)(o−クレゾラ−ト)アルミニウム等のアルミニウム錯体化合物、トリス(8−ヒドロキシキノリナ−ト)ガリウム、トリス(2−メチル−8−ヒドロキシキノリナ−ト)ガリウム、トリス(4−メチル−8−ヒドロキシキノリナ−ト)ガリウム、トリス(5−メチル−8−ヒドロキシキノリナ−ト)ガリウム、トリス(2−メチル−5−フェニル−8−ヒドロキシキノリナ−ト)ガリウム、ビス(2−メチル−8−ヒドロキシキノリナ−ト)(1−ナフトラ−ト)ガリウム、ビス(2−メチル−8−ヒドロキシキノリナ−ト)(2−ナフトラ−ト)ガリウム、ビス(2−メチル−8−ヒドロキシキノリナ−ト)(フェノラ−ト)ガリウム、ビス(2−メチル−8−ヒドロキシキノリナ−ト)(4−シアノ−1−ナフトラ−ト)ガリウム、ビス(2、4−ジメチル−8−ヒドロキシキノリナ−ト)(1−ナフトラ−ト)ガリウム、ビス(2、5−ジメチル−8−ヒドロキシキノリナ−ト)(2−ナフトラ−ト)ガリウム、ビス(2−メチル−5−フェニル−8−ヒドロキシキノリナ−ト)(フェノラ−ト)ガリウム、ビス(2−メチル−5−シアノ−8−ヒドロキシキノリナ−ト)(4−シアノ−1−ナフトラ−ト)ガリウム、ビス(2−メチル−8−ヒドロキシキノリナ−ト)クロロガリウム、ビス(2−メチル−8−ヒドロキシキノリナ−ト)(o−クレゾラ−ト)ガリウム等のガリウム錯体化合物の他、8−ヒドロキシキノリナ−トリチウム、ビス(8−ヒドロキシキノリナ−ト)銅、ビス(8−ヒドロキシキノリナ−ト)マンガン、ビス(10−ヒドロキシベンゾ[h]キノリナ−ト)ベリリウム、ビス(8−ヒドロキシキノリナ−ト)亜鉛、ビス(10−ヒドロキシベンゾ[h]キノリナ−ト)亜鉛等の金属錯体化合物があげられる。
【0128】
また、本発明に使用可能な電子注入材料の内、好ましい含窒素五員環誘導体としては、オキサゾ−ル誘導体、チアゾ−ル誘導体、オキサジアゾ−ル誘導体、チアジアゾ−ル誘導体、トリアゾ−ル誘導体があげられ、具体的には、2,5−ビス(1−フェニル)−1,3,4−オキサゾ−ル、2,5−ビス(1−フェニル)−1,3,4−チアゾ−ル、2,5−ビス(1−フェニル)−1,3,4−オキサジアゾ−ル、2−(4’−tert−ブチルフェニル)−5−(4”−ビフェニル)1,3,4−オキサジアゾ−ル、2,5−ビス(1−ナフチル)−1,3,4−オキサジアゾ−ル、1,4−ビス[2−(5 −フェニルオキサジアゾリル)。)ベンゼン、1,4−ビス[2−(5−フェニルオキサジアゾリル)−4−tert−ブチルベンゼン]、2−(4’−tert− ブチルフェニル)−5−(4”−ビフェニル)−1,3,4−チアジアゾ−ル、2,5−ビス(1−ナフチル)−1,3,4−チアジアゾ−ル、1,4−ビス[2−(5−フェニルチアジアゾリル)。)ベンゼン、2−(4’−tert−ブチルフェニル)−5−(4”−ビフェニル)−1,3,4−トリアゾ−ル、2,5−ビス(1−ナフチル)−1,3,4−トリアゾ−ル、1,4−ビス[2−(5−フェニルトリアゾリル)。]ベンゼン等があげられる。
【0129】
また、本発明に使用可能な電子注入材料の内、特に好ましいオキサジアゾール誘導体としては下記一般式[11]で表されるオキサジアゾール誘導体を示すことができる。
【0130】
一般式[11]
【化13】

【0131】
(式中、Arr1およびArr2は、それぞれ独立に、置換基を有しても良い、1価の芳香族炭化水素基もしくは1価の含窒素芳香族複素環基を表す。)
【0132】
1価の含窒素芳香族複素環基としては、2−ピリジル基、3−ピリジル基、4−ピリジル基、3−ピリダジル基、4−ピリダジル基、2−ピリミジル基、4−ピリミジル基、5−ピリミジル基、2−ピラジル基、1−イミダゾリル基等の1価の含窒素単環芳香族複素環基、2−キノリル基、3−キノリル基、4−キノリル基、5−キノリル基、6−キノリル基、7−キノリル基、8−キノリル基、2−キナゾリル基、4−キナゾリル基、5−キナゾリル基、2−キノキサリル基、5−キノキサリル基、6−キノキサリル基、1−インドリル基、9−カリバゾリル基等の1価の含窒素縮合環芳香族複素環基、2,2’−ビピリジル−3−イル基、2,2’−ビピリジル−4−イル基、3,3’−ビピリジル−2−イル基、3,3’−ビピリジル−4−イル基、4,4’−ビピリジル−2−イル基、4,4’−ビピリジル−3−イル基等の1価の含窒素環集合芳香族複素環基があげられ、さらに、これら1価の含窒素芳香族複素環基上の水素原子は、1価の脂肪族炭化水素基もしくは1価の芳香族炭化水素基で置換されていても良い。
【0133】
Arr1およびArr2として、好ましい1価の芳香族炭化水素基としては、1価の脂肪族炭化水素基もしくは1価の含窒素芳香族複素環基で置換されていても良い、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基があげられ、また好ましい1価の含窒素芳香族複素環基としては、1価の脂肪族炭化水素基もしくは1価の芳香族炭化水素基で置換されていても良い、2−ピリジル基、3−ピリジル基、4−ピリジル基、2,2’−ビピリジル−3−イル基、および2,2’−ビピリジル−4−イル基があげられる。
【0134】
以下、表4に本発明に使用可能なオキサジアゾール誘導体の具体例を示す。
【0135】
表4
【表4】

【0136】
【表4】

【0137】
【表4】

【0138】
【表4】

【0139】
また、本発明に使用可能な電子注入材料の内、特に好ましいトリアゾール誘導体としては、下記一般式[12]で表されるトリアゾール誘導体があげられる。
【0140】
一般式[12]
【化14】

【0141】
(式中、Art1〜Art3は、それぞれ独立に、置換基を有しても良い、1価の芳香族炭化水素基もしくは1価の含窒素芳香族複素環基を表す。)
【0142】
ここで、Art1およびArt2として、好ましい1価の芳香族炭化水素基としては、1価の脂肪族炭化水素基もしくは1価の含窒素芳香族複素環基で置換されていても良い、フェニル基、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基があげられ、また好ましい1価の含窒素芳香族複素環基としては、1価の脂肪族炭化水素基もしくは1価の芳香族炭化水素基で置換されていても良い、2−ピリジル基、3−ピリジル基、4−ピリジル基、2,2’−ビピリジル−3−イル基、および2,2’−ビピリジル−4−イル基があげられる。また、Art3として、好ましい1価の芳香族炭化水素基としては、1価の脂肪族炭化水素基もしくは1価の含窒素芳香族複素環基で置換されていても良い、フェニル基、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基があげられ、また好ましい1価の含窒素芳香族複素環基としては、1価の脂肪族炭化水素基もしくは1価の芳香族炭化水素基で置換されていても良い、2−ピリジル基、3−ピリジル基、および4−ピリジル基があげられる。
【0143】
以下、表5に本発明に使用可能なトリアゾール誘導体の具体例を示す。
【0144】
表5
【表5】

【0145】
【表5】

【0146】
【表5】

【0147】
【表5】

【0148】
【表5】

【0149】
また、本発明に使用可能な電子注入材料の内、特に好ましいシロール誘導体としては、下記一般式[13]で表されるシロール誘導体があげられる。
【0150】
一般式[13]
【化15】

【0151】
(式中、Rp1およびRp2は、それぞれ独立に、置換基を有しても良い、1価の脂肪族炭化水素基、1価の芳香族炭化水素基もしくは1価の含窒素芳香族複素環基を表す。Arp1〜Arp4は、それぞれ独立に、置換基を有しても良い、1価の芳香族炭化水素基もしくは1価の含窒素芳香族複素環基を表す。Rp1、Rp2、Arp1〜Arp4の隣接した基同士は互いに連結して環を形成しても良い。)
【0152】
ここで、Rp1およびRp2として、好ましい1価の脂肪族炭化水素基としては、1価の芳香族炭化水素基もしくは1価の含窒素芳香族複素環基で置換されていても良い、メチル基、エチル基、プロピル基、およびブチル基があげられ、好ましい1価の芳香族炭化水素基としては、1価の脂肪族炭化水素基もしくは1価の含窒素芳香族複素環基で置換されていても良い、フェニル基、m−ビフェニリル基、およびp−ビフェニリル基があげられ、好ましい1価の含窒素芳香族複素環基としては、1価の脂肪族炭化水素基もしくは1価の芳香族炭化水素基で置換されていても良い、2−ピリジル基、3−ピリジル基、4−ピリジル基があげられる。また、Arp1〜Arp4として、好ましい1価の芳香族炭化水素基としては、1価の脂肪族炭化水素基もしくは1価の含窒素芳香族複素環基で置換されていても良い、フェニル基、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基があげられ、また好ましい1価の含窒素芳香族複素環基としては、1価の脂肪族炭化水素基もしくは1価の芳香族炭化水素基で置換されていても良い、2−ピリジル基、3−ピリジル基、4−ピリジル基、2,2’−ビピリジル−3−イル基、および2,2’−ビピリジル−4−イル基があげられる。
【0153】
以下、表6に本発明に使用可能なシロール誘導体の具体例を示す。
【0154】
表6
【表6】

【0155】
【表6】

【0156】
【表6】

【0157】
【表6】

【0158】
【表6】

【0159】
また、本発明に使用可能な電子注入材料の内、好ましいトリアリールホスフィンオキシド誘導体としては、特開2002−63989号公報、特開2004−95221号公報、特開2004−203828号公報、特開2004−204140号公報記載のトリアリールホスフィンオキシド誘導体や下記一般式[14]で表されるトリアリールホスフィンオキシド誘導体を示すことができる。
【0160】
一般式[14]
【化16】

【0161】
(式中、Arq1〜Arq3は、それぞれ独立に、置換基を有しても良い1価の芳香族炭化水素基を表す。)
【0162】
ここでArq1〜Arq3として、好ましい1価の芳香族炭化水素基としては、1価の脂肪族炭化水素基もしくは1価の含窒素芳香族複素環基で置換されていても良い、フェニル基、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基があげられる。
【0163】
以下、表7に本発明に使用可能なトリアリールホスフィンオキシド誘導体の具体例を示す。
【0164】
表7
【表7】

【0165】
【表7】

【0166】
【表7】

【0167】
【表7】

【0168】
【表7】

【0169】
【表7】

【0170】
さらに、正孔阻止層には、発光層を経由した正孔が電子注入層に達するのを防ぎ、薄膜形成性に優れた層を形成できる正孔阻止材料が用いられる。そのような正孔阻止材料の例としては、ビス(8−ヒドロキシキノリナ−ト)(4−フェニルフェノラ−ト)アルミニウム等のアルミニウム錯体化合物や、ビス(2−メチル−8−ヒドロキシキノリナ−ト)(4−フェニルフェノラ−ト)ガリウム等のガリウム錯体化合物、2,9−ジメチル−4,7−ジフェニル−1,10−フェナントロリン(BCP)等の含窒素縮合芳香族化合物があげられる。
【0171】
本発明の有機EL素子の発光層としては、以下の機能を併せ持つものが好適である。
注入機能;電界印加時に陽極または正孔注入層より正孔を注入することができ、陰極または電子注入層より電子を注入することができる機能
輸送機能;注入した電荷(電子と正孔)を電界の力で移動させる機能
発光機能;電子と正孔の再結合の場を提供し、これを発光につなげる機能
ただし、正孔の注入されやすさと電子の注入されやすさには、違いがあってもよく、また正孔と電子の移動度で表される輸送能に大小があってもよいが、どちらか一方の電荷を移動することが好ましい。
【0172】
有機EL素子の発光材料は主に有機化合物であり、具体的には所望の色調により、次のような化合物が用いられる。
【0173】
たとえば、紫外域から紫色の発光を得る場合には、下記一般式[15]で表される化合物が好適に用いられる。
【0174】
一般式[15]
【化17】

【0175】
(式中、X1は下記一般式[16]で表される基を示し、X2は、フェニル基、1−ナフチル基、2−ナフチル基のいずれかを示す。〕
【0176】
一般式[16]
【化18】

【0177】
(式中、mは2〜5の整数を示す)
【0178】
この一般式[15]のX1、X2で表されるフェニル基、1−ナフチル基、2−ナフチル基、フェニレン基は、単数または複数の炭素数1〜4のアルキル基、炭素数1〜4のアルコキシル基、水酸基、スルホニル基、カルボニル基、アミノ基、ジメチルアミノ基またはジフェニルアミノ基等の置換基で置換されていてもよい。また、これら置換基が複数ある場合には、それらが互いに結合し、環を形成していてもよい。さらに、X1で表されるフェニレン基は、パラ位で結合したものが、結合性が良く、かつ平滑な蒸着膜が形成し易いことから好ましい。上記一般式[15]で表される化合物の具体例を示せば、下記のとおりである(ただし、Phはフェニル基を表す)。
【0179】
【化19】

【0180】
【化20】

【0181】
これら化合物の中では、特にp−クォ−タ−フェニル誘導体、p−クインクフェニル誘導体が好ましい。
【0182】
また、可視域、特に青色から緑色の発光を得るためには、例えばベンゾチアゾ−ル系、ベンゾイミダゾ−ル系、ベンゾオキサゾ−ル系等の蛍光増白剤、金属キレ−ト化オキシノイド化合物、スチリルベンゼン系化合物を用いることができる。これら化合物の具体例としては、例えば特開昭59−194393号公報に開示されている化合物を挙げることができる。さらに他の有用な化合物は、ケミストリ−・オブ・シンセティック・ダイズ(1971)628〜637頁および640頁に列挙されている。
【0183】
前記金属キレ−ト化オキシノイド化合物としては、例えば、特開昭63−295695号公報に開示されている化合物を用いることができる。その代表例としては、トリス(8−キノリノ−ル)アルミニウム等の8−ヒドロキシキノリン系金属錯体や、ジリチウムエピントリジオン等が好適な化合物として挙げることができる。
【0184】
また、前記スチリルベンゼン系化合物としては、例えば、欧州特許第0319881号明細書や欧州特許第0373582号明細書に開示されているものを用いることができる。そして、特開平2−252793号公報に開示されているジスチリルピラジン誘導体も、発光層の材料として用いることができる。このほか、欧州特許第0387715号明細書に開示されているポリフェニル系化合物も発光層の材料として用いることができる。
【0185】
さらに、上述した蛍光増白剤、金属キレ−ト化オキシノイド化合物およびスチリルベンゼン系化合物等以外に、例えば12−フタロペリノン(J. Appl. Phys.,第27巻,L713(1988年))、1,4−ジフェニル−1,3−ブタジエン、1,1,4,4−テトラフェニル−1,3−ブタジエン(以上Appl. Phys. Lett.,第56巻,L799(1990年))、ナフタルイミド誘導体(特開平2−305886号公報)、ペリレン誘導体(特開平2−189890号公報)、オキサジアゾ−ル誘導体(特開平2−216791号公報、または第38回応用物理学関係連合講演会で浜田らによって開示されたオキサジアゾ−ル誘導体)、アルダジン誘導体(特開平2−220393号公報)、ピラジリン誘導体(特開平2−220394号公報)、シクロペンタジエン誘導体(特開平2−289675号公報)、ピロロピロ−ル誘導体(特開平2−296891号公報)、スチリルアミン誘導体(Appl. Phys. Lett., 第56巻,L799(1990年)、クマリン系化合物(特開平2−191694号公報)、国際特許公報WO90/13148やAppl. Phys. Lett.,vol58,18,P1982(1991)に記載されているような高分子化合物、9,9’,10,10’−テトラフェニル−2,2’−ビアントラセン、PPV(ポリパラフェニレンビニレン)誘導体、ポリフルオレン誘導体やそれら共重合体等、例えば、下記一般式[17]〜一般式[19]の構造をもつものや、
【0186】
一般式[17]
【化21】

【0187】
(式中、Rx1およびRX2は、それぞれ独立に、1価の脂肪族炭化水素基を、n1は、3〜100の整数を表す。)
【0188】
一般式[18]
【化22】

【0189】
(式中、Rx3およびRX4は、それぞれ独立に、1価の脂肪族炭化水素基を、n2およびn3は、それぞれ独立に、3〜100の整数を表す。)
【0190】
一般式[19]
【化23】

【0191】
(式中、RX5およびRX6は、それぞれ独立に、1価の脂肪族炭化水素基を、n4およびn5は、それぞれ独立に、3〜100の整数を表す。Phはフェニル基を表す。)
【0192】
9,10−ビス(N−(4−(2−フェニルビニル−1−イル)フェニル)−N−フェニルアミノ)アントラセン等も発光層の材料として用いることができる。さらには、特開平8−12600号公報に開示されているような下記一般式[20]で示されるフェニルアントラセン誘導体も発光材料として用いることができる。
【0193】
一般式[20]
【化24】

【0194】
(式中、A1及びA2は、それぞれ独立に、モノフェニルアントリル基またはジフェニルアントリル基を示し、これらは同一でも異なっていてもよい。Lは、単結合または2価の連結基を表す。)
ここで、Lで示される2価の連結基としては、置換基を有しても良い2価の単環もしくは縮合環芳香族炭化水素基が好ましい。特に、以下の一般式[21]ないし一般式[22]で表されるフェニルアントラセン誘導体は好適である。
【0195】
一般式[21]
【化25】

【0196】
(式中、RZ1〜RZ4は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、1価の芳香族炭化水素基、アルコキシル基、アリ−ルオキシ基、ジアリ−ルアミノ基、1価の脂肪族複素環基、1価の芳香族複素環基を表し、これらは同一でも異なるものであってもよい。r1〜r4は、それぞれ独立に、0又は1〜5の整数を表す。r1〜r4が、それぞれ独立に、2以上の整数であるとき、RZ1同士、RZ2同士、RZ3同士、RZ4同士は各々同一でも異なるものであってもよく、RZ1同士、RZ2同士、RZ3同士、RZ4同士は結合して環を形成してもよい。L1は単結合又は置換基を有しても良い2価の単環もしくは縮合環芳香族炭化水素基を表し、置換基を有しても良い2価の単環もしくは縮合環芳香族炭化水素基は、アルキレン基、−O−、−S−又は−NR−(ここでRはアルキル基又はアリ−ル基を表す)が介在するものであってもよい。)
【0197】
一般式[22]
【化26】

【0198】
(式中、RZ5及びRZ6は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、1価の芳香族炭化水素基、アルコキシル基、アリ−ルオキシ基、ジアリ−ルアミノ基、1価の脂肪族複素環基、1価の芳香族複素環基を表し、これらは同一でも異なるものであってもよい。r5及びr6は、それぞれ独立に、0又は1〜5の整数を表す。r5及びr6が、それぞれ独立に、2以上の整数であるとき、RZ5同士及びRZ6同士は各々同一でも異なるものであってもよく、RZ5同士及びRZ6同士は結合して環を形成してもよい。L2は単結合又は置換基を有しても良い2価の単環もしくは縮合環芳香族炭化水素基を表し、置換基を有しても良い2価の単環もしくは縮合環芳香族炭化水素基は、アルキレン基、−O−、−S−又は−NR−(ここでRはアルキル基又はアリ−ル基を表す)が介在するものであってもよい。)
【0199】
前記一般式[22]の内、下記一般式[23]ないし一般式[24]で表されるフェニルアントラセン誘導体がさらに好適である。
【0200】
一般式[23]
【化27】

【0201】
(式中、RZ11〜RZ30は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、1価の芳香族炭化水素基、アルコキシル基、アリ−ルオキシ基、ジアリ−ルアミノ基、1価の脂肪族複素環基、1価の芳香族複素環基を表し、これらは同一でも異なるものであってもよい。また、RZ11〜RZ30は、隣り合う基同士が連結し、環を形成していても良い。k1は、0〜3の整数を表す。)
【0202】
一般式[24]
【化28】

【0203】
(式中、RZ31〜RZ50は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、1価の芳香族炭化水素基、アルコキシル基、アリ−ルオキシ基、ジアリ−ルアミノ基、1価の脂肪族複素環基、1価の芳香族複素環基を表し、これらは同一でも異なるものであってもよい。また、RZ31〜RZ50は、隣り合う基同士が連結し、環を形成していても良い。k2は、0〜3の整数を表す。)
【0204】
また、前記一般式[24]の内、下記一般式[25]で表されるフェニルアントラセン誘導体はさらに好適である。
【0205】
一般式[25]
【化29】

【0206】
(式中、RZ51〜RZ60は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、1価の芳香族炭化水素基、アルコキシル基、アリ−ルオキシ基、ジアリ−ルアミノ基、1価の脂肪族複素環基、1価の芳香族複素環基を表し、これらは同一でも異なるものであってもよい。また、RZ51〜RZ60は、隣り合う基同士が連結し、環を形成していても良い。k3は、0〜3の整数を表す。)
【0207】
上記一般式[21]〜一般式[25]の具体例としては、下記化合物があげられる。
【0208】
【化30】

【0209】
さらには、以下の化合物も具体例として挙げられる。
【0210】
【化31】

【0211】
また、下記一般式[26]で示されるアミン化合物も発光材料として有用である。
【0212】
一般式[26]
【化32】

【0213】
(式中、hは、価数であり1〜6の整数を表す。E1は、n価の芳香族炭化水素基、E2は、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。)
【0214】
ここで、E1で示されるN価の芳香族炭化水素基の母体構造としては、ナフタレン、アントラセン、9−フェニルアントラセン、9,10−ジフェニルアントラセン、ナフタセン、ピレン、ペリレン、ビフェニル、ビナフチル、ビアンスリルが好ましく、E1で示されるアミノ基としては、ジアリ−ルアミノ基が好ましい。また、nは、1〜4が好ましく、特に2であることが最も好ましい。一般式[26]の内、特に以下の一般式[27]〜一般式[36]で表されるアミン化合物は好適である。
【0215】
一般式[27]
【化33】

【0216】
(式中、Ry1〜Ry8は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry1〜Ry8の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry1〜Ry8は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0217】
一般式[28]
【化34】

【0218】
(式中、Ry11〜Ry20は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry11〜Ry20の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry11〜Ry20は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0219】
一般式[29]
【化35】

【0220】
(式中、Ry21〜Ry34は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry21〜Ry34の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry21〜Ry34は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0221】
一般式[30]
【化36】

【0222】
(式中、Ry35〜Ry52は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry35〜Ry52の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry35〜Ry52は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0223】
一般式[31]
【化37】

【0224】
(式中、Ry53〜Ry64は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry53〜Ry64の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry53〜Ry64は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0225】
一般式[32]
【化38】

【0226】
(式中、Ry65〜Ry74は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry65〜Ry74の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry65〜Ry74は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0227】
一般式[33]
【化39】

【0228】
(式中、Ry75〜Ry86は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry75〜Ry86の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry75〜Ry86は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0229】
一般式[34]
【化40】

【0230】
(式中、Ry87〜Ry96は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry87〜Ry96の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry87〜Ry96は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0231】
一般式[35]
【化41】

【0232】
(式中、Ry97〜Ry110は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry97〜Ry110の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry97〜Ry110は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0233】
一般式[36]
【化42】

【0234】
(式中、Ry111〜Ry128は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry111〜Ry128の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry111〜Ry128は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0235】
上述した一般式[27]〜一般式[36]のアミン化合物は、黄色〜赤色発光を得る場合、好適に用いることができる。以上述べた一般式[27]〜一般式[36]で表されるアミン化合物の具体例として下記構造の化合物をあげることができる(ただし、Phはフェニル基を表す)。
【0236】
【化43】

【0237】
【化44】

【0238】
【化45】

【0239】
【化46】

【0240】
【化47】

【0241】
また、上記一般式[27]〜一般式[36]において、アミノ基の代わりに、下記一般式[37]ないし一般式[38]で表されるスチリル基を少なくとも一つ含有する化合物(例えば、欧州特許第0388768号明細書、特開平3−231970号公報などに開示のものを含む)も発光材料として好適に用いることができる。
【0242】
一般式[37]
【化48】

【0243】
(式中、Ry129〜Ry131は、それぞれ独立に、水素原子、アルキル基、シクロアルキル基、1価の芳香族炭化水素基を表す。Ry129〜Ry131は、隣り合う基同士が連結し、環を形成していても良い。)
【0244】
一般式[38]
【化49】

【0245】
(式中、Ry132〜Ry138は、それぞれ独立に、水素原子、アルキル基、シクロアルキル基、1価の芳香族炭化水素基を表す。Ry134〜Ry138は、それぞれ独立に、水素原子、アルキル基、シクロアルキル基、1価の芳香族炭化水素基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry134〜Ry138の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基である。Ry132〜Ry138は、隣り合う基同士が連結し、環を形成していても良い。)
【0246】
以上述べた一般式[37]ないし一般式[38]で表されるスチリル基を少なくとも一つ含有する化合物の具体例として下記構造の化合物をあげることができる(ただし、Phはフェニル基を表す)。
【0247】
【化50】

【0248】
【化51】

【0249】
【化52】

【0250】
【化53】

【0251】
【化54】

【0252】
【化55】

【0253】
また、特開平5−258862号公報等に記載されている一般式(Rs−Q)2 −Al−O−L3(式中、L3はフェニル部分を含んでなる炭素原子6〜24個の炭化水素であり、O−L3はフェノラ−ト配位子であり、Qは置換8−キノリノラ−ト配位子を示し、Rsはアルミニウム原子に置換8−キノリノラ−ト配位子が2個を上回り結合するのを立体的に妨害するように選ばれた8−キノリノラ−ト環置換基を示す〕で表される化合物も挙げられる。具体的には、ビス(2−メチル−8−キノリノラ−ト)(パラ−フェニルフェノラ−ト)アルミニウム(III)、ビス(2−メチル−8−キノリノラ−ト)(1−ナフトラ−ト)アルミニウム(III)等が挙げられる。
【0254】
このほか、特開平6−9953号公報等によるド−ピングを用いた高効率の青色と緑色の混合発光を得る方法が挙げられる。この場合、ホストとしては、上記の発光材料、ド−パントとしては青色から緑色までの強い蛍光色素、例えばクマリン系あるいは上記のホストとして用いられているものと同様な蛍光色素を挙げることができる。具体的には、ホストとしてジスチリルアリ−レン骨格の発光材料、特に好ましくは4,4’−ビス(2,2−ジフエニルビニル)ビフェニル、ド−パントとしてはジフェニルアミノビニルアリ−レン、特に好ましくは例えばN,N−ジフェニルアミノビニルベンゼンを挙げることができる。
【0255】
白色の発光を得る発光層としては特に制限はないが、下記のものを用いることができる。
有機EL積層構造体の各層のエネルギ−準位を規定し、トンネル注入を利用して発光させるもの(欧州特許第0390551号公報)。
同じくトンネル注入を利用する素子で実施例として白色発光素子が記載されているもの(特開平3−230584号公報)。
二層構造の発光層が記載されているもの(特開平2−220390号公報および特開平2−216790号公報)。
発光層を複数に分割してそれぞれ発光波長の異なる材料で構成されたもの(特開平4−51491号公報)。
青色発光体(蛍光ピ−ク380〜480nm)と緑色発光体(480〜580nm)とを積層させ、さらに赤色蛍光体を含有させた構成のもの(特開平6−207170号公報)。
青色発光層が青色蛍光色素を含有し、緑色発光層が赤色蛍光色素を含有した領域を有し、さらに緑色蛍光体を含有する構成のもの(特開平7−142169号公報)。
これらの中では、上記の構成のものが特に好ましい。
【0256】
さらに、発光材料として、例えば、下記に示す公知の化合物が好適に用いられる(ただし、Phはフェニル基を表す)。
【0257】
【化56】

【0258】
【化57】

【0259】
【化58】

【0260】
【化59】

【0261】
【化60】

【0262】
【化61】

【0263】
【化62】

【0264】
また、本発明の有機EL素子では、リン光発光材料を用いることができる。本発明の有機EL素子に使用できるリン光発光材料またはド−ピング材料としては、例えば有機金属錯体があげられ、ここで金属原子は通常、遷移金属であり、好ましくは周期では第5周期または第6周期、族では6族から11族、さらに好ましくは8族から10族の元素が対象となる。具体的にはイリジウムや白金などである。また、配位子としては2−フェニルピリジンや2−(2’−ベンゾチエニル)ピリジンなどがあり、これらの配位子上の炭素原子が金属と直接結合しているのが特徴である。別の例としてはポルフィリンまたはテトラアザポルフィリン環錯体などがあり、中心金属としては白金などがあげられる。例えば、下記に示す公知の化合物がリン光発光材料として好適に用いられる(ただし、Phはフェニル基を表す)。
【0265】
【化63】

【0266】
【化64】

【0267】
さらに、本発明の有機EL素子の陽極に使用される材料は、仕事関数の大きい(4eV以上)金属、合金、電気伝導性化合物またはこれらの混合物を電極物質とするものが好ましく用いられる。このような電極物質の具体例としては、Au等の金属、CuI、ITO、SNO2 、ZNO等の導電性材料が挙げられる。この陽極を形成するには、これらの電極物質を、蒸着法やスパッタリング法等の方法で薄膜を形成させることができる。この陽極は、上記発光層からの発光を陽極から取り出す場合、陽極の発光に対する透過率が10%より大きくなるような特性を有していることが望ましい。また、陽極のシ−ト抵抗は、数百Ω/□以下としてあるものが好ましい。さらに、陽極の膜厚は、材料にもよるが通常10Nm〜1μm、好ましくは10〜200nmの範囲で選択される。
【0268】
また、本発明の有機EL素子の陰極に使用される材料は、仕事関数の小さい(4eV以下)金属、合金、電気伝導性化合物およびこれらの混合物を電極物質とするものが用いられる。このような電極物質の具体例としては、ナトリウム、ナトリウム−カリウム合金、マグネシウム、リチウム、マグネシウム・銀合金、アルミニウム/酸化アルミニウム、アルミニウム・リチウム合金、インジウム、希土類金属などが挙げられる。この陰極はこれらの電極物質を蒸着やスパッタリング等の方法により薄膜を形成させることにより、作製することができる。ここで、発光層からの発光を陰極から取り出す場合、陰極の発光に対する透過率は10%より大きくすることが好ましい。また、陰極としてのシ−ト抵抗は数百Ω/□以下が好ましく、さらに、膜厚は通常10nm〜1μm、好ましくは50〜200Nmである。
【0269】
本発明の有機EL素子を作製する方法については、上記の材料および方法により陽極、発光層、必要に応じて正孔注入層、および必要に応じて電子注入層を形成し、最後に陰極を形成すればよい。また、陰極から陽極へ、前記と逆の順序で有機EL素子を作製することもできる。
【0270】
この有機EL素子は、透光性の基板上に作製する。この透光性基板は有機EL素子を支持する基板であり、その透光性については、400〜700nmの可視領域の光の透過率が50%以上、好ましくは90%以上であるものが望ましく、さらに平滑な基板を用いるのが好ましい。
【0271】
これら基板は、機械的、熱的強度を有し、透明であれば特に限定されるものではないが、例えば、ガラス板、合成樹脂板などが好適に用いられる。ガラス板としては、特にソ−ダ石灰ガラス、バリウム・ストロンチウム含有ガラス、鉛ガラス、アルミノケイ酸ガラス、ホウケイ酸ガラス、バリウムホウケイ酸ガラス、石英などで成形された板が挙げられる。また、合成樹脂板としては、ポリカ−ボネ−ト樹脂、アクリル樹脂、ポリエチレンテレフタレ−ト樹脂、ポリエ−テルサルファイド樹脂、ポリサルフォン樹脂などの板が挙げられる。
【0272】
本発明の有機EL素子の形成方法としては、真空蒸着、電子線ビ−ム照射、スパッタリング、プラズマ、イオンプレ−ティング等の乾式成膜法、もしくはスピンコ−ティング、ディッピング、フロ−コ−ティング、インクジェット法等の湿式成膜法、発光体をドナ−フイルム上に蒸着する方法、また、特表2002−534782やS.T.Lee, et al., Proceedings of SID'02, p.784(2002)に記載されているレーザー熱転写法((Laser Induced Thermal Imaging、LITI法ともいわれる)のいずれかの方法を適用することができる。有機層は、特に分子堆積膜であることが好ましい。ここで分子堆積膜とは、気相状態の材料化合物から沈着され形成された薄膜や、溶液状態または液相状態の材料化合物から固体化され形成された膜のことであり、通常この分子堆積膜は、LB法により形成された薄膜(分子累積膜)とは凝集構造、高次構造の相違や、それに起因する機能的な相違により区分することができる。また特開昭57−51781号公報に開示されているように、樹脂等の結着剤と材料化合物とを溶剤に溶かして溶液とした後、これをスピンコ−ト法等により薄膜化することによっても、有機層を形成することができる。各層の膜厚は特に限定されるものではないが、膜厚が厚すぎると一定の光出力を得るために大きな印加電圧が必要となり効率が悪くなり、逆に膜厚が薄すぎるとピンホ−ル等が発生し、電界を印加しても充分な発光輝度が得にくくなる。したがって、各層の膜厚は、1nmから1μmの範囲が適しているが、10nmから0.2μmの範囲がより好ましい。
【0273】
また、有機EL素子の温度、湿度、雰囲気等に対する安定性向上のために、素子の表面に保護層を設けたり、樹脂等により素子全体を被覆や封止を施したりしても良い。特に素子全体を被覆や封止する際には、光によって硬化する光硬化性樹脂が好適に使用される。
【0274】
本発明の有機EL素子に印加する電流は通常、直流であるが、パルス電流や交流を用いてもよい。電流値、電圧値は、素子破壊しない範囲内であれば特に制限はないが、素子の消費電力や寿命を考慮すると、なるべく小さい電気エネルギ−で効率良く発光させることが望ましい。
【0275】
本発明の有機EL素子の駆動方法は、パッシブマトリクス法のみならず、アクティブマトリックス法での駆動も可能である。また、本発明の有機EL素子から光を取り出す方法としては、陽極側から光を取り出すボトム・エミッションという方法のみならず、陰極側から光を取り出すトップ・エミッションという方法にも適用可能である。これらの方法や技術は、城戸淳二著、「有機ELのすべて」、日本実業出版社(2003年発行)に記載されている。
【0276】
さらに、本発明の有機EL素子は、マイクロキャビティ構造を採用しても構わない。これは、有機EL素子は、発光層が陽極と陰極との間に挟持された構造であり、発光した光は陽極と陰極との間で多重干渉を生じるが、陽極及び陰極の反射率、透過率などの光学的な特性と、これらに挟持された有機層の膜厚とを適当に選ぶことにより、多重干渉効果を積極的に利用し、素子より取り出される発光波長を制御するという技術である。これにより、発光色度を改善することも可能となる。この多重干渉効果のメカニズムについては、J.Yamada等によるAM−LCD Digest of TechNical Papers, OD−2,p.77〜80(2002)に記載されている。
【0277】
以上述べたように、本発明の有機EL素子用材料を用いた有機EL素子は、低い駆動電圧で長時間の発光を得ることが可能である。故に、本有機EL素子は、壁掛けテレビ等のフラットパネルディスプレイや各種の平面発光体として、さらには、複写機やプリンタ−等の光源、液晶ディスプレイや計器類等の光源、表示板、標識灯等への応用が考えられる。
【実施例】
【0278】
以下、本発明を実施例で説明するが、本発明はこれら合成例になんら限定されるものではない。
【0279】
まず、本発明の材料の合成例を示す。また、説明中、%は重量%を表す。
【0280】
合成例1
化合物(1)の合成方法
合成スキームを反応1に示す。(n-C6H13は、n-ヘキシル基を表す。)
【0281】
反応1
【化65】

【0282】
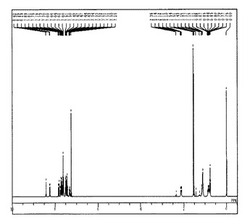
以下、反応1を参照しながら合成方法を説明する。窒素雰囲気下、(I)を5.0g(0.01mol)、3−ブロモ−9−フェニルカルバゾール(II)8.0g(0.025mol)、テトラキス(トリフェニルホスフィン)パラジウム0.96g、炭酸カリウム(2M水溶液)100g、テトラヒドロフラン100gを4つ口フラスコにいれ、5時間加熱還流した。その後、反応液をメタノール400ml中に注入し、析出した固体を濾取し、熱真空乾燥させて、粗生成物として化合物(1)が8.76g得られた。得られた粗成生物を、シリカゲルカラムクロマトグラフィーにより精製し、さらに昇華精製を行った。化合物は、マススペクトル(ブルカーダルトニクス社製、AutoflexII)、 1H−NMR、および13C−NMR(日本電子(株)製、ECX−400P)によって同定した。化合物(1)の1H−NMR、13C−NMR、UVスペクトル、蛍光(PL)スペクトルを、それぞれ図1〜図4示す。尚、UVスペクトルは、日立分光光度計(U−3500)、蛍光(PL)スペクトルは、日本分光(株)製蛍光分光光度計(FP−6500)により、測定した。
【0283】
尚、化合物(1)の合成に使用した(I)は、市販の試薬を用いた。3−ブロモ−9−フェニルカルバゾール(II)は、WO2007/43484記載の方法に従って合成したものを用いた。
【0284】
合成例2〜40
合成方法は、以下に示す反応2〜反応7を組み合わせて、表1中の化合物を合成した。
【0285】
反応2
【化66】

【0286】
R37〜R41は本発明の化合物を合成するのに必要な置換基であり、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換もしくは未置換の置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。
【0287】
合成方法としては、常法に従い、窒素気流下、−76℃において、3−ブロモ−9−フェニルカルバゾール誘導体(III)にn−ブチルリチウム(n−BuLi)を反応させてリチオ化し、生成したLi誘導体に、B(OMe)3を反応させて、目的とするボロン酸誘導(IV)体を合成した。
【0288】
反応3
【化67】

【0289】
R15、R16は本発明の化合物を合成するのに必要な置換基であり、それぞれ独立に、水素原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換もしくは未置換の置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。R37〜R41は前述のものと同義である。
【0290】
合成方法としては、2,7−ジブロモフルオレン誘導体(V)に、カルバゾール誘導体(IV)を3当量反応させる以外は合成例1と同様の操作をすることで目的化合物が得られた。
【0291】
反応4
【化68】

【0292】
ここで、R1〜R7は本発明の化合物を合成するのに必要な置換基であり、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換もしくは未置換の置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。また、Ar1は、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、または、置換もしくは未置換の1価の芳香族複素環基を表す。
【0293】
合成方法としては、窒素気流下、−78℃において、3−ブロモカルバゾール誘導体(VII)にn−ブチルリチウムを反応させてリチオ化し、生成したLi誘導体に、B(OMe)3を反応させて、目的とするボロン酸誘導体(VIII)を合成した。
【0294】
反応5
【化69】

【0295】
R17〜R22は、本発明の化合物を合成するのに必要な置換基であり、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換もしくは未置換の置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。Ar1、R1〜R7は、前述のものと同義である。
【0296】
合成方法としては、合成例1の(I)のかわりに対応するフルオレン誘導体(X)を、(II)のかわりに対応するカルバゾール誘導体(VIII)を3当量反応させる以外は、合成例1と同様の操作をすることで目的化合物(XI)が得られた。
【0297】
反応6
【化70】

【0298】
R17〜R22は、本発明の化合物を合成するのに必要な置換基であり、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換もしくは未置換の置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。
【0299】
合成方法としては、常法に従い、トルエン中、フルオレン誘導体(XII)に等量の臭素もしくはN−ブロモスクシンイミドを反応させることで(X)が得られた。
【0300】
反応7
【化71】

【0301】
R15〜R22、R1〜R7は、本発明の化合物を合成するのに必要な置換基であり、前述のものと同義である。合成方法としては、合成例1と同様の操作をすることで目的化合物が容易に得られた。
【0302】
以上の反応2〜反応7を組み合わせて得られた本発明の化合物の構造については、マススペクトル(ブルカーダルトニクス社製、AutoflexII)にて同定した。結果を表8に示す。尚、化合物番号は表1のものと同様である。
【0303】
表8
【表8】

【0304】
次に、表1の化合物(41)〜(65)の合成方法を以下に示す
【0305】
合成例41
化合物(41)の合成方法
【0306】
反応8
【化72】

【0307】
以下、反応8を参照しながら合成方法を説明する。窒素雰囲気下、(XIV)を2.73g(0.0058mol)、(II)5.0g(0.0174mol)、テトラキス(トリフェニルホスフィン)パラジウム0.5g、炭酸カリウム(2M水溶液)50g、テトラヒドロフラン50gを4つ口フラスコに加え、5時間加熱還流した。その後、反応液をメタノール400ml中に注入し、析出した固体を濾取し、熱真空乾燥させて、粗生成物として化合物(41)が3.12g得られた。得られた粗成生物を、シリカゲルカラムクロマトグラフィーにより精製し、さらに昇華精製を行った。化合物は、マススペクトル(ブルカーダルトニクス社製、AutoflexII)、 1H−NMR、および13C−NMR(日本電子製、ECX−400P)によって同定した。化合物(41)の1H−NMR、13C−NMR、UVスペクトル、蛍光(PL)スペクトルを、それぞれ図5〜図8に示す。尚、UVスペクトルは、日立分光光度計(U−3500),蛍光(PL)スペクトルは、日本分光(株)製蛍光分光光度計(FP−6500)により測定した。
【0308】
合成例42〜65
合成方法は、前述の反応、および以下に示す反応9〜反応11を組み合わせて、表2中の化合物を合成した。
【0309】
反応9
【化73】

【0310】
R23〜R36は本発明で扱う化合物を合成するのに必要な置換基であり、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換もしくは未置換の置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。また、R23〜R36は前述のものと同義である。
【0311】
合成方法としては、ジブロモスピロビフルオレノン誘導体(XIV)に、カルバゾール誘導体(IV)を3当量反応させる以外は合成例1と同様の操作をすることで目的化合物が得られる。
【0312】
反応10
【化74】

【0313】
R23〜R36は前述のものと同義である。合成方法としては、窒素気流下、−78℃において、ジブロモナフタレン誘導体(XV)にn−ブチルリチウムを反応させてリチオ化し、生成したLi誘導体に、B(OMe)3を反応させて、目的とするボロン酸誘導体(XVI)を合成した。
【0314】
反応11
【化75】

【0315】
R1〜R7、Ar1は、前述のものと同義である。合成方法としては、反応7の(XIII)のかわりに対応するスピロビフルオレノン誘導体(XVI)をカルバゾール誘導体(VII)を3当量反応させる以外は、前述と同様の操作をすることで目的化合物(XVII)が得られた。
【0316】
以上の反応8〜反応11を組み合わせて得られた本発明の化合物の構造については、マススペクトル(ブルカーダルトニクス社製、AutoflexII)にて同定した。結果を表9に示す。尚、化合物番号は表1のものと同様である。
【0317】
表9
【表9】

【0318】
以下、実施例として、本発明の材料を用いた有機EL素子の作成例を示すが、本発明は下記の実施例に限定されるものではない。また、本実施例においては、特に断りのない限り、混合比は全て重量比を示す。
【0319】
蒸着(真空蒸着)は10-6Torrの真空中で、基板加熱、冷却等の温度制御なしの条件下で行った。また、素子の発光特性評価においては、発光面積2mm×2mmの有機EL素子の特性を測定した。
【0320】
実施例1
洗浄したITO電極付きガラス板上に、化合物(21)を真空蒸着して膜厚60nmの正孔注入層を得た。次いで、表3のHTM9を真空蒸着して20nmの正孔輸送層を得た。さらに、トリス(8−ヒドロキシキノリン)アルミニウム錯体を真空蒸着して膜厚60nmの電子注入型発光層を作成し、その上に、まずフッ化リチウムを1nm、次いでアルミニウムを200nm蒸着して電極を形成して、有機EL素子を得た。
【0321】
実施例2〜7
正孔注入層を化合物(1)のかわりに、表1の化合物を用いた以外は、実施例1と同様の有機EL素子を作成した。
【0322】
また、実施例1〜7の素子を室温の環境で、10mA/cm2の電流密度で一定時間連続して発光させ輝度を測定した。結果を表10に示す。
【0323】
表10
【表10】

【0324】
実施例8
洗浄したITO電極付きガラス板上に、表2のHIM2を真空蒸着して膜厚50nmの正孔注入層を得た。次いで、表1の化合物(1)を真空蒸着して30nmの正孔輸送層を得た。さらに、トリス(8−ヒドロキシキノリン)アルミニウム錯体を真空蒸着して膜厚60nmの電子注入型発光層を作成し、その上に、まずフッ化リチウムを1nm、次いでアルミニウムを200nm蒸着して電極を形成して、有機EL素子を得た。
【0325】
実施例9〜34
正孔注入層を化合物(1)のかわりに、表1の化合物を用いた以外は、実施例8と同様の有機EL素子を作成した。
【0326】
また、実施例8〜34の素子を室温の環境で、10mA/cm2の電流密度で一定時間連続して発光させ輝度を測定した。結果を表11に示す。
【0327】
表11
【表11】

【0328】
実施例35
ITO電極付きガラス板上に、表2のHIM4を真空蒸着して膜厚50nmの正孔注入層を得た。次いで、表1の化合物(2)を真空蒸着して30nmの正孔輸送層を得た。次に、以下に示す化合物(A)を蒸着して膜厚20nmの発光層を形成した。さらに、Alq3を蒸着して膜厚20nmの電子注入層を形成した。その上に、フッ化リチウムを1nm、さらにアルミニウムを200nm真空蒸着によって電極を形成して素子を得た。この素子は、直流電圧5.0Vでの発光効率は3.0(lm/W)を示した。また、発光輝度500(cd/m2)で定電流駆動したときの半減寿命は1000時間以上であった。
【0329】
【化76】

【0330】
実施例36
ITO電極付きガラス板上に、PEDOT/PSS(ポリ(3,4−エチレンジオキシ)−2,5−チオフェン/ポリスチレンスルホン酸)をスピンコ−ト法で60nmの膜厚に製膜した。さらに、表1の化合物(5)をトルエン溶媒に溶解させスピンコ−ト法にて塗布し、膜厚50nmの正孔輸送層を作成した。この塗布基板に真空蒸着法にさらに(A)を蒸着して膜厚30nmの発光層を形成した。その上に、真空蒸着法にさらに(B)を蒸着して膜厚30nmの電子注入層を形成した。最後に、酸化リチウムを1nm、さらにアルミニウムを100nm蒸着によって陰極を形成して有機エレクトロルミネッセンス素子を得た。この素子は、直流電圧10Vでの外部量子効率は5.3%を示した。また、発光輝度100(cd/m2)で定電流駆動したときの半減寿命は5000時間以上であった。
【0331】
【化77】

【0332】
実施例37
ITO電極付きガラス板上に、表2のHIM7を真空蒸着して膜厚50nmの正孔注入層を得た。次いで、表1の化合物(3)を真空蒸着して30nmの正孔輸送層を得た。次に、以下に示す化合物(C)を蒸着して膜厚30nmの発光層を形成した。さらに、Alq3を蒸着して膜厚20nmの電子注入層を形成した。その上に、フッ化リチウムを1nm、さらにアルミニウムを200nm真空蒸着によって電極を形成して素子を得た。この素子は、直流電圧5.0Vでの発光効率は3.5(lm/W)を示した。また、発光輝度500(cd/m2)で定電流駆動したときの半減寿命は1000時間以上であった。
【0333】
【化78】

【0334】
実施例38
ITO電極付きガラス板上に、銅フタロシアニンを蒸着して膜厚50nmの正孔注入層を形成した。次に、表1の化合物(10)を蒸着して膜厚30nmの正孔輸送層を形成した。さらに、1.3.5−トリ(9H−カルバゾリール−9−イル)ベンゼンと化合物(D)とを100:8の組成比で共蒸着して膜厚45nmの発光層を形成した。さらに(E)を蒸着して膜厚5nmのブロッキング層を形成し、さらに、Alq3を蒸着して膜厚20nmの電子注入層を形成した。その上に、酸化リチウムを1nm、さらにアルミニウムを100nm蒸着によって陰極を形成して有機エレクトロルミネッセンス素子を得た。この素子は、直流電圧10Vでの外部量子効率は6.5%を示した。また、発光輝度500(cd/m2)で定電流駆動したときの半減寿命は1000時間以上であった。
【0335】
【化79】

【0336】
【化80】

【0337】
実施例39
ITO電極付きガラス板上に、表2のHIM9を蒸着して膜厚40nmの正孔注入層を形成し、さらに、本発明の化合物(44)を蒸着して膜厚35nmの正孔輸送層を形成した。さらに、以下に示す化合物(F)と以下に示す化合物(G)とを50:1の組成比で共蒸着して膜厚35nmの発光層を形成した。さらに、以下に示す化合物(H)を蒸着して膜厚30nmの電子注入層を形成した。その上に、フッ化リチウム(LiF)を1nm、さらにアルミニウム(Al)を200nm真空蒸着によって電極を形成して素子を得た。この素子は、直流電圧3.5Vでの発光効率は5.0(lm/W)を示した。また、発光輝度500(cd/m2)で定電流駆動したときの半減寿命は1000時間以上であった。
【0338】
【化81】

【0339】
【化82】

【0340】
【化83】

【0341】
実施例40
ITO電極付きガラス板上に、表2のHIM8を真空蒸着して膜厚60nmの正孔注入層を得た。次に、表1の化合物(1)と表3のHTM25を1:1の割合で共蒸着して膜厚40nmの正孔輸送層を形成した。さらにAlq3を蒸着して膜厚30nmの電子注入性発光層を形成した。その上に、フッ化リチウムを蒸着して膜厚20nmの電子注入層を形成した。さらにアルミニウムを100nm蒸着によって陰極を形成して有機EL素子を得た。この素子は、直流電圧10Vでの外部量子効率は2.5%を示した。また、発光輝度500(cd/m2)で定電流駆動したときの輝度半減寿命は1000時間以上であった。
【0342】
比較例1
化合物(1)のかわりに化合物(I)を用いた以外は実施例8と同様に素子を作成した。この素子を発光輝度500(cd/m2)で室温にて定電流駆動したときの輝度半減寿命を測定した。また、電流密度10mA/cm2で駆動させた時の初期輝度、および100℃の環境で100時間連続駆動させた後の輝度を測定した。結果を表12に示す。
【0343】
【化84】

【0344】
比較例2
化合物(1)のかわりに化合物(J)を用いた以外は実施例40と同様に素子を作成した。この素子を発光輝度500(cd/m2)で室温にて定電流駆動したときの輝度半減寿命を測定した。また、電流密度10mA/cm2で駆動させた時の初期輝度、および100℃の環境で100時間連続駆動させた後の輝度を測定した。結果を表12に示す。
【0345】
【化85】

【0346】
表12
【表12】

【0347】
表12から明らかなように、本発明の化合物はいずれも、比較例の化合物(I)、化合物(J)を用いて作成した素子よりも、長寿命で高い輝度が得られた。
【0348】
以上のように、本発明で示された有機EL素子用正孔注入/輸送材料を用いることにより、高い性能のEL素子が作成できる。比較化合物に対して格段に高い性能が発揮されることは明らかであり、有機EL素子の低駆動電圧化、長寿命化が達成できる。
【図面の簡単な説明】
【0349】
【図1】図1は、化合物(1)の1H−NMRスペクトルである。(重THF溶媒中)
【0350】
【図2】図2は、化合物(1)の13C−NMRスペクトルである。(重THF溶媒中)
【0351】
【図3】図3は、化合物(1)のUVスペクトルである。(トルエン溶媒中)
【0352】
【図4】図4は、化合物(1)のPLスペクトルである。(トルエン溶媒中)
【0353】
【図5】図5は、化合物(41)の1H−NMRスペクトルである。(重THF溶媒中)
【0354】
【図6】図6は、化合物(41)の13C−NMRスペクトルである。(重THF溶媒中)
【0355】
【図7】図7は、化合物(41)のUVスペクトルである。(トルエン溶媒中)
【0356】
【図8】図8は、化合物(41)のPLスペクトルである。(トルエン溶媒中)
【技術分野】
【0001】
本発明は新規なカルバゾリル含有有機エレクトロルミネッセンス素子用材料に関し、さらに詳しくは、有機エレクトロルミネッセンス素子(以下有機EL素子と略記)に用いた場合、分子の結晶性が低く、かつ、ガラス転移温度(Tg)が高いため、優れた性能(低電圧駆動、長寿命、高安定性)を有するカルバゾリル含有有機エレクトロルミネッセンス素子用電荷輸送材料に関する。
【背景技術】
【0002】
従来、カルバゾ−ル誘導体は各種機能材料、電子材料への応用が検討されてきた。カルバゾ−ル骨格が、正孔輸送性の性質を有すること、耐熱性の高い構造であることを利用して、例えば、電子写真感光体の電荷輸送材料や有機EL素子用材料等への応用が検討されている。代表的なものとしては、ポリビニルカルバゾ−ル(PVK)や、N,N’−ジカルバゾリル−4,4’−ビフェニル(CBP)は有機EL素子用材料として広く検討されている(非特許文献1,2参照)。通常高温環境下で有機EL素子を駆動させたり、保管したりすると、発光色の変化、発光効率の低下、駆動電圧の上昇、発光寿命の短時間化等の悪影響が生じる。これを防ぐためには材料のガラス転移温度(Tg)を高くする必要がある。PVKやCBPのようなカルバゾ−ル類はTgが比較的高く、耐熱性を有しているものの、対称性の高い構造故、真空蒸着や、スピンコ−ティングなどで薄膜を形成した際に、膜の安定性が低く、容易に結晶化してしまい、素子の寿命が極端に短いという問題点を有していた。
【0003】
このような状況の中、N−エチルカルバゾ−ルの3位をアミノ基で置換したアミン化合物が開示されている(非特許文献3,4,特許文献1参照)。これらのジアミン化合物は、正孔注入材料、正孔輸送材料として適正なIpを有していることと、カルバゾ−ル環の非対称性によって非結晶性となっているため、高い膜安定性を有しているが、一方でTgがそれほど高くなく、耐熱性に劣りEL素子として十分な寿命特性が得られなかった。
【0004】
また、低分子のカルバゾリル基を有する誘導体としては、2価の連結基で結ばれたチオフェン誘導体やナフタレン誘導体、フルオレン誘導体、スピロ誘導体が報告されている(特許文献2〜3参照)。しかし、これら誘導体を用いて作成した有機EL素子は、発光寿命が短く、色純度が優れていないという問題点を有している。
【0005】
【非特許文献1】Applied Physics Letters,2001年発行,78巻,278頁
【非特許文献2】Journal of the American Chemicaal Society 2001年発行,123巻,4304頁
【非特許文献3】European Polymer Journal 2005年発行,41巻,1821頁
【非特許文献4】Environmental and Chemical Physics 2002年発行, 24巻, 30頁
【特許文献1】特表2004−536134号公報
【特許文献2】WO03/090502号公報
【特許文献3】特表2004−217557号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明の課題は、高いTgを有しながらも、分子が結晶化しにくく、有機EL素子用材料として用いた場合に、低電圧駆動、長寿命であり、かつ、昇華法等による精製の際、有機材料に対するダメ−ジが少なく、精製も容易であるなどの優れた特性を有する有機EL素子用電荷輸送材料を提供することである。
【課題を解決するための手段】
【0007】
本発明者らは、前記諸問題を解決するために、鋭意研究を重ねた結果、本発明に至った。
すなわち本発明は、下記一般式[1]で表されるカルバゾリル基を有する有機EL素子用電荷輸送材料に関する。
【0008】
一般式[1]
【化1】

【0009】
(式中、Xは、一般式[2]または[3]で表される連結基を表す。
Ar1およびAr2は、それぞれ独立に、置換もしくは未置換の1価の芳香族炭化水素基、または、置換もしくは未置換の1価の芳香族複素環基を表す。
R1〜R14は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。)
【0010】
一般式[2]
【化2】

【0011】
(式中、R15およびR16は、それぞれ独立に、水素原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表し、
R17〜R22は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。)
【0012】
一般式[3]
【化3】

【0013】
(式中、R23〜R36は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。)
【0014】
また、本発明は、Ar1およびAr2が、それぞれ独立に、下記一般式[4]で表される置換もしくは未置換のフェニル基である有機エレクトロルミネッセンス素子用電荷輸送材料に関する。
【0015】
一般式[4]
【化4】

【0016】
(式中、R37〜R41は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換もしくは未置換の置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。また、R37〜R41は、隣接した置換基同士が結合し、新たな環を形成しても良い。)
【0017】
また、本発明は、R37〜R41が水素原子である上記のカルバゾリル基を有する有機EL素子用電荷輸送材料に関する。
【0018】
また、本発明は、正孔注入材料または正孔輸送材料である、上記のカルバゾリル基を有する有機EL素子用電荷輸送材料に関する。
【0019】
また、本発明は、一対の電極間に、正孔注入層および/または正孔輸送層を有する有機エレクトロルミネッセンス素子において、前記正孔注入層および/または正孔輸送層が、上記の有機EL素子用材料であることに関する。
【発明の効果】
【0020】
本発明の有機EL素子用材料を有機EL素子用材料として用いた有機EL素子は、薄膜の安定性が非常に高く、低い駆動電圧で発光し、かつ、長寿命であるため、壁掛けテレビ等のフラットパネルディスプレイや平面発光体として好適に使用することができ、複写機やプリンタ−等の光源、液晶ディスプレイや計器類等の光源、表示板、標識灯等への応用が可能である。
【発明を実施するための最良の形態】
【0021】
以下、詳細にわたって本発明を説明する。
【0022】
一般式[1]におけるR1〜R14は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。
【0023】
ここで、ハロゲン原子としては、フッ素原子、塩素原子、臭素原子、ヨウ素原子が挙げられる。
【0024】
ここで、1価の脂肪族炭化水素基としては、炭素数1〜18の1価の脂肪族炭化水素基を指し、そのようなものとしては、アルキル基、アルケニル基、アルキニル基、シクロアルキル基が挙げられる。
【0025】
また、アルキル基としては、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、ペンチル基、イソペンチル基、ヘキシル基、ヘプチル基、オクチル基、デシル基、ドデシル基、ペンタデシル基、オクタデシル基といった炭素数1〜18のアルキル基が挙げられる。
【0026】
また、アルケニル基としては、ビニル基、1−プロペニル基、2−プロペニル基、イソプロペニル基、1−ブテニル基、2−ブテニル基、3−ブテニル基、1−オクテニル基、1−デセニル基、1−オクタデセニル基といった炭素数2〜18のアルケニル基が挙げられる。
【0027】
また、アルキニル基としては、エチニル基、1−プロピニル基、2−プロピニル基、1−ブチニル基、2−ブチニル基、3−ブチニル基、1−オクチニル基、1−デシニル基、1−オクタデシニル基といった炭素数2〜18のアルキニル基が挙げられる。
【0028】
また、シクロアルキル基としては、シクロプロピル基、シクロブチル基、シクロペンチル基、シクロヘキシル基、シクロヘプチル基、シクロオクチル基、シクロオクタデシル基といった炭素数3〜18のシクロアルキル基が挙げられる。
【0029】
さらに、1価の芳香族炭化水素基としては、1価の単環、縮合環、環集合炭化水素基が挙げられる。ここで、1価の単環芳香族炭化水素基としては、フェニル基、o−トリル基、m−トリル基、p−トリル基、2,4−キシリル基、p−クメニル基、メシチル基等の炭素数6〜18の1価の単環芳香族炭化水素基が挙げられる。
【0030】
また、1価の縮合環炭化水素基としては、1−ナフチル基、2−ナフチル基、1−アンスリル基、2−アンスリル基、5−アンスリル基、1−フェナンスリル基、9−フェナンスリル基、1−アセナフチル基、2−アズレニル基、1−ピレニル基、2−トリフェニレル基等の炭素数10〜18の1価の縮合環炭化水素基が挙げられる。
【0031】
また、1価の環集合炭化水素基としては、o−ビフェニリル基、m−ビフェニリル基、p−ビフェニリル基等の炭素数12〜18の1価の環集合炭化水素基が挙げられる。
【0032】
また、1価の脂肪族複素環基としては、2−ピラゾリノ基、ピペリジノ基、モルホリノ基、2−モルホリニル基といった炭素数3〜18の1価の脂肪族複素環基が挙げられる。
【0033】
また、1価の芳香族複素環基としては、トリアゾリル基、3−オキサジアゾリル基、2−フラニル基、3−フラニル基、2−フリル基、3−フリル基、2−チエニル基、3−チエニル基、1−ピロ−リル基、2−ピロ−リル基、3−ピロ−リル基、2−ピリジル基、3−ピリジル基、4−ピリジル基、2−ピラジル基、2−オキサゾリル基、3−イソオキサゾリル基、2−チアゾリル基、3−イソチアゾリル基、2−イミダゾリル基、3−ピラゾリル基、2−キノリル基、3−キノリル基、4−キノリル基、5−キノリル基、6−キノリル基、7−キノリル基、8−キノリル基、1−イソキノリル基、2−キノキサリニル基、2−ベンゾフリル基、2−ベンゾチエニル基、N−インドリル基、N−カルバゾリル基、N−アクリジニル基、2−チオフェニル基、3−チオフェニル基、ビピリジル基、フェナントロリル基といった炭素数2〜18の1価の芳香族複素環基が挙げられる。
【0034】
また、アルコキシル基としては、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基、tert−ブトキシ基、オクチルオキシ基、tert−オクチルオキシ基といった炭素数1〜8のアルコキシル基が挙げられる。
【0035】
また、アリ−ルオキシ基としては、フェノキシ基、4−tert−ブチルフェノキシ基、1−ナフチルオキシ基、2−ナフチルオキシ基、9−アンスリルオキシ基といった炭素数6〜14のアリ−ルオキシ基が挙げられる。
【0036】
また、アルキルチオ基としては、メチルチオ基、エチルチオ基、tert−ブチルチオ基、ヘキシルチオ基、オクチルチオ基といった炭素数1〜8のアルキルチオ基が挙げられる。
【0037】
また、アリ−ルチオ基としては、フェニルチオ基、2−メチルフェニルチオ基、4−tert−ブチルフェニルチオ基といった炭素数6〜14のアリ−ルチオ基が挙げられる。
【0038】
また、置換アミノ基としては、N−メチルアミノ基、N−エチルアミノ基、N,N−ジエチルアミノ基、N,N−ジイソプロピルアミノ基、N,N−ジブチルアミノ基、N−ベンジルアミノ基、N,N−ジベンジルアミノ基、N−フェニルアミノ基、N−フェニル−N−メチルアミノ基、N,N−ジフェニルアミノ基、N,N−ビス(m−トリル)アミノ基、N,N−ビス(p−トリル)アミノ基、N,N−ビス(p−ビフェニリル)アミノ基、ビス[4−(4−メチル)ビフェニリル]アミノ基、N−α−ナフチル−N−フェニルアミノ基、N−β−ナフチル−N−フェニルアミノ基等の炭素数2〜26の置換アミノ基が挙げられる。
【0039】
また、アシル基としては、アセチル基、プロピオニル基、ピバロイル基、シクロヘキシルカルボニル基、ベンゾイル基、トルオイル基、アニソイル基、シンナモイル基等の炭素数2〜14のアシル基が挙げられる。
【0040】
また、アルコキシカルボニル基としては、メトキシカルボニル基、エトキシカルボニル基、ベンジルオキシカルボニル基等の炭素数2〜14のアルコキシカルボニル基が挙げられる。
【0041】
また、アリ−ルオキシカルボニル基としては、フェノキシカルボニル基、ナフチルオキシカルボニル基等の炭素数2〜14のアリ−ルオキシカルボニル基が挙げられる。
【0042】
また、アルキルスルホニル基としては、メシル基、エチルスルホニル基、プロピルスルホニル基等の炭素数2〜14のアルキルスルホニル基が挙げられる。
【0043】
また、アリ−ルスルホニル基としては、ベンゼンスルホニル基、p−トルエンスルホニル基等の炭素数2〜14のアリ−ルスルホニル基が挙げられる。
【0044】
これらR1〜R14における、1価の脂肪族炭化水素基、芳香族炭化水素基、脂肪族複素環基、芳香族複素環基は、さらに他の置換基によって置換されていても良い。そのような置換基としては、ハロゲン原子、シアノ基、アルコキシル基、アリ−ルオキシ基、アルキルチオ基、アリ−ルチオ基、置換アミノ基、アシル基、アルコキシカルボニル基、アリ−ルオキシカルボニル基、アルキルスルホニル基、アリ−ルスルホニル基等が挙げられる。これらの置環基の例としては、前述のものが挙げられる。
【0045】
一般式[1]における、Ar1およびAr2は、それぞれ独立に、置換もしくは未置換の1価の芳香族炭化水素基、または、置換もしくは未置換の1価の芳香族複素環基を表す。ここで、1価の芳香族炭化水素基、1価の芳香族複素環基は、先に示したR1〜R14における、1価の芳香族炭化水素基、1価の芳香族複素環基と同義である。
【0046】
Ar1として好ましいものとしては、置換もしくは未置換の炭素数10〜18の1価の芳香族炭化水素基、一般式[4]で表される置換もしくは未置換のフェニル基が挙げられる。
【0047】
ここで、炭素数10〜18の1価の芳香族炭化水素基としては、R1〜R14における1価の芳香族炭化水素基で説明したもののうち該当する炭素数のものと同義である。
【0048】
一般式[2]中のR15およびR16は、それぞれ独立に、水素原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表し、R17〜R22は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換もしくは未置換の置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。
【0049】
ここで、R15〜R22における、ハロゲン原子、1価の脂肪族炭化水素基、1価の芳香族炭化水素基1価の脂肪族複素環基、1価の芳香族複素環基、シアノ基、アルコキシル基、アリ−ルオキシ基、アルキルチオ基、アリ−ルチオ基、置換アミノ基、アシル基、アルコキシカルボニル基、アリ−ルオキシカルボニル基、アルキルスルホニル基、アリ−ルスルホニル基としては、R1〜R14における、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、アルコキシル基、アリ−ルオキシ基、アルキルチオ基、アリ−ルチオ基、置換アミノ基、アシル基、アルコキシカルボニル基、アリ−ルオキシカルボニル基、アルキルスルホニル基、アリ−ルスルホニル基と同義である。
【0050】
またR15〜R22が有してもよい置換基としては、前述のR1〜R14が有してもよい置換基が挙げられる。
【0051】
一般式[2]中のR15およびR16として、好ましいものとしては、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基が挙げられ、さらに好ましいものは、置換もしくは未置換の1価の芳香族炭化水素基が挙げられる。
【0052】
一般式[2]中のR17〜R22として、好ましいものとしては、水素原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基が挙げられ、さらに好ましいものは、水素原子、置換もしくは未置換の1価の芳香族炭化水素基が挙げられ、特に好ましいものは、水素原子が挙げられる。
【0053】
一般式[3]中のR23〜R36は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。
【0054】
ここで、R23〜R36における、ハロゲン原子、1価の脂肪族炭化水素基、1価の芳香族炭化水素基、1価の脂肪族複素環基、1価の芳香族複素環基、シアノ基、アルコキシル基、アリ−ルオキシ基、アルキルチオ基、アリ−ルチオ基、置換アミノ基、アシル基、アルコキシカルボニル基、アリ−ルオキシカルボニル基、アルキルスルホニル基、アリ−ルスルホニル基としては、R1〜R14における、ハロゲン原子、1価の脂肪族炭化水素基、1価の芳香族炭化水素基、1価の脂肪族複素環基、1価の芳香族複素環基、シアノ基、アルコキシル基、アリ−ルオキシ基、アルキルチオ基、アリ−ルチオ基、置換アミノ基、アシル基、アルコキシカルボニル基、アリ−ルオキシカルボニル基、アルキルスルホニル基、アリ−ルスルホニル基と同義である。
【0055】
またR23〜R36が有してもよい置換基としては、前述のR1〜R14が有してもよい置換基が挙げられる。
【0056】
一般式[3]中のR23〜R36として、好ましいものとしては、水素原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基が挙げられ、さらに好ましいものは、水素原子、置換もしくは未置換の1価の芳香族炭化水素基が挙げられ、特に好ましいものは、水素原子が挙げられる。
【0057】
一般式[4]中のR37〜R41は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。
【0058】
また、R37〜R41における、ハロゲン原子、1価の脂肪族炭化水素基、1価の芳香族炭化水素基、1価の脂肪族複素環基、1価の芳香族複素環基、シアノ基、アルコキシル基、アリ−ルオキシ基、アルキルチオ基、アリ−ルチオ基、置換アミノ基、アシル基、アルコキシカルボニル基、アリ−ルオキシカルボニル基、アルキルスルホニル基、または、アリ−ルスルホニル基は、R1〜R14における、ハロゲン原子、1価の脂肪族炭化水素基、1価の芳香族炭化水素基、1価の脂肪族複素環基、1価の芳香族複素環基、シアノ基、アルコキシル基、アリ−ルオキシ基、アルキルチオ基、アリ−ルチオ基、置換アミノ基、アシル基、アルコキシカルボニル基、アリ−ルオキシカルボニル基、アルキルスルホニル基、または、アリ−ルスルホニル基と同義である。
【0059】
また、R37〜R41が有してもよい置換基としては、前述のR1〜R14が有してもよい置換基が挙げられる。
【0060】
また、R37〜R41は、隣接した置換基同士が結合し、新たな環を形成しても良い。形成される新たな環としては、1−ナフチル基や2−ナフチル基、キノリル基等が挙げられる。
【0061】
次に、カルバゾリル基のもつ優位性を説明する。
【0062】
一般的に、カルバゾ−ル化合物は、結合を有さないジフェニルアミノ化合物と比較してその構造が強固であり、熱安定性が高い傾向にある(化5参照)。
【0063】
【化5】

【0064】
カルバゾ−ル化合物においては、窒素上のもうひとつの結合位置にはアルキル基を配したN−アルキル化合物が良く知られているが、本発明の化合物は、この位置に結合している置換基(=Ar1)が、芳香族基、または、複素芳香族基であることを特徴のひとつとしている。芳香族基や複素芳香族基は、さらに、安定性を高める効果が大きく、その中でも、安定性を高める効果が期待できるのが、Ar1が一般式[4]、すなわち、フェニル基である場合である。
【0065】
ところで、3位で結合したカルバゾリル基の効果について触れておく。通常、アミノ基は電子ドナ−として働くが、カルバゾ−ルの窒素原子は、窒素原子上に結合した置換基に対してはドナ−性をほとんど有さない。これはカルバゾ−ル環が平面性を有していて、かつ、非常に嵩高い置換基となってしまっているためであり、窒素原子上の置換基と平面構造をとりにくい事に起因していると考えられる。逆に、3位で結合したカルバゾ−ル環は環の平面性があるため、そのベンゼン環部分に対しては電子ドナ−性となりうる(化6参照)。
【0066】
【化6】

【0067】
このような理由から、本発明のカルバゾリル基を有する有機EL素子用材料は、イオン化ポテンシャルの小さな化合物(有機分子の基底状態がより高いレベルにある化合物)となりやすく、有機EL素子を作成する際には、正孔注入輸送性の高い化合物とすることが可能である。
【0068】
さらに、3位で結合したカルバゾ−ル環は、窒素原子上で結合したカルバゾ−ル環に比較して、分子の対称性が低いので、分子の結晶性が低くなり、アモルファス性が高くなるため、薄膜形成した際の安定性向上にも大きく寄与することが可能である。
【0069】
特に、本発明の有機EL素子用材料は、アモルファス性が高く、その結果として結晶化が起こりにくい。この性状は、有機EL素子用の材料として用いる場合、薄膜の安定性が向上し、有機EL素子寿命が長くなる。
【0070】
また、蒸着法により、有機EL素子を作成する際も、分子量が大きいと、蒸着によって素子を作成する場合の蒸着性が悪くなる懸念があるが、本発明の有機EL素子用材料は、蒸着時の有機化合物に対するダメ−ジも少なく、容易に素子作成が可能である。塗布法により、有機EL素子を作成する際も、汎用性有機溶媒に対する溶解性が高いため、広範囲な溶媒での使用が可能となる。
【0071】
本発明の化合物の具体例を、以下の表1に示すが、本発明は、この例に限定されるものではない。
【0072】
表1
【表1】

【0073】
【表1】

【0074】
【表1】

【0075】
【表1】

【0076】
【表1】

【0077】
【表1】

【0078】
【表1】

【0079】
【表1】

【0080】
【表1】

【0081】
【表1】

【0082】
【表1】

【0083】
【表1】

【0084】
本発明の有機EL素子用素子用材料は、種々の用途に用いることができるが、特に好ましくは、有機EL材料(有機EL用正孔注入/輸送材料)として用いられる。
【0085】
ここで、本発明の有機EL素子用正孔注入/輸送材料を用いて作成することができる有機EL素子について詳細に説明する。
【0086】
有機EL素子は、陽極と陰極間に一層または多層の有機層を形成した素子から構成されるが、ここで、一層型有機EL素子とは、陽極と陰極との間に発光層のみからなる素子を指す。一方、多層型有機EL素子とは、発光層の他に、発光層への正孔や電子の注入を容易にしたり、発光層内での正孔と電子との再結合を円滑に行わせることを目的として、正孔注入層、正孔輸送層、正孔阻止層、電子注入層などを積層させたものを指す。したがって、多層型有機EL素子の代表的な素子構成としては、(1)陽極/正孔注入層/発光層/陰極、(2)陽極/正孔注入層/正孔輸送層/発光層/陰極、(3)陽極/正孔注入層/発光層/電子注入層/陰極、(4)陽極/正孔注入層/正孔輸送層/発光層/電子注入層/陰極、(5)陽極/正孔注入層/発光層/正孔阻止層/電子注入層/陰極、(6)陽極/正孔注入層/正孔輸送層/発光層/正孔阻止層/電子注入層/陰極、(7)陽極/発光層/正孔阻止層/電子注入層/陰極、(8)陽極/発光層/電子注入層/陰極等の多層構成で積層した素子構成が考えられる。
【0087】
また、上述した各有機層は、それぞれ二層以上の層構成により形成されても良く、いくつかの層が繰り返し積層されていても良い。そのような例として、近年、光取り出し効率の向上を目的に、上記、多層型有機EL素子の一部の層を多層化する「マルチ・フォトン・エミッション」と呼ばれる素子構成が提案されている。これは例えば、ガラス基板/陽極/正孔輸送層/電子輸送性発光層/電子注入層/電荷発生層/発光ユニット/陰極から構成される有機EL素子に於いて、電荷発生層と発光ユニットの部分を複数層積層するといった方法があげられる。
【0088】
本発明の有機EL素子用正孔注入/輸送材料は、単一の化合物での使用はもちろんのこと、2種類以上の化合物を組み合わせて、すなわち混合、共蒸着、積層するなどして使用することが可能である。
【0089】
本発明の有機EL素子用材料と組み合わせて良い正孔注入材料や正孔輸送材料としては、具体的には、例えばトリアゾ−ル誘導体(米国特許3,112,197号明細書等参照)、オキサジアゾ−ル誘導体(米国特許3,189,447号明細書等参照)、イミダゾ−ル誘導体(特公昭37−16096号公報等参照)、ポリアリ−ルアルカン誘導体(米国特許3,615,402号明細書、同第3,820,989号明細書、同第3,542,544号明細書、特公昭45−555号公報、同51−10983号公報、特開昭51−93224号公報、同55−17105号公報、同56−4148号公報、同55−108667号公報、同55−156953号公報、同56−36656号公報等参照)、ピラゾリン誘導体およびピラゾロン誘導体(米国特許第3,180,729号明細書、同第4,278,746号明細書、特開昭55−88064号公報、同55−88065号公報、同49−105537号公報、同55−51086号公報、同56−80051号公報、同56−88141号公報、同57−45545号公報、同54−112637号公報、同55−74546号公報等参照)、フェニレンジアミン誘導体(米国特許第3,615,404号明細書、特公昭51−10105号公報、同46−3712号公報、同47−25336号公報、特開昭54−53435号公報、同54−110536号公報、同54−119925号公報等参照)、アリ−ルアミン誘導体(米国特許第3,567,450号明細書、同第3,180,703号明細書、同第3,240,597号明細書、同第3,658,520号明細書、同第4,232,103号明細書、同第4,175,961号明細書、同第4,012,376号明細書、特公昭49−35702号公報、同39−27577号公報、特開昭55−144250号公報、同56−119132号公報、同56−22437号公報、西独特許第1,110,518号明細書等参照)、アミノ置換カルコン誘導体(米国特許第3,526,501号明細書等参照)、オキサゾ−ル誘導体(米国特許第3,257,203号明細書等に開示のもの)、スチリルアントラセン誘導体(特開昭56−46234号公報等参照)、フルオレノン誘導体(特開昭54−110837号公報等参照)、ヒドラゾン誘導体(米国特許第3,717,462号明細書、特開昭54−59143号公報、同55−52063号公報、同55−52064号公報、同55−46760号公報、同55−85495号公報、同57−11350号公報、同57−148749号公報、特開平2−311591号公報等参照)、スチルベン誘導体(特開昭61−210363号公報、同第61−228451号公報、同61−14642号公報、同61−72255号公報、同62−47646号公報、同62−36674号公報、同62−10652号公報、同62−30255号公報、同60−93455号公報、同60−94462号公報、同60−174749号公報、同60−175052号公報等参照)、シラザン誘導体(米国特許第4,950,950号明細書)、ポリシラン系(特開平2−204996号公報)、アニリン系共重合体(特開平2−282263号公報)、特開平1−211399号公報に開示されている導電性高分子オリゴマ−(特にチオフェンオリゴマ−)等を挙げることができる。
【0090】
また、正孔注入材料や正孔輸送材料としては上記のものを使用することができるが、ポルフィリン化合物(特開昭63−2956965号公報)、芳香族第三級アミン化合物およびスチリルアミン化合物(米国特許第4,127,412号明細書、特開昭53−27033号公報、同54−58445号公報、同54−149634号公報、同54−64299号公報、同55−79450号公報、同55−144250号公報、同56−119132号公報、同61−295558号公報、同61−98353号公報、同63−295695号公報等参照)を用いることもできる。例えば、米国特許第5,061,569号に記載されている2個の縮合芳香族環を分子内に有する4,4’−ビス(N−(1−ナフチル)−N−フェニルアミノ)ビフェニル等や、特開平4−308688号公報に記載されているトリフェニルアミンユニットが3つスタ−バ−スト型に連結された4,4’,4”−トリス(N−(3−メチルフェニル)−N−フェニルアミノ)トリフェニルアミン等を挙げることができる。また、正孔注入材料として銅フタロシアニンや水素フタロシアニン等のフタロシアニン誘導体もあげられる。さらに、その他、芳香族ジメチリデン系化合物、p型Si、p型SiC等の無機化合物も正孔注入材料や正孔輸送材料の材料として使用することができる。
【0091】
芳香族三級アミン誘導体の具体例としては、例えば、N,N’−ジフェニル−N,N’−(3−メチルフェニル)−1,1’−ビフェニル−4,4’−ジアミン、N,N,N’,N’−(4−メチルフェニル)−1,1’−フェニル−4,4’−ジアミン、N,N,N’,N’−(4−メチルフェニル)−1,1’−ビフェニル−4,4’−ジアミン、N,N’−ジフェニル−N,N’−ジナフチル−1,1’−ビフェニル−4,4’−ジアミン、N,N’−(メチルフェニル)−N,N’−(4−N−ブチルフェニル)−フェナントレン−9,10−ジアミン、N,N−ビス(4−ジ−4−トリルアミノフェニル)−4−フェニル−シクロヘキサン、N,N’−ビス(4’−ジフェニルアミノ−4−ビフェニリル)−N,N’−ジフェニルベンジジン、N,N’−ビス(4’−ジフェニルアミノ−4−フェニル)−N,N’−ジフェニルベンジジン、N,N’−ビス(4’−ジフェニルアミノ−4−フェニル)−N,N’−ジ(1−ナフチル)ベンジジン、N,N’−ビス(4’−フェニル(1−ナフチル)アミノ−4−フェニル)−N,N’−ジフェニルベンジジン、N,N’−ビス(4’−フェニル(1−ナフチル)アミノ−4−フェニル)−N,N’−ジ(1−ナフチル)ベンジジン等があげられ、これらは正孔注入材料、正孔輸送材料いずれにも使用することができる。
【0092】
本発明の化合物(有機EL素子用電荷輸送材料)とともに用いる正孔注入材料、正孔輸送材料はさらに以下一般式[5]〜[10]のようなものを用いることが出来る。
【0093】
一般式[5]
【化7】

【0094】
(式中、Ra11〜Ra14は、それぞれ独立に、水素原子、アルコキシル基、もしくはシアノ基を表すが、全てが同時に水素原子となることはない。)
【0095】
ここで、アルコキシル基としては、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基、tert−ブトキシ基、オクチルオキシ基、tert−オクチルオキシ基、2−ボルニルオキシ基、2−イソボルニルオキシ基、1−アダマンチルオキシ基等の炭素数1〜18のアルコキシル基があげられる。特にRa11〜Ra14の好ましい組み合わせとしては、Ra11〜Ra14が全てメトキシ基、エトキシ基、もしくはシアノ基の場合であることが好ましい。
【0096】
一般式[6]
【化8】

【0097】
(式中、Z21は連結基であり、単結合、2価の脂肪族炭化水素基、2価の芳香族炭化水素基、酸素原子、硫黄原子のいずれかを表す。Ra21〜Ra26は、それぞれ独立に、1価の芳香族炭化水素基を表す。)
【0098】
Z21の連結基としては、単結合、ビニレン基、o−フェニレン基、m−フェニレン基、p−フェニレン基、1,4−ナフチレン基、2,6−ナフチレン基、9,10−フェナントリレン基、9,10−アンスリレン基が好ましく、単結合、ビニレン基、p−フェニレン基、1,4−ナフチレン基がさらに好ましい。また、Ra21〜Ra26としては、フェニル基、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基より選ばれる1価の芳香族炭化水素基が好ましい。
【0099】
一般式[7]
【化9】

【0100】
(式中、Z31は連結基であり、単結合、2価の脂肪族炭化水素基、2価の芳香族炭化水素基、酸素原子、硫黄原子のいずれかを表す。Ra31〜Ra36は、それぞれ独立に、1価の芳香族炭化水素基を表す。)
【0101】
Z31の連結基としては、単結合、ビニレン基、o−フェニレン基、m−フェニレン基、p−フェニレン基、1,4−ナフチレン基、2,6−ナフチレン基、9,10−フェナントリレン基、9,10−アンスリレン基が好ましく、単結合、ビニレン基、p−フェニレン基、1,4−ナフチレン基がさらに好ましい。また、Ra31〜Ra36としては、フェニル基、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基より選ばれる1価の芳香族炭化水素基が好ましい。
【0102】
一般式[8]
【0103】
【化10】

【0104】
(式中、Ra41〜Ra48は、それぞれ独立に、1価の芳香族炭化水素基を表す。)
【0105】
Ra41〜Ra48としては、フェニル基、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基より選ばれる1価の芳香族炭化水素基が好ましい。
【0106】
一般式[9]
【化11】

【0107】
(式中、Ra51〜Ra56は、それぞれ独立に、1価の芳香族炭化水素基を表す。)
【0108】
Ra51〜Ra56としては、フェニル基、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基より選ばれる1価の芳香族炭化水素基が好ましい。
【0109】
一般式[10]
【化12】

【0110】
(式中、Ra61〜Ra64は、それぞれ独立に、1価の芳香族炭化水素基を表し、pは1〜4の整数を表す。)
【0111】
Ra61〜Ra64としては、フェニル基、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基より選ばれる1価の芳香族炭化水素基が好ましい。
【0112】
以上述べた一般式[5]〜[10]で示した化合物は、特に正孔注入材料として、本発明の有機EL素子用材料と組み合わせることにより好適に用いられる。以下の表2に特に好ましい例を示す。
【0113】
表2
【表2】

【0114】
【表2】

【0115】
【表2】

【0116】
【表2】

【0117】
また、本発明の有機EL素子用材料と共に用いることが出来る正孔輸送材料としては、下記表3に示す公知の化合物があげられる。
【0118】
表3
【表3】

【0119】
【表3】

【0120】
【表3】

【0121】
【表3】

【0122】
【表3】

【0123】
【表3】

【0124】
【表3】

【0125】
この正孔注入層を形成するには、上述の化合物を、例えば真空蒸着法、スピンコ−ト法、キャスト法、LB法等の公知の方法により薄膜化するが、正孔注入層の膜厚は、特に制限はないが、通常は5nm〜5μmである。
【0126】
一方、電子注入層には、発光層に対して優れた電子注入効果を示し、かつ陰極界面との密着性と薄膜形成性に優れた電子注入層を形成できる電子注入材料が用いられる。そのような電子注入材料の例としては、金属錯体化合物、含窒素五員環誘導体、フルオレノン誘導体、アントラキノジメタン誘導体、ジフェノキノン誘導体、チオピランジオキシド誘導体、ペリレンテトラカルボン酸誘導体、フレオレニリデンメタン誘導体、アントロン誘導体、シロ−ル誘導体、トリアリ−ルホスフィンオキシド誘導体、カルシウムアセチルアセトナ−ト、酢酸ナトリウムなどがあげられる。また、セシウム等の金属をバソフェナントロリンにド−プした無機/有機複合材料(高分子学会予稿集,第50巻,4号,660頁,2001年発行)や、第50回応用物理学関連連合講演会講演予稿集、No.3、1402頁、2003年発行記載のBCP、TPP、T5MPyTZ等も電子注入材料の例としてあげられるが、素子作成に必要な薄膜を形成し、陰極からの電子を注入できて、電子を輸送できる材料であれば、特にこれらに限定されるものではない。
【0127】
上記電子注入材料の中でも特に効果的な電子注入材料としては、金属錯体化合物、含窒素五員環誘導体、シロ−ル誘導体、トリアリ−ルホスフィンオキシド誘導体があげられる。本発明に使用可能な好ましい金属錯体化合物としては、8−ヒドロキシキノリンまたはその誘導体の金属錯体が好適である。8−ヒドロキシキノリンまたはその誘導体の金属錯体の具体例としては、トリス(8−ヒドロキシキノリナ−ト)アルミニウム、トリス(2−メチル−8−ヒドロキシキノリナ−ト)アルミニウム、トリス(4−メチル−8−ヒドロキシキノリナ−ト)アルミニウム、トリス(5−メチル−8−ヒドロキシキノリナ−ト)アルミニウム、トリス(5−フェニル−8−ヒドロキシキノリナ−ト)アルミニウム、ビス(8−ヒドロキシキノリナ−ト)(1−ナフトラ−ト)アルミニウム、ビス(8−ヒドロキシキノリナ−ト)(2−ナフトラ−ト)アルミニウム、ビス(8−ヒドロキシキノリナ−ト)(フェノラ−ト)アルミニウム、ビス(8−ヒドロキシキノリナ−ト)(4−シアノ−1−ナフトラ−ト)アルミニウム、ビス(4−メチル−8−ヒドロキシキノリナ−ト)(1−ナフトラ−ト)アルミニウム、ビス(5−メチル−8−ヒドロキシキノリナ−ト)(2−ナフトラ−ト)アルミニウム、ビス(5−フェニル−8−ヒドロキシキノリナ−ト)(フェノラ−ト)アルミニウム、ビス(5−シアノ−8−ヒドロキシキノリナ−ト)(4−シアノ−1−ナフトラ−ト)アルミニウム、ビス(8−ヒドロキシキノリナ−ト)クロロアルミニウム、ビス(8−ヒドロキシキノリナ−ト)(o−クレゾラ−ト)アルミニウム等のアルミニウム錯体化合物、トリス(8−ヒドロキシキノリナ−ト)ガリウム、トリス(2−メチル−8−ヒドロキシキノリナ−ト)ガリウム、トリス(4−メチル−8−ヒドロキシキノリナ−ト)ガリウム、トリス(5−メチル−8−ヒドロキシキノリナ−ト)ガリウム、トリス(2−メチル−5−フェニル−8−ヒドロキシキノリナ−ト)ガリウム、ビス(2−メチル−8−ヒドロキシキノリナ−ト)(1−ナフトラ−ト)ガリウム、ビス(2−メチル−8−ヒドロキシキノリナ−ト)(2−ナフトラ−ト)ガリウム、ビス(2−メチル−8−ヒドロキシキノリナ−ト)(フェノラ−ト)ガリウム、ビス(2−メチル−8−ヒドロキシキノリナ−ト)(4−シアノ−1−ナフトラ−ト)ガリウム、ビス(2、4−ジメチル−8−ヒドロキシキノリナ−ト)(1−ナフトラ−ト)ガリウム、ビス(2、5−ジメチル−8−ヒドロキシキノリナ−ト)(2−ナフトラ−ト)ガリウム、ビス(2−メチル−5−フェニル−8−ヒドロキシキノリナ−ト)(フェノラ−ト)ガリウム、ビス(2−メチル−5−シアノ−8−ヒドロキシキノリナ−ト)(4−シアノ−1−ナフトラ−ト)ガリウム、ビス(2−メチル−8−ヒドロキシキノリナ−ト)クロロガリウム、ビス(2−メチル−8−ヒドロキシキノリナ−ト)(o−クレゾラ−ト)ガリウム等のガリウム錯体化合物の他、8−ヒドロキシキノリナ−トリチウム、ビス(8−ヒドロキシキノリナ−ト)銅、ビス(8−ヒドロキシキノリナ−ト)マンガン、ビス(10−ヒドロキシベンゾ[h]キノリナ−ト)ベリリウム、ビス(8−ヒドロキシキノリナ−ト)亜鉛、ビス(10−ヒドロキシベンゾ[h]キノリナ−ト)亜鉛等の金属錯体化合物があげられる。
【0128】
また、本発明に使用可能な電子注入材料の内、好ましい含窒素五員環誘導体としては、オキサゾ−ル誘導体、チアゾ−ル誘導体、オキサジアゾ−ル誘導体、チアジアゾ−ル誘導体、トリアゾ−ル誘導体があげられ、具体的には、2,5−ビス(1−フェニル)−1,3,4−オキサゾ−ル、2,5−ビス(1−フェニル)−1,3,4−チアゾ−ル、2,5−ビス(1−フェニル)−1,3,4−オキサジアゾ−ル、2−(4’−tert−ブチルフェニル)−5−(4”−ビフェニル)1,3,4−オキサジアゾ−ル、2,5−ビス(1−ナフチル)−1,3,4−オキサジアゾ−ル、1,4−ビス[2−(5 −フェニルオキサジアゾリル)。)ベンゼン、1,4−ビス[2−(5−フェニルオキサジアゾリル)−4−tert−ブチルベンゼン]、2−(4’−tert− ブチルフェニル)−5−(4”−ビフェニル)−1,3,4−チアジアゾ−ル、2,5−ビス(1−ナフチル)−1,3,4−チアジアゾ−ル、1,4−ビス[2−(5−フェニルチアジアゾリル)。)ベンゼン、2−(4’−tert−ブチルフェニル)−5−(4”−ビフェニル)−1,3,4−トリアゾ−ル、2,5−ビス(1−ナフチル)−1,3,4−トリアゾ−ル、1,4−ビス[2−(5−フェニルトリアゾリル)。]ベンゼン等があげられる。
【0129】
また、本発明に使用可能な電子注入材料の内、特に好ましいオキサジアゾール誘導体としては下記一般式[11]で表されるオキサジアゾール誘導体を示すことができる。
【0130】
一般式[11]
【化13】

【0131】
(式中、Arr1およびArr2は、それぞれ独立に、置換基を有しても良い、1価の芳香族炭化水素基もしくは1価の含窒素芳香族複素環基を表す。)
【0132】
1価の含窒素芳香族複素環基としては、2−ピリジル基、3−ピリジル基、4−ピリジル基、3−ピリダジル基、4−ピリダジル基、2−ピリミジル基、4−ピリミジル基、5−ピリミジル基、2−ピラジル基、1−イミダゾリル基等の1価の含窒素単環芳香族複素環基、2−キノリル基、3−キノリル基、4−キノリル基、5−キノリル基、6−キノリル基、7−キノリル基、8−キノリル基、2−キナゾリル基、4−キナゾリル基、5−キナゾリル基、2−キノキサリル基、5−キノキサリル基、6−キノキサリル基、1−インドリル基、9−カリバゾリル基等の1価の含窒素縮合環芳香族複素環基、2,2’−ビピリジル−3−イル基、2,2’−ビピリジル−4−イル基、3,3’−ビピリジル−2−イル基、3,3’−ビピリジル−4−イル基、4,4’−ビピリジル−2−イル基、4,4’−ビピリジル−3−イル基等の1価の含窒素環集合芳香族複素環基があげられ、さらに、これら1価の含窒素芳香族複素環基上の水素原子は、1価の脂肪族炭化水素基もしくは1価の芳香族炭化水素基で置換されていても良い。
【0133】
Arr1およびArr2として、好ましい1価の芳香族炭化水素基としては、1価の脂肪族炭化水素基もしくは1価の含窒素芳香族複素環基で置換されていても良い、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基があげられ、また好ましい1価の含窒素芳香族複素環基としては、1価の脂肪族炭化水素基もしくは1価の芳香族炭化水素基で置換されていても良い、2−ピリジル基、3−ピリジル基、4−ピリジル基、2,2’−ビピリジル−3−イル基、および2,2’−ビピリジル−4−イル基があげられる。
【0134】
以下、表4に本発明に使用可能なオキサジアゾール誘導体の具体例を示す。
【0135】
表4
【表4】

【0136】
【表4】

【0137】
【表4】

【0138】
【表4】

【0139】
また、本発明に使用可能な電子注入材料の内、特に好ましいトリアゾール誘導体としては、下記一般式[12]で表されるトリアゾール誘導体があげられる。
【0140】
一般式[12]
【化14】

【0141】
(式中、Art1〜Art3は、それぞれ独立に、置換基を有しても良い、1価の芳香族炭化水素基もしくは1価の含窒素芳香族複素環基を表す。)
【0142】
ここで、Art1およびArt2として、好ましい1価の芳香族炭化水素基としては、1価の脂肪族炭化水素基もしくは1価の含窒素芳香族複素環基で置換されていても良い、フェニル基、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基があげられ、また好ましい1価の含窒素芳香族複素環基としては、1価の脂肪族炭化水素基もしくは1価の芳香族炭化水素基で置換されていても良い、2−ピリジル基、3−ピリジル基、4−ピリジル基、2,2’−ビピリジル−3−イル基、および2,2’−ビピリジル−4−イル基があげられる。また、Art3として、好ましい1価の芳香族炭化水素基としては、1価の脂肪族炭化水素基もしくは1価の含窒素芳香族複素環基で置換されていても良い、フェニル基、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基があげられ、また好ましい1価の含窒素芳香族複素環基としては、1価の脂肪族炭化水素基もしくは1価の芳香族炭化水素基で置換されていても良い、2−ピリジル基、3−ピリジル基、および4−ピリジル基があげられる。
【0143】
以下、表5に本発明に使用可能なトリアゾール誘導体の具体例を示す。
【0144】
表5
【表5】

【0145】
【表5】

【0146】
【表5】

【0147】
【表5】

【0148】
【表5】

【0149】
また、本発明に使用可能な電子注入材料の内、特に好ましいシロール誘導体としては、下記一般式[13]で表されるシロール誘導体があげられる。
【0150】
一般式[13]
【化15】

【0151】
(式中、Rp1およびRp2は、それぞれ独立に、置換基を有しても良い、1価の脂肪族炭化水素基、1価の芳香族炭化水素基もしくは1価の含窒素芳香族複素環基を表す。Arp1〜Arp4は、それぞれ独立に、置換基を有しても良い、1価の芳香族炭化水素基もしくは1価の含窒素芳香族複素環基を表す。Rp1、Rp2、Arp1〜Arp4の隣接した基同士は互いに連結して環を形成しても良い。)
【0152】
ここで、Rp1およびRp2として、好ましい1価の脂肪族炭化水素基としては、1価の芳香族炭化水素基もしくは1価の含窒素芳香族複素環基で置換されていても良い、メチル基、エチル基、プロピル基、およびブチル基があげられ、好ましい1価の芳香族炭化水素基としては、1価の脂肪族炭化水素基もしくは1価の含窒素芳香族複素環基で置換されていても良い、フェニル基、m−ビフェニリル基、およびp−ビフェニリル基があげられ、好ましい1価の含窒素芳香族複素環基としては、1価の脂肪族炭化水素基もしくは1価の芳香族炭化水素基で置換されていても良い、2−ピリジル基、3−ピリジル基、4−ピリジル基があげられる。また、Arp1〜Arp4として、好ましい1価の芳香族炭化水素基としては、1価の脂肪族炭化水素基もしくは1価の含窒素芳香族複素環基で置換されていても良い、フェニル基、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基があげられ、また好ましい1価の含窒素芳香族複素環基としては、1価の脂肪族炭化水素基もしくは1価の芳香族炭化水素基で置換されていても良い、2−ピリジル基、3−ピリジル基、4−ピリジル基、2,2’−ビピリジル−3−イル基、および2,2’−ビピリジル−4−イル基があげられる。
【0153】
以下、表6に本発明に使用可能なシロール誘導体の具体例を示す。
【0154】
表6
【表6】

【0155】
【表6】

【0156】
【表6】

【0157】
【表6】

【0158】
【表6】

【0159】
また、本発明に使用可能な電子注入材料の内、好ましいトリアリールホスフィンオキシド誘導体としては、特開2002−63989号公報、特開2004−95221号公報、特開2004−203828号公報、特開2004−204140号公報記載のトリアリールホスフィンオキシド誘導体や下記一般式[14]で表されるトリアリールホスフィンオキシド誘導体を示すことができる。
【0160】
一般式[14]
【化16】

【0161】
(式中、Arq1〜Arq3は、それぞれ独立に、置換基を有しても良い1価の芳香族炭化水素基を表す。)
【0162】
ここでArq1〜Arq3として、好ましい1価の芳香族炭化水素基としては、1価の脂肪族炭化水素基もしくは1価の含窒素芳香族複素環基で置換されていても良い、フェニル基、1−ナフチル基、2−ナフチル基、o−ビフェニリル基、m−ビフェニリル基、およびp−ビフェニリル基があげられる。
【0163】
以下、表7に本発明に使用可能なトリアリールホスフィンオキシド誘導体の具体例を示す。
【0164】
表7
【表7】

【0165】
【表7】

【0166】
【表7】

【0167】
【表7】

【0168】
【表7】

【0169】
【表7】

【0170】
さらに、正孔阻止層には、発光層を経由した正孔が電子注入層に達するのを防ぎ、薄膜形成性に優れた層を形成できる正孔阻止材料が用いられる。そのような正孔阻止材料の例としては、ビス(8−ヒドロキシキノリナ−ト)(4−フェニルフェノラ−ト)アルミニウム等のアルミニウム錯体化合物や、ビス(2−メチル−8−ヒドロキシキノリナ−ト)(4−フェニルフェノラ−ト)ガリウム等のガリウム錯体化合物、2,9−ジメチル−4,7−ジフェニル−1,10−フェナントロリン(BCP)等の含窒素縮合芳香族化合物があげられる。
【0171】
本発明の有機EL素子の発光層としては、以下の機能を併せ持つものが好適である。
注入機能;電界印加時に陽極または正孔注入層より正孔を注入することができ、陰極または電子注入層より電子を注入することができる機能
輸送機能;注入した電荷(電子と正孔)を電界の力で移動させる機能
発光機能;電子と正孔の再結合の場を提供し、これを発光につなげる機能
ただし、正孔の注入されやすさと電子の注入されやすさには、違いがあってもよく、また正孔と電子の移動度で表される輸送能に大小があってもよいが、どちらか一方の電荷を移動することが好ましい。
【0172】
有機EL素子の発光材料は主に有機化合物であり、具体的には所望の色調により、次のような化合物が用いられる。
【0173】
たとえば、紫外域から紫色の発光を得る場合には、下記一般式[15]で表される化合物が好適に用いられる。
【0174】
一般式[15]
【化17】

【0175】
(式中、X1は下記一般式[16]で表される基を示し、X2は、フェニル基、1−ナフチル基、2−ナフチル基のいずれかを示す。〕
【0176】
一般式[16]
【化18】

【0177】
(式中、mは2〜5の整数を示す)
【0178】
この一般式[15]のX1、X2で表されるフェニル基、1−ナフチル基、2−ナフチル基、フェニレン基は、単数または複数の炭素数1〜4のアルキル基、炭素数1〜4のアルコキシル基、水酸基、スルホニル基、カルボニル基、アミノ基、ジメチルアミノ基またはジフェニルアミノ基等の置換基で置換されていてもよい。また、これら置換基が複数ある場合には、それらが互いに結合し、環を形成していてもよい。さらに、X1で表されるフェニレン基は、パラ位で結合したものが、結合性が良く、かつ平滑な蒸着膜が形成し易いことから好ましい。上記一般式[15]で表される化合物の具体例を示せば、下記のとおりである(ただし、Phはフェニル基を表す)。
【0179】
【化19】

【0180】
【化20】

【0181】
これら化合物の中では、特にp−クォ−タ−フェニル誘導体、p−クインクフェニル誘導体が好ましい。
【0182】
また、可視域、特に青色から緑色の発光を得るためには、例えばベンゾチアゾ−ル系、ベンゾイミダゾ−ル系、ベンゾオキサゾ−ル系等の蛍光増白剤、金属キレ−ト化オキシノイド化合物、スチリルベンゼン系化合物を用いることができる。これら化合物の具体例としては、例えば特開昭59−194393号公報に開示されている化合物を挙げることができる。さらに他の有用な化合物は、ケミストリ−・オブ・シンセティック・ダイズ(1971)628〜637頁および640頁に列挙されている。
【0183】
前記金属キレ−ト化オキシノイド化合物としては、例えば、特開昭63−295695号公報に開示されている化合物を用いることができる。その代表例としては、トリス(8−キノリノ−ル)アルミニウム等の8−ヒドロキシキノリン系金属錯体や、ジリチウムエピントリジオン等が好適な化合物として挙げることができる。
【0184】
また、前記スチリルベンゼン系化合物としては、例えば、欧州特許第0319881号明細書や欧州特許第0373582号明細書に開示されているものを用いることができる。そして、特開平2−252793号公報に開示されているジスチリルピラジン誘導体も、発光層の材料として用いることができる。このほか、欧州特許第0387715号明細書に開示されているポリフェニル系化合物も発光層の材料として用いることができる。
【0185】
さらに、上述した蛍光増白剤、金属キレ−ト化オキシノイド化合物およびスチリルベンゼン系化合物等以外に、例えば12−フタロペリノン(J. Appl. Phys.,第27巻,L713(1988年))、1,4−ジフェニル−1,3−ブタジエン、1,1,4,4−テトラフェニル−1,3−ブタジエン(以上Appl. Phys. Lett.,第56巻,L799(1990年))、ナフタルイミド誘導体(特開平2−305886号公報)、ペリレン誘導体(特開平2−189890号公報)、オキサジアゾ−ル誘導体(特開平2−216791号公報、または第38回応用物理学関係連合講演会で浜田らによって開示されたオキサジアゾ−ル誘導体)、アルダジン誘導体(特開平2−220393号公報)、ピラジリン誘導体(特開平2−220394号公報)、シクロペンタジエン誘導体(特開平2−289675号公報)、ピロロピロ−ル誘導体(特開平2−296891号公報)、スチリルアミン誘導体(Appl. Phys. Lett., 第56巻,L799(1990年)、クマリン系化合物(特開平2−191694号公報)、国際特許公報WO90/13148やAppl. Phys. Lett.,vol58,18,P1982(1991)に記載されているような高分子化合物、9,9’,10,10’−テトラフェニル−2,2’−ビアントラセン、PPV(ポリパラフェニレンビニレン)誘導体、ポリフルオレン誘導体やそれら共重合体等、例えば、下記一般式[17]〜一般式[19]の構造をもつものや、
【0186】
一般式[17]
【化21】

【0187】
(式中、Rx1およびRX2は、それぞれ独立に、1価の脂肪族炭化水素基を、n1は、3〜100の整数を表す。)
【0188】
一般式[18]
【化22】

【0189】
(式中、Rx3およびRX4は、それぞれ独立に、1価の脂肪族炭化水素基を、n2およびn3は、それぞれ独立に、3〜100の整数を表す。)
【0190】
一般式[19]
【化23】

【0191】
(式中、RX5およびRX6は、それぞれ独立に、1価の脂肪族炭化水素基を、n4およびn5は、それぞれ独立に、3〜100の整数を表す。Phはフェニル基を表す。)
【0192】
9,10−ビス(N−(4−(2−フェニルビニル−1−イル)フェニル)−N−フェニルアミノ)アントラセン等も発光層の材料として用いることができる。さらには、特開平8−12600号公報に開示されているような下記一般式[20]で示されるフェニルアントラセン誘導体も発光材料として用いることができる。
【0193】
一般式[20]
【化24】

【0194】
(式中、A1及びA2は、それぞれ独立に、モノフェニルアントリル基またはジフェニルアントリル基を示し、これらは同一でも異なっていてもよい。Lは、単結合または2価の連結基を表す。)
ここで、Lで示される2価の連結基としては、置換基を有しても良い2価の単環もしくは縮合環芳香族炭化水素基が好ましい。特に、以下の一般式[21]ないし一般式[22]で表されるフェニルアントラセン誘導体は好適である。
【0195】
一般式[21]
【化25】

【0196】
(式中、RZ1〜RZ4は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、1価の芳香族炭化水素基、アルコキシル基、アリ−ルオキシ基、ジアリ−ルアミノ基、1価の脂肪族複素環基、1価の芳香族複素環基を表し、これらは同一でも異なるものであってもよい。r1〜r4は、それぞれ独立に、0又は1〜5の整数を表す。r1〜r4が、それぞれ独立に、2以上の整数であるとき、RZ1同士、RZ2同士、RZ3同士、RZ4同士は各々同一でも異なるものであってもよく、RZ1同士、RZ2同士、RZ3同士、RZ4同士は結合して環を形成してもよい。L1は単結合又は置換基を有しても良い2価の単環もしくは縮合環芳香族炭化水素基を表し、置換基を有しても良い2価の単環もしくは縮合環芳香族炭化水素基は、アルキレン基、−O−、−S−又は−NR−(ここでRはアルキル基又はアリ−ル基を表す)が介在するものであってもよい。)
【0197】
一般式[22]
【化26】

【0198】
(式中、RZ5及びRZ6は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、1価の芳香族炭化水素基、アルコキシル基、アリ−ルオキシ基、ジアリ−ルアミノ基、1価の脂肪族複素環基、1価の芳香族複素環基を表し、これらは同一でも異なるものであってもよい。r5及びr6は、それぞれ独立に、0又は1〜5の整数を表す。r5及びr6が、それぞれ独立に、2以上の整数であるとき、RZ5同士及びRZ6同士は各々同一でも異なるものであってもよく、RZ5同士及びRZ6同士は結合して環を形成してもよい。L2は単結合又は置換基を有しても良い2価の単環もしくは縮合環芳香族炭化水素基を表し、置換基を有しても良い2価の単環もしくは縮合環芳香族炭化水素基は、アルキレン基、−O−、−S−又は−NR−(ここでRはアルキル基又はアリ−ル基を表す)が介在するものであってもよい。)
【0199】
前記一般式[22]の内、下記一般式[23]ないし一般式[24]で表されるフェニルアントラセン誘導体がさらに好適である。
【0200】
一般式[23]
【化27】

【0201】
(式中、RZ11〜RZ30は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、1価の芳香族炭化水素基、アルコキシル基、アリ−ルオキシ基、ジアリ−ルアミノ基、1価の脂肪族複素環基、1価の芳香族複素環基を表し、これらは同一でも異なるものであってもよい。また、RZ11〜RZ30は、隣り合う基同士が連結し、環を形成していても良い。k1は、0〜3の整数を表す。)
【0202】
一般式[24]
【化28】

【0203】
(式中、RZ31〜RZ50は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、1価の芳香族炭化水素基、アルコキシル基、アリ−ルオキシ基、ジアリ−ルアミノ基、1価の脂肪族複素環基、1価の芳香族複素環基を表し、これらは同一でも異なるものであってもよい。また、RZ31〜RZ50は、隣り合う基同士が連結し、環を形成していても良い。k2は、0〜3の整数を表す。)
【0204】
また、前記一般式[24]の内、下記一般式[25]で表されるフェニルアントラセン誘導体はさらに好適である。
【0205】
一般式[25]
【化29】

【0206】
(式中、RZ51〜RZ60は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、1価の芳香族炭化水素基、アルコキシル基、アリ−ルオキシ基、ジアリ−ルアミノ基、1価の脂肪族複素環基、1価の芳香族複素環基を表し、これらは同一でも異なるものであってもよい。また、RZ51〜RZ60は、隣り合う基同士が連結し、環を形成していても良い。k3は、0〜3の整数を表す。)
【0207】
上記一般式[21]〜一般式[25]の具体例としては、下記化合物があげられる。
【0208】
【化30】

【0209】
さらには、以下の化合物も具体例として挙げられる。
【0210】
【化31】

【0211】
また、下記一般式[26]で示されるアミン化合物も発光材料として有用である。
【0212】
一般式[26]
【化32】

【0213】
(式中、hは、価数であり1〜6の整数を表す。E1は、n価の芳香族炭化水素基、E2は、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。)
【0214】
ここで、E1で示されるN価の芳香族炭化水素基の母体構造としては、ナフタレン、アントラセン、9−フェニルアントラセン、9,10−ジフェニルアントラセン、ナフタセン、ピレン、ペリレン、ビフェニル、ビナフチル、ビアンスリルが好ましく、E1で示されるアミノ基としては、ジアリ−ルアミノ基が好ましい。また、nは、1〜4が好ましく、特に2であることが最も好ましい。一般式[26]の内、特に以下の一般式[27]〜一般式[36]で表されるアミン化合物は好適である。
【0215】
一般式[27]
【化33】

【0216】
(式中、Ry1〜Ry8は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry1〜Ry8の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry1〜Ry8は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0217】
一般式[28]
【化34】

【0218】
(式中、Ry11〜Ry20は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry11〜Ry20の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry11〜Ry20は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0219】
一般式[29]
【化35】

【0220】
(式中、Ry21〜Ry34は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry21〜Ry34の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry21〜Ry34は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0221】
一般式[30]
【化36】

【0222】
(式中、Ry35〜Ry52は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry35〜Ry52の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry35〜Ry52は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0223】
一般式[31]
【化37】

【0224】
(式中、Ry53〜Ry64は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry53〜Ry64の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry53〜Ry64は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0225】
一般式[32]
【化38】

【0226】
(式中、Ry65〜Ry74は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry65〜Ry74の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry65〜Ry74は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0227】
一般式[33]
【化39】

【0228】
(式中、Ry75〜Ry86は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry75〜Ry86の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry75〜Ry86は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0229】
一般式[34]
【化40】

【0230】
(式中、Ry87〜Ry96は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry87〜Ry96の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry87〜Ry96は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0231】
一般式[35]
【化41】

【0232】
(式中、Ry97〜Ry110は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry97〜Ry110の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry97〜Ry110は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0233】
一般式[36]
【化42】

【0234】
(式中、Ry111〜Ry128は、それぞれ独立に、水素原子、アルキル基、アルケニル基、シクロアルキル基、アルコキシル基、アリ−ルオキシ基、1価の脂肪族複素環基、1価の芳香族複素環基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry111〜Ry128の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表す。Ry111〜Ry128は同一でも異なるもので良く、隣り合う基同士が連結し、環を形成していても良い。)
【0235】
上述した一般式[27]〜一般式[36]のアミン化合物は、黄色〜赤色発光を得る場合、好適に用いることができる。以上述べた一般式[27]〜一般式[36]で表されるアミン化合物の具体例として下記構造の化合物をあげることができる(ただし、Phはフェニル基を表す)。
【0236】
【化43】

【0237】
【化44】

【0238】
【化45】

【0239】
【化46】

【0240】
【化47】

【0241】
また、上記一般式[27]〜一般式[36]において、アミノ基の代わりに、下記一般式[37]ないし一般式[38]で表されるスチリル基を少なくとも一つ含有する化合物(例えば、欧州特許第0388768号明細書、特開平3−231970号公報などに開示のものを含む)も発光材料として好適に用いることができる。
【0242】
一般式[37]
【化48】

【0243】
(式中、Ry129〜Ry131は、それぞれ独立に、水素原子、アルキル基、シクロアルキル基、1価の芳香族炭化水素基を表す。Ry129〜Ry131は、隣り合う基同士が連結し、環を形成していても良い。)
【0244】
一般式[38]
【化49】

【0245】
(式中、Ry132〜Ry138は、それぞれ独立に、水素原子、アルキル基、シクロアルキル基、1価の芳香族炭化水素基を表す。Ry134〜Ry138は、それぞれ独立に、水素原子、アルキル基、シクロアルキル基、1価の芳香族炭化水素基、もしくは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基を表すが、Ry134〜Ry138の内、少なくとも一つは、ジアルキルアミノ基、ジアリ−ルアミノ基、アルキルアリ−ルアミノ基から選ばれるアミノ基である。Ry132〜Ry138は、隣り合う基同士が連結し、環を形成していても良い。)
【0246】
以上述べた一般式[37]ないし一般式[38]で表されるスチリル基を少なくとも一つ含有する化合物の具体例として下記構造の化合物をあげることができる(ただし、Phはフェニル基を表す)。
【0247】
【化50】

【0248】
【化51】

【0249】
【化52】

【0250】
【化53】

【0251】
【化54】

【0252】
【化55】

【0253】
また、特開平5−258862号公報等に記載されている一般式(Rs−Q)2 −Al−O−L3(式中、L3はフェニル部分を含んでなる炭素原子6〜24個の炭化水素であり、O−L3はフェノラ−ト配位子であり、Qは置換8−キノリノラ−ト配位子を示し、Rsはアルミニウム原子に置換8−キノリノラ−ト配位子が2個を上回り結合するのを立体的に妨害するように選ばれた8−キノリノラ−ト環置換基を示す〕で表される化合物も挙げられる。具体的には、ビス(2−メチル−8−キノリノラ−ト)(パラ−フェニルフェノラ−ト)アルミニウム(III)、ビス(2−メチル−8−キノリノラ−ト)(1−ナフトラ−ト)アルミニウム(III)等が挙げられる。
【0254】
このほか、特開平6−9953号公報等によるド−ピングを用いた高効率の青色と緑色の混合発光を得る方法が挙げられる。この場合、ホストとしては、上記の発光材料、ド−パントとしては青色から緑色までの強い蛍光色素、例えばクマリン系あるいは上記のホストとして用いられているものと同様な蛍光色素を挙げることができる。具体的には、ホストとしてジスチリルアリ−レン骨格の発光材料、特に好ましくは4,4’−ビス(2,2−ジフエニルビニル)ビフェニル、ド−パントとしてはジフェニルアミノビニルアリ−レン、特に好ましくは例えばN,N−ジフェニルアミノビニルベンゼンを挙げることができる。
【0255】
白色の発光を得る発光層としては特に制限はないが、下記のものを用いることができる。
有機EL積層構造体の各層のエネルギ−準位を規定し、トンネル注入を利用して発光させるもの(欧州特許第0390551号公報)。
同じくトンネル注入を利用する素子で実施例として白色発光素子が記載されているもの(特開平3−230584号公報)。
二層構造の発光層が記載されているもの(特開平2−220390号公報および特開平2−216790号公報)。
発光層を複数に分割してそれぞれ発光波長の異なる材料で構成されたもの(特開平4−51491号公報)。
青色発光体(蛍光ピ−ク380〜480nm)と緑色発光体(480〜580nm)とを積層させ、さらに赤色蛍光体を含有させた構成のもの(特開平6−207170号公報)。
青色発光層が青色蛍光色素を含有し、緑色発光層が赤色蛍光色素を含有した領域を有し、さらに緑色蛍光体を含有する構成のもの(特開平7−142169号公報)。
これらの中では、上記の構成のものが特に好ましい。
【0256】
さらに、発光材料として、例えば、下記に示す公知の化合物が好適に用いられる(ただし、Phはフェニル基を表す)。
【0257】
【化56】

【0258】
【化57】

【0259】
【化58】

【0260】
【化59】

【0261】
【化60】

【0262】
【化61】

【0263】
【化62】

【0264】
また、本発明の有機EL素子では、リン光発光材料を用いることができる。本発明の有機EL素子に使用できるリン光発光材料またはド−ピング材料としては、例えば有機金属錯体があげられ、ここで金属原子は通常、遷移金属であり、好ましくは周期では第5周期または第6周期、族では6族から11族、さらに好ましくは8族から10族の元素が対象となる。具体的にはイリジウムや白金などである。また、配位子としては2−フェニルピリジンや2−(2’−ベンゾチエニル)ピリジンなどがあり、これらの配位子上の炭素原子が金属と直接結合しているのが特徴である。別の例としてはポルフィリンまたはテトラアザポルフィリン環錯体などがあり、中心金属としては白金などがあげられる。例えば、下記に示す公知の化合物がリン光発光材料として好適に用いられる(ただし、Phはフェニル基を表す)。
【0265】
【化63】

【0266】
【化64】

【0267】
さらに、本発明の有機EL素子の陽極に使用される材料は、仕事関数の大きい(4eV以上)金属、合金、電気伝導性化合物またはこれらの混合物を電極物質とするものが好ましく用いられる。このような電極物質の具体例としては、Au等の金属、CuI、ITO、SNO2 、ZNO等の導電性材料が挙げられる。この陽極を形成するには、これらの電極物質を、蒸着法やスパッタリング法等の方法で薄膜を形成させることができる。この陽極は、上記発光層からの発光を陽極から取り出す場合、陽極の発光に対する透過率が10%より大きくなるような特性を有していることが望ましい。また、陽極のシ−ト抵抗は、数百Ω/□以下としてあるものが好ましい。さらに、陽極の膜厚は、材料にもよるが通常10Nm〜1μm、好ましくは10〜200nmの範囲で選択される。
【0268】
また、本発明の有機EL素子の陰極に使用される材料は、仕事関数の小さい(4eV以下)金属、合金、電気伝導性化合物およびこれらの混合物を電極物質とするものが用いられる。このような電極物質の具体例としては、ナトリウム、ナトリウム−カリウム合金、マグネシウム、リチウム、マグネシウム・銀合金、アルミニウム/酸化アルミニウム、アルミニウム・リチウム合金、インジウム、希土類金属などが挙げられる。この陰極はこれらの電極物質を蒸着やスパッタリング等の方法により薄膜を形成させることにより、作製することができる。ここで、発光層からの発光を陰極から取り出す場合、陰極の発光に対する透過率は10%より大きくすることが好ましい。また、陰極としてのシ−ト抵抗は数百Ω/□以下が好ましく、さらに、膜厚は通常10nm〜1μm、好ましくは50〜200Nmである。
【0269】
本発明の有機EL素子を作製する方法については、上記の材料および方法により陽極、発光層、必要に応じて正孔注入層、および必要に応じて電子注入層を形成し、最後に陰極を形成すればよい。また、陰極から陽極へ、前記と逆の順序で有機EL素子を作製することもできる。
【0270】
この有機EL素子は、透光性の基板上に作製する。この透光性基板は有機EL素子を支持する基板であり、その透光性については、400〜700nmの可視領域の光の透過率が50%以上、好ましくは90%以上であるものが望ましく、さらに平滑な基板を用いるのが好ましい。
【0271】
これら基板は、機械的、熱的強度を有し、透明であれば特に限定されるものではないが、例えば、ガラス板、合成樹脂板などが好適に用いられる。ガラス板としては、特にソ−ダ石灰ガラス、バリウム・ストロンチウム含有ガラス、鉛ガラス、アルミノケイ酸ガラス、ホウケイ酸ガラス、バリウムホウケイ酸ガラス、石英などで成形された板が挙げられる。また、合成樹脂板としては、ポリカ−ボネ−ト樹脂、アクリル樹脂、ポリエチレンテレフタレ−ト樹脂、ポリエ−テルサルファイド樹脂、ポリサルフォン樹脂などの板が挙げられる。
【0272】
本発明の有機EL素子の形成方法としては、真空蒸着、電子線ビ−ム照射、スパッタリング、プラズマ、イオンプレ−ティング等の乾式成膜法、もしくはスピンコ−ティング、ディッピング、フロ−コ−ティング、インクジェット法等の湿式成膜法、発光体をドナ−フイルム上に蒸着する方法、また、特表2002−534782やS.T.Lee, et al., Proceedings of SID'02, p.784(2002)に記載されているレーザー熱転写法((Laser Induced Thermal Imaging、LITI法ともいわれる)のいずれかの方法を適用することができる。有機層は、特に分子堆積膜であることが好ましい。ここで分子堆積膜とは、気相状態の材料化合物から沈着され形成された薄膜や、溶液状態または液相状態の材料化合物から固体化され形成された膜のことであり、通常この分子堆積膜は、LB法により形成された薄膜(分子累積膜)とは凝集構造、高次構造の相違や、それに起因する機能的な相違により区分することができる。また特開昭57−51781号公報に開示されているように、樹脂等の結着剤と材料化合物とを溶剤に溶かして溶液とした後、これをスピンコ−ト法等により薄膜化することによっても、有機層を形成することができる。各層の膜厚は特に限定されるものではないが、膜厚が厚すぎると一定の光出力を得るために大きな印加電圧が必要となり効率が悪くなり、逆に膜厚が薄すぎるとピンホ−ル等が発生し、電界を印加しても充分な発光輝度が得にくくなる。したがって、各層の膜厚は、1nmから1μmの範囲が適しているが、10nmから0.2μmの範囲がより好ましい。
【0273】
また、有機EL素子の温度、湿度、雰囲気等に対する安定性向上のために、素子の表面に保護層を設けたり、樹脂等により素子全体を被覆や封止を施したりしても良い。特に素子全体を被覆や封止する際には、光によって硬化する光硬化性樹脂が好適に使用される。
【0274】
本発明の有機EL素子に印加する電流は通常、直流であるが、パルス電流や交流を用いてもよい。電流値、電圧値は、素子破壊しない範囲内であれば特に制限はないが、素子の消費電力や寿命を考慮すると、なるべく小さい電気エネルギ−で効率良く発光させることが望ましい。
【0275】
本発明の有機EL素子の駆動方法は、パッシブマトリクス法のみならず、アクティブマトリックス法での駆動も可能である。また、本発明の有機EL素子から光を取り出す方法としては、陽極側から光を取り出すボトム・エミッションという方法のみならず、陰極側から光を取り出すトップ・エミッションという方法にも適用可能である。これらの方法や技術は、城戸淳二著、「有機ELのすべて」、日本実業出版社(2003年発行)に記載されている。
【0276】
さらに、本発明の有機EL素子は、マイクロキャビティ構造を採用しても構わない。これは、有機EL素子は、発光層が陽極と陰極との間に挟持された構造であり、発光した光は陽極と陰極との間で多重干渉を生じるが、陽極及び陰極の反射率、透過率などの光学的な特性と、これらに挟持された有機層の膜厚とを適当に選ぶことにより、多重干渉効果を積極的に利用し、素子より取り出される発光波長を制御するという技術である。これにより、発光色度を改善することも可能となる。この多重干渉効果のメカニズムについては、J.Yamada等によるAM−LCD Digest of TechNical Papers, OD−2,p.77〜80(2002)に記載されている。
【0277】
以上述べたように、本発明の有機EL素子用材料を用いた有機EL素子は、低い駆動電圧で長時間の発光を得ることが可能である。故に、本有機EL素子は、壁掛けテレビ等のフラットパネルディスプレイや各種の平面発光体として、さらには、複写機やプリンタ−等の光源、液晶ディスプレイや計器類等の光源、表示板、標識灯等への応用が考えられる。
【実施例】
【0278】
以下、本発明を実施例で説明するが、本発明はこれら合成例になんら限定されるものではない。
【0279】
まず、本発明の材料の合成例を示す。また、説明中、%は重量%を表す。
【0280】
合成例1
化合物(1)の合成方法
合成スキームを反応1に示す。(n-C6H13は、n-ヘキシル基を表す。)
【0281】
反応1
【化65】

【0282】
以下、反応1を参照しながら合成方法を説明する。窒素雰囲気下、(I)を5.0g(0.01mol)、3−ブロモ−9−フェニルカルバゾール(II)8.0g(0.025mol)、テトラキス(トリフェニルホスフィン)パラジウム0.96g、炭酸カリウム(2M水溶液)100g、テトラヒドロフラン100gを4つ口フラスコにいれ、5時間加熱還流した。その後、反応液をメタノール400ml中に注入し、析出した固体を濾取し、熱真空乾燥させて、粗生成物として化合物(1)が8.76g得られた。得られた粗成生物を、シリカゲルカラムクロマトグラフィーにより精製し、さらに昇華精製を行った。化合物は、マススペクトル(ブルカーダルトニクス社製、AutoflexII)、 1H−NMR、および13C−NMR(日本電子(株)製、ECX−400P)によって同定した。化合物(1)の1H−NMR、13C−NMR、UVスペクトル、蛍光(PL)スペクトルを、それぞれ図1〜図4示す。尚、UVスペクトルは、日立分光光度計(U−3500)、蛍光(PL)スペクトルは、日本分光(株)製蛍光分光光度計(FP−6500)により、測定した。
【0283】
尚、化合物(1)の合成に使用した(I)は、市販の試薬を用いた。3−ブロモ−9−フェニルカルバゾール(II)は、WO2007/43484記載の方法に従って合成したものを用いた。
【0284】
合成例2〜40
合成方法は、以下に示す反応2〜反応7を組み合わせて、表1中の化合物を合成した。
【0285】
反応2
【化66】

【0286】
R37〜R41は本発明の化合物を合成するのに必要な置換基であり、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換もしくは未置換の置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。
【0287】
合成方法としては、常法に従い、窒素気流下、−76℃において、3−ブロモ−9−フェニルカルバゾール誘導体(III)にn−ブチルリチウム(n−BuLi)を反応させてリチオ化し、生成したLi誘導体に、B(OMe)3を反応させて、目的とするボロン酸誘導(IV)体を合成した。
【0288】
反応3
【化67】

【0289】
R15、R16は本発明の化合物を合成するのに必要な置換基であり、それぞれ独立に、水素原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換もしくは未置換の置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。R37〜R41は前述のものと同義である。
【0290】
合成方法としては、2,7−ジブロモフルオレン誘導体(V)に、カルバゾール誘導体(IV)を3当量反応させる以外は合成例1と同様の操作をすることで目的化合物が得られた。
【0291】
反応4
【化68】

【0292】
ここで、R1〜R7は本発明の化合物を合成するのに必要な置換基であり、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換もしくは未置換の置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。また、Ar1は、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、または、置換もしくは未置換の1価の芳香族複素環基を表す。
【0293】
合成方法としては、窒素気流下、−78℃において、3−ブロモカルバゾール誘導体(VII)にn−ブチルリチウムを反応させてリチオ化し、生成したLi誘導体に、B(OMe)3を反応させて、目的とするボロン酸誘導体(VIII)を合成した。
【0294】
反応5
【化69】

【0295】
R17〜R22は、本発明の化合物を合成するのに必要な置換基であり、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換もしくは未置換の置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。Ar1、R1〜R7は、前述のものと同義である。
【0296】
合成方法としては、合成例1の(I)のかわりに対応するフルオレン誘導体(X)を、(II)のかわりに対応するカルバゾール誘導体(VIII)を3当量反応させる以外は、合成例1と同様の操作をすることで目的化合物(XI)が得られた。
【0297】
反応6
【化70】

【0298】
R17〜R22は、本発明の化合物を合成するのに必要な置換基であり、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換もしくは未置換の置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。
【0299】
合成方法としては、常法に従い、トルエン中、フルオレン誘導体(XII)に等量の臭素もしくはN−ブロモスクシンイミドを反応させることで(X)が得られた。
【0300】
反応7
【化71】

【0301】
R15〜R22、R1〜R7は、本発明の化合物を合成するのに必要な置換基であり、前述のものと同義である。合成方法としては、合成例1と同様の操作をすることで目的化合物が容易に得られた。
【0302】
以上の反応2〜反応7を組み合わせて得られた本発明の化合物の構造については、マススペクトル(ブルカーダルトニクス社製、AutoflexII)にて同定した。結果を表8に示す。尚、化合物番号は表1のものと同様である。
【0303】
表8
【表8】

【0304】
次に、表1の化合物(41)〜(65)の合成方法を以下に示す
【0305】
合成例41
化合物(41)の合成方法
【0306】
反応8
【化72】

【0307】
以下、反応8を参照しながら合成方法を説明する。窒素雰囲気下、(XIV)を2.73g(0.0058mol)、(II)5.0g(0.0174mol)、テトラキス(トリフェニルホスフィン)パラジウム0.5g、炭酸カリウム(2M水溶液)50g、テトラヒドロフラン50gを4つ口フラスコに加え、5時間加熱還流した。その後、反応液をメタノール400ml中に注入し、析出した固体を濾取し、熱真空乾燥させて、粗生成物として化合物(41)が3.12g得られた。得られた粗成生物を、シリカゲルカラムクロマトグラフィーにより精製し、さらに昇華精製を行った。化合物は、マススペクトル(ブルカーダルトニクス社製、AutoflexII)、 1H−NMR、および13C−NMR(日本電子製、ECX−400P)によって同定した。化合物(41)の1H−NMR、13C−NMR、UVスペクトル、蛍光(PL)スペクトルを、それぞれ図5〜図8に示す。尚、UVスペクトルは、日立分光光度計(U−3500),蛍光(PL)スペクトルは、日本分光(株)製蛍光分光光度計(FP−6500)により測定した。
【0308】
合成例42〜65
合成方法は、前述の反応、および以下に示す反応9〜反応11を組み合わせて、表2中の化合物を合成した。
【0309】
反応9
【化73】

【0310】
R23〜R36は本発明で扱う化合物を合成するのに必要な置換基であり、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換もしくは未置換の置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。また、R23〜R36は前述のものと同義である。
【0311】
合成方法としては、ジブロモスピロビフルオレノン誘導体(XIV)に、カルバゾール誘導体(IV)を3当量反応させる以外は合成例1と同様の操作をすることで目的化合物が得られる。
【0312】
反応10
【化74】

【0313】
R23〜R36は前述のものと同義である。合成方法としては、窒素気流下、−78℃において、ジブロモナフタレン誘導体(XV)にn−ブチルリチウムを反応させてリチオ化し、生成したLi誘導体に、B(OMe)3を反応させて、目的とするボロン酸誘導体(XVI)を合成した。
【0314】
反応11
【化75】

【0315】
R1〜R7、Ar1は、前述のものと同義である。合成方法としては、反応7の(XIII)のかわりに対応するスピロビフルオレノン誘導体(XVI)をカルバゾール誘導体(VII)を3当量反応させる以外は、前述と同様の操作をすることで目的化合物(XVII)が得られた。
【0316】
以上の反応8〜反応11を組み合わせて得られた本発明の化合物の構造については、マススペクトル(ブルカーダルトニクス社製、AutoflexII)にて同定した。結果を表9に示す。尚、化合物番号は表1のものと同様である。
【0317】
表9
【表9】

【0318】
以下、実施例として、本発明の材料を用いた有機EL素子の作成例を示すが、本発明は下記の実施例に限定されるものではない。また、本実施例においては、特に断りのない限り、混合比は全て重量比を示す。
【0319】
蒸着(真空蒸着)は10-6Torrの真空中で、基板加熱、冷却等の温度制御なしの条件下で行った。また、素子の発光特性評価においては、発光面積2mm×2mmの有機EL素子の特性を測定した。
【0320】
実施例1
洗浄したITO電極付きガラス板上に、化合物(21)を真空蒸着して膜厚60nmの正孔注入層を得た。次いで、表3のHTM9を真空蒸着して20nmの正孔輸送層を得た。さらに、トリス(8−ヒドロキシキノリン)アルミニウム錯体を真空蒸着して膜厚60nmの電子注入型発光層を作成し、その上に、まずフッ化リチウムを1nm、次いでアルミニウムを200nm蒸着して電極を形成して、有機EL素子を得た。
【0321】
実施例2〜7
正孔注入層を化合物(1)のかわりに、表1の化合物を用いた以外は、実施例1と同様の有機EL素子を作成した。
【0322】
また、実施例1〜7の素子を室温の環境で、10mA/cm2の電流密度で一定時間連続して発光させ輝度を測定した。結果を表10に示す。
【0323】
表10
【表10】

【0324】
実施例8
洗浄したITO電極付きガラス板上に、表2のHIM2を真空蒸着して膜厚50nmの正孔注入層を得た。次いで、表1の化合物(1)を真空蒸着して30nmの正孔輸送層を得た。さらに、トリス(8−ヒドロキシキノリン)アルミニウム錯体を真空蒸着して膜厚60nmの電子注入型発光層を作成し、その上に、まずフッ化リチウムを1nm、次いでアルミニウムを200nm蒸着して電極を形成して、有機EL素子を得た。
【0325】
実施例9〜34
正孔注入層を化合物(1)のかわりに、表1の化合物を用いた以外は、実施例8と同様の有機EL素子を作成した。
【0326】
また、実施例8〜34の素子を室温の環境で、10mA/cm2の電流密度で一定時間連続して発光させ輝度を測定した。結果を表11に示す。
【0327】
表11
【表11】

【0328】
実施例35
ITO電極付きガラス板上に、表2のHIM4を真空蒸着して膜厚50nmの正孔注入層を得た。次いで、表1の化合物(2)を真空蒸着して30nmの正孔輸送層を得た。次に、以下に示す化合物(A)を蒸着して膜厚20nmの発光層を形成した。さらに、Alq3を蒸着して膜厚20nmの電子注入層を形成した。その上に、フッ化リチウムを1nm、さらにアルミニウムを200nm真空蒸着によって電極を形成して素子を得た。この素子は、直流電圧5.0Vでの発光効率は3.0(lm/W)を示した。また、発光輝度500(cd/m2)で定電流駆動したときの半減寿命は1000時間以上であった。
【0329】
【化76】

【0330】
実施例36
ITO電極付きガラス板上に、PEDOT/PSS(ポリ(3,4−エチレンジオキシ)−2,5−チオフェン/ポリスチレンスルホン酸)をスピンコ−ト法で60nmの膜厚に製膜した。さらに、表1の化合物(5)をトルエン溶媒に溶解させスピンコ−ト法にて塗布し、膜厚50nmの正孔輸送層を作成した。この塗布基板に真空蒸着法にさらに(A)を蒸着して膜厚30nmの発光層を形成した。その上に、真空蒸着法にさらに(B)を蒸着して膜厚30nmの電子注入層を形成した。最後に、酸化リチウムを1nm、さらにアルミニウムを100nm蒸着によって陰極を形成して有機エレクトロルミネッセンス素子を得た。この素子は、直流電圧10Vでの外部量子効率は5.3%を示した。また、発光輝度100(cd/m2)で定電流駆動したときの半減寿命は5000時間以上であった。
【0331】
【化77】

【0332】
実施例37
ITO電極付きガラス板上に、表2のHIM7を真空蒸着して膜厚50nmの正孔注入層を得た。次いで、表1の化合物(3)を真空蒸着して30nmの正孔輸送層を得た。次に、以下に示す化合物(C)を蒸着して膜厚30nmの発光層を形成した。さらに、Alq3を蒸着して膜厚20nmの電子注入層を形成した。その上に、フッ化リチウムを1nm、さらにアルミニウムを200nm真空蒸着によって電極を形成して素子を得た。この素子は、直流電圧5.0Vでの発光効率は3.5(lm/W)を示した。また、発光輝度500(cd/m2)で定電流駆動したときの半減寿命は1000時間以上であった。
【0333】
【化78】

【0334】
実施例38
ITO電極付きガラス板上に、銅フタロシアニンを蒸着して膜厚50nmの正孔注入層を形成した。次に、表1の化合物(10)を蒸着して膜厚30nmの正孔輸送層を形成した。さらに、1.3.5−トリ(9H−カルバゾリール−9−イル)ベンゼンと化合物(D)とを100:8の組成比で共蒸着して膜厚45nmの発光層を形成した。さらに(E)を蒸着して膜厚5nmのブロッキング層を形成し、さらに、Alq3を蒸着して膜厚20nmの電子注入層を形成した。その上に、酸化リチウムを1nm、さらにアルミニウムを100nm蒸着によって陰極を形成して有機エレクトロルミネッセンス素子を得た。この素子は、直流電圧10Vでの外部量子効率は6.5%を示した。また、発光輝度500(cd/m2)で定電流駆動したときの半減寿命は1000時間以上であった。
【0335】
【化79】

【0336】
【化80】

【0337】
実施例39
ITO電極付きガラス板上に、表2のHIM9を蒸着して膜厚40nmの正孔注入層を形成し、さらに、本発明の化合物(44)を蒸着して膜厚35nmの正孔輸送層を形成した。さらに、以下に示す化合物(F)と以下に示す化合物(G)とを50:1の組成比で共蒸着して膜厚35nmの発光層を形成した。さらに、以下に示す化合物(H)を蒸着して膜厚30nmの電子注入層を形成した。その上に、フッ化リチウム(LiF)を1nm、さらにアルミニウム(Al)を200nm真空蒸着によって電極を形成して素子を得た。この素子は、直流電圧3.5Vでの発光効率は5.0(lm/W)を示した。また、発光輝度500(cd/m2)で定電流駆動したときの半減寿命は1000時間以上であった。
【0338】
【化81】

【0339】
【化82】

【0340】
【化83】

【0341】
実施例40
ITO電極付きガラス板上に、表2のHIM8を真空蒸着して膜厚60nmの正孔注入層を得た。次に、表1の化合物(1)と表3のHTM25を1:1の割合で共蒸着して膜厚40nmの正孔輸送層を形成した。さらにAlq3を蒸着して膜厚30nmの電子注入性発光層を形成した。その上に、フッ化リチウムを蒸着して膜厚20nmの電子注入層を形成した。さらにアルミニウムを100nm蒸着によって陰極を形成して有機EL素子を得た。この素子は、直流電圧10Vでの外部量子効率は2.5%を示した。また、発光輝度500(cd/m2)で定電流駆動したときの輝度半減寿命は1000時間以上であった。
【0342】
比較例1
化合物(1)のかわりに化合物(I)を用いた以外は実施例8と同様に素子を作成した。この素子を発光輝度500(cd/m2)で室温にて定電流駆動したときの輝度半減寿命を測定した。また、電流密度10mA/cm2で駆動させた時の初期輝度、および100℃の環境で100時間連続駆動させた後の輝度を測定した。結果を表12に示す。
【0343】
【化84】

【0344】
比較例2
化合物(1)のかわりに化合物(J)を用いた以外は実施例40と同様に素子を作成した。この素子を発光輝度500(cd/m2)で室温にて定電流駆動したときの輝度半減寿命を測定した。また、電流密度10mA/cm2で駆動させた時の初期輝度、および100℃の環境で100時間連続駆動させた後の輝度を測定した。結果を表12に示す。
【0345】
【化85】

【0346】
表12
【表12】

【0347】
表12から明らかなように、本発明の化合物はいずれも、比較例の化合物(I)、化合物(J)を用いて作成した素子よりも、長寿命で高い輝度が得られた。
【0348】
以上のように、本発明で示された有機EL素子用正孔注入/輸送材料を用いることにより、高い性能のEL素子が作成できる。比較化合物に対して格段に高い性能が発揮されることは明らかであり、有機EL素子の低駆動電圧化、長寿命化が達成できる。
【図面の簡単な説明】
【0349】
【図1】図1は、化合物(1)の1H−NMRスペクトルである。(重THF溶媒中)
【0350】
【図2】図2は、化合物(1)の13C−NMRスペクトルである。(重THF溶媒中)
【0351】
【図3】図3は、化合物(1)のUVスペクトルである。(トルエン溶媒中)
【0352】
【図4】図4は、化合物(1)のPLスペクトルである。(トルエン溶媒中)
【0353】
【図5】図5は、化合物(41)の1H−NMRスペクトルである。(重THF溶媒中)
【0354】
【図6】図6は、化合物(41)の13C−NMRスペクトルである。(重THF溶媒中)
【0355】
【図7】図7は、化合物(41)のUVスペクトルである。(トルエン溶媒中)
【0356】
【図8】図8は、化合物(41)のPLスペクトルである。(トルエン溶媒中)
【特許請求の範囲】
【請求項1】
下記一般式[1]で表されるカルバゾリル基を有する有機エレクトロルミネッセンス素子用電荷輸送材料。
一般式[1]
【化1】

(式中、Xは、一般式[2]または[3]で表される連結基を表す。
Ar1およびAr2は、それぞれ独立に、置換もしくは未置換の1価の芳香族炭化水素基、または、置換もしくは未置換の1価の芳香族複素環基を表す。
R1〜R14は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。)
一般式[2]
【化2】

(式中、R15およびR16は、それぞれ独立に、水素原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表し、
R17〜R22は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。)
一般式[3]
【化3】

(式中、R23〜R36は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。)
【請求項2】
Ar1およびAr2が、それぞれ独立に、下記一般式[4]で表される置換もしくは未置換のフェニル基である請求項1記載の有機エレクトロルミネッセンス素子用電荷輸送材料。
一般式[4]
【化4】

(式中、R37〜R41は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。また、R37〜R41は、隣接した置換基同士が結合し、新たな環を形成しても良い。)
【請求項3】
R37〜R41が水素原子である請求項1または2記載のカルバゾリル基を有する有機エレクトロルミネッセンス素子用電荷輸送材料。
【請求項4】
正孔注入材料または正孔輸送材料である、請求項1ないし3いずれか記載のカルバゾリル基を有する有機エレクトロルミネッセンス素子用電荷輸送材料。
【請求項5】
一対の電極間に、正孔注入層および/または正孔輸送層を有する有機エレクトロルミネッセンス素子において、前記正孔注入層および/または正孔輸送層が、請求項4記載の有機エレクトロルミネッセンス素子用電荷輸送材料を含んでなる有機エレクトロルミネッセンス素子。
【請求項1】
下記一般式[1]で表されるカルバゾリル基を有する有機エレクトロルミネッセンス素子用電荷輸送材料。
一般式[1]
【化1】

(式中、Xは、一般式[2]または[3]で表される連結基を表す。
Ar1およびAr2は、それぞれ独立に、置換もしくは未置換の1価の芳香族炭化水素基、または、置換もしくは未置換の1価の芳香族複素環基を表す。
R1〜R14は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。)
一般式[2]
【化2】

(式中、R15およびR16は、それぞれ独立に、水素原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表し、
R17〜R22は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。)
一般式[3]
【化3】

(式中、R23〜R36は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。)
【請求項2】
Ar1およびAr2が、それぞれ独立に、下記一般式[4]で表される置換もしくは未置換のフェニル基である請求項1記載の有機エレクトロルミネッセンス素子用電荷輸送材料。
一般式[4]
【化4】

(式中、R37〜R41は、それぞれ独立に、水素原子、ハロゲン原子、置換もしくは未置換の1価の脂肪族炭化水素基、置換もしくは未置換の1価の芳香族炭化水素基、置換もしくは未置換の1価の脂肪族複素環基、置換もしくは未置換の1価の芳香族複素環基、シアノ基、置換もしくは未置換のアルコキシル基、置換もしくは未置換のアリ−ルオキシ基、置換もしくは未置換のアルキルチオ基、置換もしくは未置換のアリ−ルチオ基、置換アミノ基、置換もしくは未置換のアシル基、置換もしくは未置換のアルコキシカルボニル基、置換もしくは未置換のアリ−ルオキシカルボニル基、置換もしくは未置換のアルキルスルホニル基、または、置換もしくは未置換のアリ−ルスルホニル基を表す。また、R37〜R41は、隣接した置換基同士が結合し、新たな環を形成しても良い。)
【請求項3】
R37〜R41が水素原子である請求項1または2記載のカルバゾリル基を有する有機エレクトロルミネッセンス素子用電荷輸送材料。
【請求項4】
正孔注入材料または正孔輸送材料である、請求項1ないし3いずれか記載のカルバゾリル基を有する有機エレクトロルミネッセンス素子用電荷輸送材料。
【請求項5】
一対の電極間に、正孔注入層および/または正孔輸送層を有する有機エレクトロルミネッセンス素子において、前記正孔注入層および/または正孔輸送層が、請求項4記載の有機エレクトロルミネッセンス素子用電荷輸送材料を含んでなる有機エレクトロルミネッセンス素子。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2009−194042(P2009−194042A)
【公開日】平成21年8月27日(2009.8.27)
【国際特許分類】
【出願番号】特願2008−31194(P2008−31194)
【出願日】平成20年2月13日(2008.2.13)
【出願人】(000222118)東洋インキ製造株式会社 (2,229)
【Fターム(参考)】
【公開日】平成21年8月27日(2009.8.27)
【国際特許分類】
【出願日】平成20年2月13日(2008.2.13)
【出願人】(000222118)東洋インキ製造株式会社 (2,229)
【Fターム(参考)】
[ Back to top ]

