カルモジュリン様皮膚タンパク質を有効成分として含む医薬組成物
【課題】
神経細胞の機能障害又は細胞死を抑制する活性がヒューマニンよりも強い、内因性ヒューマニン受容体アゴニストを提供すること。
【解決手段】
式(I):
TGKNLSEAGLRKLI(S又はG)EVDSDGD(アミノ酸一文字表記)(I)
からなるアミノ酸配列を有する、神経細胞の機能障害又は細胞死を抑制する活性を有するペプチド、又は、式(I)からなるアミノ酸配列を含み、神経細胞の機能障害又は細胞死を抑制する活性を有するポリペプチド等を有効成分として含む、医薬組成物。
神経細胞の機能障害又は細胞死を抑制する活性がヒューマニンよりも強い、内因性ヒューマニン受容体アゴニストを提供すること。
【解決手段】
式(I):
TGKNLSEAGLRKLI(S又はG)EVDSDGD(アミノ酸一文字表記)(I)
からなるアミノ酸配列を有する、神経細胞の機能障害又は細胞死を抑制する活性を有するペプチド、又は、式(I)からなるアミノ酸配列を含み、神経細胞の機能障害又は細胞死を抑制する活性を有するポリペプチド等を有効成分として含む、医薬組成物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、カルモジュリン様皮膚タンパク質を有効成分として含む医薬組成物、特に、アルツハイマー病治療用の医薬組成物等に関する。
【背景技術】
【0002】
老化はアルツハイマー病(AD)の発症にとって極めて重要である。ADの発症にとって老化が極めて重要であるということの根底にある仮説の1つは、内因性の防御システムが高齢者ではその有効性がより低くなるというものである(Matsuoka,2009)。ヒューマニンは、抗AD防御因子候補として機能し得ると推定される内因性の神経栄養因子である(Nishimotoら,2004;Matsuokaら,2006;Matsuoka,2009、特許文献1)。
【0003】
ヒューマニンは培養神経細胞の死を抑制し、ロンドン型家族性AD変異遺伝子のアミロイド前駆タンパク質(APP)であるV642I−APPの発現によって誘導される、24個のアミノ酸からなるペプチド(MAPRGFSCLLLLTSEIDLPVKRRA)として、発現クローニング法により同定された(Hashimotoら,2000a)。アミロイドベータ(Aβ)により誘導される死、及び、家族性AD関連遺伝子の発現により誘導される死を含む、AD関連神経細胞死モデルをヒューマニンがインビトロで抑制することが、一連の研究により立証されている(概説として、Nishimotoら,2004;Matsuokaら,2006参照)。
【0004】
強力なヒューマニンペプチド誘導体はFAD遺伝子を発現するトランスジェニックマウスを含むAD関連マウスモデルの記憶障害を改善する(MamiyaとUkai,2001;Krejcovaら,2004:Tajimaら,2005;Chibaら,2005;Kunesovら,2008;Miaoら,2008;Yamadaら,2008;Chibaら,2009)。Chibaら(2009)は、ヒューマニンが、STAT3の活性化を介して、海馬のコリン作動性神経伝達を向上させることにより、ADマウスモデルの記憶障害を改善することを示した。
【0005】
ヒューマニンによってもたらされるAD関連の神経細胞死及び神経機能障害の抑制は、細胞表面上の特異的受容体へのヒューマニンの結合とSTAT3の活性化とが介在する(Hashimotoら,2000;Yamagishiら,2003;Hashimotoら,2005)。Hashimotoら(2009)は、細胞表面上のヒューマニン受容体が、IL−6受容体ファミリーに属する新規受容体であり、毛様体神経栄養因子受容体a(CNTFR)、WSX−1、及びgp130から構成されることを見出した(特許文献2)。この受容体の機能の喪失は、ヒューマニンの活性を無効にする。その特異的受容体の発見は、ヒューマニンの活性がAD関連損傷から神経細胞をインビボで保護する上で重要な役割を果たすという考えを支持するものである。
【0006】
細胞表面上の受容体に加えて、Guoら(2004)は、細胞質性のヒューマニンがBaxと結合しBaxが介在するプロアポトーシス経路を中和することにより、スタウロスポリンによって誘発される細胞死を部分的に抑制することを見出した。この知見は、細胞外から細胞表面上のヒューマニン受容体と結合するばかりでなく細胞質中のBaxとも結合することにより、その神経保護活性を示すことを示唆する(但し、後者の受容体が、AD関連神経保護に寄与することを示す証拠は存在しない)(Matsuokaら,2010)。
【0007】
ヒューマニンに対する特異的抗体を用いた複数の研究により、ヒューマニンは成人精巣において高度に発現され(Tajimaら,2003;Lueら,2010;Morettiら,2010)、神経細胞及びグリア細胞を含むその他の組織では弱く発現されることが示されている(Tajimaら,2003;Mudzumarら,2009)。この知見は、野生型のヒューマニンは非常に弱い神経保護活性を有することから、脳におけるAD関連神経毒性を抑制するためには、ヒューマニンが精巣から循環系を経由して中枢神経系に送達される必要があり得ることを示すものである。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】国際公開WO2001/021787号パンフレット
【特許文献2】国際公開WO2006/1150267号パンフレット
【発明の概要】
【発明が解決しようとする課題】
【0009】
ヒューマニンは、1〜10μMのEC50でAD関連神経細胞死を抑制する(Hashimotoら,2000)。ヒューマニンの有効濃度は、それらの生物学的活性を内分泌的に示すその他のサイトカイン及び生物活性因子の濃度と比べてはるかに高い。従って、ヒューマニンよりも強い活性を有する別の内因性ヒューマニン受容体アゴニストが、ヒューマニン受容体が介在する生存促進性経路(prosurvival pathway)を活性化する上で主要な役割を果たし得るという可能性があり、当該技術分野において基礎研究及び臨床的観点からもそのような物質を探索・同定することが強く望まれている。
【課題を解決するための手段】
【0010】
本発明者は上記課題を解決すべく鋭意研究の結果、ヒト由来の分泌型のカルモジュリン様皮膚タンパク質(CLSP)及びそのカウンターパートであるマウス由来のタンパク質がヒューマニン又はヒューマニンペプチド誘導体と同様な神経細胞の機能障害又は細胞死を抑制する活性を有しており、10〜100pMのEC50を有するヒューマニン受容体アゴニストとして機能することを初めて見出し、本発明を完成した。
【0011】
即ち、本発明は以下の態様にかかるものである。
[態様1]式(I):
TGKNLSEAGLRKLI(S又はG)EVDSDGD(アミノ酸一文字表記)(I)
からなるアミノ酸配列を有する、神経細胞の機能障害又は細胞死を抑制する活性を有するペプチド。
[態様2]態様1記載のペプチド、又は、式(I):
TGKNLSEAGLRKLI(S又はG)EVDSDGD(アミノ酸一文字表記)(I)
からなるアミノ酸配列を含み、神経細胞の機能障害又は細胞死を抑制する活性を有するポリペプチドを有効成分として含む、医薬組成物。
[態様3]以下のアミノ酸配列:
(1)配列番号1に示されるアミノ酸配列;
(2)配列番号1に示されるアミノ酸配列において、式(I)からなるアミノ酸配列以外の部分の一個又は数個のアミノ酸が、欠失、置換又は挿入されたアミノ酸配列;
(3)配列番号1に示されるアミノ酸配列における式(I)からなるアミノ酸配列以外の部分において、60%以上の同一性を有するアミノ酸配列;
(4)配列番号3又は配列番号4に示されるアミノ酸配列;
(5)配列番号3又は配列番号4に示されるアミノ酸配列において、一個又は数個のアミノ酸が、欠失、置換又は挿入されたアミノ酸配列;又は
(6)配列番号3又は配列番号4に示されるアミノ酸配列と60%以上の同一性を有するアミノ酸配列;
から成り、神経細胞の機能障害又は細胞死を抑制する活性を有するポリペプチドを有効成分として含む、医薬組成物。
[態様4]神経細胞の機能障害又は細胞死がアルツハイマー病に関連する、態様2又は3記載の医薬組成物。
[態様5]記憶傷害又は神経変性を伴う疾病の予防または治療に用いられる、態様2〜4のいずれか一項に記載の医薬組成物。
[態様6]態様1記載のペプチド、又は、態様2若しくは3に記載のポリペプチドによる神経細胞の機能障害又は細胞死を抑制する活性を検出する方法であって、(a)該ペプチド又はポリペプチドの存在下で神経細胞の機能障害又は細胞死を誘導する工程、(b)神経細胞の機能障害又は細胞死を検出する工程、を含む方法。
[態様7]態様1記載のペプチド、又は、態様2若しくは3に記載のポリペプチドによる細胞死を抑制する活性に対する化合物の効果を検出する方法であって、(a)被検化合物および該ペプチド又はポリペプチドの存在下で神経細胞の機能障害又は細胞死を誘導する工程、(b)神経細胞の機能障害又は細胞死を検出する工程、を含む方法。
[態様8]態様1記載のペプチド、又は、態様2若しくは3に記載のポリペプチドによる神経細胞の機能障害又は細胞死の抑制を調節する化合物をスクリーニングする方法であって、(a)被検試料および該ペプチド又はポリペプチドの存在下で神経細胞の機能障害又は細胞死を誘導する工程、(b)神経細胞死を検出する工程、(c)神経細胞の機能障害又は細胞死を促進または抑制する化合物を選択する工程、を含む方法。
[態様9]態様1記載のペプチド、又は、態様2若しくは3に記載のポリペプチドに結合する化合物のスクリーニング方法であって、(a)該ペプチド又はポリペプチドに被検試料を接触させる工程、(b)該ペプチド又はポリペプチドと被検試料との結合活性を検出する工程、(c)該ペプチド又はポリペプチドに結合する活性を有する化合物を選択する工程、を含む方法。
[態様10]態様1記載のペプチド、又は、態様2若しくは3に記載のポリペプチドを神経細胞に接触させる工程を含む、神経細胞の機能障害又は細胞死を抑制する方法。
[態様11]態様1記載のペプチド、又は、態様2若しくは3に記載のポリペプチドを、神経細胞の細胞機能障害若しくは神経細胞死を伴う疾患、又は、記憶傷害若しくは神経変性を伴う疾病に罹患した又はその疑いのある個体に投与する段階を含む、該疾患又は疾病を治療する方法。
[態様12]
疾患又は疾病がアルツハイマー病である、態様11記載の方法。
【発明の効果】
【0012】
本発明によって、従来知られているヒューマニン又はヒューマニンペプチド誘導体に較べて極めて顕著な神経細胞の機能障害又は細胞死を抑制する活性を有する物質を提供することが出来る。即ち、本発明のポリペプチドの一種であるCLSPの有するEC50は10〜100pMであると推定され、これは、CLSPがヒューマニン(EC50=1〜10μM)よりも105−6倍強力な上記活性を有していることを意味する。
【0013】
更に、本発明のポリペプチドの一種であるマウス由来のCLSPがインビボにおいてマウスの記憶傷害を抑制(改善)する効果を示した。
【図面の簡単な説明】
【0014】
【図1】(A)マウス精巣及び示された培養細胞(MLTC−1細胞、マウスライディッヒ細胞;TM3細胞、マウスライディッヒ細胞;NT2細胞、ヒトテラトカルシノーマ細胞)から調製した溶解物を、ヒューマニン抗体PO4をコンジュゲートさせたタンパク質Gを用いて免疫沈降させた。次に、インプット溶解物及び免疫沈降物を、Tris/Tricine SDS−PAGE、続く、銀染色法により分析した。(B)20kDの分子量を有し、NT2細胞から免疫沈降させたタンパク質を含むゲル片を切り出し、質量分析のために使用した。このタンパク質は、CLSPと同定された。下線を付したヒトCLSPのドメインは、ヒューマニンのコアドメインにわずかに類似している。
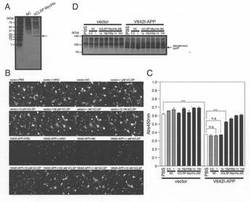
【図2】(A)SHSY−5Y細胞は、pFLAG−hCLSP、pFLAG−HN又はpFLAGベクターを用いてトランスフェクトした。pFLAG−hCLSPは、FLAGエピトープがC末端にタグ付加されているhCLSPをコードする。トランスフェクションの24時間後、それらを、Brefendin−Aと共に、又は、伴わずに6時間処理した。調整培地及び細胞溶解物を、M2抗FLAG抗体を用いるイムノブロット分析に供した。(B、C、及びD)ヒトSHSY−5Y細胞を、Myc/6xHis(MycHis)がC末端にタグ付加されているCLSPをコードするpcDNA3.1/MycHisベクター(Vec)又はpcDNA3.1/MycHis−hCLSPと共に、pcDNA3.1ベクター(Vec)又はpcDNA3.1−V642I−APPを用いてトランスフェクトした。トランスフェクションの48時間後に、それらを、WST−8細胞生存性アッセイ(B)、顕微鏡分析(C)、並びに、APP及びMycに対する抗体(hCLSP)を用いたイムノブロット分析(D)のために回収した。(E、F)SHSY−5Y細胞を、pcDNA3.1/MycHisベクター(Vec)又はpcDNA3.1/MycHis−hCLSPと共に、pcDNA3.1ベクター(Vec)又はpcDNA3.1−V642I−APPを用いてトランスフェクトした。トランスフェクション後に、細胞をhCLSPに対する抗体(CLSP−N)と一緒にインキュベートした。トランスフェクションの48時間後に、それらをWST−8細胞生存性アッセイ(E)、並びに、APP及びMycに対する抗体(hCLSP)を用いたイムノブロット分析(F)のために回収した。
【図3】(A)hCLSP欠失変異体の概略図。(B、C、D)CLSP欠失変異をコードするpcDNA3.1−MycHis(Vec)、pcDNA3.1/MycHis−hCLSP、又はpcDNA3.1−MycHisと共に、pcDNA3.1ベクター(Vec)又はpcDNA3.1−V642I−APPを用いてトランスフェクトしたヒトSH−SY5Y細胞。トランスフェクションを開始して48時間後に、それらを、顕微鏡分析(B)、WST−8アッセイ(C)、並びに、APP及びMycに対する抗体(CLSPタンパク質)を用いたイムノブロット分析(D)のために回収した。調整培地も、6xHisをタグ付加したタンパク質を吸着するTALON金属樹脂を用いてプルダウンするために回収した。次に、沈降物をMycに対する抗体を用いたイムノブロット分析により分析した。
【図4】pcDNA3.1−MycHis(Vec)、pcDNA3.1/MycHis−hCLSP−DN、又はpcDNA3.1/MycHis−sshCLSPDNと共に、pcDNA3.1ベクター(Vec)又はpcDNA3.1−V642I−APPを用いてトランスフェクトしたSHSY−5Y細胞。sshCLSPDNは、Met−マウスインスリン様増殖因子−1シグナル配列(Ser12−Gly33)−Lys−Proからなるシグナル配列がN末端に結合しているhCLSPDNである。トランスフェクションを開始してから48時間後に、細胞を、顕微鏡分析(A)、WST−8アッセイ(C)、並びに、APP及びMycに対する抗体(CLSPタンパク質)を用いたイムノブロット分析(D)のために回収した。調整培地も、6xHisをタグ付加したタンパク質を吸着するTALON金属樹脂を用いてプルダウンするために回収した。次に、沈降物を、Mycに対する抗体を用いたイムノブロット分析により分析した。ロット分析により分析した。
【図5】SHSY−5Y細胞を、pcDNA3.1ベクター(Vec)又はpcDNA3.1−V642I−APPを用いてトランスフェクトした。次に、細胞を、示された濃度の合成EHD又はEHD−Gと一緒にインキュベートした。トランスフェクションを開始してから48時間後に、細胞を、顕微鏡分析(A)、WST−8アッセイ(B)、並びに、APPに対する抗体を用いたイムノブロット分析(C)のために回収した。
【図6】(A)pcDNA3.1/MycHis−hCLSP又はベクターを用いてトランスフェクトしたCOS7細胞を、調整培地を回収する前に48時間、DMEM−10%FBS中で培養した。精製したhCLSP−MycHisのタンパク質濃度は、基準物質としてBSAを用いたTris/Tricine SDS−PAGEゲルの銀染色によって測定した(Wako Pure Chemicals)。並行して、同様に精製したベクター形質転換体の調整培地を、陰性対照(NC)として電気泳動に供した。(B、C、D)SH−SY5Y細胞を、pcDNA3.1ベクター(Vec)又はpcDNA3.1−V642I−APPを用いてトランスフェクトした。次に、細胞を、示された濃度のhCLSP−MycHis又は陰性対照(NC)と一緒にインキュベートした。トランスフェクションを開始してから48時間後に、細胞を、顕微鏡分析(B)、WST−8アッセイ(C)、並びに、APPに対する抗体を用いたイムノブロット分析(D)のために回収した。ロット分析により分析した。
【図7】(A)FBS不含でN2サプリメントを含有するDMEM培地中で48時間インキュベートされたSHSY−5Y細胞を、10μM HN、10μM HNA、又は100pM 組み換えhCLSP−MycHisを用いて、37℃にて15分間処理し、次に、ホスホSTAT3(Tyr705)及び全STAT3抗体を用いたイムノブロット分析のために回収した。HNA(ヒューマニンA;C8A−ヒューマニン)は、ヒューマニン活性を有しないヒューマニン誘導体である(Hashimotoら,2001a)。(B、C、D)SHSY−5Y細胞を、pcDNA3.1ベクター(Vec)又はpcDNA3.1−V642I−APPと共に、pcDNA3.1−MycHis(Vec)又はpcDNA3.1/MycHis−hCLSPを用いてトランスフェクトした。次に、細胞を、gp130に対する1μg/mlの中和マウスモノクローナル中和抗体と一緒にインキュベートした。トランスフェクションを開始してから48時間後に、細胞を顕微鏡分析(B)、WST−8アッセイ(C)、並びに、APPに対する抗体を用いたイムノブロット分析(D)のために回収した。ロット分析により分析した。
【図8】ヒトCNTFR−ED−Fc−6xHis(CNTFR−ED)(1μg)及びヒトgp130−ED−Fc−6xHis(gp130−ED)(1μg)を、1%のBrij96を含有する100μlのPBS中に含まれる、M2抗FLAG抗体をコンジュゲートさせたアガロース上に固定化する前に、ヒトWSX−1−ED−FLAG(WSX−1−ED)(推定5μg)と一緒に、100nMのhCLSP−MycHis又はヒューマニンの存在下又は非存在下で、6時間、37℃にてインキュベートした。次に、洗浄した沈降物及びインプット組み換えタンパク質を、抗6xHis抗体(CNTFR−ED及びgp130−EDのため)及び抗FLAG(M2)抗体(WSX−1−ED−FLAGの検出のため)を用いたイムノブロット分析に供した。ロット分析により分析した。
【図9】F11ニューロハイブリッド細胞を、pcDNA3.1/MycHisベクター、pcDNA3.1/MycHis−mCLSP−1、又はpcDNA3.1/MycHis−mCLSP−2と共に、pcDNA3.1ベクター(Vec)又はpcDNA3.1−V642I−APPを用いてトランスフェクトした。トランスフェクションを開始してから72時間後に、細胞を、顕微鏡分析(B)、WST−8アッセイ(C)、並びに、APP及びmMycに対する抗体(mCLSP)を用いたイムノブロット分析(D)のために回収した。ロット分析により分析した。
【図10A】(A)pcDNA3.1/MycHis−mCLSP−1又はベクターを用いてトランスフェクトされたCOS7細胞を、調整培地を回収する前に、DMEM−10%FBS中で48時間培養した。精製したmCLSP−MycHisのタンパク質濃度は、基準物質としてBSAを用いたTris/Tricine SDS−PAGEゲルの銀染色によって測定した(Wako Pure Chemicals)。並行して、同様に精製したベクター形質転換体の調整培地を、陰性対照(NC)として電気泳動に供した。
【図10B】(B)PBS、10pmolの精製mCLSP−1−MycHis、又は陰性対照(NC)を脳室内注入すると共に、生理食塩水又はスコポラミンを腹腔内注入したICRマウスのSA%(生理食塩水+PBS及びスコポラミン+PBS群については、N=10;スコポラミン+CLSP群については、N=12;スコポラミン+NC群については、N=9)。
【図10C】(C)7nmolのコリベリン、100pmolの精製mCLSP−1−MycHis、又はNCの腹腔内注入を行った又は行なわずに、スコポラミン処置を行ったICRマウスのSA%(生理食塩水+PBS、スコポラミン+PBS群、及びスコポラミン+コリベリン群については、N=10;スコポラミン+CLSP群については、N=11)。データは、平均±SEMで示す。統計分析は、一元配置分散分析、続いて、FisherのPLSDにより行った(*p<0.05、***p<0.001)。ロット分析により分析した。
【図11】8週齢及び27月齢のマウスの皮膚断面と海馬断面(CA1−3領域のピラミッド状の層)を、mCLSP−1又はmCLSP−2に対する抗体を用いて免疫染色した。目盛りバーは、10μm長である。
【図12A】(A)健常提供者からの100μLの血漿を、抗GST−CLSP抗血清−又は免疫前血清−をコンジュゲートさせたタンパク質Gを用いて免疫沈降させた。次に、免疫沈降物を、Tris/Tricine SDS−PAGEによって分画し、GST−CLSP抗体を用いてイムノブロットした。pcDNA3.1−hCLSP又はベクターを用いてトランスフェクトしたCOS7細胞からの粗調整培地(CM)を、陽性及び陰性対照として使用した。
【図12B】(B)ヒト血漿中のEHを検出するためのELISAアッセイ。示された濃度の精製組み換えhCLSP−MycHis及びヒト血漿をELISAアッセイのために使用した。対照hCLSP−MycHis濃度(x軸)とELISA値(y軸)との間の関係を下のパネルにプロットした。血漿サンプルは31〜53歳の4名の健常提供者から取得した。
【図13】SH−SY5Y細胞を、pcDNA3.1ベクター(Vec)又はpcDNA3.1−V642I−APPと共に、pcDNA3.1−MycHis(Vec)又はpcDNA3.1/MycHis−CLSPを用いてトランスフェクトした。次に、この細胞をヒトCNTFR又はヒトWSX−1に対する中和抗体と共にインキュベートした。トランスフェクションを開始してから48時間後に、細胞を顕微鏡分析のため(A、D)、WST−8アッセイのため(B、E)、及び、APPに対する抗体を用いたイムノブロットアッセイのため(C、F)に回収した。ヒトCNTFR又はヒト若しくは対照マウスIgGに対する1μg/mlの中和マウスモノクローナル抗体1μLを、1mlの培地を含む6ウェルディッシュの1つのウェルに添加した(A、B、C)。ヒトWSX−1のN末端16ペプチドに対するウサギポリクローナル抗体又は免疫前血清1μLを1mlの培地を含む6ウェルディッシュの1つのウェルに添加した(D、E、F)。
【図14】5μLの粗GST−CLSP抗血清及び免疫前血清をタンパク質Gビーズと一緒に混合し、ビーズ上に予め吸着させた。次に、10nM hCLSP−MycHisを含む350μLの溶液を、これらのタンパク質Gビーズを用いて免疫除去した。免疫除去後、10μLの免疫除去物及び投入物をMycに対する抗体を用いたイムノブロット分析により分析した。
【発明を実施するための形態】
【0015】
本明細書の実施例で示されるように、式(I):
TGKNLSEAGLRKLI(S又はG)EVDSDGD(アミノ酸一文字表記)(I)
からなるアミノ酸配列を有する本発明のペプチド、及び、該ペプチドを含むポリペプチド(タンパク質)、例えば、配列番号1で示されるアミノ酸配列からなるヒト由来のポリペプチドは、神経細胞の機能障害又は細胞死を抑制する活性を有する。更に、配列番号3及び配列番号4で示されるアミノ酸配列からなるマウス由来のポリペプチドも神経細胞の機能障害又は細胞死を抑制する活性を有する。
【0016】
尚、本発明において「神経細胞の機能障害又は細胞死を抑制する活性」とは、その原因又は因果関係に依らず、神経細胞における機能障害又は細胞死の少なくとも1つを抑制又は拮抗することを指す。神経細胞死の抑制は、完全な抑制ではなくても、有意に抑制されればよい。神経細胞死の抑制活性は、以下の実施例に記載された方法または他に記載の方法(例えば国際公開番号 WO00/14204参照)に従って検定することができる。
【0017】
従って、以下のアミノ酸配列:
(1)配列番号1に示されるアミノ酸配列;
(2)配列番号1に示されるアミノ酸配列において、式(I)からなるアミノ酸配列以外の部分の一個又は数個(例えば、3個〜5個)のアミノ酸が、欠失、置換又は挿入されたアミノ酸配列;
(3)配列番号1に示されるアミノ酸配列における式(I)からなるアミノ酸配列以外の部分において、60%以上、好ましくは70%以上、より好ましくは90%以上、更に好ましくは95%以上の同一性を有するアミノ酸配列;
(4)配列番号3又は配列番号4に示されるアミノ酸配列;
(5)配列番号3又は配列番号4に示されるアミノ酸配列において、一個又は数個(例えば、3個〜5個)のアミノ酸が、欠失、置換又は挿入されたアミノ酸配列;又は
(6)配列番号3又は配列番号4に示されるアミノ酸配列と60%以上、好ましくは70%以上、より好ましくは90%以上、更に好ましくは95%以上の同一性を有するアミノ酸配列;
から成り、神経細胞の機能障害又は細胞死を抑制する活性を有するポリペプチドは医薬組成物の有効成分として有用である。
【0018】
2つのアミノ酸配列における配列の同一性を決定するために、配列は比較に最適な状態に前処理される。例えば、一方の配列にギャップを入れることにより、他方の配列とのアラインメントの最適化を行う。その後、各部位におけるアミノ酸残基又は塩基が比較される。第一の配列における、ある部位に、第二の配列の相当する部位と同じアミノ酸残基又は塩基が存在する場合、それらの配列は、その部位において同一である。2つの配列における同一性は、配列間での同一である部位数の全部位(全アミノ酸又は全塩基)数に対する百分率で示される。
【0019】
上記の原理に従い、2つのアミノ酸配列における同一性は当業者に公知の任意の方法で決定することができる。例えば、Karlin及びAltshulのアルゴリズム(Proc.Natl.Acad.Sci.USA 87:2264−2268,1990及びProc.Natl.Acad.Sci.USA 90:5873−5877,1993)により決定することが出来る。このようなアルゴリズムを用いたBLASTプログラムがAltshulらによって開発された(J.Mol.Biol.215:403−410,1990)。
【0020】
さらに、Gapped BLASTはBLASTより感度良く同一性を決定するプログラムである(Nucleic Acids Res.25:3389−3402,1997)。上記のプログラムは、主に与えられた配列に対し、高い同一性を示す配列をデータベース中から検索するために用いられる。これらは、例えば米国National Center for Biotechnology Informationのインターネット上のウェブサイトにおいて利用可能である。
【0021】
或いは、配列間の同一性として、Tatiana A. Tatusovaらによって開発されたBLAST 2 Sequencesソフトウェア(FEMS Microbiol Lett.,174:247−250,1999)を用いて決定した値を用いることも可能である。このソフトウェアは米国National Center for Biotechnology Informationのインターネット上のウェブサイトにおいて利用可能であり、入手も可能である。用いるプログラム及びパラメーターは以下のとおりである。アミノ酸配列の場合、blastpプログラムを用いパラメーターとしては、Open gap:11 and extension gap:1 penalties,gap x_dropoff:50,expect:10,word size:3,Filter:ONを用いる。更に、高感度なFASTAソフトウェア(W.R.Pearson and D.J.Lipman,Proc.Natl.Acad.Sci.USA,85:2444−2448,1988)を用いて同一性を示す配列をデータベースから検索することもできる。いずれのパラメーターも、ウェブサイト上でデフォルト値として用いられているものである。
【0022】
上記の本発明のペプチド又はポリペプチド(以下、「ポリペプチド等」ともいう)は、これらの官能基を既知の方法により修飾、付加、変異、置換、または削除などにより改変された形態を持つことも可能である。このような官能基の改変は、当業者に公知の任意の方法を用いて、例えば、ポリペプチドに存在する官能基の保護、ポリペプチドの安定性または組織移行性の制御、あるいはポリペプチドの活性の制御等を目的として行なうことが出来る。
【0023】
即ち、本発明のポリペプチド等は翻訳後修飾などにより天然に修飾されていてもよい。また人工的に修飾されていてもよい。修飾には、ペプチドのバックボーン、アミノ酸側鎖、アミノ末端、またはカルボキシル末端などの修飾が含まれる。また、ポリペプチドは分岐していてもよく、環状でもよい。修飾には、アセチル化、アシル化、ADPリボシル化、アミド化、[フラビン(flavin)、ヌクレオチド、ヌクレオチド誘導体、脂質、脂質誘導体、またはホスファチジルイノシトール]等の共有結合、クロスリンク形成、環状化、ジスルフィド結合形成、脱メチル化、ピログルタミン酸化、カルボキシル化、グリコシル化、ヒドロキシル化、ヨード化、メチル化、ミリストイル化、酸化、リン酸化、ユビキチン化などが含まれるが、これらに制限されない。更に、上記ペプチド又はポリペプチドは当業者に公知の任意の塩及びエステル体とすることも可能である。
【0024】
更に、本発明のポリペプチド等は公知の任意の神経向性ペプチドと融合ポリペプチドを形成することも出来、このような融合ポリペプチドは当業者に公知の任意の方法で容易に合成することができる。
【0025】
既に述べたように、これまでの研究からアルツハイマー病において神経細胞の細胞死が起こることが明らかにされている。このため、本発明の医薬組成物(薬剤)は、アルツハイマー病における神経細胞の機能障害又は神経変性を保護する薬剤としても用いることが可能である。更に、本発明の薬剤を用いて、アルツハイマー病以外にも、記憶傷害又は神経変性を伴う疾病、例えば脳虚血による神経細胞の細胞死に起因する疾患を予防・治療することも可能である(T.Kirino,1982,Brain Res.,239:57−69)。その他、痴呆を伴うパーキンソン病(M.H.Polymeropoulos et al.,1997,Science,276:2045−2047)、びまん性レービー小体(Lewy bodies)病(M.G.Spillantini et al.,1998,Proc.Natl.Acad.Sci.USA,95:6469−6473)、ダウン症に伴う痴呆なども、治療や予防の対象となる。また、APPの類縁分子であるAPLP1が、先天性ネフローゼ症候群の原因遺伝子といわれている(Lenkkeri,U.et al.,1998,Hum.Genet.102:192−196)ことから、ネフローゼ症候群などの腎疾患も治療や予防の対象となる。
【0026】
本発明の医薬組成物は、有効成分自体を直接患者に投与する以外に、公知の製剤学的方法により製剤化することも可能である。例えば、薬理学上許容される担体もしくは媒体、具体的には、滅菌水や生理食塩水、植物油、乳化剤、懸濁剤、界面活性剤、安定剤、徐放剤などと適宜組み合わせて製剤化して投与することが考えられる。本発明の医薬組成物は、水溶液、錠剤、カプセル、トローチ、バッカル錠、エリキシル、懸濁液、シロップ、点鼻液、または吸入液などの形態であり得る。有効成分であるペプチド又はポリペプチドの含有率は使用目的及び製剤形態等に応じて適宜決定すればよい。
【0027】
患者への投与は、有効成分の性質に応じて、例えば経皮的、鼻腔内的、経気管支的、筋内的、腹腔内、静脈内、脊髄腔内、脳室内、または経口的に行われうるがそれらに限定されない。脳神経変性疾患の治療に用いる場合においては、本発明の医薬組成物は、静脈内、脊髄腔内、脳室内または硬膜内注射を含む任意の適当な経路で中枢神経系に導入するのが望ましい。投与量、投与方法は、本発明の医薬組成物の有効成分の組織移行性、治療目的、患者の体重や年齢、症状などにより変動するが、当業者であれば適宜選択することが可能である。例えば、1日1回〜数回、1回の処置当り数十μl程度の薬剤を適当な期間に亘り投与することができる。有効成分は、例えば、10 pmol〜100 nmol程度の範囲の濃度とすることができる。
【0028】
このように、本発明の医薬組成物は、アルツハイマー病等の神経細胞の細胞機能障害若しくは神経細胞死を伴う疾患、又は、記憶傷害若しくは神経変性を伴う疾病の予防または治療に広く用いることが出来る。
【0029】
従って、本発明は、本発明のポリペプチド等を神経細胞に接触させる工程を含む、神経細胞の機能障害又は細胞死を抑制する方法、及び、本発明の医薬組成物を、アルツハイマー病等の神経細胞の細胞機能障害若しくは神経細胞死を伴う疾患、又は、記憶傷害若しくは神経変性を伴う疾病に罹患した又はその疑いのあるヒト等の動物である対象(個体)に投与する段階を含む、該疾患又は疾病を治療する方法神経変性障害を伴う疾患を治療する方法に係る。
【0030】
本発明の医薬組成物の有効成分であるポリペプチド等はヒト及びマウス等の適当な種由来の細胞株等から調製することができ、更に、公知のペプチド合成技術により製造することが可能であり、また、当業者に公知の遺伝子工学的手法を用いて、これらをコードするDNAを含むベクター等を適当な宿主細胞等に導入して発現させることによって製造することも可能である。
【0031】
このようなベクターはプラスミド又はウイルス性ベクター等の当業者に公知の任意の形態であり、当業者に公知の任意の方法で容易に調製することが出来る。こうして得られたベクターには、本発明の部位特異的組換え酵素のコード領域以外に、5’および3’に非コード配列(核移行シグナル、タグ配列、非転写配列、非翻訳配列、プロモーター、エンハンサー、サプレッサー、転写因子結合配列、スプライシング配列、ポリA付加配列、IRES、mRNA安定化・不安定化配列等を含む)が適宜含まれており、発現ベクターとして機能する。
【0032】
このようなベクターを用いた当業者に公知の任意の方法、例えば、リポフェクション法、リン酸カルシウム法、並びに、エレクトロポレーション及びパーティクルガン等の各種物理的方法によって、適当な宿主細胞を容易に形質転換させることが出来る。
【0033】
宿主細胞に特に制限はなく、例えば、ヒト、サル及びマウス等を含む哺乳動物細胞、植物細胞、昆虫細胞、及び、大腸菌等の細菌類を用いることができる。こうして作製された形質転換細胞は当業者に公知の任意の条件で培養し、培養した菌体又はその培養上清等の適当な画分から目的とする本発明のポリペプチド等を容易に調製することが出来る。
【0034】
更に本発明は、本発明のポリペプチド等による神経細胞の機能障害又は細胞死を抑制する活性を検出する方法であって、(a)該ポリペプチド等の存在下で神経細胞の機能障害又は細胞死を誘導する工程、(b)神経細胞の細胞機能障害又は細胞死を検出する工程、を含む方法に係る。
【0035】
具体的な操作は、本明細書に記載された方法に従って行うことができる。この方法は、本発明のポリペプチド等が様々な細胞における細胞死に対して抑制効果を有するかどうかを決定したり、その抑制効果を定量するために用いられ得る。細胞としては特に制限はなく、細胞死を起し得るさまざまな細胞が用いられる。また、細胞死の誘導は、それぞれの細胞に応じて公知の細胞死誘導系を使用することができる。また、神経細胞を用いて、神経細胞死を誘導するさまざまな刺激、環境変化、または遺伝子発現などの諸条件に対する本発明のポリペプチド等の効果を検出するためにも用いられ得る。また、このような検出は、生物種や亜種、または個体間に存在し得る、神経細胞死における本発明のポリペプチド等に対する感受性の違いを検出するために用いられ得る。これにより、例えば民族、人種、または個人間で、本発明のポリペプチド等の有効性を検討することができる。このような方法により、例えば臨床適用に向けた詳細な条件検討を行うことができる
【0036】
又、本発明は、本発明のポリペプチド等による神経細胞の細胞死を抑制する活性に対する化合物の効果を検出する方法であって、(a)被検化合物および該ポリペプチド等の存在下で神経細胞の機能障害又は細胞死を誘導する工程、 (b)神経細胞の機能障害又は細胞死を検出する工程、を含む方法に係る。
【0037】
この方法は、本発明のポリペプチド等による神経細胞死を促進したり抑制したりする化合物をアッセイするために用いられ得る。本発明のポリペプチド等は、神経細胞表面に作用して細胞死抑制効果を発揮すると考えられる。この方法を用いれば、本発明のポリペプチド等の細胞表面への接触を阻害し得る候補化合物や、逆に促進し得る候補化合物の作用を検証することができる。
【0038】
また、この検出方法を用いて、本発明のポリペプチド等による神経細胞死の抑制を調節する化合物をスクリーニングすることも可能である。この方法は、(a)被検試料および本発明のポリペプチド等の存在下で神経細胞死を誘導する工程、(b)神経細胞死を検出する工程、および(c)神経細胞死を促進または抑制する化合物を選択する工程、を含む。工程(c)においては、任意の対照における場合と比較することができる。例えば、工程(c)において、被検試料非存在下において検出した場合に比べ、被検試料存在下において神経細胞死を促進または抑制する化合物を選択することができる。神経細胞死を促進する化合物は、本発明のポリペプチド等による神経細胞死の抑制を阻害する化合物の候補となり、神経細胞死を抑制する化合物は、本発明のポリペプチド等による神経細胞死の抑制をさらに促進する化合物の候補となる。また、上記のスクリーニングにおいて、被検試料とは別の化合物における場合を対照とすることもできる。例えば本発明のポリペプチド等による神経細胞死の抑制を調節し得る別の化合物を用いて細胞死を検出し、工程(c)において、該化合物の存在下における場合に比べ、工程(a)で用いた被検試料存在下において神経細胞死を促進または抑制する化合物を選択することもできる。このようなスクリーニングにおいては、本発明のポリペプチド等による神経細胞死の抑制の調節能に関して、既存の化合物よりもさらに高い効果を有する化合物をスクリーニングすることができる。
【0039】
上記のスクリーニングに用いる被検試料としては、例えば、精製タンパク質(抗体を含む)、遺伝子ライブラリーの発現産物、合成ペプチドのライブラリー、細胞抽出液、細胞培養上清、合成低分子化合物のライブラリー、土壌などの天然材料、放線菌ブロースなどの細菌放出物質を含む溶液などが挙げられるが、これらに制限されない。神経細胞死の誘導や本発明のポリペプチドの投与は、当業者に公知の任意の方法に従って行うことができる。
【0040】
被検試料を細胞に適用する時期に特に制限はなく、本発明のポリペプチド等を適用する前、後、または同時に適用することができる。被検試料の適用方法に制限はなく、培養細胞系であれば、例えば培地に添加される。また核酸であれば、細胞内に導入されてもよい。その他の任意の投与方法により被検試料を適用することができる。
【0041】
上記の化合物の作用の検査により評価された化合物、あるいはスクリーニングにより得られた化合物は、本発明のポリペプチド等の活性を調節する化合物の候補となり、アルツハイマー病を含む疾患の予防や治療への応用が考えられる。
【0042】
更に本発明は、本発明のポリペプチド等に結合する化合物のスクリーニング方法であって、(a)該ポリペプチド等に被検試料を接触させる工程、(b)該ポリペプチド等と被検試料との結合活性を検出する工程、(c)該蛋白質に結合する活性を有する化合物を選択する工程、を含む方法に係る。
【0043】
本発明のポリペプチド等は、スクリーニングの手法に応じて、可溶性ポリペプチドとして、また担体に結合させた形態としてスクリーニングに用いることができる。本発明のポリペプチド等は標識されていてもよい。標識としては、放射性同位元素による標識、蛍光物質による標識、ビオチンやジゴキシゲニンによる標識、タグ配列の付加などが挙げられる。
【0044】
スクリーニングに用いる被検試料としては、例えば、精製タンパク質(抗体を含む)、遺伝子ライブラリーの発現産物、合成ペプチドのライブラリー、細胞抽出液、細胞培養上清、合成低分子化合物のライブラリー、土壌などの天然材料、放線菌ブロースなどの細菌放出物質を含む溶液などが挙げられるが、これらに制限されない。被検試料は、必要に応じて適宜標識して用いられる。標識としては、例えば、放射標識、蛍光標識などが挙げられるが、これらに制限されない。
【0045】
例えば、本発明のポリペプチド等と結合するタンパク質をスクリーニングする場合は、本発明のポリペプチド等を固定したアフィニティーカラムに本発明のポリペプチドと結合するタンパク質を発現していることが予想される組織または細胞の細胞抽出物をのせ、カラムに特異的に結合するタンパク質を精製することにより、本発明のポリペプチド等に結合するタンパク質のスクリーニングを実施することが可能である。
【0046】
さらに、本発明のポリペプチド等と結合するタンパク質を発現していることが予想される組織若しくは細胞(例えば脳皮質組織、またはF11などの神経細胞)よりファージベクターを用いたcDNAライブラリーを作製し、アガロース上にプラークを形成させ、標識した本発明のポリペプチド等を用いてウエストウエスタンブロッティング法によりスクリーニングしたり、GAL4 DNA結合領域などのDNA結合ペプチドおよびGAL4転写活性化領域などの転写活性化ペプチドを、それぞれ本発明のポリペプチド等と被検タンパク質との融合タンパク質として発現させ、DNA結合ペプチドの結合配列を有するプロモーターの下流に連結させたレポーター遺伝子の発現を通して本発明のポリペプチド等と被検タンパク質との結合を検出する「twoハイブリッドシステム」等に従い実施することも可能である。
【0047】
本発明のスクリーニングにより、本発明のポリペプチド等に対する受容体をクローニングすることも考えられる。この場合、被検試料は受容体を発現していることが予想される組織または細胞、例えば脳皮質組織、神経細胞株、または神経芽細胞腫や奇形腫細胞などから調製することが好ましい。神経細胞株としては、例えばF11細胞、PC12細胞(L.A.GreeneおよびA.S.Tischler,1976,Proc.Natl.Acad.Sci.USA,73:2424−2428)、NTERA2細胞(J.SkowronskiおよびM.F.Singer,1985,Proc.Natl.Acad.Sci.USA,82:6050−6054)、SH−SY5Y細胞(L.Odelstad et al.,1981,Brain Res.,224:69−82)等が挙げられる。
【0048】
また、固定化した本発明のポリペプチド等に、合成化合物、天然物バンク、もしくはランダムファージペプチドディスプレイライブラリーなどを作用させ、結合する分子をスクリーニングすることも考えられる。また、表面プラズモン共鳴現象を利用した結合の検出によるスクリーニングも可能である(例えばビアコア(BIAcore社製)など)。これらのスクリーニングは、コンビナトリアルケミストリー技術を用いたハイスループットスクリーニングにより行うことも可能である。
【0049】
本発明のスクリーニングにより得られた本発明のポリペプチド等に結合する化合物は、本発明のポリペプチド等の活性を調節する化合物の候補となり、アルツハイマー病を含む疾患の予防や治療への応用が考えられる。
【0050】
以下、実施例に則して本発明を更に詳しく説明する。尚、本発明の技術的範囲はこれらの記載によって何等制限されるものではない。
【実施例1】
【0051】
[CLSPはヒューマニン抗体によって免疫沈降する]
ヒューマニンに対する抗体PO4(Tajimaら,2003)を用いることにより、ヒトNT2神経芽細胞腫細胞溶解物から20kDのタンパク質を免疫沈降させた(図1A)。質量分析によって、このタンパク質はCLSP(カルモジュリン様皮膚タンパク質;calmodulin−like skin protein)と同定された。ヒトCLSP(hCLSP)は146個のアミノ酸から成るタンパク質であって、主として皮膚ケラチノサイトで発現されCa2+結合モチーフであるEFハンドを有するカルモジュリン関連タンパク質である(Mehulら,2000;Hwangら,2003)。細胞内のシグナル伝達におけるその関与は、未だ特徴が明らかにされていない。かかるヒトCLSPのアミノ酸配列を配列番号1として示す。
【0052】
hCLSPは43番目から59番目のアミノ酸から成る配列:NLSEAGLRKLISEVDSDを含む。一方、24個のアミノ酸からなるヒューマニンには、17個のアミノ酸から成るコア領域(PRGFSCLLLLTSEIDLP)が含まれている。これらアミノ酸配列を比較すると、互いの同一性は低いことがわかる(下線を付したアミノ酸は同一である)(図1B)。特に、ヒューマニンの活性にとって必須である上記コア領域のPro3、Ser7、Cys8、Leu9、Leu12、Thr13、Ser14、及びPro19(特許文献1、Yamagishiら,2003)の中で、Leu9、Leu12、及びSer14がhCLSP中で保存されているにすぎない。従って、hCLSPのこの領域は構造的にはヒューマニンのコア領域との相同性又は類似性は極めて低いが、便宜的に、ヒューマニン様ドメイン(Humanin−like domain;HLD)と命名した。
【実施例2】
【0053】
[CLSPはV642I−APPによって誘発される神経細胞死を抑制する]
hCLSP(C末端にMycHisタグを付している)及びヒューマニン(C末端にFLAGタグを付している)を、ヒトSHSY−5Y神経芽細胞腫細胞中で発現させた。Hisタグに吸着するTALON Metal Resinビーズを用いたhCLSP−MycHisの精製、並びに、FLAG抗体をコンジュゲートさせたビーズを用いたヒューマニン−FLAGの精製の結果、回収した調整培地及び細胞溶解物中にhCLSP−MycHis及びヒューマニン−FLAGの存在が認められた(図2A)。小胞体−ゴルジ体輸送の阻害物質であるブレフェンディンAによる処理によって、調整培地中に分泌されるGhCLSP及びヒューマニンの量が少なくなった(図2A)。これらの結果は、CLSP(典型的な分泌リーダー配列は欠けている)が、通常の細胞内分泌メカニズムを介して分泌されることを示唆している。ヒューマニンの分泌については、初期の研究においてすでに示されている(Hashimotoら,2001a)。
【0054】
V642I−APPの強制的発現は、初期の研究から予想されるように、SHSY−5Y神経芽細胞腫細胞の死を誘発した(Hashimotoら,2000;Hashimotoら,2009)。結果として、このことは、ディッシュに付着している生存細胞数(図2B)とWST−8アッセイによる細胞生存率(図2C)の両方の減少をもたらした。hCLSPの同時発現は、V642I−APPによって誘発されるSHSY−5Y細胞の細胞死を抑制した(図2B及び2C)。イムノブロット分析によって、V642I−PPの発現をダウンレギュレートすることによりhCLSPが細胞死を抑制するという可能性は除外された(図2D)。
【0055】
免疫前血清の添加でなく、16個のアミノ酸から成るhCLSPのN末端領域(「hCLSP−N」と命名)に対する抗体をアッセイ系に添加することによって、hCLSP発現をダウンレギュレートすることなく、hCLSPによって介在される細胞死を抑制する活性が無効になった(図2E及び2F)。この結果は、分泌されたhCLSPは細胞の外側からその活性を示し、hCLSP抗体が培地中のhCLSPと結合することによりhCLSP活性を中和し得ることを示唆する。
【実施例3】
【0056】
[CLSPの培地中への分泌はV642I−APPによって誘発される細胞死に対するCLSPが介在する抑制にとって必須である]
hCLSPの欠失変異体hCLSP−DC1及びhCLSP−DC2(これらは、それぞれ、C末端領域(アミノ酸79〜146)及び(アミノ酸62〜146)を欠失している)をコードする発現ベクターを、細胞死アッセイのために構築した(図3A)。各変異体の同時発現は、V642I−APPによって誘発される細胞死を抑制した(図3B及び3C)。イムノブロット分析によって、これらの変異体が調整培地中に分泌されることが示された(図3D)。これらの結果から、N末端の1〜61領域はhCLSPによって誘導される細胞死の抑制にとって十分であることが示された。
【0057】
一方で、欠失変異体hCLSP−DN(N末側領域(アミノ酸2−39)を欠失している)をコードする発現ベクターを、別の細胞死アッセイのために構築した(図3A)。同時に、Met−IGF−1シグナル配列(Ser12−Gly33)−Lys−Proからなる25個のアミノ酸配列が分泌を促進させるためにhCLSP−DNのN末端に付いている、ss−hCLSP−DNをコードするベクターを構築した。その結果、hCLSP−DNの発現はV642I−APPによって誘発される細胞死を抑制しなかった。一方で、ss−hCLSP−DNの発現はV642I−APPによって誘発される細胞死を抑制した(図4A及び4B)。hCLSP−DNは分泌されなかったのに対して、ss−hCLSP−DNは培地中に分泌された(図4C)。この結果から、N末端の38アミノ酸領域の欠失は、CLSPの作用にとって必須であるhCLSPの培地中への分泌を阻害することが示された。
【0058】
以上のhCLSPの欠失に関する分析結果から、hCLSPに含まれる22個のアミノ酸(アミノ酸40〜61)から成る領域:TGKNLSEAGLRKLISEVDSDGD(又は、「TGL−HLD−GD」)は、神経細胞死のhCLSPが介在する抑制において中心的役割を果たすという結論がもたらされた。この領域を、内因性ヒューマニン様ドメイン(Endogenous Humanin−like Domain;EHD)と命名した。尚、かかるEHDのアミノ酸配列を配列番号2で示す。
【実施例4】
【0059】
[合成EHD(培地中に添加)はヒューマニン活性を示す]
EHDがhCLSPによって誘導される抑制のためのhCLSPのコア領域であることを確かめるために、EHDペプチドを化学的に合成し、それがhCLSPを模倣するか否かを調べた。ヒューマニン変異体S14G−ヒューマニンは野生型ヒューマニンと比べて1000倍以上強力であることから(Terashitaら,2003)、比較のためにEHD−Gも合成した(この場合、54番目のセリン(ヒューマニンにおける14番目のセリンと類似)がグリシンに置換されている)。10μMの濃度のヒューマニン又はEHDと一緒にインキュベートするとV642I−APPによって誘発される細胞死は抑制されたのに対して、10nMの濃度のヒューマニン又はEHDでは細胞死は抑制しなかった(図5A及び5B)。S54G置換は、ヒューマニン活性を増強しなかった(図5A及び5B)。これらの結果は、EHDが神経細胞の死を抑制する活性を有することを裏付けるばかりでなく、分泌されたhCLSPが細胞の外側から該活性を示すという考えをも支持するものである。これらのペプチドと一緒にインキュベートすることは、V642I−APPの発現に影響を与えなかった(図5C)。
【実施例5】
【0060】
[CLSPはヒューマニンよりもはるかに強力である]
Talon Metalビーズを用いて、hCLSP−MycHisを過剰発現するF11細胞の調整培地から、hCLSP−MycHisをアフィニティー精製した。模擬精製は骨格ベクターを用いてトランスフェクトしたF11細胞の調整培地を用いて行った。hCLSP−MycHisの濃度は、クーマシーブルー染色によって推定した(図6A)。CLSP−MycHisを過剰発現するCOS7細胞の調整培地から部分精製した各種濃度の組み換えhCLSP−MycHisを用いることにより、V642I−APPによって誘発される細胞死の抑制のためのhCLSPの有効濃度を推定した。図6B及び6Cに示されるように、hCLSP−MycHisは、用量に依存して神経細胞死を抑制した。推定されるEC50は10〜100pMである。この結果は、CLSPがヒューマニン(EC50=1〜10μM)よりも105−6倍強力であることを示した。一方で、EHDペプチドのEC50は、10nMよりも高いことから(図5)、hCLSPのEHD及び/又は調整培地中でCLSPと複合体を形成するその他のタンパク質と比較して、その他の領域が、未だ特徴が明らかにされていない方法を介してEHDのヒューマニン活性を増強する可能性が高い。
【実施例6】
【0061】
[CLSPはヒューマニン受容体を介して神経細胞の死を抑制する]
図7Aに示されるように、組み換えhCLSP−MycHis(概算濃度100nM)又は合成ヒューマニン(100μM)との同時インキュベーションは、705番目のチロシンにおけるSTAT3のリン酸化を増大させた。この結果は、CLSPがヒューマニン受容体と結合し、JAK2/STAT3生存促進経路を活性化することにより、神経細胞死を抑制することを示唆する(Hashimotoら,2009)。裏付けとして、gp130に対する中和抗体は、ヒューマニンが介在する神経保護活性についての初期の研究において示されるように(Hashimotoら,2009)、CLSPによって誘発される神経細胞死の抑制を弱めた(図7C〜D)。CNTFR及びWSX−1に対する中和抗体もまた、CLSPによって誘発される神経細胞死の抑制を弱めた(図13A〜F参照)。
【0062】
精製組み換えhCLSP−MycHis又はヒューマニンの存在下で、CNTFRの組み換え細胞外ドメイン及びgp130及び可溶性WSX−1の混合物を一緒にインキュベートすることにより行うインビトロ再構成アッセイ(Hashimotoら,2009a;Hashimotoら,2009b)において、WSX−1とCNTFRとの間、及び、WSX−1とgp130との間のヘテロダイマー化をもたらした(図8)。全てのこれらの結果は、CLSPがヒューマニン受容体アゴニストであるということを示した。
【実施例7】
【0063】
[CLSPはスコポラミンによって誘発されるマウスの記憶障害を抑制する]
ヒトCLSP遺伝子に関しては、元々Scarf1及びScarf2と名付けられた2つのマウスのカウンターパート遺伝子が存在する(Hwangら,2003)。マウスScarf1はアミノ酸レベルでヒトCLSPと50.0%の同一性を示す。マウスのScarf1及びScarf2は、高度に類似しており、それらの遺伝子はマウス染色体15.3に15.3kBの間隔で並んで配置されている(Hwangら,2003)。これら遺伝子をマウスCLSP−1(mCLSP−1)及びマウスCLSP−2(mCLSP−2)と命名する。これらのいずれかとの同時発現によってV642I−APPによって誘発されるF11細胞の細胞死が完全に抑制されたのに対して(図9)、それらは、V642I−APPによって誘発されるヒトSH−SY5Y細胞の細胞死は部分的にのみ抑制した(データは示さず)。一方で、ヒトCLSPは、V642I−APPによって誘発されるSH−SY5Y細胞の死を完全に抑制することができるのに対して、V642I−APPによって誘発されるF11細胞の死は部分的にのみ抑制した(データ示さず)。これらの結果は、CLSPが部分的に種特異的なヒューマニン活性を示すことを示している。尚、マウスScarf1及びマウスScarf2のアミノ酸配列を夫々、配列番号3及び配列番号4で示す。
【0064】
ヒューマニンペプチド誘導体は、家族性AD関連遺伝子を過剰発現するトランスジェニックADマウスを含むADマウスモデルの記憶障害を改善することが知られている(MamiyaとUkai,2001;Krejcovaら,2004:Tajimaら,2005;Chibaら,2005;Kunesovら,2008;Miaoら,2008;Yamadaら,2008;Chibaら,2009)。
【0065】
そこで、次に、CLSPがインビボにおいてヒューマニンを模倣するか否かについて検討した。mCLSP1−MycHisを過剰発現するCOS7細胞の調整培地から部分精製した組み換えmCLSP1−MycHisを使用し、陰性対照としてF11細胞の調整培地を用いて模擬精製し(図10A)、CLSP−1がスコポラミンによって誘発される記憶障害を改善するか否かをYmaze試験によって調べた(Chibaら,2005)。予め脳室内に投与された組み換えmCLSP−1−MycHisは、スコポラミンによって誘発される記憶障害を減少させたのに対して、陰性対照の投与は減少させなかった(図10B)。部分精製した組み換えmCLSP−1及び強力なヒューマニン誘導体ペプチドである合成コリベリン(Chibaら,2005)の腹腔内注入によってもスコポラミンによって誘発される記憶障害を改善した(図10C)。後の結果は、末梢的に注入されたCLSPが、血液脳関門を通過し、脳内でその活性を示すことを示唆する。
【実施例8】
【0066】
[皮膚におけるマウスCLSP−1及びCLSP−2の発現]
以前の研究によって、ヒトCLSPは皮膚及びその他の表皮組織において高度に発現することが示されている(Mehulら,2000;Hwangら,2003)。マウスCLSP−1及びCLSP−2は筋肉でも発現した(Hwangら,2003)。本発明者は、mCLSP−1及びmCLSP−2が8週齢及び20月齢のマウスの皮膚組織及び筋肉で高度に発現されていることを免疫組織化学により見出した(図11)。一方中枢神経の海馬における発現レベルは皮膚におけるレベルよりもはるかに低いことが示された(図11)。
【実施例9】
【0067】
[CLSPはヒト血漿中で検出される]
更に、健常人の血漿中のCLSPを検出した。100μLのヒト血漿をヒトCLSPに対する抗体を用いて免疫沈降させ、得られた沈降物を同じ抗体を用いてイムノブロットした。免疫沈降効率はほぼ100%であった。図12Aに示されるように、20kDの分子量を有するタンパク質はCLSP抗体によって得られた沈降物中にのみ検出された。このタンパク質は、SDS−PAGE中で組み換え野生型CLSPと完全に同じように移動した。この結果は、ヒト血液中におけるCLSPの存在を示した。血漿中のCLSPの概算濃度は500pM〜1nMであった。
【0068】
別の検出方法として、同じ抗体を使用する酵素結合免疫吸着アッセイ(ELISA)システムも開発した。このELISAは10〜50pMの濃度を有する組み換えhCLSP−MycHisを検出することが可能である(図12B)。これを利用することにより、ヒト血漿中のCLSP濃度が約50〜500pMであることを示した(図12B)。このELISAによって推定された濃度は、イムノブロット分析によって推定された濃度よりも低い。このELISAシステムは、全CLSPの画分のみを検出し得る可能性が高い。
【0069】
以上の実施例で使用された材料及び方法は以下の通りである。尚、特に記載がない場合には、当業者に公知の適当な方法・手段で実施した。
【0070】
[タンパク質の精製、ヒューマニン抗体PO4による免疫沈降]
免疫沈降物はTris/Tricine SDS−PAGE上で分離して、PVDF膜上へ転写し、銀染色MSキット(Wako Laboratory Chemical,Japan)を用いて染色した。タンパク質のバンドを切り出して、リシルエンドペプチダーゼを用いて消化し、質量分析法(Applied Biosystems社のPerSeptive Biosystem Voyager-DE/RP)により分析した。
【0071】
[遺伝子、ポリペプチド、及び材料]
ヒトおよびマウス皮膚組織よりmRNAを調製し、それぞれの遺伝子に対応したプライマーを作成して、RT-PCR方法で、hCLSPならびにmCLSP-1 及びmCLSP-1cDNAをクローニングした。RT-PCR方法でpcDNAベクター中でV642I−APPをコードするcDNAが、これまでに記述されている(Hashimotoら,2001a,b)。細菌中でGSTタグ付CLSPを作製するために、ヒトCLSP cDNAをpGEXベクター中に導入した。C末端にMycHisタグの付いたタンパク質を作製するために、ヒトCLSP(hCLSP)、hCLSP欠失変異体、マウスCLSP−1(mCLSP−1)、及び、マウスCLSP−2(mCLSP−2)をコードするcDNAを、pcDNA3.1/MycHis中に導入した。C末端にFLAGタグの付いたCLSP(CLSP−FLAG)を作製するために、ヒトCLSPcDNAを、pFLAGベクター中に導入した。
【0072】
ヒトCNTFR(アミノ酸1〜390)の細胞外ドメイン(ED)は、ヒトIgGのFc領域をコードし、C末端に6xHisタグを付加したcDNAとインフレームで融合し(CNTFR−ED−Fc−His)、ヒトWSX−1(アミノ酸1〜390)のEDは、ヒトWSX−1の完全な細胞外ドメインを含む。組み換えヒトgp130−ED−Fc−6xHisは、R&D Systems(Minneapolis,MN)から購入した。
【0073】
ヒューマニン、コリベリン(Chibaら,2005)、EHD(TGLNLSEAGLRKLISEVDSDGD)及びS54G−EHD/EHD−G(TGLNLSEAGLRKLIGEVDSDG)は、エール大学(New Haven,CT)のKeck基金バイオテクノロジー資源研究所によって合成された。
【0074】
[抗体]
抗体は以下の企業から購入した:Myc,Invitrogen(Carlsbad,CA,USA);FLAG(M2),Sigma(St.Louis,MO,USA);APP(22C11),Chemicon(Temecula,CA,USA);phoshoSTAT3(Tyr705),Cell Signaling Technology(Beverly,MA);STAT3(C−20),Santa Cruz Biotechnology(Santa Cruz,CA)。GST−hCLSPに対するウサギポリクローナル抗体(GST−CLSP抗体と命名)は、N末端にGSTタグが付けられた組み換えヒトCLSPを用いて免疫することにより作製し、細菌中で産生させた。ヒトCLSPに対する別のウサギポリクローナル抗体(CLSP−N抗体と命名)は、キーホールリンペットヘモシアニン(Sigma−Aldrich,St.Louis,MO)をコンジュゲートさせたhCLSPのN末端16アミノ酸ペプチドに相当する合成ペプチドを用いて免疫することにより作製した。CLSP−N抗体は、V642I−APPにより誘発される死のCLSPが介在する抑制を阻害する。
【0075】
「細胞、細胞死、及び生存性試験」
マウスMLTL−1マウスライディッヒ細胞(ATCC番号CRL-2065)、TM3ライディッヒ細胞(ATCC番号CRL-1714)は、ATCCから取得した。ヒトテラトカルシノーマ細胞株NTERA−2(NT2)はSTRATAGENE社から購入した。F11細胞(胚齢13日目のラット初期培養神経細胞及びマウス神経芽細胞腫N18TG2のハイブリッド))は上記のHashimotoら,2000;2000a及び2003に記載の方法で調製した。SH−SY5Y細胞(ATCC番号CRL-2266)は、10%FBSを含有するDMEM/HamのF12混合液(DMEM/F12)中で増殖させた。SH−SY5Y細胞は、6ウェルプレート中、2x105細胞/ウェルの濃度で、12〜16時間播種し、血清非存在下で、示されたベクターを用いて3時間トランスフェクトして、次に、DMEM/F12−10%中で培養した。トランスフェクションを開始して24時間後に、続いて、培地を、レスキュー因子を含有するDMEM/F12+N2補助物質(Invitrogen)と交換した。トランスフェクションを開始して48時間の時点で、細胞の死亡率及び生存率のアッセイのために細胞を回収した。細胞生存性は、WST−8アッセイ及びカルセイン染色アッセイによって測定した(Hashimotoら,2001a,b,2005a,b)。
【0076】
WST−8アッセイ(細胞計数キット−8(Dojindo,Osaka,Japan)を使用して実施)は、細胞が、水溶性の2−(2−メトキシ−4−ニトロフェリル)−3−(4−ニトロフェリル)−5−(2,4−ジスルホフェニル)−2H−テトラゾリウム一ナトリウム塩を、水溶性のフォルマザンに変換する能力に基づく。細胞は、37℃にて2時間、WST−8試薬を用いて処理し、450nmにおける吸光度を測定した。カルセイン染色は記載されるようにして行った(Bozyczko−Coyneら,1993)。手短に述べると、6MのカルセインAM(3,6−ジ−(O−アセチル)−2,7−ビス[N,N−ビス(カルボキシメチル)アミノメチル]フルオロセイン、テトラアセトキシメチルエステル;Dojindo)を細胞に添加し、カルセインAM処理後30分以上してから、カルセイン特異的蛍光(励起485nm;放射535nm)を、蛍光顕微鏡で観察するか、又は、蛍光分光光度計(Wallac 1420 ARVOsx Multilabel Counter,PerkinElmer,Wellesley,MA)で測定した。
【0077】
F11細胞を、これまでに記載されるようにして(Platikaら,1985;Hashimotoら,2000)、18%ウシ胎仔血清(FBS)(Hyclone,Logan,UT)及び抗生物質を含有する、HamのF−12培地(Sigma,St Louis,MO)中で増殖させた。HamのF−12+18%FBS(HF−18%)中で12〜16時間培養したF11細胞(6ウェルプレートの1ウェル当たり7x104細胞)を、リポフェクション法[特に明記されない限り、cDNA,1.0μg;LipofectAMINE(Invitrogen,Carlsbad,CA),2l;PLUS試薬(Invitrogen),4μl]によりV642I−APP遺伝子を用いて、血清の非存在下で3時間トランスフェクトし、HF−18%で2時間インキュベートした。トランスフェクションを開始して5時間後に、培地を、HF−10%に交換した。トランスフェクションを開始して24時間後に、次に、それらを、レスキュー因子を含有するHamのF12+N2サプリメント(Invitrogen)に交換した。トランスフェクションを開始して72時間後に、細胞の死亡率及び生存率についてのアッセイを行った。
【0078】
[イムノブロット分析]
イムノブロット分析は、従来文献に記載されるようにして行った(Hashimotoら,2001a,b)。V642I−APP発現ベクターを用いてトランスフェクトした細胞からの溶解物(1レーン当たり20μg)を、SDS−PAGE(又は、Tris/Tricine SDS−PAGE)に供し、次に、ポリ二フッ化ビニリデンシートに電気的にブロッティングした。シートを、22C11抗体に、次に、1:5000の西洋ワサビペルオキシダーゼ標識された抗マウス又は抗ラットIgG抗体(Bio−Rad,Hercules,CA)に浸した。抗原のバンドは、ECL(Amersham Biosciences,Uppsala,Sweden)により可視化した。
【0079】
[CLSPにより誘導されるHN受容体サブユニットのオリゴマー化]
組み換えヒトCNTFR−ED−Fc−6xHis及びマウスWSX−1−ED−FLAGを作製するために、COS7細胞を、各タンパク質をコードするベクターを用いてトランスフェクトした。トランスフェクションの48時間後に、Ni NTAアガロース(1:1スラリー;Invitrogen)又は抗FLAG抗体M2をコンジュゲートさせたアガロース(1:1スラリー;Sigma−Aldrich)を用いた沈降のために調整培地を回収した。結合しているCNTFR−ED−Fc−6xHisを、10mMのイミダゾール溶液を用いて洗浄し、製造業者の説明書にしたがって、250mMのイミダゾール溶液を用いて溶出した。溶出されたCNTFR−ED−Fc−6xHisを、Zeba脱塩カラム(Pierce,Rockford,IL)により脱塩し、次に、1/10容量の10xPBSを、脱塩したタンパク質溶液に添加した。オリゴマー化を誘導するために、gp130−ED−Fc−6xHis(1mg)及び/又はCNTFR−ED−Fc−6xHis(1μg)を、1%Brij96(Sigma−Aldrich)を含有する100μlのPBS中に含まれる抗FLAGmAb M2をコンジュゲートしたアガロースビーズ上に固定化されたWSX−1−ED−FLAG(推定5μg)と一緒に、ペプチドの存在下、37℃にて6時間インキュベートした。オリゴマー化されたタンパク質は、同じバッファーで十分に洗浄した後、SDS−PAGE分画及びイムノブロット分析により可視化した。
【0080】
[組み換えCLSPタンパク質の精製]
GST−融合タンパク質(GST−CLSP)を、1mM イソプロピル−チオ−b−D−ガラクトピラノシドの存在下、大腸菌BL−21中で、37℃にて4時間発現させ、従来文献に記載されるようにして精製した(Matsuokaら,2000)。
【0081】
hCLSP−MycHis及びmCLSP−1−MycHisの精製のために、COS7細胞を、pcDNA3.1/MycHis−hCLSPプラスミドを用いてトランスフェクトし、DMEM−10%FBS中で培養した。トランスフェクションの48時間後に、調整培地を回収した。分泌されたCLSP−MycHisタンパク質を、製造業者の説明書にしたがって、TALON Metal Resin(Clontech)を用いてアフィニティー精製した。溶出液は、Zebaスピンカラム(Pierce)を用いて脱塩した。1/10容量の10xPBS及び適当量のプロテアーゼカクテルComplete(Roche)溶液を、脱塩した溶出物に添加した。精製されたCLSP−MycHisのタンパク質濃度は、Tris/Tricine SDS−PAGEゲルの銀染色により推定した。BSAを、濃度標準として使用した(Wako Pure Chemicals)。模擬(mock)精製のために、COS7細胞を、骨格ベクターを用いてトランスフェクトした。続いて、上記と同じ精製手順を用いた。
【0082】
[Tyr705リン酸化STAT3の検出]
SHSY−5Y細胞を、FBSを含まない条件下、24時間、N2サプリメントを含有するDMEM培地中で培養した。次に、示されたサイトカイン類を用いて、15分間、37℃にて細胞を処理した。ホスホSTAT3(Tyr705)抗体(Cell Signaling)及びSTAT3抗体(Santa Cruz Biotechnology)を用いたイムノブロット分析のために、1%NP−40、20mM Tris−HCl(pH7.4)、150mM NaCl、1mM オルトバナジウム酸ナトリウム、及びプロテアーゼ阻害剤カクテルComplete(Roche Diagnostics,Alameda,CA)を含有するバッファーを用いて、細胞を回収した。
【0083】
[動物及びCLSP処理(インビボADモデル)]
本研究は、神経科学会の神経科学研究における動物及びヒトの利用に関する方針、並びに、東京医科大学の実験動物のケア及び利用のためのガイドラインにしたがって行われた。全ての実験手順は、東京医科大学の施設内動物実験委員会によって承認された。9週齢のICRマウスを、CLEA Japan(Tokyo,Japan)から購入した。動物は、12時間の明/暗サイクル(7:00A.M.〜7:00P.M.まで明るい)の下、通常の動物用施設において飼育した(23℃、50%湿度)(Tajimaら,2005;Yamadaら,2005;Chibaら,2005)。C57マウス(8週齢)を、Y−maze試験(YM)を行う前に一週間、馴化させた。YM当日、マウスに、YMの30分前に、5μLの生理食塩水、部分精製されたmCLSP−1−MycHis、又は、5μLの生理食塩水中の精製された陰性対照を脳室内に注入した。腹腔内注入のためには、0.21mlの滅菌生理食塩水、又は示された量の部分精製されたmCLSP−1−MycHis、精製された陰性対照、0.21mlの滅菌生理食塩水中のコリベリンを使用した。次に、スコポラミン(1mg/kg)を溶解した滅菌生理食塩水(0.2ml)をYMの30分前にマウスの皮下(s.c.)に注入した。
【0084】
[行動試験]
YMは、従来文献に記載されるようにして行った(Kawasumiら,2004;Yamadaら,2005)。YMのための装置は、それぞれが120°の角度で連結されている3つの灰色のプラスチック製アーム(40cmの長さ、12cmの高さ、底部で3cmの幅、及び頂部で10cmの幅)から作られている。マウスは、アームの端部に個別に置かれ、8分間アームを自由に探索させた。調べられたパラメーターは、(1)全アームエントリー数及び(2)自発的交代パーセンテージ(SA%)であった。SA%は、試験実施時における全選択(初めの2つのエントリーは評価することができなかったので「全エントリー引く2」)に対する、以前の2つの選択と異なるアームの選択(「成功の選択」)の比として定義された。例えば、あるマウスが10エントリーした場合(例えば、1−2−3−2−3−1−2−3−2−1)、8つの全選択(10エントリー引く2)のうち5つの成功の選択であった。その結果、本ケースにおけるSA%は、62.5%であった。
【0085】
[hCLSP抗体をコンジュゲートさせたタンパク質Gセファロースの調製及びヒト血漿の免疫沈降]
200μlの免疫前血清(Pre)又は抗hCLSP抗血清を、800μlのタンパク質Gセファロース4B(1:1スラリー、GE Health Care)と混合し、4℃にて一晩回転させた。0.2Mの四ホウ酸ナトリウム(pH9.0)で二度洗浄した後、それらを2mlの同じバッファー中に懸濁させた。次に、それらを、200μlの0.2M ピメルイミド酸ジメチル二塩酸塩(Pierce)と混合し、緩やかに振盪させながら室温にて30分間インキュベートした。0.2Mのエタノールアミンを用いて一度洗浄し、遠心分離(1000rpm、5分間、室温)により回収した後、ビーズを、10μlの0.2M エタノールアミンと混合し、緩やかに振盪させながら室温にて2時間インキュベートした。次に、ビーズをPBS中に懸濁させた。抗体のコンジュゲーション効率は、SDS−PAGEゲルの銀染色により確認した(Wako Pure Chemicals)。
【0086】
ヒト血漿を健常提供者から吸引し、氷上でEDTA−Naを含有するチューブ中に入れた。精製された血漿は、−80℃にて保存された。100μLの精製ヒト血漿を、各免疫沈降において、CLSP抗体−又は免疫前−セファロースの20μlの1:1スラリーと一緒に、4℃にて一晩インキュベートした。
【0087】
[酵素結合免疫吸着アッセイ(ELISA)]
細胞培養及びヒト血漿からの調整培地(CM)中のヒトCLSPレベルを定量するために、ELISAシステムを構築した。0.05Mの炭酸バッファー(pH9.6)で(2500倍に)希釈した抗ヒトCLSP抗体を含有するウサギ血清を用いて、96ウェルマイクロプレートを1ウェル当たり50μLの量でコーティングし、4℃にて一晩インキュベートした。各ウェルを吸引し、各洗浄工程時に、200μLのPBS(pH7.4)中0.1%Tween(登録商標)20を用いて3回洗浄した。捕捉抗体に対する非特異的結合は、3%のろ過済みスキムミルク含有PBS(150μL)を添加後37℃において1時間インキュベートし、5回の洗浄により最小にした。組み換えヒトCLSP−MycHisを、7点標準曲線を提供するように希釈した(10pM〜1nM)。100μLのヒト血漿及び基準物質をウェルに添加し(3連)、37℃にて2時間インキュベートした。5回洗浄した後、西洋ワサビペルオキシダーゼにコンジュゲートさせたアフィニティー精製したウサギ抗ヒトCLSP抗体を含むCan Get Signal(登録商標)溶液(Toyobo,Japan)(0.144μg/ml)を1ウェル当たり50μL添加し、37℃にて1時間インキュベートした。7回洗浄した後、4mg/mLのo−フェヌレンジアミンを含む0.05Mクエン酸ペルオキシドバッファー(100μL)を各ウェルに添加し、37℃にて2時間インキュベートした。次に、反応を停止させるために50μLの2N H2SO4を添加した。CLSP濃度を測定するために、吸光度(450nm)を、蛍光分光光度計(Wallac 1420 ARVOsx Multilabel Counter,PerkinElmer,Wellesley,MA)によって測定した。全てのサンプルは3連でアッセイし、値は、標準曲線に対してプロットした。このELISAの感度は1nM迄の直線範囲で10〜50pMであった。
【0088】
各サンプルは、2つの部分に分けた。そのうちの一方は、予めタンパク質Gセファロース(G3サンプル)に結合させた抗GST−hCLSP血清により、4℃にて一晩、免疫除去した。5μLの粗GST−CLSP抗血清を混合し、タンパク質Gビーズ上に、4℃にて一晩予め吸着させた。模擬手順を、免疫前血清(G0サンプル)を用いて同様にして行った。G0サンプルのELISAの値マイナスG3サンプルのELISAの値を、実際のhCLSP濃度を表すと考えた。この免疫除去手順は、5nMのhCLSP−MycHisを含有する100μLの溶液からhCLSP−MycHisをほぼ完全に免疫除去することができた(図14参照)。
【0089】
[免疫組織化学]
8週齢、20月齢のオスC57−BL6マウスを、ジエチルエーテルによって麻酔した。4%パラホルムアルデヒドを含有するリン酸バッファー(pH7.4)を用いて固定化した後、脳及び皮膚を、O.C.T.Compound(Sakura,Tokyo,Japan)中に包埋し、10μmの厚さに切断した。海馬の矢状断面を、MASコーティングしたスライドグラス(Matsunami,Osaka,Japan)上に調製した。この断面を、TBS−Tを用いて洗浄し、内因性のペルオキシダーゼ活性を消失させるために30分間、0.3% H2O2を用いて処理し、TBS−Tですすいだ。ブロッキング及び免疫染色は、M.O.M.ベーシックキット(Vector laboratories,Burlingame, CA, USA)を用いて処理した。この断面を、一次抗体として、アフィニティー精製したmCLSP−1及びmCLSP−2抗体を用いて、4℃にて一晩インキュベートした。次に、それらを、TBS−T中ですすぎ、ビオチン化ヤギ抗ウサギIgG(Vector laboratories)を用いて、室温にて30分間インキュベートし、ABCエリートキット(Vector laboratories)を用いてアビジン−ビオチン−ペルオキシダーゼ法で処理した。免疫反応性は、チラミド−FITC(TSAキット;NEN−Perkin−Elmer)を用いて可視化した。蛍光は、レーザー走査共焦点顕微鏡LSM510(Carl Zeiss,Germany)を用いて観察した。
【0090】
[統計分析]
全ての細胞死試験、細胞生存試験、結合試験、及び定量リアルタイムPCR試験を行った(n=3)。インビトロ研究における図中の全ての値は、平均±SDである。統計分析は、スチューデントのt検定を用いて行った。インビボ試験に対する統計分析は、一元配置分散分析、続いて、FisherのPLSDを用いて行い、この場合、有意差として、p<0.05が算定された。
【産業上の利用可能性】
【0091】
本発明によって初めて見出されたEHDペプチド又はCLSPの強力な神経保護活性(神経細胞の細胞機能障害又は神経細胞死を抑制する活性)は、CLSPが、ヒューマニンよりもむしろヒューマニン受容体が介在する生存促進性シグナル(prosurvival signal)の活性化において主要な役割を果たすことを示す。
【0092】
本明細書中で引用された文献のリストを以下に示す。
[引用文献リスト]
Babini E, Bertini I, Capozzi F, Chirivino E, Luchinat C. A structural and dynamic characterization of the EF-hand protein CLSP. Structure. 2006 14:1029-38.
Bozyczko-Coyne D, McKenna B W, Connors T J, Neff N T (1993) A rapid fluorometric assay to measure neuronal survival in vitro. J Neurosci Methods 50:205-216
Chiba T, Hashimoto Y, Tajima H, Yamada M, Kato R, Niikura T, Terashita K, Schulman H, Aiso S, Kita Y, Matsuoka M, Nishimoto I (2004) Neuro- protective effect of activity-dependent neurotrophic factor against toxicity from familial amyotrophic lateral sclerosis-linked mutant SOD1 in vitro and in vivo. J Neurosci Res 78:542-552.
Chiba T, Yamada M, Sasabe J, Terashita K, Shimoda M, Matsuoka M, Aiso S. Amyloid-beta causes memory impairment by disturbing the JAK2/STAT3 axis in hippocampal neurons. Mol Psychiatry. 2009, 14;206-22
Durussel I, Mehul B, Bernard D, Schmidt R, Cox JA. Cation- and peptide-binding properties of human calmodulin-like skin protein. Biochemistry. 2002 41:5439-48.
Guo B, Zhai D, Cabezas E, Welsh K, Nouraini S, Satterthwait AC, Reed JC (2003) Humanin peptide suppresses apoptosis by interfering with Bax activation. Nature 423:456 - 461.
Hashimoto Y, Niikura T, Ito Y, Nishimoto I (2000) Multiple mechanisms underlie neurotoxicity by different types of Alzheimer’s disease mutations of amyloid precursor protein. J Biol Chem 275:34541-4551.
Hashimoto Y, Niikura T, Tajima H, Yasukawa T, Sudo H, Ito Y, Kita Y, Kawasumi M, Kouyama K, Doyu M, Sobue G, Koide T, Tsuji S, Lang J, Kurokawa K, Nishimoto I (2001a) A rescue factor abolishing neuronal cell death by a wide spectrum of familial Alzheimer’s disease genes and Ab. Proc Natl Acad Sci USA 98:6336 - 6341.
Hashimoto Y, Niikura T, Ito Y, Sudo H, Hata M, Arakawa E, Abe Y, Kita Y,
Nishimoto I (2001b) Detailed characterization of neuroprotection by a rescue factor humanin against various Alzheimer’s disease-relevant in- sults. J Neurosci 21:9235-9245.
Hashimoto Y, Tsuji O, Niikura T, Yamagishi Y, Ishizaka M, Kawasumi M, Chiba T, Kanekura K, Yamada M, Tsukamoto E, Kouyama K, Terashita K, Aiso S, Lin A, Nishimoto I (2003) Involvement of c-Jun N-terminal kinase in amyloid precursor protein-mediated neuronal cell death. J Neurochem 84:864- 877.
Hashimoto Y, Suzuki H, Aiso S, Niikura T, Nishimoto I, Matsuoka M (2005) Involvement of tyrosine kinases and STAT3 in Humanin-mediated neu- roprotection. Life Sci 77:3092-3104.
Hashimoto Y, Kurita M, Aiso S, Nishimoto I, Matsuoka M Humanin inhibits neuronal cell death by interacting with a cytokine receptor complex or complexes involving CNTF receptor alfa/WSX-1/gp130 Mol. Biol. Cell 2009, 20:2864-73.
Hwang M, Morasso MI. The novel murine Ca2+-binding protein, Scarf, is differentially expressed during epidermal differentiation. J Biol Chem. 2003 278:47827-33.
Hwang M, Kalinin A, Morasso MI. The temporal and spatial expression of the novel Ca++-binding proteins, Scarf and Scarf2, during development and epidermal differentiation. Gene Expr Patterns. 2005 5:801-8.
Hwang J, Kalinin A, Hwang M, Anderson DE, Kim MJ, Stojadinovic O, Tomic-Canic M, Lee SH, Morasso MI. Role of Scarf and its binding target proteins in epidermal calcium homeostasis.J Biol Chem. 2007 282:18645-53.
Kawasumi, M., Hashimoto, Y., Chiba, T., Kanekura, K., Yamagishi, Y., Ishizaka, M., Tajima, H., Niikura, T., and Nishimoto, I. (2002) Molecular mechanisms for neuronal cell death by Alzheimer's amyloid precursor protein relevant insults. Neurosignals 11, 236-250. Review
Kunesova G, Hlavacek J, Patocka J, Evangelou A, Zikos C, Benaki D, Paravatou-Petsotas M, Pelecanou M, Livaniou E, Slaninova J.
The multiple T-maze in vivo testing of the neuroprotective effect of humanin analogues.Peptides. 2008 29:1982-7
Krejcova G, Patocka J, Slaninova J (2004) Effect of humanin analogues on experimentally induced impairment of spatial memory in rats. J Pept Sci 10:636 - 639.
Lue Y, Swerdloff R, Liu Q, Mehta H, Hikim AS, Lee KW, Jia Y, Hwang D, Cobb LJ, Cohen P, Wang C. (2010) Opposing roles of insulin-like growth factor binding protein 3 and humanin in the regulation of testicular germ cell apoptosis. Endocrinology 151, 350-357.
Mamiya T, Ukai M (2001) [Gly(14)]-Humanin improved the learning and memory impairment induced by scopolamine in vivo. Br J Pharmacol
134:1597-1599.
Matsuoka M, Matsuura Y, Semba K, Nishimoto I. (2000)
Molecular cloning of a cyclin-like protein associated with cyclin-dependent kinase 3 (cdk 3) in vivo. Biochem Biophys Res Commun. 273:442-7
Matsuoka M, Hashimoto Y, Aiso S, Nishimoto I. (2006) Humanin and colivelin: neuronal-death-suppressing peptides for Alzheimer's disease and amyotrophic lateral sclerosis. CNS Drug Rev. 12:113-22.
Matsuoka M.(2009) Humanin; a defender against Alzheimer's disease? Recent Pat CNS Drug Discov. 2009 4:37-4
Matsuoka M, Hashimoto Y. Humanin and the receptors for humanin.
Mol Neurobiol. 2010, 41, 22-8
Mehul B, Bernard D, Simonetti L, Bernard MA, Schmidt R. Identification and cloning of a new calmodulin-like protein from human epidermis. J Biol Chem. 2000 275:12841-7.
Mehul B, Bernard D, Brouard M, Delattre C, Schmidt R.Influence of calcium on the proteolytic degradation of the calmodulin-like skin protein (calmodulin-like protein 5) in psoriatic epidermis.Exp Dermatol. 2006 15:469-77.
Miao J, Zhang W, Yin R, Liu R, Su C, Lei G, Li Z. (2008) S14G-Humanin ameliorates Abeta25-35-induced behavioral deficits by reducing neuroinflammatory responses and apoptosis in mice. Neuropeptides. 42:557-67
Moretti E, Giannerini V, Rossini L, Matsuoka M, Trabalzini L, Collodel (2010) G.Immunolocalization of humanin in human sperm and testis. Fertil Steril 94, 2888-2890.
Muzumdar RH, Huffman DM, Atzmon G, Buettner C, Cobb LJ, Fishman S, Budagov T, Cui L, Einstein FH, Poduval A, Hwang D, Barzilai N, Cohen P.
Humanin: a novel central regulator of peripheral insulin action.
PLoS One. 2009 Jul 22;4(7):e6334.
Niikura, T., Hashimoto, Y., Tajima, H., and Nishimoto, I. (2002) Death and survival of neuronal cells exposed to Alzheimer's insults. J. Neurosci. Res. 70, 380-391. review
Nishimoto I, Matsuoka M, Niikura T. (2004) Unravelling the role of Humanin. Trends Mol Med 10: 102-105.
Tjima H, Niikura T, Hashimoto Y, Ito Y, Kita Y, Terashita K, Yamazaki K, Koto A, Aiso S, Nishimoto I (2002) Evidence for in vivo production of Humanin peptide, a neuroprotective factor against Alzheimer’s Disease-related insults. Neurosci Lett 324, 227-231.
Tajima H, Kawasumi M, Chiba T, Yamada M, Yamashita K, Nawa M, Kita Y, Kouyama K, Aiso S, Matsuoka M, Niikura T, Nishimoto I (2005) A Humanin derivative, S14G-HN, prevents amyloid-b-induced memory impairment in mice. J Neurosci Res 79:714 -723.
Terashita K, Hashimoto Y, Niikura T, Tajima H, Yamagishi Y, Ishizaka M, Kawasumi M, Chiba T, Kanekura K, Yamada M, Nawa M, Kita Y, Aiso S, Nishimoto I (2003) Two serine residues distinctly regulate the rescue function of Humanin, an inhibiting factor of Alzheimer’s disease-related neurotoxicity: functional potentiation by isomerization and dimeriza-tion. J Neurochem 85:1521-1538.
Yamada M, Chiba T, Sasabe J, Nawa M, Tajima H, Niikura T, Terashita K, Aiso S, Kita Y, Matsuoka M, Nishimoto I (2005) Implanted cannula- mediated repetitive administration of A 25-35 into the mouse cerebral ventricle effectively impairs spatial working memory. Behav Brain Res 164:139-146.
Yamagishi Y,HashimotoY,NiikuraT,NishimotoI (2003) Identificationof essential amino acids in Humanin, a neuroprotective factor against Alz- heimer’s disease-relevant insults. Peptides 24:585-595.
【技術分野】
【0001】
本発明は、カルモジュリン様皮膚タンパク質を有効成分として含む医薬組成物、特に、アルツハイマー病治療用の医薬組成物等に関する。
【背景技術】
【0002】
老化はアルツハイマー病(AD)の発症にとって極めて重要である。ADの発症にとって老化が極めて重要であるということの根底にある仮説の1つは、内因性の防御システムが高齢者ではその有効性がより低くなるというものである(Matsuoka,2009)。ヒューマニンは、抗AD防御因子候補として機能し得ると推定される内因性の神経栄養因子である(Nishimotoら,2004;Matsuokaら,2006;Matsuoka,2009、特許文献1)。
【0003】
ヒューマニンは培養神経細胞の死を抑制し、ロンドン型家族性AD変異遺伝子のアミロイド前駆タンパク質(APP)であるV642I−APPの発現によって誘導される、24個のアミノ酸からなるペプチド(MAPRGFSCLLLLTSEIDLPVKRRA)として、発現クローニング法により同定された(Hashimotoら,2000a)。アミロイドベータ(Aβ)により誘導される死、及び、家族性AD関連遺伝子の発現により誘導される死を含む、AD関連神経細胞死モデルをヒューマニンがインビトロで抑制することが、一連の研究により立証されている(概説として、Nishimotoら,2004;Matsuokaら,2006参照)。
【0004】
強力なヒューマニンペプチド誘導体はFAD遺伝子を発現するトランスジェニックマウスを含むAD関連マウスモデルの記憶障害を改善する(MamiyaとUkai,2001;Krejcovaら,2004:Tajimaら,2005;Chibaら,2005;Kunesovら,2008;Miaoら,2008;Yamadaら,2008;Chibaら,2009)。Chibaら(2009)は、ヒューマニンが、STAT3の活性化を介して、海馬のコリン作動性神経伝達を向上させることにより、ADマウスモデルの記憶障害を改善することを示した。
【0005】
ヒューマニンによってもたらされるAD関連の神経細胞死及び神経機能障害の抑制は、細胞表面上の特異的受容体へのヒューマニンの結合とSTAT3の活性化とが介在する(Hashimotoら,2000;Yamagishiら,2003;Hashimotoら,2005)。Hashimotoら(2009)は、細胞表面上のヒューマニン受容体が、IL−6受容体ファミリーに属する新規受容体であり、毛様体神経栄養因子受容体a(CNTFR)、WSX−1、及びgp130から構成されることを見出した(特許文献2)。この受容体の機能の喪失は、ヒューマニンの活性を無効にする。その特異的受容体の発見は、ヒューマニンの活性がAD関連損傷から神経細胞をインビボで保護する上で重要な役割を果たすという考えを支持するものである。
【0006】
細胞表面上の受容体に加えて、Guoら(2004)は、細胞質性のヒューマニンがBaxと結合しBaxが介在するプロアポトーシス経路を中和することにより、スタウロスポリンによって誘発される細胞死を部分的に抑制することを見出した。この知見は、細胞外から細胞表面上のヒューマニン受容体と結合するばかりでなく細胞質中のBaxとも結合することにより、その神経保護活性を示すことを示唆する(但し、後者の受容体が、AD関連神経保護に寄与することを示す証拠は存在しない)(Matsuokaら,2010)。
【0007】
ヒューマニンに対する特異的抗体を用いた複数の研究により、ヒューマニンは成人精巣において高度に発現され(Tajimaら,2003;Lueら,2010;Morettiら,2010)、神経細胞及びグリア細胞を含むその他の組織では弱く発現されることが示されている(Tajimaら,2003;Mudzumarら,2009)。この知見は、野生型のヒューマニンは非常に弱い神経保護活性を有することから、脳におけるAD関連神経毒性を抑制するためには、ヒューマニンが精巣から循環系を経由して中枢神経系に送達される必要があり得ることを示すものである。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】国際公開WO2001/021787号パンフレット
【特許文献2】国際公開WO2006/1150267号パンフレット
【発明の概要】
【発明が解決しようとする課題】
【0009】
ヒューマニンは、1〜10μMのEC50でAD関連神経細胞死を抑制する(Hashimotoら,2000)。ヒューマニンの有効濃度は、それらの生物学的活性を内分泌的に示すその他のサイトカイン及び生物活性因子の濃度と比べてはるかに高い。従って、ヒューマニンよりも強い活性を有する別の内因性ヒューマニン受容体アゴニストが、ヒューマニン受容体が介在する生存促進性経路(prosurvival pathway)を活性化する上で主要な役割を果たし得るという可能性があり、当該技術分野において基礎研究及び臨床的観点からもそのような物質を探索・同定することが強く望まれている。
【課題を解決するための手段】
【0010】
本発明者は上記課題を解決すべく鋭意研究の結果、ヒト由来の分泌型のカルモジュリン様皮膚タンパク質(CLSP)及びそのカウンターパートであるマウス由来のタンパク質がヒューマニン又はヒューマニンペプチド誘導体と同様な神経細胞の機能障害又は細胞死を抑制する活性を有しており、10〜100pMのEC50を有するヒューマニン受容体アゴニストとして機能することを初めて見出し、本発明を完成した。
【0011】
即ち、本発明は以下の態様にかかるものである。
[態様1]式(I):
TGKNLSEAGLRKLI(S又はG)EVDSDGD(アミノ酸一文字表記)(I)
からなるアミノ酸配列を有する、神経細胞の機能障害又は細胞死を抑制する活性を有するペプチド。
[態様2]態様1記載のペプチド、又は、式(I):
TGKNLSEAGLRKLI(S又はG)EVDSDGD(アミノ酸一文字表記)(I)
からなるアミノ酸配列を含み、神経細胞の機能障害又は細胞死を抑制する活性を有するポリペプチドを有効成分として含む、医薬組成物。
[態様3]以下のアミノ酸配列:
(1)配列番号1に示されるアミノ酸配列;
(2)配列番号1に示されるアミノ酸配列において、式(I)からなるアミノ酸配列以外の部分の一個又は数個のアミノ酸が、欠失、置換又は挿入されたアミノ酸配列;
(3)配列番号1に示されるアミノ酸配列における式(I)からなるアミノ酸配列以外の部分において、60%以上の同一性を有するアミノ酸配列;
(4)配列番号3又は配列番号4に示されるアミノ酸配列;
(5)配列番号3又は配列番号4に示されるアミノ酸配列において、一個又は数個のアミノ酸が、欠失、置換又は挿入されたアミノ酸配列;又は
(6)配列番号3又は配列番号4に示されるアミノ酸配列と60%以上の同一性を有するアミノ酸配列;
から成り、神経細胞の機能障害又は細胞死を抑制する活性を有するポリペプチドを有効成分として含む、医薬組成物。
[態様4]神経細胞の機能障害又は細胞死がアルツハイマー病に関連する、態様2又は3記載の医薬組成物。
[態様5]記憶傷害又は神経変性を伴う疾病の予防または治療に用いられる、態様2〜4のいずれか一項に記載の医薬組成物。
[態様6]態様1記載のペプチド、又は、態様2若しくは3に記載のポリペプチドによる神経細胞の機能障害又は細胞死を抑制する活性を検出する方法であって、(a)該ペプチド又はポリペプチドの存在下で神経細胞の機能障害又は細胞死を誘導する工程、(b)神経細胞の機能障害又は細胞死を検出する工程、を含む方法。
[態様7]態様1記載のペプチド、又は、態様2若しくは3に記載のポリペプチドによる細胞死を抑制する活性に対する化合物の効果を検出する方法であって、(a)被検化合物および該ペプチド又はポリペプチドの存在下で神経細胞の機能障害又は細胞死を誘導する工程、(b)神経細胞の機能障害又は細胞死を検出する工程、を含む方法。
[態様8]態様1記載のペプチド、又は、態様2若しくは3に記載のポリペプチドによる神経細胞の機能障害又は細胞死の抑制を調節する化合物をスクリーニングする方法であって、(a)被検試料および該ペプチド又はポリペプチドの存在下で神経細胞の機能障害又は細胞死を誘導する工程、(b)神経細胞死を検出する工程、(c)神経細胞の機能障害又は細胞死を促進または抑制する化合物を選択する工程、を含む方法。
[態様9]態様1記載のペプチド、又は、態様2若しくは3に記載のポリペプチドに結合する化合物のスクリーニング方法であって、(a)該ペプチド又はポリペプチドに被検試料を接触させる工程、(b)該ペプチド又はポリペプチドと被検試料との結合活性を検出する工程、(c)該ペプチド又はポリペプチドに結合する活性を有する化合物を選択する工程、を含む方法。
[態様10]態様1記載のペプチド、又は、態様2若しくは3に記載のポリペプチドを神経細胞に接触させる工程を含む、神経細胞の機能障害又は細胞死を抑制する方法。
[態様11]態様1記載のペプチド、又は、態様2若しくは3に記載のポリペプチドを、神経細胞の細胞機能障害若しくは神経細胞死を伴う疾患、又は、記憶傷害若しくは神経変性を伴う疾病に罹患した又はその疑いのある個体に投与する段階を含む、該疾患又は疾病を治療する方法。
[態様12]
疾患又は疾病がアルツハイマー病である、態様11記載の方法。
【発明の効果】
【0012】
本発明によって、従来知られているヒューマニン又はヒューマニンペプチド誘導体に較べて極めて顕著な神経細胞の機能障害又は細胞死を抑制する活性を有する物質を提供することが出来る。即ち、本発明のポリペプチドの一種であるCLSPの有するEC50は10〜100pMであると推定され、これは、CLSPがヒューマニン(EC50=1〜10μM)よりも105−6倍強力な上記活性を有していることを意味する。
【0013】
更に、本発明のポリペプチドの一種であるマウス由来のCLSPがインビボにおいてマウスの記憶傷害を抑制(改善)する効果を示した。
【図面の簡単な説明】
【0014】
【図1】(A)マウス精巣及び示された培養細胞(MLTC−1細胞、マウスライディッヒ細胞;TM3細胞、マウスライディッヒ細胞;NT2細胞、ヒトテラトカルシノーマ細胞)から調製した溶解物を、ヒューマニン抗体PO4をコンジュゲートさせたタンパク質Gを用いて免疫沈降させた。次に、インプット溶解物及び免疫沈降物を、Tris/Tricine SDS−PAGE、続く、銀染色法により分析した。(B)20kDの分子量を有し、NT2細胞から免疫沈降させたタンパク質を含むゲル片を切り出し、質量分析のために使用した。このタンパク質は、CLSPと同定された。下線を付したヒトCLSPのドメインは、ヒューマニンのコアドメインにわずかに類似している。
【図2】(A)SHSY−5Y細胞は、pFLAG−hCLSP、pFLAG−HN又はpFLAGベクターを用いてトランスフェクトした。pFLAG−hCLSPは、FLAGエピトープがC末端にタグ付加されているhCLSPをコードする。トランスフェクションの24時間後、それらを、Brefendin−Aと共に、又は、伴わずに6時間処理した。調整培地及び細胞溶解物を、M2抗FLAG抗体を用いるイムノブロット分析に供した。(B、C、及びD)ヒトSHSY−5Y細胞を、Myc/6xHis(MycHis)がC末端にタグ付加されているCLSPをコードするpcDNA3.1/MycHisベクター(Vec)又はpcDNA3.1/MycHis−hCLSPと共に、pcDNA3.1ベクター(Vec)又はpcDNA3.1−V642I−APPを用いてトランスフェクトした。トランスフェクションの48時間後に、それらを、WST−8細胞生存性アッセイ(B)、顕微鏡分析(C)、並びに、APP及びMycに対する抗体(hCLSP)を用いたイムノブロット分析(D)のために回収した。(E、F)SHSY−5Y細胞を、pcDNA3.1/MycHisベクター(Vec)又はpcDNA3.1/MycHis−hCLSPと共に、pcDNA3.1ベクター(Vec)又はpcDNA3.1−V642I−APPを用いてトランスフェクトした。トランスフェクション後に、細胞をhCLSPに対する抗体(CLSP−N)と一緒にインキュベートした。トランスフェクションの48時間後に、それらをWST−8細胞生存性アッセイ(E)、並びに、APP及びMycに対する抗体(hCLSP)を用いたイムノブロット分析(F)のために回収した。
【図3】(A)hCLSP欠失変異体の概略図。(B、C、D)CLSP欠失変異をコードするpcDNA3.1−MycHis(Vec)、pcDNA3.1/MycHis−hCLSP、又はpcDNA3.1−MycHisと共に、pcDNA3.1ベクター(Vec)又はpcDNA3.1−V642I−APPを用いてトランスフェクトしたヒトSH−SY5Y細胞。トランスフェクションを開始して48時間後に、それらを、顕微鏡分析(B)、WST−8アッセイ(C)、並びに、APP及びMycに対する抗体(CLSPタンパク質)を用いたイムノブロット分析(D)のために回収した。調整培地も、6xHisをタグ付加したタンパク質を吸着するTALON金属樹脂を用いてプルダウンするために回収した。次に、沈降物をMycに対する抗体を用いたイムノブロット分析により分析した。
【図4】pcDNA3.1−MycHis(Vec)、pcDNA3.1/MycHis−hCLSP−DN、又はpcDNA3.1/MycHis−sshCLSPDNと共に、pcDNA3.1ベクター(Vec)又はpcDNA3.1−V642I−APPを用いてトランスフェクトしたSHSY−5Y細胞。sshCLSPDNは、Met−マウスインスリン様増殖因子−1シグナル配列(Ser12−Gly33)−Lys−Proからなるシグナル配列がN末端に結合しているhCLSPDNである。トランスフェクションを開始してから48時間後に、細胞を、顕微鏡分析(A)、WST−8アッセイ(C)、並びに、APP及びMycに対する抗体(CLSPタンパク質)を用いたイムノブロット分析(D)のために回収した。調整培地も、6xHisをタグ付加したタンパク質を吸着するTALON金属樹脂を用いてプルダウンするために回収した。次に、沈降物を、Mycに対する抗体を用いたイムノブロット分析により分析した。ロット分析により分析した。
【図5】SHSY−5Y細胞を、pcDNA3.1ベクター(Vec)又はpcDNA3.1−V642I−APPを用いてトランスフェクトした。次に、細胞を、示された濃度の合成EHD又はEHD−Gと一緒にインキュベートした。トランスフェクションを開始してから48時間後に、細胞を、顕微鏡分析(A)、WST−8アッセイ(B)、並びに、APPに対する抗体を用いたイムノブロット分析(C)のために回収した。
【図6】(A)pcDNA3.1/MycHis−hCLSP又はベクターを用いてトランスフェクトしたCOS7細胞を、調整培地を回収する前に48時間、DMEM−10%FBS中で培養した。精製したhCLSP−MycHisのタンパク質濃度は、基準物質としてBSAを用いたTris/Tricine SDS−PAGEゲルの銀染色によって測定した(Wako Pure Chemicals)。並行して、同様に精製したベクター形質転換体の調整培地を、陰性対照(NC)として電気泳動に供した。(B、C、D)SH−SY5Y細胞を、pcDNA3.1ベクター(Vec)又はpcDNA3.1−V642I−APPを用いてトランスフェクトした。次に、細胞を、示された濃度のhCLSP−MycHis又は陰性対照(NC)と一緒にインキュベートした。トランスフェクションを開始してから48時間後に、細胞を、顕微鏡分析(B)、WST−8アッセイ(C)、並びに、APPに対する抗体を用いたイムノブロット分析(D)のために回収した。ロット分析により分析した。
【図7】(A)FBS不含でN2サプリメントを含有するDMEM培地中で48時間インキュベートされたSHSY−5Y細胞を、10μM HN、10μM HNA、又は100pM 組み換えhCLSP−MycHisを用いて、37℃にて15分間処理し、次に、ホスホSTAT3(Tyr705)及び全STAT3抗体を用いたイムノブロット分析のために回収した。HNA(ヒューマニンA;C8A−ヒューマニン)は、ヒューマニン活性を有しないヒューマニン誘導体である(Hashimotoら,2001a)。(B、C、D)SHSY−5Y細胞を、pcDNA3.1ベクター(Vec)又はpcDNA3.1−V642I−APPと共に、pcDNA3.1−MycHis(Vec)又はpcDNA3.1/MycHis−hCLSPを用いてトランスフェクトした。次に、細胞を、gp130に対する1μg/mlの中和マウスモノクローナル中和抗体と一緒にインキュベートした。トランスフェクションを開始してから48時間後に、細胞を顕微鏡分析(B)、WST−8アッセイ(C)、並びに、APPに対する抗体を用いたイムノブロット分析(D)のために回収した。ロット分析により分析した。
【図8】ヒトCNTFR−ED−Fc−6xHis(CNTFR−ED)(1μg)及びヒトgp130−ED−Fc−6xHis(gp130−ED)(1μg)を、1%のBrij96を含有する100μlのPBS中に含まれる、M2抗FLAG抗体をコンジュゲートさせたアガロース上に固定化する前に、ヒトWSX−1−ED−FLAG(WSX−1−ED)(推定5μg)と一緒に、100nMのhCLSP−MycHis又はヒューマニンの存在下又は非存在下で、6時間、37℃にてインキュベートした。次に、洗浄した沈降物及びインプット組み換えタンパク質を、抗6xHis抗体(CNTFR−ED及びgp130−EDのため)及び抗FLAG(M2)抗体(WSX−1−ED−FLAGの検出のため)を用いたイムノブロット分析に供した。ロット分析により分析した。
【図9】F11ニューロハイブリッド細胞を、pcDNA3.1/MycHisベクター、pcDNA3.1/MycHis−mCLSP−1、又はpcDNA3.1/MycHis−mCLSP−2と共に、pcDNA3.1ベクター(Vec)又はpcDNA3.1−V642I−APPを用いてトランスフェクトした。トランスフェクションを開始してから72時間後に、細胞を、顕微鏡分析(B)、WST−8アッセイ(C)、並びに、APP及びmMycに対する抗体(mCLSP)を用いたイムノブロット分析(D)のために回収した。ロット分析により分析した。
【図10A】(A)pcDNA3.1/MycHis−mCLSP−1又はベクターを用いてトランスフェクトされたCOS7細胞を、調整培地を回収する前に、DMEM−10%FBS中で48時間培養した。精製したmCLSP−MycHisのタンパク質濃度は、基準物質としてBSAを用いたTris/Tricine SDS−PAGEゲルの銀染色によって測定した(Wako Pure Chemicals)。並行して、同様に精製したベクター形質転換体の調整培地を、陰性対照(NC)として電気泳動に供した。
【図10B】(B)PBS、10pmolの精製mCLSP−1−MycHis、又は陰性対照(NC)を脳室内注入すると共に、生理食塩水又はスコポラミンを腹腔内注入したICRマウスのSA%(生理食塩水+PBS及びスコポラミン+PBS群については、N=10;スコポラミン+CLSP群については、N=12;スコポラミン+NC群については、N=9)。
【図10C】(C)7nmolのコリベリン、100pmolの精製mCLSP−1−MycHis、又はNCの腹腔内注入を行った又は行なわずに、スコポラミン処置を行ったICRマウスのSA%(生理食塩水+PBS、スコポラミン+PBS群、及びスコポラミン+コリベリン群については、N=10;スコポラミン+CLSP群については、N=11)。データは、平均±SEMで示す。統計分析は、一元配置分散分析、続いて、FisherのPLSDにより行った(*p<0.05、***p<0.001)。ロット分析により分析した。
【図11】8週齢及び27月齢のマウスの皮膚断面と海馬断面(CA1−3領域のピラミッド状の層)を、mCLSP−1又はmCLSP−2に対する抗体を用いて免疫染色した。目盛りバーは、10μm長である。
【図12A】(A)健常提供者からの100μLの血漿を、抗GST−CLSP抗血清−又は免疫前血清−をコンジュゲートさせたタンパク質Gを用いて免疫沈降させた。次に、免疫沈降物を、Tris/Tricine SDS−PAGEによって分画し、GST−CLSP抗体を用いてイムノブロットした。pcDNA3.1−hCLSP又はベクターを用いてトランスフェクトしたCOS7細胞からの粗調整培地(CM)を、陽性及び陰性対照として使用した。
【図12B】(B)ヒト血漿中のEHを検出するためのELISAアッセイ。示された濃度の精製組み換えhCLSP−MycHis及びヒト血漿をELISAアッセイのために使用した。対照hCLSP−MycHis濃度(x軸)とELISA値(y軸)との間の関係を下のパネルにプロットした。血漿サンプルは31〜53歳の4名の健常提供者から取得した。
【図13】SH−SY5Y細胞を、pcDNA3.1ベクター(Vec)又はpcDNA3.1−V642I−APPと共に、pcDNA3.1−MycHis(Vec)又はpcDNA3.1/MycHis−CLSPを用いてトランスフェクトした。次に、この細胞をヒトCNTFR又はヒトWSX−1に対する中和抗体と共にインキュベートした。トランスフェクションを開始してから48時間後に、細胞を顕微鏡分析のため(A、D)、WST−8アッセイのため(B、E)、及び、APPに対する抗体を用いたイムノブロットアッセイのため(C、F)に回収した。ヒトCNTFR又はヒト若しくは対照マウスIgGに対する1μg/mlの中和マウスモノクローナル抗体1μLを、1mlの培地を含む6ウェルディッシュの1つのウェルに添加した(A、B、C)。ヒトWSX−1のN末端16ペプチドに対するウサギポリクローナル抗体又は免疫前血清1μLを1mlの培地を含む6ウェルディッシュの1つのウェルに添加した(D、E、F)。
【図14】5μLの粗GST−CLSP抗血清及び免疫前血清をタンパク質Gビーズと一緒に混合し、ビーズ上に予め吸着させた。次に、10nM hCLSP−MycHisを含む350μLの溶液を、これらのタンパク質Gビーズを用いて免疫除去した。免疫除去後、10μLの免疫除去物及び投入物をMycに対する抗体を用いたイムノブロット分析により分析した。
【発明を実施するための形態】
【0015】
本明細書の実施例で示されるように、式(I):
TGKNLSEAGLRKLI(S又はG)EVDSDGD(アミノ酸一文字表記)(I)
からなるアミノ酸配列を有する本発明のペプチド、及び、該ペプチドを含むポリペプチド(タンパク質)、例えば、配列番号1で示されるアミノ酸配列からなるヒト由来のポリペプチドは、神経細胞の機能障害又は細胞死を抑制する活性を有する。更に、配列番号3及び配列番号4で示されるアミノ酸配列からなるマウス由来のポリペプチドも神経細胞の機能障害又は細胞死を抑制する活性を有する。
【0016】
尚、本発明において「神経細胞の機能障害又は細胞死を抑制する活性」とは、その原因又は因果関係に依らず、神経細胞における機能障害又は細胞死の少なくとも1つを抑制又は拮抗することを指す。神経細胞死の抑制は、完全な抑制ではなくても、有意に抑制されればよい。神経細胞死の抑制活性は、以下の実施例に記載された方法または他に記載の方法(例えば国際公開番号 WO00/14204参照)に従って検定することができる。
【0017】
従って、以下のアミノ酸配列:
(1)配列番号1に示されるアミノ酸配列;
(2)配列番号1に示されるアミノ酸配列において、式(I)からなるアミノ酸配列以外の部分の一個又は数個(例えば、3個〜5個)のアミノ酸が、欠失、置換又は挿入されたアミノ酸配列;
(3)配列番号1に示されるアミノ酸配列における式(I)からなるアミノ酸配列以外の部分において、60%以上、好ましくは70%以上、より好ましくは90%以上、更に好ましくは95%以上の同一性を有するアミノ酸配列;
(4)配列番号3又は配列番号4に示されるアミノ酸配列;
(5)配列番号3又は配列番号4に示されるアミノ酸配列において、一個又は数個(例えば、3個〜5個)のアミノ酸が、欠失、置換又は挿入されたアミノ酸配列;又は
(6)配列番号3又は配列番号4に示されるアミノ酸配列と60%以上、好ましくは70%以上、より好ましくは90%以上、更に好ましくは95%以上の同一性を有するアミノ酸配列;
から成り、神経細胞の機能障害又は細胞死を抑制する活性を有するポリペプチドは医薬組成物の有効成分として有用である。
【0018】
2つのアミノ酸配列における配列の同一性を決定するために、配列は比較に最適な状態に前処理される。例えば、一方の配列にギャップを入れることにより、他方の配列とのアラインメントの最適化を行う。その後、各部位におけるアミノ酸残基又は塩基が比較される。第一の配列における、ある部位に、第二の配列の相当する部位と同じアミノ酸残基又は塩基が存在する場合、それらの配列は、その部位において同一である。2つの配列における同一性は、配列間での同一である部位数の全部位(全アミノ酸又は全塩基)数に対する百分率で示される。
【0019】
上記の原理に従い、2つのアミノ酸配列における同一性は当業者に公知の任意の方法で決定することができる。例えば、Karlin及びAltshulのアルゴリズム(Proc.Natl.Acad.Sci.USA 87:2264−2268,1990及びProc.Natl.Acad.Sci.USA 90:5873−5877,1993)により決定することが出来る。このようなアルゴリズムを用いたBLASTプログラムがAltshulらによって開発された(J.Mol.Biol.215:403−410,1990)。
【0020】
さらに、Gapped BLASTはBLASTより感度良く同一性を決定するプログラムである(Nucleic Acids Res.25:3389−3402,1997)。上記のプログラムは、主に与えられた配列に対し、高い同一性を示す配列をデータベース中から検索するために用いられる。これらは、例えば米国National Center for Biotechnology Informationのインターネット上のウェブサイトにおいて利用可能である。
【0021】
或いは、配列間の同一性として、Tatiana A. Tatusovaらによって開発されたBLAST 2 Sequencesソフトウェア(FEMS Microbiol Lett.,174:247−250,1999)を用いて決定した値を用いることも可能である。このソフトウェアは米国National Center for Biotechnology Informationのインターネット上のウェブサイトにおいて利用可能であり、入手も可能である。用いるプログラム及びパラメーターは以下のとおりである。アミノ酸配列の場合、blastpプログラムを用いパラメーターとしては、Open gap:11 and extension gap:1 penalties,gap x_dropoff:50,expect:10,word size:3,Filter:ONを用いる。更に、高感度なFASTAソフトウェア(W.R.Pearson and D.J.Lipman,Proc.Natl.Acad.Sci.USA,85:2444−2448,1988)を用いて同一性を示す配列をデータベースから検索することもできる。いずれのパラメーターも、ウェブサイト上でデフォルト値として用いられているものである。
【0022】
上記の本発明のペプチド又はポリペプチド(以下、「ポリペプチド等」ともいう)は、これらの官能基を既知の方法により修飾、付加、変異、置換、または削除などにより改変された形態を持つことも可能である。このような官能基の改変は、当業者に公知の任意の方法を用いて、例えば、ポリペプチドに存在する官能基の保護、ポリペプチドの安定性または組織移行性の制御、あるいはポリペプチドの活性の制御等を目的として行なうことが出来る。
【0023】
即ち、本発明のポリペプチド等は翻訳後修飾などにより天然に修飾されていてもよい。また人工的に修飾されていてもよい。修飾には、ペプチドのバックボーン、アミノ酸側鎖、アミノ末端、またはカルボキシル末端などの修飾が含まれる。また、ポリペプチドは分岐していてもよく、環状でもよい。修飾には、アセチル化、アシル化、ADPリボシル化、アミド化、[フラビン(flavin)、ヌクレオチド、ヌクレオチド誘導体、脂質、脂質誘導体、またはホスファチジルイノシトール]等の共有結合、クロスリンク形成、環状化、ジスルフィド結合形成、脱メチル化、ピログルタミン酸化、カルボキシル化、グリコシル化、ヒドロキシル化、ヨード化、メチル化、ミリストイル化、酸化、リン酸化、ユビキチン化などが含まれるが、これらに制限されない。更に、上記ペプチド又はポリペプチドは当業者に公知の任意の塩及びエステル体とすることも可能である。
【0024】
更に、本発明のポリペプチド等は公知の任意の神経向性ペプチドと融合ポリペプチドを形成することも出来、このような融合ポリペプチドは当業者に公知の任意の方法で容易に合成することができる。
【0025】
既に述べたように、これまでの研究からアルツハイマー病において神経細胞の細胞死が起こることが明らかにされている。このため、本発明の医薬組成物(薬剤)は、アルツハイマー病における神経細胞の機能障害又は神経変性を保護する薬剤としても用いることが可能である。更に、本発明の薬剤を用いて、アルツハイマー病以外にも、記憶傷害又は神経変性を伴う疾病、例えば脳虚血による神経細胞の細胞死に起因する疾患を予防・治療することも可能である(T.Kirino,1982,Brain Res.,239:57−69)。その他、痴呆を伴うパーキンソン病(M.H.Polymeropoulos et al.,1997,Science,276:2045−2047)、びまん性レービー小体(Lewy bodies)病(M.G.Spillantini et al.,1998,Proc.Natl.Acad.Sci.USA,95:6469−6473)、ダウン症に伴う痴呆なども、治療や予防の対象となる。また、APPの類縁分子であるAPLP1が、先天性ネフローゼ症候群の原因遺伝子といわれている(Lenkkeri,U.et al.,1998,Hum.Genet.102:192−196)ことから、ネフローゼ症候群などの腎疾患も治療や予防の対象となる。
【0026】
本発明の医薬組成物は、有効成分自体を直接患者に投与する以外に、公知の製剤学的方法により製剤化することも可能である。例えば、薬理学上許容される担体もしくは媒体、具体的には、滅菌水や生理食塩水、植物油、乳化剤、懸濁剤、界面活性剤、安定剤、徐放剤などと適宜組み合わせて製剤化して投与することが考えられる。本発明の医薬組成物は、水溶液、錠剤、カプセル、トローチ、バッカル錠、エリキシル、懸濁液、シロップ、点鼻液、または吸入液などの形態であり得る。有効成分であるペプチド又はポリペプチドの含有率は使用目的及び製剤形態等に応じて適宜決定すればよい。
【0027】
患者への投与は、有効成分の性質に応じて、例えば経皮的、鼻腔内的、経気管支的、筋内的、腹腔内、静脈内、脊髄腔内、脳室内、または経口的に行われうるがそれらに限定されない。脳神経変性疾患の治療に用いる場合においては、本発明の医薬組成物は、静脈内、脊髄腔内、脳室内または硬膜内注射を含む任意の適当な経路で中枢神経系に導入するのが望ましい。投与量、投与方法は、本発明の医薬組成物の有効成分の組織移行性、治療目的、患者の体重や年齢、症状などにより変動するが、当業者であれば適宜選択することが可能である。例えば、1日1回〜数回、1回の処置当り数十μl程度の薬剤を適当な期間に亘り投与することができる。有効成分は、例えば、10 pmol〜100 nmol程度の範囲の濃度とすることができる。
【0028】
このように、本発明の医薬組成物は、アルツハイマー病等の神経細胞の細胞機能障害若しくは神経細胞死を伴う疾患、又は、記憶傷害若しくは神経変性を伴う疾病の予防または治療に広く用いることが出来る。
【0029】
従って、本発明は、本発明のポリペプチド等を神経細胞に接触させる工程を含む、神経細胞の機能障害又は細胞死を抑制する方法、及び、本発明の医薬組成物を、アルツハイマー病等の神経細胞の細胞機能障害若しくは神経細胞死を伴う疾患、又は、記憶傷害若しくは神経変性を伴う疾病に罹患した又はその疑いのあるヒト等の動物である対象(個体)に投与する段階を含む、該疾患又は疾病を治療する方法神経変性障害を伴う疾患を治療する方法に係る。
【0030】
本発明の医薬組成物の有効成分であるポリペプチド等はヒト及びマウス等の適当な種由来の細胞株等から調製することができ、更に、公知のペプチド合成技術により製造することが可能であり、また、当業者に公知の遺伝子工学的手法を用いて、これらをコードするDNAを含むベクター等を適当な宿主細胞等に導入して発現させることによって製造することも可能である。
【0031】
このようなベクターはプラスミド又はウイルス性ベクター等の当業者に公知の任意の形態であり、当業者に公知の任意の方法で容易に調製することが出来る。こうして得られたベクターには、本発明の部位特異的組換え酵素のコード領域以外に、5’および3’に非コード配列(核移行シグナル、タグ配列、非転写配列、非翻訳配列、プロモーター、エンハンサー、サプレッサー、転写因子結合配列、スプライシング配列、ポリA付加配列、IRES、mRNA安定化・不安定化配列等を含む)が適宜含まれており、発現ベクターとして機能する。
【0032】
このようなベクターを用いた当業者に公知の任意の方法、例えば、リポフェクション法、リン酸カルシウム法、並びに、エレクトロポレーション及びパーティクルガン等の各種物理的方法によって、適当な宿主細胞を容易に形質転換させることが出来る。
【0033】
宿主細胞に特に制限はなく、例えば、ヒト、サル及びマウス等を含む哺乳動物細胞、植物細胞、昆虫細胞、及び、大腸菌等の細菌類を用いることができる。こうして作製された形質転換細胞は当業者に公知の任意の条件で培養し、培養した菌体又はその培養上清等の適当な画分から目的とする本発明のポリペプチド等を容易に調製することが出来る。
【0034】
更に本発明は、本発明のポリペプチド等による神経細胞の機能障害又は細胞死を抑制する活性を検出する方法であって、(a)該ポリペプチド等の存在下で神経細胞の機能障害又は細胞死を誘導する工程、(b)神経細胞の細胞機能障害又は細胞死を検出する工程、を含む方法に係る。
【0035】
具体的な操作は、本明細書に記載された方法に従って行うことができる。この方法は、本発明のポリペプチド等が様々な細胞における細胞死に対して抑制効果を有するかどうかを決定したり、その抑制効果を定量するために用いられ得る。細胞としては特に制限はなく、細胞死を起し得るさまざまな細胞が用いられる。また、細胞死の誘導は、それぞれの細胞に応じて公知の細胞死誘導系を使用することができる。また、神経細胞を用いて、神経細胞死を誘導するさまざまな刺激、環境変化、または遺伝子発現などの諸条件に対する本発明のポリペプチド等の効果を検出するためにも用いられ得る。また、このような検出は、生物種や亜種、または個体間に存在し得る、神経細胞死における本発明のポリペプチド等に対する感受性の違いを検出するために用いられ得る。これにより、例えば民族、人種、または個人間で、本発明のポリペプチド等の有効性を検討することができる。このような方法により、例えば臨床適用に向けた詳細な条件検討を行うことができる
【0036】
又、本発明は、本発明のポリペプチド等による神経細胞の細胞死を抑制する活性に対する化合物の効果を検出する方法であって、(a)被検化合物および該ポリペプチド等の存在下で神経細胞の機能障害又は細胞死を誘導する工程、 (b)神経細胞の機能障害又は細胞死を検出する工程、を含む方法に係る。
【0037】
この方法は、本発明のポリペプチド等による神経細胞死を促進したり抑制したりする化合物をアッセイするために用いられ得る。本発明のポリペプチド等は、神経細胞表面に作用して細胞死抑制効果を発揮すると考えられる。この方法を用いれば、本発明のポリペプチド等の細胞表面への接触を阻害し得る候補化合物や、逆に促進し得る候補化合物の作用を検証することができる。
【0038】
また、この検出方法を用いて、本発明のポリペプチド等による神経細胞死の抑制を調節する化合物をスクリーニングすることも可能である。この方法は、(a)被検試料および本発明のポリペプチド等の存在下で神経細胞死を誘導する工程、(b)神経細胞死を検出する工程、および(c)神経細胞死を促進または抑制する化合物を選択する工程、を含む。工程(c)においては、任意の対照における場合と比較することができる。例えば、工程(c)において、被検試料非存在下において検出した場合に比べ、被検試料存在下において神経細胞死を促進または抑制する化合物を選択することができる。神経細胞死を促進する化合物は、本発明のポリペプチド等による神経細胞死の抑制を阻害する化合物の候補となり、神経細胞死を抑制する化合物は、本発明のポリペプチド等による神経細胞死の抑制をさらに促進する化合物の候補となる。また、上記のスクリーニングにおいて、被検試料とは別の化合物における場合を対照とすることもできる。例えば本発明のポリペプチド等による神経細胞死の抑制を調節し得る別の化合物を用いて細胞死を検出し、工程(c)において、該化合物の存在下における場合に比べ、工程(a)で用いた被検試料存在下において神経細胞死を促進または抑制する化合物を選択することもできる。このようなスクリーニングにおいては、本発明のポリペプチド等による神経細胞死の抑制の調節能に関して、既存の化合物よりもさらに高い効果を有する化合物をスクリーニングすることができる。
【0039】
上記のスクリーニングに用いる被検試料としては、例えば、精製タンパク質(抗体を含む)、遺伝子ライブラリーの発現産物、合成ペプチドのライブラリー、細胞抽出液、細胞培養上清、合成低分子化合物のライブラリー、土壌などの天然材料、放線菌ブロースなどの細菌放出物質を含む溶液などが挙げられるが、これらに制限されない。神経細胞死の誘導や本発明のポリペプチドの投与は、当業者に公知の任意の方法に従って行うことができる。
【0040】
被検試料を細胞に適用する時期に特に制限はなく、本発明のポリペプチド等を適用する前、後、または同時に適用することができる。被検試料の適用方法に制限はなく、培養細胞系であれば、例えば培地に添加される。また核酸であれば、細胞内に導入されてもよい。その他の任意の投与方法により被検試料を適用することができる。
【0041】
上記の化合物の作用の検査により評価された化合物、あるいはスクリーニングにより得られた化合物は、本発明のポリペプチド等の活性を調節する化合物の候補となり、アルツハイマー病を含む疾患の予防や治療への応用が考えられる。
【0042】
更に本発明は、本発明のポリペプチド等に結合する化合物のスクリーニング方法であって、(a)該ポリペプチド等に被検試料を接触させる工程、(b)該ポリペプチド等と被検試料との結合活性を検出する工程、(c)該蛋白質に結合する活性を有する化合物を選択する工程、を含む方法に係る。
【0043】
本発明のポリペプチド等は、スクリーニングの手法に応じて、可溶性ポリペプチドとして、また担体に結合させた形態としてスクリーニングに用いることができる。本発明のポリペプチド等は標識されていてもよい。標識としては、放射性同位元素による標識、蛍光物質による標識、ビオチンやジゴキシゲニンによる標識、タグ配列の付加などが挙げられる。
【0044】
スクリーニングに用いる被検試料としては、例えば、精製タンパク質(抗体を含む)、遺伝子ライブラリーの発現産物、合成ペプチドのライブラリー、細胞抽出液、細胞培養上清、合成低分子化合物のライブラリー、土壌などの天然材料、放線菌ブロースなどの細菌放出物質を含む溶液などが挙げられるが、これらに制限されない。被検試料は、必要に応じて適宜標識して用いられる。標識としては、例えば、放射標識、蛍光標識などが挙げられるが、これらに制限されない。
【0045】
例えば、本発明のポリペプチド等と結合するタンパク質をスクリーニングする場合は、本発明のポリペプチド等を固定したアフィニティーカラムに本発明のポリペプチドと結合するタンパク質を発現していることが予想される組織または細胞の細胞抽出物をのせ、カラムに特異的に結合するタンパク質を精製することにより、本発明のポリペプチド等に結合するタンパク質のスクリーニングを実施することが可能である。
【0046】
さらに、本発明のポリペプチド等と結合するタンパク質を発現していることが予想される組織若しくは細胞(例えば脳皮質組織、またはF11などの神経細胞)よりファージベクターを用いたcDNAライブラリーを作製し、アガロース上にプラークを形成させ、標識した本発明のポリペプチド等を用いてウエストウエスタンブロッティング法によりスクリーニングしたり、GAL4 DNA結合領域などのDNA結合ペプチドおよびGAL4転写活性化領域などの転写活性化ペプチドを、それぞれ本発明のポリペプチド等と被検タンパク質との融合タンパク質として発現させ、DNA結合ペプチドの結合配列を有するプロモーターの下流に連結させたレポーター遺伝子の発現を通して本発明のポリペプチド等と被検タンパク質との結合を検出する「twoハイブリッドシステム」等に従い実施することも可能である。
【0047】
本発明のスクリーニングにより、本発明のポリペプチド等に対する受容体をクローニングすることも考えられる。この場合、被検試料は受容体を発現していることが予想される組織または細胞、例えば脳皮質組織、神経細胞株、または神経芽細胞腫や奇形腫細胞などから調製することが好ましい。神経細胞株としては、例えばF11細胞、PC12細胞(L.A.GreeneおよびA.S.Tischler,1976,Proc.Natl.Acad.Sci.USA,73:2424−2428)、NTERA2細胞(J.SkowronskiおよびM.F.Singer,1985,Proc.Natl.Acad.Sci.USA,82:6050−6054)、SH−SY5Y細胞(L.Odelstad et al.,1981,Brain Res.,224:69−82)等が挙げられる。
【0048】
また、固定化した本発明のポリペプチド等に、合成化合物、天然物バンク、もしくはランダムファージペプチドディスプレイライブラリーなどを作用させ、結合する分子をスクリーニングすることも考えられる。また、表面プラズモン共鳴現象を利用した結合の検出によるスクリーニングも可能である(例えばビアコア(BIAcore社製)など)。これらのスクリーニングは、コンビナトリアルケミストリー技術を用いたハイスループットスクリーニングにより行うことも可能である。
【0049】
本発明のスクリーニングにより得られた本発明のポリペプチド等に結合する化合物は、本発明のポリペプチド等の活性を調節する化合物の候補となり、アルツハイマー病を含む疾患の予防や治療への応用が考えられる。
【0050】
以下、実施例に則して本発明を更に詳しく説明する。尚、本発明の技術的範囲はこれらの記載によって何等制限されるものではない。
【実施例1】
【0051】
[CLSPはヒューマニン抗体によって免疫沈降する]
ヒューマニンに対する抗体PO4(Tajimaら,2003)を用いることにより、ヒトNT2神経芽細胞腫細胞溶解物から20kDのタンパク質を免疫沈降させた(図1A)。質量分析によって、このタンパク質はCLSP(カルモジュリン様皮膚タンパク質;calmodulin−like skin protein)と同定された。ヒトCLSP(hCLSP)は146個のアミノ酸から成るタンパク質であって、主として皮膚ケラチノサイトで発現されCa2+結合モチーフであるEFハンドを有するカルモジュリン関連タンパク質である(Mehulら,2000;Hwangら,2003)。細胞内のシグナル伝達におけるその関与は、未だ特徴が明らかにされていない。かかるヒトCLSPのアミノ酸配列を配列番号1として示す。
【0052】
hCLSPは43番目から59番目のアミノ酸から成る配列:NLSEAGLRKLISEVDSDを含む。一方、24個のアミノ酸からなるヒューマニンには、17個のアミノ酸から成るコア領域(PRGFSCLLLLTSEIDLP)が含まれている。これらアミノ酸配列を比較すると、互いの同一性は低いことがわかる(下線を付したアミノ酸は同一である)(図1B)。特に、ヒューマニンの活性にとって必須である上記コア領域のPro3、Ser7、Cys8、Leu9、Leu12、Thr13、Ser14、及びPro19(特許文献1、Yamagishiら,2003)の中で、Leu9、Leu12、及びSer14がhCLSP中で保存されているにすぎない。従って、hCLSPのこの領域は構造的にはヒューマニンのコア領域との相同性又は類似性は極めて低いが、便宜的に、ヒューマニン様ドメイン(Humanin−like domain;HLD)と命名した。
【実施例2】
【0053】
[CLSPはV642I−APPによって誘発される神経細胞死を抑制する]
hCLSP(C末端にMycHisタグを付している)及びヒューマニン(C末端にFLAGタグを付している)を、ヒトSHSY−5Y神経芽細胞腫細胞中で発現させた。Hisタグに吸着するTALON Metal Resinビーズを用いたhCLSP−MycHisの精製、並びに、FLAG抗体をコンジュゲートさせたビーズを用いたヒューマニン−FLAGの精製の結果、回収した調整培地及び細胞溶解物中にhCLSP−MycHis及びヒューマニン−FLAGの存在が認められた(図2A)。小胞体−ゴルジ体輸送の阻害物質であるブレフェンディンAによる処理によって、調整培地中に分泌されるGhCLSP及びヒューマニンの量が少なくなった(図2A)。これらの結果は、CLSP(典型的な分泌リーダー配列は欠けている)が、通常の細胞内分泌メカニズムを介して分泌されることを示唆している。ヒューマニンの分泌については、初期の研究においてすでに示されている(Hashimotoら,2001a)。
【0054】
V642I−APPの強制的発現は、初期の研究から予想されるように、SHSY−5Y神経芽細胞腫細胞の死を誘発した(Hashimotoら,2000;Hashimotoら,2009)。結果として、このことは、ディッシュに付着している生存細胞数(図2B)とWST−8アッセイによる細胞生存率(図2C)の両方の減少をもたらした。hCLSPの同時発現は、V642I−APPによって誘発されるSHSY−5Y細胞の細胞死を抑制した(図2B及び2C)。イムノブロット分析によって、V642I−PPの発現をダウンレギュレートすることによりhCLSPが細胞死を抑制するという可能性は除外された(図2D)。
【0055】
免疫前血清の添加でなく、16個のアミノ酸から成るhCLSPのN末端領域(「hCLSP−N」と命名)に対する抗体をアッセイ系に添加することによって、hCLSP発現をダウンレギュレートすることなく、hCLSPによって介在される細胞死を抑制する活性が無効になった(図2E及び2F)。この結果は、分泌されたhCLSPは細胞の外側からその活性を示し、hCLSP抗体が培地中のhCLSPと結合することによりhCLSP活性を中和し得ることを示唆する。
【実施例3】
【0056】
[CLSPの培地中への分泌はV642I−APPによって誘発される細胞死に対するCLSPが介在する抑制にとって必須である]
hCLSPの欠失変異体hCLSP−DC1及びhCLSP−DC2(これらは、それぞれ、C末端領域(アミノ酸79〜146)及び(アミノ酸62〜146)を欠失している)をコードする発現ベクターを、細胞死アッセイのために構築した(図3A)。各変異体の同時発現は、V642I−APPによって誘発される細胞死を抑制した(図3B及び3C)。イムノブロット分析によって、これらの変異体が調整培地中に分泌されることが示された(図3D)。これらの結果から、N末端の1〜61領域はhCLSPによって誘導される細胞死の抑制にとって十分であることが示された。
【0057】
一方で、欠失変異体hCLSP−DN(N末側領域(アミノ酸2−39)を欠失している)をコードする発現ベクターを、別の細胞死アッセイのために構築した(図3A)。同時に、Met−IGF−1シグナル配列(Ser12−Gly33)−Lys−Proからなる25個のアミノ酸配列が分泌を促進させるためにhCLSP−DNのN末端に付いている、ss−hCLSP−DNをコードするベクターを構築した。その結果、hCLSP−DNの発現はV642I−APPによって誘発される細胞死を抑制しなかった。一方で、ss−hCLSP−DNの発現はV642I−APPによって誘発される細胞死を抑制した(図4A及び4B)。hCLSP−DNは分泌されなかったのに対して、ss−hCLSP−DNは培地中に分泌された(図4C)。この結果から、N末端の38アミノ酸領域の欠失は、CLSPの作用にとって必須であるhCLSPの培地中への分泌を阻害することが示された。
【0058】
以上のhCLSPの欠失に関する分析結果から、hCLSPに含まれる22個のアミノ酸(アミノ酸40〜61)から成る領域:TGKNLSEAGLRKLISEVDSDGD(又は、「TGL−HLD−GD」)は、神経細胞死のhCLSPが介在する抑制において中心的役割を果たすという結論がもたらされた。この領域を、内因性ヒューマニン様ドメイン(Endogenous Humanin−like Domain;EHD)と命名した。尚、かかるEHDのアミノ酸配列を配列番号2で示す。
【実施例4】
【0059】
[合成EHD(培地中に添加)はヒューマニン活性を示す]
EHDがhCLSPによって誘導される抑制のためのhCLSPのコア領域であることを確かめるために、EHDペプチドを化学的に合成し、それがhCLSPを模倣するか否かを調べた。ヒューマニン変異体S14G−ヒューマニンは野生型ヒューマニンと比べて1000倍以上強力であることから(Terashitaら,2003)、比較のためにEHD−Gも合成した(この場合、54番目のセリン(ヒューマニンにおける14番目のセリンと類似)がグリシンに置換されている)。10μMの濃度のヒューマニン又はEHDと一緒にインキュベートするとV642I−APPによって誘発される細胞死は抑制されたのに対して、10nMの濃度のヒューマニン又はEHDでは細胞死は抑制しなかった(図5A及び5B)。S54G置換は、ヒューマニン活性を増強しなかった(図5A及び5B)。これらの結果は、EHDが神経細胞の死を抑制する活性を有することを裏付けるばかりでなく、分泌されたhCLSPが細胞の外側から該活性を示すという考えをも支持するものである。これらのペプチドと一緒にインキュベートすることは、V642I−APPの発現に影響を与えなかった(図5C)。
【実施例5】
【0060】
[CLSPはヒューマニンよりもはるかに強力である]
Talon Metalビーズを用いて、hCLSP−MycHisを過剰発現するF11細胞の調整培地から、hCLSP−MycHisをアフィニティー精製した。模擬精製は骨格ベクターを用いてトランスフェクトしたF11細胞の調整培地を用いて行った。hCLSP−MycHisの濃度は、クーマシーブルー染色によって推定した(図6A)。CLSP−MycHisを過剰発現するCOS7細胞の調整培地から部分精製した各種濃度の組み換えhCLSP−MycHisを用いることにより、V642I−APPによって誘発される細胞死の抑制のためのhCLSPの有効濃度を推定した。図6B及び6Cに示されるように、hCLSP−MycHisは、用量に依存して神経細胞死を抑制した。推定されるEC50は10〜100pMである。この結果は、CLSPがヒューマニン(EC50=1〜10μM)よりも105−6倍強力であることを示した。一方で、EHDペプチドのEC50は、10nMよりも高いことから(図5)、hCLSPのEHD及び/又は調整培地中でCLSPと複合体を形成するその他のタンパク質と比較して、その他の領域が、未だ特徴が明らかにされていない方法を介してEHDのヒューマニン活性を増強する可能性が高い。
【実施例6】
【0061】
[CLSPはヒューマニン受容体を介して神経細胞の死を抑制する]
図7Aに示されるように、組み換えhCLSP−MycHis(概算濃度100nM)又は合成ヒューマニン(100μM)との同時インキュベーションは、705番目のチロシンにおけるSTAT3のリン酸化を増大させた。この結果は、CLSPがヒューマニン受容体と結合し、JAK2/STAT3生存促進経路を活性化することにより、神経細胞死を抑制することを示唆する(Hashimotoら,2009)。裏付けとして、gp130に対する中和抗体は、ヒューマニンが介在する神経保護活性についての初期の研究において示されるように(Hashimotoら,2009)、CLSPによって誘発される神経細胞死の抑制を弱めた(図7C〜D)。CNTFR及びWSX−1に対する中和抗体もまた、CLSPによって誘発される神経細胞死の抑制を弱めた(図13A〜F参照)。
【0062】
精製組み換えhCLSP−MycHis又はヒューマニンの存在下で、CNTFRの組み換え細胞外ドメイン及びgp130及び可溶性WSX−1の混合物を一緒にインキュベートすることにより行うインビトロ再構成アッセイ(Hashimotoら,2009a;Hashimotoら,2009b)において、WSX−1とCNTFRとの間、及び、WSX−1とgp130との間のヘテロダイマー化をもたらした(図8)。全てのこれらの結果は、CLSPがヒューマニン受容体アゴニストであるということを示した。
【実施例7】
【0063】
[CLSPはスコポラミンによって誘発されるマウスの記憶障害を抑制する]
ヒトCLSP遺伝子に関しては、元々Scarf1及びScarf2と名付けられた2つのマウスのカウンターパート遺伝子が存在する(Hwangら,2003)。マウスScarf1はアミノ酸レベルでヒトCLSPと50.0%の同一性を示す。マウスのScarf1及びScarf2は、高度に類似しており、それらの遺伝子はマウス染色体15.3に15.3kBの間隔で並んで配置されている(Hwangら,2003)。これら遺伝子をマウスCLSP−1(mCLSP−1)及びマウスCLSP−2(mCLSP−2)と命名する。これらのいずれかとの同時発現によってV642I−APPによって誘発されるF11細胞の細胞死が完全に抑制されたのに対して(図9)、それらは、V642I−APPによって誘発されるヒトSH−SY5Y細胞の細胞死は部分的にのみ抑制した(データは示さず)。一方で、ヒトCLSPは、V642I−APPによって誘発されるSH−SY5Y細胞の死を完全に抑制することができるのに対して、V642I−APPによって誘発されるF11細胞の死は部分的にのみ抑制した(データ示さず)。これらの結果は、CLSPが部分的に種特異的なヒューマニン活性を示すことを示している。尚、マウスScarf1及びマウスScarf2のアミノ酸配列を夫々、配列番号3及び配列番号4で示す。
【0064】
ヒューマニンペプチド誘導体は、家族性AD関連遺伝子を過剰発現するトランスジェニックADマウスを含むADマウスモデルの記憶障害を改善することが知られている(MamiyaとUkai,2001;Krejcovaら,2004:Tajimaら,2005;Chibaら,2005;Kunesovら,2008;Miaoら,2008;Yamadaら,2008;Chibaら,2009)。
【0065】
そこで、次に、CLSPがインビボにおいてヒューマニンを模倣するか否かについて検討した。mCLSP1−MycHisを過剰発現するCOS7細胞の調整培地から部分精製した組み換えmCLSP1−MycHisを使用し、陰性対照としてF11細胞の調整培地を用いて模擬精製し(図10A)、CLSP−1がスコポラミンによって誘発される記憶障害を改善するか否かをYmaze試験によって調べた(Chibaら,2005)。予め脳室内に投与された組み換えmCLSP−1−MycHisは、スコポラミンによって誘発される記憶障害を減少させたのに対して、陰性対照の投与は減少させなかった(図10B)。部分精製した組み換えmCLSP−1及び強力なヒューマニン誘導体ペプチドである合成コリベリン(Chibaら,2005)の腹腔内注入によってもスコポラミンによって誘発される記憶障害を改善した(図10C)。後の結果は、末梢的に注入されたCLSPが、血液脳関門を通過し、脳内でその活性を示すことを示唆する。
【実施例8】
【0066】
[皮膚におけるマウスCLSP−1及びCLSP−2の発現]
以前の研究によって、ヒトCLSPは皮膚及びその他の表皮組織において高度に発現することが示されている(Mehulら,2000;Hwangら,2003)。マウスCLSP−1及びCLSP−2は筋肉でも発現した(Hwangら,2003)。本発明者は、mCLSP−1及びmCLSP−2が8週齢及び20月齢のマウスの皮膚組織及び筋肉で高度に発現されていることを免疫組織化学により見出した(図11)。一方中枢神経の海馬における発現レベルは皮膚におけるレベルよりもはるかに低いことが示された(図11)。
【実施例9】
【0067】
[CLSPはヒト血漿中で検出される]
更に、健常人の血漿中のCLSPを検出した。100μLのヒト血漿をヒトCLSPに対する抗体を用いて免疫沈降させ、得られた沈降物を同じ抗体を用いてイムノブロットした。免疫沈降効率はほぼ100%であった。図12Aに示されるように、20kDの分子量を有するタンパク質はCLSP抗体によって得られた沈降物中にのみ検出された。このタンパク質は、SDS−PAGE中で組み換え野生型CLSPと完全に同じように移動した。この結果は、ヒト血液中におけるCLSPの存在を示した。血漿中のCLSPの概算濃度は500pM〜1nMであった。
【0068】
別の検出方法として、同じ抗体を使用する酵素結合免疫吸着アッセイ(ELISA)システムも開発した。このELISAは10〜50pMの濃度を有する組み換えhCLSP−MycHisを検出することが可能である(図12B)。これを利用することにより、ヒト血漿中のCLSP濃度が約50〜500pMであることを示した(図12B)。このELISAによって推定された濃度は、イムノブロット分析によって推定された濃度よりも低い。このELISAシステムは、全CLSPの画分のみを検出し得る可能性が高い。
【0069】
以上の実施例で使用された材料及び方法は以下の通りである。尚、特に記載がない場合には、当業者に公知の適当な方法・手段で実施した。
【0070】
[タンパク質の精製、ヒューマニン抗体PO4による免疫沈降]
免疫沈降物はTris/Tricine SDS−PAGE上で分離して、PVDF膜上へ転写し、銀染色MSキット(Wako Laboratory Chemical,Japan)を用いて染色した。タンパク質のバンドを切り出して、リシルエンドペプチダーゼを用いて消化し、質量分析法(Applied Biosystems社のPerSeptive Biosystem Voyager-DE/RP)により分析した。
【0071】
[遺伝子、ポリペプチド、及び材料]
ヒトおよびマウス皮膚組織よりmRNAを調製し、それぞれの遺伝子に対応したプライマーを作成して、RT-PCR方法で、hCLSPならびにmCLSP-1 及びmCLSP-1cDNAをクローニングした。RT-PCR方法でpcDNAベクター中でV642I−APPをコードするcDNAが、これまでに記述されている(Hashimotoら,2001a,b)。細菌中でGSTタグ付CLSPを作製するために、ヒトCLSP cDNAをpGEXベクター中に導入した。C末端にMycHisタグの付いたタンパク質を作製するために、ヒトCLSP(hCLSP)、hCLSP欠失変異体、マウスCLSP−1(mCLSP−1)、及び、マウスCLSP−2(mCLSP−2)をコードするcDNAを、pcDNA3.1/MycHis中に導入した。C末端にFLAGタグの付いたCLSP(CLSP−FLAG)を作製するために、ヒトCLSPcDNAを、pFLAGベクター中に導入した。
【0072】
ヒトCNTFR(アミノ酸1〜390)の細胞外ドメイン(ED)は、ヒトIgGのFc領域をコードし、C末端に6xHisタグを付加したcDNAとインフレームで融合し(CNTFR−ED−Fc−His)、ヒトWSX−1(アミノ酸1〜390)のEDは、ヒトWSX−1の完全な細胞外ドメインを含む。組み換えヒトgp130−ED−Fc−6xHisは、R&D Systems(Minneapolis,MN)から購入した。
【0073】
ヒューマニン、コリベリン(Chibaら,2005)、EHD(TGLNLSEAGLRKLISEVDSDGD)及びS54G−EHD/EHD−G(TGLNLSEAGLRKLIGEVDSDG)は、エール大学(New Haven,CT)のKeck基金バイオテクノロジー資源研究所によって合成された。
【0074】
[抗体]
抗体は以下の企業から購入した:Myc,Invitrogen(Carlsbad,CA,USA);FLAG(M2),Sigma(St.Louis,MO,USA);APP(22C11),Chemicon(Temecula,CA,USA);phoshoSTAT3(Tyr705),Cell Signaling Technology(Beverly,MA);STAT3(C−20),Santa Cruz Biotechnology(Santa Cruz,CA)。GST−hCLSPに対するウサギポリクローナル抗体(GST−CLSP抗体と命名)は、N末端にGSTタグが付けられた組み換えヒトCLSPを用いて免疫することにより作製し、細菌中で産生させた。ヒトCLSPに対する別のウサギポリクローナル抗体(CLSP−N抗体と命名)は、キーホールリンペットヘモシアニン(Sigma−Aldrich,St.Louis,MO)をコンジュゲートさせたhCLSPのN末端16アミノ酸ペプチドに相当する合成ペプチドを用いて免疫することにより作製した。CLSP−N抗体は、V642I−APPにより誘発される死のCLSPが介在する抑制を阻害する。
【0075】
「細胞、細胞死、及び生存性試験」
マウスMLTL−1マウスライディッヒ細胞(ATCC番号CRL-2065)、TM3ライディッヒ細胞(ATCC番号CRL-1714)は、ATCCから取得した。ヒトテラトカルシノーマ細胞株NTERA−2(NT2)はSTRATAGENE社から購入した。F11細胞(胚齢13日目のラット初期培養神経細胞及びマウス神経芽細胞腫N18TG2のハイブリッド))は上記のHashimotoら,2000;2000a及び2003に記載の方法で調製した。SH−SY5Y細胞(ATCC番号CRL-2266)は、10%FBSを含有するDMEM/HamのF12混合液(DMEM/F12)中で増殖させた。SH−SY5Y細胞は、6ウェルプレート中、2x105細胞/ウェルの濃度で、12〜16時間播種し、血清非存在下で、示されたベクターを用いて3時間トランスフェクトして、次に、DMEM/F12−10%中で培養した。トランスフェクションを開始して24時間後に、続いて、培地を、レスキュー因子を含有するDMEM/F12+N2補助物質(Invitrogen)と交換した。トランスフェクションを開始して48時間の時点で、細胞の死亡率及び生存率のアッセイのために細胞を回収した。細胞生存性は、WST−8アッセイ及びカルセイン染色アッセイによって測定した(Hashimotoら,2001a,b,2005a,b)。
【0076】
WST−8アッセイ(細胞計数キット−8(Dojindo,Osaka,Japan)を使用して実施)は、細胞が、水溶性の2−(2−メトキシ−4−ニトロフェリル)−3−(4−ニトロフェリル)−5−(2,4−ジスルホフェニル)−2H−テトラゾリウム一ナトリウム塩を、水溶性のフォルマザンに変換する能力に基づく。細胞は、37℃にて2時間、WST−8試薬を用いて処理し、450nmにおける吸光度を測定した。カルセイン染色は記載されるようにして行った(Bozyczko−Coyneら,1993)。手短に述べると、6MのカルセインAM(3,6−ジ−(O−アセチル)−2,7−ビス[N,N−ビス(カルボキシメチル)アミノメチル]フルオロセイン、テトラアセトキシメチルエステル;Dojindo)を細胞に添加し、カルセインAM処理後30分以上してから、カルセイン特異的蛍光(励起485nm;放射535nm)を、蛍光顕微鏡で観察するか、又は、蛍光分光光度計(Wallac 1420 ARVOsx Multilabel Counter,PerkinElmer,Wellesley,MA)で測定した。
【0077】
F11細胞を、これまでに記載されるようにして(Platikaら,1985;Hashimotoら,2000)、18%ウシ胎仔血清(FBS)(Hyclone,Logan,UT)及び抗生物質を含有する、HamのF−12培地(Sigma,St Louis,MO)中で増殖させた。HamのF−12+18%FBS(HF−18%)中で12〜16時間培養したF11細胞(6ウェルプレートの1ウェル当たり7x104細胞)を、リポフェクション法[特に明記されない限り、cDNA,1.0μg;LipofectAMINE(Invitrogen,Carlsbad,CA),2l;PLUS試薬(Invitrogen),4μl]によりV642I−APP遺伝子を用いて、血清の非存在下で3時間トランスフェクトし、HF−18%で2時間インキュベートした。トランスフェクションを開始して5時間後に、培地を、HF−10%に交換した。トランスフェクションを開始して24時間後に、次に、それらを、レスキュー因子を含有するHamのF12+N2サプリメント(Invitrogen)に交換した。トランスフェクションを開始して72時間後に、細胞の死亡率及び生存率についてのアッセイを行った。
【0078】
[イムノブロット分析]
イムノブロット分析は、従来文献に記載されるようにして行った(Hashimotoら,2001a,b)。V642I−APP発現ベクターを用いてトランスフェクトした細胞からの溶解物(1レーン当たり20μg)を、SDS−PAGE(又は、Tris/Tricine SDS−PAGE)に供し、次に、ポリ二フッ化ビニリデンシートに電気的にブロッティングした。シートを、22C11抗体に、次に、1:5000の西洋ワサビペルオキシダーゼ標識された抗マウス又は抗ラットIgG抗体(Bio−Rad,Hercules,CA)に浸した。抗原のバンドは、ECL(Amersham Biosciences,Uppsala,Sweden)により可視化した。
【0079】
[CLSPにより誘導されるHN受容体サブユニットのオリゴマー化]
組み換えヒトCNTFR−ED−Fc−6xHis及びマウスWSX−1−ED−FLAGを作製するために、COS7細胞を、各タンパク質をコードするベクターを用いてトランスフェクトした。トランスフェクションの48時間後に、Ni NTAアガロース(1:1スラリー;Invitrogen)又は抗FLAG抗体M2をコンジュゲートさせたアガロース(1:1スラリー;Sigma−Aldrich)を用いた沈降のために調整培地を回収した。結合しているCNTFR−ED−Fc−6xHisを、10mMのイミダゾール溶液を用いて洗浄し、製造業者の説明書にしたがって、250mMのイミダゾール溶液を用いて溶出した。溶出されたCNTFR−ED−Fc−6xHisを、Zeba脱塩カラム(Pierce,Rockford,IL)により脱塩し、次に、1/10容量の10xPBSを、脱塩したタンパク質溶液に添加した。オリゴマー化を誘導するために、gp130−ED−Fc−6xHis(1mg)及び/又はCNTFR−ED−Fc−6xHis(1μg)を、1%Brij96(Sigma−Aldrich)を含有する100μlのPBS中に含まれる抗FLAGmAb M2をコンジュゲートしたアガロースビーズ上に固定化されたWSX−1−ED−FLAG(推定5μg)と一緒に、ペプチドの存在下、37℃にて6時間インキュベートした。オリゴマー化されたタンパク質は、同じバッファーで十分に洗浄した後、SDS−PAGE分画及びイムノブロット分析により可視化した。
【0080】
[組み換えCLSPタンパク質の精製]
GST−融合タンパク質(GST−CLSP)を、1mM イソプロピル−チオ−b−D−ガラクトピラノシドの存在下、大腸菌BL−21中で、37℃にて4時間発現させ、従来文献に記載されるようにして精製した(Matsuokaら,2000)。
【0081】
hCLSP−MycHis及びmCLSP−1−MycHisの精製のために、COS7細胞を、pcDNA3.1/MycHis−hCLSPプラスミドを用いてトランスフェクトし、DMEM−10%FBS中で培養した。トランスフェクションの48時間後に、調整培地を回収した。分泌されたCLSP−MycHisタンパク質を、製造業者の説明書にしたがって、TALON Metal Resin(Clontech)を用いてアフィニティー精製した。溶出液は、Zebaスピンカラム(Pierce)を用いて脱塩した。1/10容量の10xPBS及び適当量のプロテアーゼカクテルComplete(Roche)溶液を、脱塩した溶出物に添加した。精製されたCLSP−MycHisのタンパク質濃度は、Tris/Tricine SDS−PAGEゲルの銀染色により推定した。BSAを、濃度標準として使用した(Wako Pure Chemicals)。模擬(mock)精製のために、COS7細胞を、骨格ベクターを用いてトランスフェクトした。続いて、上記と同じ精製手順を用いた。
【0082】
[Tyr705リン酸化STAT3の検出]
SHSY−5Y細胞を、FBSを含まない条件下、24時間、N2サプリメントを含有するDMEM培地中で培養した。次に、示されたサイトカイン類を用いて、15分間、37℃にて細胞を処理した。ホスホSTAT3(Tyr705)抗体(Cell Signaling)及びSTAT3抗体(Santa Cruz Biotechnology)を用いたイムノブロット分析のために、1%NP−40、20mM Tris−HCl(pH7.4)、150mM NaCl、1mM オルトバナジウム酸ナトリウム、及びプロテアーゼ阻害剤カクテルComplete(Roche Diagnostics,Alameda,CA)を含有するバッファーを用いて、細胞を回収した。
【0083】
[動物及びCLSP処理(インビボADモデル)]
本研究は、神経科学会の神経科学研究における動物及びヒトの利用に関する方針、並びに、東京医科大学の実験動物のケア及び利用のためのガイドラインにしたがって行われた。全ての実験手順は、東京医科大学の施設内動物実験委員会によって承認された。9週齢のICRマウスを、CLEA Japan(Tokyo,Japan)から購入した。動物は、12時間の明/暗サイクル(7:00A.M.〜7:00P.M.まで明るい)の下、通常の動物用施設において飼育した(23℃、50%湿度)(Tajimaら,2005;Yamadaら,2005;Chibaら,2005)。C57マウス(8週齢)を、Y−maze試験(YM)を行う前に一週間、馴化させた。YM当日、マウスに、YMの30分前に、5μLの生理食塩水、部分精製されたmCLSP−1−MycHis、又は、5μLの生理食塩水中の精製された陰性対照を脳室内に注入した。腹腔内注入のためには、0.21mlの滅菌生理食塩水、又は示された量の部分精製されたmCLSP−1−MycHis、精製された陰性対照、0.21mlの滅菌生理食塩水中のコリベリンを使用した。次に、スコポラミン(1mg/kg)を溶解した滅菌生理食塩水(0.2ml)をYMの30分前にマウスの皮下(s.c.)に注入した。
【0084】
[行動試験]
YMは、従来文献に記載されるようにして行った(Kawasumiら,2004;Yamadaら,2005)。YMのための装置は、それぞれが120°の角度で連結されている3つの灰色のプラスチック製アーム(40cmの長さ、12cmの高さ、底部で3cmの幅、及び頂部で10cmの幅)から作られている。マウスは、アームの端部に個別に置かれ、8分間アームを自由に探索させた。調べられたパラメーターは、(1)全アームエントリー数及び(2)自発的交代パーセンテージ(SA%)であった。SA%は、試験実施時における全選択(初めの2つのエントリーは評価することができなかったので「全エントリー引く2」)に対する、以前の2つの選択と異なるアームの選択(「成功の選択」)の比として定義された。例えば、あるマウスが10エントリーした場合(例えば、1−2−3−2−3−1−2−3−2−1)、8つの全選択(10エントリー引く2)のうち5つの成功の選択であった。その結果、本ケースにおけるSA%は、62.5%であった。
【0085】
[hCLSP抗体をコンジュゲートさせたタンパク質Gセファロースの調製及びヒト血漿の免疫沈降]
200μlの免疫前血清(Pre)又は抗hCLSP抗血清を、800μlのタンパク質Gセファロース4B(1:1スラリー、GE Health Care)と混合し、4℃にて一晩回転させた。0.2Mの四ホウ酸ナトリウム(pH9.0)で二度洗浄した後、それらを2mlの同じバッファー中に懸濁させた。次に、それらを、200μlの0.2M ピメルイミド酸ジメチル二塩酸塩(Pierce)と混合し、緩やかに振盪させながら室温にて30分間インキュベートした。0.2Mのエタノールアミンを用いて一度洗浄し、遠心分離(1000rpm、5分間、室温)により回収した後、ビーズを、10μlの0.2M エタノールアミンと混合し、緩やかに振盪させながら室温にて2時間インキュベートした。次に、ビーズをPBS中に懸濁させた。抗体のコンジュゲーション効率は、SDS−PAGEゲルの銀染色により確認した(Wako Pure Chemicals)。
【0086】
ヒト血漿を健常提供者から吸引し、氷上でEDTA−Naを含有するチューブ中に入れた。精製された血漿は、−80℃にて保存された。100μLの精製ヒト血漿を、各免疫沈降において、CLSP抗体−又は免疫前−セファロースの20μlの1:1スラリーと一緒に、4℃にて一晩インキュベートした。
【0087】
[酵素結合免疫吸着アッセイ(ELISA)]
細胞培養及びヒト血漿からの調整培地(CM)中のヒトCLSPレベルを定量するために、ELISAシステムを構築した。0.05Mの炭酸バッファー(pH9.6)で(2500倍に)希釈した抗ヒトCLSP抗体を含有するウサギ血清を用いて、96ウェルマイクロプレートを1ウェル当たり50μLの量でコーティングし、4℃にて一晩インキュベートした。各ウェルを吸引し、各洗浄工程時に、200μLのPBS(pH7.4)中0.1%Tween(登録商標)20を用いて3回洗浄した。捕捉抗体に対する非特異的結合は、3%のろ過済みスキムミルク含有PBS(150μL)を添加後37℃において1時間インキュベートし、5回の洗浄により最小にした。組み換えヒトCLSP−MycHisを、7点標準曲線を提供するように希釈した(10pM〜1nM)。100μLのヒト血漿及び基準物質をウェルに添加し(3連)、37℃にて2時間インキュベートした。5回洗浄した後、西洋ワサビペルオキシダーゼにコンジュゲートさせたアフィニティー精製したウサギ抗ヒトCLSP抗体を含むCan Get Signal(登録商標)溶液(Toyobo,Japan)(0.144μg/ml)を1ウェル当たり50μL添加し、37℃にて1時間インキュベートした。7回洗浄した後、4mg/mLのo−フェヌレンジアミンを含む0.05Mクエン酸ペルオキシドバッファー(100μL)を各ウェルに添加し、37℃にて2時間インキュベートした。次に、反応を停止させるために50μLの2N H2SO4を添加した。CLSP濃度を測定するために、吸光度(450nm)を、蛍光分光光度計(Wallac 1420 ARVOsx Multilabel Counter,PerkinElmer,Wellesley,MA)によって測定した。全てのサンプルは3連でアッセイし、値は、標準曲線に対してプロットした。このELISAの感度は1nM迄の直線範囲で10〜50pMであった。
【0088】
各サンプルは、2つの部分に分けた。そのうちの一方は、予めタンパク質Gセファロース(G3サンプル)に結合させた抗GST−hCLSP血清により、4℃にて一晩、免疫除去した。5μLの粗GST−CLSP抗血清を混合し、タンパク質Gビーズ上に、4℃にて一晩予め吸着させた。模擬手順を、免疫前血清(G0サンプル)を用いて同様にして行った。G0サンプルのELISAの値マイナスG3サンプルのELISAの値を、実際のhCLSP濃度を表すと考えた。この免疫除去手順は、5nMのhCLSP−MycHisを含有する100μLの溶液からhCLSP−MycHisをほぼ完全に免疫除去することができた(図14参照)。
【0089】
[免疫組織化学]
8週齢、20月齢のオスC57−BL6マウスを、ジエチルエーテルによって麻酔した。4%パラホルムアルデヒドを含有するリン酸バッファー(pH7.4)を用いて固定化した後、脳及び皮膚を、O.C.T.Compound(Sakura,Tokyo,Japan)中に包埋し、10μmの厚さに切断した。海馬の矢状断面を、MASコーティングしたスライドグラス(Matsunami,Osaka,Japan)上に調製した。この断面を、TBS−Tを用いて洗浄し、内因性のペルオキシダーゼ活性を消失させるために30分間、0.3% H2O2を用いて処理し、TBS−Tですすいだ。ブロッキング及び免疫染色は、M.O.M.ベーシックキット(Vector laboratories,Burlingame, CA, USA)を用いて処理した。この断面を、一次抗体として、アフィニティー精製したmCLSP−1及びmCLSP−2抗体を用いて、4℃にて一晩インキュベートした。次に、それらを、TBS−T中ですすぎ、ビオチン化ヤギ抗ウサギIgG(Vector laboratories)を用いて、室温にて30分間インキュベートし、ABCエリートキット(Vector laboratories)を用いてアビジン−ビオチン−ペルオキシダーゼ法で処理した。免疫反応性は、チラミド−FITC(TSAキット;NEN−Perkin−Elmer)を用いて可視化した。蛍光は、レーザー走査共焦点顕微鏡LSM510(Carl Zeiss,Germany)を用いて観察した。
【0090】
[統計分析]
全ての細胞死試験、細胞生存試験、結合試験、及び定量リアルタイムPCR試験を行った(n=3)。インビトロ研究における図中の全ての値は、平均±SDである。統計分析は、スチューデントのt検定を用いて行った。インビボ試験に対する統計分析は、一元配置分散分析、続いて、FisherのPLSDを用いて行い、この場合、有意差として、p<0.05が算定された。
【産業上の利用可能性】
【0091】
本発明によって初めて見出されたEHDペプチド又はCLSPの強力な神経保護活性(神経細胞の細胞機能障害又は神経細胞死を抑制する活性)は、CLSPが、ヒューマニンよりもむしろヒューマニン受容体が介在する生存促進性シグナル(prosurvival signal)の活性化において主要な役割を果たすことを示す。
【0092】
本明細書中で引用された文献のリストを以下に示す。
[引用文献リスト]
Babini E, Bertini I, Capozzi F, Chirivino E, Luchinat C. A structural and dynamic characterization of the EF-hand protein CLSP. Structure. 2006 14:1029-38.
Bozyczko-Coyne D, McKenna B W, Connors T J, Neff N T (1993) A rapid fluorometric assay to measure neuronal survival in vitro. J Neurosci Methods 50:205-216
Chiba T, Hashimoto Y, Tajima H, Yamada M, Kato R, Niikura T, Terashita K, Schulman H, Aiso S, Kita Y, Matsuoka M, Nishimoto I (2004) Neuro- protective effect of activity-dependent neurotrophic factor against toxicity from familial amyotrophic lateral sclerosis-linked mutant SOD1 in vitro and in vivo. J Neurosci Res 78:542-552.
Chiba T, Yamada M, Sasabe J, Terashita K, Shimoda M, Matsuoka M, Aiso S. Amyloid-beta causes memory impairment by disturbing the JAK2/STAT3 axis in hippocampal neurons. Mol Psychiatry. 2009, 14;206-22
Durussel I, Mehul B, Bernard D, Schmidt R, Cox JA. Cation- and peptide-binding properties of human calmodulin-like skin protein. Biochemistry. 2002 41:5439-48.
Guo B, Zhai D, Cabezas E, Welsh K, Nouraini S, Satterthwait AC, Reed JC (2003) Humanin peptide suppresses apoptosis by interfering with Bax activation. Nature 423:456 - 461.
Hashimoto Y, Niikura T, Ito Y, Nishimoto I (2000) Multiple mechanisms underlie neurotoxicity by different types of Alzheimer’s disease mutations of amyloid precursor protein. J Biol Chem 275:34541-4551.
Hashimoto Y, Niikura T, Tajima H, Yasukawa T, Sudo H, Ito Y, Kita Y, Kawasumi M, Kouyama K, Doyu M, Sobue G, Koide T, Tsuji S, Lang J, Kurokawa K, Nishimoto I (2001a) A rescue factor abolishing neuronal cell death by a wide spectrum of familial Alzheimer’s disease genes and Ab. Proc Natl Acad Sci USA 98:6336 - 6341.
Hashimoto Y, Niikura T, Ito Y, Sudo H, Hata M, Arakawa E, Abe Y, Kita Y,
Nishimoto I (2001b) Detailed characterization of neuroprotection by a rescue factor humanin against various Alzheimer’s disease-relevant in- sults. J Neurosci 21:9235-9245.
Hashimoto Y, Tsuji O, Niikura T, Yamagishi Y, Ishizaka M, Kawasumi M, Chiba T, Kanekura K, Yamada M, Tsukamoto E, Kouyama K, Terashita K, Aiso S, Lin A, Nishimoto I (2003) Involvement of c-Jun N-terminal kinase in amyloid precursor protein-mediated neuronal cell death. J Neurochem 84:864- 877.
Hashimoto Y, Suzuki H, Aiso S, Niikura T, Nishimoto I, Matsuoka M (2005) Involvement of tyrosine kinases and STAT3 in Humanin-mediated neu- roprotection. Life Sci 77:3092-3104.
Hashimoto Y, Kurita M, Aiso S, Nishimoto I, Matsuoka M Humanin inhibits neuronal cell death by interacting with a cytokine receptor complex or complexes involving CNTF receptor alfa/WSX-1/gp130 Mol. Biol. Cell 2009, 20:2864-73.
Hwang M, Morasso MI. The novel murine Ca2+-binding protein, Scarf, is differentially expressed during epidermal differentiation. J Biol Chem. 2003 278:47827-33.
Hwang M, Kalinin A, Morasso MI. The temporal and spatial expression of the novel Ca++-binding proteins, Scarf and Scarf2, during development and epidermal differentiation. Gene Expr Patterns. 2005 5:801-8.
Hwang J, Kalinin A, Hwang M, Anderson DE, Kim MJ, Stojadinovic O, Tomic-Canic M, Lee SH, Morasso MI. Role of Scarf and its binding target proteins in epidermal calcium homeostasis.J Biol Chem. 2007 282:18645-53.
Kawasumi, M., Hashimoto, Y., Chiba, T., Kanekura, K., Yamagishi, Y., Ishizaka, M., Tajima, H., Niikura, T., and Nishimoto, I. (2002) Molecular mechanisms for neuronal cell death by Alzheimer's amyloid precursor protein relevant insults. Neurosignals 11, 236-250. Review
Kunesova G, Hlavacek J, Patocka J, Evangelou A, Zikos C, Benaki D, Paravatou-Petsotas M, Pelecanou M, Livaniou E, Slaninova J.
The multiple T-maze in vivo testing of the neuroprotective effect of humanin analogues.Peptides. 2008 29:1982-7
Krejcova G, Patocka J, Slaninova J (2004) Effect of humanin analogues on experimentally induced impairment of spatial memory in rats. J Pept Sci 10:636 - 639.
Lue Y, Swerdloff R, Liu Q, Mehta H, Hikim AS, Lee KW, Jia Y, Hwang D, Cobb LJ, Cohen P, Wang C. (2010) Opposing roles of insulin-like growth factor binding protein 3 and humanin in the regulation of testicular germ cell apoptosis. Endocrinology 151, 350-357.
Mamiya T, Ukai M (2001) [Gly(14)]-Humanin improved the learning and memory impairment induced by scopolamine in vivo. Br J Pharmacol
134:1597-1599.
Matsuoka M, Matsuura Y, Semba K, Nishimoto I. (2000)
Molecular cloning of a cyclin-like protein associated with cyclin-dependent kinase 3 (cdk 3) in vivo. Biochem Biophys Res Commun. 273:442-7
Matsuoka M, Hashimoto Y, Aiso S, Nishimoto I. (2006) Humanin and colivelin: neuronal-death-suppressing peptides for Alzheimer's disease and amyotrophic lateral sclerosis. CNS Drug Rev. 12:113-22.
Matsuoka M.(2009) Humanin; a defender against Alzheimer's disease? Recent Pat CNS Drug Discov. 2009 4:37-4
Matsuoka M, Hashimoto Y. Humanin and the receptors for humanin.
Mol Neurobiol. 2010, 41, 22-8
Mehul B, Bernard D, Simonetti L, Bernard MA, Schmidt R. Identification and cloning of a new calmodulin-like protein from human epidermis. J Biol Chem. 2000 275:12841-7.
Mehul B, Bernard D, Brouard M, Delattre C, Schmidt R.Influence of calcium on the proteolytic degradation of the calmodulin-like skin protein (calmodulin-like protein 5) in psoriatic epidermis.Exp Dermatol. 2006 15:469-77.
Miao J, Zhang W, Yin R, Liu R, Su C, Lei G, Li Z. (2008) S14G-Humanin ameliorates Abeta25-35-induced behavioral deficits by reducing neuroinflammatory responses and apoptosis in mice. Neuropeptides. 42:557-67
Moretti E, Giannerini V, Rossini L, Matsuoka M, Trabalzini L, Collodel (2010) G.Immunolocalization of humanin in human sperm and testis. Fertil Steril 94, 2888-2890.
Muzumdar RH, Huffman DM, Atzmon G, Buettner C, Cobb LJ, Fishman S, Budagov T, Cui L, Einstein FH, Poduval A, Hwang D, Barzilai N, Cohen P.
Humanin: a novel central regulator of peripheral insulin action.
PLoS One. 2009 Jul 22;4(7):e6334.
Niikura, T., Hashimoto, Y., Tajima, H., and Nishimoto, I. (2002) Death and survival of neuronal cells exposed to Alzheimer's insults. J. Neurosci. Res. 70, 380-391. review
Nishimoto I, Matsuoka M, Niikura T. (2004) Unravelling the role of Humanin. Trends Mol Med 10: 102-105.
Tjima H, Niikura T, Hashimoto Y, Ito Y, Kita Y, Terashita K, Yamazaki K, Koto A, Aiso S, Nishimoto I (2002) Evidence for in vivo production of Humanin peptide, a neuroprotective factor against Alzheimer’s Disease-related insults. Neurosci Lett 324, 227-231.
Tajima H, Kawasumi M, Chiba T, Yamada M, Yamashita K, Nawa M, Kita Y, Kouyama K, Aiso S, Matsuoka M, Niikura T, Nishimoto I (2005) A Humanin derivative, S14G-HN, prevents amyloid-b-induced memory impairment in mice. J Neurosci Res 79:714 -723.
Terashita K, Hashimoto Y, Niikura T, Tajima H, Yamagishi Y, Ishizaka M, Kawasumi M, Chiba T, Kanekura K, Yamada M, Nawa M, Kita Y, Aiso S, Nishimoto I (2003) Two serine residues distinctly regulate the rescue function of Humanin, an inhibiting factor of Alzheimer’s disease-related neurotoxicity: functional potentiation by isomerization and dimeriza-tion. J Neurochem 85:1521-1538.
Yamada M, Chiba T, Sasabe J, Nawa M, Tajima H, Niikura T, Terashita K, Aiso S, Kita Y, Matsuoka M, Nishimoto I (2005) Implanted cannula- mediated repetitive administration of A 25-35 into the mouse cerebral ventricle effectively impairs spatial working memory. Behav Brain Res 164:139-146.
Yamagishi Y,HashimotoY,NiikuraT,NishimotoI (2003) Identificationof essential amino acids in Humanin, a neuroprotective factor against Alz- heimer’s disease-relevant insults. Peptides 24:585-595.
【特許請求の範囲】
【請求項1】
式(I):
TGKNLSEAGLRKLI(S又はG)EVDSDGD(アミノ酸一文字表記)(I)
からなるアミノ酸配列を有する、神経細胞の機能障害又は細胞死を抑制する活性を有するペプチド。
【請求項2】
請求項1記載のペプチド、又は、式(I):
TGKNLSEAGLRKLI(S又はG)EVDSDGD(アミノ酸一文字表記)(I)
からなるアミノ酸配列を含み、神経細胞の機能障害又は細胞死を抑制する活性を有するポリペプチドを有効成分として含む、医薬組成物。
【請求項3】
以下のアミノ酸配列:
(1)配列番号1に示されるアミノ酸配列;
(2)配列番号1に示されるアミノ酸配列において、式(I)からなるアミノ酸配列以外の部分の一個又は数個のアミノ酸が、欠失、置換又は挿入されたアミノ酸配列;
(3)配列番号1に示されるアミノ酸配列における式(I)からなるアミノ酸配列以外の部分において、60%以上の同一性を有するアミノ酸配列;
(4)配列番号3又は配列番号4に示されるアミノ酸配列;
(5)配列番号3又は配列番号4に示されるアミノ酸配列において、一個又は数個のアミノ酸が、欠失、置換又は挿入されたアミノ酸配列;又は
(6)配列番号3又は配列番号4に示されるアミノ酸配列と60%以上の同一性を有するアミノ酸配列;
から成り、神経細胞の機能障害又は細胞死を抑制する活性を有するポリペプチドを有効成分として含む、医薬組成物。
【請求項4】
神経細胞の機能障害又は細胞死がアルツハイマー病に関連する、請求項2又は3記載の医薬組成物。
【請求項5】
記憶傷害又は神経変性を伴う疾病の予防または治療に用いられる、請求項2〜4のいずれか一項に記載の医薬組成物。
【請求項6】
請求項1記載のペプチド、又は、請求項2若しくは3に記載のポリペプチドによる神経細胞の機能障害又は細胞死を抑制する活性を検出する方法であって、(a)該ペプチド又はポリペプチドの存在下で神経細胞の機能障害又は細胞死を誘導する工程、(b)神経細胞の機能障害又は細胞死を検出する工程、を含む方法。
【請求項7】
請求項1記載のペプチド、又は、請求項2若しくは3に記載のポリペプチドによる細胞死を抑制する活性に対する化合物の効果を検出する方法であって、(a)被検化合物および該ペプチド又はポリペプチドの存在下で神経細胞の機能障害又は細胞死を誘導する工程、(b)神経細胞の機能障害又は細胞死を検出する工程、を含む方法。
【請求項8】
請求項1記載のペプチド、又は、請求項2若しくは3に記載のポリペプチドによる神経細胞の機能障害又は細胞死の抑制を調節する化合物をスクリーニングする方法であって、(a)被検試料および該ペプチド又はポリペプチドの存在下で神経細胞の機能障害又は細胞死を誘導する工程、(b)神経細胞死を検出する工程、(c)神経細胞の機能障害又は細胞死を促進または抑制する化合物を選択する工程、を含む方法。
【請求項9】
請求項1記載のペプチド、又は、請求項2若しくは3に記載のポリペプチドに結合する化合物のスクリーニング方法であって、(a)該ペプチド又はポリペプチドに被検試料を接触させる工程、(b)該ペプチド又はポリペプチドと被検試料との結合活性を検出する工程、(c)該ペプチド又はポリペプチドに結合する活性を有する化合物を選択する工程、を含む方法。
【請求項10】
請求項1記載のペプチド、又は、請求項2若しくは3に記載のポリペプチドを神経細胞に接触させる工程を含む、神経細胞の機能障害又は細胞死を抑制する方法。
【請求項11】
請求項1記載のペプチド、又は、請求項2若しくは3に記載のポリペプチドを、神経細胞の細胞機能障害若しくは神経細胞死を伴う疾患、又は、記憶傷害若しくは神経変性を伴う疾病に罹患した又はその疑いのある個体に投与する段階を含む、該疾患又は疾病を治療する方法。
【請求項12】
疾患又は疾病がアルツハイマー病である、請求項11記載の方法。
【請求項1】
式(I):
TGKNLSEAGLRKLI(S又はG)EVDSDGD(アミノ酸一文字表記)(I)
からなるアミノ酸配列を有する、神経細胞の機能障害又は細胞死を抑制する活性を有するペプチド。
【請求項2】
請求項1記載のペプチド、又は、式(I):
TGKNLSEAGLRKLI(S又はG)EVDSDGD(アミノ酸一文字表記)(I)
からなるアミノ酸配列を含み、神経細胞の機能障害又は細胞死を抑制する活性を有するポリペプチドを有効成分として含む、医薬組成物。
【請求項3】
以下のアミノ酸配列:
(1)配列番号1に示されるアミノ酸配列;
(2)配列番号1に示されるアミノ酸配列において、式(I)からなるアミノ酸配列以外の部分の一個又は数個のアミノ酸が、欠失、置換又は挿入されたアミノ酸配列;
(3)配列番号1に示されるアミノ酸配列における式(I)からなるアミノ酸配列以外の部分において、60%以上の同一性を有するアミノ酸配列;
(4)配列番号3又は配列番号4に示されるアミノ酸配列;
(5)配列番号3又は配列番号4に示されるアミノ酸配列において、一個又は数個のアミノ酸が、欠失、置換又は挿入されたアミノ酸配列;又は
(6)配列番号3又は配列番号4に示されるアミノ酸配列と60%以上の同一性を有するアミノ酸配列;
から成り、神経細胞の機能障害又は細胞死を抑制する活性を有するポリペプチドを有効成分として含む、医薬組成物。
【請求項4】
神経細胞の機能障害又は細胞死がアルツハイマー病に関連する、請求項2又は3記載の医薬組成物。
【請求項5】
記憶傷害又は神経変性を伴う疾病の予防または治療に用いられる、請求項2〜4のいずれか一項に記載の医薬組成物。
【請求項6】
請求項1記載のペプチド、又は、請求項2若しくは3に記載のポリペプチドによる神経細胞の機能障害又は細胞死を抑制する活性を検出する方法であって、(a)該ペプチド又はポリペプチドの存在下で神経細胞の機能障害又は細胞死を誘導する工程、(b)神経細胞の機能障害又は細胞死を検出する工程、を含む方法。
【請求項7】
請求項1記載のペプチド、又は、請求項2若しくは3に記載のポリペプチドによる細胞死を抑制する活性に対する化合物の効果を検出する方法であって、(a)被検化合物および該ペプチド又はポリペプチドの存在下で神経細胞の機能障害又は細胞死を誘導する工程、(b)神経細胞の機能障害又は細胞死を検出する工程、を含む方法。
【請求項8】
請求項1記載のペプチド、又は、請求項2若しくは3に記載のポリペプチドによる神経細胞の機能障害又は細胞死の抑制を調節する化合物をスクリーニングする方法であって、(a)被検試料および該ペプチド又はポリペプチドの存在下で神経細胞の機能障害又は細胞死を誘導する工程、(b)神経細胞死を検出する工程、(c)神経細胞の機能障害又は細胞死を促進または抑制する化合物を選択する工程、を含む方法。
【請求項9】
請求項1記載のペプチド、又は、請求項2若しくは3に記載のポリペプチドに結合する化合物のスクリーニング方法であって、(a)該ペプチド又はポリペプチドに被検試料を接触させる工程、(b)該ペプチド又はポリペプチドと被検試料との結合活性を検出する工程、(c)該ペプチド又はポリペプチドに結合する活性を有する化合物を選択する工程、を含む方法。
【請求項10】
請求項1記載のペプチド、又は、請求項2若しくは3に記載のポリペプチドを神経細胞に接触させる工程を含む、神経細胞の機能障害又は細胞死を抑制する方法。
【請求項11】
請求項1記載のペプチド、又は、請求項2若しくは3に記載のポリペプチドを、神経細胞の細胞機能障害若しくは神経細胞死を伴う疾患、又は、記憶傷害若しくは神経変性を伴う疾病に罹患した又はその疑いのある個体に投与する段階を含む、該疾患又は疾病を治療する方法。
【請求項12】
疾患又は疾病がアルツハイマー病である、請求項11記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10A】


【図10B】


【図10C】


【図11】


【図12A】


【図12B】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10A】


【図10B】


【図10C】


【図11】


【図12A】


【図12B】


【図13】


【図14】


【公開番号】特開2012−131711(P2012−131711A)
【公開日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願番号】特願2010−282509(P2010−282509)
【出願日】平成22年12月20日(2010.12.20)
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に係る特許出願(平成18年度〜平成21年度独立行政法人医薬基盤研究所基礎研究推進事業、産業技術力強化法第19条の適用を受けるもの)
【出願人】(899000079)学校法人慶應義塾 (742)
【出願人】(505457994)学校法人東京医科大学 (6)
【Fターム(参考)】
【公開日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願日】平成22年12月20日(2010.12.20)
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に係る特許出願(平成18年度〜平成21年度独立行政法人医薬基盤研究所基礎研究推進事業、産業技術力強化法第19条の適用を受けるもの)
【出願人】(899000079)学校法人慶應義塾 (742)
【出願人】(505457994)学校法人東京医科大学 (6)
【Fターム(参考)】
[ Back to top ]

