カーボン単層ナノチューブの成長のための触媒
本発明は、単層カーボンナノチューブを成長させるための方法と過程を提供するものである。一形態において、支持材に接触した炭素前駆ガスと金属触媒は、金属−炭素相の共晶点(液相)の近くで反応温度まで加熱される。さらに、反応温度は、金属触媒の融点よりも低い温度である。本発明によれば、長いSWNTが形成される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、化学気相成長法を用いたカーボン単層ナノチューブの生成(合成)のための方法に関する。
【背景技術】
【0002】
触媒の特徴は、カーボン単層ナノチューブの成長にとって中心的な重要性をもつ。触媒活性度とナノチューブの成長中の融点の変化の組み合わせは、ラマン測定によれば、重要な特徴としてナノ触媒−炭素の二成分相の液相線の“V”−字型作用を促進する。事実、“L”−字型は、拡散の低い活性化エネルギーを示し、高い炭素溶解性を示し、炭化物形成を除外し、そしてそれによってナノチューブの成長のために長い“ライフタイム”を保つという理想的な特徴である。1.2nmよりも小さい直径の触媒を得るための担体の選択により、特徴の重要な変更を生じる場合がある。ナノチューブの成長のために必要な触媒の特徴と対応する合成パラメーターは提示されている。
【0003】
カーボン単層ナノチューブ(SWNTs)の成長に好ましい触媒粒子の特定の特徴の解明は、成長したナノチューブの特性制御に役立ち、最終的には、それらのユニークな特性の利用を促進するであろう(非特許文献1)。SWNTsの成長への触媒構成の影響に関する多くの研究がある。そこでは、ほとんどの場合、3d金属とそれらの組み合わせが検討されていた(非特許文献2、非特許文献3)。また、触媒の調製方法、前処理、直径、結晶及び電子構造、及び、炭化物と酸化物の形成能力もナノチューブの成長に顕著な影響を与えることが既に証明されている(非特許文献3)。これらの研究は、触媒−担体カップリング(より一般的な担体Al、Zr、Mg、Siを主成分とする酸化物)の重要な役割についての報告によって広げられた。そのうえ、合成パラメーターは、成長の熱力学と動力学に重要な影響を及ぼす(非特許文献3)。それにもかかわらず、説明された複雑さからナノチューブの成長に適した触媒に共通する機能を解明するための研究はまだ進行中である。本発明者らは、強化された合成CVD法を用いて、ナノチューブの成長中における触媒活性の変化の系統的なその場(in-situ)パラメーターの研究を行った。本発明者らは、示差走査熱量測定(DSC)とラマンの分光学測定に結果を結合することによって、ナノチューブの成長に寄与する触媒と合成パラメーターとの関係の未解明の共通する特徴を明らかにすることができ、結果的に、理想的な触媒のための特徴を予測することができることを示した。
【0004】
【非特許文献1】R. H. Baughman, A. A. Zakhidov, W. A. De Heer, Science 297, 787 (2002)
【非特許文献2】K. B. K. Teo, C. Singh, M. Chhowalla, W. I. Milne, Encyclopedia of Nanoscience and Nanotechnology X, 1-22, (2003)
【非特許文献3】A-C. Dupuis, Prog. In Materials Science 50, 929-961 (2005)
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、単層カーボンナノチューブを成長させるための方法と工程を提供するものである。一形態において、担体に接触した炭素前駆ガスと金属触媒は、金属−炭素相の共晶点(液相)の近くで反応温度まで加熱される。さらに、反応温度は、金属触媒の融点よりも低い温度である。
【課題を解決するための手段】
【0006】
本発明の一態様において、単層カーボンナノチューブ(SWNT)の生成のための化学気相成長法が提供される。本方法は、触媒の共融点近くの温度で炭素前駆体ガスを担体上の触媒と接触させ、前記炭素前駆体ガスが、当該炭素前駆体ガスが反応する割合と等しい割合で接触することにより、長いSWNTが形成されるステップを含む。
本発明の他の態様において、前記炭素前駆体ガスは、メタンであり、不活性ガス及び水素をさらに含み、前記不活性ガスは、アルゴン、ヘリウム、窒素、水素、又はこれらの組み合わせである。前記触媒は、鉄、モリブデン、又はこれらの組み合わせであり、1nmから10nmの間の粒径を有する。前記担体は、粉末状酸化物であり、Al2O3、SiO3、MgO及びゼロライトからなるグループから選択される。そして、前記触媒と前記担体とは、約1:1から約1:50の比率である。また、前記炭素前駆体ガスは、触媒1mgに対して約0.2sccmから約0.8sccmの割合で接触する。さらに、前記温度は、前記共融点よりも約5℃から約150℃高い。
【発明の効果】
【0007】
本発明によれば、単層カーボンナノチューブを成長させるための方法と過程を提供することができる。本発明によれば、長いSWNTが形成される。
【発明を実施するための最良の形態】
【0008】
特に指定のない限り、明細書及び特許請求の範囲を含む本出願において使用される次の用語は以下の定義を有する。本明細書及び添付の特許請求の範囲において用いられている単数形は、文脈が特に明確に指示しなくても、複数形を含むことに留意されたい。標準的な化学用語の定義は、Carey and Sundberg (1992) "Advanced organic Chemistry 3rd. Ed" Vols. A and B, Plenum Press, New York及びCotton et al. (1999) "Advanced Inorganic Chemistry 6th Ed." Wiley, New Yorkを含む参考資料から入手可能である。
【0009】
「単層カーボンナノチューブ」又は「一次元カーボンナノチューブ」の用語は、交換可能に用いられ、基本的に炭素原子の単層からなる壁を持っている炭素原子の薄いシートで形成され、黒鉛型結合を有する六方晶系構造に配置された円筒形状のものを指す。
【0010】
本明細書で用いられる「多層カーボンナノチューブ」の用語は、1つよりも多い同心のチューブからなるナノチューブを指す。
【0011】
「金属有機」又は「有機金属」の用語は、交換可能に用いられ、有機化合物と金属、遷移金属又は金属ハロゲン化物の配位化合物を指す。
【0012】
「共融点(共晶点ともいう)」の用語は、合金の凝固温度のうち可能な最も低い温度を指し、異なる比率で同一成分からなる他の合金の凝固温度よりも低くすることができる。
【0013】
前記触媒組織は、化学気相成長プロセスで一般的に使用され、当業者にとって知られた任意の触媒組織とすることができる。カーボンナノチューブの成長プロセスにおける前記触媒の機能は、炭素前駆体を分解し、規則的な炭素の堆積を促進することである。本発明の方法、プロセス、及び装置は、金属触媒として金属ナノ粒子を用いることが好ましい。前記触媒として選択された金属又は金属の組み合わせは、所望の粒径及び直径分布を得るために処理することができる。そして、前記金属ナノ粒子は、後記する金属成長触媒を用いたカーボンナノチューブの合成中に、担体としての使用に好適な材料上に担持されることにより分離することができる。当該技術分野で周知のように、前記担体は、触媒粒子を互いに分離させることにより触媒組織中の比表面積を大きくするために使用することができる。このような担体材料としては、結晶シリコン、ポリシリコン、シリコン窒化物、タングステン、マグネシウム、アルミニウム、及びこれらの酸化物の粉末が挙げられ、好ましくは、添加元素により任意に改質された酸化アルミニウム、酸化シリコン、酸化マグネシウム、若しくは二酸化チタン、又はこれらを組み合わせたものが担体粉末として用いられる。シリカ、アルミナ及び当該技術分野においてよく知られているその他の物質が担体として用いられてもよく、アルミナが前記した担体として用いられることが好ましい。
【0014】
前記金属触媒は、例えばV若しくはNbなどのV族金属及びこれらの混合物、Cr、W、若しくはMoが挙げられるVI族金属及びこれらの混合物、例えば、Mn、若しくはReなどが挙げられるVII族金属、例えばCo、Ni、Ru、Rh、Pd、Os、Ir、Ptなどが挙げられるVIII族金属及びこれらの混合物、又は、例えば、Ce、Eu、Er、若しくはYbなどが挙げられるランタノイド及びこれらの混合物、又は、例えば、Cu、Ag、Au、Zn、Cd、Sc、Y、若しくはLaなどが挙げられる遷移金属及びこれらの混合物から選択可能である。例えば、二元金属触媒のような本発明により採用可能な触媒の混合物の具体例としては、Co−Cr、Co−W、Co−Mo、Ni−Cr、Ni−W、Ni−Mo、Ru−Cr、Ru−W、Ru−Mo、Rh−Cr、Rh−W、Rh−Mo、Pd−Cr、Pd−W、Pd−Mo、Ir−Cr、Pt−Cr、Pt−W、及びPt−Moが挙げられる。好ましくは、前記金属触媒は鉄、コバルト、ニッケル、モリブデン、若しくはこれらの混合物であり、例えば、Fe−Mo、Co−Mo及びNi−Fe−Moなどである。
【0015】
前記金属、前記二元金属、又は前記金属の組み合わせは、規定された粒径及び直径分布を有する金属ナノ粒子を生成するのに用いられる。前記金属ナノ粒子は、Harutyunyan et al., NanoLetters 2, 525 (2002)に記載された文献の手順を用いて生成可能である。あるいはまた、前記触媒ナノ粒子は、同時継続であり共同所有である米国特許出願第10/304,316号明細書に記載されたように、不活性塩に付加された対応する金属塩の熱分解と、金属ナノ粒子を提供するために調整された溶剤の温度と、によって生成可能であり、又は、当該技術分野で知られている他の任意の方法によっても生成可能である。前記金属ナノ粒子の粒径と直径は、不活性溶剤中の適切な濃度の金属を用いることにより、及び熱分解温度での反応を持続させる時間の長さを制御することにより、制御可能である。約0.01nmから約20nm、より好ましくは約0.1nmから約3nm、最も好ましくは約0.3nmから2nmの粒径を有する前記金属ナノ粒子を生成可能である。すなわち、前記金属ナノ粒子は、0.1、1、2、3、4、5、6、7、8、9、又は10nm、及び最大で約20nmまでの粒径を有することができる。他の態様において、前記金属ナノ粒子は、粒径の幅を有することができる。例えば、前記金属ナノ粒子は、大きさ約3nmから約7nm、大きさ約5nmから約10nm、又は大きさ約8nmから約16nmの幅の粒径を有することができる。前記金属ナノ粒子は、任意に約0.5nmから約20nm、好ましくは約1nmから約15nm、より好ましくは約1nmから5nmの直径分布を有することができる。すなわち、前記金属ナノ粒子は、約1、2、3、4、5、6、7、8、9、10、11、12、13、14、又は15nmの直径分布を有することができる。
【0016】
前記金属塩は、任意の金属の塩であってもよく、金属塩の融点が不活性溶剤の沸点よりも低くなるように選択可能である。従って、前記金属塩は、金属イオン及び対イオンを含み、この対イオンは、硝酸塩、窒化物、過塩素酸塩、硫酸塩、硫化物、酢酸塩、ハロゲン化物、例えばメトキシドやエトキシドなどの酸化物、アセチルアセトナートなどとすることができる。例えば、前記金属塩は、酢酸鉄(FeAc2)、酢酸ニッケル(NiAc2)、酢酸パラジウム(PdAc2)、酢酸モリブデン(MoAc3)など、及びこれらの組み合わせとすることが可能である。前記金属塩の融点は、好ましくは不活性溶剤の沸点よりも約5℃から50℃低く、より好ましくは不活性溶剤の沸点から約5℃から20℃低い。
【0017】
前記金属塩は、溶液、懸濁液、又は分散液を提供するために不活性溶剤に溶解可能である。前記溶剤は、好ましくは有機溶剤であり、選択された金属塩が比較的溶けやすく安定化することができ、当該溶剤が実験条件化で容易に蒸発可能な十分高い蒸気圧を有するものとすることができる。前記溶剤は、グリコールエーテル、2−(2−ブトキシエトキシ)エタノール、H(OCH2CH2)2O(CH2)3CH3などのエーテルとすることができ、以下、ジエチレングリコールモノ−n−ブチルエーテルなどの一般名を用いて呼ぶこととする。
【0018】
前記金属塩と前記不活性溶剤の相対量が、製造されるナノ粒子の大きさを制御する要素となっている。広い範囲のモル比(不活性溶剤1モルに対する金属塩の総モル量である)が前記金属ナノ粒子を形成するために利用可能である。不活性溶剤に対する金属塩の一般的なモル比は、低くて約0.0222(1:45)、若しくは高くて約2.0(2:1)、又はこれらの間の任意の比率である。従って、例えば、約5.75×10-5から約1.73×10-3モル(10−300mg)のFeAc2が、約3×10-4から約3×10-3モル(50−500ml)のジエチレングリコールモノ−n−ブチルエーテルに溶解可能である。
【0019】
他の態様において、二以上の金属塩が、二以上の金属からなる金属ナノ粒子を形成させるために反応槽に添加可能である。この場合これらの金属塩の前記対イオンは同一であっても又は異なってもよい。それぞれの金属塩の相対量は、結果として得られる金属ナノ粒子の組成を制御する要素として利用可能である。前記二元金属に関して、第2の金属塩に対する第1の金属塩のモル比は、約1:10から約10:1、好ましくは約2:1から約1:2、より好ましくは約1.5:1から約1:1.5、又はこれらの間の任意の比率とすることができる。従って、例えば、酢酸ニッケルに対する酢酸鉄のモル比は、1:2、1:1.5、1.5:1、又は1:1とすることができる。当業者であれば金属塩の他の組み合わせ及び第2の金属塩に対する第1の金属塩のモル比が、様々な組成の金属ナノ粒子を合成するために利用可能であることを認識するであろう。
【0020】
前記不活性溶剤及び前記金属塩の反応溶液は、混合して均一な溶液、懸濁液、又は分散液にすることができる。前記反応溶液は、混合器、超音波発生器などの標準的な実験用撹拌器を任意に加熱して使用することによって混合可能である。このようにして得られた均一な混合物は、前記金属ナノ粒子を形成するために熱分解を受けることができる。
【0021】
前記熱分解反応は、反応槽の前記内容物を、反応槽内の少なくとも1つの前記金属塩の融点以上の温度に加熱することによって開始する。例えば、加熱マントル、加熱板、又はブンゼンバーナーなどの標準的な実験用加熱器を含む任意の好適な熱源を使用することができ、熱は還流可能である。前記熱分解の時間の長さは、所望する大きさの金属ナノ粒子が得られるように選択可能である。一般的な反応時間は、約10分から約120分、又はこれらの間の任意の整数分とすることができる。前記熱分解反応は、前記金属塩の融点よりも低い温度に反応槽の内容物の温度を下げることにより、所望の時間で終了する。
【0022】
製造された金属ナノ粒子の大きさと分布は、任意の好適な手法によって確認することができる。確認の一手法としては、透過型電子顕微鏡法(TEM)がある。好適なモデルとしては、FEI Company of Hillsboro, ORから市販されているPhillips CM300 FEG TEMが挙げられる。前記金属ナノ粒子のTEM顕微鏡写真を撮るために、1滴以上の金属ナノ粒子/不活性溶剤溶液が、TEM顕微鏡写真を得るために好適な炭素膜格子又はその他の格子に配置される。続いて、TEM装置を用いて、製造されたナノ粒子の大きさの分布を決定するために使用可能なナノ粒子の顕微鏡写真を撮影する。
【0023】
例えば、以上に詳細に説明した熱分解によって形成されたそれらの金属ナノ粒子は、固体の担体上に担持可能である。前記した固体の担体は、シリカ、アルミナ、MCM−41、MgO、ZrO2、アルミニウム−安定化酸化マグネシウム、ゼオライト、又は当該技術分野で知られている他の酸化物担体、及びこれらの組み合わせとすることができる。例えば、Al2O3−SiO2ハイブリッド担体が使用可能である。好ましくは、前記担体は、酸化アルミニウム(Al2O3)又はシリカ(SiO2)である。固体の担体として用いられる前記酸化物は粉末状であり、それによって小さな粒径と大きな比表面積を提供可能である。前記粉末状酸化物は、好ましくは約0.01μmから約100μm、より好ましくは約0.1μmから約10μm、さらに好ましくは約0.5μmから約5μm、そして最も好ましくは約1μmから約2μmの間の粒径を有する。前記粉末状酸化物は、約50−約1000m2/gの比表面積、より好ましくは約200−約800m2/gの比表面積を有することが可能である。前記粉末状酸化物は、新たに生成可能であり、市販もされている。
【0024】
一形態において、前記金属ナノ粒子は、二次的な分散及び抽出を介して固体の担体に担持される。補助的な分散は、熱分解反応後に、例えば、酸化アルミニウム(Al2O3)又はシリカ(SiO2)などの粉末状酸化物の粒子を反応槽内に導入することによって開始する。1−2μmの粒径及び300−500m2/gの比表面積を有する好適なAl2O3粉末は、Alfa Aesar of Ward Hill, MA、又はDegussa, NJから市販されている。粉末状酸化物は、前記粉末状酸化物と前記金属ナノ粒子を形成するのに用いられる金属の初期量との間の所望の重量比を実現するために追加可能である。一般的には、重量比は約10:1と約15:1の間とすることができる。例えば、100mgの酢酸鉄が出発物質として用いられる場合、約320から480mgの粉末状酸化物が前記した溶液中に導入可能である。
【0025】
前記粉末状酸化物と前記金属ナノ粒子/不活性溶剤混合物の混合物は、混合により均一な溶液、懸濁液、又は分散液を形成することができる。前記した均一な溶液、懸濁液、又は分散液は、超音波振動器、標準的な実験用撹拌器、機械的混合器、又は他の好適な手法を任意に加熱して使用することによって形成可能である。例えば、前記金属ナノ粒子、前記粉末状酸化物、及び前記不活性溶剤の混合物は、はじめにおおよそ80℃で2時間超音波で分解し、その後、均一な溶液を提供するために80℃で30分間実験用撹拌器で混合可能である。
【0026】
この二次的な分散の後、所望の金属ナノ粒子及び粉末状酸化物は前記した不活性溶剤から抽出可能である。前記した抽出は、ろ過、遠心分離、減圧下での溶剤の除去、大気圧下での溶剤の除去などにより行うことができる。前記不活性溶剤を蒸発させた後、前記粉末状酸化物及び前記金属ナノ粒子は、膜又は残渣として反応槽の壁に残る。前記粉末状酸化物がAl2O3である場合には、当該膜は一般的に黒色を呈するであろう。前記金属ナノ粒子及び前記粉末状酸化物の膜は、前記反応槽から取り除いて細かい粉末状を生成するために粉砕することができ、それによって混合物の得られる比表面積を増大させることができる。前記混合物は、乳鉢及び乳棒を用いるか、市販されている機械的グラインダーによるか、当業者にとって公知である、混合物の比表面積を増大させる他の手法によって粉砕することができる。
【0027】
どんな特定の理論によって縛られることなく、前記粉末状酸化物は抽出プロセス中に2つの機能を果たすと考えられている。前記粉末状酸化物は多孔性であり、大きい比表面積を有する。そのために、前記金属ナノ粒子は、二次的な分散中に前記粉末状酸化物の細孔内に定着する。前記粉末状酸化物の細孔内への定着は、前記金属ナノ粒子を物理的に互いに分離し、その結果抽出中の金属ナノ粒子の凝集を防止する。この効果は、用いられる粉末状酸化物の量によって補完される。前記したとおり、粉末状酸化物に対する金属ナノ粒子の重量比は、例えば、1:10から1:15の間などとすることができ、例えば、1:11、1:12、2:25、3:37、1:13、1:14などとすることができる。不活性溶剤が除去されるにつれて、比較的多くの量の粉末状酸化物は実質的にさらに金属ナノ粒子を分離するか又は「希釈する」機能を果たす。このように、本プロセスは、規定された大きさの金属ナノ粒子を提供する。
【0028】
当業者にとって自明であるように、このようにして生成された前記触媒は、後で使用するために保存可能である。他の態様において、前記金属ナノ粒子は、予め生成され、前記不活性溶剤から分離され、精製されており、その後、同じ又は異なる不活性溶剤内の好適な量の粉末状酸化物を加えることが可能である。前記金属ナノ粒子及び粉末状酸化物は、前記したように、均一に分散され、前記不活性溶剤から抽出され、そして、実質的な比表面積を増大させるために処理することが可能である。前記金属ナノ粒子及び前記粉末状酸化物の混合物を生成するための他の方法があることは、当業者にとって自明である。
【0029】
このように形成された前記金属ナノ粒子は、化学気相成長(CVD)プロセスによるカーボンナノチューブ、ナノファイバー及び他の一次元カーボンナノ構造体の合成のための成長触媒として利用可能である。
【0030】
前記カーボンナノチューブは、例えば、炭素含有ガスなどの炭素前駆体を用いることにより合成可能である。一般的に、最大で800℃から1000℃までの温度で熱分解しない任意の炭素含有ガスが使用可能である。好適な炭素含有ガスの例としては、一酸化炭素と、例えば、メタン、エタン、プロパン、ブタン、ペンタン、ヘキサン、エチレン、アセチレン及びプロピレンなどの飽和脂肪族炭化水素及び不飽和脂肪族炭化水素と、例えば、アセトン及びメタノールなどの含酸素炭化水素と、例えば、ベンゼン、トルエン、及びナフタレンなどの芳香族炭化水素と、及び、例えば、一酸化炭素及びメタンといった前記物質の混合物と、が挙げられる。一般的に、CO及びメタンは単層カーボンナノチューブの形成のための供給ガスとして好ましいのに対して、アセチレンの利用は複層カーボンナノチューブの形成を促進する。前記炭素含有ガスは、例えば、水素、ヘリウム、アルゴン、ネオン、クリプトン及びキセノン又はこれらの混合物などの希釈ガスと任意に混合されてもよい。
【0031】
本発明の方法とプロセスによれば、直径の狭い分布となるSWNTsを合成することができる。カーボンナノチューブの直径の狭い分布は、反応温度として最も融点の低い融点を選択することによって合成中に、優先的に小さい直径の触媒粒子を活性化することによって得られる。
【0032】
本発明の一形態において、粉末状酸化物に担持された前記金属ナノ粒子は、Harutyunyan et al., Nano Letters 2, 525 (2002)に記載された文献の方法によれば、前記反応温度で炭素源との接触が可能である。あるいはまた、前記粉末状酸化物に担持された前記金属ナノ粒子はエアロゾル化が可能であり、前記反応温度を維持した反応器内に導入可能である。これと同時に、前記炭素前駆体ガスを反応槽内に導入する。反応器の中での反応物質の流量は、反応槽の壁に炭素製品の堆積が減じるように制御可能である。このように製造された前記カーボンナノチューブは、収集され、分離可能である。
【0033】
前記粉末状酸化物に担持された前記金属ナノ粒子は、公知の任意の方法によってエアロゾル化可能である。一つの方法として、前記した担持された金属ナノ粒子は、例えば、ヘリウム、ネオン、アルゴン、クリプトン、キセノン、又はラドンなどの不活性ガスを使用することでエアロゾル化される。好ましくは、アルゴンが使用される。一般的に、アルゴン、又は他のどのガスも粒子インジェクターを通して反応器の中に強制的に導入される。前記粒子インジェクターは、前記担持された金属ナノ粒子を含むことができ、前記担持された金属ナノ粒子を撹拌する手段を有するものであればどんな容器でもよい。従って、粉末状の多孔性の酸化物の担体に堆積する前記触媒は、機械的な撹拌器を取り付けたビーカーに入れることができる。前記担持された金属ナノ粒子は、例えば、アルゴンなどの輸送ガス中に触媒を取り込ませることを促進させるために撹拌され、又は混合されることができる。
【0034】
触媒活性を評価するために、炭素SWNTsの成長中に炭化水素の触媒分解の結果として表れる水素濃度の変化をCVD装置のガス流の排出口に取り付けられた質量分析計(Thermo Star GSD 300T, with SEM Detector)を用いて測定した。このように、触媒の電子構造に影響を与え、同様に炭化水素分解効率に影響を与えるとともに、最終的にナノチューブの成長速度に影響を与える、触媒の特徴のいかなる変化も水素濃度の監視によって検出された。同じように、合成パラメーターの影響も明らかにされた。
【0035】
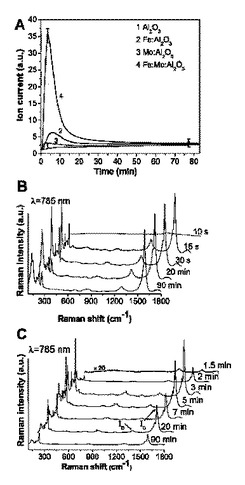
文献(A. R. Harutyunyan, B. K. Pradhan, U. J. Kim, G. Chen, P. C. Eklund, Nano Letters, 2, 525 (2002))に記載のとおり、前記炭素SWNTsは、90分間820℃でFe触媒粒子(モル比Fe:Al2O3=1:15)上にメタン(60cm3/min、Praxair、99,999%)で希釈されたアルゴン(200cm3/min)の混合ガスを流すことによって成長させた。ナノチューブの成長は、透過型電子顕微鏡法及びラマン測定によって別々に確認した。t〜7±1min(図1(a))までH2濃度が急激に増大した後、CH4(図1(a))を触媒分解していない濃度と一致する一定値にゆっくり復帰した。一方、3分間、5分間、7分間、20分間及び90分間の異なる合成持続時間の間、同様の実験条件下で炭素SWNTsの合成に用いられた各触媒サンプルをDSC測定した結果、炭素原子の触媒中への拡散により引き起こされた触媒の固体−液体(t≦7±2分の時)と液体−固体(t≦7±2分の時)の相転移と、Fe−C相の形成がおきたことがわかる(図1(b))(H. Kanzow, A. Ding, Phys. Rev. B 60, 11180 (1999)、A. R Harutyunyan, E. Mora, T. Tokune Applied Phys. Lett. 87, 051919 (2005))。図1(a)と図1(b)の結果を比較することにより、触媒活性度の増大が触媒の液化プロセスと合致していることがわかる。一方、液体−固体相転移により、触媒が非活性化されることがわかる。ラマン分光法(λ=532nm及び780nm)測定によれば、t<7から10分の試験時間に、成長したSWNTのG−バンドとD−バンド(IG/ID)の強度比の急激な増大を示している。この比率は炭素堆積物における黒鉛結晶構造オーダーの尺度である(H. Cui, G. Eres, J. Y. Howe, A. Puretzky, M. Varela, D. B. Geohegan, D. H. Lowndes, Chem. Phys. Lett. 374, 222 (2003)。同じt<7から10分の試験時間では、触媒は液相であり、高い活性度を有する(図1(c))。そして、全炭素の収量の約70wt%(Fe/アルミナ触媒に比例したwt%炭素)も得ることができた。観察された触媒の特徴の変化とナノチューブの成長の間の関係を立証するために、触媒が液化して高い活性度を有している時と、触媒が固化し始めて活性を失う時の間に12CH4ガスとともに、13C同位元素(13CH4、99.99%、Cambridge Isotope Lab. Inc.)を含むメタンガスの連続導入を用いている。一連のサンプルは、最初の3分間、最初の7分間(触媒はまだ液化している)及び最初の13分間(触媒は固化している)のメタンガス12CH4とともにそれぞれ続いて導入される17分間、続いて導入される13分間及び続いて導入される7分間の13CH4ガスを使用することにより生成した(図1(a)の差し込み図:A1、A2、A3)。重要なことは、13C同位元素を含むメタンガスを用いて得られた炭素SWNTsのラマンスペクトルは、12C同位元素のスペクトルと同じということである。唯一の主な違いは、より重い炭素原子が結果として小さいフォノンエネルギーを生じるので、ラマンシフト周波数が√(12/13)倍小さくなることである。最初の3分間の12CH4とともに続いて導入される17分間の13CH4を使用して合成されたサンプルのためにラマンスペクトルは、13C原子を含むSWNTsに対応する重要な指標を含んでおり、最初の7分間の成長持続時間のための12CH4とその後13分間の13CH4を供給するが、この指標は減少する(図2(a))。最終的に12CH4の13分間の反応持続時間と7分間の13CH4のサンプルに関するスペクトルは、12C同位元素だけのナノチューブのスペクトルと完全に同一である。触媒活性とDSC測定とこれらの結果を比較することにより、液化した触媒が炭素SWNTsの成長のために好ましいと結論される(図1(a)、(b)、(c))。さらに、成長終了の理由のうちの1つは、安定した炭化物相の形成を通しての触媒の固化である。
【0036】
Fe触媒へのMoの添加が、SWNTs製造のためにより効率的であることが知られている(A-C. Dupuis, Prog. In Materials Science 50, 929-961 (2005);Moisala, A. G. Nasibulin, E. I. Kauppinen, Journ. of Condensed Matter 15, S3011 (2003))。前記した実験は、同様の合成条件下でFe:Mo:Al2O3(一般的なモル比1:0.21:15)触媒を用いて実施された。観察された第1の顕著な特徴は、Fe:Mo:Al2O3触媒の活性度は、すべての合成持続時間の間Fe:Al2O3(図3(a))に対して著しく高く、また、合成の早い段階で炭素SWNTが生じていることが検出された。第2に、Fe:Mo:Al2O3(一般的なモル比1:0.21:15)の変化の挙動は、Fe:Al2O3触媒(1:15)とMo:Al2O3触媒(モル比0.21:15)の数学的な合計から質的及び量的に異なるのは注目に値する。この事実は、Fe−Mo合金の形成で、MoとFeの間の金属間相互作用に起因する。さらに、触媒サンプルのDSC測定から、触媒が最大90分(図1(b))のナノチューブの成長持続時間の間もまだ液体の状態であることがわかり、ナノチューブの製造が可能であることを示している。確かに、Fe触媒と対照的に、Fe/Mo触媒と13分間の12CH4とともに続いて導入される7分間の13CH4を使用して得られたナノチューブのラマンスペクトルは、13C原子を明確に検出している(図2(b))。しかしながら、触媒は、t>30分(図3(a))であるときは活性を示さず、t≧20分の後、12CH4に続いて13CH4が反応槽に導入されたたが、ナノチューブのラマンスペクトル中に13C原子の指標は検出されなかった。それ故、触媒が90分まで液化されていることがわかったが、t≧20分となったとき、触媒はナノチューブの成長を結果的に生じない。この事実は、触媒の表面を覆い、結局はそれを非活性化するナノチューブの成長とともに不規則なsp2炭素(M. S. Dresselhaus, G. Dresselhaus, M. Pimenta, P. C. Eklund, Analytical Applications of Raman Spectroscopy; Pelletier, M., Ed.; 1999, 367)の様々な形態の構造に起因すると考えられる。従って、Moの添加は、炭化物形成のために固化するのを防ぐのに重要であり、結果として、ナノチューブの成長に適した触媒のライフタイムをほぼ2倍に引き延ばす。
【0037】
触媒の特徴がナノチューブの成長に適しているとしても、適した合成条件を知ることは重要である。触媒の活性は合成中に評価された。与えられた他のパラメーターとして合成温度の変化は、純Feの場合には温度>720℃を必要とするのに対し、〜680℃までの温度で触媒Fe/Moはナノチューブの成長を開始させることができる。ナノチューブの成長が、液化を生じさせた炭素を必要とすることを考慮すると、最小合成温度はそれ故に共融点の温度によって制限される。理論に縛られないでいえば、これはまた、Moの添加が、三元状態図に従った大部分のFe−Mo−Cの共融点の温度を低下させるという事実と一致している。他方では、使用済みの特定の炭素源の熱分解温度は、最大のものから合成温度を制限する。それは、T合成(Tsynthesis)が>830℃の場合には、熱分解によって形成される炭素原子の役割が重要であり、また、急速に触媒を劣化させ、それぞれ触媒の表面とチューブの壁の表面を覆うことによりチューブの品質に影響を及ぼすことは明らかである。最終的に、T合成(Tsynthesis)>T融解(Tmelt)(触媒)とすれば、DSC測定によると、Feとアルミナの担体の間の金属間相互作用が結果として生じ、触媒がさらに非活性化される。
【0038】
従って、図1(b)から理解できるように、実際に、担持されたナノ粒子Fe−C二成分相に対する液相線は、炭素濃度に依存した「V−字型」(単調ではない)を有する。ナノチューブの成長のために使用される全ての一般的な触媒の対応する大部分の金属−炭素二成分相状態図の液相線は、「V−字型」となっている。このことは適切な温度で炭素の拡散によって触媒の液化されることを意味しているといえる。しかしながら、液相線の挙動が、ナノ触媒と担体物質との界面相互作用エネルギーに依存するということは重要である。E>0.1eVの時はさらに重要となる。さらに、この相互作用により、より小さい直径=1nmのために融点/共融点を増加するという重要な結果を生じさせる。
式

ここでTdecompは、炭化水素の熱分解温度であり、SWNTsの成長に適した触媒の特徴と合成パラメーターの間の関係について説明されている。
【0039】
以上、本発明について、特に好ましい実施形態及び様々な代替案としての実施形態を参照して説明したが、本発明の精神及び範囲を逸脱しない範囲で、形状及び細部において様々な変更が可能であることが、当業者にとって理解されるであろう。本明細書内で言及された全ての発行された特許及び刊行物が、参照により本明細書に組み込まれる。
【図面の簡単な説明】
【0040】
【図1】(a)カーボンSWNTsの成長中における水素濃度の変化を示す図である。差し込み図(A1)は、12Cと13C同位元素をそれぞれ(A1)最初の3分間とその後の17分間;(A2)最初の7分間とその後の13分間;そして(A3)最初の13分間とその後の7分間に連続導入した。(b)DSC法で測定したカーボンナノチューブの成長中におけるFe触媒の融点の変化を示す図である。(c)カーボンSWNTsの成長中におけるラマンIG/ID強度比と炭素取り込みの変化を示す図である。
【図2】12Cと13Cを含む炭素の連続導入によって合成されたカーボンSWNTsのラマンスペクトルによるラディアルブリージングモード(radial breathing mode)とタンジェンシャルモード(tangential mode)を示す図である。
【図3】(a)Al2O3;Fe:Al2O3(1:15モル比);Mo:Al2O3(0.21:15モル比);及びFe:Mo:Al2O3(1:0.21:15モル比)単体による820℃における水素濃度の変化を示す図である。(b)Fe:Mo:Al2O3(1:0.21:15)触媒の担体上のカーボンSWNTsの成長についてのラマンスペクトルの時間依存性を示す図である。(c)Fe:Al2O3(1:15)触媒の担体上のカーボンSWNTsの成長についてのラマンスペクトルの時間依存性を示す図である。
【技術分野】
【0001】
本発明は、化学気相成長法を用いたカーボン単層ナノチューブの生成(合成)のための方法に関する。
【背景技術】
【0002】
触媒の特徴は、カーボン単層ナノチューブの成長にとって中心的な重要性をもつ。触媒活性度とナノチューブの成長中の融点の変化の組み合わせは、ラマン測定によれば、重要な特徴としてナノ触媒−炭素の二成分相の液相線の“V”−字型作用を促進する。事実、“L”−字型は、拡散の低い活性化エネルギーを示し、高い炭素溶解性を示し、炭化物形成を除外し、そしてそれによってナノチューブの成長のために長い“ライフタイム”を保つという理想的な特徴である。1.2nmよりも小さい直径の触媒を得るための担体の選択により、特徴の重要な変更を生じる場合がある。ナノチューブの成長のために必要な触媒の特徴と対応する合成パラメーターは提示されている。
【0003】
カーボン単層ナノチューブ(SWNTs)の成長に好ましい触媒粒子の特定の特徴の解明は、成長したナノチューブの特性制御に役立ち、最終的には、それらのユニークな特性の利用を促進するであろう(非特許文献1)。SWNTsの成長への触媒構成の影響に関する多くの研究がある。そこでは、ほとんどの場合、3d金属とそれらの組み合わせが検討されていた(非特許文献2、非特許文献3)。また、触媒の調製方法、前処理、直径、結晶及び電子構造、及び、炭化物と酸化物の形成能力もナノチューブの成長に顕著な影響を与えることが既に証明されている(非特許文献3)。これらの研究は、触媒−担体カップリング(より一般的な担体Al、Zr、Mg、Siを主成分とする酸化物)の重要な役割についての報告によって広げられた。そのうえ、合成パラメーターは、成長の熱力学と動力学に重要な影響を及ぼす(非特許文献3)。それにもかかわらず、説明された複雑さからナノチューブの成長に適した触媒に共通する機能を解明するための研究はまだ進行中である。本発明者らは、強化された合成CVD法を用いて、ナノチューブの成長中における触媒活性の変化の系統的なその場(in-situ)パラメーターの研究を行った。本発明者らは、示差走査熱量測定(DSC)とラマンの分光学測定に結果を結合することによって、ナノチューブの成長に寄与する触媒と合成パラメーターとの関係の未解明の共通する特徴を明らかにすることができ、結果的に、理想的な触媒のための特徴を予測することができることを示した。
【0004】
【非特許文献1】R. H. Baughman, A. A. Zakhidov, W. A. De Heer, Science 297, 787 (2002)
【非特許文献2】K. B. K. Teo, C. Singh, M. Chhowalla, W. I. Milne, Encyclopedia of Nanoscience and Nanotechnology X, 1-22, (2003)
【非特許文献3】A-C. Dupuis, Prog. In Materials Science 50, 929-961 (2005)
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、単層カーボンナノチューブを成長させるための方法と工程を提供するものである。一形態において、担体に接触した炭素前駆ガスと金属触媒は、金属−炭素相の共晶点(液相)の近くで反応温度まで加熱される。さらに、反応温度は、金属触媒の融点よりも低い温度である。
【課題を解決するための手段】
【0006】
本発明の一態様において、単層カーボンナノチューブ(SWNT)の生成のための化学気相成長法が提供される。本方法は、触媒の共融点近くの温度で炭素前駆体ガスを担体上の触媒と接触させ、前記炭素前駆体ガスが、当該炭素前駆体ガスが反応する割合と等しい割合で接触することにより、長いSWNTが形成されるステップを含む。
本発明の他の態様において、前記炭素前駆体ガスは、メタンであり、不活性ガス及び水素をさらに含み、前記不活性ガスは、アルゴン、ヘリウム、窒素、水素、又はこれらの組み合わせである。前記触媒は、鉄、モリブデン、又はこれらの組み合わせであり、1nmから10nmの間の粒径を有する。前記担体は、粉末状酸化物であり、Al2O3、SiO3、MgO及びゼロライトからなるグループから選択される。そして、前記触媒と前記担体とは、約1:1から約1:50の比率である。また、前記炭素前駆体ガスは、触媒1mgに対して約0.2sccmから約0.8sccmの割合で接触する。さらに、前記温度は、前記共融点よりも約5℃から約150℃高い。
【発明の効果】
【0007】
本発明によれば、単層カーボンナノチューブを成長させるための方法と過程を提供することができる。本発明によれば、長いSWNTが形成される。
【発明を実施するための最良の形態】
【0008】
特に指定のない限り、明細書及び特許請求の範囲を含む本出願において使用される次の用語は以下の定義を有する。本明細書及び添付の特許請求の範囲において用いられている単数形は、文脈が特に明確に指示しなくても、複数形を含むことに留意されたい。標準的な化学用語の定義は、Carey and Sundberg (1992) "Advanced organic Chemistry 3rd. Ed" Vols. A and B, Plenum Press, New York及びCotton et al. (1999) "Advanced Inorganic Chemistry 6th Ed." Wiley, New Yorkを含む参考資料から入手可能である。
【0009】
「単層カーボンナノチューブ」又は「一次元カーボンナノチューブ」の用語は、交換可能に用いられ、基本的に炭素原子の単層からなる壁を持っている炭素原子の薄いシートで形成され、黒鉛型結合を有する六方晶系構造に配置された円筒形状のものを指す。
【0010】
本明細書で用いられる「多層カーボンナノチューブ」の用語は、1つよりも多い同心のチューブからなるナノチューブを指す。
【0011】
「金属有機」又は「有機金属」の用語は、交換可能に用いられ、有機化合物と金属、遷移金属又は金属ハロゲン化物の配位化合物を指す。
【0012】
「共融点(共晶点ともいう)」の用語は、合金の凝固温度のうち可能な最も低い温度を指し、異なる比率で同一成分からなる他の合金の凝固温度よりも低くすることができる。
【0013】
前記触媒組織は、化学気相成長プロセスで一般的に使用され、当業者にとって知られた任意の触媒組織とすることができる。カーボンナノチューブの成長プロセスにおける前記触媒の機能は、炭素前駆体を分解し、規則的な炭素の堆積を促進することである。本発明の方法、プロセス、及び装置は、金属触媒として金属ナノ粒子を用いることが好ましい。前記触媒として選択された金属又は金属の組み合わせは、所望の粒径及び直径分布を得るために処理することができる。そして、前記金属ナノ粒子は、後記する金属成長触媒を用いたカーボンナノチューブの合成中に、担体としての使用に好適な材料上に担持されることにより分離することができる。当該技術分野で周知のように、前記担体は、触媒粒子を互いに分離させることにより触媒組織中の比表面積を大きくするために使用することができる。このような担体材料としては、結晶シリコン、ポリシリコン、シリコン窒化物、タングステン、マグネシウム、アルミニウム、及びこれらの酸化物の粉末が挙げられ、好ましくは、添加元素により任意に改質された酸化アルミニウム、酸化シリコン、酸化マグネシウム、若しくは二酸化チタン、又はこれらを組み合わせたものが担体粉末として用いられる。シリカ、アルミナ及び当該技術分野においてよく知られているその他の物質が担体として用いられてもよく、アルミナが前記した担体として用いられることが好ましい。
【0014】
前記金属触媒は、例えばV若しくはNbなどのV族金属及びこれらの混合物、Cr、W、若しくはMoが挙げられるVI族金属及びこれらの混合物、例えば、Mn、若しくはReなどが挙げられるVII族金属、例えばCo、Ni、Ru、Rh、Pd、Os、Ir、Ptなどが挙げられるVIII族金属及びこれらの混合物、又は、例えば、Ce、Eu、Er、若しくはYbなどが挙げられるランタノイド及びこれらの混合物、又は、例えば、Cu、Ag、Au、Zn、Cd、Sc、Y、若しくはLaなどが挙げられる遷移金属及びこれらの混合物から選択可能である。例えば、二元金属触媒のような本発明により採用可能な触媒の混合物の具体例としては、Co−Cr、Co−W、Co−Mo、Ni−Cr、Ni−W、Ni−Mo、Ru−Cr、Ru−W、Ru−Mo、Rh−Cr、Rh−W、Rh−Mo、Pd−Cr、Pd−W、Pd−Mo、Ir−Cr、Pt−Cr、Pt−W、及びPt−Moが挙げられる。好ましくは、前記金属触媒は鉄、コバルト、ニッケル、モリブデン、若しくはこれらの混合物であり、例えば、Fe−Mo、Co−Mo及びNi−Fe−Moなどである。
【0015】
前記金属、前記二元金属、又は前記金属の組み合わせは、規定された粒径及び直径分布を有する金属ナノ粒子を生成するのに用いられる。前記金属ナノ粒子は、Harutyunyan et al., NanoLetters 2, 525 (2002)に記載された文献の手順を用いて生成可能である。あるいはまた、前記触媒ナノ粒子は、同時継続であり共同所有である米国特許出願第10/304,316号明細書に記載されたように、不活性塩に付加された対応する金属塩の熱分解と、金属ナノ粒子を提供するために調整された溶剤の温度と、によって生成可能であり、又は、当該技術分野で知られている他の任意の方法によっても生成可能である。前記金属ナノ粒子の粒径と直径は、不活性溶剤中の適切な濃度の金属を用いることにより、及び熱分解温度での反応を持続させる時間の長さを制御することにより、制御可能である。約0.01nmから約20nm、より好ましくは約0.1nmから約3nm、最も好ましくは約0.3nmから2nmの粒径を有する前記金属ナノ粒子を生成可能である。すなわち、前記金属ナノ粒子は、0.1、1、2、3、4、5、6、7、8、9、又は10nm、及び最大で約20nmまでの粒径を有することができる。他の態様において、前記金属ナノ粒子は、粒径の幅を有することができる。例えば、前記金属ナノ粒子は、大きさ約3nmから約7nm、大きさ約5nmから約10nm、又は大きさ約8nmから約16nmの幅の粒径を有することができる。前記金属ナノ粒子は、任意に約0.5nmから約20nm、好ましくは約1nmから約15nm、より好ましくは約1nmから5nmの直径分布を有することができる。すなわち、前記金属ナノ粒子は、約1、2、3、4、5、6、7、8、9、10、11、12、13、14、又は15nmの直径分布を有することができる。
【0016】
前記金属塩は、任意の金属の塩であってもよく、金属塩の融点が不活性溶剤の沸点よりも低くなるように選択可能である。従って、前記金属塩は、金属イオン及び対イオンを含み、この対イオンは、硝酸塩、窒化物、過塩素酸塩、硫酸塩、硫化物、酢酸塩、ハロゲン化物、例えばメトキシドやエトキシドなどの酸化物、アセチルアセトナートなどとすることができる。例えば、前記金属塩は、酢酸鉄(FeAc2)、酢酸ニッケル(NiAc2)、酢酸パラジウム(PdAc2)、酢酸モリブデン(MoAc3)など、及びこれらの組み合わせとすることが可能である。前記金属塩の融点は、好ましくは不活性溶剤の沸点よりも約5℃から50℃低く、より好ましくは不活性溶剤の沸点から約5℃から20℃低い。
【0017】
前記金属塩は、溶液、懸濁液、又は分散液を提供するために不活性溶剤に溶解可能である。前記溶剤は、好ましくは有機溶剤であり、選択された金属塩が比較的溶けやすく安定化することができ、当該溶剤が実験条件化で容易に蒸発可能な十分高い蒸気圧を有するものとすることができる。前記溶剤は、グリコールエーテル、2−(2−ブトキシエトキシ)エタノール、H(OCH2CH2)2O(CH2)3CH3などのエーテルとすることができ、以下、ジエチレングリコールモノ−n−ブチルエーテルなどの一般名を用いて呼ぶこととする。
【0018】
前記金属塩と前記不活性溶剤の相対量が、製造されるナノ粒子の大きさを制御する要素となっている。広い範囲のモル比(不活性溶剤1モルに対する金属塩の総モル量である)が前記金属ナノ粒子を形成するために利用可能である。不活性溶剤に対する金属塩の一般的なモル比は、低くて約0.0222(1:45)、若しくは高くて約2.0(2:1)、又はこれらの間の任意の比率である。従って、例えば、約5.75×10-5から約1.73×10-3モル(10−300mg)のFeAc2が、約3×10-4から約3×10-3モル(50−500ml)のジエチレングリコールモノ−n−ブチルエーテルに溶解可能である。
【0019】
他の態様において、二以上の金属塩が、二以上の金属からなる金属ナノ粒子を形成させるために反応槽に添加可能である。この場合これらの金属塩の前記対イオンは同一であっても又は異なってもよい。それぞれの金属塩の相対量は、結果として得られる金属ナノ粒子の組成を制御する要素として利用可能である。前記二元金属に関して、第2の金属塩に対する第1の金属塩のモル比は、約1:10から約10:1、好ましくは約2:1から約1:2、より好ましくは約1.5:1から約1:1.5、又はこれらの間の任意の比率とすることができる。従って、例えば、酢酸ニッケルに対する酢酸鉄のモル比は、1:2、1:1.5、1.5:1、又は1:1とすることができる。当業者であれば金属塩の他の組み合わせ及び第2の金属塩に対する第1の金属塩のモル比が、様々な組成の金属ナノ粒子を合成するために利用可能であることを認識するであろう。
【0020】
前記不活性溶剤及び前記金属塩の反応溶液は、混合して均一な溶液、懸濁液、又は分散液にすることができる。前記反応溶液は、混合器、超音波発生器などの標準的な実験用撹拌器を任意に加熱して使用することによって混合可能である。このようにして得られた均一な混合物は、前記金属ナノ粒子を形成するために熱分解を受けることができる。
【0021】
前記熱分解反応は、反応槽の前記内容物を、反応槽内の少なくとも1つの前記金属塩の融点以上の温度に加熱することによって開始する。例えば、加熱マントル、加熱板、又はブンゼンバーナーなどの標準的な実験用加熱器を含む任意の好適な熱源を使用することができ、熱は還流可能である。前記熱分解の時間の長さは、所望する大きさの金属ナノ粒子が得られるように選択可能である。一般的な反応時間は、約10分から約120分、又はこれらの間の任意の整数分とすることができる。前記熱分解反応は、前記金属塩の融点よりも低い温度に反応槽の内容物の温度を下げることにより、所望の時間で終了する。
【0022】
製造された金属ナノ粒子の大きさと分布は、任意の好適な手法によって確認することができる。確認の一手法としては、透過型電子顕微鏡法(TEM)がある。好適なモデルとしては、FEI Company of Hillsboro, ORから市販されているPhillips CM300 FEG TEMが挙げられる。前記金属ナノ粒子のTEM顕微鏡写真を撮るために、1滴以上の金属ナノ粒子/不活性溶剤溶液が、TEM顕微鏡写真を得るために好適な炭素膜格子又はその他の格子に配置される。続いて、TEM装置を用いて、製造されたナノ粒子の大きさの分布を決定するために使用可能なナノ粒子の顕微鏡写真を撮影する。
【0023】
例えば、以上に詳細に説明した熱分解によって形成されたそれらの金属ナノ粒子は、固体の担体上に担持可能である。前記した固体の担体は、シリカ、アルミナ、MCM−41、MgO、ZrO2、アルミニウム−安定化酸化マグネシウム、ゼオライト、又は当該技術分野で知られている他の酸化物担体、及びこれらの組み合わせとすることができる。例えば、Al2O3−SiO2ハイブリッド担体が使用可能である。好ましくは、前記担体は、酸化アルミニウム(Al2O3)又はシリカ(SiO2)である。固体の担体として用いられる前記酸化物は粉末状であり、それによって小さな粒径と大きな比表面積を提供可能である。前記粉末状酸化物は、好ましくは約0.01μmから約100μm、より好ましくは約0.1μmから約10μm、さらに好ましくは約0.5μmから約5μm、そして最も好ましくは約1μmから約2μmの間の粒径を有する。前記粉末状酸化物は、約50−約1000m2/gの比表面積、より好ましくは約200−約800m2/gの比表面積を有することが可能である。前記粉末状酸化物は、新たに生成可能であり、市販もされている。
【0024】
一形態において、前記金属ナノ粒子は、二次的な分散及び抽出を介して固体の担体に担持される。補助的な分散は、熱分解反応後に、例えば、酸化アルミニウム(Al2O3)又はシリカ(SiO2)などの粉末状酸化物の粒子を反応槽内に導入することによって開始する。1−2μmの粒径及び300−500m2/gの比表面積を有する好適なAl2O3粉末は、Alfa Aesar of Ward Hill, MA、又はDegussa, NJから市販されている。粉末状酸化物は、前記粉末状酸化物と前記金属ナノ粒子を形成するのに用いられる金属の初期量との間の所望の重量比を実現するために追加可能である。一般的には、重量比は約10:1と約15:1の間とすることができる。例えば、100mgの酢酸鉄が出発物質として用いられる場合、約320から480mgの粉末状酸化物が前記した溶液中に導入可能である。
【0025】
前記粉末状酸化物と前記金属ナノ粒子/不活性溶剤混合物の混合物は、混合により均一な溶液、懸濁液、又は分散液を形成することができる。前記した均一な溶液、懸濁液、又は分散液は、超音波振動器、標準的な実験用撹拌器、機械的混合器、又は他の好適な手法を任意に加熱して使用することによって形成可能である。例えば、前記金属ナノ粒子、前記粉末状酸化物、及び前記不活性溶剤の混合物は、はじめにおおよそ80℃で2時間超音波で分解し、その後、均一な溶液を提供するために80℃で30分間実験用撹拌器で混合可能である。
【0026】
この二次的な分散の後、所望の金属ナノ粒子及び粉末状酸化物は前記した不活性溶剤から抽出可能である。前記した抽出は、ろ過、遠心分離、減圧下での溶剤の除去、大気圧下での溶剤の除去などにより行うことができる。前記不活性溶剤を蒸発させた後、前記粉末状酸化物及び前記金属ナノ粒子は、膜又は残渣として反応槽の壁に残る。前記粉末状酸化物がAl2O3である場合には、当該膜は一般的に黒色を呈するであろう。前記金属ナノ粒子及び前記粉末状酸化物の膜は、前記反応槽から取り除いて細かい粉末状を生成するために粉砕することができ、それによって混合物の得られる比表面積を増大させることができる。前記混合物は、乳鉢及び乳棒を用いるか、市販されている機械的グラインダーによるか、当業者にとって公知である、混合物の比表面積を増大させる他の手法によって粉砕することができる。
【0027】
どんな特定の理論によって縛られることなく、前記粉末状酸化物は抽出プロセス中に2つの機能を果たすと考えられている。前記粉末状酸化物は多孔性であり、大きい比表面積を有する。そのために、前記金属ナノ粒子は、二次的な分散中に前記粉末状酸化物の細孔内に定着する。前記粉末状酸化物の細孔内への定着は、前記金属ナノ粒子を物理的に互いに分離し、その結果抽出中の金属ナノ粒子の凝集を防止する。この効果は、用いられる粉末状酸化物の量によって補完される。前記したとおり、粉末状酸化物に対する金属ナノ粒子の重量比は、例えば、1:10から1:15の間などとすることができ、例えば、1:11、1:12、2:25、3:37、1:13、1:14などとすることができる。不活性溶剤が除去されるにつれて、比較的多くの量の粉末状酸化物は実質的にさらに金属ナノ粒子を分離するか又は「希釈する」機能を果たす。このように、本プロセスは、規定された大きさの金属ナノ粒子を提供する。
【0028】
当業者にとって自明であるように、このようにして生成された前記触媒は、後で使用するために保存可能である。他の態様において、前記金属ナノ粒子は、予め生成され、前記不活性溶剤から分離され、精製されており、その後、同じ又は異なる不活性溶剤内の好適な量の粉末状酸化物を加えることが可能である。前記金属ナノ粒子及び粉末状酸化物は、前記したように、均一に分散され、前記不活性溶剤から抽出され、そして、実質的な比表面積を増大させるために処理することが可能である。前記金属ナノ粒子及び前記粉末状酸化物の混合物を生成するための他の方法があることは、当業者にとって自明である。
【0029】
このように形成された前記金属ナノ粒子は、化学気相成長(CVD)プロセスによるカーボンナノチューブ、ナノファイバー及び他の一次元カーボンナノ構造体の合成のための成長触媒として利用可能である。
【0030】
前記カーボンナノチューブは、例えば、炭素含有ガスなどの炭素前駆体を用いることにより合成可能である。一般的に、最大で800℃から1000℃までの温度で熱分解しない任意の炭素含有ガスが使用可能である。好適な炭素含有ガスの例としては、一酸化炭素と、例えば、メタン、エタン、プロパン、ブタン、ペンタン、ヘキサン、エチレン、アセチレン及びプロピレンなどの飽和脂肪族炭化水素及び不飽和脂肪族炭化水素と、例えば、アセトン及びメタノールなどの含酸素炭化水素と、例えば、ベンゼン、トルエン、及びナフタレンなどの芳香族炭化水素と、及び、例えば、一酸化炭素及びメタンといった前記物質の混合物と、が挙げられる。一般的に、CO及びメタンは単層カーボンナノチューブの形成のための供給ガスとして好ましいのに対して、アセチレンの利用は複層カーボンナノチューブの形成を促進する。前記炭素含有ガスは、例えば、水素、ヘリウム、アルゴン、ネオン、クリプトン及びキセノン又はこれらの混合物などの希釈ガスと任意に混合されてもよい。
【0031】
本発明の方法とプロセスによれば、直径の狭い分布となるSWNTsを合成することができる。カーボンナノチューブの直径の狭い分布は、反応温度として最も融点の低い融点を選択することによって合成中に、優先的に小さい直径の触媒粒子を活性化することによって得られる。
【0032】
本発明の一形態において、粉末状酸化物に担持された前記金属ナノ粒子は、Harutyunyan et al., Nano Letters 2, 525 (2002)に記載された文献の方法によれば、前記反応温度で炭素源との接触が可能である。あるいはまた、前記粉末状酸化物に担持された前記金属ナノ粒子はエアロゾル化が可能であり、前記反応温度を維持した反応器内に導入可能である。これと同時に、前記炭素前駆体ガスを反応槽内に導入する。反応器の中での反応物質の流量は、反応槽の壁に炭素製品の堆積が減じるように制御可能である。このように製造された前記カーボンナノチューブは、収集され、分離可能である。
【0033】
前記粉末状酸化物に担持された前記金属ナノ粒子は、公知の任意の方法によってエアロゾル化可能である。一つの方法として、前記した担持された金属ナノ粒子は、例えば、ヘリウム、ネオン、アルゴン、クリプトン、キセノン、又はラドンなどの不活性ガスを使用することでエアロゾル化される。好ましくは、アルゴンが使用される。一般的に、アルゴン、又は他のどのガスも粒子インジェクターを通して反応器の中に強制的に導入される。前記粒子インジェクターは、前記担持された金属ナノ粒子を含むことができ、前記担持された金属ナノ粒子を撹拌する手段を有するものであればどんな容器でもよい。従って、粉末状の多孔性の酸化物の担体に堆積する前記触媒は、機械的な撹拌器を取り付けたビーカーに入れることができる。前記担持された金属ナノ粒子は、例えば、アルゴンなどの輸送ガス中に触媒を取り込ませることを促進させるために撹拌され、又は混合されることができる。
【0034】
触媒活性を評価するために、炭素SWNTsの成長中に炭化水素の触媒分解の結果として表れる水素濃度の変化をCVD装置のガス流の排出口に取り付けられた質量分析計(Thermo Star GSD 300T, with SEM Detector)を用いて測定した。このように、触媒の電子構造に影響を与え、同様に炭化水素分解効率に影響を与えるとともに、最終的にナノチューブの成長速度に影響を与える、触媒の特徴のいかなる変化も水素濃度の監視によって検出された。同じように、合成パラメーターの影響も明らかにされた。
【0035】
文献(A. R. Harutyunyan, B. K. Pradhan, U. J. Kim, G. Chen, P. C. Eklund, Nano Letters, 2, 525 (2002))に記載のとおり、前記炭素SWNTsは、90分間820℃でFe触媒粒子(モル比Fe:Al2O3=1:15)上にメタン(60cm3/min、Praxair、99,999%)で希釈されたアルゴン(200cm3/min)の混合ガスを流すことによって成長させた。ナノチューブの成長は、透過型電子顕微鏡法及びラマン測定によって別々に確認した。t〜7±1min(図1(a))までH2濃度が急激に増大した後、CH4(図1(a))を触媒分解していない濃度と一致する一定値にゆっくり復帰した。一方、3分間、5分間、7分間、20分間及び90分間の異なる合成持続時間の間、同様の実験条件下で炭素SWNTsの合成に用いられた各触媒サンプルをDSC測定した結果、炭素原子の触媒中への拡散により引き起こされた触媒の固体−液体(t≦7±2分の時)と液体−固体(t≦7±2分の時)の相転移と、Fe−C相の形成がおきたことがわかる(図1(b))(H. Kanzow, A. Ding, Phys. Rev. B 60, 11180 (1999)、A. R Harutyunyan, E. Mora, T. Tokune Applied Phys. Lett. 87, 051919 (2005))。図1(a)と図1(b)の結果を比較することにより、触媒活性度の増大が触媒の液化プロセスと合致していることがわかる。一方、液体−固体相転移により、触媒が非活性化されることがわかる。ラマン分光法(λ=532nm及び780nm)測定によれば、t<7から10分の試験時間に、成長したSWNTのG−バンドとD−バンド(IG/ID)の強度比の急激な増大を示している。この比率は炭素堆積物における黒鉛結晶構造オーダーの尺度である(H. Cui, G. Eres, J. Y. Howe, A. Puretzky, M. Varela, D. B. Geohegan, D. H. Lowndes, Chem. Phys. Lett. 374, 222 (2003)。同じt<7から10分の試験時間では、触媒は液相であり、高い活性度を有する(図1(c))。そして、全炭素の収量の約70wt%(Fe/アルミナ触媒に比例したwt%炭素)も得ることができた。観察された触媒の特徴の変化とナノチューブの成長の間の関係を立証するために、触媒が液化して高い活性度を有している時と、触媒が固化し始めて活性を失う時の間に12CH4ガスとともに、13C同位元素(13CH4、99.99%、Cambridge Isotope Lab. Inc.)を含むメタンガスの連続導入を用いている。一連のサンプルは、最初の3分間、最初の7分間(触媒はまだ液化している)及び最初の13分間(触媒は固化している)のメタンガス12CH4とともにそれぞれ続いて導入される17分間、続いて導入される13分間及び続いて導入される7分間の13CH4ガスを使用することにより生成した(図1(a)の差し込み図:A1、A2、A3)。重要なことは、13C同位元素を含むメタンガスを用いて得られた炭素SWNTsのラマンスペクトルは、12C同位元素のスペクトルと同じということである。唯一の主な違いは、より重い炭素原子が結果として小さいフォノンエネルギーを生じるので、ラマンシフト周波数が√(12/13)倍小さくなることである。最初の3分間の12CH4とともに続いて導入される17分間の13CH4を使用して合成されたサンプルのためにラマンスペクトルは、13C原子を含むSWNTsに対応する重要な指標を含んでおり、最初の7分間の成長持続時間のための12CH4とその後13分間の13CH4を供給するが、この指標は減少する(図2(a))。最終的に12CH4の13分間の反応持続時間と7分間の13CH4のサンプルに関するスペクトルは、12C同位元素だけのナノチューブのスペクトルと完全に同一である。触媒活性とDSC測定とこれらの結果を比較することにより、液化した触媒が炭素SWNTsの成長のために好ましいと結論される(図1(a)、(b)、(c))。さらに、成長終了の理由のうちの1つは、安定した炭化物相の形成を通しての触媒の固化である。
【0036】
Fe触媒へのMoの添加が、SWNTs製造のためにより効率的であることが知られている(A-C. Dupuis, Prog. In Materials Science 50, 929-961 (2005);Moisala, A. G. Nasibulin, E. I. Kauppinen, Journ. of Condensed Matter 15, S3011 (2003))。前記した実験は、同様の合成条件下でFe:Mo:Al2O3(一般的なモル比1:0.21:15)触媒を用いて実施された。観察された第1の顕著な特徴は、Fe:Mo:Al2O3触媒の活性度は、すべての合成持続時間の間Fe:Al2O3(図3(a))に対して著しく高く、また、合成の早い段階で炭素SWNTが生じていることが検出された。第2に、Fe:Mo:Al2O3(一般的なモル比1:0.21:15)の変化の挙動は、Fe:Al2O3触媒(1:15)とMo:Al2O3触媒(モル比0.21:15)の数学的な合計から質的及び量的に異なるのは注目に値する。この事実は、Fe−Mo合金の形成で、MoとFeの間の金属間相互作用に起因する。さらに、触媒サンプルのDSC測定から、触媒が最大90分(図1(b))のナノチューブの成長持続時間の間もまだ液体の状態であることがわかり、ナノチューブの製造が可能であることを示している。確かに、Fe触媒と対照的に、Fe/Mo触媒と13分間の12CH4とともに続いて導入される7分間の13CH4を使用して得られたナノチューブのラマンスペクトルは、13C原子を明確に検出している(図2(b))。しかしながら、触媒は、t>30分(図3(a))であるときは活性を示さず、t≧20分の後、12CH4に続いて13CH4が反応槽に導入されたたが、ナノチューブのラマンスペクトル中に13C原子の指標は検出されなかった。それ故、触媒が90分まで液化されていることがわかったが、t≧20分となったとき、触媒はナノチューブの成長を結果的に生じない。この事実は、触媒の表面を覆い、結局はそれを非活性化するナノチューブの成長とともに不規則なsp2炭素(M. S. Dresselhaus, G. Dresselhaus, M. Pimenta, P. C. Eklund, Analytical Applications of Raman Spectroscopy; Pelletier, M., Ed.; 1999, 367)の様々な形態の構造に起因すると考えられる。従って、Moの添加は、炭化物形成のために固化するのを防ぐのに重要であり、結果として、ナノチューブの成長に適した触媒のライフタイムをほぼ2倍に引き延ばす。
【0037】
触媒の特徴がナノチューブの成長に適しているとしても、適した合成条件を知ることは重要である。触媒の活性は合成中に評価された。与えられた他のパラメーターとして合成温度の変化は、純Feの場合には温度>720℃を必要とするのに対し、〜680℃までの温度で触媒Fe/Moはナノチューブの成長を開始させることができる。ナノチューブの成長が、液化を生じさせた炭素を必要とすることを考慮すると、最小合成温度はそれ故に共融点の温度によって制限される。理論に縛られないでいえば、これはまた、Moの添加が、三元状態図に従った大部分のFe−Mo−Cの共融点の温度を低下させるという事実と一致している。他方では、使用済みの特定の炭素源の熱分解温度は、最大のものから合成温度を制限する。それは、T合成(Tsynthesis)が>830℃の場合には、熱分解によって形成される炭素原子の役割が重要であり、また、急速に触媒を劣化させ、それぞれ触媒の表面とチューブの壁の表面を覆うことによりチューブの品質に影響を及ぼすことは明らかである。最終的に、T合成(Tsynthesis)>T融解(Tmelt)(触媒)とすれば、DSC測定によると、Feとアルミナの担体の間の金属間相互作用が結果として生じ、触媒がさらに非活性化される。
【0038】
従って、図1(b)から理解できるように、実際に、担持されたナノ粒子Fe−C二成分相に対する液相線は、炭素濃度に依存した「V−字型」(単調ではない)を有する。ナノチューブの成長のために使用される全ての一般的な触媒の対応する大部分の金属−炭素二成分相状態図の液相線は、「V−字型」となっている。このことは適切な温度で炭素の拡散によって触媒の液化されることを意味しているといえる。しかしながら、液相線の挙動が、ナノ触媒と担体物質との界面相互作用エネルギーに依存するということは重要である。E>0.1eVの時はさらに重要となる。さらに、この相互作用により、より小さい直径=1nmのために融点/共融点を増加するという重要な結果を生じさせる。
式

ここでTdecompは、炭化水素の熱分解温度であり、SWNTsの成長に適した触媒の特徴と合成パラメーターの間の関係について説明されている。
【0039】
以上、本発明について、特に好ましい実施形態及び様々な代替案としての実施形態を参照して説明したが、本発明の精神及び範囲を逸脱しない範囲で、形状及び細部において様々な変更が可能であることが、当業者にとって理解されるであろう。本明細書内で言及された全ての発行された特許及び刊行物が、参照により本明細書に組み込まれる。
【図面の簡単な説明】
【0040】
【図1】(a)カーボンSWNTsの成長中における水素濃度の変化を示す図である。差し込み図(A1)は、12Cと13C同位元素をそれぞれ(A1)最初の3分間とその後の17分間;(A2)最初の7分間とその後の13分間;そして(A3)最初の13分間とその後の7分間に連続導入した。(b)DSC法で測定したカーボンナノチューブの成長中におけるFe触媒の融点の変化を示す図である。(c)カーボンSWNTsの成長中におけるラマンIG/ID強度比と炭素取り込みの変化を示す図である。
【図2】12Cと13Cを含む炭素の連続導入によって合成されたカーボンSWNTsのラマンスペクトルによるラディアルブリージングモード(radial breathing mode)とタンジェンシャルモード(tangential mode)を示す図である。
【図3】(a)Al2O3;Fe:Al2O3(1:15モル比);Mo:Al2O3(0.21:15モル比);及びFe:Mo:Al2O3(1:0.21:15モル比)単体による820℃における水素濃度の変化を示す図である。(b)Fe:Mo:Al2O3(1:0.21:15)触媒の担体上のカーボンSWNTsの成長についてのラマンスペクトルの時間依存性を示す図である。(c)Fe:Al2O3(1:15)触媒の担体上のカーボンSWNTsの成長についてのラマンスペクトルの時間依存性を示す図である。
【特許請求の範囲】
【請求項1】
単層カーボンナノチューブ(SWNT)を生成するための化学気相成長法であって、
触媒の共融点近くの温度で炭素前駆体ガスを担体上の触媒と接触させ、前記炭素前駆体ガスが、当該炭素前駆体ガスが反応する割合と等しい割合で接触することにより、長いSWNTが形成される
ことを特徴とする方法。
【請求項2】
前記炭素前駆体ガスは、メタンであることを特徴とする請求項1に記載の方法。
【請求項3】
前記炭素前駆体ガスは、不活性ガス及び水素をさらに含むことを特徴とする請求項2に記載の方法。
【請求項4】
前記不活性ガスは、アルゴン、ヘリウム、窒素、水素、又はこれらの組み合わせであることを特徴とする請求項3に記載の方法。
【請求項5】
前記触媒は、鉄、モリブデン、又はこれらの組み合わせであることを特徴とする請求項1に記載の方法。
【請求項6】
前記触媒は、1nmから10nmの間の粒径を有することを特徴とする請求項1に記載の方法。
【請求項7】
前記触媒は、約5nmの粒径を有することを特徴とする請求項6に記載の方法。
【請求項8】
前記触媒は、約3nmの粒径を有することを特徴とする請求項6に記載の方法。
【請求項9】
前記触媒は、約1nmの粒径を有することを特徴とする請求項6に記載の方法。
【請求項10】
前記担体は、粉末状酸化物であることを特徴とする請求項1に記載の方法。
【請求項11】
前記粉末状酸化物は、Al2O3、SiO3、MgO及びゼロライトからなるグループから選択されることを特徴とする請求項10に記載の方法。
【請求項12】
前記粉末状酸化物は、Al2O3であることを特徴とする請求項11に記載の方法。
【請求項13】
前記触媒と前記担体とは、約1:1から約1:50の比率であることを特徴とする請求項1に記載の方法。
【請求項14】
前記炭素前駆体ガスは、触媒1mgに対して約0.2sccmから約0.8sccmの割合で接触することを特徴とする請求項13に記載の方法。
【請求項15】
前記炭素前駆体ガスは、触媒1mgに対して約0.2sccmから約0.4sccmの割合で接触することを特徴とする請求項14に記載の方法。
【請求項16】
前記炭素前駆体ガスは、触媒1mgに対して約0.3sccmの割合で接触することを特徴とする請求項15に記載の方法。
【請求項17】
前記温度は、前記共融点よりも約5℃から約150℃高いことを特徴とする請求項1に記載の方法。
【請求項18】
前記温度は、前記共融点よりも約10℃から約100℃高いことを特徴とする請求項17に記載の方法。
【請求項19】
前記温度は、前記共融点よりも約50℃高いことを特徴とする請求項18に記載の方法。
【請求項20】
前記温度は、前記共融点よりも約80℃高いことを特徴とする請求項18に記載の方法。
【請求項1】
単層カーボンナノチューブ(SWNT)を生成するための化学気相成長法であって、
触媒の共融点近くの温度で炭素前駆体ガスを担体上の触媒と接触させ、前記炭素前駆体ガスが、当該炭素前駆体ガスが反応する割合と等しい割合で接触することにより、長いSWNTが形成される
ことを特徴とする方法。
【請求項2】
前記炭素前駆体ガスは、メタンであることを特徴とする請求項1に記載の方法。
【請求項3】
前記炭素前駆体ガスは、不活性ガス及び水素をさらに含むことを特徴とする請求項2に記載の方法。
【請求項4】
前記不活性ガスは、アルゴン、ヘリウム、窒素、水素、又はこれらの組み合わせであることを特徴とする請求項3に記載の方法。
【請求項5】
前記触媒は、鉄、モリブデン、又はこれらの組み合わせであることを特徴とする請求項1に記載の方法。
【請求項6】
前記触媒は、1nmから10nmの間の粒径を有することを特徴とする請求項1に記載の方法。
【請求項7】
前記触媒は、約5nmの粒径を有することを特徴とする請求項6に記載の方法。
【請求項8】
前記触媒は、約3nmの粒径を有することを特徴とする請求項6に記載の方法。
【請求項9】
前記触媒は、約1nmの粒径を有することを特徴とする請求項6に記載の方法。
【請求項10】
前記担体は、粉末状酸化物であることを特徴とする請求項1に記載の方法。
【請求項11】
前記粉末状酸化物は、Al2O3、SiO3、MgO及びゼロライトからなるグループから選択されることを特徴とする請求項10に記載の方法。
【請求項12】
前記粉末状酸化物は、Al2O3であることを特徴とする請求項11に記載の方法。
【請求項13】
前記触媒と前記担体とは、約1:1から約1:50の比率であることを特徴とする請求項1に記載の方法。
【請求項14】
前記炭素前駆体ガスは、触媒1mgに対して約0.2sccmから約0.8sccmの割合で接触することを特徴とする請求項13に記載の方法。
【請求項15】
前記炭素前駆体ガスは、触媒1mgに対して約0.2sccmから約0.4sccmの割合で接触することを特徴とする請求項14に記載の方法。
【請求項16】
前記炭素前駆体ガスは、触媒1mgに対して約0.3sccmの割合で接触することを特徴とする請求項15に記載の方法。
【請求項17】
前記温度は、前記共融点よりも約5℃から約150℃高いことを特徴とする請求項1に記載の方法。
【請求項18】
前記温度は、前記共融点よりも約10℃から約100℃高いことを特徴とする請求項17に記載の方法。
【請求項19】
前記温度は、前記共融点よりも約50℃高いことを特徴とする請求項18に記載の方法。
【請求項20】
前記温度は、前記共融点よりも約80℃高いことを特徴とする請求項18に記載の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公表番号】特表2009−530214(P2009−530214A)
【公表日】平成21年8月27日(2009.8.27)
【国際特許分類】
【出願番号】特願2008−553316(P2008−553316)
【出願日】平成19年1月30日(2007.1.30)
【国際出願番号】PCT/US2007/002586
【国際公開番号】WO2008/016390
【国際公開日】平成20年2月7日(2008.2.7)
【出願人】(000005326)本田技研工業株式会社 (23,863)
【出願人】(504325287)ザ オハイオ ステート ユニバーシティー リサーチ ファウンデーション (24)
【Fターム(参考)】
【公表日】平成21年8月27日(2009.8.27)
【国際特許分類】
【出願日】平成19年1月30日(2007.1.30)
【国際出願番号】PCT/US2007/002586
【国際公開番号】WO2008/016390
【国際公開日】平成20年2月7日(2008.2.7)
【出願人】(000005326)本田技研工業株式会社 (23,863)
【出願人】(504325287)ザ オハイオ ステート ユニバーシティー リサーチ ファウンデーション (24)
【Fターム(参考)】
[ Back to top ]

