ガスクラスターイオンビーム技術の適用により生物学的材料の表面の湿潤性及び/又はその他の生体適合性特性を改質する方法と製造された生物学的材料
本発明は組織の外科的移植方法を提供する。この方法は、ドナーから移植片組織を外移植するステップと、移植片組織の少なくとも第1の部分にイオンビームを照射するステップと、ガスクラスターイオンビームが照射された移植片組織をレシピエントに外科的移植するステップとを含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、一般に、哺乳類への移植用である生物学的材料に関し、特に、1)生物学的材料の表面への細胞付着のための宿主としての役割を果たし、2)生物学的材料の表面又は材料内部での細胞増殖を促進し、3)この生物学的材料の表面の中及び下での細胞浸透を促進し、及び/又は、4)その後の新組織形成を促進するために、湿潤性の改質、及び/又は、改質された生物学的材料の能力の改善を行うイオンビーム技術、好ましくは、ガスクラスターイオンビーム技術を使用する方法に関する。
【背景技術】
【0002】
ガスクラスターイオンビーム(GCIB)照射は、ナノスケール表面改質のため使用されている。同時係属中の、本願出願人により維持される米国特許出願第12/210,018号、名称“Method and System for Modifying the Wettability Characteristics of a Surface of a Medical Device by the Application of Gas Cluster Ion Beam Technology and Medical Devices Made Thereby”では、GCIBが非生物学的材料表面の親水性を改質させることが明らかにされている。GCIB処理は、半導体装置及び薄膜の製造において十分に文書化されている。しかし、筋骨格系(例えば、骨、靱帯、腱、回旋腱板、軟骨など)の組織を含む生物学的材料表面の改質と、主要な哺乳類及び鳥類の臓器系内部の上皮組織及び内皮組織のようなその他の結合組織の改質のためのGCIB処理の使用可能性は、これまでに知られていない。細胞付着の宿主構造としての役割を果たす靱帯表面の能力に関してGCIB処理が靱帯表面に生じさせる物理的改質は、これまでに知られていない。線維芽細胞及び骨芽細胞のような付着依存性細胞が十分に付着し、成長し、又は、分化するため親水性表面から恩恵を受けることと、これらの付着依存性細胞がさらに被帯電表面の方を好むこととは、一般的に知られている。親水性に関して、液滴接触角は、湿潤性の尺度として使用されることがあり、接触角測定量の減少は、一般に、より強い表面親水性を意味する。非生物学的表面上の親水性を増加させるか、又は、電荷を変化させるため、サンドブラスト法と、酸エッチング法と、プラズマ溶射コーティングと、CO2レーザー平滑化と、機械的洗浄技術、超音波洗浄技術、プラズマ洗浄技術、及び、化学的洗浄技術を含む種々の形式の洗浄法のような多数の方法がこれまでに使用されている。その他のアプローチは、界面活性剤の添加、又は、異なる湿潤性特性を有している膜若しくはコーティングの塗布を含んでいる。表面の親水性の増加、表面電荷状態の改質、又は、表面化学的性質の改質、その他のメカニズムのいずれかを用いる細胞付着の増強のためのGCIB照射による生物学的材料の表面の調製は、これまでに明らかにされていない。
【0003】
高エネルギー従来型のイオン、加速された帯電原子、又は、帯電分子のビームは、半導体装置接合を形成し、スパッタリングによって表面を改質させ、そして、薄膜の特性を改質させるために広範に利用される。従来型のイオンと異なって、ガスクラスターイオンは、標準的な温度及び圧力の条件下でガス状である材料(一般に、酸素、窒素、又は、例えば、アルゴンのような不活性ガスであるが、どのような凝縮性ガスでもガスクラスターイオンを生成するために使用できる)の多数の(典型的な分布が数百個乃至数千個であり、平均値が数千個である)弱結合原子又は分子のクラスターから形成され、各クラスターイオンは、1つ以上の電荷を共有し、高い総エネルギーをもつために(約3kV乃至約70kV以上のような)高電圧を通じて一緒に加速される。ガスクラスターイオンが形成され、加速された後、ガスクラスターイオンの電荷状態は、変更されてもよく、又は、変更状態にされてもよく(中和状態にされてもよく)、そして、ガスクラスターイオンは、より小さいクラスターイオン、及び/又は、中和されたより小さいクラスターに断片化されることがあるが、高電圧によって予め加速されることによって比較的高い総エネルギーを維持する傾向がある。ガスクラスターイオンビームは、洗浄、エッチング、平滑化、膜成長、などの目的で非生物学的材料の表面を処理するため使用されている。ガスクラスターイオンビームは、殆どの固体材料平面への平滑化効果のためよく知られ、ダイヤモンド、シリコン、及び、金属のような材料を平滑化するため使用されている。各ガスクラスターイオンの中の原子又は分子が多数であるため、かつ、原子又は分子が弱結合されているため、表面衝突時の原子又は分子の影響は、従来型の(モノマー又は分子)イオンと異なり、非常に浅い。クラスターは、衝突時に分裂させられ、各原子又は分子は、次に、加速クラスターの総エネルギーより比較的少ないエネルギー数eVだけを運ぶ。瞬時温度及び圧力は、ガスクラスターイオン衝突場所では、非常に高くなる可能性があり、種々の表面化学的性質、エッチング、及び、その他の影響が起こる可能性がある。表面化学的性質は、(例えば)表面接合を暴露することによりGCIB照射によって(従って、表面電荷状態を改質させることによって)、及び/又は、(酸素、窒素、炭素などのような反応原子又は分子を含むガスクラスターイオンを使用することにより)ガスクラスターイオンから表面へ反応原子又は分子を組み入れることによって改質させられることがある。しかし、これらの影響は、非常に表面的であり、衝突場所の下で多くても数十オングストロームだけ広がり、従って、表面的な表面衝突場所より下の深い位置にある材料には著しい破損がない。本明細書中で使用されるように、「GCIB」、「ガスクラスターイオンビーム」、及び、「ガスクラスターイオン」という用語は、加速の後に電荷状態の全部又は一部が改質(中和を含む)させられた加速ビーム及びイオンを包含することを目的とする。「GCIB」及び「ガスクラスターイオンビーム」という用語は、クラスター化されていない粒子をさらに含むことがあるとしても、加速ガスクラスターを含むすべてのビームを包含することを目的とする。GCIBは、イオン浸透が非常に浅く、数十オングストローム(数ナノメートル)より深い破損又は改質は無視できるという理由のため、本発明のための好ましいイオンビームである。
【発明の概要】
【発明が解決しようとする課題】
【0004】
一態様では、本発明は、ガスクラスターイオンビーム技術の適用によって生物学的材料の表面の湿潤性を増加させる、及び/又は、化学的性質若しくは電荷状態を変更する、及び/又は、その他の物理的特性を改質させる方法を提供する。
【0005】
さらなる態様では、本発明は、ガスクラスターイオンビーム技術の適用によって新しい細胞成長の付着、増殖、移動などのため、場合によっては、骨、線維性結合組織、上皮、内皮などのような組織に分化する新しい細胞の刺激用の生物学的材料の表面を調製する方法を提供する。
【0006】
さらに別の態様では、本発明は、ガスクラスターイオンビーム技術の適用によって、制御されたパターンで、生物学的材料の表面の一部の湿潤性を増加させる、及び/又は、新しい細胞成長の付着、増殖、移動などのため生物学的材料の表面を調製する方法を提供する。
【0007】
さらなる態様では、本発明は、ガスクラスターイオンビーム技術の適用によって、親水性が増加させられた表面又は表面部分を有している、及び/又は、細胞浸透の能力及び/又は新しい細胞の付着、成長及び分化のための宿主としての役割を果たす能力が増強された表面を有し、場合によっては、骨、繊維性結合組織、上皮、内皮などのような組織に分化する新しい細胞の刺激用の外科的に移植可能な生物学的材料を提供する。
【0008】
別の態様では、本発明は、外科的移植用の、そして、場合によっては、骨、繊維性結合組織、上皮、内皮などのような組織に分化する特定の細胞材料を刺激するための生物学的材料、及び移植片と、特定の細胞材料を生物学的材料片に組み込む生物学的材料片の調製及び/又は、外科的移植の方法とを提供する。
【課題を解決するための手段】
【0009】
本発明の上述の態様と、さらなる態様及びその他の態様と、利点とは、以下に説明される発明によって実現される。
【0010】
本発明は、表面の親水性若しくは湿潤性の程度のような表面特性を改質させるため、及び/又は、新しい細胞成長、及び/又は、例えば、骨、靱帯、腱、回旋腱板、軟骨などの筋骨格系の組織を含む生物学的材料への付着のための宿主としての役割を果たすために表面若しくは表面の一部分の適合性を改善するため、生物学的材料の表面若しくは表面の一部分のガスクラスターイオンビーム(GCIB)処理を適用する。マスキング技術の使用によって、又は、表面へのGCIBの入射を制御することにより、又は、GCIB処理の空間的広がりを制御するその他の手段によって、表面特性は、所望の領域が改質され、その他の領域が改質されない制御されたパターンで改質されることがある。このように、生物学的材料への細胞付着は(外科的に移植されたとき)、外科的結果の成功に適さない領域で細胞付着を促進することなく、所望の領域で容易にされることがある。
【0011】
発明者は、GCIB技術を用いて、例えば、(自然状態と脱細胞化状態の両方の状態で)骨及び靱帯のような筋骨格系の組織の表面を処理し、そして、ある種のGCIP処理が生物学的材料の表面の親水性の増加と、新しい細胞成長及び付着のための表面の適合性の改善とをもたらすことが分かった。本明細書中に記載された実施例は、構造的組織であるが、発明は、構造的組織に限定されない。
【0012】
パターン化された表面変化を生成するため、GCIB処理は、マスク若しくはビーム描画技術、又は、表面のある一定の領域に処理を制限するか、若しくは、ワークピースの様々な領域で様々なタイプのGCIB処理を生じるように、GCIB処理によるワークピース表面への暴露を制御する様々な他の手段を用いて制御されることがある。利用されるマスクは、ワークピースの一部分へのGCIB処理を遮断する機械的マスクでもよい。パターン化された表面変化の実現は、機械的マスクの使用に限定されない。
【0013】
本発明は、組織の外科的移植方法を提供する。この方法は、ドナーから移植片組織を外移植するステップと、移植片組織の少なくとも第1の部分にイオンビームを照射するステップと、移植片組織をレシピエントに外科的移植するステップとを含む。
【0014】
本発明は、ドナーから移植片組織を外移植するステップと、移植片組織の少なくとも第1の部分を脱細胞化するステップと、移植片組織の第1の部分のうちの少なくとも第2の部分を凍結乾燥するステップと、移植片組織の第2の部分のうちの少なくとも第3の部分に照射するステップと、移植片組織をレシピエントに外科的移植するステップとを含む、別の外科的移植方法をさらに提供する。この方法は、将来の使用のため移植片組織を保存する任意的なステップと、外科的移植のため移植片組織を離れた場所へ輸送する任意的なステップと、移植片組織の少なくとも第3の部分の少なくとも表面に細胞をシードする任意的なステップと、移植片組織の上又は中で細胞の望ましい程度の付着及び増殖を可能する任意的なステップとをさらに含む。
【0015】
本発明のその他の目的及びさらなる目的と共に、本発明をより良く理解するため、添付図面及び詳細な説明を参照し、本発明の範囲は、請求項において指示される。
【図面の簡単な説明】
【0016】
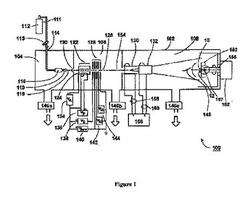
【図1】GCIB技術において知られ、かつ、本発明を実施するため適した型のガスクラスターイオンビーム処理システムの概略図である。
【図2】ワークピース・ホルダを示すガスクラスターイオンビーム処理システムの一部分の拡大図である。
【図3】本発明の実施形態による靱帯組織へのGCIB照射から生じる測定液滴接触角の減少を示すグラフである。
【図4】本発明の実施形態による骨組織へのGCIB照射から生じる測定液滴接触角の減少を示すグラフである。
【図5】対照靱帯標本上の細胞成長を示す顕微鏡写真である。
【図6】本発明の実施形態による処理された靱帯標本上の増強細胞成長を示す顕微鏡写真である。
【図7】本発明の改善された生物学的材料の有利な適用の例示的な実施形態を示す膝関節の略図である。
【発明を実施するための形態】
【0017】
表面処理の技術において知られた型の典型的なガスクラスターイオンビーム(GCIB)処理装置100を示す図面のうちの図1を参照する。本明細書中に記載された具体的なコンポーネントに制限されないが、処理装置100は、3つの連通するチャンバ108、すなわち、線源チャンバ104と、イオン化/加速チャンバ106と、ガスクラスターイオンビームによる処理のためワークピース10を位置合わせする能力をもつワークピース・ホルダ150を内部に含む処理チャンバ108とに分割された真空容器102で構成されている。
【0018】
使用中に、3つのチャンバは、真空ポンプシステム146a、146b、及び146cによってそれぞれに適当な動作圧力まで排出される。シリンダ111に蓄積された凝縮性線源ガス112(例えば、アルゴン又はN2)は、加圧下で、ガス調量弁113及びガス供給管114を通って、停滞チャンバ116に入れられ、適切に成形されたノズル110を通って実質的により低い圧力の中へ放出され、超音速ガスジェット118を生じる。ジェットの膨張から生じる冷却は、ガスジェット118の一部分を数百個から数千個(又は、さらに数万個)の弱結合原子又は分子でほとんど構成されたクラスターに凝集させる。ガス・スキマー・アパーチャ120は、このようなより高い圧力が有害である下流領域(例えば、イオナイザ122、高電圧電極126、及び、処理チャンバ108)における圧力を最小限に抑えるように、クラスタージェットに凝集されていないガス分子をクラスタージェットから部分的に分離する。適当な凝縮可能な線源ガス112は、必ずしも限定されることなく、(アルゴンのような)不活性ガスと、窒素と、二酸化炭素と、酸素とを含む。
【0019】
ガスクラスターを含有する超音速ガスジェット118が形成された後、クラスターは、イオナイザ122の中でイオン化される。イオナイザ122は、1つ以上の白熱フィラメント124から熱電子を生成し、電子を加速し、電子を案内してガスジェット118の中のガスクラスターと電子を衝突させる電子衝撃イオナイザでもよく、ジェットは、イオナイザ122の中を通過する。電子衝突は、クラスターから電子を放出させ、クラスターの一部分を正にイオン化させる。適当に付勢された高電圧電極126の組は、イオナイザ122からクラスターイオンを抽出し、ビームを形成し、その後に、加速電位(典型的に、1kVから数十kV程度まで)を用いてクラスターイオンを加速させ、初期軌道154を有するGCIB 128を形成するためクラスターイオンを集中させる。フィラメント電源136は、電圧VFを供給し、イオナイザ・フィラメント124を加熱する。アノード電源134は、電圧VAを供給し、フィラメントから放出された熱電子を加速し、熱電子をクラスター含有ガスジェット118に衝突させ、イオンを生成する。エクストラクション電源138は、電圧VEを供給し、高電圧電極を付勢し、イオナイザ122のイオン化領域からイオンを抽出し、GCIB 128を形成する。アクセラレータ電源140は、電圧VACCを供給し、イオナイザ122に関して高電圧電極を付勢し、その結果、VACCボルト(V)に一致する総GCIB加速電位を生じる。1つ以上のレンズ電源(例えば、142及び144)は、GCIB 128を集中させる電位(例えば、VL1及びVL2)を用いて高電圧電極を付勢するために設けられることがある。
【0020】
GCIB処理装置100によって処理されるワークピース10は、GCIB 128の経路に配置されたワークピース・ホルダ150に保持される。クリップ若しくはクランプでもよい任意的なリテーナ12、又は、その他の固定用アイテムがワークピース・ホルダ150上の取付位置にワークピース10を固定するため用いられることがある。ワークピース10の一様な処理が行われるように、ワークピース・ホルダ150は、均一な処理のため必要とされることがあるように、ワークピース10を適切に操作するため後述される仕方で設計される。
【0021】
図2をさらに参照すると、非平面的である、すなわち、(生物学的材料に共通して見られるような)球状若しくはカップ状の構造、丸みを帯びた構造、不規則な構造、又は、その他の非平坦構造でもよいワークピース表面は、ワークピース表面の最適なGCIB処理を実現するためにビーム入射に関してある角度の範囲内で方向付けられることがある。これは、処理最適化及び一様性をもたらすためにGCIBと適当なアライメントで処理されるすべての非平面的な表面を方向付けるため完全に関節化される能力をもつワークピース・ホルダ150を用いる。より具体的には、処理中のワークピース10が非平面的であるとき、ワークピース・ホルダ150は、GCIB処理装置100の端部に位置している機構部152によって回転させられ、関節化されることがある。関節/回転機構部152は、好ましくは、望ましいビーム入射範囲内にワークピース表面を維持するため、(GCIB 128の初期軌道154と同軸でもよい)縦軸155の周りの360度装置回転と、軸155に垂直である軸157の周りの十分な関節化とを可能にする。
【0022】
ある一定の条件下で、ワークピース10のサイズに依存して、走査システムは、大型ワークピースの一様な照射を生じることが望ましい。GCIB処理のため不可欠ではないが、2対の直角に方向付けされた静電走査プレート130及び132は、拡大された処理エリアにラスタ又はその他の走査パターンを生じるため利用されることがある。このようなビーム走査が実行されるとき、走査発生器156は、X軸走査信号電圧及びY軸走査信号電圧をリード線の対158及び160のそれぞれを介して2対の走査プレート130及び132に供給する。走査信号電圧は、一般に、GCIB 128を、ワークピース10の表面全体を走査する走査型GCIB 148に変換する異なる周波数をもつ三角波である。
【0023】
拡大された領域上のビーム走査が望ましくないとき、処理は、一般に、ビームの直径によって画定された領域に限られる。ワークピース表面でのビームの径は、ワークピースで望ましいビーム径をもたらすために1つ以上のレンズ電源(例えば、図示された142及び144)の電圧(VL1及び/又はVL2)を選択することにより設定できる。具体的に示されていないが、図1及び2では、このような従来技術のGCIB処理システムは、典型的に、処理に重要であるGCIBパラメータ(例えば、加速電位、ビーム電流、ビーム焦点、ガス流量、ワークピースに加えられるビーム照射量、ワークピース操作など)を測定し制御するセンサ及び回路を利用し、自動処理と、処理手法管理、選択及び制御のための付加的な制御及び自動化もさらに利用する。
【0024】
図1及び2は、ある種の平面的かつ簡単な形をした非平面的なワークピースを保持し操作するため適したワークピース・ホルダ及びマニピュレータを示すが、その他の種類のより簡単なホルダ及びマニピュレータとより複雑なホルダ及びマニピュレータが知られていることは、従来技術に精通した者によって理解されるであろう。例えば、Kirkpatrick他に付与された米国特許第6,676,989号は、血管ステントのような管状又は円筒状ワークピースを処理するため最適化されたホルダ及びマニピュレータを教示する。生物学的材料の多数の表面にGCIB照射を当てるためのマニピュレータは、当該技術に精通している者に知られることになるか、及び/又は、通常の技能だけを使用して容易に構築されることがある。
【0025】
試験が生物学的組織の(親水性の尺度としての)液滴接触角へのGCIB照射の影響を判定するため実行された。若いブタの膝が内側側副靱帯(MCL)及び外側側副靱帯(LCL)を大腿骨骨幹軸と共に採取するため使用された。靱帯は、その他の疎性結合組織から注意深く切り裂かれ、リン酸緩衝生理食塩水(PBS)で洗い流され、長さ約1cmと自然幅約5mmをもつ断片に切断された。骨幹軸は、長さ約2cmの円筒に切断され、さらに軸は、縦方向に切り落とされ半円形状の断片にされた。断片は、鉗子を使用して骨膜を引っ張ることにより骨膜が取り除かれ、その後にPBSで洗い流された。引き続く骨及び靱帯組織標本(対照を含む)の両方の処理は、同一であった。組織は、一晩中、PBSの中に保存された。その後、組織標本(骨及び靱帯の両方)は、PBSから取り出され、個別にGCIB処理システムの処理チャンバの中に導入された。処理チャンバは、約100ミリトールの低真空まで排気された(低真空を実現するための排気時間は、骨標本に対し約30分であり、靱帯標本に対し約2分であった)。低真空を実現後、標本は、引き続き、高真空に導入され、高真空(約6×10−5トール)に暴露された。骨組織及び靱帯組織の両方の試験標本は、その後、GCIB照射によって高真空中で処理された。対照標本は、照射されなかったが、同じ真空条件及び持続期間に晒された。GCIB照射は、30kV加速電位で1cm2当たり5×1014個のアルゴンクラスターの表面照射量を被照射表面に加えることからなる。照射時間及び対応する高真空暴露持続時間は、骨組織標本及び靱帯組織標本の両方共に約3分20秒であった。
【0026】
GCIB照射及び/又は真空暴露の後に続いて、組織標本は、生物学的安全キャビネットの中に一晩中空気乾燥するため放置された。
【0027】
標本の湿潤性は、液滴形状分析システムを使用して検査された(ドイツ国ハンブルグ市、Kruss GmbH製のモデルDSA−10、Kruss DSA1バージョン1.8分析ソフトウェア付きが組織標本上の水滴の表面接触角を判定するため使用された)。同一の測定が骨組織及び靱帯組織の照射された標本及び照射されていない対照標本の両方に対して行われた。測定毎に、データは、脱イオン水の3マイクロリットル液滴をそれぞれ(靱帯及び骨の照射された対照及び照射されていない対照の両方)の表面に置いた5秒後に取得された。すべての測定は、大気条件下で行われ、各分析は、3重に行われた(標本1つずつに3回の試験)。
【0028】
結果は、照射されていない対照標本と比較して、GCIB照射された靱帯標本及び骨標本の両方の減少した接触角によって測定されるように親水性の増加を示した。
【0029】
図3は、GCIB被照射標本及び非照射対照標本の両方の靱帯組織標本に関する3回の測定のそれぞれの液滴表面接触角試験結果を示すグラフ300である。靱帯組織上の脱イオン水を使用する液滴接触角測定は、GCIB処理に応じた靱帯組織上での表面親水性の減少を示す。液滴接触角は、非照射対照靱帯における平均55.59±9.03からGCIB被照射標本における36.09±10.93まで減少した(変化の統計的有意性p<0.004)。
【0030】
図4は、GCIB被照射標本及び非照射対照標本の両方の骨組織標本に関する3回の測定のそれぞれの液滴表面接触角試験結果を示すグラフ400である。骨組織上の脱イオン水を使用する液滴接触角測定は、GCIB処理に応じた骨組織上での表面親水性の増加を示す。液滴接触角は、非照射対照骨における平均72.86±1.47からGCIB被照射標本における61.42±1.06まで減少した(変化の統計的有意性p<0.015)。
【0031】
生物学的表面のGCIB処理がより高い親水性をもつ表面を生じるので、脱細胞化された靱帯のGCIB処理が(例えば)線維芽細胞を用いてより良く再細胞化することができる表面を生じることを示すために追加試験が行われた。ブタの前十字靱帯(ACL)が公開された外移植方法(Ross SM, Joshi R, and Frank CB; “Establishment and comparison of fibroblast cell lines from the medial collateral and anterior cruciate ligaments of the rabit”, In Vitro Cell Dev Biol 1990;26:579−84)を使用して線維芽細胞を採取するため使用された。若いブタの膝から新たに分離されたLCL及びMCLは、次に、確立された方法の技術(Woods T, Gratzer PF; “Effectiveness of three extraction techniques in the development of a decellularized bone−anterior cruciate ligament−bone graft”, Biomaterials 2005,26:7339−7349)を使用して脱細胞化された。
GCIB照射を除いて、靱帯組織標本(試験標本及び対照の両方)の引き続く処理は、同一であった。脱細胞化組織は、一晩中PBS中に保存された。その後、脱細胞化組織標本は、PBSから取り出され、GCIB処理システムの処理チャンバに個別に導入された。処理チャンバは、約100ミリトールの低真空まで排気された(低真空を実現するための排気時間は、靱帯標本に対し約2分であった)。低真空を実現後、標本は、引き続き、高真空に導入され、高真空(約6×10−5トール)に暴露された。脱細胞化靱帯組織の試験標本は、その後、GCIB照射によって高真空中で処理された。対照標本は、照射されなかったが、同じ真空条件及び持続期間に晒された。GCIB照射は、30kV加速電位で1cm2当たり5×1014個のアルゴンクラスターの表面照射量を被照射表面に加えることからなる。照射時間及び対応する高真空暴露持続時間は、両方の脱細胞化靱帯組織標本(照射及び対照)に対して約3分20秒であった。
【0032】
Sigma E1270細胞外マトリックス(ECM)中に懸濁する約2×105個の線維芽細胞が(脱細胞化され、照射された組織を新しい細胞でシードするため)靱帯標本の両側に載置され、適切な細胞成長培地(ダルベッコ改変イーグル培地と、10%ウシ胎仔血清と、(Invitrogenによって供給される)1%ペニシリン/ストレプトマイシン抗生物質)を含有する管の中に載置され、3日毎に規則的に培地を交換して18日間成長のため放置された。靱帯試料がその後にホルマリン中に固定され、組織学のため処理され、ヘマトキシリン及びエオシンで染色された。靱帯の顕微鏡検査は、GCIB処理なしの靱帯標本対照と比べて、GCIB処理を受けた靱帯標本上での非常に増強された細胞付着及び増殖を明らかにした。
【0033】
図5は、上述のように、真空暴露を含むが、GCIB照射なしで処理された、脱細胞化されたブタの靱帯組織504の非照射対照標本の表面領域502を示す顕微鏡写真500を示す。新たに成長した線維芽細胞の1−2細胞層506は、下にある靱帯組織504に付着していることが分かる。
【0034】
図6は、上述のように、真空暴露及びGCIB照射の両方を含む処理がなされた、脱細胞化されたブタの靱帯組織604のGCIB照射標本の表面領域602を示す顕微鏡写真600を示す。図6における倍率は、図5における倍率と同じである。図6では、新たに成長した線維芽細胞の3−7細胞層606が照射された表面で下にある靱帯組織604に付着していることが分かる。さらに、多数の新しい線維芽細胞(例えば、608A、608B及び608C)は、脱細胞化靱帯組織の中の非常に深い場所に埋め込まれていることが分かる。新たに成長した線維芽細胞は、GCIB被照射表面で増殖するのに加えて、靱帯に移動し始めた。
【0035】
これらの結果は、より活発な表面成長と靱帯への移動の増加とが見られるように、脱細胞化された靱帯の表面のGCIB照射が外側表面での線維芽細胞の付着、成長又は増殖のためのより好ましい環境を作り出したことを示唆する。靱帯への細胞の移動は、外科的移植のための靱帯組織エンジニアリングの分野において重要な進歩である。生物学的材料のGCIB処理は、(例えば、ACL再建のような)外科手術のための著しく改善された臨床転帰を生じることがある。これまでのところ、(例えば)ACL再建外科手術は、一部で、移植された靱帯又は腱組織の身体への統合が比較的弱いため、長い間に亘って成功を制限していた。GCIB処理された靱帯又は腱は、より急速に統合し、従来型のACL再建外科技術を用いて実現された利点を拡大するより堅固に接合された統合を形成することになる。
【0036】
初代培養細胞は、体外成長中に脱分化することはよく知られている。様々な成長因子及び分裂促進因子が細胞の当初の遺伝子型及び形態を維持するために培養に添加されることがある。初代ヒト骨芽細胞は、(Invitrogen)ダルベッコ改変イーグル培地と、10%ウシ胎仔血清と、1%ペニシリン/ストレプトマイシン抗生物質の中で見られる因子以外の付加的な成長因子又は分裂促進因子を含まない組織培養プレート中で2乃至4継代に亘って成長させられた。2乃至4継代の骨芽細胞は、対照状態か、又は、1cm2当たりに5×1014個のアルゴンクラスターでGCIBによって照射された状態のいずれかでチタンにシードされ、そして、骨芽細胞は、1日間、7日間、又は、10日間に亘って付着及び増殖のため放置された。この期間に続いて、RNAがTRIzol法(Invitrogen)を使用して細胞から抽出された。UV分光分析によるRNA定量化に続いて、等量のRNA(1マイクログラム)がiScript cDNA合成キット(Bio−Rad)を使用してcDNAに逆転写された。結果として得られた100ピコグラムのcDNAは、アルカリホスファターゼ−骨形成及び骨石化中に関連することが知られている肝臓、骨、腎臓(ALPL)と、オステオカルシンと呼ばれる骨タンパク質を生成することが知られ、ハウスキーピング遺伝子GAPDHが補正された骨γ−カルボキシグルタミン酸(gla)含有タンパク質(BGLAP)とを含む骨形成に関連することが知られている種々の遺伝子の発現解析のためリアルタイムポリメラーゼ連鎖反応(リアルタイムPCR)に晒された。発現解析は、TaqMan Gene Expression Master Mixと、遺伝子特異的プライマー(すべてApplied Biosystemsが提供)を用いるStepOneシステムで、条件及び時点毎にn=3で実行された。対照結果に対する倍率変化は、ΔΔCT法を使用して取得された。アルゴンGCIB処理されたチタン上で成長した骨芽細胞は、10日目にGCIB処理されていないチタンと比べて、ALPLにおいて3.41倍の増加をもたらし、BGLAPにおいて2.66倍の増加をもたらすことが明らかにされ(変化の統計的有意性p<0.05)、骨芽細胞が骨形成につながる分化を受けることを示す。このように、表面のGCIB処理だけで、GCIB処理された表面上で増殖する細胞の分化を誘発する。
【0037】
生物学的材料の場合、大抵は望ましくは、材料のうちの予め選択された部分だけがGCIB照射によって処理されるべきであり、その他の部分は照射されるべきでない。このような状況では、GCIBの照射の広がりを望ましいエリアだけに制限するために、GCIB断面積を制御し、GCIBの走査及び/又は偏向を制御することは、生物学的材料の選択された部分のGCIBの暴露を制御することがある。代替的に、従来のマスキング技術は、照射されることが望ましくない生物学的材料のマスク表面積を制御し、照射されることが望ましい表面積だけを暴露するため使用されることがある。その後、マスクと、マスクを通して暴露された生物学的材料とは、GCIBの拡散、又は、走査型GCIBを用いて照射される。GCIB照射を生物学的材料の選択された領域に制限する様々なその他の方法は、当業者に周知であり、本発明に包含されることが意図されている。
【0038】
生物学的材料のある一定の第1の被選択部分は、これらの被選択部分に第1のGCIB照射を実行して処理されることがある。生物学的材料の追加的な被選択部分は、1回以上の追加的なGCIB照射の処理を実行することによりさらに処理されることがある。追加的な(複数の)GCIB照射プロセスは、異なるGCIBと、真空処理条件、例えば、異なるGCIB照射量、又は、ガスクラスターイオンの中の異なる組成ガス、又は、(異なるイオンビームエネルギー及び速度を生じる)異なるビーム加速電位を用いることがある。追加的な被選択部分は、第1の被選択部分とは異なる部分でもよく、又は、第1の被選択部分に部分的若しくは完全に一致してもよく、又は、第1の被選択部分のすべてと追加部分とを含むことがある。このような選択的処理は、外科的移植又は接合後に、再細胞化と、引き続く身体への統合とにおいて異なる望ましい応答を導き出すために用いられることがある。
【0039】
さらに、生物学的材料の所定の断片は、単一のGCIB照射プロセスによってさらに一様に処理され、続いて、手術箇所、他の薬剤の塗布、又は、その他の局部的な要因に応じて、異なる積極的な仕方で外科的移植プロセスに応答することがある。例えば、ACL置換術のため使用される腱は、単一のGCIB照射プロセスを用いて一様に処理されることがある。外科的に移植されたとき、局部的な影響が原因となって、骨と接触した部分は、骨芽細胞の増強された移動、付着、及び、分化を促進し、固定用骨への腱の統合を促進する骨形成をもたらし、一方、その他の細胞型は、骨と接触していない移植された腱の他の部分へ優先的に引き付けられる。最も重要であるのは、滑液包部分で見られる靱帯線維芽細胞を含む線維芽細胞は(移植片は置換靱帯としての役割を果たす)、優先的に移植片に引き付けられ、接着し、そして、移植片に入ることである。
【0040】
多血小板血漿(PRP)と、反発性ガイダンス分子(RGMa、RGMb、及び/又は、RGMc)と、マクロファージコロニー刺激因子(M−CSF)、顆粒状マクロファージコロニー刺激因子(GM−CSF)、インターロイキン−1及びインターロイキン−9(IL1、IL6)、又は、腫瘍壊死因子α(TNFα)を含むサイトカインと、TGFβ−1、TGFβ−2、TGFβ−3、並びに、すべての骨形成タンパク質(BMPs)、アクチビンA、成長分化因子(GDF)、及び、ノーダルを含む形質転換成長因子(TGFβスーパーファミリー)のメンバーと、血小板由来成長因子(PDGF−AA、−AB、及び、−BB)と、線維芽細胞成長因子(FGF)と、インシュリンのような成長因子(IFG)と、上皮成長因子(EGF)と、又は、血管内皮成長因子(VEGF)のような適切な成長因子及び分化因子の直接的な投与によって、或いは、TGFβ又はTGFβ族のメンバーを含有する脱灰骨粉の投与によって、細胞再生が望ましい組織型を優先して分化できる。代替的に、関節滑膜腔、又は、レシピエントの大腿骨かどこかから採取された骨髄の軟膜層において見られる脂肪パッドからの間葉系幹細胞のin situ濃縮液を投与することにより、局所性のため適切な細胞へ自然に分化する細胞の再生が促進される。
【0041】
図7は、損傷した関節における靱帯置換術のための本発明の改善された生物学的材料の有利な適用の例示的な実施形態を示す膝関節の略図700である。この略図は、例示の目的のため示され、必ずしも正しい縮尺ではない。膝関節の前方十字靱帯(ACL)の破裂は、多くの場合に負傷したACLの置換の外科的移植を必要とする負傷である。靱帯若しくは腱、又は、これらの一部分は、置換移植片としての機能を果たすことがある。移植片は、自家組織、同種組織、又は、異種組織から得ることができる。種々の従来型の外科的修復術が存在する。改善されたアプローチは、図7に移植片718として指定された、脱細胞化され凍結乾燥されたGCIB照射された腱又は靱帯組織を使用する。略図700は、膝関節におけるACLの置換移植片の断面図である。大腿骨702の下端部には大腿骨軟骨706がある。脛骨704の上端部には、脛骨軟骨708がある。軟骨706と軟骨708とは、膝関節の関節接触表面を形成する。大腿骨702及び脛骨704の斜線エリアは、それぞれ、(外科的に切断されたのではなく、単に例示の目的のため)大腿骨702の切断面及び脛骨704の切断面を表す。便宜のため、断面は、置換移植片718が位置する平面を通して示される。トンネル710及び712は、大腿骨及び脛骨704のそれぞれにドリルで開けられ、さらに、骨の間の脛骨軟骨708と大腿骨軟骨706を貫通する。種々のトンネル構造が用いられ、トンネル710及び712のため示された構造は、単に実施例として意図された。明瞭さのため、膝蓋骨は示されず、関節を囲み、関節のすべての内面を濡らす滑液を維持する滑液包も示されない。本発明の置換移植片718は、トンネル710及び712の中に置かれ、それぞれ留め具714及び716によって大腿骨端部及び脛骨端部に締め付けられる。種々の留め具及び固定技術(金属及び生物分解性ポリマー留め具を含む)のうちのいずれが用いられてもよく、留め具714及び716は、単に例示的であることが意図されている。移植片718は、大腿骨トンネル710の中に挿入され、維持された大腿骨挿入部722を有し、脛骨トンネルの中に挿入され、維持された脛骨挿入部720を有している。
【0042】
一実施形態では、移植片718の脱細胞化され凍結乾燥されたGCIB被照射組織は、この移植片の外科的置換及び関節での締め付けの前に再建されない。関節を湿らせる滑液(図示せず)は、大腿骨挿入部722及び脛骨挿入部720の両方を含む移植片718と接触する。滑液の中の(又は、損傷し、摘出されたACLの残存線維の内部に存在する)線維芽細胞は、移植片718と接触し、移植片718に付着し、移植片718の内部で増殖する。これらの線維芽細胞は、成長し、適切な靱帯線維芽細胞に分化し、最終的に健康な組織を再建する。移植片718の大腿骨挿入部722及び脛骨挿入部720では、移植片が脛骨の中のトンネル712の骨、及び、大腿骨の中のトンネル710の骨と接触する場所で、挿入部720及び722は、血液及び骨芽細胞の前駆細胞を含有する骨組織と接触する。骨芽細胞は、移植片718の挿入部720及び722の表面に広がり、付着し、増殖し、そして、移植片718の挿入部720及び722の中の移植片構造体を最終的に完全に再モデル化し、置換する骨組織に分化する。
【0043】
別の実施形態では、移植片718の外科的配置の前に、挿入部720及び722になる移植片の部分、及び/又は、骨と共に挿入されない移植片の部分は、多血小板血漿(PRP)と、反発性ガイダンス分子(RGMa、RGMb、及び/又は、RGMc)と、マクロファージコロニー刺激因子(M−CSF)、顆粒状マクロファージコロニー刺激因子(GM−CSF)、インターロイキン−1及びインターロイキン−9(IL1、IL6)、又は、腫瘍壊死因子α(TNFα)を含むサイトカインと、TGFβ−1、TGFβ−2、TGFβ−3、並びに、すべての骨形成タンパク質(BMP)、アクチビンA、成長分化因子(GDF)、及び、ノーダルを含む形質転換成長因子(TGFβスーパーファミリー)のメンバーと、血小板由来成長因子(PDGF−AA、−AB、及び、−BB)と、線維芽細胞成長因子(FGF)と、インシュリンのような成長因子(IFG)と、上皮成長因子(EGF)と、又は、血管内皮成長因子(VEGF)のような適切な成長因子及び分化因子の追加で処理されることがある。代替的に、関節滑膜腔、又は、レシピエントの大腿骨かどこかから採取された骨髄の軟膜層において見られる脂肪パッドからの間葉系幹細胞のin situ濃縮液を投与することにより、局所性のため適切な細胞へ自然に分化する細胞の移殖片内部での再生が促進され、例えば、健康な骨の生成に向けて挿入部720及び722の中で付着し増殖する細胞の分化を促進する。
【0044】
さらに別の実施形態では、骨コラーゲンと、骨のその他の非石化成分とを含み、場合によっては、TGFβ又はTGFβ族のメンバーを含有する脱灰骨粉は、トンネル710及び712に挿入され、移植片718の挿入部722及び720と接触し、健康な骨の生成に向けて挿入部720及び722の中で付着し増殖する細胞の分化を促進する。
【0045】
さらなる実施形態では、関節滑膜腔、又は、患者の大腿骨かどこかから採取された骨髄の軟膜層において見られる脂肪パッドからの幹細胞が接触片718の挿入部720及び722にin situ投与され、健康な骨の生成に向けて挿入部720及び722の中で付着し増殖する細胞の分化を促進する。
【0046】
発明は、例示の目的のため、骨、靱帯及び腱を含むある種の材料の観点から説明されているが、その他の生物学的材料が本発明の範囲に含まれることが分かる。例示的な実施形態は、ACL関節修復の観点から説明されているが、広範囲のその他の関節及び軟組織移植片が本発明の恩恵を受け、本発明に含まれることが意図される。本発明の実施形態は、新鮮なブタの組織の観点から教示されているが、当業者は、用いられた技術が鳥類と人類を含むその他の哺乳類からの組織を含む、その他の組織への通常の変更と一体となって同様に用いられることが容易に分かることになり、発明者は、発明の方法が冷凍及び/又は凍結乾燥された外移植組織と一緒に、そして、類似の結果を伴う新鮮な外移植組織も同様に有利に用いることができることを実験的に確認している。
【0047】
腱組織及び靱帯組織は、当業者によく知られた従来の技術を使用して容易に凍結乾燥される。凍結乾燥された組織は、いくつかの利点を提供し、従って、本発明の技術の多数の潜在的な適用において好ましい。凍結乾燥された組織は、凍結乾燥された組織が新鮮な組織又は冷凍組織のどちらかより少ない蒸気を放出するので、プロセスのイオン照射フェーズの準備中、及び、期間中にイオンビーム照射ツールの真空システムにより小さい負荷を与える。付加的に、凍結乾燥された組織は、照射の後に続くかなりの期間に亘って劣化なしに保存でき、そして、凍結乾燥された組織の外科的移植のため、低コストの従来型の輸送方法によって遠く離れた場所へ容易に輸送又は運搬できる。凍結乾燥された被照射組織は、後に、外科的移植の直前に外科手術の場所で、(例えば、生理食塩水を用いて、又は、レシピエントの身体流体又はその他の適当な流体を用いて)再建されることがある。同様に、凍結乾燥された被照射組織は、外科的移植の直前に外科手術の場所で細胞を用いてシードすることができる。再建及び細胞シードは、移植片の適合性を高めるために細胞含有体液を用いて行われることさえある。代替的に、凍結乾燥された被照射組織は、凍結乾燥された状態でレシピエントに外科的移植可能であり、凍結乾燥された被照射組織がレシピエントの体液及び細胞に接触すると直ちに、移植片の場所で移植片組織のin situ再建及び細胞シードを生じる。一般に、凍結乾燥された被照射細胞の長い貯蔵期間は、かなりの柔軟性及び実用性を全体的な調製のプロセス及び移植片組織の移植成功に与える。
【0048】
本発明の方法と共に用いるため外移植された移植片材料は、種々の鳥類及び哺乳類の種(人類を含む)から採取されることがあり、本発明の方法によって調製された移植片材料の外科的移植は、多種多様の哺乳類の種(人類を含む)に行うことが可能であり、そして、このような移植片は、移植片組織のドナー及びレシピエントに応じて、同種移植片でもよく、自家移植片でもよく、又は、異種移植片でもよい。新しい細胞を採取し、(脱細胞化された組織及び/又は凍結乾燥された組織を含む)組織の上で成長させ、組織の中へシードする技術は、当業者に知られている技術に応じて、見込み移植片レシピエントから、又は、他の適当なドナー集団からの細胞を利用することがある。例示的なブタの靱帯を調製する際に用いられた外移植及び脱細胞化の技術は、腱組織に適用することも可能である。従って、本発明の方法は、当業者に周知の技術に従って、(必要に応じて)脱細胞化し、(必要に応じて)凍結乾燥し、そして、細胞付着及び増殖のため特定の新しい細胞を用いて、組織又は脱細胞化された組織をシードするため、(自家ドナーを含む)ドナー又は死体から腱、靱帯、又は、その他の組織を取り出すために使用できる。照射技術の使用によって、移植片材料への新しいセルの付着及び増殖の成功は、著しく改善され、レシピエントへの移植片の統合の成功可能性の増大と、全体的な医療結果の成功可能性の増大とに貢献する。
【0049】
本明細書中で使用されるように、用語「生物学的材料」は、限定されることなく、脱細胞化又は自然に細胞化された状態、生きているか又は死んでいる、新鮮、凍結、凍結及び解凍、凍結乾燥、凍結乾燥及び再建、イオン照射の有無にかかわらず、腱、靱帯、骨、軟骨、軟組織、及び、その他の組織からなる材料を含む生物学的由来のすべての組織材料を包含することを意図している。本発明は、特有の加速電位を用いて形成され、特有の照射量で投与されたGCIBの適用に関して説明されているが、その他の照射量及び加速電位が利用されてもよいことと、このような変形がGCIB照射の影響の程度に変化を生じることとが当業者によって認められることになる。本発明は、アルゴンガスで構成されたガスクラスターイオンを有するGCIBの適応に関して説明されているが、その他の組成のガス及びガス混合物も同様に有利に利用されることが当業者によって認められることになる。その他の組成のガス及びガス混合物は、希ガス、Ne、Ar、Xe及びその他のガスを含み、限定されることなく、有機及び無機の両方の酸素ガス、窒素ガス、二酸化炭素ガス、その他の炭素含有ガスを含み、その他のガスと混合されたこれらのいずれかのガスからなるガス混合物をさらに含み、このような変形は、GCIB照射の効果の程度及び形の変化を生じることになる。本発明は、以上の開示及び請求項に記載された事項の趣旨及び範囲の中で多種多様のさらなる実施形態及びその他の実施形態もまた可能であることが認められるべきである。
【技術分野】
【0001】
本発明は、一般に、哺乳類への移植用である生物学的材料に関し、特に、1)生物学的材料の表面への細胞付着のための宿主としての役割を果たし、2)生物学的材料の表面又は材料内部での細胞増殖を促進し、3)この生物学的材料の表面の中及び下での細胞浸透を促進し、及び/又は、4)その後の新組織形成を促進するために、湿潤性の改質、及び/又は、改質された生物学的材料の能力の改善を行うイオンビーム技術、好ましくは、ガスクラスターイオンビーム技術を使用する方法に関する。
【背景技術】
【0002】
ガスクラスターイオンビーム(GCIB)照射は、ナノスケール表面改質のため使用されている。同時係属中の、本願出願人により維持される米国特許出願第12/210,018号、名称“Method and System for Modifying the Wettability Characteristics of a Surface of a Medical Device by the Application of Gas Cluster Ion Beam Technology and Medical Devices Made Thereby”では、GCIBが非生物学的材料表面の親水性を改質させることが明らかにされている。GCIB処理は、半導体装置及び薄膜の製造において十分に文書化されている。しかし、筋骨格系(例えば、骨、靱帯、腱、回旋腱板、軟骨など)の組織を含む生物学的材料表面の改質と、主要な哺乳類及び鳥類の臓器系内部の上皮組織及び内皮組織のようなその他の結合組織の改質のためのGCIB処理の使用可能性は、これまでに知られていない。細胞付着の宿主構造としての役割を果たす靱帯表面の能力に関してGCIB処理が靱帯表面に生じさせる物理的改質は、これまでに知られていない。線維芽細胞及び骨芽細胞のような付着依存性細胞が十分に付着し、成長し、又は、分化するため親水性表面から恩恵を受けることと、これらの付着依存性細胞がさらに被帯電表面の方を好むこととは、一般的に知られている。親水性に関して、液滴接触角は、湿潤性の尺度として使用されることがあり、接触角測定量の減少は、一般に、より強い表面親水性を意味する。非生物学的表面上の親水性を増加させるか、又は、電荷を変化させるため、サンドブラスト法と、酸エッチング法と、プラズマ溶射コーティングと、CO2レーザー平滑化と、機械的洗浄技術、超音波洗浄技術、プラズマ洗浄技術、及び、化学的洗浄技術を含む種々の形式の洗浄法のような多数の方法がこれまでに使用されている。その他のアプローチは、界面活性剤の添加、又は、異なる湿潤性特性を有している膜若しくはコーティングの塗布を含んでいる。表面の親水性の増加、表面電荷状態の改質、又は、表面化学的性質の改質、その他のメカニズムのいずれかを用いる細胞付着の増強のためのGCIB照射による生物学的材料の表面の調製は、これまでに明らかにされていない。
【0003】
高エネルギー従来型のイオン、加速された帯電原子、又は、帯電分子のビームは、半導体装置接合を形成し、スパッタリングによって表面を改質させ、そして、薄膜の特性を改質させるために広範に利用される。従来型のイオンと異なって、ガスクラスターイオンは、標準的な温度及び圧力の条件下でガス状である材料(一般に、酸素、窒素、又は、例えば、アルゴンのような不活性ガスであるが、どのような凝縮性ガスでもガスクラスターイオンを生成するために使用できる)の多数の(典型的な分布が数百個乃至数千個であり、平均値が数千個である)弱結合原子又は分子のクラスターから形成され、各クラスターイオンは、1つ以上の電荷を共有し、高い総エネルギーをもつために(約3kV乃至約70kV以上のような)高電圧を通じて一緒に加速される。ガスクラスターイオンが形成され、加速された後、ガスクラスターイオンの電荷状態は、変更されてもよく、又は、変更状態にされてもよく(中和状態にされてもよく)、そして、ガスクラスターイオンは、より小さいクラスターイオン、及び/又は、中和されたより小さいクラスターに断片化されることがあるが、高電圧によって予め加速されることによって比較的高い総エネルギーを維持する傾向がある。ガスクラスターイオンビームは、洗浄、エッチング、平滑化、膜成長、などの目的で非生物学的材料の表面を処理するため使用されている。ガスクラスターイオンビームは、殆どの固体材料平面への平滑化効果のためよく知られ、ダイヤモンド、シリコン、及び、金属のような材料を平滑化するため使用されている。各ガスクラスターイオンの中の原子又は分子が多数であるため、かつ、原子又は分子が弱結合されているため、表面衝突時の原子又は分子の影響は、従来型の(モノマー又は分子)イオンと異なり、非常に浅い。クラスターは、衝突時に分裂させられ、各原子又は分子は、次に、加速クラスターの総エネルギーより比較的少ないエネルギー数eVだけを運ぶ。瞬時温度及び圧力は、ガスクラスターイオン衝突場所では、非常に高くなる可能性があり、種々の表面化学的性質、エッチング、及び、その他の影響が起こる可能性がある。表面化学的性質は、(例えば)表面接合を暴露することによりGCIB照射によって(従って、表面電荷状態を改質させることによって)、及び/又は、(酸素、窒素、炭素などのような反応原子又は分子を含むガスクラスターイオンを使用することにより)ガスクラスターイオンから表面へ反応原子又は分子を組み入れることによって改質させられることがある。しかし、これらの影響は、非常に表面的であり、衝突場所の下で多くても数十オングストロームだけ広がり、従って、表面的な表面衝突場所より下の深い位置にある材料には著しい破損がない。本明細書中で使用されるように、「GCIB」、「ガスクラスターイオンビーム」、及び、「ガスクラスターイオン」という用語は、加速の後に電荷状態の全部又は一部が改質(中和を含む)させられた加速ビーム及びイオンを包含することを目的とする。「GCIB」及び「ガスクラスターイオンビーム」という用語は、クラスター化されていない粒子をさらに含むことがあるとしても、加速ガスクラスターを含むすべてのビームを包含することを目的とする。GCIBは、イオン浸透が非常に浅く、数十オングストローム(数ナノメートル)より深い破損又は改質は無視できるという理由のため、本発明のための好ましいイオンビームである。
【発明の概要】
【発明が解決しようとする課題】
【0004】
一態様では、本発明は、ガスクラスターイオンビーム技術の適用によって生物学的材料の表面の湿潤性を増加させる、及び/又は、化学的性質若しくは電荷状態を変更する、及び/又は、その他の物理的特性を改質させる方法を提供する。
【0005】
さらなる態様では、本発明は、ガスクラスターイオンビーム技術の適用によって新しい細胞成長の付着、増殖、移動などのため、場合によっては、骨、線維性結合組織、上皮、内皮などのような組織に分化する新しい細胞の刺激用の生物学的材料の表面を調製する方法を提供する。
【0006】
さらに別の態様では、本発明は、ガスクラスターイオンビーム技術の適用によって、制御されたパターンで、生物学的材料の表面の一部の湿潤性を増加させる、及び/又は、新しい細胞成長の付着、増殖、移動などのため生物学的材料の表面を調製する方法を提供する。
【0007】
さらなる態様では、本発明は、ガスクラスターイオンビーム技術の適用によって、親水性が増加させられた表面又は表面部分を有している、及び/又は、細胞浸透の能力及び/又は新しい細胞の付着、成長及び分化のための宿主としての役割を果たす能力が増強された表面を有し、場合によっては、骨、繊維性結合組織、上皮、内皮などのような組織に分化する新しい細胞の刺激用の外科的に移植可能な生物学的材料を提供する。
【0008】
別の態様では、本発明は、外科的移植用の、そして、場合によっては、骨、繊維性結合組織、上皮、内皮などのような組織に分化する特定の細胞材料を刺激するための生物学的材料、及び移植片と、特定の細胞材料を生物学的材料片に組み込む生物学的材料片の調製及び/又は、外科的移植の方法とを提供する。
【課題を解決するための手段】
【0009】
本発明の上述の態様と、さらなる態様及びその他の態様と、利点とは、以下に説明される発明によって実現される。
【0010】
本発明は、表面の親水性若しくは湿潤性の程度のような表面特性を改質させるため、及び/又は、新しい細胞成長、及び/又は、例えば、骨、靱帯、腱、回旋腱板、軟骨などの筋骨格系の組織を含む生物学的材料への付着のための宿主としての役割を果たすために表面若しくは表面の一部分の適合性を改善するため、生物学的材料の表面若しくは表面の一部分のガスクラスターイオンビーム(GCIB)処理を適用する。マスキング技術の使用によって、又は、表面へのGCIBの入射を制御することにより、又は、GCIB処理の空間的広がりを制御するその他の手段によって、表面特性は、所望の領域が改質され、その他の領域が改質されない制御されたパターンで改質されることがある。このように、生物学的材料への細胞付着は(外科的に移植されたとき)、外科的結果の成功に適さない領域で細胞付着を促進することなく、所望の領域で容易にされることがある。
【0011】
発明者は、GCIB技術を用いて、例えば、(自然状態と脱細胞化状態の両方の状態で)骨及び靱帯のような筋骨格系の組織の表面を処理し、そして、ある種のGCIP処理が生物学的材料の表面の親水性の増加と、新しい細胞成長及び付着のための表面の適合性の改善とをもたらすことが分かった。本明細書中に記載された実施例は、構造的組織であるが、発明は、構造的組織に限定されない。
【0012】
パターン化された表面変化を生成するため、GCIB処理は、マスク若しくはビーム描画技術、又は、表面のある一定の領域に処理を制限するか、若しくは、ワークピースの様々な領域で様々なタイプのGCIB処理を生じるように、GCIB処理によるワークピース表面への暴露を制御する様々な他の手段を用いて制御されることがある。利用されるマスクは、ワークピースの一部分へのGCIB処理を遮断する機械的マスクでもよい。パターン化された表面変化の実現は、機械的マスクの使用に限定されない。
【0013】
本発明は、組織の外科的移植方法を提供する。この方法は、ドナーから移植片組織を外移植するステップと、移植片組織の少なくとも第1の部分にイオンビームを照射するステップと、移植片組織をレシピエントに外科的移植するステップとを含む。
【0014】
本発明は、ドナーから移植片組織を外移植するステップと、移植片組織の少なくとも第1の部分を脱細胞化するステップと、移植片組織の第1の部分のうちの少なくとも第2の部分を凍結乾燥するステップと、移植片組織の第2の部分のうちの少なくとも第3の部分に照射するステップと、移植片組織をレシピエントに外科的移植するステップとを含む、別の外科的移植方法をさらに提供する。この方法は、将来の使用のため移植片組織を保存する任意的なステップと、外科的移植のため移植片組織を離れた場所へ輸送する任意的なステップと、移植片組織の少なくとも第3の部分の少なくとも表面に細胞をシードする任意的なステップと、移植片組織の上又は中で細胞の望ましい程度の付着及び増殖を可能する任意的なステップとをさらに含む。
【0015】
本発明のその他の目的及びさらなる目的と共に、本発明をより良く理解するため、添付図面及び詳細な説明を参照し、本発明の範囲は、請求項において指示される。
【図面の簡単な説明】
【0016】
【図1】GCIB技術において知られ、かつ、本発明を実施するため適した型のガスクラスターイオンビーム処理システムの概略図である。
【図2】ワークピース・ホルダを示すガスクラスターイオンビーム処理システムの一部分の拡大図である。
【図3】本発明の実施形態による靱帯組織へのGCIB照射から生じる測定液滴接触角の減少を示すグラフである。
【図4】本発明の実施形態による骨組織へのGCIB照射から生じる測定液滴接触角の減少を示すグラフである。
【図5】対照靱帯標本上の細胞成長を示す顕微鏡写真である。
【図6】本発明の実施形態による処理された靱帯標本上の増強細胞成長を示す顕微鏡写真である。
【図7】本発明の改善された生物学的材料の有利な適用の例示的な実施形態を示す膝関節の略図である。
【発明を実施するための形態】
【0017】
表面処理の技術において知られた型の典型的なガスクラスターイオンビーム(GCIB)処理装置100を示す図面のうちの図1を参照する。本明細書中に記載された具体的なコンポーネントに制限されないが、処理装置100は、3つの連通するチャンバ108、すなわち、線源チャンバ104と、イオン化/加速チャンバ106と、ガスクラスターイオンビームによる処理のためワークピース10を位置合わせする能力をもつワークピース・ホルダ150を内部に含む処理チャンバ108とに分割された真空容器102で構成されている。
【0018】
使用中に、3つのチャンバは、真空ポンプシステム146a、146b、及び146cによってそれぞれに適当な動作圧力まで排出される。シリンダ111に蓄積された凝縮性線源ガス112(例えば、アルゴン又はN2)は、加圧下で、ガス調量弁113及びガス供給管114を通って、停滞チャンバ116に入れられ、適切に成形されたノズル110を通って実質的により低い圧力の中へ放出され、超音速ガスジェット118を生じる。ジェットの膨張から生じる冷却は、ガスジェット118の一部分を数百個から数千個(又は、さらに数万個)の弱結合原子又は分子でほとんど構成されたクラスターに凝集させる。ガス・スキマー・アパーチャ120は、このようなより高い圧力が有害である下流領域(例えば、イオナイザ122、高電圧電極126、及び、処理チャンバ108)における圧力を最小限に抑えるように、クラスタージェットに凝集されていないガス分子をクラスタージェットから部分的に分離する。適当な凝縮可能な線源ガス112は、必ずしも限定されることなく、(アルゴンのような)不活性ガスと、窒素と、二酸化炭素と、酸素とを含む。
【0019】
ガスクラスターを含有する超音速ガスジェット118が形成された後、クラスターは、イオナイザ122の中でイオン化される。イオナイザ122は、1つ以上の白熱フィラメント124から熱電子を生成し、電子を加速し、電子を案内してガスジェット118の中のガスクラスターと電子を衝突させる電子衝撃イオナイザでもよく、ジェットは、イオナイザ122の中を通過する。電子衝突は、クラスターから電子を放出させ、クラスターの一部分を正にイオン化させる。適当に付勢された高電圧電極126の組は、イオナイザ122からクラスターイオンを抽出し、ビームを形成し、その後に、加速電位(典型的に、1kVから数十kV程度まで)を用いてクラスターイオンを加速させ、初期軌道154を有するGCIB 128を形成するためクラスターイオンを集中させる。フィラメント電源136は、電圧VFを供給し、イオナイザ・フィラメント124を加熱する。アノード電源134は、電圧VAを供給し、フィラメントから放出された熱電子を加速し、熱電子をクラスター含有ガスジェット118に衝突させ、イオンを生成する。エクストラクション電源138は、電圧VEを供給し、高電圧電極を付勢し、イオナイザ122のイオン化領域からイオンを抽出し、GCIB 128を形成する。アクセラレータ電源140は、電圧VACCを供給し、イオナイザ122に関して高電圧電極を付勢し、その結果、VACCボルト(V)に一致する総GCIB加速電位を生じる。1つ以上のレンズ電源(例えば、142及び144)は、GCIB 128を集中させる電位(例えば、VL1及びVL2)を用いて高電圧電極を付勢するために設けられることがある。
【0020】
GCIB処理装置100によって処理されるワークピース10は、GCIB 128の経路に配置されたワークピース・ホルダ150に保持される。クリップ若しくはクランプでもよい任意的なリテーナ12、又は、その他の固定用アイテムがワークピース・ホルダ150上の取付位置にワークピース10を固定するため用いられることがある。ワークピース10の一様な処理が行われるように、ワークピース・ホルダ150は、均一な処理のため必要とされることがあるように、ワークピース10を適切に操作するため後述される仕方で設計される。
【0021】
図2をさらに参照すると、非平面的である、すなわち、(生物学的材料に共通して見られるような)球状若しくはカップ状の構造、丸みを帯びた構造、不規則な構造、又は、その他の非平坦構造でもよいワークピース表面は、ワークピース表面の最適なGCIB処理を実現するためにビーム入射に関してある角度の範囲内で方向付けられることがある。これは、処理最適化及び一様性をもたらすためにGCIBと適当なアライメントで処理されるすべての非平面的な表面を方向付けるため完全に関節化される能力をもつワークピース・ホルダ150を用いる。より具体的には、処理中のワークピース10が非平面的であるとき、ワークピース・ホルダ150は、GCIB処理装置100の端部に位置している機構部152によって回転させられ、関節化されることがある。関節/回転機構部152は、好ましくは、望ましいビーム入射範囲内にワークピース表面を維持するため、(GCIB 128の初期軌道154と同軸でもよい)縦軸155の周りの360度装置回転と、軸155に垂直である軸157の周りの十分な関節化とを可能にする。
【0022】
ある一定の条件下で、ワークピース10のサイズに依存して、走査システムは、大型ワークピースの一様な照射を生じることが望ましい。GCIB処理のため不可欠ではないが、2対の直角に方向付けされた静電走査プレート130及び132は、拡大された処理エリアにラスタ又はその他の走査パターンを生じるため利用されることがある。このようなビーム走査が実行されるとき、走査発生器156は、X軸走査信号電圧及びY軸走査信号電圧をリード線の対158及び160のそれぞれを介して2対の走査プレート130及び132に供給する。走査信号電圧は、一般に、GCIB 128を、ワークピース10の表面全体を走査する走査型GCIB 148に変換する異なる周波数をもつ三角波である。
【0023】
拡大された領域上のビーム走査が望ましくないとき、処理は、一般に、ビームの直径によって画定された領域に限られる。ワークピース表面でのビームの径は、ワークピースで望ましいビーム径をもたらすために1つ以上のレンズ電源(例えば、図示された142及び144)の電圧(VL1及び/又はVL2)を選択することにより設定できる。具体的に示されていないが、図1及び2では、このような従来技術のGCIB処理システムは、典型的に、処理に重要であるGCIBパラメータ(例えば、加速電位、ビーム電流、ビーム焦点、ガス流量、ワークピースに加えられるビーム照射量、ワークピース操作など)を測定し制御するセンサ及び回路を利用し、自動処理と、処理手法管理、選択及び制御のための付加的な制御及び自動化もさらに利用する。
【0024】
図1及び2は、ある種の平面的かつ簡単な形をした非平面的なワークピースを保持し操作するため適したワークピース・ホルダ及びマニピュレータを示すが、その他の種類のより簡単なホルダ及びマニピュレータとより複雑なホルダ及びマニピュレータが知られていることは、従来技術に精通した者によって理解されるであろう。例えば、Kirkpatrick他に付与された米国特許第6,676,989号は、血管ステントのような管状又は円筒状ワークピースを処理するため最適化されたホルダ及びマニピュレータを教示する。生物学的材料の多数の表面にGCIB照射を当てるためのマニピュレータは、当該技術に精通している者に知られることになるか、及び/又は、通常の技能だけを使用して容易に構築されることがある。
【0025】
試験が生物学的組織の(親水性の尺度としての)液滴接触角へのGCIB照射の影響を判定するため実行された。若いブタの膝が内側側副靱帯(MCL)及び外側側副靱帯(LCL)を大腿骨骨幹軸と共に採取するため使用された。靱帯は、その他の疎性結合組織から注意深く切り裂かれ、リン酸緩衝生理食塩水(PBS)で洗い流され、長さ約1cmと自然幅約5mmをもつ断片に切断された。骨幹軸は、長さ約2cmの円筒に切断され、さらに軸は、縦方向に切り落とされ半円形状の断片にされた。断片は、鉗子を使用して骨膜を引っ張ることにより骨膜が取り除かれ、その後にPBSで洗い流された。引き続く骨及び靱帯組織標本(対照を含む)の両方の処理は、同一であった。組織は、一晩中、PBSの中に保存された。その後、組織標本(骨及び靱帯の両方)は、PBSから取り出され、個別にGCIB処理システムの処理チャンバの中に導入された。処理チャンバは、約100ミリトールの低真空まで排気された(低真空を実現するための排気時間は、骨標本に対し約30分であり、靱帯標本に対し約2分であった)。低真空を実現後、標本は、引き続き、高真空に導入され、高真空(約6×10−5トール)に暴露された。骨組織及び靱帯組織の両方の試験標本は、その後、GCIB照射によって高真空中で処理された。対照標本は、照射されなかったが、同じ真空条件及び持続期間に晒された。GCIB照射は、30kV加速電位で1cm2当たり5×1014個のアルゴンクラスターの表面照射量を被照射表面に加えることからなる。照射時間及び対応する高真空暴露持続時間は、骨組織標本及び靱帯組織標本の両方共に約3分20秒であった。
【0026】
GCIB照射及び/又は真空暴露の後に続いて、組織標本は、生物学的安全キャビネットの中に一晩中空気乾燥するため放置された。
【0027】
標本の湿潤性は、液滴形状分析システムを使用して検査された(ドイツ国ハンブルグ市、Kruss GmbH製のモデルDSA−10、Kruss DSA1バージョン1.8分析ソフトウェア付きが組織標本上の水滴の表面接触角を判定するため使用された)。同一の測定が骨組織及び靱帯組織の照射された標本及び照射されていない対照標本の両方に対して行われた。測定毎に、データは、脱イオン水の3マイクロリットル液滴をそれぞれ(靱帯及び骨の照射された対照及び照射されていない対照の両方)の表面に置いた5秒後に取得された。すべての測定は、大気条件下で行われ、各分析は、3重に行われた(標本1つずつに3回の試験)。
【0028】
結果は、照射されていない対照標本と比較して、GCIB照射された靱帯標本及び骨標本の両方の減少した接触角によって測定されるように親水性の増加を示した。
【0029】
図3は、GCIB被照射標本及び非照射対照標本の両方の靱帯組織標本に関する3回の測定のそれぞれの液滴表面接触角試験結果を示すグラフ300である。靱帯組織上の脱イオン水を使用する液滴接触角測定は、GCIB処理に応じた靱帯組織上での表面親水性の減少を示す。液滴接触角は、非照射対照靱帯における平均55.59±9.03からGCIB被照射標本における36.09±10.93まで減少した(変化の統計的有意性p<0.004)。
【0030】
図4は、GCIB被照射標本及び非照射対照標本の両方の骨組織標本に関する3回の測定のそれぞれの液滴表面接触角試験結果を示すグラフ400である。骨組織上の脱イオン水を使用する液滴接触角測定は、GCIB処理に応じた骨組織上での表面親水性の増加を示す。液滴接触角は、非照射対照骨における平均72.86±1.47からGCIB被照射標本における61.42±1.06まで減少した(変化の統計的有意性p<0.015)。
【0031】
生物学的表面のGCIB処理がより高い親水性をもつ表面を生じるので、脱細胞化された靱帯のGCIB処理が(例えば)線維芽細胞を用いてより良く再細胞化することができる表面を生じることを示すために追加試験が行われた。ブタの前十字靱帯(ACL)が公開された外移植方法(Ross SM, Joshi R, and Frank CB; “Establishment and comparison of fibroblast cell lines from the medial collateral and anterior cruciate ligaments of the rabit”, In Vitro Cell Dev Biol 1990;26:579−84)を使用して線維芽細胞を採取するため使用された。若いブタの膝から新たに分離されたLCL及びMCLは、次に、確立された方法の技術(Woods T, Gratzer PF; “Effectiveness of three extraction techniques in the development of a decellularized bone−anterior cruciate ligament−bone graft”, Biomaterials 2005,26:7339−7349)を使用して脱細胞化された。
GCIB照射を除いて、靱帯組織標本(試験標本及び対照の両方)の引き続く処理は、同一であった。脱細胞化組織は、一晩中PBS中に保存された。その後、脱細胞化組織標本は、PBSから取り出され、GCIB処理システムの処理チャンバに個別に導入された。処理チャンバは、約100ミリトールの低真空まで排気された(低真空を実現するための排気時間は、靱帯標本に対し約2分であった)。低真空を実現後、標本は、引き続き、高真空に導入され、高真空(約6×10−5トール)に暴露された。脱細胞化靱帯組織の試験標本は、その後、GCIB照射によって高真空中で処理された。対照標本は、照射されなかったが、同じ真空条件及び持続期間に晒された。GCIB照射は、30kV加速電位で1cm2当たり5×1014個のアルゴンクラスターの表面照射量を被照射表面に加えることからなる。照射時間及び対応する高真空暴露持続時間は、両方の脱細胞化靱帯組織標本(照射及び対照)に対して約3分20秒であった。
【0032】
Sigma E1270細胞外マトリックス(ECM)中に懸濁する約2×105個の線維芽細胞が(脱細胞化され、照射された組織を新しい細胞でシードするため)靱帯標本の両側に載置され、適切な細胞成長培地(ダルベッコ改変イーグル培地と、10%ウシ胎仔血清と、(Invitrogenによって供給される)1%ペニシリン/ストレプトマイシン抗生物質)を含有する管の中に載置され、3日毎に規則的に培地を交換して18日間成長のため放置された。靱帯試料がその後にホルマリン中に固定され、組織学のため処理され、ヘマトキシリン及びエオシンで染色された。靱帯の顕微鏡検査は、GCIB処理なしの靱帯標本対照と比べて、GCIB処理を受けた靱帯標本上での非常に増強された細胞付着及び増殖を明らかにした。
【0033】
図5は、上述のように、真空暴露を含むが、GCIB照射なしで処理された、脱細胞化されたブタの靱帯組織504の非照射対照標本の表面領域502を示す顕微鏡写真500を示す。新たに成長した線維芽細胞の1−2細胞層506は、下にある靱帯組織504に付着していることが分かる。
【0034】
図6は、上述のように、真空暴露及びGCIB照射の両方を含む処理がなされた、脱細胞化されたブタの靱帯組織604のGCIB照射標本の表面領域602を示す顕微鏡写真600を示す。図6における倍率は、図5における倍率と同じである。図6では、新たに成長した線維芽細胞の3−7細胞層606が照射された表面で下にある靱帯組織604に付着していることが分かる。さらに、多数の新しい線維芽細胞(例えば、608A、608B及び608C)は、脱細胞化靱帯組織の中の非常に深い場所に埋め込まれていることが分かる。新たに成長した線維芽細胞は、GCIB被照射表面で増殖するのに加えて、靱帯に移動し始めた。
【0035】
これらの結果は、より活発な表面成長と靱帯への移動の増加とが見られるように、脱細胞化された靱帯の表面のGCIB照射が外側表面での線維芽細胞の付着、成長又は増殖のためのより好ましい環境を作り出したことを示唆する。靱帯への細胞の移動は、外科的移植のための靱帯組織エンジニアリングの分野において重要な進歩である。生物学的材料のGCIB処理は、(例えば、ACL再建のような)外科手術のための著しく改善された臨床転帰を生じることがある。これまでのところ、(例えば)ACL再建外科手術は、一部で、移植された靱帯又は腱組織の身体への統合が比較的弱いため、長い間に亘って成功を制限していた。GCIB処理された靱帯又は腱は、より急速に統合し、従来型のACL再建外科技術を用いて実現された利点を拡大するより堅固に接合された統合を形成することになる。
【0036】
初代培養細胞は、体外成長中に脱分化することはよく知られている。様々な成長因子及び分裂促進因子が細胞の当初の遺伝子型及び形態を維持するために培養に添加されることがある。初代ヒト骨芽細胞は、(Invitrogen)ダルベッコ改変イーグル培地と、10%ウシ胎仔血清と、1%ペニシリン/ストレプトマイシン抗生物質の中で見られる因子以外の付加的な成長因子又は分裂促進因子を含まない組織培養プレート中で2乃至4継代に亘って成長させられた。2乃至4継代の骨芽細胞は、対照状態か、又は、1cm2当たりに5×1014個のアルゴンクラスターでGCIBによって照射された状態のいずれかでチタンにシードされ、そして、骨芽細胞は、1日間、7日間、又は、10日間に亘って付着及び増殖のため放置された。この期間に続いて、RNAがTRIzol法(Invitrogen)を使用して細胞から抽出された。UV分光分析によるRNA定量化に続いて、等量のRNA(1マイクログラム)がiScript cDNA合成キット(Bio−Rad)を使用してcDNAに逆転写された。結果として得られた100ピコグラムのcDNAは、アルカリホスファターゼ−骨形成及び骨石化中に関連することが知られている肝臓、骨、腎臓(ALPL)と、オステオカルシンと呼ばれる骨タンパク質を生成することが知られ、ハウスキーピング遺伝子GAPDHが補正された骨γ−カルボキシグルタミン酸(gla)含有タンパク質(BGLAP)とを含む骨形成に関連することが知られている種々の遺伝子の発現解析のためリアルタイムポリメラーゼ連鎖反応(リアルタイムPCR)に晒された。発現解析は、TaqMan Gene Expression Master Mixと、遺伝子特異的プライマー(すべてApplied Biosystemsが提供)を用いるStepOneシステムで、条件及び時点毎にn=3で実行された。対照結果に対する倍率変化は、ΔΔCT法を使用して取得された。アルゴンGCIB処理されたチタン上で成長した骨芽細胞は、10日目にGCIB処理されていないチタンと比べて、ALPLにおいて3.41倍の増加をもたらし、BGLAPにおいて2.66倍の増加をもたらすことが明らかにされ(変化の統計的有意性p<0.05)、骨芽細胞が骨形成につながる分化を受けることを示す。このように、表面のGCIB処理だけで、GCIB処理された表面上で増殖する細胞の分化を誘発する。
【0037】
生物学的材料の場合、大抵は望ましくは、材料のうちの予め選択された部分だけがGCIB照射によって処理されるべきであり、その他の部分は照射されるべきでない。このような状況では、GCIBの照射の広がりを望ましいエリアだけに制限するために、GCIB断面積を制御し、GCIBの走査及び/又は偏向を制御することは、生物学的材料の選択された部分のGCIBの暴露を制御することがある。代替的に、従来のマスキング技術は、照射されることが望ましくない生物学的材料のマスク表面積を制御し、照射されることが望ましい表面積だけを暴露するため使用されることがある。その後、マスクと、マスクを通して暴露された生物学的材料とは、GCIBの拡散、又は、走査型GCIBを用いて照射される。GCIB照射を生物学的材料の選択された領域に制限する様々なその他の方法は、当業者に周知であり、本発明に包含されることが意図されている。
【0038】
生物学的材料のある一定の第1の被選択部分は、これらの被選択部分に第1のGCIB照射を実行して処理されることがある。生物学的材料の追加的な被選択部分は、1回以上の追加的なGCIB照射の処理を実行することによりさらに処理されることがある。追加的な(複数の)GCIB照射プロセスは、異なるGCIBと、真空処理条件、例えば、異なるGCIB照射量、又は、ガスクラスターイオンの中の異なる組成ガス、又は、(異なるイオンビームエネルギー及び速度を生じる)異なるビーム加速電位を用いることがある。追加的な被選択部分は、第1の被選択部分とは異なる部分でもよく、又は、第1の被選択部分に部分的若しくは完全に一致してもよく、又は、第1の被選択部分のすべてと追加部分とを含むことがある。このような選択的処理は、外科的移植又は接合後に、再細胞化と、引き続く身体への統合とにおいて異なる望ましい応答を導き出すために用いられることがある。
【0039】
さらに、生物学的材料の所定の断片は、単一のGCIB照射プロセスによってさらに一様に処理され、続いて、手術箇所、他の薬剤の塗布、又は、その他の局部的な要因に応じて、異なる積極的な仕方で外科的移植プロセスに応答することがある。例えば、ACL置換術のため使用される腱は、単一のGCIB照射プロセスを用いて一様に処理されることがある。外科的に移植されたとき、局部的な影響が原因となって、骨と接触した部分は、骨芽細胞の増強された移動、付着、及び、分化を促進し、固定用骨への腱の統合を促進する骨形成をもたらし、一方、その他の細胞型は、骨と接触していない移植された腱の他の部分へ優先的に引き付けられる。最も重要であるのは、滑液包部分で見られる靱帯線維芽細胞を含む線維芽細胞は(移植片は置換靱帯としての役割を果たす)、優先的に移植片に引き付けられ、接着し、そして、移植片に入ることである。
【0040】
多血小板血漿(PRP)と、反発性ガイダンス分子(RGMa、RGMb、及び/又は、RGMc)と、マクロファージコロニー刺激因子(M−CSF)、顆粒状マクロファージコロニー刺激因子(GM−CSF)、インターロイキン−1及びインターロイキン−9(IL1、IL6)、又は、腫瘍壊死因子α(TNFα)を含むサイトカインと、TGFβ−1、TGFβ−2、TGFβ−3、並びに、すべての骨形成タンパク質(BMPs)、アクチビンA、成長分化因子(GDF)、及び、ノーダルを含む形質転換成長因子(TGFβスーパーファミリー)のメンバーと、血小板由来成長因子(PDGF−AA、−AB、及び、−BB)と、線維芽細胞成長因子(FGF)と、インシュリンのような成長因子(IFG)と、上皮成長因子(EGF)と、又は、血管内皮成長因子(VEGF)のような適切な成長因子及び分化因子の直接的な投与によって、或いは、TGFβ又はTGFβ族のメンバーを含有する脱灰骨粉の投与によって、細胞再生が望ましい組織型を優先して分化できる。代替的に、関節滑膜腔、又は、レシピエントの大腿骨かどこかから採取された骨髄の軟膜層において見られる脂肪パッドからの間葉系幹細胞のin situ濃縮液を投与することにより、局所性のため適切な細胞へ自然に分化する細胞の再生が促進される。
【0041】
図7は、損傷した関節における靱帯置換術のための本発明の改善された生物学的材料の有利な適用の例示的な実施形態を示す膝関節の略図700である。この略図は、例示の目的のため示され、必ずしも正しい縮尺ではない。膝関節の前方十字靱帯(ACL)の破裂は、多くの場合に負傷したACLの置換の外科的移植を必要とする負傷である。靱帯若しくは腱、又は、これらの一部分は、置換移植片としての機能を果たすことがある。移植片は、自家組織、同種組織、又は、異種組織から得ることができる。種々の従来型の外科的修復術が存在する。改善されたアプローチは、図7に移植片718として指定された、脱細胞化され凍結乾燥されたGCIB照射された腱又は靱帯組織を使用する。略図700は、膝関節におけるACLの置換移植片の断面図である。大腿骨702の下端部には大腿骨軟骨706がある。脛骨704の上端部には、脛骨軟骨708がある。軟骨706と軟骨708とは、膝関節の関節接触表面を形成する。大腿骨702及び脛骨704の斜線エリアは、それぞれ、(外科的に切断されたのではなく、単に例示の目的のため)大腿骨702の切断面及び脛骨704の切断面を表す。便宜のため、断面は、置換移植片718が位置する平面を通して示される。トンネル710及び712は、大腿骨及び脛骨704のそれぞれにドリルで開けられ、さらに、骨の間の脛骨軟骨708と大腿骨軟骨706を貫通する。種々のトンネル構造が用いられ、トンネル710及び712のため示された構造は、単に実施例として意図された。明瞭さのため、膝蓋骨は示されず、関節を囲み、関節のすべての内面を濡らす滑液を維持する滑液包も示されない。本発明の置換移植片718は、トンネル710及び712の中に置かれ、それぞれ留め具714及び716によって大腿骨端部及び脛骨端部に締め付けられる。種々の留め具及び固定技術(金属及び生物分解性ポリマー留め具を含む)のうちのいずれが用いられてもよく、留め具714及び716は、単に例示的であることが意図されている。移植片718は、大腿骨トンネル710の中に挿入され、維持された大腿骨挿入部722を有し、脛骨トンネルの中に挿入され、維持された脛骨挿入部720を有している。
【0042】
一実施形態では、移植片718の脱細胞化され凍結乾燥されたGCIB被照射組織は、この移植片の外科的置換及び関節での締め付けの前に再建されない。関節を湿らせる滑液(図示せず)は、大腿骨挿入部722及び脛骨挿入部720の両方を含む移植片718と接触する。滑液の中の(又は、損傷し、摘出されたACLの残存線維の内部に存在する)線維芽細胞は、移植片718と接触し、移植片718に付着し、移植片718の内部で増殖する。これらの線維芽細胞は、成長し、適切な靱帯線維芽細胞に分化し、最終的に健康な組織を再建する。移植片718の大腿骨挿入部722及び脛骨挿入部720では、移植片が脛骨の中のトンネル712の骨、及び、大腿骨の中のトンネル710の骨と接触する場所で、挿入部720及び722は、血液及び骨芽細胞の前駆細胞を含有する骨組織と接触する。骨芽細胞は、移植片718の挿入部720及び722の表面に広がり、付着し、増殖し、そして、移植片718の挿入部720及び722の中の移植片構造体を最終的に完全に再モデル化し、置換する骨組織に分化する。
【0043】
別の実施形態では、移植片718の外科的配置の前に、挿入部720及び722になる移植片の部分、及び/又は、骨と共に挿入されない移植片の部分は、多血小板血漿(PRP)と、反発性ガイダンス分子(RGMa、RGMb、及び/又は、RGMc)と、マクロファージコロニー刺激因子(M−CSF)、顆粒状マクロファージコロニー刺激因子(GM−CSF)、インターロイキン−1及びインターロイキン−9(IL1、IL6)、又は、腫瘍壊死因子α(TNFα)を含むサイトカインと、TGFβ−1、TGFβ−2、TGFβ−3、並びに、すべての骨形成タンパク質(BMP)、アクチビンA、成長分化因子(GDF)、及び、ノーダルを含む形質転換成長因子(TGFβスーパーファミリー)のメンバーと、血小板由来成長因子(PDGF−AA、−AB、及び、−BB)と、線維芽細胞成長因子(FGF)と、インシュリンのような成長因子(IFG)と、上皮成長因子(EGF)と、又は、血管内皮成長因子(VEGF)のような適切な成長因子及び分化因子の追加で処理されることがある。代替的に、関節滑膜腔、又は、レシピエントの大腿骨かどこかから採取された骨髄の軟膜層において見られる脂肪パッドからの間葉系幹細胞のin situ濃縮液を投与することにより、局所性のため適切な細胞へ自然に分化する細胞の移殖片内部での再生が促進され、例えば、健康な骨の生成に向けて挿入部720及び722の中で付着し増殖する細胞の分化を促進する。
【0044】
さらに別の実施形態では、骨コラーゲンと、骨のその他の非石化成分とを含み、場合によっては、TGFβ又はTGFβ族のメンバーを含有する脱灰骨粉は、トンネル710及び712に挿入され、移植片718の挿入部722及び720と接触し、健康な骨の生成に向けて挿入部720及び722の中で付着し増殖する細胞の分化を促進する。
【0045】
さらなる実施形態では、関節滑膜腔、又は、患者の大腿骨かどこかから採取された骨髄の軟膜層において見られる脂肪パッドからの幹細胞が接触片718の挿入部720及び722にin situ投与され、健康な骨の生成に向けて挿入部720及び722の中で付着し増殖する細胞の分化を促進する。
【0046】
発明は、例示の目的のため、骨、靱帯及び腱を含むある種の材料の観点から説明されているが、その他の生物学的材料が本発明の範囲に含まれることが分かる。例示的な実施形態は、ACL関節修復の観点から説明されているが、広範囲のその他の関節及び軟組織移植片が本発明の恩恵を受け、本発明に含まれることが意図される。本発明の実施形態は、新鮮なブタの組織の観点から教示されているが、当業者は、用いられた技術が鳥類と人類を含むその他の哺乳類からの組織を含む、その他の組織への通常の変更と一体となって同様に用いられることが容易に分かることになり、発明者は、発明の方法が冷凍及び/又は凍結乾燥された外移植組織と一緒に、そして、類似の結果を伴う新鮮な外移植組織も同様に有利に用いることができることを実験的に確認している。
【0047】
腱組織及び靱帯組織は、当業者によく知られた従来の技術を使用して容易に凍結乾燥される。凍結乾燥された組織は、いくつかの利点を提供し、従って、本発明の技術の多数の潜在的な適用において好ましい。凍結乾燥された組織は、凍結乾燥された組織が新鮮な組織又は冷凍組織のどちらかより少ない蒸気を放出するので、プロセスのイオン照射フェーズの準備中、及び、期間中にイオンビーム照射ツールの真空システムにより小さい負荷を与える。付加的に、凍結乾燥された組織は、照射の後に続くかなりの期間に亘って劣化なしに保存でき、そして、凍結乾燥された組織の外科的移植のため、低コストの従来型の輸送方法によって遠く離れた場所へ容易に輸送又は運搬できる。凍結乾燥された被照射組織は、後に、外科的移植の直前に外科手術の場所で、(例えば、生理食塩水を用いて、又は、レシピエントの身体流体又はその他の適当な流体を用いて)再建されることがある。同様に、凍結乾燥された被照射組織は、外科的移植の直前に外科手術の場所で細胞を用いてシードすることができる。再建及び細胞シードは、移植片の適合性を高めるために細胞含有体液を用いて行われることさえある。代替的に、凍結乾燥された被照射組織は、凍結乾燥された状態でレシピエントに外科的移植可能であり、凍結乾燥された被照射組織がレシピエントの体液及び細胞に接触すると直ちに、移植片の場所で移植片組織のin situ再建及び細胞シードを生じる。一般に、凍結乾燥された被照射細胞の長い貯蔵期間は、かなりの柔軟性及び実用性を全体的な調製のプロセス及び移植片組織の移植成功に与える。
【0048】
本発明の方法と共に用いるため外移植された移植片材料は、種々の鳥類及び哺乳類の種(人類を含む)から採取されることがあり、本発明の方法によって調製された移植片材料の外科的移植は、多種多様の哺乳類の種(人類を含む)に行うことが可能であり、そして、このような移植片は、移植片組織のドナー及びレシピエントに応じて、同種移植片でもよく、自家移植片でもよく、又は、異種移植片でもよい。新しい細胞を採取し、(脱細胞化された組織及び/又は凍結乾燥された組織を含む)組織の上で成長させ、組織の中へシードする技術は、当業者に知られている技術に応じて、見込み移植片レシピエントから、又は、他の適当なドナー集団からの細胞を利用することがある。例示的なブタの靱帯を調製する際に用いられた外移植及び脱細胞化の技術は、腱組織に適用することも可能である。従って、本発明の方法は、当業者に周知の技術に従って、(必要に応じて)脱細胞化し、(必要に応じて)凍結乾燥し、そして、細胞付着及び増殖のため特定の新しい細胞を用いて、組織又は脱細胞化された組織をシードするため、(自家ドナーを含む)ドナー又は死体から腱、靱帯、又は、その他の組織を取り出すために使用できる。照射技術の使用によって、移植片材料への新しいセルの付着及び増殖の成功は、著しく改善され、レシピエントへの移植片の統合の成功可能性の増大と、全体的な医療結果の成功可能性の増大とに貢献する。
【0049】
本明細書中で使用されるように、用語「生物学的材料」は、限定されることなく、脱細胞化又は自然に細胞化された状態、生きているか又は死んでいる、新鮮、凍結、凍結及び解凍、凍結乾燥、凍結乾燥及び再建、イオン照射の有無にかかわらず、腱、靱帯、骨、軟骨、軟組織、及び、その他の組織からなる材料を含む生物学的由来のすべての組織材料を包含することを意図している。本発明は、特有の加速電位を用いて形成され、特有の照射量で投与されたGCIBの適用に関して説明されているが、その他の照射量及び加速電位が利用されてもよいことと、このような変形がGCIB照射の影響の程度に変化を生じることとが当業者によって認められることになる。本発明は、アルゴンガスで構成されたガスクラスターイオンを有するGCIBの適応に関して説明されているが、その他の組成のガス及びガス混合物も同様に有利に利用されることが当業者によって認められることになる。その他の組成のガス及びガス混合物は、希ガス、Ne、Ar、Xe及びその他のガスを含み、限定されることなく、有機及び無機の両方の酸素ガス、窒素ガス、二酸化炭素ガス、その他の炭素含有ガスを含み、その他のガスと混合されたこれらのいずれかのガスからなるガス混合物をさらに含み、このような変形は、GCIB照射の効果の程度及び形の変化を生じることになる。本発明は、以上の開示及び請求項に記載された事項の趣旨及び範囲の中で多種多様のさらなる実施形態及びその他の実施形態もまた可能であることが認められるべきである。
【特許請求の範囲】
【請求項1】
ドナーから移植片組織を外移植することと、
前記移植片組織の少なくとも第1の部分にイオンビームを照射することと、
前記移植片組織をレシピエントに外科的移植することと、
を含む、組織の外科的移植方法。
【請求項2】
前記ドナーは、哺乳類種又は鳥類種であり、前記レシピエントは、哺乳類である、請求項1に記載の方法。
【請求項3】
前記移植片組織は、同種移植片、自家移植片、又は、異種移植片である、請求項2に記載の方法。
【請求項4】
前記移植片組織は、靱帯組織又は腱組織である、請求項1に記載の方法。
【請求項5】
前記照射することの前に前記移植片組織を凍結乾燥することをさらに含む、請求項1に記載の方法。
【請求項6】
前記照射することの前に前記移植片組織の少なくとも第2の部分を脱細胞化することをさらに含み、前記第1の部分は、前記第2の部分のうちの少なくとも一部を含む、請求項1に記載の方法。
【請求項7】
前記凍結乾燥することの前に前記移植片組織の少なくとも第2の部分を脱細胞化することをさらに含み、前記第1の部分は、前記第2の部分のうちの少なくとも一部を含む、請求項5に記載の方法。
【請求項8】
シードするため細胞を採取することと、
前記外科的移植することの前に、採取された細胞を用いて前記少なくとも第1の部分のうちの少なくとも第3の部分をシードすることと、
をさらに含む、請求項1に記載の方法。
【請求項9】
前記採取された細胞は、前記レシピエントから採取された細胞である、請求項8に記載の方法。
【請求項10】
前記凍結乾燥すること及び前記照射することの後に、かつ、前記外科的移植することの前に、前記移植片組織を再建することをさらに含む、請求項5に記載の方法。
【請求項11】
前記凍結乾燥すること及び前記照射することの後に、かつ、前記シードすることの前に、前記移植片組織を再建することをさらに含む、請求項8に記載の方法。
【請求項12】
前記外科的移植することにおいて、in situ再建又はシードのため、前記少なくとも第2の部分を前記レシピエントからの体液又は細胞と接触させる、請求項6に記載の方法。
【請求項13】
前記外科的移植することの前に、前記外科的移植のため、前記移植片組織を離れた場所へ輸送することをさらに含む、請求項5に記載の方法。
【請求項14】
前記イオンビームはガスクラスターイオンビームである、請求項1に記載の方法。
【請求項15】
ドナーから移植片組織を外移植することと、
前記移植片組織の少なくとも第1の部分を脱細胞化することと、
前記移植片組織の前記第1の部分のうちの少なくとも第2の部分を凍結乾燥することと、
前記移植片組織の前記第2の部分のうちの少なくとも第3の部分に照射することと、
将来の使用のため前記移植片組織を任意的に保存することと、
外科的移植のため前記移植片組織を離れた場所へ任意的に輸送することと、
前記移植片組織の前記少なくとも第3の部分の少なくとも表面に細胞を任意的にシードすることと、
前記移植片組織の上又は中に、前記細胞を所望の程度、任意的に付着及び増殖させることと、
前記移植片組織をレシピエントに外科的移植することと、
を含む、外科的移植方法。
【請求項16】
前記第1の部分、前記第2の部分、又は、前記第3の部分は、少なくとも共通表面部分を有している、請求項15に記載の方法。
【請求項17】
成長因子と、
サイトカインと、
分化因子と、
脱灰骨粉と、
幹細胞と、
からなる群より選択された成分を含有する組成物を前記移植片組織に暴露することをさらに含む、請求項15に記載の方法。
【請求項1】
ドナーから移植片組織を外移植することと、
前記移植片組織の少なくとも第1の部分にイオンビームを照射することと、
前記移植片組織をレシピエントに外科的移植することと、
を含む、組織の外科的移植方法。
【請求項2】
前記ドナーは、哺乳類種又は鳥類種であり、前記レシピエントは、哺乳類である、請求項1に記載の方法。
【請求項3】
前記移植片組織は、同種移植片、自家移植片、又は、異種移植片である、請求項2に記載の方法。
【請求項4】
前記移植片組織は、靱帯組織又は腱組織である、請求項1に記載の方法。
【請求項5】
前記照射することの前に前記移植片組織を凍結乾燥することをさらに含む、請求項1に記載の方法。
【請求項6】
前記照射することの前に前記移植片組織の少なくとも第2の部分を脱細胞化することをさらに含み、前記第1の部分は、前記第2の部分のうちの少なくとも一部を含む、請求項1に記載の方法。
【請求項7】
前記凍結乾燥することの前に前記移植片組織の少なくとも第2の部分を脱細胞化することをさらに含み、前記第1の部分は、前記第2の部分のうちの少なくとも一部を含む、請求項5に記載の方法。
【請求項8】
シードするため細胞を採取することと、
前記外科的移植することの前に、採取された細胞を用いて前記少なくとも第1の部分のうちの少なくとも第3の部分をシードすることと、
をさらに含む、請求項1に記載の方法。
【請求項9】
前記採取された細胞は、前記レシピエントから採取された細胞である、請求項8に記載の方法。
【請求項10】
前記凍結乾燥すること及び前記照射することの後に、かつ、前記外科的移植することの前に、前記移植片組織を再建することをさらに含む、請求項5に記載の方法。
【請求項11】
前記凍結乾燥すること及び前記照射することの後に、かつ、前記シードすることの前に、前記移植片組織を再建することをさらに含む、請求項8に記載の方法。
【請求項12】
前記外科的移植することにおいて、in situ再建又はシードのため、前記少なくとも第2の部分を前記レシピエントからの体液又は細胞と接触させる、請求項6に記載の方法。
【請求項13】
前記外科的移植することの前に、前記外科的移植のため、前記移植片組織を離れた場所へ輸送することをさらに含む、請求項5に記載の方法。
【請求項14】
前記イオンビームはガスクラスターイオンビームである、請求項1に記載の方法。
【請求項15】
ドナーから移植片組織を外移植することと、
前記移植片組織の少なくとも第1の部分を脱細胞化することと、
前記移植片組織の前記第1の部分のうちの少なくとも第2の部分を凍結乾燥することと、
前記移植片組織の前記第2の部分のうちの少なくとも第3の部分に照射することと、
将来の使用のため前記移植片組織を任意的に保存することと、
外科的移植のため前記移植片組織を離れた場所へ任意的に輸送することと、
前記移植片組織の前記少なくとも第3の部分の少なくとも表面に細胞を任意的にシードすることと、
前記移植片組織の上又は中に、前記細胞を所望の程度、任意的に付着及び増殖させることと、
前記移植片組織をレシピエントに外科的移植することと、
を含む、外科的移植方法。
【請求項16】
前記第1の部分、前記第2の部分、又は、前記第3の部分は、少なくとも共通表面部分を有している、請求項15に記載の方法。
【請求項17】
成長因子と、
サイトカインと、
分化因子と、
脱灰骨粉と、
幹細胞と、
からなる群より選択された成分を含有する組成物を前記移植片組織に暴露することをさらに含む、請求項15に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公表番号】特表2012−520143(P2012−520143A)
【公表日】平成24年9月6日(2012.9.6)
【国際特許分類】
【出願番号】特願2011−554199(P2011−554199)
【出願日】平成22年3月11日(2010.3.11)
【国際出願番号】PCT/US2010/026984
【国際公開番号】WO2010/105056
【国際公開日】平成22年9月16日(2010.9.16)
【出願人】(508216552)エクソジェネシス コーポレーション (7)
【Fターム(参考)】
【公表日】平成24年9月6日(2012.9.6)
【国際特許分類】
【出願日】平成22年3月11日(2010.3.11)
【国際出願番号】PCT/US2010/026984
【国際公開番号】WO2010/105056
【国際公開日】平成22年9月16日(2010.9.16)
【出願人】(508216552)エクソジェネシス コーポレーション (7)
【Fターム(参考)】
[ Back to top ]

