ガラクトースの資化能を有するDNA、これを連結したベクター、及びこれらを導入した微生物
【課題】ガラクトースの資化に関与するDNA(遺伝子)であって、過剰発現によればガラクトースの資化能を増大させることのできる新規なDNA(遺伝子)を提供する。
【解決手段】過剰発現によりガラクトースの資化能を増大させるDNA(遺伝子)、これを連結した組み換えベクター、及びこれらを導入した組み換え微生物に関する。さらに、これらを利用してガラクトースを含む炭素源からバイオアルコールを生産する方法、及び過剰発現によってガラクトースの資化性を向上させる酵母の原因遺伝子を選別する方法に関する。上記のDNA(遺伝子)を過剰発現することによって、ガラクトースの代謝率を顕著に増大させることができる。そのため、ガラクトースを炭素源として、バイオアルコールの生産性を大きく増大させることができる。
【解決手段】過剰発現によりガラクトースの資化能を増大させるDNA(遺伝子)、これを連結した組み換えベクター、及びこれらを導入した組み換え微生物に関する。さらに、これらを利用してガラクトースを含む炭素源からバイオアルコールを生産する方法、及び過剰発現によってガラクトースの資化性を向上させる酵母の原因遺伝子を選別する方法に関する。上記のDNA(遺伝子)を過剰発現することによって、ガラクトースの代謝率を顕著に増大させることができる。そのため、ガラクトースを炭素源として、バイオアルコールの生産性を大きく増大させることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ガラクトースの資化能を有するDNA、これを連結したベクター、及びこれらを導入した微生物に関する。より具体的には、過剰発現(overexpression)によりガラクトースの資化能を増大させるDNA(遺伝子)、これを連結した組み換えベクター、及びこれらを導入した組み換え微生物に関する。
【背景技術】
【0002】
世界的に化石燃料を過剰に使用することによる資源枯渇及び環境汚染という虞が増大しつつある。このような状況の下で、安定的且つ持続的にエネルギーを生産・供給可能な、新たな再生エネルギーの登場が求められている。このような代替エネルギー開発の一環として、バイオマスからエネルギーを生産する技術が注目されている。
【0003】
近年、このようなバイオマスを実現し得る生物として、海藻類に対する関心が高まっている。かかる潜在的な生物と言える海藻類の特長は、自然界に豊富に存在し、且つライフサイクルが短いという点にある。また、海藻類は、二酸化炭素を消費して酸素を排出するという代謝を行うため、エネルギー生産と環境問題とを共に解決できるという長所を有する。しかし、海藻類を広く利用し、代替エネルギーとして一般に供給可能な程度までエネルギーを生産できていないのが現状である。
【0004】
一方、海藻類(特に紅藻類)由来のバイオマスの加水分解物には、ガラクトースが豊富に存在する。したがって、海藻類由来のバイオマスの加水分解物を、酵母を利用して有用物質へと転換することを実現するためには、加水分解物に多量に含有されているガラクトースの効果的な利用が最先に実現されなければならない。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】米国特許第7393669号明細書
【非特許文献】
【0006】
【非特許文献1】Bro C, Knudsen S, Regenberg B, Olsson L, Nielsen J. 2005. Improvement of galactose uptake in Saccharomyces cerevisiae through overexpression of phosphoglucomutase: example of transcript analysis as a tool in inverse metabolic engineering. Appl. Environ. Microbiol. 71(11):6465-72
【非特許文献2】Ostergaard S, Walloe KO, Gomes SG, Olsson L, Nielsen J. 2001. The impact of GAL6, GAL80, and MIG1 on glucose control of the GAL system in Saccharomyces cerevisiae. FEMS Yeast Res. 1(1):47-55.
【非特許文献3】Ostergaard S, Olsson L, Johnston M, Nielsen J. Increasing galactose consumption by Saccharomyces cerevisiae through metabolic engineering of the GAL gene regulatory network. 2000. Nat. Biotechnol. 18(12):1283-6.
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、自然界に存在する酵母の場合、ガラクトース代謝はするものの、その代謝速度はグルコースに比べて顕著に小さいため、実用化には程遠いという問題があった。
【0008】
そこで本発明の目的は、ガラクトースの資化に関与するDNA(遺伝子)であって、過剰発現によればガラクトースの資化能を増大させることのできる新規なDNA(遺伝子)を提供する。
【0009】
また、本発明の他の目的は、上記の新規なDNA(遺伝子)で形質転換した酵母を利用して、ガラクトースを含む炭素源からバイオアルコールの生産性を増大させる方法を提供することである。
【0010】
また、本発明のさらに他の目的は、ガラクトースの資化能を増大することのできる多様な酵母中の原因遺伝子を一度に同定可能な、ゲノムレベルのシステム生命工学的手法を提供することである。
【課題を解決するための手段】
【0011】
上記目的を達成するための本発明は、(A)配列番号:1に示される塩基配列からなるDNA、(B)配列番号:1に示される塩基配列において、1個または数個の塩基が欠失、置換、挿入または付加された塩基配列からなるDNA、及び(C)(A)の塩基配列と相補的な塩基配列にストリンジェントな条件下でハイブリダイズする塩基配列からなるDNAからなる群より選ばれるDNAであって、ガラクトースの資化性を発揮させるRNAをコードするDNAである。
【0012】
上記目的を達成するための本発明のベクターは、上記のDNAを連結してなる。
【0013】
上記目的を達成するための本発明の微生物は、上記のベクター(連結された目的DNAを含む)を利用して形質転換されてなる。
【0014】
上記目的を達成するための本発明のガラクトース資化能の増大方法は、ガラクトースを含む炭素源を微生物に資化させることを含むガラクトース資化能の増大方法であって、上記のDNA、上記のベクター、または上記の微生物を利用することにより、前記DNAを過剰発現することを特徴とする。
【0015】
上記目的を達成するための本発明のバイオアルコールの生産方法は、ガラクトースを含む炭素源を微生物に資化させることを含むバイオアルコールの生産方法であって、上記のDNA、上記のベクター、または上記の微生物を利用することを特徴とする。
【0016】
上記目的を達成するための本発明の酵母の原因遺伝子の選別方法は、遺伝子を過剰発現させてガラクトースの資化能を増大させる、酵母の原因遺伝子の選別方法であって、トリプトファンを含むマルチコピープラスミドを利用して酵母のゲノムDNAのライブラリーを構築する段階と、構築した前記ライブラリー中のゲノムDNAを酵母に形質転換させ、酵母の全遺伝子を過剰発現させて、形質転換酵母のライブラリーを製作する段階と、製作した前記ライブラリー中の形質転換酵母を、ガラクトースを唯一の炭素源として含む培地中で連続継代培養し、巨大コロニーを形成する、形質転換酵母を選別する段階と、選別した前記形質転換酵母からプラスミドを単離(回収)し、単離(回収)されたプラスミドに挿入された酵母の遺伝子配列を確認する段階とを含む。
【0017】
上記目的を達成するための本発明の遺伝子は、上記の選別方法により選別された、過剰発現によってガラクトースの資化性を増大させる。
【発明の効果】
【0018】
本発明によれば、目的DNA(遺伝子)の過剰発現によって、ガラクトースの資化性が著しく増大し、同時にエタノールの生産性も顕著に増大させることができる。
【発明を実施するための形態】
【0019】
以下、添付した図面を参照して本発明を適用した最良の実施形態を説明する。本発明の利点、特徴、及びこれを実現するための筋道は、以下の各実施形態における詳細な説明及び添付された図面を参照することにより、さらに容易に理解できる。しかしながら、本発明は、本明細書における説明以外の多様な形態で実施することもできる。したがって、本明細書で言及した実施形態のみに限定されることはない。
【0020】
[第1実施形態:ガラクトースの資化性を発揮させるRNAをコードするDNA]
本発明に係る第1実施形態は、(A)配列番号:1に示される塩基配列からなるDNA、(B)配列番号:1に示される塩基配列において、1個または数個の塩基が欠失、置換、挿入または付加された塩基配列からなるDNA、及び(C)(A)の塩基配列と相補的な塩基配列にストリンジェントな条件下でハイブリダイズする塩基配列からなるDNAからなる群より選ばれるDNAであって、ガラクトースの資化能を有するDNAに関する。
【0021】
本実施形態の対象であるDNAは、ガラクトースの資化性を発揮させるRNAをコードし、さらに、過剰発現によってガラクトース資化能を増大させることのできる遺伝子ということができる。本明細書では以下、上記(A)に係るDNAを「SNR84遺伝子」ともいう。(A)、(B)及び(C)に係るDNAのなかでも好ましくは(A)に係るDNAである。
【0022】
本発明者らは、このようなSNR84遺伝子が過剰発現した酵母において、驚くべきことに、ガラクトースの資化能が著しく増大することを最初に確認した。
【0023】
ここで、本実施形態に係るDNA(遺伝子)のメカニズムについて説明する。本実施形態に係るDNAは、酵母のBox H/ACA snoRNA(核小体低分子RNA:small nucleolar RNA)をコードしている。換言すれば、本実施形態に係るDNAは、ガラクトースの資化性を発揮させるRNA(SNR84 snoRNA)をコードするDNA(snr84 DNA)である。ここで、snoRNAとは、核小体内に局在し、リボゾーマルRNA(rRNA)前駆体のスプライシングに関与する比較的低分子のRNAを意味し、2つのグループに類別され、特異的な蛋白質とsnoRNP(スノープス)を形成している。Box H/ACA snoRNAは、そのうちの1グループである。Box H/ACA snoRNAは、RNAの両末端にBox H及びACAという共通のbox配列を有しており、Gar1という共通のタンパク質が結合する。Box H/ACA snoRNAは、rRNA(の大きなサブユニット)と短い塩基対を形成し、これによりrRNA(の大きなサブユニット)の修飾(シュードウリジン化;pseudouridylation)部位を決定する誘導RNA(gRNA)として機能することが明らかとなってきている。
【0024】
ガラクトースの資化能が著しく増大する理由は明らかではないものの、これまでの試行錯誤の結果より、以下のように推測される。すなわち、本実施形態に係るDNAが過剰発現されてSNR84 RNAの機能が活性化されることにより、rRNAのシュードウリジン化が促進され、結果としてガラクトースの資化能が増大されるメカニズムが作用するものと推測される。より具体的にいえば、rRNA(の大きなサブユニット)をシュードウリジン化するSNR84遺伝子の機能が活性化することによって、rRNAの成熟速度及び生成量が顕著に増大する。そこで、初期対数期(exponential phase)で成熟rRNAが早期に形成されると、ほとんどの酵素の生成速度が増大するようになる。このようにして、ガラクトース代謝に直接関与する酵素、及びガラクトース代謝に関連する酵素も同様に、多量且つ迅速に生成されることに起因するものと推測される。
【0025】
上記のガラクトースは、分子式C6H12O6で表されるアルドヘキソースの一種であって、酵母において、ガラクトース−1−リン酸を経てグルコース−1−リン酸になった後、発酵過程を経て代謝されることによりアルコールに分解される。このようなガラクトースの代謝過程でのバイオアルコールの生産性を、ガラクトースの消耗時間(h)に対するアルコールの生産速度(g/l)で表すことができる。したがって、ガラクトースの資化能の増大は、別の側面から見れば、バイオアルコールの生産性の増大として評価することができる。
【0026】
前記(A)に規定される、配列番号:1に示される塩基配列は、上述のように酵母中のDNAに見出すことができる。
【0027】
また、(B)に規定されるような、配列番号:1に示される塩基配列において、1個以上の塩基が欠失、置換、挿入または付加された塩基配列からなるDNAも本実施形態における遺伝子に含まれる。本明細書における「1個以上」とは、1個または2個以上(複数個)を意味する。
【0028】
塩基配列において、1個以上の塩基の欠失、置換、挿入または付加を行う手段としては、部位特異的変異(Nucleic Acid Research Vol 10, pp6487-6500, 1982)などの従来公知の種々な遺伝子工学的手法が挙げられる。
【0029】
さらに、上記(C)で規定されるDNAも本実施形態における遺伝子に含まれる。本明細書における「ストリンジェントな条件下でハイブリダイズする塩基配列からなるDNA」とは、プローブと共に0.5%SDS、0.1%ウシ血清アルブミン(BSA)、0.1%ポリビニルピロリドン、0.1%フィコール400、0.01%変性サケ精子DNAを含む6×SSC(1×SSCは、0.15MのNaCl及び0.015Mのクエン酸ナトリウムを含み、pH7.0を示す。)中、68℃にて12〜20時間インキュベートした後に、プローブとハイブリダイズしているDNAをいう。
【0030】
また、上記(B)及び(C)に係るDNAの塩基配列は、上記の配列番号:1で示される塩基配列との配列相同性の程度で表すこともできる。このような配列相同性の程度は、好ましくは60%以上、より好ましくは85%以上、さらに好ましくは95%以上である。
【0031】
本明細書における「ガラクトースの資化能」とは、ガラクトースの分解能力ないし分解度を意味し、「ガラクトースの資化性」は前記「ガラクトースの資化能」と同義で使用している。
【0032】
また、本明細書における「過剰発現」とは、多様な方法によって実現することができる。そこで、以下に制限されることはないが、以下に3つの例を挙げる。第1に、本実施形態に係る目的DNA(SNR84遺伝子を含む)を挿入したマルチコピープラスミドを酵母に形質転換することによって、酵母内の当該DNA(遺伝子)のコピー数を増やし、過剰に発現する方法が挙げられる。第2に、本実施形態に係る目的DNA(SNR84遺伝子を含む)の5’末端に過剰発現を実現するような特殊なプロモーターを結合させた上で、前記目的DNA(遺伝子)をベクターに挿入する方法が挙げられる。第3に、上記(B)及び(C)に係るDNAの塩基配列の中には、配列番号:1で表されるDNAの塩基配列と異なる配列がありうるが、かかる相違した配列に起因して当該目的DNAが過剰発現するようにする方法が挙げられる。
【0033】
なお、本実施形態に係るDNAによってコードされる、ガラクトースの資化性を発揮させるRNAもまた、本発明の対象である。そして、前記RNAは、ガラクトース代謝促進剤(中の有効成分)として用いることができる。
【0034】
[第2実施形態:第1実施形態のDNAを連結したベクター]
第2実施形態に係るベクターは、上記第1実施形態に係るDNAを連結してなる。なお、以下において、上記第1実施形態で説明した事項を本実施形態で説明することは省略する。
【0035】
本明細書における「ベクター」とは、連結された核酸断片を運搬するのに利用可能な核酸分子を意味する。かかる利用可能なベクターとして、特に制限されることはないが、バクテリア、プラスミド、ファージ、コスミド、エピソーム、ウイルス及び挿入可能なDNA断片(すなわち、相同組み換えにより宿主細胞ゲノム内に挿入可能な断片)を含むことが好ましい。ここで、ベクターの一種である「プラスミド」とは、内部に追加的にDNA断片を連結されることができる環型の二重鎖DNAループを意味する。また、「ウイルスベクター」を用いれば、付加したDNAをウイルスゲノム内に連結させることができる。上記したベクターのなかでもより好ましくはプラスミドである。
【0036】
ここで、前記ベクターは、目的タンパク質をコードする連結された遺伝子の発現を指示できるが、このようなベクターを特に、「発現ベクター」という。一般的に、組み換えDNA技術の利用において、発現ベクターはプラスミドの形態であるため、本明細書で「プラスミド」と記載している場合、「ベクター」と同義でありうる。しかし、ウイルスベクターのように同一の機能を果たす、プラスミド以外の形態の発現ベクターも含むことができることはいうまでもない。
【0037】
上記の発現ベクターは、酵母内で発現可能であり、遺伝子がベクター中に連結・挿入されるものである。このような発現ベクターの例としては、2ミクロン、pBM272、pBR322-6、pBR322-8、pCS19、pDW227、pDW229、pDW232、pEMBLYe23、pEMBLYe24、pEMBLYi21、pEMBLYi22、pEMBLYi32、pEMBLYr25、pFL2、pFL26、pFL34、pFL35、pFL36、pFL38、pFL39、pFL40、pFL44L、pFL44S、pFL45L、pFL45S、pFL46L、pFL46S、pFL59、pFL59+、pFL64-、pFL64+、pG6、pG63、pGAD10、pGAD424、pGBT9、pGKl2、pJRD171、pKD1、pNKY2003、pNKY3、pNN414、pON163、pON3、pPM668、pRAJ275、pRS200、pRS303、pRS304、pRS305、pRS306、pRS313、pRS314、pRS315、pRS316、pRS403、pRS404、pRS405、pRS406、pRS413、pRS414、pRS415、pRS416、pRS423、pRS424、pRS425、pRS426、pRSS56、pSG424、pSKS104、pSKS105、pSKS106、pSZ62、pSZ62、pUC-URA3、pUT332、pYAC2、pYAC3、pYAC4、pYAC5、pYAC55、pYACneo、pYAC-RC、pYES2、pYESHisA、pYESHisB、pYESHisC、pYEUra3、rpSE937、YCp50、YCpGAL0、YCpGAL1、YCplac111、YCplac22、YCplac33、YDp-H、YDp-K、YDp-L、YDp-U、YDp-W、YEp13、YEp213、YEp24、YEp351、YEp352、YEp353、YEp354、YEp355、YEp356、YEp356R、YEp357、YEp357R、YEp358、YEp358R、YEplac112、YEplac181、YEplac195、YIp30、YIp31、YIp351、YIp352、YIp353、YIp354、YIp355、YIp356、YIp356R、YIp357、YIp357R、YIp358、YIp358R、YIp5、YIplac128、YIplac204、YIplac211、YRp12、YRp17、YRp7、pAL19、paR3、pBG1、pDBlet、pDB248X、pEA500、pFL20、pIRT2、pIRT2U、pIRT2-CAN1、pJK148、pJK210、pON163、pNPT/ADE1-3、pSP1、pSP2、pSP3、pSP4、pUR18、pUR19、pZA57、pWH5、pART1、pCHY21、pEVP11、REP1、REP3、REP4、REP41、REP42、REP81、REP82、RIP、REP3X、REP4X、REP41X、REP81X、REP42X、REP82X、RIP3X/s、RIP4X/s、pYZ1N、pYZ41N、pYZ81N、pSLF101、pSLF102、pSLF104、pSM1/2、p2UG、pART1/N795、pYGTなどが挙げられるが、これに限定されるものではない(http://genome-www2.stanford.edu/vectordb/vector.html、及びhttp://pingu.salk.edu/~forsburg/vectors.html参照)。
【0038】
また、前記ベクターは、下記の開裂地図に示されたプラスミド(pRS42)であることが好ましい。
【0039】
【化1】

【0040】
上記のベクターは、宿主細胞内に導入されて、上記第1実施形態に係るDNA(遺伝子)によりコードされたタンパク質(融合タンパク質を含む)またはペプチドを生産できる。所望により、上記のベクターは宿主生物体により認知されるプロモーターを備えてもよい。かようなプロモーターの配列は、原核生物、真核生物またはウイルス起源であり得る。酵母に適切なプロモーターとして、以下に制限されることはないが、GAPDH、PGK、ADH、PHO5、GAL1、GAL10などが挙げられる。
【0041】
上記のベクターは更なる調節配列を含むことができる。調節配列の例として、ファージMS−2のレプリカーゼ遺伝子のシャイン−ダルガノ配列及びバクテリオファージラムダのcIIのシャイン−ダルガノ配列が代表的なものとして挙げられる。また、発現ベクターは形質転換された宿主細胞を選別するのに必要且つ適切なマーカーを含んでもよい。宿主における形質転換は、当業界において公知の多様な技術やSambrookの文献に記述されている技術を使用して行われ得る。
【0042】
本実施形態に係るベクターは、ガラクトース代謝促進物質ないしガラクトース代謝促進剤(中の有効成分)として用いることもできる。
【0043】
[第3実施形態:第1実施形態のDNAまたは第2実施形態のベクターを導入した微生物]
第3実施形態に係る微生物(組み換え微生物)は、上記第2実施形態に係るベクター(連結された目的DNAを含む)を利用して形質転換されてなる。前記目的DNAに、SNR84遺伝子が含まれることはいうまでもない。かかる組み換え微生物はガラクトースの資化性の増大をもたらし得る。なお、以下において、上記第1実施形態及び第2実施形態で説明した事項を本実施形態で説明することは省略する。
【0044】
また、前記微生物は、前記ベクター中に連結された目的DNAである遺伝子が過剰発現されてなることが好ましい。
【0045】
本実施形態に係る微生物は、バクテリア、カビまたは酵母であることが好ましく、各々の具体的な種や属については、当業界に公知のものであればいずれも使用され得る。なかでも、本発明に係るDNA(遺伝子)が酵母由来のものであることから、形質転換の容易性などを鑑みれば、前記微生物は酵母であることがより好ましい。
【0046】
前記酵母は、以下に制限されることはないが、サッカロマイセス(Saccharomyces)属、パチソレン(Pachysolen)属、クラビスポラ(Clavispora)属、クリヴェロミセス(Kluyveromyces)属、デバリオミセス(Debaryomyces)属、シュワニオミセス(Schwanniomyces)属、カンジダ(Candida)属、ピキア(Pichia)属及びデッケラ(Dekkera)属からなる群より選ばれることが好ましい。
【0047】
このような組み換え酵母菌株は、第1実施形態に係る遺伝子(SNR84遺伝子を含む)が過剰発現されることによって、グルコース及びガラクトースの混合糖(混合物)、またはガラクトースを唯一の炭素源とする培地中で、ガラクトースを迅速にバイオアルコールに転換(代謝分解)することができる。これは、第1実施形態に係る遺伝子(SNR84遺伝子を含む)の過剰発現に際して、ガラクトースを炭素源にすると、細胞の成長を有意に向上させ得るからである。このようなガラクトースの資化能の増大は、ガラクトースを炭素源とするような代謝経路を有する全ての生物において、アルコールの生産性向上をもたらしうる。
【0048】
上述のように、本発明で用いられうる酵母の形質転換法は、一般的な形質転換手法であるため、当業者であれば容易に実施可能である。例えば、上記の組み換えベクターの酵母への形質転換過程は、公知の方法に従って実施され得る(Ito, H., Y. Fukuoka, K. Murata, A. Kimura (1983) Transformation of intact yeast cells treated with alkali cations, J. Bacteriol. 153, 163-168.)。
【0049】
例えば、異種遺伝子を含むベクターを、サッカロマイセス セレビシエ(S. cerevisiae) CEN.PK2-1Dに導入して形質転換するために、Yeast Spheroplast Transformation Kit(Bio 101, Vista、カリフォルニア州)を使用することができる。そして、形質転換株は、20g/lのグルコースを含むYSC(yeast synthetic complete)培地で培養できる。その後、ガラクトース代謝能(資化能)が向上した菌株を、4%ガラクトースを含むYSC培地で連続培養した後に、固体平板培地中で選別することができる。
【0050】
また、本実施形態に係る微生物は、受託番号KCTC 11388 BPの組み換え微生物を用いることが好ましい。かかる受託された組み換え微生物は、ガラクトースの資化能に優れた菌株として本発明者らが選別したものである。そして、大韓民国大田市儒城区に在る韓国生命工学研究院遺伝子銀行に、2008年9月4日付でサッカロマイセス セレビシエ CEN.PK2−1D/pRS424−SNR84と命名して受託し、受託番号:KCTC 11388 BPが付与されたものである。
【0051】
本実施形態に係る微生物は、ガラクトース代謝促進剤(中の有効成分)として用いることもできる。
【0052】
[第4実施形態:ガラクトース資化能の増大方法]
第4実施形態に係るガラクトース資化能の増大方法は、ガラクトースを含む炭素源を微生物に資化させることを含むガラクトース資化能の増大方法であって、上記第1実施形態に係るDNA、上記第2実施形態に係るベクター、または上記第3実施形態に係る微生物を利用することにより、前記DNAを過剰発現することを特徴とする。前記過剰発現の具体的な手法については、上記第1実施形態で説明した通りである。なお、上記の第1〜第3実施形態で説明した事項を本実施形態で説明することは省略する。
【0053】
[第5実施形態:バイオアルコールの生産方法]
第5実施形態に係るバイオアルコールの生産方法は、ガラクトースを含む炭素源を微生物に資化させることを含むバイオアルコールの生産方法であって、ガラクトースの資化性(資化能)を向上(増大)するために、上記第1実施形態に係るDNA、上記第2実施形態に係るベクター、または上記第3実施形態に係る微生物を利用することを特徴とする。なお、以下において、上記の第1〜第4実施形態で説明した事項を本実施形態で説明することは省略する。
【0054】
本実施形態に係る生産方法は、上記のDNA(SNR84遺伝子を含む遺伝子)を過剰発現させて、バイオアルコールの生産性を増大することが好ましい。本実施形態において、上記のDNA(SNR84遺伝子を含む遺伝子)が過剰発現されることによって、バイオアルコールの生産性が増大しうる。すなわち、上記のバイオアルコールの生産方法によれば、上記のDNA(SNR84遺伝子を含む遺伝子)の過剰発現により、直接的または間接的にガラクトース代謝に関与する遺伝子の発現が顕著に促進される。これにより、ガラクトースを含む炭素源からガラクトースを迅速にバイオアルコールへと転換(代謝分解)させることができる。
【0055】
上記の直接的または間接的にガラクトース代謝に関与する遺伝子として、以下に制限されることはないが、例えば、gal2、gal1、gal7、gal10、gal5(pgm1、pgm2)などが挙げられる。また、上記のバイオアルコールの例として、エタノール、プロパノールもしくはブタノール等のアルコール、またはアセトンが挙げられるが、これらに限定されることはない。
【0056】
上記のガラクトースを含む炭素源は、ガラクトースのみからなるか、またはガラクトース及びグルコースの混合糖からなりうる。後者の場合、混合比率は特に制限されることはないが、ガラクトースを40%以上含むことが好ましく、50%以上含むことがより好ましい。このような条件の培地中で、本実施形態に係る生産方法を実施した場合、バイオアルコールの生産性を有意に向上させることができる。
【0057】
本発明者らが行った実験によると、ガラクトースを含む培地で、上記のDNA(SNR84遺伝子を含む遺伝子)の過剰発現によりアルコールの生産性が、既存の酵母菌株に比べて有意に増大可能なことを確認した。
【0058】
上記のガラクトースを含む炭素源(生物資源)は、海藻類バイオマスの加水分解物であり得る。
【0059】
上記の海藻類は特に制限されなく、紅藻類(例えば、ノリ(Porphyra yezoensis Ueda)、褐藻類(例えば、コンブ(Laminariaceae科の藻類)、ワカメ(Undaria pinnatifida)またはヒジキ(Hizikia fusiforme))及び緑藻類(例えば、アオノリ(Enteromorpha属)を含むことができる。
【0060】
上記の紅藻類は、例えば天草(Gelidium amansii)、オゴノリ(Gracilaria verrucosa)、ウシケノリ(Bangia atropurpurea)、マルバアマノリ(Porphyra suborbiculata)、スサビノリ(Porphyra yezoensis)、ヒラガラガラ(Galaxaura falcate)、フサノリ(Scinaia japonica)、ヒメテングサ(Gelidium divaricatum)、オオブサ(Gelidium pacificum)、ヒライボ(Lithophylum okamurae)、クサノカキ(Lithothammion cystocarpideum)、カニノテ(Amphiroa anceps)、アンピロアベアヴォイシ(Amphiroa beauvoisii)、サンゴモ(Corallina officinalis)、ピリヒバ(Corallina pilulifera)、フサカニノテ(Marginisporum aberrans)、コメノリ(Carpopeltis prolifera)、ムカデノリ(Grateloupia filicina)、タンバノリ(Grateloupia elliptica)、フダラク(Grateloupia lanceolanta)、ツルツル(Grateloupia turtuturu)、キジノオ(Phacelocarpus japonicus)、フクロフノリ(Gloiopeltis furcata)、イバラノリ(Hypnea charoides)、カギイバラノリ(Hypnea japonica)、サイダイバラ(Hypnea saidana)、コンドロスクリスプス(Chondrus cripspus)、スギノリ(Chondracanthus tenellus)、カバノリ(Gracilaria textorii)、フシツナギ(Lomentaria catenata)、イソハギ(Heterosiphonia japonica)、ユナ(Chondria crassicaulis)、イソムラサキ(Symphyocladia latiuscula)などが挙げられるが、これに限定されるものではない。
【0061】
海藻類バイオマスを利用してバイオアルコールを生産する方法は特に制限されることはなく、当業界で公知の方法により行える。例えば、紅藻類バイオマスを利用する方法を見てみると、紅藻類を直接糖化させる直接糖化工程や、紅藻類から寒天または繊維素を抽出した後、得られた抽出物を糖化させてガラクトースまたはグルコースを得る間接糖化工程などが利用できる。上記の糖化工程は、ガラクトシダーゼ酵素などを利用した酵素加水分解法または酸加水分解用の触媒を使用する酸加水分解法などが使用され得るが、これに限定されることはない。その後、所定の微生物発酵を通してエタノール、ブタノールなどのアルコール、またはアセトンなどのバイオアルコールを製造することができる。
【0062】
このように、自然界に豊富に存在する海藻類バイオマスを利用してバイオ燃料を製造する場合、原料の受給が安定的で前処理工程を経る必要がないため、生産効率に大変優れている。
【0063】
[第6実施形態:酵母の原因遺伝子の選別方法]
第6実施形態に係る酵母の原因遺伝子の選別方法は、遺伝子を過剰発現させてガラクトースの資化能を増大させる、酵母の原因遺伝子の選別方法であって、トリプトファン(trp)を含むマルチコピープラスミドを利用して酵母のゲノムDNAのライブラリーを構築する段階と、構築した前記ライブラリー中のゲノムDNAを酵母に形質転換させ、酵母の全遺伝子を過剰発現させて、形質転換酵母のライブラリーを製作する段階と、製作した前記ライブラリー中の形質転換酵母を、ガラクトースを唯一の炭素源として含む培地中で連続継代培養(Serial subculture)し、巨大コロニーを形成する、形質転換酵母を選別する段階と、選別した前記形質転換酵母からプラスミドを単離(回収)し、単離(回収)したプラスミドを導入した酵母の遺伝子配列を確認する段階とを含む。なお、以下において、上記の第1〜第5実施形態で説明した事項を本実施形態で説明することは省略する。
【0064】
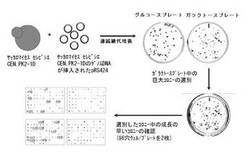
図1は、本実施形態で使用可能な遺伝子の選別方法を模式的に示した図である。図1を参照することにより、本実施形態に係る遺伝子の選別方法の一例を具体的に理解することができる。
【0065】
上記の酵母は、サッカロマイセス セレビシエ CEN.PK2−1Dであり得、上記のマルチコピープラスミドはpRS424であり得る。
【0066】
上記酵母のゲノムDNAライブラリーの製造は、制限酵素などを利用してサッカロマイセス セレビシエ CEN.PK2−1DゲノムDNAを切断する段階と、切断されたDNA断片をマルチコピープラスミド(pRS424)に導入する段階と、製造されたプラスミドを大腸菌(E. coli)で増幅させる段階とからなり得る。
【0067】
上記の形質転換酵母ライブラリーの製造において、上記の酵母への形質転換は、一般的な方法(例えば、Ito, H., Y. Fukuoka, K. Murata, A. Kimura (1983) Transformation of intact yeast cells treated with alkali cations, J. Bacteriol. 153, 163-168.)によって行える。
【0068】
その後、連続継代培養を通して巨大コロニーを形成するガラクトースの資化能が増大した形質転換酵母を選別した後、巨大コロニーから単離した形質転換酵母からプラスミドに挿入された遺伝子配列を確認する。このとき、遺伝子配列の確認は、Gel documentation(gel doc)装置またはHydra装置などを利用して行える。
【0069】
また、本実施形態に係る遺伝子の選別方法は、下記の段階を更に含んでもよい。すなわち、酵母のゲノムの塩基配列、及びプラスミドに挿入した遺伝子の両末端に存在する所定の長さの遺伝子の塩基配列を比較し、挿入遺伝子の酵母ゲノム上での位置を追跡することにより、過剰発現した遺伝子を確認する段階、並びに/または、確認した前記遺伝子を含むプラスミドを酵母に再び形質転換し、ガラクトースの資化能の増大が前記遺伝子の過剰発現によるものであることを確認する段階である。
【0070】
上記の追加可能な段階により、選別された遺伝子を明らかにし、ガラクトースの資化能の増大が誘発したことを再び確認することができる。
【0071】
[第7実施形態:遺伝子]
第7実施形態に係る遺伝子は、上記の第6実施形態に係る選別方法により選別された、過剰発現によってガラクトースの資化性を増大させるものである。また、上記の遺伝子は、(A)配列番号:1に示される塩基配列からなるDNA、(B)配列番号:1に示される塩基配列において、1個または数個の塩基が欠失、置換、挿入または付加された塩基配列からなるDNA、及び(C)(A)の塩基配列と相補的な塩基配列にストリンジェントな条件下でハイブリダイズする塩基配列からなるDNAからなる群より選ばれるDNAであって、ガラクトースの資化性を発揮させるRNAをコードするものである。なお、上記の(A)、(B)及び(C)に係るDNAのなかでも好ましくは(A)に係るDNAである。また、上記の第1〜第6実施形態で説明した事項を本実施形態で説明することは省略する。
【0072】
以下、本発明の実施例を説明するが、本発明の技術的範囲が下記の実施例に限定されることはない。
【実施例】
【0073】
[実施例1]過剰発現によりガラクトースの資化能を増大させる遺伝子の選別
マルチコピープラスミド(pRS424)(化学式1参照)を利用してS.cerevisiae CEN.PK2−1DのゲノムDNAライブラリーを製作した。製作したライブラリーのゲノムDNAを酵母に形質転換させることによって、酵母の全遺伝子が過剰発現する形質転換酵母のライブラリーを製作した。その後、ガラクトースを唯一の炭素源として含む培地(最小培地)で構築した形質転換酵母のライブラリーを培養し、連続継代培養法により、ガラクトースの資化能が増大した形質転換酵母を選別した。図2に示したように、ガラクトースの資化能が増大した(エタノールの生成度の高い)#2、5、34、37、40の酵母菌株のうち、#40の形質転換酵母からプラスミドを単離した。そして、クローニングに用いた制限酵素に対応する制限酵素部位の両側の公知の遺伝子の配列情報を利用して単離したプラスミドに導入した酵母遺伝子の配列を確認した。その後、酵母のゲノムの塩基配列と、プラスミドに挿入した遺伝子の両末端に存在する所定の長さの遺伝子の塩基配列とを比較し、導入遺伝子(挿入遺伝子)の酵母ゲノム上での位置を追跡することにより、過剰発現した遺伝子を確認した。その結果、#40の酵母菌株に導入した遺伝子の配列は、図3に示したように、酵母の第5染色体のうち1492241〜1494948の塩基配列であり、ここにSNR84遺伝子配列が含まれていることを確認した。そこで、原因遺伝子(SNR84遺伝子)がガラクトースの資化能の増大に関与するか否かを確認するために、前記原因遺伝子を含むプラスミドを酵母に再び形質転換し、ガラクトースの資化能の増大が前記原因遺伝子の過剰発現によるものであることを確認した。
【0074】
[実施例2]ガラクトースの資化能の評価
原因遺伝子(SNR84遺伝子)を含む酵母(S.cerevisiae)の第5染色体1492241〜1494948の塩基を、マルチコピープラスミドを利用してS.cerevisiae CEN.PK2−1D(MATalpha;ura3−52;trp1−289;leu2−3_112;his3 D1;MAL2−8C;SUC2)菌株に形質転換した。4%ガラクトースを含む最小培地中で20時間、培養した後、ガラクトースの資化能を観察するためにエタノール生成度を観察した。かかる結果を図4及び図5、並びに下記の表1に示した。
【0075】
【表1】

【0076】
コントロールの菌株の場合、与えられたガラクトースを全部消失(資化)するのに28時間を要し、その際のエタノール生成度は17g/lだった。また、20時間培養経過後のコントロールの菌株のエタノール生成度は14g/lであって、8g/lのガラクトースが未資化分として残存した。これに対し、snr84形質転換株(snr84の過剰発現株)の場合、20時間培養した時点でガラクトースを全部資化し、その際のエタノール生成度は18g/lであった。
【0077】
すなわち、SRN84遺伝子が過剰発現された菌株は、コントロールの菌株に比べてガラクトースの分解速度が著しく向上し、エタノールの生成度も同様に顕著に増大した。そして、驚くべきことに、エタノールの生産性は48%({0.9/0.61}×100)も増大した。
【0078】
本発明の属する分野における通常の知識を有する者であれば、上記の内容に基づき、本発明の範囲内で多種多様な応用や変形を行うことが可能である。
【図面の簡単な説明】
【0079】
【図1】本発明の第6実施形態で使用可能な遺伝子の選別方法を模式的に示した図である
【図2】図1による方法で選別された、様々な酵母菌株のエタノール生成量を示したグラフである(4%ガラクトースを含む5mlのYSC培地中で20時間培養)。
【図3】SNR84遺伝子を含む酵母の第5染色体の拡大した遺伝子地図である(酵母ゲノムのうち第5染色体の位置1492241〜1494948を示す)。
【図4】本発明の実施例2において、コントロールである野生型株を4%ガラクトースで培養したときの、資化能(発酵能)の増大効果を観察したグラフである。
【図5】本発明の実施例2において、SNR84遺伝子の形質転換株(SNR84を過剰発現させた菌株)を4%ガラクトースで培養したときの、資化能(発酵能)の増大効果を観察したグラフである。
【技術分野】
【0001】
本発明は、ガラクトースの資化能を有するDNA、これを連結したベクター、及びこれらを導入した微生物に関する。より具体的には、過剰発現(overexpression)によりガラクトースの資化能を増大させるDNA(遺伝子)、これを連結した組み換えベクター、及びこれらを導入した組み換え微生物に関する。
【背景技術】
【0002】
世界的に化石燃料を過剰に使用することによる資源枯渇及び環境汚染という虞が増大しつつある。このような状況の下で、安定的且つ持続的にエネルギーを生産・供給可能な、新たな再生エネルギーの登場が求められている。このような代替エネルギー開発の一環として、バイオマスからエネルギーを生産する技術が注目されている。
【0003】
近年、このようなバイオマスを実現し得る生物として、海藻類に対する関心が高まっている。かかる潜在的な生物と言える海藻類の特長は、自然界に豊富に存在し、且つライフサイクルが短いという点にある。また、海藻類は、二酸化炭素を消費して酸素を排出するという代謝を行うため、エネルギー生産と環境問題とを共に解決できるという長所を有する。しかし、海藻類を広く利用し、代替エネルギーとして一般に供給可能な程度までエネルギーを生産できていないのが現状である。
【0004】
一方、海藻類(特に紅藻類)由来のバイオマスの加水分解物には、ガラクトースが豊富に存在する。したがって、海藻類由来のバイオマスの加水分解物を、酵母を利用して有用物質へと転換することを実現するためには、加水分解物に多量に含有されているガラクトースの効果的な利用が最先に実現されなければならない。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】米国特許第7393669号明細書
【非特許文献】
【0006】
【非特許文献1】Bro C, Knudsen S, Regenberg B, Olsson L, Nielsen J. 2005. Improvement of galactose uptake in Saccharomyces cerevisiae through overexpression of phosphoglucomutase: example of transcript analysis as a tool in inverse metabolic engineering. Appl. Environ. Microbiol. 71(11):6465-72
【非特許文献2】Ostergaard S, Walloe KO, Gomes SG, Olsson L, Nielsen J. 2001. The impact of GAL6, GAL80, and MIG1 on glucose control of the GAL system in Saccharomyces cerevisiae. FEMS Yeast Res. 1(1):47-55.
【非特許文献3】Ostergaard S, Olsson L, Johnston M, Nielsen J. Increasing galactose consumption by Saccharomyces cerevisiae through metabolic engineering of the GAL gene regulatory network. 2000. Nat. Biotechnol. 18(12):1283-6.
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、自然界に存在する酵母の場合、ガラクトース代謝はするものの、その代謝速度はグルコースに比べて顕著に小さいため、実用化には程遠いという問題があった。
【0008】
そこで本発明の目的は、ガラクトースの資化に関与するDNA(遺伝子)であって、過剰発現によればガラクトースの資化能を増大させることのできる新規なDNA(遺伝子)を提供する。
【0009】
また、本発明の他の目的は、上記の新規なDNA(遺伝子)で形質転換した酵母を利用して、ガラクトースを含む炭素源からバイオアルコールの生産性を増大させる方法を提供することである。
【0010】
また、本発明のさらに他の目的は、ガラクトースの資化能を増大することのできる多様な酵母中の原因遺伝子を一度に同定可能な、ゲノムレベルのシステム生命工学的手法を提供することである。
【課題を解決するための手段】
【0011】
上記目的を達成するための本発明は、(A)配列番号:1に示される塩基配列からなるDNA、(B)配列番号:1に示される塩基配列において、1個または数個の塩基が欠失、置換、挿入または付加された塩基配列からなるDNA、及び(C)(A)の塩基配列と相補的な塩基配列にストリンジェントな条件下でハイブリダイズする塩基配列からなるDNAからなる群より選ばれるDNAであって、ガラクトースの資化性を発揮させるRNAをコードするDNAである。
【0012】
上記目的を達成するための本発明のベクターは、上記のDNAを連結してなる。
【0013】
上記目的を達成するための本発明の微生物は、上記のベクター(連結された目的DNAを含む)を利用して形質転換されてなる。
【0014】
上記目的を達成するための本発明のガラクトース資化能の増大方法は、ガラクトースを含む炭素源を微生物に資化させることを含むガラクトース資化能の増大方法であって、上記のDNA、上記のベクター、または上記の微生物を利用することにより、前記DNAを過剰発現することを特徴とする。
【0015】
上記目的を達成するための本発明のバイオアルコールの生産方法は、ガラクトースを含む炭素源を微生物に資化させることを含むバイオアルコールの生産方法であって、上記のDNA、上記のベクター、または上記の微生物を利用することを特徴とする。
【0016】
上記目的を達成するための本発明の酵母の原因遺伝子の選別方法は、遺伝子を過剰発現させてガラクトースの資化能を増大させる、酵母の原因遺伝子の選別方法であって、トリプトファンを含むマルチコピープラスミドを利用して酵母のゲノムDNAのライブラリーを構築する段階と、構築した前記ライブラリー中のゲノムDNAを酵母に形質転換させ、酵母の全遺伝子を過剰発現させて、形質転換酵母のライブラリーを製作する段階と、製作した前記ライブラリー中の形質転換酵母を、ガラクトースを唯一の炭素源として含む培地中で連続継代培養し、巨大コロニーを形成する、形質転換酵母を選別する段階と、選別した前記形質転換酵母からプラスミドを単離(回収)し、単離(回収)されたプラスミドに挿入された酵母の遺伝子配列を確認する段階とを含む。
【0017】
上記目的を達成するための本発明の遺伝子は、上記の選別方法により選別された、過剰発現によってガラクトースの資化性を増大させる。
【発明の効果】
【0018】
本発明によれば、目的DNA(遺伝子)の過剰発現によって、ガラクトースの資化性が著しく増大し、同時にエタノールの生産性も顕著に増大させることができる。
【発明を実施するための形態】
【0019】
以下、添付した図面を参照して本発明を適用した最良の実施形態を説明する。本発明の利点、特徴、及びこれを実現するための筋道は、以下の各実施形態における詳細な説明及び添付された図面を参照することにより、さらに容易に理解できる。しかしながら、本発明は、本明細書における説明以外の多様な形態で実施することもできる。したがって、本明細書で言及した実施形態のみに限定されることはない。
【0020】
[第1実施形態:ガラクトースの資化性を発揮させるRNAをコードするDNA]
本発明に係る第1実施形態は、(A)配列番号:1に示される塩基配列からなるDNA、(B)配列番号:1に示される塩基配列において、1個または数個の塩基が欠失、置換、挿入または付加された塩基配列からなるDNA、及び(C)(A)の塩基配列と相補的な塩基配列にストリンジェントな条件下でハイブリダイズする塩基配列からなるDNAからなる群より選ばれるDNAであって、ガラクトースの資化能を有するDNAに関する。
【0021】
本実施形態の対象であるDNAは、ガラクトースの資化性を発揮させるRNAをコードし、さらに、過剰発現によってガラクトース資化能を増大させることのできる遺伝子ということができる。本明細書では以下、上記(A)に係るDNAを「SNR84遺伝子」ともいう。(A)、(B)及び(C)に係るDNAのなかでも好ましくは(A)に係るDNAである。
【0022】
本発明者らは、このようなSNR84遺伝子が過剰発現した酵母において、驚くべきことに、ガラクトースの資化能が著しく増大することを最初に確認した。
【0023】
ここで、本実施形態に係るDNA(遺伝子)のメカニズムについて説明する。本実施形態に係るDNAは、酵母のBox H/ACA snoRNA(核小体低分子RNA:small nucleolar RNA)をコードしている。換言すれば、本実施形態に係るDNAは、ガラクトースの資化性を発揮させるRNA(SNR84 snoRNA)をコードするDNA(snr84 DNA)である。ここで、snoRNAとは、核小体内に局在し、リボゾーマルRNA(rRNA)前駆体のスプライシングに関与する比較的低分子のRNAを意味し、2つのグループに類別され、特異的な蛋白質とsnoRNP(スノープス)を形成している。Box H/ACA snoRNAは、そのうちの1グループである。Box H/ACA snoRNAは、RNAの両末端にBox H及びACAという共通のbox配列を有しており、Gar1という共通のタンパク質が結合する。Box H/ACA snoRNAは、rRNA(の大きなサブユニット)と短い塩基対を形成し、これによりrRNA(の大きなサブユニット)の修飾(シュードウリジン化;pseudouridylation)部位を決定する誘導RNA(gRNA)として機能することが明らかとなってきている。
【0024】
ガラクトースの資化能が著しく増大する理由は明らかではないものの、これまでの試行錯誤の結果より、以下のように推測される。すなわち、本実施形態に係るDNAが過剰発現されてSNR84 RNAの機能が活性化されることにより、rRNAのシュードウリジン化が促進され、結果としてガラクトースの資化能が増大されるメカニズムが作用するものと推測される。より具体的にいえば、rRNA(の大きなサブユニット)をシュードウリジン化するSNR84遺伝子の機能が活性化することによって、rRNAの成熟速度及び生成量が顕著に増大する。そこで、初期対数期(exponential phase)で成熟rRNAが早期に形成されると、ほとんどの酵素の生成速度が増大するようになる。このようにして、ガラクトース代謝に直接関与する酵素、及びガラクトース代謝に関連する酵素も同様に、多量且つ迅速に生成されることに起因するものと推測される。
【0025】
上記のガラクトースは、分子式C6H12O6で表されるアルドヘキソースの一種であって、酵母において、ガラクトース−1−リン酸を経てグルコース−1−リン酸になった後、発酵過程を経て代謝されることによりアルコールに分解される。このようなガラクトースの代謝過程でのバイオアルコールの生産性を、ガラクトースの消耗時間(h)に対するアルコールの生産速度(g/l)で表すことができる。したがって、ガラクトースの資化能の増大は、別の側面から見れば、バイオアルコールの生産性の増大として評価することができる。
【0026】
前記(A)に規定される、配列番号:1に示される塩基配列は、上述のように酵母中のDNAに見出すことができる。
【0027】
また、(B)に規定されるような、配列番号:1に示される塩基配列において、1個以上の塩基が欠失、置換、挿入または付加された塩基配列からなるDNAも本実施形態における遺伝子に含まれる。本明細書における「1個以上」とは、1個または2個以上(複数個)を意味する。
【0028】
塩基配列において、1個以上の塩基の欠失、置換、挿入または付加を行う手段としては、部位特異的変異(Nucleic Acid Research Vol 10, pp6487-6500, 1982)などの従来公知の種々な遺伝子工学的手法が挙げられる。
【0029】
さらに、上記(C)で規定されるDNAも本実施形態における遺伝子に含まれる。本明細書における「ストリンジェントな条件下でハイブリダイズする塩基配列からなるDNA」とは、プローブと共に0.5%SDS、0.1%ウシ血清アルブミン(BSA)、0.1%ポリビニルピロリドン、0.1%フィコール400、0.01%変性サケ精子DNAを含む6×SSC(1×SSCは、0.15MのNaCl及び0.015Mのクエン酸ナトリウムを含み、pH7.0を示す。)中、68℃にて12〜20時間インキュベートした後に、プローブとハイブリダイズしているDNAをいう。
【0030】
また、上記(B)及び(C)に係るDNAの塩基配列は、上記の配列番号:1で示される塩基配列との配列相同性の程度で表すこともできる。このような配列相同性の程度は、好ましくは60%以上、より好ましくは85%以上、さらに好ましくは95%以上である。
【0031】
本明細書における「ガラクトースの資化能」とは、ガラクトースの分解能力ないし分解度を意味し、「ガラクトースの資化性」は前記「ガラクトースの資化能」と同義で使用している。
【0032】
また、本明細書における「過剰発現」とは、多様な方法によって実現することができる。そこで、以下に制限されることはないが、以下に3つの例を挙げる。第1に、本実施形態に係る目的DNA(SNR84遺伝子を含む)を挿入したマルチコピープラスミドを酵母に形質転換することによって、酵母内の当該DNA(遺伝子)のコピー数を増やし、過剰に発現する方法が挙げられる。第2に、本実施形態に係る目的DNA(SNR84遺伝子を含む)の5’末端に過剰発現を実現するような特殊なプロモーターを結合させた上で、前記目的DNA(遺伝子)をベクターに挿入する方法が挙げられる。第3に、上記(B)及び(C)に係るDNAの塩基配列の中には、配列番号:1で表されるDNAの塩基配列と異なる配列がありうるが、かかる相違した配列に起因して当該目的DNAが過剰発現するようにする方法が挙げられる。
【0033】
なお、本実施形態に係るDNAによってコードされる、ガラクトースの資化性を発揮させるRNAもまた、本発明の対象である。そして、前記RNAは、ガラクトース代謝促進剤(中の有効成分)として用いることができる。
【0034】
[第2実施形態:第1実施形態のDNAを連結したベクター]
第2実施形態に係るベクターは、上記第1実施形態に係るDNAを連結してなる。なお、以下において、上記第1実施形態で説明した事項を本実施形態で説明することは省略する。
【0035】
本明細書における「ベクター」とは、連結された核酸断片を運搬するのに利用可能な核酸分子を意味する。かかる利用可能なベクターとして、特に制限されることはないが、バクテリア、プラスミド、ファージ、コスミド、エピソーム、ウイルス及び挿入可能なDNA断片(すなわち、相同組み換えにより宿主細胞ゲノム内に挿入可能な断片)を含むことが好ましい。ここで、ベクターの一種である「プラスミド」とは、内部に追加的にDNA断片を連結されることができる環型の二重鎖DNAループを意味する。また、「ウイルスベクター」を用いれば、付加したDNAをウイルスゲノム内に連結させることができる。上記したベクターのなかでもより好ましくはプラスミドである。
【0036】
ここで、前記ベクターは、目的タンパク質をコードする連結された遺伝子の発現を指示できるが、このようなベクターを特に、「発現ベクター」という。一般的に、組み換えDNA技術の利用において、発現ベクターはプラスミドの形態であるため、本明細書で「プラスミド」と記載している場合、「ベクター」と同義でありうる。しかし、ウイルスベクターのように同一の機能を果たす、プラスミド以外の形態の発現ベクターも含むことができることはいうまでもない。
【0037】
上記の発現ベクターは、酵母内で発現可能であり、遺伝子がベクター中に連結・挿入されるものである。このような発現ベクターの例としては、2ミクロン、pBM272、pBR322-6、pBR322-8、pCS19、pDW227、pDW229、pDW232、pEMBLYe23、pEMBLYe24、pEMBLYi21、pEMBLYi22、pEMBLYi32、pEMBLYr25、pFL2、pFL26、pFL34、pFL35、pFL36、pFL38、pFL39、pFL40、pFL44L、pFL44S、pFL45L、pFL45S、pFL46L、pFL46S、pFL59、pFL59+、pFL64-、pFL64+、pG6、pG63、pGAD10、pGAD424、pGBT9、pGKl2、pJRD171、pKD1、pNKY2003、pNKY3、pNN414、pON163、pON3、pPM668、pRAJ275、pRS200、pRS303、pRS304、pRS305、pRS306、pRS313、pRS314、pRS315、pRS316、pRS403、pRS404、pRS405、pRS406、pRS413、pRS414、pRS415、pRS416、pRS423、pRS424、pRS425、pRS426、pRSS56、pSG424、pSKS104、pSKS105、pSKS106、pSZ62、pSZ62、pUC-URA3、pUT332、pYAC2、pYAC3、pYAC4、pYAC5、pYAC55、pYACneo、pYAC-RC、pYES2、pYESHisA、pYESHisB、pYESHisC、pYEUra3、rpSE937、YCp50、YCpGAL0、YCpGAL1、YCplac111、YCplac22、YCplac33、YDp-H、YDp-K、YDp-L、YDp-U、YDp-W、YEp13、YEp213、YEp24、YEp351、YEp352、YEp353、YEp354、YEp355、YEp356、YEp356R、YEp357、YEp357R、YEp358、YEp358R、YEplac112、YEplac181、YEplac195、YIp30、YIp31、YIp351、YIp352、YIp353、YIp354、YIp355、YIp356、YIp356R、YIp357、YIp357R、YIp358、YIp358R、YIp5、YIplac128、YIplac204、YIplac211、YRp12、YRp17、YRp7、pAL19、paR3、pBG1、pDBlet、pDB248X、pEA500、pFL20、pIRT2、pIRT2U、pIRT2-CAN1、pJK148、pJK210、pON163、pNPT/ADE1-3、pSP1、pSP2、pSP3、pSP4、pUR18、pUR19、pZA57、pWH5、pART1、pCHY21、pEVP11、REP1、REP3、REP4、REP41、REP42、REP81、REP82、RIP、REP3X、REP4X、REP41X、REP81X、REP42X、REP82X、RIP3X/s、RIP4X/s、pYZ1N、pYZ41N、pYZ81N、pSLF101、pSLF102、pSLF104、pSM1/2、p2UG、pART1/N795、pYGTなどが挙げられるが、これに限定されるものではない(http://genome-www2.stanford.edu/vectordb/vector.html、及びhttp://pingu.salk.edu/~forsburg/vectors.html参照)。
【0038】
また、前記ベクターは、下記の開裂地図に示されたプラスミド(pRS42)であることが好ましい。
【0039】
【化1】

【0040】
上記のベクターは、宿主細胞内に導入されて、上記第1実施形態に係るDNA(遺伝子)によりコードされたタンパク質(融合タンパク質を含む)またはペプチドを生産できる。所望により、上記のベクターは宿主生物体により認知されるプロモーターを備えてもよい。かようなプロモーターの配列は、原核生物、真核生物またはウイルス起源であり得る。酵母に適切なプロモーターとして、以下に制限されることはないが、GAPDH、PGK、ADH、PHO5、GAL1、GAL10などが挙げられる。
【0041】
上記のベクターは更なる調節配列を含むことができる。調節配列の例として、ファージMS−2のレプリカーゼ遺伝子のシャイン−ダルガノ配列及びバクテリオファージラムダのcIIのシャイン−ダルガノ配列が代表的なものとして挙げられる。また、発現ベクターは形質転換された宿主細胞を選別するのに必要且つ適切なマーカーを含んでもよい。宿主における形質転換は、当業界において公知の多様な技術やSambrookの文献に記述されている技術を使用して行われ得る。
【0042】
本実施形態に係るベクターは、ガラクトース代謝促進物質ないしガラクトース代謝促進剤(中の有効成分)として用いることもできる。
【0043】
[第3実施形態:第1実施形態のDNAまたは第2実施形態のベクターを導入した微生物]
第3実施形態に係る微生物(組み換え微生物)は、上記第2実施形態に係るベクター(連結された目的DNAを含む)を利用して形質転換されてなる。前記目的DNAに、SNR84遺伝子が含まれることはいうまでもない。かかる組み換え微生物はガラクトースの資化性の増大をもたらし得る。なお、以下において、上記第1実施形態及び第2実施形態で説明した事項を本実施形態で説明することは省略する。
【0044】
また、前記微生物は、前記ベクター中に連結された目的DNAである遺伝子が過剰発現されてなることが好ましい。
【0045】
本実施形態に係る微生物は、バクテリア、カビまたは酵母であることが好ましく、各々の具体的な種や属については、当業界に公知のものであればいずれも使用され得る。なかでも、本発明に係るDNA(遺伝子)が酵母由来のものであることから、形質転換の容易性などを鑑みれば、前記微生物は酵母であることがより好ましい。
【0046】
前記酵母は、以下に制限されることはないが、サッカロマイセス(Saccharomyces)属、パチソレン(Pachysolen)属、クラビスポラ(Clavispora)属、クリヴェロミセス(Kluyveromyces)属、デバリオミセス(Debaryomyces)属、シュワニオミセス(Schwanniomyces)属、カンジダ(Candida)属、ピキア(Pichia)属及びデッケラ(Dekkera)属からなる群より選ばれることが好ましい。
【0047】
このような組み換え酵母菌株は、第1実施形態に係る遺伝子(SNR84遺伝子を含む)が過剰発現されることによって、グルコース及びガラクトースの混合糖(混合物)、またはガラクトースを唯一の炭素源とする培地中で、ガラクトースを迅速にバイオアルコールに転換(代謝分解)することができる。これは、第1実施形態に係る遺伝子(SNR84遺伝子を含む)の過剰発現に際して、ガラクトースを炭素源にすると、細胞の成長を有意に向上させ得るからである。このようなガラクトースの資化能の増大は、ガラクトースを炭素源とするような代謝経路を有する全ての生物において、アルコールの生産性向上をもたらしうる。
【0048】
上述のように、本発明で用いられうる酵母の形質転換法は、一般的な形質転換手法であるため、当業者であれば容易に実施可能である。例えば、上記の組み換えベクターの酵母への形質転換過程は、公知の方法に従って実施され得る(Ito, H., Y. Fukuoka, K. Murata, A. Kimura (1983) Transformation of intact yeast cells treated with alkali cations, J. Bacteriol. 153, 163-168.)。
【0049】
例えば、異種遺伝子を含むベクターを、サッカロマイセス セレビシエ(S. cerevisiae) CEN.PK2-1Dに導入して形質転換するために、Yeast Spheroplast Transformation Kit(Bio 101, Vista、カリフォルニア州)を使用することができる。そして、形質転換株は、20g/lのグルコースを含むYSC(yeast synthetic complete)培地で培養できる。その後、ガラクトース代謝能(資化能)が向上した菌株を、4%ガラクトースを含むYSC培地で連続培養した後に、固体平板培地中で選別することができる。
【0050】
また、本実施形態に係る微生物は、受託番号KCTC 11388 BPの組み換え微生物を用いることが好ましい。かかる受託された組み換え微生物は、ガラクトースの資化能に優れた菌株として本発明者らが選別したものである。そして、大韓民国大田市儒城区に在る韓国生命工学研究院遺伝子銀行に、2008年9月4日付でサッカロマイセス セレビシエ CEN.PK2−1D/pRS424−SNR84と命名して受託し、受託番号:KCTC 11388 BPが付与されたものである。
【0051】
本実施形態に係る微生物は、ガラクトース代謝促進剤(中の有効成分)として用いることもできる。
【0052】
[第4実施形態:ガラクトース資化能の増大方法]
第4実施形態に係るガラクトース資化能の増大方法は、ガラクトースを含む炭素源を微生物に資化させることを含むガラクトース資化能の増大方法であって、上記第1実施形態に係るDNA、上記第2実施形態に係るベクター、または上記第3実施形態に係る微生物を利用することにより、前記DNAを過剰発現することを特徴とする。前記過剰発現の具体的な手法については、上記第1実施形態で説明した通りである。なお、上記の第1〜第3実施形態で説明した事項を本実施形態で説明することは省略する。
【0053】
[第5実施形態:バイオアルコールの生産方法]
第5実施形態に係るバイオアルコールの生産方法は、ガラクトースを含む炭素源を微生物に資化させることを含むバイオアルコールの生産方法であって、ガラクトースの資化性(資化能)を向上(増大)するために、上記第1実施形態に係るDNA、上記第2実施形態に係るベクター、または上記第3実施形態に係る微生物を利用することを特徴とする。なお、以下において、上記の第1〜第4実施形態で説明した事項を本実施形態で説明することは省略する。
【0054】
本実施形態に係る生産方法は、上記のDNA(SNR84遺伝子を含む遺伝子)を過剰発現させて、バイオアルコールの生産性を増大することが好ましい。本実施形態において、上記のDNA(SNR84遺伝子を含む遺伝子)が過剰発現されることによって、バイオアルコールの生産性が増大しうる。すなわち、上記のバイオアルコールの生産方法によれば、上記のDNA(SNR84遺伝子を含む遺伝子)の過剰発現により、直接的または間接的にガラクトース代謝に関与する遺伝子の発現が顕著に促進される。これにより、ガラクトースを含む炭素源からガラクトースを迅速にバイオアルコールへと転換(代謝分解)させることができる。
【0055】
上記の直接的または間接的にガラクトース代謝に関与する遺伝子として、以下に制限されることはないが、例えば、gal2、gal1、gal7、gal10、gal5(pgm1、pgm2)などが挙げられる。また、上記のバイオアルコールの例として、エタノール、プロパノールもしくはブタノール等のアルコール、またはアセトンが挙げられるが、これらに限定されることはない。
【0056】
上記のガラクトースを含む炭素源は、ガラクトースのみからなるか、またはガラクトース及びグルコースの混合糖からなりうる。後者の場合、混合比率は特に制限されることはないが、ガラクトースを40%以上含むことが好ましく、50%以上含むことがより好ましい。このような条件の培地中で、本実施形態に係る生産方法を実施した場合、バイオアルコールの生産性を有意に向上させることができる。
【0057】
本発明者らが行った実験によると、ガラクトースを含む培地で、上記のDNA(SNR84遺伝子を含む遺伝子)の過剰発現によりアルコールの生産性が、既存の酵母菌株に比べて有意に増大可能なことを確認した。
【0058】
上記のガラクトースを含む炭素源(生物資源)は、海藻類バイオマスの加水分解物であり得る。
【0059】
上記の海藻類は特に制限されなく、紅藻類(例えば、ノリ(Porphyra yezoensis Ueda)、褐藻類(例えば、コンブ(Laminariaceae科の藻類)、ワカメ(Undaria pinnatifida)またはヒジキ(Hizikia fusiforme))及び緑藻類(例えば、アオノリ(Enteromorpha属)を含むことができる。
【0060】
上記の紅藻類は、例えば天草(Gelidium amansii)、オゴノリ(Gracilaria verrucosa)、ウシケノリ(Bangia atropurpurea)、マルバアマノリ(Porphyra suborbiculata)、スサビノリ(Porphyra yezoensis)、ヒラガラガラ(Galaxaura falcate)、フサノリ(Scinaia japonica)、ヒメテングサ(Gelidium divaricatum)、オオブサ(Gelidium pacificum)、ヒライボ(Lithophylum okamurae)、クサノカキ(Lithothammion cystocarpideum)、カニノテ(Amphiroa anceps)、アンピロアベアヴォイシ(Amphiroa beauvoisii)、サンゴモ(Corallina officinalis)、ピリヒバ(Corallina pilulifera)、フサカニノテ(Marginisporum aberrans)、コメノリ(Carpopeltis prolifera)、ムカデノリ(Grateloupia filicina)、タンバノリ(Grateloupia elliptica)、フダラク(Grateloupia lanceolanta)、ツルツル(Grateloupia turtuturu)、キジノオ(Phacelocarpus japonicus)、フクロフノリ(Gloiopeltis furcata)、イバラノリ(Hypnea charoides)、カギイバラノリ(Hypnea japonica)、サイダイバラ(Hypnea saidana)、コンドロスクリスプス(Chondrus cripspus)、スギノリ(Chondracanthus tenellus)、カバノリ(Gracilaria textorii)、フシツナギ(Lomentaria catenata)、イソハギ(Heterosiphonia japonica)、ユナ(Chondria crassicaulis)、イソムラサキ(Symphyocladia latiuscula)などが挙げられるが、これに限定されるものではない。
【0061】
海藻類バイオマスを利用してバイオアルコールを生産する方法は特に制限されることはなく、当業界で公知の方法により行える。例えば、紅藻類バイオマスを利用する方法を見てみると、紅藻類を直接糖化させる直接糖化工程や、紅藻類から寒天または繊維素を抽出した後、得られた抽出物を糖化させてガラクトースまたはグルコースを得る間接糖化工程などが利用できる。上記の糖化工程は、ガラクトシダーゼ酵素などを利用した酵素加水分解法または酸加水分解用の触媒を使用する酸加水分解法などが使用され得るが、これに限定されることはない。その後、所定の微生物発酵を通してエタノール、ブタノールなどのアルコール、またはアセトンなどのバイオアルコールを製造することができる。
【0062】
このように、自然界に豊富に存在する海藻類バイオマスを利用してバイオ燃料を製造する場合、原料の受給が安定的で前処理工程を経る必要がないため、生産効率に大変優れている。
【0063】
[第6実施形態:酵母の原因遺伝子の選別方法]
第6実施形態に係る酵母の原因遺伝子の選別方法は、遺伝子を過剰発現させてガラクトースの資化能を増大させる、酵母の原因遺伝子の選別方法であって、トリプトファン(trp)を含むマルチコピープラスミドを利用して酵母のゲノムDNAのライブラリーを構築する段階と、構築した前記ライブラリー中のゲノムDNAを酵母に形質転換させ、酵母の全遺伝子を過剰発現させて、形質転換酵母のライブラリーを製作する段階と、製作した前記ライブラリー中の形質転換酵母を、ガラクトースを唯一の炭素源として含む培地中で連続継代培養(Serial subculture)し、巨大コロニーを形成する、形質転換酵母を選別する段階と、選別した前記形質転換酵母からプラスミドを単離(回収)し、単離(回収)したプラスミドを導入した酵母の遺伝子配列を確認する段階とを含む。なお、以下において、上記の第1〜第5実施形態で説明した事項を本実施形態で説明することは省略する。
【0064】
図1は、本実施形態で使用可能な遺伝子の選別方法を模式的に示した図である。図1を参照することにより、本実施形態に係る遺伝子の選別方法の一例を具体的に理解することができる。
【0065】
上記の酵母は、サッカロマイセス セレビシエ CEN.PK2−1Dであり得、上記のマルチコピープラスミドはpRS424であり得る。
【0066】
上記酵母のゲノムDNAライブラリーの製造は、制限酵素などを利用してサッカロマイセス セレビシエ CEN.PK2−1DゲノムDNAを切断する段階と、切断されたDNA断片をマルチコピープラスミド(pRS424)に導入する段階と、製造されたプラスミドを大腸菌(E. coli)で増幅させる段階とからなり得る。
【0067】
上記の形質転換酵母ライブラリーの製造において、上記の酵母への形質転換は、一般的な方法(例えば、Ito, H., Y. Fukuoka, K. Murata, A. Kimura (1983) Transformation of intact yeast cells treated with alkali cations, J. Bacteriol. 153, 163-168.)によって行える。
【0068】
その後、連続継代培養を通して巨大コロニーを形成するガラクトースの資化能が増大した形質転換酵母を選別した後、巨大コロニーから単離した形質転換酵母からプラスミドに挿入された遺伝子配列を確認する。このとき、遺伝子配列の確認は、Gel documentation(gel doc)装置またはHydra装置などを利用して行える。
【0069】
また、本実施形態に係る遺伝子の選別方法は、下記の段階を更に含んでもよい。すなわち、酵母のゲノムの塩基配列、及びプラスミドに挿入した遺伝子の両末端に存在する所定の長さの遺伝子の塩基配列を比較し、挿入遺伝子の酵母ゲノム上での位置を追跡することにより、過剰発現した遺伝子を確認する段階、並びに/または、確認した前記遺伝子を含むプラスミドを酵母に再び形質転換し、ガラクトースの資化能の増大が前記遺伝子の過剰発現によるものであることを確認する段階である。
【0070】
上記の追加可能な段階により、選別された遺伝子を明らかにし、ガラクトースの資化能の増大が誘発したことを再び確認することができる。
【0071】
[第7実施形態:遺伝子]
第7実施形態に係る遺伝子は、上記の第6実施形態に係る選別方法により選別された、過剰発現によってガラクトースの資化性を増大させるものである。また、上記の遺伝子は、(A)配列番号:1に示される塩基配列からなるDNA、(B)配列番号:1に示される塩基配列において、1個または数個の塩基が欠失、置換、挿入または付加された塩基配列からなるDNA、及び(C)(A)の塩基配列と相補的な塩基配列にストリンジェントな条件下でハイブリダイズする塩基配列からなるDNAからなる群より選ばれるDNAであって、ガラクトースの資化性を発揮させるRNAをコードするものである。なお、上記の(A)、(B)及び(C)に係るDNAのなかでも好ましくは(A)に係るDNAである。また、上記の第1〜第6実施形態で説明した事項を本実施形態で説明することは省略する。
【0072】
以下、本発明の実施例を説明するが、本発明の技術的範囲が下記の実施例に限定されることはない。
【実施例】
【0073】
[実施例1]過剰発現によりガラクトースの資化能を増大させる遺伝子の選別
マルチコピープラスミド(pRS424)(化学式1参照)を利用してS.cerevisiae CEN.PK2−1DのゲノムDNAライブラリーを製作した。製作したライブラリーのゲノムDNAを酵母に形質転換させることによって、酵母の全遺伝子が過剰発現する形質転換酵母のライブラリーを製作した。その後、ガラクトースを唯一の炭素源として含む培地(最小培地)で構築した形質転換酵母のライブラリーを培養し、連続継代培養法により、ガラクトースの資化能が増大した形質転換酵母を選別した。図2に示したように、ガラクトースの資化能が増大した(エタノールの生成度の高い)#2、5、34、37、40の酵母菌株のうち、#40の形質転換酵母からプラスミドを単離した。そして、クローニングに用いた制限酵素に対応する制限酵素部位の両側の公知の遺伝子の配列情報を利用して単離したプラスミドに導入した酵母遺伝子の配列を確認した。その後、酵母のゲノムの塩基配列と、プラスミドに挿入した遺伝子の両末端に存在する所定の長さの遺伝子の塩基配列とを比較し、導入遺伝子(挿入遺伝子)の酵母ゲノム上での位置を追跡することにより、過剰発現した遺伝子を確認した。その結果、#40の酵母菌株に導入した遺伝子の配列は、図3に示したように、酵母の第5染色体のうち1492241〜1494948の塩基配列であり、ここにSNR84遺伝子配列が含まれていることを確認した。そこで、原因遺伝子(SNR84遺伝子)がガラクトースの資化能の増大に関与するか否かを確認するために、前記原因遺伝子を含むプラスミドを酵母に再び形質転換し、ガラクトースの資化能の増大が前記原因遺伝子の過剰発現によるものであることを確認した。
【0074】
[実施例2]ガラクトースの資化能の評価
原因遺伝子(SNR84遺伝子)を含む酵母(S.cerevisiae)の第5染色体1492241〜1494948の塩基を、マルチコピープラスミドを利用してS.cerevisiae CEN.PK2−1D(MATalpha;ura3−52;trp1−289;leu2−3_112;his3 D1;MAL2−8C;SUC2)菌株に形質転換した。4%ガラクトースを含む最小培地中で20時間、培養した後、ガラクトースの資化能を観察するためにエタノール生成度を観察した。かかる結果を図4及び図5、並びに下記の表1に示した。
【0075】
【表1】

【0076】
コントロールの菌株の場合、与えられたガラクトースを全部消失(資化)するのに28時間を要し、その際のエタノール生成度は17g/lだった。また、20時間培養経過後のコントロールの菌株のエタノール生成度は14g/lであって、8g/lのガラクトースが未資化分として残存した。これに対し、snr84形質転換株(snr84の過剰発現株)の場合、20時間培養した時点でガラクトースを全部資化し、その際のエタノール生成度は18g/lであった。
【0077】
すなわち、SRN84遺伝子が過剰発現された菌株は、コントロールの菌株に比べてガラクトースの分解速度が著しく向上し、エタノールの生成度も同様に顕著に増大した。そして、驚くべきことに、エタノールの生産性は48%({0.9/0.61}×100)も増大した。
【0078】
本発明の属する分野における通常の知識を有する者であれば、上記の内容に基づき、本発明の範囲内で多種多様な応用や変形を行うことが可能である。
【図面の簡単な説明】
【0079】
【図1】本発明の第6実施形態で使用可能な遺伝子の選別方法を模式的に示した図である
【図2】図1による方法で選別された、様々な酵母菌株のエタノール生成量を示したグラフである(4%ガラクトースを含む5mlのYSC培地中で20時間培養)。
【図3】SNR84遺伝子を含む酵母の第5染色体の拡大した遺伝子地図である(酵母ゲノムのうち第5染色体の位置1492241〜1494948を示す)。
【図4】本発明の実施例2において、コントロールである野生型株を4%ガラクトースで培養したときの、資化能(発酵能)の増大効果を観察したグラフである。
【図5】本発明の実施例2において、SNR84遺伝子の形質転換株(SNR84を過剰発現させた菌株)を4%ガラクトースで培養したときの、資化能(発酵能)の増大効果を観察したグラフである。
【特許請求の範囲】
【請求項1】
(A)配列番号:1に示される塩基配列からなるDNA、
(B)配列番号:1に示される塩基配列において、1個または数個の塩基が欠失、置換、挿入または付加された塩基配列からなるDNA、及び
(C)(A)の塩基配列と相補的な塩基配列にストリンジェントな条件下でハイブリダイズする塩基配列からなるDNAからなる群より選ばれるDNAであって、
ガラクトースの資化性を発揮させるRNAをコードする、DNA。
【請求項2】
請求項1に記載のDNAを連結した、ベクター。
【請求項3】
バクテリア、プラスミド、ファージ、コスミド、エピソーム、ウイルス、または相同組み換えにより宿主細胞ゲノム内に挿入可能なDNA断片である、請求項2に記載のベクター。
【請求項4】
下記の開裂地図に示されたプラスミドである、請求項2または3に記載のベクター。
【化1】

【請求項5】
請求項2〜4のいずれか1項に記載のベクター(連結された目的DNAを含む)を利用して形質転換されてなる、微生物。
【請求項6】
バクテリア、カビまたは酵母である、請求項5に記載の微生物。
【請求項7】
前記酵母は、サッカロマイセス属、パチソレン属、クラビスポラ属、クリヴェロミセス属、デバリオミセス属、シュワニオミセス属、カンジダ属、ピキア属及びデッケラ属からなる群より選ばれる、請求項6に記載の微生物。
【請求項8】
サッカロマイセス セレビシエ CEN.PK2−1D/pRS424−SNR84(受託番号KCTC 11388 BP)である、請求項5〜7のいずれか1項に記載の微生物。
【請求項9】
前記ベクター中に連結された目的DNAである遺伝子が過剰発現されてなる、請求項4〜8のいずれか1項に記載の微生物。
【請求項10】
ガラクトースを含む炭素源を微生物に資化させることを含むガラクトース資化能の増大方法であって、
請求項1に記載のDNA、請求項2〜4のいずれか1項に記載のベクター、または請求項5〜9のいずれか1項に記載の微生物を利用することにより、前記DNAを過剰発現することを特徴とする、ガラクトース資化能の増大方法。
【請求項11】
ガラクトースを含む炭素源を微生物に資化させることを含むバイオアルコールの生産方法であって、
請求項1に記載のDNA、請求項2〜4のいずれか1項に記載のベクター、または請求項5〜9のいずれか1項に記載の微生物を利用することを特徴とする、バイオアルコールの生産方法。
【請求項12】
前記DNAを過剰発現させて、バイオアルコールの生産性を増大する、請求項11に記載の生産方法。
【請求項13】
前記ガラクトースを含む炭素源は、ガラクトースのみからなるか、またはガラクトース及びグルコースの混合糖からなる、請求項11または12に記載の生産方法。
【請求項14】
前記ガラクトースを含む炭素源は、ガラクトースを40%以上含む、請求項11〜13のいずれか1項に記載の生産方法。
【請求項15】
遺伝子を過剰発現させてガラクトースの資化能を増大させる、酵母の原因遺伝子の選別方法であって、
トリプトファンを含むマルチコピープラスミドを利用して酵母のゲノムDNAのライブラリーを構築する段階と、
構築した前記ライブラリー中のゲノムDNAを酵母に形質転換させ、酵母の全遺伝子を過剰発現させて、形質転換酵母のライブラリーを製作する段階と、
製作した前記ライブラリー中の形質転換酵母を、ガラクトースを唯一の炭素源として含む培地中で連続継代培養し、巨大コロニーを形成する、形質転換酵母を選別する段階と、
選別した前記形質転換酵母からプラスミドを単離し、単離されたプラスミドに挿入された酵母の遺伝子配列を確認する段階とを含む、酵母の原因遺伝子の選別方法。
【請求項16】
前記酵母は、サッカロマイセス セレビシエ CEN.PK2−1Dである、請求項15に記載の選別方法。
【請求項17】
前記マルチコピープラスミドは、pRS424である、請求項15または16に記載の選別方法。
【請求項18】
酵母のゲノムの塩基配列、及びプラスミドに挿入した遺伝子の両末端に存在する所定の長さの遺伝子の塩基配列を比較し、挿入遺伝子の酵母ゲノム上での位置を追跡することにより、過剰発現した遺伝子を確認する段階、並びに/または、
確認した前記遺伝子を含むプラスミドを酵母に再び形質転換し、ガラクトースの資化能の増大が前記遺伝子の過剰発現によるものであることを確認する段階をさらに含む、請求項15〜17のいずれか1項に記載の選別方法。
【請求項19】
請求項15〜18のいずれか1項に記載の選別方法により選別された、過剰発現によってガラクトースの資化性を増大させる、遺伝子。
【請求項20】
(A)配列番号:1に示される塩基配列からなるDNA、
(B)配列番号:1に示される塩基配列において、1個または数個の塩基が欠失、置換、挿入または付加された塩基配列からなるDNA、及び
(C)(A)の塩基配列と相補的な塩基配列にストリンジェントな条件下でハイブリダイズする塩基配列からなるDNAからなる群より選ばれるDNAであって、
ガラクトースの資化性を発揮させるRNAをコードする、請求項19に記載の遺伝子。
【請求項1】
(A)配列番号:1に示される塩基配列からなるDNA、
(B)配列番号:1に示される塩基配列において、1個または数個の塩基が欠失、置換、挿入または付加された塩基配列からなるDNA、及び
(C)(A)の塩基配列と相補的な塩基配列にストリンジェントな条件下でハイブリダイズする塩基配列からなるDNAからなる群より選ばれるDNAであって、
ガラクトースの資化性を発揮させるRNAをコードする、DNA。
【請求項2】
請求項1に記載のDNAを連結した、ベクター。
【請求項3】
バクテリア、プラスミド、ファージ、コスミド、エピソーム、ウイルス、または相同組み換えにより宿主細胞ゲノム内に挿入可能なDNA断片である、請求項2に記載のベクター。
【請求項4】
下記の開裂地図に示されたプラスミドである、請求項2または3に記載のベクター。
【化1】

【請求項5】
請求項2〜4のいずれか1項に記載のベクター(連結された目的DNAを含む)を利用して形質転換されてなる、微生物。
【請求項6】
バクテリア、カビまたは酵母である、請求項5に記載の微生物。
【請求項7】
前記酵母は、サッカロマイセス属、パチソレン属、クラビスポラ属、クリヴェロミセス属、デバリオミセス属、シュワニオミセス属、カンジダ属、ピキア属及びデッケラ属からなる群より選ばれる、請求項6に記載の微生物。
【請求項8】
サッカロマイセス セレビシエ CEN.PK2−1D/pRS424−SNR84(受託番号KCTC 11388 BP)である、請求項5〜7のいずれか1項に記載の微生物。
【請求項9】
前記ベクター中に連結された目的DNAである遺伝子が過剰発現されてなる、請求項4〜8のいずれか1項に記載の微生物。
【請求項10】
ガラクトースを含む炭素源を微生物に資化させることを含むガラクトース資化能の増大方法であって、
請求項1に記載のDNA、請求項2〜4のいずれか1項に記載のベクター、または請求項5〜9のいずれか1項に記載の微生物を利用することにより、前記DNAを過剰発現することを特徴とする、ガラクトース資化能の増大方法。
【請求項11】
ガラクトースを含む炭素源を微生物に資化させることを含むバイオアルコールの生産方法であって、
請求項1に記載のDNA、請求項2〜4のいずれか1項に記載のベクター、または請求項5〜9のいずれか1項に記載の微生物を利用することを特徴とする、バイオアルコールの生産方法。
【請求項12】
前記DNAを過剰発現させて、バイオアルコールの生産性を増大する、請求項11に記載の生産方法。
【請求項13】
前記ガラクトースを含む炭素源は、ガラクトースのみからなるか、またはガラクトース及びグルコースの混合糖からなる、請求項11または12に記載の生産方法。
【請求項14】
前記ガラクトースを含む炭素源は、ガラクトースを40%以上含む、請求項11〜13のいずれか1項に記載の生産方法。
【請求項15】
遺伝子を過剰発現させてガラクトースの資化能を増大させる、酵母の原因遺伝子の選別方法であって、
トリプトファンを含むマルチコピープラスミドを利用して酵母のゲノムDNAのライブラリーを構築する段階と、
構築した前記ライブラリー中のゲノムDNAを酵母に形質転換させ、酵母の全遺伝子を過剰発現させて、形質転換酵母のライブラリーを製作する段階と、
製作した前記ライブラリー中の形質転換酵母を、ガラクトースを唯一の炭素源として含む培地中で連続継代培養し、巨大コロニーを形成する、形質転換酵母を選別する段階と、
選別した前記形質転換酵母からプラスミドを単離し、単離されたプラスミドに挿入された酵母の遺伝子配列を確認する段階とを含む、酵母の原因遺伝子の選別方法。
【請求項16】
前記酵母は、サッカロマイセス セレビシエ CEN.PK2−1Dである、請求項15に記載の選別方法。
【請求項17】
前記マルチコピープラスミドは、pRS424である、請求項15または16に記載の選別方法。
【請求項18】
酵母のゲノムの塩基配列、及びプラスミドに挿入した遺伝子の両末端に存在する所定の長さの遺伝子の塩基配列を比較し、挿入遺伝子の酵母ゲノム上での位置を追跡することにより、過剰発現した遺伝子を確認する段階、並びに/または、
確認した前記遺伝子を含むプラスミドを酵母に再び形質転換し、ガラクトースの資化能の増大が前記遺伝子の過剰発現によるものであることを確認する段階をさらに含む、請求項15〜17のいずれか1項に記載の選別方法。
【請求項19】
請求項15〜18のいずれか1項に記載の選別方法により選別された、過剰発現によってガラクトースの資化性を増大させる、遺伝子。
【請求項20】
(A)配列番号:1に示される塩基配列からなるDNA、
(B)配列番号:1に示される塩基配列において、1個または数個の塩基が欠失、置換、挿入または付加された塩基配列からなるDNA、及び
(C)(A)の塩基配列と相補的な塩基配列にストリンジェントな条件下でハイブリダイズする塩基配列からなるDNAからなる群より選ばれるDNAであって、
ガラクトースの資化性を発揮させるRNAをコードする、請求項19に記載の遺伝子。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2010−104357(P2010−104357A)
【公開日】平成22年5月13日(2010.5.13)
【国際特許分類】
【出願番号】特願2009−35837(P2009−35837)
【出願日】平成21年2月18日(2009.2.18)
【出願人】(390019839)三星電子株式会社 (8,520)
【氏名又は名称原語表記】SAMSUNG ELECTRONICS CO.,LTD.
【住所又は居所原語表記】416,Maetan−dong,Yeongtong−gu,Suwon−si,Gyeonggi−do 442−742(KR)
【Fターム(参考)】
【公開日】平成22年5月13日(2010.5.13)
【国際特許分類】
【出願日】平成21年2月18日(2009.2.18)
【出願人】(390019839)三星電子株式会社 (8,520)
【氏名又は名称原語表記】SAMSUNG ELECTRONICS CO.,LTD.
【住所又は居所原語表記】416,Maetan−dong,Yeongtong−gu,Suwon−si,Gyeonggi−do 442−742(KR)
【Fターム(参考)】
[ Back to top ]

