ガンの新規処置
【課題】ガンの処置のための新規手段の提供。
【解決手段】本発明は、哺乳類及びヒトのガンの処置のための、同種間の免疫療法剤としての使用が意図される1又は複数の細胞系を含んで成る生成物に関する。
【解決手段】本発明は、哺乳類及びヒトのガンの処置のための、同種間の免疫療法剤としての使用が意図される1又は複数の細胞系を含んで成る生成物に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、腫瘍の病巣に対する攻撃を開始するためにガンに苦しむ哺乳類又はヒトの免疫系を誘導することによって、哺乳類(ヒトを含む)の原発性、転移性及び残留性のガンの処置のための薬剤に関する。特に、本発明はワクチンアジュバント及び/又は他の補助因子を用いる又は用いない、全細胞、その誘導体及び一部の使用に関する。更に具体的には、この開示は処置計画の基礎を形成する全細胞並びにその誘導体及び一部の特定の組み合わせの使用を記載する。
【背景技術】
【0002】
ガン細胞が、それらの正常な非ガン性対応物と比較して、定性的及び定量的、空間的及び時間的に多くの変異を含み、そして腫瘍細胞の増殖及び伝播の間のある時点で、これらの一部が宿主の免疫系によって異常として認識されることができることは当業界で知られている。このことは、宿主の免疫系の力を利用し、そしてガン細胞への攻撃を指示する免疫療法を開発する世界中の多くの研究努力を導き、それによって少なくとも生命を脅かさないレベルまでその様な異常な細胞を排除してきた(Maraveyas, A. & Dalgleish, A. G. 1977 Active immunotherapy for solid tumours in vaccine design in The Role of Cytokine Networks, Ed. Gregoriadis et al., Plenum Press, New York, pages 129-145; Morton, D. L. and Ravindranath, M. H. 1996 Current concepts concerning melanoma vaccines in Tumor Immunology - Immunotherapy and Cancer Vaccines, ed. Dalgleish, A. G. and Browning, M., Cambridge University Press, pages 241-268に概説されている。更なる詳細はこれらの出版物の他の紙面を参照のこと)。
【0003】
ガンの免疫療法を追求する多くの試みがなされてきており、そしてこれらは以下の5つの範疇に分類されうる:
【0004】
非特異的免疫療法
免疫系を非特異的に刺激する試みは、William Coleyの一世紀以上前の草分け的な実験に遡る(Coley, W. B., 1894 Treatment of inoperable malignant tumours with toxins of erisipelas and the Bacillus prodigosus. Trans. Am. Surg. Assoc. 12: 183)。限定されるいくつかの場合において成功するが(例えば、泌尿器の膀胱ガンの処置のためのBCG、メラノーマ及び腎臓ガンの処置のためのIL−2)、非特異的な免疫調節が、多くのガンを処置するのに十分であることを証明しない様であることは広く認識されている。非特異的な免疫刺激剤は免疫応答性の一般的な増強される状態を導きうるが、それらは標的化能力及び、更に免疫監視をくぐり、阻止し、そしてくつがえす多くの機構及び可塑性を有するであろう腫瘍の病巣を扱うための巧妙さを欠く。
【0005】
抗体及びモノクローナル抗体
抗体、及び特にモノクローナル抗体の形態の受動免疫療法は、抗ガン剤としての、多くの研究及び開発の対象であった。最初、その素晴らしい特異性のために魔法の弾丸と呼ばれたモノクローナル抗体は、抗体自身に対する免疫応答(それによりそれらの活性が排除される)及び血管を通過して病巣に近づくことのできない抗体の能力を含むいくつかの理由のため、ガンの免疫療法の分野におけるそれらの期待を果たすのに失敗した。最近、3つの生成物がヒトへの使用のための医薬として登録され、すなわちPanorex(Glaxo−Wellcome)、Rituxan(IDEC/Genetech/Hoffman la Roche)及びHerceptin(Genetech/Hoffman la Roche)のことであり、研究及び開発のための50以上の他の計画が進行している。抗体は、(免疫学的感覚において)ガン抗原を模倣している様な抗イディオタイプ抗体を用いる能動免疫療法にも利用されうる。概念は洗練されているが、抗体に基づいた試みの利用は最終的に、哺乳類又はヒトの対象者のガン細胞のサブセットが変異し、そして特定の抗体によって認識される抗原を失い、そしてそれによって、もはや抗体で処置が不可能なガン細胞の集団の増殖を導きうるという、「免疫学的逸脱」の現象によって制限されうることを証明しうる。
【0006】
サブユニットワクチン
感染症及び他の分野のためのワクチンの実験を頼りに、多くの研究者が、排他的に又は選択的にガン細胞と関連している抗原、すなわち腫瘍特異的抗原(TSA)又は腫瘍関連抗原(TAA)を同定し、そして特異的な能動免疫療法の基礎として前記の抗原又はその画分を使用しようと努めてきた。
【0007】
TAA又はTSAの範疇に分類されるタンパク質又はそれから誘導したペプチドを同定するために、多くの方法が存在する。例えば、ディファレンシャルディスプレイ技術を利用することが可能であり、これによってRNAの発現が、病巣で排他的又は選択的に発現するRNAを同定するために、腫瘍組織と隣接している正常な組織との間で比較される。前記RNAの配列決定は、その特異的な組織でその特異的な時期に発現する複数のTAA及びTSAを同定したが、その中には、TAA又はTSAの同定が、病巣における抗原のプロファイルの十分な反映を長時間提供できない、いずれかの与えられた時期の病巣の「片鱗」のみを表すという試みの潜在的な欠陥がある。同様に、細胞障害性Tリンパ球(CTL)のクローニング及び腫瘍組織由来のcDNAの発現クローニングは、多くのTAA及びTSAの同定を、特にメラノーマにおいてもたらした。前記の試みは、TAA又はTSAの1つだけの同定が、臨床的に関連している抗原のプロファイルの適当な表現を提供できないという、ディファレンシャルディスプレイ技術と同一の固有の欠点を有する。
【0008】
50以上のその様なワクチンの試みは、広範なガンの処置において発達しているが、ヒトの医薬生成物としての市販の認可を受けたものはまだない。上文の抗体に基づいた試みに記載したものに類似の方法において、サブユニットワクチンは、免疫学的逸脱の現象によっても制限されうる。
【0009】
遺伝子治療
ヒトの対象者における多くの遺伝子治療の試験が、ガンの処置の領域内でされてきており、これらの多くが患者の免疫応答を引き起こしそして/あるいは増幅する様に検討されてきた。商業的な開発における特に注目すべきものは、Vical Incによって開発されたヒト腫瘍の範囲のためのアロベクチン−7及びロイベクチン、Calydon Incによって開発された前立腺ガンの処置のためのCN706、並びにStressGen Incの、メラノーマ及び肺ガンのためのストレスタンパク質の遺伝子治療である。現在、企業及び大学の連合によって進められている、これら及び他の多くの「免疫−遺伝子治療」が最終的に成功したのかと証明するのは尚早であるが、これらの試みのうち、商業的な利用が10年以上先であろうことは広く受け入れられている。
【0010】
細胞を基にしたワクチン
腫瘍は:潜在的な標的タンパク質の発現のダウンレギュレーション;潜在的な標的タンパク質の変異;受容体及び他のタンパク質の表面発現のダウンレギュレーション;MHCクラスI及びIIの発現のダウンレギュレーション、それによるTAA又はTSAペプチドの直接的な提示の不可能;アネルギーを導くT細胞の不完全な刺激を導く共刺激分子のダウンレギュレーション;免疫系に対するおとりとして働く、選択的な、代表的でない膜部分の分断;免疫系をアネルギー化する選択的な膜部分の分断;阻害分子の分泌;T細胞の死滅の誘導;及び多くの他の方法を含む、様々な方法において、免疫系を中和する注目すべき能力を有する。明らかなことは、身体の中の免疫学的異種性及び可塑性が、異種性を同様に組み入れる免疫療法の計画によって、ある程度適合されなければならないであろうことである。全ガン細胞、又はその粗製誘導体の、ガンの免疫療法としての使用は、ウイルス性疾患に対するワクチンとしての、全部の不活性化又は弱毒化ウイルスの使用と類似して考察されうる。潜在的な利点は:
(a)全細胞が、上述した病巣のものに適合する十分な異種性の抗原のプロファイルを提供する幅広い抗原を含み;
(b)多価であり(すなわち複数の抗原を含み)、免疫学的逸脱の危険性が低下しており(これらの抗原の全てを「欠いている」ガン細胞の確率が操作される);そして
(c)細胞を基にしたワクチンが、それ自身まだ同定されていないTSA及びTAAを含む;これは、現在まだ同定されていない抗原が知られている比較的少ないTSA/TAAよりも臨床的に関連していない様であるならば可能である、ことである。
【0011】
細胞を基にしたワクチンは、2つの範疇に分けられる。最初に、自己組織由来の細胞を基にしたものは、患者からの生検の摘出、in vitroでの腫瘍細胞の培養、トランスフェクション及び/又は他の手段による細胞の修飾、細胞複製不能にするための照射及び、続いて同一の患者に細胞を戻すためにワクチンとして注射することを含む。この試みは、過去十年にわたってかなりの注目を受けたが、この個々の目的に合わせた治療が、複数の理由から本質的に実行不能であることが次第に明らかとなってきた。この試みは時間がかかり(しばしば、ワクチンの臨床的な投与量の製造のためのリードタイムが、患者の期待寿命を超える)、高価であり、そして「注文の」生成物として、標準化した生成物を指定することができない(生成物ではなく、方法のみが標準化され、そして、それ故に最適化され、そして質が調節されうる)。更に、自己組織由来のワクチンを調製するために使用した腫瘍の生検は、ある増殖特性、それを独特なものにする周囲の組織との相互作用及び関係を有するだろう。このことは、免疫療法のための自己の細胞の使用に対する潜在的に重大な欠点を暗示しており:最初の細胞を提供する生検は、ちょうどその時点で、その環境における腫瘍の免疫学的な片鱗を提示し、そしてこれは疾患の進行全体に及んで与えられうる、維持される活性を有するワクチンのために、長時間に及ぶ免疫学的提示として不適当であると思われる。
【0012】
細胞を基にしたワクチンの第2の型及び本発明の目的は、患者にとって遺伝的に(そしてそれ故に免疫学的に)不適合な同種細胞の使用を記載する。同種細胞は自己細胞と同一な多価の利点による恩恵を受ける。更に、同種細胞のワクチンがin vitroで無期限に培養されうる不死化細胞系に基くことがある場合、次の様に、この試みは自己組織を用いる試みのリードタイム及び費用上の不利を被らない。同様に、同種間の試みは、疾患の段階の観点から見た個体の疾患のプロファイル、病巣の位置及び他の治療に対する潜在的な抵抗性に適合しうる細胞型の組み合わせを使用する機会を提供する。
【0013】
細胞を基にしたガンワクチンの利用の、多くの刊公された報告が存在している(例えば、Dranoff, G. et al. WO93/06867; Gansbacher, P. WO94/18995; Jaffee, E. M. et al. WO97/24132; Mitchell, M. S. WO90/03183; Morton, D. M. et al. WO91/06866を参照のこと)。これらの研究は、GM−CSF,IL−2、インターフェロン又は他の免疫学的に活性な分子を産生するための細胞のトランスフェクション及び「自殺」遺伝子の使用に対する、免疫療法の抗原としてガン細胞を用いる基本的な方法に由来する変形の範囲を包含する。集団は、患者のハプロタイプに対してHLA適合又は部分的に適合する同種細胞系及び更にメラノーマの領域の患者のハプロタイプに対して不適合な同種細胞系及び更にGM−CSFでトランスフェクションした不適合な同種の前立腺細胞系を使用した。
【0014】
本発明の説明
本明細書で開示されている本発明は、哺乳類及びヒトのガンの処置のための、同種間の免疫療法剤としての使用が意図される1又は複数の細胞系を含んで成る生成物に関する。
【0015】
今までのところ細胞を基にしたガンワクチンの研究全てが、共通の特徴を有しており、すなわち患者の腫瘍に存在する抗原で共有されている少なくとも複数のTSA及び/又はTAAを含む細胞を使用する意図である。それぞれの場合において、腫瘍細胞は、腫瘍細胞だけが適当なTSA又はTAAを含み、そして前記細胞の組織の起原が患者の腫瘍部位に適合するという前提で、出発点として利用される。
【0016】
本発明の主な観点は、不死化した正常な、非悪性細胞の、同種細胞のガンワクチンの基礎としての使用である。正常な細胞はTSA又は適当な濃度のTAAを持たないので、本明細書に記載の正常細胞が抗ガンワクチンとして有効であることは驚きである。この試みは一般的であり、そして処置することが意図される腫瘍と同一な特定の組織に由来する不死化した正常細胞の使用によって、いずれかの哺乳類の腫瘍に適合されうる。不死化した正常細胞は、発表されている方法を用いて当業者によって調製されてもよく、又はそれら細胞バンク、例えばATCC又はECACCに由来していてもよく、又はそれらは当業界の複数の研究グループから入手可能である。
【0017】
前立腺ガンの場合、例えばワクチンは、Rhim, J. S. and Kung, H-F., 1997 Critical Reviews in Oncogenesis 8(4): 305-328において概説され、そして引用されている方法を用いて調製されうる前立腺に由来するか、又はPNT1A(ECACC参照番号95012614)、PNT2(ECACC参照番号95012613)、PZ−HPV−7(ATCC番号:CRL−2221)、NIH1532−CP2TX(ATCC CRL−12038),NIH1535−CP1TX(ATCC CRL−12041),,NIH1542−CP3TX(ATCC CRL−12037),CA−HPV−10(ATCC CRL−2220),LnCap(ATCC CRL−1740),DU145(ATCC HTB−81),又はPC3(ATCC CRL−1435)から選択される、異なる不死化正常細胞系の1つ又はその組み合わせに基づくこともある。
【0018】
本発明の更なる観点は、1又は複数の不死化正常細胞系と、原発性及び転移性のガンの生検に由来する1,2又は3つの異なる細胞系とを組み合わせることによる、TSA及び/又はTAAの添加にある。
【0019】
全ての適当な細胞系が、大規模な細胞培養における良好な増殖並びに質の調節及び再現可能な産生を認めるのに十分な特性を示すだろう。
【0020】
前記細胞系は、それらが哺乳類又はヒトにおいて使用する前に複製不能であることを保証するために、50〜300Gyでのガンマ線照射を利用して、致死的に照射される。
【0021】
前記細胞系及び免疫療法剤として有用であると上文で引用した組み合わせは、輸送及び貯蔵を見越して凍結しなければならず、それ故に本発明の更なる観点は、凍結保護溶液で調製した、上文で引用した細胞のいずれかの組み合わせにある。適当な凍結保護溶液は、限定しないが10〜30%v/v水性グリセロール溶液、5〜20%v/vジメチルスルホキシドを含むことがあり、又は5〜20%w/vのヒト血清アルブミンが単一の凍結保護剤として又は組み合わせで、そのいずれかで使用されうる。
【0022】
本発明の更なる態様は、非特異的な免疫賦活剤、例えばBCG又はM.バッカエ(Vaccae)、破傷風毒素、ジフテリア毒素、百日咳菌、インターロイキン2、インターロイキン12、インターロイキン4、インターロイキン7、完全フロイントアジュバント、不完全フロイントアジュバント又は当業界で知られている他の非特異的薬剤との、前記細胞系の組み合わせの使用にある。その利点は、一般的な免疫賦活剤が一般的に増強されている免疫状態を作り出し、一方、細胞系の組み合わせがそれらのハプロタイプな不適合を介して免疫の増強を増し、そしてそれらの特異的な起源の異種性の結果として、TAA及びTSAの多血症に対する免疫応答を標的化する。
【0023】
本発明は次の例、及び図に関して記述される。
【図面の簡単な説明】
【0024】
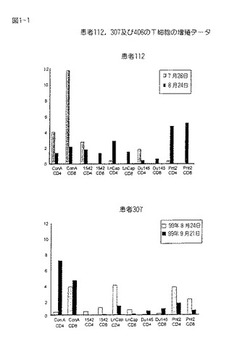
【図1−1】図1−1は患者112,307及び406のT細胞の増殖を示す。
【図1−2】図1−2は患者112,307及び406のT細胞の増殖を示す。
【図2−1】図2−1は患者115,304及び402由来の血清のウエスタンブロット解析を示す。
【図2−2】図2−2は患者115,304及び402由来の血清のウエスタンブロット解析を示す。
【図3−1】図3−1は患者112,305及び402由来の血清の抗体の力価を示す。
【図3−2】図3−2は患者112,305及び402由来の血清の抗体の力価を示す。
【図3−3】図3−3は患者112,305及び402由来の血清の抗体の力価を示す。
【図3−4】図3−4は患者112,305及び402由来の血清の抗体の力価を示す。
【図3−5】図3−5は患者112,305及び402由来の血清の抗体の力価を示す。
【図3−6】図3−6は患者112,305及び402由来の血清の抗体の力価を示す。
【図4−1】図4−1は患者110,303及び404のPSAデータを示す。
【図4−2】図4−2は患者110,303及び404のPSAデータを示す。
【図5】図5は正常なメラノサイトで免疫化したC57マウスの生存曲線を示す。
【0025】
例1
細胞の増殖、照射、調製及び保存
正常な前立腺組織に由来する不死化細胞系、すなわちPNT2は、液体窒素貯蔵物からの回収後、2mM L−グルタミン及び5%ウシ胎児血清(FCS)を添加したRPMI1640培地中で、回転びん培養において増殖した。T175静置フラスコ中での増殖の後、前記細胞は850cm2 の増殖領域を有する回転びん中に、1〜20×107 細胞/回転びんで播種した。
【0026】
原発性の前立腺組織に由来する不死化細胞系、すなわちNIH1542−CP3TXは、液体窒素貯蔵物からの回収の後、25μg/mlのウシ下垂体抽出物、5ng/mlの上皮増殖因子、2mM L−グルタミン、10mM HEPES緩衝液及び5%ウシ胎児血清(FCS)を添加したKSFM培地(以降、「修飾KSFM」と称する)中で、回転びん培養において増殖した。T175静置フラスコ中での増殖の後、前記細胞は1,700cm2 の増殖領域を有する回転びん中に、2〜5×107 細胞/回転びんで播種した。
【0027】
2つの続発性のものに由来する細胞系、すなわちLnCap及びDu145も使用し、これらはともにATCCを起源としている。LnCapは、1〜10×106 細胞/容器で播種し、そして続いてほぼ集密的になるまで増殖した後、10%FCS及び2mM L−グルタミンを添加したRPMI培地中で、大きな表面領域の静置フラスコにおいて増殖した。Du−145は、静置フラスコ中で凍結貯蔵物から増殖し、そして続いて1〜20×107 細胞/びんで、850cm2 の回転びんに播種し、そして10%FCS及び2mM L−グルタミンを含むDMEM培地中で集密的になるまで増殖した。全ての細胞系が、1倍の標準的な濃度のトリプシンを利用して採集された。DMEM中での延長した洗浄の後、前記細胞を5〜40×106 細胞/mlの濃度で再懸濁し、そしてCo60の供給源を用いて、50〜300Gyで照射した。照射後、前記細胞は10%DMSO,8%ヒト血清アルブミン/リン酸緩衝塩溶液から成る凍結保護用液中で調製され、そして使用が必要とされるまで液体窒素中で5〜150×106 細胞/μlの細胞濃度で凍結される。
【0028】
ワクチン接種
前立腺ガンの患者は、少なくとも30ng/mlの血清PSAレベルを有する、ホルモン治療に対して抵抗性があることに基づいて選択した。この試験を行うための倫理的な許可及びMCA[イギリスの薬剤管理機関(UK Medicines Control Agency)]の認可が求められ、そして得られた。
【0029】
3つのワクチン接種の計画のうち1つは、この試験の各部門に従った:
【表1】

【0030】
前記細胞は、37℃の水溶中でおだやかにあたため、そして患者への注射の前に放線菌のアジュバントと混合した。注射は、流入領域リンパ説のくぼみへの4つの注射部位で皮内から行った。投与間の最小間隔は2週間であり、そして投与の多くが4週間隔で与えられた。最初の投与前に、そしていくつかの引き続きの投与の前に、患者は上文のワクチン接種の計画において列記した4つの細胞系に対する遅延型過敏(DTH)について試験された(全ての試験がアジュバント無しの0.8×106 細胞を含む)。
【0031】
免疫学的応答の解析
(a)T細胞の増殖応答
ワクチン接種が、ワクチン接種した細胞系に由来する抗原を認識したT細胞集団の特異的な増殖をもたらしたかどうかを決定するために、我々は前立腺細胞系の溶解液での刺激の後に、T細胞での増殖アッセイを行った。クリニックに訪れた各人の全血液を抽出し、そして以下に記載する様なBrdU(ブロモデオキシウリジン)に基づいた増殖アッセイに使用した。
【0032】
患者のBrdU増殖法
【表2】

【0033】
方法
1)1mlの血液を9mlのRPMI+2mM L−gln+PS+50μM 2−Meで希釈する。血清を加えない。37℃で一晩放置する。
2)次の朝、450μlの希釈血液を48穴プレートに分割し、そして50μlの賦活溶解液を加える。前記溶解液は、腫瘍細胞(2×106 細胞等価物/ml)を液体窒素中で3回凍結融解し、そして続いて必要になるまで凍結してアリコートを保存することによって作成した。
3)37℃で5日間細胞を培養する。
4)5日目の晩に、30μg/mlのBrdUを50μl加える。
5)100μlの各試料を96穴丸底プレートに分割する。
6)プレートを遠心し、そして上清を除く。
7)室温で5分間、100μlのPharmalyseを用いて赤血球を溶解する。
8)50μlのCytofixで2回洗浄する。
9)遠心し、そして上清を軽くはじいて除去する。
10)100μlのPerm洗浄液で、室温で10分間透過処理をする。
11)Perm洗浄液で体積を合わせる補正希釈時の抗体を含んで成る、30μlの抗体混合物を加える。
12)暗がりにおいて室温で30分間インキュベートする。
13)1回洗浄し、そして100μlの2%パラホルムアルデヒド中で再懸濁する。
14)これを解析の準備ができたクラスターチューブ中の400μlのFACSフローに加える。
15)3000回のCD3の事象を保有する、FACSスキャンで解析する。
【表3】

【表4】

【表5】

【0034】
増殖アッセイの結果を図1に示し、ここで、CD4又はCD8のいずれかにポジティブなT細胞の増殖指数が、様々な細胞の溶解液に対してプロットされる。増殖指数は、T細胞が増殖するパーセンテージを溶解液無しのコントロールで割ることによって導かれる。
【0035】
患者番号112,307及び406の結果を示す。4つの細胞溶解液、すなわちNIH1542,LnCap,Du−145及びPNT−2の結果を与える。全体で、処置した患者の50%が前記細胞系のうち少なくても1つに対する特異的な増殖応答を増している。
【0036】
(b)患者の血清を利用するウエスタンブロット
標準化した細胞溶解液は、ウエスタンブロット解析のための変性SDS PAGEゲル上に同様のタンパク量を添加することを可能にするために、いくつかの前立腺細胞系について調製された。各ブロットは、分子量マーカー、並びにNIH1542,LnCap,Du−145及びPNT−2の細胞溶解液由来の等量のタンパク質が添加された。このブロットは、続いてワクチン接種前及びワクチン接種の16週後(4〜6回の投与)の患者の血清でプローブした。
【0037】
方法
a)試料の調製(前立腺の腫瘍系)
・細胞のペレットをPBS中で3回洗浄する。
・1×107 細胞/ml溶解緩衝液で再懸濁する。
・液体窒素/水溶中での素速い凍結融解に5サイクル通す。
・細胞片を除去するために5分間1500rpm で遠心する。
・膜混入物を除去するために30分間20,000rpm で超遠心する。
・200μlに分割し、そして−80℃で保存する。
【0038】
b)ゲル電気泳動
・溶解液をLaemelliの試料緩衝液と1:1で混合し、そして5分間煮沸する。
・4〜20%のグラジエンドゲルの穴に20μgの試料を添加する。
・Bjerrum及びSchafer−Nielsonのトランスファー緩衝液(SDSを含む)中で、200Vで35分間ゲルを流す。
【0039】
c)ウエスタントランスファー
・トランスファー緩衝液中で15分間、ゲル、ニトロセルロース膜及びブロッティングペーパーを平衡化する。
・セミドライの電気泳動トランスファーセルの陽極上のゲル−ニトロセルロースサンドイッチを並べる:2枚のブロッティングペーパー、ニトロセルロース膜、ゲル、2枚のブロッティングペーパー。
・陰極をかけ、そして25Vで90分間流す。
【0040】
d)タンパク質の免疫学的検出
・4℃で一晩、PBS/0.05% Tween20中の5%Marvelでニトロセルロース膜をブロッキングする。
・PBS/0.05% Tween20中で膜を2回すすぎ、続いて室温で20分間及び2×5分間、振盪プラットホーム上で洗浄する。
・振盪プラットホーム上で室温で120分間、明らかにした患者の血漿の1:20希釈液中で膜をインキュベートする。
・5分の最終洗浄を加えて、上文の様に洗浄する。
・振盪プラットホーム上で室温で90分間、ビオチン抗ヒトIgG又はIgMの1:250希釈液中で膜をインキュベートする。
・5分の最終洗浄を加えて、上文の様に洗浄する。
・振盪プラットホーム上で室温で60分間、ストレプトアビジン−西洋クサビペルオキシダーゼ結合体の1:1000希釈液中で膜をインキュベートする。
・上文の様に洗浄する。
・発色させるために、5分間ジアミノベンジジンペルオキシターゼ基質中で膜をインキュベートし、膜を水ですすぐことで反応を停止させる。
【0041】
患者112,305及び402の図3の結果は、明らかに16週の期間に及ぶワクチン接種(4〜6回の投与)が、細胞系の溶解液に対する抗体の力価及び更にはこのワクチン接種法で入手できない溶解液(DTH試験以外)に対する交差反応性の増大をもたらしうることを示している。
【0042】
(c)抗体の力価の決定
抗体の力価は、標準化した細胞系でELISAプレートをコーティングし、そしてワクチン接種した患者由来の血清に対する希釈研究を行うことで決定した。
【0043】
抗溶解液IgGを用いるELISAの方法
1.次の希釈を用いて、50μl/穴 溶解液(10μg/ml)でプレートをコートする。
【表6】

2.カバーをし、そして4℃で一晩インキュベートする。
3.2回PBS−Tweenで洗浄する。乾燥させるためにペーパータオル上でプレートをたたく。
4.PBS/10%FCSでブロックする(100μl/穴)。
5.カバーし、そして室温で1時間(最低)インキュベートする。
6.PBS−Tweenで2回洗浄する。
7.100μlのPBS−10%FCSを列2〜8に加える。
8.200μlの血漿試料(PBS−10%FCS中で1/100希釈、すなわち10μlの血漿を990μlのPBS−10%FCSに加えたもの)を列1に加え、そしてプレートの下方向への100μlの連続希釈を行う。一番下の穴から過剰な100μlを除く。カバーし、そして冷蔵庫で一晩インキュベートする。
9.ビオチン化した抗体(Pharminger;IgG 34162D)を最終濃度1mg/mlに希釈する(すなわち20ml/10ml)。
10.カバーし、そして室温で45分間インキュベートする。
11.上文の様に6回洗浄する。
12.ストレプトアビジン−HRP(Pharminger,13047E O;1:1000希釈)に希釈する(すなわち10ml−>10ml)。
13.穴当たり100mlを加える。
14.室温で30分間インキュベートする。
15.8回洗浄する
16.穴当たり100ml基質を加える。室温で10〜80分展開する。
17.100mlの1M H2SO4を加えることで発色反応を停止する。
18.405nmでODを読み取る。
【0044】
患者112,305及び402の図3結果は、基準線(O)、4週、8週及び16週の抗体の力価を示す。本データは、少なくとも4回の投与によるワクチン接種後、患者が細胞系の溶解液に対する抗体の力価及び更にはこのワクチン接種法で入手できない溶解液(DHT投与以外)に対する交差反応性の増大を示すことがあることを示す。
【0045】
(d)PSAレベルの評価
ワクチンを受けている患者のPSAレベルは、試験の開始時及びワクチン接種の間、慣習的に使用する臨床用のキットを用いて記録した。患者110,303及び404のPSA値は図4に示し(縦軸は血清PSA(ng/ml)であり;横軸は時間であり、最初の点はワクチン接種計画の開始を表す)、そしてPSA値の落ち込み又は部分的な安定化を表し、この患者の集団において、しばしば指数関数的な増大が標準的に持続する。患者110の結果は、骨の痛みを軽減するための放射線治療によって多少混乱するが、PSAレベルは放射線治療の前に低下した。
【0046】
例2:マウスのメラノーマ保護モデルにおける正常なメラノサイトの使用
正常なメラノサイト細胞系は、挑戦的な投与としてB16.F10を利用するマウスのワクチン接種保護モデルに使用した。C57マウスはPBS,5×106 個の照射されたK1735同種のメラノーマ細胞又は5×106 個の照射されたMelan P1の自己の正常なメラノサイト細胞のいずれかのうちの2つのワクチン接種を14及び7日目に受けた。0日目の挑戦は1×104 個のB16.F10細胞で行い、そして腫瘍の大きさは10日目以降から3日ごとに測定した。動物は、腫瘍が腫瘍の最大の大きさを超えて1.5×1.5cmに生育したときにと殺した。図5は、Melan 1P細胞によるワクチン接種が、この特に活動的なマウスの腫瘍に対してある程度の保護をもたらすことを示す。
【技術分野】
【0001】
本発明は、腫瘍の病巣に対する攻撃を開始するためにガンに苦しむ哺乳類又はヒトの免疫系を誘導することによって、哺乳類(ヒトを含む)の原発性、転移性及び残留性のガンの処置のための薬剤に関する。特に、本発明はワクチンアジュバント及び/又は他の補助因子を用いる又は用いない、全細胞、その誘導体及び一部の使用に関する。更に具体的には、この開示は処置計画の基礎を形成する全細胞並びにその誘導体及び一部の特定の組み合わせの使用を記載する。
【背景技術】
【0002】
ガン細胞が、それらの正常な非ガン性対応物と比較して、定性的及び定量的、空間的及び時間的に多くの変異を含み、そして腫瘍細胞の増殖及び伝播の間のある時点で、これらの一部が宿主の免疫系によって異常として認識されることができることは当業界で知られている。このことは、宿主の免疫系の力を利用し、そしてガン細胞への攻撃を指示する免疫療法を開発する世界中の多くの研究努力を導き、それによって少なくとも生命を脅かさないレベルまでその様な異常な細胞を排除してきた(Maraveyas, A. & Dalgleish, A. G. 1977 Active immunotherapy for solid tumours in vaccine design in The Role of Cytokine Networks, Ed. Gregoriadis et al., Plenum Press, New York, pages 129-145; Morton, D. L. and Ravindranath, M. H. 1996 Current concepts concerning melanoma vaccines in Tumor Immunology - Immunotherapy and Cancer Vaccines, ed. Dalgleish, A. G. and Browning, M., Cambridge University Press, pages 241-268に概説されている。更なる詳細はこれらの出版物の他の紙面を参照のこと)。
【0003】
ガンの免疫療法を追求する多くの試みがなされてきており、そしてこれらは以下の5つの範疇に分類されうる:
【0004】
非特異的免疫療法
免疫系を非特異的に刺激する試みは、William Coleyの一世紀以上前の草分け的な実験に遡る(Coley, W. B., 1894 Treatment of inoperable malignant tumours with toxins of erisipelas and the Bacillus prodigosus. Trans. Am. Surg. Assoc. 12: 183)。限定されるいくつかの場合において成功するが(例えば、泌尿器の膀胱ガンの処置のためのBCG、メラノーマ及び腎臓ガンの処置のためのIL−2)、非特異的な免疫調節が、多くのガンを処置するのに十分であることを証明しない様であることは広く認識されている。非特異的な免疫刺激剤は免疫応答性の一般的な増強される状態を導きうるが、それらは標的化能力及び、更に免疫監視をくぐり、阻止し、そしてくつがえす多くの機構及び可塑性を有するであろう腫瘍の病巣を扱うための巧妙さを欠く。
【0005】
抗体及びモノクローナル抗体
抗体、及び特にモノクローナル抗体の形態の受動免疫療法は、抗ガン剤としての、多くの研究及び開発の対象であった。最初、その素晴らしい特異性のために魔法の弾丸と呼ばれたモノクローナル抗体は、抗体自身に対する免疫応答(それによりそれらの活性が排除される)及び血管を通過して病巣に近づくことのできない抗体の能力を含むいくつかの理由のため、ガンの免疫療法の分野におけるそれらの期待を果たすのに失敗した。最近、3つの生成物がヒトへの使用のための医薬として登録され、すなわちPanorex(Glaxo−Wellcome)、Rituxan(IDEC/Genetech/Hoffman la Roche)及びHerceptin(Genetech/Hoffman la Roche)のことであり、研究及び開発のための50以上の他の計画が進行している。抗体は、(免疫学的感覚において)ガン抗原を模倣している様な抗イディオタイプ抗体を用いる能動免疫療法にも利用されうる。概念は洗練されているが、抗体に基づいた試みの利用は最終的に、哺乳類又はヒトの対象者のガン細胞のサブセットが変異し、そして特定の抗体によって認識される抗原を失い、そしてそれによって、もはや抗体で処置が不可能なガン細胞の集団の増殖を導きうるという、「免疫学的逸脱」の現象によって制限されうることを証明しうる。
【0006】
サブユニットワクチン
感染症及び他の分野のためのワクチンの実験を頼りに、多くの研究者が、排他的に又は選択的にガン細胞と関連している抗原、すなわち腫瘍特異的抗原(TSA)又は腫瘍関連抗原(TAA)を同定し、そして特異的な能動免疫療法の基礎として前記の抗原又はその画分を使用しようと努めてきた。
【0007】
TAA又はTSAの範疇に分類されるタンパク質又はそれから誘導したペプチドを同定するために、多くの方法が存在する。例えば、ディファレンシャルディスプレイ技術を利用することが可能であり、これによってRNAの発現が、病巣で排他的又は選択的に発現するRNAを同定するために、腫瘍組織と隣接している正常な組織との間で比較される。前記RNAの配列決定は、その特異的な組織でその特異的な時期に発現する複数のTAA及びTSAを同定したが、その中には、TAA又はTSAの同定が、病巣における抗原のプロファイルの十分な反映を長時間提供できない、いずれかの与えられた時期の病巣の「片鱗」のみを表すという試みの潜在的な欠陥がある。同様に、細胞障害性Tリンパ球(CTL)のクローニング及び腫瘍組織由来のcDNAの発現クローニングは、多くのTAA及びTSAの同定を、特にメラノーマにおいてもたらした。前記の試みは、TAA又はTSAの1つだけの同定が、臨床的に関連している抗原のプロファイルの適当な表現を提供できないという、ディファレンシャルディスプレイ技術と同一の固有の欠点を有する。
【0008】
50以上のその様なワクチンの試みは、広範なガンの処置において発達しているが、ヒトの医薬生成物としての市販の認可を受けたものはまだない。上文の抗体に基づいた試みに記載したものに類似の方法において、サブユニットワクチンは、免疫学的逸脱の現象によっても制限されうる。
【0009】
遺伝子治療
ヒトの対象者における多くの遺伝子治療の試験が、ガンの処置の領域内でされてきており、これらの多くが患者の免疫応答を引き起こしそして/あるいは増幅する様に検討されてきた。商業的な開発における特に注目すべきものは、Vical Incによって開発されたヒト腫瘍の範囲のためのアロベクチン−7及びロイベクチン、Calydon Incによって開発された前立腺ガンの処置のためのCN706、並びにStressGen Incの、メラノーマ及び肺ガンのためのストレスタンパク質の遺伝子治療である。現在、企業及び大学の連合によって進められている、これら及び他の多くの「免疫−遺伝子治療」が最終的に成功したのかと証明するのは尚早であるが、これらの試みのうち、商業的な利用が10年以上先であろうことは広く受け入れられている。
【0010】
細胞を基にしたワクチン
腫瘍は:潜在的な標的タンパク質の発現のダウンレギュレーション;潜在的な標的タンパク質の変異;受容体及び他のタンパク質の表面発現のダウンレギュレーション;MHCクラスI及びIIの発現のダウンレギュレーション、それによるTAA又はTSAペプチドの直接的な提示の不可能;アネルギーを導くT細胞の不完全な刺激を導く共刺激分子のダウンレギュレーション;免疫系に対するおとりとして働く、選択的な、代表的でない膜部分の分断;免疫系をアネルギー化する選択的な膜部分の分断;阻害分子の分泌;T細胞の死滅の誘導;及び多くの他の方法を含む、様々な方法において、免疫系を中和する注目すべき能力を有する。明らかなことは、身体の中の免疫学的異種性及び可塑性が、異種性を同様に組み入れる免疫療法の計画によって、ある程度適合されなければならないであろうことである。全ガン細胞、又はその粗製誘導体の、ガンの免疫療法としての使用は、ウイルス性疾患に対するワクチンとしての、全部の不活性化又は弱毒化ウイルスの使用と類似して考察されうる。潜在的な利点は:
(a)全細胞が、上述した病巣のものに適合する十分な異種性の抗原のプロファイルを提供する幅広い抗原を含み;
(b)多価であり(すなわち複数の抗原を含み)、免疫学的逸脱の危険性が低下しており(これらの抗原の全てを「欠いている」ガン細胞の確率が操作される);そして
(c)細胞を基にしたワクチンが、それ自身まだ同定されていないTSA及びTAAを含む;これは、現在まだ同定されていない抗原が知られている比較的少ないTSA/TAAよりも臨床的に関連していない様であるならば可能である、ことである。
【0011】
細胞を基にしたワクチンは、2つの範疇に分けられる。最初に、自己組織由来の細胞を基にしたものは、患者からの生検の摘出、in vitroでの腫瘍細胞の培養、トランスフェクション及び/又は他の手段による細胞の修飾、細胞複製不能にするための照射及び、続いて同一の患者に細胞を戻すためにワクチンとして注射することを含む。この試みは、過去十年にわたってかなりの注目を受けたが、この個々の目的に合わせた治療が、複数の理由から本質的に実行不能であることが次第に明らかとなってきた。この試みは時間がかかり(しばしば、ワクチンの臨床的な投与量の製造のためのリードタイムが、患者の期待寿命を超える)、高価であり、そして「注文の」生成物として、標準化した生成物を指定することができない(生成物ではなく、方法のみが標準化され、そして、それ故に最適化され、そして質が調節されうる)。更に、自己組織由来のワクチンを調製するために使用した腫瘍の生検は、ある増殖特性、それを独特なものにする周囲の組織との相互作用及び関係を有するだろう。このことは、免疫療法のための自己の細胞の使用に対する潜在的に重大な欠点を暗示しており:最初の細胞を提供する生検は、ちょうどその時点で、その環境における腫瘍の免疫学的な片鱗を提示し、そしてこれは疾患の進行全体に及んで与えられうる、維持される活性を有するワクチンのために、長時間に及ぶ免疫学的提示として不適当であると思われる。
【0012】
細胞を基にしたワクチンの第2の型及び本発明の目的は、患者にとって遺伝的に(そしてそれ故に免疫学的に)不適合な同種細胞の使用を記載する。同種細胞は自己細胞と同一な多価の利点による恩恵を受ける。更に、同種細胞のワクチンがin vitroで無期限に培養されうる不死化細胞系に基くことがある場合、次の様に、この試みは自己組織を用いる試みのリードタイム及び費用上の不利を被らない。同様に、同種間の試みは、疾患の段階の観点から見た個体の疾患のプロファイル、病巣の位置及び他の治療に対する潜在的な抵抗性に適合しうる細胞型の組み合わせを使用する機会を提供する。
【0013】
細胞を基にしたガンワクチンの利用の、多くの刊公された報告が存在している(例えば、Dranoff, G. et al. WO93/06867; Gansbacher, P. WO94/18995; Jaffee, E. M. et al. WO97/24132; Mitchell, M. S. WO90/03183; Morton, D. M. et al. WO91/06866を参照のこと)。これらの研究は、GM−CSF,IL−2、インターフェロン又は他の免疫学的に活性な分子を産生するための細胞のトランスフェクション及び「自殺」遺伝子の使用に対する、免疫療法の抗原としてガン細胞を用いる基本的な方法に由来する変形の範囲を包含する。集団は、患者のハプロタイプに対してHLA適合又は部分的に適合する同種細胞系及び更にメラノーマの領域の患者のハプロタイプに対して不適合な同種細胞系及び更にGM−CSFでトランスフェクションした不適合な同種の前立腺細胞系を使用した。
【0014】
本発明の説明
本明細書で開示されている本発明は、哺乳類及びヒトのガンの処置のための、同種間の免疫療法剤としての使用が意図される1又は複数の細胞系を含んで成る生成物に関する。
【0015】
今までのところ細胞を基にしたガンワクチンの研究全てが、共通の特徴を有しており、すなわち患者の腫瘍に存在する抗原で共有されている少なくとも複数のTSA及び/又はTAAを含む細胞を使用する意図である。それぞれの場合において、腫瘍細胞は、腫瘍細胞だけが適当なTSA又はTAAを含み、そして前記細胞の組織の起原が患者の腫瘍部位に適合するという前提で、出発点として利用される。
【0016】
本発明の主な観点は、不死化した正常な、非悪性細胞の、同種細胞のガンワクチンの基礎としての使用である。正常な細胞はTSA又は適当な濃度のTAAを持たないので、本明細書に記載の正常細胞が抗ガンワクチンとして有効であることは驚きである。この試みは一般的であり、そして処置することが意図される腫瘍と同一な特定の組織に由来する不死化した正常細胞の使用によって、いずれかの哺乳類の腫瘍に適合されうる。不死化した正常細胞は、発表されている方法を用いて当業者によって調製されてもよく、又はそれら細胞バンク、例えばATCC又はECACCに由来していてもよく、又はそれらは当業界の複数の研究グループから入手可能である。
【0017】
前立腺ガンの場合、例えばワクチンは、Rhim, J. S. and Kung, H-F., 1997 Critical Reviews in Oncogenesis 8(4): 305-328において概説され、そして引用されている方法を用いて調製されうる前立腺に由来するか、又はPNT1A(ECACC参照番号95012614)、PNT2(ECACC参照番号95012613)、PZ−HPV−7(ATCC番号:CRL−2221)、NIH1532−CP2TX(ATCC CRL−12038),NIH1535−CP1TX(ATCC CRL−12041),,NIH1542−CP3TX(ATCC CRL−12037),CA−HPV−10(ATCC CRL−2220),LnCap(ATCC CRL−1740),DU145(ATCC HTB−81),又はPC3(ATCC CRL−1435)から選択される、異なる不死化正常細胞系の1つ又はその組み合わせに基づくこともある。
【0018】
本発明の更なる観点は、1又は複数の不死化正常細胞系と、原発性及び転移性のガンの生検に由来する1,2又は3つの異なる細胞系とを組み合わせることによる、TSA及び/又はTAAの添加にある。
【0019】
全ての適当な細胞系が、大規模な細胞培養における良好な増殖並びに質の調節及び再現可能な産生を認めるのに十分な特性を示すだろう。
【0020】
前記細胞系は、それらが哺乳類又はヒトにおいて使用する前に複製不能であることを保証するために、50〜300Gyでのガンマ線照射を利用して、致死的に照射される。
【0021】
前記細胞系及び免疫療法剤として有用であると上文で引用した組み合わせは、輸送及び貯蔵を見越して凍結しなければならず、それ故に本発明の更なる観点は、凍結保護溶液で調製した、上文で引用した細胞のいずれかの組み合わせにある。適当な凍結保護溶液は、限定しないが10〜30%v/v水性グリセロール溶液、5〜20%v/vジメチルスルホキシドを含むことがあり、又は5〜20%w/vのヒト血清アルブミンが単一の凍結保護剤として又は組み合わせで、そのいずれかで使用されうる。
【0022】
本発明の更なる態様は、非特異的な免疫賦活剤、例えばBCG又はM.バッカエ(Vaccae)、破傷風毒素、ジフテリア毒素、百日咳菌、インターロイキン2、インターロイキン12、インターロイキン4、インターロイキン7、完全フロイントアジュバント、不完全フロイントアジュバント又は当業界で知られている他の非特異的薬剤との、前記細胞系の組み合わせの使用にある。その利点は、一般的な免疫賦活剤が一般的に増強されている免疫状態を作り出し、一方、細胞系の組み合わせがそれらのハプロタイプな不適合を介して免疫の増強を増し、そしてそれらの特異的な起源の異種性の結果として、TAA及びTSAの多血症に対する免疫応答を標的化する。
【0023】
本発明は次の例、及び図に関して記述される。
【図面の簡単な説明】
【0024】
【図1−1】図1−1は患者112,307及び406のT細胞の増殖を示す。
【図1−2】図1−2は患者112,307及び406のT細胞の増殖を示す。
【図2−1】図2−1は患者115,304及び402由来の血清のウエスタンブロット解析を示す。
【図2−2】図2−2は患者115,304及び402由来の血清のウエスタンブロット解析を示す。
【図3−1】図3−1は患者112,305及び402由来の血清の抗体の力価を示す。
【図3−2】図3−2は患者112,305及び402由来の血清の抗体の力価を示す。
【図3−3】図3−3は患者112,305及び402由来の血清の抗体の力価を示す。
【図3−4】図3−4は患者112,305及び402由来の血清の抗体の力価を示す。
【図3−5】図3−5は患者112,305及び402由来の血清の抗体の力価を示す。
【図3−6】図3−6は患者112,305及び402由来の血清の抗体の力価を示す。
【図4−1】図4−1は患者110,303及び404のPSAデータを示す。
【図4−2】図4−2は患者110,303及び404のPSAデータを示す。
【図5】図5は正常なメラノサイトで免疫化したC57マウスの生存曲線を示す。
【0025】
例1
細胞の増殖、照射、調製及び保存
正常な前立腺組織に由来する不死化細胞系、すなわちPNT2は、液体窒素貯蔵物からの回収後、2mM L−グルタミン及び5%ウシ胎児血清(FCS)を添加したRPMI1640培地中で、回転びん培養において増殖した。T175静置フラスコ中での増殖の後、前記細胞は850cm2 の増殖領域を有する回転びん中に、1〜20×107 細胞/回転びんで播種した。
【0026】
原発性の前立腺組織に由来する不死化細胞系、すなわちNIH1542−CP3TXは、液体窒素貯蔵物からの回収の後、25μg/mlのウシ下垂体抽出物、5ng/mlの上皮増殖因子、2mM L−グルタミン、10mM HEPES緩衝液及び5%ウシ胎児血清(FCS)を添加したKSFM培地(以降、「修飾KSFM」と称する)中で、回転びん培養において増殖した。T175静置フラスコ中での増殖の後、前記細胞は1,700cm2 の増殖領域を有する回転びん中に、2〜5×107 細胞/回転びんで播種した。
【0027】
2つの続発性のものに由来する細胞系、すなわちLnCap及びDu145も使用し、これらはともにATCCを起源としている。LnCapは、1〜10×106 細胞/容器で播種し、そして続いてほぼ集密的になるまで増殖した後、10%FCS及び2mM L−グルタミンを添加したRPMI培地中で、大きな表面領域の静置フラスコにおいて増殖した。Du−145は、静置フラスコ中で凍結貯蔵物から増殖し、そして続いて1〜20×107 細胞/びんで、850cm2 の回転びんに播種し、そして10%FCS及び2mM L−グルタミンを含むDMEM培地中で集密的になるまで増殖した。全ての細胞系が、1倍の標準的な濃度のトリプシンを利用して採集された。DMEM中での延長した洗浄の後、前記細胞を5〜40×106 細胞/mlの濃度で再懸濁し、そしてCo60の供給源を用いて、50〜300Gyで照射した。照射後、前記細胞は10%DMSO,8%ヒト血清アルブミン/リン酸緩衝塩溶液から成る凍結保護用液中で調製され、そして使用が必要とされるまで液体窒素中で5〜150×106 細胞/μlの細胞濃度で凍結される。
【0028】
ワクチン接種
前立腺ガンの患者は、少なくとも30ng/mlの血清PSAレベルを有する、ホルモン治療に対して抵抗性があることに基づいて選択した。この試験を行うための倫理的な許可及びMCA[イギリスの薬剤管理機関(UK Medicines Control Agency)]の認可が求められ、そして得られた。
【0029】
3つのワクチン接種の計画のうち1つは、この試験の各部門に従った:
【表1】

【0030】
前記細胞は、37℃の水溶中でおだやかにあたため、そして患者への注射の前に放線菌のアジュバントと混合した。注射は、流入領域リンパ説のくぼみへの4つの注射部位で皮内から行った。投与間の最小間隔は2週間であり、そして投与の多くが4週間隔で与えられた。最初の投与前に、そしていくつかの引き続きの投与の前に、患者は上文のワクチン接種の計画において列記した4つの細胞系に対する遅延型過敏(DTH)について試験された(全ての試験がアジュバント無しの0.8×106 細胞を含む)。
【0031】
免疫学的応答の解析
(a)T細胞の増殖応答
ワクチン接種が、ワクチン接種した細胞系に由来する抗原を認識したT細胞集団の特異的な増殖をもたらしたかどうかを決定するために、我々は前立腺細胞系の溶解液での刺激の後に、T細胞での増殖アッセイを行った。クリニックに訪れた各人の全血液を抽出し、そして以下に記載する様なBrdU(ブロモデオキシウリジン)に基づいた増殖アッセイに使用した。
【0032】
患者のBrdU増殖法
【表2】

【0033】
方法
1)1mlの血液を9mlのRPMI+2mM L−gln+PS+50μM 2−Meで希釈する。血清を加えない。37℃で一晩放置する。
2)次の朝、450μlの希釈血液を48穴プレートに分割し、そして50μlの賦活溶解液を加える。前記溶解液は、腫瘍細胞(2×106 細胞等価物/ml)を液体窒素中で3回凍結融解し、そして続いて必要になるまで凍結してアリコートを保存することによって作成した。
3)37℃で5日間細胞を培養する。
4)5日目の晩に、30μg/mlのBrdUを50μl加える。
5)100μlの各試料を96穴丸底プレートに分割する。
6)プレートを遠心し、そして上清を除く。
7)室温で5分間、100μlのPharmalyseを用いて赤血球を溶解する。
8)50μlのCytofixで2回洗浄する。
9)遠心し、そして上清を軽くはじいて除去する。
10)100μlのPerm洗浄液で、室温で10分間透過処理をする。
11)Perm洗浄液で体積を合わせる補正希釈時の抗体を含んで成る、30μlの抗体混合物を加える。
12)暗がりにおいて室温で30分間インキュベートする。
13)1回洗浄し、そして100μlの2%パラホルムアルデヒド中で再懸濁する。
14)これを解析の準備ができたクラスターチューブ中の400μlのFACSフローに加える。
15)3000回のCD3の事象を保有する、FACSスキャンで解析する。
【表3】

【表4】

【表5】

【0034】
増殖アッセイの結果を図1に示し、ここで、CD4又はCD8のいずれかにポジティブなT細胞の増殖指数が、様々な細胞の溶解液に対してプロットされる。増殖指数は、T細胞が増殖するパーセンテージを溶解液無しのコントロールで割ることによって導かれる。
【0035】
患者番号112,307及び406の結果を示す。4つの細胞溶解液、すなわちNIH1542,LnCap,Du−145及びPNT−2の結果を与える。全体で、処置した患者の50%が前記細胞系のうち少なくても1つに対する特異的な増殖応答を増している。
【0036】
(b)患者の血清を利用するウエスタンブロット
標準化した細胞溶解液は、ウエスタンブロット解析のための変性SDS PAGEゲル上に同様のタンパク量を添加することを可能にするために、いくつかの前立腺細胞系について調製された。各ブロットは、分子量マーカー、並びにNIH1542,LnCap,Du−145及びPNT−2の細胞溶解液由来の等量のタンパク質が添加された。このブロットは、続いてワクチン接種前及びワクチン接種の16週後(4〜6回の投与)の患者の血清でプローブした。
【0037】
方法
a)試料の調製(前立腺の腫瘍系)
・細胞のペレットをPBS中で3回洗浄する。
・1×107 細胞/ml溶解緩衝液で再懸濁する。
・液体窒素/水溶中での素速い凍結融解に5サイクル通す。
・細胞片を除去するために5分間1500rpm で遠心する。
・膜混入物を除去するために30分間20,000rpm で超遠心する。
・200μlに分割し、そして−80℃で保存する。
【0038】
b)ゲル電気泳動
・溶解液をLaemelliの試料緩衝液と1:1で混合し、そして5分間煮沸する。
・4〜20%のグラジエンドゲルの穴に20μgの試料を添加する。
・Bjerrum及びSchafer−Nielsonのトランスファー緩衝液(SDSを含む)中で、200Vで35分間ゲルを流す。
【0039】
c)ウエスタントランスファー
・トランスファー緩衝液中で15分間、ゲル、ニトロセルロース膜及びブロッティングペーパーを平衡化する。
・セミドライの電気泳動トランスファーセルの陽極上のゲル−ニトロセルロースサンドイッチを並べる:2枚のブロッティングペーパー、ニトロセルロース膜、ゲル、2枚のブロッティングペーパー。
・陰極をかけ、そして25Vで90分間流す。
【0040】
d)タンパク質の免疫学的検出
・4℃で一晩、PBS/0.05% Tween20中の5%Marvelでニトロセルロース膜をブロッキングする。
・PBS/0.05% Tween20中で膜を2回すすぎ、続いて室温で20分間及び2×5分間、振盪プラットホーム上で洗浄する。
・振盪プラットホーム上で室温で120分間、明らかにした患者の血漿の1:20希釈液中で膜をインキュベートする。
・5分の最終洗浄を加えて、上文の様に洗浄する。
・振盪プラットホーム上で室温で90分間、ビオチン抗ヒトIgG又はIgMの1:250希釈液中で膜をインキュベートする。
・5分の最終洗浄を加えて、上文の様に洗浄する。
・振盪プラットホーム上で室温で60分間、ストレプトアビジン−西洋クサビペルオキシダーゼ結合体の1:1000希釈液中で膜をインキュベートする。
・上文の様に洗浄する。
・発色させるために、5分間ジアミノベンジジンペルオキシターゼ基質中で膜をインキュベートし、膜を水ですすぐことで反応を停止させる。
【0041】
患者112,305及び402の図3の結果は、明らかに16週の期間に及ぶワクチン接種(4〜6回の投与)が、細胞系の溶解液に対する抗体の力価及び更にはこのワクチン接種法で入手できない溶解液(DTH試験以外)に対する交差反応性の増大をもたらしうることを示している。
【0042】
(c)抗体の力価の決定
抗体の力価は、標準化した細胞系でELISAプレートをコーティングし、そしてワクチン接種した患者由来の血清に対する希釈研究を行うことで決定した。
【0043】
抗溶解液IgGを用いるELISAの方法
1.次の希釈を用いて、50μl/穴 溶解液(10μg/ml)でプレートをコートする。
【表6】

2.カバーをし、そして4℃で一晩インキュベートする。
3.2回PBS−Tweenで洗浄する。乾燥させるためにペーパータオル上でプレートをたたく。
4.PBS/10%FCSでブロックする(100μl/穴)。
5.カバーし、そして室温で1時間(最低)インキュベートする。
6.PBS−Tweenで2回洗浄する。
7.100μlのPBS−10%FCSを列2〜8に加える。
8.200μlの血漿試料(PBS−10%FCS中で1/100希釈、すなわち10μlの血漿を990μlのPBS−10%FCSに加えたもの)を列1に加え、そしてプレートの下方向への100μlの連続希釈を行う。一番下の穴から過剰な100μlを除く。カバーし、そして冷蔵庫で一晩インキュベートする。
9.ビオチン化した抗体(Pharminger;IgG 34162D)を最終濃度1mg/mlに希釈する(すなわち20ml/10ml)。
10.カバーし、そして室温で45分間インキュベートする。
11.上文の様に6回洗浄する。
12.ストレプトアビジン−HRP(Pharminger,13047E O;1:1000希釈)に希釈する(すなわち10ml−>10ml)。
13.穴当たり100mlを加える。
14.室温で30分間インキュベートする。
15.8回洗浄する
16.穴当たり100ml基質を加える。室温で10〜80分展開する。
17.100mlの1M H2SO4を加えることで発色反応を停止する。
18.405nmでODを読み取る。
【0044】
患者112,305及び402の図3結果は、基準線(O)、4週、8週及び16週の抗体の力価を示す。本データは、少なくとも4回の投与によるワクチン接種後、患者が細胞系の溶解液に対する抗体の力価及び更にはこのワクチン接種法で入手できない溶解液(DHT投与以外)に対する交差反応性の増大を示すことがあることを示す。
【0045】
(d)PSAレベルの評価
ワクチンを受けている患者のPSAレベルは、試験の開始時及びワクチン接種の間、慣習的に使用する臨床用のキットを用いて記録した。患者110,303及び404のPSA値は図4に示し(縦軸は血清PSA(ng/ml)であり;横軸は時間であり、最初の点はワクチン接種計画の開始を表す)、そしてPSA値の落ち込み又は部分的な安定化を表し、この患者の集団において、しばしば指数関数的な増大が標準的に持続する。患者110の結果は、骨の痛みを軽減するための放射線治療によって多少混乱するが、PSAレベルは放射線治療の前に低下した。
【0046】
例2:マウスのメラノーマ保護モデルにおける正常なメラノサイトの使用
正常なメラノサイト細胞系は、挑戦的な投与としてB16.F10を利用するマウスのワクチン接種保護モデルに使用した。C57マウスはPBS,5×106 個の照射されたK1735同種のメラノーマ細胞又は5×106 個の照射されたMelan P1の自己の正常なメラノサイト細胞のいずれかのうちの2つのワクチン接種を14及び7日目に受けた。0日目の挑戦は1×104 個のB16.F10細胞で行い、そして腫瘍の大きさは10日目以降から3日ごとに測定した。動物は、腫瘍が腫瘍の最大の大きさを超えて1.5×1.5cmに生育したときにと殺した。図5は、Melan 1P細胞によるワクチン接種が、この特に活動的なマウスの腫瘍に対してある程度の保護をもたらすことを示す。
【特許請求の範囲】
【請求項1】
3つのヒト前立腺細胞系を含んで成る前立腺ガンの処置のための免疫療法剤であって、このうちの1つの細胞系が正常な組織に由来し、そして他の2つの細胞系が腫瘍組織に由来する免疫療法剤。
【請求項2】
3つのヒト前立腺腫瘍細胞系を含んで成る前立腺ガンの処置のための免疫療法剤であって、このうちの1つの細胞系が原発腫瘍に由来し、そして他の2つの細胞系が2つの異なる腫瘍組織に由来する免疫療法剤。
【請求項3】
3つのヒト前立腺細胞系を含んで成る前立腺ガンの処置のための免疫療法剤であって、この3つの細胞系が1,2又は3つの正常組織に由来する免疫療法剤。
【請求項4】
3つのヒト前立腺細胞系を含んで成る前立腺ガンの処置のための免疫療法剤であって、このうちの2つの細胞系が正常な組織に由来し、そして他の細胞系が腫瘍部位に由来する免疫療法剤。
【請求項5】
正常な組織由来の細胞系がPNT1A(ECACC参照番号:95012614)又はPNT2(ECACC参照番号:95012613)から選択される、請求項1,3及び4のいずれか1項に記載の免疫療法剤。
【請求項6】
腫瘍組織由来の細胞系がNIH1519−CPTX,NIH1532−CP2TX,NIH1535−CP1TX,NIH1542−CP3TX,CA−HPV−10,LnCap,DU145又はPC3から選択される、請求項1,2及び4のいずれか1項に記載の免疫療法剤。
【請求項7】
3つの細胞系、すなわちPNT2,NIH1542−CP3TX及びDU145を含んで成る前立腺ガンの処置のための免疫療法剤。
【請求項8】
3つの細胞系、すなわちPNT2,NIH1542−CP3TX及びLnCapを含んで成る前立腺ガンの処置のための免疫療法剤。
【請求項9】
3つの細胞系、すなわちPNT2,DU145及びLnCapを含んで成る前立腺ガンの処置のための免疫療法剤。
【請求項10】
前記の腫瘍細胞系が50〜300Gyで照射された、請求項1〜9のいずれか1項の免疫療法剤。
【請求項11】
前記の腫瘍細胞系が100〜150Gyで照射された、請求項1〜9のいずれか1項に記載の免疫療法剤。
【請求項12】
放線菌調製物、例えばBCG又はM.バッカエ(Vaccae)、破傷風毒素、ジフテリア毒素、百日咳菌、インターロイキン2、インターロイキン12、インターロイキン4、インターロイキン7、完全フロイントアジュバント、不完全フロイントアジュバント又は他の非特異的薬剤アジュバントから選択されるワクチンアジュバントと組み合わせた、請求項1〜11のいずれか1項に記載の免疫療法剤を含んで成る免疫原性組成物。
【請求項13】
放線菌調製物、例えばBCG又はM.バッカエから選択されるワクチンアジュバントと組み合わせた、請求項1〜11のいずれか1項に記載の免疫療法剤を含んで成る免疫原性組成物。
【請求項14】
前記細胞が、限定しないが10〜30%v/vの水性グリセロール溶液、5〜20%v/vジメチルスルホキシド又は5〜20%w/vのヒト血清アルブミンを単一の凍結保護物質として又は組み合わせて、そのいずれかで含む凍結保護溶液で調製される、請求項1〜13のいずれか1項に記載の免疫療法剤又は組成物。
【請求項15】
前記細胞が、5〜20%v/vジメチルスルホキシド及び5〜20%w/vのヒト血清アルブミンを組み合わせて含む、凍結保護溶液で調製される、請求項1〜13のいずれか1項に記載の免疫療法剤又は組成物。
【請求項16】
免疫T細胞の活性化を特徴とする患者の免疫応答を誘導する、請求項1〜15のいずれか1項に記載の免疫療法剤又は組成物。
【請求項17】
抗体産生の誘導を特徴とする患者の免疫応答を誘導する、請求項1〜15のいずれか1項に記載の免疫療法剤又は組成物。
【請求項18】
前立腺ガンの患者の血清PSAのレベルにおいて、増加又は減少の速度で低下を誘導する、請求項1〜15のいずれか1項に記載の免疫療法剤又は組成物。
【請求項19】
皮内投与される、請求項1〜18のいずれか1項に記載の免疫療法剤又は組成物。
【請求項20】
前立腺内に投与される、請求項1〜18のいずれか1項に記載の免疫療法剤又は組成物。
【請求項21】
生理学的に許容される補形薬、アジュバント又は担体と一緒に、請求項1〜20のいずれか1項に記載の免疫療法剤を含んで成るか又はそれから成る、前立腺ガンの処置のための免疫療法ワクチン組成物。
【請求項22】
適当な剤形の1又は複数回投与で、請求項1〜22のいずれか1項に記載の免疫療法剤又は組成物を患者に投与することを含む、前立腺ガンの予防又は処置の方法。
【請求項23】
ヒトの前立腺ガンの処置のための薬剤の製造における、請求項1〜11のいずれか1項に記載の免疫療法剤の使用。
【請求項1】
3つのヒト前立腺細胞系を含んで成る前立腺ガンの処置のための免疫療法剤であって、このうちの1つの細胞系が正常な組織に由来し、そして他の2つの細胞系が腫瘍組織に由来する免疫療法剤。
【請求項2】
3つのヒト前立腺腫瘍細胞系を含んで成る前立腺ガンの処置のための免疫療法剤であって、このうちの1つの細胞系が原発腫瘍に由来し、そして他の2つの細胞系が2つの異なる腫瘍組織に由来する免疫療法剤。
【請求項3】
3つのヒト前立腺細胞系を含んで成る前立腺ガンの処置のための免疫療法剤であって、この3つの細胞系が1,2又は3つの正常組織に由来する免疫療法剤。
【請求項4】
3つのヒト前立腺細胞系を含んで成る前立腺ガンの処置のための免疫療法剤であって、このうちの2つの細胞系が正常な組織に由来し、そして他の細胞系が腫瘍部位に由来する免疫療法剤。
【請求項5】
正常な組織由来の細胞系がPNT1A(ECACC参照番号:95012614)又はPNT2(ECACC参照番号:95012613)から選択される、請求項1,3及び4のいずれか1項に記載の免疫療法剤。
【請求項6】
腫瘍組織由来の細胞系がNIH1519−CPTX,NIH1532−CP2TX,NIH1535−CP1TX,NIH1542−CP3TX,CA−HPV−10,LnCap,DU145又はPC3から選択される、請求項1,2及び4のいずれか1項に記載の免疫療法剤。
【請求項7】
3つの細胞系、すなわちPNT2,NIH1542−CP3TX及びDU145を含んで成る前立腺ガンの処置のための免疫療法剤。
【請求項8】
3つの細胞系、すなわちPNT2,NIH1542−CP3TX及びLnCapを含んで成る前立腺ガンの処置のための免疫療法剤。
【請求項9】
3つの細胞系、すなわちPNT2,DU145及びLnCapを含んで成る前立腺ガンの処置のための免疫療法剤。
【請求項10】
前記の腫瘍細胞系が50〜300Gyで照射された、請求項1〜9のいずれか1項の免疫療法剤。
【請求項11】
前記の腫瘍細胞系が100〜150Gyで照射された、請求項1〜9のいずれか1項に記載の免疫療法剤。
【請求項12】
放線菌調製物、例えばBCG又はM.バッカエ(Vaccae)、破傷風毒素、ジフテリア毒素、百日咳菌、インターロイキン2、インターロイキン12、インターロイキン4、インターロイキン7、完全フロイントアジュバント、不完全フロイントアジュバント又は他の非特異的薬剤アジュバントから選択されるワクチンアジュバントと組み合わせた、請求項1〜11のいずれか1項に記載の免疫療法剤を含んで成る免疫原性組成物。
【請求項13】
放線菌調製物、例えばBCG又はM.バッカエから選択されるワクチンアジュバントと組み合わせた、請求項1〜11のいずれか1項に記載の免疫療法剤を含んで成る免疫原性組成物。
【請求項14】
前記細胞が、限定しないが10〜30%v/vの水性グリセロール溶液、5〜20%v/vジメチルスルホキシド又は5〜20%w/vのヒト血清アルブミンを単一の凍結保護物質として又は組み合わせて、そのいずれかで含む凍結保護溶液で調製される、請求項1〜13のいずれか1項に記載の免疫療法剤又は組成物。
【請求項15】
前記細胞が、5〜20%v/vジメチルスルホキシド及び5〜20%w/vのヒト血清アルブミンを組み合わせて含む、凍結保護溶液で調製される、請求項1〜13のいずれか1項に記載の免疫療法剤又は組成物。
【請求項16】
免疫T細胞の活性化を特徴とする患者の免疫応答を誘導する、請求項1〜15のいずれか1項に記載の免疫療法剤又は組成物。
【請求項17】
抗体産生の誘導を特徴とする患者の免疫応答を誘導する、請求項1〜15のいずれか1項に記載の免疫療法剤又は組成物。
【請求項18】
前立腺ガンの患者の血清PSAのレベルにおいて、増加又は減少の速度で低下を誘導する、請求項1〜15のいずれか1項に記載の免疫療法剤又は組成物。
【請求項19】
皮内投与される、請求項1〜18のいずれか1項に記載の免疫療法剤又は組成物。
【請求項20】
前立腺内に投与される、請求項1〜18のいずれか1項に記載の免疫療法剤又は組成物。
【請求項21】
生理学的に許容される補形薬、アジュバント又は担体と一緒に、請求項1〜20のいずれか1項に記載の免疫療法剤を含んで成るか又はそれから成る、前立腺ガンの処置のための免疫療法ワクチン組成物。
【請求項22】
適当な剤形の1又は複数回投与で、請求項1〜22のいずれか1項に記載の免疫療法剤又は組成物を患者に投与することを含む、前立腺ガンの予防又は処置の方法。
【請求項23】
ヒトの前立腺ガンの処置のための薬剤の製造における、請求項1〜11のいずれか1項に記載の免疫療法剤の使用。
【図1−1】


【図1−2】


【図2−1】


【図2−2】


【図3−1】


【図3−2】


【図3−3】


【図3−4】


【図3−5】


【図3−6】


【図4−1】


【図4−2】


【図5】




【図1−2】


【図2−1】


【図2−2】


【図3−1】


【図3−2】


【図3−3】


【図3−4】


【図3−5】


【図3−6】


【図4−1】


【図4−2】


【図5】


【公開番号】特開2012−21028(P2012−21028A)
【公開日】平成24年2月2日(2012.2.2)
【国際特許分類】
【出願番号】特願2011−223318(P2011−223318)
【出願日】平成23年10月7日(2011.10.7)
【分割の表示】特願2000−586359(P2000−586359)の分割
【原出願日】平成11年12月9日(1999.12.9)
【出願人】(501230845)オニバックス リミティド (1)
【Fターム(参考)】
【公開日】平成24年2月2日(2012.2.2)
【国際特許分類】
【出願日】平成23年10月7日(2011.10.7)
【分割の表示】特願2000−586359(P2000−586359)の分割
【原出願日】平成11年12月9日(1999.12.9)
【出願人】(501230845)オニバックス リミティド (1)
【Fターム(参考)】
[ Back to top ]

