キシローストランスポーター活性を有する新規タンパク質および当該タンパク質をコードするポリヌクレオチド、並びにそれらの利用
【課題】バイオマス資源のエタノール発酵において高いキシローストランスポーター活性を有する新規タンパク質および当該タンパク質をコードするポリヌクレオチドを提供する。
【解決手段】特定のアミノ酸配列、または該配列において、1または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなり、キシローストランスポーター活性を有するタンパク質、および該タンパク質をコードするポリヌクレオチドが導入された形質転換酵母、さらに該酵母を用いたエタノールの製造方法。
【解決手段】特定のアミノ酸配列、または該配列において、1または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなり、キシローストランスポーター活性を有するタンパク質、および該タンパク質をコードするポリヌクレオチドが導入された形質転換酵母、さらに該酵母を用いたエタノールの製造方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、キシローストランスポーター活性を有する新規タンパク質および当該タンパク質をコードするポリヌクレオチド、並びにそれらの利用、特にエタノール製造への利用に関する。
【背景技術】
【0002】
近年大きな問題となっている地球温暖化は、各地の平均気温の上昇だけでなく、地球規模の大気循環パターンが変わることによる大規模な気候変動を引き起こす可能性がある。急速な気候変動や異常気象は、自然災害を増加させ、社会に大きな損失を与える。とくに農業、林業、水産業など、自然を対象にした産業は、気候変動や異常気象の大きな影響を受ける。地球温暖化の主な原因は温室効果ガスであるCO2の大気中の濃度が急上昇していることである。
【0003】
化石燃料を燃やしてエネルギーを得ることが長年行われてきたが、それは地中に固定されていた炭素を大気中にCO2の形で放出していることに他ならない。CO2を放出する化石燃料を代替し、CO2の排出量を削減可能な燃料として、近年バイオエタノールが注目されている。
【0004】
バイオエタノールとは、植物資源(バイオマス資源)をアルコール発酵させ、蒸留して得られるエタノールのことを指す。バイオエタノールは植物を原料とするため、原料の植物が生育し続ける限り、エタノールを生産できる。つまり、再生可能なエネルギーである。また、植物を燃焼させてCO2を大気中に放出しても、そのCO2は生長時に吸収したCO2分を放出しただけというカーボンニュートラルの考えから、地球全体のCO2量は変わらないことになる。
【0005】
植物資源のうち、デンプンや糖質をエタノール発酵させる技術には歴史があり、すでに成熟している。しかし、デンプンや糖質のような可食部を使ってエタノール発酵させる場合食糧価格を上昇させる可能性がある。また、たとえ食糧価格を上昇させないまでも、世界中には餓えに苦しんでいる人々がいるのに食糧となりえるものから燃料を製造してよいのかという議論がある。そのため、稲わら、麦わら等の草本系バイオマスや、林地残材や建築廃材などの廃木材等の木質系バイオマス等、食糧と競合しない植物資源からエタノールを製造しようとする動きがある。
【0006】
しかし、草本系バイオマスや木質系バイオマス等からのエタノール製造にはいくつかの課題がある。堅いリグニンをどのように分解するか、セルロースをいかに効率的にグルコースに変換するか、ヘミセルロースから遊離するキシロースをどのように効率的にエタノールに変換するかという問題である。
【0007】
バイオエタノールの製造には多くの場合Saccharomyces cerevisiae(以下、本明細書において「S. cerevisiae」と略記することがある。)に属する酵母が用いられている。Saccharomyces cerevisiaeは、エタノール発酵において様々な利点を持っている。すなわち、Saccharomyces cerevisiaeは、他の生物に比べて(他の酵母と比べても)エタノール生産性が高く、エタノール耐性や草本系および木質系バイオマスの加水分解物に含まれる発酵阻害物質への耐性に優れる。Saccharomyces cerevisiaeの問題点は草本系バイオマスや木質系バイオマス等に含まれる糖のうちの3割近くを占めるキシロースを代謝できないという点である。そのため、キシロースを代謝できる菌株の育種が目指されている。
【0008】
キシロースをエタノール発酵させるためには、キシロースをキシルロースに変換し、キシルロースをリン酸化してキシルロース5−リン酸とした後、解糖系につなげる必要がある。しかし、Saccharomyces cerevisiaeは、キシロースをキシルロースに変換する経路を持っていない。このキシロースをキシルロースに変換する能力を当該酵母に付与してキシロースを代謝する技術として、キシロースイソメラーゼをコードするポリヌクレオチドで酵母を形質転換する技術が報告されている(特許文献1、2参照)。
【0009】
また、キシロースをキシルロースに変換する能力を酵母に付与する他の技術として、キシロースリダクターゼによりキシロースをキシリトールに還元し、キシリトールをキシリトールデヒドロゲナーゼによりキシルロースに変換するために、キシロースリダクターゼをコードするポリヌクレオチドとキシリトールデヒドロゲナーゼをコードするポリヌクレオチドとを導入した遺伝子組換え酵母を用いる技術が報告されている(特許文献3参照)。
【0010】
上述した技術により、Saccharomyces cerevisiaeにおけるキシロースの代謝は可能となるが、キシロースの細胞内部への取り込みはヘキソース(グルコースあるいはガラクトース)トランスポーターに依存しているため、キシロースの細胞内部への取り込みが遅いいう問題がある。かかる問題を解決するために、キシロースで自然増殖することができる酵母であるCandida intermedia(以下、本明細書において「C. intermedia」と略記することがある。)から得られたキシロース/グルコースを対象とする能動輸送体をコードするポリヌクレオチドを導入した改質酵母を用いる技術が報告されている(特許文献4参照)。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】日本国公表特許公報「特表2005−514951号公報(2005年5月26日公開)」
【特許文献2】日本国公表特許公報「特表2009−213481号公報(2009年9月24日公開)」
【特許文献3】日本国公開特許公報「特開2009−112289号公報(2009年5月28日公開)」
【特許文献4】日本国公表特許公報「特表2009−502191号公報(2009年1月29日公開)」
【発明の概要】
【発明が解決しようとする課題】
【0012】
しかし、上述した従来の技術は、いずれもキシロースを効率的にエタノールに変換するという点で未だ十分ではない。特許文献1−3に記載の技術では、キシロースの細胞内部への取り込みはヘキソーストランスポーターに依存しているため、キシロースの細胞内部への取り込みが遅いという問題がある。
【0013】
また、特許文献4に記載のSaccharomyces cerevisiaeの形質転換体は、キシロースの細胞内部への取り込みの向上を目的とするものであるが、キシロースの取り込み活性は未だ十分であるとはいえない。
【0014】
本発明は、上記の問題点に鑑みてなされたものであり、その目的は、バイオマス資源のエタノール発酵においてキシロースをより効率的に利用するために、高いキシローストランスポーター活性を有する新規タンパク質および当該タンパク質をコードするポリヌクレオチドを提供すること、およびこれらを利用することにある。
【課題を解決するための手段】
【0015】
本発明に係るタンパク質は、上記課題を解決するために、下記(a)または(b)記載のタンパク質:
(a)配列番号1に示されるアミノ酸配列からなるタンパク質、
(b)配列番号1に示されるアミノ酸配列において、1または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなり、且つ、キシローストランスポーター活性を有することを特徴としている。
【0016】
本発明に係るタンパク質は、酵母由来であることが好ましい。また、本発明に係るタンパク質は、Candida guilliermondii 由来であることがより好ましい。
【0017】
本発明に係るポリヌクレオチドは、上記タンパク質をコードするものであればよい。本発明に係るポリヌクレオチドは、下記(c)または(d)記載のポリヌクレオチドであってもよい:
(c)配列番号2に示される塩基配列をオープンリーディングフレーム領域として有するポリヌクレオチド、
(d)配列番号2に示される塩基配列からなるポリヌクレオチドと相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件でハイブリダイズし、且つ、キシローストランスポーター活性を有するタンパク質をコードするポリヌクレオチド。
【0018】
本発明に係るベクターは、本発明に係るポリヌクレオチドを含むことを特徴とする。
【0019】
本発明に係る形質転換酵母は、本発明に係るポリヌクレオチドが導入されていることを特徴とする。本発明に係る形質転換酵母は、Saccharomyces cerevisiae、Pichia stipitis、Candida intermedia、またはCandida shehataeより作製されることが好ましい。
【0020】
本発明に係る形質転換酵母は、さらに、キシロースリダクターゼをコードするポリヌクレオチドとキシリトールデヒドロゲナーゼをコードするポリヌクレオチドとが導入されていることが好ましい。また、本発明に係る形質転換酵母は、キシロースイソメラーゼをコードするポリヌクレオチドが導入されているものであってもよい。
【0021】
本発明に係るエタノールの製造方法は、本発明に係る形質転換酵母を用いることを特徴としている。
【発明の効果】
【0022】
本発明に係るタンパク質は、以上のように、上記課題を解決するために、下記(a)または(b)記載のタンパク質:
(a)配列番号1に示されるアミノ酸配列からなるタンパク質、
(b)配列番号1に示されるアミノ酸配列において、1または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなり、且つ、キシローストランスポーター活性を有するタンパク質であるので、高いキシローストランスポーター活性を有し、従来の酵母では細胞内部への取り込み活性が悪かったキシロースを、細胞内部に効率的に取り込ませることが可能となるという効果を奏する。さらに、グルコースの共存下においても、高いキシローストランスポーター活性を有し、グルコースの共存下でもキシロースを細胞内部に効率的に取り込ませることが可能となるという効果を奏する。
【0023】
それゆえ、キシロースを多く含む作物の未利用部分である草本系バイオマスや木質系バイオマスを用いたバイオエタノールの製造に利用することができる。
【0024】
また、本発明に係るポリヌクレオチドは、以上のように、下記(c)または(d)記載のポリヌクレオチド:
(c)配列番号2に示される塩基配列をオープンリーディングフレーム領域として有するポリヌクレオチド、
(d)配列番号2に示される塩基配列からなるポリヌクレオチドと相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件でハイブリダイズし、且つ、キシローストランスポーター活性を有するタンパク質をコードするポリヌクレオチド
であるので、かかるポリヌクレオチドを導入した形質転換酵母では、従来の酵母では細胞内部への取り込み活性が悪かったキシロースを、細胞内部に効率的に取り込ませることが可能となるという効果を奏する。さらに、かかるポリヌクレオチドを導入した形質転換酵母では、グルコースの共存下でもキシロースを細胞内部に効率的に取り込ませることが可能となるという効果を奏する。
【図面の簡単な説明】
【0025】
【図1】実施例において様々な酵母株のキシロース取り込み活性を測定し、比較した結果を示す図である。
【図2】実施例において高いキシロース取り込み活性を示した酵母株について、グルコース共存下におけるキシロース取り込み活性を測定した結果を示す図である。
【図3】Candida intermedia由来のGXS1およびPichia stipitis(以下、本明細書において、「P. stipitis」と略称することがある。)由来のXUT4に対するCandida guilliermondii(以下、本明細書において、「C. guilliermondii」と略称することがある。)ATCC6260データベースのBLAST検索の結果を示す図である。
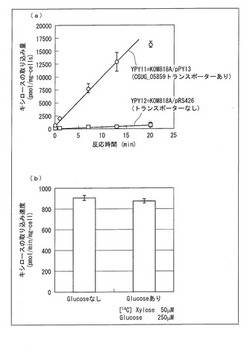
【図4】(a)はpRS426で形質転換したKOM818A株(YPY12株)と、pPY13で形質転換したKOM818A株(YPY11株)とにおけるキシロースの取り込み量を示す図であり、(b)はYPY11株のキシロースの取り込みに及ぼすグルコースの影響を示す図である。
【図5】Saccharomyces cerevisiaeにおけるエタノール発酵の経路を模式的に示す図である。
【図6】キシロースイソメラーゼをコードするポリヌクレオチドまたはキシロースリダクターゼをコードするポリヌクレオチドとキシリトールデヒドロゲナーゼをコードするポリヌクレオチドとを導入して、キシロースをキシルロースに変換する経路を付与したSaccharomyces cerevisiaeを模式的に示す図である。
【図7】キシローストランスポーターをコードするポリヌクレオチドを導入したSaccharomyces cerevisiaeを模式的に示す図である。
【発明を実施するための形態】
【0026】
上記課題を解決するために、本願発明者は、キシロース取り込み活性に優れた酵母株を特定することを目的として、糖としてキシロースのみを含む培地で様々な酵母株を培養し、それぞれの酵母株のキシロース取り込み活性をアイソトープで標識したキシロースを用いて測定した。その結果、特許文献4に記載のCandida intermediaと比較してキシロース取り込み活性が顕著に高い複数の酵母株を見出した。これらの酵母株は、キシロースからのエタノール発酵に用いることができる酵母として知られているPichia stipitisと同等あるいはより高いキシロース取り込み活性を示す。なお、Pichia stipitisにはアルコール耐性に劣るためエタノール発酵には適さないという問題がある。
【0027】
しかしながら、本願発明者が、Pichia stipitisを、キシロースとグルコースとが共存する培地で培養したところ、キシロース取り込み活性が、グルコース非存在下と比べて約10分の1に減少することを見出した。すなわち、Pichia stipitisでは、キシロースの取り込みが、グルコースにより阻害されると考えられる。実際にエタノール発酵を行う草本系バイオマスや木質系バイオマス等には、グルコースとキシロースとが含まれるので、グルコース共存下においても、キシロース取り込み活性がよいことが求められる。
【0028】
そこで、本願発明者は、キシロース取り込み活性が顕著に高いことを見出した複数種類の酵母株について、グルコースの共存下でのキシロース取り込み活性を測定した。その結果、殆どの上記酵母株で、キシロース取り込み活性が、グルコースの共存下で約1/10〜1/20に減少することが見出された。しかし、上記酵母株中で唯一、グルコース存在下でのキシロース取り込み活性の減少の程度が顕著に低い酵母株が見出された。そして、その酵母株のゲノム情報を含むデータベースを利用して、前述のPichia stipitisおよび特許文献4に記載のCandida intermediaにおいて、キシローストランスポーターであると予想されているポリヌクレオチドに対するホモロジー検索を行い、グルコース存在下においても高いキシロース取り込み活性を有するキシローストランスポーターをコードするポリヌクレオチドを同定・単離することに成功した。また、得られたポリヌクレオチドを組み込んだ形質転換酵母を作製し、当該形質転換酵母がグルコースの共存下においてもキシロースを細胞内部に効率的に取り込むことを確認して本発明を完成させるに至った。
【0029】
以下、本発明の実施の形態について、詳細に説明する。ただし、本発明はこれに限定されるものではなく、記述した範囲内で種々の変形を加えた態様で実施できるものである。また、本明細書中に記載された学術文献および特許文献の全てが、本明細書中において参考として援用される。
【0030】
(I)本発明に係るタンパク質
本発明に係るタンパク質は、下記(a)または(b)記載のタンパク質である:
(a)配列番号1に示されるアミノ酸配列からなるタンパク質、
(b)配列番号1に示されるアミノ酸配列において、1または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなり、且つ、キシローストランスポーター活性を有することを特徴とするタンパク質。
【0031】
なお、配列番号1に示すアミノ酸配列からなるタンパク質は、後述する実施例に示すポリヌクレオチド「CGUG_05859」によりコードされるタンパク質に相当している。
【0032】
ここで、上記「1または数個のアミノ酸が欠失、置換および/または付加された」とは、部位特異的突然変異誘発法等の公知の変異ペプチド作製法により欠失、置換もしくは付加できる程度の数(好ましくは10個以下、より好ましくは7個以下、さらに好ましくは5個以下)のアミノ酸が欠失、置換もしくは付加されることを意味する。
【0033】
1または数個のアミノ酸が欠失、置換および/または付加される部位は、アミノ酸が欠失、置換および/または付加された後のタンパク質がキシローストランスポーター活性を有していれば、該アミノ酸配列中のどの部位であってもよい。
【0034】
このような変異タンパク質は、公知の変異ポリペプチド作製法により人為的に導入された変異を有するタンパク質に限定されるものではなく、天然に存在するタンパク質であってもよい。タンパク質のアミノ酸配列中のいくつかのアミノ酸が、このタンパク質の構造または機能に有意に影響することなく容易に改変され得ることは、当該分野において周知である。さらに、人為的に改変させるだけでなく、天然のタンパク質において、当該タンパク質の構造または機能を有意に変化させない変異体が存在することもまた周知である。
【0035】
好ましい変異体は、保存性もしくは非保存性置換、欠失および/または付加を有する。好ましい変異としては、サイレント置換、欠失および付加であり、特に好ましくは、保存性置換である。
【0036】
代表的に保存性置換と見られるのは、脂肪族アミノ酸Ala、Val、Leu、およびIleの中での1つのアミノ酸の別のアミノ酸への置換、ヒドロキシル残基SerおよびThrの交換、酸性残基AspおよびGluの交換、アミド残基AsnおよびGlnの間の置換、塩基性残基LysおよびArgの交換、ならびに芳香族残基Phe、Tyrの間の置換である。
【0037】
また、本発明に係るタンパク質には、例えば、分子間および/または分子内架橋(例えば、ジスルフィド結合等)が施されたもの、化学修飾(例えば、糖鎖、リン酸もしくはその他の官能基等)されたもの、標識(例えば、ヒスチジンタグ等)が付与されたもの、または融合タンパク質(例えば、ストレプトアビジン、シトクロム、およびGFP等)を付与されたもの等が含まれるが、特にこれらに限定されない。
【0038】
本発明に係るタンパク質は、キシローストランスポーター活性を有する。ここで、「キシローストランスポーター」とは、キシロースの膜横断輸送に関するタンパク質をいい、細胞内部へのキシロースの取り込みを促進する機能を有する。「キシローストランスポーター活性を有する」とは、キシロースを細胞内部へ輸送することができること、換言すれば、キシロースを細胞内部に取り込むことができることをいう。
【0039】
本発明において、キシローストランスポーター活性は、従来公知の様々な方法により測定することができる。具体的には、キシローストランスポーター活性は、例えば、キシローストランスポーターを発現している菌体の懸濁液を用いて、後述する実施例に記載のキシロース取り込み活性測定法によって測定することができる。
【0040】
本発明では、細胞内部へのキシロースの取り込みが観察されることを、キシローストランスポーター活性を有するという。例えば、キシローストランスポーターを発現している菌体の懸濁液を用いて、後述する実施例に記載のキシロース取り込み活性測定法によって測定したときに、細胞内部へのキシロース取り込み活性が観察されれば、キシローストランスポーター活性を有するという。なお、キシロース取り込み活性測定法による測定時のキシロース濃度は特に限定されるものではないが、好ましくは20μM〜100mMの範囲内であり、より好ましくは50μM〜50mMの範囲内である。また、当該キシロース取り込み活性測定法によって、キシロース濃度が50mMの反応液中で、キシロースの取り込み量が、30pmol/min/OD600以上であることがより好ましく、50pmol/min/OD600以上であることがさらに好ましい。なお、実施例に記載のキシロース取り込み活性測定法の条件下では、キシロースの取り込み量は、取り込み開始からの時間と比例関係にある。
【0041】
本発明に係るタンパク質は、さらに、グルコース存在下においても高いキシローストランスポーター活性を有するものである。言い換えれば、本発明に係るタンパク質は、グルコース耐性のキシローストランスポーター活性を有するものである。
【0042】
本発明において、グルコース耐性のキシローストランスポーター活性は、キシローストランスポーターを発現している菌体の懸濁液を用いて、後述する実施例に記載のキシロース取り込み活性測定法を用いた測定を、グルコースの存在下と非存在下とで行い、グルコースの存在下と非存在下とのキシロースの取り込み量を比較することにより確認することができる。
【0043】
本発明では、例えば、上記比較において、後述する実施例に記載のキシロース取り込み活性測定法における、反応液のキシロース濃度が50mMであり、かつ、グルコースの存在下でのグルコース濃度20mMであるときに、グルコースの非存在下におけるキシロース取り込み量に対する、グルコース存在下におけるキシロース取り込み量の割合が、12%以上、より好ましくは15%以上、さらに好ましくは25%以上であるときに、グルコース耐性のキシローストランスポーター活性を有するという。かかる範囲においては、このタンパク質を発現させた酵母が、グルコースの共存下でも効率的にキシロースを取り込むため、キシロースを好適にエタノール発酵することが可能となる。
【0044】
本発明に係るタンパク質は、例えば、アミノ酸合成機等を用いて化学合成されてもよいし、遺伝子組み換え技術を用いて生産されてもよいし、天然に存在するタンパク質を単離精製したものであってもよい。
【0045】
本発明に係るタンパク質は、酵母由来のタンパク質であることがより好ましい。中でも、本発明に係るタンパク質は、Candida guilliermondii由来のタンパク質であることが特に好ましい。
【0046】
(II)本発明に係るポリヌクレオチド
本発明に係るポリヌクレオチドは、本発明に係るタンパク質をコードするポリヌクレオチドである。
【0047】
ここで、ポリヌクレオチドは、DNAの形態(例えば、cDNAもしくはゲノムDNA)、またはRNA(例えば、mRNA)の形態で存在し得る。DNAまたはRNAは二本鎖であっても、一本鎖であってもよい。一本鎖DNAまたはRNAは、コード鎖(センス鎖)であっても、非コード鎖(アンチセンス鎖)であってもよい。
【0048】
また、本発明に係るポリヌクレオチドは化学的に合成してもよく、コードするタンパク質の発現が向上するように、コドンユーセージ(Codon usage)を変更してもよい。
【0049】
本発明に係るポリヌクレオチドを改変する方法としては、通常行われるポリヌクレオチド改変方法が用いられる。すなわち、タンパク質の遺伝情報を有するポリヌクレオチドの特定の塩基を置換、欠失および/または付加することで、組換えタンパク質の遺伝情報を有するポリヌクレオチドを作製してもよい。ポリヌクレオチドの塩基を変換する具体的な方法としては、例えばポリメラーゼ連鎖反応法(PCR法)の利用が挙げられる。これらの方法は当業者に公知である。
【0050】
本発明に係るポリヌクレオチドは、本発明に係るタンパク質をコードしていればその塩基配列は特に限定されるものではない。よって本発明に係るタンパク質のアミノ酸配列に応じた塩基配列からなる全てのポリヌクレオチドが本発明に含まれる。
【0051】
本発明に係るポリヌクレオチドの一実施形態としては、例えば、下記(c)または(d)のポリヌクレオチドであり得る:
(c)配列番号2に示される塩基配列をオープンリーディングフレーム領域として有するポリヌクレオチド、
(d)配列番号2に示される塩基配列からなるポリヌクレオチドと相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件でハイブリダイズし、且つ、キシローストランスポーター活性を有するタンパク質をコードするポリヌクレオチド。
【0052】
なお、配列番号2に示す塩基配列を有するポリヌクレオチドは、後述する実施例に示すポリヌクレオチド「CGUG_05859」に相当している。
【0053】
配列番号2に示す塩基配列を有するポリヌクレオチドは、後述する実施例に示すように、Candida guilliermondii IFO0566株のゲノムDNAから単離することができる。配列番号2に示す塩基配列は、特許文献4に記載のCandida intermediaのGXS1と48%の相同性を有する。なお、ここでの相同性の解析は、GENETYXを用い、パラメータを初期設定値として算出した値である。
【0054】
本発明の一実施形態では、本発明に係るポリヌクレオチドは、化学的に合成された塩基で置換されてもよい。また、本発明に係るポリヌクレオチドが置換される部位は特に限定されず、置換後の塩基配列がコードするタンパク質が好適な性質を有していればよい。つまり、置換後の塩基配列がコードするタンパク質がキシローストランスポーター活性を有していればよい。
【0055】
また本発明に係るポリヌクレオチドには、本発明に係るタンパク質をコードするポリヌクレオチド(例えば、配列番号2に示される塩基配列を有するポリヌクレオチド)、またはこれに相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件でハイブリダイズし、且つ、キシローストランスポーター活性を有するタンパク質をコードするポリヌクレオチドも含まれる。
【0056】
本明細書において、上記「ストリンジェントな条件」とは、少なくとも90%の同一性、好ましくは少なくとも95%の同一性、最も好ましくは少なくとも97%の同一性が配列間に存在するときにのみハイブリダイゼーションが起こることを意味する。具体的には、例えば、ハイブリダイゼーション溶液(5×SSC(750mM NaCl、75mM クエン酸ナトリウム)、5×デンハート液、1% SDS、100μg/ml 変性サケ精子DNA)中にて68℃で一晩インキュベーションした後、68℃にて0.1×SSC、0.1% SDS中でフィルターを洗浄する条件を挙げることができる。
【0057】
ハイブリダイゼーションは、T. Brownらの方法(Current Protocols in Molecular Biology (ed. by Ausubel et al., Wiley Interscience)のような周知の方法で行うことができる。通常、温度が高いほど、塩濃度が低いほどストリンジェンシーは高くなり(ハイブリダイズし難くなる)、より相同性の高いポリヌクレオチドを取得することができる。
【0058】
アミノ酸配列や塩基配列の同一性は、カーリンおよびアルチュールによるアルゴリズムBLAST(Karlin S, Altschul SF, Proc. Natl. Acad. Sci. USA, 87: 2264-2268 (1990); Karlin S, Altschul SF, Proc. Natl. Acad Sci. USA, 90: 5873-5877 (1993) )を用いて決定できる。BLASTのアルゴリズムに基づいたBLASTNやBLASTXと呼ばれるプログラムが開発されている(Altschul SF, et al., J. Mol. Biol., 215: 403 (1990) )。
【0059】
本発明にかかるポリヌクレオチドを取得する方法としては、公知の技術により本発明にかかるポリヌクレオチドを含むDNA断片を単離し、クローニングする方法が挙げられる。より具体的には、例えば、本発明にかかるポリヌクレオチドの塩基配列の一部と特異的にハイブリダイズするプローブを調製し、当該プローブを用いてゲノムDNAライブラリーやcDNAライブラリーに対してスクリーニングを行えばよい。このようなプローブとしては、本発明にかかるポリヌクレオチドまたはその相補鎖の少なくとも一部に特異的にハイブリダイズするプローブであれば、いかなる配列および長さのものを用いてもよい。
【0060】
また本発明にかかるポリヌクレオチドを取得する方法としては、PCR等の増幅手段を用いる方法を挙げることができる。例えば、本発明にかかるポリヌクレオチドの5’側および3’側の配列(またはその相補配列)の中からそれぞれプライマーを調製し、これらプライマーを用いてゲノムDNA(またはcDNA)等を鋳型にしてPCR等の増幅反応を行い、両プライマー間に挟まれるDNA領域を増幅することで、本発明にかかるポリヌクレオチドを含むDNA断片を大量に取得することができる。
【0061】
本発明に係るポリヌクレオチドの塩基配列は、従来公知の方法によって決定され得る。
【0062】
本発明に係るポリヌクレオチドは、本発明に係るタンパク質をコードするポリヌクレオチドのみからなるものであってもよいが、その他の塩基配列が付加されていてもよい。付加される塩基配列としては、これに限定されるものではないが、標識(例えば、ヒスチジンタグ、Mycタグ、およびFLAGタグ等)、融合タンパク質(例えば、GSTおよびMBP等)、プロモーター配列(例えば、酵母由来プロモーター配列、ファージ由来プロモーター配列、および大腸菌由来プロモーター配列等)、およびシグナル配列(例えば、小胞体移行シグナル配列、および分泌配列等)をコードする塩基配列等が挙げられる。これらの塩基配列が付加される部位は特に限定されるものではなく、翻訳されるタンパク質のN末端であっても、C末端でもあってもよい。
【0063】
(III)本発明に係るベクターおよび形質転換酵母
本発明に係るベクターは、本発明に係るポリヌクレオチドを含むものである。当該「本発明に係るポリヌクレオチド」については、上記「(II)本発明に係るポリヌクレオチド」の項で説明したとおりであるので、ここでは説明を省略する。
【0064】
本発明に係るベクターは、本発明に係るポリヌクレオチドを含むものであれば、その他の構成は特に限定されるものではない。本発明に係るベクターを構成するベースとなるベクターとしては、従来公知の種々のベクターを用いることができる。例えば、プラスミド、ファージ、またはコスミド等を用いることができ、ベクターが導入される宿主細胞や導入方法に応じて好適なベクターが適宜選択され得る。
【0065】
本発明に係るベクターとしてプラスミドベクターを用いる場合、例えば、pAUR101、p427−TEF、p417−CYC、pRS426系のベクター等が使用できる。
【0066】
本発明に係るベクターを構築するには、本発明に係るポリヌクレオチドを分離および精製した後に、制限酵素処理等を用いて切断した当該ポリヌクレオチドの断片と、ベースとなるベクターを制限酵素で切断して得た直鎖ポリヌクレオチドとを結合閉鎖させることによって構築することができる。結合閉鎖する際には、ベクターおよび当該ポリヌクレオチドの性質に応じてDNAリガーゼ等を使用することができる。
【0067】
本発明に係るベクターを宿主細胞に導入した後、ベクターのマーカー遺伝子の発現を指標としてスクリーニングして、本発明に係るポリヌクレオチドを含有する形質転換体を得ることができる。よって、本発明に係るベクターには薬剤耐性遺伝子等のマーカー遺伝子が含まれていることが好ましい。かかる薬剤耐性遺伝子の具体的な一例としては、例えば、ハイグロマイシン、ブレオマイシン、カナマイシン、ゲンタマイシン、クロラムフェニコール等に対する薬剤耐性遺伝子を挙げることができる。これにより、上記抗生物質を含む培地中で生育する細胞を選択することによって、形質転換された宿主細胞を容易に選別することができる。
【0068】
本発明に係るベクターは、本発明に係るポリヌクレオチドを宿主細胞内で発現させるためのプロモーターをさらに有していてもよい。上記プロモーターは、本発明に係るポリヌクレオチドを宿主細胞内で発現させることが可能なプロモーターであれば特に限定されるものではなく、公知のプロモーターを好適に用いることができる。上記プロモーターは、本発明に係るポリヌクレオチドを発現し得るように連結されてベクター内に導入されていればよく、ベクターとしての具体的な構造は特に限定されるものではない。
【0069】
本発明に係るベクターは、上記プロモーター、上記マーカー遺伝子、および上述のポリヌクレオチドに加えて、さらに他のDNAセグメントを含んでいてもよい。当該他のDNAセグメントは、特に限定されるものではなく、例えば、ターミネーター、エンハンサー、翻訳効率を高めるための塩基配列等を挙げることができる。
【0070】
また、本発明に係るベクターの増幅方法(生産方法)も特に限定されるものではなく、従来公知の方法を用いることができる。一般的には大腸菌を宿主細胞として当該大腸菌内でベクターを増幅させることができる。このとき、ベクターの種類に応じて、好ましい大腸菌の種類を選択することができる。
【0071】
また、本発明には、上述した本発明に係るポリヌクレオチドが導入されている形質転換酵母も含まれる。
【0072】
宿主細胞がキシローストランスポーターを持たない酵母である場合は、図5に示すように、キシロースの細胞内部への取り込みはヘキソース(グルコースあるいはガラクトース)トランスポーターに依存しており、木質系バイオマスの加水分解物のような、グルコースとキシロースとの共存下ではグルコースが先に取り込まれ、キシロースは後から取り込まれるため、キシロースを完全に利用しようとすると、発酵時間が長時間となるという問題があった。上述したポリヌクレオチドが導入されている形質転換酵母を用いることにより、図7に示すように、キシロースをキシローストランスポーターにより、細胞内部に取り込むことができると考えられる。それゆえ、バイオエタノールの発酵時間を短縮することができ、装置の回転率を上げることができる。また、保温や撹拌等に要する経費も発酵時間の短縮に伴い削減できる。
【0073】
また、キシロースを多く含む作物未利用部分である草本系バイオマスや木質系バイオマスを用いることにより、バイオエタノールの製造コストを低減することができる。
【0074】
かかる形質転換酵母は、例えば、本発明に係るベクターで形質転換された形質転換酵母を包含する。本発明に係るベクターによって形質転換される宿主細胞としては、酵母であれば特に限定されるものではないが、例えば、Saccharomyces cerevisiae、Pichia stipitis、Candida intermedia、Candida shehatae等を利用することができる。
【0075】
上記宿主細胞に本発明に係るベクターを導入する方法としては、特に限定されるものではなく、例えば、カルシウムイオンの存在下で組換えDNAを導入する方法や、エレクトロポレーション法を用いる方法等の従来公知の方法が適用され得る。
【0076】
本発明に係るベクターが宿主細胞に導入されたか否かの確認は、従来公知のPCR法、サザンハイブリダイゼーション法、ノーザンハイブリダイゼーション法等によって確認することができる。また、本発明に係るベクターに含まれているポリヌクレオチドがコードするタンパク質の発現を、キシロース取り込み活性を測定することにより確認することが可能である。また、本発明に係るベクターにカナマイシン耐性やハイグロマイシン耐性などの薬剤耐性マーカー遺伝子が導入されている場合は、上記抗生物質を含む培地中で生育する細胞を選択することによって、形質転換された宿主細胞を容易に選別することができる。
【0077】
このようにして得られた形質転換酵母は、本発明に係るタンパク質を発現しているので、当該タンパク質を調製するために用いることができる。
【0078】
また、本発明にかかる形質転換酵母は、上述した本発明に係るポリヌクレオチドに加えて、さらに、キシロースリダクターゼをコードするポリヌクレオチドとキシリトールデヒドロゲナーゼをコードするポリヌクレオチドとが導入されていてもよい。
【0079】
特に、宿主細胞が、図5に示すように、キシロースをキシルロースに変換する経路を有さない酵母である場合は、キシロースリダクターゼをコードするポリヌクレオチドとキシリトールデヒドロゲナーゼをコードするポリヌクレオチドとが導入されていることにより、図6に示すように、キシロースをキシリトールに還元し、キシリトールをキシルロースに変換することができる。それゆえ、宿主細胞内部に取り込まれたキシロースを好適に代謝することができる。
【0080】
また、本発明にかかる形質転換酵母は、上述した本発明に係るポリヌクレオチドに加えて、さらに、キシロースイソメラーゼをコードするポリヌクレオチドが導入されていてもよい。
【0081】
特に、宿主細胞が、キシロースをキシルロースに変換する経路を有さない酵母である場合は、キシロースイソメラーゼをコードするポリヌクレオチドとが導入されていることにより、図6に示すように、キシロースをキシルロースに変換することができる。それゆえ、宿主細胞内部に取り込まれたキシロースを好適に代謝することができる。
【0082】
なお、キシロースリダクターゼをコードするポリヌクレオチド、キシリトールデヒドロゲナーゼをコードするポリヌクレオチド、および、キシロースイソメラーゼをコードするポリヌクレオチドとしては、特に限定されるものではなく、従来公知のポリヌクレオチドを好適に用いることができる。また、これらのポリヌクレオチドを導入する方法も特に限定されるものではなく、従来公知の方法を用いればよい。具体的には、例えば、特許文献1〜3に記載のポリヌクレオチド、導入方法を用いることができる。
【0083】
(IV)本発明に係るエタノールの製造方法
本発明に係るエタノールの製造方法は、上述した本発明に係る形質転換酵母を用いる方法であればよい。
【0084】
本発明に係る形質転換酵母を用いることにより、従来の酵母では細胞内部への取り込み活性が悪かったキシロースを、グルコースの共存下でも、細胞内部に効率的に取り込ませることが可能となる。それゆえ、キシロースを多く含む草本系バイオマスや木質系バイオマスのエタノール発酵を効率的に行うことができる。
【0085】
本発明にかかるエタノールの製造方法は、特に限定されるものではなく、バイオエタノールを製造することができる方法であればどのような方法であってもよい。なお、培地に含まれるキシロースの濃度は、0.013〜2Mであることが好ましく、0.033〜1.87Mであることがより好ましく、0.033〜1.67Mであることがさらに好ましい。また、培地に含まれるグルコースの濃度は、0.056〜1.67Mであることが好ましく、0.11〜1.56Mであることがより好ましく、0.11〜1.39Mであることがさらに好ましい。培養温度は、通常用いられる温度であればよく、例えば、25〜37℃であり、より好ましくは28〜32℃である。また、反応は、発酵は連続式で行っても、バッチ式で行っても良い。
【0086】
培養開始から、通常12〜72時間後の培地を回収してエタノールを分離する。培地よりエタノールを分離する方法としては、蒸留法、逆浸透膜濃縮法、浸透気化膜濃縮法等の公知の方法が用いられるが、蒸留法による方法がより好ましい。次いで、分離したエタノールをさらに精製することによって、エタノールを得ることができる。
【0087】
本発明は上述した各実施形態に限定されるものではなく、請求項に示した範囲で種々の変更が可能であり、異なる実施形態にそれぞれ開示された技術的手段を適宜組み合わせて得られる実施形態についても本発明の技術的範囲に含まれる。
【実施例】
【0088】
以下、本発明を実施例により具体的に説明するが、本発明は実施例によって限定されるものではない。
【0089】
なお、実施例において使用した培地は以下に示す方法で調製した。また、キシロース取り込み活性は、以下に示すキシロース取り込み活性測定法を用いて測定した。
【0090】
<LB培地>
Becton Dickinson社製のLuria-Bertani(LB) Miller培地を使用した。プレート作製の際には寒天を終濃度2%(w/v)になるよう加えた。必要に応じて、アンピシリンを終濃度100μg/mlになるよう添加した。
【0091】
<YP培地>
YP培地の組成を表1に示す。炭素源は終濃度2%(w/v)になるよう加えた。プレート作製の際には寒天を終濃度2%(w/v)になるよう加えた。必要に応じて、選択マーカーとしてAureobasidin A(AbA)(タカラバイオ社)またはG418二硫酸塩(ナカライテスク社)を、それぞれ終濃度0.5μg/mlまたは0.025〜0.25mg/mlになるよう添加した。
【0092】
【表1】

【0093】
<YNB培地>
最少培地として、Difco yeast nitrogen base w/o amino acids(YNB)(Becton Dickinson社)を終濃度0.67%(w/v)で使用した。炭素源は終濃度で2%(w/v)になるよう加えた。必要に応じて、アミノ酸等を表2の濃度になるように加えた。プレート作製の際には寒天を終濃度で2%(w/v)になるよう加えた。必要に応じて、G418を終濃度0.025〜0.25mg/mlになるように加えた。
【0094】
【表2】

【0095】
<キシロース取り込み活性測定法>
[1-14C] D-Xylose(Moravek Biochemicals社)を用いて、Spencer-Martinsら(Spencer-Martins, I., and van Uden, N. (1985) Catabolite interconversion of glucose transport systems in the yeast Candida wickerhamii. Biochimica et Biophysica Acta 812: 168-172)の方法を参考にして以下のように行った。
【0096】
前培養液を本培養用の液体培地にOD600=0.2になるように植菌し、210rpmで旋回あるいは振とうしながら30℃で3〜12時間培養し、対数増殖期の菌体を回収した。氷冷水で2回洗菌後、OD600=0.5になるように氷冷水に懸濁した。
【0097】
なお、実施例1の場合、前培養はYP+グルコース培地を用い、培養温度30℃、290rpmで旋回培養した。本培養はYP+キシロース培地を用いた。実施例6の場合は、前培養はYNB+2%(w/v) グルコース+各20mg/Lのヒスチジン、ロイシン、トリプトファン、アデニン培地を用い、培養温度30℃で旋回あるいは振とう培養した。本培養はYNB+1%(w/v) グルコース+1%(w/v) キシロース+各20mg/Lのヒスチジン、ロイシン、トリプトファン、アデニン培地を用い、培養温度30℃で旋回あるいは振とう培養した。
【0098】
100mM Tris−クエン酸緩衝液(pH 5.0)20μlを入れたサンプルチューブに菌体懸濁液20μlを混ぜ合わせた後、チューブを25℃のウォーターバス中で5分間プリインキュベートした。
【0099】
上記混合液20μlに[1-14C] D-xylose 20μlを加え、反応を開始した。一定時間の後に混合液20μlをサンプリングし、フィルター(ポアサイズ0.2μm、cellulose acetate製;Advantec Toyo社)上に捕集し、菌体と反応液を分離した。なお、サンプリングする時間分チューブを用意した。
【0100】
フィルター上に残った菌体を速やかに氷冷水3mlで2回洗浄後、フィルターを乾燥させた。Ultima Gold (Perkin Elmer社)5mlにフィルターを浸漬させ、シンチレーションカウンター(Aloka liquid scintillation counter)を用いて、フィルター上の菌体に含まれる放射線量を測定した。
【0101】
[1- 14C] D-Xyloseを用いて作成した検量線により、菌体内に取り込まれたキシロース量(pmol)を算出した。
【0102】
〔実施例1:高活性を示すキシローストランスポーターを有する酵母菌株のスクリーニング〕
<様々な酵母のキシロース取り込み活性の測定>
高いキシロース取り込み活性を有する酵母株を特定する目的で、様々な酵母株のキシロース取り込み活性を測定し、比較した。
【0103】
キシロース生育が可能な株、およびキシロース発酵性酵母として知られているいくつかの株、合計27種、30株について50mMキシロースおよび1mMキシロースを用いて、取り込み活性を測定した。
【0104】
いずれの酵母も、前培養はYP+グルコース培地を用い、培養温度30℃、290rpmで旋回培養した。本培養は300ml容三角フラスコに60mlのYP+キシロース培地を調製し、培養温度30℃、210rpmで旋回培養した。一般的なYP+グルコース培地ではなくYP+キシロース培地を用いた理由は、キシロース高親和性トランスポーターがあるとすれば、キシロースが豊富な条件下で特異的に発現する可能性があると考えたからである。ただし、キシロースを代謝できないS. cerevisiae IFO0565株については、本培養もYP+グルコース培地で行った。上記の前培養液を用いて、本培養開始時の濁度をOD600=0.2とし、培養を開始した。約3時間後の対数増殖期の菌体を遠心回収し、キシロース取り込み活性を測定した。結果を図1に示した。
【0105】
キシロースからのエタノール発酵の研究で報告の多いPichia stipitisと同等あるいはより好成績な菌株が見つかった。
【0106】
<グルコースによるキシロースの取り込み阻害>
しかしながら、Pichia stipitisを、キシロースとグルコースとが共存する培地で培養したところ、キシロースの取り込みが、グルコース非存在下と比べて約10分の1に減少していた。そこで、50mMキシロースで高いキシロース取り込み活性を示した上位7株について、グルコース共存下におけるキシロース取り込み活性を測定した。20mMグルコースと50mMキシロースの混合液を用いた場合のキシロース取り込み活性と、50mMキシロース液のみを用いた場合のキシロース取り込み活性を図2に示す。
【0107】
測定に供試した7株すべてにおいて、グルコースが共存する時キシロースの取り込み量が減少した。50mMキシロース単独の場合に比べて、20mMグルコースが共存する場合、6株ではキシロース取り込み活性が1/10から1/20に低下したが、Candida guilliermondii IFO0566株においては、1/3程度の低下にとどまり、他の株に比べて顕著に活性が残存していることが見出された。かかる結果から、C. guilliermondiiにはキシロースに対する親和性が高い、キシロース取り込みに優れたトランスポーターが存在すると考えられる。
【0108】
〔実施例2:データベースを利用したキシローストランスポーター遺伝子の探索〕
最近、C. guilliermondii ATCC6260のゲノム情報を含んだデータベース『Candida DB』が公開された (Rossignol, T., Lechat, P., Cuomo, C., Zeng, Q., Moszer, I., d'Enfert, C. (2008) CandidaDB: a multi-genome database for Candida species and related Saccharomycotina. Nucleic Acids Research 36: 557-561)。そこで、このデータベースを利用してBLAST検索を行い、既知のキシローストランスポーター遺伝子と相同性が高い遺伝子をクローニングすることにした。
【0109】
グルコース・キシロース/プロトンシンポーターであるCandida intermedia由来のGXS1(Leandro, M. J., Goncalves, P., Spencer-Martins, I. (2006) Two glucose/xylose transporter genes from the yeast Candida intermedia: first molecular characterization of a yeast xylose-H+ symporter. Biochem. J. 395: 543-549)、および高親和性キシローストランスポーターと推定されているP. stipitis由来のXUT4 (Jeffries, T. W., Grigoriev, I. V., Grimwood, J., Laplaza, J. M., Aerts, A., Salamov, A., Schmutz, J., Lindquist, E., Dehal, P., Shapiro, H., Jin, Y. S., Passoth, V., and Richardson, P. M. (2007)Genome sequence of the lignocellulose-bioconverting and xylose-fermenting yeast Pichia stipitis. Nat. Biotechnol. 25:319-326)をqueryのアミノ酸配列としてBLAST検索した結果、C. guilliermondiiにこれらの遺伝子と似た配列を持つ遺伝子が存在することが示唆された。
【0110】
図3に、BLAST検索の結果、スコア200以上であったものを示す。なお、C. guilliermondiiは、通常と異なる翻訳コドンを用いるCTG cladeと呼ばれる生物群に属しており、この点には注意が必要である。通常のuniversal codonでは、CTGコドンはロイシンを指定するが、CTGcladeではセリンを指定する。したがって、C. guilliermondiiトランスポーター遺伝子をS. cerevisiaeで発現させる場合には、CTGコドンをまったく含まないトランスポーター遺伝子を用いるか、CTGコドンを通常のセリン指定コドンに置き換えた改変遺伝子を用いる必要がある。
【0111】
〔実施例3:CGUG_05859遺伝子のクローニング〕
酵母のゲノムDNAの抽出は、Wizard Genomic DNA Purification Kit (Promega社)を用いて行った。Candida guilliermondii IFO0566株から抽出したゲノムDNAを鋳型として、データベースの配列情報をもとに5’末端に制限酵素サイトをもつように設計した下記プライマーを作製し、CGUG_05859遺伝子をPCR増幅した。
Cg05859F(BamHI):5’- CCCGGATCCATGGCTTACGAGGACAAA-3’(配列番号3)
Cg05859R(XhoI):5’-CCCCTCGAGTTATACCTGCGACTTCTC-3’(配列番号4)
なお、PCRは表3の反応液を用いて、表4の反応条件で行った。
【0112】
【表3】

【0113】
【表4】

【0114】
PCR産物は、Wizard SV Gel and PCR Clean-Up System (Promega社)を用いて精製した。このPCR増幅断片と高発現多コピーのプラスミドp427−TEF(Dualsystems Biotech社)を制限酵素BamHIとXhoIで切断した。Davisらの方法 (Davis, R. W., Bostein, D., and Roth, J. R. (1980) Advanced Bacterial Genetics, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY)で、DNA断片をアガロースゲル電気泳動で分離後、Wizard SV Gel and PCR Clean-Up Systemを用いて精製した。
【0115】
制限酵素処理したPCR断片とp427−TEFは、東洋紡社のLigation highキットver. 2を用いて繋ぎ合わせた。
【0116】
このDNA液を用いて大腸菌DH5α株を形質転換し、100μg/mlのアンピシリンを含むLB寒天培地で形質転換株を選択した。得られた形質転換株からWizard Plus SV Minipreps DNA Purification System (Promega社)を用いてプラスミドを抽出し、ABI PRISM 310NT Genetic Analyzer (Applied Biosystems社)を用いてその塩基配列を決定し、CGUG_05859遺伝子がクローニングできていることを確認し、そのプラスミドをpYO1017とした。
【0117】
pYO1017をSacIで切断し、約800bpのDNA断片をpRS426(ATCCから取り寄せ)のSacIサイトに挿入した。得られたプラスミドをBamHIとKpnIで切断して、その間にpYO1017をBamHIとKpnIで切断して得られた短い方のDNA断片を挿入してプラスミドpPY13を得た。pPY13は、TEF1遺伝子のプロモーターの制御下にCGUG_05859遺伝子が位置しており、大腸菌用の選択マーカーとしてはアンピシリン耐性、酵母用の選択マーカーとしてはURA3を持っている構造となっている。
【0118】
〔実施例4:KOM818A株の作製〕
宿主としたキシロース発酵性のS. cerevisiae株KOM818A(W303−1A, but aur1::AUR1−C−TDH3p−XYL1P.stipitis−TDH3tTDH3p−XYL2P.stipitis−TDH3tPGK1p−XKSS.cerevisiae−PGK1t)を、S. cerevisiaeの実験室株であるW303−1A(Thomas & Rothstein, Cell 56:619-630, 1989)に、P. stipitis由来のキシロースリダクターゼをコードするポリヌクレオチド、P. stipitis由来のキシリトールデヒドロゲナーゼをコードするポリヌクレオチド、および、S. cerevisiae由来のキシルロキナーゼをコードするポリヌクレオチドを導入することにより作製した。
【0119】
NotI認識配列を5’末端につけたオリゴヌクレオチド
XYL1−f(Not1):5’-AAGGAAAAAAGCGGCCGCATGCCTTCTATTAAGTTGAACTC-3’(配列番号5)
XYL1−r(Not1):5’-AAGGAAAAAAGCGGCCGCTTAGACGAAGATAGGAATC-3’(配列番号6)
を用いてP. stipitisのXYL1のORFをPCR増幅し、YEGAp(Hong, J., Tamaki, H., Akiba, S., Yamamoto, K., and Kumagai, H. (2001) JBB 92: 434-441)のNotIサイトに挿入したプラスミドpKOM1を作製した。
【0120】
NotI認識配列を5’末端につけたオリゴヌクレオチド
XYL2−f(Not1):5’-AAGGAAAAAAGCGGCCGCATGACTGCTAACCCTTCCTT-3’(配列番号7)
XYL2−r(Not1):5’-AAGGAAAAAAGCGGCCGCTTACTCAGGGCCGTCAATGA-3’(配列番号8)
を用いてP.stipitisのXYL2のORFをPCR増幅し、YEGApのNotIサイトに挿入したプラスミドpKOM2を作製した。
【0121】
SacIおよびKpnI認識配列を5’末端につけたオリゴヌクレオチド
GAP−XYL1−GAPt(f−Sac1):5’-GGGGAGCTCCTCACACGGAACACCACTAATGG-3’(配列番号9)
GAP−XYL1−GAPt(r−Kpn1):5’-GGGGGTACCAATGAATCGAAAATGTCATTAAAATAG-3’(配列番号10)
を用いてpKOM1のTDH3p−XYL1−TDH3t部分をPCR増幅し、pAUR101(タカラバイオ)のSacI−KpnIサイト間に挿入した。
【0122】
さらに、このプラスミドのXbaIサイトに、XbaIを5’末端につけたオリゴヌクレオチド
Gap−XYL2−t(Xba1−f):5’-AAATCTAGAAAGCTTACCAGTTCTCACAC-3’(配列番号11)
Gap−XYL2−t(Xba1-r):5’-CCCTCTAGAAAGCTTTCAATCAATGAATC-3’(配列番号12)
を用いてpKOM2のTDH3p−XYL2−TDH3t部分をPCR増幅したDNA断片を挿入したプラスミドpKOM7を作製した。
【0123】
EcoRIおよびBamHI認識配列を5’末端につけたオリゴヌクレオチド
XKS−f(EcoR1):5’-GGGGAATTCATGTTGTGTTCAGTAATTCAGAG-3’(配列番号13)
XKS−r(BamH1):5’-GGGGGATCCTTAAGGGGACAATCTTGGAA-3’(配列番号14)
を用いてS. cerevisiaeのXKS1のORFを増幅し、BYP5050のEcoRI−BamHIサイト間に挿入したプラスミドpKOM3を作製した。
【0124】
さらに、Sse8387I認識配列を5’末端につけたオリゴヌクレオチド
PGKp(Sse8387I):5’-CCCCCTGCAGGTTTAAAGATGCCGATTTGG-3’(配列番号15)
PGKt(Sse8387I):5’-CAACCTGCAGGGACCAGCTTTAACGAACGC-3’(配列番号16)
を用いてpKOM3のPGK1p−XKS1−PGK1t部分をPCR増幅し、pKOM7のSse8387Iサイトに挿入したプラスミドpKOM10を作製した。
【0125】
ApaIを用いてpKOM10のAUR−1C内を切断した。その結果得られたリニアDNAを酵母細胞内に導入すると、酵母染色体におけるaur−1の遺伝子座において相同組み換えが起こり、抗生物質AbA耐性のクローンが形質転換体として得られる(Hashida-Okado, T., Ogawa, A., Kato, I., and Takesako, K. (1998) Transformation system for prototrophic industrial yeasts using the AUR1 gene as a dominant selection marker. FEBS lett. 425: 117-122)。W303−1AにpKOM10をインテグレートした株を作製し、AbA耐性で選択し、KOM818A株とした。
【0126】
なお、形質転換は以下のようにして行った。
【0127】
酵母をYP+グルコース+20mg/L アデニン培地中でOD600=1.3〜1.5になるまで培養した後、集菌した(3000rpm、5分間)。氷冷した1Mソルビトール溶液で2回洗菌したのち、1ml程度の氷冷した1Mソルビトール溶液に懸濁した。
【0128】
この懸濁液95μlとプラスミド5μlを電極間隔が2mmのエレクトロポレーション用キュベットに入れて、Gene Pulser Xcell PCシステム(BIO-RAD社)を用いて1.5kV、5mSでエレクトロポレーションを行った。サンプルを0.5μg/ml AbAを含む選択培地に塗付し、30℃で2〜3日培養した。
【0129】
〔実施例5:酵母の形質転換〕
キシロース発酵性の組換えS. cerevisiae株KOM818Aを、CGUG_05859遺伝子を含むベクターであるpPY13で形質転換してYPY11株を得た。形質転換方法は、選択培地として、YNB+2%(w/v)グルコース+各20mg/Lのアデニン、ヒスチジン、トリプトファン、ロイシン+2%(w/v)寒天培地を使用した以外は実施例4に記載の方法と同様にして行った。
【0130】
また、同様にして、KOM818Aをベクターコントロール株であるpRS426で形質転換してYPY12株を得た。
【0131】
〔実施例6:CGUG_05859遺伝子を導入した形質転換酵母のキシロース取り込み活性の測定〕
実施例5で得られたYPY11株を用いてキシロース取り込み活性を測定した。コントロールとしてはYPY12株を用いた。キシロース取り込み活性を測定は上記キシロース取り込み活性測定法により行い、反応液中のキシロース濃度としては50μM、グルコース濃度としてはグルコース阻害を見るときはさらにグルコースを250μMとなるようにして行った。
【0132】
結果を図4に示す。図4の(a)に示すように、ベクターコントロール株であるpRS426で形質転換したKOM818A株(YPY12株)は、ほとんどキシロース取り込み活性がなかったが、CGUG_05859遺伝子を含むpPY13で形質転換したKOM818A株(YPY11株)はキシロース取り込み活性を示し、CGUG_05859遺伝子がキシローストランスポーターをコードしていることが明らかとなった。また、図4の(b)に示すように、キシロース50μM、グルコース250μMでキシロースの取り込み実験を行ったところ、キシロース取り込み活性はほとんど阻害されないことが明らかとなった。
【0133】
以上のように、本願発明者は、草木系バイオマスや木質系バイオマスからバイオエタノールを発酵生産する際に期待される、グルコース共存下でも阻害されないキシローストランスポーターをコードする遺伝子(CGUG_05859遺伝子)をCandida guilliermondiiで発見し、Saccharomyces cerevisiaeで発現させることに成功した。
【0134】
CGUG_05859遺伝子の塩基配列はGXS1との相同性が48%であった。また、CGUG_05859遺伝子にはCTGコドンは1つも含まれていない。
【0135】
〔比較例1:CGUG_01830遺伝子、CGUG_00247遺伝子をそれぞれ導入した形質転換酵母のキシロース取り込み活性の測定〕
図3に、BLAST検索の結果、スコア200以上であったものとして示されるCGUG_01830遺伝子と、CGUG_00247遺伝子とを用いて、それぞれ実施例と同様にして、形質転換酵母を作製し、キシロース取り込み活性を測定した。その結果、CGUG_01830遺伝子、CGUG_00247遺伝子をそれぞれ導入した形質転換酵母は、キシロース取り込み活性を示さなかった。
【産業上の利用可能性】
【0136】
本発明に係るタンパク質は、グルコースの共存下でも、高いキシローストランスポーター活性を有し、従来の酵母では細胞内部への取り込み活性が悪かったキシロースを、グルコースの共存下でも、細胞内部に効率的に取り込ませることが可能となる。
【0137】
それゆえ、キシロースを多く含む作物の未利用部分である草木系バイオマスや木質系バイオマスを用いたバイオエタノールの製造に利用することができ、非常に有用である。
【技術分野】
【0001】
本発明は、キシローストランスポーター活性を有する新規タンパク質および当該タンパク質をコードするポリヌクレオチド、並びにそれらの利用、特にエタノール製造への利用に関する。
【背景技術】
【0002】
近年大きな問題となっている地球温暖化は、各地の平均気温の上昇だけでなく、地球規模の大気循環パターンが変わることによる大規模な気候変動を引き起こす可能性がある。急速な気候変動や異常気象は、自然災害を増加させ、社会に大きな損失を与える。とくに農業、林業、水産業など、自然を対象にした産業は、気候変動や異常気象の大きな影響を受ける。地球温暖化の主な原因は温室効果ガスであるCO2の大気中の濃度が急上昇していることである。
【0003】
化石燃料を燃やしてエネルギーを得ることが長年行われてきたが、それは地中に固定されていた炭素を大気中にCO2の形で放出していることに他ならない。CO2を放出する化石燃料を代替し、CO2の排出量を削減可能な燃料として、近年バイオエタノールが注目されている。
【0004】
バイオエタノールとは、植物資源(バイオマス資源)をアルコール発酵させ、蒸留して得られるエタノールのことを指す。バイオエタノールは植物を原料とするため、原料の植物が生育し続ける限り、エタノールを生産できる。つまり、再生可能なエネルギーである。また、植物を燃焼させてCO2を大気中に放出しても、そのCO2は生長時に吸収したCO2分を放出しただけというカーボンニュートラルの考えから、地球全体のCO2量は変わらないことになる。
【0005】
植物資源のうち、デンプンや糖質をエタノール発酵させる技術には歴史があり、すでに成熟している。しかし、デンプンや糖質のような可食部を使ってエタノール発酵させる場合食糧価格を上昇させる可能性がある。また、たとえ食糧価格を上昇させないまでも、世界中には餓えに苦しんでいる人々がいるのに食糧となりえるものから燃料を製造してよいのかという議論がある。そのため、稲わら、麦わら等の草本系バイオマスや、林地残材や建築廃材などの廃木材等の木質系バイオマス等、食糧と競合しない植物資源からエタノールを製造しようとする動きがある。
【0006】
しかし、草本系バイオマスや木質系バイオマス等からのエタノール製造にはいくつかの課題がある。堅いリグニンをどのように分解するか、セルロースをいかに効率的にグルコースに変換するか、ヘミセルロースから遊離するキシロースをどのように効率的にエタノールに変換するかという問題である。
【0007】
バイオエタノールの製造には多くの場合Saccharomyces cerevisiae(以下、本明細書において「S. cerevisiae」と略記することがある。)に属する酵母が用いられている。Saccharomyces cerevisiaeは、エタノール発酵において様々な利点を持っている。すなわち、Saccharomyces cerevisiaeは、他の生物に比べて(他の酵母と比べても)エタノール生産性が高く、エタノール耐性や草本系および木質系バイオマスの加水分解物に含まれる発酵阻害物質への耐性に優れる。Saccharomyces cerevisiaeの問題点は草本系バイオマスや木質系バイオマス等に含まれる糖のうちの3割近くを占めるキシロースを代謝できないという点である。そのため、キシロースを代謝できる菌株の育種が目指されている。
【0008】
キシロースをエタノール発酵させるためには、キシロースをキシルロースに変換し、キシルロースをリン酸化してキシルロース5−リン酸とした後、解糖系につなげる必要がある。しかし、Saccharomyces cerevisiaeは、キシロースをキシルロースに変換する経路を持っていない。このキシロースをキシルロースに変換する能力を当該酵母に付与してキシロースを代謝する技術として、キシロースイソメラーゼをコードするポリヌクレオチドで酵母を形質転換する技術が報告されている(特許文献1、2参照)。
【0009】
また、キシロースをキシルロースに変換する能力を酵母に付与する他の技術として、キシロースリダクターゼによりキシロースをキシリトールに還元し、キシリトールをキシリトールデヒドロゲナーゼによりキシルロースに変換するために、キシロースリダクターゼをコードするポリヌクレオチドとキシリトールデヒドロゲナーゼをコードするポリヌクレオチドとを導入した遺伝子組換え酵母を用いる技術が報告されている(特許文献3参照)。
【0010】
上述した技術により、Saccharomyces cerevisiaeにおけるキシロースの代謝は可能となるが、キシロースの細胞内部への取り込みはヘキソース(グルコースあるいはガラクトース)トランスポーターに依存しているため、キシロースの細胞内部への取り込みが遅いいう問題がある。かかる問題を解決するために、キシロースで自然増殖することができる酵母であるCandida intermedia(以下、本明細書において「C. intermedia」と略記することがある。)から得られたキシロース/グルコースを対象とする能動輸送体をコードするポリヌクレオチドを導入した改質酵母を用いる技術が報告されている(特許文献4参照)。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】日本国公表特許公報「特表2005−514951号公報(2005年5月26日公開)」
【特許文献2】日本国公表特許公報「特表2009−213481号公報(2009年9月24日公開)」
【特許文献3】日本国公開特許公報「特開2009−112289号公報(2009年5月28日公開)」
【特許文献4】日本国公表特許公報「特表2009−502191号公報(2009年1月29日公開)」
【発明の概要】
【発明が解決しようとする課題】
【0012】
しかし、上述した従来の技術は、いずれもキシロースを効率的にエタノールに変換するという点で未だ十分ではない。特許文献1−3に記載の技術では、キシロースの細胞内部への取り込みはヘキソーストランスポーターに依存しているため、キシロースの細胞内部への取り込みが遅いという問題がある。
【0013】
また、特許文献4に記載のSaccharomyces cerevisiaeの形質転換体は、キシロースの細胞内部への取り込みの向上を目的とするものであるが、キシロースの取り込み活性は未だ十分であるとはいえない。
【0014】
本発明は、上記の問題点に鑑みてなされたものであり、その目的は、バイオマス資源のエタノール発酵においてキシロースをより効率的に利用するために、高いキシローストランスポーター活性を有する新規タンパク質および当該タンパク質をコードするポリヌクレオチドを提供すること、およびこれらを利用することにある。
【課題を解決するための手段】
【0015】
本発明に係るタンパク質は、上記課題を解決するために、下記(a)または(b)記載のタンパク質:
(a)配列番号1に示されるアミノ酸配列からなるタンパク質、
(b)配列番号1に示されるアミノ酸配列において、1または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなり、且つ、キシローストランスポーター活性を有することを特徴としている。
【0016】
本発明に係るタンパク質は、酵母由来であることが好ましい。また、本発明に係るタンパク質は、Candida guilliermondii 由来であることがより好ましい。
【0017】
本発明に係るポリヌクレオチドは、上記タンパク質をコードするものであればよい。本発明に係るポリヌクレオチドは、下記(c)または(d)記載のポリヌクレオチドであってもよい:
(c)配列番号2に示される塩基配列をオープンリーディングフレーム領域として有するポリヌクレオチド、
(d)配列番号2に示される塩基配列からなるポリヌクレオチドと相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件でハイブリダイズし、且つ、キシローストランスポーター活性を有するタンパク質をコードするポリヌクレオチド。
【0018】
本発明に係るベクターは、本発明に係るポリヌクレオチドを含むことを特徴とする。
【0019】
本発明に係る形質転換酵母は、本発明に係るポリヌクレオチドが導入されていることを特徴とする。本発明に係る形質転換酵母は、Saccharomyces cerevisiae、Pichia stipitis、Candida intermedia、またはCandida shehataeより作製されることが好ましい。
【0020】
本発明に係る形質転換酵母は、さらに、キシロースリダクターゼをコードするポリヌクレオチドとキシリトールデヒドロゲナーゼをコードするポリヌクレオチドとが導入されていることが好ましい。また、本発明に係る形質転換酵母は、キシロースイソメラーゼをコードするポリヌクレオチドが導入されているものであってもよい。
【0021】
本発明に係るエタノールの製造方法は、本発明に係る形質転換酵母を用いることを特徴としている。
【発明の効果】
【0022】
本発明に係るタンパク質は、以上のように、上記課題を解決するために、下記(a)または(b)記載のタンパク質:
(a)配列番号1に示されるアミノ酸配列からなるタンパク質、
(b)配列番号1に示されるアミノ酸配列において、1または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなり、且つ、キシローストランスポーター活性を有するタンパク質であるので、高いキシローストランスポーター活性を有し、従来の酵母では細胞内部への取り込み活性が悪かったキシロースを、細胞内部に効率的に取り込ませることが可能となるという効果を奏する。さらに、グルコースの共存下においても、高いキシローストランスポーター活性を有し、グルコースの共存下でもキシロースを細胞内部に効率的に取り込ませることが可能となるという効果を奏する。
【0023】
それゆえ、キシロースを多く含む作物の未利用部分である草本系バイオマスや木質系バイオマスを用いたバイオエタノールの製造に利用することができる。
【0024】
また、本発明に係るポリヌクレオチドは、以上のように、下記(c)または(d)記載のポリヌクレオチド:
(c)配列番号2に示される塩基配列をオープンリーディングフレーム領域として有するポリヌクレオチド、
(d)配列番号2に示される塩基配列からなるポリヌクレオチドと相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件でハイブリダイズし、且つ、キシローストランスポーター活性を有するタンパク質をコードするポリヌクレオチド
であるので、かかるポリヌクレオチドを導入した形質転換酵母では、従来の酵母では細胞内部への取り込み活性が悪かったキシロースを、細胞内部に効率的に取り込ませることが可能となるという効果を奏する。さらに、かかるポリヌクレオチドを導入した形質転換酵母では、グルコースの共存下でもキシロースを細胞内部に効率的に取り込ませることが可能となるという効果を奏する。
【図面の簡単な説明】
【0025】
【図1】実施例において様々な酵母株のキシロース取り込み活性を測定し、比較した結果を示す図である。
【図2】実施例において高いキシロース取り込み活性を示した酵母株について、グルコース共存下におけるキシロース取り込み活性を測定した結果を示す図である。
【図3】Candida intermedia由来のGXS1およびPichia stipitis(以下、本明細書において、「P. stipitis」と略称することがある。)由来のXUT4に対するCandida guilliermondii(以下、本明細書において、「C. guilliermondii」と略称することがある。)ATCC6260データベースのBLAST検索の結果を示す図である。
【図4】(a)はpRS426で形質転換したKOM818A株(YPY12株)と、pPY13で形質転換したKOM818A株(YPY11株)とにおけるキシロースの取り込み量を示す図であり、(b)はYPY11株のキシロースの取り込みに及ぼすグルコースの影響を示す図である。
【図5】Saccharomyces cerevisiaeにおけるエタノール発酵の経路を模式的に示す図である。
【図6】キシロースイソメラーゼをコードするポリヌクレオチドまたはキシロースリダクターゼをコードするポリヌクレオチドとキシリトールデヒドロゲナーゼをコードするポリヌクレオチドとを導入して、キシロースをキシルロースに変換する経路を付与したSaccharomyces cerevisiaeを模式的に示す図である。
【図7】キシローストランスポーターをコードするポリヌクレオチドを導入したSaccharomyces cerevisiaeを模式的に示す図である。
【発明を実施するための形態】
【0026】
上記課題を解決するために、本願発明者は、キシロース取り込み活性に優れた酵母株を特定することを目的として、糖としてキシロースのみを含む培地で様々な酵母株を培養し、それぞれの酵母株のキシロース取り込み活性をアイソトープで標識したキシロースを用いて測定した。その結果、特許文献4に記載のCandida intermediaと比較してキシロース取り込み活性が顕著に高い複数の酵母株を見出した。これらの酵母株は、キシロースからのエタノール発酵に用いることができる酵母として知られているPichia stipitisと同等あるいはより高いキシロース取り込み活性を示す。なお、Pichia stipitisにはアルコール耐性に劣るためエタノール発酵には適さないという問題がある。
【0027】
しかしながら、本願発明者が、Pichia stipitisを、キシロースとグルコースとが共存する培地で培養したところ、キシロース取り込み活性が、グルコース非存在下と比べて約10分の1に減少することを見出した。すなわち、Pichia stipitisでは、キシロースの取り込みが、グルコースにより阻害されると考えられる。実際にエタノール発酵を行う草本系バイオマスや木質系バイオマス等には、グルコースとキシロースとが含まれるので、グルコース共存下においても、キシロース取り込み活性がよいことが求められる。
【0028】
そこで、本願発明者は、キシロース取り込み活性が顕著に高いことを見出した複数種類の酵母株について、グルコースの共存下でのキシロース取り込み活性を測定した。その結果、殆どの上記酵母株で、キシロース取り込み活性が、グルコースの共存下で約1/10〜1/20に減少することが見出された。しかし、上記酵母株中で唯一、グルコース存在下でのキシロース取り込み活性の減少の程度が顕著に低い酵母株が見出された。そして、その酵母株のゲノム情報を含むデータベースを利用して、前述のPichia stipitisおよび特許文献4に記載のCandida intermediaにおいて、キシローストランスポーターであると予想されているポリヌクレオチドに対するホモロジー検索を行い、グルコース存在下においても高いキシロース取り込み活性を有するキシローストランスポーターをコードするポリヌクレオチドを同定・単離することに成功した。また、得られたポリヌクレオチドを組み込んだ形質転換酵母を作製し、当該形質転換酵母がグルコースの共存下においてもキシロースを細胞内部に効率的に取り込むことを確認して本発明を完成させるに至った。
【0029】
以下、本発明の実施の形態について、詳細に説明する。ただし、本発明はこれに限定されるものではなく、記述した範囲内で種々の変形を加えた態様で実施できるものである。また、本明細書中に記載された学術文献および特許文献の全てが、本明細書中において参考として援用される。
【0030】
(I)本発明に係るタンパク質
本発明に係るタンパク質は、下記(a)または(b)記載のタンパク質である:
(a)配列番号1に示されるアミノ酸配列からなるタンパク質、
(b)配列番号1に示されるアミノ酸配列において、1または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなり、且つ、キシローストランスポーター活性を有することを特徴とするタンパク質。
【0031】
なお、配列番号1に示すアミノ酸配列からなるタンパク質は、後述する実施例に示すポリヌクレオチド「CGUG_05859」によりコードされるタンパク質に相当している。
【0032】
ここで、上記「1または数個のアミノ酸が欠失、置換および/または付加された」とは、部位特異的突然変異誘発法等の公知の変異ペプチド作製法により欠失、置換もしくは付加できる程度の数(好ましくは10個以下、より好ましくは7個以下、さらに好ましくは5個以下)のアミノ酸が欠失、置換もしくは付加されることを意味する。
【0033】
1または数個のアミノ酸が欠失、置換および/または付加される部位は、アミノ酸が欠失、置換および/または付加された後のタンパク質がキシローストランスポーター活性を有していれば、該アミノ酸配列中のどの部位であってもよい。
【0034】
このような変異タンパク質は、公知の変異ポリペプチド作製法により人為的に導入された変異を有するタンパク質に限定されるものではなく、天然に存在するタンパク質であってもよい。タンパク質のアミノ酸配列中のいくつかのアミノ酸が、このタンパク質の構造または機能に有意に影響することなく容易に改変され得ることは、当該分野において周知である。さらに、人為的に改変させるだけでなく、天然のタンパク質において、当該タンパク質の構造または機能を有意に変化させない変異体が存在することもまた周知である。
【0035】
好ましい変異体は、保存性もしくは非保存性置換、欠失および/または付加を有する。好ましい変異としては、サイレント置換、欠失および付加であり、特に好ましくは、保存性置換である。
【0036】
代表的に保存性置換と見られるのは、脂肪族アミノ酸Ala、Val、Leu、およびIleの中での1つのアミノ酸の別のアミノ酸への置換、ヒドロキシル残基SerおよびThrの交換、酸性残基AspおよびGluの交換、アミド残基AsnおよびGlnの間の置換、塩基性残基LysおよびArgの交換、ならびに芳香族残基Phe、Tyrの間の置換である。
【0037】
また、本発明に係るタンパク質には、例えば、分子間および/または分子内架橋(例えば、ジスルフィド結合等)が施されたもの、化学修飾(例えば、糖鎖、リン酸もしくはその他の官能基等)されたもの、標識(例えば、ヒスチジンタグ等)が付与されたもの、または融合タンパク質(例えば、ストレプトアビジン、シトクロム、およびGFP等)を付与されたもの等が含まれるが、特にこれらに限定されない。
【0038】
本発明に係るタンパク質は、キシローストランスポーター活性を有する。ここで、「キシローストランスポーター」とは、キシロースの膜横断輸送に関するタンパク質をいい、細胞内部へのキシロースの取り込みを促進する機能を有する。「キシローストランスポーター活性を有する」とは、キシロースを細胞内部へ輸送することができること、換言すれば、キシロースを細胞内部に取り込むことができることをいう。
【0039】
本発明において、キシローストランスポーター活性は、従来公知の様々な方法により測定することができる。具体的には、キシローストランスポーター活性は、例えば、キシローストランスポーターを発現している菌体の懸濁液を用いて、後述する実施例に記載のキシロース取り込み活性測定法によって測定することができる。
【0040】
本発明では、細胞内部へのキシロースの取り込みが観察されることを、キシローストランスポーター活性を有するという。例えば、キシローストランスポーターを発現している菌体の懸濁液を用いて、後述する実施例に記載のキシロース取り込み活性測定法によって測定したときに、細胞内部へのキシロース取り込み活性が観察されれば、キシローストランスポーター活性を有するという。なお、キシロース取り込み活性測定法による測定時のキシロース濃度は特に限定されるものではないが、好ましくは20μM〜100mMの範囲内であり、より好ましくは50μM〜50mMの範囲内である。また、当該キシロース取り込み活性測定法によって、キシロース濃度が50mMの反応液中で、キシロースの取り込み量が、30pmol/min/OD600以上であることがより好ましく、50pmol/min/OD600以上であることがさらに好ましい。なお、実施例に記載のキシロース取り込み活性測定法の条件下では、キシロースの取り込み量は、取り込み開始からの時間と比例関係にある。
【0041】
本発明に係るタンパク質は、さらに、グルコース存在下においても高いキシローストランスポーター活性を有するものである。言い換えれば、本発明に係るタンパク質は、グルコース耐性のキシローストランスポーター活性を有するものである。
【0042】
本発明において、グルコース耐性のキシローストランスポーター活性は、キシローストランスポーターを発現している菌体の懸濁液を用いて、後述する実施例に記載のキシロース取り込み活性測定法を用いた測定を、グルコースの存在下と非存在下とで行い、グルコースの存在下と非存在下とのキシロースの取り込み量を比較することにより確認することができる。
【0043】
本発明では、例えば、上記比較において、後述する実施例に記載のキシロース取り込み活性測定法における、反応液のキシロース濃度が50mMであり、かつ、グルコースの存在下でのグルコース濃度20mMであるときに、グルコースの非存在下におけるキシロース取り込み量に対する、グルコース存在下におけるキシロース取り込み量の割合が、12%以上、より好ましくは15%以上、さらに好ましくは25%以上であるときに、グルコース耐性のキシローストランスポーター活性を有するという。かかる範囲においては、このタンパク質を発現させた酵母が、グルコースの共存下でも効率的にキシロースを取り込むため、キシロースを好適にエタノール発酵することが可能となる。
【0044】
本発明に係るタンパク質は、例えば、アミノ酸合成機等を用いて化学合成されてもよいし、遺伝子組み換え技術を用いて生産されてもよいし、天然に存在するタンパク質を単離精製したものであってもよい。
【0045】
本発明に係るタンパク質は、酵母由来のタンパク質であることがより好ましい。中でも、本発明に係るタンパク質は、Candida guilliermondii由来のタンパク質であることが特に好ましい。
【0046】
(II)本発明に係るポリヌクレオチド
本発明に係るポリヌクレオチドは、本発明に係るタンパク質をコードするポリヌクレオチドである。
【0047】
ここで、ポリヌクレオチドは、DNAの形態(例えば、cDNAもしくはゲノムDNA)、またはRNA(例えば、mRNA)の形態で存在し得る。DNAまたはRNAは二本鎖であっても、一本鎖であってもよい。一本鎖DNAまたはRNAは、コード鎖(センス鎖)であっても、非コード鎖(アンチセンス鎖)であってもよい。
【0048】
また、本発明に係るポリヌクレオチドは化学的に合成してもよく、コードするタンパク質の発現が向上するように、コドンユーセージ(Codon usage)を変更してもよい。
【0049】
本発明に係るポリヌクレオチドを改変する方法としては、通常行われるポリヌクレオチド改変方法が用いられる。すなわち、タンパク質の遺伝情報を有するポリヌクレオチドの特定の塩基を置換、欠失および/または付加することで、組換えタンパク質の遺伝情報を有するポリヌクレオチドを作製してもよい。ポリヌクレオチドの塩基を変換する具体的な方法としては、例えばポリメラーゼ連鎖反応法(PCR法)の利用が挙げられる。これらの方法は当業者に公知である。
【0050】
本発明に係るポリヌクレオチドは、本発明に係るタンパク質をコードしていればその塩基配列は特に限定されるものではない。よって本発明に係るタンパク質のアミノ酸配列に応じた塩基配列からなる全てのポリヌクレオチドが本発明に含まれる。
【0051】
本発明に係るポリヌクレオチドの一実施形態としては、例えば、下記(c)または(d)のポリヌクレオチドであり得る:
(c)配列番号2に示される塩基配列をオープンリーディングフレーム領域として有するポリヌクレオチド、
(d)配列番号2に示される塩基配列からなるポリヌクレオチドと相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件でハイブリダイズし、且つ、キシローストランスポーター活性を有するタンパク質をコードするポリヌクレオチド。
【0052】
なお、配列番号2に示す塩基配列を有するポリヌクレオチドは、後述する実施例に示すポリヌクレオチド「CGUG_05859」に相当している。
【0053】
配列番号2に示す塩基配列を有するポリヌクレオチドは、後述する実施例に示すように、Candida guilliermondii IFO0566株のゲノムDNAから単離することができる。配列番号2に示す塩基配列は、特許文献4に記載のCandida intermediaのGXS1と48%の相同性を有する。なお、ここでの相同性の解析は、GENETYXを用い、パラメータを初期設定値として算出した値である。
【0054】
本発明の一実施形態では、本発明に係るポリヌクレオチドは、化学的に合成された塩基で置換されてもよい。また、本発明に係るポリヌクレオチドが置換される部位は特に限定されず、置換後の塩基配列がコードするタンパク質が好適な性質を有していればよい。つまり、置換後の塩基配列がコードするタンパク質がキシローストランスポーター活性を有していればよい。
【0055】
また本発明に係るポリヌクレオチドには、本発明に係るタンパク質をコードするポリヌクレオチド(例えば、配列番号2に示される塩基配列を有するポリヌクレオチド)、またはこれに相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件でハイブリダイズし、且つ、キシローストランスポーター活性を有するタンパク質をコードするポリヌクレオチドも含まれる。
【0056】
本明細書において、上記「ストリンジェントな条件」とは、少なくとも90%の同一性、好ましくは少なくとも95%の同一性、最も好ましくは少なくとも97%の同一性が配列間に存在するときにのみハイブリダイゼーションが起こることを意味する。具体的には、例えば、ハイブリダイゼーション溶液(5×SSC(750mM NaCl、75mM クエン酸ナトリウム)、5×デンハート液、1% SDS、100μg/ml 変性サケ精子DNA)中にて68℃で一晩インキュベーションした後、68℃にて0.1×SSC、0.1% SDS中でフィルターを洗浄する条件を挙げることができる。
【0057】
ハイブリダイゼーションは、T. Brownらの方法(Current Protocols in Molecular Biology (ed. by Ausubel et al., Wiley Interscience)のような周知の方法で行うことができる。通常、温度が高いほど、塩濃度が低いほどストリンジェンシーは高くなり(ハイブリダイズし難くなる)、より相同性の高いポリヌクレオチドを取得することができる。
【0058】
アミノ酸配列や塩基配列の同一性は、カーリンおよびアルチュールによるアルゴリズムBLAST(Karlin S, Altschul SF, Proc. Natl. Acad. Sci. USA, 87: 2264-2268 (1990); Karlin S, Altschul SF, Proc. Natl. Acad Sci. USA, 90: 5873-5877 (1993) )を用いて決定できる。BLASTのアルゴリズムに基づいたBLASTNやBLASTXと呼ばれるプログラムが開発されている(Altschul SF, et al., J. Mol. Biol., 215: 403 (1990) )。
【0059】
本発明にかかるポリヌクレオチドを取得する方法としては、公知の技術により本発明にかかるポリヌクレオチドを含むDNA断片を単離し、クローニングする方法が挙げられる。より具体的には、例えば、本発明にかかるポリヌクレオチドの塩基配列の一部と特異的にハイブリダイズするプローブを調製し、当該プローブを用いてゲノムDNAライブラリーやcDNAライブラリーに対してスクリーニングを行えばよい。このようなプローブとしては、本発明にかかるポリヌクレオチドまたはその相補鎖の少なくとも一部に特異的にハイブリダイズするプローブであれば、いかなる配列および長さのものを用いてもよい。
【0060】
また本発明にかかるポリヌクレオチドを取得する方法としては、PCR等の増幅手段を用いる方法を挙げることができる。例えば、本発明にかかるポリヌクレオチドの5’側および3’側の配列(またはその相補配列)の中からそれぞれプライマーを調製し、これらプライマーを用いてゲノムDNA(またはcDNA)等を鋳型にしてPCR等の増幅反応を行い、両プライマー間に挟まれるDNA領域を増幅することで、本発明にかかるポリヌクレオチドを含むDNA断片を大量に取得することができる。
【0061】
本発明に係るポリヌクレオチドの塩基配列は、従来公知の方法によって決定され得る。
【0062】
本発明に係るポリヌクレオチドは、本発明に係るタンパク質をコードするポリヌクレオチドのみからなるものであってもよいが、その他の塩基配列が付加されていてもよい。付加される塩基配列としては、これに限定されるものではないが、標識(例えば、ヒスチジンタグ、Mycタグ、およびFLAGタグ等)、融合タンパク質(例えば、GSTおよびMBP等)、プロモーター配列(例えば、酵母由来プロモーター配列、ファージ由来プロモーター配列、および大腸菌由来プロモーター配列等)、およびシグナル配列(例えば、小胞体移行シグナル配列、および分泌配列等)をコードする塩基配列等が挙げられる。これらの塩基配列が付加される部位は特に限定されるものではなく、翻訳されるタンパク質のN末端であっても、C末端でもあってもよい。
【0063】
(III)本発明に係るベクターおよび形質転換酵母
本発明に係るベクターは、本発明に係るポリヌクレオチドを含むものである。当該「本発明に係るポリヌクレオチド」については、上記「(II)本発明に係るポリヌクレオチド」の項で説明したとおりであるので、ここでは説明を省略する。
【0064】
本発明に係るベクターは、本発明に係るポリヌクレオチドを含むものであれば、その他の構成は特に限定されるものではない。本発明に係るベクターを構成するベースとなるベクターとしては、従来公知の種々のベクターを用いることができる。例えば、プラスミド、ファージ、またはコスミド等を用いることができ、ベクターが導入される宿主細胞や導入方法に応じて好適なベクターが適宜選択され得る。
【0065】
本発明に係るベクターとしてプラスミドベクターを用いる場合、例えば、pAUR101、p427−TEF、p417−CYC、pRS426系のベクター等が使用できる。
【0066】
本発明に係るベクターを構築するには、本発明に係るポリヌクレオチドを分離および精製した後に、制限酵素処理等を用いて切断した当該ポリヌクレオチドの断片と、ベースとなるベクターを制限酵素で切断して得た直鎖ポリヌクレオチドとを結合閉鎖させることによって構築することができる。結合閉鎖する際には、ベクターおよび当該ポリヌクレオチドの性質に応じてDNAリガーゼ等を使用することができる。
【0067】
本発明に係るベクターを宿主細胞に導入した後、ベクターのマーカー遺伝子の発現を指標としてスクリーニングして、本発明に係るポリヌクレオチドを含有する形質転換体を得ることができる。よって、本発明に係るベクターには薬剤耐性遺伝子等のマーカー遺伝子が含まれていることが好ましい。かかる薬剤耐性遺伝子の具体的な一例としては、例えば、ハイグロマイシン、ブレオマイシン、カナマイシン、ゲンタマイシン、クロラムフェニコール等に対する薬剤耐性遺伝子を挙げることができる。これにより、上記抗生物質を含む培地中で生育する細胞を選択することによって、形質転換された宿主細胞を容易に選別することができる。
【0068】
本発明に係るベクターは、本発明に係るポリヌクレオチドを宿主細胞内で発現させるためのプロモーターをさらに有していてもよい。上記プロモーターは、本発明に係るポリヌクレオチドを宿主細胞内で発現させることが可能なプロモーターであれば特に限定されるものではなく、公知のプロモーターを好適に用いることができる。上記プロモーターは、本発明に係るポリヌクレオチドを発現し得るように連結されてベクター内に導入されていればよく、ベクターとしての具体的な構造は特に限定されるものではない。
【0069】
本発明に係るベクターは、上記プロモーター、上記マーカー遺伝子、および上述のポリヌクレオチドに加えて、さらに他のDNAセグメントを含んでいてもよい。当該他のDNAセグメントは、特に限定されるものではなく、例えば、ターミネーター、エンハンサー、翻訳効率を高めるための塩基配列等を挙げることができる。
【0070】
また、本発明に係るベクターの増幅方法(生産方法)も特に限定されるものではなく、従来公知の方法を用いることができる。一般的には大腸菌を宿主細胞として当該大腸菌内でベクターを増幅させることができる。このとき、ベクターの種類に応じて、好ましい大腸菌の種類を選択することができる。
【0071】
また、本発明には、上述した本発明に係るポリヌクレオチドが導入されている形質転換酵母も含まれる。
【0072】
宿主細胞がキシローストランスポーターを持たない酵母である場合は、図5に示すように、キシロースの細胞内部への取り込みはヘキソース(グルコースあるいはガラクトース)トランスポーターに依存しており、木質系バイオマスの加水分解物のような、グルコースとキシロースとの共存下ではグルコースが先に取り込まれ、キシロースは後から取り込まれるため、キシロースを完全に利用しようとすると、発酵時間が長時間となるという問題があった。上述したポリヌクレオチドが導入されている形質転換酵母を用いることにより、図7に示すように、キシロースをキシローストランスポーターにより、細胞内部に取り込むことができると考えられる。それゆえ、バイオエタノールの発酵時間を短縮することができ、装置の回転率を上げることができる。また、保温や撹拌等に要する経費も発酵時間の短縮に伴い削減できる。
【0073】
また、キシロースを多く含む作物未利用部分である草本系バイオマスや木質系バイオマスを用いることにより、バイオエタノールの製造コストを低減することができる。
【0074】
かかる形質転換酵母は、例えば、本発明に係るベクターで形質転換された形質転換酵母を包含する。本発明に係るベクターによって形質転換される宿主細胞としては、酵母であれば特に限定されるものではないが、例えば、Saccharomyces cerevisiae、Pichia stipitis、Candida intermedia、Candida shehatae等を利用することができる。
【0075】
上記宿主細胞に本発明に係るベクターを導入する方法としては、特に限定されるものではなく、例えば、カルシウムイオンの存在下で組換えDNAを導入する方法や、エレクトロポレーション法を用いる方法等の従来公知の方法が適用され得る。
【0076】
本発明に係るベクターが宿主細胞に導入されたか否かの確認は、従来公知のPCR法、サザンハイブリダイゼーション法、ノーザンハイブリダイゼーション法等によって確認することができる。また、本発明に係るベクターに含まれているポリヌクレオチドがコードするタンパク質の発現を、キシロース取り込み活性を測定することにより確認することが可能である。また、本発明に係るベクターにカナマイシン耐性やハイグロマイシン耐性などの薬剤耐性マーカー遺伝子が導入されている場合は、上記抗生物質を含む培地中で生育する細胞を選択することによって、形質転換された宿主細胞を容易に選別することができる。
【0077】
このようにして得られた形質転換酵母は、本発明に係るタンパク質を発現しているので、当該タンパク質を調製するために用いることができる。
【0078】
また、本発明にかかる形質転換酵母は、上述した本発明に係るポリヌクレオチドに加えて、さらに、キシロースリダクターゼをコードするポリヌクレオチドとキシリトールデヒドロゲナーゼをコードするポリヌクレオチドとが導入されていてもよい。
【0079】
特に、宿主細胞が、図5に示すように、キシロースをキシルロースに変換する経路を有さない酵母である場合は、キシロースリダクターゼをコードするポリヌクレオチドとキシリトールデヒドロゲナーゼをコードするポリヌクレオチドとが導入されていることにより、図6に示すように、キシロースをキシリトールに還元し、キシリトールをキシルロースに変換することができる。それゆえ、宿主細胞内部に取り込まれたキシロースを好適に代謝することができる。
【0080】
また、本発明にかかる形質転換酵母は、上述した本発明に係るポリヌクレオチドに加えて、さらに、キシロースイソメラーゼをコードするポリヌクレオチドが導入されていてもよい。
【0081】
特に、宿主細胞が、キシロースをキシルロースに変換する経路を有さない酵母である場合は、キシロースイソメラーゼをコードするポリヌクレオチドとが導入されていることにより、図6に示すように、キシロースをキシルロースに変換することができる。それゆえ、宿主細胞内部に取り込まれたキシロースを好適に代謝することができる。
【0082】
なお、キシロースリダクターゼをコードするポリヌクレオチド、キシリトールデヒドロゲナーゼをコードするポリヌクレオチド、および、キシロースイソメラーゼをコードするポリヌクレオチドとしては、特に限定されるものではなく、従来公知のポリヌクレオチドを好適に用いることができる。また、これらのポリヌクレオチドを導入する方法も特に限定されるものではなく、従来公知の方法を用いればよい。具体的には、例えば、特許文献1〜3に記載のポリヌクレオチド、導入方法を用いることができる。
【0083】
(IV)本発明に係るエタノールの製造方法
本発明に係るエタノールの製造方法は、上述した本発明に係る形質転換酵母を用いる方法であればよい。
【0084】
本発明に係る形質転換酵母を用いることにより、従来の酵母では細胞内部への取り込み活性が悪かったキシロースを、グルコースの共存下でも、細胞内部に効率的に取り込ませることが可能となる。それゆえ、キシロースを多く含む草本系バイオマスや木質系バイオマスのエタノール発酵を効率的に行うことができる。
【0085】
本発明にかかるエタノールの製造方法は、特に限定されるものではなく、バイオエタノールを製造することができる方法であればどのような方法であってもよい。なお、培地に含まれるキシロースの濃度は、0.013〜2Mであることが好ましく、0.033〜1.87Mであることがより好ましく、0.033〜1.67Mであることがさらに好ましい。また、培地に含まれるグルコースの濃度は、0.056〜1.67Mであることが好ましく、0.11〜1.56Mであることがより好ましく、0.11〜1.39Mであることがさらに好ましい。培養温度は、通常用いられる温度であればよく、例えば、25〜37℃であり、より好ましくは28〜32℃である。また、反応は、発酵は連続式で行っても、バッチ式で行っても良い。
【0086】
培養開始から、通常12〜72時間後の培地を回収してエタノールを分離する。培地よりエタノールを分離する方法としては、蒸留法、逆浸透膜濃縮法、浸透気化膜濃縮法等の公知の方法が用いられるが、蒸留法による方法がより好ましい。次いで、分離したエタノールをさらに精製することによって、エタノールを得ることができる。
【0087】
本発明は上述した各実施形態に限定されるものではなく、請求項に示した範囲で種々の変更が可能であり、異なる実施形態にそれぞれ開示された技術的手段を適宜組み合わせて得られる実施形態についても本発明の技術的範囲に含まれる。
【実施例】
【0088】
以下、本発明を実施例により具体的に説明するが、本発明は実施例によって限定されるものではない。
【0089】
なお、実施例において使用した培地は以下に示す方法で調製した。また、キシロース取り込み活性は、以下に示すキシロース取り込み活性測定法を用いて測定した。
【0090】
<LB培地>
Becton Dickinson社製のLuria-Bertani(LB) Miller培地を使用した。プレート作製の際には寒天を終濃度2%(w/v)になるよう加えた。必要に応じて、アンピシリンを終濃度100μg/mlになるよう添加した。
【0091】
<YP培地>
YP培地の組成を表1に示す。炭素源は終濃度2%(w/v)になるよう加えた。プレート作製の際には寒天を終濃度2%(w/v)になるよう加えた。必要に応じて、選択マーカーとしてAureobasidin A(AbA)(タカラバイオ社)またはG418二硫酸塩(ナカライテスク社)を、それぞれ終濃度0.5μg/mlまたは0.025〜0.25mg/mlになるよう添加した。
【0092】
【表1】

【0093】
<YNB培地>
最少培地として、Difco yeast nitrogen base w/o amino acids(YNB)(Becton Dickinson社)を終濃度0.67%(w/v)で使用した。炭素源は終濃度で2%(w/v)になるよう加えた。必要に応じて、アミノ酸等を表2の濃度になるように加えた。プレート作製の際には寒天を終濃度で2%(w/v)になるよう加えた。必要に応じて、G418を終濃度0.025〜0.25mg/mlになるように加えた。
【0094】
【表2】

【0095】
<キシロース取り込み活性測定法>
[1-14C] D-Xylose(Moravek Biochemicals社)を用いて、Spencer-Martinsら(Spencer-Martins, I., and van Uden, N. (1985) Catabolite interconversion of glucose transport systems in the yeast Candida wickerhamii. Biochimica et Biophysica Acta 812: 168-172)の方法を参考にして以下のように行った。
【0096】
前培養液を本培養用の液体培地にOD600=0.2になるように植菌し、210rpmで旋回あるいは振とうしながら30℃で3〜12時間培養し、対数増殖期の菌体を回収した。氷冷水で2回洗菌後、OD600=0.5になるように氷冷水に懸濁した。
【0097】
なお、実施例1の場合、前培養はYP+グルコース培地を用い、培養温度30℃、290rpmで旋回培養した。本培養はYP+キシロース培地を用いた。実施例6の場合は、前培養はYNB+2%(w/v) グルコース+各20mg/Lのヒスチジン、ロイシン、トリプトファン、アデニン培地を用い、培養温度30℃で旋回あるいは振とう培養した。本培養はYNB+1%(w/v) グルコース+1%(w/v) キシロース+各20mg/Lのヒスチジン、ロイシン、トリプトファン、アデニン培地を用い、培養温度30℃で旋回あるいは振とう培養した。
【0098】
100mM Tris−クエン酸緩衝液(pH 5.0)20μlを入れたサンプルチューブに菌体懸濁液20μlを混ぜ合わせた後、チューブを25℃のウォーターバス中で5分間プリインキュベートした。
【0099】
上記混合液20μlに[1-14C] D-xylose 20μlを加え、反応を開始した。一定時間の後に混合液20μlをサンプリングし、フィルター(ポアサイズ0.2μm、cellulose acetate製;Advantec Toyo社)上に捕集し、菌体と反応液を分離した。なお、サンプリングする時間分チューブを用意した。
【0100】
フィルター上に残った菌体を速やかに氷冷水3mlで2回洗浄後、フィルターを乾燥させた。Ultima Gold (Perkin Elmer社)5mlにフィルターを浸漬させ、シンチレーションカウンター(Aloka liquid scintillation counter)を用いて、フィルター上の菌体に含まれる放射線量を測定した。
【0101】
[1- 14C] D-Xyloseを用いて作成した検量線により、菌体内に取り込まれたキシロース量(pmol)を算出した。
【0102】
〔実施例1:高活性を示すキシローストランスポーターを有する酵母菌株のスクリーニング〕
<様々な酵母のキシロース取り込み活性の測定>
高いキシロース取り込み活性を有する酵母株を特定する目的で、様々な酵母株のキシロース取り込み活性を測定し、比較した。
【0103】
キシロース生育が可能な株、およびキシロース発酵性酵母として知られているいくつかの株、合計27種、30株について50mMキシロースおよび1mMキシロースを用いて、取り込み活性を測定した。
【0104】
いずれの酵母も、前培養はYP+グルコース培地を用い、培養温度30℃、290rpmで旋回培養した。本培養は300ml容三角フラスコに60mlのYP+キシロース培地を調製し、培養温度30℃、210rpmで旋回培養した。一般的なYP+グルコース培地ではなくYP+キシロース培地を用いた理由は、キシロース高親和性トランスポーターがあるとすれば、キシロースが豊富な条件下で特異的に発現する可能性があると考えたからである。ただし、キシロースを代謝できないS. cerevisiae IFO0565株については、本培養もYP+グルコース培地で行った。上記の前培養液を用いて、本培養開始時の濁度をOD600=0.2とし、培養を開始した。約3時間後の対数増殖期の菌体を遠心回収し、キシロース取り込み活性を測定した。結果を図1に示した。
【0105】
キシロースからのエタノール発酵の研究で報告の多いPichia stipitisと同等あるいはより好成績な菌株が見つかった。
【0106】
<グルコースによるキシロースの取り込み阻害>
しかしながら、Pichia stipitisを、キシロースとグルコースとが共存する培地で培養したところ、キシロースの取り込みが、グルコース非存在下と比べて約10分の1に減少していた。そこで、50mMキシロースで高いキシロース取り込み活性を示した上位7株について、グルコース共存下におけるキシロース取り込み活性を測定した。20mMグルコースと50mMキシロースの混合液を用いた場合のキシロース取り込み活性と、50mMキシロース液のみを用いた場合のキシロース取り込み活性を図2に示す。
【0107】
測定に供試した7株すべてにおいて、グルコースが共存する時キシロースの取り込み量が減少した。50mMキシロース単独の場合に比べて、20mMグルコースが共存する場合、6株ではキシロース取り込み活性が1/10から1/20に低下したが、Candida guilliermondii IFO0566株においては、1/3程度の低下にとどまり、他の株に比べて顕著に活性が残存していることが見出された。かかる結果から、C. guilliermondiiにはキシロースに対する親和性が高い、キシロース取り込みに優れたトランスポーターが存在すると考えられる。
【0108】
〔実施例2:データベースを利用したキシローストランスポーター遺伝子の探索〕
最近、C. guilliermondii ATCC6260のゲノム情報を含んだデータベース『Candida DB』が公開された (Rossignol, T., Lechat, P., Cuomo, C., Zeng, Q., Moszer, I., d'Enfert, C. (2008) CandidaDB: a multi-genome database for Candida species and related Saccharomycotina. Nucleic Acids Research 36: 557-561)。そこで、このデータベースを利用してBLAST検索を行い、既知のキシローストランスポーター遺伝子と相同性が高い遺伝子をクローニングすることにした。
【0109】
グルコース・キシロース/プロトンシンポーターであるCandida intermedia由来のGXS1(Leandro, M. J., Goncalves, P., Spencer-Martins, I. (2006) Two glucose/xylose transporter genes from the yeast Candida intermedia: first molecular characterization of a yeast xylose-H+ symporter. Biochem. J. 395: 543-549)、および高親和性キシローストランスポーターと推定されているP. stipitis由来のXUT4 (Jeffries, T. W., Grigoriev, I. V., Grimwood, J., Laplaza, J. M., Aerts, A., Salamov, A., Schmutz, J., Lindquist, E., Dehal, P., Shapiro, H., Jin, Y. S., Passoth, V., and Richardson, P. M. (2007)Genome sequence of the lignocellulose-bioconverting and xylose-fermenting yeast Pichia stipitis. Nat. Biotechnol. 25:319-326)をqueryのアミノ酸配列としてBLAST検索した結果、C. guilliermondiiにこれらの遺伝子と似た配列を持つ遺伝子が存在することが示唆された。
【0110】
図3に、BLAST検索の結果、スコア200以上であったものを示す。なお、C. guilliermondiiは、通常と異なる翻訳コドンを用いるCTG cladeと呼ばれる生物群に属しており、この点には注意が必要である。通常のuniversal codonでは、CTGコドンはロイシンを指定するが、CTGcladeではセリンを指定する。したがって、C. guilliermondiiトランスポーター遺伝子をS. cerevisiaeで発現させる場合には、CTGコドンをまったく含まないトランスポーター遺伝子を用いるか、CTGコドンを通常のセリン指定コドンに置き換えた改変遺伝子を用いる必要がある。
【0111】
〔実施例3:CGUG_05859遺伝子のクローニング〕
酵母のゲノムDNAの抽出は、Wizard Genomic DNA Purification Kit (Promega社)を用いて行った。Candida guilliermondii IFO0566株から抽出したゲノムDNAを鋳型として、データベースの配列情報をもとに5’末端に制限酵素サイトをもつように設計した下記プライマーを作製し、CGUG_05859遺伝子をPCR増幅した。
Cg05859F(BamHI):5’- CCCGGATCCATGGCTTACGAGGACAAA-3’(配列番号3)
Cg05859R(XhoI):5’-CCCCTCGAGTTATACCTGCGACTTCTC-3’(配列番号4)
なお、PCRは表3の反応液を用いて、表4の反応条件で行った。
【0112】
【表3】

【0113】
【表4】

【0114】
PCR産物は、Wizard SV Gel and PCR Clean-Up System (Promega社)を用いて精製した。このPCR増幅断片と高発現多コピーのプラスミドp427−TEF(Dualsystems Biotech社)を制限酵素BamHIとXhoIで切断した。Davisらの方法 (Davis, R. W., Bostein, D., and Roth, J. R. (1980) Advanced Bacterial Genetics, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY)で、DNA断片をアガロースゲル電気泳動で分離後、Wizard SV Gel and PCR Clean-Up Systemを用いて精製した。
【0115】
制限酵素処理したPCR断片とp427−TEFは、東洋紡社のLigation highキットver. 2を用いて繋ぎ合わせた。
【0116】
このDNA液を用いて大腸菌DH5α株を形質転換し、100μg/mlのアンピシリンを含むLB寒天培地で形質転換株を選択した。得られた形質転換株からWizard Plus SV Minipreps DNA Purification System (Promega社)を用いてプラスミドを抽出し、ABI PRISM 310NT Genetic Analyzer (Applied Biosystems社)を用いてその塩基配列を決定し、CGUG_05859遺伝子がクローニングできていることを確認し、そのプラスミドをpYO1017とした。
【0117】
pYO1017をSacIで切断し、約800bpのDNA断片をpRS426(ATCCから取り寄せ)のSacIサイトに挿入した。得られたプラスミドをBamHIとKpnIで切断して、その間にpYO1017をBamHIとKpnIで切断して得られた短い方のDNA断片を挿入してプラスミドpPY13を得た。pPY13は、TEF1遺伝子のプロモーターの制御下にCGUG_05859遺伝子が位置しており、大腸菌用の選択マーカーとしてはアンピシリン耐性、酵母用の選択マーカーとしてはURA3を持っている構造となっている。
【0118】
〔実施例4:KOM818A株の作製〕
宿主としたキシロース発酵性のS. cerevisiae株KOM818A(W303−1A, but aur1::AUR1−C−TDH3p−XYL1P.stipitis−TDH3tTDH3p−XYL2P.stipitis−TDH3tPGK1p−XKSS.cerevisiae−PGK1t)を、S. cerevisiaeの実験室株であるW303−1A(Thomas & Rothstein, Cell 56:619-630, 1989)に、P. stipitis由来のキシロースリダクターゼをコードするポリヌクレオチド、P. stipitis由来のキシリトールデヒドロゲナーゼをコードするポリヌクレオチド、および、S. cerevisiae由来のキシルロキナーゼをコードするポリヌクレオチドを導入することにより作製した。
【0119】
NotI認識配列を5’末端につけたオリゴヌクレオチド
XYL1−f(Not1):5’-AAGGAAAAAAGCGGCCGCATGCCTTCTATTAAGTTGAACTC-3’(配列番号5)
XYL1−r(Not1):5’-AAGGAAAAAAGCGGCCGCTTAGACGAAGATAGGAATC-3’(配列番号6)
を用いてP. stipitisのXYL1のORFをPCR増幅し、YEGAp(Hong, J., Tamaki, H., Akiba, S., Yamamoto, K., and Kumagai, H. (2001) JBB 92: 434-441)のNotIサイトに挿入したプラスミドpKOM1を作製した。
【0120】
NotI認識配列を5’末端につけたオリゴヌクレオチド
XYL2−f(Not1):5’-AAGGAAAAAAGCGGCCGCATGACTGCTAACCCTTCCTT-3’(配列番号7)
XYL2−r(Not1):5’-AAGGAAAAAAGCGGCCGCTTACTCAGGGCCGTCAATGA-3’(配列番号8)
を用いてP.stipitisのXYL2のORFをPCR増幅し、YEGApのNotIサイトに挿入したプラスミドpKOM2を作製した。
【0121】
SacIおよびKpnI認識配列を5’末端につけたオリゴヌクレオチド
GAP−XYL1−GAPt(f−Sac1):5’-GGGGAGCTCCTCACACGGAACACCACTAATGG-3’(配列番号9)
GAP−XYL1−GAPt(r−Kpn1):5’-GGGGGTACCAATGAATCGAAAATGTCATTAAAATAG-3’(配列番号10)
を用いてpKOM1のTDH3p−XYL1−TDH3t部分をPCR増幅し、pAUR101(タカラバイオ)のSacI−KpnIサイト間に挿入した。
【0122】
さらに、このプラスミドのXbaIサイトに、XbaIを5’末端につけたオリゴヌクレオチド
Gap−XYL2−t(Xba1−f):5’-AAATCTAGAAAGCTTACCAGTTCTCACAC-3’(配列番号11)
Gap−XYL2−t(Xba1-r):5’-CCCTCTAGAAAGCTTTCAATCAATGAATC-3’(配列番号12)
を用いてpKOM2のTDH3p−XYL2−TDH3t部分をPCR増幅したDNA断片を挿入したプラスミドpKOM7を作製した。
【0123】
EcoRIおよびBamHI認識配列を5’末端につけたオリゴヌクレオチド
XKS−f(EcoR1):5’-GGGGAATTCATGTTGTGTTCAGTAATTCAGAG-3’(配列番号13)
XKS−r(BamH1):5’-GGGGGATCCTTAAGGGGACAATCTTGGAA-3’(配列番号14)
を用いてS. cerevisiaeのXKS1のORFを増幅し、BYP5050のEcoRI−BamHIサイト間に挿入したプラスミドpKOM3を作製した。
【0124】
さらに、Sse8387I認識配列を5’末端につけたオリゴヌクレオチド
PGKp(Sse8387I):5’-CCCCCTGCAGGTTTAAAGATGCCGATTTGG-3’(配列番号15)
PGKt(Sse8387I):5’-CAACCTGCAGGGACCAGCTTTAACGAACGC-3’(配列番号16)
を用いてpKOM3のPGK1p−XKS1−PGK1t部分をPCR増幅し、pKOM7のSse8387Iサイトに挿入したプラスミドpKOM10を作製した。
【0125】
ApaIを用いてpKOM10のAUR−1C内を切断した。その結果得られたリニアDNAを酵母細胞内に導入すると、酵母染色体におけるaur−1の遺伝子座において相同組み換えが起こり、抗生物質AbA耐性のクローンが形質転換体として得られる(Hashida-Okado, T., Ogawa, A., Kato, I., and Takesako, K. (1998) Transformation system for prototrophic industrial yeasts using the AUR1 gene as a dominant selection marker. FEBS lett. 425: 117-122)。W303−1AにpKOM10をインテグレートした株を作製し、AbA耐性で選択し、KOM818A株とした。
【0126】
なお、形質転換は以下のようにして行った。
【0127】
酵母をYP+グルコース+20mg/L アデニン培地中でOD600=1.3〜1.5になるまで培養した後、集菌した(3000rpm、5分間)。氷冷した1Mソルビトール溶液で2回洗菌したのち、1ml程度の氷冷した1Mソルビトール溶液に懸濁した。
【0128】
この懸濁液95μlとプラスミド5μlを電極間隔が2mmのエレクトロポレーション用キュベットに入れて、Gene Pulser Xcell PCシステム(BIO-RAD社)を用いて1.5kV、5mSでエレクトロポレーションを行った。サンプルを0.5μg/ml AbAを含む選択培地に塗付し、30℃で2〜3日培養した。
【0129】
〔実施例5:酵母の形質転換〕
キシロース発酵性の組換えS. cerevisiae株KOM818Aを、CGUG_05859遺伝子を含むベクターであるpPY13で形質転換してYPY11株を得た。形質転換方法は、選択培地として、YNB+2%(w/v)グルコース+各20mg/Lのアデニン、ヒスチジン、トリプトファン、ロイシン+2%(w/v)寒天培地を使用した以外は実施例4に記載の方法と同様にして行った。
【0130】
また、同様にして、KOM818Aをベクターコントロール株であるpRS426で形質転換してYPY12株を得た。
【0131】
〔実施例6:CGUG_05859遺伝子を導入した形質転換酵母のキシロース取り込み活性の測定〕
実施例5で得られたYPY11株を用いてキシロース取り込み活性を測定した。コントロールとしてはYPY12株を用いた。キシロース取り込み活性を測定は上記キシロース取り込み活性測定法により行い、反応液中のキシロース濃度としては50μM、グルコース濃度としてはグルコース阻害を見るときはさらにグルコースを250μMとなるようにして行った。
【0132】
結果を図4に示す。図4の(a)に示すように、ベクターコントロール株であるpRS426で形質転換したKOM818A株(YPY12株)は、ほとんどキシロース取り込み活性がなかったが、CGUG_05859遺伝子を含むpPY13で形質転換したKOM818A株(YPY11株)はキシロース取り込み活性を示し、CGUG_05859遺伝子がキシローストランスポーターをコードしていることが明らかとなった。また、図4の(b)に示すように、キシロース50μM、グルコース250μMでキシロースの取り込み実験を行ったところ、キシロース取り込み活性はほとんど阻害されないことが明らかとなった。
【0133】
以上のように、本願発明者は、草木系バイオマスや木質系バイオマスからバイオエタノールを発酵生産する際に期待される、グルコース共存下でも阻害されないキシローストランスポーターをコードする遺伝子(CGUG_05859遺伝子)をCandida guilliermondiiで発見し、Saccharomyces cerevisiaeで発現させることに成功した。
【0134】
CGUG_05859遺伝子の塩基配列はGXS1との相同性が48%であった。また、CGUG_05859遺伝子にはCTGコドンは1つも含まれていない。
【0135】
〔比較例1:CGUG_01830遺伝子、CGUG_00247遺伝子をそれぞれ導入した形質転換酵母のキシロース取り込み活性の測定〕
図3に、BLAST検索の結果、スコア200以上であったものとして示されるCGUG_01830遺伝子と、CGUG_00247遺伝子とを用いて、それぞれ実施例と同様にして、形質転換酵母を作製し、キシロース取り込み活性を測定した。その結果、CGUG_01830遺伝子、CGUG_00247遺伝子をそれぞれ導入した形質転換酵母は、キシロース取り込み活性を示さなかった。
【産業上の利用可能性】
【0136】
本発明に係るタンパク質は、グルコースの共存下でも、高いキシローストランスポーター活性を有し、従来の酵母では細胞内部への取り込み活性が悪かったキシロースを、グルコースの共存下でも、細胞内部に効率的に取り込ませることが可能となる。
【0137】
それゆえ、キシロースを多く含む作物の未利用部分である草木系バイオマスや木質系バイオマスを用いたバイオエタノールの製造に利用することができ、非常に有用である。
【特許請求の範囲】
【請求項1】
下記(a)または(b)記載のタンパク質:
(a)配列番号1に示されるアミノ酸配列からなるタンパク質、
(b)配列番号1に示されるアミノ酸配列において、1または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなり、且つ、キシローストランスポーター活性を有することを特徴とするタンパク質。
【請求項2】
酵母由来であることを特徴とする請求項1に記載のタンパク質。
【請求項3】
Candida guilliermondii 由来であることを特徴とする請求項1または2に記載のタンパク質。
【請求項4】
請求項1〜3のいずれか1項に記載のタンパク質をコードすることを特徴とするポリヌクレオチド。
【請求項5】
下記(c)または(d)記載のポリヌクレオチド:
(c)配列番号2に示される塩基配列をオープンリーディングフレーム領域として有するポリヌクレオチド、
(d)配列番号2に示される塩基配列からなるポリヌクレオチドと相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件でハイブリダイズし、且つ、キシローストランスポーター活性を有するタンパク質をコードするポリヌクレオチド。
【請求項6】
請求項4または5に記載のポリヌクレオチドを含むことを特徴とするベクター。
【請求項7】
請求項4または5に記載のポリヌクレオチドが導入されていることを特徴とする形質転換酵母。
【請求項8】
Saccharomyces cerevisiae、Pichia stipitis、Candida intermedia、またはCandida shehataeより作製されることを特徴とする請求項7に記載の形質転換酵母。
【請求項9】
さらに、キシロースリダクターゼをコードするポリヌクレオチドとキシリトールデヒドロゲナーゼをコードするポリヌクレオチドとが導入されていることを特徴とする請求項7または8に記載の形質転換酵母。
【請求項10】
さらに、キシロースイソメラーゼをコードするポリヌクレオチドが導入されていることを特徴とする請求項7〜9のいずれか1項に記載の形質転換酵母。
【請求項11】
請求項7〜10のいずれかに記載の形質転換酵母を用いたエタノールの製造方法。
【請求項1】
下記(a)または(b)記載のタンパク質:
(a)配列番号1に示されるアミノ酸配列からなるタンパク質、
(b)配列番号1に示されるアミノ酸配列において、1または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなり、且つ、キシローストランスポーター活性を有することを特徴とするタンパク質。
【請求項2】
酵母由来であることを特徴とする請求項1に記載のタンパク質。
【請求項3】
Candida guilliermondii 由来であることを特徴とする請求項1または2に記載のタンパク質。
【請求項4】
請求項1〜3のいずれか1項に記載のタンパク質をコードすることを特徴とするポリヌクレオチド。
【請求項5】
下記(c)または(d)記載のポリヌクレオチド:
(c)配列番号2に示される塩基配列をオープンリーディングフレーム領域として有するポリヌクレオチド、
(d)配列番号2に示される塩基配列からなるポリヌクレオチドと相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件でハイブリダイズし、且つ、キシローストランスポーター活性を有するタンパク質をコードするポリヌクレオチド。
【請求項6】
請求項4または5に記載のポリヌクレオチドを含むことを特徴とするベクター。
【請求項7】
請求項4または5に記載のポリヌクレオチドが導入されていることを特徴とする形質転換酵母。
【請求項8】
Saccharomyces cerevisiae、Pichia stipitis、Candida intermedia、またはCandida shehataeより作製されることを特徴とする請求項7に記載の形質転換酵母。
【請求項9】
さらに、キシロースリダクターゼをコードするポリヌクレオチドとキシリトールデヒドロゲナーゼをコードするポリヌクレオチドとが導入されていることを特徴とする請求項7または8に記載の形質転換酵母。
【請求項10】
さらに、キシロースイソメラーゼをコードするポリヌクレオチドが導入されていることを特徴とする請求項7〜9のいずれか1項に記載の形質転換酵母。
【請求項11】
請求項7〜10のいずれかに記載の形質転換酵母を用いたエタノールの製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2012−170422(P2012−170422A)
【公開日】平成24年9月10日(2012.9.10)
【国際特許分類】
【出願番号】特願2011−37519(P2011−37519)
【出願日】平成23年2月23日(2011.2.23)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成22年度、農林水産省、「地域活性化のためのバイオマス利用技術の開発」委託プロジェクト、「稲わら等の作物の未利用部分や資源作物、木質バイオマスを効率的にエタノール等に変換する技術の開発」、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504255685)国立大学法人京都工芸繊維大学 (203)
【Fターム(参考)】
【公開日】平成24年9月10日(2012.9.10)
【国際特許分類】
【出願日】平成23年2月23日(2011.2.23)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成22年度、農林水産省、「地域活性化のためのバイオマス利用技術の開発」委託プロジェクト、「稲わら等の作物の未利用部分や資源作物、木質バイオマスを効率的にエタノール等に変換する技術の開発」、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504255685)国立大学法人京都工芸繊維大学 (203)
【Fターム(参考)】
[ Back to top ]

