キトサン−含有保護用組成物
部分的に架橋された多糖およびさらなる架橋剤の混合物を含有する流体を使用して、生体組織および構造を保護することができる。この混合物は、好ましくはスプレー可能なものであり、in situの架橋を通じて流体保護層を形成し、好ましくは治療部位からこぼれたり流れたりせず、そしてより迅速に硬化するが治療部位での生体許容性が潜在的に低い架橋剤を使用することを回避することができる。
【発明の詳細な説明】
【技術分野】
【0001】
[0001] 本発明は、キトサンに関し、そして耳、鼻、喉、四肢、および脊柱の組織および構造の中または上で使用するための材料に関する。
【背景技術】
【0002】
[0002] 様々なキトサン-含有材料およびキトサン誘導体が、外科的修復または薬物送達のために使用されてきた。そのような材料または誘導体に関連する文献には、以下の様なものが含まれる。U.S.特許No. 6,514,522(Domb)、特許No. 6,602,952 B1(Bentley et al.)、および特許No. 7,053,068 B2(Prinz)、U.S.特許出願公開No. US 2005/0238702 A1(Ishihara et al.)、カナダ特許出願No. 2 348 842 A1(Bernkop-Schnurch)、公開PCT出願No. WO 98/31712 A2(B.F. Goodrich Co.)、Aspden et al, Chitosan as a Nasal Delivery System: The Effect of Chitosan on In Vitro and In Vivo Mucociliary Transport Rates in Human Turbinates and Volunteers, J Pharm Sci, 86, 4, 509-513 (1997)、Costain et al., Prevention of postsurgical adhesions with N,O-carboxymethyl chitosan: Examination of the most efficacious preparation and the effect of N,O-carboxymethyl chitosan on postsurgical healing, Surgery, 121, 3, 314-319 (1997)、Mi et al., Synthesis and Characterization of a Novel Chitosan-Based Network Prepared Using Naturally-Occurring Crosslinker, J Polym Sci, Part A: Polym Chem, 38, 2804-2814 (2000)、Mi et al., Synthesis and characterization of biodegradable TPP/genipin co-crosslinked chitosan gel beads, Polymer, 44, 6521-30 (2003)、Roldo et al., Mucoadhesive thiolated chitosans as platforms for oral controlled drug delivery: synthesis and in vitro evaluation, European Journal of Pharmaceutics and Biopharmaceutics, 57, 115-121 (2004)、Krauland et al., Viscoelastic Properties of a New in situ Gelling Thiolated Chitosan Conjugate, Drug Development And Industrial Pharmacy, 31, 885-893 (2005)、Bernkop-Schnurch, Thiomers: A new generation of mucoadhesive polymers, Advanced Drug Delivery Reviews, 57, 1569-1582 (2005)、Bernkop-Schnurch et al., Thiomers: Preparation and in vitro evaluation of a mucoadhesive nanoparticulate drug delivery system, International journal of Pharmaceutics, 317, 76-81 (2006)、Hong et al., Covalently crosslinked chitosan hydrogel: Properties of in vitro degradation and chondrocyte encapsulation, Acta Biomaterialia, 3, 1, 23 - 31 (2007)およびWeng et al., Rheological Characterization of in Situ Crosslinkable Hydrogels Formulated from Oxidized Dextran and N-Carboxyethyl Chitosan, Biomacromolecules, 8, 1109-1115 (2007)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】U.S.特許No. 6,514,522(Domb)
【特許文献2】U.S.特許No. 6,602,952 B1(Bentley et al.)
【特許文献3】U.S.特許No. 7,053,068 B2(Prinz)
【特許文献4】U.S.特許出願公開No. US 2005/0238702 A1(Ishihara et al.)
【特許文献5】カナダ特許出願No. 2 348 842 A1(Bernkop-Schnurch)
【特許文献6】公開PCT出願No. WO 98/31712 A2(B.F. Goodrich Co.)
【非特許文献】
【0004】
【非特許文献1】Aspden et al, J Pharm Sci, 86, 4, 509-513 (1997)
【非特許文献2】Costain et al., Surgery, 121, 3, 314-319 (1997)
【非特許文献3】Mi et al., J Polym Sci, Part A: Polym Chem, 38, 2804-2814 (2000)
【非特許文献4】Mi et al., Polymer, 44, 6521-30 (2003)
【非特許文献5】Roldo et al., European Journal of Pharmaceutics and Biopharmaceutics, 57, 115-121 (2004)
【非特許文献6】Krauland et al., Drug Development And Industrial Pharmacy, 31, 885-893 (2005)
【非特許文献7】Bernkop-Schnurch, Advanced Drug Delivery Reviews, 57, 1569-1582 (2005)
【非特許文献8】Bernkop-Schnurch et al., International journal of Pharmaceutics, 317, 76-81 (2006)
【非特許文献9】Hong et al., Acta Biomaterialia, 3, 1, 23 - 31 (2007)
【非特許文献10】Weng et al., Biomacromolecules, 8, 1109-1115 (2007)
【発明の概要】
【0005】
[0003] キトサンおよびその誘導体は、水溶液中に溶解することができる。そのような溶液をスプレー適用するため(例えば、スプレーノズルまたはニードルを通じて)、低粘性が必要である。いったんスプレー適用された溶液が意図する治療部位に到達すると、水和または希釈が生じる可能性があり、それにより粘性がさらに低下する。従って、スプレー適用された溶液は、所望の治療部位から流れだすか、所望の治療部位により迅速に再吸収されるか、またはそうでなければ早期に所望の治療部位から消失する可能性がある。それらの早期の消失の可能性を減少するために、キトサンを送達前に架橋することができるが、しかし架橋ポリマーは、スプレー適用のためには粘性が高すぎる可能性がある。キトサンをキトサンと架橋剤とを送達後に組み合わせることにより、キトサンをin situで架橋することもできるが、しかし潜在的に有害な架橋剤が使用されないならば、架橋反応を実際の使用のために非常にゆっくりと進行させることができる。
【0006】
[0004] 本発明は、一側面において、部分的に架橋された多糖を含む第1の成分と多糖用のさらなる架橋剤を含む第2の成分との二成分組成物を提供し、ここで多糖またはさらなる架橋剤はキトサンまたはキトサン誘導体を含み、そして組成物は、水和されそして混合された場合に、流体としてスプレーアプリケータを介して送達されて、薄く共形な保護層を体温での実質的に垂直な皮膚表面上に提供することができる。開示された組成物を、望ましくは、乾燥(例えば、凍結乾燥)形状のキトサンを含有する成分とともに複数成分スプレーディスペンサー中にパッケージングし、使用時または使用時近くに水和し、そしてさらなる架橋剤を含有する成分と迅速に混合され、そして生体組織または生体構造上の所望の標的領域に対してスプレー適用される。混合された成分は、混合物がスプレーアプリケータを介して移動する際には流体(すなわち、ゲル化されていない)であり、そしてゲルを実質的に形成することができるか(例えば、標的領域上に付着した時またはその数分後までに)、または標的領域上にある場合に流体のままであってもよい。
【0007】
[0005] 本発明は、別の側面において、体温表面上に保護層を提供し、この層は部分的に架橋された多糖と多糖用のさらなる架橋剤との混合物であって最初は流体である混合物を含み、ここで多糖またはさらなる架橋剤はキトサンまたはキトサン誘導体を含み、そして部分的に架橋された多糖は、さらなる架橋剤と混合される前に部分的に架橋されたものである。この層は、最初は流体の層であってもよく、またはこの層および体温表面を互いに接触させる時点までにゲルを形成する、最初は流体の混合物であってもよい。
【0008】
[0006] 本発明は、別の側面において、以下の工程:
a) 部分的に架橋された多糖溶液を含む第1の成分と多糖用のさらなる架橋剤を含む第2の成分との二成分組成物を混合する工程(ここで、多糖またはさらなる架橋剤がキトサンまたはキトサン誘導体を含む);
b) 生体組織または構造上に向けられる流体としての混合された二成分を適用して、その上に保護層を形成する工程;
を含む、生体組織または構造を治療するための方法を提供する。
【0009】
[0007] 開示された組成物、保護層および方法は、耳、鼻、または喉における粘膜組織、および四肢または脊柱における開口部、陥凹部、通路、または接合部を治療するために特に有用である。好ましい態様において、適用された組成物は、それがスプレー適用された標的領域から、こぼれたり流れたりしない。部分的に架橋された多糖を使用しそしてそれをさらなる架橋剤と混合してかなり粘性なスプレー不能ゲルではなく低粘性または半-粘性の流体を形成することにより、スプレー可能組成物を、流体形式でスプレー装置を介して投薬し、標的領域に適用して流体またはほんの最近にゲル化した保護層を形成し、そして実質的にまたは完全に標的領域上に保持することができる。このアプローチにより、より迅速に硬化するが、しかし潜在的には生体許容性が低い架橋剤を標的領域にて使用することを回避することができる。所望する場合、開始多糖溶液が部分的に架橋されるならば必要とされていたはずの濃度と比較して顕著に低い濃度で、生体許容性が低い架橋剤を使用することもできる。
【図面の簡単な説明】
【0010】
【図1】[0008] 図1は、開示された方法を示すスキーム図である。
【図2】[0009] 図2は、開示された方法において使用することができる、機器の透視図である。
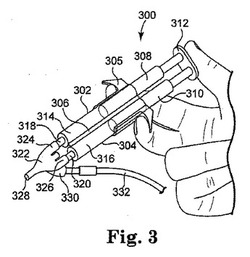
【図3】[0010] 図3は、開示された方法において使用することができるディスペンサーの透視図である。
【発明を実施するための形態】
【0011】
[0011] 参考文献と同様に、図面の様々な図における符号は、同様のエレメントを示す。図面中のエレメントは、同一縮尺というわけではない。
【0012】
発明の詳細な説明
[0012] 以下の詳細な説明は、特定の態様を記述し、そして限定する意味では利用されない。本明細書中の全ての重量、量、および比は、特に記載しない限り重量である。以下に示される用語は、以下の意味を有する。
【0013】
[0013] 用語“接着”は、身体構造または補綴材料を、組織に対してくっつけること、組織と組織とを長期間の間緊密に接触させるようにくっつけること、または通常の開放空間を介して身体構造、補綴材料または組織を互いに結合させる組織を形成すること、をいう。
【0014】
[0014] 用語“抗菌性”は、Staphylococcus aureus、Pseudomonas aeruginosa、Streptococcus pneumonia、Haemophilus influenzae、またはMoraxella catarrhalisの1またはそれ以上の個体群における、90%より多い数値的減少(すなわち、少なくとも1-logオーダーの減少)を引き起こす能力のことをいう。
【0015】
[0015] 用語“付着した”および“接着した”は、細菌性バイオフィルムおよび表面に関連して使用される場合、バイオフィルムが表面上で確立され、そして少なくとも部分的に表面をコーティングするかまたは被覆し、表面からの除去に対していくらか抵抗性を有することを意味する。この関係性の性質が複雑であまりよく理解されていないため、付着または接着についての具体的なメカニズムは、そのような使用により意図されない。
【0016】
[0016] 用語“細菌性バイオフィルム”は、細菌により生成される細胞外多糖(EPS)マトリクス中に含有される群落中の有機体(生物)を含む、表面に対して付着した細菌の群落を意味する。
【0017】
[0017] 用語“生体適合性”は、物質に関連して使用される場合、物質が、生体に対して顕著な有害作用または望まれない作用を何も示さないことを意味する。
【0018】
[0018] 用語“生物分解性”は、物質に関連して使用される場合、物質がin vivoで分解されまたは破壊されて、より小さな化学的種または物理的種を形成することを意味する。そのような分解プロセスは、酵素的、化学的または物理的であってもよい。
【0019】
[0019] 用語“生体吸収性”は、物質に関連して使用される場合、物質が、生体により吸収されることができることを意味する
[0020] 用語“体温”は、哺乳動物に関連して使用される場合、通常の直腸温を意味する(例えば、ヒトの場合には約37℃;ネコ、ウシ、イヌ、またはウマの場合には約38℃;そしてヒツジの場合には約39℃)。
【0020】
[0021] 用語“粘着性”は、液体またはゲルに関連して使用される場合、水平面上に静置される場合の液体またはゲルが(全ての場合に必要というわけではないが)、それ自体にくっつき、そして単一の塊を形成する傾向があることを意味する。
【0021】
[0022] 用語“破砕される”は、粒子材料に関連して使用される場合、カッティング、研磨、微粉砕、粉末化、または外部から印加された力を使用したその他の粒子破砕プロセスにより、粒子が破砕されそしてサイズが小さくなったことを意味する。
【0022】
[0023] 用語“共形(conformal)”は、組織またはその他の身体構造に対して適用される組成物に関連して使用される場合、組成物が、組成物が適用される領域上に実質的な連続層を形成することができることを意味する。
【0023】
[0024] 用語“分離”、“除去”および“崩壊”は、表面に対して付着したかまたは接着した細菌性バイオフィルムに関連して使用される場合、最初には表面上に存在していた少なくとも顕著な量のバイオフィルムが、もはや表面に対して付着したりまたは接着したりしないことを意味する。分離、除去または崩壊の具体的なメカニズムは、その様な使用により意図されない。
【0024】
[0025] 用語“流体”は、物質に関連して使用される場合、物質が、その保管係数(G')よりも大きい損失係数(G'')そして1よりも大きい損失タンジェント(tan δ)を有する液体であることを意味する。
【0025】
[0026] 用語“さらなる架橋剤”は、開示された二成分組成物の第2の成分中で使用され、そして開示された部分的に架橋された多糖を架橋することができる架橋剤を意味する。
【0026】
[0027] 用語“ゲル”は、物質に関連して使用される場合、物質が変形可能なものであり(すなわち、固体ではない)、G''がG'未満でそしてtan δが1未満であることを意味する。
【0027】
[0028] 用語“ゲル化”は、ゲル層の形成に関連して使用される場合、G''がG'と等しくそしてtan δが1に等しい時間を意味する。
【0028】
[0029] 用語“止血”は、血流を止めるかまたは凝固を促進する機器または材料を意味する。
【0029】
[0030] 用語“ハイドロゲル”は、ゲルに関連して使用される場合、ゲルが、親水性でありそして水を含有することを意味する。
【0030】
[0031] 用語“水和”は、機器または物質に関連して使用される場合、機器または物質が、均一に分散された化学的な結合水を含有することを意味する。“完全に水和”された機器または物質は、水和のための追加の水を取り込むことができない。“部分的に水和”された機器または物質は、水和のための追加の水を取り込むことができる。
【0031】
[0032] 用語“内耳”は、三半規管および蝸牛を意味する。
【0032】
[0033] 用語“中耳”は、鼓膜、耳小骨連鎖などの内部構造、乳様突起などの周囲の裏打ち構造および境界構造により規定される領域を意味する。
【0033】
[0034] 用語“粘膜接着性”は、機器または物質に関連して使用される場合、機器または物質が、粘液被覆上皮に対して接着し得ることを意味する。
【0034】
[0035] 用語“鼻腔または副鼻腔”は、鼻および洞内の通常は空気で満たされた通路および室を規定する様々な組織のことをいい、組織には鼻孔(nostrilsまたはnares)、鼻甲介(nasal conchaまたはturbinates)、前頭骨、篩骨、ちょう形骨洞および上顎洞、副鼻腔口および鼻咽頭が含まれる(しかし、これらには限定されない)。
【0035】
[0036] 用語“部分的な架橋剤”は、多糖を架橋して、部分的に架橋された多糖を形成することができる架橋剤を意味する。
【0036】
[0037] 用語“部分的に架橋された”は、多糖に関連して使用された場合、2またはそれ以上の多糖分子が、一緒になって水和された場合には流体であり、そしてin situでさらに架橋することができるオリゴマー成分またはポリマー成分を形成することを意味する。
【0037】
[0038] 用語“多糖”には、多糖の誘導体および修飾された多糖、ならびに個々の多糖種の誘導体および個々の修飾多糖種が含まれる。例えば、用語“カルボキシメチルセルロース”には、カルボキシメチルセルロース誘導体および修飾カルボキシメチルセルロースが含まれ、用語“キトサン”にはキトサン誘導体および修飾キトサンが含まれ、そして用語“でんぷん”には、でんぷん誘導体および修飾でんぷんが含まれる。
【0038】
[0039] 用語“保護”は、組織またはその他の身体構造上の組成物の層に関連して使用される場合、例えば、炎症性応答の調節、食作用、粘膜リモデリング、繊毛再生、または正常機能のその他の完全なまたは部分的な回復などの1またはそれ以上の治癒メカニズムを介して、層が、傷害組織表面、炎症組織表面または外科的修復組織表面を、正常な状態に戻すことを補助することができることを意味する。
【0039】
[0040] 用語“滞留時間”は、組織またはその他の身体構造上の保護ゲル層に関連して使用される場合、ゲル層またはその部分が巨視的観察のもとin vivoで依然としてその場に存在している期間を意味する。
【0040】
[0041] 用語“溶媒”は、溶質がその中で溶解されるかまたは懸濁される溶媒またはその他の担体を含有する、溶液または分散系を形成することを意味する。
【0041】
[0042] 用語“実質的にコラーゲン不含”は、牛海綿状脳症(BSE)または変異型クロイツフェルト・ヤコブ病(vCJD)の伝播またはそれへの感染の潜在的リスクをもたらさないように、実質的に低量のコラーゲンを含有することを意味する。
【0042】
[0043] 用語“実質的に垂直”は、皮膚表面に関連して使用される場合、水平に対してその方向が90±10°である表面のことをいう。この言い回しは、実質的に垂直な表面に対してのみまたは皮膚表面に対してのみ、開示された組成物を適用することを示唆することを意味していない。しかしながら、出願人は、複雑な機器またはその他の測定装置または測定技術を必要とすることなく、実質的に垂直な皮膚表面を使用して、スプレー適用のあいだ、そしてスプレー適用の直後に、開示された組成物の特定のレオロジー特性を評価することができることを明らかにした。
【0043】
[0044] 用語“薄い”は、組織またはその他の身体構造上の保護層に関連して使用される場合、約2ミリメートル未満の平均厚を有することを意味する。
【0044】
[0045] 図1に関して、開示された方法は、例えば、患者の鼻腔または副鼻腔100中で行うことができ、鼻孔114a、114bを介してアクセスすることができる上顎洞110a、110bおよび前頭洞112a、112bが含まれる。鼻孔114a、114bを含めて患者の外的特徴が、点線で示されることに注目すべきである。患者が、例えば、慢性鼻副鼻腔炎を患っている場合、上顎洞110aの表面と関連する治療部位116などの1またはそれ以上の治療部位を、医学的にまたは必要であれば外科的に対処することができる。治療部位116には、上顎洞110aの線毛上皮が含まれ、そしてバイオフィルムが含まれていてもよい(図1中には示さず)。治療部位は、天然の組織である必要はなく、そして代わりに、細菌性バイオフィルムの層により少なくとも部分的に被覆されていてもよい、洞充填(sinus packing)またはステントなどの人工的構造であってもよい(図1中には示さず)。存在する場合、バイオフィルムは、病巣洗浄管(irrigation duct)(図1においては隠されている)を含有する関節結合可能な送達チューブ122とともに、イントロデューサー122の遠位端にてノズル124へと流れそして従って治療部位へと流れることができる溶媒システムを介して、イントロデューサー120を使用して、治療部位116に対して適用することができる溶媒システム(例えば、U.S.特許出願公開No. US 2007/0264310 A1に記載される溶媒システム)を使用して除去することができる。溶媒システムおよびバイオフィルムの残留物を、吸引管(図1においては隠されている)を介して、治療部位から除去することができる。部分的に架橋された多糖とさらなる架橋剤とを含有する開示された組成物を、同様に、イントロデューサー120中で同一のまたは異なる病巣洗浄管(irrigation duct)を使用して、治療部位にて適用することができる。当業者は、開示された組成物(そして必要であれば溶媒システム)を、その他の方法またはその他の装置を使用して、治療部位に対して適用することができることを理解するであろう。例示的なその他の方法には、動力スプレーまたはその他のスプレー塗布、洗浄(lavage)、ミスト、モッピング、ウィッキング、ドリッピング、注入、そして穿孔(trephination)が含まれ、そして例示的なその他の装置には、スプレーノズル(例えば、単一成分または複数成分のスプレーノズル)およびシリンジ(例えば、単一バレルまたは複数バレルのガラスまたはプラスチックシリンジおよびバルブシリンジ)が含まれる。治療方法を、身体のその他の部分において行うこともできる。治療方法は、組織(例えば、粘膜組織)の治療や、耳、喉、四肢または脊柱中またはその近傍の構造の治療を含む、血管外適用において、特に有用性を有する。
【0045】
[0046] 図2は、開示された治療方法において使用することができる例示的な機器200を示す。機器200には、ハンドル202およびイントロデューサー222が含まれ、その遠位端224(全般を参照)には、スプレーノズル、病巣洗浄管(irrigation duct)および吸引管が含まれるが含まれる(図2においては別々に番号を付けていない)。機器200には、場合によりさらに、第1のアクチュエータアッセンブリ226(全般を参照)および第2のアクチュエータアッセンブリ228(全般を参照)が含まれていてもよい。第1のアクチュエータアッセンブリ226中の調節ホイール230は、イントロデューサー222の曲げをもたらすようにユーザにより機能させることができ、そして第2のアクチュエータアッセンブリ228中の調節ホイール232は、イントロデューサー222の遠位端224からスプレーされる液体のイントロデューサー222に対する運動または回転をもたらすようにユーザーにより機能させることができる。ハンドル202は、一般に、様々な機器200のその他の成分のためのハウジングとして、そしてイントロデューサー222のための支持体として、機能する。ハンドル202は、ピストルグリップ様形状を有していてもよく、グリップ部分234およびノーズ236を規定する。グリップ部分234は、ユーザーの手により握られるようなサイズおよび形状を有し、一方でノーズ236は、イントロデューサー222に結合するように適合される。トリガ238および関連するセンサおよびバルブ(図2においては示されていない)を使用して、開示された再水和ゲル(そして使用する場合、開示された溶媒システム)の、洗浄チューブ(irrigation tube)240を通じた流れ、そしてそれ故に遠位端224中そして所望の治療部位上でのスプレーノズルを介した流れを調節することができる。トリガ238を、多方向性の可動域とともに提供することができ、そして1またはそれ以上の追加のセンサおよびバルブ(図2中には示されない)と組み合わせて、遠位端224での吸引管を介した、そしてそれ故吸引チューブ242を通した、溶媒システム、バイオフィルム残留物およびその他のデブリの治療部位からの除去を、調節することができる。トリガ238を使用して、洗浄チューブ(irrigation tube)240中の別個の管腔を通じて、そしてそれ故に遠位端224中そして所望の治療部位上でのスプレーノズルを介して、開示された再水和ゲルの流れを調節することもできる。
【0046】
[0047] 図3は、開示された方法において使用することができる例示的なディスペンサー300を示す。ディスペンサー300には、グリップ305により受容され、中央部スパイン306で組み合わされ、そしてピストン型のプランジャー308および310をそれぞれが含有する、一対のシリンジ本体302および304が含まれる。プランジャー308および310は、プランジャー308および310を同時に作動させることができる共通の押し込みフランジ312により組み合わされている。シリンジ本体302および304は、それぞれ、部分的に架橋された多糖314およびさらなる架橋剤316を含有する。多糖314は、通常は、輸送および保存のために乾燥形状、例えば、凍結乾燥形状、で提供され、そして使用時に水和される。さらなる架橋剤316を(選択されたさらなる架橋剤およびその保存安定性に依存するが)、輸送および保存のために乾燥形状または水和された形状で提供することができ、そして乾燥形状で提供される場合には使用時に水和する。多糖314またはさらなる架橋剤316が水和される場合、このことは、例えば、水またはその他の適切な水性溶媒(例えば、リン酸緩衝化塩類溶液、または“PBS”)をシリンジポート318および320の一方または両方に引き込みながらプランジャー308および310を引き出すことにより、そしてその後シリンジ本体302および304の含有物を適切に水和させることまたはその含有物に適切に水和を引き起こすことより、行うことができる。水またはその他の適切な水性溶媒は、好都合なことに、同様のコンパニオンシリンジ(図3には示されていない)中に提供されていてもよく、この場合のシリンジポートは、適切なチューブまたはその他の付属品を使用して、ポート318および320と流体連通してそれぞれが組み合わされている。ディスペンサー300およびコンパニオンシリンジの含有物は、水和が完了するまでそれぞれの押し込みフランジを交互に押し込んだり引き出したりして往復して通過させることができる。
【0047】
[0048] ディスペンサー300には、ガス補助チップ322も含まれていてもよく、ここには流体入り口324および326がそれぞれシリンジポート318および320と結合していてもよく、そして流体出口328を使用して、開示された組成物のスプレーを所望の治療部位に向けることができ、または適切な伸長スプレーヘッドを附属してもよい。ガス入り口330は、チューブ332を介して適切なガス(例えば、窒素)を供給され、押し込みフランジ312が押し下げられる場合、適切な流体スプレーパターンの形成を補助することができる。図3において示されるものなどの様々なディスペンサーは、市販されているものであり、Micromedics, Inc.由来のFIBRIJETTM SA-3652およびSA-6105ガス補助アプリケータキットやBaxter International Inc.由来のDUPLOJECTTMアプリケータおよびTISSOMATTM圧力調節装置が含まれる。
【0048】
[0049] 適用された組成物は、治療部位(例えば、鼻腔または副鼻腔、または四肢または脊柱の部分における開口部、陥凹部、通路または接合部)を満たすことができ、その場合、開示された保護層は、非常に厚くてもよく、層を通じて様々な厚さを有していてもよく、そして空気またはその他の付近のガスに曝露されない。開示された組成物は、薄いフィルムまたはその他の共形コーティングとして適用することもでき、その場合、開示された保護層は、相対的に薄く、そして空気またはその他の付近のガスに曝露され、そして層を通じて実質的に均質な厚さを有していてもよい。保護層は流体であり、そしてスプレー適用の時点ではゲルではなく、そして好ましくは治療部位からこぼれたり流れたりしない。保護層は、その後ゲルを形成してもよいが、しかしそうなることが必要というわけではない。保護層は、望ましくは、治療部位にて粘膜組織またはその他の天然の組織(例えば、軟骨または骨)に接着し、そして層の天然の分解または吸収が、例えば、1日〜数日(例えば、2、3または4日)、数週間または数ヶ月間のin vivoでの滞留時間の後に生じるまで、分離またはその他の崩壊に耐性である。その一方で、細菌の再定着または再感染を、顕著に減少または予防することができ、そして治癒の改善そして繊毛再生の改善が生じうる。保護層は、細菌接着忌避(repellence)、抗-感染性特性、局所免疫修飾、組織保護、疼痛または出血の減少または除去、炎症の軽減、繊毛再生のための環境の最適化、重大な生体構造(critical anatomy)に対する接着の減少、などを含む(しかしこれらには限定されない)、様々な治療上の利点を提供することができる。これらの利点は、a)殺菌、b)細菌定着の阻害、c)細菌の組織への接着性の阻害、d)組織の病的状態(morbidity)または膿瘍形成の減少、e)疾患再発の減少または予防(例えば、具体的には、細菌毒素およびEPSに関連する慢性炎症の減少)、f)例えば、血小板凝集を促進する湿潤創傷の維持により、または過剰なざらつきの形成を伴わない乾燥創傷の閉合による、治癒のあいだの組織のコーティングおよび保護、g)止血、h)粘膜の繊毛再生用の環境の最適化、i)繊毛の成長または再生の高速化、そしてj)(1または複数の)治療剤の治療部位への送達、を含む様々なメカニズムのために生じる可能性がある。望ましくは、保護層は、接着していない部分における繊毛を天然の律動的繊毛運動(すなわち、繊毛拍動)を自由に受けるようにしたまま粘膜の部分に接着することができ、所望される場合には抗菌剤または追加の治療剤も送達することができ、そして望ましくは細菌が治療部位に接着することを妨害しまたは予防することができる。
【0049】
[0050] 様々な多糖またはその誘導体を、開示された組成物、保護層および方法において使用することができる。例示的な多糖には、アルギネート、カラギーナン、セルロース(例えば、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、メチルセルロースおよびヒドロキシプロピルメチルセルロース)、キチン、キトサン、コンドロイチン硫酸、デキストラン、ガラクトマンナン、グリコーゲン、ヒアルロン酸、でんぷん、およびその他の生体適合性多糖、およびこれらの混合物が含まれる。キトサン(塩およびその他のキトサン誘導体を含む)は、特に好ましい多糖である。例示的なキトサンおよびそれらの塩(クエン酸塩、硝酸塩、乳酸塩、リン酸塩、塩化物塩、およびグルタミン酸塩を含む)を、KitoZyme S.A.、Fluka Chemie AG、FMC BioPolymer ASのNovaMatrixユニット、Heppe Medical、およびSigma-Aldrich Co.含む様々な商業的供給源から得ることができる。キトサンは、加水分解によりキチン(ポリ-N-アセチル-D-グルコサミン)の脱アセチル化を通じてN-アセチル基を除去することにより、合成することもできる。得られたオリゴマーまたはポリマーは、複数の繰り返しユニット(例えば、約2〜約10000の繰り返しユニット、約60〜約600の繰り返しユニット、または選択された最終用途のための所望され得るその他の量)を有する。その繰り返しユニットのいくつかまたは全ては脱アセチル化アミノ基を含有し(例えば、全繰り返しユニットの約30〜約100%または約60〜約100%)、残りの繰り返しユニットは(もし存在する場合には)アセチル化アミノ基を含有する。キトサンは、グルコサミンモノマーから構成されるポリマーであり、そして様々な数平均分子量(例えば、約400〜約2000 kDa、約10〜約500 kDa、または約10〜約100 kDa)を有してもよい。キトサンは、例えば、約50 kDa未満の数平均分子量を有する超低分子量材料、約50〜約200 kDaの数平均分子量を有する低分子量材料、約200〜約500 kDaの数平均分子量を有する中間分子量材料、または約500 kDaを越える数平均分子量を有する高分子量材料であってもよい。キトサン誘導体、例えば、1またはそれ以上のヒドロキシル基またはアミノ基が誘導体の可溶性または粘膜接着特性を変化させることを目的として修飾された誘導体、も使用することができる。例示的な誘導体には、チオール化キトサン、およびカルボキシメチルキトサン、アセチル化キトサン、アルキル化キトサンまたはスルホン酸化キトサン(例えば、O-アルキルエーテル、O-アシルエステル、カチオン化トリメチルキトサンおよびポリエチレングリコールで修飾されたキトサン)などの非-チオール化キトサン誘導体が含まれる。キトサン誘導体は、様々な供給源から得ることができる。例えば、チオール化キトサンは、ThioMatrix Forschungs Beratungs GmbHおよびMucobiomer Biotechnologische Forschungs-und Entwicklungs GmbHから得ることができ、または例えば、上述した公開PCT出願No. WO 03/020771 A1中に記載されるかまたは上述したRoldo et al.の文献、Krauland et al.の文献、Bernkop-Schnurch and Bernkop-Schnurch et al.の文献に記載される様に、キトサンと適切なチオール化反応剤との反応により調製することができる。追加の好ましい多糖には、上述したものなどのセルロース、キチン、コンドロイチン硫酸、デキストラン、グリコーゲン、ヒアルロン酸、およびでんぷんが含まれる。
【0050】
[0051] 多糖は、パッケージングされる前に部分的に架橋され、そして最終消費者に対して発送されまたは提供される。部分的架橋は、様々な方法で行うことができる。例えば、部分的架橋を、自由流動性の水和可能な多糖粒子の集合体を個別に部分的に架橋して、自由流動性の水和可能な部分的に架橋された多糖粒子の集合体を形成するデヒドロサーマル架橋プロセスを使用して行うことができる。デヒドロサーマル架橋は、実質的に、個体状態の架橋プロセスであり、この場合、材料を熱および減圧の一方または両方に曝露して、初期脱水を生じさせ、その後追加水の喪失および分子間縮合プロセスまたは分子内縮合プロセスを介した架橋結合の形成を生じさせる。外部架橋剤を追加することは必要なく、そして開示された粒子の場合、そのような架橋剤の存在は、それらの自由流動性の性質をそのままにすることをより困難にする可能性がある。デヒドロサーマル架橋は、望ましくは、架橋されるべき生成物を約1%未満の水分含量に対して水和すること、そして十分な追加的な加熱または減圧を使用して所望の架橋密度を達成すること、が関連する。例えば、減圧の非存在下にて、約80℃より高い温度、約90℃より高い温度、約100℃より高い温度または約120℃より高い温度を使用することができ、より高い温度が一般的にはより迅速な反応速度をもたらす。多糖は、望ましくは、褐色化を生じるのに十分なほどの程度には加熱せず、そして従って160℃未満の温度または150℃未満の温度が好ましい。かなり長い加熱時間を取る場合、例えば、140〜150℃で約40時間+ウォームアップおよびクールダウンのために全部で約20時間のあいだ、周囲圧力であることが必要である可能性がある。減圧を使用する場合、より低い温度を使用することができ、そして少なくとも約1 mm Hgの減圧、および好ましくは少なくとも約10-3 mm Hgの減圧が好ましい。このように、温度が高くなればなるほど、必要とされる減圧または所定の架橋密度に達するために必要な加熱時間は低くなり、そして逆も成り立つ。したがって、少なくとも約10時間の時間、少なくとも約20時間の時間、少なくとも約30時間の時間または約40〜約60時間の時間、および約2週間未満または約1週間未満の時間(ウォームアップおよびクールダウンのために必要とされる時間を計測せず)を使用することができるが、正確な加熱時間または加熱時間の範囲を特定することは困難である。多くの事例において、例えば、デヒドロサーマル的に架橋された粒子を水和し(以下にさらに詳細に説明するが、さらなる架橋剤を含有する開示された第2の成分を添加することなく)、そして得られた集合体を実施例1において示したように体温で実質的に垂直な表面に対してスプレーすることにより、加熱時間、温度および圧力を経験的に決定することで十分である。集合体が粘度が高すぎてスプレー可能ではない場合、部分的架橋の程度を低下させなければならない。集合体がスプレー可能ではあるがこぼれたり流れたりしない場合、部分的架橋の程度はそのままにしてもよく、または所望の場合にはさらに部分的架橋の程度を低下させてもよい。器具類を使用して、集合体についてのレオロジー特性を測定することもでき、例えば、流体またはゲルが得られるかどうかを決定することができ、部分的な架橋の程度を低下させて、早期のゲル形成を防止しまたは阻害する。
【0051】
[0052] 部分的な架橋を、様々な外部架橋剤を使用して行うこともでき、それはそのように使用される場合、部分的架橋剤として言及することができる。例示的な部分的架橋剤には、ゲニピン、酸化多糖(酸化でんぷん、またはグルタルアルデヒドなど)が含まれ、部分的にその良好な生体適合性のおかげで、そしてそのいくらかゆっくりとした架橋速度にも関わらず、ゲニピンが好ましい。部分的架橋剤の量は、選択された多糖および部分的架橋剤に依存して大幅に変更されてもよい。多数の事例において、部分的架橋剤の量を経験的に、例えば、選択された量の多糖および部分的架橋剤を一緒に反応させ、得られた生成物を必要ならば水和し、そして得られた集合体を体温で実質的に垂直な表面に対して上述した様にスプレーすることにより、決定することで十分である。
【0052】
[0053] 酸化多糖を部分的架橋剤として使用する場合、多糖の部分的(過度には完了しない)架橋を促進することができるアルデヒド基を提供するためにちょうど十分な程度にまで、多糖を酸化することができる。多糖は、所望される場合、異なる程度(例えば、より高い程度)にまで酸化することができ、そして多糖量を調節(例えば、増加)することができる。好ましくは、部分的架橋反応は、多糖および部分的架橋剤を混合した後、数日または数時間以内(例えば、2日未満、1日未満、12時間未満、または8時間未満)に実質的に完了する。アルギネート、カラギーナン、セルロース(例えば、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、メチルセルロース、およびヒドロキシプロピルメチルセルロース)、キチン、コンドロイチン硫酸、デキストラン、ガラクトマンナン、グリコーゲン、ヒアルロン酸、でんぷん、および酸化をされることができるその他の生体適合性多糖を含め、様々な酸化多糖を使用することができる。酸化多糖(酸化セルロース(例えば、上述したもの)、キチン、コンドロイチン硫酸、デキストラン、グリコーゲン、ヒアルロン酸、およびでんぷんなど)が、特に好ましい。酸化多糖を調製するための代表的な酸化剤または酸化技術には、a)過ヨウ素酸ナトリウム、b)ジ-tert-アルキルニトロキシル触媒の存在下での次亜塩素酸イオン、c)例えば、ルテニウムを使用した金属触媒酸化、d)例えばハロカーボン中の例えば二酸化窒素を使用する無水酸化、e)でんぷん、グアーおよびその他の多糖の酵素的酸化または化学-酵素的酸化、f)ジメチルスルホキシド(DMSO)またはジアセトキシヨードベンゼンなどの穏やかな酸化剤を用いた2,2,6,6-テトラメチルピペリジン-1-オキシル(TEMPO)触媒酸化、そして当業者に知られうるその他の酸化剤および酸化技術、を使用することが含まれる。選択された酸化剤または酸化技術に依存して、様々な程度の酸化、様々な程度のポリマー化、そして酸化部位を使用することができる。例えば、酸化は、第1のヒドロキシル基(例えば、グルカンの無水グルコース単位における6-ヒドロキシル基)に向けることができ、保存された環状構造を有するカルボキシル-多糖が得られる。酸化もまた、単糖環に存在する近接のジオール基(例えば、無水グルコース単位のC2-C3部位)に向けることができ、単糖単位の切断そしてジアルデヒド官能基の生成を生じる。そのような酸化多糖のジアルデヒド含量は、例えば、利用可能な酸化部位の2%〜ほぼ100%、例えば、30%より多く、または50%よりも多く、の酸化の程度の範囲であってもよい。酸化多糖は、その他の官能基、例えば、ヒドロキシアルキル基、カチオン基、カルボキシル基、そしてその他の酸性基を含有してもよい。一般化のため、多糖酸化の程度が上昇するため、低下した量の酸化多糖を部分的架橋剤として使用することができる。
【0053】
[0054] 2種またはそれ以上の粒子多糖の混合物を含有する組成物を使用する場合、1またはそれ以上の多糖粒子を、部分的に架橋することができる。このことにより、流体挙動、スプレー特性、最終的なゲル化時間(存在する場合)、そして設置後の分解速度などの特性をカスタマイズすることが可能になる。所望される場合、1またはそれ以上の部分的に架橋された多糖のブレンドを、追加の部分的架橋反応、例えば、デヒドロサーマル架橋反応、に供することができる。製造部署において、すぐに使える形態またはすぐに使える形態に近い形態に混合物をパッケージングすることと比較して通常は不便なことではあるものの、粒子を別個にしたままにすることもでき、そしてその後に最終使用者により混合されてもよい。
【0054】
[0055] 多糖は、望ましくは、乾燥粒子形状で提供され、例えば、平均粒子径が約1 mm未満、約100μm未満、約1〜約80μm、または1μm未満である自由流動性の粒子として、提供される。そのようにすることは、長期の保存の間の分解を減少させることの助けになる可能性がある。
【0055】
[0056] 多糖は、通常は、さらなる架橋剤と混合しそして得られた流体混合物を治療部位に設置する直前に、水和する。水和は、多糖を水またはいずれかその他の所望の有効成分を含有する水溶液中に溶解することにより、行うことができる。例えば、通常の塩類溶液およびPBSが好ましく、そして容易に利用可能な水和溶液である。水和溶液中の多糖の量は、多糖の分子量に部分的に依存していてもよく、そして例えば、溶液量の約1〜約20%、約1〜約10%または約1〜約5%であってもよい。同時係属中のU.S.仮出願シリアルNo. 61/047,580(2008年4月24日出願)(US公開出願US 2009/0291911 A1)は、粒子を生体適合性の水-混和性極性分散剤中に分散し、そして分散物を粒子用の十分な水性溶媒と組み合わせてそれらを粘着性のハイドロゲルに変換することにより、デヒドロサーマル的に架橋された多糖粒子を再水和するための好ましい技術を記載する。この技術は、ハイドロゲルではなく流体が水和の後に形成するために十分な程度で部分的に架橋された多糖粒子を使用して、本発明において使用するために適合させてもよい。いくらかの乾燥粉末材料は水と混合された場合に凝集物を形成する傾向があるため、多糖粒子を水和して滑らかな流体混合物を得ることは難しい可能性がある。しかしながら、凝集物の形成は、多糖粒子を生体適合性の水-混和性極性分散剤中に分散することにより、その後分散物を十分な水性粒子溶媒(aqueous particle solvent)(すなわち、粒子用の水-ベースの溶媒)と混合して粒子を凝集物-不含の流体溶液へと変換することにより、回避することができる。分散剤は、粒子用には十分に弱い(poor)溶媒であり、そのため粒子と分散剤との混合物は、真の溶液を形成しない。そのような分散の場合、粒子は、望ましくは、十分に小さく、そのため、例えば、粒子と分散剤とを一緒に攪拌することによりそれらを攪拌した後、分散は安定でありまたは準安定である(例えば、コロイド分散または適度に持続性の懸濁物)。理論に縛られることなく、水性粒子溶媒(aqueous particle solvent)の添加は、それぞれの懸濁された粒子の表面で、周囲の分散剤の水性粒子溶媒(aqueous particle solvent)層への溶解を介して、水和をほぼ同時的に生じさせると考えられており、それにより水和されなかった多糖の可視的な凝集物を形成することなく流体溶液の形成を可能にする。このように、乾燥粉末にされた多糖が通常はそのようにはならないにもかかわらず、分散された多糖は、水または水溶液と組み合わされて、凝集物-不含の流体溶液を形成することができる。例えば、図3との関連で記載したように2本のシリンジのあいだで通過させること、穏やかに攪拌し、またはその他の単純な混合技術を使用して、そして機械的なスターラーを使用する必要なく、開示された混合方法を使用して、満足のいく凝集物-不含の流体を調製することができる。開示された混合方法は、粉末多糖を水または酸性化水とともに単純に混合したのでは得ることができなかった、非常に濃縮された流体溶液の形成を可能にすることができる。多糖は粉末状にされたものであってもよいが、望ましくは粉末状にされていないものである。
【0056】
[0057] 分散剤および水性粒子溶媒(aqueous particle solvent)の選択は、選択された多糖に依存する可能性がある。純水における可溶性が相対的に低いが、水を酸性化すると可溶性になるキトサンなどの多糖について、脱イオン水を分散剤として使用することができ、そして酸性化水を水性粒子溶媒(aqueous particle solvent)として使用することができる。分散剤と水性溶媒のその他の組合せも使用することができる。例えば、エタノール、イソプロパノールまたはアセトンを、多数の多糖(キトサンおよびキトサンを含有するブレンドを含む)についての分散剤として使用することができ、そして脱イオン水、通常の塩類溶液またはPBSを水性粒子溶媒(aqueous particle solvent)として使用することができる。
【0057】
[0058] 様々なさらなる架橋剤を開示された組成物の第2の成分中、そして開示された保護層および方法において、使用することができる。さらなる架橋剤は、望ましくは、比較的即効性のものであり、それにより二成分が混合されそして体温で垂直な表面にスプレーされる場合にこぼれたりまたは流れたりしない二成分組成物を提供する。例示的なさらなる架橋剤には、酸化多糖、キトサンおよびグルタルアルデヒドが含まれ、酸化多糖が好ましい。酸化多糖は、潜在的に生体許容性が低い低分子量のアルデヒドを使用することを回避しつつ、特に迅速な架橋を提供する様である。酸化多糖中のアルデヒド基もまた、粘膜接着を亢進することができる。酸化多糖は、生物分解性、生体吸収性、薬物送達特性、または止血特性の改善または良好な調節を含む、追加の利点を提供することができる。部分的架橋剤との関連で上述したものを含め、様々な酸化多糖を使用することができる。酸化セルロース、キチン、コンドロイチン硫酸、デキストラン、グリコーゲン、ヒアルロン酸およびでんぷんなどの酸化多糖は、特に好ましい。酸化多糖をさらなる架橋剤として使用する場合、多糖は、望ましくは、多糖および酸化多糖が水性溶液中で組み合わされた場合に部分的に架橋された多糖の迅速なさらなる架橋を促進することができるアルデヒド基を提供するために十分な程度で、酸化される。代表的な酸化剤または酸化技術および代表的な酸化の程度には、部分的架橋剤との関連で上述したものが含まれる。
【0058】
[0059] 部分的架橋剤およびさらなる架橋剤は、同一のものであっても別個のものであってもよく、例えば、少量の部分的架橋剤を使用して部分的に架橋された多糖を調製し、その後多量の同一の架橋剤をさらなる架橋剤として、開示された二成分組成物中で使用することができる。例えば、グルタルアルデヒドまたはキトサンを、部分的架橋剤およびさらなる架橋剤の両方として使用することができる。
【0059】
[0060] さらなる架橋剤は、望ましくは、水またはその他の適切な溶媒中に使用前に溶解する。推奨されるさらなる架橋剤のタイプおよび量は、典型的には、さらなる架橋剤分子量、部分的に架橋された多糖のタイプおよび量、そしてその中の架橋のための残りの部位の利用可能性に依存する。さらなる架橋剤の量は、例えば、開示された第2の成分の約1〜約20%、約1〜約10%または約1〜約5%であってもよい。
【0060】
[0061] 部分的に架橋された多糖およびさらなる架橋剤のタイプおよび量の選択は、望ましくは、第1の成分および第2の成分を混合しそして得られた混合物を生体組織または構造上にスプレーしまたはそれ以外の方法で向けるために必要とされる可能性がある可能性のある最小時間および最大時間を考慮に入れる。早期のゲル形成を、適切な容器中に水(例えば、100 mL)を場合により適切な架橋クエンチャー(例えば、グルコサミン)と混合させて入れ、第1の成分と第2の成分との新鮮な混合物および選択的な水-可溶性比色色素(例えば、上述した様な色素)を調製し、そしてその混合物を水表面上に短い空中距離(例えば、数mm)を超えて下方に迅速にスプレーし、そしてゲル粒子が形成されるかどうかまたは色素痕跡が水中で可視化できるかどうかを観察することにより、推定することができる。
【0061】
[0062] 多糖またはさらなる架橋剤は、キトサンまたはキトサン誘導体を含有する。第1の成分が部分的に架橋されたキトサンを含有しそして第2の成分が酸化キトサンを含有する二成分組成物もまた、調製することができる。
【0062】
[0063] 開示された組成物は、望ましくは、実質的にコラーゲンを含まない。好ましくは、組成物は、十分にコラーゲン不含(例えば、コラーゲンを何も含まない)なものであり、ヒトにおいて制限なしに世界中で販売可能になる。
【0063】
[0064] 開示された組成物は、典型的には滅菌に供され、そして最終消費者への出荷前に適切なシール化パッケージング(例えば、複数成分シリンジ、(1または複数の)バイアル、または適切な材料からなるマルチチャンバポーチ)中におかれる。追加的な特性カスタマイズを、γ線照射処理または電子線(E-Beam)処理等の滅菌手順を使用して制御された鎖切断を生じさせることにより、行うことができる。同日に出願された同時係属中PCT出願公開No.WO2009/132229 A2に記載される様に、低温イオン化放射線滅菌(例えば、低温E-Beam滅菌)を使用して、鎖切断の程度を制限することができる。滅菌するかどうかに関わらず、通常は、部分的に架橋された多糖を含有する第1の成分を、使用直前まで、さらなる架橋剤を含有する第2の成分から分離し続ける。
【0064】
[0065] 部分的に架橋された多糖およびさらなる架橋剤は、例えば、約20:1〜約1:20、約10:1〜約1:10、約5:1〜約1:10、約3:1〜約1:5、または約20:1のモル比で組み合わせることができる。いったん第1の成分と第2の成分とが混合されたら、好ましくはさらなる架橋反応が混合の開始後数分以内(例えば、5分未満、3分未満、2分未満、または1分未満)に実質的に完了し、望ましくは体温で垂直な皮膚表面上の標的領域からこぼれたり流れたりしない、最初は流体である保護層が得られる。リン酸イオンの存在は、架橋反応を促進するようである。部分的に架橋された多糖とさらなる架橋剤の一方または両方のための溶媒としてPBSを使用することにより、ホスフェートを提供することができる。
【0065】
[0066] 開示された組成物および保護層には、場合により、水和の前または後の様々なその他の有効成分が含まれていてもよい。例示的なその他の有効成分には、非水性溶媒、酸、塩基、緩衝化剤、抗菌剤、治療剤、およびその他のアジュバントが含まれる。酸、塩基または緩衝化剤は、例えば、ヒト組織と接触するために適切なpH、例えば、4.5よりも高いpH、ほぼ中性のpH、または8.5未満のpH、で組成物、保護層、またはその両方を維持することができる。例示的な緩衝化剤には、バルビタールナトリウム(barbitone sodium)、グリシンアミド、グリシン、塩化カリウム、リン酸カリウム、炭酸水素カリウムフタレート、酢酸ナトリウム、クエン酸ナトリウム、リン酸ナトリウム、およびそれらの共役酸が含まれる。
【0066】
[0067] 開示された組成物は、望ましくは、別個の抗菌剤を追加する必要なしに、もともと抗菌性である。抗菌活性は、組成物中のキトサンまたはキトサン誘導体の比率(より高い比率は、より高い抗菌性活性をもたらす傾向がある)により、そして利用可能なキトサンアミン基の数により、影響される可能性がある。従って、少数の利用可能なアミノ水素原子を含有するキトサン基(例えば、上述したWeng et al.の論文において所望されるN-カルボキシエチル誘導体)を使用することは、禁忌を示す可能性がある。いずれにしても、所望の場合、別個の抗菌剤を使用することができる。そのような抗菌剤の有用なリストは、例えば、上述したU.S.特許出願公開No. US 2007/0264310 A1中に見出すことができる。
【0067】
[0068] 開示された組成物中で使用することができる例示的な治療剤には、鎮痛薬、抗-コリン作動薬、抗-真菌剤、抗ヒスタミン剤、ステロイド性または非ステロイド性抗-炎症剤、抗-寄生虫剤、抗ウイルス剤、生物静力学的組成物、化学療法剤/抗腫瘍剤、サイトカイン、充血除去剤、止血剤(例えば、トロンビン)、免疫抑制剤、粘液溶解剤、核酸、ペプチド、タンパク質、ステロイド、血管収縮剤、ビタミン、これらの組合せ、そして当業者に知られているその他の治療用材料を含む、目的とする治療部位での使用のために適したいずれかの材料が含まれる。そのような治療剤の有用なリストは、例えば、上述のU.S.特許出願公開No. US 2007/0264310 A1中に見出すことができる。
【0068】
[0069] 開示された組成物中に含ませることができるその他のアジュバントには、染料、色素、またはその他の着色剤(例えば、FD & C Red No. 3、FD & C Red No. 20、FD & C Yellow No. 6、FD & C Blue No.2、D & C Green No. 5、D & C Orange No. 4、D & C Red No. 8、キャラメル、二酸化チタン、果物または野菜の着色剤(ビート粉末、またはβ-カロテン、ターメリック、パプリカ)、および当業者に知られているその他の材料);指示薬;アニス油、サクラ、桂皮油、柑橘油(例えば、レモン油、ライム油またはオレンジ油)、ココア、ユーカリ、ハーブ芳香剤(例えば、丁子油、セージ油またはカッシア油)、ラクトース、マルトース、メントール、ペパーミント油、サッカリン、シクラミン酸ナトリウム、スペアミント油、ソルビトール、スクロース、バニリン、冬緑油、キシリトール、およびこれらの混合物を含む(しかしこれらには限定されない)香味剤または甘味剤;抗酸化剤;消泡剤;および増粘剤およびチキソトロープ(thixotropes)を含むレオロジー修正剤;が含まれる。開示された組成物は、望ましくは、粘膜組織または構造(例えば、鼻腔または副鼻腔中の組織)に潜在的に悪影響を与える可能性がある成分を含有しない。
【0069】
[0070] 組織から水を除去すること、例えば、ポリープまたは浮腫性組織から液体を除去すること、が好ましい事例において、高張性剤を、開示された組成物中で使用することができる。例示的な高張性剤には、フロセミド、塩化ナトリウムゲルおよび組織から水を引き出すその他の塩調製物または粘膜層の浸透圧容量を直接的または間接的に変化させるその他の物質が含まれる。治療剤の持続性放出または遅延放出が望ましい場合、離型剤修正剤が含まれていてもよい。
【0070】
[0071] 望ましくは、開示された組成物を、細菌性バイオフィルムを崩壊しそしてその回復を阻止する複数工程の処置手順の一部として使用することができる。例えば、洗浄/崩壊、殺傷、通気、保護/コーティング、そして回復(Healing)と幅広く分類することができる一連の工程を行うことができる。これらの様々な工程を、例えば殺傷工程および通気工程が行われる順番を逆転させることができるなどの様々な順列で、行うことができる。図1および図2に関連して検討する様に、洗浄/崩壊工程を、溶媒システムを投与することにより行うことができる。殺傷工程を、適切な抗菌剤を治療部位に適用することにより、行うことができる。このことは、例えば、別個に適用される組成物として溶媒システム中において、または溶媒システム中そして別個に適用される組成物中の両方において、抗菌剤を含ませることにより、達成することができる。抗菌剤を、手術後に適用しまたは投与することもできる。通気工程を、開口している閉塞された通路または部分的に閉塞された通路(例えば、鼻適用のための洞または洞小孔)により治療される組織に対して空気通路を提供しまたは空気通路を改良することにより、行うことができる。このことは、例えば、閉塞組織構造を外科的に除去することにより、またはそのような構造を手作業により排除することにより、達成することができる。保護/コーティング工程を、このように処理された組織の少なくとも部分を上述した部分的に架橋された多糖およびさらなる架橋剤とを含有する開示された保護層でコーティングすることにより、行うことができる。回復工程を、洗浄され、保護され、そしてシールされた組織表面を、例えば、炎症性応答の調節、食作用、粘膜リモデリング、繊毛再生、または正常な機能の完全なまたは部分的な回復、などの1またはそれ以上の治癒メカニズムを介して、正常の状態へと回復させることにより、行うことができる。複数工程の治療計画には、洗浄工程が含まれてもよくまたはその後に洗浄工程を行ってもよく、ここでは、部分的に架橋された多糖およびさらなる架橋剤とを含有する開示された保護層が、所望の期間、例えば、1日以上、3日以上、約4〜7日内、または約7〜28日内に、そして望ましくは大きな固形の塊を取り除くことなく、治療部位から消失する様に十分に生物分解性または生体吸収性である。開示された方法は、有利には、外科手術を必要とすることなく、例えば、随意的な溶媒システムを適用しそして除去することにより、そして通常の吸引/吸着技術を介して開示された保護層を適用することにより、または罹患組織を単純に洗い流すことにより、達成することができる。比較されうる一連の工程は、中耳または内耳の部分における複数工程の治療計画において、行うことができる。そのような計画のさらなる詳細は、U.S.特許出願公開No. US 2007/0264310 A1中に見出すことができる。
【0071】
[0072] 本発明は、以下の限定的ではない実施例においてさらに説明される。
【実施例】
【0072】
実施例1 酸化多糖を用いた部分的架橋
[0073] キトサン溶液を、水またはPBS中、様々な量のキトサングルタメート(FMC BioPolymer ASのNovaMatrixユニットから入手したPROTASANTM UP G 113、または“G 113”)を溶解することにより調製した。酸化メチルセルロース(“OXMC”)溶液を、部分的に酸化されたメチルセルロース(Sigma Aldrich Companyから入手したMO387)を過ヨウ素酸ナトリウムと反応させることにより、調製した。溶液を様々な比で混合し、ガラスペトリ皿に注ぎ入れ、そして冷凍乾燥させることにより凍結乾燥させて、白色泡状生成物を提供した。凍結乾燥させた生成物を、水中に浸漬し、そして定性的な水の取り込み速度を決定する様に観察した。結果を、表1に示す。
【0073】
【表1】

[0074] 追加の製剤を、酸化メチルセルロースではなく、酸化ヒドロキシプロピルメチルセルロース(Sigma Aldrich Companyから入手した、442755部分的に酸化されたヒドロキシプロピルメチルセルロース)を使用して、同様に調製した。これらは、より迅速な水の取り込みを示した。
【0074】
[0075] 表1に示される凍結乾燥された生成物は、様々な程度の架橋を示し、実行No. 1の製剤は最も高い程度の架橋を示し、そして実行No. 4の製剤は最も低い程度を示した。得られた水和された生成物は、ゲニピンなどのさらなる架橋剤と混合することができ、そして治療部位上にまたは治療部位中にスプレーされるかまたは注入された。
【0075】
実施例2 グルタルアルデヒドを用いた部分的架橋
[0076] PBS中G113キトサングルタメートの5%溶液の1.5 mL部分およびPBS中グルタルアルデヒドの0.015%溶液の1.5 mL部分を、それぞれ3 mL単一バレルシリンジ中に入れた。シリンジの先端は、カニューレを使用して接続され、そしてその含有物は2本のシリンジプランジャーを交互に押し込んだり引き出したりすることにより均一になるまで混合した。混合物を一晩おいた。得られた部分的に架橋された多糖は、2.5%キトサングルタメート溶液と75 ppmグルタルアルデヒドとの反応生成物を含有した。
【0076】
実施例3 スプレー適用
[0077] PBS中ジアルデヒドでんぷん(Monomer-Polymer & Dajac Labs, Inc.から入手したNo. 9056、>80%酸化でんぷん)溶液を凍結乾燥し、その後凍結乾燥生成物を十分に脱イオン化した水中に溶解することにより水和して、5%酸化でんぷんを含有するさらなる架橋剤溶液を提供した。ガス補助アプリケーター(Micromedics, Inc.から入手したFIBRIJET SA-6030レギュレータ、一対の3 ccシリンジを附属したFIBRIJET SA-3652スプレーセットを調節する)を使用して、実施例2で得られた部分的に架橋された多糖溶液と5%酸化でんぷん溶液とを1:1の比で垂直方向のヒトの手に対してスプレー適用し、体温で実質的に垂直な組織表面に対する設定時間と接着とを観察した。約3〜4 mLの混合物をスプレーして、流体保護層を形成した。組成物は、良好なスプレー特性を示し、付着部位に十分に接着しているようであり、そして付着部位を薄く共形なフィルムで被覆している様であり、そしてこぼれたりたれたりまたは流れたりしなかった。得られた保護層は、粘着性で、柔軟性があり、十分に接着し、そして水に曝されると滑らかになった。保護層を除去するためには洗浄(Scrubbing)が必要であった。
【0077】
[0078] 比較実行において、部分的に架橋された多糖溶液を、部分的に架橋しなかった2.5%キトサングルタメート溶液に置換した。スプレー適用したコーティングは、付着後すぐに流れそしてこぼれ始めた。コーティングは、最初は薄くそして水っぽく、そしてスプレー後約16秒後には粘着性で、流れやすくない状態になった。コーティングは、部分的に架橋された多糖を使用して調製されたコーティングと比較して、安定さが低くそして硬さが低いようであった。
【0078】
実施例4 キトサンを用いた部分的架橋
[0079] 実施例2の方法を使用して、酸化されたメチルセルロース溶液を、架橋されていない形状および部分的に架橋された形状で、様々な量のキトサングルタメートを部分的架橋剤として使用して、調製した。15%の酸化されたメチルセルロース溶液を、MO387メチルセルロース(Sigma-Aldrich Co.)を過ヨウ素酸ナトリウムと脱イオン水中で反応させることにより、作成した。反応生成物を、その後凍結乾燥し、そしてPBS中で再水和した。この溶液の0.5 mLの部分を3 mLのシリンジ中に取り、そしてPBS中0.3%G113キトサングルタメート溶液の0.5 mL部分を含有するシリンジと混合し、脱気し、そして24時間そのままにし、それにより0.15%キトサンと反応させた7.5%酸化メチルセルロースを含有する部分的に架橋された多糖を提供した(溶液A)。同様にして、メチルセルロース溶液の0.5 mL部分を、PBS中0.5%G113キトサングルタメート溶液の0.5 mL部分を含有するシリンジと混合して、それにより0.25%キトサンと反応させた7.5%酸化メチルセルロースを含有する部分的に架橋された多糖を提供した(溶液B)。非-架橋7.5%酸化メチルセルロース溶液を、対照として調製した(溶液C)。
【0079】
[0080] 実施例3の方法を使用して、溶液A、溶液Bおよび溶液Cを、PBS中5%G113キトサングルタメート溶液と1:1の比で垂直-方向のヒトの手にスプレー適用した。約2 mLのそれぞれの混合物をスプレーして、流体保護層を形成した。溶液Aおよび溶液Bを使用して作成した組成物は、良好なスプレー特性を示し、付着部位に十分に接着し、そして付着部位を薄く共形なフィルムで被覆するようであり、そしてこぼれたり落ちたり流れたりしなかった。溶液Bを使用して作成した組成物は、溶液Aを使用して作成した組成物と比較して、わずかながらより固い保護層を形成したようであった。両方の保護層とも、粘着性で、柔軟性があり、十分に接着し、そして水に曝されると滑らかになった。コーティングを除去するためには洗浄(Scrubbing)が必要であった。
【0080】
[0081] 溶液Cを使用して作成した組成物は、適用後すぐに流れ始め、そしてそしてスプレー後約20〜30秒後には流れるのが止まり、そして固定(set)されたようであった。
【0081】
[0082] 上述した結果は、部分的に架橋された多糖が、さらなる架橋剤と組み合わされて、薄く共形な流体保護層を体温での実質的に垂直な組織表面上でin situで迅速に形成する流体のスプレー可能混合物を調製することができることを示す。製剤は、それぞれの場合において、スプレー可能で、抗菌性で、生分解性または生体吸収性であり、そして薬物送達のための骨格として機能することができる。
【0082】
[0083] 好ましい態様を記載することを目的として、本明細書中に具体的な態様を説明しそして記載したが、当業者には、同一の目的を達成すると予想された幅広い様々な代替的なまたは均等な実施が、本発明の概念から離れることなく示されそして記載された特定の態様と置換しうるものであることを理解するであろう。この用途は、本明細書中で検討された好ましい態様のいずれの適合またはバリエーションもカバーする様に意図される。したがって、本発明は、請求の範囲およびその均等範囲によってのみ限定されることが明確に意図される。
【技術分野】
【0001】
[0001] 本発明は、キトサンに関し、そして耳、鼻、喉、四肢、および脊柱の組織および構造の中または上で使用するための材料に関する。
【背景技術】
【0002】
[0002] 様々なキトサン-含有材料およびキトサン誘導体が、外科的修復または薬物送達のために使用されてきた。そのような材料または誘導体に関連する文献には、以下の様なものが含まれる。U.S.特許No. 6,514,522(Domb)、特許No. 6,602,952 B1(Bentley et al.)、および特許No. 7,053,068 B2(Prinz)、U.S.特許出願公開No. US 2005/0238702 A1(Ishihara et al.)、カナダ特許出願No. 2 348 842 A1(Bernkop-Schnurch)、公開PCT出願No. WO 98/31712 A2(B.F. Goodrich Co.)、Aspden et al, Chitosan as a Nasal Delivery System: The Effect of Chitosan on In Vitro and In Vivo Mucociliary Transport Rates in Human Turbinates and Volunteers, J Pharm Sci, 86, 4, 509-513 (1997)、Costain et al., Prevention of postsurgical adhesions with N,O-carboxymethyl chitosan: Examination of the most efficacious preparation and the effect of N,O-carboxymethyl chitosan on postsurgical healing, Surgery, 121, 3, 314-319 (1997)、Mi et al., Synthesis and Characterization of a Novel Chitosan-Based Network Prepared Using Naturally-Occurring Crosslinker, J Polym Sci, Part A: Polym Chem, 38, 2804-2814 (2000)、Mi et al., Synthesis and characterization of biodegradable TPP/genipin co-crosslinked chitosan gel beads, Polymer, 44, 6521-30 (2003)、Roldo et al., Mucoadhesive thiolated chitosans as platforms for oral controlled drug delivery: synthesis and in vitro evaluation, European Journal of Pharmaceutics and Biopharmaceutics, 57, 115-121 (2004)、Krauland et al., Viscoelastic Properties of a New in situ Gelling Thiolated Chitosan Conjugate, Drug Development And Industrial Pharmacy, 31, 885-893 (2005)、Bernkop-Schnurch, Thiomers: A new generation of mucoadhesive polymers, Advanced Drug Delivery Reviews, 57, 1569-1582 (2005)、Bernkop-Schnurch et al., Thiomers: Preparation and in vitro evaluation of a mucoadhesive nanoparticulate drug delivery system, International journal of Pharmaceutics, 317, 76-81 (2006)、Hong et al., Covalently crosslinked chitosan hydrogel: Properties of in vitro degradation and chondrocyte encapsulation, Acta Biomaterialia, 3, 1, 23 - 31 (2007)およびWeng et al., Rheological Characterization of in Situ Crosslinkable Hydrogels Formulated from Oxidized Dextran and N-Carboxyethyl Chitosan, Biomacromolecules, 8, 1109-1115 (2007)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】U.S.特許No. 6,514,522(Domb)
【特許文献2】U.S.特許No. 6,602,952 B1(Bentley et al.)
【特許文献3】U.S.特許No. 7,053,068 B2(Prinz)
【特許文献4】U.S.特許出願公開No. US 2005/0238702 A1(Ishihara et al.)
【特許文献5】カナダ特許出願No. 2 348 842 A1(Bernkop-Schnurch)
【特許文献6】公開PCT出願No. WO 98/31712 A2(B.F. Goodrich Co.)
【非特許文献】
【0004】
【非特許文献1】Aspden et al, J Pharm Sci, 86, 4, 509-513 (1997)
【非特許文献2】Costain et al., Surgery, 121, 3, 314-319 (1997)
【非特許文献3】Mi et al., J Polym Sci, Part A: Polym Chem, 38, 2804-2814 (2000)
【非特許文献4】Mi et al., Polymer, 44, 6521-30 (2003)
【非特許文献5】Roldo et al., European Journal of Pharmaceutics and Biopharmaceutics, 57, 115-121 (2004)
【非特許文献6】Krauland et al., Drug Development And Industrial Pharmacy, 31, 885-893 (2005)
【非特許文献7】Bernkop-Schnurch, Advanced Drug Delivery Reviews, 57, 1569-1582 (2005)
【非特許文献8】Bernkop-Schnurch et al., International journal of Pharmaceutics, 317, 76-81 (2006)
【非特許文献9】Hong et al., Acta Biomaterialia, 3, 1, 23 - 31 (2007)
【非特許文献10】Weng et al., Biomacromolecules, 8, 1109-1115 (2007)
【発明の概要】
【0005】
[0003] キトサンおよびその誘導体は、水溶液中に溶解することができる。そのような溶液をスプレー適用するため(例えば、スプレーノズルまたはニードルを通じて)、低粘性が必要である。いったんスプレー適用された溶液が意図する治療部位に到達すると、水和または希釈が生じる可能性があり、それにより粘性がさらに低下する。従って、スプレー適用された溶液は、所望の治療部位から流れだすか、所望の治療部位により迅速に再吸収されるか、またはそうでなければ早期に所望の治療部位から消失する可能性がある。それらの早期の消失の可能性を減少するために、キトサンを送達前に架橋することができるが、しかし架橋ポリマーは、スプレー適用のためには粘性が高すぎる可能性がある。キトサンをキトサンと架橋剤とを送達後に組み合わせることにより、キトサンをin situで架橋することもできるが、しかし潜在的に有害な架橋剤が使用されないならば、架橋反応を実際の使用のために非常にゆっくりと進行させることができる。
【0006】
[0004] 本発明は、一側面において、部分的に架橋された多糖を含む第1の成分と多糖用のさらなる架橋剤を含む第2の成分との二成分組成物を提供し、ここで多糖またはさらなる架橋剤はキトサンまたはキトサン誘導体を含み、そして組成物は、水和されそして混合された場合に、流体としてスプレーアプリケータを介して送達されて、薄く共形な保護層を体温での実質的に垂直な皮膚表面上に提供することができる。開示された組成物を、望ましくは、乾燥(例えば、凍結乾燥)形状のキトサンを含有する成分とともに複数成分スプレーディスペンサー中にパッケージングし、使用時または使用時近くに水和し、そしてさらなる架橋剤を含有する成分と迅速に混合され、そして生体組織または生体構造上の所望の標的領域に対してスプレー適用される。混合された成分は、混合物がスプレーアプリケータを介して移動する際には流体(すなわち、ゲル化されていない)であり、そしてゲルを実質的に形成することができるか(例えば、標的領域上に付着した時またはその数分後までに)、または標的領域上にある場合に流体のままであってもよい。
【0007】
[0005] 本発明は、別の側面において、体温表面上に保護層を提供し、この層は部分的に架橋された多糖と多糖用のさらなる架橋剤との混合物であって最初は流体である混合物を含み、ここで多糖またはさらなる架橋剤はキトサンまたはキトサン誘導体を含み、そして部分的に架橋された多糖は、さらなる架橋剤と混合される前に部分的に架橋されたものである。この層は、最初は流体の層であってもよく、またはこの層および体温表面を互いに接触させる時点までにゲルを形成する、最初は流体の混合物であってもよい。
【0008】
[0006] 本発明は、別の側面において、以下の工程:
a) 部分的に架橋された多糖溶液を含む第1の成分と多糖用のさらなる架橋剤を含む第2の成分との二成分組成物を混合する工程(ここで、多糖またはさらなる架橋剤がキトサンまたはキトサン誘導体を含む);
b) 生体組織または構造上に向けられる流体としての混合された二成分を適用して、その上に保護層を形成する工程;
を含む、生体組織または構造を治療するための方法を提供する。
【0009】
[0007] 開示された組成物、保護層および方法は、耳、鼻、または喉における粘膜組織、および四肢または脊柱における開口部、陥凹部、通路、または接合部を治療するために特に有用である。好ましい態様において、適用された組成物は、それがスプレー適用された標的領域から、こぼれたり流れたりしない。部分的に架橋された多糖を使用しそしてそれをさらなる架橋剤と混合してかなり粘性なスプレー不能ゲルではなく低粘性または半-粘性の流体を形成することにより、スプレー可能組成物を、流体形式でスプレー装置を介して投薬し、標的領域に適用して流体またはほんの最近にゲル化した保護層を形成し、そして実質的にまたは完全に標的領域上に保持することができる。このアプローチにより、より迅速に硬化するが、しかし潜在的には生体許容性が低い架橋剤を標的領域にて使用することを回避することができる。所望する場合、開始多糖溶液が部分的に架橋されるならば必要とされていたはずの濃度と比較して顕著に低い濃度で、生体許容性が低い架橋剤を使用することもできる。
【図面の簡単な説明】
【0010】
【図1】[0008] 図1は、開示された方法を示すスキーム図である。
【図2】[0009] 図2は、開示された方法において使用することができる、機器の透視図である。
【図3】[0010] 図3は、開示された方法において使用することができるディスペンサーの透視図である。
【発明を実施するための形態】
【0011】
[0011] 参考文献と同様に、図面の様々な図における符号は、同様のエレメントを示す。図面中のエレメントは、同一縮尺というわけではない。
【0012】
発明の詳細な説明
[0012] 以下の詳細な説明は、特定の態様を記述し、そして限定する意味では利用されない。本明細書中の全ての重量、量、および比は、特に記載しない限り重量である。以下に示される用語は、以下の意味を有する。
【0013】
[0013] 用語“接着”は、身体構造または補綴材料を、組織に対してくっつけること、組織と組織とを長期間の間緊密に接触させるようにくっつけること、または通常の開放空間を介して身体構造、補綴材料または組織を互いに結合させる組織を形成すること、をいう。
【0014】
[0014] 用語“抗菌性”は、Staphylococcus aureus、Pseudomonas aeruginosa、Streptococcus pneumonia、Haemophilus influenzae、またはMoraxella catarrhalisの1またはそれ以上の個体群における、90%より多い数値的減少(すなわち、少なくとも1-logオーダーの減少)を引き起こす能力のことをいう。
【0015】
[0015] 用語“付着した”および“接着した”は、細菌性バイオフィルムおよび表面に関連して使用される場合、バイオフィルムが表面上で確立され、そして少なくとも部分的に表面をコーティングするかまたは被覆し、表面からの除去に対していくらか抵抗性を有することを意味する。この関係性の性質が複雑であまりよく理解されていないため、付着または接着についての具体的なメカニズムは、そのような使用により意図されない。
【0016】
[0016] 用語“細菌性バイオフィルム”は、細菌により生成される細胞外多糖(EPS)マトリクス中に含有される群落中の有機体(生物)を含む、表面に対して付着した細菌の群落を意味する。
【0017】
[0017] 用語“生体適合性”は、物質に関連して使用される場合、物質が、生体に対して顕著な有害作用または望まれない作用を何も示さないことを意味する。
【0018】
[0018] 用語“生物分解性”は、物質に関連して使用される場合、物質がin vivoで分解されまたは破壊されて、より小さな化学的種または物理的種を形成することを意味する。そのような分解プロセスは、酵素的、化学的または物理的であってもよい。
【0019】
[0019] 用語“生体吸収性”は、物質に関連して使用される場合、物質が、生体により吸収されることができることを意味する
[0020] 用語“体温”は、哺乳動物に関連して使用される場合、通常の直腸温を意味する(例えば、ヒトの場合には約37℃;ネコ、ウシ、イヌ、またはウマの場合には約38℃;そしてヒツジの場合には約39℃)。
【0020】
[0021] 用語“粘着性”は、液体またはゲルに関連して使用される場合、水平面上に静置される場合の液体またはゲルが(全ての場合に必要というわけではないが)、それ自体にくっつき、そして単一の塊を形成する傾向があることを意味する。
【0021】
[0022] 用語“破砕される”は、粒子材料に関連して使用される場合、カッティング、研磨、微粉砕、粉末化、または外部から印加された力を使用したその他の粒子破砕プロセスにより、粒子が破砕されそしてサイズが小さくなったことを意味する。
【0022】
[0023] 用語“共形(conformal)”は、組織またはその他の身体構造に対して適用される組成物に関連して使用される場合、組成物が、組成物が適用される領域上に実質的な連続層を形成することができることを意味する。
【0023】
[0024] 用語“分離”、“除去”および“崩壊”は、表面に対して付着したかまたは接着した細菌性バイオフィルムに関連して使用される場合、最初には表面上に存在していた少なくとも顕著な量のバイオフィルムが、もはや表面に対して付着したりまたは接着したりしないことを意味する。分離、除去または崩壊の具体的なメカニズムは、その様な使用により意図されない。
【0024】
[0025] 用語“流体”は、物質に関連して使用される場合、物質が、その保管係数(G')よりも大きい損失係数(G'')そして1よりも大きい損失タンジェント(tan δ)を有する液体であることを意味する。
【0025】
[0026] 用語“さらなる架橋剤”は、開示された二成分組成物の第2の成分中で使用され、そして開示された部分的に架橋された多糖を架橋することができる架橋剤を意味する。
【0026】
[0027] 用語“ゲル”は、物質に関連して使用される場合、物質が変形可能なものであり(すなわち、固体ではない)、G''がG'未満でそしてtan δが1未満であることを意味する。
【0027】
[0028] 用語“ゲル化”は、ゲル層の形成に関連して使用される場合、G''がG'と等しくそしてtan δが1に等しい時間を意味する。
【0028】
[0029] 用語“止血”は、血流を止めるかまたは凝固を促進する機器または材料を意味する。
【0029】
[0030] 用語“ハイドロゲル”は、ゲルに関連して使用される場合、ゲルが、親水性でありそして水を含有することを意味する。
【0030】
[0031] 用語“水和”は、機器または物質に関連して使用される場合、機器または物質が、均一に分散された化学的な結合水を含有することを意味する。“完全に水和”された機器または物質は、水和のための追加の水を取り込むことができない。“部分的に水和”された機器または物質は、水和のための追加の水を取り込むことができる。
【0031】
[0032] 用語“内耳”は、三半規管および蝸牛を意味する。
【0032】
[0033] 用語“中耳”は、鼓膜、耳小骨連鎖などの内部構造、乳様突起などの周囲の裏打ち構造および境界構造により規定される領域を意味する。
【0033】
[0034] 用語“粘膜接着性”は、機器または物質に関連して使用される場合、機器または物質が、粘液被覆上皮に対して接着し得ることを意味する。
【0034】
[0035] 用語“鼻腔または副鼻腔”は、鼻および洞内の通常は空気で満たされた通路および室を規定する様々な組織のことをいい、組織には鼻孔(nostrilsまたはnares)、鼻甲介(nasal conchaまたはturbinates)、前頭骨、篩骨、ちょう形骨洞および上顎洞、副鼻腔口および鼻咽頭が含まれる(しかし、これらには限定されない)。
【0035】
[0036] 用語“部分的な架橋剤”は、多糖を架橋して、部分的に架橋された多糖を形成することができる架橋剤を意味する。
【0036】
[0037] 用語“部分的に架橋された”は、多糖に関連して使用された場合、2またはそれ以上の多糖分子が、一緒になって水和された場合には流体であり、そしてin situでさらに架橋することができるオリゴマー成分またはポリマー成分を形成することを意味する。
【0037】
[0038] 用語“多糖”には、多糖の誘導体および修飾された多糖、ならびに個々の多糖種の誘導体および個々の修飾多糖種が含まれる。例えば、用語“カルボキシメチルセルロース”には、カルボキシメチルセルロース誘導体および修飾カルボキシメチルセルロースが含まれ、用語“キトサン”にはキトサン誘導体および修飾キトサンが含まれ、そして用語“でんぷん”には、でんぷん誘導体および修飾でんぷんが含まれる。
【0038】
[0039] 用語“保護”は、組織またはその他の身体構造上の組成物の層に関連して使用される場合、例えば、炎症性応答の調節、食作用、粘膜リモデリング、繊毛再生、または正常機能のその他の完全なまたは部分的な回復などの1またはそれ以上の治癒メカニズムを介して、層が、傷害組織表面、炎症組織表面または外科的修復組織表面を、正常な状態に戻すことを補助することができることを意味する。
【0039】
[0040] 用語“滞留時間”は、組織またはその他の身体構造上の保護ゲル層に関連して使用される場合、ゲル層またはその部分が巨視的観察のもとin vivoで依然としてその場に存在している期間を意味する。
【0040】
[0041] 用語“溶媒”は、溶質がその中で溶解されるかまたは懸濁される溶媒またはその他の担体を含有する、溶液または分散系を形成することを意味する。
【0041】
[0042] 用語“実質的にコラーゲン不含”は、牛海綿状脳症(BSE)または変異型クロイツフェルト・ヤコブ病(vCJD)の伝播またはそれへの感染の潜在的リスクをもたらさないように、実質的に低量のコラーゲンを含有することを意味する。
【0042】
[0043] 用語“実質的に垂直”は、皮膚表面に関連して使用される場合、水平に対してその方向が90±10°である表面のことをいう。この言い回しは、実質的に垂直な表面に対してのみまたは皮膚表面に対してのみ、開示された組成物を適用することを示唆することを意味していない。しかしながら、出願人は、複雑な機器またはその他の測定装置または測定技術を必要とすることなく、実質的に垂直な皮膚表面を使用して、スプレー適用のあいだ、そしてスプレー適用の直後に、開示された組成物の特定のレオロジー特性を評価することができることを明らかにした。
【0043】
[0044] 用語“薄い”は、組織またはその他の身体構造上の保護層に関連して使用される場合、約2ミリメートル未満の平均厚を有することを意味する。
【0044】
[0045] 図1に関して、開示された方法は、例えば、患者の鼻腔または副鼻腔100中で行うことができ、鼻孔114a、114bを介してアクセスすることができる上顎洞110a、110bおよび前頭洞112a、112bが含まれる。鼻孔114a、114bを含めて患者の外的特徴が、点線で示されることに注目すべきである。患者が、例えば、慢性鼻副鼻腔炎を患っている場合、上顎洞110aの表面と関連する治療部位116などの1またはそれ以上の治療部位を、医学的にまたは必要であれば外科的に対処することができる。治療部位116には、上顎洞110aの線毛上皮が含まれ、そしてバイオフィルムが含まれていてもよい(図1中には示さず)。治療部位は、天然の組織である必要はなく、そして代わりに、細菌性バイオフィルムの層により少なくとも部分的に被覆されていてもよい、洞充填(sinus packing)またはステントなどの人工的構造であってもよい(図1中には示さず)。存在する場合、バイオフィルムは、病巣洗浄管(irrigation duct)(図1においては隠されている)を含有する関節結合可能な送達チューブ122とともに、イントロデューサー122の遠位端にてノズル124へと流れそして従って治療部位へと流れることができる溶媒システムを介して、イントロデューサー120を使用して、治療部位116に対して適用することができる溶媒システム(例えば、U.S.特許出願公開No. US 2007/0264310 A1に記載される溶媒システム)を使用して除去することができる。溶媒システムおよびバイオフィルムの残留物を、吸引管(図1においては隠されている)を介して、治療部位から除去することができる。部分的に架橋された多糖とさらなる架橋剤とを含有する開示された組成物を、同様に、イントロデューサー120中で同一のまたは異なる病巣洗浄管(irrigation duct)を使用して、治療部位にて適用することができる。当業者は、開示された組成物(そして必要であれば溶媒システム)を、その他の方法またはその他の装置を使用して、治療部位に対して適用することができることを理解するであろう。例示的なその他の方法には、動力スプレーまたはその他のスプレー塗布、洗浄(lavage)、ミスト、モッピング、ウィッキング、ドリッピング、注入、そして穿孔(trephination)が含まれ、そして例示的なその他の装置には、スプレーノズル(例えば、単一成分または複数成分のスプレーノズル)およびシリンジ(例えば、単一バレルまたは複数バレルのガラスまたはプラスチックシリンジおよびバルブシリンジ)が含まれる。治療方法を、身体のその他の部分において行うこともできる。治療方法は、組織(例えば、粘膜組織)の治療や、耳、喉、四肢または脊柱中またはその近傍の構造の治療を含む、血管外適用において、特に有用性を有する。
【0045】
[0046] 図2は、開示された治療方法において使用することができる例示的な機器200を示す。機器200には、ハンドル202およびイントロデューサー222が含まれ、その遠位端224(全般を参照)には、スプレーノズル、病巣洗浄管(irrigation duct)および吸引管が含まれるが含まれる(図2においては別々に番号を付けていない)。機器200には、場合によりさらに、第1のアクチュエータアッセンブリ226(全般を参照)および第2のアクチュエータアッセンブリ228(全般を参照)が含まれていてもよい。第1のアクチュエータアッセンブリ226中の調節ホイール230は、イントロデューサー222の曲げをもたらすようにユーザにより機能させることができ、そして第2のアクチュエータアッセンブリ228中の調節ホイール232は、イントロデューサー222の遠位端224からスプレーされる液体のイントロデューサー222に対する運動または回転をもたらすようにユーザーにより機能させることができる。ハンドル202は、一般に、様々な機器200のその他の成分のためのハウジングとして、そしてイントロデューサー222のための支持体として、機能する。ハンドル202は、ピストルグリップ様形状を有していてもよく、グリップ部分234およびノーズ236を規定する。グリップ部分234は、ユーザーの手により握られるようなサイズおよび形状を有し、一方でノーズ236は、イントロデューサー222に結合するように適合される。トリガ238および関連するセンサおよびバルブ(図2においては示されていない)を使用して、開示された再水和ゲル(そして使用する場合、開示された溶媒システム)の、洗浄チューブ(irrigation tube)240を通じた流れ、そしてそれ故に遠位端224中そして所望の治療部位上でのスプレーノズルを介した流れを調節することができる。トリガ238を、多方向性の可動域とともに提供することができ、そして1またはそれ以上の追加のセンサおよびバルブ(図2中には示されない)と組み合わせて、遠位端224での吸引管を介した、そしてそれ故吸引チューブ242を通した、溶媒システム、バイオフィルム残留物およびその他のデブリの治療部位からの除去を、調節することができる。トリガ238を使用して、洗浄チューブ(irrigation tube)240中の別個の管腔を通じて、そしてそれ故に遠位端224中そして所望の治療部位上でのスプレーノズルを介して、開示された再水和ゲルの流れを調節することもできる。
【0046】
[0047] 図3は、開示された方法において使用することができる例示的なディスペンサー300を示す。ディスペンサー300には、グリップ305により受容され、中央部スパイン306で組み合わされ、そしてピストン型のプランジャー308および310をそれぞれが含有する、一対のシリンジ本体302および304が含まれる。プランジャー308および310は、プランジャー308および310を同時に作動させることができる共通の押し込みフランジ312により組み合わされている。シリンジ本体302および304は、それぞれ、部分的に架橋された多糖314およびさらなる架橋剤316を含有する。多糖314は、通常は、輸送および保存のために乾燥形状、例えば、凍結乾燥形状、で提供され、そして使用時に水和される。さらなる架橋剤316を(選択されたさらなる架橋剤およびその保存安定性に依存するが)、輸送および保存のために乾燥形状または水和された形状で提供することができ、そして乾燥形状で提供される場合には使用時に水和する。多糖314またはさらなる架橋剤316が水和される場合、このことは、例えば、水またはその他の適切な水性溶媒(例えば、リン酸緩衝化塩類溶液、または“PBS”)をシリンジポート318および320の一方または両方に引き込みながらプランジャー308および310を引き出すことにより、そしてその後シリンジ本体302および304の含有物を適切に水和させることまたはその含有物に適切に水和を引き起こすことより、行うことができる。水またはその他の適切な水性溶媒は、好都合なことに、同様のコンパニオンシリンジ(図3には示されていない)中に提供されていてもよく、この場合のシリンジポートは、適切なチューブまたはその他の付属品を使用して、ポート318および320と流体連通してそれぞれが組み合わされている。ディスペンサー300およびコンパニオンシリンジの含有物は、水和が完了するまでそれぞれの押し込みフランジを交互に押し込んだり引き出したりして往復して通過させることができる。
【0047】
[0048] ディスペンサー300には、ガス補助チップ322も含まれていてもよく、ここには流体入り口324および326がそれぞれシリンジポート318および320と結合していてもよく、そして流体出口328を使用して、開示された組成物のスプレーを所望の治療部位に向けることができ、または適切な伸長スプレーヘッドを附属してもよい。ガス入り口330は、チューブ332を介して適切なガス(例えば、窒素)を供給され、押し込みフランジ312が押し下げられる場合、適切な流体スプレーパターンの形成を補助することができる。図3において示されるものなどの様々なディスペンサーは、市販されているものであり、Micromedics, Inc.由来のFIBRIJETTM SA-3652およびSA-6105ガス補助アプリケータキットやBaxter International Inc.由来のDUPLOJECTTMアプリケータおよびTISSOMATTM圧力調節装置が含まれる。
【0048】
[0049] 適用された組成物は、治療部位(例えば、鼻腔または副鼻腔、または四肢または脊柱の部分における開口部、陥凹部、通路または接合部)を満たすことができ、その場合、開示された保護層は、非常に厚くてもよく、層を通じて様々な厚さを有していてもよく、そして空気またはその他の付近のガスに曝露されない。開示された組成物は、薄いフィルムまたはその他の共形コーティングとして適用することもでき、その場合、開示された保護層は、相対的に薄く、そして空気またはその他の付近のガスに曝露され、そして層を通じて実質的に均質な厚さを有していてもよい。保護層は流体であり、そしてスプレー適用の時点ではゲルではなく、そして好ましくは治療部位からこぼれたり流れたりしない。保護層は、その後ゲルを形成してもよいが、しかしそうなることが必要というわけではない。保護層は、望ましくは、治療部位にて粘膜組織またはその他の天然の組織(例えば、軟骨または骨)に接着し、そして層の天然の分解または吸収が、例えば、1日〜数日(例えば、2、3または4日)、数週間または数ヶ月間のin vivoでの滞留時間の後に生じるまで、分離またはその他の崩壊に耐性である。その一方で、細菌の再定着または再感染を、顕著に減少または予防することができ、そして治癒の改善そして繊毛再生の改善が生じうる。保護層は、細菌接着忌避(repellence)、抗-感染性特性、局所免疫修飾、組織保護、疼痛または出血の減少または除去、炎症の軽減、繊毛再生のための環境の最適化、重大な生体構造(critical anatomy)に対する接着の減少、などを含む(しかしこれらには限定されない)、様々な治療上の利点を提供することができる。これらの利点は、a)殺菌、b)細菌定着の阻害、c)細菌の組織への接着性の阻害、d)組織の病的状態(morbidity)または膿瘍形成の減少、e)疾患再発の減少または予防(例えば、具体的には、細菌毒素およびEPSに関連する慢性炎症の減少)、f)例えば、血小板凝集を促進する湿潤創傷の維持により、または過剰なざらつきの形成を伴わない乾燥創傷の閉合による、治癒のあいだの組織のコーティングおよび保護、g)止血、h)粘膜の繊毛再生用の環境の最適化、i)繊毛の成長または再生の高速化、そしてj)(1または複数の)治療剤の治療部位への送達、を含む様々なメカニズムのために生じる可能性がある。望ましくは、保護層は、接着していない部分における繊毛を天然の律動的繊毛運動(すなわち、繊毛拍動)を自由に受けるようにしたまま粘膜の部分に接着することができ、所望される場合には抗菌剤または追加の治療剤も送達することができ、そして望ましくは細菌が治療部位に接着することを妨害しまたは予防することができる。
【0049】
[0050] 様々な多糖またはその誘導体を、開示された組成物、保護層および方法において使用することができる。例示的な多糖には、アルギネート、カラギーナン、セルロース(例えば、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、メチルセルロースおよびヒドロキシプロピルメチルセルロース)、キチン、キトサン、コンドロイチン硫酸、デキストラン、ガラクトマンナン、グリコーゲン、ヒアルロン酸、でんぷん、およびその他の生体適合性多糖、およびこれらの混合物が含まれる。キトサン(塩およびその他のキトサン誘導体を含む)は、特に好ましい多糖である。例示的なキトサンおよびそれらの塩(クエン酸塩、硝酸塩、乳酸塩、リン酸塩、塩化物塩、およびグルタミン酸塩を含む)を、KitoZyme S.A.、Fluka Chemie AG、FMC BioPolymer ASのNovaMatrixユニット、Heppe Medical、およびSigma-Aldrich Co.含む様々な商業的供給源から得ることができる。キトサンは、加水分解によりキチン(ポリ-N-アセチル-D-グルコサミン)の脱アセチル化を通じてN-アセチル基を除去することにより、合成することもできる。得られたオリゴマーまたはポリマーは、複数の繰り返しユニット(例えば、約2〜約10000の繰り返しユニット、約60〜約600の繰り返しユニット、または選択された最終用途のための所望され得るその他の量)を有する。その繰り返しユニットのいくつかまたは全ては脱アセチル化アミノ基を含有し(例えば、全繰り返しユニットの約30〜約100%または約60〜約100%)、残りの繰り返しユニットは(もし存在する場合には)アセチル化アミノ基を含有する。キトサンは、グルコサミンモノマーから構成されるポリマーであり、そして様々な数平均分子量(例えば、約400〜約2000 kDa、約10〜約500 kDa、または約10〜約100 kDa)を有してもよい。キトサンは、例えば、約50 kDa未満の数平均分子量を有する超低分子量材料、約50〜約200 kDaの数平均分子量を有する低分子量材料、約200〜約500 kDaの数平均分子量を有する中間分子量材料、または約500 kDaを越える数平均分子量を有する高分子量材料であってもよい。キトサン誘導体、例えば、1またはそれ以上のヒドロキシル基またはアミノ基が誘導体の可溶性または粘膜接着特性を変化させることを目的として修飾された誘導体、も使用することができる。例示的な誘導体には、チオール化キトサン、およびカルボキシメチルキトサン、アセチル化キトサン、アルキル化キトサンまたはスルホン酸化キトサン(例えば、O-アルキルエーテル、O-アシルエステル、カチオン化トリメチルキトサンおよびポリエチレングリコールで修飾されたキトサン)などの非-チオール化キトサン誘導体が含まれる。キトサン誘導体は、様々な供給源から得ることができる。例えば、チオール化キトサンは、ThioMatrix Forschungs Beratungs GmbHおよびMucobiomer Biotechnologische Forschungs-und Entwicklungs GmbHから得ることができ、または例えば、上述した公開PCT出願No. WO 03/020771 A1中に記載されるかまたは上述したRoldo et al.の文献、Krauland et al.の文献、Bernkop-Schnurch and Bernkop-Schnurch et al.の文献に記載される様に、キトサンと適切なチオール化反応剤との反応により調製することができる。追加の好ましい多糖には、上述したものなどのセルロース、キチン、コンドロイチン硫酸、デキストラン、グリコーゲン、ヒアルロン酸、およびでんぷんが含まれる。
【0050】
[0051] 多糖は、パッケージングされる前に部分的に架橋され、そして最終消費者に対して発送されまたは提供される。部分的架橋は、様々な方法で行うことができる。例えば、部分的架橋を、自由流動性の水和可能な多糖粒子の集合体を個別に部分的に架橋して、自由流動性の水和可能な部分的に架橋された多糖粒子の集合体を形成するデヒドロサーマル架橋プロセスを使用して行うことができる。デヒドロサーマル架橋は、実質的に、個体状態の架橋プロセスであり、この場合、材料を熱および減圧の一方または両方に曝露して、初期脱水を生じさせ、その後追加水の喪失および分子間縮合プロセスまたは分子内縮合プロセスを介した架橋結合の形成を生じさせる。外部架橋剤を追加することは必要なく、そして開示された粒子の場合、そのような架橋剤の存在は、それらの自由流動性の性質をそのままにすることをより困難にする可能性がある。デヒドロサーマル架橋は、望ましくは、架橋されるべき生成物を約1%未満の水分含量に対して水和すること、そして十分な追加的な加熱または減圧を使用して所望の架橋密度を達成すること、が関連する。例えば、減圧の非存在下にて、約80℃より高い温度、約90℃より高い温度、約100℃より高い温度または約120℃より高い温度を使用することができ、より高い温度が一般的にはより迅速な反応速度をもたらす。多糖は、望ましくは、褐色化を生じるのに十分なほどの程度には加熱せず、そして従って160℃未満の温度または150℃未満の温度が好ましい。かなり長い加熱時間を取る場合、例えば、140〜150℃で約40時間+ウォームアップおよびクールダウンのために全部で約20時間のあいだ、周囲圧力であることが必要である可能性がある。減圧を使用する場合、より低い温度を使用することができ、そして少なくとも約1 mm Hgの減圧、および好ましくは少なくとも約10-3 mm Hgの減圧が好ましい。このように、温度が高くなればなるほど、必要とされる減圧または所定の架橋密度に達するために必要な加熱時間は低くなり、そして逆も成り立つ。したがって、少なくとも約10時間の時間、少なくとも約20時間の時間、少なくとも約30時間の時間または約40〜約60時間の時間、および約2週間未満または約1週間未満の時間(ウォームアップおよびクールダウンのために必要とされる時間を計測せず)を使用することができるが、正確な加熱時間または加熱時間の範囲を特定することは困難である。多くの事例において、例えば、デヒドロサーマル的に架橋された粒子を水和し(以下にさらに詳細に説明するが、さらなる架橋剤を含有する開示された第2の成分を添加することなく)、そして得られた集合体を実施例1において示したように体温で実質的に垂直な表面に対してスプレーすることにより、加熱時間、温度および圧力を経験的に決定することで十分である。集合体が粘度が高すぎてスプレー可能ではない場合、部分的架橋の程度を低下させなければならない。集合体がスプレー可能ではあるがこぼれたり流れたりしない場合、部分的架橋の程度はそのままにしてもよく、または所望の場合にはさらに部分的架橋の程度を低下させてもよい。器具類を使用して、集合体についてのレオロジー特性を測定することもでき、例えば、流体またはゲルが得られるかどうかを決定することができ、部分的な架橋の程度を低下させて、早期のゲル形成を防止しまたは阻害する。
【0051】
[0052] 部分的な架橋を、様々な外部架橋剤を使用して行うこともでき、それはそのように使用される場合、部分的架橋剤として言及することができる。例示的な部分的架橋剤には、ゲニピン、酸化多糖(酸化でんぷん、またはグルタルアルデヒドなど)が含まれ、部分的にその良好な生体適合性のおかげで、そしてそのいくらかゆっくりとした架橋速度にも関わらず、ゲニピンが好ましい。部分的架橋剤の量は、選択された多糖および部分的架橋剤に依存して大幅に変更されてもよい。多数の事例において、部分的架橋剤の量を経験的に、例えば、選択された量の多糖および部分的架橋剤を一緒に反応させ、得られた生成物を必要ならば水和し、そして得られた集合体を体温で実質的に垂直な表面に対して上述した様にスプレーすることにより、決定することで十分である。
【0052】
[0053] 酸化多糖を部分的架橋剤として使用する場合、多糖の部分的(過度には完了しない)架橋を促進することができるアルデヒド基を提供するためにちょうど十分な程度にまで、多糖を酸化することができる。多糖は、所望される場合、異なる程度(例えば、より高い程度)にまで酸化することができ、そして多糖量を調節(例えば、増加)することができる。好ましくは、部分的架橋反応は、多糖および部分的架橋剤を混合した後、数日または数時間以内(例えば、2日未満、1日未満、12時間未満、または8時間未満)に実質的に完了する。アルギネート、カラギーナン、セルロース(例えば、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、メチルセルロース、およびヒドロキシプロピルメチルセルロース)、キチン、コンドロイチン硫酸、デキストラン、ガラクトマンナン、グリコーゲン、ヒアルロン酸、でんぷん、および酸化をされることができるその他の生体適合性多糖を含め、様々な酸化多糖を使用することができる。酸化多糖(酸化セルロース(例えば、上述したもの)、キチン、コンドロイチン硫酸、デキストラン、グリコーゲン、ヒアルロン酸、およびでんぷんなど)が、特に好ましい。酸化多糖を調製するための代表的な酸化剤または酸化技術には、a)過ヨウ素酸ナトリウム、b)ジ-tert-アルキルニトロキシル触媒の存在下での次亜塩素酸イオン、c)例えば、ルテニウムを使用した金属触媒酸化、d)例えばハロカーボン中の例えば二酸化窒素を使用する無水酸化、e)でんぷん、グアーおよびその他の多糖の酵素的酸化または化学-酵素的酸化、f)ジメチルスルホキシド(DMSO)またはジアセトキシヨードベンゼンなどの穏やかな酸化剤を用いた2,2,6,6-テトラメチルピペリジン-1-オキシル(TEMPO)触媒酸化、そして当業者に知られうるその他の酸化剤および酸化技術、を使用することが含まれる。選択された酸化剤または酸化技術に依存して、様々な程度の酸化、様々な程度のポリマー化、そして酸化部位を使用することができる。例えば、酸化は、第1のヒドロキシル基(例えば、グルカンの無水グルコース単位における6-ヒドロキシル基)に向けることができ、保存された環状構造を有するカルボキシル-多糖が得られる。酸化もまた、単糖環に存在する近接のジオール基(例えば、無水グルコース単位のC2-C3部位)に向けることができ、単糖単位の切断そしてジアルデヒド官能基の生成を生じる。そのような酸化多糖のジアルデヒド含量は、例えば、利用可能な酸化部位の2%〜ほぼ100%、例えば、30%より多く、または50%よりも多く、の酸化の程度の範囲であってもよい。酸化多糖は、その他の官能基、例えば、ヒドロキシアルキル基、カチオン基、カルボキシル基、そしてその他の酸性基を含有してもよい。一般化のため、多糖酸化の程度が上昇するため、低下した量の酸化多糖を部分的架橋剤として使用することができる。
【0053】
[0054] 2種またはそれ以上の粒子多糖の混合物を含有する組成物を使用する場合、1またはそれ以上の多糖粒子を、部分的に架橋することができる。このことにより、流体挙動、スプレー特性、最終的なゲル化時間(存在する場合)、そして設置後の分解速度などの特性をカスタマイズすることが可能になる。所望される場合、1またはそれ以上の部分的に架橋された多糖のブレンドを、追加の部分的架橋反応、例えば、デヒドロサーマル架橋反応、に供することができる。製造部署において、すぐに使える形態またはすぐに使える形態に近い形態に混合物をパッケージングすることと比較して通常は不便なことではあるものの、粒子を別個にしたままにすることもでき、そしてその後に最終使用者により混合されてもよい。
【0054】
[0055] 多糖は、望ましくは、乾燥粒子形状で提供され、例えば、平均粒子径が約1 mm未満、約100μm未満、約1〜約80μm、または1μm未満である自由流動性の粒子として、提供される。そのようにすることは、長期の保存の間の分解を減少させることの助けになる可能性がある。
【0055】
[0056] 多糖は、通常は、さらなる架橋剤と混合しそして得られた流体混合物を治療部位に設置する直前に、水和する。水和は、多糖を水またはいずれかその他の所望の有効成分を含有する水溶液中に溶解することにより、行うことができる。例えば、通常の塩類溶液およびPBSが好ましく、そして容易に利用可能な水和溶液である。水和溶液中の多糖の量は、多糖の分子量に部分的に依存していてもよく、そして例えば、溶液量の約1〜約20%、約1〜約10%または約1〜約5%であってもよい。同時係属中のU.S.仮出願シリアルNo. 61/047,580(2008年4月24日出願)(US公開出願US 2009/0291911 A1)は、粒子を生体適合性の水-混和性極性分散剤中に分散し、そして分散物を粒子用の十分な水性溶媒と組み合わせてそれらを粘着性のハイドロゲルに変換することにより、デヒドロサーマル的に架橋された多糖粒子を再水和するための好ましい技術を記載する。この技術は、ハイドロゲルではなく流体が水和の後に形成するために十分な程度で部分的に架橋された多糖粒子を使用して、本発明において使用するために適合させてもよい。いくらかの乾燥粉末材料は水と混合された場合に凝集物を形成する傾向があるため、多糖粒子を水和して滑らかな流体混合物を得ることは難しい可能性がある。しかしながら、凝集物の形成は、多糖粒子を生体適合性の水-混和性極性分散剤中に分散することにより、その後分散物を十分な水性粒子溶媒(aqueous particle solvent)(すなわち、粒子用の水-ベースの溶媒)と混合して粒子を凝集物-不含の流体溶液へと変換することにより、回避することができる。分散剤は、粒子用には十分に弱い(poor)溶媒であり、そのため粒子と分散剤との混合物は、真の溶液を形成しない。そのような分散の場合、粒子は、望ましくは、十分に小さく、そのため、例えば、粒子と分散剤とを一緒に攪拌することによりそれらを攪拌した後、分散は安定でありまたは準安定である(例えば、コロイド分散または適度に持続性の懸濁物)。理論に縛られることなく、水性粒子溶媒(aqueous particle solvent)の添加は、それぞれの懸濁された粒子の表面で、周囲の分散剤の水性粒子溶媒(aqueous particle solvent)層への溶解を介して、水和をほぼ同時的に生じさせると考えられており、それにより水和されなかった多糖の可視的な凝集物を形成することなく流体溶液の形成を可能にする。このように、乾燥粉末にされた多糖が通常はそのようにはならないにもかかわらず、分散された多糖は、水または水溶液と組み合わされて、凝集物-不含の流体溶液を形成することができる。例えば、図3との関連で記載したように2本のシリンジのあいだで通過させること、穏やかに攪拌し、またはその他の単純な混合技術を使用して、そして機械的なスターラーを使用する必要なく、開示された混合方法を使用して、満足のいく凝集物-不含の流体を調製することができる。開示された混合方法は、粉末多糖を水または酸性化水とともに単純に混合したのでは得ることができなかった、非常に濃縮された流体溶液の形成を可能にすることができる。多糖は粉末状にされたものであってもよいが、望ましくは粉末状にされていないものである。
【0056】
[0057] 分散剤および水性粒子溶媒(aqueous particle solvent)の選択は、選択された多糖に依存する可能性がある。純水における可溶性が相対的に低いが、水を酸性化すると可溶性になるキトサンなどの多糖について、脱イオン水を分散剤として使用することができ、そして酸性化水を水性粒子溶媒(aqueous particle solvent)として使用することができる。分散剤と水性溶媒のその他の組合せも使用することができる。例えば、エタノール、イソプロパノールまたはアセトンを、多数の多糖(キトサンおよびキトサンを含有するブレンドを含む)についての分散剤として使用することができ、そして脱イオン水、通常の塩類溶液またはPBSを水性粒子溶媒(aqueous particle solvent)として使用することができる。
【0057】
[0058] 様々なさらなる架橋剤を開示された組成物の第2の成分中、そして開示された保護層および方法において、使用することができる。さらなる架橋剤は、望ましくは、比較的即効性のものであり、それにより二成分が混合されそして体温で垂直な表面にスプレーされる場合にこぼれたりまたは流れたりしない二成分組成物を提供する。例示的なさらなる架橋剤には、酸化多糖、キトサンおよびグルタルアルデヒドが含まれ、酸化多糖が好ましい。酸化多糖は、潜在的に生体許容性が低い低分子量のアルデヒドを使用することを回避しつつ、特に迅速な架橋を提供する様である。酸化多糖中のアルデヒド基もまた、粘膜接着を亢進することができる。酸化多糖は、生物分解性、生体吸収性、薬物送達特性、または止血特性の改善または良好な調節を含む、追加の利点を提供することができる。部分的架橋剤との関連で上述したものを含め、様々な酸化多糖を使用することができる。酸化セルロース、キチン、コンドロイチン硫酸、デキストラン、グリコーゲン、ヒアルロン酸およびでんぷんなどの酸化多糖は、特に好ましい。酸化多糖をさらなる架橋剤として使用する場合、多糖は、望ましくは、多糖および酸化多糖が水性溶液中で組み合わされた場合に部分的に架橋された多糖の迅速なさらなる架橋を促進することができるアルデヒド基を提供するために十分な程度で、酸化される。代表的な酸化剤または酸化技術および代表的な酸化の程度には、部分的架橋剤との関連で上述したものが含まれる。
【0058】
[0059] 部分的架橋剤およびさらなる架橋剤は、同一のものであっても別個のものであってもよく、例えば、少量の部分的架橋剤を使用して部分的に架橋された多糖を調製し、その後多量の同一の架橋剤をさらなる架橋剤として、開示された二成分組成物中で使用することができる。例えば、グルタルアルデヒドまたはキトサンを、部分的架橋剤およびさらなる架橋剤の両方として使用することができる。
【0059】
[0060] さらなる架橋剤は、望ましくは、水またはその他の適切な溶媒中に使用前に溶解する。推奨されるさらなる架橋剤のタイプおよび量は、典型的には、さらなる架橋剤分子量、部分的に架橋された多糖のタイプおよび量、そしてその中の架橋のための残りの部位の利用可能性に依存する。さらなる架橋剤の量は、例えば、開示された第2の成分の約1〜約20%、約1〜約10%または約1〜約5%であってもよい。
【0060】
[0061] 部分的に架橋された多糖およびさらなる架橋剤のタイプおよび量の選択は、望ましくは、第1の成分および第2の成分を混合しそして得られた混合物を生体組織または構造上にスプレーしまたはそれ以外の方法で向けるために必要とされる可能性がある可能性のある最小時間および最大時間を考慮に入れる。早期のゲル形成を、適切な容器中に水(例えば、100 mL)を場合により適切な架橋クエンチャー(例えば、グルコサミン)と混合させて入れ、第1の成分と第2の成分との新鮮な混合物および選択的な水-可溶性比色色素(例えば、上述した様な色素)を調製し、そしてその混合物を水表面上に短い空中距離(例えば、数mm)を超えて下方に迅速にスプレーし、そしてゲル粒子が形成されるかどうかまたは色素痕跡が水中で可視化できるかどうかを観察することにより、推定することができる。
【0061】
[0062] 多糖またはさらなる架橋剤は、キトサンまたはキトサン誘導体を含有する。第1の成分が部分的に架橋されたキトサンを含有しそして第2の成分が酸化キトサンを含有する二成分組成物もまた、調製することができる。
【0062】
[0063] 開示された組成物は、望ましくは、実質的にコラーゲンを含まない。好ましくは、組成物は、十分にコラーゲン不含(例えば、コラーゲンを何も含まない)なものであり、ヒトにおいて制限なしに世界中で販売可能になる。
【0063】
[0064] 開示された組成物は、典型的には滅菌に供され、そして最終消費者への出荷前に適切なシール化パッケージング(例えば、複数成分シリンジ、(1または複数の)バイアル、または適切な材料からなるマルチチャンバポーチ)中におかれる。追加的な特性カスタマイズを、γ線照射処理または電子線(E-Beam)処理等の滅菌手順を使用して制御された鎖切断を生じさせることにより、行うことができる。同日に出願された同時係属中PCT出願公開No.WO2009/132229 A2に記載される様に、低温イオン化放射線滅菌(例えば、低温E-Beam滅菌)を使用して、鎖切断の程度を制限することができる。滅菌するかどうかに関わらず、通常は、部分的に架橋された多糖を含有する第1の成分を、使用直前まで、さらなる架橋剤を含有する第2の成分から分離し続ける。
【0064】
[0065] 部分的に架橋された多糖およびさらなる架橋剤は、例えば、約20:1〜約1:20、約10:1〜約1:10、約5:1〜約1:10、約3:1〜約1:5、または約20:1のモル比で組み合わせることができる。いったん第1の成分と第2の成分とが混合されたら、好ましくはさらなる架橋反応が混合の開始後数分以内(例えば、5分未満、3分未満、2分未満、または1分未満)に実質的に完了し、望ましくは体温で垂直な皮膚表面上の標的領域からこぼれたり流れたりしない、最初は流体である保護層が得られる。リン酸イオンの存在は、架橋反応を促進するようである。部分的に架橋された多糖とさらなる架橋剤の一方または両方のための溶媒としてPBSを使用することにより、ホスフェートを提供することができる。
【0065】
[0066] 開示された組成物および保護層には、場合により、水和の前または後の様々なその他の有効成分が含まれていてもよい。例示的なその他の有効成分には、非水性溶媒、酸、塩基、緩衝化剤、抗菌剤、治療剤、およびその他のアジュバントが含まれる。酸、塩基または緩衝化剤は、例えば、ヒト組織と接触するために適切なpH、例えば、4.5よりも高いpH、ほぼ中性のpH、または8.5未満のpH、で組成物、保護層、またはその両方を維持することができる。例示的な緩衝化剤には、バルビタールナトリウム(barbitone sodium)、グリシンアミド、グリシン、塩化カリウム、リン酸カリウム、炭酸水素カリウムフタレート、酢酸ナトリウム、クエン酸ナトリウム、リン酸ナトリウム、およびそれらの共役酸が含まれる。
【0066】
[0067] 開示された組成物は、望ましくは、別個の抗菌剤を追加する必要なしに、もともと抗菌性である。抗菌活性は、組成物中のキトサンまたはキトサン誘導体の比率(より高い比率は、より高い抗菌性活性をもたらす傾向がある)により、そして利用可能なキトサンアミン基の数により、影響される可能性がある。従って、少数の利用可能なアミノ水素原子を含有するキトサン基(例えば、上述したWeng et al.の論文において所望されるN-カルボキシエチル誘導体)を使用することは、禁忌を示す可能性がある。いずれにしても、所望の場合、別個の抗菌剤を使用することができる。そのような抗菌剤の有用なリストは、例えば、上述したU.S.特許出願公開No. US 2007/0264310 A1中に見出すことができる。
【0067】
[0068] 開示された組成物中で使用することができる例示的な治療剤には、鎮痛薬、抗-コリン作動薬、抗-真菌剤、抗ヒスタミン剤、ステロイド性または非ステロイド性抗-炎症剤、抗-寄生虫剤、抗ウイルス剤、生物静力学的組成物、化学療法剤/抗腫瘍剤、サイトカイン、充血除去剤、止血剤(例えば、トロンビン)、免疫抑制剤、粘液溶解剤、核酸、ペプチド、タンパク質、ステロイド、血管収縮剤、ビタミン、これらの組合せ、そして当業者に知られているその他の治療用材料を含む、目的とする治療部位での使用のために適したいずれかの材料が含まれる。そのような治療剤の有用なリストは、例えば、上述のU.S.特許出願公開No. US 2007/0264310 A1中に見出すことができる。
【0068】
[0069] 開示された組成物中に含ませることができるその他のアジュバントには、染料、色素、またはその他の着色剤(例えば、FD & C Red No. 3、FD & C Red No. 20、FD & C Yellow No. 6、FD & C Blue No.2、D & C Green No. 5、D & C Orange No. 4、D & C Red No. 8、キャラメル、二酸化チタン、果物または野菜の着色剤(ビート粉末、またはβ-カロテン、ターメリック、パプリカ)、および当業者に知られているその他の材料);指示薬;アニス油、サクラ、桂皮油、柑橘油(例えば、レモン油、ライム油またはオレンジ油)、ココア、ユーカリ、ハーブ芳香剤(例えば、丁子油、セージ油またはカッシア油)、ラクトース、マルトース、メントール、ペパーミント油、サッカリン、シクラミン酸ナトリウム、スペアミント油、ソルビトール、スクロース、バニリン、冬緑油、キシリトール、およびこれらの混合物を含む(しかしこれらには限定されない)香味剤または甘味剤;抗酸化剤;消泡剤;および増粘剤およびチキソトロープ(thixotropes)を含むレオロジー修正剤;が含まれる。開示された組成物は、望ましくは、粘膜組織または構造(例えば、鼻腔または副鼻腔中の組織)に潜在的に悪影響を与える可能性がある成分を含有しない。
【0069】
[0070] 組織から水を除去すること、例えば、ポリープまたは浮腫性組織から液体を除去すること、が好ましい事例において、高張性剤を、開示された組成物中で使用することができる。例示的な高張性剤には、フロセミド、塩化ナトリウムゲルおよび組織から水を引き出すその他の塩調製物または粘膜層の浸透圧容量を直接的または間接的に変化させるその他の物質が含まれる。治療剤の持続性放出または遅延放出が望ましい場合、離型剤修正剤が含まれていてもよい。
【0070】
[0071] 望ましくは、開示された組成物を、細菌性バイオフィルムを崩壊しそしてその回復を阻止する複数工程の処置手順の一部として使用することができる。例えば、洗浄/崩壊、殺傷、通気、保護/コーティング、そして回復(Healing)と幅広く分類することができる一連の工程を行うことができる。これらの様々な工程を、例えば殺傷工程および通気工程が行われる順番を逆転させることができるなどの様々な順列で、行うことができる。図1および図2に関連して検討する様に、洗浄/崩壊工程を、溶媒システムを投与することにより行うことができる。殺傷工程を、適切な抗菌剤を治療部位に適用することにより、行うことができる。このことは、例えば、別個に適用される組成物として溶媒システム中において、または溶媒システム中そして別個に適用される組成物中の両方において、抗菌剤を含ませることにより、達成することができる。抗菌剤を、手術後に適用しまたは投与することもできる。通気工程を、開口している閉塞された通路または部分的に閉塞された通路(例えば、鼻適用のための洞または洞小孔)により治療される組織に対して空気通路を提供しまたは空気通路を改良することにより、行うことができる。このことは、例えば、閉塞組織構造を外科的に除去することにより、またはそのような構造を手作業により排除することにより、達成することができる。保護/コーティング工程を、このように処理された組織の少なくとも部分を上述した部分的に架橋された多糖およびさらなる架橋剤とを含有する開示された保護層でコーティングすることにより、行うことができる。回復工程を、洗浄され、保護され、そしてシールされた組織表面を、例えば、炎症性応答の調節、食作用、粘膜リモデリング、繊毛再生、または正常な機能の完全なまたは部分的な回復、などの1またはそれ以上の治癒メカニズムを介して、正常の状態へと回復させることにより、行うことができる。複数工程の治療計画には、洗浄工程が含まれてもよくまたはその後に洗浄工程を行ってもよく、ここでは、部分的に架橋された多糖およびさらなる架橋剤とを含有する開示された保護層が、所望の期間、例えば、1日以上、3日以上、約4〜7日内、または約7〜28日内に、そして望ましくは大きな固形の塊を取り除くことなく、治療部位から消失する様に十分に生物分解性または生体吸収性である。開示された方法は、有利には、外科手術を必要とすることなく、例えば、随意的な溶媒システムを適用しそして除去することにより、そして通常の吸引/吸着技術を介して開示された保護層を適用することにより、または罹患組織を単純に洗い流すことにより、達成することができる。比較されうる一連の工程は、中耳または内耳の部分における複数工程の治療計画において、行うことができる。そのような計画のさらなる詳細は、U.S.特許出願公開No. US 2007/0264310 A1中に見出すことができる。
【0071】
[0072] 本発明は、以下の限定的ではない実施例においてさらに説明される。
【実施例】
【0072】
実施例1 酸化多糖を用いた部分的架橋
[0073] キトサン溶液を、水またはPBS中、様々な量のキトサングルタメート(FMC BioPolymer ASのNovaMatrixユニットから入手したPROTASANTM UP G 113、または“G 113”)を溶解することにより調製した。酸化メチルセルロース(“OXMC”)溶液を、部分的に酸化されたメチルセルロース(Sigma Aldrich Companyから入手したMO387)を過ヨウ素酸ナトリウムと反応させることにより、調製した。溶液を様々な比で混合し、ガラスペトリ皿に注ぎ入れ、そして冷凍乾燥させることにより凍結乾燥させて、白色泡状生成物を提供した。凍結乾燥させた生成物を、水中に浸漬し、そして定性的な水の取り込み速度を決定する様に観察した。結果を、表1に示す。
【0073】
【表1】

[0074] 追加の製剤を、酸化メチルセルロースではなく、酸化ヒドロキシプロピルメチルセルロース(Sigma Aldrich Companyから入手した、442755部分的に酸化されたヒドロキシプロピルメチルセルロース)を使用して、同様に調製した。これらは、より迅速な水の取り込みを示した。
【0074】
[0075] 表1に示される凍結乾燥された生成物は、様々な程度の架橋を示し、実行No. 1の製剤は最も高い程度の架橋を示し、そして実行No. 4の製剤は最も低い程度を示した。得られた水和された生成物は、ゲニピンなどのさらなる架橋剤と混合することができ、そして治療部位上にまたは治療部位中にスプレーされるかまたは注入された。
【0075】
実施例2 グルタルアルデヒドを用いた部分的架橋
[0076] PBS中G113キトサングルタメートの5%溶液の1.5 mL部分およびPBS中グルタルアルデヒドの0.015%溶液の1.5 mL部分を、それぞれ3 mL単一バレルシリンジ中に入れた。シリンジの先端は、カニューレを使用して接続され、そしてその含有物は2本のシリンジプランジャーを交互に押し込んだり引き出したりすることにより均一になるまで混合した。混合物を一晩おいた。得られた部分的に架橋された多糖は、2.5%キトサングルタメート溶液と75 ppmグルタルアルデヒドとの反応生成物を含有した。
【0076】
実施例3 スプレー適用
[0077] PBS中ジアルデヒドでんぷん(Monomer-Polymer & Dajac Labs, Inc.から入手したNo. 9056、>80%酸化でんぷん)溶液を凍結乾燥し、その後凍結乾燥生成物を十分に脱イオン化した水中に溶解することにより水和して、5%酸化でんぷんを含有するさらなる架橋剤溶液を提供した。ガス補助アプリケーター(Micromedics, Inc.から入手したFIBRIJET SA-6030レギュレータ、一対の3 ccシリンジを附属したFIBRIJET SA-3652スプレーセットを調節する)を使用して、実施例2で得られた部分的に架橋された多糖溶液と5%酸化でんぷん溶液とを1:1の比で垂直方向のヒトの手に対してスプレー適用し、体温で実質的に垂直な組織表面に対する設定時間と接着とを観察した。約3〜4 mLの混合物をスプレーして、流体保護層を形成した。組成物は、良好なスプレー特性を示し、付着部位に十分に接着しているようであり、そして付着部位を薄く共形なフィルムで被覆している様であり、そしてこぼれたりたれたりまたは流れたりしなかった。得られた保護層は、粘着性で、柔軟性があり、十分に接着し、そして水に曝されると滑らかになった。保護層を除去するためには洗浄(Scrubbing)が必要であった。
【0077】
[0078] 比較実行において、部分的に架橋された多糖溶液を、部分的に架橋しなかった2.5%キトサングルタメート溶液に置換した。スプレー適用したコーティングは、付着後すぐに流れそしてこぼれ始めた。コーティングは、最初は薄くそして水っぽく、そしてスプレー後約16秒後には粘着性で、流れやすくない状態になった。コーティングは、部分的に架橋された多糖を使用して調製されたコーティングと比較して、安定さが低くそして硬さが低いようであった。
【0078】
実施例4 キトサンを用いた部分的架橋
[0079] 実施例2の方法を使用して、酸化されたメチルセルロース溶液を、架橋されていない形状および部分的に架橋された形状で、様々な量のキトサングルタメートを部分的架橋剤として使用して、調製した。15%の酸化されたメチルセルロース溶液を、MO387メチルセルロース(Sigma-Aldrich Co.)を過ヨウ素酸ナトリウムと脱イオン水中で反応させることにより、作成した。反応生成物を、その後凍結乾燥し、そしてPBS中で再水和した。この溶液の0.5 mLの部分を3 mLのシリンジ中に取り、そしてPBS中0.3%G113キトサングルタメート溶液の0.5 mL部分を含有するシリンジと混合し、脱気し、そして24時間そのままにし、それにより0.15%キトサンと反応させた7.5%酸化メチルセルロースを含有する部分的に架橋された多糖を提供した(溶液A)。同様にして、メチルセルロース溶液の0.5 mL部分を、PBS中0.5%G113キトサングルタメート溶液の0.5 mL部分を含有するシリンジと混合して、それにより0.25%キトサンと反応させた7.5%酸化メチルセルロースを含有する部分的に架橋された多糖を提供した(溶液B)。非-架橋7.5%酸化メチルセルロース溶液を、対照として調製した(溶液C)。
【0079】
[0080] 実施例3の方法を使用して、溶液A、溶液Bおよび溶液Cを、PBS中5%G113キトサングルタメート溶液と1:1の比で垂直-方向のヒトの手にスプレー適用した。約2 mLのそれぞれの混合物をスプレーして、流体保護層を形成した。溶液Aおよび溶液Bを使用して作成した組成物は、良好なスプレー特性を示し、付着部位に十分に接着し、そして付着部位を薄く共形なフィルムで被覆するようであり、そしてこぼれたり落ちたり流れたりしなかった。溶液Bを使用して作成した組成物は、溶液Aを使用して作成した組成物と比較して、わずかながらより固い保護層を形成したようであった。両方の保護層とも、粘着性で、柔軟性があり、十分に接着し、そして水に曝されると滑らかになった。コーティングを除去するためには洗浄(Scrubbing)が必要であった。
【0080】
[0081] 溶液Cを使用して作成した組成物は、適用後すぐに流れ始め、そしてそしてスプレー後約20〜30秒後には流れるのが止まり、そして固定(set)されたようであった。
【0081】
[0082] 上述した結果は、部分的に架橋された多糖が、さらなる架橋剤と組み合わされて、薄く共形な流体保護層を体温での実質的に垂直な組織表面上でin situで迅速に形成する流体のスプレー可能混合物を調製することができることを示す。製剤は、それぞれの場合において、スプレー可能で、抗菌性で、生分解性または生体吸収性であり、そして薬物送達のための骨格として機能することができる。
【0082】
[0083] 好ましい態様を記載することを目的として、本明細書中に具体的な態様を説明しそして記載したが、当業者には、同一の目的を達成すると予想された幅広い様々な代替的なまたは均等な実施が、本発明の概念から離れることなく示されそして記載された特定の態様と置換しうるものであることを理解するであろう。この用途は、本明細書中で検討された好ましい態様のいずれの適合またはバリエーションもカバーする様に意図される。したがって、本発明は、請求の範囲およびその均等範囲によってのみ限定されることが明確に意図される。
【特許請求の範囲】
【請求項1】
部分的に架橋された多糖を含む第1の成分と多糖用のさらなる架橋剤を含む第2の成分との二成分組成物であって、多糖またはさらなる架橋剤はキトサンまたはキトサン誘導体を含み、そして組成物が水和されそして混合された場合に、組成物をスプレーアプリケータを介して流体として送達し、薄く共形な保護層を体温で実質的に垂直な皮膚表面上に提供することができる、前記二成分組成物。
【請求項2】
多糖がキトサンまたはキトサン誘導体を含む、請求項1に記載の組成物。
【請求項3】
さらなる架橋剤がキトサンまたはキトサン誘導体を含む、請求項1に記載の組成物。
【請求項4】
多糖およびさらなる架橋剤がキトサンまたはキトサン誘導体を含む、請求項1に記載の組成物。
【請求項5】
多糖またはさらなる架橋剤がセルロースまたはセルロース誘導体を含む、請求項1に記載の組成物。
【請求項6】
多糖またはさらなる架橋剤がでんぷんまたはでんぷん誘導体を含む、請求項1に記載の組成物。
【請求項7】
多糖またはさらなる架橋剤が、キチン、コンドロイチン硫酸、デキストラン、グリコーゲン、ヒアルロン酸、またはそれらの誘導体を含む、請求項1に記載の組成物。
【請求項8】
多糖およびさらなる架橋剤を約20:1〜約1:20のモル比で組み合わせる、請求項1に記載の組成物。
【請求項9】
多糖およびさらなる架橋剤を約3:1〜約1:5のモル比で組み合わせる、請求項1に記載の組成物。
【請求項10】
リン酸イオンをさらに含む、請求項1に記載の組成物。
【請求項11】
シリンジ中にパッケージングされる、請求項1に記載の組成物。
【請求項12】
多糖が乾燥粒子形状である、請求項11に記載の組成物。
【請求項13】
水和されそして混合された場合に、組成物が、スプレー適用されて、薄く、共形でそして初めは流体の保護層を、体温で実質的に垂直な皮膚表面上に形成することができ、そしてそのように適用した場合には表面からこぼれたり流れたりしない、請求項1に記載の組成物。
【請求項14】
最初は部分的に架橋された多糖と多糖用のさらなる架橋剤との流体混合物を含む、体温表面上の保護層であって、多糖またはさらなる架橋剤はキトサンまたはキトサン誘導体を含み、そして部分的に架橋された多糖がさらなる架橋剤との混合前に部分的に架橋されたものである、前記保護層。
【請求項15】
多糖がキトサンまたはキトサン誘導体を含む、請求項14に記載の保護層。
【請求項16】
さらなる架橋剤がキトサンまたはキトサン誘導体を含む、請求項14に記載の保護層。
【請求項17】
多糖およびさらなる架橋剤がキトサンまたはキトサン誘導体を含む、請求項14に記載の保護層。
【請求項18】
多糖またはさらなる架橋剤が、セルロースまたはセルロース誘導体を含む、請求項14に記載の保護層。
【請求項19】
多糖またはさらなる架橋剤がでんぷんまたはでんぷん誘導体を含む、請求項14に記載の保護層。
【請求項20】
多糖またはさらなる架橋剤が、キチン、コンドロイチン硫酸、デキストラン、グリコーゲン、ヒアルロン酸またはそれらの誘導体を含む、請求項14に記載の保護層。
【請求項21】
層が表面からこぼれたり流れたりしない、請求項14に記載の保護層。
【請求項22】
以下の工程:
a) 部分的に架橋された多糖溶液を含む第1の成分と多糖用のさらなる架橋剤を含む第2の成分との二成分組成物を混合する工程、ここで、多糖またはさらなる架橋剤は、キトサンまたはキトサン誘導体を含む;
b) 流体としての混合された成分を生体組織または構造上に向けて適用して、その上に保護層を形成する工程;
を含む、生体組織または構造を処置するための方法。
【請求項23】
組成物をマルチ-バレルシリンジを使用して混合することを含む、請求項22に記載の方法。
【請求項24】
流体をスプレーすることにより適用する、請求項22に記載の方法。
【請求項25】
流体を鼻腔に対して適用することを含む、請求項22に記載の方法。
【請求項26】
流体を副鼻腔に対して適用することを含む、請求項22に記載の方法。
【請求項27】
流体を中耳または内耳に対して適用することを含む、請求項22に記載の方法。
【請求項28】
流体を四肢における開口部、陥凹部、通路、または接合部に対して適用することを含む、請求項22に記載の方法。
【請求項29】
流体を脊柱における開口部、陥凹部、通路、または接合部に対して適用することを含む、請求項22に記載の方法。
【請求項30】
混合された成分が組織または構造からこぼれたり流れたりしない、請求項22に記載の方法。
【請求項31】
多糖がキトサンまたはキトサン誘導体を含む、請求項22に記載の方法。
【請求項32】
さらなる架橋剤がキトサンまたはキトサン誘導体を含む、請求項22に記載の方法。
【請求項33】
多糖またはさらなる架橋剤がセルロースまたはセルロース誘導体を含む、請求項22に記載の方法。
【請求項34】
多糖またはさらなる架橋剤がでんぷんまたはでんぷん誘導体を含む、請求項22に記載の方法。
【請求項35】
多糖またはさらなる架橋剤が、キチン、コンドロイチン硫酸、デキストラン、グリコーゲン、ヒアルロン酸、またはそれらの誘導体を含む、請求項22に記載の方法。
【請求項36】
組成物がリン酸イオンをさらに含む、請求項22に記載の方法。
【請求項1】
部分的に架橋された多糖を含む第1の成分と多糖用のさらなる架橋剤を含む第2の成分との二成分組成物であって、多糖またはさらなる架橋剤はキトサンまたはキトサン誘導体を含み、そして組成物が水和されそして混合された場合に、組成物をスプレーアプリケータを介して流体として送達し、薄く共形な保護層を体温で実質的に垂直な皮膚表面上に提供することができる、前記二成分組成物。
【請求項2】
多糖がキトサンまたはキトサン誘導体を含む、請求項1に記載の組成物。
【請求項3】
さらなる架橋剤がキトサンまたはキトサン誘導体を含む、請求項1に記載の組成物。
【請求項4】
多糖およびさらなる架橋剤がキトサンまたはキトサン誘導体を含む、請求項1に記載の組成物。
【請求項5】
多糖またはさらなる架橋剤がセルロースまたはセルロース誘導体を含む、請求項1に記載の組成物。
【請求項6】
多糖またはさらなる架橋剤がでんぷんまたはでんぷん誘導体を含む、請求項1に記載の組成物。
【請求項7】
多糖またはさらなる架橋剤が、キチン、コンドロイチン硫酸、デキストラン、グリコーゲン、ヒアルロン酸、またはそれらの誘導体を含む、請求項1に記載の組成物。
【請求項8】
多糖およびさらなる架橋剤を約20:1〜約1:20のモル比で組み合わせる、請求項1に記載の組成物。
【請求項9】
多糖およびさらなる架橋剤を約3:1〜約1:5のモル比で組み合わせる、請求項1に記載の組成物。
【請求項10】
リン酸イオンをさらに含む、請求項1に記載の組成物。
【請求項11】
シリンジ中にパッケージングされる、請求項1に記載の組成物。
【請求項12】
多糖が乾燥粒子形状である、請求項11に記載の組成物。
【請求項13】
水和されそして混合された場合に、組成物が、スプレー適用されて、薄く、共形でそして初めは流体の保護層を、体温で実質的に垂直な皮膚表面上に形成することができ、そしてそのように適用した場合には表面からこぼれたり流れたりしない、請求項1に記載の組成物。
【請求項14】
最初は部分的に架橋された多糖と多糖用のさらなる架橋剤との流体混合物を含む、体温表面上の保護層であって、多糖またはさらなる架橋剤はキトサンまたはキトサン誘導体を含み、そして部分的に架橋された多糖がさらなる架橋剤との混合前に部分的に架橋されたものである、前記保護層。
【請求項15】
多糖がキトサンまたはキトサン誘導体を含む、請求項14に記載の保護層。
【請求項16】
さらなる架橋剤がキトサンまたはキトサン誘導体を含む、請求項14に記載の保護層。
【請求項17】
多糖およびさらなる架橋剤がキトサンまたはキトサン誘導体を含む、請求項14に記載の保護層。
【請求項18】
多糖またはさらなる架橋剤が、セルロースまたはセルロース誘導体を含む、請求項14に記載の保護層。
【請求項19】
多糖またはさらなる架橋剤がでんぷんまたはでんぷん誘導体を含む、請求項14に記載の保護層。
【請求項20】
多糖またはさらなる架橋剤が、キチン、コンドロイチン硫酸、デキストラン、グリコーゲン、ヒアルロン酸またはそれらの誘導体を含む、請求項14に記載の保護層。
【請求項21】
層が表面からこぼれたり流れたりしない、請求項14に記載の保護層。
【請求項22】
以下の工程:
a) 部分的に架橋された多糖溶液を含む第1の成分と多糖用のさらなる架橋剤を含む第2の成分との二成分組成物を混合する工程、ここで、多糖またはさらなる架橋剤は、キトサンまたはキトサン誘導体を含む;
b) 流体としての混合された成分を生体組織または構造上に向けて適用して、その上に保護層を形成する工程;
を含む、生体組織または構造を処置するための方法。
【請求項23】
組成物をマルチ-バレルシリンジを使用して混合することを含む、請求項22に記載の方法。
【請求項24】
流体をスプレーすることにより適用する、請求項22に記載の方法。
【請求項25】
流体を鼻腔に対して適用することを含む、請求項22に記載の方法。
【請求項26】
流体を副鼻腔に対して適用することを含む、請求項22に記載の方法。
【請求項27】
流体を中耳または内耳に対して適用することを含む、請求項22に記載の方法。
【請求項28】
流体を四肢における開口部、陥凹部、通路、または接合部に対して適用することを含む、請求項22に記載の方法。
【請求項29】
流体を脊柱における開口部、陥凹部、通路、または接合部に対して適用することを含む、請求項22に記載の方法。
【請求項30】
混合された成分が組織または構造からこぼれたり流れたりしない、請求項22に記載の方法。
【請求項31】
多糖がキトサンまたはキトサン誘導体を含む、請求項22に記載の方法。
【請求項32】
さらなる架橋剤がキトサンまたはキトサン誘導体を含む、請求項22に記載の方法。
【請求項33】
多糖またはさらなる架橋剤がセルロースまたはセルロース誘導体を含む、請求項22に記載の方法。
【請求項34】
多糖またはさらなる架橋剤がでんぷんまたはでんぷん誘導体を含む、請求項22に記載の方法。
【請求項35】
多糖またはさらなる架橋剤が、キチン、コンドロイチン硫酸、デキストラン、グリコーゲン、ヒアルロン酸、またはそれらの誘導体を含む、請求項22に記載の方法。
【請求項36】
組成物がリン酸イオンをさらに含む、請求項22に記載の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公表番号】特表2011−518839(P2011−518839A)
【公表日】平成23年6月30日(2011.6.30)
【国際特許分類】
【出願番号】特願2011−506466(P2011−506466)
【出願日】平成21年4月23日(2009.4.23)
【国際出願番号】PCT/US2009/041592
【国際公開番号】WO2009/132228
【国際公開日】平成21年10月29日(2009.10.29)
【出願人】(591007804)メドトロニック,インコーポレイテッド (243)
【住所又は居所原語表記】710Medtronic Parkway,Minneapolis,Minnesota 55432,U.S.A
【Fターム(参考)】
【公表日】平成23年6月30日(2011.6.30)
【国際特許分類】
【出願日】平成21年4月23日(2009.4.23)
【国際出願番号】PCT/US2009/041592
【国際公開番号】WO2009/132228
【国際公開日】平成21年10月29日(2009.10.29)
【出願人】(591007804)メドトロニック,インコーポレイテッド (243)
【住所又は居所原語表記】710Medtronic Parkway,Minneapolis,Minnesota 55432,U.S.A
【Fターム(参考)】
[ Back to top ]

