キナゾリン誘導体と血小板血症の治療におけるその使用
式(I)から式(III)の化合物、又はその平衡化した形態の、治療的に効果的な量を投与することを備えた、患者の血小板血症の治療方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、血小板血症を治療するために有用な化合物に関する。本発明はまた、血小板数を低減させるために有用な化合物に関する。
【背景技術】
【0002】
血小板血症は、血小板の増加又は異常な産生を伴う慢性疾患である。血小板は血液凝固に関係しているため、それらの異常な産生は、患者の消化管出血、心臓麻痺と心臓拍動の危険性が増加するという結果を伴う、血栓の不適切な産生又は出血を招く可能性がある。
【0003】
アナグレライドは、本態性血小板血症や種々のほかの骨髄増殖症候群の治療に用いられるキナゾリン誘導ホスホジエステラーゼ阻害薬である。アナグレライドは、米国とカナダで本態性血小板血症の治療のために1997年に承認され発売された。1998年の12月に、米国食品医薬品局は、特に、真性赤血球増加症(PV)と慢性骨髄性白血病(CML)を含む、骨髄増殖症候群に従属的な血小板血症を有する患者の治療のために、アナグレライドの拡大ラベルを承認した。
【0004】
本発明により包含される化合物は、3−ヒドロキシアナグレライドである。これは、アナグレライドの代謝産物である(例えば、米国公開第20040209907号として公開された米国特許出願第10/762,566号を参照)。
【0005】
アナグレライドの様々な代謝産物は、文献中で検討されている:Erusalimsky et al. (2002) Is the platelet lowering activity of anagrelidemediated by its major metabolite 2-amino-5,6-dichloro-3,4-dihydroquinazoline(RL603)? Exp Hematol. 30:625-7;Lane et al. (2001) Anagrelidemetabolite induces thrombocytopenia in mice by inhibiting megakaryocyte maturation without inducing platelet aggregation. Exp Hematol. 29:1417-241;及びGaver et al. (1981) Disposition of anagrelide, an inhibitor of platelet aggregation. Clin PharmacolTher. 29:381-6。
【0006】
本発明の目的の一つは、血小板血症を治療するために用いられる可能性のあるアナグレライドに関連する化合物を提供することである。
【発明の開示】
【0007】
一実施形態において、本発明は、
【化13】

【化14】

【化15】

である化合物、その平衡化した形態、その薬学的に許容可能な塩、又はその平衡化した形態の薬学的に許容可能な塩を提供し、
ここで
R1は、H、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、又はC6−10アリールであり;
R2は、
【化16】

又は
【化17】

であり;
R3は、OH、ハロゲン、SH、O−C1−6アルキル又はヒドロキシル模倣基であり;及び
XとYは独立してH又はハロゲンである。
【0008】
上記化合物について好ましくは、ベンジル環の5位と6位にXとYの置換基を含む。
【0009】
式(I)から式(III)の化合物は、血小板血症の治療と血小板数の低減に有用である。式(I)から式(III)の化合物は、少なくとも1つのほかの治療剤と組み合わせて用いることができる。
【0010】
本発明はまた、式(I)から式(III)の化合物のいずれかと薬学的に許容可能な担体又は賦形剤とからなる医薬製剤を提供する。
【0011】
さらなる実施例において、血小板血症の治療用の薬剤を製造するための、式(I)から式(III)の化合物の使用法が提供される。
【図面の簡単な説明】
【0012】
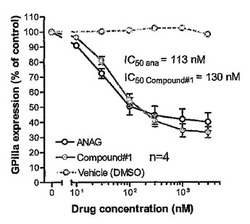
【図1】以下の実施例3でより十分に説明されるように、TPO誘導巨核球系(MK)成熟におけるアナグレライドと化合物番号1の効果を比較する用量反応グラフである。
【図2】以下の実施例3でより十分に説明されるように、アナグレライドと化合物番号1による巨核細胞形成の選択的阻害を比較するグラフである。
【発明を実施するための最良の形態】
【0013】
特に定義されない限り、ここで用いられるすべての技術的及び科学的用語は、本発明の属する分野における通常の知識を有する者によって一般的に理解されるものと同じ意味を有する。ここで引用される、すべての刊行物、特許出願、特許、その他の参考文献は、それらの全体が引用されて組み込まれる。抵触の場合は、定義を含む本明細書は規制されるだろう。さらに、材料、方法、例は、単に説明的なものであって、限定することを意図しているものではない。
【0014】
本発明の一実施形態において、本発明の化合物は、以下の実施形態におけるものを、独立して又は組み合わせて、包含している。
【0015】
一実施形態において、本発明は、
【化18】

【化19】

【化20】

の式の化合物、その平衡化した形態、その薬学的に許容可能な塩、又はその平衡化した形態の薬学的に許容可能な塩を提供し、
ここで
R1は、H、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、又はC6−10アリールであり;
R2は、
【化21】

又は
【化22】

であり;
R3は、OH、ハロゲン、SH、O−C1−6アルキル又はヒドロキシル模倣(hydroxymimetic)基であり;及び
XとYは独立して、H又はハロゲンである。
【0016】
好ましい実施形態は、ベンジル環の5位と6位にXとYの置換基を含む。
【0017】
一実施形態において、R1は、H又はC1−6アルキルである。別の実施形態において、R1は、H又はCH3である。別の実施形態において、R1は、Hである。
【0018】
一実施形態において、R3は、OH又はO−C1−6アルキルである。別の実施形態において、R3は、OH又はOCH3である。別の実施形態において、R3は、OHである。
【0019】
一実施形態において、Xは、H又はハロゲンである。別の実施形態において、Xは、Hである。別の実施形態において、Xは、Clである。別の実施形態において、Yは、H又はClである。別の実施形態において、Yは、Hである。別の実施形態において、Yは、Clである。
【0020】
一実施形態において、治療される血小板血症は、骨髄増殖性の血液疾患を伴う。
【0021】
一実施形態において、血小板血症は、本態性血小板血症(ET)、慢性骨髄性白血病(CML)、真性赤血球増加症(PV)、原因不明の骨髄化生(AMM)、又は鎌状赤血球貧血(SCA)を伴う。
【0022】
さらなる実施形態において、血小板血症は、ET、CML、PV、AMM、又はSCAが原因となって引き起こされたものである。
【0023】
さらなる実施形態において、式(I)から(III)の化合物は、患者の血小板数を低減するために使用可能である。
【0024】
本発明の化合物としては、N−(5,6−ジクロロ−3,4−ジヒドロキナゾリン−2−イル)−2−オキソアセトアミドである
【化23】

と;N−(5,6−ジクロロ−3,4−ジヒドロキナゾリン−2−イル)−2−オキソアセトアミド水化物である
【化24】

と;6,7−ジクロロ−3−ヒドロキシ−1,5−ジヒドロ−イミダゾ[2,1−b]キナゾリン−2−オンである
【化25】

と;6,7−ジクロロ−3−ヒドロキシ−1,5−ジヒドロ−イミダゾ[2,1−b]キナゾリン−2−オンである
【化26】

と;6,7−ジクロロ−1−ヒドロキシ−3,5−ジヒドロ−イミダゾ[1,2−a]キナゾリン−2−オンである
【化27】

が挙げられる。
【0025】
本発明によれば、化合物は、十分に純粋な形態である。
【0026】
本発明で用いられる用語「十分に純粋」は、標準的な分析方法により測定したときに、化合物が少なくとも80%純粋であり、好ましくは少なくとも85%純粋であり、より好ましくは少なくとも90%純粋であり、さらにより好ましくは少なくとも95%純粋であり、最も好ましくは少なくとも99%純粋であることを意味する。
【0027】
いかなる理論に拘束されることなく(機構の理解は本発明の実施に必要ではなく、本発明は特定の機構に限定されない)、本発明者らは、本発明の化合物が平衡化した形態にあると考えている。本発明の化合物の平衡化した形態は、以下のように表現される:
【化28】

【0028】
ここで用いられる用語「平衡化した形態」は、式(I)から(III)の化合物の互変体を含む。
【0029】
本発明の化合物の平衡化した形態は、下記のようにも表現される。
【0030】
【化29】

【0031】
このすべての平衡化した形態は、本発明の範囲に含まれる。
【0032】
この分野で通常の知識を有する者によって、化合物(I)から(III)が互変体又は光学異性体として存在してもよいことが理解されるだろう。この化合物のすべての平衡化した異性体と互変体は、本発明の範囲内に含まれる。単一の光学異性体又は鏡像異性体は、この分野でよく知られた方法、例えば、キラルHPLC、酵素分解、及びキラル助剤によって得ることができ、或いは、立体選択的に合成可能である。
【0033】
ここで用いられる「ヒドロキシ模倣」は、ヒドルキシル(−OH)基に関係する化学的な官能基を表している。これは、水素結合の供与体又は受容体として振舞うことのできる官能基である。ヒドロキシ模倣基の例としては、限定されないがNH2−とSH−が挙げられる。
【0034】
本発明の化合物の薬学的に許容可能な塩もまた提供される。一般式(I)から(III)の化合物の用語「薬学的に許容可能な塩」に関して、それが意味するものは、薬学的に許容可能な無機及び有機の酸と塩基から誘導されたものである。適切な酸の例としては、塩酸、臭化水素酸、硫酸、硝酸、過塩素酸、フマル酸、マレイン酸、リン酸、グリコール酸、乳酸、サリチル酸、コハク酸、トルエン−p−スルホン酸、酒石酸、酢酸、クエン酸、メタンスルホン酸、ギ酸、安息香酸、マロン酸、ナフタレン−2−スルホン酸、ベンゼンスルホン酸が挙げられる。シュウ酸などの他の酸は、それ自体、薬学的に許容可能ではないが、本発明の化合物とその薬学的に許容可能な酸付加塩を取得するときの中間体として有用かもしれない。
【0035】
適切な塩基から得られる塩としては、アルカリ金属(例えば、ナトリウム)塩、アルカリ土類金属(例えば、マグネシウム)塩、アンモニウム塩、NR4(ここで、Rは、C1−4アルキル)塩が挙げられる。
【0036】
本出願で用いられる用語「アルキル」は、置換されていない又は置換された(ハロゲン、ニトロ、CONH2、COOH、O−C1−6アルキル、O−C2−6アルケニル、ヒドロキシル、アミノ、又はCOOQ、ここで、QはC1−6アルキル、C2−6アルケニル;C2−6アルキニルによって)直鎖、分岐鎖又は環状の炭化水素部分(例えば、イソプロピル、エチル、フルオロエチル又はシクロプロピル)を表す。アルキルという用語は、1つ以上の水素元素がハロゲン、より好ましくは、ハロゲンはフッ素によって置換されたアルキル(例えば、−CF3又は−CH2CF3)をも含むことを意図している。
【0037】
ここで用いられる用語「アルケニル」と「アルキニル」は、少なくとも1つの不飽和基(例えば、アリル)を含むアルキル(上記で定義した)を表す。
【0038】
硫黄原子を含む場合、硫黄原子は、異なった酸化状態:S、SO、又はSO2であってもよい。このすべての酸化状態は、本発明の範囲内にある。
【0039】
ここでハロゲンは、フッ素、塩素、臭素、ヨウ素を意味する。
【0040】
状態、疾患又は病気の「治療すること」又は「治療」は:
(1)状態、疾患又は病気で苦しませ又はかかりやすくする可能性があるが、状態、疾患又は病気の臨床症状又は潜在症状を未だに経験又は露呈していない、哺乳類に現れる状態、疾患又は病気の臨床症状の出現を予防又は遅延させること、
(2)状態、疾患又は病気を抑制すること、すなわち、病気の進展又はその再発(維持治療の場合)又は少なくとも1つのその臨床症状又は潜在症状を停止、低減又は遅延させること、或いは、
(3)病気を緩和すること、すなわち、状態、疾患又は病気、又は少なくとも1つのその臨床症状又は潜在症状を後退させること、
を含む。
【0041】
「治療的に効果的な量」は、状態、疾患又は病気を治療するために患者に投与されたときに、その治療を達成するために十分な化合物の量を意味する。「治療的に効果的な量」は、化合物、病気及とその重症度、及び治療される対象の年齢、体重、体調と感応性によって異なるだろう。
【0042】
それが必要となる患者は、本発明の化合物の投与によって恩恵を受ける個体、例えば人間や他の哺乳類である。
【0043】
治療される患者に対する恩恵は、統計的に有意であるか、少なくとも患者や医師に認知可能である。
【0044】
治療に用いるために必要とされる本発明の化合物の量は、選択された個々の化合物によってのみ異なるのではなく、投与の経路、治療を要する病気の性状、患者の年齢と状態によっても異なり、最終的には主治医や獣医の判断によることが理解されるであろう。しかしながら、通常、適切な投与量は、1日につき約0.001〜約50mg/kg体重の範囲内であり、好ましくは、1日につき約0.001〜約5mg/kg体重、より好ましくは、1日につき約0.001〜約0.5mg/kg体重、最も望ましくは、1日につき約0.001〜約0.1mg/kg体重である。さらなる実施形態においては、その範囲は1日につき約0.1〜約750mg/kg体重、0.5〜60mg/kg/日の範囲、及び1〜20mg/kg/日の範囲であってもよい。
【0045】
望ましい投与量は、好都合に単回投与で与えられてもよく、又は分割投与として適切な間隔をおいて、例えば、1日に2回、3回、4回又はそれ以上で投与されてもよい。その化合物が経皮又は徐放性製剤で投与される場合は、その化合物は1日に1回又はそれ以下で投与されてもよい。
【0046】
その化合物は、例えば、活性成分を単位剤形ごとに0.1〜50mg、好都合には0.1〜5mg、又は最も好都合には0.1〜5mg含有する単位剤形で、好都合に投与される。よりさらなる実施形態において、その化合物は、例えば、活性成分を単位剤形ごとに10〜1500mg、好ましくは20〜1000mg、又はより好ましくは50〜700mg含有する単位剤形で、好都合に投与可能である。
【0047】
理想的にはその活性成分は、約0.01〜約5μM、約0.01〜約1μM、約0.01〜約75μM、約2〜約50μM、又は約3〜約30μMの活性化合物の最高血漿濃度を達成するために投与されるべきである。例えば、活性成分の0.1〜5%溶液を、状況に応じて生理食塩水溶液で、静脈注射することによって、又は、約0.1〜約5mg又は約1〜約500mgの活性成分を含む丸薬として経口投与することによって、これを達成することができる。望ましい血中濃度は、約0.0001〜約1.0mg/kg/時間、又は約0.0001〜約0.5mg/kg/時間の活性成分を供給する連続注入によって、又は約0.001〜約0.1mg/kgの活性成分を含む断続注入によって、維持することができる。さらなる実施形態において、望ましい血中濃度は、約0.01〜約5.0mg/kg/時間の活性成分を供給する連続注入によって、又は約0.4〜約15mg/kgの活性成分を含む断続注入によって、維持することができる。
【0048】
治療に用いるために、本発明の化合物は未加工の化学薬品として投与可能ではあるが、医薬製剤中に活性成分を与えるのが好ましい。本発明はしたがって、さらに、式(I)から式(III)の化合物、又はその平衡化した形態と、1つ又はそれ以上の薬学的に許容可能な担体と、及び、付加的に他の医薬及び/又は予防薬の成分からなる医薬製剤を提供する。担体は、製剤の他の成分と相性がよく、その受容者に有毒でない、という意味で、「許容可能」でなければならない。
【0049】
医薬製剤としては、経口、直腸、鼻、局所(頬と舌下を含む)、経皮、膣、又は非経口(筋肉、皮下及び静脈を含む)の投与に適したもの、又は、吸息や吸入による投与に適した形態のものが挙げられる。その製剤は、必要に応じて、好都合なように別個の投薬単位で与えられてもよく、薬学の分野でよく知られたいずれの方法によって調製されてもよい。すべての方法は、活性化合物を液体担体又は微細に分割された固体担体又は両方と結合させるステップと、そして、必要な場合は、その製品を望ましい剤形に成形するステップを備えている。
【0050】
経口投与に適した医薬製剤は、カプセル、カシェ剤、又は錠剤(それぞれ規定量の活性成分を含む)などの別個の単位として;粉剤、又は顆粒として;又は、溶液、懸濁液、又は乳濁液として、好都合なように提供することができる。活性成分は、丸薬、舐剤、又はペーストとしても提供することができる。経口投与のための錠剤とカプセルは、結合剤、充填剤、滑剤、崩壊剤、又は湿潤剤などの従来の賦形剤を含んでいてもよい。錠剤は、この分野でよく知られた方法を用いてコーティングされてもよい。経口液体製剤は、例えば、水性又は油性の懸濁液、溶液、乳濁液、シロップ剤、又はエリキシル剤の形態であってもよく、又は、使用前に水や他の適切な媒体とともに構成される乾燥製品であってもよい。この液体製剤は、懸濁化剤、乳化剤、非水溶性媒体(食用油を含む)、防腐剤などの従来の添加剤を含んでいてもよい。
【0051】
本発明の化合物は、非経口投与(例えば、静脈内ボーラス、又は連続注入などの注射)のために製剤されてもよく、アンプル剤、予め充填された注射器、小体積注入の単位投薬形態、又は、防腐剤が添加された複数投薬容器で提供されてもよい。その組成は、油性又は水性の媒体中の、懸濁液、溶液、又は乳濁液などの形態をとってもよく、懸濁化剤、安定化剤、及び/又は分散剤などの調剤用の薬剤を含んでいてもよい。その代わりに、その活性成分は、無菌固体の無菌分離によって、又は、液体からの凍結乾燥によって得られ、使用前に、適切な媒体、例えば、無菌であって発熱物質を含まない水とともに構成されるための、粉末の形態であってもよい。
【0052】
表皮に局所的に投与するために、本発明の化合物は、軟膏、クリーム又はローションとして、又は経皮パッチとして製剤されてもよい。その経皮パッチは、リナロール、カルバクロール、チモール、シトラール、メントール、又はt−アネトールなどの浸透促進剤を含んでいてもよい。軟膏とクリームは、例えば、適切な増粘剤、及び/又はゲル化剤を添加した、水性又は油性の基剤をとともに製剤されてもよい。ローションは、水性又は油性の基剤を用いて製剤されてもよく、一般には、1つ又はそれ以上の乳化剤、増粘剤、着色剤も含むであろう。
【0053】
口内の局所投与に適した製剤としては、風味を付けた基剤、通常はショ糖とアカシア、又はトラガカント、に活性成分を備えたトローチ剤;ゼラチンとグリセリン、又はショ糖とアカシアなどの不活性な基剤に活性成分を備えた錠剤;及び適切な液体担体に活性成分を備えた洗口剤が挙げられる。
【0054】
直腸の投与に適した担体が個体の医薬製剤は、最も好ましくは、単位投薬座薬として提供される。適切な担体としては、ココアバターやこの分野で通常用いられる他の材料が挙げられ、座薬は、活性化合部を、その後に型の中で冷却され成形される、軟化又は融解した担体とともに混合することによって、都合よく形成することができる。
【0055】
膣の投与に適した製剤は、活性成分に加えて、この分野において適切であることが知られている担体を含む、ペッサリー、タンポン、クリーム、ゲル、ペースト、泡、又はスプレーとして提供することができる。
【0056】
経鼻投与のために、本発明の化合物は、液体スプレー又は分散性の粉末として、又は滴剤の形態で用いることができる。滴剤は、一つ以上の分散剤、可溶化剤、又は懸濁化剤も備えた、水溶性又は非水溶性の基剤とともに製剤することができる。液体スプレーは、好都合なことに加圧型包装から供給される。
【0057】
吸入による投与のために、本発明の化合物は、吸入器、噴霧器、又は加圧型包装、又はエアゾールスプレーを供給する他の便利な手段から、都合よく供給される。加圧型包装は、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、二酸化炭素、又は他の適切なガスなど、適切な高圧ガスを含んでいてもよい。加圧されたエアゾールの場合、投薬単位は測定量を供給するためのバルブを備えることによって、決定することができる。
【0058】
あるいは、吸息又は吸引により投与するために、本発明の化合物は、乾燥粉末組成、例えば、この化合物とラクトース又はデンプンなどの適切な粉末基剤との粉末混合物の形態で供給可能である。この粉末組成は単位投薬形態で、例えば、カプセル又はカートリッジ、又は、例えば、ゼラチン又はブリスター包装で与えることができ、そこから粉末を、吸入器を用いて投与することができる。
【0059】
要求される場合は、上述の製剤は、活性成分の持続した放出を与えるために適合させることができる。
【0060】
さらなる実施形態において、式(I)から式(III)の化合物の少なくとも1つと、アナグレライド、ヒドロキシ尿素、P32、ブスルファン、アスピリン、クロピドグレル、α−インターフェロン、チクロピジン、及びジピリダモールから選ばれるさらなる治療薬の少なくとも1つを含む、血小板血症の治療に有用な組み合わせが提供される。
【0061】
さらなる実施形態において、式(I)から式(III)の化合物の少なくとも1つと、アナグレライド、ヒドロキシ尿素、ブスルファン、α−インターフェロンから選ばれるさらなる治療薬の少なくとも1つを含む、血小板血症の治療に有用な組み合わせが提供される。
【0062】
上で言及した組み合わせを、医薬製剤の形態で使用するために好都合に与えることができ;そして、このため、薬学的に許容可能な担体とともに上で明示されたような組み合わせからなる医薬製剤は、本発明のさらなる実施形態を構成する。
【0063】
この組み合わせの個々の成分は、連続して、又は同時に、個々の医薬製剤で、又は混合した医薬製剤で、投与することができる。
【0064】
式(I)から式(III)の化合物、又はその平衡化した形態が第二の治療薬との組み合わせで用いられるとき、それぞれの化合物の投薬量は、化合物が単独で使用されるときと同じであっても異なっていてもよい。適切な投薬量は、この分野で通常の知識を有する者によって容易に正しく評価されるだろう。
【0065】
本発明の化合物と第二の治療薬の間の比率は、この分野で通常の知識を有する者によって容易に正しく評価されるだろう。例えば、本発明の化合物:第二の治療薬を、約1:5000〜約1:500、約1:500〜約1:100、約1:1〜約1:50、約1:1〜約1:30、約1:1〜約1:20、約1:1〜約1:15、約1:1〜約1:10、約1:1〜約1:5、約1:1〜約1:3で使用してもよい。
【0066】
さらなる治療薬が添加された場合は、比率はそれ相応に調整されるだろう。
【0067】
米国仮出願第60/598,432号(2004年8月4日出願)、及びここに同時に出願されたその仮出願ではない出願は、両方とも末梢動脈障害の治療とホスホジエステラーゼIIIの阻害のためにこの文書の化合物を対象にしているが、その全体が言及されることによってここに組み込まれる。
【0068】
以下の実施例は、本発明の様々な実施形態を説明するために提供されるものであり、範囲を限定するものと判断されるべきではない。
【実施例1】
【0069】
本発明の化合物番号1の合成
271のm/z値を有する化合物番号1の、N−(5,6−ジクロロ−3,4−ジヒドロキナゾリン−2−イル)−2−オキソアセトアミド(1)を合成した。化合物番号1は、その水化物(2)としても存在することができる。
【0070】
【化30】

【0071】
化合物番号1の合成
【0072】
【化31】

【0073】
この要求されたアルデヒド(1)へのアプローチは、ジシクロヘキシルカルボジイミド(DCC)型カップリングアプローチを用いた、2−アミノ−5,6−ジクロロ−3,4−ジヒドロキナゾリン(A)とグリオキサル酸水化物(B)の反応を必要とした。
【0074】
(A)とグリオキサル酸(B)のカップリングは、ジシクロヘキシルカルボジイミド(DCC)、ジメチルアミノピリジン(DMAP)を用いて、ジクロロメタン(DCM)中で行われた。製品(A)は、この分野で知られた方法によって得られる(例えば、米国特許第6,194,420号、2001年2月27日発行、を参照)。少量のジメチルホルムアミド(DMF)を加えて製品(A)の溶解を助けた。これらの試薬をジクロロメタン溶媒中で混合すると、沈殿物が生じた。この沈殿物を濾別し、溶媒を蒸発させた。この粗製反応混合物をLC−MSによって分析したところ、90%の出発物質と、7%の質量数が271の物質が示された。
【0075】
この反応は、150mgスケールで実施した。この反応中に生成した沈殿物(170mg)を集め、濾液の内容物と同様に分析した。LC-MS分析によると、沈殿物は2つの主要な成分、製品(A)(ピーク面積25%)と質量数が271の物質(ピーク面積66%)から構成されていた;しかし、同じ物質のNMR分析により、主成分は、実際は、カップリング試薬DCCが反応した形である、ジシクロヘキシル尿素(DCU)であることが示された。HPLCによってこの物質の精製を試みたところ、DCUは除去された(NMR分析により測定)が、(A)(ピーク面積18%)と質量数が271の物質(ピーク面積73%)の混合物が得られた。しかし、生成物を含んだ唯一の芳香族のピークがNMRスペクトルに見られた。
【0076】
化合物番号1の精製は、逆相クロマトグラフィーを用いることによって成功した。水からメタノールの勾配溶媒により、3つの明確な画分が得られた:はじめに(A)、2番目に質量数が271の物質、そして、最後にDCU(NMRとHPLC分析により測定)。
【0077】
上で示したように、化合物番号1は化合物番号3と化合物番号4の平衡化した形態である。したがって、上述したように、この実施例の条件下では、化合物は相互変換しており、化合物番号3と化合物番号4(ともに3−ヒドロキシアナグレライドとして知られている)も存在しているものと思われる。
【実施例2】
【0078】
化合物番号1の別の合成法
ステップ1
[スキーム1:出発物質(RL603)]
【0079】
【化32】

【0080】
2.2当量の水素化ナトリウムと1.1当量の2,3−イソプロピリデングリセリン酸エチルを用いることによって、RL603は、確実に穏やかによい収率でアシル化されて、生成物B(スキーム1)が得られる。水素化ナトリウムとともにTHF中で、50℃で30分、不活性雰囲気下で加熱することによって、RL603のアニオンを生成させた。つぎに、混合物を室温まで冷却し、エステルを加え、反応は3日間撹拌した。蛍光性の酸化された不純物の生成を防ぐために、生成物の迅速な精製と処理が望まれる。精製は、通常の水抽出とシリカのクロマトグラフィー(40〜50%酢酸エチル/60〜50%ガソリンで溶出)によって行った。
【0081】
[スキーム2:2,3−イソプロピリデングリセリン酸エチルの合成]
【0082】
【化33】

【0083】
2,3−イソプロピリデングリセリン酸エチルを準備した。1,2:5,6−ジ−イソプロピリデン−マンニトールを、過ヨウ素酸ナトリウム又は過ヨウ素酸テトラ−ブチルアンモニウムのいずれかで処理し、つづいて過マンガン酸カリウムで処理し、粗製イソプロピリデン−グリセリン酸カリウムを得たが、これはエタノールから再結晶によって精製できる。これをDMF中で、好ましくはヨードエタン又はジエチル硫酸(後者を使用すると生成物の回収が難しくなる)で処理し、エチルエステルを生成させた(スキーム2)。必要に応じてこのエステルを蒸留した。
【0084】
ステップ2
[スキーム3:化合物Bの化合物Cへの加水分解]
【0085】
【化34】

【0086】
アセタール−アシル化RL603誘導体Bを、水:THFの50:50混合液中で、0.1M HClで一晩処理したところ、RL603と求められるジオールCのほぼ等量の混合物が得られた(スキーム3)。5:3の水:トリフルオロ酢酸を1時間使用すると、非常にきれいに選択的に、求められるジオール(C)が得られ、溶媒の除去以外、精製は必要ない。
【0087】
ステップ3
[化合物(C)の化合物番号1への変換及びHPLC]
メタノール水又はアセトン中で過ヨウ素酸ナトリウムを用いることによって、ジオール(C)を化合物番号1へ変換した。ジオールは、溶解性が低い。RL603へ戻る加水分解と、化合物番号1の異性体と思われるものの生成が確認された(この化合物番号1の異性体(iso-化合物番号1)は、ジオール(C)の過ヨウ素酸塩分裂から生成した中間体のアルデヒドの環閉鎖の別モードに由来していると思われる)。
【0088】
化合物番号1と化合物番号1の異性体(化合物番号5の互変体)の異性化を下記に示す:
【0089】
【化35】

【実施例3】
【0090】
臍帯血CD34+細胞由来の分化した巨核球の培地における化合物番号1の評価
材料と方法
[薬品]化合物番号1を室温に保った。保存溶液(10mM)をDMSO又はPBS pH5.0で、示されるように作成した。細胞懸濁液に加える前に、保存溶液を培地中で速やかに希釈した。
【0091】
細胞培養と巨核球系分化の分析
[細胞培養と投薬計画]臍帯血CD34+細胞を米国バイオホイットタッカー(Biowhittacker)から購入し、又は標準的な実験室の手順を用いた免疫磁気分離(immunomagneticselection)によって新たに分離した。細胞を24ウェルの組織培養プレートに、0.15×106細胞/mlの密度で播種し、12〜14日間、40ng/mlのTPOと、アナグレライド、化合物番号1、又は担体(DMSO)を含むイスコブ変法ダルベッコ培地(Iscove's modified Dulbecco's medium)(Mathur A, Hong Y, Martin JF, Erusalimsky JD (2001) Megakaryocytic differentiation is accompanied by a reduction in cell migratory potential. Br J Haematol 112:459 中で説明されている)で培養した。
【0092】
[細胞計数]細胞密度を、シスメックスCDA−500パーティクルアナライザー(Sysmex CDA-500 Particle Analyzer)を用いて測定した。
【0093】
[巨核球系分化の分析]CD61の発現(巨核球系分化のマーカー)を抗GPIIIa抗体を用いたフローサイトメトリーによって定量化した。細胞直径を、シスメックスCDA−500パーティクルアナライザーを用いて測定した。
【0094】
結果
[CD34造血前駆細胞のTPO誘導巨核球系成熟に関する化合物番号1の評価]
血漿含有培地においてトロンボポイエチン(TPO)を用いて成長させたCD34+細胞の巨核球系成熟におけるアナグレライドと化合物番号1の効果を、培地中のGPIIIa陽性細胞の百分率を記録することによって、評価した。アナグレライドと化合物番号1は、30mMの低い濃度で、このプロセスの有意な阻害作用を引き起こした(それぞれコントロールに対し、アナグレライドと化合物番号1について、28%と20%の阻害作用、P=0.004と0.005)。巨核球系成熟に対する活性に関し、アナグレライドと化合物番号1を詳細に比較したところ(図1)、投薬量の効果を考慮した場合に、その2つの化合物の間に有意な差異は見られなかった(化合物番号1対アナグレライドの分散分析(ANOVA)によりP=0.38)。実際に、2つの化合物は等しい効力を持っており、IC50は110〜130nMであり、1μMにおいて最大効力を有していた。図1の結果は、並行して実施された未処理のサンプルと相対的に示されている。表示されているように、値は、2〜4回の独立した実験の平均値±標準誤差(SE)を示している。それぞれの実験は、異なった提供者に由来する細胞で行った。
【0095】
[インビトロの巨核球形成(megakaryocytopoiesis)における化合物番号1の全体的な効果]
表1は、アナグレライドと化合物番号1が、最終細胞密度、GPIIIa活性細胞の割合、この抗原の発現の相対レベル、細胞のサイズ(後者は細胞成熟とDNA量の両方の関数である)などの幾らかの巨核球分化パラメータにわたって、十分な類似した抑制作用を有していることを示している。
【0096】
これらの培地中のアナグレライドと化合物番号1の抑制作用が巨核球系統に選択的であるか否かを判断するために、非巨核球系細胞の成長について、これらの成分の効果を評価した。12日のコントロール培地において、この細胞(CD61−)は全集団の20〜30%を示している。図2に、巨核球の特徴を発現する細胞の最終的な数の減少のはっきりとした対比が表されているように、アナグレライドも化合物番号1も非巨核球系細胞の成長を抑制しなかった。
【0097】
【表1】

【0098】
CD34+細胞を、材料と方法で説明したように、TPOを追加した血漿含有培地中で、示された化合物(1.0μM)の存在下、又は非存在下で12日間培養した。図2の結果は、未処理のサンプルと相対的に示されている。値は、異なった提供者に由来する細胞で行なわれた、表示された回数の独立した実験の平均値±SEを示している。コントロールに対して、*はP<0.05;**はP<0.01。
【実施例4】
【0099】
6,7−ジクロロ−3−ヒドロキシ−1,5−ジヒドロ−イミダゾ[2,1−b]キナゾリン−2−オン(化合物番号3)の合成
【0100】
【化36】

【0101】
試薬と条件:
ステップ(i):KMnO4、KOH、水、室温、4時間、濾過及び蒸発、ついでDMF、ヨウ化エチル、室温、一晩、水抽出(aqueous work-up)、全体で収率56%。
【0102】
ステップ(ii):2−アミノ−5,6−ジクロロ−3,4−ジヒドロキナゾリン、
【0103】
【化37】

【0104】
NaH、THF,50℃、30分、ついで室温、48時間、水抽出及びカラムクロマトグラフィー、収率50%。
【0105】
ステップ(iii):CF3CO2H、水、室温、1時間、蒸発、凍結乾燥及びエーテルとともに粉砕、収率100%。
【0106】
ステップ(iv):NaIO4、pH5.1緩衝液、アセトン、10℃、20分、蒸発、凍結乾燥及びカラムクロマトグラフィー、収率31%。
【0107】
精製
生成物のクロマトグラフによる分離(異性体である化合物番号5(6,7−ジクロロ−1−ヒドロキシ−3,5−ジヒドロ−イミダゾ[1,2−a]キナゾリン−2−オン)からの分離)を、圧縮空気圧力下のガラスカラム中の順相シリカで、0〜10%メタノール/100〜90%酢酸エチルの勾配で溶出して、実施した。画分を、数滴の濃縮アンモニアを含むTHF(テトラヒドロフラン)で溶出するTLC(薄層クロマトグラフィー)によって分析した。
【0108】
分析データ:
NMR
1H NMR(300Hz,:7.47(1H,d,J=8.7Hz),6.96(1H,d,J=8.7Hz),6.91(1H,d,J=8.7Hz),5.01(1H,d,J=6.7Hz),4.58+4.47(2H,ABシステム,J=14.6Hz).
13C NMR(75MHz,DMSO−D6):130.00, 129.49, 125.32, 120.41, 113.05, 81.29, 41.89(弱いサンプル、いくつかのシグナルは決定されなかった。)
赤外分光分析
IR(ニート):1643,1563,1471cm−1.
質量分析
(EI):271(M+,100%),214(86%),199(34%).
分子量決定
高分解能質量分析:計算値 270.991532 検出値 270.992371
融点
融点:170℃(分解)
【技術分野】
【0001】
本発明は、血小板血症を治療するために有用な化合物に関する。本発明はまた、血小板数を低減させるために有用な化合物に関する。
【背景技術】
【0002】
血小板血症は、血小板の増加又は異常な産生を伴う慢性疾患である。血小板は血液凝固に関係しているため、それらの異常な産生は、患者の消化管出血、心臓麻痺と心臓拍動の危険性が増加するという結果を伴う、血栓の不適切な産生又は出血を招く可能性がある。
【0003】
アナグレライドは、本態性血小板血症や種々のほかの骨髄増殖症候群の治療に用いられるキナゾリン誘導ホスホジエステラーゼ阻害薬である。アナグレライドは、米国とカナダで本態性血小板血症の治療のために1997年に承認され発売された。1998年の12月に、米国食品医薬品局は、特に、真性赤血球増加症(PV)と慢性骨髄性白血病(CML)を含む、骨髄増殖症候群に従属的な血小板血症を有する患者の治療のために、アナグレライドの拡大ラベルを承認した。
【0004】
本発明により包含される化合物は、3−ヒドロキシアナグレライドである。これは、アナグレライドの代謝産物である(例えば、米国公開第20040209907号として公開された米国特許出願第10/762,566号を参照)。
【0005】
アナグレライドの様々な代謝産物は、文献中で検討されている:Erusalimsky et al. (2002) Is the platelet lowering activity of anagrelidemediated by its major metabolite 2-amino-5,6-dichloro-3,4-dihydroquinazoline(RL603)? Exp Hematol. 30:625-7;Lane et al. (2001) Anagrelidemetabolite induces thrombocytopenia in mice by inhibiting megakaryocyte maturation without inducing platelet aggregation. Exp Hematol. 29:1417-241;及びGaver et al. (1981) Disposition of anagrelide, an inhibitor of platelet aggregation. Clin PharmacolTher. 29:381-6。
【0006】
本発明の目的の一つは、血小板血症を治療するために用いられる可能性のあるアナグレライドに関連する化合物を提供することである。
【発明の開示】
【0007】
一実施形態において、本発明は、
【化13】

【化14】

【化15】

である化合物、その平衡化した形態、その薬学的に許容可能な塩、又はその平衡化した形態の薬学的に許容可能な塩を提供し、
ここで
R1は、H、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、又はC6−10アリールであり;
R2は、
【化16】

又は
【化17】

であり;
R3は、OH、ハロゲン、SH、O−C1−6アルキル又はヒドロキシル模倣基であり;及び
XとYは独立してH又はハロゲンである。
【0008】
上記化合物について好ましくは、ベンジル環の5位と6位にXとYの置換基を含む。
【0009】
式(I)から式(III)の化合物は、血小板血症の治療と血小板数の低減に有用である。式(I)から式(III)の化合物は、少なくとも1つのほかの治療剤と組み合わせて用いることができる。
【0010】
本発明はまた、式(I)から式(III)の化合物のいずれかと薬学的に許容可能な担体又は賦形剤とからなる医薬製剤を提供する。
【0011】
さらなる実施例において、血小板血症の治療用の薬剤を製造するための、式(I)から式(III)の化合物の使用法が提供される。
【図面の簡単な説明】
【0012】
【図1】以下の実施例3でより十分に説明されるように、TPO誘導巨核球系(MK)成熟におけるアナグレライドと化合物番号1の効果を比較する用量反応グラフである。
【図2】以下の実施例3でより十分に説明されるように、アナグレライドと化合物番号1による巨核細胞形成の選択的阻害を比較するグラフである。
【発明を実施するための最良の形態】
【0013】
特に定義されない限り、ここで用いられるすべての技術的及び科学的用語は、本発明の属する分野における通常の知識を有する者によって一般的に理解されるものと同じ意味を有する。ここで引用される、すべての刊行物、特許出願、特許、その他の参考文献は、それらの全体が引用されて組み込まれる。抵触の場合は、定義を含む本明細書は規制されるだろう。さらに、材料、方法、例は、単に説明的なものであって、限定することを意図しているものではない。
【0014】
本発明の一実施形態において、本発明の化合物は、以下の実施形態におけるものを、独立して又は組み合わせて、包含している。
【0015】
一実施形態において、本発明は、
【化18】

【化19】

【化20】

の式の化合物、その平衡化した形態、その薬学的に許容可能な塩、又はその平衡化した形態の薬学的に許容可能な塩を提供し、
ここで
R1は、H、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、又はC6−10アリールであり;
R2は、
【化21】

又は
【化22】

であり;
R3は、OH、ハロゲン、SH、O−C1−6アルキル又はヒドロキシル模倣(hydroxymimetic)基であり;及び
XとYは独立して、H又はハロゲンである。
【0016】
好ましい実施形態は、ベンジル環の5位と6位にXとYの置換基を含む。
【0017】
一実施形態において、R1は、H又はC1−6アルキルである。別の実施形態において、R1は、H又はCH3である。別の実施形態において、R1は、Hである。
【0018】
一実施形態において、R3は、OH又はO−C1−6アルキルである。別の実施形態において、R3は、OH又はOCH3である。別の実施形態において、R3は、OHである。
【0019】
一実施形態において、Xは、H又はハロゲンである。別の実施形態において、Xは、Hである。別の実施形態において、Xは、Clである。別の実施形態において、Yは、H又はClである。別の実施形態において、Yは、Hである。別の実施形態において、Yは、Clである。
【0020】
一実施形態において、治療される血小板血症は、骨髄増殖性の血液疾患を伴う。
【0021】
一実施形態において、血小板血症は、本態性血小板血症(ET)、慢性骨髄性白血病(CML)、真性赤血球増加症(PV)、原因不明の骨髄化生(AMM)、又は鎌状赤血球貧血(SCA)を伴う。
【0022】
さらなる実施形態において、血小板血症は、ET、CML、PV、AMM、又はSCAが原因となって引き起こされたものである。
【0023】
さらなる実施形態において、式(I)から(III)の化合物は、患者の血小板数を低減するために使用可能である。
【0024】
本発明の化合物としては、N−(5,6−ジクロロ−3,4−ジヒドロキナゾリン−2−イル)−2−オキソアセトアミドである
【化23】

と;N−(5,6−ジクロロ−3,4−ジヒドロキナゾリン−2−イル)−2−オキソアセトアミド水化物である
【化24】

と;6,7−ジクロロ−3−ヒドロキシ−1,5−ジヒドロ−イミダゾ[2,1−b]キナゾリン−2−オンである
【化25】

と;6,7−ジクロロ−3−ヒドロキシ−1,5−ジヒドロ−イミダゾ[2,1−b]キナゾリン−2−オンである
【化26】

と;6,7−ジクロロ−1−ヒドロキシ−3,5−ジヒドロ−イミダゾ[1,2−a]キナゾリン−2−オンである
【化27】

が挙げられる。
【0025】
本発明によれば、化合物は、十分に純粋な形態である。
【0026】
本発明で用いられる用語「十分に純粋」は、標準的な分析方法により測定したときに、化合物が少なくとも80%純粋であり、好ましくは少なくとも85%純粋であり、より好ましくは少なくとも90%純粋であり、さらにより好ましくは少なくとも95%純粋であり、最も好ましくは少なくとも99%純粋であることを意味する。
【0027】
いかなる理論に拘束されることなく(機構の理解は本発明の実施に必要ではなく、本発明は特定の機構に限定されない)、本発明者らは、本発明の化合物が平衡化した形態にあると考えている。本発明の化合物の平衡化した形態は、以下のように表現される:
【化28】

【0028】
ここで用いられる用語「平衡化した形態」は、式(I)から(III)の化合物の互変体を含む。
【0029】
本発明の化合物の平衡化した形態は、下記のようにも表現される。
【0030】
【化29】

【0031】
このすべての平衡化した形態は、本発明の範囲に含まれる。
【0032】
この分野で通常の知識を有する者によって、化合物(I)から(III)が互変体又は光学異性体として存在してもよいことが理解されるだろう。この化合物のすべての平衡化した異性体と互変体は、本発明の範囲内に含まれる。単一の光学異性体又は鏡像異性体は、この分野でよく知られた方法、例えば、キラルHPLC、酵素分解、及びキラル助剤によって得ることができ、或いは、立体選択的に合成可能である。
【0033】
ここで用いられる「ヒドロキシ模倣」は、ヒドルキシル(−OH)基に関係する化学的な官能基を表している。これは、水素結合の供与体又は受容体として振舞うことのできる官能基である。ヒドロキシ模倣基の例としては、限定されないがNH2−とSH−が挙げられる。
【0034】
本発明の化合物の薬学的に許容可能な塩もまた提供される。一般式(I)から(III)の化合物の用語「薬学的に許容可能な塩」に関して、それが意味するものは、薬学的に許容可能な無機及び有機の酸と塩基から誘導されたものである。適切な酸の例としては、塩酸、臭化水素酸、硫酸、硝酸、過塩素酸、フマル酸、マレイン酸、リン酸、グリコール酸、乳酸、サリチル酸、コハク酸、トルエン−p−スルホン酸、酒石酸、酢酸、クエン酸、メタンスルホン酸、ギ酸、安息香酸、マロン酸、ナフタレン−2−スルホン酸、ベンゼンスルホン酸が挙げられる。シュウ酸などの他の酸は、それ自体、薬学的に許容可能ではないが、本発明の化合物とその薬学的に許容可能な酸付加塩を取得するときの中間体として有用かもしれない。
【0035】
適切な塩基から得られる塩としては、アルカリ金属(例えば、ナトリウム)塩、アルカリ土類金属(例えば、マグネシウム)塩、アンモニウム塩、NR4(ここで、Rは、C1−4アルキル)塩が挙げられる。
【0036】
本出願で用いられる用語「アルキル」は、置換されていない又は置換された(ハロゲン、ニトロ、CONH2、COOH、O−C1−6アルキル、O−C2−6アルケニル、ヒドロキシル、アミノ、又はCOOQ、ここで、QはC1−6アルキル、C2−6アルケニル;C2−6アルキニルによって)直鎖、分岐鎖又は環状の炭化水素部分(例えば、イソプロピル、エチル、フルオロエチル又はシクロプロピル)を表す。アルキルという用語は、1つ以上の水素元素がハロゲン、より好ましくは、ハロゲンはフッ素によって置換されたアルキル(例えば、−CF3又は−CH2CF3)をも含むことを意図している。
【0037】
ここで用いられる用語「アルケニル」と「アルキニル」は、少なくとも1つの不飽和基(例えば、アリル)を含むアルキル(上記で定義した)を表す。
【0038】
硫黄原子を含む場合、硫黄原子は、異なった酸化状態:S、SO、又はSO2であってもよい。このすべての酸化状態は、本発明の範囲内にある。
【0039】
ここでハロゲンは、フッ素、塩素、臭素、ヨウ素を意味する。
【0040】
状態、疾患又は病気の「治療すること」又は「治療」は:
(1)状態、疾患又は病気で苦しませ又はかかりやすくする可能性があるが、状態、疾患又は病気の臨床症状又は潜在症状を未だに経験又は露呈していない、哺乳類に現れる状態、疾患又は病気の臨床症状の出現を予防又は遅延させること、
(2)状態、疾患又は病気を抑制すること、すなわち、病気の進展又はその再発(維持治療の場合)又は少なくとも1つのその臨床症状又は潜在症状を停止、低減又は遅延させること、或いは、
(3)病気を緩和すること、すなわち、状態、疾患又は病気、又は少なくとも1つのその臨床症状又は潜在症状を後退させること、
を含む。
【0041】
「治療的に効果的な量」は、状態、疾患又は病気を治療するために患者に投与されたときに、その治療を達成するために十分な化合物の量を意味する。「治療的に効果的な量」は、化合物、病気及とその重症度、及び治療される対象の年齢、体重、体調と感応性によって異なるだろう。
【0042】
それが必要となる患者は、本発明の化合物の投与によって恩恵を受ける個体、例えば人間や他の哺乳類である。
【0043】
治療される患者に対する恩恵は、統計的に有意であるか、少なくとも患者や医師に認知可能である。
【0044】
治療に用いるために必要とされる本発明の化合物の量は、選択された個々の化合物によってのみ異なるのではなく、投与の経路、治療を要する病気の性状、患者の年齢と状態によっても異なり、最終的には主治医や獣医の判断によることが理解されるであろう。しかしながら、通常、適切な投与量は、1日につき約0.001〜約50mg/kg体重の範囲内であり、好ましくは、1日につき約0.001〜約5mg/kg体重、より好ましくは、1日につき約0.001〜約0.5mg/kg体重、最も望ましくは、1日につき約0.001〜約0.1mg/kg体重である。さらなる実施形態においては、その範囲は1日につき約0.1〜約750mg/kg体重、0.5〜60mg/kg/日の範囲、及び1〜20mg/kg/日の範囲であってもよい。
【0045】
望ましい投与量は、好都合に単回投与で与えられてもよく、又は分割投与として適切な間隔をおいて、例えば、1日に2回、3回、4回又はそれ以上で投与されてもよい。その化合物が経皮又は徐放性製剤で投与される場合は、その化合物は1日に1回又はそれ以下で投与されてもよい。
【0046】
その化合物は、例えば、活性成分を単位剤形ごとに0.1〜50mg、好都合には0.1〜5mg、又は最も好都合には0.1〜5mg含有する単位剤形で、好都合に投与される。よりさらなる実施形態において、その化合物は、例えば、活性成分を単位剤形ごとに10〜1500mg、好ましくは20〜1000mg、又はより好ましくは50〜700mg含有する単位剤形で、好都合に投与可能である。
【0047】
理想的にはその活性成分は、約0.01〜約5μM、約0.01〜約1μM、約0.01〜約75μM、約2〜約50μM、又は約3〜約30μMの活性化合物の最高血漿濃度を達成するために投与されるべきである。例えば、活性成分の0.1〜5%溶液を、状況に応じて生理食塩水溶液で、静脈注射することによって、又は、約0.1〜約5mg又は約1〜約500mgの活性成分を含む丸薬として経口投与することによって、これを達成することができる。望ましい血中濃度は、約0.0001〜約1.0mg/kg/時間、又は約0.0001〜約0.5mg/kg/時間の活性成分を供給する連続注入によって、又は約0.001〜約0.1mg/kgの活性成分を含む断続注入によって、維持することができる。さらなる実施形態において、望ましい血中濃度は、約0.01〜約5.0mg/kg/時間の活性成分を供給する連続注入によって、又は約0.4〜約15mg/kgの活性成分を含む断続注入によって、維持することができる。
【0048】
治療に用いるために、本発明の化合物は未加工の化学薬品として投与可能ではあるが、医薬製剤中に活性成分を与えるのが好ましい。本発明はしたがって、さらに、式(I)から式(III)の化合物、又はその平衡化した形態と、1つ又はそれ以上の薬学的に許容可能な担体と、及び、付加的に他の医薬及び/又は予防薬の成分からなる医薬製剤を提供する。担体は、製剤の他の成分と相性がよく、その受容者に有毒でない、という意味で、「許容可能」でなければならない。
【0049】
医薬製剤としては、経口、直腸、鼻、局所(頬と舌下を含む)、経皮、膣、又は非経口(筋肉、皮下及び静脈を含む)の投与に適したもの、又は、吸息や吸入による投与に適した形態のものが挙げられる。その製剤は、必要に応じて、好都合なように別個の投薬単位で与えられてもよく、薬学の分野でよく知られたいずれの方法によって調製されてもよい。すべての方法は、活性化合物を液体担体又は微細に分割された固体担体又は両方と結合させるステップと、そして、必要な場合は、その製品を望ましい剤形に成形するステップを備えている。
【0050】
経口投与に適した医薬製剤は、カプセル、カシェ剤、又は錠剤(それぞれ規定量の活性成分を含む)などの別個の単位として;粉剤、又は顆粒として;又は、溶液、懸濁液、又は乳濁液として、好都合なように提供することができる。活性成分は、丸薬、舐剤、又はペーストとしても提供することができる。経口投与のための錠剤とカプセルは、結合剤、充填剤、滑剤、崩壊剤、又は湿潤剤などの従来の賦形剤を含んでいてもよい。錠剤は、この分野でよく知られた方法を用いてコーティングされてもよい。経口液体製剤は、例えば、水性又は油性の懸濁液、溶液、乳濁液、シロップ剤、又はエリキシル剤の形態であってもよく、又は、使用前に水や他の適切な媒体とともに構成される乾燥製品であってもよい。この液体製剤は、懸濁化剤、乳化剤、非水溶性媒体(食用油を含む)、防腐剤などの従来の添加剤を含んでいてもよい。
【0051】
本発明の化合物は、非経口投与(例えば、静脈内ボーラス、又は連続注入などの注射)のために製剤されてもよく、アンプル剤、予め充填された注射器、小体積注入の単位投薬形態、又は、防腐剤が添加された複数投薬容器で提供されてもよい。その組成は、油性又は水性の媒体中の、懸濁液、溶液、又は乳濁液などの形態をとってもよく、懸濁化剤、安定化剤、及び/又は分散剤などの調剤用の薬剤を含んでいてもよい。その代わりに、その活性成分は、無菌固体の無菌分離によって、又は、液体からの凍結乾燥によって得られ、使用前に、適切な媒体、例えば、無菌であって発熱物質を含まない水とともに構成されるための、粉末の形態であってもよい。
【0052】
表皮に局所的に投与するために、本発明の化合物は、軟膏、クリーム又はローションとして、又は経皮パッチとして製剤されてもよい。その経皮パッチは、リナロール、カルバクロール、チモール、シトラール、メントール、又はt−アネトールなどの浸透促進剤を含んでいてもよい。軟膏とクリームは、例えば、適切な増粘剤、及び/又はゲル化剤を添加した、水性又は油性の基剤をとともに製剤されてもよい。ローションは、水性又は油性の基剤を用いて製剤されてもよく、一般には、1つ又はそれ以上の乳化剤、増粘剤、着色剤も含むであろう。
【0053】
口内の局所投与に適した製剤としては、風味を付けた基剤、通常はショ糖とアカシア、又はトラガカント、に活性成分を備えたトローチ剤;ゼラチンとグリセリン、又はショ糖とアカシアなどの不活性な基剤に活性成分を備えた錠剤;及び適切な液体担体に活性成分を備えた洗口剤が挙げられる。
【0054】
直腸の投与に適した担体が個体の医薬製剤は、最も好ましくは、単位投薬座薬として提供される。適切な担体としては、ココアバターやこの分野で通常用いられる他の材料が挙げられ、座薬は、活性化合部を、その後に型の中で冷却され成形される、軟化又は融解した担体とともに混合することによって、都合よく形成することができる。
【0055】
膣の投与に適した製剤は、活性成分に加えて、この分野において適切であることが知られている担体を含む、ペッサリー、タンポン、クリーム、ゲル、ペースト、泡、又はスプレーとして提供することができる。
【0056】
経鼻投与のために、本発明の化合物は、液体スプレー又は分散性の粉末として、又は滴剤の形態で用いることができる。滴剤は、一つ以上の分散剤、可溶化剤、又は懸濁化剤も備えた、水溶性又は非水溶性の基剤とともに製剤することができる。液体スプレーは、好都合なことに加圧型包装から供給される。
【0057】
吸入による投与のために、本発明の化合物は、吸入器、噴霧器、又は加圧型包装、又はエアゾールスプレーを供給する他の便利な手段から、都合よく供給される。加圧型包装は、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、二酸化炭素、又は他の適切なガスなど、適切な高圧ガスを含んでいてもよい。加圧されたエアゾールの場合、投薬単位は測定量を供給するためのバルブを備えることによって、決定することができる。
【0058】
あるいは、吸息又は吸引により投与するために、本発明の化合物は、乾燥粉末組成、例えば、この化合物とラクトース又はデンプンなどの適切な粉末基剤との粉末混合物の形態で供給可能である。この粉末組成は単位投薬形態で、例えば、カプセル又はカートリッジ、又は、例えば、ゼラチン又はブリスター包装で与えることができ、そこから粉末を、吸入器を用いて投与することができる。
【0059】
要求される場合は、上述の製剤は、活性成分の持続した放出を与えるために適合させることができる。
【0060】
さらなる実施形態において、式(I)から式(III)の化合物の少なくとも1つと、アナグレライド、ヒドロキシ尿素、P32、ブスルファン、アスピリン、クロピドグレル、α−インターフェロン、チクロピジン、及びジピリダモールから選ばれるさらなる治療薬の少なくとも1つを含む、血小板血症の治療に有用な組み合わせが提供される。
【0061】
さらなる実施形態において、式(I)から式(III)の化合物の少なくとも1つと、アナグレライド、ヒドロキシ尿素、ブスルファン、α−インターフェロンから選ばれるさらなる治療薬の少なくとも1つを含む、血小板血症の治療に有用な組み合わせが提供される。
【0062】
上で言及した組み合わせを、医薬製剤の形態で使用するために好都合に与えることができ;そして、このため、薬学的に許容可能な担体とともに上で明示されたような組み合わせからなる医薬製剤は、本発明のさらなる実施形態を構成する。
【0063】
この組み合わせの個々の成分は、連続して、又は同時に、個々の医薬製剤で、又は混合した医薬製剤で、投与することができる。
【0064】
式(I)から式(III)の化合物、又はその平衡化した形態が第二の治療薬との組み合わせで用いられるとき、それぞれの化合物の投薬量は、化合物が単独で使用されるときと同じであっても異なっていてもよい。適切な投薬量は、この分野で通常の知識を有する者によって容易に正しく評価されるだろう。
【0065】
本発明の化合物と第二の治療薬の間の比率は、この分野で通常の知識を有する者によって容易に正しく評価されるだろう。例えば、本発明の化合物:第二の治療薬を、約1:5000〜約1:500、約1:500〜約1:100、約1:1〜約1:50、約1:1〜約1:30、約1:1〜約1:20、約1:1〜約1:15、約1:1〜約1:10、約1:1〜約1:5、約1:1〜約1:3で使用してもよい。
【0066】
さらなる治療薬が添加された場合は、比率はそれ相応に調整されるだろう。
【0067】
米国仮出願第60/598,432号(2004年8月4日出願)、及びここに同時に出願されたその仮出願ではない出願は、両方とも末梢動脈障害の治療とホスホジエステラーゼIIIの阻害のためにこの文書の化合物を対象にしているが、その全体が言及されることによってここに組み込まれる。
【0068】
以下の実施例は、本発明の様々な実施形態を説明するために提供されるものであり、範囲を限定するものと判断されるべきではない。
【実施例1】
【0069】
本発明の化合物番号1の合成
271のm/z値を有する化合物番号1の、N−(5,6−ジクロロ−3,4−ジヒドロキナゾリン−2−イル)−2−オキソアセトアミド(1)を合成した。化合物番号1は、その水化物(2)としても存在することができる。
【0070】
【化30】

【0071】
化合物番号1の合成
【0072】
【化31】

【0073】
この要求されたアルデヒド(1)へのアプローチは、ジシクロヘキシルカルボジイミド(DCC)型カップリングアプローチを用いた、2−アミノ−5,6−ジクロロ−3,4−ジヒドロキナゾリン(A)とグリオキサル酸水化物(B)の反応を必要とした。
【0074】
(A)とグリオキサル酸(B)のカップリングは、ジシクロヘキシルカルボジイミド(DCC)、ジメチルアミノピリジン(DMAP)を用いて、ジクロロメタン(DCM)中で行われた。製品(A)は、この分野で知られた方法によって得られる(例えば、米国特許第6,194,420号、2001年2月27日発行、を参照)。少量のジメチルホルムアミド(DMF)を加えて製品(A)の溶解を助けた。これらの試薬をジクロロメタン溶媒中で混合すると、沈殿物が生じた。この沈殿物を濾別し、溶媒を蒸発させた。この粗製反応混合物をLC−MSによって分析したところ、90%の出発物質と、7%の質量数が271の物質が示された。
【0075】
この反応は、150mgスケールで実施した。この反応中に生成した沈殿物(170mg)を集め、濾液の内容物と同様に分析した。LC-MS分析によると、沈殿物は2つの主要な成分、製品(A)(ピーク面積25%)と質量数が271の物質(ピーク面積66%)から構成されていた;しかし、同じ物質のNMR分析により、主成分は、実際は、カップリング試薬DCCが反応した形である、ジシクロヘキシル尿素(DCU)であることが示された。HPLCによってこの物質の精製を試みたところ、DCUは除去された(NMR分析により測定)が、(A)(ピーク面積18%)と質量数が271の物質(ピーク面積73%)の混合物が得られた。しかし、生成物を含んだ唯一の芳香族のピークがNMRスペクトルに見られた。
【0076】
化合物番号1の精製は、逆相クロマトグラフィーを用いることによって成功した。水からメタノールの勾配溶媒により、3つの明確な画分が得られた:はじめに(A)、2番目に質量数が271の物質、そして、最後にDCU(NMRとHPLC分析により測定)。
【0077】
上で示したように、化合物番号1は化合物番号3と化合物番号4の平衡化した形態である。したがって、上述したように、この実施例の条件下では、化合物は相互変換しており、化合物番号3と化合物番号4(ともに3−ヒドロキシアナグレライドとして知られている)も存在しているものと思われる。
【実施例2】
【0078】
化合物番号1の別の合成法
ステップ1
[スキーム1:出発物質(RL603)]
【0079】
【化32】

【0080】
2.2当量の水素化ナトリウムと1.1当量の2,3−イソプロピリデングリセリン酸エチルを用いることによって、RL603は、確実に穏やかによい収率でアシル化されて、生成物B(スキーム1)が得られる。水素化ナトリウムとともにTHF中で、50℃で30分、不活性雰囲気下で加熱することによって、RL603のアニオンを生成させた。つぎに、混合物を室温まで冷却し、エステルを加え、反応は3日間撹拌した。蛍光性の酸化された不純物の生成を防ぐために、生成物の迅速な精製と処理が望まれる。精製は、通常の水抽出とシリカのクロマトグラフィー(40〜50%酢酸エチル/60〜50%ガソリンで溶出)によって行った。
【0081】
[スキーム2:2,3−イソプロピリデングリセリン酸エチルの合成]
【0082】
【化33】

【0083】
2,3−イソプロピリデングリセリン酸エチルを準備した。1,2:5,6−ジ−イソプロピリデン−マンニトールを、過ヨウ素酸ナトリウム又は過ヨウ素酸テトラ−ブチルアンモニウムのいずれかで処理し、つづいて過マンガン酸カリウムで処理し、粗製イソプロピリデン−グリセリン酸カリウムを得たが、これはエタノールから再結晶によって精製できる。これをDMF中で、好ましくはヨードエタン又はジエチル硫酸(後者を使用すると生成物の回収が難しくなる)で処理し、エチルエステルを生成させた(スキーム2)。必要に応じてこのエステルを蒸留した。
【0084】
ステップ2
[スキーム3:化合物Bの化合物Cへの加水分解]
【0085】
【化34】

【0086】
アセタール−アシル化RL603誘導体Bを、水:THFの50:50混合液中で、0.1M HClで一晩処理したところ、RL603と求められるジオールCのほぼ等量の混合物が得られた(スキーム3)。5:3の水:トリフルオロ酢酸を1時間使用すると、非常にきれいに選択的に、求められるジオール(C)が得られ、溶媒の除去以外、精製は必要ない。
【0087】
ステップ3
[化合物(C)の化合物番号1への変換及びHPLC]
メタノール水又はアセトン中で過ヨウ素酸ナトリウムを用いることによって、ジオール(C)を化合物番号1へ変換した。ジオールは、溶解性が低い。RL603へ戻る加水分解と、化合物番号1の異性体と思われるものの生成が確認された(この化合物番号1の異性体(iso-化合物番号1)は、ジオール(C)の過ヨウ素酸塩分裂から生成した中間体のアルデヒドの環閉鎖の別モードに由来していると思われる)。
【0088】
化合物番号1と化合物番号1の異性体(化合物番号5の互変体)の異性化を下記に示す:
【0089】
【化35】

【実施例3】
【0090】
臍帯血CD34+細胞由来の分化した巨核球の培地における化合物番号1の評価
材料と方法
[薬品]化合物番号1を室温に保った。保存溶液(10mM)をDMSO又はPBS pH5.0で、示されるように作成した。細胞懸濁液に加える前に、保存溶液を培地中で速やかに希釈した。
【0091】
細胞培養と巨核球系分化の分析
[細胞培養と投薬計画]臍帯血CD34+細胞を米国バイオホイットタッカー(Biowhittacker)から購入し、又は標準的な実験室の手順を用いた免疫磁気分離(immunomagneticselection)によって新たに分離した。細胞を24ウェルの組織培養プレートに、0.15×106細胞/mlの密度で播種し、12〜14日間、40ng/mlのTPOと、アナグレライド、化合物番号1、又は担体(DMSO)を含むイスコブ変法ダルベッコ培地(Iscove's modified Dulbecco's medium)(Mathur A, Hong Y, Martin JF, Erusalimsky JD (2001) Megakaryocytic differentiation is accompanied by a reduction in cell migratory potential. Br J Haematol 112:459 中で説明されている)で培養した。
【0092】
[細胞計数]細胞密度を、シスメックスCDA−500パーティクルアナライザー(Sysmex CDA-500 Particle Analyzer)を用いて測定した。
【0093】
[巨核球系分化の分析]CD61の発現(巨核球系分化のマーカー)を抗GPIIIa抗体を用いたフローサイトメトリーによって定量化した。細胞直径を、シスメックスCDA−500パーティクルアナライザーを用いて測定した。
【0094】
結果
[CD34造血前駆細胞のTPO誘導巨核球系成熟に関する化合物番号1の評価]
血漿含有培地においてトロンボポイエチン(TPO)を用いて成長させたCD34+細胞の巨核球系成熟におけるアナグレライドと化合物番号1の効果を、培地中のGPIIIa陽性細胞の百分率を記録することによって、評価した。アナグレライドと化合物番号1は、30mMの低い濃度で、このプロセスの有意な阻害作用を引き起こした(それぞれコントロールに対し、アナグレライドと化合物番号1について、28%と20%の阻害作用、P=0.004と0.005)。巨核球系成熟に対する活性に関し、アナグレライドと化合物番号1を詳細に比較したところ(図1)、投薬量の効果を考慮した場合に、その2つの化合物の間に有意な差異は見られなかった(化合物番号1対アナグレライドの分散分析(ANOVA)によりP=0.38)。実際に、2つの化合物は等しい効力を持っており、IC50は110〜130nMであり、1μMにおいて最大効力を有していた。図1の結果は、並行して実施された未処理のサンプルと相対的に示されている。表示されているように、値は、2〜4回の独立した実験の平均値±標準誤差(SE)を示している。それぞれの実験は、異なった提供者に由来する細胞で行った。
【0095】
[インビトロの巨核球形成(megakaryocytopoiesis)における化合物番号1の全体的な効果]
表1は、アナグレライドと化合物番号1が、最終細胞密度、GPIIIa活性細胞の割合、この抗原の発現の相対レベル、細胞のサイズ(後者は細胞成熟とDNA量の両方の関数である)などの幾らかの巨核球分化パラメータにわたって、十分な類似した抑制作用を有していることを示している。
【0096】
これらの培地中のアナグレライドと化合物番号1の抑制作用が巨核球系統に選択的であるか否かを判断するために、非巨核球系細胞の成長について、これらの成分の効果を評価した。12日のコントロール培地において、この細胞(CD61−)は全集団の20〜30%を示している。図2に、巨核球の特徴を発現する細胞の最終的な数の減少のはっきりとした対比が表されているように、アナグレライドも化合物番号1も非巨核球系細胞の成長を抑制しなかった。
【0097】
【表1】

【0098】
CD34+細胞を、材料と方法で説明したように、TPOを追加した血漿含有培地中で、示された化合物(1.0μM)の存在下、又は非存在下で12日間培養した。図2の結果は、未処理のサンプルと相対的に示されている。値は、異なった提供者に由来する細胞で行なわれた、表示された回数の独立した実験の平均値±SEを示している。コントロールに対して、*はP<0.05;**はP<0.01。
【実施例4】
【0099】
6,7−ジクロロ−3−ヒドロキシ−1,5−ジヒドロ−イミダゾ[2,1−b]キナゾリン−2−オン(化合物番号3)の合成
【0100】
【化36】

【0101】
試薬と条件:
ステップ(i):KMnO4、KOH、水、室温、4時間、濾過及び蒸発、ついでDMF、ヨウ化エチル、室温、一晩、水抽出(aqueous work-up)、全体で収率56%。
【0102】
ステップ(ii):2−アミノ−5,6−ジクロロ−3,4−ジヒドロキナゾリン、
【0103】
【化37】

【0104】
NaH、THF,50℃、30分、ついで室温、48時間、水抽出及びカラムクロマトグラフィー、収率50%。
【0105】
ステップ(iii):CF3CO2H、水、室温、1時間、蒸発、凍結乾燥及びエーテルとともに粉砕、収率100%。
【0106】
ステップ(iv):NaIO4、pH5.1緩衝液、アセトン、10℃、20分、蒸発、凍結乾燥及びカラムクロマトグラフィー、収率31%。
【0107】
精製
生成物のクロマトグラフによる分離(異性体である化合物番号5(6,7−ジクロロ−1−ヒドロキシ−3,5−ジヒドロ−イミダゾ[1,2−a]キナゾリン−2−オン)からの分離)を、圧縮空気圧力下のガラスカラム中の順相シリカで、0〜10%メタノール/100〜90%酢酸エチルの勾配で溶出して、実施した。画分を、数滴の濃縮アンモニアを含むTHF(テトラヒドロフラン)で溶出するTLC(薄層クロマトグラフィー)によって分析した。
【0108】
分析データ:
NMR
1H NMR(300Hz,:7.47(1H,d,J=8.7Hz),6.96(1H,d,J=8.7Hz),6.91(1H,d,J=8.7Hz),5.01(1H,d,J=6.7Hz),4.58+4.47(2H,ABシステム,J=14.6Hz).
13C NMR(75MHz,DMSO−D6):130.00, 129.49, 125.32, 120.41, 113.05, 81.29, 41.89(弱いサンプル、いくつかのシグナルは決定されなかった。)
赤外分光分析
IR(ニート):1643,1563,1471cm−1.
質量分析
(EI):271(M+,100%),214(86%),199(34%).
分子量決定
高分解能質量分析:計算値 270.991532 検出値 270.992371
融点
融点:170℃(分解)
【特許請求の範囲】
【請求項1】
十分に純粋な形態の式
【化1】

【化2】

【化3】

の化合物、その平衡化した形態、その化合物の薬学的に許容可能な塩、又はその平衡化した形態の薬学的に許容可能な塩であって、
ここで
R1は、H、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、又はC6−10アリールであり;
R2は、
【化4】

又は
【化5】

であり;
R3は、OH、ハロゲン、SH、O−C1−6アルキル又はヒドロキシル模倣基であり;及び
XとYは独立して、H又はハロゲンである化合物。
【請求項2】
式
【化6】

である請求項1記載の化合物。
【請求項3】
R2が
【化7】

である請求項2記載の化合物。
【請求項4】
R1がH又はC1−6アルキルである請求項2記載の化合物。
【請求項5】
R1がHである請求項2記載の化合物。
【請求項6】
XがH又はハロゲンである請求項2記載の化合物。
【請求項7】
YがH又はClである請求項2記載の化合物。
【請求項8】
XがClである請求項2記載の化合物。
【請求項9】
YがClである請求項2記載の化合物。
【請求項10】
化合物が
【化8】

【化9】

【化10】

【化11】

又は
【化12】

である請求項1記載の化合物。
【請求項11】
請求項1記載の化合物の治療的に効果的な量を、患者へその必要に応じて投与することを備えた血小板血症の治療方法。
【請求項12】
血小板血症が本態性血小板血症(ET)、慢性骨髄性白血病(CML)、真性赤血球増加症(PV)、原因不明の骨髄化生(AMM)、又は鎌状赤血球貧血(SCA)を伴う請求項11記載の方法。
【請求項13】
請求項10記載の化合物の治療的に効果的な量を、患者へその必要に応じて投与することを備えた血小板血症の治療方法。
【請求項14】
血小板血症が本態性血小板血症(ET)、慢性骨髄性白血病(CML)、真性赤血球増加症(PV)、原因不明の骨髄化生(AMM)、又は鎌状赤血球貧血(SCA)を伴う請求項14記載の方法。
【請求項15】
請求項1記載の化合物の少なくとも1つと、アナグレライド、ヒドロキシ尿素、P32、ブスルファン、アスピリン、クロピドグレル、α−インターフェロン、チクロピジン、及びジピリダモールから選ばれる治療薬の少なくとも1つを含む組成。
【請求項1】
十分に純粋な形態の式
【化1】

【化2】

【化3】

の化合物、その平衡化した形態、その化合物の薬学的に許容可能な塩、又はその平衡化した形態の薬学的に許容可能な塩であって、
ここで
R1は、H、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、又はC6−10アリールであり;
R2は、
【化4】

又は
【化5】

であり;
R3は、OH、ハロゲン、SH、O−C1−6アルキル又はヒドロキシル模倣基であり;及び
XとYは独立して、H又はハロゲンである化合物。
【請求項2】
式
【化6】

である請求項1記載の化合物。
【請求項3】
R2が
【化7】

である請求項2記載の化合物。
【請求項4】
R1がH又はC1−6アルキルである請求項2記載の化合物。
【請求項5】
R1がHである請求項2記載の化合物。
【請求項6】
XがH又はハロゲンである請求項2記載の化合物。
【請求項7】
YがH又はClである請求項2記載の化合物。
【請求項8】
XがClである請求項2記載の化合物。
【請求項9】
YがClである請求項2記載の化合物。
【請求項10】
化合物が
【化8】

【化9】

【化10】

【化11】

又は
【化12】

である請求項1記載の化合物。
【請求項11】
請求項1記載の化合物の治療的に効果的な量を、患者へその必要に応じて投与することを備えた血小板血症の治療方法。
【請求項12】
血小板血症が本態性血小板血症(ET)、慢性骨髄性白血病(CML)、真性赤血球増加症(PV)、原因不明の骨髄化生(AMM)、又は鎌状赤血球貧血(SCA)を伴う請求項11記載の方法。
【請求項13】
請求項10記載の化合物の治療的に効果的な量を、患者へその必要に応じて投与することを備えた血小板血症の治療方法。
【請求項14】
血小板血症が本態性血小板血症(ET)、慢性骨髄性白血病(CML)、真性赤血球増加症(PV)、原因不明の骨髄化生(AMM)、又は鎌状赤血球貧血(SCA)を伴う請求項14記載の方法。
【請求項15】
請求項1記載の化合物の少なくとも1つと、アナグレライド、ヒドロキシ尿素、P32、ブスルファン、アスピリン、クロピドグレル、α−インターフェロン、チクロピジン、及びジピリダモールから選ばれる治療薬の少なくとも1つを含む組成。
【図1】


【図2】




【図2】


【公表番号】特表2008−509162(P2008−509162A)
【公表日】平成20年3月27日(2008.3.27)
【国際特許分類】
【出願番号】特願2007−525069(P2007−525069)
【出願日】平成17年8月4日(2005.8.4)
【国際出願番号】PCT/US2005/028086
【国際公開番号】WO2006/017822
【国際公開日】平成18年2月16日(2006.2.16)
【出願人】(507037013)シア ホールディングス,アーゲー (2)
【Fターム(参考)】
【公表日】平成20年3月27日(2008.3.27)
【国際特許分類】
【出願日】平成17年8月4日(2005.8.4)
【国際出願番号】PCT/US2005/028086
【国際公開番号】WO2006/017822
【国際公開日】平成18年2月16日(2006.2.16)
【出願人】(507037013)シア ホールディングス,アーゲー (2)
【Fターム(参考)】
[ Back to top ]

