キナーゼ阻害化合物
本開示は、Jak2キナーゼ活性を調節できる新規化合物、Jak2媒介疾患もしくは障害を呈しているかもしくは呈しやすい対象における治療もしくは予防における治療的使用を有する化合物、ならびにそれらの使用方法およびそれらの組成物に関する。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願
本出願は、2008年12月9日に出願された米国仮出願第61/201,406号の利益および優先権を主張し、この仮出願の内容は、それらの全体を参照することにより本明細書に組み込まれる。
【0002】
連邦支援の研究下で行われた調査に対する合衆国政府の権利
本発明は、米国国立衛生研究所/NHLBIに付与された認可番号R01−HL67277の一部財政的援助のもとに行われた。合衆国政府は、本発明において一定の権利を有する。
【背景技術】
【0003】
タンパク質キナーゼは、細胞内の様々なシグナル形質導入過程の制御を担う構造的に関連した酵素の大ファミリーを構成する。(Hardie, G. and Hanks, S. The Protein Kinase Facts Book, I and II, Academic Press, San Diego, Calif.: 1995を参照されたい)。キナーゼはリン酸化する基質によりファミリーに分類し得る(例えば、タンパク質−チロシン、タンパク質−セリン/トレオニン、脂質など)。通常、これらのキナーゼファミリーのそれぞれに相当する配列モチーフは同定されている(例えば、Hanks, S. K., Hunter, T., FASEB J. 1995, 9, 576−596; Knighton et al., Science 1991, 253, 407−414; Hiles et al., Cell 1992, 70, 419−429; Kunz et al., Cell 1993, 73, 585−596; Garcia−Bustos et al., EMBO J. 1994, 13, 2352−2361を参照されたい)。
【0004】
一般的に、タンパク質キナーゼは、ヌクレオシド三リン酸から、シグナル伝達経路に関与するタンパク質受容体へのホスホリル移行をもたらすことにより細胞内シグナル伝達を媒介する。これらのリン酸化事象は、標的タンパク質の生物学的機能を調節または制御できる分子のオン/オフスイッチとして作用する。これらのリン酸化事象は、様々な細胞外および他の刺激(例えば、環境ストレス、化学物質ストレス、薬剤(例えば、サイトカインおよび増殖因子を含む)によるシグナル伝達)に対する反応において最終的に誘発される。
【0005】
ヤヌスキナーゼ(JAK)はJak1、Jak2、Jak3およびTYK2からなるチロシンキナーゼファミリーである。JAKはサイトカインのシグナル伝達において重要な役割を果たす。JAKファミリーキナーゼのダウンストリーム基質は、シグナル伝達性転写因子(STAT)タンパク質を含む。JAK/STATシグナル伝達は、多くの異常な免疫反応、例えばアレルギー、喘息、自己免疫性疾患(移植拒絶など)、関節リウマチ、筋委縮性側索硬化症および多発性硬化症ならびに固形および血液悪性腫瘍(白血病およびリンパ腫など)の媒介に関係している。JAK/STAT経路における医薬的介入については、概説されている[Frank, Mol. Med. 5, 432−456 (1999) & Seidel et al., Oncogene 19, 2645−2656 (2000)]。
【0006】
Jak1、Jak2、およびTYK2は遍在的に発現する一方、Jak3は大部分が血球内で発現する。Jak3は共通のサイトカイン受容体γ鎖に独占的に結合し、IL−2、IL−4、IL−7、IL−9、およびIL−15により活性化される。IL−4およびIL−9により誘発されるマウス肥満細胞の増殖および生存は、実際には、Jak3およびγ鎖シグナル伝達依存性であることが示されている(Suzuki et al., Blood 96, 2172−2180 (2000))。
【0007】
ある既知のJak2阻害化合物が治療的使用のために提案されているが、これらの化合物は部分的に標的特異性の欠如のために頻繁に制限される。したがって、Jak2媒介疾患を媒介するが、副作用はなく、既存薬の選択制限のない、有用な治療薬が必要とされている。
【発明の概要】
【0008】
本発明は、対象のJak2媒介疾患および障害を治療するために使用できる化合物、ならびにその方法および使用を提供する。
【0009】
1つの態様では、本発明は、式(I)の化合物に関し、
【化1】

式中、
R1とR2はそれぞれ独立してH、−(炭素数1〜4)アルキル、−(炭素数2〜8)アルケニル、−(炭素数2〜8)アルキニル、
【化2】

であり、
ここで、−(炭素数1〜4)アルキルはさらに1つ以上の水酸基もしくはハロゲンと置換でき;
または
R1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成し、ただしR1とR2は窒素原子と一緒になってピペラジン環を形成し、ピペラジン環上の第二の窒素はさらに任意に−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルと置換でき、ここで−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルは1つ以上の水酸基、ハロゲンもしくは−(炭素数1〜3)アルキルと置換できることを条件とし;
R3はH、−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、もしくはアリールであり;
R4はHもしくはR7であり;
R5はH、−(炭素数1〜4)アルキル、−C(CH3)2−R6、もしくはR7であり;ただしR4がHで、R5がR7もしくは−C(CH3)2−R6である場合、およびR5がHもしくは−(炭素数1〜4)アルキルである場合、R4はR7であり、ここでR4とR5は同時にR7となることはできないことを条件とし;
R6はH、−(炭素数1〜4)アルキル、フェニル、もしくは
【化3】

であり、
式中、R1とR2は上に定義したとおりであり;
R7は
【化4】

であり;
式中、R8とR9はそれぞれ独立してH、−OH、−O−(炭素数1〜4)アルキル、−CH2−NR1R2であり、式中、R1とR2は上に定義したとおりであり;
R10は各存在において独立して水素、もしくは−(炭素数1〜3)アルキルであり;
R11はH、アシル、トシル、−(炭素数1〜4)アルキル、もしくはアリールであり;
またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物であり;
ただし化合物は、以下ではないことを条件とする:
i.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
ii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
iii.5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
iv.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
v.4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
vi.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
vii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
viii.4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)。
【0010】
式(I)の化合物の1つの実施形態では、R11は水素である。別の実施形態では、R10は各存在において独立して水素、メチルまたはエチルである。
【0011】
式(I)の化合物の1つの実施形態では、R3はHである。別の実施形態では、R4とR5の一方はR7である。分離された実施形態では、R7は
【化5】

である。
【0012】
式(I)の化合物の1つの実施形態では、R4はR7である。別の実施形態では、R5はHである。1つの実施形態では、R8は−CH2−NR1R2であり、R9は水酸基であり、R1とR2は式(I)で定義される。1つの実施形態では、R10は各存在において独立して水素またはメチルである。別の実施形態では、R1とR2は各存在において独立して−(炭素数1〜4)アルキルである。さらに別の実施形態では、R1とR2は結合している窒素原子と一緒になってピペリジニル、ピロリジニルまたはイミダゾリル環を形成し、式中、R10は各存在において同じである。
【0013】
1つの実施形態では、R10はエチルである。別の実施形態では、R1とR2は独立してエチルまたはイソプロピルである。別の実施形態では、R1とR2は結合している窒素原子と一緒になってピロリジニルまたはイミダゾリル環を形成する。
【0014】
別の実施形態では、R4はHである。ある実施形態では、R5はR7である。1つの実施形態では、R8は水酸基であり、R9は−CH2−NR1R2であり、式中、R1とR2は式(I)で定義される。1つの実施形態では、R10はメチルである。別の実施形態では、R1とR2は各存在において独立して−(炭素数1〜4)アルキルであるか、またはR1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成する。別の実施形態では、R1とR2は独立してプロピルまたはイソプロピルであり、R10がHまたはエチルである場合、R10は各存在において同じである。別の実施形態では、R10がエチルである場合、R1とR2は結合している窒素原子と一緒になってピペリジニル、ピロリジニルまたはイミダゾリル環を形成する。
【0015】
ある実施形態では、化合物は、以下からなる群((A)群)またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される
a)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
b)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
c)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
d)5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
e)5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
f)5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
g)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
h)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;
i)5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
j)5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;
k)5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)2HCl;
l)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
m)5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
n)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
o)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
p)5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
q)5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
r)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
s)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
t)5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
u)5,5−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
v)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
w)4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
x)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
y)5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
z)5,5−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
aa)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
bb)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
cc)4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
dd)4,4−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
ee)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
ff)5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
gg)5,5−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
hh)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
ii)4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);ならびに
jj)4,4−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール)。
【0016】
本明細書に提示する各化合物の化学名は、化合物のシス異性体とトランス異性体の両方を明示的に包含する。
【0017】
別の態様では、本発明は、式(II)の化合物またはその医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物に関し、
【化6】

式中、
R1とR2はそれぞれ独立してH、−(炭素数1〜4)アルキル、−(炭素数2〜8)アルケニル、−(炭素数2〜8)アルキニル、
【化7】

であり、
式中、−(炭素数1〜4)アルキルはさらに1つ以上の水酸基もしくはハロゲンと置換でき;
または
R1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成し、ただしR1とR2は窒素原子と一緒になってピペラジン環を形成し、ピペラジン環上の第二の窒素はさらに任意に−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルと置換でき、ここで−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルは1つ以上の水酸基、ハロゲンもしくは−(炭素数1〜3)アルキルと置換できることを条件とし;
R3はH、−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールであり;
R4はHまたはR7であり;
R5はH、−(炭素数1〜4)アルキル、−C(CH3)2−R6、もしくはR7であり、ただしR4がHで、R5がR7もしくは−C(CH3)2−R6である場合、およびR5がHもしくは−(炭素数1〜4)アルキルである場合、R4はR7であり、ここでR4とR5は同時にR7となることはできないことを条件とし;
R6はH、−(炭素数1〜4)アルキル、フェニル、もしくは
【化8】

であり、
式中、R1とR2は上に定義したとおりであり;
R7は
【化9】

であり;
式中、R8とR9はそれぞれ独立してH、−OH、−O−(炭素数1〜4)アルキル、−CH2−NR1R2であり、式中、R1とR2は上に定義したとおりであり;
R10は各存在において独立して水素、もしくは−(炭素数1〜3)アルキルであり;
R11はH、アシル、トシル、−(炭素数1〜4)アルキル、もしくはアリールである。
【0018】
ある実施形態では、式(I)または式(II)の化合物は、以下からなる群の化合物ではない:4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「G6」);4,4−(ヘキサン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(とも呼ぶ「D1);4−ベンジル−2−((ジエチルアミノ)メチル)フェノール(「D2」とも呼ぶ);2,2−(メチルアザンジイル)ビス(メチレン)ビス(4−メチルフェノール)(「D3」とも呼ぶ);2−((ジメチルアミノ)メチル)−4−(4−(4−ヒドロキシフェニル)ヘキサン−3−イル)フェノール(「D4」とも呼ぶ);2,2−(ピペラジン−1,4−ジイルビス(メチレン))ビス(4−エチルフェノール)(「D5」とも呼ぶ);2,2−(ピペラジン−1,4−ジイルビス(メチレン))ビス(4−メチルフェノール)(「D6」とも呼ぶ);6,6−(メチルアザンジイル)ビス(メチレン)ビス(2−メチルフェノール)(「D7」とも呼ぶ);2,2−(2−ヒドロキシ−5−(4−(4−ヒドロキシフェニル)ヘキサ−3−エン−3−イル)ベンジルアザンジイル)ジエタノール(「D10」とも呼ぶ);2−((ジメチルアミノ)メチル)−4−(2−フェニルプロパン−2−イル)フェノール(「D11」とも呼ぶ);2−シクロヘキシル−6−((ジエチルアミノ)メチル)−4−tert−ペンチルフェノール(「D12」とも呼ぶ);3−((ジエチルアミノ)メチル)−5−tert−ペンチルビフェニル−2−オール(「D13」とも呼ぶ);5−tert−ブチル−3−((ジエチルアミノ)メチル)ビフェニル−2−オール(「D14」とも呼ぶ);3−((ジメチルアミノ)メチル)ビフェニル−2−オール(「D21」とも呼ぶ);2−((ジエチルアミノ)メチル)−4−(4−(4−メトキシフェニル)ヘキサ−3−エン−3−イル)フェノール(「D22」とも呼ぶ);2−((ベンジルアミノ)メチル)−4,6−ジメチルフェノール(「D23」とも呼ぶ);2−シクロヘキシル−6−((ジエチルアミノ)メチル)−4−(2−フェニルプロパン−2−イル)フェノール(「D25」とも呼ぶ);2−((ジメチルアミノ)メチル)−4−(4−(4−メトキシフェニル)ヘキサ−3−エン−3−イル)フェノール(「D28」とも呼ぶ);5,5−(ヘキサン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「D30」とも呼ぶ)。
【0019】
ある実施形態では、本発明は、以下からなる群(B群)またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物を提供する:4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)2HCl;5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);ならびに4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);ならびに4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)。
【0020】
(B)群に提示する各化合物名は、化合物のシス異性体とトランス異性体の両方を明示的に包含することを意味する。
【0021】
ある実施形態では、化合物は、以下の群(C群)またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される:
1)(Z)−および(E)−4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「NB−1」):
【化10】

2)(Z)−および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「NB−2」):
【化11】

3)(Z)−および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「NB−3」):
【化12】

4)(Z)−および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−4」):
【化13】

5)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「NB−5」):
【化14】

6)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−6」):
【化15】

7)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−7」):
【化16】

8)(Z)−および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl(「NB−8」):
【化17】

9)(Z)−および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl(「NB−9」):
【化18】

10)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl(「NB−10」):
【化19】

11)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl(「NB−11」):
【化20】

12)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−12」):
【化21】

13)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−13」):
【化22】

14)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−14」):
【化23】

15)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−15」):
【化24】

16)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−16」):
【化25】

17)(Z)および(E)−(5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−17」):
【化26】

18)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(モルホリノメチル)フェノール)(「NB−18」):
【化27】

;
19)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(モルホリノメチル)フェノール)(「NB−19」):
【化28】

20)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−20」):
【化29】

21)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−21」):
【化30】

;
22)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−(モルホリノメチル)フェノール)(「NB−22」):
【化31】

23)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−23」):
【化32】

24)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−24」):
【化33】

25)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−25」):
【化34】

26)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(モルホリノメチル)フェノール)(「NB−26」):
【化35】

27)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−27」):
【化36】

28)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−28」):
【化37】

29)(Z)および(E)−2−((ジエチルアミノ)メチル)−4−(4−(4−ヒドロキシフェニル)ヘキサ−3−エン−3−イル)フェノール(「NB−29」):
【化38】

;
30)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ジフェノール(「NB−30」)
【化39】

31)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ジフェノール(「NB−31」):
【化40】

32)(Z)および(E)−3,3−(エテン−1,2−ジイル)ジフェノール(「NB−32」):
【化41】

33)(Z)および(E)−3,3−(ブタ−2−エン−2,3−ジイル)ジフェノール(「NB−33」):
【化42】

;
34)(Z)および(E)−4,4−(エテン−1,2−ジイル)ジフェノール(「NB−34」):
【化43】

;ならびに
35)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「G6」):
【化44】

。
【0022】
さらに別の実施形態では、化合物は、(上に定義した)NB−1、NB−2、NB−3、NB−4、NB−5、NB−6、NB−7、NB−8、NB−9、NB−10、NB−11、およびNB−12からなる群((D)群)、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される。
【0023】
本発明の別の態様は、式(III)の化合物またはその医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物に関し、
【化45】

式(III)
式中、
R1とR2はそれぞれ独立してH、−(炭素数1〜4)アルキル、−(炭素数2〜8)アルケニル、−(炭素数2〜8)アルキニル、
【化46】

であり、
式中、−(炭素数1〜4)アルキルはさらに1つ以上の水酸基もしくはハロゲンと置換でき;
または
R1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成し、ただしR1とR2は窒素原子と一緒になってピペラジン環を形成し、ピペラジン環上の第二の窒素はさらに任意に−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルと置換でき、ここで−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルは1つ以上の水酸基、ハロゲンもしくは−(炭素数1〜3)アルキルと置換できることを条件とし;
R11はH、アシル、トシル、−(炭素数1〜4)アルキル、もしくはアリールであり;
R4とR5はHもしくはR12であり、ただしR4とR5の一方はH、他方はR12であることを条件とし;
R12は
【化47】

であり、
式中、R4とR5の両方が結合するアリール基はR12の芳香族環の−OR11のメタもしくはパラであり;
R10は水素、もしくは−(炭素数1〜3)アルキルであり;
ただし化合物は、以下ではないことを条件とする:
i.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
ii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
iii.5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
iv.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
v.4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
vi.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
vii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
viii.4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)。
【0024】
本発明は、対象のJak2媒介疾患または障害の治療または予防方法も提供する。ある実施形態では、本方法は、有効量の上に定義した式(I)、(II)および(III)から選択される化合物、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物を、対象のJak2媒介疾患または障害が治療または予防されるように対象に投与する工程を含む。ある実施形態では、対象に投与する化合物は、式(I)もしくは式(III)の化合物、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物である。
【0025】
1つの実施形態では、化合物は、上に定義した(A)、(B)、(C)もしくは(D)群、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物から選択される。別の実施形態では、化合物は、(B)群、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物から選択される。別の実施形態では、化合物は、(C)群から選択される化合物またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物である。さらに別の実施形態では、化合物は、(D)群の化合物またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物である。
【0026】
1つの実施形態では、本発明の化合物を、約0.001mg/Kg/日〜約200mg/Kg/日、または約0.001mg/Kg/日〜約30mg/Kg/日の用量で対象に投与する。ある実施形態では、本発明の化合物を、約0.1mg/Kg/日〜約10mg/Kg/日の用量で対象に投与する。1つの実施形態では、化合物を、約1mg/Kg/日の用量で対象に投与する。
【0027】
1つの実施形態では、本方法は、追加の治療薬を対象に投与することも含む。1つの実施形態では、本発明の化合物および追加の治療薬を同時投与する。別の実施形態では、本発明の化合物および追加の治療薬を連続投与する。
【0028】
1つの実施形態では、Jak2媒介疾患または障害は、真性赤血球増加症、本態性血小板血症、または特発性骨髄化生である。別の実施形態では、Jak2媒介障害は、心疾患または心障害である。ある実施形態では、心疾患または心障害は、心肥大、心虚血再灌流、および心不全の群から選択される。
【0029】
別の実施形態では、化合物はJak2−V617F変異の阻害剤でもある。
【0030】
別の実施形態では、上に定義した式(I)、式(II)もしくは式(III)の化合物またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物は、Jak2自己リン酸化を阻害する。別の実施形態では、上に定義した式(I)、(II)および(III)の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物は、c−SrcもしくはTyk2自己リン酸化をJak2自己リン酸化ほど効果的には阻害しない。
【0031】
さらに別の実施形態では、対象はJak2−V617F変異(1つまたは複数)を有すると同定される。
【0032】
別の態様では、本発明は、対象の癌の治療または予防方法を提供する。本方法は、有効量の式(I)、(II)もしくは(III)の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物を、癌が治療もしくは予防されるように対象に投与することを含む。ある実施形態では、化合物は、上に定義した(A)、(B)、(C)もしくは(D)群から選択される化合物、それらの医薬上許容可能な塩、水和物もしくは溶媒和化合物である。1つの実施形態では、化合物は、(B)群、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物から選択される化合物である。別の実施形態では、化合物は、(C)群、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物から選択される化合物である。さらに別の実施形態では、化合物は、(D)群、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物から選択される化合物である。
【0033】
1つの実施形態では、本発明の化合物を、約0.001mg/Kg/日〜約200mg/Kg/日、または約0.001mg/Kg/日〜約30mg/Kg/日の用量で対象に投与する。ある実施形態では、本発明の化合物を、約0.1mg/Kg/日〜約10mg/Kg/日の用量で対象に投与する。ある実施形態では、化合物を、約1mg/Kg/日の用量で対象に投与する。
【0034】
1つの実施形態では、癌は、白血病、リンパ腫、骨髄腫、および固形腫瘍の群から選択される。別の実施形態では、癌は、慢性骨髄性白血病(CML)、急性骨髄性白血病(AML)、および急性前骨髄球性白血病(APL)の群から選択される。
【0035】
別の態様では、本発明は、Jak2依存性細胞増殖の低減方法を提供する。本方法は、(例えば、インビトロまたはインビボ、例えば、対象における)細胞をJak2阻害剤と接触させることを含み、ここで阻害剤は、上に定義した式(I)、(II)もしくは(III)の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物である。ある実施形態では、化合物は、上に定義した(A)、(B)、(C)もしくは(D)群、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物から選択される。1つの実施形態では、化合物は、(B)群の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物である。ある実施形態では、化合物は、(C)群の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物である。さらに別の実施形態では、化合物は、(D)群の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物であると定めている。
【0036】
1つの実施形態では、本発明の化合物を、約0.001mg/Kg/日〜約200mg/Kg/日、または約0.001mg/Kg/日〜約30mg/Kg/日の用量で細胞または対象に投与する。ある実施形態では、本発明の化合物を、約0.1mg/Kg/日〜約10mg/Kg/日の用量で対象に投与する。ある実施形態では、化合物を、約1mg/Kg/日の用量で対象に投与する。
【0037】
本発明の別の態様は、かかる治療を必要とすることが同定されている対象のJak2の阻害方法を提供する。本方法は、有効量の式(I)、(II)もしくは(III)の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物を、対象のJak2が阻害されるように対象に投与することを含む。ある実施形態では、化合物は、上に定義した(A)、(B)、(C)もしくは(D)群、それらの医薬上許容可能な塩、水和物もしくは溶媒和化合物から選択される。ある実施形態では、化合物は、(C)もしくは(D)群の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物である。
【0038】
1つの実施形態では、化合物を、約0.001mg/Kg/日〜約200mg/Kg/日、または約0.001mg/Kg/日〜約30mg/Kg/日の用量で、治療を必要とすることが同定されている対象に投与する。ある実施形態では、化合物を、約0.1mg/Kg/日〜約10mg/Kg/日の用量で対象に投与する。ある実施形態では、化合物を、約1mg/Kg/日の用量で対象に投与する。
【0039】
別の態様では、本発明は、対象の血液疾患または障害の治療方法を提供する。本方法は、有効量の式(I)、(II)もしくは(III)の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物を、血液疾患もしくは障害が治療されるように対象に投与することを含む。ある実施形態では、化合物は、上に定義した(A)、(B)、(C)もしくは(D)群、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物から選択される。ある実施形態では、化合物は、(C)もしくは(D)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。
【0040】
本発明は、医薬組成物も提供し、ここで組成物は、Jak2活性を調節できる化合物、またはその医薬上許容可能なエステル、塩、もしくはプロドラッグを医薬上許容可能な担体と共に含む。1つの実施形態では、化合物は、式(II)の化合物またはその医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物である。ある実施形態では、化合物は、上に定義した式(I)もしくは(III)の化合物、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物である。ある実施形態では、化合物は、上に定義した(A)、(B)、(C)もしくは(D)群、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物から選択される。1つの実施形態では、化合物は、(B)群の化合物、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物である。別の実施形態では、化合物は、(C)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。さらに別の実施形態では、化合物は、(D)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。
【0041】
本発明は、対象のJak2関連疾患または障害を治療または予防するためのキットも提供する。キットは、Jak2活性を調節できる少なくとも1つの化合物、ならびにJak2関連疾患もしくは障害の治療もしくは予防における使用説明書を含み、ここで化合物は、上に定義した式(I)、(II)もしくは(III)の化合物、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物である。ある実施形態では、化合物は、上に定義した(A)、(B)、(C)もしくは(D)群、それらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される。1つの実施形態では、化合物は、(B)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。別の実施形態では、化合物は、(C)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。さらに別の実施形態では、化合物は、(D)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。
【0042】
1つの実施形態では、Jak2関連疾患または障害は、癌、血液障害および心障害からなる群から選択される。
【0043】
別の態様では、本発明は、製薬のため本明細書の任意の式の化合物の使用を提供する。ある実施形態では、薬は、Jak2関連疾患または障害(例えば、癌、血液疾患または障害など)の治療のための薬である。
【0044】
本発明は、Jak2の結合ポケットに結合する化合物の設計、評価および同定方法も提供する。本発明の他の態様および実施形態は、以下に開示する。
【図面の簡単な説明】
【0045】
本発明を以下の限定されない実施例に準拠して、かつ下図に準拠して、以下に詳述する:
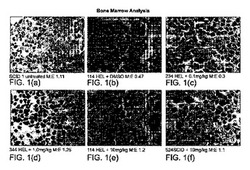
【図1】(a〜f)骨髄分析を示す:1(a)は、未処理SCID 1を示し、ここで脊髄細胞:赤血球系細胞の比率は1.11であり;1(b)は、DMSOで処理した114HEL細胞を示し、ここで脊髄細胞:赤血球系細胞の比率は0.47であり;1(c)は、0.1mg/kg G6で処理した234AHEL細胞を示し、ここで脊髄細胞:赤血球系細胞の比率は0.3であり;1(d)は、1.0mg/kg G6で処理した344HEL細胞を示し、ここで脊髄細胞:赤血球系細胞の比率は1.25であり;1(e)は、10mg/kg G6で処理した444HEL細胞を示し、ここで脊髄細胞:赤血球系細胞の比率は1.2であり;1(f)は、10mg/kg G6で処理した524SCIDを示し、ここで脊髄細胞:赤血球系細胞の比率は1.1である。
【図2】G6がJak2−V617F依存性HEL細胞増殖を阻害することを示す結果を示す;
【図3】G6がJak2−V617F依存性細胞増殖を50%阻害するために必要な時間を示す。
【図4】G6がJak2−V617F依存性HEL細胞増殖を用量依存的かつ時間依存的に阻害することを示す結果を示す;
【図5】NB−1はJak2−V617F依存性HEL細胞増殖を阻害することを示す結果を示す;
【図6】NB−2はJak2−V617F依存性HEL細胞増殖を阻害することを示す結果を示す;
【図7】G6はc−Srcチロシンキナーゼ活性に対して無効であることを示す結果を示す;
【図8】G6は、細胞アポトーシスを増大することにより細胞数を低減することを示す結果を示す;
【図9】G6はJak2−V617F依存性巨核球コロニー形成をブロックすることを示すエクスビボ結果を示す;
【図10】G6、NB−1およびNB−2は真性赤血球増加症患者由来の病的細胞増殖を用量依存的に低減することを示すエクスビボ結果を示す;
【図11】G6は末梢血中の芽細胞パーセンテージを用量依存的に低下させることを示すインビボ結果を示す;
【図12】G6は最小用量1mg/kg/日でHEL細胞誘発性の脊髄細胞:赤血球系細胞の比率の低下を逆転したことを示すインビボ試験結果を表すグラフである;
【図13】G6処理は未成熟赤血球細胞ではなく成熟赤血球細胞の低減数と相関することを示すインビボ試験結果を表すグラフである;
【図14】G6は脾臓重量の体重に対する比率を低下させることを示すインビボ試験結果を表すグラフである。
【図15】Jak2−V617F自己リン酸化アッセイにおいて試験したいくつかの化合物の結果を示す。
【発明を実施するための形態】
【0046】
本発明は、式(I)で定義される新規構造の化合物を対象とする。ある実施形態では、化合物は式(III)の化合物である。これらの化合物は、Jak2結合相互作用を調節することができる。本発明は、式(II)に定義され、Jak2活性の阻害剤として使用できる化合物にも関し、この化合物はJak2相互作用を標的とすることによりJak2変異を阻害することもできる。本発明の化合物は、Jak2媒介疾患または障害、特に、Jak2およびJak2変異が著しい役割を担うある増殖疾患の種類を治療または予防するための新規治療薬の候補である。
【0047】
本発明は、以下に叙述した化合物が、様々な疾患療法のために、ある標的との相互作用に選択性を示す(例えば、Jak2またはJak2変異に選択的である)ことの発見にも、少なくとも部分的に関する。
【0048】
1.定義
本発明を詳述する前に、本発明がより容易に理解され得るように、ある用語を最初に定義し、便宜上ここに収集する。
【0049】
本明細書および特許請求の範囲に使用される単数形「a」、「an」、および「the」は、文脈においてはっきりと別段の指摘がされない限り、複数形の指示対象を含む。例えば、「細胞(a cell)」という用語は、それらの混合物を含む複数の細胞(cells)を含む。「核酸分子(a nucleic acid molecule)」という用語は、複数の核酸分子(nucleic acid molecules)を含む。
【0050】
本開示では、「含む(comprises)」、「含んでいる(comprising)」、「含んでいる(containing)」および「有する」などは、米国特許法で認められる意味を含むこともでき、「含む(includes)」、「含んでいる(including)」などを意味することもできる;「本質的に〜からなる(consisting essentially of)」または「本質的になる(consists essentially)」とは、同様に米国特許法で認められる意味を有し、用語は開放表現であり、先行技術の実施形態を除いて列挙したものを超える存在により列挙したものの基本的または新規特徴が変更されない限り、列挙したものより多くの存在が可能である。
【0051】
「投与」または「投与する」という用語は、本発明の化合物を、それらの目的の機能を遂行するために対象へ導入する経路を含む。使用してよい投与経路の例としては、注射(皮下、静脈内、非経口、腹腔内、髄腔内)、経口、吸入、直腸および経皮が挙げられる。医薬調製物は、各投与経路に適した形態により投与し得る。例えば、これらの調製物を、錠剤もしくはカプセル形態で、注射、吸入、洗眼液、軟膏、坐剤など、注射、注入もしくは吸入投与;ローションもしくは軟膏により局所投与;ならびに坐剤により直腸投与する。経口投与が好ましい。注射はボーラスであることも持続注入であることもできる。投与経路に応じて、本発明の化合物は、その目的の機能を遂行する能力に対して有害な作用を及ぼし得る天然状態から保護するために選択された物質によりコーティングすることも配置することもできる。本発明の化合物は、単独で投与することもでき、上記の別の薬剤のいずれかもしくは医薬上許容可能な担体、または両方と併用投与することもできる。本発明の化合物は、他の薬剤投与前、薬剤と同時に、または薬剤の投与後に投与できる。さらに、本発明の化合物は、その活性代謝産物、またはインビボでより活性の代謝産物に変換したプロドラッグ形態で投与することもできる。
【0052】
「との併用」という語句は、本発明の化合物(例えば式(I)、式(II)または式(III)から選択される化合物)を第二の薬剤(式(I)、式(II)または式(III)から選択される第二の化合物など)、または特定の疾患もしくは障害に使用される既存の治療薬と共に提供するすべての投与形態を指すことを意図し、2つは同時にまたは任意の順で連続して投与する。
【0053】
「アルキル」という用語は、直鎖アルキル基、分岐鎖アルキル基、シクロアルキル(脂環式)基、アルキル置換シクロアルキル基、およびシクロアルキル置換アルキル基を含む、飽和脂肪族基のラジカルを指す。アルキルという用語は、さらにアルキル基を含み、これはさらに、炭化水素骨格の1つ以上の炭素を置換した酸素、窒素、硫黄またはリン原子を含むことができる(例えば、酸素、窒素、硫黄またはリン原子)。好ましい実施形態では、直鎖または分岐鎖アルキルの骨格に炭素原子が30個以下あり(例えば、直鎖の場合は炭素数1〜30、分岐鎖の場合は炭素数3〜30)、好ましくは26個以下、より好ましくは20個以下、さらにより好ましくは4個以下の炭素原子がある。同様に、好ましいシクロアルキルの環構造には炭素原子が3〜10個あり、より好ましくは環構造に3、4、5、6または7個の炭素がある。
【0054】
さらに、本明細書および本文を通して使用されるアルキルという用語は、「非置換アルキル」と「置換アルキル」の両方を含み、後者は、炭化水素骨格の1つ以上の炭素上の水素を置換する置換基を有するアルキル部分を指すことを意図する。かかる置換基としては、例えば、ハロゲン、ヒドロキシル、アルキルカルボニルオキシ、アリールカルボニルオキシ、アルコキシカルボニルオキシ、アリールオキシカルボニルオキシ、カルボン酸塩、アルキルカルボニル、アルコキシカルボニル、アミノカルボニル、アルキルチオカルボニル、アルコキシル、リン酸塩、ホスホン酸塩、ホスフィン酸塩、シアノ、アミノ(アルキルアミノ、ジアルキルアミノ、アリールアミノ、ジアリールアミノ、およびアルキルアリールアミノを含む)、アシルアミノ(アルキルカルボニルアミノ、アリールカルボニルアミノ、カルバモイルおよびウレイドを含む)、アミジノ、イミノ、スルフヒドリル、アルキルチオ、アリールチオ、チオカルボン酸塩、硫酸塩、スルホナト、スルファモイル、スルホンアミド、ニトロ、トリフルオロメチル、シアノ、アジド、ヘテロシクリル、アルキルアリール、または芳香族もしくは複素芳香族部分を挙げることができる。炭化水素鎖上で置換される部分は、適切な場合、それ自体を置換できることが、当業者により理解されるであろう。シクロアルキルは、例えば、上記の置換基とさらに置換することができる。「アルキルアリール」部分は、アリール(例えば、フェニルメチル(ベンジル))と置換するアルキルである。「アルキル」という用語は、上記のアルキルと鎖長が類似し、上記のアルキルへの置換が可能であるが、それぞれ二重結合または三重結合を少なくとも1つ含む不飽和脂肪族基も指す。
【0055】
炭素数を他に特定しない限り、本明細書で使用する「低級アルキル」とは、上に定義するアルキル基だが、骨格構造(直鎖でも分岐鎖でもよい)に1〜10個の炭素、より好ましくは1〜6個、さらにより好ましくは1〜4個の炭素原子を有するアルキル基を意味する。低級アルキル基の例としては、メチル、エチル、n−プロピル、i−プロピル、tert−ブチル、ヘキシル、ヘプチル、オクチルなどが挙げられる。好ましい実施形態では、「低級アルキル」という用語は、骨格の炭素原子が4個以下である直鎖アルキル、例えば、炭素数1〜4アルキルを含む。
【0056】
「アルコキシアルキル」、「ポリアミノアルキル」および「チオアルコキシアルキル」という用語は、上記のアルキル基を指し、これらはさらに、炭化水素骨格の1つ以上の炭素と置換した酸素、窒素または硫黄原子(例えば、酸素、窒素または硫黄原子)を含む。
【0057】
「アルケニル」および「アルキニル」という用語は、上記のアルキルと鎖長が類似し、上記のアルキルへの置換が可能であるが、それぞれ二重結合または三重結合を少なくとも1つ含む不飽和脂肪族基を指す。例えば、本発明は、シアノ基およびプロパルギル基を意図する。
【0058】
本明細書で使用する「アリール」という用語は、0〜4個のヘテロ原子を含み得る5員環および6員環の単環式芳香族基(例えば、ベンゼン、ピロール、フラン、チオフェン、イミダゾール、ベンゾキサゾール、ベンゾチアゾール、トリアゾール、テトラゾール、ピラゾール、ピリジン、ピラジン、ピリダジンおよびピリミジンなど)を含むアリール基ラジカルを指す。アリール基としては、多環縮合芳香族基(ナフチル、キノリル、インドリルなど)も挙げられる。環構造にヘテロ原子を有するアリール基は、「アリール複素環」、「ヘテロアリール」または「複素芳香族」とも呼び得る。芳香族環は、上記のような置換基(例えば、ハロゲン、ヒドロキシル、アルコキシ、アルキルカルボニルオキシ、アリールカルボニルオキシ、アルコキシカルボニルオキシ、アリールオキシカルボニルオキシ、カルボン酸塩、アルキルカルボニル、アルコキシカルボニル、アミノカルボニル、アルキルチオカルボニル、リン酸塩、ホスホン酸塩、ホスフィン酸塩、シアノ、アミノ(アルキルアミノ、ジアルキルアミノ、アリールアミノ、ジアリールアミノ、およびアルキルアリールアミノを含む)、アシルアミノ(アルキルカルボニルアミノ、アリールカルボニルアミノ、カルバモイルおよびウレイドを含む)、アミジノ、イミノ、スルフヒドリル、アルキルチオ、アリールチオ、チオカルボン酸塩、硫酸塩、スルホナト、スルファモイル、スルホンアミド、ニトロ、トリフルオロメチル、シアノ、アジド、ヘテロシクリル、アルキルアリール、または芳香族もしくは複素芳香族部分)と1つ以上の環位置で置換できる。アリール基は、多環(例えば、テトラリン)を形成するように、芳香族ではない脂環または複素環と縮合または架橋することもできる。
【0059】
「と結合する」という用語は、化学実体もしくは化合物、またはその部分、ならびにタンパク質上の結合ポケットもしくは結合部位間の近接した状態を指す。結合は非共有結合であってもよいし(ここで並置は、水素結合またはファンデルワールスもしくは静電相互作用によるものがエネルギー的に好ましい)、共有結合であってもよい。
【0060】
本明細書で使用する「結合ポケット」という用語は、分子もしくは分子複合体領域を指し、その形の結果として、好ましくは別の化学実体または化合物と結合する。
【0061】
本発明の化合物の「生体活性」という言葉は、本発明の化合物により反応細胞中に誘発されたすべての活性を含む。この言葉は、これらの化合物により誘発されたゲノムおよび非ゲノム活性を含む。
【0062】
「生体組成物」または「生体試料」とは、細胞または生体高分子を含むかまたはそれに由来する組成物を指す。細胞含有組成物としては、例えば、哺乳類血液、赤血球濃縮物、血小板濃縮物、白血球濃縮物、血球タンパク質、血漿、多血小板血漿、血漿濃縮物、血漿の任意の分画由来の沈殿物、血漿の任意の分画由来の上清、血漿タンパク質分画、精製もしくは部分的に精製した血液タンパク質もしくは他の成分、血清、精液、哺乳類初乳、乳汁、唾液、胎盤抽出物、寒冷沈降物、寒冷上清、細胞可溶化物、哺乳類細胞培養もしくは培養培地、発酵生成物、腹水、血球中に誘発したタンパク質、ならびに正常細胞もしくは(例えば、組換えDNAまたはモノクローナル抗体技術を介した)形質転換した細胞により細胞培養中で産生した生成物が挙げられる。生体組成物は無細胞であることができる。好ましい実施形態では、適切な生体組成物または生体試料は、赤血球懸濁液である。いくつかの実施形態では、血球懸濁液は哺乳類の血球を含む。好ましくは、血球はヒト、非ヒト霊長類、イヌ、ネコ、ウマ、ウシ、ヤギ、ヒツジまたはブタから得られる。好ましい実施形態では、血球懸濁液は、赤血球および/または血小板および/または白血球および/または骨髄細胞を含む。
【0063】
「キラル」という用語は、鏡像パートナーを重ねることができない特性を有する分子を指し、一方、「アキラル」という用語は、鏡像パートナーに重ねることができる分子を指す。
【0064】
「ジアステレオマー」という用語は、非対称の2つ以上の中心およびそれらの分子が互いに鏡像ではない立体異性体を指す。
【0065】
「有効量」という用語は、必要な投与量および必要な期間において、(例えば、本明細書に叙述した障害を治療する上で十分な)所望の結果を得るために有効な量を含む。有効量の本発明の化合物は、要因(疾患状態、年齢、および対象の体重、ならびに対象において所望の反応を誘発する本発明の化合物の能力など)に応じて変わり得る。投与量投与計画は、至適治療反応を提供するために調整してよい。有効量は、本発明の化合物の任意の毒性または有害な作用(例えば、副作用)よりも治療的に有益な効果が勝る量でもある。
【0066】
本発明の化合物の「治療的有効量」という言葉は、単回または複数回投与時、Jak2媒介障害に対して、またはかかるJak2媒介障害患者をかかる治療の不在下で予期されるよりも延命する上で有効な薬剤量を指す。
【0067】
本発明の化合物の治療有効量(すなわち、有効な投与量)は、約0.001〜約100mg/kg体重、または約0.1〜約10mg/kg体重の範囲であり得る。対象を効果的に治療するために必要とされる投与量に影響を与え得るある要因(疾患もしくは障害の重症度、前治療、対象の全身健康および/もしくは年齢、ならびに他の疾患既往が挙げられるが、これらに限定されない)については、当業者に理解されるであろう。さらに、治療有効量の本発明の化合物による対象の治療は、単一の治療を含むこともでき、好ましくは、一連の治療を含むことができる。1つの例では、約0.1〜100mg/kg体重、週1回約1〜10週間の範囲の本発明の化合物で対象を治療する。ある例では、週1回2〜8週間、および約3〜7週間である。治療するために使用される本発明の化合物の有効な投与量は、特定の治療過程を通して増量しても減量してもよいことも理解されるであろう。
【0068】
「薬剤」とは、ポリペプチド、ポリヌクレオチド、またはその断片もしくはアナログ、小分子、または他の生物学的活性分子を意味する。
【0069】
「鏡像異性体」という用語は、重ねることができない互いに鏡像である化合物の2つの立体異性体を指す。2つの鏡像異性体の等モル混合物は、「ラセミ混合物」または「ラセミ体」と呼ぶ。
【0070】
「ハロアルキル」という用語は、ハロゲン(例えば、フルオロメチルおよびトリフルオロメチル)によりモノ、ジまたはポリ置換された上に定義するアルキル基を含むことを意図する。
【0071】
「ハロゲン」という用語は、フッ素(F)、塩素(Cl)、臭素(Br)またはヨウ素(I)を示す。
【0072】
「ヒドロキシル」という用語は、水酸基(−OH)を意味する。
【0073】
本明細書で使用する「ヘテロ原子」という用語は、炭素または水素以外の任意の要素の原子を意味する。好ましいヘテロ原子は、窒素、酸素、硫黄およびリンである。
【0074】
「血液疾患または障害」という用語は、血液または造血組織の疾患または障害を指すことを意味する。
【0075】
「癌」という用語は、不適切に高レベルの細胞分裂、不適切に低レベルのアポトーシス、または両方に引き起こされるかまたはそれらに至る任意の疾患を指すことを意味する。癌の例としては、白血病(例えば、急性白血病、急性リンパ性白血病、急性骨髄性白血病、急性骨髄芽球性白血病、急性前骨髄球性白血病、急性骨髄単球性白血病、急性単球性白血病、急性赤白血病、慢性白血病、慢性骨髄性白血病、慢性リンパ性白血病)、真性赤血球増加症、リンパ腫(ホジキン病、非ホジキン病)、ヴァルデンストレームマクログロブリン血症、重鎖疾患、ならびに固形腫瘍、例えば肉腫および癌腫(例えば、線維肉腫、粘液肉腫、脂肪肉腫、軟骨肉腫、骨原性肉腫、脊索腫、血管肉腫、内皮肉腫、リンパ管肉腫、リンパ管内皮細胞肉腫、滑膜腫、中皮腫、ユーイング腫瘍、平滑筋肉腫、横紋筋肉腫、結腸癌、膵臓癌、乳癌、卵巣癌、前立腺癌、平上皮細胞癌、基底細胞癌、腺癌、汗腺癌、脂腺癌、乳頭状癌、乳頭腺癌、嚢胞腺癌、髄様癌、気管支原性癌、腎細胞癌、肝細胞腫、胆管癌、絨毛癌、精上皮腫、胎生期癌、ウィルムス腫瘍、子宮頚癌、子宮癌、精巣癌、肺癌、小細胞肺癌、膀胱癌、上皮癌、神経膠腫、星細胞腫、髄芽腫、頭蓋咽頭腫、上衣腫、松果体腫、血管芽細胞腫、聴神経腫、乏突起膠腫、シュワン腫、髄膜腫、黒色腫、神経芽細胞腫、および網膜芽細胞腫)などが挙げられるが、これらに限定されない。リンパ増殖性障害も増殖性疾患とみなされる。
【0076】
「癌の治療」という語句は、悪性細胞または癌細胞の殺傷を指す。治療とは、腫瘍中の主題の細胞死を引き起こすことを意味する。あるいは、癌の「治療」とは、対象の癌症状の抑止あるいは改善を意味する。
【0077】
「改善された生体特性」という言葉は、本発明の化合物に付随する、本発明の化合物のインビボでの有効性を高める任意の活性を指す。好ましい実施形態では、この用語は、任意の定性的または定量的に改善された本発明の化合物の治療特性(低下した毒性など)を指す。
【0078】
「細胞増殖性障害」という用語は、望ましくないかまたは制御されない細胞増殖に関わる障害を含む。かかる障害の例としては、腫瘍もしくは癌(例えば、乳、卵巣、前立腺、肺(小細胞および非小細胞)、甲状腺、膵臓、乳または結腸などの固形腫瘍))、肉腫、白血病、骨髄腫、リンパ腫、または黒色腫が挙げられるが、これらに限定されない。
【0079】
「任意に置換した」という用語は、1つ以上の利用可能な位置、典型的には1、2、3、4または5位が、水素以外の1つ以上の適切な基(同じでも異なってもよい)により置換されていないか置換されている基を包含することを意図する。かかる任意の置換基としては、例えば、水酸基、ハロゲン、シアノ、ニトロ、炭素数1〜8アルキル、炭素数2〜8アルケニル、炭素数2〜8アルキニル、炭素数1〜8アルコキシ、炭素数2〜8アルキルエーテル、炭素数3〜8アルカノン、炭素数1〜8アルキルチオ、アミノ、モノ−またはジ−(炭素数1〜8アルキル)アミノ、ハロ炭素数1〜8アルキル、ハロ炭素数1〜8アルコキシ、炭素数1〜8アルカノイル、炭素数2〜8アルカノイルオキシ、炭素数1〜8アルコキシカルボニル、−COOH、−CONH2、モノ−またはジ−(炭素数1〜8アルキル)アミノカルボニル、−SO2NH2、および/またはモノまたはジ(炭素数1〜8アルキル)スルホンアミド、ならびに炭素環および複素環基が挙げられる。任意の置換は、「0〜X個の置換基と置換した」(Xは可能な最大置換基数)という語句によっても示される。ある任意の置換基は、0から2、3または4個の独立して選択された置換基と置換される(すなわち、置換されないか列挙した置換基の最大数まで置換される)。
【0080】
「異性体」または「立体異性体」という用語は、化学構造は同じであるが、空間の原子または基の配置が異なる化合物を指す。
【0081】
「調節」という用語は、例えば、本発明の化合物の曝露に対する反応における細胞の増殖能の上昇または低下、例えば、所望の最終結果(例えば、治療結果)が得られるような動物における少なくとも副細胞集団の増殖阻害を指す。ある好ましい例では、調節は、阻害である。「阻害」という用語は、標的活性、例えば細胞増殖を低減する、抑制する、減弱する、減退する、抑止する、または安定させることを意味する。ある例では、本発明は、Jak2活性を調節する化合物を特徴とする。
【0082】
「化合物を得る」の「得る」という用語は、化合物の購入、合成あるいは獲得を含むことを意図する。
【0083】
本明細書で使用する「非経口投与」および「非経口的に投与する」という語句は、腸内および局所投与以外の投与方法、通常、注射であり、静脈内、筋肉内注射、動脈内、髄腔内、嚢内、眼窩内、心臓内、皮内、腹腔内、経気管、皮下、表皮下、関節内、嚢下、くも膜下、脊髄内および胸骨内注射および注入が挙げられるが、これらに限定されない投与方法を意味する。
【0084】
「多環式」または「多環ラジカル」という用語は、2つ以上の炭素が2つの隣接する環(例えば、環は「縮合環」である)に共通している、2つ以上の環のラジカル(例えば、シクロアルキル、シクロアルケニル、シクロアルキニル、アリールおよび/またはヘテロシクリル)を指す。隣接していない原子を介して結合する環は、「架橋」環と呼ばれる。多環の各環は、上記のような置換基、例えば、ハロゲン、ヒドロキシル、アルキルカルボニルオキシ、アリールカルボニルオキシ、アルコキシカルボニルオキシ、アリールオキシカルボニルオキシ、カルボン酸塩、アルキルカルボニル、アルコキシカルボニル、アミノカルボニル、アルキルチオカルボニル、アルコキシル、リン酸塩、ホスホン酸塩、ホスフィン酸塩、シアノ、アミノ(アルキルアミノ、ジアルキルアミノ、アリールアミノ、ジアリールアミノ、およびアルキルアリールアミノを含む)、アシルアミノ(アルキルカルボニルアミノ、アリールカルボニルアミノ、カルバモイルおよびウレイドを含む)、アミジノ、イミノ、スルフヒドリル、アルキルチオ、アリールチオ、チオカルボン酸塩、硫酸塩、スルホナト、スルファモイル、スルホンアミド、ニトロ、トリフルオロメチル、シアノ、アジド、ヘテロシクリル、アルキル、アルキルアリール、または芳香族もしくは複素芳香族部分と置換できる。
【0085】
「真性赤血球増加症」という用語は、骨髄による細胞の過剰産生に起因する血球(原発性赤血球)中の異常増殖を特徴とする疾患を指すことを意味する。
【0086】
「本態性血小板血症」という用語は、骨髄中巨核球による血小板の過剰産生を特徴とする血液障害を指すことを意味する。
【0087】
「原発性骨髄線維症」という用語は、線維性(瘢痕)組織によって骨髄が置換される骨髄障害を指すことを意味する。
【0088】
「プロドラッグ(prodrug)」または「プロドラッグ(pro−drug)」という用語は、インビボで代謝できる部分を有する化合物を含む。通常、プロドラッグはエステラーゼまたは他の機序によりインビボで代謝されて薬剤を活性化する。プロドラッグおよびそれらの使用の例は当技術分野において周知である(例えば、Berge et al. (1977) ”Pharmaceutical Salts”, J. Pharm. Sci.66:1−19を参照されたい)。プロドラッグは、化合物の最終単離および精製中に、または適切なエステル化剤とその遊離酸形態もしくはヒドロキシル中の精製化合物に別々に反応することによりin situ調製できる。ヒドロキシル基はカルボン酸処理を介してエステルに変換できる。プロドラッグ部分の例としては、置換したおよび置換しない、分岐または非分岐低級アルキルエステル部分、(例えば、プロピオン酸エステル)、低級アルケニルエステル、ジ低級アルキルアミノ低級アルキルエステル(例えば、ジメチルアミノエチルエステル)、アシルアミノ低級アルキルエステル(例えば、アセチルオキシメチルエステル)、アシルオキシ低級アルキルエステル(例えば、ピバロイルオキシメチルエステル)、アリールエステル(フェニルエステル)、アリール低級アルキルエステル(例えば、ベンジルエステル)、置換(例えば、メチル、ハロ、またはメトキシ置換基との)アリールおよびアリール低級アルキルエステル、アミド、低級アルキルアミド、ジ低級アルキルアミド、およびヒドロキシアミドが挙げられる。好ましいプロドラッグ部分は、プロピオン酸エステルおよびアシルエステルである。他のインビボ機序を介して活性形態に変換したプロドラッグも含まれる。
【0089】
化合物の「予防的有効量」という言葉は、患者に単回または複数回用量投与時に、本明細書に叙述した障害の予防または治療において有効である、本明細書の任意の式あるいは他に本明細書に記載の本発明の化合物の量を指す。
【0090】
「低下した毒性」という言葉は、本発明の化合物のインビボ投与時に誘発された任意の望ましくない副作用の低下を含むことを意図する。
【0091】
「スルフヒドリル」または「チオール」という用語は、SH基を意味する。
【0092】
「対象」という用語は、Jak2媒介障害を呈しているかあるいは本発明の化合物の投与から便益を受けることができる生物(ヒトおよび非ヒト動物など)を含む。好ましいヒトとしては、Jak2媒介障害、本明細書に叙述した障害、または本明細書に記載の関連状態を呈しているかまたは呈する傾向があるヒト患者が挙げられる。本発明の「非ヒト動物」という用語は、すべての脊椎動物、例えば、哺乳類、例えば、齧歯動物、例えば、マウス、および非哺乳類(非ヒト霊長類、例えば、ヒツジ、イヌ、ウシ、鶏、両生類、爬虫類など)を含む。
【0093】
「Jak2媒介疾患または障害」という用語は、Jak2により媒介されたかもしくはJak2と関連した疾患もしくは障害、またはJak2変異を意味する。
【0094】
「Jak2媒介疾患または障害を呈しやすい」という用語は、Jak2媒介疾患/障害、例えば、Jak2媒介の発現リスクのある対象、すなわち、Jak2媒介疾患/障害を呈している対象、Jak2媒介疾患/障害の家族歴または既往歴を有する対象などを含むことを意味する。
【0095】
本明細書で使用する「全身投与」、「全身に投与した」、「末梢投与」および「末梢に投与した」という語句は、本発明の化合物、薬剤または他の物質を、患者系に入り、したがって代謝および他の過程に供するように投与すること、例えば、皮下投与を意味する。
【0096】
キラル中心の命名法に関して、「d」および「l」配置という用語は、IUPAC推奨により定義されるとおりである。ジアステレオマー、ラセミ体、エピマーおよび鏡像異性体という用語の使用に関して、調製物の立体化学について記載する通常の文脈において使用される。
【0097】
2.化合物
1つの態様では、本発明は、式(I)の化合物またはその医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物を提供し:
【化48】

式中、
R1とR2はそれぞれ独立してH、−(炭素数1〜4)アルキル、−(炭素数2〜8)アルケニル、−(炭素数2〜8)アルキニル、
【化49】

であり、
式中、−(炭素数1〜4)アルキルはさらに1つ以上の水酸基もしくはハロゲンと置換でき;
または
R1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成し、ただしR1とR2は窒素原子と一緒になってピペラジン環を形成し、ピペラジン環上の第二の窒素はさらに−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルと置換でき、ここで−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルは1つ以上の水酸基、ハロゲンもしくは−(炭素数1〜3)アルキルと置換できることを条件とし;
R3はH、−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールであり;
R4はHもしくはR7であり;
R5はH、−(炭素数1〜4)アルキル、−C(CH3)2−R6、もしくはR7であり、ただしR4がHで、R5がR7もしくは−C(CH3)2−R6である場合、およびR5がHもしくは−(炭素数1〜4)アルキルである場合、R4はR7であり、ここでR4とR5は同時にR7となることはできないことを条件とし;
R6はH、−(炭素数1〜4)アルキル、フェニル、もしくは
【化50】

であり
式中、R1とR2は上に定義したとおりであり;
R7は
【化51】

であり;
式中、R8とR9はそれぞれ独立してH、−OH、−O−(炭素数1〜4)アルキル、−CH2−NR1R2であり、式中、R1とR2は上に定義したとおりであり;
R10は各存在において水素、もしくは−(炭素数1〜3)アルキルであり;
R11はH、アシル、トシル、−(炭素数1〜4)アルキル、もしくはアリールであり;
ただし化合物は、以下ではないことを条件とする:
i.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
ii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
iii.5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
iv.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
v.4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
vi.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
vii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
viii.4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)。
【0098】
1つの実施形態では、R10は各存在において独立して水素、メチルまたはエチルである。別の実施形態では、R11はHである。
【0099】
式(I)の化合物のある実施形態では、R3はHである。別の実施形態では、R4とR5の一方はR7である。分離された実施形態では、R7は
【化52】

である。
【0100】
1つの実施形態では、R4はR7である。別の実施形態では、R5はHである。ある実施形態では、R8は−CH2−NR1R2であり、R9は水酸基であり、式中、R1とR2は式(I)で定義される。1つの実施形態では、R10は各存在において独立して水素またはメチルである。別の実施形態では、R1とR2は各存在において独立して−(炭素数1〜4)アルキルである。さらに別の実施形態では、R1とR2は結合している窒素原子と一緒になってピペリジニル、ピロリジニルまたはイミダゾリル環を形成し、式中、R10は各存在において同じである。
【0101】
別の実施形態では、R10はエチルである。さらに別の実施形態では、R1とR2は各存在において独立してエチル、またはイソプロピルである。ある実施形態では、R1とR2は結合している窒素原子と一緒になってピロリジニルまたはイミダゾリル環を形成する。
【0102】
別の実施形態では、R4はHである。ある実施形態では、R5はR7である。1つの実施形態では、R8は水酸基であり、R9は−CH2−NR1R2であり、式中、R1とR2は式(I)で定義される。1つの実施形態では、R10はメチルである。ある実施形態では、R1とR2は各存在において独立して−(炭素数1〜4)アルキルであるか、またはR1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成する。別の実施形態では、R1とR2は独立してプロピルまたはイソプロピルであり、R10がHまたはエチルである場合、R10は各存在において同じである。別の実施形態では、R10がエチルである場合、R1とR2は結合している窒素原子と一緒になってピペリジニル、ピロリジニルまたはイミダゾリル環を形成する。
【0103】
ある実施形態では、化合物は、以下の群((A)群)ならびにそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される:
a)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
b)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
c)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
d)5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
e)5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
f)5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
g)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
h)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;
i)5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
j)5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;
k)5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)2HCl;
l)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
m)5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
n)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
o)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
p)5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
q)5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
r)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
s)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
t)5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
u)5,5−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
v)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
w)4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
x)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
y)5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
z)5,5−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
aa)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
bb)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
cc)4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
dd)4,4−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
ee)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
ff)5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
gg)5,5−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
hh)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
ii)4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
jj)4,4−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール)。
【0104】
上に列挙した各化合物名は、化合物のシス異性体とトランス異性体の両方を包含することを意味する。
【0105】
別の実施形態では、本発明は、式(II)の化合物またはその医薬上許容可能な塩、水和物もしくは溶媒和化合物に関し、
【化53】

式中、
R1とR2はそれぞれ独立してH、−(炭素数1〜4)アルキル、−(炭素数2〜8)アルケニル、−(炭素数2〜8)アルキニル、
【化54】

であり、
式中、−(炭素数1〜4)アルキルはさらに1つ以上の水酸基もしくはハロゲンと置換でき;
または
R1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成し、ただしR1とR2は窒素原子と一緒になってピペラジン環を形成し、ピペラジン環上の第二の窒素はさらに−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルと置換でき、ここで−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルは1つ以上の水酸基、ハロゲンもしくは−(炭素数1〜3)アルキルと置換できることを条件とし;
R3はH、−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールであり;
R4はHもしくはR7であり;
R5はH、−(炭素数1〜4)アルキル、−C(CH3)2−R6、もしくはR7であり、ただしR4がHで、R5がR7もしくは−C(CH3)2−R6である場合、およびR5がHもしくは−(炭素数1〜4)アルキルである場合、R4はR7であり、ここでR4とR5は同時にR7となることはできないことを条件とし;
R6はH、−(炭素数1〜4)アルキル、フェニル、もしくは
【化55】

であり、
式中、R1とR2は上に定義したとおりであり;
R7は
【化56】

であり;
式中、R8とR9はそれぞれ独立してH、−OH、−O−(炭素数1〜4)アルキル、−CH2−NR1R2であり、式中、R1とR2は上に定義したとおりであり;
R10は各存在において独立して水素、もしくは−(炭素数1〜3)アルキルであり;
R11はH、アシル、トシル、−(炭素数1〜4)アルキル、もしくはアリールである。
【0106】
特に、本発明は、以下からなるB群の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物に関する:4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)、4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)、4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)、5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)、5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)、5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)、5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)、5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)、5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl、5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)2HCl;5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)、4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)、および4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)。
【0107】
特に指定のない限り、本明細書の各化合物の化学名は、化合物のシス異性体とトランス異性体の両方を明示的に包含することを意味する。
【0108】
ある実施形態では、本発明は、以下の群(C群)またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物を提供する:
1)(Z)−および(E)−4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「NB−1」):
【化57】

2)(Z)−および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「NB−2」):
【化58】

3)(Z)−および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「NB−3」):
【化59】

4)(Z)−および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−4」):
【化60】

5)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「NB−5」):
【化61】

6)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−6」):
【化62】

7)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−7」):
【化63】

8)(Z)−および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl(「NB−8」):
【化64】

9)(Z)−および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl(「NB−9」):
【化65】

10)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl(「NB−10」):
【化66】

11)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl(「NB−11」):
【化67】

12)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−12」):
【化68】

13)(Z)もしくは(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−13」):
【化69】

14)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−14」):
【化70】

15)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−15」):
【化71】

;
16)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−16」):
【化72】

;
17)(Z)および(E)−(5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−17」):
【化73】

18)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(モルホリノメチル)フェノール)(「NB−18」):
【化74】

19)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(モルホリノメチル)フェノール)(「NB−19」):
【化75】

20)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−20」):
【化76】

21)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−21」):
【化77】

22)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−(モルホリノメチル)フェノール)(「NB−22」):
【化78】

23)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−23」):
【化79】

24)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−24」):
【化80】

25)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−25」):
【化81】

26)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(モルホリノメチル)フェノール)(「NB−26」):
【化82】

27)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−27」):
【化83】

28)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−28」):
【化84】

29)(Z)および(E)−2−((ジエチルアミノ)メチル)−4−(4−(4−ヒドロキシフェニル)ヘキサ−3−エン−3−イル)フェノール(「NB−29」):
【化85】

30)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ジフェノール(「NB−30」)
【化86】

31)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ジフェノール(「NB−31」):
【化87】

32)(Z)および(E)−3,3−(エテン−1,2−ジイル)ジフェノール(「NB−32」):
【化88】

33)(Z)および(E)−3,3−(ブタ−2−エン−2,3−ジイル)ジフェノール(「NB−33」):
【化89】

34)(Z)および(E)−4,4−(エテン−1,2−ジイル)ジフェノール(「NB−34」):
【化90】

ならびに
35)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「G6」):
【化91】

。
【0109】
1つの実施形態では、化合物は、NB−1、NB−2、NB−3、NB−4、NB−5、NB−6、NB−7、NB−8、NB−9、NB−10、NB−11およびNB−12からなる群((D)群)、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される。
【0110】
さらに別の実施形態では、化合物は式(III)の化合物またはその医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物であり、
【化92】

式中、
R1とR2はそれぞれ独立してH、−(炭素数1〜4)アルキル、−(炭素数2〜8)アルケニル、−(炭素数2〜8)アルキニル、
【化93】

であり、
式中、−(炭素数1〜4)アルキルはさらに1つ以上の水酸基もしくはハロゲンと置換でき;
または
R1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成し、ただしR1とR2は窒素原子と一緒になってピペラジン環を形成し、ピペラジン環上の第二の窒素はさらに−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルと置換でき、ここで−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルは1つ以上の水酸基、ハロゲンもしくは−(炭素数1〜3)アルキルと置換できることを条件とし;
R11はH、アシル、トシル、−(炭素数1〜4)アルキル、もしくはアリールであり;
R4とR5はHもしくはR12であり、ただしR4とR5の一方はH、他方はR12であることを条件とし;
R12は
【化94】

であり、
式中、R4とR5の両方が結合するアリール基はR12の芳香族環の−OR11のメタもしくはパラであることができ;
R10は水素、もしくは−(炭素数1〜3)アルキルであり;
ただし化合物は、以下ではないことを条件とする:
i.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
ii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
iii.5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
iv.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
v.4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
vi.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
vii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
viii.4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)。
【0111】
1つの実施形態では、式(III)のR11は水素である。別の実施形態では、R10は各存在において水素、メチルまたはエチルである。
【0112】
1つの実施形態では、R12は
【化95】

である。
【0113】
式(III)の化合物の1つの実施形態では、R4はR12であり、R5はHである。1つの実施形態では、R4とR5が結合するアリール基はR12の芳香族環の−OR11のメタである。
【0114】
式(III)の化合物の1つの実施形態では、R10は各存在において水素またはメチルである。別の実施形態では、R1とR2は各存在において−(炭素数1〜4)アルキルである。さらに別の実施形態では、R1とR2は結合している窒素原子と一緒になってピペリジニル、ピロリジニルまたはイミダゾリル環を形成し、式中、R10は各存在において同じである。
【0115】
1つの実施形態では、R10はエチルである。別の実施形態では、R1とR2はエチルまたはイソプロピルである。別の実施形態では、R1とR2は結合している窒素原子と一緒になってピロリジニルまたはイミダゾリル環を形成する。
【0116】
ある実施形態では、R4はHであり、R5はR12である。1つの実施形態では、R4とR5が結合するアリール基はR12の芳香族環の−OR11のパラである。
【0117】
1つの実施形態では、R10はメチルである。別の実施形態では、R1とR2は各存在において−(炭素数1〜4)アルキルであるか、またはR1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成する。別の実施形態では、R10がHまたはエチルである場合、R10は各存在において同じであり、R1とR2はプロピルまたはイソプロピルである。別の実施形態では、R10がエチルである場合、R1とR2は結合している窒素原子と一緒になってピペリジニル、ピロリジニルまたはイミダゾリル環を形成する。
【0118】
本明細書の化合物名は、これらの化合物のそれぞれのシス異性体とトランス異性体の両方を明示的に包含することを意味する。
【0119】
1つの実施形態では、化合物は、スチルベンまたはスチルベノイド誘導体である。
【0120】
別の実施形態では、化合物は、(Z)もしくは(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「G6」)、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物である。
【0121】
また、本発明の化合物は1つ以上の不斉中心を含んでよく、したがってラセミ体およびラセミ混合物、単一の鏡像異性体、個々のジアステレオマーおよびジアステレオマー混合物として生じてよい。これらの化合物のかかる異性型はすべて明示的に意図される。本発明の化合物は複数の互変異性型でも示され得、かかる場合には、本発明は、本明細書に記載の化合物のすべての互変異性型を明示的に含む。かかる化合物のかかる異性型はすべて明示的に含まれる。本明細書に記載の化合物の結晶形態も含まれる。
【0122】
本発明の化合物は、Jak2−結合活性およびその化合物を用いた方法を(直接的または間接的に)調節(例えば、阻害または刺激)できる。化合物および方法の他の態様は以下を含む、対象はJak2−V617F変異を有することが同定されている;対象はJak2 JH2ドメイン中のK603Q、D620EまたはC644S変異を有することが同定されている;対象はJak2 JH2ドメイン中のK603Q、D620EおよびC644S変異を有することが同定されている;または対象はJak2 JH2ドメイン中のK603Q、D620EおよびC644S変異を有すると同定されており、Jak2−V617F変異を有さないことが同定されている。
【0123】
本発明は、上述した化合物の医薬上許容可能なエステル、塩、溶媒和物、水和物またはプロドラッグにも関する。
【0124】
天然または合成異性体は、当技術分野において知られているいくつかの方法において分離できる。ラセミ混合物の2つの鏡像異性体を分離する方法としては、キラル定常期を用いたクロマトグラフィーが挙げられる(例えば、”Chiral Liquid Chromatography,” W.J. Lough, Ed. Chapman and Hall, New York (1989)を参照されたい)。鏡像異性体は従来の分解技術により分離することもできる。例えば、ジアステレオマー塩の形成および分別晶出を用いて鏡像異性体を分離することができる。カルボン酸の鏡像異性体を分離するため、鏡像異性的に純粋なキラル塩基(ブルシン、キニーネ、エフェドリン、ストリキニーネなど)を追加してジアステレオマー塩を形成できる。あるいは、ジアステレオマーエステルを鏡像異性的に純粋なキラルアルコール(メントールなど)により形成し、続いてジアステレオマーエステルの分離および加水分解により遊離した鏡像異性的に豊富なカルボン酸を得ることができる。アミノ化合物の光学異性体を分離するため、キラルカルボン酸またはスルホン酸(カンファースルホン酸、酒石酸、マンデル酸、または乳酸など)を添加してジアステレオマー塩を形成することができる。
【0125】
本発明の化合物は、様々な方法(このうち一部は当技術分野において知られている)に従い調製できる。本発明の化合物の合成方法を、実施例1に例示する;他の調製方法は当業者にとって明らかであろう。反応状態の最適化方法、必要に応じて、競合副産物を最小限に抑える方法は、当技術分野において知られている。本方法は、最終的に本明細書の化合物を合成するために、本明細書に具体的に記載した工程の前または後のいずれかに工程を追加して適切な保護基を添加または除去してもよい。加えて、所望の化合物を得るために、代替的な配列に様々な合成工程を実施してよい。適切な化合物の合成にとって有用である合成化学形質転換および保護基方法(保護および脱保護)は当技術分野において知られており、例えば、R. Larock, Comprehensive Organic Transformations, VCH Publishers (1989); T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and Sons (1999); L. Fieser and M. Fieser, Fieser and Fiesers Reagents for Organic Synthesis, John Wiley and Sons (1994);およびL. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995)ならびにそれらの続版に記載されている方法が挙げられる。
【0126】
また、本発明は、以下の残基の1つ以上により定義されるJak2キナーゼ結合ポケットと会合または結合する化合物を提供する;GLN14 LEU15 GLY16 LYS17 GLY21 SER22 VAL39 ALA40 VAL41 ARG57 ILE70 ARG86 ILE88 MET89 GLU90 TYR91 LEU92 PRO93 TYR94 GLY95 LEU97 ARG98 ALA138 THR139 ARG140 ILE152 GLY153 ASP154 PHE155、または本明細書に記載の方法にとって有用であるJak2タンパク質−タンパク質結合パートナー結合ポケット(Jak2が生物学的過程または機序を媒介する標的を含む)。1つの態様では、被験化合物とJak2キナーゼドメインとの相互作用は、1つの水素原子結合受容体とGlu90との相互作用および1つの水素原子結合供与体とLeu92との相互作用を含む。いかなる理論にも縛られることを望まず、ある強力なJak2阻害剤の活性に役立つ上でこれらの相互作用は重要であり得ると考えられる。
【0127】
3.本発明の化合物の使用
Jak2対立遺伝子中の体細胞変異は、真性赤血球増加症(PV)と診断された事実上すべての患者、および約50%の本態性血小板血症(ET)および慢性特発性骨髄線維症(CIMF)患者に説明される(Kaushansky, K. Best Pract Res. Clin. Haematol. 2007, 20:5−12)。最も一般的なJak2変異は、コドン617位にてフェニルアラニンのバリンへの置換(V617F)に至る、エクソン12内のヌクレオチド1849位のG→T点変異の結果である。変異は、JAK相同2(JH2)負制御ドメインに位置し、その存在は、正常の細胞増殖を管理する負のフィードバック機序に対して無反応であるJak2キナーゼ活性を上昇する。変異の原因は、レシピエント動物において赤血球増加症および骨髄線維症に至ったマウスのトランスフェクション試験によりインビボで支持されている(Lacout C. et al. Blood 2006, 108: 1652−1660)。追加の体細胞のJak2機能獲得変異が、V617F陰性赤血球増加症患者のエクソン12中で検出されている(Zhang SJ, Int J. Lab. Hematol. 2007, 29:71−72)(PCT特許出願/米国特許第08/007073号も参照されたい、この内容は、参照することにより本明細書に組み込まれる)。
【0128】
本発明者らは、新規Jak2チロシンキナーゼ阻害剤である小分子クラスを見出した。特に、ある実施形態では、Jak2小分子阻害剤は、上に定義した式(II)の化合物、またはそれらの医薬上許容可能な塩、エステル、水和物もしくはその溶媒和化合物である。1つの実施形態では、ある実施形態では、Jak2小分子阻害剤は、式(I)の化合物である。ある実施形態では、阻害剤は、式(III)の化合物である。ある実施形態では、Jak2小分子阻害剤は、上に定義した(A)、(B)、(C)もしくは(D)群の化合物、それらの医薬上許容可能な塩、水和物もしくは溶媒和化合物である。1つの実施形態では、化合物は、(B)群の化合物、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物である。別の実施形態では、化合物は、(C)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。さらに別の実施形態では、化合物は、(D)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。
【0129】
さらに別の実施形態では、化合物は、スチルベンまたはスチルベノイド誘導体である。1つの実施形態では、化合物は、(E)もしくは(Z)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物である。
【0130】
別の態様では、本発明は、有効量の本発明の化合物を対象に投与することによる、対象のJak2媒介疾患または障害(例えば、真性赤血球増加症、本態性血小板血症、特発性骨髄化生)の治療方法を提供する。1つの実施形態では、本発明の化合物は、式(II)の化合物である。別の実施形態では、対象に投与する化合物は、式(I)または(III)の化合物である。
【0131】
ある実施形態では、化合物は、上記の(A)、(B)、(C)もしくは(D)群か、またはそれらの医薬上許容可能な塩、エステル、水和物もしくはその溶媒和化合物から選択される。1つの実施形態では、化合物は、(B)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。別の実施形態では、化合物は、(C)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。さらに別の実施形態では、化合物は、(D)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。
【0132】
さらに別の実施形態では、化合物はスチルベンまたはスチルベノイド誘導体である。別の実施形態では、化合物は、(E)もしくは(Z)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ジエチルアミノ)メチル)フェノール)、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物である。
【0133】
ある実施形態では、本発明の化合物を、約0.001mg/Kg/日および約200mg/Kg/日の用量で対象に投与する。別の実施形態では、本発明の化合物を、約0.1mg/Kg/日〜約10mg/Kg/日の用量で対象に投与する。1つの実施形態では、本発明の化合物を、約1mg/Kg/日の用量で対象に投与する。
【0134】
本発明の化合物は、本発明の化合物と接触させることができる細胞のJak2またはJak2変異活性を直接的または間接的のいずれかで調節して、疾患もしくは障害過程を阻害するかまたはJak2の代謝的カスケードを調節し得る。本発明の化合物を細胞と接触させることまたは対象に投与することは、不必要なまたは望ましくないJak2またはJak2変異媒介障害を呈しているかまたは呈しやすい細胞または対象を治療する1つの方法である。
【0135】
1つの実施形態では、本発明の化合物は、Jak2自己リン酸化を阻害することにより、Jak2またはJak2変異活性を直接的または間接的のいずれかで調節し得る。別の実施形態では、本発明の化合物はc−SrcまたはTyk2自己リン酸化をJak2自己リン酸化ほど効果的には阻害しない。態様では、化合物は、c−SrcまたはTyk2の自己リン酸化阻害よりも少なくとも2倍、5倍、10倍、25倍、50倍または100倍高いJak2(またはJak2変異)自己リン酸化阻害レベルを示す。
【0136】
ある実施形態では、本発明の方法は、治療有効量の本発明の化合物を、別の製薬的活性化合物と併用して対象に投与することを含む。ある実施形態では、かかる有効量は、約0.001mg/Kg/日〜約200mg/Kg/日、約0.001mg/Kg/日〜約30mg/Kg/日の用量である。別の実施形態では、本発明の化合物を、約0.1mg/Kg/日〜約10mg/Kg/日の用量で対象に投与する。1つの実施形態では、本発明の化合物を、約1mg/Kg/日の用量で対象に投与する。
【0137】
製薬的活性化合物の例としては、増殖性障害を治療することが知られている化合物、例えば、抗癌剤、抗腫瘍剤、抗血管新生薬、化学治療薬、抗体などが挙げられる。使用してよい他の製薬的活性化合物については、Harrisons Principles of Internal Medicine, Thirteenth Edition, Eds. T.R. Harrison et al. McGraw−Hill N.Y., NY;およびthe Physicians Desk Reference 50th Edition 1997, Oradell New Jersey, Medical Economics Co.(これらの完全な内容は、参照することにより本明細書に明示的に組み込まれる)に見出すことができる。本発明の化合物および製薬的活性化合物は、対象に、同じ医薬組成物中で投与してもよいし、異なる医薬組成物中で(同時にまたは異なる時点で)投与してもよい。
【0138】
ある実施形態では、本発明の化合物を既存の抗癌治療薬との併用療法に使用できる。従来の治療投与計画としては、例えば、放射線、薬剤、または両方の併用が挙げられる。放射線に加えて、ビンクリスチン、プレドニゾン、メトトレキサート、メルカプトプリン、シクロホスファミドおよびシタラビンが、通常、互いに併用して、急性白血病を治療するために頻繁に使用される。他の例としては、例えば、本明細書に記載の化合物との併用時に利点(例えば、細胞の化学増感)を示すドキソルビシン、シスプラチン、タキソール、5−フルオロウラシル、エトポシドなどが挙げられる。慢性白血病では、例えば、ブスルファン、メルファラン、およびクロラムブシルを併用使用できる。プロテオソーム阻害剤(例えば、MG−132)、ヒドロキシ尿素(例えば、Hydreaまたはヒドロキシカルバミド)またはキナーゼ阻害剤(例えば、GLEEVEC)も本明細書の化合物との併用に使用できる。従来の抗癌剤のほとんどは毒性が高く、治療施行中に患者の具合を非常に悪化させる傾向がある。積極療法は、すべての癌細胞が破壊されない限り、残りの細胞は増殖して再発を引き起こすという前提に基づいている。
【0139】
本発明の化合物の治療的に有効な抗増殖量または予防的に有効な抗増殖量の決定は、当業者として、医師または獣医(「担当医」)が、既知の技術の使用によりおよび類似状況下で得た結果を観察することにより、容易に行うことができる。投与量は、担当医の判断における患者の必要条件;治療する病状の重症度ならびに使用されている特定の化合物に応じて変更してよい。治療的に有効な抗増殖量もしくは用量、および予防的に有効な抗増殖量または用量の決定において、担当医は、関与する特定の障害;特定の薬剤の薬力学的特性ならびにその投与方法および投与経路;治療の所望の時間経過;哺乳類の種;そのサイズ、年齢、および全身健康;関与する特定の疾患;疾患の関与の程度もしくは重症度;個々の患者の反応;投与した特定の化合物;投与方法;投与した調製物の生物学的利用率の特性;選択された用量投与計画;同時治療の種類(すなわち、他に同時投与した治療薬と本発明の化合物との相互作用);ならびに他の関連状況が挙げられるが、これらに限定されないいくつかの要因を考慮する。
【0140】
治療は、化合物の至適用量未満である低用量で開始できる。その後、その状況下で至適効果に達するまで投与量を漸増してよい。便宜上、総1日投与量は分割してよく、所望の場合は1日に一部投与する。本発明の化合物の治療的有効量および予防的に有効な抗増殖量は、約0.1ミリグラム/キログラム体重/日(mg/kg/日)〜約200mg/kg/日で変わることが予期される。ある実施形態では、かかる投与量は約0.001mg/Kg/日〜約30mg/Kg/日である。別の実施形態では、投与量は約0.1mg/Kg/日〜約10mg/Kg/日である。1つの特定の実施形態では、投与量は約1mg/Kg/日である。
【0141】
動物(例えば、イヌ、鶏、および齧歯動物)における疾患または障害の予防または治療に使用される本発明の化合物は、ヒト腫瘍の治療にも有用であり得る。ヒト腫瘍の治療分野の者は、動物試験で得られたデータに基づき、ヒトに対する化合物の投与量および投与経路を知るであろう。
【0142】
さらに別の態様では、本発明は、本明細書に説明される疾患、障害または症状を対象において治療または予防するために、本明細書の任意の式の化合物を、単独で、または製薬における追加治療薬1つ以上と併用して、単一組成物または分割した投与形態のいずれかで使用することを提供する。本発明の別の態様は、本明細書に叙述した疾患、障害またはその症状を対象において治療または予防するために本明細書の式の化合物を使用する。
【0143】
Jak2媒介障害のための予防的処置を必要とする患者の同定は、十分に当業者の能力および知識内である。主題の方法により治療できるJak2媒介障害発現リスクのある患者の、ある同定方法は、医療分野において理解されている(主題の患者における家族歴、および疾患状態の発現に関連したリスク因子の存在など)。臨床家は、かかる候補患者を、例えば、臨床検査、身体検査および既往歴/家族歴を用いて容易に同定できる。
【0144】
対象における治療の有効性の評価方法は、当技術分野において周知である方法(例えば、Jak2媒介障害が存在する場所での腫瘍サイズの決定または癌マーカーのスクリーニング)により治療前のJak2媒介障害の程度を決定し、次いで治療有効量の本発明による細胞増殖の阻害剤(例えば、本明細書に記載のもの)を対象に投与することを含む。化合物の投与から適切な期間(例えば、1日、1週間、2週間、1ヶ月、6ヶ月)後、Jak2媒介障害範囲を再決定する。ある実施形態は、投与の24〜72時間以内に決定を行うと定める。1つの実施形態では、投与の48時間以内に決定を行うと定める。
【0145】
Jak2媒介障害の程度または侵襲性の調節(例えば、低下)は、治療の有効性を示唆する。Jak2媒介障害の程度または侵襲性は、治療を通して定期的に決定してよい。例えば、Jak2媒介障害の程度または侵襲性は、治療の有効性をさらに評価するために数時間、数日または数週間ごとに確認してよい。Jak2媒介障害の程度または侵襲性の低下は、治療が有効であることを示唆する。記載の方法を用いて、Jak2媒介障害の阻害剤による治療から便益を受け得る患者をスクリーニングまたは選択してよい。
【0146】
本明細書で使用する「対象から生体試料を得る」とは、本明細書に記載の方法における使用のために試料を得ることを含む。生体試料については、上に記載している。
【0147】
さらに別の態様は、Jak2媒介結合パートナーまたはその特異ドメインとの相互作用を調節する化合物を同定する方法を提示する。本方法は、被験化合物の存在および/または不在下で、Jak2媒介結合パートナーもしくはその特異ドメインの結晶構造(任意にアポ形態または複合化)を得ること、またはJak2媒介結合パートナーもしくはその特異ドメインの結晶構造(任意にアポ形態または複合化)に関する情報を得ることを含み得る。次いで、Jak2媒介結合パートナー内もしくは上、またはその特異ドメインの結晶構造の結合部位に化合物をコンピュータモデル化して、Jak2媒介結合パートナーもしくはその特異ドメインと被験化合物との間の相互作用の安定化を予測し得る。いったん潜在的な調節化合物を同定したら、細胞アッセイ、例えば本明細書で同定されたものなど、および当技術分野において知られている競合アッセイ(PCT公開WO2008/153900号も参照されたい、この内容は、参照することにより本明細書に組み込まれる)を用いて、これらの化合物をスクリーニングし得る。このようにして同定された化合物は治療薬として有用である。
【0148】
別の態様では、本明細書の式の化合物を治療的有効量で、医薬上許容可能な担体または希釈剤と共にパッケージ化する。組成物は、Jak2媒介障害を呈しているかまたは呈しやすい対象を治療するために製剤化して、Jak2媒介障害を呈しているかまたは呈しやすい対象を治療する説明書とパッケージ化してよい。
【0149】
別の態様では、本発明は、細胞増殖の阻害方法を提供する。1つの実施形態では、本発明による細胞増殖(またはJak2媒介障害)の阻害方法は、Jak2もしくはJak2媒介結合パートナーまたはその特異ドメインを調節できる化合物と細胞を接触させることを含む。いずれかの実施形態にて、接触は、インビトロで(例えば、細胞を囲む流体、例えば、細胞が生存するかまたは存在する増殖培地へ化合物を添加することにより)行ってよい。接触は、化合物を細胞に直接接触させて行ってもよい。代わりに、接触は、インビボで(例えば、化合物を対象中に通過させることにより)行ってもよい;例えば、投与後、投与経路に応じて、化合物は消化管もしくは血流を介して移動する場合もあり、治療を必要とする細胞に直接適用もしくは投与される場合もある。
【0150】
ある実施形態では、本方法は、本発明の化合物と細胞を24〜72時間接触させることを含む。別の実施形態では、本方法は、本発明の化合物と細胞を、最大48時間接触させることを含む。
【0151】
ある実施形態では、対象のJak2媒介障害の阻害方法は、有効量の本発明の化合物(すなわち、本明細書に記載の化合物)を対象に投与することを含む。投与は、製薬分野において知られているいずれの投与経路によって行ってもよい。対象は、Jak2媒介障害を呈し得るか、Jak2媒介障害発現リスクを呈し得るか、またはJak2媒介障害に対する感受性を上昇できる状態への予測されたもしくは予測されない曝露(例えば、発癌性物質または電離性放射線への曝露)前に予防治療が必要であり得る。
【0152】
対象は、Jak2媒介障害リスクを呈している場合もあり、Jak2媒介障害の症状を示している場合もあり、Jak2媒介障害を呈しやすい場合もあり、および/またはJak2媒介障害と診断されている場合もある。
【0153】
状態の調節によって対象が治療に対して良好な臨床反応を示し得ることが示唆される場合、対象は化合物で治療し得る。例えば、化合物の治療的有効量(1回または複数回)を対象に投与できる。
【0154】
本方法は、培養細胞上(例えばインビトロもしくはエクスビボ)で実施することも、動物対象に存在する細胞上(例えば、インビボ)で実施することもできる。本発明の化合物は、増殖細胞の一次培養、例えば、変換細胞、腫瘍細胞系などを用いて最初にインビトロ試験することができる。
【0155】
別の態様では、本明細書の方法は、以下を含む:本発明の化合物を、Jak2媒介疾患もしくは障害の治療または予防のために対象に投与すること;または本発明の化合物を、Jak2依存性細胞増殖を低減するために対象に投与すること;本発明の化合物を、血液疾患もしくは障害を治療するために対象に投与すること;本発明の化合物を、癌を治療するために対象に投与すること。
【0156】
本明細書に叙述した方法は、特記した治療を必要とする対象の同定を含む。かかる治療を必要とする対象の同定は、対象の判断であることも、医療専門家の判断であることもでき、主観的(例えば意見)であることも、客観的(例えば検査または診断方法により測定可能)であることもできる。他の方法では、対象を前スクリーニングし、またはかかる治療の関連マーカーもしくは適性指標を評価することによりかかる治療を必要とすることを同定する。
【0157】
本方法は、培養細胞上(例えばインビトロもしくはエクスビボ)で実施することも、動物対象に存在する細胞上(例えば、インビボ)で実施することもできる。本発明の化合物は、細胞または他の哺乳類もしくは非哺乳類動物モデルを用いて最初にインビトロ試験することができる。あるいは、本発明の化合物の効果は、動物モデルを用いてインビボで特性化することができる。
【0158】
4.医薬組成物
本発明は、有効量の本発明の化合物および医薬上許容可能な担体を含む医薬組成物も提供する。さらなる実施形態では、有効量は、先に記載のJak2媒介疾患または障害を治療するために有効である。
【0159】
1つの実施形態では、医薬上許容可能な製剤、例えば、医薬上許容可能な製剤を対象に投与後、少なくとも12時間、24時間、36時間、48時間、1週間、2週間、3週間、または4週間持続した本発明の化合物の送達を対象に提供する医薬上許容可能な製剤を用いて、本発明の化合物を対象に投与する。
【0160】
ある実施形態では、これらの医薬組成物を対象に適切に局所または経口投与する。他の実施形態では、以下に詳述するとおり、本発明の医薬組成物は固体または液体形態での投与用に特別に製剤化してよく、それらは以下に適応させたものを含む:(1)経口投与、例えば、水薬(水溶液もしくは非水溶液または懸濁液)、錠剤、巨丸剤、粉末、顆粒剤、ペースト;(2)非経口投与、例えば、皮下、筋肉内注射もしくは静脈内注射、例えば、滅菌溶液もしくは懸濁液;(3)局所適用、例えば、皮膚に適用するためのクリーム、軟膏もしくはスプレー;(4)膣内もしくは直腸内、例えば、ペッサリー、クリームもしくは発泡体;または(5)エアロゾル、例えば、水性エアロゾル、リポソーム調製物もしくは固体粒子で化合物を含むもの。
【0161】
「医薬上許容可能な」という語句は、健全な医療判断の範囲内で、ヒトおよび動物組織との接触に使用する上で適し、過度の毒性、刺激、アレルギー反応、または他の問題もしくは合併症なく、妥当な利益/リスク比相応の本発明の化合物、本発明の化合物を含む組成物および/または投与形態を指す。
【0162】
「医薬上許容可能な担体」という語句は、ある臓器または身体の一部から、別の臓器または身体の一部への対象化学物質の運搬または輸送に関与する医薬上許容可能な物質、組成物またはビヒクル(液体または固体充填剤、希釈剤、賦形剤、溶媒または封入物質など)を含む。各担体は、製剤の他の成分と適合し、患者に有害ではないという意味で「許容可能」である。医薬上許容可能な担体として役立ち得る物質の一部の例としては、以下が挙げられる:(1)糖(ラクトース、グルコースおよびスクロースなど);(2)澱粉(トウモロコシ澱粉およびジャガイモ澱粉など);(3)セルロース、およびその誘導体(ナトリウムカルボキシメチルセルロース、エチルセルロースおよび酢酸セルロースなど);(4)粉末トラガカント;(5)麦芽;(6)ゼラチン;(7)タルク;(8)賦形剤(カカオ脂および坐剤用ワックスなど);(9)油(落花生油、綿実油、紅花油、ゴマ油、オリーブ油、トウモロコシ油および大豆油など);(10)グリコール(プロピレングリコールなど);(11)ポリオール(グリセリン、ソルビトール、マンニトールおよびポリエチレングリコールなど);(12)エステル(エチルオレエートおよびエチルラウラートなど);(13)寒天;(14)緩衝剤(水酸化マグネシウムおよび水酸化アルミニウムなど);(15)アルギン酸;(16)発熱性物質を含まない水;(17)等張生理食塩水;(18)リンガー溶液;(19)エチルアルコール;(20)リン酸緩衝液;ならびに(21)医薬製剤に使用される他の無毒な適合性のある物質。
【0163】
湿潤剤、乳化剤および滑沢剤(ラウリル硫酸ナトリウムおよびステアリン酸マグネシウムなど)、ならびに着色剤、放出剤、コーティング剤、甘味料、香味剤および香料、保存剤および抗酸化剤も組成物に存在することができる。
【0164】
医薬上許容可能な抗酸化剤の例としては、(1)水溶性の抗酸化剤(アスコルビン酸、塩酸システイン、重硫酸ナトリウム、メタ重亜硫酸ナトリウム、亜硫酸ナトリウムなど);(2)油溶性の抗酸化剤(アスコルビン酸パルミテート、ブチルヒドロキシアニソール(BHA)、ブチルヒドロキシトルエン(BHT)、レクチン、プロピルガラート、アルファ−トコフェロールなど);ならびに(3)金属キレート剤(クエン酸、エチレンジアミン四酢酸(EDTA)、ソルビトール、酒石酸、リン酸など)が挙げられる。
【0165】
本発明の化合物を含む組成物としては、経口、経鼻、局所(口腔および舌下を含む)、直腸、膣、エアロゾルおよび/または非経口投与に適したものが挙げられる。組成物は都合よく単位投与形態であってよく、薬学の分野において周知である任意の方法により調製してよい。担体物質と併用して単一投与形態を形成することができる活性成分量は、治療対象の宿主、特定の投与方法に応じて変更されるであろう。担体物質と併用して単一投与形態を形成することができる活性成分量は通常、治療効果を生じる化合物量であるだろう。通常、この量は、100パーセント中、約1パーセント〜約99パーセントの活性成分、例えば、約5パーセント〜約70パーセント、例えば、約10パーセント〜約30パーセントの範囲であろう。
【0166】
これらの組成物の調製方法は、本発明の化合物を、担体および、任意に1つ以上の付帯成分と結合させる工程を含む。一般的に、製剤は、一様におよび本質的に、本発明の化合物を、液体担体もしくは細分化した固体担体またはその両方と結合させ、次いで、必要に応じて、製品を造形することにより調製する。
【0167】
経口投与に適切な本発明の組成物は、カプセル、カシェ剤、丸剤、錠剤、薬用ドロップ(香味付けた基礎原料、通常スクロースおよびアラビアゴムもしくはトラガカントを使用)、粉末、顆粒剤、または水性もしくは非水性液体での溶液もしくは懸濁液として、または水中油型もしくは油中水型乳剤として、またはエリキシル剤もしくはシロップ剤として、またはトローチ(不活性な基礎材料、例えば、ゼラチンおよびグリセリン、またはスクロースおよびアラビアゴムなどを使用)および/または口内洗浄剤などでよく、各々は所定量の本発明の化合物を活性成分として含む。化合物は巨丸剤、舐剤またはペーストとして投与してもよい。
【0168】
本発明の経口投与用の固体投与形態(カプセル、錠剤、丸剤、糖衣錠、粉末、顆粒剤など)において、活性成分は、1つ以上の医薬上許容可能な担体(クエン酸ナトリウムまたはリン酸二カルシウムなど、および/または下記のいずれか)と混合する:(1)充填剤またはエキステンダー(澱粉、ラクトース、スクロース、グルコース、マンニトール、および/またはケイ酸など);(2)結合剤(例えば、カルボキシメチルセルロース、アルギナート、ゼラチン、ポリビニルピロリドン、スクロースおよび/またはアラビアゴムなど);(3)保湿剤(グリセロールなど);(4)崩壊剤(寒天、炭酸カルシウム、ジャガイモまたはタピオカ澱粉、アルギン酸、あるシリカート、および炭酸ナトリウムなど);(5)溶液緩染剤(パラフィンなど);(6)吸収促進剤(四級アンモニウム化合物など);(7)湿潤剤(例えば、アセチルアルコールおよびグリセロールモノステアレートなど);(8)吸収剤(カオリンおよびベントナイト白土など);(9)滑沢剤(タルク、ステアリン酸カルシウム、ステアリン酸マグネシウム、固体ポリエチレングリコール、ラウリル硫酸ナトリウム、およびそれらの混合物など);ならびに(10)着色剤。カプセル、錠剤および丸剤の場合は、医薬組成物は緩衝剤を含んでもよい。類似の種類の固体組成物も、軟および硬ゼラチンカプセルにおける充填剤として、ラクトースまたは乳糖、ならびに高分子量ポリエチレングリコールなどの賦形剤を使用してよい。
【0169】
錠剤は、加圧またはモールディングにより、任意に1つ以上の付帯成分と共に作製してよい。加圧された錠剤は、結合剤(例えば、ゼラチンまたはヒドロキシプロピルメチルセルロースなど)、滑沢剤、不活性希釈剤、保存剤、崩壊剤(例えば、ナトリウム澱粉グリコーレートまたは架橋結合ナトリウムカルボキシメチルセルロース)、界面活性剤または分散剤を用いて調製してよい。成形した錠剤は、適切な機械において不活性液体希釈剤で示させた粉末活性成分の混合物をモールディングすることにより作製してよい。
【0170】
本発明の医薬組成物の錠剤および他の固体投与形態(糖衣錠、カプセル、丸剤および顆粒剤など)は、任意にコーティングおよび外殻(腸溶コーティングおよび医薬製剤技術の分野において周知である他のコーティングなど)によりスコアしてもよいし調製してもよい。それらはまた、活性成分の徐放または制御放出を提供するように製剤化してもよく、その場合、例えば、ヒドロキシプロピルメチルセルロースが所望の放出プロファイルを提供するように割合を変えて使用してもよく、他の重合体マトリックス、リポソームおよび/またはミクロスフィアが使用されてもよい。それらは、例えば、細菌保持フィルターを介した濾過により滅菌してもよく、使用直前に滅菌水または他の一部の滅菌注射用媒体に溶解できる滅菌固体組成物の形態に滅菌剤を組み込むことにより滅菌してもよい。これらの組成物はまた、任意に乳白剤を含んでもよく、任意に遅延化した方法で活性成分(1つまたは複数)を消化管のある部分のみにまたは消化管のある部分に選択的に放出する組成物であってもよい。使用できる包埋用組成物の例としては、重合体物質およびワックスが挙げられる。活性成分は、適切な場合、1つ以上の上記の賦形剤と共にマイクロカプセル形態に封入することもできる。
【0171】
本発明の化合物の経口投与用の液体投与形態としては、医薬上許容可能なエマルジョン、マイクロエマルジョン、溶液、懸濁液、シロップおよびエリキシル剤が挙げられる。活性成分に加えて、液体投与形態は当技術分野において一般的に使用される不活性希釈剤(例えば、水または他の溶媒など)、可溶化剤および乳化剤(エチルアルコール、イソプロピルアルコール、炭酸エチル、酢酸エチル、ベンジルアルコール、安息香酸ベンジル、プロピレングリコール、1,3−ブチレングリコール、油(特に、綿実油、落花生油、トウモロコシ油、胚芽油、オリーブ油、ヒマシ油およびゴマ油)、グリセロール、テトラヒドロフリルアルコール、ポリエチレングリコールおよびソルビタン脂肪酸エステル、ならびにそれらの混合物など)を含んでよい。
【0172】
不活性希釈剤に加えて、経口組成物はまた、補助剤(湿潤剤、乳化剤および懸濁剤、甘味料、香味剤、着色剤、香料および保存剤など)を含んでもよい。
【0173】
懸濁液は、本発明の活性化合物に加えて、懸濁剤(例えば、エトキシル化イソステアリルアルコール、ポリオキシエチレンソルビトールおよびソルビタンエステル、微結晶性セルロース、メタ水酸化アルミニウム、ベントナイト、寒天およびトラガカント、ならびにそれらの混合物を含んでよい。
【0174】
本発明の直腸投与または膣投与用の医薬組成物は坐剤として存在してよく、これは本発明の化合物を1つ以上混合して、1つ以上の適切な非刺激性の賦形剤または担体(例えば、カカオ脂、ポリエチレングリコール、坐剤用ワックスまたはサリチル酸塩を含む)と調製してもよく、室温で固体だが体温で液体であるため直腸または膣腔内で融解して活性薬剤を放出する。
【0175】
膣投与に適切な本発明の組成物としては、ペッサリー、タンポン、クリーム、ゲル、ペースト、発泡体またはスプレー製剤も挙げられ、当技術分野において知られている適切な担体を含んでよい。
【0176】
本発明の化合物の局所または経皮投与用の投与形態としては、粉末、スプレー、軟膏、ペースト、クリーム、ローション、ゲル、溶液、パッチおよび吸入剤が挙げられる。本発明の活性化合物は、滅菌条件下で、医薬上許容可能な担体と、および必要であり得るいずれかの保存剤、緩衝剤、または推進剤と混合してよい。
【0177】
軟膏、ペースト、クリームおよびゲルは、本発明の化合物に加えて、賦形剤(動物脂および植物脂、油、ワックス、パラフィン、澱粉、トラガカント、セルロース誘導体、ポリエチレングリコール、ケイ素樹脂、ベントナイト、ケイ酸、タルクおよび酸化亜鉛、またはそれらの混合物など)を含んでよい。
【0178】
粉末およびスプレーは、本発明の化合物に加えて、賦形剤(ラクトース、タルク、ケイ酸、水酸化アルミニウム、ケイ酸カルシウムおよびポリアミド粉末、またはこれらの物質の混合物など)を含むことができる。追加的に、スプレーは、慣習的な推進剤、例えば、クロロフルオロ炭化水素、揮発性の置換しない炭化水素(ブタンおよびプロパンなど)などを含むことができる。
【0179】
本発明の化合物は代替的にエアロゾルにより投与できる。これは、化合物を含む水性エアロゾル、リポソーム調製物または固体粒子を調製することにより達成する。非水性(例えば、フッ化炭素推進剤)懸濁液を使用できる。化合物の減成に至り得る剪断薬への曝露を最小限に抑えるため、音波噴霧器が好ましい。
【0180】
通常、水性エアロゾルは、従来の医薬上許容可能な担体および安定剤と共に薬剤の水溶液または懸濁液を製剤化することにより作製する。担体および安定剤は特定の化合物の必要条件によって異なるが、典型的には、非イオン性界面活性剤(Tweens、Pluronics、またはポリエチレングリコール)、無害なタンパク質、例えば、血清アルブミン、ソルビタンエステル、オレイン酸、レクチン、アミノ酸(グリシンなど)など、緩衝剤、塩、糖または糖アルコールを含む。エアロゾルは通常、等張液から調製する。
【0181】
経皮的パッチは、本発明の化合物の体内に制御して送達する付加的な利点を有し得る。かかる投与形態は、薬剤を適切な媒体に溶解または分散することにより調製し得る。吸収増進剤も使用して皮膚を経て活性成分の流動を増大することができる。かかる流動の速度は、速度制御膜を提供すること、または重合体マトリックスもしくはゲルに活性成分を分散することのいずれかにより制御できる。
【0182】
眼科用製剤、眼軟膏、粉末、溶液などもまた、本発明の範囲内であると意図される。
【0183】
本発明の適切な非経口投与のための医薬組成物は、1つ以上の本発明の化合物を1つ以上の医薬上許容可能な滅菌等張性水溶液または非水溶液、分散液、懸濁液またはエマルジョン、または使用直前に滅菌注射液または分散液に対して再構成され得る滅菌粉末と併用して含んでよく、抗酸化剤、緩衝剤、静菌剤、製剤を目的のレシピエントの血液と等張にする溶質、または沈殿防止剤または増粘剤を含んでもよい。
【0184】
本発明の医薬組成物において適用してよい適切な水性および非水性担体の例としては、水、エタノール、ポリオール(グリセロール、プロピレングリコール、ポリエチレングリコールなど)、およびそれらの適切な混合物、植物油(オリーブ油など)、ならびに注射用の有機エステル(エチルオレエートなど)が挙げられる。適切な流動性を、例えば、コーティング物質(レクチンなど)の使用により、分散液の場合は必要な粒子サイズの維持により、および界面活性剤の使用により維持することができる。
【0185】
これらの組成物は、補助剤(保存剤、湿潤剤、乳化剤および分粉末など)を含んでもよい。微生物の活動の防止は、様々な抗菌剤および抗真菌剤、例えば、パラベン、クロロブタノール、フェノールソルビン酸などを含むことにより確保し得る。等張剤(糖、塩化ナトリウムなど)を組成物に含めることも望ましい場合がある。加えて、持続性吸収型の注射用の製薬学的形態は、吸収を遅らせる薬剤(モノステアリン酸アルミニウムおよびゼラチンなど)を含めることによりもたらし得る。
【0186】
ある場合には、薬剤の効果を延長するために、皮下注射または筋肉内注射からの薬剤の吸収を緩慢化することが望まれる。これは、水溶性に乏しい結晶または非晶物質の液体懸濁液を用いることにより達成し得る。薬剤の吸収速度は溶解速度に依存し、順に、結晶サイズおよび結晶形態に依存し得る。あるいは、非経口投与した薬剤形態の遅延化した吸収は、油ビヒクル中に薬剤を溶解または懸濁することにより達成される。
【0187】
注射用デポ形態は、生分解性の重合体(ポリラクチド−ポリグリコリドなど)中に本発明の化合物のマイクロカプセルマトリックスを形成することにより作製される。重合体に対する薬剤の比率、および使用した特定の重合体の性質に応じて、薬剤の放出速度が制御され得る。他の生分解性重合体の例としては、ポリ(オルトエステル)およびポリ(アンヒドライド)が挙げられる。注射用デポ製剤はまた、薬剤を体組織と適合するリポソームまたはマイクロエマルジョンに封入することによっても調製される。
【0188】
本発明の化合物をヒトおよび動物に医薬品として投与時、それらは、それ自体で、または、例えば、0.1〜99.5%(より好ましくは、0.5〜90%)の活性成分を医薬上許容可能な担体と併用して含む医薬組成物として投与できる。
【0189】
選択された投与経路に関わらず、適切な水和形態に使用し得る本発明の化合物および/または本発明の医薬組成物は、当業者に知られている従来の方法により医薬上許容可能な投与形態に製剤化し得る。
【0190】
本発明の医薬組成物における活性成分の投与の実際の投与量レベルおよび時間経過は、特定の患者、組成物、および投与方法において、患者に対して毒性なく、所望の治療反応を達成するために有効な活性成分量を得るために変更してよい。ある実施形態では、活性成分投与の時間経過は、24〜72時間である。1つの実施形態では、投与の時間経過は、最大48時間である。
【0191】
本発明の化合物の好ましい用量は、患者が忍容でき重篤な副作用を発現しない最大量である。例えば、本発明の化合物は、約0.001mg〜約200mg/kg体重、約0.001〜約30mg/kgまたは約0.1mg〜約10mg/kg体重の濃度で投与する。上に列挙した値の中間範囲も本発明の一部であることを意図する。特定の例では、本発明の化合物は、約1mg/Kg/日の用量で投与する。
【0192】
6.スクリーニング方法およびシステム
別の態様では、本発明は、本明細書で同定された結合ポケットのいずれか一方または両方の構造座標、または同様に造形された相同結合ポケットを含む機械可読記憶媒体を提供する。これらのデータをコード化したかかる記憶媒体は、コンピュータスクリーンまたは類似の視聴機器でかかる結合ポケットを含む分子もしくは分子複合体の3次元グラフィカル描写を表示できる。
【0193】
本発明は、前述の結合ポケットに結合する化合物の設計、評価および同定方法も提供する。したがって、コンピュータは、結合ポケットを含む分子もしくは分子複合体の3次元グラフィカル構造を産生する。
【0194】
別の実施形態では、本発明は、Jak2もしくはそのドメイン、または分子もしくは分子複合体のホモログの3次元描写の構造座標により定義される分子もしくは分子複合体の3次元描写を産生するコンピュータを提供し、ここでホモログは、アミノ酸の骨格原子からの標準偏差が2.0以下(より好ましくは1.5以下)のオングストロームである結合ポケットを含む。
【0195】
例示的な実施形態では、コンピュータまたはコンピュータシステムは、例えば、米国特許第5,978,740号および/または同第6,183,121号(参照することにより本明細書に組み込まれる)に開示されている、当技術分野における従来の構成要素を含むことができる。例えば、コンピュータシステムは、中央処理装置(「CPU」)、作業記憶(例えば、RAM(ランダムアクセスメモリ)または「磁心」記憶装置であり得る)、大容量記憶装置(1つ以上のディスクドライブまたはCD−ROMドライブなど)、1つ以上のブラウン管(CRT)もしくは液晶表示装置(LCD)表示末端、1つ以上のキーボード、1つ以上の入力系統、ならびに1つ以上の出力系統(これらがすべて従来のシステムバスにより相互接続する)を含むコンピュータを含むことができる。
【0196】
本発明の機械可読なデータを、データ系統により接続したモデム(1つまたは複数)の使用を介してコンピュータに入力し得る。代替的にまたは追加的に、入力ハードウェアは、CD−ROMドライブ、ディスクドライブまたはフラッシュメモリを含んでよい。表示末端と連結して、キーボードも入力機器として使用してよい。
【0197】
出力系統によりコンピュータに接続した出力ハードウェアも同様に従来の機器に実装してよい。例として、出力ハードウェアは、プログラム(QUANTAまたはPYMOLなど)を用いて、本発明の結合ポケットのグラフィカル描写を表示するためのCRTまたはLCD表示末端を含んでよい。出力ハードウェアは、プリンター、または後の使用のためにシステム出力を記憶するディスクドライブも含み得る。
【0198】
処理において、CPUは様々な入力および出力機器の使用を調整し、大容量記憶からのデータアクセスおよび作業記憶の往復アクセスを調整し、ならびに一連のデータプロセス工程を決定する。いくつかのプログラムを、本発明の機械可読なデータ(市販のソフトウェアを含む)をプロセスするために使用してよい。
【0199】
本発明による機械可読なデータ記憶用の磁気記憶媒体は従来のものであることができる。磁気データ記憶媒体は、システム(上記のコンピュータシステムなど)により実行できる機械可読なデータでコード化できる。媒体は、従来のものであり得る適切な基質を有し、片面または両面にやはり従来のものであり得る適切なコーティングを施し、極性または配向を磁気的に改変できる磁気ドメインを含む従来のフロッピー(登録商標)ディスクまたはハードディスクであることができる。媒体は、ディスクドライブまたは他のデータ記憶機器の軸を受け入れるための開口部(示されない)も有し得る。
【0200】
媒体の磁気ドメインは、システム(本明細書に記載のコンピュータシステムなど)による実行のため、従来の機械可読データ(本明細書に記載のものなど)であり得る方法でコード化するように極性化または配向されている。
【0201】
光学読み取り可能なデータ記憶媒体は、機械可読なデータまたは一連の説明書でコード化することもでき、これはコンピュータシステムにより実行可能である。媒体は、従来の読み出し専用記憶装置のコンパクトディスク(CD−ROM)または書換え可能な媒体(光学読み取りかつ光磁気書き込み可能な光磁気ディスクなど)であることができる。
【0202】
CD−ROMの場合、周知のとおり、ディスクコーティングは反射性であり、機械可読なデータをコード化する複数のピットを刻印している。ピット配置はコーティング表面のレーザー光を反射させることにより読み込まれる。(好ましくは実質的に透明である)保護コーティングが反射コーティングの上面に提供される。
【0203】
光磁気ディスクの場合は、周知のとおり、データ記録コーティングにはピットはないが、レーザーによりある温度を超えて熱した際、極性または配向が磁気的に変化し得る複数の磁気ドメインを有する。ドメインの配向は、コーティングからレーザー光反射した偏光を測定することにより読み込むことができる。ドメイン配置は上記データをコード化する。
【0204】
結合ポケットを含む分子もしくは分子複合体の3次元構造に座標を移すソフトウェアによるコンピュータプログラム化と連動して使用時、様々な目的(創薬など)のために構造データを用いてよい。
【0205】
例えば、データによりコード化される構造は、化学実体と結合するその能力について計算的に評価し得る。Jak2の結合ポケットまたはその特異ドメインと結合する化学実体は潜在的な薬剤候補である。あるいは、データによりコード化される構造は、コンピュータスクリーン上のグラフィカルな3次元描写において表示し得る。これにより、構造の目視検査、ならびに化学実体と結合した構造の目視検査が可能となる。
【0206】
したがって、別の実施形態により、本発明は、a)Jak2の結合ポケットもしくはその特異ドメインを含む分子もしくは分子複合体、またはb)分子もしくは分子複合体のホモログであり、アミノ酸の骨格原子からの標準偏差が2.0(より好ましくは1.5)以下のオングストロームである結合ポケットを含むホモログ、と結合する化学実体の可能性の評価方法に関する。
【0207】
この方法は、以下の工程を含む:
i)計算方法を用いて、化学実体と分子もしくは分子複合体の結合ポケットとの間の適合処理を実施する工程;ならびに
ii)適合処理の結果を分析し、化学実体と結合ポケットとの間の結合を定量化する工程。本明細書で使用する「化学実体」という用語は、化学化合物、少なくとも2つの化学化合物の複合体、ならびにかかる化合物もしくは複合体の断片を指す。
【0208】
本発明によるJak2に結合するかもしくはJak2を阻害する化合物、またはその特異ドメイン結合ポケットの設計には通常、いくつかの要因が考慮される。第一に、実体は、一部またはすべてのJak2結合部位またはその特異ドメイン関連結合ポケットと物理的かつ構造的に結合できなければならない。この結合において重要である非共有結合分子相互作用としては、水素結合、ファンデルワールス相互作用、疎水性相互作用および静電相互作用が挙げられる。第二に、実体は、Jak2またはその特異ドメイン関連結合ポケット(1つまたは複数)と直接結合できる立体構造を想定できなければならない。実体のある部分はこれらの結合に直接関与しないが、実体のそれらの部分は依然として分子全体の立体構造に影響を与え得る。これは、次に、効能に対して著しい衝撃を与え得る。かかる立体構造的な必要条件としては、結合ポケットのすべてもしくは一部と会合する化学実体の全体の3次元構造および配向、または結合ポケットもしくはそのホモログと直接相互作用するいくつかの化学実体を含む実体の官能基間の空間を含む。
【0209】
コンピュータモデリング技術を用いて、実際の合成および試験前に、Jak2またはその特異ドメイン関連結合ポケット上の化学実体の潜在的阻害または結合効果を分析してよい。所定の実体の理論的構造によって、それと標的結合ポケットとの間の相互作用および結合が不十分であることが暗示される場合、実体の試験は不要となる。しかしながら、コンピュータモデリングによって強い相互作用が示唆される場合、分子を合成して、結合ポケットへの結合能を試験し得る。これは、例えば、Jak2またはその特異ドメイン活性を分子が阻害する能力を、例えば、本明細書に記載のアッセイまたは当技術分野において知られているアッセイを用いて試験することにより達成し得る。このようにして、無効な化合物の合成を回避し得る。
【0210】
Jak2の潜在的阻害剤またはその特異ドメイン関連結合ポケットは、化学実体または断片がJak2またはその特異ドメイン関連結合ポケットと結合する能力をスクリーニングおよび選択する一連の工程を用いて計算的に評価してよい。
【0211】
当業者は、化学実体または断片のJak2またはその特異ドメイン関連結合ポケットと結合する能力をスクリーニングするためにいくつかの方法の1つを使用してよい。この過程は、Jak2結合部位、または本明細書に記載のその特異ドメイン構造座標、または機械可読な記憶媒体から生成された類似形を定義する他の座標に基づき、コンピュータスクリーン上で、例えば、Jak2またはその特異ドメイン関連結合ポケットの目視検査により開始し得る。次いで、選択した断片または化学実体を上記に定義される結合ポケット内の様々な配向、または結合内に配置し得る。結合は、ソフトウェア(QuantaおよびDOCKなど)を用いて、その後、標準的な分子力学力場のエネルギー最小化および分子動力学(CHARMMおよびAMBERなど)により達成し得る。
【0212】
(例えば、当技術分野において知られているおよび/または市販のおよび/または本明細書に記載の)特化コンピュータプログラムも断片または化学実体の選択過程を補助し得る。
【0213】
いったん適切な化学実体または断片を選択したら、それらは単一の化合物または複合体中に会合させることができる。会合前に、コンピュータスクリーン上に表示される3次元画像上で、標的結合ポケットの構造座標に関連する断片の相互関係の目視検査を行ってよい。
【0214】
上記のように結合ポケット阻害剤を段階的に、1つの断片または化学実体を一度に製造する工程に進む代わりに、阻害剤または他の結合化合物を、空の結合部位を用いるかまたは任意に既知の阻害剤(1つまたは複数)のいくつかの部分(1つまたは複数)を含んで全体としてまたは「新規(de novo)」で設計してよい。当技術分野において知られている多くの新規(de novo)リガンド設計方法があり、このうち一部は、市販されている(例えば、Tripos Associates, St. Louis, Mo.から入手可能なLeapFrog)。
【0215】
他の分子モデリング技術も本発明に従い使用してよい[例えば、N. C. Cohen et al., ”Molecular Modeling Software and Methods for Medicinal Chemistry, J. Med. Chem., 33, pp. 883−894 (1990)を参照されたい; M. A. Navia and M. A. Murcko, ”The Use of Structural Information in Drug Design”, Current Opinions in Structural Biology, 2, pp. 202−210 (1992); L. M. Balbes et al., ”A Perspective of Modern Methods in Computer−Aided Drug Design”, in Reviews in Computational Chemistry, Vol. 5, K. B. Lipkowitz and D. B. Boyd, Eds., VCH, New York, pp. 337−380 (1994)も参照されたい; W. C. Guida, ”Software For Structure−Based Drug Design”, Curr. Opin. Struct. Biology,, 4, pp. 777−781 (1994)も参照されたい]。
【0216】
いったん化合物を設計または選択したら、結合ポケットに結合し得る実体の有効性を試験して計算評価により最適化してよい。
【0217】
化合物の変形エネルギーおよび静電相互作用を評価するために、当技術分野において特定のコンピュータソフトウェアが利用可能である。かかる使用のために設計されたプログラムの例としては、AMBER;QUANTA/CHARMM(Accelrys, Inc., Madison, WI)などが挙げられる。これらのプログラムは、例えば、市販のグラフィカルなワークステーションを用いて実装してよい。他のハードウェアシステムおよびソフトウェアパッケージは当業者に知られるであろう。
【0218】
別の技術としては、例えば、本明細書に記載の化合物の仮想ライブラリーのシリコンスクリーニングが挙げられる。何千もの化合物を迅速にスクリーニングして、最高仮想化合物を、(例えば、合成およびインビトロ試験により)さらなるスクリーニングのために選択することができる。小分子データベースは、Jak2ドメイン、またはその結合ポケットの特異ドメインについてスクリーニングできる。このスクリーニングでは、かかる実体の結合部位に対する適合の質を、形の相補性、または推定した相互作用エネルギーのいずれかにより判断してよい。
【0219】
7.キット
本発明は、キットも特徴とする。キットには、Jak2活性を調節できる化合物が含まれる。本発明の任意の化合物、または1つ以上の化合物を本発明のキットに含むことができる。1つの態様では、キットは上に定義した式(II)の化合物、またはその医薬製剤が含まれる。ある実施形態では、キットには上に定義した式(I)もしくは(III)の化合物、またはその医薬製剤が含まれる。1つの実施形態では、キットには上に定義した(A)、(B)、(C)、もしくは(D)群の化合物、またはそれらの医薬製剤が含まれる。1つの実施形態では、キットにはスチルベンまたはスチルベノイド誘導体である化合物が含まれる。
【0220】
別の実施形態では、キットは上に定義した(B)群の化合物、またはそれらの製薬上の塩、エステル、溶媒和化合物もしくはプロドラッグを含む。別の実施形態では、キットは上に定義した(D)群の化合物、またはそれらの製薬上の塩、エステル、溶媒和化合物もしくはプロドラッグを含む。さらに別の実施形態では、キットは上に定義したG6化合物、またはその製薬上の塩、エステル、溶媒和化合物もしくはプロドラッグを含む。
【0221】
ある実施形態では、キットは本発明の化合物を約0.001mg/Kg/日〜約200mg/Kg/日、または約0.001mg/Kg/日〜約30mg/Kg/日の投与量で含む。いくつかの実施形態では、キットは本発明の化合物を約0.1mg/Kg/日〜約10mg/Kg/日の投与量で含む。特定の例では、本発明の化合物は、キットに約1mg/Kg/日の投与量で含まれる。
【0222】
キットは、癌の治療における使用、血液障害の治療における使用、心障害の治療における使用、およびJak2依存性細胞増殖の低減における使用のための説明書も含む。
【0223】
担体手段は、1つ以上の容器手段(バイアル、管など)を含むために適しており、それぞれの容器手段は本方法に使用される別々の要素の1つを含む。本明細書に提示した説明を考慮して、当業者は容器手段間の必要な試薬の配分を容易に決定できる。
【0224】
以下の実施例は、例証として提示し、これらに限定されない。特定の実施例を提示しているが、上の説明は例証であり、これらに限定されない。先に記載した実施形態の任意の1つ以上の特徴は、いかなる方法によっても、本発明における他の任意の実施形態の1つ以上の特徴と組み合わせることができる。さらに、本明細書の再検討時、本発明の多くのバリエーションが当業者にとって明らかとなるであろう。本発明の範囲は、したがって、上の説明に準拠して決定すべきではなく、それらの均等物の完全な範囲と共に添付の特許請求の範囲に準拠して決定すべきである。
実施例
【実施例1】
【0225】
化合物の合成
【化96】

合成スキームI
本発明のある化合物は、上の合成スキームIに示される例示的な合成スキームにより調製できる。
【0226】
中間体(I)を得るための合成手順:電磁撹拌棒および逆流コンデンサーの入った、火炎乾燥した二口丸底フラスコ内に乾燥THF(180mL)および亜鉛(8価)を添加した。TiCl4(4価)を0℃で滴下した。TiCl4の追加を完了後、反応混合物を2時間逆流させた。次いで、生成した褐色混合物を0℃に冷却してから、開始物質(アルデヒドまたはケトン)(1価)を20mL乾燥THF溶液としてゆっくりと添加した。反応混合物を逆流させてTLC(酢酸エチル/ヘキサンの2:3混合物)により反応進行をモニタリングした。終了時、反応混合物を濃縮し、酢酸エチル(150mL)で希釈した。酢酸エチル溶液に、飽和K2CO3溶液(100mL)を添加し、7時間撹拌して濾過した。濾過液を酢酸エチルで抽出し、有機層を飽和NaCl溶液、水で洗浄して、無水Na2SO4上で乾燥した。濃縮した粗混合物をシリカゲル上で酢酸エチル:ヘキサンの1:9混合物とカラムクロマトグラフして中間体(I)のE異性体とZ異性体をスチルベン生成物として得た。スチルベン生成物(中間体(I))を真空乾燥し、1H−および13C−NMR分光学により特性を決定した。
【0227】
生成物(II)を得るための合成手順:中間体(I)(1価)を一口丸底フラスコ内で15mLメタノール中に溶解し、パラホルムアルデヒド(2.1価)および適切なアミン(2.2価)を添加した。TLC(酢酸エチル:ヘキサンの2:3混合物)を用いて反応混合物を還流させて、反応進行をモニタリングした。反応終了時、混合物を室温に冷却して真空濃縮した。残基を酢酸エチル中に溶解し、1M HCl溶液で処理した。水相を分離し、pHが7になるまで1M NaOH溶液で処理し、酢酸エチルで抽出した。有機層を飽和NaCl溶液、水で洗浄し、無水Na2SO4上で乾燥し、真空濃縮して、生成物(II)をE−異性体とZ−異性体の混合物として得た。次いで、1H−および13C−NMR分光学により生成物(II)の特性を決定した。
【0228】
E−異性体とZ−異性体の両方を上の合成スキームを介して合成できる。上の手順の修正版を使用して本発明の追加の化合物を調製できる。例えば、置換アルケンを調製するための代替方法を用いて中間体(I)の変異体を調製することができる。
【実施例2】
【0229】
Jak2−V617F依存性HEL細胞増殖の阻害:
方法:Jak2−V617F発現ヒト赤白血病(HEL)細胞を96ウェルプレートに約40,000細胞/ウェルでプレート化し、ビヒクル対照(0.25%DMSO)または25μM Jak2キナーゼ阻害剤のいずれかでインキュベートした。次いで、その時点(0、4、24、48および72時間目)でトリパンブルー排除および血球計数器を介して生存細胞数を決定した。MultiScreen(登録)Solubility Filter Plate (Millipore)(薬剤の水溶解度を決定するための定量方法:至適化および標準方法との相関関係;http://www.millipore.com/techpublications/tech1/an1730en00を参照されたい)および分光光度計を用いて水溶解度を決定した。
【0230】
結果:試験した様々なJak2キナーゼ阻害剤の増殖阻害および水溶解度を下表1に要約する。
【表1】

【0231】
表1は、様々な化合物による、G6に類似した良好な細胞阻害を示す(NB−2およびNB−6が相対的に中程度、G6のそれぞれ約53%および約19%細胞を阻害したことを除く)。表1は、試験した化合物のほとんどの水溶解度値が約400〜500μMであったことも示す。
【0232】
さらに、G6の試験結果を図2、3、および4に要約する。図2は、G6のJak2−V617F依存性HEL細胞増殖の阻害IC50は、約4μMであることを示す。図3は、G6がJak2−V617F依存性細胞増殖を50%阻害するために必要な時間は約11時間であることを示す。図4は、G6がJak2−V617F依存性HEL細胞増殖を用量依存的かつ時間依存的に阻害することを示す。
【0233】
NB−1およびNB−2の試験結果をそれぞれ図5および6に要約する。図5は、NB−1のJak2−V617F依存性HEL細胞増殖の阻害IC50は約4μMであることを示す。図6は、NB−2のJak2−V617F依存性HEL細胞増殖の阻害IC50は約9μMであることを示す。
【実施例3】
【0234】
病的細胞増殖に対するJak2キナーゼ阻害剤のエクスビボ試験
方法:真性赤血球増加症を確認し、Jak2−V617F陽性とも同定された60歳雌から骨髄由来単核細胞を採取した。骨髄由来単核細胞をIMDM培地で3回洗浄し、4×105細胞/mLの1mLメチルセルロース培地(0.9%メチルセルロース、30%熱不活化FCS、0.1mM 2−メルカプトエタノール、0.9%BSA、0.05%NaHCO3、2mM/Lグルタミン、ペニシリン、ストレプトマイシン、50ng/mL SCF、および20ng/mL IL−3(Stem Cell Technologies, Vancouver, BC)でプレート化した。ビヒクル対照(0.25%DMSO)または阻害剤を指定の濃度(25または2.5μM)で添加した。EPO(1U/mL)も指定のとおり添加した。次いで、14日目のコロニー形成評価時まで培養液を37℃、5%CO2でインキュベートした。結果を複製培養液/4×105細胞由来の平均コロニー数として表した。
【0235】
結果:G6、NB−1およびNB−2は病的細胞増殖を低減することを示すG6、NB−1およびNB−2の試験結果を図10に要約する。
【実施例4】
【0236】
NOD−SCIDマウスモデルのJak2−V61F誘発性血液疾患における阻害剤の治療有効性を示すためのアッセイ
方法:本実験において、NOD−SCIDマウス、N=36を6群(n=6匹)に無作為化した。ベースライン末梢血試料および体重を0日目に測定した。7日目、2×106HEL細胞を2、3、4および5群の各マウスに注入した。28日目から49日まで、1群マウスは完全に未投薬とし、2群マウスにはDMSOを投与し、3群マウスには0.1mg/kg/日のG6を投与し、4群マウスには1.0mg/kg/日のG6を投与し、5群マウスには10mg/kg/日のG6を投与し、6群マウスには10mg/kg/日のG6を投与した。次いで、すべてのマウスを安楽死させた。
【0237】
本実験において、以下の測定可能な評価項目を評価した。末梢血において、総白血球(WBC)数、芽細胞パーセンテージ、有核赤血球(RBC)パーセンテージ、およびヘマトクリットを測定した。骨髄において、定量的細胞質、および脊髄細胞の赤血球細胞に対する(M:E)比率を評価した。さらに組織学的分析を用いて、脾臓、脳、腎臓、肝臓、および肺における毒性を評価した。
【0238】
21標準規格注射針を用いた週1回の顎下出血により、末梢血試料を採取した。血液試料をスライドガラス上に塗布し、染色して、乾燥させた。次いで、各スライド上の末梢芽細胞を病理光学顕微鏡を用いて集計した。次いで、各治療群の平均末梢芽細胞パーセントを時間関数としてグラフ化した。
【0239】
剖検時、各動物由来の大腿骨をホルマリン固定し、脱灰してからパラフィン包埋した。次いで、パラフィン切片を作製し、ヘマトキシリンおよびエオシンで染色し、乾燥させた。次いで、治療群に盲検の獣医病理学者が脊髄および赤血球細胞数を集計した。次いで、脊髄の赤血球細胞に対する比率を治療群の関数としてグラフ化した。さらに、成熟および未成熟赤血球細胞数の平均を治療群の関数としてグラフ化した。
【0240】
追加的に、剖検時、動物の最終測量を行い、次いで各マウスから脾臓を除去した。各脾臓の湿重量を記録し、脾臓重量の体重に対する比率を治療群の関数としてグラフ化した。
【0241】
結果:要約すると、SCID−NODマウス尾静脈内へのHEL細胞の注射は、1)末梢血中の芽細胞の増大;2)骨髄中の赤血球細胞数の増大(赤白血病);ならびに3)脊髄の赤血球に対する比率の低下、に証明される著しいJak2病原に至った。
【0242】
G6の試験結果を、図1、11、12、13、および14に示す。図1は、骨髄分析を示す:1(a)は、未処理SCID 1を示し、ここで脊髄細胞:赤血球系細胞の比率は1.11であり;1(b)は、DMSOで処理した114HEL細胞を示し、ここで脊髄細胞:赤血球系細胞の比率は0.47であり;1(c)は、0.1mg/kg G6で処理した234AHEL細胞を示し、ここで脊髄細胞:赤血球系細胞の比率は0.3であり;1(d)は、1.0mg/kg G6で処理した344HEL細胞を示し、ここで脊髄細胞:赤血球系細胞の比率は1.25であり;1(e)は、10mg/kg G6で処理した444HEL細胞を示し、ここで脊髄細胞:赤血球系細胞の比率は1.2であり;1(f)は、10mg/kg G6で処理した524SCIDを示し、ここで脊髄細胞:赤血球系細胞の比率は1.1である。
【0243】
図11は、G6は末梢血中の芽細胞パーセンテージを用量依存的に低下させることを示す;
図12は、G6は最小用量1mg/kg/日でHEL細胞誘発性の脊髄細胞:赤血球系細胞の比率の低下を逆転したことを示す;
図13は、G6処理は未成熟赤血球細胞ではなく成熟赤血球細胞の低減数と相関することを示す;
図14は、G6は脾臓重量の体重に対する比率を低下させることを示す。
【0244】
さらに、G6の10mg/kg/日投与量は、骨髄壊死(マウス6匹中2匹)および脾臓壊死(マウス6匹中3匹)に示されたように、ある程度の毒性を示すことが見出された;それでもなお、該動物の脳、腎臓、肝臓、および肺においては、マウスに10mg/kg/日投与時でさえ組織学的に正常であることが見出され、G6は、組織全体において毒性ではないことが示された。末梢血の顆粒球、好中球、および好酸球数はマウスに10mg/kg/日投与時でさえすべて正常であり、G6は、赤血球前駆に特異的であることが示された。
【0245】
まとめると、本明細書において報告された結果は、1)末梢血中の芽細胞の低減;2)骨髄中の赤血球細胞;特に成熟赤血球細胞の低減;3)病的脊髄の赤血球に対する比率の逆転;ならびに4)脾臓重量の体重に対する比率の低下、により証明されたG6処理で補正したJak2−V617F媒介病原を示す。
【実施例5】
【0246】
c−Srcアッセイ
約4μL(12単位)の触媒的に活性化した組換えp60c−src(Upstate Biotechnology)を、DMSOまたは25μM Z3のいずれかの存在下、46μLインビトロキナーゼ反応緩衝液(50mM HEPES、pH7.6、5mM MnCl2、5mM MgCl2、100mM NaCl、0.5mM DTT)中でインキュベートした。反応物を室温で20分間インキュベートし、次いでSDS含有緩衝液を追加して停止した。試料を抗Src(pY418)ポリクローナル抗体(Biosource)でウエスタンブロット化した。試料を続いてc−Src抗体(Biosource, Upstate Biotechnology)の混合物(それぞれ最終希釈1:1000)で免疫ブロットして、すべての試料において等量c−Srcタンパク質を示す。
【0247】
G6がc−Srcチロシンキナーゼ活性に対して無効であることを示すG6の結果を図7に要約する。
【実施例6】
【0248】
アポトーシスアッセイ
Jak2−V617F発現HEL細胞をビヒクル対照(DMSO)、または25μM阻害剤のいずれかに48時間曝露した。次いで、アネキシンV/ヨウ化プロピジウムFACS分析を介してアポトーシス細胞パーセンテージを決定した。
【0249】
様々な化合物/条件の試験結果を表2に要約する。さらに図8にもG6の試験結果を示す。
【表2】

【0250】
表2は、NB−1はG6と同様にHEL細胞増殖を抑制する一方、NB−2は、G6ほど効果的ではないことも示す。図8は、G6は細胞アポトーシスを増大することにより細胞数を低減することを示す。
【実施例7】
【0251】
Jak2−V617F自己リン酸化アッセイ
野生型マウスJak2cDNA(pRC−CMV−Jak2−V617F)をコードする5.0μgのプラスミドを含む血清非含有培地において、バクテリオファージT7プロモーターの制御下、製造業者の説明書(Invitrogen)に従いリポフェクチンを用いて、BSC−40細胞をトランスフェクトした。4時間後、細胞を感染効率(MOI)1.0で組換えワクチニアウイルスvTF7−3に感染させた。1時間後、リポフェクチン/DNA/vTF7−3を含む培地を細胞から除去し、新規の、血清含有培地と交換した。この時点で阻害剤を10〜100μMの範囲の用量で細胞に添加した。細胞を一晩37℃で増殖させて高レベル発現させ、続いてJak2をチロシン自己リン酸化させた。阻害剤の追加から16時間後、細胞を2容量の氷冷PBSで洗浄し(1mM Na3VO4を含む)、0.8mL氷冷RIPA緩衝液(プロテアーゼ阻害剤を含む)中で溶解させた。試料を氷上で1時間、超音波分解してインキュベートした。試料を16,000×g、4℃で5分間回転し、可溶性タンパク質溶解物を含む上清を換算した。換算した溶解物(約400μg/ml)を2μgの抗体および20μlのProtein A/G Plus agarose ビーズ(Santa Cruz Biotechnology)を用いて4℃で2〜4時間免疫沈殿した。遠心分離後、洗浄緩衝液(25mMトリス、pH7.5、150mM NaCl、および0.1%トリトンX−100)でタンパク質複合体を3回洗浄し、SDS含有試料緩衝液中で再懸濁した。結合タンパク質を煮沸し、SDS−PAGEにより分離し、ニトロセルロース膜上に移した。抗Jak2−pAb(HR758)の免疫沈降はSanta Cruz Biotechnologyから入手した。抗Tyr(P)−mAb(クローンPY20)の免疫沈降はBD Transduction Laboratoriesから入手した。リン酸化レベルを強化した化学ルミネセンスを用いて検出した。抗Tyr(P)ウエスタンブロッティング法を、クローン4G10(Upstate Biotechnology)、PY99(Santa Cruz Biotecnology)およびPY20(BD Transduction Laboratories)からなる抗体の混合物(それぞれ最終希釈1:1000)を用いて実施した。抗Jak2抗体(758〜776)はUpstate Biotechnology (Millipore)から入手した。
【0252】
Jak2−V617F自己リン酸化アッセイにおいて試験した様々な化合物の試験結果を図15に要約する。
【実施例8】
【0253】
Jak2−阻害剤がJak2−V617f依存性巨核球コロニー形成をブロックすることを示すためのエクスビボ試験
本態性血小板血症を確認したJak2−V617F陽性の61歳雄から骨髄由来単核細胞を採取した。細胞をIMDM培地で3回洗浄し、4×105細胞/mLの1mLメチルセルロース培地(0.9%メチルセルロース、30%熱不活化FCS、0.1mM 2−メルカプトエタノール、0.9%BSA、0.05%NaHCO3、2mM/Lグルタミン、ペニシリン、ストレプトマイシン、50ng/mL SCF、および20ng/mL IL−3(Stem Cell Technologies, Vancouver, BC)でプレート化した。ビヒクル対照(0.25%DMSO)またはG6(25μM)を指定のとおり添加した。TPO(1U/mL)も指定のとおり添加した。次いで、14日目のコロニー形成評価時まで培養液を37℃、5%CO2でインキュベートした。結果を複製培養液/4×105細胞由来の平均コロニー数として表した。
【0254】
G6はJak2−V617F依存性巨核球コロニー形成をブロックすることをはっきりと示すG6の試験結果を図9に要約する。
【実施例9】
【0255】
骨髄免疫組織化学:免疫化学を10%中性緩衝ホルマリン固定しパラフィン包埋した組織上で実施した。活性STAT5検出のため、マウスモノクローナル抗ホスホ−STAT5a/b(Y694/99; Advantex BioReagents LLP)を1:500希釈し、切片上で一晩4℃でインキュベートした。ビオチニル化二次抗体およびストレプトアビジン−ペルオキシダーゼ複合体(DAKO)により抗原−抗体複合体を検出した。対比染色にヘマトキシリンを用いた。BioGenex AR10回復緩衝液を用いて熱することにより(95℃、20分)、抗原を回復した。NIS−ELEMENT Dソフトウェアを用いて染色強度を定量化した。DNA鎖切断の3−ヒドロキシル末端を特異的に標識するTUNEL(末端デオキシヌクレオチジルトランスフェラーゼ媒介dUTP−ビオチン−ニック末端標識)法を介して、アポトーシス細胞を同定した。TUNEL手順において、すべての試薬(緩衝液を含む)はApopTag Kit (Millipore)の一部であった。TUNEL陽性細胞は、メチルグリーン対比染色に対して褐色の細胞核に強く染色されているように見えた。
【実施例10】
【0256】
ホスホ−STAT分析:製造業者の説明書(Invitrogen)に従い、STAT1、3、5a/bホスホ3−Plexアッセイキット、固相サンドイッチ免疫アッセイを用いてホスホ−STAT1[pY701]、STAT3[pY705]、およびSTAT5a/b[pY694/699](STAT5aにおいて[pY694]、およびSTAT5bにおいて[pY699])を測定した。各分析物に特異的な3つのビーズ領域のスペクトル特性をLuminex(登録)100(商標登録)機器によりモニタリングした。
【0257】
本明細書の可変要因の任意の定義における化学基リストの列挙は、その可変要因の、リストに挙げた任意の単一の基または基の組み合わせとしての定義を含む。本明細書の1つの要素、1つの実施形態の列挙は、任意の単一要素もしくは実施形態または任意の他の要素、実施形態またはその部分との組み合わせとして要素または実施形態を含む。
【0258】
本明細書に引用した特許、特許出願および刊行物の各開示がそれらの全体を参照することにより本明細書に組み込まれる。
【0259】
本発明は特定の実施形態に準拠して開示しているが、本発明の他の実施形態およびバリエーションも本発明の真意および範囲から逸脱せずに当業者により案出し得ることが明らかである。特許請求の範囲は、かかる実施形態および均等物のバリエーションをすべて含むと解釈されることを意図する。
【技術分野】
【0001】
関連出願
本出願は、2008年12月9日に出願された米国仮出願第61/201,406号の利益および優先権を主張し、この仮出願の内容は、それらの全体を参照することにより本明細書に組み込まれる。
【0002】
連邦支援の研究下で行われた調査に対する合衆国政府の権利
本発明は、米国国立衛生研究所/NHLBIに付与された認可番号R01−HL67277の一部財政的援助のもとに行われた。合衆国政府は、本発明において一定の権利を有する。
【背景技術】
【0003】
タンパク質キナーゼは、細胞内の様々なシグナル形質導入過程の制御を担う構造的に関連した酵素の大ファミリーを構成する。(Hardie, G. and Hanks, S. The Protein Kinase Facts Book, I and II, Academic Press, San Diego, Calif.: 1995を参照されたい)。キナーゼはリン酸化する基質によりファミリーに分類し得る(例えば、タンパク質−チロシン、タンパク質−セリン/トレオニン、脂質など)。通常、これらのキナーゼファミリーのそれぞれに相当する配列モチーフは同定されている(例えば、Hanks, S. K., Hunter, T., FASEB J. 1995, 9, 576−596; Knighton et al., Science 1991, 253, 407−414; Hiles et al., Cell 1992, 70, 419−429; Kunz et al., Cell 1993, 73, 585−596; Garcia−Bustos et al., EMBO J. 1994, 13, 2352−2361を参照されたい)。
【0004】
一般的に、タンパク質キナーゼは、ヌクレオシド三リン酸から、シグナル伝達経路に関与するタンパク質受容体へのホスホリル移行をもたらすことにより細胞内シグナル伝達を媒介する。これらのリン酸化事象は、標的タンパク質の生物学的機能を調節または制御できる分子のオン/オフスイッチとして作用する。これらのリン酸化事象は、様々な細胞外および他の刺激(例えば、環境ストレス、化学物質ストレス、薬剤(例えば、サイトカインおよび増殖因子を含む)によるシグナル伝達)に対する反応において最終的に誘発される。
【0005】
ヤヌスキナーゼ(JAK)はJak1、Jak2、Jak3およびTYK2からなるチロシンキナーゼファミリーである。JAKはサイトカインのシグナル伝達において重要な役割を果たす。JAKファミリーキナーゼのダウンストリーム基質は、シグナル伝達性転写因子(STAT)タンパク質を含む。JAK/STATシグナル伝達は、多くの異常な免疫反応、例えばアレルギー、喘息、自己免疫性疾患(移植拒絶など)、関節リウマチ、筋委縮性側索硬化症および多発性硬化症ならびに固形および血液悪性腫瘍(白血病およびリンパ腫など)の媒介に関係している。JAK/STAT経路における医薬的介入については、概説されている[Frank, Mol. Med. 5, 432−456 (1999) & Seidel et al., Oncogene 19, 2645−2656 (2000)]。
【0006】
Jak1、Jak2、およびTYK2は遍在的に発現する一方、Jak3は大部分が血球内で発現する。Jak3は共通のサイトカイン受容体γ鎖に独占的に結合し、IL−2、IL−4、IL−7、IL−9、およびIL−15により活性化される。IL−4およびIL−9により誘発されるマウス肥満細胞の増殖および生存は、実際には、Jak3およびγ鎖シグナル伝達依存性であることが示されている(Suzuki et al., Blood 96, 2172−2180 (2000))。
【0007】
ある既知のJak2阻害化合物が治療的使用のために提案されているが、これらの化合物は部分的に標的特異性の欠如のために頻繁に制限される。したがって、Jak2媒介疾患を媒介するが、副作用はなく、既存薬の選択制限のない、有用な治療薬が必要とされている。
【発明の概要】
【0008】
本発明は、対象のJak2媒介疾患および障害を治療するために使用できる化合物、ならびにその方法および使用を提供する。
【0009】
1つの態様では、本発明は、式(I)の化合物に関し、
【化1】

式中、
R1とR2はそれぞれ独立してH、−(炭素数1〜4)アルキル、−(炭素数2〜8)アルケニル、−(炭素数2〜8)アルキニル、
【化2】

であり、
ここで、−(炭素数1〜4)アルキルはさらに1つ以上の水酸基もしくはハロゲンと置換でき;
または
R1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成し、ただしR1とR2は窒素原子と一緒になってピペラジン環を形成し、ピペラジン環上の第二の窒素はさらに任意に−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルと置換でき、ここで−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルは1つ以上の水酸基、ハロゲンもしくは−(炭素数1〜3)アルキルと置換できることを条件とし;
R3はH、−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、もしくはアリールであり;
R4はHもしくはR7であり;
R5はH、−(炭素数1〜4)アルキル、−C(CH3)2−R6、もしくはR7であり;ただしR4がHで、R5がR7もしくは−C(CH3)2−R6である場合、およびR5がHもしくは−(炭素数1〜4)アルキルである場合、R4はR7であり、ここでR4とR5は同時にR7となることはできないことを条件とし;
R6はH、−(炭素数1〜4)アルキル、フェニル、もしくは
【化3】

であり、
式中、R1とR2は上に定義したとおりであり;
R7は
【化4】

であり;
式中、R8とR9はそれぞれ独立してH、−OH、−O−(炭素数1〜4)アルキル、−CH2−NR1R2であり、式中、R1とR2は上に定義したとおりであり;
R10は各存在において独立して水素、もしくは−(炭素数1〜3)アルキルであり;
R11はH、アシル、トシル、−(炭素数1〜4)アルキル、もしくはアリールであり;
またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物であり;
ただし化合物は、以下ではないことを条件とする:
i.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
ii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
iii.5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
iv.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
v.4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
vi.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
vii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
viii.4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)。
【0010】
式(I)の化合物の1つの実施形態では、R11は水素である。別の実施形態では、R10は各存在において独立して水素、メチルまたはエチルである。
【0011】
式(I)の化合物の1つの実施形態では、R3はHである。別の実施形態では、R4とR5の一方はR7である。分離された実施形態では、R7は
【化5】

である。
【0012】
式(I)の化合物の1つの実施形態では、R4はR7である。別の実施形態では、R5はHである。1つの実施形態では、R8は−CH2−NR1R2であり、R9は水酸基であり、R1とR2は式(I)で定義される。1つの実施形態では、R10は各存在において独立して水素またはメチルである。別の実施形態では、R1とR2は各存在において独立して−(炭素数1〜4)アルキルである。さらに別の実施形態では、R1とR2は結合している窒素原子と一緒になってピペリジニル、ピロリジニルまたはイミダゾリル環を形成し、式中、R10は各存在において同じである。
【0013】
1つの実施形態では、R10はエチルである。別の実施形態では、R1とR2は独立してエチルまたはイソプロピルである。別の実施形態では、R1とR2は結合している窒素原子と一緒になってピロリジニルまたはイミダゾリル環を形成する。
【0014】
別の実施形態では、R4はHである。ある実施形態では、R5はR7である。1つの実施形態では、R8は水酸基であり、R9は−CH2−NR1R2であり、式中、R1とR2は式(I)で定義される。1つの実施形態では、R10はメチルである。別の実施形態では、R1とR2は各存在において独立して−(炭素数1〜4)アルキルであるか、またはR1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成する。別の実施形態では、R1とR2は独立してプロピルまたはイソプロピルであり、R10がHまたはエチルである場合、R10は各存在において同じである。別の実施形態では、R10がエチルである場合、R1とR2は結合している窒素原子と一緒になってピペリジニル、ピロリジニルまたはイミダゾリル環を形成する。
【0015】
ある実施形態では、化合物は、以下からなる群((A)群)またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される
a)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
b)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
c)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
d)5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
e)5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
f)5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
g)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
h)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;
i)5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
j)5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;
k)5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)2HCl;
l)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
m)5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
n)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
o)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
p)5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
q)5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
r)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
s)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
t)5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
u)5,5−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
v)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
w)4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
x)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
y)5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
z)5,5−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
aa)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
bb)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
cc)4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
dd)4,4−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
ee)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
ff)5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
gg)5,5−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
hh)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
ii)4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);ならびに
jj)4,4−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール)。
【0016】
本明細書に提示する各化合物の化学名は、化合物のシス異性体とトランス異性体の両方を明示的に包含する。
【0017】
別の態様では、本発明は、式(II)の化合物またはその医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物に関し、
【化6】

式中、
R1とR2はそれぞれ独立してH、−(炭素数1〜4)アルキル、−(炭素数2〜8)アルケニル、−(炭素数2〜8)アルキニル、
【化7】

であり、
式中、−(炭素数1〜4)アルキルはさらに1つ以上の水酸基もしくはハロゲンと置換でき;
または
R1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成し、ただしR1とR2は窒素原子と一緒になってピペラジン環を形成し、ピペラジン環上の第二の窒素はさらに任意に−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルと置換でき、ここで−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルは1つ以上の水酸基、ハロゲンもしくは−(炭素数1〜3)アルキルと置換できることを条件とし;
R3はH、−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールであり;
R4はHまたはR7であり;
R5はH、−(炭素数1〜4)アルキル、−C(CH3)2−R6、もしくはR7であり、ただしR4がHで、R5がR7もしくは−C(CH3)2−R6である場合、およびR5がHもしくは−(炭素数1〜4)アルキルである場合、R4はR7であり、ここでR4とR5は同時にR7となることはできないことを条件とし;
R6はH、−(炭素数1〜4)アルキル、フェニル、もしくは
【化8】

であり、
式中、R1とR2は上に定義したとおりであり;
R7は
【化9】

であり;
式中、R8とR9はそれぞれ独立してH、−OH、−O−(炭素数1〜4)アルキル、−CH2−NR1R2であり、式中、R1とR2は上に定義したとおりであり;
R10は各存在において独立して水素、もしくは−(炭素数1〜3)アルキルであり;
R11はH、アシル、トシル、−(炭素数1〜4)アルキル、もしくはアリールである。
【0018】
ある実施形態では、式(I)または式(II)の化合物は、以下からなる群の化合物ではない:4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「G6」);4,4−(ヘキサン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(とも呼ぶ「D1);4−ベンジル−2−((ジエチルアミノ)メチル)フェノール(「D2」とも呼ぶ);2,2−(メチルアザンジイル)ビス(メチレン)ビス(4−メチルフェノール)(「D3」とも呼ぶ);2−((ジメチルアミノ)メチル)−4−(4−(4−ヒドロキシフェニル)ヘキサン−3−イル)フェノール(「D4」とも呼ぶ);2,2−(ピペラジン−1,4−ジイルビス(メチレン))ビス(4−エチルフェノール)(「D5」とも呼ぶ);2,2−(ピペラジン−1,4−ジイルビス(メチレン))ビス(4−メチルフェノール)(「D6」とも呼ぶ);6,6−(メチルアザンジイル)ビス(メチレン)ビス(2−メチルフェノール)(「D7」とも呼ぶ);2,2−(2−ヒドロキシ−5−(4−(4−ヒドロキシフェニル)ヘキサ−3−エン−3−イル)ベンジルアザンジイル)ジエタノール(「D10」とも呼ぶ);2−((ジメチルアミノ)メチル)−4−(2−フェニルプロパン−2−イル)フェノール(「D11」とも呼ぶ);2−シクロヘキシル−6−((ジエチルアミノ)メチル)−4−tert−ペンチルフェノール(「D12」とも呼ぶ);3−((ジエチルアミノ)メチル)−5−tert−ペンチルビフェニル−2−オール(「D13」とも呼ぶ);5−tert−ブチル−3−((ジエチルアミノ)メチル)ビフェニル−2−オール(「D14」とも呼ぶ);3−((ジメチルアミノ)メチル)ビフェニル−2−オール(「D21」とも呼ぶ);2−((ジエチルアミノ)メチル)−4−(4−(4−メトキシフェニル)ヘキサ−3−エン−3−イル)フェノール(「D22」とも呼ぶ);2−((ベンジルアミノ)メチル)−4,6−ジメチルフェノール(「D23」とも呼ぶ);2−シクロヘキシル−6−((ジエチルアミノ)メチル)−4−(2−フェニルプロパン−2−イル)フェノール(「D25」とも呼ぶ);2−((ジメチルアミノ)メチル)−4−(4−(4−メトキシフェニル)ヘキサ−3−エン−3−イル)フェノール(「D28」とも呼ぶ);5,5−(ヘキサン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「D30」とも呼ぶ)。
【0019】
ある実施形態では、本発明は、以下からなる群(B群)またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物を提供する:4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)2HCl;5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);ならびに4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);ならびに4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)。
【0020】
(B)群に提示する各化合物名は、化合物のシス異性体とトランス異性体の両方を明示的に包含することを意味する。
【0021】
ある実施形態では、化合物は、以下の群(C群)またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される:
1)(Z)−および(E)−4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「NB−1」):
【化10】

2)(Z)−および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「NB−2」):
【化11】

3)(Z)−および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「NB−3」):
【化12】

4)(Z)−および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−4」):
【化13】

5)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「NB−5」):
【化14】

6)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−6」):
【化15】

7)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−7」):
【化16】

8)(Z)−および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl(「NB−8」):
【化17】

9)(Z)−および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl(「NB−9」):
【化18】

10)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl(「NB−10」):
【化19】

11)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl(「NB−11」):
【化20】

12)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−12」):
【化21】

13)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−13」):
【化22】

14)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−14」):
【化23】

15)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−15」):
【化24】

16)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−16」):
【化25】

17)(Z)および(E)−(5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−17」):
【化26】

18)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(モルホリノメチル)フェノール)(「NB−18」):
【化27】

;
19)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(モルホリノメチル)フェノール)(「NB−19」):
【化28】

20)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−20」):
【化29】

21)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−21」):
【化30】

;
22)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−(モルホリノメチル)フェノール)(「NB−22」):
【化31】

23)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−23」):
【化32】

24)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−24」):
【化33】

25)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−25」):
【化34】

26)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(モルホリノメチル)フェノール)(「NB−26」):
【化35】

27)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−27」):
【化36】

28)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−28」):
【化37】

29)(Z)および(E)−2−((ジエチルアミノ)メチル)−4−(4−(4−ヒドロキシフェニル)ヘキサ−3−エン−3−イル)フェノール(「NB−29」):
【化38】

;
30)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ジフェノール(「NB−30」)
【化39】

31)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ジフェノール(「NB−31」):
【化40】

32)(Z)および(E)−3,3−(エテン−1,2−ジイル)ジフェノール(「NB−32」):
【化41】

33)(Z)および(E)−3,3−(ブタ−2−エン−2,3−ジイル)ジフェノール(「NB−33」):
【化42】

;
34)(Z)および(E)−4,4−(エテン−1,2−ジイル)ジフェノール(「NB−34」):
【化43】

;ならびに
35)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「G6」):
【化44】

。
【0022】
さらに別の実施形態では、化合物は、(上に定義した)NB−1、NB−2、NB−3、NB−4、NB−5、NB−6、NB−7、NB−8、NB−9、NB−10、NB−11、およびNB−12からなる群((D)群)、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される。
【0023】
本発明の別の態様は、式(III)の化合物またはその医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物に関し、
【化45】

式(III)
式中、
R1とR2はそれぞれ独立してH、−(炭素数1〜4)アルキル、−(炭素数2〜8)アルケニル、−(炭素数2〜8)アルキニル、
【化46】

であり、
式中、−(炭素数1〜4)アルキルはさらに1つ以上の水酸基もしくはハロゲンと置換でき;
または
R1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成し、ただしR1とR2は窒素原子と一緒になってピペラジン環を形成し、ピペラジン環上の第二の窒素はさらに任意に−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルと置換でき、ここで−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルは1つ以上の水酸基、ハロゲンもしくは−(炭素数1〜3)アルキルと置換できることを条件とし;
R11はH、アシル、トシル、−(炭素数1〜4)アルキル、もしくはアリールであり;
R4とR5はHもしくはR12であり、ただしR4とR5の一方はH、他方はR12であることを条件とし;
R12は
【化47】

であり、
式中、R4とR5の両方が結合するアリール基はR12の芳香族環の−OR11のメタもしくはパラであり;
R10は水素、もしくは−(炭素数1〜3)アルキルであり;
ただし化合物は、以下ではないことを条件とする:
i.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
ii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
iii.5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
iv.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
v.4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
vi.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
vii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
viii.4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)。
【0024】
本発明は、対象のJak2媒介疾患または障害の治療または予防方法も提供する。ある実施形態では、本方法は、有効量の上に定義した式(I)、(II)および(III)から選択される化合物、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物を、対象のJak2媒介疾患または障害が治療または予防されるように対象に投与する工程を含む。ある実施形態では、対象に投与する化合物は、式(I)もしくは式(III)の化合物、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物である。
【0025】
1つの実施形態では、化合物は、上に定義した(A)、(B)、(C)もしくは(D)群、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物から選択される。別の実施形態では、化合物は、(B)群、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物から選択される。別の実施形態では、化合物は、(C)群から選択される化合物またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物である。さらに別の実施形態では、化合物は、(D)群の化合物またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物である。
【0026】
1つの実施形態では、本発明の化合物を、約0.001mg/Kg/日〜約200mg/Kg/日、または約0.001mg/Kg/日〜約30mg/Kg/日の用量で対象に投与する。ある実施形態では、本発明の化合物を、約0.1mg/Kg/日〜約10mg/Kg/日の用量で対象に投与する。1つの実施形態では、化合物を、約1mg/Kg/日の用量で対象に投与する。
【0027】
1つの実施形態では、本方法は、追加の治療薬を対象に投与することも含む。1つの実施形態では、本発明の化合物および追加の治療薬を同時投与する。別の実施形態では、本発明の化合物および追加の治療薬を連続投与する。
【0028】
1つの実施形態では、Jak2媒介疾患または障害は、真性赤血球増加症、本態性血小板血症、または特発性骨髄化生である。別の実施形態では、Jak2媒介障害は、心疾患または心障害である。ある実施形態では、心疾患または心障害は、心肥大、心虚血再灌流、および心不全の群から選択される。
【0029】
別の実施形態では、化合物はJak2−V617F変異の阻害剤でもある。
【0030】
別の実施形態では、上に定義した式(I)、式(II)もしくは式(III)の化合物またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物は、Jak2自己リン酸化を阻害する。別の実施形態では、上に定義した式(I)、(II)および(III)の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物は、c−SrcもしくはTyk2自己リン酸化をJak2自己リン酸化ほど効果的には阻害しない。
【0031】
さらに別の実施形態では、対象はJak2−V617F変異(1つまたは複数)を有すると同定される。
【0032】
別の態様では、本発明は、対象の癌の治療または予防方法を提供する。本方法は、有効量の式(I)、(II)もしくは(III)の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物を、癌が治療もしくは予防されるように対象に投与することを含む。ある実施形態では、化合物は、上に定義した(A)、(B)、(C)もしくは(D)群から選択される化合物、それらの医薬上許容可能な塩、水和物もしくは溶媒和化合物である。1つの実施形態では、化合物は、(B)群、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物から選択される化合物である。別の実施形態では、化合物は、(C)群、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物から選択される化合物である。さらに別の実施形態では、化合物は、(D)群、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物から選択される化合物である。
【0033】
1つの実施形態では、本発明の化合物を、約0.001mg/Kg/日〜約200mg/Kg/日、または約0.001mg/Kg/日〜約30mg/Kg/日の用量で対象に投与する。ある実施形態では、本発明の化合物を、約0.1mg/Kg/日〜約10mg/Kg/日の用量で対象に投与する。ある実施形態では、化合物を、約1mg/Kg/日の用量で対象に投与する。
【0034】
1つの実施形態では、癌は、白血病、リンパ腫、骨髄腫、および固形腫瘍の群から選択される。別の実施形態では、癌は、慢性骨髄性白血病(CML)、急性骨髄性白血病(AML)、および急性前骨髄球性白血病(APL)の群から選択される。
【0035】
別の態様では、本発明は、Jak2依存性細胞増殖の低減方法を提供する。本方法は、(例えば、インビトロまたはインビボ、例えば、対象における)細胞をJak2阻害剤と接触させることを含み、ここで阻害剤は、上に定義した式(I)、(II)もしくは(III)の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物である。ある実施形態では、化合物は、上に定義した(A)、(B)、(C)もしくは(D)群、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物から選択される。1つの実施形態では、化合物は、(B)群の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物である。ある実施形態では、化合物は、(C)群の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物である。さらに別の実施形態では、化合物は、(D)群の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物であると定めている。
【0036】
1つの実施形態では、本発明の化合物を、約0.001mg/Kg/日〜約200mg/Kg/日、または約0.001mg/Kg/日〜約30mg/Kg/日の用量で細胞または対象に投与する。ある実施形態では、本発明の化合物を、約0.1mg/Kg/日〜約10mg/Kg/日の用量で対象に投与する。ある実施形態では、化合物を、約1mg/Kg/日の用量で対象に投与する。
【0037】
本発明の別の態様は、かかる治療を必要とすることが同定されている対象のJak2の阻害方法を提供する。本方法は、有効量の式(I)、(II)もしくは(III)の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物を、対象のJak2が阻害されるように対象に投与することを含む。ある実施形態では、化合物は、上に定義した(A)、(B)、(C)もしくは(D)群、それらの医薬上許容可能な塩、水和物もしくは溶媒和化合物から選択される。ある実施形態では、化合物は、(C)もしくは(D)群の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物である。
【0038】
1つの実施形態では、化合物を、約0.001mg/Kg/日〜約200mg/Kg/日、または約0.001mg/Kg/日〜約30mg/Kg/日の用量で、治療を必要とすることが同定されている対象に投与する。ある実施形態では、化合物を、約0.1mg/Kg/日〜約10mg/Kg/日の用量で対象に投与する。ある実施形態では、化合物を、約1mg/Kg/日の用量で対象に投与する。
【0039】
別の態様では、本発明は、対象の血液疾患または障害の治療方法を提供する。本方法は、有効量の式(I)、(II)もしくは(III)の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物を、血液疾患もしくは障害が治療されるように対象に投与することを含む。ある実施形態では、化合物は、上に定義した(A)、(B)、(C)もしくは(D)群、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物から選択される。ある実施形態では、化合物は、(C)もしくは(D)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。
【0040】
本発明は、医薬組成物も提供し、ここで組成物は、Jak2活性を調節できる化合物、またはその医薬上許容可能なエステル、塩、もしくはプロドラッグを医薬上許容可能な担体と共に含む。1つの実施形態では、化合物は、式(II)の化合物またはその医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物である。ある実施形態では、化合物は、上に定義した式(I)もしくは(III)の化合物、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物である。ある実施形態では、化合物は、上に定義した(A)、(B)、(C)もしくは(D)群、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物から選択される。1つの実施形態では、化合物は、(B)群の化合物、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物である。別の実施形態では、化合物は、(C)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。さらに別の実施形態では、化合物は、(D)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。
【0041】
本発明は、対象のJak2関連疾患または障害を治療または予防するためのキットも提供する。キットは、Jak2活性を調節できる少なくとも1つの化合物、ならびにJak2関連疾患もしくは障害の治療もしくは予防における使用説明書を含み、ここで化合物は、上に定義した式(I)、(II)もしくは(III)の化合物、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物である。ある実施形態では、化合物は、上に定義した(A)、(B)、(C)もしくは(D)群、それらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される。1つの実施形態では、化合物は、(B)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。別の実施形態では、化合物は、(C)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。さらに別の実施形態では、化合物は、(D)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。
【0042】
1つの実施形態では、Jak2関連疾患または障害は、癌、血液障害および心障害からなる群から選択される。
【0043】
別の態様では、本発明は、製薬のため本明細書の任意の式の化合物の使用を提供する。ある実施形態では、薬は、Jak2関連疾患または障害(例えば、癌、血液疾患または障害など)の治療のための薬である。
【0044】
本発明は、Jak2の結合ポケットに結合する化合物の設計、評価および同定方法も提供する。本発明の他の態様および実施形態は、以下に開示する。
【図面の簡単な説明】
【0045】
本発明を以下の限定されない実施例に準拠して、かつ下図に準拠して、以下に詳述する:
【図1】(a〜f)骨髄分析を示す:1(a)は、未処理SCID 1を示し、ここで脊髄細胞:赤血球系細胞の比率は1.11であり;1(b)は、DMSOで処理した114HEL細胞を示し、ここで脊髄細胞:赤血球系細胞の比率は0.47であり;1(c)は、0.1mg/kg G6で処理した234AHEL細胞を示し、ここで脊髄細胞:赤血球系細胞の比率は0.3であり;1(d)は、1.0mg/kg G6で処理した344HEL細胞を示し、ここで脊髄細胞:赤血球系細胞の比率は1.25であり;1(e)は、10mg/kg G6で処理した444HEL細胞を示し、ここで脊髄細胞:赤血球系細胞の比率は1.2であり;1(f)は、10mg/kg G6で処理した524SCIDを示し、ここで脊髄細胞:赤血球系細胞の比率は1.1である。
【図2】G6がJak2−V617F依存性HEL細胞増殖を阻害することを示す結果を示す;
【図3】G6がJak2−V617F依存性細胞増殖を50%阻害するために必要な時間を示す。
【図4】G6がJak2−V617F依存性HEL細胞増殖を用量依存的かつ時間依存的に阻害することを示す結果を示す;
【図5】NB−1はJak2−V617F依存性HEL細胞増殖を阻害することを示す結果を示す;
【図6】NB−2はJak2−V617F依存性HEL細胞増殖を阻害することを示す結果を示す;
【図7】G6はc−Srcチロシンキナーゼ活性に対して無効であることを示す結果を示す;
【図8】G6は、細胞アポトーシスを増大することにより細胞数を低減することを示す結果を示す;
【図9】G6はJak2−V617F依存性巨核球コロニー形成をブロックすることを示すエクスビボ結果を示す;
【図10】G6、NB−1およびNB−2は真性赤血球増加症患者由来の病的細胞増殖を用量依存的に低減することを示すエクスビボ結果を示す;
【図11】G6は末梢血中の芽細胞パーセンテージを用量依存的に低下させることを示すインビボ結果を示す;
【図12】G6は最小用量1mg/kg/日でHEL細胞誘発性の脊髄細胞:赤血球系細胞の比率の低下を逆転したことを示すインビボ試験結果を表すグラフである;
【図13】G6処理は未成熟赤血球細胞ではなく成熟赤血球細胞の低減数と相関することを示すインビボ試験結果を表すグラフである;
【図14】G6は脾臓重量の体重に対する比率を低下させることを示すインビボ試験結果を表すグラフである。
【図15】Jak2−V617F自己リン酸化アッセイにおいて試験したいくつかの化合物の結果を示す。
【発明を実施するための形態】
【0046】
本発明は、式(I)で定義される新規構造の化合物を対象とする。ある実施形態では、化合物は式(III)の化合物である。これらの化合物は、Jak2結合相互作用を調節することができる。本発明は、式(II)に定義され、Jak2活性の阻害剤として使用できる化合物にも関し、この化合物はJak2相互作用を標的とすることによりJak2変異を阻害することもできる。本発明の化合物は、Jak2媒介疾患または障害、特に、Jak2およびJak2変異が著しい役割を担うある増殖疾患の種類を治療または予防するための新規治療薬の候補である。
【0047】
本発明は、以下に叙述した化合物が、様々な疾患療法のために、ある標的との相互作用に選択性を示す(例えば、Jak2またはJak2変異に選択的である)ことの発見にも、少なくとも部分的に関する。
【0048】
1.定義
本発明を詳述する前に、本発明がより容易に理解され得るように、ある用語を最初に定義し、便宜上ここに収集する。
【0049】
本明細書および特許請求の範囲に使用される単数形「a」、「an」、および「the」は、文脈においてはっきりと別段の指摘がされない限り、複数形の指示対象を含む。例えば、「細胞(a cell)」という用語は、それらの混合物を含む複数の細胞(cells)を含む。「核酸分子(a nucleic acid molecule)」という用語は、複数の核酸分子(nucleic acid molecules)を含む。
【0050】
本開示では、「含む(comprises)」、「含んでいる(comprising)」、「含んでいる(containing)」および「有する」などは、米国特許法で認められる意味を含むこともでき、「含む(includes)」、「含んでいる(including)」などを意味することもできる;「本質的に〜からなる(consisting essentially of)」または「本質的になる(consists essentially)」とは、同様に米国特許法で認められる意味を有し、用語は開放表現であり、先行技術の実施形態を除いて列挙したものを超える存在により列挙したものの基本的または新規特徴が変更されない限り、列挙したものより多くの存在が可能である。
【0051】
「投与」または「投与する」という用語は、本発明の化合物を、それらの目的の機能を遂行するために対象へ導入する経路を含む。使用してよい投与経路の例としては、注射(皮下、静脈内、非経口、腹腔内、髄腔内)、経口、吸入、直腸および経皮が挙げられる。医薬調製物は、各投与経路に適した形態により投与し得る。例えば、これらの調製物を、錠剤もしくはカプセル形態で、注射、吸入、洗眼液、軟膏、坐剤など、注射、注入もしくは吸入投与;ローションもしくは軟膏により局所投与;ならびに坐剤により直腸投与する。経口投与が好ましい。注射はボーラスであることも持続注入であることもできる。投与経路に応じて、本発明の化合物は、その目的の機能を遂行する能力に対して有害な作用を及ぼし得る天然状態から保護するために選択された物質によりコーティングすることも配置することもできる。本発明の化合物は、単独で投与することもでき、上記の別の薬剤のいずれかもしくは医薬上許容可能な担体、または両方と併用投与することもできる。本発明の化合物は、他の薬剤投与前、薬剤と同時に、または薬剤の投与後に投与できる。さらに、本発明の化合物は、その活性代謝産物、またはインビボでより活性の代謝産物に変換したプロドラッグ形態で投与することもできる。
【0052】
「との併用」という語句は、本発明の化合物(例えば式(I)、式(II)または式(III)から選択される化合物)を第二の薬剤(式(I)、式(II)または式(III)から選択される第二の化合物など)、または特定の疾患もしくは障害に使用される既存の治療薬と共に提供するすべての投与形態を指すことを意図し、2つは同時にまたは任意の順で連続して投与する。
【0053】
「アルキル」という用語は、直鎖アルキル基、分岐鎖アルキル基、シクロアルキル(脂環式)基、アルキル置換シクロアルキル基、およびシクロアルキル置換アルキル基を含む、飽和脂肪族基のラジカルを指す。アルキルという用語は、さらにアルキル基を含み、これはさらに、炭化水素骨格の1つ以上の炭素を置換した酸素、窒素、硫黄またはリン原子を含むことができる(例えば、酸素、窒素、硫黄またはリン原子)。好ましい実施形態では、直鎖または分岐鎖アルキルの骨格に炭素原子が30個以下あり(例えば、直鎖の場合は炭素数1〜30、分岐鎖の場合は炭素数3〜30)、好ましくは26個以下、より好ましくは20個以下、さらにより好ましくは4個以下の炭素原子がある。同様に、好ましいシクロアルキルの環構造には炭素原子が3〜10個あり、より好ましくは環構造に3、4、5、6または7個の炭素がある。
【0054】
さらに、本明細書および本文を通して使用されるアルキルという用語は、「非置換アルキル」と「置換アルキル」の両方を含み、後者は、炭化水素骨格の1つ以上の炭素上の水素を置換する置換基を有するアルキル部分を指すことを意図する。かかる置換基としては、例えば、ハロゲン、ヒドロキシル、アルキルカルボニルオキシ、アリールカルボニルオキシ、アルコキシカルボニルオキシ、アリールオキシカルボニルオキシ、カルボン酸塩、アルキルカルボニル、アルコキシカルボニル、アミノカルボニル、アルキルチオカルボニル、アルコキシル、リン酸塩、ホスホン酸塩、ホスフィン酸塩、シアノ、アミノ(アルキルアミノ、ジアルキルアミノ、アリールアミノ、ジアリールアミノ、およびアルキルアリールアミノを含む)、アシルアミノ(アルキルカルボニルアミノ、アリールカルボニルアミノ、カルバモイルおよびウレイドを含む)、アミジノ、イミノ、スルフヒドリル、アルキルチオ、アリールチオ、チオカルボン酸塩、硫酸塩、スルホナト、スルファモイル、スルホンアミド、ニトロ、トリフルオロメチル、シアノ、アジド、ヘテロシクリル、アルキルアリール、または芳香族もしくは複素芳香族部分を挙げることができる。炭化水素鎖上で置換される部分は、適切な場合、それ自体を置換できることが、当業者により理解されるであろう。シクロアルキルは、例えば、上記の置換基とさらに置換することができる。「アルキルアリール」部分は、アリール(例えば、フェニルメチル(ベンジル))と置換するアルキルである。「アルキル」という用語は、上記のアルキルと鎖長が類似し、上記のアルキルへの置換が可能であるが、それぞれ二重結合または三重結合を少なくとも1つ含む不飽和脂肪族基も指す。
【0055】
炭素数を他に特定しない限り、本明細書で使用する「低級アルキル」とは、上に定義するアルキル基だが、骨格構造(直鎖でも分岐鎖でもよい)に1〜10個の炭素、より好ましくは1〜6個、さらにより好ましくは1〜4個の炭素原子を有するアルキル基を意味する。低級アルキル基の例としては、メチル、エチル、n−プロピル、i−プロピル、tert−ブチル、ヘキシル、ヘプチル、オクチルなどが挙げられる。好ましい実施形態では、「低級アルキル」という用語は、骨格の炭素原子が4個以下である直鎖アルキル、例えば、炭素数1〜4アルキルを含む。
【0056】
「アルコキシアルキル」、「ポリアミノアルキル」および「チオアルコキシアルキル」という用語は、上記のアルキル基を指し、これらはさらに、炭化水素骨格の1つ以上の炭素と置換した酸素、窒素または硫黄原子(例えば、酸素、窒素または硫黄原子)を含む。
【0057】
「アルケニル」および「アルキニル」という用語は、上記のアルキルと鎖長が類似し、上記のアルキルへの置換が可能であるが、それぞれ二重結合または三重結合を少なくとも1つ含む不飽和脂肪族基を指す。例えば、本発明は、シアノ基およびプロパルギル基を意図する。
【0058】
本明細書で使用する「アリール」という用語は、0〜4個のヘテロ原子を含み得る5員環および6員環の単環式芳香族基(例えば、ベンゼン、ピロール、フラン、チオフェン、イミダゾール、ベンゾキサゾール、ベンゾチアゾール、トリアゾール、テトラゾール、ピラゾール、ピリジン、ピラジン、ピリダジンおよびピリミジンなど)を含むアリール基ラジカルを指す。アリール基としては、多環縮合芳香族基(ナフチル、キノリル、インドリルなど)も挙げられる。環構造にヘテロ原子を有するアリール基は、「アリール複素環」、「ヘテロアリール」または「複素芳香族」とも呼び得る。芳香族環は、上記のような置換基(例えば、ハロゲン、ヒドロキシル、アルコキシ、アルキルカルボニルオキシ、アリールカルボニルオキシ、アルコキシカルボニルオキシ、アリールオキシカルボニルオキシ、カルボン酸塩、アルキルカルボニル、アルコキシカルボニル、アミノカルボニル、アルキルチオカルボニル、リン酸塩、ホスホン酸塩、ホスフィン酸塩、シアノ、アミノ(アルキルアミノ、ジアルキルアミノ、アリールアミノ、ジアリールアミノ、およびアルキルアリールアミノを含む)、アシルアミノ(アルキルカルボニルアミノ、アリールカルボニルアミノ、カルバモイルおよびウレイドを含む)、アミジノ、イミノ、スルフヒドリル、アルキルチオ、アリールチオ、チオカルボン酸塩、硫酸塩、スルホナト、スルファモイル、スルホンアミド、ニトロ、トリフルオロメチル、シアノ、アジド、ヘテロシクリル、アルキルアリール、または芳香族もしくは複素芳香族部分)と1つ以上の環位置で置換できる。アリール基は、多環(例えば、テトラリン)を形成するように、芳香族ではない脂環または複素環と縮合または架橋することもできる。
【0059】
「と結合する」という用語は、化学実体もしくは化合物、またはその部分、ならびにタンパク質上の結合ポケットもしくは結合部位間の近接した状態を指す。結合は非共有結合であってもよいし(ここで並置は、水素結合またはファンデルワールスもしくは静電相互作用によるものがエネルギー的に好ましい)、共有結合であってもよい。
【0060】
本明細書で使用する「結合ポケット」という用語は、分子もしくは分子複合体領域を指し、その形の結果として、好ましくは別の化学実体または化合物と結合する。
【0061】
本発明の化合物の「生体活性」という言葉は、本発明の化合物により反応細胞中に誘発されたすべての活性を含む。この言葉は、これらの化合物により誘発されたゲノムおよび非ゲノム活性を含む。
【0062】
「生体組成物」または「生体試料」とは、細胞または生体高分子を含むかまたはそれに由来する組成物を指す。細胞含有組成物としては、例えば、哺乳類血液、赤血球濃縮物、血小板濃縮物、白血球濃縮物、血球タンパク質、血漿、多血小板血漿、血漿濃縮物、血漿の任意の分画由来の沈殿物、血漿の任意の分画由来の上清、血漿タンパク質分画、精製もしくは部分的に精製した血液タンパク質もしくは他の成分、血清、精液、哺乳類初乳、乳汁、唾液、胎盤抽出物、寒冷沈降物、寒冷上清、細胞可溶化物、哺乳類細胞培養もしくは培養培地、発酵生成物、腹水、血球中に誘発したタンパク質、ならびに正常細胞もしくは(例えば、組換えDNAまたはモノクローナル抗体技術を介した)形質転換した細胞により細胞培養中で産生した生成物が挙げられる。生体組成物は無細胞であることができる。好ましい実施形態では、適切な生体組成物または生体試料は、赤血球懸濁液である。いくつかの実施形態では、血球懸濁液は哺乳類の血球を含む。好ましくは、血球はヒト、非ヒト霊長類、イヌ、ネコ、ウマ、ウシ、ヤギ、ヒツジまたはブタから得られる。好ましい実施形態では、血球懸濁液は、赤血球および/または血小板および/または白血球および/または骨髄細胞を含む。
【0063】
「キラル」という用語は、鏡像パートナーを重ねることができない特性を有する分子を指し、一方、「アキラル」という用語は、鏡像パートナーに重ねることができる分子を指す。
【0064】
「ジアステレオマー」という用語は、非対称の2つ以上の中心およびそれらの分子が互いに鏡像ではない立体異性体を指す。
【0065】
「有効量」という用語は、必要な投与量および必要な期間において、(例えば、本明細書に叙述した障害を治療する上で十分な)所望の結果を得るために有効な量を含む。有効量の本発明の化合物は、要因(疾患状態、年齢、および対象の体重、ならびに対象において所望の反応を誘発する本発明の化合物の能力など)に応じて変わり得る。投与量投与計画は、至適治療反応を提供するために調整してよい。有効量は、本発明の化合物の任意の毒性または有害な作用(例えば、副作用)よりも治療的に有益な効果が勝る量でもある。
【0066】
本発明の化合物の「治療的有効量」という言葉は、単回または複数回投与時、Jak2媒介障害に対して、またはかかるJak2媒介障害患者をかかる治療の不在下で予期されるよりも延命する上で有効な薬剤量を指す。
【0067】
本発明の化合物の治療有効量(すなわち、有効な投与量)は、約0.001〜約100mg/kg体重、または約0.1〜約10mg/kg体重の範囲であり得る。対象を効果的に治療するために必要とされる投与量に影響を与え得るある要因(疾患もしくは障害の重症度、前治療、対象の全身健康および/もしくは年齢、ならびに他の疾患既往が挙げられるが、これらに限定されない)については、当業者に理解されるであろう。さらに、治療有効量の本発明の化合物による対象の治療は、単一の治療を含むこともでき、好ましくは、一連の治療を含むことができる。1つの例では、約0.1〜100mg/kg体重、週1回約1〜10週間の範囲の本発明の化合物で対象を治療する。ある例では、週1回2〜8週間、および約3〜7週間である。治療するために使用される本発明の化合物の有効な投与量は、特定の治療過程を通して増量しても減量してもよいことも理解されるであろう。
【0068】
「薬剤」とは、ポリペプチド、ポリヌクレオチド、またはその断片もしくはアナログ、小分子、または他の生物学的活性分子を意味する。
【0069】
「鏡像異性体」という用語は、重ねることができない互いに鏡像である化合物の2つの立体異性体を指す。2つの鏡像異性体の等モル混合物は、「ラセミ混合物」または「ラセミ体」と呼ぶ。
【0070】
「ハロアルキル」という用語は、ハロゲン(例えば、フルオロメチルおよびトリフルオロメチル)によりモノ、ジまたはポリ置換された上に定義するアルキル基を含むことを意図する。
【0071】
「ハロゲン」という用語は、フッ素(F)、塩素(Cl)、臭素(Br)またはヨウ素(I)を示す。
【0072】
「ヒドロキシル」という用語は、水酸基(−OH)を意味する。
【0073】
本明細書で使用する「ヘテロ原子」という用語は、炭素または水素以外の任意の要素の原子を意味する。好ましいヘテロ原子は、窒素、酸素、硫黄およびリンである。
【0074】
「血液疾患または障害」という用語は、血液または造血組織の疾患または障害を指すことを意味する。
【0075】
「癌」という用語は、不適切に高レベルの細胞分裂、不適切に低レベルのアポトーシス、または両方に引き起こされるかまたはそれらに至る任意の疾患を指すことを意味する。癌の例としては、白血病(例えば、急性白血病、急性リンパ性白血病、急性骨髄性白血病、急性骨髄芽球性白血病、急性前骨髄球性白血病、急性骨髄単球性白血病、急性単球性白血病、急性赤白血病、慢性白血病、慢性骨髄性白血病、慢性リンパ性白血病)、真性赤血球増加症、リンパ腫(ホジキン病、非ホジキン病)、ヴァルデンストレームマクログロブリン血症、重鎖疾患、ならびに固形腫瘍、例えば肉腫および癌腫(例えば、線維肉腫、粘液肉腫、脂肪肉腫、軟骨肉腫、骨原性肉腫、脊索腫、血管肉腫、内皮肉腫、リンパ管肉腫、リンパ管内皮細胞肉腫、滑膜腫、中皮腫、ユーイング腫瘍、平滑筋肉腫、横紋筋肉腫、結腸癌、膵臓癌、乳癌、卵巣癌、前立腺癌、平上皮細胞癌、基底細胞癌、腺癌、汗腺癌、脂腺癌、乳頭状癌、乳頭腺癌、嚢胞腺癌、髄様癌、気管支原性癌、腎細胞癌、肝細胞腫、胆管癌、絨毛癌、精上皮腫、胎生期癌、ウィルムス腫瘍、子宮頚癌、子宮癌、精巣癌、肺癌、小細胞肺癌、膀胱癌、上皮癌、神経膠腫、星細胞腫、髄芽腫、頭蓋咽頭腫、上衣腫、松果体腫、血管芽細胞腫、聴神経腫、乏突起膠腫、シュワン腫、髄膜腫、黒色腫、神経芽細胞腫、および網膜芽細胞腫)などが挙げられるが、これらに限定されない。リンパ増殖性障害も増殖性疾患とみなされる。
【0076】
「癌の治療」という語句は、悪性細胞または癌細胞の殺傷を指す。治療とは、腫瘍中の主題の細胞死を引き起こすことを意味する。あるいは、癌の「治療」とは、対象の癌症状の抑止あるいは改善を意味する。
【0077】
「改善された生体特性」という言葉は、本発明の化合物に付随する、本発明の化合物のインビボでの有効性を高める任意の活性を指す。好ましい実施形態では、この用語は、任意の定性的または定量的に改善された本発明の化合物の治療特性(低下した毒性など)を指す。
【0078】
「細胞増殖性障害」という用語は、望ましくないかまたは制御されない細胞増殖に関わる障害を含む。かかる障害の例としては、腫瘍もしくは癌(例えば、乳、卵巣、前立腺、肺(小細胞および非小細胞)、甲状腺、膵臓、乳または結腸などの固形腫瘍))、肉腫、白血病、骨髄腫、リンパ腫、または黒色腫が挙げられるが、これらに限定されない。
【0079】
「任意に置換した」という用語は、1つ以上の利用可能な位置、典型的には1、2、3、4または5位が、水素以外の1つ以上の適切な基(同じでも異なってもよい)により置換されていないか置換されている基を包含することを意図する。かかる任意の置換基としては、例えば、水酸基、ハロゲン、シアノ、ニトロ、炭素数1〜8アルキル、炭素数2〜8アルケニル、炭素数2〜8アルキニル、炭素数1〜8アルコキシ、炭素数2〜8アルキルエーテル、炭素数3〜8アルカノン、炭素数1〜8アルキルチオ、アミノ、モノ−またはジ−(炭素数1〜8アルキル)アミノ、ハロ炭素数1〜8アルキル、ハロ炭素数1〜8アルコキシ、炭素数1〜8アルカノイル、炭素数2〜8アルカノイルオキシ、炭素数1〜8アルコキシカルボニル、−COOH、−CONH2、モノ−またはジ−(炭素数1〜8アルキル)アミノカルボニル、−SO2NH2、および/またはモノまたはジ(炭素数1〜8アルキル)スルホンアミド、ならびに炭素環および複素環基が挙げられる。任意の置換は、「0〜X個の置換基と置換した」(Xは可能な最大置換基数)という語句によっても示される。ある任意の置換基は、0から2、3または4個の独立して選択された置換基と置換される(すなわち、置換されないか列挙した置換基の最大数まで置換される)。
【0080】
「異性体」または「立体異性体」という用語は、化学構造は同じであるが、空間の原子または基の配置が異なる化合物を指す。
【0081】
「調節」という用語は、例えば、本発明の化合物の曝露に対する反応における細胞の増殖能の上昇または低下、例えば、所望の最終結果(例えば、治療結果)が得られるような動物における少なくとも副細胞集団の増殖阻害を指す。ある好ましい例では、調節は、阻害である。「阻害」という用語は、標的活性、例えば細胞増殖を低減する、抑制する、減弱する、減退する、抑止する、または安定させることを意味する。ある例では、本発明は、Jak2活性を調節する化合物を特徴とする。
【0082】
「化合物を得る」の「得る」という用語は、化合物の購入、合成あるいは獲得を含むことを意図する。
【0083】
本明細書で使用する「非経口投与」および「非経口的に投与する」という語句は、腸内および局所投与以外の投与方法、通常、注射であり、静脈内、筋肉内注射、動脈内、髄腔内、嚢内、眼窩内、心臓内、皮内、腹腔内、経気管、皮下、表皮下、関節内、嚢下、くも膜下、脊髄内および胸骨内注射および注入が挙げられるが、これらに限定されない投与方法を意味する。
【0084】
「多環式」または「多環ラジカル」という用語は、2つ以上の炭素が2つの隣接する環(例えば、環は「縮合環」である)に共通している、2つ以上の環のラジカル(例えば、シクロアルキル、シクロアルケニル、シクロアルキニル、アリールおよび/またはヘテロシクリル)を指す。隣接していない原子を介して結合する環は、「架橋」環と呼ばれる。多環の各環は、上記のような置換基、例えば、ハロゲン、ヒドロキシル、アルキルカルボニルオキシ、アリールカルボニルオキシ、アルコキシカルボニルオキシ、アリールオキシカルボニルオキシ、カルボン酸塩、アルキルカルボニル、アルコキシカルボニル、アミノカルボニル、アルキルチオカルボニル、アルコキシル、リン酸塩、ホスホン酸塩、ホスフィン酸塩、シアノ、アミノ(アルキルアミノ、ジアルキルアミノ、アリールアミノ、ジアリールアミノ、およびアルキルアリールアミノを含む)、アシルアミノ(アルキルカルボニルアミノ、アリールカルボニルアミノ、カルバモイルおよびウレイドを含む)、アミジノ、イミノ、スルフヒドリル、アルキルチオ、アリールチオ、チオカルボン酸塩、硫酸塩、スルホナト、スルファモイル、スルホンアミド、ニトロ、トリフルオロメチル、シアノ、アジド、ヘテロシクリル、アルキル、アルキルアリール、または芳香族もしくは複素芳香族部分と置換できる。
【0085】
「真性赤血球増加症」という用語は、骨髄による細胞の過剰産生に起因する血球(原発性赤血球)中の異常増殖を特徴とする疾患を指すことを意味する。
【0086】
「本態性血小板血症」という用語は、骨髄中巨核球による血小板の過剰産生を特徴とする血液障害を指すことを意味する。
【0087】
「原発性骨髄線維症」という用語は、線維性(瘢痕)組織によって骨髄が置換される骨髄障害を指すことを意味する。
【0088】
「プロドラッグ(prodrug)」または「プロドラッグ(pro−drug)」という用語は、インビボで代謝できる部分を有する化合物を含む。通常、プロドラッグはエステラーゼまたは他の機序によりインビボで代謝されて薬剤を活性化する。プロドラッグおよびそれらの使用の例は当技術分野において周知である(例えば、Berge et al. (1977) ”Pharmaceutical Salts”, J. Pharm. Sci.66:1−19を参照されたい)。プロドラッグは、化合物の最終単離および精製中に、または適切なエステル化剤とその遊離酸形態もしくはヒドロキシル中の精製化合物に別々に反応することによりin situ調製できる。ヒドロキシル基はカルボン酸処理を介してエステルに変換できる。プロドラッグ部分の例としては、置換したおよび置換しない、分岐または非分岐低級アルキルエステル部分、(例えば、プロピオン酸エステル)、低級アルケニルエステル、ジ低級アルキルアミノ低級アルキルエステル(例えば、ジメチルアミノエチルエステル)、アシルアミノ低級アルキルエステル(例えば、アセチルオキシメチルエステル)、アシルオキシ低級アルキルエステル(例えば、ピバロイルオキシメチルエステル)、アリールエステル(フェニルエステル)、アリール低級アルキルエステル(例えば、ベンジルエステル)、置換(例えば、メチル、ハロ、またはメトキシ置換基との)アリールおよびアリール低級アルキルエステル、アミド、低級アルキルアミド、ジ低級アルキルアミド、およびヒドロキシアミドが挙げられる。好ましいプロドラッグ部分は、プロピオン酸エステルおよびアシルエステルである。他のインビボ機序を介して活性形態に変換したプロドラッグも含まれる。
【0089】
化合物の「予防的有効量」という言葉は、患者に単回または複数回用量投与時に、本明細書に叙述した障害の予防または治療において有効である、本明細書の任意の式あるいは他に本明細書に記載の本発明の化合物の量を指す。
【0090】
「低下した毒性」という言葉は、本発明の化合物のインビボ投与時に誘発された任意の望ましくない副作用の低下を含むことを意図する。
【0091】
「スルフヒドリル」または「チオール」という用語は、SH基を意味する。
【0092】
「対象」という用語は、Jak2媒介障害を呈しているかあるいは本発明の化合物の投与から便益を受けることができる生物(ヒトおよび非ヒト動物など)を含む。好ましいヒトとしては、Jak2媒介障害、本明細書に叙述した障害、または本明細書に記載の関連状態を呈しているかまたは呈する傾向があるヒト患者が挙げられる。本発明の「非ヒト動物」という用語は、すべての脊椎動物、例えば、哺乳類、例えば、齧歯動物、例えば、マウス、および非哺乳類(非ヒト霊長類、例えば、ヒツジ、イヌ、ウシ、鶏、両生類、爬虫類など)を含む。
【0093】
「Jak2媒介疾患または障害」という用語は、Jak2により媒介されたかもしくはJak2と関連した疾患もしくは障害、またはJak2変異を意味する。
【0094】
「Jak2媒介疾患または障害を呈しやすい」という用語は、Jak2媒介疾患/障害、例えば、Jak2媒介の発現リスクのある対象、すなわち、Jak2媒介疾患/障害を呈している対象、Jak2媒介疾患/障害の家族歴または既往歴を有する対象などを含むことを意味する。
【0095】
本明細書で使用する「全身投与」、「全身に投与した」、「末梢投与」および「末梢に投与した」という語句は、本発明の化合物、薬剤または他の物質を、患者系に入り、したがって代謝および他の過程に供するように投与すること、例えば、皮下投与を意味する。
【0096】
キラル中心の命名法に関して、「d」および「l」配置という用語は、IUPAC推奨により定義されるとおりである。ジアステレオマー、ラセミ体、エピマーおよび鏡像異性体という用語の使用に関して、調製物の立体化学について記載する通常の文脈において使用される。
【0097】
2.化合物
1つの態様では、本発明は、式(I)の化合物またはその医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物を提供し:
【化48】

式中、
R1とR2はそれぞれ独立してH、−(炭素数1〜4)アルキル、−(炭素数2〜8)アルケニル、−(炭素数2〜8)アルキニル、
【化49】

であり、
式中、−(炭素数1〜4)アルキルはさらに1つ以上の水酸基もしくはハロゲンと置換でき;
または
R1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成し、ただしR1とR2は窒素原子と一緒になってピペラジン環を形成し、ピペラジン環上の第二の窒素はさらに−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルと置換でき、ここで−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルは1つ以上の水酸基、ハロゲンもしくは−(炭素数1〜3)アルキルと置換できることを条件とし;
R3はH、−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールであり;
R4はHもしくはR7であり;
R5はH、−(炭素数1〜4)アルキル、−C(CH3)2−R6、もしくはR7であり、ただしR4がHで、R5がR7もしくは−C(CH3)2−R6である場合、およびR5がHもしくは−(炭素数1〜4)アルキルである場合、R4はR7であり、ここでR4とR5は同時にR7となることはできないことを条件とし;
R6はH、−(炭素数1〜4)アルキル、フェニル、もしくは
【化50】

であり
式中、R1とR2は上に定義したとおりであり;
R7は
【化51】

であり;
式中、R8とR9はそれぞれ独立してH、−OH、−O−(炭素数1〜4)アルキル、−CH2−NR1R2であり、式中、R1とR2は上に定義したとおりであり;
R10は各存在において水素、もしくは−(炭素数1〜3)アルキルであり;
R11はH、アシル、トシル、−(炭素数1〜4)アルキル、もしくはアリールであり;
ただし化合物は、以下ではないことを条件とする:
i.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
ii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
iii.5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
iv.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
v.4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
vi.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
vii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
viii.4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)。
【0098】
1つの実施形態では、R10は各存在において独立して水素、メチルまたはエチルである。別の実施形態では、R11はHである。
【0099】
式(I)の化合物のある実施形態では、R3はHである。別の実施形態では、R4とR5の一方はR7である。分離された実施形態では、R7は
【化52】

である。
【0100】
1つの実施形態では、R4はR7である。別の実施形態では、R5はHである。ある実施形態では、R8は−CH2−NR1R2であり、R9は水酸基であり、式中、R1とR2は式(I)で定義される。1つの実施形態では、R10は各存在において独立して水素またはメチルである。別の実施形態では、R1とR2は各存在において独立して−(炭素数1〜4)アルキルである。さらに別の実施形態では、R1とR2は結合している窒素原子と一緒になってピペリジニル、ピロリジニルまたはイミダゾリル環を形成し、式中、R10は各存在において同じである。
【0101】
別の実施形態では、R10はエチルである。さらに別の実施形態では、R1とR2は各存在において独立してエチル、またはイソプロピルである。ある実施形態では、R1とR2は結合している窒素原子と一緒になってピロリジニルまたはイミダゾリル環を形成する。
【0102】
別の実施形態では、R4はHである。ある実施形態では、R5はR7である。1つの実施形態では、R8は水酸基であり、R9は−CH2−NR1R2であり、式中、R1とR2は式(I)で定義される。1つの実施形態では、R10はメチルである。ある実施形態では、R1とR2は各存在において独立して−(炭素数1〜4)アルキルであるか、またはR1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成する。別の実施形態では、R1とR2は独立してプロピルまたはイソプロピルであり、R10がHまたはエチルである場合、R10は各存在において同じである。別の実施形態では、R10がエチルである場合、R1とR2は結合している窒素原子と一緒になってピペリジニル、ピロリジニルまたはイミダゾリル環を形成する。
【0103】
ある実施形態では、化合物は、以下の群((A)群)ならびにそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される:
a)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
b)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
c)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
d)5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
e)5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
f)5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
g)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
h)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;
i)5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
j)5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;
k)5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)2HCl;
l)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
m)5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
n)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
o)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
p)5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
q)5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
r)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
s)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
t)5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
u)5,5−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
v)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
w)4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
x)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
y)5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
z)5,5−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
aa)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
bb)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
cc)4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
dd)4,4−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
ee)5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
ff)5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
gg)5,5−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
hh)4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
ii)4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
jj)4,4−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール)。
【0104】
上に列挙した各化合物名は、化合物のシス異性体とトランス異性体の両方を包含することを意味する。
【0105】
別の実施形態では、本発明は、式(II)の化合物またはその医薬上許容可能な塩、水和物もしくは溶媒和化合物に関し、
【化53】

式中、
R1とR2はそれぞれ独立してH、−(炭素数1〜4)アルキル、−(炭素数2〜8)アルケニル、−(炭素数2〜8)アルキニル、
【化54】

であり、
式中、−(炭素数1〜4)アルキルはさらに1つ以上の水酸基もしくはハロゲンと置換でき;
または
R1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成し、ただしR1とR2は窒素原子と一緒になってピペラジン環を形成し、ピペラジン環上の第二の窒素はさらに−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルと置換でき、ここで−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルは1つ以上の水酸基、ハロゲンもしくは−(炭素数1〜3)アルキルと置換できることを条件とし;
R3はH、−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールであり;
R4はHもしくはR7であり;
R5はH、−(炭素数1〜4)アルキル、−C(CH3)2−R6、もしくはR7であり、ただしR4がHで、R5がR7もしくは−C(CH3)2−R6である場合、およびR5がHもしくは−(炭素数1〜4)アルキルである場合、R4はR7であり、ここでR4とR5は同時にR7となることはできないことを条件とし;
R6はH、−(炭素数1〜4)アルキル、フェニル、もしくは
【化55】

であり、
式中、R1とR2は上に定義したとおりであり;
R7は
【化56】

であり;
式中、R8とR9はそれぞれ独立してH、−OH、−O−(炭素数1〜4)アルキル、−CH2−NR1R2であり、式中、R1とR2は上に定義したとおりであり;
R10は各存在において独立して水素、もしくは−(炭素数1〜3)アルキルであり;
R11はH、アシル、トシル、−(炭素数1〜4)アルキル、もしくはアリールである。
【0106】
特に、本発明は、以下からなるB群の化合物、またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物に関する:4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)、4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)、4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)、5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)、5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)、5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)、5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)、5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)、5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl、5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)2HCl;5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)、4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)、および4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)。
【0107】
特に指定のない限り、本明細書の各化合物の化学名は、化合物のシス異性体とトランス異性体の両方を明示的に包含することを意味する。
【0108】
ある実施形態では、本発明は、以下の群(C群)またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物を提供する:
1)(Z)−および(E)−4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「NB−1」):
【化57】

2)(Z)−および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「NB−2」):
【化58】

3)(Z)−および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「NB−3」):
【化59】

4)(Z)−および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−4」):
【化60】

5)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「NB−5」):
【化61】

6)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−6」):
【化62】

7)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−7」):
【化63】

8)(Z)−および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl(「NB−8」):
【化64】

9)(Z)−および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl(「NB−9」):
【化65】

10)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl(「NB−10」):
【化66】

11)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl(「NB−11」):
【化67】

12)(Z)−および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−12」):
【化68】

13)(Z)もしくは(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−13」):
【化69】

14)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−14」):
【化70】

15)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−15」):
【化71】

;
16)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−16」):
【化72】

;
17)(Z)および(E)−(5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−17」):
【化73】

18)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(モルホリノメチル)フェノール)(「NB−18」):
【化74】

19)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(モルホリノメチル)フェノール)(「NB−19」):
【化75】

20)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−20」):
【化76】

21)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−21」):
【化77】

22)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−(モルホリノメチル)フェノール)(「NB−22」):
【化78】

23)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)(「NB−23」):
【化79】

24)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−24」):
【化80】

25)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−25」):
【化81】

26)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(モルホリノメチル)フェノール)(「NB−26」):
【化82】

27)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)(「NB−27」):
【化83】

28)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)(「NB−28」):
【化84】

29)(Z)および(E)−2−((ジエチルアミノ)メチル)−4−(4−(4−ヒドロキシフェニル)ヘキサ−3−エン−3−イル)フェノール(「NB−29」):
【化85】

30)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ジフェノール(「NB−30」)
【化86】

31)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ジフェノール(「NB−31」):
【化87】

32)(Z)および(E)−3,3−(エテン−1,2−ジイル)ジフェノール(「NB−32」):
【化88】

33)(Z)および(E)−3,3−(ブタ−2−エン−2,3−ジイル)ジフェノール(「NB−33」):
【化89】

34)(Z)および(E)−4,4−(エテン−1,2−ジイル)ジフェノール(「NB−34」):
【化90】

ならびに
35)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「G6」):
【化91】

。
【0109】
1つの実施形態では、化合物は、NB−1、NB−2、NB−3、NB−4、NB−5、NB−6、NB−7、NB−8、NB−9、NB−10、NB−11およびNB−12からなる群((D)群)、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される。
【0110】
さらに別の実施形態では、化合物は式(III)の化合物またはその医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物であり、
【化92】

式中、
R1とR2はそれぞれ独立してH、−(炭素数1〜4)アルキル、−(炭素数2〜8)アルケニル、−(炭素数2〜8)アルキニル、
【化93】

であり、
式中、−(炭素数1〜4)アルキルはさらに1つ以上の水酸基もしくはハロゲンと置換でき;
または
R1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成し、ただしR1とR2は窒素原子と一緒になってピペラジン環を形成し、ピペラジン環上の第二の窒素はさらに−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルと置換でき、ここで−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルは1つ以上の水酸基、ハロゲンもしくは−(炭素数1〜3)アルキルと置換できることを条件とし;
R11はH、アシル、トシル、−(炭素数1〜4)アルキル、もしくはアリールであり;
R4とR5はHもしくはR12であり、ただしR4とR5の一方はH、他方はR12であることを条件とし;
R12は
【化94】

であり、
式中、R4とR5の両方が結合するアリール基はR12の芳香族環の−OR11のメタもしくはパラであることができ;
R10は水素、もしくは−(炭素数1〜3)アルキルであり;
ただし化合物は、以下ではないことを条件とする:
i.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
ii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
iii.5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
iv.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
v.4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
vi.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
vii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
viii.4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)。
【0111】
1つの実施形態では、式(III)のR11は水素である。別の実施形態では、R10は各存在において水素、メチルまたはエチルである。
【0112】
1つの実施形態では、R12は
【化95】

である。
【0113】
式(III)の化合物の1つの実施形態では、R4はR12であり、R5はHである。1つの実施形態では、R4とR5が結合するアリール基はR12の芳香族環の−OR11のメタである。
【0114】
式(III)の化合物の1つの実施形態では、R10は各存在において水素またはメチルである。別の実施形態では、R1とR2は各存在において−(炭素数1〜4)アルキルである。さらに別の実施形態では、R1とR2は結合している窒素原子と一緒になってピペリジニル、ピロリジニルまたはイミダゾリル環を形成し、式中、R10は各存在において同じである。
【0115】
1つの実施形態では、R10はエチルである。別の実施形態では、R1とR2はエチルまたはイソプロピルである。別の実施形態では、R1とR2は結合している窒素原子と一緒になってピロリジニルまたはイミダゾリル環を形成する。
【0116】
ある実施形態では、R4はHであり、R5はR12である。1つの実施形態では、R4とR5が結合するアリール基はR12の芳香族環の−OR11のパラである。
【0117】
1つの実施形態では、R10はメチルである。別の実施形態では、R1とR2は各存在において−(炭素数1〜4)アルキルであるか、またはR1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成する。別の実施形態では、R10がHまたはエチルである場合、R10は各存在において同じであり、R1とR2はプロピルまたはイソプロピルである。別の実施形態では、R10がエチルである場合、R1とR2は結合している窒素原子と一緒になってピペリジニル、ピロリジニルまたはイミダゾリル環を形成する。
【0118】
本明細書の化合物名は、これらの化合物のそれぞれのシス異性体とトランス異性体の両方を明示的に包含することを意味する。
【0119】
1つの実施形態では、化合物は、スチルベンまたはスチルベノイド誘導体である。
【0120】
別の実施形態では、化合物は、(Z)もしくは(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)(「G6」)、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物である。
【0121】
また、本発明の化合物は1つ以上の不斉中心を含んでよく、したがってラセミ体およびラセミ混合物、単一の鏡像異性体、個々のジアステレオマーおよびジアステレオマー混合物として生じてよい。これらの化合物のかかる異性型はすべて明示的に意図される。本発明の化合物は複数の互変異性型でも示され得、かかる場合には、本発明は、本明細書に記載の化合物のすべての互変異性型を明示的に含む。かかる化合物のかかる異性型はすべて明示的に含まれる。本明細書に記載の化合物の結晶形態も含まれる。
【0122】
本発明の化合物は、Jak2−結合活性およびその化合物を用いた方法を(直接的または間接的に)調節(例えば、阻害または刺激)できる。化合物および方法の他の態様は以下を含む、対象はJak2−V617F変異を有することが同定されている;対象はJak2 JH2ドメイン中のK603Q、D620EまたはC644S変異を有することが同定されている;対象はJak2 JH2ドメイン中のK603Q、D620EおよびC644S変異を有することが同定されている;または対象はJak2 JH2ドメイン中のK603Q、D620EおよびC644S変異を有すると同定されており、Jak2−V617F変異を有さないことが同定されている。
【0123】
本発明は、上述した化合物の医薬上許容可能なエステル、塩、溶媒和物、水和物またはプロドラッグにも関する。
【0124】
天然または合成異性体は、当技術分野において知られているいくつかの方法において分離できる。ラセミ混合物の2つの鏡像異性体を分離する方法としては、キラル定常期を用いたクロマトグラフィーが挙げられる(例えば、”Chiral Liquid Chromatography,” W.J. Lough, Ed. Chapman and Hall, New York (1989)を参照されたい)。鏡像異性体は従来の分解技術により分離することもできる。例えば、ジアステレオマー塩の形成および分別晶出を用いて鏡像異性体を分離することができる。カルボン酸の鏡像異性体を分離するため、鏡像異性的に純粋なキラル塩基(ブルシン、キニーネ、エフェドリン、ストリキニーネなど)を追加してジアステレオマー塩を形成できる。あるいは、ジアステレオマーエステルを鏡像異性的に純粋なキラルアルコール(メントールなど)により形成し、続いてジアステレオマーエステルの分離および加水分解により遊離した鏡像異性的に豊富なカルボン酸を得ることができる。アミノ化合物の光学異性体を分離するため、キラルカルボン酸またはスルホン酸(カンファースルホン酸、酒石酸、マンデル酸、または乳酸など)を添加してジアステレオマー塩を形成することができる。
【0125】
本発明の化合物は、様々な方法(このうち一部は当技術分野において知られている)に従い調製できる。本発明の化合物の合成方法を、実施例1に例示する;他の調製方法は当業者にとって明らかであろう。反応状態の最適化方法、必要に応じて、競合副産物を最小限に抑える方法は、当技術分野において知られている。本方法は、最終的に本明細書の化合物を合成するために、本明細書に具体的に記載した工程の前または後のいずれかに工程を追加して適切な保護基を添加または除去してもよい。加えて、所望の化合物を得るために、代替的な配列に様々な合成工程を実施してよい。適切な化合物の合成にとって有用である合成化学形質転換および保護基方法(保護および脱保護)は当技術分野において知られており、例えば、R. Larock, Comprehensive Organic Transformations, VCH Publishers (1989); T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and Sons (1999); L. Fieser and M. Fieser, Fieser and Fiesers Reagents for Organic Synthesis, John Wiley and Sons (1994);およびL. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995)ならびにそれらの続版に記載されている方法が挙げられる。
【0126】
また、本発明は、以下の残基の1つ以上により定義されるJak2キナーゼ結合ポケットと会合または結合する化合物を提供する;GLN14 LEU15 GLY16 LYS17 GLY21 SER22 VAL39 ALA40 VAL41 ARG57 ILE70 ARG86 ILE88 MET89 GLU90 TYR91 LEU92 PRO93 TYR94 GLY95 LEU97 ARG98 ALA138 THR139 ARG140 ILE152 GLY153 ASP154 PHE155、または本明細書に記載の方法にとって有用であるJak2タンパク質−タンパク質結合パートナー結合ポケット(Jak2が生物学的過程または機序を媒介する標的を含む)。1つの態様では、被験化合物とJak2キナーゼドメインとの相互作用は、1つの水素原子結合受容体とGlu90との相互作用および1つの水素原子結合供与体とLeu92との相互作用を含む。いかなる理論にも縛られることを望まず、ある強力なJak2阻害剤の活性に役立つ上でこれらの相互作用は重要であり得ると考えられる。
【0127】
3.本発明の化合物の使用
Jak2対立遺伝子中の体細胞変異は、真性赤血球増加症(PV)と診断された事実上すべての患者、および約50%の本態性血小板血症(ET)および慢性特発性骨髄線維症(CIMF)患者に説明される(Kaushansky, K. Best Pract Res. Clin. Haematol. 2007, 20:5−12)。最も一般的なJak2変異は、コドン617位にてフェニルアラニンのバリンへの置換(V617F)に至る、エクソン12内のヌクレオチド1849位のG→T点変異の結果である。変異は、JAK相同2(JH2)負制御ドメインに位置し、その存在は、正常の細胞増殖を管理する負のフィードバック機序に対して無反応であるJak2キナーゼ活性を上昇する。変異の原因は、レシピエント動物において赤血球増加症および骨髄線維症に至ったマウスのトランスフェクション試験によりインビボで支持されている(Lacout C. et al. Blood 2006, 108: 1652−1660)。追加の体細胞のJak2機能獲得変異が、V617F陰性赤血球増加症患者のエクソン12中で検出されている(Zhang SJ, Int J. Lab. Hematol. 2007, 29:71−72)(PCT特許出願/米国特許第08/007073号も参照されたい、この内容は、参照することにより本明細書に組み込まれる)。
【0128】
本発明者らは、新規Jak2チロシンキナーゼ阻害剤である小分子クラスを見出した。特に、ある実施形態では、Jak2小分子阻害剤は、上に定義した式(II)の化合物、またはそれらの医薬上許容可能な塩、エステル、水和物もしくはその溶媒和化合物である。1つの実施形態では、ある実施形態では、Jak2小分子阻害剤は、式(I)の化合物である。ある実施形態では、阻害剤は、式(III)の化合物である。ある実施形態では、Jak2小分子阻害剤は、上に定義した(A)、(B)、(C)もしくは(D)群の化合物、それらの医薬上許容可能な塩、水和物もしくは溶媒和化合物である。1つの実施形態では、化合物は、(B)群の化合物、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物である。別の実施形態では、化合物は、(C)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。さらに別の実施形態では、化合物は、(D)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。
【0129】
さらに別の実施形態では、化合物は、スチルベンまたはスチルベノイド誘導体である。1つの実施形態では、化合物は、(E)もしくは(Z)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物である。
【0130】
別の態様では、本発明は、有効量の本発明の化合物を対象に投与することによる、対象のJak2媒介疾患または障害(例えば、真性赤血球増加症、本態性血小板血症、特発性骨髄化生)の治療方法を提供する。1つの実施形態では、本発明の化合物は、式(II)の化合物である。別の実施形態では、対象に投与する化合物は、式(I)または(III)の化合物である。
【0131】
ある実施形態では、化合物は、上記の(A)、(B)、(C)もしくは(D)群か、またはそれらの医薬上許容可能な塩、エステル、水和物もしくはその溶媒和化合物から選択される。1つの実施形態では、化合物は、(B)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。別の実施形態では、化合物は、(C)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。さらに別の実施形態では、化合物は、(D)群、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である。
【0132】
さらに別の実施形態では、化合物はスチルベンまたはスチルベノイド誘導体である。別の実施形態では、化合物は、(E)もしくは(Z)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ジエチルアミノ)メチル)フェノール)、またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物である。
【0133】
ある実施形態では、本発明の化合物を、約0.001mg/Kg/日および約200mg/Kg/日の用量で対象に投与する。別の実施形態では、本発明の化合物を、約0.1mg/Kg/日〜約10mg/Kg/日の用量で対象に投与する。1つの実施形態では、本発明の化合物を、約1mg/Kg/日の用量で対象に投与する。
【0134】
本発明の化合物は、本発明の化合物と接触させることができる細胞のJak2またはJak2変異活性を直接的または間接的のいずれかで調節して、疾患もしくは障害過程を阻害するかまたはJak2の代謝的カスケードを調節し得る。本発明の化合物を細胞と接触させることまたは対象に投与することは、不必要なまたは望ましくないJak2またはJak2変異媒介障害を呈しているかまたは呈しやすい細胞または対象を治療する1つの方法である。
【0135】
1つの実施形態では、本発明の化合物は、Jak2自己リン酸化を阻害することにより、Jak2またはJak2変異活性を直接的または間接的のいずれかで調節し得る。別の実施形態では、本発明の化合物はc−SrcまたはTyk2自己リン酸化をJak2自己リン酸化ほど効果的には阻害しない。態様では、化合物は、c−SrcまたはTyk2の自己リン酸化阻害よりも少なくとも2倍、5倍、10倍、25倍、50倍または100倍高いJak2(またはJak2変異)自己リン酸化阻害レベルを示す。
【0136】
ある実施形態では、本発明の方法は、治療有効量の本発明の化合物を、別の製薬的活性化合物と併用して対象に投与することを含む。ある実施形態では、かかる有効量は、約0.001mg/Kg/日〜約200mg/Kg/日、約0.001mg/Kg/日〜約30mg/Kg/日の用量である。別の実施形態では、本発明の化合物を、約0.1mg/Kg/日〜約10mg/Kg/日の用量で対象に投与する。1つの実施形態では、本発明の化合物を、約1mg/Kg/日の用量で対象に投与する。
【0137】
製薬的活性化合物の例としては、増殖性障害を治療することが知られている化合物、例えば、抗癌剤、抗腫瘍剤、抗血管新生薬、化学治療薬、抗体などが挙げられる。使用してよい他の製薬的活性化合物については、Harrisons Principles of Internal Medicine, Thirteenth Edition, Eds. T.R. Harrison et al. McGraw−Hill N.Y., NY;およびthe Physicians Desk Reference 50th Edition 1997, Oradell New Jersey, Medical Economics Co.(これらの完全な内容は、参照することにより本明細書に明示的に組み込まれる)に見出すことができる。本発明の化合物および製薬的活性化合物は、対象に、同じ医薬組成物中で投与してもよいし、異なる医薬組成物中で(同時にまたは異なる時点で)投与してもよい。
【0138】
ある実施形態では、本発明の化合物を既存の抗癌治療薬との併用療法に使用できる。従来の治療投与計画としては、例えば、放射線、薬剤、または両方の併用が挙げられる。放射線に加えて、ビンクリスチン、プレドニゾン、メトトレキサート、メルカプトプリン、シクロホスファミドおよびシタラビンが、通常、互いに併用して、急性白血病を治療するために頻繁に使用される。他の例としては、例えば、本明細書に記載の化合物との併用時に利点(例えば、細胞の化学増感)を示すドキソルビシン、シスプラチン、タキソール、5−フルオロウラシル、エトポシドなどが挙げられる。慢性白血病では、例えば、ブスルファン、メルファラン、およびクロラムブシルを併用使用できる。プロテオソーム阻害剤(例えば、MG−132)、ヒドロキシ尿素(例えば、Hydreaまたはヒドロキシカルバミド)またはキナーゼ阻害剤(例えば、GLEEVEC)も本明細書の化合物との併用に使用できる。従来の抗癌剤のほとんどは毒性が高く、治療施行中に患者の具合を非常に悪化させる傾向がある。積極療法は、すべての癌細胞が破壊されない限り、残りの細胞は増殖して再発を引き起こすという前提に基づいている。
【0139】
本発明の化合物の治療的に有効な抗増殖量または予防的に有効な抗増殖量の決定は、当業者として、医師または獣医(「担当医」)が、既知の技術の使用によりおよび類似状況下で得た結果を観察することにより、容易に行うことができる。投与量は、担当医の判断における患者の必要条件;治療する病状の重症度ならびに使用されている特定の化合物に応じて変更してよい。治療的に有効な抗増殖量もしくは用量、および予防的に有効な抗増殖量または用量の決定において、担当医は、関与する特定の障害;特定の薬剤の薬力学的特性ならびにその投与方法および投与経路;治療の所望の時間経過;哺乳類の種;そのサイズ、年齢、および全身健康;関与する特定の疾患;疾患の関与の程度もしくは重症度;個々の患者の反応;投与した特定の化合物;投与方法;投与した調製物の生物学的利用率の特性;選択された用量投与計画;同時治療の種類(すなわち、他に同時投与した治療薬と本発明の化合物との相互作用);ならびに他の関連状況が挙げられるが、これらに限定されないいくつかの要因を考慮する。
【0140】
治療は、化合物の至適用量未満である低用量で開始できる。その後、その状況下で至適効果に達するまで投与量を漸増してよい。便宜上、総1日投与量は分割してよく、所望の場合は1日に一部投与する。本発明の化合物の治療的有効量および予防的に有効な抗増殖量は、約0.1ミリグラム/キログラム体重/日(mg/kg/日)〜約200mg/kg/日で変わることが予期される。ある実施形態では、かかる投与量は約0.001mg/Kg/日〜約30mg/Kg/日である。別の実施形態では、投与量は約0.1mg/Kg/日〜約10mg/Kg/日である。1つの特定の実施形態では、投与量は約1mg/Kg/日である。
【0141】
動物(例えば、イヌ、鶏、および齧歯動物)における疾患または障害の予防または治療に使用される本発明の化合物は、ヒト腫瘍の治療にも有用であり得る。ヒト腫瘍の治療分野の者は、動物試験で得られたデータに基づき、ヒトに対する化合物の投与量および投与経路を知るであろう。
【0142】
さらに別の態様では、本発明は、本明細書に説明される疾患、障害または症状を対象において治療または予防するために、本明細書の任意の式の化合物を、単独で、または製薬における追加治療薬1つ以上と併用して、単一組成物または分割した投与形態のいずれかで使用することを提供する。本発明の別の態様は、本明細書に叙述した疾患、障害またはその症状を対象において治療または予防するために本明細書の式の化合物を使用する。
【0143】
Jak2媒介障害のための予防的処置を必要とする患者の同定は、十分に当業者の能力および知識内である。主題の方法により治療できるJak2媒介障害発現リスクのある患者の、ある同定方法は、医療分野において理解されている(主題の患者における家族歴、および疾患状態の発現に関連したリスク因子の存在など)。臨床家は、かかる候補患者を、例えば、臨床検査、身体検査および既往歴/家族歴を用いて容易に同定できる。
【0144】
対象における治療の有効性の評価方法は、当技術分野において周知である方法(例えば、Jak2媒介障害が存在する場所での腫瘍サイズの決定または癌マーカーのスクリーニング)により治療前のJak2媒介障害の程度を決定し、次いで治療有効量の本発明による細胞増殖の阻害剤(例えば、本明細書に記載のもの)を対象に投与することを含む。化合物の投与から適切な期間(例えば、1日、1週間、2週間、1ヶ月、6ヶ月)後、Jak2媒介障害範囲を再決定する。ある実施形態は、投与の24〜72時間以内に決定を行うと定める。1つの実施形態では、投与の48時間以内に決定を行うと定める。
【0145】
Jak2媒介障害の程度または侵襲性の調節(例えば、低下)は、治療の有効性を示唆する。Jak2媒介障害の程度または侵襲性は、治療を通して定期的に決定してよい。例えば、Jak2媒介障害の程度または侵襲性は、治療の有効性をさらに評価するために数時間、数日または数週間ごとに確認してよい。Jak2媒介障害の程度または侵襲性の低下は、治療が有効であることを示唆する。記載の方法を用いて、Jak2媒介障害の阻害剤による治療から便益を受け得る患者をスクリーニングまたは選択してよい。
【0146】
本明細書で使用する「対象から生体試料を得る」とは、本明細書に記載の方法における使用のために試料を得ることを含む。生体試料については、上に記載している。
【0147】
さらに別の態様は、Jak2媒介結合パートナーまたはその特異ドメインとの相互作用を調節する化合物を同定する方法を提示する。本方法は、被験化合物の存在および/または不在下で、Jak2媒介結合パートナーもしくはその特異ドメインの結晶構造(任意にアポ形態または複合化)を得ること、またはJak2媒介結合パートナーもしくはその特異ドメインの結晶構造(任意にアポ形態または複合化)に関する情報を得ることを含み得る。次いで、Jak2媒介結合パートナー内もしくは上、またはその特異ドメインの結晶構造の結合部位に化合物をコンピュータモデル化して、Jak2媒介結合パートナーもしくはその特異ドメインと被験化合物との間の相互作用の安定化を予測し得る。いったん潜在的な調節化合物を同定したら、細胞アッセイ、例えば本明細書で同定されたものなど、および当技術分野において知られている競合アッセイ(PCT公開WO2008/153900号も参照されたい、この内容は、参照することにより本明細書に組み込まれる)を用いて、これらの化合物をスクリーニングし得る。このようにして同定された化合物は治療薬として有用である。
【0148】
別の態様では、本明細書の式の化合物を治療的有効量で、医薬上許容可能な担体または希釈剤と共にパッケージ化する。組成物は、Jak2媒介障害を呈しているかまたは呈しやすい対象を治療するために製剤化して、Jak2媒介障害を呈しているかまたは呈しやすい対象を治療する説明書とパッケージ化してよい。
【0149】
別の態様では、本発明は、細胞増殖の阻害方法を提供する。1つの実施形態では、本発明による細胞増殖(またはJak2媒介障害)の阻害方法は、Jak2もしくはJak2媒介結合パートナーまたはその特異ドメインを調節できる化合物と細胞を接触させることを含む。いずれかの実施形態にて、接触は、インビトロで(例えば、細胞を囲む流体、例えば、細胞が生存するかまたは存在する増殖培地へ化合物を添加することにより)行ってよい。接触は、化合物を細胞に直接接触させて行ってもよい。代わりに、接触は、インビボで(例えば、化合物を対象中に通過させることにより)行ってもよい;例えば、投与後、投与経路に応じて、化合物は消化管もしくは血流を介して移動する場合もあり、治療を必要とする細胞に直接適用もしくは投与される場合もある。
【0150】
ある実施形態では、本方法は、本発明の化合物と細胞を24〜72時間接触させることを含む。別の実施形態では、本方法は、本発明の化合物と細胞を、最大48時間接触させることを含む。
【0151】
ある実施形態では、対象のJak2媒介障害の阻害方法は、有効量の本発明の化合物(すなわち、本明細書に記載の化合物)を対象に投与することを含む。投与は、製薬分野において知られているいずれの投与経路によって行ってもよい。対象は、Jak2媒介障害を呈し得るか、Jak2媒介障害発現リスクを呈し得るか、またはJak2媒介障害に対する感受性を上昇できる状態への予測されたもしくは予測されない曝露(例えば、発癌性物質または電離性放射線への曝露)前に予防治療が必要であり得る。
【0152】
対象は、Jak2媒介障害リスクを呈している場合もあり、Jak2媒介障害の症状を示している場合もあり、Jak2媒介障害を呈しやすい場合もあり、および/またはJak2媒介障害と診断されている場合もある。
【0153】
状態の調節によって対象が治療に対して良好な臨床反応を示し得ることが示唆される場合、対象は化合物で治療し得る。例えば、化合物の治療的有効量(1回または複数回)を対象に投与できる。
【0154】
本方法は、培養細胞上(例えばインビトロもしくはエクスビボ)で実施することも、動物対象に存在する細胞上(例えば、インビボ)で実施することもできる。本発明の化合物は、増殖細胞の一次培養、例えば、変換細胞、腫瘍細胞系などを用いて最初にインビトロ試験することができる。
【0155】
別の態様では、本明細書の方法は、以下を含む:本発明の化合物を、Jak2媒介疾患もしくは障害の治療または予防のために対象に投与すること;または本発明の化合物を、Jak2依存性細胞増殖を低減するために対象に投与すること;本発明の化合物を、血液疾患もしくは障害を治療するために対象に投与すること;本発明の化合物を、癌を治療するために対象に投与すること。
【0156】
本明細書に叙述した方法は、特記した治療を必要とする対象の同定を含む。かかる治療を必要とする対象の同定は、対象の判断であることも、医療専門家の判断であることもでき、主観的(例えば意見)であることも、客観的(例えば検査または診断方法により測定可能)であることもできる。他の方法では、対象を前スクリーニングし、またはかかる治療の関連マーカーもしくは適性指標を評価することによりかかる治療を必要とすることを同定する。
【0157】
本方法は、培養細胞上(例えばインビトロもしくはエクスビボ)で実施することも、動物対象に存在する細胞上(例えば、インビボ)で実施することもできる。本発明の化合物は、細胞または他の哺乳類もしくは非哺乳類動物モデルを用いて最初にインビトロ試験することができる。あるいは、本発明の化合物の効果は、動物モデルを用いてインビボで特性化することができる。
【0158】
4.医薬組成物
本発明は、有効量の本発明の化合物および医薬上許容可能な担体を含む医薬組成物も提供する。さらなる実施形態では、有効量は、先に記載のJak2媒介疾患または障害を治療するために有効である。
【0159】
1つの実施形態では、医薬上許容可能な製剤、例えば、医薬上許容可能な製剤を対象に投与後、少なくとも12時間、24時間、36時間、48時間、1週間、2週間、3週間、または4週間持続した本発明の化合物の送達を対象に提供する医薬上許容可能な製剤を用いて、本発明の化合物を対象に投与する。
【0160】
ある実施形態では、これらの医薬組成物を対象に適切に局所または経口投与する。他の実施形態では、以下に詳述するとおり、本発明の医薬組成物は固体または液体形態での投与用に特別に製剤化してよく、それらは以下に適応させたものを含む:(1)経口投与、例えば、水薬(水溶液もしくは非水溶液または懸濁液)、錠剤、巨丸剤、粉末、顆粒剤、ペースト;(2)非経口投与、例えば、皮下、筋肉内注射もしくは静脈内注射、例えば、滅菌溶液もしくは懸濁液;(3)局所適用、例えば、皮膚に適用するためのクリーム、軟膏もしくはスプレー;(4)膣内もしくは直腸内、例えば、ペッサリー、クリームもしくは発泡体;または(5)エアロゾル、例えば、水性エアロゾル、リポソーム調製物もしくは固体粒子で化合物を含むもの。
【0161】
「医薬上許容可能な」という語句は、健全な医療判断の範囲内で、ヒトおよび動物組織との接触に使用する上で適し、過度の毒性、刺激、アレルギー反応、または他の問題もしくは合併症なく、妥当な利益/リスク比相応の本発明の化合物、本発明の化合物を含む組成物および/または投与形態を指す。
【0162】
「医薬上許容可能な担体」という語句は、ある臓器または身体の一部から、別の臓器または身体の一部への対象化学物質の運搬または輸送に関与する医薬上許容可能な物質、組成物またはビヒクル(液体または固体充填剤、希釈剤、賦形剤、溶媒または封入物質など)を含む。各担体は、製剤の他の成分と適合し、患者に有害ではないという意味で「許容可能」である。医薬上許容可能な担体として役立ち得る物質の一部の例としては、以下が挙げられる:(1)糖(ラクトース、グルコースおよびスクロースなど);(2)澱粉(トウモロコシ澱粉およびジャガイモ澱粉など);(3)セルロース、およびその誘導体(ナトリウムカルボキシメチルセルロース、エチルセルロースおよび酢酸セルロースなど);(4)粉末トラガカント;(5)麦芽;(6)ゼラチン;(7)タルク;(8)賦形剤(カカオ脂および坐剤用ワックスなど);(9)油(落花生油、綿実油、紅花油、ゴマ油、オリーブ油、トウモロコシ油および大豆油など);(10)グリコール(プロピレングリコールなど);(11)ポリオール(グリセリン、ソルビトール、マンニトールおよびポリエチレングリコールなど);(12)エステル(エチルオレエートおよびエチルラウラートなど);(13)寒天;(14)緩衝剤(水酸化マグネシウムおよび水酸化アルミニウムなど);(15)アルギン酸;(16)発熱性物質を含まない水;(17)等張生理食塩水;(18)リンガー溶液;(19)エチルアルコール;(20)リン酸緩衝液;ならびに(21)医薬製剤に使用される他の無毒な適合性のある物質。
【0163】
湿潤剤、乳化剤および滑沢剤(ラウリル硫酸ナトリウムおよびステアリン酸マグネシウムなど)、ならびに着色剤、放出剤、コーティング剤、甘味料、香味剤および香料、保存剤および抗酸化剤も組成物に存在することができる。
【0164】
医薬上許容可能な抗酸化剤の例としては、(1)水溶性の抗酸化剤(アスコルビン酸、塩酸システイン、重硫酸ナトリウム、メタ重亜硫酸ナトリウム、亜硫酸ナトリウムなど);(2)油溶性の抗酸化剤(アスコルビン酸パルミテート、ブチルヒドロキシアニソール(BHA)、ブチルヒドロキシトルエン(BHT)、レクチン、プロピルガラート、アルファ−トコフェロールなど);ならびに(3)金属キレート剤(クエン酸、エチレンジアミン四酢酸(EDTA)、ソルビトール、酒石酸、リン酸など)が挙げられる。
【0165】
本発明の化合物を含む組成物としては、経口、経鼻、局所(口腔および舌下を含む)、直腸、膣、エアロゾルおよび/または非経口投与に適したものが挙げられる。組成物は都合よく単位投与形態であってよく、薬学の分野において周知である任意の方法により調製してよい。担体物質と併用して単一投与形態を形成することができる活性成分量は、治療対象の宿主、特定の投与方法に応じて変更されるであろう。担体物質と併用して単一投与形態を形成することができる活性成分量は通常、治療効果を生じる化合物量であるだろう。通常、この量は、100パーセント中、約1パーセント〜約99パーセントの活性成分、例えば、約5パーセント〜約70パーセント、例えば、約10パーセント〜約30パーセントの範囲であろう。
【0166】
これらの組成物の調製方法は、本発明の化合物を、担体および、任意に1つ以上の付帯成分と結合させる工程を含む。一般的に、製剤は、一様におよび本質的に、本発明の化合物を、液体担体もしくは細分化した固体担体またはその両方と結合させ、次いで、必要に応じて、製品を造形することにより調製する。
【0167】
経口投与に適切な本発明の組成物は、カプセル、カシェ剤、丸剤、錠剤、薬用ドロップ(香味付けた基礎原料、通常スクロースおよびアラビアゴムもしくはトラガカントを使用)、粉末、顆粒剤、または水性もしくは非水性液体での溶液もしくは懸濁液として、または水中油型もしくは油中水型乳剤として、またはエリキシル剤もしくはシロップ剤として、またはトローチ(不活性な基礎材料、例えば、ゼラチンおよびグリセリン、またはスクロースおよびアラビアゴムなどを使用)および/または口内洗浄剤などでよく、各々は所定量の本発明の化合物を活性成分として含む。化合物は巨丸剤、舐剤またはペーストとして投与してもよい。
【0168】
本発明の経口投与用の固体投与形態(カプセル、錠剤、丸剤、糖衣錠、粉末、顆粒剤など)において、活性成分は、1つ以上の医薬上許容可能な担体(クエン酸ナトリウムまたはリン酸二カルシウムなど、および/または下記のいずれか)と混合する:(1)充填剤またはエキステンダー(澱粉、ラクトース、スクロース、グルコース、マンニトール、および/またはケイ酸など);(2)結合剤(例えば、カルボキシメチルセルロース、アルギナート、ゼラチン、ポリビニルピロリドン、スクロースおよび/またはアラビアゴムなど);(3)保湿剤(グリセロールなど);(4)崩壊剤(寒天、炭酸カルシウム、ジャガイモまたはタピオカ澱粉、アルギン酸、あるシリカート、および炭酸ナトリウムなど);(5)溶液緩染剤(パラフィンなど);(6)吸収促進剤(四級アンモニウム化合物など);(7)湿潤剤(例えば、アセチルアルコールおよびグリセロールモノステアレートなど);(8)吸収剤(カオリンおよびベントナイト白土など);(9)滑沢剤(タルク、ステアリン酸カルシウム、ステアリン酸マグネシウム、固体ポリエチレングリコール、ラウリル硫酸ナトリウム、およびそれらの混合物など);ならびに(10)着色剤。カプセル、錠剤および丸剤の場合は、医薬組成物は緩衝剤を含んでもよい。類似の種類の固体組成物も、軟および硬ゼラチンカプセルにおける充填剤として、ラクトースまたは乳糖、ならびに高分子量ポリエチレングリコールなどの賦形剤を使用してよい。
【0169】
錠剤は、加圧またはモールディングにより、任意に1つ以上の付帯成分と共に作製してよい。加圧された錠剤は、結合剤(例えば、ゼラチンまたはヒドロキシプロピルメチルセルロースなど)、滑沢剤、不活性希釈剤、保存剤、崩壊剤(例えば、ナトリウム澱粉グリコーレートまたは架橋結合ナトリウムカルボキシメチルセルロース)、界面活性剤または分散剤を用いて調製してよい。成形した錠剤は、適切な機械において不活性液体希釈剤で示させた粉末活性成分の混合物をモールディングすることにより作製してよい。
【0170】
本発明の医薬組成物の錠剤および他の固体投与形態(糖衣錠、カプセル、丸剤および顆粒剤など)は、任意にコーティングおよび外殻(腸溶コーティングおよび医薬製剤技術の分野において周知である他のコーティングなど)によりスコアしてもよいし調製してもよい。それらはまた、活性成分の徐放または制御放出を提供するように製剤化してもよく、その場合、例えば、ヒドロキシプロピルメチルセルロースが所望の放出プロファイルを提供するように割合を変えて使用してもよく、他の重合体マトリックス、リポソームおよび/またはミクロスフィアが使用されてもよい。それらは、例えば、細菌保持フィルターを介した濾過により滅菌してもよく、使用直前に滅菌水または他の一部の滅菌注射用媒体に溶解できる滅菌固体組成物の形態に滅菌剤を組み込むことにより滅菌してもよい。これらの組成物はまた、任意に乳白剤を含んでもよく、任意に遅延化した方法で活性成分(1つまたは複数)を消化管のある部分のみにまたは消化管のある部分に選択的に放出する組成物であってもよい。使用できる包埋用組成物の例としては、重合体物質およびワックスが挙げられる。活性成分は、適切な場合、1つ以上の上記の賦形剤と共にマイクロカプセル形態に封入することもできる。
【0171】
本発明の化合物の経口投与用の液体投与形態としては、医薬上許容可能なエマルジョン、マイクロエマルジョン、溶液、懸濁液、シロップおよびエリキシル剤が挙げられる。活性成分に加えて、液体投与形態は当技術分野において一般的に使用される不活性希釈剤(例えば、水または他の溶媒など)、可溶化剤および乳化剤(エチルアルコール、イソプロピルアルコール、炭酸エチル、酢酸エチル、ベンジルアルコール、安息香酸ベンジル、プロピレングリコール、1,3−ブチレングリコール、油(特に、綿実油、落花生油、トウモロコシ油、胚芽油、オリーブ油、ヒマシ油およびゴマ油)、グリセロール、テトラヒドロフリルアルコール、ポリエチレングリコールおよびソルビタン脂肪酸エステル、ならびにそれらの混合物など)を含んでよい。
【0172】
不活性希釈剤に加えて、経口組成物はまた、補助剤(湿潤剤、乳化剤および懸濁剤、甘味料、香味剤、着色剤、香料および保存剤など)を含んでもよい。
【0173】
懸濁液は、本発明の活性化合物に加えて、懸濁剤(例えば、エトキシル化イソステアリルアルコール、ポリオキシエチレンソルビトールおよびソルビタンエステル、微結晶性セルロース、メタ水酸化アルミニウム、ベントナイト、寒天およびトラガカント、ならびにそれらの混合物を含んでよい。
【0174】
本発明の直腸投与または膣投与用の医薬組成物は坐剤として存在してよく、これは本発明の化合物を1つ以上混合して、1つ以上の適切な非刺激性の賦形剤または担体(例えば、カカオ脂、ポリエチレングリコール、坐剤用ワックスまたはサリチル酸塩を含む)と調製してもよく、室温で固体だが体温で液体であるため直腸または膣腔内で融解して活性薬剤を放出する。
【0175】
膣投与に適切な本発明の組成物としては、ペッサリー、タンポン、クリーム、ゲル、ペースト、発泡体またはスプレー製剤も挙げられ、当技術分野において知られている適切な担体を含んでよい。
【0176】
本発明の化合物の局所または経皮投与用の投与形態としては、粉末、スプレー、軟膏、ペースト、クリーム、ローション、ゲル、溶液、パッチおよび吸入剤が挙げられる。本発明の活性化合物は、滅菌条件下で、医薬上許容可能な担体と、および必要であり得るいずれかの保存剤、緩衝剤、または推進剤と混合してよい。
【0177】
軟膏、ペースト、クリームおよびゲルは、本発明の化合物に加えて、賦形剤(動物脂および植物脂、油、ワックス、パラフィン、澱粉、トラガカント、セルロース誘導体、ポリエチレングリコール、ケイ素樹脂、ベントナイト、ケイ酸、タルクおよび酸化亜鉛、またはそれらの混合物など)を含んでよい。
【0178】
粉末およびスプレーは、本発明の化合物に加えて、賦形剤(ラクトース、タルク、ケイ酸、水酸化アルミニウム、ケイ酸カルシウムおよびポリアミド粉末、またはこれらの物質の混合物など)を含むことができる。追加的に、スプレーは、慣習的な推進剤、例えば、クロロフルオロ炭化水素、揮発性の置換しない炭化水素(ブタンおよびプロパンなど)などを含むことができる。
【0179】
本発明の化合物は代替的にエアロゾルにより投与できる。これは、化合物を含む水性エアロゾル、リポソーム調製物または固体粒子を調製することにより達成する。非水性(例えば、フッ化炭素推進剤)懸濁液を使用できる。化合物の減成に至り得る剪断薬への曝露を最小限に抑えるため、音波噴霧器が好ましい。
【0180】
通常、水性エアロゾルは、従来の医薬上許容可能な担体および安定剤と共に薬剤の水溶液または懸濁液を製剤化することにより作製する。担体および安定剤は特定の化合物の必要条件によって異なるが、典型的には、非イオン性界面活性剤(Tweens、Pluronics、またはポリエチレングリコール)、無害なタンパク質、例えば、血清アルブミン、ソルビタンエステル、オレイン酸、レクチン、アミノ酸(グリシンなど)など、緩衝剤、塩、糖または糖アルコールを含む。エアロゾルは通常、等張液から調製する。
【0181】
経皮的パッチは、本発明の化合物の体内に制御して送達する付加的な利点を有し得る。かかる投与形態は、薬剤を適切な媒体に溶解または分散することにより調製し得る。吸収増進剤も使用して皮膚を経て活性成分の流動を増大することができる。かかる流動の速度は、速度制御膜を提供すること、または重合体マトリックスもしくはゲルに活性成分を分散することのいずれかにより制御できる。
【0182】
眼科用製剤、眼軟膏、粉末、溶液などもまた、本発明の範囲内であると意図される。
【0183】
本発明の適切な非経口投与のための医薬組成物は、1つ以上の本発明の化合物を1つ以上の医薬上許容可能な滅菌等張性水溶液または非水溶液、分散液、懸濁液またはエマルジョン、または使用直前に滅菌注射液または分散液に対して再構成され得る滅菌粉末と併用して含んでよく、抗酸化剤、緩衝剤、静菌剤、製剤を目的のレシピエントの血液と等張にする溶質、または沈殿防止剤または増粘剤を含んでもよい。
【0184】
本発明の医薬組成物において適用してよい適切な水性および非水性担体の例としては、水、エタノール、ポリオール(グリセロール、プロピレングリコール、ポリエチレングリコールなど)、およびそれらの適切な混合物、植物油(オリーブ油など)、ならびに注射用の有機エステル(エチルオレエートなど)が挙げられる。適切な流動性を、例えば、コーティング物質(レクチンなど)の使用により、分散液の場合は必要な粒子サイズの維持により、および界面活性剤の使用により維持することができる。
【0185】
これらの組成物は、補助剤(保存剤、湿潤剤、乳化剤および分粉末など)を含んでもよい。微生物の活動の防止は、様々な抗菌剤および抗真菌剤、例えば、パラベン、クロロブタノール、フェノールソルビン酸などを含むことにより確保し得る。等張剤(糖、塩化ナトリウムなど)を組成物に含めることも望ましい場合がある。加えて、持続性吸収型の注射用の製薬学的形態は、吸収を遅らせる薬剤(モノステアリン酸アルミニウムおよびゼラチンなど)を含めることによりもたらし得る。
【0186】
ある場合には、薬剤の効果を延長するために、皮下注射または筋肉内注射からの薬剤の吸収を緩慢化することが望まれる。これは、水溶性に乏しい結晶または非晶物質の液体懸濁液を用いることにより達成し得る。薬剤の吸収速度は溶解速度に依存し、順に、結晶サイズおよび結晶形態に依存し得る。あるいは、非経口投与した薬剤形態の遅延化した吸収は、油ビヒクル中に薬剤を溶解または懸濁することにより達成される。
【0187】
注射用デポ形態は、生分解性の重合体(ポリラクチド−ポリグリコリドなど)中に本発明の化合物のマイクロカプセルマトリックスを形成することにより作製される。重合体に対する薬剤の比率、および使用した特定の重合体の性質に応じて、薬剤の放出速度が制御され得る。他の生分解性重合体の例としては、ポリ(オルトエステル)およびポリ(アンヒドライド)が挙げられる。注射用デポ製剤はまた、薬剤を体組織と適合するリポソームまたはマイクロエマルジョンに封入することによっても調製される。
【0188】
本発明の化合物をヒトおよび動物に医薬品として投与時、それらは、それ自体で、または、例えば、0.1〜99.5%(より好ましくは、0.5〜90%)の活性成分を医薬上許容可能な担体と併用して含む医薬組成物として投与できる。
【0189】
選択された投与経路に関わらず、適切な水和形態に使用し得る本発明の化合物および/または本発明の医薬組成物は、当業者に知られている従来の方法により医薬上許容可能な投与形態に製剤化し得る。
【0190】
本発明の医薬組成物における活性成分の投与の実際の投与量レベルおよび時間経過は、特定の患者、組成物、および投与方法において、患者に対して毒性なく、所望の治療反応を達成するために有効な活性成分量を得るために変更してよい。ある実施形態では、活性成分投与の時間経過は、24〜72時間である。1つの実施形態では、投与の時間経過は、最大48時間である。
【0191】
本発明の化合物の好ましい用量は、患者が忍容でき重篤な副作用を発現しない最大量である。例えば、本発明の化合物は、約0.001mg〜約200mg/kg体重、約0.001〜約30mg/kgまたは約0.1mg〜約10mg/kg体重の濃度で投与する。上に列挙した値の中間範囲も本発明の一部であることを意図する。特定の例では、本発明の化合物は、約1mg/Kg/日の用量で投与する。
【0192】
6.スクリーニング方法およびシステム
別の態様では、本発明は、本明細書で同定された結合ポケットのいずれか一方または両方の構造座標、または同様に造形された相同結合ポケットを含む機械可読記憶媒体を提供する。これらのデータをコード化したかかる記憶媒体は、コンピュータスクリーンまたは類似の視聴機器でかかる結合ポケットを含む分子もしくは分子複合体の3次元グラフィカル描写を表示できる。
【0193】
本発明は、前述の結合ポケットに結合する化合物の設計、評価および同定方法も提供する。したがって、コンピュータは、結合ポケットを含む分子もしくは分子複合体の3次元グラフィカル構造を産生する。
【0194】
別の実施形態では、本発明は、Jak2もしくはそのドメイン、または分子もしくは分子複合体のホモログの3次元描写の構造座標により定義される分子もしくは分子複合体の3次元描写を産生するコンピュータを提供し、ここでホモログは、アミノ酸の骨格原子からの標準偏差が2.0以下(より好ましくは1.5以下)のオングストロームである結合ポケットを含む。
【0195】
例示的な実施形態では、コンピュータまたはコンピュータシステムは、例えば、米国特許第5,978,740号および/または同第6,183,121号(参照することにより本明細書に組み込まれる)に開示されている、当技術分野における従来の構成要素を含むことができる。例えば、コンピュータシステムは、中央処理装置(「CPU」)、作業記憶(例えば、RAM(ランダムアクセスメモリ)または「磁心」記憶装置であり得る)、大容量記憶装置(1つ以上のディスクドライブまたはCD−ROMドライブなど)、1つ以上のブラウン管(CRT)もしくは液晶表示装置(LCD)表示末端、1つ以上のキーボード、1つ以上の入力系統、ならびに1つ以上の出力系統(これらがすべて従来のシステムバスにより相互接続する)を含むコンピュータを含むことができる。
【0196】
本発明の機械可読なデータを、データ系統により接続したモデム(1つまたは複数)の使用を介してコンピュータに入力し得る。代替的にまたは追加的に、入力ハードウェアは、CD−ROMドライブ、ディスクドライブまたはフラッシュメモリを含んでよい。表示末端と連結して、キーボードも入力機器として使用してよい。
【0197】
出力系統によりコンピュータに接続した出力ハードウェアも同様に従来の機器に実装してよい。例として、出力ハードウェアは、プログラム(QUANTAまたはPYMOLなど)を用いて、本発明の結合ポケットのグラフィカル描写を表示するためのCRTまたはLCD表示末端を含んでよい。出力ハードウェアは、プリンター、または後の使用のためにシステム出力を記憶するディスクドライブも含み得る。
【0198】
処理において、CPUは様々な入力および出力機器の使用を調整し、大容量記憶からのデータアクセスおよび作業記憶の往復アクセスを調整し、ならびに一連のデータプロセス工程を決定する。いくつかのプログラムを、本発明の機械可読なデータ(市販のソフトウェアを含む)をプロセスするために使用してよい。
【0199】
本発明による機械可読なデータ記憶用の磁気記憶媒体は従来のものであることができる。磁気データ記憶媒体は、システム(上記のコンピュータシステムなど)により実行できる機械可読なデータでコード化できる。媒体は、従来のものであり得る適切な基質を有し、片面または両面にやはり従来のものであり得る適切なコーティングを施し、極性または配向を磁気的に改変できる磁気ドメインを含む従来のフロッピー(登録商標)ディスクまたはハードディスクであることができる。媒体は、ディスクドライブまたは他のデータ記憶機器の軸を受け入れるための開口部(示されない)も有し得る。
【0200】
媒体の磁気ドメインは、システム(本明細書に記載のコンピュータシステムなど)による実行のため、従来の機械可読データ(本明細書に記載のものなど)であり得る方法でコード化するように極性化または配向されている。
【0201】
光学読み取り可能なデータ記憶媒体は、機械可読なデータまたは一連の説明書でコード化することもでき、これはコンピュータシステムにより実行可能である。媒体は、従来の読み出し専用記憶装置のコンパクトディスク(CD−ROM)または書換え可能な媒体(光学読み取りかつ光磁気書き込み可能な光磁気ディスクなど)であることができる。
【0202】
CD−ROMの場合、周知のとおり、ディスクコーティングは反射性であり、機械可読なデータをコード化する複数のピットを刻印している。ピット配置はコーティング表面のレーザー光を反射させることにより読み込まれる。(好ましくは実質的に透明である)保護コーティングが反射コーティングの上面に提供される。
【0203】
光磁気ディスクの場合は、周知のとおり、データ記録コーティングにはピットはないが、レーザーによりある温度を超えて熱した際、極性または配向が磁気的に変化し得る複数の磁気ドメインを有する。ドメインの配向は、コーティングからレーザー光反射した偏光を測定することにより読み込むことができる。ドメイン配置は上記データをコード化する。
【0204】
結合ポケットを含む分子もしくは分子複合体の3次元構造に座標を移すソフトウェアによるコンピュータプログラム化と連動して使用時、様々な目的(創薬など)のために構造データを用いてよい。
【0205】
例えば、データによりコード化される構造は、化学実体と結合するその能力について計算的に評価し得る。Jak2の結合ポケットまたはその特異ドメインと結合する化学実体は潜在的な薬剤候補である。あるいは、データによりコード化される構造は、コンピュータスクリーン上のグラフィカルな3次元描写において表示し得る。これにより、構造の目視検査、ならびに化学実体と結合した構造の目視検査が可能となる。
【0206】
したがって、別の実施形態により、本発明は、a)Jak2の結合ポケットもしくはその特異ドメインを含む分子もしくは分子複合体、またはb)分子もしくは分子複合体のホモログであり、アミノ酸の骨格原子からの標準偏差が2.0(より好ましくは1.5)以下のオングストロームである結合ポケットを含むホモログ、と結合する化学実体の可能性の評価方法に関する。
【0207】
この方法は、以下の工程を含む:
i)計算方法を用いて、化学実体と分子もしくは分子複合体の結合ポケットとの間の適合処理を実施する工程;ならびに
ii)適合処理の結果を分析し、化学実体と結合ポケットとの間の結合を定量化する工程。本明細書で使用する「化学実体」という用語は、化学化合物、少なくとも2つの化学化合物の複合体、ならびにかかる化合物もしくは複合体の断片を指す。
【0208】
本発明によるJak2に結合するかもしくはJak2を阻害する化合物、またはその特異ドメイン結合ポケットの設計には通常、いくつかの要因が考慮される。第一に、実体は、一部またはすべてのJak2結合部位またはその特異ドメイン関連結合ポケットと物理的かつ構造的に結合できなければならない。この結合において重要である非共有結合分子相互作用としては、水素結合、ファンデルワールス相互作用、疎水性相互作用および静電相互作用が挙げられる。第二に、実体は、Jak2またはその特異ドメイン関連結合ポケット(1つまたは複数)と直接結合できる立体構造を想定できなければならない。実体のある部分はこれらの結合に直接関与しないが、実体のそれらの部分は依然として分子全体の立体構造に影響を与え得る。これは、次に、効能に対して著しい衝撃を与え得る。かかる立体構造的な必要条件としては、結合ポケットのすべてもしくは一部と会合する化学実体の全体の3次元構造および配向、または結合ポケットもしくはそのホモログと直接相互作用するいくつかの化学実体を含む実体の官能基間の空間を含む。
【0209】
コンピュータモデリング技術を用いて、実際の合成および試験前に、Jak2またはその特異ドメイン関連結合ポケット上の化学実体の潜在的阻害または結合効果を分析してよい。所定の実体の理論的構造によって、それと標的結合ポケットとの間の相互作用および結合が不十分であることが暗示される場合、実体の試験は不要となる。しかしながら、コンピュータモデリングによって強い相互作用が示唆される場合、分子を合成して、結合ポケットへの結合能を試験し得る。これは、例えば、Jak2またはその特異ドメイン活性を分子が阻害する能力を、例えば、本明細書に記載のアッセイまたは当技術分野において知られているアッセイを用いて試験することにより達成し得る。このようにして、無効な化合物の合成を回避し得る。
【0210】
Jak2の潜在的阻害剤またはその特異ドメイン関連結合ポケットは、化学実体または断片がJak2またはその特異ドメイン関連結合ポケットと結合する能力をスクリーニングおよび選択する一連の工程を用いて計算的に評価してよい。
【0211】
当業者は、化学実体または断片のJak2またはその特異ドメイン関連結合ポケットと結合する能力をスクリーニングするためにいくつかの方法の1つを使用してよい。この過程は、Jak2結合部位、または本明細書に記載のその特異ドメイン構造座標、または機械可読な記憶媒体から生成された類似形を定義する他の座標に基づき、コンピュータスクリーン上で、例えば、Jak2またはその特異ドメイン関連結合ポケットの目視検査により開始し得る。次いで、選択した断片または化学実体を上記に定義される結合ポケット内の様々な配向、または結合内に配置し得る。結合は、ソフトウェア(QuantaおよびDOCKなど)を用いて、その後、標準的な分子力学力場のエネルギー最小化および分子動力学(CHARMMおよびAMBERなど)により達成し得る。
【0212】
(例えば、当技術分野において知られているおよび/または市販のおよび/または本明細書に記載の)特化コンピュータプログラムも断片または化学実体の選択過程を補助し得る。
【0213】
いったん適切な化学実体または断片を選択したら、それらは単一の化合物または複合体中に会合させることができる。会合前に、コンピュータスクリーン上に表示される3次元画像上で、標的結合ポケットの構造座標に関連する断片の相互関係の目視検査を行ってよい。
【0214】
上記のように結合ポケット阻害剤を段階的に、1つの断片または化学実体を一度に製造する工程に進む代わりに、阻害剤または他の結合化合物を、空の結合部位を用いるかまたは任意に既知の阻害剤(1つまたは複数)のいくつかの部分(1つまたは複数)を含んで全体としてまたは「新規(de novo)」で設計してよい。当技術分野において知られている多くの新規(de novo)リガンド設計方法があり、このうち一部は、市販されている(例えば、Tripos Associates, St. Louis, Mo.から入手可能なLeapFrog)。
【0215】
他の分子モデリング技術も本発明に従い使用してよい[例えば、N. C. Cohen et al., ”Molecular Modeling Software and Methods for Medicinal Chemistry, J. Med. Chem., 33, pp. 883−894 (1990)を参照されたい; M. A. Navia and M. A. Murcko, ”The Use of Structural Information in Drug Design”, Current Opinions in Structural Biology, 2, pp. 202−210 (1992); L. M. Balbes et al., ”A Perspective of Modern Methods in Computer−Aided Drug Design”, in Reviews in Computational Chemistry, Vol. 5, K. B. Lipkowitz and D. B. Boyd, Eds., VCH, New York, pp. 337−380 (1994)も参照されたい; W. C. Guida, ”Software For Structure−Based Drug Design”, Curr. Opin. Struct. Biology,, 4, pp. 777−781 (1994)も参照されたい]。
【0216】
いったん化合物を設計または選択したら、結合ポケットに結合し得る実体の有効性を試験して計算評価により最適化してよい。
【0217】
化合物の変形エネルギーおよび静電相互作用を評価するために、当技術分野において特定のコンピュータソフトウェアが利用可能である。かかる使用のために設計されたプログラムの例としては、AMBER;QUANTA/CHARMM(Accelrys, Inc., Madison, WI)などが挙げられる。これらのプログラムは、例えば、市販のグラフィカルなワークステーションを用いて実装してよい。他のハードウェアシステムおよびソフトウェアパッケージは当業者に知られるであろう。
【0218】
別の技術としては、例えば、本明細書に記載の化合物の仮想ライブラリーのシリコンスクリーニングが挙げられる。何千もの化合物を迅速にスクリーニングして、最高仮想化合物を、(例えば、合成およびインビトロ試験により)さらなるスクリーニングのために選択することができる。小分子データベースは、Jak2ドメイン、またはその結合ポケットの特異ドメインについてスクリーニングできる。このスクリーニングでは、かかる実体の結合部位に対する適合の質を、形の相補性、または推定した相互作用エネルギーのいずれかにより判断してよい。
【0219】
7.キット
本発明は、キットも特徴とする。キットには、Jak2活性を調節できる化合物が含まれる。本発明の任意の化合物、または1つ以上の化合物を本発明のキットに含むことができる。1つの態様では、キットは上に定義した式(II)の化合物、またはその医薬製剤が含まれる。ある実施形態では、キットには上に定義した式(I)もしくは(III)の化合物、またはその医薬製剤が含まれる。1つの実施形態では、キットには上に定義した(A)、(B)、(C)、もしくは(D)群の化合物、またはそれらの医薬製剤が含まれる。1つの実施形態では、キットにはスチルベンまたはスチルベノイド誘導体である化合物が含まれる。
【0220】
別の実施形態では、キットは上に定義した(B)群の化合物、またはそれらの製薬上の塩、エステル、溶媒和化合物もしくはプロドラッグを含む。別の実施形態では、キットは上に定義した(D)群の化合物、またはそれらの製薬上の塩、エステル、溶媒和化合物もしくはプロドラッグを含む。さらに別の実施形態では、キットは上に定義したG6化合物、またはその製薬上の塩、エステル、溶媒和化合物もしくはプロドラッグを含む。
【0221】
ある実施形態では、キットは本発明の化合物を約0.001mg/Kg/日〜約200mg/Kg/日、または約0.001mg/Kg/日〜約30mg/Kg/日の投与量で含む。いくつかの実施形態では、キットは本発明の化合物を約0.1mg/Kg/日〜約10mg/Kg/日の投与量で含む。特定の例では、本発明の化合物は、キットに約1mg/Kg/日の投与量で含まれる。
【0222】
キットは、癌の治療における使用、血液障害の治療における使用、心障害の治療における使用、およびJak2依存性細胞増殖の低減における使用のための説明書も含む。
【0223】
担体手段は、1つ以上の容器手段(バイアル、管など)を含むために適しており、それぞれの容器手段は本方法に使用される別々の要素の1つを含む。本明細書に提示した説明を考慮して、当業者は容器手段間の必要な試薬の配分を容易に決定できる。
【0224】
以下の実施例は、例証として提示し、これらに限定されない。特定の実施例を提示しているが、上の説明は例証であり、これらに限定されない。先に記載した実施形態の任意の1つ以上の特徴は、いかなる方法によっても、本発明における他の任意の実施形態の1つ以上の特徴と組み合わせることができる。さらに、本明細書の再検討時、本発明の多くのバリエーションが当業者にとって明らかとなるであろう。本発明の範囲は、したがって、上の説明に準拠して決定すべきではなく、それらの均等物の完全な範囲と共に添付の特許請求の範囲に準拠して決定すべきである。
実施例
【実施例1】
【0225】
化合物の合成
【化96】

合成スキームI
本発明のある化合物は、上の合成スキームIに示される例示的な合成スキームにより調製できる。
【0226】
中間体(I)を得るための合成手順:電磁撹拌棒および逆流コンデンサーの入った、火炎乾燥した二口丸底フラスコ内に乾燥THF(180mL)および亜鉛(8価)を添加した。TiCl4(4価)を0℃で滴下した。TiCl4の追加を完了後、反応混合物を2時間逆流させた。次いで、生成した褐色混合物を0℃に冷却してから、開始物質(アルデヒドまたはケトン)(1価)を20mL乾燥THF溶液としてゆっくりと添加した。反応混合物を逆流させてTLC(酢酸エチル/ヘキサンの2:3混合物)により反応進行をモニタリングした。終了時、反応混合物を濃縮し、酢酸エチル(150mL)で希釈した。酢酸エチル溶液に、飽和K2CO3溶液(100mL)を添加し、7時間撹拌して濾過した。濾過液を酢酸エチルで抽出し、有機層を飽和NaCl溶液、水で洗浄して、無水Na2SO4上で乾燥した。濃縮した粗混合物をシリカゲル上で酢酸エチル:ヘキサンの1:9混合物とカラムクロマトグラフして中間体(I)のE異性体とZ異性体をスチルベン生成物として得た。スチルベン生成物(中間体(I))を真空乾燥し、1H−および13C−NMR分光学により特性を決定した。
【0227】
生成物(II)を得るための合成手順:中間体(I)(1価)を一口丸底フラスコ内で15mLメタノール中に溶解し、パラホルムアルデヒド(2.1価)および適切なアミン(2.2価)を添加した。TLC(酢酸エチル:ヘキサンの2:3混合物)を用いて反応混合物を還流させて、反応進行をモニタリングした。反応終了時、混合物を室温に冷却して真空濃縮した。残基を酢酸エチル中に溶解し、1M HCl溶液で処理した。水相を分離し、pHが7になるまで1M NaOH溶液で処理し、酢酸エチルで抽出した。有機層を飽和NaCl溶液、水で洗浄し、無水Na2SO4上で乾燥し、真空濃縮して、生成物(II)をE−異性体とZ−異性体の混合物として得た。次いで、1H−および13C−NMR分光学により生成物(II)の特性を決定した。
【0228】
E−異性体とZ−異性体の両方を上の合成スキームを介して合成できる。上の手順の修正版を使用して本発明の追加の化合物を調製できる。例えば、置換アルケンを調製するための代替方法を用いて中間体(I)の変異体を調製することができる。
【実施例2】
【0229】
Jak2−V617F依存性HEL細胞増殖の阻害:
方法:Jak2−V617F発現ヒト赤白血病(HEL)細胞を96ウェルプレートに約40,000細胞/ウェルでプレート化し、ビヒクル対照(0.25%DMSO)または25μM Jak2キナーゼ阻害剤のいずれかでインキュベートした。次いで、その時点(0、4、24、48および72時間目)でトリパンブルー排除および血球計数器を介して生存細胞数を決定した。MultiScreen(登録)Solubility Filter Plate (Millipore)(薬剤の水溶解度を決定するための定量方法:至適化および標準方法との相関関係;http://www.millipore.com/techpublications/tech1/an1730en00を参照されたい)および分光光度計を用いて水溶解度を決定した。
【0230】
結果:試験した様々なJak2キナーゼ阻害剤の増殖阻害および水溶解度を下表1に要約する。
【表1】

【0231】
表1は、様々な化合物による、G6に類似した良好な細胞阻害を示す(NB−2およびNB−6が相対的に中程度、G6のそれぞれ約53%および約19%細胞を阻害したことを除く)。表1は、試験した化合物のほとんどの水溶解度値が約400〜500μMであったことも示す。
【0232】
さらに、G6の試験結果を図2、3、および4に要約する。図2は、G6のJak2−V617F依存性HEL細胞増殖の阻害IC50は、約4μMであることを示す。図3は、G6がJak2−V617F依存性細胞増殖を50%阻害するために必要な時間は約11時間であることを示す。図4は、G6がJak2−V617F依存性HEL細胞増殖を用量依存的かつ時間依存的に阻害することを示す。
【0233】
NB−1およびNB−2の試験結果をそれぞれ図5および6に要約する。図5は、NB−1のJak2−V617F依存性HEL細胞増殖の阻害IC50は約4μMであることを示す。図6は、NB−2のJak2−V617F依存性HEL細胞増殖の阻害IC50は約9μMであることを示す。
【実施例3】
【0234】
病的細胞増殖に対するJak2キナーゼ阻害剤のエクスビボ試験
方法:真性赤血球増加症を確認し、Jak2−V617F陽性とも同定された60歳雌から骨髄由来単核細胞を採取した。骨髄由来単核細胞をIMDM培地で3回洗浄し、4×105細胞/mLの1mLメチルセルロース培地(0.9%メチルセルロース、30%熱不活化FCS、0.1mM 2−メルカプトエタノール、0.9%BSA、0.05%NaHCO3、2mM/Lグルタミン、ペニシリン、ストレプトマイシン、50ng/mL SCF、および20ng/mL IL−3(Stem Cell Technologies, Vancouver, BC)でプレート化した。ビヒクル対照(0.25%DMSO)または阻害剤を指定の濃度(25または2.5μM)で添加した。EPO(1U/mL)も指定のとおり添加した。次いで、14日目のコロニー形成評価時まで培養液を37℃、5%CO2でインキュベートした。結果を複製培養液/4×105細胞由来の平均コロニー数として表した。
【0235】
結果:G6、NB−1およびNB−2は病的細胞増殖を低減することを示すG6、NB−1およびNB−2の試験結果を図10に要約する。
【実施例4】
【0236】
NOD−SCIDマウスモデルのJak2−V61F誘発性血液疾患における阻害剤の治療有効性を示すためのアッセイ
方法:本実験において、NOD−SCIDマウス、N=36を6群(n=6匹)に無作為化した。ベースライン末梢血試料および体重を0日目に測定した。7日目、2×106HEL細胞を2、3、4および5群の各マウスに注入した。28日目から49日まで、1群マウスは完全に未投薬とし、2群マウスにはDMSOを投与し、3群マウスには0.1mg/kg/日のG6を投与し、4群マウスには1.0mg/kg/日のG6を投与し、5群マウスには10mg/kg/日のG6を投与し、6群マウスには10mg/kg/日のG6を投与した。次いで、すべてのマウスを安楽死させた。
【0237】
本実験において、以下の測定可能な評価項目を評価した。末梢血において、総白血球(WBC)数、芽細胞パーセンテージ、有核赤血球(RBC)パーセンテージ、およびヘマトクリットを測定した。骨髄において、定量的細胞質、および脊髄細胞の赤血球細胞に対する(M:E)比率を評価した。さらに組織学的分析を用いて、脾臓、脳、腎臓、肝臓、および肺における毒性を評価した。
【0238】
21標準規格注射針を用いた週1回の顎下出血により、末梢血試料を採取した。血液試料をスライドガラス上に塗布し、染色して、乾燥させた。次いで、各スライド上の末梢芽細胞を病理光学顕微鏡を用いて集計した。次いで、各治療群の平均末梢芽細胞パーセントを時間関数としてグラフ化した。
【0239】
剖検時、各動物由来の大腿骨をホルマリン固定し、脱灰してからパラフィン包埋した。次いで、パラフィン切片を作製し、ヘマトキシリンおよびエオシンで染色し、乾燥させた。次いで、治療群に盲検の獣医病理学者が脊髄および赤血球細胞数を集計した。次いで、脊髄の赤血球細胞に対する比率を治療群の関数としてグラフ化した。さらに、成熟および未成熟赤血球細胞数の平均を治療群の関数としてグラフ化した。
【0240】
追加的に、剖検時、動物の最終測量を行い、次いで各マウスから脾臓を除去した。各脾臓の湿重量を記録し、脾臓重量の体重に対する比率を治療群の関数としてグラフ化した。
【0241】
結果:要約すると、SCID−NODマウス尾静脈内へのHEL細胞の注射は、1)末梢血中の芽細胞の増大;2)骨髄中の赤血球細胞数の増大(赤白血病);ならびに3)脊髄の赤血球に対する比率の低下、に証明される著しいJak2病原に至った。
【0242】
G6の試験結果を、図1、11、12、13、および14に示す。図1は、骨髄分析を示す:1(a)は、未処理SCID 1を示し、ここで脊髄細胞:赤血球系細胞の比率は1.11であり;1(b)は、DMSOで処理した114HEL細胞を示し、ここで脊髄細胞:赤血球系細胞の比率は0.47であり;1(c)は、0.1mg/kg G6で処理した234AHEL細胞を示し、ここで脊髄細胞:赤血球系細胞の比率は0.3であり;1(d)は、1.0mg/kg G6で処理した344HEL細胞を示し、ここで脊髄細胞:赤血球系細胞の比率は1.25であり;1(e)は、10mg/kg G6で処理した444HEL細胞を示し、ここで脊髄細胞:赤血球系細胞の比率は1.2であり;1(f)は、10mg/kg G6で処理した524SCIDを示し、ここで脊髄細胞:赤血球系細胞の比率は1.1である。
【0243】
図11は、G6は末梢血中の芽細胞パーセンテージを用量依存的に低下させることを示す;
図12は、G6は最小用量1mg/kg/日でHEL細胞誘発性の脊髄細胞:赤血球系細胞の比率の低下を逆転したことを示す;
図13は、G6処理は未成熟赤血球細胞ではなく成熟赤血球細胞の低減数と相関することを示す;
図14は、G6は脾臓重量の体重に対する比率を低下させることを示す。
【0244】
さらに、G6の10mg/kg/日投与量は、骨髄壊死(マウス6匹中2匹)および脾臓壊死(マウス6匹中3匹)に示されたように、ある程度の毒性を示すことが見出された;それでもなお、該動物の脳、腎臓、肝臓、および肺においては、マウスに10mg/kg/日投与時でさえ組織学的に正常であることが見出され、G6は、組織全体において毒性ではないことが示された。末梢血の顆粒球、好中球、および好酸球数はマウスに10mg/kg/日投与時でさえすべて正常であり、G6は、赤血球前駆に特異的であることが示された。
【0245】
まとめると、本明細書において報告された結果は、1)末梢血中の芽細胞の低減;2)骨髄中の赤血球細胞;特に成熟赤血球細胞の低減;3)病的脊髄の赤血球に対する比率の逆転;ならびに4)脾臓重量の体重に対する比率の低下、により証明されたG6処理で補正したJak2−V617F媒介病原を示す。
【実施例5】
【0246】
c−Srcアッセイ
約4μL(12単位)の触媒的に活性化した組換えp60c−src(Upstate Biotechnology)を、DMSOまたは25μM Z3のいずれかの存在下、46μLインビトロキナーゼ反応緩衝液(50mM HEPES、pH7.6、5mM MnCl2、5mM MgCl2、100mM NaCl、0.5mM DTT)中でインキュベートした。反応物を室温で20分間インキュベートし、次いでSDS含有緩衝液を追加して停止した。試料を抗Src(pY418)ポリクローナル抗体(Biosource)でウエスタンブロット化した。試料を続いてc−Src抗体(Biosource, Upstate Biotechnology)の混合物(それぞれ最終希釈1:1000)で免疫ブロットして、すべての試料において等量c−Srcタンパク質を示す。
【0247】
G6がc−Srcチロシンキナーゼ活性に対して無効であることを示すG6の結果を図7に要約する。
【実施例6】
【0248】
アポトーシスアッセイ
Jak2−V617F発現HEL細胞をビヒクル対照(DMSO)、または25μM阻害剤のいずれかに48時間曝露した。次いで、アネキシンV/ヨウ化プロピジウムFACS分析を介してアポトーシス細胞パーセンテージを決定した。
【0249】
様々な化合物/条件の試験結果を表2に要約する。さらに図8にもG6の試験結果を示す。
【表2】

【0250】
表2は、NB−1はG6と同様にHEL細胞増殖を抑制する一方、NB−2は、G6ほど効果的ではないことも示す。図8は、G6は細胞アポトーシスを増大することにより細胞数を低減することを示す。
【実施例7】
【0251】
Jak2−V617F自己リン酸化アッセイ
野生型マウスJak2cDNA(pRC−CMV−Jak2−V617F)をコードする5.0μgのプラスミドを含む血清非含有培地において、バクテリオファージT7プロモーターの制御下、製造業者の説明書(Invitrogen)に従いリポフェクチンを用いて、BSC−40細胞をトランスフェクトした。4時間後、細胞を感染効率(MOI)1.0で組換えワクチニアウイルスvTF7−3に感染させた。1時間後、リポフェクチン/DNA/vTF7−3を含む培地を細胞から除去し、新規の、血清含有培地と交換した。この時点で阻害剤を10〜100μMの範囲の用量で細胞に添加した。細胞を一晩37℃で増殖させて高レベル発現させ、続いてJak2をチロシン自己リン酸化させた。阻害剤の追加から16時間後、細胞を2容量の氷冷PBSで洗浄し(1mM Na3VO4を含む)、0.8mL氷冷RIPA緩衝液(プロテアーゼ阻害剤を含む)中で溶解させた。試料を氷上で1時間、超音波分解してインキュベートした。試料を16,000×g、4℃で5分間回転し、可溶性タンパク質溶解物を含む上清を換算した。換算した溶解物(約400μg/ml)を2μgの抗体および20μlのProtein A/G Plus agarose ビーズ(Santa Cruz Biotechnology)を用いて4℃で2〜4時間免疫沈殿した。遠心分離後、洗浄緩衝液(25mMトリス、pH7.5、150mM NaCl、および0.1%トリトンX−100)でタンパク質複合体を3回洗浄し、SDS含有試料緩衝液中で再懸濁した。結合タンパク質を煮沸し、SDS−PAGEにより分離し、ニトロセルロース膜上に移した。抗Jak2−pAb(HR758)の免疫沈降はSanta Cruz Biotechnologyから入手した。抗Tyr(P)−mAb(クローンPY20)の免疫沈降はBD Transduction Laboratoriesから入手した。リン酸化レベルを強化した化学ルミネセンスを用いて検出した。抗Tyr(P)ウエスタンブロッティング法を、クローン4G10(Upstate Biotechnology)、PY99(Santa Cruz Biotecnology)およびPY20(BD Transduction Laboratories)からなる抗体の混合物(それぞれ最終希釈1:1000)を用いて実施した。抗Jak2抗体(758〜776)はUpstate Biotechnology (Millipore)から入手した。
【0252】
Jak2−V617F自己リン酸化アッセイにおいて試験した様々な化合物の試験結果を図15に要約する。
【実施例8】
【0253】
Jak2−阻害剤がJak2−V617f依存性巨核球コロニー形成をブロックすることを示すためのエクスビボ試験
本態性血小板血症を確認したJak2−V617F陽性の61歳雄から骨髄由来単核細胞を採取した。細胞をIMDM培地で3回洗浄し、4×105細胞/mLの1mLメチルセルロース培地(0.9%メチルセルロース、30%熱不活化FCS、0.1mM 2−メルカプトエタノール、0.9%BSA、0.05%NaHCO3、2mM/Lグルタミン、ペニシリン、ストレプトマイシン、50ng/mL SCF、および20ng/mL IL−3(Stem Cell Technologies, Vancouver, BC)でプレート化した。ビヒクル対照(0.25%DMSO)またはG6(25μM)を指定のとおり添加した。TPO(1U/mL)も指定のとおり添加した。次いで、14日目のコロニー形成評価時まで培養液を37℃、5%CO2でインキュベートした。結果を複製培養液/4×105細胞由来の平均コロニー数として表した。
【0254】
G6はJak2−V617F依存性巨核球コロニー形成をブロックすることをはっきりと示すG6の試験結果を図9に要約する。
【実施例9】
【0255】
骨髄免疫組織化学:免疫化学を10%中性緩衝ホルマリン固定しパラフィン包埋した組織上で実施した。活性STAT5検出のため、マウスモノクローナル抗ホスホ−STAT5a/b(Y694/99; Advantex BioReagents LLP)を1:500希釈し、切片上で一晩4℃でインキュベートした。ビオチニル化二次抗体およびストレプトアビジン−ペルオキシダーゼ複合体(DAKO)により抗原−抗体複合体を検出した。対比染色にヘマトキシリンを用いた。BioGenex AR10回復緩衝液を用いて熱することにより(95℃、20分)、抗原を回復した。NIS−ELEMENT Dソフトウェアを用いて染色強度を定量化した。DNA鎖切断の3−ヒドロキシル末端を特異的に標識するTUNEL(末端デオキシヌクレオチジルトランスフェラーゼ媒介dUTP−ビオチン−ニック末端標識)法を介して、アポトーシス細胞を同定した。TUNEL手順において、すべての試薬(緩衝液を含む)はApopTag Kit (Millipore)の一部であった。TUNEL陽性細胞は、メチルグリーン対比染色に対して褐色の細胞核に強く染色されているように見えた。
【実施例10】
【0256】
ホスホ−STAT分析:製造業者の説明書(Invitrogen)に従い、STAT1、3、5a/bホスホ3−Plexアッセイキット、固相サンドイッチ免疫アッセイを用いてホスホ−STAT1[pY701]、STAT3[pY705]、およびSTAT5a/b[pY694/699](STAT5aにおいて[pY694]、およびSTAT5bにおいて[pY699])を測定した。各分析物に特異的な3つのビーズ領域のスペクトル特性をLuminex(登録)100(商標登録)機器によりモニタリングした。
【0257】
本明細書の可変要因の任意の定義における化学基リストの列挙は、その可変要因の、リストに挙げた任意の単一の基または基の組み合わせとしての定義を含む。本明細書の1つの要素、1つの実施形態の列挙は、任意の単一要素もしくは実施形態または任意の他の要素、実施形態またはその部分との組み合わせとして要素または実施形態を含む。
【0258】
本明細書に引用した特許、特許出願および刊行物の各開示がそれらの全体を参照することにより本明細書に組み込まれる。
【0259】
本発明は特定の実施形態に準拠して開示しているが、本発明の他の実施形態およびバリエーションも本発明の真意および範囲から逸脱せずに当業者により案出し得ることが明らかである。特許請求の範囲は、かかる実施形態および均等物のバリエーションをすべて含むと解釈されることを意図する。
【特許請求の範囲】
【請求項1】
式(I)の化合物またはその医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物であり、
【化1】

式中、
R1とR2はそれぞれ独立してH、−(炭素数1〜4)アルキル、−(炭素数2〜8)アルケニル、−(炭素数2〜8)アルキニル、
【化2】

であり、
式中、−(炭素数1〜4)アルキルはさらに1つ以上の水酸基もしくはハロゲンと置換でき;
または
R1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成し、ただしR1とR2は窒素原子と一緒になってピペラジン環を形成し、ピペラジン環上の第二の窒素はさらに−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルと置換でき、ここで−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルは1つ以上の水酸基、ハロゲンもしくは−(炭素数1〜3)アルキルと置換できることを条件とし;
R3はH、−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールであり;
R4はHもしくはR7であり;
R5はH、−(炭素数1〜4)アルキル、−C(CH3)2−R6、もしくはR7であり;ただしR4がHであり、R5がR7もしくは−C(CH3)2−R6である場合、およびR5がHもしくは−(炭素数1〜4)アルキルである場合、R4はR7であり、ここでR4とR5は同時にR7となることはできないことを条件とし;
R6はH、−(炭素数1〜4)アルキル、フェニル、もしくは
【化3】

であり
式中、R1とR2は上に定義したとおりであり;
R7は
【化4】

であり;
式中、R8とR9はそれぞれ独立してH、−OH、−O−(炭素数1〜4)アルキル、−CH2−NR1R2であり、式中、R1とR2は上に定義したとおりであり;
R10は各存在において独立して水素、もしくは−(炭素数1〜3)アルキルであり;
R11はH、アシル、トシル、−(炭素数1〜4)アルキル、もしくはアリールであり;
ただし化合物は、以下ではないことを条件とする:
I.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
II.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
III.5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
IV.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
V.4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
VI.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
VII.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
VIII.4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)。
【請求項2】
R10がH、メチルまたはエチルであり、R11がHである、請求項1の化合物。
【請求項3】
R3がHであり、R7が
【化5】

である、請求項2の化合物。
【請求項4】
R4がR7であり、R5がHである、請求項3の化合物。
【請求項5】
R8が−CH2−NR1R2であり、R9がヒドロキシルである、請求項4の化合物。
【請求項6】
R10が各存在において独立して水素またはメチルである、請求項5の化合物。
【請求項7】
R1とR2が各存在において独立して−(炭素数1〜4)アルキルであり;またはR1とR2が結合している窒素原子と一緒になってピペリジニル、ピロリジニルもしくはイミダゾリル環を形成し、ただしR10は各存在において同じであることを条件とする、請求項6の化合物。
【請求項8】
R10がエチルであり、R1とR2がエチルもしくはイソプロピルであり;またはR1とR2が結合している窒素原子と一緒になってピロリジニルもしくはイミダゾリル環を形成する、請求項5の化合物。
【請求項9】
R4がHであり、R5がR7である、請求項3の化合物。
【請求項10】
R8がヒドロキシルであり、R9が−CH2−NR1R2である、請求項9の化合物。
【請求項11】
R10がメチルである、請求項10の化合物。
【請求項12】
R1とR2が各存在において−(炭素数1〜4)アルキルであるか、またはR1とR2が結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成する、請求項11の化合物。
【請求項13】
R10がHまたはエチルであり、R1とR2がプロピルまたはイソプロピルであり、ただしR10は各存在において同じであることを条件とする、請求項10の化合物。
【請求項14】
R10がエチルであり、R1とR2が結合している窒素原子と一緒になってピペリジニル、ピロリジニルまたはイミダゾリル環を形成する、請求項10の化合物。
【請求項15】
R4とR5の一方がR7である、請求項1の化合物。
【請求項16】
前記化合物が以下の群またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である、請求項1の化合物、
a)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
b)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
c)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
d)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
e)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
f)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
g)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
h)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;
i)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
j)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;
k)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)2HCl;
l)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
m)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
n)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
o)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
p)(Z)および(E)−5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
q)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
r)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
s)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
t)(Z)および(E)−5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
u)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
v)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
w)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
x)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
y)(Z)および(E)−5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
z)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
aa)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
bb)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
cc)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
dd)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
ee)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
ff)(Z)および(E)−5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
gg)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
hh)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
ii)4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);ならびに
jj)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール)。
【請求項17】
前記化合物が以下からなる群またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される、請求項1の化合物、
1)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
2)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
3)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
4)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
5)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
6)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
7)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
8)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
9)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;
10)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
11)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;
12)5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
13)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
14)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
15)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
16)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
17)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
18)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(モルホリノメチル)フェノール);
19)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(モルホリノメチル)フェノール);
20)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
21)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
22)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−(モルホリノメチル)フェノール);
23)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
24)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
25)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
26)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(モルホリノメチル)フェノール);
27)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
28)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
29)(Z)および(E)−2−((ジエチルアミノ)メチル)−4−(4−(4−ヒドロキシフェニル)ヘキサ−3−エン−3−イル)フェノール;
30)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ジフェノール;
31)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ジフェノール;
32)(Z)および(E)−3,3−(エテン−1,2−ジイル)ジフェノール;
33)(Z)および(E)−3,3−(ブタ−2−エン−2,3−ジイル)ジフェノール;ならびに
34)(Z)および(E)−4,4−(エテン−1,2−ジイル)ジフェノール。
【請求項18】
有効量の請求項1の化合物を対象に投与することを含む、対象のJak2媒介疾患または障害の治療または予防方法。
【請求項19】
対象に追加の治療薬を投与する、請求項18の方法。
【請求項20】
請求項1の化合物またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物ならびに追加の治療薬を同時もしくは連続投与する、請求項18の方法。
【請求項21】
Jak2媒介疾患または障害が、真性赤血球増加症、本態性血小板血症、または特発性骨髄化生である、請求項18の方法。
【請求項22】
請求項1の化合物またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物がJak2−V617F変異阻害剤である、請求項18の方法。
【請求項23】
請求項1の化合物またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物がc−SrcもしくはTyk2自己リン酸化をJak2自己リン酸化ほど効果的には阻害しない、請求項18の方法。
【請求項24】
Jak2媒介障害が心疾患または心障害である、請求項18の方法。
【請求項25】
心疾患または心障害が、心肥大、心虚血再灌流、および心不全の群から選択される、請求項24の方法。
【請求項26】
請求項1の化合物が以下の群またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される、請求項18の方法、4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)2HCl;5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);ならびに4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)。
【請求項27】
請求項1の化合物またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物を、約0.001mg/Kg/日〜約200mg/Kg/日の用量で対象に投与する、請求項18の方法。
【請求項28】
前記化合物またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物を、約0.1mg/Kg/日〜約10mg/Kg/日の用量で対象に投与する、請求項27の方法。
【請求項29】
前記化合物またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物を、約1mg/Kg/日の用量で対象に投与する、請求項28の方法。
【請求項30】
有効量の請求項1の化合物を対象に投与することを含む、対象の癌の治療方法。
【請求項31】
癌が、白血病、リンパ腫、骨髄腫、および固形腫瘍の群から選択される、請求項30の方法。
【請求項32】
癌が、慢性骨髄性白血病(CML)、急性骨髄性白血病(AML)、および急性前骨髄球性白血病(APL)の群から選択される、請求項30の方法。
【請求項33】
Jak2依存性細胞増殖の低減方法であり、前記方法が細胞をJak2阻害剤と接触させることを含み、ここで阻害剤は、請求項1の化合物である、Jak2依存性細胞増殖の低減方法。
【請求項34】
対象のJak2が阻害されるように請求項1の化合物を対象に投与することを含む、かかる治療を必要とすると同定された対象のJak2の阻害方法。
【請求項35】
有効量の請求項1の化合物を対象に投与することを含む、対象の血液疾患または障害の治療方法。
【請求項36】
医薬上許容可能な担体と共に請求項1の化合物を含む医薬組成物。
【請求項37】
請求項1の化合物ならびに前記疾患もしくは障害の治療における使用説明書を含む、対象のJak2関連疾患もしくは障害を治療するためのキット。
【請求項38】
前記疾患または障害が、癌、血液障害および心障害の群から選択される、請求項36のキット。
【請求項39】
式(III)の化合物またはその医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物であり、
【化6】

式中、
R1とR2はそれぞれ独立してH、−(炭素数1〜4)アルキル、−(炭素数2〜8)アルケニル、−(炭素数2〜8)アルキニル、
【化7】

式中、−(炭素数1〜4)アルキルはさらに1つ以上の水酸基もしくはハロゲンと置換でき;
または
R1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成し、ただしR1とR2は窒素原子と一緒になってピペラジン環を形成し、ピペラジン環上の第二の窒素はさらに−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルと置換でき、ここで−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルは1つ以上の水酸基、ハロゲンもしくは−(炭素数1〜3)アルキルと置換できることを条件とし;
R11はH、アシル、トシル、−(炭素数1〜4)アルキル、もしくはアリールであり;
R4とR5はHもしくはR12であり、ただしR4とR5の一方はH、他方はR12であることを条件とし;
R12は
【化8】

であり、
式中、R4とR5の両方が結合するアリール基はR12の芳香族環の−OR11のメタもしくはパラであり;
R10は水素、もしくは−(炭素数1〜3)アルキルであり;
ただし化合物は、以下ではないことを条件とする:
i.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
ii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
iii.5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
iv.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
v.4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
vi.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
vii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
viii.4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)。
【請求項40】
以下からなる群またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される、請求項1の化合物:
1)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
2)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
3)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
4)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
5)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
6)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
7)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
8)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
9)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;
10)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
11)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;ならびに
12)5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)。
【請求項1】
式(I)の化合物またはその医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物であり、
【化1】

式中、
R1とR2はそれぞれ独立してH、−(炭素数1〜4)アルキル、−(炭素数2〜8)アルケニル、−(炭素数2〜8)アルキニル、
【化2】

であり、
式中、−(炭素数1〜4)アルキルはさらに1つ以上の水酸基もしくはハロゲンと置換でき;
または
R1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成し、ただしR1とR2は窒素原子と一緒になってピペラジン環を形成し、ピペラジン環上の第二の窒素はさらに−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルと置換でき、ここで−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルは1つ以上の水酸基、ハロゲンもしくは−(炭素数1〜3)アルキルと置換できることを条件とし;
R3はH、−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールであり;
R4はHもしくはR7であり;
R5はH、−(炭素数1〜4)アルキル、−C(CH3)2−R6、もしくはR7であり;ただしR4がHであり、R5がR7もしくは−C(CH3)2−R6である場合、およびR5がHもしくは−(炭素数1〜4)アルキルである場合、R4はR7であり、ここでR4とR5は同時にR7となることはできないことを条件とし;
R6はH、−(炭素数1〜4)アルキル、フェニル、もしくは
【化3】

であり
式中、R1とR2は上に定義したとおりであり;
R7は
【化4】

であり;
式中、R8とR9はそれぞれ独立してH、−OH、−O−(炭素数1〜4)アルキル、−CH2−NR1R2であり、式中、R1とR2は上に定義したとおりであり;
R10は各存在において独立して水素、もしくは−(炭素数1〜3)アルキルであり;
R11はH、アシル、トシル、−(炭素数1〜4)アルキル、もしくはアリールであり;
ただし化合物は、以下ではないことを条件とする:
I.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
II.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
III.5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
IV.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
V.4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
VI.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
VII.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
VIII.4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)。
【請求項2】
R10がH、メチルまたはエチルであり、R11がHである、請求項1の化合物。
【請求項3】
R3がHであり、R7が
【化5】

である、請求項2の化合物。
【請求項4】
R4がR7であり、R5がHである、請求項3の化合物。
【請求項5】
R8が−CH2−NR1R2であり、R9がヒドロキシルである、請求項4の化合物。
【請求項6】
R10が各存在において独立して水素またはメチルである、請求項5の化合物。
【請求項7】
R1とR2が各存在において独立して−(炭素数1〜4)アルキルであり;またはR1とR2が結合している窒素原子と一緒になってピペリジニル、ピロリジニルもしくはイミダゾリル環を形成し、ただしR10は各存在において同じであることを条件とする、請求項6の化合物。
【請求項8】
R10がエチルであり、R1とR2がエチルもしくはイソプロピルであり;またはR1とR2が結合している窒素原子と一緒になってピロリジニルもしくはイミダゾリル環を形成する、請求項5の化合物。
【請求項9】
R4がHであり、R5がR7である、請求項3の化合物。
【請求項10】
R8がヒドロキシルであり、R9が−CH2−NR1R2である、請求項9の化合物。
【請求項11】
R10がメチルである、請求項10の化合物。
【請求項12】
R1とR2が各存在において−(炭素数1〜4)アルキルであるか、またはR1とR2が結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成する、請求項11の化合物。
【請求項13】
R10がHまたはエチルであり、R1とR2がプロピルまたはイソプロピルであり、ただしR10は各存在において同じであることを条件とする、請求項10の化合物。
【請求項14】
R10がエチルであり、R1とR2が結合している窒素原子と一緒になってピペリジニル、ピロリジニルまたはイミダゾリル環を形成する、請求項10の化合物。
【請求項15】
R4とR5の一方がR7である、請求項1の化合物。
【請求項16】
前記化合物が以下の群またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される化合物である、請求項1の化合物、
a)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
b)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
c)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
d)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
e)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
f)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
g)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
h)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;
i)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
j)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;
k)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)2HCl;
l)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
m)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
n)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
o)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
p)(Z)および(E)−5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
q)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
r)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
s)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
t)(Z)および(E)−5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
u)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
v)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
w)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
x)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
y)(Z)および(E)−5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
z)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
aa)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
bb)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
cc)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
dd)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);
ee)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
ff)(Z)および(E)−5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
gg)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
hh)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);
ii)4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);ならびに
jj)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール)。
【請求項17】
前記化合物が以下からなる群またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される、請求項1の化合物、
1)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
2)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
3)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
4)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
5)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
6)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
7)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
8)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
9)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;
10)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
11)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;
12)5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
13)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
14)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
15)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
16)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
17)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
18)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(モルホリノメチル)フェノール);
19)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(モルホリノメチル)フェノール);
20)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
21)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
22)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−(モルホリノメチル)フェノール);
23)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
24)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
25)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
26)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(モルホリノメチル)フェノール);
27)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
28)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);
29)(Z)および(E)−2−((ジエチルアミノ)メチル)−4−(4−(4−ヒドロキシフェニル)ヘキサ−3−エン−3−イル)フェノール;
30)(Z)および(E)−4,4−(ヘキサ−3−エン−3,4−ジイル)ジフェノール;
31)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ジフェノール;
32)(Z)および(E)−3,3−(エテン−1,2−ジイル)ジフェノール;
33)(Z)および(E)−3,3−(ブタ−2−エン−2,3−ジイル)ジフェノール;ならびに
34)(Z)および(E)−4,4−(エテン−1,2−ジイル)ジフェノール。
【請求項18】
有効量の請求項1の化合物を対象に投与することを含む、対象のJak2媒介疾患または障害の治療または予防方法。
【請求項19】
対象に追加の治療薬を投与する、請求項18の方法。
【請求項20】
請求項1の化合物またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物ならびに追加の治療薬を同時もしくは連続投与する、請求項18の方法。
【請求項21】
Jak2媒介疾患または障害が、真性赤血球増加症、本態性血小板血症、または特発性骨髄化生である、請求項18の方法。
【請求項22】
請求項1の化合物またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物がJak2−V617F変異阻害剤である、請求項18の方法。
【請求項23】
請求項1の化合物またはそれらの医薬上許容可能な塩、水和物もしくは溶媒和化合物がc−SrcもしくはTyk2自己リン酸化をJak2自己リン酸化ほど効果的には阻害しない、請求項18の方法。
【請求項24】
Jak2媒介障害が心疾患または心障害である、請求項18の方法。
【請求項25】
心疾患または心障害が、心肥大、心虚血再灌流、および心不全の群から選択される、請求項24の方法。
【請求項26】
請求項1の化合物が以下の群またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される、請求項18の方法、4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)2HCl;5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((ジイソプロピルアミノ)メチル)フェノール);5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);5,5−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((1H−イミダゾール−1−イル)メチル)フェノール);5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);ならびに4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)。
【請求項27】
請求項1の化合物またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物を、約0.001mg/Kg/日〜約200mg/Kg/日の用量で対象に投与する、請求項18の方法。
【請求項28】
前記化合物またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物を、約0.1mg/Kg/日〜約10mg/Kg/日の用量で対象に投与する、請求項27の方法。
【請求項29】
前記化合物またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物を、約1mg/Kg/日の用量で対象に投与する、請求項28の方法。
【請求項30】
有効量の請求項1の化合物を対象に投与することを含む、対象の癌の治療方法。
【請求項31】
癌が、白血病、リンパ腫、骨髄腫、および固形腫瘍の群から選択される、請求項30の方法。
【請求項32】
癌が、慢性骨髄性白血病(CML)、急性骨髄性白血病(AML)、および急性前骨髄球性白血病(APL)の群から選択される、請求項30の方法。
【請求項33】
Jak2依存性細胞増殖の低減方法であり、前記方法が細胞をJak2阻害剤と接触させることを含み、ここで阻害剤は、請求項1の化合物である、Jak2依存性細胞増殖の低減方法。
【請求項34】
対象のJak2が阻害されるように請求項1の化合物を対象に投与することを含む、かかる治療を必要とすると同定された対象のJak2の阻害方法。
【請求項35】
有効量の請求項1の化合物を対象に投与することを含む、対象の血液疾患または障害の治療方法。
【請求項36】
医薬上許容可能な担体と共に請求項1の化合物を含む医薬組成物。
【請求項37】
請求項1の化合物ならびに前記疾患もしくは障害の治療における使用説明書を含む、対象のJak2関連疾患もしくは障害を治療するためのキット。
【請求項38】
前記疾患または障害が、癌、血液障害および心障害の群から選択される、請求項36のキット。
【請求項39】
式(III)の化合物またはその医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物であり、
【化6】

式中、
R1とR2はそれぞれ独立してH、−(炭素数1〜4)アルキル、−(炭素数2〜8)アルケニル、−(炭素数2〜8)アルキニル、
【化7】

式中、−(炭素数1〜4)アルキルはさらに1つ以上の水酸基もしくはハロゲンと置換でき;
または
R1とR2は結合している窒素原子と一緒になって5員環もしくは6員環の複素環を形成し、ただしR1とR2は窒素原子と一緒になってピペラジン環を形成し、ピペラジン環上の第二の窒素はさらに−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルと置換でき、ここで−(炭素数1〜4)アルキル、−(炭素数3〜7)シクロアルキル、アリールもしくはアシルは1つ以上の水酸基、ハロゲンもしくは−(炭素数1〜3)アルキルと置換できることを条件とし;
R11はH、アシル、トシル、−(炭素数1〜4)アルキル、もしくはアリールであり;
R4とR5はHもしくはR12であり、ただしR4とR5の一方はH、他方はR12であることを条件とし;
R12は
【化8】

であり、
式中、R4とR5の両方が結合するアリール基はR12の芳香族環の−OR11のメタもしくはパラであり;
R10は水素、もしくは−(炭素数1〜3)アルキルであり;
ただし化合物は、以下ではないことを条件とする:
i.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
ii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
iii.5,5−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
iv.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
v.4,4−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);もしくは
vi.4,4−(ヘキサ−3−エン−3,4−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
vii.4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);もしくは
viii.4,4−(エテン−1,2−ジイル)ビス(2−(ピロリジン−1−イルメチル)フェノール)。
【請求項40】
以下からなる群またはそれらの医薬上許容可能な塩、エステル、水和物もしくは溶媒和化合物から選択される、請求項1の化合物:
1)(Z)および(E)−4,4−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
2)(Z)および(E)−4,4−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
3)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
4)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
5)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール);
6)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール);
7)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール);
8)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
9)(Z)および(E)−5,5−(ブタ−2−エン−2,3−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;
10)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジエチルアミノ)メチル)フェノール)2HCl;
11)(Z)および(E)−5,5−(エテン−1,2−ジイル)ビス(2−((ジメチルアミノ)メチル)フェノール)2HCl;ならびに
12)5,5−(エテン−1,2−ジイル)ビス(2−(ピペリジン−1−イルメチル)フェノール)。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【公表番号】特表2012−511585(P2012−511585A)
【公表日】平成24年5月24日(2012.5.24)
【国際特許分類】
【出願番号】特願2011−540877(P2011−540877)
【出願日】平成21年12月9日(2009.12.9)
【国際出願番号】PCT/US2009/067402
【国際公開番号】WO2010/068710
【国際公開日】平成22年6月17日(2010.6.17)
【出願人】(509017000)ユニバーシティ オブ フロリダ リサーチ ファウンデーション,インコーポレイテッド (8)
【出願人】(510261131)ユニバーシティ・オブ・サウス・フロリダ (3)
【氏名又は名称原語表記】UNIVERSITY OF SOUTH FLORIDA
【Fターム(参考)】
【公表日】平成24年5月24日(2012.5.24)
【国際特許分類】
【出願日】平成21年12月9日(2009.12.9)
【国際出願番号】PCT/US2009/067402
【国際公開番号】WO2010/068710
【国際公開日】平成22年6月17日(2010.6.17)
【出願人】(509017000)ユニバーシティ オブ フロリダ リサーチ ファウンデーション,インコーポレイテッド (8)
【出願人】(510261131)ユニバーシティ・オブ・サウス・フロリダ (3)
【氏名又は名称原語表記】UNIVERSITY OF SOUTH FLORIDA
【Fターム(参考)】
[ Back to top ]

